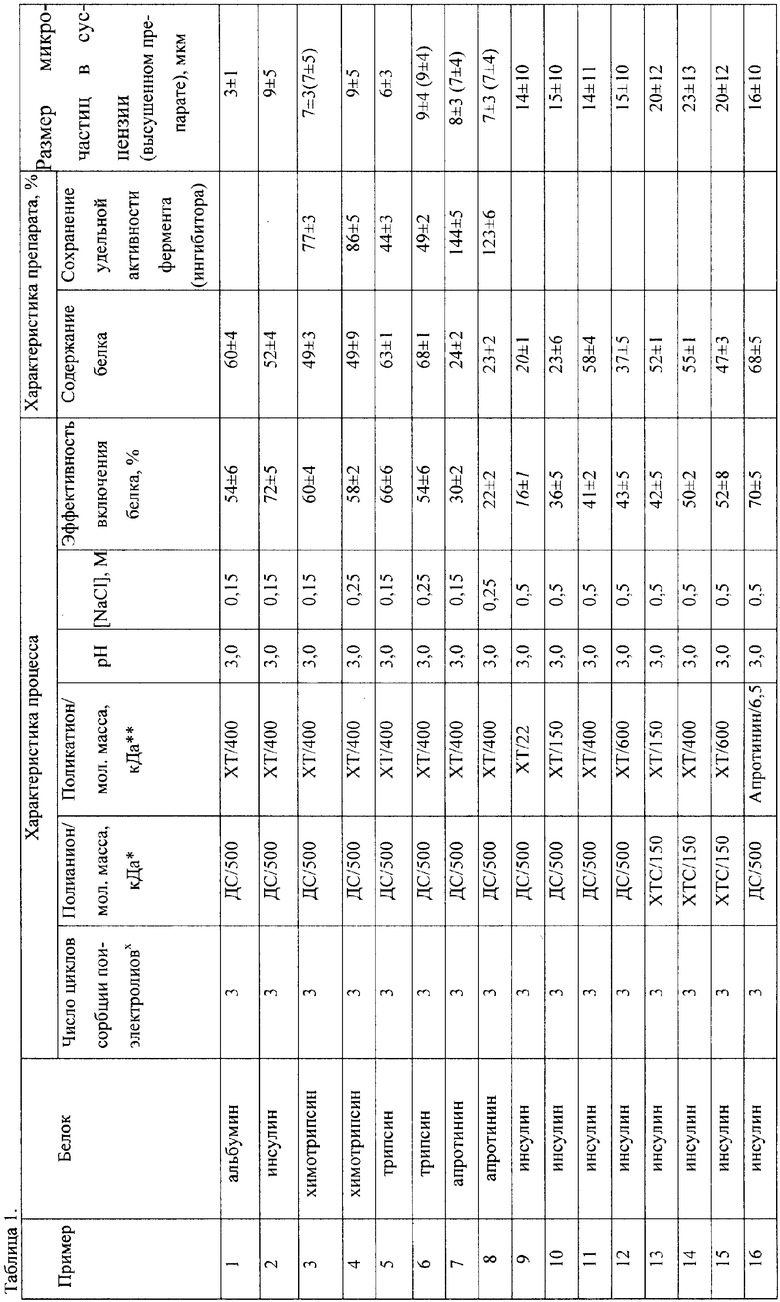
Изобретение относится к области фармации, биохимии и биотехнологии, а именно к способу получения микрочастиц, чувствительных к изменению состава окружающей среды и обеспечивающих рН-чувствительное высвобождение целевого вещества, предпочтительно предназначенного для лечения, профилактики и диагностики.
Известен способ получения полиэлектролитных микрокапсул путем последовательной адсорбции противоположно заряженных полиэлектролитов на растворимых микроматрицах, последующее растворение матриц и включение в полученные полые микрокапсулы действующего вещества [1]. Недостатком этого способа получения является низкое количество действующего вещества, включаемого в полиэлектролитные стенки полых микрокапсул.
Наиболее близким по технической сущности к заявляемому способу является способ получения полиэлектролитных микрокапсул последовательной адсорбцией противоположно заряженных полиэлектролитов на нерастворимых микроматрицах с включенным действующим веществом [2]. Недостатком этого способа являются сложности с включением действующего вещества в микроматрицы, а также использование большого количества стадий адсорбции полиэлектролитов на микроматрицах. Кроме того, при высокой эффективности включения действующего вещества в микрокапсулы, в данном способе не показано высвобождение действующего вещества из микрокапсул при изменении состава окружающей среды, что является важным при их применении.
Предложен более простой и менее многостадийный процесс получения полиэлектролитных микрочастиц путем адсорбции противоположно заряженных полиэлектролитов на микроматрицах, содержащих действующее вещество. При этом полиэлектролитные микрочастицы характеризуются высоким содержанием активного вещества - до 90% от массы микрочастиц (в зависимости от условий получения микрочастиц и количества стадий сорбции полиэлектролитов).
Сущность изобретения
Объектом изобретения является способ получения полиэлектролитных микрочастиц путем проведения ряда стадий последовательной послойной адсорбции противоположно заряженных полиэлектролитов на нерастворимых микроматрицах, содержащих инкапсулируемое вещество при рН 3-8 и добавлении хлорида натрия до его концентрации в растворе 0-2,5 М.
В случае использования в качестве действующего вещества белков нерастворимые микроматрицы получают путем микроагрегирования белков высаливанием или более предпочтительно путем образования белок-полиэлектролитных комплексов микронных размеров. В качестве белков могут быть использованы, например, альбумин, химотрипсин и другие ферменты, гормоны роста, факторы роста, антигены, цитокины и др.
Защита высвобождающихся из микрочастиц белков от действия протеолитических ферментов обеспечивается за счет высвобождения их в виде комплекса с полиэлектролитом, а также путем использования при получении микрочастиц на одной или нескольких стадий сорбции в качестве полиэлектролита ингибиторов протеиназ.
В случае использования в качестве действующего вещества нерастворимых в воде веществ микроматрицы для нанесения полиэлектролитов получают тонким помолом субстанций нерастворимых в воде веществ, в частности до среднего размера частиц 1-10 мкм или менее, или ультраозвучиванием их суспензии с получением частиц наноразмеров, в частности 100-200 нм. Например, в качестве нерастворимых в воде веществ могут быть использованы стероиды, антиоксиданты, например кверцетин и соединения селена, противоопухолевые вещества, например метотрексат и паклитаксель, фтивазид, фуросемид и др.
В случае использования в качестве действующего вещества масел или жидких гидрофобных веществ в качестве микроматриц для нанесения полиэлектролитов применяют эмульсии этих веществ, содержащие ионный детергент, подвергнутые ультраозвучиванию. В качестве таких веществ могут быть использованы, например, масляные экстракты из растительного сырья, токоферол ацетат, каротиноиды и др.
В качестве полиэлектролитов могут быть использованы природные или синтетические полианионы или поликатионы.
Предпочтительно использование в качестве полианионов - декстрансульфата, хитозансульфата, хитозансукцината, хитозанфталата, дермотансульфата, хондро-этилсульфата, альгината, полистиролсульфоната, а также анионных белковых ингибиторов протеиназ (ингибитор из сои типа Баумана-Бирк, ингибитора протеиназ из утиных яиц), а в качестве поликатионов - хитозана, протамина, полилизина, поли-L-орнитина, желатины, полиэтиленимина, полиаллиламина и основного ингибитора протеиназ (апротинина).
Проведение процесса сборки полиэлектролитных микрочастиц при строго определенных значениях рН раствора позволяет получать микрочастицы, высвобождающие инкапсулированное вещество в активном состоянии при желаемых значениях рН, при этом скорость высвобождения целевого вещества регулируется ионной силой раствора при сборке микрочастиц, количеством стадий сорбции полиэлектролитов, варьированием химической природы полиэлектролитов и их молекулярных масс. При варьировании исходных размеров микроагрегатов, содержащих активное вещество, и при ультразвуковом воздействии на микрочастицы удается получать частицы от нано- до микроразмера.
Полиэлектролитные микрочастицы с инкапсулированным веществом могут храниться в течение 3 лет в виде суспензии без агрегирования и потери активности инкапсулированного вещества.
Полиэлектролитные микрочастицы с инкапсулированным веществом могут быть лиофильно высушены из водной суспензии. Ресуспензированные после лиофилизации полиэлектролитные микрочастицы сохраняют свой исходный размер до высушивания, а инкапсулированное в них вещество сохраняет свою активность.
Использование биосовместимых и биодеградируемых полиэлектролитов при получении микрочастиц позволяет использовать полиэлектролитные микрочастицы в качестве лекарственных средств, обеспечивающих рН-чувствительное высвобождение активного инкапсулируемого вещества, например, при их попадании в определенные участки желудочно-кишечного тракта.
Микрочастицы на основе как синтетических, так и природных полиэлектролитов с включенным инкапсулируемым веществом могут применяться в биокатализе как биореакторы или в биотехнологии, как контейнеры, содержащие активные вещества.
Способ получения полиэлектролитных микрочастиц, содержащих инкапсулируемое вещество, иллюстрируется следующими примерами.
Примеры 1-17.
Получение лиофильно высушенных полиэлектролитных микрочастиц на основе микроматриц, представляющих собой нерастворимые комплексы белков с полианионами.
Для получения микроматриц нерастворимого комплекса белок-полианион смешивали 5 мл раствора белка (20 мг/мл) и 5 мл раствора полианиона (5 мг/мл). По примерам 1-17 использованные полиэлектролиты, рН и концентрация NaCl при получении микрочастиц приведены в таблице 1. Суспензию перемешивали 20 мин (300 об/мин), осадок микрочастиц сепарировали и дважды промывали раствором без полиэлектролита.
К осадку микрочастиц нерастворимого комплекса белок-полианион прибавляли 10 мл раствора поликатиона (2,5 мг/мл). Смесь перемешивали 20 мин, осадок сепарировали и дважды промывали раствором без полиэлектролита.
Процесс повторяли до достижения трех стадий сорбции полиэлектролитов, затем микрочастицы суспензировали в растворе с теми же рН и концентрацией NaCl и хранили в таком виде при 4-6°С. Изучали эффективность включения белков в микрочастицы, в суспензии микрочастиц изучали размер микрочастиц, содержание в микрочастицах белка и активность включенных ферментов.
Образцы по примерам 3, 6-9 промывали трижды 1 мМ HCl и лиофильно высушивали. После высушивания образцы суспендировали в 1 мМ HCl и изучали размер микрочастиц (данные приведены в скобках в последней колонке таблицы 1).
Примеры 18-21.
Получение полиэлектролитных микрочастиц на основе микроматриц, представляющих собой нерастворимые комплексы белков с поликатионами.
Для получения микроматриц на нерастворимого комплекса белок-поликатион смешивали 5 мл раствора белка (20 мг/мл) и 5 мл раствора хитозана с молекулярной массой 22 кД. (5 мг/мл). По примерам 18-19 использованные полиэлектролиты, рН и концентрация NaCl при получении микрочастиц приведены в таблице 1. Суспензию перемешивали 20 мин (300 об/мин), осадок микрочастиц сепарировали и дважды промывали раствором без полиэлектролита,
К осадку микрочастиц нерастворимого комплекса белок-поликатион прибавляли 10 мл раствора полианиона (2,5 мг/мл). Смесь перемешивали 20 мин, осадок сепарировали и дважды промывали раствором без полиэлектролита.
Процесс повторяли до достижения трех стадий сорбции полиэлектролитов, затем микрочастицы суспензировали в растворе с теми же рН и концентрацией NaCl и хранили в таком виде при 4-6°С.
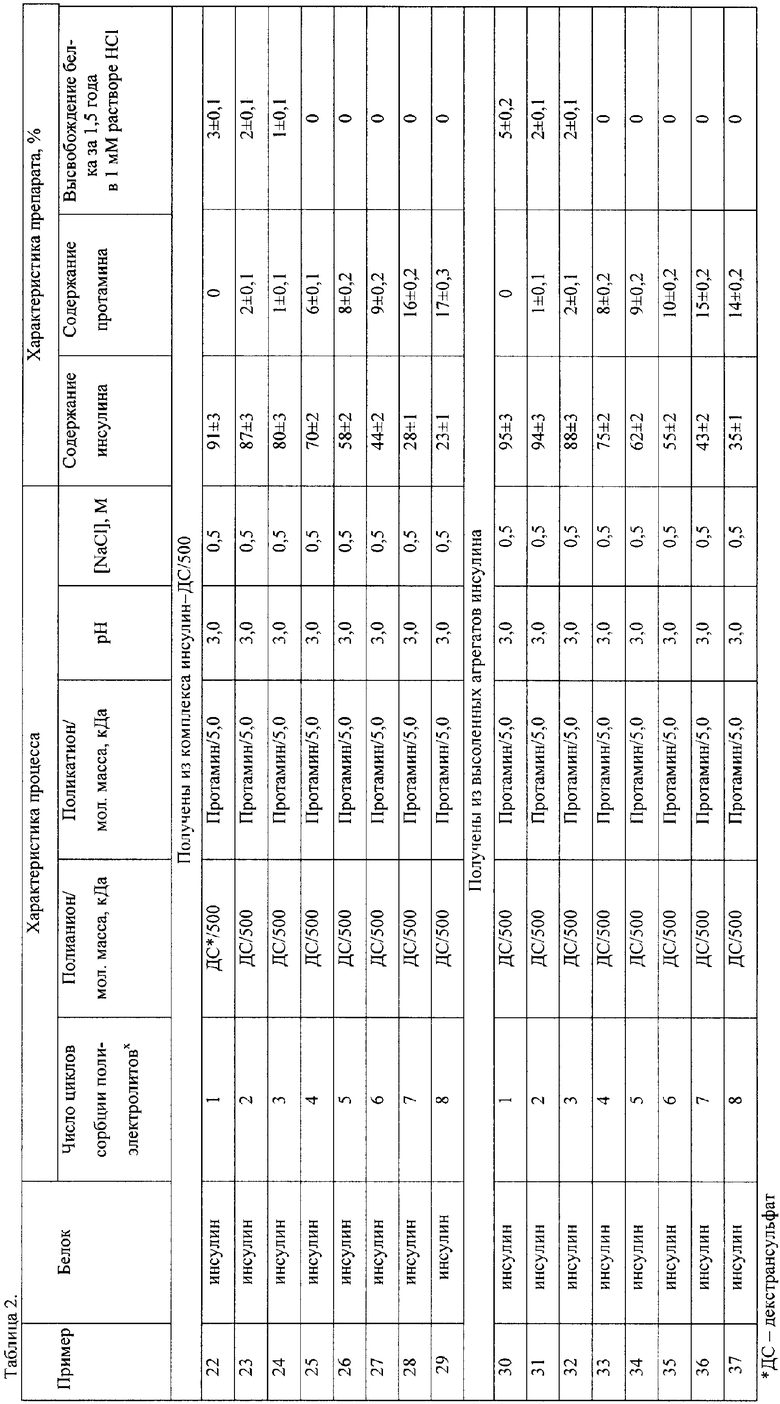
Примеры 22-29.
Процесс получения полиэлектролитных микрочастиц на суспензии микрочастиц нерастворимого комплекса белок-полианион проводили аналогично примерам 1-17, используя в качестве белка - инсулин, полианиона - ДС, поликатиона - протамин, до достижения от 1 до 8 стадий собрции полиэлектролитов (таблица 2, верхняя часть).
Готовые микрочастицы трижды суспензировали в 1 мМ HCl, хранили в 1 мМ HCl при 4-6°С. Через 3 года изучали стабильность микрочастиц, анализируя количество белка, высвободившегося из микрочастиц.
Примеры 30-37.
Для получения полиэлектролитных матриц высоленных микроагрегатов белка к 5 мл раствора инсулина (20 мг/мл) добавляли 0,15 г NaCl. Смесь перемешивали 1 ч.
Процесс получения полиэлектролитных микрочастиц на высоленных микроагрегатах белка проводили аналогично примерам 18-25, используя в качестве полианиона - ДС, поликатиона - протамин, до достижения от 1 до 8 стадий сорбции полиэлектролитов (см. таблицу 2).
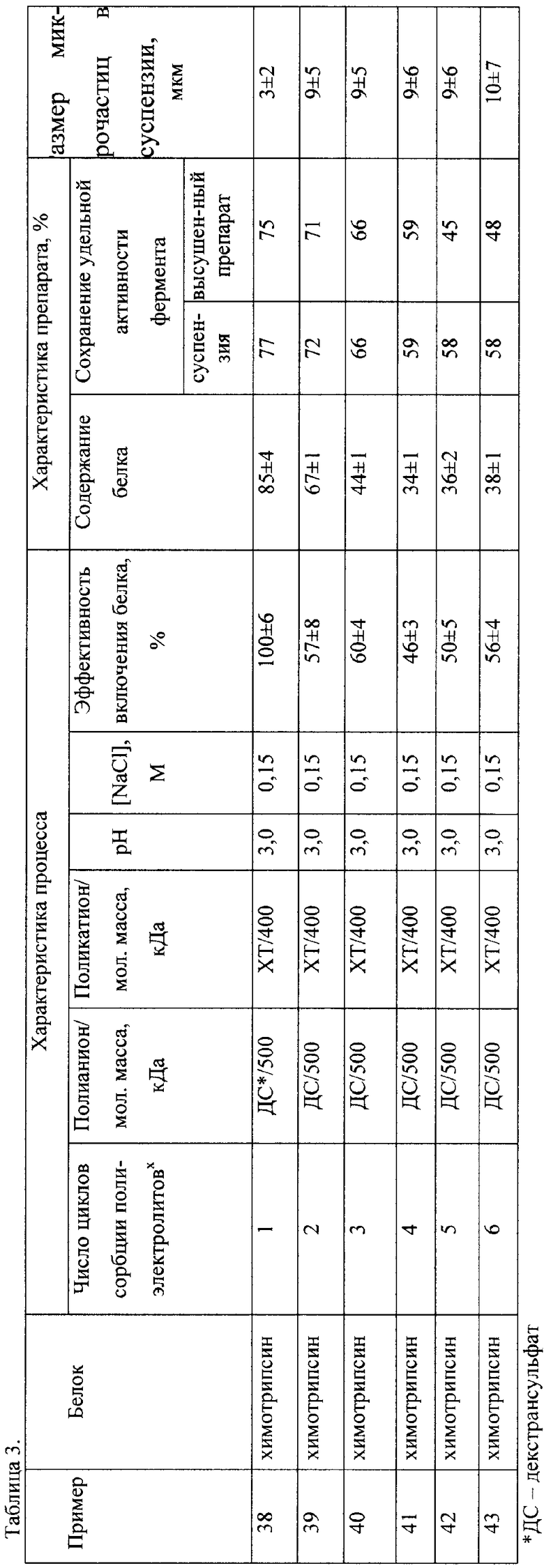
Примеры 38-43.
Получение лиофильно высушенных полиэлектролитных микрочастиц на основе микроматриц, представляющих собой микрочастицы высоленных агрегатов белков.
Процесс получения полиэлектролитных микрочастиц на суспензии нерастворимого комплекса белок-полианион проводили аналогично примерам 1-17, используя в качестве белка - химотрипсин, полианиона - декстрансульфат с молекулярной массой 500 кДа, поликатиона - хитозан с молекулярной массой 400 кДа до достижения от 1 до 6 стадий сорбции полиэлектролитов.
Готовые микрочастицы трижды промывали помывали 1 мМ HCl и лиофильно высушивали и хранили при 4-6°С. После высушивания образцы мирочастиц суспендировали в 1 мМ HCl и изучали активность химотрисина.
Получение полиэлектролитных частиц, обработанных ультразвуком
Пример 44.
10 мл суспензии полиэлектролитных микрочастиц с химотрипсином, полученных по примеру 4, подвергали озвучиванию с помощью диспергатора ультразвукового «УЗДНА-А» (рабочая частота генератора 22 кГц) на ледяной бане. Через 2 мин озвучивания средний размер микрочастиц составил 3±2 мкм, удельная активность химотрипсина 83±3%.
Пример 45.
5 мл суспензии полиэлектролитных микрочастиц с инсулином (средний размер 5-13 мкм), полученных по примеру 33, подвергали озвучиванию по примеру 44 в течение 3 мин. Средний размер частиц после озвучивание составил 100-200 нм.
рН чувствительное высвобождение капсулированных веществ из полиэлектролитных микрочастиц.
Пример 46.
Аликвоту суспензии полиэлектролитных микрочастиц с альбумином, полученных по примеру 1, смешивали с универсальным буфером (0,02 М Н3PO4, 0,02 М СН3СООН, 0,02 М Н3ВО3+0,1 М NaOH, рН 3-8) до получения конечной концентрации белка 0,25 мг/мл. После 1 часа перемешивания на качалке (100 об/мин) образцы 5 мин центрифугировали при 1000 g и в супернатанте определяли концентрацию белка.
Высвобождение белка из микрочастиц, определенное как отношение содержания белка в супернатанте и в суспензии микрочастиц в зависимости от рН, показано на фиг.1 А
Примеры 47-50.
Процесс проводили по примеру 46, используя образцы полиэлектролитных микрочастиц, полученные по примерам 2 (с инсулином), 3 (с химотрипсином), 5 (с трипсином), 7 (с апротинином). Результаты показаны на фиг.1 А.
Фиг.1. Влияние рН на высвобождение белка из полиэлектролитных микрочастиц. Номер кривой соответствует номеру примера, по которому получены микрочастицы.
Регулирование скорости высвобождения инкапсулированного вещества из полиэлектролитных микрочастиц варьированием числа стадий сорбции полиэлектролитов, последовательностью использования полианионов и поликатионов на последней стадии сорбции при получении микрочастиц и использование полиэлектролитных микрочастиц как средств, высвобождающих капсулированные вещества.
Примеры 51-56.
Процесс высвобождения белка проводили по примеру 46, используя образцы микрочастиц с химотрипсином с различным числом стадий сорбции полиэлектролитов декстрансульфата с молекулярной массой 500 кДа и хитозана с молекулярной массой 400 кДа, полученные по примерам 38-43. Результаты показаны на фиг.1 Б.
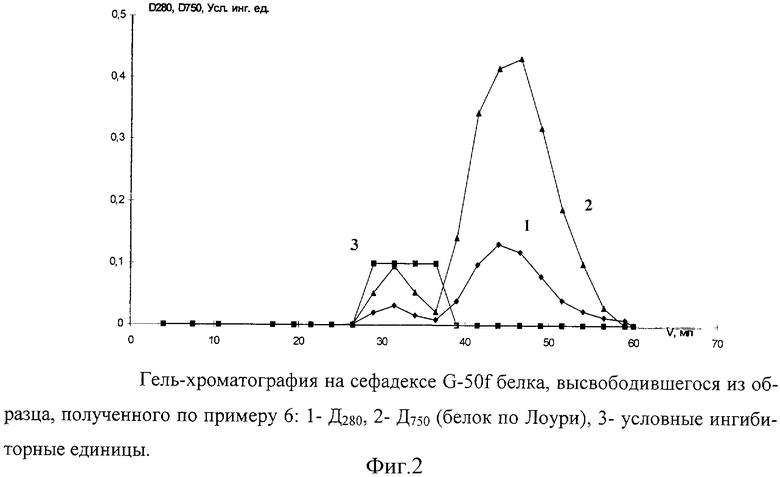
Пример 57.
Процесс высвобождения белка проводили по примеру 46 при рН 7,0, используя образец микрочастиц с инсулином, полученный по примеру 6 с использованием трех стадий сорбции декстрансульфата с молекулярной массой 500 кДа и ингибитора протеиназ - апротинина.
Супернатант хроматографировали на колонке с сефадексем G-50f (19,5×2,0 см) в универсальном буфере с рН 7,0 (фиг.2). На выходе с колонки анализировали содержание белка и активность ингибитора протеиназ. Обнаружено наличие активного ингибитора протеиназ, находящегося в высокомолекулярном комплексе с полиэлектролитами, и инсулина в не связанном с полиэлектролитами состоянии.
Фиг.2. Гель-хроматография на сефадексе G-50f белка, высвободившегося из образца, полученного по примеру 6: 1- Д280, 2 -Д750 (белок по Лоури), 3- условные ингибиторные единицы.
Пример 58.
Использования полиэлектролитных микрочастиц как биокатализаторов.
Использовали суспезию микрочастиц, полученных по примеру 43. Аликвоту суспензии разбавляли в 100 раз 0,001 М HCl. Через 10 мин измеряли активность химотрипсина в суспензии с использованием в качестве субстрата бензоил-аргинин-этилового эфира. Сохранение удельной активности химотрипсина составило 9%.
Аликвоту суспензии разбавляли в 100 раз 0,05 М фосфатным буфером. Через 10 мин измеряли активность химотрипсина в суспензии с использованием в качестве субстрата бензоил-аргинин-этилового эфира. Сохранение удельной активности химотрипсина по отношению к ферменту, взятому для микрокапсулирования, составило 19%.
Аликвоту суспензии смешивали с 9 объемами раствора 0,025 М NaOH. Через 30 сек прозрачный раствор разбавляли 90 объемами 0,05 М трис-буферы с рН 7,8. Через 10 мин измеряли активность химотрипсина, высвободившегося при разрушении микрочастиц,
суспензии с использованием в качестве субстрата бензоил-аргинин-этилового эфира.
Сохранение удельной активности химотрипсина составило 58%.
Получение полиэлктролитных микрочастиц на основе микроматриц плохо растворимых веществ.
Пример 59.
Для получения микроматриц нерастворимого вещества кверцетин подвергали тонкому помолу на агатовой ступке и суспендировали до концентрации 2 мг/мл в растворе 0,25 М NaCl с рН 3,0 в течение 20 мин.
Для получения полиэлектролитных микрочастиц смешивали 5 мл озвученной суспензии кверцетина и 5 мл раствора декстрансульфата с молекулярной массой 500 кДа (5 мг/мл) в 0,25 М NaCl с рН 3,0. Смесь перемешивали 30 мин (300 об/мин), осадок сепарировали и дважды промывали раствором без полиэлектролита. К осадку микрочастиц прибавляли 10 мл раствора хитозана с молекулярной массой 400 кДа (2,5 мг/мл) в 0,25 М NaCl с рН 3,0. Смесь перемешивали 20 мин, осадок микрочастиц сепарировали и дважды промывали раствором без полиэлектролита. К осадку микрочастиц прибавляли 10 мл раствор декстрансульфата (2,5 мг/мл) в 0,25 М NaCl с рН 3,0. Смесь перемешивали 20 мин, осадок микрочастиц сепарировали и дважды промывали раствором без полиэлектролита, затем полиэлектролитные микрочастицы суспензировали в растворе с 1 мМ HCl и хранили в таком виде при 4-6°С. Полиэлектролитные микрочастицы имели средний размер 15±10 мкм, содержание кверцетина в них составило 85±5%.
Пример 60.
Для получения микроматриц нерастворимого вещества суспензию 15 мг/мл 1,5 дифенил-3-селенапентадион-1,5 в воде подвергали озвучиванию по примеру 44 в течение 5 мин.
Для получения полиэлектролитных микрочастиц смешивали 5 мл озвученной суспензии и 5 мл раствора хитозана с молекулярной массой 150 кДа (2 мг/мл) с рН 3,0 смешивали и перемешивали 10 мин (300 об/мин), осадок сепарировали и дважды промывали 0,001 М HCl. К осадку микрочастиц прибавляли 10 мл раствора хитозан-сульфата с молекулярной массой 150 кДа (2 мг/мл) с рН 3,0. Смесь перемешивали 10 мин, осадок микрочастиц сепарировали и дважды промывали раствором без полиэлектролита. Указанную процедуру повторяли до достижения 5 стадий сорбции полиэлектролитов. По окончании процесса осадок дважды промывали, а затем полиэлектролитные микрочастицы суспензировали в растворе с 1 мМ HCl и хранили в таком виде при 4-6°С. Полиэлектролитные микрочастицы с 1,5 дифенил-3-селенапентадион-1,5 имели средний размер 3±2,5 мкм.
10 мл суспензии сепарировали и отделяли супернатант. К осадку приливали 10 подсолнечного масла и перемешивали (100 об/мин). Через 7 ч не было обнаружено высвобождения 1,5 дифенил-3-селенапентадион-1,5 из микрочастиц. В контрольной суспензии через 10 мин после добавления подсолнечного масла наблюдалось полное растворение суспензии микроматриц озвученого 1,5 дифенил-3-селенапентадион-1,5.
Пример 61.
Способ получения полиэлектролитных микрочастиц на основе микроматриц, представляющих собой микроэмульсии масел.
Для получения микроматриц готовили эмульсию, содержащую токоферола 2,5% об. и 0,1% вес. додецилсульфата натрия.
Для получения микрочастиц эмульсию смешивали с раствором 2 мг/мл полиаллиламина с молекулярной массой 60 кДа в соотношении 1:1 по объему и подвергали озвучиванию по примеру 44 в течение 1 мин. Полученную суспензию смешивали в соотношении 1:1 с раствором 2 мг/мл полистиролсульфоната с молекулярной массой 70 кДа и перемешивали 10 мин (300 об/мин). Осадок сепарировали с использованием ультрафильтрации и дважды промывали раствором 0,15 М NaCl с рН 4,0. К осадку последовательно прибавляли по одному объему растворов полиэлектролитов в 0,15 М NaCl с рН 4,0, инкубировали 10 мин и дважды промывали растворами без полиэлектролитов до достижения пяти стадий сорбции полиэлектролитов. Полиэлектролитные микрочастицы с токоферолом имели средний размер 10±5 мкм.
1. DE 19902553 A1, 22.02.1999. Polyelectrolythullen auf biologischen Templaten. B01J 13/02.
2. DE 10037707 A1, 2.08.2000. Polyelectrolytkapselnherstellung durch Oberflachenprazipitation. B01J 13/02.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗАГРУЖЕННЫХ БЕЛКОМ ПОЛИЭЛЕКТРОЛИТНЫХ НАНО- И МИКРОКАПСУЛ | 2007 |
|
RU2369386C2 |
| УЛЬТРАТОНКОЕ ПОЛИМЕРНОЕ ПОКРЫТИЕ, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И ФЕРМЕНТАТИВНЫЙ БИОСЕНСОР НА ЕГО ОСНОВЕ | 2006 |
|
RU2333231C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОСНОВНОГО ИНГИБИТОРА ПРОТЕИНАЗ ИЗ ОРГАНОВ КРУПНОГО РОГАТОГО СКОТА | 1993 |
|
RU2067868C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОСНОВНОГО ИНГИБИТОРА ПРОТЕИНАЗ ИЗ ОРГАНОВ КРУПНОГО РОГАТОГО СКОТА | 1996 |
|
RU2101291C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛИРОВАННОЙ ФОРМЫ ТЕРАПЕВТИЧЕСКОГО БЕЛКА СУПЕРОКСИДДИСМУТАЗЫ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ | 2015 |
|
RU2583923C1 |
| Способ получения полиэлектролитных микрокапсул | 2017 |
|
RU2641034C1 |
| МИКРОДИАГНОСТИКУМ И СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА | 2006 |
|
RU2316769C1 |
| ТОНКОПЛЕНОЧНЫЙ МАТЕРИАЛ, СОДЕРЖАЩИЙ ФУНКЦИОНАЛЬНЫЕ КОМПОНЕНТЫ, И СПОСОБ ПОЛУЧЕНИЯ ТОНКОПЛЕНОЧНОГО МАТЕРИАЛА, СОДЕРЖАЩЕГО ФУНКЦИОНАЛЬНЫЕ КОМПОНЕНТЫ | 2006 |
|
RU2326898C1 |
| АНТИГЕННЫЕ КОМПОЗИЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА И СПОСОБЫ | 2011 |
|
RU2609661C2 |
| ПЛАНАРНЫЙ ТВЕРДОФАЗНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОПРЕДЕЛЕНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ МЕТОДОМ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДЕТЕКТИРОВАНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ | 2016 |
|
RU2659987C2 |
Изобретение относится к области фармации, медицины, биохимии и биотехнологии, а именно к способу получения полиэлектролитных микрочастиц, содержащих целевое вещество и чувствительных к изменению состава окружающей среды. Изобретение заключается в том, что получают полиэлектролитные микрочастицы путем послойной адсорбции противоположно заряженных полиэлектролитов на микроагрегатах, содержащих инкапсулирумое вещество. Данные полиэлектролитные микрочастицы могут быть использованы как в медицине в качестве систем доставки лекарственных средств, обеспечивающих рН-чувствительное высвобождение инкапсулируемого вещества, так и в биотехнологии в качестве биокатализаторов, стабилизированных по отношению к неблагоприятным условиям. Изобретение обеспечивает получение полиэлектролитных микрочастиц, характеризующихся высоким содержанием активного вещества до 90% от массы микрочастиц. Предложенный способ более простой и менее многостадийный. 3 н. и 6 з.п. ф-лы, 2 ил., 3 табл.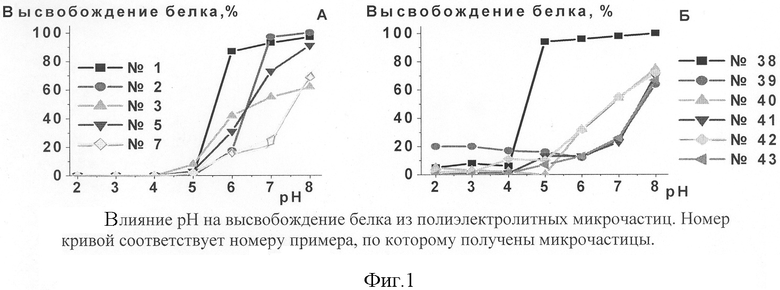
| DE 10037707 A, 14.02.2002 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМ | 1999 |
|
RU2216315C2 |
| ПРОМЫШЛЕННЫЙ СПОСОБ ФОРМИРОВАНИЯ МИКРОЧАСТИЦ (ВАРИАНТЫ) И МИКРОЧАСТИЦЫ, ПОЛУЧЕННЫЕ ЭТИМ СПОСОБОМ (ВАРИАНТЫ) | 1996 |
|
RU2159148C2 |
| МИКРОЧАСТИЦЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2201214C2 |
| ВЫСУШЕННЫЕ РАСПЫЛЕНИЕМ МИКРОЧАСТИЦЫ КАК ТЕРАПЕВТИЧЕСКИЕ НОСИТЕЛИ | 1995 |
|
RU2147226C1 |
Авторы
Даты
2007-06-10—Публикация
2005-12-27—Подача