Настоящее изобретение относится к новым производным оксазола, их получению и применению в качестве лекарственных средств. В частности, настоящее изобретение относится к соединениям формулы (I)
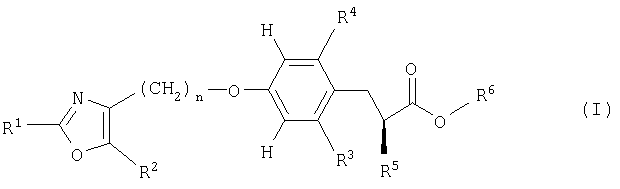
в которой R1 представляет собой арил или гетероарил;
R2 представляет собой водород, низший алкил или фтор-(низший алкил);
R3 и R4 независимо друг от друга представляют собой водород, гидрокси, галоген, низший алкил, фтор-(низший алкил), гидрокси-(низший алкил), низший алкокси-(низший алкил), низший алкокси, фтор-(низший алкокси), гидрокси-(низший алкокси), (низший алкокси)-(низший алкокси) или низший алкенил,
где по меньшей мере один из радикалов R3 и R4 не представляет собой водород;
R5 представляет собой низший алкокси, фтор-(низший алкокси), низший алкенилокси, фтор-(низший алкенилокси), арилокси, арил-(низший алкокси) или арил-фтор-(низший алкокси);
R6 представляет собой водород или низший алкил;
n означает 1, 2 или 3;
и их фармацевтически приемлемым солям и/или фармацевтически приемлемым сложным эфирам.
Рецепторы, активированные пролифератором пероксисомы (PPAR - сокр. от англ. Peroxisome Proliferator Activated Receptors), являются членами суперсемейства ядерных гормональных рецепторов, которые представляют собой лиганд-активированные факторы транскрипции, регулирующие экспрессию генов. Различные подтипы этих рецепторов идентифицированы и клонированы. Они включают PPARα, PPARβ, также известный как PPARδ и PPARγ. Существует по меньшей мере две основные изоформы PPARγ. Хотя PPARγ1 экспрессируется во многих тканях, изоформу PPARγ2 наибольшей длины обнаруживают почти исключительно в адипоцитах. В противоположность этому PPARα преимущественно экспрессируется в печени, почках и сердце. Рецепторы вида PPAR модулируют множество реакций организма, включая гомеостаз глюкозы и гомеостаз липидов, дифференцировку клеток, воспалительные реакции и кардиоваскулярные проявления.
Диабет представляет собой заболевание, при котором у пациента снижена способность контролировать содержание глюкозы в крови, поскольку у такого пациента частично потеряна способность должным образом реагировать на воздействие инсулина. При диабете типа II (T2D), который часто называют инсулиннезависимым сахарным диабетом (NIDDM) и от которого страдают 80-90% от общего числа больных диабетом в развитых странах, островки Лангерганса в поджелудочной железе еще продуцируют инсулин. Однако в органах-мишенях, главным образом в мышцах печени и жировой ткани, проявляется значительная резистентность к стимуляции инсулином, и организм компенсирует это продуцированием повышенного количества инсулина, что не соответствует физиологическим нормам. Однако на поздних стадиях заболевания секреция инсулина снижается вследствие истощения поджелудочной железы. В дополнение к этому диабет типа II (T2D) характеризуется синдромом метаболического сердечно-сосудистого заболевания. К числу заболеваний, сопутствующих диабету типа II, относятся, например, резистентность к инсулину, дислипидемия, гипертензия (повышенное давление крови), эндотелиальная дисфункция и воспалительный атеросклероз.
Согласно современным представлением первоначальная стадия лечения диабета включает, как правило, диету с низким содержанием жиров и глюкозы, а также физические упражнения. Однако иногда успех лечения может быть умеренным, и поскольку заболевание прогрессирует, становится необходимым лечение с использованием лекарственных средств, например, таких как сульфонилмочевины и метформин. Недавно представлен новый перспективный класс лекарственных средств, которые возвращают пациенту чувствительность (восприимчивость) к собственному инсулину (сенсибилизаторы инсулина), при этом содержание глюкозы в крови и содержание триглицеридов в крови возвращаются к нормальному, и таким образом исключается или по меньшей мере снижается необходимость в экзогенном инсулине. Пиоглитазон (pioglitazone, Actos™) и росиглитазон (rosiglitazone, Avandia™) относятся к классу тиазолидиндионов (TZD), являющихся PPARγ-агонистами и являются первыми соединениями этого класса, которые были опробованы в некоторых странах для лечения инсулиннезависимого сахарного диабета. Однако этим соединениям присущи нежелательные побочные эффекты, включая нечасто встречающееся, но сильное токсическое действие на печень (как наблюдалось в случае троглитазона) и эти соединения в случае приема человеком приводят к повышению массы тела. Вследствие этого имеется острая потребность в более совершенных и более эффективных лекарственных средствах для лечения инсулиннезависимого сахарного диабета. Согласно данным проведенных в последние годы исследований совместное агонистическое действие в отношении PPARα и PPARγ позволяет соединениям проявлять повышенный терапевтический потенциал, то есть такие соединения будут способствовать улучшению липидного профиля в дополнение к нормализации содержания глюкозы и инсулина (Keller и Wahli: Trends Endocrin. Metab. 1993; 4:291-296, Macdonald and Lane: Current Biology Vol.5 pp.618-621 (1995)). Кроме того, на основании недавних исследований высказано предположение о том, что независимое воздействие на сенсибилизацию к инсулину, медиатором которого является PPARα, может привести к вторичному эффекту - снижению содержания липидов (Guerre-Millo et al; J Biol Chem 2000; 275: 16638-16642). Следовательно, можно ожидать, что придание PPARγ-агонистам PPARα-активности приведет к получению более эффективных лекарственных средств, предназначенных для лечения и/или профилактики диабета.
Новые соединения согласно настоящему изобретению превосходят соединения, известные из предшествующего уровня техники, поскольку они связываются и активируют как PPARα, так и PPARγ, одновременно и очень эффективно. Таким образом, в этих соединениях сочетается антигликемический эффект активации PPARγ с анти-дислипидемическим эффектом активации PPARα. Следовательно, снижаются содержание глюкозы и инсулина в плазме (=активизация инсулина), снижается содержание триглицеридов и повышается содержание α-липопротеинов высокой плотности (ЛВП) холестерина (=улучшение липидного профиля). В дополнение такие соединения также могут понижать величину ЛНП (липопротеины низкой плотности) холестерина, понижать давление крови и противодействовать воспалительному атеросклерозу. Поскольку многие аспекты совокупности симптомов заболевания инсулиннезависимым диабетом имеют отношение к PPARα и γ соагонистам, такие соединения, как предполагается, будут обладать более высоким терапевтическим потенциалом по сравнению с соединениями, уже известными из предшествующего уровня техники.
Соединения согласно настоящему изобретению, кроме того, обладают более выраженными фармакологическими свойствами по сравнению с известными соединениями.
Если не указано иное, то для иллюстрации и установления значения и объема различных терминов, приведенных в тексте настоящей заявки, используются приведенные ниже формулировки.
В описании настоящей заявки термин "низший" используют для обозначения группы, состоящей от из от одного до семи, предпочтительно от одного до четырех, атомов углерода.
Термин "галоген" относится к фтору, хлору, брому и иоду.
Термин "защитная группа" относится к таким группам, как, например, ацил, алкоксикарбонил, арилоксикарбонил, силил, или производные имина, которые используют для того, чтобы временно блокировать реакционную способность функциональных групп. Хорошо известны такие защитные группы, как, например, трет-бутилоксикарбонильная, бензилоксикарбонильная, флуоренилметилоксикарбонильная или дифенилметиленовая, которые могут быть использованы для защиты аминогрупп, или низшие алкил-, -β-триметилсилилэтил- и β-трихлорэтиловые сложноэфирные групп, которые могут быть использованы для защиты карбоксигрупп.
Термин "алкил", отдельно или в сочетании с другими группами, относится к моновалентному насыщенному алифатическому углеводородному радикалу с линейной или разветвленной цепью, содержащему от одного до двадцати атомов углерода, предпочтительно от одного до шестнадцати атомов углерода, более предпочтительно от одного до десяти атомов углерода.
Термин "низший алкил", отдельно или в сочетании с другими группами, относится к моновалентному алкильному радикалу с линейной или разветвленной цепью, содержащему от одного до семи атомов углерода, предпочтительно от одного до четырех атомов углерода. Значение этого термина дополнительно может быть проиллюстрировано указанием таких радикалов как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и подобными им.
Термин "фтор-(низший алкил)" относится к низшей алкильной группе, которая моно- или множественно замещена фтором. Примерами групп фтор-(низший алкил) являются, например, CF3, CF3СН2 и (CF3)2СН.
Термин "алкокси" относится к группе R'-O-, в которой R' представляет собой алкил. Термин "низший алкокси" относится к группе R'-O-, в которой R' представляет собой низший алкил. Примерами низших алкоксигрупп являются, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и гексилокси.
Термин "фтор-(низший алкокси)" относится к группе R"-O-, в которой R" представляет собой фтор-(низший алкил). Примерами групп фтор-(низший алкокси) являются, например, CF3-О, CF3СН2-О и (CF3)2СН-O.
Термин "низший алкенил", отдельно или в комбинации, означает углеводородный остаток с линейной или разветвленной цепью, включающий олефиновую связь и вплоть до 8, предпочтительно до 6, наиболее предпочтительно до 4 атомов углерода. Примерами алкенильных групп являются этенил, 1-пропенил, 2-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил и изобутенил. Предпочтительным примером является 2-пропенил.
Термин "низший алкенилокси" означает группу R"-O-, в которой R" представляет собой низший алкенил. Примером группы «низший алкенилокси» является бутенилокси, в частности бут-3-енилокси.
Термин "фтор-(низший алкенилокси)" относится к группам «низший алкенилокси», как определено выше, которые являются моно- или множественно замещенными фтором. Примерами групп фтор-(низший алкенилокси) являются, например (Z)- или (Е)-4,4,4-трифтор-бут-2-ен-1-ил.
Термин "арил" относится к фенильной или нафтильной группе, предпочтительно к фенильной группе, которая может быть моно- или множественно замещенной, в частности моно-, ди- или тризамещенной, галогеном, гидрокси, группой CN, группой CF3, группой NO2, группой NH2, группой N(H, низший алкил), группой N(низший алкил)2, карбокси, аминокарбонилом, низшим алкилом, группой фтор-(низший алкил), низшим алкокси, фенилом и/или группой фенилокси. Предпочтительными заместителями являются галоген, низший алкил, фтор-(низший алкил) и/или низший алкокси.
Термин "гетероарил" относится к ароматической 5- или 6-членной кольцевой системе, которая может включать 1, 2 или 3 атома, выбранных из азота, кислорода и/или серы, такие как фурил, пиридил, 1,2-, 1,3- и 1,4-диазинил, тиенил, изоксазолил, оксазолил, имидазолил или пирролил. Термин "гетероарил" дополнительно относится к бициклическим ароматическим группам, включающим два 5- или 6-членных кольца, где одно или более кольцо может включать 1, 2 или 3 атома, выбранных из азота, кислорода или серы, например, таким как индол или хинолин, или к частично гидрированным бициклическим ароматическим группам, например, таким как индолинил. Гетероарильная группа может быть замещенной таким образом, как описано выше в отношении термина «арил». Предпочтительные гетероарильные группы представляют собой, например, тиенил и фурил, которые необязательно могут быть замещены таким образом, как описано выше, предпочтительно галогеном, группой CF3, низшим алкилом и/или низшим алкокси.
Термин "фармацевтически приемлемые соли" означает соли соединения формулы (I), образованные с фармацевтически приемлемыми основаниями, такие как соли щелочных металлов, например Na- и К-соли, соли щелочноземельных металлов, например Са- и Mg-соли, и соли аммония или соли замещенного аммония, например, такие как соли триметиламмония.
Соединения формулы (I) также могут быть сольватированными, например, гидратированными. Сольватирование может быть осуществлено в процессе получения или иметь место, например, вследствие гигроскопичности первоначально безводного соединения формулы (I) (гидратация). Термин «фармацевтически приемлемые соли» также включает фармацевтически приемлемые сольваты.
Термин "фармацевтически приемлемые сложные эфиры" включает производные соединения формулы (I), в которых карбоксигруппа превращена в сложноэфирную. Низший алкил, гидрокси-(низший алкил), (низший алкокси)-(низший алкил), амино-(низший алкил), моно- или ди-(низший алкил)-амино-(низший алкил), морфолино-(низший алкил), пирролидино-(низший алкил), пиперидино-(низший алкил), пиперазино-(низший алкил), низший алкилпиперазино-(низший алкил) и аралкиловые сложные эфиры являются примерами подходящих сложных эфиров. Метиловые, этиловые, пропиловые, бутиловые и бензиловые сложные эфиры являются предпочтительными сложными эфирами. Метиловые и этиловые сложные эфиры являются особенно предпочтительными. Термин "фармацевтически приемлемые сложные эфиры" дополнительно относится к соединениям формулы (I), в которых гидроксигруппы превращены в соответствующие сложноэфирные группы взаимодействием с неорганическими или органическими кислотами, такими как азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, янтарная кислота, виннокаменная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота и подобными кислотами, которые нетоксичны по отношению к живым организмам.
Более конкретно, настоящее изобретение относится к соединениям формулы (I)

в которой R1 представляет собой арил или гетероарил;
R2 представляет собой водород, низший алкил, или фтор-(низший алкил);
R3 и R4 независимо друг от друга представляют собой водород, гидрокси, галоген, низший алкил, фтор-(низший алкил), гидрокси-(низший алкил), (низший алкокси)-(низший алкил), низший алкокси, фтор-(низший алкокси), гидрокси-(низший алкокси), (низший алкокси)-(низший алкокси) или низший алкенил,
где по меньшей мере один из радикалов R3 и R4 не означает водород;
R5 представляет собой низший алкокси, фтор-(низший алкокси), низший алкенилокси, фтор-(низший алкенилокси), арилокси, арил-(низший алкокси) или арил-фтор-(низший алкокси);
R6 представляет собой водород или низший алкил;
n означает 1, 2 или 3,
и к их фармацевтически приемлемым солям и/или фармацевтически приемлемым сложным эфирам.
Предпочтительными являются соединения формулы (I)

в которой R1 представляет собой арил или гетероарил;
R2 представляет собой водород, низший алкил, или фтор-(низший алкил);
R3 и R4 независимо друг от друга представляют собой водород, гидрокси, галоген, низший алкил, фтор-(низший алкил), гидрокси-(низший алкил), (низший алкокси)-(низший алкил), низший алкокси, фтор-(низший алкокси), гидрокси-(низший алкокси), (низший алкокси)-(низший алкокси) или низший алкенил,
где по меньшей мере один из радикалов R3 и R4 не представляет собой водород;
R5 представляет собой низший алкокси, фтор-(низший алкокси), низший алкенилокси, фтор-(низший алкенилокси), арилокси, арил-(низший алкокси) или арил-фтор-(низший алкокси);
R6 представляет собой водород или низший алкил;
n означает 1,
и их фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры.
Соединения формулы (I), как описано выше, включают асимметрический атом углерода, который является соседним по отношению к радикалу R5. Атом углерода, к которому присоединен R5, находится в S-конфигурации в соответствии с системой Кана-Ингольда-Прелога.
Соединения формулы (I), приведенной выше, в которой R1 означает арил, являются предпочтительными. Соединения, в которых R1 означает фенил, необязательно замещенный заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из низшего алкила, низшего алкокси, галогена и радикала фтор-(низший алкил), также являются предпочтительными, причем такие соединения, в которых R1 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из низшего алкила, низшего алкокси и галогена, являются более предпочтительными, а соединения, в которых R1 представляет собой фенил, 2-метилфенил, 4-изопропоксифенил, 4-фтор-3-метилфенил, 2-фторфенил, 4-изопропилфенил, 2-этокси-4-фторфенил, 3-метоксифенил или 4-трет-бутилфенил, являются особенно предпочтительными. Соединения, в которых R1 представляет собой фенил, замещенный метилом и/или фтором, являются предпочтительными, в особенности 2-метилфенил или 2-фторфенил.
Кроме того, предпочтительными являются соединения, как определено выше, в которых R2 представляет собой водород или низший алкил, причем водород или метил являются особенно предпочтительными. Водород и метил по отдельности составляют отдельные предпочтительные варианты осуществления настоящего изобретения. Соединения, в которых R2 представляет собой низший алкил, предпочтительно метил, также предпочтительны.
Соединения формулы (I), в которой R3 и R4 независимо друг от друга представляют собой водород, гидрокси, галоген, низший алкил, фтор-(низший алкил) или низший алкокси, где по меньшей мере один из радикалов R3 и R4 не означает водород, также относятся к предпочтительным вариантам осуществления настоящего изобретения. Соединения, в которых R3 представляет собой водород или метил, также являются предпочтительными. Заместители водород и метил по отдельности относятся к предпочтительным вариантам осуществления настоящего изобретения. Соединения, как определено выше, в которых R4 представляет собой метил, этил, фтор, хлор, трифторметил, гидрокси, метокси, этокси или изопропокси, являются особенно предпочтительными. Предпочтительно R3 представляет собой водород и R4 представляет собой низший алкил, в частности метил.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы (I), как определено выше, в которой R5 представляет собой низший алкокси, более предпочтительно метокси или этокси, более предпочтительно этокси. Другие предпочтительные соединения представляют собой такие соединения, где R6 означает водород.
Предпочтительные соединения представляют собой такие соединения, в которых R1 означает фенил, замещенный метилом и/или фтором, R2 представляет собой низший алкил, R3 представляет собой водород, R4 представляет собой низший алкил, R5 представляет собой низший алкокси и R6 представляет собой водород. Более предпочтительные соединения представляют собой такие соединения, в которых R1 означает 2-метилфенил или 2-фторфенил, R2 означает метил, R3 означает водород, R4 означает метил, R5 означает этокси и R6 означает водород.
Соединения формулы (I), в которой n означает 1, 2 или 3, по отдельности относятся к предпочтительным вариантам осуществления настоящего изобретения.
Фармацевтически приемлемые соли соединения формулы (I) и фармацевтически приемлемые сложные эфиры соединения формулы (I), в отдельности, относятся к предпочтительным вариантам осуществления настоящего изобретения. Особенно предпочтительны соединения формулы (I).
Предпочтительными соединениями общей формулы (I) являются соединения, выбранные из группы, включающей следующие соединения:
(S)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-3-{4-[2-(3,5-диметоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-3-(4-{2-[2-(4-хлорфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)-2-этоксипропионовая кислота,
(S)-2-этокси-3-[2-этил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-{2-этил-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-[2-этил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{2-этил-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{2-фтор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-3-[2-хлор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(2-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-трифторметилфенил}пропионовая кислота,
(S)-3-{2-гидрокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-2-метоксипропионовая кислота,
(S)-2-этокси-3-[2-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота,
(S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}-2-этоксипропионовая кислота,
(S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота,
(S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота,
(S)-3-{4-[2-(3,5-дихлорфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота,
(S)-3-{4-[2-(3,5-диметилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-{2-метил-4-[5-метил-2-(2-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-{2-метил-4-[5-метил-2-(3-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{2-метил-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{2-метил-4-[5-метил-2-(3,4,5-триметоксифенил)оксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-(4-{2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)пропионовая кислота,
(S)-2-этокси-3-{2-метил-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовая кислота,
(S)-2-этокси-3-[2-метил-4-(2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-3-{4-[2-(2-хлорфенил)оксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-{2-этокси-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-{2-этокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовая кислота,
(S)-2-этокси-3-{2-этокси-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовая кислота,
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-изопропоксифенил}-2-этоксипропионовая кислота и
(S)-2-этокси-3-[2-фтор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота
и их фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры.
Наиболее предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, включающей следующие соединения:
(S)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовая кислота,
(S)-3-{2-гидрокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-2-метоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота,
(S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота,
(S)-2-этокси-3-(4-{2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)пропионовая кислота,
(S)-2-этокси-3-{2-метил-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовая кислота и
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-изопропоксифенил}-2-этоксипропионовая кислота,
и их фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры.
Другие, особенно предпочтительные соединения формулы (I), представляют собой соединения, выбранные из группы, включающей следующие соединения:
(S)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота,
(S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовая кислота,
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-изопропоксифенил}-2-этоксипропионовая кислота
и их фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры.
Каждое из указанных выше соединений в отдельности представляет собой предпочтительный вариант осуществления настоящего изобретения, в частности, предпочтительным вариантом осуществления настоящего изобретения являются (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота и ее фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры. Другим примером предпочтительного индивидуального соединения является (S)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота и ее фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры. Соединения, такие как описано выше, которые не представляют собой фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры, являются предпочтительными.
Соединения формулы (I), в которых имеется один или более асимметрических атомов углерода, могут существовать в виде оптически чистых энантиомеров, оптически чистых диастереоизомеров или смесей диастереоизомеров. Оптически активные формы могут быть получены, например, посредством разделения рацематов, асимметрическим синтезом или посредством асимметрической хроматографии (хроматография с использованием хиральных адсорбентов или элюентов). В объем изобретения входят все формы, в которых асимметрический атом углерода, к которому присоединен R5, находится в S-конфигурации.
Необходимо отметить, что все соединения общей формулы (I) в соответствии с настоящим изобретением могут быть превращены в соответствующие производные по функциональной группе, такое превращение позволяет осуществить in vivo обратное превращение с получением при этом исходного соединения. Физиологически приемлемые и метаболически изменяющиеся производные, которые способны к продуцированию in vivo исходных соединений общей формулы (I), также входят в объем настоящего изобретения.
Другой аспект настоящего изобретения относится к способу получения соединения формулы (I), как определено выше, указанный способ включает удаление защитной группы соединения формулы (II)
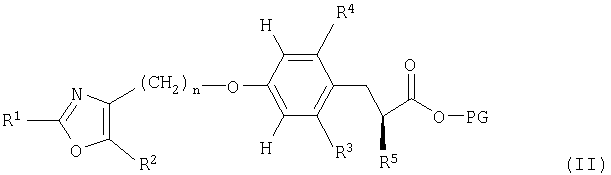
в которой R1, R2, R3, R4, R5 и n являются такими, как определено выше, a PG означает защитную группу.
Возможные защитные группы PG, входящие в соединение формулы (II), представляют собой, например, низший алкил-, β-триметилсилилэтил- и β-трихлорэтиловые сложноэфирные группы, которые могут быть использованы для защиты соответствующей карбоксигруппы. Группы низших алкиловых сложных эфиров могут быть удалены в присутствии основания, например, такого как LiOH или NaOH, в среде растворителя, например, такого как Н2О, этанол, тетрагидрофуран или диоксан, или в смеси таких растворителей, например, в интервале температур 10-50°С. β-Трихлорэтиловая сложноэфирная защитная группа может быть удалена в присутствии Zn в уксусной кислоте, например, в интервале температур 10-50°С. β-Триметилсилилэтиловая сложноэфирная защитная группа могут быть удалена в присутствии тетрабутиламмонийфторида в тетрагидрофуране, например, в интервале температур 20-65°С. Способы превращения соединения формулы (I), как определено выше, в фармацевтически приемлемую соль известны из предшествующего уровня техники.
Кроме того, настоящее изобретение относится к соединениям формулы (I), как определено выше, которые получают способом, определенным выше.
Как описано выше, соединения формулы (I) согласно настоящему изобретению могут быть использованы в качестве лекарственных средств для лечения и/или профилактики заболеваний, модуляторами при которых являются антагонисты PPARα и/или PPARβ. Примерами таких заболеваний служат диабет, в частности инсулиннезависимый сахарный диабет, повышенное давление крови (гипертония), повышенное содержание липидов и холестерина, атеросклеротические заболевания, метаболический синдром, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистоза яичников, воспалительные заболевания, например, такие как болезнь Крона (гранулематозная болезнь, «crown disease»), воспалительное заболевание кишечника, колит, панкреатит, застой желчи (холестаз)/фиброз печени и заболевания, которые имеют воспалительный компонент, например, такие как болезнь Альцгеймера или ослабленная/поддающаяся улучшению когнитивная функция) и пролиферативные заболевания (различные виды рака, например липосаркома, рак ободочной и толстой кишки, рак предстательной железы, рак поджелудочной железы и рак молочной железы). Предпочтительным является применение в качестве лекарственного средства для лечения и/или профилактики инсулиннезависимого сахарного диабета.
Настоящее изобретение также относится к фармацевтическим композициям, включающим соединение, как определено выше, и фармацевтически приемлемый носитель и/или фармацевтически приемлемое вспомогательное вещество.
Дополнительно настоящее изобретение относится к соединениям, как определено выше, для применения в качестве терапевтически активных соединений, в частности в качестве терапевтически активных соединений для лечения и/или профилактики заболеваний, которые модулируются агонистами в отношении PPARα и/или PPARγ. Примерами таких заболеваний являются диабет, в частности инсулиннезависимый сахарный диабет, повышенное давление крови (гипертония), повышенное содержание липидов и холестерина, атеросклеротические заболевания, метаболический синдром, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистоза яичников, воспалительные заболевания и пролиферативные заболевания, предпочтительно инсулиннезависимый сахарный диабет.
В соответствии с другим вариантом осуществления настоящее изобретение относится к способу лечения и/или профилактики заболеваний, которые модулируются агонистами в отношении PPARα и/или PPARγ, указанный способ включает введение соединения формулы (I) человеку или животному. Предпочтительными примерами таких заболеваний являются диабет, в частности инсулиннезависимый сахарный диабет, повышенное давление крови (гипертония), повышенное содержание липидов и холестерина, атеросклеротические заболевания, метаболический синдром, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистоза яичников, воспалительные заболевания и пролиферативные заболевания, предпочтительно, для лечения и/или профилактики инсулиннезависимого сахарного диабета.
Настоящее изобретение также относится к применению соединений, как определено выше, для лечения и/или профилактики заболеваний, которые модулируются агонистами в отношении PPARα и/или PPARγ. Предпочтительными примерами таких заболеваний являются диабет, в частности инсулиннезависимый сахарный диабет, повышенное давление крови (гипертония), повышенное содержание липидов и холестерина, атеросклеротические заболевания, метаболический синдром, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистоза яичников, воспалительные заболевания и пролиферативные заболевания, предпочтительно, инсулиннезависимый сахарный диабет.
В дополнение, настоящее изобретение относится к применению соединений, которые определены выше, для получения лекарственных средств для лечения и/или профилактики заболеваний, которые модулируются агонистами в отношении PPARα и/или PPARγ. Предпочтительными примерами таких заболеваний являются диабет, в частности инсулиннезависимый сахарный диабет, повышенное давление крови (гипертония), повышенное содержание липидов и холестерина, атеросклеротические заболевания, метаболический синдром, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистоза яичников, воспалительные заболевания и пролиферативные заболевания, предпочтительно инсулиннезависимый сахарный диабет. Такие лекарственные средства включают соединение, как это определено выше.
Соединения формулы (I) могут быть получены способами, приведенными ниже, способами, указанными в примерах или аналогичными способами. Соответствующие условия проведения отдельных стадий реакции известны специалисту в данной области техники. Исходные вещества являются либо коммерчески доступными, либо могут быть получены с использованием методов, аналогичных приведенным ниже, с использованием методов, описанных в цитированной литературе, или с использованием методов, известных из предшествующего уровня техники.
Гомохиральные соединения формулы (I) (соединения 10 и 11 на схеме 1 и соединения 6 и 7 на схеме 3) могут быть получены в соответствии с методами, которые показаны на схемах 1 и 3, или с использованием аналогичных методов.
Рацематы соединений формулы (I) [соединения 9 и соединения 10 на схеме 2 и соединения 9 и 11 на схеме 4] могут быть, например, синтезированы согласно методам, показанным на схемах 2 или 4 или с использованием аналогичных методов. Оптически чистый (S)-энантиомер может быть затем получен из рацематов соединений формулы (I) с использованием методов, известных из предшествующего уровня техники, таких как разделение оптических антиподов через диастереомерные соли посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами с использованием либо хиральных адсорбентов, либо хирального элюента.
Схема 1
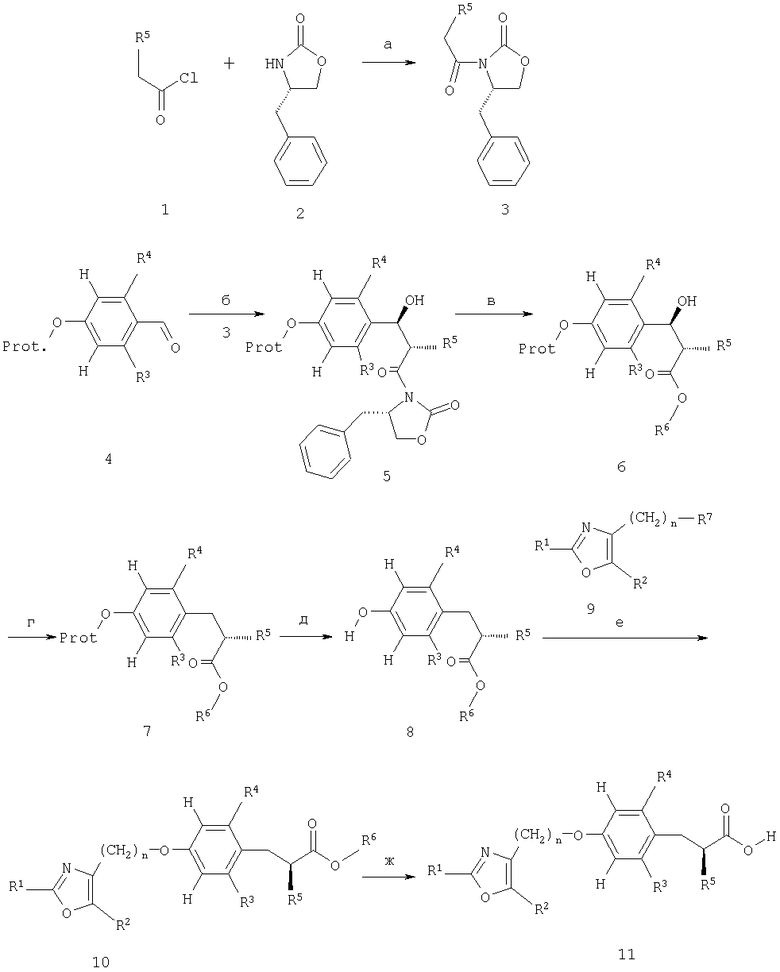
Гомохиральные сложные эфиры альфа-алкоксифенилпропионовой кислоты формулы 10 и свободные кислоты формулы 11 могут быть получены способом, показанным на схеме 1, или с использованием способов, аналогичных способам, известным из предшествующего уровня техники.
Хорошо известное хиральное вспомогательное соединение 2, представляющее собой [(S)-4-бензилоксазолидин-2-он], подвергают конденсации с алкоксиацетилхлоридом 1 в присутствии сильного основания, например, такого как н-бутиллитий, в инертном растворителе, таком как тетрагидрофуран, при температуре приблизительно -78°С с получением при этом функционального блока 3 (стадия а). Последний затем обрабатывают таким образом, как описано в литературе [Tetrahedron Asymmetry (1999), 10, 1353-1367] трифлатом дибутилбора и третичным амином, таким как триэтиламин в дихлорметане, с получением при этом соответствующего енолята бора, который затем взаимодействует при низкой температуре с альдегидами 4 (полученными, как показано на схеме 5) с образованием при этом соединений 5 (стадия б). В таких альдольных продуктах 5 один из четырех возможных стереоизомеров значительно преобладает (стереохимия показана без строгих доказательств положения бензила). Соединения 5 превращают в фенольные промежуточные соединения 8 посредством трехстадийного процесса, включающего i) осторожное контролируемое получение сложного эфира с использованием только минимального избытка алкоголята в соответствующем спирте в качестве растворителя или в таких растворителях, как тетрагидрофуран или диоксан, при температуре, варьирующейся в интервале от -20°С до комнатной температуры, с получением при этом сложноэфирных производных 6 (стадия в); ii) удаление бензильной гидроксигруппы соединения 6 с использованием восстанавливающего агента, например, такого как триэтилсилан в присутствии кислоты Льюиса, трифторида бора, или с использованием протоносодержащей кислоты, такой как трифторуксусная кислота, в подходящем растворителе, таком как сама трифторуксусная кислота или дихлорметан, при температуре от 0 до 60°С с получением при этом защищенного фенольного производного 7 (стадия г); iii) последующее удаление защитной группы, например бензильной группы, по общепринятой методике, например посредством каталитического гидрирования с использованием водорода и катализатора, такого как палладий, или с использованием диметилсульфида и диэтилэфирата трифторида бора в среде растворителя, такого как дихлорметан, при температуре от комнатной температуры до температуры образования флегмы, растворителем с получением при этом фенольных производных 8 (стадия д); порядок проведения трех стадий реакции (в), (г), (д) является взаимозаменяемым, и каталитическое гидрирование также может быть использовано для одновременного удаления функциональной бензильной гидроксигруппы и бензильной защитной группы предпочтительно с использованием палладия на углероде в качестве катализатора в присутствии кислоты, например, такой как щавелевая кислота, в среде растворителя, такого как спирты, при температуре приблизительно равной комнатной температуре и при давлении водорода вплоть до 100 бар.
Арилоксазольные производные 9 (полученные таким образом, как показано на схемах 6 и 7) подвергают конденсации с фенолами 8 в соответствии с известными методиками: в том случае, когда R7 представляет собой гидроксигруппу, например, по реакции Мицунобу (Mitsunobu), с использованием в качестве реагентов трифенилфосфина и ди-трет-бутил-, диизопропил- или диэтилазодикарбоксилата; это превращение предпочтительно проводят в среде растворителя, например, такого как толуол, дихлорметан или тетрагидрофуран, при температуре окружающей среды. В качестве альтернативы, в том случае, когда R7 представляет собой галогенидный, мезилатный или тозилатный фрагмент, арилоксазольные производные 9 могут быть подвергнуты взаимодействию с фенолами 8 в среде растворителей, например, таких как N,N-диметилформамид, ацетонитрил, ацетон или метилэтилкетон, в присутствии слабого основания, например, такого как карбонат калия или цезия, при температуре, варьирующейся от комнатной температуры до 140°С, предпочтительно приблизительно при 50°С, с получением при этом соединений - производных простого эфира 10 (стадия е). Эти соединения могут быть необязательно подвергнуты гидролизу в соответствии со стандартными методиками, например, посредством обработки гидроксидом щелочного металла, например, таким как LiOH или NaOH, в смеси полярных растворителей, например, такой как смесь тетрагидрофуран/этанол/вода, с получением при этом карбоновых кислот 11 (стадия ж). Если тщательно контролировать условия реакции, как подробно описано в экспериментальной части, то при такой последовательности реакций вряд ли произойдет какая-либо рацемизация. Оптическая чистота соединений 10 и 11 может быть определена посредством хиральной ЖХВР или с использованием 1Н-ЯМР-спектроскопии в присутствии хирального растворителя, например, такого как 1-(9-антрил)-2,2,2-трифторэтанол, и как было установлено, во всех приведенных примерах оптическая чистота составляет более, чем 95%.
Схема 2
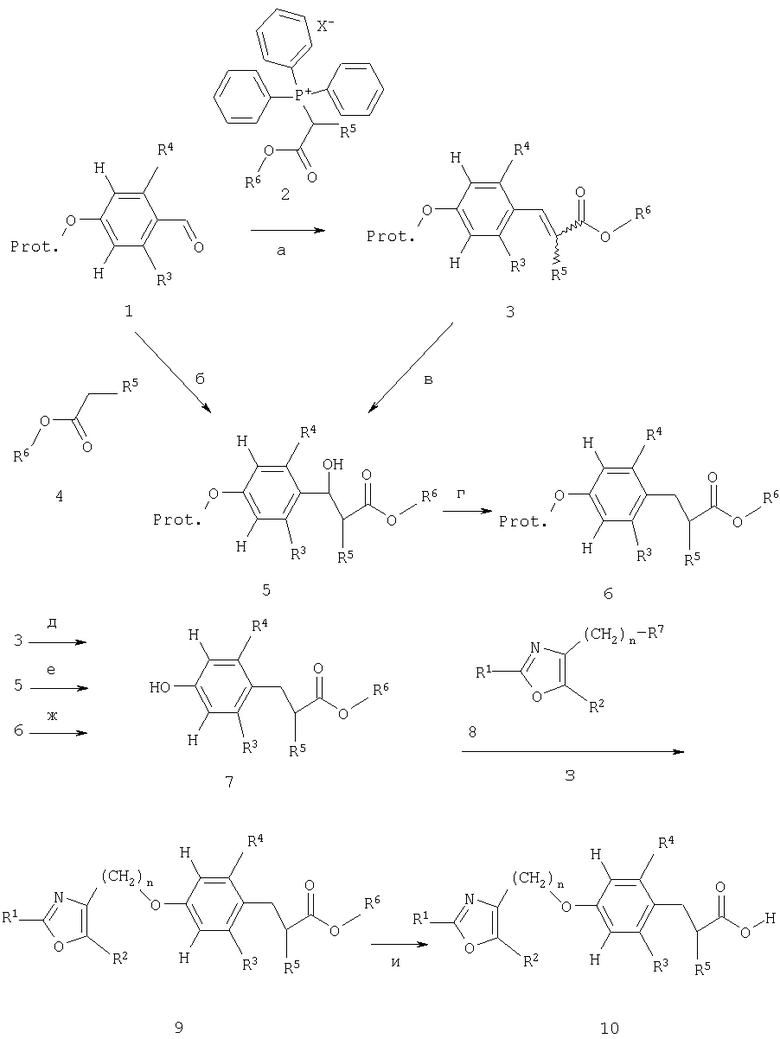
Альдегиды 1 (получены, как показано на схеме 5) могут вступать во взаимодействие с солью Виттига (Wittig) 2, например, такой как (1,2-диэтокси-2-оксоэтил)трифенилфосфонийхлорид или (1,2-диметокси-2-оксоэтил)трифенил-фосфонийбромид, в среде растворителя, например, такого как изопропанол, дихлорметан или тетрагидрофуран, или в смеси таких растворителей в присутствии основания, например, такого как карбонат калия, 1,8-диазабицикло[5,4,0]ундец-7-ен (ДБУ) или 1,1,3,3-тетраметилгуанидин, предпочтительно при температуре от 0°С до температуры образования флегмы растворителем, с образованием при этом сложных акриловых эфиров 3 в виде Е и/или Z изомеров (стадия а). Гидрирование акриловых сложных эфиров 3 с использованием в качестве катализатора палладия на углероде предпочтительно при комнатной температуре и давлении водорода, составляющем 1 атм, в среде растворителя, например, такого как метанол, этанол, тетрагидрофуран, уксусная кислота, дихлорметан и их смеси, позволяет получить рацемические сложные эфиры 7, при условии, что защитная группа может быть удалена посредством восстановления (стадия д).
В качестве альтернативы, альдегиды 1 подвергают взаимодействию с енолятом сложных эфиров алкоксиуксусной кислоты 4 (предпочтителен литий-енолят, полученный при -78°С посредством обработки соединения 4 сильным, не нуклеофильным основанием, например, таким как диизопропиламид лития, в инертном растворителе, таком как тетрагидрофуран), предпочтительно при температуре приблизительно -78°С в среде растворителей, таких как тетрагидрофуран, с получением при этом альдольного продукта 5 в виде смеси диастереомеров (стадия б). Удаление бензильной группы таким образом, как описано выше, для превращения соединения 6 в соединение 7 на схеме 1, приводит к получению рацемических сложных эфиров 6 (стадия г); последующее удаление защитной группы, например бензильной группы, может быть затем осуществлено по общепринятой методике, как показано для превращения соединений 7 в соединения 8 на схеме 1, с получением при этом фенольных соединений 7 (стадия г). Каталитическое гидрирование также может быть использовано для одностадийного превращения гидроксисоединений 5 с защищенной бензильной группой в фенольные соединения 7 (стадия е), как показано для превращения соединений 6 в соединения 8 на схеме 1. Отщепление защитной группы также может быть осуществлено до удаления бензильной гидроксигруппы; в таком случае для удаления бензильной гидроксигруппы могут быть выбраны аналогичные условия реакции, как только что было описано для превращения соединений 5.
В качестве альтернативного способа соединения 5 могут быть обработаны каталитическим количеством кислоты, например, такой как пара-толуолсульфоновая кислота, в среде растворителя, такого как бензол или толуол, предпочтительно в условиях, позволяющих осуществлять удаление образующейся воды (например, с использованием ловушки Дина-Старка или в присутствии молекулярных сит) при температуре от комнатной температуры до температуры образования флегмы растворителем, с получением при этом сложных акриловых эфиров 3 (стадия в).
Превращение фенольных промежуточных соединений 7 в сложные эфиры 9 и/или кислоты 10 может быть осуществлено совершенно аналогично тому, что указано для гомохиральных фенольных промежуточных соединений 8 на схеме 1 (стадии з, и).
Схема 3
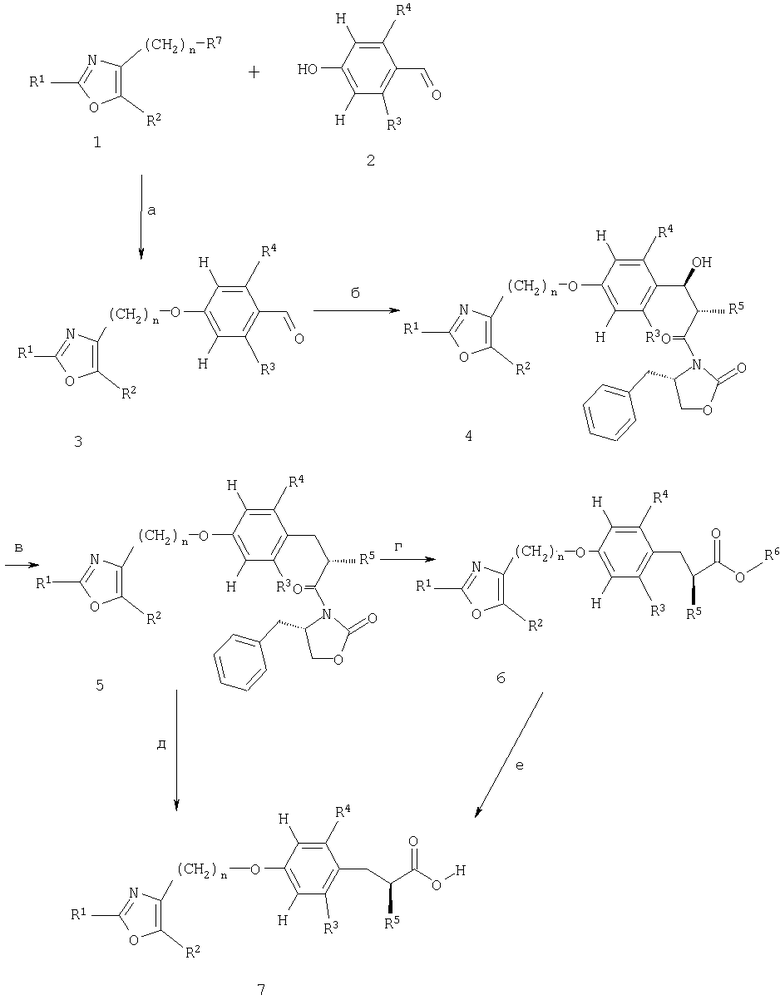
Гомохиральные сложные эфиры альфа-алкоксифенилпропионовой кислоты формулы 6 и свободные кислоты формулы 7 также могут быть получены в соответствии с линейной последовательностью реакций, приведенных на схеме 3. Таким образом, различные типы реакций, уже показанные на схеме 1, используют в различном порядке, начиная с конденсации арилоксазолсинтонов 1 (полученных, как показано на схемах 6 и 7) с фенолами 2 (получены как показано на схеме 5) с получением при этом производных простых эфиров 3, содержащих альдегидный фрагмент (стадия а). В том случае, когда R3 и/или R4 содержат функциональную группу, присутствие которой может быть несовместимым с последующими стадиями реакции, например, R3 и/или R4 может представлять собой фенольную ОН-группу, то тогда к такой функциональной группе следует присоединить защитную группу, например трет-бутилдиметилсилильный фрагмент. Такая защитная группа может быть удалена позднее на подходящей стадии процесса последовательно осуществляемых реакций.
Указанные производные простых эфиров 3 затем подвергают взаимодействию с хиральными синтонами (соединения 3 на схеме 1) с получением при этом альдольных аддуктов 4 (стадия б). После удаления функциональной бензильной гидроксигруппы в соединении 4 получают соединения 5 (стадия в), которые могут быть превращены в соответствующие сложные эфиры 6 (стадия г) или кислоты 7 (стадия д), как показано для аналогичных реакций, приведенных на схемах 1 и 2 соответственно.
Сложноэфирные производные 6 необязательно могут быть подвергнуты гидролизу до кислот 7 (стадия е). Оптическая чистота соединений 6 и 7 может быть определена хиральной ЖХВР или посредством 1Н-ЯМР-спектроскопии в присутствии хирального растворителя типа 1-(9-антрил)-2,2,2-трифторэтанола и, как было установлено, составляет более чем 95% во всех приведенных примерах.
Схема 4. часть I
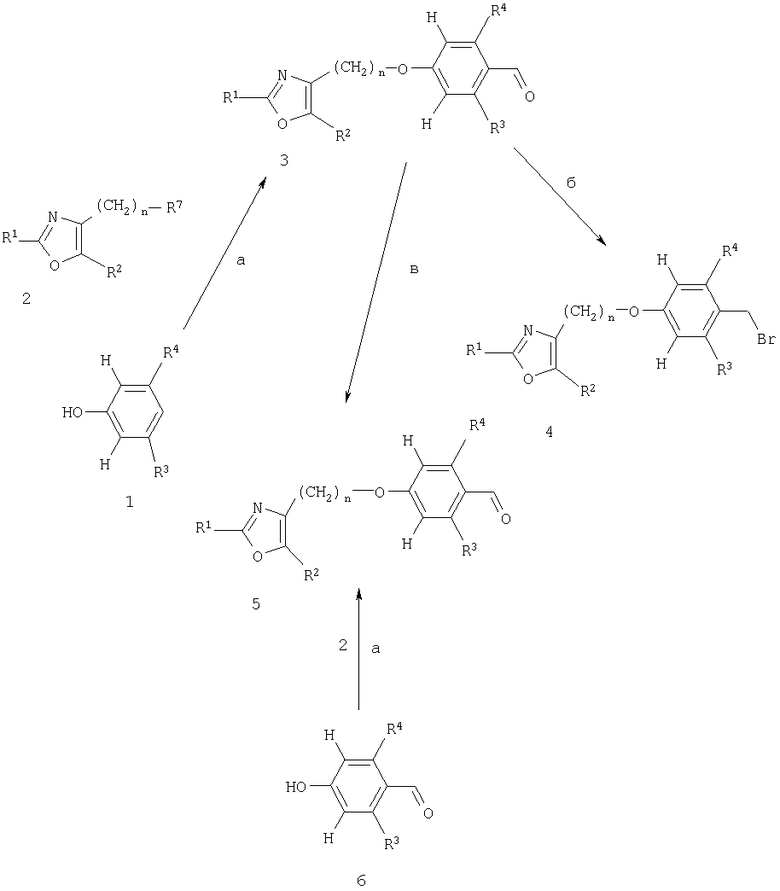
Схема 4, часть II
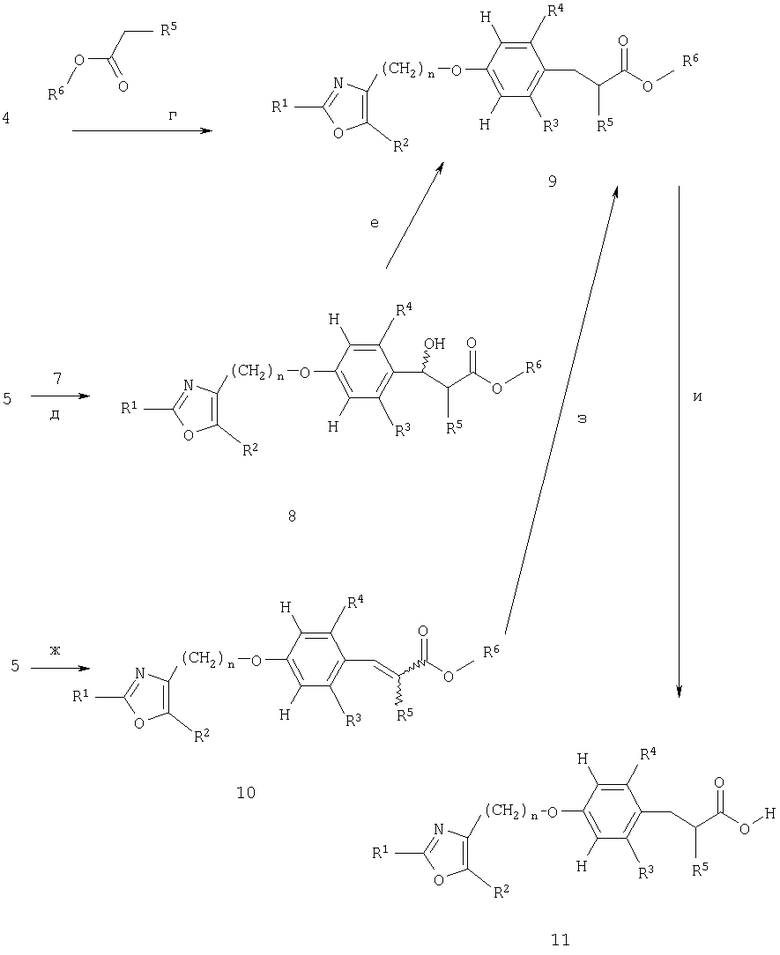
Арилоксазольные производные 2 (получены, как указано на схемах 6 и 7) подвергают конденсации с фонолами 1 или альдегидами 6 (получены, как указано на схеме 5) совершенно аналогично тому, что описано для случая гомохиральных фенольных промежуточных соединений 8 и арилоксазольных производных 9, показанных на схеме 1; таким образом получают производные простых эфиров 3 или альдегиды 5 (стадия а). Последние затем подвергают бромметилированию, например, посредством обработки триоксаном и HBr, предпочтительно, 62%-ным водным раствором HBr, в инертном растворителе, предпочтительно в среде дихлорметана, предпочтительно при 0°С с получением при этом высокореакционноспособного, часто совершенно нестабильного электрофила 4 (стадия б). Электрофил 4 подходит для алкилирования енолята сложных эфиров алкоксиуксусной кислоты 7 (R6=низший алкил), предпочтительно, литий-енолята, полученного при -78°С посредством обработки соединения 7 сильным не нуклеофильным основанием, таким как литийдиизопропиламид, в инертном растворителе, например, таком как тетрагидрофуран, с получением при этом сложных эфиров 9 (стадия г). Для того чтобы повысить реакционную способность нуклеофила-енолята, взаимодействие предпочтительно осуществляют в присутствии сорастворителя, такого как гексаметилфосфорамид (ГМФА) или 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (ДМПУ).
В качестве альтернативы альдегидные производные 5, которые также могут быть доступны из производных - простых эфиров 3 посредством формилирования по Вильсмейеру (Vilsmeier) или посредством формилирования с использованием дихлорметилметилового простого эфира в присутствии тетрахлорида титана предпочтительно в дихлорметане при температуре от -78°С до температуры образования флегмы растворителем (стадия в), подвергают взаимодействию с енолятом сложных эфиров алкоксиуксусной кислоты 7, как показано для аналогичного взаимодействия соединений 1 и соединений 4 на схеме 2, с получением при этом альдольных продуктов 8 в виде смеси диастереомеров (стадия д). Удаление бензильной гидроксигруппы соединений 8 приводит к образованию рацемических сложных эфиров 9 (стадия е), как показано для аналогичных реакций на схемах 1, 2 и 3 соответственно.
В качестве альтернативы альдегиды 5 вступают во взаимодействие с солями Виттига (Wittig), как показано для превращения соединений 1 в соединения 3 на схеме 2, с получением при этом акриловых сложных эфиров 10 в виде Е и/или Z изомеров (стадия ж). Гидрирование акриловых сложных эфиров 10, как показано для аналогичной реакции на схеме 2, приводит к получению соединений 9 (стадия з). Гидролиз рацемического сложноэфирного соединения 9 может быть осуществлен совершенно аналогично тому, что показано для гомохиральных соединений 10 на схеме 1, с получением при этом карбоновых кислот 11 (стадия и).
Альдегиды 4 (схема 1), альдегиды 1 (схема 2), альдегиды 2 (схема 3) и альдегиды 6 (схема 4) известны или могут быть синтезированы с использованием методов, известных из предшествующего уровня техники. Примеры возможного синтеза ключевых промежуточных соединений приведены на схеме 5.
Схема 5
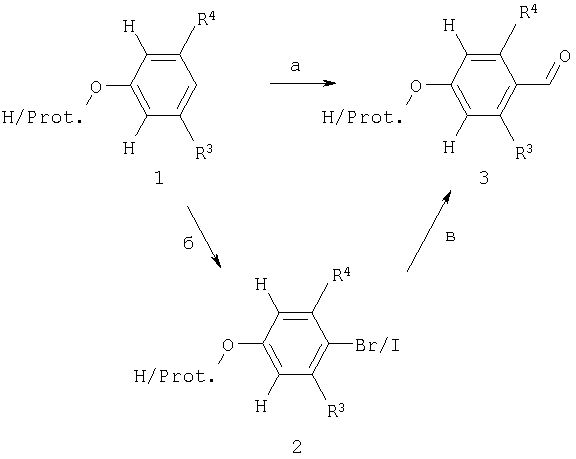
Известные фенолы 1 могут быть превращены в альдегиды 3 либо посредством известных реакций формилирования, например формилированием по Вильсмейеру (Vilsmeier), посредством обработки гексаметилентетрамином в кислой среде, например, в присутствии серной кислоты или предпочтительно в присутствии трифторуксусной кислоты в качестве растворителя, между 0°С и температурой образования флегмы трифторуксусной кислотой, или посредством формилирования дихлорметилметиловым простым эфиром в присутствии тетрахлорида титана предпочтительно в дихлорметане при температуре от -78°С и до температуры образования флегмы растворителем (стадия а); в качестве альтернативы может быть использована двухстадийная методика: введение атома галогена в пара-положение, например, посредством использования N-бром- или N-иодсукцинимида, например, в смеси концентрированной серной кислоты и тетрагидрофурана, предпочтительно при температуре окружающей среды, с последующей заменой галогена металлом, осуществляемой с использованием алкиллитиевого реагента, такого как н-бутиллитий, предпочтительно при температуре приблизительно -78°С, и с последующей остановкой реакции обработкой полученного арил-Li-соединения формильным реагентом переноса, таким как N,N-диметилформамид или N-формилпиперидин (стадии 6 и в). В качестве альтернативы для введения формильной группы на стадии (в) может быть использована реакция карбонилирования, например, посредством использования формиата натрия, бис(трифенилфосфин)палладий (II)дихлорида и газообразного СО в среде растворителя, такого как N,N-диметилформамид, предпочтительно при температуре приблизительно 100°С.
Схема 6
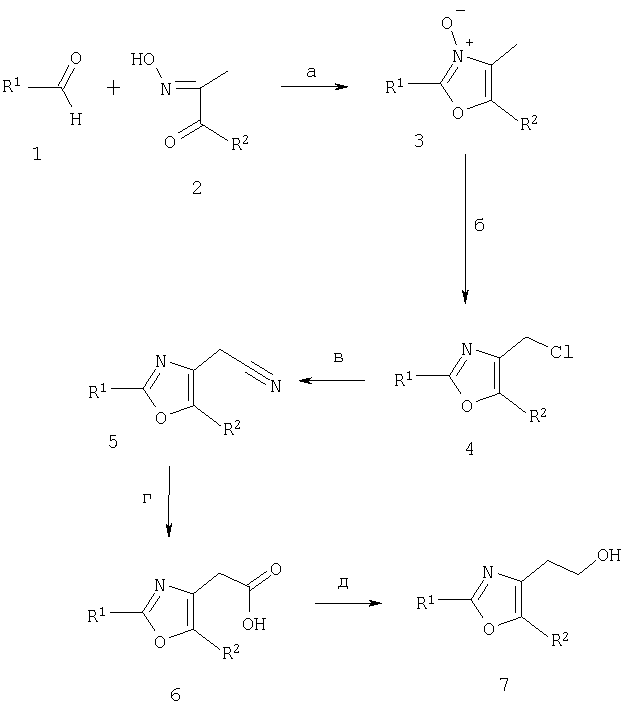
Альдегиды 1 являются коммерчески доступными или известными соединениями. Они вступают в конденсацию с дикетомонооксимами 2 в соответствии с тем, что описано в литературе (Diels, О.; Riley, К.; Chem Ber (1915), 48, 897) в присутствии сильной кислоты, обычно HCl, в полярном растворителе, таком как АсОН, с образованием при этом оксазол-N-оксидов 3 (стадия а). Последующая обработка с использованием POCl3 в дихлорметане при кипячении с обратным холодильником приводит к получению соответствующих первичных хлоридов 4 (Goto, Y.; Yamazaki, M.; Hamana, M.; Chem Pharm Bull (1971), 19, 2050), стадия б. Первичные хлориды 4 либо используют как таковые, либо превращают в соответствии с хорошо известными методами в соответствующие первичные спирты [например, с использованием уксусной кислоты в присутствии иодида натрия, карбоната калия при повышенной температуре и с последующим омылением образовавшегося ацетата (например, с использованием гидроксида лития в смеси этанол/вода при комнатной температуре)]. В качестве альтернативы первичные хлориды 4 далее обрабатывают по SN2-реакции, используя NaCN, и получают, через нитрилы 5 (стадия в), в результате полного гидролиза (стадия г) и восстановления (стадия д), например восстановления бораном в тетрагидрофуране, блоки 7 для дальнейшего синтеза. Гидроксиэтильные производные 7 или гидроксиметильные производные получают из соответствующих первичных хлоридов 4 или они могут быть превращены в соединения 9 (схема 1), 8 (схема 2), 1 (схема 3) или 2 (схема 4), например, посредством обработки метансульфонилхлоридом в дихлорметане в присутствии основания, такого как триэтиламин, предпочтительно в интервале температур от -20°С до комнатной температуры или посредством взаимодействия с тетрахлоридом углерода или тетрабромидом углерода и трифенилфосфином в среде растворителя, например, такого как тетрагидрофуран, предпочтительно в интервале температур от комнатной температуры до температуры флегмообразования растворителей, с получением при этом соединений 9 (схема 1), 8 (схема 2), 1 (схема 3) или 2 (схема 4) в виде метансульфонатов, хлоридов или бромидов соответственно.
4-Хлорметил-2-арил- или 2-гетероарилоксазолы 4, в которых R2 означает водород, предпочтительно получают из соответствующих арил- или гетероарилкарбоксамидов и 1,3-дихлорацетона, как описано, например, в Bioorg. Med. Chem. Lett. (2000), 10 (17), 2041-2044.
Схема 7
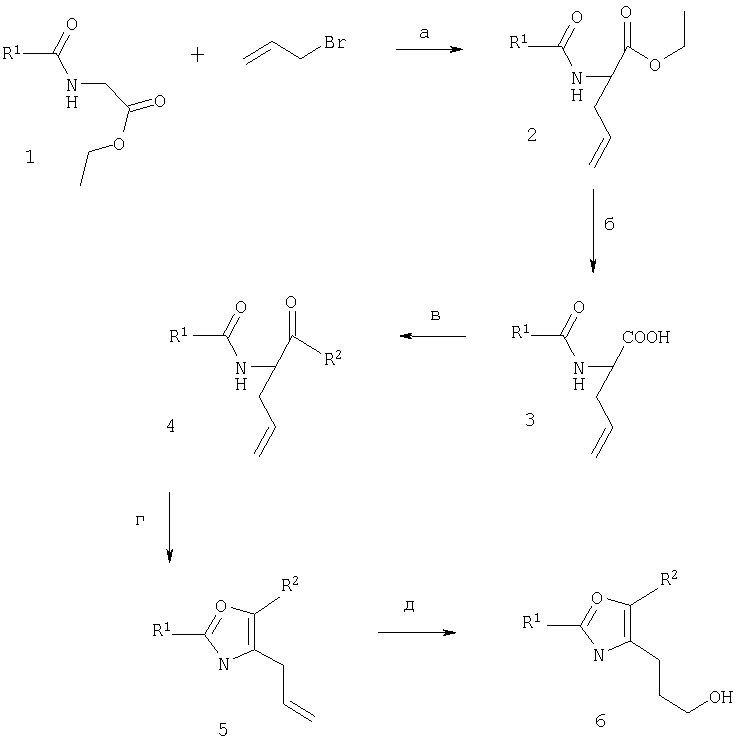
Сложные эфиры N-ацилглицина 1 являются либо коммерчески доступными, известными или могут быть получены по общепринятым методикам проведения N-ацилирования. Моноаллилированные сложные эфиры 2 могут быть легко получены посредством двойного депротонирования соединения 1 с использованием сильного, не нуклеофильного основания, такого как LiHMDS, в апротонном растворителе, например, таком как ТГФ, обычно при -78°С с последующей обработкой аллилбромидом с получением при этом селективно С-алкилированных продуктов 2 (стадия а). Обычный гидролиз позволяет получить промежуточные соединения - кислоты 3 (стадия б), которые затем переводят, в соответствии с хорошо известными из литературы методиками (J. Med. Chem. (1996), 39, 3897), в соединения 4 (стадия в). Замыкание кольца и образование оксазола с использованием трифторуксусной кислоты и трифторуксусного ангидрида или реагента Бургесса (Burgess) (метил-N-триэтиламмониосульфонилкарбамат) позволяет получить ключевые производные 5 (стадия г), которые, в заключение, превращают посредством гидроборирования в целевые спирты 6, например, с использованием 9-BBN в ТГФ и посредством последующей окислительной обработки с использованием Н2О2 и NaOH (стадия д). Спирты 6 соответствуют требованиям или могут быть превращены в соединения 9 (схема 1), 8 (схема 2), 1 (схема 3) или 2 (схема 4), например, посредством обработки метансульфонилхлоридом в дихлорметане в присутствии основания, например, такого как триэтиламин, предпочтительно в интервале температур от -20°С и до комнатной температуры, или посредством взаимодействия с тетрахлоридом углерода или тетрабромидом углерода и трифенилфосфином в среде растворителей, например, таких как тетрагидрофуран, предпочтительно в интервале температур от комнатной температуры до температуры флегмообразования растворителей, с получением таким образом соединений 9 (схема 1), 8 (схема 2), 1 (схема 3) или 2 (схема 4) в виде метансульфонатов, хлоридов или бромидов соответственно.
Следующие тесты проводят для того, чтобы определить активность соединений формулы (I).
Информацию о предшествующем уровне техники и используемых методах исследования можно найти в Nichols JS et al. "Development of a scintillation proximity assay for peroxisome proliferator-activated receptor gamma ligand binding domain", (1998) Anal. Biochem. 257: 112-119.
Полноразмерные клоны кДНК для PPARα человека и PPARγ мыши получают посредством RT-PCR (полимеразной цепной реакции с обратной транскрипцией) из адипозы человека и кРНК из печени мыши, соответственно клонированных в плазмидных векторах, с подтверждением структуры ДНК-секвенированием. Были сконструированы бактериальные векторы экспрессии и векторы экспрессии, имеющие отношение к млекопитающим, для того чтобы продуцировать глутатион-s-трансферазу (GST - сокр. от англ. glutathione-S-transferase) и Ga14 ДНК связывающий домен белков, слитых с доменами связывания лигандов (LBD - сокр. от англ. ligand binding domains) PPARγ (аминокислоты 174-476) и PPARα (аминокислоты 167-469). Для достижения этого порции клонированных последовательностей, кодирующих LBDs, амплифицируют из клонов полной длины посредством полимеразной цепной реакции (ПЦР) и затем субклонируют в плазмидных векторах. Структуру полученных в результате этого клонов подтверждают посредством ДНК-анализа последовательности.
Индукцию, экспрессию и очистку слитых белков GST-LBD осуществляют в клетках Е. coli штамм BL21 (pLysS) с использованием известных общепринятых методик (ссылка: Current Protocols in Molecular Biology, Wiley Press, edited by Ausubel et al.).
Исследование связывания радиоактивных лигандов
Связывание с рецептором PPARα исследуют в ТКЕ10 (10 мМ Трис-HCl, рН 8, 50 мМ KCl, 2 мМ ЭДТК, 0,1 мг/мл БСА, не содержащего жирных кислот, и 10 мМ DTT). В каждую из 96 лунок помещают 2,4 мкг-эквивалента GST-PPARα-LBD слитого белка и радиоактивный лиганд, например 2(S)-(2-бензоилфениламино)-3-{4-[1,1-дитритио-2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовую кислоту (40000 распадов в минуту) инкубируют в объеме 100 мкл при комнатной температуре в течение 2 часов. Связанный лиганд отделяют от несвязанного лиганда посредством твердофазного разделения, используя пластины «MultiScreen plates» (Millipore), заполненные 80 мкл SG25 в соответствии с инструкцией изготовителя.
Связывание с рецептором PPARγ исследуют в ТКЕ50 (50 мМ Трис-HCl, рН 8, 50 мМ KCl, 2 мМ ЭДТК, 0,1 мг/мл свободного от жирных кислот БСА и 10 мМ DTT). В каждой из 96 лунок 140 нг-эквивалента GST-PPARγ-LBD слитого белка подвергают связыванию с 10 мкг частиц SPA (Pharmacia Amersham) в конечном объеме, составляющем 50 мкл, при встряхивании. Полученную суспензию инкубируют в течение 1 ч при комнатной температуре и центрифугируют в течение 2 мин при 1300. Супернатант (надосадочная жидкость), содержащий несвязанный белок, удаляют и полусухой осадок, содержащий покрытые рецептором частички, повторно растворяют в 50 мкл ТКЕ. Для связывания радиоактивного лиганда, например, добавляют 2(S)-(2-бензоилфениламино)-3-{4-[1,1-дитритио-2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовую кислоту (10000 распадов в минуту), 50 мкл, реакционную смесь инкубируют при комнатной температуре в течение 1 ч и осуществляют подсчет сцинтилляционных вспышек. Все исследования связывания проводят в 96-луночных планшетах и количество связанного лиганда измеряют счетчиком «Packard TopCount» с использованием пластин «OptiPlates» («Packard»). Неспецифическое связывание определяют в присутствии 10-4 М соединения, не содержащего метку. Кривые зависимости отклика от величины дозы строят по данным для трех образцов в интервале концентраций от 10-10 М до 10-4 М.
Исследование с использованием люциферазного транскрипционного гена-репортера
Клетки почек детенышей хомяков (ВНК21 АТСС CCL10) выращивают в среде DMEM (модифицированная Дульбекко среда Игла), содержащей 10% FBS при 37°С в атмосфере, содержащей смесь 95% O2:5% СО2. Клетки высевают в 6-луночные планшеты с плотностью 105 клетки/лунка и затем транзиентно в замкнутом объеме трансфектируют с либо pFA-PPARγ-LBD, либо с pFA-PPARαLBD экспрессионной плазмидой плюс репортерная плазмида и экспрессионная плазмида, кодирующая секретируемую форму щелочной фосфатазы (SEAP - сокр. от англ. secretable form of alkaline phosphatase), в качестве нормализационного контроля. Трансфекцию заканчивают с реагентом «Fugene 6» («Roche Molecular Biochemicals») в соответствии с прилагаемой инструкцией. Через шесть часов после трансфекции клетки собирают посредством трипсинизации и высевают в 96-луночные планшеты с плотностью 104 клетки/лунка. Через 24 часа для того, чтобы осуществилось присоединение клеток, среду удаляют и заменяют 100 мкл среды, которая не содержит фенолового красного и содержит тестируемые соединения или контрольные лиганды (конечная концентрация ДМСО составляет 0,1%). После инкубирования клеток в течение 24 часов вместе с соединениями 50 мкл супернатанта отделяют и анализируют в отношении активности SEAP («Roche Molecular Biochemicals»). Остаток супернатанта отбрасывают, добавляют по 50 мкл фосфатно-солевого буферного раствора (PBS) в каждую лунку, а затем один объем люциферазного реагента «Luciferase Constant-Light Reagent» («Roche Molecular Biochemicals») для того, чтобы лизировать клетки и инициировать люциферазную реакцию. Величину люминесценции как для SEAP, так и для люциферазы измеряют с использованием счетчика «Packard TopCount». Активность люциферазы нормализуют по отношению к SEAP-контролю и выражают транскрипционную активность в присутствии тестируемых соединений как активацию по отношению к активации клеток, которые инкубировали в отсутствие соединений. Значения ЕС50 вычисляют с использованием программы «XLfit» («ID Business Solutions Ltd», Великобритания).
Свободные кислоты соединений согласно настоящему изобретению (R6 представляет собой водород) характеризуются значениями IC50, составляющими от 0,1 нМ до 50 мкМ, предпочтительно от 1 нМ до 10 мкМ для PPARα и PPARγ. Кроме того, соединения характеризуются значениями EC50, составляющими от 0,1 нМ до 50 мкМ, предпочтительно от 1 нМ до 10 мкМ для PPARα и PPARγ. Соединения, в которых R6 не означает водород, превращаются in vivo в соединения, в которых R6 представляет собой водород. В приведенной ниже таблице приведены результаты измерений для некоторых выбранных соединений согласно настоящему изобретению и для соединений, уже известных из предшествующего уровня техники (например, для розиглитазона: Rosiglitasone, Drugs 1999, Vol 57 (6), 921-930).
IC50
IC50
EC50
EC50
Соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут быть введены, например, перорально, например, в форме таблеток, таблеток с покрытием, драже, жестких и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в виде суппозиториев, парентерально, например, в форме растворов для инъекций или растворов для вливаний, или местно, например, в виде мазей, кремов или масел.
Получение фармацевтических препаратов может быть осуществлено каким-либо способом, известным специалисту в данной области техники, посредством введения описанных соединений формулы (I) и их фармацевтически приемлемых производных в лекарственные формы вместе с подходящим нетоксичным, инертным, терапевтически пригодным твердым или жидким веществом-носителем и, если необходимо, с обычным фармацевтическим вспомогательным веществом.
Подходящие вещества-носители представляют собой не только неорганические вещества-носители, но также и органические вещества-носители. Таким образом, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли могут быть использованы в качестве веществ-носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Подходящие вещества-носители для мягких желатиновых капсул представляют собой, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в случае мягких желатиновых капсул в зависимости от природы активного ингредиента носитель может не потребоваться). Подходящие вещества-носители для получения растворов и сиропов представляют собой, например, такие носители как вода, полиолы, сахароза, инвертный сахар и тому подобное. Подходящие вещества-носители для получения растворов для инъекций представляют собой, например, воду, спирты, полиолы, глицерин и растительные масла. Подходящие вещества-носители для суппозиториев, представляют собой, например, природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Подходящие вещества-носители для препаратов, предназначенных для местного введения, представляют собой глицериды, полусинтетические и синтетические глицериды, гидрированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стерины, полиэтиленгликоли и производные целлюлозы.
В качестве вспомогательных фармацевтических веществ следует рассматривать обычные стабилизаторы, консерванты, смачивающие и эмульгирующие агенты; агенты, улучшающие консистенцию; агенты, улучшающие вкус и запах, соли для регулирования осмотического давления, буферные растворы, солюбилизаторы, подкрашивающие и маскирующие агенты и антиоксиданты.
Дозировка соединений формулы (I) может варьироваться в широких пределах в зависимости от заболевания, подлежащего регулированию, возраста и индивидуального состояния пациента, а также способа введения и должна, безусловно, соответствовать индивидуальным требованиям в каждом конкретном случае. Для взрослых пациентов следует рассматривать дневные дозы, составляющие приблизительно от 0,1 до приблизительно 1000 мг, в особенности приблизительно от 0,1 мг до приблизительно 100 мг. В зависимости от дозировки удобно вводить дневную дозу в виде нескольких дозированных единиц.
Фармацевтические препараты подходящим образом содержат приблизительно 0,05-500 мг, предпочтительно 0,05-100 мг, соединения формулы (I).
Приведенные ниже примеры служат для более подробной иллюстрации настоящего изобретения. Однако эти примеры, как предполагается, не ограничивают каким-либо образом объем настоящего изобретения.
Примеры
Сокращения:
AcOEt = этилацетат, АсОН = уксусная кислота, nBu2BOTf = трифлат дибутилбора, н-BuLi = н-бутиллитий, ДБАД = ди-трет-бутилазодикарбоксилат, ДБУ = 1,8-диазабицикло[5,4,0]ундец-7-ен, ДАДК = диэтилазодикарбоксилат, ДИАД = диизопропилазодикарбоксилат, ДМПУ = 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон, экв. = эквиваленты, ч = час (часы), ЖХВР = жидкостная хроматография высокого разрешения, ЛДА = диизопропиламид лития, мин = минута (минуты), POCl3 = оксихлорид фосфора, ТГФ = тетрагидрофуран.
Пример 1
а] (S)-4-Бензил-3-[(2S,3R)-3-(4-бензилокси-2-метилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он
(S)-4-Бензил-3-этоксиацетилоксазолидин-2-он (12,45 г, 47 ммоль) (информацию о получении (S)-4-бензил-3-этоксиацетилоксазолидин-2-она см. D.Haigh, Н.С.Birrell, В.С.С.Cantello, D.S.Eggleston, R.С.Haltiwanger, R.M.Hindley, A. Ramaswamy, N.С.Stevens, Tetrahedron: Asymmetry 1999, 10, 1353-1367) растворяют в сухом дихлорметане (270 мл) в атмосфере аргона и затем полученный раствор охлаждают до -78°С. Добавляют триэтиламин (7,98 мл, 57 ммоль), а затем медленно добавляют, в течение приблизительно 20 мин, трифлат ди-н-бутилбора (1 М раствор в дихлорметане, 50 мл, 50 ммоль), поддерживая температуру реакции ниже -70°С. Полученную смесь перемешивают при -78°С в течение 50 мин, охлаждающую баню заменяют на баню со льдом и затем полученную смесь перемешивают при 0°С дополнительно 50 минут перед тем, как повторно охладить до -78°С. Добавляют раствор 4-бензилокси-2-метилбензальдегида (10,7 г, 47 ммоль) в сухом дихлорметане (130 мл) в течение приблизительно 45 мин, таким образом, чтобы поддерживать температуру реакции ниже -70°С. Полученную смесь перемешивают при -78°С в течение 45 мин, нагревают от -78 до 0°С и перемешивают при 0°С в течение дополнительных 1,5 часа. Реакционную смесь выливают в смесь ледяная вода/насыщенный раствор соли и экстрагируют два раза дихлорметаном. Объединенные экстракты промывают насыщенным раствором соли и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении и затем полученный остаток очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 22,3 г (45,6 ммоль, выход 96%) указанного в заголовке соединения в виде бесцветного маслянистого вещества. Согласно данным 1Н-ЯМР спектроскопии один из изомеров в значительной степени преобладает. Конфигурация предварительно отнесена к 2S, 3R, согласно D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: 512,3 (M+Na)+, 472,3, 447,2, 387,2, 327,2, 295,3, 267,3, 232,1, 175,1.
б] Метиловый эфир (2S,3R)-3-(4-бензилокси-2-метилфенил)-2-этокси-3-гидроксипропионовой кислоты
5,4 М раствор метоксида натрия (7,3 мл, 39,5 ммоль) добавляют к охлаждаемой льдом и перемешиваемой суспензии (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-метилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-она (17,6 г, 36 ммоль) в сухом метаноле (87 мл). Полученную смесь перемешивают при 0°С в течение 15 мин, реакцию останавливают и нейтрализуют реакционную смесь добавлением разбавленного водного раствора хлороводородной кислоты (1,0 М). Полученный раствор концентрируют при пониженном давлении и затем полученный остаток растворяют в смеси ледяная вода/этилацетат в соотношении 1/1. Слои разделяют и затем водный слой экстрагируют два раза этилацетатом. Объединенные органические слои промывают ледяной водой и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении и затем полученный остаток очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 8,6 г (25 ммоль, выход 69%) указанного в заголовке соединения в виде светло-желтого маслянистого вещества. Согласно данным 1Н-ЯМР спектроскопии получают один отдельный диастереомер.
Масс-спектр: 367,2 (M+Na)+, 362,2 (M+NH4)+, 327,3, 299,3, 239,3, 211,2.
в] Метиловый эфир (2S)-3-(4-бензилокси-2-метилфенил)-2-этоксипропионовой кислоты
Триэтилсилан (23 мл, 145 ммоль) добавляют к энергично перемешиваемому, охлаждаемому льдом раствору метилового эфира (2S,3R)-3-(4-бензилокси-2-метилфенил)-2-этокси-3-гидроксипропионовой кислоты (5 г, 14,5 ммоль) в трифторуксусной кислоте (84 мл) в атмосфере аргона. Полученную смесь перемешивают при 0°С в течение 30 мин и дополнительно 2 ч. при температуре окружающей среды. Полученный раствор выливают на раскрошенный лед и экстрагируют этилацетатом. Органический слой промывают два раза водой и нейтрализуют насыщенным водным раствором бикарбоната натрия. Этилацетатный слой промывают насыщенным раствором соли и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, получая при этом бесцветное маслообразное вещество, которое очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 2,15 г (6,5 ммоль, выход 45%) указанного в заголовке соединения в виде бесцветного маслянистого вещества.
Масс-спектр: 351,2 (M+Na)+, 346,3 (M+NH4)+, 283,2, 276,2, 223,2, 195,5.
г] Метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты
Раствор метилового эфира (2S)-3-(4-бензилокси-2-метилфенил)-2-этоксипропионовой кислоты (3,6 г, 11 ммоль) в метаноле (300 мл) гидрируют над 10%-ным палладием на углероде (1 г) при температуре окружающей среды в течение 2 ч. Катализатор отфильтровывают и растворитель упаривают при пониженном давлении, получая при этом 2 г (8,4 ммоль, выход 77%) указанного в заголовке соединения в виде желтой жидкости, которую используют на следующей стадии без дополнительной очистки.
Масс-спектр: 261,2 (M+Na)+, 256,1 (M+NH4)+, 239,3 (М+Н)+, 193,2, 151,1.
д] 4-Хлорметил-5-метил-2-о-толилоксазол
2-Метилбензальдегид (19,3 мл, 166 ммоль) растворяют в уксусной кислоте (175 мл) и обрабатывают диацетилмонооксимом (16,8 г, 166 ммоль). Барботируют через полученный раствор поток сухого HCl в течение 2 ч. при 0°С и дополнительно 2 ч. при температуре окружающей среды (реакция несколько экзотермична). Реакционную смесь выливают в ледяную воду и экстрагируют два раза дихлорметаном. Объединенные экстракты промывают водой, насыщенным водным раствором бикарбоната натрия (до достижения значения рН, равного 8) и насыщенным раствором соли. Органический слой высушивают над сульфатом натрия и затем полученный раствор концентрируют до объема приблизительно 100 мл при пониженном давлении. Добавляют хлороформ (200 мл) и полученный раствор доводят до объема приблизительно 100 мл при пониженном давлении. Добавляют хлороформ (100 мл) и затем полученный раствор неочищенного 3-оксида 4,5-диметил-2-о-толилоксазола охлаждают до 0°С. Добавляют раствор оксихлорида фосфора (16,7 мл, 183 ммоль) в хлороформе (175 мл) в течение 10 мин. Реакционную смесь кипятят с обратным холодильником в течение 12 ч., охлаждают до 0°С и подщелачивают (рН 10) посредством осторожного добавления концентрированного водного раствора NH3. Полученную суспензию выливают в ледяную воду и экстрагируют два раза дихлорметаном. Объединенные экстракты промывают ледяной водой и насыщенным раствором соли, после чего высушивают над сульфатом натрия. После удаления растворителя при пониженном давлении получают желтое маслянистое вещество, которое очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 29 г (131 ммоль, выход 79%) указанного в заголовке соединения в виде желтого маслянистого вещества, которое затвердевает при стоянии.
Масс-спектр: 221,1 (M)+, 186,1, 118,0, 89,0, 43,1.
е] Метиловый эфир (S)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты
Смесь метилового эфира (S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (80 мг, 0,34 ммоль), 4-хлорметил-5-метил-2-о-толилоксазола (82 мг, 0,37 ммоль), карбоната цезия (120 мг, 0,37 ммоль) и следов иодида калия суспендируют в ацетоне (8 мл). Полученную смесь кипятят с обратным холодильником в течение 5 ч, растворитель упаривают при пониженном давлении и полученный остаток растворяют в смеси 2 н. HCl/ледяная вода в соотношении 1/1 и этилацетате. Слои разделяют и затем водный слой экстрагируют два раза этилацетатом. Объединенные органические слои промывают два раза насыщенным раствором соли и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении и затем полученный остаток очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 100 мг (0,24 ммоль, выход 70%) указанного в заголовке соединения в виде желтого маслянистого вещества.
Масс-спектр: 446,2 (M+Na)+, 424,3 (М+Н)+, 345,1, 269,2, 229,2, 215,4, 186,3.
ж] (S)-2-Этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота
К раствору метилового эфира (S)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты (100 мг, 0,24 ммоль) в смеси ТГФ/метанол в соотношении 2/1 (1,5 мл) добавляют 1 н. водный раствор LiOH (1,4 мл, 1,4 ммоль). Реакционную смесь перемешивают в течение 1,5 ч при температуре окружающей среды, нейтрализуют 1 н. водным раствором HCl при охлаждении льдом и концентрируют при пониженном давлении. Полученный остаток растворяют в смеси 1 н. HCl/ледяная вода в соотношении 1/1 и этилацетате, слои разделяют и водный слой экстрагируют этилацетатом. Объединенные органические слои промывают смесью ледяная вода/насыщенный раствор соли в соотношении 1/1, высушивают над сульфатом натрия и растворитель упаривают в вакууме, получая при этом указанное в заголовке соединение (88 мг, 0,21 ммоль, выход 91%) в виде не совсем белого твердого вещества, которое перекристаллизовывают из смеси дихлорметан/гексан, получая при этом бесцветные кристаллы. Согласно данным хиральной ЖХВР соответствующего сложного метилового эфира («Chiralcel-ODH») энантиомерный избыток составляет 98,6%.
Масс-спектр: 408,5 (М-Н)+, 362,3, 305,4, 280,9, 255,1, 216,6.
Пример 1a
а] Этиловый эфир 3-(4-бензилокси-2-метилфенил)-2-этокси-3-гидроксипропионовой кислоты (смесь стереоизомеров)
К охлажденному до -78°С 2 М раствору литийдиизопропиламида (305 ммоль) в смеси ТГФ/н-гептан (152,4 мл) добавляют раствор этилового эфира этоксиуксусной кислоты (45,2 мл, 331 ммоль) в тетрагидрофуране (240 мл) в течение 1,5 ч. в атмосфере аргона. Полученную смесь перемешивают в течение 30 мин. Добавляют по каплям раствор 4-бензилокси-2-метилбензальдегида (30 г, 132,6 ммоль) в тетрагидрофуране (420 мл) в течение 50 мин. Реакционную смесь перемешивают в течение 2 ч. при -78°С, выливают в смесь ледяная вода/водный раствор хлорида аммония в соотношении 1/1 и экстрагируют два раза этилацетатом. Объединенные экстракты промывают три раза смесью ледяная вода/насыщенный раствор соли в соотношении 1/1 и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, и затем полученный остаток очищают колоночной хроматографией (силикагель, н-гептан/AcOEt), получая при этом 48,8 г (136,2 ммоль) указанного в заголовке соединения в виде смеси стереоизомеров, представляющей собой желтое маслянистое вещество.
Масс-спектр: 376,4 (M+NH4)+, 341,4, 186,5.
б] Этиловый эфир (Z)-3-(4-бензилокси-2-метилфенил)-2-этоксиакриловой кислоты
К раствору этилового эфира 3-(4-бензилокси-2-метилфенил)-2-этокси-3-гидроксипропионовой кислоты (смесь стереоизомеров; 48,8 г, 136,2 ммоль) в N,N-диметилформамиде (500 мл) добавляют серную кислоту (19,6 мл, 96%). Реакционную смесь нагревают до 100°С в течение 2,5 ч., охлаждают до температуры окружающей среды, выливают в смесь ледяная вода/насыщенный водный раствор NaHCO3 в соотношении 1/1 и экстрагируют два раза этилацетатом. Объединенные экстракты промывают смесью ледяной воды и насыщенного раствора соли в соотношении 1/1 и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, получая при этом 46,1 г (135,4 ммоль) неочищенного этилового эфира (Z)-3-(4-бензилокси-2-метилфенил)-2-этоксиакриловой кислоты, который используют на следующей стадии без дополнительной очистки.
Масс-спектр: 358,3 (M+NH4)+, 341,4 (М+Н)+, 292,4, 222,4, 187,4.
в] Этиловый эфир (Z)-2-этокси-3-(4-гидрокси-2-метилфенил)акриловой кислоты
К раствору этилового эфира (Z)-3-(4-бензилокси-2-метилфенил)-2-этоксиакриловой кислоты (46,1 г, 135,4 ммоль) в дихлорметане (500 мл) добавляют BF3·OEt2 (186 мл, 677 ммоль, 46%) и диметилсульфид (149 мл, 2,03 моль). Реакционную смесь перемешивают при температуре окружающей среды в течение 14 ч., выливают в ледяную воду и экстрагируют два раза дихлорметаном. Объединенные экстракты промывают смесью ледяной воды и насыщенного раствора соли в соотношении 1/1 и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении и затем полученный остаток очищают колоночной хроматографией (силикагель, н-гептан/AcOEt), получая при этом 23,1 г (92,3 ммоль, выход 68% для трех стадий) указанного в заголовке соединения в виде желтых кристаллов.
Масс-спектр: 248,9 (М+Н)+, 219,9.
г] Этиловый эфир (Z)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]акриловой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир (Z)-2-этокси-3-(4-гидрокси-2-метилфенил)акриловой кислоты подвергают взаимодействию с 4-хлорметил-5-метил-2-о-толилоксазолом (пример 1 е]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир (Z)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]акриловой кислоты в виде бесцветных кристаллов.
Масс-спектр: 458,4 (M+Na)+, 436,4 (M+H)+, 291,5, 187,5.
д] (Z)-2-Этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]акриловая кислота
К раствору этилового эфира (Z)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]акриловой кислоты (6,8 г, 15,6 ммоль) в смеси ТГФ/метанол в соотношении 2/1 (102 мл) добавляют 3 М водный раствор NaOH (26 мл, 78 ммоль). Реакционную смесь перемешивают в течение 3 ч. при температуре окружающей среды, концентрируют при пониженном давлении, разбавляют ледяной водой и подкисляют 1 М водным раствором HCl. После двукратной экстракции этилацетатом объединенные экстракты промывают смесью ледяная вода/насыщенный раствор соли в соотношении 1/1 (три раза) и высушивают органический слой над сульфатом натрия. Растворитель удаляют при пониженном давлении и затем неочищенный продукт перекристаллизовывают из смеси дихлорметан/н-гептан, получая при этом указанное в заголовке соединение (6,3 г, 15,5 ммоль, выход 99%) в виде бесцветных кристаллов.
Масс-спектр: 406,3 (М-Н)+, 334,2, 255,2.
е] (S)-2-Этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 6а в], (Z)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]акриловую кислоту гидрируют в течение 16 ч. при давлении водорода, составляющем 60 бар, при 40°С в смеси дихлорметан/метанол/30%-ный водный раствор NaOH в соотношении 1/1/0,04, используя катализатор [Ru(OAc)2((+)-TMBTP)] и получая при этом после выделения черное твердое вещество с энантиомерной чистотой 93% и химической чистотой >99% согласно данным ЖХВР. Неочищенный продукт очищают колоночной хроматографией (силикагель, н-гептан/AcOEt/AcOH, два раза), получая при этом коричневые кристаллы, которые перекристаллизовывают из этилацетата, получая при этом указанное в заголовке соединение в виде не совсем белых кристаллов. Согласно данным хиральной ЖХВР (колонка «Chiralcel-ODH», 25 см×4,6 мм, 97% гептан/3% изопропанол с 0,15% трифторуксусной кислоты, скорость потока 0,8 мл/мин, 25°С, 274 нм. Время удерживания: R-кислота 19,3 мин, S-кислота 21,6 мин, α, β - ненасыщенная Z-кислота 28,2 мин), энантиомерный избыток составляет 99,8%.
Масс-спектр: 408,3 (М-Н)+, 362,2.
Пример 2
а] 2-(4-Изопропоксифенил)-4,5-диметилоксазол 3-оксид гидрохлорид
Через суспензию монооксима диацетила (1 г, 9,9 ммоль) и 4-изопропоксибензальдегида (1,6 г, 9,9 ммоль) в уксусной кислоте (10 мл) барботируют сухой хлороводород в течение 30 мин при охлаждении льдом и дополнительно 45 мин при температуре окружающей среды. Реакционную смесь охлаждают до 0°С, добавляют диэтиловый эфир (25 мл) в течение 5 мин, и образовавшийся осадок отфильтровывают и промывают диэтиловым эфиром, охлажденным льдом, получая при этом указанное в заголовке соединение (2,5 г, 8,8 ммоль, выход 89%) в виде бесцветных кристаллов.
Масс-спектр: 247,2 (M-HCl)+, 205,1, 188,1, 121,2, 93,2, 43,3.
б] 4-Хлорметил-2-(4-изопропоксифенил)-5-метилоксазол
К раствору 2-(4-изопропоксифенил)-4,5-диметилоксазол 3-оксида гидрохлорида (2,5 г, 8,8 ммоль) в хлороформе (12 мл) добавляют раствор оксихлорида фосфора (1 мл, 11 ммоль) в хлороформе (12 мл) в течение 5 мин. Реакционную смесь кипятят с обратным холодильником в течение 45 мин, охлаждают до 0°С и подщелачивают (рН 10) посредством осторожного добавления концентрированного водного раствора NH3. Полученную суспензию выливают в ледяную воду и экстрагируют два раза дихлорметаном. Объединенные экстракты промывают ледяной водой и насыщенным раствором соли и затем высушивают над сульфатом натрия. После удаления растворителя при пониженном давлении получают коричневое маслянистое вещество, которое очищают колоночной хроматографией (силикагель, дихлорметан), получая при этом 1,6 г (6 ммоль, выход 60%) указанного в заголовке соединения в виде бесцветного маслянистого вещества.
Масс-спектр: 266,3 (M+H)+, 224,2, 188,3.
в] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 1 г]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропоксифенил)-5-метилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 490,2 (M+Na)+, 468,2 (М+Н)+, 269,2, 230,2, 188,3.
г] (S)-2-Этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 452,3 (М-Н)-, 343,0, 283,3, 246,8, 218.7.
Пример 3
а] Метиловый эфир (S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 1 г]) подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 432,3 (M+Na)+, 410,3 (М+Н)+, 293,2, 269,2, 187,2, 172,2.
б] (S)-2-Этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовую кислоту в виде бесцветного твердого вещества, которое перекристаллизовывают из смеси гексан/дихлорметан, получая при этом бесцветные кристаллы. Согласно данным хиральной ЖХВР соответствующего метилового эфира («Chiralcel-OJ») энантиомерный избыток составляет 99,0%.
Масс-спектр: 394,2 (М-Н)-, 348,2. 293,2, 223,1.
Пример 3а
а] Этиловый эфир (Z)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]акриловой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир (Z)-2-этокси-3-(4-гидрокси-2-метилфенил)акриловой кислоты (пример 1а, в]) подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом (пример 3 а]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир (Z)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]акриловой кислоты в виде бесцветного твердого вещества.
Масс-спектр: 444,3 (M+Na)+, 422,5 (М+Н)+, 267,5, 213,5.
б] (Z)-2-Этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]акриловая кислота
Используя методику, аналогичную описанной в примере 1а, е], этиловый эфир (Z)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]обрабатывают NaOH, получая при этом (Z)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]акриловую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 394,3 (М+Н)+, 279,3, 249,3.
в] (S)-2-Этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 6а, в], (Z)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]акриловую кислоту гидрируют в автоклаве емкостью 35 мл в течение 16 ч. при давлении водорода 60 бар при 40°С в смеси дихлорметан/метанол/30% водный раствор NaOH в соотношении 1/1/0,03, используя катализатор [Ru(OAc)2((+)-TMBTP)] и получая при этом после выделения черное твердое вещество с энантиомерной чистотой 93% и химической чистотой, составляющей >99% согласно данным ЖХВР. Неочищенный продукт очищают колоночной хроматографией (силикагель, н-гептан/AcOEt/AcOH, два раза), получая при этом коричневые кристаллы, которые перекристаллизовывают из этилацетата с получением при этом указанного в заголовке соединения в виде бесцветных кристаллов. Согласно данным хиральной ЖХВР (колонка «Chiralcel-OJH», 25 см×4,6 мм, 80% гептан/20% этанол с 1,5% трифторуксусной кислоты, скорость потока 0,8 мл/мин, 25°С, 275 нм. Время удерживания: R-кислота 26,4 мин, S-кислота 29,1 мин, α, β - ненасыщенная Z-кислота 32,6 мин) энантиомерный избыток составляет 99,2%.
Масс-спектр: 394,2 (М-Н)-, 348,2.
Пример 4
а] Метиловый эфир (S)-3-{4-[2-(3,5-диметоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 1г]) подвергают взаимодействию с 4-хлорметил-2-(3,5-диметоксифенил)-5-метилоксазолом (получен из 3,5-диметоксибензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 2а] и б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-{4-[2-(3,5-диметоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 492,2 (M+Na)+, 470,1 (M+H)+, 273,2, 232,1, 205,2, 164,2.
б] (S)-3-{4-[2-(3,5-Диметоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-{4-[2-(3,5-диметоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-{4-[2-(3,5-диметоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 454,3 (М-Н)-, 408,2, 364,1, 305,0, 255,0, 223,1.
Пример 5
а] 2-(4-Фтор-3-метилфенил)-4,5-диметилоксазол 3-оксид
Через суспензию монооксима диацетила (11 г, 108,6 ммоль) и 4-фтор-3-метилбензальдегида (15 г, 108,6 ммоль) в уксусной кислоте (100 мл), барботируют сухой хлороводород в течение 30 мин при охлаждении льдом и дополнительно 45 мин при температуре окружающей среды. Реакционную смесь выливают в ледяную воду и экстрагируют два раза этилацетатом. Объединенные экстракты промывают ледяной водой, насыщенным водным раствором бикарбоната натрия (до достижения значения рН, равного 8) и насыщенным раствором соли. Органический слой высушивают над сульфатом натрия и растворитель удаляют при пониженном давлении, получая при этом указанное в заголовке соединение (12,3 г, 55,6 ммоль, выход 51%) в виде желтых кристаллов.
Масс-спектр: 222,1 (M+H)+, 205,1, 176,1, 137,1, 109,1.
б] 4-Хлорметил-2-(4-фтор-3-метилфенил)-5-метилоксазол
Используя методику, аналогичную описанной в примере 2 б], 2-(4-фтор-3-метилфенил)-4,5-диметилоксазол 3-оксид обрабатывают оксихлоридом фосфора в хлороформе с получением при этом 4-хлорметил-2-(4-фтор-3-метилфенил)-5-метилоксазола в виде бесцветного твердого вещества.
Масс-спектр: 239,0 (M)+, 204,1, 136,1, 43,2.
в] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 1 г]) подвергают взаимодействию с 4-хлорметил-2-(4-фтор-3-метилфенил)-5-метилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 464,2 (M+Na)+, 442,2 (М+Н)+, 349,1, 317,0, 280,2, 245,2, 204,1.
г] (S)-2-Этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 426,1 (М-Н)-, 348,4, 263,2, 174,8.
Пример 6
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 1 г]) подвергают взаимодействию с 4-хлорметил-2-(2-фторфенил)-5-метилоксазолом (получен из 2-фторбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 450,2 (M+Na)+, 428,3 (М+Н)+, 368,0, 231,2, 190,3.
б] (S)-2-Этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовую кислоту в виде бесцветного твердого вещества, которое перекристаллизовывают из смеси гексан/дихлорметан с получением при этом бесцветных кристаллов. Согласно данным хиральной ЖХВР энантиомерный избыток соответствующего метилового эфира («Chiralcel-ODH») составляет 99,4%.
Масс-спектр: 412,3 (М-Н)-, 366,5, 278,4, 254,9, 223,1.
Пример 6а
а] Этиловый эфир (Z)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}акриловой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир (Z)-2-этокси-3-(4-гидрокси-2-метилфенил)акриловой кислоты (пример 1а, в]) подвергают взаимодействию с 4-хлорметил-2-(2-фторфенил)-5-метилоксазолом (пример 6 а]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир (Z)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}акриловой кислоты в виде бесцветных кристаллов.
Масс-спектр: 462,4 (M+Na)+, 440,4 (М+Н)+, 206,4.
б] (Z)-2-Этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}акриловая кислота
Используя методику, аналогичную описанной в примере 1а, е], этиловый эфир (Z)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}акриловой кислоты обрабатывают, используя NaOH, с получением при этом (Z)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}акриловой кислоты в виде бесцветного твердого вещества.
Масс-спектр: 412,4 (М+Н)+.
в] (S)-2-Этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота
В защитную камеру с перчатками (содержание О2 ≤ 2 част. на млн.) помещают автоклав из нержавеющей стали емкостью 185 мл с 11,5 г (Z)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}акриловой кислоты (28,0 ммоль), 35 мл дихлорметана, 35 мл метанола, 2,5 мл 30%-ного водного раствора NaOH (14,0 ммоль) и 22,6 мг (0,028 ммоль) [Ru(OAc)2((+)-TMBTP)]. TMBTP представляет собой 4,4'-бис(дифенилфосфино)-2,2',5,5'-тетраметил-3,3'-дитиофен, его синтез в виде (R) или (S) энантиомера описан в опубликованной международной заявке WO 96/01831, заявитель Italfarmaco Sud, а также в статье: Т.Benincori et al., J. Org. Chem. 2000, 65, 2043. Комплекс [Ru(OAc)2((+)-TMBTP)] синтезируют по аналогии с общей методикой, опубликованной в N.Feiken et al., Organometallics 1997, 16, 537, 31Р-ЯМР (CDCl3): 61,4 м.д. Автоклав герметично закрывают и проводят гидрирование при перемешивании при 40°С при давлении водорода 60 бар. Через 16 ч автоклав открывают и полученный желто-коричневый раствор упаривают досуха на роторном испарителе (50°С/5 мбар). Полученный остаток растворяют в 60 мл этилацетата, 60 мл воды и 3 мл водной хлороводородной кислоты (25%). Органический слой отделяют и упаривают досуха (50°С/5 мбар), получая при этом 12 г неочищенного продукта в виде твердого вещества с энантиомерной чистотой 92% и химической чистотой >99% согласно данным ЖХВР. Неочищенный продукт растворяют в дихлорметане, добавляют (S)-фенилэтиламин (4,12 мл, 31,1 ммоль) и удаляют растворитель при пониженном давлении. Полученный коричневый остаток перекристаллизовывают из этилацетата с получением при этом бесцветных кристаллов, которые суспендируют в смеси ледяная вода/этилацетат в соотношении 1/1. Значение рН суспензии доводят до 1, используя 1 М водную хлороводородную кислоту, слои разделяют и затем водный слой экстрагируют дополнительно два раза этилацетатом. Объединенные экстракты промывают ледяной водой и насыщенным раствором соли в соотношении 1/1, высушивают над сульфатом натрия и затем растворитель удаляют в вакууме, получая при этом бесцветные кристаллы, которые перекристаллизовывают из этилацетата, получая при этом 8,45 г (20,4 ммоль, выход 73%) указанного в заголовке соединения в виде бесцветных кристаллов. Согласно данным хиральной ЖХВР (колонка «Chiralcel-ODH», 25 см (4,6 мм, 97% гептан/3% изопропанол с 0,15% трифторуксусной кислоты, скорость потока 0,7 мл/мин, 25°С, 274 нм. Время удерживания: R-кислота 30,2 мин, S-кислота 32,8 мин, α, β - ненасыщенная Z-кислота 39,1 мин) энантиомерный избыток составляет 100%.
Масс-спектр: 412,0 (М-Н)-.
Пример 7
а] (S)-4-Бензил-3-[(2S)-3-(4-бензилокси-2-метилфенил)-2-этоксипропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 в], (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-метилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он (пример 1 а]) обрабатывают триэтилсиланом в трифторуксусной кислоте с получением при этом указанного в заголовке соединения в виде бесцветной жидкости.
Масс-спектр: 496,2 (M+Na)+, 491,3 (M+NH4)+, 474,2 (М+Н)+, 428,3, 352,3, 251,2, 175,2.
б] (S)-4-Бензил-3-[(2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 г], (S)-4-бензил-3-[(2S)-3-(4-бензилокси-2-метилфенил)-2-этоксипропионил]оксазолидин-2-он гидрируют над 10%-ным палладием на углероде, получая при этом указанное в заголовке соединение в виде желтого жидкого вещества.
Масс-спектр: 382,1 (М-Н)-, 324,9, 305,1, 282,9, 261,8, 255,2, 221,4, 175,6.
в] (S)-4-Бензил-3-[(2S)-3-(4-{2-[2-(4-хлорфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)-2-этоксипропионил]оксазолидин-2-он
К охлаждаемому льдом раствору (S)-4-бензил-3-[(2S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионил]оксазолидин-2-она (100 мг, 260 мкмоль), 2-[2-(4-хлорфенил)-5-метилоксазол-4-ил]этанола (93 мг, 390 мкмоль) (получен из метил-3-оксопентаноата и 4-хлорбензамида аналогично методике проведения последовательных реакций, описанных для случая синтеза 2-(5-метил-2-фенилоксазол-4-ил)этанола в М.Scalone, PCT WO 01/79202 А1) и трифенилфосфина (103 мг, 390 мкмоль) в тетрагидрофуране (2,5 мл) добавляют диэтилазодикарбоксилат (61 мкл, 390 мкмоль). Охлаждающую баню убирают и продолжают перемешивание в течение 12 ч. После упаривания растворителя при пониженном давлении получают желтое маслянистое вещество, которое очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 70 мг (120 мкмоль, выход 45%) указанного в заголовке соединения в виде бесцветного маслянистого вещества.
Масс-спектр: 626,3 (M+Na)+, 603,2 (М)+, 557,2, 479,3, 381,2, 351,1, 273,2, 187,2.
г] (S)-3-(4-{2-[2-(4-Хлорфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)-2-этоксипропионовая кислота
(S)-4-Бензил-3-[(2S)-3-(4-{2-[2-(4-хлорфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)-2-этоксипропионил]оксазолидин-2-он (70 мг, 120 мкмоль) растворяют в охлажденном льдом ТГФ (0,7 мл) и обрабатывают 1 н. раствором NaOH (0,3 мл, 300 мкмоль) при 0°С в течение 2 ч. Реакционную смесь выливают в ледяную воду, экстрагируют два раза диэтиловым эфиром и затем объединенные органические слои промывают ледяной водой. Объединенные водные слои подкисляют 1 н. раствором HCl и экстрагируют два раза этилацетатом. Объединенные экстракты промывают насыщенным раствором соли и высушивают над сульфатом натрия. После упаривания растворителя получают 47 мг (110 мкмоль, выход 91%) указанного в заголовке соединения в виде желтого жидкого вещества.
Масс-спектр: 442,1 (М-Н)-, 396,1, 362,0, 223,6, 176,4.
Пример 8
а] 1-Этил-3-(фенилметокси)бензол
К суспензии карбоната калия (17 г, 123 ммоль) в N,N-диметилформамиде (40 мл) добавляют раствор 3-этилфенола (14,8 мл, 123 ммоль) в N,N-диметилформамиде (40 мл) при 2°С в атмосфере аргона. После перемешивания в течение 50 мин при 2°С добавляют бензилбромид (14,6 мл, 123 ммоль) в течение 15 мин при 2°С. Полученную смесь перемешивают дополнительно 30 мин при 2°С и в течение 12 ч. при температуре окружающей среды. После добавления ледяной воды (250 мл) полученный раствор экстрагируют два раза диэтиловым эфиром. Объединенные экстракты промывают два раза насыщенным раствором соли и высушивают над сульфатом натрия. После упаривания растворителя получают желтое маслянистое вещество, которое очищают колоночной хроматографией (силикагель, циклогексан), получая при этом 24,3 г (114 ммоль, выход 93%) указанного в заголовке соединения в виде желтого жидкого вещества.
Масс-спектр: 212,2 (М+Н)+, 183,1, 91,2, 65,1.
б] 1-Бром-2-этил-4-(фенилметокси)бензол
К раствору 1-этил-3-(фенилметокси)бензола (15 г, 71 ммоль) в ТГФ (200 мл) добавляют N-бромсукцинимид (16,3 г, 92 ммоль) и концентрированную серную кислоту (2,4 мл). Полученный раствор перемешивают в течение 5 ч. при температуре окружающей среды. Добавляют при охлаждении льдом бикарбонат натрия (3,6 г) и 10%-ный водный раствор NaHSO3 (400 мл). Полученную смесь перемешивают в течение 10 мин и затем выливают в этилацетат. Затем фазы разделяют и экстрагируют водную фазу этилацетатом. Объединенные экстракты промывают ледяной водой и насыщенным раствором соли и высушивают над сульфатом натрия. После удаления растворителя при пониженном давлении получают желтое маслянистое вещество, которое очищают колоночной хроматографией (силикагель, циклогексан), получая при этом 17,1 г (58,7 ммоль, выход 83%) указанного в заголовке соединения в виде бесцветной жидкости.
Масс-спектр: 292,0 (М)+, 290,0 (М)+, 212,2, 91,1, 65,2.
в] 4-Бензилокси-2-этилбензальдегид
1,6 М раствор н-BuLi в гексане (44,4 мл, 69,9 ммоль) добавляют в течение 10 мин к перемешиваемому охлажденному (-85°С) раствору 1-бром-2-этил-4-(фенилметокси)бензола (18,5 г, 63,5 ммоль) в сухом ТГФ (22 мл). Полученную смесь перемешивают в течение 1 ч. при -85°С в атмосфере аргона. Добавляют N,N-диметилформамид (25,5 мл, 330,4 ммоль) и дают температуре медленно подняться до комнатной температуры. Насыщенный водный раствор NH4Cl (70 мл) добавляют при охлаждении льдом. Полученную смесь экстрагируют два раза дихлорметаном, объединенные экстракты промывают насыщенным раствором соли и высушивают над сульфатом натрия. После удаления растворителя при пониженном давлении получают желтое маслянистое вещество, которое очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 11,9 г (49,5 ммоль, выход 78%) указанного в заголовке соединения в виде желтого маслянистого вещества.
Масс-спектр: 240,1 (М+Н)+, 91,1, 77,1, 65,2.
г] (S)-4-Бензил-3-(2S,3R)-3-(4-бензилокси-2-этилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 а], (S)-4-бензил-3-этоксиацетилоксазолидин-2-он (информацию о получении (S)-4-бензил-3-этоксиацетилоксазолидин-2-она см. D.Haigh, Н.С.Birrell, В.С.С.Cantello, D.S.Eggleston, R.С.Haltiwanger, R.M.Hindley, A.Ramaswamy, N.С.Stevens, Tetrahedron: Asymmetry 1999, 10, 1353-1367) подвергают взаимодействию с 4-бензилокси-2-этилбензальдегидом в присутствии триэтиламина и трифлата ди-н-бутилбора с получением при этом (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-этилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-она в виде желтого вспененного вещества. Согласно данным 1Н-ЯМР спектроскопии один из изомеров в значительной степени преобладает. Конфигурацию предварительно рассматривают как 2S, 3R в соответствии с D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: 526,3 (M+Na)+, 521,3 (M+NH4)+, 486,2, 381,2, 309,2, 281,2, 253,3, 178,1.
д] Метиловый эфир (2S,3R)-3-(4-бензилокси-2-этилфенил)-2-этокси-3-гидроксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 б], (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-этилфенил)-2-этокси-3-гидроксипропионил]-оксазолидин-2-он обрабатывают метоксидом натрия в метаноле, получая при этом метиловый эфир (2S,3R)-3-(4-бензилокси-2-этилфенил)-2-этокси-3-гидроксипропионовой кислоты в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии получают один отдельный диастереомер.
Масс-спектр: 381,2 (M+Na)+, 376,3 (М+NH4)+, 341,3, 295,3, 253.2, 225,3.
е] Метиловый эфир (2S)-3-(4-бензилокси-2-этилфенил)-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1в], метиловый эфир (2S,3R)-3-(4-бензилокси-2-этилфенил)-2-этокси-3-гидроксипропионовой кислоты обрабатывают триэтилсиланом в трифторуксусной кислоте, получая при этом метиловый эфир (2S)-3-(4-бензилокси-2-этилфенил)-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 365,2 (M+Na)+, 360,2 (M+NH4)+, 297,3, 283,2, 237,2, 209,3, 181,2.
ж] Метиловый эфир (2S)-2-этокси-3-(2-этил-4-гидроксифенил)пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 г], метиловый эфир (2S)-3-(4-бензилокси-2-этилфенил)-2-этоксипропионовой кислоты гидрируют над 10%-ным палладием на углероде, получая при этом метиловый эфир (2S)-2-этокси-3-(2-этил-4-гидроксифенил)пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 275,2 (M+Na)+, 270,3 (M+NH4)+, 253,3 (М+Н)+, 207,2, 175,2, 165,3, 147,2.
з] Метиловый эфир (S)-2-этокси-3-[2-этил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-этил-4-гидроксифенил)пропионовой кислоты подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[2-этил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 446,3 (M+Na)+, 424,3 (М+Н)+, 378,3, 213,3, 172,3.
и] (S)-2-Этокси-3-[2-этил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[2-этил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[2-этил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовую кислоту в виде бесцветного вспененного вещества.
Масс-спектр: 408,2 (М-Н)-, 362,0, 318,2, 236,7, 190,0.
Пример 9
а] Метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-этил-4-гидроксифенил)пропионовой кислоты (пример 8 ж]) подвергают взаимодействию с 4-хлорметил-2-(4-фтор-3-метилфенил)-5-метилоксазолом (пример 5б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 478,3 (M+Na)+, 456,3 (М+Н)+, 371,3, 271,3, 245,3, 204,2.
б] (S)-2-Этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1ж], метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 440,3 (М-Н)-, 393,9, 350,1, 255,2, 237,4, 203,6.
Пример 10
а] Метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-этил-4-гидроксифенил)пропионовой кислоты (пример 8 ж]) подвергают взаимодействию с 4-хлорметил-2-(2-фторфенил)-5-метилоксазолом (получен из 2-фторбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 464,2 (M+Na)+, 459,3 (M+NH4)+, 442,2 (М+Н)+, 396,2, 231,2, 190,3.
б] (S)-2-Этокси-3-{2-этил-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{2-этил-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 450,2 (M+Na)+, 428,3 (М+Н)+, 382,2, 231,2, 190,3.
Пример 11
а] Метиловый эфир (S)-2-этокси-3-[2-этил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-этил-4-гидроксифенил)пропионовой кислоты (пример 8 ж]) подвергают взаимодействию с 4-хлорметил-5-метил-2-о-толилоксазолом (пример 1 д]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[2-этил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 460,2 (М+Na)+, 438,3 (М+Н)+, 407,2, 227,2, 186,3.
б] (S)-2-Этокси-3-[2-этил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[2-этил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[2-этил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 446,2 (M+Na)+, 424,3 (M+H)+, 372,4, 230,2, 186,3.
Пример 12
а] Метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-этил-4-гидроксифенил)пропионовой кислоты (пример 8 ж]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропоксифенил)-5-метилоксазолом (пример 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 504,4 (M+Na)+, 482,4 (М+Н)+, 271,2, 230,2, 188,3.
б] (S)-2-Этокси-3-{2-этил-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил} пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{2-этил-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{2-этил-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 490,2 (M+Na)+, 468,2 (М+Н)+, 416,1, 371,4, 323,3, 271,3, 230,2, 188,3.
Пример 13
а] 1-Бром-2-фтор-4-(фенилметокси)бензол
Используя методику, аналогичную описанной в примере 8 б], 1-фтор-3-(фенилметокси)бензол (см. информацию о получении 1-фтор-3-(фенилметокси)бензола: A.A.Durrani, J.H.P.Tyman, J.Chem. Soc., Perkin Trans. 1 1979, 8, 2079-2087) обрабатывают N-бромсукцинимидом в присутствии концентрированной серной кислоты, получая при этом 1-бром-2-фтор-4-(фенилметокси)бензол в виде бесцветного маслянистого вещества.
б] 4-Бензилокси-2-фторбензальдегид
Используя методику, аналогичную описанной в примере 8 в], 1-бром-2-фтор-4-(фенилметокси)бензол обрабатывают, используя н-BuLi и N,N-диметилформамид в сухом тетрагидрофуране, получая при этом 4-бензилокси-2-фторбензальдегид в виде не совсем белых кристаллов.
Масс-спектр: 230,1 (М)+, 91,0, 65,2.
в] (S)-4-Бензил-3-[(2S,3R)-3-(4-бензилокси-2-фторфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 а], (S)-4-бензил-3-этоксиацетилоксазолидин-2-он (см. информацию о получении (S)-4-бензил-3-этоксиацетилоксазолидин-2-она: D.Haigh, Н.С.Birrell, В.С.С.Cantello, D.S.Eggleston, R.С.Haltiwanger, R.M.Hindley, A.Ramaswamy, N.С.Stevens, Tetrahedron: Asymmetry 1999, 10, 1353-1367) подвергают взаимодействию с 4-бензилокси-2-фторбензальдегидом в присутствии триэтиламина и трифлата ди-н-бутилбора, получая при этом (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-фторфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он в виде бесцветного вспененного вещества. Согласно данным 1Н-ЯМР спектроскопии в значительной степени преобладает один из изомеров. Конфигурацию предварительно рассматривают как 2S, 3R в соответствии с D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: 516,2 (M+Na)+, 476,2, 435,3, 419,3, 387,1, 330,2, 279,1, 227,2, 203,1.
г] Метиловый эфир (2S,3R)-3-(4-бензилокси-2-фторфенил)-2-этокси-3-гидроксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 б], (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-фторфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он обрабатывают метоксидом натрия в метаноле, получая при этом метиловый эфир (2S,3R)-3-(4-бензилокси-2-фторфенил)-2-этокси-3-гидроксипропионовой кислоты в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии получают один отдельный диастереомер.
Масс-спектр: 371,3 (M+Na)+, 331,3, 303,2, 279,2, 242,2.
д] Метиловый эфир (2S)-3-(4-бензилокси-2-фторфенил)-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 в], метиловый эфир (2S,3R)-3-(4-бензилокси-2-фторфенил)-2-этокси-3-гидроксипропионовой кислоты обрабатывают триэтилсиланом в трифторуксусной кислоте, получая при этом метиловый эфир (2S)-3-(4-бензилокси-2-фторфенил)-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 355,2 (M+Na)+, 350,3 (M+NH4)+, 333,3 (М+Н)+, 287,2, 273,3, 245,3.
е] Метиловый эфир (2S)-2-этокси-3-(2-фтор-4-гидроксифенил)пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 г], метиловый эфир (2S)-3-(4-бензилокси-2-фторфенил)-2-этоксипропионовой кислоты гидрируют над 10%-ным палладием на углероде, получая при этом метиловый эфир (2S)-2-этокси-3-(2-фтор-4-гидроксифенил)пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 265,2 (M+Na)+, 260,2 (M+NH4)+, 243,3 (М+Н)+, 197,1, 183,2, 155,3.
ж] Метиловый эфир (S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-фтор-4-гидроксифенил)пропионовой кислоты подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 436,2 (M+Na)+, 414,2 (М+Н)+, 354,4, 213,3, 172,3.
з] (S)-2-Этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 422,2 (M+Na)+, 400,4 (М+Н)+, 304,0, 269,2, 241,3, 213,3, 187,3, 172,3.
Пример 14
а] Метиловый эфир (S)-2-этокси-3-{2-фтор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-фтор-4-гидроксифенил)пропионовой кислоты (пример 13 е]) подвергают взаимодействию с 4-хлорметил-2-(2-фторфенил)-5-метилоксазолом (получен из 2-фторбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{2-фтор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 454,3 (M+Na)+, 449,3 (M+NH4)+, 432,4 (М+Н)+, 371,4, 304,2, 269,0, 231,3.
б] (S)-2-Этокси-3-{2-фтор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{2-фтор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{2-фтор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 416,2 (М-Н)-, 370,1, 326,2, 255,3, 227,2.
Пример 15
а] (S)-4-Бензил-3-[(2S,3R)-3-(4-бензилокси-2-хлорфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 а], (S)-4-бензил-3-этоксиацетилоксазолидин-2-он (информацию о получении (S)-4-бензил-3-этоксиацетилоксазолидин-2-она см. D.Haigh, H.С.Birrell, В.С.С.Cantello, D.S.Eggleston, R.С.Haltiwanger, R.M.Hindley, A.Ramaswamy, N.С.Stevens, Tetrahedron: Asymmetry 1999, 10, 1353-1367) подвергают взаимодействию с 4-бензилокси-2-хлорбензальдегидом (информацию о получении 4-бензилокси-2-хлорбензальдегида см. Т.Kimachi, M.Kawase, S.Matsuki, К.Tanaka, F.Yoneda, J. Chem. Soc., Perkin Trans. 1 1990, 253-256) в присутствии триэтиламина и трифлата ди-н-бутилбора, получая при этом (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-хлорфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии один из изомеров в значительной степени преобладает. Конфигурацию предварительно относят к 2S, 3R в соответствии с D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: 532,3 (M+Na)+, 527,2 (M+NH4)+, 446,1, 381,2, 315,1, 287,2, 243,2, 178,2.
б] Метиловый эфир (2S,3R)-3-(4-бензилокси-2-хлорфенил)-2-этокси-3-гидроксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 б], (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-хлорфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он обрабатывают метоксидом натрия в метаноле, получая при этом метиловый эфир (2S,3R)-3-(4-бензилокси-2-хлорфенил)-2-этокси-3-гидроксипропионовой кислоты в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии получают один отдельный диастереомер.
Масс-спектр: 387,1 (M+Na)+, 382,2 (M+NH4)+, 328,2, 319,2, 279,2, 203,2.
в] Метиловый эфир (2S)-3-(4-бензилокси-2-хлорфенил)-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 в], метиловый эфир (2S,3R)-3-(4-бензилокси-2-хлорфенил)-2-этокси-3-гидроксипропионовой кислоты обрабатывают триэтилсиланом в трифторуксусной кислоте, получая при этом метиловый эфир (2S)-3-(4-бензилокси-2-хлорфенил)-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 371,4 (M+Na)+, 366,2 (M+NH4)+, 303,2, 269,2, 222,2, 187,2.
г] Метиловый эфир (2S)-3-(2-хлор-4-гидроксифенил)-2-этоксипропионовой кислоты
Диметилсульфид (5,8 мл, 79 ммоль) и диэтилэфират трифторида бора (чистота 46%, 4,3 мл, 16 ммоль) добавляют к охлаждаемому льдом раствору метилового эфира (2S)-3-(4-бензилокси-2-хлорфенил)-2-этоксипропионовой кислоты (1,1 г, 3,2 ммоль) в дихлорметане (34 мл) в атмосфере аргона. Полученную смесь перемешивают в течение 5 ч. при температуре окружающей среды, выливают в смесь ледяная вода/насыщенный раствор соли в соотношении 1/1 и экстрагируют два раза дихлорметаном. Объединенные экстракты промывают смесью ледяная вода/насыщенный раствор соли в соотношении 1/1 и высушивают над сульфатом натрия. После удаления растворителя при пониженном давлении получают бесцветное маслянистое вещество, которое очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 0,6 г (2,3 ммоль, выход 74%) указанного в заголовке соединения в виде бесцветного маслянистого вещества.
Масс-спектр: 281,0 (M+Na)+, 276,1 (M+NH4)+, 251,3, 213,3, 187,2.
д] Метиловый эфир (S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-3-(2-хлор-4-гидроксифенил)-2-этоксипропионовой кислоты подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 452,3 (М+Na)+, 430,3 (М+Н)+, 251,3, 213,3, 172,2.
е] (S)-3-[2-Хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 438,0 (M+Na)+, 416,1 (М+Н)+, 371,4, 304,1, 263,1, 213,3, 172,3.
Пример 16
а] Метиловый эфир (S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-3-(2-хлор-4-гидроксифенил)-2-этоксипропионовой кислоты (пример 15 г]) подвергают взаимодействию с 4-хлорметил-2-(4-фтор-3-метилфенил)-5-метилоксазолом (пример 5 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 484,2 (M+Na)+, 462,2 (M+H)+, 345,1, 245,3, 204,2, 166,4.
б] (S)-3-{2-Хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси] фенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 470,0 (М+Na)+, 448,2 (М+Н)+, 371,4, 275,2, 245,3, 204,2, 187,3.
Пример 17
а] Метиловый эфир (S)-3-{2-хлор-4-(2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-3-(2-хлор-4-гидроксифенил)-2-этоксипропионовой кислоты (пример 15 г]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропоксифенил)-5-метилоксазолом (пример 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-{2-хлор-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 510,3 (M+Na)+, 488,3 (М+Н)+, 271,3, 230,2, 188,3.
б] (S)-3-{2-Хлор-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-{2-хлор-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-{2-хлор-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовую кислоту в виде бесцветного вспененного вещества.
Масс-спектр: 496,1 (M+Na)+, 474,2 (М+Н)+, 424,3, 271,2, 230,2, 188,3, 172,2.
Пример 18
а] Метиловый эфир (S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-3-(2-хлор-4-гидроксифенил)-2-этоксипропионовой кислоты (пример 15 г]) подвергают взаимодействию с 4-хлорметил-2-(2-фторфенил)-5-метилоксазолом (получен из 2-фторбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 470,1 (M+Na)+, 448,2 (М+Н)+, 269,1, 231,2, 190,3, 163,3.
б] (S)-3-{2-Хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 456,1 (M+Na)+, 434,2 (М+Н)+, 428,3, 382,1, 279,1, 231,2, 190,3.
Пример 19
а] Метиловый эфир (S)-3-[2-хлор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-3-(2-хлор-4-гидроксифенил)-2-этоксипропионовой кислоты (пример 15 г]) подвергают взаимодействию с 4-хлорметил-5-метил-2-о-толилоксазолом (пример 1 д]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-[2-хлор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 444,2 (М+Н)+, 319,3, 279,2, 227,3, 186,3, 181,2, 166,3.
б] (S)-3-[2-Хлор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота
Используя методику, аналогичную той, которая описана в примере 1 ж], метиловый эфир (S)-3-[2-хлор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-[2-хлор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]-2-этоксипропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 430,3 (М+Н)+, 390,2, 349,3, 292,4, 279,2, 186,3, 176,2, 161,3.
Пример 20
а] Метиловый эфир (S)-3-{2-хлор-4-[2-(2-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-3-(2-хлор-4-гидроксифенил)-2-этоксипропионовой кислоты (пример 15 г]) подвергают взаимодействию с 4-хлорметил-2-(2-метоксифенил)-5-метилоксазолом (получен из 2-метоксибензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-{2-хлор-4-[2-(2-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 482,2 (M+Na)+, 360,2 (M+H)+, 391,2, 330,3, 284,1, 254,2, 202,2.
б] (S)-3-{2-Хлор-4-[2-(2-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-{2-хлор-4-[2-(2-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-{2-хлор-4-[2-(2-метоксифенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовую кислоту в виде бесцветного вспененного вещества.
Масс-спектр: 468,1 (M+Na)+, 446,2 (M+H)+, 371,4, 329,2, 269,2, 202,1.
Пример 21
а] 1-Бром-2-трифторметил-4-(фенилметокси)бензол
Раствор 1-трифторметил-3-(фенилметокси)бензола (5,7 г, 22,6 ммоль) в ледяной уксусной кислоте (25 мл) с ацетатом натрия (2,7 г, 32,5 ммоль) охлаждают до 0°С и медленно при перемешивании добавляют бром (1,6 мл, 31,7 ммоль). Устанавливают предохранительную трубку с хлоридом кальция и затем смесь перемешивают в темноте, при комнатной температуре, в течение 24 ч. Полученную суспензию разбавляют дихлорметаном и промывают 10%-ным водным раствором тиосульфата, водным раствором карбоната калия и водой. Органический слой высушивают над сульфатом натрия и затем растворитель удаляют при пониженном давлении, получая при этом желтое маслянистое вещество, которое очищают колоночной хроматографией (силикагель, циклогексан), получая при этом 6 г бесцветного маслянистого вещества. Согласно данным 1Н-ЯМР маслянистое вещество состоит из смеси исходного вещества и указанного в заголовке соединения в соотношении 1/1. Эту смесь используют на следующей стадии без дополнительной очистки.
б] 4-Бензилокси-2-трифторметилбензальдегид
Используя методику, аналогичную описанной в примере 8 в], 1-бром-2-трифторметил-4-(фенилметокси)бензол обрабатывают, используя н-BuLi и N,N-диметилформамид в сухом тетрагидрофуране, получая при этом 4-бензилокси-2-трифторметилбензальдегид в виде бесцветной жидкости.
Масс-спектр: 298,3 (М+NH4)+, 281,1 (M)+, 236,1, 224,3, 181,2.
в] (S)-4-Бензил-3-[(2S,3R)-3-(4-бензилокси-2-трифторметилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 а], (S)-4-бензил-3-этоксиацетилоксазолидин-2-он (информацию о получении (S)-4-бензил-3-этоксиацетилоксазолидин-2-она см. D.Haigh, Н.С.Birrell, В.С.С.Cantello, D.S.Eggleston, R.С.Haltiwanger, R.M.Hindley, A.Ramaswamy, N.С.Stevens, Tetrahedron: Asymmetry 1999, 10, 1353-1367) подвергают взаимодействию с 4-бензилокси-2-трифторметилбензальдегидом в присутствии триэтиламина и трифлата ди-н-бутилбора с получением при этом (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-трифторметилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-она в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии один из четырех изомеров является в значительной степени преобладающим. Конфигурацию предварительно устанавливают как 2S, 3R в соответствии с D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: 566,3 (M+Na)+, 561,4 (M+NH4)+, 526,3, 458,2, 349,3, 301,3.
г] Метиловый эфир (2S,3R)-3-(4-бензилокси-2-трифторметилфенил)-2-этокси-3-гидроксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 б], (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-трифторметилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он обрабатывают метоксидом натрия в метаноле, получая при этом метиловый эфир (2S,3R)-3-(4-бензилокси-2-трифторметилфенил)-2-этокси-3-гидроксипропионовой кислоты в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии получают один отдельный диастереомер.
Масс-спектр: 421,2 (M+Na)+, 416,2 (M+NH4)+, 381,3, 353,2, 313,3, 222.2, 192,4.
д] Метиловый эфир (2S)-3-(4-бензилокси-2-трифторметилфенил)-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 в], метиловый эфир (2S,3R)-3-(4-бензилокси-2-трифторметилфенил)-2-этокси-3-гидроксипропионовой кислоты обрабатывают триэтилсиланом в трифторуксусной кислоте, получая при этом метиловый эфир (2S)-3-(4-бензилокси-2-трифторметилфенил)-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 405,4 (M+Na)+, 400,4 (M+NH4)+, 337,2, 269,2.
е] Метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-трифторметилфенил)пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 г], метиловый эфир (2S)-3-(4-бензилокси-2-трифторметилфенил)-2-этоксипропионовой кислоты гидрируют над 10% палладием на углероде с получением при этом метилового эфира (2S)-2-этокси-3-(4-гидрокси-2-трифторметилфенил)пропионовой кислоты в виде желтого твердого вещества.
Масс-спектр: 291,1 (М-Н)-, 255,2, 206,0, 174,1, 141,1.
ж] Метиловый эфир (S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-трифторметилфенил)пропионовой кислоты подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 486,3 (M+Na)+, 464,3 (М+Н)+, 411,0, 371,4, 304,2, 279,3.
з] (S)-2-Этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 448,2 (М-Н)-, 431,1, 402,2, 277,2, 231,1.
Пример 22
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-трифторметилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-трифторметилфенил)пропионовой кислоты (пример 21 е]) подвергают взаимодействию с 4-хлорметил-2-(2-фторфенил)-5-метилоксазолом (получен из 2-фторбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-трифторметилфенил}пропионовой кислоты в виде бесцветного твердого вещества.
Масс-спектр: 504,3 (M+Na)+, 482,3 (M+H)+, 428,5, 345,2, 303,8, 269,2, 231,2.
б] (S)-2-Этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-трифторметилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-трифторметилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-трифторметилфенил}пропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 466,3 (М-Н)-, 420,1, 376,3, 316,9, 277,1, 231,2.
Пример 23
а] 2-Гидрокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензальдегид
Раствор 2,4-дигидроксибензальдегида (2 г, 14,5 ммоль) в 20 мл ТГФ охлаждают до 0°С. К этому раствору добавляют трифенилфосфин (9,7 г, 37 ммоль), 2-(2-фенил-5-метилоксазол-4-ил)этанол (2,84 г, 14 ммоль) и в заключение в течение 0,75 часов раствор ди-трет-бутилазодикарбоксилата (8,52 г, 37 ммоль) в 20 мл ТГФ. Реакционную смесь перемешивают в течение ночи при комнатной температуре, упаривают досуха, очищают посредством хроматографии (SiO2; AcOEt/гептан) и затем полученный продукт перекристаллизовывают из смеси AcOEt/эфир/гептан, получая при этом 2,2 г (выход 46%) указанного в заголовке соединения в виде бесцветного твердого вещества.
б] 2-[Диметил-(1,1,2-триметилпропил)силанилокси]-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензальдегид
К раствору 2-гидрокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-бензальдегида (540 мг, 1,67 ммоль) в 8 мл N,N-диметилформамида, охлажденному до 0°С, добавляют 398 мг (5,85 моль) имидазола и 1,1 мл (5,85 ммоль) гексилдиметилхлорсилана. Реакционную смесь перемешивают 50 минут при 0°С, разбавляют, используя AcOEt, промывают смесью вода/лед, HCl (1М)/лед и насыщенным раствором соли и затем водный слой экстрагируют, используя AcOEt. Объединенные органические слои высушивают над Na2SO4 и упаривают. После хроматографии (SiO2; AcOEt/гептан) получают 346 мг (выход 45%) указанного в заголовке соединения в виде маслянистого вещества.
Масс-спектр: (М+Н+)+ 466,3.
в] (S)-4-Бензил-3-((2S,3R)-3-{2-[диметил-(1,1,2-триметилпропил)силанилокси]-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-3-гидрокси-2-метоксипропионил)оксазолидин-2-он
1,8 г (7,21 ммоль) (S)-4-бензил-3-метоксиацетилоксазолидин-2-она (информацию о получении (S)-4-бензил-3-метоксиацетил-оксазолидин-2-она см. D.Hunziker, N.Wu, К.Kenoshita, D.E.Cane, С.Khosia, Tetrahedron Lett. 1999, 40, 635-638) растворяют в атмосфере аргона в 10 мл CH2Cl2 и обрабатывают, используя 1,44 мл (8,42 ммоль) основания Хюнига (Hünig). После охлаждения до -78°С медленно добавляют nBu2BOTf (7,21 мл 1М раствора в СН2Cl2) и таким образом формирование енолборината происходит в течение 0,25 часа при -78°С и в течение 1 часа при 0°С. После повторного охлаждения до -78°С добавляют раствор 2,8 г (6 ммоль) 2-[диметил-(1,1,2-триметилпропил)силанилокси]-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензальдегида в 10 мл CH2Cl2, используя капельную воронку, в течение 90 минут и полученную смесь выдерживают в течение 95 минут при -78°С и в течение одного часа при 0°С. Затем смесь выливают на колотый лед, дважды экстрагируют, используя AcOEt, промывают насыщенным раствором соли и водой, высушивают над сульфатом магния и после упаривания растворителей с последующей хроматографией (силикагель, гептан/AcOEt) остается 2,905 г (выход 67%) указанного в заголовке соединения в виде желтого маслянистого вещества. Согласно данным 1Н-ЯМР спектроскопии один из изомеров в значительной степени преобладает. Конфигурацию предварительно определяют как 2S, 3R в соответствии с D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: (M+Na+)+ 737,3, (M+H+)+ 715,3.
г] (S)-4-Бензил-3-(3-{2-[диметил-(1,1,2-триметилпропил)силанилокси]-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-2-(2S)-метоксипропионил)оксазолидин-2-он
Полученный выше (S)-4-бензил-3-((2S,3R)-3-{2-[диметил-(1,1,2-триметилпропил)силанилокси]-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-3-гидрокси-2-метоксипропионил)оксазолидин-2-он (2,8 г, 3,91 ммоль) растворяют в 10 мл трифторуксусной кислоты, обрабатывают при 0°С, используя 10 мл триэтилсилана, и затем выдерживают в течение 3 часов при температуре окружающей среды. Реакционную смесь затем выливают на смесь колотый лед/AcOEt/NaOH (1 M), органический слой промывают водой и насыщенным раствором соли, высушивают над сульфатом магния и упаривают досуха. После экспресс-хроматографии (SiO2, гептан/AcOEt) получают 1,6 г (выход 58%) указанного в заголовке соединения (чистота ˜80%) в виде желтого вспененного вещества.
Масс-спектр: 596,4 (M)+.
д] (S)-4-Бензил-3-(3-{2-гидрокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-(2S)-2-метоксипропионил)оксазолидин-2-он
К раствору (S)-4-бензил-3-(3-{2-[диметил-(1,1,2-триметилпропил)силанилокси]-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-2-(2S)-метоксипропионил)оксазолидин-2-она (1,6 г, 2,29 ммоль) в 10 мл метанола добавляют NH4F (169 мг, 4,58 ммоль) и реакционную смесь выдерживают при комнатной температуре в течение 2 часов. Затем ее разбавляют, используя AcOEt, промывают смесью вода/лед и насыщенным раствором соли, водный слой экстрагируют, используя AcOEt, объединенные органические слои высушивают над Na2SO4 и упаривают. Как установлено, неочищенный продукт (1,22 г) представляет собой смесь указанного в заголовке соединения и метилового эфира (S)-3-{2-гидрокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-2-метоксипропионовой кислоты, и эту смесь используют без проведения очистки на следующей стадии.
е] (S)-3-{2-Гидрокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}-2-метоксипропионовая кислота
1,22 г полученной, как указано выше, смеси растворяют в 5 мл ТГФ и обрабатывают, используя 5 мл 1 н. раствора NaOH. Реакционную смесь выдерживают при 0°С в течение ночи. Затем реакционную смесь промывают дважды эфиром. Водный слой подкисляют (рН 3, используя смесь HCl (1 М)/лед), экстрагируют дважды, используя AcOEt, органические слои высушивают над сульфатом магния и упаривают, получая при этом неочищенный продукт, который очищают посредством хроматографии, используя смесь AcOEt/гептан, для удаления хиральных примесей. Таким образом получают 0,240 г (выход 27%) указанного в заголовке соединения в виде белого твердого вещества. Согласно данным хиральной ЖХВР («Chiralpak-AD») наблюдается энантиомерный избыток, близкий к 100%.
Масс-спектр: 396,2 (М-Н)-.
Пример 24
а] (S)-4-Бензил-3-[(2S,3R)-3-(4-бензилокси-2-метоксифенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 а], (S)-4-бензил-3-этоксиацетилоксазолидин-2-он (информацию о получении (S)-4-бензил-3-этоксиацетил-оксазолидин-2-она см. D.Haigh, Н.С.Birrell, В.С.С.Cantello, D.S.Eggleston, R.С.Haltiwanger, R.M.Hindley, A.Ramaswamy, N.С.Stevens, Tetrahedron: Asymmetry 1999, 10, 1353-1367) подвергают взаимодействию с 4-бензилокси-2-метоксибензальдегидом в присутствии триэтиламина и трифлата ди-н-бутилбора, получая при этом (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-метоксифенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он в виде светло-желтой жидкости. Согласно данным 1Н-ЯМР спектроскопии один из изомеров в значительной степени преобладает. Конфигурацию предварительно определяют как 2S, 3R в соответствии с D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: 528,3 (M+Na)+, 523,3 (M+NH4)+, 488,3, 442,4, 311,2, 239,3.
б] Метиловый эфир (2S,3R)-3-(4-бензилокси-2-метоксифенил)-2-этокси-3-гидроксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 б], (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2-метоксифенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он обрабатывают метоксидом натрия в метаноле, получая при этом метиловый эфир (2S,3R)-3-(4-бензилокси-2-метоксифенил)-2-этокси-3-гидроксипропионовой кислоты в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии получают один отдельный диастереомер.
Масс-спектр: 383,2 (M+Na)+, 378,2 (M+NH4)+, 343,2, 311,2, 283,2, 239,3, 163,2.
в] Метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метоксифенил)пропионовой кислоты
Раствор метилового эфира (2S,3R)-3-(4-бензилокси-2-метоксифенил)-2-этокси-3-гидроксипропионовой кислоты (100 мг, 200 мкмоль) и дигидрата щавелевой кислоты (150 мг, 1,2 ммоль) в изопропаноле (2 мл) гидрируют при давлении 50 атмосфер над 10%-ным палладием на углероде (20 мг) при температуре окружающей среды в течение 6,5 ч. Катализатор отфильтровывают и затем растворитель упаривают при пониженном давлении. Полученный остаток растворяют в смеси ледяная вода/водный раствор бикарбоната натрия в соотношении 1/1 и экстрагируют два раза этилацетатом. Объединенные экстракты промывают два раза смесью ледяная вода/насыщенный раствор соли в соотношении 1/1 и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, получая при этом желтую жидкость, которую очищают колоночной хроматографией (силикагель, смесь циклогексан/AcOEt), получая при этом 43 мг (170 мкмоль, выход 85%) указанного в заголовке соединения в виде светло-желтой жидкости.
Масс-спектр: 277,1 (M+Na)+, 209,2, 195,3, 181,2, 177,2, 167,2.
г] Метиловый эфир (S)-2-этокси-3-[2-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метоксифенил)пропионовой кислоты подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[2-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 448,2 (M+Na)+, 426,3 (M+H)+, 380,2, 319,2, 213,3, 172,2.
д] (S)-2-Этокси-3-[2-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[2-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[2-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 410,6 (М-Н)-, 369,9, 304,2, 285,2, 261,3, 238,9, 229,6, 191,3.
Пример 25
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метоксифенил)пропионовой кислоты (пример 24 в]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропилфенил)-5-метилоксазолом (получен из 4-изопропилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты в виде оранжевой жидкости.
Масс-спектр: 490,2 (M+Na)+, 468,2 (М+Н)+, 344,3, 311,2, 255,2, 214,4, 198,4.
б] (S)-2-Этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 476,2 (M+Na)+, 454,3 (М+Н)+, 404,5, 255,2, 214,3.
Пример 26
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метоксифенил)пропионовой кислоты (пример 24 в]) подвергают взаимодействию с 4-хлорметил-2-(4-фтор-3-метилфенил)-5-метилоксазолом (пример 5 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 480,4 (M+Na)+, 458,3 (М+Н)+, 412,2, 245,3, 204,2, 177,2.
б] (S)-2-Этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 466,1 (М+Na)+, 444,2 (М+Н)+, 392,1, 365,2, 297,3, 245,3, 204,2.
Пример 27
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метоксифенил)пропионовой кислоты (пример 24 в]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропоксифенил)-5-метилоксазолом (пример 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 506,5 (M+Na)+, 484,3 (М+Н)+, 323,3, 271,3, 230,2, 188,3.
б] (S)-2-Этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 492,2 (M+Na)+, 470,2 (М+Н)+, 357,2, 335,2, 279,2, 235,2, 187,3.
Пример 28
а] Метиловый эфир (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2-метоксифенил)пропионовой кислоты (пример 24 в]) подвергают взаимодействию с 4-хлорметил-2-(3-хлорфенил)-5-метилоксазолом (получен из 3-хлорбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3, по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 482,2 (M+Na)+, 460,2 (М+Н)+, 414,1, 357,2, 335,3, 279,2, 235,2, 206,1.
б] (S)-3-{4-[2-(3-Хлорфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}-2-этоксипропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 468,1 (M+Na)+, 446,1 (М+Н)+, 394,2, 352,2, 302,2, 269,2, 206,1, 149,1.
Пример 29
а] 4-Бензилокси-2,6-диметилбензальдегид
Используя методику, аналогичную описанной в примере 8 а], 4-гидрокси-2,6-диметилбензальдегид подвергают взаимодействию с бензилбромидом в присутствии карбоната калия с получением при этом 4-бензилокси-2,6-диметилбензальдегида в виде оранжевой жидкости.
Масс-спектр: 241,2 (М+Н)+, 181,0.
б] (S)-4-Бензил-3-[(2S,3R)-3-(4-бензилокси-2,6-диметилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он
Используя методику, аналогичную описанной в примере 1 а], (S)-4-бензил-3-этоксиацетилоксазолидин-2-он (информацию о получении (S)-4-бензил-3-этоксиацетилоксазолидин-2-она см. D.Haigh, H.С.Birrell, В.С.С.Cantello, D.S.Eggleston, R.С.Haltiwanger, R.M.Hindley, A.Ramaswamy, N.С.Stevens, Tetrahedron: Asymmetry 1999, 10, 1353-1367) подвергают взаимодействию с 4-бензилокси-2,6-диметилбензальдегидом в присутствии триэтиламина и трифлата ди-н-бутилбора с получением при этом (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2,6-диметилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-она в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии один из изомеров в значительной степени преобладает. Конфигурацию предварительно определяют как 2S, 3R, в соответствии с D.Haigh et al., Tetrahedron: Asymmetry 1999, 10, 1353-1367.
Масс-спектр: 526,3 (M+Na)+, 486,3, 425,3, 358,2, 309,1, 281,2, 253,1, 237,2, 178,2.
в] Метиловый эфир (2S,3R)-3-(4-бензилокси-2,6-диметилфенил)-2-этокси-3-гидроксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 б], (S)-4-бензил-3-[(2S,3R)-3-(4-бензилокси-2,6-диметилфенил)-2-этокси-3-гидроксипропионил]оксазолидин-2-он обрабатывают метоксидом натрия в метаноле, получая при этом метиловый эфир (2S,3R)-3-(4-бензилокси-2,6-диметилфенил)-2-этокси-3-гидроксипропионовой кислоты в виде бесцветной жидкости. Согласно данным 1Н-ЯМР спектроскопии получают один отдельный диастереомер.
Масс-спектр: 381,2 (M+Na)+, 376,3 (M+NH4)+, 341,2, 313,2, 269,2, 213,3, 187,2.
г] Метиловый эфир (2S)-3-(4-бензилокси-2,6-диметилфенил)-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 в], метиловый эфир (2S,3R)-3-(4-бензилокси-2,6-диметилфенил)-2-этокси-3-гидроксипропионовой кислоты обрабатывают триэтилсиланом в трифторуксусной кислоте, получая при этом метиловый эфир (2S)-3-(4-бензилокси-2,6-диметилфенил)-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 360,3 (M+NH4)+, 284,1, 269,2, 201,1, 163,3.
д] Метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2,6-диметилфенил)пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 г], метиловый эфир (2S)-3-(4-бензилокси-2,6-диметилфенил)-2-этоксипропионовой кислоты гидрируют над 10%-ным палладием на углероде, получая при этом метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2,6-диметилфенил)пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 275,2 (M+Na)+, 270,3 (M+NH4)+, 253,3 (M+H)+, 207,2, 165,3.
е] Метиловый эфир (S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2,6-диметилфенил)пропионовой кислоты подвергают взаимодействию с 4-хлорметил-5-метил-2-фенилоксазолом в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 446,4 (M+Na)+, 357,0, 275,0, 169,1.
ж] (S)-3-[2,6-Диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 432,2 (M+Na)+, 410,2 (M+H)+, 355,0, 329,4, 293,4, 244,3, 174,3, 166,3.
Пример 30
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2,6-диметилфенил)пропионовой кислоты (пример 29 д]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропоксифенил)-5-метилоксазолом (пример 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 504,3 (M+Na)+, 482,3 (M+H)+, 299,3, 271,2, 230,2, 188,3, 161,3.
б] (S)-2-Этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовую кислоту в виде бесцветного вспененного вещества.
Масс-спектр: 490,2 (M+Na)+, 468,2 (М+Н)+, 416,2, 305,2, 271,3, 230,2, 188,3.
Пример 31
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2,6-диметилфенил)пропионовой кислоты (пример 29 д]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропилфенил)-5-метилоксазолом (получен из 4-изопропилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 488,3 (M+Na)+, 466,3 (М+Н)+, 255,2, 214,4, 187,3.
б] (S)-2-Этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 474,2 (M+Na)+, 452,3 (M+H)+, 400,4, 357,1, 279,2, 214,4.
Пример 32
а] Метиловый эфир (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2,6-диметилфенил)пропионовой кислоты (пример 29 д]) подвергают взаимодействию с 4-хлорметил-2-(3-хлорфенил)-5-метилоксазолом (получен из 3-хлорбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]), в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 480,3 (M+Na)+, 458,3 (М+Н)+, 412,2, 330,2, 302,2, 247,2, 206,1.
б] (S)-3-{4-[2-(3-Хлорфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}-2-этоксипропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 466,2 (M+Na)+, 444,2 (М+Н)+, 380,2, 305,2, 287,2, 254,3, 215,3, 206,2, 198,2.
Пример 33
а] Метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(4-гидрокси-2,6-диметилфенил)пропионовой кислоты (пример 29 д]) подвергают взаимодействию с 4-хлорметил-2-(4-фтор-3-метилфенил)-5-метилоксазолом (пример 5 б]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 478,3 (M+Na)+, 456,3 (М+Н)+, 371,4, 339,1, 304,1, 245,3, 222,2, 204,2.
б] (S)-2-Этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 464,2 (M+Na)+, 442,3 (M+H)+, 349,3, 285,1, 266,2, 245,4, 225,3, 187,2.
Пример 34
а] Этиловый эфир 3-(4-бензилокси-2-метилфенил)-2(Z,E)-этоксиакриловой кислоты
Суспензию (1,2-диэтокси-2-оксоэтил)трифенилфосфоний хлорида [Tetrahedron 50 (25), 7543-56 (1994)] (35,5 г, 82,9 ммоль) и ДБУ (13,6 мл, 91,2 ммоль) в ТГФ (60 мл) перемешивают в течение 10 мин. при температуре окружающей среды. Добавляют 4-бензилокси-2-метилбензальдегид (12,5 г, 55,2 ммоль) и затем реакционную смесь кипятят с обратным холодильником в течение 16 ч. Растворитель концентрируют при пониженном давлении, полученный остаток переносят в AcOEt и промывают насыщенным водным раствором NH4Cl и насыщенным раствором соли. Органический слой высушивают над сульфатом натрия, растворитель удаляют при пониженном давлении и затем полученный остаток очищают колоночной хроматографией (силикагель, гексан/AcOEt), получая при этом 14,5 г (42,6 ммоль, выход 77%) указанного в заголовке соединения в виде желтого жидкого вещества.
Масс-спектр: 340,2 (M)+, 249,2, 147,1, 91,1.
б] Этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты
Раствор этилового эфира 3-(4-бензилокси-2-метилфенил)-2(Z,Е)-этокси-акриловой кислоты (1 г, 2,9 ммоль) в этаноле (50 мл) гидрируют над 10%-ным палладием на углероде (250 мг) при температуре окружающей среды в течение 2 ч. Катализатор отфильтровывают и растворитель упаривают при пониженном давлении, получая при этом 600 мг (2,4 ммоль, выход 81%) указанного в заголовке соединения в виде желтого жидкого вещества, которое используют на следующей стадии без дополнительной очистки.
Масс-спектр: 270,4 (М+NH4)+, 253 (М)+, 207,2, 165,3.
в] Этиловый эфир [рац]-3-{4-[2-(3.5-дихлорфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты подвергают взаимодействию с 4-хлорметил-2-(3,5-дихлорфенил)-5-метилоксазолом (получен из 3,5-дихлорбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 2 а] и б]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-3-{4-[2-(3,5-дихлорфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 493,3 (М+Н)+, 453,3, 375,4, 331,4, 275,2, 240,2, 200,2.
г] (S)-3-{4-[2-(3,5-Дихлорфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-3-{4-[2-(3,5-дихлорфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-3-{4-[2-(3,5-дихлорфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовую кислоту в виде бесцветной жидкости, которая может быть разделена на ее оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-ил-этиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 486,1 (M+Na)+, 466,1 (М+Н)+, 464,2 (М+Н)+, 433,1, 351,0, 293,2, 269,2, 187,2.
Пример 35
а] Этиловый эфир [рац]-3-{4-[2-(3,5-диметилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-2-(3,5-диметилфенил)-5-метилоксазолом (получен из 3,5-диметилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 2 а] и б]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-3-{4-[2-(3,5-диметилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 474,2 (M+Na)+, 452,3 (М+Н)+, 431,4, 375,3, 331,3, 275,2, 241,3, 200,2.
б] (S)-3-{4-[2-(3,5-Диметилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-3-{4-[2-(3,5-диметилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-3-{4-[2-(3,5-диметилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовую кислоту в виде бесцветной жидкости, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с получением диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-ил-этиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, с использованием либо хиральных адсорбентов, либо хирального элюента с получением при этом указанного в заголовке соединения.
Масс-спектр: 422,3 (М-Н)-, 375,9, 339,2, 319,3, 305,6, 282,2, 255,4, 222,9.
Пример 36
а] Этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(2-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-5-метил-2-(2-трифторметилфенил)оксазолом (получен из 2-трифторметилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(2-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 514,2 (M+Na)+, 492,2 (M+H)+, 448,2, 407,2, 322,2, 281,1, 266,3, 240,2.
б] (S)-2-Этокси-3-{2-метил-4-[5-метил-2-(2-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(2-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(2-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветной жидкости, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 462,2 (М-Н)-, 416,4, 372,1, 353,4, 337,3, 309,5, 255,0, 223,0.
Пример 37
а] Этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-5-метил-2-(3-трифторметилфенил)оксазолом (получен из 3-трифторметилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 514,3 (M+Na)+, 509,4 (M+NH4)+, 492,2 (М+Н)+, 446,1, 281,1, 240,2.
б] (S)-2-Этокси-3-{2-метил-4-[5-метил-2-(3-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветного твердого вещества, которое может быть разделено на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 462,1 (М-Н)-, 404,8, 387,0, 353,2, 319,0, 282,9, 268,7, 255,2, 241,0, 226,9.
Пример 38
а] Этиловый эфир [рац]-2-этокси-3-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-2-(4-фторфенил)-5-метилоксазолом (получен из 4-фторбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 2 а] и б]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-2-этокси-3-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 442,2 (М+Н)+, 391,2, 319,3, 231,2, 198,2, 190,3, 181,2, 166,3.
б] (S)-2-Этокси-3-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3- {4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовую кислоту в виде бесцветной жидкости, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов получением диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 412,2 (М-Н)-, 366,0, 322,3, 303,1, 283,3, 254,8, 222,9, 194,6.
Пример 39
а] Этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-5-метил-2-(4-трифторметилфенил)оксазолом (получен из 4-трифторметилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 2 а] и б]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 514,2 (M+Na)+, 509,4 (M+NH4)+, 492,2 (М+Н)+, 446,2, 418,2, 281,1, 240,2, 172,2.
б] (S)-2-Этокси-3-{2-метил-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветного твердого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов получением диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 462,2 (М-Н)-, 416,2, 399,1, 372,3, 341,7, 317,1, 255,4.
Пример 40
а] Этиловый эфир [рац]-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропилфенил)-5-метилоксазолом (получен из 4-изопропилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]), в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 488,3 (M+Na)+, 466,2 (М+Н)+, 422,3, 391,2, 279,2, 214,4.
б] (S)-2-Этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3- {4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовую кислоту в виде бесцветной жидкости, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 436,2 (М-Н)-, 410,9, 389,8, 363,3, 328,7, 305,0, 282,9, 254,9, 222,8.
Пример 41
а] Этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3,4,5-триметоксифенил)оксазол-4-илметокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-5-метил-2-(3,4,5-триметоксифенил)оксазолом (получен из 3,4,5-триметоксибензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 2 а] и б]) в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3,4,5-триметоксифенил)оксазол-4-илметокси]фенил}пропионовой кислоты в виде желтого жидкого вещества.
Масс-спектр: 536,3 (M+Na)+, 514,3 (М+Н)+, 470,2, 340,0, 303,2, 262,2, 214,3, 168,2.
б] (S)-2-Этокси-3-{2-метил-4-[5-метил-2-(3,4,5-триметоксифенил)оксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3,4,5-триметоксифенил)оксазол-4-илметокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3-{2-метил-4-[5-метил-2-(3,4,5-триметоксифенил)оксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветного твердого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 485,3 (М)-.
Пример 42
а] Этиловый эфир [рац]-2-этокси-3-(4-{2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)пропионовой кислоты
Используя методику, аналогичную описанной в примере 7 в], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этанолом (получен из 4-фтор-2-гидроксибензальдегида [J.Chem. Soc., Perkin Trans. 1 (1994), (13), 1823-31] посредством i) обработки этилиодидом, карбонатом калия в N,N-диметилформамиде с получением при этом 2-этокси-4-фторбензальдегида; ii) превращения 2-этокси-4-фтор-бензальдегида в 4-хлорметил-2-(2-этокси-4-фторфенил)-5-метилоксазол по аналогии с методиками, описанными в примерах 2 а] и б]; iii) превращения 4-хлорметил-2-(2-этокси-4-фторфенил)-5-метилоксазола в 2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этанол посредством обработки цианидом натрия в ДМСО с последующим гидролизом нитрильной функциональной группы гидроксидом натрия в смеси этанол/вода при кипячении с обратным холодильником и восстановления образовавшейся кислоты с использованием ВН3×ТГФ в тетрагидрофуране при комнатной температуре в присутствии трифенилфосфина и диэтилазодикарбоксилата с получением при этом этилового эфира [рац]-2-этокси-3-(4-{2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)пропионовой кислоты в виде светло-желтой жидкости.
Масс-спектр: 522,2 (M+Na)+, 500,3 (M+H)+, 456,3, 426,3, 398,2, 248,2, 220,2, 149,1.
б] (S)-2-Этокси-3-(4-{2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-(4-{2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3-(4-{2-[2-(2-этокси-4-фторфенил)-5-метилоксазол-4-ил]этокси}-2-метилфенил)пропионовую кислоту в виде бесцветного твердого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с получением диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 470,1 (М-Н)-, 424,2, 387,0, 326,5, 281,1, 255,0, 204,9.
Пример 43
а] Этиловый эфир [рац]-2-этокси-3-{2-метил-4-[3-(5-метил-2-фенилоксазол-4-ил)-пропокси]фенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 7 в], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 3-(5-метил-2-фенилоксазол-4-ил)-пропан-1-олом (J.L.Collins, M.Dezube, J.A.Oplinger, A.Jeffrey, Т.М.Willson, International Patent Appl., Publication No. WO 0008002 (A1), 2000) в присутствии трифенилфосфина и диэтилазодикарбоксилата с получением при этом этилового эфира [рац]-2-этокси-3-{2-метил-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовой кислоты в виде желтой жидкости.
Масс-спектр: 474,3 (M+Na)+, 452,5 (М+Н)+, 382,4, 241,3.
б] (S)-2-Этокси-3-{2-метил-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил)пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{2-метил-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3-{2-метил-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовую кислоту в виде бесцветной жидкости, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 422,3 (М-Н)-, 376,3, 299,1.
Пример 44
а] Метиловый эфир (S)-2-этокси-3-[2-метил-4-(2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир (S)-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 1 г]) подвергают взаимодействию с 4-хлорметил-2-фенилоксазол [получен из бензамида и 1,3-дихлорацетона, как описано в Bioorg. Med. Chem. Lett. (2000), 10 (17), 2041-2044] в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[2-метил-4-(2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 418,2 (M+Na)+, 396,2 (М+Н)+, 350,2, 336,3, 308,1, 251,2, 186,3, 158,2.
б] (S)-2-Этокси-3-[2-метил-4-(2-фенилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[2-метил-4-(2-фенилоксазол-4-илметокси)фенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[2-метил-4-(2-фенилоксазол-4-илметокси)фенил]пропионовую кислоту в виде бесцветного твердого вещества.
Масс-спектр: 404,3 (M+Na)+, 382,2 (М+Н)+, 325,2, 293,2, 250,2, 212,3, 172,3, 158,2.
Пример 45
а] Этиловый эфир [рац]-3-{4-[2-(2-хлорфенил)оксазол-4-илметокси]-2-метилфенил)-2-этоксипропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-2-(2-хлорфенил)оксазолом [получен из 2-хлорбензамида и 1,3-дихлорацетона с использованием методики, аналогичной той, которая описана для 4-хлорметил-2-фенилоксазола в Bioorg. Med. Chem. Lett. (2000), 10 (17), 2041-2044] в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-3-{4-[2-(2-хлорфенил)оксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 466,1 (M+Na)+, 444,2 (M+H)+, 371,4, 327,0, 192,2, 163,4.
б] (S)-3-{4-[2-(2-Хлорфенил)оксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-3-{4-[2-(2-хлорфенил)оксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-3-{4-[2-(2-хлорфенил)оксазол-4-илметокси]-2-метилфенил}-2-этоксипропионовую кислоту в виде бесцветной жидкости, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 438,2 (M+Na)+, 416,1 (M+H)+, 340,4, 280,2, 220,4, 192,2, 173,1.
Пример 46
а] Этиловый эфир [рац]-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-метилфенил)пропионовой кислоты (пример 34 б]) подвергают взаимодействию с 4-хлорметил-2-(3-метоксифенил)оксазолом [получен из 3-метоксибензамида и 1,3-дихлорацетона по методике, аналогичной описанной методике синтеза 4-хлорметил-2-фенилоксазола, см. Bioorg. Med. Chem. Lett. (2000), 10 (17), 2041-2044] в присутствии карбоната цезия и иодида калия, получая при этом этиловый эфир [рац]-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовой кислоты в виде бесцветной жидкости.
Масс-спектр: 462,2 (M+Na)+, 440,2 (M+H)+, 394,2, 366,2, 291,4.
б] (S)-2-Этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], этиловый эфир [рац]-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовой кислоты обрабатывают, используя LiOH и получая при этом [рац]-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовую кислоту в виде бесцветной жидкости, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 434,3 (M+Na)+, 412,2 (М+Н)+, 360,1, 304,1, 261,2, 229,2, 188,3, 160,3.
Пример 47
а] Этиловый эфир [рац]-3-(4-бензилокси-2-этоксифенил)-2-этокси-3-гидроксипропионовой кислоты [смесь диастереомеров]
ЛДА получают добавлением 13,3 мл н-BuLi (1,5 М, гексан) к раствору 2,85 мл (20,0 ммоль) диизопропиламина в 90 мл абс. ТГФ при -5°С. После охлаждения до -78°С добавляют 2,81 мл (20,0 ммоль) этилэтоксиацетата, растворенного в 10 мл абс. ТГФ, и затем полученную смесь выдерживают в течение 15 минут при этой температуре для того, чтобы достичь полного депротонирования. Затем добавляют 2,05 г (8,0 ммоль) 4-бензилокси-2-этоксибензальдегида [получен из 2-гидрокси-4-бензилоксибензальдегида и этилиодида с использованием методики, аналогичной описанной для получения 4-бензилокси-2-изопропоксибензальдегида в Chemical & Pharmaceutical Bulletin (1998), 46 (2), 222-230: 2-гидрокси-4-бензилоксибензальдегид, изопропилбромид, иодид калия, карбонат калия, N,N-диметилформамид, 100°С], растворенного в 20 мл абс. ТГФ. После перемешивания в течение 30 минут при температуре сухого льда реакцию останавливают обработкой реакционной смеси раствором хлорида аммония, подогревают до 0°С, затем экстрагируют дважды, используя AcOEt, промывают водой, высушивают над сульфатом натрия и упаривают досуха. После экспресс-хроматографии (SiO2, гексан/AcOEt в соотношении от 9:1 до 1:1) получают 3,09 г (выход 99% от теоретического) этиловый эфир [рац]-3-(4-бензилокси-2-этоксифенил)-2-этокси-3-гидроксипропионовой кислоты [смесь диастереомеров] в виде светло-желтого маслянистого вещества.
Масс-спектр: 371,4 [(M+H)+-Н2O].
б] Этиловый эфир 3-(4-бензилокси-2-этоксифенил)-2(Z,E)этоксиакриловой кислоты
3,26 г (8,39 ммоль) этилового эфира [рац]-3-(4-бензилокси-2-этоксифенил)-2-этокси-3-гидроксипропионовой кислоты [смесь диастереомеров] и 0,15 г (0,84 ммоль) 4-толуолсульфоновой кислоты перемешивают в 200 мл бензола при кипячении с обратным холодильником в течение 30 минут. После упаривания досуха с последующей экспресс-хроматографией (SiO2, смесь гексан/AcOEt в соотношении от 95:5 до 4:1) получают 2,12 г (выход 68% от теоретического) этилового эфира 3-(4-бензилокси-2-этоксифенил)-2(Z,Е)-этоксиакриловой кислоты в виде светло-желтого маслянистого вещества.
Масс-спектр: 370,1 (М)+.
в] Этиловый эфир [рац]-2-этокси-3-(2-этокси-4-гидроксифенил)пропионовой кислоты
0,90 г Pd/C (10%) добавляют в атмосфере аргона к 4,49 г (12,1 ммоль) этилового эфира 3-(4-бензилокси-2-этоксифенил)-2(Z,Е)-этоксиакриловой кислоты, растворенной в 80 мл этанола. Атмосферу затем заменяют Н2 и полученную смесь быстро перемешивают при комнатной температуре в течение двух часов. После фильтрации через дикалит (dicalite) и упаривания растворителей остается 4,23 г светло-желтого маслянистого вещества. После экспресс-хроматографии (SiO2, гексан/AcOEt в соотношении от 95:5 до 1:1) получают 3,41 г (выход 99% от теоретического) этилового эфира [рац]-2-этокси-3-(2-этокси-4-гидроксифенил)пропионовой кислоты в виде светло-желтого маслянистого вещества.
Масс-спектр: 281,0 (М-Н)-.
г] (S)-3-{4-[2-(4-трет-Бутилфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(2-этокси-4-гидроксифенил)пропионовой кислоты подвергают взаимодействию с 2-(4-трет-бутилфенил)-4-хлорметил-5-метилоксазолом (получен из 4-трет-бутил-бензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в N,N-диметилформамиде в присутствии карбоната калия, получая при этом этиловый эфир [рац]-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовой кислоты, который затем подвергают омылению, используя методику, аналогичную описанной в примере 1 ж], получая при этом [рац]-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовую кислоту в виде бесцветного аморфного вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 480,4 (М-Н)-.
Пример 48
(S)-2-Этокси-3-{2-этокси-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(2-этокси-4-гидроксифенил)пропионовой кислоты (пример 47 в]) подвергают взаимодействию с 4-хлорметил-2-(4-изопропоксифенил)-5-метилоксазолом (пример 2 б]) в N,N-диметилформамиде в присутствии карбоната калия, получая при этом этиловый эфир [рац]-2-этокси-3-{2-этокси-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил)пропионовой кислоты, который затем подвергают омылению, используя методику, аналогичную описанной в примере 1 ж], получая при этом [рац]-2-этокси-3-{2-этокси-4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]фенил}пропионовую кислоту в виде бесцветного твердого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 482,3 (М-Н)-.
Пример 49
(S)-3-{4-[2-(3-Хлорфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(2-этокси-4-гидроксифенил)пропионовой кислоты (пример 47 в]) подвергают взаимодействию с 4-хлорметил-2-(3-хлорфенил)-5-метилоксазолом (получен из 3-хлорбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в N,N-диметилформамиде в присутствии карбоната калия с получением при этом этилового эфира [рац]-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовой кислоты, который затем подвергают омылению, используя методику, аналогичную описанной в примере 1 ж], получая при этом [рац]-3-{4-[2-(3-хлорфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовую кислоту в виде бесцветного твердого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 458,2 (М-Н)-.
Пример 50
(S)-2-Этокси-3-{2-этокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 7 в], этиловый эфир [рац]-2-этокси-3-(2-этокси-4-гидроксифенил)пропионовой кислоты (пример 47 в]) подвергают взаимодействию с 2-(5-метил-2-фенилоксазол-4-ил)этанолом в тетрагидрофуране в присутствии трифенилфосфина и ДБАД (ди-трет-бутилазодикарбоксилат), получая при этом этиловый эфир [рац]-2-этокси-3-{2-этокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовой кислоты, который затем подвергают омылению, используя методику, аналогичную описанной в примере 1 ж], с получением при этом [рац]-2-этокси-3-{2-этокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовой кислоты в виде бесцветного маслянистого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 438,2 (М-Н)-.
Пример 51
(S)-2-Этокси-3-{2-этокси-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовая кислота
Используя методику, аналогичную описанной в примере 7 в], этиловый эфир [рац]-2-этокси-3-(2-этокси-4-гидроксифенил)пропионовой кислоты (пример 47 в]) подвергают взаимодействию с 3-(5-метил-2-фенилоксазол-4-ил)пропан-1-олом (J.L.Collins, M.Dezube, J.A.Oplinger, A.Jeffrey, Т.М.Willson, International Patent Appl., Publication No. WO 0008002 (A1), 2000) в тетрагидрофуране в присутствии трифенилфосфина и ДБАД (ди-трет-бутилазодикарбоксилат), получая при этом этиловый эфир [рац]-2-этокси-3-{2-этокси-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовой кислоты, который затем подвергают омылению, используя методику, аналогичную описанной в примере 1 ж], с получением при этом [рац]-2-этокси-3-{2-этокси-4-[3-(5-метил-2-фенилоксазол-4-ил)пропокси]фенил}пропионовой кислоты в виде бесцветного маслянистого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 452,2 (М-Н)-.
Пример 52
а] Этиловый эфир [рац]-3-(4-бензилокси-2-изопропоксифенил)-2-этокси-3-гидроксипропионовой кислоты [смесь диастереомеров]
Используя методику, аналогичную описанной в примере 47 а], 4-бензилокси-2-изопропоксибензальдегид [Chemical & Pharmaceutical Bulletin (1998), 46 (2), 222-230] подвергают взаимодействию с енолятом этилэтоксиацетата с получением при этом этилового эфира [рац]-3-(4-бензилокси-2-изопропоксифенил)-2-этокси-3-гидроксипропионовой кислоты в виде смеси диастереомеров в виде светло-желтого маслянистого вещества.
Масс-спектр: 402,0 (М)+.
б] Этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-изопропоксифенил)пропионовой кислоты
В атмосфере аргона 0,80 г Pd/C (10%) и 6,0 г дигидрата щавелевой кислоты добавляют к 3,20 г (7,95 ммоль) этилового эфира [рац]-3-(4-бензилокси-2-изопропоксифенил)-2-этокси-3 -гидроксипропионовой кислоты [смесь диастереомеров], растворенного в 60 мл изопропанола. Полученный раствор перемешивают в течение 24 часов при комнатной температуре и давлении водорода 50 бар. После фильтрации через дикалит (dicalite) и упаривания растворителей с последующей экспресс-хроматографией (SiO2, смесь гексан/AcOEt в соотношении от 9:1 до 1:1) остается 0,69 г (выход 29% от теоретического) этилового эфира [рац]-2-этокси-3-(4-гидрокси-2-изопропоксифенил)пропионовой кислоты в виде желтого маслянистого вещества.
Масс-спектр: 295,2 (М-Н)-.
в] (S)-3-{4-[2-(4-трет-Бутилфенил)-5-метилоксазол-4-илметокси]-2-изопропоксифенил}-2-этоксипропионовая кислота
Используя методику, аналогичную описанной в примере 1 е], этиловый эфир [рац]-2-этокси-3-(4-гидрокси-2-изопропоксифенил)пропионовой кислоты подвергают взаимодействию с 2-(4-трет-бутилфенил)-4-хлорметил-5-метилоксазолом (получен из 4-трет-бутилбензальдегида и диацетилмонооксима с последующей обработкой с использованием POCl3 по аналогии с методиками, описанными в примерах 5 а] и 2 б]) в N,N-диметилформамиде в присутствии карбоната калия, получая при этом этиловый эфир [рац]-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-изопропоксифенил}-2-этоксипропионовой кислоты, который затем подвергают омылению, используя методику, аналогичную описанной в примере 1 ж], получая при этом [рац]-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-изопропоксифенил}-2-этоксипропионовую кислоту в виде вязкого бесцветного маслянистого вещества, эта кислота может быть разделена на оптические антиподы с использованием методов, известных из предшествующего уровня техники, таких как разделение антиподов с использованием получения диастереомерных солей посредством кристаллизации с оптически чистыми аминами, например, такими как (R)- или (S)-1-фенилэтиламин, (R)- или (S)-1-нафталин-1-илэтиламин, бруцин, хинин и хинидин, или посредством разделения антиподов специальными хроматографическими методами, используя либо хиральные адсорбенты, либо хиральный элюент с получением при этом указанного в заголовке соединения.
Масс-спектр: 494,3 (М-Н)-.
Пример 53
а] Метиловый эфир (S)-2-этокси-3-[2-фтор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты
Используя методику, аналогичную описанной в примере 1 е], метиловый эфир (2S)-2-этокси-3-(2-фтор-4-гидроксифенил)пропионовой кислоты (пример 13 е]) подвергают взаимодействию с 4-хлорметил-5-метил-2-о-толилоксазолом (пример 1 д]) в присутствии карбоната цезия и иодида калия, получая при этом метиловый эфир (S)-2-этокси-3-[2-фтор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты в виде бесцветного маслянистого вещества.
Масс-спектр: 450,4 (M+Na)+, 445,4 (М+NH4)+, 428,5 (М+Н)+, 391,4, 279,3, 227,4, 186,3.
б] (S)-2-Этокси-3-[2-фтор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота
Используя методику, аналогичную описанной в примере 1 ж], метиловый эфир (S)-2-этокси-3-[2-фтор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовой кислоты обрабатывают, используя LiOH и получая при этом (S)-2-этокси-3-[2-фтор-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовую кислоту в виде бесцветной жидкости.
Масс-спектр: 412,2 (М-Н)-, 366,2.
Пример А
Таблетки, содержащие указанные ниже ингредиенты, могут быть получены общепринятым образом:
Пример Б
Капсулы, содержащие указанные ниже ингредиенты, могут быть получены общепринятым образом:
Пример В
Растворы для инъекций могут иметь следующий состав:
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СОЕДИНЕНИЯ 2-АРИЛТИАЗОЛА В КАЧЕСТВЕ АГОНИСТОВ PPAR α И PPAR γ | 2003 |
|
RU2296754C2 |
| ЗАМЕЩЕННЫЕ КАРБОНОВЫМИ КИСЛОТАМИ ОКСАЗОЛОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ PPAR-АЛЬФА И ГАММА-АКТИВАТОРОВ ПРИ ЛЕЧЕНИИ ДИАБЕТА | 2002 |
|
RU2278859C2 |
| N-ЗАМЕЩЕННЫЕ 1Н-ИНДОЛ-5-ПРОПИОНОВЫЕ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭТИ СОЕДИНЕНИЯ, И ИХ ПРИМЕНЕНИЕ (ВАРИАНТЫ) | 2003 |
|
RU2296759C2 |
| ИНДОЛИЛПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2315767C2 |
| ЗАМЕЩЕННЫЕ 4-АЛКОКСИОКСАЗОЛПРОИЗВОДНЫЕ В КАЧЕСТВЕ АГОНИСТОВ PPAR | 2003 |
|
RU2312106C2 |
| ГЕКСАФТОРИЗОПРОПАНОЛ-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПРОСТЫХ ЭФИРОВ | 2005 |
|
RU2383524C2 |
| ФЕНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ PPAR АГОНИСТОВ | 2004 |
|
RU2374230C2 |
| ФЕНИЛГЛИЦИНОВЫЕ ПРОИЗВОДНЫЕ | 1999 |
|
RU2198871C1 |
| ПРОИЗВОДНЫЕ ОКСАДИАЗОЛОНА В КАЧЕСТВЕ АГОНИСТОВ PPAR-ДЕЛЬТА | 2005 |
|
RU2374243C2 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ СЕНСИБИЛИЗАТОРОВ ИНСУЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АКТИВИРУЮЩИМ ДЕЙСТВИЕМ В ОТНОШЕНИИ PRARα И/ИЛИ PRARγ | 2003 |
|
RU2295520C2 |
Изобретение относится к новым соединеним формулы (I) и их фармацевтически приемлемым солям и/или фармацевтически приемлемым сложным эфирам. Соединения настоящего изобретения обладают свойствами агонистов рецепторов, активированных пролифератором пароксисомы (PPAR агонистов) и могут найти применение для лечения таких заболеваний, как сахарный диабет, гипертония, атеросклеротические заболевания и т.д. В общей формуле (I)
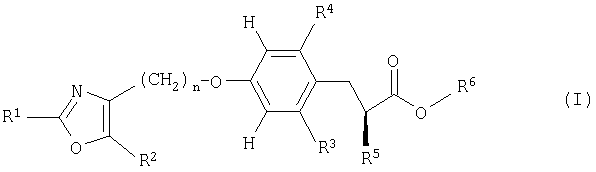
R1 представляет собой фенил, необязательно моно-, ди- или тризамещенный галогеном, низшим алкилом, фтор-(низшим алкилом), низшим алкокси; R2 представляет собой водород или низший алкил; R3 и R4 независимо друг от друга представляют собой водород, гидрокси, галоген, низший алкил, фтор-(низший алкил), низший алкокси, где по меньшей мере один из радикалов R3 и R4 не представляет собой водород; R5 представляет собой низший алкокси; R6 представляет собой водород или низший алкил; n равно 1. Изобретение также относится к фармкомпозиции на основе соединений изобретения. 2 н. и 17 з.п. ф-лы, 1 табл.
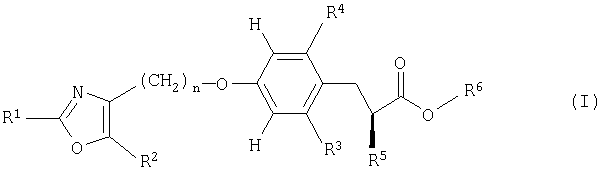
в которой
R1 представляет собой фенил, необязательно моно-, ди- или тризамещенный галогеном, низшим алкилом, фтор-низшим алкилом, низшим алкокси;
R2 представляет собой водород или низший алкил;
R3 и R4 независимо друг от друга представляют собой водород, гидрокси, галоген, низший алкил, фтор-(низший алкил), низший алкокси,
где по меньшей мере один из радикалов R3 и R4 не представляет собой водород;
R5 представляет собой низший алкокси;
R6 представляет собой водород или низший алкил;
n равно 1;
и их фармацевтически приемлемые соли и/или фармацевтически приемлемые сложные эфиры.
(S)-2-этокси-3-[2-метил-4-(5-метил-2-о-толилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропоксифенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-[2-метил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-2-этокси-3-{2-этил-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}пропионовая кислота,
(S)-2-этокси-3-[2-фтор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]пропионовая кислота,
(S)-3-[2-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(4-фтор-3-метилфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-3-{2-хлор-4-[2-(2-фторфенил)-5-метилоксазол-4-илметокси]фенил}-2-этоксипропионовая кислота,
(S)-2-этокси-3-[4-(5-метил-2-фенилоксазол-4-илметокси)-2-трифторметилфенил]пропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2-метоксифенил}пропионовая кислота,
(S)-3-[2,6-диметил-4-(5-метил-2-фенилоксазол-4-илметокси)фенил]-2-этоксипропионовая кислота,
(S)-2-этокси-3-{4-[2-(4-изопропилфенил)-5-метилоксазол-4-илметокси]-2,6-диметилфенил}пропионовая кислота,
(S)-2-этокси-3-{4-[2-(3-метоксифенил)оксазол-4-илметокси]-2-метилфенил}пропионовая кислота,
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-этоксифенил}-2-этоксипропионовая кислота, и
(S)-3-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-илметокси]-2-изопропоксифенил}-2-этоксипропионовая кислота,
и их фармацевтически приемлемые соли и/или их фармацевтически приемлемые сложные эфиры.
| Огнетушитель | 0 |
|
SU91A1 |
| ПРОИЗВОДНЫЕ ПРОПИОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2174121C2 |
| Резервуар для керосиновых ламп типа "Примус" | 1924 |
|
SU1403A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 00/08002, 17.02.2000 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2007-07-27—Публикация
2003-10-06—Подача