ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к растению ячменя с пониженной активностью ветвящего крахмал фермента (SBE, starch branching enzyme), IIa (SBEIIa) в эндосперме, приводящей к повышению относительного содержания амилозы в зерновом крахмале. Изобретение также относится к зерну и к крахмалу, а также к пищевым и непищевым продуктам, полученным из них.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
У зерновых культур крахмал составляет примерно до 45-65% массы зрелого зерна. Крахмал состоит из двух типов молекул, амилозы и амилопектина. Амилоза представляет собой по существу линейную молекулу, состоящую из α-1,4-сшитых гликозидных цепей, тогда как амилопектин является высокоразветвленной молекулой с α-1,6-гликозидными связями, сшивающими линейные цепи.
Синтез крахмала в эндосперме высших растений осуществляется группой ферментов, катализирующих четыре ключевые стадии. Во-первых, АДФ-глюкозофосфорилаза активирует мономерный предшественник крахмала посредством синтеза АДФ-глюкозы из G-1-P (глюкозо-1-фосфата) и АТФ. Во-вторых, активированный донор гликозила, АДФ-глюкоза, переносится синтазами крахмала к не восстанавливающему концу уже существующей связи α-1-4. В-третьих, ферменты, ветвящие крахмал, вводят точки ветвления посредством расщепления района α-1,4-сшитого глюкана с последующим переносом расщепленной цепи на акцепторную цепь с образованием новой α-1,6-связи. Ферменты, ветвящие крахмал, являются единственными ферментами, которые могут вводить α-1,6-сшивки в α-полиглюканы и, следовательно, играют существенную роль в образовании амилопектина. Наконец, ферменты, удаляющие разветвление крахмала, удаляют некоторые разветвляющие связи, хотя механизм, посредством которого они действуют, не выяснен (Myers et al., 2000).
Хотя ясно, что по меньшей мере эти четыре активности необходимы для нормального синтеза крахмальной гранулы у высших растений, в эндосперме высших растений обнаружены множественные изоформы каждой из этих четырех активностей, и для индивидуальных изоформ предложены конкретные роли на основании мутационного анализа (Wang et al., 1998, Buleon et al., 1998) или посредством модификации уровней экспрессии гена с использованием трансгенных подходов (Abel et al., 1996, Jobling et al., 1999, Scwall et al., 2000). Однако точный вклад каждой изоформы каждой активности в биосинтез крахмала до сих пор неизвестен, и не известно, имеются ли существенные различия в этих вкладах между видами. В эндосперме зерновых присутствует две формы АДФ-глюкозофосфорилазы, одна форма внутри амилопласта и одна форма в цитоплазме (Denyer et al., 1996, Thorbjomsen et al., 1996). Каждая форма состоит из двух типов субъединиц. Морщинистый (sh2) и ломкий (bt2) мутанты у кукурузы представляют собой повреждения в большой и малой субъединицах соответственно (Girouz and Hannah, 1994). В эндосперме зерновых обнаружено четыре класса синтазы крахмала, одна изоформа, которая локализована исключительно внутри крахмальной гранулы, гранулосвязанная синтаза крахмала (GBSS), две формы, которые распределены между гранулой и растворимой фракцией (SSI, Li et al., 1999a, SSII, Li et al., 1999b), и четвертая форма, которая полностью локализована в растворимой фракции (SSIII, Сао et al., 2000, Li et al., 1999b, Li et al., 2000). Показано, что GBSS является существенной для синтеза амилозы (Shure et al., 1983), и показано, что мутации в SSII и SSIII изменяют структуру амилопектина (Gao et al., 1998, Craig et al., 1998). Мутации, определяющие роль активности SSI, не описаны.
В эндосперме зерновых экспрессируется три формы ветвящего фермента: ветвящий фермент I (SBEI), ветвящий фермент IIa (SBEIIa) и ветвящий фермент IIb (SBEIIb) (Hedman and Boyer, 1982, Boyerand Preiss, 1978, Mizuno et al., 1992, Sun et al., 1997). Показано, что у кукурузы и риса высокоамилозные фенотипы являются результатом повреждений в гене SBEIIb, также известном как ген amylose extender (ae) (Boyer and Preiss, 1981, Mizuno et al., 1993, Nishi et al., 2001). У этих мутантов по SBEIIb крахмальные гранулы эндосперма проявляли аномальную морфологию, содержание амилозы было в значительной степени повышено, частота разветвлений остаточного амилопектина была снижена, и доля коротких цепей (<DP17, особенно DP8-12) была низкой. Кроме того, температура клейстеризации крахмала была повышена. В дополнение к этому присутствовал значительный объем вещества, которое определили как «промежуточное» между амилозой и амилопектином (Boyer et al., 1980, Takeda et al., 1993b). Напротив, мутанты растений кукурузы по гену SBEIIa вследствие мутаторного (Mu) инсерционного элемента и, следовательно, с недостаточной экспрессией белка SBEIIa были неотличимы от растений дикого типа по разветвлению крахмала эндосперма (Blauth et al., 2001), хотя у них был изменен крахмал листьев. Подобным образом растения риса с дефицитом активности SBEIIa не проявляли значительного изменения профиля цепей амилопектина в эндосперме (Nakamura, 2002).
У кукурузы мутация dull1 вызывает пониженное содержание крахмала и повышенные уровни амилозы в эндосперме со степенью изменения в зависимости от генетического фона, а также повышенную степень разветвления остаточного амилопектина (Shannon and Garwood, 1984). Ген, соответствующий этой мутации, был идентифицирован и выделен путем стратегии мечения транспозоном с использованием транспозона-мутатора (Mu), и показано, что он кодирует фермент, обозначенный как синтаза крахмала II (SSII) (Gao et al., 1998). В настоящее время этот фермент признают членом семейства SSIII у зерновых. Мутантный эндосперм имеет пониженные уровни активности SBEIIa, ассоциированные с мутацией dull1. У других зерновых соответствующая мутация не описана. Неизвестно, имеют ли отношение эти открытия к другим зерновым, например к ячменю.
В WO 94/09144 предложено использование смысловых и антисмысловых генов для изменения природных соотношений синтазы крахмала (SS) и SBE у кукурузы. Однако не представлены данные, подтверждающие предложенные молекулярные стратегии, и отсутствует предложение по специфичному снижению активности SBEIIa.
У картофеля негативная регуляция одного SBEI оказывает минимальные воздействия на структуру крахмала (Filpse et al., 1996), хотя в следующей работе идентифицированы качественные изменения (Safford et al., 1998).
Однако у картофеля негативная регуляция SBEI и SBEII в сочетании повышала относительное содержание амилозы значительно больше, чем негативная регуляция одного SBEII (Schwall et al., 2000).
У высших растений присутствует два типа ферментов, удаляющих разветвление, и они определены на основании их субстратной специфичности как ферменты, удаляющие разветвление, типа изоамилазы, и ферменты, удаляющие разветвление, типа пуллуланазы (Myers et al., 2000). Мутации Sugary-1 у кукурузы и риса ассоциированы с недостаточностью обоих ферментов, удаляющих разветвление (James et al., 1995, Kubo et al., 1999), однако причинная мутация картируется в той же локализации, что и ген фермента, удаляющего разветвление, типа изоамилазы. У мутанта sta-7 Chlamydomonas (Mouille, 1996), аналога мутации sugary-1 кукурузы, негативно регулируется только изоамилазная активность. Гены биосинтеза крахмала, которые клонированы из зерновых, перечислены в таблице 1.
Крахмал широко используют в пищевой, бумажной и химической промышленности. Физическая структура крахмала может оказывать существенное влияние на питательные и технологические свойства крахмала для пищевых или непищевых промышленных продуктов. В качестве показателя структуры крахмала можно рассматривать несколько характеристик, включая распределение цепей амилопектина по длине, степень кристалличности и наличие форм кристалличности, таких как V-комплексная форма кристалличности крахмала. Длина цепи амилопектина может быть показателем измененной кристалличности и измененной клейстеризации, и также считают, что она коррелирует с пониженной ретроградацией амилопектина. Кроме того, считают, что измененное распределение цепей амилопектина по длине отражает органолептические свойства пищевых продуктов, в которые этот крахмал включен в значительных количествах. Пониженная кристалличность крахмала может также быть показателем пониженной температуры клейстеризации крахмала, и считают, что она связана с улучшенными органолептическими свойствами.
Относительно высокая температура клейстеризации большинства высокоамилозных крахмалов является недостатком для некоторых пищевых применений. Температура клейстеризации отражает энергию измельчения, необходимую для обработки таких пищевых продуктов. Для обработки зерна или муки для производства пищевых продуктов из таких зерен или крахмалов обычно необходимы более высокие температуры. Поэтому продукты, содержащие высокоамилозные крахмалы, являются, как правило, более дорогостоящими. Кроме того, для приготовления этих произведенных пищевых продуктов или для приготовления пищи из муки, содержащей высокоамилозные крахмалы, потребителю может понадобиться затратить больше времени и использовать более высокие температуры. Высокоамилозные крахмалы, имеющие пониженные или нормальные температуры клейстеризации, имели бы преимущество во многих пищевых применениях.
Состав крахмала, в частности, в форме, называемой устойчивым крахмалом, весьма важен для здоровья кишечника, в частности для здоровья толстого кишечника. Соответственно, у некоторых хлебных злаков, таких как кукуруза, разработаны высокоамилозные крахмалы для использования в пищевых продуктах как средства, способствующие здоровью кишечника. Благоприятные эффекты устойчивого крахмала являются результатом обеспечения питания толстого кишечника, где кишечная микрофлора получает источник энергии, который подвергается ферментации с образованием среди прочего жирных кислот с короткой цепью. Эти жирные кислоты с короткой цепью обеспечивают питательные вещества для колоноцитов, усиливают захват некоторых питательных веществ через толстый кишечник и способствуют физиологической активности ободочной кишки. Как правило, если не обеспечивать устойчивые крахмалы или другое диетическое волокно, ободочная кишка относительно неактивна в метаболизме.
Другим питательным компонентом хлебных злаков и, в частности, ячменя является β-глюкан. β-Глюкан состоит из глюкозных единиц, связанных β (1-4) и/или β (1-3) гликозидными сшивками, и не разрушается человеческими пищеварительными ферментами, что делает его пригодным в качестве источника диетического волокна. β-Глюканы могут частично подвергаться ферментативному гидролизу эндогенными бактериями ободочной кишки, в процессе ферментации которых образуются жирные кислоты с короткой цепью (преимущественно ацетат, пропионат и бутират), которые полезны для клеток слизистой оболочки, выстилающих тонкий кишечник и ободочную кишку (Sakata and Engelhard, 1983). Поглощение β-глюкана также обладает эффектом повышения выделения желчных кислот, приводящим к снижению суммарного сывороточного холестерина и липопротеинов низкой плотности (ЛПНП), что уменьшает риск ишемической болезни сердца. Подобным образом β-глюкан действуют посредством ослабления сдвигов концентрации глюкозы в крови после приема пищи. Считают, что эти эффекты могут быть также основаны на повышении вязкости содержимого желудка и тонкого кишечника.
Хотя модифицированные крахмалы или β-глюканы, например, можно использовать в пищевых продуктах, которые обеспечивают функционирование, в норме не обеспечиваемое немодифицированными источниками, такая обработка имеет тенденцию либо изменять другие важные компоненты, либо является нежелательной вследствие процессов, вовлеченных в модификацию. Следовательно, предпочтительно обеспечить источники составных частей, которые можно использовать в пищевых продуктах в немодифицированной форме.
Ячмень (Hordeum vulgare) является четвертой из наиболее широко распространенных зерновых культур, культивируемой во всем мире и относительно недостаточно используемой в плане потребления человеком, кроме использования в производстве алкогольного пива. В среднем зерно ячменя содержит примерно 64% крахмала, 11% белка и 5% β-глюкана (обычно 3-6%). Остальные 20% включают влагу, волокно и другие минорные компоненты.
Известные вариации в структуре крахмала ячменя ограничены относительно вариаций, доступных у кукурузы. Мутанты по SBEIIb, соответствующие фенотипам amylose extender у кукурузы или риса, у ячменя не охарактеризованы. Фенотип, придаваемый мутациями SBEIIa или SBEIIb, у ячменя неизвестен. Наиболее хорошо охарактеризованными мутациями являются мутация waxy и высокоамилозная мутация, идентифицированная как АС38. High Amylose Glacier (AC38) имеет относительно умеренное повышение содержания амилозы до максимума примерно 45% от суммарного крахмала. Двойные мутанты с фенотипом waxy также сконструированы и охарактеризованы (Schondelmaier et al., 1992; Fujita et al., 1999).
Идентифицированы другие мутанты ячменя, имеющие высокое содержание амилозы в крахмале. Химически индуцированные мутанты по гену SSIIa имели более высокие уровни амилозы в зерновом крахмале, примерно до 65-70% (WO 02/37955 А1). Мутанты М292 и М342 также показали существенно сниженную среднюю массу зерна как следствие пониженного синтеза крахмала от средней массы примерно 51 мг для родительской линии Himalaya до 32 и 35 мг для М292 и М342 соответственно. Хотя эти мутанты сохранили длину и толщину зерна дикого типа, они были выровнены от 2,8 мм средней толщины для Himalaya до 1,6-1,8 мм и имели центральную по существу незаполненную область, что привело в результате к худшим характеристикам измельчения. Обнаружено, что отношение длины зерна (L) к толщине (Т) является полезным диагностическим параметром для мутантных аллелей, причем мутантные семена и семена дикого типа имеют отношение LT более 3,5 и менее 3,5 соответственно. Содержание крахмала мутантных линий было снижено от 49,0% для Himalaya до 17,7 и 21,9% для М292 и М342 соответственно. Было показано, что хотя имело место снижение содержания амилозы на зерно от 6,2 мг на зерновку до 4,0 и 4,8 мг у М292 и М342 соответственно, но при этом имело место резкое снижение содержания амилопектина на зерновку от 18,7 у Himalaya до 1,6 и 2,9 мг у мутантов. Это показывает, что относительно высокий уровень амилозы был результатом сниженного продуцирования амилопектина. Уровни зернового β-глюкана были повышены у мутантов более чем до 10%. Крахмал проявлял пониженные температуры клейстеризации. Мутанты SBEIIa имели измененное распределение активностей SBEIIa и SBEIIb между крахмальной гранулой и растворимыми фракциями эндосперма, однако они были по существу не изменены по уровню активностей в эндосперме в целом (WO 02/37955; Morell et al., 2003).
Хотя крахмалы с повышенным содержанием амилозы этих типов полезны, крахмал ячменя с более высоким содержанием амилозы предпочтителен, в частности, если это связано с улучшенным синтезом крахмала и другими характеристиками, например меньшей необходимостью в модификации после сбора. Такие крахмальные продукты также относительно устойчивы к перевариванию и приносят большую пользу здоровью.
ОБЩИЕ ПОЛОЖЕНИЯ
Специалистам в данной области техники должно быть понятно, что изобретение, описанное здесь, является предметом вариаций и модификаций, иных, чем описанные конкретно. Должно быть понятно, что изобретение, описанное здесь, включает все такие вариации и модификации. Изобретение также включает все такие стадии, признаки, композиции и соединения, относящиеся к данному описанию или указанные в нем, индивидуально или в совокупности, а также все и любые комбинации любых двух или более чем двух указанных стадий или признаков.
На протяжении всего описания, если в контексте не требуется иное, слово «содержать» и варианты, такие как «содержит» и «содержащий», следует понимать как подразумевающее включение определенного целого или стадии либо группы неких целых или стадий, но не исключение любого другого целого или стадии либо любой другой группы целых или стадий. Настоящее изобретение не следует ограничивать в объеме конкретными воплощениями, описанными здесь, которые предназначены только в целях приведения примеров. Функционально эквивалентные продукты, композиции и способы явно находятся в пределах объема изобретения, как описано здесь.
Библиографические детали публикаций, на которые ссылается автор в данном описании, представлены в конце описания. Ссылки, упомянутые здесь, включены здесь путем ссылки в их полных объемах. Сделанные здесь ссылки на уровень техники, включая любой один или более чем один документ уровня техники, не следует понимать как подтверждение или предположение, что указанный уровень техники является общеизвестным в Австралии или образует часть общеизвестного в Австралии.
Как его используют здесь, термин «получен (происходит) от» следует понимать как указание на то, что конкретное целое или группа целых имеют происхождение от указанных видов, но они не обязательно были получены непосредственно из указанного источника.
Обозначение нуклеотидных остатков, относящееся сюда, является таким, как рекомендовано Биохимической Номенклатурной Комиссией IUPAC-IUB, где А представляет собой аденин, С представляет собой цитозин, G представляет собой гуанин, Т представляет собой тимидин.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Первый аспект изобретения касается зерна, полученного от растения ячменя, которое имеет пониженный уровень активности фермента SBEIIa в эндосперме, причем крахмал указанного зерна имеет относительное содержание амилозы по меньшей мере 40% (мас./мас.). Относительное содержание амилозы может предпочтительно быть выше, чем 50% или 75%, и предпочтительно зерно является неморщинистым.
Второй аспект изобретения касается зерна ячменя, содержащего крахмал, имеющий относительное содержание амилозы по меньшей мере 75% (мас./мас.).
В третьем аспекте изобретение относится к муке или муке из цельного зерна, полученной из зерна первого или второго аспектов изобретения, или к пищевым продуктам, включающим такую муку или муку из цельного зерна.
В четвертом аспекте изобретение относится к крахмалу, полученному из зерна растения ячменя, которое имеет пониженный уровень активности фермента SBEIIa в эндосперме, причем указанный крахмал является немодифицированным и имеет относительное содержание амилозы по меньшей мере 40% (мас./мас.). В конкретной форме четвертого аспекта растение ячменя дополнительно имеет пониженный уровень активности фермента SBEIIb в эндосперме.
В пятом аспекте изобретение относится к композиции, содержащей крахмал согласно четвертому аспекту изобретения и другой пищевой ингредиент или воду.
В шестом аспекте изобретение относится к композиции, содержащей крахмальные гранулы эндосперма ячменя и другой пищевой ингредиент или воду, где крахмал этих крахмальных гранул содержит по меньшей мере 75% (мас./мас.) амилозы.
В седьмом аспекте изобретение относится к растению ячменя, имеющему пониженный уровень активности фермента SBEIIa, где крахмал в зерне этого растения ячменя имеет относительное содержание амилозы по меньшей мере 40% (мас./мас.) или предпочтительно по меньшей мере 50% или по меньшей мере 75%.
В восьмом аспекте изобретение относится к способу получения растения ячменя с пониженным уровнем активности фермента SBEIIa в эндосперме, причем крахмал зерна этого растения ячменя имеет содержание амилозы по меньшей мере 40% (мас./мас.), включающему стадии (а) введения генетической вариации в родительское растение ячменя и (б) идентификации растений или семян-потомков этого родительского растения ячменя, которые имеют пониженную активность SBEIIa.
В девятом аспекте изобретение относится к способу получения растения ячменя, имеющего пониженную активность ферментативных активностей как SBEIIa, так и SBEIIb в эндосперме, включающему: (а) мутагенез семян от растения, имеющего пониженную активность ферментативной активности SBEIIa; или (б) мутагенез семян от растения, имеющего пониженную активность ферментативной активности SBEIIb; или (в) скрещивание растения, имеющего пониженную активность фермента SBEIIa, с растением, имеющим пониженную активность фермента SBEIIb; и идентификацию растения ячменя, имеющего пониженную активность и SBEIIa, и SBEIIb.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1. Нуклеотидная последовательность кДНК SBEIIa ячменя (SEQ ID No. 1).
Фиг.2. Нуклеотидная последовательность кДНК SBEIIb ячменя (SEQ ID No. 2).
Фиг.3. Последовательность гена разветвляющего крахмал фермента IIa (SEQID No. 3) (wSBEII-D1) из A. tauschii, соответствующего гену SBEIIa генома D гексаплоидной пшеницы (Т. aestivum).
Фиг.4. Частичная последовательность гена SBEIIb пшеницы (SEQ ID No. 4) (wbe2b геномный).
Фиг.5. Схематические конструкции дуплекс-РНК. А. Использованный порядок элементов гена: промотор, последовательность гена SBEIIa или SBEIIb (экзоны 1, 2 и 3) в смысловой ориентации, интрон (интрон 3), последовательность гена SBEIIa или SBEIIb (экзоны 1, 2, 3 и 4) в антисмысловой ориентации и последовательность терминатора транскрипции/полиаденилирования. Б. Транскрипт генов ds-SBEIIa и ds-SBEIIb образует «шпилечную» структуру РНК с двунитевым районом, образованным в результате гибридизации между смысловой и антисмысловой последовательностями. Интронная последовательность, ограниченная нуклеотидами G и AG, подвергнута сплайсингу.
Фиг.6. ПЦР анализ линий ячменя, трансгенных по ds-SBEIIa и ds-SBEIIb. Для идентификации положительных трансгенных линий использовали пары праймеров BX17F/AR2bkpnR для SBEIIb и BX17F/AR2akpnR для SBEIIa, которые амплифицируют первый и второй фрагменты соответствующих конструкций, которые включают экзоны 1, 2, 3 и интрон 3 (смысловая ориентация). GP означает нетрансформированный Golden Promise. Центральная дорожка показывает маркеры молекулярного размера.
Фиг.7. Саузерн-блот-анализ линий ячменя, трансгенных по ds-SBEIIa и ds-SBEIIb. А. Положительные трансгены ячменя ds-SBEIIa, как показано с помощью блот-гибридизации по Саузерну. Ожидаемый размер полосы составляет 1836 п.о. Б. Положительные трансгены ячменя ds-SBEIIb, как показано способом Саузерна. Ожидаемый размер полосы - 1907 п.о. GP означает Golden Promise (отрицательный контроль).
Фиг.8. Вестерн-блот-анализ линий ячменя, трансгенных по ds-SBEIIa и ds-SBEIIb. Десять семян Т1 (семена от растений ТО) линий IIb 4.3 и IIb 4.4 анализировали на экспрессию SBEIIb с помощью Вестерн-блот-анализа, используя электрофорез в ПААГ в неденатурирующих условиях и специфичное антитело к SBEIIb. Дорожка 1 (+) представляет собой положительный контроль, сорт Glacier.
Фиг.9. Вестерн-блот-анализ линий ячменя, трансгенных по ds-SBEIIa и ds-SBEIIb. Десять семян Т1 (семена от растений Т0) линии IIa 4.1 анализировали на экспрессию A. SBEIIa или Б. SBEIIb с помощью Вестерн-блот-анализа, используя электрофорез в ПААГ в неденатурирующих условиях и специфичные антитела к SBEIIa или к SBEIIb. Дорожки на обоих гелях представляют одни и те же семена. Дорожка 1 (+) на каждой панели представляет собой положительный контроль, сорт Glacier.
Фиг.10. Вестерн-блот-анализ трансгенных линий ячменя ds-SBEIIa и ds-SBEIIb. Десять семян Т1 (семена от растений ТО) линии IIb 4.1 анализировали на экспрессию А. SBEIIb или Б. SBEIIa с помощью Вестерн-блот-анализа, используя электрофорез в ПААГ в неденатурирующих условиях и специфичные антитела к SBEIIb или к SBEIIa. Дорожки на обоих гелях представляют одни и те же семена. Дорожка 1 (+) на каждой панели представляет собой положительный контроль, сорт Glacier.
Фиг.11. Морфология крахмальных гранул трансгенного ячменя ds-SBEIIa. Крахмальные гранулы из отдельных семян визуализировали посредством световой микроскопии из обоих трансгенных семян, ds-SBEIIa и ds-SBEIIb. Фиг.11А, семя с экспрессией SBEIIa дикого типа (дорожка IIa 4.2.3). Фиг.11Б, семя с отсутствием экспрессии SBEIIa (дорожка IIa 4.2.5). Наблюдали значительные морфологические изменения в крахмале из семян с отсутствием SBEIIa, но не SBEIIb.
Фиг.12. Сканирующая электронная микроскопия (СЭМ) крахмальных гранул. А. крахмальные гранулы дикого типа (дорожка IIa 4.2.3), Б. и В. - из трансгенного эндосперма ds-SBEIIa (дорожка IIa 4.2.5). Крахмальные гранулы из семени ds-SBEIIb (SBEIIb инактивирован) не кажутся морфологически измененными по сравнению с диким типом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изменение SBEIIa у ячменя
Изобретение основано на открытии того, что снижение активности SBEIIa в эндосперме ячменя приводит в результате к модифицированному продуцированию крахмала, в частности к высокой аккумуляции амилозы в зерне ячменя. Этот неожиданный результат противоречит открытиям у кукурузы и риса, где мутация в SBEIIa не изменяет профиль амилопектина (Blauth et al., 2001, Nakamura, 2000). Предпочтительно существует изменение в одной или более чем одной дополнительной ферментативной активности биосинтеза крахмала, и более предпочтительно снижение как в SBEIIb, так и в SBEIIa. Также предпочтительно зерно этого растения ячменя является неморщинистым.
Способ получения растения ячменя
В одном аспекте в изобретении предложен способ снижения активности ветвящего крахмал фермента IIa (SBEIIa) в эндосперме ячменя. Снижение активности может быть по меньшей мере на 40% или, возможно, предпочтительно по меньшей мере на 50% по сравнению с уровнем активности в эндосперме немодифицированного (контрольного) ячменя, более предпочтительно по меньшей мере на 75%, и даже более предпочтительно по меньшей мере на 90% или 95%. Этот способ может включать изменение экспрессии гена SBEIIa ячменя либо он может включать мутацию гена SBEIIa ячменя, где активность SBEIIa в эндосперме понижена.
Этот способ может включать стадию определения активности SBEIIa в эндосперме ячменя предпочтительно путем измерения уровня белка, например путем иммунологического обнаружения, или уровня его соответствующей мРНК способами, хорошо известными в данной области техники, такими как блот-гибридизационный анализ по Норзерну или полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Этот способ может дополнительно включать стадию отбора или скрининга на растение ячменя или зерно, имеющее пониженную активность SBEIIa в его эндосперме. Стадия отбора может быть основана на пониженном уровне активности SBEIIa или белка, либо она может быть основана на фенотипе зерна растения ячменя, таком как повышенное содержание амилозы или пониженное содержание амилопектина, либо на визуальном фенотипе, например морщинистом зерне.
Активность SBE можно измерить с помощью ферментативного анализа, например с помощью анализа фосфорилазной стимуляции (Boyer and Preiss, 1978). Этот анализ измеряет стимуляцию посредством SBE включения глюкозо-1-фосфата в нерастворимый в метаноле полимер (α-D-глюкан) фосфорилазой а. Активность SBE можно измерить с помощью анализа йодного окрашивания, который измеряет снижение поглощения комплекса глюкан-полийод, образующегося в результате разветвления глюкановых полимеров. Активность SBE можно также оценивать с помощью анализа связи разветвлений, который измеряет образование восстанавливающих концов из восстановленной амилозы в качестве субстрата после ферментативного гидролиза изоамилазой (Takeda et al., 1993a). Предпочтительно активность измеряют в отсутствие активности SBEI или SBEIIb. Изоформы SBE показывают различные субстратные специфичности, например SBEI проявляет более высокую активность в разветвлении амилозы, тогда как SBEIIa и SBEIIb показывает более высокие скорости разветвления с амилопектиновым субстратом. Эти изоформы можно также различить на основании длины глюкановой цепи, которая переносится.
В следующем аспекте в изобретении предложен способ снижения активности множественных ферментативных активностей биосинтеза крахмала в эндосперме ячменя, где одной из активностей является SBEIIa. Предпочтительно понижены активности как SBEIIa, так и SBEIIb, и даже более предпочтительно активность SBEI также понижена. Другими ферментативными активностями биосинтеза крахмала, которые могут быть понижены в комбинации с SBEIIa, являются: SSI, SSII, SSIII. Также могут быть изменены ферменты, удаляющие разветвление крахмала, например, активность изоамилазы или пуллуланазы. В следующем воплощении активности ферментативных активностей биосинтеза крахмала могут быть изменены у растения в тканях, иных, чем эндосперм, например активность SBEI или SBEII может быть повышена в листьях для компенсации некоторой потери активности, вызванной трансгеном, кодирующим SBEIIa-ингибиторную молекулу, предназначенным, прежде всего, для экспрессии в эндосперме. Альтернативно синтез крахмала может быть дополнительно улучшен путем сверхэкспрессии одного или более чем одного фермента биосинтеза крахмала в комбинации с понижением SBEIIa. Гены, кодирующие такие ферменты, могут происходить из любых источников, например из бактериальных или других источников, иных, нежели ячмень, и они могут быть модифицированы в направлении изменения каталитических свойств, например изменения температурной зависимости ферментов (WO 94/09144).
В следующем аспекте в изобретении предложен способ повышения уровня амилозы (в виде процента от крахмала) в зерне ячменя, включающий стадию понижения активности SBEIIa в эндосперме ячменя. Содержание амилозы предпочтительно составляет по меньшей мере 50%, более предпочтительно по меньшей мере 60% и даже более предпочтительно - по меньшей мере 65, 75% или 70%. В следующих предпочтительных воплощениях изобретения этот способ, пример которого приведен здесь, обеспечивает содержание амилозы по меньшей мере 80% или 90%.
Высокоамилозный фенотип может быть достигнут с помощью частичного или полного прерывания экспрессии гена SBEIIa или генов SBEIIa и SBEIIb. Степень, в которой этот ген ингибирован, будет в некоторой степени определять характеристики крахмала, полученного из зерна ячменя. Любая из ряда методик гель-электрофореза, проводимого на белках, экстрагированных из модифицированного эндосперма ячменя, выявит природу и степень модификации в отношении активности SBEIIa и/или SBEIIb. Модификация может проявляться как понижение активности SBEIIa и/или SBEIIb, полное прекращение ферментативной активности или изменение в распределении SBEIIb или других ферментов внутри эндосперма. Для проведения этих тестов крахмал можно экстрагировать из эндосперма ячменя и анализировать белки, например, как описано в Rahman et al., 1995. Методики, хорошо известные в данной области техники, такие как ДСН-ПААГ электрофорез (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и иммуноблоттинг, проводят на растворимой фракции и фракции крахмальных гранул и идентифицируют растения ячменя, где произошли модификации в отношении ферментов SBEIIa и/или SBEIIb.
Растения ячменя
В следующем аспекте в изобретении предложено растение ячменя (Hordeum vulgare) с пониженным уровнем активности SBEIIa в эндосперме во время по меньшей мере некоторого развития зерна, причем это растение ячменя способно давать зерно, крахмал которого имеет высокое относительное содержание амилозы. Предпочтительно уровень SBEIIa понижен в эндосперме по меньшей мере на 50%, более предпочтительно по меньшей мере на 75% и наиболее предпочтительно - по меньшей мере на 90% или на 95% по сравнению с диким типом. Термин «дикий тип» имеет свое обычное значение в области генетики и включает сорта или генотипы ячменя, которые не модифицированы так, как описано здесь.
В изобретении также предложены растения и зерно потомства, которые обладают желаемыми характеристиками родителей.
Изобретение также охватывает растения ячменя, которые имеют измененную активность SBEIIb или другие ферментативные активности биосинтеза крахмала в дополнение к пониженной активности SBEIIa. Растения, имеющие пониженные активности SBEIIa и SBEIIb, могут быть получены путем скрещивания растения, пониженного по SBEIIa, с растением, пониженным по SBEIIb, либо путем введения трансгена, кодирующего молекулу, которая ингибирует экспрессию генов как SBEIIa, так и SBEIIb. Изобретение также охватывает мутацию(и) в других генетических фонах. Исходные измененные (мутантные) растения можно скрещивать с растениями, содержащими более желательный генетический фон. После исходного скрещивания можно провести подходящее число обратных скрещиваний для удаления менее желательного генетического фона. Желаемый генетический фон может включать подходящую комбинацию генов, обеспечивающих коммерческий выход и другие характеристики, такие как агротехника, устойчивость к абиотическому стрессу или зерно без пленки. Этот генетический фон может также включать другие измененные гены биосинтеза или модификации крахмала, например фенотип amylose extender или мутацию amo1 в ячмене High Amylose Glacier (ген неизвестен), мутацию waxy (обнаруженную, например, в сорте Waxiro), мутантный ген в высокоамилозном сорте МК6827 (доступен от USDA ARS National Small Grain Germplasm Research Facility Aberdeen, Idaho 831290 USA) или в высокоамилозных разновидностях М292 и М342 (мутация в гене SSIIa), либо гены-модификаторы. Кроме того, желательным может быть объединение других двойных и тройных мутаций с комбинациями вышеуказанных линий и в скрещиваниях с другими линиями ячменя, которые имеют морщинистый эндосперм, где причинный ген неизвестен.
Зерно
В изобретении также предложено зерно ячменя, содержащее крахмал, измененный по сравнению с диким типом. Этот измененный крахмал по меньшей мере частично является следствием пониженной активности SBEIIa во время развития эндосперма зерна ячменя. Это зерно содержит повышенные уровни амилозы в виде процента от суммарного крахмала и пониженное содержание амилопектина по сравнению с диким типом, который имеет примерно 25% амилозы и 75% амилопектина. Предпочтительно обе активности, SBEIIa и SBEIIb, понижены во время развития эндосперма. Еще более предпочтительно активность SBEI также понижена. Уровни амилозы, измеренные способами, хорошо известными в данной области техники, предпочтительно составляют по меньшей мере 50% от суммарного крахмала, более предпочтительно по меньшей мере 60% и еще более предпочтительно - по меньшей мере 65%, 70%, 75%, 80% или 90%. О повышенных уровнях амилозы может свидетельствовать аномальная морфология крахмальной гранулы, или потеря двойного лучепреломления гранул при наблюдении в световой микроскоп, или другими способами. Предпочтительно уровень амилозы измеряют йодометрическим способом, который может представлять собой спектрофотометрический способ (например, Morrison and Laignelet, 1983) или высокоэффективную жидкостную хроматографию (ВЭЖХ, например, Batey and Curtin, 1996).
Зерно растения ячменя может иметь повышенный уровень β-глюкана, который может быть связан с повышенным притоком углерода в синтез этого полимера, а не в синтез амилопектина. Альтернативно это зерно может иметь нормальные уровни β-глюкана, например в диапазоне 3,0-6,0% от массы зрелого зерна. Более предпочтительно зерно содержит как повышенные уровни амилозы, так и нормальные уровни β-глюкана. Такая комбинация является неожиданной, основанной на составе крахмала в зерне из ячменя, мутантного по SSIIa (WO 02/37955). Зерно может содержать крахмал, который имеет измененные температуры клейстеризации и/или измененные характеристики набухания во время и после клейстеризации. Это зерно также предпочтительно имеет неморщинистый фенотип.
В изобретении также предложена мука или мука простого помола, полученная из этого зерна. Она может быть необработанной или обработанной, например, путем фракционирования или отбеливания. В изобретении далее предложено зерно ячменя, пригодное для производства пищевых продуктов, полученное от растения ячменя, имеющего измененный уровень активности SBEIIa в эндосперме, причем крахмал указанного зерна имеет высокое содержание амилозы и пониженное содержание амилопектина. Кроме того, изобретение охватывает зерно, которое было обработано иными путями, так что это зерно может быть молотым, размельченным, обрушенным, плющеным или дробленым.
Крахмал
В другом аспекте в изобретении предложен крахмал, полученный из зерна растения ячменя, как описано выше, имеющего пониженный уровень активности SBEIIa в эндосперме, причем этот крахмал имеет повышенное содержание амилозы и пониженное содержание амилопектина. Предпочтительно понижены активности как SBEIIa, так и SBEIIb, и более предпочтительно активность SBEI также понижена. В другом аспекте в изобретении предложен крахмал, полученный из зерна растения ячменя, содержащий по меньшей мере 50% амилозы, предпочтительно по меньшей мере 60% амилозы и еще более предпочтительно - по меньшей мере 65%, 70%, 75%, 80% или 90% амилозы. Очищенный крахмал может быть получен из зерна способом размалывания, например способом влажного размалывания, который включает отделение крахмала от белка, жира и волокна. Исходным продуктом процесса размалывания является смесь или композиция крахмальных гранул, и изобретение, таким образом, охватывает такие гранулы. Крахмал этих гранул содержит по меньшей мере 50% амилозы, предпочтительно 70%, 75% или 80% амилозы.
Крахмал может содержать повышенный уровень устойчивого крахмала с измененной структурой, характеризующейся специфическими физическими характеристиками, включающими одну или более чем одну из группы, состоящей из физической недоступности для пищеварительных ферментов, причиной которой может быть высокое содержание β-глюкана, измененной морфологии крахмальных гранул, наличия существенного связанного с крахмалом липида, измененной кристалличности и измененного распределения цепей амилопектина по длине. Высокое содержание амилозы также вносит вклад в уровень устойчивого крахмала.
В изобретении также предложен крахмал из зерна приведенного в примере растения ячменя, содержащего повышенные количества диетического волокна, предпочтительно в сочетании с повышенным уровнем устойчивого крахмала. Это повышение также, по меньшей мере отчасти, является результатом высокого относительного уровня амилозы.
Способы снижения активности гена: Трансгены
Активность SBEIIa и, возможно, других генов биосинтеза или модификации крахмала предпочтительно изменяют путем введения генетической вариации в растение, которую можно осуществить путем встраивания трансгена в растение ячменя. «Генетическая вариация» означает любое изменение в геноме, которое в данном контексте влияет на активность SBEIIa, и включает мутации, такие как точечные мутации, замены, инверсии, транслокации и предпочтительно делеции, а также встраивание трансгенов. «Трансген», как на него ссылаются здесь, имеет свое обычное в области биотехнологии значение и включает генетическую последовательность, которая получена или изменена с помощью технологии рекомбинантных ДНК или РНК и которая была введена в интересующий организм или клетку. Трансген может включать генетическую последовательность, полученную из этого организма или клетки, например антисмысловую последовательность. Трансген типично включает экзогенную нуклеиновую кислоту, которая не является полученной из указанного организма или клетки. «Трансгенный» относится к организму или клетке, содержащим трансген. «Нетрансгенный» относится к отсутствию какого-либо трансгена в геноме. Трансген предпочтительно интегрирован в геном организма или клетки для стабильного наследования.
Способ снижения активности SBEIIa может включать стадию встраивания трансгена в регенерируемую клетку ячменя и регенерации трансгенного растения ячменя из трансформированной клетки. Ветвящие ферменты, вовлеченные в синтез амилопектина, включают SBEI, SBEIIa и SBEIIb, и изобретение охватывает пониженную экспрессию одного SBEIIa или в сочетании с изменением экспрессии SBEIIb или SBEI. Следовательно, трансген(ы) может(гут) инактивировать более чем один из этих генов. Кроме того, инактивация SBEIIb и/или SBEI может быть прямой, при которой мишенью трансгена (например, кодирующего дуплексную РНК, антисмысловую или рибозимную РНК, смотри ниже) непосредственно является экспрессия гена SBEIIb или SSEI, либо он может косвенно приводить в результате к изменению экспрессии SBEIIb или SBEI. Например, мишенью трансгенной РНК может быть только ген SBEIIa/PHK в смысле идентичности последовательности или спаривания оснований, но она также приводит в результате к снижению SBEIIb или SBEI посредством изменения стабильности или распределения белка. Дополнительные формы настоящего изобретения относятся к сочетанию измененной активности SBEIIa и изменения одного или более чем одного из других ферментов синтеза амилопектина, которые могут включать SSI, SSII, SSIII и ферменты, удаляющие разветвление, такие как изоамилаза или пуллуланаза. Экспрессию любого из них или их всех можно изменить путем встраивания трансгена.
Для генов синтеза амилопектина у ячменя известно несколько последовательностей ДНК, любая из которых может быть основой для разработки трансгенов для инактивации этих генов у ячменя. Они включают SBEIIa (GenBank, номера по каталогу AF064562 и AF064560), SBEIIb (GenBank, номера по каталогу AF064563 и AF064561). Гомологи гена SBEI ячменя можно выделить, используя последовательности, основанные на последовательностях ДНК из других хлебных злаков, например, с помощью методик, изложенных в WO 99/14314, Li et al., для Triticum. Последовательность для SBEI Trincum tauschii, которая высоко гомологична гену SBEI генома D пшеницы и имеет высокую степень подобия гену ячменя, можно найти в публикации патентной заявки WO 99/14314 или ссылки, цитируемой здесь, и этот документ включен здесь путем ссылки. Последовательность SBEI пшеницы может быть доступна в базе данных GenBank, номер по каталогу AF076679. Гомологи других генов синтеза амилопектина из пшеницы или других близкородственных видов можно также использовать для модификации уровней экспрессии генов у ячменя. Такие гены или их фрагменты могут быть получены способами, хорошо известными в данной области техники, включая ПЦР амплификацию или гибридизацию с мечеными зондами.
Термин «жесткие условия гибридизации», как его используют здесь, означает, что гибридизация будет, как правило, проходить, если имеет место по меньшей мере 90%-ная и предпочтительно по меньшей мере 95%-ная идентичность последовательностей между зондом и последовательностью-мишенью. Примером жестких условий гибридизации является инкубация в течение ночи в растворе, содержащем 50% формамид, 5×SSC (1×SSC=150 мМ NaCl, 15 мМ тринатрийцитрат), 50 мМ фосфат натрия (рН 7,6), 5× раствор Денхардта, 10% декстрансульфат и 20 мкг/мл денатурированной фрагментированной ДНК-носителя, такой как ДНК спермы лосося, с последующей отмывкой подложки для гибридизации в 0,1×SSC примерно при 65°С. Другие условия гибридизации и отмывки хорошо известны, и их примеры приведены в Sambrook et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, NY (1989), в частности, в главе 11.
Район(ы) гомологии, используемые при получении трансгенной конструкции, должны иметь по меньшей мере 85%-ную идентичность соответствующему гену ячменя, предпочтительно по меньшей мере 90%-ную и еще более предпочтительно - по меньшей мере 95-100%-ную идентичность в соответствующем районе. Также предпочтительно, чтобы специфичной мишенью трансгена были гены синтеза амилопектина, экспрессирующиеся в эндосперме ячменя, и чтобы его воздействие на синтез амилопектина в других частях растения было меньшим или минимальным. Этого можно достичь путем использования подходящих регуляторных последовательностей, таких как специфичные для эндосперма промоторы в трансгене.
Антисмысловые
Генно-инженерные или трансгенные подходы к изменению, в частности к специфичному снижению, генной активности у растений хорошо известны в данной области техники. Эти способы введения генетической вариации в растение ячменя включают экспрессию соответствующей антисмысловой молекулы, которая комплементарна РНК гена-мишени и может гибридизоваться с ней. Считают, что антисмысловые молекулы препятствуют трансляции, либо процессингу, либо стабильности мРНК гена-мишени, инактивируя посредством этого его экспрессию. Способы получения антисмысловых последовательностей хорошо известны в данной области техники, и их примеры можно найти в патенте США №5190131, в описании к европейскому патенту 0467349-А1, в описании к европейскому патенту 0223399-А1 и в описании к европейскому патенту 0240208, которые включены здесь путем ссылки. Обзор использования антисмысловых методик у растений сделан Bourque (1995) и Senior (1998). Bourque перечисляет большое число примеров того, как антисмысловые последовательности были использованы в растительных системах в качестве способа инактивации гена. Она также установила, что достижение 100% ингибирования какой-либо ферментативной активности может быть необязательным, поскольку частичное ингибирование с большой вероятностью приведет в результате к измеримому изменению в системе. Senior (1998) установил, что антисмысловые методы в настоящее время являются хорошо разработанной техникой для манипуляции с экспрессией генов.
Антисмысловые молекулы для генов SBEIIa, SBEIIb, SBEI или других генов биосинтеза амилопектина ячменя могут быть основаны на последовательностях мРНК ячменя либо основаны на гомологиях с последовательностями ДНК или мРНК, полученных из других видов, например пшеницы. Эти антисмысловые последовательности могут соответствовать структурным генам или последовательностям, которые осуществляют регуляцию экспрессии гена или событие сплайсинга. Например, антисмысловая последовательность может соответствовать мишени кодирующего района гена SBEIIa или другого гена ячменя, либо 5'-нетранслируемому району (UTR), либо 3'-UTR, либо их комбинации. Она может быть комплементарна частично интронным последовательностям, которые могут подвергаться сплайсингу во время или после транскрипции, но предпочтительно только экзонным последовательностям гена-мишени. С учетом обычно большей дивергенции UTR выбор этих районов в качестве мишени обеспечивает более высокую специфичность ингибирования гена. Длина антисмысловой последовательности должна составлять по меньшей мере 19 соседних нуклеотидов, предпочтительно по меньшей мере 50 нуклеотидов и более предпочтительно - по меньшей мере 100, 200, 500 или 1000 нуклеотидов. Можно использовать полноразмерную последовательность, комплементарную полноразмерному транскрипту гена. Длина наиболее предпочтительно составляет 100-2000 нуклеотидов. Степень гомологии антисмысловой последовательности с транскриптом-мишенью должна составлять по меньшей мере 85%, предпочтительно по меньшей мере 90% и более предпочтительно - 95-100%. Молекула антисмысловой РНК может, конечно, содержать посторонние последовательности, которые могут функционировать как стабилизирующие молекулу.
Косупрессия
Другим молекулярно-биологическим подходом, который можно использовать, является косупрессия. Механизм косупрессии недостаточно хорошо понят, но считают, что в него вовлечено посттрансляционное молчание гена (PTGS, post-transcriptional gene silencing), и в этом отношении он может быть очень похож на многие примеры антисмысловой супрессии. Он включает введение в растение дополнительной копии гена или его фрагмента в смысловой ориентации по отношению к промотору для его экспрессии. Размер этого смыслового фрагмента, его соответствие районам гена-мишени и степень его гомологии с геном-мишенью такие же, как для описанных выше антисмысловых последовательностей. В некоторых случаях эта дополнительная копия последовательности гена препятствует экспрессии гена-мишени растения. В плане способов осуществления подходов косупрессии сделана ссылка на патентную заявку WO 97/20936 и описание к европейскому патенту 0465572.
Молчание гена, опосредованное двунитевой РНК
Следующим способом, который можно применять для введения генетической вариации в растение ячменя, является молчание гена, опосредованное дуплексной или двунитевой РНК. В данный способ также вовлечено PTGS. При данном способе вводят ДНК, которая направляет синтез по меньшей мере частично двунитевого(ых) РНК продукта(ов). ДНК, таким образом, содержит как смысловую, так и антисмысловую последовательности, которые при транскрипции в РНК могут гибридизоваться с образованием двунитевого района РНК. В предпочтительном воплощении смысловая и антисмысловая последовательности разделены спейсерным районом, который содержит интрон, который при транскрипции в РНК подвергается сплайсингу. Показано, что этот порядок приводит в результате к более высокой эффективности молчания гена. Двунитевой район может содержать одну или две молекулы РНК, транскрибируемые либо с одного, либо с двух районов ДНК. Присутствие этой двунитевой молекулы запускает ответ от эндогенной системы растения, который разрушает как двунитевую РНК, так и гомологичный РНК транскрипт гена-мишени растения, эффективно снижая или элиминируя активность этого гена-мишени. В плане способов применения этой методики сделана ссылка на описание к австралийскому патенту 99/292514-А и на описание к патентной заявке WO 99/53050. Длина смысловой и антисмысловой последовательностей, которые гибридизуются, должна в каждом случае составлять по меньшей мере 19 соседних нуклеотидов, предпочтительно по меньшей мере 50 нуклеотидов и более предпочтительно - по меньшей мере 100, 200, 500 или 1000 нуклеотидов. Можно использовать полноразмерную последовательность, соответствующую полноразмерному транскрипту гена. Длины наиболее предпочтительно составляют 100-2000 нуклеотидов. Степень гомологии смысловой и антисмысловой последовательностей с транскриптом-мишенью должна составлять по меньшей мере 85%, предпочтительно по меньшей мере 90% и более предпочтительно - 95-100%. Молекула РНК может, конечно, содержать посторонние последовательности, которые могут функционировать как стабилизирующие молекулу.
Рибозимы
Рибозимы можно использовать для введения генетической вариации, ответственной за инактивацию экспрессии желаемого гена у ячменя. Рибозимы представляют собой молекулы РНК с ферментативной или каталитической функцией, которые могут расщеплять другие молекулы РНК в специфичных сайтах, определенных одной или чаще двумя гибридизующимися последовательностями. Расщепление РНК инактивирует экспрессию гена-мишени. Рибозимы могут также действовать как антисмысловая молекула, которая может вносить вклад в инактивацию гена. Рибозимы содержат один или более чем один каталитический домен, предпочтительно типа головки молотка или шпильки, между гибридизующимися последовательностями. Можно использовать другие рибозимные мотивы, включая РНКазу Р, интроны группы I или II и типы вируса гепатита дельта. Сделана ссылка на описание к европейскому патенту 0321201 и патент США №6221661. Использование рибозимов для инактивации генов у трансгенных растений продемонстрировано, например Wegener et al. (1994).
Генетические конструкции/векторы
В изобретении также предложены выделенные молекулы нуклеиновой кислоты, включая РНК и предпочтительно ДНК, которые кодируют ингибирующую ген молекулу. Предпочтительно эти молекулы нуклеиновой кислоты кодируют молекулы антисмысловых, смысловых (косупрессия), двунитевых РНК или рибозимов, мишенью которых является последовательность гена SBEIIa ячменя, и эффективны в инактивации его экспрессии в эндосперме растения ячменя. В изобретении также предложены генетические конструкции, содержащие выделенную молекулу нуклеиновой кислоты, содержащие один или более чем один регуляторный элемент, такой как промоторы, энхансеры и последовательности терминации транскрипции или полиаденилирования. Такие элементы хорошо известны в данной области техники. Эти генетические конструкции могут также содержать интронные последовательности, которые способствуют экспрессии трансгена в растениях, в частности в однодольных растениях, таких как ячмень. Термин «интрон» используют в его обычном смысле как означающий генетический сегмент, который транскрибируется, но не кодирует белок, и который подвергается сплайсингу из РНК перед трансляцией. Интроны могут быть включены в 5'-UTR или в кодирующий район, если трансген кодирует транслируемый продукт, либо где-либо в транскрибируемый район, если он не кодирует транслируемый продукт.
Далее в изобретении предложены векторы, например плазмидные векторы, содержащие такие генетические конструкции. Термин «вектор» включает экспрессионный вектор, способный к экспрессии in vitro или in vivo, и трансформационный вектор, способный к переносу из одной клетки или организма в другую(ой). Эти векторы содержат последовательности, которые обеспечивают их репликацию в клетках, например в прокариотических клетках, таких как Е.coli или Agrobacterium. Предпочтительно вектор представляет собой бинарный вектор, содержащий последовательность Т-ДНК, определенную по меньшей мере одной пограничной последовательностью Т-ДНК, которую можно вводить в клетки ячменя. Далее в изобретении предложены клетки, содержащие такие векторы, например клетки Agrobacterium или ячменя, которые могут представлять собой регенерируемые клетки, такие как клетки скутеллума незрелых зародышей. Альтернативно эти клетки могут представлять собой трансформированные клетки ячменя, содержащие трансген.
Промоторы/терминаторы
Трансген или другая генетическая конструкция по изобретению может включать район инициации транскрипции (промотор), который может обеспечивать регулируемую или конститутивную экспрессию в эндосперме ячменя. Этот промотор может быть тканеспецифичным, обеспечивающим экспрессию селективно или исключительно в эндосперме. Этот промотор может быть выбран либо из специфичных для эндосперма (таких как промотор высокомолекулярного глютенина, промотор SSI пшеницы, промотор SBEII пшеницы, промотор GBSS пшеницы) промоторов или промоторов, не специфичных для эндосперма (таких как промотор убиквитина, либо промоторы CaMV35S или 35S с энхансером). Промотор можно модулировать факторами, такими как температура, свет или стресс. Обычно промотор обеспечивает экспрессию 5' генетической последовательности. Конструкция может также содержать другие элементы, которые усиливают транскрипцию, такие как nos 3' или ocs 3', районы полиаденилирования или терминаторы транскрипции. Проиллюстрированные районы ДНК будут включены в векторы, содержащие подходящие последовательности селективного гена-маркера и другие элементы, или в векторы, которые котрансформируют с векторами, содержащими эти последовательности.
Способы трансформации ячменя
Способы трансформации однодольных растений, таких как ячмень, для введения генетической вариации в растение путем встраивания экзогенной нуклеиновой кислоты и для регенерации растений из протопластов или незрелых растительных зародышей хорошо известны в данной области техники, смотри, например, Wan and Lemaux (1994), Tingay et al. (1997), заявку на канадский патент 2092588, Nehra, заявку на австралийский патент №61781/94 Национального Исследовательского Совета Канады, австралийский патент №667939 Japan Tobacco Inc., международную патентную заявку PCT/US 97/10621 Monsanto Company, патент США 5589617, другие способы изложены в описании к заявке WO 99/14314. Векторы, несущие желаемую нуклеотидную последовательность или генетическую конструкцию и селективный маркер, можно вводить в регенерируемые клетки ячменя культивируемых тканей растений или эксплантатов либо в подходящие растительные системы, такие как протопласты. Селективный ген-маркер может обеспечивать клеткам ячменя устойчивость к антибиотикам или гербицидам или давать возможность утилизации субстратов, таких как манноза. Селективный маркер предпочтительно придает клеткам ячменя устойчивость к гигромицину. Регенерируемые клетки ячменя получают предпочтительно из скутеллума незрелых зародышей, зрелых зародышей, каллуса, полученного из них, или ткани меристемы.
Трансформированное растение может содержать селективный маркерный ген, либо такой ген можно удалить во время или после регенерации, например, путем вырезания селективного маркерного гена из генома или путем сегрегации селективного маркерного гена из трансгена, ингибирующего SBEIIa.
Скрининг растений, в которых трансген или мутация интегрировали в хромосому, можно проводить, например, путем использования подходящего нуклеиново-кислотного зонда, специфичного для трансгена, или путем фенотипического наблюдения. Любой из нескольких способов можно использовать для определения присутствия трансформированного растения. Например, полимеразную цепную реакцию (ПЦР) можно использовать для амплификации последовательностей, которые являются уникальными для трансформированного растения, с обнаружением амплифицированных продуктов с помощью гель-электрофореза или других методов. ДНК можно экстрагировать из растений, используя общепринятые методы, и реакцию ПЦР проводят, используя праймеры, которые будут различать трансформированные и нетрансформированные растения. Например, праймеры могут быть сконструированы так, чтобы амплифицировать район ДНК из трансформирующего вектора, считываемого на конструкцию, а обратный праймер сконструирован на основании интересующего гена. Эти праймеры будут амплифицировать фрагмент только в случае, если растение успешно трансформировано. Альтернативным способом подтверждения положительного трансформанта является блот-гибридизация по Саузерну, хорошо известная в данной области техники. Растения, которые являются трансформированными, или мутант можно также идентифицировать, то есть отличить от нетрансформированных растений или растений дикого типа, по их фенотипу, например, придаваемому наличием селективного маркерного гена либо наличием конкретного белка, иммунологическими способами, либо по отсутствию белка, например, по отсутствию белка SBEIIa в эндосперме, что определяют на основании ELISA анализа (твердофазного иммуноферментного анализа). Индикацию, используемую при скрининге таких растений, можно также проводить путем наблюдения фенотипических признаков зерна, например путем визуальной проверки или измерения морщинистого зерна, либо тестирования на повышенное содержание амилозы, либо микроскопической проверки на наличие двойного лучепреломления.
Мутация
Введение генетической вариации, приводящее к пониженной активности фермента SBEIIa или другого фермента в эндосперме ячменя, может быть достигнуто в результате подходящих мутаций в пределах соответствующего гена или регуляторных последовательностей этого гена. Степень, в которой этот ген ингибирован, будет до некоторой степени определять характеристики полученного крахмала. Эти мутации могут представлять собой мутации усечения или null-мутации, и известно, что они оказывают значительное воздействие на природу крахмала, однако измененная структура амилопектина также будет в результате получаться у мутанта с сохранением остаточного уровня экспрессии, у которого ферментативная активность синтеза амилопектина снижена в степени, достаточной для того, чтобы обеспечить интересующую характеристику крахмала или зерна ячменя. Другие хромосомные перестройки могут быть также эффективны, и они могут включать делеции, инверсии, дупликации или точечные мутации.
Мутагенез может быть осуществлен химическим путем или посредством облучения, например путем обработки семян ЭМС или азидом натрия (Zwar and Chandler, 1995), либо гамма-излучением. Выделение мутантов может быть осуществлено путем скрининга растений или семян, подвергнутых мутагенезу. Например, можно проводить скрининг популяции ячменя, подвергнутой мутагенезу, на высокое содержание амилозы в зерне и/или на более длинное, чем обычное, распределение цепей амилопектина по длине, либо на потерю белка SBEIIa с помощью ELISA, либо на измененную морфологию зерна (Green et al., 1997). Скрининг предпочтительно осуществляют в генотипе ячменя, в котором уже отсутствует одна из активностей SBE, например в отрицательном по SBEIIb генетическом фоне. Затем такие мутации можно вводить в желаемые генетические фоны путем скрещивания мутанта с растением желаемого генетического фона и проведения подходящего числа обратных скрещиваний для вытеснения исходно нежелательного родительского генетического фона.
Мутации в генах, кодирующих SBEIIa или другие ферменты, вовлеченные в синтез амилопектина, будут, как правило, вызывать повышенное относительное содержание амилозы. Количество амилозы на индивидуальное зерно может быть повышено вследствие измененного притока углерода от амилопектина к амилозе, либо оно может быть снижено, если имеет место существенное снижение продуцирования крахмала на зерно. В любом случае относительный уровень амилозы в виде процента крахмала повышается.
Пригодность для производства пищевых продуктов
В другом аспекте в изобретении предложен ячмень, который пригоден для производства пищевых продуктов, зерно, полученное от растения ячменя, имеющего пониженный уровень активности SBEIIa в эндосперме развивающегося зерна, и крахмал указанного зерна, имеющий относительно высокое содержание амилозы и пониженное содержание амилопектина. Растение ячменя по настоящему изобретению предпочтительно представляет собой растение, имеющее зерно, которое пригодно для производства пищевых продуктов и, в частности, для промышленного производства пищевых продуктов. Такое производство пищевых продуктов может включать производство муки или других продуктов, которые могут представлять собой ингредиент промышленной пищевой продукции.
Желаемый генетический фон ячменя будет включать соображения агрономической урожайности и другие характеристики. Такие характеристики могут учитывать, желательно ли иметь озимый или яровой тип ячменя, агрономические показатели, устойчивость к болезням и устойчивость к абиотическому стрессу. В Австралии может быть желательным скрещивать между собой сорта ячменя, такие как Sloop, Schooner, Chebec, Franklin, Arapiles, Tantangara, Galleon, Gairdner или Picolla. Приведенные примеры являются специфичными для Австралийского промышленного района, а другие сорта могут быть подходящими для других районов выращивания. Предпочтительно, чтобы вариант ячменя по изобретению обеспечивал урожай не менее чем 80% от соответствующей разновидности дикого типа, по меньшей мере в нескольких районах выращивания, более предпочтительно не менее чем 90% и еще более предпочтительно - не менее чем 95%. Урожайность можно легко измерить в контролируемых полевых испытаниях. Также предпочтительно, чтобы растения ячменя были лишены оболочки или были «голыми», поскольку наличие пленки на зернах ячменя вносит дополнительные трудности в обработку зерна.
Содержание крахмала в зерне должно составлять по меньшей мере примерно 12% (мас./мас.) или 15%, предпочтительно по меньшей мере 25%, более предпочтительно по меньшей мере 35% и еще более предпочтительно - близко к уровням дикого типа 45-50% (мас./мас.). Более низкие содержания крахмала, чем у дикого типа, вероятно, являются следствием пониженных уровней амилопектина. Зерно может быть также пригодно для промышленного производства пищевых продуктов в связи с относительно высокой ценностью высокоамилозных продуктов. Другие желательные характеристики включают способность зерна к измельчению. Хотя обрушенный ячмень можно производить из большинства форм зерна, некоторые конфигурации зерна особенно устойчивы к измельчению. Другой характеристикой, которая может влиять на промышленную применимости зерна, является окраска продукта, произведенного из этого зерна. Если пленка или другая часть зерна имеет значительное окрашивание, иное, чем обычное, это может ограничивать его промышленное использование до конкретного употребления, например в качестве компонента хлеба, содержащего окрашенные цельные или дробленые зерна. Типично у ячменя значительное окрашивание является пурпурным, и эта окраска может быть яркой или интенсивной, что весьма нежелательно в большинстве пищевых продуктов. Другим аспектом, который может придать растению ячменя более высокую ценность, является степень экстракции крахмала из зерна, причем более высокие скорости экстракции более полезны. Форма зерна также является еще одним признаком, который может влиять на промышленную пригодность растения, поскольку форма зерна может влиять на легкость или, напротив, трудность измельчения этого зерна. Например, зерно ячменя высокоамилозного растения МК6827 имеет очень вытянутую морфологию зерна, которая затрудняет его измельчение и обработку. Удобной мерой этой продолговатой формы и связанной с ней применимости является отношение длины зерна к толщине зерна (отношение L/T). Это отношение часто продиктовано природой крахмала. Предпочтительно, чтобы это отношение было менее чем примерно 5,5, более предпочтительно - в интервале от примерно 4 до примерно 5 и наиболее предпочтительно - менее чем 3,5, в среднем.
Более наполненное зерно может быть желательным в отношении достижения более высоких урожаев и некоторых преимуществ изобретения, которые могут быть достигнуты, таких как производство крахмала с высокими уровнями амилозы или альтернативного крахмала с измененными распределениями цепей по длине. Таким образом, зерно предпочтительно имеет неморщинистый фенотип. Другие аспекты изобретения могут, однако, быть лучше реализованы с помощью зерна, которое является менее наполненным. Таким образом, доля алейронового слоя или зародыша в отношении к крахмалу может быть выше в менее наполненном зерне, посредством этого обеспечивая ячменную муку или другой продукт, который имеет больше полезных составных частей алейронового слоя. Продукт с высоким алейроновым слоем может, таким образом, иметь более высокое содержание некоторых витаминов, таких как фолат, или более высокое содержание некоторых минералов, таких как кальций, и это в сочетании с более высокими уровнями устойчивого крахмала и/или более высокими уровнями β-глюкана может обеспечить синергические эффекты, такие как обеспечение усиленной абсорбции минералов в толстом кишечнике.
Чтобы максимизировать количество амилозы, для растения ячменя может быть желательным иметь также другие фенотипические характеристики в дополнение к пониженной активности SBEIIa. Генетический фон может, следовательно, включать дополнительно мутацию amo1 в АС38 (причинный ген неизвестен) и мутацию waxy (обнаруженную, например, в сорте Waxiro). Дополнительно может быть желательным получение двойных мутаций у других доступных мутантов ячменя с морщинистыми эндоспермами, где причинный ген неизвестен.
Крахмал легко выделяют из растения ячменя, используя стандартные способы, например, способ Schulman et al. (1991). В промышленном масштабе можно использовать влажное или сухое измельчение. Крахмал, полученный из зерна растения ячменя по изобретению, имеет высокое относительное содержание амилозы. Растения ячменя, имеющие по меньшей мере 35-45% амилозы в крахмале, считают высокоамилозными. В настоящем изобретении, однако, предложен ячмень с содержанием амилозы свыше 50% (мас./мас.), предпочтительно по меньшей мере 60% и более предпочтительно - по меньшей мере 70%, 75%, 80% или 90%.
Должно быть понятно, что указанный относительный уровень амилозы находится в отношении к суммарному содержанию крахмала, и, следовательно, остальная часть крахмала может преимущественно представлять собой промежуточный тип крахмала, либо может преимущественно представлять собой амилопектин, либо смесь обоих типов.
β-Глюкан
Известно, что существует широкое разнообразие уровней β-глюкана у ячменя в диапазоне от примерно 4% до примерно 18% мас./мас. ячменя, но более типично от 4% до примерно 8% (например, Izydorcyk et al., 2000). Разработаны улучшенные линии ячменя, например, содержащие между примерно 15% и примерно 18% мас./мас. β-глюкана, но обладающие фенотипом waxy.
Уровни β-глюкана, предполагаемые данным изобретением, могут зависеть от генетического фона, при котором ферментативная активность синтеза амилопектина, включая SBEIIa, понижена. Воплощение, приведенное в примере, показывает относительно нормальный синтез β-глюкана, однако в других формах изобретения может рассматриваться повышенный относительный уровень β-глюкана. Таким образом, зерно растения ячменя предпочтительно имеет содержание β-глюкана между примерно 3 и 6% (мас./мас.) от суммарной массы беспокровного зерна. Другие формы изобретения могут, однако, иметь содержание β-глюкана более 6% или выше, например 6-8%. Измеренные уровни β-глюкана у мутанта waxy достигают от 15 до 18%, например сорт Prowashonupana, имеющийся в продаже под названием Sustagrain™ (ConAgra™ Specially Grain Products Company, Omaha, Neb. USA), и настоящее изобретение может предусматривать такие же высокие уровни, как у этого сорта, или выше.
Температура клейстеризации
Клейстеризация представляет собой разрушение (прерывание) молекулярного порядка внутри крахмальной гранулы с сопутствующими необратимыми изменениями в свойствах, таких как гранулярное набухание, плавление кристаллита, потеря двойного лучепреломления, развитие вязкости и солюбилизация крахмала. Высокоамилозный крахмал из ае (amylose extender) мутантов кукурузы показал более высокую температуру клейстеризации, чем у нормальной кукурузы (Fuwa et al., 1999, Krueger et al., 1987). С другой стороны, крахмал из мутантов ячменя sex6, у которых отсутствует активность синтазы крахмала IIa, имел более низкие температуры клейстеризации, и энтальпия пика клейстеризации была понижена по сравнению с таковой у контрольных растений (Morell et al., 2003).
В другом аспекте изобретения крахмал может иметь измененную температуру клейстеризации, как измерено с помощью дифференциальной сканирующей калориметрии. Она может быть либо повышена, либо понижена по сравнению с крахмалом из растений дикого типа. Измененная температура клейстеризации может быть дополнением к относительно высокому содержанию амилозы. Если температура клейстеризации понижена, она может быть понижена по сравнению с крахмалом, продуцируемым другими разновидностями ячменя с повышенным содержанием амилозы, либо она может быть понижена по сравнению с крахмалом, полученным из ячменя с нормальными уровнями амилозы. Альтернативные формы изобретения предусматривают температуры клейстеризации, которые не изменены или повышены относительно крахмала ячменя дикого типа. Температура клейстеризации крахмала ячменя дикого типа составляет типично примерно 56°С для температуры первого пика, измеренного с помощью дифференциальной сканирующей калориметрии.
Объем набухания
Крахмал может также характеризоваться скоростью его набухания в избытке нагретой воды по сравнению с крахмалом дикого типа. Объем набухания типично измеряют путем смешивания крахмала или муки с избытком воды и нагревания до повышенных температур, типично выше 90°С. Затем образец собирают с помощью центрифугирования, и объем набухания выражают в виде массы осажденного вещества, разделенной на сухую массу образца. Низкая характеристика набухания полезна, если желательно увеличить содержание крахмала пищевого продукта, в частности гидратированного пищевого продукта.
Кристалличность
Структура крахмала ячменя отобранных форм по настоящему изобретению может также отличаться тем, что степень кристалличности понижена по сравнению с нормальным крахмалом, выделенным из ячменя. Пониженную кристалличность крахмала также считают связанной с усиленными органолептическими свойствами и способствующей более мягкому вкусовому ощущению. Таким образом, крахмал может дополнительно обладать пониженной кристалличностью, являющейся результатом пониженных уровней активности одного или более чем одного фермента синтеза амилопектина. Кристалличность обычно исследуют с помощью рентгеновской кристаллографии.
Распределение цепей амилопектина по длине
Одной из мер измененной структуры амилопектина является распределение цепей по длине или степень полимеризации крахмала. Распределение цепей по длине можно определить, используя электрофорез углеводов с помощью флуорофора (FACE, fluorophore assisted carbohydrate electrophoresis) после удаления разветвления изоамилазой. Амилопектин крахмала по изобретению может иметь распределение цепей по длине в интервале от 5 до 60, что выше, чем распределение крахмала из растений дикого типа после удаления разветвления. Крахмал с более длинными цепями будет также иметь соответствующее снижение частоты разветвления. Таким образом, крахмал может также иметь распределение более длинных цепей амилопектина в еще присутствующем амилопектине.
Пищевые характеристики
Крахмал является главным источником углеводов в питании человека, и зерно по изобретению и продукты, полученные из него, можно использовать для изготовления пищевых продуктов. Эти пищевые продукты могут потребляться человеком или животными, например при разведении скота или в кормах для домашних животных. Зерно, полученное из измененного растения ячменя, можно легко использовать в процессах изготовления пищевых продуктов, и, следовательно, изобретение включает молотое, размельченное, дробленое, обрушенное или плющеное зерно либо продукты, полученные из обработанного или цельного зерна растения ячменя, описанного выше, включая муку. Эти продукты затем можно использовать в различных пищевых продуктах, например в мучных продуктах, таких как хлеб, пирожные, бисквиты и тому подобное, либо в пищевых добавках, таких как загустители или связующие агенты, либо для получения солодовых или других ячменных напитков, макаронных изделий и супов быстрого приготовления. Зерно или продукты, полученные из этого зерна по изобретению, особенно желательны в крупах для завтрака. Высокоамилозные крахмалы по изобретению можно также использовать для образования гелей высокой прочности, которые полезны в кондитерской промышленности или обеспечивают возможность уменьшения времени формования и консервирования. Их можно также использовать в качестве покрытия, например для уменьшения абсорбции масла в картофеле или других пищевых продуктах глубокой заморозки.
Диетическое волокно
Диетическое волокно в данном описании представляет собой углеводы и продукты ферментативного гидролиза углеводов, которые не всасываются в тонком кишечнике здоровых людей, но поступают в толстый кишечник. Оно включает устойчивый крахмал, β-глюкан и другие растворимые и нерастворимые углеводные полимеры. Следует включать ту часть углеводов, которая является ферментируемой, по меньшей мере частично, в толстом кишечнике резидентной микрофлорой.
Крахмал по изобретению предпочтительно содержит относительно высокие уровни диетического волокна, более конкретно амилозы, и возможно повышенный уровень β-глюкана. Содержание диетического волокна зерна по настоящему изобретению может быть или может не быть результатом только повышенного относительного содержания амилозы в эндосперме. β-Глюкан может присутствовать в повышенных уровнях и как таковой может вносить значительный вклад в уровень диетического волокна.
Аспекты данного изобретения могут быть также результатом сочетания алейронового слоя и зародыша в сочетании с высокими уровнями диетического волокна. Конкретно это может происходить, когда в зерне присутствуют более высокие относительные уровни алейрона или зародыша. Во-первых, ячмень имеет значительно более высокий алейроновый слой, чем другие хлебные коммерческие злаки, поскольку он имеет трехклеточный алейроновый слой. Во-вторых, если зерно ячменя является слегка морщинистым, эндосперм присутствует в пониженных количествах, и алейроновый слой и зародыш присутствуют в относительно повышенных количествах. Таким образом, ячмень имеет относительно высокий уровень некоторых полезных элементов или витаминов в сочетании с повышенной устойчивостью, и такие элементы включают двухвалентные катионы, такие как биологически доступный Са++, и витамины, такие как фолат, или антиоксиданты, такие как токоферолы и токотриенолы. Кальций необходим для роста и образования кости и другой кальцинированной ткани и снижает риск остеопороза поздних периодов жизни. Обнаружено, что фолиевая кислота обладает защитным эффектом против пороков нервной трубки при разумном употреблении и снижает риск сердечно-сосудистого заболевания, посредством этого усиливая эффекты сочетания устойчивого крахмала и β-глюкана. Также считают, что фолиевая кислота обладает эффектом уменьшения риска некоторых раков. Токоферол и токотриенолы обладают полезными эффектами антиоксидантов, и считают, что они уменьшают риск рака и сердечного заболевания, а также обладают эффектом снижения нежелательных эффектов окисления компонентов пищи, таких как жирные кислоты, которые могут привести к прогорклости. Одной из конкретных форм измельченного продукта может быть такая форма, где алейроновый слой включен в этот измельченный продукт. Конкретный процесс измельчения можно осуществить так, чтобы увеличить количество алейронового слоя в измельченном продукте. Ссылка на такой способ сделана в Fenech et al. (1999). Таким образом, любой продукт, полученный из зерна, измельченного или обработанного иначе так, чтобы включить алейроновый слой и зародыш, будет иметь полезные питательные дополнительные свойства, не требуя добавления этих элементов из других источников.
Устойчивый крахмал
Устойчивый крахмал определяют как сумму крахмала и продуктов ферментативного гидролиза крахмала, не всасывающихся в тонком кишечнике здоровых людей, но поступающих в толстый кишечник. Таким образом, устойчивый крахмал исключает продукты, перевариваемые и всасывающиеся в тонком кишечнике. Устойчивые крахмалы включают физически недоступный крахмал (форма RS1), устойчивые гранулы (RS2), ретроградированные крахмалы (RS3) и химически модифицированные крахмалы (RS4).
Измененная структура крахмала и, в частности, высокие уровни амилозы крахмала по изобретению приводят к увеличению устойчивости крахмала при употреблении в пищу. Устойчивый крахмал может также повышаться, если β-глюкан присутствует в повышенных уровнях, что, вероятно, оказывает защитные воздействия посредством связывания β-глюкана с крахмальной гранулой. Крахмал может находиться в RS1 форме, которая до некоторой степени недоступна ферментативному гидролизу. Вероятно, связь крахмал-липид, как измерено на основании V-комплексной кристалличности, также вносит вклад в уровень устойчивого крахмала. В этом случае устойчивость, вероятно, возникает из-за физической недоступности крахмала благодаря присутствию липида, и, соответственно, может рассматриваться как RS1 крахмал. Крахмал приведенного в примере растения ячменя может быть устойчив к ферментативному гидролизу в связи со структурой крахмальной гранулы и, соответственно, может иметь RS2 крахмал. Каждая из этих характеристик может присутствовать по отдельности или в сочетании.
Должно быть понятно, что одно из преимуществ настоящего изобретения состоит в том, что оно обеспечивает продукты, которые обладают особенной питательной ценностью, и при этом отсутствует необходимость в модификации крахмала или других составных частей зерна ячменя. Однако может быть желательно получить модификации крахмала, β-глюкана или другой составной части зерна, и изобретение охватывает такую модифицированную составную часть. Способы модификации хорошо известны и включают экстракцию крахмала или β-глюкана либо другой составной части общепринятыми способами и модификацию крахмалов для повышения устойчивой формы. Крахмал или β-глюкан можно модифицировать путем обработки нагреванием и/или влагой, физически (например, измельчение в шаровой мельнице), ферментативным путем (используя, например, α- или β-амилазу, пуллуланазу или тому подобное), химическим гидролизом (влажным или сухим, используя жидкие или газообразные реагенты), окислением, поперечным связыванием бифункциональными реагентами (например, триметафосфатом натрия, оксихлоридом фосфора) или карбоксиметилированием.
Гликемический индекс
Гликемический индекс (ГИ) представляет собой сравнение воздействия тестируемых пищевых продуктов с воздействием белого хлеба или глюкозы на сдвиги концентрации глюкозы в крови. Гликемический индекс представляет собой меру вероятного эффекта пищевого продукта, касающегося концентрации глюкозы в сыворотке после приема пищи и потребности в инсулине для гомеостаза глюкозы в крови. Одним из важных продуктов, предложенных изобретением как результат высокого содержания амилозы и, возможно, высокого содержания β-глюкана, является низкокалорийный продукт с пониженным гликемическим индексом. Низкокалорийный продукт может быть основан на включении муки, полученной из измельченного зерна ячменя. Может быть желательным, однако, сначала обрушить зерно, удаляя, возможно, 10% или 20% мас./мас. зерна, удаляя посредством этого алейроновый слой, и при большем снижении удаляя также зародыш. Эффект стадии обрушения состоит в снижении содержания липида и, следовательно, в снижении калорийности пищевого продукта. Такие пищевые продукты будут обладать эффектом насыщения, улучшения здоровья толстого кишечника, снижения сывороточной концентрации глюкозы и липида после приема пищи, а также обеспечения низкокалорийного пищевого продукта. Использование обрушенного продукта будет приводить в результате к уменьшению питательных преимуществ, обеспечиваемых алейроновым слоем и зародышем. Мука, полученная из обрушенного продукта, вероятно, имеет улучшенный внешний вид, поскольку продукт, полученный таким способом, имеет тенденцию к белому цвету.
Непищевые применения
В настоящем изобретении предложены модифицированные или улучшенные крахмалы, имеющие повышенные уровни амилозы и пониженные уровни амилопектина, свойства которых удовлетворяют любому из разнообразных промышленных требований. Крахмал широко применяют в непищевых отраслях промышленности, включая бумажную, текстильную, картонную и клеевую промышленности (Young, 1984). Физические свойства немодифицированного крахмала ограничивают его полезность при некоторых применениях и часто выдвигают требование химической модификации, которая может быть дорогостоящей или обладать другими недостатками. В изобретении предложен крахмал, для которого может требоваться меньшая модификация после получения, в частности, вследствие сниженного содержания амилопектина в сочетании с другими физическими свойствами. Например, температура образования клейстера, устойчивость к сдвигающему напряжению, прочность пленки и/или устойчивость к воде - крахмалов и продукта, полученного из зерна по данному изобретению, могут быть изменены. Крахмал можно также использовать для получения биологически разлагаемого упаковочного материала для сыпучих материалов, который можно использовать в качестве замены полистирола.
Должно быть понятно, что, хотя даны указания на аспекты настоящего изобретения, это изобретение может относиться к комбинациям двух или более чем двух аспектов настоящего изобретения.
ПРИМЕРЫ
ПРИМЕР 1. МАТЕРИАЛЫ И МЕТОДЫ
Среда, индуцирующая каллус
Для индукции каллуса из зародыша ячменя использовали среду BCI-DM, содержащую Dicamba (2,5 мг/л). Состав одного литра среды:
рН доводили до 5,8 и добавляли 3,5 г/л Phytagel. После автоклавирования среды добавляли 150 мг/л тиментина и 50 мг/л гигромицина.
Среда регенерации ячменя
Каллусы ячменя регенерировали в среде FHG, содержащей ВАР (1 мг/л).
рН доводили до 5,8 и добавляли 3,5 г/л Phytagel. После автоклавирования среды добавляли 150 мг/л тиментина и 20 мг/л гигромицина.
Определение и анализ углеводов
Крахмал выделяли из зерна ячменя, используя способ Schulman et al. (1991). Содержание крахмала определяли, используя набор для анализа общего крахмала, поставляемый Megazyme (Bray, Co Wicklow, Republic of Ireland). Затем содержание крахмала сравнивали с контрольными растениями. Вычитание массы крахмала из общей массы зерна с получением общего некрахмального содержимого зерна определяет, является ли снижение общей массы следствием снижения содержания крахмала.
Определение содержания амилозы или отношения амилоза/амилопектин способом ВЭЖХ для разделения неразветвленных крахмалов или способом связывания йода проводили, как описано Batey and Curtin (1996). Кратко, крахмал обезжиривали путем его растворения в ДМСО и переосаждения этанолом. После повторного растворения крахмала в ДМСО и добавления воды, дальнейшего разбавления и добавления раствора йода/йодида калия поглощение раствора измеряли при 605 нм. Содержание амилозы определяли на основании стандартной кривой, полученной для смесей амилозы и амилопектина, перекрывающей диапазон 0-100% амилозы. Анализ отношения амилоза/амилопектин неразветвленных крахмалов можно также проводить согласно Case et al. (1998).
Уровни β-глюкана определяли, используя набор, поставляемый Megazyme (Bray, Co Wicklow, Republic of Ireland).
Крахмалы подвергали удалению разветвлений и распределения цепей по длине анализировали, используя электрофорез углеводов с помощью флуорофора (FACE, fluorophore assisted carbohydrate electrophoresis), используя капиллярный электрофорезный прибор согласно Morell et al. (1998).
Дифференциальная сканирующая калориметрия (ДСК)
ДСК измеряет изменения в температурах клейстеризации, которые появились в крахмале в связи с изменениями в соотношении амилозы и амилопектина. Клейстеризацию измеряли в дифференциальном сканирующем калориметре Pyris 1 (Perkin Elmer, Norwalk CT, USA). Крахмал смешивали с водой в отношении 2 части воды:1 часть крахмала и эту смесь (40-50 мг, точная навеска) помещали в кристаллизатор из нержавеющей стали и запаивали. Образец сканировали при 10°С в минуту от 20°С до 140°С, причем в качестве сравнения использовали пустой кристаллизатор из нержавеющей стали. Температуры и энтальпию клейстеризации определяли, используя программное обеспечение Pyris.
RVA анализ
Вязкость измеряли на приборе Rapid-Visco-Analyser (RVA, Newport Scientific Pty Ltd, Warriewood, Sydney), используя условия, описанные в Batey et al., 1997, для муки из цельного зерна. Чтобы ингибировать α-амилазы, во все анализы включали нитрат серебра в концентрации 12 мМ. Измеряемыми параметрами были пиковая вязкость (максимальная вязкость горячего клейстера), сила удерживания, конечная вязкость и температура образования клейстера.
Набухание муки
Объем набухания муки определяли согласно способу Konik-Rose et al. (2001). Повышенное поглощение воды измеряли путем взвешивания образца до и после смешивания образца с водой при определенных температурах и последующего сбора клейстризированного вещества.
ПРИМЕР 2: ВЫДЕЛЕНИЕ ГЕНОВ SBE ИЗ ЯЧМЕНЯ
Конструирование кДНК и геномных библиотек ячменя
Библиотеки кДНК и геномные библиотеки ячменя получали стандартными способами в фаговых векторах (Sambrook et al., 1989). Библиотеку кДНК получали в векторе ZipLox (Life Technology) согласно протоколам, поставляемым с реагентами. Титр библиотеки, тестированной штаммом Е.coli Y1090(ZL), составлял 2×106 БОЕ (бляшкообразующие единицы). Геномную библиотеку ячменя, полученную от Е. Lagudah (CSIRO), сконструировали из ДНК из сорта Morex. ДНК подвергали ферментативному гидролизу Mbol и лигировали в вектор EMBL3cos, гидролизованный EcoRI/BamHI. Клонированные фрагменты можно высвобождать при ферментативном гидролизе SalI.
Выделение последовательностей генов SBEIIa и SBEIIb из геномной библиотеки Н. vulgare
Условиями для скрининга библиотеки были: гибридизация в смеси 25% формамид, 5×SSC, 0,1% ДСН, 10× растворе Денхардта, 10 мкг/мл ДНК спермы лосося при 42°С в течение 16 ч с последующей отмывкой 2×SSC, 0,1% ДСН при 65°С в течение 3×1 ч (средняя жесткость). Клоны, содержащие гены SBEIIa и SBEIIb или их существенные участки, выделяли и секвенировали. Сравнения последовательности ДНК с последовательностями с номерами по каталогу, перечисленными в таблице 1, подтвердили, что оба интересующих гена были выделены из ячменя. Последовательности кДНК SBEIIa и SBEIIb могут быть также получены с помощью ПЦР с обратной траскрипцией (ОТ-ПЦР) со специфичными праймерами, методики, хорошо известной в данной области техники. Последовательности кДНК SBEIIa и SBEIIb ячменя показаны на Фиг.1 и 2, а геномные последовательности SBEIIa и SBEIIb пшеницы показаны на Фиг.3 и 4.
Гены ферментов, разветвляющих крахмал, охарактеризованные у зерновых
ПРИМЕР 3: КОНСТРУКЦИИ ДЛЯ ЭКСПЕРИМЕНТОВ ПО ТРАНСФОРМАЦИИ ДЛЯ ИЗМЕНЕНИЯ ЭКПРЕССИИ SBEIIA И SBEIIB ЯЧМЕНЯ
Дуплекс-РНК (dsPHK) конструкции получали для снижения экспрессии либо SBEIIa, либо SBEIIb генов ячменя. В таких конструкциях желаемая последовательность нуклеиновой кислоты, соответствующая участку генов SBEIIa или SBEIIb, встречалась как в смысловой, так и в антисмысловой ориентациях относительно промотора, так что экспрессируемая РНК содержала комплементарные районы, которые были способны к спариванию оснований и образованию дуплексной или двунитевой РНК. Спейсерный район между смысловой и антисмысловой последовательностями содержал интронную последовательность, которая при транскрипции в виде участка РНК в трансформированном растении будет подвергаться сплайсингу с образованием компактной «шпилечной» дуплексной структуры. Обнаружено, что включение интрона повышает эффективность молчания генов, придаваемого дуплекс-РНК конструкциями (Smith et al., 2000). Желаемая нуклеиновая кислота была сшита с промоторной последовательностью высокомолекулярного глютенина (HMWG) (промотор субъединицы гена DX5, номер по каталогу Х12928, Anderson et al., 1989) и терминаторной последовательностью гена нопалинсинтазы из Agrobacterium (nos3').
Дуплекс-РНК конструкции, содержащие смысловые/антисмысловые фрагменты SBEIIa или SBEIIb, полученные из генов пшеницы SBEIIa и SBEIIb из соображений высокой степени идентичности последовательности между генами пшеницы и ячменя, исходно конструировали в векторе pDV03000, a затем вырезали и лигировали с трансформирующим вектором ячменя pWBVec8. Эти конструкции схематически показаны на Фиг.5. Вектор pWBVec8 содержат ряд сайтов ферментативной рестрикции для встраивания желаемых последовательностей ДНК.
Дуплекс-РНК конструкцию SBEIIa, содержащую 1536 п.о. нуклеотидной последовательности, амплифицировали с помощью ПЦР из гена SBEIIa пшеницы (GenBank, номер по каталогу AF338431, см. Фиг.3). Эта последовательность включала 468 п.о. последовательности, которая содержала полноразмерные экзоны 1 и 2 и часть экзона 3 (положения нуклеотидов 1058-1336, 1664-1761 и 2038-2219 на Фиг.3) с сайтами рестрикции EcoRI и KpnI на каждой стороне (фрагмент 1), 512 п.о. последовательности, состоящей из части экзонов 3 и 4 и полноразмерного интрона 3 SBEIIa (положения нуклеотидов 2220-2731 на Фиг.3) с сайтами рестрикции KpnI и SacI на каждой стороне (фрагмент 2) и фрагмент 528 п.о., состоящий из полноразмерных экзонов 1, 2 и 3 SBEIIa (положения нуклеотидов 1058-1336, 1664-1761 и 2038-2279 на Фиг.3) с сайтами рестрикции BamHI и SacI на каждой стороне (фрагмент 3). Фрагменты 1, 2 и 3 лигировали таким образом, что последовательность фрагмента 3 была лигирована с фрагментом 2 в антисмысловой ориентации относительно фрагмента 1. Эту генную конструкцию в векторе pDV03000 обозначили pDV03-IIa, и дуплекс-РНК ген обозначили ds-SBEIIa.
Стратегия для дуплекс-РНК конструкции SBEIIb была подобной. Конструкцию SBEIIb, содержащую фрагмент 1607 п.о., амплифицировали с помощью ПЦР из гена SBEIIb пшеницы (эта последовательность изображена на Фиг.4). Эта последовательность включала 471 п.о. последовательности, которая содержала полноразмерные экзоны 1 и 2 и часть экзона 3 (положения нуклеотидов 489-640, 789-934 и 1598-1769 на Фиг.4) с сайтами рестрикции EcoRI и KpnI на каждой стороне (фрагмент 1), 589 п.о. последовательности, состоящей из части экзонов 3 и 4 и полноразмерного интрона 3 SBEIIb (положения нуклеотидов 1770-2364 на Фиг.4) с сайтами рестрикции KpnI и SacI на каждой стороне (фрагмент 2) и фрагмент 528 п.о., состоящий из полноразмерных экзонов 1, 2 и 3 SBEIIb (положения нуклеотидов 489-640, 789-934 и 1598-1827 на Фиг.4) с сайтами рестрикции BamHI и SacI на каждой стороне (фрагмент 3). Фрагменты 1, 2 и 3 лигировали таким образом, что последовательность фрагмента 3 была лигирована с фрагментом 2 в антисмысловой ориентации относительно фрагмента 1. Эту генную конструкцию SBEIIb дуплекс-РНК в векторе pDV03000 обозначили pDV03-IIb, и дуплекс-РНК ген обозначили ds-SBEIIb.
Кассеты промотор - смысловая/антисмысловая - терминатор встраивали в бинарный вектор pWBVec8, используя ферменты рестрикции ApaI и NotI. Конструкцию SBEIIa в векторе pWBVec8 обозначили pVec8-IIa, a конструкцию SBEIIb в векторе pWBVec8 обозначили pVec8-IIb. Эти конструкции показаны схематически на Фиг.5.
Идентичность между использованными последовательностями SBEIIa пшеницы и соответствующей последовательностью SBEIIa ячменя составляла 93% при использовании программы Gap для сравнения последовательностей. Подобным образом, идентичность между последовательностью SBEIIb пшеницы и соответствующей последовательностью SBEIIb ячменя составляла 92%. Технология дуплекс-РНК эффективна для молчания экспрессии генов, имеющих последовательности с идентичностями выше примерно 85% в отношении дуплексного района, и, следовательно, ожидали, что дуплекс, сконструированный с последовательностями пшеницы, будет эффективен против последовательностей ячменя.
ПРИМЕР 4: ТРАНСФОРМАЦИЯ ЯЧМЕНЯ
Способы трансформации ячменя посредством Agrobacterium tumefaciens или biolistics описаны (Tingay et al., 1997; Wan et al., 1994) и могут быть использованы для переноса конструкций ДНК, генерирующих трансгенные растения. В данном примере генные конструкции в бинарных векторах, полученные, как описано выше, вводили в высоковирулентный штамм Agrobacterium с помощью трехродительской конъюгации и затем использовали для введения Т-ДНК, содержащей ингибиторный ген (ds-SBEIIa или ds-SBEIIb) и селективный маркерный ген (кодирующий устойчивость к гигромицину, экспрессируемую с промотора CaMV35S), в регенерируемые клетки скутеллума незрелых зародышей ячменя, как описано ниже.
Развивающиеся семена ячменя от сорта Golden Promise, 12-15 суток после опыления, извлекали из растущего колоса выращенных в теплице растений и стерилизовали в течение десяти минут в 20%-ном (об./об.) отбеливающем веществе, после чего ополаскивали один раз 95%-ным этанолом и семь раз стерильной водой. Затем зародыши (примерно от 1,5 до 2,5 мм в размере) выделяли из семян в асептических условиях, и центральный цилиндр вырезали из каждого зародыша. Зародыши помещали отрезанной стороной вниз на чашку Петри, содержащую среду индукции каллуса. Трансконъюганты Agrobacterium (штамм AGL1) выращивали в бульоне MG/L (содержащем 5 г маннита, 1 г L-глутаминовой кислоты, 0,2 г KH2PO4, 0,1 г NaCl, 0,1 г MgSO4·7H2O, 5 г триптона, 2,5 г дрожжевого экстракта и 1 мкг биотина на литр, рН 7,0), содержащем стрептомицин (50 мг/л) и рифампицин (20 мг/л) при аэрации при 28°С до концентрации примерно 2-3×108 клеток/мл, а затем примерно 300 мкл клеточной суспензии добавляли к зародышам в чашке Петри. Через 2 мин избыточную жидкость удаляли из чашки наконечником, и зародыши переворачивали так, чтобы отрезанная сторона (осевая сторона скутеллума) была сверху. Затем зародыши переносили на свежую чашку со средой индукции каллуса и помещали в темноту на 2-3 суток при 24°С. Зародыши переносили на селективную среду индукции каллуса (50 мкг/мл гигромицина и 150 мкг/мл тиментина). Зародыши оставляли на этой среде на 2 недели в темноте при 24°С. Затем здоровый каллус отделяли и помещали на свежую селективную среду и инкубировали в течение следующих двух недель при 24°С в темноте. После этого зародыши инкубировали при 24°С на свету в течение 2 недель на регенерационной среде, содержащей цитокинин, и переносили в корнеобразующую среду, содержащую цитокинин и ауксин, на три 2-недельных периода. Затем молодые растения переносили на твердую смесь и держали на увлажненной террасе в течение 2 недель и, наконец, переносили в стеклянную теплицу. Этим способом обработали всего 400 зародышей, используя pVec8-IIb, и 300 зародышей, используя pVec8-IIa, и 18 растений из 7 каллусов для трансформации IIb и 18 растений из 14 каллусов для трансформации IIa выжили на селективной среде, что позволяет предположить, что они были успешно трансформированы этими генными конструкциями. Ожидали, что не у всех растений, которые были трансформированы селективным маркерным геном, интегрировал SBEIIa или SBEIIb ингибиторный ген; их можно было легко отличить, как описано в следующих примерах.
ПРИМЕР 5: АНАЛИЗ РАСТЕНИЙ И ЗЕРНА ЯЧМЕНЯ, ТРАНСФОРМИРОВАННЫХ ДУПЛЕКС-РНК КОНСТРУКЦИЯМИ
Наличие или отсутствие трансгена(ов) в растениях, либо в семенах или растениях-потомках ячменя определяли или подтверждали с помощью методик ПЦР или анализа блот-гибридизации по Саузерну. ДНК получали из образцов листьев от предполагаемых трансформированных растений стандартными способами.
ПЦР анализ трансформированных растений ячменя - обнаружение трансгенов
Прямой и обратный праймеры, используемые для скрининга на наличие трансгена ds-SBEIIa, были следующими: ВХ17 3' (5'-САА ССА TGT CCT GAA ССТ ТСА СС-3') SEQ ID No. 5 и AR2akpnR (5'-GGT ACC ССА TCT CCT GGT TTT GGG АСА AC-3') SEQ ID No. 6 соответственно. Эта пара праймеров амплифицировала фрагмент 569 п.о., соответствующий положению внутри промоторной последовательности HMWG трансгена до положения нуклеотида 2219 на Фиг.3, из тех растений, которые содержали трансген ds-SBEIIa. Праймеры, используемые для скрининга на наличие трансгена ds-SBEIIb, были следующими: ВХ17 3' (как выше) и AR2bkpnR (5'-GGT ACC GTC CAT TTC CCG GTG GTG GCA G-3') SEQ ID No. 7. Эта пара праймеров амплифицировала продукт 571 п.о., соответствующий положению внутри промоторной последовательности HMWG трансгена до положения нуклеотида 1768 на Фиг.4, из тех линий, которые содержали трансген ds-SBEIIb. ПЦР амплификацию проводили в 20 мкл реакционной смеси, содержащей 2,5 единицы Hotstar Taq, 1×буфер с добавленным ферментом, содержащий 1,5 мМ MgCl2, 0,125 мМ каждого дезоксинуклеотидтрифосфата (dNTPs), 1 мкМ каждого из прямых и обратных праймеров и 100 нг ДНК. Программа ПЦР включала начальную стадию денатурации при 95°С в течение 5 мин с последующими 36 циклами 95°С в течение 30 сек, 59°С в течение 1 мин и 72°С в течение 2 мин и заканчивалась 72°С в течение 5 мин.
Положительные трансформанты ячменя идентифицировали для обеих конструкций SBEIIa и SBEIIb (Фиг.6). Данные суммированы в таблице 2.
Суммирование результатов ПЦР и блот-гибридизации по Саузерну трансгенных линий ячменя SBEIIa и SBEIIb
(с): слабый; (ос): очень слабый; нр: нет результата
Блот-гибридизационный анализ по Саузерну трансформированного ячменя
Блот-гибридизационный анализ по Саузерну проводили на ДНК из растений, трансгенных по ds-SBEIIa и ds-SBEIIb, и их потомства, чтобы подтвердить результаты ПЦР. ДНК, подвергнутую гидролизу EcoRI, получали из растений стандартными способами, подвергали электрофорезу в 1%-ных агарозных гелях и переносили с помощью блоттинга на нейлоновую мембрану Hybond N+ (Amersham). Радиоактивно меченные зонды получали из района интрона 3 генов SBEIIa (положения 2220-2731, см. Фиг.3) и SBEIIb (положения 2019-2391, см. Фиг.4). Эти сегменты являются участками соответствующих конструкций ds-SBEIIa и ds-SBEIIb (пример 3) и были мечены радиоактивными метками, используя систему мечения ДНК Megaprime (Amersham Pharmacia Biotech UK Ltd), и использовались для гибридизации. Гибридизацию проводили в смеси 25% (об./об.) формамид, 5×SSC, 0,1% ДСН, 10× раствор Денхардта, 100 мкг/мл ДНК спермы лосося при 42°С в течение 16 ч с последующей отмывкой 2×SSC, 0,1% ДСН при 65°С в течение 3×1 ч. Авторадиография мембран выявила полосы положительной гибридизации на дорожках, соответствующих растениям, которые являлись положительными по этим конструкциям (Фиг.7). Фрагменты эндогенных генов ячменя SBEIIa и SBEIIb не обнаруживались при гибридизации в связи с отличием по последовательности использованного зонда интрона 3 пшеницы.
Результаты анализов ПЦР и гибридизации по Саузерну суммированы в таблице 2. В целом результаты ПЦР и гибридизации по Саузерну хорошо коррелировали. Расхождения могли быть связаны с ложноотрицательными результатами и могут быть легко разрешены с помощью повторных анализов. Растения, которые являлись положительными по трансгенам, как продемонстрировано обоими способами, включали 4 независимых события трансформации для ds-SBEIIa по Саузерну (IIa 4.1, IIa 4.2, IIa 5 и IIa 6) и 5 независимых событий для ds-SBEIIb (событие № IIb 2, IIb 3, IIb 4, IIb 5 и IIb 9).
Анализ белков эндосперма ячменя с помощью электрофореза в полиакриламидном геле (ПААГ)
Чтобы определить воздействие трансгенов ds-SBEIIa и ds-SBEIIb на экспрессию генов SBEIIa и SBEIIb ячменя у трансформированных растений, экспрессию специфичных белков в ткани эндосперма развивающихся зерен определяли с помощью электрофореза в ПААГ в неденатурирующих условиях и Вестерн-блот-анализа. Поскольку ожидали, что семена Т1 (семена от растений Т0) будут расщепляться по трансгенам, эндосперм от каждого из десяти индивидуальных развивающихся зерен Т1 от каждого растения Т0 на 20-ые сутки после цветения анализировали на экспрессию белка SBEIIa и SBEIIb. Чтобы сохранить растения Т1, зародыши извлекали из развивающихся зерен и культивировали для регенерации растений Т1. Эндосперм, отсеченный от всех материнских тканей (0,2 г), гомогенизировали в 600 мкл 50 мМ буфера KPi (42 мМ К2HPO4 и 8 мМ КН2PO4), рН 7,5, содержащего 5 мМ ЭДТА, 20% глицерина, 5 мМ ДТТ (дититреитол) и 1 мМ Pefabloc. Измельченные образцы центрифугировали в течение 10 мин при 13000 g, а супернатант делили на аликвоты и замораживали при -80°С до использования. Уровни белка измеряли с реагентом Кумасси, используя БСА (бычий сывороточный альбумин) в качестве стандарта. Суммарные растворимые белки, эквивалентные 20 мкг, экстрагированные из каждого эндосперма, наносили на дорожку и подвергали электрофорезу в 8%-ных неденатурирующих полиакриламидных гелях, содержащих 0,34 М Трис-HCl (рН 8,8), акриламид (8%), персульфат аммония (0,06%) и TEMED (0,1%). После электрофореза белки переносили на нитроцеллюлозную мембрану согласно Morell et al. (1997) и подвергали иммунологической реакции со специфичными антителами на SBEIIa и SBEIIb. Антитело, использованное для обнаружения SBEIIa, представляло собой 3KLH из кроликов, которое было выработано против синтетического пептида AASPGKVLVPDESDDLGC SEQ ID No. 8 (последовательность с N-конца SBEIIa) и разбавлено 1:5000 для использования. Антитело, использованное для обнаружения SBEIIb, представляло собой R6, выработанное против синтетического пептида AGGPSGEVMIGC SEQ ID No. 9 (выведенная последовательность с N-конца SBEIIb) и разбавленное 1:6000 перед использованием. Второе антитело представляло собой GAR-HRP конъюгат (разведение 1:3000), и иммунореактивные полосы выявляли, используя систему обнаружения Amersham ECL.
Экспрессия белка в развивающихся семенах Т1 от растений, трансформированных генами ds-SBEIIa и ds-SBEIIb, как оказалось, претерпевала сегрегацию в соотношении 1:2:1 сильные полосы:умеренные - слабые полосы:отсутствие полос для некоторых из трансформированных линий (например, см. Фиг.8 и 9). Это соотношение соответствует ожидаемому соотношению сегрегации гомозиготы (дикий тип = нуль по трансгенам):гетерозиготы:гомозиготы по трансгену. Растения Т1 из спасенных эмбрионов выращивали для получения семян Т2, которые подвергали скринингу с помощью ПЦР и анализа экспрессии белка, чтобы подтвердить генетический статус семян Т1 в отношении трансгена.
Эти данные указывают на то, что дуплекс-РНК конструкции эффективны в снижении экспрессии генов SBEIIa и SBEIIb в эндосперме ячменя.
Экспрессию гена SBEIIb в трансгенных семенах, содержащих трансген ds-SBEIIa, и экспрессию гена SBEIIa в семенах, содержащих ds-SBEIIb, также анализировали способом Вестерн-блоттинга. Неожиданно в трансгенных семенах, содержащих ds-SBEIIa, например, в результате события трансформации IIa 4.1, был значительно снижен SBEIIb. Смотри Фиг.9, демонстрирующий только низкий уровень экспрессии SBEIIb в семенах от линии IIa 4.1.8 (отметим очень слабые полосы на 4 дорожках из 7). Эта линия содержала трансген ds-SBEIIa и имела пренебрежимо малую экспрессию SBEIIa. Однако противоположный эффект не наблюдали в семенах, трансгенных по ds-SBEIIb. Экспрессия SBEIIa была неизмененной в семенах, в которых SBEIIb был полностью молчащим за счет ds-SBEIIb (Фиг.10), а именно для трансгенных линий, являвшихся результатом событий трансформации IIb 4 и IIb 2. Район, включающий экзоны 1-3, использовали для обеих дуплексных конструкций ds-SBEIIa и ds-SBEIIb. Выравнивание последовательностей SBEIIa и SBEIIb в этом районе выявило только примерно 70% идентичности. Наиболее длинный промежуток 100% идентичности представлял собой район из 21 п.о. в экзоне 2. Хотя все же возможно, что экспрессия SBEIIb подавлялась конструкцией ds-SBEIIa за счет гомологии последовательности, возможно также, что активность SBEIIb была понижена трансгеном ds-SBEIIa за счет какого-либо другого механизма.
Уровни экспрессии генов SBEIIa и SBEIIb могут быть также специфично определены на уровнях мРНК с помощью стандартных методик, таких как способы гибридизации по Норзерну и ОТ-ПЦР, например, используя зонды из неконсервативных районов или пары праймеров, которые гибридизуются с уникальными сайтами в одном из генов, но не в другом, например, в 3'-нетранслируемых районах. Такие районы или сайты можно легко идентифицировать путем сравнения последовательностей этих двух генов.
ПРИМЕР 6. АНАЛИЗ СОСТАВА И СОДЕРЖИМОГО ЗЕРНА, ВКЛЮЧАЯ КРАХМАЛ
Состав и содержимое зерна, в частности, для крахмала можно измерить, используя стандартные методики, такие как описанные в примере 1.
После экстракции растворимых белков, как описано выше, крахмальные гранулы из индивидуальных образцов эндосперма из развивающихся семян, содержащих трансген ds-SBEIIa, визуализировали под световым микроскопом. Значительное изменение морфологии крахмальной гранулы (смотри, например, Фиг.11) наблюдали в развивающемся эндосперме, в котором была снижена экспрессия SBEIIa, для трех из пяти проанализированных событий трансформации: IIa 4.1, IIa 4.2 и IIa 13, но не для событий IIa 5 или IIa 6, которые могли иметь меньшую степень инактивации гена. Например, крахмал из семян IIa 4.2.5, который не имел полосы SBEIIa на белковом иммуноблоте, был в высокой степени искажен по сравнению с нормальными гранулами в семенах IIa 4.2.3, которые имели сильную полосу SBEIIa на белковом иммуноблоте (таблица 3). Результаты световой микроскопии были подтверждены сканирующей электронной микроскопией (СЭМ), которую можно также использовать для непосредственного наблюдения крахмальных гранул. Для этого очищенный крахмал распыляли с золотом и сканировали при 15 кВ при комнатной температуре. Семена со сниженной экспрессией SBEIIa проявляли искаженную неправильную форму, которая была видна под сканирующим электронным микроскопом, например искажение гранул в семенах IIa 4.2.5 по сравнению с семенами IIa 4.2.3 (Фиг.12).
В противоположность растениям, содержащим ds-SBEIIa, растения, трансформированные ds-SBEIIb, показали крахмальные гранулы эндосперма с нормальной морфологией при исследовании с помощью микроскопии, например линия IIb 4.1 (смотри таблицу 3). Это позволяет предположить, что снижение экспрессии одного SBEIIb существенно не изменяет морфологию крахмальных гранул.
Морфология крахмальных гранул тканей эндосперма Т1 трансгенных линий ячменя ds-SBEIIa и ds-SBEIIb
Двойное лучепреломление представляет собой способность вещества отражать свет в двух направлениях; оно образует темный крест, называемый «мальтийским крестом», на каждой крахмальной грануле при наблюдении в поляризующем микроскопе. Двойное лучепреломление является показателем степени упорядоченной структурной организации полимеров внутри гранул (Thomas and Atwell, 1999). Крахмальные гранулы из эндосперма семян IIa 4.2.5 (с пониженной активностью SBEIIa) в поляризованном свете показали, что в этих гранулах имеет место значительная потеря двойного лучепреломления по сравнению с гранулами из семян IIa 4.2.3 (дикий тип). В среднем 44,8% гранул в семенах IIa 4.2.5 не имели двойного лучепреломления в противоположность 2,2% в семенах IIa 4.2.3 (таблица 4). Потеря двойного лучепреломления в крахмальных гранулах в целом хорошо коррелирует с повышенным содержанием амилозы.
Двойное лучепреломление крахмальных гранул из эндосперма Т1 трансгенных линий ячменя ds-SBEIIa
Анализ массы зерна трансгенных семян из растений, выращенных в теплице, из линии IIa 4.2, содержащей ds-SBEIIa, выявил, что даже в семенах с сильно искаженными крахмальными гранулами отсутствовало значительное снижение массы зерна и, следовательно, продукции крахмала (таблица 5). Это отличается от пониженной массы зерна, наблюдаемой у ячменя, который является мутантным по гену SSIIa, который проявляет значительно сниженную продукцию крахмала (Morel et al., 2003). Это позволяет предположить, что средняя масса зерна и, следовательно, урожай ячменя с пониженной активностью SBEIIa в эндосперме, выращенного в поле, является почти нормальным.
Масса зерна семян Т1 из трансгенной по SBEIIa линии ячменя IIa 4.2
Уровни амилозы и амилопектина в зерне трансгенного ячменя
Семена с крахмальными гранулами, имеющими искаженную форму, описаны у высокоамилозного ячменя (Morell et al., 2003) и у кукурузы с низким амилопектином (LAPS), имеющей примерно 90% амилозы в крахмале (Sidebottom et al., 1998). Содержание амилозы можно определить с помощью ВЭЖХ с вытеснением по размеру в 90% (мас./об.) ДМСО или по величине синего окрашивания йодом (йодометрический способ), как описано в примере 1. На основании массы зерна и содержания амилозы количество амилозы, запасаемой на зерно, можно вычислить и сравнить для трансгенных и контрольных линий.
Крахмал выделяли из зерен ячменя поколения Т1 с расщеплением по ds-SBEIIa или поколения Т2 (возможно, гомозиготного по ds-SBEIIa) от растений, трансгенных по гену ds-SBEIIa или полученных в результате скрещивания между линией IIa 4.2.5 и линией IIb 4.3.8 (содержащей как ds-SBEIIa, так и ds-SBEIIb), и содержание амилозы определяли колориметрическим способом по Morrison and Laignelet (1983). Определяли содержание амилозы крахмала из пяти объединенных образцов зерна, перечисленных ниже. Поглощение, считываемое при 650 нм, переводили в процентное содержание амилозы, используя уравнение регрессии, выведенное на основании стандартных образцов (в диапазоне от 0 до 100% амилозы), полученных из амилозы и амилопектина картофеля, Y=137,38х-30,361, где х представляет собой поглощение при 650 нм, а Y представляет собой процентное содержание амилозы.
Образцы:
Пул 1: семь семян Т1, которые показали сильное искажение крахмальных гранул, от трансгенной линии IIa 4.1.
Пул 2: шесть семян Т1, которые показали некоторое искажение гранул, от трансгенной линии IIa 4.1.
Пул 3: семь семян Т1, которые имели гранулы нормального вида, от трансгенной линии IIa 4.1.
Пул 4: шесть семян Т2, которые показали сильное искажение гранул, от трансгенной линии IIa 4.2.5.
Пул 5: пять семян F1, которые показали сильное искажение гранул, от скрещивания между IIa 4.2.5 и IIb 4.3.8 (трансгенной линии по ds-SBEIIb).
Контроли: мутант ячменя М292 по SSIIa (Morel et al., 2003), ячмень сорта Himalaya и мутант пшеницы по SSIIa (Yamamori et al., 2000).
Крахмал из зерен от ячменя с пониженной активностью SBEIIa на основании искаженных крахмальных гранул показывал более чем 80% амилозы. Содержание амилозы повышалось со степенью искажения крахмальных гранул, сравнить пулы 1, 2 и 3 (таблица 6). Содержание амилозы для пулов 1 и 2 было выше, чем для крахмала из мутантной по SSIIa линии ячменя М292 (таблица 6). Содержание амилозы было даже выше (более 90%) в пуле 5, состоящем из зерен F1 от скрещивания между трансгенными линиями ds-SBEIIa и ds-SBEIIb. Следует отметить, что на значения поглощения, полученные этим способом, может несколько влиять структура амилопектина.
Содержание амилозы в зерне трансгенных линий ячменя с пониженной активностью SSIIa
Это означает, что содержание амилопектина в крахмале этих зерен значительно снижено, от примерно 75% у дикого типа до менее чем 20% или даже менее чем 10%, поскольку крахмал зерновых состоит почти исключительно из амилозы и амилопектина.
ПРИМЕР 7. МУТАЦИЯ ГЕНА SBEIIA У ЯЧМЕНЯ
Мутация гена SBEIIa у ячменя, приводящая к отсутствию экспрессии SBEIIa, может быть получена посредством либо облучения гамма-лучами, либо с помощью химического мутагенеза, например этилметансульфонатом (ЭМС). Для индукции мутации гамма-лучами семена облучали в дозе 20-50 кР из источника 60Со (Zikiryaeva and Kasimov, 1972). ЭМС мутагенез осуществляли путем обработки семян ЭМС (0,03% об./об.), как по Mullins et al. (1999). Мутантные зерна идентифицировали на основании повышенного содержания амилозы или измененной морфологии крахмала зерна и подтверждали описанными выше способами. Мутанты по SBEIIa можно подвергнуть повторному мутагенезу во втором раунде и провести скрининг потомства на потерю активности SBEIIb в дополнение к SBEIIa, либо мутант по SBEIIa можно скрестить с мутантом по SBEIIb, чтобы объединить эти мутации и получить нетрансгенный вариант ячменя, у которого по существу отсутствует активность SBEII в эндосперме.
ПРИМЕР 8. КЛОНИРОВАНИЕ ГЕНА SBEI И КОНСТРУКЦИИ ДЛЯ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ SBEI У ЯЧМЕНЯ
Выделение гена SBEI может быть осуществлено путем гибридизации зондов с кДНК или геномной библиотекой ячменя либо способами ПЦР. Конструкция праймеров ПЦР может быть основана на гомологичных генах из пшеницы, например, на основании последовательности ДНК, представленной в GenBank AF076679. Используемые праймеры могут быть следующими;
5' ACGAAGATGCTCTGCCTCAC 3' SEQ ID No. 10 и
5' GTCCAACATCATAGCCATTT 3' SEQ ID No. 11, и они приводят в результате к продукту ПЦР примерно 1015 п.о.
Последовательности гена SBEI используют для конструирования ингибиторных генных конструкций подобно тому, как описано выше для SBEIIa и SBEIIb, и вводят их в ячмень.
ПРИМЕР 9. КОМБИНИРОВАНИЕ МУТАНТОВ ПО SBEIIA С ДРУГИМИ МУТАНТАМИ СИНТЕЗА КРАХМАЛА
Растения, трансгенные по ds-SBEIIa и сниженные по активности SBEIIa, скрещивали с линиями ячменя М292 (мутант по SSIIa) и High Amylose Glacier (HAG). Были поставлены следующие скрещивания:
1) линия IIa 4.1.10 × HAG
2) линия IIa 4.1.16 × HAG
3) линия IIa 4.1.20 × М292
4) линия IIa 4.1.19 × HAG
Растения F1 подвергали самоопылению и линии, гомозиготные по обеим мутациям, идентифицировали с помощью генетического и молекулярного анализа. Ожидали, что комбинирование трансгена ds-SBEIIa с мутацией SSIIa приведет к крахмалам с очень высоким содержанием амилозы вместе с высоким содержанием глюкана. Комбинирование трансгена ds-SBEIIa с мутацией HAG может привести к дальнейшему изменению в составе крахмала с улучшенными функциями в дополнение к высокому содержанию амилозы.
ПРИМЕР 10. ХАРАКТЕРИСТИКИ ЯЧМЕНЯ, ВЫРАЩЕННОГО В ПОЛЕ
Массы зерна и содержание β-глюкана измеряли для нескольких разновидностей ячменя, выращенных в поле, включая линии М292 и М342 (мутант SSIIa, примерно 60-65% амилозы). На основании результатов (таблица 7) следует отметить, что у зерна М292 и М342 был снижен размер зерна и повышено содержание β-глюкана относительно разновидностей дикого типа (3,0-6,0% β-глюкана). Средняя масса выращенного в поле зерна дикого типа находилась в интервале 35-45 г/1000 зерен, выращенных в этих условиях. Содержание β-глюкана в зернах разновидностей дикого типа находилось в интервале 3-6%.
Масса зерна и уровни β-глюкана у ячменя, выращенного в поле
Специалистам в данной области техники будет понятно, что различные модификации и изменения данных способов могут быть сделаны, не отклоняясь от объема изобретения.
Пример 11.
Примеры заявленных композиций
Батончики-мюсли
Предварительно нагревают печь до 175°С. Смазывают маслом форму для пирога размером 27,5 см × 17,5 см. В кастрюле среднего размера при небольшом нагреве объединяют масло, сахар, воду, сахарную пудру и мед. Варят при перемешивании до тех пор, пока сахар не растворится. Прекращают нагревание. Добавляют зерно ячменя, кокосовый орех, воздушный рис, воздушные зерна пшеницы, плоды абрикоса и изюм. Смесь перемешивают деревянной ложкой до получения однородной массы. Полученную массу перекладывают в подготовленную форму для пирога. Запекают в течение 15-18 минут в предварительно нагретой печи. Форму охладить и мюсли нарезать брусочками.
Предварительно нагревают печь до 190°С. Сбрызгивают формочки для пышек противопригарным раствором или кладут в них специальные бумажные формочки для пышек. Перемешивают муку из цельного зерна ячменя, кондитерскую муку, пекарский порошок и соль в миске среднего размера до получения однородной массы. В большой миске взбивают яйца, затем взбитые яйца добавляют в мед и взбивают в течение 30 секунд. Затем добавляют молоко, масло и ванильный экстракт и взбивают. Затем полученную массу смешивают с полученной смесью из муки. Полученной массой заполняют формочки на три четверти. Выпекают в течение 22 минут. Полученные пышки охлаждают в течение 5 минут.












| название | год | авторы | номер документа |
|---|---|---|---|
| ПШЕНИЦА С МОДИФИЦИРОВАННОЙ АКТИВНОСТЬЮ ВЕТВЯЩЕГО ФЕРМЕНТА, А ТАКЖЕ ПОЛУЧЕННЫЕ ИЗ НЕЕ КРАХМАЛ И КРАХМАЛСОДЕРЖАЩИЕ ПРОДУКТЫ | 2004 |
|
RU2377303C2 |
| Высокоамилозная пшеница | 2011 |
|
RU2619636C2 |
| ЯЧМЕНЬ С ПОНИЖЕННОЙ АКТИВНОСТЬЮ СИНТАЗЫ КРАХМАЛА II (SSII) И КРАХМАЛСОДЕРЖАЩИЕ ПРОДУКТЫ С ПОНИЖЕННЫМ СОДЕРЖАНИЕМ АМИЛОПЕКТИНА | 2001 |
|
RU2268584C2 |
| ВЫСОКОАМИЛОЗНАЯ ПШЕНИЦА-III | 2017 |
|
RU2811010C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ КРАХМАЛА С НОВЫМИ ФУНКЦИЯМИ | 2016 |
|
RU2745568C2 |
| СПОСОБ ВЫЯВЛЕНИЯ СОБЫТИЙ РЕДАКТИРОВАНИЯ ГЕНА SBEIIA У ЗЕРНОВЫХ КУЛЬТУР С ПОМОЩЬЮ НАБОРА ОЛИГОНУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ | 2023 |
|
RU2833965C1 |
| ИНКАПСУЛИРОВАНИЕ ПОЛИПЕПТИДОВ В МАТРИЦУ КРАХМАЛА | 1997 |
|
RU2268301C9 |
| АУТОПРОЦЕССИРУЮЩИЕСЯ РАСТЕНИЯ И ЧАСТИ РАСТЕНИЙ | 2002 |
|
RU2312144C2 |
| СПОСОБ ПРЕОБРАЗОВАНИЯ ГРАНУЛИРОВАННОГО КРАХМАЛА В ЭТАНОЛ | 2007 |
|
RU2460798C2 |
| ЯЧМЕНЬ С НИЗКИМ СОДЕРЖАНИЕМ ГОРДЕИНОВ | 2008 |
|
RU2518241C2 |
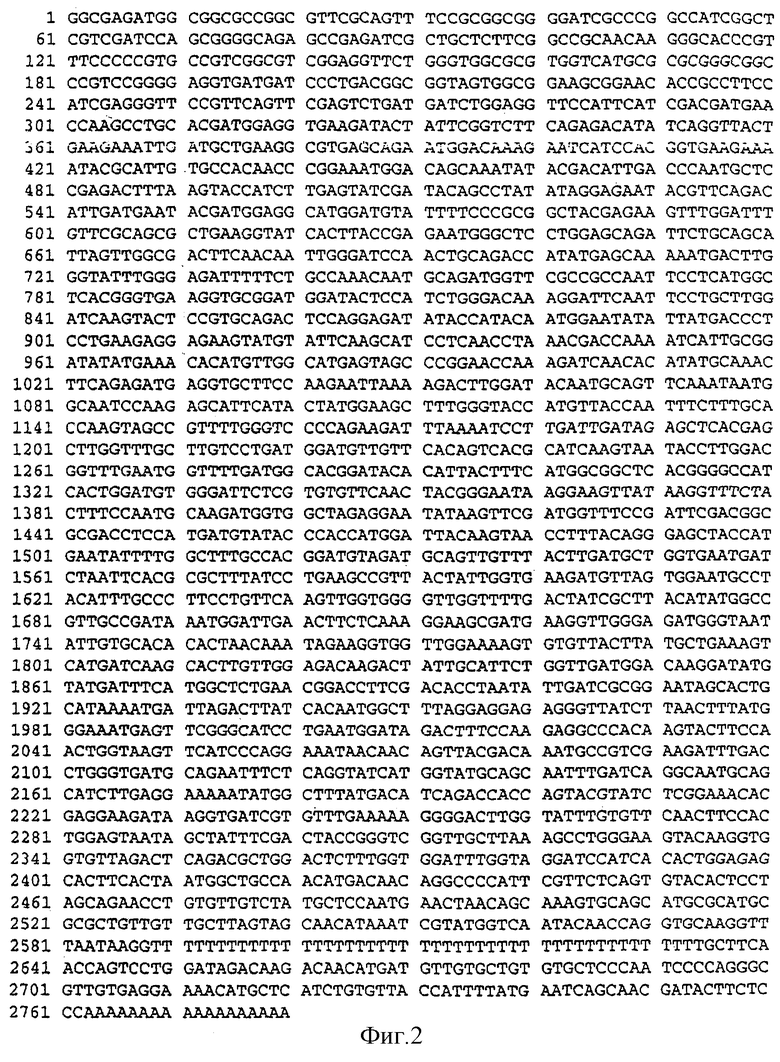

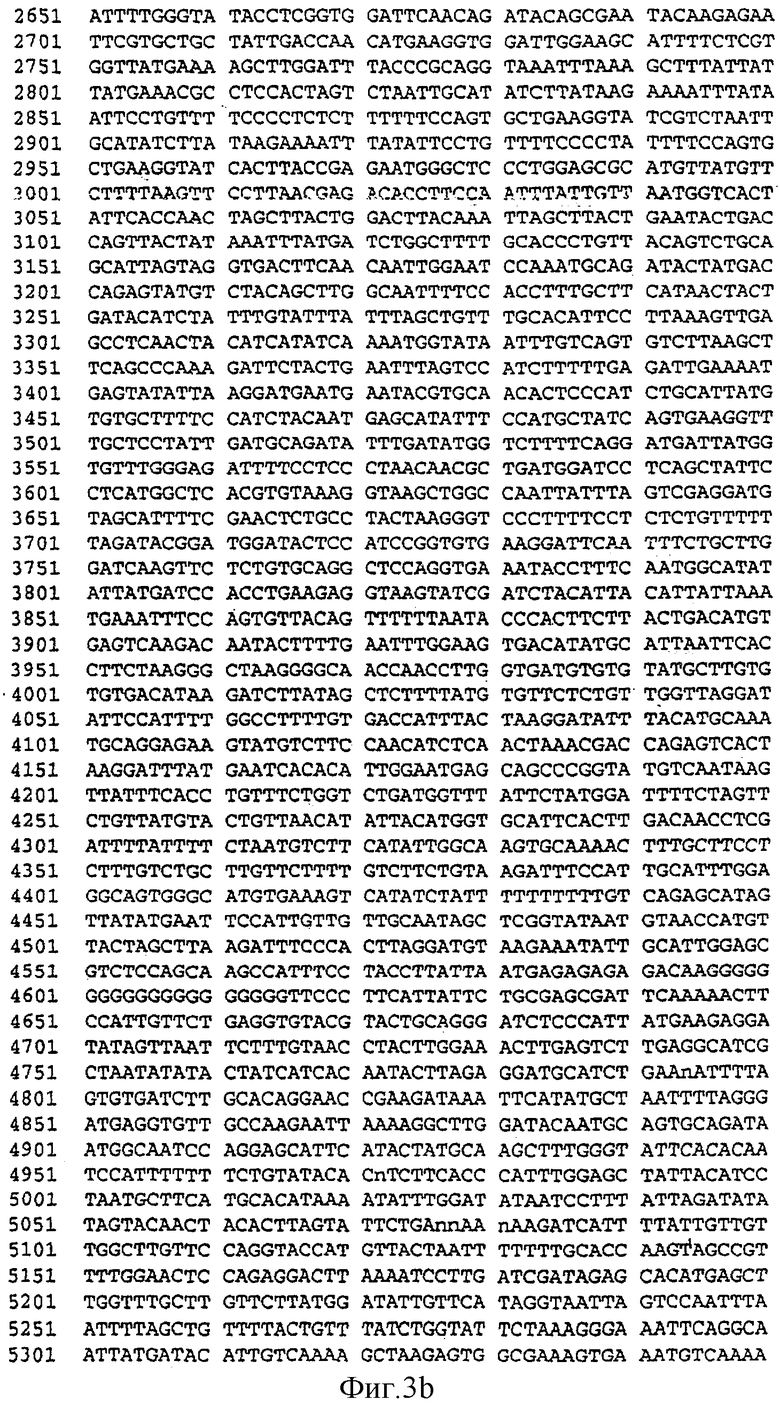
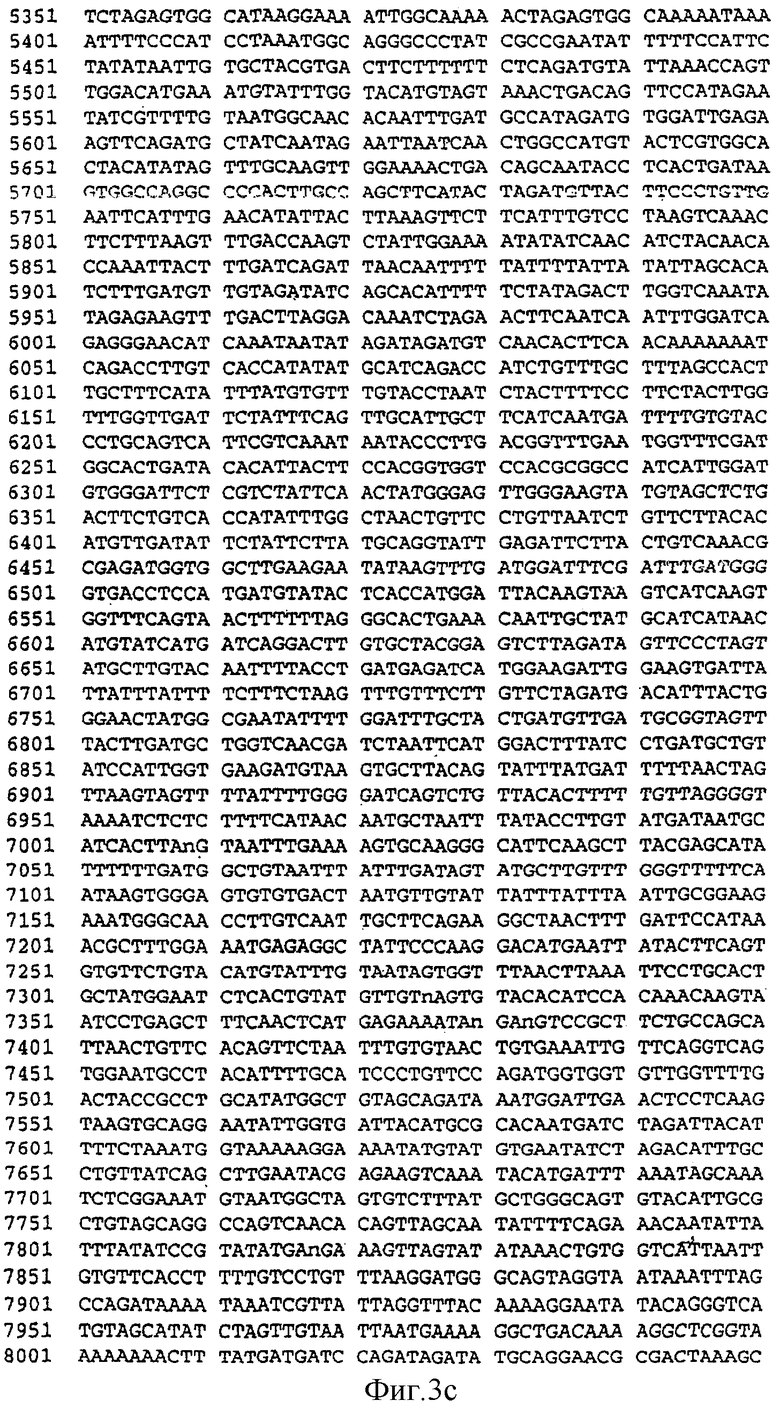


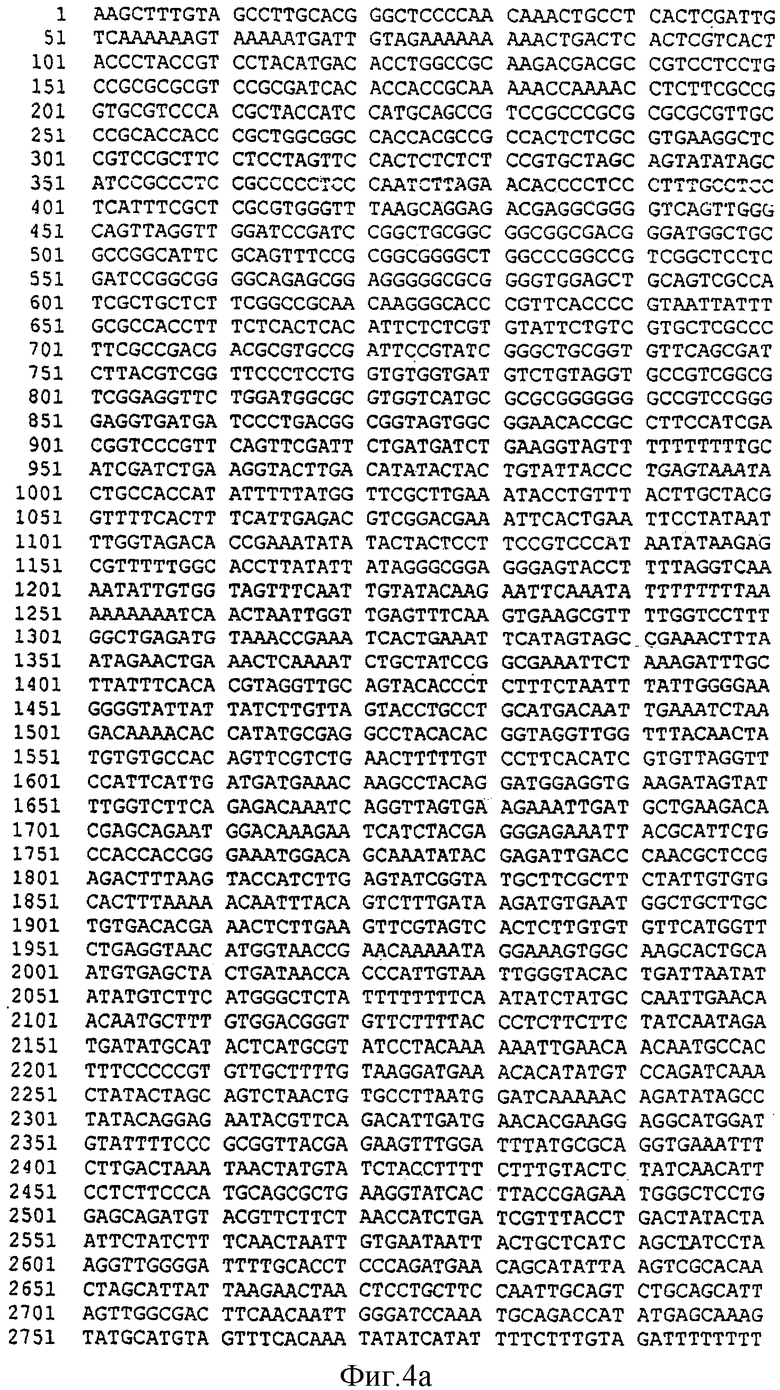


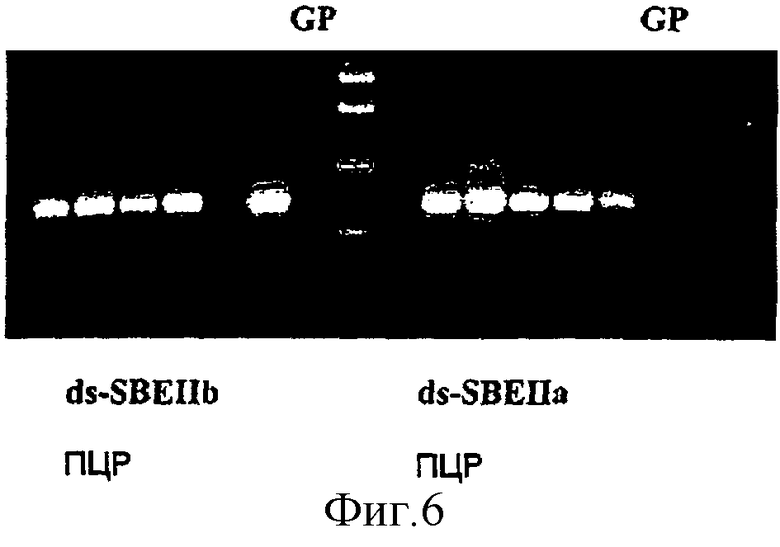
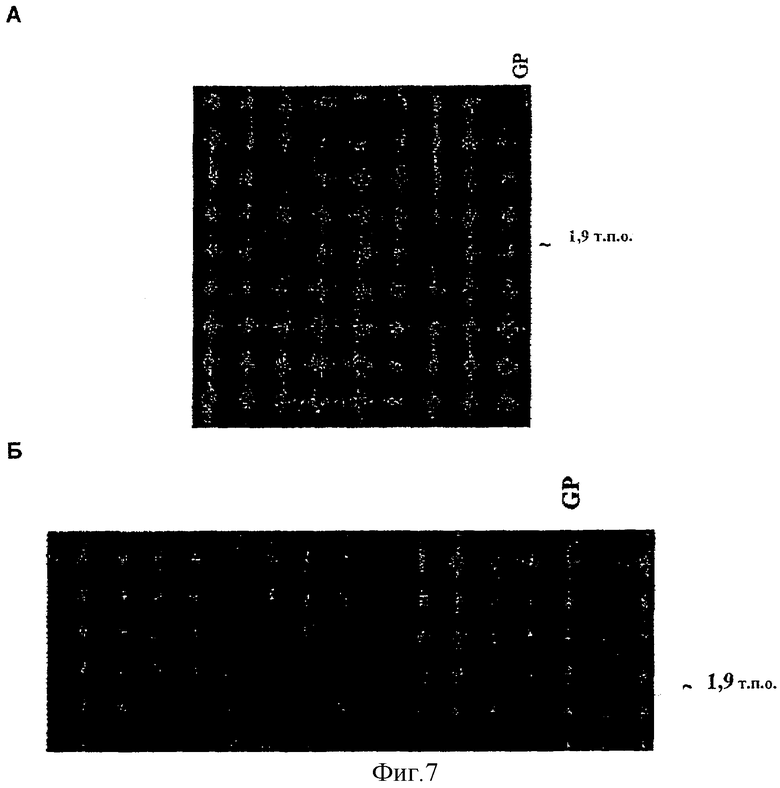

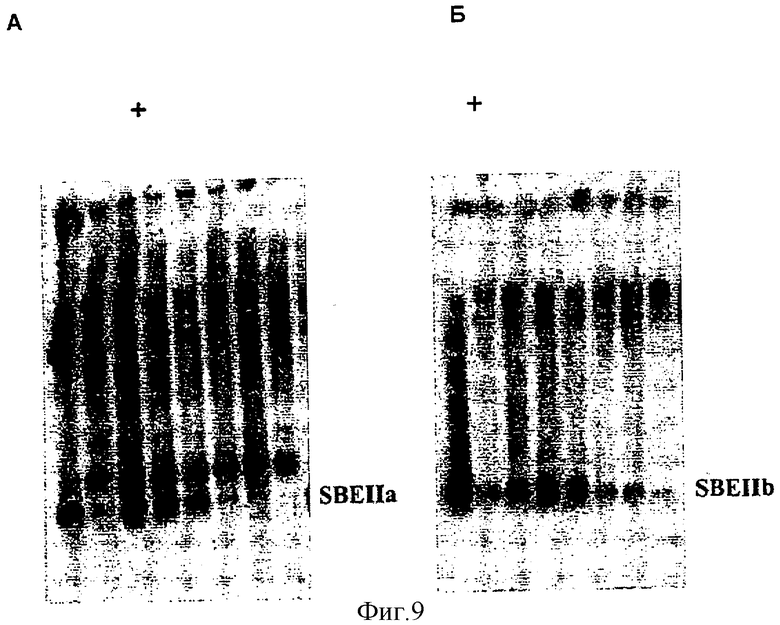
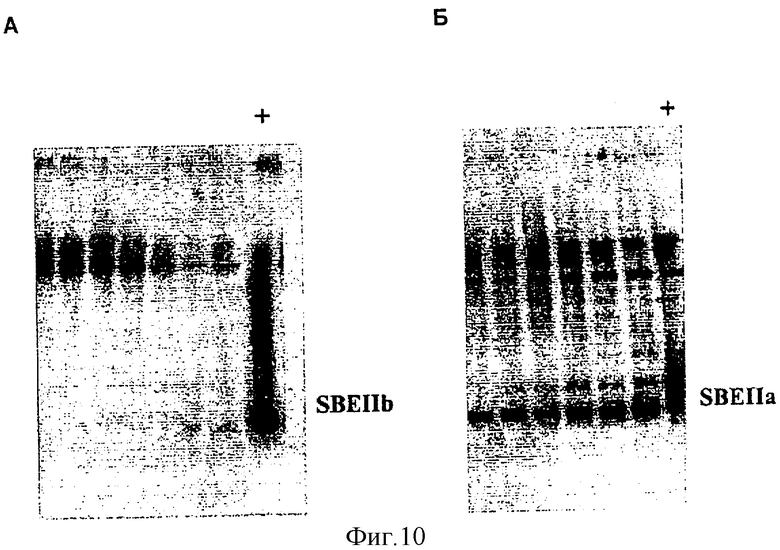
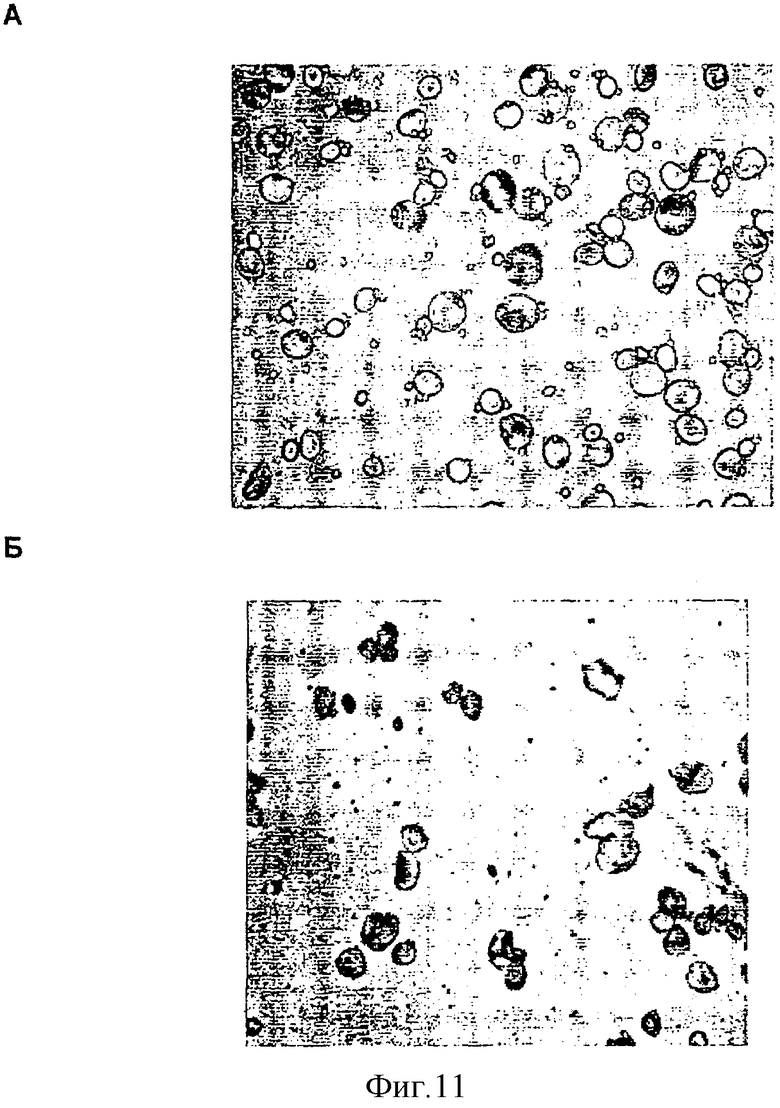

Растение ячменя, содержащее мутацию в гене SBEIIa или трансген, кодирующий ингибитор активности SBEIIa, имеет пониженный уровень активности фермента SBEIIa. Крахмал, полученный из зерна от такого растения, может иметь содержание амилозы по меньше мере 40% (мас./мас.). Этот ячмень может, кроме того, иметь пониженные уровни активности SBEIIb. Зерно ячменя может иметь неморщинистый фенотип, несмотря на повреждение пути синтеза амилопектина. 10 н. и 36 з.п. ф-лы, 12 ил., 7 табл.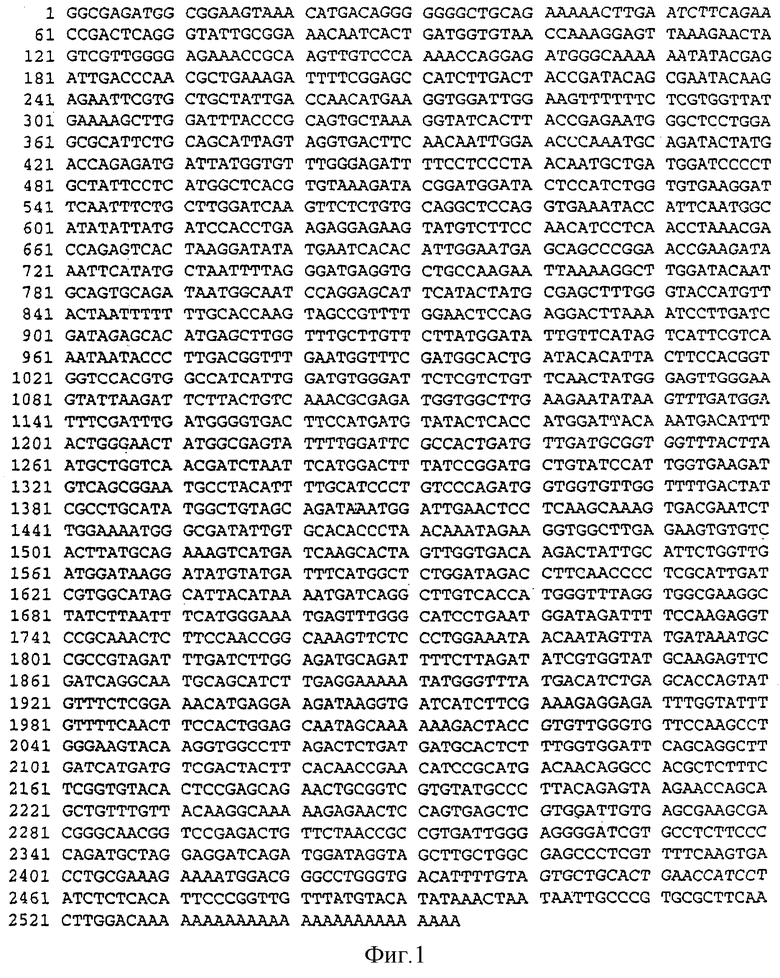
а) введения генетической вариации в родительское растение или семя ячменя, включающего либо введение мутации в ген SBElla, либо введение трансгена, который кодирует ингибитор активности SBElla, и
б) идентификации растения или семени-потомка родительского растения или семени ячменя со стадии (а), где это растение или семя-потомок имеет пониженную активность SBElla в эндосперме.
а) мутагенез семени от растения, имеющего пониженную активность ферментативной активности SBElla, посредством которого вводят мутацию в ген SBEllb, либо
б) скрещивание растения, имеющего пониженную ферментативную активность SBElla, с растением, имеющим пониженную ферментативную активность SBEllb;
и идентификацию растения ячменя, имеющего пониженную активность как SBElla, так и SBEllb.
| WO 00/15810 A1, 23.03.2000 | |||
| PHOTOSYNTHESIS: FROM LIGHT TO BIOSPHERE, vol.V, p.313-316, 1995 | |||
| RU 96124069 A, 10.02.1999. |
Авторы
Даты
2007-08-10—Публикация
2003-05-09—Подача