Область техники, к которой относится изобретение
Настоящее изобретение относится к рекомбинантному антителу против остеопонтина и к способу терапевтического лечения аутоиммунных заболеваний, ревматизма и ревматоидного артрита с использованием указанного антитела.
Предшествующий уровень техники
Остеопонтин (далее обозначаемый "OPN") представляет собой кислый кальций-связывающий гликопротеин, широко представлен в костной ткани. Известно, что три типа изоформ человеческого OPN, а именно остеопонтин-а (далее обозначаемый "OPN-а"), остеопонтин-b (далее обозначаемый "OPN-b") и остеопонтин-с (далее обозначаемый "OPN-с"), генерируются в природе путем альтернативного сплайсинга (Y. Saitoh et al., (1995): Laboratory Investigation, 72, 55-63). Предполагается, что из них предшественник OPN-а имеет аминокислотную последовательность SEQ ID NO:1, представленную ниже в списке последовательностей, где сигнальный пептид отщепляется после секреции с образованием зрелой формы OPN-а I17-N314. Кроме того, в биологическом организме зрелый OPN расщепляется тромбином со стороны С-конца от 168-го аргининового остатка на два фрагмента, а именно на N-концевой и С-концевой фрагменты.
Описанный выше OPN обладает различными физиологически и патологически важными функциями, например участвует в клеточной адгезии, в миграции клеток, в онкогенезе, в стимуляции иммунного ответа и в ингибировании опосредованного комплементом цитолиза. Различные типы рецепторов, присутствующие на клеточной поверхности, опосредуют различные функции. OPN имеет последовательность RGD (например, OPN-а имеет последовательность, простирающуюся от остатка в положении 159 до остатка в положении 161). Интегриновые молекулы, распознающие последовательность RGD, такие как αVβ3, αVβ1 и αVβ5, являются главными рецепторами OPN; в частности, интегриновые молекулы αVβ3, αVβ1 и αVβ5 опосредуют клеточную адгезию клеток гладких мышц сосудов. Кроме того, αVβ3 участвует в миграции макрофагов, лимфоцитов, эндотелиальных клеток и клеток гладких мышц и т.п.
Кроме того, недавно проводимые исследования показали, что OPN также связывается через последовательность SVVYGLR с интегриновыми молекулами α9β1, α4β1 и α4β7, и были также обнаружены различия в механизме их связывания, а именно было установлено, что α4β1 связывается как с OPN, еще не расщепленным тромбином (OPN нерасщепленного типа), так с N-концевым фрагментом расщепленного тромбином OPN (OPN расщепленного типа), в то время как α9β1 связывается только с расщепленным тромбином OPN. (Y. Yokosaki et al., (1999): The Journal of Biological Chemistry 274, 36328-36334/P.M. Green et al., (2001): FEBS Letters 503, 75-79/S.T. Barry et al., (2000): Experimental Cell Research 258, 342-351). По своим аминокислотным последовательностям интегриновые субъединицы α9 и α4 или интегриновые субъединицы β1 и β2 имеют большое сходство друг с другом. Кроме того, интегриновые молекулы α4β1 и α4β7 присутствуют, главным образом, в лимфоцитах и моноцитах, в то время как в нейтрофилах такие интегриновые молекулы экспрессируются на очень низком уровне. Альтернативно, в нейтрофилах α9β1 экспрессируются с высокой степенью селективности и их основной функцией является стимуляция миграции нейтрофилов посредством VCAM-1 и тенасцина-С. Кроме того, интегрин также по-разному экспрессируется в мышечных клетках, в эпителиальных клетках и в клетках печени и т.п. Как описано выше, цитоплазматические домены интегриновых субъединиц α4 и α9 кооперативно стимулируют миграцию лейкоцитов в область воспаления и их агрегацию в этой области посредством передачи отдельных клеточных сигналов по путям, незначительно отличающимся друг от друга, и усиливают их инфильтрирующую активность. Таким образом, интегриновые субъединицы участвуют в различных воспалительных реакциях.
Как описано выше, интегриновые молекулы различных типов стимулируют миграцию лейкоцитов и, таким образом, участвуют в воспалительных реакциях. Поэтому фармацевтические вещества, ингибирующие такую активность интегринов, могут обладать потенциальной полезностью в качестве противовоспалительного средства. Так, например, интегрин αVβ3 экспрессируется в остеокластах, в клетках сосудистого эндотелия и в клетках гладких мышц и т.п. В настоящее время проводятся исследования по продуцированию анти-αVβ3 антител, которые ингибируют связывание между интегрином αVβ3 и различными связывающими лигандами, и, возможно оказывают, например, ингибирующее действие на поражение суставов.
Поскольку рецепторы семейства интегринов обычно присутствуют в различных тканях, где они осуществляют главные функции по регуляции жизненно важных процессов, то использование антител против интегрина в целях терапевтического лечения ревматоидного артрита и остеоартрита, вероятно, может приводить к такому же ингибированию в других участках организма, но может также приводить к возникновению побочных эффектов.
Кроме того, в WO 01/71358 описаны способ скрининга для выявления вещества, ингибирующего связывание между интегрином α4 и остеопонтином, и способ терапевтического лечения воспалительных заболеваний с применением вещества, обнаруженного посредством такого скрининга.
На патогенез ревматоидного артрита указывают различные факторы. И эти факторы обсуждаются во многих работах. Однако не все эти факторы достоверны. Кроме того, известные в настоящее время терапевтические способы являются нозотропными (симптоматическими) и, по существу, не дают удовлетворительных результатов.
Следовательно, существует крайняя необходимость в точном определении патогенеза ревматоидного артрита и в разработке более эффективного терапевтического способа его лечения. Поэтому целью настоящего изобретения является решение указанных проблем.
Кроме того, ревматоидный артрит трудно отличить от остеоартрита. Поэтому другой целью настоящего изобретения является разработка диагностического способа.
Авторами настоящего изобретения было обнаружено, что концентрация OPN в жидкостях суставной полости у больных ревматизмом и у больных остеоартритом имеет более высокие значения. Кроме того, авторами настоящего изобретения было обнаружено, что в первое время у больных ревматизмом наблюдается увеличение содержания N-концевого фрагмента OPN, расщепленного тромбином, по сравнению с общим количеством OPN. Таким образом, авторами было высказано предположение, что OPN может быть глубоко вовлечен в начало развития этих заболеваний. Затем это предположение авторов настоящего изобретения было проверено в экспериментах с использованием мышей, дефицитных по OPN.
Кроме того, авторами настоящего изобретения были получены антитела, специфически распознающие N-концевой фрагмент и С-концевой фрагмент, отличающийся от расщепленного тромбином OPN. Затем в экспериментах, проводимых с применением OPN, авторы настоящего изобретения обнаружили, в частности, что N-концевой фрагмент расщепленного тромбином OPN присутствовал в высоких концентрациях в жидкостях суставной полости у больных ревматоидным артритом.
Более того, авторы настоящего изобретения обратили свое внимание на тот факт, что высокая концентрация N-концевого фрагмента наблюдается у больных ревматоидным артритом и указанный фрагмент содержит как сайты последовательности RGD, так и сайты последовательности SVVYGLR, которые могут распознаваться интегрином человека. Затем авторами настоящего изобретения было сделано предположение, что антитело, способное одновременно блокировать оба сайта данных последовательностей, должно ингибировать связывание между OPN и интегрином в настолько широких пределах, что это антитело могло бы быть эффективным для терапевтического лечения ревматоидного артрита и остеоартрита.
Кроме того, OPN присутствует в почках, плаценте, яичнике, головном мозге, в коже и т.п., но, главным образом, он экспрессируется в костной ткани. Авторы настоящего изобретения считают, что для терапевтического лечения ревматоидного артрита связывание между OPN и интегрином должно предпочтительно блокироваться по механизму, который является более специфическим по отношению к OPN. Поскольку различные интегриновые молекулы могут участвовать в воспалении путем кооперативного действия, то авторы настоящего изобретения считают, что такое действие должно быть эффективным для более широкого блокирования связывания с указанными различными интегриновыми молекулами.
Поэтому авторами настоящего изобретения было получено антитело, которое может ингибировать связывание между сайтом последовательности RGD человеческого OPN и интегрином и связывание между сайтом последовательности SVVYGLR человеческого OPN и интегрином, и это действие антитела было подтверждено в исследованиях клеточной адгезии и клеточной миграции и т.п. Кроме того, авторами настоящего изобретения было выделено антитело против синтетического пептида, соответствующего внутренней последовательности мышиного OPN, и была проведена оценка эффективности такого антитела в качестве терапевтического агента с использованием мышиной модели артрита.
Более конкретно, поскольку мышиный OPN имеет последовательности RGD и SLAYGLR, распознаваемые мышиным интегрином, которые локализованы в положениях аминокислотной последовательности, гомологичных их положениям в человеческом OPN, то было выделено антитело М5, одновременно блокирующее такие последовательности. Было подтверждено, что связывание антитела М5 с мышиным OPN и с продуктами его расщепления тромбином ингибировалось пептидом GRGDSP, включающим последовательность RGD, и что антитело М5 ингибировало миграцию TNF-α-ативированного моноцита, полученного из мышиной селезенки. Также наблюдалось, что антитело М5 оказывало подавляющее действие на поражение кости, как было оценено в культуральной системе клеток свода черепа мыши. Кроме того, было подтверждено, что антитело при его введении в мышиную модель коллагенового артрита обладает заметным терапевтическим эффектом.
Указанные выше результаты давали веское основание предполагать, что данное антитело, которое может одновременно блокировать связывание сайтов последовательностей RGD и SVVYGLR с интегрином человека, может ингибировать связывание между OPN и интегрином так, чтобы являться эффективным для терапевтического лечения ревматоидного артрита и т.п.. Кроме того, полученные результаты дают основание предполагать, что это антитело может быть эффективным не только для лечения ревматизма, такого как ювенильный суставной ревматизм и хронический ревматизм, но также и для лечения псориатического артрита и псориаза. Кроме того, хроническое отторжение органа после его трансплантации характеризуется осложнением, вызванным васкулярными и бронхиальными окклюзионными расстройствами. Результаты гистологических анализов позволяют предположить, что активация Т-клеток и макрофагов стимулирует продуцирование цитокина и факторов роста, приводящее к васкулярным эндотелиально-клеточным расстройствам и пролиферации клеток гладких мышц сосудов, которая может приводить посредством фиброгенеза и т.п. к окклюзии сосудов (P. Freese et al., (2001): Nephrol Dial Transplant, 16, 2401-2406/J.R. Waller et al., (2001): British Journal of Surgery, 88, 1429-1441/S.R. Lehtonen et al., (2001): Transplantation, 72, 1138-1144). Также сообщалось, что OPN играет важную роль в активации макрофагов и в фиброгенезе клеток гладких мышц сосудов (A. O'Regan et al., (2000): Int. J. Exp. Pathol, 81, 373-390). Таким образом, OPN-ингибирующее антитело настоящего изобретения подавляет миграцию моноцитов и нейтрофилов и тем самым, возможно, ингибирует процесс развития такого фиброгенеза. Таким образом, данное антитело ингибирует хроническое отторжение органов после их трансплантации, что в результате способствует приживлению органа. Кроме того, указанное антитело может быть эффективным для терапевтического лечения аутоиммунных заболеваний, включая системные аутоиммунные заболевания, эритематоз, увеит, болезнь Бехчета, дерматомиозит, пролиферирующий клубочковый нефрит, саркоидоз и т.п.
На основании установленных выше фактов авторами настоящего изобретения было обнаружено антитело против остеопонтина, которое может ингибировать связывание между интегрином, распознающим сайт аминокислотной последовательности RGD, и остеопонтином или его фрагментом, а также может ингибировать связывание между интегрином, распознающим сайт аминокислотной последовательности SVVYGLR или соответствующую ей последовательность, и остеопонтином или его фрагментом. Авторами была подана Международная заявка (РСТ/JР02/03382), относящаяся к указанному антителу.
Описание изобретения
Антитело против остеопонтина представляет собой антитело, вырабатываемое у мышей (далее называемое "мышиным антителом") и имеющее высокий уровень аффинности по отношению к остеопонтину человека, ингибируя активность остеопонтина, стимулирующую миграцию периферических моноцитов или нейтрофилов. Поэтому предполагается, что указанное мышиное антитело может быть использовано в качестве терапевтического агента для лечения различных воспалительных заболеваний, включая, главным образом, ревматоидное заболевание человека. Однако введение мышиного антитела человеку сталкивается с определенными трудностями, связанными с факторами риска, такими как индуцирование антигенности, а также с неэффективностью белка из-за снижения его времени полужизни, поскольку данное мышиное антитело продуцируется у мышей.
Поэтому авторы настоящего изобретения модифицировали это мышиное антитело методами генной инженерии, не снижая его активности, и в результате ими было получено антитело против остеопонтина с пониженным индуцированием нежелательной антигенности.
Другими словами, объектами настоящего изобретения являются следующие объекты [1]-[45]:
[1] Антитело против остеопонтина или фрагмент антитела, где указанное антитело может ингибировать связывание между интегрином, распознающим сайт аминокислотной последовательности RGD, и остеопонтином или его фрагментом, а также может ингибировать связывание между интегрином, распознающим сайт аминокислотной последовательности SVVYGLR, и остеопонтином или его фрагментом.
[2] Антитело против остеопонтина по п. [1], где указанное антитело продуцировано против пептида, содержащего неполную аминокислотную последовательность RGDSVVYGLRS в качестве антигена.
[3] Антитело против остеопонтина по п. [1] или [2], где указанное антитело продуцировано против пептида VDTYDGRGDSVVYGLRS в качестве антигена.
[4] Антитело против остеопонтина по любому из пп. [1]-[3], где указанным антителом является моноклональное антитело.
[5] Антитело против остеопонтина по любому из пп. [1]-[3], где указанным антителом является химерное антитело.
[6] Антитело против остеопонтина по п. [5], где указанное антитело имеет нижеследующую тяжелую цепь (а) и нижеследующую легкую цепь (b):
(а) тяжелую цепь, содержащую вариабельную область тяжелой цепи, полученной от мыши, и константную область тяжелой цепи, полученной от человека; и
(b) легкую цепь, содержащую вариабельную область легкой цепи, полученной от мыши, и константную область легкой цепи, полученной от человека.
[7] Антитело против остеопонтина по п. [5] или [6], отличающееся тем, что мышиная вариабельная область тяжелой цепи в тяжелой цепи (а) имеет аминокислотную последовательность, представленную в SEQ ID NO:19.
[8] Антитело против остеопонтина по п. [5] или [6], отличающееся тем, что мышиная вариабельная область легкой цепи в легкой цепи (b) имеет аминокислотную последовательность, представленную в SEQ ID NO:20.
[9] Антитело против остеопонтина по п. [5] или [6], где константная область тяжелой цепи в тяжелой цепи (а) представляет собой человеческий Ig-γ1.
[10] Антитело против остеопонтина по пп. [5] или [6], где константная область легкой цепи в легкой цепи (b) представляет собой человеческий Igk.
[11] Антитело против остеопонтина по пп. [1]-[3], где указанным антителом является гуманизированное антитело.
[12] Антитело против остеопонтина по п. [11], где указанное антитело против остеопонтина имеет нижеследующую тяжелую цепь (с) и нижеследующую легкую цепь (d):
(с) тяжелую цепь, содержащую вариабельную область тяжелой цепи и константную область тяжелой цепи, полученную от человека, где указанная вариабельная область тяжелой цепи состоит из определяющей комплементарность области, происходящей от мышиной вариабельной области тяжелой цепи, и каркасной области, происходящей от человеческой вариабельной области тяжелой цепи; и
(d) легкую цепь, содержащую вариабельную область легкой цепи и константную область легкой цепи, полученную от человека, где указанная вариабельная область легкой цепи состоит из определяющей комплементарность области, происходящей от мышиной вариабельной области легкой цепи, и каркасной области, происходящей от человеческой вариабельной области легкой цепи;
[13] Антитело против остеопонтина по п. [11] или [12], отличающееся тем, что определяющая комплементарность область в мышиной вариабельной области тяжелой цепи в тяжелой цепи (с) представляет собой аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID N№:21-23.
[14] Антитело против остеопонтина по п.[11] или [12], отличающееся тем, что определяющая комплементарность область в мышиной вариабельной области легкой цепи в легкой цепи (d) представляет собой аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:24-26.
[15] Антитело против остеопонтина по п. [11] или [12], отличающееся тем, что вариабельная область тяжелой цепи в тяжелой цепи (с) представляет собой аминокислотную последовательность, описанную в SEQ ID NO:28.
[16] Антитело против остеопонтина по п. [11] или [12], отличающееся тем, что вариабельная область легкой цепи в легкой цепи (d) представляет собой аминокислотную последовательность, описанную в SEQ ID NO:30.
[17] Антитело против остеопонтина по п. [11] или [12], где константная область тяжелой цепи в тяжелой цепи (с) представляет собой человеческий Igγ1.
[18] Антитело против остеопонтина по п. [11] или [12], где константная область легкой цепи в легкой цепи (d) представляет собой человеческий Igk.
[19] Нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в SEQ ID NO:19.
[20] Нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в SEQ ID NO:20.
[21] Нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в SEQ ID NO:28.
[22] Нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в SEQ ID NO:30.
[23] Вектор, содержащий нуклеотидную последовательность по п. [19] и последовательность человеческого гена Igγ1.
[24] Вектор, содержащий нуклеотидную последовательность по п. [20] и последовательность человеческого гена Igk.
[25] Вектор, содержащий нуклеотидную последовательность по п. [21] и последовательность человеческого гена Igγ1.
[26] Вектор, содержащий нуклеотидную последовательность по п. [22] и последовательность человеческого гена Igk.
[27] Клетка-хозяин, трансформированная векторами по пп. [23] и [24].
[28] Клетка-хозяин, трансформированная векторами по пп. [25] и [26].
[29] Способ продуцирования химерного антитела против остеопонтина по пп. [5] или [6], отличающийся тем, что он предусматривает культивирование клетки-хозяина по п. [27] и сбор указанного антитела из жидкой культуры.
[30] Способ продуцирования гуманизированного антитела против остеопонтина по пп. [11] или [12], отличающийся тем, что он предусматривает культивирование клетки-хозяина по п. [28] и сбор указанного антитела из жидкой культуры.
[31] Терапевтический агент для лечения аутоиммунных заболеваний, где указанный терапевтический агент содержит антитело по любому из [1]-[6], [11] или [12] или фрагмент указанного антитела в качестве эффективных ингредиентов.
[32] Терапевтический агент для лечения ревматизма, где указанный терапевтический агент содержит антитело по любому из [1]-[6], [11] или [12] или фрагмент указанного антитела в качестве эффективных ингредиентов.
[33] Терапевтический агент для лечения ревматоидного артрита, где указанный терапевтический агент содержит антитело по любому из [1]-[6], [11] или [12] или фрагмент указанного антитела в качестве эффективных ингредиентов.
[34] Терапевтический агент для лечения остеоартрита, где указанный терапевтический агент содержит антитело по любому из [1]-[6], [11] или [12] или фрагмент указанного антитела в качестве эффективных ингредиентов.
[35] Способ терапевтического лечения аутоиммунных заболеваний, отличающийся тем, что он предусматривает введение антитела по любому из пп. [1]-[6], или [11], или [12] или фрагмента указанного антитела пациенту, страдающему аутоиммунными заболеваниями.
[36] Способ терапевтического лечения ревматоидного артрита, отличающийся тем, что он предусматривает введение антитела по любому из пп. [1]-[6], или [11], или [12] или фрагмента указанного антитела пациенту, страдающему ревматоидным артритом.
[37] Способ терапевтического лечения ревматизма, отличающийся тем, что он предусматривает введение антитела по любому из пп. [1]-[6], или [11], или [12] или фрагмента указанного антитела пациенту, страдающему ревматизмом.
[38] Способ терапевтического лечения остеоартрита, отличающийся тем, что он предусматривает введение антитела по любому из пп. [1]-[6], или [11], или [12] или фрагмента указанного антитела пациенту, страдающему остеоартритом.
[39] Применение антитела по любому из пп. [1]-[6], [11] или [12] или фрагмента указанного антитела в целях получения лекарственного средства для лечения аутоимунных заболеваний.
[40] Применение антитела по любому из пп. [1]-[6], [11] или [12] или фрагмента указанного антитела в целях получения лекарственного средства для лечения ревматизма.
[41] Применение антитела по любому из пп. [1]-[6], [11] или [12] или фрагмента указанного антитела в целях получения лекарственного средства для лечения ревматоидного артрита.
[42] Применение антитела по любому из пп. [1]-[6], [11] или [12] или фрагмента указанного антитела в целях получения лекарственного средства для лечения остеоартрита.
[43] Способ скрининга терапевтического агента для лечения аутоиммунных заболеваний, отличающийся тем, что он предусматривает оценку уровня тестируемого соединения, ингибирующего связывание между сайтом последовательности RGD остеопонтина и интегрином и/или связывание между сайтом последовательности SVVYGLR и интегрином.
[44] Способ скрининга терапевтического агента для лечения ревматизма, отличающийся тем, что он предусматривает оценку уровня тестируемого соединения, ингибирующего связывание между сайтом последовательности RGD остеопонтина и интегрином и/или связывание между сайтом последовательности SVVYGLR и интегрином.
[45] Способ скрининга терапевтического агента для лечения ревматоидного артрита, отличающийся тем, что он предусматривает оценку уровня тестируемого соединения, ингибирующего связывание между сайтом последовательности RGD остеопонтина и интегрином и/или связывание между сайтом последовательности SVVYGLR и интегрином.
Краткое описание фигур
На фиг.1 представлен график, иллюстрирующий ингибирование RGD-зависимой клеточной адгезии к OPN.
На фиг.2 представлен график, иллюстрирующий ингибирование RGD-зависимой и RGD-независимой клеточной адгезии между nOPN и α9-трансформированной клеткой SW480 мышиным антителом 2К1.
На фиг.3а представлен график, иллюстрирующий OPN-индуцированную миграцию клеток.
На фиг.3b представлен график, иллюстрирующий ингибирование OPN-индуцированной миграции клеток антителами.
На фиг.4 представлен график, иллюстрирующий изменение степени поражения артритом в зависимости от времени у мыши, дефицитной по гену OPN, по сравнению с нормальной мышью при введении этим мышам индивидуальных доз смеси антител/ЛПС, вызывающей артрит.
На фиг.5 представлен график, иллюстрирующий сравнительное опухание запястий у мышей, дефицитных по гену OPN, и у нормальных мышей при введении этим мышам индивидуальных доз смеси антител/ЛПС, вызывающей артрит.
На фиг.6а представлены кривые данных, полученных посредством датчика BIACORE-2000 с использованием мышиного антитела 2К1 в качестве аналита.
На фиг.6b представлены кривые данных, полученных посредством датчика BIACORE-2000 с использованием химерного антитела 2К1 в качестве аналита.
На фиг.7 показано сравнение аминокислотных последовательностей VH в мышином антителе 2К1 и в матричном антителе человека.
На фиг.8 показано сравнение аминокислотных последовательностей VL в мышином антителе 2К1 и в матричном антителе человека.
На фиг.9 показана аминокислотная последовательность VH гуманизированного антитела 2К1 и его нуклеотидная последовательность, кодирующая указанную аминокислотную последовательность.
На фиг.10 показана аминокислотная последовательность VL гуманизированного антитела 2К1 и его нуклеотидная последовательность, кодирующая указанную аминокислотную последовательность.
На фиг.11 показана схема конструирования праймеров для амплификации нуклеотидной последовательности VH для гуманизированного антитела 2К1.
На фиг.12 показана схема конструирования праймера для амплификации нуклеотидной последовательности VL гуманизированного антитела 2К1.
На фиг.13 представлен график, иллюстрирующий активности связывания гуманизированного антитела 2К1 и химерного антитела 2К1 в различных концентрациях с пептидом остеопонтина.
На фиг. 14 представлен график, иллюстрирующий зависимую от концентрации адгезию мышиного OPN к NIH 3Т3.
На фиг. 15 представлен график, иллюстрирующий ингибирование адгезии мышиного OPN к NIH 3Т3 пептидом GRGDSP.
На фиг. 16 представлен график, иллюстрирующий ингибирование адгезии мышиного OPN к NIH 3Т3 антителом М5.
Наилучшие варианты осуществления изобретения
В соответствии с настоящим изобретением химерное антитело против остеопонтина и гуманизированное антитело против остеопонтина могут быть получены путем модификации константной области мышиного антитела против остеопонтина (называемого далее "OPN-ингибирующим антителом"), ингибирующего связывание между интегрином, распознающим сайт последовательности RGD, и OPN или его фрагментом, а также ингибирующего связывание между интегрином, распознающим сайт последовательности SVVYGLR или сайт соответствующей ей последовательности, и OPN или его фрагментом, как описано, например, в Международной заявке (РСТ/JР02/03382), относящейся к химерному антителу (см. публикацию заявки на выдачу Европейского патента ЕР 0125023) или к гуманизированному антителу (см. публикацию заявки на выдачу Европейского патента ЕР 0239400 или ЕР045126), методами генной инженерии так, чтобы полученное антитело, вводимое человеку или животному, могло иметь такую же константную область, как и антитело индивидуума, подвергаемого терапевтическому лечению.
Молекулы антитела отдельных классов имеют общую фундаментальную структуру, которая состоит из тяжелой цепи с молекулярной массой 50000-70000 дальтон и легкой цепи с молекулярной массой 20000-30000 дальтон. Указанная тяжелая цепь включает полипептидную цепь, в основном содержащую примерно 440 аминокислотных остатков. Каждый класс антител имеет свою собственную характерную структуру, конкретно называемую γ, μ, α, δ или ε-цепями, соответствующими IgG, IgM, IgA, IgD или IgE соответственно. Кроме того, IgG подразделяется на подклассы IgG1, IgG2, IgG3 и IgG4, каждый из которых конкретно обозначается γ1, γ2, γ3 или γ4 соответственно. Что касается легкой цепи, то известны два ее типа, L-тип и К-тип, каждый из которых состоит из полипептидной цепи, содержащей примерно 220 аминокислотных остатков и конкретно называемой λ- и k-цепями соответственно. Пептидная фундаментальная структура молекулы антитела состоит из двух эквивалентных тяжелых цепей и двух эквивалентных легких цепей, которые связаны вместе дисульфидной связью (S-S-связью) и нековалентной связью, с образованием антитела с молекулярной массой от 150000 до 190000 дальтон. Каждая из указанных двух типов легкой цепи может составлять пары с тяжелой цепью любого типа. Каждая молекула антитела всегда состоит из двух легких цепей одного и того же типа и двух тяжелых цепей одного и того же типа.
Тяжелая цепь имеет четыре S-S-связи внутри молекулы (пять S-S-связей в случае μ- или ε-цепи), а легкая цепь имеет две S-S-связи внутри молекулы. Каждая область из 100-110 аминокислотных остатков образует одну петлю. По своей стерической структуре все петли имеют сходство между собой и называются структурным звеном или доменом. Аминокислотные последовательности N-концевых доменов как в тяжелой цепи, так и в легкой цепи не являются константными, даже если эти домены происходят от одного и того же класса (подкласса) антител животных одного и того же вида. Поэтому N-концевые домены называются вариабельной областью (V-областью, вариабельной областью)(отдельные домены называются Vн и VL). Аминокислотная последовательность на С-концевой стороне от указанных доменов антител каждого класса или каждого подкласса является почти константной. Поэтому эта область называется константной областью (С-областью, константной областью)(отдельные домены конкретно обозначаются СН1, СН2, СН3 или CL).
Антигенная детерминанта (эпитоп) антитела состоит из VH и VL. Специфичность связывания определяется аминокислотной последовательностью этого сайта. Таким образом, биологические активности связывания с комплементами и различными клетками отражают структурные различия в С-области каждого класса Ig. Известно, что вариабельность указанной вариабельной области в легкой и тяжелой цепях фактически ограничена тремя небольшими определяющими комплементарность областями, присутствующими в каждой из указанных цепей. Такие области называются определяющими комплементарность областями (CDR). Остальная часть вариабельной области называется каркасной областью (FR) и является относительно константной. Обычно лишь 5-10 аминокислотных остатков в определяющей комплементарность области каждой вариабельной области образуют антигенную детерминанту.
Белок, который состоит из мышиной вариабельной области, способной распознавать антиген, и в остальном других областей человеческого типа, называется химерным антителом. Кроме того, в данном случае химерное антитело, распознающее остеопонтин и его фрагмент, называется химерным антителом против остеопонтина. Более того, генетически модифицированный рекомбинантный белок, который состоит из определяющей комплементарность области (сайт антигенной детерминанты), происходящей от антиген-специфического мышиного моноклонального антитела, и у которого все остальные области заменены областями, происходящими от молекулы иммуноглобулина человека, называется гуманизированным антителом. Кроме того, в данном случае гуманизированное антитело, распознающее остеопонтин и его фрагмент, называется гуманизированным антителом против остеопонтина.
В соответствии с настоящим изобретением химерное антитело против остеопонтина и гуманизированное антитело против остеопонтина может быть соответствующим образом сконструировано с использованием любых OPN-ингибирующих антител, которые могут ингибировать связывание между интегрином, распознающим последовательность RGD, таким как αVβ1, αVβ3 и αVβ5, и изоформой остеопонтина, такой как OPN-а, OPN-b, OPN-с или их N-концевые фрагменты, и которые могут также ингибировать связывание между интегрином, распознающим последовательность SVVYGLR, таким как α9β1, α4β1 и α4β7, и изоформой остеопонтина, такой как OPN-а, OPN-b, OPN-с или их N-концевых фрагментов. Термин "Последовательность SVVYGLR или ее соответствующая последовательность" означает последовательности, описанные ниже: то есть последовательность SVVYGLR представляет собой последовательность, простирающуюся от серина в положении 162 до аргинина в положении 168 в человеческом OPN, и термин "соответствующая ей последовательность" означает последовательность, соответствующую последовательности SVVYGLR, в OPN, полученном от одного из других млекопитающих, например последовательность SVVYGLR, полученную от свиней и идентичную человеческой последовательности, последовательность SVAYGLR, полученную от обезьян, последовательность SLAYGLR, полученную от мышей и крыс, последовательность SVAYGLK, полученную от коров, и последовательность SVAYRLK, полученную от кроликов.
OPN-ингибирующее антитело настоящего изобретения может быть получено любым способом, при условии, что полученное антитело будет сохранять нужные свойства. OPN-ингибирующее антитело может быть получено с использованием в качестве антигена, например, OPN-а, OPN-b, OPN-с или их N-концевого фрагмента или с использованием пептида, содержащего аминокислотную последовательность RGDSVVYGLR или соответствующую ей последовательность (называемую далее "OPN-родственным пептидом"). Используемый здесь "фрагмент OPN" означает фрагменты OPN, генерированные путем протеолиза OPN протеиназами и т.п., и включает, например, фрагмент, выделенный путем протеолиза тромбином.
OPN-ингибирующее антитело предпочтительно получают с использованием пептида, содержащего последовательность RGDSVVYGLR в качестве антигена. Более предпочтительно OPN-ингибирующее антитело получают с использованием в качестве антигена пептида (VDTYDGRGDSVVYGLRS), который содержит две указанные последовательности, расположенные друг за другом, и который начинается от валинового остатка в положении 153 и заканчивается сериновым остатком в положении 169 в OPN-а, и последующей обработкой этого пептида в соответствии с общей методикой. Для усиления антигенности предпочтительно в качестве антигена использовать продукт OPN-родственного пептида, связанного с биополимерным соединением.
Для исследований OPN-ассоциированных заболеваний, проводимых на мышах в качестве экспериментальных животных, предпочтительно использовать OPN-ингибирующее антитело против мышиного OPN. Такое антитело предпочтительно получают с использованием пептида, содержащего последовательность RGDSVVYGLR в качестве антигена.
Примерами биополимерного соединения, связывающегося с OPN-родственным пептидом, являются гемоцианин лимфы улитки Macroschisma (обозначаемый далее "KLH"), овальбумин (обозначаемый далее "OVA"), альбумин бычьей сыворотки (обозначаемый далее "BSA"), альбумин кроличьей сыворотки (обозначаемый далее "RSA") и тироглобулин. Из них более предпочтительными являются либо KLH, либо тироглобулин.
OPN-родственный пептид и биополимерное соединение могут быть связаны вместе известными методами, например методом с использованием смешанного ангидрида кислоты (B.F. Erlanger et al., (1954): J. Biol. Chem. 234, 1090-1094) или методом с использованием активированного сложного эфира (A.E. Karu et al., (1994) J. Agric. Food Chem. 42, 301-309).
Смешанный ангидрид кислоты, используемый в указанном способе, может быть получен реакцией Шоттена-Баумана, которой подвергают OPN-родственный пептид, затем пептид подвергают реакции с биополимерным соединением с получением целевого продукта в виде полимерного соединения, связанного с пептидом. В способе с использованием смешанного ангидрида кислоты эфиром галогенмуравьиной кислоты являются, например, метилхлорформиат, метилбромформиат, этилхлорформиат, этилбромформиат, изобутилхлорформиат и т.п. Отношение пептида, эфира галогенмуравьиной кислоты и полимерного соединения, используемых в указанном способе, может варьироваться в широком диапазоне. В настоящем изобретении реакцию Шоттена-Баумана осуществляют в присутствии основного соединения. Основным соединением, используемым в данной реакции, являются соединения для установленного использования в реакции Шоттена-Баумана, например органические основания, такие как триэтиламин, триметиламин, пиридин, диметиланилин, N-метилморфолин, диазабициклонен (DBN), диазабициклоундецен (DBU), диазабициклооктан (DABCO) и т.п., и неорганические основания, такие как карбонат калия, карбонат натрия, бикарбонат калия, бикарбонат натрия и т.п.
Кроме того, данная реакция обычно протекает при -20-100°С, предпочтительно при 0-50°С. Время реакции составляет примерно от 5 минут до 10 часов, предпочтительно от 5 минут до 2 часов.
Реакцию между полученным смешанным ангидридом кислоты и биополимерным соединением обычно осуществляют при температуре от -20°С до 150°С, предпочтительно при 0-100°С, в течение периода времени примерно от 5 минут до 10 часов, предпочтительно от 5 минут до 5 часов. Способ с использованием смешанного ангидрида кислоты обычно осуществляют в растворителе. Таким растворителем являются, например, любые растворители, которые обычно применяют в способе с использованием смешанного ангидрида кислоты, в частности галогенированные углеводороды, такие как дихлорметан, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; сложные эфиры, такие как метилацетат и этилацетат; непротонные полярные растворители, такие как N,N-дметилформамид, диметилсульфоксид и гексаметилфосфотриамид и т.п.
Альтернативно, способ с использованием активированных сложных эфиров обычно осуществляют следующими образом. Сначала OPN-родственный пептид растворяют в органическом растворителе для осуществления реакции с N-гидроксисукцинимидом в присутствии связывающего агента, в результате чего получают активированный N-гидроксисукцинимидом сложный эфир.
В качестве связывающего агента могут быть использованы связывающие агенты для установленного использования в реакции конденсации, например, такие как дициклогексилкарбодиимид, карбонилдиимидазол и водорастворимый карбодиимид. Альтернативно, в качестве органического растворителя могут быть использованы, например, N,N-дметилформамид (ДМФА), диметилсульфоксид и диоксан. Молярное отношение пептида и связывающего агента, такого как N-гдроксисукцинимид, используемого в данной реакции, предпочтительно составляет от 1:10 до 10:1, наиболее предпочтительно 1:1. Температура реакции составляет 0-50°С, предпочтительно 22-27°С, и время проведения реакции составляет от 5 минут до 24 часов, предпочтительно от одного часа до 2 часов. Подходящей температурой реакции является температура в пределах от конкретной точки плавления или выше до конкретной точки кипения или ниже.
После реакции связывания реакционный раствор добавляют к раствору для растворения в нем биополимерного соединения для проведения реакции. В случае, когда биополимерное соединение имеет свободную аминогруппу, то, например, между аминогруппой и карбоксильной группой пептида образуется кислотно-амидная связь. Температура реакции составляет 0-60°С, предпочтительно 5-40°С и более предпочтительно 22-27°С, и время проведения реакции составляет от 5 минут до 24 часов, предпочтительно от одного часа до 16 часов и более предпочтительно от одного часа до 2 часов.
Реакционный продукт между OPN-родственным пептидом и биополимерным соединением, генерированный указанным способом, очищают диализом или на обессоливающей колонке и т.п., с выделением продукта OPN-родственного пептида, связанного с биополимерным соединением (далее называемого просто "связанным продуктом").
Ниже приводится описание способа продуцирования антитела с использованием полученного таким образом связанного продукта в качестве антигена и способа иммуноанализа с применением данного антитела. Для получения указанного антитела могут быть использованы известные подходящие способы, которые описаны, например, Zoku Seikagaku Jikken Koza (Biochemical Experimental Lecture Series) и Men-eki Seikagaku Kenkyu Ho (Immuno-Biochemistry Research Method) (Nihon Seikagaku Gakkai hen (Japan Biochemical Association, ed.)).
Для получения поликлонального антитела с применением связанного продукта настоящего изобретения животное иммунизируют указанным связанным продуктом в целях выделения антитела у данного животного.
Более конкретно, например, связанный продукт, такой как продукт связывания OPN-родственного пептида с тироглобулином, сначала растворяют в натрийфосфатном буфере (далее называемом "PBS"), затем смешивают с полным адъювантом Фрейнда или с неполным адъювантом Фрейнда или со вспомогательным агентом, таким как квасцы. Полученную смесь используют в качестве иммуногена для иммунизации млекопитающего.
Для осуществления установленного метода иммунизации может быть использовано любое животное, включая, например, мышей, крыс, кроликов, коз и лошадей. Кроме того, введение доз иммуногена для иммунизации может быть осуществлено любым способом, например путем подкожной инъекции, внутрибрюшинной инъекции, внутривенной инъекции и внутримышечной инъекции. При этом предпочтительной является подкожная инъекция или внутрибрюшинная инъекция. Иммунизация может быть проведена один раз или несколько раз через определенные интервалы времени, предпочтительно от одной недели до 5 недель. Затем в соответствии с общим способом у иммунизованного животного берут кровь, из которой выделяют сыворотку. OPN-ингибирующее антитело может быть выделено путем очистки фракции поликлонального антитела.
Кроме того, в соответствии с общим способом иммунную клетку, выделенную путем иммунизации животного указанным связанным продуктом, подвергают слиянию с миеломной клеткой с получением гибридомы. OPN-ингибирующее антитело может быть выделено в виде моноклонального антитела путем сбора данного антитела из гибридомной культуры.
Как описано выше, в соответствии с настоящим изобретением химерное антитело против остеопонтина и гуманизированное антитело против остеопонтина могут быть получены на основе моноклонального OPN-ингибирующего антитела или гибридомы, генерирующей это антитело, как описано в публикациях заявок на выдачу Европейских патентов ЕР 0125023, ЕР 0239400 и ЕР 045126 и т.п. В соответствии с настоящим изобретением особенно предпочтительно, если химерное антитело или гуманизированное антитело получают из мышиного антитела способом, описанным в публикации Международной заявки WO 94/20632.
В случае, если индивидуумом, подвергаемым лечению, является человек, а животным, генерирующим OPN-ингибирующее антитело, является мышь, то предпочтительно применять, например, антитело, в котором вариабельная область мышиного антитела конъюгирована с константной областью антитела человека (называемого далее "химерным антителом"), и антитело, полученное путем трансплантации, главным образом определяющей комплементарность области из вариабельной области мышиного антитела в антитело человека (называемое далее "гуманизированным антителом"). Кроме того, для продуцирования антитела подходящим может оказаться способ с использованием трансгенного животного, такого как мышь, которой был введен ген химерного антитела или ген гуманизированного антитела, либо способ фагового дисплея.
Выделенное таким образом OPN-ингибирующее антитело может быть использовано в чистом виде. Кроме того, OPN-ингибирующее антитело может быть использовано в форме белка, имеющего, по крайней мере, часть полипептидов тяжелой цепи и/или легкой цепи, составляющих данное антитело и состоящих из полипептидной цепи, которая обладает активностью связывания с данным антигеном. Более того, OPN-ингибирующее антитело может быть также использовано в форме фрагментов антитела, происходящих от OPN-ингибирующего антитела, таких как одноцепочечное антитело (scFv), Fab и F(ab')2.
В частности, для получения химерного антитела из мышиного антитела ген вариабельной области указанного мышиного антитела сначала клонируют с использованием антителогенерирующей гибридомы (например, гибридомы, описанной в примере 2 (FERM ВР-7883)) в соответствии с общим способом и определяют нуклеотидную последовательность и аминокислотную последовательность, кодируемую данным геном. Ген вариабельной области мышиного антитела, определенной таким образом, и лидерную последовательность этого антитела и т.п. конъюгируют с геном константной области антитела человека соответствующего класса, предпочтительно с геном константной области антитела класса IgG, с получением гена химерного антитела.
Затем ген химерного антитела встраивают в подходящий экспрессирующий вектор, затем его вводят в культивируемые клетки. И, наконец, данные клетки культивируют с получением химерного антитела из супернатанта культуры.
Определенный таким образом ген вариабельной области мышиного антитела амплифицируют проведением ПЦР с использованием праймеров, имеющих нуклеотидные последовательности, соответствующие лидерной последовательности и J-области мышиного антитела, получая фрагменты, несущие вариабельную область гена. Предпочтительно в оба конца этих фрагментов, несущих вариабельную область гена, вводят сайты узнавания рестриктирующими ферментами для клонирования.
Полученный таким образом генный фрагмент лигируют с генным фрагментом, несущим константную область антитела человека, и конструируют ген для химерного антитела (называемый далее просто "геном химерного антитела"). Данная комбинация не ограничивается какой-либо конкретной комбинацией и включает любую комбинацию, способную, в конечном счете, экспрессировать подходящую активность связывания с антигеном. В зависимости от цели применения может быть выбрана константная область любого подкласса (например, константная область γ1, γ2, γ3 или γ4 тяжелой цепи и λ или κ-цепь легкой цепи). Может оказаться подходящей комбинация с геном константной области, сконструированным в целях усиления или ослабления функции данной константной области.
В качестве экспрессирующего вектора, конъюгированного с выделенным таким образом геном химерного антитела, могут быть использованы такие экспрессирующие векторы, такие как AG-γ1 и AG-κ, описанные в публикации Международной заявки WO 94/20632. Однако в этих целях может быть использован, без каких-либо ограничений, любой вектор, способный экспрессировать ген химерного антитела. Использование экспрессирующего вектора AG-γ1 или AG-κ, несущего ген Ig, является предпочтительным, поскольку для конструирования экспрессирующего вектора, несущего ген химерного антитела, необходимо лишь встраивание фрагмента для вариабельной области, происходящего от гена мышиного антитела.
Экспрессирующий вектор может быть введен в культивируемые клетки, например, способом с использованием фосфата кальция.
Что касается клеточных культур, предназначенных для введения в них экспрессирующего вектора, то для этого могут быть использованы такие клеточные культуры, как клетки СНО-DG44, которые могут быть культивированы в соответствии с общей методикой.
После культивирования химерное антитело, аккумулированное в культуральном бульоне, может быть очищено посредством хроматографии различных типов, например, на колонке с белком А.
Антигенность полученного таким образом химерного антитела может быть проанализирована с помощью ELISA или BIAcore (BIAcore К.К.) с использованием, например, пептида остеопонтина.
Кроме того, в соответствии с настоящим изобретением гуманизированное антитело, наиболее близкое к человеческому антителу, чем к химерному антителу, может быть получено, например, способом, описанным ниже.
В частности, для получения гуманизированного антитела из мышиного антитела аминокислотных остатков определяющей комплементарность области (CDR) в вариабельной области мышиного антитела сначала определяют в соответствии с классификацией по Кабату (Kabat et al.) (Immunological Interest 4th ed., Public Health Service, NIH, Washington DC, 1987). Аминокислотные остатки, находящиеся, главным образом, возле CDR в вариабельной области мышиного антитела, трансплантируют в матричное антитело человека в целях конструирования аминокислотной последовательности с CDR мышиного антитела и каркасом антитела человека для вариабельной области. Для этого конструируют нуклеотидную последовательность ДНК, кодирующую аминокислотную последовательность вариабельной области, в результате чего получают фрагмент гена вариабельной области с нуклеотидной последовательностью, сконструированный посредством ПЦР и техники рекомбинантных ДНК. Затем ген вариабельной области конъюгируют с геном константной области антитела человека соответствующего класса, предпочтительно с геном константной области антитела класса IgG, и получают ген гуманизированного антитела. Затем ген гуманизированного антитела конъюгируют с подходящим экспрессирующим вектором для введения в культивируемую клетку. И, наконец, данную клетку культивируют так, чтобы из супернатанта культуры можно было выделить гуманизированное антитело.
В описанном выше способе получения гуманизированного антитела ген определяющей комплементарность области в гене вариабельной области мышиного антитела может быть определен, исходя из гена вариабельной области мышиного антитела, идентифицированного в процессе получения химерного антитела в пределах определяющей комплементарность области в соответствии с классификацией по Кабату.
Альтернативно, в качестве гена каркасной области матричного антитела человека последовательность, имеющую высокую степень гомологии с аминокислотной последовательностью в каркасной области мышиного антитела, выбирают, например, из антител зародышевой линии человек. Затем в соответствии с общей методикой получают нуклеотидную последовательность, кодирующую аминокислотную последовательность, которая может быть затем использована в нужных целях.
После конъюгирования гена определяющей комплементарность области мышиного антитела с геном каркасной области матричного антитела человека получают фрагмент гена способом, аналогичным способу получения химерного антитела. После конъюгирования фрагмента гена с геном константной области антитела человека получают ген гуманизированного антитела (называемого далее просто "геном гуманизированного антитела").
После получения гена гуманизированного антитела введение данного гена гуманизированного антитела в экспрессирующий вектор; введение указанного экспрессирующего вектора в культивируемую клетку; культивирование указанной клетки; очистку полученного антитела и т.п. осуществляют способом аналогично способу получения химерного антитела.
В случае гуманизированного антитела, где заменены только аминокислоты в определяющей комплементарность области, активность связывания данного антитела с антигеном обычно снижается по сравнению с природным мышиным антителом. Поэтому в большинстве случаев некоторые аминокислоты в природном мышином антителе трансплантируют вместе с некоторыми аминокислотами, находящимися поблизости от определяющей комплементарность области. Кроме того, для повышения активности связывания и усиления аффинности антитела могут быть модифицированы аминокислоты не только каркасной области антитела человека, но также и аминокислоты вариабельной области (например, путем замены, инсерции и делеции одной или нескольких аминокислот). Полученные таким образом антитела также входят в объем определения гуманизированных антител настоящего изобретения.
Гуманизированное антитело может быть получено конструированием гена, экспрессирующего вариабельную область матричного антитела человека, где аминокислотную последовательность, находящуюся, главным образом, поблизости от определяющей комплементарность области мышиного антитела, трансплантируют способом, аналогично способу, описанному для получения химерного антитела.
Химерное антитело и гуманизированное антитело (называемые далее "рекомбинантными OPN-ингибирующими антителами") обладают такой же активностью связывания с антигеном, как и природное мышиное антитело, что позволяет решить такие проблемы, как индуцирование антигенности или снижение времени полужизни антитела.
Выделенные таким образом рекомбинантные OPN-ингибирующие антитела могут быть затем очищены, если это необходимо, после чего они в соответствии с общей методикой могут быть включены в стандартные лекарственные формы для терапевтического лечения ревматоидного артрита, ревматизма, такого как ювенильный суставной ревматизм и хронический ревматизм, псориатического артрита и псориаза; для подавления хронического отторжения трансплантата после трансплантации органов; и для терапевтического лечения аутоиммунных заболеваний, таких как системные аутоиммунные заболевания, эритематоз, увеит, болезнь Бехчета, дерматомиозит, пролиферирующий клубочковый нефрит и саркоидоз.
Рекомбинантные OPN-ингибирующие антитела настоящего изобретения могут быть предпочтительно применены в качестве терапевтического агента для лечения ревматизма или терапевтического агента для лечения ревматоидного артрита. Примерами лекарственных форм таких терапевтических агентов для лечения ревматизма и т.п. являются парентеральные формы, такие как лекарственные формы для инъекций и вливаний, которые предпочтительно вводят путем внутривенной инъекции и подкожной инъекции (в качестве терапевтического агента для лечения аутоиммунных заболеваний, примеры которых описаны выше). Кроме того, такие препараты могут включать фармацевтически приемлемые носители и добавки в фармацевтически приемлемых количествах в зависимости от используемой лекарственной формы.
Количество рекомбинантных OPN-ингибирующих антител, включенных в данный препарат, варьируется в зависимости от тяжести симптомов заболевания и возраста пациента, от конкретно используемой лекарственной формы препарата или титра связывания рекомбинантного OPN-ингибирующего антитела или т.п. Так, например, подходящее для использования количество составляет примерно от 0,1 мг/кг до 100 мг/кг.
Рекомбинантные OPN-ингибирующие антитела, используемые в качестве эффективного ингредиента в полученном таким образом терапевтическом агенте настоящего изобретения, обладают высоким уровнем связывания с последовательностями RGD и SVVYGLR в рекомбинантном OPN и ингибируют связывание между указанными областями OPN и интегрином. Поэтому OPN-ингибирующие антитела могут подавлять обострение симптомов ревматизма, ревматоидного артрита и других аутоиммунных заболеваний.
Поскольку рекомбинантные OPN-ингибирующие антитела настоящего изобретения специфически связываются с областью OPN, но не с областью интегрина, то потенциально антитела никогда не ингибируют другие важные функции интегрина. Поэтому предполагается, что в этом случае можно избежать нежелательных побочных эффектов.
Кроме того, рекомбинантные OPN-ингибирующие антитела настоящего изобретения могут быть также применены в целях скрининга терапевтического агента для лечения аутоиммунных заболеваний. Как описано выше, соединение, ингибирующее связывание между RGD-последовательностью OPN и интегрином, и ингибирующее связывание между SVVYGLR-последовательностью OPN и интегрином, может служить в качестве терапевтического агента для лечения аутоиммунных заболеваний. Таким образом, возможность применения подвергаемого скринингу вещества (тестируемого вещества) в качестве терапевтического агента для лечения аутоиммунных заболеваний может быть оценена в реакционной системе, полученной путем добавления тестируемого вещества и рекомбинантных антител, конкурентно ингибирующих OPN, в аналитическую систему в присутствии указанных количеств рекомбинантного OPN и интегрина с проведением анализа на степень ингибирования связывания между OPN и интегрином по сравнению с количеством используемого рекомбинантного OPN-ингибирующего антитела.
Аналогичным образом соединение, ингибирующее связывание между RGD-последовательностью OPN и интегрином и ингибирующее связывание между SVVYGLR-последовательностью OPN и интегрином, может служить в качестве терапевтического агента для лечения ревматизма и ревматоидного артрита. Поэтому рекомбинантные OPN-ингибирующие антитела применяют для создания реакционной системы, аналогичной описанной выше, которая может быть использована для скрининга на ревматизм и ревматоидный артрит.
Кроме того, рекомбинантные OPN-ингибирующие антитела настоящего изобретения могут быть использованы в качестве диагностического агента для лечения ревматизма. Как описано выше, было установлено, что у больного артрозом, в частности ревматоидным артритом, присутствует высокая концентрация N-концевого фрагмента, образующегося при расщеплении OPN тромбином. Таким образом, анализ OPN или его N-концевого фрагмента в образце с использованием рекомбинантных OPN-ингибирующих антител может быть применен для диагностики ревматизма. Как и в способе, описанном выше, для проведения общего иммунохимического анализа могут быть использованы следующие различные способы ["Hybridoma Method and Monoclonal Antibody", issued by R&D Planning KK., pp. 30-53, March 5, 1982]: способ радиоиммуноанализа (РИА), ELISA (E. Engvall et al., (1980): Methods in Enzymol., 70, 419-439), способ флуоресцентных антител, способ бляшек, способ пятен, агрегационный способ, способ Ухтерлони и т.п.
Такой способ может быть выбран в соответствии с различными аспектами. С точки зрения чувствительности, простоты и т.п. предпочтительным является ELISA. Более предпочтительный способ предусматривает иммобилизацию рекомбинантных OPN-ингибирующих антител настоящего изобретения на носителе и мечение антитела, распознающего область OPN, отличающуюся от области рекомбинантных OPN-ингибирующих антител настоящего изобретения, в целях детекции OPN или его N-концевого фрагмента. Таким образом, указанный способ детекции может быть применен в целях обнаружения диагностического агента для лечения ревматоидного артрита.
Веществами, используемыми для мечения антител, являются ферменты, такие как пероксидаза хрена (называемая далее "ПХ") и щелочная фосфатаза (называемая далее "ЩФ"), флуоресцентные вещества, такие как флуоресцеинизоцианат и родамин, радиоактивные вещества, такие как 32Р и 125I, хемилюминесцентные вещества и т.п.
Методика проведения, например, "сэндвич"-анализа как одного из нескольких специфических способов детекции изоформ OPN описана ниже. В частности, данная методика включает первую стадию (а) иммобилизации антитела против изоформы OPN настоящего изобретения на носителе; вторую стадию (b) блокирования поверхности носителя, который не содержит иммобилизованного на нем антитела, материалом, не являющимся родственным данному антигену, например белком. Данная методика, кроме того, включает стадию (с) добавления образца, содержащего различные концентрации изоформы OPN к полученной смеси для генерирования комплекса "изоформа OPN-антитело"; стадию (d) последующего добавления меченого антитела против изоформы OPN для связывания данного антитела с иммобилизованным комплексом "антиген-антитело" и конечную стадию (е) оценки количества связанной с носителем метки для определения количества свободной изоформы OPN в образце, исходя из предварительно построенной стандартной кривой.
Носителем, используемым на стадии (а) для иммобилизации антитела, являются, но не ограничиваются ими, любые носители, подходящие для проведения иммунохимических анализов. Таким носителем может быть, например, полистироловый 96-луночный микротитрационный планшет или микротитрационный планшет для связывания с аминогруппой. Например, для последующей иммобилизации антитела на носителе обычно добавляют буфер, содержащий указанное антитело, и инкубируют с данным носителем. В качестве буферов могут быть использованы известные буферы, например 10 мМ PBS. Концентрация антитела в буфере может варьироваться в широком диапазоне. Обычно его концентрация составляет примерно 0,01-100 мкг/мл, предпочтительно 0,1-20 мкг/мл. Кроме того, при использовании в качестве носителя 96-луночного микротитрационного планшета, количество буфера составляет 300 мкг/лунка или менее, предпочтительно примерно 20-150 мкл/лунка. Кроме того, обычно подходящими условиями инкубирования являются, но не ограничиваются ими, инкубирование в течение ночи примерно при 4°С.
Кроме того, на стадии блокирования (b) указанное блокирование осуществляют в целях предотвращения неспецифической адсорбции на носителе, поскольку в OPN в образце, добавляемом на следующей стадии, может присутствовать часть, способная адсорбироваться на носителе независимо от реакции "антиген-антитело". В качестве блокирующего агента может быть использован, например, альбумин бычьей сыворотки (BSA) и раствор сепарированного молока. Кроме того, могут быть использованы и другие коммерчески доступные блокирующие агенты, такие как Block-ACE (производимый Dainippon Pharmaceutical Co., Ltd.; Code No. UK-25B). В частности, без каких-либо ограничений блокирование осуществляют добавлением, например, соответствующего объема Block-Ace к части с иммобилизованным на ней антигеном с последующим инкубированием в течение ночи примерно при 4°С и промывкой полученной части буфером. Таким буфером является, но не ограничивается им, например, буфер, содержащий 10 мМ PBS, рН 7,2, 0,8% (масс/об) NaCl, 0,02% (масс/об) KCl и 0,02% (об/об) твина 20.
Затем на стадии (с) образец, содержащий изоформу OPN, подвергают контакту с иммобилизованным антителом, что приводит к присоединению данной изоформы OPN к иммобилизованному антителу и тем самым к образованию комплекса "иммобилизованное антитело-изоформа OPN". Условия реакции не имеют конкретных ограничений, но в основном данную реакцию осуществляют при температуре примерно 37°С в течение примерно одного часа. После завершения реакции носитель промывают буфером для удаления непрореагировавшего белка и т.п. Буфером, используемым для реакции, предпочтительно является буфер, состоящий из 10 мМ PBS, рН 7,2 и 0,05% (об/об) твина 20.
Затем на стадии (d) комплекс "иммобилизованное антитело-изоформа OPN-меченное антитело" получают добавлением меченого антитела, распознающего другой эпитоп изоформы OPN, связанной с иммобилизованным антителом. После завершения реакции носитель предпочтительно промывают буфером для удаления непрореагировавшего белка и т.п. В качестве буфера для реакции используют буфер, описанный на стадии (с).
При этом необходимо, чтобы меченое антитело, используемое на стадии (d), распознавало эпитоп, отличающийся от эпитопа, распознаваемого иммобилизованным антителом на стадии (а). Если в качестве иммобилизованного антитела применяется поликлональное антитело, распознающее первую половину домена, то в качестве меченого антитела, связанного с ферментом (например, ПХ или ЩФ или т.п.), используют, например, поликлональное антитело, распознающее вторую половину домена изоформы OPN. Использование таких антител, распознающих различные сайты, описанные выше, позволяют проводить в высокой степени чувствительный специфический анализ изоформы OPN, образующейся в результате селективного сплайсинга.
Количество меченого антитела, используемого на стадии (d), предпочтительно примерно в 5000-10000 раз превышает количество иммобилизованного антитела, связанного с носителем. В конечном анализе для реакции желательно использовать меченое антитело, разведенное предпочтительно до конечной максимальной величины оптической плотности от 1,5 до 2,0. Для такого разведения могут быть использованы буферы, и указанную реакцию предпочтительно осуществляют примерно при 37°С в течение примерно 30 минут с последующей промывкой буферами после завершения реакции. Однако условия осуществления такой реакции не имеют конкретных ограничений. Описанные выше реакции позволяют осуществлять связывание комплекса "антитело-изоформа OPN-меченное антитело" с носителем.
И, наконец, на стадии (е) для измерения оптической плотности в целях вычисления количества OPN, исходя из стандартной кривой, добавляют раствор хромогенного субстрата, реагирующего с веществом для мечения в комплексе "иммобилизованное антитело-изоформа OPN-меченное антитело".
Если веществом для мечения антитела служит фермент пероксидазы, то может быть использован, например, раствор хромогенного субстрата, содержащего перекись водорода и 3,3',5,5'-тетраметилбензидин (ТМВ) или о-фенилендиамин (OPD). Условия хромогенной реакции не имеют конкретных ограничений, и такую хромогенную реакцию осуществляют путем добавления раствора хромогенного субстрата для реакции примерно при 25°С в течение примерно 20 минут, с последующим добавлением 1 н. серной кислоты для прекращения ферментативной реакции. В случае использования ТМВ ход хромогенной реакции анализируют, исходя из оптической плотности при 450 нм. Альтернативно, если веществом для мечения служит фермент ЩФ, то подходящий метод предусматривает проведение хромогенной реакции с использованием п-нитрофенилфосфорной кислоты (pNPP) в качестве субстрата, добавление 2 н. NaOH для прекращения ферментативной реакции и измерение оптической плотности при 415 нм.
С использованием стандартной кривой, предварительно построенной, исходя из оптической плотности реакционного раствора с добавлением известных концентраций изоформы OPN, может быть вычислена концентрация изоформы OPN в образце.
Способ детекции изоформы OPN настоящего изобретения применяется для выявления функций OPN и для диагностики и терапевтического лечения заболеваний, за которые ответственен OPN. Одним из примеров применения такого способа является набор для детекции воспалительных патологий, с помощью которого можно дифференцировать ревматизм и ревматоидный артрит, то есть набор для специфической детекции N-концевого фрагмента OPN, расщепленного тромбином, и OPN нерасщепленного типа и тем самым для детекции присутствия или отсутствия любых воспалительных патологий.
В частности, как описано выше, N-концевой фрагмент расщепленного тромбином OPN, очевидно, наблюдается в высокой концентрации в суставных полостях у больных ревматоидным артритом. Однако у больных остеоартритом такая тенденция слабо выражена. Как описано выше, содержание N-концевого фрагмента OPN, присутствующего в суставной полости, варьируется для каждого конкретного больного. Поэтому для дифференциального диагноза ревматизма и остеоартрита может оказаться достаточным измерение содержания N-концевого фрагмента по отношению ко всему OPN.
В качестве более конкретного примера должны быть продуцированы антитела против отдельных пептидов нижеследующих трех последовательностей, которые являются общими для всех трех изоформ OPN, а именно OPN-а, OPN-b и OPN-с.

Из них последовательность (1) присутствует на N-концевой стороне от сайта расщепления тромбином, а также она присутствует во всем не расщепленном тромбином OPN и на N-концевом фрагменте. Альтернативно, последовательность (2) присутствует на С-концевой стороне от сайта расщепления тромбином, а также она присутствует во всем не расщепленном тромбином OPN, но никогда не присутствует на N-концевом фрагменте. Далее, последовательность (3) соответствует аминокислотным остаткам в положениях 17-31 на N-концевой стороне OPN, а также она присутствует во всем не расщепленном тромбином OPN и на N-концевом фрагменте. Диагностический набор для дифференциального диагноза ревматизма и остеоартрита у пациентов может состоять из реагентов для иммуноанализа двух типов, предусматривающего применение антител, конкретно соответствующих трем типам последовательностей пептидов. Другими словами, первый реагент для иммуноанализа с использованием двух типов антител против пептидов, представленных последовательностями (3) и (2), предназначен для анализа не расщепляемого тромбином OPN, обычно распознаваемого обоими антителами в образце. Затем детекцию можно осуществить способом аналогично "сэндвич"-способу, который предусматривает иммобилизацию, например, антитела против пептида с последовательностью (3) на носителе, реакцию данного антитела с образцом, взятым у пациента, промывку носителя и затем добавление антитела против пептида с последовательностью (2) в качестве антитела для мечения. В случае второго реагента для иммуноанализа, кроме того, используются два антитела против пептидов, представленных последовательностями (1) и (3) в целях проведения общего анализа на не расщепленный тромбином OPN и N-концевой фрагмент, генерируемый при расщеплении тромбином в образце, где оба они обычно распознаются данными антителами. В этом случае детекцию можно осуществить способом аналогично "сэндвич"-способу, который предусматривает иммобилизацию, например, антитела против пептида с последовательностью (1) на носителе, реакцию данного антитела с образцом, взятым у пациента, промывку носителя и затем добавление антитела против пептида с последовательностью (3), используемого в качестве антитела для мечения. Затем результаты анализов образца, взятого у одного и того же пациента, проводимых с использованием реагентов для иммуноанализа двух типов, сравнивают друг с другом для определения отношения количеств N-концевого фрагмента, генерированного путем расщепления тромбином, к общему количеству OPN у пациента, что позволяет дифференцировать ревматизм и остеоартрит.
Примеры
Настоящее изобретение более подробно описано в нижеследующих примерах и в сравнительном примере. Однако настоящее изобретение не ограничивается этими примерами. В описанных ниже примерах эксперименты, проводимые с использованием коммерчески доступных наборов и реагентов, осуществляют в соответствии с прилагаемыми протоколами, если это не оговорено особо.
Пример 1
Клонирование, конструирование, очистка и реагенты для гибридного белка GST-OPN
Клонирование и очистку белка осуществляли в основном описанным способом (S. Kon et al., (2000): J. Cell. Biochem. 77:487-498).
кДНК человеческих изоформ OPN, т.е. OPN-a и OPN-b, выделяли следующим образом. Используя РНК, полученную из клеточной линии рака почек человека NRC-12, в качестве матрицы, синтезировали кДНК; затем, используя кДНК в качестве матрицы, проводили ПЦР с помощью следующих праймеров OPN-5 и OPN-3 для выделения кДНК, кодирующих полноразмерные человеческие OPN-а и OPN-b, каждый из которых включает соответствующие области сигнальных пептидов.
Затем, как описано в указанной выше ссылке, клонированные таким образом кДНК OPN-а и OPN-b встраивали в вектор рGEX4Т (Ameraham Pharmacia Biotech, Tokyo, Japan) так, чтобы указанные кДНК находились в той же рамке считывания, что и ген GST (глутатион-S-трансферазы; ЕС2.5.1.18), для экспрессии в форме гибридного GST-белка в клетках Escherichia coli JМ109 (выделенные таким образом гибридные белки GST-OPN далее обозначаются "GST-OPN-а" и "GST-OPN-b").


кДНК, кодирующую человеческую изоформу OPN-с, получали проведением двухстадийной ПЦР с использованием кДНК OPN-а в качестве матрицы. На первой стадии ПЦР проводили отдельно с использованием OPN-5 и указанного ниже праймера OPNct-3 или указанных ниже праймеров OPNct-5 и OPN-3; затем полученные два ПЦР-продукта смешивали вместе, подвергали тепловой обработке, постепенно охлаждали для отжига и затем добавляли фермент для удлинения. Затем на второй стадии проводили ПЦР с использованием праймеров OPN-5 и OPN-3 для выделения кДНК, кодирующей полноразмерный человеческий OPN-с, включающий область сигнального пептида. кДНК изоформы "с" интегрировали в вектор рGEX4Т способом аналогично способу, используемому для изоформ а и b, в целях получения гибридного GST-белка (обозначаемого далее "GST-OPN-с").


кДНК, кодирующую половину молекулы с аминоконцевой стороны (М1-R168) от сайта расщепления OPN-а тромбином, выделяли проведением ПЦР с использованием кДНК OPN-а в качестве матрицы и OPN-5 вместе с описанным ниже праймером OPNnh-3. Способом аналогично способу, используемому для изоформ а и b, полученную кДНК интегрировали в вектор рGEX4Т для получения GST-белка (обозначаемого далее "GST-N-половиной").

Белок остеопонтин (hOPN-C-половина) с карбоксильной стороны от сайта расщепления OPN-а тромбином получали проведением двухстадийной ПЦР с использованием кДНК OPN-а в качестве матрицы. На первой стадии ПЦР проводили отдельно с использованием OPN-5, указанного ниже праймера OPNch-3, указанного ниже праймера OPNch-5 и праймера OPN-3. На второй стадии проводили ПЦР с использованием праймеров OPN-5 и OPN-3 для получения белка OPN с карбоксильной стороны. Способом аналогично способу, используемому для изоформ а и b, осуществляли рекомбинацию в вектор рGEX4Т, в результате чего получали GST-белок (обозначаемый далее "GST-С-половиной").


Различные рекомбинантные гибридные белки GST-OPN получали в Escherichia coli общим способом и затем очищали на колонке с глутатионсефарозой способом, описанным в указанной выше ссылке. Из них белок "GST-N-половина" расщепляли рестриктирующей протеазой (PreScission; Ameraham Pharmacia Biotech, Tokyo, Japan) в сайте связывания для элиминации молекулы GST-белка и тем самым для выделения белка (обозначаемого далее "nOPN"), состоящего из аминоконцевой половины молекулы (117-R168) одного OPN.
Альтернативно, кДНК, кодирующую полноразмерный OPN-а (М1-N314), встраивали, кроме того, в вектор рсDNA3.1(+) (Invitrogen Corporation) для трансфекции в клетки СНО-К1 (приготавливаемые Dainippon Pharmaceutical Co., Ltd.) (далее называемые "клетками СНО/OPN-a"). Связанный с сахарной цепью OPN-a (называемый далее "СНО/OPN-а"), выделенный из данных клеток, очищали следующим образом. В частности, супернатант культуры клеток СНО/OPN-а подвергали ионообменной колоночной хроматографии на колонке с DEAE-сефарозой CL-6В (Ameraham Pharmacia Biotech, Tokyo, Japan), гель-хроматографии на колонке с ULTROGEL AcA44 (BioSepra SA) и непрерывной хроматографии с обращенной фазовой на колонке с RESOURCE RPC (Ameraham Pharmacia Biotech, Tokyo, Japan). В результате очистка была завершена.
Различные пептиды, используемые для исследований по иммунной сенсибилизации и связыванию, либо закупали у Sigma Genosis Japan, либо получали способом химического синтеза с использованием Fmoc (N-(9-флуоренил)метоксикарбонила) на пептидном синтезаторе (модель 432А; производимая PerkinElmer Life Science, Inc.) и очищали хроматографией с обращенной фазой на колонке С18.
Пример 2
Продуцирование мышиных моноклональных антител
Синтетические пептиды, соответствующие внутренним последовательностям человеческого OPN, получали, как описано ниже, и затем использовали для иммунизации.
Пептид 1:
CVDTYDGRGDSVVYGLRS (C+V153 до S169)
Пептид 2:
CIDSQELSKVSREFHSH (C+I261 до Н276)
В частности, пептид 1 имеет последовательности RGD и SVVYGLR, распознающие интегриновые рецепторы αVβ3 и α9β1 соответственно.
Данные пептиды связывали с тироглобулином и затем их использовали для иммунизации мышей в соответствии с общей методикой. У иммунизованных мышей непрерывно выделяли спленоциты, которые затем подвергали слиянию с мышиными миеломными клетками Р3-Х63-Аg8-653 с использованием полиэтиленгликоля. В соответствии со способом, описанным у M. Kinebuchi et al. (1991): J. Immunol., 146, 3721-3728, для иммунизации отбирали гибридому, реагирующую с каждым из данных пептидов.
У мышей, иммунизованных пептидами 1 и 2, выделяли моноклональные антитела, обозначенные 2К1 и 4С1 соответственно. Гибридома, генерирующая моноклональное антитело 2К1, была депонирована 20 июня 2001 под номером FERM ВР-7883 в Центре по депонированию патентуемых микроорганизмов, Национальный институт современных промышленных наук и технологий (AIST Tsukuba Central 6, 1-1-1, Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan). Кроме того, моноклональное антитело 53 (mAb53) выделяли путем иммунизации полноразмерным рекомбинантным человеческим OPN (D.S. Bautista et al., (1994): J. Biol. Chem., 269, 23280-23285).
Пример 3
Реактивность OPN и продуктов его расщепления тромбином с мышиными моноклональными антителами
Активность связывания мышиных моноклональных антител 2К1 (называемых далее "мышиным антителом 2К1") и 4С1, выделенных, как описано в примере 2 и специфичных к OPN и продуктам его расщепления тромбином, тестировали методом Вестерн-блоттинга. Было обнаружено, что мышиное антитело 2К1 реагирует с GST-OPN-а, GST-OPN-b, GST-OPN-с и GST-N-половиной. Было также обнаружено, что антитело 4С1 реагирует с GST-OPN-а, GST-OPN-b, GST-OPN-с и с GST-С-половиной. Кроме того, моноклональные антитела не только связывались с рекомбинантными OPN негликозилированного типа, генерированными в Escherichia coli, но также реагировали с белком СНО/OPN-а, связанным с сахарной цепью, и с его продуктами расщепления тромбином (называемыми далее "OPN, расщепленным тромбином").
Пример 4
Ингибирование клеточной адгезии к OPN мышиными моноклональными антителами
Для того чтобы оценить, ингибируют ли мышиные моноклональные антитела клеточную адгезию к OPN или нет, использовали следующий способ. Сначала 96-луночный планшет предварительно сенсибилизировали различными концентрациями СНО/OPN-а при 4°С в течение ночи и затем обрабатывали 0,5% BSA в PBS при 37°С в течение 10 минут для блокирования неспецифической адгезии. Человеческие фибробласты TIG-7 или клетки SW480, трансформированные кДНК интегриновой субъединицы α9 (далее называемые "α9-трансформированными клетками SW480"), суспендировали в D-МЕМ, содержащей 0,25% BSA, затем 200 мкл полученной клеточной суспензии (при концентрации 5×104 клеток/лунка) инъецировали в 96-луночный планшет, предварительно сенсибилизированый СНО/OPN-а или nOPN в присутствии или в отсутствие различных концентраций моноклональных антител или синтетических пептидов, и инкубировали при 37°С в течение одного часа.
Культуральную среду удаляли из планшета и все лунки два раза промывали D-MEM, содержащей 0,25% BSA. Прилипшие клетки фиксировали и окрашивали 0,5% кристаллическим фиолетовым в 20% метаноле в течение 30 минут.
Все лунки три раза промывали водой и затем прилипшие клетки солюбилизировали в 20% уксусной кислоте. Полученный супернатант, выделенный из каждой лунки, анализировали с помощью иммунопланшет-ридера в целях измерения оптической плотности при 590 нм для подсчета относительного числа клеток, прилипших к лунке. Все анализы проводили с тремя повторами и осуществляли, по крайней мере, три независимых эксперимента. Полученные значения представляли собой среднее для трех независимых экспериментов.
Известно, что TIG-7 обладает высокой степенью адгезии к OPN, но, как было показано на фиг.1А, адгезия явно ингибировалась пептидом GRGDSP (100 мкг/мл), но не ингибировалась контрольным пептидом (К296-N314, как С-концевая область OPN) (100 мкг/мл). Таким образом, адгезия зависит от RGD. Кроме того, как показано на фиг.1В, мышиное антитело 2К1 при 200 мкг/мл явно ингибировало клеточную адгезию к OPN. Более того, как показано на фиг.1С, действие мышиного 2К1, направленное на ингибирование клеточной адгезии, было сравнимо с действием mAb53 и зависело от концентрации. Кроме того, мышиное 2К1 и mAb53 ни в одном случае не ингибировали адгезию клеток TIG-7 к витронектину (VN) или к фибронектину (FN).
На фиг.2 показано ингибирование моноклональными антителами адгезии nOPN и витронектина к α9-трансформированным клеткам SW480. Как показано на фиг.2А, адгезия между 1 мкг/мл витронектина и α9-трансформированными клетками SW480 ингибировалась 200 мкМ пептида GRGDSP (RGD) и поэтому такая адгезия зависела от RGD. Адгезия α9-трансформированных клеток SW480 к 3 мкг/мл nOPN ингибировалась комбинацией 200 мкМ пептида GRGDSP (RGD) и анти-α9β1 моноклональным антителом Y9А2 (A. Wang et al., (1996): Am. J. Respir. Cell. Mol. Biol., 15, 664-672), и поэтому такая адгезия является RGD-зависимой и RGD-независимой. Кроме того, на фиг.2В показано влияние мышиного 2К1 на адгезию α9-трансформированных клеток SW480 к nOPN и к витронектину. Адгезия между α9-трансформированными клетками SW480 и витронектином ни в одном случае не ингибировалась мышиным антителом 2К1, однако мышиное антитело 2К1 ингибировало адгезию между клетками SW480 и nOPN. Следовательно, это указывает на то, что мышиное антитело 2К1 сохраняло свою способность ингибировать RGD-зависимую адгезию.
Пример 5
Ингибирование OPN-индуцированной миграции моноцитов мышиными моноклональными антителами
Тест на миграцию клеток U937 проводили с использованием системы ChemoTx101-8 (Neuro Probe Inc.). Клетки доводили до концентрации 2×106 клеток/мл путем добавления среды D-MEM, содержащей 0,1% BSA, затем их наносили на верхний слой фильтра (с размером пор 8 мкм) и в нижний слой добавляли белок OPN.
Планшет ChemoTx оставляли на 4 часа в присутствии 5% СО2 при 37°С. После выдерживания планшета в указанных условиях фильтр фиксировали метанолом и затем окрашивали гематоксилином и эозином (Н-Е). Число клеток, мигрировавших на нижнюю поверхность фильтра, подсчитывали под микроскопом (увеличение ×400). Тест проводили с тремя повторениями и данные выражали как средние значения. Результаты представлены на фиг.3.
На фиг.3а показана миграция клеток U937 по направлению к СНО/OPN-а, к расщепленному тромбином OPN и к GST-N-половине при указанных концентрациях. Кроме того, на фиг.3b проиллюстрированы анализы на ингибирование с использованием отдельных OPN при 10 мкг/мл в присутствии или в отсутствие мышиного антитела 2К1, mAb53 или контрольного мышиного IgG при 50 мкг/мл после антиген-специфической очистки.
Как показано на фиг.3а и 3b, СНО/OPN-а, расщепленный тромбином OPN и GST-N-половиной, индуцировали миграцию человеческих моноцитов U937 в зависимости от концентрации (А). Мышиное антитело 2К1 явно ингибировало миграцию моноцитов, индуцированную СНО/OPN-а, расщепленным тромбином OPN и GST-N-половиной. В противоположность этому mAb53 ингибировало только миграцию моноцитов, индуцированную полноразмерным OPN (В).
Сравнительный пример 1
OPN и индуцирование артрита
Для того чтобы определить, какую роль играет OPN в развитии артрита, в соответствии с общей методикой искусственно вводили мышам, дефицитным по гену OPN (S.R. Rittling et al., (1998): J. Bone and Mminer. Res., 13(7), 1101-1111), в целях проведения экспериментов по сравнению с нормальными мышами.
Смесь артритогенного моноклонального антитела, имеющаяся в продаже как вещество, стимулирующее развитие артрита (коммерчески доступное под торговым названием "смесь для индуцирования артрита, Arthrogen-CIA® mAb, артритогенная смесь mAb, производимая Iwai Chemical Pharmaceutical Co., Ltd.), отдельно вводили мышам, дефицитным по гену OPN (OPN-/-) и нормальным мышам (OPN+/+) в соответствии с инструкцией, прилагаемой к данному продукту для индуцирования артрита. Затем оценивали степень тяжести заболевания. В качестве контроля мышам двух типов вводили дозу физиологического раствора.
Сравнение тяжести поражения артритом проводили, исходя из оценок степени поражения артритом в соответствии со следующей стандартной шкалой оценок и исходя из наблюдения опухания запястий на 10-й день после введения дозы. Результаты представлены на фиг.4 и 5.
Как видно из фиг.4, нормальные мыши, которым вводили дозы смеси артритогенных антител/липосахарида (обозначаемого далее "ЛПС"), имели более высокий балл по шкале оценок артрита на 4-й день после введения дозы, который был на том же уровне вплоть до 10-го дня, после чего достигал максимального значения (12 и более). Альтернативно, у мышей, дефицитных по гену OPN, оценка поражения артритом возрастала на 5-й день и далее, но максимальная оценка составляла лишь 4 или менее. Кроме того, у всех мышей группы, которой вводили физиологический раствор, не наблюдалось увеличения оценки поражения артритом.
Кроме того, как показано на фиг.5, опухание запястья у мышей, дефицитных по гену OPN, было явно незначительным по сравнению с нормальными мышами, что явно указывало на участие OPN в развитии артрита.
Пример 6
Ингибирующая активность мышиного антитела 2К1, направленная на миграцию периферических лейкоцитов человека
В соответствии с описанным ниже методом оценивали ингибирующую активность мышиного антитела 2К1, направленную на активируемую цитокинами миграцию периферических лейкоцитов человека. В таблице 1 представлены результаты ингибирующей активности, направленной на миграцию нейтрофилов, в то время как в таблице 2 представлены результаты ингибирующей активности, направленной на миграцию моноцитов.
<Экспериментальный способ>
Способом с использованием среды Фиколл из периферической крови нормального человека выделяли фракцию моноцитов и фракцию нейтрофилов (P.M. Daftarian et al., (1996): Journal of Immunology, 157, 12-20). Промежуточный слой между средой Фиколл и сывороткой собирали и культивировали во флаконе при 37°С в течение одного часа. Полученные прилипшие клетки использовали в качестве моноцитов. К слою эритроцитов, оставшемуся после сбора фракции моноцитов, добавляли 5-кратный объем 3% декстрана-PBS для агрегации эритроцитов и затем центрифугировали при 150×g и при 4°С в течение 5 минут.
Агрегированные эритроциты осаждались, в то время как в полученном супернатанте нейтрофилы присутствовали в суспендированном состоянии. Затем фракцию центрифугировали при 500×g и при комнатной температуре в течение 20 минут для выделения нейтрофилов. Полученные таким образом моноциты и нейтрофилы культивировали в течение ночи с человеческим TNF-α (20 нг/мл) для активации. Затем полученные активированные моноциты и нейтрофилы использовали для экспериментов по миграции.
Эксперименты по миграции осуществляли с использованием 48-луночной камеры для микрохемотаксиса (производимой Neuro Probe Inc.). После добавления различных концентраций мышиного антитела 2К1 к расщепленному тромбином OPN и после предварительного выдерживания при 37°С в течение 15 минут указанные смеси добавляли в нижнюю камеру (до конечной концентрации человеческого OPN 10 мкг/мл). Затем, после нанесения на поликарбонатный фильтр (с размером пор 5 мкм), 50 мкл клеточной суспензии (2×106 клеток/мл) добавляли в верхнюю камеру.
После культивирования в присутствии 5% СО2 при 37°С в течение 2 часов поликарбонатный фильтр снимали для удаления клеток с верхней поверхности фильтра и затем клетки, мигрировавшие на обратную сторону фильтра, окрашивали красителем Diff-Quick (производимого Baxter International Inc.). Окрашенные клетки подсчитывали при увеличении ×40. Результаты представлены как средние величины (клетки/мм3)±среднее отклонение на 6 лунок.
<Результаты эксперимента>
Мышиное антитело 2К1 ингибировало миграцию TNF-α-ативированных периферических нейтрофилов и моноцитов человека в направлении к расщепленному тромбином OPN.
Ингибирование миграции нейтрофилов
Ингибирование миграции моноцитов
Пример 7
Получение химеры "антитело 2К1-экспрессирующая плазмида"
В соответствии со способом получения химерного антитела на основе моноклонального антитела против ВИЧ (антитела С25), как описано в публикации Международной заявки WO94/20632, химерное антитело "мышь-человек" 2К1 (иногда вызываемое "химерным антителом 2К1" или "антителом С2К1") получали путем конъюгирования гена вариабельной области тяжелой цепи (VH) мышиного антитела 2К1 с геном человеческого Igγ1 и путем конъюгирования гена вариабельной области легкой цепи (VL) мышиного антитела 2К1 с геном человеческого Igκ, выделенных, как описано в примере 2.
Сначала мРНК гибридомы, генерирующей мышиное антитело 2К1, экстрагировали с использованием реагента ISOGEN (Nippon Gene). Используя мРНК в качестве матрицы, осуществляли синтез кДНК с использованием нестатистического гексамера pd(N)6 и сфер Ready-To-Go You-Prime First-Strand Beads (все произведены Amersham Bioscience, Со., Ltd.).
Используя кДНК в качестве матрицы и праймер, соответствующий лидерной последовательности гена VH мышиного антитела 2К1, и праймер, соответствующий J-области гена VH, представленных ниже и сконструированных в соответствии с классификацией последовательностей нуклеиновых кислот для V- и J-областей по Кабату и др. (Immunological Interest 4th ed., Public Health Service, NIH, Washington DC, 1987), область VH амплифицировали с помощью ДНК-полимеразы Ех Taq (TAKARA SHUZO CO., LTD.).
Праймер для лидерной последовательности (VH):

Праймер для J-области (VH):

Праймер для лидерной последовательности и праймер для J-области отдельно содержали последовательность, распознаваемую рестриктирующим ферментом HindIII, и последовательность, распознаваемую рестриктирующим ферментом BamHI, используемые для клонирования.
Что касается гена VL, то фрагмент гена VL, содержащий сайт, распознаваемый рестриктирующим ферментом HindIII, и сайт, распознаваемый рестриктирующим ферментом BamHI, на обоих концах последовательности получали способом аналогично способу получения гена VH, с использованием праймера, соответствующего следующей лидерной последовательности, и праймера, соответствующего J-области.
Праймер для лидерной последовательности (VL):

Праймер для J-области (VL):

Полученные таким образом фрагменты VH- и VL-гена гидролизовали ферментами HindIII и BamHI (оба от TAKARA SHUZO CO., LTD.) и затем интегрировали в экспрессирующие векторы AG-γ1 и AG-κ (публикация Международной заявки WO94/20632). В частности, вектор AG-γ1 имеет промотор β-актина, ген константной области γ1-цепи иммуноглобулина человека и селективный маркерный ген резистентности к неомицину (neo). Путем встраивания гена VH мышиного антитела 2К1 в область между HindIII-распознаваемой последовательностью и BamHI-распознаваемой последовательностью, находящуюся выше гена γ1, может быть получена плазмида, экспрессирующая тяжелую цепь химерного антитела 2К1. Кроме того, вектор AG-κ имеет промотор β-актина, ген константной области κ-цепи иммуноглобулина человека и ген дигидрофолатредуктазы (dhfr) в качестве селективного маркера. Путем встраивания гена VL мышиного антитела 2К1 в область между HindIII-распознаваемой последовательностью и BamHI-распознаваемой последовательностью, находящуюся выше гена κ, может быть получена плазмида, экспрессирующая легкую цепь химерного антитела 2К1.
Эти экспрессирующие плазмиды в соответствии с общей методикой вводили в штамм НВ101 Escherichia coli, который затем культивировали в массовом масштабе. Полученные плазмиды очищали с использованием набора EndoFree Plasmid Mega (QIAGEN Inc.).
Пример 8
Экспрессия химерного антитела 2К1
Экспрессирующие плазмиды тяжелой цепи и легкой цепи химерного антитела 2К1, очищенного, как описано выше в примере 7, смешивали и использовали для трансфекции клеток штамма СНО-DG44 стандартным кальцийфосфатным способом. В результате отбора на культуральной среде МЕМ (Invitrogen), в которую добавляли 0,5 мг/мл генетицина (Invitrogen) и 10% FCS, не содержащей нуклеотида и приготовленной диализом (Invitrogen), получали клетку-трансформант, генерирующую химерное антитело 2К1.
Клетки культивировали в 500 мл культуральной среды МЕМ, в которую добавляли 2% диализованной FCS. Полученный супернатант культуры пропускали через колонку с белком А (Amersham Bioscience, Со., Ltd.) и затем подвергали диализу против PBS с получением очищенного химерного антитела 2К1. Концентрацию очищенного химерного антитела 2К1 определяли с помощью набора для анализа на белок DC (BIO-RAD). И, наконец, получали 1,4 мг очищенного антитела.
Пример 9
Ингибирующая активность мышиного антитела 2К1, направленная на миграцию периферических моноцитов человека
В соответствии с описанным ниже способом оценивали ингибирующую активность очищенного химерного антитела 2К1, выделенного, как описано в примере 8, по отношению к активируемой цитокинами миграции периферических моноцитов человека.
Сначала кровь, взятую у нормального индивидуума с использованием гепарина, 2-кратно разводили культуральной средой RPMI 1640. Разведенную кровь наносили на среду Фиколл-Пак (Pharmacia), а затем центрифугировали при 400×g при комнатной температуре в течение 30 минут. Белый слой, наблюдаемый на границе между плазмой крови и средой Фиколл-Пак, выделяли и использовали в качестве моноцитов. Полученные таким образом моноциты культивировали в течение ночи с человеческим TNF-α (20 нг/мл). Полученные активированные моноциты использовали в эксперименте по миграции.
Эксперименты по миграции осуществляли с использованием 48-луночной камеры для микрохемотаксиса (Neuro Probe Inc.). Человеческий OPN подвергали реакции с коровьим тромбином (Sigma) при 37°С в течение 2 часов для расщепления. После добавления различных концентраций химерного антитела 2К1 к полученному расщепленному тромбином человеческому OPN и после выдерживания при 37°С в течение 15 минут полученную смесь добавляли в нижнюю камеру (конечная концентрация человеческого OPN составляла 10 мкг/мл). Затем, после нанесения на поликарбонатный фильтр (с размером пор 5 мкм), 50 мкл клеточной суспензии (2×106 клеток/мл) добавляли в верхнюю камеру.
После культивирования в присутствии 5% СО2 при 37°С в течение 2 часов поликарбонатный фильтр вынимали и клетки, находящиеся на поверхности верхнего фильтра, удаляли и окрашивали красителем Diff-Quick (Baxter). Клетки на поверхности верхнего фильтра подсчитывали при увеличении ×40. Результаты представлены как средние величины (клетки/мм3)±среднее отклонение на 6 лунок.
Как показано в таблице 3, химерное антитело 2К1 ингибировало миграцию TNF-α-активированных периферических нейтрофилов и моноцитов человека в направлении к расщепленному тромбином OPN.
Ингибирующая активность, направленная на миграцию моноцитов:
** Р<0,01 (односторонний ANOVA, критерий Даннетта)
Пример 10
Анализ величины KD химерного антитела 2К1
Величину KD химерного антитела 2К1 оценивали следующим образом. Сначала неполный пептид GRGDSVVYGLR остеопонтина человека биотинилировали с использованием набора для биотинилирования (Dojindo Corporate). Микросхему датчика (сенсора) SA устанавливали на BIACORE-2000 для связывания с лигандом 23 RU (Bin-GRGDSVVYGLR). Мышиное антитело 2К1 непрерывно пропускали в качестве аналита с получением сенсорограммы, представленной на фиг.6а. Кроме того, в качестве аналита пропускали химерное антитело 2К1 с получением сенсорограммы, представленной на фиг.6b. На каждой из этих фигур по оси абсцисс отложено время, а по оси ординат отложен относительный ответ (RU). Данные, полученные исходя из указанных сенсорограмм, анализировали путем построения глобальной кривой связывания при 1:1 (Langmuir) с использованием аналитической программы BIACORE Evaluation Version 3.0. Результаты представлены на фиг.6. На фиг.6а представлена сенсорограмма, построенная при различных концентрациях указанного мышиного антитела 2К1. На фиг.6b представлена сенсорограмма, построенная при различных концентрациях указанного химерного антитела 2К1.
Полученная в результате измерений величина KD мышиного антитела 2К1 составляла 1,2×10-10М, и величина KD химерного антитела 2К1 составляла 9,2×10-11М. При этом какого-либо снижения аффинности химерного антитела 2К1 не наблюдалось, что было обусловлено использованием химерного препарата мышиного антитела 2К1.
Пример 11
Получение гена гуманизированного антитела 2К1
Матричное антитело человека, в которое должны быть введены аминокислоты определяющей комплементарность области (CDR) VH или VL мышиного антитела 2К1, выбирали из антител зародышевой линии человека, имеющих аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям каркасных областей (FR) VH и VL мышиного антитела 2К1. В частности, в качестве VH матричного антитела человека выбирали комбинацию DP-88 (регистрационный № Z49804) с JН6 (регистрационный № Х69866), в то время как в качестве VL матричного антитела человека выбирали комбинацию DPK-13 (регистрационный № Х93631) с Jκ2 (регистрационный № AJ399904) и комбинацию DPK-18 (регистрационный № Х93635) с Jκ2 (регистрационный № AJ399904). Аминокислотную последовательность VH (SEQ ID NO:19) и аминокислотную последовательность VL (SEQ ID NO:20) мышиного антитела 2К1 сравнивали с аминокислотными последовательностями VH и VL матричного антитела человека, которые отдельно показаны на фиг.7 и 8. Область CDR указана в соответствии с классификацией по Кабату и др.
CDR области VH имеет следующую аминокислотную последовательность:

CDR VL-области имеет следующую аминокислотную последовательность:
CDR1 (SEQ ID NO:24): RSSQSIVHSNGNTYLE
CDR2 (SEQ ID NO:25): KVSNRFS
CDR3 (SEQ ID NO:26): FQGSHVPLT
Гуманизированное антитело получали путем введения необходимых аминокислотных последовательностей VH и VL мышиного антитела 2К1 в VH и VL матричного антитела человека. В частности, конструировали нуклеотидную последовательность ДНК, кодирующей аминокислотную последовательность, полученную путем замены аминокислотной последовательности CDR аминокислотной последовательностью CDR мышиного антитела 2К1. Затем, как описано ниже, сконструированный фрагмент гена последовательности нуклеиновой кислоты получали проведением ПЦР и технологией рекомбинантных ДНК. Аминокислотная последовательность DPK13 имела более высокую гомологию с мышиным антителом 2К1 только для FR2 VL. Для остальных частей FR выбирали аминокислотную последовательность DPK-18. Аминокислотную последовательность JН6 выбирали только для FR4 VH. Для остальных частей FR выбирали аминокислотную последовательность DPK-88.
Полученные таким образом аминокислотные последовательности VH и VL гуманизированного антитела 2К1 (иногда называемого ниже "антителом R2К1") и кодирующие их нуклеотидные последовательности отдельно представлены на фиг.9 (SEQ ID NO:27 и 28) и 10 (SEQ ID NO:29 и 30). В качестве лидерной последовательности антитела служила та же самая последовательность, которую использовали в гуманизированном моноклональном антителе против ВИЧ (антителе RС25), описанном в публикации Международной заявки РСТ WO 94/20632 (подчеркнутые части на фиг.9 и 10). Кроме того, к обоим концам нуклеотидных последовательностей, кодирующих VH и VL, добавляли рестрикционные сайты HindIII и BamHI для клонирования.
Для получения ДНК-фрагментов с нуклеотидными последовательностями, представленными на фиг.9 и 10, осуществляли, фактически, общий синтез олигонуклеотидов ДНК проведением ПЦР. Как показано на фигуре, в частности, для VH, конструировали и синтезировали шесть олигонуклеотидов ДНК (SEQ ID по) так, чтобы они покрывали полноразмерную нуклеотидную последовательность VH, показанную на фиг.9. Используя данные ДНК, проводили ПЦР в соответствии со следующими методиками. Используя смесь 10 ммоль каждого из шести типов олигонуклеотидов ДНК в качестве матрицы (TAKARA SHUZO CO., LTD.) проводили стадии: 96°С в течение 20 секунд, 55°С в течение 30 секунд и 72°С в течение 3 минут, и этот цикл повторяли 10 раз. Затем для амплификации полноразмерной VH, используя 1 мкл полученного ПЦР-продукта в качестве матрицы, олигонуклеотиды ДНК с подчеркнутыми на фиг.11 (SEQ ID NO:37 и 38) последовательностями и ДНК-полимеразы Pyrobest, проводили стадии: 96°С в течение 20 секунд, 55°С в течение 30 секунд и 72°С в течение 3 минут, и этот цикл повторяли 25 раз. Полученный ДНК-фрагмент лигировали с вектором pCR-Blunt с использованием набора для ПЦР-клонирования Zero Blunt PCR Cloning (Invitrogen) и встраивали в Escherichia coli для клонирования. Из полученных клонов Escherichia coli получали плазмидную ДНК с использованием набора QIAprep Spin Miniprep (QIAGEN). Используя плазмидную ДНК в качестве матрицы с использованием праймера М13-М4 и праймера М13-RV (оба от TAKARA SHUZO CO, LTD.) и набора CEQ DTCS-Quick Start (BECKMAN COULTER) для реакции секвенирования, нуклеотидную последовательность клонированной ДНК анализировали на автоматическом секвенаторе CEQ 2000 (BECKMAN COULTER) и получали клон, имеющий нуклеотидную последовательность, представленную на фиг.9.
Для VL использовали шесть олигонуклеотидов ДНК (SEQ ID NO:39-44), представленных на фиг.12, для проведения 10 циклов ПЦР методом, описанным выше. Используя амплифицированный продукт в качестве матрицы и олигонуклеотиды ДНК с подчеркнутыми на фиг.12 последовательностями (SEQ ID NO:45 и 46) в качестве праймера, осуществляли 25 циклов ПЦР, как описано выше. Путем последующего применения методик, описанных для VH, может быть получен клон, имеющий нуклеотидную последовательность, представленную на фиг.10.
Пример 12
Получение плазмиды, экспрессирующей гуманизированное антитело 2К1
Плазмиду, экспрессирующую гуманизированное антитело 2К1, получали способом, аналогично способу получения плазмиды, экспрессирующей химерное антитело 2К1, как описано в примере 7. Из клона, содержащего гены VH и VL гуманизированного антитела 2К1, полученного, как описано в примере 11, экстрагировали плазмидную ДНК общим способом. Данный клон гидролизовали ферментами HindIII и BamHI с получением ДНК-фрагментов для VH и VL, которые интегрировали в экспрессирующие векторы AG-γ1 и AG-κ. Полученные таким образом плазмиды, экспрессирующие тяжелую цепь гуманизированного антитела 2К1 и его легкую цепь, вводили в Escherichia coli для культивирования в массовом масштабе. Плазмидную ДНК, экспрессирующую тяжелую цепь и легкую цепь и присутствующую в Escherichia coli, очищали для трансфекции.
Пример 13
Экспрессия гуманизированного антитела 2К1
Плазмиду, экспрессирующую тяжелую цепь гуманизированного антитела 2К1, полученного, как описано в примере 12, смешивали с плазмидой, экспрессирующей легкую цепь данного антитела, и затем данную смесь использовали для трансфекции клеточного штамма СНО-DG44 кальцийфосфатным способом. Используя супернатант 3-дневной культуры указанного клеточного штамма в культуральной среде МЕМ, в которую добавляли 0,5 мг/мл генетицина и 10% диализованного FCS, антигенсвязывающую активность гуманизированного антитела 2К1, содержащегося в данной культуре, анализировали с помощью ELISA. Сначала для измерения концентрации гуманизированного антитела 2К1, присутствующего в культуральной среде, проводили "сэндвич"-ELISA с использованием Fc-фрагмента козьего антитела против человеческих IgG (CAPPEL) и конъюгата "белок А-ПХ" (ZYMED LABORATORIES, INC.). В этом случае приготавливали серийные разведения коммерчески доступного антитела человека IgG1 (Biogenesis) и использовали в качестве стандартного образца. Кроме того, концентрацию химерного антитела 2К1 также измеряли с помощью ELISA, описанного выше.
Пример 14
Подтверждение активностей связывания химерного антитела 2К1 и гуманизированного антитела 2К1 с пептидом остеопонтина
Исходя из концентраций гуманизированного антитела 2К1 и химерного антитела 2К1, определенных в примере 13, активности связывания химерного антитела 2К1 и гуманизированного антитела 2К1 с пептидом остеопонтина (CVDTYDGRGDSVVYGLRS) сравнивали с активностями ELISA-стандарта Kon et al. (Journal of Cellular Biology, 88:420-432 (2002)).
Серийные разведения гуманизированного антитела 2К1 и химерного антитела 2К1 на микротитрационном планшете подвергали реакции с иммобилизованным на нем пептидом остеопонтина, перекрестно сшитым с BSA (BSA-CVDTYDGRGDSVVYGLRS). Затем антитела, связанные с BSA-CVDTYDGRGDSVVYGLRS, подвергали реакции с конъюгатом "белок А-ПХ" и, наконец, с ТМВ (Dojindo Corporate) и измеряли оптическую плотность на длине волны 450 нм.
Кроме того, аналогичным образом также проводили измерения реакции на планшете. Результаты представлены на фиг.13.
На фиг.13 по оси абсцисс отложены концентрации антител, а по оси ординат отложена оптическая плотность, где заштрихованный кружок обозначает активность связывания химерного антитела 2К1 с BSA-CVDTYDGRGDSVVYGLRS, в то время как заштрихованный квадрат обозначает активность связывания гуманизированного антитела 2К1 с BSA-CVDTYDGRGDSVVYGLRS. Кроме того, в качестве негативного контроля также показана активность связывания химерного антитела 2К1 с BSA (незаштрихованные кружки) и активность гуманизированного антитела 2К1 с BSA (незаштрихованные квадраты).
Следовательно, было показано, что гуманизированное антитело 2К1 и химерное антитело 2К1 обладают активностью связывания только с BSA-CVDTYDGRGDSVVYGLRS, но не с BSA. Таким образом, было показано, что активности связывания данных антител являются специфичными для пептида остеопонтина. Кроме того, уровни активностей связывания обоих антител с BSA-CVDTYDGRGDSVVYGLRS были аналогичными.
Как описано выше, химерное антитело 2К1 и исходное мышиное антитело 2К1 обладали аналогичными уровнями антигенсвязывающей активности. Таким образом, было ясно показано, что гуманизированное антитело 2К1, полученное в соответствии с настоящим изобретением, имело антигенсвязывающую активность, аналогичную антигенсвязывающей активности исходного мышиного антитела 2К1.
Пример 15
Получение антитела М5
Для иммунизации получали следующий синтетический пептид, соответствующий внутренней последовательности (С + V138-R153) мышиного OPN.
Пептид М5:
CVDVPNGRGDSLAYGLR
Данный пептид связывали с тироглобулином для последующей иммунизации кроликов в соответствии с общей методикой. У иммунизованных кроликов брали антисыворотку для получения антитела М5 с использованием колонки, упакованной пептидом М5, который своим N-концевым цистеином связывали через дисульфидную связь с тиолсефарозными сферами (Ameraham Pharmacia Biotech, Tokyo, Japan).
Пример 16
Реактивность антитела М5 с OPN и продуктами его расщепления тромбином
Активность связывания антитела М5, выделенного, как описано в примере 13, с OPN и продуктами его расщепления тромбином тестировали способом Вестерн-блоттинга. В качестве OPN использовали рекомбинантный мышиный OPN в гликозилированной форме, генерированный в клетках СНО. Антитело М5 реагировало с OPN и продуктами его расщепления тромбином.
Пример 17
Ингибирование антителом М5 клеточной адгезии к OPN
Для того чтобы оценить, ингибирует ли антитело М5 клеточную адгезию к OPN или нет, использовали способ, описанный у S. Kon et al. ((2000): J. Cell. Biochem. 84(2), 420-432). В качестве OPN использовали полноразмерный мышиный OPN, из которого был предварительно удален GST-сегмент с помощью протеазы PreScission (Ameraham Pharmacia Biotech, Tokyo, Japan) (обозначаемый далее "mOPN/de-GST"). Используемыми клетками были мышиные клетки NIH 3Т3.
Как показано на фиг.14, клетки NIH 3Т3 обнаруживали зависимую от концентрации адгезию к mOPN/de-GST. Кроме того, как показано на фиг.15, адгезия заметно ингибировалась пептидом GRGDSP (100 мкг/мл), и поэтому адгезия зависела от RGD. Как показано на фиг.16, антитело М5 при концентрации 200 мкг/мл заметно ингибировало адгезию клеток к OPN.
Пример 18
Ингибирующая активность антитела М5, направленная на миграцию мышиных моноцитов селезенки
Ингибирующую активность антитела М5 по отношению к миграции активированных цитокинами мышиных моноцитов селезенки оценивали описанным ниже способом. Результаты представлены в таблице 4.
<Экспериментальный способ>
Спленоциты, полученные от мыши С57ВL/6, выращивали на предметном стекле до образования монокультуры клеток, которые затем культивировали в колбе при 37°С в течение одного часа. Полученные прилипшие клетки использовали в качестве моноцитов. Моноциты культивировали в течение ночи и активировали человеческим TNF-α (20 нг/мл). Полученные активированные моноциты использовали для эксперимента по миграции. Эксперимент по миграции осуществляли способом, описанным выше в примере 6 для человеческого образца.
<Результаты эксперимента>
Антитело М5 ингибировало миграцию TNF-α-активированных моноцитов, полученных из мышиной селезенки, в направлении к расщепленному тромбином мышиному OPN, выделенному в результате расщепления полноразмерного мышиного OPN (полученного Genzyme Corporation) коровьим тромбином (производимым Sigma).
Пример 19
Действие антитела М5, направленное на подавление костного поражения
Описанным ниже способом проводили оценку действия антитела М5, направленного на подавление поражения кости в культуральной системе органов свода черепа. Результаты представлены в таблице 5.
<Экспериментальный способ>
У новорожденной мыши на 1-й день после рождения иссекали черепную кость и после доведения до нужного размера половину этой кости помещали в каждую лунку 24-луночного планшета. Затем для индуцирования поражения кости в каждую лунку добавляли паратиреоидный гормон человека (ПТГ) (1-34), конечную концентрацию которого доводили до 10 нМ добавлением культурального бульона D-MEM (с добавленной 10% бычьей сывороткой). Антитело М5 добавляли до конечной концентрации 200 мкг/мл. После культивирования при 37°С в течение одной недели количество кальция, выделенного из кости в культуральный бульон, анализировали с помощью теста на кальций Е WAKO (Wako Pure Chemical Industries, Ltd.).
<Результаты эксперимента>
Без добавления ПТГ содержание кальция составляло 7,02 мг/мл. Однако при добавлении ПТГ содержание кальция составляло 9,11 мг/мл. Следовательно, эти наблюдения указывают на стимуляцию высвобождения кальция из кости. При добавлении антитела М5 в концентрации 200 мкг/мл было подтверждено, что резорбция кости ингибировалась примерно на 70%.
Пример 20
Действие антитела М5 в мышиной модели коллагенового артрита
Действие антитела М5 в мышиной модели коллагенового артрита оценивали в соответствии с описанным ниже способом. В таблице 6 представлены результаты оценки поражения артритом; в таблице 7 представлены результаты оценки отека лапы; в таблице 8 представлены результаты оценки изменения массы тела; и в таблице 9 представлены результаты оценки изменения потребления пищи.
<Экспериментальный способ>
Для индуцирования артрита использовали артритогенную смесь антител (коммерчески доступная под торговым названием "смесь для индуцирования артрита, Arthrogen-CIA® mAb, артритогенная смесь mAb, производимая Iwai Chemical Pharmaceutical Co., Ltd.), распознающих четыре эпитопа, специфичных для коллагена. Указанную артритогенную смесь внутривенно вводили мышам и через 3 дня внутрибрюшинно вводили ЛПС (100 мкг), что приводило к индуцированию артрита. Через 3 дня после введения дозы ЛПС наблюдалось развитие артрита, которое достигало максимума на 6-й день.
Непосредственно перед введением дозы ЛПС и через 3 дня после ее введения внутривенно вводили антитело М5 в дозе 40 мкг, 150 мкг или 400 мкг. В качестве контрольной группы использовали группу, которой вводили кроличьи IgG (в дозе 400 мкг). Кроме того, непосредственно перед введением дозы ЛПС и через 3 дня после ее введения внутривенно вводили антитело против мышиного TNF-α в дозе 200 мкг/мышь. В качестве контрольной группы использовали группу, которой вводили крысиные IgG (в дозе 200 мкг). Кроме того, один раз в день, начиная со дня введения ЛПС, и в последующие дни перорально вводили МТХ (в дозе 3,2 мг/кг). Затем МТХ растворяли в 5 мл 0,5% раствора метилцеллюлозы. В качестве контрольной группы использовали группу, которой вводили 5 мл 0,5% раствора метилцеллюлозы.
В этих четырех экспериментах для каждой группы, состоящей из пяти животных, проводили оценки поражения артритом, а именно оценку отека лапы, изменение массы тела и потребления пищи.
<Результаты эксперимента>
Как показано в таблицах 6-9, антитело М5 оказывало явное подавляющее действие на увеличение степени поражения артритом, замедляло развитие артрита и ингибировало развитие отека лапы в мышиной модели артрита (терапевтический эффект). Начало развития артрита подавлялось в зависимости от концентрации на таком уровне, что данный эффект превышал эффект введения дозы антитела против мышиного TNF-α (при дозе 200 мкг/мышь). В противоположность этому МТХ почти не обладало фармацевтическим действием.
Кроме того, в нормальной группе мышей-моделей через 3 дня после введения ЛПС наблюдалось заметное снижение массы тела примерно на 3 г, и эта тенденция сохранялась в течение 3-6 дней, хотя такое снижение более или менее замедлялось. В группах, которым вводили антитело М5 (150 мкг, 400 мкг), и альтернативно, в группе, которой вводили антитело против мышиного TNF-α, наблюдалось заметное улучшение в отношении изменения массы тела. Что касается потребления пищи, то для каждого из фармацевтических веществ наблюдалось быстрое снижение массы тела за период вплоть до 3 дней после введения ЛПС, однако на 3-6 дни у групп, которым вводили антитело М5, и у групп, которым вводили антитело против мышиного TNF-α, такое снижение замедлялось. В таблице 6 представлены результаты оценки поражения артритом; в таблице 7 показано ингибирующее действие на отек лапы; в таблицах 8 и 9 показано влияние на изменение массы тела и изменение потребления пищи соответственно.
группа
которой
вводили
кроличьи IgG
(доза; 400
мкг/мышь)
лапа
0,003**
лапа
0,004**
лапа
лапа
Пример 21
Доступность пептидов OPN-родственного фрагмента
Пептиды OPN-родственного фрагмента в форме, очищенной с помощью ВЭЖХ-хроматографии, закупали у Auspep Inc., Parkiville, Australia. Аминокислотные последовательности этих пептидов представлены ниже как (1)-(3).

Пример 22
Получение антигенов для иммунизации
Продукты пептидов OPN-родственного фрагмента, связанные с тироглобулином, получали в качестве иммуногенов с использованием EMCS (N-(6-малеимидокапроилокси)сукцинимида), как описано ниже. Для получения таких продуктов молярное отношение тироглобулина, пептида OPN-родственного фрагмента и EMCS составляло 1:300:400.
4 мг каждого из пептидов OPN-родственного фрагмента примера 21 растворяли примерно в 1 мл дистиллированной воды. Альтернативно, 5 мг тироглобулина, растворенного в 1 мл 0,01 М фосфатного буфера, рН 7,0, и EMCS, растворенного при 80 мкг/мкл в диметилформамиде в количествах, соответствующих указанным молярным концентрациям, смешивали и получали раствор комплекса "тироглобулин-EMCS". Раствор комплекса разделяли на три порции. К каждой порции добавляли раствор пептида OPN-рдственного фрагмента в количестве, соответствующем указанной молярной концентрации, получали в результате раствор перекрестно сшитого с EMCS продукта пептида OPN-рдственного фрагмента, связанного с тироглобулином.
Раствор такого связанного продукта подвергали диализу с использованием PBS с доведением концентрации указанного связанного продукта до 10 мкг/мкл. Связанный продукт пептида OPN-родственного фрагмента и тироглобулина использовали в качестве антигена для иммунизации.
Пример 23
Получение антигенов для скрининга
В качестве белков для скрининга способом, описанным в примере 1, получали гибридные белки, образованные между GST и изоформами человеческого OPN, а именно GST-OPN-а, GST-OPN-b и GST-OPN-с, и гибридные белки, образованные между GST и фрагментом OPN, находящимся со стороны аминогруппы (GST-N-пловина) от сайта расщепления тромбином, и фрагментом OPN, находящимся со стороны карбоксильной группы (GST-Спловина) от того же сайта расщепления тромбином, и эти белки использовали для оценки реактивности антисыворотки с OPN.
Пример 24
Иммунная сенсибилизация
Кроликов иммунизировали, используя антигены для иммунизации, то есть продукты связывания пептидов OPN-родственного фрагмента и тироглобулина, полученных, как описано в примере 22. Иммунизацию осуществляли путем введения бустер-инъекции 100 мкл (100 мкг) раствора связанного продукта один раз в неделю или один раз в две недели. Антигены смешивали с полным адъювантом Фрейнда для первой иммунизации и затем смешивали с неполным адъювантом Фрейнда для второй иммунизации и для последующих иммунизаций. После восьми иммунизаций из собранной крови отделяли сыворотку, которую затем использовали в качестве антисыворотки.
Пример 25
Реактивность антисыворотки с OPN
Пептиды OPN-родственного фрагмента, полученные, как описано в примере 21, разводили 0,1М карбонатным буфером, рН 9,5, до 10 мкг/мл и затем иммобилизовали при 50 мкл/лунка на 96-луночном планшете.
После промывки PBS и блокирования раствором 0,1% BSA/PBS/0,05% NaN3 2-кратные серийные разведения 100-кратного разведения антисыворотки, выделенной, как описано в примере 24, помещали в объеме 50 мкл в лунку и оставляли на 30 минут при 37°С для реакции.
После прекращения реакции лунку четыре раза промывали 0,05% Твина 20-PBS. Затем в каждую лунку добавляли 50 мкл каждого из ПХ-меченных антител против кроличьих IgG (приготавливаемых IBL Co., Ltd.) и оставляли для реакции на 30 минут при 37°С. После прекращения реакции в каждую лунку добавляли 100 мкл (каждого) 0,05М цитратного буфера (рН 4,5), содержащего 0,4 мг/мл ортофенилендиамина (OPD) и водной 0,03%-ной перекиси водорода. Затем планшет оставляли на 15 минут в темноте при комнатной температуре для хромогенной реакции. После проведения хромогенной реакции в каждую лунку добавляли 100 мкл 1 н. серной кислоты для завершения реакции и для измерения оптической плотности при 492 нм.
Альтернативно, с использованием белков OPN, полученных, как описано в примере 23, оценивали реактивность антисыворотки способом Вестерн-блоттинга. В результате антисыворотка против пептидов OPN-родственного фрагмента hOPN1 и hOPN5 реагировала с GST-OPN-а, GST-OPN-b, GST-OPN-с и с GST-N-половиной, но никогда не реагировала с GST-C-половиной. Альтернативно, антисыворотка против пептида OPN-родственного фрагмента hOPN3 реагировала с GST-OPN-а, GST-OPN-b, GST-OPN-с и с GST-С-половиной, но никогда не реагировала с GST-N-половиной.
Пример 26
Получение ПХ-связанных продуктов антител против пептидов OPN-родственного фрагмента
ПХ-связанные продукты антител против пептидов OPN-родственного фрагмента hOPN3 и hOPN1 получали следующим образом. 20 мг каждого антитела против пептида OPN-родственного фрагмента гидролизовали пепсином и затем подвергали гель-фльтрации для очистки F(ab')2-фрагмента антитела против пептида OPN-родственного фрагмента. Затем F(ab')2-фрагмент восстанавливали до Fab'-фрагмента с использованием 2-мркаптоэтанола. ПХ подвергали реакции с EMCS при 37°С в течение 60 минут с последующей гель-фильтрацией, в результате чего получали связанный продукт ПХ-EMCS, который затем подвергали реакции с Fab'-фрагментом антитела против пептида OPN-родственного фрагмента при 4°С в течение ночи и затем гель-фильтрации с получением перекрестно сшитого с EMCS и связанного с ПХ продукта антитела против пептида OPN-родственного фрагмента.
Пример 27
Конструирование систем для "сэндвич"-ELISA
С использованием комбинации планшета для "сэндвич"-ELISA и меченых антител получали два типа систем, а именно 1-3 и 5-1. В частности, систему 1-3 получали следующим образом. 10 мкг/мл антитела против пептида OPN-родственного фрагмента hOPN1 добавляли 100 мкл-порциями в 96-луночный ELISA-планшет. После проведения реакции в течение ночи при 4°С осуществляли блокирование 10% раствором BSA/PBS/NaN3. Полученный таким образом планшет использовали в качестве планшета для "сэндвич"-ELISA. ПХ-связанный продукт антитела против пептида OPN-родственного фрагмента hOPN3, полученный, как описано в примере 26, определяли как меченое антитело. Как описано выше, комбинацию между иммобилизирующим планшетом, полученным с использованием антитела против hOPN1, и меченым антителом, полученным с использованием антитела против hOPN3, определяли как систему 1-3.
Аналогичным образом комбинацию между иммобилизирующим планшетом, полученным с использованием антитела против hOPN5, и меченым антителом, полученным с использованием антитела против hOPN1, конструировали как систему 5-1.
Пример 28
Анализ на остеопонтин у тестируемого индивидуума с использованием систем "сэндвич"-ELISA
Анализ на белок OPN проводили следующим способом. 100 мкл раствора, содержащего образец плазмы или образец жидкости, взятой из суставной полости тестируемого индивидуума, добавляли в "сэндвич"-ELISA-планшеты систем 1-3 и 5-1 и проводили реакцию при 37°С в течение одного часа. После проведения реакции планшеты четыре раза промывали 0,05% твина 20-PBS и затем добавляли 100 мкл каждого из меченых антител, специфичных к отдельным системам, и проводили реакцию при 4°С в течение 30 минут. После проведения реакции планшеты шесть раз промывали 0,05% твина 20-PBS и затем добавляли 100 мкл раствора ТМВ (тетраметилбензидина). Затем полученные планшеты оставляли на 30 минут в темноте при комнатной температуре. Для завершения реакции использовали 1 н. серную кислоту, после чего оценивали оптическую плотность при 450 нм.
В таблице 10 указаны величины OPN в жидкостях суставной полости больных (13 случаев) ревматизмом, измеренные указанным способом; в таблице 11 представлены величины OPN в жидкостях суставной полости больных (12 случаев) остеоартритом. Кроме того, в таблице 12 представлены величины OPN в плазме больных ревматизмом (16 случаев); в таблице 13 представлены величины OPN в плазме больных остеоартритом (7 случаев) и в таблице 14 представлены величины OPN в плазме нормальных индивидуумов (6 случаев).
Как видно из представленных результатов, полученных с использованием системы 1-3, сравнение величин OPN плазмы у больных ревматоидным артритом, у больных остеоартритом и у нормальных индивидуумов не выявило никаких заметных различий. Однако в случае системы 5-1 сравнение величин OPN плазмы у больных ревматоидным артритом, у больных остеоартритом и у нормальных индивидуумов показало, что у больных ревматоидным артритом и у больных остеоартритом величины OPN в плазме были значительно выше, чем величины OPN у нормальных индивидуумов. При этом уровень значимости был выше у больных ревматоидным артритом. Это указывает на то, что общее количество OPN, полученное с использованием системы 5-1, является эффективным для диагноза артрита общей категории.
Альтернативно, величины OPN в жидкости суставной полости больных ревматоидным артритом и у больных остеоартритом превышали количества OPN в плазме, что явно указывало на локальное продуцирование OPN.
Кроме того, для систем 1-3 и 5-1 сравнение величин OPN в жидкости суставной полости у больных ревматоидным артритом и у больных остеоартритом показало, что величина OPN у больных ревматоидным артритом значительно превышала величину OPN у больных остеоартритом.
В качестве нового показателя было оценено отношение величин OPN с использованием систем 1-3 и 5-1. Этот показатель может быть использован для сравнения количеств расщепленного тромбином OPN. Величины OPN в плазме и в жидкости суставной полости у больных ревматоидным артритом составляли 1 или менее, а величины OPN у больных остеоартритом составляли 2 или более. Следовательно, у этих больных наблюдались значительные различия. Таким образом, величины OPN, полученные с системами 1-3/5-1, могут быть применены для диагностического способа дифференциации больных ревматоидным артритом от больных остеоартритом на ранней стадии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО ПРОТИВ ОСТЕОПОНТИНА ЧЕЛОВЕКА | 2007 |
|
RU2429016C2 |
| АНТИТЕЛО ПРОТИВ ОСТЕОПОНТИНА И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2299888C2 |
| УЛУЧШЕННОЕ ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К ЧЕЛОВЕЧЕСКОМУ α9-ИНТЕГРИНУ | 2009 |
|
RU2503720C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К Toll-ПОДОБНЫМ РЕЦЕПТОРАМ 2 И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2563344C2 |
| ХИМЕРНЫЕ И ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ ИНТЕГРИНА α5β1, КОТОРЫЕ МОДУЛИРУЮТ АНГИОГЕНЕЗ | 2003 |
|
RU2346701C2 |
| ПЕПТИД ИЛИ ПЕПТИДНЫЙ КОМПЛЕКС, СВЯЗЫВАЮЩИЙСЯ С альфа2-ИНТЕГРИНОМ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ УКАЗАННОГО ВЕЩЕСТВА | 2011 |
|
RU2588668C2 |
| АНТИТЕЛО К Myl9 | 2017 |
|
RU2741802C2 |
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ ИНТЕГРИН ανβ8 | 2011 |
|
RU2565539C2 |
| МОЛЧАЩИЕ АНТИ-CD28-АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2261723C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ TNFα | 2012 |
|
RU2549700C1 |






















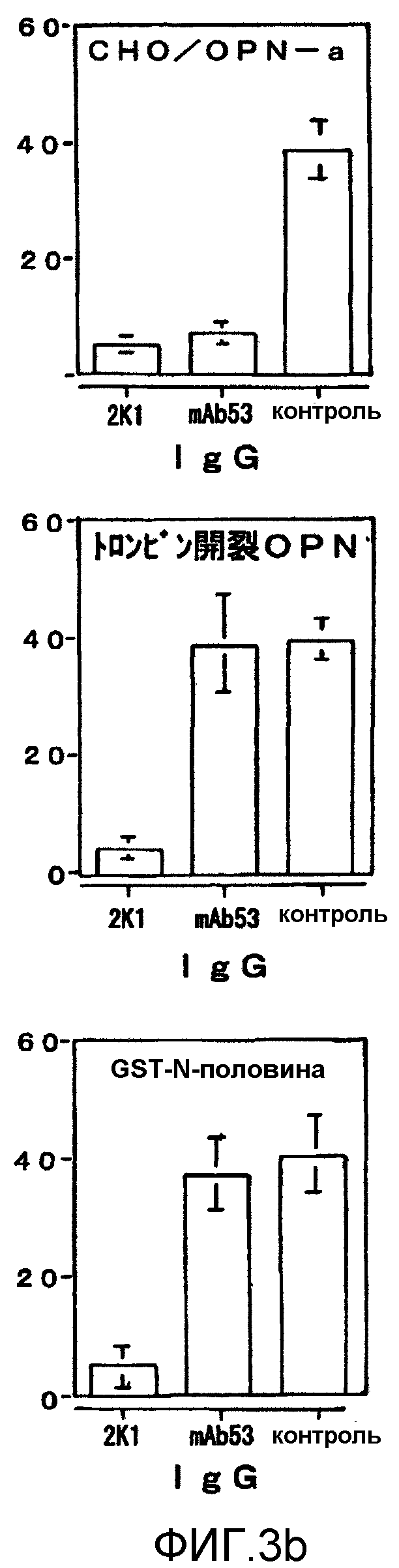


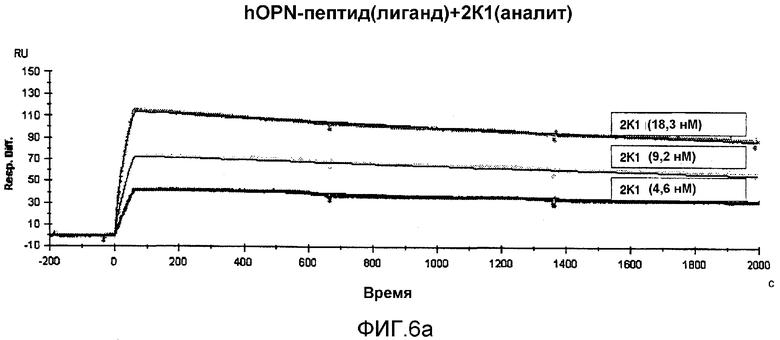

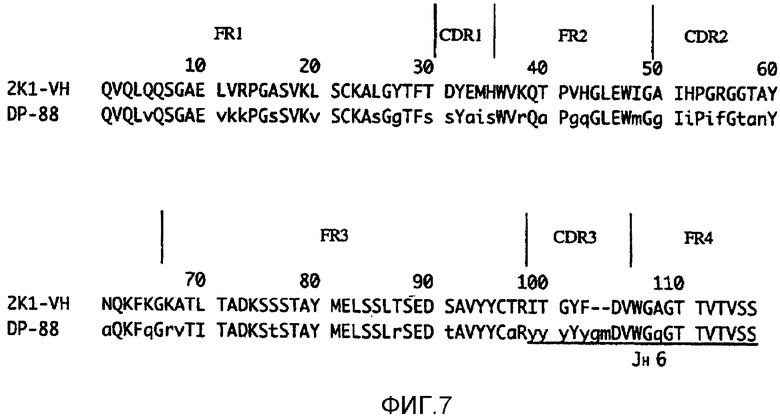









Изобретение относится к области иммунологии и может быть использовано в медицине для лечения аутоиммунных заболеваний, ревматизма, ревматоидного артрита. Рекомбинантное антитело (Ат) против остеопонтина сконструировано таким образом, что, по крайней мере, константные области в тяжелой и легкой цепях представляют собой области человеческого Ат. Ат по изобретению ингибирует связывание интегрина, распознающего последовательность RGD и SVVYGLR, с остеопонтином или его фрагментом. В изобретении описаны нуклеотидные последовательности (НП), кодирующие тяжелую и легкую цепи рекомбинантного Ат, а также экспрессионные векторы, содержащие соответствующие НП. Описана клетка-хозяин для продуцирования Ат, трансформированная двумя векторами для экспрессии легкой и тяжелой цепей Ат, а также способ с использованием указанной клетки-хозяина для получения рекомбинантного Ат. Раскрыто применение Ат в качестве лекарственного средства для лечения аутоиммунных заболеваний, ревматизма или ревматоидного артрита. Рекомбинантное Ат может быть применено в качестве средства для диагностики и в способе диагностики ревматизма. Использование изобретения позволит повысить точность определения патогенеза ревматоидного артрита и эффективность терапевтического способа лечения. 28 н. и 17 з.п. ф-лы, 16 ил., 14 табл.
(a) тяжелая цепь, содержащая вариабельную область тяжелой цепи, происходящей от мыши, и константную область тяжелой цепи, происходящей от человека, и
(b) легкая цепь, содержащая вариабельную область легкой цепи, происходящей от мыши, и константную область легкой цепи, происходящей от человека.
(c) тяжелая цепь, содержащая вариабельную область тяжелой цепи и константную область тяжелой цепи, происходящей от человека, где указанная вариабельная область тяжелой цепи состоит из гипервариабельной области в вариабельной области тяжелой цепи, происходящей от мыши, и каркасной области в вариабельной области тяжелой цепи, происходящей от человека;
(d) легкая цепь, содержащая вариабельную область легкой цепи и константную область легкой цепи, происходящей от человека, где указанная вариабельная область легкой цепи состоит из гипервариабельной области в вариабельной области легкой цепи, происходящей от мыши, и каркасной области в вариабельной области легкой цепи, происходящей от человека.
| WO 9915904 A, 01.04.1999. |
Авторы
Даты
2007-08-27—Публикация
2002-09-25—Подача