Область техники
[0001] Настоящее изобретение относится к антителу, которое связывается с полипептидом регуляторной легкой цепи миозина (Myl)9, или к его Myl9-связывающему фрагменту, а также к фармацевтической композиции, содержащей указанные антитело или его Myl9-связывающий фрагмент.
[0002]
Уровень техники
CD69 представляет собой трансмембранный белок II типа, который принадлежит к семейству лектинов C-типа. CD69 широко используется в качестве индикатора активации лимфоцитов (непатентный литературный источник 1), и, как сообщалось до настоящего времени, вовлечен в воспалительные заболевания, такие как очаговое воспаление, артрит и симптомы аллергии дыхательных путей (непатентные литературные источники 2 и 3).
[0003]
В последние годы сообщалось, что CD69 взаимодействует с полипептидом регуляторной легкой цепи миозина (Myl)9, который представляет собой одну из субъединиц, составляющих миозин, и при этом были представлены стратегии терапии воспалительных заболеваний, которые нацелены на Myl9 (патентный литературный источник 1).
Ингибитор контрольных точек иммунного ответа представляет собой группу недавно разработанных противораковых лекарственных средств, и он ингибирует белки, экспрессируемые в раковых клетках и лимфоцитах (T-клетках), которые тормозят функционирование иммунной системы. Эти белки называют контрольными точками иммунного ответа. Известно, что белок 1 программируемой клеточной смерти (PD-1), лиганд 1 белка программируемой клеточной смерти (PD-L1), антиген 4, ассоциированный с цитотоксическими T-лимфоцитами (CTLA-4), и подобные молекулы действуют в качестве контрольных точек иммунного ответа. Несколько ингибиторов контрольных точек иммунного ответа были одобрены в качестве лекарственных средств, и их пути терапевтического применения включают применение при злокачественной меланоме, немелкоклеточном раке легкого, почечноклеточной карциноме, злокачественной лимфоме, множественной миеломе, раке головы и шеи и уротелиальном раке. Кроме того, лечение ингибиторами контрольных точек иммунного ответа в отдельности или в комбинации с другим противораковым лекарственным средством является эффективным против раковых заболеваний, таких как рак ободочной и прямой кишки, рак молочной железы, гепатоцеллюлярная карцинома, рак желудка, рак пищевода, рак яичника, мелкоклеточный рак легкого, мезотелиома, рак эндометрия, согласно результатам клинических испытаний.
Список использованной литературы
Патентная литература
[0004]
[Патентный литературный источник 1] WO2014/192915
Непатентная литература
[0005]
[Непатентный литературный источник 1] Testi, R. et al., Immunol. Today 15:479-483, 1994.
[Непатентный литературный источник 2] Murata, K. et al.: CD69-null mice protected from arthritis induced with anti-type II collagen antibodies. Int. Immunol. 15:987-992, 2003
[Непатентный литературный источник 3] Miki-Hosokawa, T. et al.: CD69 controls the pathogenesis of allergic airway inflammation. J. Immunol. 183; 8203-8215, 2009
Краткое описание изобретения
Техническая задача
[0006]
Антитела и антигенсвязывающие фрагменты могут становиться желаемыми терапевтическими лекарственными средствами благодаря специфичности связывания, которой они обладают. Антитела и антигенсвязывающие фрагменты можно использовать для минимизации потенциальных побочных эффектов путем нацеливания исключительно на конкретные клетки или ткани. Существует потребность в идентификации антитела, применимого для нацеливания на Myl9, а также гуманизированного антитела, которое применяется в качестве фармацевтического средства.
[0007]
Следовательно, целью настоящего изобретения является обеспечение антитела к Myl9 или его Myl9-связывающего фрагмента, которые связываются с Myl9 и могут ингибировать взаимодействие между Myl9 и CD69 у людей, а также фармацевтической композиции, содержащей их.
Решение задачи
[0008]
В результате обширного исследования для решения вышеупомянутых задач авторы настоящего изобретения успешно получили мышиное моноклональное антитело к Myl9 мыши/человека, которое связывается с Myl9 человека и мыши и может ингибировать взаимодействие с CD69. В результате этого авторы настоящего изобретения получили гуманизированное или химерное антитело, содержащее последовательность области, определяющей комплементарность (CDR (иногда может называться "гипервариабельной областью")), указанного мышиного моноклонального антитела к Myl9 мыши/человека в вариабельной области тяжелой и легкой цепей, путем идентификации CDR указанного мышиного моноклонального антитела к Myl9 мыши/человека.
Другими словами, настоящее изобретение охватывает следующие отличительные признаки.
[0009] [1] Антитело к полипептиду регуляторной легкой цепи миозина (Myl)9 или его Myl9-связывающий фрагмент, содержащие:
(a) CDR1 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 28;
(b) CDR2 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 30;
(c) CDR3 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 32;
(d) CDR1 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 33;
(e) CDR2 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 34; и
(f) CDR3 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 35.
[00010]
[2] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [1], где указанное антитело представляет собой гуманизированное или химерное антитело.
[00011]
[3] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [1] или [2], где указанный Myl9 представляет собой Myl9 человека.
[00012]
[4] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно любому из [1]-[3], которые ингибируют взаимодействие между Myl9 и CD69, где
указанное антитело содержит тяжелую цепь и легкую цепь,
вариабельная область указанной тяжелой цепи содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, и
вариабельная область указанной легкой цепи содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65, 66, 67 или 68.
[00013]
[5] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно любому из [1]-[4], где указанное антитело выбрано из группы, состоящей из следующих антител:
(1) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(2) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(3) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(4) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(5) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(6) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(7) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(8) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(9) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(10) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(11) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(12) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(13) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(14) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(15) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(16) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(17) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(18) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(19) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65;
(20) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 67;
(21) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66; и
(22) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00014]
[6] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно любому из [1]-[5], которые содержат тяжелую и легкую цепи, где константная область указанной тяжелой цепи принадлежит к IgG.
[00015]
[7] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [6], где константная область указанной тяжелой цепи представляет собой константную область человеческого IgG2.
[00016]
[8] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [7], где указанная константная область человеческого IgG2 имеет мутации V234A и G237A.
[00017]
[9] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [7] или [8], где указанная константная область имеет делецию С-концевого лизинового остатка.
[00018]
[10] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [6], где константная область указанной легкой цепи включает в себя константную область человеческого Igκ.
[00019]
[11] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно любому из [1]-[10], где указанные антитело или его Myl9-связывающий фрагмент ингибируют взаимодействие между Myl12a или Myl12b и CD69.
[00020]
[12] Фармацевтическая композиция, содержащая антитело или его Myl9-связывающий фрагмент согласно любому из [1]-[11] и фармацевтически приемлемый носитель или добавку.
[00021]
[13] Фармацевтическая композиция согласно [12] для лечения аллергического воспаления дыхательных путей или воспалительного заболевания кишечника.
[00022]
[14] Фармацевтическая композиция согласно [13], где воспалительное заболевание кишечника представляет собой неспецифический язвенный колит или болезнь Крона.
[00023]
[15] Фармацевтическая композиция согласно [12] для лечения опухоли, где фармацевтическая композиция применяется в комбинации с ингибитором контрольных точек иммунного ответа.
[00024]
[16] Фармацевтическая композиция согласно [15], где ингибитор контрольных точек иммунного ответа представляет собой ингибитор PD-1.
[00025]
[17] Фармацевтическая композиция согласно [16], где ингибитор PD-1 представляет собой антитело к PD-1 или антитело к PD-L1.
[18] Фармацевтическая композиция согласно [16], где ингибитор PD-1 представляет собой антитело к PD-1.
[00026]
[19] Фармацевтическая композиция согласно любому из [15]-[18], где опухоль выбрана из группы, состоящей из рака ободочной и прямой кишки, злокачественной меланомы, немелкоклеточного рака легкого, почечноклеточной карциномы, злокачественной лимфомы, множественной миеломы, рака головы и шеи, уротелиального рака, рака молочной железы, гепатоцеллюлярной карциномы, рака желудка, рака пищевода, рака яичника, мелкоклеточного рака легкого, мезотелиомы и рака эндометрия.
[20] Фармацевтическая композиция согласно [19], где опухоль представляет собой рак ободочной и прямой кишки.
[00027]
Кроме того, настоящее изобретение охватывает следующие отличительные признаки.
[1'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00028]
[2'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00029]
[3'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00030]
[4'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00031]
[5'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00032]
[6'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00033]
[7'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00034]
[8'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00035]
[9'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00036]
[10'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00037]
[11'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00038]
[12'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00039]
[13'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00040]
[14'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00041]
[15'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00042]
[16'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00043]
[17'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00044]
[18'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00045]
[19'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65.
[00046]
[20'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 67.
[00047]
[21'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66.
[00048]
[22'] Антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[00049]
[23'] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно любому из [1']-[22'], которые ингибируют взаимодействие между Myl9 и CD69.
[00050]
[24'] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно любому из [1']-[23'], которые содержат тяжелую и легкую цепи, где константная область указанной тяжелой цепи принадлежит к IgG.
[00051]
[25'] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [24'], где константная область указанной тяжелой цепи представляет собой константную область человеческого IgG2.
[00052]
[26'] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [25'], где указанная константная область человеческого IgG2 имеет мутации V234A и G237A.
[00053]
[27'] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [25'] или [26'], где указанная константная область имеет делецию С-концевого лизинового остатка.
[00054]
[28'] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно [24'], где константная область указанной легкой цепи включает в себя константную область человеческого Igκ.
[29'] Антитело к Myl9 или его Myl9-связывающий фрагмент согласно любому из [1']-[28'], где указанные антитело или его Myl9-связывающий фрагмент ингибируют взаимодействие между Myl12a или Myl12b и CD69.
[00055]
[30'] Фармацевтическая композиция, содержащая антитело или его Myl9-связывающий фрагмент согласно любому из [1']-[29'] и фармацевтически приемлемый носитель или добавку.
[00056]
[31'] Фармацевтическая композиция согласно [30'] для лечения аллергического воспаления дыхательных путей или воспалительного заболевания кишечника.
[00057]
[32'] Фармацевтическая композиция согласно [31'], где воспалительное заболевание кишечника представляет собой неспецифический язвенный колит или болезнь Крона.
[00058]
[33'] Фармацевтическая композиция согласно [30'] для лечения опухоли, где фармацевтическая композиция применяется в комбинации с ингибитором контрольных точек иммунного ответа.
[00059]
[34'] Фармацевтическая композиция согласно [33'], где ингибитор контрольных точек иммунного ответа представляет собой ингибитор PD-1.
[00060]
[35'] Фармацевтическая композиция согласно [34'], где ингибитор PD-1 представляет собой антитело к PD-1 или антитело к PD-L1.
[36'] Фармацевтическая композиция согласно [34'], где ингибитор PD-1 представляет собой антитело к PD-1.
[00061]
[37'] Фармацевтическая композиция согласно любому из [33']-[36'], где опухоль выбрана из группы, состоящей из рака ободочной и прямой кишки, злокачественной меланомы, немелкоклеточного рака легкого, почечноклеточной карциномы, злокачественной лимфомы, множественной миеломы, рака головы и шеи, уротелиального рака, рака молочной железы, гепатоцеллюлярной карциномы, рака желудка, рака пищевода, рака яичника, мелкоклеточного рака легкого, мезотелиомы и рака эндометрия.
[38'] Фармацевтическая композиция согласно [37'], где опухоль представляет собой рак ободочной и прямой кишки.
[00062]
Изобретение с любой комбинацией одного или нескольких аспектов настоящего изобретения, перечисленных выше, также охватывается объемом настоящего изобретения.
Полезные эффекты изобретения
[00063]
В соответствии с настоящим изобретением представлены антитело к Myl9 или его Myl9-связывающий фрагмент, которые связываются с Myl9 и могут ингибировать взаимодействие между Myl9 и CD69, а также фармацевтическая композиция, содержащая их.
Краткое описание графических материалов
[00064]
На фигуре 1-1 показано каждое из сравнения аминокислотных последовательностей Myl9 мыши и Myl9 человека (A) и сравнения аминокислотных последовательностей Myl3 мыши и Myl3 человека (B). *: консервативная аминокислота; -: гэп; подчеркивание: аминокислотная последовательность пептида, применяемого для иммунизации мышей с целью получения антитела A.
На фигуре 1-2 показано каждое из сравнения аминокислотных последовательностей Myl3 мыши и Myl9 мыши (С) и сравнения аминокислотных последовательностей Myl3 человека и Myl9 человека (D). *: консервативная аминокислота; -: гэп.
На фигуре 2 представлен результат, демонстрирующий способность моноклонального антитела к Myl9 мыши/человека (антитела A) к связыванию с Myl9 мыши и Myl9 человека, а также с Myl3 мыши и Myl3 человека.
На фигуре 3 показано зависимое от концентрации связывание CD69 мыши с сахарной цепью (A) или без нее (B) с Myl9 мыши, а также то, что указанное связывание в значительной степени ингибировалось моноклональным антителом к Myl9 мыши/человека (антителом A) (C).
На фигуре 4-1 показан подавляющий эффект введения моноклонального антитела к Myl9 мыши/человека (антитела A) в отношении инфильтрации клеток вокруг бронхиолы, индуцируемой во время воспаления дыхательных путей. На фигуре 4A показаны результаты окрашивания гематоксилином/эозином (окрашивания HE) и окрашивания PAS после введения моноклонального антитела к Myl9 мыши/человека (антитела A) мышам с индуцированным воспалением дыхательных путей. На фигуре 4B показано число инфильтрирующих клеток, наблюдаемых в жидкости бронхоальвеолярного лаважа, и типы инфильтрирующих клеток после введения моноклонального антитела к Myl9 мыши/человека (антитела A) мышам с индуцированным воспалением дыхательных путей. На фигуре 4С показано количество цитокина, вырабатываемого после введения моноклонального антитела к Myl9 мыши/человека (антитела A) мышам с индуцированным воспалением дыхательных путей.
На фигуре 4-2 показано сравнение индуцированного метахолином сопротивления дыхательных путей в день 17 после индуцирования воспаления дыхательных путей между группой введения антитела А (D), группой введения поликлонального антитела к Myl9/12 (E) и группами введения контрольного антитела (D, E).
На фигуре 5 показаны результаты потери веса (верхняя фигура) и индекс активности заболевания (DAI) (нижняя фигура) вследствие влияния моноклонального антитела к Myl9 мыши/человека (антитела A) в модели воспалительного заболевания кишечника с переносом CD4-положительных CD45RB-резко положительных (CD4+ CD45RBвысокий) T-лимфоцитов.
На фигуре 6-1 показаны результаты ELISA, дающие оценку способности химерных и гуманизированных антител, полученных из антитела A, к связыванию с Myl9 человека.
На фигуре 6-2 показаны результаты ELISA, дающие оценку способности химерных и гуманизированных антител, полученных из антитела A, к связыванию с Myl9 человека.
На фигуре 6-3 показаны результаты ELISA, дающие оценку способности химерных и гуманизированных антител, полученных из антитела A, к связыванию с Myl9 человека.
На фигуре 7 показано каждое из сравнения аминокислотных последовательностей Myl9 мыши, Myl12a мыши и Myl12b мыши (A) и сравнения аминокислотных последовательностей Myl9 человека, Myl12a человека и Myl12b человека (B). *: консервативная аминокислота; -: гэп; подчеркивание: аминокислотная последовательность пептида, применяемого для иммунизации мышей с целью получения антитела A.
На фигуре 8 показаны результаты ELISA, дающие оценку способности антитела A к связыванию с Myl9 мыши, Myl12a мыши и Myl12b мыши (A), а также с Myl9 человека, Myl12a человека и Myl12b человека (B).
На фигуре 9A показаны результаты ELISA, дающие оценку способности химерных и гуманизированных антител, полученных из антитела A, к связыванию с Myl12a и 12b человека.
На фигуре 9В показаны результаты ELISA, дающие оценку способности гуманизированного антитела, полученного из антитела A, к связыванию с Myl12a и 12b человека.
На фигуре 9С показаны результаты ELISA, дающие оценку способности гуманизированного антитела, полученного из антитела A, к связыванию с Myl12a и 12b человека.
На фигуре 10 показано сравнение аминокислотных последовательностей внеклеточных областей CD69 человека и мыши.
На фигуре 11 показано зависимое от концентрации связывание внеклеточной области CD69 человека с Myl9 человека, а также Myl12a и 12b, характеризующимися высокой степенью гомологии в отношении Myl9 человека.
На фигуре 12 показаны результаты зависимого от концентрации ингибирования антителом A связывания между внеклеточными областями CD69 человека и Myl9 человека (A), Myl12a человека (B) или Myl12b человека (C).
На фигуре 13-1 показаны результаты зависимого от концентрации ингибирования химерными и гуманизированными антителами, полученными из антитела A, связывания между Myl9 человека и внеклеточной областью CD69 человека.
Фигура 13-2 является продолжением фигуры 13-1.
Фигура 13-3 является продолжением фигуры 13-2.
Фигура 13-4 является продолжением фигуры 13-3.
Фигура 13-5 является продолжением фигуры 13-4.
На фигуре 14-1 показаны результаты зависимого от концентрации ингибирования химерными и гуманизированными антителами, полученными из антитела A, связывания между Myl12a человека или Myl12b человека и внеклеточной областью CD69 человека.
Фигура 14-2 является продолжением фигуры 14-1.
Фигура 14-3 является продолжением фигуры 14-2.
Фигура 14-4 является продолжением фигуры 14-3.
На фигуре 15 показаны результаты анализа экспрессии Myl9, Myl12a и Myl12b в ткани подкожной опухоли в линии мышиных раковых клеток ободочной и прямой кишки CT26.WT.
На фигуре 16 показано ингибирование роста опухоли в контрольной группе (A), группе введения антитела А в отдельности (B), группе введения антитела к PD-1 в отдельности (C) и группе введения комбинации антитела А и антитела к PD-1 (D) в моделях подкожной трансплантации линии мышиных раковых клеток ободочной и прямой кишки CT26.WT.
Описание вариантов осуществления
[00065]
Настоящее изобретение относится к антителу к Myl9, которое связывается с полипептидом регуляторной легкой цепи миозина (далее в данном документе называемым Myl) 9.
[00066]
Антитело к Myl9, применяемое в настоящем изобретении, представляет собой антитело, которое может распознавать и связывать Myl9, и, как описывается ниже, указанное антитело может представлять собой интактное антитело. В качестве альтернативы, антитело к Myl9, применяемое в настоящем изобретении, может представлять собой рекомбинантное антитело (такое как химерное антитело, гуманизированное антитело или человеческое антитело) или химически синтезированное антитело, а также его антигенсвязывающий фрагмент, при условии, что они обладают аффинностью связывания с Myl9. В настоящем документе Myl9 можно понимать как означающий Myl9, происходящий от человека или мыши. Аминокислотная последовательность Myl9, происходящего от человека или мыши, может быть получена из общедоступных баз данных, где регистрируется информация о последовательностях генов и аминокислотных последовательностях, таких как Genbank, предоставляемая Национальным центром биотехнологической информации США, или аминокислотная последовательность может быть определена на основании информации о последовательности гена Myl9, получаемой путем разработки праймера на основании информации о последовательности оснований в Myl9 близкородственного вида животного и клонирования из РНК, экстрагированной из животных желаемых видов. Например, информация об аминокислотной последовательности Myl9 человека и мыши зарегистрирована в базе данных под № доступа в Genbank NP_006088.2 (SEQ ID NO: 2) и № доступа в Genbank NP_742116.1 (SEQ ID NO: 1) соответственно.
[00067]
В одном аспекте настоящего изобретения Myl9 содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 1, или пептид, представленный аминокислотной последовательностью, имеющей замену, добавление или делецию одной или нескольких аминокислот в указанной аминокислотной последовательности. "Несколько", как используется в настоящем документе в отношении Myl9, не ограничено при условии сохранения функциональных свойств, эквивалентных таковым у пептида, представленного его исходной аминокислотной последовательностью, и составляет от 2 до 20, например, от 2 до 15, от 2 до 10, от 2 до 9, от 2 до 8, от 2 до 7, от 2 до 6 или от 2 до 5. В другом аспекте настоящего изобретения Myl9 содержит пептид, представленный аминокислотной последовательностью, характеризующейся по меньшей мере 90%, например, 91%, 92%, 93%, 94% или 95%, степенью гомологии в отношении аминокислотной последовательности, приведенной под SEQ ID NO: 1.
[00068]
Как используется в настоящем документе, "степень гомологии" аминокислотной последовательности означает степень гомологии, вычисленную с помощью алгоритма CLUSTALW с использованием попарного выравнивания при следующей установке параметров:
Размер участка максимального совпадения (слова): 1
Размер окна: 5
Штраф за введение гэпа: 3
Число непрерывно совпадающих к-плетов: 5
Метод оценки: ПРОЦЕНТНЫЙ
[00069]
В одном аспекте настоящего изобретения Myl9 содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 2, или пептид, представленный аминокислотной последовательностью, имеющей замену, добавление или делецию одной или нескольких аминокислот в указанной аминокислотной последовательности. "Несколько", как используется в настоящем документе в отношении Myl9, не ограничено при условии сохранения функциональных свойств, эквивалентных таковым у пептида, представленного его исходной аминокислотной последовательностью, и составляет от 2 до 20, например, от 2 до 15, от 2 до 10, от 2 до 9, от 2 до 8, от 2 до 7, от 2 до 6 или от 2 до 5. В другом аспекте настоящего изобретения Myl9 содержит пептид, представленный аминокислотной последовательностью, характеризующейся по меньшей мере 90%, например, 91%, 92%, 93%, 94% или 95%, степенью гомологии в отношении аминокислотной последовательности, приведенной под SEQ ID NO: 2.
[00070]
В одном аспекте настоящего изобретения Myl9 содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 3, или пептид, представленный аминокислотной последовательностью, имеющей замену, добавление или делецию одной или нескольких аминокислот в указанной аминокислотной последовательности. "Несколько", как используется в настоящем документе в отношении Myl9, не ограничено при условии сохранения функциональных свойств, эквивалентных таковым у пептида, представленного его исходной аминокислотной последовательностью, и составляет от 2 до 20, например, от 2 до 15, от 2 до 10, от 2 до 9, от 2 до 8, от 2 до 7, от 2 до 6 или от 2 до 5. В другом аспекте настоящего изобретения Myl9 содержит пептид, представленный аминокислотной последовательностью, характеризующейся по меньшей мере 90%, например, 91%, 92%, 93%, 94% или 95%, степенью гомологии в отношении аминокислотной последовательности, приведенной под SEQ ID NO: 3.
[00071]
В одном аспекте настоящего изобретения аминокислотные последовательности Myl9 мыши и Myl12a мыши, а также Myl9 мыши и Myl12b мыши соответственно характеризуются 94,2% и 93,6% степенью гомологии, а Myl12a мыши и Myl12b мыши характеризуются 97,7% степенью гомологии. Аминокислотные последовательности Myl9 человека и Myl12a человека, а также Myl9 человека и Myl12b человека соответственно характеризуются 91,8% и 93,0% степенью гомологии, а Myl12a человека и Myl12b человека характеризуются 96,5% степенью гомологии. По этой причине антитело, которое распознает Myl9, иногда распознает Myl12a. Более того, антитело, которое распознает Myl9, иногда распознает Myl12b. Таким образом, в одном варианте осуществления настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением также могут распознавать Myl12a и/или Myl12b.
[00072]
В одном аспекте настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением представляют собой антитело, которое ингибирует связывание между Myl9 и внеклеточной областью CD69. Например, антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут представлять собой антитело или его антигенсвязывающий фрагмент, которые ингибируют связывание между любой частью внеклеточной области CD69 и Myl9, который содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 4, или пептид, представленный аминокислотной последовательностью, имеющей замену, добавление или делецию одной или нескольких аминокислот в указанной аминокислотной последовательности. "Несколько", как используется в настоящем документе в отношении внеклеточной области CD69, составляет без ограничения от 2 до 15, например, от 2 до 14, от 2 до 13, от 2 до 12, от 2 до 11, от 2 до 10, от 2 до 9, от 2 до 8, от 2 до 7, от 2 до 6 или от 2 до 5. В другом аспекте настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут представлять собой антитело или его антигенсвязывающий фрагмент, которые ингибируют связывание между любой частью внеклеточной области CD69, которая содержит пептид, представленный аминокислотной последовательностью, характеризующейся по меньшей мере 90%, например, 91%, 92%, 93%, 94% или 95%, степенью гомологии в отношении аминокислотной последовательности, приведенной под SEQ ID NO: 4, и Myl9.
[00073]
В другом аспекте настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением представляют собой антитело, которое ингибирует связывание между Myl12a и/или Myl12b и внеклеточной областью CD69. Например, антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут представлять собой антитело или его антигенсвязывающий фрагмент, которые ингибируют связывание между любой частью внеклеточной области CD69, которая содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 97, или пептид, представленный аминокислотной последовательностью, имеющей замену, добавление или делецию одной или нескольких аминокислот в указанной аминокислотной последовательности, и Myl12a и/или Myl12b. В другом аспекте настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут представлять собой антитело или его антигенсвязывающий фрагмент, которые ингибируют связывание между любой частью внеклеточной области CD69, которая содержит пептид, представленный аминокислотной последовательностью, характеризующейся по меньшей мере 90%, например, 91%, 92%, 93%, 94% или 95%, степенью гомологии в отношении аминокислотной последовательности, приведенной под SEQ ID NO: 97, и Myl12a и/или Myl12b.
[00074]
В одном аспекте настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент могут связываться с Myl9 млекопитающего (например, грызунов, таких как мышь, крыса, или кролика, обезьяны, коровы, лошади, козы, человека и т. п.) с ингибированием взаимодействия между Myl9 и CD69 и предпочтительно могут связываться с Myl9 человека с ингибированием взаимодействия между Myl9 человека и CD69 человека. "Ингибирует взаимодействие между Myl9 и CD69" в настоящем документе означает исчезновение или снижение взаимодействия между Myl9 и CD69. Взаимодействие между Myl9 и CD69 можно оценить путем измерения изменения функции CD69, которое является результатом совместного действия Myl9 и CD69 (например, экспрессии или усиления функции CD69 или физиологической функции в результате изменения функции CD69 вследствие действия Myl9), или путем измерения миграции CD4+ T-клеток, которые имеют экспрессируемый CD69, в костный мозг.
[00075]
В другом аспекте настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент также могут связываться с Myl12a и/или Myl12b млекопитающего (например, грызунов, таких как мышь, крыса, или кролика, обезьяны, коровы, лошади, козы, человека и т. п.) с ингибированием взаимодействия между Myl12a и/или Myl12b и CD69 и предпочтительно также могут связываться с Myl12a человека и/или Myl12b человека с ингибированием взаимодействия между Myl12a человека и/или Myal12b человека и CD69 человека. "Ингибирует взаимодействие между Myl12a и/или Myl12b и CD69" в настоящем документе означает исчезновение или снижение взаимодействия между Myl12a и/или Myl12b и CD69. Взаимодействие между Myl12a и/или Myl12b и CD69 можно оценить путем измерения изменения функции CD69, которое является результатом совместного действия Myl12a и/или Myl12b и CD69 (например, экспрессии или усиления функции CD69 или физиологической функции в результате изменения функции CD69 вследствие действия Myl12a и/или Myl12b), или путем измерения миграции CD4+ T-клеток, которые имеют экспрессируемый CD69, в костный мозг.
[00076]
Способом, используемым для измерения свойства связывания антигена (такого как аффинность связывания и межвидовая реактивность) у антитела или его антигенсвязывающего фрагмента, может являться способ, хорошо известный специалистам в данной области. Например, аффинность связывания можно измерить с помощью, без ограничения, биосенсора Biacore®, биосенсора KinExA, сцинтилляционного анализа сближения, ELISA, иммунологического анализа ORIGEN (IGEN Inc.), проточной цитометрии, тушения флуоресценции, флуоресцентного перехода, дрожжевого дисплея или иммуноокрашивания и т.п. Нейтрализующую активность антитела или его антигенсвязывающего фрагмента в отношении связывания между Myl9 и CD69 можно измерить с помощью, без ограничения, биосенсора Biacore®, ELISA или проточной цитометрии и т.п.
[00077]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением предпочтительно могут представлять собой любое из моноклонального антитела, поликлонального антитела или их Myl9-связывающего фрагмента, которые связываются с Myl9 или другими пептидными молекулами, имеющими аминокислотную последовательность области связывания Myl9 с указанным антителом.
[00078]
Моноклональное антитело в настоящем документе может означать антитело, полученное из популяции практически однородных антител. Другими словами, отдельные антитела, содержащиеся в указанной популяции, являются идентичными, за исключением возможного присутствия небольшого количества существующих в природе мутантных форм. Моноклональное антитело направлено против одного сайта антигена. Кроме того, в отличие от типичного поликлонального антитела, которое нацеливается на разные антигены или разные эпитопы, каждое моноклональное антитело нацеливается на один эпитоп антигена. Определение "моноклональное" указывает на свойство антитела, полученного из популяции практически однородных антител, и оно не должно истолковываться как ограниченное необходимостью получения антител конкретным способом.
[00079]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением в настоящем документе могут принадлежать к любому классу, такому как IgG, IgA или IgM (или их подклассу), и не ограничены конкретным классом. Иммуноглобулины разделяют на различные классы в зависимости от аминокислотной последовательности константной области тяжелой цепи (иногда называемой Н-цепью) антитела. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, некоторые из которых могут быть дополнительно разделены на подклассы (изотипы), такие как IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие различным классам иммуноглобулинов, соответственно называются α, δ, ε, γ и μ. Более того, типы легкой цепи (иногда называемой L-цепью) антитела включают в себя λ- и κ-цепи.
[00080]
В одном аспекте антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут представлять собой антитело IgG, например, антитело IgG1 или антитело IgG2 и т. п. Более того, антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут находиться в форме мономера, димера или мультимера.
[00081]
Myl9-связывающий фрагмент в настоящем документе представляет собой функциональный и структурный фрагмент антитела к Myl9 и конкретно не ограничен, при условии, что он обладает способностью к связыванию с Myl9. Примеры такого Myl9-связывающего фрагмента могут включать в себя без ограничения Fab, Fab', F(ab')2, Fv, одноцепочечный (ScFv), их варианты, слитый белок или слитый пептид, содержащие часть антитела, другие модифицированные структуры иммуноглобулиновой молекулы, содержащие сайт распознавания Myl9, и т. п.
[00082]
Myl9-связывающий фрагмент антитела к Myl9 может быть получен путем протеолитического расщепления полного антитела с помощью, например, протеазы, такой как папаин или пепсин, или может непосредственно вырабатываться рекомбинантной клеткой-хозяином (например, эукариотической, такой как дрожжевая клетка, растительная клетка, клетка насекомого или клетка млекопитающего, или прокариотической, такой как клетка E. coli). Например, F(ab')2-фрагмент можно образовать путем отбора Fab'-SH-фрагментов непосредственно из E. coli и осуществления с ними химического связывания. F(ab')2 также можно образовать путем применения лейциновой "застежки" GCN4, которая способствует сборке молекул F(ab')2. Более того, при получении scFv с помощью технологии химического синтеза можно применять автоматический синтезатор. При получении scFv с помощью технологии генетической рекомбинации подходящую плазмиду, содержащую полинуклеотид, кодирующий scFv, можно вводить в подходящую клетку-хозяина (например, эукариотическую, такую как дрожжевая клетка, растительная клетка, клетка насекомого или клетка млекопитающего, или прокариотическую, такую как клетка E. coli). Полинуклеотид, кодирующий scFv, представляющий интерес, можно получить с помощью хорошо известной операции, такой как лигирование полинуклеотидов. Полученный в результате scFv можно выделять с помощью стандартной технологии очистки белка, хорошо известной из уровня техники.
[00083]
Вариабельная область антитела в настоящем документе означает вариабельную область легкой цепи антитела, вариабельную область тяжелой цепи антитела или как то, так и другое. Более того, константная область антитела в настоящем документе означает константную область легкой цепи антитела, константную область тяжелой цепи антитела или как то, так и другое. Каждая вариабельная область тяжелой и легкой цепей состоит из четырех каркасных областей (FR), соединенных тремя CDR, также известными как гипервариабельные области. CDR в каждой цепи удерживаются вблизи друг от друга с помощью FR и вместе с CDR в другой цепи участвуют в образовании антигенсвязывающего сайта в антителе. Технология определения CDR может включать без ограничения, например, (1) подход, основанный на межвидовой вариабельности последовательностей (такой как в Kabat et al, Sequences of Proteins of Immunological Interest, 5th ed., 1991, National Institutes of Health, Bethesda MD); и (2) подход, основанный на исследовании кристаллической структуры комплексов антиген-антитело (Al-Lazikani et al., 1997 J. Molec. Biol. 273:927-948). Эти или другие подходы можно использовать в комбинации.
[00084]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением представляют собой рекомбинантное антитело (такое как химерное антитело, гуманизированное антитело или человеческое антитело) или химически синтезированное антитело, антитело млекопитающего, отличного от человека (например, грызунов, таких как мышь, крыса, или кролика, обезьяны, коровы, лошади, козы и т.п.), или их Myl9-связывающий фрагмент. Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением представляют собой гуманизированное или химерное антитело, предпочтительно гуманизированное антитело. Химерное антитело представляет собой, например, антитело, в котором вариабельная область антитела, отличного от человеческого (как, например, мышиного или крысиного), введена в константную область человеческого антитела, и относится, например, к антителу, в котором вариабельная область получена из антитела, отличного от человеческого, а константная область получена из человеческого антитела. Гуманизированное антитело представляет собой, например, антитело, в котором гипервариабельная область антитела, отличного от человеческого, введена в человеческое антитело, и относится, например, к антителу, в котором CDR получена из антитела, отличного от человеческого, а остальные области антитела получены из человеческого антитела. Следует отметить, что в соответствии с настоящим изобретением граница между химерным антителом и гуманизированным антителом не обязательно должна быть четкой, и антитело может находиться в состоянии, которое может называться химерным антителом или гуманизированным антителом. Аспектом предпочтительного гуманизированного антитела в настоящем документе является антитело, в котором CDR получена из антитела грызуна, а остальные области антитела получены из человеческого антитела, особенно предпочтительно антитело, в котором CDR получена из мышиного антитела, а остальные области антитела получены из человеческого антитела. Гуманизацию также можно осуществлять путем введения последовательности CDR, полученной из антитела, например, грызуна, в соответствующий сайт человеческого антитела посредством способа пересадки CDR (см. Jones et al., Nature 321:522-525(1986); Riechmann et al., Nature 332:323-327(1988); и Verhoeyen et al., Science 239:1534-1536(1988); Kontermann and Dubel, Antibody Engineering, Springer Lab Manual (2001), и Tsurushita et al., Methods 36:69-83 (2005)). В некоторых случаях гуманизированное антитело также может представлять собой гуманизированное антитело, в котором несколько аминокислотных остатков в FR замещены аминокислотными остатками, полученными из аналогичного сайта в антителе, отличном от человеческого.
[00085]
Для снижения антигенности может быть важно, чтобы при получении гуманизированного антитела было выбрано применение вариабельных областей человека как для легких, так и для тяжелых цепей. Аминокислотную последовательность вариабельной области антитела грызунов, таких как мышь, крыса или кролик, подвергают скринингу по всей библиотеке известных последовательностей человеческих FR. Затем аминокислотную последовательность человеческого антитела, наиболее близкую к последовательности антитела грызуна, принимают в качестве человеческой FR гуманизированного антитела. Например, в качестве литературного источника можно использовать O'Brien and Jones, Antibody Engineering (Springer Lab Manual), 567-590. Согласно другому способу используют конкретную каркасную область, полученную из последовательности, общей для всех человеческих антител в конкретной подгруппе легкой или тяжелой цепи. Одну и ту же каркасную область можно использовать для нескольких различных гуманизированных антител. Например, в качестве литературного источника можно использовать Carter et al., Proc. Natl. Acad. Sci. USA 89:4285-4289 (1992), и Presta et al., J. Immunol. 151:2623-2632 (1993).
[00086]
Кроме того, желательно, чтобы гуманизированное антитело в целом сохраняло высокую аффинность связывания с антигенами и другие предпочтительные биологические признаки. Для достижения этой цели согласно одному способу гуманизированное антитело получают с помощью стадии анализа исходной последовательности и различных концептуальных гуманизированных продуктов, используя трехмерные модели исходной последовательности и гуманизированной последовательности. Как правило, трехмерная модель иммуноглобулина доступна для применения и известна специалистам в данной области. Доступна для применения компьютерная программа, которая иллюстрирует и представляет потенциальную трехмерную конформацию выбранной последовательности иммуноглобулина-кандидата. Посредством исследования этих иллюстрируемых трехмерных конформаций возможен анализ аминокислотных остатков, которые влияют на способность иммуноглобулина-кандидата связываться со своим антигеном. С помощью данного способа можно разработать остатки FR так, что будет достигнуто желаемое свойство антитела, такое как сохранение аффинности связывания с одним или несколькими целевыми антигенами (такими как Myl9 или его фрагмент).
[00087]
Антитело, в котором представленное выше на примере химерное или гуманизированное антитело соответствующим образом изменено (например, путем модификации антитела или частичных замены, добавления или делеции аминокислотной последовательности антитела) с сохранением при этом функции указанного антитела (или с целью дополнения или улучшения функции указанного антитела), также охватывается антителом в соответствии с настоящим изобретением. В частности, антитело, в котором лизин (Lys), расположенный на карбоксильном конце (C-конце) тяжелой цепи, подвергнут делеции искусственным способом, таким как генетическая модификация, для уменьшения неоднородности антител, вырабатываемых антителообразующими клетками, также охватывается объемом настоящего изобретения. Примеры другой частичной замены могут включать в себя без ограничения антитело, в котором аминокислотный остаток в положении 234 в тяжелой цепи подвергнут мутации по типу замены валина (V) на аланин (A), антитело, в котором аминокислотный остаток в положении 237 в тяжелой цепи подвергнут мутации по типу замены глицина (G) на аланин (A), а также их комбинация и т.п. Следует отметить, что указанные мутации соответственно описаны в настоящем документе как V234A и G237A.
[00088]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут быть модифицированы при необходимости. Модификация антитела к Myl9 или его Myl9-связывающего фрагмента в соответствии с настоящим изобретением может представлять собой модификацию, в результате которой изменяется (a) трехмерная структура аминокислотной последовательности в модифицированной области, такая как листовая или спиральная конформация; (b) заряд или состояние гидрофобности молекулы в целевом сайте или (c) эффект модификации в отношении поддержания объема боковой цепи, или, в качестве альтернативы, может быть реализована модификация, при которой эти изменения не являются четко выраженными.
[00089]
Модификацию антитела к Myl9 или его Myl9-связывающего фрагмента в соответствии с настоящим изобретением можно осуществлять путем, например, замены, делеции, добавления и т. п. аминокислотных остатков, задающих конфигурацию.
[00090]
Аминокислота в настоящем документе используется в самом широком своем смысле и включает в себя не только природные аминокислоты, такие как серин (Ser), аспарагин (Asn), валин (Val), лейцин (Leu), изолейцин (Ile), аланин (Ala), тирозин (Tyr), глицин (Gly), лизин (Lys), аргинин (Arg), гистидин (His), аспарагиновая кислота (Asp), глутаминовая кислота (Glu), глутамин (Gln), треонин (Thr), цистеин (Cys), метионин (Met), фенилаланин (Phe), триптофан (Trp) и пролин (Pro), но также и неприродные аминокислоты, такие как варианты и производные аминокислот. Специалистам в данной области будет понятно с учетом данного широкого определения, что примеры аминокислот в настоящем документе могут включать в себя L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как варианты и производные аминокислот; аминокислоты, которые не являются материалами, задающими конфигурацию белков in vivo, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, обладающие свойствами аминокислот, хорошо известные специалистам в данной области. Примеры неприродной аминокислоты могут включать в себя α-метиламинокислоты (такие как α-метилаланин), D-аминокислоты (такие как D-аспарагиновая кислота и D-глутаминовая кислота), гистидиноподобные аминокислоты (такие как 2-аминогистидин, β-гидроксигистидин, гомогистидин, α-фторметилгистидин и α-метилгистидин), аминокислоты с избытком метиленовых групп в боковой цепи (гомоаминокислоты) и аминокислоты, в которых карбоксилатная функциональная группа в боковой цепи аминокислоты замещена сульфонатной группой (такие как цистеиновая кислота).
[00091]
Остатки встречающихся в природе аминокислот могут быть разделены, например, на следующие группы на основании общих свойств боковой цепи:
(1) гидрофобные: Met, Ala, Val, Leu и Ile;
(2) нейтральные гидрофильные: Cys, Ser и Thr;
(3) кислые: Asp и Glu;
(4) основные: Asn, Gln, His, Lys и Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly и Pro; и
(6) ароматические: Trp, Tyr и Phe.
[00092]
Неконсервативную замену в аминокислотной последовательности, задающей конфигурацию антитела или его антигенсвязывающего фрагмента, можно выполнить путем изменения аминокислоты, которая принадлежит к одной из этих групп, на аминокислоту, которая принадлежит к другой группе. Более консервативную замену можно выполнить путем изменения аминокислоты, которая принадлежит к одной из этих групп, на другую аминокислоту, которая принадлежит к той же группе. Аналогично можно соответствующим образом выполнить делецию или замену в аминокислотной последовательности.
[00093]
Модификация аминокислоты, задающей конфигурацию антитела или его антигенсвязывающего фрагмента, может представлять собой, например, посттрансляционную модификацию, такую как гликозилирование с помощью сахара, ацетилирование или фосфорилирование. Антитело может быть гликозилированным в консервативном положении в своей константной области. Гликозилирование антитела, как правило, является либо N-связанным, либо O-связанным. N-связанное означает связывание сахарного фрагмента с боковой цепью аспарагинового остатка. Трипептидные последовательности аспарагин-X-серин, аспарагин-X-треонин и аспарагин-X-цистеин (где X представляет собой любую аминокислоту, отличную от пролина) являются последовательностями распознавания для ферментативного добавления сахарного фрагмента к боковой цепи аспарагина. Потенциальный сайт гликозилирования присутствует, если любая из этих трипептидных последовательностей присутствует в антителе или его антигенсвязывающем фрагменте. O-связанное гликозилирование может представлять собой связывание N-ацетилгалактозамина, галактозы либо ксилозы с гидроксиаминокислотой (такой как серин или треонин), а в некоторых случаях может представлять собой связывание с 5-гидроксипролином или 5-гидроксилизином. Условие гликозилирования (например, если гликозилирование выполняют с помощью биологического способа, тип клетки-хозяина или среды для культивирования клеток, pH и т. п.) может быть соответствующим образом выбрано специалистом в данной области в соответствии с целью.
[00094]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением можно дополнительно модифицировать на основании общих технических принципов, хорошо известных специалистам в данной области, с помощью других способов модификации в отдельности или в комбинации.
[00095]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением можно получать с помощью способа, хорошо известного специалистам в данной области. Например, антитело можно получать с помощью гибридомы, которая вырабатывает антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, или антитело можно получать путем интеграции гена, кодирующего антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, в вектор экспрессии и введения указанного вектора экспрессии в клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) и т.п. Ген, кодирующий антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, предпочтительно имеет ДНК, кодирующую сигнальную последовательность, и более предпочтительно имеет ДНК, кодирующую сигнальную последовательность, на 5'-конце ДНК, кодирующей вариабельную область тяжелой цепи, и ДНК, кодирующей вариабельную область легкой цепи. Сигнальная последовательность представляет собой аминокислотные остатки, присутствующие на N-конце белка, которые необходимы секреторному белку или интегральному мембранному белку для прохождения через липидный бислой после его синтеза на рибосоме. Сигнальная последовательность в настоящем документе конкретно не ограничена, при условии, что она представляет собой последовательность, обладающую этой функцией. Сигнальная последовательность, которая может содержаться в антителе к Myl9 или его Myl9-связывающем фрагменте в соответствии с настоящим изобретением, могут включать в себя сигнальные последовательности, происходящие от человека, мыши, крысы, кролика, осла, козы, лошади, птицы, собаки, кошки, дрожжей и т.п. Сигнальная последовательность в одном конкретном аспекте может включать в себя пептид, содержащий аминокислотную последовательность, представленную под SEQ ID NO: 12, в качестве сигнальной последовательности, соответствующей тяжелой цепи, и пептид, содержащий аминокислотную последовательность, представленную под SEQ ID NO: 14, в качестве сигнальной последовательности, соответствующей легкой цепи. Более того, замена, добавление или делеция одной или нескольких (например, 2, 3, 4 или 5) аминокислот могут присутствовать в аминокислотной последовательности, представленной под SEQ ID NO: 12, или в аминокислотной последовательности, представленной под SEQ ID NO: 14, при условии, что они являются функционально эквивалентными.
[00096]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут быть выделяемыми или очищаемыми согласно способам, хорошо известным специалистам в данной области. В настоящем документе "выделенный" или "очищенный" означает искусственные выделение или очистку из естественного состояния. Если молекула или композиция встречается в природе, то это означает, что она является "выделенной" или "очищенной", если ее изменили или удалили из среды ее естественного существования, или обладает обеими этими характеристиками. Примеры способа выделения или очистки могут включать в себя без ограничения электрофорез, молекулярно-биологические, иммунологические или хроматографические способы и т.п., в частности, ионообменную хроматографию, гидрофобную хроматографию или обращенно-фазовую HPLC-хроматографию, или изоэлектрическое фокусирование и т.п.
[00097]
"Ингибитор контрольных точек иммунного ответа" в настоящем документе означает ингибитор молекулы-контрольной точки иммунного ответа, которая принимает участие в механизме контрольных точек иммунного ответа, системе подавления T-клеточной активации, и включает в себя ингибитор PD-1 и ингибитор CTLA-4. Термин "молекула-контрольная точка иммунного ответа" охватывает как рецепторы, так и лиганды, которые функционируют в качестве контрольных точек иммунного ответа.
[00098]
Термин "применяемый в комбинации с ингибитором контрольных точек иммунного ответа" в настоящем документе означает, что фармацевтическую композицию, содержащую антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением и фармацевтически приемлемый носитель или добавку, вводят пациенту с опухолью вместе с ингибитором контрольных точек иммунного ответа примерно в одно и то же время в качестве части терапевтического режима. Фармацевтическую композицию и ингибитор контрольных точек иммунного ответа можно вводить пациенту одновременно, раздельно, непрерывно или через определенные интервалы времени с эффективным количеством каждого из них при введении в комбинации. Терапевтический режим может предусматривать другое противораковое средство. Фармацевтическую композицию и ингибитор контрольных точек иммунного ответа можно вводить пациенту в отдельных циклах введения. Если фармацевтическая композиция и ингибитор контрольных точек иммунного ответа вводятся одновременно, то можно вводить один комбинированный препарат, содержащий их.
[00099]
"Ингибитор PD-1" в настоящем документе означает вещество, которое непосредственно или опосредованно действует на PD-1 с ингибированием подавляющего действия PD-1 в отношении T-клеток. Ингибитор PD-1 включает в себя низкомолекулярное соединение, пептид и антитело к PD-1, которые связываются с PD-1 с ингибированием его подавляющего действия в отношении T-клеток, а также низкомолекулярное соединение, пептид и антитело к PD-L1, которые связываются с PD-L1 и ингибируют его активность связывания с PD-1 с ингибированием подавляющего действия PD-1 в отношении T-клеток. Антитело к PD-1 включает в себя без ограничения пембролизумаб, ниволумаб и MEDI0680 (AMP-514). Антитело к PD-L1 включает в себя без ограничения атезолизумаб, дурвалумаб и авелумаб.
[000100]
"Ингибитор CTLA-4" в настоящем документе означает вещество, которое действует на CTLA-4 с ингибированием подавляющего действия CTLA-4 в отношении T-клеток. Ингибитор CTLA-4 включает в себя низкомолекулярное соединение, пептид и антитело к CTLA-4, которые связываются с CTLA-4 с ингибированием его подавляющего действия в отношении T-клеток. Антитело к CTLA-4 включает в себя без ограничения ипилимумаб и тремелимумаб.
[000101]
"Злокачественная лимфома" в настоящем документе означает группу злокачественных опухолей системы крови, которые развиваются из лимфатических тканей. Злокачественная лимфома включает в себя лимфому Ходжкина и неходжкинскую лимфому, а последняя включает в себя диффузную крупноклеточную В-клеточную лимфому и т.п.
[000102]
"Рак головы и шеи" в настоящем документе означает общий термин для злокачественной опухоли, которая развивается в области от лица до шеи и включает в себя в качестве части плоскоклеточный рак головы и шеи.
[000103]
"Уротелиальный рак" в настоящем документе означает злокачественную эпителиальную опухоль, которая развивается из уротелиальных клеток и включает в себя рак почечной лоханки, рак мочевыводящих путей и рак мочевого пузыря в качестве более узких терминов.
[000104]
"Рак молочной железы" в настоящем документе означает карциному, которая развивается в тканях молочной железы. Частью рака молочной железы является трижды негативный рак молочной железы, при котором не экспрессируются эстрогеновые рецепторы, прогестероновые рецепторы и рецептор 2 эпидермального фактора роста человека (HER-2).
[000105]
В другом предпочтительном варианте осуществления настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент имеют следующую CDR:
(a) CDR1 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 28;
(b) CDR2 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 30;
(c) CDR3 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 32;
(d) CDR1 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 33;
(e) CDR2 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 34; и
(f) CDR3 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 35.
[000106]
В другом предпочтительном варианте осуществления настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент содержат тяжелую и легкую цепи, при этом вариабельная область указанной тяжелой цепи содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, а вариабельная область указанной легкой цепи содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65, 66, 67 или 68.
[000107]
Аминокислотная последовательность вариабельной области указанной тяжелой или легкой цепи может содержать замену, добавление или делецию одной или нескольких аминокислот в указанной последовательности. "Несколько", как используется в настоящем документе, не ограничено, при условии, что аффинность связывания с Myl9 сохраняется, а взаимодействие между Myl9 и CD69 ингибируется, и составляет от 2 до 15, более предпочтительно от 2 до 10, например, 9, 8, 7, 6, 5, 4, 3 или 2. В качестве альтернативы, аминокислотная последовательность вариабельной области указанной тяжелой или легкой цепи содержит пептид, представленный аминокислотной последовательностью, характеризующейся по меньшей мере 90%, например, 91%, 92%, 93%, 94% или 95%, степенью гомологии в отношении указанной последовательности.
[000108]
В другом предпочтительном варианте осуществления настоящего изобретения антитело к Myl9 или его Myl9-связывающий фрагмент представляют собой антитело, которое содержит вариабельные области тяжелой цепи и легкой цепи, состоящие из следующих комбинаций:
(1) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(2) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(3) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(4) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(5) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(6) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(7) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(8) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(9) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(10) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(11) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(12) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(13) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(14) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(15) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(16) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(17) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(18) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(19) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65;
(20) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 67;
(21) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66; и
(22) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
[000109]
В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением.
[000110]
Фармацевтическая композиция, содержащая антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, в форме водного или сухого препарата может дополнительно содержать фармацевтически приемлемый носитель, наполнитель и/или стабилизатор. Примеры приемлемого носителя, наполнителя или стабилизатора включают в себя солевой раствор; буфер, такой как фосфорная кислота, лимонная кислота или другие органические кислоты; антиоксидант, в том числе аскорбиновую кислоту; низкомолекулярный полипептид; белок (такой как сывороточный альбумин, желатин или иммуноглобулин); гидрофильный полимер, такой как поливинилпирролидон; аминокислоту; моносахариды, дисахариды и другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатирующее средство, такое как EDTA; сахарные спирты, такие как маннит или сорбит; противоион, который образует соль, такой как натрий; или неионогенное поверхностно-активное вещество, такое как TWEEN™, PLURONICS™ или PEG.
[000111]
Фармацевтическая композиция, содержащая антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, может быть инкапсулирована, например, в микрокапсулу, в коллоидную систему доставки лекарственных средств (такую как липосома, альбуминовая микросфера, микроэмульсия, наночастица или нанокапсула) или в макроэмульсию. При необходимости введения антитела с замедленным высвобождением в составе препарата, обладающего свойством высвобождения, подходящим для любого заболевания, при котором требуется введение антитела, может быть предусмотрено микроинкапсулирование антитела. Примеры матрицы с замедленным высвобождением включают в себя сложный полиэфир, гидрогель (такой как поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полимолочные кислоты, сополимер L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый сополимер этилена и винилацетата, разлагаемый сополимер молочной кислоты и гликолевой кислоты, такой как LUPRON DEPOT™ (инъекционная микросфера, состоящая из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляную кислоту.
[000112]
Как описано выше, антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением могут ингибировать взаимодействие между Myl9 и CD69. Следовательно, фармацевтическая композиция, содержащая антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, может быть применима для лечения заболевания, связанного со взаимодействием между Myl9 и CD69, например, аллергического воспаления дыхательных путей, такого как астма, хронический аллергический ринит или некоторые виды синусита, воспалительного заболевания дыхательных путей, такого как синусит, не включенный в аллергическое воспаление дыхательных путей, а также воспалительного заболевания кишечника, такого как неспецифический язвенный колит, болезнь Крона, болезнь Бехчета и эозинофильная дисфункция желудочно-кишечного тракта. Другими словами, в другом аспекте настоящее изобретение охватывает способ лечения воспалительного заболевания дыхательных путей или воспалительного заболевания кишечника, включающий стадию введения субъекту терапевтически эффективного количества антитела к Myl9 или его Myl9-связывающего фрагмента в соответствии с настоящим изобретением. Кроме того, в другом аспекте настоящее изобретение охватывает применение антитела к Myl9 или его Myl9-связывающего фрагмента в соответствии с настоящим изобретением для изготовления терапевтического лекарственного средства против воспалительного заболевания дыхательных путей или воспалительного заболевания кишечника. В другом аспекте настоящее изобретение охватывает антитело к Myl9 или его Myl9-связывающий фрагмент для применения в способе лечения воспалительного заболевания дыхательных путей или воспалительного заболевания кишечника. Более того, в другом аспекте настоящее изобретение охватывает антитело к Myl9 или его Myl9-связывающий фрагмент для изготовления фармацевтического средства для лечения воспалительного заболевания дыхательных путей или воспалительного заболевания кишечника.
[000113]
Фармацевтическая композиция, содержащая антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, может быть применима для лечения опухоли, такой как рак ободочной и прямой кишки, злокачественная меланома, немелкоклеточный рак легкого, почечноклеточная карцинома, злокачественная лимфома, множественная миелома, рак головы и шеи, уротелиальный рак, рак молочной железы, гепатоцеллюлярная карцинома, рак желудка, рак пищевода, рак яичника, мелкоклеточный рак легкого, мезотелиома и рак эндометрия, в комбинации с ингибитором контрольных точек иммунного ответа. Другими словами, в другом аспекте настоящее изобретение охватывает способ лечения опухоли, включающий стадию введения субъекту терапевтически эффективного количества антитела к Myl9 или его Myl9-связывающего фрагмента в соответствии с настоящим изобретением, где антитело к Myl9 или его Myl9-связывающий фрагмент вводят субъекту в комбинации с ингибитором контрольных точек иммунного ответа. Кроме того, в другом аспекте настоящее изобретение охватывает применение антитела к Myl9 или его Myl9-связывающего фрагмента в соответствии с настоящим изобретением для изготовления терапевтического лекарственного средства против опухоли, подлежащего применению в комбинации с ингибитором контрольных точек иммунного ответа. В другом аспекте настоящее изобретение охватывает антитело к Myl9 или его Myl9-связывающий фрагмент для применения в способе лечения опухоли, подлежащие введению в комбинации с ингибитором контрольных точек иммунного ответа. Более того, в другом аспекте настоящее изобретение охватывает антитело к Myl9 или его Myl9-связывающий фрагмент для изготовления фармацевтического средства для лечения опухоли, подлежащие применению в комбинации с ингибитором контрольных точек иммунного ответа.
[000114]
Если фармацевтическую композицию, содержащую антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, применяют в комбинации с ингибитором контрольных точек иммунного ответа для лечения опухоли, то антитело к Myl9 или его Myl9-связывающий фрагмент предпочтительно представляют собой антитело или его связывающий фрагмент, которые также ингибируют взаимодействие между Myl12a и/или Myl12b и CD69.
[000115]
Антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением можно использовать в терапевтическом способе в отдельности или в комбинации с другими средствами или композициями (в способе лечения опухоли антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением вводят в комбинации с ингибитором контрольных точек иммунного ответа). Например, антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением и другое средство можно вводить в одно и то же время или в разное время. Такая комбинированная терапия предусматривает комбинированное введение (два или более средств содержатся в одном и том же или в отдельных препаратах) и раздельное введение (например, в одно и то же время или последовательно). При раздельном введении двух или более средств введение антитела к Myl9 или его Myl9-связывающего фрагмента в соответствии с настоящим изобретением может происходить до или после осуществления способа сопроводительной терапии.
[000116]
Субъект, которому вводят фармацевтическую композицию, содержащую антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, не ограничен, и настоящее изобретение используется в отношении человека или млекопитающего, отличного от человека (грызунов, таких как мышь, крыса, или кролика, обезьяны, коровы, лошади, козы и т.п.).
[000117]
Способ введения фармацевтической композиции, содержащей антитело к Myl9 или его Myl9-связывающий фрагмент в соответствии с настоящим изобретением, субъекту (как, например, путь введения, дозировка, суточная частота введения и график введения) не ограничен и может быть соответствующим образом определен специалистом в данной области (таким как врач) в зависимости от состояния здоровья субъекта, степени заболевания, типа средства, применяемого в комбинации, и т.п.
[000118]
При условии, что это не является технически противоречивым, любые один из несколько из всех без исключения аспектов, описываемых в настоящем документе, могут быть соответствующим образом объединены для осуществления настоящего изобретения. Кроме того, при условии, что это не является технически противоречивым, предпочтительно, чтобы все без исключения предпочтительные или преимущественные аспекты, описываемые в настоящем документе, были соответствующим образом объединены для осуществления настоящего изобретения.
[000119]
Все раскрытия литературных источников, цитируемых в настоящем документе, следует считать полностью включенными в настоящий документ посредством ссылки, и специалисты в данной области могут включать раскрытое содержание, относящееся к этим литературным источникам, в качестве части настоящего описания согласно контексту настоящего документа без отступления от объема настоящего изобретения.
[000120]
Литературные источники, цитируемые в настоящем документе, представлены исключительно с целью раскрытия состояния соответствующей технологии, предшествующего дате подачи настоящей заявки, и это не должно истолковываться как признание авторами настоящего изобретения того, что настоящее изобретение не имеет права считаться предшествующим указанным раскрытиям как более раннее изобретение или по любой другой причине. Все описания этих литературных источников основываются на информации, доступной авторам настоящей заявки, и никоим образом не составляют признание того, что эти описания верны.
[000121]
Термины, используемые в настоящем документе, применяются для описания конкретных вариантов осуществления и не предусмотрены для ограничения настоящего изобретения.
[000122]
Если контекст явно не указывает на то, что это нужно понимать иначе, термин "содержать", используемый в настоящем документе, предусматривает наличие описываемых объектов (таких как компоненты, стадии, элементы или числа) и не исключает наличие других объектов (таких как компоненты, стадии, элементы и числа). Термин "состоять из" охватывает аспекты, описываемые терминами "состоять из" и/или "состоять по сути из".
[000123]
Термин "нейтрализующая активность", используемый в настоящем документе, означает активность ингибирования связывания между Myl9 и CD69 и/или активность снижения передачи сигнала, ответа в виде экспрессии молекул или изменения функциональных свойств клетки, которая индуцируется внутри организма человека вследствие взаимодействия между Myl9 и CD69.
[000124]
Если не указано иное, все термины, используемые в настоящем документе (в том числе технические и научные термины), имеют те же значения, которые широко известны специалистам в области технологии, к которой относится настоящее изобретение. Используемые в настоящем документе термины, если явно не указано иное, следует истолковывать как имеющие значения, соответствующие значениям в настоящем документе и в соответствующих областях техники, и не следует истолковывать как имеющие упрощенные или чрезмерно формальные значения.
[000125]
Такие термины, как первый и второй, используются для представления различных элементов, и следует отметить, что эти элементы не ограничиваются самими этими терминами. Эти термины используются исключительно с целью проведения различий между одним элементом и другим, и, например, можно описывать первый элемент как второй элемент и аналогичным образом описывать второй элемент как первый элемент без отступления от объема настоящего изобретения.
[000126]
Числовые значения, используемые в настоящем документе для указания содержания компонента или диапазона числовых значений и т.п., если явно не указано, следует понимать как модифицированные термином "приблизительно". Например, если явно не указано, "4°C" понимают как означающее "приблизительно 4°C", и специалисты в данной области могут естественным путем и с достаточными основаниями понять его пределы в соответствии с общими техническими принципами и контекстом настоящего описания.
[000127]
Если четко не указано, что контекст подразумевает иное, при использовании в описании и формуле изобретения данного документа следует понимать, что каждый аспект, представленный в форме единственного числа, также может иметь форму множественного числа, если это не является технически противоречивым, и наоборот.
[000128]
Далее настоящее изобретение будет подробно описано со ссылкой на примеры. Однако настоящее изобретение может быть осуществлено в различных аспектах и не должно истолковываться как ограничиваемое примерами, описываемыми в настоящем документе. Специалисты в соответствующей области техники могут реализовать настоящее изобретение с различными модификациями, добавлениями, делециями, заменами и т.п. без изменения объема настоящего изобретения.
Примеры
[000129]
Пример 1. Получение моноклонального антитела к Myl9 мыши/человека
Получение мышиного моноклонального антитела к Myl9 мыши/человека
Для получения моноклонального антитела к Myl9 мыши (№ доступа в Genbank NP_742116.1, SEQ ID NO: 1) и Myl9 человека (№ доступа в Genbank NP_006088.2, SEQ ID NO: 2) пептид, имеющий цистеин (Cys), добавленный на C-конец N-концевой последовательности, общей для Myl9 мыши и Myl9 человека (положения 1-27) (далее в данном документе называемый пептидом Myl9 мыши/человека) (SEQ ID NO: 3), и белок, имеющий слитый с ним гемоцианин фиссуреллы (KLH) (далее в данном документе называемый "конъюгатом пептид Myl9 мыши/человека-KLH"), получали с помощью следующих стадий. Сравнение последовательностей Myl9 мыши и Myl9 человека показано на фигуре 1-1A.
[000130]
Сначала синтезировали пептид Myl9 мыши/человека (SEQ ID NO: 3) путем отправки в TORAY Research Center, Inc., а конъюгат пептид Myl9 мыши/человека-KLH получали с помощью набора для микроцентрифугирования Imject, содержащего активированный малеимидом mcKLH (Thermo Fisher Scientific).
[000131]
Десять микрограммов конъюгата пептид Myl9 мыши/человека-KLH смешивали с таким же количеством адъюванта GERBU (GERBU Biotechnik GmbH) и подкожно инъецировали мышам C57BL/6J в подушечки лап. Затем аналогичным образом вводили конъюгат пептид Myl9 мыши/человека-KLH в дни 3, 7 и 10. Адъювант GERBU (GERBU Biotechnik GmbH) применяли в дни 3 и 10. Мышей умерщвляли в день 13, и собирали периферические лимфатические узлы для получения клеток лимфатических узлов. В присутствии GenomeONE-CF (Ishihara Sangyo Kaisha, Ltd.) полученные клетки лимфатических узлов и клетки миеломы P3U1 (предоставленные профессором Jun Shimizu, Киотский университет) сливали в пропорции 5:1. Указанные слитые клетки культивировали в 96-луночном пластиковом планшете. Спустя 7 дней инкубирования (5% CO2, 37°C) собирали надосадочную жидкость культуры.
[000132]
Полученной надосадочной жидкостью культуры заполняли лунки, характеризующиеся реакционной активностью в отношении пептида Myl9 мыши/человека, а также ингибирующей активностью в отношении связывания между белком внеклеточной области CD69 мыши и Myl9 мыши.
[000133]
Реакционную активность в отношении пептида Myl9 мыши/человека оценивали с использованием белка, имеющего бычий сывороточный альбумин (BSA), слитый с пептидом Myl9 мыши/человека (SEQ ID NO: 3) (далее в данном документе называемого конъюгатом пептид Myl9 мыши/человека-BSA), с помощью ELISA.
[000134]
Пептид Myl9 мыши/человека (SEQ ID NO: 3) синтезировали путем отправки в TORAY Research Center, Inc., а конъюгат пептид Myl9 мыши/человека-BSA получали с помощью набора для микроцентрифугирования Imject, содержащего активированный малеимидом BSA (Thermo Fisher Scientific).
[000135]
Плазмида, кодирующая белок внеклеточной области CD69 мыши (положения 62-199) (SEQ ID NO: 4), имеющий FLAG-метку, добавленную на N-конце (далее в данном документе называемый 3 x FLAG-EC CD69 мыши), была предоставлена Тибским университетом, и ее вводили путем трансфекции в клетки Expi293F (Invitrogen/LifeTechnologies) с помощью набора для трансфекции ExpiFectamine 293 (Thermo Fisher Scientific/Gibco). Спустя 4 дня инкубирования (8% CO2, 37°C) собирали надосадочную жидкость культуры. Из собранной надосадочной жидкости культуры очищали 3 x FLAG-EC CD69 мыши с помощью аффинного геля на основе антитела M2 к FLAG (SIGMA). После очистки выполняли обработку с отщеплением сахарной цепи с помощью PNGase F (New England BioLabs).
[000136]
Для получения конъюгата глутатион-S-трансфераза (GST)-His-Myl9 мыши (далее в данном документе называемого конъюгатом GST-His-Myl9 мыши) плазмиду, предоставленную Тибским университетом, экспрессировали в BL21-Gold (DE3) pLys E. coli (Agilent Technologies) и очищали с помощью глутатион-сефарозы 4 Fast Flow (GE Healthcare).
[000137]
Осуществляли ELISA с использованием пептида Myl9 мыши/человека-BSA согласно следующим стадиям. Пептидом Myl9 мыши/человека-BSA покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS надосадочную жидкость культуры указанных слитых клеток добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания добавляли меченное пероксидазой хрена антитело к мышиному IgG (Jackson ImmunoResearch Laboratories), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (PerkinElmer).
[000138]
Оценивание ингибирующей активности в отношении связывания между белком внеклеточной области CD69 мыши и Myl9 мыши осуществляли согласно следующим стадиям. Конъюгатом GST-His-Myl9 мыши покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS надосадочную жидкость культуры указанных слитых клеток добавляли в лунки. Ее инкубировали при комнатной температуре в течение одного часа. В лунки добавляли конъюгат 3 x FLAG-EC CD69 мыши, подвергнутый обработке с отщеплением сахарной цепи. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания добавляли меченное пероксидазой хрена антитело к FLAG (SIGMA), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (PerkinElmer).
[000139]
Гибридомы клонировали из лунок, заполненных на вышеупомянутых стадиях, с помощью способа предельных разведений с получением в конечном итоге клона гибридомы, который экспрессирует мышиное антитело к Myl9 мыши/человека, обладающее реакционной активностью в отношении пептида Myl9 мыши/человека, а также ингибирующей активностью в отношении связывания между белком внеклеточной области CD69 мыши и Myl9 мыши.
[000140]
Полученный клон гибридомы культивировали, а антитело к Myl9 мыши/человека ("антитело A" (иногда описываемое как "mAb A")) очищали от надосадочной жидкости культуры с помощью белка A (GE Healthcare). С помощью набора для изотипирования моноклональных антител (Serotec) определяли изотип антитела A как IgG2c, κ.
[000141]
Анализ способности антитела A к связыванию с белком Myl9 мыши/человека
Способность антитела A к связыванию с Myl9 мыши и человека оценивали с помощью ELISA. Согласно приведенным ниже стадиям получали белки, имеющие гистидиновую метку, связанную с C-концом каждого из Myl3 мыши (№ доступа в Genbank NP_034989.1, SEQ ID NO: 5), Myl9 мыши, Myl3 человека (№ доступа в Genbank NP_000249.1, SEQ ID NO: 6) и Myl9 человека (далее в данном документе соответственно называемых Myl3 мыши-His, Myl9 мыши-His, Myl3 человека-His и Myl9 человека-His). Показано сравнение аминокислотных последовательностей Myl3 мыши и Myl3 человека (фигура 1-1B), Myl3 мыши и Myl9 мыши (фигура 1-2C), а также Myl3 человека и Myl9 человека (фигура 1-2D).
[000142]
Гены, кодирующие белки Myl3 мыши и Myl9 мыши, были предоставлены Тибским университетом. Гены, кодирующие белки Myl3 человека и Myl9 человека, амплифицировали из кДНК сердца человека посредством ПЦР. Эти гены встраивали в сайт BgIII/BamHI вектора pET42b (Merck), имеющего встроенный в него ген, кодирующий расщепляющую последовательность протеазы PreScission (GE Healthcare). Полученный вектор вводили путем трансформации в штамм BL21-Gold (DE3) pLys E. coli (Agilent Technologies) для обеспечения экспрессии Myl3 мыши-His, Myl9 мыши-His, Myl3 человека-His и Myl9 человека-His с присоединенной GST-меткой. Экспрессируемые белки очищали с помощью глутатион-сефарозы 4 Fast Flow (GE Healthcare), GST-метку отщепляли с помощью протеазы PreScission, а Myl3 мыши-His, Myl9 мыши-His, Myl3 человека-His и Myl9 человека-His очищали с помощью смолы TALON Superflow для аффинной хроматографии на иммобилизованных ионах металла (CLONTECH).
[000143]
Способность к связыванию с Myl9 мыши/человека оценивали согласно приведенным ниже стадиям с помощью ELISA. Соединениями Myl3 мыши-His, Myl9 мыши-His, Myl3 человека-His и Myl9 человека-His покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS получали десять четырехкратных серийных разведений антитела A из концентрации 10 мкг/мл и добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания добавляли меченное пероксидазой хрена антитело к мышиному IgG (Jackson ImmunoResearch Laboratories), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (PerkinElmer).
[000144]
Антитело A демонстрировало зависимое от концентрации связывание с Myl9 мыши и человека, но не связывалось с Myl3 мыши и человека, характеризующимися низкой степенью гомологии в отношении Myl9 мыши и человека (фигура 2).
[000145]
Оценивание ингибирующей активности антитела A в отношении связывания между белком внеклеточной области CD69 мыши и Myl9 мыши
Оценивание ингибирующей активности антитела A в отношении связывания между белком внеклеточной области CD69 мыши и Myl9 мыши выполняли с помощью конкурентного ELISA. Сначала получали белок внеклеточной области CD69 мыши и белок Myl9 мыши.
[000146]
В частности, каждый из Myl3 и Myl9 мыши клонировали из кДНК костного мозга и сердечной мышечной ткани и встраивали в сайт множественного клонирования вектора pET42b (Merck). Полученный вектор экспрессии вводили путем трансформации в компетентные клетки Rosetta (Merck), и отбирали клоны, имеющие вектор экспрессии. Каждую из культуральных сред с предварительно культивированными клонами добавляли к 500 мл раствора LB, содержащего канамицин, и эту смесь культивировали во встряхивателе при 37°C. Добавляли IPTG (Nacalai) в конечной концентрации 1 мM при OD600=0,4, и осуществляли индуцированную экспрессию белков Myl3 и Myl9 мыши в течение 3 часов при 37°C. Через 3 часа клетки собирали путем центрифугирования, лизировали с помощью лизирующего буфера [Tris-HCl (pH 8,0) и 150 мM NaCl], а затем гомогенизировали с помощью ультразвукового диспергатора при охлаждении на льду. Нерастворимую фракцию удаляли путем центрифугирования, смесь пропускали через фильтр на 0,45 мкм (Corning), а затем очищали на колонке, упакованной гранулами Ni-NTA (QIAGEN). Гранулы промывали промывочным буфером [Tris-HCl (pH 8,0), 150 мM NaCl и 10 мM имидазола], а затем связанный белок элюировали элюирующим буфером [Tris-HCl (pH 8,0), 150 мM NaCl и 500 мM имидазола]. Полученные белки GST-His-Myl3 мыши и GST-His-Myl9 мыши подвергали замене раствора на PBS с использованием PD10 (GE Healthcare). Использовали раствор реагента Бредфорда (BIO-RAD) для измерения концентрации очищенного белка.
[000147]
Затем выполняли ELISA для анализа наличия или отсутствия связи между Myl9 мыши и CD69 мыши (фигуры 3A и 3B). В частности, белок GST-His-Myl3 мыши и белок GST-His-Myl9 мыши добавляли при концентрации 5 мкг/мл, и их инкубировали в течение ночи при 4°C для иммобилизации их на планшете для ELISA. На следующий день использовали Block Ace (Sumitomo Dainippon Pharma Co., Ltd.) для обеспечения блокирования при комнатной температуре в течение одного часа, а затем эту смесь промывали три раза промывочным буфером (50 мM HEPES (pH 6,5), 150 мM NaCl и 0,02% Tween 20). В каждую лунку добавляли разные концентрации белка 3 x FLAG-EC CD69 мыши, и осуществляли их реакцию при комнатной температуре в течение полутора часов. На фигуре 3B использован белок 3 x FLAG-EC CD69 мыши, в котором N-связанная сахарная цепь была отщеплена с помощью PNGase F (NEB). Обработку с отщеплением N-связанной сахарной цепи выполняли путем использования 1000 ед. PNGase F на 4 мкг белка 3 x FLAG-EC CD69 мыши. После трехкратного промывания промывочным буфером добавляли меченное HRP антитело к FLAG (M2) (Sigma), осуществляли его реакцию при комнатной температуре в течение одного часа, а затем промывали пять раз промывочным буфером. Раствор TMB (BIO-RAD) применяли в качестве окрашивающего субстрата, и реакцию гасили с помощью 1 н. H2SO4. Использовали SpectraMAX Paradigm (Molecular Devices) для измерения значения при 450 нм.
[000148]
Как показано на фигурах 3A и 3B, выявляли значительное зависимое от концентрации связывание CD69 мыши с Myl9 мыши.
[000149]
Конкурентный ELISA выполняли для оценивания ингибирующей активности антитела A в отношении связывания между белком внеклеточной области CD69 мыши и Myl9 мыши. В частности, белок GST (Abcam) и белок GST-His-Myl9 мыши добавляли в покрытый глутатионом планшет (Thermo) для их иммобилизации. Каждую лунку блокировали с помощью Block Ace при комнатной температуре в течение одного часа, а затем трижды промывали промывочным буфером (PBS и 0,02% Tween 20). Антитело A и поликлональное антитело к Myl9/12 добавляли в концентрациях, описанных на фигуре 3C, и осуществляли их реакцию при комнатной температуре в течение одного часа. Добавляли белок 3 x FLAG-EC CD69 мыши, обработанный PNGase F, осуществляли его реакцию в течение ночи при 4°C и трижды промывали промывочным буфером. Добавляли меченное HRP антитело к FLAG (M2) (Sigma), осуществляли его реакцию при комнатной температуре в течение одного часа, а затем промывали пять раз промывочным буфером. Раствор TMB (BIO-RAD) применяли в качестве окрашивающего субстрата, и реакцию гасили с помощью 1 н. H2SO4. Использовали SpectraMAX Paradigm (Molecular Devices) для измерения значения при 450 нм.
[000150]
Как показано на фигуре 3C, связывание между CD69 мыши и Myl9 мыши было зависимым от концентрации и в значительной степени ингибировалось в присутствии антитела A. Такая ингибирующая активность, как правило, была выше, чем у поликлонального антитела к Myl9/12.
[000151]
Анализ последовательности антитела A
Последовательности ДНК, кодирующие сигнальные последовательности тяжелой и легкой цепей, а также вариабельную область антитела A, амплифицировали с помощью способа 5'-RACE (быстрой амплификации 5'-концов кДНК). Общую РНК получали из указанной гибридомы с помощью набора RNeasy Mini (QIAGEN) и обрабатывали ДНКазой (QIAGEN, набор ДНКаз, не содержащих РНКаз). Двухнитевую кДНК получали из указанной общей РНК с помощью набора для синтеза кДНК (TAKARA). 5'-адаптор, полученный путем отжига ДНК-олигонуклеотида ad29S (ACATCACTCCGT) (SEQ ID NO: 7) и ДНК-олигонуклеотида ad29AS (ACGGAGTGATGTCCGTCGACGTATCTCTGCGTTGATACTTCAGCGTAGCT) (SEQ ID NO: 8), добавляли к указанной кДНК. Полученную кДНК амплифицировали с помощью прямого 5'-праймера (праймера 5'-PCR4, AGCTACGCTGAAGTATCAACGCAGAG) (SEQ ID NO: 9) и обратного 3'-праймера (GCCAGTGGATAGACTGATGG (SEQ ID NO: 10) использовали для амплификации тяжелой цепи IgG мыши, а GATGGATACAGTTGGTGCAGC (SEQ ID NO: 11) использовали для амплификации легкой цепи Igκ мыши). Амплифицированную кДНК встраивали в вектор pCR2.1 (Invitrogen/LifeTechnologies). Последовательность гена антитела A анализировали с помощью ABI3130XL (SEQ ID NO: 12-19).
[000152]
Полноразмерные последовательности тяжелой и легкой цепей антитела A получали с помощью следующих стадий. Общую РНК получали из указанной гибридомы с помощью набора RNeasy Mini (QIAGEN) и обрабатывали ДНКазой (QIAGEN, набор ДНКаз, не содержащих РНКаз). кДНК получали из указанной общей РНК с помощью набора для синтеза кДНК (TAKARA). При использовании полученной кДНК в качестве матрицы последовательности генов, кодирующие тяжелую и легкую цепи антитела A, амплифицировали посредством ПЦР с прямым 5'-праймером (GCGAAGCTTGCCGCCACCATGGAATGGAGCTGGGTCTTTC (SEQ ID NO: 20) применяли для амплификации тяжелой цепи, а GCGAAGCTTGCCGCCACCATGAAGTTGCCTGTTAGGCTG (SEQ ID NO: 21) применяли для амплификации легкой цепи) и обратным 3'-праймером (GCGGAATTCATCATTTACCCAGAGACCGGGAGATGG (SEQ ID NO: 22) применяли для амплификации тяжелой цепи, а GCGGAATTCACTAACACTCATTCCTGTTGAAGCTCTTGAC (SEQ ID NO: 23) применяли для амплификации легкой цепи), и каждую из них клонировали в векторы pEE6.4 и pEE12.4 (Lonza). Последовательности генов анализировали с помощью ABI3130XL (SEQ ID NO: 12-19 и 24-27).
[000153]
Для определения CDR антитела A аминокислотную последовательность антитела A нумеровали согласно системе нумерации по Кабат с использованием программного обеспечения Abysis (лицензированного UCL), и на основании этой нумерации определяли CDR согласно определению Кабат или способу определения AbM для идентификации CDR (SEQ ID NO: 28-43).
[000154]
Пример 2. Оценивание лекарственного эффекта антитела A в мышиной модели индуцированного OVA воспаления дыхательных путей
Эффект введения in vivo очищенного мышиного антитела к Myl9 мыши/человека (антитела A) в отношении аллергического воспаления дыхательных путей проверяли в модели индуцированного OVA воспаления дыхательных путей.
[000155]
Сначала исследовали подавляющий эффект введения антитела A в отношении инфильтрации клеток вокруг бронхиолы, индуцируемой во время воспаления дыхательных путей. В частности, мышам BALB/c дикого типа внутрибрюшинно вводили 100 мкг/мышь овальбумина (OVA) (SIGMA) с 4 мг/мышь квасцов (Thermo) для иммунизации. День первого введения устанавливали как день 0, а второе введение выполняли в день 7. Воспаление дыхательных путей индуцировали, подвергая мышей небулайзерной ингаляции 1% раствора OVA (10 мг/мл солевого раствора) в течение 30 минут с помощью ультразвукового волнового небулайзера (Omron) в дни 14 и 16 (ингаляция OVA). Группу без ингаляции OVA готовили как контрольную группу (без ингаляции). Антитело A или контрольное мышиное антитело IgG2a, κ (BioLegend) вводили внутрибрюшинно при 100 мкг каждого в дни 13 и 15. В день 18 легкое мыши иссекали, фиксировали 10% раствором формалина, а затем заливали в парафин с получением тканевых срезов, и выполняли окрашивание гематоксилином/эозином (окрашивание H & E) и окрашивание PAS (реактивом Шиффа с йодной кислотой) (фигура 4-1A).
[000156]
Как показано на фигуре 4-1A, наблюдали сильную инфильтрацию клеток вокруг бронхиолы в группе введения контрольного антитела, которая получала ингаляцию OVA, но инфильтрация клеток в значительной степени подавлялась в группе введения антитела А, которая получала ингаляцию OVA (фигура 4-1A, наверху). Более того, в группе введения контрольного антитела, которая получала ингаляцию OVA, наблюдали выработку слизи, которая характеризовалась положительным окрашиванием PAS, внутри бронхиолы, но выработка слизи также в значительной степени подавлялась в группе введения антитела А, которая получала ингаляцию OVA (фигуры 4-1A, внизу).
[000157]
Затем в день 17 после индуцирования воспаления дыхательных путей выполняли бронхоальвеолярный лаваж и сравнивали число инфильтрирующих клеток и типы инфильтрирующих клеток, наблюдаемых в жидкости бронхоальвеолярного лаважа (BALF), между группой введения антитела А и группой введения контрольного антитела. Бронхоальвеолярный лаваж выполняли путем внутрибрюшинного введения мышам пентобарбитала Na (70-90 мг/кг) для анестезии, а затем рассечения дыхательных путей для вставки канюли (Becton Dickinson) и инъекции солевого раствора (Otsuka Pharmaceutical) в легкое для сбора клеток. Для собранных клеток подсчитывали число клеток (всех клеток). Далее эти клетки суспендировали в эмбриональной телячьей сыворотке (FCS) и наклеивали на предметное стекло с помощью Cytospin 3 (Thermo Fisher Scientific). Для окрашивания использовали реагент Май-Грюнвальда-Гимзы (MERCK), и клетки идентифицировали как эозинофилы, нейтрофилы, лимфоциты и макрофаги согласно морфологическим критериям.
[000158]
Как показано на фигуре 4-1B, общее число инфильтрирующих клеток было в значительной степени понижено, и число различных клеток среди эозинофилов, нейтрофилов, лимфоцитов и макрофагов также было в значительной степени понижено в группе введения антитела А по сравнению с группой введения контрольного антитела.
[000159]
Затем сравнивали различные цитокины (IL-4, IL-5, IL-6, IL-13 и RANTES), содержащиеся в собранной жидкости бронхоальвеолярного лаважа, между группой введения антитела А и группой введения контрольного антитела. Для измерения применяли микрочипы на основе цитометрических гранул (BD Biosciences).
[000160]
Как показано на фигуре 4-1C, выработка любого из цитокинов (IL-4, IL-5, IL-6, IL-13 и RANTES) уменьшалась в группе введения антитела А по сравнению с группой введения контрольного антитела.
[000161]
Затем индуцированное метахолином сопротивление дыхательных путей в день 17 после индуцирования воспаления дыхательных путей сравнивали между группой введения антитела А (фигура 4-2D), группой введения поликлонального антитела к Myl9/12 (фигура 4-2E) и группами введения контрольного антитела.
[000162]
Как показано на фигуре 4-2D, сопротивление дыхательных путей повышалось в зависимости от концентрации метахолина в группе введения контрольного антитела, тогда как повышение в группе введения антитела А в значительной степени подавлялось. Более того, как показано на фигуре 4-2E, в группе введения поликлонального антитела к Myl9/12 хотя и наблюдалось подавление зависимого от концентрации метахолина повышения сопротивления дыхательных путей, но не наблюдалось существенное различие в его эффекте. Это позволило предположить, что антитело A оказывает более мощный эффект против воспаления дыхательных путей, чем поликлональное антитело к Myl9/12.
[000163]
Пример 3. Оценивание лекарственного эффекта антитела A в мышиной модели колита
В Powrie et al., Int. Immunol., 5, 1461-1471, 1993 упоминалось получение модели воспалительного заболевания кишечника с переносом CD4-положительных CD45RB-резко положительных (CD4+CD45RBвысокий) T-лимфоцитов. Селезенку самок мышей Balb/c (Charles River Laboratories Japan, Inc.) возрастом 8-10 недель иссекали и измельчали с помощью шлифованного стекла для отделения клеток селезенки. К отделенным клеткам селезенки добавляли 5 мл дистиллированной воды, содержащей 155 мM хлорида аммония, 10 мM гидрокарбоната калия и 80 мкM EDTA-4Na, на селезенку и оставляли при комнатной температуре на 5 минут для лизиса эритроцитов. К раствору клеток селезенки добавляли двойной объем PBS, и эту смесь центрифугировали при 1500 об./мин. в течение 5 минут, а осадок собирали. CD4+ T-лимфоциты очищали от отделенных клеток селезенки с помощью набора для выделения CD4+ T-клеток (от Miltenyi). Для отделения CD4-положительных CD45RB-резко положительных T-лимфоцитов очищенные CD4 T-лимфоциты подвергали двойному окрашиванию меченным фикоэритрином (PE) антителом к CD4 (от eBioscience) и меченным изотиоцианатом флуоресцеина (FITC) антителом к CD45RB (от eBioscience). После двойного окрашивания CD4-положительные CD45RB-резко положительные клетки сортировали с помощью FACSAria (от Becton, Dickinson and Company) для сбора клеток, представляющих интерес. После промывания собранных клеток с помощью PBS их суспендировали в PBS до концентрации клеток 2×106 клеток/мл. В полость брюшины каждой из самок мышей SCID возрастом 8 недель (CLEA Japan, Inc.) переносили по 250 мкл, т. e. 5×105 клеток/мышь, CD4-положительных CD45RB-резко положительных клеток, полученных согласно описанному выше. Восьми животным на группу мышей SCID с перенесенными CD4-положительными CD45RB-резко положительными клетками вводили 500 мкг контрольного антитела (мышиного IgG) и 500 мкг антитела A (антитела в растворе PBS) дважды в неделю, начиная с дня 11 после переноса клеток. Следует отметить, что введение осуществляли в хвостовую вену. Кроме того, в качестве группы отрицательного контроля мышиные CD4+ T-лимфоциты, которые очищали с помощью набора для выделения CD4+ T-клеток (от Miltenyi), но не разделяли по интенсивности экспрессии CD45RB (CD4-положительные клетки в целом), переносили при 5×105 клеток/мышь. Аутопсию выполняли через 27 дней после переноса клеток для определения балльных показателей и оценивания потери веса и характера каловых масс в толстой кишке. Определение балльных показателей характера каловых масс, используемое при индуцированном декстрансульфатом натрия колите (Cooper et al., Lab. Invest., 69, 238-249, 1993), применяли для определения балльных показателей каловых масс.
[000164]
Наблюдали значительное уменьшение индекса активности заболевания (DAI) в группе введения антитела А по сравнению с группой введения контрольного антитела (фигура 5).
[000165]
Пример 4. Получение химерных и гуманизированных антител из антитела A
Получение химерного антитела и гуманизированного антитела
Сначала конструировали вектор экспрессии для химерного антитела. В качестве тяжелой цепи последовательность гена, кодирующую сигнальную последовательность тяжелой цепи антитела A (SEQ ID NO: 16), и последовательность гена, кодирующую вариабельную область (SEQ ID NO: 17), встраивали в вектор экспрессии (pcDNA3.4), содержащий последовательность гена (SEQ ID NO: 45), кодирующую константную область человеческого IgG2, имеющую мутации V234A и G237A и делецию С-концевого лизинового остатка (SEQ ID NO: 44), а в качестве легкой цепи последовательность гена, кодирующую сигнальную последовательность легкой цепи антитела A (SEQ ID NO: 18), и последовательность гена, кодирующую вариабельную область (SEQ ID NO: 19), встраивали в вектор экспрессии (pcDNA3.4), содержащий последовательность гена (SEQ ID NO: 47), кодирующую константную область человеческого Igκ (SEQ ID NO: 46), конструируя тем самым вектор экспрессии для химерного антитела. Для получения химерного антитела с использованием системы экспрессии Expi293 (Gibco/ThermoFisher) указанный вектор экспрессии вводили путем трансфекции в клетки Expi293F (Gibco/ThermoFisher). Надосадочную жидкость собирали и очищали с помощью белка A (GE Healthcare). В настоящем документе "V234A" представляет собой мутацию, при которой валин в положении 234 заменен аланином, и "G237A" представляет собой мутацию, при которой глицин в положении 237 заменен аланином.
[000166]
Затем разрабатывали вариабельную область гуманизированного антитела. На основании высокой степени гомологии в отношении каркасной области (FR) антитела A FR человеческого антитела IGKV2-28*01 (SEQ ID NO: 48) или IGKV2-24*01 (SEQ ID NO: 49) и JK4 (SEQ ID NO: 50) для легкой цепи и IGHV1-69*02 (SEQ ID NO: 51), IGHV1-46*01 (SEQ ID NO: 52) или IGHV7-4-1*02 (SEQ ID NO: 53) и JH4 (SEQ ID NO: 54) для тяжелой цепи отбирали в качестве FR гуманизированного антитела. Затем использовали прогностическую модель 3D-структуры мышиного антитела A для предсказания аминокислоты в FR, которая взаимодействует с аминокислотой в CDR и пересаживается вместе с CDR (SEQ ID NO: 28-35). Каждую из константной области человеческого IgG2, имеющей мутации V234A и G237A и имеющей делецию С-концевого лизинового остатка (SEQ ID NO: 44), и константной области человеческого Igκ (SEQ ID NO: 46) использовали в качестве константных областей тяжелой и легкой цепей. HK1-4 (SEQ ID NO: 55), HK1-5 (SEQ ID NO: 56), HK1-6 (SEQ ID NO: 57), HK1-A (SEQ ID NO: 58), HK2-5 (SEQ ID NO: 59), HK2-6 (SEQ ID NO: 60), HK2-9 (SEQ ID NO: 61) и HK3-2 (SEQ ID NO: 62) разрабатывали в качестве вариабельных областей тяжелой цепи гуманизированного антитела, на которое пересаживали CDR, определенные с помощью способа определения по Кабат (SEQ ID NO: 28, 30 и 32), HA1-4 (SEQ ID NO: 63) и HA1-6 (SEQ ID NO: 64) разрабатывали в качестве вариабельных областей тяжелой цепи гуманизированного антитела, на которое пересаживали CDR, определенные с помощью способа определения AbM (SEQ ID NO: 29, 31, 32), HK1-4, HK1-5, HK1-6, HK1-A, HA1-4 и HA1-6 разрабатывали в качестве вариабельных областей тяжелой цепи гуманизированного антитела, в котором используются IGHV1-69*02 и JH4, HK2-5, HK2-6 и HK2-9 разрабатывали в качестве вариабельных областей тяжелой цепи гуманизированного антитела, в котором используются IGHV1-46*01 и JH4, HK3-2 разрабатывали в качестве вариабельных областей тяжелой цепи гуманизированного антитела, в котором используются IGHV7-4-1*02 и JH4, L1-4 (SEQ ID NO: 65), L1-5 (SEQ ID NO: 66) и L1-A (SEQ ID NO: 67) разрабатывали в качестве вариабельных областей легкой цепи гуманизированного антитела, в котором используются IGKV2-28*01 и JK4, а L4-2 (SEQ ID NO: 68) разрабатывали в качестве вариабельной области легкой цепи гуманизированного антитела, в котором используются IGKV2-24*01 и JK4.
[000167]
Последовательности генов, кодирующие аминокислотные последовательности HK1-4, HK1-5 и HK1-6, получали путем разработки аминокислотной последовательности, в которой CDR тяжелой цепи антитела A (SEQ ID NO: 28, 30 и 32) были пересажены на IGHV1-69*02 (SEQ ID NO: 51) и JH4 (SEQ ID NO: 54), а сигнальная последовательность (SEQ ID NO: 69) была добавлена на N-конец, преобразования разработанной аминокислотной последовательности в последовательность гена и синтеза последовательности гена в GenScript USA Inc., а также введения мутаций посредством ПЦР (HK1-4: SEQ ID NO: 70, HK1-5: SEQ ID NO: 71, HK1-6: SEQ ID NO: 72, сигнальная последовательность: SEQ ID NO: 73). Последовательность гена, кодирующую аминокислотную последовательность HK1-A, получали путем преобразования из аминокислотной последовательности, имеющей сигнальную последовательность (SEQ ID NO: 69), добавленную на N-конец HK1-A, и синтезировали в GenScript USA Inc. (HK1-A: SEQ ID NO: 74, сигнальная последовательность: SEQ ID NO: 75). Последовательности генов, кодирующие аминокислотные последовательности HK2-5, HK2-6 и HK2-9, получали путем разработки аминокислотной последовательности, в которой CDR тяжелой цепи антитела A (SEQ ID NO: 28, 30 и 32) были пересажены на IGHV1-46*01 (SEQ ID NO: 52) и JH4 (SEQ ID NO: 54), а сигнальная последовательность (SEQ ID NO: 69) была добавлена на N-конец, преобразования разработанной аминокислотной последовательности в последовательность гена и синтеза последовательности гена в GenScript USA Inc., а также введения мутаций посредством ПЦР (HK2-5: SEQ ID NO: 76, HK2-6: SEQ ID NO: 77, HK2-9: SEQ ID NO: 78, сигнальная последовательность: SEQ ID NO: 79). Последовательность гена, кодирующую аминокислотную последовательность HK3-2, синтезировали путем преобразования аминокислотной последовательности, имеющей сигнальную последовательность (SEQ ID NO: 69), добавленную на N-конец HK3-2, в последовательность гена в GenScript USA Inc. (HK3-2: SEQ ID NO: 80, сигнальная последовательность: SEQ ID NO: 81). Последовательности генов, кодирующие аминокислотные последовательности HA1-4 и HA1-6, получали путем разработки аминокислотной последовательности, в которой CDR тяжелой цепи антитела A (SEQ ID NO: 29, 31 и 32) были пересажены на IGHV1-69*02 (SEQ ID NO: 51) и JH4 (SEQ ID NO: 54), а сигнальная последовательность (SEQ ID NO: 69) была добавлена на N-конец, преобразования в последовательность гена и синтеза последовательности гена в GenScript USA Inc., а также введения мутаций посредством ПЦР (HA1-4: SEQ ID NO: 82, HA1-6: SEQ ID NO: 83, сигнальная последовательность: SEQ ID NO: 84). Последовательности генов, кодирующие аминокислотные последовательности L1-4 и L1-5, получали путем разработки аминокислотной последовательности, в которой CDR легкой цепи антитела A (SEQ ID NO: 33-35) были пересажены на IGKV2-28*01 (SEQ ID NO: 48) и JK4 (SEQ ID NO: 50), а сигнальная последовательность (SEQ ID NO: 85) была добавлена на N-конец, преобразования в последовательность гена и синтеза последовательности гена в GenScript USA Inc., а также введения мутаций посредством ПЦР (L1-4: SEQ ID NO: 86, L1-5: SEQ ID NO: 87, сигнальная последовательность SEQ ID NO: 88). Последовательности генов, кодирующие аминокислотные последовательности L1-A и L4-2, синтезировали путем преобразования аминокислотных последовательностей, имеющих сигнальную последовательность (SEQ ID NO: 85), добавленную на N-конец L1-A и L4-2, в последовательности генов в GenScript USA Inc. (L1-A: SEQ ID NO: 89, сигнальная последовательность L1-A: SEQ ID NO: 90, L4-2: SEQ ID NO: 91, сигнальная последовательность L4-2: SEQ ID NO: 92). Гены, кодирующие эти вариабельные области тяжелой цепи гуманизированного антитела и сигнальные последовательности, встраивали в вектор экспрессии (pcDNA3.4), содержащий последовательность гена (SEQ ID NO: 45), кодирующую константную область человеческого IgG2, имеющую мутации V234A и G237A и имеющую делецию С-концевого лизинового остатка (SEQ ID NO: 44). Гены, кодирующие эти вариабельные области легкой цепи гуманизированного антитела и сигнальные последовательности, встраивали в вектор экспрессии (pcDNA3.4), содержащий последовательность гена (SEQ ID NO: 47), кодирующую константную область человеческого Igκ (SEQ ID NO: 46). В настоящем документе "V234A" представляет собой мутацию, при которой валин в положении 234 заменен аланином, и "G237A" представляет собой мутацию, при которой глицин в положении 237 заменен аланином. Для получения антитела с использованием системы экспрессии Expi293 (Gibco/ThermoFisher) указанный вектор экспрессии вводили путем трансфекции в клетки Expi293F (Gibco/ThermoFisher) в комбинациях, показанных в таблице 1. Надосадочную жидкость собирали и очищали с помощью белка A (GE Healthcare).
[000168]
[Таблица 1]
[000169]
Анализ способности химерных и гуманизированных антител, полученных из антитела A, к связыванию с белком Myl9 человека
Способность химерных и гуманизированных антител, полученных из антитела A, к связыванию с Myl9 человека оценивали с помощью ELISA. Белки Myl3 человека-His и Myl9 человека-His получали с помощью способов, описанных в примере 1.
[000170]
Способность к связыванию с Myl9 человека оценивали согласно приведенным ниже стадиям с помощью ELISA. Соединениями Myl3 человека-His и Myl9 человека-His покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS получали семь шестикратных серийных разведений химерных и гуманизированных антител из концентрации 10 мкг/мл и добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания добавляли меченное пероксидазой хрена антитело к человеческому IgG (Jackson ImmunoResearch Laboratories), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (PerkinElmer).
[000171]
Все гуманизированные антитела из таблицы 1 связывались зависимым от концентрации образом с Myl9 человека в той же степени, что и химерное антитело, и не связывались с Myl3 человека (фигуры 6-1-6-3).
[000172]
Пример 5. Способность антитела A и химерных и гуманизированных антител на его основе к связыванию с белками Myl12a и 12b мыши/человека
Получение белков Myl12a и Myl12b мыши/человека
Согласно приведенным ниже стадиям получали белки, имеющие гистидиновую метку, связанную с C-концом каждого из Myl12a мыши (№ доступа в Genbank NP_080340.2, SEQ ID NO: 93), Myl12b мыши (№ доступа в Genbank NP_075891.1, SEQ ID NO: 94), Myl12a человека (№ доступа в Genbank NP_001289976.1, SEQ ID NO: 95) и Myl12b человека (№ доступа в Genbank NP_001138416.1, SEQ ID NO: 96) (далее в данном документе соответственно называемых Myl12a мыши-His, Myl12b мыши-His, Myl12a человека-His и Myl12b человека-His). Показано сравнение аминокислотных последовательностей между Myl9, Myl12a и Myl12b мыши (фигура 7A), а также Myl9, Myl12a и Myl12b человека (фигура 7B).
[000173]
Гены, кодирующие белки Myl12a и Myl12b мыши, были предоставлены Тибским университетом. Гены, кодирующие белки Myl12a и Myl12b человека, амплифицировали из кДНК сердца или тонкой кишки человека посредством ПЦР. Эти гены встраивали в сайт BgIII/BamHI вектора pET42b (Merck), имеющего встроенный в него ген, кодирующий расщепляющую последовательность протеазы PreScission (GE Healthcare). Полученный вектор вводили путем трансформации в штамм BL21-Gold (DE3) pLys E. coli (Agilent Technologies) для обеспечения экспрессии Myl12a мыши-His, Myl12b мыши-His, Myl12a человека-His и Myl12b человека-His с присоединенной GST-меткой. Экспрессируемые белки очищали с помощью глутатион-сефарозы 4 Fast Flow (GE Healthcare), GST-метку отщепляли с помощью протеазы PreScission, а Myl12a мыши-His, Myl12b мыши-His, Myl12a человека-His и Myl12b человека-His очищали с помощью смолы TALON Superflow для аффинной хроматографии на иммобилизованных ионах металла (CLONTECH).
[000174]
К Myl12a мыши-His, Myl12b мыши-His, Myl12a человека-His, Myl12b человека-His или Myl3 мыши-His, Myl9 мыши-His, Myl3 человека-His, Myl9 человека-His, очищенным согласно примеру 1, добавляли дитиотреитол (Wako) в конечной концентрации 50 мM, и выполняли инкубирование при 4°C в течение одного часа для получения мономеров. Диализ выполняли с использованием PBS после инкубирования.
[000175]
Анализ способности антитела A к связыванию с белками Myl12a и Myl12b мыши/человека
Способность антитела A к связыванию с Myl12a и Myl12b мыши/человека оценивали согласно приведенным ниже стадиям с помощью ELISA. Соединениями Myl3 мыши-His, Myl9 мыши-His, Myl12a мыши-His, Myl12b мыши-His, Myl3 человека-His, Myl9 человека-His, Myl12a человека-His и Myl12b человека-His покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS получали одиннадцать четырехкратных серийных разведений антитела A из концентрации 10 мкг/мл и добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания добавляли меченное пероксидазой хрена антитело к мышиному IgG (Jackson ImmunoResearch Laboratories), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (Thermo Scientific).
[000176]
Антитело A демонстрировало зависимое от концентрации связывание с Myl12a и Myl12b, которые характеризуются высокой степенью гомологии с Myl9 мыши и человека, но не связывалось с Myl3 мыши и человека, характеризующимися низкой степенью гомологии в отношении Myl9 мыши и человека (фигуры 8A и B).
[000177]
Анализ способности химерных и гуманизированных антител, полученных из антитела A, к связыванию с белками Myl12a и Myl12b человека
Способность химерных и гуманизированных антител, полученных из антитела A, к связыванию с Myl12a и Myl12b человека оценивали согласно приведенным ниже стадиям с помощью ELISA. Соединениями Myl3 человека-His, Myl9 человека-His, Myl12a человека-His и Myl12b человека-His соответственно покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS химерные и гуманизированные антитела соответственно разбавляли в концентрации 0,01, 0,1 и 1 мкг/мл и добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания добавляли меченное пероксидазой хрена антитело к человеческому IgG (Jackson ImmunoResearch Laboratories), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (Thermo Scientific).
[000178]
Химерные и гуманизированные антитела демонстрировали зависимое от концентрации связывание с Myl12a и Myl12b, которые характеризуются высокой степенью гомологии с Myl9 человека, но не связывались с Myl3 человека, характеризующимся низкой степенью гомологии с Myl9 человека (фигуры 9-A - 9-C).
[000179]
Пример 6. Ингибирующий эффект антитела A и химерных и гуманизированных антител на его основе в отношении активности связывания между Myl9 человека, Myl12a человека и Myl12b человека и белком внеклеточной области CD69 человека
Связывание между белками Myl9, Myl12a и Myl12b человека и белком внеклеточной области CD69 человека
Связывание белков Myl9, Myl12a и Myl12b человека и белка внеклеточной области CD69 человека оценивали с помощью ELISA. Белок, имеющий FLAG-метку, добавленную на N-конец внеклеточной области (положения 64-199, SEQ ID NO: 97) белка CD69 человека (далее в данном документе называемый белком 3 x FLAG-EC CD69 человека), получали согласно приведенным ниже стадиям. Показано сравнение аминокислотных последовательностей между внеклеточными областями белков CD69 человека и мыши (фигура 10).
[000180]
Экспрессионная плазмида, содержащая ген, кодирующий белок 3 x FLAG-EC CD69 человека, была предоставлена Тибским университетом, и ее вводили путем трансфекции в клетки Expi293F (Invitrogen/LifeTechnologies) с помощью набора для трансфекции ExpiFectamine 293 (Thermo Fisher Scientific/Gibco). Спустя 4 дня инкубирования (8% CO2, 37°C) собирали надосадочную жидкость культуры. Из собранной надосадочной жидкости культуры очищали белок 3 x FLAG-EC CD69 человека с помощью аффинного геля на основе антитела M2 к FLAG (SIGMA). После очистки димеризованный белок собирали с использованием Superdex200 или Superdex75.
[000181]
Оценивание связывания между Myl9, Myl12a и Myl12b человека и белком внеклеточной области CD69 человека осуществляли с помощью ELISA. Соединениями Myl3 человека-His, Myl9 человека-His, Myl12a человека-His и Myl12b человека-His, полученными в примере 5, соответственно покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS получали шесть трехкратных серийных разведений белка 3 x FLAG-EC CD69 человека из концентрации 10 мкг/мл с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 и добавляли в лунки. После инкубирования при комнатной температуре в течение полутора часов и трехкратного промывания с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 добавляли меченное пероксидазой хрена антитело к FLAG (M2) (SIGMA), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (Thermo Scientific).
[000182]
Белок внеклеточной области CD69 человека демонстрировал зависимое от концентрации связывание с Myl9, Myl12a и Myl12b человека, которые характеризуются высокой степенью гомологии с Myl9 человека, но не связывался с Myl3 человека, характеризующимся низкой степенью гомологии с Myl9 человека (фигура 11).
[000183]
Оценивание ингибирующей активности антитела A в отношении активности связывания Myl9 человека, Myl12a человека и Myl12b человека и белка внеклеточной области CD69 человека
Оценивание ингибирующей активности антитела A в отношении связывания между Myl9 человека, Myl12a человека и Myl12b человека и белком внеклеточной области CD69 человека осуществляли согласно следующим стадиям с помощью ELISA. Соединениями Myl9 человека-His, Myl12a человека-His и Myl12b человека-His, полученными в примере 5, соответственно покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS получали семь трехкратных серийных разведений антитела A или контрольного антитела (антитела к динитрофенолу, мышиного IgG2c, κ) из концентрации 30 мкг/мл с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 и добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания белок 3 x FLAG-EC CD69 человека разбавляли до концентрации 10 мкг/мл с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 и добавляли в лунки. После инкубирования при комнатной температуре в течение полутора часов и трехкратного промывания с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 добавляли меченное пероксидазой хрена антитело к FLAG (M2) (SIGMA), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (Thermo Scientific).
[000184]
Антитело A демонстрировало зависимое от концентрации ингибирование связывания между Myl9 человека, Myl12a человека и Myl12b человека и белком внеклеточной области CD69 человека (фигура 12). Контрольное антитело не демонстрировало ингибирующую активность. Фон на фигуре означает окрашивание при реакции между белком 3 x FLAG-EC CD69 человека и меченным пероксидазой хрена антителом к FLAG (M2) (SIGMA) в лунке, в которой не иммобилизованы Myl9 человека-His, Myl12a человека-His или Myl12b человека-His.
[000185]
Оценивание ингибирующей активности химерных и гуманизированных антител, полученных из антитела A, в отношении активности связывания Myl9 человека и белка внеклеточной области CD69 человека
Оценивание ингибирующей активности химерных и гуманизированных антител, полученных из антитела A, в отношении связывания между Myl9 человека и белком внеклеточной области CD69 человека осуществляли согласно следующим стадиям с помощью ELISA. Соединением Myl9 человека-His, полученным в примере 5, покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS получали семь трехкратных серийных разведений антитела A, химерных антител, гуманизированных антител или контрольного антитела (человеческого IgG2, κ, Sigma) из концентрации 30 мкг/мл с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 и добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания белок 3 x FLAG-EC CD69 человека разбавляли до концентрации 10 мкг/мл с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 и добавляли в лунки. После инкубирования при комнатной температуре в течение полутора часов и трехкратного промывания с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 добавляли меченное пероксидазой хрена антитело к FLAG (M2) (SIGMA), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (Thermo Scientific).
[000186]
Химерные и гуманизированные антитела, полученные из антитела A, демонстрировали зависимое от концентрации ингибирование связывания между Myl9 человека и белком внеклеточной области CD69 человека (фигуры 13-1-13-5). Контрольное антитело не демонстрировало ингибирующую активность. Фон на фигуре означает окрашивание при реакции между белком 3 x FLAG-EC CD69 человека и меченным пероксидазой хрена антителом к FLAG (M2) (SIGMA) в лунке, в которой не иммобилизован Myl9 человека-His.
[000187]
Оценивание ингибирующей активности химерных и гуманизированных антител, полученных из антитела A, в отношении активности связывания Myl12a человека и Myl12b человека и белка внеклеточной области CD69 человека
Оценивание ингибирующей активности химерных и гуманизированных антител, полученных из антитела A, в отношении связывания между Myl12a человека и Myl12b человека и белком внеклеточной области CD69 человека осуществляли согласно следующим стадиям с помощью ELISA. Соединениями Myl12a человека-His и Myl12b человека-His, полученными в примере 5, соответственно покрывали лунки 96-луночного планшета (Nunc). После инкубирования в течение ночи при 4°C лунки блокировали при комнатной температуре в течение одного часа с помощью 1 x Block Ace (DS Pharma Biomedical Co., Ltd.). После трехкратного промывания с помощью 0,02% Tween 20/PBS антитело A, химерное антитело, гуманизированные антитела или контрольное антитело (человеческий IgG2, κ, Sigma) разбавляли до концентраций 0,1, 1 и 10 мкг/мл с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 и добавляли в лунки. После инкубирования при комнатной температуре в течение одного часа и трехкратного промывания белок 3 x FLAG-EC CD69 человека разбавляли до концентрации 10 мкг/мл с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 и добавляли в лунки. После инкубирования при комнатной температуре в течение полутора часов и трехкратного промывания с помощью 50 мM NaOAc (pH 5,5)/150 мM NaCl/0,02% Tween 20 добавляли меченное пероксидазой хрена антитело к FLAG (M2) (SIGMA), и эту смесь инкубировали при комнатной температуре в течение одного часа. После 5-кратного промывания в лунки добавляли раствор TMBZ (3,3',5,5'-тетраметилбензидина), и эту смесь инкубировали в течение 5-20 минут при комнатной температуре. В лунки добавляли равное количество раствора для гашения реакции (2 н. H2SO4), и считывали поглощение при 450 нм с помощью считывающего устройства для микропланшетов (Thermo Scientific).
[000188]
Химерные и гуманизированные антитела, полученные из антитела A, демонстрировали зависимое от концентрации ингибирование связывания между Myl12a и Myl12b человека и белком внеклеточной области CD69 человека (фигуры 14-1-14-4). Контрольное антитело не демонстрировало ингибирующую активность. Фон на фигуре означает окрашивание при реакции между белком 3 x FLAG-EC CD69 человека и меченным пероксидазой хрена антителом к FLAG (M2) (SIGMA) в лунке, в которой не иммобилизованы Myl12a человека-His или Myl12b человека-His.
[000189]
Пример 7. Противоопухолевый эффект комбинированного введения антитела A и антитела к PD-1
Линию мышиных раковых клеток ободочной и прямой кишки CT26.WT (№ в ATCC CRT-2638), культивируемую в культуральной среде RPMI1640, содержащей 10% FBS и пенициллин/стрептомицин, суспендировали в фосфатно-солевом буферном растворе с получением клеточной суспензии в концентрации 1×107 клеток/мл. Клеточную суспензию трансплантировали подкожно в правую область спины мышам возрастом 6 недель (BALB/c, самки, Charles River Laboratories Japan, Inc.) в дозе 0,1 мл. Через шесть дней после трансплантации измеряли наибольший диаметр и короткую ось опухоли электронным цифровым штангенциркулем (штангенциркулем Digimatic (TM), Mitutoyo Corporation). Объем опухоли вычисляли с помощью следующей расчетной формулы:
объем опухоли (мм3) = наибольший диаметр (мм) × короткая ось (мм) × короткая ось (мм)/2.
На фигуре 15 показаны результаты анализа экспрессии генов в ткани подкожной опухоли в линии мышиных раковых клеток ободочной и прямой кишки CT26.WT. Нуклеиновую кислоту экстрагировали из опухолевой ткани, происходящей из CT26.WT, с помощью реагента TRIzol (зарегистрированный товарный знак) (Thermo Fisher Scientific), а общую РНК получали с помощью набора RNeasy Mini (Qiagen). Из общей РНК получали библиотеку с помощью набора SureSelect для получения нитеспецифических библиотек РНК (Agilent Technologies) для анализа по методу секвенирования РНК, и выполняли секвенирование с помощью HiSeq4000 (Illumina). Данные в файлах в формате Fastq, полученных в ходе секвенирования, нормализовали с помощью способа TPM (число транскриптов на миллион), и измеряли экспрессию Myl9, Myl12a и Myl12b. В опухолевой ткани уровень экспрессии Myl9 был низким, а уровни экспрессии Myl12a и Myl12b были высокими.
Мышей разделяли на группы на основании объема опухоли в первый день введения таким образом, что среднее значение объема опухоли в каждой группе было практически равным. Антитело A и антитело к PD-1 (BoXCell, № по каталогу BE0146) получали в виде 2 мг/мл раствора с помощью фосфатно-солевого буферного раствора и вводили мышам внутрибрюшинно в дозе 0,1 мл/мышь по два раза за семь дней, в общей сложности четыре раза (в дни 6, 9, 13 и 16 после трансплантации раковых клеток). В контрольной группе мышам внутрибрюшинно вводили фосфатно-солевой буферный раствор в дозе 0,2 мл/мышь по два раза за семь дней, в общей сложности четыре раза (в дни 6, 9, 13 и 16 после трансплантации раковых клеток). Каждая группа состояла из 7-8 мышей.
На фигуре 16 показаны изменения расчетных объемов опухолей с течением дней в контрольной группе (A), группе введения антитела А (B), группе введения антитела к PD-1 (C) и группе введения комбинации антитела A и антитела к PD-1 (D) до последнего дня теста (дня 30). Как показано на фигуре 16B, антитело A в отдельности почти не ингибировало рост опухоли. Антитело к PD-1 в отдельности слабо ингибировало рост опухоли по сравнению с контрольной группой (фигура 16C). Комбинированное введение антитела A и антитела к PD-1 в значительной степени ингибировало рост опухоли, и было подтверждено исчезновение опухолей у мышей (2/10) (фигура 16D). Приведенные выше результаты позволяют предположить синергический эффект комбинированного введения антитела A и антитела к PD-1.
Промышленная применимость
[000190]
Могут быть представлены антитело к Myl9 или его Myl9-связывающий фрагмент, которые связываются с Myl9 и могут ингибировать взаимодействие между Myl9 и CD69, а также фармацевтическая композиция, содержащая их. Антитело или фармацевтическая композиция в соответствии с настоящим изобретением могут быть применимыми для лечения заболевания, связанного со взаимодействием между Myl9 и CD69, например, аллергического воспаления дыхательных путей, такого как астма, хронический аллергический ринит или некоторые виды синусита, воспалительного заболевания дыхательных путей, такого как синусит, не включенный в аллергическое воспаление дыхательных путей, а также воспалительного заболевания кишечника, такого как неспецифический язвенный колит, болезнь Крона, болезнь Бехчета и эозинофильная дисфункция желудочно-кишечного тракта. Антитело в соответствии с настоящим изобретением также может ингибировать взаимодействие между Myl12 и CD69. Следовательно, антитело или фармацевтическая композиция в соответствии с настоящим изобретением могут быть применимыми для лечения заболевания, ассоциированного со взаимодействием между Myl9 и/или Myl12 и CD69, например, опухоли, такой как рак ободочной и прямой кишки, злокачественная меланома, немелкоклеточный рак легкого, почечноклеточная карцинома, злокачественная лимфома, множественная миелома, рак головы и шеи, уротелиальный рак, рак молочной железы, гепатоцеллюлярная карцинома, рак желудка, рак пищевода, рак яичника, мелкоклеточный рак легкого, мезотелиома и рак эндометрия, в комбинации с ингибитором контрольных точек иммунного ответа.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЭЙСАЙ Ар ЭНД Ди МЕНЕДЖМЕНТ КО., ЛТД.
ТИБА ЮНИВЕРСИТИ
<120> АНТИТЕЛО К MYL9
<130> ESAP1508F
<150> JP2016-003429
<151> 2016-01-12
<160> 97
<170> PatentIn version 3.5
<210> 1
<211> 172
<212> PRT
<213> Mus musculus
<400> 1
Met Ser Ser Lys Arg Ala Lys Ala Lys Thr Thr Lys Lys Arg Pro Gln
1 5 10 15
Arg Ala Thr Ser Asn Val Phe Ala Met Phe Asp Gln Ser Gln Ile Gln
20 25 30
Glu Phe Lys Glu Ala Phe Asn Met Ile Asp Gln Asn Arg Asp Gly Phe
35 40 45
Ile Asp Lys Glu Asp Leu His Asp Met Leu Ala Ser Leu Gly Lys Asn
50 55 60
Pro Thr Asp Glu Tyr Leu Glu Gly Met Met Asn Glu Ala Pro Gly Pro
65 70 75 80
Ile Asn Phe Thr Met Phe Leu Thr Met Phe Gly Glu Lys Leu Asn Gly
85 90 95
Thr Asp Pro Glu Asp Val Ile Arg Asn Ala Phe Ala Cys Phe Asp Glu
100 105 110
Glu Ala Ser Gly Phe Ile His Glu Asp His Leu Arg Glu Leu Leu Thr
115 120 125
Thr Met Gly Asp Arg Phe Thr Asp Glu Glu Val Asp Glu Met Tyr Arg
130 135 140
Glu Ala Pro Ile Asp Lys Lys Gly Asn Phe Asn Tyr Val Glu Phe Thr
145 150 155 160
Arg Ile Leu Lys His Gly Ala Lys Asp Lys Asp Asp
165 170
<210> 2
<211> 172
<212> PRT
<213> Homo sapiens
<400> 2
Met Ser Ser Lys Arg Ala Lys Ala Lys Thr Thr Lys Lys Arg Pro Gln
1 5 10 15
Arg Ala Thr Ser Asn Val Phe Ala Met Phe Asp Gln Ser Gln Ile Gln
20 25 30
Glu Phe Lys Glu Ala Phe Asn Met Ile Asp Gln Asn Arg Asp Gly Phe
35 40 45
Ile Asp Lys Glu Asp Leu His Asp Met Leu Ala Ser Leu Gly Lys Asn
50 55 60
Pro Thr Asp Glu Tyr Leu Glu Gly Met Met Ser Glu Ala Pro Gly Pro
65 70 75 80
Ile Asn Phe Thr Met Phe Leu Thr Met Phe Gly Glu Lys Leu Asn Gly
85 90 95
Thr Asp Pro Glu Asp Val Ile Arg Asn Ala Phe Ala Cys Phe Asp Glu
100 105 110
Glu Ala Ser Gly Phe Ile His Glu Asp His Leu Arg Glu Leu Leu Thr
115 120 125
Thr Met Gly Asp Arg Phe Thr Asp Glu Glu Val Asp Glu Met Tyr Arg
130 135 140
Glu Ala Pro Ile Asp Lys Lys Gly Asn Phe Asn Tyr Val Glu Phe Thr
145 150 155 160
Arg Ile Leu Lys His Gly Ala Lys Asp Lys Asp Asp
165 170
<210> 3
<211> 28
<212> PRT
<213> Homo sapiens
<400> 3
Met Ser Ser Lys Arg Ala Lys Ala Lys Thr Thr Lys Lys Arg Pro Gln
1 5 10 15
Arg Ala Thr Ser Asn Val Phe Ala Met Phe Asp Cys
20 25
<210> 4
<211> 138
<212> PRT
<213> Mus musculus
<400> 4
Asn Val Gly Lys Tyr Asn Cys Pro Gly Leu Tyr Glu Lys Leu Glu Ser
1 5 10 15
Ser Asp His His Val Ala Thr Cys Lys Asn Glu Trp Ile Ser Tyr Lys
20 25 30
Arg Thr Cys Tyr Phe Phe Ser Thr Thr Thr Lys Ser Trp Ala Leu Ala
35 40 45
Gln Arg Ser Cys Ser Glu Asp Ala Ala Thr Leu Ala Val Ile Asp Ser
50 55 60
Glu Lys Asp Met Thr Phe Leu Lys Arg Tyr Ser Gly Glu Leu Glu His
65 70 75 80
Trp Ile Gly Leu Lys Asn Glu Ala Asn Gln Thr Trp Lys Trp Ala Asn
85 90 95
Gly Lys Glu Phe Asn Ser Trp Phe Asn Leu Thr Gly Ser Gly Arg Cys
100 105 110
Val Ser Val Asn His Lys Asn Val Thr Ala Val Asp Cys Glu Ala Asn
115 120 125
Phe His Trp Val Cys Ser Lys Pro Ser Arg
130 135
<210> 5
<211> 204
<212> PRT
<213> Mus musculus
<400> 5
Met Ala Pro Lys Lys Pro Glu Pro Lys Lys Asp Asp Ala Lys Ala Ala
1 5 10 15
Ala Pro Lys Ala Ala Pro Ala Pro Ala Ala Ala Pro Ala Ala Ala Pro
20 25 30
Ala Ala Ala Pro Glu Pro Glu Arg Pro Lys Glu Ala Glu Phe Asp Ala
35 40 45
Ser Lys Ile Lys Ile Glu Phe Thr Pro Glu Gln Ile Glu Glu Phe Lys
50 55 60
Glu Ala Phe Leu Leu Phe Asp Arg Thr Pro Lys Gly Glu Met Lys Ile
65 70 75 80
Thr Tyr Gly Gln Cys Gly Asp Val Leu Arg Ala Leu Gly Gln Asn Pro
85 90 95
Thr Gln Ala Glu Val Leu Arg Val Leu Gly Lys Pro Lys Gln Glu Glu
100 105 110
Leu Asn Ser Lys Met Met Asp Phe Glu Thr Phe Leu Pro Met Leu Gln
115 120 125
His Ile Ser Lys Asn Lys Asp Thr Gly Thr Tyr Glu Asp Phe Val Glu
130 135 140
Gly Leu Arg Val Phe Asp Lys Glu Gly Asn Gly Thr Val Met Gly Ala
145 150 155 160
Glu Leu Arg His Val Leu Ala Thr Leu Gly Glu Arg Leu Thr Glu Asp
165 170 175
Glu Val Glu Lys Leu Met Ala Gly Gln Glu Asp Ser Asn Gly Cys Ile
180 185 190
Asn Tyr Glu Ala Phe Val Lys His Ile Met Ala Ser
195 200
<210> 6
<211> 195
<212> PRT
<213> Homo sapiens
<400> 6
Met Ala Pro Lys Lys Pro Glu Pro Lys Lys Asp Asp Ala Lys Ala Ala
1 5 10 15
Pro Lys Ala Ala Pro Ala Pro Ala Pro Pro Pro Glu Pro Glu Arg Pro
20 25 30
Lys Glu Val Glu Phe Asp Ala Ser Lys Ile Lys Ile Glu Phe Thr Pro
35 40 45
Glu Gln Ile Glu Glu Phe Lys Glu Ala Phe Met Leu Phe Asp Arg Thr
50 55 60
Pro Lys Cys Glu Met Lys Ile Thr Tyr Gly Gln Cys Gly Asp Val Leu
65 70 75 80
Arg Ala Leu Gly Gln Asn Pro Thr Gln Ala Glu Val Leu Arg Val Leu
85 90 95
Gly Lys Pro Arg Gln Glu Glu Leu Asn Thr Lys Met Met Asp Phe Glu
100 105 110
Thr Phe Leu Pro Met Leu Gln His Ile Ser Lys Asn Lys Asp Thr Gly
115 120 125
Thr Tyr Glu Asp Phe Val Glu Gly Leu Arg Val Phe Asp Lys Glu Gly
130 135 140
Asn Gly Thr Val Met Gly Ala Glu Leu Arg His Val Leu Ala Thr Leu
145 150 155 160
Gly Glu Arg Leu Thr Glu Asp Glu Val Glu Lys Leu Met Ala Gly Gln
165 170 175
Glu Asp Ser Asn Gly Cys Ile Asn Tyr Glu Ala Phe Val Lys His Ile
180 185 190
Met Ser Ser
195
<210> 7
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 7
acatcactcc gt 12
<210> 8
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 8
acggagtgat gtccgtcgac gtatctctgc gttgatactt cagcgtagct 50
<210> 9
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 9
agctacgctg aagtatcaac gcagag 26
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 10
gccagtggat agactgatgg 20
<210> 11
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 11
gatggataca gttggtgcag c 21
<210> 12
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 12
Met Glu Trp Ser Trp Val Phe Leu Phe Leu Leu Ser Val Ile Ala Gly
1 5 10 15
Val Gln Ser
<210> 13
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 13
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Val Arg Pro Gly Ala
1 5 10 15
Ser Val Thr Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Lys Gln Thr Pro Val His Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Ile Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 14
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 14
Met Lys Leu Pro Val Arg Leu Leu Val Leu Met Phe Trp Ile Pro Ala
1 5 10 15
Ser Ser Ser
<210> 15
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 15
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Arg Ser
35 40 45
Pro Lys Leu Leu Ile Ser Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Thr Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 16
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 16
atggaatgga gctgggtctt tctcttcctc ctgtcagtaa ttgcaggtgt ccaatcc 57
<210> 17
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 17
caggttcaac tgcagcagtc tggggctgag gtggtgaggc ctggggcttc agtgacgctg 60
tcctgcaagg cttcgggcta cacatttact gactatgaaa tgcactgggt gaagcagaca 120
cctgtgcatg gcctggaatg gattggagct attgatcctg aaactggtgg tactgcctac 180
aatcagaagt tcaagggcaa ggccatactg actgcagaca aatcctccaa cacagcctac 240
atggagctcc gcagcctgac atctgaggac tctgccgtct attactgtac agactatgat 300
tacgacgggt ttgcttactg gggccaaggg actctggtca ctgtctctgc a 351
<210> 18
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 18
atgaagttgc ctgttaggct gttggtgctg atgttctgga ttcctgcttc cagcagt 57
<210> 19
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 19
gatgttgtga tgacccaaac tccactctcc ctgcctgtca gtcttggaga tcaagcctcc 60
atctcttgca gatctagtca gagccttgta cacagtaatg gaaacaccta tttacattgg 120
tacctgcaga agccaggccg gtctccaaag ctcctgatct ccaaagtttc caaccgattt 180
tctggggtcc cagacaggtt cagtggcagt ggatcaggga cagatttcac actcaagatc 240
accagagtgg aggctgagga tctgggagtt tatttctgct ctcaaaatac acatgttcct 300
ccgctcacgt tcggtgctgg gaccaagctg gagctgaaa 339
<210> 20
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 20
gcgaagcttg ccgccaccat ggaatggagc tgggtctttc 40
<210> 21
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 21
gcgaagcttg ccgccaccat gaagttgcct gttaggctg 39
<210> 22
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 22
gcggaattca tcatttaccc agagaccggg agatgg 36
<210> 23
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический праймер
<400> 23
gcggaattca ctaacactca ttcctgttga agctcttgac 40
<210> 24
<211> 335
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 24
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly
1 5 10 15
Gly Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Leu Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Thr Ser Asn Thr Trp Pro Ser Gln Thr Ile
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile Glu Pro Arg Val Pro Ile Thr Gln Asn Pro Cys Pro Pro Leu Lys
100 105 110
Glu Cys Pro Pro Cys Ala Ala Pro Asp Leu Leu Gly Gly Pro Ser Val
115 120 125
Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser Leu Ser
130 135 140
Pro Met Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro Asp
145 150 155 160
Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala Gln
165 170 175
Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val Val Ser
180 185 190
Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys
195 200 205
Cys Lys Val Asn Asn Arg Ala Leu Pro Ser Pro Ile Glu Lys Thr Ile
210 215 220
Ser Lys Pro Arg Gly Pro Val Arg Ala Pro Gln Val Tyr Val Leu Pro
225 230 235 240
Pro Pro Ala Glu Glu Met Thr Lys Lys Glu Phe Ser Leu Thr Cys Met
245 250 255
Ile Thr Gly Phe Leu Pro Ala Glu Ile Ala Val Asp Trp Thr Ser Asn
260 265 270
Gly Arg Thr Glu Gln Asn Tyr Lys Asn Thr Ala Thr Val Leu Asp Ser
275 280 285
Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Gln Lys Ser Thr
290 295 300
Trp Glu Arg Gly Ser Leu Phe Ala Cys Ser Val Val His Glu Gly Leu
305 310 315 320
His Asn His Leu Thr Thr Lys Thr Ile Ser Arg Ser Leu Gly Lys
325 330 335
<210> 25
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 25
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
1 5 10 15
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
20 25 30
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
35 40 45
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
65 70 75 80
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
85 90 95
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
100 105
<210> 26
<211> 1008
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 26
gccaaaacaa cagccccatc ggtctatcca ctggcccctg tgtgtggagg tacaactggc 60
tcctcggtga ctctaggatg cctggtcaag ggttatttcc ctgagccagt gaccttgacc 120
tggaactctg gatccctgtc cagtggtgtg cacaccttcc cagctctcct gcagtctggc 180
ctctacaccc tcagcagctc agtgactgta acctcgaaca cctggcccag ccagaccatc 240
acctgcaatg tggcccaccc ggcaagcagc accaaagtgg acaagaaaat tgagcccaga 300
gtgcccataa cacagaaccc ctgtcctcca ctcaaagagt gtcccccatg cgcagctcca 360
gacctcttgg gtggaccatc cgtcttcatc ttccctccaa agatcaagga tgtactcatg 420
atctccctga gccccatggt cacatgtgtg gtggtggatg tgagcgagga tgacccagac 480
gtccagatca gctggtttgt gaacaacgtg gaagtacaca cagctcagac acaaacccat 540
agagaggatt acaacagtac tctccgggtg gtcagtgccc tccccatcca gcaccaggac 600
tggatgagtg gcaaggagtt caaatgcaag gtcaacaaca gagccctccc atcccccatc 660
gagaaaacca tctcaaaacc cagagggcca gtaagagctc cacaggtata tgtcttgcct 720
ccaccagcag aagagatgac taagaaagag ttcagtctga cctgcatgat cacaggcttc 780
ttacctgccg aaattgctgt ggactggacc agcaatgggc gtacagagca aaactacaag 840
aacaccgcaa cagtcctgga ctctgatggt tcctacttca tgtacagcaa gctcagagta 900
caaaagagca cttgggaaag aggaagtctt ttcgcctgct cagtggtcca cgagggtctg 960
cacaatcacc ttacgactaa gaccatctcc cggtctctgg gtaaatga 1008
<210> 27
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 27
cgggctgatg ctgcaccaac tgtatccatc ttcccaccat ccagtgagca gttaacatct 60
ggaggtgcct cagtcgtgtg cttcttgaac aacttctacc ccaaagacat caatgtcaag 120
tggaagattg atggcagtga acgacaaaat ggcgtcctga acagttggac tgatcaggac 180
agcaaagaca gcacctacag catgagcagc accctcacgt tgaccaagga cgagtatgaa 240
cgacataaca gctatacctg tgaggccact cacaagacat caacttcacc cattgtcaag 300
agcttcaaca ggaatgagtg ttag 324
<210> 28
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 28
Asp Tyr Glu Met His
1 5
<210> 29
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 29
Gly Tyr Thr Phe Thr Asp Tyr Glu Met His
1 5 10
<210> 30
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 30
Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 31
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 31
Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala
1 5 10
<210> 32
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 32
Tyr Asp Tyr Asp Gly Phe Ala Tyr
1 5
<210> 33
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 33
Arg Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 34
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 34
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 35
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 35
Ser Gln Asn Thr His Val Pro Pro Leu Thr
1 5 10
<210> 36
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 36
gactatgaaa tgcac 15
<210> 37
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 37
ggctacacat ttactgacta tgaaatgcac 30
<210> 38
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 38
gctattgatc ctgaaactgg tggtactgcc tacaatcaga agttcaaggg c 51
<210> 39
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 39
gctattgatc ctgaaactgg tggtactgcc 30
<210> 40
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 40
tatgattacg acgggtttgc ttac 24
<210> 41
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 41
agatctagtc agagccttgt acacagtaat ggaaacacct atttacat 48
<210> 42
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 42
aaagtttcca accgattttc t 21
<210> 43
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 43
tctcaaaata cacatgttcc tccgctcacg 30
<210> 44
<211> 325
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 44
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Ala Ala Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly
325
<210> 45
<211> 978
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 45
gctagcacaa aaggcccctc tgtcttccct ctggctccct gctcccgctc cacctccgag 60
tccactgccg ctctgggctg tctggtcaag gattacttcc ctgagccagt cactgtgagt 120
tggaactcag gcgccctgac cagcggagtc cacacatttc ccgctgtgct gcagagctcc 180
ggcctgtact ccctgtctag tgtggtcacc gtgccttcaa gcaatttcgg gactcagacc 240
tatacatgca acgtggacca taagccatct aatactaagg tcgataaaac cgtggagcga 300
aaatgctgcg tggaatgccc accttgtcct gctccaccag ccgctgcacc aagcgtgttc 360
ctgtttcctc caaagcccaa agacacactg atgatcagca gaactcctga ggtcacctgc 420
gtggtcgtgg acgtgtccca cgaggatccc gaagtccagt ttaactggta cgtggatggg 480
gtcgaagtgc ataatgcaaa gactaaacct cgggaggaac agttcaactc tacctttaga 540
gtcgtgagtg tgctgacagt cgtgcaccag gactggctga acggaaagga gtataagtgc 600
aaagtgtcta ataagggcct gcccgcccct atcgagaaaa caattagtaa gactaaaggc 660
cagccaaggg aaccccaggt gtacacactg ccccctagtc gcgaggaaat gacaaagaac 720
caggtctcac tgacttgtct ggtgaaaggg ttctatccat ccgacattgc cgtggagtgg 780
gaatctaatg gacagcccga aaacaattac aagaccacac cacccatgct ggacagcgat 840
ggatccttct ttctgtattc aaagctgacc gtggataaaa gccggtggca gcagggcaat 900
gtcttttcct gctctgtgat gcacgaagcc ctgcacaacc actacactca gaagtccctg 960
tccctgtctc ctggctga 978
<210> 46
<211> 107
<212> PRT
<213> Homo sapiens
<400> 46
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 47
<211> 324
<212> ДНК
<213> Homo sapiens
<400> 47
cgtacggtcg ccgccccctc cgtgtttatt tttcctccat ctgacgaaca gctgaagagt 60
gggaccgcct ccgtggtgtg cctgctgaac aatttctacc cccgggaggc caaggtgcag 120
tggaaagtcg acaacgctct gcagtctggc aatagtcagg agtcagtgac tgaacaggac 180
agcaaggatt ccacctattc tctgagctcc accctgacac tgagcaaagc agattacgaa 240
aagcacaaag tctatgcctg cgaagtgacc caccaggggc tgagcagtcc agtgaccaag 300
tcctttaaca ggggagagtg ttga 324
<210> 48
<211> 101
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 48
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Pro
100
<210> 49
<211> 100
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 49
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Thr Gln Phe Pro
100
<210> 50
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 50
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 51
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 51
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Thr Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Ile Pro Ile Leu Gly Ile Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 52
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 52
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 53
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 53
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Asn Thr Gly Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 54
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 54
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10 15
<210> 55
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 56
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 56
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 57
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 57
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 58
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 58
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 59
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 59
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 60
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 60
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Met Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 61
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 61
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 62
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 62
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 63
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 63
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 64
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 64
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Asp Pro Glu Thr Gly Gly Thr Ala Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asp Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 65
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 65
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Ser Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 66
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 66
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Ser Ile Thr Pro Gly
1 5 10 15
Glu Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Ser Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 67
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 67
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Ser Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 68
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 68
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Ser Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 69
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 69
Met Glu Trp Ser Trp Val Phe Leu Phe Phe Leu Ser Val Thr Thr Gly
1 5 10 15
Val His Ser
<210> 70
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 70
caggtccagc tggtccagtc aggagccgaa gtgaagaaac ccgggagctc cgtgaaggtc 60
agttgcaaag cctccggcgg gactttcagc gactacgaga tgcactgggt gaggcaggct 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaacaggagg cactgcatac 180
aaccagaagt ttaaaggccg ggcgaccatt acagcagaca agtccacttc taccgcctat 240
atggagctgc gtagtctgcg gtctgaagat acagccgtct actattgtgc tgattacgac 300
tatgatggct tcgcctattg gggccagggg accctggtga cagtctcaag c 351
<210> 71
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 71
caggtccagc tggtccagtc aggagccgaa gtgaagaaac ccgggagctc cgtgaaggtc 60
agttgcaaag cctccggcgg gactttcagc gactacgaga tgcactgggt gaggcaggct 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaacaggagg cactgcatac 180
aaccagaagt ttaaaggccg ggtgaccatt acagcagaca agtccacttc taccgcctat 240
atggagctgt ctagtctgcg gtctgaagat acagccgtct actattgtgc tgattacgac 300
tatgatggct tcgcctattg gggccagggg accctggtga cagtctcaag c 351
<210> 72
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 72
caggtccagc tggtccagtc aggagccgaa gtgaagaaac ccgggagctc cgtgaaggtc 60
agttgcaaag cctccggcgg gactttcagc gactacgaga tgcactgggt gaggcaggct 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaacaggagg cactgcatac 180
aaccagaagt ttaaaggccg ggtgaccatt acagcagaca agtccacttc taccgcctat 240
atggagctgc gtagtctgcg gtctgaagat acagccgtct actattgtgc tgattacgac 300
tatgatggct tcgcctattg gggccagggg accctggtga cagtctcaag c 351
<210> 73
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 73
atggaatggt cttgggtctt tctgttcttt ctgtctgtca caaccggagt gcatagc 57
<210> 74
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 74
caggtccagc tggtccagtc aggagccgag gtgaagaaac ccggcagctc cgtgaaggtc 60
agttgcaagg ccagcgggta cacattcagc gattatgaga tgcactgggt caggcaggca 120
ccaggacagg gactggagtg gatcggagca attgaccctg aaacaggcgg gactgcctac 180
aaccagaagt ttaaaggccg ggccaccatc acagctgata agtcaactag caccgcttat 240
atggagctgc ggtccctgag atctgaagac actgcagtgt actattgtac cgactacgat 300
tatgacgggt tcgcctactg ggggcaggga accctggtga cagtctctag t 351
<210> 75
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 75
atggaatggt catgggtctt tctgttcttt ctgtcagtca caaccggagt gcatagc 57
<210> 76
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 76
caggtccagc tggtgcagtc aggagccgaa gtgaagaaac ccggcgcatc cgtgaaggtc 60
tcttgcaaag ccagcgggta caccttcaca gactatgaga tgcactgggt ccgacaggca 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaacaggcgg gactgcatac 180
aaccagaagt ttaaaggccg ggtgactatg accgcagaca catcaactag caccgcctat 240
atggagctga gctccctgag gagcgaagat accgccgtgt actattgtgc tgattacgac 300
tatgatgggt tcgcttactg ggggcaggga accctggtga cagtctctag t 351
<210> 77
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 77
caggtccagc tggtgcagtc aggagccgaa gtgaagaaac ccggcgcatc cgtgaaggtc 60
tcttgcaaag ccagcgggta caccttcaca gactatgaga tgcactgggt ccgacaggca 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaacaggcgg gactgcatac 180
aaccagaagt ttaaaggccg ggcgactatg accgcagaca catcaactag caccgcctat 240
atggagctga gctccctgag gagcgaagat accgccgtgt actattgtgc tgattacgac 300
tatgatgggt tcgcttactg ggggcaggga accctggtga cagtctctag t 351
<210> 78
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 78
caggtccagc tggtgcagtc aggagccgaa gtgaagaaac ccggcgcatc cgtgaaggtc 60
tcttgcaaag ccagcgggta caccttcaca gactatgaga tgcactgggt ccgacaggca 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaacaggcgg gactgcatac 180
aaccagaagt ttaaaggccg ggtgactatg accgcagaca aatcaactag caccgcctat 240
atggagctga gctccctgag gagcgaagat accgccgtgt actattgtgc tgattacgac 300
tatgatgggt tcgcttactg ggggcaggga accctggtga cagtctctag t 351
<210> 79
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 79
atggaatggt catgggtctt tctgttcttt ctgtccgtca caaccggggt ccactct 57
<210> 80
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 80
caggtgcagc tggtgcagtc tgggagcgag ctgaagaaac ccggggcatc agtgaaggtc 60
agctgcaaag cctccggata caccttcaca gactatgaga tgcactgggt gcggcaggca 120
ccaggacagg gactggagtg gatgggcgct atcgatcctg aaactggcgg gaccgcatac 180
aaccagaagt ttaaagggag attcgtgttt agtctggaca catctgtcag tactgcctat 240
ctgcagatta gctccctgaa ggccgaagat accgctgtct actattgtgc tgactacgat 300
tacgacggct tcgcctattg ggggcaggga acactggtca ctgtctcttc t 351
<210> 81
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 81
atggaatggt cttgggtctt tctgttcttt ctgtctgtca caaccggggt ccactct 57
<210> 82
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 82
caggtccagc tggtccagag tggggctgaa gtgaagaaac ccggcagctc cgtgaaggtc 60
agttgcaaag cctccgggta caccttcaca gactatgaga tgcactgggt gaggcaggca 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaaccggcgg gacagcctac 180
gctcagaagt ttcagggccg ggcgactatt accgctgaca aatccacatc tactgcatat 240
atggagctgc gtagtctgcg gagcgaagat acagcagtct actattgtgc cgattacgac 300
tatgatgggt tcgcctactg ggggcaggga actctggtga ccgtctcaag c 351
<210> 83
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 83
caggtccagc tggtccagag tggggctgaa gtgaagaaac ccggcagctc cgtgaaggtc 60
agttgcaaag cctccgggta caccttcaca gactatgaga tgcactgggt gaggcaggca 120
ccaggacagg gactggagtg gatgggagct atcgatcctg aaaccggcgg gacagcctac 180
gctcagaagt ttcagggccg ggtgactatt accgctgaca aatccacatc tactgcatat 240
atggagctgc gtagtctgcg gagcgaagat acagcagtct actattgtgc cgattacgac 300
tatgatgggt tcgcctactg ggggcaggga actctggtga ccgtctcaag c 351
<210> 84
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 84
atggaatggt cttgggtctt tctgttcttt ctgagcgtga ctaccggagt gcatagc 57
<210> 85
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 85
Met Ser Val Pro Thr Gln Val Leu Gly Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Asp Ala Arg Cys
20
<210> 86
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 86
gatattgtga tgacccagtc tcctctgtcc ctgccagtga caccaggaga gcctgcctct 60
atcagttgca ggagctccca gtctctggtc cacagtaacg gcaatactta cctgcattgg 120
tatctgcaga agccagggca gagcccccag ctgctgatct ccaaagtgtc aaaccggttc 180
agcggagtcc ctgacagatt ttcaggcagc gggtccggaa ccgatttcac actgaagatt 240
tcccgggtgg aggctgaaga cgtgggcgtc tacttttgtt ctcagaatac ccacgtgccc 300
cctctgactt ttggcggggg aaccaaggtc gagatcaag 339
<210> 87
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 87
gatattgtga tgacccagtc tcctctgtcc ctgtcaatca caccaggaga gcaggcctct 60
atcagttgca ggagctccca gtctctggtc cacagtaacg gcaatactta cctgcattgg 120
tatctgcaga agccagggca gagcccccag ctgctgatct ccaaagtgtc aaaccggttc 180
agcggagtcc ctgacagatt ttcaggcagc gggtccggaa ccgatttcac actgaagatt 240
tcccgggtgg aggctgaaga cgtgggcgtc tacttttgtt ctcagaatac ccacgtgccc 300
cctctgactt ttggcggggg aaccaaggtc gagatcaag 339
<210> 88
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 88
atgtccgtgc ctactcaggt gctggggctg ctgctgctgt ggctgaccga tgcccgctgc 60
<210> 89
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 89
gatgtcgtga tgacccagtc tcctctgagc ctgccagtga caccaggaga gcctgcctct 60
atcagttgca ggagctccca gtcactggtc cacagcaacg gcaatactta cctgcattgg 120
tatctgcaga agccagggca gtccccccag ctgctgatct ctaaagtgag taaccggttc 180
tctggagtcc ctgacagatt ttcaggcagc gggtccggaa ccgatttcac actgaagatt 240
agtcgggtgg aggctgaaga cgtgggcgtc tacttctgtt ctcagaatac ccacgtgccc 300
cctctgactt ttggcggggg aaccaaggtc gagatcaag 339
<210> 90
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 90
atgtccgtgc ctactcaggt gctggggctg ctgctgctgt ggctgaccga tgcccgatgt 60
<210> 91
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 91
gatgtcgtga tgacccagtc tcctctgagc ctgccagtga caccaggaga gcctgcctct 60
atcagttgca ggagctccca gtcactggtc cacagcaacg gcaatactta cctgcattgg 120
tatctgcaga agccagggca gtccccccag ctgctgatct ctaaagtgag taaccggttc 180
tctggagtcc ctgacagatt ttcaggcagc gggtccggaa ccgatttcac actgaagatt 240
agtcgggtgg aggctgaaga cgtgggcgtc tacttctgtt ctcagaatac ccacgtgccc 300
cctctgactt ttggcggggg aaccaaggtc gagatcaag 339
<210> 92
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 92
atgagcgtgc ctacccaggt gctgggactg ctgctgctgt ggctgactga tgcccgatgt 60
<210> 93
<211> 172
<212> PRT
<213> Mus musculus
<400> 93
Met Ser Ser Lys Arg Ala Lys Thr Lys Thr Thr Lys Lys Arg Pro Gln
1 5 10 15
Arg Ala Thr Ser Asn Val Phe Ala Met Phe Asp Gln Ser Gln Ile Gln
20 25 30
Glu Phe Lys Glu Ala Phe Asn Met Ile Asp Gln Asn Arg Asp Gly Phe
35 40 45
Ile Asp Lys Glu Asp Leu His Asp Met Leu Ala Ser Met Gly Lys Asn
50 55 60
Pro Thr Asp Glu Tyr Leu Asp Ala Met Met Asn Glu Ala Pro Gly Pro
65 70 75 80
Ile Asn Phe Thr Met Phe Leu Thr Met Phe Gly Glu Lys Leu Asn Gly
85 90 95
Thr Asp Pro Glu Asp Val Ile Arg Asn Ala Phe Ala Cys Phe Asp Glu
100 105 110
Glu Ala Ile Gly Thr Ile Gln Glu Asp Tyr Leu Arg Glu Leu Leu Thr
115 120 125
Thr Met Gly Asp Arg Phe Thr Asp Glu Glu Val Asp Glu Leu Tyr Arg
130 135 140
Glu Ala Pro Ile Asp Lys Lys Gly Asn Phe Asn Tyr Ile Glu Phe Thr
145 150 155 160
Arg Ile Leu Lys His Gly Ala Lys Asp Lys Asp Asp
165 170
<210> 94
<211> 172
<212> PRT
<213> Mus musculus
<400> 94
Met Ser Ser Lys Lys Ala Lys Thr Lys Thr Thr Lys Lys Arg Pro Gln
1 5 10 15
Arg Ala Thr Ser Asn Val Phe Ala Met Phe Asp Gln Ser Gln Ile Gln
20 25 30
Glu Phe Lys Glu Ala Phe Asn Met Ile Asp Gln Asn Arg Asp Gly Phe
35 40 45
Ile Asp Lys Glu Asp Leu His Asp Met Leu Ala Ser Leu Gly Lys Asn
50 55 60
Pro Thr Asp Ala Tyr Leu Asp Ala Met Met Asn Glu Ala Pro Gly Pro
65 70 75 80
Ile Asn Phe Thr Met Phe Leu Thr Met Phe Gly Glu Lys Leu Asn Gly
85 90 95
Thr Asp Pro Glu Asp Val Ile Arg Asn Ala Phe Ala Cys Phe Asp Glu
100 105 110
Glu Ala Thr Gly Thr Ile Gln Glu Asp Tyr Leu Arg Glu Leu Leu Thr
115 120 125
Thr Met Gly Asp Arg Phe Thr Asp Glu Glu Val Asp Glu Leu Tyr Arg
130 135 140
Glu Ala Pro Ile Asp Lys Lys Gly Asn Phe Asn Tyr Ile Glu Phe Thr
145 150 155 160
Arg Ile Leu Lys His Gly Ala Lys Asp Lys Asp Asp
165 170
<210> 95
<211> 171
<212> PRT
<213> Homo sapiens
<400> 95
Met Ser Ser Lys Arg Thr Lys Thr Lys Thr Lys Lys Arg Pro Gln Arg
1 5 10 15
Ala Thr Ser Asn Val Phe Ala Met Phe Asp Gln Ser Gln Ile Gln Glu
20 25 30
Phe Lys Glu Ala Phe Asn Met Ile Asp Gln Asn Arg Asp Gly Phe Ile
35 40 45
Asp Lys Glu Asp Leu His Asp Met Leu Ala Ser Leu Gly Lys Asn Pro
50 55 60
Thr Asp Glu Tyr Leu Asp Ala Met Met Asn Glu Ala Pro Gly Pro Ile
65 70 75 80
Asn Phe Thr Met Phe Leu Thr Met Phe Gly Glu Lys Leu Asn Gly Thr
85 90 95
Asp Pro Glu Asp Val Ile Arg Asn Ala Phe Ala Cys Phe Asp Glu Glu
100 105 110
Ala Thr Gly Thr Ile Gln Glu Asp Tyr Leu Arg Glu Leu Leu Thr Thr
115 120 125
Met Gly Asp Arg Phe Thr Asp Glu Glu Val Asp Glu Leu Tyr Arg Glu
130 135 140
Ala Pro Ile Asp Lys Lys Gly Asn Phe Asn Tyr Ile Glu Phe Thr Arg
145 150 155 160
Ile Leu Lys His Gly Ala Lys Asp Lys Asp Asp
165 170
<210> 96
<211> 172
<212> PRT
<213> Homo sapiens
<400> 96
Met Ser Ser Lys Lys Ala Lys Thr Lys Thr Thr Lys Lys Arg Pro Gln
1 5 10 15
Arg Ala Thr Ser Asn Val Phe Ala Met Phe Asp Gln Ser Gln Ile Gln
20 25 30
Glu Phe Lys Glu Ala Phe Asn Met Ile Asp Gln Asn Arg Asp Gly Phe
35 40 45
Ile Asp Lys Glu Asp Leu His Asp Met Leu Ala Ser Leu Gly Lys Asn
50 55 60
Pro Thr Asp Ala Tyr Leu Asp Ala Met Met Asn Glu Ala Pro Gly Pro
65 70 75 80
Ile Asn Phe Thr Met Phe Leu Thr Met Phe Gly Glu Lys Leu Asn Gly
85 90 95
Thr Asp Pro Glu Asp Val Ile Arg Asn Ala Phe Ala Cys Phe Asp Glu
100 105 110
Glu Ala Thr Gly Thr Ile Gln Glu Asp Tyr Leu Arg Glu Leu Leu Thr
115 120 125
Thr Met Gly Asp Arg Phe Thr Asp Glu Glu Val Asp Glu Leu Tyr Arg
130 135 140
Glu Ala Pro Ile Asp Lys Lys Gly Asn Phe Asn Tyr Ile Glu Phe Thr
145 150 155 160
Arg Ile Leu Lys His Gly Ala Lys Asp Lys Asp Asp
165 170
<210> 97
<211> 136
<212> PRT
<213> Homo sapiens
<400> 97
Gly Gln Tyr Asn Cys Pro Gly Gln Tyr Thr Phe Ser Met Pro Ser Asp
1 5 10 15
Ser His Val Ser Ser Cys Ser Glu Asp Trp Val Gly Tyr Gln Arg Lys
20 25 30
Cys Tyr Phe Ile Ser Thr Val Lys Arg Ser Trp Thr Ser Ala Gln Asn
35 40 45
Ala Cys Ser Glu His Gly Ala Thr Leu Ala Val Ile Asp Ser Glu Lys
50 55 60
Asp Met Asn Phe Leu Lys Arg Tyr Ala Gly Arg Glu Glu His Trp Val
65 70 75 80
Gly Leu Lys Lys Glu Pro Gly His Pro Trp Lys Trp Ser Asn Gly Lys
85 90 95
Glu Phe Asn Asn Trp Phe Asn Val Thr Gly Ser Asp Lys Cys Val Phe
100 105 110
Leu Lys Asn Thr Glu Val Ser Ser Met Glu Cys Glu Lys Asn Leu Tyr
115 120 125
Trp Ile Cys Asn Lys Pro Tyr Lys
130 135
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СВЯЗЫВАЮЩИЙ RGMa БЕЛОК И ЕГО ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2809500C2 |
| АНТИТЕЛО ПРОТИВ SIRPα | 2019 |
|
RU2791002C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2021 |
|
RU2840407C1 |
| КОНСТРУКЦИИ ДНК-АНТИТЕЛ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ БОЛЕЗНИ ЛАЙМА | 2017 |
|
RU2813829C2 |
| НАЦЕЛЕННЫЕ НА uPARAP КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2740311C2 |
| НЕВИРУСНЫЙ ИММУНОТАРГЕТИНГ | 2020 |
|
RU2833379C2 |
| АНТИТЕЛО ПРОТИВ LAG-3 | 2017 |
|
RU2744866C2 |
| Прогнозирование риска развития нежелательной реакции, связанной с введением антитела к ALK2, и способности отвечать на лечение антителом к ALK2 | 2019 |
|
RU2783762C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |


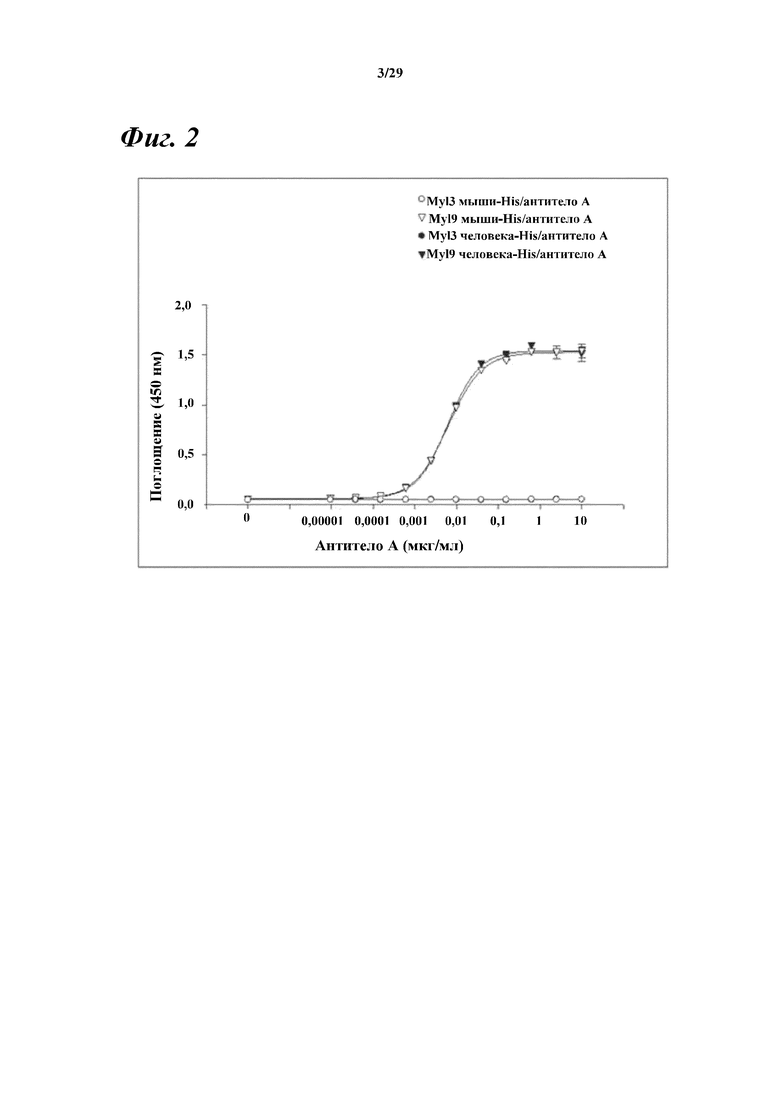
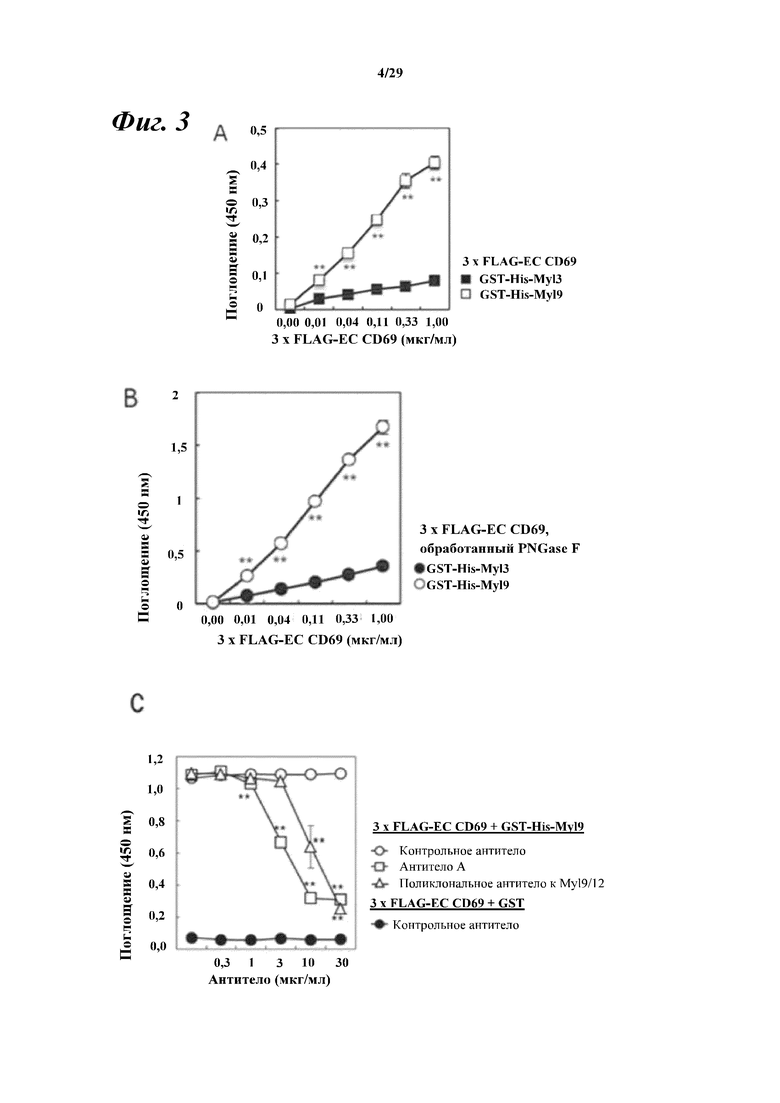
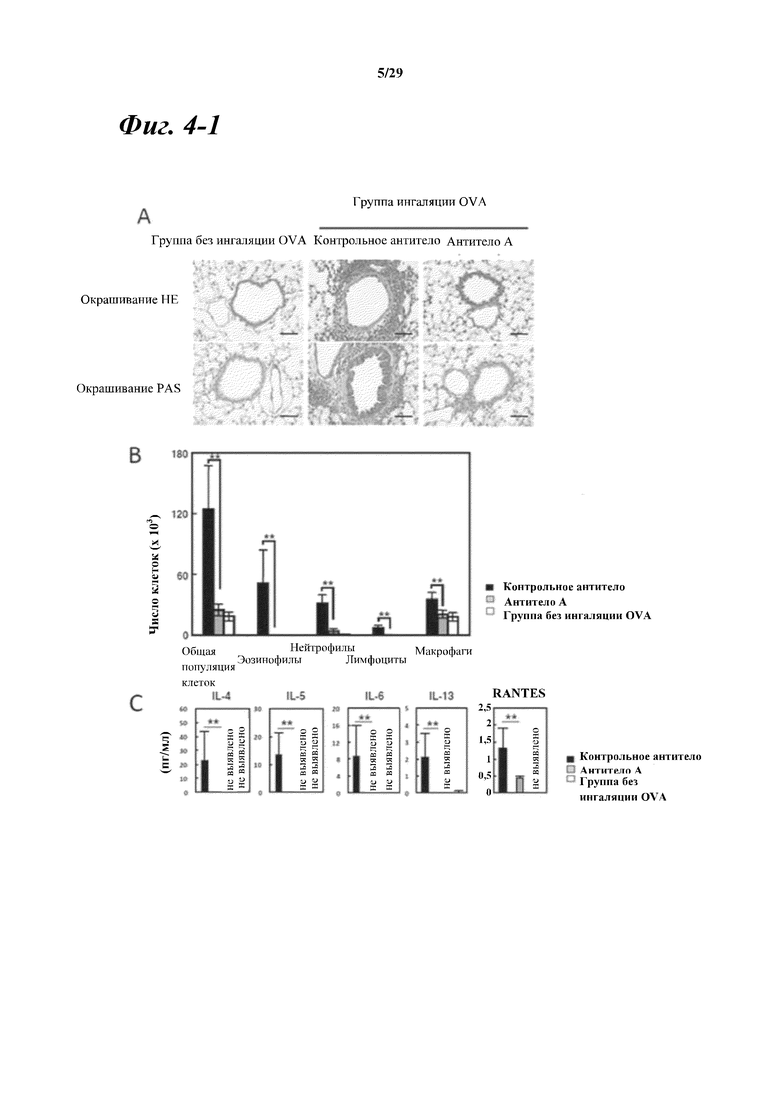
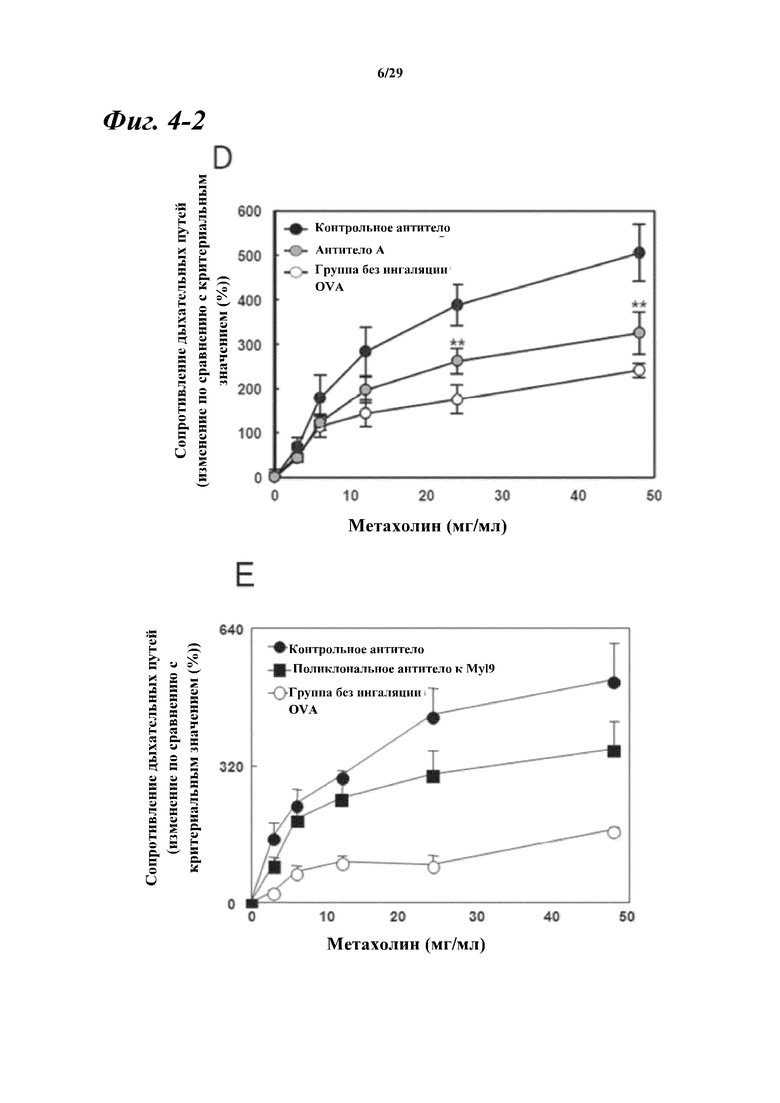
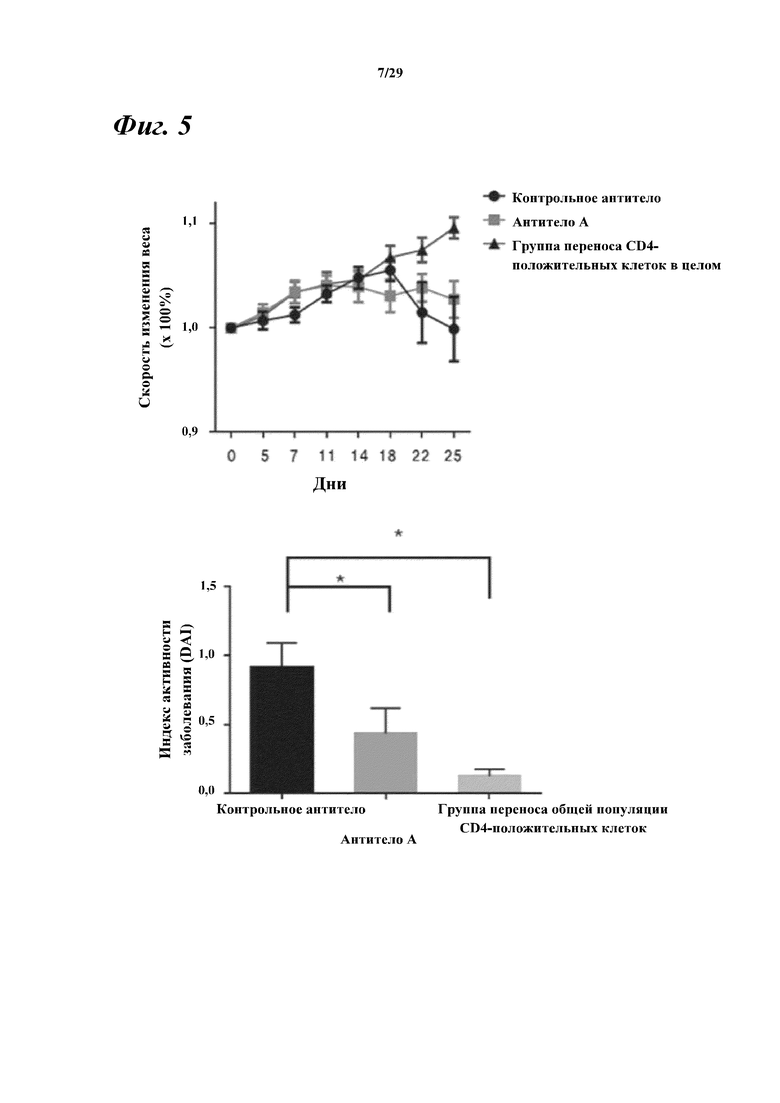
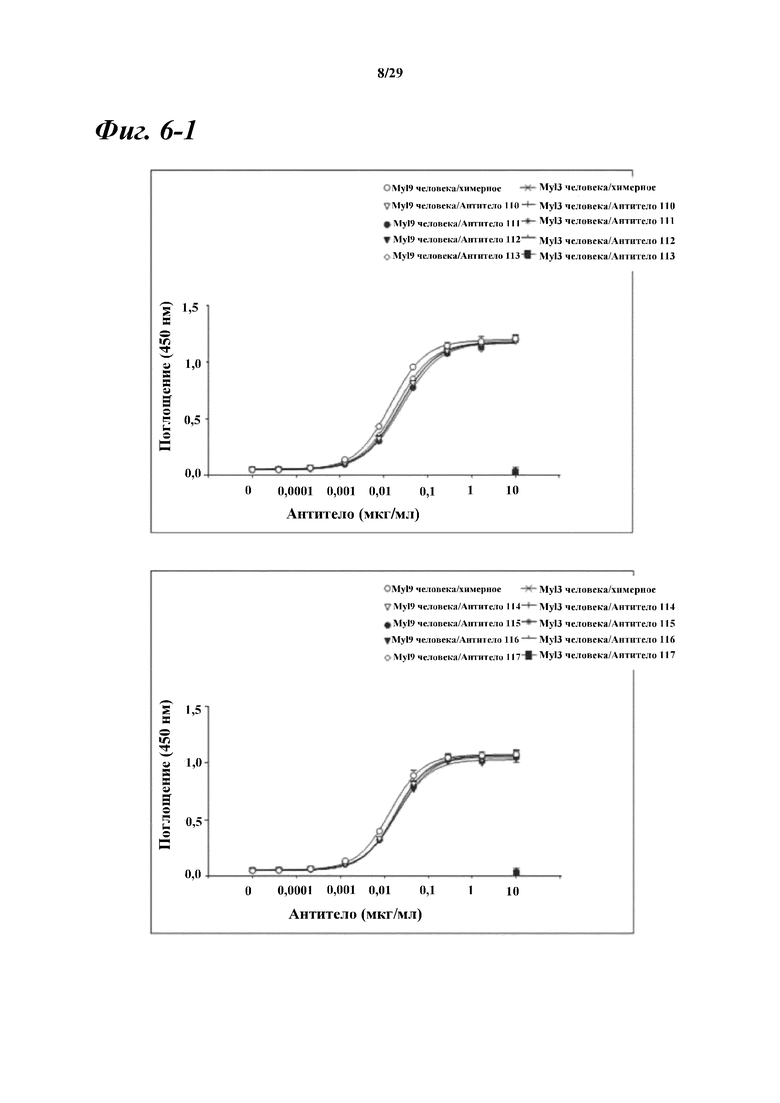
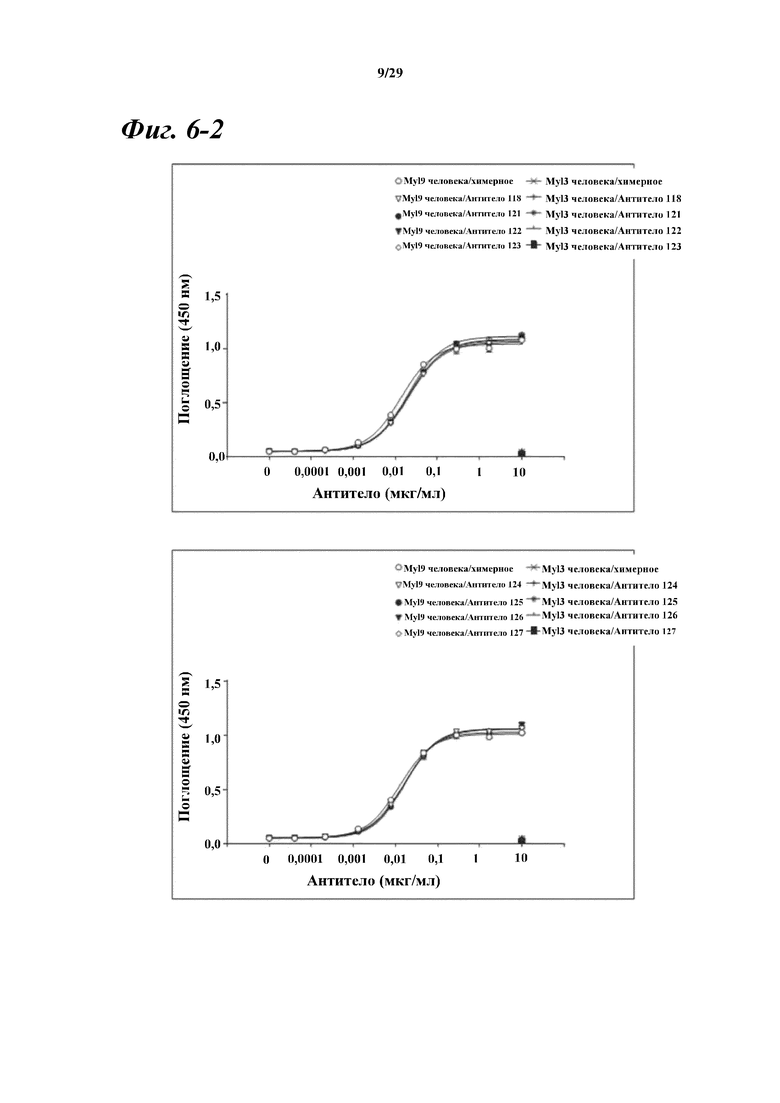
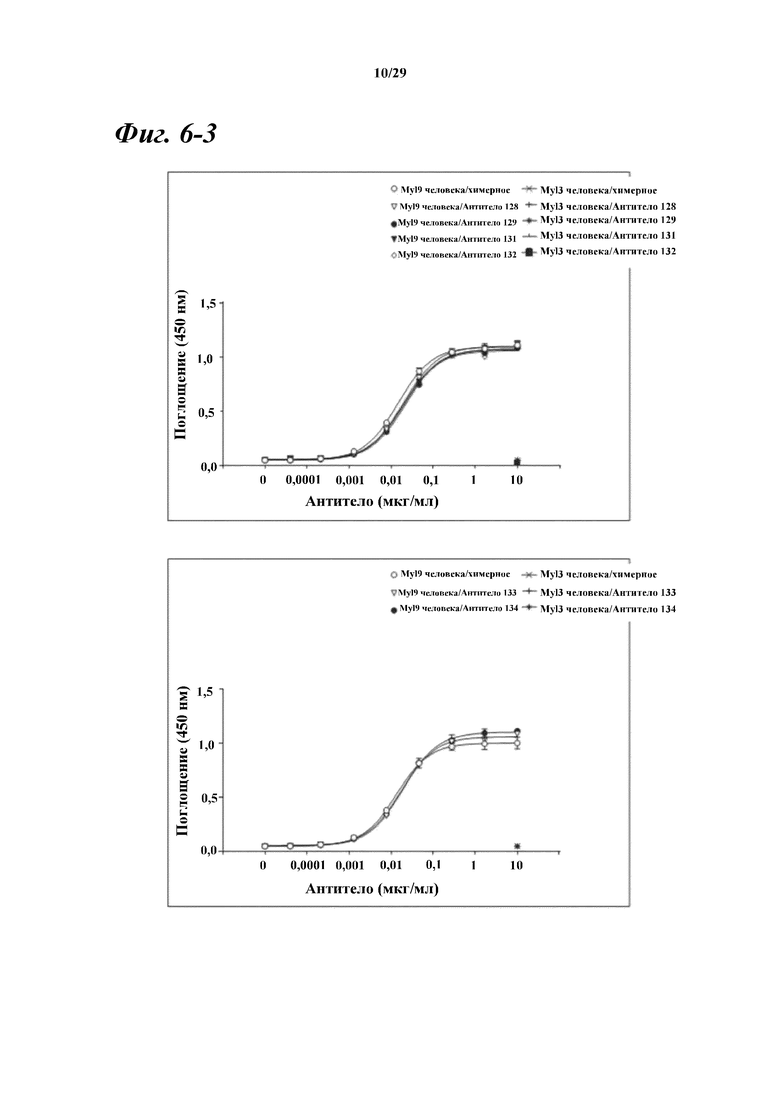

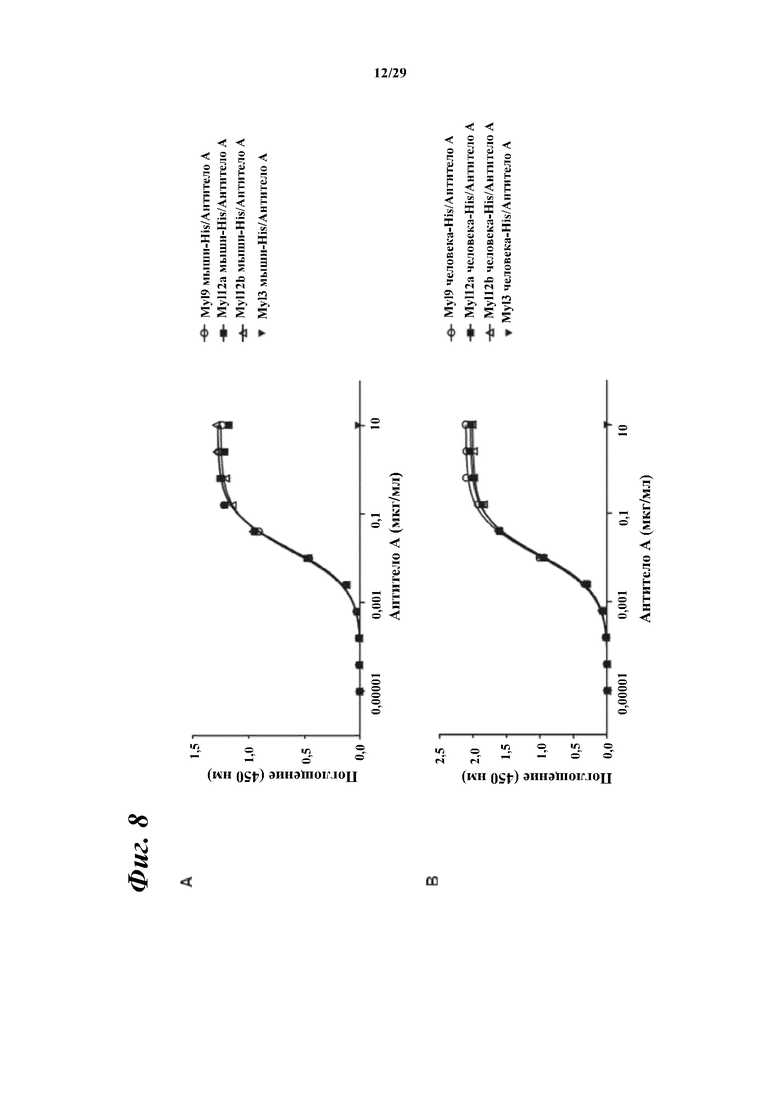

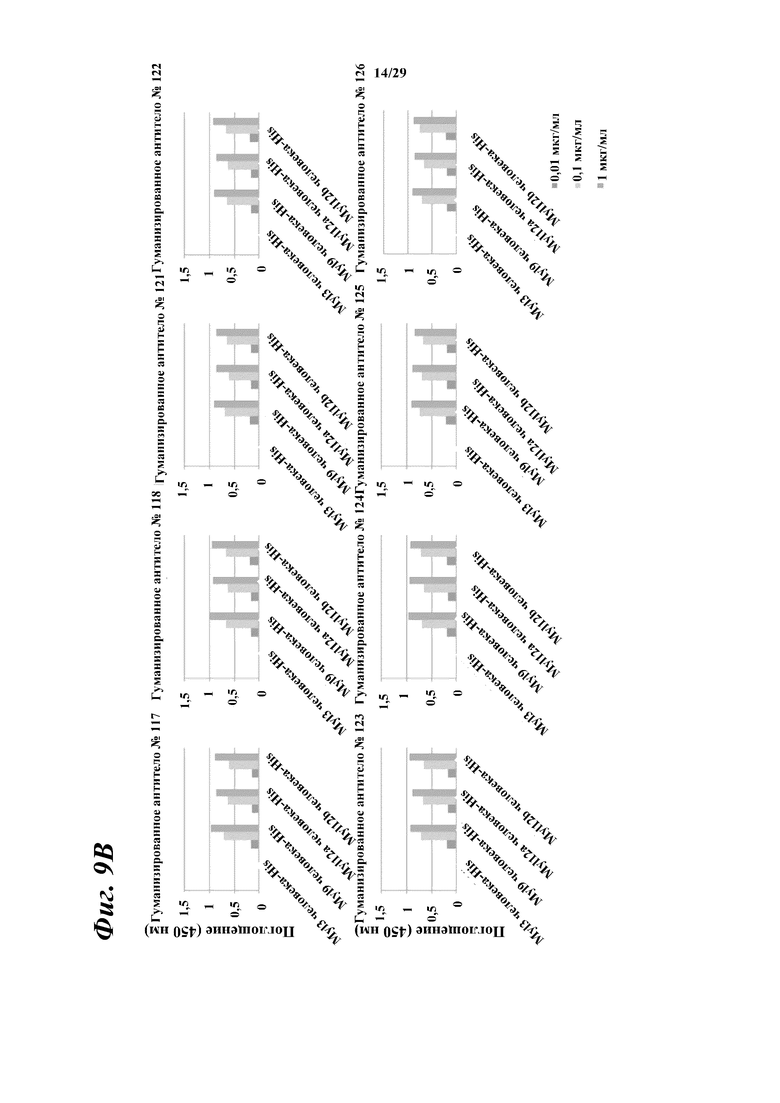


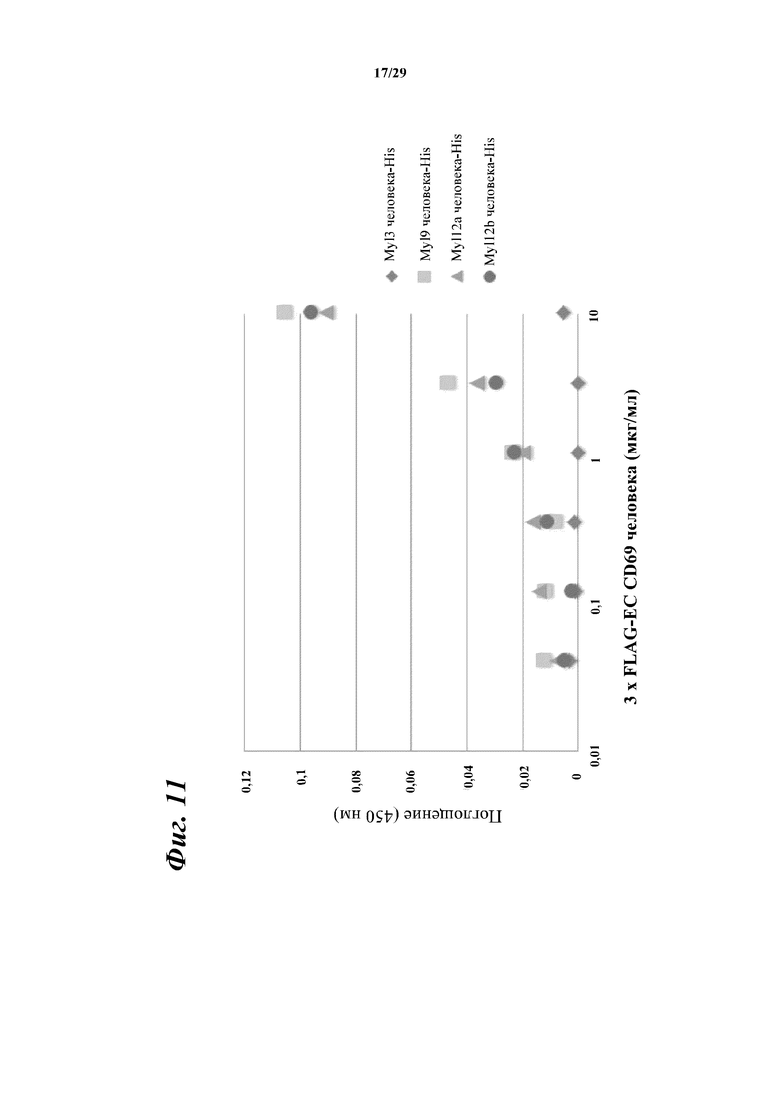
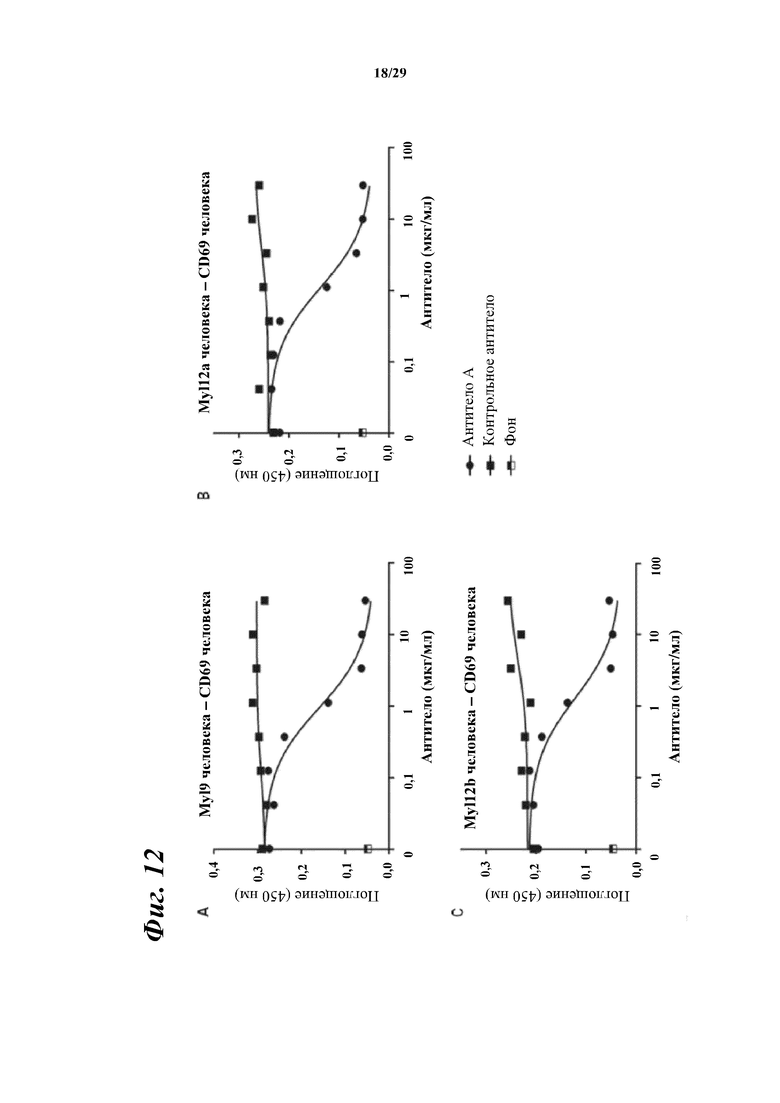
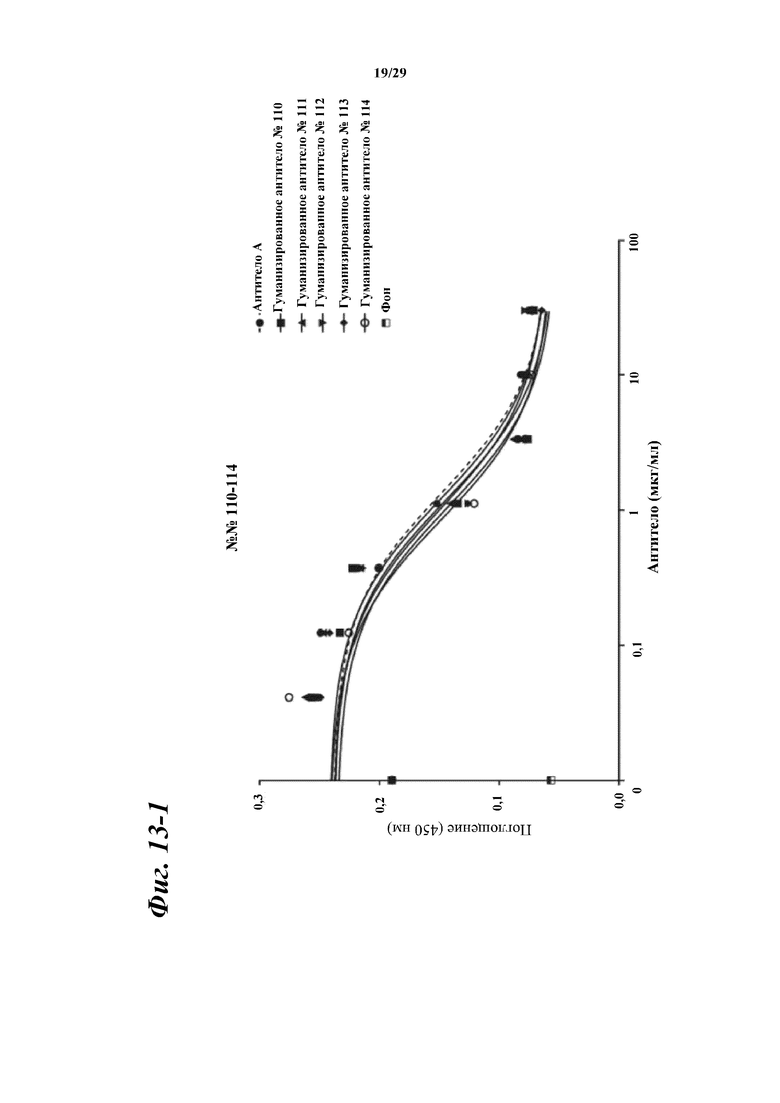
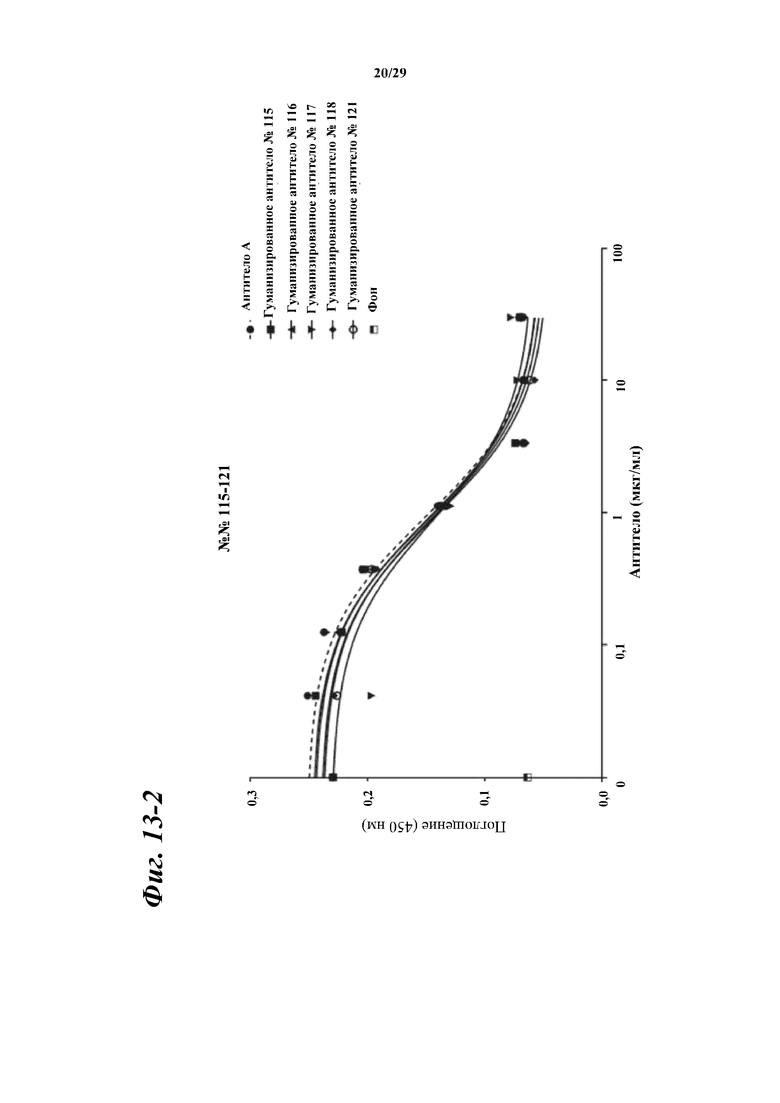
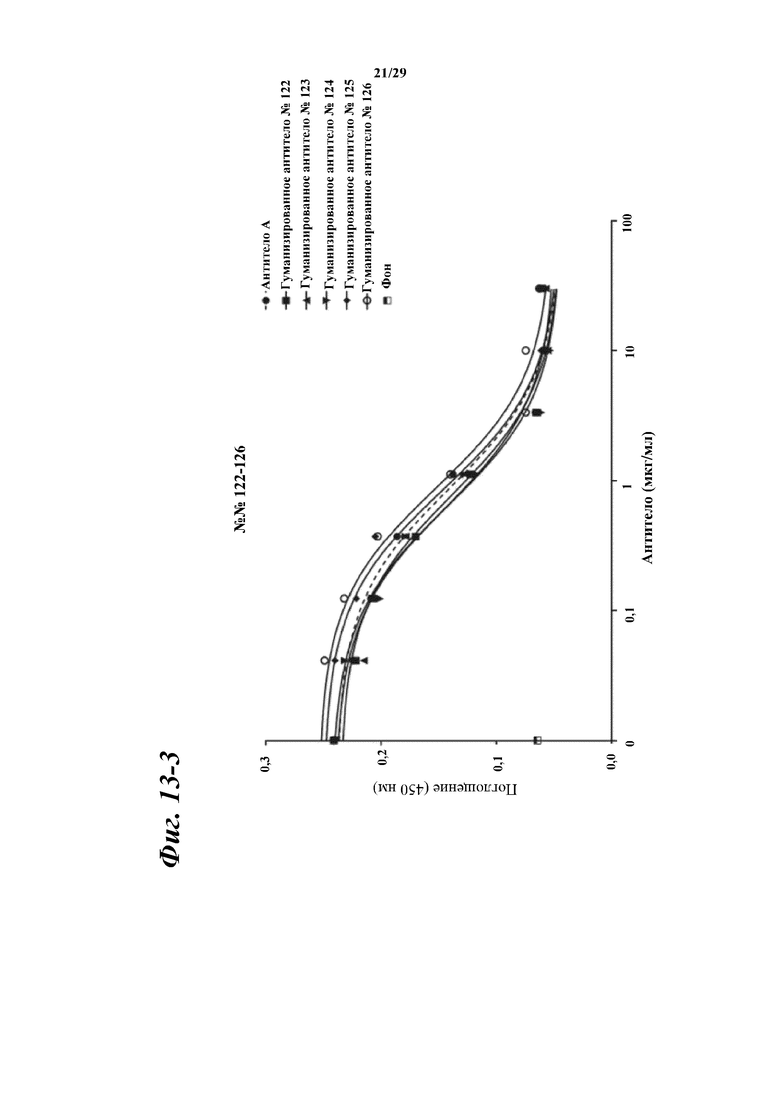
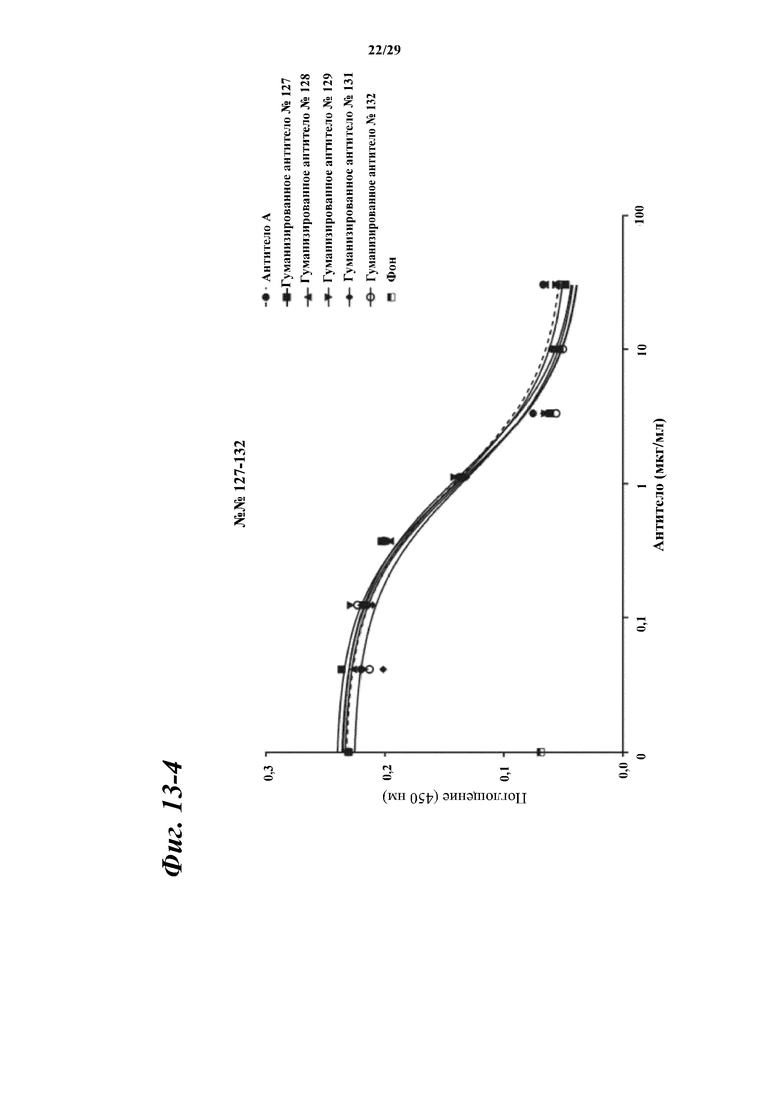
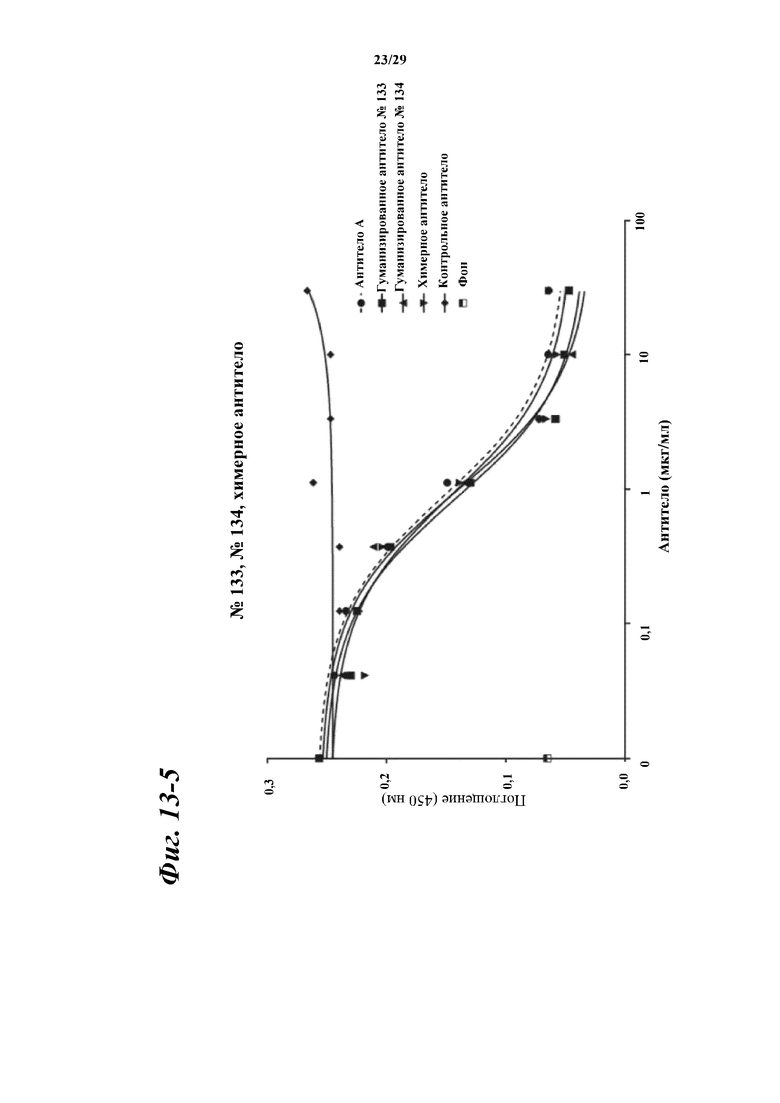
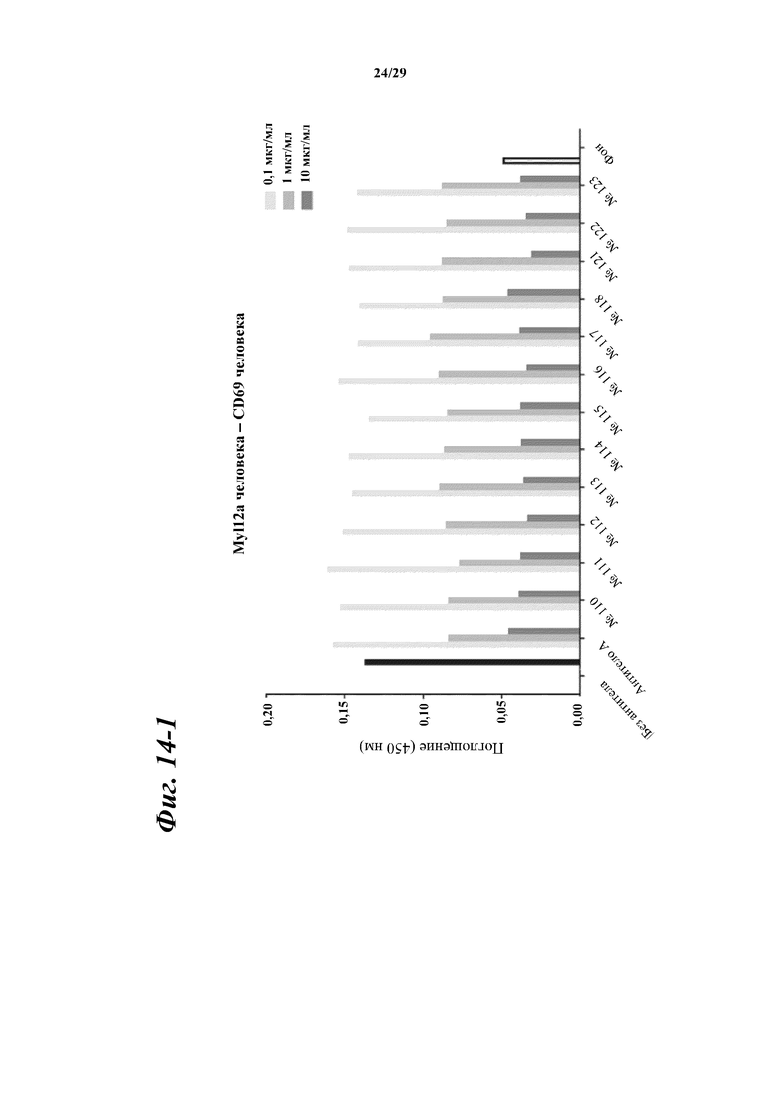
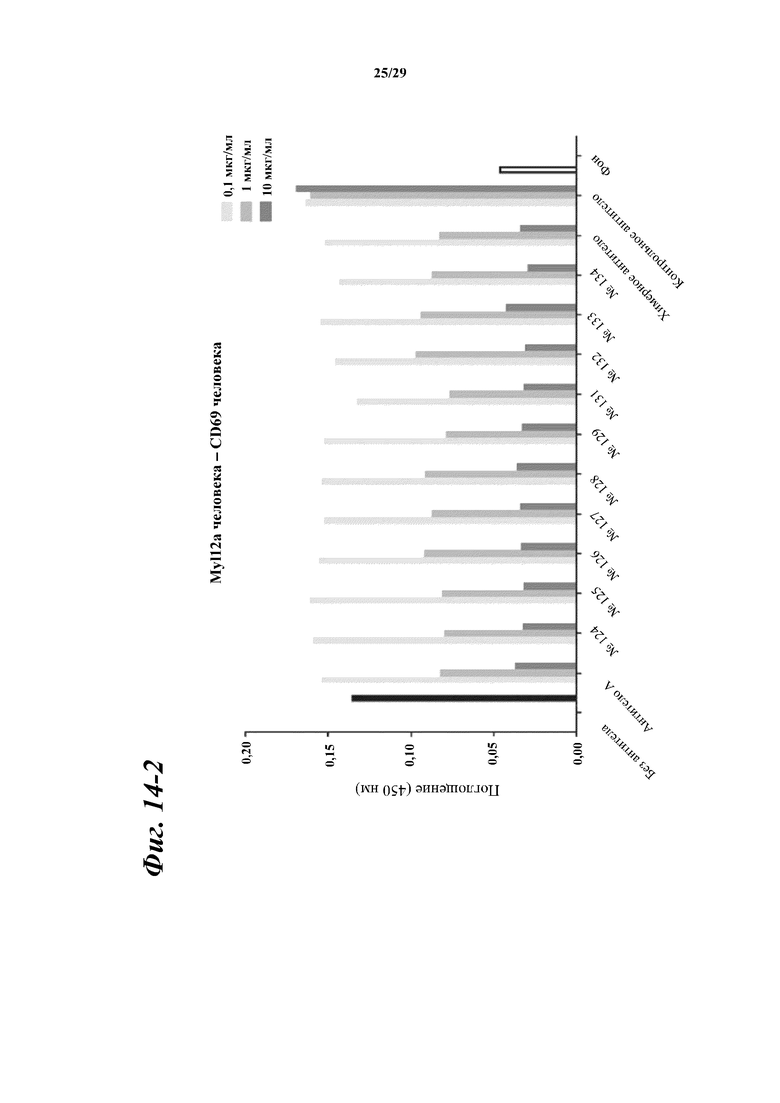
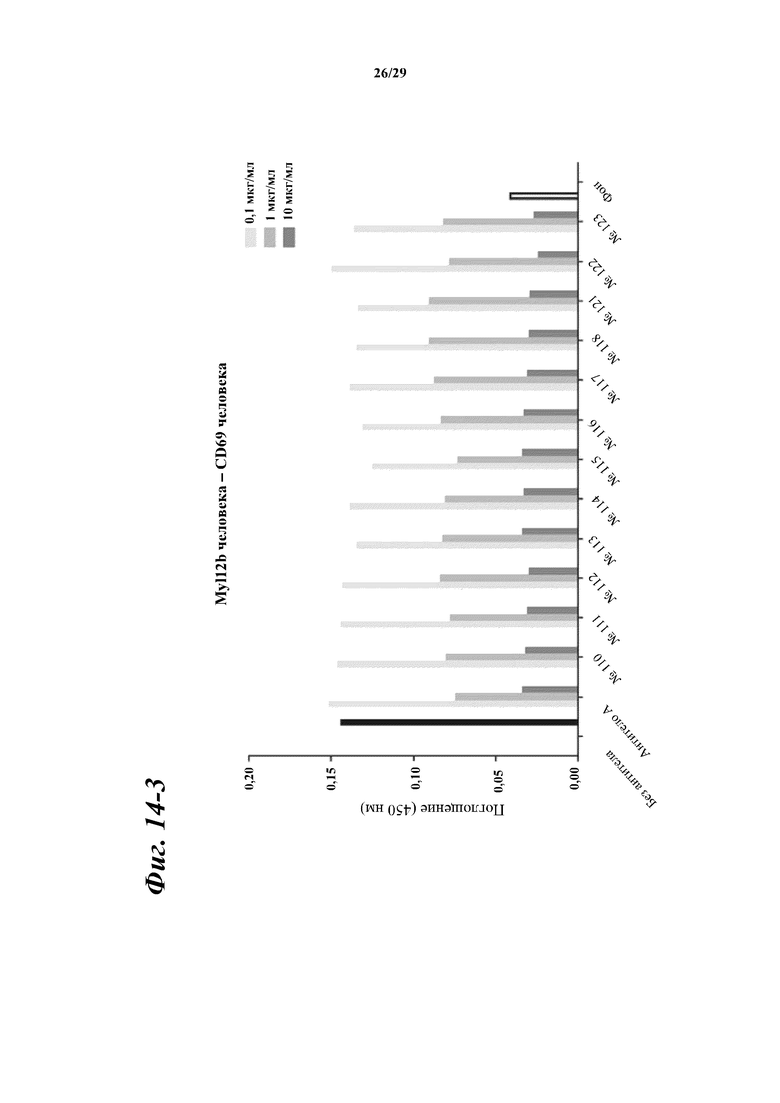
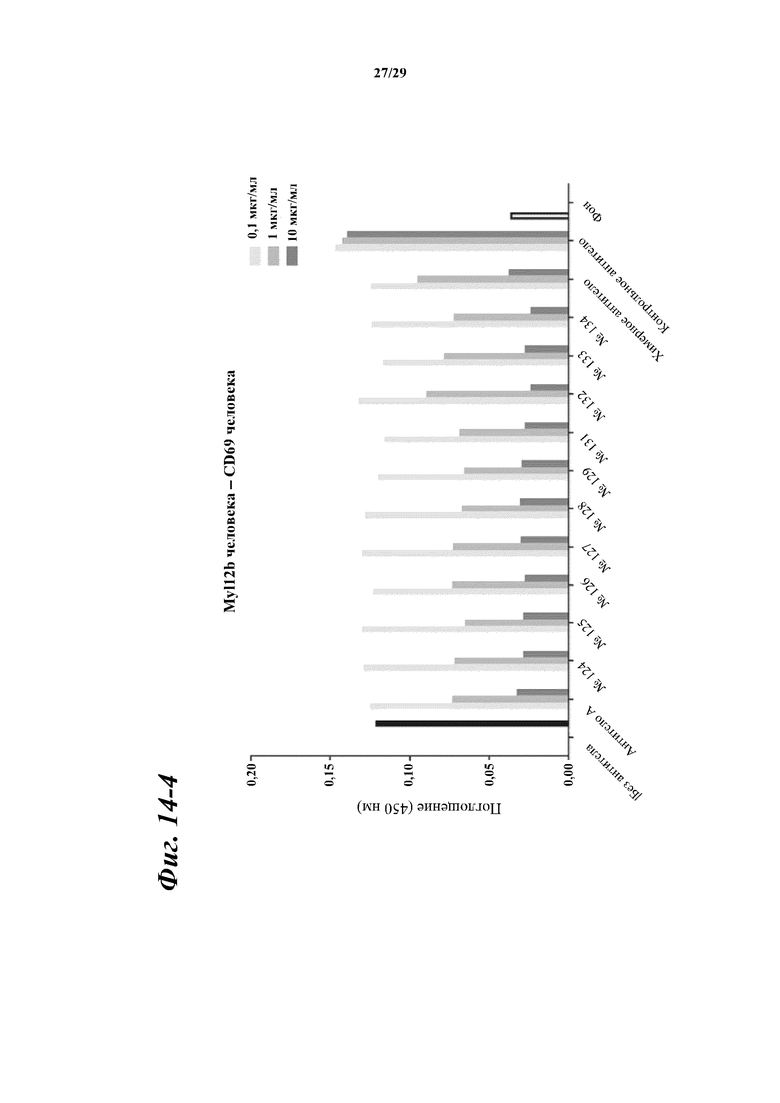
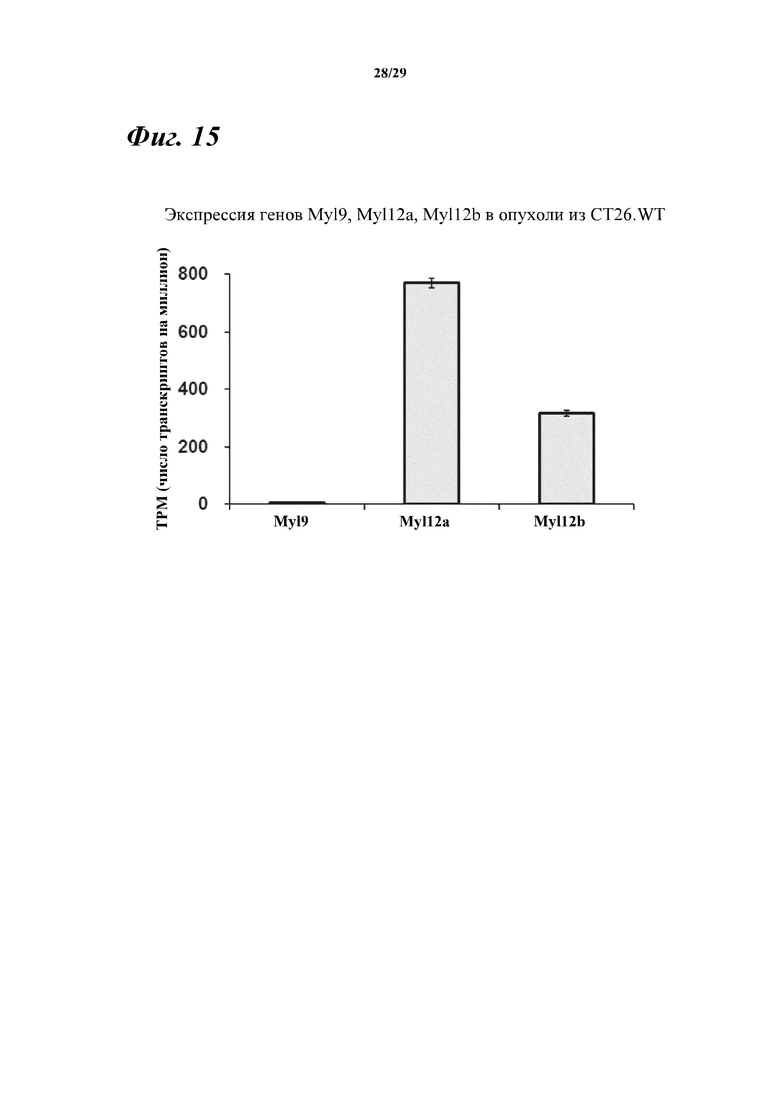
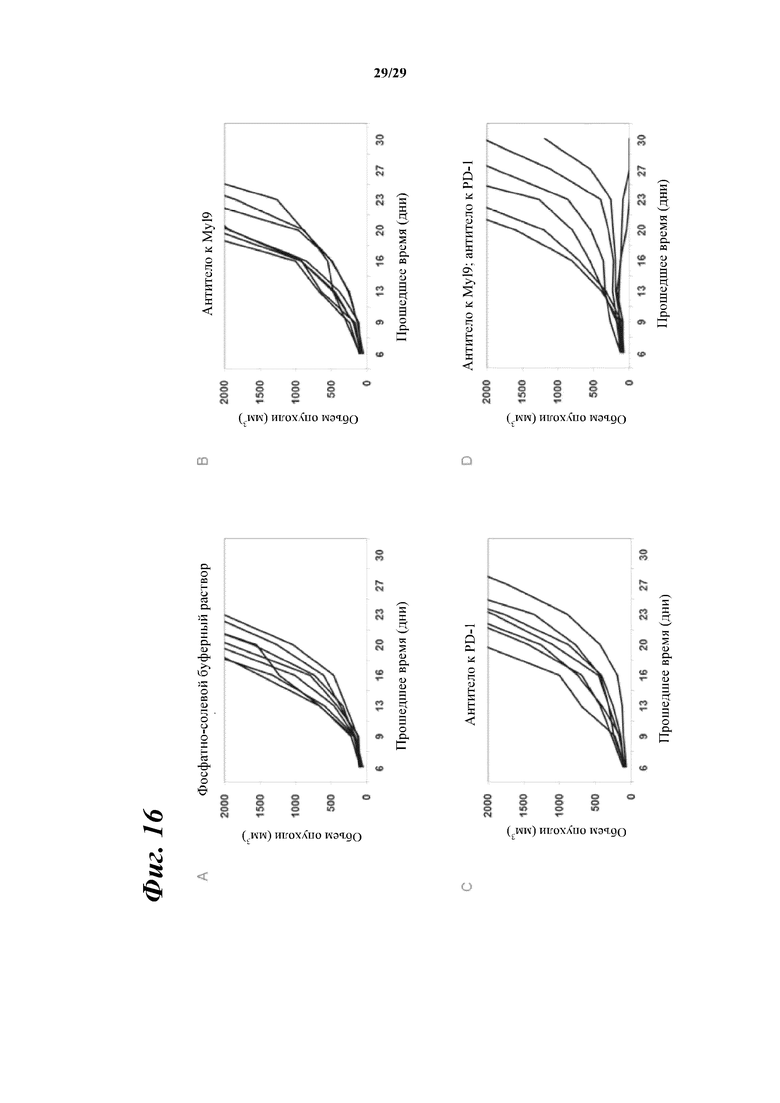
Группа изобретений относится к антителу к полипептиду регуляторной легкой цепи миозина (Myl)9 или его Myl9-связывающему фрагменту и их применению. Предложено антитело к Myl9 или его Myl9-связывающий фрагмент, содержащие (a) CDR1 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью SEQ ID NO: 28, (b) CDR2 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью SEQ ID NO: 30, (c) CDR3 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью SEQ ID NO: 32, (d) CDR1 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью SEQ ID NO: 33, (e) CDR2 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью SEQ ID NO: 34 и (f) CDR3 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью SEQ ID NO: 35. Предложены также варианты антитела к Myl9 или его Myl9-связывающего фрагмента, выделенная нуклеиновая кислота, кодирующая антитело к Myl9 или его Myl9-связывающий фрагмент, вектор экспрессии, содержащий вышеуказанную нуклеиновую кислоту, клетка-хозяин для получения вышеуказанного антитела или его Myl9-связывающего фрагмента, содержащая вектор, способ получения вышеуказанного антитела или его Myl9-связывающего фрагмента, а также фармацевтическая композиция, содержащая терапевтически эффективное количество антитела или его Myl9-связывающего фрагмента. Изобретение позволяет ингибировать взаимодействие между Myl9 и CD69. 9 н. и 16 з.п. ф-лы, 16 ил., 1 табл., 7 пр.
1. Антитело к полипептиду регуляторной легкой цепи миозина (Myl)9 или его Myl9-связывающий фрагмент, содержащее(ий):
(a) CDR1 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 28;
(b) CDR2 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 30;
(c) CDR3 тяжелой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 32;
(d) CDR1 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 33;
(e) CDR2 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 34; и
(f) CDR3 легкой цепи, состоящую из пептида, представленного аминокислотной последовательностью, приведенной под SEQ ID NO: 35.
2. Антитело к Myl9 или его Myl9-связывающий фрагмент по п. 1, где указанное антитело представляет собой гуманизированное или химерное антитело.
3. Антитело к Myl9 или его Myl9-связывающий фрагмент по п. 1 или 2, где указанный Myl9 представляет собой Myl9 человека.
4. Антитело к Myl9 или его Myl9-связывающий фрагмент по любому из пп. 1-3, которые ингибируют взаимодействие между Myl9 и CD69, где
указанное антитело содержит тяжелую цепь и легкую цепь,
вариабельная область указанной тяжелой цепи содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, и
вариабельная область указанной легкой цепи содержит пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65, 66, 67 или 68.
5. Антитело к Myl9 или его Myl9-связывающий фрагмент по любому из пп. 1-4, где указанное антитело выбрано из группы, состоящей из следующих антител:
(1) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(2) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(3) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(4) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(5) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(6) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(7) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(8) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(9) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66;
(10) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(11) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(12) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(13) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(14) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(15) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(16) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(17) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(18) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(19) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65;
(20) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 67;
(21) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66; и
(22) антитела, содержащего вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
6. Антитело к Myl9 или его Myl9-связывающий фрагмент, где указанное антитело выбрано из группы, состоящей из следующих антител:
(1) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(2) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 63, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(3) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 56, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(4) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 57, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(5) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 55, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(6) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 58, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(7) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 59, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(8) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 60, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(9) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 61, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68;
(10) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 65;
(11) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 67;
(12) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 66; и
(13) антитело, содержащее вариабельную область тяжелой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 62, и вариабельную область легкой цепи, содержащую пептид, представленный аминокислотной последовательностью, приведенной под SEQ ID NO: 68.
7. Антитело к Myl9 или его Myl9-связывающий фрагмент по любому из пп. 1-6, которые содержат тяжелую и легкую цепи, где константная область указанной тяжелой цепи принадлежит к IgG.
8. Антитело к Myl9 или его Myl9-связывающий фрагмент по п. 7, где константная область указанной тяжелой цепи представляет собой константную область человеческого IgG2.
9. Антитело к Myl9 или его Myl9-связывающий фрагмент по п. 8, где указанная константная область человеческого IgG2 имеет мутации V234A и G237A.
10. Антитело к Myl9 или его Myl9-связывающий фрагмент по п. 8 или 9, где указанная константная область имеет делецию С-концевого лизинового остатка.
11. Антитело к Myl9 или его Myl9-связывающий фрагмент по п. 7, где константная область указанной легкой цепи включает в себя константную область человеческого Igκ.
12. Антитело к Myl9 или его Myl9-связывающий фрагмент по любому из пп. 1-11, где указанные антитело или его Myl9-связывающий фрагмент ингибируют взаимодействие между Myl12a или Myl12b и CD69.
13. Выделенная нуклеиновая кислота, кодирующая антитело к Myl9 или его Myl9-связывающий фрагмент по любому из пп. 1-12.
14. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 13.
15. Клетка-хозяин для получения антитела к Myl9 или его Myl9-связывающего фрагмента, содержащая вектор по п. 14.
16. Способ получения антитела к Myl9 или его Myl9-связывающего фрагмента, включающий стадию культивирования клетки хозяина по п. 15.
17. Фармацевтическая композиция, содержащая терапевтически эффективное количество антитела или его Myl9-связывающего фрагмента по любому из пп. 1-12 и фармацевтически приемлемый носитель или добавку, для лечения воспалительного заболевания кишечника.
18. Фармацевтическая композиция по п. 17, где воспалительное заболевание кишечника представляет собой неспецифический язвенный колит или болезнь Крона.
19. Фармацевтическая композиция, содержащая терапевтически эффективное количество антитела или его Myl9-связывающего фрагмента по любому из пп. 1-12 и фармацевтически приемлемый носитель или добавку, для лечения аллергического воспаления дыхательных путей.
20. Фармацевтическая композиция, содержащая терапевтически эффективное количество антитела или его Myl9-связывающего фрагмента по любому из пп. 1-12 и и фармацевтически приемлемый носитель или добавку, для лечения опухоли, где фармацевтическая композиция применяется в комбинации с ингибитором контрольных точек иммунного ответа.
21. Фармацевтическая композиция по п. 20, где ингибитор контрольных точек иммунного ответа представляет собой ингибитор PD-1.
22. Фармацевтическая композиция по п. 21, где ингибитор PD-1 представляет собой антитело к PD-1 или антитело к PD-L1.
23. Фармацевтическая композиция по п. 21, где ингибитор PD-1 представляет собой антитело к PD-1.
24. Фармацевтическая композиция по любому из пп. 20-23, где опухоль выбрана из группы, состоящей из рака ободочной и прямой кишки, злокачественной меланомы, немелкоклеточного рака легкого, почечноклеточной карциномы, злокачественной лимфомы, множественной миеломы, рака головы и шеи, уротелиального рака, рака молочной железы, гепатоцеллюлярной карциномы, рака желудка, рака пищевода, рака яичника, мелкоклеточного рака легкого, мезотелиомы и рака эндометрия.
25. Фармацевтическая композиция по п. 24, где опухоль представляет собой рак ободочной и прямой кишки.
| WO 2014192915 A1, 04.12.2014 | |||
| WO 2015190538 A1, 17.12.2015 | |||
| WO 2010123012 A1, 28.10.2010 | |||
| PARK I | |||
| et al | |||
| Myosin regulatory light chains are required to maintain the stability of myosin II and cellular integrity | |||
| Biochem J | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| АЛЬТШУЛЕР Е.П | |||
| и др | |||
| Получение рекомбинантных антител и способы увеличения их аффинности | |||
| Успехи | |||
Авторы
Даты
2021-01-28—Публикация
2017-01-11—Подача