Область изобретения
Данное изобретение относится к полностью гуманизированным антителам и их фрагментам, и, в частности, к полностью гуманизированным антителам, которые обладают специфичностью связывания с Toll-подобным рецептором 2 (TLR2, TLR-2). Изобретение также распространяется на применение указанных полностью гуманизированных антител для лечения и профилактики воспалительных и аутоиммунных заболеваний, опосредованных активацией Toll-подобного рецептора 2 и передачей сигнала через него.
Уровень техники
Toll-подобные рецепторы (TLR) образуют семейство рецепторов, распознающих паттерны, которые играют ключевую роль в формировании врожденного иммунного ответа, а также участвуют в восстановлении тканей, поддержании целостности тканей и развитии опухолей. На сегодняшний день у людей выявлено одиннадцать Toll-подобных рецепторов. Члены семейства Toll-подобных рецептор являются высоко консервативными, при этом большинство видов млекопитающих имеют от 10 до 15 Toll-подобных рецепторов. Каждый Toll-подобный рецептор распознает специфические патоген-связанные молекулярные мотивы. Toll-подобный рецептор 2 (TLR2, CD282, TLR-2) может быть активирован пептидогликаном, липопротеинами, липотейхоевой кислотой и эндогенными лигандами.
Известно множество моноклональных антител, которые обладают специфичностью связывания с Toll-подобным рецептором 2. WO 01/36488 раскрывает антитело, обозначенное как TL2.1, которое получено из гибридомной клеточной линии, сданной на хранение в соответствии с Будапештским договором в Европейскую коллекцию клеточных культур (ЕСАСС) под регистрационным номером 99102832. Это антитело выступает антагонистом активации Toll-подобного рецептора 2, экспрессированного на клетках человека.
WO 2005/028509 раскрывает мышиное моноклональное антитело, обозначенное как Т2.5, которое специфически ингибирует активацию TLR2 млекопитающих. Показано, что моноклональное антитело Т2.5 перекрестие реагирует как с человеческой, так и с мышиной формами TLR2. Этот документ также содержит экспериментальные данные, которые показывают, что мышиное моноклональное анти-TLR2-антитело TL2.1, описанное в WO 01/36488, перекрестно не реагирует ни с человеческой, ни с мышиной формами TLR2, как было указано в описании этой патентной заявки. Точнее, в WO 2005/028509 показано, что антитело TL2.1 связывается только с человеческим Toll-подобным рецептором 2, но не с мышиным Toll-подобным рецептором 2. Моноклональное антитело Т2.5 из WO 2005/028509 было сконструировано против внеклеточного домена TLR2, и поэтому оно обладает специфичностью связывания с эпитопом в этой области Toll-подобного рецептора 2.
WO 2005/019431 раскрывает антитело, которое обладает специфичностью связывания с TLR2 и обозначено как 11G7. Это мышиное антитело может быть получено из гибридомной клеточной линии 11G7, сданной на хранение в Американскую коллекцию типовых культур (АТСС) под обозначением РТА-5014. Моноклональное антитело 11G7 селективно связывается с внеклеточным доменом TLR2 и может блокировать индукцию продукции цитокинов человеческими мононуклеарами периферической крови (МНПК), стимулированными агонистом, который активирует гетеродимер, образующийся между Toll-подобным рецептором 1 (TLR1) и TLR2. Антитело 11G7 не ингибирует продукцию цитокинов клетками МНПК, стимулированными агонистом, который индуцирует сигнал через гетеродимер, образованный между Toll-подобным рецептором 6 (TLR6) и TLR2.
Было показано, что применение моноклональных антител грызунов, например мышиных моноклональных антител, в терапевтических целях in vivo связано с развитием нежелательных иммунных реакций, которые развиваются у субъекта, которому вводится антитело. Такие иммунные реакции могут привести к выработке антител, которые эффективно нейтрализуют эффективность терапевтического антитела. Такие иммунные реакции, как правило, относятся к ответу в виде человеческого антимышиного антитела (НАМА, human anti-mouse antibody). НАМА-ответы ставят под угрозу терапевтическую эффективность введенного антитела различным образом, в том числе нарушая способность терапевтического антитела связывать его цель, и это ставит под угрозу терапевтический эффект антитела.
Для решения проблемы нежелательных НАМА-ответов, развивающихся у лиц против вводимых терапевтических антител, был разработан ряд подходов. Как правило, эти подходы включают методики, которые приводят к замене некоторых компонентов мышиного антитела на эквивалентные части, полученные из человеческого антитела. Такие подходы могут, например, приводить к продукции химерных антител, которые содержат мышиные вариабельные области, соединенные с константными областями человеческого происхождения. Кроме того, может быть использована методика, известная как «CDR-прививка», в которой определяющие комплементарность области (CDR) из мышиного антитела привиты каркасной области, предусмотренной областями вариабельных доменов легкой и тяжелой цепей человеческого антитела. Это приводит к продукции антитела, которое сохраняет специфичность связывания с мышиным антителом, но в котором только нечеловеческие компоненты являются привитыми мышиными CDR-областями.
Тем не менее, в обоих этих подходах терапевтическая эффективность полученного гуманизированного антитела может быть нарушена. Например, компонент мышиной вариабельной области химерного антитела все еще может стать основанием для НАМА-ответа. Кроме того, было отмечено, что если продуцируются CDR-привитые гуманизированные антитела, то простая трансплантация CDR-областей часто приводит к снижению терапевтической эффективности антитела из-за уменьшения аффинности связывания антитела.
Поэтому изобретатель указал на необходимость получить полностью гуманизированные моноклональные антитела, которые обладают специфичностью связывания с Toll-подобным рецептором 2 и выступают антагонистами функции TLR2, но являются преимущественно неиммуногенными у людей. После продолжительных экспериментов изобретатель получил полностью гуманизированное моноклональное антитело, которое обладает специфичностью связывания с человеческим Toll-подобным рецептором 2 и которое является антагонистом функции TLR2 независимо от того, формирует ли Toll-подобный рецептор 2 гетеродимер с Toll-подобным рецептором 1 или с Toll-подобным рецептором 6. Это антагонистическое антитело TLR2 не производится по ранее известным химерной методике или методике CDR-прививки и, следовательно, не содержит никаких мышиных аминокислотных остатков. Кроме того, было показано, что антитело опосредует TLR2-нейтрализацию без необходимости связываться с антигеном CD32 на клеточной поверхности, что является функциональным требованием других известных антагонистических антител к Toll-подобному рецептору 2. Кроме того, полностью гуманизированное антитело изобретения является первым полностью человеческим TLR2-нейтрализующим антителом, известным в данной области. Антитело не демонстрирует никакие Т-клеточные эпитопы, и поэтому при его введении у субъекта не развиваются нейтрализующие антитела против него. Анти-TLR2-антагонистические антитела также демонстрируют высокий уровень перекрестной реактивности с Toll-подобным рецептором 2, экспрессирующимся на широком спектре клеток млекопитающих, при этом удивительным образом наблюдается связывание полностью гуманизированного антитела с Toll-подобным рецептором 2, экспрессированным на клетках человека, мыши и обезьяны.
Краткое описание изобретения
В соответствии с первым аспектом изобретения предусмотрено нейтрализующее антитело или его антиген-связывающая часть, которая способна специфически связываться с Toll-подобным рецептором 2 (TLR2, CD282, TLR-2), где антитело или его антиген-связывающая часть включает в себя, состоит или в основном состоит из легкой цепи и тяжелой цепи, где вариабельная область легкой цепи (VL) включает аминокислотную последовательность, идентичную или по существу гомологичную аминокислотной последовательности SEQ ID №1, и где вариабельная область тяжелой цепи (VH) включает в себя, состоит или в основном состоит из аминокислотной последовательности, идентичной или по существу гомологичной аминокислотной последовательности SEQ ID №4.
Как определено в данном документе, термин «нейтрализующее антитело» описывает антитело, которое способно нейтрализовать биологическую активацию Toll-подобного рецептора 2 и передачу сигнала через него. Нейтрализующее антитело, которое также может быть отнесено к антагонистическому антителу, или блокирующее антитело, специфически и предпочтительно селективно связывается с Toll-подобным рецептором 2 и ингибирует одну или более биологическую активность Toll-подобного рецептора 2. Например, нейтрализующее антитело может ингибировать связывание лиганда или субстрата, такого как лиганд Toll-подобного рецептора 2, с сайтом связывания лиганда Toll-подобного рецептора 2. Кроме того, нейтрализующее антитело может предотвратить активацию Toll-подобного рецептора 2, уже связанного лигандом-агонистом, например, нарушая связывание лиганда-агониста. Как правило, нейтрализующее антитело селективно связывает Toll-подобный рецептор 2 и, следовательно, по существу не связывает другие члены семейства Toll-подобных рецепторов (например, Toll-подобный рецептор 4) в физиологических или терапевтических условиях.
В некоторых воплощениях антитело, нейтрализующее Toll-подобный рецептор 2, опосредует антагонизм функциональной активности Toll-подобного рецептора 2 независимо от требований антитела против Toll-подобного рецептора 2 или его связывающего фрагмента в отношении связывания с CD32 (Fc-гамма рецептором II (FcyRII, FcgRII), в частности CD32a и/или CD32b. Соответственно, нейтрализация Toll-подобного рецептора 2 не требует связывания антитела, и в частности Fc-части антитела или фрагмента антитела, с CD32.
Как правило, антитела против Toll-подобного рецептора 2 данного изобретения характеризуются тем, что они не содержат каких-либо связывающих эпитопов, против которых может быть опосредован иммунный ответ, когда субъекту, в частности человеку, вводят антитело. Такая характеристика важна для предотвращения образования нейтрализующих антител против антител изобретения у субъекта, которому вводят антитела, так как терапевтическая эффективность антител может быть сильно нарушена, если возникает такой иммунный ответ.
Как правило, нейтрализующее антитело против Toll-подобного рецептора 2 является полностью гуманизированным антителом. Т.е. все комбинации аминокислотных остатков, которые содержит антитело, имеют полностью человеческое происхождение и поэтому не содержат, например, человеческих и нечеловеческих областей. В частности, антитело изобретения включает только последовательности вариабельной области человека. Следовательно, антитело изобретения отличается, например, от химерного моноклонального антитела, которое состоит из аминокислотных остатков, полученных и из мышиной, и из человеческой вариабельных областей тяжелой и легкой цепей, или от CDR-привитого «гуманизированного» антитела, где определяющие комплементарность области (CDR) вариабельных областей тяжелой и легкой цепей содержат аминокислотные остатки, полученные из мышиного антитела, в то время как связанные каркасные области (FR) антитела и константные области (CR) получены из человеческого антитела. Таким образом, полностью гуманизированное антитело изобретения имеет вариабельные и константные области как тяжелой, так и легкой цепей, каждая из которых имеет человеческое происхождение или по существу идентична последовательности человеческого происхождения, хотя и не обязательно из этого же антитела. Полностью гуманизированные антитела изобретения в дальнейшем могут называться «гуманизированными» антителами или антителами, полученными полностью из человеческих последовательностей.
Аминокислотная последовательность вариабельной области легкой цепи (VL) антитела изобретения показана ниже как SEQ ID №1:
DIVLTQSPATLSLSPGERATLSCRASESVEYYGTSLMQWYQQKPGQPPKLLIFG ASNVESGVPDRFSGSGSGTDFTLKISRVEAEDVGMYFCQQSRKLPWTFGGGTKVEIK
В SEQ ID №1, как показано на фиг.1, подчеркнутые остатки относятся к месту областей, определяющих комплементарность, где остатки с 24 по 34 относятся к CDR1, остатки с 50 по 56 относятся к CDR2, и остатки с 89 по 97 относятся к CDR3. На фиг.1В показана нуклеотидная последовательность вариабельной легкой цепи и выведенная аминокислотная последовательность. На этой фиг. остатки домена легкой цепи условно пронумерованы в соответствии с системой нумерации Кабат (Kabat EA et al. (1991) Sequences of proteins of immunological interest, 5th edition. Bethesda: US Department of Health and Human Services).
Следует отметить, что выявление этих CDR-остатков согласуется с остатками, приданными CDR-областям с использованием системы нумерации Кабат, где VLCDR1 (т.е. определяющая комплементарность область 1 вариабельного домена легкой цепи) содержит остатки с 24 по 34, VLCDR2 (определяющая комплементарность область 1 вариабельного домена легкой цепи) содержит остатки с 50 по 56, и VLCDR3 (определяющая комплементарность область 1 вариабельного домена легкой цепи) содержит остатки с 89 по 97.
Как определено в данном документе, аминокислотная последовательность, которая существенно гомологична аминокислотной последовательности SEQ ID №1, обозначает аминокислотную последовательность, которая по меньшей мере на 90% идентична, более предпочтительно на 95% идентична и наиболее предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID №1 на протяжении не менее 20, 50 или 100 аминокислот или на всей длине последовательности. Как правило, такие гомологичные аминокислотные последовательности будут обладать специфичностью связывания с Toll-подобным рецептором 2 и, при связывании с Toll-подобным рецептором 2, они будут выступать антагонистами функциональной активности Toll-подобного рецептора 2.
Как правило, вариабельная область легкой цепи (VL) соединяется с константным доменом (CL) человеческого иммуноглобулина Каппа для образования легкой цепи, при этом указанная легкая цепь является легкой цепью гуманизированного антитела.
Соответственно, в некоторых воплощениях, где антитело или связывающий представитель изобретения содержит легкую цепь, эта легкая цепь имеет аминокислотную последовательность SEQ ID №2:
DIVLTQSPATLSLSPGERATLSCRASESVEYYGTSLMQWYQQKPGQPPKLLIFG ASNVESGVPDRFSGSGSGTDFTLKISRVEAEDVGMYFCQQSRKLPWTFGGGTKVEIKR TVAAPSVFIFPPSDEQLKSGTASWCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQ DSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
В некоторых других воплощениях изобретение распространяется на антитело или связывающего представителя, включающего легкую цепь, которая включает в себя, состоит или в основном состоит из аминокислотной последовательности, которая по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и наиболее предпочтительно на 98% идентична аминокислотной последовательности SEQ ID №2. Как правило, антитело, которое включает аминокислотную последовательность, идентичную по меньшей мере на 80% или более с аминокислотной последовательностью SEQ ID №2, будет специфически связываться с Toll-подобным рецептором 2 и при связывании с ним будет служить антагонистом функциональной активности Toll-подобного рецептора 2.
В некоторых воплощениях аминокислотная последовательность легкой цепи, определенная в SEQ ID №2 и показанная на фиг.3, кодируется нуклеотидной последовательностью SEQ ID №3, показанной на фиг.4. В последовательности SEQ ID №: 3, показанной на фиг.4, подчеркнутые нуклеиновые кислоты кодируют аминокислоты вариабельной области легкой цепи.
В одном воплощении аминокислотная последовательность вариабельной области тяжелой цепи (VH) показана ниже как SEQ ID №4:
QVQLVQSGSELKKPGASVKLSCKASGFTFTTYGINWVRQAPGQGLEWIGWIYP RDGSTNFNENFKDRATITVDTSASTAYMELSSLRSEDTAVYFCARLTGGTFLDYWGQG TTVTVSS
В SEQ ID №4, показанной на фиг.2, подчеркнутые остатки относятся к аминокислотным остаткам трех областей, определяющих комплементарность, в которых остатки с 31 по 35 относятся к CDR1 (VHCDR1 (определяющая комплементарность область 1 вариабельного домена тяжелой цепи), остатки с 50 по 65 относятся к CDR2 (VHCDR2), и остатки с 95 по 103 относятся к CDR3 (VHCDR3). Следует отметить, что положение этих остатков CDR немного отличается от положения, обычно приписываемого CDR-областям с использованием системы нумерации Кабат, где CDR1 представлен остатками с 31 по 35, CDR2 представлен остатками с 50 по 66, а CDR3 представлен остатками с 95 по 103.
Под упоминаемой в данном документе аминокислотной последовательностью, которая по существу гомологична аминокислотной последовательности SEQ ID №4, понимается аминокислотная последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, более предпочтительно на 95% идентична аминокислотной последовательности и наиболее предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID №4 на протяжении не менее 20, 50 или 100 аминокислот. В некоторых других воплощениях изобретение распространяется на антитело или связывающий представитель, содержащий вариабельный домен тяжелой цепи (VH), который содержит, состоит или в основном состоит из аминокислотной последовательности, гомологичной по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и наиболее предпочтительно на 98% аминокислотной последовательности SEQ ID №4.
Как правило, вариабельная область тяжелой цепи (VH) соединена с другой аминокислотной последовательностью, которая содержит по меньшей мере один иммуноглобулиновый константный домен. В некоторых воплощениях иммуноглобулиновый константный домен получают из антитела подкласса IgG (иммуноглобулин G), формируя полную тяжелую цепь гуманизированного антитела изобретения. Таким образом, указанный константный домен может состоять из СН1, СН2 и СН3 вместе с подходящим линкером, расположенным между указанными доменами СН1 и СН2.
В некоторых воплощениях иммуноглобулиновые константные домены получены из иммуноглобулина изотипа IgG, как правило, иммуноглобулина G изотипа 4 (IgG4). Антитела IgG4 являются динамическими молекулами, которые обменивают Fab-ветви путем замены тяжелой цепи и присоединенной легкой цепи (половина молекулы) парой тяжелая цепь-легкая цепь из другой молекулы; эта замена приводит к образованию биспецифических антител. Таким образом, в некоторых воплощениях вносят по меньшей мере одну мутацию в аминокислотную последовательность по меньшей мере одного константного домена иммуноглобулина lgG4 для предотвращения замены Fab-ветви. Таким образом, в некоторых воплощениях изобретения, где антитело или фрагмент антитела состоит из константных доменов, полученных из IgG4, мутация аминокислотного остатка 241 тяжелой цепи, расположенная в шарнирной области, будет выполняться так, что остаток серина заменяется на остаток пролина (S241P) (как описано в Angal S. etal. Molecular Immunology. 1993. Vol.30. No.1. p105-108).
Таким образом, в некоторых воплощениях аминокислотные остатки, используемые как остатки константных доменов тяжелой и легкой цепи, получены из иммуноглобулина изотипа lgG4. В некоторых других воплощениях иммуноглобулин получают из иммуноглобулина подкласса IgG и изотипа IgG1, IgG2 или IgG3. В некоторых других воплощениях аминокислотные остатки, используемые как остатки константных доменов тяжелой и легкой цепи, получены из иммуноглобулина подтипа IgA.
В различных других воплощениях одна или более мутация, замена, делеция или вставка может быть внесена в аминокислотную последовательность константного домена антитела для того, чтобы изменить функциональные свойства антитела. Например, по меньшей мере одна аминокислотная мутация, вставка, удаление и/или замена может быть сделана в аминокислотных остатках константного домена для изменения по меньшей мере одного свойства, выбранного среди: эффекторной функции, активности или времени полужизни антитела, но не ограничиваясь ими.
В некоторых воплощениях аминокислотная последовательность тяжелой цепи антитела в соответствии с данным изобретением, которая включает домены VH-CH1-CH2-CH3 и которая также включает шарнирную область, приведена ниже как SEQ ID №5:
QVQLVQSGSELKKPGASVKLSCKASGFTFTTYGINWVRQAPGQGLEWIGWIYP RDGSTNFNENFKDRATITVDTSASTAYMELSSLRSEDTAVYFCARLTGGTFLDYWGQG TTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHT FPAVLQSSGLYSLSSWTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCP APEFLGGPSVFLFPPKPKDTLMISRTPEVTCWVDVSQEDPEVQFNWYVDGVEVHNAK TKPREEQFNSTYRWSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQ VYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFF LYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK
В некоторых других воплощениях изобретение распространяется на антитело или связывающий представитель, содержащий тяжелую цепь, которая содержит гомологичную аминокислотную последовательность с идентичностью аминокислотной последовательности по меньшей мере 80%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно 98% с аминокислотной последовательностью SEQ ID №5.
В некоторых воплощениях аминокислотная последовательность тяжелой цепи, указанная в SEQ ID №5 и показанная на фиг.5, кодируется нуклеотидной последовательностью SEQ ID №6, показанной на фиг.6. В последовательности SEQ ID №5, показанной на фиг.5, остатки, выделенные жирным шрифтом, представляют шарнирную область, остатки, выделенные курсивом, являются остатками константного домена СН1, подчеркнутые остатки являются остатками константного домена СН2, а остатки, перечисленные после подчеркнутых остатков, являются остатками константного домена СН3. В некоторых воплощениях константные домены СН1, СН2 и/или СНЗ могут быть заменены, целиком или частично, доменом СН1, СН2 или СН3, полученным из любого подходящего подтипа иммуноглобулина, такого как, но не ограничиваясь ими, IgG1, IgG2, IgA или IgM. В некоторых воплощениях также может быть предложена делеция, добавление или замена по меньшей мере одного аминокислотного остатка, находящегося в любом константном домене. Как правило, указанные делеции, добавления или замены приводят к функциональному изменению связывающих свойств Fc-части антитела или фрагмента антитела, и, в частности, к модуляции способности Fc-области антитела связываться с Fc-рецептором и опосредовать эффекторные функции.
В некоторых других воплощениях данное изобретение распространяется на выделенное антитело, включающее вариабельный домен легкой цепи SEQ ID №1 или вариант, который по меньшей мере на 90% идентичен его аминокислотной последовательности, и вариабельный домен тяжелой цепи SEQ ID №4 или вариант, который по меньшей мере на 90% идентичен его аминокислотной последовательности.
В некоторых других воплощениях предусмотрено антитело, сформированное из легкой цепи с аминокислотной последовательностью SEQ ID №2 или варианта, по меньшей мере на 90% идентичного ее последовательности, и тяжелой цепи с аминокислотной последовательностью SEQ ID №5 или варианта, по меньшей мере на 90% идентичного ее последовательности.
Следует иметь в виду, что вариабельный и константный домены как легкой, так и тяжелой цепей для применения в изготовлении антител и фрагментов антител данного изобретения, могут включать варианты этих доменов, например, указанные вариабельный и константный домены могут содержать одно или больше аминокислотное изменение по сравнению с последовательностью этих доменов, описанной в данном документе. Следует отметить, что вариантные константные домены могут быть длиннее или короче, чем константные домены, описанные в данном документе. В некоторых воплощениях вариантные вариабельные или константные домены могут иметь гомологию последовательности по меньшей мере с 90% идентичностью или сходством с константным доменом антитела дикого типа.
Упоминаемая в данном документе «гомология последовательностей» также может быть указана как идентичность последовательностей или сходство последовательностей. Термин «идентичность» или «идентичность последовательностей», используемый в данном документе, означает, что в той или иной конкретной позиции в выравниваемых последовательностях аминокислотные остатки идентичны. Термин «сходство» или «сходство последовательностей», используемый в данном документе, означает, что в любой конкретной позиции в выровненных последовательностях аминокислотный остаток принадлежит одному типу. Например, лейцин может быть заменен на остаток изолейцина или валина. Это может быть указано как консервативная замена. Предпочтительно, когда аминокислотные последовательности изобретения модифицированы путем консервативной замены любого из аминокислотных остатков, содержащихся в них; эти изменения не влияют на специфичность связывания и функциональную активность полученного антитела по сравнению с немодифицированным антителом.
Гомология последовательностей или идентичность последовательностей по отношению к (нативному) полипептиду изобретения и его функциональному производному относится к проценту аминокислотных остатков в кандидатной последовательности, которые совпадают с остатками соответствующего нативного полипептида после выравнивания последовательностей и введения пробелов, если это необходимо, для достижения максимального процента гомологии, и не рассматривает никакие консервативные замены как часть идентичности последовательности. Ни N-, ни С-концевое удлинение, ни вставки не должны толковаться как уменьшение идентичности или гомологии последовательностей. Специалистам в этой области хорошо известны способы и компьютерные программы для выполнения выравнивания двух или более аминокислотных последовательностей и определения идентичности или гомологии их последовательностей. Например, процент идентичности или сходства двух аминокислотных последовательностей легко вычислить с помощью алгоритмов, например, BLAST (Altschul et al. 1990), FASTA (Pearson & Lipman 1988) или алгоритма Смита-Вотермана (Smith & Waterman, 1981).
В еще одном аспекте данное изобретение предусматривает полностью гуманизированное антитело, которое обладает специфичностью связывания с эпитопом, присутствующим на Toll-подобном рецепторе 2, который распознается мышиным моноклональным антителом Т2.5, где указанное человеческое антитело включает:
- легкую цепь, где вариабельная область включает, состоит или в основном состоит из аминокислотной последовательности SEQ ID №1,
- тяжелую цепь, где вариабельный домен включает, состоит или в основном состоит из аминокислотной последовательности SEQ ID №4.
В некоторых воплощениях антитело может быть конъюгировано по меньшей мере с одним эффектором или репортерной молекулой.
В некоторых других аспектах данное изобретение распространяется на полностью гуманизированное моноклональное антитело, обозначаемое как OPN-305, которое включает вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID №1 и вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID №4. Антитело OPN-305 также может быть определено как имеющее легкую цепь, состоящую из или состоящую в основном из аминокислотной последовательности SEQ ID №2, и тяжелую цепь, состоящую из или состоящую в основном из аминокислотной последовательности SEQ ID №5.
Термин «состоит в основном из» или «состоящий в основном из», используемый в данном документе, означает, что полипептид может иметь дополнительные особенности или элементы, кроме описанных, при условии, что такие дополнительные особенности или элементы существенно не влияют на способность антитела или фрагмента антитела специфически связываться с Toll-подобным рецептором 2. Т.е. антитело или фрагменты антитела, включающие полипептиды, могут иметь дополнительные особенности или элементы, которые не влияют на способность антитела или фрагментов антител связываться с Toll-подобным рецептором 2 и выступать антагонистами функциональной активности Toll-подобного рецептора 2, например изменения, внесенные в аминокислотную последовательность для уменьшения иммуногенности антитела. Например, полипептид, состоящий в основном из специфической последовательности, может содержать один, два, три, четыре, пять или более дополнительных аминокислот на одном или обоих концах последовательности при условии, что дополнительные аминокислоты не мешают, не ингибируют, не блокируют и не прерывают роль полипептида в антителе или фрагменте антитела. Точно так же полипептидная молекула, которая способствует антагонистическим антителам к Toll-подобному рецептору 2 изобретения, может быть химически модифицирована одной или более функциональной группой, при условии, что такие функциональные группы не влияют на способность антитела или фрагмента антитела связываться с Toll-подобным рецептором 2 и выступать антагонистом его функции.
В некоторых других аспектах данное изобретение распространяется на выделенное, полностью гуманизированное моноклональное антитело, которое содержит вариабельную область легкой цепи, которая включает, состоит или в основном состоит из аминокислотной последовательности SEQ ID №1, и/или вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID №4.
Как определено в данном документе, «полностью гуманизированное» антитело относится к антителу, имеющему вариабельную область, в которой каркасные области (FR), константные области (CR) и области, определяющие комплементарность (CDR), получены из человеческих зародышевых иммуноглобулиновых последовательностей. Кроме того, если антитело содержит константные области, то эти константные области также получены из человеческих зародышевых иммуноглобулиновых последовательностей. Полностью гуманизированные антитела изобретения могут включать аминокислотные остатки, не кодируемые человеческими иммуноглобулиновыми последовательностями, такими как мутации, введенные случайно или с помощью сайт-специфического мутагенеза in vitro. Тем не менее, полностью гуманизированное антитело не обязательно должно включать антитела, в которых CDR-последовательности, полученные из зародышевых линий других видов млекопитающих, таких как мыши, были привиты в человеческие каркасные последовательности. Полностью гуманизированное моноклональное антитело представляет собой антитело, которое демонстрирует единую специфичность связывания и которое имеет вариабельные области, в которых и каркасный, и CDR-участки получены из человеческих зародышевых иммуноглобулиновых последовательностей. Оно отличается, например, от гуманизированного моноклонального антитела, где CDR-последовательности, полученные из зародышевых линий других видов млекопитающих, таких как мышь, были привиты в человеческие каркасные последовательности.
В воплощениях, где предложена только аминокислотная последовательность вариабельной тяжелой (VH) или вариабельной легкой (VL) последовательности, изобретение распространяется на способы получения антител, которые связываются с внеклеточным доменом Toll-подобного рецептора 2, в частности, Toll-подобного рецептора 2 млекопитающих, как правило, Toll-подобного рецептора 2 человека, где функция указанных антител состоит в противодействии функции Toll-подобного рецептора 2 при скрининге указанных последовательностей вариабельного домена в отношении библиотеки комплементарных последовательностей вариабельного домен в соответствии с доктриной Portolano et al. (Portolano et al. The Journal of Immunology (1993). 150:880-887) и Clarkson et al. (Clarkson et al. Nature (1991) 352:624-628).
В некоторых других воплощениях данное изобретение предусматривает выделенное антитело, которое специфически связывается с человеческим Toll-подобным рецептором 2, при этом указанное антитело включает вариабельный домен тяжелой цепи, который включает, состоит или в основном состоит из аминокислотной последовательности SEQ ID №4, и вариабельный домен легкой цепи, который включает, состоит или в основном состоит из аминокислотной последовательности SEQ ID №1. В некоторых воплощениях выделенное антитело является практически чистым выделенным антителом, которое по существу не содержит других антител, обладающих другой антигенной специфичностью. В некоторых других воплощениях антитело является рекомбинантным антителом, т.е. антителом, полученным с помощью рекомбинантных способов.
В некоторых дополнительных аспектах предлагается антитело, которое специфически связывается с Toll-подобным рецептором 2, где антитело состоит или в основном состоит из легкой цепи с аминокислотной последовательностью SEQ ID №2 и тяжелой цепи с аминокислотной последовательностью SEQ ID №5, где антитело перекрестно реагирует (т.е. обладает специфичностью связывания) с Toll-подобным рецептором 2, экспрессированным на клетках человека, мыши и обезьяны. Как правило, антитело связывается с Toll-подобным рецептором 2 на сайте связывания лигандов, который при связывании антитела предотвращает активацию Toll-подобного рецептора 2 путем связывания лиганда-агониста с сайтом связывания лиганда Toll-подобного рецептора 2.
В разных дополнительных аспектах данное изобретение распространяется на поливалентный моноспецифический антиген-связывающий белок, состоящий из двух, трех, четырех или более антител, определенных в предыдущих аспектах изобретения, или их фрагментов, где указанные антитела связаны друг с другом путем связывающей структуры.
В разных дополнительных аспектах данное изобретение распространяется на связывающих представителей или антиген-связывающие фрагменты, полученные из полностью гуманизированных антител приведенных выше аспектов изобретения. Такие антиген-связывающие фрагменты относятся к одному или более фрагментам антитела, которые сохраняют способность специфически связываться с антигеном, как правило, Toll-подобным рецептором 2. Было показано, что антиген-связывающая функция антитела может быть выполнена фрагментами антитела полной длины. В некоторых воплощениях связывающие представители или антиген-связывающие фрагменты могут быть выделенными связывающими представителями. Связывающий представитель или антиген-связывающий фрагмент изобретения может включать фрагмент антитела данного изобретения, например фрагмент молекулы полностью гуманизированного антитела, например только тяжелую или легкую цепь, или, например, вариабельный домен тяжелой и/или легкой цепи. В некоторых воплощениях связывающий представитель обычно включает, состоит или в основном состоит из VH- и/или VL-домена антитела. VH-домены связывающих представителей также предложены как часть изобретения. Внутри каждого VH- и VL-домена есть три области, определяющие комплементарность («CDR»), вместе с четырьмя каркасными областями («FR»), Домен VH, как правило, состоит из трех HCDR (определяющих комплементарность областей тяжелой цепи), а домен VL, как правило, состоит из трех LCDR (определяющих комплементарность областей легкой цепи). Соответственно, связывающий представитель может включать домен VH, содержащий в последовательности области VH CDR1 (или HCDR1), CDR2 (HCDR2) и CDR3 (HCDR3), а также множество связанных каркасных участков. Связывающий участник может дополнительно или альтернативно включать домен VL, содержащий домены VL CDR1, CDR2 и CDR3 вместе с соответствующими каркасными областями. Домены VH или VL обычно включают четыре каркасных участка, FR1, FR2, FR3 и FR4, чередующиеся между тремя областями, определяющими комплементарность, в следующей последовательности: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4.
Вариабельная область легкой цепи (VL) состоит из трех областей, определяющих комплементарность (CDR), которые играют определенную роль в присвоении антителу или связывающему фрагменту специфичности связывания. Области, определяющие комплементарность, также могут быть известны как гипервариабельные области. Три области, определяющие комплементарность, приведены ниже как SEQ ID №7, SEQ ID №8 и SEQ ID №9, связанные с VLCDR1, VLCDR2 и VLCDR3.
VLCDR1: Arg-Ala-Ser-Glu-Ser-Val-Glu-Tyr-Tyr-Gly-Thr-Ser-Leu-Met-GIn (RASESVEYYGTSLMQ (SEQ ID №7))
VLCDR2: Gly-Ala-Ser-Asn-Val-Glu-Ser (GASNVES (SEQ ID №8)) VLCDR3: GIn-Gln-Ser-Arg-Lys-Leu-Pro-Trp-Thr (QQSRKLPWT (SEQ ID №9))
Фиг.1А показывает аминокислотную последовательность VL-домена антитела данного изобретения, указанную в SEQ ID №1. На фиг.1В показана нуклеотидная последовательность и выведенная аминокислотная последовательность вариабельной легкой цепи. Расположение областей VLCDR1, VLCDR2 и VLCDR3 показано на фиг.1А подчеркиванием соответствующих аминокислотных остатков, которые содержат каждую определяющую комплементарность область (CDR).
На фиг.1В остатки вариабельного домена легкой цепи условно пронумерованы в соответствии с системой нумерации, разработанной Кабатом и соавт.(Kabat, E.A., Wu, T.T., Perry, H., Gottesman, K. and Foeller, C. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition. NIH Publication No. 91-3242). Система нумерации Кабат обычно используется, когда речь идет об остатках в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи). Эта система нумерации используется в данном описании, за исключением случаев, когда указано иное. Обозначения остатков по Кабат не всегда соответствуют непосредственно линейной нумерации аминокислотных остатков вариабельных областей тяжелой и легкой цепей данного изобретения. Фактическая линейная аминокислотная последовательность может содержать меньше или больше аминокислот, чем в строгой нумерации Кабата, соответствуя укорочению или вставке структурного компонента, будь то в каркасной области или в определяющей комплементарность области (CDR) основной структуры вариабельного домена тяжелой или легкой цепи. Правильная нумерация остатков Кабат может быть определена для любого данного антитела путем выравнивания остатков в последовательности антитела со стандартной последовательностью, к которой была применена нумерация Кабат.
VLCDR1 (также известная как VL-CRD1, определяющая комплементарность область вариабельного домена легкой цепи 1 или CDR-L1) состоит из 15 аминокислотных остатков, представленных остатками с 24 по 38 в последовательности вариабельного домена легкой цепи, показанной на фиг.1А. Эти остатки представлены в виде остатков с 24 по 34 на фиг.1В, где из-за расчета взяты остатки 27, 27а, 27b, 27с и 27d. Таким образом, в случае VLCDR1 взято 15 остатков, чтобы сравнять с областью CDRL1, определенной в соответствии с Кабат.
VLCDR2 (также известная как VL-CRD2, определяющая комплементарность область вариабельного домена легкой цепи 2, или CDR-L2), как показано на фиг.1А, состоит из 7 аминокислотных остатков и располагается с остатка 50 по 56 последовательности вариабельного домена, как показано на фиг.1В. Эти остатки точно коррелируют с остатками с 50 по 56, как взятые для уравнивания с областью CDRL2, определенной в соответствии с Кабат.
VLCDR3 (также известный как VL-CRD3, определяющая комплементарность область вариабельного домена легкой цепи 3, или CDR-L3), как показано на фиг.1А, состоит из 9 аминокислотных остатков и располагается с остатка 89 по 97 из последовательности вариабельного домена легкой цепи, указанной на фиг.1В. Эти остатки точно коррелируют с остатками с 89 по 97, как взятые для уравнивания с областью CDRL3, определенной в соответствии с Кабат.
Вариабельная область тяжелой цепи (VH) также включает три области, определяющие комплементарность (CDR), которые играют определенную роль в присвоении специфичности связывания антителу или фрагменту антитела. Три области, определяющие комплементарность, приведены ниже как SEQ ID №10, SEQ ID №11 и SEQ ID №12, связанные с VHCDR1, VHCDR2 и VHCDR3.
VHCDR1: Thr-Tyr-Gly-lle-Asn (TYGIN (SEQ ID №10)).
VHCDR2: Trp-lle-Tyr-Pro-Arg-Asp-Gly-Ser-Thr-Asn-Phe-Asn-Glu-Asn-Phe-Leu-Asp (WIYPRDGSTNFNENFKD (SEQ ID №11)).
VHCDR3: Leu-Thr-Gly-Gly-Thr-Phe-Leu-Asp-Tyr (LTGGTFLDY (SEQ ID №12)).
Фиг.2А показывает аминокислотную последовательность домена VH, как показано в SEQ ID №2. Фиг.2В показывает нуклеотидную последовательность и выведенную аминокислотную последовательность вариабельной тяжелой цепи.
На фиг.2В остатки вариабельного домена тяжелой цепи условно пронумерованы в соответствии с системой, разработанной Кабат (см. выше). Расположение областей VHCDR1, VHCDR2 и VHCDR3 показано на фиг.2А подчеркиванием соответствующих аминокислотных остатков.
VHCDR1 (также известная как VH-CRD1, определяющая комплементарность область тяжелой цепи 1, или CDR-H1) состоит из 5 аминокислотных остатков, представленных остатками с 31 по 35 из последовательности вариабельного домена. Эти остатки точно коррелируют с остатками с 31 по 35, как взятые для уравнивания с CDRH1-областью, определенной в соответствии с Кабат.
VHCDR2 (также известная как VH-CRD2, определяющая комплементарность область тяжелой цепи 2, или CDRH2) состоит из 17 аминокислотных остатков и находится с остатка 50 по 65 из последовательности вариабельного домена. Эти остатки точно коррелируют с остатками с 50 по 65, как взятые для уравнивания с CDRI-12-областью, определяемой в соответствии с Кабат.
VHCDR3 (также известная как VH-CRD3, определяющая комплементарность область тяжелой цепи 3, или CDRH3) состоит из 9 аминокислотных остатков и находится с остатка 95 по 103 из последовательности вариабельного домена легкой цепи. Благодаря наличию двух остатков в позиции 100 и 100а, которые рассматриваются для выравнивания с остатком 100 из СОРН3-области Кабат, производной CDRH3-области, как показано на фиг.2В, эти 9 остатков коррелируют именно с 8 остатками (остатки с 95 по 102) из СОНК2-области, определяемой в соответствии с Кабат.
CDR легкой цепи связаны с CDR тяжелой цепи, чтобы придать антителу или фрагменту антитела специфичность связывания, в случаях, когда присутствуют оба набора CDR. Известно, что вклад, сделанный вариабельной областью легкой цепи в энергетику связывания, мал по сравнению с соответствующей вариабельной областью тяжелой цепи. Соответственно, отдельные области тяжелой цепи, к которым относятся в последовательности три определяющие комплементарность области (VHCDR1, VHCDR2 и VHCDR3), как известно, имеют антиген-связывающую способность и обычно упоминаются как однодоменные антитела. Такие фрагменты антител, предусмотренные данным изобретением, основаны на предоставлении вариабельного домена тяжелой цепи данного изобретения, такого как определенный в SEQ ID №1.
В различных дополнительных аспектах изобретение распространяется на полностью гуманизированное антитело или родственный связывающий участник, который обладает специфичностью связывания с Toll-подобным рецептором 2 (TLR2, TLR-2, CD282) и который включает, состоит или в основном состоит из по меньшей мере одной аминокислотной последовательности, выбранной из группы, включающей с SEQ ID №7 по SEQ ID №12. В некоторых воплощениях связывающий участник содержит аминокислотные последовательности SEQ ID №10, 11 и 12. В некоторых других воплощениях предусмотрен связывающий участник, который включает, состоит или в основном состоит из аминокислотной последовательности SEQ ID №10, SEQ ID №11 и SEQ ID №12. В некоторых воплощениях каждая из SEQ ID №10, SEQ ID №11 и SEQ ID №12 может быть представлена в последовательности с каркасными областями, которые с ними перемежаются.
В некоторых воплощениях аминокислотные последовательности доменов VH или VL могут содержать по меньшей мере одну обратную мутацию, при этом указанная обратная мутация представляет собой замену аминокислотного остатка в определенной позиции последовательности, чтобы повысить специфичность связывания гуманизированного антитела или его фрагмента с TLR2 и/или чтобы повысить терапевтическую эффективность гуманизированного антитела в качестве антагониста TLR2. Как правило, такое изменение может быть внесено в остатки каркасной области в пределах вариабельных областей легкой и тяжелой цепи таким образом, чтобы уменьшить иммуногенность антитела. В некоторых воплощениях также могут быть использованы методики инженерии для изменения антитела данного изобретения, например, путем внесения в Fc-область изменений, которые могут изменить время полужизни в сыворотке, связывание комплемента, Fc-рецепторное связывание и/или антиген-зависимую цитотоксичность. Кроме того, в некоторых воплощениях могут быть получены антитела или фрагменты антител с измененным паттерном гликозилирования. В некоторых воплощениях антитело изобретения изменено для увеличения или уменьшения степени гликозилирования антитела. Гликозилирование полипептидов, как правило, является либо N-связанным, либо O-связанным. N-связанное относится к присоединению углеводной группировки к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х является любой аминокислотой, кроме пролина, являются последовательностями распознавания для ферментативного присоединения углеводной группировки к боковой цепи аспарагина. Таким образом, наличие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к присоединению одного из Сахаров (N-ацетилгалактозамина, галактозы или ксилозы) к гидроксиаминокислоте, чаще всего к серину или треонину, хотя также может быть использован 5-гидроксипролин или 5-гидроксилизин.
В некоторых других воплощениях антитела могут быть пегилированы путем взаимодействия антитела с производным полиэтиленгликоля (ПЭГ). В некоторых воплощениях антитело дефукозилировано и, следовательно, не содержит фукозных остатков.
В некоторых воплощениях изменения биологических свойств антитела могут быть достигнуты путем выбора замен, которые влияют на (а) структуру полипептидной основы в области замены, например, в виде листа или спиральной конформации, (б) заряд или гидрофобность молекулы в целевом сайте, или (в) основную часть боковой цепи. Аминокислоты могут быть сгруппированы в соответствии со сходствами в свойствах их боковых цепей (в A.L.Lehninger, Biochemistry, second ed., pp.73-75, Worth Publishers, New York (1975)): (1) неполярные: Ala (A), Val (V), Leu (L), lie (I), Pro (P), Phe (F), Trp (W), Met (M); (2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gin (Q); (3) кислые: Asp (D), Glu (E); (4) основные: Lys (К), Arg (R), His(H). Кроме того, природные остатки могут быть разделены на группы на основании общих свойств боковой цепи: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, He; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gin; (3) кислые: Asp, Glu; (4) основные: His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; (6) ароматические: Trp, Tyr, Phe. Неконсервативные замены влекут за собой обмен члена одного из этих классов на член другого класса. Такие замененные остатки также могут быть введены в консервативные замещаемые сайты или в другие (например, неконсервативные) сайты.
В некоторых дополнительных аспектах данное изобретение распространяется на применение VL-домена SEQ ID №1 и/или VH-домена из SEQ ID №4 в формировании гуманизированного антитела или его фрагмента, где указанное антитело или фрагмент обладает специфичностью связывания с Toll-подобным рецептором 2, и где указанное антитело или фрагмент функционирует как антагонист функциональной активности Toll-подобного рецептора 2.
В некоторых других воплощениях данное изобретение распространяется на связывающего представителя, который обладает специфичностью связывания с Toll-подобным рецептором 2 и который функционирует как TLR2-антагонист, при этом связывающий представитель включает, состоит или в основном состоит из аминокислотной последовательности SEQ ID №1 или SEQ ID №4 или последовательности, которая имеет аминокислотную последовательность, гомологичную ей по меньшей мере на 80%, более предпочтительно по меньшей на мере 90%, более предпочтительно по меньшей мере на 95% и наиболее предпочтительно по меньшей мере на 98%.
В некоторых дополнительных аспектах изобретение распространяется на полностью гуманизированное моноклональное антитело, обозначенное OPN-305, которое охарактеризовано в приведенных ниже примерах. Аминокислотная последовательность вариабельного домена легкой цепи (VL) OPN-305 показана в SEQ ID №1, в то время как аминокислотная последовательность вариабельного домена тяжелой цепи (VH) OPN-305 показана в SEQ ID №4. Кроме того, аминокислотная последовательность тяжелой цепи OPN-305 показана в SEQ ID №5, в то время как аминокислотная последовательность легкой цепи OPN-305 показана в SEQ ID №2.
Антитело может быть получено с помощью рекомбинантных средств, таких как клеточная культура, или же антитело может быть выделенным антителом. В некоторых воплощениях могут быть сделаны другие модификации в Fc-части тяжелой цепи, и, в частности, в константных доменах антитела СН2 и СН3. В таких воплощениях антитело будет состоять из легкой цепи с аминокислотной последовательностью SEQ ID №2 и вариабельным доменом тяжелой цепи с аминокислотной последовательностью SEQ ID №4. В некоторых воплощениях из полностью гуманизированного антитела OPN-305 может быть получен связывающий фрагмент, такой как фрагмент Fab, фрагмент F'ab или sc-Fv.
В разных дополнительных аспектах данное изобретение распространяется на иммуноконъюгат, включающий антитело данного документа или его антиген-связывающую часть, связанную с молекулой-партнером. В некоторых воплощениях такой конъюгат молекулы-партнера и антитела конъюгирован с помощью химического линкера, такого как пептидильный линкер, гидразиновый линкер или дисульфидный линкер. В некоторых воплощениях связанный партнер является эффекторной молекулой, меткой, лекарством или молекулой-носителем. Специалистам в данной области известны подходящие методики соединения антител изобретения и с пептидильными, и непептидильными партнерами. Примеры подходящих меток включают выявляемые метки, например радиоактивные, или ферментативные метки, например пероксидаза хрена, или химические группировки, такие как биотин. Кроме того, метка может быть функциональной меткой, такой как рицин, или пролекарством, которое способно превращаться в активный препарат на сайте связывания антитела.
В различных дополнительных аспектах изобретение распространяется на биспецифичные молекулы, включающие антитело или их антиген-связывающую часть, связанную со второй функциональной группировкой, имеющей специфичность связывания, отличную от указанного антитела или его антиген-связывающей части.
В некоторых дополнительных аспектах данное изобретение распространяется на моноклональное антитело, связывающий фрагмент, полученный из антитела, пептид, олигонуклеотид, пептидомиметик или органическое соединение, которое специфически связывается с тем же эпитопом, который представлен на внеклеточном домене Toll-подобного рецептора 2, который связывает моноклональное антитело OPN-305, где моноклональное антитело не является коммерчески доступным антителом, обозначенным Т2.5. Как правило, эпитоп, который специфически связывается соединением, состоит из аминокислотной последовательности SEQ ID №13 и/или SEQ ID №14. Такие соединения имеют возможность перекрестно конкурировать с антителами, описанными в данном документе, в связывании с Toll-подобным рецептором 2 на том же эпитопе. Такие соединения могут быть идентифицированы путем исследования перекрестного связывания, которое можно провести в отношении антитела данного изобретения, например, OPN-305.
В разных дополнительных аспектах данное изобретение распространяется на применение полностью гуманизированного антитела, полностью гуманизированного моноклонального антитела или связывающего представителя, полученного из них, в соответствии с данным изобретением в области профилактики и/или лечения заболевания или состояния, которое опосредовано в целом или частично активацией Toll-подобного рецептора 2 и/или внутриклеточной передачей сигнала через него.
В некоторых воплощениях TLR2-опосредованное заболевание или состояние является воспалительным состоянием.
В некоторых воплощениях связывающий представитель может быть выбран из группы, включающей, но не ограничиваясь ими, фрагмент Fab, фрагмент Fab', scFv (одноцепочечный вариабельный фрагмент), пептидомиметик, двухвалентное антитело или родственное поливалентное производное.
Методики, используемые для рекомбинантного получения Fab-, Fab'- и F(ab')2-фрагментов, хорошо известны специалистам в данной области и включают описанные в Международной патентной публикации PCTWO 92/22324, Sawai et al., "Direct Production of the Fab Fragment Derived From the Sperm Immobilizing Antibody Using Polymerase Chain Reaction and CDNa Expression Vectors", 1995, AJRI 34:26-34, и Mullinax et al., "Expression of a Heterodimeric Fab Antibody Protein in One Cloning Step", 1992, BioTechniques 12(6):864-869 и Better et al., "Escherichia coli Secretion of an Active Chimeric Antibody Fragment" 1988, Science 240:1041-1043, содержание которых включено в данный документ посредством ссылки.
Примеры методик, которые могут быть использованы для получения scFv (одноцепочечных Fv-фрагментов), представлены в Huston et al., "Protein Engineering of Single-Chain Fv Analogs and Fusion Proteins", Methods in Enzymology, vol. 203:46-88 (1991), содержание которого включено в данный документ посредством ссылки.
В некоторых воплощениях фрагменты антител могут быть получены из антител полной длины посредством протеолитического расщепления в соответствии со способом Morimoto (Morimoto et al., "Single-step purification of F(ab').sub.2 fragments of mouse monoclonal antibodies (immunoglobulins G1) by hydrophobic interaction high performance liquid chromatography using TSKgel Phenyl-5PW" Journal of Biochemical and Biophysical Methods 24:107-117 (1992)). Фрагменты антитела также теперь можно получить непосредственно с помощью клеток-хозяев (см. Carter et al., "High level Escherichia coli expression and production of a bivalent humanized antibody fragment" Bio/Technology 10:163-167 (1992)).
В разных дополнительных аспектах данное изобретение предусматривает способ лечения и/или профилактики воспалительного состояния, которое опосредовано полностью или частично Toll-подобным рецептором 2, при этом указанный способ включает следующие этапы:
- обеспечение терапевтически эффективного количества гуманизированного антитела или его связывающего фрагмента в соответствии с данным изобретением, и
- введение его субъекту, нуждающемуся в таком лечении.
В некоторых воплощениях способ включает введение поливалентного моноспецифического антиген-связывающего белка, состоящего из двух, трех, четырех или более антител в соответствии с изобретением.
Другой аспект данного изобретения относится к фармацевтической композиции, включающей гуманизированное антитело, гуманизированное моноклональное антитело, его антиген-связывающую часть, иммуноконъюгат или биспецифическую молекулу в соответствии с данным изобретением по меньшей мере с одним фармацевтически приемлемым носителем, разбавителем или эксципиентом.
В некоторых воплощениях состав является жидким составом, лиофилизированным составом, лиофилизированным составом, который восстанавливают в жидкость, или аэрозольным составом. В некоторых воплощениях антитело в составе находится в концентрации: от примерно 0,5 мг/мл до примерно 250 мг/мл, от примерно 0,5 мг/мл до примерно 45 мг/мл, от примерно 0,5 мг/мл до примерно 100 мг/мл, от примерно 100 мг/мл до примерно 200 мг/мл или от примерно 50 мг/мл до примерно 250 мг/мл.
В некоторых воплощениях состав также включает буфер. Как правило, рН состава составляет от примерно рН 5,5 до примерно рН 6,5.
В некоторых воплощениях буфер может содержать от примерно 4 мМ до примерно 60 мМ гистидинового буфера, от примерно 5 мМ до примерно 25 мМ сукцинатного буфера или от примерно 5 мМ до примерно 25 мМ ацетатного буфера. В некоторых воплощениях буфер содержит хлорид натрия в концентрации от примерно 10 мМ до 300 мМ, как правило, примерно 125 мМ, и цитрат натрия в концентрации от примерно 5 мМ до 50 мМ, как правило, 25 мМ. В некоторых воплощениях состав также может содержать поверхностно-активное вещество в концентрации от примерно 0% до примерно 0,2%. В некоторых воплощениях поверхностно-активное вещество выбрано из группы, включающей, но не ограничиваясь ими: полисорбат-20, полисорбат-40, полисорбат-60, полисорбат-65, полисорбат-80, полисорбат-85 и их комбинации. В предпочтительном воплощении поверхностно-активное вещество является полисорбатом-20. В некоторых воплощениях состав также содержит от примерно 0,001% до примерно 0,05% Твина и может также содержать хлорид натрия в концентрации примерно 125 мМ и цитрат натрия в концентрации примерно 25 мМ.
В некоторых воплощениях фармацевтическая композиция также может содержать или вводиться субъекту по меньшей мере с одним иммуномодулирующим соединением, таким как иммуносупрессивное соединение, вторичное антитело или его фрагмент или рекомбинантный белок.
Антитело и связывающая часть данного изобретения также может использоваться в диагностике, например, в диагностике in vivo и отображении болезненных состояний, связанных с Toll-подобным рецептором 2, где антитело изобретения может быть использовано для выявления и связывания с клетками, экспрессирующими Toll-подобный рецептор 2. Кроме того, в некоторых воплощениях вторичная молекула или соединение может быть соединено с антителом изобретения для применения в нацеливании вторичной молекулы или соединения на клетки, которые экспрессируют Toll-подобный рецептор 2.
В некоторых дополнительных аспектах данное изобретение предусматривает набор для лечения или профилактики воспалительного состояния или заболевания, опосредованного Toll-подобным рецептором 2. В некоторых воплощениях набор включает антитело в соответствии с данным изобретением или его антиген-связывающий фрагмент, который способен связываться с Toll-подобным рецептором 2 и выступать антагонистом его функциональной активности, а также инструкции для введения его пациенту.
В соответствии с еще одним аспектом предусмотрено гуманизированное нейтрализующее антитело или его антиген-связывающая часть, где антитело специфически связывается с Toll-подобным рецептором 2 млекопитающих с КD 1×10-8 или меньше, но не связывается с CD32 (Fc-гамма-рецептором II), где антитело специфически связывается с таким же эпитопом, представленным на внеклеточном домене Toll-подобного рецептора 2, что и коммерчески доступное антитело, обозначенное Т2.5.
В соответствии с еще одним аспектом предусмотрено выделенное моноклональное антитело или его антиген-связывающая часть, которая связывает эпитоп на Toll-подобном рецепторе 2 млекопитающего с КD 1×10-8 или меньше и не связывается с CD32 (Fc-гамма-рецептором II), где эпитоп распознается контрольным антителом, где контрольное антитело включает вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID №4 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID №1.
В соответствии с еще одним аспектом предусмотрено выделенное человеческое моноклональное антитело или его антиген-связывающая часть, которая специфически связывается с Toll-подобным рецептором 2 млекопитающих и обладает следующими свойствами:
- связывается с Toll-подобным рецептором 2 млекопитающих с КD 1×10-8 или меньше,
- не связывается с CD32 (Fc-рецептором-гамма II),
- перекрестно реагирует с человеческим Toll-подобным рецептором 2, мышиным Toll-подобным рецептором 2 и обезьяньим Toll-подобным рецептором 2.
Fab-связывающие представители
В некоторых воплощениях вышеизложенных аспектов изобретения предложен фрагмент антитела или антиген-связывающая часть антитела. Примеры связывающих фрагментов включают Fab-, F'ab-, или F(ab')2-фрагменты, которые являются моновалентными фрагментами, состоящими из или состоящими в основном из доменов VL, VH, CL и СН1 гетеротетрамерного антитела. В некоторых воплощениях домен VL имеет аминокислотную последовательность SEQ ID №1, а домен VH имеет аминокислотную последовательность SEQ ID №4. В некоторых воплощениях домены CL и СН1 основаны на аминокислотной последовательности домена CL и СН1 иммуноглобулина подкласса IgG и изотипа lgG4, или доменов СН1 и CL, показанных в SEQ ID №5 на фиг.5. В некоторых воплощениях Fab-фрагмент этого воплощения изобретения может быть использован для лечения или профилактики состояний, включая, но не ограничиваясь ими, псориаз, дерматит и глазные болезни, включая увеит и AMD (возрастную дегенерацию желтого пятна).
Однодоменные связывающие представители
В дополнение к предоставлению гуманизированного моноклонального антитела, которое обладает специфичностью связывания с TLR2 и которое выступает антагонистом функции TLR2, данное изобретение также распространяется на связывающие представители, отличные от антител, содержащих пару связывающих доменов на основе аминокислотной последовательности области VL (вариабельная легкая цепь), определенной в SEQ ID №1, и аминокислотной последовательности области VH (вариабельная тяжелая цепь), определенной в SEQ ID №4. В частности, изобретение распространяется на односвязывающие домены, которые основаны либо на VL-, либо на VH-области гуманизированных антител изобретения.
Соответственно, в некоторых других воплощениях данного изобретения предложен связывающий представитель, который включает, состоит или в основном состоит из односвязывающего домена, полученного из гуманизированного антитела изобретения. В некоторых воплощениях односвязывающий домен получен из аминокислотной последовательности VH (вариабельного домена тяжелой цепи), определенной в SEQ ID №4. Такой связывающий домен может быть использован в качестве целевого агента для TLR2, так как иммуноглобулиновые VH-домены, как известно, способны связывать целевые антигены специфическим образом.
Модификация остатков CDR
Специалистам в данной области будет понятно, что последовательности определяющих комплементарность областей (определенных в SEQ ID №7, 8, 9, 10, 11 и 12), а также последовательности гипервариабельных и вариабельных областей могут быть изменены без потери способности специфически связываться с TLR2. Например, CDR-области связывающих представителей, полученные из гуманизированных антител данного изобретения, могут быть идентичны или высоко гомологичны (например, с 95% идентичностью последовательностей или выше) с аминокислотными последовательностями, определенными здесь в SEQ ID №7, 8, 9, 10, 11 и 12. Как определено в данном документе, термин «высоко гомологичный» означает, что в последовательности CDR может быть сделано от 1 до 5 аминокислотных замен. В некоторых воплощениях степень гомологии, которая существует между соответствующими CDR, гипервариабельными областями или вариабельными областями и их немодифицированными аналогами, будет составлять по меньшей мере 80%, предпочтительно 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно более 98%. Такие измененные последовательности входят в рамки данного изобретения в случаях, когда измененная или гомологичная связывающая часть сохраняет способность специфически связываться с TLR2 и выступает антагонистом его функциональной активности.
Полинуклеотиды
В разных дополнительных аспектах данное изобретение распространяется на полинуклеотиды и, в частности, на выделенные полинуклеотиды, которые кодируют гуманизированные антитела, фрагменты антител и связывающие представители данного изобретения.
Соответственно, в другом аспекте данного изобретения предложен полинуклеотид, который кодирует аминокислотную последовательность SEQ ID №1 и/или SEQ ID №4. В некоторых воплощениях полинуклеотид является выделенным полинуклеотидом.
Как определено в данном документе, термин «полинуклеотид» включает любой полирибонуклеотид или полидезоксирибонуклеотид, который может быть неизмененной РНК или ДНК или измененной РНК или ДНК, в том числе, но не ограничиваясь ими, одно- и двухцепочечной РНК, и РНК, которая представляет собой смесь одно- и двухцепочечной областей.
Полинуклеотид изобретения, например полинуклеотид, который кодирует полипептид или полипептиды, содержащие аминокислотную последовательность SEQ ID №1 или SEQ ID №4, включает их аллельные варианты и/или их комплементарные последовательности, в том числе полинуклеотид, который гибридизуется с такими нуклеотидными последовательностями в условиях умеренной или высокой жесткости.
В различных дополнительных аспектах изобретение распространяется на экспрессионный вектор, содержащий полинуклеотид, который кодирует полипептид с SEQ ID №1 и/или SEQ ID №4. Кроме того, изобретение распространяется на клетку-хозяина, трансформированную таким вектором.
Гибридомные клеточные линии
Еще один аспект данного изобретения предусматривает гибридную клеточную линию (гибридому), которая экспрессирует антитело с аминокислотной последовательностью вариабельного домена тяжелой цепи SEQ ID №1 и аминокислотной последовательностью вариабельного домена легкой цепи SEQ ID №4.
Краткое описание графических материалов
На фиг.1А представлена SEQ ID №1, которая является аминокислотной последовательностью вариабельного домена легкой цепи антитела в соответствии с изобретением. На фиг.1В представлена нуклеотидная последовательность вариабельной легкой цепи (SEQ ID №17) и выведенная аминокислотная последовательность (SEQ ID №18), которая была пронумерована в соответствии с Кабат.
На фиг.2А представлена SEQ ID №4, которая является аминокислотной последовательностью вариабельного домена тяжелой цепи антитела в соответствии с изобретением. На фиг.2В представлена нуклеотидная последовательность вариабельной тяжелой цепи (SEQ ID №19) и выведенная аминокислотная последовательность (SEQ ID №20), которая была пронумерована в соответствии с Кабат.
На фиг.3 представлена SEQ ID №2, которая показывает аминокислотную последовательность легкой цепи антитела в соответствии с изобретением.
На фиг.4 представлена SEQ ID №3, которая показывает нуклеиновокислотную последовательность, которую можно транслировать, чтобы закодировать аминокислотную последовательность SEQ ID №2.
На фиг.5 представлена SEQ ID №5, которая является аминокислотной последовательностью тяжелой цепи антитела в соответствии с изобретением.
На фиг.6 представлена SEQ ID №6, которая является нуклеиновокислотной последовательностью, которую можно транслировать, чтобы закодировать аминокислотную последовательность SEQ ID №5.
На фиг.7 представлена SEQ ID №15, которая предусматривает аминокислотную последовательность человеческого Toll-подобного рецептора 2.
На фиг.8 представлена SEQ ID №16, которая предусматривает аминокислотную последовательность мышиного Toll-подобного рецептора 2.
На фиг.9 показано, что OPN-305-опосредованный антагонизм Toll-подобного рецептора 2 не зависит от связывания антитела с CD32, группа 1 демонстрирует добавление контрольного козлиного антитела, группа 2 демонстрирует добавление козлиного анти-hCD32a блокирующего антитела, а группа 3 демонстрирует добавление козлиного анти-hCD32b блокирующего антитела.
На фиг.10 показано, что антагонизм Toll-подобного рецептора 2, опосредованный моноклональным антителом OPN301, зависит от связывания антитела с CD32 (фиг.10А), в то время как OPN-305-опосредованный антагонизм Toll-подобного рецептора 2 не зависит от связывания антитела с CD32 (фиг.10В).
На фиг.11 представлены результаты анализа FACS, которые показали, что OPN-305 обладает специфичностью связывания с человеческим Toll-подобным рецептором 2 (фиг.11А), тогда как контрольное изотипическое IgG4 антитело не конкурирует с OPN-301 в связывании с Toll-подобным рецептором 2 (фиг.11В).
На фиг.12 показано, что OPN-305 (OPN-305-21) подавляет мышиные TLR2-ответы эквивалентным мышиному OPN-301-антителу образом.
На фиг.13 показаны записи трех FACS-анализов, которые показывают, что OPN-305 связывается с TLR2 обезьяны, который экспрессируется на гранулоцитах (фиг.13А) и моноцитах (фиг.13В), но не лимфоцитах (фиг.13С).
На фиг.14 показаны записи двух FACS-анализов, которые показывают, что OPN-305 конкурирует с анти-TLR2 мышиным моноклональным антителом OPN-301 в связывании с обезьяньим TLR2, где на фиг.14(А) показаны результаты для гранулоцитов, а на фиг.14(В) показаны результаты для моноцитов.
На фиг.15(А) и (В) показаны записи образцов антител, которые были получены при гель-проникающей хроматографии на колонке 16/60 Sephacryl S200. На фиг.15(А) показано анти-Т1Р2 химерное антитело, на фиг.15(В) показано OPN305-антитело (VK5/VH4). В каждом случае был собран мономерный пик, охватывающий фракции с В8 по В4.
На фиг.16 показан предварительный скрининг анализируемых образцов на цитотоксичность и модуляцию активности Т-клеток, проверенных в образцах от четырех доноров. Образец 1 (первый столбец каждой группы (черный прямоугольник)) является химерным анти-TLR2 антителом, образец 2 (второй столбец каждой группы результатов (белый прямоугольник) представляет собой VK5/VH4 (OPN305), образец 3 (третий прямоугольник (темно-серый) является сравнительным антителом, обозначенным как VK5/VH5 вместе с KLH, в то время как образец 4 (четвертый прямоугольник на правой стороне каждой группы (светло-серый)) является контролем только с KLH. Результаты показывают подсчет жизнеспособных клеток на 7 день. SI образцов, инкубированных в присутствии KLH, сравнивали с KLH в одиночку. SI усредняли для четырехдневного периода забора. Отсечение для определения положительных реакций с SI s 2.
На фиг.17(А), (В) и (С) представлены три гистограммы, показывающие результаты тестирования Episcreen. Химерные анти-TLR2-, VK5/VH4- и VK5/VH5-антитела тестировали в анализе временной динамики Т-клеток EpiScreen™ с использованием МНПК от 21 донора. Смешанные культуры МНПК, инкубированные с тестируемыми антителами, отбирали на 5, 6, 7 и 8 дни и подвергали импульсному мечению 3H-тимидином. Клетки собирали и измеряли включение радиоактивности с помощью сцинтилляционного счетчика. Результаты трех измерений для каждого образца усредняли и нормировали путем преобразования в индекс стимуляции (SI). SI для каждого момента времени для каждого донора показано выше для (а) химерного антитела, (b) анти-TLR2-антитела OPN-305 (обозначаемого VK5/VH4), (с) сравнительного анти-TLR2-антитела, обозначаемого VK5/VH5. Отсечение для определения положительных реакций с SI52 подчеркнуто толстой черной горизонтальной линией, и значительные ответы (p<0,05 в t-тесте Стьюдента) помечены (*).
На фиг.18 показано сравнение иммуногенности, предсказанной с помощью методики EPISCREEN™, и иммуногенности, наблюдаемой в клинических условиях. технологии. 16 терапевтических белков были протестированы на их относительный риск иммуногенности с помощью методики EPISCREEN™. Результаты были нанесены на график в зависимости от частоты иммуногенности (реакций против терапевтических антител), наблюдаемой для каждого белка при использовании в клинике (данные получены из PubMed). Показаны линия регрессии и коэффициент корреляции.
На фиг.19 показано выравнивание аминокислотной последовательности вариабельного домена легкой цепи анти-TLR2-моноклонального антитела OPN-305 (SEQ ID №22) и мышиного анти-TLR2-моноклонального антитела Т2.5 (SEQ ID №21), где показано, что определяемая идентичность последовательностей составляет 89,2%.
На фиг.20 показано выравнивание аминокислотной последовательности вариабельного домена тяжелой цепи анти-TLR2-моноклонального антитела OPN-305 (SEQ ID №24) и мышиного анти-TLR2-моноклонального антитела Т2.5 (SEQ ID №23), где показано, что определяемая идентичность последовательностей составляет 88,1%.
На фиг.21 показано, что полное подавление Т1-Р2-зависимой передачи сигнала достигается с менее чем максимальным связыванием рецептора OPN-305.
Ингибирование активности NF-kB наблюдается в зависимости от дозы после обработки Pam3Csk4 (фиг.21А и В). OPN305 почти полностью ингибирует активность NF-kB при концентрации 2 мкг/мл (фиг.21С).
Фиг.22А изображает NF-kB-зависимую активность SEAP в зависимости от концентрации Pam3CSK4, а на фиг.22В изображен график Лайнуивера-Берка 1/v от 1/s.
На фиг.23 показано три графика, А, В и С, показывающие, что опосредованные Toll-подобным рецептором ответы на флагеллин (TLR5, фиг.23С) и LPS (TLR4, фиг.23В) были неизменными по сравнению с контрольными клетками, которые не подвергали воздействию OPN-305. Как и ожидалось, опосредованный Toll-подобным рецептором 2 ответ на Pam3CSK и FSL-1 был заблокирован OPN-305 (фиг.23А). Это говорит о том, что OPN-305 не вызывает какого-либо неожиданного увеличения или уменьшения реагирования TLR4 или TLR5 на лиганды.
На фиг.24 показано, что моноклональное антитело OPN-305 ингибирует Раm3СSK4-индуцированный сепсис. Группам самок мышей линии BALB/c (n=4) вводили OPN-305 в указанных дозах за 30 минут до введения 100 мкг Pam3Csk4.
На фиг.25 показано, что OPN305 ингибирует Pam3Csk4-индуцированный сепсис. В этом эксперименте OPN305 вводили внутривенно за 30 минут до внутрибрюшинного введения 100 мкг Pam3Csk4. Четыре часа спустя мышей умерщвляли путем смертельной анестезии и забирали кровь. Получали сыворотку и определяли концентрацию цитокинов иммуноферментным способом. Сыворотки разводили 1/10 для ИФА на КС и IL 12р40 и 1/5 для ИФА на IL-6.
На фиг.26 показан TLR2, экспрессированный на крысиных альвеолярных макрофагах (NR8383) и определенный с помощью OPN305. (А) Немеченые клетки, (В) положительный контроль; поликлональное кроличье первичное антитело против крысиного TLR2, вторичное антитело представляло собой антикроличье Alexa Fluor-488; (С) клетки, обработанные поликлональным человеческим lgG4, вторичное антитело было человеческим анти-!д04 РЕ; (D) OPN305-меченые клетки, вторичное антитело анти-человеческий lgG4 РЕ.
На фиг.27 показан TLR2, экспрессированный на свиных МНПК и помеченный OPN305. МНПК очищали разделением с помощью Ficoll. A-C представляют МНПК от свиньи 666, a DF от свиньи 488. А, D не мечены; В, Е помечены поликлональным человеческим IgG4 со вторичным мечением РЕ-меченым противочеловеческим IgG4; С, F мечены OPN305, а затем РЕ-меченым противочеловеческим IgG4.
Подробное описание изобретения
Данное изобретение предусматривает полностью человеческое моноклональное антитело, которое обладает специфичностью связывания с Toll-подобным рецептором 2 и которое при связывании с Toll-подобным рецептором 2 выступает антагонистом функциональной активности Toll-подобного рецептора 2. Изобретение также предусматривает связывающие фрагменты, полученные из полностью человеческого антитела, а также связывающие фрагменты, которые содержат, состоят или в основном состоят из аминокислотной последовательности вариабельного домена легкой цепи SEQ ID №1 и/или аминокислотной последовательности вариабельного домена тяжелой цепи SEQ ID №4.
Под термином «антагонизм функции Toll-подобного рецептора 2» или похожими терминами, такими как «антагонист Toll-подобного рецептора 2» или «агонист Toll-подобного рецептора 2», подразумевается, что антитело, фрагмент или связывающий представитель специфически связывается с Toll-подобным рецептором 2 и ингибирует или блокирует связывание лиганда или связывающего соединения с Toll-подобным рецептором 2, который, в свою очередь, вызывает активацию Toll-подобного рецептора 2, например, лиганд Toll-подобного рецептора 2. Антитело, фрагмент или связывающий представитель может также ингибировать активацию и функцию Toll-подобного рецептора 2, ингибируя или подавляя внутриклеточную передачу сигнала, опосредованную Toll-подобным рецептором 2, после связывания лиганда Toll-подобного рецептора 2. Под «активацией и последующей передачей сигнала, опосредованной Toll-подобным рецептором 2» подразумевается любой внутриклеточный сигнальный путь, индуцированный путем активации TLR2. Сигнальный путь может быть специфическим путем TLR2 или «общим» сигнальным путем, например, когда сигнальный путь может активироваться за счет других источников, например, посредством активации рецепторов, отличных от TLR2, которые способствуют активации медиаторов иммунного ответа, таких как транскрипционный фактор NF-kappaB.
TLR2, как известно, димеризуется в бифункциональные гетеродимеры. В частности, TLR2, как известно, формирует гетеродимер либо с Toll-подобным рецептором 1, либо с Toll-подобным рецептором 6. Возможно, что гетеродимеры также образуются с Toll-подобным рецептором 4 (TLR4, TLR-4) и Toll-подобным рецептором 10 (TLR10, TLR-10). Считается, что эта димеризация связана с разграничением, которое приводит к связыванию TLR2 различными лигандами микробного происхождения. Изобретателем было определено, что гуманизированные антитела изобретения функционируют как антагонисты функции TLR2 независимо от того, образован ли гетеродимер Toll-подобного рецептора 2 с Toll-подобным рецептором 1 или с Toll-подобным рецептором 6.
Эпитоп связывания антитела
Гуманизированные антитела изобретения или их фрагменты или связывающие представители на их основе селективно связываются с Toll-подобным рецептором 2 и выступают антагонистами его функции. Моноклональные антитела могут блокировать активацию рецептора его лигандом, связываясь с рецептором вблизи сайта связывания лиганда, что приводит к стерическому препятствию, которое исключает возможность подхода лиганда к сайту связывания лиганда.
Без связи с какой-либо теорией изобретатель идентифицировал сайт связывания, который связывается гуманизированными антителами в соответствии с данным изобретением. Антитело связывается с эпитопом, который включает остатки, полученные из N-концевой и С-концевой областей зрелого внеклеточного домена Toll-подобного рецептора 2 (TLR2). В некоторых воплощениях эпитоп включает аминокислотные остатки с 19 по 39 из М-конца Toll-подобного рецептора 2, определенные в 586-аминокислотной последовательности Toll-подобного рецептора 2, при этом указанными аминокислотами являются KEESSNQASLSCDRNGICKGS (SEQ ID №13). Связывающий эпитоп также включает аминокислотные остатки с 538 по 549 из Toll-подобного рецептора 2, которые расположены в С-концевой области аминокислотной последовательности SEQ ID №1, и эта последовательность содержит аминокислоты CSCEFLSFTQEQQ (SEQ ID №14).
Перекрестная реактивность
Как правило, TLR2, который является антагонистом антител, фрагментов антител или связывающих представителей изобретения, представляет собой TLR2 млекопитающих (или его функциональный вариант), например, человеческий TLR2 или мышиный TLR2. В некоторых воплощениях TLR2, который выступает антагонистом, представляет собой человеческую форму TLR2 с аминокислотной последовательностью, показанной на фиг.7 как SEQ ID №15, последовательность человеческого Toll-подобного рецептора полной длины, содержащую 784 аминокислоты, с регистрационным номером Genbank AAC 34133 (URL www.ncbi.nlm.nih.gov).
В некоторых других воплощениях Toll-подобный рецептор 2 представляет собой мышиный TLR2, включающий аминокислотную последовательность, обозначенную на фиг.8 как SEQ ID №16, с регистрационным номером Genbank NP_036035 (Mus musculus).
В некоторых других воплощениях антитела, фрагменты антител или связывающие представители изобретения выступают антагонистами функциональной активности или передачи сигнала через Toll-подобный рецептор 2, экспрессированный на клетках обезьян.
В некоторых других воплощениях антитело может иметь константу диссоциации (Kd), выбранную из группы, состоящей из: (i) константы диссоциации между 10-7 М и 10-11 М, (ii) константы диссоциации между 10-8 М и 10-9 М, (iii) константы диссоциации между 10-9 М и 10-10 М, (iv) константы диссоциации между 10-11 М и 10-12 М. В некоторых воплощениях антитела изобретения или их фрагменты могут связываться с человеческим или мышиным Toll-подобным рецептором 2 с Kd 3×10-8 или меньше, или 4×10-8 или меньше.
Таким образом, связывание антитела изобретения с Toll-подобным рецептором 2 может привести к блокированию внутриклеточной передачи сигнала, связанной с лиганд/рецептор-взаимодействием TLR2 и его лиганда.
Структура антитела
Антитело и фрагменты антитела изобретения являются полностью человеческими. Т.е. аминокислотные остатки, которые содержит антитело, получены из человеческого вида, в отличие, например, от мыши. Таким образом, антитело изобретения является менее иммуногенным, чем мышиное антитело или химерное антитело, такое как мышиное/человеческое антитело.
Иммуногенность, которая возникает при введении мышиного или химерного антитела, является наиболее значительным барьером для терапевтического применения моноклональных антител. Соответственно, предоставление полностью человеческого антитела преодолевает проблемы, связанные с предоставлением мышиных или человеческих/мышиных химерных антител, которые при введении субъекту более одного раза могут привести к иммуногенным реакциям, таким как НАМА-реакция, направленный против антитела. Эта реакция выводит мышиное или химерное антитело из сыворотки субъекта, тем самым мешая антителам достигать их цели и производить их предполагаемый терапевтический эффект. Соответственно, полностью человеческое антитело данного изобретения дает существенное преимущество перед такими мышиными и химерными антителами.
Одной из существенных причин иммуногенности против антитела являются эпитопы CD4+ Т-клеток, присутствующие на антителе. Таким образом, антитело и связывающие фрагменты данного изобретения были проанализированы с целью выявления и изменения любых CD4+ Т-клеточных эпитопов, присутствующих на антителе или фрагменте антитела. Этот процесс также снижает иммуногенность антитела и фрагментов антитела данного изобретения.
Более того, антитело или фрагменты антитела изобретения могут быть сопряжены с одной или более методикой, которые также могут быть использованы для обеспечения того, чтобы не возник иммунный ответ против антитела при введении его субъекту. Примеры таких методик хорошо известны специалистам в данной области и включают, но не ограничиваясь ими, деиммунизацию, перестановку генов и ПЭГилирование.
Кроме того, в целях усиления биологической функции или терапевтической активности антитела или фрагмента антитела изобретения, также могут быть использованы методики оптимизации. Такие методики включают, но не ограничиваясь ими, изменения следующих характеристик антитела: активность, аффинность, специфичность связывания, Коп (константа скорости ассоциации), К off (константа скорости диссоциации), термодинамическая устойчивость, растворимость, время полужизни в сыворотке, экспрессия, кинетика сворачивания белка, восприимчивость к протеазе, эффекторная функция Fc-области и рециркуляция лекарственных средств. Биологические функции или терапевтические активности, которые могут быть изменены, включают, но не ограничиваясь ими: повышение эффективности, улучшение фармакокинетического профиля, повышение удобства для пациента, снижение стоимости товаров, улучшение профиля безопасности, снижение иммуногенности и длительный срок хранения.
Лечение ТLR2-опосредованного заболевания
Гуманизированные антитела, фрагменты антител и связывающие представители изобретения могут вызывать иммуносупрессию (подавление иммунного ответа, в особенности провоспалительного иммунного ответа), в частности, путем подавления активации и передачи сигнала, опосредованной Toll-подобным рецептором 2. Это подавление функции Toll-подобного рецептора 2 было определено изобретателем как имеющее пользу в лечении или профилактике заболеваний, в которых активация Toll-подобного рецептора 2 и передача сигнала через него способствует развитию и прогрессированию заболевания.
Антитело изобретения может быть использовано, например, в способах лечения in vitro, ex vivo и in vivo.
В некоторых других аспектах изобретение распространяется на применение антител, фрагментов антител или связывающих представителей изобретения для лечения заболеваний, опосредованных активацией Toll-подобного рецептора 2 и передачей через него сигнала.
Лечение ишемии
Соответственно, в другом аспекте данное изобретение предлагает способ лечения и/или профилактики повреждающего действия ишемии/реперфузии или состояния, вызванного им или связанного с ними, при этом способ включает следующие этапы:
- обеспечение терапевтически эффективного количества гуманизированного антитела или его связывающего фрагмента, как определено в данном документе, и
- введение указанного соединения субъекту, нуждающемуся в таком лечении.
Другой аспект изобретения предусматривает полностью гуманизированное антитело в соответствии с данным изобретением или связывающего представителя, полученного из него, для применения в лечении повреждающего действия ишемии/реперфузии или воспалительного заболевания сердца, которое опосредовано целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
Другой аспект предусматривает применение гуманизированного антитела в соответствии с данным изобретением или его фрагмента или связывающего представителя, полученного из него, для производства лекарственного средства для лечения или профилактики повреждающего действия ишемии/реперфузии или воспалительного заболевания сердца, которое опосредовано целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
В некоторых воплощениях воспалительное заболевание сердца возникает в результате реперфузионного повреждения и может быть выбрано из группы, включающей, но не ограничиваясь ими: ишемию миокарда, ишемическую болезнь сердца, гипертоническую ишемию миокарда, застойную сердечную недостаточность, ишемию тканей, ишемию органов, острый коронарный синдром, гипертрофию, инфаркт мозга, инфаркт миокарда, аритмию, повреждающее действие ишемии/реперфузии (I/R повреждение).
Ишемия возникает, когда орган или часть тела не получает достаточного количества крови. Орган, который лишен достаточного количества крови, называют гипоксическим. Реперфузия возникает, когда в органе возобновляется кровоток после временного его отсутствия. Реперфузионное повреждение относится к повреждению, которое возникает в ткани или органе при восстановлении кровоснабжения тканей после периода ишемии. Отсутствие кислорода и питательных веществ в период ишемии приводит к периоду воспаления и окислительного повреждения, когда кровоток возвращается. Примеры повреждающего действия ишемии/реперфузии включают гипоксию, инсульт, инфаркт миокарда, хроническую почечную недостаточность или трансплантацию органов.
В некоторых воплощениях способ данного аспекта изобретения может быть использован для лечения или профилактики повреждающего действия ишемии/реперфузии, которое может возникнуть в результате трансплантации органов у субъекта. В некоторых воплощениях антитело изобретения может быть использовано для лечения и/или профилактики ишемии, которая может возникнуть в результате трансплантации солидных органов.
Еще один аспект данного изобретения предусматривает способ снижения одной или более биологической активности Toll-подобного рецептора 2 (TLR2) в TLR2-экспрессирующих клетках или тканях, причастных к повреждающему действию ишемии/реперфузии, связанному с трансплантацией у субъекта солидных органов, при этом способ включает:
- контактирование клетки или ткани с антагонистическим антителом Toll-подобного рецептора 2 в соответствии с данным изобретением, в количестве, достаточном для снижения одной или более биологической активности TLR2 в клетке или ткани.
В некоторых воплощениях TLR2-экспрессирующая клетка или ткань является клеткой или тканью миокарда. В некоторых воплощениях TLR2-экспрессирующая клетка или ткань является клеткой или тканью, связанной с индуцированным реперфузией воспалительным заболеванием сердца, выбранным из группы, включающей, но не ограниченной ими: ишемию миокарда, ишемическую болезнь сердца, гипертоническую ишемию миокарда, застойную сердечную недостаточность, ишемию тканей, ишемию органов, острый коронарный синдром, гипертрофию, инфаркт мозга, инфаркт миокарда, аритмию, повреждающее действие ишемии/реперфузии (I/R повреждение).
В некоторых воплощениях способ применяется к человеческому субъекту, страдающему от повреждающего действия ишемии/реперфузии или имеющему риск его развития.
Еще один аспект данного изобретения предусматривает применение антитела в соответствии с данным изобретением, либо его связывающего фрагмента для применения в лечении или профилактике ишемии и реперфузии, связанной с трансплантацией солидных органов.
Лечение аутоиммунных заболеваний
В другом аспекте данное изобретение предусматривает способ лечения и/или профилактики аутоиммунного заболевания или состояния, связанного с ним, при этом способ включает следующие этапы:
- обеспечение терапевтически эффективного количества гуманизированного антитела или его связывающего фрагмента, как определено в данном документе, и
- введение указанного соединения субъекту, нуждающемуся в таком лечении.
Еще один аспект изобретения предусматривает гуманизированное антитело в соответствии с данным изобретением или связывающего представителя, полученного из него, для применения в лечении аутоиммунного заболевания, которое опосредовано целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
Другой аспект предусматривает применение гуманизированного антитела в соответствии с данным изобретением или связывающего представителя, полученного из него, для применения в лечении аутоиммунного заболевания, которое опосредовано целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
В некоторых воплощениях аутоиммунное заболевание является аутоиммунным артритом, в частности ревматоидным артритом. В некоторых воплощениях аутоиммунное заболевание выбрано из группы, включающей псориаз, дерматит. В некоторых других воплощениях аутоиммунное заболевание является диабетом. Как правило, диабет является сахарным диабетом. В некоторых воплощениях диабет является сахарным диабетом 1 типа. В некоторых других воплощениях диабет является сахарным диабетом 2 типа.
В некоторых воплощениях состояние, которое имеется у субъекта с сахарным диабетом, можно назвать диабетическим осложнением. Такие диабетические осложнения могут быть острыми осложнениями, хроническими осложнениями или их комбинацией.
Когда диабетическое осложнение является острым осложнением, это осложнение может быть выбрано из группы, включающей, но не ограничиваясь ими, ретинопатию, невропатию, нарушение периферического кровообращения, кожные язвы, полиурию, полидипсию, полифагию, диабетический кетоацидоз (ДКА) и некетоновое гиперосмолярное состояние. В некоторых других воплощениях такое состояние может быть состоянием, которое возникло как результат любого из предыдущих острых или хронических заболеваний и может включать, но не ограничиваясь ими, слепоту, протеинурию, боль, онемение, ощущение холода, перемежающуюся хромоту и гангрену.
В некоторых других воплощениях диабетические осложнения могут быть хроническими осложнениями, такими как сосудистые заболевания в результате хронически высокого уровня глюкозы в крови, приводящего к повреждению кровеносных сосудов (ангиопатии). В таких воплощениях, где повреждение сосудов происходит в мелких кровеносных сосудах, оно может привести к микроангиопатии, что может привести к диабетической ретинопатии, диабетической нейропатии и диабетической нефропатии.
В соответствии с еще одним аспектом изобретения предусмотрен способ лечения или профилактики у субъекта нарушения, связанного с ожирением, которое опосредовано целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2, при этом способ включает введение субъекту терапевтически эффективного количества антитела по любому из приведенных выше аспектов данного изобретения или связывающего представителя, полученного из него.
В еще одном аспекте изобретения предусмотрено гуманизированное антитело в соответствии с данным изобретением или связывающий представитель, полученный из него, для применения в лечении и/или профилактике ожирения, которое опосредовано целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
Еще один аспект предусматривает применение гуманизированного антитела в соответствии с данным изобретением или связывающего представителя, полученного из него, для изготовления лекарственного средства для лечения или профилактики болезненного состояния, связанного с ожирением, где состояние вызвано в целом или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
В некоторых воплощениях связанное с ожирением расстройство является по меньшей мере одним состоянием, выбранным из группы, включающей, но не ограничиваясь ими, сахарный диабет, в частности сахарный диабет типа 2, инсулинорезистентность, гиперинсулинемию, снижение клиренса глюкозы, дислипидемию, неалкогольную жировую болезнь печени, гипертонию, воспаление, гепатомегалию, стеатоз печени, инфаркт миокарда, астму или инсульт.
Еще один аспект данного изобретения предусматривает способ лечения у субъекта инсулинорезистентности, при этом способ включает введение субъекту терапевтически эффективного количества антитела в соответствии с данным изобретением или связывающего представителя, предусмотренного данным изобретением.
Еще один аспект изобретения предусматривает гуманизированное антитело, его фрагмент или связывающего представителя, полученного из него, для применения в лечении у субъекта инсулинорезистентности, которая опосредована целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
Еще один аспект предусматривает применение гуманизированного антитела в соответствии с данным изобретением или связывающего представителя, полученного из него, в изготовлении лекарственного средства для лечения или профилактики у субъекта инсулинорезистентности, которая опосредована целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
Лечение заболевания глаз
В некоторых дополнительных аспектах данное изобретение распространяется на способы лечения и/или профилактики глазного заболевания, которые включают следующие этапы:
- обеспечение терапевтически эффективного количества гуманизированного антитела, связывающего фрагмента или связывающего представителя, предусмотренного данным изобретением, и
- введение указанного соединения субъекту, нуждающемуся в таком лечении.
Еще один аспект данного изобретения предусматривает применение антитела в соответствии с данным изобретением или связывающего представителя, полученного из него, для лечения или профилактики глазного заболевания.
В некоторых воплощениях глазное заболевание представляет собой увеит или возрастную макулярную дегенерацию (ВМД).
Лечение почечного воспаления
Еще один аспект данного изобретения предусматривает способ лечения и/или профилактики почечного воспаления и заболевания или состояния, вызванного им или связанного с ним, при этом способ включает следующие этапы:
- обеспечение терапевтически эффективного количества гуманизированного антитела, связывающего фрагмента или связывающего представителя, предусмотренного данным изобретением, и
- введение указанного соединения субъекту, нуждающемуся в таком лечении.
Еще один аспект изобретения предусматривает гуманизированное антитело в соответствии с данным изобретением или связывающего представителя, полученного из него, для применения в лечении почечного воспаления или почечного заболевания, опосредованного целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
Еще один аспект предусматривает применение гуманизированного антитела в соответствии с данным изобретением или связывающего представителя, полученного из него, в изготовлении лекарственного средства для лечения или профилактики почечного воспаления или почечного заболевания, опосредованного целиком или частично активацией Toll-подобного рецептора 2 лигандом Toll-подобного рецептора 2.
Как определено в данном документе, термины «почечное воспаление» и «почечное заболевание» распространяются на состояния, которые по существу характеризуются возникновением воспаления в почке или в клетках почки, или когда возникновение воспалительного процесса в почках обусловлено заболеванием или воспалительным состоянием, которое в первую очередь поражает в организме не почки, а другое место. В частности, воспаление может произойти в местах, включая, но не ограничиваясь ими; клубочек, Боуменову капсулу или Боуменово пространство. Как правило, воспаление приводит по меньшей мере к частичному нарушению функции почек и/или почечной недостаточности.
В некоторых воплощениях почечное воспаление и заболевание включает «заболевание почек», где термин «заболевание почек» в целом относится к расстройству у человека по меньшей мере одной почки, где расстройство ставит под угрозу или нарушает функцию почки(почек), что физиологически характеризуется, например, потерей белка с мочой или выведением азотистых продуктов. Заболевание почек может также быть результатом первичной патологии почек, таких как повреждение клубочков или канальцев, или результатом повреждения другого органа, например поджелудочной железы, что негативно сказывается на способности почек выполнять биологические функции, такие как сохранение белка. Таким образом, заболевание почек у человека может быть прямым или косвенным влиянием болезненного состояния, которое может влиять на другие органы. Примеры заболеваний, которые влияют на почки, но которые не повреждают именно почки, включают сахарный диабет и системную красную волчанку. Термины «почечная недостаточность» и «заболевание почек» используются в данном документе как взаимозаменяемые с фразой «заболевания почек». Заболевания почек могут, например, быть результатом или следствием какого-либо изменения, повреждения или травмы клубочков, канальцев или интерстициальной ткани коры почек или мозгового вещества почек.
В некоторых воплощениях заболевание почек также может быть прогрессирующим заболеванием почек. Термин «прогрессирующее заболевание почек», используемый в данном документе, относится к любому заболеванию почек, которое со временем (например, в течение дней, недель, месяцев, лет) приводит к потере почками их функции. Как определено в данном документе, термин «функция почек», как правило, относится к физиологическому свойству почек, такому как способность сохранять белок, тем самым предотвращая протеинурию (например, альбуминурию). Почечная функция может быть оценена, например, по клубочковой фильтрации (например, по клиренсу креатинина), по экскреции белка с мочой, например, альбуминурии, по азоту мочевины в крови, по сывороточному или плазменному креатинину или по любой их комбинации.
Примеры конкретных состояний, которые подпадают под значение термина «почечное воспаление и заболевание» включают, но не ограничиваясь ими: почечные расстройства, которые включают, но не ограничиваясь ими: хроническую почечную недостаточность, острую почечную недостаточность, гетерологичный нефротоксический нефрит, гломерулонефрит, склероз клубочков, системную красную волчанку (СКВ), диабетическую нефропатию, диабетическую нефропатию, которая сопровождает склероз печени, гломерулонефрит, который сопровождается склерозом печени.
В некоторых других воплощениях почечное воспаление и заболевание может быть связано с иммуно-опосредованным заболеванием, которое поражает клетки почек и/или почечную функцию. Такие состояния могут включать, но не ограничиваясь ими: иммуноглобулин А-нефропатию, мембранопролиферативный гломерулонефрит, мезангиальный пролиферативный гломерулонефрит, непролиферативный гломерулонефрит, мембранозный гломерулонефрит, болезнь минимальных изменений, первичный фокально-сегментарный гломерулосклероз (ФСГС), фибриллярный гломерулонефрит, иммунотактоидный гломерулонефрит, пролиферативный гломерулонефрит, прогрессивный гломерулонефрит, анти-ГМБ-гломерулонефрит, ишемию почек, почечный васкулит, в том числе болезнь, связанную с анти-нейтрофильными цитоплазматическими антителами (АНЦА) (например, гранулематоз Вегенера), волчаночный нефрит, гломерулонефрит, связанный с криоглобулинемией, бактериальный эндокардит, пурпуру Шенлейна-Геноха, постинфекционный гломерулонефрит, гепатит С, диабетическую нефропатию, амилоидоз, гипертонический нефросклероз, болезнь легких цепей при множественной миеломе, вторичный фокальный гломерулосклероз и гипертонический нефросклероз.
Термин «почечное воспаление и заболевание» также охватывает острую почечную недостаточность. Острая почечная недостаточность («ОПН») относится к клиническим состояниям, связанным с быстрой, неуклонно растущей азотемией с олигурией (<500 мл/сут) или без нее. Причины ОПН могут быть сгруппированы в три диагностические категории: преренальные (неадекватный почечный кровоток); постренальные (обструкция), а также почечные. Патофизиология ОПН является сложной и многофакторной. Современные концепции предполагают, что ОПН может быть результатом прямой травмы почечных канальцев, ишемии почек или интратубулярной обструкции. Клинически ОПН приводит к ухудшению клубочковой фильтрации и снижению секреции продуктов обмена веществ, воды и электролитов. Перегрузка жидкостью, электролитный дисбаланс и уремический синдром приводят к дисфункции органов. Дисфункция органов в конечном итоге может привести к смерти.
В разных дополнительных аспектах данное изобретение распространяется на способы модуляции функции (например, изменения одной или более биологической активности TLR2) в TLR2-отвечающих клетках и/или тканях (например, в ткани, которая подверглась ишемии или которая может подвергнуться ишемии, или которая может подвергнуться реперфузии, в бета-клетках островков Лангерганса поджелудочной железы или любом другом типе клеток, которые экспрессируют TLR2 и которые замешаны в TLR2-опосредованном болезненном состоянии или его развитии). Способ включает контактирование TLR2-отвечающей клетки и/или TLR2-отвечающей ткани с гуманизированным антителом или его фрагментом, как это предусмотрено изобретением, в количестве, достаточном для того, чтобы проявить антагонизм функции TLR2-отвечающей клетки или ткани или биологической активности TLR2 в клетке или ткани. В одном воплощении этап контактирования может быть осуществлен in vitro, например, в клеточном лизате или в восстановленной системе. Кроме того, рассматриваемый способ может быть выполнен на клетках в культуре, например, in vitro или ex vivo. Например, клетки, такие как очищенные или рекомбинантные клетки, можно культивировать in vitro, и этап контактирования может быть осуществлен путем добавления модулятора TLR2 в культуральную среду. Как правило, TLR2-отвечающая клетка является клеткой млекопитающего, такой как клетка человека. В некоторых воплощениях TLR2-отвечающая ткань является тканью, которая подверглась ишемии и в которой может возникнуть реперфузия, или является клеточной популяцией, связанной с ней. В других воплощениях этот способ может быть выполнен на клетках, присутствующих у субъекта, например, как часть протокола in vivo, или на животном (в том числе, например, на человеке или на животной модели in vivo). Протокол in vivo может быть терапевтическим или профилактическим, а воспалительная модель может быть, например, генетически модифицированной моделью, например, животной моделью со сверхэкспрессией TLR2 или мутацией или делецией в TLR-рецепторе. Для способов in vivo может быть предоставлено гуманизированное антитело или его фрагмент отдельно или в комбинации с другим агентом, таким как вторичное терапевтическое средство, например противовоспалительный препарат, или фармацевтически приемлемый носитель, эксципиент или разбавитель. Как правило, антитело вводят субъекту, страдающему или имеющему риск развития ^К2-опосредованного состояния, такого как ревматоидный артрит, повреждающее действие ишемии/реперфузии, сахарный диабет или почечное воспаление, в количестве, достаточном для противодействия одной или более TLR2-опосредованной активности или функции у субъекта. В некоторых воплощениях количество или доза вводимого гуманизированного анти-TLR2 антитела изобретения можно определить до введения путем тестирования in vitro или ex vivo количества антитела, необходимого для изменения, например уменьшения или подавления, одной или более функциональной активности TLR2, при этом указанная функциональная активность, как правило, включает одну или более биологическую активность TLR2, описанную в данном документе.
Понятно, что любой из вышеперечисленных способов лечения может быть осуществлен с использованием иммуноконъюгата изобретения вместо или в дополнение к анти-TLR2-антителам изобретения или связывающим фрагментам антитела.
В некоторых дополнительных аспектах изобретение распространяется на применение антител данного изобретения в диагностических целях. Таким образом, другой аспект изобретения предлагает способ диагностики расстройства, связанного с повышенной экспрессией Toll-подобного рецептора 2. В некоторых воплощениях способ включает контактирование тестируемой клетки с анти-ТLR2-антителом изобретения; определение уровня экспрессии TLR2 (количественное или качественное) на тестируемой клетке путем выявления связывания анти-TLR2-антитела с TLR2; и сравнение уровня экспрессии TLR2 на тестируемой клетке с уровнем экспрессии TLR2 на контрольной клетке (например, на нормальной клетке того же тканевого происхождения, что и тестируемая клетка, или на клетке, экспрессирующей TLR2 на уровне, сравнимом с такой нормальной клеткой), где более высокий уровень экспрессии TLR2 на тестируемой клетке по сравнению с контрольной клеткой указывает на наличие расстройства, связанного с повышенной экспрессией TLR2. В некоторых воплощениях тестируемую клетку получают у лиц, у которых подозревается расстройство, связанное с повышенной экспрессией TLR2. В некоторых воплощениях расстройство представляет собой воспалительное расстройство или иммуно-опосредованное расстройство, как описано выше.
Терапевтическая эффективность
Изобретателем было установлено, что гуманизированное анти-TLR2-антитело, которое предусмотрено в данном документе, терапевтически является более желательным, чем мышиное моноклональное анти-TLR2-антитело, известное в данной области.
В дополнение к структурным различиям, которые существуют между вариабельными доменами легкой и тяжелой цепи гуманизированных антител изобретения и мышиных анти-^Р2-антител уровня техники, изобретатель также неожиданно выявил ряд функциональных преимуществ, предоставляемых гуманизированным антителом данного изобретения, которые сделали бы применение такого антитела более предпочтительным в клинических условиях.
Без какой-либо связи изобретатель определил, что по сравнению с мышиным моноклональным анти-TLR2-антителом 11G7 полностью гуманизированное антитело в соответствии с данным изобретением демонстрирует превосходную функциональную и клиническую полезность в качестве антитела, выступающего антагонистом TLR2-функции независимо от того, формирует TLR2 гетеродимер с TLR1 или с TLR6.
В отношении мышиного антитела TL2.1 изобретатель определил, что гуманизированное антитело данного изобретения перекрестно реагирует с различными формами TLR2 млекопитающих, таких как человек, мышь, крыса, свинья и обезьяна, тогда как мышиное антитело TL2.1 демонстрирует специфичность связывания только с TLR2 человека. Кроме того, гуманизированное антитело данного изобретения не включает мышиные аминокислотные остатки, и, соответственно, вероятность того, что при введении его субъекту появятся нейтрализующие антитела против него, является минимальной по сравнению с антителом TL2.1 мышиного происхождения.
Что касается антитела Т2.5, изобретателем неожиданно было установлено, что антитело Т2.5 (мышиное антитело к Toll-подобному рецептору 2 (TLR2), полученное из гибридомного клона Т2.5, HyCult Biotechnology b.v., Cell Science, Кантон, США: каталоговый номер 1054) опосредует антагонизм активации TLR2 и передачи через него сигнала, что происходит С032-зависимым образом. Изобретателем было определено, что полностью гуманизированные антитела данного изобретения не требуют CD32, чтобы опосредовать супрессию TLR2-сигналинга, т.е. связывание CD32, например Fc-областью антитела, не должно происходить для того, чтобы опосредовать антагонизм TLR2-рецептора при связывании Fab-части антитела. Таким образом, антагонизм функции Toll-подобного рецептора 2, который опосредован полностью гуманизированным моноклональным антителом данного изобретения OPN-305, опосредован CD32-независимым образом. Это включает связывание и CD32a, и CD32b. Это неожиданное наблюдение, которое было сделано изобретателем, является клинически значимым, так как полностью гуманизированное антитело данного изобретения имеет потенциально больший доступ для пациентов.
Кроме того, предполагается, что полностью гуманизированные антитела данного изобретения связываются с эпитопом, определенным по остаткам на N- и С-концах TLR2-аминокислотной последовательности. Это отличается от WO 2005/028509, в котором заявляется, что эпитоп, связанный моноклональным антителом Т2.5, находится на N-конце (только) TLR2 последовательности.
Кроме того, как свидетельствуют сравнительные примеры, приведенные в данном документе, изобретатель подтвердил, что полностью гуманизированное антитело данного изобретения демонстрирует сниженный профиль иммуногенности, т.е. что антитела являются менее иммуногенными в связи с отсутствием Т-клеточных эпитопов. Соответственно, маловероятно, что антитела в соответствии с изобретением будут вызывать нейтрализующий ответ против них при введении человеческому субъекту. Эта функциональная характеристика означает, что полностью гуманизированное антитело данного изобретения является гораздо более желательным для применения в клинических условиях, чем мышиные антитела TL2.1, Т2.5 и 11G7, которые известны в данной области, или химерные антитела или гуманизированные антитела, которые могут быть разработаны на основе традиционных методик CDR-прививки.
Антитела
Термин «антитело» обозначает иммуноглобулин, природный или частично или полностью синтезированный. Термин также охватывает любые полипептиды, белки или пептиды, имеющие связывающий домен, который является связывающим доменом гуманизированных антител изобретения или гомологичен ему.
Иммуноглобулины, как правило, имеют гетеротетрамерную структуру, включающую две идентичные тяжелые цепи и две идентичные легкие цепи, связанные между собой дисульфидными мостиками. Каждая тяжелая и легкая цепь включает вариабельный домен, который обеспечивает специфичность связывания с антигеном, при этом данные домены называют VH- и VL-доменами для тяжелой и легкой цепей, соответственно. Каждая цепь также включает по меньшей мере один константный домен, при этом легкая цепь имеет один константный домен, обозначаемый CL-доменом, а тяжелая цепь включает три константных домена, СН1, СН2 и СН3. Некоторые изотипы антител также включают другой константный домен, называемый СН4-доменом. У людей существует 5 различных классов антител, а именно: IgG, IgA, IgE и IgD IgM.
Fc-домен антитела, как правило, включает последние два константных домена каждой тяжелой цепи. Они димеризуются, формируя Fc-домен, который несет ответственность за опосредование эффекторных функций антитела, таких как ADCC (антителозависимая клеточноопосредованная цитотоксичность) и связывание комплемента. Fc-область антитела также играет определенную роль во времени полужизни антитела в кровотоке. В Fc-области могут быть сделаны изменения для модуляции функции антитела.
Так как антитела могут быть изменены несколькими способами, то термин «антитело» следует толковать как затрагивающее любой специфически связывающий представитель, который имеет такую же специфичность связывания, как гуманизированные антитела данного изобретения. Соответственно, термин «антитело» распространяется на фрагменты антител и гомологи, а также на любой полипептид, содержащий иммуноглобулин-связывающий домен, который имеет специфичность связывания с Toll-подобным рецептором 2 и служит антагонистом функции TLR2.
Кроме того, известно, что фрагменты целого антитела могут выполнять функцию связывания антигенов. Примеры таких связывающих фрагменты включают, но не ограничиваясь ими: (i) Fab-фрагменты, состоящие из VL-, VH- CL-и СН1-доменов гетеротетрамерного антитела, (ii) F(ab')2-фрагменты, двухвалентные фрагменты, состоящие из двух Fab-фрагментов, соединенных дисульфидным мостиком в шарнирной области, (iii) Fab'-фрагмент, Fab-фрагмент с частью шарнирной области, (iv) Fd-фрагменты, состоящие из VH- и CH1-доменов гетеротетрамерного антитела, (v) Fv-фрагменты, состоящие из VH- и VL-доменов гетеротетрамерного антитела, (vi) scFv (одноцепочечные Fv-молекулы), в которых домен VH и домен VL связаны пептидным линкером, (vii) выделенный CDR, такой как VHCDR3, (viii) двухвалентные антитела, которые являются мультимерами полипептидов, которые могут быть поливалентными или полиспецифичными фрагментами, полученными с помощью методик генного слияния.
В некоторых дополнительных аспектах изобретение также распространяется на биспецифичные антитела. Они могут включать обычные биспецифичные антитела, которые могут быть получены путем химической конъюгации или с помощью гибридных гибридомных клеточных линий. Кроме того, биспецифичные антитела могут быть получены из фрагментов биспецифичных антител, таких как scFv-димеры или двухвалентные антитела. В некоторых воплощениях могут быть использованы scFv-димеры, а не целые антитела. Такие двухвалентные антитела могут быть сконструированы с помощью только вариабельных доменов и, следовательно, предоставлены без Fc-области; такая структура снижает возможность возникновения НАМА или антиидиотипического иммунного ответа.
Аминокислотные остатки в доменах антитела условно пронумерованы в соответствии с системой, разработанной Кабат и соавт.(URL www.kabatdatabase.com). Эта нумерация используется в данном описании, если не указано иное.
Пептидомиметики
Данное изобретение также распространяется на пептидомиметики, которые основаны на антителах данного изобретения или их связывающих фрагментах. Используемый в данном документе термин «пептидомиметик» или «пептидный миметик» обозначает молекулы, которые не являются полипептидами, но которые имитируют аспекты их структуры и которые, в контексте данного изобретения, специфично связываются с Toll-подобным рецептором 2 таким образом, что приводят к функциональной активности Toll-подобного рецептора 2, являясь их агонистами. Таким образом, изобретение распространяется на пептидомиметики, основанные на антителах изобретения, которые действуют как антагонисты Toll-подобного рецептора 2.
Антагонисты-пептидомиметики могут быть получены обычными химическими способами (см., например, Damewood J.R. "Peptide Mimetic Design with the Aid of Computational Chemistry" in Reviews in Computational Biology, 2007, Vol.9, pp.1-80, John Wiley and Sons, Inc., New York, 1996; Kazmierski W.K., "Methods of Molecular Medicine: Peptidomimetic Protocols," Humana Press, New Jersey, 1999). Пептидомиметики, которые могут быть так получены, являются антагонистами Toll-подобного рецептора 2, где указанные пептидомиметики основаны на антителах данного изобретения и, в частности, основаны на вариабельных областях тяжелой и легкой цепей. Например, могут быть получены полисахариды, которые имеют такие же функциональные группы, как пептиды. Пептидомиметики могут быть получены, например, путем создания трехмерной структуры пептидного агента в среде, в которой он связывается или будет связываться с молекулой-мишенью. Пептидомиметик включает по меньшей мере два компонента, связывающую группировку или группировки и остов или несущую конструкцию.
Связывающие группировки представляют собой химические атомы или группы, которые будут реагировать или формировать комплекс (например, за счет гидрофобных или ионных взаимодействий) с молекулой-мишенью, например с аминокислотой(ами), на сайте связывания лиганда или вблизи него, например на эпитопе Toll-подобного рецептора 2, включающем аминокислотную последовательность SEQ ID №3 или SEQ ID №4. Например, связывающие группировки в пептидомиметике могут быть такими же, как и в пептидном или белковом антагонисте. Связывающая группировка может быть атомом или химической группой, которая вступает в реакцию с Toll-подобным рецептором 2 так же, как антитела данного изобретения или аналогичным образом. Примеры связывающих группировок, годных для применения в проектировании пептидомиметика для основной аминокислоты в пептиде, включают азотсодержащие группы, такие как аминовые, аммонийные, гуанидиновые и амидные или фосфониумные. Примеры связывающих группировок, подходящих для применения в создании пептидомиметика для кислой аминокислоты, включают, например, карбоксил, сложный эфир низшего алкила и карбоновой кислоты, сульфокислоту, сложный эфир низшего алкила и сульфоновой кислоты или фосфористую кислоту или ее сложный эфир.
Несущая конструкция является химическим объектом, который при связывании со связывающей группировкой или группировками обеспечивает трехмерную конфигурацию пептидомиметика. Несущая конструкция может быть органической или неорганической. Примеры органических несущих конструкций включают полисахариды, полимеры или олигомеры органических синтетических полимеров (например, поливинилового спирта или полилактида). Предпочтительно, чтобы несущая конструкция обладала практически такими же размерами и параметрами, что и пептидный остов или несущая конструкция. Их можно определить путем вычисления или измерения размеров атомов и связей пептида и пептидомиметика. В одном воплощении азот пептидной связи можно заменить кислородом или серой, например, формируя полиэфирный остов. В другом воплощении карбонильную группу можно заменить сульфонильной или сульфинильной, тем самым образуя полиамид (например полисульфонамид). Можно получить обратные амиды пептида (например, заменяя одну или более -CONH-группу на -NHCO-группу). В еще одном воплощении пептидный остов может быть заменен полисилановым остовом.
Эти соединения могут быть изготовлены с помощью известных способов. Например, полиэстеровый пептидомиметик может быть получен путем замены гидроксильной группой соответствующей α-аминогруппы аминокислот, тем самым образуя гидроксиаминокислоту и последовательно этерифицируя гидроксикислоты, также блокируя основные и кислые боковые цепи, чтобы свести к минимуму побочные реакции. Как правило, определение соответствующего пути химического синтеза можно легко провести при определении химической структуры.
Пептидомиметики могут быть синтезированы и собраны в библиотеки, включающие от нескольких до многих отдельных молекулярных видов. Такие библиотеки могут быть получены с помощью хорошо известных способов комбинаторной химии, и можно провести исследование, чтобы определить, содержит ли библиотека один или более пептидомиметик с требуемой активностью. Такие пептидомиметики-антагонисты могут быть выделены с помощью соответствующих способов.
Соответственно, некоторые другие аспекты данного изобретения распространяются на пептидомиметики, которые разработаны на основе паратопов антител данного изобретения, связывающих Toll-подобный рецептор 2. В частности, такие пептидомиметики основаны на структуре CDR-областей антител, описанных в данном документе. Методики производства таких пептидомиметиков хорошо известны специалистам в данной области и включают способ Dougall et al. ("Design of pharmacologic agents based on antibody structure", Trends in Biotechnology. 1994. 12. p372-379). Также методики Saragovi et al. (Saragovi, et al., "Design and Synthesis of a Mimetic from an Antibody Complementarity-Determining Region", Science 253:792-795 (1991) и Saragovi et al., "Loops and Secondary Structure Mimetics: Development and Applications in Basic Science and Rational Drug Design", Biotechnology 10: 773-778 (1992)). Такие пептидомиметики могут, в частности, быть основаны на CDR3 тяжелой цепи. Williams, et al. (Williams et al., "Design of Bioactive Peptides Based on Antibody Hypervariable Region Structures", J.Biol. Chem. 266: 5182-5160 (1991)) описывает выделение и синтез конформационно ограниченных пептидов, полученных из определяющих комплементарность областей легкой цепи антител. Эта CDR особенно важна для специфичности связывания антитела вследствие сложного генетического механизма, который влияет на его структуру, являясь причиной средних или длинных петель, которые имеют разнообразные модели взаимодействия. Конформационные свойства пептидных петель или обратных разворотов считаются важными посредниками в биологической активности полипептидов. Развороты предусматривают соответствующие ориентации связывающих групп, необходимые для биологической активности за счет стабилизации сложенной конформации в маленькую молекулу, и могут быть вовлечены и в сайты связывания, и в сайты распознавания.
Данное изобретение также распространяется на антитела-миметики, такие как Affibodies, доменные антитела, Nanobodies, UniBodies, DARPins, Anticalins, Avimers, Versabodies и Duocalins, которые основаны на антителах к Toll-подобному рецептору 2 данного изобретения. Специалистам в данной области известен широкий спектр методик для антител-миметиков. Например, так называемые доменные антитела (Domantis, Великобритания) являются небольшими функциональными связывающими единицами антител, которые соответствуют вариабельным областям либо легких, либо тяжелых цепей человеческих антител. Инструкции для производства таких доменных антител можно найти в патенте США №6291158, патенте США №6582915 и патенте США №6593081. Нанотела являются терапевтическими белками, полученными из антител, которые обладают уникальными структурными и функциональными свойствами тяжелых цепей природных антител, найденных у верблюдовых. Unibodies также являются другой методикой получения фрагментов антитела, основанной на удалении шарнирой области антител IgG4. Удаление шарнирной области приводит к получению молекулы, размер которой составляет примерно половину размера традиционного антитела IgG4, и которая имеет одновалентную область связывания. Unibodies сохраняют свойство антител IgG4 быть инертными и, следовательно, не вызывают иммунный ответ. Таким образом, как и терапевтические средства, основанные на антителах IgG4, такие как описанные в данном документе воплощения антител данного изобретения, Unibodies могут быть использованы как антагонисты специфических функций клеток, но гибель клеток, как правило, не происходит, так как Unibody, как и антитело IgG4, не опосредует иммунный ответ против мишени, с которой оно связывается. Unibodies выводятся из организма с той же скоростью, что и IgG4, и связываются с их целевыми антигенами с аналогичной аффинностью.
Другие связывающие молекулы включают: молекулы аффител (affibody) (патент США 5831012), DARPins (разработанные белки с анкририновыми повторами) (Международная публикация патентной заявки РСТ WO 02/20565) и антикалины (патент США №7250297 и WO 99/16873). Verabodies являются другой методикой имитации антитела. Versabodies (Amunix, публикация патента США №2007/0191272) являются небольшими белками, называемыми микропротеинами, 3-5 кДа, с более чем 15% остатков цистеина, которые образуют остов с высокой плотностью дисульфидных связей, который заменяет гидрофобное ядро, обычно существующее в белке.
Avimers являются еще одним типом миметических антител. Avimers получают путем рекомбинации семейств человеческих сывороточных белков. Они являются одинарными белковыми цепями, состоящими из модульных связывающих доменов, каждый из которых предназначен для связывания со специфическим целевым сайтом. Avimers могут связываться одновременно с сайтами на одинарной белковой мишени и/или с сайтами на многобелковых мишенях. Известный как многоточечное присоединение или авидность, этот связывающий механизм имитирует способ взаимодействия клеток и молекул в организме, поддерживает образование антагонистов и агонистов и позволяет получить препараты с множественными функциями и высокой активностью. Библиотеки Avimers могут быть получены в соответствии с WO 2004/044011, который включен в данный документ посредством ссылки и, в частности, с Примером 6 на стр.99, и, например, патентами США (публикации) №№US 2005/0053973, US 2005/0089932, US 2005/0164301. Библиотеки Avimers также доступны коммерчески от Avidia Inc, Маунтин-Вью, Калифорния, США.
Производство антител
Антитела и связывающие представители изобретения могут быть изготовлены полностью или частично путем химического синтеза. Например, антитела и связывающие представители изобретения могут быть получены с помощью методик, хорошо известных специалистам в данной области, таких как стандартный жидкофазный пептидный синтез или твердофазный пептидный синтез. Кроме того, антитела и связывающие представители могут быть приготовлены в растворе с использованием методик жидкофазного пептидного синтеза или также путем сочетания твердофазной, жидкофазной химии и химии растворов.
Данное изобретение также распространяется на продукцию антител или связывающих представителей изобретения путем экспрессии нуклеиновой кислоты, которая кодирует по меньшей мере одну аминокислоту, которая содержит антитело изобретения в подходящей экспрессионной системе, так что может быть закодирован требуемый пептид или полипептид. Например, для обеспечения данного изобретения может быть экспрессирована нуклеиновая кислота, кодирующая аминокислоты легкой цепи, и вторая нуклеиновая кислота, кодирующая аминокислоты тяжелой цепи.
Соответственно, в некоторых других аспектах изобретения предложены нуклеиновые кислоты, кодирующие аминокислотные последовательности, которые образуют антитела или связывающие представители данного изобретения.
Как правило, нуклеиновые кислоты, кодирующие аминокислотные последовательности, которые образуют антитела или связывающие представители данного изобретения, могут быть предоставлены в выделенной или очищенной форме или могут быть предоставлены в форме, которая практически не содержит материал, который может быть в природе связан с ней, за исключением одной или более регуляторной последовательности. Нуклеиновая кислота, которая экспрессирует антитело или связывающий представитель изобретения, может быть полностью или частично синтетической и может включать, но не ограничиваясь ими, ДНК, к ДНК и РНК.
Нуклеиновокислотные последовательности, кодирующие антитела или связывающие представители изобретения, могут быть легко получены специалистом с использованием методик, хорошо известных специалистам в данной области, таких как описанные в Sambrook et al. "Molecular Cloning", A laboratory manual, cold Spring Harbor Laboratory Press, Volumes 1-3, 2001 (ISBN-0879695773), и Ausubel et al. Short Protocols in Molecular Biology. John Wiley and Sons, 4th Edition, 1999 (ISBN - 0471250929). Указанные методики включают (i) применение полимеразной цепной реакции (ПЦР) для амплификации образцов нуклеиновых кислот, (ii) химический синтез, или (iii) получение к ДНК-последовательностей. ДНК, кодирующие антитела или связывающие представители изобретения, могут быть получены и использованы любым подходящим способом, известным специалистам в данной области, в том числе со взятием кодирующей ДНК, определением подходящих рестрикционных ферментов, распознающих сайты по сторонам от части, которая будет экспрессирована, и вырезанием указанной части из ДНК. Вырезанная часть может быть функционально связана с подходящим промотором и экспрессирована в подходящей экспрессионной системе, такой как коммерчески доступная экспрессионная система. Кроме того, соответствующие фрагменты ДНК можно амплифицировать с использованием соответствующих ПЦР-праймеров. Изменения в последовательности ДНК могут быть сделаны с помощью сайт-направленного мутагенеза.
Нуклеиновокислотные последовательности, кодирующие антитела или связывающие представители изобретения, могут быть предоставлены как конструкции в форме плазмиды, вектора, транскрипционной или экспрессионной кассеты, которая включает по меньшей мере одну нуклеиновую кислоту, описанную выше. Конструкция может находиться в рекомбинантной клетке-хозяине, которая содержит одну или более конструкцию, описанную выше. Экспрессии можно удобно достичь путем культивирования в соответствующих условиях рекомбинантных клеток-хозяев, содержащих подходящие Нуклеиновокислотные последовательности. После экспрессии антитело или фрагменты антитела можно выделить и/или очистить, используя любую подходящую методику по мере необходимости.
Системы для клонирования и экспрессии полипептида в различных клетках-хозяевах хорошо известны. Подходящими клетками-хозяевами являются бактерии, клетки млекопитающих, дрожжей, насекомых и бакуловирусные системы. Клеточные линии млекопитающих, доступные в данной области для экспрессии гетерологичного полипептида, включают клетки яичника китайского хомяка (СНО), клетки HeLa, клетки почек детеныша хомяка и клетки мышиной миеломы NS0. Как правило, предпочтительным бактериальным хозяином является E.coli. Экспрессия антител и фрагментов антител в прокариотических клетках, таких как E.coli, хорошо известна в данной области. Экспрессия в эукариотических клетках в культуре также доступна специалистам в данной области как вариант получения связывающего представителя.
Специалистам в данной области хорошо известны общие методики производства антител, в т.ч. такие методики, которые обсуждаются, например, в Kohler and Milstein (1975) Nature 256: 495-497; патенте США №4376110; Harlow and Lane, Antibodies: a Laboratory Manual, (1988) Cold Spring Harbor. Методики изготовления рекомбинантных молекул антител описаны в приведенных выше ссылках, а также, например, в европейском патенте №0368684.
В некоторых воплощениях изобретения используются рекомбинантные нуклеиновые кислоты, включающие вставку, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антител или связывающих представителей. По определению такие нуклеиновые кислоты включают кодирующие одноцепочечные нуклеиновые кислоты, двухцепочечные нуклеиновые кислоты, состоящие из указанных кодирующих нуклеиновых кислот и комплементарных им нуклеиновых кислот, или эти комплементарные (одноцепочечные) нуклеиновые кислоты сами по себе.
Кроме того, нуклеиновые кислоты, кодирующие вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антител, могут быть ферментативно или химически синтезированными нуклеиновыми кислотами с подлинной последовательностью, кодирующей природный вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи или их мутант.
Антитело изобретения может быть получено с помощью рекомбинантных средств не только напрямую, но и как гибридный полипептид с гетерологичным полипептидом, который предпочтительно является сигнальной последовательностью, или другим полипептидом, имеющим специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно является такой, которая распознается и процессируется (например, расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не процессируют нативную сигнальную последовательность антитела, сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы лидерных пептидов щелочной фосфатазы, пенициллиназы, ЛП или термостабильного энтеротоксина II.
Выделенный
Термин «выделенный», используемый по отношению к полностью гуманизированным антителам изобретения или связывающим представителям, полученным из них, или полипептидам, их кодирующим, относится к состоянию, в котором указанные антитела, связывающие представители или нуклеиновые кислоты (полинуклеотиды) предоставляются в выделенной и/или очищенной форме, т.е. они разделены, выделены или очищены от их природной среды и предоставлены в практически чистой или однородной форме или, в случае нуклеиновых кислот, свободны или практически свободны от нуклеиновых кислот или генов иного происхождения, отличного от последовательности, кодирующей полипептид с искомой функцией. Соответственно, такие выделенные антитела, связывающие представители и выделенные нуклеиновые кислоты будут свободны или практически свободны от материала, с которым они в природе связаны, например свободны от других полипептидов или нуклеиновых кислот, с которыми они находятся в их природной среде или в среде, в которой они получены(например, в клеточной культуре), когда такое получение является рекомбинантной ДНК-методикой, практикуемой in vitro и in vivo.
Антитела, связывающие представители и нуклеиновые кислоты могут быть составлены с разбавителями или адъювантами, но, тем не менее, для практических целей должны рассматриваться как предусмотренные в выделенном виде. Например, антитела и связывающие представители можно смешать с желатином или другими носителями, если использовать для покрытия микротитровальных планшетов для применения в иммунологических анализах, или смешать с фармацевтически приемлемыми носителями или разбавителями для применения в диагностических или терапевтических целях. Антитела или связывающие представители могут быть гликозилированы природным путем или с помощью систем гетерологичных эукариотических клеток (например, клеток СНО и NSO,) или они могут быть негликозилированными (например, если получены путем экспрессии в прокариотических клетках).
Гетерогенные препараты, включающие молекулы гуманизированных анти-TLR2-антител, также являются частью изобретения. Например, такие препараты могут быть смесями антител с тяжелыми цепями полной длины и тяжелыми цепями без С-концевого лизина с различной степенью гликозилирования и/или изменением аминокислот, таким как циклизация N-концевой глутаминовой кислоты с формированием пироглутаминового остатка.
Введение
Моноклональное антитело или связывающий представитель данного изобретения может быть введен в одиночку, но предпочтительно его вводят в виде фармацевтической композиции, которая обычно включает подходящий фармацевтически приемлемый эксципиент, разбавитель или носитель, выбранный в зависимости от предполагаемого пути введения. Примеры подходящих фармацевтических носителей включают: воду, глицерин, этанол и т.п.
Моноклональное антитело или связывающий представитель данного изобретения можно вводить пациенту, нуждающемуся в лечении, любым подходящим путем. Как правило, композицию можно вводить парентерально путем инъекции или инфузии. Примеры предпочтительных путей парентерального введения включают, но не ограничиваясь ими, внутривенный, внутрисердечный, внутриартериальный, внутрибрюшинный, внутримышечный, внутриполостной, подкожный, чресслизистый, ингаляционный или трансдермальный. Пути введения также могут включать местный и энтеральный путь, например, чресслизистый (в том числе легочный), пероральный, назальный, ректальный.
В воплощениях, где композицию поставляют в виде инъекционной композиции, например для внутривенного, внутрикожного или подкожного применения, активный ингредиент может быть в форме парентерально приемлемого водного раствора, который является апирогенным и имеет подходящий рН, изотоничность и стабильность. Соответствующие специалисты в данной области способны приготовить подходящие растворы, используя, например, изотонические носители, такие как инъекционный хлорид натрия, инъекционный раствор Рингера или инъекционный лактат Рингера. При необходимости могут быть включены консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
Композицию также можно вводить через микросферы, липосомы, другие системы доставки микрочастиц или составы с замедленным высвобождением, помещенные в некоторые ткани, включая кровь.
Примеры методик и протоколов, упомянутых выше, и других методик и протоколов, которые могут быть использованы в соответствии с изобретением, можно найти в Remington's Pharmaceutical Sciences, 18th edition, Gennaro, A.R., Lippincott Williams & Wilkins; 20th edition ISBN 0-912734-04-3, и Pharmaceutical Dosage Forms and Drug Delivery Systems; Ansel, H.C. et al. 7th Edition ISBN 0-683305-72-7, который в полном объеме включен в данный документ посредством ссылки.
Как правило, композицию изобретения субъекту вводят в «терапевтически эффективном количестве», которое является количеством, достаточным для того, чтобы продемонстрировать пользу введенной субъекту композиции. Фактическая вводимая доза, а также скорость и длительность курса введения будут зависеть и могут быть определены с учетом характера и тяжести состояния, которое подвергается лечению, а также таких факторов, как возраст, пол и вес субъекта, подлежащего лечению, а также пути введения. Также должное внимание следует уделить свойствам композиции, например, ее связывающей активности и времени полужизни в плазме in vivo, концентрации антитела или связывающего представителя в составе, а также пути, месту и скорости доставки.
Режимы дозировки могут включать однократное введение композиции или многократное введение доз композиции. Композиции также могут вводиться последовательно или раздельно с другими терапевтическими и лекарственными средствами, которые используются для лечения состояния, при котором антитело или связывающий представитель данного изобретения вводят для лечения.
Примеры схем дозировок, которые используют для введения субъекту, могут быть выбраны из группы, включающей, но не ограничиваясь ими; от 1 мкг/кг/сут до 20 мг/кг/сут, от 1 мкг/кг/сут до 10 мг/кг/сут, от 10 мкг/кг/сут до 1 мг/кг/сут. В некоторых воплощениях дозировка будет такой, что концентрация антитела в плазме крови составит от 1 мкг/мл до 100 мкг/мл. Тем не менее, фактическая доза вводимой композиции, а также скорость и длительность курса введения будут зависеть от характера и тяжести состояния, подлежащего лечению. Назначение лечения, например решения по дозировке и т.д., в конечном счете находится под ответственностью и на усмотрение врачей общей практики и других врачей, и при этом, как правило, учитывается расстройство, подлежащее лечению, состояние пациента, место доставки, способ введения и другие факторы, известные практикующим специалистам.
Определения
Если иное не определено, то все технические и научные термины, используемые в данном документе, имеют обычный смысл, понятный специалистам в области данного изобретения.
Необходимо понимать, что в данном описании, если контекст не требует иного, термины «включать» или «содержать» или вариации, такие как «содержит» или «содержащий», «включает» или «включающий», предполагают включение определенного целого числа или группы целых чисел, но не исключают любые другие целые числа или группу целых чисел.
Используемые в данном документе термины в единственном числе включают единственное и множественное число объектов, если из контекста явно не следует иное. Так, например, ссылка на «активный агент» или «фармакологически активный агент» включает один активный агент, а также два или более различных активных агента в комбинации, в то время как ссылки на «носитель» включает смесь двух или более носителей, а также один носитель и т.п.
Термины «специфически связывается», «селективно связывается» или «специфичность связывания» относятся к способности полностью гуманизированных антител или связывающих соединений изобретения связываться с целевым эпитопом, присутствующим на Toll-подобном рецепторе, с более высокой аффинностью, чем при связывании с нецелевым эпитопом. В некоторых воплощениях специфическое связывание относится к связыванию с мишенью с аффинностью, которая по меньшей мере в 10, 50, 100, 250, 500 или 1000 раз больше, чем аффинность к нецелевому эпитопу. В некоторых воплощениях эту аффинность определяют в анализе аффинности ИФА. В некоторых воплощениях эту аффинность определяют в анализе BIAcore. В некоторых воплощениях аффинность определяют кинетическим способом. В некоторых воплощениях аффинность определяют с помощью равновесного раствора.
Используемый в данном документе термин «эффективное количество» или «терапевтически эффективное количество» означает количество агента, связывающего соединения, малой молекулы, гибридного белка или пептидомиметика изобретения, которое требуется для подавления TLR2-опосредованного воспаления в почке или которое уменьшает выраженность TLR2-опосредованного заболевания почек и/или по меньшей мере одного симптома этого заболеваний или состояния, связанного с ним.
Используемый в данном документе термин «профилактически эффективное количество» относится к количеству композиции, которое требуется для предотвращения начального развития, прогрессирования или рецидивирования TLR2-опосредованного заболевания или воспалительного состояния или по меньшей мере одного его симптома у субъекта после введения соединений данного изобретения.
Используемый в данном документе термин «лечение» и связанные с ним термины, такие как «лечить» и «лечащий», означают уменьшение прогрессии, тяжести и/или продолжительности TLR2-опосредованного состояния или по меньшей мере одного его симптома, при этом указанное уменьшение или улучшение получено путем введения связывающего соединения, специфичного к TLR2-связывающему эпитопу данного изобретения. Таким образом, термин «лечение» относится к любому режиму, который может принести пользу субъекту. Лечение может проводиться по отношению к имеющемуся состоянию или может быть профилактическим (профилактическое лечение). Лечение может включать лечебный, смягчающий или профилактический эффект. Ссылки в данном документе на «терапевтическое» и «профилактическое» лечение следует рассматривать в самом широком контексте. Термин «терапевтическое» не обязательно означает, что субъекта лечат до полного выздоровления. Аналогично, «профилактическое» не обязательно означает, что у субъекта в конечном итоге не разовьется болезненное состояние.
Используемый в данном документе термин «субъект» относится к животным, предпочтительно млекопитающим, и, в частности, к человеку. В конкретном воплощении субъектом является млекопитающее, в частности человек. Термин «субъект» и термин «пациент», используемые в данном документе, являются взаимозаменяемыми.
Данное изобретение будет описано со ссылкой на следующие примеры, которые предусмотрены в демонстрационных целях и не предназначены для ограничения данного изобретения.
ПРИМЕРЫ
Пример 1 - Производство полностью гуманизированного моноклонального антитела
TLR2-антагонистические антитела данного изобретения, как правило, являются полностью гуманизированными антителами. Эти антитела имеют полностью человеческое происхождение, и, следовательно, не содержат области или аминокислотные комбинации, полученные из нечеловеческих видов, таких как мыши.
Одним из способов производства полностью гуманизированных антител данного изобретения является использование методики составления человеческого антитела (Antitope, Великобритания), описанной в Международной патентной заявке РСТ №WO 2006/082406. Такие антитела являются составными белками, содержащими два или более сегмента аминокислотной последовательности, полученные из человеческих антител. Сегменты могут быть выбраны таким образом, что присутствия Т-клеточных эпитопов в конечном антителе можно избежать, например путем проверки остатков, в частности вариабельных областей легкой и тяжелой цепи, чтобы они не содержали связывающие мотивы МНС II класса или чтобы они не содержали остатки, которые закрепляют связывание пептидов МНС II класса. Кроме того, способы анализа вариабельных областей полностью гуманизированного антитела изобретения in-silico подтверждают, что Т-клеточные эпитопы отсутствуют.
В производстве полностью гуманизированного антитела с использованием методики составления человеческого антитела производится конечное антитело, которое содержит композицию многих сегментов последовательностей, из которых все имеют человеческое происхождение и все получены из различных человеческих антител. Вкратце, методика включает этапы: анализа вариабельных областей тяжелой и легкой цепи исходного моноклонального антитела, например мышиного или химерного антитела, которое обладает специфичностью связывания с Toll-подобным рецептором 2, чтобы определить области, определяющие комплементарность (CDR). Белковые модели вариабельных областей антител также получают с использованием существующих структур антител в качестве шаблонов с использованием программы Swiss PDB. Затем эти структурные модели анализируют для выявления в вариабельных доменах исходного антитела важных «сдерживающих» аминокислот, которые могут иметь важное значение для связывающих свойств антитела. Остатки, содержащиеся в CDR-областях (как они определены с использованием определений Кабат и Чотиа), а также ряд остатков каркасной области, как правило, являются важными. Структурная информация от белковой модели используется для идентификации и сравнения остатков, которые имеют решающее значение для подтверждения антитела и связывания со структурно эквивалентными остатками из существующих структур антитела и баз данных последовательностей. Эти аминокислоты могут быть кандидатами для включения в один или более вариант конечных гуманизированных последовательностей. При изготовлении антитела данного изобретения было обнаружено, что и VH-, и VK-последовательности мышиного анти-TLR2-антитела, на которых основано полностью гуманизированное антитело данного изобретения (мышиное антитело к Toll-подобному рецептору 2 (TLR2), полученное из гибридомного клона Т2.5, HyCult Biotechnology b.v., Cell Sciences, Кантон, США: каталоговый номер 1054), содержат типичные остатки каркасной области, особенно в VH, где антитело имеет очень общие конфигурации последовательности в критических позициях, например, остатки Кабата 45-49 (LEWIG) и 92-94 (CAR).
Аминокислотные последовательности исходных вариабельных областей моноклональных тяжелой и легкой цепей затем сравнивали с соответствующими сегментами последовательностей человеческих вариабельных областей с целью выявления потенциальных человеческих последовательностей тяжелой и легкой цепи для возможного включения в конечную гуманизированную последовательность. Затем конечные полностью гуманизированные тяжелые и легкие цепи разрабатывали исключительно из сегментов человеческих последовательностей вариабельных областей.
Полностью гуманизированное антитело разрабатывали и производили, вначале синтезируя гены VH- и VK-областей с помощью ряда перекрывающихся олигонуклеотидов, которые отжигали, лигировали и амплифицировали с помощью ПЦР для получения синтетических V-областей полной длины. Затем полинуклеотидные последовательности клонировали непосредственно в подходящий вектор экспрессии, примеры которого хорошо известны специалистам в данной области, например в систему экспрессионного вектора, которая кодирует антитело, такое как IgG. В случае экспрессионного вектора, используемого в производстве антитела данного изобретения OPN-305, система экспрессионного вектора связана с последовательностью, полученной из lgG4, включающей измененную шарнирную область (замена S241P), а также тяжелые цепи и легкую каппа-цепь. Тяжелые и легкую цепи после этого стабильно трансфицировали в клетки NSO путем электропорации и выбирали с помощью 200 нМ метотрексата (Sigma, каталоговый номер М8407). Устойчивые к метотрексату колонии проверяли по уровню экспрессии IgG.
Хотя использовали NSO клетки, также могут быть использованы любые подходящие клеточные линии, известные специалистам в данной области. В частности, применение клеток млекопитающих в культуре клеток млекопитающих является предпочтительным в качестве платформы для производства антител и связывающих фрагментов изобретения. Применение клеток млекопитающих особенно предпочтительно благодаря профилю N-гликозилирования, который применяется для белка, такому как профиль гликозилирования, аналогичный обнаруженным на человеческих белках. Клеточные линии, которые обычно используются для культур клеток млекопитающих, включают СНО, гибридомные клетки NSO, клетки почек детенышей хомяка (ВНК) и человеческие клетки PER.C6™. Линии клеток млекопитающих, которые чаще всего используются для производства культур клеток млекопитающих в масштабных объемах, представляют собой клеточные линии СНО и NS0. Эти типы клеток, которые относительно легко подвергаются генетической инженерии, были подробно охарактеризованы, их сравнительно легко вырастить в большом объеме и можно получить высокие титры рекомбинантных белков в растворе. Обе клеточные линии СНО и NS0 могут производить высокие уровни экспрессии белка.
В дополнение к платформам экспрессии белка на основании клеток млекопитающих для продукции белков изобретения также могут быть использованы экспрессионные системы на основе растений или трансгенные животные системы.
Затем составные антитела очищали от супернатантов клеточных культур на колонке с белок А-сефарозой (GE Healthcare, каталоговый номер 110034-93) и количественно оценивали при ОП 280 нм, используя рассчитанный коэффициент экстинкции, где Ес(0,1%)=1,43. Затем очищенные антитела тестировали в конкурентном анализе ИФА для подтверждения связывания с Toll-подобным рецептором 2. Это связывание можно сравнить со связыванием контрольного антитела, такого как биотинилированная форма антитела, связывающего Toll-подобный рецептор 2, на котором была основана разработка полностью человеческого антитела. В частности, можно нанести на график абсорбцию, полученную в конкурентном анализе ИФА, в зависимости от концентрации образца, и провести прямые линии через каждую из этих групп данных, относящихся к полному человеческому и исходному биотинилированному антителу. Уравнения линий использовали для расчета концентрации, необходимой для ингибирования связывания биотинилированного контрольного антитела с TLR2 на 50% (так называемое значение IC50). Значение IC50 может быть использовано для расчета разницы в эффективности связывания. Определенная эффективность связывания может быть важным определением специфичности полностью гуманизированного антитела, которое было получено. Также могут быть выполнены другие сравнения, например, сравнение полностью гуманизированного антитела с химерным или мышиным антителом, которое обладает специфичностью связывания с тем же антигеном.
Пример 2 - Определение связывающих свойств моноклонального антитела OPN-305
Изобретателем неожиданно было установлено, что TLR2-антагонистическому мышиному моноклональному антителу Т2.5 необходимо связывание с CD32, чтобы в полной мере выступать антагонистом функции Toll-подобного рецептора 2. Эксперимент был выполнен таким образом, чтобы подтвердить, что это функциональное ограничение, связанное с использованием антитела Т2.5, не было также связано с использованием моноклонального антитела OPN-305 для того, чтобы опосредовать его эффект нейтрализации биологической активности Toll-подобного рецептора 2.
Материалы и методы:
Клетки ТНР-1 представляют собой моноцитарные клетки периферической крови человека. В ответ на лиганды Toll-подобного рецептора в ТНР1-клетках активируется транскрипционный фактор NF-kappaB и другие транскрипционные факторы. Клеточную линию ТНР-1 Blue стабильно трансфицировали плазмидой, кодирующей ген секретируемой эмбриональной щелочной фосфатазы (SEAP) под контролем промотора, индуцируемого несколькими факторами транскрипции, такими как NF-kappaB и АР-1. Вариант клеточной линии ТНР-1 CD14 Blue имеет сверхэкспрессию CD14 на клеточной поверхности для повышенной чувствительности. Полученные клетки ТНР-1 CD14 Blue устойчивы к выбранным маркерам зеоцину и бластицидину. При TLR-стимуляции клетки ТНР-1 Blue активируют фактор транскрипции, а затем секрецию SEAP, которую затем выявляют с использованием репортерной системы QUANTI-Blue. QUANTI-Blue является колориметрическим ферментативным анализом, разработанным для определения активности секретируемой щелочной фосфатазы (SEAP) в супернатантах клеточных культур. В присутствии SEAP среда QUANTI-Blue приобретает фиолетово-синий цвет, который можно легко обнаружить невооруженным глазом или количественно оценить по оптической плотности (ОП) при 625-655 нм.
Клетки ТНР-1 CD14 Blue инкубировали с моноклональным анти-Т!-Р2-антителом OPN-305 (1 мкг/мл), предварительно смешанным с анти-CD32a-антителом (RnD №AF1875) или анти-CD32b-антителом (RnD №AF1330) или козлиным IgG в диапазоне от 5 мкг/мл до 0,18 мкг/мл) в течение 5 минут при 37°С перед стимуляцией 20 нг/мл TLR1/TLR2-агониста Pam3CSK4. Моноклональное антитело OPN-305 является полностью гуманизированным антителом, имеющим легкую цепь, определенную в данном документе как SEQ ID №2, и тяжелую цепь, определенную в данном документе как SEQ ID №5.
Затем клетки инкубировали в течение ночи при температуре 37°С.Затем супернатанты удаляли и инактивировали теплом перед добавлением QUANTI-Blue (Invivogen, Сан-Диего, США). Колориметрические изменения, представляющие активацию NF-kB, измеряли при 650 нм с использованием люминометра.
Результаты, приведенные на фиг.9, демонстрируют, что функциональная активность OPN-305 в качестве антагониста Toll-подобного рецептора 2 не блокируется при добавлении анти-CD32a/b-антител. Таким образом, это означает, что нейтрализующая активность Тоll-подобного рецептора 2, опосредованная OPN-305, не зависит от связывания с CD32a или CD32b.
Пример 3 - Роль CD32 в антагонизме Toll-подобному рецептору 2
Результаты примера 2 показывают, что антагонизм Toll-подобному рецептору 2 полностью гуманизированного антитела изобретения OPN-305 не зависит от связывания антитела с CD32 (с CD32a или CD32b).
Для того, чтобы убедиться в этом и провести сравнение с другими TLR2-антагонистическими антителами, известными в данной области, такими как мышиное TLR2-моноклональное антитело Т2.5 (OPN-301), были проведены другие эксперименты.
Материалы и методы:
Клетки ТНР-1 CD14 Blue (Invivogen, Сан-Диего, США) предварительно инкубировали с дозами антител, которые блокируют CD32a или CD32b.
Предварительно инкубированные клетки ТНР-1 CD14 Blue инкубировали с увеличивающимися дозами (i) противочеловеческого антитела FcgammaRlla (CD32a) (R&D Systems, каталоговый номер AF1875, используемый в предыдущем примере), (ii) противочеловеческого антитела FcgammaRII (CD32) (R&D Systems, каталоговый номер AF1330) или (iii) изотипического контрольного антитела (козлиный IgG (R&D Systems, каталоговый номер АВ-108-С). Затем к клеткам добавляли 200 нг/мл мышиного анти-Т1-К2-антитела Т2.5 (OPN-301) или полностью гуманизированного антитела OPN-305. Затем клетки стимулировали 100 нг/мл TLR2-агониста Pam3CSK4 (Invivogen) в течение ночи.
Результаты
NF-kB-зависимую продукцию SEAP измеряли в клеточных супернатантах. На фиг.10А показаны результаты для клеток, на которых воздействовали OPN-301 (мышиным анти-TLR2-антителом Т2.5). На фиг.10В показаны результаты для клеток, на которых воздействовали полностью гуманизированным TLR2-антагонистическим антителом OPN-305. На фиг.10А колонка А относится к клеткам, стимулированным только Pam3CSK4. Колонка В относится к клеткам, подвергшимся действию антитела OPN-301. Колонка С относится к антителу OPN301 вместе с 0,4 мкг/мл анти-CD32a/b или контрольного козлиного IgG-антитела. Колонка D относится к антителу OPN301 вместе с 2 мкг/мл анти-CD32a/b-антитела или контрольного козлиного lgG-антитела. Колонка Е относится к антителу OPN301 с 10 мкг/мл анти-CD32a/b-антитела или контрольного козлиного lgG-антитела.
На фиг.10 В колонка А относится к клеткам, стимулированным только Pam3CSK4. Колонка В относится к клеткам, подвергшимся действию антитела OPN-305. Колонка С относится к антителу OPN305 вместе с 0,4 мкг/мл анти-CD32a/b или контрольного козлиного IgG-антитела. Колонка D относится к антителу OPN305 вместе с 2 мкг/мл анти-CD32a/b-антитела или контрольного козлиного IgG-антитела. Колонка Е относится к антителу OPN305 с 10 мкг/мл анти-CD32a/b-антитела или контрольного козлиного IgG-антитела.
Сравнение данных, приведенных на фиг.2, ясно показывает, что TLR2-антагонизм, который опосредован OPN-305, не зависит от взаимодействия антитела с CD32, так как блокирование CD32 специфическим антителом CD32a или CD32 не влияет на способность OPN305 нейтрализовать TLR2. Напротив, показано, что мышиное антитело Т2.5 (OPN-301) зависит от связывания с CD32 при опосредовании полной нейтрализации функциональной активности Toll-подобного рецептора 2. Без связи с какой-либо теорией изобретатель предсказывает, что, опосредуя Т!-Р2-антагонизм, антитело OPN-301 связывается с TLR2 и CD32, при этом данное взаимодействие с CD32 необходимо для опосредования антагонизма Toll-подобного рецептора 2. Таким образом, существует функциональное различие между механизмом действия OPN-305-антитела и OPN-301-антитела в отношении противодействия функциональной активности Toll-подобного рецептора 2. Таким образом, TLR2-антагонистическая активность OPN-301 может быть заблокирована при связывании с CD32. Тем не менее, блокирование способности OPN-305 связываться с CD32, CD32a или CD32b не влияет на его способность противодействовать функциональной активности Toll-подобного рецептора 2.
Пример 4 - Подтверждение специфичности связывания OPN-305 с Toll-подобным рецептором 2
Эксперимент был разработан для подтверждения, что моноклональное антитело изобретения OPN-305 демонстрирует специфичность связывания с Toll-подобным рецептором 2 и, в частности, с человеческим Toll-подобным рецептором 2.
Материалы и методы:
Клетки НЕК 293 (почки человеческого эмбриона 293), стабильно трансфицированные Toll-подобным рецептором 1 и Toll-подобным рецептором 2, чтобы сформировался TLR1/TLR2-гетеродимер, инкубировали с 1,0 мкг/мл биотинилированной формы мышиного анти-TLR2 антитела OPN-301 (Т2.5) либо самостоятельно, либо в присутствии 1,0 мкг или 10 мкг/мл полностью гуманизированного анти-Т1К2-антитела OPN-305 или изотипического контрольного IgG4-антитела OPN-305 в течение 30 минут на льду.
Моноклональное антитело OPN-301 является мышиным IgG1 анти-TLR2-антителом (мышиное антитело к Toll-подобному рецептору 2 (TLR2), клон Т2.5, HyCult Biotechnology b.v., Cell Sciences, Кантон, США: каталоговый номер 1054).
Моноклональное антитело OPN-305 является полностью человеческим антителом с легкой цепью, определенной в данном документе как SEQ ID №2, и тяжелой цепью, определенной в данном документе как SEQ ID №5.
Затем клетки промывали и инкубировали со стрептавидином, конъюгированным с РЕСу7 в течение еще 30 минут. Связывание измеряли с помощью FACScalibur (Becton Dickinson). Результаты показаны на фиг.11.
Фиг.11А относится к связыванию OPN-305 (обозначенному как вариант 21). Двигаясь слева направо, наиболее темная линия первого пика относится к красной линии. Более светлая линия в первом пике относится к зеленой линии. Двигаясь вправо, третий, четвертый и пятый пики являются фиолетовым, синим и черным пиками, соответственно. Связывание OPN-305 было продемонстрировано сдвигом влево от синей и фиолетовой гистограмм (представляющих OPN-301 и OPN-305) по сравнению с OPN-301 в одиночку (черные гистограммы), который показывает, что OPN-305 конкурирует с OPN-301 в связывании человеческого TLR2 на клетках НЕК. В заключение, на фиг.11А показан дозозависимый сдвиг пиков, что указывает на конкуренцию в связывании между OPN-301 и OPN-305 с человеческим Toll-подобный рецептором 2.
Фиг.11 В показывает результаты связывания с изотипическим контролем IgG4. Так как изотипическое контрольное антитело IgG4 не имеет специфичности связывания с TLR2, оно не конкурирует за связывание. Поэтому нет сдвига в черном, фиолетовом или синем пиках, которые сгруппированы вместе и представлены в виде второго пика, показанного в правой части фиг.11В. Пик на левой стороне относится к красному пику (более темная линия) и зеленому пику (более светлая линия). Таким образом, эти результаты подтверждают, что OPN-305 обладает специфичностью связывания с человеческим Toll-подобным рецептором 2.
Пример 5 - Перекрестная реактивность OPN-305 с мышиным Toll-подобным рецептором 2
Определив в примере 4, что OPN-305 демонстрирует специфичность связывания с человеческим Toll-подобным рецептором 2, этот эксперимент анализирует, демонстрирует ли моноклональное антитело OPN-305 внутривидовую перекрестную реактивность с Toll-подобным рецептором 2, которая позволит OPN-305 связываться с Toll-подобным рецептором 2 других видов млекопитающих, таким как мышиный Toll-подобный рецептор 2.
Материалы и методы:
Мышиные макрофаги J774 культивировали с плотностью 1×106/мл в присутствии 5 мкг/мл OPN-305 (называемого OPN-305-21), OPN-301 (Т2.5) или соответствующего изотипического контрольного антитела (мышиный IgG1 для OPN-301 и человеческий IgG4 для OPN-305) в течение 6 часов при температуре 37°С. Клетки подвергали влиянию TLR2-агониста HKLM (Invivogen, Сан-Диего, США, каталоговый номер tlr-kit2). HKLM представляет собой лиофилизированный убитый нагреванием препарат Listeria Monocytogenes (LM), факультативно-внутриклеточной грамположительной бактерии. Затем удаляли супернатанты и измеряли уровни мышиного ФНО-(с помощью специфического ИФА ELISA duoset от RnD systems (R&D Systems).
Результаты
Результаты показаны на графике фиг.12. Он показывает, что OPN-305 подавляет мышиные TLR2-ответы аналогично ингибированию OPN-301. Соответственно, OPN-305 перекрестно реагирует в связывании Toll-подобного рецептора 2, экспрессированного на поверхности мышиных клеток.
В заключение, было показано, что OPN-305 подавляет секрецию ФНО-(мышиными макрофагами J774, стимулированными TLR2-агонистом.
Пример 6 - Перекрестная реактивность OPN-305 по отношению к обезьяньему Toll-подобному рецептору 2
Далее были проведены эксперименты для определения специфичности связывания OPN-305 с Toll-подобным рецептором 2, экспрессированным на клетках обезьян. Это определило бы, реагирует ли антитело OPN-305 перекрестно с более широким разнообразием форм Toll-подобного рецептора 2 млекопитающих, а не только с человеческой и мышиной формами.
Связывание OPN-305 с обезьяньим Toll-подобным рецептором 2 определяли как путем прямого связывания антитела, так и путем конкурентного связывающего анализа.
(I) Прямое связывание
Клетки цельной крови от обезьян Масаса cynomologus инкубировали с 1,0 мкг/мл OPN-305 или изотипическим контрольным антителом lgG4 в течение 30 минут при комнатной температуре, затем инкубировали с PharmLyse (BD Biosciences) для лизиса эритроцитов, затем анализировали с помощью FITC-меченого противочеловеческого IgG4.
Результаты показаны на фиг.13А, В и С.Различные типы клеток пропускали в соответствии с их характеристиками при прямом и боковом светорассеянии. Фиг.13А относится к гранулоцитам. Фиг.13В относится к моноцитам. Фиг.13С относится к лимфоцитам. Связывание было продемонстрировано сдвигом вправо гистограммы клеток, инкубированных с OPN-305 (синяя гистограмма - это пик в правой части группы пиков), по сравнению с клетками, инкубированными с изотипическим контрольным антителом (зеленая гистограмма - это второй пик при движении слева направо, этот пик более светлый). Результаты в фиг.13А и 13В показывают, что синий пик сдвинулся дальше вправо, чем зеленый пик. Это показывает, что OPN-305 связывается с TLR2 обезьян, который экспрессируется на гранулоцитах и моноцитах. Таким образом, OPN-305 демонстрирует широкую перекрестную реактивность с Toll-подобным рецептором 2, экспрессированным на различных типах клеток.
(ii) Конкурентный анализ
Клетки цельной крови от обезьян Масаса cynomologus инкубировали с 1,0 мкг/мл OPN-301 в одиночку или в присутствии 1,0 мкг или 10 мкг/мл OPN-305 или изотипического контрольного антитела IgG4 (для OPN305) в течение 30 минут при комнатной температуре. Затем клетки промывали и инкубировали со стрептавидином, конъюгированным с РЕСу7, еще в течение 30 минут.
Моноклональное антитело OPN-301 является мышиным lgG1 анти-Т1-К2-антителом (мышиное антитело против Toll-подобного рецептора 2 (TLR2), клон Т2.5, HyCult Biotechnology b.v., Cell Sciences, Кантон, США: каталоговый номер 1054).
Моноклональное антитело OPN-305 является полностью человеческим антителом с легкой цепью, определенной в данном документе как SEQ ID №2, и тяжелой цепью, определенной в данном документе как SEQ ID №5.
Связывание измеряли с помощью FACScalibur от Becton Dickinson. Результаты показаны на фиг.14А, В и С. Фиг.14А относится к гранулоцитам. Фиг.14В относится к моноцитам. Фиг.14С относится к лимфоцитам. Связывание OPN-305 продемонстрировано сдвигом влево зеленых гистограмм (представляющих OPN-301+OPN-305) по сравнению с OPN-301 в одиночку (черные гистограммы), который демонстрирует, что OPN-305 конкурирует с OPN-301 за связывание с TLR2 обезьяны. Соответственно, снова можно видеть, что OPN305 конкурирует за связывание Toll-подобного рецептора 2 обезьяны. Это еще раз подтверждает, что OPN-305 перекрестно реагирует с Toll-подобным рецептором 2, экспрессированным на клетках человека, мыши или обезьяны.
Пример 7 - Иммуногенность моноклонального антитела OPN-305
Анализ антитела OPN-305 проводили для определения наличия иммуногенных эпитопов, которые могут привести к иммунной реакции, такой как НАМА-реакция, возникающая против антитела у субъекта, которому вводили это антитело. Как уже говорилось выше, наличие Т-клеточных эпитопов является крайне нежелательным, так как продукция нейтрализующего антитела привела бы к тому, что антитело больше не было бы пригодно для введения пациенту в терапевтических целях. Поэтому было проверено, что антитело OPN-305 точно не содержит Т-клеточных эпитопов.
Материалы и методы:
Подготовка и отбор доноров МНПК
Мононуклеарные клетки периферической крови (МНПК) выделяли из лейкоцитарной пленки здоровых доноров (полученной из крови в течение 24 часов), полученной из Национальной службы переливания крови (больница Адденбрука, Кембридж, Великобритания). МНПК выделяли из лейкоцитарной пленки с помощью центрифугирования в градиенте плотности LYMPHOPREP™ (Axis-Shield, Данди, Великобритания) и удаляли CD8+Т-клетки с помощью CD8+ROSETTESEP™ (StemCell Technologies Inc., Лондон, Великобритания). Доноры были охарактеризованы путем определения гаплотипов HLA-DR с использованием набора для гистотипирования на основании ПЦР с сиквенсспецифическими праймерами (Biotest, Landsteinerstraβe, Дания), а также определения Т-клеточных реакций на контрольный антиген гемоцианин морского моллюска фиссуреллии (KLH) (Pierce, Rockford, США). Затем МНПК замораживали и хранили в жидком азоте до использования.
Была выбрана когорта из 21 донора с лучшим представлением количества и частоты HLA-DR-аллотипов, экспрессированных в мировой популяции. Анализ аллотипов, экспрессированных в когорте, против тех, которые экспрессированы в мировом населении, показал, что был достигнут охват более 80%, и что были хорошо представлены все основные HLA-DR-аллели (индивидуальные аллотипы с частотой более 5%, экспрессированные в мировом населении).
Анализы временной динамики Т-клеточной пролиферации EpiScreen
Антитело подвергали анализу, чтобы определить наличие Т-клеточных эпитопов, как описано в международной патентной заявке №WO 2007/099341. МНПК от каждого донора размораживали, подсчитывали и оценивали жизнеспособность. Клетки восстанавливали в культуральной среде AIMV (Invitrogen, Пейсли, Великобритания) при комнатной температуре и ресуспендировали в AIMV с плотностью 4,6×106 МНПК/мл. Для каждого донора создавали смешанные культуры, в которых в общей сложности 1 мл стока пролиферативных клеток вносили в 24-луночный планшет. Всего 1 мл каждого разведенного тестируемого образца добавляли к МНПК для получения конечной концентрации 50 мкг/мл образца. Для каждого донора также был включен положительный контроль (клетки, инкубированные с 100 мкг/мл KLH) и отрицательный контроль (клетки, инкубированные только с культуральной средой). Для первых 4 доноров в тест был включен дополнительный контроль для модуляции Т-клеточного ответа тестируемыми образцами, где к МНПК добавляли и тестируемый образец, и KLH. Сравнение этих образцов с KLH в одиночку может быть использовано для оценки влияний тестируемых образцов на пролиферацию. Культуры инкубировали всего в течение 8 дней при температуре 37°С с 5% CO2. В дни 5, 6, 7 и 8 клетки в каждой лунке нежно ресуспендировали и 3х аликвоты по 100 мкл переносили в отдельные лунки с круглым дном в 96-луночном планшете. Культуры подвергали импульсам 1µCi [3Н]-тимидина (Perkin ElmerTM, Waltham, Массачусетс, США) в 100 мкл культуральной среды AIMV и инкубировали в течение еще 18 часов перед сбором на плоский фильтр (Perkin ElmerTM, Waltham, Массачусетс, США) с помощью коллектора клеток TomTec Mach III. Количество импульсов в минуту (cpm) для каждой лунки определяли путем сцинтилляционного подсчета MELTILEX™ (Perkin Elmer™, Уолтем, Массачусетс, США) на счетчике Microplate Beta Counter в режиме Paralux для подсчета при низком фоне. Для оценки потенциальной токсичности анализируемых образцов подсчитывали жизнеспособность клеток (с использованием счетчика VICELL™ и методики исключения трипанового синего красителя) в образцах тестируемых культур и сред и контролей KLH для первых 10 доноров после инкубации в течение 7 дней.
Анализ данных EpiScreen
Для анализа пролиферации был ранее установлен эмпирический порог индекса стимуляции (SI), равный или больше 2 (SI≥2), в соответствии с которым образцы, индуцирующие пролиферативные ответы выше этого порога, считаются положительными (включающие пограничные значения ≥1,95 выделены). Проведение экстенсивного анализа и предыдущие исследования показали, что это минимальный сигнал для шумового порога, позволяющий получить максимальную чувствительность без появления большого числа ложноположительных ответов. Для набора данных по пролиферации (n=3) положительные ответы определяли по статистическим и эмпирическим пороговым значениям:
Значение (p<0,05) ответа путем сравнения cpm анализируемых лунок с контрольными лунками со средой с использованием непарного t-теста Стьюдента двух образцов.
Индекс стимуляции больше 2 (SI≥2), где SI=среднее (cpm) анализируемых лунок/среднее (cpm) контрольных лунок.
Кроме того, вариации внутри анализа оценивали путем расчета коэффициента дисперсии и стандартного отклонения (SD) исходных данных от повторных культур.
Результаты
Анти-TLR2-антитело OPN-305 (VK5/VH4) очищали до гомогенности с помощью аффинной хроматографии с белком А, а затем гель-проникающей хроматографии.
Вариант, называемый VK5/VH4, является полностью гуманизированным моноклональным антителом OPN-305, описанным в данном документе. Моноклональное антитело OPN-305 является полностью гуманизированным антителом с аминокислотной последовательностью легкой цепи, определенной в данном документе как SEQ ID №2, и аминокислотной последовательностью тяжелой цепи, определенной в данном документе как SEQ ID №5.
Все препараты были получены из одиночных пиков, представляющих мономерное неагрегированное антитело (фиг.15А и В), и было выявлено, что они содержат эндотоксин<5 EU/мг.
Три анализируемых образца тестировали на когорте из 21 здорового донора с помощью анализа временной динамики Т-клеток EpiScreen™ (Antitope, Великобритания), чтобы определить относительный риск иммуногенности. Образцы тестировали в конечной концентрации 50 мкг/мл, так как это количество обеспечивало насыщающую концентрацию, которой было достаточно для стимуляции выявляемого белок-специфического Т-клеточного ответа.
Были проанализированы результаты исследований Т-клеточной модуляции и клеточной токсичности. Жизнеспособность клеток в культурах после семи дней составляла от 65% до 95% и была сходна во всех анализируемых образцах, контрольных средах и контроле KLH. Таким образом, считается, что анализируемые образцы не имели токсического действия на клетки, используемые в анализе. Кроме того, на фиг.16 показано, что между SI, индуцированными KLH в одиночку или в присутствие образцов, никаких существенных различий не было (t-тест Стьюдента p<0,05). Этим подтверждается, что анализируемые образцы непосредственно не модулируют CD4+Т-клеточную активацию в ответ на KLH (контрольный антиген). На фиг.16 показаны результаты предварительного отбора анализируемых образцов по цитотоксичности и активности Т-клеточной модуляции.
Образец 1 является химерным анти-TLR2 (F'ab-фрагмент, полученный из мышиного антитела Т2.5, конъюгированного с Fc-областью человеческого IgG4), образец 2 является анти-TLR2-антителом OPN-305 (VK5/VH4, OPN305), образец 3 является вариантом анти-TLR2-антитела, обозначенным VK5/VH5.
Были проанализированы результаты анализа временной динамики пролиферации EpiScreen™, проведенного с OPN-305 (VK5/VH4, OPN-305) и VK5/VH5 сравнительными антителами против Toll-подобного рецептора 2, а также химерными анти-Т1-К2-антителами (фиг.17А, В и С). Химерное анти-TLR2-антитело стимулировало ответ у 4 из 21 донора (18% когорты), когда SIS2, и в t-тесте Стьюдента была достигнута статистическая значимость (p<0,05). Донор 20 дал особенно энергичную реакцию с высокими SI на протяжении всего времени анализа, и у донора 3 на 6 день также наблюдалась сильная реакция (SI=6,99). Напротив, ни один из доноров в исследуемой когорте не реагировал положительно на OPN-305. Следовательно, антитело OPN-305 (VK5/VH4) не вызывало никаких значительных Т-клеточных реакций у доноров, которые положительно реагировали на химерное антитело.
Выводы
Положительные ответы CD4+Т-клеточной пролиферации на химерное антитело, наблюдаемые в Т-клеточном анализе временной динамики EpiScreen™, находились в ожидаемом диапазоне 15-40%. Важно отметить, что на контрольный антиген, KLH, наблюдались частые и мощные Т-клеточные реакции, которые указывают, что анализ функционировал, как ожидалось. Результаты также показывают, что полностью гуманизированное антитело OPN-305 (VK5/VH4) не вызывало никаких положительных иммунных реакций ни у одного из доноров, и следовательно, считается, что это антитело имеет низкий риск иммуногенности в клинической практике.
На фиг.18 показана четкая корреляция между уровнем иммуногенности, наблюдаемым с помощью анализа EpiScreen™, и уровнем иммуногенности (реакциями против белкового терапевтического антитела), который действительно наблюдался в клинике против большого набора терапевтических белков (Baker and Jones, 2007). Высокие уровни иммуногенности наблюдались и в клинических данных, и в анализах EpiScreen™ для таких белков, как Инфликсимаб и Кэмпас, в то время относительно низкие уровни иммуногенности наблюдались для таких белков, как Ксолар, Герцептин и Авастин. Важно отметить, что антитело OPN-305 индуцировало реакции у<10% когорты, что, исходя из прошлого опыта, связано у биотерапевтических средств с низким риском иммуногенности.
Пример 8 - Определение и сравнение аффинности связывания моноклонального антитела OPN-305
Иммунологические биосенсоры, например инструменты для поверхностного плазменного резонанса (SPR, surface plasmon resonance) Biacore™, которые измеряют связывание и диссоциацию комплексов антиген-антитело в режиме реального времени, позволяют определить кинетику связывания. Скорость диссоциации соединения и ее последующая оптимизация особенно важны для разработки биофармацевтического антитела. Biacore использует поверхностный плазменный резонанс (SPR) для наблюдения за взаимодействием между молекулой-«лигандом» поверхности связывания и ее партнером по связыванию в растворе «аналита» (анализируемого вещества) в режиме реального времени. SPR является феноменом волны зарядовой плотности электрона, который возникает на поверхности металлического слоя при отражении света в условиях полного внутреннего отражения. Поверхностные плазмоны, которые создаются, чувствительны к любым изменениям показателя преломления среды на противоположной стороне металлического слоя в отраженном свете. Белок-белковые взаимодействия, происходящие на поверхности, влияют на показатель преломления среды и поэтому могут быть выявлены. Связывание молекул с лиганд-модифицированной сенсорной поверхностью генерирует ответ, который пропорционален оцениваемой массе, позволяя выявить небольшие изменения в количестве связанного аналита (до низкого уровня порядка пикограммов). Эта методика может быть использована для измерения константы аффинности (KD) в диапазоне от 10-5 до 10-12 М, константы скорости ассоциации (ka) в диапазоне от 103 до 107 М-1 с-1 и константы скорости диссоциации (kd) в диапазоне от 10-1 и 10-6 с-1 (1-3).
Цель данного исследования заключалась в использовании инструмента поверхностного плазменного резонанса Biacore T100 (Biacore, Inc) с высокой разрешающей кинетической характеризацией взаимодействия между двумя связанными рецепторами и тремя моноклональными антителами. Два рецептора в исследовании были рекомбинантными, rhTLR-2 (рекомбинантный человеческий TLR-2) и rmTLR2/Fc (рекомбинантный мышиный TLR-2).
Материалы и методы
Подготовка инструментов
Перед прогоном любых образцов выполняли проверку системы (Biacore Preventative Maintenance Kit 2). Все системы проходили проверку (насос для реагента, рефрактометр, инъекции, селектор шума, смешивания и буфера), так что прибор имел критерии, установленные заводом-изготовителем. После проверки системы Desorb/Sanitize (Biacore Preventative Maintenance Kit 2) запускали программу для чистки инструмента.
Проведение анализа
Подготовка системы
При вставлении чипа СМ5 систему включали и затем нормировали раствором BIAnormalising (Biacore Preventative Maintenance Kit 2). Все образцы прогоняли при 25°С в держателе для образцов, находящемся при 25°С, если иное не указано. Чип вводили в систему с HBS-EP, который использовали в качестве рабочего буфера. Поверхность чипа затравливали двумя 30-секундными введениями 50 мМ NaOH, который затем оставляли до получения стабильной базальной линии во всех проточных кюветах (Fc, flow cell).
Подготовка образцов
Анализировали два антитела, антитело против Toll-подобного рецептора 2, OPN-305, описанное в данном документе, и мышиное антитело против Toll-подобного рецептора 2 Т2.5 (полученное из гибридомного клона Т2.5, HyCult Biotechnology b.v., Cell Sciences, Кантон, США: каталоговый номер 1054). Оба моноклональных антитела хранили в виде, в котором они были при поставке, и разводили до 1 мкг/мл для всех прогонов при иммобилизации. Рецепторы rhTLR-2 и rmTLR2/Fc восстанавливали из сухого порошка с помощью HBS-EP до конечной концентрации 1000 нМ и хранили при температуре 4°С.К этому раствору белок-носитель не добавляли.
Условия иммобилизации и активность
Прямой анализ был выбран для этого исследования на основании результатов предыдущих исследований, где было показано, что эти настройки являются оптимальными. Для кинетических экспериментов количество иммобилизованного лиганда нужно ограничить, чтобы избежать эффекта переноса массы на поверхности чипа.
При использовании средней ММ 77,5 кДа для аналита гликозилированного человеческого рецептора (rhTLR-2), 150 кДа для лиганда (МКА) и стехиометрии (Sm) 2, идеальное целевое количество лиганда для иммобилизации должно было составлять 145 RU. Этот уровень иммобилизации также подходит для мышиного рецептора, хотя его ММ составляет 98 кДа.
Все антитела иммобилизованы с использованием стандартной химии связывания амина. Иммобилизацию проводили при концентрации белка примерно 1 мкг/мл в 10 мМ ацетатном буфере с рН 5,5 до уровня целевой реакции 150 RU на трех сенсорных чипах СМ5 Series S. Кинетические данные получали при скорости потока 40 мкл/мин, чтобы свести к минимуму возможные последствия переноса массы. Помимо кинетических анализов, в начале кинетического пробега повторяли пустой аналит (без рецептора) и аналит с единой концентрацией (100 нМ), чтобы проверить стабильность поверхности и двух рецепторов. Кинетический анализ проводили в двух повторах и сравнивали результаты.
Для того, чтобы наблюдать достаточное снижение сигнала (3-10%) в фазе диссоциации кинетических циклов, диссоциацию измеряли в течение 2000 секунд.
Результаты
Результаты показаны в таблице 1. Скорость ассоциации (Коп) и скорость диссоциации (Код) рассчитывали с использованием двухвалентной модели связывания (программное обеспечение BIAcore Evaluation Software версии 3.2). Константу равновесия диссоциации (Ко) рассчитывали как соотношение Koff/Kon.
Результаты показывают, что OPN-305 связывается и с человеческим Toll-подобным рецептором 2, и с мышиным Toll-подобным рецептором 2 с более высокой аффинностью, чем моноклональное антитело Т2.5. На фиг.19 показано выравнивание, демонстрирующее идентичность последовательности между аминокислотными последовательностями полностью гуманизированного анти-TLR2-антитела OPN-305 и мышиного анти-TLR2-антитела Т.5. Можно увидеть расхождение в идентичности последовательности более 10%. Далее, фиг.20 показывает выравнивание аминокислотных последовательностей вариабельных доменов тяжелых цепей полностью гуманизированного анти-TLR2-антитела OPN-305 и мышиного анти-TLR2-антитела Т.5. Опять же, присутствует расхождение в идентичности последовательности более 10%. Без связи с какой-либо теорией изобретатель прогнозирует, что изменения в аминокислотной последовательности легкой и тяжелой цепей антитела OPN-305 по сравнению с мышиным антителом Т2.5 повышают специфичность связывания и аффинность антитела OPN-305 к Toll-подобному рецептору 2.
Пример 9 - Исследование занятости рецептора TLR2
Этот эксперимент был предназначен для определения минимального уровня занятости, необходимого для ингибирования биологической активности моноклонального антитела OPN-305 при связывании с TLR2. Рассматривали связывание в зависимости от функции с использованием репортерной клеточной линии ТНР-1. В частности, биологическую активность OPN-305 оценивали в РатЗС8К4-индуцированных клетках THP1-CD14.
Материалы и методы
Клетки THP1-CD14 высевали с плотностью 1×106 клеток на лунку в 12-луночном планшете. OPN-305 добавляли в лунки в различных концентрациях (от 0,000488 мкг/мл до 2 мкг/мл) перед добавлением Pam3Csk4 (200 нг/мл). Клетки инкубировали в течение ночи при температуре 37°С.Управляемую NF-kB активность SEAP измеряли путем инкубации инактивированных теплом кондиционированных сред с 160 мкл реагента Quantiblue (Invivogen) в течение 90 минут при 37°С и измеряли абсорбцию при 650 нм.
Для определения занятости рецепторов OPN305 на клетках THP1-CD14, клетки THP1-CD14 Blue помещали в FACS-пробирки (1×106/пробирка) и FcR блокировали анти-CD32-блокирущим реагентом (Mitenyl Biotec) в течение 15 минут. Клетки метили OPN-305 в различных концентрациях (от 0,000488 мкг/мл до 2 мкг/мл) в течение 15 минут при комнатной температуре. После промывки клетки инкубировали с RPE-конъюгированным противочеловеческим lgG4 в течение 15 минут при комнатной температуре. После заключительного этапа промывания клетки фиксировали 2% формолсолевым раствором в 1% BSA/PBS перед выявлением. Процент специфического связывания рассчитывали по формуле:

Результаты
Результаты приведены на фиг.21А, В и С.Эти результаты показывают, что ингибирование активности NF-kB наблюдается в зависимости от дозы после обработки Pam3Csk4 (фиг.21А и В). OPN-305 практически полностью ингибирует активность NF-kB при концентрациях 2 мкг/мл (фиг.21С). Процент специфического связывания OPN-305 на клетках THP1-CD14 рассчитывали по формуле, описанной выше.
Эксперименты по насыщению соединения с клетками ТНР-1 были связаны обратным образом с ингибированием биологической активности в той же популяции клеток. Полное ингибирование Т1-К2-зависимой передачи сигнала может быть достигнуто с меньшим, чем максимальное связывание рецептора. Это сложная система, и вполне вероятно, что уровни TLR2 значительно выше, чем гетеродимерных партнеров TLR1 и TLR6. Занятость рецепторов показывает насыщение связывания TLR2 как в виде мономера, так и в виде гетеродимера. Вполне вероятно, что объяснением очевидной утраты биологической активности с занятостью рецепторов менее 100% может быть нейтрализация TLR2, достаточная для уменьшения вероятности того, что свободный TLR2 найдет партнера для формирования функционального сигнального комплекса.
Пример 10 - Определение того, действует ли антитело OPN-305 как конкурентный или неконкурентный ингибитор Т1Р2-зависимой передачи сигнала
Материалы и методы
Клетки ТНР1 CD14 Blue высевали с плотностью 100000 клеток на лунку в 96-луночном планшете. Клетки предварительно кратко инкубировали с 0, 1, 10 и 100 нг/мл OPN-305, а затем стимулировали различными дозами Pam3Csk4 в течение ночи при 37°С. 40 мкл супернатанта удаляли и инактивировали теплом при температуре 65°С в течение 10 минут. Управляемую NF-kB активность SEAP измеряли путем инкубации инактивированных теплом кондиционированных сред с 160 мкл реагента Quantiblue (Invivogen) в течение 90 минут при температуре 37°С с последующей регистрацией при 650 нм. Предполагая, что рецептор в клеточном анализе ведет себя подобно ферменту, был построен график зависимости V (активность NF-kB) от S [Pam3CSK4], а также двойные обратные графики, линеаризованные по Лайнуиверу и Берку (1/v от 1/s).
Результаты
Результаты показаны на фиг.22, где фиг.22А изображает NF-kB-зависимую активность SEAP в зависимости от концентрации Pam3CSK4, а фиг.22В изображает графики, линеаризованные по Лайнуиверу и Берку (1/v от 1/s).
Эти результаты показывают, что при увеличении концентрации лиганда виден классический сдвиг дозозависимой кривой вправо (фиг.22А). Анализ графиков, линеаризованных по Лайнуиверу и Берку (фиг.22В), подтверждает конкурентный механизм при низкой концентрации лиганда, но изменение кинетики как лиганда превышает определенный порог. Установление характера ингибиторного действия является сложной задачей в клетках, так как считывание данных является биологической активностью и оно зависит не только от взаимодействия TLR2/лиганд, но также от привлечения TLR1 или TLR6 для создания компетентного димерного сигнального комплекса. Анализ профиля экспрессии с использованием публично доступных баз данных позволяет предположить, что TLR2 присутствует в значительном избытке над TLR1 или TLR6, которые могут объяснить возможность двухфазного ответа как результат титрования молекул-партнеров.
Пример 11 - Определение того, влияет ли связывание OPN-305 с TLR2 на ответ на другие Т1-Р2-лиганды
Этот эксперимент рассматривает, влияет ли OPN-305-ингибирование TLR2 на реакцию других TLR с их соответствующими лигандами.
Материалы и методы
Клетки ТНР1 CD14 Blue высевали с плотностью 25000 клеток на лунку в 384-луночном планшете. Клетки предварительно инкубировали в течение 120 минут с 0, 1, 10 и 100 нг/мл OPN-305 или человеческим контрольным изотипическим lgG4-антителом, прежде чем стимулировать различными дозами различных агонистов лигандов Toll-подобных рецепторов. NF-kB-управляемую активность SEAP измеряли непосредственно в кондиционированных средах после инкубации в течение ночи с использованием сред для обнаружения НЕК blue.
Флагеллин использовали как лиганд TLR5, сверхчистый ЛПС как лиганд TLR4, а Pam3CSK и FSL-1 как лиганды TLR2.
Результаты
Результаты приведены на фиг.23А, В и С. Ответы на флагеллин (фиг.23С) и ЛПС (фиг.23В) были неизменными по сравнению с контрольными клетками, которые не подвергали воздействию OPN-305. Как и ожидалось, Pam3CSK- и FSL-1-опосредованная активация TLR2 была заблокирована OPN-305 (фиг.23А). Ответы на флагеллин и ЛПС были неизменными по сравнению с контрольными клетками, которые не подвергали воздействию OPN-305. Как и ожидалось, Pam3CSK- и FSL-1-реакции были заблокированы OPN-305. Это подтверждает, что OPN-305 не приводит ни к какому неожиданному увеличению или уменьшению реагирования TLR4 или TLR5 на лиганды.
Пример 12 - Примерение OPN-305 в лечении сепсиса
Материалы и методы:
Группам самок мышей BALB/c (n=4) вводили моноклональное антитело OPN-305 в дозе 10 мг/кг, 2 мг/кг и 0,4 мг/кг за 30 минут до введения 100 мкг Pam3Csk4. Все введения осуществляли внутрибрюшинно. Четыре часа спустя мышей умерщвляли путем смертельной анестезии и забирали кровь. Получали сыворотку и определяли концентрацию цитокинов с помощью ИФА. Сыворотку разводили 1/10 для ИФА на КС и на IL-12p40 и 1/5 для ИФА на IL-6.
Результаты:
Результаты приведены на фиг.24А, В и С. Показано, что OPN305 ингибирует РатЗСзК4-индуцированный сепсис. Низкие дозы (0,4 мг/кг) введенного анти-TLR2 OPN305 могут существенно ингибировать Pam3CSK4-индуцированные цитокины у мышей.
Этот эксперимент также повторяли с OPN-305, используя только i.v. (внутривенное) введение антитела OPN305, а затем введение i.p.(внутрибрюшинное) TLR2-агониста Pam3CSK, чтобы убедиться, что положительный эффект не является следствием того, что антитело и агонист доставляются в один и тот же компартмент.
Результаты этого эксперимента представлены на фиг.25А и В. Результаты показывают, что моноклональное антитело OPN-305 ингибирует Pam3Csk4-индуцированный сепсис. Этот результат эквивалентен предыдущему эксперимент, демонстрируя, что OPN-305, доставляемый системно, может ингибировать продукцию цитокинов сыворотки в ответ на i.p.(внутрибрюшинное) введение Pam3CSK.
Пример 13 - Связывание моноклонального антитела OPN-305 с TLR2, экспрессированным на клетках крысы
Материалы и методы
Клетки NR8383 получали из АТСС и выращивали в среде FK12 в соответствии с инструкциями АТСС. Клетки блокировали крысиным специфическим анти-CD32 (мышиным IgG1) в течение 10 минут при комнатной температуре. Клетки обрабатывали OPN305 (или изотипом) в течение 15 минут, промывали, выявляли с помощью RPE-противочеловеческого IgG4 и фиксировали 2% формолсолевым раствором перед выявлением. Клетки NR8383 также метили поликлональным кроличьим антителом против крысиного TLR2 и выявляли с помощью противокроличьего IgG Alexa Fluor 488.
Результаты:
Результаты, приведенные на фиг.26, показывают, что TLR2 экспрессируется на крысиных альвеолярных макрофагах (NR8383) и выявляется с помощью OPN305. (А) Немеченые клетки, (В) положительный контроль; поликлональное кроличье первичное антитело против крысиного TLR2; вторичным антителом было противокроличье Alexa Fluor-488, (С) клетки, обработанные поликлональным человеческим lgG4, вторичным антителом было человеческое анти-IgG4 РЕ; (D) клетки, меченые OPN305; вторичным антителом было противочеловеческое lgG4 РЕ.
Пример 14 - Связывание моноклонального антитела OPN-305 с TLR2, экспрессированным на клетках свиньи
Материалы и методы
МНПК свиньи очищали из крови с помощью Ficoll. Клетки подсчитывали и 1×106 клеток помещали в пробирку. В отсутствие специфического CD32-блокирующего реагента для свиней клетки блокировали с использованием человеческого анти-С032 в матрице из 50% FCS/BSA в PBS в течение 10 минут.
Клетки инкубировали с OPN305 (или изотипическим контролем) в течение 15 минут при комнатной температуре. 11-111 (мышиное против свиного TLR2, получено от Javier Dominguez) использовали в качестве положительного контроля. После промывки клетки инкубировали с RPE-конъюгированным противочеловеческим IgG4 в течение 15 минут при комнатной температуре. После заключительного этапа промывки клетки фиксировали, извлекали и анализировали.
Результаты
Результаты показаны на фиг.27. TLR2 экспрессировали на МНПК свиньи и метили OPN305. МНПК очищали путем разделения на Ficoll. A-C представляют МНПК от свиньи 666, a D-F от свиньи 488. A, D не мечены; В, Е мечены контрольным поликлональным человеческим IgG4 со вторичным мечением РЕ-меченым противочеловеческим IgG4; С, F мечены OPN305 с последующим мечением РЕ-меченым противочеловеческим IgG4.
Все документы, указанные в данном описании, включены в данный документ посредством ссылки. Специалисту в данной области будут очевидны различные модификации и вариации в отношении описанных воплощений изобретения, не выходящие за рамки изобретения. Хотя изобретение было описано в связи с конкретными предпочтительными воплощениями, следует понимать, что заявленное изобретение не должно быть чрезмерно ограничено такими специфическими воплощениями. Действительно, различные модификации описанных режимов осуществления изобретения, которые очевидны специалистам в данной области, покрываются данным изобретением.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНОЕ АНТИТЕЛО ПРОТИВ ОСТЕОПОНТИНА И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2305111C2 |
| АНТИТЕЛА ПРОТИВ IL2 | 2006 |
|
RU2425054C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2610663C2 |
| НОВЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ ДИМЕРИЗАЦИЮ С-МЕТ, И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2552161C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| АНТИГЕНСВЯЗЫВАЮЩИЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОДУКТА ДЛЯ АДРЕСНОЙ ДОСТАВКИ ПРИ ЛЕЧЕНИИ РАКА | 2012 |
|
RU2659094C2 |
| АНТИТЕЛО ПРОТИВ IGF-1R И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ АДРЕСУЮЩЕГО ПЕРЕНОСЧИКА ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2698977C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2595394C2 |
| АНТИТЕЛА ПРОТИВ TFR И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПРОЛИФЕРАТИВНЫХ И ВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2016 |
|
RU2737637C2 |























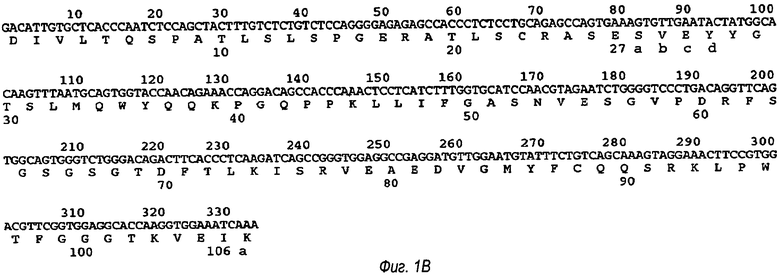

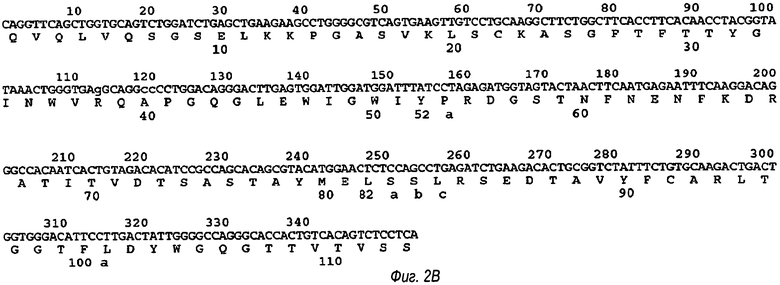






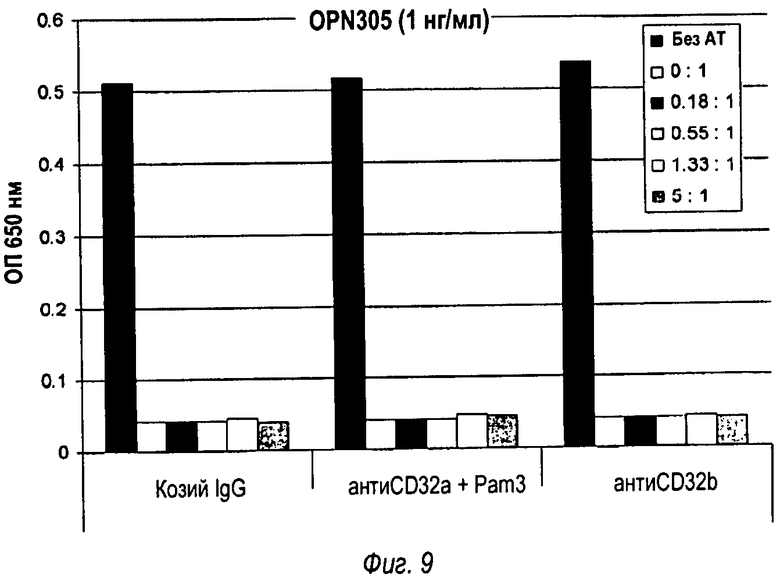
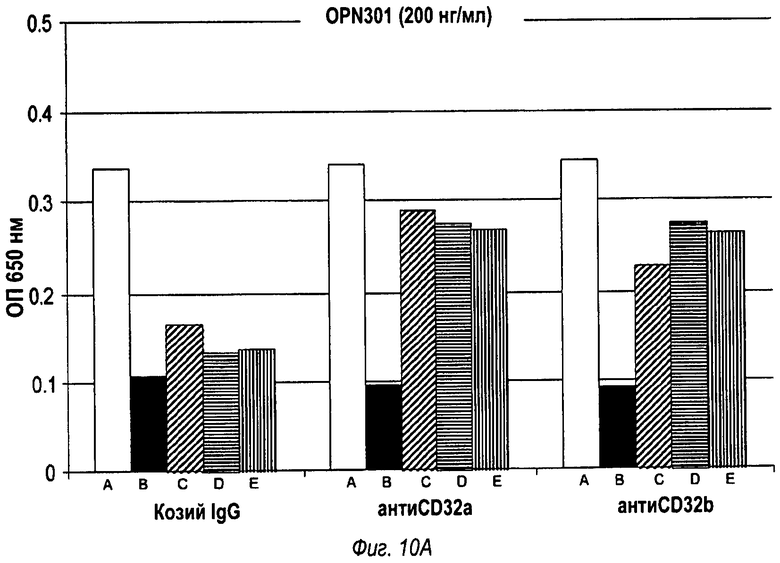
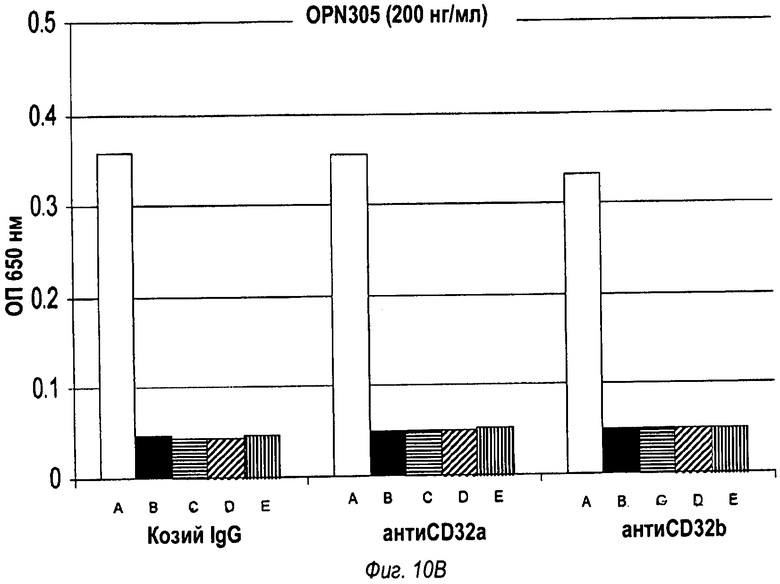
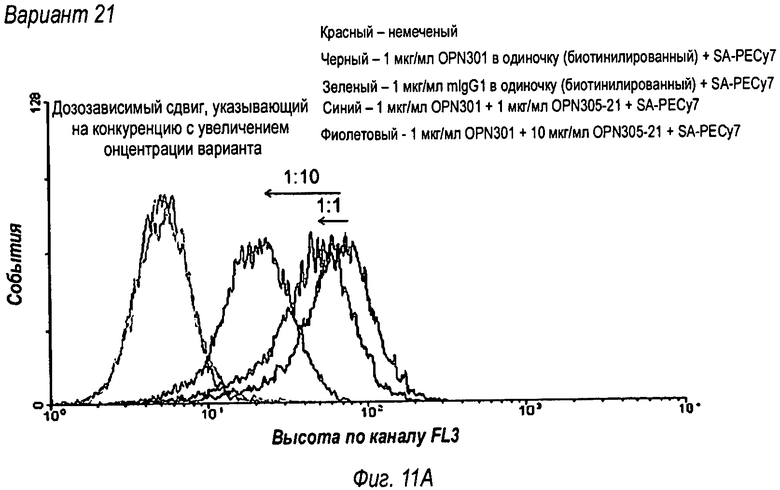
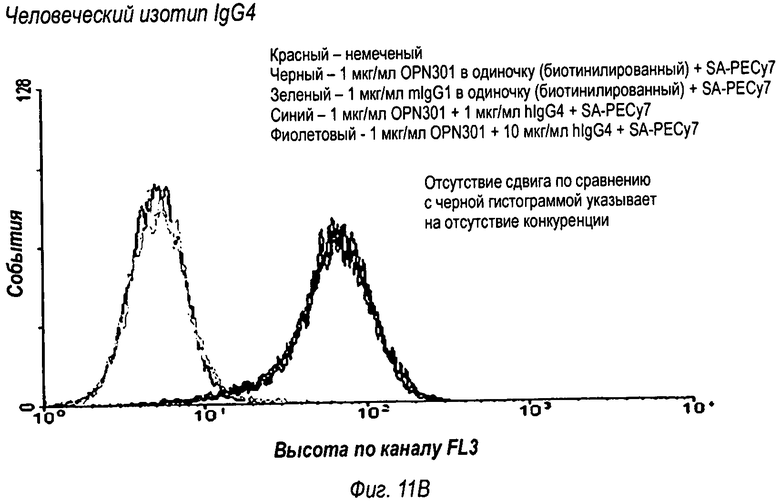
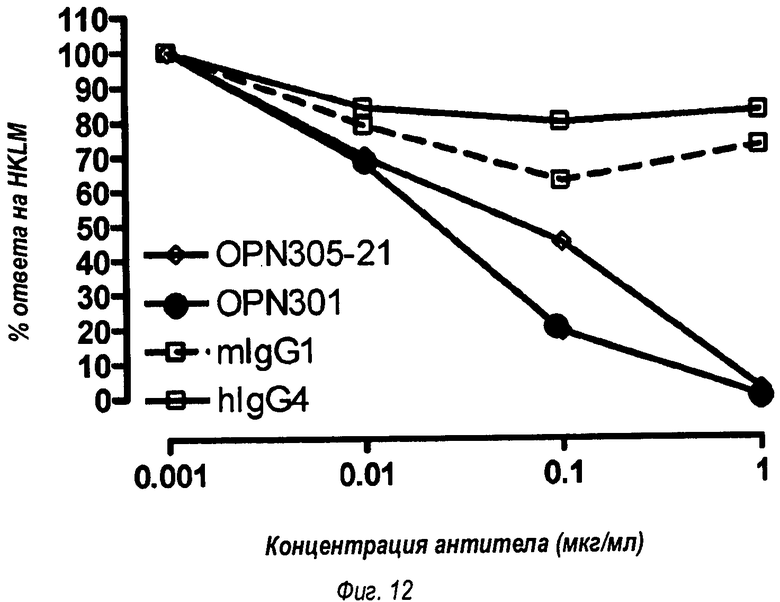
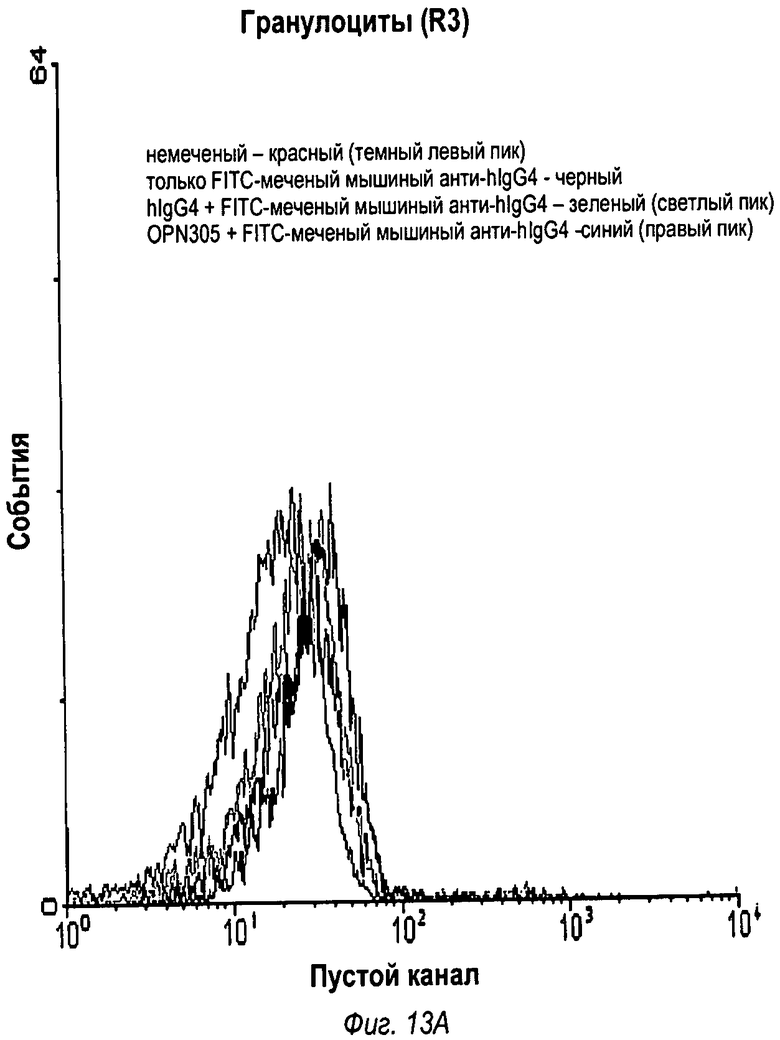
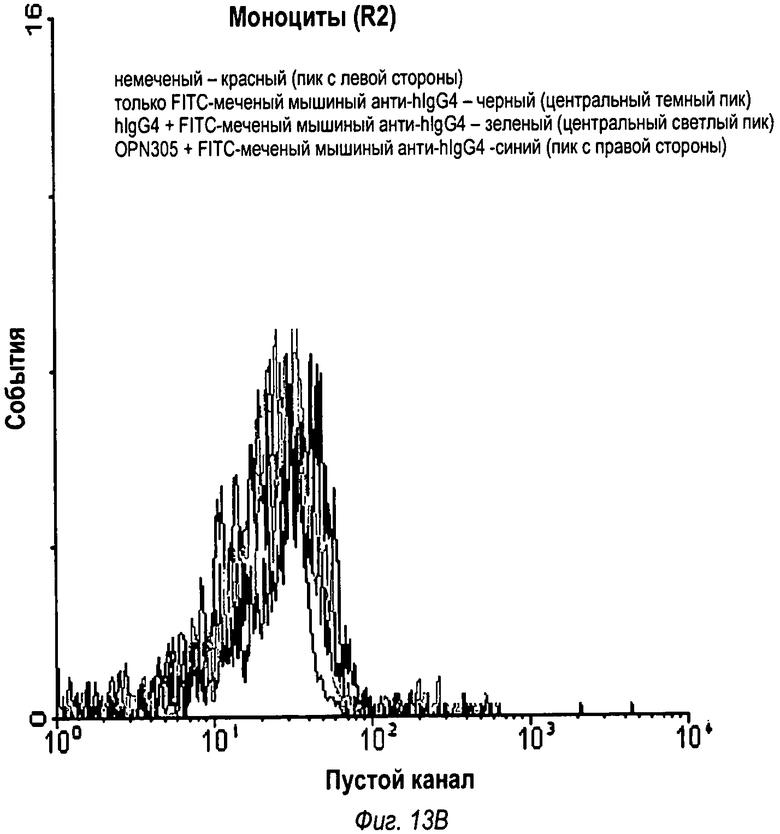

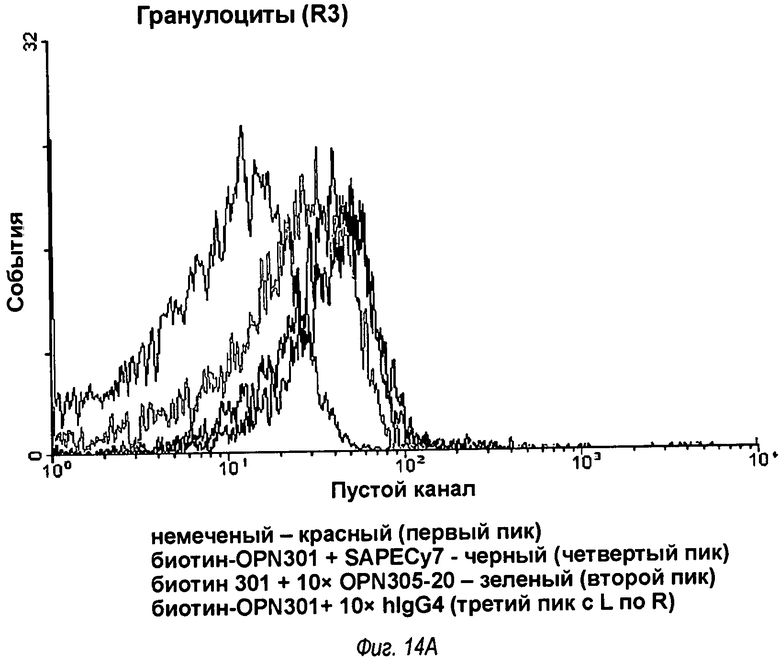
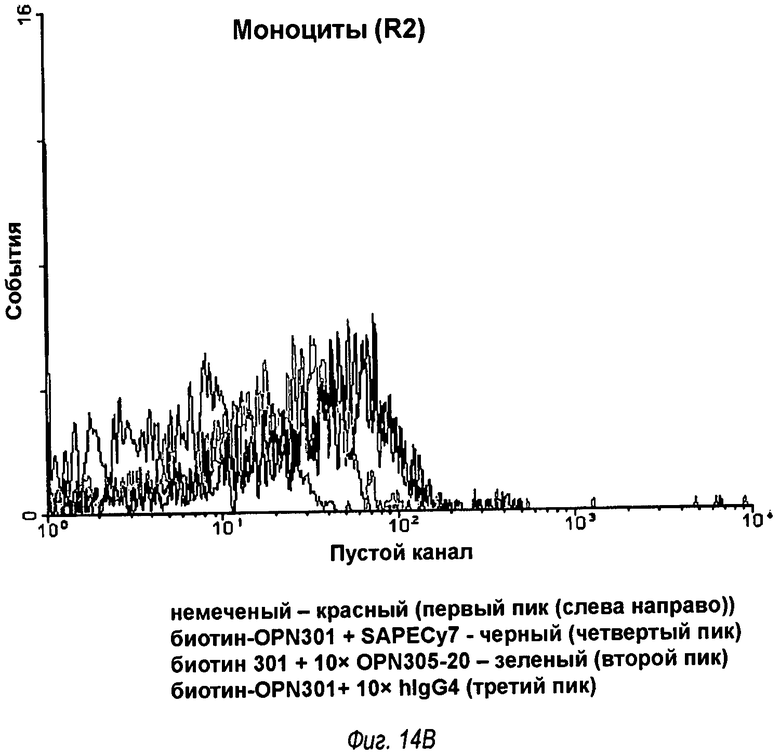
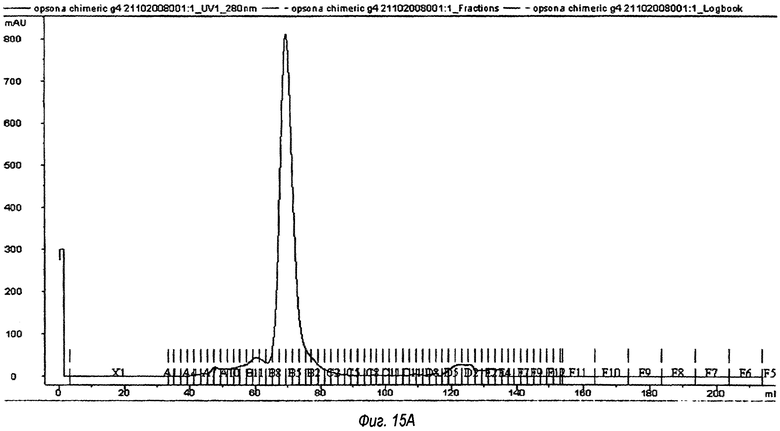
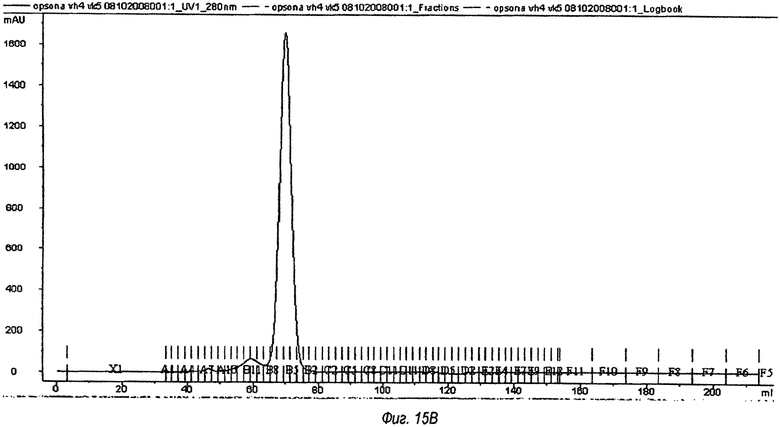
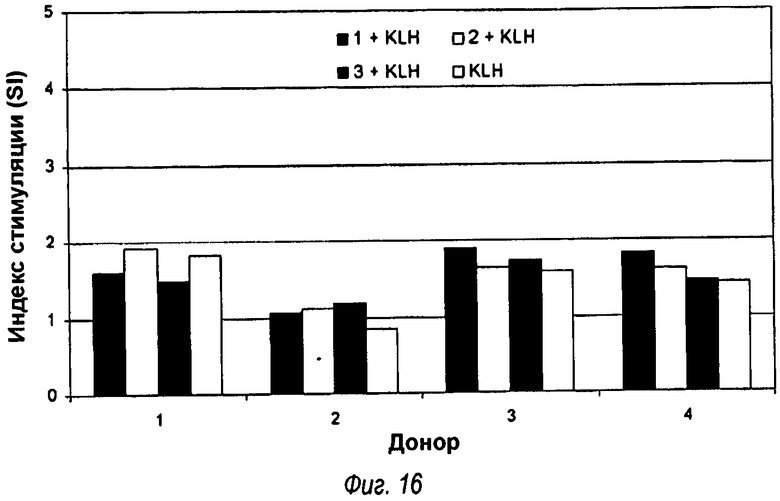
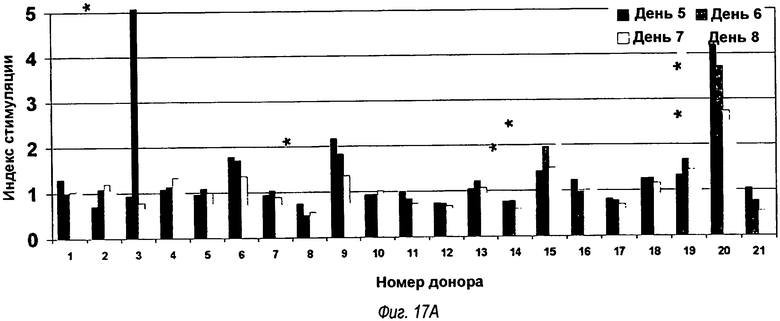
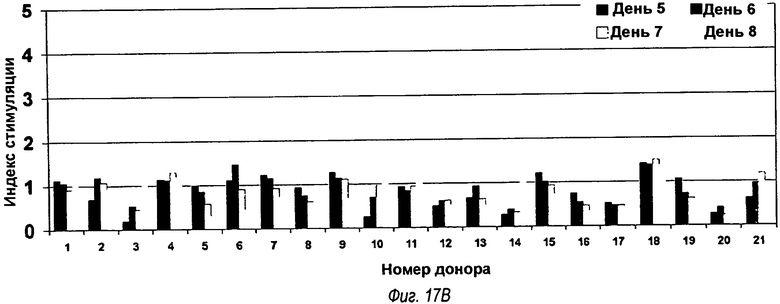
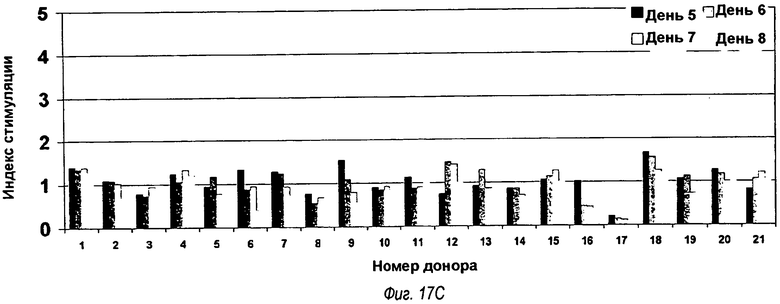
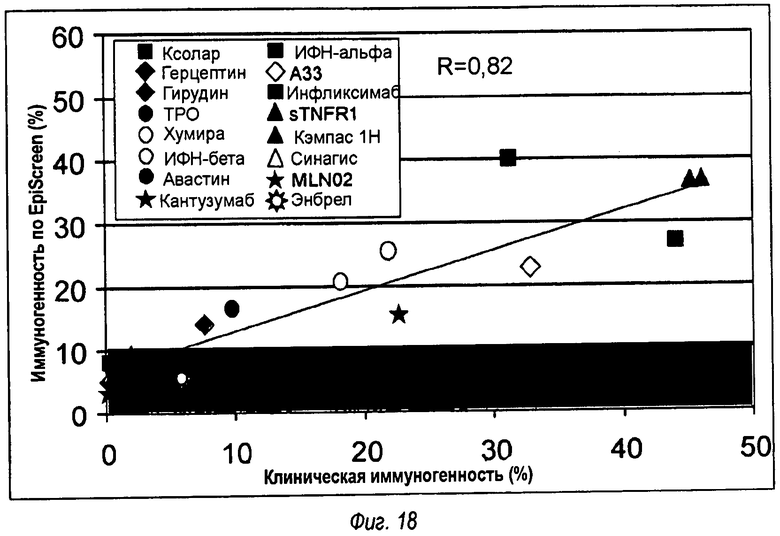



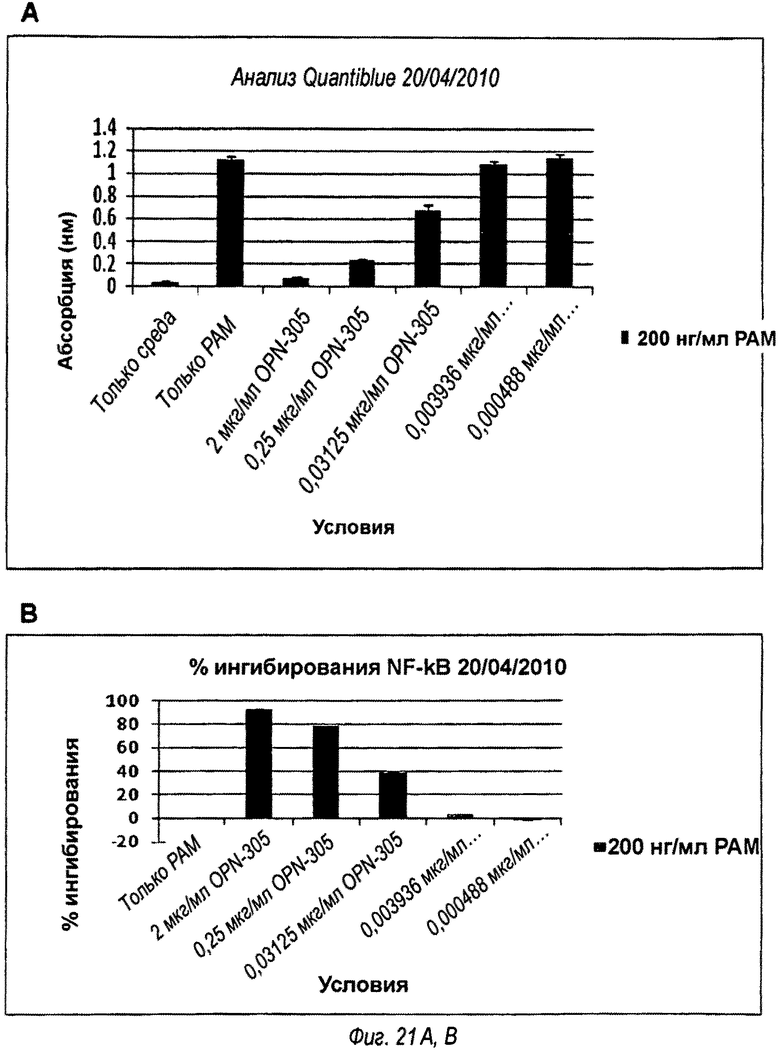
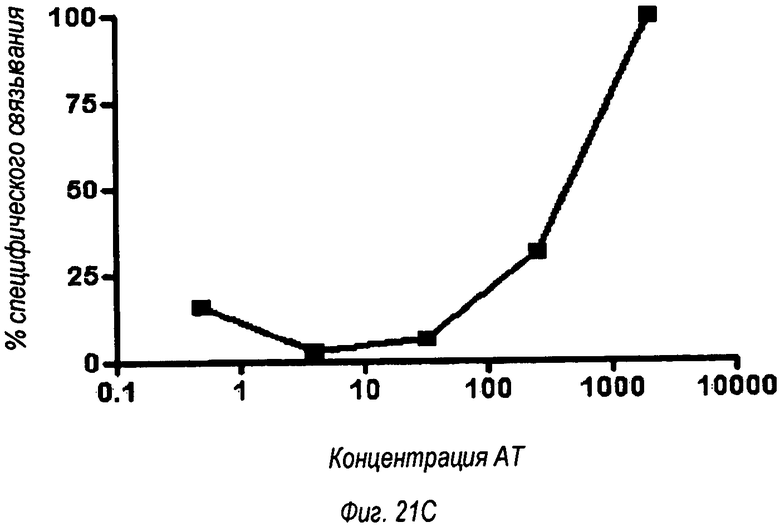
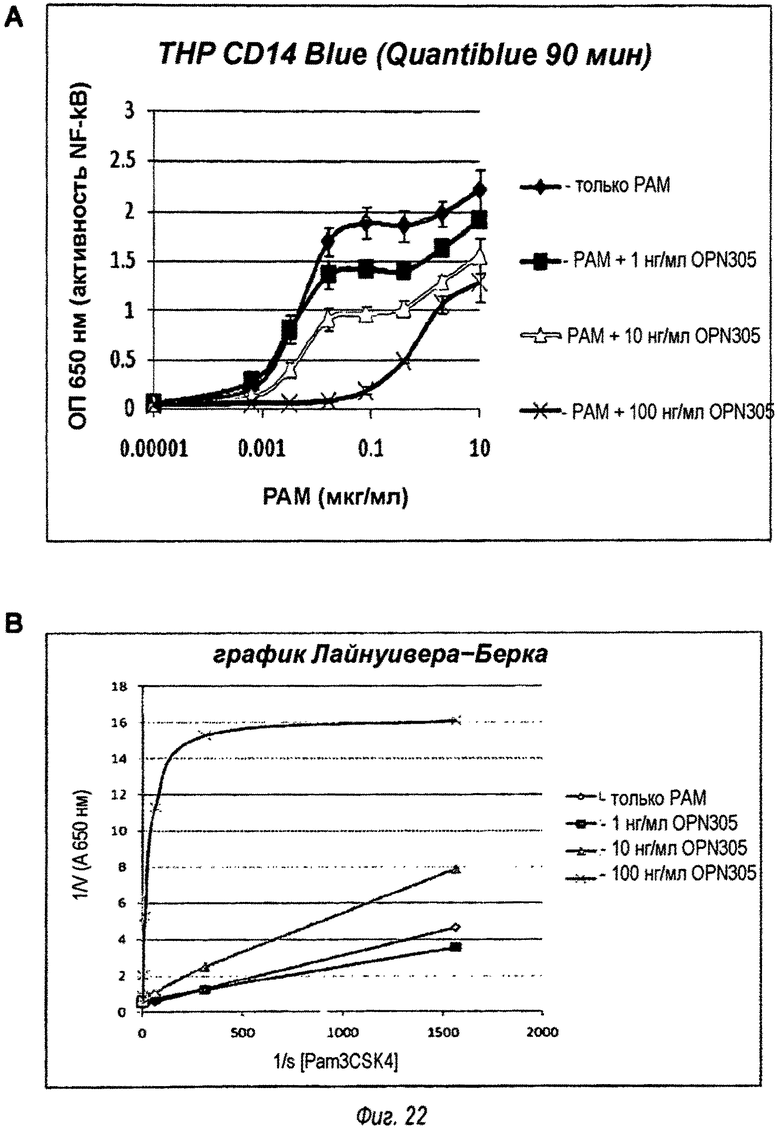
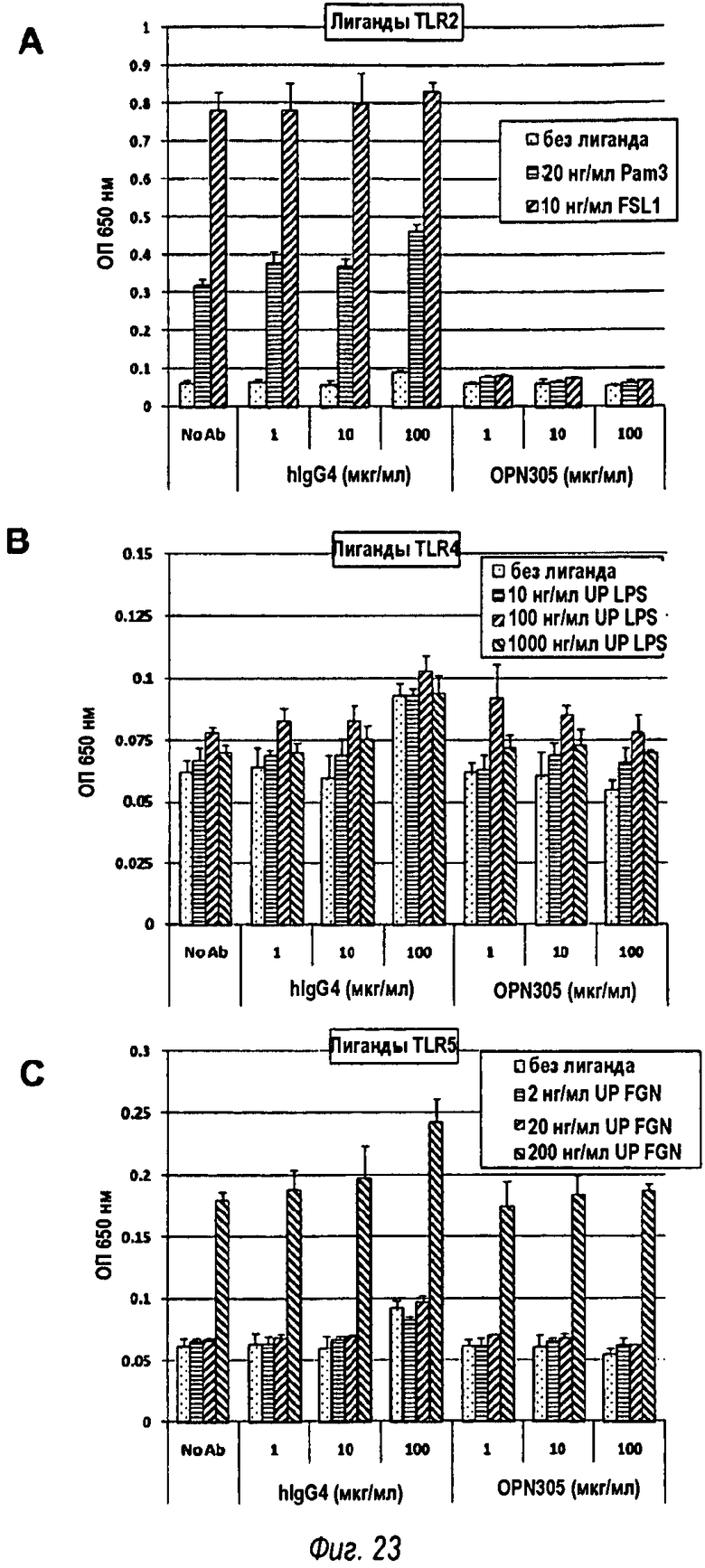
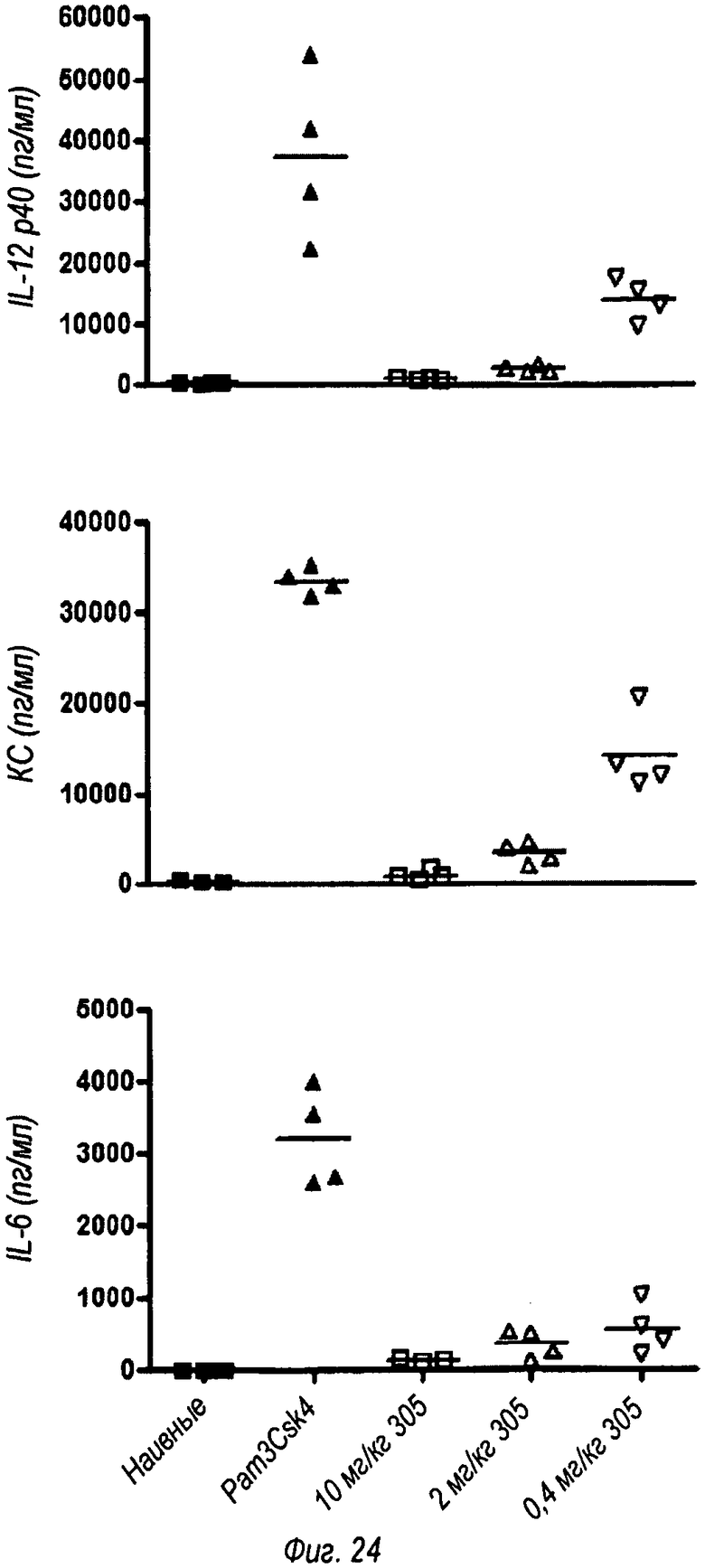
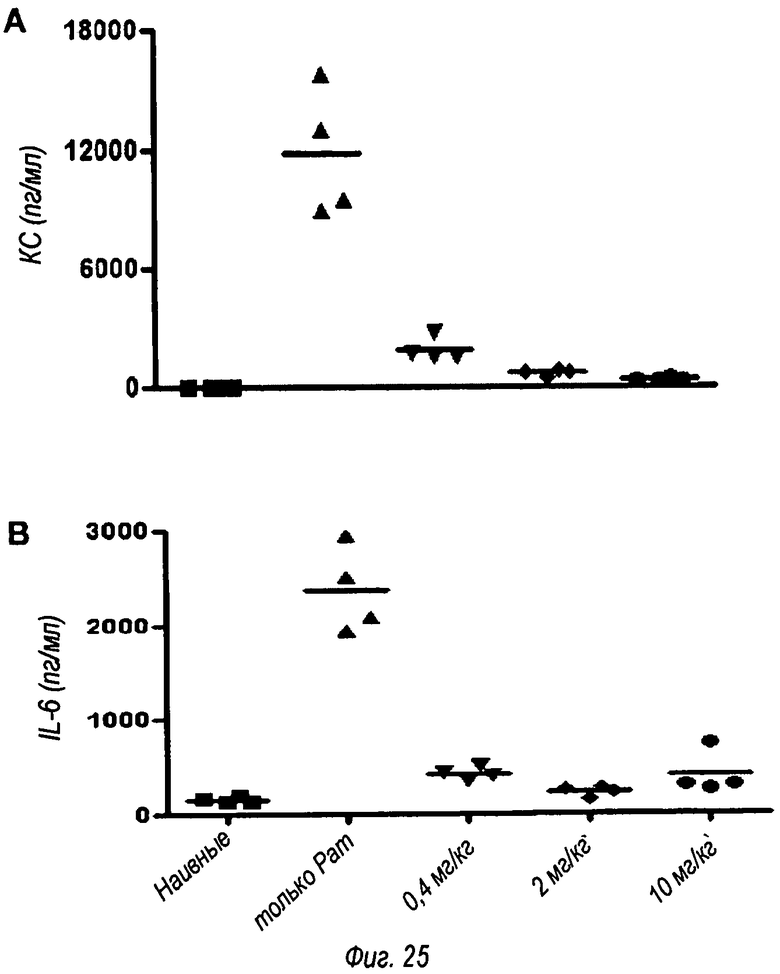
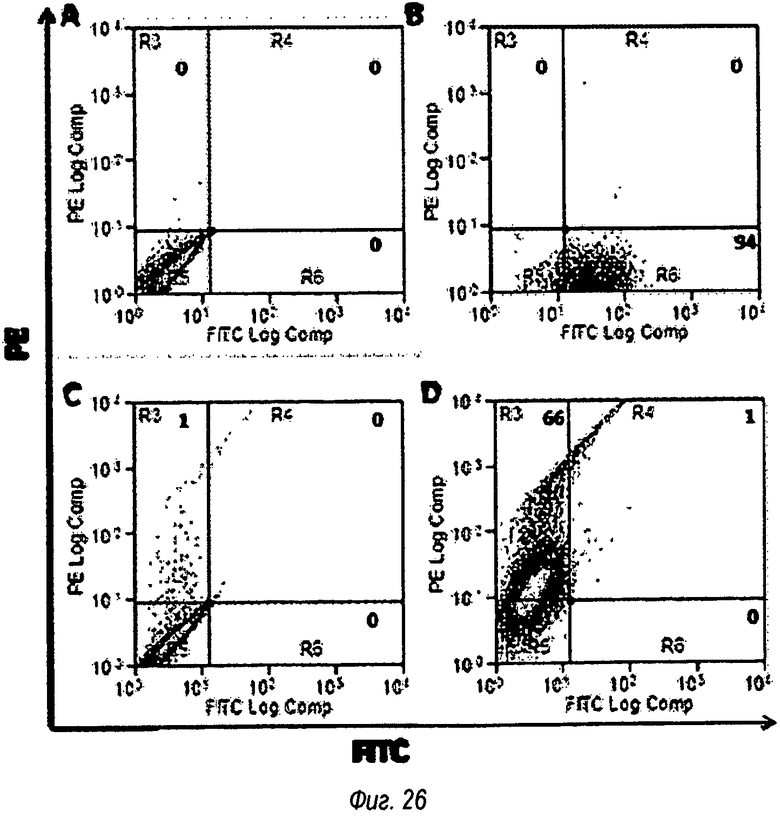

Изобретение относится к области иммунологии. Представлено выделенное антитело или его антиген-связывающая часть, содержащие вариабельную область легкой цепи и вариабельную область тяжелой цепи с аминокислотными последовательностями, раскрытыми в описании, или с аминокислотными последовательностями вариабельных областей, по меньшей мере на 90% идентичными указанным последовательностям, где вариабельная область легкой цепи содержит CDR1: RASESVEYYGTSLMQ, CDR2: GASNVES и CDR3: QQSRKLPWT, и вариабельная область тяжелой цепи содержит CDR1: TYGIN, CDR2: WIYPRDGSTNFNENFKD и CDR3: LTGGTFLDY, где антитело или его антиген-связывающая часть специфически связывают внеклеточный домен Toll-подобного рецептора 2 и являются антагонистом функции Toll-подобного рецептора 2. Описаны также выделенная нуклеиновокислотная молекула, кодирующая указанные антитело или антиген-связывающую часть; экспрессионный вектор, содержащий указанную нуклеиновокислотную молекулу; и клетка-хозяин для получения антитела по настоящему изобретению, содержащая указанный экспрессионный вектор. Предложено применение указанных антитела или антиген-связывающей части в изготовлении лекарственного средства для лечения воспалительного, дыхательного или аутоиммунного состояния или заболевания, опосредованного активацией Toll-подобного рецептора 2. Раскрыт способ изготовления антитела к Toll-подобному рецептору 2 или его антиген-связывающей части по настоящему изобретению, включающего этапы экспрессии антитела или антиген-связывающей части в клетке-хозяине и выделение антитела или антиген-связывающей части из клетки-хозяина. Изобретение позволяет расширить арсенал средств, представляющих собой ингибирующие антитела к Toll-подобному рецептору 2. 8 н. и 15 з.п. ф-лы, 27 ил., 1 табл., 14 пр.
1. Нейтрализующее антитело или его антиген-связывающая часть, содержащая вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID №1 и вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID №4, где это антитело или антиген-связывающая часть специфически связывается с Toll-подобным рецептором 2 и является антагонистом функции Toll-подобного рецептора 2.
2. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1, где вариабельный домен легкой цепи соединен с каппа константным доменом.
3. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1 или 2, где вариабельный домен тяжелой цепи соединен по меньшей мере с одним константным доменом, полученным из антитела подкласса иммуноглобулинов G, изотипа 4 (IgG4).
4. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 3, в котором аминокислотный остаток 241 шарнирной области тяжелой цепи заменен с остатка серина на остаток пролина.
5. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1 или 2, в котором легкая цепь включает аминокислотную последовательность SEQ ID №2.
6. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1 или 2, где тяжелая цепь имеет аминокислотную последовательность SEQ ID №5.
7. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 5, где тяжелая цепь имеет аминокислотную последовательность SEQ ID №5.
8. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1 или 2, где антитело представляет собой полностью гуманизированное антитело.
9. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1 или 2, где антитело представляет собой выделенное антитело.
10. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1 или 2, которое связывается с Toll-подобным рецептором 2 млекопитающих с KD 4×10-8 М или меньше.
11. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 10, которое связывается с Toll-подобным рецептором 2 млекопитающих с KD 3×10-8 М или меньше.
12. Нейтрализующее антитело к Toll-подобному рецептору 2 или его антиген-связывающая часть по п. 1 или 2, где антитело или его антиген-связывающая часть обладают специфичностью связывания к Toll-подобному рецептору 2 человека, к Toll-подобному рецептору 2 мыши и к Toll-подобному рецептору 2 обезьяны.
13. Антиген-связывающая часть нейтрализующего антитела к Toll-подобному рецептору 2, полученная из антитела по любому из предыдущих пунктов, где антиген-связывающая часть является фрагментом Fab или scFv.
14. Выделенное антитело или его антиген-связывающая часть, содержащие вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID №1 или последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID №1, и вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID №4 или последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID №4, где вариабельная область легкой цепи содержит CDR1, CDR2 и CDR3 с последовательностями SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9 соответственно, и вариабельная область тяжелой цепи содержит CDR1, CDR2 и CDR3 с последовательностями SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12 соответственно, где антитело или его антиген-связывающая часть специфически связывают внеклеточный домен Toll-подобного рецептора 2 и являются антагонистом функции Toll-подобного рецептора 2 независимо от связывания антитела или его антиген-связывающей части с CD32.
15. Выделенное антитело или его антиген-связывающая часть по п. 14, где антитело или его антиген-связывающая часть обладают специфичностью связывания к Toll-подобному рецептору 2 человека, к Toll-подобному рецептору 2 мыши и к Toll-подобному рецептору 2 обезьяны.
16. Выделенное антитело или его антиген-связывающая часть по п. 14 или 15, где вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID №1 или последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID №1, и вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID №4 или последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID №4.
17. Выделенное антитело или его антиген-связывающая часть по п. 14 или 15, где вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID №1 или последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID №1, и вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID №4 или последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID №4.
18. Выделенная нуклеиновокислотная молекула, кодирующая антитело или антиген-связывающую часть по любому из пп. 1-17.
19. Экспрессионный вектор, содержащий нуклеиновокислотную молекулу по п. 18.
20. Клетка-хозяин для получения антитела по пп. 1-17, содержащая экспрессионный вектор по п. 19.
21. Способ изготовления антитела к Toll-подобному рецептору 2 или его антиген-связывающей части по любому из пп. 1-17, который включает этапы экспрессии антитела или антиген-связывающей части в клетке-хозяине по п. 20 и выделение антитела или антиген-связывающей части из клетки-хозяина.
22. Применение антитела или антиген-связывающей части по любому из пп. 1-17 в изготовлении лекарственного средства для лечения воспалительного, дыхательного или аутоиммунного состояния или заболевания, опосредованного активацией Toll-подобного рецептора 2.
23. Применение по п. 22, где воспалительное, дыхательное или аутоиммунное состояние или заболевание выбрано из группы, состоящей из: ревматоидного артрита, бронхиальной астмы, хронической обструктивной болезни легких, аллергической реакции, псориаза, дерматита, рассеянного склероза, атеросклероза и повреждающего действия ишемии/реперфузии, ишемии/реперфузии после трансплантации органов, глазных заболеваний, увеита, возрастной макулярной дегенерации, почечного воспаления, диабета.
| WO2009019260 A2, 12.02.2009 | |||
| US7071310 B1, 04.07.2006 | |||
| АФНАСЬЕВ С.С | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ крашения тканей | 1922 |
|
SU62A1 |
Авторы
Даты
2015-09-20—Публикация
2010-07-06—Подача