Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к улучшенному гуманизированному антителу к человеческому α9-интегрину. Более точно, оно относится к улучшенному гуманизированному антителу Y9A2, обладающему активностью связывания с белком человека α9-интегрином, ингибируя α9-интегринзависимую клеточную адгезию, и улучшенной активностью и/или свойствами по сравнению с мышиным антителом Y9A2 к человеческому α9-интегрину. Предполагается, что такое гуманизированное антитело может использоваться в качестве лекарственного средства для диагностики, профилактики или лечения аутоиммунных заболеваний, таких как ревматоидный артрит, заболеваний иммунной системы, таких как аллергия и отторжение трансплантатов, и различных других заболеваний, в патогенез которых вовлечен α9-интегрин.
Уровень техники
[0002] Интегрин, гликопротеин клеточной поверхности, представляет собой молекулу адгезии, которая функционирует главным образом как рецептор клеточной адгезии с внеклеточным матриксом (коллаген, ламинин и т.п.) и членами семейства иммуноглобулинов (ICAM-1, VCAM-1 и т.п.), и опосредует передачу сигналов из внеклеточного матрикса. Таким образом, клетки получают сигналы из внеклеточного матрикса, в результате чего происходит индукция их дифференцировки, пролиферации, гибели и т.п. Интегрин представляет собой гетеродимер, состоящий из двух субъединиц, α цепи и β цепи; имеет различные α цепи и β цепи, встречающиеся в широком многообразии комбинаций, и имеет 24 члена суперсемейства интегринов. Мыши с нокаутированным интегрином рождаются либо мертвыми, либо больными, независимо от того, какая из субъединиц отсутствует, что предполагает необходимость каждого отдельного интегрина для поддержания жизненных функций. Следовательно, предполагается, что интегрин, который передает клеткам информацию об окружающих условиях для стимуляции их ответов, функционирует во всех ситуациях биологических явлений и опосредует широкий диапазон патологических условий.
[0003] Интегрин также необходим для выживания организмов, и, как предполагается, играет роль даже в болезненных состояниях; имеются сообщения о некоторых случаях, когда подавление активности интегринов помогало при лечении патологических состояний. Например, ингибитор интегрина тромбоцитов αIIbβ3, известный как абциксимаб (торговая марка: ReoPro; Eli Lilly), одобрен в качестве терапевтического лекарственного средства для лечения рестеноза после ЧТКА (чрескожной транслюминальной коронарной ангиопластики, percutaneous transluminal coronary angioplasty (PCTA)). Натализумаб (торговая марка: Antegren; ELAN Company), ингибитор α4β1 (VLA4), одобрен в качестве терапевтического лекарственного средства для лечения рассеянного склероза. Витаксин (MEDIMMUNE Company), ингибитор αvβ3, находится в разработке на стадии клинических исследований ингибирующего воздействия на неоваскуляризацию, на активацию остеокластов и т.п.
[0004] Интегрин α9β1 экспрессируется в макрофагах, NKT-клетках, дендритных клетках и нейтрофилах и, согласно сообщениям, играет важную роль в инфильтрации и адгезии этих воспалительных клеток, резорбции костей и т.п. Недавно было опубликовано сообщение о том, что интегрин α9β1 вовлечен в формирование остеокластов, и было выдвинуто предположение о его причастности к деструкции костей (Непатентный документ 1). Его известные лиганды включают укороченный остеопонтин (N-терминальный OPN), VCAM-1, тенасцин C и т.п. В клинических условиях наблюдали значимо увеличенный уровень интегрина α9β1 в синовиальных тканях пациентов с ревматоидным артритом (Непатентный документ 2).
[0005] Следовательно, для диагностики, профилактики или лечения различных заболеваний, в патогенез которых вовлечен α9-интегрин, было бы полезно разработать моноклональное антитело, которое специфически связывается с белком α9-интегрином, подавляя α9-интегрин-зависимую клеточную адгезию.
[0006] Антитела, которые, как сообщалось, обладают функцией ингибирующего воздействия на человеческий α9-интегрин, представляют собой мышиное моноклональное антитело Y9A2 (Непатентный документ 3) и 1K11, 24I11, 21C5 и 25B6 (Патентный документ 1) и 28S1 (Патентный документ 2). Полученные в экспериментах in vitro результаты показали, что эти антитела способны подавлять зависимую от человеческого α9-интегрина клеточную адгезию. Помимо этого, поскольку Y9A2 ингибирует клеточную адгезию как к остеопонтину, так и к тенасцину С, предполагается, что оно является самым многообещающим в качестве кандидата на лекарственное средство на основе антитела к α9-интегрину.
[0007] Однако необходимо отметить, что Y9A2 представляет собой мышиное антитело, полученное путем иммунизации мыши антигеном, и, следовательно, с точки зрения безопасности (индукции антигенности) и эффективности (укороченного времени полужизни), фактически не представляется возможным прямое введение этого антитела человеку. Поэтому необходима модификация с целью трансформации антитела в молекулу, имеющую аминокислотную последовательность человеческого антитела при сохранении активности Y9A2, т.е. гуманизация.
[0008] В настоящее время, в качестве способа продуцирования гуманизированного антитела, наиболее общепринятым является способ, основанный на методе, включающем перенос аминокислоты гипервариабельного участка (далее в настоящем документе называемом CDR) согласно разработке Winter и др. (Непатентный документ 4). Также хорошо известно, что одновременный перенос не только аминокислоты, содержащейся в CDR, но также и аминокислоты, не относящейся к CDR, но ответственной за сохранение структуры CDR или связывание с антигеном, т.е. находящейся в каркасном участке (далее в настоящем документе называемом FR), из чужеродного антитела, которое является донором аминокислоты CDR для человеческого антитела, которое является акцептором CDR, важен для воспроизведения врожденной активности антитела-донора (Непатентные документы 4 и 5).
[0009] Однако продуцирование гуманизированного антитела на основе переноса CDR связано с несколькими проблемами. Во-первых, наиболее общей проблемой является то, что даже подходящий выбор аминокислоты FR, необходимой для воспроизведения активности антитела-донора, не может устранить трудности, связанные с получением гуманизированного антитела, обладающего аффинностью к антигену и биологической активностью, превышающей активность антитела-донора.
[0010] В последние годы, на рынке появилось большое количество химерных антител, гуманизированных антител и человеческих антител в виде фармацевтических продуктов моноклональных антител. Эффективная доза любого из них является чрезвычайно высокой и составляет несколько мг на 1 кг массы тела. Поэтому, фармацевтические препараты с антителами являются очень дорогими, что, в свою очередь, с экономической точки зрения, ложится тяжелым бременем на пациентов и увеличивает медицинские затраты. Главные факторы, определяющие эффективную дозу лекарственного средства на основе антитела, включают аффинность антитела к антигену и количество антигенов в организме. В частности, с точки зрения этих аспектов, улучшение аффинности антитела к антигену приводит к уменьшению дозы и является очень полезным улучшением, приводящим также, с экономической точки зрения, к уменьшению бремени на пациентов и сокращению медицинских затрат.
[0011] Для достижения увеличенной аффинности антитела к антигену часто используется способ, включающий замену аминокислоты в вариабельной области антитела. Однако если антитело и антиген являются различными, также изменяются последовательность и пространственная структура аминокислот в CDR, а также меняется положение аминокислоты, участвующей в антиген-антитело взаимодействии. Поэтому практически невозможно определить положение аминокислоты в FR, которая должна быть перенесена вместе с CDR, применимое к любому антителу.
[0012] Другая проблема заключается в том, что хотя в темплатное человеческое антитело обычно переносятся все аминокислоты CDR мышиного антитела-донора в процессе получения гуманизированного антитела, основанном на CDR-переносе, аминокислотная последовательность CDR, полученная из мышиного антитела, которая является важной для связывания с антигеном, иногда проявляет антигенность по отношению к человеку, часто вызывая генерацию анти-идиотипных антител.
[0013] Таким образом, для производства гуманизированного антитела необходим выбор соответствующего антитела-акцептора и выбор заменяемых аминокислот CDR и аминокислот FR для получения активности, превышающей активность антитела-донора, при этом не вызывая антигенности по отношению к человеку и не уменьшая стабильности антитела. Это требует значительного мастерства и использования метода проб и ошибок.
Патентный документ 1: WO 2006/075784
Патентный документ 2: WO 2008/007804
Непатентный документ 1: Journal of Bone and Mineral Research, 2006, 21: 1657-1665
Непатентный документ 2: The Journal of Clinical Investigation, 2005, 115: 1060-1067
Непатентный документ 3: Am. J. Respir. Cell Mol. Biol., 1996, 15: 664-672
Непатентный документ 4: Science, 239, 1534-1536 (1988)
Непатентный документ 5: Proc. Natl. Acad. Sci. USA, 86, 10029-10033 (1989)
Раскрытие изобретения
Проблемы, решаемые изобретением
[0014] Целью настоящего изобретения является решение вышеупомянутых различных проблем, связанных с гуманизированными антителами, и обеспечение гуманизированных антител к человеческому α9-интегрину, обладающих улучшенной активностью и/или свойствами по сравнению с мышиным антителом-донором к человеческому α9-интегрину (Y9A2).
Средства для решения указанных проблем
[0015] Следовательно, настоящее изобретение содержит приведенные ниже изобретения (1)-(15), в виде веществ, полезных с точки зрения медицины или промышленности, и способов.
(1) Гуманизированное антитело к человеческому α9-интегрину, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранные из следующего:
(a) вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:11, и вариабельной области легкой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:17;
(b) вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:13, и вариабельной области легкой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:17; и
(c) вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:15, и вариабельной области легкой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:9.
(2) Гуманизированное антитело к человеческому α9-интегрину, описанное выше в (1), в котором константная область тяжелой цепи антитела представляет собой Igγ1 человека.
(3) Гуманизированное антитело к человеческому α9-интегрину, описанное выше в (1), в котором константная область легкой цепи антитела представляет собой Igκ человека.
(4) Гуманизированное антитело к человеческому α9-интегрину, описанное выше в (1), в котором константная область тяжелой цепи антитела представляет собой Igγ1 человека, а гуманизированное антитело к человеческому α9-интегрину, описанное выше в (1), в котором константная область тяжелой цепи антитела представляет собой Igκ человека.
(5) Гуманизированное антитело к человеческому α9-интегрину, описанное выше в (1), в котором тяжелая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:19, а легкая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:25.
(6) Гуманизированное антитело к человеческому α9-интегрину, описанное выше в (1), в котором тяжелая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:21, а легкая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:25.
(7) Гуманизированное антитело к человеческому α9-интегрину, описанное выше в (1), в котором тяжелая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:23, а легкая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:27.
(8) Полинуклеотид, содержащий последовательность, кодирующую вариабельную область тяжелой цепи гуманизированного антитела к человеческому α9-интегрину, описанному выше в (1).
(9) Полинуклеотид, содержащий последовательность, кодирующую вариабельную область легкой цепи гуманизированного антитела к человеческому α9-интегрину, описанному выше в (1).
(10) Вектор экспрессии, содержащий полинуклеотид, описанный выше в (8) и/или полинуклеотид, описанный выше в (9).
(11) Клетка-хозяин, включающая вектор экспрессии, описанный выше в (10).
(12) Способ продуцирования гуманизированного антитела к человеческому α9-интегрину, включающий стадию культивирования клетки-хозяина, описанную выше в (11), для получения возможности экспрессировать гуманизированное антитело к человеческому α9-интегрину.
(13) Терапевтическое лекарственное средство от ревматоидного артрита, содержащее гуманизированное антитело к человеческому α9-интегрину, описанное выше в любом из (1)-(7).
(14) Способ профилактики или лечения ревматоидного артрита, включающий стадию введения терапевтически эффективного количества гуманизированного антитела к человеческому α9-интегрину, описанному выше в любом из (1)-(7).
(15) Применение гуманизированного антитела к человеческому α9-интегрину, описанного выше в любом из (1)-(7), в процессе производства фармацевтического препарата для профилактики или лечения ревматоидного артрита.
Эффект, обеспечиваемый изобретением
[0016] Согласно настоящему изобретению, предоставляется гуманизированное антитело к человеческому α9-интегрину, имеющее улучшенную активность и/или свойства по сравнению с мышиным антителом-донором к человеческому α9-интегрину. Гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению обладает сильным противовоспалительным действием и сильным действием подавления костной деструкции путем блокирования взаимодействия между человеческим α9-интегрином и его многочисленными лигандами и является применимым для профилактики или лечения различных заболеваний, в патогенезе которых участвует человеческий α9-интегрин. Кроме того, гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению обеспечивает превосходные преимущества при использовании в клинике, такие как уменьшение дозы, увеличение интервала между введениями, усовершенствование способа введения (например, путем подкожной инъекции) и т.п., и обладает высокой терапевтической эффективностью и хорошей переносимостью пациентами.
Краткое описание чертежей
[0017] На Фиг.1 показана аминокислотная последовательность VH мышиного антитела Y9A2.
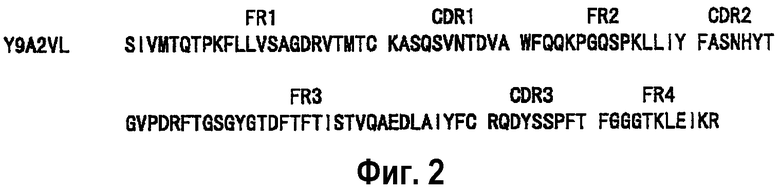
На Фиг.2 показана аминокислотная последовательность VL мышиного антитела Y9A2.
На Фиг.3 показана структура олиго-ДНК для продуцирования гена, кодирующего RY9A2VHv5, который является одним из примеров VH гуманизированного антитела Y9A2.
На Фиг.4 показана структура олиго-ДНК для продуцирования гена, кодирующего RY9A2VLv01, который является одним из примеров VL гуманизированного антитела Y9A2.
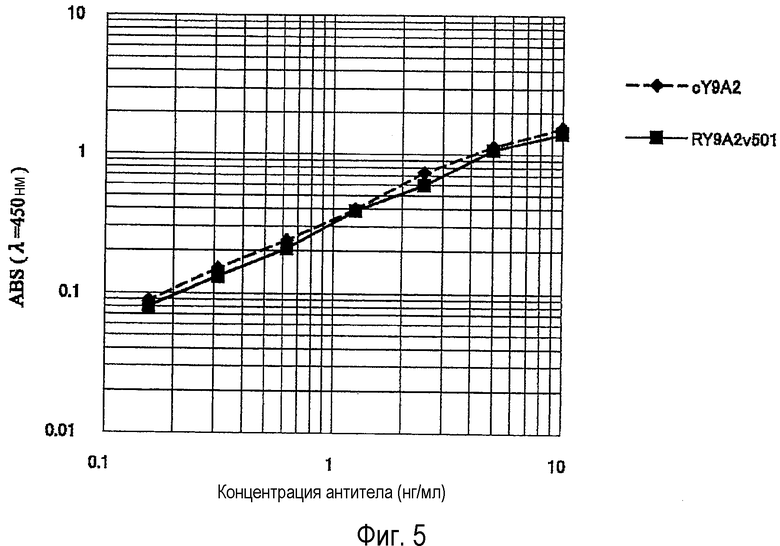
На Фиг.5 показаны результаты клеточного ELISA для химерного антитела Y9A2 и антитела RY9A2v501.
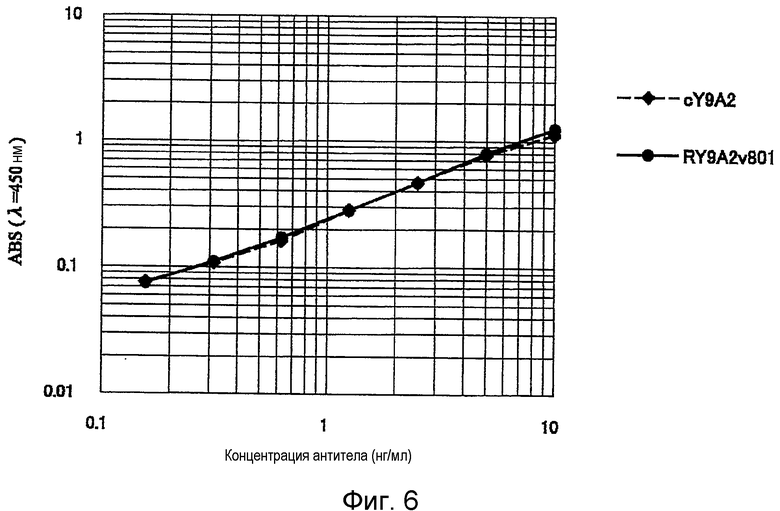
На Фиг.6 показаны результаты клеточного ELISA для химерного антитела Y9A2 и антитела RY9A2v801.
Лучшие варианты осуществления изобретения
[0018] Ниже подробно описано настоящее изобретение.
Авторы настоящего изобретения продемонстрировали хорошую изобретательность и рассмотрели вопросы, связанные с продуцированием гуманизированного антитела для мышиного антитела Y9A2 к человеческому α9-интегрину, и успешно получили три вида гуманизированного антитела к человеческому α9-интегрину (далее в настоящем документе называемом гуманизированным антителом Y9A2 или RY9A2), обладающих значительно улучшенной активностью и/или свойствами по сравнению с Y9A2.
[0019] Более точно, авторы настоящего изобретения сначала перенесли аминокислотную последовательность CDR и несколько аминокислот FR вариабельной области тяжелой цепи (далее в настоящем документе называемой VH) и вариабельной области легкой цепи (далее в настоящем документе называемой VL) мышиного антитела Y9A2 к человеческому α9-интегрину (далее в настоящем документе называемом мышиным антителом Y9A2) в темплатное человеческое антитело для получения двух видов гуманизированных антител RY9A2v501 и RY9A2v801 к человеческому α9-интегрину, каждое из которых обладает активностью, равной активности мышиного антитела Y9A2. CDR определяли согласно классификации Кабата (Kabat) и др. (Sequences of Proteins of Immunological Interest 4th ed., Public Health Service, NIH, Washington DC, 1987). Аминокислотные последовательности VH для RY9A2v501 и RY9A2v801 приведены в SEQ ID NO:5 и SEQ ID NO:7, соответственно. В настоящем документе VH для RY9A2v801 представляет собой VH для RY9A2v501, где 4 аминокислотных остатка из аминокислотных остатков FR, полученных из мышиного антитела Y9A2, заменены на соответствующие аминокислоты темплатного человеческого антитела. Аминокислотная последовательность VL обоих гуманизированных антител приведена в SEQ ID NO:9 и является общей для обоих антител.
[0020] Затем, для получения гуманизированного антитела с более высокой аффинностью к человеческому α9-интегрину по сравнению с активностью исходного мышиного антитела Y9A2, без риска индуцирования антигенности гуманизированного антитела и пониженной стабильности при его хранении, авторы настоящего изобретения рассмотрели замену аминокислотных последовательностей в CDR из VH и VL вышеупомянутых двух видов гуманизированных антител. В результате было подтверждено, что следующие 3 вида гуманизированных антител к человеческому α9-интегрину обладают значительно улучшенной активностью и/или свойствами по сравнению с активностью и/или свойствами исходного мышиного антитела Y9A2:
1) гуманизированное антитело к человеческому α9-интегрину, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:11, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:17.
2) гуманизированное антитело к человеческому α9-интегрину, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:13, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:17.
3) гуманизированное антитело к человеческому α9-интегрину, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:15, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:9.
[0021] Гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению может быть легко получено специалистами в данной области на основе информации о последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи этого антитела, раскрытого в настоящем документе, с использованием способа, хорошо известного в данной области. В частности, получают генный сегмент вариабельной области тяжелой цепи, имеющий базовую последовательность, которая кодирует аминокислоты вариабельной области тяжелой цепи гуманизированного антитела по настоящему изобретению, и генный сегмент вариабельной области легкой цепи, имеющий базовую последовательность, которая кодирует аминокислоты вариабельной области легкой цепи гуманизированного антитела по настоящему изобретению. Затем, гены вариабельных областей соединяют с геном константной области из соответствующего класса человеческого антитела для получения гена гуманизированного антитела. Затем, этот ген гуманизированного антитела соединяют с соответствующим вектором экспрессии и вводят в культивируемую клетку. Наконец, культивируют эту культивируемую клетку, таким образом получают возможность для выделения гуманизированного антитела из супернатанта культуры.
[0022] Каждый из вышеописанных генных сегментов вариабельных областей, который кодирует аминокислоты вариабельных областей тяжелой цепи и легкой цепи гуманизированного антитела по настоящему изобретению, может быть синтезирован, например, на основе базовых последовательностей вариабельных областей тяжелой цепи и легкой цепи, или базовых последовательностей, сконструированных на основе аминокислотных последовательностей вариабельных областей тяжелой цепи и легкой цепи, и известным в данной области способом синтеза генов. В качестве такого способа синтеза генов могут использоваться различные способы, известные специалистам в данной области, такие как способ синтеза гена антитела, описанный в WO90/07861 и т.п. Кроме того, после получения генного сегмента вариабельной области антитела по настоящему изобретению также могут быть получены другие антитела по настоящему изобретению путем введения мутаций в заданный участок генного сегмента. В качестве такого способа введения мутаций могут быть использованы различные способы, очевидные для специалистов в данной области, такие как сайт-направленный мутагенез (Current Protocols in Molecular Biology edit. Ausubel et al. (1987) Publish. John Wiley & Sons Section 8.1-8.5).
[0023] Затем, для получения гена гуманизированного антитела соединяют вышеописанные генные сегменты вариабельных областей и ген константной области человеческого антитела. Хотя в качестве константной области используемого человеческого антитела может быть выбран любой подкласс константной области (например, γ1, γ2, γ и γ4 в качестве тяжелых цепей, константные области λ и κ цепей в качестве легких цепей), предпочтительно могут использоваться Igγ1 человека в качестве константной области тяжелой цепи и Igκ человека в качестве константной области легкой цепи.
[0024] После получения такого гена гуманизированного антитела, могут быть выполнены следующие стадии: введение гена гуманизированного антитела в вектор экспрессии, введение вектора экспрессии в культивируемые клетки, культивирование культивируемых клеток, очистка антитела и т.п. с помощью различных, хорошо известных в данной области способов или с помощью способов получения гуманизированного антитела к человеческому остеопонтину, описанных в WO2007/139164 или WO2003/027151.
[0025] В качестве вектора экспрессии, предназначенного для соединения с полученным таким образом геном гуманизированного антитела, можно использовать векторы экспрессии, описанные в заявке на патент WO94/20632, приведенной в официальном бюллетене международных заявок на патент (International Patent Publication Official Gazette), такие как AG-γ1 и AG-γ, при этом на вектор экспрессии отсутствуют какие-либо ограничения при условии, что он может экспрессировать ген гуманизированного антитела. Предпочтительно использовать вектор экспрессии, уже имеющий ген константной области человеческого Ig, такой как AG-γ1 или AG-γ, поскольку он мог бы стать вектором экспрессии, имеющим ген гуманизированного антитела для случая простого введения в него гена вариабельной области гуманизированного антитела. В векторе экспрессии может использоваться лидерная последовательность для усиления внеклеточной секреции и экспрессии антитела. В качестве лидерной последовательности может использоваться лидерная последовательность, полученная из Y9A2, или лидерная последовательность, полученная из другого антитела (например, гуманизированного антитела к остеопонтину, описанного в WO2007/139164).
[0026] Вышеописанный вектор экспрессии вводят в культивируемые клетки, например, используя систему экспрессии FreeStyle 293 (Invitrogen), кальций-фосфатный способ и т.п.
[0027] В качестве примеров культивируемых клеток, в которые вводится вектор экспрессии, можно привести культивируемые клетки, такие как клетки 293, клетки CHO-DG44, которые можно культивировать обычным способом.
[0028] После вышеописанного культивирования накопленное в супернатанте культуры антитело может быть очищено с помощью различного вида колоночной хроматографии, например хроматографией с использованием колонок с протеином А.
[0029] В качестве способа, используемого для измерения активности связывания полученного гуманизированного антитела с человеческим α9-интегрином, можно указать ELISA, FACS и т.п. В случае использования ELISA, например, клетки (например, клетки SW480), экспрессирующие α9-интегрин, иммобилизуют на планшете ELISA, добавляют туда гуманизированное антитело с тем, чтобы вызвать реакцию, и к этому добавляют вторичное антитело, такое как человеческое антитело IgG, меченное ферментом, например, пероксидазой хрена (HRP), вызывая реакцию. Клетки промывают, добавляют к ним субстрат, вызывающий окрашивание (например, TMB, в случае HRP метки), и измеряют абсорбцию.
[0030] В качестве способа оценки наличия у полученного гуманизированного антитела функции ингибирующей активности в отношении человеческого α9-интегрина, можно использовать тест на ингибирование (описанный в J. Biol. Chem., 274:36328-36334, 1999) зависимой от человеческого α9-интегрина клеточной адгезии к молекуле человеческого остеопонтина. Таким образом, вариант RAA (последовательность RGD заменяют на RAA для подавления реакции с другим интегрином; далее в настоящем документе иногда называемый nOPN-RAA) N-терминального OPN (N терминальный фрагмент после расщепления остеопонтина тромбином; далее в настоящем документе иногда называемый nOPN), который является одним из α9 лигандов, иммобилизуют на планшете и блокируют. После добавления различных гуманизированных антител добавляют клетки экспрессии α9 и инкубируют при 37°C в течение 1 часа. Клетки фиксируют и окрашивают кристаллическим фиолетовым и метанолом, и промывают. Краску с прикрепленных клеток экстрагируют Тритоном X-100 и измеряют абсорбцию при длине волны, равной 595 нм.
[0031] Кроме того, в качестве способа, используемого для детальной оценки наличия у полученного гуманизированного антитела функции ингибирующей активности в отношении человеческого α9-интегрина, можно упомянуть способ, основанный на тесте ингибирования клеточной миграции, описанный в Molecular Biology of the cell, 12: 3214-3225, 2001. Таким образом, nOPN-RAA иммобилизуют в верхнем слое системы Transwell и устанавливают на планшете, а затем в нижний слой добавляют среду F15, содержащую 10% FCS. В верхний слой одновременно добавляют клетки экспрессии α9 и гуманизированное антитело и инкубируют при 37°C в течение 16 часов. После того, как клетки мигрируют в более низкий слой системы Transwell, выполняют количественное определение, например, с помощью набора для анализа клеточной миграции с использованием 24-луночного планшета (Cell Migration 24-well Assay) QCM Chemotaxis (Millipore).
[0032] Можно легко получить 3 вида гуманизированных антител к человеческому α9-интегрину по настоящему изобретению путем синтеза ДНК, кодирующей аминокислотную последовательность VH, приведенную в SEQ ID NO:11, 13 или 15, и ДНК, кодирующую аминокислотную последовательность VL, приведенную в SEQ ID NO:17 или 9, с помощью хорошо известного в данной области способа, путем соединения их с соответствующим классом гена константной области человеческого антитела, предпочтительно гена Igγ1 константной области тяжелой цепи человека и гена Igκ константной области легкой цепи человека, с целью создания гена гуманизированного антитела, путем введения гена гуманизированного антитела в вектор экспрессии с помощью различных хорошо известных в данной области способов или способа, описанного в WO02/081522 или WO03/027151 и т.п., путем введения вектора экспрессии в культивируемые клетки, культивирования культивируемых клеток и очистки антитела от полученной культуры. Предпочтительно, ДНК, кодирующие аминокислотные последовательности VH, приведенные в SEQ ID NO:11, 13 и 15, содержат базовые последовательности, приведенные в SEQ ID NO:12, 14 и 16, соответственно. Предпочтительно, ДНК, кодирующие аминокислотные последовательности VL, приведенные в SEQ ID NO:17 и 9, содержат базовые последовательности, приведенные в SEQ ID NO:18 и 10, соответственно.
[0033] Предпочтительная тяжелая цепь гуманизированного антитела по настоящему изобретению, которую получают путем присоединения к вариабельной области тяжелой цепи, приведенной в SEQ ID NO:11, и константной области человеческого Igγ1, представляет собой тяжелую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:19. Предпочтительная легкая цепь гуманизированного антитела по настоящему изобретению, которую получают путем присоединения к вариабельной области легкой цепи, приведенной в SEQ ID NO:17, и константной области человеческого Igκ, представляет собой легкую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:25. Предпочтительно, ДНК, кодирующая тяжелую цепь гуманизированного антитела, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:19, содержит базовую последовательность, приведенную в SEQ ID NO:20. Предпочтительно, ДНК, кодирующая легкую цепь гуманизированного антитела, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:25, содержит базовую последовательность, приведенную в SEQ ID NO:26. В качестве гуманизированного антитела к α9-интегрину по настоящему изобретению, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:19, и легкую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:25, может быть упомянуто описанное ниже в примерах антитело RY9A2v12(M34L)012.
[0034] Предпочтительная тяжелая цепь гуманизированного антитела по настоящему изобретению, которая получена путем присоединения к вариабельной области тяжелой цепи, приведенной в SEQ ID NO:13, и константной области Igγ1 человека, представляет собой тяжелую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:21. Предпочтительная легкая цепь гуманизированного антитела по настоящему изобретению, которая получена путем присоединения к вариабельной области легкой цепи, приведенной в SEQ ID NO:17, и константной области Igκ человека, представляет собой легкую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:25. Предпочтительно, ДНК, кодирующая тяжелую цепь гуманизированного антитела, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:21, содержит базовую последовательность, приведенную в SEQ ID NO:22. Предпочтительно, ДНК, кодирующая легкую цепь гуманизированного антитела, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:25, содержит базовую последовательность, приведенную в SEQ ID NO:26. В качестве гуманизированного антитела к α9-интегрину по настоящему изобретению, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:21, и легкую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:25, может быть упомянуто описанное ниже в примерах антитело RY9A2v11(M34L)012.
[0035] Предпочтительная тяжелая цепь гуманизированного антитела по настоящему изобретению, которая получена путем присоединения к вариабельной области тяжелой цепи, приведенной в SEQ ID NO:15, и константной области человеческого Igγ1, представляет собой тяжелую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:23. Предпочтительная легкая цепь гуманизированного антитела по настоящему изобретению, которая получена путем присоединения к вариабельной области легкой цепи, приведенной в SEQ ID NO:9, и константной области человеческого Igγ, представляет собой легкую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:27. Предпочтительно, ДНК, кодирующая тяжелую цепь гуманизированного антитела, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:23, содержит базовую последовательность, приведенную в SEQ ID NO:24. Предпочтительно, ДНК, кодирующая легкую цепь гуманизированного антитела, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:27, содержит базовую последовательность, приведенную в SEQ ID NO:28. В качестве гуманизированного антитела к α9-интегрину по настоящему изобретению, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:23, и легкую цепь, состоящую из аминокислотной последовательности, приведенной в SEQ ID NO:27 SEQ, может быть упомянуто описанное ниже в примерах антитело RY9A2v05(IAW)01.
[0036] Полученное таким образом гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению после дальнейшей очистки, если это необходимо, может быть приготовлено в виде фармацевтического препарата согласно обычному способу и использоваться для профилактики аутоиммунных заболеваний, таких как ревматоидный артрит и т.п., заболеваний иммунной системы, таких как аллергия, отторжение трансплантантов и т.п., и заболеваний, в патогенезе которых принимает участие α9-интегрин, таких как остеопороз, хроническое обструктивное заболевание легких, рак и т.п.
[0037] Гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению может использоваться предпочтительно в качестве терапевтического агента для лечения ревматоидного артрита. В качестве примеров дозированных форм для таких терапевтических агентов можно приготовить препарат для парентерального введения, например, в виде инъекций или капельной инфузии, предпочтительным же является внутривенное введение, подкожное введение и т.п. При приготовлении фармацевтического препарата могут использоваться, в пределах фармацевтически приемлемого диапазона, носители и добавки, которые соответствуют этим дозированным формам.
[0038] Количество гуманизированного антитела к человеческому α9-интегрину по настоящему изобретению, добавляемое при приготовлении вышеописанного препарата, изменяется в зависимости от тяжести симптомов пациента и его возраста, дозированной формы используемого препарата или титра связывания антитела и т.п.; например, можно использовать примерно от 0,1 мг/кг до 100 мг/кг.
[0039] Настоящее изобретение также предоставляет полинуклеотид, кодирующий гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению или тяжелую цепь и/или легкую цепь его вариабельных областей, и вектора экспрессии, содержащие то же самое. Вектор экспрессии по настоящему изобретению не имеет каких-либо ограничений при условии, что он может экспрессировать ген, который кодирует гуманизированное антитело по настоящему изобретению или тяжелую цепь или легкую цепь его вариабельных областей в различных клетках-хозяевах, прокариотических клетках и/или эукариотических клетках, и продуцировать эти полипептиды. Например, могут быть упомянуты плазмидные векторы, вирусные векторы (например, аденовирусные, ретровирусные) и т.п.
[0040] Вектор экспрессии по настоящему изобретению может включать ген, который кодирует гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению или тяжелую цепь и/или легкую цепь его вариабельных областей, и функционально соединенный с геном промотором. В качестве промотора для экспрессии гена, который кодирует гуманизированное антитело по настоящему изобретению или тяжелую цепь и/или легкую цепь его вариабельных областей в бактерии, если хозяином является бактерия рода Escherichia, может быть упомянут, например, промотор Trp, промотор lac, промотор recA, промотор λPL, промотор lpp, промотор tac и т.п. В качестве промотора для экспрессии гена, который кодирует гуманизированное антитело или тяжелую цепь и/или легкую цепь его вариабельных областей в дрожжах, могут быть упомянуты, например, промотор PH05, промотор PGK, промотор GAP и промотор ADH; если хозяином является бактерия рода Bacillus, может быть упомянут промотор SL01, промотор SP02, промотор penP и т.п. Если хозяином является эукариотическая клетка, такая как относящаяся к клетке млекопитающего, может быть упомянут промотор β-актина, промотор CAG (Niwa H. et al., Gene, 108, 193-200, 1991), промотор, полученный из SV40, промотор ретровируса, промотор белков теплового шока и т.п.
[0041] Если в качестве клетки-хозяина используются бактерии, в частности, Escherichia coli, вектор экспрессии по настоящему изобретению может также включать кодон инициации, стоп-кодон, область терминации и реплицируемый участок. Если в качестве хозяина используются дрожжи, животная клетка или клетка насекомого, вектор экспрессии по настоящему изобретению может включать кодон инициации и стоп-кодон. В этом случае, энхансерная последовательность, некодирующая области на 5'-конце и 3'-конце гена, который кодирует гуманизированное антитело по настоящему изобретению или тяжелую цепь и/или легкую цепь его вариабельных областей, может находиться в сайте сплайсинга, участке полиаденилирования или реплицируемом участке и т.п. Кроме того, также может быть включен маркер селекции (например, ген резистентности к тетрациклину, ген резистентности к ампициллину, ген резистентности к канамицину, ген резистентности к неомицину, ген дигидрофолатредуктазы), обычно используемый согласно объекту исследования.
[0042] Настоящее изобретение также предоставляет трансформант, вводимый в ген, который кодирует гуманизированное антитело по настоящему изобретению или тяжелую цепь и/или легкую цепь его вариабельных областей. Такой трансформант может быть получен, например, путем трансформации клетки-хозяина вектором экспрессии по настоящему изобретению. Клетка-хозяин, обычно используемая для получения трансформанта, не имеет каких-либо ограничений при условии, что она соответствует вышеупомянутому вектору экспрессии и является трансформируемой; в качестве примера могут быть приведены различные клетки, такие как встречающиеся в природе клетки или искусственно полученные линии клеток, которые обычно используются в области техники настоящего изобретения (например, бактериальные (бактерии рода Escherichia, бактерии рода Bacillus), дрожжевые (рода Saccharomyces, рода Pichia и т.п.), животные клетки или клетки насекомых (например, Sf9) и т.п.). Трансформацию можно выполнять по существу известным способом.
[0043] Настоящее изобретение также предоставляет способ продуцирования гуманизированного антитела к человеческому α9-интегрину по настоящему изобретению, включающий экспрессию гена, кодирующего гуманизированное антитело или тяжелую цепь и/или легкую цепь вариабельной области по настоящему изобретению в клетке-хозяине, а именно, с помощью такого трансформанта. Предпочтительно, клетка-хозяин, используемая для этого способа, содержит вектор экспрессии по настоящему изобретению, где вектор экспрессии может отдельно или одновременно содержать полинуклеотиды, кодирующие тяжелую цепь и легкую цепь вариабельных областей гуманизированного антитела к человеческому α9-интегрину.
[0044] При продуцировании гуманизированного антитела к человеческому α9-интегрину по настоящему изобретению трансформант может быть культивирован в питательной среде. Питательная среда предпочтительно содержит источник углерода и источник неорганического азота или источник органического азота, необходимый для роста трансформанта. В качестве примеров источника углерода могут быть упомянуты глюкоза, декстран, растворимый крахмал, сахароза и т.п.; в качестве примеров источника неорганического азота или источника органического азота могут быть упомянуты соли аммония, нитраты, аминокислоты, жидкий кукурузный экстракт, пептон, казеин, мясной экстракт, соевый жмых, картофельный экстракт и т.п. При желании могут быть включены другие питательные вещества (например, неорганические соли (например, хлорид кальция, дигидрофосфат натрия, хлорид магния), витамины, антибиотики (например, тетрациклин, неомицин, ампициллин, канамицин и т.п.) и т.п.).
[0045] Культивирование трансформанта может выполняться по существу известным способом. Подбирают соответствующие условия культивирования, например, температуру, pH среды и время культивирования. Например, если хозяином является животная клетка, в качестве среды может использоваться среда MEM (Science, Vol. 122, p. 501, 1952), среда DMEM (Virology, Vol. 8, p. 396, 1959), среда RPMI1640 (J. Am. Med. Assoc., Vol. 199, p. 519, 1967), среда 199 (Proc. Soc. Exp. Biol. Med., Vol. 73, p. 1, 1950), содержащая примерно 5-20% эмбриональной бычьей сыворотки, и т.п. pH среды предпочтительно находится в пределах примерно 6-8, культивирование обычно выполняют при температуре, равной примерно 30-40°C, в течение примерно 15-72 часов, и по мере необходимости культуру можно аэрировать или перемешивать. Если хозяином является клетка насекомого, можно использовать, например, среду Грейса (Grace), содержащую эмбриональную бычью сыворотку (Proc. Natl. Acad. Sci. USA, Vol. 82, p. 8404, 1985), и т.п., и pH среды предпочтительно находится в пределах примерно 5-8. Культивирование обычно выполняют при температуре примерно 20-40°C в течение 15-100 часов, и по мере необходимости культуру можно аэрировать или перемешивать. Если хозяином являются бактерии, актиномицеты, дрожжи, или мицелиальные грибы, подходящей является, например, жидкая среда, содержащая вышеописанные источники питательных веществ. Предпочтительной является среда с pH от 5 до 8. Если хозяином является E. coli, то в качестве предпочтительной среды можно привести среду LB, среду M9 (Miller et al., Exp. Mol. Genet, Cold Spring Harbor Laboratory, p. 431, 1972) и т.п. В этом случае, культивирование обычно проводят при температуре 14-43°C в течение примерно 3-24 часов, аэрируя или перемешивая культуру по мере необходимости. Если хозяином является бактерия рода Bacillus, культивирование, как правило, можно проводить при 30-40°C в течение примерно 16-96 часов, аэрируя или перемешивая культуру по мере необходимости. Если хозяином являются дрожжи, в качестве примеров среды можно привести минимальную среду Буркхолдера (Burkholder) (Bostian, Proc. Natl. Acad. Sci. USA, Vol. 77, p. 4505, 1980), при этом желательно, чтобы pH находился в пределах 5-8. Культивирование обычно проводят при температуре, равной примерно 20-35°C, в течение примерно 14-144 часов, при этом по мере необходимости культуру можно аэрировать или перемешивать.
[0046] Гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению может быть выделено, предпочтительно изолировано и очищено, из культивируемого трансформанта, как описано выше. В качестве примеров способа изоляции и очистки можно привести способы, основанные на разнице в растворимости, такие как высаливание и осаждение растворителем; способы, основанные на разнице в молекулярной массе, такие как диализ, ультрафильтрация, гель-фильтрация и электрофорез в полиакриламидном геле с додецилсульфатом натрия; способы, основанные на разнице в электрическом заряде, такие как ионно-обменная хроматография и хроматография на гидроксилапатите; способы, основанные на специфической аффинности, такие как аффинная хроматография; способы, основанные на разнице в гидрофобности, такие как высокоэффективная жидкостная хроматография с обращенной фазой; способы, основанные на разнице в изоэлектрической точке, такие как изоэлектрическое фокусирование; и т.п.
[0047] Ниже настоящее изобретение раскрыто подробно со ссылкой на примеры, которые не следует рассматривать, как ограничивающие изобретение.
ПРИМЕРЫ
[0048] Что касается части, в которых используются коммерчески доступные наборы или реактивы, если не определено иное, эксперименты проводились согласно прилагаемому протоколу.
[0049] Пример 1: Определение последовательности вариабельной области мышиного антитела Y9A2 и получение химерного антитела Y9A2
Определяли гены вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) мышиного антитела Y9A2 и выполняли лигирование гена VH с геном Igγ1 человека и лигировангие гена VL с геном Igκ человека для получения химерного антитела мышь-человек (далее в настоящем документе называемое химерным антителом Y9A2). Использовали нижеследующие процедуры.
[0050] Сначала, используя реактив TRIzol (Invitrogen), извлекали РНК из продуцирующего гибридому мышиного антитела Y9A2, которое было предоставлено Университетом Калифорнии в Сан-Франциско (UCSF). Используя РНК в качестве матрицы, синтезировали кДНК, используя случайный праймер (Random Primer) и обратную транскриптазу SuperScript III (оба фирмы Invitrogen). Затем, используя эту кДНК в качестве матрицы и праймер для лидерной области, а также праймер для J области, разработанные согласно классификации последовательностей области V и J-области по Кабату (Kabat) и др. (Sequences of Proteins of Immunological Interest 4th ed., Public Health Service, NIH, Washington DC, 1987), амплифицировали генный сегмент VH с помощью ДНК-полимеразы Ex Taq (TAKARA BIO INC). Праймеры для вышеупомянутой лидерной области и праймеры для J-области, используемые в данном эксперименте, добавляли с последовательностью узнавания HindIII и последовательностью узнавания BamHI, соответственно. Что касается VL, то генный сегмент VL получали таким же способом, как это описано для VH, используя праймер, соответствующий лидерной последовательности, и праймер, соответствующий J-области.
[0051] Полученные таким образом генные сегменты VH и VL расщепляли с помощью HindIII и BamHI (обе фирмы TAKARA BIO INC), и лигировали с AG-γ1 и AG-κ (WO94/20632), соответственно, которые представляют собой векторы экспрессии. AG-γ1 имеет промотор β актина, ген γ1-цепи константной области человеческого иммуноглобулина и ген резистентности к неомицину (neo) в качестве маркера селекции, и становится плазмидой, экспрессирующей тяжелую цепь химерного антитела Y9A2, при введении гена VH мышиного антитела Y9A2 между последовательностью узнавания HindIII и последовательностью узнавания BamHI, расположенной выше гена γ1. AG-κ имеет промотор β актина, ген κ-цепи константной области человеческого иммуноглобулина и ген дигидрофолатредуктазы (dhfr) в качестве маркера селекции, и также становится плазмидой, экспрессирующей легкую цепь химерного антитела Y9A2, при введении гена VL мышиного антитела Y9A2 между последовательностью узнавания HindIII и последовательностью узнавания BamHI, расположенной выше гена κ.
[0052] Эти плазмиды экспрессии вводили в Escherichia coli согласно обычному способу получения трансформированного клона, из которого получали плазмидную ДНК, используя набор QIAprep Spin Miniprep (QIAGEN). Используя полученную плазмидную ДНК в качестве матрицы и набор GenomeLab DTCS-Quick Start с автоматическим секвенсером CEQ2000 (оба фирмы BECKMAN COULTER), анализировали клонированные базовые последовательности VH и VL. Базовые последовательности VH и VL приведены в SEQ ID NO:2 и SEQ ID NO:4, соответственно. Аминокислотные последовательности VH и VL, которые были определены на основе полученных последовательностей, показаны на Фиг.1 и Фиг.2, соответственно. Кроме того, они приведены в SEQ ID NO:1 и SEQ ID NO:3, соответственно.
[0053] Вышеупомянутый клон Escherichia coli культивировали в больших количествах и очищали плазмиду экспрессии тяжелой цепи и плазмиду экспрессии легкой цепи химерного антитела Y9A2, используя набор EndoFree Plasmid Maxi (QIAGEN). Их смешали и вводили в клетку, используя систему экспрессии FreeStyle 293 (Invitrogen), таким образом временно экспрессируя химерное антитело Y9A2. Концентрацию химерного антитела Y9A2, содержащегося в полученном супернатанте культуры, измеряли с помощью сэндвич-ELISA, используя козье антитело против Fc человеческого IgG (CAPPEL) и белок A-HRP (ZYMED). В этом случае, готовили серию разбавлений коммерчески доступного антитела человеческого IgG1 (Биогенетика) и использовали их в качестве стандартного образца. Затем, выполняли аффинную очистку химерного антитела Y9A2 из вышеупомянутого супернатанта культуры, используя колонку с протеином А (GE Healthcare), для получения очищенного химерного антитела Y9A2. Вычисляли концентрацию очищенного химерного антитела Y9A2, где концентрация составляла 1 мг/мл, когда абсорбция при длине волны 280 нм составляла 1,4.
[0054] Пример 2: тест на ингибирование клеточной адгезии химерного антитела Y9A2
Для сравнения активности очищенного химерного антитела Y9A2, которое было получено способом, описанным в вышеприведенном разделе, с активностью мышиного антитела Y9A2 (CHEMICON INTERNATIONAL), выполняли тест на ингибирование клеточной адгезии, описанный в J. Biol. Chem., 274: 36328-36334, 1999. Более точно, вариант (nOPN-RAA), в котором последовательность RGD, содержащаяся в N-терминальном фрагменте (nOPN), полученном в результате расщепления остеопонтина тромбином, заменена на RAA, иммобилизовали и блокировали, и добавляли мышиное антитело Y9A2 или очищенное химерное антитело Y9A2. Затем, добавляли клетки SW480, экспрессирующие молекулы человеческого α9-интегрина (далее в настоящем документе называемая клеткой SW480/hα9), и смесь инкубировали при 37°C в течение 1 часа. После этого клетки фиксировали и окрашивали кристаллическим фиолетовым и метанолом и промывали. Краску в прикрепленных клетках экстрагировали Тритоном X-100, и измеряли абсорбцию при длине волны 595 нм.
[0055] В результате, как показано в таблице 1, было найдено, что IC50 мышиного антитела Y9A2 и очищенного химерного антитела Y9A2 было практически одинаковым, и что эти антитела обладают активностью ингибирования адгезии клеток SW480/hα9 к nOPN-RAA. IC50 определяли при концентрации антитела к α9-интегрину, необходимой для ингибирования клеточной адгезии до 50% уровня, которая происходит без добавления антитела к α9-интегрину.
[0056]
Результаты теста на ингибирование клеточной адгезии мышиного антитела Y9A2 и химерного антитела Y9A2
[0057] Пример 3: Продуцирование гена гуманизированного антитела Y9A2
Темплатное человеческое антитело, предназначенное для введения аминокислот гипервариабельной области (CDR) VH и VL мышиного антитела Y9A2, выбирали из зародышевых линий человеческого антитела, имеющих аминокислотные последовательности, высоко гомологичные аминокислотной последовательности каркасного участка (FR) VH и VL мышиного антитела Y9A2. Более точно, выбранная темплатная VH человека представляла собой комбинацию DP-88 и JH6, а выбранная темплатныая VL человека представляла собой комбинацию DPK-1 и Jκ4.
[0058] В FR вышеуказанных темплатных VH и VL человеческого антитела вводили необходимые аминокислотные последовательности из VH и VL мышиного антитела Y9A2 для получения гуманизированного антитела. Более точно, что касается VH, аминокислотную последовательность CDR и несколько сайтов из аминокислотной последовательности FR вышеупомянутой темплатной VH человеческого антитела сначала заменяли соответствующими аминокислотными последовательностями VH мышиного антитела Y9A2. Создавали аминокислотные последовательности VH области двух видов гуманизированных антител Y9A2, т.е. RY9A2VHv5 и RY9A2VHv8 (SEQ ID NO:5 и SEQ ID NO:7, соответственно), а затем создавали базовые последовательности ДНК, кодирующие эти аминокислотные последовательности (SEQ ID NO:6 и SEQ ID NO:8, соответственно). В RY9A2VHv8 четыре из аминокислотных остатков FR, полученных из мышиного антитела Y9A2 в RY9A2VHv5, заменяли аминокислотными остатками темплатного человеческого антитела.
[0059] Что касается VL, аминокислотные последовательности CDR VL области вышеупомянутого темплатного человеческого антитела заменяли аминокислотной последовательностью CDR VL области мышиного антитела Y9A2, создавали аминокислотную последовательность RY9A2VLv01, которая представляет собой VL гуманизированного антитела Y9A2 (SEQ ID NO:9), и затем создавали базовую последовательность ДНК, кодирующую эту аминокислотную последовательность (SEQ ID NO:10).
[0060] Для продуцирования фрагментов ДНК, кодирующих вышеупомянутые RY9A2VHv5, RY9A2VHv8 и RY9A2VLv01, выполняли полный синтез с помощью ПЦР, используя в качестве материала олиго-ДНК. Более точно, синтезировали RY9A2VHv5 путем деления его на 6 видов олиго-ДНК (описанных в SEQ ID NO:29-34) с тем, чтобы покрыть полную длину VH, как это показано соответствующим образом на Фиг.3, и выполняли ПЦР, используя их согласно описанной ниже процедуре. То есть смешивали эквивалентные количества 6-ти видов олиго-ДНК. Используя смесь в качестве матрицы и ДНК-полимеразу Pyrobest (TAKARA BIO), выполняли 15 циклов: 96°C в течение 30 секунд, 50°C в течение 30 секунд и 72°C в течение 3 минут. Затем, используя продукт ПЦР (1 мкл) в качестве матрицы, олиго-ДНК, имеющую указанную на Фиг.3 последовательность (приведенную в SEQ ID NO:35 и 36) в качестве праймера и ДНК-полимеразу Pyrobest, выполняли следующие 25 циклов: 96°C в течение 20 секунд и 72°C в течение 2 минуты, для амплификации VH полной длины. Таким же образом продуцировали RY9A2VHv8.
[0061] Для продуцирования RY9A2VLv01 выполняли 15 циклов ПЦР таким же образом, как описано выше для шести олиго-ДНК (приведенных в SEQ ID NO:37-42), показанных на Фиг.4, и выполняли 25 циклов ПЦР таким же образом, как описано выше, используя продукт амплификации в качестве матрицы и олиго-ДНК, имеющую последовательность, отмеченную на Фиг.4 жирным шрифтом (приведенную в SEQ ID NO:43 и 44), в качестве праймера, амплифицируя таким образом VL полной длины.
[0062] В обоих вышеуказанных VH и VL в качестве лидерной последовательности антитела использовали последовательность одного и того же гуманизированного моноклонального антитела к остеопонтину, описанному в WO2007/139164. Кроме того, для клонирования добавляли оба конца полученного фрагмента ДНК с последовательностью узнавания HindIII и последовательностью узнавания BamHI.
[0063] Полученные таким образом фрагменты ДНК для VH и VL расщепляли рестрикционными ферментами HindIII и BamHI, лигировали с вышеупомянутыми векторами экспрессии AG-γ1 и AG-κ, соответственно, и вводили в Escherichia coli согласно обычному способу клонирования. Плазмидную ДНК получали из полученного клона Escherichia coli, используя набор QIAprep Spin Miniprep (QIAGEN). Используя полученную плазмидную ДНК в качестве матрицы, анализировали базовые последовательности клонированных VH и VL, используя набор GenomeLab DTCS-Quick Start и автоматический секвенсер CEQ2000 (оба фирмы BECKMAN COULTER), получая таким образом клоны, имеющие разработанные базовые последовательности. Эти клоны культивировали, и очищали плазмиды экспрессии тяжелой цепи и легкой цепи, используя набор EndoFree Plasmid Maxi (QIAGEN).
[0064] Очищенную плазмиду экспрессии тяжелой цепи и очищенную плазмиду экспрессии легкой цепи смешивали и смесь вводили в клетку для временной экспрессии антитела, используя систему экспрессии FreeStyle 293. В этом случае гуманизированное антитело Y9A2, экспрессированное путем комбинации плазмиды экспрессии тяжелой цепи, вставленной с RY9A2VHv5, и плазмидой экспрессии легкой цепи, вставленной с RY9A2VLv01, назвали антителом RY9A2v501, а гуманизированное антитело Y9A2, экспрессированное путем комбинации плазмиды экспрессии тяжелой цепи, вставленной с RY9A2VHv8, и плазмиды экспрессии легкой цепи, вставленной с RY9A2VLv01, назвали антителом RY9A2v801.
[0065] Измерение концентрации каждого гуманизированного антитела Y9A2, накопленной в супернатанте культуры, и получение очищенного антитела из супернатанта культуры выполняли таким же способом, как и в случае вышеупомянутого химерного антитела Y9A2.
[0066] Пример 4: Подтверждение активности связывания гуманизированного антитела Y9A2 с человеческим α9-интегрином
Антитело RY9A2v501 и антитело RY9A2v801, экспрессированные вышеупомянутым способом, сравнивали с химерным антителом Y9A2 (далее в настоящем документе называемом антителом cY9A2) в отношении их активности связывания с молекулой человеческого α9-интегрина согласно способу клеточного ELISA. Более точно, выполняли иммобилизацию клеток SW480, экспрессирующих молекулы человеческого α9-интегрина, на планшете ELISA, проводили реакцию с вышеупомянутым антителом cY9A2 или антителом RY9A2v501, или антителом RY9A2v801 и проводили реакцию с HRP-меченным козьим антителом к человеческому IgG (Fc) (American Qualex) в качестве вторичного антитела. Добавляли TMB для получения окраски, для подавления реакции добавляли растворенную серную кислоту и измеряли абсорбцию при длине волны 450 нм. В результате, как показано на Фиг.5 и Фиг.6, было подтверждено, что антитело RY9A2v501 и антитело RY9A2v801 обладают активностью связывания с молекулой человеческого α9-интегрина, которая эквивалентна активности связывания антитела cY9A2.
[0067] Пример 5: тест на ингибирование клеточной адгезии гуманизированного антитела Y9A2
Вышеупомянутые очищенное антитело RY9A2v501, очищенное антитело RY9A2v801 и мышиное антитело Y9A2 подвергали тесту на ингибирование клеточной адгезии, как описано в Примере 2.
[0068] Результаты показаны в таблице 2. IC50 (мкг/мл) определяли для концентрации антитела к α9-интегрину, необходимой для подавления клеточной адгезии до 50% уровня, которая происходит без добавления антитела к α9-интегрину. Среднее значение IC50 мышиного антитела Y9A2 составляло 0,070 мкг/мл. В таблице 2 показана специфическая активность гуманизированного антитела для случая, когда значение IC50 мышиного Y9A2 равно 1. В таблице 2 показано среднее значение для двух прогонов теста. Как показано в таблице 2, было подтверждено, что вышеуказанные два вида гуманизированных антител обладают активностью ингибирования клеточной адгезии, эквивалентной активности мышиного антитела Y9A2.
Результаты тестов на ингибирование клеточной адгезии для мышиного антитела Y9A2, антитела RY9A2v501 и антитела RY9A2v801
[0070] Пример 6: Продуцирование улучшенного гуманизированного антитела Y9A2
Как упоминалось выше, поскольку можно получить два вида гуманизированных антител Y9A2 (антитела RY9A2v501 и антитела RY9A2v801), обладающих такой же активностью ингибрования клеточной адгезии, что и активность исходного мышиного антитела Y9A2, авторы настоящего изобретения попытались дополнительно улучшить гуманизированное антитело Y9A2 путем введения мутации в эти гуманизированные антитела.
[0071] В результате изобретательской деятельности и серии рассуждений, авторы настоящего изобретения успешно получили гуманизированное антитело Y9A2, обладающее активностью, которая значительно превосходила активность мышиного антитела Y9A2; были получены следующие три вида антител: антитело RY9A2v12(M34L)012, антитело RY9A2v11(M34L)012 и антитело RY9A2v5(IAW)01.
[0072] 1. Антитело RY9A2v12(M34L)012
Вариабельная область тяжелой цепи (VH) антитела RY9A2v12(M34L)012 имеет аминокислотную последовательность, показанную в SEQ ID NO:11, а вариабельная область легкой цепи (VL) имеет аминокислотную последовательность, показанную в SEQ ID NO:17. Базовые последовательности VH и VL антитела RY9A2v12(M34L)012 приведены в SEQ ID NO:12 и 18, соответственно. VH антитела RY9A2v12(M34L)012 представляет собой вышеупомянутую RY9A2VHv8 (SEQ ID NO:7), в которой метиониновый остаток (34-й аминокислотный остаток аминокислотной последовательности VH) в CDR1 замещен лейцином, а также лизиновый остаток и остаток аспарагиновой кислоты (65-й и 66-й аминокислотные остатки аминокислотной последовательности VH) в CDR2 замещены глутамином и глицином, соответственно. VL антитела RY9A2v12(M34L)012 представляет собой вышеупомянутую RY9A2VLv01 (SEQ ID NO:9), в которой лизиновый остаток (24-й аминокислотный остаток аминокислотной последовательности VL) в CDR1 замещен аргинином.
[0073] 2. Антитело RY9A2v11(M34L)012
VH антитела RY9A2v11(M34L)012 имеет аминокислотную последовательность, показанную в SEQ ID NO:13, а VL имеет аминокислотную последовательность, показанную в SEQ ID NO:17. Базовые последовательности VH и VL антитела RY9A2v11(M34L)012 приведены в SEQ ID NO:14 и 18, соответственно. VH антитела RY9A2v11(M34L)012 представляет собой вышеупомянутую RY9A2VHv5 (SEQ ID NO:5), в которой метиониновый остаток (34-й аминокислотный остаток аминокислотной последовательности VH) в CDR1 замещен лейцином, а также лизиновый остаток и остаток аспарагиновой кислоты (65-й и 66-й аминокислотные остатки аминокислотной последовательности VH) в CDR2 замещены глутамином и глицином, соответственно. VL антитела RY9A2v11(M34L)012 представляет собой вышеупомянутую RY9A2VLv01 (SEQ ID NO: 9), в которой лизиновый остаток (24-й аминокислотный остаток аминокислотной последовательности VL) в CDR1 замещен аргинином.
[0074] 3. Антитело RY9A2v5(IAW)01
VH антитела RY9A2v5(IAW)01 имеет аминокислотную последовательность, показанную в SEQ ID NO:15, а VL имеет аминокислотную последовательность, показанную в SEQ ID NO:9. Базовые последовательности VH и VL для RY9A2v5(IAW)01 приведены в SEQ ID NO:16 и 10, соответственно. VH антитела RY9A2v5(IAW)01 представляет собой вышеупомянутую RY9A2VHv5 (SEQ ID NO:5), в которой метиониновый остаток (34-й аминокислотный остаток аминокислотной последовательности VH) в CDR1 замещен изолейцином, а также остаток аспарагиновой кислоты и фенилаланиновый остаток (104-й и 105-й аминокислотные остатки аминокислотной последовательности VH) в CDR3 замещены аланином и триптофаном, соответственно. VL антитела RY9A2v5(IAW)01 представляет собой такую же аминокислотную последовательность, как упоминалось выше для RY9A2VLv01 (SEQ ID NO:9).
[0075] Фрагменты ДНК VH и VL вышеупомянутых 3 видов улучшенных гуманизированных антител Y9A2 лигировали с векторами экспрессии AG-γ1 и AG-κ для экспрессии плазмиды таким же способом, как описано выше. Плазмиду экспрессировали, используя систему экспрессии FreeStyle 293, и из супернатанта культуры получали различные очищенные антитела, используя колонку с протеином А, как описано выше.
[0076] Пример 7: Подтверждение активности связывания улучшенного гуманизированного антитела Y9A2 с человеческим α9-интегрином
Для трех видов гуманизированных антител Y9A2 и антитела cY9A2, продуцированных как описано выше, подтверждали активность связывания с человеческим α9-интегрином с помощью клеточного ELISA так же, как описано в Примере 4. В результате для всех улучшенных гуманизированных антител Y9A2 можно было подтвердить тот факт, что они имеют активность связывания с человеческим α9-интегрином, аналогичную химерному антителу Y9A2.
[0077] Пример 8: тест на ингибирование клеточной адгезии улучшенного гуманизированного антитела Y9A2 к человеческому nOPN
Для сравнения активности 3 видов улучшенных гуманизированных антител Y9A2 с активностями мышиного антитела Y9A2 выполняли тест на ингибирование клеточной адгезии таким же способом, как описано в Примере 2.
[0078] Результаты показаны в таблице 3. IC50 (мкг/мл) определяли для концентрации антитела к α9-интегрину, которая необходима для ингибирования клеточной адгезии до 50% уровня, которое происходит без добавления антитела к α9-интегрину. Средние значения IC50 мышиного антитела Y9A2 были равны 0,039 мкг/мл. В таблице 3 показана специфическая активность гуманизированного антитела Y9A2 для случая, когда значение IC50 для мышиного Y9A2 равно 1. Средние значения для 2 или 3 прогонов теста показаны в таблице 3. Было обнаружено, что 3 вида улучшенного гуманизированного антитела Y9A2 обладают не менее чем в 4 раза улучшенной активностью ингибирования клеточной адгезии по сравнению с активностью мышиного антитела Y9A2.
[0079]
Результаты теста на ингибирование клеточной адгезии улучшенного гуманизированного антитела Y9A2
[0080] Пример 9: Тест на ингибирование клеточной адгезии улучшенного гуманизированного антитела Y9A2 к человеческому VCAM-1 и человеческому тенасцину C
Исследовали три вида улучшенного гуманизированного антитела Y9A2, используя лиганд, отличающийся от nOPN-RAA, использованного в вышеприведенном тесте на ингибирование клеточной адгезии. Более точно, аналогичным способом исследовали ингибирующее воздействие на клеточную адгезию к человеческому VCAM-1/Ig (R&D) и варианту человеческого тенасцина C-RAA, в котором последовательность RGD человеческого тенасцина C замещена RAA.
[0081] Средние значения двух прогонов теста показаны в таблице 4. Средние значения IC50 активности ингибирования клеточной адгезии мышиного антитела Y9A2 к человеческому VCAM-1 и человеческому тенасцину C-RAA составляли 0,077 мкг/мл и 0,041 мкг/мл, соответственно. В таблице 4 показана специфическая активность гуманизированного антитела Y9A2 для случая, когда значение IC50 мышиного антитела Y9A2 равно 1. Было найдено, что 3 вида улучшенного гуманизированного антитела Y9A2 показывают активность ингибирования, по меньшей мере эквивалентную активности мышиного антитела Y9A2, хотя активность может меняться в зависимости от используемого лиганда.
[0082]
Результаты теста на ингибирование клеточной адгезии улучшенного гуманизированного антитела Y9A2 к VCAM-1 и тенасцину C
[0083] Пример 10: тест на ингибирование клеточной адгезии улучшенного гуманизированного антитела Y9A2
Исследовали три вида улучшенного гуманизированного антитела Y9A2 относительно их ингибирующего воздействия на миграционную активность клеток SW480/hα9 против nOPN-RAA. Эксперимент был основан на тесте ингибирования клеточной миграции, описанном в Molecular Biology of the cell, 12: 3214-3225, 2001, в который было внесено несколько небольших изменений. Более точно, выполняли иммобилизацию nOPN-RAA в верхнем слое системы Transwell (Millipore), устанавливали на планшете, и затем в нижний слой добавляли среду F15, содержащую 10% FCS. Мышиное антитело Y9A2 или гуманизированное антитело Y9A2 добавляли вместе с клетками SW480/hα9 в верхний слой, и смесь инкубировали при 37°C в течение 16 часов. Затем клетки, которые мигрировали в нижний слой системы Transwell, определяли количественно, используя набор для анализа миграции клеток с использованием 24-луночного планшета (Cell Migration 24-well Assay) QCM Chemotaxis (Millipore). Миграционную активность, ингибированную добавлением избыточного количества (100 мкг/мл) мышиного антитела Y9A2, определяли как α9-зависимую миграционную активность (100% ингибирование), а процент ингибирования каждого антитела показан в таблице 5.
[0084] Значимое ингибирующее воздействие на миграцию было обнаружено только при добавлении 50 мкг/мл мышиного антитела Y9A2; однако улучшенное гуманизированное антитело Y9A2, полученное авторами настоящего изобретения, показывало значимое ингибирующее воздействие при концентрации 5 мкг/мл, которая представляет собой 1/10 воздействия, оказываемого мышиным антителом Y9A2. Был выполнен тест на значимое различие, t-тест Студента, относительно антител и в отсутствии антител. *: P<0,05, **: P<0,01.
[0085]
Результаты теста на ингибирование клеточной миграции улучшенного гуманизированного антитела Y9A2
20
50
24
99*
[0086] Значимое ингибирующее воздействие на клеточную миграцию непосредственно связано с клинически эффективной концентрацией, где клинически эффективная концентрация, соответствующая 1/10, приводит к более длительным интервалам между введениями (например, одно введение в две недели становится одним введением в несколько месяцев и т.д.) в клинической практике, и концентрация в крови, поддерживаемая на уровне примерно в 5 мкг/мл, дает возможность для разработки подкожно вводимого препарата. Поскольку в настоящее время во всем мире разрешено самостоятельное введение подкожно вводимых препаратов, то для случая хронического заболевания это дает значительные преимущества как пациентам, так и работникам медицинских учреждений. Следовательно, улучшение биологической активности согласно настоящему изобретению в значительной степени способствует не только терапевтической эффективности антитела, но также и улучшению его переносимости пациентами.
[0087] Пример 11: тест на теплостойкость улучшенного гуманизированного антитела Y9A2
Три вида улучшенного гуманизированного антитела Y9A2 и мышиное антитело Y9A2 инкубировали при 70°C в течение 2 часов или 10 часов, и оценивали их теплостойкость, используя тест на ингибирование клеточной адгезии, описанный в Примере 8.
[0088] Средние значения 4-х экспериментов приведены в таблице 6. Показан процент остаточной активности каждого антитела после термообработки, где за 100% ингибирующей активности клеточной адгезии принята активность без термообработки. Хотя мышиное антитело Y9A2 показало уменьшение активности через 2 часа, 3 вида улучшенного гуманизированного антитела Y9A2 сохраняли 85% или более активность даже после инкубации в течение 10 часов. Следовательно, свойство улучшенного гуманизированного антитела Y9A2 сохранять достаточно высокую стабильность при высоких температурах дает возможность для разработки удобного препарата, который может храниться при комнатной температуре, наряду с препаратами, находящимися на стадии клинической разработки.
[0089]
Результаты теста на теплостойкость улучшенного гуманизированного антитела Y9A2
Промышленная применимость
[0090] Улучшенное гуманизированное антитело к человеческому α9-интегрину по настоящему изобретению обладает улучшенной активностью и/или свойствами по сравнению с мышиным антителом-донором к человеческому α9-интегрину и сильным противовоспалительным действием и сильным действием подавления костной деструкции благодаря блокированию взаимодействия между человеческим α9-интегрином и его многочисленными лигандами и может применяться для профилактики или лечения различных заболеваний, в патогенезе которых участвует человеческий α9-интегрин.
Настоящая заявка основана на заявках на патент № 2008-004975, поданной в Японии (дата подачи: 11 января 2008) и № 2008-282496 (даты подачи: 31 октября 2008), содержание которых полностью включено в настоящий документ.
























Настоящее изобретение относится к области иммунологии. Предложено гуманизированное антитело к человеческому интегрину альфа-9 (α9), полученное из антитела Y9A2 мыши и обладающее улучшенной активностью и термостабильностью. Также рассмотрен полинуклеотид, вектор экспрессии, клетка-хозяин и способ продуцирования гуманизированного антитела по изобретению с их использованием, а также терапевтическое лекарственное средство от ревматоидного артрита, способ профилактики или лечения ревматоидного артрита и применения гуманизированного антитела по изобретению при изготовлении фармацевтического препарата для профилактики или лечения ревматоидного артрита. Данное изобретение может найти дальнейшее применение в терапии ассоциированных с интегрином α9 заболеваний человека. 8 н. и 6 з.п. ф-лы, 6 ил., 6 табл., 11 пр.
1. Гуманизированное антитело к человеческому α9-интегрину, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранные из следующего:
(a) вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:11, и вариабельной области легкой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:17,
(b) вариабельной области тяжелей цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:13, и вариабельной области легкой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:17, и
(c) вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:15, и вариабельной области легкой цепи, состоящей из аминокислотной последовательности, приведенной в SEQ ID NO:9.
2. Гуманизированное антитело к человеческому α9-интегрину по п.1, в котором константная область тяжелой цепи антитела представляет собой Igγ1 человека.
3. Гуманизированное антитело к человеческому α9-интегрину по п.1, в котором константная область легкой цепи антитела представляет собой Igκ человека.
4. Гуманизированное антитело к человеческому α9-интегрину по п.1, в котором константная область тяжелой цепи антитела представляет собой Igγ1 человека, а константная область легкой цепи антитела представляет собой Igκ человека.
5. Гуманизированное антитело к человеческому α9-интегрину по п.1, в котором тяжелая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:19, а легкая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:25.
6. Гуманизированное антитело к человеческому α9-интегрину по п.1, в котором тяжелая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:21, а легкая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:25.
7. Гуманизированное антитело к человеческому α9-интегрину по п.1, в котором тяжелая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:23, а легкая цепь состоит из аминокислотной последовательности, приведенной в SEQ ID NO:27.
8. Полинуклеотид, содержащий последовательность, кодирующую тяжелую цепь гуманизированного антитела к человеческому α9-интегрину по п.1, и последовательность, кодирующую легкую цепь гуманизированного антитела к человеческому α9-интегрину по п.1.
9. Вектор экспрессии, содержащий последовательность, кодирующую тяжелую цепь гуманизированного антитела к человеческому α9-интегрину по п.1, и последовательность, кодирующую легкую цепь гуманизированного антитела к человеческому α9-интегрину по п.1.
10. Клетка-хозяин, способная экспрессировать гуманизированное антитело к человеческому α9-интегрину, включающая вектор экспрессии по п.9.
11. Способ продуцирования гуманизированного антитела к человеческому α9-интегрину, включающий стадию культивирования клетки-хозяина по п.10 для получения возможности экспрессировать гуманизированное антитело к человеческому α9-интегрину.
12. Терапевтическое лекарственное средство от ревматоидного артрита, содержащее терапевтически эффективное количество гуманизированного антитела к человеческому α9-интегрину по любому из пп.1-7.
13. Способ профилактики или лечения ревматоидного артрита, включающий стадию введения терапевтически эффективного количества гуманизированного антитела к человеческому α9-интегрину по любому из пп.1-7.
14. Применение гуманизированного антитела к человеческому α9-интегрину по любому из пп.1-7 при изготовлении фармацевтического препарата для профилактики или лечения ревматоидного артрита.
| WANG A | |||
| et al | |||
| "Differential regulation of airway epithelial integrins by growth factors." Am | |||
| J | |||
| Respir | |||
| Cell Mol | |||
| Biol | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| НАПРАВЛЕННЫЙ ОТВЕТВИТЕЛЬ | 1979 |
|
SU1840135A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| YOKOSAKI Y et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
Авторы
Даты
2014-01-10—Публикация
2009-01-09—Подача