ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к анти-CD28-антителам, дефектным по митогенной активности, и их применениям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Иммунные реакции, в частности отторжение органных трансплантантов, главным образом, приписывается активации Т-лимфоцитов. Данная активация Т-клеток индуцируется сигналом от антигенпрезентирующих клеток (АРС). Сигнал от АРС включает первый сигнал, опосредуемый Т-клеточным рецептором (TCR), и второй сигнал (костимуляторный сигнал), опосредуемый костимуляторными молекулами. Первый сигнал происходит от главного комплекса гистосовместимости (МНС), где АРС представляет антиген Т-клеток через TCR. Второй сигнал опосредуется несколькими костимулирующими молекулами, примеры которых включают В7 (В7-1 (CD80) и В7-2 (CD86)), известные в качестве лигандов на АРС и CD28, CTLA-4 и т.п. в качестве рецепторов на Т-клетках. Лиганд В7 представляет гликопротеин, относящийся к надсемейству иммуноглобулинов и экспрессирующийся в В-клетках и т.д., которые относятся к группе антигенпрезентирующих клеток. Как CD28, так и CTLA-4, которые распознают В7 как общий лиганд, являются трансмембранными гликопротеинами, относящимися к надсемейству иммуноглобулинов. Таким образом, активация Т-клеток регулируется одновременной передачей первого сигнала через TCR и второго сигнала, например, от В7 и CD28/CTLA-4. Известно, что сигнал от В7 на CD28 стимулирует, в то время как сигнал от В7 на CTLA-4 ингибирует активацию Т-клеток [Waterhouse et al., Science, 270:985-988 (1995)].
До настоящего времени для индукции иммуносупрессии или толерантности предпринимались попытки блокировать сигнал B7-CD28 введением CTLA-4Ig, анти-B7-1-антител/анти-В7-2-антител, анти-CD28-антител или тому подобного. Например, CTLA-4Ig связывается с B7, нарушая тем самым взаимодействие между В7 и CD28, и, как следствие, блокирует сигнал от CD28 с проявлением иммуносупрессорной активности. Однако, поскольку одновременно также ингибируется взаимодействие между В7 и CTLA-4, сигнал от CTLA-4, отрицательно воздействующий на активацию Т-клеток, также подавляется таким образом, что в итоге желаемая толерантность не достигается [Kirk et al., Proc. Natl. Acad. Sci. USA, 94:8789-8794 (1997)]. Также были получены анти-В7-антитела, и сообщалось, что они подавляют активацию Т-клеток, но, как и в случае с CTLA-4Ig, они также подавляют CTLA-4-сигнал. В опыте in vitro было установлено, что анти-CD28-антитела оказывают митогенное действие в отношении Т-клеток, а сочетание стимуляции под воздействием данных антител и анти-CD3-антител способствует росту и активации Т-клеток и усиливает продукцию цитокинов [WO 90/05541, Eur. J. Immunology, 16, 1289-1296 (1986), и т.д.] Кроме того, митогенная стимуляция СD28-рецептора Т-клеток под действием анти-CD28-антител, стимулированная in vivo, приводила к генерации Т-активирующего сигнала, аналогичного второму сигналу от В7 на CD28 [Yin et al., J. Immunology, 163:4328-4334 (1999)]. Данные Т-активирующие функции позволяют предположить, что анти-СD28-антитела можно использовать в качестве иммунопотенциатора при лечении злокачественных опухолей и СПИДа (WO 90/05541).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Анти-СD28-антитела, полученные обычными способами, проявляют митогенное действие в отношении Т-клеток. Несмотря на то, что данная митогенная активность не полностью понятна, полагают, что возможной причиной является связывание Fc-области анти-CD28-антитела с Fc-рецептором антигенпрезентирующей клетки [Cole et al., J. Immunology, 36:159 (1997)]. Следовательно, используя генно-инженерную технологию, авторы ввели мутации в связывающий сайт Fc-рецептора анти-CD28-антител для модификации антител с тем, чтобы они не обладали митогенной активностью. Авторы настоящего изобретения получили одни такие антитела, TN228 IgG2M3, в которых IgG2M3 имеет две замены аминокислот в гене IgG. Кроме того, авторы показали, что полученные молчащие анти-CD28-антитела не обладают митогенной активностью, что чрезвычайно применимо для индукции Т-клеточной толерантности.
Следовательно, настоящее изобретение относится к анти-CD28-антителам, не обладающим митогенной активностью (в последующем относится к молчащим анти-CD28-антителам), и способам подавления иммунных реакций, особенно отторжения трансплантантов, и индукции иммунотолерантности с использованием указанных антител.
Объектом настоящего изобретения являются молчащие анти-СD28-антитела, где анти-CD28-антитела могут быть химерными антителами и/или гуманизированными антителами. Вариабельные области анти-CD28-антител могут включать аминокислотные последовательности, представленные SEQ ID NO: 2, 4, 7 и 9, и полинуклеотиды, кодирующие такие аминокислотные последовательности. Например, такие полинуклеотиды включают SEQ ID NO: 1, 3, 6 и 8.
Другим объектом настоящего изобретения являются векторы и клетки-хозяева, включающие полинуклеотиды, которые кодируют анти-CD28-антитела.
Другим объектом настоящего изобретения являются способы получения молчащих анти-CD28-антител культивированием клетки-хозяина, включающей полинуклеотиды, которые кодируют анти-CD28-антитела в условиях, обеспечивающих экспрессию полинуклеотида, и выделением продуцируемых продуктов гена.
Другим объектом настоящего изобретения является фармацевтическая композиция, включающая одно или несколько молчащих анти-CD28-антител, предпочтительно, смешанных с одним или несколькими фармацевтически приемлемыми ингредиентами.
Молчащие анти-CD28-антитела применимы для индукции Т-клеточной толерантности, иммуносупрессии и в качестве профилактического/терапевтического препарата против отторжения трансплантанта органа или ткани. Следовательно, настоящее изобретение относится к способам индукции Т-клеточной толерантности, иммуносупрессии и профилактической или лечебной терапии при отторжении трансплантанта органа или ткани введением одного или нескольких молчащих анти-CD28-антител млекопитающему. Предпочтительно, такие молчащие анти-CD28-антитела вводят в виде фармацевтической композиции, описанной здесь, и она может включать дополнительные подходящие лекарственные препараты/фармацевтические средства.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1. Плазмидные конструкции для экспрессии антител ChTN228.
Гены VL и VH мышиных антител TN228 конструировали в виде миниэкзонов, фланкированных сайтами XbaI. Последовательность гена VL включали в экспрессирующий вектор pVk, а последовательность гена VH включали в экспрессирующий вектор pVg2M3.
Фиг.2. Нуклеотидные последовательности и выведенные аминокислотные последовательности легкой цепи ChTN228 в миниэкзонах. Сигнальные пептидные последовательности выделены курсивом. CDR подчеркнуты. Зрелая легкая цепь начинается с остатка аспарагиновой кислоты (жирный шрифт). Нетранслируемые и интронные последовательности приведены в нижнем регистре. (SEQ ID NO: 1 и 2).
Фиг.3. Нуклеотидные последовательности и выведенные аминокислотные последовательности вариабельных областей тяжелой цепи ChTN228 в миниэкзонах. Сигнальные пептидные последовательности выделены курсивом. CDR подчеркнуты. Зрелая тяжелая цепь начинается с остатка глутамина (жирный шрифт). Нетранслируемые и интронные последовательности приведены в нижнем регистре (SEQ ID NO: 3 и 4).
Фиг.4. Конкурентный анализ. Клетки P815/CD28- инкубировали с 25 Нг MuTN228-FITC и двукратными серийными разведениями ChTN228 или MuTN228, как описано. Клетки P815/CD28+ также инкубировали с одним MuTN228-FITC, без какого-либо конкурента. Строили график зависимости среднего значения флуоресценции от концентрации конкурента.
Фиг.5. Ингибирующее действие TN228-IgG2m3 на первичную MLR(1) человека. Отдельно представлено ингибирование в процентах первичной MLR для четырех индивидуумов.
Фиг.6. Ингибирующее действие TN228-IgG2m3 на первичную MLR(2) человека. Отдельно представлено ингибирование в процентах первичной MLR для четырех индивидуумов.
Фиг.7. Действие TN228-IgG2m3 на вторичную MLR.
Данные по двум добровольцам представлены отдельно.
Поглощение [3H]-тимидина при вторичной MLR выражено в виде процента от числа распадов в минуту при стимуляции только Raji в первичной MLR, принятого за 100. TN228-IgG2m3: 0,1 мкг/мл.
Фиг.8. Плазмидные конструкции для экспрессии антител HuTN228. VL и VH гуманизированных TN228 конструировали в виде миниэкзонов, фланкированных сайтами XbaI. Последовательность гена VL включали в экспрессирующий вектор pVk, а последовательность гена VH включали в экспрессирующий вектор pVg2M3.
Фиг.9. Нуклеотидные последовательности и выведенные аминокислотные последовательности вариабельных областей тяжелой цепи HuTN228 в миниэкзонах. Сигнальные пептидные последовательности выделены курсивом. CDR подчеркнуты. Зрелая тяжелая цепь начинается с остатка глутамина (жирный шрифт) (SEQ ID NO: 6 и 7).
Фиг.10. Нуклеотидные последовательности и выведенные аминокислотные последовательности вариабельных областей легкой цепи HuTN228 в миниэкзонах. Сигнальные пептидные последовательности выделены курсивом. CDR подчеркнуты. Зрелая легкая цепь начинается с остатка аспарагиновой кислоты (жирный шрифт) (SEQ ID NO: 8 и 9).
Фиг.11. Конкурентный анализ с использованием FACS. В конкурентном анализе с проточной цитометрией определяли связывание FITC-меченых MuTN228 с клетками P815/CD28+ в присутствии различных количеств конкурентных антител MuTN228 или HuTN228, как описано в примерах.
Фиг.12. Конкурентный анализ с использованием ELISA. В конкурентном анализе с использованием ELISA определяли связывание биотинилированных MuTN228 с sCD28-Fc в присутствии различных количеств конкурентных антител MuTN228 или HuTN228, как описано в примерах.
Фиг.13. Конкурентный анализ с использованием I-125. В конкурентном анализе с использованием 125I-меченных антител определяли связывание 125I-меченных MuTN228 с клетками P815/CD28+ в присутствии различных количеств конкурентных антител MuTN228 или HuTN228, как описано в примерах.
Фиг.14. Плазмидные конструкции для экспрессии антител PV1-IgG3. VL и VH PV1 конструировали в виде миниэкзонов, фланкированных сайтами XbaI. Последовательность гена VL включали в экспрессирующий вектор pMVk.rg.dE, а последовательность гена VH - в экспрессирующий вектор pMVg3.D.Tt. Затем две плазмиды рекомбинировали с получением одной плазмиды, коэкспрессирующей тяжелую и легкую цепи PV1-IgG3.
Фиг.15А. Последовательности кДНК и выведенные аминокислотные последовательности легкой цепи и тяжелой цепи в миниэкзонах. CDR подчеркнуты. Зрелая легкая цепь начинается с остатка аспарагиновой кислоты (дважды подчеркнут) в положении 20 (SEQ ID NO: 10 и 11).
Фиг.15В. Последовательности кДНК и выведенные аминокислотные последовательности вариабельных областей PV1 в миниэкзонах. CDR подчеркнуты. Зрелая тяжелая цепь начинается с глутамина (дважды подчеркнут) в положении 20 (SEQ ID NO: 12 и 13).
Фиг.16. Анализ PV-1-IgG3 гель-хроматографией с использованием ВЭЖХ, как описано в разделе «Способы». Белок определяли по поглощению при 280 нм.
Фиг.17. Анализ SDS-PAGE мышиного контрольного изотипа IgG3 (полоса 1), PV1 (полоса 2) и PV1-IgG3 (полоса 3). Белки на фотоснимке А проходили в невосстанавливающих условиях, а на фотоснимке В - в восстанавливающих условиях. ММ означает маркеры молекулярной массы. Числа представляют стандарты ММ в кДа.
Фиг.18. Клетки EL4 окрашивали PV1 (А), 37.51 (В) или PV1-IgG3 (С) и анализировали по способу проточной цитометрии. Использованными вторичными антителами были: FITC-меченые ослиные антитела против IgG (H+L) армянского хомяка для PV1, FITC-меченые ослиные антитела против IgG золотистого хомяка для 37.51 и FITC-меченые козьи антитела против мышиной каппа-цепи для PV1-IgG3. На графиках сплошной линией представлены клетки, окрашенные только вторичными антителами. На графиках прерывистой линией представлены клетки, окрашенные как первичными, так и вторичными антителами, как описано в разделе «Способы». Мышиный контрольный изотип IgG3 не окрашивал клетки EL4 (данные не представлены).
Фиг.19. (А). Избыток PV1 или PV1-IgG3 конкурирует с R-PE-мечеными PV1 за связывание с клетками EL4. Тонкой сплошной линией в гистограмме проточной цитометрии представлены клетки без какого-либо окрашивания, жирной сплошной линией - клетки, окрашенные только R-PE-PV1, тонкой прерывистой линией - клетки, окрашенные R-PE-FV1 и избытком немеченых PV1, и тонкой двойной прерывистой линией - клетки, окрашенные R-PE-PV1 и избытком немеченых PV1-IgG3. Избыток мышиного контрольного изотипа IgG3 не оказывал воздействия на связывание R-PE-PV1 с клетками EL4 (данные не представлены). (В). Избыток 145.2С11 или 145.2С11-IgG3 конкурирует с R-PE-мечеными 145.2С11 за связывание с EL4. Тонкой сплошной линией представлены клетки без какого-либо окрашивания, жирной сплошной линией - клетки, окрашенные только R-PE-145.2C11, толстой прерывистой линией - клетки, окрашенные R-PE-145.2C11 и избытком немеченых 145.2С11, и тонкой двойной прерывистой линией - клетки, окрашенные R-PE-145.2C11 и избытком немеченых 145.2C11-IgG3. (С). Избыток PV1 конкурирует с PV1-IgG3 за связывание с клетками EL4. Клетки EL4 окрашивали PV1-IgG3 с и без избытка PV1. Клетки отмывали и окрашивали мышиными IgG3-специфическими, FITC-мечеными ослиными антителами против мышиного IgG3 (H+L). Тонкой сплошной линией представлены клетки, окрашенные только вторичными антителами, жирной сплошной линией - клетки, окрашенные PV1-IgG3 и вторичными антителами, и тонкой прерывистой линией - клетки, окрашенные PV1-IgG3 и избытком PV1, и вторичными антителами.
Фиг.20. Мышиные спленоциты, окрашенные PV1-IgG3 и 145.2С11. Клетки окрашивали контрольным мышиным изотипом IgG3 (А) или PVl-IgG3 (В), проводили контрастное окрашивание R-PE-мечеными козьими антителами против мышиного IgG3 и FITC-мечеными 145.2С11, и проводили анализ по способу двухцветной проточной цитометрии, как описано в разделе «Материалы и способы». Анализировали клетки только в окне лимфоцитов. PV1-IgG3-положительные клетки находились в верхних квадратах, и CD3-положительные клетки находились в правых боковых квадратах. Число в каждом квадрате представляет процент клеток в данном конкретном квадрате.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В контексте настоящего изобретения термин «молчащие анти-CD28-антитела» означает любые анти-CD28-антитела, дефектные по митогенной активности. Конкретнее, эти антитела, которые специфически связываются с антигенами CD28-рецептора на поверхности Т-клеток и не стимулируют рост или активацию Т-клеток при комбинированной стимуляции анти-СD3-антителами.
Молчащие анти-CD28-антитела могут быть сконструированы на основе анти-CD28-антител или продуцирующей анти-CD28-антитела гибридомы мутацией или модификацией агонистических анти-CD28-антител методом генной инженерии или химической модификацией. Например, выбрав использование технологии генной инженерии, аффинность связывания анти-CD28-антител для Fc-рецепторов может быть снижена или элиминирована введением мутации в аминокислотную последовательность Fc-домена антител. Например, молчащие анти-СD28-антитела можно получить выделением кДНК из гибридомных клеток, способных продуцировать моноклональные анти-CD28-антитела, и введением мутации(ий) в область последовательности, соответствующей Fc-домену, который играет важную роль в связывании с Fc-рецептором (WO 88/07089). Сайт мутации особым образом не ограничивается, при условии, что можно ингибировать связывание с Fc-рецепторами. Таким образов, в случае класса IgG-антител, например, предпочтительными являются аминокислотные остатки Н-цепи 234, 235, 236, 237, 318, 320 и 322, и молчащие анти-CD28-антитела можно сконструировать заменой, по меньшей мере, одной из данных аминокислот на другую аминокислоту.
Источник таких молчащих анти-CD28-антител может быть рассудительно выбран соответственно целевому животному, у которого используются антитела. Например, отличные от человеческих мококлональные антитела содержат аминокислотные последовательности, показывающие антигенность у людей весьма широкого спектра. Многие исследования показали, что иммунный ответ пациента на чужеродные антитела после введения антител является очень сильным, и само введение антител может вызвать у пациента тяжелое состояние или привести к потере у антител терапевтической применимости. Следовательно, рекомендуется заменить Fc-область таким образом, чтобы сделать антитела более гомологичными для подвергающегося лечению ими целевого животного, заменить каркасные участки вариабельных областей или использовать антитела, полученные от трансгенного животного, которому введен ген антитела целевого животного. Например, когда антитела предназначены для введения человеку, возможно применение химерных антител (ЕР 125023) с замененной Fc-областью, гуманизированных антител с замененным каркасным участком (ЕР 0239400, ЕР 045126) или человеческих антител (ЕР 546073, WO 97/07671), полученных от трансгенного животного, которому введен ген человеческого антитела. Митогенную активность антител можно уменьшить или элиминировать введением мутаций в данные антитела методами генной инженерии, такими как описаны выше, или химической модификацией.
В качестве конкретных примеров анти-СD28-антител, имеющих молчащие Fc-области, можно упомянуть не только антитела, описанные ниже в разделе «Примеры», но также антитела, полученные синтетическим путем с использованием гена константной области от подвергающего лечению целевого животного и полинуклеотидов вариабельной области, основанных на аминокислотных последовательностях вариабельных областей, представленных в SEQ ID NO: 2 и 4 или SEQ ID NO: 7 и 9. Примерами таких полинуклеотидов являются таковые с последовательностями SEQ ID NO: 1, 3, 6 и 8.
Более конкретными примерами данного изобретения являются HuTN228 и MuTN228, их Fab-фрагменты, их F(ab)'2-фрагменты, их производные и т.д.
Как очевидно специалистам в данной области, в результате вырожденности триплетного кода почти любая аминокислота может быть представлена более чем одним триплетным кодоном в кодирующей нуклеотидной последовательности. Кроме того, изменения пары минорных оснований могут привести к изменению (консервативной замене) кодируемой аминокислотной последовательности без существенного изменения биологической активности продукта гена. Таким образом, последовательность нуклеиновой кислоты, кодирующая белок или пептид, раскрытые здесь, можно несколько модифицировать (например, заменой нуклеотида в триплетном кодоне), и она по-прежнему будет кодировать соответствующий продукт гена с той же аминокислотной последовательностью.
Термин «эксгрессирующий вектор» относится к полинуклеотиду, который кодирует пептид по изобретению и содержит последовательности, необходимые для его экспрессии в выбранной клетке-хозяине. Как правило, экспрессирующие векторы включают промотор и терминатор транскрипции или обеспечивают условия для встраивания смежно с эндогенным промотором. Обычно экспрессирующие векторы представляют плазмиды, дополнительно включающие репликон и один или несколько селектируемых маркеров. Однако, альтернативно, экспрессирующие векторы могут быть вирусными рекомбинантами, предназначенными для инфицирования хозяина, или интегрирующими векторами, предназначенными для интеграции в предпочтительный сайт внутри генома хозяина. Примеры экспрессирующих векторов раскрыты в Molecular Cloning: A Laboratory Manual, Second Edition, Sambrook, Fritsch, and Maniatis, Cold Spring Harbor Laboratory Press, 1989.
Подходящие клетки-хозяева для экспрессии молчащих анти-СD28-антител включают прокариоты, дрожжи, архебактерии и эукариотические клетки. В данной области хорошо известны соответствующие клонирующие и экспрессирующие векторы для использования таких хозяев как бактерии, грибы, дрожжи и клетки млекопитающих, например, описанные Pouwels et al., Cloning Vectors: A Laboratory Manual, Elsevier, New York (1985). Предпочтительно, клетки являются клетками млекопитающих. Вектор может быть плазмидным вектором, одно- или двухцепочечным фаговым вектором или вирусным вектором с одно- или двухцепочечной РНК или ДНК. Подобные векторы можно ввести в клетки в виде полинуклеотидов, предпочтительно, ДНК, хорошо известными методами для введения ДНК или РНК в клетки. Векторы, в случае фаговых и вирусных векторов, также могут быть, предпочтительно, введены в клетки в виде упакованного или инкапсулированного вируса хорошо известными методами инфицирования и трансдукции. Вирусные векторы могут быть компетентными по репликации или дефектными по репликации. В последнем случае, как правило, размножение вируса будет иметь место только в соответствующих клетках-хозяевах. Можно также использовать бесклеточные трансляционные системы для получения белков с использованием РНК, полученной из настоящих ДНК-конструкций.
Молчащие анти-CD28-антитела/белки можно выделить способами выделения/очистки, используемыми для белков, хорошо известными в области белковой химии. Конкретнее можно упомянуть, например, экстракцию, перекристаллизацию, высаливание сульфатом аммония, сульфатом натрия и т.д., центрифугирование, диализ, ультрафильтрацию, адсорбционную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, нормальнофазовую хроматографию, обращеннофазовую хроматографию, гель-фильтрацию, проникающую гель-хроматографию, аффинную хроматографию, электрофорез, противоточное распределение и т.д. и их комбинации.
По настоящему изобретению очищенные антитела можно получить с использованием рекомбинантных экспрессирующих систем, описанных выше. Способ включает культивирование клетки-хозяина, трансформированной экспрессирующим вектором, содержащий последовательность ДНК, которая кодирует белок, в условиях, способствующих в достаточной мере экспрессии белка. Затем белок выделяют из культуральной среды или клеточных экстрактов в зависимости от используемой экспрессирующей системы. Как это известно специалистам в данной области, способы выделения рекомбинантного белка будут варьировать в зависимости от таких факторов, как тип используемых клеток-хозяев, а также от того, секретируется или нет рекомбинантный белок в культуральную среду.
Молчащие анти-СD28-антитела при включении в фармацевтическую композицию можно использовать при (а) отторжении трансплантантоз после трансплантации органов или тканей, таких как сердце, почки, печень, костный мозг, кожа, роговица, легкие, поджелудочная железа, тонкий кишечник, мышцы, нервы и т.д.; (b) реакциях трансплантант-против-хозяина при трансплантации костного мозга; (с) аутоиммунных заболеваниях, таких как ревматоидный артрит, системная красная волчанка, рассеянный склероз, тяжелая псевдопаралическая миастения, диабет типа I и т.д., и (d) иммунных заболеваний, таких как астма, атопический дерматит и т.д.
Тогда как ожидается, что молчащие анти-СD28-антитела может подавлять иммунные реакции и отторжение трансплантантов и индуцировать иммунотолерантность сами по себе, их также можно использовать в комбинации с другими препаратами. Среди таких других препаратов, которые пригодны для комбинирования с молчащими анти-CD28-антителами, находятся различные иммуносупрессоры, такие как рапамицин, дезоксиспергаулин, анти-СD40-антитела, анти-СD40L-антитела, програф, циклоспорин А, анти-IL-2-антитела, антитело против рецептора IL-2, анти-IL-12-антитела, антитела против рецептора IL-12 и MMF. Рапамицин, в частности, ингибирует передачу сигнала, относящегося к росту Т-клеток, среди сигналов от рецептора IL-2, но не ингибирует передачу сигнала, относящегося к апоптозу, так что ожидается, что его применение в комбинации со специфическим ингибитором сигнала CD28 будет полезным.
Молчащие анти-CD28-антитела по данному изобретению можно вводить перорально или парентерально, предпочтительно, внутривенным, внутримышечным или подкожным путем.
Молчащие анти-CD28-антитела по данному изобретению можно приготовить в форме раствора или лиофилизованного порошка и, где необходимо, можно включить их в состав композиции вместе с фармацевтически приемлемыми добавками, такими как наполнитель, разбавитель, стабилизатор, изотонический агент и буфер. Предпочтительные добавки включают сахар, такой как мальтоза, поверхостно-активное вещество, такое как полисорбат, аминокислоту, такую как глицин, белок, такой как человеческий сывороточный альбумин, и соль, такую как хлорид натрия.
Также можно выбрать лекарственную форму в виде инъекционных препаратов (растворов, суспензий, эмульсий, твердых веществ для растворения перед использованием и т.д.), таблеток, капсул, гранул, порошков, жидкостей, включений в липосомы, мазей, гелей, порошков для наружного применения, спреев, порошков для ингаляций, глазных капель, глазных мазей, суппозиториев, пессариев и тому подобное, в зависимости от пути введения, и можно соответственно ввести в композицию пептид по настоящему изобретению. Составление композиций в основном описано в Chapter 25.2 of Comprehensive Medical Chemistry, Volume 5, Editor Hansch et al., Pergamon Press, 1990.
Доза фармацевтической композиции по данному изобретению зависит, среди других переменных, от конкретной композиции, типа заболевания, на которое направлено лечение или профилактика, пути введения, возраста и состояния пациента и продолжительности лечения. Однако в случае внутривенного, внутримышечного или подкожного введения взрослому человеку можно вводить 0,01-100 мг/кг, предпочтительно, 0,1-10 мг/кг в сутки.
Когда молчащие анти-CD28-антитела по данному изобретение используют для подавления отторжения трансплантанта или индукции иммунотолерантности при трансплантации органа или ткани, композицию можно вводить в дозе примерно 1 мг/кг/сутки непосредственно перед трансплантацией, сразу же после трансплантации и на 3, 7, 12, 18, 25, 35, 45 и 60 сутки после трансплантации внутривенной, внутримышечной или подкожной инъекцией. Частота и доза введения могут быть адекватно повышены или понижены при контроле протекания реакции отторжения после трансплантации.
В то время как интервал между введениями зависит, среди прочих факторов, от использованного пути введения и состояния пациента, возможно не только непрерывное введение, но также прерывистое введение. Так, поскольку молчащие анти-СD28-антитела по данному изобретению представляет собой антитело, оно обеспечивает непрерывное действие так, что прерывистое введение может обеспечивать ожидаемый эффект. В отношении периода лечения, если состояние толерантности достигнуто, то данную толерантность можно поддерживать, даже если применение молчащих анти-CD28-антител прекращено. В данном отношении эти молчащие анти-CD28-антитела, несомненно, являются более эффективными по сравнению с иммуносупрессорным действием других иммуносупрессоров, эффект которых снижается после прекращения введения.
ПРИМЕРЫ
Описав в основном настоящее изобретение, подробнее понять его можно, обратившись к некоторым конкретным примерам, которые приводятся здесь только для целей иллюстрации и не предназначены для его ограничения, если не указано иначе. Приведенные ниже примеры осуществляются с использованием обычных методов, которые хорошо известны и обычны для специалистов в данной области, в противном случае некоторые из них описаны подробно.
Пример 1. Секвенирование аминокислотной последовательности мышиных антител против человеческого CD28
Гибридома, продуцирующая антитела против человеческого CD28 (клон: TN228, каппа-цепь мышиного IgGI), была любезно предоставлена Dr. Yagita (Juntendo University School of Medicine, Japan). Примерно 0,2 мг выделенных антител против человеческого CD28 (TN228) восстанавливали в 0,64 М гуанидин-HCl, 0,28 М Трис-HCl, рН 8,5, 0,055 М DT7 в течение 90 минут при 60°С (в атмосфере аргона), карбоксиметилировали добавлением йодуксусной кислоты до 0,13 М в течение 45 минут при комнатной температуре (в темноте) с последующим добавлением DTr до 0,32 М (для остановки реакции карбоксиметилирования) и сразу же проводили обмен на буфер в 0,1 М фосфате натрия, 0,002 М ЭДТА, рН 8,0 с использованием колонки PD-10 (каталог # 17-0851-01, Amersham Pharmacia Biotech, Uppsala, Sweden). Элюат доводили до 0,005 M DTT, 0,02% глицерина, и одну треть раствора (примерно 0,35 мл) переносили в отдельную пробирку для N-концевого деблокирования тяжелой цепи. Пробу расщепляли 1800 мкЕ пироглутаматаминопептидазы (каталог #7334, Takara Shuzo Co., Ltd., Tokyo, Japan) в течение 24 часов при 45°С. N-концевые последовательности легкой и тяжелой цепей из деблокированной пробы определяли в 20 циклах автоматического расщепления по Эдману и РТН-анализом на белковом секвенаторе Модель 241 (Hewlett Packard, Palo Alto, CA). РТН-производные анализировали на колонке Hypersil ODS C18. Анализ на секвенаторе и ВЭЖХ проводили, следуя инструкциям изготовителя, с использованием реагентов, растворителей и колонок, полученных от Hewlett Packard.
Результаты N-концевого секвенирования деблокированных пироглутаматаминопептидазой TN228 были следующими:
Пример 2. Клонирование кДНК вариабельной области
кДНК V-области легкой и тяжелой цепей TN228 клонировали из гибридомных клеток якорной полимеразной цепной реакцией (ПЦР) по способу, описанному Со et al. (Со M.S., N.M. Avadalovic, P.С. Caron, M.V. Avadalovic, D.A. Scheinberg and С. Queen, 1992. Chimeric and humanized antibodies with specificity for the CD33 antigen, J. Immunol., 148:1149-1154). Амплификацию проводили с кДНК с использованием 3'-праймеров, которые гибридизировали соответственно с С-областями мышиной каппа- и гамма-цепи, и 5'-праймеров, которые гибридизировали к добавленному G-хвосту кДНК. Для ПЦР гена VL 3'-праймер имел последовательность (SEQ ID NO: 14):
5' TATAGAGCTCAAGCTTGGATGGTGGGAAGATGGATACAGTTGGTGC 3'
с остатками 17-46, гибридизированными с мышиной СК-областыо. Для ПЦР гена VH 3'-праймеры имели вырожденные последовательности (SEQ ID NO: 15, 16 и 17):
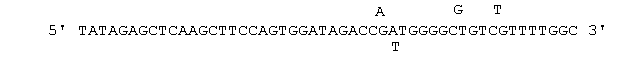
с остатками 17-50, гибридизированными с мышиным геном СН1 IgG. Негибридизированные последовательности в двух группах праймеров включали сайты рестрикции, использованные для клонирования. кДНК VL и VH субклонировали в вектор TOPOII Blunt (Invitrogen, Inc., Carlsbad, CA) для определения последовательности.
Несколько клонов легкой и тяжелой цепей секвенировали из двух независимых реакций ПЦР. Для легкой цепи установили две уникальные последовательности, гомологичные вариабельным областям мышиной легкой цепи. Одна последовательность гена VL была нефункциональной за счет мутации со сдвигом рамки считывания, и ее идентифицировали как непродуктивную аллель. Другая последовательность гена VL была типичной для функционального гена вариабельной области мышиной каппа-цепи. Для гена тяжелой цепи была идентифицирована уникальная последовательность, гомологичная гену вариабельной области типичной мышиной тяжелой цепи. Эти нуклеотидные последовательности и их выведенные аминокислотные последовательности вариабельной области представлены на фиг.2 и фиг.3.
Пример 3. Конструирование и экспрессия химерных TN228-IgG2M3
Способы
Гены VL и VH TN228 превращали с помощью ПЦР в сегменты миниэкзонов, фланкированные с сайгами XbaI, как описано Не et al. (He X.Y., Z. Xu, J. Melrose, A. Mullowney, M. Vasquez, С. Queen, V. Vexler, С. Klingbeil, M.S. Co and E.L. Berg, 1998, Humanization and pharmacokinetics of a monoclonal antibody with specificity for both E- and P-selectin, J. Immunol., 160: 1029-1035), и субклонировали в экспрессирующие плазмиды легкой цепи и тяжелой цепи (фиг.1). Каждый миниэкзон включал сигнальную пептидную последовательность, последовательность гена зрелой вариабельной области и вырезанную донорную последовательность, полученную из гена наиболее гомологичной мышиной J-цепи. Подобные вырезанные донорные последовательности использовали для сплайсирования экзона гена V-области с геном константой области человеческого антитела. Каждый миниэкзон секвенировали после его клонирования в экспрессирующем векторе для гарантии получения правильной последовательности и отсутствия ошибок при ПЦР. Экзоны генов константных областей в плазмидах, экспрессирующих легкую и тяжелую цепи, также подтверждали секвенированием.
В данном описании ChTN228 относится к химерным антителам, включающим вариабельные области VL и VH мышиных TN228, константную область человеческого IgG2M3 для тяжелой цепи и константную область человеческой каппа-цепи для легкой цепи. Константную область тяжелой цепи модифицировали (Cole M.S., С. Anasetti and J.Y. Tso, 1997, Human IgG2 variants of chimeric anti-CD3 are nonmitogenic to Т cells, J. Immunol., 159: 3613-3621) из зародышевого человеческого геномного фрагмента 2, и легкую цепь получали из зародышевого человеческого геномного фрагмента К. Оба гена тяжелой и легкой цепи находятся под контролем раннего промотора и энхансера цитомегаловируса человека. Ген тяжелой цепи регулируется терминатором транскрипции, полученным из гена человеческого комплемента С2 (Ashfield R., P. Enriquez-Harris and N.J. Proudfoot, 1991, Transcriptional termination between the closely linked human complement genes C2 and factor B: common termination factor for C2 and c-myc? EMBO J., 10: 4197-4207). Селективный ген-маркер легкой цепи gpt (Mulligan R.C. and P. Berg, 1981, Selection for animal cells that express the Escherichia coli gene coding for xanthine-guanine phosphoribosyltransferase, Proc. Natl. Acad. Sci. USA, 78: 2072-2076) и селективный ген-маркер тяжелой цепи dhfr (Simonsen С.С. and A.D. Levinson, 1983, Isolation and expression of an altered mouse dihydrofolate reductase cDNA, Proc. Natl. Acad. Sci. USA, 80:2495-2499) находятся под контролем раннего промотора из SV40. Для экспрессии химерных TN228 проводили временную трансфекцию в клетки COS-7 (линия обезьяньих почечных клеток) с использованием липофектамина (каталог #13964-013, GIBCO BRL). Истощенные среды от временных трансфектантов анализировали на продукцию человеческого IgG2M3 с помощью ELISA с использованием специфических козьих антител против гамма-цепи человеческого IgG в качестве захватывающего реагента и HRP-меченых козьих антител против человеческой каппа-цепи в качестве развивающего реагента. Истощенные среды также тестировали на способность ChTN228 связываться с клетками P815/CD28+ (стабильно трансфицированная клетка с CD28 в Р815 (мышиная мастоцитома)) непрямым иммунофлуоресцентным окрашиванием и анализировали проточной цитометрией. Для получения стабильной клеточной линии химерные экспрессирующие плазмиды трансфицкровали в клеточную линию мышиной миеломы Sp2/0 электропорацией и отбирали трансфектанты с экспрессией gpt. Истощенные среды от стабильных трансфектантов анализировали ELISA, как в случае временной трансфекции.
Результаты
Клонированные гены VL и VH превращали в миниэкзоны с помощью ПЦР (фиг.2 и 3) и субклонировали в векторы, экспрессирующие легкую и тяжелую цепи, как описано выше и представлено на фиг.1.
Временная трансфекция клеток COS-7: химерные экспрессирующие векторы временно трансфицировали в линию обезьяньих почечных клеток COS-7 для получения химерных антител TN228+. Истощенную среду от трансфицированных клеток тестировали с помощью ELISA на продукцию химерных IgG2M3-антител и проточной цитометрией на связывание с клетками P815/CD28+. В обоих тестах истощенная среда давала положительную реакцию. Выход химерных антител в результате временной трансфекции составлял ˜0,9 мкг/мл. Антитела ChTN228 из временного супернатанта связывалось с клетками P815/CD28+ в зависимости от концентрации (данные не представлены).
Стабильная трансфекция клеток Sp2/0: химерные экспрессирующие векторы трансфицировали в клетки Sp2/0 для получения стабильной клеточной линии. Истощенные среды от нескольких трансфектантов тестировали на продукцию химерных антител TN228 и на связывание с клетками P815/CD28+, как в случае с временными трансфектантами. Большинство трансфектантов давали положительную реакцию в обоих тестах. Выбирали один трансфектант с более высокой продуктивностью антител и размножали в 5 л среды без сыворотки. ChTN228 выделяли из 5 л истощенной среды аффинной хроматографией. Выход выделенных антител составлял ˜25 мг.
Пример 4. Очистка белка химерных антител ChTN228
Один из трансфектантов с высокой экспрессией ChTN228 после стабильной трансфекции (клон 7Н) культивировали в 5 л среды без сыворотки для гибридом GIBCO (каталог % 12045-076, GIBCO BRL). Собирали истощенный культуральный супернатант, когда жизнеспособность клеток достигала 10% или ниже, концентрировали до 500 мл и наносили на колонку с белком А-сефарозой емкостью 5 мл с использованием насоса Pharmacia Pl (2-3 мл/минуту). Колонку промывали PBS перед элюированием антител 0,1 М глицином, 0,1 М NaCl, pH 2,7. Элюированный белок диализовали против 3 смен по 2 л PBS каждая и затем обессоливали на колонке PD-10, уравновешенной PBS, содержащим дополнительно 0,1 М NaCl. Раствор обессоленного белка фильтровали через фильтр с размером пор 0,2 мкм перед хранением при 4°С.
Пример 5. Определение чистоты гель-ВЭЖХ и SDS-PAGE
Гель-ВЗЖХ проводили с использованием системы Perkin Elmer HPLC, состоящей из процессора РЕ ISS 200 Advanced LC Sample, насоса РЕ Series 410 Bio LC, диодового детектора РЕ 235С и РЕ Nelson 600 Series LINK. Для регуляции автосамплера, насоса и детектора использовали программное обеспечение Perkin Elmer Turbochrom Navigator, Version 4.1, а также для получения, хранения и обработки данных. Разделения достигали с использованием двух колонок для гель-ВЭЖХ TosoHaas TSK-GEL G3000SWXL, размером 7,8 мм ×300 мм, с величиной частиц 5 мкм и размером пор 250  (каталог # 08541, TosoHaas, Montgomeryville, MD), соединенных последовательно. Подвижной фазой служила смесь 200 мМ фосфата калия/150 мМ хлорида калия при рН 6,9, и скорость потока равнялась 1,00 мл/минуту. Элюат с колонки контролировали спектрофотометрически при 220 нм и 280 нм. Объем введения составлял 50 мкл (50 мкг) пробы ChTN228.
(каталог # 08541, TosoHaas, Montgomeryville, MD), соединенных последовательно. Подвижной фазой служила смесь 200 мМ фосфата калия/150 мМ хлорида калия при рН 6,9, и скорость потока равнялась 1,00 мл/минуту. Элюат с колонки контролировали спектрофотометрически при 220 нм и 280 нм. Объем введения составлял 50 мкл (50 мкг) пробы ChTN228.
SDS-PAGE проводили обычным методом в градиентном 4-20% геле (каталог # ЕС6025, Novex, San Diego, CA).
Чистоту выделенных ChTN228 анализировали гель-ВЭЖХ и SDS-PAGE. По результатам этого анализа белок представлял 96,5% мономер, его подвижность соответствовала белку с молекулярной массой ˜160 кДа. Анализ MuTN228, контрольного изотипа MuFd79 (мышиный IgGI), ChTN228 и контрольного изотипа НuЕР5С7 (человеческий IgG2M3) с помощью SDS-PAGE в невосстанавливающих условиях также указывал, что все четыре антитела имели молекулярную массу примерно 150-160 кДа. В результате анализа тех же четырех белков в восстанавливающих условиях было показано, что все четыре антитела включали тяжелую цепь с молекулярной массой примерно 50 кДа и легкую цепь с молекулярной массой примерно 25 кДа.
Пример 6. Конкурентный анализ
Способы
Провели титрование с использованием серийных двукратных разведении MuTN228-FITC-антител, начиная с концентрации 250 нг/тест. Клетки P815/CD28+ (5×105 клеток/тест) инкубировали с FITC-меченными антителами в течение 1 часа на льду, отмывали PBS и анализировали проточной цитометрией. Для конкурентного анализа 25 нг MuTN228-FITC и серийные двукратные разведения конкурентных антител ChTN228 или MuTN228, начиная с концентрации 800 нг/тест, добавляли к клеткам P815/CD28+ (5×105 клеток/тест). В качестве контроля клетки P815/CD28+ (5×105 клеток/тест) инкубировали с 25 нг одного MuTN228-FITC (т.е. без конкурента). Также тестировали антитела контрольного изотипа НuЕР5С7 и MuFd79 (800 нг/тест) в качестве конкурентов. Клетки инкубировали со смесью антител в конечном объеме 150 мкл в течение 1 часа на льду (в темноте), затем отмывали и анализировали проточной цитометрией.
Результаты
Специфичность связывания антител MuTN228 и ChTN228 сравнивали в конкурентном анализе с использованием проточной цитометрии, как описано в разделе «Способы». Различные количества немеченых MuTN228 или ChTN228 смешивали с 25 нг FITC-меченых антител MuTN228 и инкубировали с клетками P815/CD28+. Как MuTN228, так и ChTN228 конкурировали с MuTN228-FITC в зависимости от концентрации, что указывает на то, что связывание обоих антител является специфическим для антигена CD28 (фиг.4). Антитела контрольного изотипа MuFd79 и НuЕP5С7 не конкурировали с MuTN228-FITC, что указывает на то, что антитела MuTN228 и ChTN228 распознают антиген CD28 посредством специфических взаимодействий V-области.
Пример 7. Химерные антитела против человеческого CD28 с пониженной аффинностью к человеческому FR ингибируют первичную реакцию смешанной культуры лимфоцитов Приготовление клеток
Одноядерные клетки из периферической крови человека (РВМС) получали от нормальных здоровых добровольцев центрифугированием в градиенте плотности с использованием фиколлапака плюс (Amersham Pharmacia Biotech, Tokyo, Japan). Человеческую кровь разбавляли равным объемом среды RPMI1640 и наносили на фиколл-пак плюс. После центрифугирования в течение 30 минут при комнатной температуре РВМС собирали и отмывали средой RPMI1640. Затем РВМС суспендировали в среде (RPMI1640, содержащая 2,5% человеческой сыворотки типа АВ, 2-меркаптоэтанол и антибиотики) и наносили на колонку из нейлонового волокна (Wako junyaku, Osaka, Japan). Через 1 час инкубации при 37°С в атмосфере с 5% CO2 Т-клетки элюировали теплой средой.
Линии человеческих В-клеток (Raji and JY) использовали в качестве стимулирующих клеток в реакции смешанной культуры лимфоцитов. Эти клетки облучали рентгеновскими лучами (2000R) перед использованием.
Первичная реакция смешанной культуры лимфоцитов (1-ая MLR)
Выделенные человеческие Т-клетки (1×105 клеток/лунку) и обработанные рентгеновскими лучами клетки Raji (1×105 клеток/лунку) помещали в 96-луночный плоскодонный микропланшет. Антитела добавляли к культуральной среде и клетки инкубировали в течение 7 суток. Все культуры метили в течение последних 6 часов [3Н]-тимидином из расчета 10 кБк/лунку (Amersham Pharmacia biotech). Клетки собирали и определяли включенную радиоактивность на жидкостном сцинтилляционном счетчике.
Действие TN228-IgG2m3 (ChTN228) на первичную MLR представлено на фиг.5 и 6. Исходные антитела против человеческого CD28 TN228 (MuTN228) не ингибировали первичную MLR, однако химерные антитела TN228-IgG2m3 ингибировали ее в зависимости от дозы. Следовательно, превращение Fc-области антител против человеческого CD28 в таковую с пониженной аффинностью к человеческому Fc R превращает антитела в антагонистические в отношении пролиферации Т-клеток.
Химерные антитела против человеческого CD28, которые имели пониженную аффинность к человеческому Fc R, уменьшали низкую реактивность Т-клетки во вторичной реакции смешанной культуры лимфоцитов.
Вторичная реакция смешанной культуры лимфоцитов (2-ая MLR)
Выделенные человеческие Т-клетки (1×105 клеток/лунку) и обработанные рентгеновскими лучами клетки Raji (1×105 клеток/лунку) помещали в 96-луночные плоскодонные микропланшеты. Антитела добавляли к культуральной среде и клетки инкубировали. Через 5 суток клетки собирали, отмывали свежей средой. Клетки суспендировали в свежей среде и культивировали в течение 8 суток. Клетки повторно стимулировали обработанными рентгеновскими лучами клетками Raji или JY. Через еще 7 суток культивирования клетки инкубировали с [3H]-тимидином из расчета 10 кБк/лунку в течение 6 часов. Клетки собирали и определяли радиоактивность на жидкостном сцинтилляционном счетчике.
TN228-IgG2m3 ингибировал первичную MLR (фиг.5 и 6). Затем заявители исследовали действие данных антител на вторичную MLR. Антитела вносили в культуру первичной MLR, затем антитела выделяли из культурального супернатанта. После культивирования в среде без антител клетки повторно стимулировали теми же стимулирующими клетками (Raji) или стимулятором третьей группы (JY). Пролиферация клеток, обработанных TN228-IgG2m3 в первичной MLR, была снижена по сравнению с необработанными клетками. Однако оба вида клеток пролиферировали почти в одинаковой степени со стимулятором третьей группы (JY) (фиг.7). Этот результат указывает на то, что антитела против человеческого CD28 с пониженной аффинностью по отношению к человеческому Fc R могут индуцировать активность Т-клетки посредством ало-антигенной стимуляции.
Пример 8. Конструирование вариабельных областей гуманизированных TN228
Последовательности V-области MuTN228 анализировали компьютерным моделированием. Основываясь на поиске гомологии последовательности к базе данных последовательности антител Kabat (8. Johnson G. and Т.Т. Wu, 2000, Kabat database and its applications: 30 years after the first variability plot, Nucleic Acids Res., 28: 214-218), выбрали IC4 (Manheimmer-Lory A., J.B. Katz, M. Pillinger, C. Ghossein, A. Smith, B. Diamond, 1991, Molecular characteristics of antibodies bearing an anti-DNA-associated idiotype, J. Exp. Med. 174: 1639-1652) для обеспечения каркасной области для вариабельных областей тяжелой и легкой цепи гуманизированных TN228. Вариабельный домен тяжелой цепи гуманизированных TN228 имел 65 остатков из 85 остатков каркасной области, которые были идентичны таковым для каркасной области тяжелой цепи мышиных TN228, или, иначе, идентичность последовательности составляла 76%. Вариабельный домен легкой цепи гуманизированных TN228 имел 56 остатков из 80 остатков каркасной области, которые были идентичны таковым для каркасной области легкой цепи мышиных TN228, или, иначе, идентичность последовательности составляла 70%.
Использовали компьютерные программы ABMOD и ENCAD (Levitt M., 1983, Molecular dynamics of native protein, I. Computer simulations of trajectories, J. Mol. Biol., 168: 595-620) для конструирования молекулярной модели вариабельного домена TN228, которую использовали для расположения аминокислот в каркасной области мышиных TN228, которые являются достаточно близкими к CDR для потенциального взаимодействия с ними. Для конструирования вариабельных областей тяжелой и легкой цепей гуманизированных TN228 CDR из тяжелой цепи мышиных TN228 вставляли в каркасные области человеческой тяжелой цепи IC4, и CDR из легкой цепи мышиных TN228 вставляли в каркасные области человеческой легкой цепи IC4. В положениях каркасной области, где по данным компьютерной модели можно было предположить о тесном контакте с CDR, аминокислоты из мышиных антител замещали на аминокислоты исходной человеческой каркасной области. Для гуманизированных TN228 это было сделано в остатках 27, 29, 30, 48, 67, 71 и 78 тяжелой цепи. Для легкой цепи замены не были сделаны (т.е. была проведена прямая вставка CDR из МuTN228 в каркасную область IC4). Кроме того, остатки каркасной области, которые только в редких случаях находились в их положениях в базе данных человеческих антител, заменяли человеческими согласованными аминокислотами в данных положениях. Для гуманизированных TN228 это было сделано в остатках 23, 40, 73, 83 и 85 тяжелой цепи и в остатках 69 и 77 легкой цепи. Аминокислотные последовательности вариабельных областей тяжелой и легкой цепи гуманизированных TN228 представлены на фиг.9 и 10.
Пример 9. Конструирование и экспрессия гуманизированных TN228-IgG2M3
Способы
При получении аминокислотных последовательностей гуманизированных вариабельных областей, как описано выше, конструировали гены для их кодирования, включая сигнальные пептиды, вырезанные донорные сигналы и соответствующие сайты рестрикции ферментами (фиг.8). Гены вариабельных областей тяжелой и легкой цепей конструировали и амплифицировали с использованием восьми перекрывающихся синтетических олигонуклеотидов размером в пределах примерно от 65 до 80 оснований (He X.Y., Z. Xu, J. Melrose, A. Mullowney, M. Vasquez, C. Queen, V. Vexler, C. Klingbeil, M.S. Co and S.L. Berg, 1998, Humarnization and pharmacokinetics of a monoclonal antibody with specificity for both E- and P-selectin, J. Immunol., 160:1029-1035). Олигонуклеотиды отжигали попарно и наращивали с помощью фрагмента Кленова ДНК-полимеразы I с получением двухцепочечных фрагментов. Полученные фрагменты денатурировали, отжигали попарно и наращивали с помощью фрагмента Кленова с получением двух фрагментов. Данные фрагменты денатурировали, отжигали попарно и еще наращивали с получением полноразмерного гена. Полученный продукт амплифицировали в реакции полимеразной цепной реакции (ПЦР) с использованием Taq-полимеразы, очищали в геле, расщепляли с помощью XbaI, вновь очищали в геле и субклонировали в сайт XbaI pVg2M3 для экспрессии тяжелой цепи и pVk для экспрессии легкой цепи. Ранее были описаны вектор pVg2M3 для экспрессии человеческой тяжелой гамма-цепи 2 (Cole M.S., C. Anasetti and J.Y. Tso, 1997, Human IgG2 variants of chimeric anti-CD3 are nonmitogenic to Т cells, J. Immunol., 159: 3613-3621) и вектор pVk для экспрессии человеческой легкой каппа-цепи (Со M.S., N.M.Avadalovic, P.C.Caron, M.V.Avadalovic, D.A.Scheinberg and C. Queen, 1992, Chimeric and humanized antibodies with specificity for the CD33 antigen, J. Immunol., 148: 1149-1154).
Последовательности V-областей и экзонов константных областей тяжелой и легкой цепей в конечных плазмидах подтверждали секвенированием нуклеотидных последовательностей. Структуры конечных плазмид в целом подтверждали картированием с рестрикцией. Все манипуляции с ДНК проводили с использованием обычных способов.
В данном списании HuTN228 относятся к гуманизированным антителам, содержащим вариабельные области VL и VH гуманизированных TN228, константную область человеческих IgG2M3 для тяжелой цепи и константную область человеческой каппа-цепи для легкой цепи. Константная область тяжелой цепи была модифицирована (Cole M.S., С. Anasetti and J.Y. Tso, 1997, Human IgG2 variants of chimeric anti-CD3 are nonmitogenic to Т cells, J. Immunol., 159: 3613-3621) из зародышевого человеческого геномного фрагмента 2, и легкую цепь получали из зародышевого человеческого геномного фрагмента К. Ранний промотор и энхансер цитомегаловируса человека регулируют оба гена тяжелой и легкой цепи. Ген тяжелой цепи находится под контролем терминатора транскрипции, полученного из гена человеческого комплемента С2 (Ashfield, R.P. Enriquez-Harris and N.J. Proudfoot, 1991, Transcriptional Termination between the closely linked human complement genes C2 and factor B: common termination factor for C2 and c-myc? EMBO J., 10: 4197-4207). Селективный ген-маркер легкой цепи gpt (Mulligan R.C. and P. Berg, 1981, Selection for animal cells that express the Escherichia coli gene coding for xanthine-guanine phosphoribosyltransferase, Proc. Natl. Acad. Sci. USA, 78: 2072-2076) и селективный ген-маркер тяжелой цепи dhfr (Simonsen С.С. and A.D. Levinson, 1983, Isolation and expression of an altered mouse dihydrofolate reductase cDNA, Proc. Natl. Acad. Sci. USA, 80: 2495-2499) находятся под контролем раннего промотора SV40.
Для экспрессии HuTN228 проводили временную трансфекцию в клетки COS-7 (линия обезьяньих почечных клеток) с использованием липофектамина 2000 (каталог #11668-027, Life Technologies). Истощенные среды от временных трансфектантов анализировали на продукцию человеческих IgG2М3-антител с помощью ELISA с использованием специфических козьих антител против гамма-цепи человеческого IgG в качестве захватывающего реагента и HRP-меченые козьи антитела против человеческой каппа-цепи в качестве развивающего реагента. Истощенные среды также тестировали на способность HuTN228 связываться с клетками P815/CD28+ непрямым иммунофлуоресцентным окрашиванием и анализировали проточной цитометрией (данные не представлены). Для получения стабильной клеточной линии гуманизированные экспрессирующие плазмиды трансфицировали в клеточную линик мышиной миеломы Sp2/0 электропорацией и отбирали трансфектанты с экспрессией gpt. Истощенные среды от стабильных трансфектантов анализировали ELISA, как в случае временной трансфекции.
Результаты
Основываясь на конструкции аминокислотной последовательности гуманизированной V-области, конструировали V-гены тяжелой и легкой цепей (фиг.9 и 10), как описано в разделе «Способы». V-гены тяжелой и легкой цепей клонировали, соответственно, в векторы pVg2M3 и pVk, как показано на фиг.8. Несколько клонов анализировали секвенированием нуклеотидной последовательности и правильные клоны экспрессирующих векторов тяжелой и легкой цепей использовали для трансфекции. Константные области экспрессирующих векторов тяжелой и легкой цепей также подвергались секвенированию.
Пример 10. Экспрессия HuTN228
Временная трансфекция клеток COS-7: экспрессирующие векторы временно трансфицировали в линию обезьяньих почечных клеток COS-7 для получения антител HuTN228. Истощенную среду от трансфицированных клеток тестировали с помощью ELISA на продукцию гуманизированных gG2М3-антител и проточной цитометрией на связывание с клетками P815/CD28+ (данные не представлены). Истощенная среда давала положительную реакцию в обоих тестах. Выход гуманизированных антител в результате временной трансфекции составлял ˜3,7 мкг/мл. Антитела HuTN228 из временного супернатанта связывалось с клетками P815/CD28+ в зависимости от концентрации (данные не представлены).
Стабильная трансфекция клеток Sp2/0: гуманизированные экспрессирующие векторы трансфицировали в клетки Sp2/0 для получения стабильной клеточной линии. Истощенные среды от нескольких трансфектантов тестировали на продукцию антител HuTN228, как в случае с временными трансфектантами. Выбирали один трансфектант (клон 4) с более высокой продуктивностью антител и размножали в среде без сыворотки для гибридом GIBCO. Антитела HuTN228 выделяли из 570 мл истощенной среды аффинной хроматографией. Выход выделенных антител составлял ˜7 мг.
Пример 11. Очистка белка
Один из трансфектантов с высокой экспрессией HuTN228 после стабильной трансфекции (клон 4) культивировали в 570 мл среды без сыворотки для гибридом GIBCO (каталог #12045076, Life Technologies). Собирали истощенный культуральный супернатант, когда жизнеспособность клеток достигала 10% или ниже, и наносили на колонку с белком А-сефарозой емкостью 2 мл. Колонку промывали PBS перед элюированием антител 0,1 М глицином, 0,1 М Had, pH 2,5. Элюированный белок диализовали против 3 смен по 2 л PBS каждая и затем обессоливали на колонке PD-10, уравновешенной PBS, содержащим дополнительно 0,1 М NaCl. Раствор обессоленного белка фильтровали через фильтр с размером пор 0,2 мкм перед хранением при 40°С.
Пример 12. Определение чистоты гель-ВЭЖХ и SDS-PAGE
Способы
Гель-ВЭЖХ проводили с использованием системы Perkin Elmer HPLC, состоящей из процессора РЕ ISS 200 Advanced LC Sample, насоса РЕ Series 410 Bio LC, диодового детектора РЕ 235С и РЕ Nelson 600 Series LINK. Для регуляции автосамплера, насоса и детектора использовали программное обеспечение Perkin Elmer Turbochrom Navigator, Version 4.1, а также для получения, хранения и обработки данных. Разделения достигали с использованием двух колонок для гель-ВЭЖХ TosoHaas TSK-GEL G3000SWXL (размером 7,8 мм ×300 мм, с величиной частиц 5 мкм, и размером пор 250 ; каталог #08541, TosoHaas, Montgomeryville, MD), соединенных последовательно. Подвижной фазой служила смесь 200 мМ фосфата калия/150 мМ хлорида калия при pH 6,9, и скорость потока равнялась 1,00 мл/минуту. Элюат с колонки контролировали спектрофотометрически при 220 нм и 280 нм. Объем введения составлял 60 мкл (60 мкг) пробы HuTN228.
; каталог #08541, TosoHaas, Montgomeryville, MD), соединенных последовательно. Подвижной фазой служила смесь 200 мМ фосфата калия/150 мМ хлорида калия при pH 6,9, и скорость потока равнялась 1,00 мл/минуту. Элюат с колонки контролировали спектрофотометрически при 220 нм и 280 нм. Объем введения составлял 60 мкл (60 мкг) пробы HuTN228.
SDS-PAGE проводили обычным способом в градиентном 4-20% геле (каталог # ЕС6025, Novex, San Diego, CA).
Изотип выделенных антител подтверждали с использованием набора для ELISA для определения подкласса человеческих IgG (каталог #99-1000, Zymed Laboratories, South San Francisco, CA), следуя рекомендациям изготовителя.
Результаты
Чистоту выделенных антител HuTN228 анализировали гель-ВЭЖХ и SDS-PAGE. Хроматограмма элюирования HuTN228 не представлена. По результатам этого анализа белок представляет ˜98% мономер и имеет подвижность, соответствующую белку с молекулярной массой ˜160 кДа.
Анализ MuTN228 контрольного изотипа MuFd79 (мышиный IgG1), HuTN228 и контрольного изотипа НuЕР5С7 (человеческий IgG2M3) с помощью SDS-PAGE в невосстанавливающих условиях также указывал, что все четыре антитела имели молекулярную массу, равную примерно 150-160 кДа. В результате анализа тех же четырех белков в восстанавливающих условиях было показано, что все четыре антитела включали тяжелую цепь с молекулярной массой примерно 50 кДа и легкую цепь с молекулярной массой примерно 25 кДа.
Определение изотипа указывало, что изотип антитела HuTN228 совпадал с предполагаемым изотипом IgG2 (данные не представлены).
Пример 13. Конкурентный анализ с использованием FACS
Способы
Провели титрацию с использованием серийных двухкратных разведений антител MuTN228-FITC, начиная с 250 нг/тест. Клетки P815/CD28+ (3×105 клеток/тест) инкубировали с FITC-меченым антителом в течение 1 часа на льду в 100 мкл буфера для окрашивания для FACS (FSB=PBS, 2% FBS, 3% нормальной мышиной сыворотки, 0,1% NaN3), отмывали 2 мл FSB и анализировали проточной цитометрией (данные не представлены).
Для конкурентного анализа MuTN228-FITC (50 нг/тест) в 25 мкл FSB смешивали с трехкратными серийными разведениями конкурентных антител HuTN228 или MuTN228 (начиная с 200 мкг/мл) в 25 мкл FSB и добавляли к клеткам P815/CD28+ (3×105 клеток/тест) в 50 мкл FSB. В качестве контроля клетки P815/CD28+ инкубировали с одними MuTN228-FITC (50 нг/тест в 50 мкл FSB). Также тестировали антитела контрольного изотипа НuЕР2С7 (человеческий IgG2M3) и MuFd79 (мышиный IgG1) (200 нг/тест) в 25 мкл FSB в качестве неспецифических конкурентов. Клетки инкубировали со смесью антител в конечном объеме 100 мкл в течение 1 часа на льду (в темноте), затем отмывали 2 мл FSB и анализировали проточной цитометрией. Данный опыт повторяли три раза.
Результаты
Специфичность связывания антител MuTN228 и HuTN228 с молекулами CD28 на клетках P815/CD28+ сравнивали в конкурентном анализе с использованием проточной цитометрии, как описано в разделе «Способы». Типичные данные представлены на фиг.5. Как MuTN228, так и HuTN228 конкурировали с MuTN228-FITC в зависимости от концентрации, что указывает на то, что связывание обоих антител является специфическим для антигена CD28. Относительное связывание HuTN228 было в несколько раз меньше по сравнению с MuTN228. Антитела контрольного изотипа MuFd79 и НuЕР5С7 не конкурировали с MuTN228-FITC, что указывает на то, что антитела MuTN228 и HuTN228 распознают антиген CD28 посредством специфических взаимодействий V-области.
Пример 14. Конкурентный анализ с использованием ELISA
Способы
96-луночный планшет для постановки ELISA (Nunc-Iimiuno plate, каталог #439454, NalgeNunc, Naperville, IL) покрывали sCD28-Fc из расчета 100 мкл/лунку (0,5 нг/мл в PBS) (sCD28-Fc означает слитый белок, в котором внеклеточные домены CD28 объединяли с доменами СН2 и СНЗ IgGI) в течение ночи при 4°С. Планшет блокировали в течение 30 минут блокирующим буфером Superblock из расчета 300 мкл/лунку в ТВС (каталог #37535, Pierce, Rockford, IL) и промывали 300 мкл/лунку буфером для промывания для постановки ELISA (EWB=PBS, 0,1% Tween-20). В трех параллелях вносили смесь MuTN228-биотин (0,5 мкг/мл) в 100 мкл буфера для ELISA (EB=PBS, 1% BSA, 0,1% Tween-20) и трехкратные серийные разведения конкурентных антител HuTN228 или MuTN228 (начиная со 100 мкг/мл) в 100 мкл ЕВ в конечном объеме 200 мкл/лунку. Антитела контрольного изотипа НuЕР5С7 и MuFd79 (100 мкг/мл) в 100 мкл ЕВ также тестировали в качестве неспецифических конкурентов. В качестве «неконкурентного» контроля добавляли 100 мкл ЕВ к 100 мкл МuТN228-биотин (0,5 мкг/мл). В качестве контрольной пробы в оставшиеся лунки (не содержащие MuTN228-биотин) вносили 200 мкл ЕВ. Планшет инкубировали при комнатной температуре в течение 1,5 часов при встряхивании. После промывания лунок 4 раза EWB из расчета 300 мкл/лунку во все лунки добавляли 100 мкл/лунку стрептавидин-HRP (1 мкг/мл, каталог #21124, Pierce). Планшет инкубировали при комнатной температуре в течение 1 часа при встряхивании. После промывания лунок, как указано выше, во все лунки вносили субстрат ABTS из расчета 100 мкл/лунку (каталог #507602 и 506502, KPL, Gaithersburg, MD). Планшет инкубировали при комнатной температуре в течение 5-7 минут и определяли оптическую плотность при 415 нм. Опыт повторяли три раза.
Результаты
Специфичность связывания антител HuTN228 и MuTN228 с SCD28-Fc сравнивали в конкурентном анализе с использованием ELISA, как описано в разделе «Способы». Типичные данные представлены на фиг.12. Как MuTN228, так и HuTN228 конкурировали с MuTN228-биотин в зависимости от концентрации. Антитела контрольного изотипа MuFd79 и НuЕР5С7 не конкурировали с МuТN228-биотин, что указывает на то, что антитела MuTN228 и HuTN228 распознают антиген CD28 посредством взаимодействий V-области. Значения IC50 для MuTN228 и HuTN228 для всех трех опытов представлены в таблице 2. Относительное связывание HuTN228 в среднем было в 2,6 раза ниже по сравнению с MuTN228.
Суммарные данные конкурентного анализа с использованием ELISA
Пример 15. Конкурентный анализ с использованием 125Т-меченых антител
Способы
Относительную аффинность связывания антител MuTN228 и HuTN228 определяли по способу Queen et al. (Quenn C., W.P.Schneider, H.E.Selick, P.W.Payne, N.F.Landolfi, J.F.Duncan, N.M.Avdalovic, M. Levitt, R.P.Junghans, T.A.Waldmann, 1989, A humanized antibody that binds to the interleukin 2 receptor, Proc. Natl. Acad. Sci., 86: 10029-10033). Вкратце, ˜10 нг 125I-меченых MuTN228 в 50 мкл буфера для связывания (BB=PBS, 2% FBS, 1 мкг/мл мышиного IgG, 0,1% NaN3) смешивали в трех параллелях с трехкратными серийными разведениями конкурентных антител MuTN228 или HuTN228 (начиная с 400 мкг/мл) в 50 мкл ВВ, добавляли к 100 мкл клеток P815/CD28+ (2,5×105 клеток/тест) в пробирках для инкубирования (Skatron Macrowell Tube Strips, каталог #15773, Molecular Devices, Sunnyvale, CA) и инкубировали в течение 90 минут при 4°С при мягком встряхивании. Антитела контрольного изотипа НuЕР5С7 и MuFd79 (400 мкг/мл) в 50 мкл ВВ также тестировали в качестве неспецифических конкурентов. После инкубации смесь клетки-антитела переносили в центрифужные пробирки (Sarstedt Micro Tubes, каталог #72.702, Sarstedt, Newton, NC), содержащие 0,1 мл смеси 80% дибутилфталата -20% оливкового масла, пробирки для инкубации один раз промывали 50 мкл ВВ, и связанную и свободную радиоактивность разделяли центрифугированием, как описано (Kuziel W.A., S.J. Morgan, T.C. Dawson, S. Griffin, 0. Smithies, К. Ley, N. Maeda, 1997, Severe reduction in leukocyte adhesion and monocyte extravasation in mice deficient in CC chemokine receptor 2, Proc. Natl. Acad. Sci., 94:12053-12058). Данный опыт повторяли три раза.
Результаты
Относительнуэ аффинность связывания антител MuTN228 и HuTN228 сравнивали в конкурентном анализе с использованием 125I-меченных антител, как описано в разделе «Способы». Типичные данные представлены на фиг.13. Как MuTN228, так и HuTN228 конкурировали с 125I-меченными MuTN228 в зависимости от концентрации. Антитело контрольного изотипа MuFd79 показывало слабую, но воспроизводимую конкуренцию при высоких концентрациях, но антитела контрольного изотипа НuЕР5С7 не конкурировало с 125I-меченными MuTN228, что указывает на то, что антитела HuTN228 распознают антиген CD28 посредством специфических взаимодействий V-области. Значения IC50 MuTN228 и HuTN228 для всех трех опытов представлены в таблице 3. Кажущаяся аффинность связывания HuTN228 была примерно в 2,4 раза ниже по сравнению с антителами MuTN228.
Суммарные данные конкурентного анализа с использованием I-125
Пример 16. Секвенирование аминокислотной последовательности антител хомяка против мышиного CD28
Способы
Гибридома и антитела. Гибридому, продуцирующую антитела армянского хомяка против мышиного CD28 PV1, получали от АТСС (АТСС НВ-12352). Очищенные PV1, R-фикоэритрин (R-PE)-меченые PV1 получали от Southern Biotechnology (Birmingham, AL). Антитела золотистого хомяка против CD28 37.51 получали от PharMingen (San Diego, CA). Вторичные антитела ослиное флуоресцеин (FITC)-меченное против IgG (H+L) армянского хомяка, ослиные FITC-меченное против IgG (H+L) золотистого хомяка, ослиные FITC-меченное против мышиного IgG (H+L), ослиные R-PE-F(ab')2 против мышиного IgG (H+L) получали от Jackson ImmunoResearch (West Grove, PA) и козьи FITC-меченные против мышиной каппа-цепи, козьи R-PE-меченные против мышиного IgG3 и меченные пероксидазой хрена (HRP) козьи против мышиной каппа-цепи были получены от Southerm Biotechnology. Козьи антитела ) против мышиного IgG3 и мышиный контрольный изотип IgG3 FLOPC22 получали от Sigma Chemicals (St. Louis, МО). Антитела армянского хомяка против мышиного CD3 145.2С11 и его хомячий/мышиный химерный вариант 145.2C11-IgG3 получали в лаборатории заявителей. FITC-меченые 145.2С11 получали от Boehringer Mannheim (Indianapolis, IN).
Клонирование кДНК вариабельной области. кДНК V-области легкой и тяжелой цепей PV1 клонировали из гибридомных клеток якорной полимеразной цепной реакцией (ПЦР) по способу, описанному Со et al. (Co M.S., N.M. Avadalovic, P.С. Caron, M.V.Avadalovic, D.A. Scheinberg and C. Queen, 1992, J. Inununol., 148:1149-1154). Амплификацию проводили с кДНК с использованием 3'-праймеров, которые гибридизовались соответственно с С-областями хомячьей каппа- и гамма-цепи, и 5'-праймеров, которые гибридизовались с добавленным G-хвостом кДНК. Для VLPCR 3'-праймер имел последовательность 5' TATAGAGCTCCACTTCCAGTGCCC (SEQ ID NO: 20) с остатками 11-24, гибридизованными с хомячьей СК-областью. Для VHPCR 3'-праймеры имели вырожденные последовательности (SEQ ID NO: 17, 18 и 19):
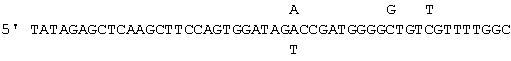
с остатками 19-50, гибридизованными с геном наиболее характерной для грызунов СН1 IgG. Негибридизованные последовательности в двух группах праймеров включали сайты рестрикции, использованные для клонирования. кДНК VL и VH субклонировали в вектор pUC19 для определения последовательности. Во избежание ошибок при ПЦР секвенировали пять независимых клонов каждой кДНК и отбирали только клоны с последовательностью, согласующейся с консенсусной последовательностью для экспрессии химерных PV1.
Результаты
Клонирование кДНК V-области PV1. кДНК V-области легкой и тяжелой цепей PV1 клонировали из гибридомных клеток, как описано в разделе «Способы». Для VLPCR только 3'-праймер, соответствующий Сγ-области хомяка, может продуцировать продукт кДНК VL из PV1. С другой стороны, 3'-праймер из Сγ-области хомяка не давал какого-либо ПЦР-продукта. Данные результаты указывают, что гибридома, продуцирующая PV1, использует каппа-цепь для их легкой цепи. Секвенировали несколько клонов легкой и тяжелой цепей и установили, что они содержат, соответственно, те же VL и VH. Ограниченные данные по последовательности СH1 и Сγ указывали, что клонированные тяжелая и легкая цепи по своей природе не являются мышиными.
Пример 17. Конструирование и экспрессия химерных PVl-IgG3
Способы
Гены VL и VH PV1 получали с помощью ПЦР в сегментах миниэкэонов, фланкированных с сайтами Xbal, как описано (Не X.Y., Z.Xu, J. Melrose, A. Mullowney, M. Vasquez, С. Queen, V. Vexler, С. Klingbeil, M.S. Со and E.L. Berg, 1998, J. Immunol., 160: 1029-1035), и их по отдельности вводили в плазмиды, экспрессирующие легкую и тяжелую цепи (фиг.14). Каждый миниэкзон включал сигнальную пептидную последовательность, последовательность зрелой вариабельной области и 5'-вырезанную донорную последовательность, полученную из гена наиболее гомологичной мышиной J-цепи. Подобный вырезанный донор используется для сплайсирования экзона гена V-области с геном константной области мышиных антител. Каждый миниэкзон вновь секвенировали после его клонирования в экспрессирующем векторе для гарантии включения правильного сигнала сплайсинга и отсутствия ошибок при ПЦР.
Сконструировали вектор для экспрессии генов тяжелой и легкой цепи химерного FV1-IgG3 из одной плазмиды. В данном описании PV1-IgG3 относится к химерным антителам, содержащим вариабельные области VL и VH PV1 хомяка, константную область мышиных IgG3 для тяжелой цепи и константную область мышиной каппа-цепи для легкой цепи. Экспрессирующий вектор pV1.g3.rg.dE (фиг.14) получали двухстадийным клонированием, аналогичным описанному Cole et al. (Cole M.S., С. Anasetti and J.Y. Tso, 1997, J. Immunol., 159: 3613-3621). Константную область тяжелой цепи получали из мышиного геномного фрагмента γ3 и легкую цепь - из κ-фрагмента. Оба гена тяжелой и легкой цепи находятся под контролем раннего промотора и энхансера цитомегаловируса человека, и они разделены терминатором транскрипции, полученным из гена человеческого комплемента С2 (Ashfield R., P. Enriquez-Harris and N.J. Proudfoot, 1991, EMBO J., 10: 4197-4207). Селектируемый ген-маркер gpt (Mulligan R.C. and P. Berg, 1981, Proc. Natl. Acad. Sci. USA, 78: 2072-2076) регулируется модифицированным ранним промотором SV40. Для экспрессии химерных PV1-IgG3 единичный плазмидный вектор трансфицировали в линию мышиных миеломных клеток NS0, и трансфектанты отбирали по экспрессии gpt. Истощенные среды от трансфектантов анализировали на продукцию мышиных антител IgG3 с помощью ELISA с использованием козьего антитела против мышиного IgG3 в качестве захватывающего реагента и HPR-меченых козьих антител против мышиной каппа-цепи в качестве проявителя. Тест является специфическим для мышиных IgG3, другие мышиные изотипы IgG дают отрицательную реакцию в данном анализе.
Результаты
Экспрессия химерного PV1-IgG3. Клонированные гены VL и VH превращали в миниэкзоны (фиг.15В) и включали в экспрессирующий вектор, как описано в разделе «Материалы и способы» и на фиг.15В. Затем экспрессирующий вектор трансфицировали в линию мышиных миеломных клеток NS0 для получения химерного PV1-IgG3. Истощенные среды от нескольких трансфектантов анализировали ELISA на продукцию мышиных антител IgG3 и FACS на связывание с клетками EL4. Большинство трансфектантов давало положительную реакцию в обоих тестах. Выбирали один трансфектант с высокой продуктивностью антител и размножали в 1 л среды без сыворотки. PV1-IgG3 выделяли из 1 л истощенной среды аффинной хроматографией. Выход составлял >10 мг/л.
Пример 18. Характеристика выделенных химерных PV1-IgG3 с использованием ВЭЖХ и SDS-PAGE
Способы
Очистка белка. Один из трансфектантов с высокой экспрессией IgG3 (клон #1) культивировали в 1 л среды без сыворотки для гибридом Gibco. Собирали истощенный культуральный супернатант, когда жизнеспособность клеток достигала 30% или ниже, концентрировали до 200 мл и наносили на колонку с белком А-сефарозой емкостью 5 мл с использованием насоса Pharmacia P1 (2-3 мл/минуту). Затем колонку промывали PBS, содержащим дополнительно 0,1 М NaCl (конечная концентрация NaCl составляла 0,25 М) перед элюированием антител 3,5 М MgCl2. Затем элюированный белок обессоливали на колонке PD10, уравновешенной PBS, содержащим дополнительно 0,1 М NaCl. Раствор обессоленного белка фильтровали через фильтр с размером пор 0,2 мкм перед хранением при 4°С. Как все мышиные IgG3, PV1-IgG3 при высокой концентрации (>1 мг/мл) выпадает в осадок на холоде, но вновь переходит в раствор при нагревании при 37°С. Антитело остается в растворе при комнатной температуре. По-видимому, многократные циклы осаждения на холоде не влияют на активность антител связываться с антигеном.
Определение чистоты гель-ВЭЖХ и SDS-PAGE. Гель-ВЭЖХ проводили с использованием системы Perkin Elmer HPLC, состоящей из процессора PE ISS 200 Advanced LC Sample, насоса РЕ Series 410 Bio LC, дискового детектора РЕ 235С и РЕ Nelson 600 Series LINK. Для регуляции автосамплера, насоса и детектора использовали программное обеспечение Perkin Elmer Turbochrom. Navigator, Version 4.1, а также для получения, хранения и обработки данных. Разделения достигали с использованием двух колонок для гель-ВЭЖХ TosoHaas TSK-GEL G3000SWXL (TosoHaas, каталог #08541, размером 7,8 мм ×300 мм, с величиной частиц -5 мкм и размером пор 250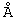 ), соединенных последовательно. Подвижной фазой служила смесь 200 мМ фосфата калия/150 мК хлорида калия при рН 6,9, и скорость потока равнялась 1,00 мл/минуту. Элюат с колонки контролировали спектрофотометрически при 220 нм и 280 нм. Объем введения составлял 50 мкл (63,5 мкг) неразбавленной пробы PV1-IgG3. SDS-PAGE проводили обычным способом.
), соединенных последовательно. Подвижной фазой служила смесь 200 мМ фосфата калия/150 мК хлорида калия при рН 6,9, и скорость потока равнялась 1,00 мл/минуту. Элюат с колонки контролировали спектрофотометрически при 220 нм и 280 нм. Объем введения составлял 50 мкл (63,5 мкг) неразбавленной пробы PV1-IgG3. SDS-PAGE проводили обычным способом.
Результаты
Чистоту выделенных PV1-IgG3 анализировали гель-ВЭЖХ и SDS-PAGE. Хроматограмма ВЭЖХ PV1-IgG3 представлена на фиг.16. По результатам этого анализа белок представляет 99% мономер и обладает подвижностью, соответствующей молекулярной массе 150 кДа. Анализ PV1, PVl-IgG3 и контрольного изотипа с помощью SDS-PAGE в невосстанавливающих условиях также указывал, что все три антитела имеют молекулярную массу, равную примерно 150 кДа (фиг.17А). Видимые на фиг.17А небольшие полосы были артефактами за счет кипячения проб в SDS без восстановления. Они отражают нарушенные дисульфидные связи между цепями в антителах. Однако в результате анализа тех же трех белков в восстанавливающих условиях (фиг.17В) было показано, что PV1, но не PV1-IgG3 или контрольный изотип, имели тяжелую цепь с молекулярной массой несколько выше 50 кДа, молекулярной массы, обычно характерной для IgG. Таким образом, хомячьи антитела PV1 подвергается гликозилированию тяжелой цепи в положении Asn297 в СН3, или они имеют дополнительный сайт гликозилирования в других положениях тяжелой цепи. Как уже обсуждалось выше, подобный необычный характер гликозилирования может приводить к неспецифическому связыванию PV1 с клетками EL4, возможно, в результате взаимодействия лектин/углеводород.
Пример 19
Способы
Проточная цитометрия. Клетки EL4 мышиной Т-клеточной линии (2,5×105 клеток/0,2 мл) окрашивали 1 мкг/мл PV1, 37.51 или PVl-IgG3 при 4°С в течение 30 минут, промывали 2 мл охлажденного PBS и окрашивали 20 мкл специфических флуорохром-меченых вторичных антител (10 мкг/мл). Через 20 минут инкубации при 4°С в темноте клетки промывали PBS и анализировали на FACS (Becton Dickenson, Milpitas, CA).
В конкурентном анализе клетки EL4 (2,5×105 клеток/0,2 мл) окрашивали 1 мкг/мл R-PE-PV1 и 25 мкг/мл PV1, PVl-IgG3 или контрольного изотипа IgG3 при 4°C в течение 30 минут в темноте, отмывали PBS и анализировали на FACS. Аналогичный конкурентный анализ проводили с использованием различных вариантов 145.2С11. В обратном конкурентном анализе клетки EL4 (2,5×105 клеток/0,2 мл) окрашивали 1 мкг/мл PV1-IgG3 и 25 мкг/мл PV1 при 4°С в течение 30 минут, 2 раза отмывали PBS, окрашивали FITC-меченными ослиными против мышиного IgG3 (H+L), отмывали и анализировали на FACS. Для контроля неспецифического связывание вторичных антител с PV1 клетки EL4 окрашивали избытком PV1 без PV1-IgG3 и анализировали.
Для окрашивания мышиных Т-клеток спленоциты мышей BALB/c (2,5×105 клеток/0,2 мл) окрашивали 1 мкг/мл мышиного контрольного изотипа IgG3 (FLOPC21) или PV1-IgG3 при 4°C в течение 30 минут, отмывали 2 мл охлажденного PBS и окрашивали 20 мкл FITC-меченых 145.2С11 (10 мкг/мл) и 20 мкл R-PE-меченных козьих против мышиного IgG3 (10 мкг/мл). Через 20 минут инкубации при 4°С в темноте клетки отмывали PBS и анализировали на FACS.
Результаты
Характеристика PV1 и PVl-IgG3 проточной цитометрией. PV1 использовали для окрашивания линии CD28-положительных Т-клеток EL4 и анализировали на FACS. Характер окрашивания указывал, что PV1 связываются с клетками EL4 по двум различным сайтам (фиг.17А). Кроме того, PV1, а также несколько антител армянского хомяка против мышиных Т-клеток (145.2С11, анти-СD3; Н57-597, анти-TCR и UC10-4F10-11, анти-СТLА4) также связываются неспецифически с линией СD28-отрицательных миеломных клеток NS0 (данные не представлены). С другой стороны, антитела золотистого хомяка против CD28 37.51 связываются специфически только с одним сайтом клеток ЕL4 (фиг.17В). Оказалось, что в дополнение к связыванию с СD28 PV1 также связываются неспецифически с другими сайтами, возможно, за счет взаимодействия типа углеводород/пектин. Как представлено на фиг.17С, химерные PV1-IgG3 не обладают подобной активностью неспецифического связывания. Антитела связываются с клетками EL4 аналогично 37.51, и они не связываются с CD28-отрицательными клетками NSO (данные не представлены). Таким образом, способность PV1 к неспецифическому связыванию относится к константной области тяжелой цепи данных конкретных антител, и она элиминируется при химеризации.
Для демонстрации того, что PV1-IgG3 обладает CD28-специфической связывающей активностью, заявители использовали конкурентный анализ с помощью FACS. В данных опытах R-PE-меченые PV1 смешивали с избытком (25-кратном) немеченых PV1, PV1-IgG3 или мышиного контрольного IgG3, и смесь использовали для окрашивания клеток EL4. Как представлено на фиг.18А, как PV1, так и PV1-IgG3, но не контрольный изотип, предупреждали связывание R-PE-меченых PV1 с клетками EL4. Ингибирование под действием PV1-IgG3 было менее выражено по сравнению с PV1, и заявители объясняли эти данные тем, что PV1-IgG3 конкурируют с R-РЕ-мечеными PV1 за сайты CD28, но не за неспецифические сайты. Аналогично, 145.2С11 (армянского хомяка против мышиного CD3) и химерные 145.2C11-IgG3 предупреждали связывание R-PE-меченых 145.2С11 с клетками EL4 (фиг.18В), но химерные антитела были менее эффективны за счет их неспособности элиминировать неспецифическое связывание R-PE-145.2C11 с клетками.
Заявители также проводили обратный конкурентный анализ с использованием избытка (25-кратного) PV1 для конкуренции с PV1-IgG3 за связывание с клетками EL4. Несмотря на то что в данном случае PV1-IgG3 не был помечен, он специфически распознавался ослиными FITC-меченными антителами против мышиных. Данные на фиг.18С показывают, что ингибирование связывания PV1-IgG3 с клетками EL4 избытком PV1 было почти полным, что указывает на то, что PV1 и PV1-IgG3 связываются с одним и тем же эпитопом.
Наконец, PV1-IgG3 использовали для окрашивания мышиных спленоцитов. Покрытые PV1-IgG3 спленоциты специфически распознавались вторичными R-РЕ-мечеными козьими антителами против мышиного IgG3. Одновременно к спленоцитам также добавляли FITC-меченные 145.2С11 для мечения СD3-положительных клеток. При двухцветной проточной цитометрии PV1-IgG3 специфически окрашивали СD3-положительные клетки, но не СD3-отрицательные клетки (фиг.19В). С другой стороны, мышиный контрольный изотип IgG3 не окрашивал СD3-положительные клетки (фиг.19А). Таким образом, химерные PV1-IgG3 распознавали антиген, который экспрессировался в мышиных Т-клетках, антигенсвязывающая активность, которая совпадает с анти-CD28-антителами.
Пример 20. Индукция артрита, вызванного коллагеном
Способы
Мышей иммунизировали внутрикожно в основание хвоста 125 мкг бычьего CII (Collagen Gijutsu Kenkyukai, Japan), эмульгированного равным объемом CFA (Wako, Japan). Мышам проводили бустерную иммунизацию внутрикожным введением 125 мкг бычьего CII в CFA на 21-е сутки. Мышей обрабатывали анти-CD28-антителами (PV1-IgG3) в дозе 1 мг/кг/сутки непрерывной инфузией с помощью осмотического насоса в течение 7 суток после первоначальной иммунизации. Развитие артрита наблюдали осмотром четырех лап на 11-е сутки после второй иммунизации, и воспаление четырех лап оценивали в баллах от 0 до 3, как описано ранее (Tada Y., A. Ho, D.-R. Koh, T.W. Mak, 1996, J. Immunol., 156:4520; Tada Y., A. Ho, T. Matsuyama, T.W. Mak, 1997, J. Exp. Med., 185:231). В баллах оценивали состояние каждой лапы и суммировали число баллов по четырем лапам так, что максимальное число баллов на мышь составляло 12. Показатель артрита рассчитывали делением общего числа баллов для опытной мыши на общее число мышей.
Результаты
Мышей иммунизировали бычьими CII и наблюдали развитие артрита. На 11-е сутки после второй иммунизации показатель артрита значительно снизился у мышей, обработанных анти-CD28-антителами (0,63±0,50) (Р<0,01) по отношению к контрольным (7,50±0,66).
Пример 21
Способы
Мыши; животные
Мышей самок BALB/c и С3Н получали от Charles River Japan, Inc. (Yokohama, Japan). Животных размещали в специальные, не содержащие патогенов устройства в микроизолированных клетках с фильтруемым воздухом и свободным доступом к корму и воде. В начале опыта все мыши были в возрасте 6-8 недель.
Антитела
Молчащие антитела против мышиного CD28 (PV1-IgG3) имели одинаковую специфичность с таковым клона PV1, но не обладала высокой агонистической активностью in vitro (Fc→IgG3). Антитела против мышиного CD154 (TRAP1, IgGI) получали от 3D PharMingen (San Diego, СА). CTLA4-Ig (CTLA-4/Fc Chimera) получали от Genzyme (Cambridge, MA).
Трансплантация кожи с хвоста
Трансплантакты полной толщины (0,5 см2) с хвоста мыши-донора (BALB/c:H-2d) трансплантировали на дорсальную область грудной клетки мыши-реципиента (С3Н:Н-2b) и фиксировали с помощью бандажа на 7 суток. Затем ежедневно визуально обследовали приживаемость трансплантанта. Отторжение определяли как потерю живой эпидермальной трансплантированной ткани на >80%. Статистическую обработку проводили с использованием теста множественного сравнения Даннетта. Значения Р<0,05 считались статистически значимыми.
Обработка
Реципиентов кожных трансплантантов обрабатывали 10, 50, 250 мкг молчащих против мышиного CD28, 250 мкг против мышиного CD154 и 100 мкг CTLA4-Ig, которые вводили внутрибрюшинно в сутки трансплантации (0 сутки) и после операции на 3- и 6-е сутки.
Результаты
Одновременная блокада Т-клеточных костимуляторных путей с участием CD40 и CD28 введением молчащих против мышиного CD28 и против мышиного CD154 эффективно способствовала приживаемости кожного аллотрансплантанта у мышей С3Н. У контрольных мышей отторжение трансплантанта произошло на 9-е сутки. Анти-СD40L mAb только незначительно удлиняли период выживания аллотрансплантанта (MST 10 суток), но приживаемость в значительной степени улучшалась при комбинированном введении с CD28, удлиняя среднее время выживаемости (MST) до 33 суток. Данная стратегия была значительно менее эффективной при введении CTLA4-Ig и против мышиного CD40L mAb при значении MST, равном 12 суткам.
Пример 22. Получение Fab- и F(ab')2-фрагментов анти-СD28-антител
Получение Fab-фрагмента анти-СР28-антител
Антитела против человеческого CD28 (HuTN228) расщепляли иммобилизованным фицином (Pierce, USA). Иммобилизованный фицин активировали 50 мМ Трис-HCl буфером, рН 6,8, содержащим 5 мМ ЭДТА и 11,5 цистеина·HCl, и наполняли им колонку. На колонку наносили раствор антител и инкубировали при 37°С в течение 2-3 суток. Колонку промывали PBS и расщепленный материал концентрировали ультрафильтрацией. Сконцентрированный расщепленный материал наносили на колонку для гель-фильтрации (TSKgel-3000SW×1, Tosoh, Japan), собирали соответствующие фракции и концентрировали ультрафильтрацией. Определяли концентрацию белка по поглощению при 280 нм (поглощение 280=1,4 для 1 мг/мл), и размер фрагментов подтверждает SDS-PAGE. Получение F(ab')2-фрагмента анти-СD28-антител
F(ab')2-фрагмент антител против человеческого CD28 получали таким же способом, как Fab-фрагмент, за исключением используемой концентрации цистеина (1/15 мМ) и периода инкубации (в течение ночи).
Понятно, что в свете вышеприведенных наставлений возможны многочисленные модификации и вариации настоящего изобретения. Следовательно, необходимо понимать, что в объеме прилагаемой формулы изобретения практика изобретения может быть иной, чем здесь конкретно описано.
Все заявки, патентные заявки, патенты и другие документы, упомянутые выше, включены в описание в полном объеме.













| название | год | авторы | номер документа |
|---|---|---|---|
| ВЕКТОР ЭКСПРЕССИИ CAR И CAR-ЭКСПРЕССИРУЮЩИЕ Т-КЛЕТКИ | 2015 |
|
RU2670147C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИММУННЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2203682C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К СD52 | 2012 |
|
RU2605307C2 |
| СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ КИШЕЧНЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2281118C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CTLA4 | 2012 |
|
RU2629768C2 |
| РЕКОМБИНАНТНОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ К CD4, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ПСОРИАЗА | 1992 |
|
RU2170256C2 |
| PD-1 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ. | 2016 |
|
RU2722451C1 |
| ЧЕЛОВЕЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ AILIM, КОСТИМУЛИРУЮЩЕЙ МОЛЕКУЛЫ ПЕРЕДАЧИ СИГНАЛА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2001 |
|
RU2262511C2 |
| АНТИТЕЛО ПРОТИВ ILT17 | 2012 |
|
RU2599450C2 |
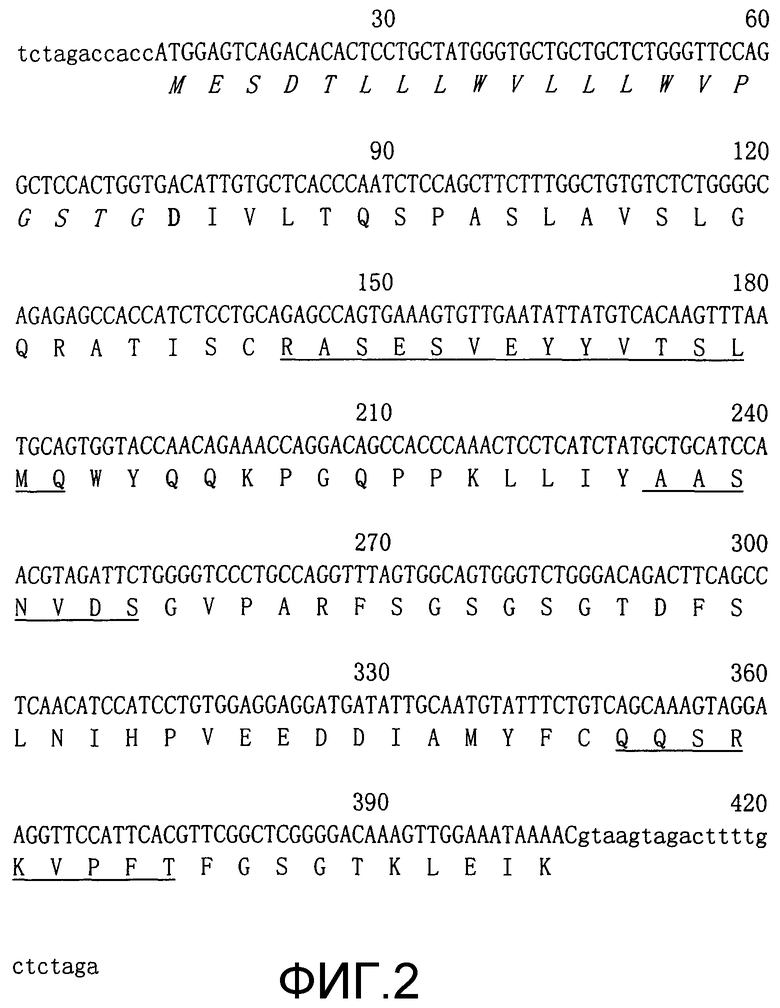
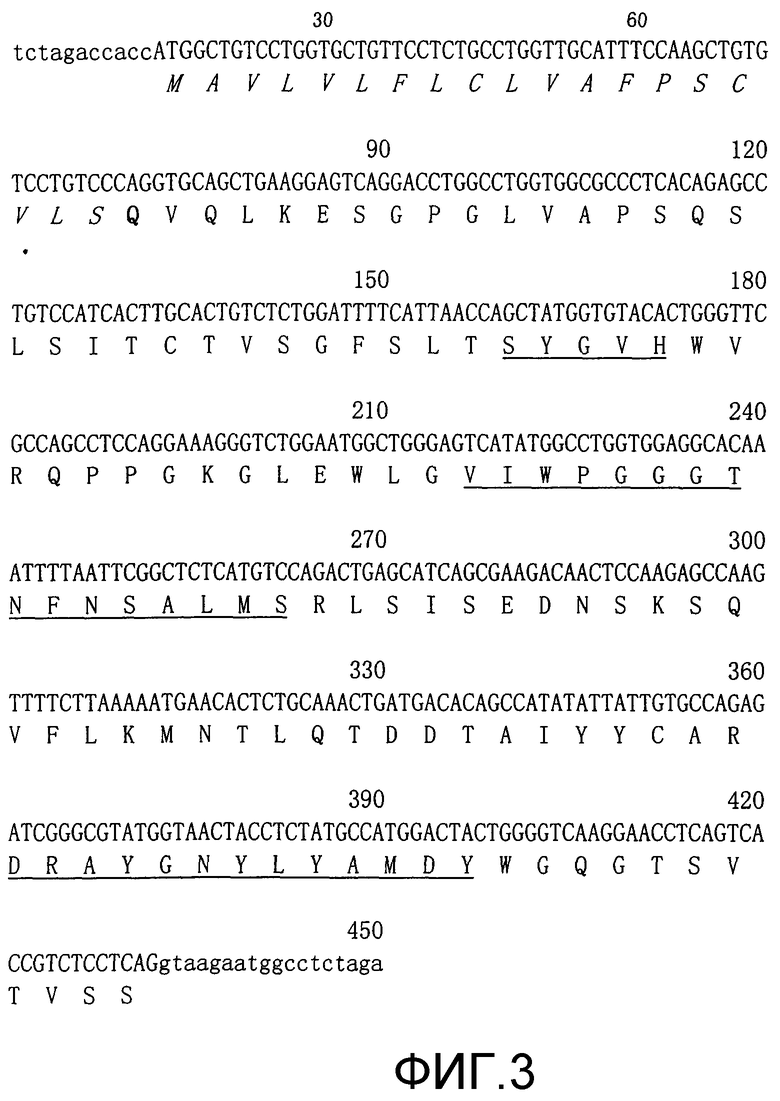
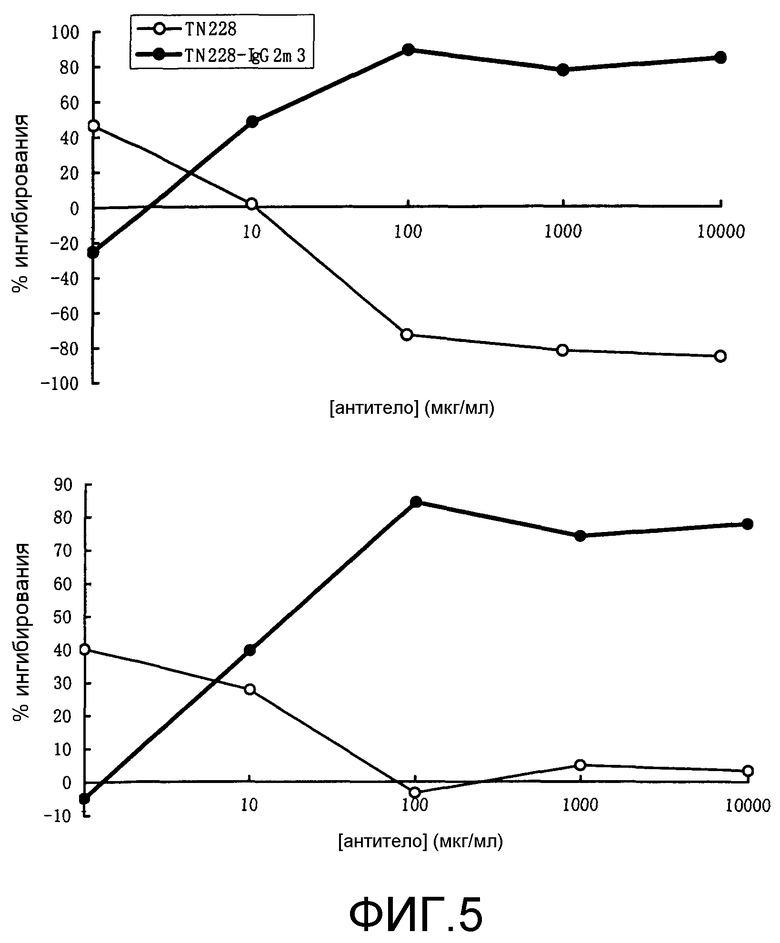
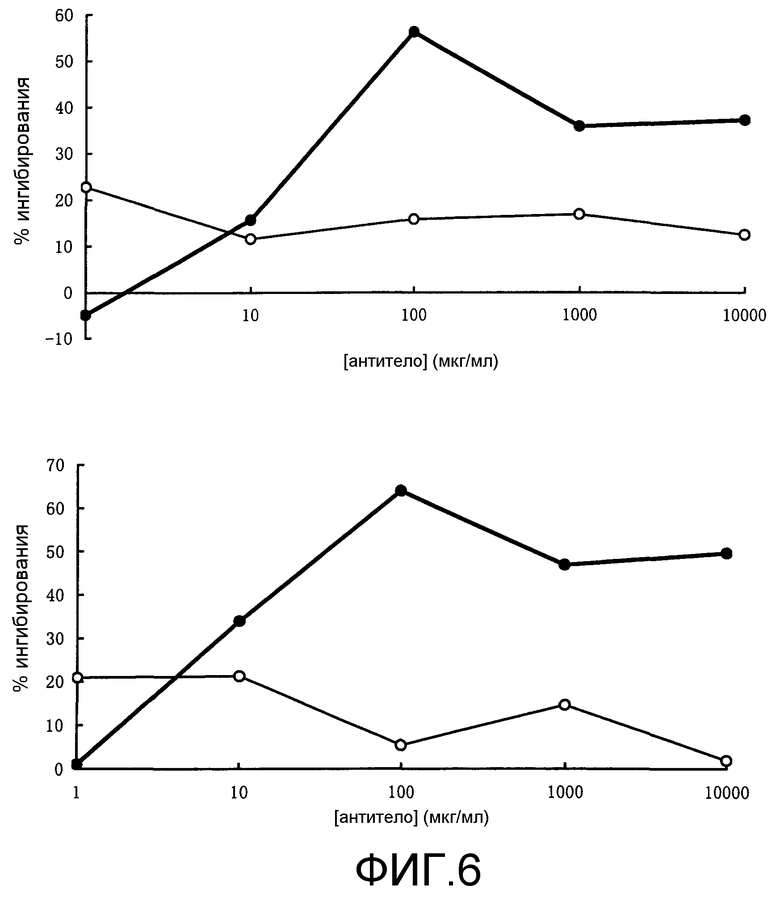
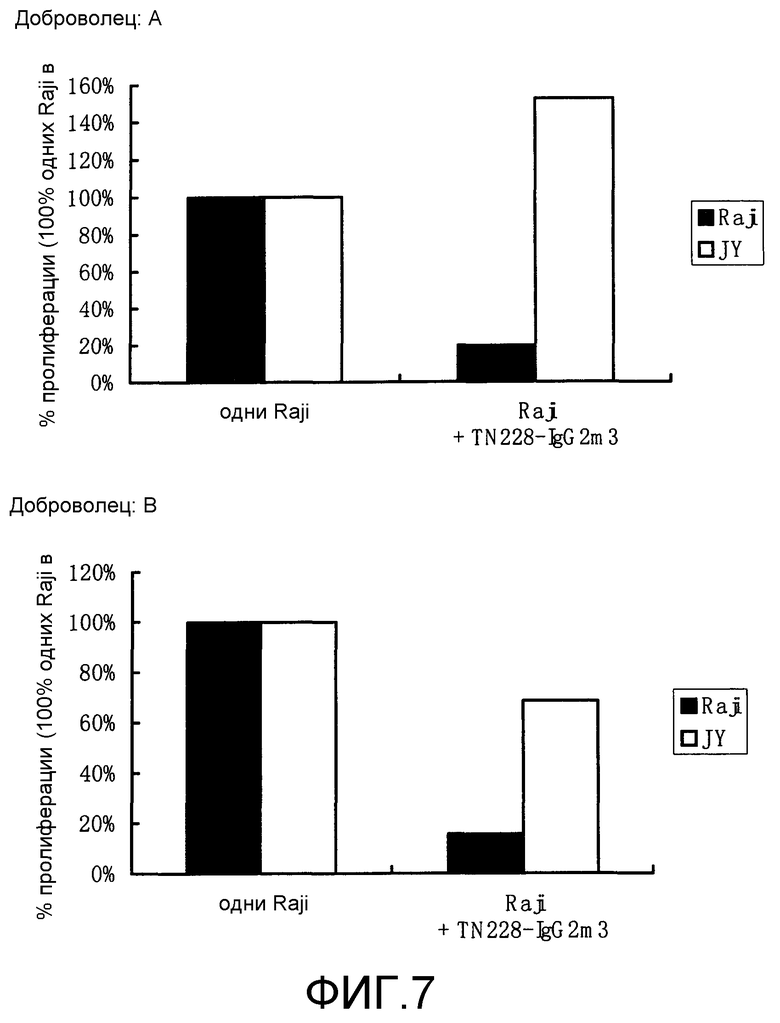
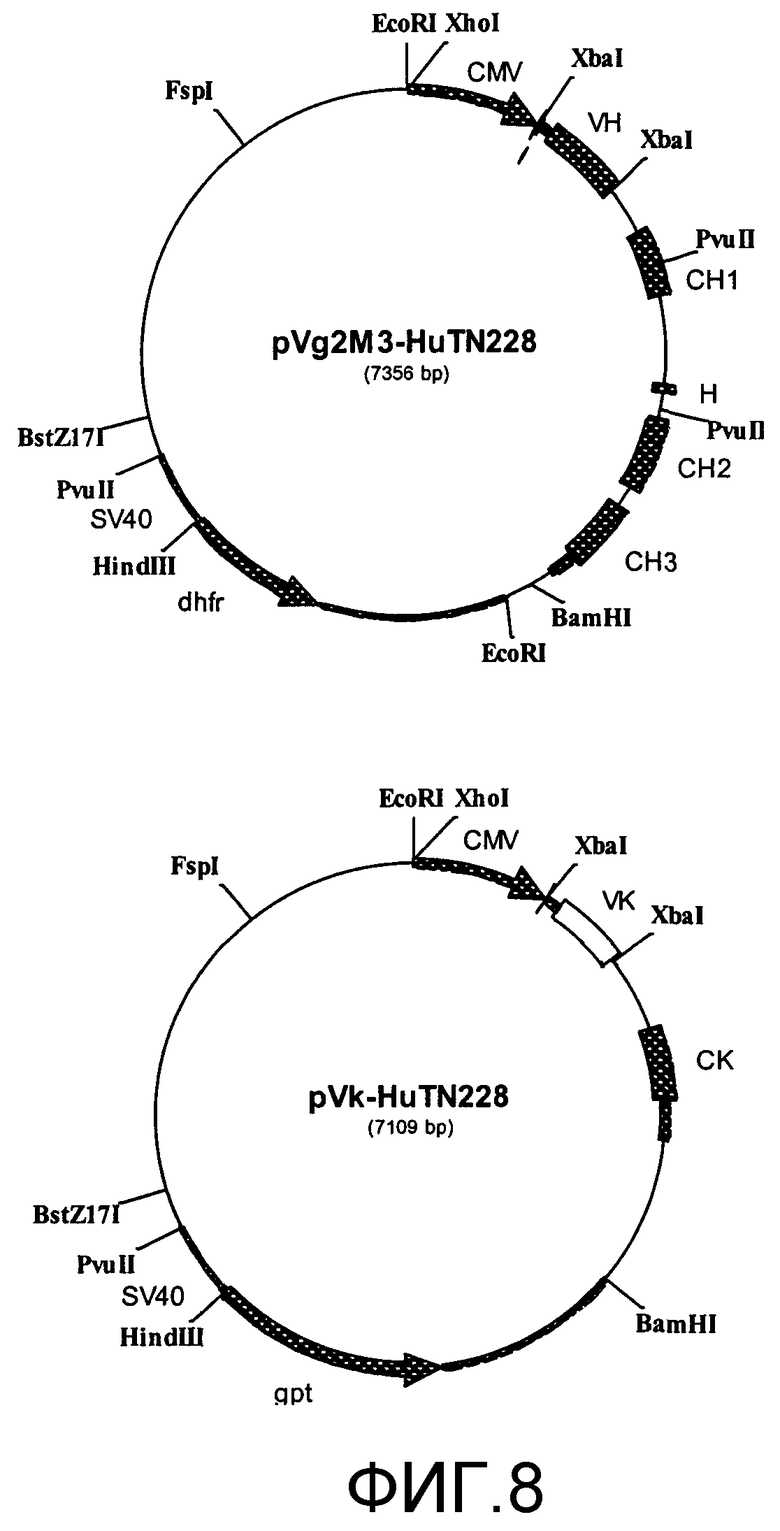

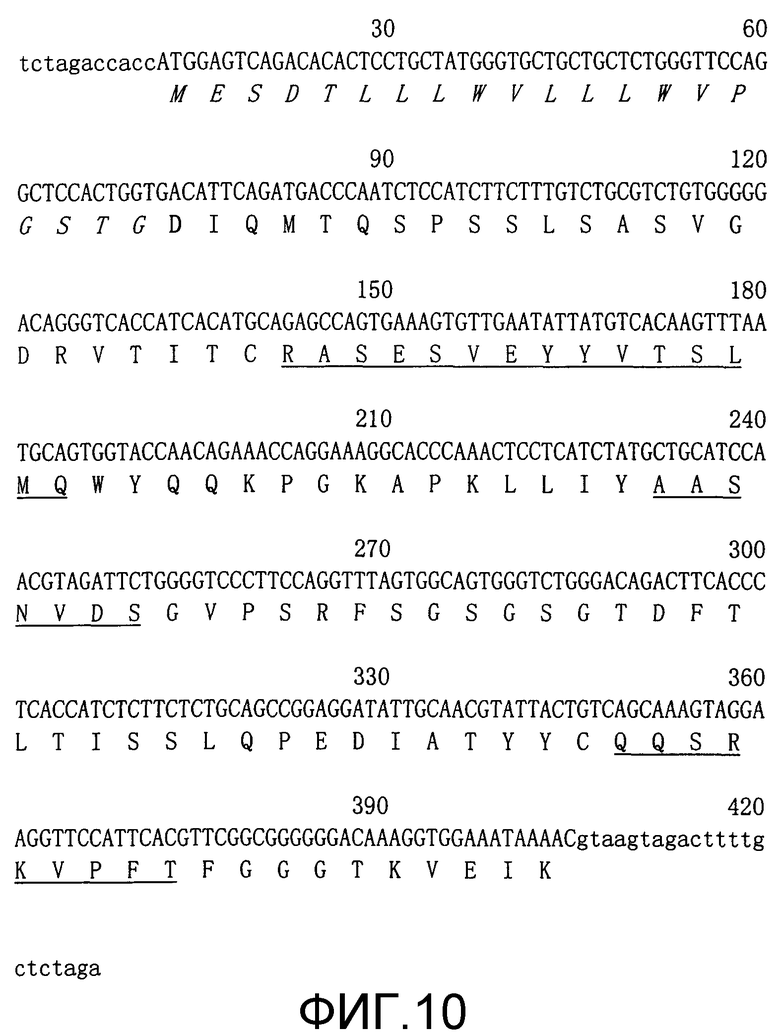
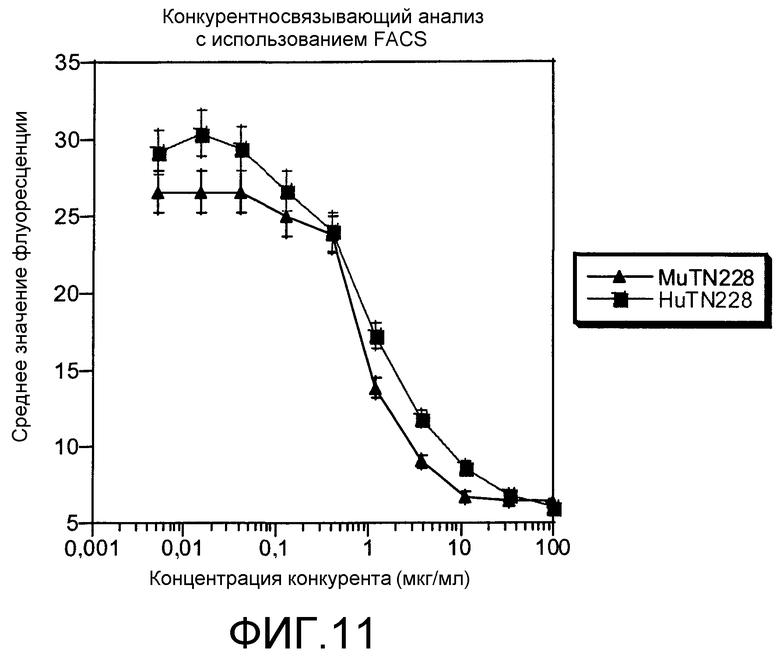
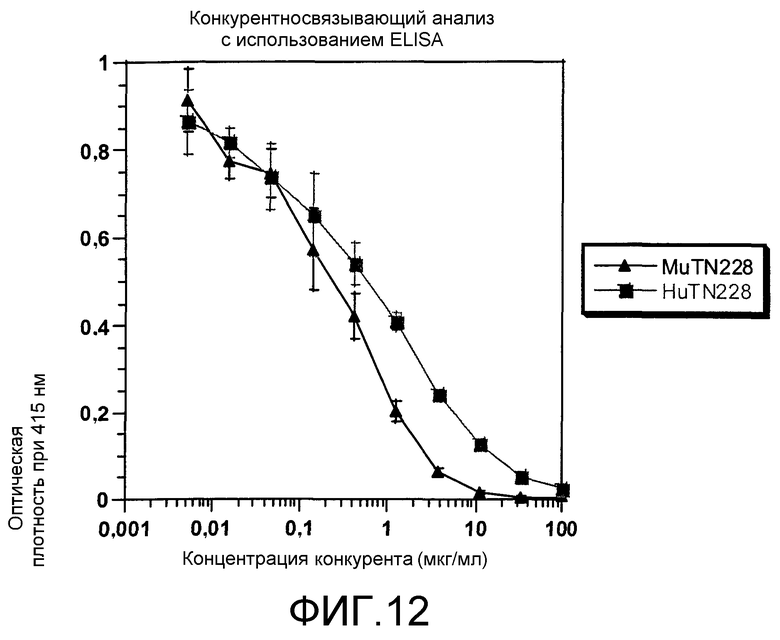
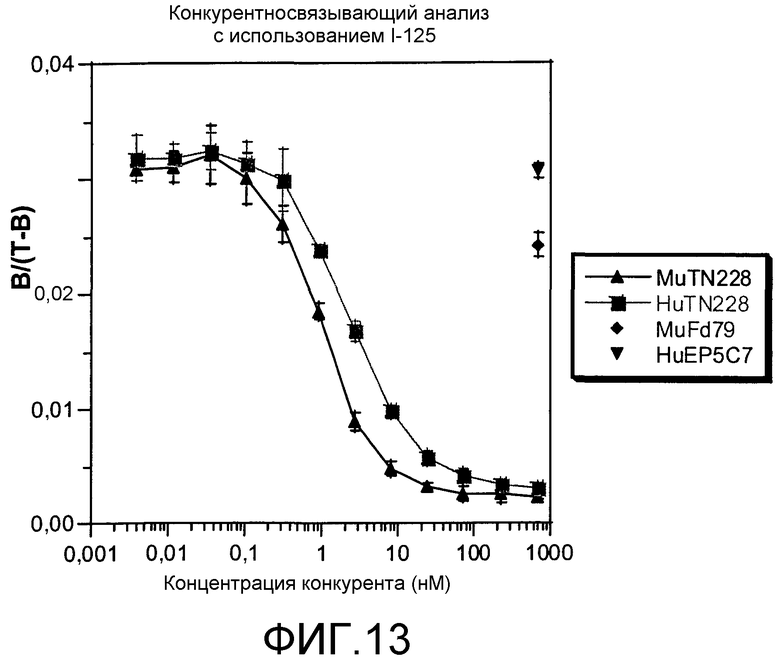
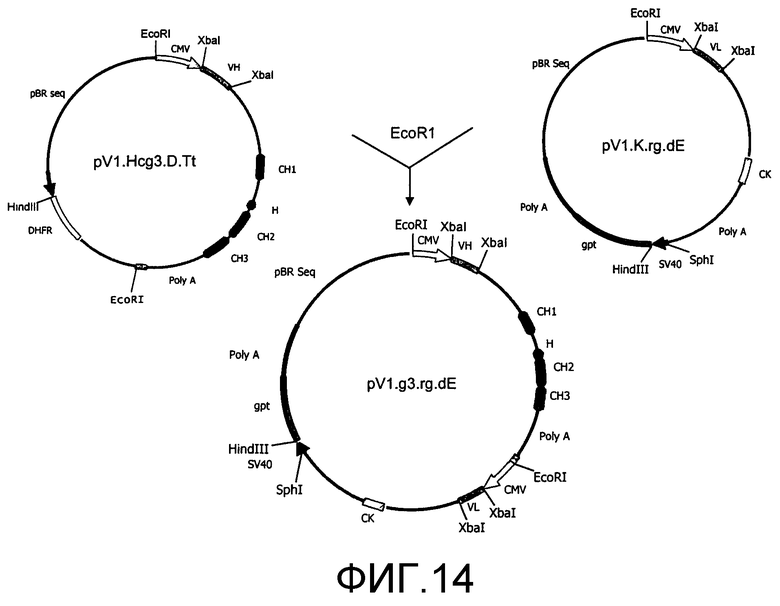


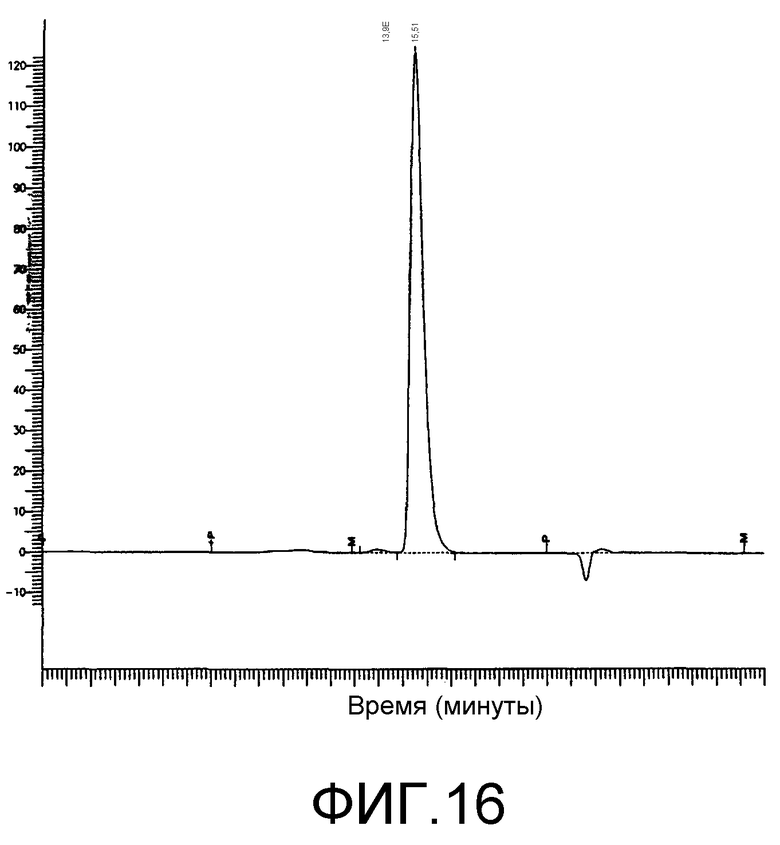
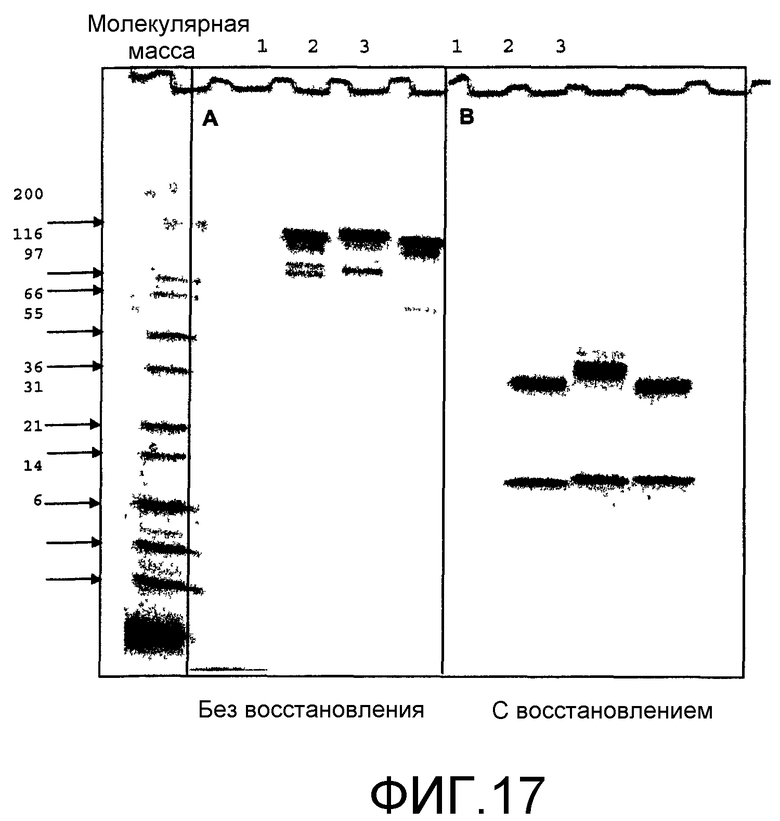
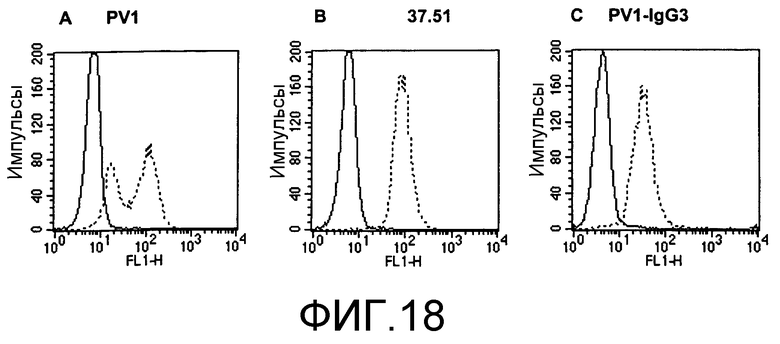
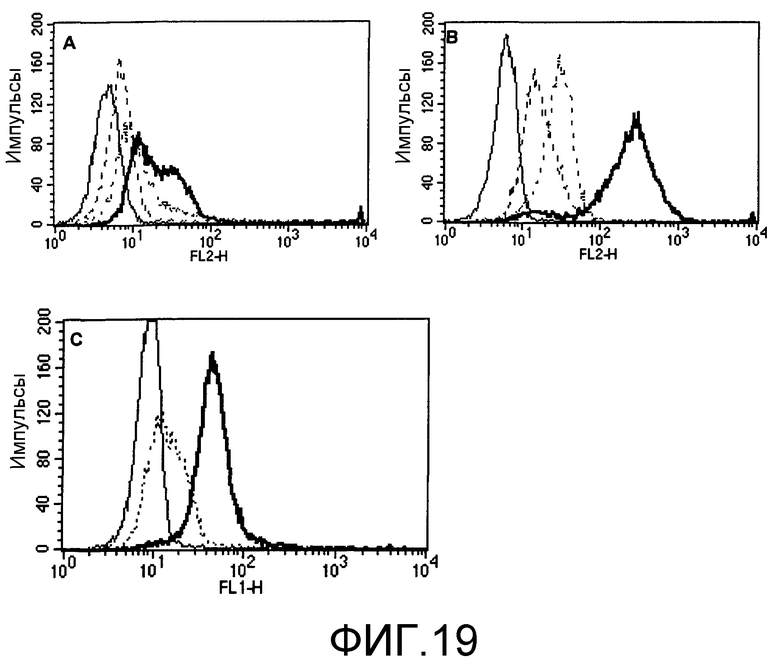
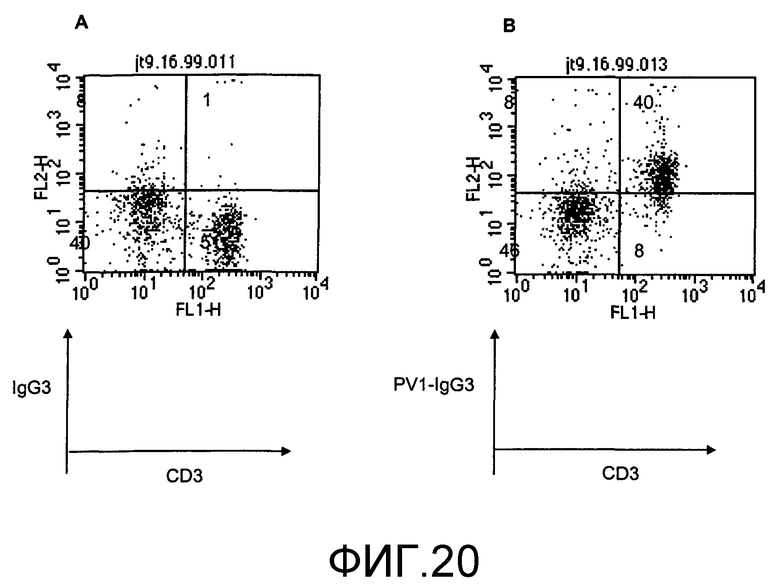
Изобретение относится к области терапевтической иммунологии. сущность изобретения состоит в том. что разработаны способы получения молчащих анти-СD28-антител, при этом способ получения предусматривает культивирование клетки-хозяина в подходящих условиях с последующим выделением экспрессированного антитела. Описаны также фармацевтическая композиция, экспрессирующий вектор, антитела и способ лечения отторжения трансплантата органа или ткани у пациента. Технический результат - расширение арсенала средств, предназначенных для предотвращения отторжения трансплантата. 14 н. и 11 з.п.ф-лы, 3 табл., 20 ил.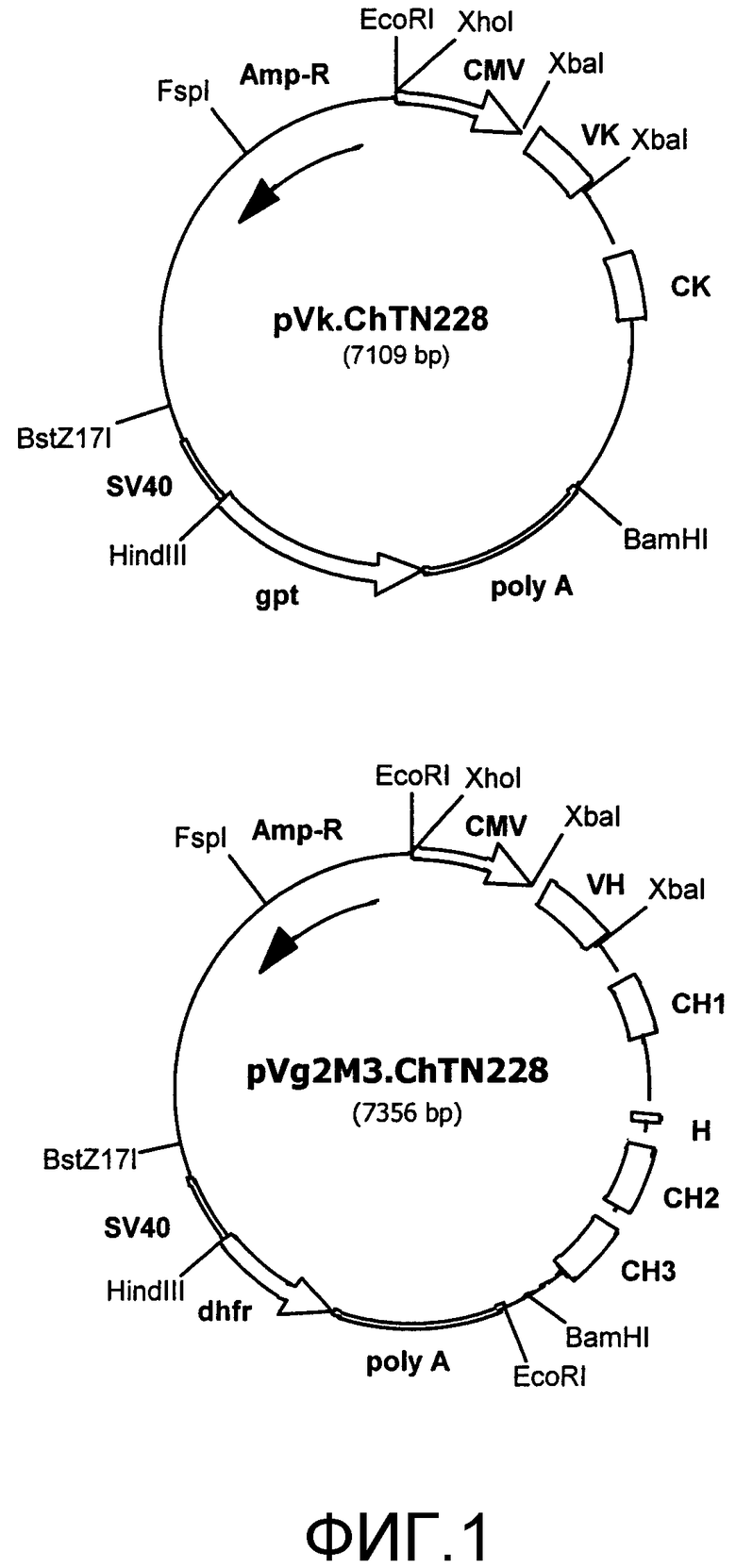
| US 5580756 А, 03.12.1996 | |||
| TAN et al, «Humanization of an Anti-CD28 Antibody...» 2000, v.96, № 11, p.31A. |
Авторы
Даты
2005-10-10—Публикация
2001-12-14—Подача