Изобретение относится к медицинской вирусологии и касается получения быстрорастущего штамма вируса гепатита А (ВГА). Этот штамм может быть использован в профилактических и диагностических целях в медицине.
Известно получение штамма ВГА из клинического материала с последующим выращиванием на культуре клеток AGMK (первичные клетки почки африканской зеленой обезьяны). Такой штамм НМ-175 получен Deamer и соавт. (Патент США №4532215, МПК А61К 39/29, опубл. 30.07.1985). Штамм прошел несколько серийных пассажей.
Однако такой штамм обеспечивает получение заметного количества антигена только после 21 дня культивирования на культуре клеток AGMK при отсутствии цитопатического эффекта. Отсутствие цитопатического эффекта затрудняет технологический контроль за процессом культивирования и предполагает использование трудоемких методов определения концентрации вируса в материале.
Известен штамм ВГА № YN5, адаптированный к клеткам Vero, рекомендуемый для приготовления инактивированных вакцин против ВГА (патент Китая №1443844, МПК С12N 7/01, опубл. 24.09.2003).
Известен отечественный штамм ВГА ГКВ-801 (авторское свид. СССР №1606533, МПК С12N 7/00, опубл. 15.11.1990), нарабатываемый на культуре клеток FRhK-4.
Недостатком указанных штаммов является также отсутствие цитопатического эффекта при их культивировании и длительность культивирования (более 8 суток).
Наиболее близким штаммом-прототипом является штамм ВГА МБ-7, который депонирован под №213 в коллекции Государственного института стандартизации и контроля медицинских и биологических препаратов им. Л.А.Тарасевича (патент РФ №1806190, МПК C12N 7/00, опубл. 30.03.93).
Штамм получен из фекалий больного с клинически выраженными признаками гепатита А в 1988 г. Приготовленную 10% суспензию фекалий на 0,1 М Na-фосфатном буфере (рН 7,4) ресуспендируют, центрифугируют в течение 10 мин при 1500-2000 об/мин. Супернатант фильтруют через фильтр 0,22 мкм (производство Millipore), фасуют по 0,5 мл в стерильные флаконы и хранят при температуре (минус 7,0±0,5)°С. Полученный супернатант используют в качестве инокулята для получения штамма ВГА на клетках FRhK-4. На сформированный монослой клеток FRhK-4 наносят инокулят. После адсорбции в сосуд добавляют ростовую поддерживающую среду. Через неделю после заражения культуральную жидкость сливают, клетки промывают раствором трипсина-версена и отслоившиеся клетки собирают в натрий-солевом фосфатном буфере. Собранные клетки трижды промораживают и клеточный лизат используют в качестве инокулята для следующего пассажа. Уже на втором пассаже в клетках FRhK-4 выявляется антиген. Антиген также выявляется в процессе адаптации полученного штамма к перевиваемой культуре клеток почки зеленой мартышки 4647 и диплоидной культуре клеток легкого человека Л-68.
Недостатком штамма-прототипа является то, что он имеет недостаточную продукцию антигена на тех культурах клеток, к которым он адаптирован, а также достаточно длительное время культивирования (11-12 суток) при наработке вирусного антигена.
Техническим результатом предлагаемого изобретения является создание штамма-продуцента с более высокой продуктивностью антигена ВГА и с более короткими сроками культивирования ВГА, нарабатываемого на культуре клеток, лицензированной для производства вакцин, т.е. разрешенной для использования в производстве иммунопрофилатических средств.
Указанный технический результат достигается созданием штамма virus hepatitis A hominis № Геп А - 293 для приготовления вакцинных и диагностических препаратов, который превосходит штамм-прототип как по продуктивности (количеству инфекционного вируса и вирусспецифического антигена) и по кинетике накопления антигена ВГА, так и по времени культивирования.
Штамм получен путем адаптации штамма-прототипа ВГА МБ-7 к культуре клеток почки эмбриона человека №293. В результате адаптации указанного штамма он приобрел новые свойства, обеспечивающие сокращение сроков культивирования ВГА на 5-6 дней и повышение выхода антигена.
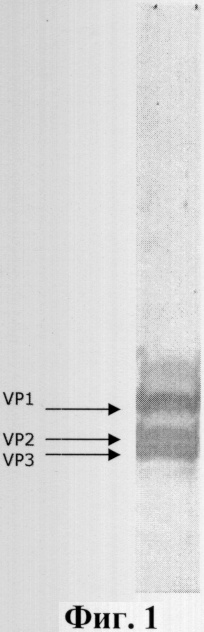
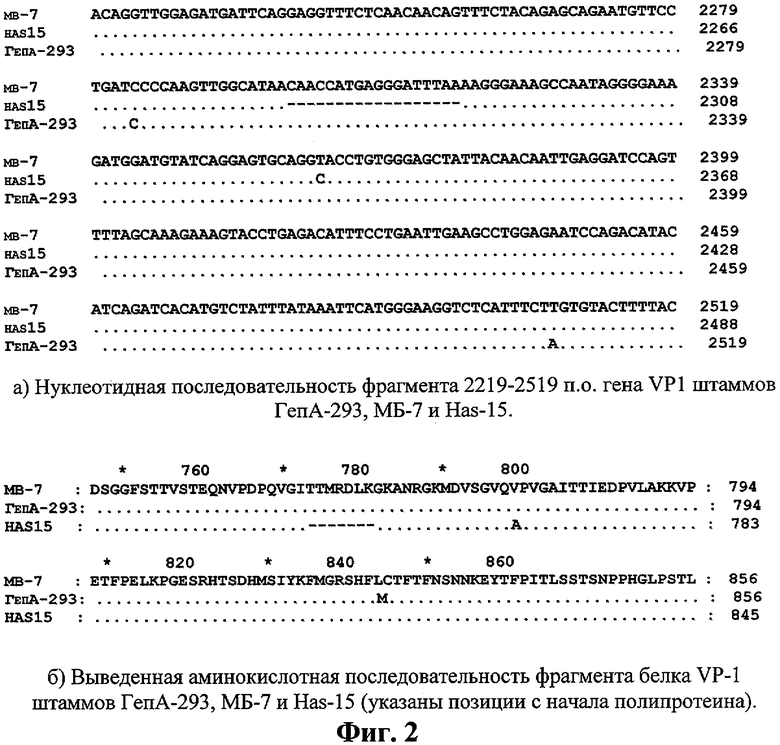
На фиг.1 изображена электрофореграмма иммуноблоттинга клонированного очищенного штамма ГепА-293 со специфичными к ВГА иммуноглобулинами. Вирусные антигены выявляли мышиной антисывороткой в разведении 1/200. На фиг.2 приведено сравнение нуклеотидной последовательности гена белка VP1 штаммов ГепА-293, МБ-7 и Has-15.
Характеристика клеточной культуры 293:
Номер по каталогу американской коллекции клеточных культур АТСС CRL 1573 (American Type Culture Collection Catalogue of Cell Lines and Hybridomas Sixth Edition, 1988, p151). Клетки 293 это трансформированные ДНК аденовируса (Ад5) клетки почки эмбриона человека. Они содержат и экспрессируют трансформирующие гены аденовируса пятого типа, благодаря этому свойству их используют для получения мутантов, дефектных по репликации в нормальных клетках (J.Gen.Virol. 36: 59-72, 1977; Virology 77: 319-329, 1977. Submitted by: F.L Graham, Master University, Hamilton, Ontario, Canada).
Линия клеток 293 поступила в коллекцию НИИКК ФГУП ГНЦВБ «Вектор» из Национального института Здоровья США в 2001 году. В ГНЦ ВБ «Вектор» культура клеток была заморожена на 9-м пассаже после поступления. В 2002 году в ГНЦ ВБ «Вектор» были созданы и паспортизованы рабочий и посевной банки этой клеточной культуры и в 2003 году банки были аттестованы для производства вакцин и препаратов, предназначенных для лечения онкологических больных (протокол №14 от 28.10.03. заседания Ученого Совета ГИСК им. Л.А.Тарасовича; протокол №9 от 20.11.03. Комитета МИБП).
Наличие такого штамма чрезвычайно актуально для разработки эффективной технологии производства инактивированной вакцины против вирусного гепатита А.
Штамм ВГА ГепА-293 депонирован под регистрационным №V-346 в коллекции культур микроорганизмов Государственного научного центра вирусологии и биотехнологии «Вектор» (справка №0705 от 12 июля 2005 г. о депонировании штамма).
Штамм получен из штамма-прототипа ВГА МБ-7 путем его адаптации к культуре клеток 293 (клетки почки эмбриона человека, экспрессирующие гены Е1А и Е1В аденовируса 5-го серотипа). Клетки 293 культивируют как монослойную культуру на среде Игла ДМЕМ (Gibco BRL, Германия), содержащей 5% сыворотки плода коровы (СПК) (Gibco BRL, Германия) с 80 мкг/мл гентамицина сульфата. Адаптацию проводят на растущих клетках, при нарастании клеток 293 до 50% от монослоя на культуральных флаконах 25 см2 (Orange, США) проводят инфицирование с множественностью 1.0 ИД50 штамма МБ-7 на клетку, после адсорбции (1.5 ч при 37°С) клетки инкубируют в среде Игла ДМЕМ с 5% СПК в течение 5-ти суток (клетки формируют монослой), после чего культуральную жидкость сливают, клетки снимают с субстрата раствором Версена-трипсина и ресуспендируют в 1 мл среды Игла ДМЕМ, 2/3 инфицированных клеток отбирают для анализа, а 1/3 высаживают на свежую ростовую среду, клетки дорастают до монослоя, через 5 суток процедуру повторяют. Проводят 5 последовательных пересевов, отобранные после каждого субпассажа суспензии клеток подвергают трехкратному замораживанию-оттаиваниию для освобождения вируса и наличие антигена ВГА определяют методом иммуноферментного анализа (ИФА). Антиген ВГА начинает определяться на третьем субпассаже, а на пятом достигает концентрации 1:64. Визуальные проявления инфекции на протяжении всех субпассажей не выявляются.
Для дальнейшей адаптации вируссодержащей жидкостью, полученной после пяти субпассажей клеток, инфицированных шт. МБ-7 (после трехкратного замораживания-оттаивания отобранных клеток), заражают субконфлюентный монослой клеток 293 (культуральные флаконы, 25 см2) с множественностью 0.1 ИД50/кл. После инкубации в течение 9-ти дней клетки отбирают раствором Версена-трипсина и ресуспендируют в 1 мл среды Игла ДМЕМ, 2/3 клеток отбирают для анализа, а треть вновь высаживают. Титр антигена ВГА составляет 1:128. Проводят еще два аналогичных цикла, титр антигена ВГА достигает значения 1:256. При выполнении очередного субпассажа инфицированные клетки не прикрепляются к субстрату и погибают; вероятно, концентрация вируса в пассируемых клетках достигает уровня, критичного для жизнеспособности клетки. Для наработки адаптированного штамма вируссодержащей суспензией, полученной при проведении предпоследнего субпассажа (предшествующего субпассажу клеток, при котором клетки не прикрепились к субстрату и погибли), проводят инфицирование субконфлюентного монослоя клеток 293 на культуральном флаконе площадью 175 см2 с множественностью заражения 1 ИД50/кл. Через 9 дней после инфицирования клетки отбирают, ресуспендируют в 1 мл среды, проводят 3 цикла замораживания-оттаивания и определяют титр антигена ВГА и инфекционный титр. Титр антигена ВГА составляет 1:2560. Инфекционный титр определяют микрометодом на 96-луночных культуральных планшетах (Costar, США) с клетками 293 и выражают через 50% инфекционную дозу - ИД50. Инфицированные стандартными десятикратными разведениями вируссодержащей суспензии клетки инкубируют в течение 6 суток, после чего клетки из каждой лунки отбирают и треть клеток высаживают на новый планшет (т.е. делают субпассаж клеток из каждой лунки), и инкубируют еще в течение 6 суток. Учет результатов проводят по выявлению антигена ВГА методом ИФА. Титр вируса рассчитывают по методу Кербера. Lg ИД50/мл равняется 8.8.
Полученный в результате адаптации ВГА к культуре клеток 293 штамм ГепА-293 подвергают двум циклам клонирования методом предельных разведений и нарабатывают препаративное количество клонированного вируса. Вируссодержащая суспензия клонированного шт. ГепА-293 с инфекционным титром 9.0 Lg ИД50/мл и содержащая ВГА специфический антиген в титре 1:5120 закладывается на хранение при -70°С.
Штамм характеризуется следующими признаками.
Морфологические признаки. Вирионы шт. ГепА-293 имеют типичную для ВГА морфологию и представляют собой сферические частицы диаметром 25-28 нм. Плавучая плотность вирусных частиц в градиенте хлористого цезия составляет 1.34 г/см3, константа седиментации - 155S, что полностью соответствует физическим характеристикам ранее описанных штаммов ВГА.
Культуральные свойства. Для культивирования штамма ВГА ГепА-293 на клетках 293 используют среду Игла ДМЕМ, содержащую 5% сыворотки плода коровы (СПК) с 80 мкг/мл гентамицина сульфата. В качестве ростовой для клеток используют ту же среду с тем же процентным содержанием фетальной сыворотки и указанными выше концентрациями антибиотиков. При культивировании клеток, инфицированных с большой множественностью (100-10 ИД50/кл), отмечается цитопатическое воздействие вируса на клетки: клетки не формируют сливной монослой, появляется токсическая зернистость, клетки округляются и основная масса клеток отслаивается от субстрата к 6-7 суткам после инфицирования; при заражении с меньшей множественностью визуальных проявлений инфекции не отмечается.
Репликативные свойства шт. ГепА-293. Клетки 293 и 46-47 (диплоидная культура клеток почки зеленой мартышки, лицензированная для использования в производстве вакцин) на культуральных 96-луночных микропланшетах инфицируют с одинаковой множественностью шт. ГепА-293 и МБ-7. После адсорбции клетки отмывают и инкубируют при 37°С в атмосфере, содержащей 5% СО2. Клетки для определения содержания антигена ВГА отбирают на 0, 4, 5, 6, 7 и 10-е сутки после инфицирования (по 4 лунки с монослоем на каждую точку, клетки из каждой лунки трехкратно замораживают-оттаивают в 50 мкл среды, клеточные лизаты из 4-х лунок объединяют, центрифугируют и полученные супернатанты анализируют в ИФА). Результаты представлены в таблице. Для шт. ГепА-293 максимальная концентрация антигена определяется на 6-7 сутки. Штамм-аналог МБ-7 на культуре 293 антиген ВГА не продуцирует. На культуре клеток 46-47 достоверных отличий между ГепА-293 и МБ-7 по продукции антигена не отмечено. Кинетика накопления антигена в клетках 293, инфицированных ГепА-293, значительно опережает таковую в клетках 46-47, инфицированных исходным МБ-7 либо ГепА-293. В инфицированных ГепА-293 клетках 293 продукция антигена достигает значительного уровня уже к 5-м суткам после заражения, максимальные значения отмечаются на 6-7 сутки. На культуре 46-47, инфицированных той же дозой МБ-7 или ГепА-293, на 7 сутки концентрация антигена, по крайней мере, на порядок меньше, максимального значения концентрация продуцированного антигена достигает к 12-м суткам.
Для сравнения продуктивности штаммов ГепА-293 и МБ-7 проводят инфицирование культур клеток 293 и 46-47 соответственно в идентичных условиях (культуральные флаконы 175 см2, множественность заражения 1 ИД50/кл). Ифицированные клетки отбирают в сроки, когда концентрация вирусспецифического антигена достигает максимального значения на соответствующей культуре (клетки 293, инфицированные шт. ГепА-293, через 6 суток после заражения, клетки 46-47, зараженные шт. МБ-7, через 12). В полученных клеточных лизатах (клетки ресуспендируют в 1 мл среды и трехкратно замораживают-оттаивают) определяют титры вирусспецифического антигена и инфекционные титры. Титры антигена ВГА в клетках 293 и 46-47, инфицированных шт. ГепА-293 и МБ-7, составили 1:2560 и 1:640 соответственно, инфекционные тиры 8.8 Lg ИД50/мл и 7.0 Lg ИД50/мл соответственно. Инфекционный титр шт. ГепА-293 определяют на культуре 293 (как описано выше), титр шт. МБ-7 определяют микрометодом на 96-луночных культуральных планшетах с культурой клеток 46-47, учет результатов проводят по выявлению антигена ВГА методом ИФА через 12 суток после инфицирования. Таким образом, шт. ГепА-293 при культивировании на культуре клеток 293 значительно превосходит штамм-аналог МБ-7 при культивировании на клетках 46-47 как по продуктивности (количества инфекционного вируса и вирусспецифического антигена), так и по кинетике накопления антигена ВГА.
Иммуногенные свойства. С целью исследования иммуногенных свойств адаптированного к 293 клеткам шт. МБ7 проводят иммунизацию мышей, шт. ГепА-293 вводят внутрибрюшинно, трехкратно (на 0, 14 и 21 сутки, первая иммунизация с полным адъювантом Фрейнда), в дозе 5×107 ЕД50. Кровь забирают на 7 сутки после последнего введения, наличие специфичных к ВГА антител в сыворотке крови определяют в ИФА и реакции нейтрализации. При постановке ИФА в качестве антигена используют как ГепА-293, так и шт. МБ-7. Титр анти ВГА антител в обоих случаях составляет 1:100000. Реакцию нейтрализации проводят микрометодом с использованием специфичных к ВГА и нормальных мышиных иммуноглобулинов. В течение 1.5 ч стандартные 10-ти кратные разведения шт. ГепА-293 и МБ-7 в равных объемах инкубируют с иммуноглобулинами в разведении 1:50, после чего по 0.1 мл каждого комплекса вносят в лунки 96-луночной планшеты с культивированными клетками 46-47. После адсорбции (1.5 ч при 37°С) клетки отмывают и инкубируют при 37°С в атмосфере, содержащей 5% СО2, в течение 12 дней, учет проводят по выявлению антигена ВГА методом ИФА. Результаты реакции нейтрализации выражают через индекс нейтрализации (ИН), иммуноглобулины мышей, иммунизированных ГепА-293, нейтрализовали шт. МБ-7 и шт. ГепА-293 с lgИН, равным - 4.0. Полученные данные свидетельствуют, что шт. ГепА-293 является высокоиммуногенным и что он сохраняет антигенные свойства шт. МБ-7.
Для выявления структурных белков ВГА в препарате очищенного клонированного штамма ГепА-293 и их взаимодействия со специфичными к ВГА иммуноглобулинами, а также для оценки степени чистоты выполняют гель-электрофорез с последующим иммуноблоттингом вирусных белков со специфичными к ВГА мышиными иммуноглобулинами. Результаты представлены на Фиг.1. При проведении иммуноблоттинга выявили 3 доминантных белка, соответствующих по молекулярной массе белкам ВГА VP1 (34000), VP2 (25500) и VP3 (23000). Препарат очищенного ГепА-293 содержит все структурные белки ВГА, вирусные белки эффективно взаимодействуют с иммуноглобулинами, специфичными к ВГА.
С целью молекулярно-биологического исследования штамма ГепА-293 и генетического подтверждения его принадлежности к ВГА проводят ПЦР - анализ кДНК, полученной на матрице вирусной РНК и частичное секвенирование генома. Вирусную РНК выделяют обработкой протеиназой К в концентрации 500 мг/мл при 37°С в течение 30 мин с последующей депротеинизацией фенолом. кДНК синтезируют с помощью статистического гексануклеотида 5'-N6-3'. Методом ПЦР с использованием соответствующей пары олигонуклеотидных праймеров амплифицируют фрагмент гена белка VP1 ВГА длиной 300 нуклеотидов. Полученный фрагмент очищают с использованием набора SNAP Gel Purification Kit 1(Invitrogen) и секвенируют на Beckman Coulter SEQ 2000XL DNA Analysis System. Анализ нуклеотидной последовательности фрагмента гена VP1 шт. ГепА-293 выявил наличие 2 нуклеотидных замен по отношению к последовательности прототипного шт. МБ-7, одна из которых приводит к аминокислотной замене Leu→Met в позиции 259 белка VP1 (Фиг. 2). В остальном последовательность анализируемого фрагмента гена VP1 шт. ГепА-293 полностью идентична последовательности соответствующей области генома шт. МБ-7, включая наличие 18 нуклеотидов, отсутствующих в последовательности шт. HAS 15. Данное исследование подтвердило подлинность шт. ГепА-293 (принадлежность к ВГА и происхождение от прототипного шт. МБ-7) и выявило наличие точечных замен в составе гена VP1, приобретенных в процессе адаптации к культуре клеток 293.
Таким образом, адаптированный к культуре клеток 293 штамм ВГА ГепА-293 обладает быстрорастущим фенотипом (сокращение сроков культивирования ВГА на 5-6 дней) и при культивировании на клетках 293 значительно превосходит по продуктивности (количества продуцированного инфекционного вируса и вирусспецифического антигена) и по кинетике накопления антигена ВГА штамм-аналог МБ-7 при культивировании на другой, разрешенной к использованию в производстве вакцинных препаратов культуре клеток 46-47 (шт. МБ-7 на клетках 293 не реплицируется). Штамм ГепА-293 по морфологическим, физическим и антигенным свойствам не отличается от прототипного штамма МБ-7 и естественно циркулирующего в природе ВГА.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ВИРУСА ГЕПАТИТА А ДЛЯ ПРИГОТОВЛЕНИЯ ВАКЦИННЫХ И ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ | 2008 |
|
RU2405037C2 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ВИРУСА ГЕПАТИТА А | 2009 |
|
RU2404804C2 |
| Штамм VIRUS нератIтIS А номINIS для приготовления вакцинных и диагностических препаратов | 1991 |
|
SU1806190A3 |
| ШТАММ О №2102/Забайкальский/2010 ВИРУСА ЯЩУРА Aphtae epizooticae ТИПА О ДЛЯ КОНТРОЛЯ АНТИГЕННОЙ И ИММУНОГЕННОЙ АКТИВНОСТИ ПРОТИВОЯЩУРНЫХ ВАКЦИН И ДЛЯ ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ И СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ЯЩУРА ТИПА О | 2014 |
|
RU2563522C1 |
| Штамм вируса гепатита А для накопления биомассы, используемой для приготовления профилактических и диагностических препаратов | 1987 |
|
SU1474171A1 |
| ШТАММ ЭНТЕРОВИРУСА А71 ТИПА СУБГЕНОТИПА С4, ИСПОЛЬЗУЕМЫЙ ДЛЯ ДИАГНОСТИКИ И ИЗУЧЕНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2014 |
|
RU2565811C1 |
| ВИРУСНЫЕ ВАКЦИНЫ | 2003 |
|
RU2268067C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГЕПАТИТА А | 2006 |
|
RU2314125C1 |
| ШТАММ А 2045/КИРГИЗИЯ/2007 ВИРУСА ЯЩУРА Aphtae epizooticae ТИПА А ДЛЯ КОНТРОЛЯ АНТИГЕННОЙ И ИММУНОГЕННОЙ АКТИВНОСТИ ПРОТИВОЯЩУРНЫХ ВАКЦИН И ДЛЯ ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ И СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ЯЩУРА ТИПА А | 2010 |
|
RU2451745C2 |
| Штамм О N 2212/Приморский/2014 вируса ящура Aphtae epizooticae типа О для контроля антигенной и иммуногенной активности противоящурных вакцин и для изготовления биопрепаратов для диагностики и специфической профилактики ящура типа О | 2016 |
|
RU2650768C1 |
Изобретение относится к биотехнологии. Штамм virus hepatitis A hominis № Геп А-293 депонирован в Коллекции культур микроорганизмов Государственного научного центра вирусологии и биотехнологии «Вектор» и зарегистрирован под № V-346. Штамм превосходит штамм-прототип как по продуктивности (количеству инфекционного вируса и вируспецифического антигена) и по кинетике накопления антигена вируса гепатита А, так и по времени культивирования. 2 ил., 1 табл.
Штамм virus hepatitis A hominis № Геп А-293 для приготовления вакцинных и диагностических препаратов, депонированный в Коллекции культур микроорганизмов Государственного научного центра вирусологии и биотехнологии "Вектор" и зарегистрированный под № V-346.
| Штамм VIRUS нератIтIS А номINIS для приготовления вакцинных и диагностических препаратов | 1991 |
|
SU1806190A3 |
| Штамм вируса гепатита А для приготовления диагностических препаратов | 1988 |
|
SU1606533A1 |
| Устройство для бездуговой коммутации электрической цепи | 1984 |
|
SU1164799A1 |
| US 4532215 A, 30.07.1985. | |||
Авторы
Даты
2007-09-20—Публикация
2005-09-09—Подача