Область техники
Изобретение относится к области органической химии, а именно к гетероциклическим соединениям, которые могут найти применение в качестве медицинских препаратов.
Уровень техники
Известен способ получения трициклических производных бензо-1,4-тиазин-1,6-диоксидов на основе 3,6-бис(винилсульфонил)-1,2,4,5-тетрафторбензола (Амосова С.В., Гостевская В.И., Гаврилова Г.М. и др., Химия гетероц. соедин., 1996, №9, с.1195-1198) [1], (Амосова С.В., Гостевская В.И., Гаврилова Г.М. и др. Изв. АН. Сер. Хим., 1996, №2, с.430-433) [2] с использованием в качестве промежуточного продукта 3,6-бис(винилсульфида)-1,2,4,5-тетрафторбензола, получаемого из гексафторбензола и натрийвинилсульфида.
Способ имеет очевидные недостатки, заключающиеся в том, что при синтезе этого базового вещества используются опасные соединения, служащие постоянными источниками чрезвычайных происшествий в лабораториях и на производстве: ацетилен, сероводород, дивинилсульфид, металлический натрий и жидкий аммиак (Амосова С.В., Гостевская В.И., Гаврилова Г.М. и др. Ж. орган. хим., 1992, 28 (7), 1463-1466) [3], (Гаврилова Г.М., Амосова С.В. Рос. хим. ж. (Ж. Рос. хим. об-ва им.Д.И.Менделеева), 2005, т.XLIX, №6. с.69-76) [4].
Ключевой стадией этого способа является процесс приготовления натрийвинилсульфида, который синтезируют из дивинилсульфида и металлического натрия в жидком аммиаке. Использование в качестве растворителя жидкого аммиака ограничивает температуру проведения реакций температурой кипения самого растворителя (-36°С). Дивинилсульфид также ядовит, он не является товарным продуктом, способ его производства проблематичен, стадию его получения также необходимо включать в общую схему известного процесса. Далее 3,6-бис(винилсульфид)-1,2,4,5-тетрафторбензол окисляют до 3,6-бис(винилсульфон)-1,2,4,5-тетрафторбензола, который вовлекают в циклизацию с первичными аминами. Способ ограничен получением лишь спонтанно образующимися при повышенной температуре трициклическими соединениями. Суммарный выход пятистадийного способа получения циклических продуктов невысок. Указанные недостатки существенно сужают сферу применения известного способа даже в лабораторной практике, патенты на основе этого способа нами не обнаружены.
Отметим, что 1,4-пиридотиазин-1,1-диоксиды по этому способу получены не были [4], другие, традиционные способы синтеза циклических сульфонов также относятся к производным бензольного, но не пиридиниевого ряда (Лозинский М.О., Демченко A.M., Шиванюк А.Ф. «Избранные методы синтеза и модификации гетероциклов». / Под ред. Карцева В.Г. М.: IBS PRESS, 2003, т.2, с.305-334) [5].
Известно, что именно гетероциклические соединения, в том числе и производные пиридина, выступают в качестве наиболее перспективных объектов для поиска среди них лекарственных препаратов, наличие атомов фтора в молекуле также повышает их потенциальную фармакологическую значимость [4].
Задача изобретения
Задачей изобретения является создание способа получения новых гетероциклических соединений пиридиниевого ряда, более технологичного, безопасного и дешевого.
Поставленная задача решена созданием способа получения нового класса веществ - бициклических 1,4-пиридотиазин-1,1-диоксидов общей формулы
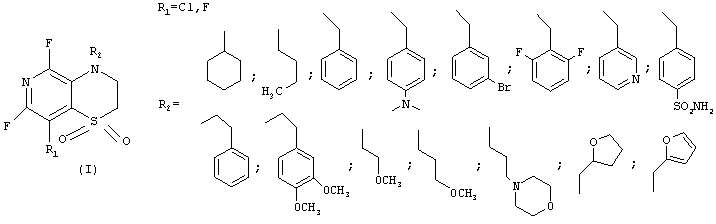
где R1 - атом фтора или хлора, R2 - разветвленный или неразветвленный алкил, циклоалкил, восстановленный или не восстановленный арил или гетероарил, не обязательно замещенные кислород- и (или) азотсодержащими фрагментами, одним или несколькими атомами галогенов, заключающегося в использовании ациклических сульфонов общей формулы (II)
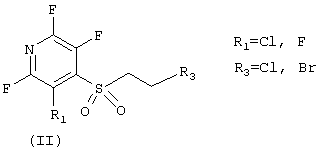
где R1 - атом фтора или хлора, R3 - атом хлора или брома, в реакции с первичными аминами, желательно в присутствии неорганических или органических оснований, лучше карбонатов или гидроокисей щелочных металлов, третичных органических аминов или смесей оснований, не обязательно в среде растворителей, лучше - в апротонных биполярных средах, их смесях между собой или водой.
Описание способа
Способ предполагает стадию получения ациклических сульфонов общей формулы (II), которая проходит в три последовательные стадии (схема 1).
Схема 1:
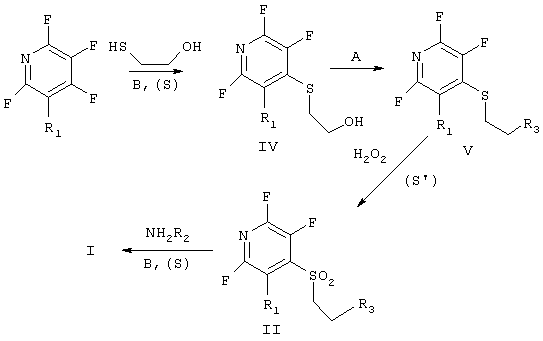
В - основание; (S) - растворитель; А - HBr, SOCl2;
(S') - органическая кислота или ее ангидрид; R3 - Cl, Br.
На первой стадии получают соответствующие сульфиды (IV), при этом используют товарные меркаптоэтанол и полигалоидированые пиридины (пентафторпиридин, 3-хлор-2,4,5,6-тетрафторпиридин) в присутствии неорганических или органических оснований, третичных органических аминов или смесей оснований, не обязательно в среде растворителей, лучше - в апротонных биполярных средах, их смесях между собой или водой.
Далее остаток меркаптоэтанола превращают в реакционноспособный фрагмент - SCH2CH2R3 (R3 - атомы хлора или брома) путем обработки сульфидов (IV) HBr или SOCl2 в присутствии пиридина - по известным, простым и безопасным лабораторным методикам. На последней стадии сульфиды (V), содержащие вышеупомянутые реакционные фрагменты, вовлекают в реакции окисления в присутствии Н2O2 и органической кислоты или ее ангидрида.
Все стадии процесса осуществляются в безопасных условиях, с доступными товарными реагентами, выходы промежуточных (IV, V, II) продуктов не менее 70%.
Конечные стадии формирования 1,4-пиридотиазин-1,1-диоксидов (I) протекают при комнатной температуре в результате взаимодействия ациклических сульфонов (II) с эквимолярными количествами первичных аминов в органическом растворителе.
Примеры осуществления способа
Синтез ациклических сульфонов общей формулы (II)
Синтез 4-(2-Бром-этилсульфонил)-2,3,5,6-тетрафторпиридина
Стадия 1 (схема 1)
К раствору пентафторпиридина (5.4 г, 0.0319 моль) в 25 мл CH3CN, охлажденному до 0°С. прибавляли меркаптоэтанол (2.49 г, 0.0319 моль). Далее в течение 30 минут при перемешивании и охлаждении на ледяной бане прикапывали триэтиламин (3.23 г, 0.0319 моль). После прибавления триэтиламина реакционную массу выдерживали при комнатной температуре 1 час. Окончание реакции фиксировали при помощи ТСХ (гексан:этилацетат, 2:1) и ЯМР 19F. В реакционную массу добавляли NaHCO3 (2.95 г, 0.0351 моль) и упаривали при пониженном давлении до образования маслянистого продукта. Полученный продукт промывали CHCl3, фильтровали через бумажный фильтр, фильтрат упаривали. Получали 7.184 г индивидуального маслянистого продукта (выход 98% в расчете на пентафторпиридин). 1Н-ЯМР (CDCl3, δ, м.д.): 2.38 (уш. с, 1Н, ОН); 2.75 (м, 2Н, CH2-О); 3.25 (м, 2Н, CH2-S). 19F-ЯМР (CDCl3, δ, м.д.): 24.72 (м, 2F, F-3, F-5); 71.23 (м, 2F, F-2, F-6).
Стадия 2 (схема 1)
К продукту, выделенному на первой стадии (4.11 г, 0.0181 моль), прибавляли HBr (14.64 г, 0.181 моль, 47%-ный раствор). Полученную смесь нагревали с обратным холодильником на песчаной бане в течение 8 часов при 170°С. Окончание реакции контролировали при помощи ТСХ (CHCl3) по исчезновению пятна исходного продукта. Реакционную массу разбавляли 15 мл Н2O и экстрагировали CHCl3 (2×30 мл). Экстракт сушили MgSO4, отфильтровывали и упаривали. Получали 4.54 г маслянистого продукта (выход 82%). 1Н-ЯМР (CDCl3, δ, м.д.): 2.98 (м, 4Н, S-СН2-СН2-Br). 19F-ЯМР (CDCl3, δ, м.д.): 24.95 (м, 2F, F-3, F-5); 72.24 (м, 2F, F-2, F-6).
Стадия 3 (схема 1)
Продукт, выделенный на второй стадии (1.18 г, 0.004 моль), растворяли в 5 мл CF3СООН. К полученному раствору прикапывали Н2О2 (2.76 г, 0.0284 моль, 35%-ный раствор) и выдерживали 24 часа при комнатной температуре. Реакционную массу охлаждали, выпавший осадок отфильтровывали, промывали Н2О, сушили сначала на воздухе, затем в вакууме водоструйного насоса над NaOH. Получали 1.18 г (выход 90%) индивидуального продукта. Осадок кристаллизовали из CHCl3, получали 0.86 г кристаллического продукта с Тпл.=138-139°C. Элементный анализ. Найдено: С 26.33, 26.48; Н 1.39, 1.47; F 24.36, 23.63; Br 25.36, 25.61; N 4.7; S 9.88, 10.16. C7H4BrF4NO2S. Вычислено: С 26.10; Н 1.25; Br 24.81; F 23.60; N 4.35; 0 9.94; S 9.96. 1Н-ЯМР (CDCl3, δ, м.д.): 1.13 (м, 2Н, СН2-Br); 3.35 (м, 2Н, СН2-SO2). 19F-ЯМР (CDCl3, δ, м.д.): 26.09 (м, F-3, F-5); 78.24 (м, 2F, F-2, F-6).
Синтез бициклических 1,4-пиридотиазин-1,1-диоксидов общей формулы (I)
Пример 1. Синтез 5,7,8-Трифтор-4-(3-метоксипропил)-3,4-дигидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксида
К раствору 4-(2-Бром-этилсульфонил)-2,3,5,6-тетрафторпиридина (1 г, 0.0031 моль) в 10 мл ДМФА прибавляли 3-метоксипропиламин (0.2796 г, 0.0031 моль) и триэтиламин (0.6598 г, 0.0065202 моль). Реакционную массу выдерживали 1.5 часа при комнатной температуре и перемешивании.
Контроль за прохождением реакции осуществляли при помощи ТСХ (гексан:этилацетат, 1:1) и ЯМР 19F.
Реакционную массу выливали при перемешивании в холодный насыщенный водный раствор Na2СО3. Выпавший осадок отфильтровывали, промывали дистиллированой Н2О, сушили сначала на воздухе, затем в вакууме водоструйного насоса над NaOH. Получали 0.83 грамма индивидуального по ТСХ продукта, выход - 86.8% в расчете на 4-(2-Бром-этилсульфонил)-2,3,5,6-тетрафторпиридин. Осадок кристаллизовали из этанола, получали 0.53 г кристаллического продукта.
Элементный анализ. Найдено: С 42.99, 42.74; Н 4.33, 4.06; F 18.09, 18.41; N 9.32; S 10.97, 10.56. С11H13F3N2O3S. Вычислено: С 42.58; Н 4.22; F 18.37; N 9.03; S 10.33. 1Н-ЯМР (CDCl3, δ, м.д.): 1.83 (м, 2Н, СН2-СН2-СН2-O); 3.21 (с, 3Н, СН3-O); 3.31-3.53 (м, 6Н, CH2-N-CH2, СН2-O); 3.79 (м, 2Н, CH2-SO2). 19F-ЯМР (CDCl3, δ, м.д.): 18.32 (м. 1F, F-8); 62.20 (м, 1F, F-7); 89.26 (м, 1F, F-5). Тпл.=76°С.
Пример 2. Синтез 8-Хлор-5,7-дифтор-4-(3-метоксипропил)-3,4-дигидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксида
К раствору 4-(2-Бром-этилсульфонил)-3-хлор-2,5,6-трифторпиридина (2.97 г, 0.00877 моль) в 25 мл ДМФА прибавляли 3-метоксипропиламин (0.78 г, 0.00877 моль) и триэтиламин (1.86 г, 0.01842 моль). Реакционную массу выдерживали 18 ч при комнатной температуре и перемешивании.
Контроль за прохождением реакции осуществляли при помощи ТСХ (гексан:этилацетат, 3:1) и ЯМР 19F.
Реакционную массу выливали при перемешивании в холодный насыщенный водный раствор Na2СО3. Выпавший маслянистый осадок отфильтровывали, промывали дистиллированой Н2О, сушили сначала на воздухе, затем в вакууме водоструйного насоса над NaOH. Получали 2.05 грамма индивидуального по ТСХ продукта, выход - 72% в расчете на 4-(2-Бром-этилсульфонил)-3-хлор-2,5,6-трифторпиридин. Осадок кристаллизовали два раза из этанола, получали 0.85 г кристаллического продукта, Тпл.=87-88°С.
Элементный анализ. Найдено: С 40.97, 40.63; Н 4.11, 4.28; Cl 10.63, 11.09; F 11.77, 11.58; N 8.45; S 9.95, 10.23. C11H13ClF2N2O3S. Вычислено: С 40.43; Н 4.01; Cl 10.85; F 11.63; N 8.57; S 9.81.
1H-ЯМР (CDCl3, δ, м.д.): 1.91 (м, 2Н, СН2-CH2-CH2-О); 3.29 (с, 3Н, СН3-O): 3.35-3.52 (м, 6Н, CH2-N-CH2, СН2-О); 3.83 (м, 2Н, СН2-SO2).
19F-ЯМР (CDCl3, δ, м.д.): 79.21 (д, 1F, F-7); 91.94 (д, 1F, F-5)
Ниже приводятся характеристики полученных по аналогичным методикам следующих бициклических 1,4-пиридотиазин-1,1-диоксидов, выходы продуктов составили от 70% до 90%.
4-Бензил-5,7,8-трифтор-3,4-дигидро-2Н-пиридо[43-b][1,4]тиазин-1,1-диоксид
Найдено: С 51.43, 51.77; Н 3.59, 3.26; F 17.40, 17.52; N 8.61; S 10.04, 10.13. C14H11F3N2O2S. Вычислено: С 51.22; Н 3.38; F 17.36; N 8.53; S, 9.77.
1Н-ЯМР (CDCl3, δ, м.д.): 3.54 (м, 2Н, CH2-SO2); 3.75 (м, 2Н, СН2-N); 4.54 (с, 2Н, N-CH2-Ph); 7.34 (м, 5Н, СН2-Ph).
19H-ЯМР (CDCl3, δ, м.д.): 16.65 (м, 1F, F-8); 62.78 (м, 1F, F-7): 90.04 (м, 1F, F-5). Тпл.=91-92°С.
5,7,8-Трифтор-4-пиридин-3-илметил-3,4-дигидро-2Н-пиридо[4,3-b][1,4]-тиазин-1,1-диоксид
Найдено: С 47.43, 47.76; Н 3.43, 3.28; F 17.52, 17.47; N 12.61; S 9.66, 9.54. C13H10F3N3O2S. Вычислено: С 47.42; Н 3.06; F 17.31; N 12.26; S 9.74.
1Н-ЯМР (CDCl3, DMSO-D6 δ, м.д.): 3.74 (м, 4Н, N-CH2-CH2-SO2); 4.57 (с, 2Н, СН2-Ру); 7.36 (м, 1Н, Н-5'); 7.80 (д, 1Н, Н-4'); 8.56 (д, 2Н, Н-3', Н-4').
19F-ЯМР (CDCl3, DMSO-D6 δ, м.д.): 16.49 (м, 1F, F-8); 61.94 (м, 1F, F-7); 89.17 (м, 1F, F-5). Тпл.=151-152°С.
5,7,8-Трифтор-4-(тетрагидрофуран-2-илметил)-3,4-дигидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксид
Найдено: С 45.12, 44.91; Н 3.93, 4.18; F 17.49, 17.75; N 8.70; S 10.11, 10.06. C12H13F3N2O3S. Вычислено: С 44.72; Н 4.07; F 17.68; N 8.69; S 9.95.
1Н-ЯМР (CDCl3, δ, м.д.): 1.35-1.64 (м, 2Н, Н-3'); 1.79-2.16 (м, 2Н, Н-4'); 3.07-3.53 (м, 2Н, СН-CH2-N); 3.61-4.22 (м, 7Н, N-CH2-CH2-SO2, СН2-O, СН-O).
19F-ЯМР (CDCl3, δ, м.д.): 18.59 (м, 1F, F-8); 62.38 (м, 1F, F-7); 90.45 (м, 1F, F-5). Тпл.=106-107°С.
5,7,8-Трифтор-4-фуран-2-илметил-3,4-дигидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксид
Найдено: С 45.37, 45.61; Н 2.88, 2.99; F 17.72, 17.87; N 8.73; S 9.92, 10.04. C12H9F3N2O3S. Вычислено: С 45.28; Н 2.85; F 17.91; N 8.80; S 10.07.
1Н-ЯМР (CDCl3, δ, м.д.): 3.23 (м, 2Н, CH2-N); 3.94 (м, 2Н, CH2-SO2); 4.55 (с, 2Н, N-CH2-C); 6.30 (м, 2Н, Н-3', Н-4'); 7.36 (с, 1Н, Н-5').
19F-ЯМР (CDCl3, δ, м.д.): 18.58 (м, 1F, F-8); 64.86 (м, 1F, F-7); 91.73 (м, 1F, F-5). Тпл.=76-78°С.
5,7,8-Трифтор-4-(2-метоксиэтил)-3,4-дигидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксид
Найдено: С 40.63, 40.88; Н 3.82, 3.97; F 19.27, 19.45; N 9.61; S 10.69, 10.84. C10H11F3N2O3S. Вычислено: С 40.54; Н 3.74; F 19.24; N 9.46; S 10.82.
1Н-ЯМР (CDCl3, δ, м.д.): 3.31 (с, 3Н, СН3-O); 3.51 (м, 4Н, CH2-N-СН2); 3.62 (м, 2Н, СН2-O); 3.95 (м, 2Н, CH2-SO2).
19F-ЯМР (CDCl3, δ, м.д.): 18.64 (м, 1F, F-8); 62.82 (м, 1F, F-7); 89.94 (м, 1F, F-5). Tпл.=78°C.
4-Бутил-5,7,8-трифтор-3,4-дигидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксид
Найдено: С 44.97, 45.01; Н 4.50, 4.73; F 19.24, 19.57; N 9.40; S 11.23, 11.12. C11H13F3N2O2S. Вычислено: С 44.89; Н 4.45; F 19.37; N 9.52; S 10.90.
1Н-ЯМР (CDCl3, δ, м.д.): 0.86 (т, 3Н, Н-4', J4'з'7.3); 1.27 (м, 2Н, H-3' J3'4'7.4); 1.54 (м, 2Н, Н-2'); 3.25 (м, 2Н, Н-1'); 3.27 (м, 2Н, CH2-N); 3.76 (м, 2Н, CH2-SO2).
19F-ЯМР (CDCl3, δ, м.д.): 18.34 (м, 1F, F-8); 62.27 (м, 1F, F-7); 89.53 (м, 1F, F-5). Тпл.=102-103°C.
4-(5,7,8-Трифтор-1,1-диоксо-2,3-дигидро-1H-1λ6-пиридо[4,3-b][1,4]тиазин-4-илметил)-бензилсульфамид
Найдено: С 41.44, 41.56; Н 2.99, 3.03; F 13.75, 14.23; N 10.36; S 15.92, 16.11. C14H12F3N3O4S2. Вычислено: С 41.28; Н 2.97; F 13.99; N 10.31; S 15.74.
1Н-ЯМР (DMSO-D6, δ, м.д.): 3.65 (с, 4Н, N-CH2-CH2-SO2); 4.55 (с, 2Н, N-CH2-Ph); 7.13 (с, 2Н, NH2-SO2); 7.44 (д, 2Н, H-3',5'-Ph); 7.79 (д, 2Н, H-2-′,6'-Ph).
19F-ЯМР (DMSO-D6, δ, м.д.): 16.81 (м, 1F, F-8); 62.09 (м, 1F, F-7); 89.03 (м, 1F, F-5). Тпл.=201-202°С.
(5,7,8-Трифтор-1,1-диоксо-2,3-дигидро-1H-1λ6-пиридо[4,3-b][1,4]-тиазин-4-ил)-уксусная кислота, этиловый эфир
Найдено: С 40.82, 41.36; Н 3.73, 3.61; F 17.67, 17.73; N 8.92; S 10.03. 10.14. C11H11F3N2O4S. Вычислено: С 40.74; Н 3.42; F 17.58; N 8.64; S 9.89.
1Н-ЯМР (CDCl3, δ, м.д.): 1.25 (т, 3Н, СН3-CH2-О); 3.59 (м, 2Н, CH2-N); 3.94 (м, 2Н, СН2-SO2): 4.14-4.37 (м, 4Н, N-CH2-СОО,О-CH2).
19F-ЯМР (CDCl3, δ, м.д.): 18.67 (м, 1F, F-8); 63.70 (м, 1F, F-7); 88.28 (м, 1F, F-5). Тпл.=78-79°С.
8-Хлор-5,7-дифтор-4-пиридин-3-илметил-3,4-дигидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксид
Найдено: С 45.51, 45.26; Н 3.07, 3.06; Cl 10.36, 10.53; F 11.29, 11.18; N 12.20; S 9.31. 9.53. C13H10ClF2N3O2S. Вычислено: С 45.16; Н 2.92; Cl 10.25; F 10.99; N 12.15; S 9.27.
1Н-ЯМР (CDCl3, DMSO-D6, δ, м.д.): 3.71 (м, 4Н, N-CH2-CH2-SO2); 4.53 (м, 2Н, N-CH2-Py); 7.35 (м, 1Н, H-5'-Py); 7.81 (м, 1Н, H-6'-Py); 8.54 (м, 1Н, H-2'-Py); 8.62 (с, 1Н, H-4'-Py).
19F-ЯМР (CDCl3, DMSO-D6, δ, м.д.): 79.96 (д, 1F, F-7); 91.67 (д, 1F, F-5). Тпл.=170-171°С.
8-Хлор-5,7-дифтор-4-(тетрагидрофуран-2-илметил)-3,4-дегидро-2Н-пиридо[4,3-b][1,4]тиазин-1,1-диоксид
Найдено: С 41.87, 42.39; Н 3.92, 3.89; Cl 10.63, 10.46; F 11.31, 11.43; N 8.28; S 9.56, 9.69. C12H13ClF2N2O3S. Вычислено: С 42.55; Н 3.87; Cl 10.47; F 11.22; N 8.27; S 9.47.
1Н-ЯМР (CDCl3, δ, м.д.): (CDCl3, δ, м.д.): 1.35-1.62 (м, 2Н, Н-3'); 1.76-2.15 (м, 2Н, Н-4'); 3.05-3.54 (м, 2Н, СН-CH2-N); 3.62-4.19 (м, 7Н, N-CH2-CH2-SO2, СН2-O, СН-O).
19F-ЯМР (CDCl3, δ, м.д.): (CDCl3, δ, м.д.): 79.37 (д, 1F, F-7); 93.01 (д, 1F, F-5). Тпл.=115-116°С.
Приведенные примеры подтверждают получение заявляемого класса соединений - бициклических 1,4-пиридотиазин-1,1-диоксидов общей формулы (I).
Предлагаемые новые соединения могут найти применение в качестве препаратов для медицины и сельского хозяйства, а также служить промежуточными продуктами для получения большого числа производных путем замещения в них нуклеофильно подвижных атомов фтора.
Использованные источники информации
1. Амосова С.В., Гостевская В.И., Гаврилова Г.М. и др. Химия гетероц. соедин., 1996, №9, с.1195-1198.
2. Амосова С.В., Гостевская В.И., Гаврилова Г.М. и др. Изв. АН. Сер. Хим., 1996, №2, с.430-433.
3. Амосова С.В., Гостевская В.И., Гаврилова Г.М. и др. Ж. орган, хим., 1992, 28 (7), 1463-1466.
4. Гаврилова Г.М., Амосова С.В. Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева), 2005, т.XLIX, №6, с.69-76.
5. Лозинский М.О., Демченко A.M., Шиванюк А.Ф. «Избранные методы синтеза и модификации гетероциклов». Под ред. Карцева В.Г. М.: IBS PRESS, 2003. т.2, с.305-334.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФТОРИРОВАННЫЕ 4-ФУРФУРИЛ-3,4-ДИГИДРО-2Н-БЕНЗО[1,4]ТИАЗИН-1,1-ДИОКСИДЫ, ОБЛАДАЮЩИЕ ВЫСОКОЙ АРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2626239C1 |
| 4-АРИЛ(ГЕТАРИЛ)МЕТИЛ-ЗАМЕЩЕННЫЕ 8-ЦИКЛОПЕНТИЛАМИНО-5,7-ДИФТОР-3,4-ДИГИДРО-2Н-БЕНЗО[1,4]ТИАЗИН-1,1-ДИОКСИДЫ, ОБЛАДАЮЩИЕ ГИПЕРТЕНЗИВНЫМ ДЕЙСТВИЕМ | 2016 |
|
RU2627499C1 |
| Комплексы цинка 2-(N-тозиламинобензилиден)-2'-иминоалкилпиридинов, обладающие люминесцентной активностью | 2016 |
|
RU2616979C1 |
| БИС[2-(ТОЗИЛАМИНО)БЕНЗИЛИДЕН-N-АЛКИЛ(АРИЛ, ГЕТАРИЛ)АМИНАТЫ]ЦИНКА, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЮМИНОФОРОВ | 2006 |
|
RU2295527C1 |
| ИНГИБИТОРЫ ТЕЛОМЕРАЗЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2468030C2 |
| ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2001 |
|
RU2276151C2 |
| ПОЛУЧЕНИЕ НОВОГО КЛАССА ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ЧЕТЫРЕХАТОМНЫЙ ФТОРСОДЕРЖАЩИЙ ФРАГМЕНТ МОСТИКОГО ТИПА | 2012 |
|
RU2511009C2 |
| Способ получения 2-фтор-3-метилбут-2-ениламина или его гидрохлорида (Варианты) | 2016 |
|
RU2610281C1 |
| СИНТЕЗ НОВОГО КЛАССА ФТОРСОДЕРЖАЩИХ ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ С ИСПОЛЬЗОВАНИЕМ ХЛАДОНА 114В2 В КАЧЕСТВЕ ИСХОДНОГО СОЕДИНЕНИЯ | 2012 |
|
RU2505529C1 |
| СПОСОБ ПОЛУЧЕНИЯ VIC-ДИХЛОРФТОРАНГИДРИДА | 2000 |
|
RU2252210C2 |
Изобретение относится к области органической химии, описываются бициклические 1,4-пиридотиазин-1,1-диоксиды общей формулы (I)
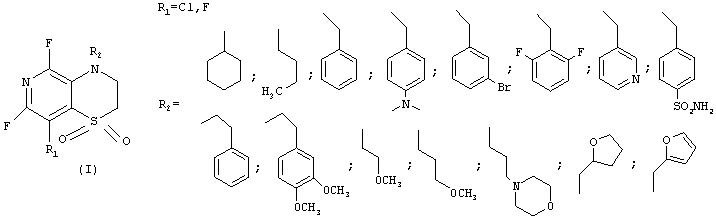
где R1 - атом фтора или хлора, R2 - разветвленный или неразветвленный алкил, циклоалкил, восстановленный или не восстановленный арил или гетероарил, не обязательно замещенные кислород- и (или) азотсодержащими фрагментами, одним или несколькими атомами галогенов, а также способ получения данных соединений, заключающийся в использовании ациклических сульфонов в реакции с первичными аминами, желательно в присутствии неорганических или органических оснований, лучше карбонатов или гидроокисей щелочных металлов, третичных органических аминов или смесей оснований, не обязательно в среде растворителей, лучше - в апротонных биполярных средах, их смесях между собой или водой. Технический результат - создание технологичного и безопасного способа получения новых гетероциклических соединений пиридиниевого ряда, которые могут найти применение в качестве медицинских препаратов. 2 н.п. ф-лы.
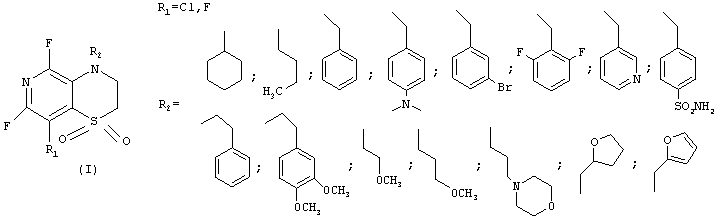 где R1 - атом фтора или хлора, R2 - разветвленный или неразветвленный алкил, циклоалкил, восстановленный или не восстановленный арил или гетероарил, не обязательно замещенные кислород-, и (или) азотсодержащими фрагментами, одним или несколькими атомами галогенов.
где R1 - атом фтора или хлора, R2 - разветвленный или неразветвленный алкил, циклоалкил, восстановленный или не восстановленный арил или гетероарил, не обязательно замещенные кислород-, и (или) азотсодержащими фрагментами, одним или несколькими атомами галогенов.

где R1 - атом фтора или хлора, R2 - разветвленный или неразветвленный алкил, циклоалкил, восстановленный или не восстановленный арил или гетероарил, не обязательно замещенные кислород-, и (или) азотсодержащими фрагментами, одним или несколькими атомами галогенов, заключающийся в использовании ациклических сульфонов общей формулы (II)
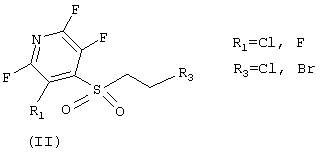
где R1 - атом фтора или хлора, R2 - атом хлора или брома, которые синтезируют из меркаптоэтанола и полигалоидированых пиридинов в присутствии неорганических или органических оснований, третичных органических аминов или смесей оснований, не обязательно в среде растворителей, лучше - в апротонных биполярных средах, их смесях между собой или водой, затем остаток меркаптоэтанола превращают в реакционноспособный фрагмент - SCH2CH2R3 (R3 - атомы хлора или брома) путем обработки получившихся сульфидов HBr или SOCl2 в присутствии пиридина, затем сульфиды, содержащие вышеупомянутые реакционные фрагменты - SCH2CH2R3 (R3 - атомы хлора или брома), вовлекают в реакции окисления в присутствии Н2О2 и органической кислоты или ее ангидрида, конечные стадии формирования 1,4-пиридотиазин-1,1 -диоксидов (I) протекают при комнатной температуре в результате взаимодействия ациклических сульфонов (II) с эквимолярными количествами первичных аминов в органическом растворителе.
| Пиридо (2,3-е)-1,2,4-тиадиазин-1,1диоксиды, обладающие анальгетическим и противовоспалительным действием | 1977 |
|
SU711037A1 |
| Пиридо (2,3-е)-1,2,4-тиадиазин-1,1диоксиды, обладающие анальгетическим и противовоспалительным действием | 1977 |
|
SU711037A1 |
| Водомерное стекло | 1929 |
|
SU18762A1 |
Авторы
Даты
2007-09-27—Публикация
2006-05-24—Подача