Изобретение относится к области органического синтеза, в частности к способу получения 2-фтор-3-метилбут-2-ениламина (I) или его гидрохлорида (II), которые находят широкое применение для получения ряда биологически активных структур, в которых он выступает в качестве ключевого структурного фрагмента.
Так, в частности, II был использован для получения новых агрохимикатов [Clemenceau D., Cousseau J., Martin V., Molines H., Wakselman C., Mornet R., Nogue F., and Laloue M. Synthesis and Cytokinin Activity of New Zeatin Derivatives // J. Agric. Food Chem. 1996, pp. 320-323)], потенциальных препаратов для лечения офтальмологических расстройств [Flohr S., Hommel U., Lorthiois E.L.J., Maibaum J.K., Ostermann N., Randl S.A., Vulpetti A., Quancard J., and Rogel O. Preparation of pyrrolidine derivatives and their use as complement alternative pathway modulators for treatment of ophthalmic and other diseases // WO 2014002052, 2014)], потенциальных противовоспалительных препаратов [Wiles J.A., Deshpande M. Preparation of N-benzyl-(S)-1-[2-(indol-1-yl)acetyl]pyrrolidine-2-carboxamide derivatives as factor D inhibitors useful for treating inflammatory disorders // US 20150239837, 2015)], а также соединений, проявляющих противовирусную активность [Не Н., Shi W., Jiang Z., Han L., Sun J., Li J., Chen S. Imidazole derivative used as antiviral agent and use thereof in preparation of medicament // WO 2015085844, 2015)].
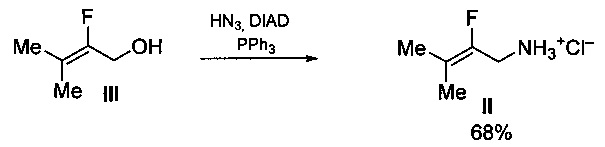
Известен способ получения 2-фтор-3-метилбут-2-ениламина в виде гидрохлорида (II) из 2-фтор-3-метилбут-2-енилового спирта (III) действием азидоводородной кислоты (HN3) в присутствии ди-изо-пропилового эфира азодикарбоновой кислоты (DIAD) и трифенилфосфина (PPh3) с выходом 68% [Clemenceau D., Cousseau J., Martin V., Molines H., Wakselman C., Mornet R., Nogue F., and Laloue M. Synthesis and Cytokinin Activity of New Zeatin Derivatives // J. Agric. Food Chem. 1996, pp. 320-323)]. Процесс протекает по следующей схеме:
В свою очередь исходный 2-фтор-3-метилбут-2-ениловый спирт (III) получают по трехстадийной схеме [Flohr S., Hommel U., Lorthiois E.L.J., Maibaum J.K., Ostermann N., Randl S.A., Vulpetti A., Quancard J., and Rogel O. Preparation of pyrrolidine derivatives and their use as complement alternative pathway modulators for treatment of ophthalmic and other diseases // WO 2014002052, 2014)], включающей нагревание при 130°C этилового эфира бромфторуксусной кислоты с триэтилфосфитом с получением триэтилового эфира 2-фтор-2-фосфонуксусной кислоты с выходом 86%, который далее действием гидрида натрия и ацетона превращают в этиловый эфир 2-фтор-3-метилбут-2-еновой кислоты с выходом 47%, который действием алюмогидрида лития (LiAlH4) превращают в 2-фтор-3-метилбут-2-ениловый спирт (III) с выходом 90%. Процесс протекает по следующей схеме:
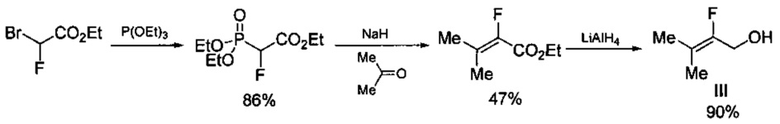
Общий выход гидрохлорида 2-фтор-3-метилбут-2-ениламина (II) в расчете на коммерчески доступный этиловый эфир бромфторуксусной кислоты составляет 25%.
Основными недостатками этого способа являются сложность получения исходного 2-фтор-3-метилбут-2-енилового спирта (III), необходимость использования дорогостоящих реагентов (DIAD и PPh3) для активации гидроксигруппы и использование высокотоксичной и взрывоопасной HN3 в качестве источника аминогруппы, а также недостаточно высокий выход в пересчете на коммерчески доступный этиловый эфир бромфторуксусной кислоты.
Также известен способ получения 2-фтор-3-метилбут-2-ениламина в виде гидрохлорида (II), принятый за прототип, из 2-фтор-3-метилбут-2-енилового спирта (III) через промежуточное получение N-(2-фтор-3-метилбут-2-енил)фталимида (IV) с выходом 31% по реакции III с фталимидом в присутствии диэтилового эфира азодикарбоновой кислоты (DEAD) и PPh3 [Flohr S., Hommel U., Lorthiois E.L.J., Maibaum J.K., Ostermann N., Randl S.A., Vulpetti A., Quancard J., and Rogel O. Preparation of pyrrolidine derivatives and their use as complement alternative pathway modulators for treatment of ophthalmic and other diseases // WO 2014002052, 2014)]. Последующая обработка N-(2-фтор-3-метилбут-2-енил)фталимида (IV) сначала гидразином в метаноле, а затем раствором HCl в диоксане дает гидрохлорид 2-фтор-3-метилбут-2-ениламина (II) в виде смеси с хлоридом гидразиния (N2H5Cl) и фталгидразидом, что не позволяет определить точный выход продукта. Процесс протекает по следующей схеме:
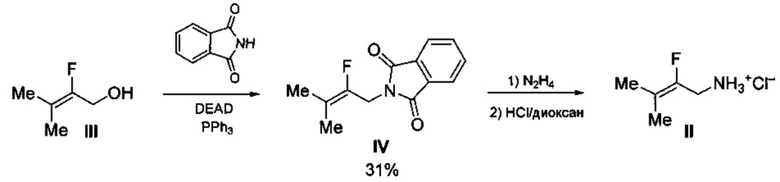
При этом выход гидрохлорида 2-фтор-3-метилбут-2-ениламина (II) в расчете на доступный этиловый эфир бромфторуксусной кислоты составляет менее 11%.
Основными недостатками этого способа являются сложность получения исходного 2-фтор-3-метилбут-2-енилового спирта (III) и необходимость использования дорогостоящих реагентов (DEAD и PPh3) для активации гидроксигруппы, а также недостаточно высокий выход в пересчете на коммерчески доступный этиловый эфир бромфторуксусной кислоты.
Технической задачей настоящего изобретения является повышение выхода целевого продукта из промышленно доступного сырья и упрощение технологии его получения.
Технический результат, достигаемый при реализации предлагаемого способа, заключается в повышении выхода целевого продукта (32-36%) на промышленно доступный изобутилен, упрощении технологии его получения за счет сокращения числа стадий, исходя из промышленно доступного изобутилена, а также отказ от использования дорогостоящих реагентов, используемых в прототипе.
Технический результат достигается предлагаемым способом получения 2-фтор-3-метилбут-2-ениламина (I) или его гидрохлорида (II) (вариант 1), заключающимся в том, что исходный 2-фтор-2-хлор-1,1-диметилциклопропан (V) подвергают нагреванию в присутствии каталитических количеств смеси CuCl и LiCl в среде ацетонитрила (CH3CN) при температуре 80-90°С с последующей обработкой полученной реакционной смеси фталимидом калия в среде диметилформамида при температуре 100-120°С и образующийся при этом промежуточный N-(2-фтор-3-метилбут-2-енил)фталимид (IV) подвергают взаимодействию с гидразин гидратом в среде метанола с последующим выделением целевого продукта в виде основания (I), либо в виде его гидрохлорида (II) путем обработки основания известным способом, например, концентрированной HCl в среде этанола.
Процесс протекает по следующей схеме:
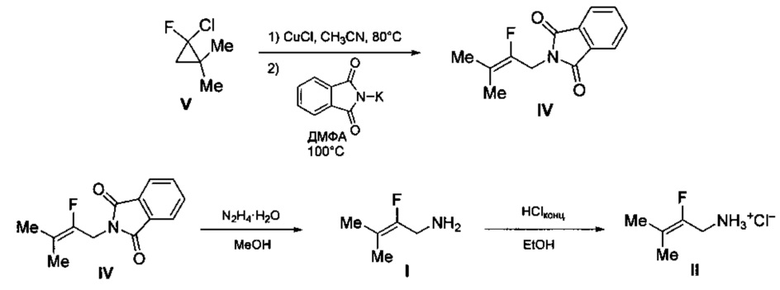
Выход целевого 2-фтор-3-метилбут-2-ениламина в виде основания (I) или в виде гидрохлорида (II) в пересчете на 2-фтор-2-хлор-1,1-диметилциклопропан (V) составляет 41%.
В свою очередь 2-фтор-2-хлор-1,1-диметилциклопропан (V) может быть получен из широкодоступных изобутилена и дихлорфторметана действием насыщенного водного раствора KOH в присутствии каталитических количеств хлорида бензилтриэти л аммония (ТЕБАХ) с выходом 88% [Новиков М.А., Волчков Н.В., Липкинд М.Б., Нефедов О.М.. Каталитическая скелетная изомеризация гем-фторхлорциклопропанов под действием CuCl с получением фторхлоралкенов и фторхлоралкадиенов // Изв. ак. наук, Сер. хим., 2013, стр. 71-82]. Процесс протекает по следующей схеме:
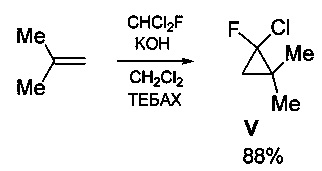
Общий выход целевого 2-фтор-3-метилбут-2-ениламина в виде основания (I) или в виде гидрохлорида (II) в пересчете на доступный изобутилен составляет 36%.
Технический результат достигается предлагаемым способом получения 2-фтор-3-метилбут-2-ениламина (I) или его гидрохлорида (II) (вариант 2), заключающимся в том, что исходный 2-фтор-2-хлор-1,1-диметилциклопропан (V) подвергают нагреванию в присутствии каталитических количеств смеси CuCl и LiCl в среде ацетонитрила при 80-90°С с последующей обработкой реакционной смеси уротропином при кипячении в среде дихлорметана и полученный при этом промежуточный хлорид (2-фтор-3-метилбут-2-енил)уротропиния (VI) обрабатывают водным раствором соляной кислотой в этаноле с последующим выделением целевого продукта в виде основания (I), либо в виде его гидрохлорида (II) путем обработки основания известным способом, например, концентрированной HCl в среде этанола.
Процесс протекает по следующей схеме:
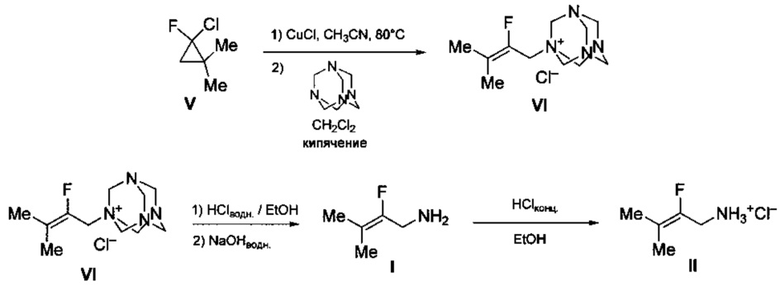
Выход целевого 2-фтор-3-метилбут-2-ениламина в виде основания (I) или в виде гидрохлорида (II) в пересчете на 2-фтор-2-хлор-1,1-диметилциклопропан (IV) составляет 37%, а в пересчете на доступный изобутилен - 32%.
Разработанный способ иллюстрируется примерами:
ПРИМЕР 1. Получение 2-фтор-3-метилбут-2-ениламина (I). Вариант 1.
К смеси 10.2 г (182 ммоль) изобутилена, 27.8 г (270 ммоль) CHCl2F, 0.47 г (2 ммоль) ТЕБАХ и 10 мл CH2Cl2 при охлаждении на бане со льдом и активном перемешивании (прим. 800 об./мин) прибавляют по каплям раствор 19.3 г (293 ммоль) KOH в 13 мл воды в течение 1 часа, перемешивают далее при 0°С еще 2 часа, контролируя конверсию методом ГХ. Реакционную смесь разбавляют 50 мл воды, органический слой промывают 2 раза по 20 мл воды, высушивают над СаСl2. Полученную смесь перегоняют при атмосферном давлении, собирая фракцию с т. кип. 80-81°С. Получают 19.6 г 2-фтор-2-хлор-1,1-диметилциклопропана (V) в виде бесцветной жидкости (выход 88%).
Спектр ЯМР 1Н (CDCl3, 200.1 МГц, δ, м.д., J/Гц): 0.97 (д.д., 1Н, циклопроп., J=7.0, J=7.0), 1.21 (д.д., 1Н, циклопроп., J=17.2, J=7.0), 1.27 (с., 3Н, СН3), 1.26 (с., 3Н, СН3). Спектр ЯМР 19F (CDCl3, 188.3 МГц, δ, м.д., J/Гц): -141.3 (д.д., J=17.2, J=7.0). Спектр ЯМР 13С (CDCl3, 50.3 МГц, δ, м.д., J/Гц): 19.1 (д., СН3, J=9), 22.6 (д., СН3, J=1), 24.8 (д., С, J=10), 27.6 (д., СН2, J=10), 99.2 (д., CFCl, J=292). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 122, 124 [М+] (9, 3), 107, 109 [М+-СН3] (65, 20), 87 [М+-Сl] (100), 71 (29), 59 (37).
Смесь 19.6 г (160 ммоль) 2-фтор-2-хлор-1,1-диметилциклопропана V, 795 мг (8.0 ммоль) CuCl, 680 мг (16 ммоль) LiCl и 40 мл CH3CN нагревают при температуре в интервале 80-90°С в атмосфере аргона в течение 36 часов. Реакционную смесь добавляют к суспензии 27.8 г (150 ммоль) фталимида калия в 100 мл ДМФА. Полученную смесь перемешивают при температуре в интервале 100-120°С в течение 3 часов. Реакционную смесь разбавляют 300 мл СН2Сl2, промывают 10 раз по 500 мл воды, 1 раз насыщенным раствором NaCl, высушивают над K2СО3. Растворитель отгоняют на роторном испарителе, остаток перекристаллизовывают из EtOH. Получают 16.8 г N-(2-фтор-3-метилбут-2-енил)фталимида IV (выход 45%, т. пл. 110-111°С).
Спектр ЯМР lH (CDCl3, 200.1 МГц, δ, м.д., J/Гц): 1.66 (д., 3Н, СН3, J=3.4), 1.86 (д., 3Н, СН3, J=3.0), 4.47 (д., 1Н, =СН-, J=20.4), 7.65-7.78 (м., 2Н, аром.), 7.80-7.91 (м., 2Н, аром.). Спектр ЯМР 19F (CDCl3, 188.3 МГц, δ, м.д., J/Гц): -119.7 (т. кв. кв., J=20.4, 3.4, 3.0). Спектр ЯМР 13С (CDCl3, 50.3 МГц, δ, м.д., J/Гц): 15.9 (д., СН3, J=8.5), 17.6 (д., СН3, J=4.8), 35.2 (д., СН2, J=31.3), 113.3 (д., =СМе2, J=15.4), 123.4 (с., 2СН-аром.), 132.1 (с., 2С-аром.), 134.0 (с., 2СН-аром.), 148.0 (д., =CF-, J=243), 167.8 (с., 2 С=О). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 233 [М]+ (20), 218 [М-СН3]+ (4), 213 [М-HF]+ (100), 198 (12), 185 (31), 170 (33), 160 (38), 148 (7), 133 (12), 130 (27), 105 (19), 104 (15), 86 (14), 85 (13), 76 (15). HRMS (ESI), рассчитано для C13H12FNO2: М+Н, 234.0925; M+Na, 256.0744. Найдено: М+Н, 234.0920; M+Na, 274.0738.
К раствору 22.4 г (96 ммоль) N-(2-фтор-3-метилбут-2-енил)фталимида (IV) в 300 мл МеОН добавляют по каплям 5.1 мл (106 ммоль) N2H4⋅H2O. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов. Выпавший осадок отфильтровывают, к фильтрату при перемешивании и охлаждении на бане со льдом прикапывают 20 мл (прим. 200 ммоль) конц. НСl и упаривают на роторном испарителе. Остаток растворяют в 300 мл воды, полученную суспензию фильтруют от осадка, фильтрат промывают 3 раза по 50 мл CH2Cl2, затем прибавляют при охлаждении на бане со льдом 6М раствор NaOH до рН=14. Полученный раствор насыщают NaCl и экстрагируют 3 раза по 100 мл СН2Сl2. Экстракт высушивают над K2СO3, растворитель отгоняют при атмосферном давлении, остаток перегоняют при пониженном давлении, собирая фракцию с т. кип. 65-66°С / 100 мм рт.ст. Получают 8.90 г 2-фтор-3-метилбут-2-ениламина (I) (выход 90%).
Спектр ЯМР 1Н (CDCl3, 200.1 МГц, δ, м.д., J/Гц): 1.25 (с., 2Н, NH2), 1.62-1.67 (м., 6Н, 2СН3), 3.40 (д., 2Н, СН2, J=21.9). Спектр ЯМР 19F (CDCl3, 188.3 МГц, δ, м.д., J/Гц): -120.0 (т. кв. кв., J=21.9, 3.0, 3.0). Спектр ЯМР 13С (CDCl3, 50.3 МГц, δ, м.д., J/Гц): 15.3 (д., СН3, J=8.9), 17.1 (д., СН3, J=5.5), 39.1 (д., СН2, J=31.0), 108.1 (д., =СМе2, J=17.2), 154.3 (д., =CF-, J=241.0). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 103 [М+] (30), 102 (16), 88 (100), 86 (90), 85 (49), 68 (25), 59 (25), 41 (26). HRMS (ESI), рассчитано для C5H10FN: М+Н, 104.0870. Найдено: М+Н, 104.0867.
ПРИМЕР 2. Получение 2-фтор-3-метилбут-2-ениламина (I). Вариант 2.
Смесь 19.6 г (160 ммоль) 1,1-диметил-2-фтор-2-хлорциклопропана (V), полученного как описано в примере 1, 795 мг (8.0 ммоль) CuCl, 680 мг (16 ммоль) LiCl и 40 мл CH3CN нагревают при температуре в интервале 80-90°С в атмосфере аргона в течение 36 часов. Реакционную смесь разбавляют 200 мл СН2Сl2, промывают 10 раз по 300 мл воды, высушивают над MgSO4. Осушитель отфильтровывают, к фильтрату добавляют 21.0 г (150 ммоль) уротропина и перемешивают при кипячении в течение 18 часов. Выпавший осадок отфильтровывают, промывают на фильтре 3 раза CH2Cl2, высушивают под вакуумом. Получают 26.0 г хлорида N-(2-фтор-3-метилбут-2-енил)уротропиния (VI) (выход 62%).
Спектр ЯМР 1Н (DMSO-d6, 200.1 МГц, δ, м.д., J/Гц): 1.74 (д., 3Н, СН3, J=3.2), 1.79 (д., 3Н, СН3, J=2.5), 3.92 (д., 2Н, СН2, J=24.8), 4.43-4.71 (м., 6Н, 3СН2-уротропин), 5.26 (с., 6Н, 3СН2-уротропин). Спектр ЯМР 19F (DMSO-d6, 188.3 МГц, δ, м.д., J/Гц): 106.0 (т., J=24.8). Спектр ЯМР 13С (DMSO-d6, 50.3 МГц, δ, м.д., J/Гц): 16.3 (д., СН3, J=8.3), 18.1 (д., СН3, J=3.8), 52.4 (д., СН2, J=30.9), 69.6 (с, 3СН2-уротропин), 77.5 (с., 3СН2-уротропин), 123.2 (д., =СМе2, J=15.2), 142.20 (д., =CF-, J=236.9). HRMS (ESI), рассчитано для C11H20FN4: M+, 227.1667. Найдено: M+, 227.1670.
К раствору 70 мл (прим. 700 ммоль) конц. HCl и 60 мл воды в 300 мл EtOH добавляют 23.4 г (89 ммоль) хлорида N-(2-фтор-3-метилбут-2-енил)уротропиния (VI). Полученный раствор выдерживают при комнатной температуре в течение 24 часов, после чего упаривают на роторном испарителе. Остаток растворяют в 300 мл воды, полученный раствор промывают 3 раза по 50 мл СН2Сl2, затем прибавляют при охлаждении на бане со льдом 6М раствор NaOH до рН=14. Полученный раствор насыщают NaCl и экстрагируют 3 раза по 100 мл СН2Сl2. Экстракт высушивают над K2СO3, растворитель отгоняют при атмосферном давлении, остаток перегоняют при пониженном давлении, собирая фракцию с т. кип. 65-66°С /100 мм рт.ст. Получают 5.41 г 2-фтор-3-метилбут-2-ениламина (I) (выход 59%).
Спектр ЯМР 1Н (CDCl3, 200.1 МГц, δ, м.д., J/Гц): 1.25 (с., 2Н, NH2), 1.62-1.67 (м., 6Н, 2СН3), 3.40 (д., 2Н, СН2, J=21.9). Спектр ЯМР 19F (CDCl3, 188.3 МГц, δ, м.д., J/Гц): -120.0 (т. кв. кв., J=21.9, 3.0, 3.0). Спектр ЯМР 13С (CDCl3, 50.3 МГц, δ, м.д., J/Гц): 15.3 (д., СН3, J=8.9), 17.1 (д., СН3, J=5.5), 39.1 (д., СН2, J=31.0), 108.1 (д., =СМе2, J=17.2), 154.3 (д., =CF-, J=241.0). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 103 [М+] (30), 102 (16), 88 (100), 86 (90), 85 (49), 68 (25), 59 (25), 41 (26).
ПРИМЕР 3. Получение гидрохлорида 2-фтор-3-метилбут-2-ениламина (II).
К раствору 8.90 г (86 ммоль) 2-фтор-3-метилбут-2-ениламина (I), полученного в примере 1 или в примере 2, в 160 мл EtOH при охлаждении на бане с водой добавляют 16 мл (прим. 160 ммоль) конц. НСl, упаривают на роторном испарителе, остаток высушивают в высоком вакууме над Р2О5. Получают 12.0 г гидрохлорида 2-фтор-3-метилбут-2-ениламина (II) (выход 100%).
Спектр ЯМР lH (DMSO-d6, 200.1 МГц, δ, м.д., J/Гц): 1.61 (д., 3Н, СН3, J=3.3), 1.65 (д., 3Н, СН3, J=2.9), 3.63 (д., 2Н, СН2, J=22.0), 8.62 (уш. с., 3Н, NH3+). Спектр ЯМР 19F (DMSO-d6, 188.3 МГц, δ, м.д., J/Гц): -117.3 (т., J=22.0). Спектр ЯМР 13С (DMSO-d6, 50.3 МГц, δ, м.д., J/Гц): 15.7 (д., СН3, J=8.1), 17.5 (д., СН3, J=4.0), 35.7 (д., СН2, J=31.0), 115.1 (д., =СМе2, J=14.8), 147.1 (д., =CF-, J=239.0).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3-(2-АЛКИНИЛ)-1,3-ОКСАЗОЛИДИНОВ | 2014 |
|
RU2565780C1 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ЦИКЛООКСИГЕНАЗЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2631317C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИЦИКЛОАЛКИЛ(БИЦИКЛО[2.2.1]ГЕПТ-2-ИЛ)АЛКИЛБОРОНАТОВ | 2019 |
|
RU2710586C1 |
| Способ получения ω-(бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов | 2016 |
|
RU2616974C1 |
| НОВЫЕ 2',5'-ДИАРИЛСПИРО[ИНДОЛ-3,3'-ПИРРОЛИДИН]-2(1Н)-ОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730287C1 |
| ФОСФОНИЕВЫЕ СОЛИ НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2011 |
|
RU2466728C1 |
| Способ получения гидрохлорида 2-(1,2,3-тиадиазол-4-ил)бензиламина | 2023 |
|
RU2825395C1 |
| СИНТЕЗ НОВОГО КЛАССА ФТОРСОДЕРЖАЩИХ ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ С ИСПОЛЬЗОВАНИЕМ ХЛАДОНА 114В2 В КАЧЕСТВЕ ИСХОДНОГО СОЕДИНЕНИЯ | 2012 |
|
RU2505529C1 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| Антибактериальные средства на основе производных ципрофлоксацина | 2016 |
|
RU2636751C1 |
Изобретение относится к вариантам способа получения 2-фтор-3-метилбут-2-ениламина (I) или его гидрохлорида (II). Соединения являются ключевым структурным фрагментом ряда биологически активных соединений. Например, гидрохлорид (II) может быть использован для получения агрохимикатов. Соединения могут быть использованы также для получения препаратов для лечения офтальмологических расстройств, противовоспалительных или противовирусных соединений. Способ заключается в том, что 2-фтор-2-хлор-1,1-диметилциклопропан подвергают нагреванию в присутствии каталитических количеств смеси CuCl и LiCl в среде ацетонитрила при температуре 80-90°С с последующей обработкой полученной реакционной смеси фталимидом калия в среде диметилформамида при температуре 100-120°С и образующийся при этом промежуточный N-(2-фтор-3-метилбут-2-енил)фталимид обрабатывают гидразин гидратом в среде метанола. Либо 2-фтор-2-хлор-1,1-диметилциклопропан подвергают взаимодействию с уротропином при кипячении в среде хлористого метилена и образующийся при этом промежуточный хлорид N-(2-фтор-3-метилбут-2-енил)уротропиния обрабатывают водным раствором соляной кислоты в этиловом спирте. Целевой продукт выделяют в виде основания (I) либо в виде его гидрохлорида (II). Исходный 2-фтор-2-хлор-1,1-диметилциклопропан может быть получен из широкодоступного изобутилена. Способ позволяет повысить выход целевого продукта (32-36% вместо 11%), сократить количество стадий и исключить дорогостоящие реагенты. 2 н.п. ф-лы, 3 пр.
1. Способ получения 2-фтор-3-метилбут-2-ениламина или его гидрохлорида, включающий стадию получения промежуточного N-(2-фтор-3-метилбут-2-енил)фталимида, отличающийся тем, что исходный 2-фтор-2-хлор-1,1-диметилциклопропан подвергают нагреванию в присутствии каталитических количеств смеси CuCl и LiCl в среде ацетонитрила при температуре 80-90°С с последующей обработкой полученной реакционной смеси фталимидом калия в среде диметилформамида при температуре 100-120°С и образующийся при этом промежуточный N-(2-фтор-3-метилбут-2-енил)фталимид подвергают взаимодействию с гидразин гидратом в среде метанола с последующим выделением целевого продукта в виде основания либо в виде его гидрохлорида.
2. Способ получения 2-фтор-3-метилбут-2-ениламина или его гидрохлорида, отличающийся тем, что исходный 2-фтор-2-хлор-1,1-диметилциклопропан подвергают нагреванию в присутствии смеси CuCl и LiCl в среде ацетонитрила при 80-90°С с последующей обработкой полученной реакционной смеси уротропином при кипячении в среде хлористого метилена и образующийся при этом промежуточный хлорид N-(2-фтор-3-метилбут-2-енил)уротропиния обрабатывают водным раствором соляной кислоты в этиловом спирте с последующим выделением целевого продукта в виде основания либо в виде его гидрохлорида.
| WO 2014002052 A1, 03.01.2014 | |||
| СОЕДИНЕНИЯ ТИЕНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2331648C2 |
Авторы
Даты
2017-02-08—Публикация
2016-02-26—Подача