Область техники, к которой относится изобретение
Изобретение относится к быстрому и эффективному способу выполнения сорбционного иммуноферментного анализа для выявления малых количеств биомолекул, таких как антиген, антитело и т.д. Изобретение, в частности, относится к опосредованной нагреванием иммобилизации антигена или антитела на активированную поверхность с последующим проведением дальнейших стадий ELISA при контролируемой температуре. Способ по изобретению снижает общее время, требуемое для проведения ELISA, примерно до 3 ч. Выполнение ELISA по изобретению является быстрым, экономичным, воспроизводимым и простым.
Способ по изобретению может использоваться для проведения ELISA, необходимого в клинической диагностике, молекулярной биологии, сельском хозяйстве, пищевой технологии, науке об окружающей среде и т.д. Способ ELISA по изобретению является простым, позволяет сэкономить время и избегает затратной по времени процедуры. Данный способ имеет потенциал для автоматизации.
Уровень техники изобретения
Сорбционный иммуноферментный анализ (ELISA) является очень чувствительным способом, используемым для выявления конкретных антигенов и антител. ELISA стал подходящим инструментом для диагностики заболеваний животных и растений. ELISA может также применяться для скрининга моноклональных антител в течение процесса их продукции (Douillard, J. Y. and Hoffman, T., 1983), для выявления остатка пестицидов при продукции сельскохозяйственных культур (Van Emon, J.M. and Lopez-Avila, V., 1992) и для образцов окружающей среды, таких как почва и вода (Ghassempour et al. 2002), для выявления апоптоза в тканевых культурах и т.д. (Salgame, P. et al, 1996).
Обычные способы ELISA, проводимые путем иммобилизации антигена или антитела на полистирольном планшете для микротитрования путем адсорбции, имеют следующие недостатки: (i) результаты ELISA в различных лунках и планшетах обычно не соответствуют друг другу (Kricka et al., 1980; Hermann and Collins, 1976); (ii) требуется длительное время инкубации; (iii) во время промывки некоторые биомолекулы могут отсоединяться, что приводит к невоспроизводимым результатам (Engvall and Perlmann, 1971); и (iv) обычно имеет место низкая чувствительность (Kemeny, 1997). С другой стороны ковалентное связывание является более чувствительным (Deshpande, 1996), минимизирует неспецифичное связывание и устраняет указанные выше недостатки (Douglas and Monteith, 1994). Сообщалось о ковалентном связывании иммуногенов на привитых пластиковых поверхностях (Larsson, P. H. et al, 1987).
Aleixo et al. (1985) активировали инертную полистирольную поверхность путем нитрования ароматического кольца полистирола с последующим восстановлением нитрогруппы до аминогруппы. Аминополистирол далее активировали путем химических реакций, таких как диазотирование, и полученную в результате активированную поверхность использовали для ковалентной иммобилизации антигена.
Несмотря на это общепринятый способ ELISA требует для выполнения очень длительного времени, которое варьирует от нескольких часов до 2 суток. Это является основным недостатком различных способов ELISA, основанных на адсорбции или на ковалентном связывании. В случае медицинской срочности теряется драгоценное время для диагностики до того, как пациенту можно обеспечить лечение. В сельском хозяйстве ELISA может использоваться для выявления остатка пестицидов при продукции культур (Van Emon, J. M. and Lopez-Avila, V., 1992) и для исследования образцов окружающей среды (Ghassempour et al. 2002).
Bora et al. (2002) сообщают о быстром и простом способе ELISA в варианте сэндвич-метода с двумя антителами (DAS) и об ELISA с прямым покрытием антигеном (DAC) путем ковалентной иммобилизации антигена или антитела на активированной полистирольной поверхности, который разработан Nahar et al. (2001) с использованием быстрого и простого способа, где применяется 1-фтор-2-нитро-4-азидобензол (FNAB). Выявление антител при более низких концентрациях также успешно проводится с использованием активированной поверхности. Результат ELISA, полученный данным способом в течение восьми часов, как обнаружено, был сходным с результатами, полученными обычным способом ELISA, проведенным в течение пятнадцати часов. Хотя данный способ был сокращен до периода времени, примерно равного восьми часам, все же требовалось уменьшить длительность процедуры ELISA, имея в виду ее обширное применение в диагностике.
Авторы настоящего изобретения сократили процедуру ELISA путем проведения ELISA на светочувствительной полимерной поверхности при повышенной температуре. Более конкретно, его проводили на светочувствительных поликарбонатных и полистирольных планшетах при температуре в интервале от 30 до 70°C. Хотя доступен опосредованный микроволновым излучением быстрый ELISA на активированной поверхности (P. Nahar et al. A rapid method for enzyme-linked immunosorbent assay. Патент США № 6498016 (2002); заявка PCT № WO 02/14868 A), данный способ высокочувствителен, и небольшое изменение энергии или времени (даже в секундах) может испортить эксперимент ELISA. Данный способ также требует для проведения ELISA наличия микроволновой печи или микроволнового устройства.
В доступной литературе не описан способ ELISA на светочувствительной поверхности при повышенной температуре (при температуре, более высокой, чем 37°С, при которой обычно проводится общепринятый ELISA) путем обычного нагревания, такого как нагревание в электропечи, инкубаторе, на водяной бане, в термоциклере и т.д.
Основное преимущество настоящего изобретения состоит в том, что слабое изменение энергии или времени не портит экспериментов ELISA в отличие от опосредованного микроволновым излучением ELISA.
Недостатки способов уровня техники
ELISA данным способом также является очень емкой по времени процедурой.
ELISA проводили на твердой фазе, полученной на светочувствительной поверхности, и получали примерно 1,5-2 раза более высокие считываемые сигнала.
Процедура ELISA очень чувствительна. Небольшое изменение оптимальных условий может навредить процедуре ELISA.
Цели изобретения
Главной целью настоящего изобретения является предоставление опосредованного нагреванием способа ELISA на активированной поверхности, проводимого в течение короткого времени.
Другой целью настоящего изобретения является предоставление быстрого способа, который может проводиться при высокой температуре с использованием любого температурного источника.
Другой целью изобретения является предоставление быстрого способа, который имеет потенциал для автоматизации.
Сущность изобретения
Для достижения данных целей и преодоления недостатков известного способа ELISA предоставляется быстрый и эффективный способ опосредованного нагреванием ELISA (HELISA), который включает в себя стадии (i) ковалентной иммобилизации антигена или антитела на активированной твердой поверхности путем нагревания, (ii) блокирования свободной поверхности блокирующим средством при контролируемом нагревании, (iii) связывания антитела или антигена путем контролируемого нагревания, (iv) связывания конъюгата путем контролируемого нагревания, (v) добавления красителя-субстрата в лунки и (vi) регистрации величины поглощения.
Способ опосредованного нагреванием ELISA (HELISA) выполняют на активированной поверхности в течение времени, менее чем 3 ч, и с той же эффективностью, что и при общепринятом ELISA, проводимом при 37°C, примерно в течение 15 ч. Для преодоления проблемы отделения твердой фазы, полученной путем адсорбции, авторы активируют поверхность лунок планшета для ПЦР перед применением.
Активированная поверхность связывает антиген (иммобилизует) за счет ковалентной связи при контролируемой температуре. Данный ковалентно иммобилизованный антиген достаточно стабилен, чтобы переносить повторяемые, но краткие периоды воздействия нагревания, которые требуются для проведения последующих этапов ELISA. Последующие стадии связывания биомолекул в способе ELISA осуществляются посредством нековалентного связывания, которое чувствительно к энергии нагревания. Данные проблемы преодолеваются путем контроля времени и температуры на данной стадии.
Новизна настоящего изобретения состоит в том, что ELISA проводят на активированной поверхности, способной образовывать ковалентную связь с биомолекулой.
В способе по изобретению все стадии ELISA, такие как связывание антигена, блокирование, связывание антитела и конъюгата, проводят путем термальной активации в термоциклере, и только реакцию фермент-субстрат проводят вне термоциклера при комнатной температуре.
Способ ELISA по изобретению является быстрым, со сравнимым или даже лучшим результатом ELISA по отношению к общепринятому способу.
Другая новизна настоящего изобретения состоит в том, что способ ELISA по изобретению может быть полностью или частично автоматизирован с применением специально сконструированного устройства.
Другая новизна настоящего изобретения состоит в том, что способ по изобретению может применяться для других иммунологических анализов, таких как радиоиммунный анализ, сорбционный радиоиммунный тест, сорбционный радиоаллергологический тест, иммунный анализ на основе биотина-авидина/стрептавидина, иммуноблоттинг, иммуноокрашивание и т.д., не говоря уже о других типах ELISA, таких как прямой ELISA, непрямой ELISA, сэндвич-ELISA и тому подобное.
Подробное описание изобретения
Настоящее изобретение предоставляет простой подход для способа сорбционного иммуноферментного анализа на активированной поликарбонатной или полистирольной поверхности путем воздействия нагреванием.
Активированная поверхность иммобилизирует антиген посредством ковалентного связывания путем термохимической реакции. Данный ковалентно иммобилизованный антиген достаточно стабилен для того, чтобы перенести повторяемые периоды воздействия нагревания, которые необходимы для проведения последующих стадий ELISA. ELISA представляет собой многоэтапный и чувствительный процесс, где несоответствие условий на любой стадии может испортить итоговый результат.
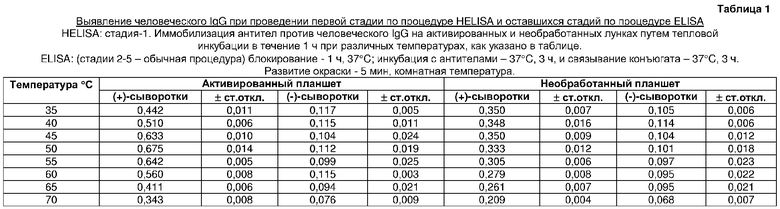
В способе по изобретению первую стадию ELISA проводили путем ковалентной иммобилизации антител козы против человеческих IgG на активированном поликарбонатном планшете для ПЦР посредством термальной инкубации в течение 1 ч при разных температурах. Обнаружено, что оптимальной температурой для иммобилизации антигена является 50°C. Эксперименты, проведенные по связыванию антител козы против человеческих IgG в течение того же времени при той же температуре инкубации на необработанной поверхности, показали более низкие результаты ELISA (таблица 1).
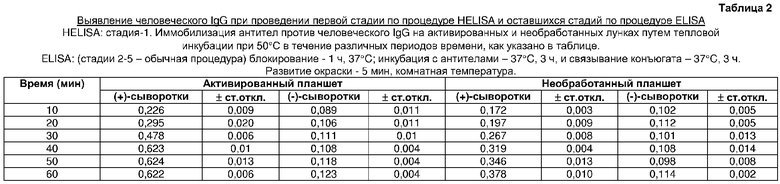
Иммобилизация антител козы против человеческих IgG на активированном поликарбонатном планшете для ПЦР посредством инкубации при температуре 50°C выявлялась даже через 20 мин, и она возрастала при возрастании времени инкубации. В течение 60 мин связывание антигена становится более или менее тем же, как после 40 мин тепловой инкубации. Следовательно, за оптимальное время для иммобилизации антигена было принято время 40 мин (таблица 2).
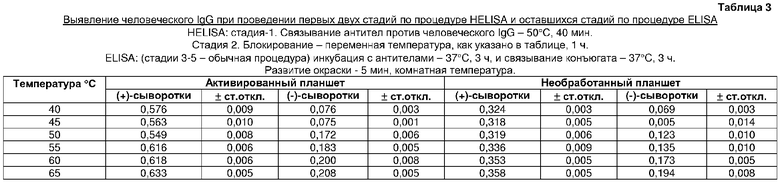
На второй стадии HELISA проводили блокирование 2% BSA в течение 1 ч при различных температурах в термоциклере. Оптимальная температура блокирования составляла 40°C. Дальнейшее повышение температуры инкубации характеризовалось неспецифическим связыванием (таблица 3).
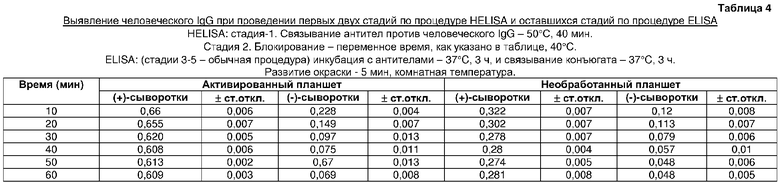
Обнаружено, что оптимальное время блокирования при 40°C 2% BSA составляло 40 мин. Кроме того, снижение времени инкубации характеризовалось неадекватным блокированием (таблица 4).
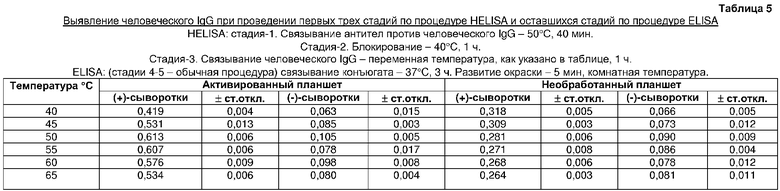
На третьей стадии HELISA проводили связывание антитела с иммобилизованным антигеном в течение 1 ч при различных температурах. Обнаружено, что человеческие IgG оптимально связывались с твердой фазой при 50°C (таблица 5). Обнаружено, что оптимальное время связывания антитела с иммобилизованным антигеном при 50°C составляет 45 мин (таблица 6).
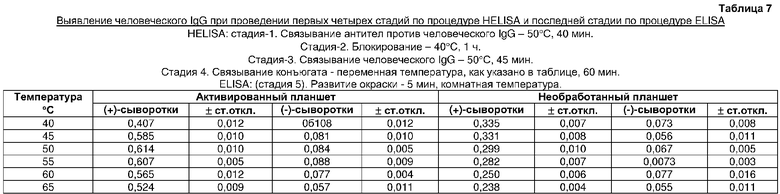
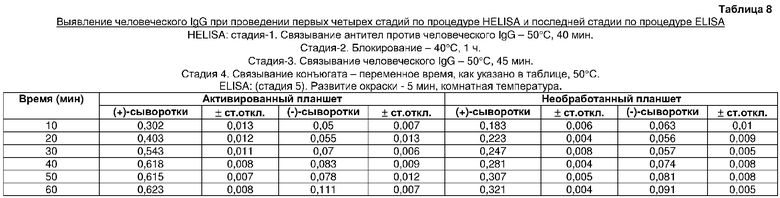
На четвертой стадии HELISA проводили связывание конъюгата в течение 1 ч при различных температурах. Отличный результат получали при температуре инкубации, равной 50°C (таблица 7). Оптимизацию времени связывания конъюгата проводили в термоциклере при 50°C путем инкубации в течение различных периодов времени. Лучший результат получали в течение 40 мин (таблица 8).
Во всех экспериментах получали более низкие результаты ELISA, когда они проводились на необработанной поверхности.
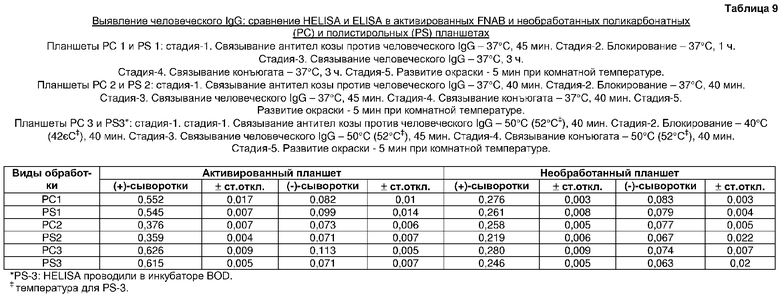
Авторы также сравнивали ELISA на активированных поликарбонатных и полистирольных планшетах при 37°C. Так, обнаружено, что при проведении стадий ELISA, таких как связывание антигена, блокирование, связывание антител и связывание конъюгата антитела, в течение 45 мин, 1 ч, 3 ч и 3 ч соответственно, значения результатов ELISA на обеих поверхностях были сходными (таблица 9).
Авторы также сравнивали значения результатов ELISA, полученные на активированных поликарбонатных и полистирольных планшетах, при проведении стадий ELISA при 37°C с периодами HELISA, такими как 40 мин, 40 мин, 45 мин и 40 мин соответственно. На обоих планшетах результаты были намного ниже по сравнению с обычным ELISA или HELISA (таблица 9). Это показывало, что температура ответственна за улучшенный ELISA.
В другом эксперименте стадии HELISA (50°C, 40 мин; 40°C, 40 мин; 50°C, 45 мин и 50°C, 40 мин) проводили на обоих активированных поверхностях. Для поликарбонатного ПЦР-планшета при высокотемпературной инкубации использовали термоциклер, а для полистирольного планшета для микротитрования использовали обычный инкубатор, поскольку нормальные полистирольные планшеты для ELISA не подходят к обычному термоциклеру. Однако температуру инкубатора для HELISA на полистирольном планшете поддерживали на уровне на 2°C выше температуры термоциклера для каждой стадии ELISA. В инкубаторе требуется немного более высокая температура, поскольку там передача тепла идет немного медленнее, чем в термоциклере.
HELISA также может проводиться на полистирольных планшетах в инкубаторе без повышения его температуры, но с продлением каждой стадии ELISA на 5 мин для компенсации задержки переноса тепла в инкубаторе. Во всех случаях поверхности без активации характеризовались намного меньшим значением поглощения.
Результаты, полученные на обоих данных планшетах, были очень сходными, указывая на то, что опосредованный нагреванием ELISA (HELISA) может также проводиться на активированном полистирольном планшете для микротитрования.
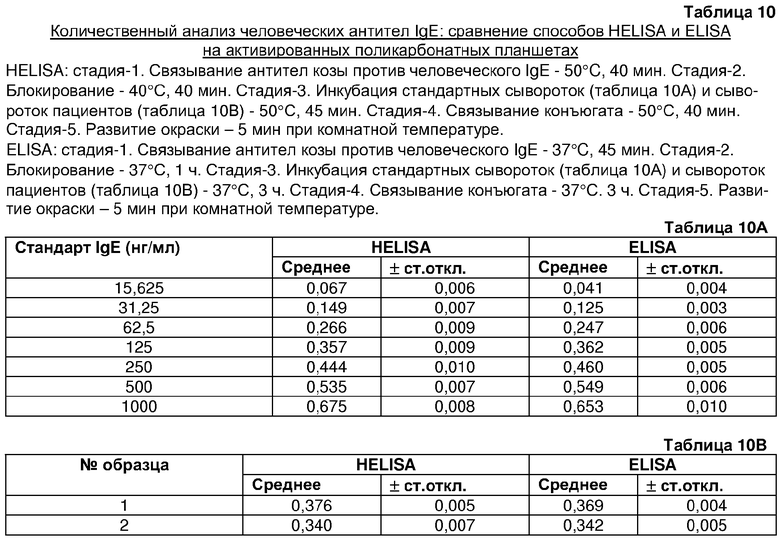
Также способом по изобретению выявляли IgE с той же эффективностью, что и IgG. Стандартная кривая, полученная для количественного анализа человеческого IgE (таблица 10A) и количества, присутствующего в сыворотке пациента (таблица 10B), посредством способов HELISA (в течение 2 ч 50 мин) и ELISA (в течение 7 ч 50 мин), показала сравнимые результаты (таблица 10). Таким образом, способ по изобретению может снизить время анализа до 2 ч 50 мин с 7 ч 50 мин без влияния на значение результата ELISA.
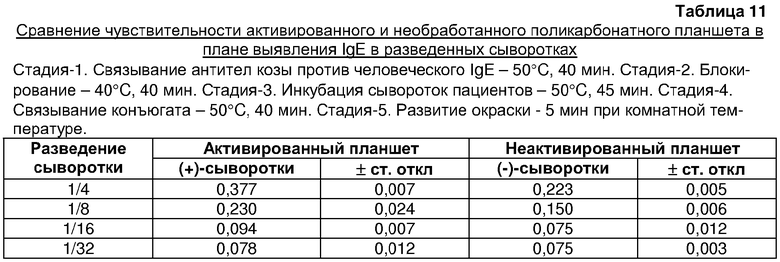
Способ HELISA по изобретению также является очень чувствительным, как видно из таблицы 11, где он выявил IgE в 1/8 разведении сыворотки пациента. Таким образом, настоящее изобретение является быстрым, чувствительным и простым и может осуществляться в любых нормальных лабораторных условиях.
Общее время, требуемое для HELISA, составляет менее 3 ч. Однако время, требуемое на каждую стадию, может изменяться в зависимости от биомолекул, где отличные результаты могут быть получены путем небольшой модификации условий реакции, которая представляет собой небольшое изменение по длительности и температуры инкубации. Вместо термоциклера HELISA также может проводиться в инкубаторе, поддерживающем температуру 52°C для связывания антигена, связывания антитела и связывания конъюгата, и 42°C для блокирования, в течение периода времени, равного 40, 45, 40 и 40 мин соответственно.
Соответственно, настоящее изобретение относится к быстрому способу сорбционного иммуноферментного анализа, характеризующегося применением активированной твердой основы, где указанный способ включает:
(a) предоставление активированной твердой основы,
(b) загрузку биомолекулы, выбранной из антигена или антитела, путем растворения указанной биомолекулы в покрывающем буфере в активированной лунке указанной твердой основы, и нагревание указанной лунки до температуры в интервале 40-80°C в течение периода времени в интервале 10-70 мин, с последующей тщательной промывкой лунки подходящим промывочным буфером,
(c) блокирование лунки, содержащей иммобилизированную биомолекулу, полученной выше на стадии (b), путем загрузки блокирующего раствора в указанную лунку и нагревания указанной лунки до температуры в интервале 40-70°C в течение периода времени в интервале 10-60 мин и промывки лунки подходящим промывочным буфером,
(d) загрузку соответствующего антитела или антигена, растворенного в буфере, в лунку с иммобилизированным антигеном или антителом, полученную на стадии (c), с последующим нагреванием указанной лунки до температуры в интервале 40-80°C в течение периода времени в интервале 10-70 мин, с последующей промывкой промывочным буфером,
(e) загрузку подходящим конъюгатом фермента, растворенным в подходящем буфере в указанной лунке, полученной на стадии (d), и нагревание указанной лунки до температуры в интервале 40-80°C в течение периода времени в интервале 20-70 мин, с последующей промывкой промывочным буфером,
(f) добавление буфера с красителем-субстратом в указанную лунку, полученную выше на стадии (e), и поддержание ее в течение периода времени в интервале 4-10 мин в темноте с последующим добавлением останавливающего раствора и измерения оптической плотности данного раствора посредством спектрофотометра на подходящей длине волны.
В варианте осуществления настоящего изобретения используемая твердая основа выбрана из группы, состоящей из материалов, таких как поликарбонат, полистирол, полипропилен, полиэтилен, стекло, целлюлоза, нитроцеллюлоза, силикагель, поливинилхлорид и тому подобное.
В варианте осуществления настоящего изобретения использумые предпочтительные твердые основы представляют собой поликарбонат и полистирол.
Еще в одном варианте осуществления выбранная твердая основа имеет любой вид, форму и размер, например представляет собой планшет для ПЦР, планшет для ELISA, планшет с микролунками, листы, частицы для тестирования, такие как гранулы или микросферы, пробирки для тестирования, палочки для тестирования, полосы для тестирования, лунка или модуль.
В варианте осуществления настоящего изобретения активированная твердая основа, используемая для иммобилизации биомолекул, выбрана из любой твердой основы, способной связывать молекулы-лиганды, в частности, путем ковалентного связывания.
Еще в одном варианте осуществления настоящего изобретения активированная твердая основа может иметь активную функциональную группу для ковалентного связывания, которая выбрана из галогенида, альдегида, ацетила, эпоксида, сукцинамида, изотиоцианата, ацилазида и тому подобного.
Еще в одном варианте осуществления настоящего изобретения активная функциональная группа может присутствовать в самой основе или может вводиться общепринятыми химическими, фотохимическими или другими способами, известными в данной области.
Еще в одном варианте осуществления настоящего изобретения функциональную группу вводят на твердую основу путем фотохимической реакции с использованием фотохимически активного соединения, которое выбрано из 4-азидо-1-фтор-2-нитробензола (1-фтор-2-нитро-4-азидобензола), N-гидроксисульфосукцинимидил-4-азидобензоата, N-гидроксисульфосукцинимидил-4-азидосалициловой кислоты, хинона или его производных и тому подобного.
Еще в одном варианте осуществления настоящего изобретения поликарбонатную и полистирольную поверхность активируют путем покрытия 4-азидо-1-фтор-2-нитробензолом и воздействия на покрытую основу УФ-облучения при 365 нм.
Еще в одном варианте осуществления настоящего изобретения источник света для фотохимической реакции выбран из УФ-лампы, лазерного пучка, яркого солнечного света и тому подобного.
Еще в одном варианте осуществления настоящего изобретения время для фотохимической реакции для активации твердой основы выбирают в интервале от 10 секунд до 10 часов.
Еще в одном варианте осуществления изобретения инкубацию проводят в устройстве, выбранном из лабораторного термоциклера для полимеразной цепной реакции (ПЦР), специально сконструированного термоциклера, инкубатора, водяной бани или любого устройства или камеры, в которой генерируется тепло, и тому подобного.
Еще в одном предпочтительном варианте осуществления изобретения первую стадию стадию ELISA проводят путем ковалентного связывания антигена или антитела на активированном планшете при нагревании до температуры в интервале 40-80°С в течение периода времени в интервале 10-70 мин.
Еще в одном предпочтительном варианте осуществления изобретения вторую стадию ELISA, которая представляет собой стадию блокирования, проводят при нагревании до температуры в интервале 40-70°C в течение периода времени в интервале 10-60 мин.
Еще в одном предпочтительном варианте осуществления изобретения третью стадию ELISA, которая представляет собой связывание соответствующего антитела или антигена, проводят при нагревании в интервале 40-80°C в течение периода времени в интервале 10-70 мин.
Еще в одном предпочтительном варианте осуществления изобретения четвертую стадию ELISA, которая представляет собой связывание конъюгата с ферментом, проводят путем нагревания при температуре в интервале 40-80°C в течение периода времени в интервале 10-70 мин.
Еще в одном предпочтительном варианте осуществления изобретения общее время связывания антигена, блокирования и связывания конъюгата изменяется от 2 до 4 ч там, где общее время общепринятого способа ELISA обычно изменяется от 8 ч до 24 ч.
Еще в одном предпочтительном варианте осуществления изобретения антиген может растворяться в покрывающем буфере, таком как карбонатный буфер, фосфатный буфер и подобный буфер подходящей композиции, характеризующемся pH в интервале от 6,5 до 11, с молярностью в интервале от 0,005 M до 0,1 M, и данный буфер должен быть совместим с антигеном.
Еще в одном предпочтительном варианте осуществления изобретения используемый буфер для промывки представляет собой смесь фосфатного буфера, характеризующегося pH в интервале от 6,5 до 11, с молярностью от 0,005 до 0,1 M, с Tween 20 в интервале от 0,05 до 3%.
Еще в одном предпочтительном варианте осуществления изобретения блокирующий реагент выбран из бычьего сывороточного альбумина, порошкового обезжиренного молока и желатина и тому подобного.
В другом варианте осуществления настоящего изобретения биомолекула выбрана из антигена и антитела. Антиген может представлять собой любую биомолекулу, микроорганизм и т.д., который вызывает или потенциально способен вызвать иммунный ответ.
В другом варианте осуществления настоящего изобретения конъюгат выбирают из биомолекулы, имеющей антитело или антиген, конъюгированный с ферментом, выбранным из пероксидазы хрена или щелочной фосфатазы. Еще в одном предпочтительном варианте осуществления изобретения фермент может замещаться меткой, выбранной из хромофора, флуорофора и тому подобного, которая облегчает анализ. Еще в одном предпочтительном варианте осуществления изобретения способ по изобретению может использоваться для других иммунных анализов, таких как радиоиммунный анализ, сорбционный радиоиммунный тест, сорбционный радиоаллергологический тест, иммунный анализ на основе биотина-авидина/стрептавидина, иммуноблоттинг, иммуноокрашивание и т.д., не говоря уже о других типах ELISA, таких как прямой ELISA, непрямой ELISA, сэндвич-ELISA и тому подобное.
Еще в одном предпочтительном варианте осуществления изобретения способ по изобретению может автоматизироваться или полуавтоматизироваться. Может быть сделано устройство для того, чтобы для него подходили ELISA-планшеты для микротитрования для опосредованного нагреванием сорбционного иммуноферментного анализа (HELISA), причем данное устройство содержит реакционную камеру, состоящую из системы быстрого нагревания до температуры в интервале 40-70°C и системы охлаждения, такой как вытяжной вентилятор, для проведения стадий связывания антигена, блокирования, связывания антитела и связывания конъюгата фермента с антителом.
В способе по изобретению инертную твердую поверхность, такую как поликарбонатный планшет для ПЦР (обычно применяемый для полимеразной цепной реакции) и 96-луночный полистирольный планшет для микротитрования, активировали путем фотохимической реакции, проводимой в сухих условиях с использованием FNAB. Твердую основу активировали путем воздействия на покрытую FNAB основу УФ-излучения или яркого солнечного света. Данную активированную основу применяли для опосредованного нагреванием ELISA (HELISA) и для контрольного ELISA по выявлению антител, например антител козы против человеческого IgG и антител козы против человеческого IgE.
Тепловую реакцию проводили внутри термоциклера (Perkin Elmer, Gene Amp PCR System 2400) или в инкубаторе BOD.
В качестве покрывающего буфера применяли карбонатный буфер, pH 9,6, 0,1 M.
В качестве буфера для разведения антител использовали фосфатно-солевой буфер (PBS), pH 7,2, 0,01 M.
В качестве промывочного буфера во всех экспериментах использовали фосфатно-солевой буфер (PBS), pH 7,2, 0,01 M, с 0,1% Tween 20, кроме указанных иначе случаев. Блокирующий раствор получали путем растворения 2% BSA в 0,01 M PBS, pH 7,2. Субстратный раствор получали путем добавления 0,067% о-фенилендиамина и 0,043% H2O2 в 0,1 M фосфатно-цитратный буфер, pH 4,5. Нормальные сыворотки козы брали в качестве сывороток отрицательного контроля (-сыворотки). 100 мкл разведенных (1:300)-сывороток применяли для каждой лунки.
Конъюгированные с пероксидазой хрена антитела против кроличьего IgG приобретали от Sigma в виде лиофилизованного порошка.
После восстановления оптимальное разведение, как было обнаружено, составляло 1:5000, что определено посредством шахматного титрования, и это разведение применяли в экспериментах.
Во всех экспериментах ELISA значения поглощения выражали в виде среднего из трех повторностей.
ELISA представляет собой 5-стадийную процедуру, а именно связывание антигена, блокирование, связывание антитела, связывание конъюгата и развитие окраски. Каждую стадию HELISA оптимизировали путем проведения последовательных стадий обычной процедурой ELISA. Обычный ELISA проводили путем покрытия лунок антигеном в течение ночи при 4°C (45 мин при 37°C для активированных лунок), блокирования в течение 1 ч при 37°C, с последующим связыванием антитела и конъюгата при 37°C, каждое из которых длится в течение 3 ч, и развития окраски, которое представляет собой реакцию фермент-субстрат, при комнатной температуре в течение 5 мин, с последующим считыванием поглощения.
Настоящее изобретение и его преимущества
2. Способ занимает даже меньше времени, чем недавно опубликованный способ ELISA (около 8 ч) (Bora et al. 2002) на светочувствительной поверхности.
3. Способ по изобретению чувствителен и требует малых количеств ценного антигена или антитела.
4. Способ по изобретению прост и не требует дополнительных оценок, реагентов или оборудования. Его можно проводить на обычном лабораторном устройстве, таком как термоциклер, инкубатор, или даже на водяной бане.
5. Способ может быть легко автоматизирован.
6. Небольшое отклонение условий инкубирования от оптимальных условий значимо не воздействует на результат ELISA по настоящему изобретения.
Изобретение далее объясняется с помощью следующих примеров, и они не предназначены для ограничения объема изобретения.
Пример 1
Активация поликарбонатных и полистирольных поверхностей
В лунки планшета для ПЦР (поликарбонатный планшет, Greiner, Германия) загружали 6,0 мкмоль 1-фтор-2-нитро-4-азидобензола (FNAB), растворенного в 50 мкл метанола на лунку, и сушили полностью в темноте. Покрытые FNAB лунки затем облучали в течение 7,5 мин УФ-излучением при длине волны 365 нм в UV Stratalinker 2400 (Stratagene®, США) или держали под ярким солнечным светом в течение 15 мин. Лунки полистирольного планшета для микротитрования активировали сходным образом с использованием 10 мкмоль FNAB, растворенного в 50 мкл метанола, высушенного и облученного в течение 10 мин при 365 нм или в солнечном свете в течение 15 мин.
Затем лунки промывали несколько раз метанолом для удаления несвязавшегося линкера и сушили при комнатной температуре. Данные активированные лунки применяли для иммобилизации антигена или антитела в процедуре по изобретению.
Пример 2
Определение концентрации антител козы против человеческого IgG для получения твердой фазы на активированной поликарбонатной поверхности
Серии двойных разведений (2000-0,061 г/мл) антител козы против человеческого IgG (разведенных 0,1 M карбонатно-бикарбонатным буфером, pH 9,6) загружали в трех повторностях в лунки (90 мкл/лунку для каждого разведения) активированных и необработанных поликарбонатных планшетов. Затем планшеты инкубировали при 50°C в течение 1 ч в термоциклере. Затем планшеты шесть раз промывали буфером для промывки (0,05% Tween 20 с 0,01 M PBS) и стадию блокирования проводили 2%-ным раствором BSA (100 мкл/лунку) при 37°C в течение 1 ч. После промывки каждую лунку загружали 90 мкл 250 нг/мл раствора человеческого IgG (растворенного в 0,01 M PBS, pH 7,4), и планшеты инкубировали при 37°С в течение 3 ч. Планшеты опять промывали шесть раз, и в каждую лунку загружали 90 мкл раствора конъюгата антител козы против человеческого IgG с пероксидазой (растворенного в 0,01 M PBS, pH 7,4) в разведении 1/5000 (об./об.), и инкубировали при 37°C в течение 3 ч. После промывки 90 мкл раствора субстрата-красителя (0,4 мг o-фенилендиамина гидрохлорида и 2 мкл H2О2 в 10 мл 0,2 M цитратного буфера, pH 5) загружали в каждую лунку. Развитие окраски останавливали через 5 мин добавлением 10 мкл 5% H2SO4. Растворы переносили в лунки с полистирольным планшетом для микротитрования и регистрировали поглощение при 490 нм.
Пример 3
Оптимизация температуры для иммобилизации антител козы против человеческого IgG на активированных и необработанных поликарбонатных планшетах (таблица 1)
Лунки восьми активированных поликарбонатных планшетов загружали в трех повторностях раствором антител козы против человеческого IgG (90 мкл/лунку раствора 250 нг/мл) и инкубировали в течение 60 мин при 35, 40, 45, 50, 55, 60, 65 и 70°C, соответственно, в термоциклере. Антитела козы против человеческого IgG также сходным образом иммобилизовали на необработанных поликарбонатных планшетах. Затем оставшиеся стадии ELISA проводили с данными твердыми фазами обычным способом ELISA, как описано в примере 2.
Пример 4
Оптимизация времени инкубации антител козы против человеческого IgG для получения твердой фазы (таблица 2)
Лунки шести активированных и шести необработанных поликарбонатных планшетов загружали в трех повторностях 90 мкл/лунку антител козы против человеческого IgG (250 нг/мл), и планшеты инкубировали при 50°C в течение 10, 20, 30, 40, 50 и 60 мин, соответственно, в термоциклере. Оставшиеся стадии ELISA проводили с данными твердыми фазами путем общепринятого способа ELISA, описанного в примере 2.
Пример 5
Исследования температуры инкубации стадии блокирования (таблица 3)
Антитела козы против человеческого IgG иммобилизовали в трех повторностях, как описано выше в трех параллельных лунках шести активированных планшетов при 50°C и 40 мин инкубации. После промывки в лунки загружали 100 мкл 2% (мас./об.) раствора BSA. Затем планшеты инкубировали в течение 1 ч при 40, 45, 50, 55, 60 и 65°C, соответственно. Инкубацию с человеческим IgG и с конъюгатом вторичного антитела с ферментом проводили при 37°C в течение 3 ч с каждым из антител. Контрольные эксперименты с необработанными планшетами проводили сходно для каждой соответствующей температуры.
Пример 6
Оптимизация времени инкубации для стадии блокирования (таблица 4)
Антитела козы против человеческого IgG иммобилизовали в трех повторностях, как описано в примере 5, в лунках шести активированных планшетах. После промывки в лунки загружали 100 мкл 2% (мас./об.) раствора BSA. Затем планшеты инкубировали при 40°С в течение 10, 20, 30, 40, 50 и 60 мин, соответственно. Инкубацию с человеческим IgG и с конъюгатом вторичного антитела с ферментом проводили при 37°C в течение 3 ч с каждым из антител. Контрольные эксперименты с необработанными планшетами проводили сходно для каждого соответствующего периода времени.
Пример 7
Оптимальная доза человеческого IgG, требуемого для анализа
Твердые фазы получали путем иммобилизации антител козы против человеческого IgG (250 нг/мл) в активированных и необработанных лунках поликарбонатного планшета при 50°C в течение 40 мин. Промывку и блокирование (40°C, 40 мин) проводили, как описано выше. Затем лунки загружали серией двукратных разведений (1000-0,122 нг/мл) человеческого раствора IgG и инкубировали в течение 3 ч при 37°C. Остальные стадии ELISA проводили, как описано выше.
Пример 8
Определение оптимальной температуры связывания человеческого IgG с твердой фазой (таблица 5)
Твердую фазу получали на активированном поликарбонатном планшете, как описано в примере 5. Блокирование проводили в оптимальных условиях (40°C, 40 мин), как описано выше. После промывки 90 мкл человеческого IgG (из раствора 125 нг/мл) инкубировали с твердой фазой в течение 60 мин при 40°С. Планшет промывали, и 90 мл разведенного 1/5000 конъюгата антител козы против человеческого IgG с пероксидазой инкубировали в течение 3 ч при 37°C. Поглощение регистрировали, как описано. Сходным образом, еще пять экспериментов проводили путем увеличения температуры инкубации человеческого IgG на 5°C до 65°C. Контрольные эксперименты с необработанными планшетами проводили для соответствующей температуры.
Пример 9
Связывание человеческого IgG с твердой фазой в течение различного времени инкубации (таблица 6)
90 мкл раствора человеческого IgG (из раствора 125 нг/мл) инкубировали при 50°C в течение 15 мин с твердой фазой, полученной в примере 8. Затем промытые лунки инкубировали с разведенным 1/5000 конъюгатом антител козы против человеческого IgG с пероксидазой при 37°C в течение 3 ч и анализировали, как описано ранее. Еще четыре эксперимента проводили путем инкубации человеческого IgG в течение 30, 45, 60 и 90 мин, соответственно. Контрольные эксперименты проводили с необработанной поликарбонатной поверхностью в сходных условиях.
Пример 10
Оптимальная температура для связывания конъюгата антител козы против человеческого IgG с пероксидазой с человеческим IgG, связанным с твердой фазой (таблица 7)
Получение твердой фазы и блокирование проводили, как в примере 8. Инкубацию человеческого IgG проводили при 50°C в течение 45 мин, как описано выше. Затем инкубировали разведение 1/5000 об./об. конъюгата антител козы против человеческого IgG с пероксидазой (90 мкл/лунку) в течение 60 мин при 40°C. После промывки регистрировали поглощение, как указано выше. Еще пять экспериментов проводили сходным образом при других температурах инкубации (45, 50, 55, 60 и 65°C) конъюгата вторичных антител с ферментом. Контрольные эксперименты проводили с необработанной поверхностью в сходных условиях.
Пример 11
Оптимизация времени инкубации для связывания конъюгата антител козы против человеческого IgG с пероксидазой с человеческим IgG, связанным с твердой фазой (таблица 8)
Иммобилизацию антител козы против человеческого IgG, блокирование и инкубацию человеческого IgG проводили, как в примере 10. Конъюгат вторичного антитела с ферментом (1/5000 об./об.) инкубировали при 50°C в течение 10 мин и анализировали. Еще пять экспериментов проводили путем инкубации конъюгата в течение 20, 30, 40, 50 и 60 мин, соответственно. Контрольные эксперименты проводили в течение соответствующего времени с необработанной поверхностью.
Пример 12
Сравнительные исследования HELISA и обычного ELISA на поликарбонатных и полистирольных поверхностях для выявления человеческого IgG (таблица 9)
В поликарбонатных (PC 1) и полистирольных (PS 1) планшетах проводили ELISA путем иммобилизации антител козы против человеческого IgG в течение 45 мин при 37°C, блокирования в течение 1 ч при 37°C, связывания человеческого IgG в течение 3 ч при 37°C и связывания конъюгата в течение 3 ч при 37°C. В планшете PC 2 и PS 2 проводили ELISA путем иммобилизации антител козы против человеческого IgG в течение 40 мин, блокирования в течение 40 мин, связывания человеческого IgG в течение 45 мин и связывания конъюгата в течение 40 мин при 37°C. В планшете PC 3 проводили HELISA путем иммобилизации антител козы против человеческого IgG в течение 40 мин при 50°C, блокирования в течение 40 мин при 40°C, связывания человеческого IgG в течение 45 мин при 50°C и связывания конъюгата в течение 40 мин при 50°C. HELISA на планшете PS 3 проводили в инкубаторе сходно с PC 3, за исключением того, что температура каждой стадии была на 2°С выше, чем в эксперименте PC 3, проведенном в термоциклере. Все данные эксперименты проводили с активированными и необработанными планшетами.
Пример 13
Количественное определение IgE в сыворотках пациентов путем HELISA и обычного ELISA
А. Получение стандартных кривых путем HELISA и обычного ELISA (таблица 10А)
В способе HELISA антитела козы против человеческого IgE (0,75 мкл раствора 1 мкг/мл) иммобилизовали на активированные поликарбонатные лунки в течение 40 мин при 50°С. Планшет промывали шесть раз буфером для промывки (50 мМ Tris, 0,14 M NaCl, pH 8,0 и 0,05% Tween 20). Блокирование проводили 2% BSA путем инкубации планшета при 40°С в течение 40 мин. Затем лунки загружали 0,75 мкл стандартов IgE (Bethyl Laboratories Inc., США) в серии двукратных разведений (1000, 500, 250, 125, 62,5, 31,25 и 15,34 нг/мл) и инкубировали в течение 45 мин при 50°С. После промывки лунки загружали 0,75 мкл раствора конъюгата антител козы против человеческого IgE с пероксидазой и инкубировали в течение 40 мин при 50°С. Планшет опять промывали и анализировали на предмет наличия фермента.
Обычный ELISA проводили путем иммобилизации захватывающего антитела (антитело козы против человеческого IgE) на активированной поверхности путем инкубации в течение 45 мин при 37°С или в течение ночи при 4°С. Блокирование проводили в течение 1 ч при 37°С. Стандарт IgE и конъюгат инкубировали каждый в течение 3 ч при 37°С.
В. Определение IgE в сыворотках пациентов (таблица 10В)
HELISA и обычный ELISA проводили сходно, за исключением того, что вместо стандартов IgE применяли разведенные 1/4 (об./об.) сыворотки пациентов для определения IgE в сыворотках пациентов.
Пример 14
Чувствительность твердой фазы в плане выявления IgE в сыворотках пациентов (таблица 11)
Захватывающее антитело иммобилизовали в течение 40 мин при 50°С на необработанных и активированных поликарбонатных лунках. После блокирования в течение 40 мин при 40°С лунки загружали сывороткой крови человека в различных разведениях (1/4, 1/8, 1/16 и 1/32) и инкубировали в течение 45 мин при температуре 50°С. Инкубацию конъюгата проводили при 50°С в течение 40 мин. Развитие окраски проводили при комнатной температуре в течение 5 мин. Поглощение регистрировали, как описано выше.

Преимущества
На выполнение обычных способов ELISA обычно уходит 8-15 ч, что является основным недостатком способа, используемого во всем мире в различных областях, не говоря о клинической диагностике. В случае медицинской срочности на диагностику теряется драгоценное время до того, как пациенту можно провести лечение. Поэтому изобретенный здесь быстрый способ ELISA (HELISA) является выгодным и может использоваться для диагностики заболеваний, биомедицинских исследований и в других связанных областях. Основные преимущества способа ELISA по изобретению являются следующими.
1. Способ по изобретению быстрее, чем общепринятый способ ELISA.
2. Общее время, требуемое для способа по изобретению, не превышает 3 ч. Таким образом, избегается емкая по времени процедура.
3. Способ по изобретению чувствительный и требует малых количеств ценного антигена или антитела.
4. Способ прост и не требует для своего выполнения какой-либо дополнительной оценки или реагента.
5. Способ по изобретению является экономически эффективным и не требует какого-либо дополнительного оборудования, кроме нагревательного устройства, которое обычно для большинства лабораторий.
6. Способ по изобретению воспроизводим, что является важным критерием для ELISA.
7. Способ дает минимальное или незначительное неспецифическое связывание.
8. Способ имеет потенциал для автоматизации, что может минимизировать ошибки, связанные с действиями персонала.
Ссылки
1. Douillard, J.Y. and Hoffman, T. (1983) Methods in Enzymology 92, 168-74.
2. Van Emon, J.M. and Lopez-Avila, V. (1992) Analytical Chemistry64, 79A-88A.
3. Ghassempour, A. Mohammadkhah, A., Najafi, F. and Rajabdeh, M. (2002) Anal. Sci. 8, 779-83.
4. Salgame, P., Varadhachary, A.S, Primiano, L.L., Finke, J.E., Muller, S. and Monestier, M. (1996) Nucleic Acids Res. 25, 680-1.
5. Kricka, L.J., Carter, T.J., Burt, S.M., Kennedy, J.H., Holder, R.L. and Halliday, M.I., 1980. Clin. Chem. 26, 741-4.
6. Hermann, J.E. and Collins, M.F. (1976) J. Immunol. Methods10, 363-6.
7. Engvall, E. and Perlmann, P. (1971) Immunochemistry8, 871-4.
8. Kemeny, D.M., 1997. In: Johnstone, A.P., Turner, M.W. (Eds.), Immunochemistry I: A Practical Approach. IRL Press at Oxford Univ. Press, New York, and pp.147-175.
9. Deshpande, S.S. (1996) Enzyme Immunoassays from Concept to Product Development. Chapman & Hall, New York.
10. Douglas, A.S. and Monteith, C.A. (1994) Clin. Chem. 40, 1833-37.
11. Larsson, P.H., Johansson, S.G.O., Hult, A. and Gothe, S. (1987) J. Immunol. Methods 98, 129-35.
12. Aleixo, J.A.G., Swaminathan, В., Minnich, S.A. and Wallshein, V.A. (1985) J. Immunoassay6, 391-401.
13. Bora, U., Chugh, L. and Nahar, P. (2002). J. Immunol. Methods268, 171-8.
14. Nahar, P., Wali, N.M. and Gandhi, R.P. (2001) Anal. Biochem.294, 148-53.
Другие ссылки
Патентные документы
1. P. Nahar. Способ фотохимической активации полимерной поверхности и иммобилизации биомолекул на активированной поверхности. Патент США, подан в июне 2002 г., NF 304/02.
2. P. Nahar, U. Bora and G. L. Sharma. (2002) Быстрый способ сорбционного иммуноферментного анализа. Патент США № 6498016.
3. P. Nahar, U. Bora and G. L. Sharma. Быстрый способ сорбционного иммуноферментного анализа. Заявка PCT № WO 02/14868 A1.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЫСТРЫЙ СПОСОБ ДЛЯ СВЧ-ОПОСРЕДОВАННОГО ИММУНОСОРБЕНТНОГО ТВЕРДОФАЗНОГО АНАЛИЗА | 2000 |
|
RU2249218C2 |
| СПОСОБ СЕНСИБИЛИЗАЦИИ ПЛАНШЕТА ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА ПОЛИСАХАРИДНЫМИ АНТИГЕНАМИ | 2008 |
|
RU2380709C1 |
| МОНОКЛОНАЛЬНОЕ АНТИИДИОТИПИЧЕСКОЕ АНТИТЕЛО Ab2, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ИСПОЛЬЗОВАНИЯ ПРОТИВ БОЛЕЗНЕЙ, СОПРОВОЖДАЮЩИХСЯ ЭКСПРЕССИЕЙ Lewis Y6 АНТИГЕНА, И ДЛЯ ОЧИСТКИ ВАРИАНТА BR55-2 АНТИТЕЛА, ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИЙ СОСТАВ | 1993 |
|
RU2208642C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ ИММУННОГО ОТВЕТА (ВАРИАНТЫ) | 1996 |
|
RU2197733C2 |
| Моноклональное антиидиотипическое антитело АИ-К11В, обладающее антигенными свойствами морфина | 2020 |
|
RU2745374C1 |
| АНТИТЕЛО ПРОТИВ ОСТЕОПОНТИНА И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2299888C2 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ПРЕЖДЕВРЕМЕННОЙ НЕДОСТАТОЧНОСТИ ЯИЧНИКОВ ПО ОПРЕДЕЛЕНИЮ АУТОАНТИТЕЛ К СТЕРОИДОГЕННЫМ ФЕРМЕНТАМ ЦИТОХРОМА Р450 В СЫВОРОТКЕ (ПЛАЗМЕ) КРОВИ МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2023 |
|
RU2829511C1 |
| КОМПОЗИЦИИ РЕКОМБИНАНТНЫХ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2009 |
|
RU2540146C2 |
| КОМПОЗИЦИИ РЕКОМБИНАНТНЫХ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2008 |
|
RU2488596C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АУТОАНТИТЕЛ К ПРОГЕСТЕРОНУ В СЫВОРОТКЕ И ПЛАЗМЕ КРОВИ ЧЕЛОВЕКА МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2014 |
|
RU2567724C1 |
Изобретение относится к области медицины, биологии, сельского хозяйства, к способу проведения сорбционного иммуноферментного анализа для выявления малых количеств биомолекул, таких как антиген, антитело и т.д. Изобретение, в частности, относится к опосредованной нагреванием иммобилизации антигена или антитела на активированную поверхность с последующим проведением дальнейших стадий ELISA при контролируемой температуре. Изобретение снижает общее время, требуемое для проведения ELISA, примерно до 3 ч. Изобретение является быстрым, экономичным, воспроизводимым и простым. 2 н. и 22 з.п. ф-лы, 16 табл.
а. предоставление активированной твердой основы, по меньшей мере, с одной активированной лункой,
b. загрузку биомолекулы, выбранной из антигена или антитела, путем растворения указанной биомолекулы в покрывающем буфере в активированной лунке указанной твердой основы, и нагревание указанной лунки до температуры в интервале 40-80°С в течение периода времени в интервале 10-70 мин, с последующей тщательной промывкой лунки подходящим промывочным буфером,
с. блокирование лунки, содержащей иммобилизированную биомолекулу, полученной выше на стадии (b) путем загрузки блокирующего раствора в указанную лунку и нагревания указанной лунки до температуры в интервале 40-70°С в течение периода времени в интервале 10-60 мин, и промывки лунки подходящим промывочным буфером,
d. загрузку соответствующего антитела или антигена, растворенного в буфере, в лунку с иммобилизированным антигеном или антителом, полученную на стадии (с), с последующим нагреванием указанной лунки до температуры в интервале 40-80°С в течение периода времени в интервале 10-70 мин, с последующей промывкой промывочным буфером,
е. загрузку подходящим конъюгатом фермента, растворенным в подходящем буфере в указанной лунке, полученной на стадии (d), и нагревание указанной лунки до температуры в интервале 40-80°С в течение периода времени в интервале 20-70 мин, с последующей промывкой промывочным буфером,
f. добавление буфера с красителем-субстратом в указанную лунку, полученную на стадии (е), и его выдерживание в течение периода в интервале 4-10 мин в темноте с последующим добавлением останавливающего раствора и измерения оптической плотности данного раствора посредством спектрофотометра на подходящей длине волны.
| US 6498016 B1, 24.12.2002 | |||
| WO 8903038 A1, 06.04.1989 | |||
| 0 |
|
SU236069A1 | |
| Устройство для декодирования двухчастотных цифровых сигналов | 1980 |
|
SU857974A1 |
| Устройство для автоматического контроля и сортировки ферромагнитных изделий | 1939 |
|
SU58428A1 |
| JP 6160393 А, 07.06.1994 | |||
| JP 6043161 А, 18.02.1994 | |||
| LABROUSS H | |||
| et al | |||
| Effect of temperature on the reactivities of polyreactive and monospecific IgG antibodies | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
Авторы
Даты
2007-10-27—Публикация
2003-03-31—Подача