Изобретение относится к области биологии и медицины и может использоваться для создания пластырей, повязок, протезов и имплантантов.
Предшествующий уровень техники
Получение материалов с новыми свойствами для медицинских целей является одной из наиболее актуальных задач в современной науке. Известен пластырь (заявка России №2000111948), содержащий опорный слой, нанесенную на него пластырную массу с действующим веществом и защитный слой, отличающийся тем, что опорный слой выполнен из полимерного материала с покрытием, исключающим проникновение летучих соединений из пластырной массы в окружающую среду при апплицировании на кожу, пластырная масса представляет собой полимерный слой.
Известен также бактерицидный лейкопластырь (заявка России №99111169), состоящий из гигроскопичного атравматичного материала, пропитанного раствором антисептических веществ: фурацилина, синтомицина и бриллиантового зеленого в 40% растворе этилового спирта и лейкопластырной ленты, на которой фиксирован гигроскопичный атравматичный материал, отличающийся тем, что бактерицидный лейкопластырь содержит повышенные концентрации составляющих лекарственных веществ по отношению к атравматичному материалу.
Известен также способ лечения ожоговых ран с помощью пленочного перевязочного материала (заявка России №96116806), содержащего смесь лекарственных препаратов, при котором ожоговые раны предварительно припудривают порошком биопрепарата на основе водорастворимого кератина, а лечение проводят до полного некролизиса ожоговых ран с помощью пленочного перевязочного материала, содержащего ряды отверстий, образующих прямоугольники сплошной поверхности с размерами сторон 100 и 200 мм, при этом отверстия выполнены прямоугольными с размерами сторон 1 и 3-5 мм на расстоянии 1мм.
Углеродные покрытия относятся к покрытиям, имеющим высокую биологическую совместимость и тромборезистентность (Diamond and Related Materials, v.4 (1995) p. 1142-44). Так, известен способ производства полимерных протезов с биологически совместимым углеродным покрытием (патент США N 533845). Углеродное покрытие наносится на основу посредством распыления катода при давлении при напряжении 2000-3200 В.
Однородное биологически совместимое покрытие углерода формируется на поверхности основы с плотностью покрытия 2.1 г/см3.
Известен также способ производства полимерного протезов с биологически совместимым биологическим покрытием (патент США N 5084151). Покрытие образуется при давлении 10-10 mbar. Луч плазмы направлен к катоду углерода. Распыляемые атомы углерода попадают на подложку, нагретую до температуры 250 градусов Цельсия. Покрытие имеет турбостратную структуру.
Наиболее близким к заявляемому техническому решению является материал тетракарбон с поликристаллической структурой, обладающий высокой биосовместимостью и состоящий из структурно-упорядоченного нормально ориентированного к поверхности основы полимера (патент США N US 6555224).
Недостатками известных покрытий являются низкие бактерицидные свойства, высокая свертываемость крови, вследствие чего образуются тромбы или коллагеновые рубцы.
Раскрытие изобретения
Целью изобретения является увеличение бактерицидных свойств, ускорение заживления ожеговых и донорских ран путем формирования оптимальных условий для внутриклеточного обмена продуктами роста, сокращение время их лечения, исключение (снижение) возможности образования коллагеновых рубцов, а также уменьшение риска образования тромбов, отторжения имплантанта, развития воспаления.
Поставленная цель достигается применением в качестве медицинского покрытия монокристаллического углерода, поверхность которого по своим ориентационньм свойствам и способностью индуцировать структурную упорядоченность белков может активно использоваться в процессе производства медицинских материалов для ускоренного заживления ран, в частности пластырей. Покрытие выполнено из монокристаллического углерода с этактичной (от греческого "eu tacticos" - хорошо организованной) гомеотропной структурой.
Указанная цель достигается тем, что в медицинском покрытии, состоящем из структурно-упорядоченного нормально ориентированного к поверхности основы полимера, покрытие выполнено из монокристаллического углерода.
Указанная цель достигается тем, что монокристаллический углерод обладает этактичной гомеотропной структурой.
Указанная цель достигается тем, что монокристаллический углерод легирован азотом при следующем соотношении ингредиентов: азот от 1 до 12%, углерод от 88 до 99%.
Указанная цель достигается тем, что покрытие выполнено с возможностью регулирования адсорбции и структурной упорядоченности белков на его поверхности
Указанная цель достигается тем, что покрытие выполнено с обеспечением оптимальной степени свертывания крови.
Указанная цель достигается тем, что монокристаллический углерод нанесен частично или полностью на поверхность протезов сосудов кровеносной системы.
Указанная цель достигается тем, что покрытие нанесено на основу пластыря, содержащего также защитный слой и поверхности с нанесенным на них клеем.
Указанная цель достигается тем, что покрытие нанесено на основу, выполненную в виде сетки.
Указанная цель достигается тем, что покрытие нанесено на основу, выполненную в виде повязки.
Указанная цель достигается тем, что покрытие нанесено на основу, содержащую ряды отверстий.
Описание изобретения
Молекулярная организация многих внутриклеточных органелл и тканей живых организмов близка к структуре жидких кристаллов-смектиков, холестериков и др. Более того, термин "жидкие кристаллы" был введен в связи с исследованиями оптических свойств эфира холестерина - вещества биологического происхождения. В последнее время интенсивно исследуются эпитропно-жидкокристаллические процессы самоорганизации биологических структур на различного рода биосовместимых поверхностях. При этом использование термина "самоорганизация" отражает тот фундаментальный факт, что ряд надмолекулярных агрегатов в живых клетках не требует для поддержания своего существования затраты энергии, а возникает самопроизвольно в растворах подходящего состава (при определенной температуре) подобно мицеллам в растворах амфифильных молекул. Исследование физико-химических свойств искусственных мембран и, в частности, их взаимодействие с белками, которые в живых организмах катализируют биохимические реакции, имеет важное значение в изучении жизнедеятельности клеток. Возникновение атеросклероза может быть, например, интерпретировано как следствие нарушения обмена веществ, в результате которого концентрация холестерина в клеточных мембранах кровеносных сосудов достигает значения, при котором начинает отслаиваться жидкокристаллическая фаза. Один из важнейших коллоидно-химических методов регулирования смачивания основан на адсорбции поверхностно-активных веществ из раствора на поверхности твердого тела.
Адсорбционные слои меняют поверхностные свойства материала - степень гидрофильности и гидрофобности. Закономерности смачивания в белковых системах играют важную роль при отборе полимерных материалов для протезирования кровеносных сосудов. Наиболее частым осложнением после введения синтетических протезов кровеносной системы является образование тромбов.
В связи с этим регулирование тромборезистентности полимерных материалов, предназначенных для контакта с кровью, представляет кардинальную проблему химии медико-биологических полимеров. Эта проблема очень сложна и пока еще нет достаточно полной теории, которая связала бы физико-химические свойства полимерных покрытий с их гемосовместимостью. Поэтому определенный практический интерес представляют эмпирические результаты, позволяющие оценивать тромборезистентности материала. Известно, что смачиваемость низкоэнергетических материалов (к ним относится большинство полимеров) снижается по мере уменьшения так называемого критического поверхностного натяжения σкр подложки.
В ряде экспериментов, выполненных нами in vitro, было установлено, что между временем свертывания крови τсв и величиной ряда материалов существует количественная зависимость, а именно lg τсв линейно возрастает при уменьшении σкр. Исходя из этого, одним из перспективных материалов в качестве полимерных биосовместимых покрытий, повышающих их тромборезистентность, может быть создание новых углеродных материалов с этактичной (от греческого "eu tacticos" - хорошо организованной) гомеотропной структурой, в контакте с которой кровь имеет высокую биосовместимость и к которой проявляет оптимальную смачивающую способность.
Процесс получения монокристаллического углерода, легированного азотом, заключался в следующем:
В вакуумную камеру помещают материал, предназначенный для нанесения покрытия. В качестве материала могут использоваться различные твердые и пластичные материалы, например керамика, сталь, легированная сталь, нержавеющая сталь с различным содержанием хрома, стальная фольга, титан, композиционные материалы, стекло, кремний, силикон или перевязочные материалы (бинты, пластыри, коллагеновые губки и т.д.). Материал располагают на термостоле, который обеспечивает ему необходимый температурный режим. Далее камеру вакуумируют до 10-7-10-9 мм рт. столба, а затем при необходимости очищают поверхность материала при помощи источника инертного газа, например ионами аргона. Затем при помощи источника инертного газа активируют поверхность материала, при этом его охлаждают или нагревают при помощи термостола, а затем наносят покрытие с монокристаллической структурой с использованием импульсного генератора плазмы. Плотность плазмы варьируют от 2×1014-1×1015см-3. Скорость процесса нанесения монокристаллического покрытия регулируют путем изменения давления в рабочей камере при помощи вакуумного насоса, частотой импульсов генератора плазмы и управлением температурного режима с использованием термостола, на котором располагается материал для нанесения покрытия. В период кластерного осаждения покрытия в вакуумную камеру по направлению к рабочей поверхности материала (подложке) вводится азот в количестве от 1 до 12%. Азот вводится в камеру синхронно с генерацией кластеров покрытия. Контроль содержания азота в получаемом монокристаллическом покрытии осуществлялся в процессе нанесения специальными датчиками. По достижении необходимой величины легирования подача азота прекращается.
Краткое описание фигур чертежей
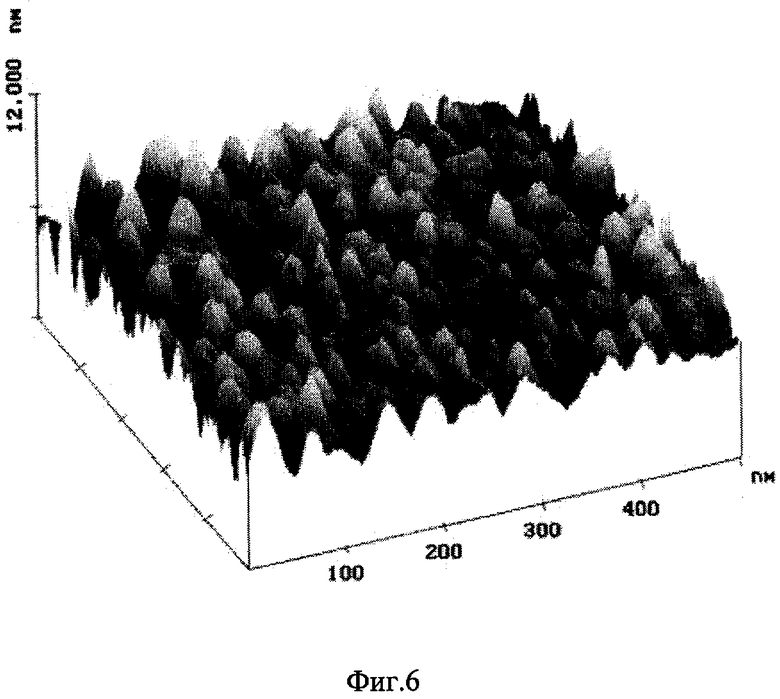
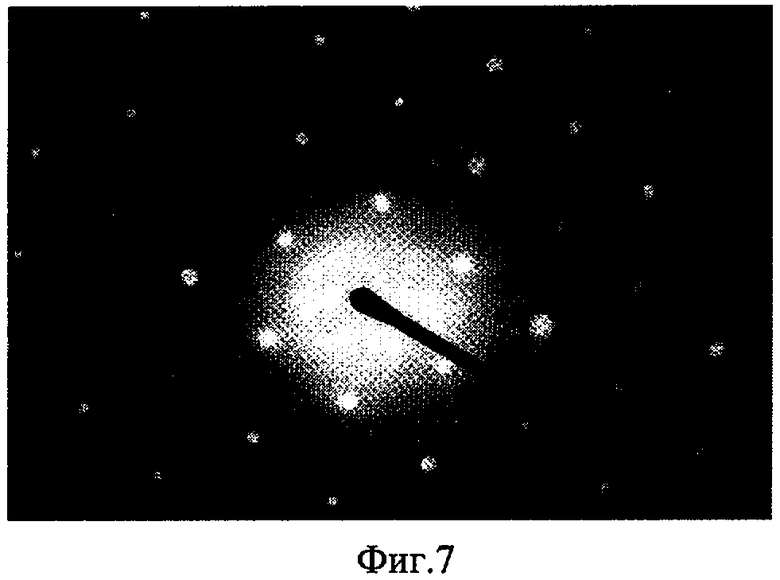
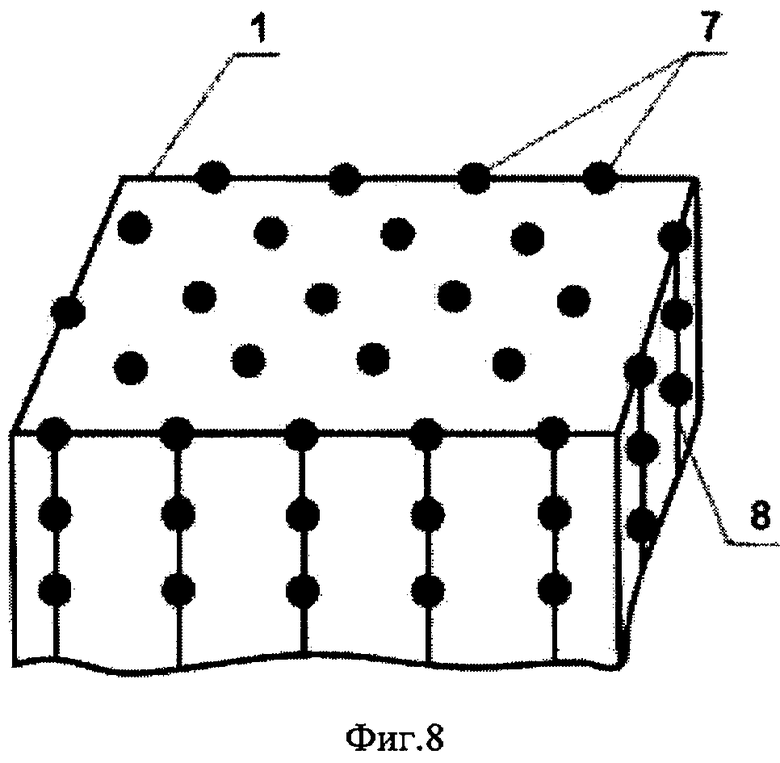
Изобретение поясняется чертежами, где на фиг.1 показана конфигурация структурной упорядоченности белка коллагена на поверхности монокристаллического углерода, на фиг.2-4 изображены возможные схемы выполнения монокристаллического покрытия на разных основах, на фиг.5 показана скорость свертывания крови на поверхности различных материалов в сравнении с монокристаллическим углеродом, на фиг.6 показано изображение структурной упорядоченности молекул белка на поверхности монокристаллического углерода, на фиг.7 показана картина электронной дифракции монокристаллического углеродного покрытия, а на фиг.8 - модель атомной структуры монокристаллического углерода.
Медицинское покрытие 1 состоит из слоя монокристаллического углерода (фиг.1), контактирующего, например, с белком коллагена 2. Медицинское покрытие 1 нанесено на основу (подложку) 3 (фиг.2). Медицинское покрытие 1 может быть нанесено на основу 3 как сплошным слоем, так и частично. Основа 3 может быть выполнена сплошной или с отверстиями, например сетчатой (не показана). Основа 3 может быть выполнена также в виде повязки.
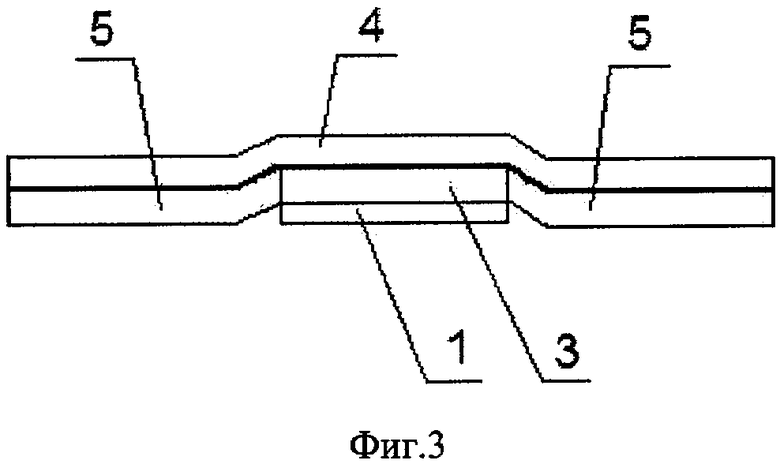
Медицинское покрытие 1 нанесено на основу 3 (фиг.3), скрепленную с защитным слоем пластыря 4 с нанесенными на него клеевыми слоями 5.
Медицинское покрытие 1 нанесено на основу 6 (фиг.4), выполненную в виде протеза сосуда.
Медицинское покрытие 1 состоит из атомов углерода 7, соединенных в цепочки 8 (фиг.8).
Варианты осуществления изобретения
Изобретение осуществляют следующим образом. Пластырь (фиг.3) скрепляют при помощи клеевых слоев 5 с поверхностью кожного покрова, причем медицинское покрытие 1, выполненное из монокристаллического углерода, соприкасается с кожной (ожоговой) раной (не показана). При этом коллагеновые белковые молекулы структурно упорядочиваются на поверхности монокристаллического углерода за счет его решетчатого специфического строения. Далее коллаген, находясь в благоприятных условиях для внутриклеточного обмена, благодаря этактичной структуре монокристаллического углерода ассоциируется в фибриллы. В свою очередь фибриллы образуют супрамолекулярные ансамбли, играющие in vivo роль внеклеточного матрикса, выполняющего не только функции несущих конструкций, но и определенную роль в передаче информации клеткам, регулируя их адгезию, миграцию и др., а также специфические взаимодействия с белками, нуклеиновыми кислотами и неорганическими ионами. При такой ассоциации белков возрастает скорость сращивания тканей с протезными материалами или тканей друг с другом на поврежденных участках и соответственно процесс заживления ран.
Конфигурация структурной упорядоченности белка коллагена 2 на медицинском покрытии 1 показана на фиг.1. Медицинское покрытие - монокристаллический углерод, наносят на основу 3 (фиг.2), например подложку SiO2, с предварительным ее очищением ионным излучением аргона. Затем методом импульсной конденсации углеродной плазмы наносится покрытие линейно-цепочечного углерода заданной толщины. Для легирования углеродного покрытия может быть введен азот от 1 до 15%. Толщина покрытия регулировалась временем нанесения. Контроль толщины полученного таким образом покрытия осуществлялся с помощью атомного силового микроскопа. Структура полученного углеродного покрытия контролировалась с использованием просвечивающего электронного микроскопа (фиг.6). Биомедицинские эксперименты с использованием покрытий на основе монокристаллического углерода показали полное отсутствие денатурирования белков на его поверхности, а также что исследуемое покрытие имеет оптимальную тромборезистентность, обладает большей биоинертностью и, следовательно, уникальной биосовместимостью в сравнении с такими материалами, как стекло, алмаз, тетракарбон и др., характеризуется длительной работоспособностью в условиях биологической среды, имеет высокую пористость, усталостную прочность и необычно низкий потенциал свертывания крови (прекрасную совместимость с кровью). Исследования показали, что монокристаллический углерод как медицинское покрытие можно широко использовать как при производстве различных протезов (межпозвонковых дисков, сердечных клапанов, внутрикостных штифтов и др.), так и при производстве различного рода перевязочного материала (пластыри, пленки, бинты и др.)
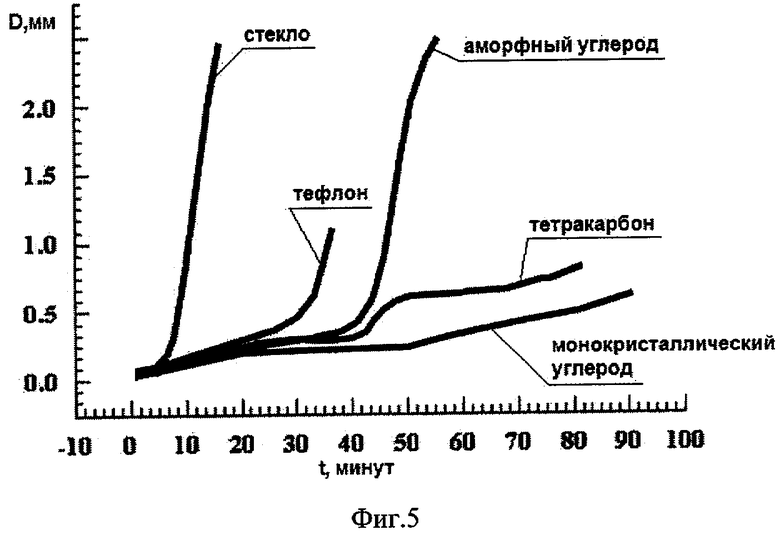
Предлагаемое медицинское покрытие - монокристаллический углерод - обладает отсутствием нежелательных реакций тканей организма на имплантаты и продукты их износа, а следовательно, уникальной биосовместимостью и оптимальной (наилучшей) среди сравниваемых материалов (стекло, тефлон, аморфный углерод, тетракарбон) степенью тромборезистентности. На фиг.5 приведена зависимость образования тромботического слоя D (скорость свертываемости крови) от времени. Как видно из фиг.5, меньше всего тромбозов образуется на поверхности монокристаллического углерода.
Покрытие поверхности монокристаллическим углеродом придает ей оптимальную тромборезистентность (превосходит тетракарбон, полистерин, являющиеся до этого времени лучшими по этим показателям) и позволяет улучшить биосовместимость медицинских имплантатов и протезов, уменьшает риск образования тромбов, отторжения имплантата, развития воспаления. Монокристаллическое углеродное покрытие является прекрасным ориентантом для различных молекул белков. Такое уникальное свойство покрытия положительно влияет на ускоренное сращивание тканей организма и заживления ран путем формирования оптимальных условий для внутриклеточного обмена продуктами роста. В экспериментах исследовалась адсорбция высокоочищенных радиоактивно меченых белков человека фибриногена и альбумина на поверхностях монокристаллического углерода и монокристаллического углерода с измененной структурой. На фиг.7 показана картина электронной дифракции монокристаллического углеродного покрытия. Картина доказывает структурную упорядоченность белка на поверхности медицинского покрытия. Количество адсорбированного белка на исследуемой поверхности определялось с помощью гамма - счетчика после отмывки углеродных подложек от несвязавшихся белков и визуализировалось с использованием атомно-силовой микроскопии (фис.6). При прямой адсорбции молекул белка на подложку углерода горизонтальные размеры в режиме прерывистого контакта получаются завышенными из-за уширения, вызванного конечным радиусом кривизны зонда.
На фиг.8 изображена модель атомной структуры полученного монокристаллического углерода.
Исследования показали, что используя легирование монокристаллического углерода азотом, можно регулировать адсорбцию и структурную упорядоченность белков на его поверхности и управлять как ориентацией, так и процессами смачивания.
Промышленная применимость
При анализе изобретения на соответствие критерию "новизна" выявлено, что часть признаков заявленной совокупности является новой, следовательно, изобретение соответствует критерию "новизна".
При анализе изобретения на соответствие критерию "изобретательский уровень" выявлено, что техническое решение анализируемого объекта ново, следовательно, признаки соответствуют критерию "изобретательский уровень", поскольку оно представляет собой новую совокупность признаков как сочетание известных признаков и нового технического свойства, а также представляет собой новую структуру и связи элементов. Кроме того, посредством предлагаемого материала достигнут результат, удовлетворяющий давно существующим потребностям : увеличением бактерицидных свойств, ускорением заживления ожоговых и донорских ран путем формирования оптимальных условий для внутриклеточного обмена продуктами роста, сокращения время их лечения и т.п.
Изобретение может использоваться в промышленности, может быть тиражировано и, следовательно, соответствует критерию "промышленная применимость".
| название | год | авторы | номер документа |
|---|---|---|---|
| БАКТЕРИЦИДНОЕ МЕДИЦИНСКОЕ ПОКРЫТИЕ | 2007 |
|
RU2385167C2 |
| УГЛЕРОДНЫЙ ПОЛИМЕР | 2003 |
|
RU2282583C2 |
| СПОСОБ НАНЕСЕНИЯ ПОКРЫТИЯ НА УСТРОЙСТВА И ИНСТРУМЕНТЫ ДЛЯ ОСТЕОСИНТЕЗА, ОРТОПЕДИЧЕСКИЕ ИМПЛАНТАТЫ ИЗ МЕТАЛЛА | 2018 |
|
RU2697855C1 |
| АНТИФРИКЦИОННОЕ ПОКРЫТИЕ | 2002 |
|
RU2230238C1 |
| АНТИФРИКЦИОННОЕ ПОКРЫТИЕ | 2019 |
|
RU2728449C1 |
| АНТИФРИКЦИОННОЕ ПОКРЫТИЕ | 2014 |
|
RU2570057C1 |
| Метод получения стабилизированных линейных цепочек углерода в жидкости | 2019 |
|
RU2744089C1 |
| БИОСПИЦА ДЛЯ ОСТЕОСИНТЕЗА | 2007 |
|
RU2361537C2 |
| СЕТЧАТЫЙ ЭНДОПРОТЕЗ ДЛЯ ВОССТАНОВИТЕЛЬНОЙ ХИРУРГИИ | 2005 |
|
RU2316290C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПРОТЕЗА КЛАПАНА СЕРДЦА | 1996 |
|
RU2115388C1 |
Изобретение относится к области биологии и медицины и может использоваться для создания пластырей, повязок, протезов и имплантантов. Медицинское покрытие состоит из структурно-упорядоченного нормально ориентированного к поверхности основы слоя монокристаллического углерода, контактирующего, например, с белком коллагена. Медицинское покрытие 1 нанесено на основу (подложку) и обладает этактичной гомеотропной структурой. Медицинское покрытие обеспечивает увеличение бактерицидных свойств, ускорение заживления ожоговых и донорских ран путем формирования оптимальных условий для внутриклеточного обмена продуктами роста, сокращение время их лечения, исключение (снижение) возможности образования коллагеновых рубцов, а также уменьшение риска образования тромбов, отторжения имплантанта, развития воспаления. 7 з.п. ф-лы, 8 ил.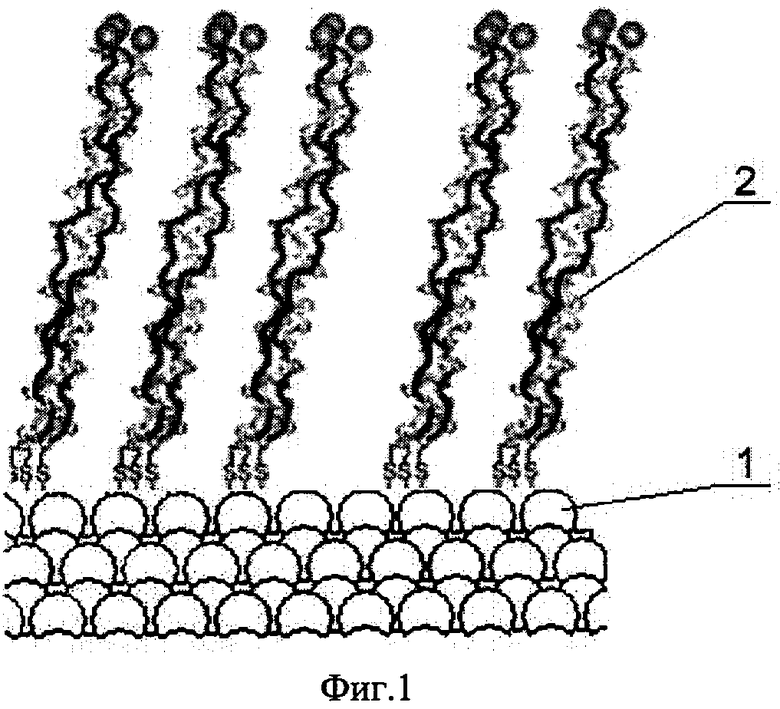
| US 6555224 А, 07.02.2002 | |||
| RU 97115373 А, 20.07.1999 | |||
| RU 2002134815 А, 20.06.2004. |
Авторы
Даты
2007-11-20—Публикация
2004-12-08—Подача