Изобретение относится к химии производных адамантана, а именно к новому способу получения α-адамантилсодержащих производных триметилбицикло[2.2.1]гептан-2-она общей формулы:
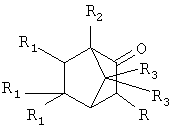
где R=Ad, R1=Н, R2=R3=СН3 (1); R=R3=Н, R1=СН3, R2=Ad (2);
R=Ad-Br; R1=H, R2=R3-СН3 (3).
которые являются потенциально биологически-активными веществами.
Известен способ получения алкильных кетонов триметилбицикло[2.2.1]гептана, основанный на обработке триметилбицикло[2.2.1]гептан-2-она (камфоры) алкилирующим агентом-алкилиден-трифенилфосфараном с последующим окислением интермедиата хромовой кислотой [патент GB 1180531, МКИ С07С 49/26, опубл. 04.02.1970].
Существенным недостатком данного метода алкилирования является, прежде всего, получение алкильных кетонов триметилбицикло[2.2.1]гептана, то есть алкилирование происходит по С=O группе исходного триметилбицикло[2.2.1]гептан-2-она.
Из всех других известных способов алкилирования бициклических кетонов нами не встречен ни один касающийся адамантилирования исходных бициклических кетонов.
Соединения заявляемой структурной формулы раннее в научно-технической и патентной литературе не описаны.
Задачей предлагаемого изобретения является разработка технологичного одностадийного метода синтеза α-адамантилсодержащих производных триметилбицикло[2.2.1]гептан-2-она, протекающего с высоким выходом.
Техническим результатом является расширение арсенала химических соединений, получаемых с высоким выходом новым способом.
Поставленный технический результат достигается в новом способе получения α-адамантилсодержащих производных триметилбицикло-[2.2.1]гептан-2-она общей формулы:
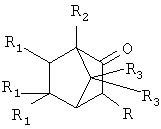
где R=Ad, R1=Н, R2=R3=СН3 (1); R=R3=Н, R1=CH3, R2=Ad (2);
R=Ad-Br; R1=H, R2=R3=CH3 (3).
заключающийся в присоединении к производному адамантана соответствующего производного триметилбицикло[2.2.1]гептан-2-она, причем в качестве производного адамантана используют 1,3-дегидроадаманган, а в качестве производного триметилбицикло[2.2.1]гептан-2-она: 1,7,7-триметилбицикло[2.2.1]гептан-2-он, 3-бром-1,7,7-триметил-бицикло[2.2.1]-гептан-2-он, 5,5,6-триметилбицикло[2.2.1]гептан-2-он, и процесс проводят при их мольном соотношении, равном 1:1 при температуре 100°С в течение 5 часов.
Сущностью метода является реакция присоединения к 1,3-дегидроадамангапу(1,3-ДГА) производных триметилбицикло[2.2.1]гептан-2-она по α-углеродному атому:
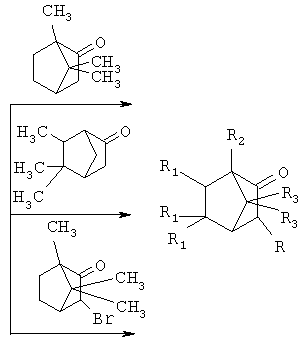
где R=Ad, R1=H, R2=R3=СН3 (1); R=R3=H, R1=CH3, R2=Ad (2);
R=Ad-Br; R1=H, R2=R3=СН3 (3).
Высокая нуклеофильность 1,3-дегидроадамантана позволяет получать продукты присоединения данных производных триметилбицикло[2.2.1]-гептан-2-она с высокими выходами в достаточно мягких условиях в одну стадию.
Производные триметилбицикло[2.2.1]-гептан-2-она дают почти все характерные для кетонов реакции.
Преимуществом данного метода является высокий выход (≈90%), а также возможность получения практически любых гомологов данного ряда, которые также являются потенциально биологически-активными веществами.
При взаимодействии 1,3-ДГА с 1,7,7-триметилбицикло-[2.2.1]гептан-2-оном и 3-бром-1,7,7-триметилбицикло[2.2.1]гептан-2-оном образуются два стереоизомерных продукта присоединения по α-углеродному атому, по-видимому, стерео(Е-,Z-)изомеры. Уникальным является также то, что взаимодействие 1,3-ДГА с 3-бром-1,7,7-триметил-бицикло[2.2.1]-гептан-2-оном происходит не по С-H связи α-углеродного атома, а по связи C-Br с образованием 1,7,7-триметил-3-(1-бромадамант-3-ил)-бицикло[2.2.1]-гептан-2-она.
При взаимодействии 1,3-ДГА с 5,5,6-триметилбицикло[2.2.1]гептан-2-оном образуется продукт присоединения по третичному α-углеродному атому. Данный маршрут реакции объясняется стабильностью и относительной реакционной способностью радикалов в радикальных реакциях. На радикальный механизм реакции указывает обнаружение в продуктах реакции, по результатам хроматомасс-спектроскопии, 1,1'-диадамантила - продукта рекомбинации 1-адамантильных радикалов. Наиболее стабильным и реакционно-способным будет радикал у третичного α-углеродного атома, кроме того, он имеет возможность делокализации неспаренного электрона при участии π-электронов карбонильной группы.
Как показали проведенные исследования, реакция чувствительна к температуре. Обнаружено, что при уменьшении температуры реакции со 100 до 35-40°С выход уменьшается, так как проведение взаимодействия в среде кипящего диэтилового эфира не приводило к получению целевых продуктов реакции. Дальнейшее повышение температуры (более 100°С) ведет к снижению выхода целевых продуктов, что, по-видимому, связано с протеканием побочной реакции рекомбинации 1-адамантильных радикалов.
Целесообразным молярным соотношением реагентов 1,3-ДГА: производное триметилбицикло[2.2.1]гептан-2-она является 1:1, так как при нем достигается высокий выход целевых соединений.
Уменьшение продолжительности реакции менее 5 часов, при прочих равных условиях, ведет к некоторому уменьшению выхода целевых продуктов. Увеличение продолжительности реакции свыше 5 часов не приводит к существенному изменению выхода целевых продуктов.
Способ осуществляется следующим образом.
К эквимолярному количеству производного триметилбицикло[2.2.1]-гептан-2-она приливают раствор 1,3-дегидроадамантана в абсолютном диэтиловом эфире. Эфир отгоняют и смесь 1,3-дегидроадамантана и производного триметилбицикло[2.2.1]-гептан-2-она нагревают в течение 5 часов при температуре 100°С. Синтезированные α-адамантилсодержащих производные триметилбицикло[2.2.1]гептан-2-она направляются на стадию очистки. Выход целевых продуктов составляет 90%.
Изобретение иллюстрируется следующими примерами:
Пример 1.
Синтез 1,7,7-триметил-3-(адамант-1-ил)-бицикло[2.2.1]гептан-2-она.
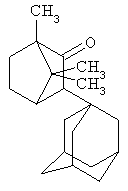
В реакторе с мешалкой к 1,52 г (0,01 моль) 1,7,7-триметилбицикло[2.2.1]гептан-2-она в атмосфере сухого азота при комнатной температуре прикалывают раствор 1,34 г (0,01 моль) свежевозогнанного 1,3-ДГА в 20 мл абсолютного диэтилового эфира.
Растворитель отгоняют, после чего доводят температуру реакционной массы до 100°С, выдерживают без перемешивании 5 часов. По окончании реакции массу вакуумируют и получают 2,57 г (0,009 моль, 90%) 1,7,7-триметил-3-(адамапт-1-ил)-бицикло[2.2.1]гептан-2-она, представляющего собой бесцветные кристаллы с Тпл. = 115-118°С.
ЯМР 1Н - спектр δ м.д.: 0,7-0,9 с (9Н, 3СН3); 1 -2,3 с (21 Н);
Масс-спектр, м/е: 286 (17%) M+, 258 (2%) [М-СО]+, 135 (100%) Ad+.
Пример 2.
Синтез 5,5,6-триметил-1-(адамант-1-ил)-бицикло[2.2.1] гептан-2-она.
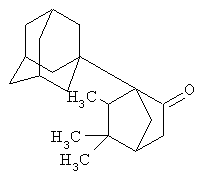
Аналогично, из 1,52 г (0,01 моль) 5,5,6-триметилбицикло[2.2.1]гептан-2-она и 1,34 г (0,01 моль) свежевозогнанного 1,3-ДГА получают 2,57 г (0,009 моль, 90%) 5,5,6-триметил-1-(адамант-1-ил)-бицикло[2.2.1]гептан-2-она, представляющего собой бесцветные кристаллы с Тпл.=98-101°С.
ИК-спектр ν, см-1: 3460, 2886, 2840, 1750, 1450, 1417, 1350, 1061, 1021
Масс-спектр, м/е: 286 (7,5%) M+, 271 (1%) М-СН3), 135 (100%). Ad+.
Пример 3.
Синтез 1,7,7-триметил-3-(1-бромадамант-3-ил)-бицикло[2.2.1]-гептан-2-она.
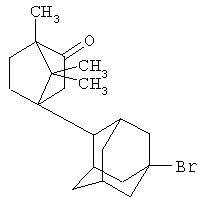
Аналогично, из 2,31 г (0,01 моль) 3-бром-1,1,7-триметилбицикло[2.2.1]гептан-2-она и 1,34 г (0,01 моль) свежевозогнанного 1,3-ДГА получают 3,3 г (0,009 моль, 90%) 1,7,7-триметил-3-(1-бромадамант-3-ил)-бицикло[2.2.1]гептан-2-она представляющего собой бесцветные кристаллы с Тпл.=85-87°С.
ЯМР 1Н - спектр δ м.д.: 0,7-0,9 с (9Н, 3СН3); 1 -2,3 с (20Н);
Масс спектр, м/е: 364 (17,5%) M+, 338 (1%)([М-Br]+-СО), 285 (100%) [М-Br]+, 215 (20%) AdBr+, 133 (17,5%).
Выводы.
Разработан технологически малостадийный метод синтеза α-адамантилсодержащих производных триметилбицикло[2.2.1]гептан-2-она, протекающий с высоким выходом. Структура описанных соединений подтверждена ЯМР1Н-, ИК- и масс-спектрами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ СИММЕТРИЧНЫХ 1,4-ДИКЕТОНОВ | 2006 |
|
RU2330013C1 |
| СПОСОБ ПОЛУЧЕНИЯ α-АДАМАНТИЛСОДЕРЖАЩИХ АЛИФАТИЧЕСКИХ И ЖИРНОАРОМАТИЧЕСКИХ КЕТОНОВ | 2000 |
|
RU2186760C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АДАМАНТИЛСОДЕРЖАЩИХ АЛЬДЕГИДОВ | 2003 |
|
RU2240303C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ НИТРИЛОВ | 2003 |
|
RU2240310C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2006 |
|
RU2309932C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ ФЕНОЛА | 2006 |
|
RU2326104C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-БРОМАДАМАНТИЛ-1-АЛКИЛ(АРИЛ)КЕТОНОВ | 2006 |
|
RU2309937C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ β-ДИКЕТОНОВ И КЕТОЭФИРОВ | 2000 |
|
RU2187493C1 |
| СПОСОБ ПОЛУЧЕНИЯ (АДАМАНТ-1-ИЛМЕТИЛЕН)СОДЕРЖАЩИХ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2006 |
|
RU2309931C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ НАФТАЛИНА | 2006 |
|
RU2309933C1 |
Изобретение относится к способу получения α-адамантилсодержащих производных триметилбицикло[2.2.1]гептан-2-она общей формулы:
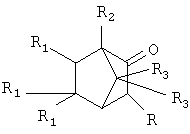
где R=Ad, R1=H, R2=R3=СН3 (1); R=R3=Н, R1=CH3, R2=Ad (2); R=Ad-Br; R1=H, R2=R3=СН3 (3), которые являются потенциально биологически-активными веществами. Способ заключается в том, что присоединяют к производному адамантана соответствующего производного триметилбицикло[2.2.1]гептан-2-она, причем в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве производного триметилбицикло[2.2.1]гептан-2-она используют: 1,7,7-триметилбицикло[2.2.1]гептан-2-он, 3-бром-1,7,7-триметилбицикло[2.2.1]-гептан-2-он, 5,5,6-триметилбицикло[2.2,1]гептан-2-он, и процесс проводят при их мольном соотношении, равном 1:1 при температуре 100°С в течение 5 часов. Способ позволяет получить заявленные соединения с высоким выходом.
Способ получения α-адамантилсодержащих производных триметилбицикло-[2.2.1]гептан-2-она общей формулы
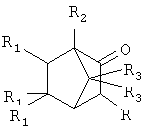
где R=Ad, R1=H, R2=R3=СН3 (1);
R=R3=Н, R1=CH3, R2=Ad (2);
R=Ad-Br; R1=H, R2=R3=СН3 (3),
заключающийся в присоединении к производному адамантана, соответствующего производного триметилбицикло[2.2.1]гептан-2-она, причем в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве производного триметилбицикло[2.2.1]гептан-2-она используют 1,7,7-триметилбицикло[2.2.1]гептан-2-он, 3-бром-1,7,7-триметилбицикло[2.2.1]гептан-2-он, 5,5,6-триметилбицикло[2.2,1]гептан-2-он, и процесс проводят при их мольном соотношении, равном 1:1 при температуре 100°С в течение 5 ч.
| Канатно-поршневой податчик | 1984 |
|
SU1180531A1 |
| 2-ФЕНИЛ-2-МЕТИЛАМИНОЭТОКСИ-1,7,7-ТРИМЕТИЛБИЦИКЛО[2,2,1]ГЕПТАН, ЕГО ОПТИЧЕСКИ АКТИВНЫЕ ИЗОМЕРЫ И ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1997 |
|
RU2199523C2 |
Авторы
Даты
2007-11-27—Публикация
2006-07-11—Подача