Изобретение относится к медицине, а именно к неврологии, и может использоваться для установления генеза полиневропатии у онкологических больных, а также для дифференциальной диагностики в спорных случаях.
Полиневропатии (ПНП) - это одна из сложных форм патологического процесса, где до сих пор не выделен доминирующий фактор этиологии заболевания и не разработана обобщающая теория патогенеза. Полиневропатии - не единая болезнь, а группа болезней различной этиологии (1, 4, 6). Это заболевание относится к числу наиболее распространенных. Оно занимает четвертое место среди других причин временной нетрудоспособности (1, 6).
Большинство периферических нервов выполняют смешанные функции и включают двигательные, чувствительные и вегетативные волокна. В соответствии с этим различают преимущественно двигательные, чувствительные или вегетативные полиневропатии (5, 6).
В зависимости от преимущественного поражения тех или иных структур периферического нерва выделяют паренхиматозные формы полиневропатии: аксонопатии, миелинопатии, интерстициальные полиневропатии с поражением соединительных оболочек и генерализованные (6, 13).
Одним из вариантов полиневропатии, который по своей этиологии и патогенезу есть разновидность паранеопластического синдрома, являются паранеопластические полиневропатии. Паранеопластические полиневропатии встречается по данным различных авторов от 7,5 до 48% случаев в зависимости от формы опухолевого процесса (11, 21).
Паранеопластические синдромы - это нарушения, вызванные опухолевым процессом и проявившиеся на расстоянии от опухоли и ее метастазов, т.е. в органах-мишенях (11). Критериями паранеопластических заболеваний в мировой литературе принято считать: сосуществование неонкологического и онкологического заболеваний; их параллельное развитие; исчезновение доброкачественного заболевания после хирургического удаления опухоли, а также после эффективного химиотерапевтического или лучевого лечения; возобновление или появление паранеопластического синдрома при рецидиве основного заболевания или метастазировании; статистически достоверная корреляция обоих процессов (18).
Паранеопластическая сенсорная невропатия. У онкологических больных в подавляющем большинстве случаев сенсорная невропатия развивается при мелкоклеточном раке легкого и лимфоме, встречается при раке молочной железы, семиноме (15). У многих пациентов ее развитие опережает постановку диагноза рака. Клиника синдрома представлена прогрессирующим нарушением чувствительности, чаще развивающимся подостро в сроки от нескольких недель до нескольких месяцев и характеризующимися болью, парестезиями, гипералгезией, дизестезиями онемением в конечностях, а иногда и в периоральной области. Нарушения обычно начинаются в дистальных отделах и распространяются проксимально, чаще поражаются верхние конечности. Объективно отмечают снижение вибрационного и суставно-мышечного чувств; двигательные нарушения отсутствуют, хотя у многих пациентов наблюдают некоторую мышечную слабость и гипотонию. Сухожильные рефлексы снижены или выпадают (18). При электронейромиографии выявляют нарушение проведения по чувствительным нервам (3, 6, 16, 18).
Развитие синдрома связывают с наличием специфических антинейрональных (анти-Hu) антител. Это комплементсвязывающие поликлональные IgG-антитела, реагирующие с ядрами нейронов ЦНС, клетками спинальных ганглиев и нейронами ганглия тройничного нерва (14, 18, 19). Антигены, распознаваемые анти-Hu-антителами, характеризуются как протеины с молекулярной массой от 35 до 40 кД. Они присутствуют в подавляющем большинстве случаев при мелкоклеточном раке легкого и не обнаруживаются при других опухолях или в нормальной ткани (17). Поэтому анти-Hu-антитела являются высокоспецифичным маркером мелкоклеточного рака легкого с сопутствующими неврологическими нарушениями (14, 16, 19). Отмечено, что у некоторых больных мелкоклеточным раком легкого без паранеопластических нарушений с низким титром анти-Hu-антител опухоль имеет тенденцию к относительному ограничению; полагают, что защитную функцию в этих случаях выполняет противоопухолевая иммунная реакция, противодействующая распространению болезни; высокий титр ухудшает и прогноз опухоли (17).
Сенсомоторная невропатия. По данным литературы, частота синдрома варьируется в зависимости от характера и цели исследования. Teravainen H. и Larson A. (1977), обследовав 33 больных раком легкого, выявили полиневропатию у 48%. Hawley R. и соавт. (1980) пришли к выводу, что у больных раком частота возникновения невропатии не увеличивается в тех случаях, когда нет существенной потери массы тела.
Вегетативная невропатия. При злокачественных новообразованиях (чаще мелкоклеточном раке легкого) сообщают о синдроме ортостатической гипотензии, расстройствах перистальтики пищевода, желудка, тонкой кишки, интестинальной псевдообструкции, нейрогенном мочевом пузыре. Антинейрональные ядерные антитела были обнаружены только при мелкоклеточном раке легкого. Так, Lennon V. и соавт. (1991), обследовав 34 больных мелкоклеточным раком легкого, данный синдром выявили у 5. Из них у 4 пациентов изменились IgG-антитела, которые реагировали с нейронами в субмукозных сплетениях и мышечных оболочках тонкой кишки и желудка. Вегетативную невропатию у больных с системными опухолями трудно диагностировать. Она может быть обусловлена вовлечением вегетативных волокон при миелопатии или периферической невропатии с заинтересованностью пре- или постганглионарных волокон (11).
Таким образом, паранеопластическая полиневропатия является частым осложнением при опухолях разной локализации, более того, зачастую их развитие опережает клинические проявления рака. Однако, при этом, встает вопрос о генезе обнаруженной полиневропатии. В том случае, если у онкологического больного обнаружена полиневропатия, совершенно не обязательно, что это паранеопластическая полиневропатия, вполне возможно имеется сопутствующая неврологическая патология и уточнение происхождения полиневропатии вполне актуально для решения вопросов, связанных с прогнозированием исхода и лечением полиневропатии. В ситуации, когда пациенту поставлен диагноз полинеропатии в качестве основного заболевания, генез ее (в настоящее время) определяется на основе клинических данных, крайне приблизительно, выявление паранеопластического происхождения полиневропатии, открывает широкие возможности для более ранней диагностики онкологических заболеваний.
На сегодняшний день единственным способом подтверждения паранеопластического генеза полиневропатии является обнаружение антинейрональных (анти-Hu антител), что достаточно трудоемко и очень дорого (порядка 400 долларов США только за реактивы). При этом, пока паранеопластические антигены, точнее, антитела против них могут рассматриваться только как потенциальные маркеры раковых заболеваний: возможность использования этих антигенов для диагностики рака стала исследоваться совсем недавно и сегодня еще не накоплены статистические данные, достаточные для утверждения, что появление антител к данному паранеопластическому антигену у обследуемого предвещает во всех случаях (или хотя бы с достаточно высокой вероятностью) появление у него злокачественной опухоли. Нет также достаточной статистики о том, у какой доли пациентов при каждом данном виде рака синтезируется тот или иной паранеопластический антиген и появляются антитела к нему (7).
Именно этот способ мы выбрали за прототип.
Недостатками способа-прототипа являются:
1) необходимость в специальной дорогостоящей аппаратуре,
2) необходимость в большом количестве дорогостоящих реактивов,
3) сложность исполнения анализа,
4) необходимость наличия специально оборудованной лаборатории,
5) большая продолжительность работы квалифицированного персонала (не менее 5 часов),
6) дороговизна анализа для пациента (стоимость одного анализа около 12000 рублей)
В задачу предлагаемого изобретения положено удешевление и упрощение установления генеза паранеопластической ПНП.
Поставленная задача в способе установления генеза паранеопластической ПНП по результатам исследования плазмы крови, достигается тем, что плазму крови исследуют методом клиновидной дегидратации, при этом каплю плазмы предварительно высушивают на предметном стекле в течение 18-24 часов при комнатной температуре и минимальном движении воздуха, затем анализируют структуру полученной фации под микроскопом, и при наличии сочетания двух признаков - волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации - делают заключение о паранеопластическом генезе поленевропатии.
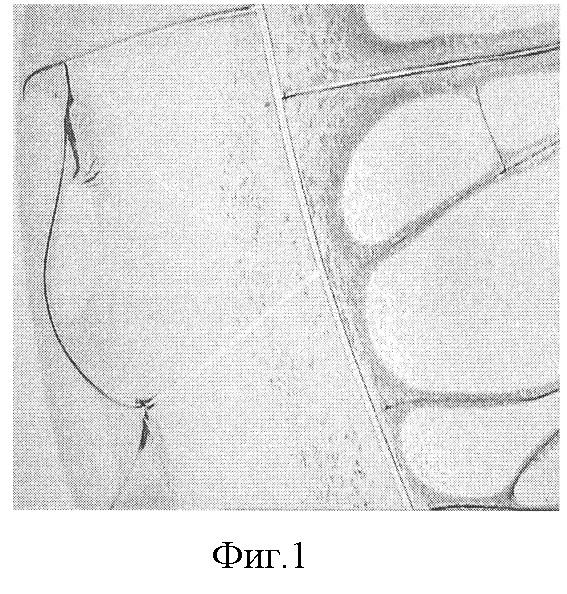
На фиг.1 - представлена микрофотография (увеличение ×40) фации плазмы крови в норме, где отражены две зоны - периферическая и центральная, в периферической зоне располагаются овальные конкреции и аркообразные трещины, которые в виде прямых радиальных трещин продолжаются в центральной зоне.
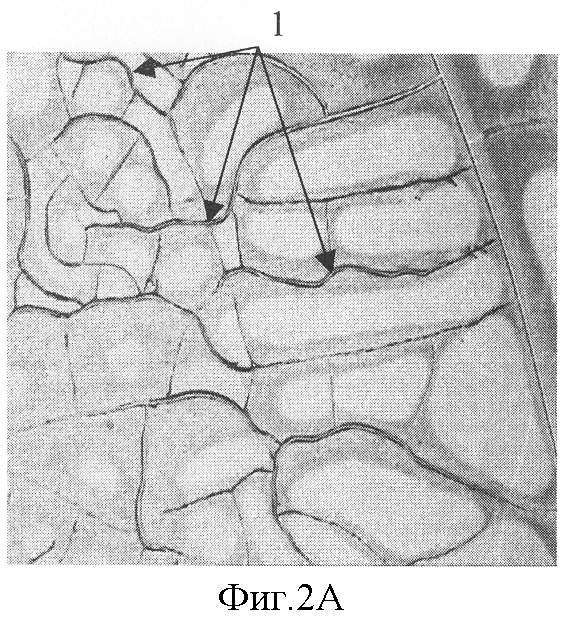
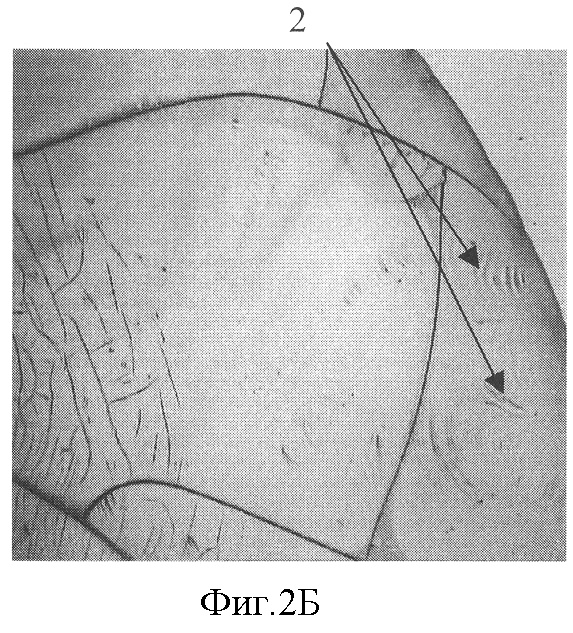
На фиг.2 представлена микрофотография (увеличение ×40) фации плазмы крови больной раком молочной железы с паранеопластической полинеропатией, 2А - волнообразные трещины в центральной зоне фации (указаны стрелками 1) и 2Б - морщины в периферической зоне фации (указаны стрелками 2).
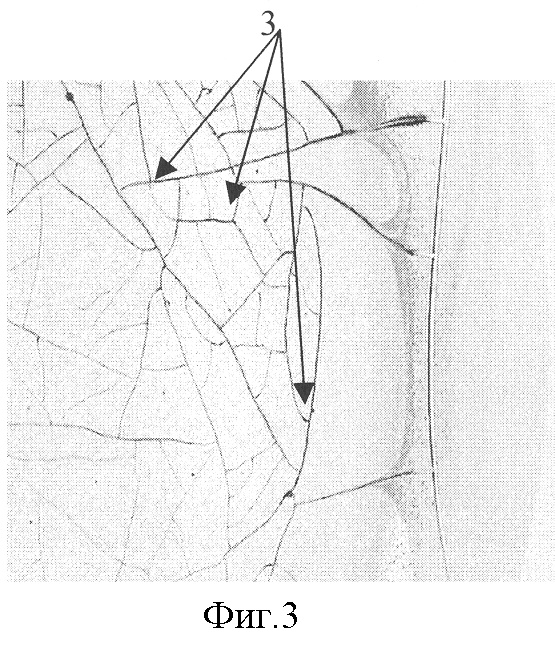
На фиг.3 представлена микрофотография (увеличение ×40) фации плазмы крови больной раком молочной железы без паранеопластической полиневропатии, где показана сеть прямых трещин в центральной зоне фации (указаны стрелками 3).
Метод клиновидной дегидратации, позволяет делать видимой молекулярную организацию биологических жидкостей путем перевода ее на макроуровень (12). После высыхания капли в стандартных условиях на твердой подложке количество солей увеличивается от периферии к центру, а количество органических веществ - от центра к периферии (10). Плазма крови оказалась гораздо более сложным объектом изучения вследствие большой вариабельности ее состава и свойств. Кроме выявления зональных структур в диагностике имеет значение форма, количество и размеры трещин, а также выявление патологических структур в высохшей пленке - фации - плазмы крови (8). Предложен "Способ оценки состояния гомеостаза" (9), в котором по параметрам зональных структур высушенной капли биологической жидкости определяют состояние гомеостаза как нормальное или патологическое, а также как устойчивое или неустойчивое. Но какая конкретно патология может быть диагностирована, не указывается. И с точки зрения установления генеза и дифференциальной диагностики ПНП этот метод не использовался.
В соответствии с целями и задачами работы осуществлено комплексное обследование 35 человек. Из них: 12 больных с раком молочной железы (РМЖ), 13 больных раком легкого (РЛ), 10 больных раком желудка (РЖ). Среди обследованных 35 больных были пациенты в возрасте от 30 до 76 лет (средний возраст 52 года).
Комплекс исследований включал неврологическое обследование и электрофизиологические методы: электронейромиографию (ЭНМГ) и игольчатую электромиографию (ЭМГ). Исследование проводилось до начала лечения. Клиническое обследование включало сбор анамнеза, неврологический осмотр. Электронейромиографические показатели регистрировались на аппарате "MBN-нейромиограф" (Россия). Электронейромиографическое исследование осуществлялось при помощи стимулирующего поверхностного пластинчатого электрода (катод располагался дистальнее, анод проксимальнее), а отведение стандартным набором монополярных, пластинчатых электродов диаметром 5 мм. Использовался постоянный прямоугольный ток частотой 1 Гц, длительностью 200 мс и сила тока подбиралась супрамаксимальная.
Исследовались следующие нервы.
1) Моторные порции срединных нервов, малоберцовые нервы.
Оценивались: амплитуда моторного ответа (М-ответ), форма М-ответа, длительность М-ответа, площадь М-ответа - комбинированный показатель, латентность М-ответа, скорость проведения импульса (СПИ), резидуальная латентность (РЛ).
2) Сенсорные порции срединных нервов и икроножные нервы исследовались по антидромной методике (дистальное наложение отводящих электродов и стимуляция аналогично исследованию СПИ по двигательным волокнам).
Оценивались: амплитуда потенциала действия (ПД), форма ПД, длительность ПД, площадь ПД, латентность ПД, СПИ по сенсорным волокнам.
3) Симпатические порции срединных и большеберцовых нервов.
Оценивались: амплитуда вызванного кожного симпатического потенциала (ВКСП), форма ВКСП, терминальная латентность ВКСП.
Игольчатая электромиография проводилась концентрическими биполярными игольчатыми электродами площадью сечения 0,07 мм.
Регистрирующий игольчатый электрод вводился в двигательную точку передней большеберцовой мышцы справа.
Анализировалась спонтанная активность в покое: активность введения, активность концевой пластинки, потенциалы фибрилляций (ПФ), положительные острые волны (ПОВ), потенциалы фасцикуляций; а также параметры потенциалов двигательных единиц (ПДЕ).
Потенциал двигательной единицы характеризовали следующие основные параметры: амплитуда потенциала двигательной единицы; длительность, фазность.
При обработке результатов электронейромиографического и электромиографического исследований использовались нормативные показатели разработанные в Отделе нервно-мышечной патологии человека с Российским миастеническим центром НИИ общей патологии и патофизиологии РАМН, руководитель Гехт Б.М.
При первичном клиническом осмотре только 5 больных (14%) предъявляли жалобы на парестезии и онемение в дистальных отделах конечностей, преимущественно в ногах, возникшие подостро (за несколько месяцев) и медленно прогрессирующие. Остальные пациенты жалоб неврологического характера не предъявляли.
В неврологическом статусе у 11 (31%) пациентов имела место симметричная гипестезия по периферическому типу, снижение вибрационной чувствительности при всех частотах, а также снижение мышечно-суставного чувства при исследовании верхних и нижних конечностей. Отчетливое снижение сухожильных рефлексов отмечалось у 10 больных (28%).
Число больных с жалобами и изменениями в неврологическом статусе принципиально не отличалось при раке молочной железы и раке легкого и полностью отсутствовали при раке желудка.
При выявлении рака молочной железы у 41%, а раком легкого у 46% пациентов имеют место клинические проявления вегетативно-сенсорной полиневропатии. В то же время у 54% больных РЛ и у 50% РМЖ регистрируются статистически достоверные изменения ЭНМГ и ЭМГ показателей.
Необходимо отметить, что статистически значимые изменения ЭНМГ показателей при всех стадиях рака были зафиксированы с сенсорных и симпатических порций срединных нервов, икроножных, малоберцовых и симпатических порций большеберцовых нервов.
Всем больным до лечения проводилось исследование плазмы крови методом клиновидной дегидратации.
При сопоставлении результатов ЭНМГ и ЭМГ обследования и структуры фации плазмы крови оказалось, что у 90% больных, которым был поставлен диагноз паранеопластической ПНП, выявлялось сочетание двух признаков - волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации. На фиг.2 представлена микрофотография фации плазмы крови больной К. (увеличение ×40), 2А - волнообразные трещины в центральной зоне фации (указаны стрелками 1) и 2Б - морщины в периферической зоне фации (указаны стрелками 2).
Необходимое оборудование для исследования плазмы крови методом клиновидной дегидратации:
1) предметные стекла,
2) пипеточный микродозатор,
3) световой микроскоп.
Предполагаемый способ имеет следующие преимущества в сравнении с прототипом:
1) упрощение (не требуется специальной дорогостоящей аппаратуры и реактивов),
2) удешевление (усредненная стоимость предлагаемого нами метода - 100 руб.),
3) ускорение (время работы с образцом составляет в среднем около 15 минут).
Предлагаемый способ осуществляют следующим образом: у больных с клиническими признаками ПНП забирают кровь из локтевой вены натощак, центрифугируют ее в течение 10 минут при 1500 об/мин, плазму в количестве 0,01 мл с помощью пипеточного микродозатора наносят на чистое предметное стекло и высушивают при комнатной температуре в закрытом шкафу. Через 18-24 часа полученную фацию рассматривают под микроскопом в проходящем свете на малом увеличении. При наличии сочетания двух признаков - волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации делается заключение о том, что ПНП имеет паранеопластический генез. Необходимость и существенность условий высушивания (18-24 часа при минимальном движении воздуха) объясняется тем, что: а) 18-24 часа являются оптимальным временем (8) так как через это время завершается формирование стабильной структуры фации; б) движение воздуха может привести к нарушению симметрии фации.
Способ может применяться для установления генеза полиневропатии у онкологических больных, а также он позволяет заподозрить паранеопластический генез полиневропатии при наличии соответствующих неврологических нарушений, если опухоль не обнаружена, и, следовательно, способствовать более ранней диагностике онкологических заболеваний. При своей простоте и дешевизне спосб имеет чувствительность 90%, специфичность 100%.
Одним из возможных механизмов развития паранеопластической ПНП является аутоиммунный механизм развития (11). В крови циркулируют антинейрональные антитела - белки, которые в норме отсутствуют. Мы предполагаем, что волнообразные трещины в центральной зоне фации плазмы крови могут являться маркерами аутоиммунных процессов. Нами было обследовано 100 больных с различными заболеваниями, в патогенезе которых аутоиммунный компонент отсутствует (сирингомиелия, острый и хронический калькулезный холецистит), только у 2 из них присутствовал этот признак. При заболеваниях, в патогенезе которых предполагается наличие аутоиммунного компонента, волнообразные трещины встречаются достаточно часто: при рассеянном склерозе в 36,5% случаев (из 52 обследованных), при миастении - в 47,4% случаев (из 19 обследованных).
В норме трещины в центральной зоне фации плазмы крови прямые и имеют преимущественно радиальное направление. Возможно, наличие в плазме крови аутоантител - патологических белков, может приводить к появлению волнообразных трещин. Исследования in vitro показали, что форма трещин фации белоксодержащих жидкостей, в том числе и плазмы крови, может быть связана с конформационными изменениями белковых молекул (2). Авторы метода клиновидной дегидратации обращали внимание скорее на расположение трещин (радиальное, циркулярное), а не на их форму, и волнообразные трещины ранее описаны не были.
Морщины в периферической зоне фации плазмы крови являются маркером интоксикации (8). Обнаружение их у онкологических больных возможно, так как одним из синдромов, сопровождающих процесс опухолевого роста, является интоксикация (20).
У пациентов со злокачественными новообразованиями без неврологической симптоматики в фации плазмы крови в 28% случаев присутствовали волнообразные трещины, и 28% случаев - морщины, но сочетания этих признаков ни у кого отмечено не было. В связи с этим можно предположить, что возникновение паранеопластической ПНП может быть обусловлено совместным повреждающим действием антинейрональных антител и токсинов.
В качестве иллюстрации заявляемой диагностической технологии приводим примеры, подтверждающие практическое применение данной методики.
Клинический пример №1.
Больная К-ва, 53 года, № истории болезни 985. Поступила в областной онкологический диспансер 23.02.04 с диагнозом: Рак правой молочной железы T2N1Mx.
Наследственность и анамнез в отношении неврологической патологии со стороны периферической нервной системы не прослеживаются.
При поступлении предъявляла жалобы на чувство онемения, "ползания мурашек" в дистальных отделах нижних конечностей, а также слабость в мышцах ног, особенно голени, затруднение при ходьбе.
Считает себя больной около двух месяцев, когда появилось уплотнение в области правой молочной железы.
В неврологическом статусе: снижена сила в мышцах голеней до 4 баллов, сухожильные рефлексы d=s, с ног торпидны, гипестезия по типу удлиненных перчаток и гольфов.
В анализе крови обращает на себя внимание повышение СОЭ до 27 мм/ч.
При исследовании вибрационной чувствительности: снижение с рук до 20 дБ и с ног до 25 дБ при всех частотах.
По данным ЭНМГ исследования: амплитуда М-ответов при исследовании срединных нервов составляла 6,5 мВ, ТЛ - 3,3 мс, длительность - 6,3 мс, площадь - 22,4 мкВс, РЛ - 2,1 мс; амплитуда М-ответов с малоберцовых нервов равнялась 3,3 мВ, длительность - 4,5 мс, площадь - 16,5 мкВс. С малоберцовых нервов ТЛ - 3,73 мс, РЛ - 2,82 мс, СРВ по ДВ с срединных нервов - 55,3 м/с, СРВ по ДВ с малоберцовых нервов - 43,4 м/с. Показатели амплитуды ПД с срединных нервов составляли 0,0062 мВ, длительности ПД - 1,7 мс, площади ПД - 0,0034 мкВс; ТЛ - 2,8 мс, СРВ по СВ - 53,1 м/с. Амплитуда ПД с икроножных нервов была 0,0054 мВ, длительность ПД - 1,52 мс, площадь ПД - 0,0031 мкВс; СРВ по СВ и ТЛ равнялись соответственно 46,2 м/с и 3,2 мс. Амплитуда ВКСП, зарегистрированная с ладоней, составляла 146 мкВ, ТЛ - 2,35 с; при регистрации со стоп - 123 мкВ, а ТЛ - 2,17 секунды. С передней большеберцовой мышцы спонтанная активность регистрировалась с наличием 5 потенциалов фибрилляций, 4 потенциалов фасцикуляций, 4 положительных острых волн. Потенциалы двигательных единиц преобладали полифазные - 40%, с увеличенной средней амплитудой 851 мкВ, длительностью 12,5 мс.
На основании клинической картины и результатов электронейромиографического исследования поставлен диагноз: паранеопластическая моторно-сенсорно-вегетативная полиневропатия.
При исследовании плазмы крови методом клиновидной дегидратации выявлялось сочетание двух признаков - волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации. Микрофотография (увеличение ×40) фации плазмы крови представлена на фиг.2, где 2А - волнообразные трещины в центральной зоне фации (указаны стрелками 1) и 2Б - морщины в периферической зоне фации (указаны стрелками 2). В крови обнаружены анти-Hu антитела.
Данный клинический пример иллюстрирует ситуацию, когда при первичном обращении больной раком молочной железы имеет место паранеопластическая полиневропатия, генез которой подтвержден методом клиновидной дегидратации и обнаружением анти-Hu антител.
Клинический пример №2.
Больная А-ва, 62 года, № истории болезни 1023. Поступила в областной онкологический диспансер 13.04.04 с диагнозом: Рак левой молочной железы T1N1Mx.
Наследственность и анамнез в отношении неврологической патологии со стороны периферической нервной системы не прослеживаются.
При поступлении жалоб неврологического характера не предъявляла.
Считает себя больной около трех месяцев, когда появилось уплотнение в области правой молочной железы.
В неврологическом статусе без изменений
В анализе крови обращает на себя внимание повышение СОЭ до 23 мм/ч.
По данным ЭНМГ исследования: амплитуда М-ответов при исследовании срединных нервов составляла 6,5 мВ, ТЛ - 3,3 мс, длительность - 6,3 мс, площадь - 22,4 мкВс, РЛ - 2,1 мс; амплитуда М-ответов с малоберцовых нервов равнялась 3,9 мВ, длительность - 4,5 мс, площадь - 16,5 мкВс. С малоберцовых нервов ТЛ - 3,73 мс, РЛ - 2,82 мс, СРВ по ДВ с срединных нервов - 55,3 м/с, СРВ по ДВ с малоберцовых нервов - 43,4 м/с. Показатели амплитуды ПД с срединных нервов составляли 0,0062 мВ, длительности ПД - 1,7 мс, площади ПД - 0,0034 мкВс; ТЛ - 2,8 мс, СРВ по СВ - 53,1 м/с. Амплитуда ПД с икроножных нервов была 0,0061 мВ, длительность ПД - 1,52 мс, площадь ПД - 0,0031 мкВс; СРВ по СВ и ТЛ равнялись соответственно 46,2 м/с и 3,2 мс. Амплитуда ВКСП, зарегистрированная с ладоней, составляла 365 мкВ, ТЛ - 1,35 с; при регистрации со стоп - 254 мкВ, а ТЛ - 1,17 секунды. С передней большеберцовой мышцы спонтанная активность не регистрировалась. Параметры потенциалов двигательных единиц были в пределах нормы.
На основании клинической картины и результатов электронейромиографического исследования признаков поражения периферической нервной системы не обнаружено.
При исследовании плазмы крови методом клиновидной дегидратации: в периферической зоне фации присутствовали трещины, параллельные краю, а в центральной зоне - прямые трещины образовывали беспорядочную сеть, волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации не выявлялось. Микрофотография (увеличение ×40) фации плазмы крови представлена на фиг.3, где показана сеть прямых трещин (указаны стрелками 3).
Анти-Hu антител в крови не обнаружено.
Данный клинический пример иллюстрирует ситуацию, когда при отсутствии клинических проявлений полиневропатии и нормальной ЭНМГ картине волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации не отмечено, анти-Hu антител в крови не обнаружено.
Источники информации
1. Антонов И.П. Классификация заболеваний периферической нервной системы и формулировка диагноза // Журнал невропатологии и психиатрии им С.С.Корсакова. - 1985. - №4. - С.481-487.
2. Белова Л.М., Потехина Ю.П. Исследование конформационных изменений молекулы альбумина в различных условиях методом клиновидной дегидратации / Нижегородский медицинский журнал. - 2003. - №3-4. - С.86-90.
3. Гехт Б.М., Касаткина Л.Ф., Самойлов М.И., Санадзе А.Г. Электромиография в диагностике нервно-мышечных заболеваний. - Издательство Таганрогского государственного радиотехнического университета. - 1997. - 370 с.
4. Жиронкина Н.П. Полиневропатии // Международный медицинский журнал. - 1998. - Т.4. - №2. - С.60-63.
5. Манелис Э.С. К этиологии и патогенезу полиневритов: Обзор литературы // Журнал невропатологии и психиатрии имени С.С.Корсакова. - 1986. - Т.86, выпуск 11. - С.1720-1726.
6. Трошин В.Д., Бурцев Е.М. Основы неврологии: Руководство. - Н.Новгород: изд-во НГМА, 1998. - 345 с.
7. Филиппов П.П. Паранеопластические антигены и ранняя диагностика рака // Соросовский образовательный журнал. - 2000. - Т.6. - №9. - С.25-30.
8. Шабалин В.Н., Шатохина С.Н. Морфология биологических жидкостей человека. - М.: Хризостом, 2001. - 304 с.
9. Шабалин В.Н., Шатохина С.Н., Шабалин В.В. Способ оценки состояния гомеостаза. - Патент РФ №2147124 С1.
10. Шабалин В.Н., Шатохина С.Н. Клиническая кристаллография: становление, проблемы, перспективы // Кристаллографические методы исследования в медицине: Сб. науч. тр. I Всеросс. научно-практ. конф. - М., 1997. - С.3-9.
11. Шакирова И.Н. Паранеопластические синдромы // Журнал неврологии и психиатрии им. С.С.Корсакова. - 1999. - №10. - С.55-61.
12. Шатохина С.Н., Шабалин В.Н. Ранняя диагностика уролитиаза, определение степени его активности и состава камнеобразующих солей мочи (система Литое) // Урология и нефрология. - 1998, №1. - С.19-23.
13. Эсбери А.К., Джиллиата Р.У. Заболевания периферической нервной системы. - М.: Медицина, 1987. - 203 с.
14. Bechich S., Graus F., Arboix A., Isidro A., Marti M., Rosell F. Anti-Hu-associated paraneoplastic sensory neuropathy and breast cancer // J. Neurol. - 2000. - V.247. - №7. - P.552-3.
15. Bunn P.Jr., Ridgway E. Cancer: Principles and Practice of Oncology, 4 th ed. Eds. DeVita V., Hellman S., Rosenberg S.J.B. - Philadelphia. - 1993. - P.2026-2067.
16. Camdessanche J.P., Antoine J.C., Honnorat J., Vial C., Petiot P., Convers P., Michel D.Paraneoplastic peripheral neuropathy associated with anti-Hu antibodies. A clinical and electrophysiological study of 20 patients // Brain. - 2002. - V.125. - Pt.1. - P.166-75.
17. Dalmau J.O., Posner J.B. Paraneoplastic syndromes affecting the nervous system. // Semin. Oncol. - 1997. - Vol.24. - P.318-28.
18. Fetel M., Younger D. Merritt's Textbook of Neurology, 9 th ed. Eds. L. Rowland. - Philadelphia. - 1995. - P.935-945.
19. Kuronuma K., Nishiyama K., Murakami S., Tanaka N., Takahashi M., Kojima H., Fujishima Т., Tanaka H., Takahashi H., Koba H., Tanaka K., Abe S. Small cell lung cancer associated with anti-Hu antibody-positive paraneoplastic neurologic syndrome [Article in Japanese] // Nihon Kokyuki Gakkai Zasshi. - 2000. - V.38. - №2. - P.148-52.
20. Posner J.B. Paraneoplastic syndromes // Neurol. Clim. - 1991. - V.9 - №4. - Р.919-36.
21. Storstein A., Vedeler C. Neuropathy and malignancy: a retrospective survey. // J. Neurol. - 2001. - Vol.248. - P.322-7.
22. Walcher J., Witter Т., Rupprecht H.D. Hepatocellular carcinoma presenting with paraneoplastic demyelinating polyneuropathy and PR3-antineutrophil cytoplasmic antibody // J. Clin. Gastroenterol. - 2002. - V.35. - №4. - P.364-5.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УСТАНОВЛЕНИЯ УРЕМИЧЕСКОГО ГЕНЕЗА ПОЛИНЕВРОПАТИИ | 2006 |
|
RU2314527C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 2003 |
|
RU2242759C1 |
| СПОСОБ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ СОЛИДНЫХ ОПУХОЛЕЙ И ИХ ОТДАЛЕННЫХ МЕТАСТАЗОВ | 2011 |
|
RU2456602C1 |
| СПОСОБ КОМПЛЕКСНОЙ ОЦЕНКИ РАЗЛИЧНЫХ УРОВНЕЙ ПОРАЖЕНИЯ СТРУКТУР ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ | 2012 |
|
RU2485518C1 |
| СПОСОБ ДИАГНОСТИКИ ПОЛИНЕВРОПАТИИ ТОНКИХ ВОЛОКОН У ПАЦИЕНТОВ С ЦЕЛИАКИЕЙ | 2014 |
|
RU2575835C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ДИСТАЛЬНЫМИ ДИАБЕТИЧЕСКИМИ ПОЛИНЕВРОПАТИЯМИ | 1999 |
|
RU2167681C1 |
| СПОСОБ ДИАГНОСТИКИ АКСОНАЛЬНО-ДЕМИЕЛИНИЗИРУЮЩИХ ПОЛИНЕВРОПАТИЙ | 2010 |
|
RU2441240C1 |
| СПОСОБ ДИАГНОСТИКИ ГИПЕРПАРАПРОТЕИНЕМИИ | 2004 |
|
RU2273026C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ОСЛОЖНЕНИЙ У ДЕТЕЙ | 1996 |
|
RU2140643C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕЛОГО ТЕЧЕНИЯ ДИАБЕТИЧЕСКОЙ ПЕРИФЕРИЧЕСКОЙ ПОЛИНЕЙРОПАТИИ У ДЕТЕЙ И ПОДРОСТКОВ | 2007 |
|
RU2339955C1 |
Изобретение относится к медицине, а именно к неврологии, и может применяться для установления генеза полиневропатии. Осуществление способа: плазму крови исследуют методом клиновидной дегидратации, при этом каплю плазмы предварительно высушивают на предметном стекле и затем анализируют структуру полученной фации под микроскопом. При наличии сочетания двух признаков - волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации делается заключение о том, что полиневропатия имеет паранеопластический генез. Использование способа дает возможность установления генеза полиневропатии у онкологических больных, а также позволяет заподозрить паранеопластический генез полиневропатии при наличии соответствующих неврологических нарушений, если опухоль не обнаружена, и следовательно, способствует более ранней диагностике онкологических заболеваний. 3 ил.
Способ установления паранеопластического генеза полиневропатии, включающий исследование плазмы крови, отличающийся тем, что плазму крови исследуют методом клиновидной дегидратации, при этом каплю плазмы предварительно высушивают на предметном стекле в течение 18-24 ч при комнатной температуре и минимальном движении воздуха, затем анализируют структуру полученной фации под микроскопом, и при наличии сочетания двух признаков - волнообразных трещин в центральной зоне фации и морщин в периферической зоне фации - делают заключение о паранеопластическом генезе поленевропатии.
| ФИЛИППОВ П.П | |||
| Паранеопластические антигены и ранняя диагностика рака | |||
| Соросовский образовательный журнал, 2000, Т.6, №9, с.25-30 | |||
| Способ диагностики поражения нервной системы при лейкозе | 1991 |
|
SU1765767A1 |
| US 6193948 B1, 27.02.2001 | |||
| ШАБАЛИН В.Н | |||
| и др | |||
| Морфология биологических жидкостей человека | |||
| - М.: Хризосом, 2001, с.304 | |||
| GAMDESSANCHE J | |||
| P | |||
| et al | |||
| Paraneoplastic peripheral neuropathy associated | |||
Авторы
Даты
2008-01-20—Публикация
2006-02-06—Подача