Область изобретения
Настоящее изобретение относится к устройству и способу осуществления иммунологических анализов. Устройство содержит одноразовый иммуносенсор.
Предпосылки к созданию изобретения
Биомедицинские сенсоры используются для определения наличия и/или концентрации широкого ряда аналитов. В случае, когда аналитом является белок, используемый чувствительный элемент обычно представляет собой антитело, поскольку взаимодействие антитела с белком (антигеном) является весьма специфичным. Подобные иммунологические анализы обычно подпадают под две категории: получают "ответ да/нет", например, простым визуальным выявлением, или концентрацию антигена, определенную количественным методом. Большинство количественных методов требуют дорогостоящего оборудования, такого как сцинтилляционные счетчики (для мониторинга радиоактивности), спектрофотометры, спектрофлюориметры (см., например, US 5156972), поверхностные плазмонные резонансные инструменты (см., например, US 5965456) и т.п. Таким образом, было бы выгодно разработать количественный иммунологический анализ, который был бы недорогим и достаточно простым в обращении, который был бы удобным для применения как в помещениях, так и в полевых условиях. Подобный иммуносенсор не требует центрифугирования, разведения, использования пипеток, промывания или этапов экспозиции, а также требует минимальных расходов.
Обычные иммунологические анализы классифицируют на две категории: конкурентные анализы и иммуносэндвичи. В конкурентном анализе антиген в тест-образце с комплексом антиген-зонд (обычно называемым комплексом-репортером), и смесь затем конкурирует за связывание с антителом. Зондом может являться радиоактивный изотоп, фермент, флуорофор или хромофор. В анализе иммуносэндвич антиген в тест-образце связывается с антителом, а затем второй комплекс антитело-зонд связывается с антигеном. В данных известных ранее методах обычно требуется один или более этапов промывания. Этапы промывания привносят сложность в процедуру анализа и могут приводить к утечкам биологически опасных жидкостей. Таким образом, было бы выгодно разработать устройство для осуществления иммунологического анализа, который не требует этапов промывания и является удобным для однократного применения в качестве одноразового устройства.
Сущность изобретения
Разработан количественный, недорогой, одноразовый иммуносенсор, который не требует этапов промывания и, таким образом, не допускает утечек жидкостей. Для иммуносенсоров в определенных вариантах осуществления настоящего изобретения от потребителя не требуется этапов измерения времени (экспозиции), а сенсор можно легко адаптировать к взаимодействиям антиген-антитело в широких кинетических пределах. Сенсоры предпочтительных вариантов осуществления настоящего изобретения имеют ряд потенциальных преимуществ. Указанные сенсоры легче изготавливать, поскольку реагенты можно размещать на одной стадии и/или только на одной части реакционной камеры или подложке, которая в ней содержится.
Указанные сенсоры могут использовать комплекс псевдоантиген-зонд, комплекс модифицированный антиген-зонд или комплекс антиген-зонд. Термин "псевдоантиген", используемый в настоящем документе, является широким термином и используется в своем обычном значении, включая, без ограничения, антигены, отличные от антигена, представляющего интерес, которые связываются с иммобилизованным антителом, но не так прочно, как антиген, представляющий интерес. Термин "модифицированный антиген", используемый в настоящем документе, является широким термином и используется в своем обычном значении, включая, без ограничения, антигены, которые были химически или каким-либо другим способом модифицированы таким образом, что модифицированный антиген связывается с иммобилизованным антителом, но не так прочно, как антиген, представляющий интерес. Антиген в комплексе антиген-зонд, который может быть тем же самым или отличаться от антигена, представляющего интерес, в силу того, что он связан с зондом, будет связываться с иммобилизованным антителом, но не так прочно, как антиген, представляющий интерес, который находится в несвязанном состоянии. В то время как обсуждаются предпочтительные варианты осуществления настоящего изобретения, прежде всего, в связи с псевдоантигеном, следует понимать, что псевдоантиген может быть заменен на комплекс антиген-зонд или модифицированный антиген.
Будет проще гарантировать, что соотношение антитела и антигена-зонда, модифицированного антигена-зонда или псевдоантиген-зонда в реакционной камере будет правильным, поскольку это будет происходить практически автоматически, когда антиген-зонд, модифицированный антиген-зонд или псевдоантиген-зонд связан с антителом во время изготовления сенсора, в противоположность ранее существовавшим способам, при которых правильное соотношение обычно достигают путем контролирования степеней нанесения слоя реагента и плотностей поверхности. Сенсор предпочтительных вариантов осуществления также может особенно хорошо подходить для замедления кинетики иммунной реакции, при которых процессы связывания могут происходить медленно. Применение нечеловеческого псевдоантигена для производства сенсора может понизить вероятность передачи заразных болезней, когда сенсор контактирует с каплей крови на пальце пациента.
В первом варианте осуществления настоящего изобретения обеспечивают одноразовое устройство для применения для выявления антигена-мишени в образце жидкости; указанное устройство включает в себя реакционную камеру, иммобилизованное антитело, фиксированное внутри реакционной камеры, комплекс-репортер, включающий зонд и антиген комплекса-репортера, в котором зонд связан с антигеном комплекса-репортера, в котором антиген комплекса-репортера связан с иммобилизованным антителом и в котором антиген комплекса-репортера связан менее прочно, чем антиген-мишень, с иммобилизованным антителом, камеру выявления, вход для образца в реакционную камеру и проход для образца между реакционной камерой и камерой выявления.
В первом варианте осуществления настоящего изобретения антиген комплекса-репортера может представлять собой антиген-мишень, псевдоантиген или модифицированный антиген. Зонд может включать радиоактивные изотопы, хромофоры или флуорофоры.
В первом варианте осуществления настоящего изобретения зонд может включать фермент, такой как глюкозодегидрогеназа. Когда зондом является фермент, камера выявления может дополнительно включать в себя субстрат для фермента, например окисляемый субстрат, такой как глюкоза. Камера выявления может также дополнительно включать в себя медиатор, такой как дихлорфенолиндофенол, или комплексы между переходными металлами и азотсодержащими гетероатомными видами, или феррицианид. Устройство может дополнительно включать в себя буфер, который корригирует рН образца, такой как фосфат или меллитат. Устройство может также включать в себя стабилизатор, причем стабилизатор стабилизирует один или более антигенов-мишеней, антиген комплекса-репортера, фермент и иммобилизованное антитело. Субстрат фермента можно закреплять на внутренней поверхности камеры выявления.
В первом варианте осуществления настоящего изобретения иммобилизованное антитело можно закреплять на внутренней поверхности реакционной камеры.
В первом варианте осуществления настоящего изобретения устройство также включает в себя поддерживающий материал. Поддерживающий материал может содержаться внутри камеры выявления и может включать в себя первое вещество, такое как субстрат фермента, медиатор или буфер, который может быть закреплен на поддерживающем материале или находиться внутри поддерживающего материала. Поддерживающий материал может содержаться внутри реакционной камеры и может включать в себя второе вещество, такое как иммобилизованное антитело, комплекс-репортер или агент, который предотвращает неспецифическое связывание белков с внутренней поверхностью реакционной камеры, который может быть закреплен на поддерживающем материале или находиться внутри поддерживающего материала. Поддерживающий материал может включать в себя сетчатый материал, например материал, содержащий полимер, такой как полиолефин, полиэфир, нейлон, целлюлоза, полистирол, поликарбонат, полисульфон или их смеси. Поддерживающий материал может включать в себя волокнистый наполняющий материал, такой как волокнистый наполняющий материал, включающий полимер, такой как полиолефин, полиэфир, нейлон, целлюлоза, полистирол, поликарбонат, полисульфон или их смеси. Поддерживающий материал может включать в себя пористый материал, такой как агломерированный порошок, или макропористую мембрану, например макропористую мембрану, включающую в себя полимерный материал, такой как полисульфон, дифторид поливинилидена, нейлон, ацетат целлюлозы, полиметакрилат, полиакрилат или их смеси. Поддерживающий материал может включать в себя гранулы.
В первом варианте осуществления настоящего изобретения камера выявления включает в себя первый электрод и второй электрод. По меньшей мере, один из первого электрода и второго электрода включает в себя материал, такой как алюминий, медь, никель, хром, сталь, нержавеющая сталь, палладий, платина, золото, иридий, углерод, углерод, смешанный со связывающим агентом, оксид индия, оксид олова, проводящий электричество полимер или их смеси.
В первом варианте осуществления настоящего изобретения стенка камеры выявления может быть прозрачной для излучения, испускаемого или поглощаемого зондом, и излучение является показателем присутствия или отсутствия комплекса-репортера в камере выявления.
В первом варианте осуществления настоящего изобретения устройство включает в себя детектор, который выявляет состояние, при котором реакционная камера является практически заполненной.
В первом варианте осуществления настоящего изобретения устройство включает в себя средство для прокола, которое образует отверстие в дистальном конце камеры выявления. Устройство может также содержать отверстие в дистальном конце реакционной камеры.
В первом варианте осуществления настоящего изобретения антиген-мишень включает в себя человеческий С-реактивный белок. Антиген комплекса-репортера может включать в себя мономерный С-реактивный белок. Альтернативно, антиген комплекса-репортера может содержать С-реактивный белок, полученный от видов животных, не являющихся человеком, или химически модифицированный С-реактивный белок, при этом аффинность химически модифицированного С-реактивного белка в отношении антитела меньше аффинности человеческого С-реактивного белка в отношении антитела.
В первом варианте осуществления настоящего изобретения стенка камеры выявления или стенка реакционной камеры содержит материал, такой как полиэфир, полистирол, поликарбонат, полиолефин, полиэтилентерефталат или их смеси. Стенка камеры выявления или стенка реакционной камеры может также содержать наполнитель, такой как диоксид титана, углерод, диоксид кремния, стекло и их смеси.
В первом варианте осуществления настоящего изобретения зонд содержит кофактор фермента, такой как флавинмононуклеотид, флавинадениндинуклеотид, никотинамидадениндинуклеотид или пирролохинолинхинон. Кофактор фермента может быть связан с антигеном комплекса-репортера посредством гибкого спейсера. Камера выявления также может включать в себя субстрат фермента или апофермент.
В первом варианте осуществления настоящего изобретения зонд включает в себя регулятор ферментативной активности, такой как киназа или фосфорилаза. Камера выявления также может включать в себя субстрат фермента или фермент.
В первом варианте осуществления настоящего изобретения зонд содержит белковую субъединицу, которая представляет собой часть фермента, состоящего из множества субъединиц.
Во втором варианте осуществления настоящего изобретения разработан способ определения количества антигена-мишени в образце жидкости, указанный способ включает в себя следующие этапы: помещение образца жидкости в реакционную камеру, содержащую иммобилизованное антитело и комплекс-репортер, содержащий зонд, соединенный с антигеном комплекса-репортера, при котором антитело фиксировано в реакционной камере, при котором антиген комплекса-репортера связан с иммобилизованным антителом и при котором антиген комплекса-репортера связан с иммобилизованным антителом гораздо слабее, чем антиген-мишень, диссоциирование части антигена комплекса-репортера от иммобилизованного антитела в образец жидкости, связывание части антигена-мишени с иммобилизованным антителом, перенос образца жидкости в камеру выявления и определение количества комплекса-репортера в образце жидкости, при котором количество комплекса-репортера является показателем количества антигена-мишени, первоначально присутствовавшего в образце жидкости.
Во втором варианте осуществления настоящего изобретения этап переноса образца жидкости в камеру выявления включает в себя перенос образца жидкости в электрохимический элемент, имеющий первый электрод и второй электрод. Этап определения количества комплекса-репортера в образце жидкости может также включать создание потенциала между первым электродом и вторым электродом в электрохимическом элементе и измерение тока, при котором ток является показателем количества комплекса-репортера, присутствующего в образце жидкости, и при котором количество комплекса-репортера является показателем количества антигена-мишени.
Во втором варианте осуществления настоящего изобретения этап переноса образца жидкости в камеру выявления включает в себя перенос образца жидкости в камеру выявления, содержащую часть, проницаемую для электромагнитного излучения. Этап определения количества комплекса-репортера в образце жидкости может также включать в себя этапы воздействия на часть, проницаемую для электромагнитного излучения, электромагнитным излучением, при котором электромагнитное излучение проходит через образец жидкости или отражается от образца жидкости, и мониторинга свойства электромагнитного излучения после его прохождения через образец жидкости или его отражения от образца жидкости, при котором свойство является показателем количества комплекса-репортера, присутствующего в образце жидкости, и при котором количество комплекса-репортера является показателем количества антигена-мишени.
Краткое описание чертежей
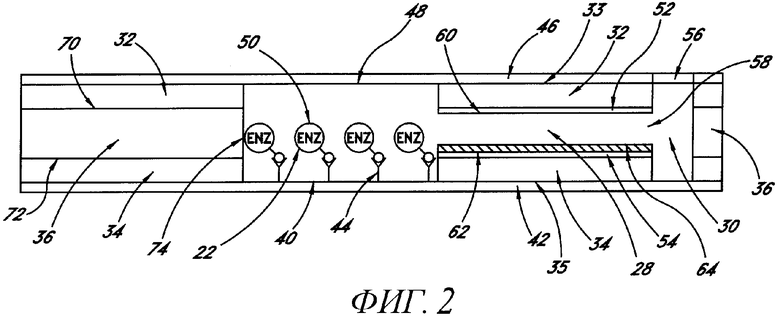
Фиг.1 показывает горизонтальную проекцию (не изменять масштаб) иммуносенсора первого предпочтительного варианта осуществления настоящего изобретения, который включает в себя электрохимический элемент.
Фиг.2 показывает поперечное сечение (не изменять масштаб) вдоль линии A-A' варианта иммуносенсора фиг.1.
Фиг.3 показывает горизонтальную проекцию (не изменять масштаб) иммуносенсора предпочтительного варианта осуществления настоящего изобретения, который содержит электрохимический элемент.
Фиг.4 показывает поперечное сечение (не изменять масштаб) вдоль линии В-В' варианта иммуносенсора фиг.3.
Подробное описание предпочтительных вариантов осуществления настоящего изобретения
Следующее описание и примеры подробно иллюстрируют предпочтительный вариант осуществления настоящего изобретения. Специалистам будет понятно, что настоящее изобретение включает в свой объем многочисленные вариации и модификации настоящего изобретения. Соответственно, описание предпочтительного варианта осуществления не предполагает ограничения объема настоящего изобретения.
Создана сенсорная полоска, которая содержит две камеры: реакционную камеру и камеру выявления. Образец получает реакционная камера, в которой компоненты образца подвергают иммунологической реакции. Один или более продуктов иммунологической реакции выявляют в камере выявления, чтобы количественно определить антиген, присутствующий в образце. Реакционная камера и камера выявления устроены таким образом, что образец может протекать из реакционной камеры в камеру выявления.
После того как в реакционной камере произошла иммунологическая реакция, по меньшей мере, некоторая часть прореагировавшего образца перемещается в камеру выявления, где выявляют наличие зонда и анализируют для получения результата. Предпочтительно, чтобы переместилось достаточное количество образца так, чтобы камера выявления была достаточно заполнена, а именно чтобы достаточное количество образца переместилось в камеру выявления так, чтобы наличие зонда можно было обнаружить и проанализировать с помощью применяемого способа выявления.
Реакционная камера содержит антитела к антигену, представляющему интерес, иммобилизованные внутри реакционной камеры. Антитела можно иммобилизовать на стенке самой камеры. Альтернативно, антитела можно иммобилизовать на подложке, содержащейся в реакционной камере. Подходящие подложки включают в себя, без ограничения, волокнистые материалы, макропористые материалы, порошкообразные материалы или в особенно предпочтительных вариантах осуществления настоящего изобретения гранулы материала такого, который хорошо известен для поддержания антител.
В предпочтительных вариантах осуществления настоящего изобретения иммобилизованные антитела связаны с тем, что называют "псевдоантигеном", соединенным с зондом. Псевдоантиген-зонд связывается с иммобилизованным антителом, но не настолько сильно, как антиген, представляющий интерес. Если, например, антиген, который необходимо обнаружить, представляет собой человеческий белок, то подходящий псевдоантиген-зонд может содержать животную версию того же самого белка, такого как собачий белок или свиной белок, соединенный с зондом. В данном примере антитела к человеческой версии белка иммобилизуют в реакционной камере, а животную версию белка, соединенную с подходящим зондом, связывают с иммобилизованным антителом для образования комплекса антитело-псевдоантиген-зонд.
Когда образец заполняет реакционную камеру, малая часть комплекса псевдоантиген-зонд диссоциирует в раствор, поскольку данный комплекс относительно слабо связан с антителом. Динамическое равновесие будет существовать между связанным комплексом псевдоантиген-зонд и свободным комплексом псевдоантиген-зонд, оставляя некоторое количество свободных сайтов связывания антитела. Если в растворе имеется антиген, то он прочно свяжется со свободными сайтами связывания антитела, предпочтительнее, чем комплекс псевдоантиген-зонд, и, таким образом, оставить псевдоантиген-зонд в растворе. Данный процесс будет продолжаться до тех пор, пока практически весь антиген в образце не свяжется с антителами, а равное количество комплекса псевдоантиген-зонд не окажется в свободном виде в растворе. Таким образом, каждый антиген, который связывается с иммобилизованным антителом, будет вытеснять один комплекс псевдоантиген-зонд в раствор.
Когда весь антиген или заранее определенная его фракция в образце свяжется с иммобилизованными антителами, концентрация комплекса псевдоантиген-зонд в растворе будет отражать оригинальную концентрацию антигена в образце. В предпочтительных вариантах осуществления настоящего изобретения равновесие между свободным и связанным комплексами псевдоантиген-зонд лежит в основе уверенности в том, что антиген в растворе прекратил связываться с антителом предпочтительнее комплекса псевдоантиген-зонд. Следовательно, применяют псевдоантиген-зонд, который более слабо связывается с антителом, чем антиген-мишень, но нет необходимости физического удаления комплекса псевдоантиген-зонд с антитела перед введением образца, как при некоторых ранее существовавших методиках.
После того как иммунологические реакции состоялись, жидкий образец, содержащий любой комплекс псевдоантиген-зонд, высвобожденный из антител, переносится в камеру выявления. В камере выявления определяют концентрацию комплекса псевдоантиген-зонд, присутствующего в образце, и получают результат.
Малое количество комплекса псевдоантиген-зонд может диссоциировать в раствор даже в отсутствие антигена в образце, в результате того, что связанный и свободный комплексы псевдоантиген-зонд достигают равновесия в растворе. Если это имеет место, тот сигнал, генерированный в камере выявления, из-за наличия указанного свободного комплекса псевдоантиген-зонд, считают фоновым сигналом, который вычитают из концентрации антигена, полученного как часть процедуры анализа.
В одновременно рассматриваемой заявке № 09/616433, поданной 14 июля 2000 г., включенной в настоящий документ в качестве ссылки, описана полоска для иммунологического анализа, с присоединенной иммунологической реакцией и камерой выявления. В отличие от сенсора, описанного в настоящем документе, в котором используют псевдоантиген-зонд, исходно комплексированный с антителом, иммобилизованным на поверхности внутри реакционной камеры, в сенсоре заявки № 09/616433 перед помещением образца в реакционную камеру антитела иммобилизуют на одной поверхности, а антиген-зонд иммобилизуют на другой поверхности реакционной камеры. Когда образец помещают в реакционную камеру, антиген-зонд растворяется в растворе и конкурирует с антигеном образца за сайты связывания антитела. Способ применения сенсора заявки № 09/616433 основан, прежде всего, на кинетических факторах, чтобы гарантировать связывание антигена с антителом (поскольку достигает его первым) предпочтительнее связывания комплекса антиген-зонд. Следовательно, существует необходимость пространственного удаления комплекса антиген-зонд из антитела в реакционной камере, и сенсор может функционировать, когда антиген и антиген-зонд связываются с антителом с одинаковой силой.
В предпочтительных вариантах осуществления настоящего изобретения сенсор представляет собой одноэтапный иммуносенсор, не требующий промывания. Данный сенсор представляет собой одноразовое устройство, которое обеспечивает работу реакционной камеры и камеры выявления. Можно использовать любой доступный способ выявления. Подходящие способы выявления включают в себя, например, визуальное выявление, при котором наблюдается проявление окрашивания, или спектроскопическое выявление, при котором отраженный или пропущенный свет используют для измерения изменений поглощения света. В предпочтительном варианте осуществления настоящего изобретения способ выявления представляет собой электрохимический способ, при котором измеряют электрический ток или потенциал, связанный с продуктами иммунологических реакций.
Способы и устройства для осуществления электрохимических измерений в образцах жидкостей дополнительно обсуждаются в одновременно рассматриваемой патентной заявке США № 09/616556, поданной 14 июля 2000 г., которая включена в настоящий документ в качестве ссылки.
Фиксирование времени, требующегося на различные этапы теста, т.е. этап реакции и этап выявления, можно производить вручную. Альтернативно, фиксирование времени можно осуществлять автоматически в ответ на триггерный сигнал, который генерируется, когда реакционная камера и/или камера выявления наполняется.
Варианты сенсоров, подходящих для применения с электрохимическим выявлением, проиллюстрированы на фиг.1 и 2, а также на фиг.3 и 4. Фиг.1 представляет собой горизонтальную проекцию первого варианта сенсорной полоски, а фиг.2 представляет собой поперечное сечение, показывающее детали реакционной камеры и камеры выявления. Фиг.3 представляет собой горизонтальную проекцию второго варианта сенсорной полоски, а фиг.4 представляет собой поперечное сечение, показывающее детали реакционной камеры и камеры выявления.
Сенсор
Иммуносенсоры по настоящему изобретению можно изготовить с помощью хорошо известной технологии тонкослойных устройств, которая используется при изготовлении электрохимических устройств для измерения уровня глюкозы (см., например, US 5942102, включенный в настоящий документ в качестве ссылки). Подобные технологии с некоторыми модификациями можно также использовать для изготовления иммуносенсоров, в которых способы электрохимического выявления не применяются.
В предпочтительных вариантах иммуносенсоров, показанных на фиг.1 и 2, а также на фиг.3 и 4, камера выявления содержит электрохимический элемент. Иммуносенсоры можно изготавливать путем сборки различных тонких слоев материалов, имеющих удобную форму, в соответствии со способами изготовления тонкослойных сенсоров, хорошо известных специалистам. Обычно процесс изготовления включает в себя накладывание друг на друга одного или более спейсерных слоев между верхним слоем и нижним слоем.
В предпочтительном варианте осуществления настоящего изобретения сенсор 20 представляет собой электрохимический элемент 28, в котором используется фермент, например глюкозооксидаза или глюкозодегидрогеназа, в качестве зонда, как показано на фиг.1, горизонтальная проекция подобного сенсора 20, и на фиг.2 - поперечное сечение сенсора по линии А-А'. Реакционную камеру 22 и камеру 28 выявления изготавливают формированием апертуры, простирающейся через листок электрически резистивного материала 36. Апертуре придается такая форма, что она определяет боковую стенку как реакционной камеры 22, так и камеры 28 выявления, а также проход 38 для образца между указанными двумя камерами 22 и 28. Благодаря тому что апертура простирается от проксимального конца 24 реакционной камеры 22 насквозь, до края листка 37, формируется также вход 24 для образца. В одном варианте осуществления настоящего изобретения толщина листка 36 определяет полную высоту реакционной камеры 22 и камеры 28 выявления, которые являются одинаковыми. В другом варианте осуществления настоящего изобретения высота реакционной камеры 22 превышает высоту камеры 28 выявления. Реакционную камеру 22, имеющую большую высоту, чем камера 28 выявления, изготавливают путем наслаивания друг на друга множества листков 32, 34 и 36 вместе. Средний листок 36 слоя имеет апертуру, определяющую боковые стенки 74 и 76 как реакционной камеры 22, так и камеры 28 выявления, как описано выше. Указанный средний слой 36 помещен между двумя или более дополнительными слоями 32 и 34, дополнительные слои 32 и 34 имеют апертуру, определяющую боковую стенку 74 только реакционной камеры 22, а слои 32 и 34, таким образом, определяют торцевые стенки 60 и 62 камеры 28 выявления. В указанном варианте осуществления торцевые стенки 60 и 62 камеры выявления содержат электроды 52 и 54, которые можно изготовить, как описано ниже.
Как показано на фиг.2, антитела 44 прикреплены ко дну 40 реакционной камеры 22. Псевдоантиген-зонд 50 образует комплекс с антителами 44. Антитело может быть закреплено на любой подходящей поверхности реакционной камеры, например к стенке или к поверхности подложки внутри реакционной камеры 22.
Первый тонкий электродный слой 52 смонтирован или сформирован на одной стороне 70 листка электрически резистивного материала 36, простираясь поверх апертуры, образующей камеру 28 выявления, и образуя торцевую стенку 60. Слой 52 может быть приклеен к листку 36, например, с помощью клея. Подходящие клеи включают в себя, например, клеи, активируемые при нагревании, клеи, эффективные при кратковременном прижатии, клеи, отверждающиеся при нагревании, клеи, отверждающиеся при химическом воздействии, термоплавкие клеи, клеи, приобретающие текучесть при нагревании.
Электродный слой 52 может быть изготовлен путем нанесения (например, путем нанесения распылением, как описано в WO97/18464, путем трафаретной печати или путем любого другого удобного способа) на листок из электрически резистивного материала 32 подходящего материала, например алюминия, меди, никеля, хрома, стали, нержавеющей стали, платины, палладия, углерода, углерода, смешанного со связывающим агентом, оксида индия, оксида олова, смешанных оксидов индия/олова, золота, серебра, иридия, их смесей, проводящих электричество полимеров, таких как полипиррол или полиацетилен. Если электрод 52 предназначен для использования в качестве катода в электрохимическом элементе, то подходящие материалы включают в себя, например, алюминий, медь, никель, хром, сталь, нержавеющую сталь, платину, палладий, углерод, углерод, смешанный со связывающим агентом, оксид индия, оксид олова, смешанные оксиды индия/олова, золото, серебро, иридий, их смеси, проводящие электричество полимеры, таких как полипиррол или полиацетилен. Если электрод 52 предназначен для использования в качестве анода в электрохимическом элементе или должен контактировать с окислителями в процессе изготовления или хранения сенсора, то подходящие материалы включают в себя, например, платину, палладий, углерод, углерод, смешанный со связывающим агентом, оксид индия, оксид олова, смешанные оксиды индия/олова, золото, серебро, иридий, их смеси, проводящие электричество полимеры, такие как полипиррол или полиацетилен. Материалы, подходящие для применения в качестве электродов 52 и 54, являются совместимыми с реагентами, присутствующими в сенсоре 20, а именно они не вступают в химические взаимодействия с реагентами при потенциале выбора или в процессе изготовления и хранения сенсора.
Второй тонкий электродный слой 54 смонтирован на противоположной стороне 72 листка электрически резистивного материала 36, также простираясь поверх апертуры, образующей камеру 28 выявления, и образуя вторую торцевую стенку 62. В указанном варианте осуществления настоящего изобретения инертный, электрически изолирующий слой 36 отделяет друг от друга содержащие электроды субстраты 32 и 34. Предпочтительно изолирующий слой 36 держит слои 32 и 34 на предопределенном расстоянии друг от друга. При условии, что указанное разделение достаточно мало, например меньше или равно приблизительно 500 микрон, ток, протекающий между электродами 52 и 54, будет прямо пропорционален концентрации восстановленного медиатора после подходящего короткого времени по сравнению с временем, требующимся на выявление. В указанном варианте осуществления настоящего изобретения скорость появления тока прямо зависит от скорости ферментативной реакции и, следовательно, от количества присутствующего фермента.
В определенных вариантах осуществления настоящего изобретения может быть предпочтительной другая конфигурация электродов, а не положение друг против друга, например положение бок в бок или параллельно, но с некоторым смещением. Электроды могут быть идентичными или практически одинаковыми по размеру или могут быть различных размеров и/или различных форм. Электроды могут содержать один и тот же проводящий материал или различные материалы. Другие вариации конфигурации электродов, расстояние между ними, а также конструкция или изготовление будут очевидны для специалиста в данной области.
В предпочтительном варианте осуществления настоящего изобретения электродные слои 52 и 54 смонтированы параллельно, друг против друга, на расстоянии, меньшем или равном 500, 450, 400, 350, 300, 250 или 200 микрон и более предпочтительно приблизительно от 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 микрон до приблизительно 75, 100, 125, 150 или 175 микрон. В некоторых вариантах осуществления настоящего изобретения, однако, может быть предпочтительным расстояние между электродами, превышающее 500 микрон, например 600, 700, 800, 900 или 1000 микрон, или даже превышающее 1, 2, 3, 4 или 5 мм.
Объем камеры выявления или реакционной камеры обычно составляет приблизительно от 0,3 микролитров или менее до приблизительно 100 микролитров или более, предпочтительно приблизительно от 0,5, 0,6, 0,7, 0,8 или 0,9 микролитров до приблизительно 20, 30, 40, 50, 60, 70, 80 или 90 микролитров и наиболее предпочтительно приблизительно от 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5 микролитров до приблизительно 6, 7, 8, 9, 10, 12, 14, 16 или 18 микролитров. Однако в некоторых вариантах осуществления настоящего изобретения могут быть предпочтительными большие или меньшие объемы одной из или обеих реакционной камеры и камеры выявления.
Электроды 54 и 52 в камере 28 выявления могут быть приведены в электрическое соединение с помощью измерителя (не показан) через край 66 соединения. Соединители (не показаны) находятся в электрическом соединении с электродами 54 и 56 в камере 28 выявленияпосредством проводящих межсоединений (не показаны). В предпочтительном варианте осуществления настоящего изобретения, показанном на фиг.1, указанные проводящие межсоединения состоят из расширений пленок проводника 52 и 54, покрывающих внутренние поверхности 32 и 34. Измеритель в соединении с участком 66 соединения способен прилагать потенциал между электродами 52 и 54 в камере 28 выявления, анализируя вырабатываемые электрические сигналы, показывая ответ, необязательно, сохраняя ответ в памяти, и, необязательно, передавая сохраненные ответы на внешнее устройство, такое как принтер или компьютер.
В других вариантах осуществления настоящего изобретения, в которых используется электрохимическое выявление, обычно используются полоски проводящего материала на одной или обеих внутренних поверхностях камеры выявления с наличием, по меньшей мере, двух электродов, а именно чувствительного электрода и электрода счетчика/эталона. Необязательно, может присутствовать третий электрод, который служит отдельным эталонным электродом.
При использовании способов потенциометрического выявления измеритель способен определять разницу потенциалов между чувствительным электродом и эталонным электродом, но не обязательно способен прилагать потенциал между электродами.
В вариантах осуществления, при которых в качестве способа выявления используют визуальное выявление или отражательную спектроскопию, слои 32 и 46 и/или слои 34 и 42 являются прозрачными для длины волны излучения, которое должно наблюдаться. В случае визуального выявления наблюдается простое изменение цвета в камере 28 выявления. В случае отражательной спектроскопии выявляющее излучение просвечивает через слои 32 и 46 и/или слои 34 и 42 и анализируется излучение, отраженное от раствора в камере 28 выявления. В случае пропускающей спектроскопии в качестве способа выявления слои 32, 46, 34 и 42 являются прозрачными для излучения с выбранной длиной волны. Излучение просвечивает через образец в камере 28 выявления, и измеряется ослабление луча.
В предпочтительном варианте осуществления настоящего изобретения слой 36 содержит субстрат со слоем клея (не показан), нанесенным на его верхнюю поверхность 70 и нижнюю поверхность 72. Примеры материалов, подходящих в качестве субстрата слоя 36, включают в себя полиэфир, полистирол, поликарбонат, полиолефины и предпочтительно полиэтилентерефталат. Указанные материалы могут быть натуральными или могут быть наполнены подходящими наполнителями для придания желательных оптических или механических свойств. Примеры материалов, подходящих в качестве наполнителей, включают в себя, без ограничения, диоксид титана, углерод, диоксид кремния и стекло. Примерами подходящих клеев являются клеи, эффективные при кратковременном прижатии, отверждающиеся при нагревании или при химическом воздействии, а также термоплавкие клеи и клеи, приобретающие текучесть при нагревании. Альтернативно, спейсерные слои сами по себе могут состоять из подходящего клея.
Если вход 24 для образца в процессе изготовления еще не был сформирован, то его обеспечивают, например, формированием бороздки (не показана) на конце 37 устройства 20, которое пересекает реакционную камеру 22.
Заштрихованный кружок на фиг.1 обозначает апертуру 30, проходящую сквозь слои 32, 34 и 36, но не через слои 42 и 46, апертура в слое 34 открывается в камеру 28 выявления. Поскольку слои 42 и 46 первоначально не были прорезаны, единственным отверстием в атмосферу камеры 28 выявления является проход 38 для образца, открывающийся в реакционную камеру 22. Таким образом, когда реакционная камера 22 заполняется образцом, проход 38 для образца в камеру 28 выявления блокирован. Это удерживает воздух в камере 28 выявления и практически предохраняет ее от заполнения образцом. Малое количество образца проникнет в камеру 28 выявления за время между первым контактом образца с проходом 38 в камеру 28 выявления и контактом образца с дальней стороной прохода 38. Однако, как только образец полностью пройдет вдоль прохода 38 в камеру 28 выявления, дальнейшего заполнения камеры 28 выявления не будет. Объем реакционной камеры 22 обычно выбирают таким образом, чтобы он был, по меньшей мере, равным и предпочтительно превышал объем камеры 28 выявления. Путем открытия отверстия 30 в атмосферу образец переносится и заполняет камеру 28 выявления. Отверстие можно открыть с помощью иглы, соединенной с соленоидом измерителя.
Иммуносенсор 100 другого варианта осуществления настоящего изобретения, как изображено на фиг.3 и 4, можно изготовить следующим образом. Первый слой 112 определенной формы и второй спейсерный слой 114 определенной формы имеют одинаковую толщину и располагаются поверх нижнего слоя 116. Первый спейсерный слой 112 представляет собой прямоугольник и расположен на проксимальном крае 118 нижнего слоя 116. Второй спейсерный слой 114 также представляет собой прямоугольник и расположен на нижнем слое 116 на расстоянии от первого спейсерного слоя 112. Дистальный край 120 первого спейсерного слоя 116 и проксимальный край 122 второго спейсерного слоя 114 образуют части 120, 122 боковых стенок реакционной камеры 124. Нижний слой 116 формирует нижнюю стенку 126 реакционной камеры 124. Антитела 164 прикреплены ко дну 126 реакционной камеры 124. Антиген-зонд или псевдоантиген-зонд 162 связываются с закрепленными антителами 164.
Третий спейсерный слой 128 определенной формы, сходный по форме с первым спейсерным слоем 112 определенной формы, располагается поверх первого спейсерного слоя 112 определенной формы. Четвертый спейсерный слой 130 имеет прорезь 132, простирающуюся через проксимальный конец 134 спейсерного слоя 130 по направлению к центру спейсерного слоя 130. Четвертый спейсерный слой 130 располагают поверх второго спейсерного слоя 114 определенной формы с проксимальными концами 122, 134 на одной линии. Прорезь 132 в четвертом спейсерном слое формирует боковые стенки (не показаны) камеры 132 выявления. Часть 138 второго спейсерного слоя, обнаженная прорезью 132 в четвертом спейсерном слое 130, формирует дно 138 камеры 132 выявления. Проксимальный конец 140 прорези 132 формирует проход 140 между реакционной камерой 124 и камерой 132 выявления. Проксимальный конец 134 четвертого спейсерного слоя 130 формирует часть 134 боковой стенки реакционной камеры 124.
Пятый спейсер 142 определенной формы, сходный по форме с первым спейсерным слоем 112 определенной формы и третьим спейсерным слоем 128 определенной формы, располагают поверх третьего спейсерного слоя 128. Шестой спейсерный слой 144 определенной формы, сходный по форме со вторым спейсерным слоем 114 определенной формы, располагают поверх четвертого спейсерного слоя 130 определенной формы с проксимальными концами 146, 122 в одну линию. Часть 170 шестого спейсерного слоя определенной формы, обнаженная прорезью 132 в четвертом спейсерном слое 130, формирует верхушку 170 камеры 132 выявления. Апертура 148 простирается через шестой спейсерный слой определенной формы 144. Дистальный конец 150 апертуры 148 и дистальный конец 152 прорези 132 располагают в линию. Апертура 148 формирует часть 150 боковой стенки отверстия 154, позволяя перемещать воздух из камеры 132 выявления по мере ее заполнения образцом. Верхний слой 156 подогнан поверх пятого спейсерного слоя 142 и шестого спейсерного слоя 144. Верхний слой 156 включает в себя также апертуру 158 аналогичного размера и формы и расположен в одну линию с апертурой 148 в шестом спейсерном слое 144 определенной формы.
В некоторых вариантах осуществления настоящего изобретения может быть предпочтительной задержка заполнения камеры 132 выявления на некоторое время после того, как образец заполнил реакционную камеру 124, чтобы выиграть время для протекания иммунологических реакций в реакционной камере 124. В указанных вариантах осуществления настоящего изобретения это достигают созданием вентильного отверстия 158 в слое 116 и/или 156 после завершения иммунологических реакций. Когда реакционную камеру 124 заполняют образцом, воздух задерживается в камере 132 выявления, что предохраняет ее от заполнения образцом. В удобное время после заполнения образцом реакционной камеры 124, по меньшей мере, один верхний слой 156 и нижний слой 116 можно проколоть поверх вентильного отверстия 148 или ниже вентильного отверстия 154 посредством подходящего устройства, такого как игла или лезвие. Когда это произошло, воздух в камере 132 выявления может выходить через отверстие 148 или отверстие 154, образованные в слое 116 и/или 156, через апертуру 148 или 154, что позволяет образцу проникать в камеру 132 выявления из реакционной камеры 124 по принципу капиллярности, а вытесняемому воздуху - выходить наружу.
Высоту камеры 132 выявления обычно подбирают так, чтобы она была меньше высоты реакционной камеры 124 так, чтобы в комбинации с силами поверхностного натяжения поверхностей 132 и 124 капиллярные силы в камере 132 выявления были больше, чем в реакционной камере 124. Более мощные капиллярные силы в камере 132 выявления способствуют засасыванию образца в камеру 132 выявления, в то же время опустошая реакционную камеру 124. Этот способ использования разницы в капиллярных силах для заполнения камеры подробно описан в одновременно рассматриваемой заявке № 09/536234, поданной 27 марта 2000 г.
В предпочтительных вариантах осуществления настоящего изобретения высота реакционной камеры обычно больше высоты камеры выявления. Высота камеры выявления составляет обычно около 500 микрон или менее, предпочтительно приблизительно 450, 400, 350, 300, 250 микрон или менее и, более предпочтительно, приблизительно от 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 микрон до приблизительно 75, 100, 125, 150, 175 или 200 микрон. Указанные высоты камеры выявления особенно хорошо подходят для применения, при котором верхняя и нижняя стенки камеры выявления содержат электродные слои. Однако могут иметь место определенные варианты осуществления настоящего изобретения, при которых осуществляют электрохимическое выявление, при котором могут быть предпочтительными высоты элемента больше, чем приблизительно 500 микрон. Указанные высоты камеры выявления могут также подходить, когда применяют способы выявления, отличные от электрохимического выявления. Когда применяют другой способ выявления, например способ оптической плотности, могут быть предпочтительными разные высоты элемента. В указанных вариантах осуществления высота элемента составляет приблизительно 600, 700, 800 или 900 микрон или более, или даже могут быть предпочтительными высоты приблизительно 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5 мм или более. Высота реакционной камеры обычно превышает высоту камеры выявления. Однако в некоторых вариантах осуществления настоящего изобретения может быть предпочтительным использование реакционной камеры, имеющей такую же высоту, как у камеры выявления, или сходную с ней высоту, или даже меньшую высоту по сравнению с высотой камеры выявления. Высота камеры выявления обычно составляет приблизительно от 5 микрон или менее до приблизительно 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5 мм или более, предпочтительно приблизительно 900, 800, 700, 600 или 500 микрон или менее, более предпочтительно приблизительно 450, 400, 350, 300 или 250 микрон или менее и наиболее предпочтительно приблизительно от 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 микрон до приблизительно 75, 100, 125, 150, 175, 200 или 250 микрон.
Когда иммуносенсор 100 представляет собой электрохимический сенсор 100, верхняя поверхность второго спейсерного слоя и нижняя поверхность 160 шестого спейсерного слоя 144, которые обнажаются прорезью 132 в четвертом спейсерном слое 130, могут быть частично или полностью покрыты проводящим материалом. Альтернативно, слои 114 и 144 могут сами быть изготовлены из материалов, проводящих электричество. Электрическое соединение между двумя проводящими слоями (не показано) и измерителем (не показан) делает возможными электрохимические измерения внутри камеры выявления.
Способы изготовления
Для иллюстрации подробности изготовления сенсоров предпочтительных вариантов осуществления настоящего изобретения обсуждаются со ссылкой на сенсор, изображенный на фиг.3 и 4. Сенсорная полоска 100 обычно состоит из слоев материала, ламинированных вместе. Один или более спейсерных слоев 128, 130 используют для пространственного отделения слоев 112 и 114 и слоев 142 и 144 друг от друга. Спейсерные слои имеют клейкие поверхности, чтобы слои 112, 128 и 142 и слои 114, 130 и 144 удерживались вместе. Альтернативно, сами спейсерные слои могут состоять из клея или могут содержать материал, способный прилипать к прилегающим слоям при воздействии тепла и/или давления в процессе ламинирования.
Камера 132 выявления представляет собой капиллярное пространство, где слои 114 и 144 формируют торцевые стенки пространства, а толщина слоев 128, 130 определяет высоту. Слои 114 и 144 могут также служить субстратами для электродных покрытий (не показаны), которые сами формируют электроды, будучи изготовлены из проводящих электричество материалов. При изготовлении камеру 132 выявления обычно формируют пробиванием или каким-либо другим способом, удаляющим часть слоя 130. Указанное вырезание части слоя 130 может также служить для определения электродной области электрохимического элемента.
Реакционную камеру 124 можно сформировать пробиванием или каким-либо другим способом, удаляющим часть спейсерных слоев, при этом участки удаляют таким образом, что реакционная камера перекрывает камеру 132 выявления, в результате чего камера 132 выявления открывается в реакционную камеру 124. Слои 116 и 156 затем можно ламинировать до внешней поверхности слоев 112, 114 и слоев 142, 144 соответственно для формирования торцевых стенок 126, 174 реакционной камеры 124. Иммунологические химические реагенты 164 и 162 могут быть нанесены в виде покрытия на внутреннюю поверхность 126 и/или 174 слоев 116 и/или 156 до или после ламинирования 116 и 156 на слои 112, 114 и слои 142, 144 соответственно. Слои 116 и 156 могут быть приклеены к слоям 112, 114 и слоям 142, 144 соответственно посредством клейкого слоя на внешней поверхности слоев 112, 114 и слоев 142, 144 соответственно или на внутренней поверхности слоев 116 и 156.
Отверстие 148 и/или 154 предпочтительно формировать путем пробивания отверстия сквозь слои 114, 130 и 144. С точки зрения упрощения процесса изготовления полоски особенно предпочтительно формировать отверстие 148 и/или 154 одновременно с вырезанием части для реакционной камеры 124 и/или камеры 132 выявления, поскольку в этом случае проще достигать воспроизводимых пространственных взаимодействий между камерой (камерами) и отверстием, а также уменьшить количество этапов процесса.
В другом варианте осуществления настоящего изобретения отверстие 148, 154, 158 можно формировать пробиванием сквозь слои 114, 116, 130, 144 и 156 и дополнительных пленочных слоев (не показаны), ламинированных поверх обоих концов сформированного таким способом отверстия. Это имеет то преимущество, что позволяет оптимизировать свойства слоев 116 и 156, и вентильное отверстие покрывают пленочными слоями (не показано) по отдельности. Альтернативно, вентильное отверстие 148, 154, 158 может быть сформировано путем пробивания сквозь слои 114, 130, 144 и 116 или 156 до ламинирования слоев 116 или 156 соответственно. Это оставляет отверстие 158 только на одной поверхности полоски 100 и, таким образом, используют только одну покрывающую пленку.
В еще одном варианте осуществления настоящего изобретения слои 116 и 156 могут быть сформированы и ламинированы на слои 114 и 144 таким образом, что слои 116 и 156 не достигают участка, на котором формируется отверстие 158. В этом случае необходимо только пробить слои 114, 130 и 144 для формирования отверстия 148, 154, 158 и дополнительные пленочные слои (не показаны), ламинированные поверх обоих концов образованного таким путем отверстия.
Слои могут быть приклеены друг к другу любым подходящим способом, например с помощью клея, эффективного при кратковременном прижатии, отверждающихся клеев, термоплавких клеев, с помощью ламинирования путем использования нагревания и/или давления, механических крепежей.
Описанные выше конфигурации для сенсора представляют собой всего лишь две из множества возможных конфигураций для сенсора, что будет оценено специалистом. Например, отверстие может быть образовано на верхушке полоски, на дне полоски и на верхушке и на дне полоски или сквозь одну или более сторон полоски. Отверстие может быть любой удобной формы и может простираться непосредственно в часть камеры выявления или может иметь окружной проход в камеру выявления. Камера выявления может быть любой удобной формы, например прямоугольной, квадратной, круглой или неправильной. Камера выявления может примыкать к реакционной камере, или можно сформировать отдельный проход для образца между реакционной камерой и камерой выявления. Образец может иметь доступ в реакционную камеру по любой из сторон полоски, как в сенсоре на фиг.4 и 3, или только сквозь одну сторону полоски, с противоположной стороной, блокированной спейсером, как на фиг.1 и 2. Камера выявления может быть любой удобной формы, например прямоугольной, квадратной, круглой или неправильной. Камера выявления может помещаться внутри полоски, и доступ в камеру выявления может быть обеспечен одним или более входами для образца через верхушку, дно или стороны полоски. Обычно конкретную конфигурацию выбирают так, чтобы способ изготовления можно было упростить, например, путем осуществления меньшего количества этапов или использования меньшего количества компонентов.
Электрохимическое выявление
В случае, когда сенсор представляет собой электрохимический элемент, электродные слои, например слои 52 и 54 сенсора на фиг.1 и 2, изготавливают с электрическим соединителем, позволяющим помещать сенсор 20 в измерительную цепь. По меньшей мере, один из электродов 52 или 54 в элементе 28 является чувствительным электродом, т.е. электродом, чувствительным к количеству окисленной или восстановленной формы аналита в образце. В случае потенциометрического сенсора 20, в котором потенциал чувствительного электрода 52 или 54 является показателем уровня присутствующего аналита, имеет место второй электрод 54 или 52, действующий как эталонный электрод, который создает эталонный потенциал. В случае амперометрического сенсора 20, в котором ток в чувствительном электроде является показателем уровня аналита в образце, имеет место, по меньшей мере, один электрод 54 или 52, который действует как противоположный электрод для замыкания электрической цепи. Указанный второй электрод 54 или 52 может также действовать как эталонный электрод. Альтернативно, отдельный электрод (не показан) может выполнять функцию эталонного электрода.
Если иммуносенсор 20 действует как электрохимический элемент 28, то листок 36, содержащий апертуры, определяющие реакционную камеру 22 и/или камеру 28 выявления, содержит электрически резистивный материал. В предпочтительном варианте осуществления настоящего изобретения листки 32 и 34 также содержат электрически резистивный материал. Подходящие электрически резистивные материалы включают в себя, например, полиэфиры, полистиролы, поликарбонаты, полиолефины, их смеси. Предпочтительным полиэфиром является полиэтилентерефталат. В сенсоре, изображенном на фиг.1 и 2, слои 32 и 34 являются субстратами, покрытыми электропроводящим материалом 52 и 54. Электропроводящий материал 52 или 54 нанесен в виде покрытия на поверхность 60 или 62, обращенную к камере 28 выявления, а клейкий слой (не показан) нанесен на поверхность 33 или 35, обращенную к слою 42 или 46 соответственно.
В варианте осуществления, изображенном на фиг.3 и 4, камера 132 выявления имеет электропроводящие покрытия (не показаны) на внутренние поверхности 138 и 170, которые являются подходящими для использования в качестве электродов в электрохимическом сенсорном элементе. В камере 132 выявления также содержится слой 172 сухого реагента, содержащего субстрат для фермента-зонда и, если необходимо, редокс-вещества, способные осуществлять цикл фермента между его окисленной и восстановленной формами и способные окисляться или восстанавливаться на электродах элемента.
В камере 132 выявления может также присутствовать буфер для контроля рН. При работе иммуносенсора электроды соединены с внешним электронным измерительным устройством (не показано) через внешние соединители (не показаны), например язычковые вилки, известные специалистам. Подходящие соединители описаны в заявке № 09/399512, поданной 20 сентября 1999 г., и в одновременно рассматриваемой заявке № 60/345743, поданной 4 января 2002 г.
Если иммуносенсор 20, 100 работает с использованием способа выявления, отличного от электрохимического способа выявления, то материалы, из которых изготовлен сенсор, не обязательно должны быть электрически резистивными. Однако полимерные материалы, описанные выше, являются предпочтительными для использования при изготовлении иммуносенсоров предпочтительных вариантов осуществления благодаря простоте их изготовления, низкой стоимости и отсутствия реактивности в отношении реагентов и образцов.
Оптическое выявление
В альтернативном варианте осуществления используют систему оптического, а не электрохимического выявления. Согласно указанному альтернативному варианту осуществления настоящего изобретения электроды не являются необходимыми, и используют внешний источник света и фотоэлемент для анализа пропускаемого через раствор или отражающегося от раствора света в камере выявления. В одном варианте осуществления настоящего изобретения предпочтительно пропускать свет через верхнюю поверхность сенсора, затем через образец, где он отражается от нижнего сенсорного слоя, а затем возвращается через образец и верхний слой, где и выявляется. В другом варианте осуществления настоящего изобретения свет пропускают через боковую поверхность камеры выявления, и он полностью внутренне отражается между торцевыми поверхностями камеры выявления до тех пор, пока он не проходит наружу через другую сторону камеры выявления, где и выявляется. В указанных вариантах осуществления слои, располагающиеся поверх, по сторонам и/или ниже камеры выявления, являются практически прозрачными для анализирования света, который прошел через слой или слои. Методика, описанная в одновременно рассматриваемой заявке № 09/404119, поданной 23 сентября 1999 г., может быть адаптирована для использования в иммуносенсорах предпочтительных вариантов осуществления настоящего изобретения, в которых используют системы оптического выявления. Альтернативно, в некоторых вариантах осуществления настоящего изобретения может быть предпочтительным использование комбинации способов электрохимического выявления и оптического выявления, что также описано в заявке № 09/404119.
Реагенты и другие материалы, присутствующие в иммуносенсоре
Реагенты для использования в реакционной камере, например иммобилизованное антитело, псевдоантиген-зонд, буфер, медиатор, могут закрепляться на стенках реакционной камеры или на стенках камеры выявления, на независимой подложке, содержащейся внутри камер, внутри матрикса или могут быть самозакрепляющимися. Если реагенты должны быть закреплены на стенках камеры или электродах, химические вещества можно наносить с помощью методики печати, хорошо известной специалистам, например струйной печати, трафаретной печати, щелевого покрытия, литографии. В предпочтительном варианте осуществления настоящего изобретения раствор, содержащий реагент, наносят на поверхность внутри камеры и позволяют ему высохнуть.
В большей степени, чем иммобилизация или сушка реагентов или других химических веществ на поверхностях реакционной камеры или камеры выявления, может быть выгодным их закрепление на подложке или заключение их в одну или более независимых подложек, которые затем помещают в камеру. Подходящие независимые подложки включают, без ограничения, сетчатые материалы, нетканые листовые материалы, волокнистые наполняющие материалы, макропористые мембраны, агломерированные порошки, гели или гранулы. Преимущества независимых подложек включают увеличение площади поверхности, что позволяет включать в реакционную камеру больше антител или псевдоантигена-зонда, если это желательно. В подобном варианте осуществления настоящего изобретения антитело, связанное с псевдоантигеном-зондом, высушивают на кусочке пористого материала, который затем помещают в реакционную камеру. Также проще во время изготовления отмывать несвязанный белок из независимых подложек, таких как гранулы, по сравнению с отмыванием несвязанного белка с поверхности реакционной камеры.
В особенно предпочтительном варианте осуществления настоящего изобретения антитело, связанное с псевдоантигеном-зондом, закрепляют на гранулах. Указанные гранулы могут включать полимерный материал, например латекс или агарозу, необязательно, упакованные в магнитный материал (такой как гамма Fe2O3 и Fe3O4). Материал для гранул выбирают таким образом, чтобы получить удобную подложку для антитела. Подходящие гранулы могут включать гранулы, продающиеся под торговым наименованием DYNABEADS® компанией Dynal Biotech of Oslo, Норвегия. Необязательно, магнит может быть включен в измеритель, чтобы удерживать магнитные гранулы в реакционной камере и устранить их движение в камеру выявления.
В еще одном варианте осуществления настоящего изобретения стенки реакционной камеры являются пористыми, антитело, связанное с псевдоантигеном-зондом, инкорпорировано в поры. В указанном варианте жидкий образец способен проникать в пористую стенку, но не вытекать из обозначенного участка. Это осуществляют с помощью использования макропористой мембраны для формирования стенки реакционной камеры и прессованием мембраны вокруг реакционной камеры для предотвращения утечки образца за пределы обозначенного участка, как описано в патенте США № 5980709, выданном Hodges et al.
Подходящие независимые подложки, такие как гранулы, сетчатые материалы, нетканые листовые материалы и волокнистые наполняющие материалы, включают в себя полиолефины, полиэфиры, нейлоны, целлюлозу, полистиролы, поликарбонаты, полисульфоны и их смеси. Подходящие макропористые мембраны могут быть изготовлены из полимерных материалов, включая полисульфоны, поливинилидендифториды, нейлоны, ацетаты целлюлозы, полиметакрилаты, полиакрилаты и их смеси.
Антитело, связанное с псевдоантигеном-зондом, может содержаться в матриксе, например поливинилацетате. Путем изменения характеристик растворимости матрикса в образце можно достигать контролируемого высвобождения белка или антитела в образец.
Как показано на фиг.2, высушенные реагенты 64 могут, необязательно, располагаться в камере 28 выявления. Указанные реагенты могут включать в себя субстрат фермента (используемый в качестве зонда) и медиатор, способный реагировать с ферментной частью комплекса псевдоантиген-фермент-зонд 50 с появлением поддающегося выявлению сигнала. Субстрат фермента и медиатор, если они присутствуют, должны быть в достаточном количестве так, чтобы скорость реакции любого присутствующего фермента с субстратом фермента 64 определялась количеством присутствующего фермента. Например, если ферментом является глюкозооксидаза или глюкозодегидрогеназа, подходящий медиатор фермента 64 и глюкоза (если она уже не присутствует в образце) располагаются в камере 28 выявления.
В варианте осуществления, при котором используют систему электрохимического выявления, подходящим медиатором является феррицианид. Другие подходящие медиаторы включают в себя дихлорфенолиндофенол и комплексы между переходными металлами и азотсодержащими гетероатомными соединениями. Также может быть включен буфер для корригирования рН образца в камере 28 выявления, если это необходимо. Глюкоза, медиатор и буферные реагенты 64 присутствуют в достаточных количествах так, чтобы скорость реакции фермента с субстратом фермента 64 ограничивалась концентрацией присутствующего фермента.
Внутренняя поверхность 40 субстрата 42, которая формирует основание реакционной камеры 22, покрыта псевдоантигеном-зондом 50, связанным с антителами 44 к антигену, который необходимо выявить в образце. Антитела 44 адсорбированы или каким-либо другим способом иммобилизованы на поверхности 40 субстрата 42 так, что они не удаляются с субстрата 42 во время теста. Необязательно, во время или после нанесения антител 44 на внутреннюю поверхность 40 субстрата 42 агент, предназначенный для предотвращения неспецифического связывания белков, может быть нанесен на указанную поверхность (не показано). Пример указанного агента, хорошо известный специалистам, представляет собой альбумин бычьей сыворотки (BSA). Также можно использовать неионное поверхностно-активное вещество в качестве указанного агента, например TRITON® ×100, поверхностно-активное вещество, которое производит компания Rohm & Haas of Philadelphia, Pennsylvania, или TWEEN®, поверхностно-активные вещества, которые производит компания ICI Americas of Wilmington, Delaware. Выбранное неионное поверхностно-активное вещество не денатурирует белки. Покрытие 44 на внутренней поверхности 40 субстрата 42 находится в сухом состоянии, когда оно готово для проведения теста.
В предпочтительных вариантах, когда используют электрохимическое выявление, ферменты можно использовать в качестве зонда. Примеры подходящих ферментов включают в себя, без ограничения, пероксидазу хрена, глюкозооксидазу и глюкозодегидрогеназу, например PQQ-зависимую глюкозодегидрогеназу или NAD-зависимую глюкозодегидрогеназу.
Зондом может также служить кофактор фермента. Примеры подходящих кофакторов включают в себя, без ограничения, флавинмононуклеотид, флавинадениндинуклеотид, никотинамидадениндинуклеотид и пирролохинолинхинон. Кофактор предпочтительно связан с антигеном посредством гибкого спейсера, чтобы позволять кофактору связываться в апоферментом. Когда зонд представляет собой кофактор, апофермент может быть, необязательно, высушен вместе с субстратом фермента и медиатором в реакционной камере.
Зонд также может представлять собой регулятор активности фермента. Примеры подходящих регуляторов ферментов включают в себя, без ограничения, киназы или фосфорилазы. Регуляторы ферментов могут изменять активность фермента путем изменения состояния фосфорилирования, метилирования, аденилирования, уридилирования или аденозиндифосфатрибозилирования фермента. Регуляторы фермента могут также изменять активность фермента путем отщепления от фермента пептида. Когда зонд представляет собой регулятор фермента, фермент высушивают вместе с субстратом фермента и медиатором в реакционной камере.
Зонд может представлять собой белковую субъединицу, которая является частью комплекса, состоящего из множества субъединиц. Примером указанной белковой субъединицы является одна из субъединиц в ферменте цитохромоксидазы, состоящей из множества субъединиц.
Антитело и псевдоантиген-зонд могут комплексироваться друг с другом до высушивания в реакционной камере. Условия комплексирования выбирают таким образом, чтобы минимизировать количество свободного (некомплексированного) псевдоантигена-зонда, поскольку это соединение будет увеличивать фоновый сигнал при анализе. Количество свободного антитела также сводят к минимуму, поскольку это соединение будет связывать антиген и препятствовать вытеснению им псевдоантигена-зонда, что уменьшает чувствительность анализа. Например, возможно оптимизировать комплексирование псевдоантигенов-зондов с антителами путем нагрузки растворов инертными макромолекулами, такими как полиэтиленгликоль, которые исключают объем для белков и, таким образом, повышают их термодинамическую активность и усиливают аффинность их связывания друг с другом. См., например, Minton, Biopolymers, Vol. 20, pp. 2093-2120 (1981).
Выгодной является иммобилизация антитела на гранулах до их комплексирования с псевдоантигеном-зондом. Это позволяет занимать все сайты антитела путем экспозиции их для высокой концентрации псевдоантигена-зонда. Избыток псевдоантигена-зонда затем легко устраняют центрифугированием и промыванием гранул.
Иммуносенсор является наиболее чувствительным к концентрациям антигена приблизительно от 1 нМ до 10 мкМ (микромоль). Для антигена с относительной молярной массой 100000 это соответствует приблизительно от 0,1 мкг/мл (микрограммов/мл) до 1000 мкг/мл (микрограммов/мл). Однако сенсор можно модифицировать (например, путем изменения разделения между электродами или путем применения другого характера импульсов напряжения) для анализа концентраций антигена в пределах от 0,1 нМ или менее до 0,1 мМ или более.
Максимальный поддающийся выявлению лимит анализа определяется концентрацией псевдоантигена-зонда/антитела в реакционной камере. Указанная молярная концентрация, таким образом, приблизительно соответствует ожидаемым пределам молярных концентраций антигена, с которыми обычно сталкиваются в образцах, представляющих интерес. Например, концентрация С-реактивного белка, с которой имеют дело в обычной больничной лаборатории, составляет приблизительно от 10 нМ до 10 мкМ (микромоль).
Примеры антигенов, которые можно подвергать анализу, включают в себя, без ограничения, альфа-фетопротеин, карциноэмбриональный антиген, С-реактивный белок, сердечный тропонин I, сердечный тропонин Т, дигоксин, ферритин, гамма-глутамилтрансферазу, гликозилированный гемоглобин, гликозилированный белок, гепатит А, В и С, хорионический гонадотропин, вирус иммунодефицита человека, инсулин, сывороточный амилоид А, тромбластин, простатоспецифический антиген, протромбин, тироксин, опухолевый антиген СА125, опухолевый антиген СА15-3, опухолевый антиген СА27/29, опухолевый антиген СА19-9 и опухолевый антиген NMР22.
Сенсоры предпочтительных вариантов осуществления настоящего изобретения не ограничивают анализом человеческих антигенов, но также подходят для использования в ветеринарии и животноводстве. Также, если антиген является слишком маленьким, чтобы быть иммуногенным, то его можно прикреплять к носителю в качестве гаптена и таким образом можно получать к нему антитела. Следовательно, настоящее изобретение не ограничивается анализом белковых антигенов или больших молекул, но оно применимо также и для малых антигенов.
Антитела, подходящие для применения в сенсорах предпочтительных вариантов осуществления настоящего изобретения, включают в себя, без ограничения, натуральные антитела, такие как IgG, IgM и IgA. Подходящие антитела можно также получать из фрагментов натуральных антител, таких как F(ab)2 или Fab. Антитело можно составить из фрагментов, полученных с помощью генной инженерии, или синтетических фрагментов натуральных антител, таких как соединения scFv (одноцепочечный вариабельный фрагмент).
Антитела можно комплексировать с натуральными антигенными зондами или с "псевдоантигенными" зондами. Примеры псевдоантигенов включают в себя антигены из других видов. Например, если нужно исследовать человеческий С-реактивный белок, то псевдоантиген может включать С-реактивный белок собаки, кошки, лошади, крупного рогатого скота, овцы, свиньи или птицы. Псевдоантигены можно также получить путем модификации натурального антигена. Например, если нужно исследовать человеческий С-реактивный белок, то псевдоантиген может включать мономерную форму нативного пентамера, или С-реактивный белок, у которого его аминогруппа, карбоксильная, гидроксильная, тиоловая или дисульфидная группы химически модифицированы.
Использование сенсора для определения наличия или отсутствия антигена
Сенсор можно использовать для определения наличия или отсутствия антигена в образце следующим образом. С учетом фиг.3 и 4 полоска-сенсор 100 содержит реакционную камеру 124 и камеру 132 выявления. Образец помещают в реакционную камеру 124 через вход 166 или 168. Разделение между слоями 116 и 156 и энергия поверхностного натяжения их внутренних поверхностей таковы, что образец будет втягиваться в реакционную камеру 124 под действием капиллярных сил. Реакционная камера 124 содержит антитела 164, иммобилизованные на внутренней поверхности 126 реакционной камеры 124. Комплексы псевдоантиген-зонд 162 связаны с антителами 164 таким образом, что практически все сайты распознавания антигена антителом блокированы псевдоантигеном-зондом 162. В указанном варианте осуществления настоящего изобретения зондом является фермент.
На фиг.4 антитело показано как покрытие только на одной поверхности 126 реакционной камеры 124, но оно может быть с успехом покрыто на более чем одной поверхности 126 реакционной камеры 124 или нанесено на отдельную подложку (не показана), которая содержится в реакционной камере 124. Однако для простоты изготовления обычно предпочтительно, чтобы антитела 164 покрывали только одну часть реакционной камеры 124 или на одном подложечном материале. Когда используют одну подложку для иммобилизации антител 164, подложка такова, что она не проникает в камеру 132 выявления во время проведения теста. Этого можно достигать, например, приклеиванием подложки к, по меньшей мере, одной поверхности 126 реакционной камеры 124 или выбором размера или формы подложки таким образом, что она не может проникнуть через проход для образца 134 в камеру 132 выявления, или выбором подложки достаточной плотности так, что она остается на более низкой поверхности 126 реакционной камеры 124, когда образец перемещается в камеру 132 выявления.
Когда образец заполняет реакционную камеру 124, зонд 162 псевдоантиген-фермент, связанный с антителом 164, контактирует с образцом и малая фракция псевдоантигена-зонда диссоциирует от антитела 164 в образец. Затем требуется время, достаточное для достижения динамического равновесия между связанным и несвязанным зондом 162 псевдоантиген-фермент. Если в образце присутствует антиген, то антиген, который связывается более прочно с антителом 164, чем зонд 162 псевдоантиген-фермент, в конце концов замещает зонд 162 псевдоантиген-фермент. Таким образом, каждый антиген, который связывается с иммобилизованным антителом 164, будет вытеснять один зонд 162 псевдоантиген-ферментв раствор.
Окончание этапа реакции представляет собой предопределенное время после помещения образца в реакционную камеру 124. Предопределенное время устанавливают таким образом, что времени достаточно для того, чтобы практически весь антиген в образце вытеснил зонд 162 псевдоантиген-ферменти связался с антителом 164. Альтернативно, предопределенное время можно устанавливать таким образом, что известная фракция антигена замещает зонд 162 псевдоантиген-ферменти связывается с антителом.
Время, в течение которого образец вводится в реакционную камеру 124, может быть указано для потребителя, например, путем прекращения нажатия на кнопку измерителя (не показано), соединенного с сенсором 100. Это действие используют для запуска устройства, отсчитывающего время (не показано). В случае визуального выявления измерительное устройство не является необходимым. В указанном варианте осуществления настоящего изобретения пользователь засекает время реакции вручную.
В случае, когда используют электрохимическое выявление для обнаружения результата иммунологических реакций, индикатор того, что образец помещен в реакционную камеру 124, может быть автоматизированным. Как описано выше, когда образец заполняет реакционную камеру 124, малая часть камеры 132 выявления в месте ее отверстия 140, ведущего в реакционную камеру 124, может быть увлажнено образцом. Если применяют электрохимическое выявление, то, по меньшей мере, два электрода (не показано) присутствуют в камере 132 выявления. Если данные электроды (не показаны) располагают в камере 134 выявления таким образом, что, по меньшей мере, часть каждого электрода (не показано) контактирует с образцом во время заполнения реакционной камеры 124, присутствие образца соединит электроды (не показано) и создаст электрический сигнал, который можно использовать в качестве триггера для устройства, отсчитывающего время.
Через предопределенное время после запуска устройства, отсчитывающего время, как потребителем, так и автоматически фаза иммунологической реакции рассматривается как завершенная. Когда фаза иммунологической реакции теста завершена, открывается в атмосферу отверстие 158. Например, игла, активированная соленоидом в измерительном устройстве, может использоваться для прокола слоя 156 и/или слоя 116 или дополнительно слоев 114 и 44, что открывает дистальный конец 152 камеры 132 выявления в атмосферу. Прокол может осуществляться автоматически измерителем, как в примере выше, или вручную потребителем в случае визуального выявления, когда измеритель можно не использовать, например, потребитель вставляет иглу через слои 156, 116, 114 и/или 144 в камеру выявления, создавая, таким образом, отверстие 158.
Вскрытие отверстия 158 в атмосферу позволяет воздуху, захваченному камерой 132 выявления, выйти наружу, что позволяет камере 132 выявления заполняться прореагировавшим образцом из реакционной камеры 124. Прореагировавший образец переместится в камеру 132 выявления благодаря возросшим капиллярным силам в камере 132 выявления по сравнению с имеющимися в реакционной камере 124. В предпочтительном варианте осуществления настоящего изобретения возросшие капиллярные силы обеспечиваются подходящим покрытием поверхностей 138 и 160 камеры 132 выявления или более предпочтительно подбором капиллярной дистанции для камеры 132 выявления, которая меньше таковой для реакционной камеры 124. В указанном варианте капиллярная дистанция определяется как наименьшее измерение в камере.
Когда камера 132 выявления заполнена, реагенты 172 растворяются в образце. Ферментный компонент реакционного слоя взаимодействует с субстратом фермента и медиатором, в результате чего получают восстановленный медиатор. Указанный восстановленный медиатор электрохимически окисляется на электроде (не показано), действующем как анод в камере 134 выявления, с получением электрического тока. В одном варианте осуществления настоящего изобретения степень изменения данного тока со временем используют как индикатор присутствия и количества фермента, который присутствует в прореагировавшем образце. Если степень изменения тока меньше предопределенного порогового значения (принимая во внимание, что некоторое количество зонда 162 псевдоантиген-фермент высвободилось в раствор в результате динамического равновесия, которое установилось между свободным и связанным зондом 162 псевдоантиген-фермент), то это является индикатором незначимого количества зонда 162 псевдоантиген-фермент, присутствующего в прореагировавшем образце, что указывает на отсутствие антигена в оригинальном образце. Если степень изменения тока превышает пороговую степень, это указывает, что зонд 162 псевдоантиген-фермент присутствует в прореагировавшем образце в количестве, превышающем пороговое значение, и, таким образом, антиген также исходно присутствует в образце. В одном варианте осуществления настоящего изобретения степень изменения тока используют для измерения относительного количества антигена, исходно присутствовавшего в образце.
Приведенное выше описание раскрывает несколько способов и материалы настоящего изобретения. Настоящее изобретение подвержено модификациям в том, что касается способов и материалов, а также изменениям в способах изготовления и оборудовании. Указанные модификации будут очевидны для специалиста при изучении данного описания или при практике изобретения, описанного в настоящем документе. Как следствие, настоящее описание не предназначено для ограничения конкретными вариантами осуществления, описанными в настоящем документе, но оно охватывает все модификации и альтернативы в пределах истинного объема и идеи настоящего изобретения, воплощенного в прилагаемой формуле изобретения. Все патенты, заявки и другие ссылки, противопоставленные в настоящем документе, полностью включены в настоящий документ в качестве ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОСЕНСОР | 2001 |
|
RU2278612C2 |
| МИКРОФЛЮИДНЫЕ УСТРОЙСТВА И СПОСОБЫ ИХ ПОДГОТОВКИ И ПРИМЕНЕНИЯ | 2006 |
|
RU2423073C2 |
| СПОСОБ ДЕТЕКЦИИ БЕЛКОВ | 2012 |
|
RU2606852C2 |
| СИСТЕМЫ И СПОСОБЫ ДЛЯ УЛУЧШЕННОЙ СТАБИЛЬНОСТИ ЭЛЕКТРОХИМИЧЕСКИХ СЕНСЕРОВ | 2011 |
|
RU2647473C2 |
| СИСТЕМЫ И СПОСОБЫ ИЗМЕРЕНИЙ АНАЛИТА С ВЫСОКОЙ ТОЧНОСТЬЮ | 2010 |
|
RU2564923C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ИЛИ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНАЛИТА В ОБРАЗЦЕ | 1990 |
|
RU2102759C1 |
| Способ детекции антител в биоматериале с использованием стеклянных микроструктурных волноводов | 2021 |
|
RU2753856C1 |
| СПОСОБ МНОГОПРОФИЛЬНОГО ИММУНОХИМИЧЕСКОГО ВЫЯВЛЕНИЯ АНТИГЕНОВ В ЖИДКИХ ОБРАЗЦАХ | 2003 |
|
RU2296995C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ВЫЯВЛЕНИЯ БАКТЕРИАЛЬНОГО ЗАРАЖЕНИЯ ОБРАЗЦА КРОВИ И ТКАНИ | 2000 |
|
RU2536209C2 |
| БЫСТРЫЙ БИОСЕНСОР СО СЛОЕМ РЕАГЕНТА | 2007 |
|
RU2482495C2 |


Настоящее изобретение относится к диагностическим методам. Устройство для выявления антигена-мишени в жидком образце содержит реакционную камеру; иммобилизованное антитело, фиксированное внутри реакционной камеры; комплекс-репортер, содержащий зонд и антиген комплекса-репортера, в котором зонд связан с антигеном комплекса-репортера, антиген комплекса-репортера связан с иммобилизованным антителом и в котором антиген комплекса-репортера связан менее прочно, чем антиген-мишень, с иммобилизованным антителом. Устройство содержит камеру выявления, вход для образца в реакционную камеру и проход для образца между реакционной камерой и камерой выявления. Предложен способ определения количества антигена-мишени в образце жидкости с использованием вышеуказанного устройства. При диссоциации части антигена комплекса-репортера от иммобилизованного антитела в образец жидкости происходит связывание антигена-мишени с иммобилизованным антителом. При переносе образца жидкости в камеру выявления определяют количество комплекса-репортера, которое является показателем количества антигена-мишени, первоначально присутствовавшего в образце жидкости. Заявляемое устройство является одноразовым иммуносенсором, не требующим этапов промывания. Кроме того, от потребителя не требуется этапов измерения времени, а сенсор можно легко адаптировать к взаимодействиям антиген-антитело в широких кинетических пределах. Использование устройства позволяет с высокой точностью количественно определить наличие или отсутствие антигена в образце. 2 н. и 39 з.п. ф-лы, 4 ил.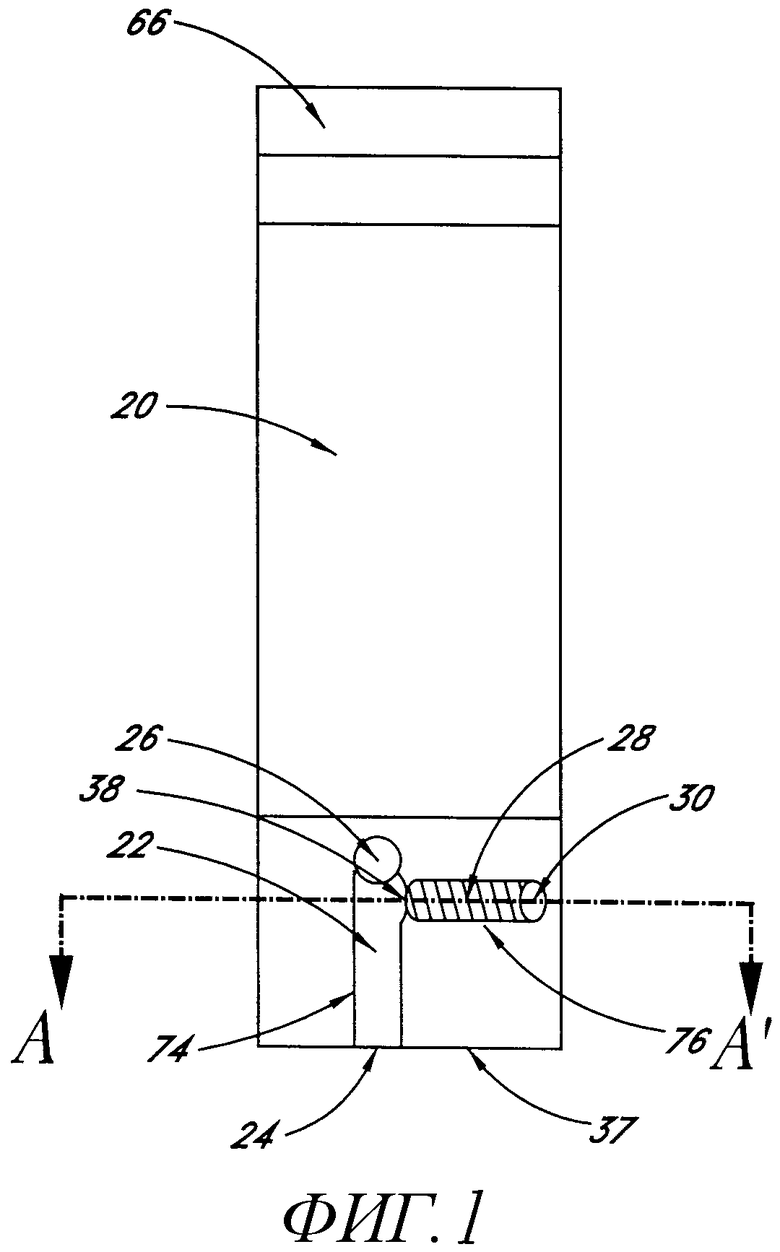
помещения жидкого образца в реакционную камеру, содержащую иммобилизованное антитело и комплекс-репортер, содержащий зонд, связанный с антигеном комплекса-репортера, причем антитело фиксировано внутри реакционной камеры, и антиген комплекса-репортера связан с иммобилизованным антителом, причем антиген комплекса-репортера связан с иммобилизованным антителом менее прочно, чем антиген-мишень,
диссоциации части антигена комплекса-репортера из иммобилизованного антитела в жидкий образец,
связывания части антигена-мишени с иммобилизованным антителом,
перемещения жидкого образца в камеру выявления, и
определения количества комплекса-репортера в жидком образце, при котором количество комплекса-репортера является индикатором количества антигена-мишени, исходно присутствовавшего в жидком образце.
приложение потенциала между первым электродом и вторым электродом, и измерение тока, причем ток является индикатором количества комплекса-репортера, присутствующего в жидком образце, и количество комплекса-репортера является индикатором количества антигена-мишени, исходно присутствовавшего в жидком образце.
воздействия на часть, проницаемую для электромагнитного излучения, электромагнитным излучением, причем электромагнитное излучение проходит через жидкий образец или отражается от жидкого образца, и
мониторинга свойства электромагнитного излучения после его прохождения через жидкий образец или его отражения от жидкого образца, причем свойство является индикатором количества комплекса-репортера, присутствующего в жидком образце, и количество комплекса-репортера является индикатором количества антигена-мишени, исходно присутствовавшего в жидком образце.
| УСИЛИТЕЛЬ С УСТРОЙСТВОМ ЗАЩИТЫ от ПЕРЕГРУЗОК ВХОДНОЙ ЦЕПИ | 0 |
|
SU208763A1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ЭЛЕКТРОХИМИЧЕСКОГО АНАЛИЗА БИОМОЛЕКУЛ | 1998 |
|
RU2161653C2 |
| US 4859583, 22.08.1989 | |||
| СПОСОБ ОБНАРУЖЕНИЯ ВИРУСА ГЕПАТИТА С (ВАРИАНТЫ), НАБОР, СПОСОБ ОПРЕДЕЛЕНИЯ ОБРАЗЦА КРОВИ, РЕАГЕНТ | 1991 |
|
RU2180354C2 |
| СПОСОБ ИНДИКАЦИИ МИКРООРГАНИЗМОВ | 1999 |
|
RU2165081C2 |
| BERNARD A, Micromosaic immunoassays, Anal Chem | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| PMID 11195515 [реферат] [он-лайн] [найдено 21.11.2006] | |||
| Найдено из базы данных PubMed. | |||
Авторы
Даты
2008-01-20—Публикация
2003-03-20—Подача