Настоящее изобретение относится к производному малононитрила, имеющему пятичленное кольцо, содержащее атом азота, и его применению.
Разработаны и предложены для практического применения соединения, обладающие пестицидной активностью.
Задачей настоящего изобретения является создание соединения, обладающего превосходной активностью против вредителей, пестицидной композиции, включающей упомянутое соединение в качестве активного ингредиента, и способ борьбы с вредителями нанесением упомянутого соединения.
Настоящее изобретение относится к производному малононитрила, представленному формулой (I):
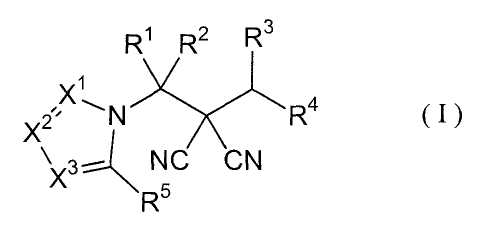
где в формуле
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из Х1, Х2 и Х3 представляет собой атом азота или CR6;
каждый из R5 и R6 представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, меркаптогруппу, формильную группу, группу SF5, карбоксильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкенилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкинилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, группу, обозначенную
NR10R11, группу, обозначенную С(=Х5)NR12NR13, группу, обозначенную (СН2)mQ, группу, обозначенную С(=NOR17)R18, или атом водорода;
в случае, когда один из R5 и R6 связан с двумя атомами в соседних положениях или два R6 связаны с двумя атомами в соседних положениях, они могут быть связаны друг с другом в концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, причем в этом случае, по меньшей мере, одна метиленовая группа указанной алкандиильной группы или указанной алкендиильной группы может быть заменена на атом кислорода или атом серы или группу NR7;
R7 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
каждый из R10 и R11 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, (С1-С5-алкоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена)-С1-С3-алкильную группу, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
каждый из R12 и R13 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, группу, обозначенную (СН2)mQ, или атом водорода;
или R12 и R13 соединяются друг с другом в своих концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из R17 и R18 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, группу, обозначенную (СН2)mQ, или атом водорода;
Q представляет собой арильную группу, необязательно замещенную, по меньшей мере, одним R14;
каждый из R14 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом галогена;
m равно целому числу от 0 до 5;
Х5 представляет собой атом кислорода или атом серы.
Указанное производное малононитрила называется в дальнейшем «соединением настоящего изобретения». Настоящее изобретение далее предлагает пестицидную композицию, включающую эффективное количество соединения настоящего изобретения и носитель, способ борьбы с вредителями, включающий нанесение эффективного количества соединения настоящего изобретения на вредителей или места обитания вредителей, и применение соединения настоящего изобретения для борьбы с вредителями.
В настоящем изобретении алкандиильная группа представляет собой группу, имеющую свободные валентности на двух разных атомах углерода, содержащихся в насыщенной углеводородной цепи и алкендиильная группа представляет собой группу, имеющую свободные валентности на двух разных атомах углерода, содержащихся в углеводородной цепи, имеющей одну или две двойные связи.
В настоящем изобретении фторалкильная группа представляет собой алкильную группу, которая замещена одним или несколькими атомами фтора, такой термин, как «С1-С6» означает общее число атомов углерода, которое содержит каждый такой заместитель.
В соединении настоящего изобретения С1-С5-алкильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, представленная R1 и R2, включает, например, С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, такую как метильная группа, этильная группа, пропильная группа, 1-метилэтильная группа (в дальнейшем может называться изопропильной группой), хлорметильная группа, фторметильная группа, дифторметильная группа, трифторметильная группа, 2,2,2-трифторэтильная группа и 1,1,2,2-тетрафторэтильная группа, и 1,1-диметилэтильную группу (в дальнейшем может называться трет-бутильной группой);
С2-С5-алкенильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, винильную группу, 2,2-дифторвинильную группу, 1,2,2-трифторвинильную группу, 1-пропенильную группу и 2-пропенильную группу;
С2-С5-алкинильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, этинильную группу, 1-пропинильную группу, 2-пропинильную группу и 3,3,3-трифтор-1-пропинильную группу.
С1-С5-Алкоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена, представленным R2, включает, например, C1-C3-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, такую как метоксигруппа, этоксигруппа, 1-метилэтоксигруппа, трифторметоксигруппа, дифторметоксигруппа, 2,2,2-трифторэтоксигруппа и 1,1,2,2-тетрафторметоксигруппа; и бутоксигруппу.
С1-С5-Алкильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, представленным R3 и R4, включает, например, метильную группу, этильную группу, 1-метилэтильную группу, 2-метилпропильную группу, пропильную группу, бутильную группу, 3-метилбутильную группу, 2,2-диметилпропильную группу, фторметильную группу, хлорметильную группу, 2,2-дифторэтильную группу, 2,2-дихлорэтильную группу, 3,3-дифторпропильную группу, 3,3-дихлорэтильную группу, трифторметильную группу, трихлорэтильную группу, 2,2,2-трифторэтильную группу, 2,2,2-трихлорэтильную группу, 3,3,3-трифторпропильную группу, 3,3,3-трихлорпропильную группу, 2,2-дифторпропильную группу, 3,3-дифторбутильную группу, 1-бром-2,2,2-трифторэтильную группу, 1-хлор-2,2,2-трифторэтильную группу, 1,2,2,2-тетрафторэтильную группу, пентафторэтильную группу, 2,2,3,3,3-пентафторпропильную группу, 1,1,2,2-тетрафторэтильную группу и 2,2,3,3-тетрафторпропильную группу;
С2-С5-алкенильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, винильную группу, аллильную группу, 1-пропенильную группу, 3-бутенильную группу, 2-метил-1-пропенильную группу, 3-метил-2-бутенильную группу, 3-пентенильную группу, 4-пентенильную группу, 3-метил-3-бутенильную группу, 4-метил-3-пентенильную группу, 1-хлорвинильную группу, 2-хлорвинильную группу, 1-фторвинильную группу, 2-фторвинильную группу, 2,2-дихлорвинильную группу, 2,2-дибромвинильную группу, 2,2-дифторвинильную группу, 1,2,2-трифторвинильную группу, 1-(трифторметил)винильную группу, 2-хлор-2-пропенил, 3-хлор-2-пропенил, 2-фтор-2-пропенил, 3-фтор-2-пропенил, 3,3-дихлор-2-пропенил, 3,3-дибром-2-пропенил, 3,3-дифтор-2-пропенил, 2,3,3-трифтор-2-пропенильную группу, 2-(трифторметил)-2-пропенильную группу, 2,3,3,3-тетрафтор-1-пропенильную группу, 1,2,3,3,3-пентафтор-1-пропенильную группу, 3,4,4-трифтор-3-бутенильную группу, 3,4,4,4-тетрафтор-2-бутенильную группу, 2,3,4,4,4-пентафтор-2-бутенильную группу и 4,5,5-трифтор-4-пентенильную группу;
С2-С5-алкинильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 3-метил-1-бутинильную группу, 2-хлор-1-пропинильную группу, 3-хлор-2-пропинильную группу, 3,3,3-трифтор-1-пропинильную группу и 4,4,4-трифтор-2-бутинильную группу;
С3-С5-циклоалкильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, включает, например, циклопропильную группу, 2,2-дихлорциклопропильную группу, 2,2-дифторциклопропильную группу, 2,2,3,3-тетрафторциклопропильную группу, 2,2-дихлорциклобутильную группу, 2,2-дифторциклобутильную группу, 2,2,3,3-тетрафторциклобутильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу;
С4-С5-циклоалкенильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, 2-фтор-2-циклопентенильную группу.
С2-С6-Алкандиильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и образованная связыванием R3 и R4, включает, например, этиленовую группу, пропиленовую группу, триметиленовую группу и тетраметиленовую группу;
С4-С6-алкендиильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и образованная связыванием R3 и R4, включает, например, 2-бутениленовую группу и 2-пентениленовую группу.
Атом галогена, представленный R5, R6 и R14, включает атом фтора, атом хлора, атом брома и атом йода.
С1-С5-Алкильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6, R7, R10, R11, R12, R13, R14, R17 и R18, включает, например, метильную группу, этильную группу, 1-метилэтильную группу, 1-этилэтильную группу, 1,1-диметилэтильную группу, н-пропильную группу, 1-метилпропильную группу, 1-этилпропильную группу, 1,1-диметилпропильную группу, 2,2-диметилпропильную группу, 1,2-диметилпропильную группу, 1,1,2-триметилпропильную группу, н-бутильную группу, 1-метилбутильную группу, 2-метилбутильную группу, 3-метилбутильную группу, н-пентильную группу, фторметильную группу, хлорметильную группу, бромметильную группу, йодметильную группу, дифторметильную группу, хлордифторметильную группу, бромдифторметильную группу, трифторметильную группу, дихлорметильную группу, трихлорметильную группу, 1-хлорэтильную группу, 1-бромэтильную группу, 1-йодметильную группу, 1-фторэтильную группу, 2-хлорэтильную группу, 2-бромэтильную группу, 2-йодметильную группу, 2-фторэтильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, 2,2,2-трихлорэтильную группу, пентафторэтильную группу, 2,2,2-трифтор-1-хлорэтильную группу, 3-фторпропильную группу, 3-хлорпропильную группу, 1-фтор-1-метилэтильную группу, 1-хлор-1-метилэтильную группу, 2-хлор-1,1-диметилэтильную группу, 2-фтор-1,1-диметилэтильную группу, гептафторпропильную группу, 1,1,2,2,3,3-гексафтор-н-пропильную группу, 4-хлорбутильную группу, 4-фторбутильную группу, 5-хлорпентильную группу и 5-фторпентильную группу.
С2-С5-Алкенильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5 или R6, включает, например, винильную группу, 1-метилвинильную группу, 1-пропенильную группу, 1-метил-1-пропенильную группу, 2-метил-1-пропенильную группу, 1,2-диметил-1-пропенильную группу, 2-пропенильную группу, 1-метил-2-пропенильную группу, 2-метил-2-пропенильную группу, 1,1-диметил-2-пропенильную группу, 1,2-диметил-2-пропенильную группу и 2,2-дифторвинильную группу, 2-хлор-2-пропенильную группу, 2,2-дихлор-2-пропенильную группу, 2-бром-2-пропенильную группу, 2,2-дибром-2-пропенильную группу, 2-фтор-2-пропенильную группу и 2,2-дифтор-2-пропенильную группу.
С3-С5-Алкенильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R7, R10, R11, R12, R13, R17 и R18, включает, например, 1-метилвинильную группу, 1-пропенильную группу, 1-метил-1-пропенильную группу, 2-метил-1-пропенильную группу, 1,2-диметил-1-пропенильную группу, 2-пропенильную группу, 1-метил-2-пропенильную группу, 2-метил-2-пропенильную группу, 1,1-диметил-2-пропенильную группу, 1,2-диметил-2-пропенильную группу, 2-хлор-2-пропенильную группу, 2,2-дихлор-2-пропенильную группу, 2-бром-2-пропенильную группу, 2,2-дибром-2-пропенильную группу, 2-фтор-2-пропенильную группу и 2,2-дифтор-2-пропенильную группу.
С2-С5-Алкинильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5 или R6, включает, например, этинильную группу, 1-пропинильную группу, 2-пропинильную группу и 3,3,3-трифтор-1-пропинильную группу.
С3-С5-Алкинильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R7, R10, R11, R12, R13, R17 и R18, включает, например, 1-пропинильную группу, 2-пропинильную группу и 3,3,3-трифтор-1-пропинильную группу.
С3-С6-Циклоалкильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой и представленная R5, R6, R7, R10, R11, R12, R13, R14, R17 и R18, включает, например, циклопропильную группу, 1-метилциклопропильную группу, 2,2-дихлорциклопропильную группу, 2,2-дихлор-1-метилциклопропильную группу, 2,2-дифторциклопропильную группу, 2,2-дифтор-1-метилциклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
С1-С5-Алкоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6 и R14, включает, например, метоксигруппу, этоксигруппу, пропоксигруппу, трифторметоксигруппу, бромдифторметоксигруппу, дифторметоксигруппу, хлордифторметоксигруппу, пентафторэтоксигруппу, 2,2,2-трифторэтоксигруппу и 1,1,2,2-тетрафторэтоксигруппу.
С3-С6-Алкенилоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5 и R6, включает, например, 1-пропенилоксигруппу, 2-пропенилоксигруппу и 2,2-дифтор-2-пропенилоксигруппу.
С3-С6-Алкинилоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5 и R6, включает, например, 2-пропинилоксигруппу, 2-бутинилоксигруппу и 3,3,3-трифтор-1-пропинилоксигруппу.
(С1-С5-Алкоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена)-С1-С3-алкильная группа, представленная R10 и R11, включает, например, метоксиметильную группу, этоксиметильную группу, 1-метоксиэтильную группу, 1-этоксиэтильную группу и трифторметоксиметильную группу.
С1-С5-Алкилтиогруппа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6 и R14, включает, например, метилтиогруппу, этилтиогруппу, трифторметилтиогруппу, хлордифторметилтиогруппу, бромдифторметилтиогруппу, дибромфторметилтиогруппу, 2,2,2-трифторэтилтиогруппу, 1,1,2,2-тетрафторэтилтиогруппу и пентафторэтилтиогруппу.
С3-С5-Алкенилтиогруппа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6 и R14, включает, например, 1-пропенилтиогруппу, 2-пропенилтиогруппу и 2,2-дифтор-2-пропенилтиогруппу.
С3-С5-Алкинилтиогруппа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6 и R14, включает, например, 2-пропинилтиогруппу, 2-бутинилтиогруппу и 3,3,3-трифтор-1-пропинилтиогруппу.
С1-С5-Алкилсульфинильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6, R10, R11 и R14, включает, например, метилсульфинильную группу и трифторметилсульфинильную группу.
С1-С5-Алкилсульфонильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6, R10, R11 и R14, включает, например, метилсульфонильную группу и трифторметилсульфонильную группу.
С2-С6-Алкилкарбонильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная R5, R6, R7, R10, R11 и R14, включает, например, ацетильную группу, пропионильную группу, 2,2-диметилпропионильную группу и трифторацетильную группу.
С2-С5-Алкоксикарбонильная группа, представленная R5, R6, R7, R10, R11 и R14, включает, например, метоксикарбонильную группу, этоксикарбонильную группу, 1-метилэтоксикарбонильную группу и трет-бутоксикарбонильную группу.
В случае, когда R5 и R6 связаны с атомами в соседних положениях или два R6 связаны с атомами в соседних положениях, они соединяются друг с другом в концевых своих положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена и включающей, например, пропиленовую группу, триметиленовую группу и тетраметиленовую группу; С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена и включающей, например, 2-бутениленовую группу и 2-пентениленовую группу.
С2-С6-Алкандиильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена и представленная комбинацией R12 и R13, включает, например, этиленовую группу, пропиленовую группу, триметиленовую группу и тетраметиленовую группу; С4-С6-алкендиильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, 2-бутениленовую группу и 2-пентениленовую группу.
Соединения настоящего изобретения включают, например, следующие соединения:
производное малононитрила формулы (I), в которой R1 представляет собой атом водорода;
производное малононитрила формулы (I), в которой R2 представляет собой метильную группу;
производное малононитрила формулы (I), в которой R1 и R2 представляют собой атомы водорода;
производное малононитрила формулы (I), в которой R1 представляет собой атом водорода и R2 представляет собой метильную группу;
производное малононитрила формулы (I), в которой R3 представляет собой атом водорода;
производное малононитрила формулы (I), в которой R4 представляет собой С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой R4 представляет собой винильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 2-пропенильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 2,2-дифторвинильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 1-(трифторметил)винильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 3,3-дифтор-2-пропенильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 2,3,3-трифтор-2-пропенильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 3,3,3-трифтор-1-пропенильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой С2-С5-галогеналкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой R4 представляет собой С1-С5-фторалкильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой фторметильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 2,2-дифторэтильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 2,2,2-трифторэтильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой пентафторэтильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 3,3,3-трифторпропильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 2,2,3,3,3-пентафторпропильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой С3-С6-циклоалкильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой 2,2-дихлорциклопропильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой циклопропильную группу;
производное малононитрила формулы (I), в которой R4 представляет собой циклобутильную группу;
производное малононитрила формулы (I), в которой R3 представляет собой атом водорода и R4 представляет собой винильную группу и 2-пропенильную группу;
производное малононитрила формулы (I), в которой R3 представляет собой атом водорода и R4 представляет собой 2,2-дифторвинильную группу, 1-(трифторметил)винильную группу, 3,3-дифтор-2-пропенильную группу, 2,3,3-трифтор-2-пропенильную группу или 3,3,3-трифтор-1-пропенильную группу;
производное малононитрила формулы (I), в которой R3 представляет собой атом водорода и R4 представляет собой фторметильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, 1,1,2,2,2-пентафторэтильную группу, 3,3,3-трифторпропильную группу или 2,2,3,3,3-пентафторпропильную группу;
производное малононитрила формулы (I), в которой R3 представляет собой атом водорода и R4 представляет собой циклопропильную группу, циклобутильную группу или 2,2-дихлорциклопропильную группу;
производное малононитрила формулы (I), в которой R1, R2 и R3 представляют собой атомы водорода и R4 представляет собой винильную группу или 2-пропенильную группу;
производное малононитрила формулы (I), в которой R1, R2 и R3 представляют собой атомы водорода и R4 представляет собой 2,2-дифторвинильную группу, 1-(трифторметил)винильную группу, 3,3-дифтор-2-пропенильную группу, 2,3,3-трифтор-2-пропенильную группу или 3,3,3-трифтор-1-пропенильную группу;
производное малононитрила формулы (I), в которой R1 и R3 представляют собой атомы водорода, R2 представляет собой метильную группу и R4 представляет собой 2,2-дифторвинильную группу или 1-(трифторметил)винильную группу, 3,3-дифтор-2-пропенильную группу, 2,3,3-трифтор-2-пропенильную группу или 3,3,3-трифтор-1-пропенильную группу;
производное малононитрила формулы (I), в которой R1, R2 и R3 представляют собой атомы водорода и R4 представляет собой фторметильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, пентафторэтильную группу, 3,3,3-трифторпропильную группу или 2,2,3,3,3-пентафторпропильную группу;
производное малононитрила формулы (I), в которой R1 и R3 представляют собой атомы водорода, R2 представляет собой метильную группу и R4 представляет собой фторметильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, пентафторэтильную группу, 3,3,3-трифторпропильную группу или 2,2,3,3,3-пентафторпропильную группу;
производное малононитрила формулы (I), в которой R1, R2 и R3 представляют собой атомы водорода и R4 представляет собой циклопропильную группу, циклобутильную группу или 2,2-дихлорциклопропильную группу;
производное малононитрила формулы (I), в которой каждый из Х1, Х2 и Х3 представляет собой CR6;
производное малононитрила формулы (I), в которой Х1 представляет собой атом азота и каждый из Х2 и Х3 представляет собой CR6;
производное малононитрила формулы (I), в которой Х2 представляет собой атом азота и каждый из Х1 и Х3 представляет собой CR6;
производное малононитрила формулы (I), в которой Х3 представляет собой атом азота и каждый из Х1 и Х2 представляет собой CR6;
производное малононитрила формулы (I), в которой Х1 и Х2 представляют собой атомы азота и Х3 представляет собой CR6;
производное малононитрила формулы (I), в которой Х1 и Х3 представляют собой атомы азота и Х2 представляет собой CR6;
производное малононитрила формулы (I), в которой Х1, Х2 и Х3 представляют собой атомы азота;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную атомом(ами) галогена, или С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой этильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой 1-метилэтильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой 1,1-диметилэтильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой 2,2-диметилпропильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой трифторметильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой пентафторэтильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой 1-метилвинильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой этинильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой циклопропильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой 1-метилциклопропильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкенилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С3-С6-алкинилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой пропаргилоксигруппу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой 2-бутинилоксигруппу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой 3-бутинилоксигруппу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную атомом(ами) галогена, или С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой метилтиогруппу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой трифторметилтиогруппу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой пропаргилтиогруппу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой метилсульфинильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой трифторметилсульфинильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой метилсульфонильную группу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой цианогруппу;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой атом галогена;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой атом брома;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой атом хлора;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой атом фтора;
производное малононитрила формулы (I), в которой Х3 представляет собой CR6 и
R6 представляет собой нитрогруппу;
производное малононитрила формулы (I), в которой R1 представляет собой атом водорода и R2 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I), в которой R1 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода, и R2 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С3-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
производное малононитрила формулы (I), в которой каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой R1 представляет собой атом водорода, R2 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водород, каждый из R3 и R4 представляет собой C1-C5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, C2-C5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, C2-C5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, C3-C5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена,
производное малононитрила формулы (I), в которой R1 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода, R2 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С3-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода, каждый из R3 и R4 представляет собой C1-C5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, C2-C5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, C2-C5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, C3-C5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
производное малононитрила формулы (I), в которой R3 представляет собой атом водорода, R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы;
производное малононитрила формулы (I), в которой R1 представляет собой атом водорода, R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода, R3 представляет собой атом водорода, R4 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы;
производное малононитрила формулы (I), в которой R1 представляет С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода, R2 представляет собой С1-С3-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С3-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппа или атом водорода, R3 представляет собой атом водорода, R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы;
производное малононитрила, представленное формулой (I-1),
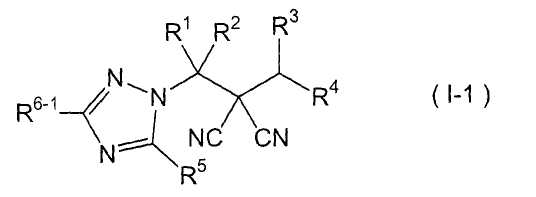
где в формуле
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С4-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из R5 и R6-1 представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, меркаптогруппу, формильную группу, группу SF5, карбоксильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкенилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкинилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, фенильную группу или атом водорода;
производное малононитрила формулы (I-1), в которой R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
R5 представляет собой атом водорода;
и R6-1 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-1), в которой R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
R5 представляет собой атом водорода;
и R6-1 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-1), в которой R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
и R6-1 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-1), в которой R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой 2,2,2-трифторметильную группу или винильную группу;
и R6-1 представляет собой атом водорода, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила, представленное формулой (I-2),
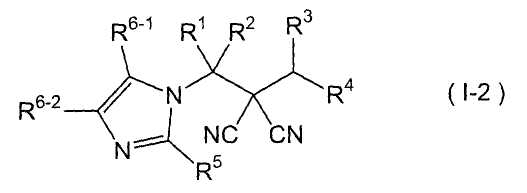
где в формуле
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С4-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из R5 и R6-1 и R6-2 представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, меркаптогруппу, формильную группу, группу
SF5, карбоксильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкенилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкинилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, фенильную группу или атом водорода;
производное малононитрила формулы (I-2), в которой
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С4-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
R5 представляет собой атом водорода;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-2), в которой
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
R5 представляет собой атом водорода;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-2), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена,
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-2), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой 2,2,2-трифторметильную группу или винильную группу;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила, представленное формулой (I-3),
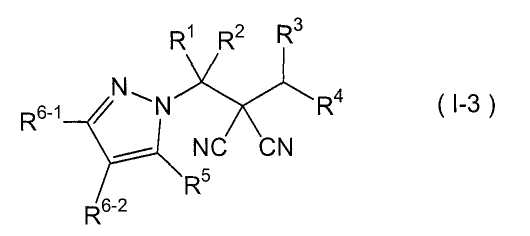
где в формуле
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С4-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из R5 и R6-1 и R6-2 представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, меркаптогруппу, формильную группу, группу
SF5, карбоксильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкенилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкинилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, фенильную группу или атом водорода;
производное малононитрила, представленное формулой (I-3), в которой
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
R5 представляет собой атом водорода;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила, представленное формулой (I-3), в которой
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
R5 представляет собой атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-3), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-3), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
R6-1 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
и R6-2 представляет собой атом галогена или атом водорода;
производное малононитрила формулы (I-3), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой 2,2,2-трифторметильную группу или винильную группу;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-3), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой 2,2,2-трифторметильную группу или винильную группу;
R6-1 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
и R6-2 представляет собой атом галогена или атом водорода;
производное малононитрила, представленное формулой (I-4)
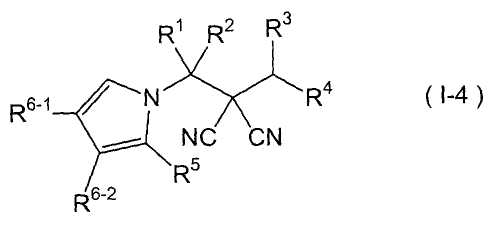
где в формуле
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из R5, R6-1 и R6-2 представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, меркаптогруппу, формильную группу, группу
SF5, карбоксильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкенилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкинилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, фенильную группу или атом водорода;
производное малононитрила, представленное формулой (I-4), в которой
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в их концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
R5 представляет собой атом водорода;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила, представленное формулой (I-4), в которой
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппу или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R5 представляет собой атом водорода;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-4), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
производное малононитрила формулы (I-4), в которой
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой 2,2,2-трифторметильную группу или винильную группу;
и каждый из R6-1 и R6-2 представляет собой атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода.
В представлениях соединений от формулы (I-1) до формулы (I-4) представленный
R6-1 или R6-2 атом галогена включает, например, атом фтора, атом хлора и атом брома;
С1-С5-алкильная группа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, С1-С5-фторалкильную группу, такую как трифторметильная группа, 2,2,2-трифторэтильная группа и тому подобное, и алкильную группу, которая имеет разветвление в 1-положении, такую как изопропильная группа, трет-бутильная группа, 1,1-диметилпропильная группа и тому подобное;
С1-С5-алкоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, метоксигруппу, этоксигруппу, 1-метилэтоксигруппу и тому подобное;
С1-С5-алкилтиогруппа, необязательно замещенная, по меньшей мере, одним атомом галогена, включает, например, метилтиогруппу, этилтиогруппу, 1-метилэтилтиогруппу и тому подобное.
Далее будет описан способ получения соединения настоящего изобретения.
Соединение настоящего изобретения можно получить, например, согласно нижеследующим способам (способу получения 1), (способу получения 2).
(Способ получения 1)
Способ включает взаимодействие соединения (а) и соединения (b)
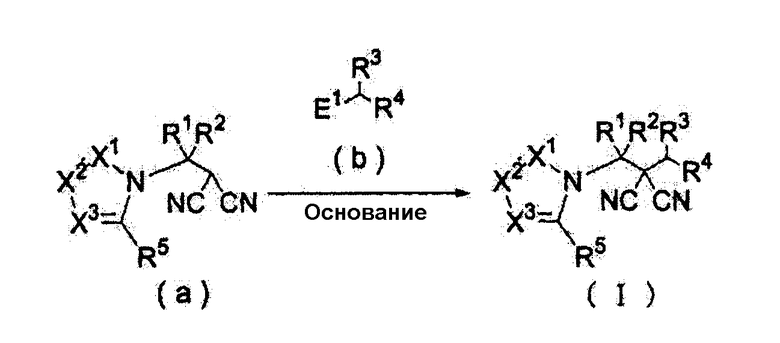
где в формулах
R1 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
R2 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, цианогруппа или атом водорода;
каждый из R3 и R4 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или, по меньшей мере, одной С1-С3-алкильной группой, С4-С5-циклоалкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода,
или R3 и R4 соединяются друг с другом в концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из Х1, Х2 и Х3 представляет собой атом азота или CR6;
каждый из R5 и R6 представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, меркаптогруппу, формильную группу, группу SF5, карбоксильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкенилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-алкинилоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, группу, обозначенную
NR10R11, группу, обозначенную С(=Х5)NR12NR13, группу, обозначенную (СН2)mQ, группу, обозначенную С(=NOR17)R18, или атом водород;
в случае, когда один из R5 и R6 или два R6 связаны с двумя атомами в соседних положениях, они могут быть связаны друг с другом в концевых положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С4-С6-алкендиильной группы. Причем в этом случае, по меньшей мере, одна метиленовая группа указанной алкандиильной группы или указанной алкендиильной группы может быть заменена на атом кислорода или атом серы или группу NR7;
R7 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
каждый из R10 и R11 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, (С1-С5-алкоксигруппа, необязательно замещенная, по меньшей мере, одним атомом галогена)-С1-С3-алкильную группу, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом водорода;
каждый из R12 и R13 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, группу, обозначенную (СН2)mQ, или атом водорода;
или R12 и R13 соединяются друг с другом в концевых своих положениях с образованием С2-С6-алкандиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена, или С2-С6-алкендиильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена;
каждый из R17 и R18 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, группу, обозначенную (СН2)mQ, или атом водорода;
Q представляет собой арильную группу, необязательно замещенную, по меньшей мере, одним R14;
каждый из R14 представляет собой С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6-циклоалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или, по меньшей мере, одной С1-С3-алкильной группой, С1-С5-алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкенилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С5-алкинилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или атом галогена;
m равно целому числу от 0 до 5;
Х5 представляет собой атом кислорода или атом серы;
Е1 представляет собой уходящую группу, такую как атом хлора, атом брома, атом йода, метансульфонильную группу, трифторметансульфонильную группу, толуолсульфонильную группу, метансульфонилоксигруппу, трифторметансульфонилоксигруппу и толуолсульфонилоксигруппу и тому подобное.
Реакцию обычно проводят в растворителе и в присутствии основания.
Растворитель, используемый для реакции, включает, например, амиды кислот, такие как N,N-диметилформамид и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, органические сернистые соединения, такие как диметилсульфоксид, сульфолан и тому подобное, галогенированные углеводороды, такие как 1,2-дихлорэтан, хлорбензол и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, и их смеси.
Используемые для реакции основания включают, например, неорганические основания, такие как гидрид натрия, карбонат натрия, карбонат калия и тому подобное, алкоксиды щелочных металлов, такие как трет-бутоксид калия и тому подобное, амиды щелочных металлов, такие как диизопропиламид лития и тому подобное, и органические основания, такие как 4-(диметиламино)пиридин, 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]-7-ундецен и тому подобное.
Количество основания, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (а).
Количество соединения (b), используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (а).
Температура реакции обычно находится в диапазоне от -20 до 100°С и время реакции обычно находится в диапазоне от 1 до 24 часов.
После завершения реакции соединение настоящего изобретения, представленное формулой (I), можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение настоящего изобретения, представленное формулой (I), можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(Способ получения 2)
Способ включает в себя взаимодействие соединения (с) и соединения (d)
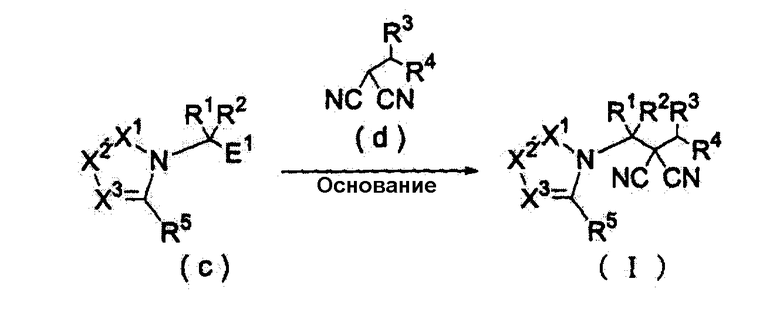
где в формулах E1, R1, R2, R3, R4, R5, X1, X2 и Х3 имеют такие же значения, как описаны выше.
Реакцию обычно проводят в растворителе и в присутствии основания.
Растворители, используемые для реакции, включают, например, амиды кислот, такие как N,N-диметилформамид и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, органические сернистые соединения, такие как диметилсульфоксид, сульфолан и тому подобное, галогенированные углеводороды, такие как 1,2-дихлорэтан, хлорбензол и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, и их смеси.
Используемые для реакции основания включают, например, неорганические основания, такие как гидрид натрия, карбонат натрия, карбонат калия и тому подобное, алкоксиды щелочных металлов, такие как трет-бутоксид калия и тому подобное, амиды щелочных металлов, такие как диизопропиламид лития и тому подобное, и органические основания, такие как 4-(диметиламино)пиридин, 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]-7-ундецен и тому подобное.
Количество основания, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (с).
Количество соединения (d), используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (с).
Температура реакции обычно находится в диапазоне от -20 до 100°С и время реакции обычно находится в диапазоне от 1 до 24 часов.
После завершения реакции соединение настоящего изобретения, представленное формулой (I), можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение настоящего изобретения, представленное формулой (I), можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
Затем будет описан способ получения промежуточного соединения в качестве ссылочного способа получения.
(Ссылочный способ получения 1)
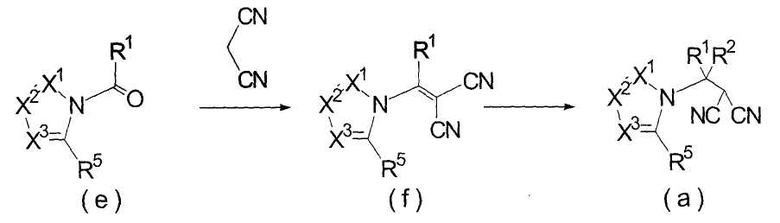
где в формулах R1, R2, R5, X1, X2 и Х3 имеют такие же значения, как описаны выше.
(Первая стадия)
Соединение (f) можно получить взаимодействием соединения (е) с малононитрилом.
Реакцию обычно проводят в растворителе. Растворители, используемые для реакции, включают, например, амиды кислот, такие как N,N-диметилформамид и тому подобное, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, галогенированные углеводороды, такие как хлороформ, 1,2-дихлорэтан, хлорбензол и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, спирты, такие как метанол, этанол, изопропанол и тому подобное, и их смеси.
Реакцию, если требуется, проводят в присутствии основания, и основания, используемые для реакции, включают, например, гидроксид тетрабутиламмония и тому подобное.
Количество основания, используемого для реакции, обычно составляет 0,01-0,5 моль на 1 моль соединения (е).
Количество малононитрила, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (е).
Температура реакции обычно находится в диапазоне от -20 до 100°С, и время реакции обычно находится в диапазоне от 1 до 24 часов.
Реакцию, если нужно, можно проводить вместе с удалением воды, образуемой при реакции, из реакционной системы.
После завершения реакции соединение (f) можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение (f) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(Вторая стадия)
(1) Случай, когда R2 представляет С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена.
Соединение (а) можно получить взаимодействием соединения (f) с металлорганическим соединением.
Взаимодействие обычно проводят в растворителе.
Растворитель, используемый в реакции, включает, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, и их смеси.
Металлорганические соединения, используемые для реакции, включают, например, органические соединения магния, такие как метилмагнийиодид, этилмагнийбромид, изопропилмагнийбромид, винилмагнийбромид, этинилмагнийбромид, диметилмагний и тому подобное, органические соединения лития, такие как метиллитий и тому подобное, органические соединения цинка, такие как диэтилцинк и тому подобное, и органическое соединение меди, такое как трифторметилмедь и тому подобное.
Количество металлорганического соединения, используемого для реакции, обычно составляет 1-10 моль на моль соединения (f).
Реакцию, если нужно, можно проводить в присутствии соли меди. Соли меди, используемые для реакции, включают, например, иодид меди(I), бромид меди(I) и тому подобное. Количество соли меди, используемой для реакции, обычно составляет 0,05-1 моль на 1 моль соединения (f).
Температура реакции обычно находится в диапазоне от -20 до 100°С, и время реакции обычно находится в диапазоне от 1 до 24 часов.
После завершения реакции соединение (а) можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение (а) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(2) Случай, когда R2 представляет собой атом водорода.
Соединение (а) можно получить превращением соединения (f) посредством восстановительной реакции.
Реакцию восстановления обычно проводят в растворителе.
Растворители, используемые для такой реакции, включают, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, спирты, такие как метанол, этанол, изопропанол и тому подобное, воду и их смеси.
Восстанавливающий агент, используемый для реакции, включает, например, борогидрид натрия.
Количество восстанавливающего агента, используемого для реакции, обычно составляет 0,25-2 моль на 1 моль соединения (f).
Температура реакции обычно находится в диапазоне 0-50°С, и время реакции обычно находится в диапазоне от мгновенного до 24 часов.
После завершения реакции соединение (а) можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение (а) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(3) Случай, когда R2 представляет собой цианогруппу.
Соединение (а) можно получить взаимодействием соединения (f) с цианидным соединением.
Реакцию обычно проводят в растворителе.
Растворители, используемые для реакции, включают, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, и их смеси.
Цианидные соединения, используемые для реакции, включают, например, цианид тетрабутиламмония.
Количество цианидного соединения, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (f).
Температура реакции обычно находится в диапазоне от -20 до 100°С, и время реакции обычно находится в диапазоне от 1 до 24 часов.
После завершения реакции соединение (а) можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение (а) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(Ссылочный пример получения 2)
Соединение (d) можно получить взаимодействием соединения (b) с малононитрилом.
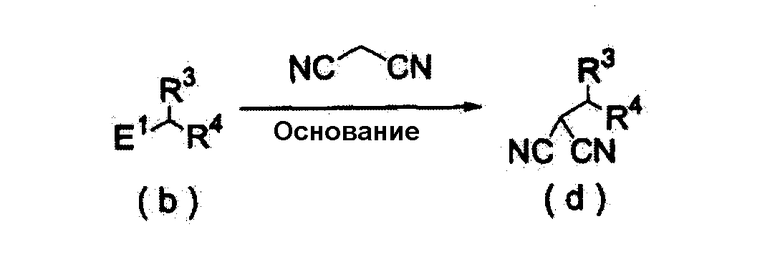
где в формулах Е1, R3 и R4 имеют такие же значения, как описаны выше.
Реакцию обычно проводят в растворителе и в присутствии основания.
Растворители, используемые для реакции, включают, например, амиды кислот, такие как N,N-диметилформамид и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, органические сернистые соединения, такие как диметилсульфоксид, сульфолан и тому подобное, галогенированные углеводороды, такие как 1,2-дихлорэтан, хлорбензол и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, и их смеси.
Используемые для реакции основания включают, например, неорганические основания, такие как гидрид натрия, карбонат натрия, карбонат калия и тому подобное, алкоксиды щелочных металлов, такие как трет-бутоксид калия и тому подобное, амиды щелочных металлов, такие как диизопропиламид лития и тому подобное, и органические основания, такие как диметиламинопиридин, 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]-7-ундецен и тому подобное.
Количество основания, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (b).
Количество малононитрила, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (b).
Температура реакции обычно находится в диапазоне от -20 до 100°С, и время реакции обычно находится в диапазоне от 1 до 24 часов.
После завершения реакции соединение (d) можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение (d) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(Ссылочный способ получения 3)
Соединение (d) можно получить следующим способом.
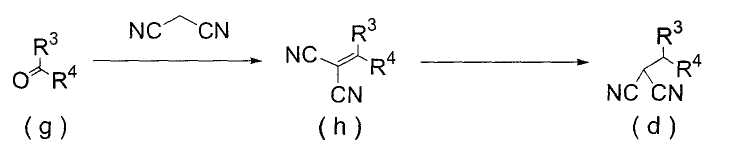
где в формулах R3 и R4 имеют такие же значения, как описаны выше.
(Первая стадия)
Соединение (h) можно получить взаимодействием соединения (g) с малононитрилом.
Реакцию обычно проводят в растворителе. Растворители, используемые для реакции, включают, например, амиды кислот, такие как N,N-диметилформамид и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, галогенированные углеводороды, такие как хлороформ, 1,2-дихлорэтан, хлорбензол и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, спирты, такие как метанол, этанол, изопропанол и тому подобное, и их смеси.
Реакцию, если требуется, проводят в присутствии основания. Основания, используемые для реакции, включают, например, гидроксид тетрабутиламмония и тому подобное.
Количество основания, используемого для реакции, обычно составляет 0,01-0,5 моль на 1 моль соединения (g).
Количество малононитрила, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (g).
Температура реакции обычно находится в диапазоне от -20 до 100°С, и время реакции обычно находится в диапазоне от 1 до 24 часов.
Реакцию, если нужно, можно проводить вместе с удалением из реакционной системы воды, образуемой при реакции.
После завершения реакции соединение (h) можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение (h) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(Вторая стадия)
Соединение (d) можно получить превращением соединения (h) посредством взаимодействия с восстанавливающим агентом.
Реакцию восстановления обычно проводят в растворителе.
Растворители, используемые для такой реакции, включают, например, спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и тому подобное, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и тому подобное, галогенированные углеводороды, такие как 1,2-дихлорэтан, хлорбензол и тому подобное, ароматические углеводороды, такие как толуол, ксилол и тому подобное, и их смеси.
Восстанавливающий агент, используемый для реакции, включает, например, борогидрид натрия, борогидрид лития, диизобутилалюминийгидрид и тому подобное.
Количество восстанавливающего агента, используемого для реакции, зависит от типа используемого для реакции восстанавливающего агента, обычно оно составляет 0,25-5 моль на 1 моль соединения (h).
Температура реакции обычно находится в диапазоне от -20 до 100°С, и время реакции обычно находится в диапазоне от 1 до 24 часов.
После завершения реакции соединение (d) можно выделить проведением последующей обработки реакционной смеси, такой как выливание реакционной смеси в воду, экстракция органическим растворителем с последующим концентрированием экстракта. Выделенное соединение (d) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(Ссылочный способ получения 4)
Соединение (с-1), у которого R2 представляет собой атом водорода в соединении (с), можно получить следующим способом.
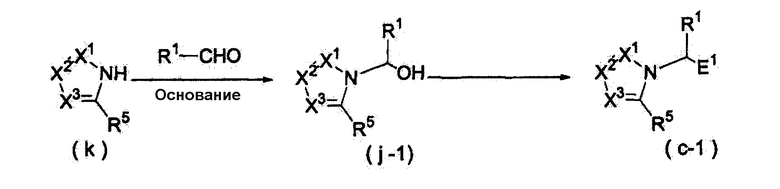
где в формулах Е1, R1, R5, X1, X2 и Х3 имеют такие же значения, как описаны выше.
(Первая стадия)
Соединение (j-1) можно получить взаимодействием соединения (k) с R1-CHO.
Реакцию проводят в присутствии или отсутствие растворителя. В случае, когда реакцию проводят в присутствии растворителя, растворители, которые применяют для реакции, включают, например, ароматические углеводороды, такие как толуол, бензол и тому подобное, галогенированные углеводороды, такие как хлорбензол и тому подобное, и их смеси.
Реакцию, если требуется, проводят в присутствии основания. В случае, когда реакцию проводят в присутствии основания, основания, используемые для реакции, включают, например, органические основания, такие как триэтиламин, этилдиизопропиламин и тому подобное, и количество основания, используемого для реакции, обычно составляет 0,5-5 моль на 1 моль соединения (k).
Количество R1-CHO, используемого для реакции, обычно составляет 1-10 моль на 1 моль соединения (k).
Температура реакции обычно находится в диапазоне 50-150°С, и время реакции обычно находится в диапазоне 1-24 часа.
После завершения реакции соединение (j-1) можно выделить проведением последующей обработки реакционной смеси, такой как добавление органического растворителя, в том числе ацетона, к реакционной смеси, если требуется, и фильтрование реакционной смеси, затем концентрирование фильтрата. Выделенное соединение (j-1) можно, если требуется, очищать хроматографией, перекристаллизацией и тому подобное.
(Вторая стадия)
Соединение (с-1) можно получить галогенированием соединения (j-1), например, взаимодействием соединения (j-1) с галогенирующим агентом, таким как тионилхлорид, оксихлорид фосфора и тому подобное; или сульфонильной этерификацией, такой как взаимодействие соединения (j-1) с ангидридом сульфоновой кислоты или сульфонилхлоридом, таким как ангидрид трифторметансульфоновой кислоты, метансульфонилхлорид, толуолсульфонилхлорид и тому подобное.
Среди соединений (с), (е), (k) и (j-1) соединение, у которого Х1, Х2 и Х3 представляют собой CR6, можно синтезировать согласно способу, описанному в Houben-Weyl, Methoden der Organischen Chemi, Hetarene I, Teil. 1, p. 556-779.
Среди соединений (с), (е), (k) и (j-1) соединение, у которого Х1 представляет собой атом азота и Х2 и Х3 представляют собой атомы азота, можно синтезировать согласно способу, описанному в Houben-Weyl, Methoden der Organischen Chemi, Hetarene III, Teil. 3, p. 399-710.
Среди соединений (с), (е), (k) и (j-1) соединение, у которого Х2 представляет собой атом азота и Х1 и Х3 представляют собой CR6, можно синтезировать согласно способу, описанному в Houben-Weyl, Methoden der Organischen Chemi, Hetarene III, Teil. 3, p. 1-192.
Среди соединений (с), (е), (k) и (j-1) соединение, у которого Х1 и Х2 представляют собой атомы азота и Х3 представляет собой CR6, можно синтезировать согласно способу, описанному в Houben-Weyl, Methoden der Organischen Chemi, Hetarene III, Teil. 4, p. 305-389.
Среди соединений (с), (е), (k) и (j-1) соединение, у которого Х1 и Х3 представляет собой атомы азота и Х2 представляет собой CR6, можно синтезировать согласно способу, описанному в Houben-Weyl, Methoden der Organischen Chemi, Hetarene III, Teil. 4, p. 479-586.
Среди соединений (с), (е), (k) и (j-1) соединение, у которого Х1, Х2 и Х3 представляют собой атомы азота, можно синтезировать согласно способу, описанному в Houben-Weyl, Methoden der Organischen Chemi, Hetarene I, Teil. 4, p. 664-777.
Вредители, в борьбе с которыми соединения настоящего изобретения обладают активностью, могут включать, например, членистоногих вредителей, таких как насекомые-вредители и клещи-вредители и тому подобное, и нематод-вредителей. Конкретные примеры их перечислены ниже:
Hemiptera (полужесткокрылые насекомые):
Delphacidae, такие как Laodelphax striatellus, Nilaparvata lugens, Sogatella furcifera и тому подобное,
Deltocephalidae, такие как Nephotettix cincticeps, Nephotettix virescens и тому подобное,
Aphididae, такие как Aphis gossypii, Myzus persicae и тому подобное,
Pentatomidae, такие как Nezara antennata, Riptortus clavetus, Eysarcoris lewisi, Eysarcoris parvus, Plautia stali, Halyomorpha mista и тому подобное,
Aleyrodidae, такие как Trialeurodes vaporariorum, Bemisia argentifolii и тому подобное,
Coccidae, такие как Aonidiella aurantii, Comstockaspis perniciosa, Unaspis citri, Ceroplastes rubens, Icerya purchasi и тому подобное,
Tingidae,
Psyllidae и тому подобное;
Lepidoptera (чешуекрылые насекомые):
Pyralidae, такие как Chilo suppressalis, Cnaphalocrocis medinalis, Notarcha derogata, Plodia interpunctella и тому подобное,
Noctuidae, такие как Spodoptera litura, Pseudaletia separata, Thoricoplusia spp., Heliothis spp., Helicoverpa spp. и тому подобное,
Pieridae, такие как Pieris rapae и тому подобное,
Tortricidae, такие как Adoxophyes spp., Grapholita molesta, Cydia pomonella и тому подобное,
Carposinidae, такие как Carposina niponensis и тому подобное,
Lyonetiidae, такие как Lyonetia spp. и тому подобное,
Lymantriidae, такие как Lymantria spp., Euproctis spp. и тому подобное,
Yponomeutidae, такие как Plutella xylostella и тому подобное,
Gelechiidae, такие как Pectinophora gossypiella и тому подобное,
Arctiidae, такие как Hyphantria cunea и тому подобное,
Tineidae, такие как Tinea translucens, Tineola bisselliella и тому подобное;
Diptera (двукрылые насекомые):
Calicidae, такие как Culex pipiens pallens, Culex tritaeniorhynchus, Culex quinquefasciatus и тому подобное,
Aedes spp., такие как Aedes aegypti, Aedes albopictus и тому подобное,
Anopheles spp., такие как Anopheles sinensis и тому подобное,
Chironomidae,
Muscidae, такие как Musca domestica, Muscina stabulans и тому подобное,
Calliphoridae,
Sarcophagidae,
Fanniidae,
Anthomyiidae, такие как Delia platura, Delia antiqua и тому подобное,
Tephritidae,
Drosophilidae,
Psychodidae,
Tabanidae,
Simuliidae,
Stomoxyidae,
Agromyzidae и тому подобное;
Coleoptera (жесткокрылые насекомые):
Diabrotica spp., такие как Diabrotica virgifera virgifera, Diabrotica undecimpunctata howardi и тому подобное,
Scarabaeidae, такие как Anomala cuprea, Anomala rufocuprea и тому подобное,
Curculionidae, такие как Sitophilus zeamais, Lissorhoptrus oryzophilus, Callosobruchuys chienensis и тому подобное,
Tenebrionidae, такие как Tenebrio molitor, Tribolium castaneum и тому подобное,
Chrysomelidae, такие как Oulema oryzae, Aulacophora femoralis, Phyllotreta striolata, Leptinotarsa decemlineata и тому подобное,
Anobiidae,
Epilachna spp., такие как Epilachna vigintioctopunctata и тому подобное,
Lyctidae,
Bostrychidae,
Cerambycidae,
Paederus fuscipes;
Blattodea (таракановые насекомые):
Blattella germanica, Periplaneta fuliginosa, Periplaneta americana, Periplaneta brunnea, Blatta orientalis и тому подобное;
Thysanoptera (пузыреногие насекомые):
Thripspalmi, Thrips tabaci, Frankliniella occidentalis, Frankliniella intonsa и тому подобное;
Hymenoptera (перепончатокрылые насекомые):
Formicidae, Vespidae, bethylid wasp, Tenthredinidae, такие как Athalia japonica и тому подобное;
Orthoptera (прямокрылые насекомые):
Gryllotalpidae, Acrididae и тому подобное;
Aphaniptera:
Ctenocephalides felis, Ctenocephalides canis, Pulex irritans, Xenopsylla cheopis и тому подобное;
Anoplura (вши):
Pediculus humanus corporis, Phthirus pubis, Haematopinus eurysternus, Dalmalinia ovis и тому подобное;
Isoptera (термиты):
Reticulitermes speratus, Coptotermes formosanus и тому подобное;
Acarina (клещи):
Tetranychidae, такие как Tetranychus urtlcae, Tetranychus kanzawai, Panonychus citri, Panonychus ulmi, Oligonychus spp. и тому подобное,
Eriophyidae, такие как Aculops pelekassi, Aculus schlechtendali и тому подобное,
Tarsonemidae, такие как Polyphagotarsonemus latus и тому подобное,
Tenuipalpidae,
Tuckerellidae,
Ixodidae, такие как Haemaphysalis longicornis, Haemaphysalis flava, Dermacentor taiwanicus, Ixodes ovatus, Ixodes persulcatus, Boophilus microplus и тому подобное,
Acaridae, такие как Tyrophagus putrescentiae и тому подобное,
Epidermoptidae, такие как Dermatophagoides farinae, Dermatophagoides ptrenyssnus и тому подобное,
Cheyletidae, такие Cheyletus eruditus, Cheyletus malaccensis, Cheyletus moorei и тому подобное,
Dermanyssidae;
Araneae (пауки):
Chiracanthium japonicum, Latrodectus hasseltii и тому подобное;
Chilopoda (губоногие насекомые):
Thereuonema hilgendorfi, Scolopendra subspinipes и тому подобное;
Diplopoda (двупароногие):
Oxidus gracilis, Nedyopus tambanus и тому подобное;
Isopoda:
Armadillidium vulgare и тому подобное;
Gastropoda (брюхоногие моллюски):
Limax marginatus, Limax flavus и тому подобное;
Nematoda (нематоды):
Pratylenchus coffeae, Pratylenchus fallax, Heterodera glycines, Globodera rostochiensis, Meloidogyne hapla, Meloidogyne incognita и тому подобное.
Пестицидная композиция настоящего изобретения содержит эффективное количество соединения настоящего изобретения и инертный носитель. Обычно она является препаратом, полученным смешиванием соединения настоящего изобретения и носителя, такого как твердый носитель, жидкий носитель и/или газообразный носитель, и, если необходимо, добавлением поверхностно-активного вещества и другой добавки для препарата. Препарат включает, например, эмульгируемый концентрат, масляный раствор, препарат в виде шампуня, сыпучий порошок, дуст, смачиваемый порошок, гранулы, препарат в виде пасты, микрокапсулы, пену, аэрозоль, препарат с газообразным диоксидом углерода, таблетки и препарат в смоле. Эти препараты можно превратить для применения в отравленную приманку, противомоскитную спираль, электрический противомоскитный мат, агент для окуривания, фумигант или покрытие.
В пестицидной композиции настоящего изобретения соединение настоящего изобретения обычно содержится в количестве 0,1-95 мас.%.
Твердые носители для препарата включают, например, тонкоизмельченный порошок или гранулы глины (например, каолина, диатомита, бентонита, глины Fubasami, кислотной глины и т.д.), синтетический гидратированный оксид кремния, тальк, керамику, другие неорганические материалы (например, серицит, кварц, серу, активированный уголь, карбонат кальция, гидратированный диоксид кремния) или химические удобрения (например, сульфат аммония, фосфат аммония, нитрат аммония, хлорид аммония, мочевину).
Жидкие носители для препарата включают, например, ароматические или алифатические углеводороды (например, ксилол, толуол, алкилнафталин, фенилксилилэтан, керосин, легкое масло, гексан, циклогексан), галогенированные углеводороды (например, хлорбензол, дихлорметан, дихлорэтан, трихлорэтан), спирты (например, метанол, этанол, изопропиловый спирт, бутанол, гексанол, этиленгликоль), простые эфиры (например, диэтиловый эфир, диметиловый эфир этиленгликоля, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монометиловый эфир пропиленгликоля, тетрагидрофуран, диоксан), сложные эфиры (например, этилацетат, бутилацетат), кетоны (например, ацетон, метилэтилкетон, метилизобутилкетон, циклогексанон), нитрилы (например, ацетонитрил, изобутиронитрил), сульфоксиды (например, диметилсульфоксид), амиды кислот (например, N,N-диметилформамид, N,N-диметилацетамид), растительные масла (например, соевое масло, хлопковое масло), растительные эфирные масла (например, апельсиновое масло, масло иссопа, лимонное масло) и воду.
Газообразные носители для препарата включают, например, газообразный бутан, хлорфторуглероды, сжиженный нефтяной газ (LPG), диметиловый эфир, диоксид углерода и тому подобное.
Поверхностно-активные вещества включают, например, алкилсульфатные соли, соли алкилсульфоновых кислот, соли алкиларилсульфоновых кислот, алкилариловые простые эфиры и их полиоксиэтиленпроизводные, простые эфиры полиэтиленгликолей, сложные эфиры многоатомных спиртов и производные спиртов ряда сахаров.
Другие добавки для препарата включают в себя связывающие вещества, диспергаторы, стабилизаторы и тому подобное, в частности, например, казеин, желатин, полисахариды (например, крахмал, аравийскую камедь, производные целлюлозы, альгиновую кислоту), производные лигнина, бентонит, сахара, синтетические водорастворимые полимеры (например, поливиниловый спирт, поливинилпирролидон, полиакриловую кислоту), РАР (кислый изопропилфосфат), ВНТ (2,6-ди-трет-бутил-4-метилфенол), ВНА (смесь 2-трет-бутил-4-метоксифенола и 3-трет-бутил-4-метоксифенола), растительные масла, минеральные масла, жирные кислоты и эфиры жирных кислот.
Основы для препарата в смоле включают, например, сополимер на основе поливинилхлорида, полиуретан и тому подобное. К этим основам, если необходимо, можно добавить пластификатор, такой как фталаты (например, диметилфталат, диоктилфталат), адипаты и стеараты. Препарат в смоле можно получить замешиванием такого соединения в основу с применением известной замесочной машины и затем формованием литьевым формованием, экструзией, прессованием и тому подобное, и, кроме того, если необходимо, посредством способа формования, резки и тому подобное, препарат в смоле можно превратить в такую форму препарата в смоле, как панель, пленка, лента, сетка, шнур и тому подобное. Эти препараты в смоле можно превратить, например, в ошейник или хомут для животных, ушные бирки для животных, препарат в виде листа, шнур для приманивания, подпорки для садоводства.
Основы для отравленной приманки включают, например, муку хлебных злаков, растительные масла, сахара и кристаллическую целлюлозу, и, кроме того, если необходимо, к основе могут быть добавлены антиоксиданты, такие как дибутилгидрокситолуол и нордигидрогвайаретовая кислота, консерванты, такие как дегидроуксусная кислота, агенты для предотвращения поедания приманки детьми и домашними питомцами, такие как порошок перца жгучего, и приманивающие насекомых ароматические добавки, такие как добавка сырного запаха, добавка лукового запаха и арахисовое масло.
С вредителями можно бороться посредством нанесения эффективного количества соединения настоящего изобретения непосредственно на вредителей и/или места обитания вредителей (например, растения, животное, почву). Препарат пестицидной композиции настоящего изобретения обычно применяют в качестве способа борьбы с вредителями в соответствии с настоящим изобретением.
Когда пестицидную композицию настоящего изобретения применяют для борьбы с вредителями в сельском хозяйстве и лесоводстве, наносимое количество обычно составляет 1-10000 г/га, предпочтительно 10-1000 г/га в качестве активного ингредиента. Препараты в виде эмульгируемых концентратов, смачиваемых порошков, текучих составов и микрокапсул обычно наносят после разбавления водой, чтобы иметь концентрацию активного ингредиента 1-10000 м.д., тогда как дусты и гранулы обычно наносят как таковые. Эти препараты можно распылять непосредственно на растение, которое защищают от вредителей. С вредителями, живущими в почве, можно бороться обработкой почвы этими препаратами, и препараты можно также применять для обработки грядок перед посадкой растений или для обработки посадочных лунок или нижней части растений при посадке. Кроме того, препарат в виде листов пестицидной композиции настоящего изобретения можно применять таким способом, как обертывание их вокруг растений, растягивание вблизи растений и покрытие поверхности почвы у нижней части растений.
Когда пестицидную композицию настоящего изобретения применяют в период эпидемии, применяемое количество обычно составляет 0,001-10 мг/м3 в качестве активного ингредиента в случае применения для открытого пространства и 0,001-100 мг/м2 в качестве активного ингредиента в случае нанесения на поверхность растений. Препараты в виде эмульгируемых концентратов, смачиваемых порошков, текучих составов и микрокапсул обычно наносят после разбавления водой, чтобы иметь концентрацию активного ингредиента 0,01-10000 м.д., тогда как масляные растворы, аэрозоли, агенты для окуривания и отравленные приманки применяют как таковые.
Когда пестицидную композицию настоящего изобретения применяют для борьбы с паразитами, живущими на наружной стороне домашнего скота, такого как корова, лошадь, свинья, овца, коза и цыпленок, и небольшого животного, такого как собака, кошка, крыса и мышь, пестицидную композицию можно наносить на указанное животное методом, известным в ветеринарии. В частности, для системной борьбы пестицидную композицию вводят посредством, например, таблетки, смеси с кормом, суппозитория или инъекции (например, внутримышечной, подкожной, внутривенной, внутрибрюшинной) и для несистемной борьбы ее применяют таким способом, как разбрызгивание масляного раствора или водного жидкого препарата, проведение обработки наливкой или обработки пятнами, мытье указанного животного препаратом в виде шампуня, прикрепление препарата в смоле к указанному животному в виде ошейника или хомута или ушной бирки и тому подобное. Когда соединение настоящего изобретения вводят животному, его количество обычно находится в диапазоне 0,1-1000 мг/кг массы тела животного.
Пестицидную композицию настоящего изобретения можно также применять в смеси или в комбинации с другими инсектицидами, нематоцидами, акарицидами, фунгицидами, гербицидами, регуляторами роста растений, синергистами, удобрениями, структурообразователями, кормами для животных и тому подобное.
Активные ингредиенты такого другого инсектицида и акарицида включают, например, пиретроидные соединения, такие как аллетрин, тетраметрин, праллетрин, фенотрин, резметрин, цифенотрин, перметрин, циперметрин, альфа-циперметрин, зета-циперметрин, делтаметрин, тралометрин, цифлутрин, бета-цифлутрин, цигалотрин, лямбда-цигалотрин, флуметрин, имипротрин, этофенпрокс, фенвалерат, эсфенвалерат, фенпропатрин, силафлуофен, бифентрин, трансфлутрин, флуцитринат, тау-флувалинат, акринатрин и тефлутрин; фосфорорганические соединения, такие как дихлофос, фенитротион, цианофос, профенофос, сулпрофос, фентоат, изоксатион, тетрахлорвинфос, фентион, хлорпирифос, диазинон, ацефат, тербуфос, форат, хлорэтоксифос, фостиазат, этопрофос, кадузафос и метидатион; карбаматные соединения, такие как пропоксур, карбарил, метоксадиазон, фенобукарб, метомил, тиодикарб, аланикарб, бенфукарб, оксамил, алдикарб и метиокарб; производные бензоилфенилмочевины, такие как луфенурон, хлорфлуазурон, гексафлумурон, дифлубензурон, трифлумурон, тефлубензурон, флуфеноксурон, флуазурон, новалурон и триазурон; подобные ювенильным гормонам вещества, такие как пирипроксифен, метопрен, гидропрен и феноксикарб; неоникотиноидные соединения, такие как ацетамиприд, нитенпирам, тиаклоприд, тиаметоксам и динотефуран; производные N-фенилгидразина, такие как ацетопрол и этипрол; производные бензоилгидразина, такие как тебуфенозид, хромафенозид, метоксифенозид и галофенозид; диафентиурон; пимерозин; флоникамид; триазамат; бупрофезин; спинозад; эмамектина бензоат; хлорфенаприл; индоксакарб МР; пиридалил; циромазин; фенпироксимат; тебуфенпирад; толфенпирад; пиридабен; пиримидифен; флуакрипирим; этоксазол; феназахин; ацехиноцил; гекситиазокс; клофентезин; фенбутатина оксид; дикофол, пропаргит; абамектин; милбемектин; амитраз; картап; бенсултап; тиоциклам; эндосулфан; спиродиклофен; спиромезифен и азадирахтин.
Активные ингредиенты такого другого фунгицида включают, например, стробилуриновые соединения, такие как азоксистробин; фосфорорганические соединения, такие как толклофос-метил; производные азола, такие как трифлумизол, перфуразоат и дифеноконазол; фталид; флутоланил; валидамицин; пробеназол; дикломезин; пенцикурон; дазомет, канзугамицин; IBP; пироквилон; оксолиновую кислоту, трициклазол; феримзон; мепронил; EDDP; изопротиолан; карпропамин; диклоцимет; фураметрип; флудиоксонил; процимидон и диэтофенкарб.
ПРИМЕРЫ
Настоящее изобретение описывается более подробно включением в описание примеров получения, примеров препаратов, примеров испытаний и тому подобное, которые не должны рассматриваться как ограничение изобретения.
Настоящее изобретение иллюстрируется следующими примерами получения соединений настоящего изобретения.
Пример получения 1
0,76 г Гидрохлорида 1-(хлорметил)-1Н-пиразола и 0,81 г (3,3,3-трифторпропил)малононитрила растворяют в 10 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,38 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 5 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют простым метил-трет-бутиловым эфиром (может далее обозначаться МТВЕ). Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-этилацетат, получая при этом 0,36 г (1Н-пиразол-1-илметил)(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (1) настоящего изобретения), формула которого показана ниже.
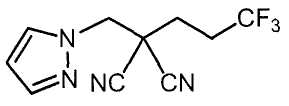
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,21-2,27 (2Н, м), 2,47-2,59 (2Н, м), 4,76 (2Н, с), 6,42 (1Н, т), 7,63-7,64 (2Н, м).
Пример получения 2
0,77 г Гидрохлорида 3-изопропил-1-(хлорметил)-1Н-пиразола и 0,64 г (3,3,3-трифторпропил)малононитрила растворяют в 8 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,54 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле и затем перекристаллизовывают из смеси гексан-этилацетат, получая при этом 0,42 г [(3-изопропил-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (2) настоящего изобретения), формула которого показана ниже.
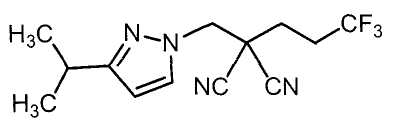
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,24 (6Н, д), 2,20-2,24 (2Н, м), 2,47-2,58 (2Н, м), 2,93-3,00, (1Н, м), 4,34 (2Н, с), 6,20 (1Н, д), 7,50 (1Н, д).
Пример получения 3
1,16 г Гидрохлорида 3-трет-бутил-1-(хлорметил)-1Н-пиразола и 0,98 г (3,3,3-трифторпропил)малононитрила растворяют в 17 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,54 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,63 г [(3-трет-бутил-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (3) настоящего изобретения), формула которого показана ниже.
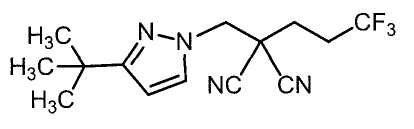
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,28 (9Н, с), 2,19-2,24 (2Н, м), 2,48-2,57 (2Н, м), 4,64 (2Н, с), 6,23 (1Н, д), 7,49 (1Н, д).
Пример получения 4
1,24 г Гидрохлорида 3-трет-бутил-1-(хлорметил)-1Н-пиразола и 0,63 г аллилмалононитрила растворяют в 18 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,63 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,38 г аллил-[(3-трет-бутил-1Н-пиразол-1-ил)метил]малононитрила (обозначаемого далее соединением (4) настоящего изобретения), формула которого показана ниже.

1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,30 (9Н, с), 2,69 (2Н, дд), 4,58 (2Н, с), 5,45-5,51 (2Н, м), 5,88-5,99 (1Н, м), 6,21 (1Н, д), 7,48 (1Н, д).
Пример получения 5
0,58 г Гидрохлорида 2-(хлорметил)-6,6-диметил-2,4,5,6-тетрагидроциклопента[c]пиразола и 0,43 г (3,3,3-трифторпропил)малононитрила растворяют в 8 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 0,73 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,27 г [(6,6-диметил-5,6-дигидроциклопента[c]пиразол-2(4Н)-ил)этил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (5) настоящего изобретения), формула которого показана ниже.
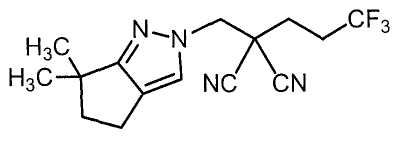
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,24 (6Н, с), 2,15-2,23 (4Н, м), 2,42-2,65 (4Н, м), 5,97 (2Н, с), 7,15 (1Н, с).
Пример получения 6
1,44 г 1-(Хлорметил)-3-(трифторметил)-1Н-пиразола и 1,30 г (3,3,3-трифторпропил)малононитрила растворяют в 16 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,21 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают перекристаллизации из смеси гексан-этилацетат, получая при этом 0,87 г {[3-(трифторметил)-1Н-пиразол-1-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (6) настоящего изобретения), формула которого показана ниже.
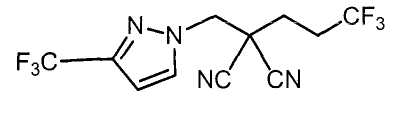
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,25-2,29 (2Н, м), 2,50-2,61 (2Н, м), 4,75 (2Н, с), 6,70 (1Н, с), 7,72 (1Н, с).
Пример получения 7
1,33 г 1-(Хлорметил)-3-(трифторметил)-1Н-пиразола и 0,76 г аллилмалононитрила растворяют в 21 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,99 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-этилацетат, получая при этом 0,57 г аллил-{[3-(трифторметил)-1Н-пиразол-1-ил]метил}малононитрила (обозначаемого далее соединением (7) настоящего изобретения), формула которого показана ниже.
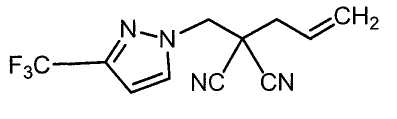
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,74 (2Н, д), 4,69 (2Н, с), 5,49-5,54 (2Н, м), 5,87-5,98 (1Н, м), 6,67 (1Н, с), 7,71 (1Н, с).
Пример получения 8
1,57 г Гидрохлорида 1-хлорметил-3-формилпиразола и 1,52 г (3,3,3-трифторпропил)малононитрила растворяют в 30 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,76 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 5 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,05 г [(3-формил-1Н-пиразол-1-ил]метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (8) настоящего изобретения), формула которого показана ниже.
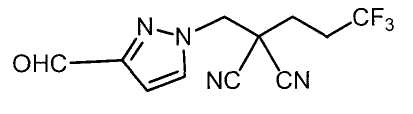
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,28-2,34 (2Н, м), 2,52-2,63 (2Н, м), 4,77 (2Н, с), 6,93 (1Н, с), 7,70 (1Н, с), 9,99 (1Н, с).
Пример получения 9
1,00 г 1-(Хлорметил)-3-циано-1Н-пиразола и 1,15 г (3,3,3-трифторпропил)малононитрила растворяют в 21 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,96 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 5 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,11 г [(3-циано-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (9) настоящего изобретения), формула которого показана ниже.
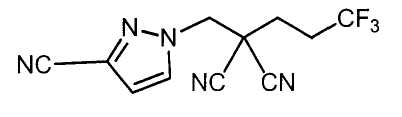
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,23-2,27 (2Н, м), 2,49-2,60 (2Н, м), 4,75 (2Н, с), 7,60 (1Н, с), 7,66 (1Н, с).
Пример получения 10
2,01 г Гидрохлорида 1-(хлорметил)-3-фенил-1Н-пиразола и 1,42 г (3,3,3-трифторпропил)малононитрила растворяют в 27 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,43 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,66 г [(3-фенил-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (10) настоящего изобретения), формула которого показана ниже.
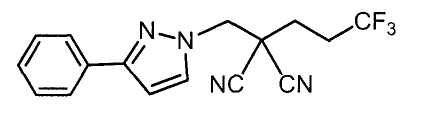
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,33-2,37 (2Н, м), 2,53-2,62 (2Н, м), 4,73 (2Н, с), 6,70 (1Н, д), 7,33-7,44 (3Н, м), 7,64 (1Н, д), 7,87-7,80 (2Н, м).
Пример получения 11
1,38 г Гидрохлорида 4-бром-3-изопропил-1-(хлорметил)-1Н-пиразола и 0,81 г (3,3,3-трифторпропил)малононитрила растворяют в 15 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,38 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,91 г [(4-бром-3-изопропил-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (11) настоящего изобретения), формула которого показана ниже.
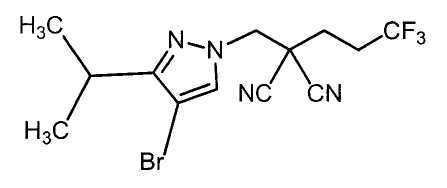
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,25 (6Н, д), 2,20-2,29 (2Н, м), 2,51-2,58 (2Н, м), 3,00-3,06 (1Н, м), 4,60 (2Н, с), 7,56 (1Н, с).
Пример получения 12
1,85 г Гидрохлорида 4-бром-3-трет-бутил-1-(хлорметил)-1Н-пиразола и 1,18 г (3,3,3-трифторпропил)малононитрила растворяют в 21 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,02 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,91 г [(4-бром-3-трет-бутил-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (12) настоящего изобретения), формула которого показана ниже.
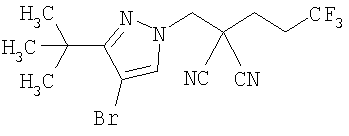
1H-ЯМР (СDСl3, ТМС, δ (м.д.)): 1,38 (9Н, с), 2,20-2,23 (2Н, м), 2,49-2,61 (2Н, м), 4,57 (2Н, с), 7,57 (1Н, с).
Пример получения 13
0,98 г Гидрохлорида 4-хлор-3-трет-бутил-(1-хлорметил)-1Н-пиразола и 0,65 г (3,3,3-трифторпропил)малононитрила растворяют в 12 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,11 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,40 г [(4-хлор-3-трет-бутил-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (13) настоящего изобретения), формула которого показана ниже.
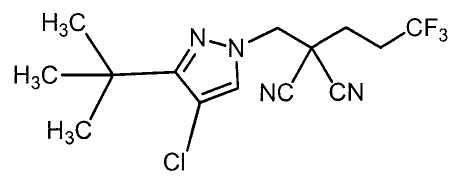
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,36 (9Н, с), 2,20-2,24 (2Н, м), 2,49-2,61 (2Н, м), 4,56 (2Н, с), 7,54 (1Н, с).
Пример получения 14
1,84 г Гидрохлорида 4-бром-3-трет-бутил-1-(хлорметил)-1Н-пиразола и 0,77 г аллилмалононитрила растворяют в 21 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,02 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,84 г аллил-[(4-бром-3-трет-бутил-1Н-пиразол-1-ил)метил]малононитрила (обозначаемого далее соединением (14) настоящего изобретения), формула которого показана ниже.
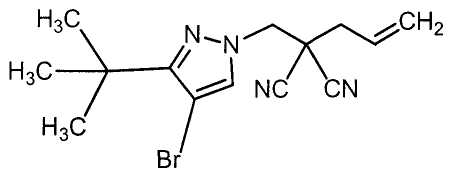
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,40 (9Н, с), 2,71 (2Н, д), 4,51 (2Н, с), 5,43-5,52 (2Н, м), 5,87-5,98 (1Н, м), 7,56 (1Н, с).
Пример получения 15
1,67 г 4-Бром-1-(хлорметил)-3-трифторметил-1Н-пиразола и 1,03 г (3,3,3-трифторпропил)малононитрила растворяют в 18 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,74 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,97 г аллил-[(4-бром-3-трифторметил-1Н-пиразол-1-ил)метил]-(3,3,3-трифторметил)малононитрила (обозначаемого далее соединением (15) настоящего изобретения), формула которого показана ниже.
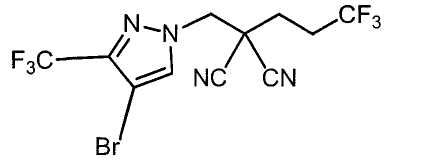
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,25-2,30 (2Н, м), 2,49-2,62 (2Н, м), 4,70 (2Н, с), 7,77 (1Н, с).
Пример получения 16
1,67 г 4-Бром-1-(хлорметил)-3-(трифторметил)-1Н-пиразола и 0,67 г аллилмалононитрила растворяют в 18 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,74 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,90 г аллил-{[4-бром-(3-трифторметил)-1Н-пиразол-1-ил]метил}малононитрила (обозначаемого далее соединением (16) настоящего изобретения), формула которого показана ниже.

1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,75 (2Н, д), 4,63 (2Н, с), 5,50-5,55 (2Н, м), 5,86-5,97 (1Н, м), 7,76 (1Н, с).
Пример получения 17
0,93 г Гидрохлорида 1-(хлорметил)-3,5-диметил-1Н-пиразола и 0,81 г (3,3,3-трифторпропил)малононитрила растворяют в 15 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,38 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 4 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,45 г соединения (обозначаемого далее соединением (17) настоящего изобретения), формула которого показана ниже.
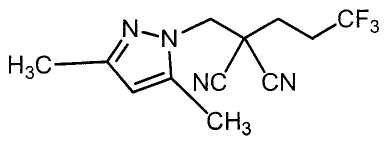
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,23 (3Н, с), 2,37 (3Н, с), 2,41-2,61 (4Н, м), 4,52 (2Н, с), 5,91 (1Н, с).
Пример получения 18
1,46 г Гидрохлорида 1-(хлорметил)-4-метил-1Н-пиразола и 1,42 г (3,3,3-трифторпропил)малононитрила растворяют в 30 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,40 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,83 г соединения (обозначаемого далее соединением (18) настоящего изобретения), формула которого показана ниже.
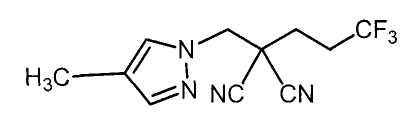
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,11 (3Н, с), 2,20-2,24 (2Н, м), 2,46-2,58 (2Н, м), 4,64 (2Н, с), 7,38 (1Н, с), 7,42 (Н, с).
Пример получения 19
1,44 г Гидрохлорида 4-хлор-1-(хлорметил)-1Н-пиразола и 1,56 г (3,3,3-трифторпропил)малононитрила растворяют в 30 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,76 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,73 г [(4-хлор-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (19) настоящего изобретения), формула которого показана ниже.
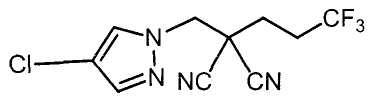
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,17-2,31 (2Н, м), 2,46-2,60 (2Н, м), 4,64 (2Н, с), 7,57 (1Н, с), 7,63 (1Н, с).
Пример получения 20
1,43 г Гидрохлорида 4-хлор-1-(хлорметил)-1Н-пиразола и 1,01 г аллилмалононитрила растворяют в 30 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,76 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,22 г аллил-[(4-хлор-1Н-пиразол-1-ил)метил]малононитрила (обозначаемого далее соединением (20) настоящего изобретения), формула которого показана ниже.
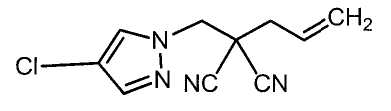
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,72 (2Н, д), 4,58 (2Н, с), 5,46-5,52 (2Н, м), 5,87-5,98 (1Н, м), 7,57 (1Н, с), 7,63 (1Н, с).
Пример получения 21
3,27 г Гидрохлорида 4-бром-1-(хлорметил)-1Н-пиразола и 2,29 г (3,3,3-трифторпропил)малононитрила растворяют в 28 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 3,89 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 3,28 г [(4-бром-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (21) настоящего изобретения), формула которого показана ниже.
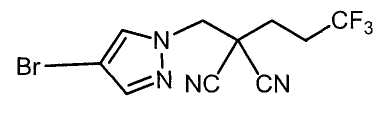
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,17-2,27 (2Н, м), 4,48-2,60 (2Н, м), 4,66 (2Н, с), 7,60 (1Н, с), 7,65 (1Н, с).
Пример получения 22
0,60 г 1-(Хлорметил)-4-(трифторметил)-1Н-пиразола и 0,54 г (3,3,3-трифторпропил)малононитрила растворяют в 10 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 0,99 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле и затем перекристаллизовывают из смеси гексан-хлороформ, получая при этом 0,19 г {[4-(трифторметил)-1Н-пиразол-1-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (22) настоящего изобретения), формула которого показана ниже.
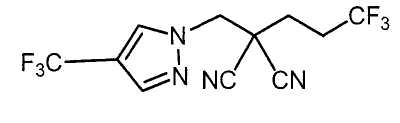
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,28-2,32 (2Н, м), 2,53-2,57 (2Н, м), 4,71 (2Н, с), 7,85 (1Н, с), 7,93 (1Н, с).
Пример получения 23
0,80 г 1-(Хлорметил)-4-метоксикарбонил-1Н-пиразола и 0,75 г (3,3,3-трифторпропил)малононитрила растворяют в 15 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,27 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле и затем перекристаллизовывают из смеси гексан-хлороформ, получая при этом 0,48 г [{4-(метоксикарбонил)-1Н-пиразол-1-ил}метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (23) настоящего изобретения), формула которого показана ниже.
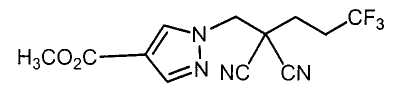
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,27-2,32 (2Н, м), 2,47-2,62 (2Н, м), 3,86 (3Н, с), 4,71 (2Н, с), 8,03 (1Н, с), 8,12 (1Н, с).
Пример получения 24
0,79 г 1-(Хлорметил)-4-метоксикарбонил-1Н-пиразола и 0,49 г аллилмалононитрила растворяют в 15 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,26 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле и затем перекристаллизовывают из смеси гексан-хлороформ, получая при этом 0,50 г аллил-[{4-(метоксикарбонил)-1Н-пиразол-1-ил}метил]малононитрила (обозначаемого далее соединением (24) настоящего изобретения), формула которого показана ниже.
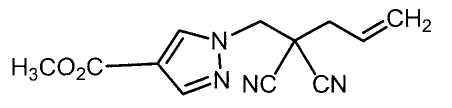
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,76 (2Н, д), 3,85 (3Н, с), 4,64 (2Н, с), 5,47-5,54 (2Н, м), 5,85-5,99 (1Н, м), 8,02 (1Н, с), 8,11 (1Н, с).
Пример получения 25
1,13 г 1-(Хлорметил)-3-(трифторметил)-4-этоксикарбонил-1Н-пиразола и 0,71 г (3,3,3-трифторпропил)малононитрила растворяют в 13 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,22 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,30 г {[4-этоксикарбонил-3-(трифторметил)пиразол-1Н-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (25) настоящего изобретения), формула которого показана ниже.
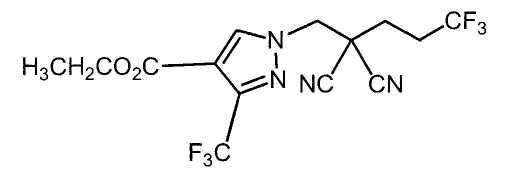
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,37 (3Н, т), 2,30-2,34 (2Н, м), 2,52-2,63 (2Н, м), 4,35 (2Н, кв.), 4,73 (2Н, с), 8,24 (1Н, с).
Пример получения 26
1,25 г 1-(Хлорметил)-3-(трифторметил)-4-этоксикарбонил-1Н-пиразола и 0,52 г аллилмалононитрила растворяют в 15 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,35 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле и затем перекристаллизовывают из гексана, получая при этом 0,14 г аллил-{[4-этоксикарбонил-3-(трифторметил)пиразол-1Н-ил]метил}малононитрила (обозначаемого далее соединением (26) настоящего изобретения), формула которого показана ниже.
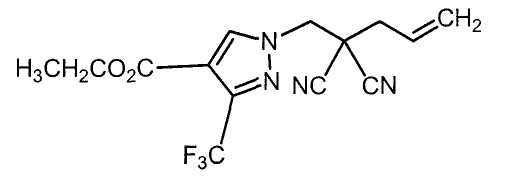
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,36 (3Н, т), 2,80 (2Н, д), 4,30 (2Н, кв.), 4,68 (2Н, с), 5,46-5,56 (2Н, м), 5,88-5,98 (1Н, м), 8,24 (1Н, с).
Пример получения 27
0,77 г Гидрохлорида 1-(хлорметил)-1Н-1,2,4-триазола и 0,81 г (3,3,3-трифторпропил)малононитрила растворяют в 15 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,38 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 7 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают, получая при этом 0,42 г [(1Н-1,2,4-триазол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (27) настоящего изобретения), формула которого показана ниже.
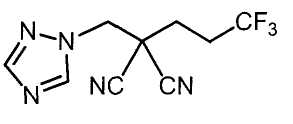
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,31-2,37 (2Н, м), 2,52-2,63 (2Н, м), 4,77 (2Н, с), 8,09 (1Н, с), 8,33 (1Н, с).
Пример получения 28
0,78 г Гидрохлорида 3-изопропил-1-(хлорметил)-1Н-1,2,4-триазола и 0,65 г (3,3,3-трифторпропил)малононитрила растворяют в 12 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,10 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-МТВЕ, получая при этом 0,31 г [(3-изопропил-1Н-1,2,4-триазол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (28) настоящего изобретения), формула которого показана ниже.
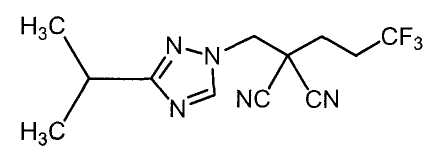
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,32 (6Н, д), 2,31-2,35 (2Н, м), 2,45-2,63 (2Н, м), 3,06-3,13 (1Н, м), 4,68 (2Н, с), 8,19 (1Н, с).
Пример получения 29
1,61 г Гидрохлорида 3-трет-бутил-1-(хлорметил)-1Н-1,2,4-триазола и 1,24 г (3,3,3-трифторпропил)малононитрила растворяют в 22 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,13 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 4 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-МТВЕ, получая при этом 0,77 г [(3-трет-бутил-1Н-1,2,4-триазол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (29) настоящего изобретения), формула которого показана ниже.
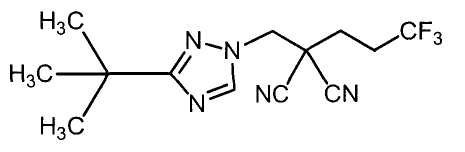
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,37 (9Н, с), 2,31-2,34 (2Н, м), 2,51-2,63 (2Н, м), 4,67 (2Н, с), 8,18 (1Н, с).
Пример получения 30
0,98 г Гидрохлорида 3-(1,1-диметилпропил)-1-(хлорметил)-1Н-1,2,4-триазола и 0,65 г (3,3,3-трифторпропил)малононитрила растворяют в 12 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,11 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-МТВЕ, получая при этом 0,29 г {[3-(1,1-диметилпропил)-1Н-1,2,4-триазол-1-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (30) настоящего изобретения), формула которого показана ниже.
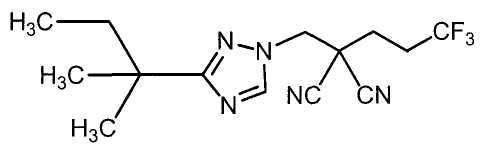
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 0,72 (3Н, т), 1,33 (6Н, с), 1,69 (2Н, кв), 2,31-2,35 (2Н, м), 2,51-2,63 (2Н, м), 4,68 (2Н, с), 8,19 (1Н, с).
Пример получения 31
1,28 г Гидрохлорида 1-(хлорметил)-3-трет-бутил-1Н-1,2,4-триазола и 0,77 г аллилмалононитрила растворяют в 21 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 1,01 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 4 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-МТВЕ, получая при этом 0,16 г аллил-[(3-трет-бутил-1Н-1,2,4-триазол-1-ил)метил]малононитрила (обозначаемого далее соединением (31) настоящего изобретения), формула которого показана ниже.
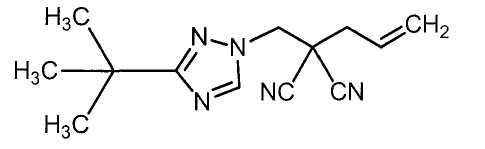
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,38 (9Н, с), 2,79 (2Н, д), 4,61 (2Н, с), 5,50-5,54 (2Н, м), 5,89-6,00 (1Н, м), 8,16 (1Н, с).
Пример получения 32
2,03 г Гидрохлорида 5-бром-3-трет-бутил-1-(хлорметил)-1Н-1,2,4-триазола и 1,30 г (3,3,3-трифторпропил)малононитрила растворяют в 24 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,21 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,76 г [(5-бром-3-трет-бутил-1Н-1,2,4-триазол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (32) настоящего изобретения), формула которого показана ниже.
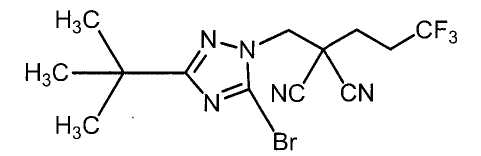
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,34 (9Н, с), 2,40-2,45 (2Н, м), 2,51-2,64 (2Н, м), 4,62 (2Н, с).
Пример получения 33
1,56 г 1-(Хлорметил)-3-(трифторметил)-1Н-1,2,4-триазола и 1,38 г (3,3,3-трифторпропил)малононитрила растворяют в 25 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,35 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 4 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-МТВЕ, получая при этом 0,15 г {[3-(трифторметил)-1Н-1,2,4-триазол-1-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (33) настоящего изобретения), формула которого показана ниже.
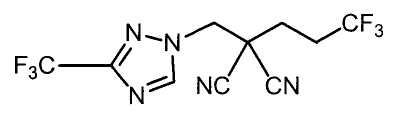
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,34-2,38 (2Н, м), 2,51-2,65 (2Н, м), 4,82 (2Н, с), 8,45 (1Н, с).
Пример получения 34
1,74 г 1-(Хлорметил)-3-(пентафторэтил)-1Н-1,2,4-триазола и 1,20 г (3,3,3-трифторпропил)малононитрила растворяют в 21 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,04 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 4 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-МТВЕ, получая при этом 0,25 г {[3-(пентафторэтил)-1Н-1,2,4-триазол-1-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (34) настоящего изобретения), формула которого показана ниже.
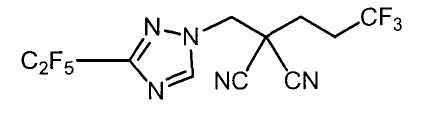
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,32-2,36 (2Н, м), 2,52-2,64 (2Н, м), 4,84 (2Н, с), 8,47 (1Н, с).
Пример получения 35
2,24 г 1-(Хлорметил)-3-(пентафторэтил)-1Н-1,2,4-триазола и 1,02 г аллилмалононитрила растворяют в 28 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,76 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, затем подвергают препаративной высокоэффективной жидкостной хроматографии, получая при этом 0,54 г аллил-{[3-(пентафторэтил)-1Н-1,2,4-триазол-1-ил]метил}малононитрила (обозначаемого далее соединением (35) настоящего изобретения), формула которого показана ниже.
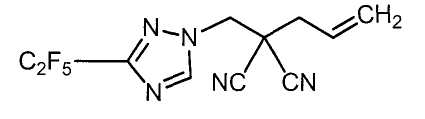
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,81 (2Н, д), 4,76 (2Н, с), 5,53-5,59 (2Н, м), 5,88-5,97 (1Н, м), 8,45 (1Н, с).
Пример получения 36
2,01 г 1-(Хлорметил)-3-(пентафторэтил)-1Н-пиразола и 1,39 г (3,3,3-трифторпропил)малононитрила растворяют в 25 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,38 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,31 г {[3-(пентафторэтил)-1Н-пиразол-1-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (36) настоящего изобретения), формула которого показана ниже.
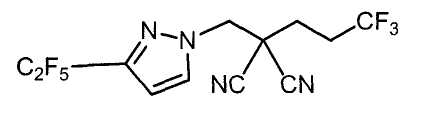
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,23-2,27 (2Н, м), 2,49-2,59 (2Н, м), 4,77 (2Н, с), 6,72 (1Н, д), 7,75 (1Н, д).
Пример получения 37
6,84 г 4-Бром-1-(хлорметил)-3-(пентафторэтил)-1Н-пиразола и 3,54 г (3,3,3-трифторпропил)малононитрила растворяют в 60 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 6,08 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 7,15 г [(4-бром-3-(пентафторэтил)-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (37) настоящего изобретения), формула которого показана ниже.
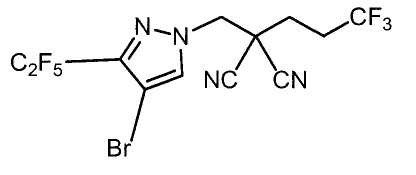
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,24-2,29 (2Н, м), 2,49-2,61 (2Н, м), 4,75 (2Н, с), 7,81 (1Н, с).
Пример получения 38
2,90 г Гидрохлорида 1-(хлорметил)-4-(трифторметил)-1Н-имидазола и 2,11 г (3,3,3-трифторпропил)малононитрила растворяют в 39 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 3,59 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,12 г {[4-(трифторметил)-1Н-имидазол-1-ил]метил}-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (38) настоящего изобретения), формула которого показана ниже.
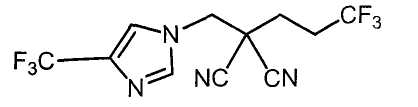
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,24-2,28 (2Н, м), 2,54-2,65 (2Н, м), 4,53 (2Н, с), 7,50 (1Н, с), 7,73 (1Н, с).
Пример получения 39
1,70 г 1-(Хлорметил)-3-циано-1Н-индола и 1,45 г (3,3,3-трифторпропил)малононитрила растворяют в 27 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 2,49 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 7 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,48 г [{3-циано-1Н-индол-1-ил}метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (39) настоящего изобретения), формула которого показана ниже.
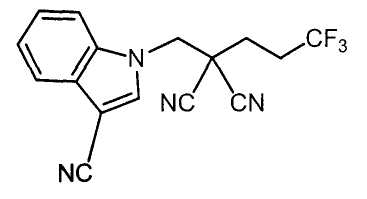
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,28-2,32 (2Н, м), 2,51-2,63 (2Н, м), 4,78 (2Н, с), 7,37-7,47 (2Н, м), 7,53 (1Н, д), 7,80-7,83 (2Н, м).
Пример получения 40
3,02 г 1-(Хлорметил)-3-формил-1Н-индола и 2,53 г (3,3,3-трифторпропил)малононитрила растворяют в 45 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют при перемешивании 4,35 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 2,68 г [{3-формил-1Н-индол-1-ил}метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (40) настоящего изобретения), формула которого показана ниже.
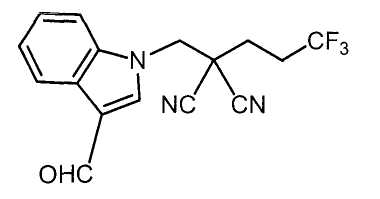
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 2,33-2,51 (2Н, м), 2,59-2,75 (2Н, м), 5,29 (2Н, с), 7,30-7,40 (2Н, м), 7,97 (1Н, д), 8,14 (1Н, д), 8,36 (1Н, с), 10,04 (1Н, с).
Пример получения 41
3,53 г 1-(Хлорметил)-3-(трифторацетил)-1Н-индола и 2,19 г (3,3,3-трифторпропил)малононитрила растворяют в 27 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 3,74 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 3,06 г [{3-(трифторацетил)-1Н-индол-1-ил}метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (41) настоящего изобретения), формула которого показана ниже.
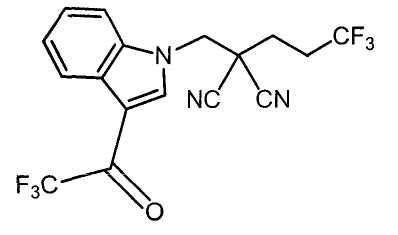
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,33-2,37 (2Н, м), 2,53-2,65 (2Н, м), 4,85 (2Н, с), 7,44-7,50 (2Н, м), 7,52-7,57 (1Н, м), 8,16 (1Н, с), 8,44-8,47 (1Н, м).
Пример получения 42
1,21 г [(1Н-Пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (соединение (1) настоящего изобретения) растворяют в 50 мл ацетонитрила. К раствору добавляют 2,19 г нитрата аммония-церия(IV) и 1,02 г йода с последующим перемешиванием смеси при комнатной температуре в течение 10 часов. Реакционную смесь концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,71 г [(4-йод-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (42) настоящего изобретения), формула которого показана ниже.
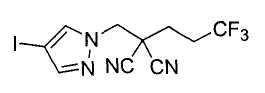
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,04-2,27 (2Н, м), 2,48 (2Н, м), 4,69 (2Н, с), 7,65 (1Н, с), 7,67 (1Н, с).
Пример получения 43
0,21 г 1-(Хлорметил)-4-[(дихлорфторметил)тио]-1Н-пиразола и 0,14 г (3,3,3-трифторпропил)малононитрила растворяют в 2 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 0,12 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 0,06 г [(4-{(дихлорфторметил)тио}-1Н-пиразол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (43) настоящего изобретения), формула которого показана ниже.

1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,24-2,33 (2Н, м), 2,49-2,59 (2Н, м), 5,43 (2Н, с), 7,83 (1Н, с), 7,96 (1Н, с).
Пример получения 44
0,61 г 1-(Хлорметил)-3-{[(дихлорфторметил]тио}-1Н-индола и 0,35 г (3,3,3-трифторпропил)малононитрила растворяют в 2 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 0,28 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,65 г [(3-{(дихлорфторметил)тио}-1Н-индол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (44) настоящего изобретения), формула которого показана ниже.
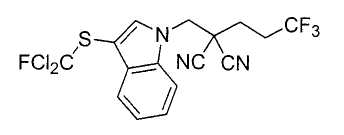
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,05-2,28 (2Н, м), 2,49-2,60 (2Н, м), 4,80 (2Н, с), 7,34-7,42 (2Н, м), 7,50 (1Н, д), 7,67 (1Н, с), 7,86 (1Н, с).
Пример получения 45
0,61 г 1-Хлорметил-3-нитро-1Н-пиррола и 0,65 г (3,3,3-трифторпропил)малононитрила растворяют в 10 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 0,28 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,80 г [(3-нитро-1Н-пиррол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (45) настоящего изобретения), формула которого показана ниже.
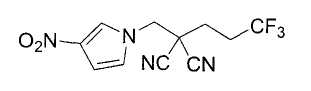
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,22-2,26 (2Н, м), 2,52-2,63 (2Н, м), 4,46 (2Н, с),6,81-6,83 (1Н, м), 6,88 (1Н, т), 7,69 (1Н, д).
Пример получения 46
0,80 г 1-Хлорметил-3-циано-4-трифторметил-1Н-пиррола и 0,67 г (3,3,3-трифторпропил)малононитрила растворяют в 10 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 0,57 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,33 г [(3-циано-4-трифторметил-1Н-пиррол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (46) настоящего изобретения), формула которого показана ниже.
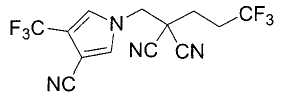
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 2,45-2,51 (2Н, м), 2,62-2,74 (2Н, м), 4,98 (2Н, с), 7,76-7,77 (1Н, м), 8,04 (1Н, д).
Пример получения 47
0,23 г 1-Хлорметил-4-трифторметил-3-этоксикарбонил-1Н-пиррола и 0,15 г (3,3,3-трифторпропил)малононитрила растворяют в 2 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 0,13 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,20 г [(3-этоксикарбонил-4-трифторметил-1Н-пиррол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (47) настоящего изобретения), формула которого показана ниже.

1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,35 (3Н, т), 2,21-2,26 (2Н, м), 2,56-2,63 (2Н, м), 4,35 (2Н, кв.),4,45 (2Н,с), 7,20 (1Н, д), 7,53 (1Н, д).
Пример получения 48
0,27 г 1-Хлорметил-3-циано-1Н-пиррола и 0,34 г (3,3,3-трифторпропил)малононитрила растворяют в 3 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 0,29 г карбоната калия с последующим перемешиванием смеси при комнатной температуре в течение 1 часа. К реакционной смеси добавляют воду и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,37 г [(3-циано-1Н-пиррол-1-ил)метил]-(3,3,3-трифторпропил)малононитрила (обозначаемого далее соединением (48) настоящего изобретения), формула которого показана ниже.
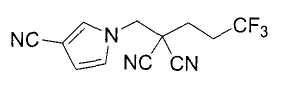
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,18-2,23 (2Н, м), 2,46-2,64 (2Н, м), 4,46 (2Н, с), 6,58-6,59 (1Н, м), 6,87-6,88 (1Н, м), 7,33-7,35 (1Н, м).
Далее иллюстрируются ссылочные примеры получения промежуточных соединений.
Ссылочный пример получения 1-1
1Н-пиразол-1-илметанол
Смесь 2,04 г пиразола, 2,00 г параформальдегида и 1 мл триэтиламина перемешивают при 130°С в течение 10 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон и затем смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К остатку добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 3,10 г 1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,51 (2Н, с), 6,30 (1Н, т), 7,58-7,61 (2Н, м).
Ссылочный пример получения 1-2
Гидрохлорид 1-(хлорметил)-1Н-пиразола
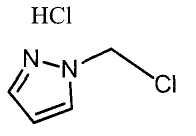
3,10 г 1Н-пиразол-1-илметанола растворяют в 100 мл дихлорметана. К раствору добавляют 6,8 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-хлороформ, получая при этом 2,66 г гидрохлорида 1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,91 (2Н, с), 6,38 (1Н, т), 7,61-7,68 (2Н, м).
Ссылочный пример получения 2-1
3-Изопропил-1Н-пиразол
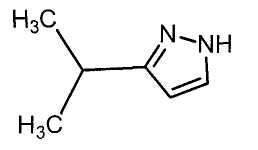
В атмосфере азота смесь 17,23 г изопропилметилкетона и 12,01 г метилформиата охлаждают до 0°С и затем к смеси на протяжении периода 1 час добавляют 22,44 г трет-бутоксида калия, растворенного в 200 мл тетрагидрофурана. Во время добавления температуру смеси поддерживают ниже 20°С. После этого реакционную смесь перемешивают при 30°С в течение 5 часов. К реакционной смеси, которую охлаждают до комнатной температуры, добавляют 200 мл диэтилового эфира, в результате чего образуется твердое вещество. Твердое вещество собирают фильтрованием и промывают 20 мл диэтилового эфира. Полученное твердое вещество сушат при пониженном давлении, получая при этом 14,14 г калиевой соли 1-гидрокси-4-метил-1-пентен-3-она. 14,14 г калиевой соли 1-гидрокси-4-метил-1-пентен-3-она суспендируют в 90 мл этанола. К суспензии добавляют 5,11 г гидрата гидразина и смесь кипятят с обратным холодильником в течение 7 часов. К реакционной смеси, которую охлаждают до комнатной температуры, добавляют 30 мл воды и смесь концентрируют до 30 мл при пониженном давлении. Остаток экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 6,83 г 3-изопропил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,29 (6Н, д), 3,01-3,08 (1Н, м), 6,10 (1Н, с), 7,49 (1Н, с).
Ссылочный пример получения 2-2
3-Изопропил-1Н-пиразол-1-илметанол
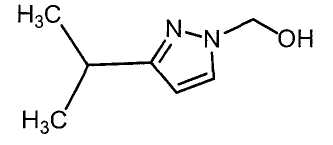
Смесь 1,15 г 3-изопропил-1Н-пиразола, 0,94 г параформальдегида и 0,14 г триэтиламина перемешивают при 130°С в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К остатку добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 1,28 г 3-изопропил-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,24 (6Н, д), 2,94-3,02 (1Н, м), 5,48 (2Н, с), 6,10 (1Н, д), 7,47 (1Н, д).
Ссылочный пример получения 2-3
Гидрохлорид 3-изопропил-1-(хлорметил)-1Н-пиразола
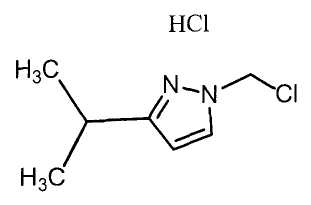
1,28 г 3-Изопропил-1Н-пиразол-1-илметанола растворяют в 20 мл дихлорметана. К раствору добавляют 2 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,58 г гидрохлорида 3-изопропил-1-(хлорметил)-1Н-пиразола.
Ссылочный пример получения 3-1
3-трет-Бутил-1Н-пиразол
В атмосфере азота смесь 50,00 г пинаколона и 42,00 г метилформиата охлаждают до 0°С и затем к смеси на протяжении периода 3 часов добавляют 56,00 г трет-бутоксида калия. Во время добавления температуру смеси поддерживают ниже 20°С. После этого реакционную смесь перемешивают при 30°С в течение 5 часов. К реакционной смеси, которую охлаждают до комнатной температуры, добавляют диэтиловый эфир, в результате чего образуется твердое вещество. Твердое вещество собирают фильтрованием и сушат при пониженном давлении, получая при этом 32,12 г калиевой соли 1-гидрокси-4,4-диметил-1-пентен-3-она. 21,61 г калиевой соли 1-гидрокси-4,4-диметил-1-пентен-3-она суспендируют в 150 мл этанола. К суспензии добавляют 6,52 г гидрата гидразина и затем смесь кипятят с обратным холодильником в течение 7 часов. К реакционной смеси, которую охлаждают до комнатной температуры, добавляют 50 мл воды и смесь концентрируют до 40 мл при пониженном давлении. Концентрированный раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 6,83 г 3-трет-бутил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,34 (9Н, с), 6,11 (1Н, д), 7,47 (1Н, д).
Ссылочный пример получения 3-2
3-трет-Бутил-1Н-пиразол-1-илметанол
Смесь 1,28 г 3-трет-бутил-1Н-пиразола, 0,66 г параформальдегида и 0,3 г триэтиламина перемешивают при 130°С в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К остатку добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 1,07 г 3-трет-бутил-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,28 (9Н, с), 5,50 (2Н, с), 6,13 (1Н, с), 7,46 (1Н, с).
Ссылочный пример получения 3-3
Гидрохлорид 3-трет-бутил-1-(хлорметил)-1Н-пиразола
1,07 г 3-трет-Бутил-1Н-пиразол-1-илметанола растворяют в 140 мл дихлорметана. К раствору добавляют 2 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре на протяжении ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,66 г гидрохлорида 3-трет-бутил-1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 6,25 (2Н, с), 6,40 (1Н, д), 7,69 (1Н, д).
Ссылочный пример получения 4-1
6,6-Диметил-2,4,5,6-тетрагидроциклопента[c]пиразол

В атмосфере азота смесь 12,22 г 2,2-диметилциклопентанона и 6,01 г метилформиата охлаждают до 0°С и затем к смеси на протяжении периода 1 часа добавляют 6,74 г трет-бутоксида калия. Во время добавления температуру смеси поддерживают ниже 20°С. После этого реакционную смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют диэтиловый эфир, в результате чего образуется твердое вещество. Твердое вещество собирают фильтрованием. Полученное твердое вещество сушат при пониженном давлении, получая при этом 9,94 г калиевой соли 1-гидроксиметилен-5,5-диметилциклопентанона. 9,94 г калиевой соли 1-гидроксиметилен-5,5-диметилциклопентанона суспендируют в 80 мл этанола. К суспензии добавляют 2,80 г гидрата гидразина и затем смесь кипятят с обратным холодильником в течение 5 часов. К реакционной смеси, которую охлаждают до комнатной температуры, добавляют 50 мл воды и смесь концентрируют до 40 мл при пониженном давлении. Концентрированный раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,68 г 6,6-диметил-2,4,5,6-тетрагидроциклопента[c]пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,32 (6Н, с), 2,23-2,28 (2Н, т), 2,60-2,64 (2Н, т), 7,11 (1Н, с).
Ссылочный пример получения 4-2
{6,6-Диметил-5,6-дигидроциклопента[c]пиразол-2(4Н)-ил}метанол
Смесь 1,68 г 6,6-диметил-2,4,5,6-тетрагидроциклопента[c]пиразола, 0,41 г параформальдегида и 0,2 г триэтиламина перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К остатку добавляют гексан, в результате чего образуются кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 0,31 г {6,6-диметил-5,6-дигидроциклопента[c]пиразол-2(4Н)-ил}метанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,28 (6Н, с), 2,18 (2Н, т), 2,59 (2Н, т), 5,44 (2Н, с), 7,13 (1Н, с).
Ссылочный пример получения 4-3
Гидрохлорид 1-(хлорметил)-6,6-диметил-5,6-дигидроциклопента[c]пиразола
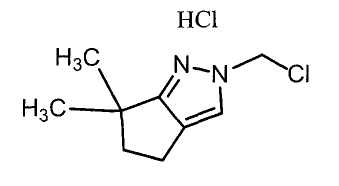
0,31 г (6,6-Диметил-5,6-дигидроциклопента[c]пиразол-2(4Н)-ил}метанол растворяют в 5 мл дихлорметана. К раствору добавляют 1 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 0,58 г гидрохлорида 1-(хлорметил)-6,6-диметил-5,6-дигидроциклопента[c]пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,46 (6Н, с), 2,33 (2Н, т), 2,73 (2Н, т), 6,18 (2Н, с), 7,45 (1Н, с).
Ссылочный пример получения 5-1
3-(Трифторметил)-1Н-пиразол-1-илметанол
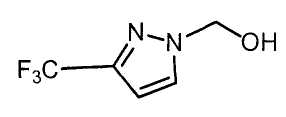
Смесь 4,08 г 3-(трифторметил)-1Н-пиразола, 2,00 г параформальдегида и 1 мл триэтиламина перемешивают при 80°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К остатку добавляют гексан, в результате чего образуются кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 4,31 г 3-(трифторметил)-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 4,73 (1Н, ушир. с), 5,58 (2Н, с), 6,58 (1Н, с), 7,66 (1Н, с).
Ссылочный пример получения 5-2
1-(Хлорметил)-3-(трифторметил)-1Н-пиразол

1,33 г 3-(Трифторметил)-1Н-пиразол-1-илметанола растворяют в 40 мл дихлорметана. К раствору добавляют 2,7 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,44 г 1-(хлорметил)-3-(трифторметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,88 (2Н, с), 6,62 (1Н, д), 7,68 (1Н, д).
Ссылочный пример получения 6-1
1-(Гидроксиметил)-3-формил-1Н-пиразол
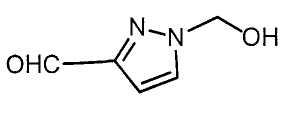
Смесь 0,96 г 3-формил-1Н-пиразола, 0,60 г параформальдегида и 0,3 мл триэтиламина перемешивают при 100°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 1,21 г 1-(гидроксиметил)-3-формил-1Н-пиразола. Сырой продукт применяют в следующем способе без очистки.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,63 (2Н, с), 6,84 (1Н, д), 7,67 (1Н, д), 9,96 (1Н, с).
Ссылочный пример получения 6-2
Гидрохлорид 1-(хлорметил)-3-формил-1Н-пиразола

1,21 г 1-(Гидроксиметил)-3-формил-1Н-пиразола растворяют в 50 мл дихлорметана. К раствору добавляют 2,4 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,57 г гидрохлорида 1-(хлорметил)-3-формил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,92 (2Н, с), 6,88 (1Н, с), 7,67 (1Н, с), 10,00 (1Н, с).
Ссылочный пример получения 7-1
3-Циано-1Н-пиразол
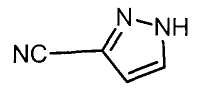
2,18 г 3-Формил-1Н-пиразола растворяют в 12 мл пиридина. К раствору добавляют 1,58 г гидрохлорида гидроксиламина с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют 30 мл уксусного ангидрида с последующим перемешиванием при 100°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры ее концентрируют при пониженном давлении. К остатку добавляют 30 мл этанола и затем смесь перемешивают при 100°С в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры ее концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,86 г 3-циано-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 6,79 (1Н, д), 7,75 (1Н, д).
Ссылочный пример получения 7-2
1-(Гидроксиметил)-3-циано-1Н-пиразол

Смесь 0,86 г 3-циано-1Н-пиразола и 0,55 г параформальдегида перемешивают при 130°С в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. После фильтрования смеси фильтрат концентрируют при пониженном давлении, получая при этом 0,89 г 1-(гидроксиметил)-3-циано-1Н-пиразола.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 5,54 (2Н, с), 6,70 (1Н, д), 7,72 (1Н, д).
Ссылочный пример получения 7-3
3-Циано-1-(хлорметил)-1Н-пиразол
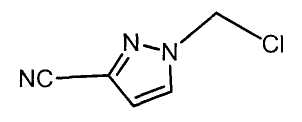
0,89 г 1-(Гидроксиметил)-3-циано-1Н-пиразола растворяют в 30 мл дихлорметана. К раствору добавляют 1,6 мл тионилхлорида с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,00 г 3-циано-1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,87 (2Н, с), 6,76 (1Н, с), 7,72 (1Н, с).
Ссылочный пример получения 8-1
3-Фенил-1Н-пиразол-1-илметанол
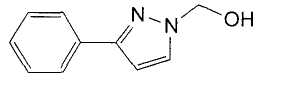
Смесь 2,88 г 3-фенил-1Н-пиразола, 0,67 г параформальдегида и 0,3 мл триэтиламина перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. После фильтрования смеси к фильтрату добавляют гексан для образования кристаллического вещества. Кристаллическое вещество собирают, получая при этом 2,64 г 3-фенил-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,56 (2Н, с), 6,58 (1Н, д), 7,31-7,42 (3Н, м), 7,59 (1Н, д), 7,76-7,79 (2Н, м).
Ссылочный пример получения 8-2
Гидрохлорид 1-(хлорметил)-3-фенил-1Н-пиразола
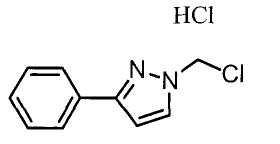
1,74 г 3-Фенил-1Н-пиразол-1-илметанола растворяют в 50 мл дихлорметана. К раствору добавляют 3,4 мл тионилхлорида с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют гексан и хлороформ для получения кристаллического вещества. Кристаллическое вещество собирают, получая при этом 2,01 г гидрохлорида 1-(хлорметил)-3-фенил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 6,15 (2Н, с), 6,76 (1Н, д), 7,39-7,49 (3Н, м), 7,76 (1Н, д), 7,90-7,94 (2Н, м).
Ссылочный пример получения 9-1
4-Бром-3-изопропил-1Н-пиразол
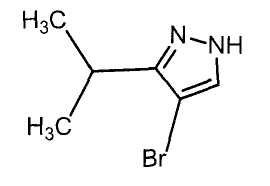
1,10 г 3-изопропил-1Н-пиразола суспендируют в 20 мл воды и к суспензии добавляют 1,6 г 50% водного раствора гидроксида натрия. Смесь охлаждают до 0°С и затем к смеси добавляют 1,76 г брома с последующим перемешиванием смеси при комнатной температуре в течение 5 часов. Реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,88 г 4-бром-3-изопропил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,31 (6Н, д), 3,07-3,18 (1Н, м), 7,49 (1Н, c),
Ссылочный пример получения 9-2
4-Бром-3-изопропил-1Н-пиразол-1-илметанол
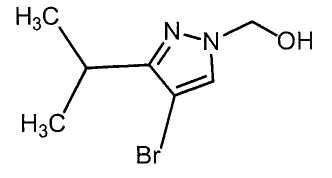
Смесь 1,88 г 4-бром-3-изопропил-1Н-пиразола, 0,60 г параформальдегида и 0,10 г триэтиламина перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют и фильтрат концентрируют при пониженном давлении, получая при этом 1,29 г 4-бром-3-изопропил-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,26 (6Н, д), 3,02-3,11 (1Н, м), 5,43 (2Н, с), 7,54 (1Н, с).
Ссылочный пример получения 9-3
Гидрохлорид 4-бром-3-изопропил-1-(хлорметил)-1Н-пиразола
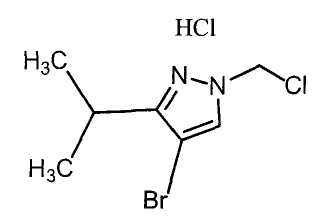
1,29 г 4-Бром-3-изопропил-1Н-пиразол-1-илметанола растворяют в 20 мл дихлорметана. К раствору добавляют 2 мл тионилхлорида с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,28 г гидрохлорида 4-бром-3-изопропил-1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,29 (6Н, д), 2,99-3,10 (1Н, м),5,75 (2Н, с), 7,54 (1Н, с).
Ссылочный пример получения 10-1
4-Бром-3-трет-бутил-1Н-пиразол
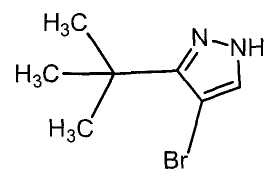
2,48 г 3-трет-Бутил-1Н-пиразола суспендируют в 35 мл воды и к суспензии добавляют 2,5 г 50% водного раствора гидроксида натрия. Смесь охлаждают до 0°С и затем к смеси добавляют 3,50 г брома с последующим перемешиванием при комнатной температуре в течение 7 часов. Реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 3,14 г 4-бром-3-трет-бутил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,45 (9Н, с), 7,48 (1Н, с).
Ссылочный пример получения 10-2
4-Бром-3-трет-бутил-1Н-пиразол-1-илметанол
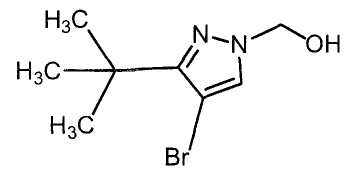
Смесь 3,14 г 4-бром-3-трет-бутил-1Н-пиразола, 0,93 г параформальдегида и 0,11 г триэтиламина перемешивают при 130°С в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. К остатку, полученному концентрированием фильтрата при пониженном давлении, добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 3,79 г 4-бром-3-трет-бутил-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,37 (9Н, с), 5,40 (2Н, с), 7,55 (1Н, с).
Ссылочный пример получения 10-3
Гидрохлорид 4-бром-3-трет-бутил-1-(хлорметил)-1Н-пиразола
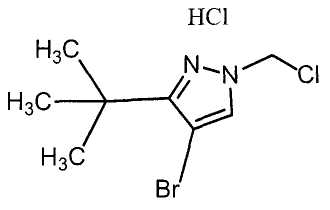
3,79 г 4-Бром-3-трет-бутил-1Н-пиразол-1-илметанола растворяют в 45 мл дихлорметана. К раствору добавляют 3,4 мл тионилхлорида с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении. Полученное твердое вещество промывают гексаном и хлороформом, получая при этом 3,69 г гидрохлорида 4-бром-3-трет-бутил-1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,40 (9Н, с), 5,76 (2Н, с), 7,56 (1Н, с).
Ссылочный пример получения 11-1
3-трет-Бутил-4-хлор-1Н-пиразол
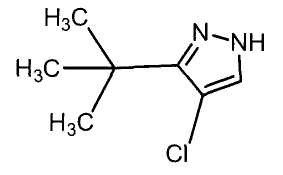
1,42 г 3-трет-Бутил-1Н-пиразола растворяют в 230 мл хлороформа. К раствору добавляют 1,55 г N-хлорсукцинимида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении и остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,62 г 3-трет-бутил-4-хлор-1Н-пиразола.
Ссылочный пример получения 11-2
3-трет-Бутил-4-хлор-1Н-пиразол-1-метанол
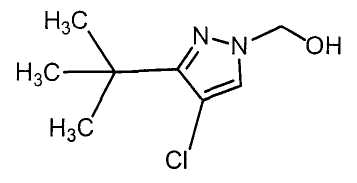
Смесь 0,62 г 3-трет-бутил-4-хлор-1Н-пиразола, 0,24 г параформальдегида и 0,10 г триэтиламина перемешивают при 130°С в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. К остатку, полученному концентрированием фильтрата при пониженном давлении, добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 0,82 г 3-трет-бутил-4-хлор-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,38 (9Н, с), 5,39 (2Н, с), 7,51 (1Н, с).
Ссылочный пример получения 11-3
Гидрохлорид 3-трет-бутил-4-хлор-1-(хлорметил)-1Н-пиразола
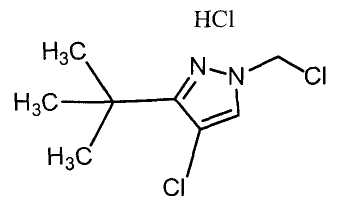
0,82 г 3-трет-Бутил-4-хлор-1Н-пиразол-1-илметанола растворяют в 45 мл дихлорметана. К раствору добавляют 3,4 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 0,98 г гидрохлорида 3-трет-бутил-4-хлор-1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,39 (9Н, с), 5,75 (2Н, с), 7,52 (1Н, с).
Ссылочный пример получения 12-1
4-Бром-3-(трифторметил)-1Н-пиразол
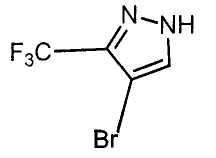
3,50 г 3-(Трифторметил)-1Н-пиразола суспендируют в 45 мл воды и к суспензии добавляют 3,2 г 50% водного раствора гидроксида натрия. Смесь охлаждают до 0°С и затем к смеси добавляют 3,20 г брома с последующим перемешиванием при комнатной температуре в течение 7 часов. Реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. К остатку добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 3,38 г 4-бром-3-(трифторметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 7,72 (1Н, с).
Ссылочный пример получения 12-2
4-Бром-3-(трифторметил)-1Н-пиразол-1-илметанол
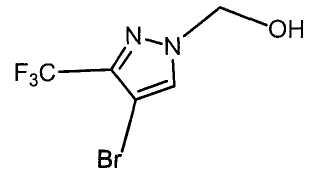
Смесь 3,38 г 4-бром-3-(трифторметил)-1Н-пиразола и 0,66 г параформальдегида перемешивают при 140°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. К остатку, полученному концентрированием фильтрата при пониженном давлении, добавляют гексан, в результате чего получают кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 3,28 г 4-бром-3-(трифторметил)-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,52 (2Н, с), 7,71 (1Н, с).
Ссылочный пример получения 12-3
4-Бром-1-(хлорметил)-3-(трифторметил)-1Н-пиразол

3,28 г 4-Бром-3-(трифторметил)-1Н-пиразол-1-илметанола растворяют в 40 мл дихлорметана. К раствору добавляют 2,9 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении. Полученное твердое вещество промывают смесью гексана и хлороформа, получая при этом 3,33 г 4-бром-1-(хлорметил)-3-(трифторметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,82 (2Н, с), 7,74 (1Н, с).
Ссылочный пример получения 13
Гидрохлорид 1-(хлорметил)-3,5-диметилпиразола
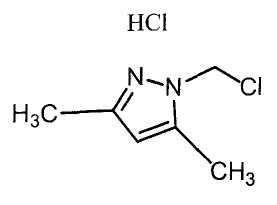
0,63 г 3,5-Диметил-1Н-пиразол-1-илметанола растворяют в 25 мл дихлорметана. К раствору добавляют 1,2 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 0,93 г гидрохлорида 1-(хлорметил)-3,5-диметил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,49 (3Н, с), 2,50 (3Н, с), 6,20 (3Н, с).
Ссылочный пример получения 14-1
4-Метил-1Н-пиразол-1-илметанол
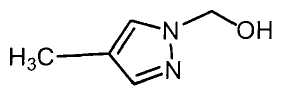
Смесь 1,93 г 4-метил-1Н-пиразола, 0,97 г параформальдегида и 0,4 мл триэтиламина перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. К остатку, полученному концентрированием фильтрата при пониженном давлении, добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 1,72 г 4-метил-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,08 (3Н, с), 5,43 (2Н, с), 7,36 (2Н, с).
Ссылочный пример получения 14-2
Гидрохлорид 1-(хлорметил)-4-метил-1Н-пиразола
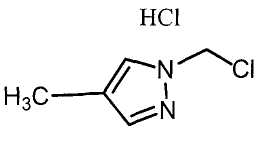
1,12 г 4-метил-1Н-пиразол-1-илметанола растворяют в 50 мл дихлорметана. К раствору добавляют 3,4 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,61 г гидрохлорида 1-(хлорметил)-4-метил-1Н-пиразола.
Ссылочный пример получения 15-1
4-Хлор-1Н-пиразол-1-илметанол
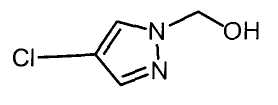
Смесь 2,05 г 4-хлорпиразола, 0,66 г параформальдегида и 0,11 г триэтиламина перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. К остатку, полученному концентрированием фильтрата при пониженном давлении, добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 2,73 г 4-хлор-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,45 (2Н, с), 7,49 (1Н, с), 7,60 (1Н, с).
Ссылочный пример получения 15-2
Гидрохлорид 4-хлор-1-(хлорметил)-1Н-пиразола
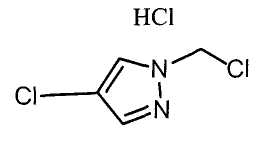
2,73 г 4-Хлор-1Н-пиразол-1-илметанола растворяют в 20 мл дихлорметана. К раствору добавляют 4,4 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 2,90 г гидрохлорида 4-хлор-1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,81 (2Н, с), 7,53 (1Н, с), 7,60 (1Н, с).
Ссылочный пример получения 16-1
4-Бром-1Н-пиразол-1-илметанол
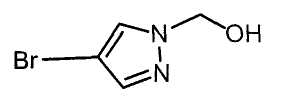
Смесь 2,94 г 4-бром-1Н-пиразола, 0,66 г параформальдегида и 0,3 мл триэтиламина перемешивают при 130°С в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. К остатку, полученному концентрированием фильтрата при пониженном давлении, добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 2,97 г 4-бром-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,46 (2Н, с), 7,53 (1Н, с), 7,63 (1Н, с).
Ссылочный пример получения 16-2
Гидрохлорид 4-бром-1-(хлорметил)-1Н-пиразола
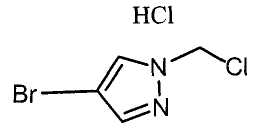
2,97 г 4-Бром-1Н-пиразол-1-илметанола растворяют в 100 мл дихлорметана. К раствору добавляют 5 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 3,27 г гидрохлорида 4-бром-1-(хлорметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,83 (2Н, с), 7,57 (1Н, с), 7,63 (1Н, с).
Ссылочный пример получения 17-1
4-(Трифторметил)-1Н-пиразол
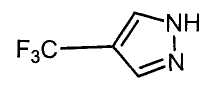
Указанное выше соединение получают способом, описанным в Tetrahedron Letters 1829 (1996).
Ссылочный пример получения 17-2
4-(Трифторметил)пиразол-1-ил-1Н-метанол
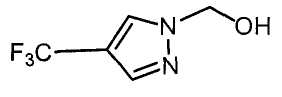
Смесь 0,59 г 4-(трифторметил)-1Н-пиразола и 0,26 г параформальдегида перемешивают при 130°С в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 0,60 г 4-(трифторметил)-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,58 (2Н, с), 7,77 (1Н, с), 7,90 (1Н, с).
Ссылочный пример получения 17-3
1-(Хлорметил)-4-(трифторметил)-1Н-пиразол
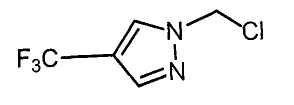
0,60 г 4-(Трифторметил)-1Н-пиразол-1-илметанола растворяют в 10 мл дихлорметана. К раствору добавляют 1 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 0,60 г 4-(хлорметил)-1-(трифторметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,89 (2Н, с), 7,80 (1Н, с), 7,91 (1Н, с).
Ссылочный пример получения 18-1
4-Метоксикарбонил-1Н-пиразол
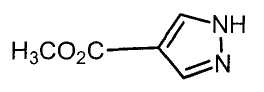
44,45 г Метил-3,3-диметоксипропионата и 45 мл метилформиата растворяют в 180 мл диметоксиэтана. К раствору в атмосфере азота добавляют 12,8 г 60% гидрида натрия, поддерживая температуру раствора во время добавления 40-50°С. Затем смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют 180 мл диэтилового эфира, в результате чего образуется твердое вещество. Твердое вещество собирают фильтрованием с последующим промыванием его 60 мл диэтилового эфира. Полученное твердое вещество сушат при пониженном давлении в течение ночи, получая при этом 49,41 г натриевой соли метил-2-(диметоксиметил)-3-гидроксиакрилата. 9,91 г натриевой соли метил-2-(диметоксиметил)-3-гидроксиакрилата суспендируют в 100 мл этанола. К суспензии добавляют 2,50 г гидрата гидразина с последующим перемешиванием смеси при комнатной температуре в течение 3 часов и при 80°С в течение 1 часа. К реакционной смеси добавляют 100 мл воды, смесь охлаждают до комнатной температуры. Смесь концентрируют при пониженном давлении приблизительно до 100 мл. Концентрированный раствор экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток растворяют в этилацетате, к раствору добавляют активированный уголь и его перемешивают в течение ночи. Суспензию фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси гексан-этилацетат, получая при этом 1,40 г 4-метоксикарбонил-1Н-пиразола.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 3,74 (3Н, с), 8,08 (2Н, с), 13,43 (1Н, с).
Ссылочный пример получения 18-2
1-(Гидроксиметил)-4-метоксикарбонил-1Н-пиразол
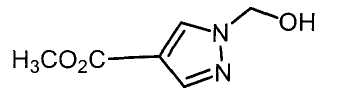
Смесь 1,40 г 4-метоксикарбонил-1Н-пиразола, 0,37 г параформальдегида и 0,11 г триэтиламина перемешивают при 130°С в течение 1 часа. К смеси добавляют 0,74 г параформальдегида и 2 мл триэтиламина и смесь перемешивают при 130°С в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. После фильтрования смеси фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,38 г 1-(гидроксиметил)-4-метоксикарбонил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 3,84 (3Н, с), 5,53 (2Н, с), 7,96 (1Н, с), 8,08 (1Н, с).
Ссылочный пример получения 18-3
1-(Хлорметил)-4-метоксикарбонил-1Н-пиразол
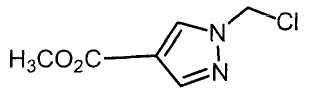
1,38 г 1-(Гидроксиметил)-4-метоксикарбонил-1Н-пиразола растворяют в 10 мл дихлорметана. К раствору добавляют 1 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,59 г 1-(хлорметил)-4-метоксикарбонил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 3,85 (3Н, с), 5,85 (2Н, с), 7,98 (1Н, с), 8,10 (1Н, с).
Ссылочный пример получения 19-1
1-(Гидроксиметил)-3-(трифторметил)-4-этоксикарбонил-1Н-пиразол
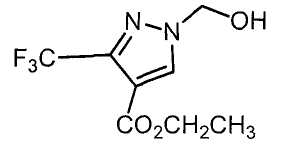
Смесь 2,08 г 3-(трифторметил)-4-этоксикарбонил-1Н-пиразола и 0,66 г параформальдегида перемешивают при 150°С в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. После фильтрования смеси фильтрат концентрируют при пониженном давлении, получая при этом 2,23 г 1-(гидроксиметил)-3-(трифторметил)-4-этоксикарбонил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,34 (3Н, т), 4,30 (2Н, кв), 5,58 (2Н, с), 8,21 (1Н, с).
Ссылочный пример получения 19-2
1-(Хлорметил)-3-(трифторметил)-4-этоксикарбонил-1Н-пиразол
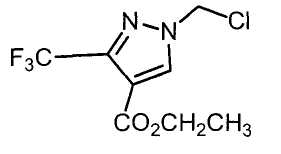
2,23 г 1-(Гидроксиметил)-3-(трифторметил)-4-этоксикарбонил-1Н-пиразола растворяют в 30 мл дихлорметана. К раствору добавляют 1,4 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 2,38 г 1-(хлорметил)-3-(трифторметил)-4-этоксикарбонил-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,31 (3Н, т), 4,31 (2Н, кв.), 5,85 (2Н, с), 8,20 (1Н, с).
Ссылочный пример получения 20
Гидрохлорид 1-хлорметил-1Н-1,2,4-триазола
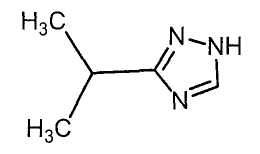
Указанное выше соединение получают способом, описанным в JP S57-165374 A.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 6,26 (2Н, с), 8,16 (1Н, с), 8,85 (1Н, с).
Ссылочный пример получения 21-1
3-Изопропил-1Н-1,2,4-триазол
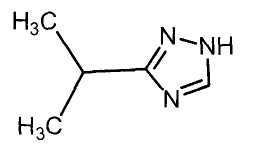
Указанное выше соединение получают способом, аналогичным способу, описанному в JP Н6-87839 A.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,39 (6Н, д), 3,14-3,74 (1Н, м), 7,99 (1Н, с).
Ссылочный пример получения 21-2
3-Изопропил-1Н-1,2,4-триазол-1-илметанол
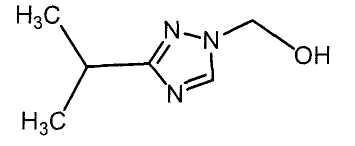
Смесь 1,15 г 3-изопропил-1Н-1,2,4-триазола, 0,94 г параформальдегида и 0,14 г триэтиламина перемешивают при 150°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 1,28 г 3-изопропил-1Н-триазол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,32 (6Н, д), 3,04-3,12 (1Н, м), 5,54 (2Н, с), 8,14 (1Н, с).
Ссылочный пример получения 21-3
Гидрохлорид 1-(хлорметил)-3-изопропил-1Н-1,2,4-триазола
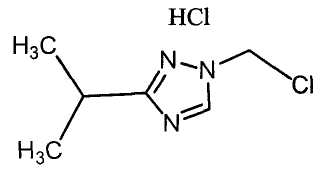
1,28 г 3-Изопропил-1Н-1,2,4-триазол-1-илметанола растворяют в 20 мл дихлорметана и к раствору добавляют 2 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 8 часов. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют диэтиловый эфир, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 1,58 г гидрохлорида 1-(хлорметил)-3-изопропил-1Н-1,2,4-триазола.
Ссылочный пример получения 22-1
3-трет-Бутил-1Н-1,2,4-триазол
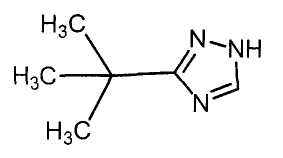
Указанное выше соединение получают способом, описанным в JP Н6-87839 A.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,45 (9Н, с), 8,25 (1Н, с).
Ссылочный пример получения 22-2
3-трет-Бутил-1Н-1,2,4-триазол-1-илметанол
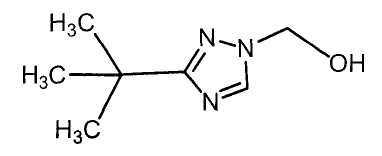
Смесь 3,76 г 3-трет-бутил-1Н-1,2,4-триазола, 1,00 г параформальдегида и 0,3 мл триэтиламина перемешивают при 150°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 1,38 г 3-трет-бутил-1Н-триазол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,37 (9Н, с), 1,81 (1Н, ушир. с), 5,55 (2Н, с), 8,16 (1Н, с).
Ссылочный пример получения 22-3
Гидрохлорид 3-трет-бутил-1-(хлорметил)-1Н-1,2,4-триазола
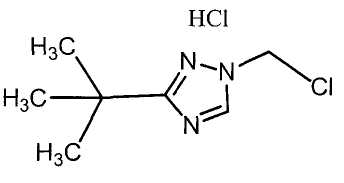
Смесь 1,38 г 3-трет-бутил-1Н-1,2,4-триазол-1-илметанола и 2,7 мл тионилхлорида перемешивают в условиях кипячения с обратным холодильником в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры реакционную смесь концентрируют при пониженном давлении. Остаток перекристаллизовывают из гексана, получая при этом 1,72 г гидрохлорида 3-трет-бутил-1-(хлорметил)-1Н-1,2,4-триазола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,36 (9Н, с), 5,83 (2Н, с), 8,17 (1Н, с).
Ссылочный пример получения 23-1
3-(1,1-Диметилпропил)-1Н-1,2,4-триазол
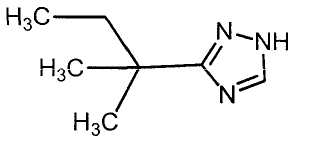
Указанное выше соединение получают способом, аналогичным способу, описанному в JP Н6-87839 A.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 0,77 (3Н, т), 1,40 (6Н, с), 1,74 (2Н, кв.), 7,98 (1Н, с).
Ссылочный пример получения 23-2
3-(1,1,-Диметилпропил)-1Н-1,2,4-триазол-1-илметанол
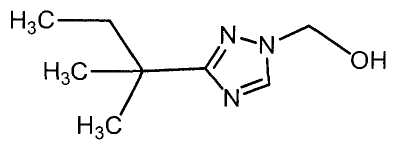
Смесь 0,86 г 3-(1,1-диметилпропил)-1Н-1,2,4-триазола, 0,37 г параформальдегида и 0,63 г триэтиламина перемешивают при 150°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 1,10 г 3-(1,1-диметилпропил)-1Н-триазол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 0,73 (3Н, т), 1,33 (6Н, с), 1,71 (2Н, кв.), 5,54 (2Н, с), 8,16 (1Н, с).
Ссылочный пример получения 23-3
Гидрохлорид 1-(хлорметил)-3-(1,1-диметилпропил)-1Н-1,2,4-триазола
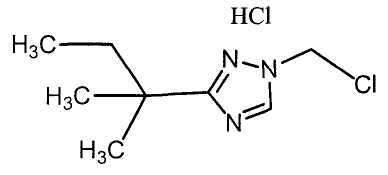
1,10 г 3-(1,1-Диметилпропил)-1Н-1,2,4-триазол-1-илметанола растворяют в 18 мл дихлорметана. К раствору добавляют 1,8 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 8 часов. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,47 г гидрохлорида 1-(хлорметил)-3-(1,1-диметилпропил)-1Н-1,2,4-триазола.
Ссылочный пример получения 24-1
5-Бром-3-трет-бутил-1Н-1,2,4-триазол
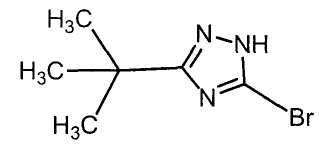
Смесь 2,51 г 3-трет-бутил-1Н-1,2,4-триазола, 35 мл воды и 2,5 мл 50% водного раствора гидроксида натрия охлаждают до 0°С, затем к смеси добавляют 3,5 г брома. Смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь экстрагируют этилацетатом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток перекристаллизовывают из гексана, получая при этом 3,80 г 5-бром-3-трет-бутил-1Н-1,2,4-триазола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,41 (9Н, с), 11,60 (1Н, ушир. с).
Ссылочный пример получения 24-2
5-Бром-3-трет-бутил-1Н-1,2,4-триазол-1-илметанол
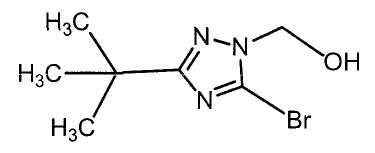
Смесь 3,45 г 5-бром-3-трет-бутил-1Н-1,2,4-триазола, 0,61 г параформальдегида и 0,17 мл триэтиламина перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют. К остатку добавляют гексан и смесь фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 2,88 г 5-бром-3-трет-бутил-1Н-1,2,4-триазол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,34 (9Н, с), 5,55 (2Н, с).
Ссылочный пример получения 24-3
Гидрохлорид 5-бром-3-трет-бутил-1-(хлорметил)-1Н-1,2,4-триазола

2,88 г 5-Бром-3-трет-бутил-1Н-1,2,4-триазол-1-илметанола растворяют в 100 мл дихлорметана. К раствору добавляют 4,2 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют хлороформ и смесь фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 2,03 г гидрохлорида 5-бром-3-трет-бутил-1-(хлорметил)-1Н-1,2,4-триазола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,35 (9Н, с), 5,79 (2Н, с).
Ссылочный пример получения 25-1
3-(Трифторметил)-1Н-1,2,4-триазол
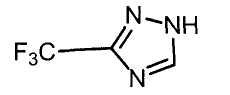
4,76 г гидрата гидразина растворяют в 160 мл этанола и раствор охлаждают до 0°С. К раствору на протяжении периода 30 минут по каплям добавляют 14,21 г этил-2,2,2-трифторацетата с последующим перемешиванием смеси при 0°С в течение 1 часа. К реакционной смеси добавляют 9,89 г соли формамидинуксусной кислоты с последующим перемешиванием смеси при комнатной температуре в течение 30 минут. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют 200 мл уксусной кислоты с последующим перемешиванием смеси при 100°С в течение 5 часов. Реакционную смесь, которую охлаждают до комнатной температуры, концентрируют при пониженном давлении. К остатку добавляют насыщенный водный раствор гидрокарбоната натрия, чтобы установить рН 6. Затем раствор экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток перекристаллизовывают из гексана, получая при этом 5,44 г 3-(трифторметил)-1Н-1,2,4-триазола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 8,45 (1Н, с), 12,47 (1Н, ушир. с).
Ссылочный пример получения 25-2
3-(Трифторметил)-1Н-1,2,4-триазол-1-илметанол
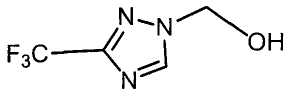
Смесь 2,74 г 3-(трифторметил)-1Н-1,2,4-триазола и 1,20 г параформальдегида перемешивают при 150°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон и смесь фильтруют. Фильтрат концентрируют. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 3,15 г 3-(трифторметил)-1Н-1,2,4-триазол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 4,04 (1Н, т), 5,67 (2Н, д), 8,37 (1Н, с).
Ссылочный пример получения 25-3
1-(Хлорметил)-3-(трифторметил)-1Н-1,2,4-триазол
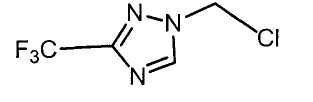
1,52 г 5-(трифторметил)-1Н-1,2,4-триазол-1-илметанола растворяют в 50 мл дихлорметана и к раствору добавляют 2,7 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,36 г 1-(хлорметил)-3-(трифторметил)-1Н-1,2,4-триазола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,92 (2Н, с), 8,44 (1Н, с).
Ссылочный пример получения 26-1
3-(Пентафторэтил)-1Н-1,2,4-триазол
1,25 г Гидрата гидразина растворяют в 45 мл этанола и раствор охлаждают до 0°С. К раствору на протяжении периода 15 минут добавляют по каплям 5,38 г этил-2,2,3,3,3-пентафторпропионата с последующим перемешиванием при 0°С в течение 1 часа. К реакционной смеси добавляют 2,61 г соли формамидинуксусной кислоты с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют 50 мл уксусной кислоты с последующим перемешиванием при 100°С в течение 5 часов. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют насыщенный водный раствор гидрокарбоната натрия, так чтобы достичь рН приблизительно 6. Раствор затем экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 2,98 г 3-пентафторэтил-1Н-1,2,4-триазола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 8,47 (1Н, с), 12,39 (1Н, ушир. с).
Ссылочный пример получения 26-2
3-(Пентафторэтил)-1Н-1,2,4-триазол-1-илметанол
Смесь 1,45 г 3-(пентафторпропил)-1Н-1,2,4-триазола и 0,46 г параформальдегида перемешивают при 150°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют. К остатку добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 1,52 г 3-(пентафторэтил)-1Н-1,2,4-триазол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,69 (2Н, с), 8,41 (1Н, с).
Ссылочный пример получения 26-3
1-(Хлорметил)-3-(пентафторэтил)-1Н-1,2,4-триазола
1,52 г 3-(Пентафторпропил)-1Н-1,2,4-триазол-1-илметанола растворяют в 50 мл дихлорметана и к раствору добавляют 2,7 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 1,36 г 1-(хлорметил)-3-(пентафторпропил)-1Н-1,2,4-триазола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,93 (2Н, с), 8,44 (1Н, с).
Ссылочный пример получения 27-1
3-(Пентафторэтил)-1Н-пиразол-1-илметанол
Смесь 1,86 г 3-(пентафторпропил)-1Н-пиразола и 0,60 г параформальдегида перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 1,98 г 3-(пентафторпропил)-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 4,54 (1Н, ушир. с), 5,58 (2Н, д), 6,60 (1Н, д), 7,68 (1Н, д).
Ссылочный пример получения 27-2
1-(Хлорметил)-3-(пентафторэтил)-1Н-пиразол

1,98 г 3-(Пентафторпропил)-1Н-пиразол-1-илметанола растворяют в 20 мл дихлорметана. К раствору добавляют 1,5 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 2,01 г 1-(хлорметил)-3-(пентафторпропил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,89 (2Н, с), 6,65 (1Н, д), 7,71 (1Н, д).
Ссылочный пример получения 28-1
4-Бром-3-(пентафторэтил)-1Н-пиразол
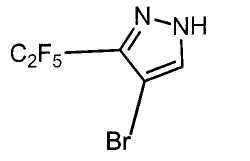
9,30 г 3-(Пентафторэтил)-1Н-пиразола суспендируют в 90 мл воды и к суспензии добавляют 6,0 г 50% водного раствора гидроксида натрия. Смесь охлаждают до 0°С, затем к смеси добавляют 8,79 г брома с последующим перемешиванием при комнатной температуре в течение 7 часов. Реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении, получая при этом 13,72 г 4-бром-3-(пентафторэтил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 7,71 (1Н, с).
Ссылочный пример получения 28-2
4-Бром-3-(пентафторэтил)-1Н-пиразол-1-илметанол
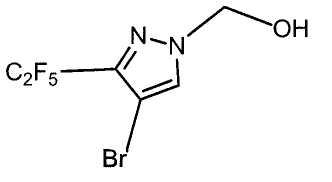
Смесь 13,72 г 4-бром-3-(пентафторпропил)-1Н-пиразола и 3,00 г параформальдегида перемешивают при 130°С в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. К фильтрату добавляют гексан, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 7,69 г 4-бром-3-(пентафторпропил)-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 3,53 (1Н, ушир. с), 5,54 (2Н, с), 7,73 (1Н, с).
Ссылочный пример получения 28-3
4-Бром-1-(хлорметил)-3-(пентафторэтил)-1Н-пиразол
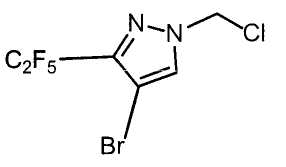
6,49 г 4-Бром-3-(пентафторпропил)-1Н-пиразол-1-илметанола растворяют в 60 мл дихлорметана. К раствору добавляют 3,2 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 6,84 г 4-бром-1-(хлорметил)-3-(пентафторпропил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,82 (2Н, с), 7,75 (1Н, с).
Ссылочный пример получения 29-1
4-(Трифторметил)-1Н-имидазол-1-илметанол
Смесь 1,80 г 4-(трифторметил)-1Н-имидазола, 0,78 г параформальдегида перемешивают при 140°С в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры добавляют ацетон. Смесь фильтруют и затем фильтрат концентрируют при пониженном давлении, получая при этом 2,16 г 4-(трифторметил)-1Н-имидазол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,39 (2Н, д), 7,44 (1Н, с), 7,61 (1Н, с).
Ссылочный пример получения 29-2
Гидрохлорид 1-(хлорметил)-4-(трифторметил)-1Н-имидазола
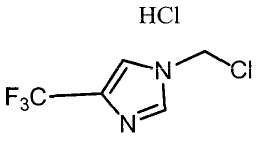
2,16 г 4-(Трифторметил)-1Н-имидазол-1-илметанола растворяют в 40 мл дихлорметана. К раствору добавляют 1,9 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении, получая при этом 2,90 г гидрохлорида 1-(хлорметил)-4-(трифторметил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 6,12 (2Н, с), 8,10 (1Н, с), 8,16 (1Н, с).
Ссылочный пример получения 30-1
3-Циано-1Н-индол-1-илметанол
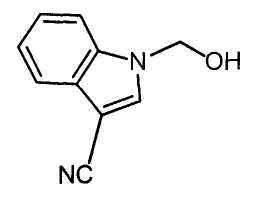
Смесь 1,42 г 3-циано-1Н-индола, 0,60 г параформальдегида и 0,1 г триэтиламина перемешивают при 130°С в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,69 г 3-циано-1Н-индол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 3,73 (1Н, ушир., с), 5,64 (2Н, д), 7,29-7,39 (2Н, м), 7,56-7,59 (1Н, м), 7,71-7,75 (2Н, м).
Ссылочный пример получения 30-2
1-(Хлорметил)-3-циано-1Н-индол
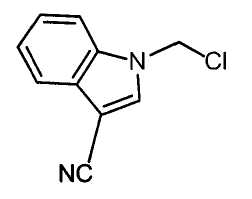
1,69 г 3-Циано-1Н-индол-1-илметанола растворяют в 30 мл дихлорметана. К раствору добавляют 1,4 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. Реакционную смесь концентрируют при пониженном давлении, получая при этом 70 г 1-(хлорметил)-3-циано-1Н-индола.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 6,44 (2Н, с), 7,34-7,48 (2Н, м), 7,64-7,74 (1Н, м), 7,83 (1Н, д), 8,47 (1Н, с).
Ссылочный пример получения 31-1
3-Формил-1Н-индол-1-илметанол
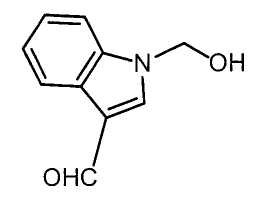
Смесь 5,81 г 3-формил-1Н-индола, 1,80 г параформальдегида и 0,40 г триэтиламина перемешивают при 120°С в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют и затем фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 3,08 г 3-формил-1Н-индол-1-илметанола.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 5,61 (2Н, д), 6,78 (1Н, т), 7,21-7,34 (2Н, м), 7,49 (1Н, д), 8,08 (1Н, д), 8,34 (1Н, с), 9,94 (1Н, с).
Ссылочный пример получения 31-2
1-(Хлорметил)-3-формил-1Н-индол
3,08 г 3-формил-1Н-индол-1-илметанола растворяют в 60 мл дихлорметана. К раствору добавляют 2,5 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. Реакционную смесь концентрируют при пониженном давлении, получая при этом 3,02 г 1-(хлорметил)-3-формил-1Н-индола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,99 (2Н, с), 7,35-7,52 (3Н, м), 7,81 (1Н, с), 7,83 (1Н, д), 8,32 (1Н, д), 10,05 (1Н, с).
Ссылочный пример получения 32-1
3-(Трифторацетил)-1Н-индол-1-илметанол
Смесь 4,80 г 3-(трифторацетил)-1Н-индола, 1,35 г параформальдегида и 0,10 г триэтиламина перемешивают при 130°С в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют ацетон. Смесь фильтруют и затем фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле и к остатку добавляют гексан, в результате образуется кристаллическое вещество. Кристаллическое вещество собирают, получая при этом 5,36 г 3-(трифторацетил)-1Н-индол-1-илметанола.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 5,71 (2Н, д), 6,92 (1Н, т), 7,36-7,43 (2Н, м), 7,76 (1Н, д), 8,19 (1Н, д), 8,31 (1Н, с).
Ссылочный пример получения 32-2
1-(Хлорметил)-3-(трифторацетил)-1Н-индол
5,36 г 3-(Трифторацетил)-1Н-индол-1-илметанола растворяют в 60 мл дихлорметана. К раствору добавляют 2,5 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. Реакционную смесь концентрируют при пониженном давлении и остаток перекристаллизовывают из смеси гексан-хлороформ, получая при этом 3,79 г 1-(хлорметил)-3-(трифторацетил)-1Н-индола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 6,00 (2Н, с), 7,30-7,57 (3Н, м), 8,05 (1Н, с), 8,39-8,41 (1Н, м).
Ссылочный пример получения 33-1
2-(4-Метоксибензил)-4-тиоцианато-2Н-пиразол-3-иламин
3,89 г Тиоцианата калия суспендируют в 40 мл метанола. В атмосфере азота эту суспензию охлаждают до -78°С. 1,76 г брома, который растворен в 40 мл метанола, добавляют по каплям к суспензии в течение периода 30 минут с последующим перемешиванием в течение 30 минут. Затем к ней по каплям в течение 10 минут добавляют 2,03 г 2-(4-метоксибензил)-2Н-пиразол-3-иламина, который растворен в 10 мл метанола, с последующим перемешиванием при -78°С в течение 1 часа и при комнатной температуре в течение 8 часов. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют воду и смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и затем концентрируют. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,54 г 2-(4-метоксибензил)-4-тиоцианато-2Н-пиразол-3-иламина.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 3,72 (3Н, с), 5,07 (2Н, с), 6,37 (2Н, ушир. с), 6,87 (2Н, д), 7,14 (2Н, д), 7,42 (1Н, с).
Ссылочный пример получения 33-2
4-{[5-Амино-1-(4-метоксибензил)-1Н-пиразол-4-ил]дитио}-1-(4-метоксибензил)-1Н-пиразол-5-амин
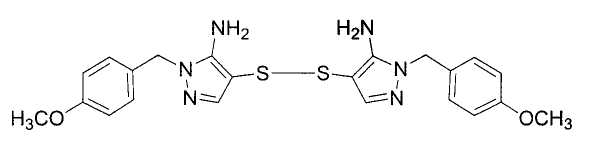
1,42 г 2-(4-Метоксибензил)-4-тиоцианато-2Н-пиразол-3-иламина добавляют к 20 мл 10% водного раствора гидроксида натрия и затем смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры, в результате чего образуется кристаллическое вещество. Кристаллическое вещество собирают фильтрованием. Кристаллы промывают 30 мл воды три раза. Кристаллы сушат при пониженном давлении, получая при этом 1,27 г 4-{[5-амино-1-(4-метоксибензил)-1Н-пиразол-4-ил]дитио}-1-(4-метоксибензил)-1Н-пиразол-5-амина.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 3,71 (6Н, с), 5,07 (4Н, с), 5,73 (4Н, ушир. с), 6,83 (4Н, д), 6,98 (2Н, с), 7,07 (4Н, д).
Ссылочный пример получения 33-3
4-{[Дихлорфторметил]тио}-1-(4-метоксибензил)-1Н-пиразол-5-амин
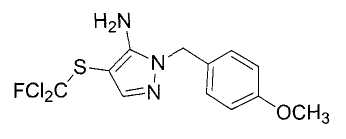
1,58 г 4-{[5-Амино-1-(4-метоксибензил)-1Н-пиразол-4-ил]дитио}-1-(4-метоксибензил)-1Н-пиразол-5-амин растворяют в 20 мл N,N-диметилформамида. К раствору при охлаждении льдом добавляют 20 мл воды, 1,42 г гидрокарбоната натрия и 2,93 г гидросульфита натрия. К смеси добавляют 5,28 г трихлорфторметана с последующим перемешиванием при комнатной температуре в течение 15 часов. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой, сушат над сульфатом натрия и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 1,04 г 4-{[дихлорфторметил]тио}-1-(4-метоксибензил)-1Н-пиразол-5-амина.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 3,79 (3Н, с), 3,99 (2Н, ушир. с), 5,16 (2Н, с), 6,86 (2Н, д), 7,11 (2Н, д), 7,52 (1Н, с).
Ссылочный пример получения 33-4
4-{[Дихлорфторметил]тио}-1-(4-метоксибензил)-1Н-пиразол

1,04 г 4-{[Дихлорфторметил]тио}-1-(4-метоксибензил)-1Н-пиразол-5-амина растворяют в 20 мл тетрагидрофурана. К раствору добавляют 1,55 г трет-бутилнитрита с последующим кипячением смеси с обратным холодильником в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляют воду и смесь экстрагируют диэтиловым эфиром. Органический слой промывают водой, сушат над сульфатом натрия и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,94 г 4-{[дихлорфторметил]тио}-1-(4-метоксибензил)-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 3,81 (3Н, с), 5,27 (2Н, с), 6,89 (2Н, д), 7,19 (2Н, д), 7,60 (1Н, с), 7,72 (1Н, с).
Ссылочный пример получения 33-5
4-{[Дихлорфторметил]тио}-1Н-пиразол
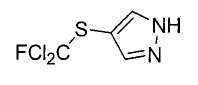
4-{[Дихлорфторметил]тио}-1-(4-метоксибензил)-1Н-пиразол растворяют в 6 мл трифторуксусной кислоты с последующим перемешиванием раствора при 65°С в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры к ней добавляют насыщенный водный раствор гидрокарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,19 г 4-{[дихлорфторметил]тио}-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 7,88 (2Н, с).
Ссылочный пример получения 33-6
4-{[Дихлорфторметил]тио}-1Н-пиразол-1-илметанол
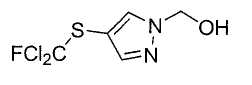
0,19 г 4-{[Дихлорфторметил]тио}-1Н-пиразола растворяют в 5 мл тетрагидрофурана. К раствору добавляют 5 мл 36% формальдегида в воде и 0,1 мл 10% гидроксида тетрабутиламмония в воде с последующим перемешиванием при комнатной температуре в течение 4 часов. К реакционной смеси добавляют воду и смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 0,22 г 4-{[дихлорфторметил]тио}-1Н-пиразол-1-илметанола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,57 (2Н, с), 7,77 (1Н, с), 7,90 (1Н, с).
Ссылочный пример получения 33-7
1-(Хлорметил)-4-{[дихлорфторметил)тио}-1Н-пиразол

0,22 г 4-{[Дихлорфторметил]тио}-1Н-пиразол-1-илметанола растворяют в 10 мл хлороформа. К раствору добавляют 0,3 мл тионилхлорида и смесь кипятят с обратным холодильником в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении, получая при этом 0,21 г 1-(хлорметил)-4-{[дихлорфторметил)тио}-1Н-пиразола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,88 (2Н, с), 7,79 (1Н, с), 7,92 (1Н, с).
Ссылочный пример получения 34-1
3-{[Дихлорфторметил]тио}-1Н-индол-1-илметанол
0,50 г 3-{[Дихлорфторметил]тио}-1Н-индола растворяют в 10 мл тетрагидрофурана. К раствору добавляют 10 мл 36% формальдегида в воде и 0,4 мл 10% гидроксида тетрабутиламмония в воде с последующим перемешиванием смеси при комнатной температуре в течение 30 минут. К реакционной смеси добавляют воду и смесь экстрагируют МТВЕ. Органический слой промывают водой, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 0,54 г 3-{[дихлорфторметил]тио}-1Н-индол-1-илметанола.
1Н-ЯМР (ДМСО-d6, ТМС, δ (м.д.)): 5,61 (2Н, д), 6,73 (1Н, т), 7,23-7,33 (2Н, м), 7,66-7,70 (2Н, м), 8,04 (1Н, с).
Ссылочный пример получения 34-2
1-(Хлорметил)-3-{[дихлорфторметил]тио}-1Н-индол
0,54 г 3-{[Дихлорфторметил]тио}-1Н-индол-1-илметанола растворяют в 10 мл хлороформа. К раствору добавляют 0,3 мл тионилхлорида и смесь кипятят с обратным холодильником в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении, получая при этом 0,61 г 1-(хлорметил)-3-{[дихлорфторметил]тио}-1Н-индола.
Ссылочный пример получения 35
1-Хлорметил-3-нитро-1Н-пиррол
Смешивают 840 мг 3-нитро-1Н-пиррола, 15 мл тетрагидрофурана и 15 мл 36% формальдегида в воде. При комнатной температуре добавляют 0,5 мл 10% гидроксида тетрабутиламмония в воде с последующим перемешиванием смеси при комнатной температуре в течение 30 минут. Реакционную смесь выливают в смесь лед-вода и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 1-гидроксиметил-3-нитро-1Н-пиррол.
Полученный 1-гидроксиметил-3-нитро-1Н-пиррол растворяют в 3 мл хлороформа и к раствору добавляют 3 мл тионилхлорида с последующим перемешиванием раствора при комнатной температуре в течение 1 часа. После охлаждения реакционной смеси до 0°С ее выливают в смесь лед-вода. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, получая при этом 620 мг 1-хлорметил-3-нитро-1Н-пиррола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,63 (2Н, с), 6,77-6,78 (2Н, м), 7,68-7,69 (1Н, м).
Ссылочный пример получения 36
1-Хлорметил-3-циано-4-трифторметил-1Н-пиррол
Смешивают 585 мг 3-циано-4-трифторметил-1Н-пиррола, 10 мл тетрагидрофурана и 10 мл 36% формальдегида в воде. К смеси при комнатной температуре добавляют 0,1 мл 10% гидроксида тетрабутиламмония в воде с последующим перемешиванием смеси при комнатной температуре в течение 30 минут. Реакционную смесь выливают в смесь лед-вода и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 1-гидроксиметил-3-циано-4-трифторметил-1Н-пиррол.
Полученный 1-гидроксиметил-3-циано-4-трифторметил-1Н-пиррол растворяют в 3 мл хлороформа и добавляют 3 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 1 часа. После охлаждения реакционной смеси до 0°С ее выливают в смесь лед-вода. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 800 мг 1-хлорметил-3-циано-4-трифторметил-1Н-пиррола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,62 (2Н, с), 7,21 (1Н, д), 7,39 (1Н, д).
Ссылочный пример получения 37
1-Хлорметил-4-трифторметил-3-этоксикарбонил-1Н-пиррол
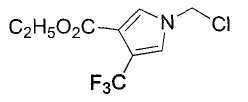
Смешивают 207 мг 4-трифторметил-3-этоксикарбонил-1Н-пиррола, 5 мл тетрагидрофурана и 5 мл 36% формальдегида в воде. К смеси при комнатной температуре добавляют 0,2 мл 10% гидроксида тетрабутиламмония в воде с последующим перемешиванием при комнатной температуре в течение 10 минут. Реакционную смесь выливают в смесь лед-вода и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом сырой продукт, 1-гидроксиметил-4-трифторметил-3-этоксикарбонил-1Н-пиррол.
Полученный 1-гидроксиметил-4-трифторметил-3-этоксикарбонил-1Н-пиррол растворяют в 3 мл хлороформа и добавляют 4 мл тионилхлорида с последующим кипячением с обратным холодильником в течение 30 минут. После охлаждения реакционной смеси до 0°С ее выливают в смесь лед-вода. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 225 мг 1-хлорметил-4-трифторметил-3-этоксикарбонил-1Н-пиррола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,35 (3Н, т), 4,31 (2Н, кв.), 5,64 (2Н, с), 7,17 (1Н, д), 7,51 (1Н, д).
Ссылочный пример получения 38
1-Хлорметил-3-циано-1Н-пиррол
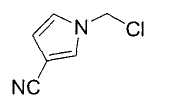
Смешивают 670 мг 3-циано-1Н-пиррола, 10 мл тетрагидрофурана и 10 мл 36% формальдегида в воде. При комнатной температуре добавляют 0,1 мл 10% гидроксида тетрабутиламмония в воде с последующим перемешиванием смеси при комнатной температуре в течение 30 минут. Реакционную смесь выливают в смесь лед-вода и общую смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении, получая при этом 1-гидроксиметил-3-циано-1Н-пиррол.
Полученный 1-гидроксиметил-3-циано-1Н-пиррол растворяют в 3 мл хлороформа, добавляют 2 мл тионилхлорида с последующим перемешиванием смеси при комнатной температуре в течение 1 часа. После охлаждения реакционной смеси до 0°С ее выливают в смесь лед-вода. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении и подвергают колоночной хроматографии на силикагеле, получая при этом 290 мг 1-хлорметил-3-циано-1Н-пиррола.
1Н-ЯМР (CDCl3, ТМС, δ (м.д.)): 5,66 (2Н, с), 6,46-6,47 (1Н, м), 6,84 (1Н, д), 7,32-7,33 (1Н, м).
Примеры препаратов приводятся ниже. Кроме того, «часть» означает массовую часть. Соединения настоящего изобретения обозначают их номерами, указанными выше.
Пример 1 препарата
9 частей каждого из соединений на от (1) до (48) настоящего изобретения растворяют в 37,5 части ксилола и 37,5 части диметилформамида и к раствору добавляют 10 частей полиоксиэтиленстирилфенилового простого эфира и 6 частей додецилбензолсульфоната кальция с последующим перемешиванием и тщательным смешиванием, получая при этом эмульгируемый концентрат каждого соединения.
Пример 2 препарата
К 40 частям каждого из соединений от (1) до (48) настоящего изобретения добавляют 5 частей SORPOL 5060 (зарегистрированное торговое название для TOHO KAGAKU KOGYO) с последующим хорошим перемешиванием смеси. К смеси добавляют 32 части CARPLEX #80 (зарегистрированное торговое название для SHIONOGI & Co., тонкоизмельченный порошок синтетического гидратированного оксида кремния) и 23 части диатомовой земли 300 меш с последующим перемешиванием смеси электрическим смесителем, получая при этом смачиваемый порошок для каждого соединения.
Пример 3 препарата
К 3 частям каждого из соединений от (1) до (48) настоящего изобретения добавляют 5 частей тонкоизмельченного порошка синтетического гидратированного оксида кремния, 5 частей додецилбензолсульфоната натрия, 30 частей бентонита и 57 частей глины с последующим хорошим перемешиванием и смешиванием смеси. Затем к этой смеси добавляют подходящее количество воды с последующим дополнительным перемешиванием, гранулированием гранулятором и сушкой на воздухе смеси, получая при этом гранулы каждого соединения.
Пример 4 препарата
4,5 частей каждого из соединений от (1) до (48) настоящего изобретения, 1 часть тонкоизмельченного порошка синтетического гидратированного оксида кремния, 1 часть Doriresu В (Sankyo Co., Ltd.) в качестве флоккулянта и 7 частей глины хорошо смешивают в ступке с последующим перемешиванием и смешиванием электрическим смесителем. К образовавшейся смеси добавляют 86,5 части комковой глины с последующим хорошим перемешиванием и смешиванием смеси, получая при этом дуст каждого соединения.
Пример 5 препарата
10 частей каждого из соединений от (1) до (48) настоящего изобретения, 35 частей белого угля, содержащего 50 частей аммониевой соли сульфата полиоксиэтиленалкилового простого эфира и 55 частей воды смешивают и измельчают способом мокрого измельчения, получая при этом препарат каждого соединения.
Пример 6 препарата
0,5 части каждого из соединений от (1) до (48) настоящего изобретения растворяют в 10 частях дихлорметана и образовавшийся раствор смешивают с 89,5 части Iso-Par М (изопарафин, зарегистрированное торговое название для EXXON CHEMICAL LTD), получая при этом масляный раствор.
Пример 7 препарата
0,1 части каждого из соединений от (1) до (48) настоящего изобретения и 49,9 части NEO-CHIOZOL (CHUO KASEI Co., LTD) загружают в баллон для аэрозоля и на баллоне закрепляют аэрозольный клапан. Затем в баллон помещают 25 частей диметилового простого эфира и 25 частей LPG с последующим встряхиванием баллона и установкой на нем пускателя с получением таким образом масляного аэрозоля.
Пример 8 препарата
0,6 части каждого из соединений от (1) до (48) настоящего изобретения, 0,01 части ВНТ, 5 частей ксилола, 3,39 части дезодорированного керосина и 1 часть эмульгатора [Atmos 300 (зарегистрированное торговое название для ATMOS CHEMICAL LTD)] смешивают и растворяют. Полученный раствор и 50 частей дистиллированной воды загружают в аэрозольный контейнер и на контейнере закрепляют клапан. 40 частей пропеллента (LPG) загружают под давлением через клапан, получая таким образом водный аэрозоль.
Нижеследующий пример испытания демонстрирует, что соединение настоящего изобретения обладает пестицидной активностью и может использоваться в качестве активного ингредиента композиции для борьбы с вредителями. Соединения настоящего изобретения обозначают их номерами, указанными выше.
Пример испытания 1
Препарат, полученный согласно примеру 5 препарата с применением соединения настоящего изобретения (2), (3), (4), (5), (6), (7), (8), (9), (11), (12), (13), (14), (15), (16), (18), (20), (21), (22), (26), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38), (39), (45) и (48) соответственно, разбавляли водой таким образом, чтобы концентрация активного ингредиента стала 500 м.д., получая таким образом пестицидный раствор для испытания.
Пятьдесят граммов формованного Bonsoru 2 (изготовлен Sumitomo Chemical Co., Ltd) помещали в полиэтиленовую чашку и в полиэтиленовой чашке высевали 10-15 семян риса. Затем растения риса выращивали до развития вторых листьев и затем нарезали на черенки одинаковой высоты 5 см. Пестицидный раствор для испытания, полученный выше, распыляли при норме 20 мл/чашку на эти растения риса. После того как пестицидный раствор, распыленный на растения риса, был высушен, их помещали в пластиковую чашку, затем тридцать личинок Nilaparvata lugens первой возрастной стадии развития помещали свободным образом на растениях риса с последующим покрытием пластиковой чашки крышкой для того, чтобы испытываемые вредители не убежали. Затем пластиковую чашку оставляли в теплице (25°С). На шестой день после высвобождения личинок Nilaparvata lugens подсчитывали число паразитарных Nilaparvata lugens на растениях риса.
В результате обработки каждым из соединений настоящего изобретения (2), (3), (4), (5), (6), (7), (8), (9), (11), (12), (13), (14), (15), (16), (18), (20), (21), (22), (26), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38), (39), (45) и (48) число паразитарных Nilaparvata lugens было не более 3.
Пример испытания 2
Препарат, полученный согласно примеру препарата 5 с применением соединения настоящего изобретения (2), (4), (6), (8), (9), (11), (12), (13), (15), (18), (21), (22), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38), (44), (46) и (47) соответственно, разбавляли водой таким образом, чтобы концентрация активного ингредиента стала 500 м.д., получая таким образом пестицидный раствор для испытания.
Полиэтиленовую чашку засевали огурцами и растения выращивали до развития первого настоящего листа, приблизительно двадцати Aphis gossypii давали возможность развиваться как паразитам на растениях. На следующий день на растения огурцов разбрызгивали указанный выше раствор для испытания при норме расхода 20 мл/чашку. На шестой день после нанесения подсчитывали число Aphis gossypii.
В результате этого при обработке каждым из соединений настоящего изобретения (2), (4), (6), (8), (9), (11), (12), (13), (15), (18), (21), (22), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38), (44), (46) и (47) число паразитарных насекомых было не более 3.
Пример испытания 3
Препарат, полученный согласно примеру препарата 5 с
применением соединения настоящего изобретения (2), (3), (4), (6), (7), (8), (11), (12), (13), (15), (16), (19), (20), (21), (22), (28), (29), (30), (31), (32), (33), (34), (36), (37), (38) и (39) соответственно, разбавляли водой таким образом, чтобы концентрация активного ингредиента стала 500 м.д., получая таким образом пестицидный раствор для испытания.
На дно полиэтиленовой чашки, имеющей диаметр 5,5 см, помещали фильтровальную бумагу, имеющую такой же диаметр, и на фильтровальную бумагу добавляли по каплям 0,7 мл указанного выше пестицидного раствора для испытания с последующим помещением на нее равномерно 30 мг сахарозы в качестве приманки. Десять самок Musca domestica взрослой стадии помещали свободным образом в полиэтиленовую чашку и чашку покрывали крышкой. Через 24 часа подсчитывали число выживших и мертвых Musca domestica и вычисляли процент мертвых насекомых.
В результате этого при обработке каждым из соединений настоящего изобретения (2), (3), (4), (6), (7), (8), (11), (12), (13), (15), (16), (19), (20), (21), (22), (28), (29), (30), (31), (32), (33), (34), (36), (37), (38) и (39) процент мертвых насекомых был 90% или больше.
Пример испытания 4
Препарат, полученный согласно примеру препарата 5 с применением соединения настоящего изобретения (2), (3), (4), (6), (7), (8), (9), (11), (12), (13), (15), (16), (18), (19), (20), (21), (22), (27), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38) и (43) соответственно, разбавляли водой таким образом, чтобы концентрация активного ингредиента стала 500 м.д., получая таким образом пестицидный раствор для испытания.
На дно полиэтиленовой чашки, имеющей диаметр 5,5 см, помещали фильтровальную бумагу, имеющую такой же диаметр, и на фильтровальную бумагу добавляли по каплям 0,7 мл указанного выше пестицидного раствора для испытания с последующим помещением на нее равномерно 30 мг сахарозы в качестве приманки. Двух самцов Blattella germanica взрослой стадии помещали свободным образом в полиэтиленовую чашку и чашку покрывали крышкой. Спустя 6 дней подсчитывали число выживших и мертвых Blattella germanica и вычисляли процент мертвых насекомых.
В результате этого при обработке каждым из соединений настоящего изобретения (2), (3), (4), (6), (7), (8), (9), (11), (12), (13), (15), (16), (18), (19), (20), (21), (22), (27), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38) и (43) процент мертвых насекомых был 100%.
Пример испытания 5
Препарат, полученный согласно примеру препарата 5 с применением соединения настоящего изобретения (1), (2), (3), (4), (5), (6), (7), (8), (9), (10), (11), (12), (13), (14), (15), (16), (17), (18), (19), (20), (21), (22), (23), (25), (27), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38), (39), (41), (44), (45), (46), (47) и (48) соответственно, разбавляли водой таким образом, чтобы концентрация активного ингредиента стала 500 м.д., получая таким образом пестицидный раствор для испытания.
0,7 мл указанного выше пестицидного раствора для испытания добавляли к 100 мл воды, пропущенной через ионообменник (концентрация активного ингредиента: 3,5 м.д.). Двадцать личинок Culex pipiens pallens последней возрастной стадии помещали в раствор. Спустя один день подсчитывали число выживших и мертвых Culex pipiens pallens и вычисляли процент мертвых вредителей.
В результате этого при обработке каждым из соединений настоящего изобретения (1), (2), (3), (4), (5), (6), (7), (8), (9), (10), (11), (12), (13), (14), (15), (16), (17), (18), (19), (20), (21), (22), (23), (25), (27), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38), (39), (41), (44), (45), (46), (47) и (48) процент мертвых вредителей был не меньше чем 95%.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Соединения настоящего изобретения обладают превосходной активностью в борьбе против вредителей и являются применимыми в качестве активного ингредиента пестицида.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ИЗОКСАЗОЛИНА И ГЕРБИЦИД, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2002 |
|
RU2286989C2 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДНОГО СОЕДИНЕНИЯ | 2008 |
|
RU2451681C2 |
| ИНГИБИТОР СВЯЗЫВАНИЯ СФИНГОЗИН-1-ФОСФАТА | 2007 |
|
RU2395499C2 |
| СОЕДИНЕНИЕ МАЛОНОНИТРИЛА В КАЧЕСТВЕ ПЕСТИЦИДА ДЛЯ БОРЬБЫ С ВРЕДИТЕЛЯМИ СЕЛЬСКОГО ХОЗЯЙСТВА | 2005 |
|
RU2347779C2 |
| СПОСОБ РЕГИОСЕЛЕКТИВНОГО СИНТЕЗА ПРОИЗВОДНЫХ 1-АЛКИЛ-3-ГАЛОГЕНАЛКИЛПИРАЗОЛ-4-КАРБОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2498978C2 |
| ИЗОКСАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И ГЕРБИЦИДЫ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2000 |
|
RU2237664C2 |
| ПРОИЗВОДНЫЕ 5,6-БИСАРИЛ-2-ПИРИДИНКАРБОКСАМИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ УРОТЕНЗИНА II | 2009 |
|
RU2497808C2 |
| СОЕДИНЕНИЯ МАЛОНОНИТРИЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПЕСТИЦИДОВ | 2002 |
|
RU2274638C2 |
| СОЕДИНЕНИЕ ПИРАЗИНА И СОДЕРЖАЩЕЕ ЕГО СРЕДСТВО ДЛЯ БОРЬБЫ С ЧЛЕНИСТОНОГИМИ ВРЕДИТЕЛЯМИ | 2016 |
|
RU2734971C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-([1,3]ДИОКСОЛАН-4-ИЛМЕТИЛ)-1Н-ПИРАЗОЛ-3-ИЛАМИНА | 2013 |
|
RU2621725C2 |
Изобретение относится к новым производным малононитрила формулы (I), которые могут найти применение для борьбы с насекомыми-вредителями. В формуле (I)
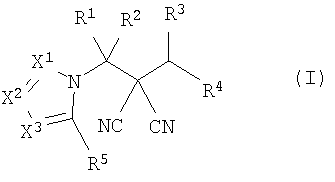
R1 представляет собой атом водорода; R2 представляет собой атом водорода;
R3 представляет собой атом водорода; R4 представляет собой С1-С5-алкильную группу, замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу; R5 представляет собой атом водорода, атом галогена, С1-С5-алкильную группу; по меньшей мере, одно из значений X1, X2 и X3 представляет собой CR6, а другие означают атомы азота; R6 представляет собой атом водорода, атом галогена, цианогруппу, нитрогруппу, формильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена,
С1-С5-алкилтиогруппу, замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу или группу (СН2)mQ, где m=0, a Q означает фенил; и в случае, когда один из R5 и R6 связан с двумя атомами в соседних положениях или два R6 связаны с двумя атомами в соседних положениях, они могут быть связаны друг с другом в концевых положениях с образованием С2-С6-алкандиильной группы или С4-С6-алкендиильной группы. Изобретение также относится к композиции и способу борьбы с насекомыми-вредителями. 4 н. и 7 з.п. ф-лы.
1. Производное малононитрила, представленное формулой (I):
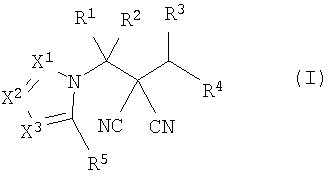
где в формуле R1 представляет собой атом водорода;
R2 представляет собой атом водорода;
R3 представляет собой атом водорода;
R4 представляет собой С1-С5-алкильную группу, замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкенильную группу;
R5 представляет собой атом водорода, атом галогена, С1-С5-алкильную группу;
по меньшей мере, одно из значений X1, X2 и X3 представляет собой CR6, а другие означают атомы азота;
R6 представляет собой атом водорода, атом галогена, цианогруппу, нитрогруппу, формильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, или группу (CH2)mQ, где m=0, а Q означает фенил; и
в случае, когда один из R5 и R6 связан с двумя атомами в соседних положениях или два R6 связаны с двумя атомами в соседних положениях, они могут быть связаны друг с другом в концевых положениях с образованием С2-С6-алкандиильной группы, или С4-С6-алкендиильной группы.
2. Производное малононитрила по п.1, которое представлено формулой (I-1):
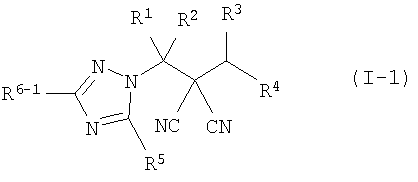
где в формуле R1, R2, R3 и R4 имеют такие же значения, как указаны в п.1;
R5 представляет собой атом водорода, атом галогена, или С1-С5-алкильную группу;
R6-1 представляет собой атом водорода, атом галогена, или С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена.
3. Производное малононитрила по п.1, которое представлено формулой (I-2):
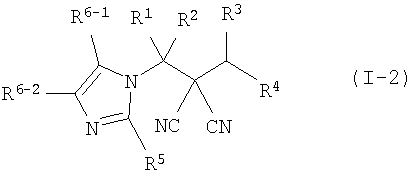
где в формуле R1, R2, R3 и R4 имеют такие же значения, как указаны в п.1;
R5 представляет собой атом водорода;
каждый из R6-1 и R6-2 представляет собой атом водорода, С1-С5-алкильную группу, замещенную, по меньшей мере, одним атомом галогена.
4. Производное малононитрила по п.1, которое представлено формулой (I-3):
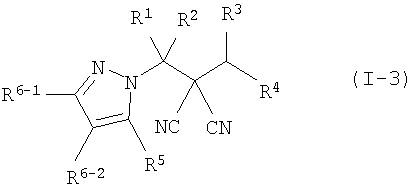
где в формуле
R1, R2, R3 и R4 имеют такие же значения, как указаны в п.1;
R5 представляет собой атом водорода, атом галогена или С1-С5-алкильную группу;
каждый из R6-1 и R6-2 представляет собой атом водорода, атом галогена, цианогруппу, нитрогруппу, формильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу, или фенильную группу.
5. Производное малононитрила по п.1, которое представлено формулой (I-4):
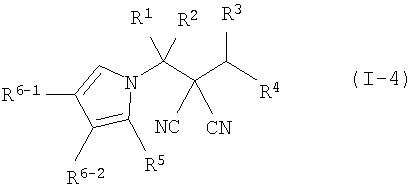
где в формуле
R1, R2, R3 и R4 имеют такие же значения, как указаны в п.1;
R5 представляет собой атом водорода, атом галогена, или С1-С5-алкильную группу;
каждый из R6-1 и R6-2 представляет собой атом водорода, атом галогена, цианогруппу, нитрогруппу, формильную группу, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С5-алкилтиогруппу, замещенную, по меньшей мере, одним атомом галогена, С2-С6-алкилкарбонильную группу, замещенную, по меньшей мере, одним атомом галогена, С2-С5-алкоксикарбонильную группу.
6. Производное малононитрила по любому из п.п.2-5, где
R5 представляет собой атом водорода;
каждый из R6-1 и R6-2 представляет собой атом водорода, атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С1-С5-алкилтиогруппу, замещенную, по меньшей мере, одним атомом галогена.
7. Производное малононитрила по любому из п.п.2-5, где
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой С1-С5-алкильную группу, замещенную, по меньшей мере, одним атомом галогена, или С2-С5-алкенильную группу;
каждый из R6-1 и R6-2 представляет собой атом водорода, атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С1-С5-алкилтиогруппу, замещенную, по меньшей мере, одним атомом галогена.
8. Производное малононитрила по любому из пп.2-5, где
R1, R2, R3 и R5 представляют собой атомы водорода;
R4 представляет собой 2,2,2-трифторэтильную группу или винильную группу;
каждый из R6-1 и R6-2 представляет собой атом водорода, атом галогена, С1-С5-алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С1-С5-алкилтиогруппу, замещенную, по меньшей мере, одним атомом галогена.
9. Композиция для борьбы с насекомыми-вредителями, включающая эффективное количество производного малононитрила по п.1 и носитель.
10. Способ борьбы с насекомыми-вредителями, включающий нанесение эффективного количества производного малононитрила по п.1 на насекомых-вредителей или места их обитания.
11. Применение производного малононитрила по п.1 в качестве агента для борьбы с вредителями.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Средство для борьбы с вредителями | 1977 |
|
SU793356A3 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| JP 2004099597 A, 02.04.2004. | |||
Авторы
Даты
2009-07-27—Публикация
2005-01-12—Подача