Изобретение относится к медицине, а именно к фармацевтической химии и фармакологии, и может быть использовано для создания новых корректоров гемореологических нарушений.
Прототипом и препаратом сравнения является пентоксифиллин (3,7-диметил-1-(5-оксогексил)ксантин, Aventis, Германия), который длительное время используется в клинике как корректор реологических нарушений (Н.Hikiami, Н.Goto, N.Sekiya [et al.] // Phytomedicine. - 2003. - Vol.10, №6-7. - P. 459-466).
Задачей изобретения является расширение арсенала биологически активных веществ, обладающих гемореологической активностью.
Технический результат - получение веществ, обладающих выраженной гемореологической активностью.
Сущность изобретения: производные 3-метил-7-(тиетанил-3)-ксантина (Ia, b, с, d) формулы
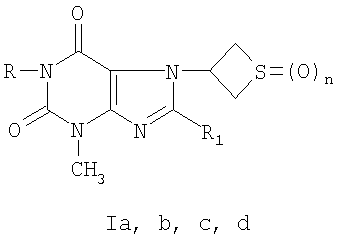
где R=С2Н5, 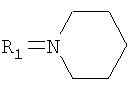 , n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=Н, R1=SCH2CONHNH2, n=0(Ic); R=Н, R1=SCH2CONHNH2, n=2(Id), обладающие гемореологической активностью.
, n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=Н, R1=SCH2CONHNH2, n=0(Ic); R=Н, R1=SCH2CONHNH2, n=2(Id), обладающие гемореологической активностью.
Заявляемые соединения синтезируют следующим образом.
Соединение Ia синтезировали из 8-бром-3-метил-7-(тиетанил-3)-ксантина (Алкилирование производных ксантина и бензимидазола эпитио-хлоргидрином. / Ф.А.Халиуллин, В.А.Катаев, Ю.В.Строкин // Химия гетероцикл. соединений. - 1991. - №4. - С.516-518) в 3 стадии. Взаимодействием 8-бром-3-метил-7-(тиетанил-3)ксантина с йодистым этилом получали 8-бром-3-метил-7-(тиетанил-3)-1-этилксантин. Окислением атома серы тиетанового цикла 2-кратным мольным избытком перекиси водорода в среде ледяной уксусной кислоты синтезировали 8-бром-3-метил-7-(1-оксо-тиетанил-3)-1-этилксантин, при кипячении которого с 3-кратным мольным избытком пиперидина в этаноле образуется 3-метил-8-пиперидино-7-(тиетанил-3)-1-этилксантин.
Соединение Ib образуется при алкилировании 8-бром-3-метил-7-(тиетанил-3)ксантина йодистым пропилом и окислении полученного 8-бром-3-метил-1-пропил-7-(тиетанил-3)ксантина под действием 2-кратного мольного избытка перекиси водорода в среде ледяной уксусной кислоты.
Соединение Ic синтезировали в 3 стадии. Взаимодействием 8-бром-3-метил-7-(тиетанил-3)ксантина с тиогликолевой кислотой получали 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусную кислоту, из которой синтезировали этиловый эфир 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты при кипячении в среде этанола в присутствии концентрированной серной кислоты. При взаимодействии последнего с 10-кратным мольным избытком гидразин-гидрата образуется гидразид 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты.
Соединение Id образуется в 4 стадии. Окислением 8-бром-3-метил-7-(тиетанил-3)ксантина 10-кратным мольным избытком перекиси водорода получали 8-бром-3-метил-7-(1,1-диоксотиетанил-3)ксантин, при взаимодействии которого с тиогликолевой кислотой образуется 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусная кислота. При кипячении последней в среде этанола в присутствии концентрированной серной кислоты получали этиловый эфир 2-[3-метил-7-(1,1-диоксотиетанил-3)-ксантинил-8-тио]уксусной кислоты. Взаимодействием полученного эфира с 5-кратным мольным избытком гидразин-гидрата синтезировали гидразид 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты.
Пример 1. Синтез соединения Ia
К раствору 0,67 г (12 ммоль) гидроксида калия в 4 мл воды добавляют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина. В полученную смесь добавляют 80 мл диметилформамида и 1,87 г (12 ммоль) йодистого этила. Перемешивают при комнатной температуре в течение 4 часов. Осадок отфильтровывают, промывают водой, сушат. Фильтрат разбавляют водой до выпадения осадка, выпавший осадок отфильтровывают, промывают водой, сушат. Осадки соединяют, получают 3,05 г (88%) 8-бром-3-метил-7-(тиетанил-3)-1-этилксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, при нагревании в этаноле. Тпл. 223-225°С.
Элементный анализ.
Найдено, %: С 38,2 Н 3,7 N 16,3 - C11H13BrN4O2S
Вычислено, %: С 38,3 Н 3,8 N 16,2
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1,24 (3Н, т, J 7,02 Гц, СН3), 3,23-3,34 (2Н, м, S(CH)2), 3,51 (3Н, с, 3-NCH3), 4,10 (2Н, кв, J 7,02 Гц, 1-NCH2), 4,31-4,42 (2Н, м, S(CH)2), 5,90-6,06 (1Н, м, NCH).
Спектр ЯМР 13С (CDCl3), δ,. м.д.: 13,11 (СН3), 29,75 (3-NCH3), 34,80 (S(CH2)2), 37,07 (1-NCH2), 52,92 (NCH), 109,26; 126,63; 149,01; 150,57; 153,72 (углероды ксантина).
Раствор 1,73 г (5 ммоль) 8-бром-3-метил-7-(тиетанил-3)-1-этилксантина и 1,13 г (10 ммоль) 30%-ного раствора перекиси водорода в 40 мл ледяной уксусной кислоты выдерживают при комнатной температуре в течение 1,5 часов. Нейтрализуют концентрированным раствором аммиака при температуре не выше 15°С до рН 7. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 0,88 г (49%) 8-бром-3-метил-7-(1-оксотиетанил-3)-1-этилксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, этаноле, при нагревании в воде. Тпл. 233-234°С.
Элементный анализ.
Найдено, %: С 36,5 Н 3,5 N 15,8 - С11Н13BRN4O3S
Вычислено, %: С 36,6 Н 3,6 N 15,5
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1,25 (3Н, т, J 7,04 Гц, СН3), 3,41-3,52 (2Н, м, S(CH)2), 3,55 (3Н, с, 3-NCH3), 4,09 (2Н, кв, J 7,04 Гц, 1-NCH2), 4,28-4,39 (2Н, м, S(CH)2), 6,43-6,57 (1Н, м, NCH).
Раствор 1,08 г (3 ммоль) 8-бром-3-метил-7-(1-оксотиетанил-3)-1-этилксантина и 0,77 г (9 ммоль) пиперидина в 30 мл этанола кипятят в течение 5 часов. Охлаждают, выпавший осадок отфильтровывают, промывают этанолом, водой, сушат. Получают 0,75 г (68%) соединения Ia. Очищают кристаллизацией из этанола. Тпл. 209-210°С.
Элементный анализ.
Найдено, %: С 52,2 Н 6,4 N 19,2 - С16Н23N5O3S
Вычислено, %: С 52,6 Н 6,3 N 19,2
ИК-спектр (вазелиновое масло), ν, см-1: 1064,8 (S=O вал.), 1612,3; 1648,8; 1690,0 (С=С вал., C=N вал., СО вал.).
Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в разведенной хлористо-водородной кислоте, хлороформе, диметилформамиде, этаноле, при нагревании в воде.
Пример 2. Синтез соединения Ib
К раствору 0,67 г (12 ммоль) гидроксида калия в 4 мл воды добавляют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина. В полученную смесь добавляют 80 мл диметилформамида и 2,04 г (12 ммоль) йодистого пропила. Перемешивают при комнатной температуре в течение 4 часов. Разбавляют водой до выпадения осадка. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 3,02 г (84%) 8-бром-3-метил-1-пропил-7-(тиетанил-3)ксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, при нагревании в этаноле. Тпл. 223-225°С.
Элементный анализ.
Найдено, %: С 40,3 Н 4,3 N 15,5 - C12H15BrN4O2S
Вычислено, %: С 40,1 Н 4,2 N 15,6
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0,98 (3Н, т, J 7,00 Гц, СН3), 1,63-1,78 (2Н, м, CH2), 3,28-3,37 (2Н, м, S(CH)2), 3,55 (3Н, с, 3-NCH3), 4,00-4,07 (2Н, м, 1-NCH2), 4,36-4,46 (2Н, м, S(СН)2), 5,94-6,09 (1Н, м, NCH).
Раствор 1,80 г (5 ммоль) 8-бром-3-метил-1-пропил-7-(тиетанил-3)-ксантина и 1,13 г (10 ммоль) 30%-ного раствора перекиси водорода в 30 мл ледяной уксусной кислоты выдерживают при комнатной температуре в течение 1,5 часов. Нейтрализуют концентрированным раствором аммиака при температуре не выше 15°С до рН 7. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 0,97 г (52%) соединения Ib. Очищают кристаллизацией из этанола. Тпл. 215-216°С.
Элементный анализ.
Найдено, %: С 38,4 Н 3,7 N 14,8 - C12H15BrN4O3S
Вычислено, %: С 38,4 Н 4,0 N 14,9
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0,96 (3Н, т, J 7,44 Гц, СН3), 1,60-1,74 (2Н, м, СН2), 3,40-3,51 (2Н, м, S(CH)2), 3,55 (3Н, с, 3-NCH3), 3,92-4,01 (2Н, м, 1-NCH2), 4,28-4,39 (2Н, м, S(CH)2), 6,42-6,57 (1Н, м, NCH).
Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, хлороформе, диметилформамиде, при нагревании в этаноле.
Пример 3. Синтез соединения Ic
К 100 мл воды добавляют 1,68 г (30 ммоль) гидроксида калия, приливают 1,84 г (20 ммоль) тиогликолевой кислоты, к полученному раствору прибавляют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина, кипятят 1,5 часа. Затем раствор охлаждают до комнатной температуры, добавляют разведенную хлористо-водородную кислоту до рН 3, выпавший осадок отфильтровывают, промывают водой, сушат. Получают 2,75 г (84%) 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из воды. Белое кристаллическое вещество, растворимое в диметилсульфоксиде, диметилформамиде, растворе гидроксида калия, при нагревании в воде. Тпл. 236-238°С с разложением.
Элементный анализ.
Найдено, %: С 40,1 Н 3,6 N 17,2 - C11H12N4O4S2
Вычислено, %: С 40,2 Н 3,7 N 17,1
Спектр ЯМР 1H (DMSO-D6), δ, м.д.: 3,21-3,38 (5Н, м, NCH3, S(CH)2), 4,08 (2Н, с, SCH2), 4,13-4,28 (2Н, м, S(CH)2), 5,71-5,88 (1Н, м, NCH), 11,14 (1H, c, NH).
К суспензии 1,64 г (5 ммоль) 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты в 80 мл безводного этанола добавляют 3,0 мл концентрированной серной кислоты в 20 мл безводного этанола. Полученную суспензию кипятят в течение 3 часов. Осадок отфильтровывают, промывают водой, сушат. Получают 1,37 г (77%) этилового эфира 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворимое в этаноле, хлороформе, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде. Тпл. 226-228°С.
Элементный анализ.
Найдено, %: С 43,7 Н 4,4 N 15,8 - C13H16N4O4S2
Вычислено, %: С 43,8 Н 4,5 N 15,7
Спектр ЯМР 1Н (DMSO-D6), δ, м.д.: 1,30 (3Н, т, J 7,10 Гц, ССН3), 3,28-3,42 (2Н, м, S(CH)2), 3,49 (3Н, с, NCH3), 4,08 (2Н, с, SCH2), 4,24 (2Н, кв, J 7,10 Гц, ОСН2), 4,32-4,43 (2Н, м, S(CH)2), 5,81-5,97 (1Н, м, NCH), 8,67 (1H, c, NH).
К суспензии 0,89 г (2,5 ммоль) этилового эфира 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты в 90 мл этанола добавляют 1,46 г (25 ммоль) 55%-ного раствора гидразин-гидрата в 10 мл этанола. Полученную суспензию кипятят 7 часов. Осадок отфильтровывают, промывают этанолом, сушат. Получают 0,70 г (82%) соединения 1с. Очищают кристаллизацией из воды. Тпл. 221-223°С.
Элементный анализ.
Найдено, %: С 38,5 Н 4,0 N 24,3 - C11H14N6O3S2
Вычислено, %: С 38,6 Н 4,1 N 24,5
Спектр ЯМР 1Н (DMSO-D6), δ, м.д.: 3,21-3,42 (м, NCH3, S(CH)2), 3,93 и 4,33 (2Н, два с, SCH2(Z и Е)), 4,12-4,22 (2Н, м, S(CH)2), 4,32 и 4,55 (2Н, два с, NH2(Z и Е)), 4,33 (с, SCH2), 5,72-5,91 (1Н, м, NCH), 8,75 и 9,34 (1Н, два с, NH(E и Z)), 11,27 (1Н, м, NH-ксантинового бицикла).
Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде.
Пример 4. Синтез соединения Id
При нагревании растворяют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина в 50 мл ледяной уксусной кислоты. Затем добавляют 11,34 г (100 ммоль) 30%-ного раствора перекиси водорода небольшими порциями. Смесь кипятят 0,5 часа. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 2,05 г (59%) 8-бром-3-метил-7-(1,1-диоксотиетанил-3)ксантина. Очищают кристаллизацией из диметилформамида. Белое кристаллическое вещество, растворяется в диметилсульфоксиде, растворе гидроксида калия, при нагревании в диметилформамиде. Тпл.>280°С с разложением.
Элементный анализ.
Найдено, %: С 30,9 Н 2,5 N 16,2 - C9H9BrN4O4S
Вычислено, %: С 31,0 Н 2,6 N 16,1
ИК-спектр (вазелиновое масло), ν, см-1: 1160; 1320 (SO2 вал.), 1620; 1710; 1730 (С=С вал., C=N вал., С=О вал.), 3160 (NH вал.).
К 100 мл воды добавляют 1,68 г (30 ммоль) гидроксида калия, приливают 1,84 г (20 ммоль) тиогликолевой кислоты, к полученному раствору прибавляют 3,49 г (10 ммоль) 8-бром-3-метил-7-(1,1-диоксотиетанил-3)-ксантина, кипятят 1 час. Затем раствор охлаждают до комнатной температуры, добавляют разведенную хлористо-водородную кислоту до рН 3, выпавший осадок отфильтровывают, промывают водой, сушат. Получают 3,2 г (92%) 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из смеси этанол-вода (объемное соотношение 1:1). Белое кристаллическое вещество, растворимое в диметилсульфоксиде, диметилформамиде, растворе гидроксида калия, при нагревании в воде. Тпл. 276-278°С с разложением.
Элементный анализ.
Найдено, %: С 36,6 Н 3,5 N 15,7 - С11Н12N4O6S2
Вычислено, %: С 36,7 Н 3,4 N 15,6
ИК-спектр (вазелиновое масло), ν, см-1: 1170; 1340 (SO2 вал.), 1625; 1690; 1710; 1740 (C=Свал., C=Nвал., C=Овал.), 3160 (NHвал.).
К суспензии 1,80 г (5 ммоль) 2-[3-метил-7-(1,1-диоксотиетанил-3)-ксантинил-8-тио]уксусной кислоты в 80 мл безводного этанола добавляют 4,5 мл концентрированной серной кислоты в 30 мл безводного этанола. Полученную суспензию кипятят в течение 7 часов. Осадок отфильтровывают, промывают этанолом, водой, сушат. Получают 1,70 г (88%) этилового эфира 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворимое в этаноле, хлороформе, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде. Тпл. 266-268°С с разложением.
Элементный анализ.
Найдено, %: С 40,1 Н 4,1 N 14,3 - C13H16N4O6S2
Вычислено, %: С 40,2 Н 4,2 N 14,4
Спектр ЯМР 1H (DMSO-D6), δ, м.д.: 1,18 (3Н, т, J 7,10 Гц, ССН3), 3,31 (3Н, с, NCH3), 4,07-4,19 (4Н, м, SCH2, ОСН2), 4,49-4,63 (2Н, м, S(СН)2), 4,96-5,11 (2Н, м, S(CH)2), 5,30-5,46 (1Н, м, NCH), 8,32 (1H, с, NH).
К суспензии 1,94 г (5 ммоль) этилового эфира 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты в 90 мл этанола добавляют 1,46 г (25 ммоль) 55%-ного раствора гидразингидрата в 10 мл этанола. Полученную суспензию кипятят 7 часов. Осадок отфильтровывают, промывают этанолом, сушат. Получают 1,81 г (97%) соединения Id. Очищают кристаллизацией из воды. Тпл. 247-248°С с разложением.
Элементный анализ.
Найдено, %: С 35,2 Н 3,6 N 22,4 - С11Н14N6O5S2
Вычислено, %: С 35,3 Н 3,8 N 22,5
Спектр ЯМР 1Н (DMSO-D6), δ, м.д.: 3,34 (3Н, с, NCH3), 3,89 и 4,32 (2Н, два с, SCH2 (Z и Е)), 4,48-4,62 (2Н, м, S(СН)2), 4,97-5,11 (2Н, м, S(CH)2), 5,42-5,57 (1Н, м, NCH), 8,73 и 9,34 (1Н, два с, NH (E и Z)); 11,39 (1Н, с, NH-ксантинового бицикла).
Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде.
Острая токсичность заявляемых соединений.
Острую токсичность определяли на крысах при внутривенном введении. Гибель животных регистрировали в течение двух недель. Расчет величины LD50 производили по методу Прозоровского (Прозоровский В.Б. и соавт. // Фармакол. и токсикол. - 1978. - №4. - С.497-502.). Результаты представлены в таблице 1.
Гемореологическая активность.
Гемореологическую активность заявляемых соединений изучали методом воспроизведения нарушений реологических свойств крови in vitro. Синдром повышенной вязкости крови моделировали с помощью гипертермии (Плотников М.Б., Колтунов А.А., Алиев О.И. // Бюлл. эксп.биол. и мед. - 1996. - №9. - С.274-275.) с использованием крови кроликов. Заявляемые соединения и препарат сравнения в концентрациях 10, 50, 100 и 500 мкмоль/л добавляли в пробы за 10 минут до начала инкубации. В контрольные образцы добавляли 10 мкл теплого (37°С) физиологического раствора (0,89%-ный раствор хлорида натрия). Вязкость проб крови измеряли в сантипуазах (сПз) до и после инкубации на вискозиметре АКР-2 (Rus-Can Research Ltd., Россия), принцип действия которого основан на методе ротационной вискозиметрии со свободно плавающим цилиндром-ротором (Добровольский Н.А., Лопухин Ю.М., Парфенов А.С.[и др.] // Реологические исследования в медицине: сб. науч. тр. - М.: НЦХ РАМН, 1998. - С.45-51.). Влияние веществ на агрегацию эритроцитов оценивали по индексу агрегации, рассчитываемому как отношение вязкости крови при скорости сдвига 3 с-1 к вязкости крови при 100 с-1 (Dintenfass L. // Aging. - 1989. - №1. - Р.99-125.). Расчет ингибирующего влияния заявляемых соединений на агрегацию эритроцитов проводили по формуле:
ИнАЭ=100-(В/А)·100%,
где ИнАЭ - индекс ингибирования агрегации эритроцитов;
А - индекс агрегации эритроцитов без изучаемого соединения;
В - индекс агрегации эритроцитов после инкубации суспензии с изучаемым соединением.
Заявляемые соединения в исследуемых концентрациях вызывали статистически значимое по сравнению с контролем снижение индекса ингибирования агрегации эритроцитов (табл.2). Для соединений Ia, Ib, Ic, Id величина гемореологического эффекта превышает активность препарата сравнения. Наибольшая величина эффекта наблюдается для соединения Id в концентрации 100 мкмоль/л.
При определении величины эффективной концентрации (ЕС20), вызывающей снижение индекса ингибирования агрегации эритроцитов на 20% (табл.2) (Духанин А.С., Губаева Ф.Р. // Эксперим. и клинич. фармакология. - 1998. - №4. - С.66-71.), установлено, что заявляемые соединения Ia, Ib, Ic и Id превосходят препарат сравнения в 1,71, 1,46, 2,85 и 4,27 раза соответственно.
В качестве объективного показателя условной широты терапевтического действия использовали условный терапевтический индекс (УТИ), который рассчитывали делением показателя острой токсичности LD50 на показатель эффективной концентрации ЕС20. УТИ для соединения Ia равен 4,45, соединения Ib - 6,22, Ic - 5,84, Id -8,23, пентоксифиллина - 1,92. По величине УТИ заявляемые соединения Ia, Ib, Ic и Id превосходят препарат сравнения в 2,32, 3,24, 3,04 и 4,29 раза соответственно.
Таким образом, представленные химические соединения (Ia, b, с, d) обладают большей гемореологической активностью, чем пентоксифиллин, являясь менее токсичными веществами.
ПРОИЗВОДНЫЕ 3-МЕТИЛ-7-(ТИЕТАНИЛ-3)КСАНТИНА, ОБЛАДАЮЩИЕ ГЕМОРЕОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ
** - отличие от контроля достоверно (р<0,01);
*** - отличие от контроля достоверно (р<0,001).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2-[1-(1,1-ДИОКСОТИЕТАНИЛ-3)-1,2,4-ТРИАЗОЛИЛ-5-ТИО]УКСУСНОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ГЕМОРЕОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2339632C1 |
| ЦИКЛОГЕКСИЛАММОНИЕВАЯ СОЛЬ 2-[3-МЕТИЛ-7-(1,1-ДИОКСОТИЕТАНИЛ-3)-1-ЭТИЛКСАНТИНИЛ-8-ТИО]УКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩАЯ АНТИТРОМБОЭМБОЛИЧЕСКОЕ ДЕЙСТВИЕ | 2012 |
|
RU2504546C1 |
| 3-МЕТИЛ-8-ПИПЕРАЗИНО-7-(ТИЕТАНИЛ-3)-1-ЭТИЛКСАНТИНА ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ АНТИАГРЕГАЦИОННУЮ И ДЕЗАГРЕГАЦИОННУЮ АКТИВНОСТЬ | 2009 |
|
RU2404181C1 |
| СОЛИ [3-МЕТИЛ-1-Н-ПРОПИЛ-7-(1,1-ДИОКСОТИЕТАНИЛ-3)КСАНТИНИЛ-8-ТИО]УКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ ПРОАГРЕГАНТНУЮ АКТИВНОСТЬ | 2011 |
|
RU2459825C1 |
| ПРОИЗВОДНЫЕ ТИЕТАНСОДЕРЖАЩИХ 1-БУТИЛ-3-МЕТИЛКСАНТИНОВ, ПРОЯВЛЯЮЩИЕ АНТИОКСИДАНТНУЮ АКТИВНОСТЬ | 2020 |
|
RU2740926C1 |
| Производные 1-(3,5-ди-трет-бутил-4-гидроксибензил)изатина, обладающие антиагрегационной активностью | 2023 |
|
RU2822271C1 |
| ГИДРОХЛОРИДЫ 1-АЛКИЛ-3-МЕТИЛ-8-ПИПЕРАЗИНО-7-(ТИЕТАНИЛ-3)КСАНТИНА, ПРОЯВЛЯЮЩИЕ АНТИТРОМБОТИЧЕСКИЙ ЭФФЕКТ ПОСРЕДСТВОМ БЛОКИРОВАНИЯ РЕЦЕПТОРОВ ТРОМБОЦИТОВ ГП IIb-IIIa | 2017 |
|
RU2640579C1 |
| 5(6)-НИТРО-1-(1,1-ДИОКСОТИЕТАНИЛ-3)-2-ХЛОРБЕНЗИМИДАЗОЛ, ПРОЯВЛЯЮЩИЙ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2225401C1 |
| ЦИКЛОГЕКСИЛАММОНИЕВАЯ СОЛЬ [3-МЕТИЛ-1-Н-ПРОПИЛ-7-(1-ОКСОТИЕТАНИЛ-3)КСАНТИНИЛ-8-ТИО]УКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩАЯ АНТИТРОМБОТИЧЕСКУЮ АКТИВНОСТЬ | 2011 |
|
RU2459826C1 |
| КАЛИЕВАЯ СОЛЬ 2-[5(6)-НИТРО-1-(ТИЕТАНИЛ-3)-БЕНЗИМИДАЗОЛИЛ-2-ТИО]УКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩАЯ КАРДИОТОНИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2225866C1 |
Изобретение относится к фармацевтической химии и фармакологии и касается новых производных 3-метил-7-(тиетанил-3)ксантина формул Ia, b, с, d. Соединения по изобретению обладают большей гемореологической активностью, чем пентоксифиллин, являясь менее токсичными. Технический результат - получение новых, неописанных ранее производных 3-метил-7-(тиетанил-3)ксантина формул Ia, b, с, d, обладающих гемореологической активностью. 2 табл.
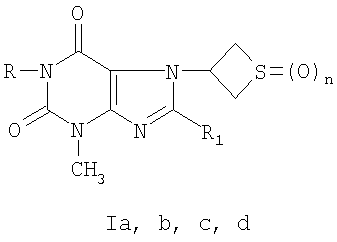
где R=C2H5, R1=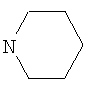 , n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).
, n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).
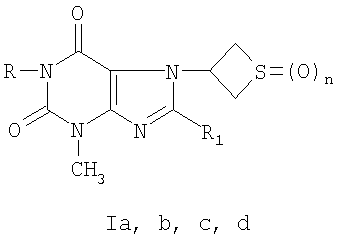
где R=C2H5, R1=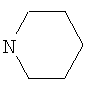 , n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).
, n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).
| Пастушенко Е.В | |||
| и др | |||
| Изучение комплексообразования ряда производных тиетанилксантина и тиетанилбензимидазола с переходными металлами, Башкирский химический журнал, 2004, т.11, №2, 66-68 | |||
| Токунова Э.Ф | |||
| и др | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Халиуллин | |||
Авторы
Даты
2008-02-10—Публикация
2006-12-26—Подача