ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет на основании предварительной заявки США № 60/899070, поданной 1 февраля 2007 г., и предварительной заявки США № 61/000540, поданной 25 октября 2007 г. Все содержание вышеуказанных заявок включено в данное описание в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Рак молочной железы является наиболее распространенным типом рака среди женского населения Западных стран, в США он поражает более 180000 женщин каждый год. Заболевание возникает в молочной железе, которая имеет разветвленную систему протоков. Каждая молочная железа, или грудная железа, содержит от 15 до 20 сегментов, называемых долями, причем каждая доля содержит ряд разветвленных потоков, выходящих в сосок. Эпителиальные клетки, выстилающие каждый проток, отвечают за продукцию молока. Полагают, что инвазивный рак молочной железы возникает в нормальном эпителии конечного элемента протока/доли в результате ряда увеличивающихся аномальных пролиферативных повреждений. Когда опухоль приобретает способность к метастазированию, клетки рака молочной железы распространяются в другие органы, что значительно затрудняет лечение. Чаще всего участками метастазов рака молочной железы являются легкие, печень и кости. Метастазы в костях обычно связаны с сильной болью, разрежением костей и повышением риска переломов. Многие антиэстрогенные терапии, используемые для лечения рака молочной железы, также связаны с разрежением костей.
У пациентов с диагнозом рак молочной железы первичную опухоль обычно удаляют с помощью хирургической операции и/или лучевой терапии, после чего проводят вспомогательную терапию, чтобы воздействовать на все раковые клетки, которые могли распространиться в отдаленные участки. К вспомогательной терапии относится цитотоксическая химиотерапия и/или эндокринная терапия. Хотя химиотерапия эффективна при лечении разных типов злокачественных заболеваний, многие противоопухолевые соединения вызывают нежелательные побочные эффекты. Кроме того, многие опухоли не отвечают на химиотерапию и эндокринную терапию или приобретают устойчивость к ним. Хотя вспомогательная терапия снижает процент смертности среди пациентов с раком молочной железы, коэффициент 10-летней выживаемости среди пациентов с наиболее распространенными гистопатологическими типами инвазивного рака молочной железы составляет пока только 35-50% (Weigelt et al. 2005 Nat. Rev. Cancer 5: 591-602). Кроме того, многие женщины, которые могли бы подвергаться только локальному лечению, в случае плохого прогноза необязательно получают вспомогательную терапию.
Следовательно, для лечения рака молочной железы требуются более действенные и эффективные молекулярные мишени. Альтернативные способы лечения, которые являются менее токсичными и/или более эффективными, чем химиотерапия и эндокринная терапия, улучшают режимы лечения и повышают выживание. Кроме того, в клинике можно использовать средства, пригодные для профилактического лечения пациентов с риском развития инвазивного или метастатического рака молочной железы. Следовательно, целью настоящего изобретения является предоставление альтернативных композиций и способов лечения рака молочной железы, или подавления или предотвращения развития рака молочной железы у пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Отчасти настоящее изобретение относится к применению антагонистов активина, а также антагонистов ActRIIa для лечения или профилактики рака молочной железы, или разрежения костей, связанного с раком молочной железы. В частности, данное описание предлагает способы лечения или профилактики рака молочной железы с использованием растворимой формы ActRIIa, которая действует как ингибитор активина. Хотя растворимый ActRIIa может воздействовать на рост или выживание раковых клеток посредством механизма, отличного от антагонизма по отношению к активину, целевые терапевтические средства можно выбирать на основе антагонизма по отношению к активину, или антагонизма по отношению ActRIIa, или и того, и другого. Такие средства имеют общее название антагонисты активина-ActRIIa. Следовательно, в некоторых воплощениях описание предлагает способы применения антагонистов активина-ActRIIa, включающих в себя, например, активин-связывающие полипептиды ActRIIa, антитела против активина, антитела против ActRIIa, активин- или ActRIIa-направленные малые молекулы и аптамеры, и нуклеиновые кислоты, которые уменьшают экспрессию активина и ActRIIa, для лечения или профилактики рака молочной железы у пациентов, нуждающихся в этом. Как описано в патентной заявке США № 11/603485, включенной в данное описание в качестве ссылки, антагонисты активина-ActRIIa можно использовать для стимулирования роста костей и увеличения плотности костей. Как описано в данном документе, такие антагонисты также можно использовать для лечения или профилактики рака молочной железы, метастазов рака молочной железы в костях и разрежения костей, связанного с раком молочной железы.
В некоторых аспектах изобретение предлагает способы лечения или профилактики рака молочной железы с помощью полипептидов, в том числе растворимого активин-связывающего полипептида ActRIIa, который связывается с активином. На основе полипептидов ActRIIa можно получить фармацевтическую композицию, содержащую активин-связывающий полипептид ActRIIa и фармацевтически приемлемый носитель. Активин-связывающий полипептид ActRIIa может связываться с активином с KD, составляющей менее 1 микромоля, или менее 100, 10 или 1 наномоля. Активин-связывающий полипептид ActRIIa может селективно связываться с активином по сравнению с GDF11 и/или GDF8, причем KD при связывании с активином может быть, по меньшей мере, в 10, 20 или 50 раз ниже, чем при связывании с GDF11 и/или GDF8. Без связи с каким-либо конкретным механизмом действия полагают, что данная степень селективности в отношении ингибирования активина по сравнению с ингибированием GDF11/GDF8 объясняет влияние на кости, или выживание, или рост опухолевых клеток при отсутствии сопутствующего детектируемого воздействия на мышцы. Во многих воплощениях выбирают полипептид ActRIIa, влияние которого на мышцы составляет менее 15%, менее 10% или менее 5% при использовании доз, обеспечивающих желательное воздействие на раковые клетки. Чистота композиции, определяемая методом эксклюзионной хроматографии, может составлять, по меньшей мере, 95% по отношению к другим полипептидным компонентам, и необязательно чистота композиции может составлять, по меньшей мере, 98%. Для получения такой композиции можно использовать любой описанный в данном документе активин-связывающий полипептид ActRIIa, такой как полипептид, имеющий аминокислотную последовательность, выбранную из SEQ ID NO:2, 3, 7 или 12, или имеющий аминокислотную последовательность, которая, по меньшей мере, на 80%, 85%, 90%, 95%, 97% или 99% идентична аминокислотной последовательности, выбранной из SEQ ID NO:2, 3, 7, 12 или 13. Активин-связывающий полипептид ActRIIa может включать в себя функциональный фрагмент природного полипептида ActRIIa, такой как фрагмент, содержащий, по меньшей мере, 10, 20, 30, 50, 90 или более аминокислот последовательности, выбранной из SEQ ID NO:1-3, или последовательности SEQ ID NO:2, утратившей от 10 до 15 C-концевых аминокислот ("хвост").
Растворимый активин-связывающий полипептид ActRIIa может содержать одно или более изменений в аминокислотной последовательности (например, в лиганд-связывающем домене) по сравнению с природным полипептидом ActRIIa. Примеры изменений полипептида ActRIIa приведены в WO 2006/012627, стр. 59-60, который включен в данное описание в качестве ссылки. Изменение аминокислотной последовательности может приводить, например, к изменению гликозилирования полипептида, продуцирующегося в клетке млекопитающего, насекомого или в другой эукариотической клетке, или к изменению протеолитического расщепления полипептида по сравнению с природным полипептидом ActRIIa.
Активин-связывающий полипептид ActRIIa может представлять собой слитый белок, один домен которого представляет собой полипептид ActRIIa (например, лиганд-связывающий фрагмент ActRIIa), а один или более других доменов представляют собой фрагменты, придающие желательные свойства, например, улучшающие фармакокинетику, упрощающие очистку, повышающие способность достигать конкретные ткани и др. Например, домен слитого белка может улучшать один или более факторов, включающих в себя стабильность in vivo, период полужизни in vivo, поглощение/введение, тканевую локализацию или тканевое распределение, образование белковых комплексов, мультимеризацию слитого белка и/или очистку. Активин-связывающий слитый белок ActRIIa может содержать домен Fc иммуноглобулина (дикого типа или мутантный), или сывороточный альбумин, или фрагмент другого полипептида, который обеспечивает желательные свойства, такие как улучшенная фармакокинетика, повышенная растворимость или повышенная стабильность. В предпочтительном воплощении гибрид ActRIIa-Fc содержит относительно неструктурированный линкер, расположенный между доменом Fc и внеклеточным доменом ActRIIa. Данный неструктурированный линкер может соответствовать неструктурированному участку С-конца внеклеточного домена ActRIIa, содержащему примерно 15 аминокислот ("хвост"), или он может представлять собой искусственную последовательность, содержащую 1, 2, 3, 4 или 5 аминокислот, или составляющую в длину от 5 до 15, 20, 30, 50 или более аминокислот, которая соответственно не имеет вторичной структуры, или он может представлять собой смесь указанных фрагментов. Линкер может быть обогащен остатками глицина и пролина и может содержать, например, одинарную последовательность остатка треонина/серина и остатков глицина, или повторяющиеся последовательности остатка треонина/серина и остатков глицина (например, синглеты или повторы TG4 или SG4). Слитый белок может содержать последовательность, облегчающую очистку, такую как эпитопный маркер, маркер FLAG, полигистидиновая последовательность и слияние GST. Растворимый полипептид ActRIIa необязательно содержит один или несколько остатков модифицированных аминокислот, выбранных из: гликозилированной аминокислоты, пэгилированной аминокислоты, фарнезилированной аминокислоты, ацетилированной аминокислоты, биотинилированной аминокислоты, аминокислоты, конъюгированной с липидным фрагментом, и аминокислоты, конъюгированной с органическим дериватизирующим средством. Фармацевтический препарат также может содержать одно или несколько дополнительных соединений, таких как соединение, используемое для лечения костного нарушения. Предпочтительно фармацевтический препарат практически не содержит пирогенов. Как правило, белок ActRIIa предпочтительно экспрессируют в клеточной линии млекопитающих, которая обеспечивает соответствующее природное гликозилирование белка, позволяющее уменьшить вероятность нежелательного иммунного ответа у пациента. Успешно применяются человеческие клеточные линии и клеточные линии CHO, предположительно можно использовать другие традиционные экспрессионные системы млекопитающих. Кроме того, дрожжевые клетки, а также клетки других типов можно подвергнуть генетическим изменениям, обеспечивающим способность клеток экспрессировать ферменты млекопитающих, которые катализируют гликозилирование, в результате чего гликозилирование белков, экспресируемых в данных клетках, отличных от клеток млекопитающих, проходит в строго контролируемом режиме гликозилирования млекопитающих. Указанные рекомбинантные клеточные линии также можно использовать для экспрессии белков, описанных в данном документе.
Как описано в данном документе, белки ActRIIa, обозначаемые ActRIIa-Fc (форма с минимальным линкером между фрагментом ActRIIa и фрагментом Fc), обладают желательными свойствами, включающими в себя селективное связывание с активином по сравнению с GDF8 и/или GDF11, высокое сродство связывания лиганда и период полужизни у животных моделей, превышающий две недели. В некоторых воплощениях изобретение предлагает способы лечения или профилактики рака молочной железы с помощью полипептидов ActRIIa-Fc и фармацевтических препаратов, содержащих такие полипептиды и фармацевтически приемлемый наполнитель.
В некоторых аспектах изобретение предлагает способы лечения или профилактики рака молочной железы с помощью нуклеиновых кислот, кодирующих растворимый активин-связывающий полипептид ActRIIa. Выделенный полинуклеотид может содержать последовательность, кодирующую растворимый активин-связывающий полипептид ActRIIa, такой как описано выше. Например, выделенная нуклеиновая кислота может содержать последовательность, кодирующую внеклеточный домен (например, лиганд-связывающий домен) ActRIIa, и последовательность, кодирующую частично или полностью трансмембранный домен и/или цитоплазматический домен ActRIIa, кроме стоп-кодона, располагающегося в трансмембранном домене или цитоплазматическом домене, или между внеклеточным доменом и трансмембранным или цитоплазматическим доменом. Например, выделенный полинуклеотид может содержать полноразмерную последовательность полинуклеотида ActRIIa, такую как SEQ ID NO:4 или 5, или ее частично укороченную версию, причем указанный выделенный полинуклеотид может дополнительно содержать кодон терминации транскрипции, располагающийся на расстоянии, по меньшей мере, шестисот нуклеотидов от 3'-конца, или таким образом, чтобы после трансляции полинуклеотида внеклеточный домен был необязательно сопряжен с укороченным фрагментом полноразмерного ActRIIa. Предпочтительной нуклеотидной последовательностью является SEQ ID NO:14. Нуклеиновые кислоты, используемые в соответствии с описанными в данном документе способами, могут быть функционально связаны с промотором, обеспечивающим экспрессию, и изобретение также предлагает клетки, трансформированные такими рекомбинантными полинуклеотидами. Предпочтительно клетка представляет собой клетку млекопитающего, такую как клетка яичника китайского хомячка (CHO).
Изобретение также предлагает способы получения растворимого активин-связывающего полипептида ActRIIa, который можно использовать для лечения или профилактики рака молочной железы. Такой способ может включать в себя экспрессию любой из нуклеиновых кислот (например, SEQ ID NO:4, 5 или 14), раскрытых в данном описании, в подходящей клетке, такой как клетка CHO. Такой способ может включать в себя: a) культивирование клетки в условиях, подходящих для экспрессии растворимого полипептида ActRIIa, где указанная клетка трансформирована конструкцией, обеспечивающей экспрессию растворимого ActRIIa; и b) выделение экспрессированного растворимого полипептида ActRIIa. Растворимый полипептид ActRIIa можно выделить в виде частично очищенных фракций, или фракций с высокой степенью очистки. Очистку можно проводить в несколько стадий, включающих в себя, например, одну, две, три или более из перечисленных ниже стадий, используемых в любом порядке: хроматография на белке A, анионообменная хроматография (например, на сефарозе Q), хроматография с использованием гидрофобных взаимодействий (например, на фенилсефарозе), гель-хроматография и катионообменная хроматография.
В некоторых аспектах описанный в данном документе антагонист активина-ActRIIa, такой как растворимый активин-связывающий полипептид ActRIIa, можно использовать в способе лечения, профилактики или ингибирования рака молочной железы у субъекта, в том чиисле, например, в способах замедления появления рака молочной железы, подавления развития рака молочной железы, уменьшения размера опухоли, предотвращения роста опухоли, замедления появления метастазов или профилактики метастазов, в том числе в кости. В некоторых воплощениях изобретение предлагает способы уменьшения или подавления роста или выживания клеток рака молочной железы у пациентов, нуждающихся в этом. Способ может включать в себя введение субъекту, нуждающемуся в этом, эффективного количества антагониста активина-ActRIIa. В некоторых аспектах изобретение предлагает применение антагонистов активина-ActRIIa для получения лекарственного средства для лечения или профилактики рака молочной железы, как описано в данном документе. Изобретение также относится к комбинированным терапиям, включающим в себя применение антагониста активина-ActRIIa вместе с лучевой терапией, химиотерапией (например, с использованием цитотоксического средства) и/или эндокринной терапией. Антагонист может представлять собой слитый белок ActRIIa-Fc, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность, которая, по меньшей мере, на 90% идентична аминокислотной последовательности SEQ ID NO:3.
В других воплощениях настоящее изобретение относится к способам профилактики или замедления появления рака молочной железы у пациентов, имеющих один или несколько факторов риска рака молочной железы. В некоторых воплощениях изобретение относится к способам профилактики или замедления появления метастатического заболевания у пациентов с диагнозом первичная опухоль молочной железы или пролиферативное поражение молочной железы. Способ профилактики или замедления появления рака молочной железы у пациента-человека может включать в себя введение пациенту-человеку, нуждающемуся в этом, эффективного количества полипептида, выбранного из группы, состоящей из: a) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:2; b) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:3; и c) полипептида, содержащего, по меньшей мере, 50 последовательных аминокислот, выбранных из SEQ ID NO:2.
Другие воплощения данного изобретения относятся к способу ингибирования активин-опосредованного сигнального пути у пациента-человека, страдающего от рака молочной железы. В некоторых воплощениях данный способ включает в себя введение пациенту-человеку эффективного количества антагониста активина-ActRIIa. В других воплощениях антагонист представляет собой полипептид, выбранный из группы, состоящей из: a) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:2; b) полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:3; и c) полипептид, содержащий, по меньшей мере, 50 последовательных аминокислот, выбранных из SEQ ID NO:2.
В некоторых аспектах изобретение предлагает способ идентификации средства, которое подавляет рост или выживание раковых клеток (например, клеток рака молочной железы). Данный способ включает в себя: a) идентификацию тестируемого средства, которое связывается с активином или лиганд-связывающим доменом полипептида ActRIIa; и b) определение влияния средства на пролиферацию, выживание или апоптоз раковых клеток.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 показана очистка ActRIIa-hFc, экспрессированного в клетках CHO. Очищенный белок имеет один, четко определенный пик, визуализированный с помощью колонки для определения размера (левая панель) и SDS-PAGE с окрашиванием Кумасси (правая панель) (левая линия: стандарты с определенной молекулярной массой; правая линия: ActRIIa-hFc).
На фигуре 2 показаны результаты анализа связывания ActRIIa-hFc с активином и GDF-11 методом BiaCoreTM.
На фигуре 3 показано, что обработка ActRIIa-mFc значительно уменьшает образование метастатических повреждений у мышиной модели метастатического рака молочной железы. Визуализацию мышей проводят неинвазивным способом (флуоресцентная визуализация под анестезией) через пять недель после внутрисердечного введения клеток рака молочной железы MDA-MB-231, экспрессирующих люциферазу. Видимые метастатические повреждения наблюдаются у 12 из 14 мышей, обработанных средой, и только у 4 из 12 мышей, обработанных ActRIIa-mFc.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Обзор
Суперсемейство трансформирующих факторов роста-бета (TGF-beta) включает в себя ряд факторов роста, которые содержат элементы и структурные мотивы с одинаковыми последовательностями. Известно, что данные белки оказывают биологическое действие на широкий ряд клеток как позвоночных, так и беспозвоночных. Члены данного суперсемейства выполняют важные функции в процессе эмбрионального развития, участвуя в формировании структуры и тканевой специализации, и могут влиять на ряд процессов дифференциации, включающих в себя адипогенез, миогенез, хондрогенез, кардиогенез, гемопоэз, нейрогенез и дифференциацию эпителиальных клеток. Это семейство подразделяется на две основные ветви: BMP/GDF и TGF-бета/активин, члены которых оказывают разное, зачастую взаимодополняющее действие. Изменение активности члена семейства TGF-бета зачастую приводит к значительным физиологическим изменениям в организме. Например, породы крупного рогатого скота Piedmontese и Belgian Blue несут мутацию с потерей функции в гене GDF8 (также называемом миостатин), которая вызывает значительное увеличение мышечной массы. Grobet et al., Nat Genet. 1997, 17(l):71-4. Кроме того, у людей неактивные аллели GDF8 связаны с повышенной мышечной массой и, по имеющимся данным, с исключительной силой. Schuelke et al., N Engl J Med 2004, 350:2682-8.
Активины представляют собой димерные полипептидные факторы роста, принадлежащие к суперсемейству TGF-бета. Существуют три основные формы активина (A, B и AB), которые представляют собой гомо/гетеродимеры двух близкородственных субъединиц β (βAβA, βBβB и βAβB соответственно). Человеческий геном также кодирует активин C и активин E, которые, в основном, экспрессируются в печени, кроме того, известны гетеродимерные формы, содержащие βc или βE. Активины, входящие в состав суперсемейства TGF-β, представляют собой уникальные и полифункциональные факторы, которые могут стимулировать продукцию гормонов в клетках яичников и плаценты, поддерживать жизнеспособность нервных клеток, положительно или отрицательно, в зависимости от типа клеток, влиять на развитие клеточного цикла и индуцировать мезодермальную дифференциацию, по меньшей мере, у эмбрионов амфибий (DePaolo et al., 1991, Proc Soc Ep Biol Med. 198:500-512; Dyson et al., 1997, Curr Biol. 7:81-84; Woodruff, 1998, Biochem Pharmacol. 55:953-963). Кроме того, показано, что активин B участвует в регуляции дифференциации эпителиальных клеток молочной железы у мышей (Robinson and Hennighausen, 1997 Development 124: 2701-2708). В некоторых тканях сигнальный путь активина подавляется под действием родственного гетеродимера, ингибина. Например, в процессе высвобождения фолликулстимулирующего гормона (FSH) из гипофиза активин стимулирует секрецию и синтез FSH, а ингибин препятствует секреции и синтезу FSH. Другие белки, способные регулировать биоактивность активина и/или связываться с активином, включают в себя фоллистатин (FS), фоллистатин-родственный (FSRP) и α2-макроглобулин.
Сигналы TGF-β опосредуются гетеродимерными комплексами серин/треонинкиназных рецепторов типа I и типа II, которые после стимуляции лигандом фосфорилируют и активируют нижестоящие белки Smad (Massague, 2000, Nat. Rev. Mol. Cell Biol. 1:169-178). Указанные рецепторы типа I и типа II представляют собой трансмембранные белки, состоящие из лиганд-связывающего внеклеточного домена, содержащего участок, обогащенный цистеином, трансмембранного домена и цитоплазматического домена, обладающего ожидаемой специфичностью к серин/треонину. Рецепторы типа I участвуют в передаче сигнала; а рецепторы типа II нужны для связывания лигандов и для экспрессии рецепторов типа I. Рецепторы активина типов I и II образуют стабильные комплексы после связывания с лигандом с последующим фосфорилированием рецепторов типа I под действием рецепторов типа II.
Два родственных рецептора типа II, ActRIIa и ActRIIb, были идентифицированы как рецепторы активинов типа II (Mathews and Vale, 1991, Cell 65:973-982; Attisano et al., 1992, Cell 68: 97-108). Помимо активинов, ActRIIa и ActRIIb могут биохимически взаимодействовать с некоторыми другими белками семейства TGF-β, включающими в себя BMP7, Nodal, GDF8 и GDF11 (Yamashita et al., 1995, J. Cell Biol. 130:217-226; Lee and McPherron, 2001, Proc. Natl. Acad. Sci. 98:9306-9311; Yeo and Whitman, 2001, Mol. Cell 7: 949-957; Oh et al., 2002, Genes Dev. 16:2749-54). ALK4 является основным рецептором типа I активинов, в особенности, активина A, а ALK-7 также может служить рецептором активинов, в особенности, активина B.
Как описано в данном документе, растворимый полипептид ActRIIa (sActRIIa), который более предпочтительно связывается с активином A, чем с другими членами семейства TGF-β, такими как GDF8 или GDF11, можно использовать для лечения или профилактики рака, в особенности, рака молочной железы. Без связи с каким-либо конкретным механизмом, полагают, что эффект sActRIIa обусловлен, в первую очередь, антагонистическим действием по отношению к активину, причем очень сильное связывание активина (константа диссоциации на пикомолярном уровне) обеспечивается конкретной конструкцией sActRIIa, используемой в данных исследованиях. Антагонисты активина-ActRIIa включают в себя, например, активин-связывающие растворимые полипептиды ActRIIa, антитела, способные связываться с активином (в особенности, с субъединицами активина A или B, также называемыми βA или βB) и нарушать связывание с ActRIIa, антитела, способные связываться с ActRIIa и нарушать связывание с активином, отличные от антител белки, выбранные по способности связываться с активином или ActRIIa (примеры таких белков, а также способов их получения и отбора можно найти, например, в WO/2002/088171, WO/2006/055689 и WO/2002/032925), рандомизированные пептиды, выбранные по способности связываться с активином или ActRIIa, зачастую гибридизованные с доменом Fc. Два разных белка (или других фрагмента), обладающие способностью связывать активин или ActRIIa, в особенности, активин-связывающие средства, которые блокируют участки связывания типа I (например, растворимый рецептор активина типа I) и типа II (например, растворимый рецептор активина типа II) соответственно, можно соединить с получением бифункциональной связывающей молекулы. Также можно использовать аптамеры нуклеиновых кислот, малые молекулы и другие средства, ингибирующие сигнальный путь активин-ActRIIa. Разные белки обладают антагонистической активностью по отношению к активину-ActRIIa, в том числе ингибин (т.е. альфа-субъединица ингибина), хотя ингибин необратимо подавляет активность активина не во всех тканях, фоллистатин (например, фоллистатин-288 и фоллистатин-315), FSRP, активин C, альфа(2)-макроглобулин и мутантная форма активина A M108A (замена метионина на аланин в положении 108). Как правило, альтернативные формы активина, особенно с изменениями в связывающем домене рецептора типа I, могут связываться с рецепторами типа II и не могут образовывать активный трехкомпонентный комплекс, действуя, таким образом, как антагонисты. Кроме того, в качестве антагонистов активина-ActRIIa можно использовать нуклеиновые кислоты, такие как антисмысловые молекулы, siРНК или рибозимы, которые ингибируют активин A, B, C или E, или, предпочтительно, экспрессию ActRIIa. Используемый антагонист активина-ActRIIa может обладать селективностью в отношении ингибирования активин-опосредуемого сигнального пути по сравнению с другими членами семейства TGF-бета, в особенности, такими как GDF8 и GDF11. Растворимые белки ActRIIb связываются с активином, однако белок дикого типа не обладает значительной селектичностью связывания с активином по сравнению с GDF8/11. Тем не менее, такие полипептиды ActRIIb, а также измененные формы ActRIIb с разными связывающими свойствами (см., например, WO 2006/012627, pp. 55-59, включенный в данное описание в качестве ссылки) могут оказывать желательное действие на раковые клетки. Природному или измененному ActRIIb можно придать дополнительную специфичность к активину путем присоединения второго, активин-селективного связывающего средства.
Термины, упоминающиеся в данном описании в контексте настоящего изобретения и в конкретном контексте, в котором применяется каждый термин, имеют значения, традиционно используемые в данной области. Некоторые термины обсуждаются ниже и на протяжении описания, чтобы дополнительно разъяснить практикующему специалисту описание композиций и способов данного изобретения, а также получения и применения композиций. Объем или значение какого-либо термина зависят от контекста, в котором используется данный термин.
Термины "примерно" или "приблизительно", как правило, относятся к приемлемой степени ошибки количественных измерений, связанной с природой или точностью измерений. Обычно величина ошибки находится в пределах, например, 20 процентов (%), предпочтительно, 10% и более предпочтительно, 5% от заданного значения или интервала значений.
Альтернативно, в особенности в применении к биологическим системам, термины "примерно" и "приблизительно" могут относиться к значениям, находящимся, предпочтительно, в 5-кратном диапазоне, более предпочтительно, в 2-кратном диапазоне относительно заданного значения. Если не указано иначе, многочисленные количественные значения, приведенные в данном описании, являются приблизительными, то есть термины "примерно" и "приблизительно" могут подразумеваться, даже если они специально не указаны.
Способы данного изобретения могут включать в себя стадии сравнения последовательностей, например, последовательности дикого типа с одной или несколькими мутантными последовательностями (вариантами последовательности). Такое сравнение обычно включает в себя выравнивание полимерных последовательностей, например, с помощью программ и/или алгоритмов для выравнивания последовательностей, хорошо известных в данной области (например, BLAST, FASTA и MEGALIGN, а также многие другие). Опытным специалистам хорошо известно, что, если мутация включает в себя вставку или делецию остатка, при таком выравнивании последовательностей вводится "пробел" (обычно обозначаемый прочерком или "A") в полимерной последовательности, не содержащей вставленного или удаленного остатка.
Термин "гомологичный", во всех грамматических формах и вариантах написания, относится к взаимосвязи двух белков, имеющих "единое эволюционное происхождение", включающих в себя белки из суперсемейств организмов одного вида, а также гомологичные белки из организмов разных видов. Такие белки (и кодирующие их нуклеиновые кислоты) обладают гомологией последовательностей, что отражается в подобии их последовательностей, которое выражается либо в виде процента идентичности, либо в виде присутствия конкретных остатков или мотивов и консервативных положений.
Термин "подобие последовательностей" во всех его грамматических формах относится к степени идентичности или соответствия нуклеотидных или аминокислотных последовательностей, которые могут иметь или не иметь единое эволюционное происхождение.
Однако при традиционном использовании и в настоящей заявке термин "гомологичный" в сочетании с таким наречием, как "высоко", может относиться к подобию последовательностей и может быть связан или не связан с единым эволюционным происхождением.
Термин "рак молочной железы" относится к любому пролиферативному поражению или пролиферативной аномалии молочной железы, которые включают в себя, например, доброкачественные поражения, предраковые и раковые поражения, солидные опухоли и метастатические заболевания (как с локальным метастазированием, например, на стадии III, так и с более широким метастазированием, например, на стадии IV). Рак молочной железы включает в себя, без ограничения, такие заболевания, как аденокарцинома, дольковую (мелкоклеточную) карциному, внутрипротоковую карциному, медуллярный рак молочной железы, слизеобразующий рак молочной железы, канальцевый рак молочной железы, папиллярный рак молочной железы, болезнь Педжета и воспалительный рак молочной железы. Рак молочной железы также связан с заболеваниями других органов, таких как легкие, печень и кости, которые возникают вследствие метастатического поражения молочной железы. Рак молочной железы также охватывает гормонозависимые и гормононезависимые опухоли. Обычно гормононезависимый рак молочной железы характеризуется отсутствием или пониженными уровнями рецепторов эстрогена и/или прогестерона, такой рак, как правило, является устойчивым к антигормональной (в особенности, антиэстрогенной) терапии. Рак молочной железы также классифицируют на основе экспрессии Her2, причем опухоли Her2+ имеют более плохой прогноз, чем опухоли Her2-.
2. Полипептиды ActRIIa
В некоторых аспектах настоящее изобретение относится к способам лечения или профилактики рака молочной железы с помощью полипептидов ActRIIa. В данном описании термин "ActRIIa" относится к семейству белков-рецепторов активина типа IIa (ActRIIa) любых видов, а также к вариантам, полученным из таких белков ActRIIa в результате мутагенеза или другой модификации. Упоминание ActRIIa в данном описании следует понимать как упоминание любой из идентифицированных в настоящее время форм. Члены семейства ActRIIa обычно представляют собой трансмембранные белки, состоящие из лиганд-связывающего внеклеточного домена, содержащего обогащенный цистеином участок, трансмембранного домена и цитоплазматического домена с ожидаемой серин/треонинкиназной активностью.
Термин "полипептид ActRIIa" охватывает полипептиды, включающие в себя любые природные полипептиды из семейства ActRIIa, а также любые их варианты (в том числе мутанты, фрагменты, слияния и пептидомиметики), сохраняющие полезную активность. См., например, WO/2006/012627. Например, полипептид ActRIIa включает в себя полипептид, полученный из последовательности любого известного ActRIIa и имеющий последовательность, по меньшей мере, примерно на 80% идентичную последовательности полипептида ActRIIa, и, необязательно, идентичную, по меньшей мере, на 85%, 90%, 95%, 97%, 99% или больше. Например, полипептид ActRIIa данного изобретения может связываться и ингибировать функцию белка ActRIIa и/или активина. Полипептид ActRIIa можно выбрать по способности ингибировать пролиферацию или выживание раковых клеток in vivo. Примеры полипептида ActRIIa включают в себя предшественник человеческого полипептида ActRIIa (SEQ ID NO:1) и растворимый человеческий полипептид ActRIIa (например, SEQ ID NO:2, 3, 7 и 12).
Предшественник человеческого ActRIIa имеет следующую белковую последовательность:

Сигнальный пептид подчеркнут одной чертой; внеклеточный домен выделен жирным шрифтом, а потенциальные участки N-связанного гликозилирования подчеркнуты двойной чертой.
Растворимая (внеклеточная), процессированная полипептидная последовательность человеческого ActRIIa:
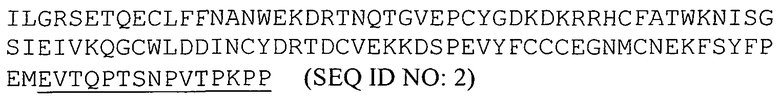
Следует отметить, что N-концевая последовательность, начинающаяся с "ILG...", была определена экспериментально и отличается от N-концевой последовательности "AIL...", которая обычно приводится в литературе. C-концевой "хвост" внеклеточного домена подчеркнут. Последовательность с делецией "хвоста" (последовательность Δ15):

Нуклеотидная последовательность, кодирующая человеческий белок-предшественник ActRIIa (нуклеотиды 164-1705 последовательности из Genbank № NM_001616):

Нуклеотидная последовательность, кодирующая человеческий растворимый (внеклеточный) полипептид ActRIIa:
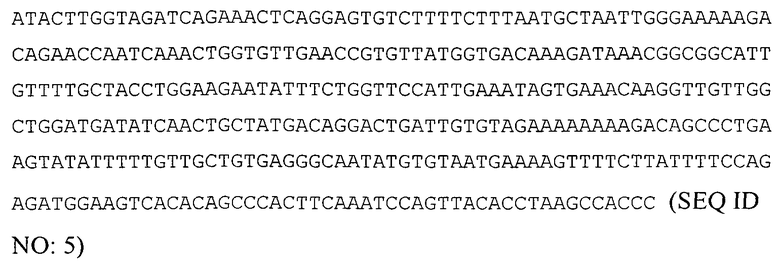
В конкретном воплощении изобретение относится к способам лечения или профилактики рака молочной железы с помощью растворимого полипептида ActRIIa. Как описано в данном документе, термин "растворимый полипептид ActRIIa" обычно относится к полипептидам, содержащим внеклеточный домен белка ActRIIa. Термин "растворимый полипептид ActRIIa" в данном описании включает в себя любой природный внеклеточный домен белка ActRIIa, а также все его варианты (в том числе мутанты, фрагменты и пептидомиметические формы). Активин-связывающий полипептид ActRIIa представляет собой полипептид, сохраняющий способность связываться с активином, в том числе, например, с активином AA, AB, BB, или с формами, содержащими субъединицу C или E. Необязательно активин-связывающий полипептид ActRIIa связывается с активином AA с константой диссоциации 1 нМ или менее. Внеклеточный домен белка ActRIIa связывается с активином и, как правило, является растворимым, следовательно, его можно назвать растворимый, активин-связывающий полипептид ActRIIa. Примеры растворимого, активин-связывающего полипептида ActRIIa включают в себя растворимый полипептид, описанный как SEQ ID NO:2, 3, 7, 12 и 13. SEQ ID NO:7, называемый ActRIIa-hFc, подробно описан в разделе Примеры. Другие примеры растворимого, активин-связывающего полипептида ActRIIa помимо внеклеточного домена белка ActRIIa содержат сигнальную последовательность, например, лидерную последовательность мелитина медоносной пчелы (SEQ ID NO:8), лидерную последовательность тканевого активатора плазминогена (TPA) (SEQ ID NO:9) или нативную лидерную последовательность ActRIIa (SEQ ID NO:10). В полипептиде ActRIIa-hFc, описанном как SEQ ID NO:13, используют лидерную последовательность tPA.
Функционально активные фрагменты полипептида ActRIIa можно получить путем скрининга полипептидов, полученных рекомбинантным способом с использованием соответствующего фрагмента нуклеиновой кислоты, кодирующей полипептид ActRIIa. Кроме того, фрагменты можно синтезировать химически с помощью хорошо известных в данной области способов, таких как традиционные f-Moc- или t-Boc-способы твердофазной химии Меррифильда. Полученные (рекомбинантными или химическими способами) фрагменты можно подвергнуть тестированию, чтобы идентифицировать пептидильные фрагменты, которые могут функционировать как антагонисты (ингибиторы) белка ActRIIa или сигнального пути, опосредуемого активином.
Функционально активные варианты полипептида ActRIIa можно получить путем скрининга библиотек модифицированных полипептидов, полученных рекомбинантным способом с использованием соответствующих мутантных нуклеиновых кислот, кодирующих полипептид ActRIIa. Полученные варианты можно подвергнуть тестированию, чтобы идентифицировать те из них, которые могут функционировать как антагонисты (ингибиторы) белка ActRIIa или сигнального пути, опосредуемого активином. В некоторых воплощениях функциональный вариант полипептида ActRIIa содержит аминокислотную последовательность, которая, по меньшей мере, на 75% идентична аминокислотной последовательности, выбранной из SEQ ID NO:2 или 3. В некоторых случаях функциональный вариант имеет аминокислотную последовательность, по меньшей мере, на 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичную аминокислотной последовательности, выбранной из SEQ ID NO:2 или 3.
Функциональные варианты можно получить путем модификации структуры полипептида ActRIIa с целью, например, повышения терапевтической эффективности или стабильности (например, срока хранения ex vivo и устойчивости к протеолитической деградации in vivo). Модифицированные полипептиды ActRIIa, которые сохраняют способность связываться с активином, считаются функциональными эквивалентами природного полипептида ActRIIa. Модифицированный полипептид ActRIIa можно получить, например, путем замены, делеции или добавления аминокислоты. Например, можно ожидать, что отдельная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серин, или подобная замена аминокислоты на структурно родственную аминокислоту (например, консервативная мутация) не будет оказывать сильного влияния на биологическую активность получаемой молекулы. Консервативными называют замены в пределах семейства аминокислот с похожими боковыми цепями. Путем анализа способности вариантного полипептида ActRIIa вызывать у клеток ответ подобно полипептиду ActRIIa дикого типа можно легко определить, приводит ли изменение аминокислотной последовательности полипептида ActRIIa к получению функционального гомолога.
В некоторых воплощениях настоящее изобретение предлагает способы лечения или профилактики рака молочной железы с помощью полипептидов ActRIIa, несущих специфические мутации, приводящие к изменению гликозилирования полипептида. Такие мутации осуществляют с целью введения или устранения одного или нескольких участков гликозилирования, таких как участки O-связанного или N-связанного гликозилирования. Участки распознавания аспарагин-связанного гликозилирования, как правило, содержат трипептидную последовательность, аспарагин-X-треонин или аспарагин-X-серин (где "X" обозначает любую аминокислоту), которая специфически распознается соответствующими ферментами клеточного гликозилирования. Изменение последовательности полипептида дикого типа ActRIIa также можно осуществить путем добавления или введения в результате замены одного или нескольких остатков серина или треонина (в случае участков O-связанного гликозилирования). Несколько аминокислотных замен или делеций по одному или обоим из первого и третьего аминокислотного положения участка распознавания гликозилирования (и/или делеция аминокислоты во втором положении) приводят к отсутствию гликозилирования по модифицированной трипептидной последовательности. Другие способы увеличения числа углеводных фрагментов на полипептиде ActRIIa включают в себя химическое или ферментативное присоединение гликозидов к полипептиду ActRIIa. В зависимости от используемого способа присоединения сахар (сахара) можно присоединять к (a) аргинину и гистидину; (b) свободным гидроксильным группам; (c) свободным сульфгидрильным группам, например, присутствующим на цистеине; (d) свободным гидроксильным группам, например, присутствующим на серине, треонине или гидроксипролине; (e) ароматическим остаткам, например, фенилаланина, тирозина или триптофана; или (f) амидной группе глутамина. Удаление одного или нескольких углеводных фрагментов, присутствующих на полипептиде ActRIIa, можно осуществить химическим или ферментативным способом. Химическое дегликозилирование можно проводить, например, путем обработки полипептида ActRIIa трифторметансульфоновой кислотой или эквивалентным соединением. Такая обработка приводит к отщеплению большей части или всех сахаров за исключением связующего сахара (N-ацетилглюкозамина или N-ацетилгалактозамина), а аминокислотная последовательность при этом остается интактной. Ферментативное отщепление углеводных фрагментов с полипептида ActRIIa можно проводить с помощью ряда эндо- и экзогликозидаз, как описано Thotakura et al. (1987) Meth. Enzymol. 138:350. При необходимости последовательность полипептида ActRIIa можно корректировать, в зависимости от типа используемой системы экспрессии, поскольку клетки млекопитающих, дрожжей, насекомых и растений обеспечивают разный характер гликозилирования, на который может оказывать влияние аминокислотная последовательность пептида. Как правило, белки ActRIIa, предназначенные для применения у людей, можно экспрессировать в линии клеток млекопитающих, обеспечивающей подходящий характер гликозилирования, такой как клеточная линия HEK293 или CHO, хотя предполагается, что для экспрессии также можно использовать и другие линии клеток млекопитающих.
Данное описание также предлагает способы получения мутантов, в частности наборов комбинаторных мутантов полипептида ActRIIa, а также мутантов, полученных в результате усечения; для идентификации функциональных вариантов последовательности особенно полезны наборы комбинаторных мутантов. Цель скрининга таких комбинаторных библиотек может заключаться в получении, например, вариантов полипептида ActRIIa, которые связываются с активином или другими лигандами. Ниже описаны несколько способов скрининга, которые можно использовать для анализа вариантов. Например, вариант полипептида ActRIIa можно подвергнуть скринингу на способность связывать лиганд ActRIIa, предотвращать связывание лиганда ActRIIa с полипептидом ActRIIa, или препятствовать передаче сигнала, инициированного лигандом ActRIIa.
Активность полипептида ActRIIa или его вариантов также можно тестировать с помощью клеточного анализа или анализа in vivo. Например, можно анализировать влияние варианта полипептида ActRIIa на пролиферацию и выживание раковых клеток. Раковыми клетками называют клетки живого субъекта, составляющие солидную опухоль, или клетки опухоли, распространившиеся в другие участки организма живого субъекта (т.е. метастатические клетки). Кроме того, раковыми клетками также можно называть клетки, полученные из раковой опухоли и культивируемые in vitro. К раковым клеткам также относятся, например, клеточные линии, которые можно культивировать in vitro или использовать в исследованиях с применением ксенотрансплантатов животных. Раковыми клетками также называют клетки, полученные из метастатических клеток в результате клеточного деления после метастазирования. Клетки могу быть гормонозависимыми (например, положительными по рецептору эстрогенов) или гормононезависимыми (например, отрицательными по рецептору эстрогенов). Пролиферацию или выживание раковых клеток можно анализировать в присутствии одного или нескольких рекомбинантных белковых лигандов ActRIIa (например, активина), причем клетки можно трансфицировать, чтобы они продуцировали полипептид ActRIIa и/или его варианты и, необязательно, лиганд ActRIIa. Подобным образом, полипептид ActRIIa можно ввести мыши или другому животному и анализировать один или несколько параметров, таких как размер опухоли, скорость пролиферации клеток или апоптоз по сравнению с контролем.
С помощью комбинаторных способов можно получить варианты, которые обладают более высокой селективностью или общей активностью, чем природный полипептид ActRIIa. Подобным образом, путем мутагенеза можно получить варианты, период полужизни которых в клетке значительно отличается от периода полужизни соответствующего полипептида ActRIIa дикого типа. Например, измененный белок может иметь либо более высокую, либо более низкую устойчивость к протеолитическому расщеплению или другим клеточным процессам, приводящим к разрушению или иной инактивации нативного полипептида ActRIIa. Такие варианты, а также кодирующие их гены, можно использовать для изменения уровней полипептида ActRIIa путем модуляции уровня полужизни полипептида ActRIIa. Например, короткий период полужизни может быть связан с более кратковременными биологическими эффектами, и, если вариант является частью индуцируемой системы экспрессии, он может обеспечивать более строгий контроль за уровнем рекомбинатного полипептида ActRIIa в клетке. Период полужизни слитого белка, содержащего Fc, можно изменить путем введения мутаций в линкер (если он присутствует) и/или фрагмент Fc.
Комбинаторную библиотеку можно получить с использованием библиотеки вырожденных генов, кодирующих библиотеку полипептидов, каждый из которых содержит, по меньшей мере, фрагмент потенциальных полипептидных последовательностей ActRIIa. Например, смесь синтетических олигонуклеотидов можно лигировать с помощью ферментов в последовательности генов так, чтобы вырожденный набор нуклеотидных последовательностей потенциального полипептида ActRIIa экспрессировался в виде отдельных полипептидов, или, альтернативно, в виде ряда более крупных слитых белков (например, в случае фагового дисплея).
Существует много способов получения библиотеки потенциальных гомологов из вырожденных олигонуклеотидных последовательностей. Химический синтез вырожденных последовательностей генов можно проводить в автоматическом синтезаторе ДНК с последующим лигированием синтетических генов в подходящий вектор экспрессии. Способы синтеза вырожденных олигонуклеотидов хорошо известны в данной области (см., например, Narang, SA (1983) Tetrahedron 39:3; Itakura et al., (1981) Recombinant DNA, Proc. 3rd Cleveland Sympos. Macromolecules, ed. AG Walton, Amsterdam: Elsevier pp273-289; Itakura et al., (1984) Annu. Rev. Biochem. 53:323; Itakura et al., (1984) Science 198:1056; Ike et al., (1983) Nucleic Acid Res. 11:477). Такие методы применяются в направленной эволюции других белков (см., например, Scott et al., (1990) Science 249:386-390; Roberts et al., (1992) PNAS USA 89:2429-2433; Devlin et al., (1990) Science 249: 404-406; Cwirla et al., (1990) PNAS USA 87: 6378-6382; а также патенты США №№ 5223409, 5198346 и 5096815).
Альтернативно для получения комбинаторной библиотеки можно использовать другие формы мутагенеза. Например, варианты полипептида ActRIIa можно получить и выделить из библиотеки путем скрининга, например, методом аланин-сканирующего мутагенеза и т.п. (Ruf et al., (1994) Biochemistry 33: 1565-1572; Wang et al., (1994) J. Biol. Chem. 269:3095-3099; Balint et al., (1993) Gene 137: 109-118; Grodberg et al., (1993) Eur. J. Biochem. 218:597-601; Nagashima et al., (1993) J. Biol. Chem. 268:2888-2892; Lowman et al., (1991) Biochemistry 30:10832-10838; и Cunningham et al., (1989) Science 244: 1081-1085), линкер-сканирующего мутагенеза (Gustin et al., (1993) Virology 193:653-660; Brown et al., (1992) Mol. Cell Biol. 12:2644-2652; McKnight et al., (1982) Science 232:316); насыщающего мутагенеза (Meyers et al., (1986) Science 232:613); ПЦР-мутагенеза (Leung et al., (1989) Method Cell Mol Biol 1:11-19); или неспецифического мутагенеза, в том числе химического мутагенеза и др. (Miller et al., (1992) A Short Course in Bacterial Genetics, CSHL Press, Cold Spring Harbor, NY; and Greener et al., (1994) Strategies in Mol Biol 7:32-34). Линкер-сканирующий мутагенез, особенно в комбинаторной химии, является эффективным способом идентификации укороченных (биоактивных) форм полипептида ActRIIa.
В данной области известен широкий ряд способов скрининга генных продуктов комбинаторных библиотек, полученных путем точечных мутаций и усечений, и, в связи с этим, способов скрининга библиотек кДНК на генные продукты, обладающие определенным свойством. Такие методы, как правило, адаптируются для быстрого скрининга библиотек генов, полученных путем комбинаторного мутагенеза полипептида ActRIIa. Наиболее широко используемые методы скрининга больших библиотек генов обычно включают в себя клонирование генной библиотеки в реплицируемых векторах экспрессии, трансформацию подходящих клеток полученной библиотекой векторов и экспрессию комбинаторных генов в условиях, в которых детекция желательной активности позволяет относительно просто выделить вектор, который содержит ген, кодирующий детектируемый продукт. Предпочтительные анализы включают в себя анализы связывания активина и анализы клеточных сигнальных путей, опосредуемых активином.
В некоторых воплощениях полипептид ActRIIa, используемый в соответствии с описанными здесь способами, может дополнительно содержать пост-трансляционные модификации помимо исходно присутствующих в полипептиде ActRIIa. Такие модификации включают в себя, без ограничения, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование и ацилирование. В результате модифицированный полипептид ActRIIa может содержать отличные от аминокислот элементы, такие как полиэтиленгликоли, липиды, поли- или моносахариды и фосфаты. Влияние таких отличных от аминокислот элементов на функциональные свойства полипептида ActRIIa можно анализировать с помощью способов, описанных в данном документе для других вариантов полипептида ActRIIa. Если полипептид ActRIIa продуцируется в клетках в результате расщепления образующейся формы полипептида ActRIIa, пост-трансляционный процессинг также может иметь важное значение для правильных укладки и/или функционирования белка. Для осуществления таких пост-трансляционных модификаций разные клетки (такие как CHO, HeLa, MDCK, WI38, NIH-3T3 или HEK293) имеют специфические структуры и характерные механизмы, соответственно можно выбрать подходящие клетки, обеспечивающие правильные модификацию и процессинг полипептида ActRIIa.
В некоторых аспектах функциональные варианты или модифицированные формы полипептида ActRIIa включают в себя слитые белки, содержащие, по меньшей мере, фрагмент полипептида ActRIIa и один или несколько доменов слияния. Хорошо известные примеры таких доменов слияния включают в себя, без ограничения, полигистидин, Glu-Glu, глутатион-S-трансферазу (GST), тиоредоксин, белок A, белок G, константный участок тяжелой цепи иммуноглобулина (Fc), белок, связывающий мальтозу (MBP), или человеческий сывороточный альбумин. Можно выбрать домен слияния, придающий желательное свойство. Например, некоторые домены слияния являются особенно полезными для выделения слитых белков методом аффинной хроматографии. Для аффинной очистки используют подходящие носители для аффинной хроматографии, такие как глутатион-, амилаза- и никель- или кобальт-конъюгированные смолы. Многие такие носители доступны в виде "наборов", таких как система очистки Pharmacia GST и система QIAexpressTM (Qiagen), используемые с партнерами по слиянию (HIS6). В качестве другого примера, можно выбрать домен слияния, облегчающий детекцию полипептида ActRIIa. Примеры таких детекционных доменов включают в себя разные флюоресцентные белки (например, GFP), а также "эпитопные маркеры", которые обычно представляют собой короткие петидные последовательности, специфические антитела против которых являются доступными. Хорошо известные эпитопные маркеры, специфические моноклональные антитела против которых являются широко доступными, включают в себя маркеры FLAG, гемагглютинин вируса гриппа (HA) и c-myc. В некоторых случаях домены слияния содержат участок расщепления протеазой, такой как фактор Xa или тромбин, который обеспечивает частичное расщепление слитых белков под действием соответствующей протеазы и высвобождение рекомбинатных белков. Затем высвобожденные белки можно отделить от домена слияния путем последующего хроматографического разделения. В некоторых предпочтительных воплощениях полипептид ActRIIa сливают с доменом, который стабилизирует полипептид ActRIIa in vivo ("стабилизирующий" домен). Под "стабилизацией" понимают увеличение периода полужизни в сыворотке, независимо от того, происходит ли оно в результате уменьшения разрушения, уменьшения выведения почками или другого фармакокинетического эффекта. Известно, что слияние с Fc-фрагментом иммуноглобулина придает желательные фармакокинетические свойства широкому ряду белков. Слияние с человеческим сывороточным альбумином также придает желательные свойства. Можно выбрать домены слияния других типов, в том числе мультимеризующие (например, димеризующие, тетрамеризующие) домены и функциональные (которые выполняют другую биологическую функцию) домены.
В качестве конкретного примера настоящее изобретение предлагает способы лечения или профилактики рака молочной железы с помощью слитого белка, содержащего растворимый внеклеточный домен ActRIIa, гибридизованный с доменом Fc (например, SEQ ID NO:6).

Необязательно домен Fc содержит одну или несколько мутаций по таким остаткам, как Asp-265, лизин 322 и Asn-434. В некоторых случаях мутантный домен Fc, содержащий одну или более таких мутаций (например, мутацию Asp-265), обладает пониженной способностью связываться с рецептором Fcγ по сравнению с доменом Fc дикого типа. В других случаях мутантный домен Fc, содержащий одну или несколько таких мутаций (например, мутацию Asn-434), обладает пониженной способностью связываться с MHC класса I-родственным рецептором Fc (FcRN) по сравнению с доменом Fc дикого типа. Как правило, домен Fc может содержать более мелкие или более крупные фрагменты константного участка иммуноглобулина, при условии, что полученный "домен Fc" сохраняет способность к ковалентной димеризации посредством дисульфидных связей с образованием относительно стабильного растворимого белка.
Следует понимать, что разные элементы слитых белков могут соединяться в любом порядке, обеспечивающем желательные функциональные свойства. Например, полипептид ActRIIa может присоединяться к гетерологичному домену по С-концу, или, альтернативно, гетерологичный домен может присоединяться к полипептиду ActRIIa по C-концу. Домен полипептида ActRIIa и гетерологичный домен не обязательно примыкают друг к другу в слитом белке, другие домены или аминокислотные последовательности могут присоединяться по C- или N-концу к любому домену или между доменами.
В некоторых воплощениях полипептиды ActRIIa, используемые в соответствии с описанными здесь способами, могут содержать одну или несколько модификаций, способствующих стабилизации полипептида ActRIIa. Например, такие модификации могут повышать период полужизни полипептида ActRIIa in vitro, увеличивать период полужизни полипептида ActRIIa в кровотоке или уменьшать протеолитическую деградацию полипептида ActRIIa. Такие стабилизирующие модификации включают в себя, без ограничения, слитые белки (в том числе, например, слитые белки, содержащие полипептид ActRIIa и стабилизирующий домен), модификации участка гликозилирования (в том числе, например, добавления участка гликозилирования в полипептид ActRIIa) и модификации углеводного фрагмента (в том числе, например, удаление углеводных фрагментов из полипептида ActRIIa). В данном описании термин "стабилизирующий домен" относится не только к гибридизационному домену (например, Fc), присутствующему в слитых белках, но также включает в себя небелковые модификации, такие как углеводный фрагмент или такой небелковый фрагмент, как полиэтиленгликоль.
В некоторых воплощениях в описанных здесь способах используют выделенные и/или очищенные формы полипептида ActRIIa, которые получают путем отделения или освобождения иным образом от других белков. Обычно полипептид ActRIIa получают путем экспрессии рекомбинантных нуклеиновых кислот.
3. Нуклеиновые кислоты, кодирующие полипептиды ActRIIa
Настоящее описание предлагает выделенные и/или рекомбинантные нуклеиновые кислоты, кодирующие любые полипептиды ActRIIa (например, растворимые полипептиды ActRIIa), в том числе фрагменты, функциональные варианты и слитые белки, раскрытые в данном описании. Например, SEQ ID NO:4 кодирует природный предшественник человеческого полипептида ActRIIa, а SEQ ID NO:5 кодирует процессированный внеклеточный домен ActRIIa. Рассматриваемые нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными. Указанные нуклеиновые кислоты могут представлять собой молекулы ДНК или РНК. Указанные нуклеиновые кислоты можно использовать, например, в способах получения полипептида ActRIIa или в качестве непосредственных терапевтических средств (например, используемых в генной терапии).
В некоторых аспектах указанные нуклеиновые кислоты, кодирующие полипептид ActRIIa, также включают в себя нуклеиновые кислоты, являющиеся вариантами SEQ ID NO:4 или 5. Вариантные нуклеотидные последовательности включают в себя последовательности, такие как аллельные варианты, которые отличаются друг от друга заменой, добавлением или делецией одного или нескольких нуклеотидов.
В некоторых воплощениях изобретение предлагает способы лечения или профилактики рака молочной железы с помощью выделенных или рекомбинантных нуклеотидных последовательностей, которые, по меньшей мере, на 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичны SEQ ID NO:4 или 5. Рядовой специалист в данной области должен понимать, что нуклеотидные последовательности, комплементарные SEQ ID NO:4 или 5, а также варианты SEQ ID NO:4 или 5 также входят в объем данного изобретения. В других воплощениях нуклеотидные последовательности, описанные в данном документе, могут быть выделенными, рекомбинантными и/или слитыми с гетерологичной нуклеотидной последовательностью, или они могут входить в состав библиотеки ДНК.
В других воплощениях нуклеиновые кислоты, используемые в соответствии со способами, описанными в данном документе, также включают в себя нуклеотидные последовательности, которые гибридизуются в условиях высокой жесткости с нуклеотидной последовательностью, описанной в SEQ ID NO:4 или 5, последовательности, комплементарные SEQ ID NO:4 или 5, или их фрагменты. Рядовому специалисту в данной области хорошо известно, что условия соответствующей жесткости, которые инициируют гибридизацию ДНК, можно варьировать. Например, гибридизацию можно проводить в условиях 6,0× хлорид натрия/цитрат натрия (SSC), примерно при 45°C, с последующим промыванием 2,0× SSC при 50°C. Например, концентрация соли может варьироваться от условий низкой жесткости, включающих в себя примерно 2,0× SSC при 50°C, до условий высокой жесткости, включающих в себя примерно 0,2× SSC при 50°C. Кроме того, температура на стадии промывания может повышаться от условий низкой жесткости, включающих в себя комнатную температуру, примерно 22°C, до условий высокой жесткости, соответствующих примерно 65°C. И температуру, и концентрацию соли можно варьировать, либо одну из этих переменных можно поддерживать на постоянном уровне, а другую варьировать. В одном воплощении в описанных в данном документе способах используются нуклеиновые кислоты, которые гибридизуются в условиях низкой жесткости, соответствующих 6× SSC при комнатной температуре с последующим промыванием при 2× SSC при комнатной температуре.
Выделенные нуклеиновые кислоты, которые отличаются от нуклеиновых кислот с последовательностью SEQ ID NO:4 или 5 вследствие вырожденности генетического кода, также можно использовать в способах настоящего изобретения. Например, некоторые аминокислоты могут кодироваться несколькими триплетами. Кодоны, которые кодируют одну аминокислоту, или синонимы (например, CAU и CAC являются синонимами для гистидина), могут обуславливать "молчащие" мутации, которые не влияют на аминокислотную последовательность белка. Однако можно ожидать, что в клетках млекопитающих присутствует полиморфизм последовательностей ДНК, приводящий к изменениям аминокислотных последовательностей кодируемых белков. Специалистам в данной области известно, что указанные вариации по одному или нескольким нуклеотидам (примерно до 3-5% нуклеотидов) нуклеиновых кислот, кодирующих конкретный белок, могут существовать у субъектов определенных видов вследствие природных аллельных вариаций. Каждая и все такие нуклеотидные вариации, а также обусловленный ими аминокислотный полиморфизм, входят в объем данного изобретения.
В некоторых воплощениях описанные в данном документе рекомбинантные нуклеиновые кислоты могут быть функционально связаны с одной или несколькими регуляторными нуклеотидными последовательностями в экспрессионной конструкции. Регуляторные нуклеотидные последовательности, как правило, соответствуют клетке-хозяину, используемой для экспрессии. В данной области известно много типов векторов экспрессии и регуляторных последовательностей, подходящих для ряда клеток-хозяев. Как правило, указанные одна или несколько регуляторных нуклеотидных последовательностей могут включать в себя, без ограничения, промоторные последовательности, лидерные или сигнальные последовательности, участки связывания рибосом, последовательности инициации и терминации транскрипции, последовательности инициации и терминации трансляции, а также энхансерные или активаторные последовательности. Известные в данной области конститутивные и индуцируемые промоторы также входят в объем настоящего изобретения. Промоторы могут быть либо природными, или гибридными, в которых объединены элементы нескольких промоторов. Экспрессионная конструкция может находиться в клетке на эписоме, такой как плазмида, или экспрессионная конструкция может быть вставлена в хромосому. В предпочтительном воплощении вектор экспрессии содержит селектируемый маркерный ген, облегчающий отбор трансформированных клеток-хозяев. Селектируемые маркерные гены хорошо известны в данной области, их выбирают в зависимости от используемой клетки-хозяина.
В некоторых аспектах в описанных здесь способах используют вектор экспрессии, содержащий нуклеотидную последовательность, которая кодирует полипептид ActRIIa, функционально связанный, по меньшей мере, с одной регуляторной последовательностью. Регуляторные последовательности известны в данной области, они используются для управления экспрессией полипептида ActRIIa. Соответственно, термин регуляторная последовательность включает в себя промоторы, энхансеры и другие элементы, контролирующие экспрессию. Примеры регуляторных последовательностей описаны в Goeddel; Gene Expression Technology: Methods in Enzymology, Academic Press, San Diego, CA (1990). Например, любую из широкого ряда последовательностей, которые способны регулировать экспрессию последовательности ДНК, если они функционально связаны с ней, можно использовать в указанных векторах для экспрессии последовательностей ДНК, кодирующих полипептид ActRIIa. В качестве таких регулирующих экспрессию последовательностей можно использовать, например, ранний и поздний промоторы SV40, промотор tet, предранний промотор аденовируса или цитомегаловируса, промоторы RSV, систему lac, систему trp, систему TAC или TRC, промотор T7, экспрессия которого управляется РНК-полимеразой, основные операторные и промоторные участки фага лямбда, регулирующие участки белка оболочки fd, промотор 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы, например Pho5, промоторы факторов α-спаривания дрожжей, полиэдрический промотор бакуловирусной системы и другие последовательности, которые, как известно, регулируют экспрессию генов прокариотических или эукариотических клеток или их вирусов, а также разные сочетания указанных элементов. Следует принимать во внимание, что конструкция вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансформации, и/или тип экспрессируемого белка. Кроме того, нужно также учитывать число копий вектора, возможность регулировать данное число копий и экспрессию любого другого белка, кодируемого вектором, такого как антибиотический маркер.
Описанную в данном документе рекомбинантную нуклеиновую кислоту можно получить путем лигирования клонированного гена, или его фрагмента, в вектор, подходящий для экспрессии либо в прокариотических клетках, либо в эукариотических клетках (дрожжей, птиц, насекомых или млекопитающих), или и в тех, и в других. Для экспрессии рекомбинантного полипептида ActRIIa используют плазмиды и другие векторы. Например, векторы, подходящие для экспрессии в прокариотических клетках, таких как E. coli, включают в себя плазмиды следующих типов: плазмиды, полученные из pBR322, плазмиды, полученные из pEMBL, плазмиды, полученные из pEX, плазмиды, полученные из pBTac, и плазмиды, полученные из pUC.
Некоторые векторы экспрессии млекопитающих содержат как прокариотические последовательности, облегчающие размножение вектора в бактериях, так и один или несколько транскрипционных элементов, экспрессирующихся в эукариотических клетках. Векторы, полученные из pcDNAI/amp, pcDNAI/neo, pRc/CMV, pSV2gpt, pSV2neo, pSV2-dhfr, pTk2, pRSVneo, pMSG, pSVT7, pko-neo и pHyg, являются примерами векторов экспрессии млекопитающих, подходящих для трансфекции эукариотических клеток. Некоторые из данных векторов модифицируют последовательностями бактериальных плазмид, таких как pBR322, чтобы облегчить репликацию и селекцию по устойчивости к лекарственному средству как в прокариотических, так и в эукариотических клетках. Альтернативно, для транзиторной экспрессии белков в эукариотических клетках можно использовать производные вирусов, таких как вирус папилломы крупного рогатого скота (BPV-I) или вирус Эпштейна-Барра (pHEBo, pREP-производные и p205). Примеры других вирусных (в том числе ретровирусных) систем экспрессии можно найти ниже в описании систем доставки, используемых в генной терапии. В данной области известно много способов получения плазмид и трансформации организмов-хозяев. Другие системы экспрессии, подходящие как для прокариотических, так и для эукариотических клеток, а также общие рекомбинантные способы можно найти в Molecular Cloning A Laboratory Manual, 3rd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press, 2001). В некоторых случаях для экспрессии рекомбинантных полипептидов желательно использовать бакуловирусную систему экспрессии. Примеры таких бакуловирусных систем экспрессии включают в себя pVL-производные векторы (такие как pVL1392, pVL1393 и pVL941), pAcUW-производные векторы (такие как pAcUWl) и pBlueBac-производные векторы (такие как β-gal-содержащий pBlueBac III).
В предпочтительном воплощении конструируют вектор, подходящий для получения целевого полипептида ActRIIa в клетках CHO, такой как вектор Pcmv-Script (Stratagene, La Jolla, Calif.), векторы pcDNA4 (Invitrogen, Carlsbad, Calif.) и векторы pCI-neo (Promega, Madison, Wise). Очевидно, что конструкции конкретных генов можно использовать для индукции экспрессии целевого полипептида ActRIIa в клетках, выращиваемых в культуре, например, с получением белков, в том числе слитых или вариантных, которые затем можно подвергнуть очистке.
Данное описание также относится к клетке-хозяину, трансфицированной рекомбинантным геном, содержащим последовательность (например, SEQ ID NO:4 или 5), кодирующую один или несколько целевых полипептидов ActRIIa. Клетка-хозяин может быть прокариотической или эукариотической. Например, полипептид ActRIIa, описанный в данном документе, можно экспрессировать в бактериальных клетках, таких как E. coli, клетках насекомых (например, с использованием бакуловирусной системы экспрессии), клетках дрожжей или клетках млекопитающих. Специалистам в данной области известны и другие подходящие клетки-хозяева.
Данное описание также предлагает способы получения целевого полипептида ActRIIa. Например, клетку-хозяина, трансфицированную вектором экспрессии, кодирующим полипептид ActRIIa, можно культивировать в условиях, обеспечивающих экспрессию полипептида ActRIIa. Если полипептид ActRIIa секретируется из клеток в среду, его можно выделить из смеси клеток и среды, содержащей полипептид ActRIIa. Альтернативно, полипептид ActRIIa может оставаться в цитоплазматической или мембранной фракции, в этом случае клетки собирают, лизируют и затем выделяют белок. Клеточая культура включает в себя клетки-хозяева, среду и другие побочные продукты. Подходящие среды для культивирования клеток хорошо известны в данной области. Целевой полипептид ActRIIa можно выделить из культуральной среды, клеток-хозяев или того и другого, с помощью хорошо известных в данной области способов очистки белков, таких как ионообменная хроматография, гель-фильтрационная хроматография, ультрафильтрация, электрофорез, иммуноаффинная очистка с использованием антител, специфичных в отношении конкретных эпитопов полипептида ActRIIa, и аффинная очистка с использованием средства, связывающегося с доменом, слитым с полипептидом ActRIIa (например, колонку с белком A можно использовать для очистки слияния ActRIIa-Fc). В предпочтительном воплощении полипептид ActRIIa представляет собой слитый белок, который содержит домен, облегчающий очистку. В предпочтительном воплощении очистка включает в себя ряд стадий колоночной хроматографии, в том числе, например, три или более из перечисленных ниже, в любом порядке: хроматография на белке A, хроматография на сефарозе Q, хроматография на фенилсефарозе, гель-хроматография и катионообменная хроматография. Очистку можно дополнить фильтрацией вируса и сменой буфера. Как показано в данном описании, белок ActRIIa-hFc очищают до чистоты, составляющей >98% по данным гель-хроматографии и >95% по результатам SDS PAGE. Такой уровень чистоты достаточен для достижения желательных результатов у мышей, крыс и отличных от человека приматов.
В другом воплощении слитый ген, кодирующий лидерную последовательность очистки, такую как последовательность участка поли-(His)/энтерокиназного расщепления, на N-конце целевого фрагмента рекомбинантного полипептида ActRIIa, может облегчать очистку экспрессируемого слитого белка методом аффинной хроматографии с использованием Ni2+-металлосодержащей смолы. Затем лидерную последовательность очистки можно удалить путем обработки энтерокиназой с получением очищенного полипептида ActRIIa (например, см. Hochuli et al., (1987) J. Chromatography 411: 177; и Janknecht et al., PNAS USA 88:8972).
Способы получения слитых генов хорошо известны. В основном присоединение разных фрагментов ДНК, кодирующих разные полипептидные последовательности, проводят с помощью традиционных методов, с использованием "тупых" или "липких" концов для лигирования, которые получают путем соответствующего расщепления рестриктазой, "липкие" концы дополняют соответствующим образом, после чего, чтобы избежать нежелательного присоединения, проводят обработку щелочной фосфатазой и затем ферментативное лигирование. В другом воплощении синтез слитых генов можно осуществить традиционными методами с использованием автоматических синтезаторов ДНК. Альтернативно можно провести амплификацию генных фрагментов методом ПЦР с использованием якорных праймеров, которые обеспечивают комплементарное соединение "липких" концов двух последовательных фрагментов гена, после чего можно провести отжиг с получением химерной генной последовательности (см., например, Current Protocols in Molecular Biology, eds. Ausubel et al., John Wiley & Sons: 1992).
4. Альтернативные антагонисты активина и ActRIIa
Настоящее описание предлагает способы лечения или профилактики рака молочной железы с помощью антагонистов сигнального пути активина-ActRIIa. Хотя растворимый полипептид ActRIIa, в частности ActrIIa-Fc, являются предпочтительными антагонистами, и хотя такие антагонисты могут влиять на рост или выживание клеток рака молочной железы посредством механизма, отличного от механизма проявления антагонизма по отношению к активину (например, ингибирование активина может свидетельствовать о способности средства ингибировать активность ряда молекул, возможно, включающих в себя другие члены суперсемейства TGF-бета, и такое совокупное ингибирование может вызывать желательное влияние на рост или выживание клеток рака молочной железы), полагают, что можно использовать и другие типы антагонистов активина-ActRIIa, включающие в себя антитела против активина (например, активина βA, βB, βС и βЕ), антитела против ActRIIa, антисмысловые нуклеиновые кислоты, РНКi или рибозимы, которые ингибируют продукцию ActRIIa, а также другие ингибиторы активина или ActRIIa, в особенности, препятствующие связыванию активин-ActRIIa. В некоторых воплощениях в способах настоящего изобретения используют специфические антагонисты активина B (например, антитела против активина B).
Антитело, способное специфически взаимодействовать с полипептидом ActRIIa (таким как растворимый полипептид ActRIIa), которое либо конкурирует с лигандом за связывание с полипептидом ActRIIa, либо иным образом ингибирует опосредованный ActRIIa сигнальный путь, можно использовать в качестве антагониста полипептида ActRIIa. Подобным образом, в качестве антагониста можно использовать антитело, которое способно специфически взаимодействовать с полипептидом активином βA, βB, βС или βЕ или любым гетеродимером активина, и нарушать связывание ActRIIa.
С помощью стандартных способов, используя иммуногены, полученные из полипептида ActRIIa или полипептида активина, можно получить антисыворотку или моноклональные антитела против белка/пептида (см., например, Antibodies: A Laboratory Manual ed. by Harlow and Lane (Cold Spring Harbor Press: 1988)). Млекопитающее, такое как мышь, хомяк или кролик, можно иммунизировать иммуногенной формой полипептида ActRIIa, антигенным фрагментом, способным вызывать образование антител, или слитым белком. Способы придания иммуногенности белку или пептиду включают в себя конъюгирование с носителями, а также другие способы, хорошо известные в данной области. Иммуногенный фрагмент полипептида ActRIIa или активина можно вводить в присутствии адъюванта. Развитие иммунного ответа можно отслеживать путем определения титра антител в плазме или сыворотке. Уровень антител можно определять с помощью стандартного метода ELISA или других иммунологических анализов с использованием иммуногена в качестве антигена.
После иммунизации животного антигенным препаратом полипептида ActRIIa можно получить антисыворотку и, при необходимости, из сыворотки можно выделить поликлональные антитела. Чтобы получить моноклональные антитела, у иммунизированного животного собирают клетки, продуцирующие антитела (лимфоциты), и сливают их с помощью стандартных методов слияния сомматических клеток с иммортализованными клетками, такими как клетки миеломы, с получением гибридомных клеток. Такие методы хорошо известны в данной области и включают в себя, например, гибридомный метод (исходно разработанный Kohler and Milstein, (1975) Nature, 256: 495-497), метод получения гибридом с использованием человеческих B-клеток (Kozbar et al., (1983) Immunology Today, 4: 72), а также метод EBV-гибридомы, позволяющий получать человеческие моноклональные антитела (Cole et al., (1985) Monoclonal Антитела and Cancer Therapy, Alan R. Liss, Inc. pp. 77-96). Гибридомные клетки подвергают иммунохимическому скринингу на продукцию антител, способных специфически взаимодействовать с полипептидом ActRIIa, после чего из культуры, содержащей такие гибридомные клетки, выделяют моноклональные антитела. Антитела также можно получить путем скрининга библиотек (например, библиотек фаговых дисплеев) вариабельных доменов антител или фрагментов Fab с выявлением членов, способных связываться с выбранным антигеном (например, активином или ActRIIa). Данный in vitro способ часто используют в случае белков, являющихся высококонсервативными у млекопитающих, в особенности у мышей и людей.
Термин "антитело" в данном описании относится к целым антителам, например, любого изотипа (IgG, IgA, IgM, IgE и др.), и включает в себя фрагменты или домены иммуноглобулинов, способные взаимодействовать с конкретным антигеном. Фрагменты антител можно получить с помощью традиционных способов, после чего их можно подвергнуть скринингу на пригодность и/или способность взаимодействовать с конкретным, представляющим интерес эпитопом. Таким образом, данный термин включает в себя сегменты фрагментов молекулы антитела, полученных путем протеолитического расщепления или с помощью рекомбинантных способов, которые способны селективно взаимодействовать с конкретным белком. Неограничивающие примеры таких фрагментов, полученных протеолитическими и/или рекомбинантными способами, включают в себя Fab, F(ab')2, Fab', Fv и одноцепочечные антитела (scFv), содержащие домен V[L] и/или домен V[H], соединенные пептидным линкером. scFv можно соединить ковалентным или нековалентным способом с получением антител, содержащих два или более участков связывания. Термин "антитело" также включает в себя поликлональные антитела, моноклональные антитела или другие очищенные препараты антител, а также рекомбинантные антитела. Термин "рекомбинантное антитело" относится к антителу, или антиген-связывающему домену иммуноглобулина, экспрессированному с использованием нуклеиновой кислоты, сконструированной с помощью методов молекулярной биологии, и включает в себя гуманизированное антитело или полностью человеческое антитело, полученное из одноцепочечного антитела. Термин "рекомбинантное антитело" также охватывает однодоменные и одноцепочечные антитела.
В некоторых воплощениях описанных здесь способов можно использовать антитело, такое как, например, моноклональное антитело. Также предлагаются способы получения новых антител. Например, способ получения моноклонального антитела, способного специфически связываться с полипептидом ActRIIa или полипептидом активином, может включать в себя введение мыши иммуногенной композиции, содержащей антигенный полипептид, в количестве, эффективном для стимулирования детектируемого иммунного ответа, получение от мышей клеток, продуцирующих антитело (например, клеток селезенки), и слияние антитело-продуцирующих клеток с клетками миеломы с получением антитело-продуцирующих гибридом, и тестирование антитело-продуцирующих гибридом с целью идентификации гибридом, продуцирующих моноклональное антитело, способное специфически связываться с антигеном. После получения гибридомы можно размножить в клеточной культуре, необязательно в таких условиях культивирования, в которых полученные из гибридомы клетки продуцируют моноклональное антитело, способное специфически связываться с антигеном. Моноклональное антитело можно выделить из культуры клеток.
Определение "способное специфически взаимодействовать с" в применении к антителу означает, в соответствии с принятым в данной области значением, что антитело является достаточно селективным в отношении представляющего интерес антигена (например, полипептида ActRIIa) по сравнению с другими антигенами, которые не представляют интерес, чтобы антитело можно было использовать как минимум для детекции присутствия представляющего интерес антигена в биологическом образце конкретного типа. Для некоторых способов применения антитела, таких как терапевтическое применение, может потребоваться более высокая степень специфичности связывания. Как правило, моноклональные антитела обладают более высокой (по сравнению с поликлональными антителами) способностью эффективно различать целевые антигены и перекрестно-взаимодействующие полипептиды. Одним из факторов, влияющих на специфичность взаимодействия антитело:антиген, является сродство антитела к антигену. Хотя желательной специфичности можно достичь при разных значениях сродства, предпочтительные антитела обычно имеют сродство (константу диссоциации), составляющее приблизительно 10-6, 10-7, 10-8, 10-9 M или менее.
Кроме того, способы скрининга антител с целью идентификации целевого антитела могут зависеть от свойств получаемого антитела. Например, если антитело предназначается для связывания антигена в растворе, желательно тестировать связывание в растворе. Существует ряд разных способов тестирования взаимодействия антител с антигенами с целью идентификации особенно желательных антител. Такие способы включают в себя ELISA, анализы связывания методом поверхностного плазмонного резонанса (например, анализ связывания BiacoreTM, Biacore AB, Uppsala, Sweden), сэндвич-анализы (например, система с использованием парамагнитных гранул IGEN International, Inc., Gaithersburg, Maryland), вестерн-блоттинг, анализы методом иммунопреципитации и иммуногистохимии.
Примеры категорий нуклеотидных соединений, являющихся антагонистами активина или ActRIIa, включают в себя антисмысловые нуклеиновые кислоты, конструкции РНКi и конструкции каталитических нуклеиновых кислот. Соединение в виде нуклеиновой кислоты может быть одноцепочечным или двухцепочечным. Двухцепочечное соединение также может содержать выступающие участки или участки с отсутствием комплементарности, где одна из цепей является одноцепочечной. Одноцепочечное соединение может содержать участки самокомплементарности, то есть соединение может образовывать структуру, называемую "шпилька" или "стебель-петля", и может содержать участок, структура которого представляет собой двойную спираль. Соединение в виде нуклеиновой кислоты может включать в себя нуклеотидную последовательность, комплементарную участку, содержащему не более 1000, не более 500, не более 250, не более 100, или не более 50, 35, 25, 22, 20, 18 или 15 нуклеотидов полноразмерной нуклеотидной последовательности ActRIIa или нуклеотидной последовательности активина βA, βB, βС или βЕ. Участок комплементарности предпочтительно составляет, по меньшей мере, 8 нуклеотидов, и, необязательно, примерно от 18 до 35 нуклеотидов. Участок комплементарности может находиться в интроне, кодирующей последовательности или некодирующей последовательности целевого транскрипта, такой как фрагмент кодирующей последовательности. Обычно длина соединения в виде нуклеиновой кислоты составляет примерно от 8 до 500 нуклеотидов или пар оснований, необязательно длина составляет примерно от 14 до 50 нуклеотидов. Нуклеиновая кислота может представлять собой ДНК (особенно, в случае применения антисмысловой последовательности), РНК или гибрид РНК:ДНК. Одна цепь может содержать смесь ДНК и РНК, а также модифицированные формы, которые нельзя легко классифицировать как ДНК или РНК. Подобным образом, двухцепочечное соединение может представлять собой ДНК:ДНК, ДНК:РНК или РНК:РНК, и любая цепь может содержать смесь ДНК и РНК, а также модифицированные формы, которые нельзя легко классифицировать как ДНК или РНК. Соединение в виде нуклеиновой кислоты может содержать любую из ряда модификаций, в том числе одну или несколько модификаций скелета (сахар-фосфатных фрагментов природной нуклеиновой кислоты, включающих в себя межнуклеотидные связи) или оснований (пуриновых или пиримидиновых фрагментов природной нуклеиновой кислоты). Антисмысловое соединение в виде нуклеиновой кислоты обычно составляет в длину примерно от 15 до 30 нуклеотидов и зачастую содержит одну или более модификаций, улучшающих такие характеристики, как стабильность в сыворотке, в клетке или в участке возможной доставки соединения, таком как желудок в случае пероральной доставки соединений, и легкие в случае доставки соединений путем ингаляции. В случае конструкции РНКi цепь, комплементарная целевому транскрипту, обычно представляет собой РНК или ее модификации. Другая цепь может представлять собой РНК, ДНК или любую другую вариацию. Дуплексный фрагмент двухцепочечной или одноцепочечной "шпилечной" конструкции РНКi обычно имеет длину от 18 до 40 нуклеотидов, необязательно от 21 до 23 нуклеотидов, при условии, что он служит субстратом дайсера. Каталитические или ферментные нуклеиновые кислоты могут представлять собой рибозимы или ферменты ДНК и, кроме того, могут содержать модифицированные формы. Соединения в виде нуклеиновой кислоты могут ингибировать экспрессию мишени примерно на 50%, 75%, 90% или более при контакте с клетками в физиологических условиях в концентрации, в которой несмысловой или смысловой контроль оказывает небольшой эффект или не оказывает эффекта. Предпочтительные концентрации нуклеотидных соединений при тестировании эффекта составляют 1, 5 и 10 микромолей. Также можно тестировать влияние соединений в виде нуклеиновой кислоты, например, на пролиферацию или выживание клеток рака молочной железы или опухолей молочной железы.
5. Анализы, используемые для скрининга
В некоторых аспектах настоящее изобретение относится к применению полипептидов ActRIIa (например, растворимого полипептида ActRIIa) и полипептидов активина для идентификации соединений (средств), являющихся агонистами или антагонистами сигнального пути активина-ActRIIa. Соединения, идентифицированные с помощью такого скрининга, можно тестировать на способность модулировать рост или выживание раковых клеток, в особенности, клеток рака молочной железы, in vivo или in vitro. Данные соединения можно тестировать, например, на животных моделях, таких как мышиные модели ксенотрансплантатов. Примером животной модели является мышиная модель рака молочной железы MDA-MB231; клетки MDA-MB231 являются гормонозависимыми и склонны к метастазированию в кости. Другие животные модели рака молочной железы можно получить, например, путем имплантации клеток нейробластомы крысы (из которых изначально выделен онкоген neu) или neu-трансформированных клеток N1H-3T3 голым мышам, в основном по способу, описанному Drebin et al. Proc. Nat. Acad. Sci. USA, 83: 9129-9133 (1986).
Существуют многочисленные способы скрининга терапевтических средств для лечения или профилактики рака молочной железы с использованием в качестве мишени сигнального пути активина и ActRIIa. В некоторых воплощениях, чтобы идентифицировать средства, подавляющие активин- или ActRIIa-опосредованные эффекты в выбранной клеточной линии, можно использовать скрининг соединений с высокой пропускной способностью. В некоторых воплощениях проводят анализ, позволяющий выбрать и идентифицировать соединения, способные специфически ингибировать или уменьшать связывание полипептида ActRIIa с активином. Альтернативно анализ можно использовать для идентификации соединений, способных увеличивать связывание полипептида ActRIIa с активином. В другом воплощении соединения можно идентифицировать по их способности взаимодействовать с активином или полипептидом ActRIIa.
Можно использовать ряд аналитических форматов, причем анализы, специально не описанные в данном документе, в свете настоящего описания могут учитываться специалистом в данной области. Как описано в данном документе, тестируемые соединения (средства) можно получить с помощью любого комбинаторного химического способа. Альтернативно испытуемые соединения могут представлять собой природные биомолекулы, синтезированные in vivo или in vitro. Соединения (средства), подлежащие тестированию на способность модулировать тканевый рост, можно получить, например, с использованием бактерий, дрожжей, растений или других организмов (например, натуральные продукты), с помощью химических способов (например, малые молекулы, в том числе пептидомиметики) или рекомбинантных способов. Тестируемые соединения в соответствии с данным описанием включают в себя непептидильные органические молекулы, пептиды, полипептиды, петидомиметики, сахара, гормоны и молекулы нуклеиновых кислот. В конкретном воплощении тестируемое средство представляет собой малую органическую молекулу, молекулярная масса которой составляет менее чем приблизительно 2000 дальтон.
Тестируемые соединения могут предоставляться в виде отдельных, дискретных веществ, или в составе библиотек повышенной сложности, например, полученных с помощью методов комбинаторной химии. Такие библиотеки могут содержать, например, спирты, алкилгалогениды, амины, амиды, сложные эфиры, альдегиды, простые эфиры, а также органические соединения других классов. Для тестирования можно использовать либо выделенные соединения, либо смеси соединений, особенно на начальных стадиях скрининга. Необязательно соединения могут быть дериватизированы другими соединениями и могут содержать дериватизирующие группы, облегчающие выделение соединений. Неограничивающие примеры дериватизирующих групп включают в себя биотин, флюоресцеин, дигоксигенин, зеленый флюоресцентный белок, изотопы, полигистидин, магнитные гранулы, глутатион S-трансферазу (GST), фотоактивируемые сшивающие группы или любые их сочетания.
Во многих программах скрининга лекарственных средств, предназначенных для тестирования библиотек соединений и природных экстрактов, желательно использовать анализы с высокой пропускной способностью, чтобы максимально увеличить число соединений, анализируемых в заданный период времени. Для первичного скрининга зачастую предпочтительно использовать анализы, проводимые в бесклеточных системах, например, полученных с использованием очищенных или полуочищенных белков, которые обеспечивают быстрое тестирование и относительно простую детекцию изменения молекулярной мишени, опосредованного тестируемым соединением. Кроме того, в системе in vitro такие эффекты тестируемого соединения, как токсичность или биодоступность, как правило, можно игнорировать, и основное внимание фокусировать на влиянии лекарственного средства на молекулярную мишень, которое отражается в изменении сродства связывания полипептида ActRIIa с активином.
В примере используемого для скрининга анализа, который приводится только для иллюстрации, представляющее интерес соединение приводят в контакт с выделенным и очищенным полипептидом ActRIIa, который, как правило, способен связываться с активином. Затем к смеси соединения и полипептида ActRIIa добавляют композицию, содержащую лиганд ActRIIa. Чтобы определить способность соединения ингибировать (или усиливать) образование комплекса полипептида ActRIIa с активином, проводят детекцию и количественное определение комплексов ActRIIa/активин. Эффективность соединения можно оценить с помощью кривых доза-ответ, полученных с использованием разных концентраций тестируемого соединения. Кроме того, можно провести контрольный анализ с получением базовой линии, используемой для сравнения. Например, в контрольном анализе выделенный и очищенный активин добавляют к композиции, содержащей полипептид ActRIIa, после чего определяют количество образовавшегося комплекса ActRIIa/активин в отсутствии тестируемого соединения. Следует понимать, что, как правило, реагенты можно добавлять в любом порядке или одновременно. Кроме того, для получения подходящей бесклеточной аналитической системы вместо очищенных белков можно использовать клеточные экстракты или лизаты.
Образование комплекса полипептида ActRIIa с активином можно детектировать разными методами. Чтобы количественно определить изменение образования комплексов, например, с помощью иммунологического или хроматографического анализа, можно использовать белки, содержащие детектируемые метки, такие как полипептид ActRIIa или активин, меченные радиоактивной меткой (такой как 32P, 35S, 14C или 3H), флуоресцентной меткой (такой как FITC) или ферментной меткой.
В некоторых воплощениях для измерения, прямого или косвенного, степени взаимодействия полипептида ActRIIa со связывающим его белком можно использовать анализы поляризации флюоресценции и резонансного переноса энергии флуоресценции (FRET). Другие подходящие способы детекции включают в себя, например, методы с использованием оптических волноводов (публикация PCT WO 96/26432 и патент США № 5677196), поверхностного плазмонного резонанса (SPR), детектора поверхностного заряда и детектора поверхностного усилия.
Для идентификации средств, нарушающих или усиливающих взаимодействие полипептида ActRIIa со связывающим его белком, можно использовать анализ взаимодействия с улавливанием, также известный как "двухгибридный анализ". См., например, патент США № 5283317; Zervos et al. (1993) Cell 72:223-232; Madura et al. (1993) J Biol Chem 268:12046-12054; Bartel et al. (1993) Biotechniques 14:920-924 и Iwabuchi et al. (1993) Oncogene 8:1693-1696). В конкретном воплощении для идентификации соединений (например, малых молекул или пептидов), вызывающих диссоциацию комплекса полипептида ActRIIa со связывающим его белком, можно использовать обратную двухгибридную систему. См., например, Vidal and Legrain, (1999) Nucleic Acid Res 27:919-29; Vidal and Legrain, (1999) Trends Biotechnol 17:374-81; и патенты США №№ 5525490; 5955280 и 5965368.
В некоторых воплощениях соединения идентифицируют по их способности взаимодействовать с описанными здесь полипептидами ActRIIa или активином. Взаимодействие соединения с полипептидом ActRIIa или активином может быть ковалентным или нековалентным. Например, такое взаимодействие можно идентифицировать in vitro на белковом уровне с помощью биохимических способов, включающих в себя фотосшивание, связывание радиомеченного лиганда и аффинную хроматографию (Jakoby WB et al., 1974, Methods in Enzymology 46: 1). В некоторых случаях соединения можно подвернуть скринингу с помощью анализа, основанного на механизме действия, такого как детекция соединений, способных связываться с активином или полипептидом ActRIIa. В таком анализе можно использовать твердофазное или жидкофазное связывание. Альтернативно клетку можно трансфицировать геном, кодирующим активин или полипептид ActRIIa, вместе с репортерной системой (такой как β-галактозидаза, люцифераза или зеленый флюоресцентный белок), с последующим скринингом в отношении библиотеки, необязательно с использованием скрининга с высокой пропускной способностью, или против отдельных членов библиотеки. Можно использовать и другие анализы на основе механизма действия, например анализы связывания с детекцией изменения свободной энергии. Анализы связывания можно проводить с использованием мишени, фиксированной на лунке, грануле или чипе, или уловленной иммобилизованным антителом, или выделенной методом капиллярного электрофореза. Связанные соединения обычно детектируют колориметрическим методом, флюоресцентным методом или методом поверхностного плазмонного резонанса.
6. Примеры терапевтического применения
В некоторых воплощениях настоящее изобретение предлагает способы лечения или профилактики рака молочной железы у субъекта, нуждающегося в этом, путем введения субъекту терапевтически эффективного количества антагониста активина-ActRIIa, такого как, например, полипептид ActRIIa. Указанные способы можно использовать для терапевтического, а также профилактического лечения людей, в особенности женщин с высоким риском развития рака молочной железы. Поскольку каждая женщина имеет риск развития рака молочной железы, к женщинам с высоким риском развития рака молочной железы относятся женщины, у которых факторы риска свидетельствуют о повышенной возможности развития заболевания по сравнению с популяцией в целом, или с популяцией женщин определенной возрастной группы. Примеры факторов риска включают в себя возраст, семейный анамнез или генетическую предрасположенность, образ жизни, включающий в себя физическую нагрузку и диету, воздействие радиации или других канцерогенных факторов, возраст во время рождения первого ребенка, генетические изменения и увеличение массы после менопаузы.
В данном описании термин терапевтическое средство, "предотвращающее" нарушение или состояние, относится к соединению, которое уменьшает число случаев нарушения или состояния в статистическом образце после обработки по сравнению с необработанным контрольным образцом, или замедляет появление одного или нескольких симптомов или характерных признаков нарушения или состояния по сравнению с необработанным контрольным образцом. Например, предотвращение рака молочной железы означает отсутствие новых повреждений после обработки, или отсутствие, или замедление появления метастатического заболевания.
Термин "лечение рака молочной железы" относится к улучшению одного или нескольких симптомов или характеристик заболевания по сравнению с необработанным контролем или по сравнению с тяжестью заболевания до лечения. Термин не подразумевает обязательное вылечивание пациента, получающего лечение, или полное устранение заболевания. Средство, с помощью которого можно лечить рак молочной железы, может представлять собой средство, уменьшающее тяжесть одного или нескольких симптомов или характерных признаков заболевания. Следует отметить, что на рост и развитие опухоли влияют разные факторы, в том числе медиаторы развития клеточного цикла и клеточного деления и регуляторы клеточной смерти, или апоптоза. Соответственно, лечение рака молочной железы может включать в себя уменьшение пролиферации или частоты деления раковых клеток. Альтернативно или дополнительно, лечение рака молочной железы может включать в себя уменьшение выживания раковых клеток, уменьшение апоптоза или уменьшение встречаемости или тяжести метастатического рака молочной железы, в особенности метастазов рака молочной железы в костях. Соответственно в некоторых воплощениях лечение рака молочной железы может включать в себя как уменьшение клеточного деления, так и увеличение гибели клеток. Независимо от механизма эффективность средства для лечения рака молочной железы можно определить с помощью измеряемых показателей, таких как снижение числа раковых клеток по сравнению с контролем (в результате либо уменьшения пролиферации, либо увеличения апоптоза, либо того и другого), или уменьшение размера опухоли по сравнению с контролем. Следовательно, лечение рака молочной железы или ингибирование роста опухолевых или раковых клеток предположительно не зависит от механизма, посредством которого происходит изменение. Результаты и профилактики и лечения можно определить путем диагностики, проводимой лечащим врачем или другим медицинским работником, а также путем анализа предполагаемого результата введения терапевтического средства.
Влияние, оказываемое рассматриваемыми антагонистами на развитие рака молочной железы у людей, можно оценить по уменьшению или исчезновению измеряемого признака заболевания, и/или по отсутствию новых повреждений или предотвращению метастазирования. Например, антагонисты активина-ActRIla могут значительно уменьшать или замедлять развитие рака молочной железы у пациентов, имеющих неинвазивный или инвазивный рак молочной железы. Кроме того, антагонисты могут предотвращать или уменьшать риск развития рака молочной железы у здоровых женщин, имеющих факторы риска данного заболевания. Антагонисты также могут уменьшать риск встречаемости рака молочной железы у пациентов с семейным анамнезом.
Соответственно, антагонисты активина-ActRIIa можно использовать для предотвращения или замедления возникновения рака молочной железы у субъектов, имеющих риск развития данного заболевания, причем такие антагонисты можно использовать в выбранных популяциях пациентов. Примеры соответствующих популяций пациентов включают в себя пациентов с семейным анамнезом рака молочной железы и яичников, например женщин, у матерей или сестер которых диагностировано данное заболевание. Такие популяции также охватывают пациентов, несущих мутации в генах BRCA 1/2 или других генах, свидетельствующие о предрасположенности женщин к раку молочной железы или яичников. В одном воплощении антагонист активина-ActRIIa используют для лечения пациента, который заведомо имеет высокий риск развития рака молочной железы, но у которого данное заболевание не диагностировано. Такое лечение можно начинать, когда пациент достигает возраста 30, 35 или 40 лет, или если пациент-женщина не планирует забеременеть (т.е. пациент не собирается выкармливать ребенка) или находится в менопаузе. В частности, данные, представленные в настоящем документе, демонстрируют, что антагонисты активина-ActRIIa ингибируют метастатическое распространение линии клеток рака молочной железы, введенных в общий кровоток, и, следовательно, такие антагонисты можно использовать для профилактики метастазирования опухолей молочной железы. Такие соединения можно использовать для лечения любого пациента, у которого диагностирован рак молочной железы или у которого может развиться рак молочной железы. Кроме того, пациентам, которым предлагают профилактическую, или элективную, мастэктомию вследствие повышенного риска развития опухоли молочной железы, можно рекомендовать вместо или в дополнение к такой операции принимать антагонист активина-ActRIIa, чтобы уменьшить риск метастатического распространения недетектируемых опухолей.
Раскрытые в данном описании антагонисты активина-ActRIIa, в особенности, белки ActRIIa-Fc, можно использовать для лечения или профилактики рака молочной железы у пациентов, в том числе у пациентов с солидными опухолями, а также у пациентов с метастатическим раком. Антагонисты активина-ActRIIa также можно вводить людям с предраковым или доброкачественным поражением молочной железы или с аномальными пролиферативными нарушениями, включающими в себя типичную гиперплазию, атипичную гиперплазию, и неинвазивную или внутриэпителиальную карциному. Антагонисты настоящего изобретения можно использовать для лечения или профилактики как гормонозависимого или чувствительного к гормонам рака (например, рака, положительного по рецептору эстрогенов), так и гормононезависимого (например, рака, отрицательного по рецептору эстрогенов, или рака, несущего мутацию рецептора эстрогенов). Антагонисты активина-ActRIIa также можно использовать в качестве терапевтических средств для лечения рака, при котором факторы роста или онкогены находятся в активированном состоянии (например, рака молочной железы, при котором экспрессируется тирозинкиназа c-erbB-2 (также известная как HER-2/Neu)). Доказано, что антагонисты активина-ActRIIa являются особенно полезными для лечения опухолей, экспрессирующих повышенные (по сравнению с нормальными клетками тканей молочной железы) уровни активина (например, A, AB или B) или повышенные уровни ActRIIa или ActRIIb.
Настоящее изобретение утверждает, что эффективность традиционных противораковых способов лечения (например, химиотерапии, лучевой терапии, фототерапии, иммунотерапии и хирургии) можно повысить путем применения указанных антагонистов. Соответственно, антагонисты активина-ActRIIa можно использовать в комбинированных терапиях, используемых для лечения, профилактики или подавления рака молочной железы. Антагонисты можно вводить пациентам в сочетании с лучевой терапией и/или хирургическим вмешательством, а также с цитотоксической химиотерапией и/или эндокринной терапией. Такие комбинированные способы лечения могут действовать синергически, позволяя снизить дозу каждого отдельного препарата, и в результате уменьшить вредные побочные эффекты, оказываемые каждым препаратом в более высоких дозах. В других случаях злокачественные опухоли, устойчивые к терапии, могут отвечать на лечение сочетанием двух или более разных препаратов. Соответственно, настоящее описание относится к введению антагониста активина-ActRIIa в сочетании с другим традиционным противоопухолевым средством, либо одновременно, либо последовательно, с целью усиления терапевтического эффекта противоопухолевого средства или преодоления устойчивости клеток к такому противоопухолевому средству.
Примеры фармацевтических соединений, которые можно использовать в комбинированной противоопухолевой терапии, включают в себя: аминоглутетимид, амсакрин, анастрозол, аспарагиназу, bcg, бикалутамид, блеомицин, бусерелин, бусульфан, кампотецин, капецитабин, карбоплатин, кармутин, хлорамбуцил, цисплатин, кладрибин, клодронат, кохицин, циклофосфамид, ципротерон, цитарабин, дакарбазин, дактиномицин, даунорубицин, диенэстрол, диэтилстилбестрол, доцетаксел, доксорубицин, эпирубицин, эстрадиол, эстрамустин, этопозид, эксеместан, филграстим, флударабин, флудрокортизон, фторурацил, флуоксиместрон, флутамид, гемцитабин, генистеин, госерелин, гидроксимочевину, идарубицин, ифосфамид, иматиниб, интерферон, иринотекан, иронотекан, летрозол, лейковорин, лейпролид, левамизол, ломустин, мехлоретамин, медроксипрогестерон, мегестрол, мелфалан, меркаптопурин, месна, метотрексат, митомицин, митотан, митоксантрон, нилутамид, нокодазол, октреотид, оксалиплатин, паклитаксел, памидронат, пентостатин, пликамицин, порфимер, прокарбазин, ралтитрексед, ритуксимаб, стрептозоцин, сурамин, тамоксифен, темозомид, тенипозид, тестостерон, тиогуанин, тиотепа, титаноцена дихлорид, топотекан, трастузумаб, третиноин, винбластин, винкристин, виндезин и винорелбин.
Указанные химиотерапевтические противоопухолевые соединения можно подразделить, в зависимости от механизма действия, например, на следующие группы: антиметаболиты/противораковые средства, такие как аналоги пиримидина (5-фторурацил, флоксуридин, капецитабин, гемцитабин и цитарабин) и аналоги пурина, антагонисты фолата и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин (кладрибин)); антипролиферативные/антимитотические средства, включающие в себя природные продукты, такие как алкалоиды барвинка (винбластин, винкристин и винорелбин), средства, разрушающие микротрубочки, такие как таксан (паклитаксел, доксетаксел), винкристин, винбластин, нокодазол, эпоилоны и навелбин, эпидиподофиллотоксины (этопозид, тенипозид), средства, разрушающие ДНК (актиномицин, амсакрин, антрациклины, блеомицин, бусульфан, камптотецин, карбоплатин, хлорамбуцил, цисплатин, циклофосфамид, цитоксан, дактиномицин, даунорубицин, доксорубицин, эпирубицин, гексаметилмеламиноксалиплатин, ифосфамид, мелфалан, мерхлоретамин, митомицин, митоксантрон, нитрозомочевина, пликамицин, прокарбазин, таксол, таксотере, тенипозид, триэтилентиофосфорамид и этопозид (VP 16)); антибиотики, такие как дактиномицин (актиномицин D), даунорубицин, доксорубицин (адриамицин), идарубицин, антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин; ферменты (L-аспарагиназа, которая системно метаболизирует L-аспарагин и удаляет клетки, не способные синтезировать собственный аспарагин); антитромбоцитарные средства; антипролиферативные/антимитотические средства, такие как азотистые иприты (мехлоретамин, циклофосфамид и его аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты-бусульфан, нитрозомочевины (кармустин (BCNU) и его аналоги, стрептозоцин), тразены-дакарбазинин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолевой кислоты (метотрексат); координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглутетимид; гормоны, аналоги гормонов (эстроген, тамоксифен, госерелин, бикалутамид, нилутамид) и ингибиторы ароматазы (летрозол, анастрозол); противокоагулирующие средства (гепарин, соли синтетического гепарина и другие ингибиторы тромбина); фибринолитические средства (такие как активатор тканевого плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абциксимаб; антимиграторные средства; антисекреторные средства (бревелдин); иммунодепрессивные средства (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолята мофетил); антиангиогенные средства (TNP-470, генистеин) и ингибиторы факторов роста (ингибиторы фактора роста эндотелия сосудов (VEGF), ингибиторы фактора роста фибробластов (FGF)); блокатор рецептора ангиотензина; доноры оксида азота; антисмысловые олигоуклеотиды; антитела (трастузумаб); ингибиторы клеточного цикла и индукторы дифференцировки (третиноин); ингибиторы mTOR, ингибиторы топоизомеразы (доксорубицин (адриамицин), амсакрин, кампототецин, даунорубицин, дактиномицин, энипозид, эпирубицин, этопозид, идарубицин и митоксантрон, топотекан, иринотекан), кортикостероиды (кортизон, дексаметазон, гидрокортизон, метилпреднизолон, пренизон и пренизолон); киназные ингибиторы передачи сигнала факторов роста; индукторы митохондриальной дисфункции и активаторы каспазы; а также средства, разрушающие хроматин.
В некоторых воплощениях фармацевтические соединения, которые можно использовать для комбинированной терапии, включают в себя антиангиогенные средства, такие как (1) ингибиторы высвобождения "ангиогенных молекул", например bFGF (основной фактор роста фибробластов); (2) нейтрализаторы ангиогенных молекул, такие как антитела против βbFGF; и (3) ингибиторы ответа эндотелиальных клеток на ангиогенные стимулы, включающие в себя ингибитор коллагеназы, ингибиторы выворачивания базальной мембраны, ангиостатические стероиды, грибковые ингибиторы ангиогенеза, тромбоцитарный фактор 4, тромбоспондин, лекарственные средства против артрита, такие как D-пеницилламин итиомалат золота, аналоги витамина D3, альфа-интерферон и т.п. Другие ингибиторы ангиогенеза можно найти в Blood et al., Bioch. Biophys. Acta., 1032:89-1 18 (1990), Moses et al., Science, 248: 1408-1410 (1990), Ingber et al., Lab. Invest., 59:44-51 (1988), и патенты США №№ 5092885, 5112946, 5192744, 5202352 и 6573256. Кроме того, существует широкий ряд соединений, которые можно использовать для ингибирования ангиогенеза, например, пептиды или средства, которые блокируют VEGF-опосредованный путь ангиогенеза, белок эндостатин или его производные, лизин-связывающие фрагменты ангиостатина, меланин или меланин-стимулирующие соединения, фрагменты плазминогена (например, кренделеобразные домены 1-3 плазминогена), субъединицы тропоина, антагонисты витронектина αvβ3, пептиды, полученные из сапосина B, антибиотики или их аналоги (например, тетрациклин или неомицин), диеногест-содержащие композиции, соединения, содержащие MetAP-2 ингибиторное ядро, присоединенное к пептиду, соединение EM-138, халькон и его аналоги, а также ингибиторы нааладазы. См., например, патенты США №№ 6395718, 6462075, 6,465,431, 6475784, 6482802, 6482810, 6500431, 6500924, 6518298, 6521439, 6525019, 6538103, 6544758, 6544947, 6548477, 6559126 и 6569845.
В зависимости от природы комбинированной терапии, введение терапевтических антагонистов данного изобретения можно проводить во время и/или после введения другой терапии. Описанные здесь антагонисты можно вводить в виде одной дозы или в виде нескольких доз. В некоторых случаях введение антагонистов начинают, по меньшей мере, за несколько дней до традиционной терапии, хотя в других случаях введение начинают либо непосредственно перед традиционной терапией, либо во время традиционной терапии.
7. Фармацевтические композиции
В некоторых воплощениях описанные здесь антагонисты активина-ActRIIa объединяют с фармацевтически приемлемым носителем. Например, полипептид ActRIIa можно вводить отдельно или в составе фармацевтической композиции (терапевтической композиции). На основе антагонистов настоящего изобретения можно получить композиции, пригодные для введения любым подходящим способом, которые можно использовать в медицине и ветеринарии.
В некоторых воплощениях способы лечения или профилактики рака молочной железы, описанные в данном документе, включают в себя системное введение композиции или локальное введение композиции в виде имплантата или устройства. Предназначенные для введения терапевтические композиции настоящего изобретения обязательно находятся в виде физиологически приемлемой формы, не содержащей пирогенов. В соответствии со способами настоящего изобретения, отличные от антагонистов активина-ActRIIa терапевтические средства, которые могут необязательно входить в состав описанной выше композиции, и указанные антагонисты можно вводить одновременно или последовательно.
Как правило, антагонисты активина-ActRIIa вводят парентерально. Фармацевтические композиции, подходящие для парентерального введения, могут содержать один или несколько полипептидов ActRIIa в сочетании с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые можно разводить в стерильных растворах или дисперсиях для инъекций непосредственно перед применением, указанные композиции также могут содержать антиоксиданты, буферы, бактериостатические средства, растворы, придающие композиции изотонические свойства по отношению к крови предполагаемого реципиента, или суспендирующие, или загущающие средства. Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях данного изобретения, включают в себя воду, этанол, полиолы (такое как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), а также их подходящие смеси, растительные масла, такие как оливковое масло и органические сложные эфиры для инъекций, такие как этилолеат. Подходящую текучесть можно обеспечивать, например, путем применения веществ, формирующих покрытие, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и путем применения поверхностно-активных веществ.
Кроме того, композицию можно заключить в капсулу или ввести в составе формы для доставки к целевому участку ткани (такому как эпителий молочной железы). В некоторых воплощениях описанные здесь композиции могут содержать матрикс, обеспечивающий доставку одного или нескольких терапевтических соединений (например, полипептида ActRIIa) к целевому участку ткани (такому как эпителий молочной железы), который имеет структуру, позволяющую обнаружить ткань, и обладает оптимальной способностью к резорбции в организме. Например, матрикс может обеспечивать медленное высвобождение полипептида ActRIIa. Такие матриксы могут быть изготовлены из материалов, использующихся в настоящее время для других имплантируемых медицинских устройств.
Выбор материала матрикса определяется биосовместимостью, способностью к биоразрушению, механическими свойствами, внешним видом и граничными свойствами. Конкретное применение указанной композиции определяет соответствующий состав. В качестве матриксов для композиций можно использовать биоразрушаемые, химически определенные сульфат кальция, трикальция фосфат, гидроксиаппатит, полимолочную кислоту и полиангидриды. Другими подходящими веществами являются биоразрушаемые и биологически определенные соединения, такие как костный или кожный коллаген. Другие матриксы состоят из чистых белков или компонентов внеклеточного матрикса. Другие возможные матриксы, которые не являются биоразрушаемыми и являются химически определенными, включают в себя спеченный гидроксиаппатит, биостекло, алюминаты или другие керамические материалы. Матриксы могут состоять из сочетаний любых из вышеуказанных типов веществ, таких как полимолочная кислота и гидроксиаппатит или коллаген и трикальция фосфат. Биокерамические вещества могут быть модифицированы в композиции, например в кальций-алюминат-фосфат, и обработаны с целью изменения размера пор, размера частиц, формы частиц и способности к биоразрушению.
В некоторых воплощениях описанные здесь антагонисты можно вводить перорально, например, в виде таких форм, как капсулы, саше, пилюли, таблетки, пастилки (полученные с использованием ароматизированной основы, такой как сахароза и гуммиарабик или трагакант), порошки, гранулы, или растворы, или суспензии в водной или неводной жидкости, или жидкие эмульсии "масло в воде" или "вода в масле", или эликсиры, или сиропы, или пастилки (полученные с использованием инертного основания, такого как желатин и глицерин, или сахарозы и гуммиарабика) и/или жидкости для полоскания рта и т.п., каждая из которых содержит предварительно определенное количество средства в качестве активного ингредиента. Антагонист также можно вводить в виде болюса, электуария или пасты.
Твердые лекарственные формы для перорального введения (капсулы, таблетки, пиллюли, драже, порошки, гранулы и т.п.) могут содержать один или несколько антагонистов в смеси с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или фосфат дикальция, и/или любым из веществ, включающих в себя: (1) наполнители или разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремневая кислота; (2) связующие средства, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или гуммиарабик; (3) увлажняющие средства, такие как глицерин; (4) дезинтегрирующие средства, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал из кассавы, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) средства, замедляющие растворение, такие как парафин; (6) средства, ускоряющие абсорбцию, такие как соединения четвертичного аммония; (7) увлажняющие средства, такие как, например, цетиловый спирт и моностеарат глицерина; (8) абсорбенты, такие как каолин и бентонитовая глина; (9) смазывающие средства, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) окрашивающие средства. В случае капсул, таблеток и пилюль фармацевтические композиции также могут содержать забуферивающие средства. Твердые композиции подобного типа также могут применяться для наполнения мягких и твердых желатиновых капсул с использованием таких наполнителей, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п.
Жидкие лекарственные формы для перорального введения включают в себя фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активного ингредиента жидкие лекарственные формы могут содержать инертные разбавители, традиционно используемые в данной области, такие как вода или другие растворители, солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в особенности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и жирнокислотные эфиры сорбитана, а также их смеси. Помимо инертных разбавителей пероральные композиции также могут содержать вспомогательные средства, такие как увлажняющие средства, эмульгирующие и суспендирующие средства, подслащивающие средства, ароматизирующие средства, красители, отдушки и консерванты.
Суспензии помимо активных соединений могут содержать суспендирующие средства, такие как этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также их смеси.
Композиции, используемые в соответствии с описанными здесь способами, также могут содержать адъюванты, такие как консерванты, увлажняющие средства, эмульгирующие средства и дезинтегрирующие средства. Заражение микроорганизмами можно предотвратить путем применения разных противобактериальных и противогрибковых средств, таких как парабен, хлорбутанол, фенолсорбиновая кислота и т.п. Иногда желательно вводить в состав композиций средства, обеспечивающие изотоничность, такие как сахара, хлорид натрия и т.п. Кроме того, пролонгированную абсорбцию инъецируемых фармацевтических форм можно достичь путем применения средств, замедляющих абсорбцию, таких как моностеарат алюминия и желатин.
Следует понимать, что режим дозирования, подходящий для лечения или профилактики рака молочной железы, определяет лечащий врач с учетом разных факторов, которые могут оказывать влияние на действие соединений настоящего изобретения (например, полипептида ActRIIa). Разные факторы включают в себя, без ограничения, возраст, пол и диету пациента, тяжесть заболевания, время введения и другие клинические факторы. Добавление в конечную композицию других известных фаторов роста также может влиять на режим дозирования. Развитие заболевания можно отслеживать путем периодического анализа разных факторов, включающих в себя, без ограничения, размер опухоли, стадию или гистологическое состояние, статус рецепторов эстрогенов или прогестерона, инвазию сосудов и метастазирование в региональные лимфатические узлы. Клиницист также может отслеживать уровни маркеров, таких так белок uPA/PAI1 - высокие уровни uPA и PAI1 связаны с высоким риском метастазирования - и амплификацию гена и/или экспрессию белка Her-2, которые также связаны с метастазированием (Weigelt et al. 2005 Nat. Rev. Cancer 5: 591-602). Профили экспрессии генов также можно использовать для мониторинга развития заболевания (van 't Veer et al. 2002 Nature 415: 530-536 и van de Vijver et al. 2002 N. Engl. J. Med. 347: 1999-2009).
В некоторых воплощениях настоящее изобретение также предлагает способы лечения или профилактики рака молочной железы, которые включают в себя генную терапию, обеспечивающую продукцию полипептида ActRIIa in vivo. Терапевтический эффект такой терапии достигается в результате введения полинуклеотидных последовательностей ActRIIa в клетки или ткани, пораженные раком молочной железы, такие как, например, эпителиальные клетки молочной железы. Доставку полинуклеотидных последовательностей ActRIIa можно осуществить с помощью рекомбинантного вектора экспрессии, такого как химерный вирус, или коллоидной дисперсионной системы. Предпочтительно терапевтическую доставку полинуклеотидных последовательностей ActRIIa осуществляют с помощью таргетированных липосом.
Различные вирусные векторы, которые можно использовать для генной терапии в соответствии с настоящим описанием, включают в себя аденовирусы, вирус герпеса, вирус коровьей оспы или РНК-вирус, такой как ретровирус. Ретровирусный вектор можно получить из мышиного или птичьего ретровируса. Примеры ретровирусных векторов, содержащих один чужеродный ген, включают в себя, без ограничения: вирус мышиного лейкоза Молони (MoMuLV), вирус саркомы мышей Харви (HaMuSV), вирус опухоли молочной железы мышей (MuMTV) и вирус саркомы Рауса (RSV). Ряд других ретровирусных векторов может содержать несколько генов. Все указанные векторы могут переносить или содержать ген селектируемого маркера, позволяющий идентифицировать и производить трансформированные клетки. Ретровирусным векторам можно придать специфичность к мишени путем присоединения, например, сахара, гликолипида или белка. Предпочтительно таргетирование осуществляют с помощью антитела. Специалистам в данной области известно, что целевую специфическую доставку ретровирусного вектора, содержащего полинуклеотид ActRIIa, можно обеспечить путем вставки специфических полинуклеотидных последовательностей в геном ретровируса или присоединения их к вирусной оболочке.
Альтернативно, клетки тканевой культуры можно непосредственно трансфицировать плазмидами, кодирующими ретровирусные структурные гены gag, pol и env, путем традиционной трансфекции с использованием фосфата кальция. Затем указанные клетки трансфицируют векторной плазмидой, содержащей представляющие интерес гены. Полученные клетки высвобождают ретровирусный вектор в культуральную среду.
Другой системой целевой доставки полинуклеотидов ActRIIa является коллоидная дисперсионная система. Коллоидные дисперсионные системы включают в себя макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и липид-содержащие системы, включающие в себя эмульсии масло в воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой данного изобретения является липосома. Липосомы представляют собой искусственные мембранные везикулы, которые можно использовать в качестве средств доставки in vitro и in vivo. РНК, ДНК и интактные вирионы можно заключить в капсулу в водной среде и доставлять к клеткам в биологически активной форме (см., например, Fraley, et al., Trends Biochem. Sci., 6:77, 1981). Способы эффективного переноса генов с использованием липосом известны в данной области и описаны, например, Mannino, et al., Biotechniques, 6:682, 1988. Липосома обычно состоит из нескольких фосфолипидов, как правило, в сочетании со стероидами, в особенности с холестерином. Можно использовать и другие фосфолипиды или другие липиды. Физические характеристики липосом зависят от pH, ионной силы и присутствия двухвалентных катионов.
Примеры липидов, используемых для получения липосом, включают в себя фосфатидильные соединения, такие как фосфатидилглицерин, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, сфинголипиды, цереброзиды и ганглиозиды. Типичные фоссфолипиды включают в себя яичный фосфатидилхолин, дипальмитоилфосфатидилхолин и дистеароилфосфатидилхолин. Таргетирование липосом может быть, например, органоспецифичным, клеточноспецифичным и органеллоспецифичным, или оно может быть основано на другой специфичности, известной в данной области.
ПРИМЕРЫ
Нижеследующие примеры, приведенные только для иллюстрации некоторых аспектов и воплощений настоящего изобретения, но не для ограничения изобретения, позволяют легче понять описанное в общем изобретение.
Пример 1: Слитые белки ActRIIa-Fc
Авторы настоящего изобретения конструируют растворимый слитый белок ActRIIa, который содержит внеклеточный домен человеческого ActRIIa, сопряженный с человеческим или мышиным доменом Fc через минимальный линкер. Полученные конструкции обозначают ActRIIa-hFc и ActRIIa-mFc соответственно.
Последовательность ActRIIa-hFc, выделенного из клеточных линий CHO (SEQ ID NO:7):

Белки ActRIIa-hFc и ActRIIa-mFc экспрессируют в клеточных линиях CHO. Используют три разные лидерные последовательности:
(i) мелитина медоносной пчелы (HBML): MKFLVNVALVFMVVYISYIYA (SEQ ID NO:8),
(ii) активатора тканевого плазминогена (TPA): MDAMKRGLCCVLLLCGAVFVSP (SEQ ID NO:9) и
(iii) нативную: MGAAAKLAFAVFLISCSSGA (SEQ ID NO:10).
Выбранная форма, полученная с использованием лидера TPA, до процессинга имеет следующую аминокислотную последовательность:

Этот полипептид кодирует следующая нуклеотидная последовательность:


И ActRIIa-hFc, и ActRIIa-mFc можно успешно использовать для рекомбинантной экспрессии. Как показано на фигуре 1, очищенный белок имеет один, четко очерченный пик. С помощью N-концевого секвенирования обнаруживают одну последовательность -ILGRSTQE (SEQ ID NO:11). Очистку можно проводить с помощью ряда стадий колоночной хроматографии, включающих в себя, например, в любом порядке три или более из перечисленных ниже: хроматография на белке A, хроматография на сефарозе Q, хроматография на фенилсефарозе, гель-хроматография и катионообменная хроматография. Очистку можно дополнить фильтрацией вируса и сменой буфера. Чистота белка ActRIIa-hFc составляет >98% по данным гель-хроматографии и >95% по результатам SDS PAGE.
ActRIIa-hFc и ActRIIa-mFc имеют высокое сродство к лигандам, особенно к активину A. GDF-11 или активин A ("ActA") иммобилизуют на чипе Biacore CM5 с использованием стандартной процедуры присоединения амина. Белки ActRIIa-hFc и ActRIIa-mFc загружают на систему и измеряют связывание. ActRIIa-hFc связывается с активином с константой диссоциации (KD) 5×10-12, а с GDF11 данный белок связывается с KD 9,96×10-9. См. фигуру 2. ActRIIa-mFc ведет себя подобным образом.
ActRIIa-hFc является очень стабильным в фармакокинетических исследованиях. Крысам вводят белок ActRIIa-hFc в дозах 1 мг/кг, 3 мг/кг или 10 мг/кг и через 24, 48, 72, 144 и 168 часов измеряют уровень белка в плазме. В отдельном исследовании крысы получают белок в дозах 1 мг/кг, 10 мг/кг или 30 мг/кг. У крыс период полужизни ActRIIa-hFc в сыворотке составляет 11-14 дней, и уровни лекарственного средства в кровотоке через две недели являются довольно высокими (11 мкг/мл, 110 мкг/мл или 304 мкг/мл при исходном введении 1 мг/кг, 10 мг/кг или 30 мг/кг соответственно). У яванского макака период полужизни в плазме значительно превышает 14 дней, а уровни лекарственного средства в кровотоке составляют 25 мкг/мл, 304 мкг/мл или 1440 мкг/мл при исходном введении 1 мг/кг, 10 мг/кг или 30 мг/кг соответственно.
Пример 2: Определение характеристик белка ActRIIa-hFc
ActRIIa-hFc слитый белок экспрессируют в стабильно трансфицированных клетках CHO-DUKX B11 из вектора pAID4 (SV40 ori/энхансер, CMV промотор) с использованием лидерной последовательности тканевого плазминогена SEQ ID NO:9. Белок, очищенный по способу, описанному выше в примере 1, имеет последовательность SEQ ID NO:7. Фрагмент Fc представляет собой последовательность Fc человеческого IgG1, как показано в SEQ ID NO:7. Анализ сиаловых кислот показывает, что белок в среднем содержит примерно от 1,5 до 2,5 молей сиаловых кислот на молекулу слитого белка ActRIIa-hFc.
Этот очищенный белок имеет значительно более длинный период полужизни в сыворотке всех тестируемых животных, в том числе пациентов-людей, у которых период полужизни составляет 25-32 дней (см. пример 3, ниже). Белок, экспрессированный в клетках CHO, имеет более высокое сродство к лиганду активина B, чем слитый белок ActRIIa-hFc, экспрессированный в человеческих клетках 293 (del Re et al., J Biol Chem. 2004 Dec 17;279(51):53126-35.). Кроме того, лидерная последовательность tPa обеспечивает более высокую продукцию, чем другие лидерные последовательности, и, в отличие от ActRIIa-Fc, экспрессированного с использованием нативного лидера, высокочистую N-концевую последовательность. С использованием нативной лидерной последовательности получают два основных вида ActRIIa-Fc, которые имеют разные N-концевые последовательности.
Пример 3: Клинические испытания на людях
Чтобы оценить, в первую очередь, безопасность применения у здоровых постклимактерических женщин, белок, описанный в примере 2, вводят пациентам-людям по случайной, дважды слепой схеме с использованием контроля-плацебо. Сорок восемь субъектов случайным образом распределяют в группы по 6 человек, получающие либо одну дозу ActRIIa-hFc, либо плацебо (5 получают активное соединение:1 получает плацебо). Уровни доз варьируют от 0,01 до 3,0 мг/кг внутривенно (IV) и от 0,03 до 0,1 мг/кг подкожно (SC). Всех субъектов наблюдают в течение 120 дней. Субъектов отстраняют от участия в исследовании, если они принимали лекарственные средства, влияющие на метаболизм костей, в пределах 6 месяцев до начала исследования. Анализ безопасности проводят в каждой группе, чтобы определить эскалацию дозировки. Помимо фармакокинетических (PK) анализов также анализируют биологическую активность ActRIIa-hFc путем измерения уровней биохимических маркеров формирования и резорбции кости и FSH.
В данном исследовании серьезные побочные эффекты не обнаружены. Побочные эффекты (AE), как правило, являются умеренными и временными. В соответствии с результатами предварительного анализа, AE включают в себя головную боль, повышенные данные лабораторных анализов, симптомы простуды, рвоту или тошноту, внутривенную инфильтрацию и гематому в участке введения.
С помощью PK анализа ActRIIa-hFc определяют линейную зависимость от дозы и средний период полужизни, составляющий приблизительно 25-32 дней. Площадь под кривой (AUC) для ActRIIa-hFc находится в линейной зависимости от дозы, а абсорбция после SC введения является практически полной. Полученные данные показывают, что SC введение является предпочтительным способом, поскольку оно обеспечивает такие же биодоступность и период полужизни в сыворотке, как и IV введение, но позволяет избежать резкого увеличения сывороточной концентрации лекарственного средства в первые несколько дней после IV введения. ActRIIa-hFc вызывает быстрое и стабильное дозозависимое увеличение сывороточных уровней костной щелочной фосфатазы (BAP), которая является маркером анаболического роста костей, и дозозависимое уменьшение уровней C-концевого телопептида коллагена типа 1 и тартрат-устойчивой кислой фосфатазы 5b, которые являются маркерами резорбции костей. В отношении других маркеров, таких как P1NP, получены неубедительные результаты. Уровни BAP близки к насыщающим при максимальной дозе лекарственного средства, указывая на то, что полумаксимального эффекта, оказываемого на этот анаболический костный биомаркер, можно достичь при дозе 0,3 мг/кг, при том, что увеличение варьируется до 3 мг/кг. Рассчитанное по зависимости фармакодинамического эффекта от AUC, EC50 лекарственного средства составляет 51465 (день*нг/мл). Такие изменения костного биомаркера сохраняются в течение примерно 120 дней при максимальных тестируемых уровнях дозы. Существует дозозависимое уменьшение сывороточных уровней FSH, согласующееся с ингибированием активина.
Однократное введение ActRIIa-hFc здоровым постклимактерическим женщинам является безопасным и хорошо переносится в тестируемом диапазоне уровней дозы. Пролонгированные PK и фармакодинамические эффекты позволяют предположить, что в будущих исследованиях можно использовать периодическое введение. Например, на основе периода полужизни в сыворотке, введение можно проводить ежемесячно или каждые две, три, четыре, пять или шесть недель. Кроме того, поскольку фармакодинамический эффект связан не только с нахождением лекарственного средства в сыворотке, введение можно проводить на основе фармакодинамического эффекта, свидетельствующего о том, что введение каждые три месяца, или каждые два, три, четыре, пять, шесть или даже двенадцать месяцев может быть эффективным, вызывая желательный эффект у пациентов. Такие клинические испытания демонстрируют, что у людей ActRIIa-hFc действует как остеоанаболическое средство, и что существуют биологические факты, свидетельствующие о том, что он увеличивает формирование костей и уменьшает резорбцию костей.
Пример 4: ActRIIa-Fc ослабляет или предотвращает разрежение кости, вызванное метастазами рака молочной железы
Показано, что от 65 до 75 процентов раковых опухолей молочной железы метастазируют в кости, приводя к значительному повреждению структуры кости, увеличивая риск переломов и вызывая боль и другие побочные эффекты. Авторы настоящего изобретения анализируют влияние ActRIIa-Fc на мышиную модель рака молочной железы, который метастазирует в кости.
Сублинию клеточной линии рака молочной железы человека MDA-MB-231 (клон 2287, Kang et al. Cancer Cell 2003, vol 3:537-549) культивируют in vitro, и клетки собирают при плотности 5×106 клеток/мл. Клеточная линия MDA-MB-231 хорошо подходит для высевания в кости и вызывает повреждение кости, подобное вызываемому метастазами. 10 мкл клеток вводят в большеберцовую кость самок бестимусных голых мышей возрастом 6 недель на 0 день исследования. На 10 день исследования мыши получают ActRIIa-mFc (10 мг/кг/два раза в неделю/подкожно) (n=8) или среду PBS (n=7). Развитие заболевания отслеживают по изменению минеральной плотности кости, определяемому методом двухэнергетической рентгеновской абсорбциометрии (PIXIMus) с интервалами в неделю. Мышей обрабатывают ActRIIa-mFc в течение 4 недель, затем их умерщвляют и у каждого животного собирают большеберцовые кости (как зараженные опухолью, так и не зараженные опухолью). Затем большеберцовые кости обрабатывают и препараруют для микрокомпьютерной томографии (microCT) и гистологического анализа.
Введение клеток MDA-MB-231 в большеберцовые кости бестимусных голых мышей вызывает развитие остеолитических поврежедний в зараженной большеберцовой кости по сравнению с противоположной ногой. Анализ MicroCT проксимальной большеберцовой кости показывает, что у мышей, обработанных средой PBS, в большеберцовой кости, несущей MDA-MB-231, происходит 62% уменьшение объема губчатой ткани по сравнению с не зараженной опухолью большеберцовой костью. Обработка ActRIIa-mFc приводит к 70% или 147% увеличению в интактной или несущей опухоль большеберцовой кости соответственно по сравнению со средой (P<0,01 в обоих случаях). Несущая опухоль большеберцовая кость ActRIIa-mFc-обработанных мышей имеет такую же плотность губчатого вещества кости, как и интактная большеберцовая кость VEH-обработанных мышей (p=0,39).
Полученные результаты показывают, что ActRIIa-mFc может устранять повреждение кости, связанное с присутствием клеток опухоли молочной железы в кости.
Пример 5: ActRIIa-Fc уменьшает метастазы рака молочной железы и повышает выживание
Чтобы получить модель метастатического заболевания, клетки MDA-MB-231 можно ввести мышам путем внутрисердечной инъекции. Клетки, введенные в левый желудочек, мигрируют посредством кровотока и образуют местастатические повреждения в удаленных участках. Производная клеточная линия MDA-MB-231-luc-D3H2LN (Caliper Life Sciences) экспрессирует люциферазу, которая позволяет проводить неинвазивный мониторинг образования метастатической опухоли путем получения биофотонных изображений (Caliper Life Sciences). Данную модель используют для анализа способности ActRIIa-mFc уменьшать метастазирование рака молочной железы.
Клетки MDA-MB-231-luc-D3H2LN вводят путем внутрисердечной инъекции двадцати шести бестимусным голым мышам. Четырнадцать мышей обрабатывают средой (забуференным фосфатом физиологическим раствором - PBS), а двенадцать обрабатывают ActRIIa-mFc (10 мг/кг, дважды в неделю, путем подкожной инъекции), начиная за две недели до введения опухоли и затем на протяжении всего исследования. Другие девять мышей получают суррогатные клетки и ActRIIa-mFc. Мышей периодически анестезируют и детектируют развитие метастазов путем визуализации биолюминесцентной эмиссии.
В группе, получающей ActRIIa-mFc, значительно уменьшается развитие метастатических повреждений. На пятой неделе у двенадцати из четырнадцати мышей, обработанных средой, наблюдаются множественные интенсивные флюоресцентные сигналы, свидетельствующие о распространении метастазов, тогда как только у четырех из двенадцати мышей, обработанных ActRIIa-mFc, наблюдаются подобные повреждения (фигура 3). Количественное определение интенсивности флюоресценции показывает примерно десятикратное уменьшение флюоресцентного сигнала у обработанных мышей.
Кроме того, обработка ActRIIa-mFc заметно увеличивает выживание мышей. На сороковой день исследования все (14/14) мыши, обработанные средой, умирают или подвергаются эвтаназии (в соответствии со стандартной инструкцией по гуманному обращению с лабораторными животными), тогда как только две (2/12) из мышей, обработанных ActRIIa-mFc, умирают или подвергаются эвтаназии. На сорок пятый день 3/12 мышей, обработанных ActRIIa-mFc, умирают или подвергаются эвтаназии, но ни одна мышь из получающих суррогатные клетки не умирает.
Таким образом, обработка ActRIIa-mFc вызывает у данной модели метастатического рака молочной железы значительное уменьшение метастатических повреждений и повышает выживание. Полученные результаты показывают, что ActRIIa-Fc можно использовать для лечения рака молочной железы у пациентов-людей, в особенности в сочетании с такими способами лечения, как хирургическое вмешательство, гормональная терапия или традиционная химиотерапия, которые направлены на лечение первичной опухоли.
Пример 6: Альтернативные белки ActRIIa-Fc
Ряд вариантов ActRIIa, которые можно использовать в соответствии со способами настоящего изобретения, описан в Международной патентной заявке, опубликованной как WO2006/012627 (см., например, стр. 55-60), которая включена в данное описание в качестве ссылки во всей полноте. Альтернативная конструкция может содержать делецию C-концевого хвоста (последние 15 аминокислот внеклеточного домена ActRIIa). Последовательность такой конструкции приведена ниже (фрагмент Fc подчеркнут) (SEQ ID NO:12):

ВКЛЮЧЕНИЕ В КАЧЕСТВЕ ССЫЛКИ
Все упомянутые здесь публикации и патенты включены в данное описание в качестве ссылки, как если бы в отношении каждой отдельной заявки или каждого патента было специально и отдельно указано, что они включены в качестве ссылки. В случае конфликта настоящая заявка, в том числе все приведенные здесь определения, будут контролироваться.
Несмотря на то, что выше рассматриваются конкретные воплощения настоящего изобретения, приведенное описание является иллюстративным, но не ограничивающим. Многие вариации станут очевидными для специалистов в данной области в свете данного описания и приведенной ниже формуле изобретения. Полный объем данного изобретения определяется в формуле изобретения, наряду с полным объемом эквивалентов, и в описании, наряду с такими вариациями.











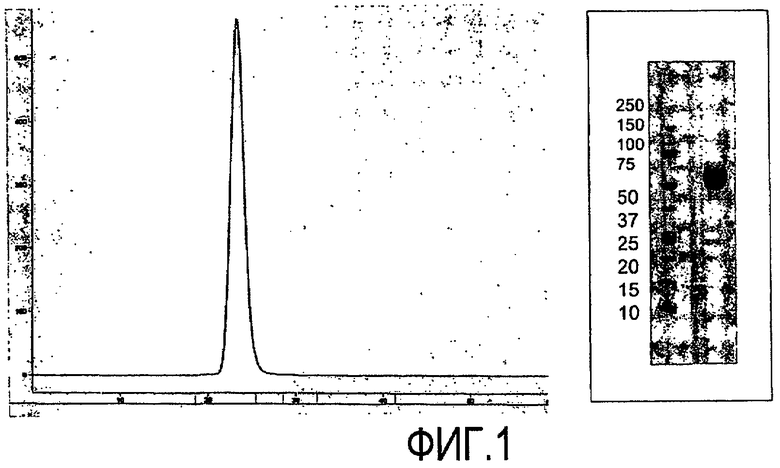
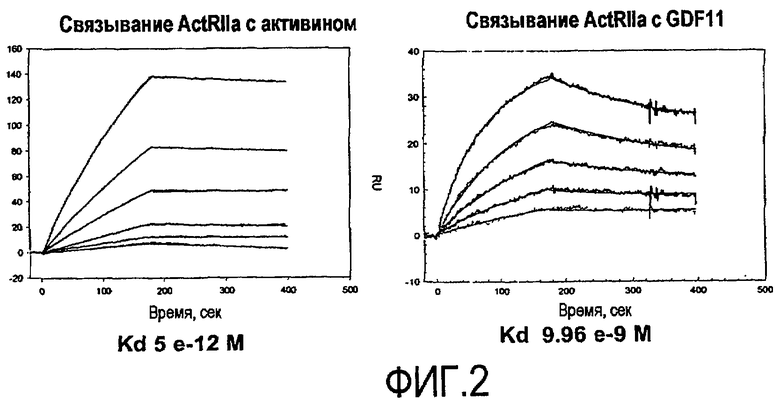
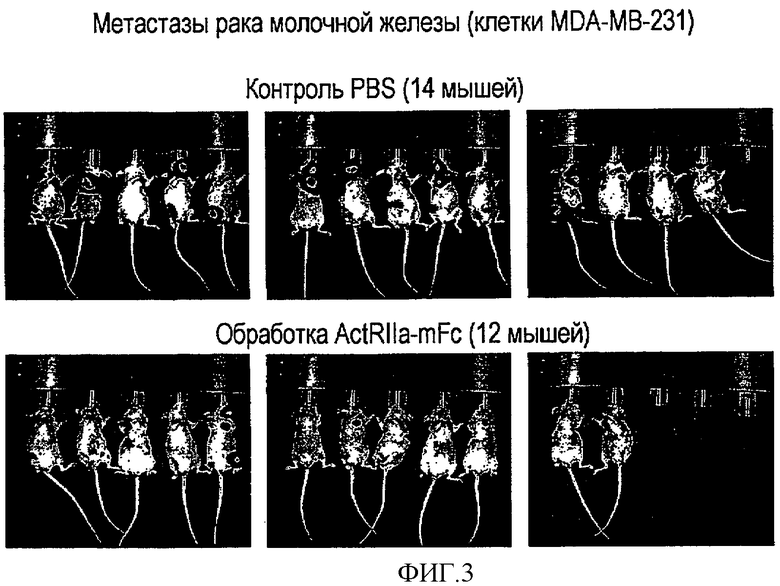
Группа изобретений относится к онкологии, а именно раскрывает слитый белок ActRIIa-Fc, его применение и способ лечения связанного с раком молочной железы разрежения кости у человека введением эффективного количества данного белка. Группа изобретений позволяет предотвратить или подавить развитие разрежения кости у пациента. 3 н. и 29 з.п. ф-лы, 3 ил., 6 пр.
1. Способ лечения связанного с раком молочной железы разрежения кости у пациента-человека, причем данный способ включает в себя введение пациенту эффективного количества слитого белка ActRIIa-Fc.
2. Способ по п.1, где слитый белок ActRIIa-Fc выбран из группы, состоящей из:
а. полипептида, содержащего аминокислотную последовательность по меньшей мере, на 90% идентичную SEQ ID NO:2;
b. полипептида, содержащего аминокислотную последовательность, по меньшей мере, на 90% идентичную SEQ ID NO:3; и
с. полипептида, содержащего, по меньшей мере, 50 последовательных аминокислот SEQ ID NO:2.
3. Способ по п.1, где слитый белок ActRIIa-Fc имеет одну или более из следующих характеристик:
i. связывается с лигандом ActRIIa с KD, составляющей, по меньшей мере, 10-7 M; и
ii. ингибирует сигнальный путь ActRIIa в клетке.
4. Способ по п.1, где указанный слитый белок ActRIIa-Fc содержит один или более модифицированных аминокислотных остатков, выбранных из: гликозилированной аминокислоты, пэгилированной аминокислоты, фарнезилированной аминокислоты, ацетилированной аминокислоты, биотинилированной аминокислоты, аминокислоты, конъюгированной с липидным фрагментом, и аминокислоты, конъюгированной с органическим дериватизирующим средством.
5. Способ по п.2, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность, которая, по меньшей мере, на 95% идентична аминокислотной последовательности SEQ ID NO:2.
6. Способ по п.2, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность, которая, по меньшей мере, на 95% идентична аминокислотной последовательности SEQ ID NO:3.
7. Способ по п.6, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность SEQ ID NO:3.
8. Способ по п.5, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность SEQ ID NO:2.
9. Способ по п.2, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность, которая, по меньшей мере, на 95% идентична аминокислотной последовательности SEQ ID NO:7.
10. Способ по п.9, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность SEQ ID NO:7.
11. Способ по п.1, где слитый белок ActRIIa-Fc представляет собой димер, образованный из двух полипептидов, каждый из которых содержит аминокислотную последовательность, которая, по меньшей мере, на 90% идентична аминокислотной последовательности SEQ ID NO:2, и где слитый белок ActRIIa-Fc содержит три или более фрагмента, состоящих из сиаловых кислот.
12. Способ по п.11, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность SEQ ID NO:2.
13. Способ по п.11 или 12, где слитый белок ActRIIa-Fc содержит от трех до пяти фрагментов, состоящих из сиаловых кислот.
14. Способ по п.1, где способ вызывает у пациента увеличение массы скелетных мышц менее чем на 10%.
15. Способ по п.1, где слитый белок ActRIIa-Fc вводят пациенту так, чтобы достичь концентрации в сыворотке пациента, составляющей, по меньшей мере, 0,2 мг/кг.
16. Способ по п.11, где слитый белок ActRIIa-Fc содержит аминокислотную последовательность SEQ ID NO:7.
17. Способ по п.1, где слитый белок ActRIIa-Fc имеет период полужизни в сыворотке нормальных здоровых людей от 15 до 40 дней.
18. Способ по п.1, где слитый белок ActRIIa-Fc вводят пациенту не чаще, чем раз в неделю.
19. Способ по п.1, где слитый белок ActRIIa-Fc вводят пациенту не чаще, чем раз в месяц.
20. Способ по п.1, где слитый белок ActRIIa-Fc вводят пациенту не чаще, чем раз в три месяца.
21. Способ по п.1, где пациент получает или получил в течение одного года до введения слитого белка ActRIIa-Fc антирезорбтивную терапию.
22. Способ по п.21, где антирезорбтивное средство выбрано из группы, состоящей из: бифосфонатного средства, антагониста лиганда RANK и антагониста остеопротегрина.
23. Способ по п.1, дополнительно включающий в себя подвергание пациента-человека лучевой терапии или эндокринной терапии или введение ему цитотоксического средства.
24. Способ по п.1, где пациент-человек представляет собой женщину, имеющую один или более факторов риска рака молочной железы.
25. Способ по п.1, дополнительно включающий в себя подвергание субъекта лучевой терапии или эндокринной терапии или введение ему цитотоксического средства.
26. Способ по п.1, где пациент имеет риск развития метастатического рака.
27. Способ по п.1, где рак является метастатическим.
28. Способ по п.1, где пациент страдает раком молочной железы, отрицательным по рецептору эстрогенов.
29. Способ по п.1, где пациент имеет первичную опухоль молочной железы или пролиферативное поражение молочной железы, и где пациенту вводят слитый белок ActRIIa-Fc до развития метастатических повреждений.
30. Способ по п.1, где пациент имеет первичную опухоль молочной железы или пролиферативное поражение молочной железы, и где пациенту вводят слитый белок ActRIIa-Fc до метастатического распространения раковых клеток молочной железы в кость.
31. Применение слитого белка ActRIIa-Fc для производства лекарственного средства для лечения связанного с раком молочной железы разрежения кости у пациента-человека.
32. Слитый белок ActRIIa-Fc для применения в лечении связанного с раком молочной железы разрежения костей у пациента-человека.
| WO 2006012627 A2, 02.02.2006 | |||
| US 2006068468 A1, 30.03.2006 | |||
| JELENA KRNETA et al | |||
| Dissociation of Angiogenesis and Tumorigenesis in Follistatin- and Activin-Expressing Tumors, Cancer Res June 1, 2006 66; 5686-5695 | |||
| LAURA SMITH et al., The analysis of doxorubicin resistance in human breast cancer cells using antibody microarrays, Mol Cancer Ther |
Авторы
Даты
2013-01-27—Публикация
2008-02-01—Подача