Предшествующий уровень техники
Область, к которой относится изобретение
В общих чертах настоящее изобретение относится к области биохимии и биофизики. Более конкретно настоящее изобретение относится к молекулам, связывающим нуклеиновую кислоту, или к аптамерам, содержащим репортерные молекулы, используемые для передачи сигнала о присутствии когнатных лигандов в растворе. Описание прототипов
Метод SELEX (далее называемый SELEX), описанный в патенте США № 5475096 и в патенте США № 5270163, применяется к классу продуктов, представляющих собой молекулы нуклеиновой кислоты, каждая из которых имеет уникальную последовательность и каждая из которых обладает способностью специфически связываться с нужным соединением или с молекулой-мишенью. Каждая молекула нуклеиновой кислоты представляет собой специфический лиганд для данного соединения или молекулы-мишени. Метод SELEX основан лишь на том представлении, что нуклеиновые кислоты обладают достаточной способностью образовывать различные двух- и трехмерные структуры и достаточным химическим разнообразием своих мономеров, чтобы взаимно действовать в качестве лигандов (то есть образовывать пары специфического связывания) фактически с любым химическим соединением, независимо от того, является ли оно мономерным или полимерным. В качестве мишеней могут служить молекулы любого размера.
Метод SELEX предусматривает отбор из смеси кандидатов и ступенчатую итерацию для уточнения структуры с использованием той же самой общей схемы отбора, которая позволяет получить практически любой нужный критерий аффинности и селективности связывания. Этот метод, основанный на использовании смеси нуклеиновых кислот, предпочтительно содержащих сегмент рандомизированной последовательности, включает стадии контактирования данной смеси с мишенью в условиях, благоприятствующих связыванию; отделения несвязанных нуклеиновых кислот от нуклеиновых кислот, связанных с молекулами-мишенями; диссоциации пар "нуклеиновая кислота - мишень"; амплификации нуклеиновых кислот, диссоциированных из пар "нуклеиновая кислота - мишень", с получением обогащенной лигандами смеси нуклеиновых кислот с последующим повторением циклов, включающих стадии связывания, разделения, диссоциации и амплификации столько раз, сколько это необходимо.
Смесь нуклеиновых кислот, содержащая большое число возможных последовательностей и структур, включает широкий диапазон аффинностей связывания для данной мишени. Смесь нуклеиновых кислот, содержащая, например, рандомизированный сегмент из 20 нуклеотидов, может иметь от 4 до 20 возможных кандидатов. Наиболее вероятно, что с мишенью будут связываться те нуклеотиды, которые имеют более высокие аффинные константы (константы связывания по сродству) по отношению к данной мишени. После разделения, диссоциации и амплификации генерируют вторую смесь нуклеиновых кислот, обогащенную кандидатами с более высокой аффинностью связывания.
Дополнительные раунды отбора постепенно приводят к получению все лучших лигандов до тех пор, пока полученная смесь нуклеиновых кислот не будет преимущественно состоять только из одной или малого числа последовательностей. Затем они могут быть клонированы, секвенированы и тестированы по отдельности на аффинность связывания как чистые лиганды.
Циклы отбора, разделения и амплификации повторяют до тех пор, пока не будет достигнута поставленная цель. В наиболее общем случае, отбор/разделение/амплификацию продолжают до тех пор, пока после повторения данного цикла уже не достигается какого-либо значительного увеличения силы связывания. Этот способ может быть применен к образцу, имеющему примерно 10-18 различных молекул нуклеиновых кислот. Нуклеиновые кислоты исследуемой смеси предпочтительно включают часть рандомизированной последовательности, а также консервативные последовательности, необходимые для эффективной амплификации. Варианты последовательностей нуклеиновых кислот могут быть продуцированы различными способами, включая синтез рандомизированных последовательностей нуклеиновых кислот и отбор по размеру из произвольно расщепленных клеточных нуклеиновых кислот. Вариабельная часть последовательности может содержать полностью или частично рандомизированную последовательность; причем она может также содержать субчасти консервативной последовательности, объединенной с рандомизированной последовательностью. Изменения в последовательностях исследуемых нуклеиновых кислот могут быть введены или усилены путем мутагенеза до или во время повторения стадий отбора/разделения/амплификации.
Большинство стандартных диагностических анализов основаны на иммобилизации либо биополимерных рецепторов, либо их лигандов. Такие анализы занимают много времени и являются трудоемкими, а поэтому необходимо разработать гомогенные форматы анализов, которые не требуют проведения множества стадий иммобилизаций или промывки. Аптамеры и ранее применялись в диагностических анализах, хотя они, главным образом, использовались как замена антителам. Так, например, Gilardi et al. конъюгировали флуоресцентные красители со связывающим мальтозу белком и тем самым имели возможность непосредственно считывать концентрации мальтозы в растворе1, а Marvin и Hellinga конъюгировали флуоресцентные красители со связывающим глюкозу белком с последующим считыванием концентраций глюкозы в растворе2.
Ранее олигонуклеотиды и нуклеиновые кислоты были адаптированы для распознавания гибридизации3 и имели потенциальную возможность для их использования для детекции металлов4. Были отобраны аптамеры для широкого множества аналитов-мишеней, например ионов, небольших органических веществ, белков и надмолекулярных структур, таких как вирусы или ткани18'19.
Превращение связывающихся с лигандами белков5 или небольших молекул6 в биосенсоры в высокой степени зависит от структуры и динамики данного рецептора, а поэтому более легко могут быть превращены в биосенсоры7,8 аптамеры. В основном аптамеры подвергают "соответствующим образом стимулированному" конформационному изменению в присутствии их когнатных лигандов9, и, таким образом, присоединенный краситель легко подвергается лиганд-зависимому изменению в своем локальном окружении. В отличие от других реагентов, например антител, аптамеры легко синтезируются, и в их специфические сайты могут быть легко введены красители. Таким образом, аптамерные биосенсоры могут быть быстро генерированы с использованием рациональных и рандомизированных стратегий генной инженерии.
В предшествующих работах отсутствуют данные о молекулах (аптамерах), связывающихся с нуклеиновыми кислотами и содержащих репортерные молекулы, которые передают сигнал о присутствии когнатных лигандов в растворе. Настоящее изобретение удовлетворяет давно назревшим требованиям и позволяет реализовать цели, преследуемые специалистами в данной области техники.
Краткое описание изобретения
В одном из вариантов своего осуществления настоящее изобретение относится к способу преобразования конформационного изменения передающего сигнал аптамера, после его связывания с лигандом, в дифференциальный сигнал, генерированный репортерной молекулой, причем указанный способ включает стадии контактирования передающего сигнал аптамера с лигандом, где указанный передающий сигнал аптамер связывается с указанным лигандом; и детекции дифференциального сигнала, генерированного репортерной молекулой в результате конформационного изменения передающего сигнал аптамера, который после связывания с лигандом передает сигнал о конформационном изменении.
В другом варианте своего осуществления настоящее изобретение относится к способу преобразования конформационного измерения передающего сигнал аптамера, после связывания с лигандом, в оптический сигнал, генерированный флуоресцентным красителем. Этот способ включает стадии контактирования сигнального аптамера с лигандом, где указанный передающий сигнал аптамер связывается с указанным лигандом; и детекции оптического сигнала, генерированного флуоресцентным красителем, в результате конформационного изменения передающего сигнал аптамера, который, после связывания с лигандом, передает сигнал о конформационном изменении.
В еще одном варианте своего осуществления настоящее изобретение относится к способу количественного определения лиганда, описанного выше, включающему стадии контактирования передающего сигнал аптамера, описанного выше, с лигандом, где указанный передающий сигнал аптамер связывается с указанным лигандом; и измерения увеличения оптического сигнала, описанного выше, после связывания передающего сигнал аптамера с лигандом, где указанное увеличение оптического сигнала положительно коррелирует с количеством лиганда, связанного с передающим сигнал аптамером.
Другие и дополнительные аспекты, отличительные признаки, эффекты и преимущества настоящего изобретения будут очевидны из нижеследующего описания предпочтительных вариантов настоящего изобретения, представленных в иллюстративных целях.
Краткое описание графического материала
Для того чтобы вышеупомянутые отличительные признаки, преимущества и цели настоящего изобретения, а также другие его аспекты стали очевидными, достижимыми и более понятными в деталях, ниже приводится подробное описание изобретения, вкратце описанного выше, со ссылками на некоторые варианты его осуществления, проиллюстрированные в прилагаемом ниже графическом материале. Этот графический материал представляет собой часть настоящего описания. Однако следует отметить, что прилагаемый графический материал иллюстрирует предпочтительные варианты осуществления изобретения, а поэтому он не должен рассматриваться как ограничение его объема.
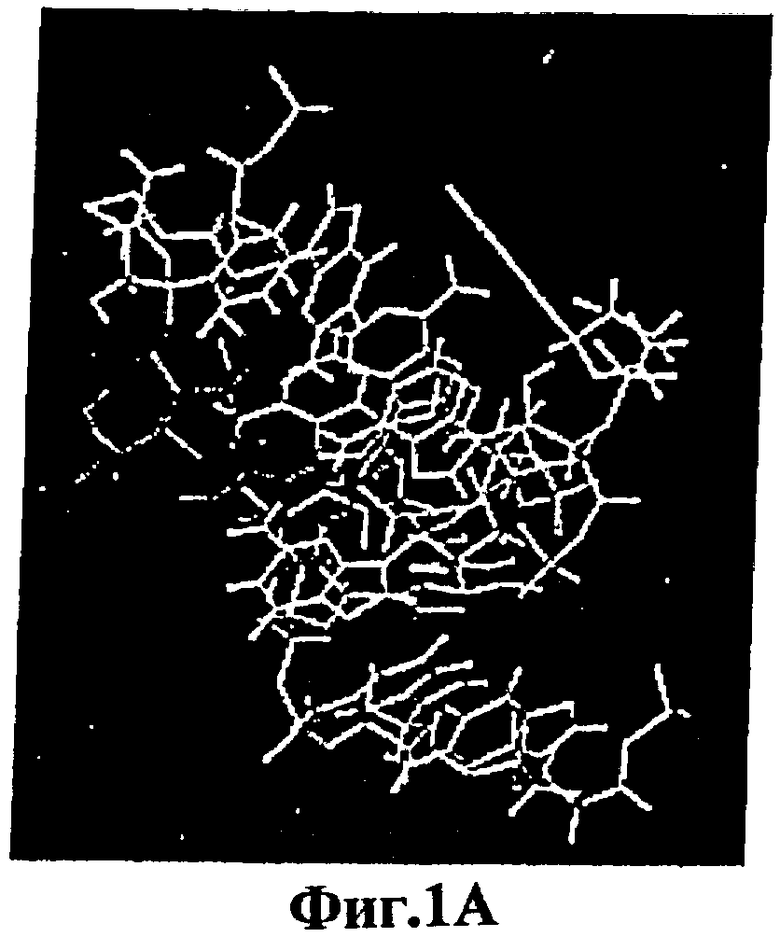
На фигуре 1 показаны трехмерные модели антиаденозиновых аптамеров, полученных исходя из ЯМР-анализов11,12. Некоторые из сайтов, выбранных для включения красителя ATP-R-Acl3 (синего) в РНК-аптамер или красителя DFL7-8 (оранжевого) в ДНК-аптамер, показаны желтым. Связанные аденозины показаны пурпурным.
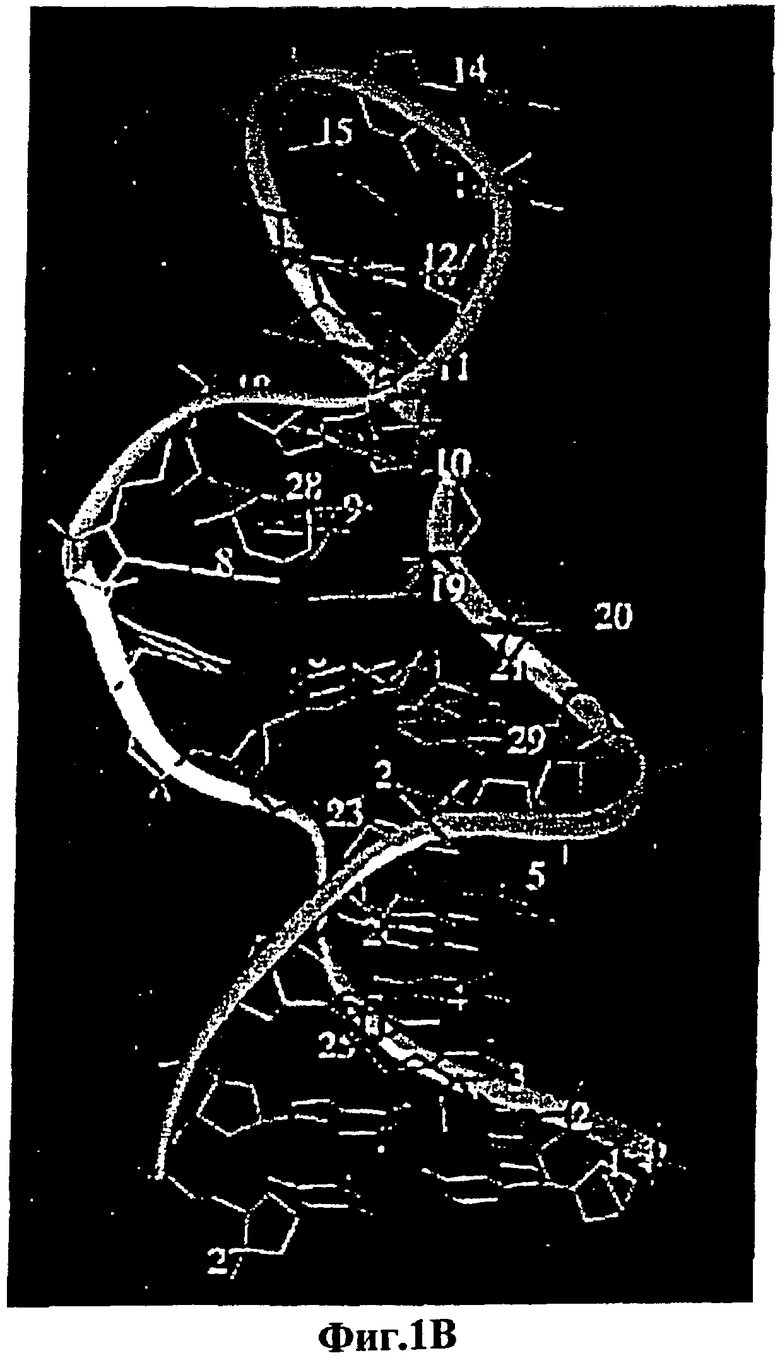
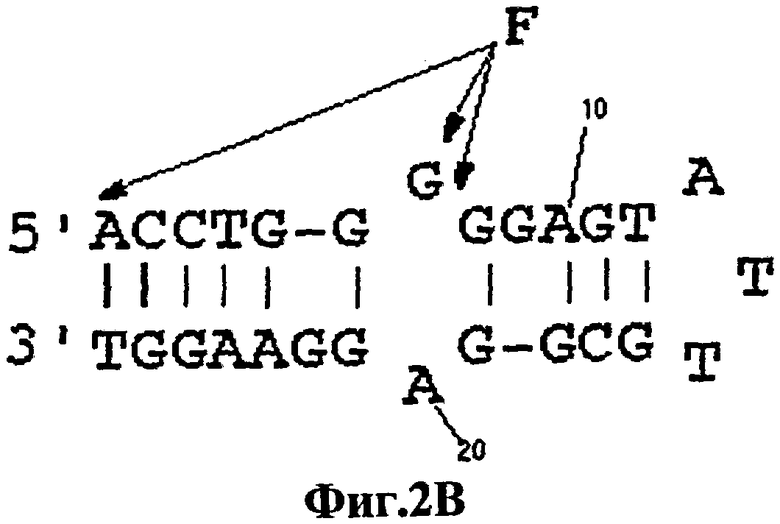
На фигуре 2 показаны сайты включения красителя в РНК- и ДНК-аптамеры. На фигуре 2А, в РНК-аптамерах, вместо остатка 13 (ATP-R-Acl3) включен акридин. Флуоресцеин введен в 5'-конец (ATP-R-F1), в 5'-конец с гептаадениловым линкером (ATP-R-F2) и вместо остатка 13 (ATP-R-F13). На фигуре 2В, в ДНК-аптамерах, флуоресцеин был введен в 5'-конец (DFLO), вместо остатка 7 (DFL7) и между остатками 7 и 8 (DFL7-8). Остатки были пронумерованы от 5'-конца на вторичных структурах.
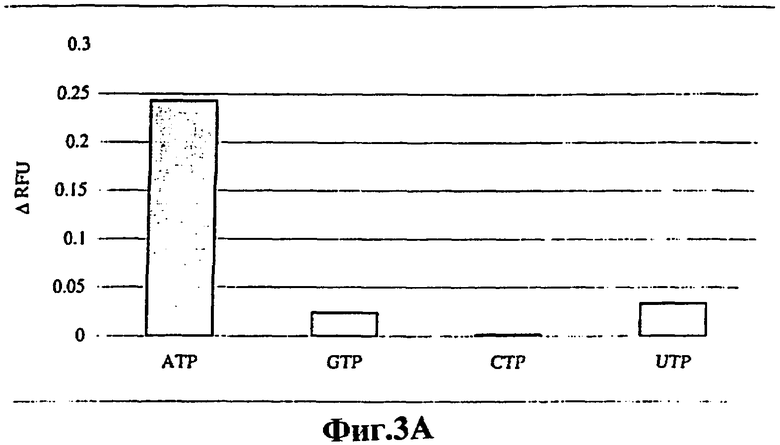
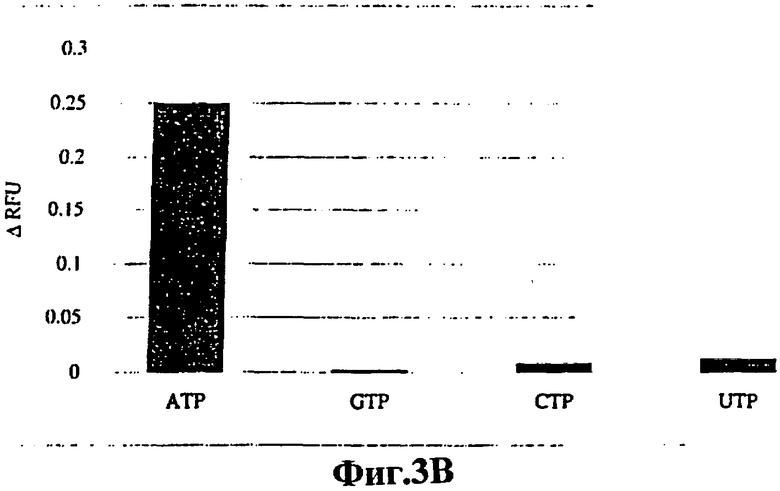
На фигуре 3 показаны специфичности передающих сигналы аптамеров ATP-R-Acl3 (фигура ЗА) и DFL7-8 (фигура 3В). Фракционное увеличение относительных единиц флуоресценции (ARFU) измеряли в присутствии АТР, GTP, СТР и UTP (1 мМ лиганд для ATP-R-Acl3, 200 мкМ лиганд для DFL7-8).
На фигуре 4 показаны мутантные варианты передающих сигналы аптамеров ATP-R-Acl3 (фигура 4А) и DFL7-8 (фигура 4В), которые не дают сигнала. ARFU измеряли в присутствии АТР (1 мМ лиганд для ATP-R-Acl3 и Mut34, 250 мкМ лиганд для DFL7-8 и Mut9/22).
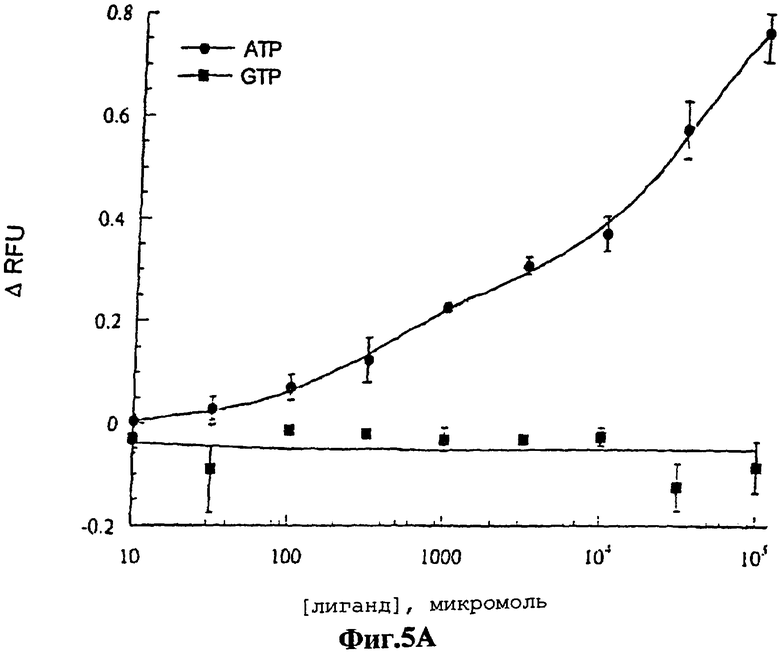
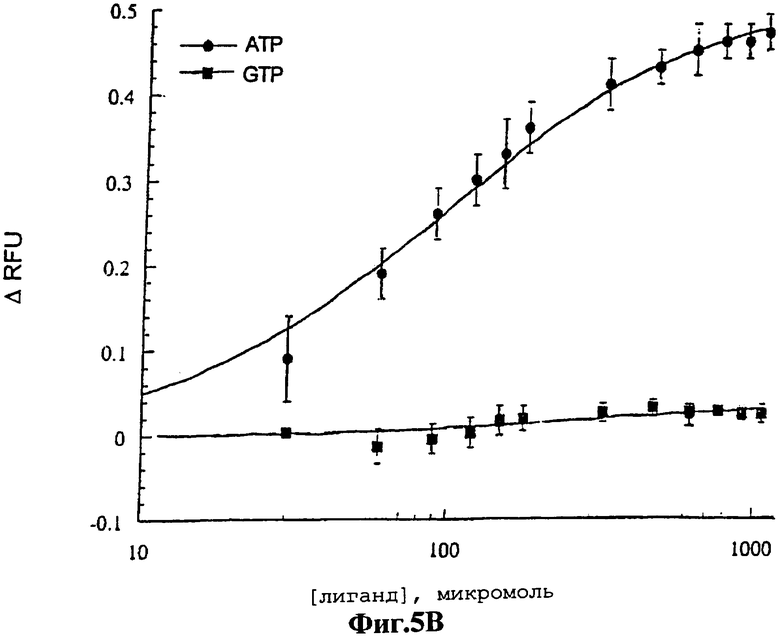
На фигуре 5 показаны кривые ответа для передающих сигналы аптамеров ATP-R-Acl3 (фигура 5А) и DFL7-8 (фигура 5В). Кривые ARFU строили при различных концентрациях АТР (•) и GTP (•). Исходные данные приводятся как среднее из трех величин со стандартными отклонениями. Данные представлены в виде кривой, построенной с использованием программы Kaleidograph (Synergy Software).
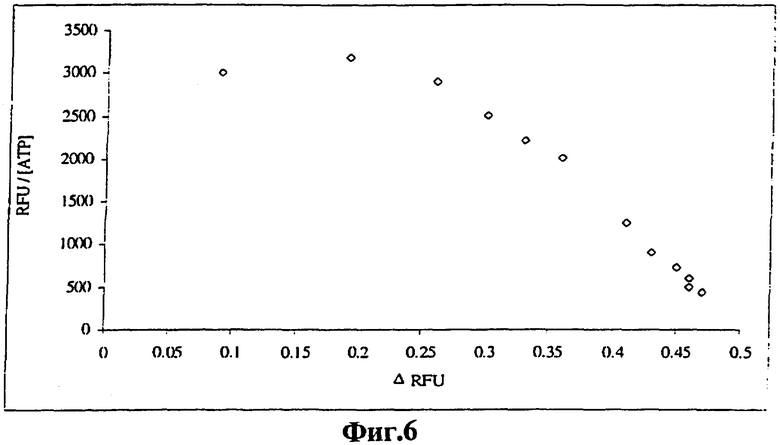
На фиг.6 представлен график Скэтчарда, построенный исходя из кривой ответа для передающего сигнал ДНК-аптамера. Был построен график фракционного увеличения RFU, ARFU (ось x) в зависимости от отношения ARFU/[АТР] (ось у).
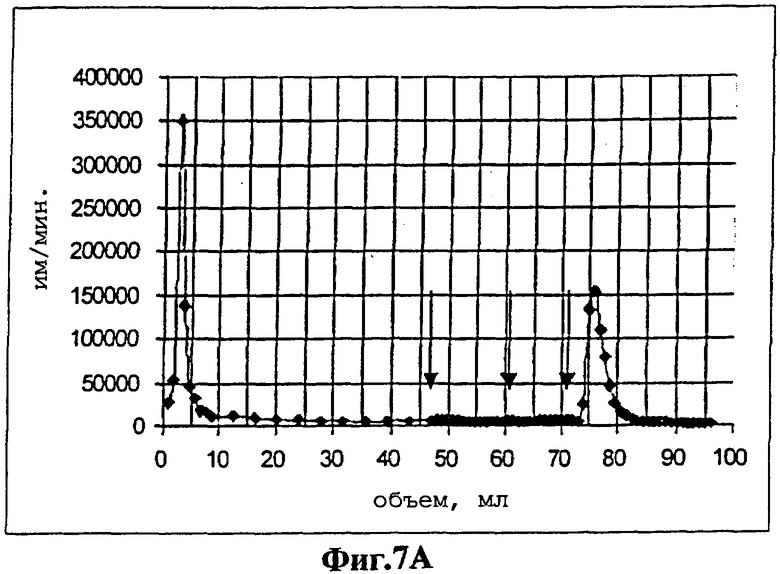
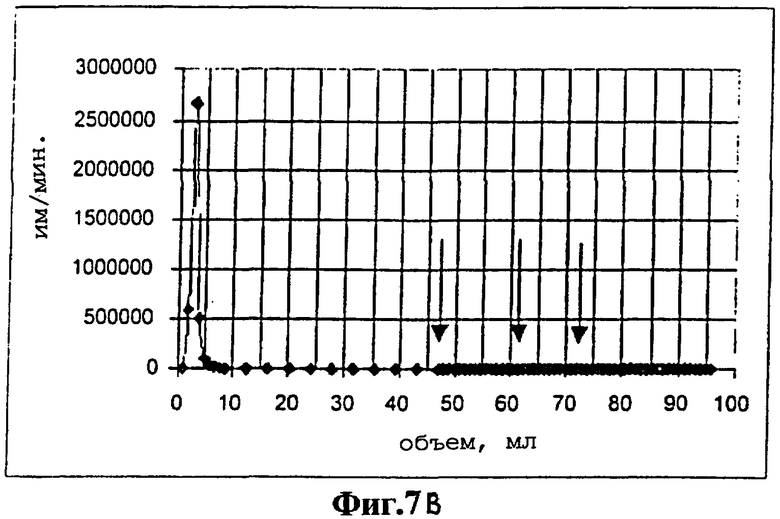
На фиг.7 представлены профили элюирования для передающих сигнал аптамеров DFL7-8 (Фиг.7А) и его двойного мутанта Mut9/22 (фигура 7В). После нанесения радиоактивно меченного аптамера колонку промывали 44 мл буфера для отбора. Затем наносили 0,3 мМ раствора GTP в буфере для отбора (15 мл) (первая стрелка слева). После промывки колонки еще 10 мл буфера для отбора (вторая стрелка) добавляли 0,3 мМ раствора АТР в буфере для отбора (15 мл) (третья стрелка).
Подробное описание изобретения
В одном из вариантов своего осуществления настоящее изобретение относится к способу преобразования конформационного изменения передающего сигнал аптамера после его связывания с лигандом в дифференциальный сигнал, генерированный репортерной молекулой, причем указанный способ включает стадии контактирования передающего сигнал аптамера с лигандом, где указанный передающий сигнал аптамер связывается с лигандом; и детекции дифференциального сигнала, генерированного указанной репортерной молекулой в результате конформационного изменения передающего сигнал аптамера, который, после связывания с лигандом, передает сигнал о конформационном изменении.
Дифференциальный сигнал может быть оптическим, электрохимическим или ферментативным. Характерными примерами оптических сигналов являются флуоресценция, колориметрическая интенсивность, анизотропия, поляризация, время жизни, длина волны излучения и длина волны возбуждения. Репортерная молекула, генерирующая эти сигналы, может быть ковалентно связана с аптамером во время химического синтеза, во время транскрипции или после транскрипции, либо она может быть нековалентно присоединена к указанному аптамеру. Такой репортерной молекулой может быть флуоресцентный краситель, такой как акридин или флуоресцеин. Аптамер может, но необязательно, представлять собой модифицированную ДНК или РНК, но он может не включать белок или биополимер, а указанный лиганд может представлять собой молекулу, не являющуюся нуклеиновой кислотой и связывающуюся с передающим сигнал аптамером. Указанные лиганд и передающий сигнал аптамер могут находиться в растворе. Передающий сигнал аптамер может быть также иммобилизован на твердом носителе, и, кроме того, он может быть параллельно иммобилизован на твердом носителе с образованием передающих сигнал чипов.
В другом варианте своего осуществления, настоящее изобретение относится к способу преобразования конформационного изменения передающего сигнал аптамера, после связывания с лигандом, в оптический сигнал, генерированный флуоресцентным красителем, причем указанный способ включает стадии контактирования передающего сигнал аптамера с лигандом, где указанный передающий сигнал аптамер связывается с лигандом; и детекции оптического сигнала, генерированного флуоресцентным красителем, в результате конформационного изменения передающего сигнал аптамера, который, после связывания с лигандом, передает сигнал о конформационном изменении.
В этом аспекте настоящего изобретения оптические сигналы могут быть такими, как они описаны в настоящей заявке. Репортерной молекулой может быть флуоресцентный краситель, такой как акридин или флуоресцеин. Указанный краситель ковалентно связывается с аптамером путем замены нуклеиновой кислоты в данном аптамере, либо он встраивается между двумя нуклеиновыми кислотами, не оказывая влияния на сайт связывания с лигандом. Указанным аптамером может быть антиаденозиновый РНК-аптамер, такой как ATP-R-Acl3, или антиаденозиновый ДНК-аптамер, такой как DFL7-8. В этих случаях указанным лигандом является аденозин. Указанные лиганд и передающий сигнал аптамер могут находиться в растворе, либо передающий сигнал аптамер может быть иммобилизован на твердом носителе. Путем параллельной иммобилизации передающего сигнал аптамера могут быть получены передающие сигнал чипы.
В еще одном варианте своего осуществления настоящее изобретение относится к способу количественного определения лиганда, описанного выше, включающему стадии контактирования сигнального аптамера, описанного выше, с лигандом, где указанный передающий сигнал аптамер связывается с указанным лигандом, и измерения увеличения оптического сигнала, описанного выше, после связывания передающего сигнал аптамера с лигандом, где указанное увеличение оптического сигнала положительно коррелирует с количеством лиганда, связанного с передающим сигнал аптамером.
Настоящее изобретение относится к способу детекции и количественной оценки присутствия когнатных лигандов или аналитов в растворе с использованием сконструированных аптамеров, которые содержат, inter alia, флуоресцентные красители.
Используемый здесь термин "аптамер" или "отобранные молекулы, связывающиеся с нуклеиновой кислотой" включает немодифицированные или химически модифицированные РНК или ДНК. Inter alia, указанным способом отбора может быть аффинная хроматография или разделение с использованием фильтра и амплификация посредством обратной транскрипции (ОТ), полимеразной цепной реакции (ПЦР) или изотермической амплификации.
Используемый здесь термин "передающий сигнал аптамер" включает аптамеры с репортерными молекулами, присоединенными так, чтобы после конформационных изменений, возникающих в результате взаимодействия указанного аптамера с лигандом, эти репортерные молекулы давали дифференциальный сигнал.
Используемый здесь термин "репортерная молекула" включает, но не ограничивается ими, красители, которые продуцируют сигнал в виде флуоресценции или колориметрической интенсивности, анизотропии, поляризации, времени жизни или изменений длин волн излучения или возбуждения. Репортерными молекулами могут быть также молекулы, электрохимическое состояние которых подвергается изменениям, например, в окислительно-восстановительной реакции, где локальное окружение электронного носителя изменяет восстановительный потенциал этого носителя, либо такими молекулами могут быть сигнал-генерирующие ферменты, такие как бета-галактозидаза или люцифераза.
Используемый здесь термин "лиганд" включает любую молекулу, которая связывается с аптамером, за исключением последовательностей нуклеиновой кислоты. Однако лиганды могут представлять собой структуры нуклеиновых кислот, такие как "стебель-петля".
Используемый здесь термин "присоединенный" включает, но не ограничивается ими, ковалентное связывание либо во время химического синтеза, либо во время транскрипции РНК, или после транскрипции РНК. Этот термин также включает нековалентное присоединение; например, аптамер, нековалентно связанный с активным центром фермента, высвобождается после взаимодействия с лигандом и активирует этот фермент.
Используемый здесь термин "конформационные изменения" включает, но не ограничивается ими, изменения в пространственном расположении, включая очень незначительные изменения в химическом окружении без сопутствующего изменения пространственного расположения.
Используемый здесь термин "дифференциальный сигнал" включает, но не ограничивается ими, измеряемые оптические, электрохимические или ферментативные сигналы.
Нижеследующие примеры приводятся в целях иллюстрации различных вариантов осуществления изобретения и никоим образом не ограничивают объема настоящего изобретения.
Пример 1. Материалы
АТР (динатриевая соль) и GTP (динатриевая соль) были закуплены у Roche Molecular Biochemicals, а АТР-агароза (С8-связь, 9-атомный спейсер) была закуплена у Sigma. Флуоресцеин-фосфорамидит, 5'-флуоресцеин-фосфорамидит и акридин-фосфорамидит были закуплены у Glen Research. Полинуклеотид-киназа Т4 и полинуклеотид-киназный буфер были закуплены у New England Biolabs. Радиоактивный [γ-32P] АТР был закуплен у ICN.
Пример 2. Получение передающих сигнал аптамеров
Ряд конъюгатов "аптамер-краситель" (Фиг.2) были синтезированы и деблокированы, как описано ранее20-23. Флуоресцеин-фосфорамидит и акридин-фосфорамидит были использованы в синтезе аптамеров с внутренней меткой, а аптамеры с концевой меткой были генерированы с использованием 5'-флуоресцеин-фосфорамидита. Деблокирование конъюгатов "РНК-аптамер-краситель" осуществляли в соответствии с модифицированной процедурой, описанной Wincott et al23. В первой стадии деблокирования смолы суспендировали в смеси NH4OH:EtOH (3:1) в течение 13 часов при комнатной температуре, а не в течение 17 часов при 55°С. Аптамеры очищали с помощью электрофореза в полиакриламидном геле, элюировали 0,3 М NaOAc в течение ночи при 37°С и осаждали этанолом. Аптамеры ресуспендировали в 50 мкл Н2O, а затем количественно оценивали путем измерения А260 с использованием коэффициента экстинкции 0,025 мл·см-1·мкг-1 для РНК и 0,027 мл·см-1·мкг-1 для ДНК.
Аптамеры подвергали тепловому уравновешиванию в буфере для отбора, а условия определяли эмпирически с получением оптимальной интенсивности флуоресценции. Перед измерением флуоресценции, РНК-аптамеры (500 нМ) суспендировали в буфере для отбора, 300 мМ NaCI, 20 мМ Трис-HCl, рН 7,6, 5 мМ MgCl2 16, подвергали тепловой денатурации при 65°С в течение 3 минут, а затем медленно охлаждали до 25°С в термоячейке при скорости охлаждения 1°С за 12 секунд. ДНК-аптамеры (150 нМ) суспендировали в буфере для отбора17, подвергали тепловой денатурации при 75°С в течение 3 минут и оставляли для охлаждения до комнатной температуры в течение 10-15 минут.
Пример 3
Измерения флуоресценции
Все измерения флуоресценции проводили на люминесцентном спектрометре Серии 2 от SLM-AMINCO Spectronic Instruments. Экспериментальные образцы подвергали возбуждению при их соответствующих максимумах (акридин, λex=450 нм; флуоресцеин λex=495 нм), а интенсивность флуоресценции измеряли при соответствующих максимумах значений излучения (акридин, λem=495 нм; флуоресцеин, λem=515 нм). Растворы аптамеров (200 мкл для РНК, 1000 мкл для ДНК) вводили пипеткой в флуориметрическую ячейку (Starna Cells, Inc.) и добавляли растворы лигандов в различных концентрациях, но в стандартных объемах (50 мкл для РНК, 1,5 мкл для ДНК).
Пример 4
Измерения аффинности связывания путем изократического элюирования
Для мечения по 5'-концу аптамеры инкубировали в течение 1 часа при 37°С в реакционной смеси полинуклеотид-киназ Т4 (1 мкл полинуклеотид-киназы Т4 (10 единиц), 2 мкл ДНК, 0,5 мкл 10х полинуклеотид-киназного буфера, 0,5 мкл [γ-32P] АТР (7000 Ки/ммоль), 6 мкл Н2O до полного объема 10 мкл). Колонку с АТР-агарозой с полным объемом (Vt) 1,5 мл и "пустым" объемом (Vo) 1,16 мл уравновешивали 25 мл буфера для отбора. Аптамеры (10 мкг) подвергали тепловому уравновешиванию и наносили на колонку. Концентрация АТР ([L], см. ниже) на колонке составляла 2,6 мМ. Затем колонку промывали буфером для отбора и собирали 1 мл фракции. Части (5 мкл) каждой фракции наносили пятнами на найлоновый фильтр, и количество радиоактивности определяли с помощью устройства Phosphorimager (Molecular Dynamics). Колонку проявляли дополнительным количеством (44 мл) буфера для отбора, а затем 15 мл 0,3 мМ раствора GTP в буфере для отбора. После промывки колонки еще 10 мл буфера для отбора все оставшееся количество радиоактивности было полностью проэлюировано 15 мл 0,3 мМ раствора АТР в буфере для отбора. Для аптамера DFL7-8, для проявления колонки, перед добавлением раствора АТР, использовали конечный объем элюирования (Ve) 73 мл. Верхний предел для Кd передающего сигнал аптамера для АТР-агарозы вычисляли по уравнению:
Kd=[L]·(Vt-V0)/(Ve-V0)16.
Были опубликованы некоторые трехмерные структуры аптамеров, которые связываются с небольшими органическими лигандами10-14. Структуры двух антиаденозиновых аптамеров11,12,15, одна из которых была отобрана из РНК-пула16, а другая из ДНК-пула17, были использованы в настоящем изобретении для конструирования передающих сигнал аптамеров (Фиг.1). Для визуализации и модификации структур этих анти-АТР аптамеров была использована программа Insight 2 (Molecular Simulations). Флуоресцентные красители были присоединены непосредственно к функциональным остаткам, а способность полученных химер передавать сигнал была оценена путем определения наличия изменений интенсивности флуоресценции, возникающих в присутствии когнатного лиганда, АТР.
Различные передающие сигнал антиаденозиновые аптамеры, полученные из РНК и ДНК, селективно передают сигнал о присутствии аденозина в растворе. Увеличение интенсивности флуоресценции репродуцируемым образом соответствует увеличению концентрации аденозина, и это соответствие используется для количественной оценки. В способах настоящего изобретения флуорофоры помещают либо вблизи от лиганд-связывающих сайтов аптамеров, во избежание их блокирования или разрушения, либо их помещают так, чтобы можно было прослеживать более крупные индуцированные лигандом конформационные изменения в структуре аптамеров (например, спиральное вращение). Так, например, остаток 13 антиаденозинового РНК-аптамера является смежным со связывающим "карманом", но не участвует во взаимодействии с АТР, а вместо этого данный остаток обращен в раствор (фигура 1А). Поэтому в РНК-аптамер вместо аденозина в положении 13 вводят акридиновую часть, ATP-R-Acl3 (фигура 2). Аналогичным образом, остаток 7 в ДНК-аптамере находится вблизи сайта связывания и не взаимодействует непосредственно с АТР (фигура 1В). Поэтому вместо остатка 7 используют флуорофоры, которые вводят между остатками 7 и 8 DFL-7 и DFL-8 соответственно (фигура 2).
Из различных протестированных конструкций, аптамеры АТР-R-F1, ATP-R-F2, ATP-R-F13, DFLO и DFL7 обнаруживали незначительное изменение в интенсивности (5% или менее) после добавления АТР. Однако аптамеры ATP-R-Acl3 и DFL7-8 обнаруживали значительное увеличение интенсивности флуоресценции в присутствии 1 мМ АТР. Такое увеличение ответа составляло в пределах от 25 до 45%.
Пример 5
Специфичность передающих сигнал аптамеров
Для оценки специфичности передающих сигнал аптамеров ATP-R-Acl3 (фигура 3А) и DFL7-8 (фигура 3В) по отношению к АТР изменения флуоресценции измеряли в присутствии GTP, СТР и UTP. Какого-либо значительного лиганд-зависимого увеличения флуоресценции не наблюдалось. Кроме того, были сконструированы мутантные варианты ATP-R-Acl3 и DFL7-8, не связывающиеся с АТР, путем делеции или замены ключевых функциональных остатков. Из исследований, проведенных методом мутагенеза, известно, что остаток G34 РНК-аптамера играет существенную роль в связывании16, а остатки G9 и G22 в ДНК-аптамере имеют важное значение для контакта с АТР-лигандами. Были сконструированы мутантный РНК-аптамер, у которого отсутствовал G34 (Mut 34) (фигура 4А), и двойной мутант ДНК-аптамера, у которого оба G9 и G22 были заменены цитидиновыми остатками (Mut 9/22) (фигура 4В). Указанные мутантные передающие сигнал аптамеры не обнаруживали АТР-зависимого увеличения флуоресценции.
Для иллюстрации того факта, что передающие сигнал аптамеры могут быть использованы для количественной оценки аналитов в растворе, были построены кривые ответа путем измерения интенсивностей флуоресценции ATP-R-Acl3 (фигура 5А) и DFL7-8 (фигура 5В) в зависимости от концентраций АТР и GTP. Оба передающих сигнал аптамера обнаруживали постепенное увеличение интенсивности флуоресценции с увеличением АТР, но при этом они обнаруживали незначительное изменение или вообще не обнаруживали изменений в интенсивности флуоресценции с увеличением GTP. Хотя кривые ответа для передающих сигнал аптамеров были полностью воспроизводимыми, однако, они не могут быть аппроксимированы с помощью простых моделей связывания на основе известных Кd для исходных аптамеров. Тем не менее, исходные данные связывания для ДНК-аптамера17 были получены на основе предположения, что он содержит лишь один сайт связывания с лигандом, тогда как ЯМР-структура обнаруживает два сайта связывания с лигандом.
Для того чтобы определить, обнаруживает ли данный передающий сигнал аптамер оба АТР-связывающих сайта, была построена кривая изменения флуоресценции в зависимости от отношения изменения флуоресценции к концентрации несвязанного АТР. Полученный нелинейный график Скэтчарда (Фиг.6) является двухфазным, что дает основание предположить присутствие множества сайтов связывания. Данные передачи сигнала описывают модель, в которой аптамер кооперативно связывается с двумя молекулами АТР, в соответствии со следующим уравнением:
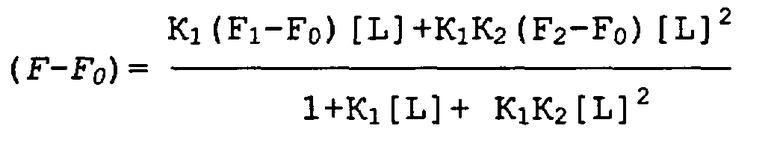
F: Сигнал флуоресценции;
F0: Флуоресценция субстрата, не образовавшего комплекс;
F1: Флуоресценция одинарно связанного субстрата;
F2: Флуоресценция вдвойне связанного субстрата;
K1: Константа образования комплекса первого порядка;
К2: Константа образования комплекса второго порядка.
Этот анализ дал две константы диссоциации, что указывает на присутствие сайта с более высокой аффинностью с Kd,1 (1/K1)=30±18 мкМ и сайта с более низкой аффиностью с Кd,2 (1/К2)=53±30 мкМ. Вычисленное относительное изменение флуоресценции после связывания с первым АТР (F1) было пренебрежимо мало, -0,004%, а вычисленное относительное изменение флуоресценции, обусловленное образованием третичного комплекса (F2), составляло 49%. Сходство аффинностей между двумя сайтами связывания соответствует последовательности и структурной симметрии антиаденозинового ДНК-аптамера. Поскольку наибольшее изменение флуоресценции наблюдается после образования третичного комплекса, аффинность участка, содержащего флуоресцеиновый репортер, слегка изменяется и передающий сигнал аптамер сообщает, главным образом, о взаимодействии лиганда с этим участком.
Способности к связыванию передающих сигнал аптамеров были независимо оценены методом изократического элюирования, в котором определяют Кd аптамера для АТР16. Передающие сигнал аптамеры наносили на АТР-аффинную колонку и постепенно элюировали буфером и нуклеотидами. Передающий сигнал РНК-аптамер, ATP-R-Acl3, плохо связывался с колонкой и, по оценкам, его Кd превышал миллимолярный диапазон. Эти результаты соответствуют относительно большому количеству АТР, необходимому для генерирования сигнала (Фиг.5А). Уменьшение аффинности РНК-аптамера после введения акридина аналогично уменьшению аффинности, наблюдаемому после введения красителей в белки, связывающие мальтозу и глюкозу1,2.
В противоположность этому передающий сигнал ДНК-аптамер DFL7-8 (Фиг.7А) имеет видимый Kd менее чем 13 микромоль и не может элюироваться из АТР-аффинной колонки с GTP. Аффинность ДНК-аптамера, полученная после проведения колоночной хроматографии, сравнима с вышеуказанной аффинностью, вычисленной для вышеуказанного сайта с более низкой аффинностью. Не передающий сигнал двойной мутант, Mut9/22, не связывался с аффинной колонкой (фигура 7В). Более низкий Кd передающего сигнал ДНК-аптамера, по сравнению с Кd передающего сигнал РНК-аптамера, соответствует лучшему сигнальному ответу, продуцируемому передающим сигнал ДНК-аптамером (фигура 5В). Однако прямое сравнение исследований ДНК-аптамера по его связыванию и передачи сигнала представляют определенные трудности, поскольку немодифицированный аптамер содержит два кооперативных сайта связывания с аденозином17, которые могут подвергаться дифференциальному воздействию при введении красителя.
Пример 6
Другие передающие сигнал аптамеры
Предусматривается, что репортерные молекулы, включающие передающий сигнал аптамер, могут представлять собой другие молекулы, не являющиеся флуоресцентными красителями или другими флуорофорами, и могут генерировать дифференциальный сигнал, не являющийся оптическим. Электрохимическое состояние таких молекул может подвергаться изменениям, то есть изменениям окислительно-восстановительного потенциала, возникающим в результате изменения локального окружения электронного носителя, которое может генерировать дифференциальный сигнал. При таких взаимодействиях конформационное изменение не может быть пространственным, однако может иметь место изменение в химическом окружении. Альтернативно репортерная молекула может представлять собой фермент, который сам может генерировать дифференциальный сигнал, например бета-галактозидазу или люциферазу.
Сама репортерная молекула может быть нековалентно связана с аптамером. Нековалентное присоединение репортерной молекулы, например, к активному центру фермента может генерировать дифференциальный сигнал после взаимодействия с лигандом, при этом связывание лиганда с передающим сигнал аптамером изменяет нековалентное связывание репортерной молекулы с активным центром и тем самым активирует данный фермент.
Пример 7
Диагностические анализы
Тот факт, что конъюгаты "аптамер - краситель" могут непосредственно передавать сигнал о присутствии и количестве аналитов в растворе и при этом не требуют проведения предварительных стадий иммобилизации или промывки, позволяет использовать аптамеры в способах, которые в настоящее время недоступны для других аптамеров, таких как антитела. Множество новых реагентов для сенсорных матриц могут быть быстро синтезированы путем простого добавления флуоресцентных красителей к существующим аптамерам, описанным в настоящей работе. Если учесть тот факт, что первая генерация сконструированных соединений способна детектировать аналиты в микромолярном - миллимолярном диапазонах, то такая возможность становится еще более вероятной. Чувствительность передающих сигнал аптамеров еще более повышается при введении более широкого ряда красителей в более широком диапазоне положений. Ниже приводятся работы, цитируемые в настоящей заявке.
1. Gilardi, G.; Zhou, L. Q.; Hibbert, L.; Cass, A. E. Anal. Chem. 1994, 66, 3840-7.
2. Marvin, J. S.; Corcoran, E. E.; Hattangadi, N. A.;
Zhang, J. V.; Gere, S. A.; Hellinga, H. W. Proc. Natl. Acad. Sci. USA 1997, 94, 4366-71.
3. Tyagi, S.; Kramer, F. R. Nat Biotechnol. 1996, 14, 303-8.
4. Walter, P.; Murchie, A.; Lilley, D. Biochemistry 1998, 37, 17629-36.
5. Giuliano, К.; Taylor, D. Trends Biotechnol. 1998, 16, 135-40.
6. Lehn, J.M., Science 1993, 260, 1762-3.
7. Bier, F. F.; Furste, J. P. Exs 1997, 80, 97-120.
8. Osborne, S. E.; Matsumura, I.; Ellington, A. D. Curr Opin Chem. Biol. 1997, 1, 5-9.
9. Westhof, E.; Patel, D. J. Curr Opin Struct. Biol. 1997, 7, 305-9.
10. Patel, D. J.; Suri, A. K.; Jiang, F.; Jiang, L.; Fan,
P.; Kumar, R. A.; Nonin, S. J. Mol. Biol. 1997, 272, 645-64.
11. Lin, С. Н.; Patel, D. J. Chem. Biol. 1997, 4, 817-32.
12. Jiang, F.; Kumar, R. A.; Jones, R. A.; Patel, D. J. Nature 1996, 382, 183-6.
13. Jiang, L.; Suri, А. К.; Fiala, R.; Patel, D. J. Chem. Biol. 1997, 4, 35-50.
14. Dieckmann, Т.; Butcher, S. E.; Sassanfar, M.;
Szostak, J. W.; Feigon, J., J. Mol. Biol. 1997, 273, 467-78.
15. Dieckmann, Т.; Suzuki, E.; Nakamura, G. К.; Feigon, J. Rna 1996, 2, 628-40.
16. Sassanfar, M.; Szostak, J.W., Nature 1993, 364, 550-3.
17. Huizenga, D. E.; Szostak, 0. W. Biochemistry 1995, 34, 656-65.
18. Uphoff, K. W.; Bell, S. D.; Ellington, A.D., Curr. Opin. Struct. Biol. 1996, 6, 281-8.
19. Conrad, R. С.; Giver, L.; Tian, Y.; Ellington, A. D. Methods Enzymol 1996, 267, 336-67.
20. Andrus, А.; Сох, S.; Beavers, S.; Parker, A.;
Anuskiewicz, J.; Mullah, B. Nucleic Acids Symp. Ser., 1997, 37, 317-8.
21. Scaringe, S.A.; Francklyn, С.; Usman, N. Nucleic Acids Res., 1990, 18, 5433-41.
22. Maglott, E. J.; Glick, G. D. Nucleic Acids Res 1998, 26, 1301-8.
23. Wincott, F.; DiRenzo, A.; Shaffer, C.; Grimm, S.;
Tracz, D.; Workman, C.; Sweedler, D.; Gonzalez, C.; Scaringe, S.; Usman, N. Nucleic Acids Res., 1995, 23, 2677-84.
Все патенты или публикации, упомянутые в настоящем описании, являются показателями предшествующего уровня в данной области техники, к которой относится настоящее изобретение. Кроме того, указанные патенты и публикации вводятся в настоящее описание посредством ссылки так же, как если бы каждая отдельная и конкретно указанная публикация была введена посредством ссылки.
Для каждого специалиста очевидно, что настоящее изобретение хорошо адаптировано для осуществления поставленных целей и получения вышеупомянутых конечных результатов и преимуществ, а также результатов-преимуществ, присущих данному изобретению. Представленные в настоящей заявке примеры вместе с описанием способов, процедур, обработок, молекул и конкретных соединений являются репрезентативными и иллюстрируют предпочтительные варианты осуществления настоящего изобретения, но при этом они не должны рассматриваться как ограничение объема изобретения. Существо настоящего изобретения, объем которого ограничен формулой изобретения, охватывает изменения и другие применения, которые могут быть осуществлены специалистами.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛИЗ СВЯЗЫВАНИЯ С ЛИГАНДОМ ДЛЯ ОБНАРУЖЕНИЯ ГИББЕРЕЛЛИНОВ | 2017 |
|
RU2748481C2 |
| НЕРЕПЛИКАТИВНЫЕ ТРАНСДУКТОРНЫЕ ЧАСТИЦЫ И ОСНОВАННЫЕ НА ТРАНСДУКТОРНЫХ ЧАСТИЦАХ РЕПОРТЕРНЫЕ СИСТЕМЫ | 2014 |
|
RU2661101C2 |
| ЭКЗОГЕННЫЙ КОНТРОЛЬ ЭКСПРЕССИИ ГЕНОВ МЛЕКОПИТАЮЩИХ С ПОМОЩЬЮ ОПОСРЕДОВАННОЙ АПТАМЕРАМИ МОДУЛЯЦИИ ПОЛИАДЕНИЛИРОВАНИЯ | 2016 |
|
RU2769991C2 |
| СПОСОБЫ ОДНОВРЕМЕННОГО ВЫЯВЛЕНИЯ ОБОИХ КОМПОНЕНТОВ СВЯЗЫВАЮЩЕЙСЯ ПАРЫ | 2000 |
|
RU2251111C2 |
| МУЛЬТИПЛЕКСНЫЕ АНАЛИЗЫ НА ОСНОВЕ АПТАМЕРОВ | 2013 |
|
RU2666989C2 |
| Высокопроизводительный скрининг соединений, модулирующих экспрессию клеточных макромолекул | 2012 |
|
RU2612017C2 |
| Комплексы на основе микропузырьков и способы применения | 2012 |
|
RU2613321C2 |
| КОМПОЗИЦИИ И СПОСОБЫ С УЧАСТИЕМ НУКЛЕИНОВЫХ КИСЛОТ, НАЦЕЛЕННЫХ НА НУКЛЕИНОВЫЕ КИСЛОТЫ | 2014 |
|
RU2662932C2 |
| ДНК-аптамеры к праймазе и ДНК-полимеразе PrimPol человека | 2020 |
|
RU2770691C2 |
| УНИВЕРСАЛЬНАЯ БИОСЕНСОРНАЯ СИСТЕМА ДЛЯ ДЕТЕКЦИИ АНАЛИТА | 2017 |
|
RU2737943C1 |


Изобретение относится к области биохимии и биофизики и может быть использовано для детекции веществ. Передающий сигнал аптамер, который представляет собой нуклеиновую кислоту, содержащую флуоресцентный краситель, связывают с лигандом. Затем регистрируют повышение интенсивности флуоресцентного излучения флуоресцентного красителя передающего сигнал аптамера. Применение данного способа преобразования конформационного изменения передающего сигнал аптамера во флуоресцентный сигнал позволяет обнаружить когнатные лиганды в растворе. 11 з.п. ф-лы, 13 ил.
(a) наличие передающего сигнал аптамера, представляющего собой нуклеиновую кислоту, содержащего флуоресцентный краситель, ковалентно связанный с указанным аптамером в положении, в котором не происходит непосредственного взаимодействия с лигандом, где при связывании аптамера с лигандом происходит конформационное изменение аптамера и усиливается интенсивность флуоресценции флуоресцентного красителя;
(b) взаимодействие передающего сигнал аптамера, представляющего собой нуклеиновую кислоту, с лигандом в условиях, при которых происходит связывание указанного передающего сигнал аптамера и лиганда; и
(c) определение повышения интенсивности флуоресценции флуоресцентного красителя в результате конформационного изменения указанного передающего сигнал аптамера при связывании с лигандом.
| US 5641629 А, 24.06.1997 | |||
| US 5989823 А, 23.11.1999 | |||
| US 5631146 А, 20.05.1997 | |||
| PROC NATL ACAD SCI USA | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| ДИНАТРИЕВАЯ СОЛЬ J -МЕЧЕНОГО АДЕНИЛИЛ(2` - 5`) АДЕНИЛИЛ(2` - 5`) АДЕНОЗИНТИРОЗИНА МЕТИЛОВОГО ЭФИРА В КАЧЕСТВЕ ЛИГАНДА ДЛЯ РАДИОИММУНОЛОГИЧЕСКОГО ОПРЕДЕЛЕНИЯ 2`,5`-ОЛИГОАДЕНИЛАТОВ | 1990 |
|
SU1746684A1 |
Авторы
Даты
2008-02-10—Публикация
2001-02-02—Подача