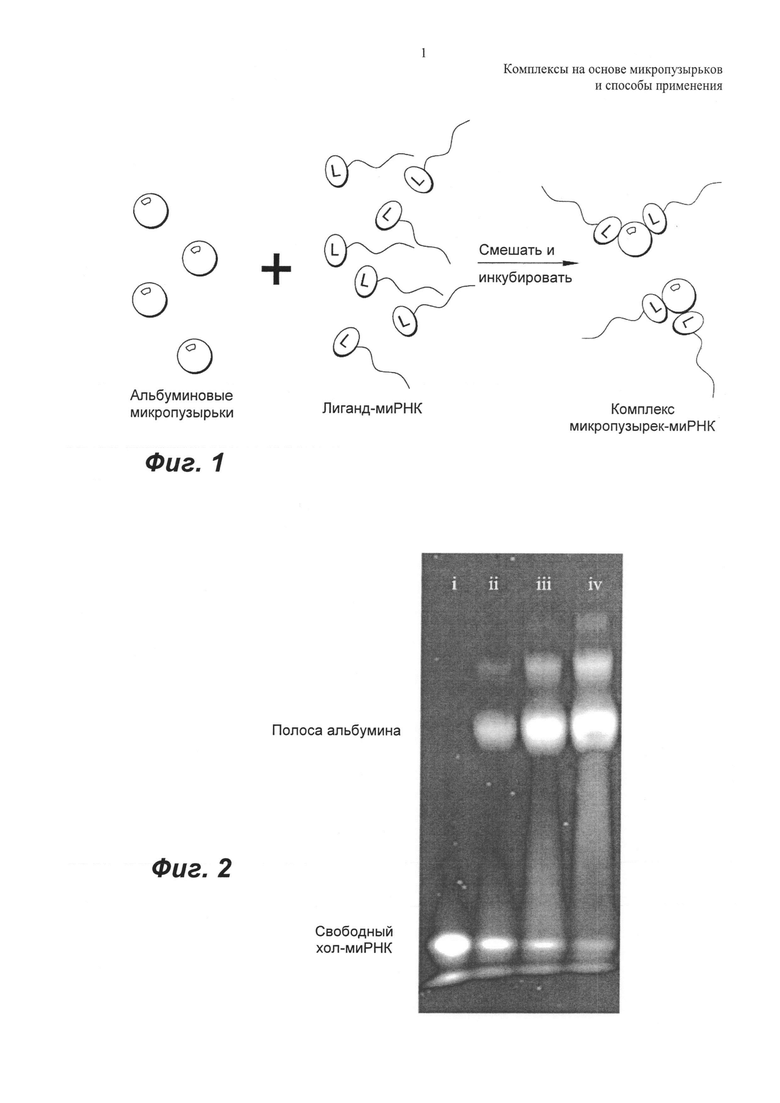
В общем, изобретение относится к новому способу связывания терапевтических агентов с фармацевтическими средствами на основе альбуминовых микропузырьков с использованием присоединения к этим агентам лигандов с аффинностью к альбумину. Связывание обеспечивает способ доставки терапевтических агентов с помощью микропузырьков в интересующие клетки или ткани-мишени, in vitro или in vivo.
Обнаружили, что опосредованное ультразвуком разрушение микропузырьков, переносящих лекарственные средства, является полезным в качестве неинвазивной системы доставки лекарственного средства. Лекарственные средства или другие терапевтические агенты можно включать в микропузырьки различными способами, включая связывание лекарственного средства с оболочкой микропузырька и присоединение лигандов. Например, микропузырьки, наполненные перфторуглеродом, являются достаточно стабильными для циркулирования в сосудистой системе в качестве агентов кровяного русла; они действуют в качестве носителей данных агентов, пока не будет достигнут интересующий сайт. Затем можно использовать ультразвук, прикладываемый к поверхности кожи, для взрыва микропузырьков в данном сайте, вызывая локализованное высвобождение лекарственного средства или терапевтических агентов в сайт-специфичных положениях.
Более конкретно, использовали альбуминовые микропузырьки и доставляли в конкретный орган-мишень посредством сайт-направленного акустического ультразвука. Альбумин представляет собой главный белок в крови, и его природная физиологическая роль заключается в связывании и переносе широкого спектра липофильных/плохо растворимых лигандов по всему организму. Данные лиганды, которые могут иметь аффинность к альбумину, включают жирные кислоты и другие продукты биосинтеза и катаболизма, которые являются гидрофобными по природе. Альбуминовые микропузырьки, как таковые, применяли для переноса множества терапевтических агентов на основе белков и других биологических веществ, включая олигонуклеотиды (ODN) и полинуклеотиды, такие как антисмысловые ODN, с последовательностями, комплементарными конкретной последовательности матричной РНК-мишени (мРНК). Данные комплексы микропузырек-нуклеиновая кислота могут быть получены из немодифицированных ODN, которые смешивают с альбумином или липидными компонентами во время образования оболочки микропузырька, или, в качестве альтернативы, образование комплекса можно осуществлять посредством смешивания заранее полученных микропузырьков с интересующим ODN. В обоих случаях ODN действует путем механистического вмешательства в процессы трансляции гена или в более раннее событие процессинга. Преимуществом данного подхода является потенциал для ген-специфичных действий, который должен отражаться в относительно низкой дозе и минимальных незапланированных побочных эффектах.
Однако известно, что основной барьер для преобразования мощной биологической активности ODN в лекарственные средства заключается в эффективной и безопасной доставке лекарственного средства. Например, проблемы, связанные с клинической безопасностью, возникающие до того, как может быть достигнута терапевтическая эффективность, препятствовали доставке ODN с химической композицией, вирусными векторами и доставке в виде частиц. Кроме того, применение альбуминовых микропузырьков в качестве носителя ODN, таких как миРНК (малая интерферирующая РНК), ограничено вследствие ограниченного связывания ODN с альбуминовым микропузырьком, а также стабильности комплекса альбумин-ODN. Из-за отрицательного потенциала поверхности оболочки альбумина, отрицательно заряженные более короткие нуклеиновые кислоты не очень хорошо связываются с микропузырьком, и эффективности генной трансфекции с использованием данных комплексов обычно являются субоптимальными.
Таким образом, существует потребность в улучшении связывания терапевтических агентов с микропузырьком, а также в улучшении стабильности и эффективности комплекса на основе микропузырьков.
Кроме того, существует потребность в снижении токсичности при селективной доставке высоко цитотоксичных лекарственных средств. Ненаправленная доставка таких лекарственных средств может обуславливать системную токсичность и препятствует применению многих из этих лекарственных средств вообще или в более высоких дозах, требующихся для хорошей эффективности. Попытки доставлять их в виде пролекарств во многих случаях облегчали данную проблему, однако, не всегда легко добиться селективного поглощения в ткани-мишени, так как большинство механизмов поглощения в пораженной заболеванием ткани также представлено в нормальной ткани. Следовательно, усиление поглощения данных лекарственных средств в избранных тканях посредством неприродных механизмов, как здесь описано, может иметь значительную ценность.
Здесь предложены новые композиции и способы увеличенного связывания терапевтических лекарственных средств с микропузырьками с использованием аффинности композиций лиганд-терапевтическое средство в отношении альбуминовой оболочки.
Циркуляция микропузырьков, переносящих терапевтическую композицию, в большом круге кровообращения может быть легко визуализирована посредством ультразвуковой визуализации. Терапевтический агент высвобождается из микропузырьков с использованием триггера в виде высокоэнергетического импульсного ультразвука, специфичного для места лечения. Кавитация микропузырьков вызывает сонопорацию соседних клеток/ткани.
В одном воплощении раскрыт комплекс на основе микропузырьков, содержащий микропузырек, имеющий наружную оболочку, содержащую смесь нативного и денатурированного альбумина, и полую сердцевину, инкапсулирующую газ перфторуглерод, терапевтический агент, выбранный из группы, включающей низкомолекулярный химиотерапевтический агент, пептид, углевод или олигонуклеотид, и бифункциональный линкер, у которого один конец присоединен к терапевтическому агенту, а другой конец присоединен к лиганду посредством взаимодействия реакционноспособной группы на лиганде. Лиганд связан с наружной оболочкой микропузырька посредством гидрофобных взаимодействий.
В другом воплощении раскрыт способ для доставки вышеупомянутого комплекса на основе микропузырьков в ткань-мишень. Способ включает следующие стадии: получение комплекса на основе микропузырьков, введение комплекса на основе микропузырьков субъекту, где субъект является источником ткани-мишени, и введение субъекту ультразвуковой энергии, где ультразвуковой энергии достаточно для того, чтобы вызвать кавитацию комплекса на основе микропузырька в ткани-мишени.
Эти и другие отличительные признаки, аспекты и преимущества настоящего изобретения станут понятнее при прочтении следующего подробного описания со ссылкой на сопровождающие графические материалы, где:
ФИГ.1 представляет собой изображение нековалентного связывания миРНК-лиганда с альбуминовыми микропузырьками.
ФИГ.2 представляет собой репрезентативный микроснимок анализа сдвига в геле для смеси миРНК, конъюгированной с холестерином (2 пкмоль) и варьирующих количеств оптизона (0, 9, 22 и 46 пкмоль для i, ii, iii и iv соответственно).
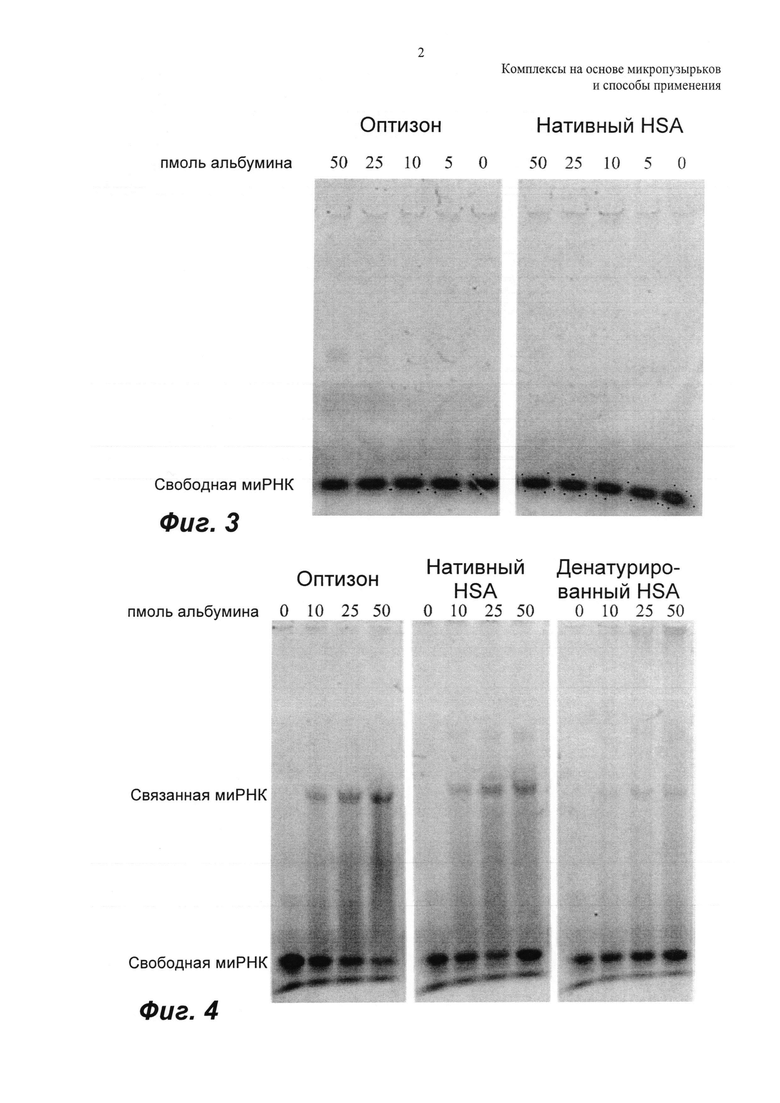
ФИГ.3 представляет собой репрезентативный микроснимок анализа сдвига в геле для Cy3-миРНК (4 пкмоль), смешанной с различными концентрациями либо оптизона, либо нативного HSA (человеческий сывороточный альбумин), которая не демонстрирует сдвига в анализе в геле.
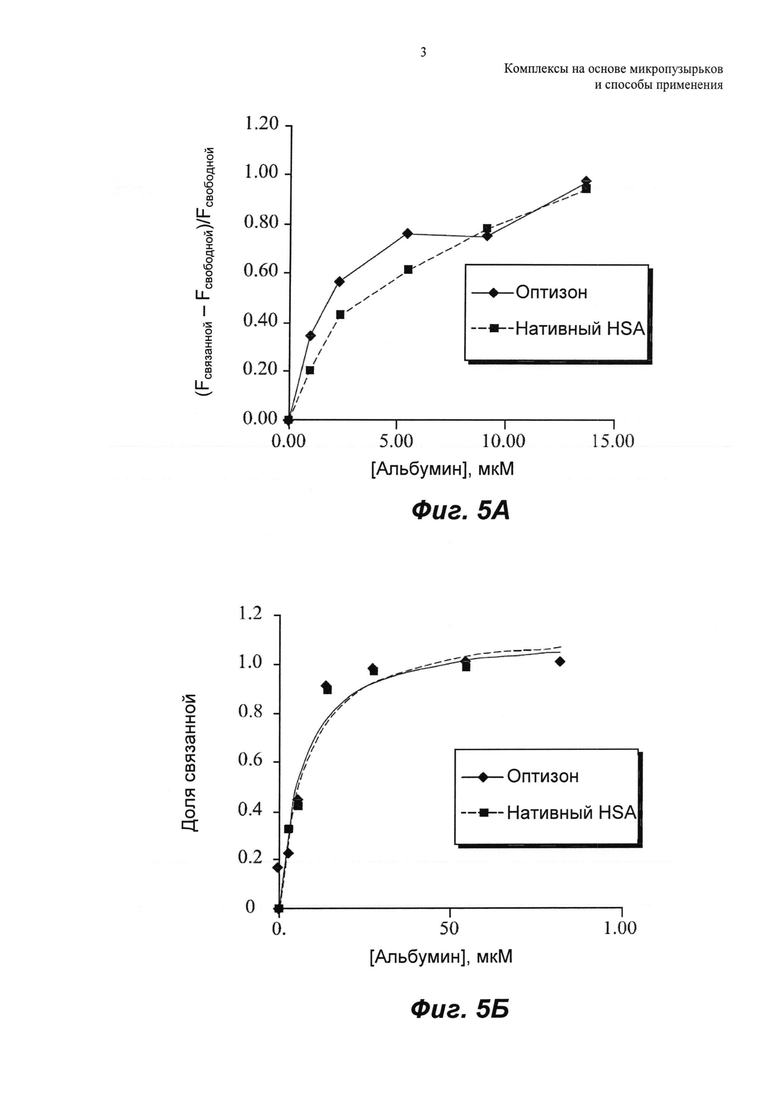
ФИГ.4 представляет собой репрезентативный микроснимок анализа в геле для Cy3-холестерин-миРНК (2 пкмоль), смешанной с различными концентрациями либо оптизона, либо нативного HSA, либо денатурированного HSA.
ФИГ.5 представляет собой графическое изображение свойств связывания холестерин-миРНК с оптизоном и нативным HSA; (А) относительную флуоресценцию полос холестерин-миРНК измеряют на основе анализа сдвига в геле; (Б) долю связанной миРНК вычисляли из относительной флуоресценции и откладывали на графике относительно концентрации альбумина.
ФИГ.6 представляет собой графическое изображение поглощения миРНК опухолевыми клетками U-87 в opticell, которое количественно оценивают измерением клеточной cy3-флуоресценции.
ФИГ.7 включает микроснимки флуоресцентных изображений, показывающих сравнение трансфекции миРНК при использовании липидного трансфицирующего реактива (RNAifect) и оптизона.
ФИГ.8 представляет собой графическое изображение средних значений флуоресценции клеток и стандартной ошибки трансфекции миРНК при использовании липидного трансфицирующего реактива (PHKifect) и оптизона.
ФИГ.9 представляет собой графическое изображение доли флуоресцеинмиристата, связанного с Optison и нативным HSA, при расчете из значений анизотропии.
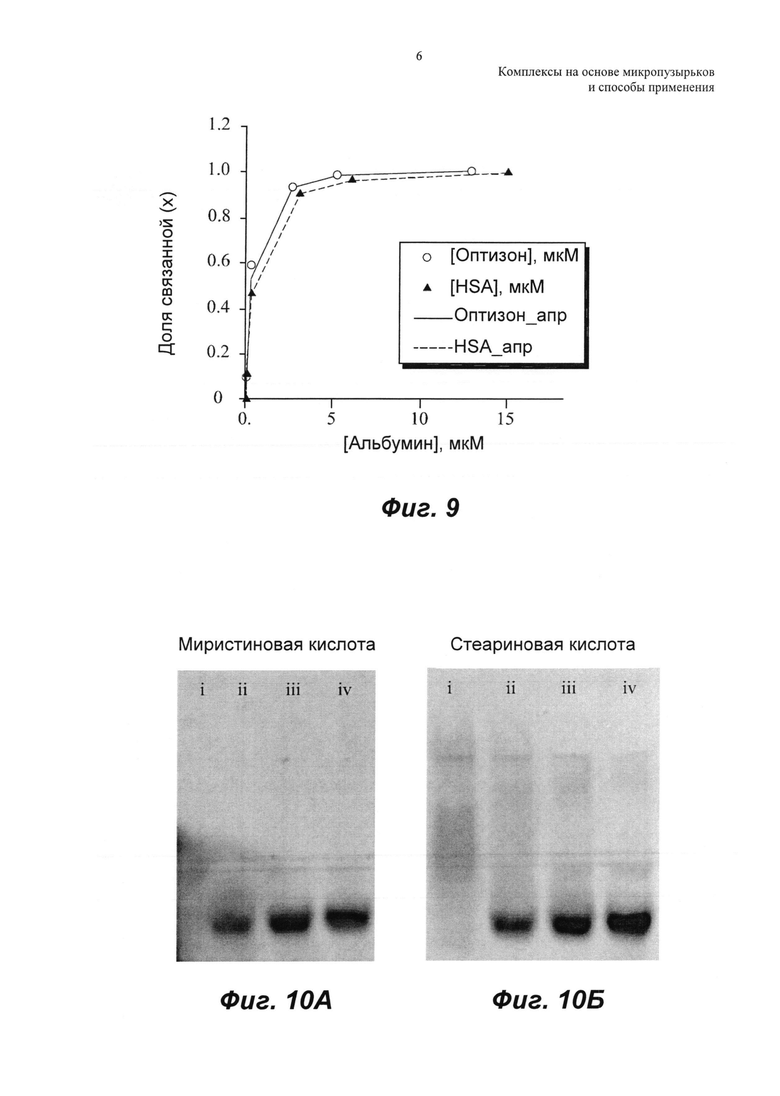
ФИГ.10А и Б представляют собой флуоресцеин, связанный с Optison (0, 8, 40 и 200 пкмоль для i, ii, iii и iv соответственно) и визуализированный на геле в виде темных полос для флуоресцеин-миристата (63 пкмоль) и флуоресцеин-стеарата (180 пкмоль) соответственно.
Следующее подробное описание приведено в качестве примера и не предназначено для того, чтобы ограничивать изобретение согласно данной заявке и применения изобретения. Кроме того, отсутствует намерение ограничиваться какой-либо теорией, представленной в предшествующем уровне техники изобретения или описаниях графических материалов.
В общем, изобретение относится к доставке терапевтического агента в интересующие клетки или ткань при помощи микропузырьков, in vitro или in vivo.
В определенном воплощении терапевтический агент может состоять из низкомолекулярного химиотерапевтического агента, пептида, углевода или олигонуклеотида; и бифункционального линкера, у которого один конец присоединен к терапевтическому агенту, а другой конец присоединен к лиганду посредством взаимодействия реакционноспособной группы на лиганде, и где лиганд связан с наружной оболочкой микропузырька. В определенном воплощении терапевтический агент может представлять собой олигонуклеотид (ODN). Термин «олигонуклеотиды» относится к полимерам нуклеиновых кислот, которые образуются посредством расщепления связи в более длинных нуклеиновых кислотах или синтезируются с использованием строительных блоков, защищенным фосфорамидитам природных или химически модифицированных нуклеозидов или, в меньшей степени, к ненуклеозидным соединениям. Длина олигонуклеотида может варьировать от короткого полимера нуклеиновой кислоты из пятидесяти или меньшего числа пар оснований до более, чем 200 пар оснований. Термин «ODN» в том виде, как он здесь используется, также относится к полинуклеотидам, имеющим больше, чем 200 пар оснований. Также включены антисмысловые ODN, которые относятся к одноцепочечным ДНК или РНК, которые комплементарны выбранной последовательности. В случае антисмысловой РНК, антисмысловая РНК препятствует трансляции белка с определенных нитей матричной РНК посредством связывания с ними. Антисмысловую ДНК можно применять для направления на специфичную комплементарную (кодирующую или некодирующую) РНК. Также включены малые интерферирующие РНК (миРНК), иногда известные как короткие интерферирующие РНК или РНК сайленсинга, представляющие собой класс молекул двухцепочечных РНК, типично имеющих длину 20-25 нуклеотидов, которые выполняют в биологии множество функций, включая путь РНК-интерференции (РНКи), где она препятствует экспрессии конкретного гена, в качестве противовирусного механизма, или в формировании структуры хроматина генома.
В определенном воплощении терапевтический агент может представлять собой цитотоксин. Термин «цитотоксин» в том виде, как он здесь используется, относится к веществу, которое имеет токсический эффект на клетки. Например, цитотоксин может вызывать переносимый некроз, при котором они теряют целостность мембраны и погибают в результате клеточного лизиса. В других примерах цитотоксин может быть ассоциирован с зависимой от антител клеточно-опосредованной цитотоксичностью, при которой клетка маркируется антителом и подвергается воздействию определенных лимфоцитов.
Примеры цитотоксичных агентов перечислены в "The Pharmacological Basis of Therapeutics," Tenth Edition, McGraw-Hill, New York, 2001, Goodman и Oilman. Они включают таксол; азотистые иприты, такие как мехлоретамин, циклофосфамид, мелфалан, урамустин и хлорамбуцил; производные этиленимина, такие как тиотепа; алкилсульфонаты, такие как бусульфан; нитрозомочевины, такие как кармустин, ломустин, семустин и стрептозоцин; триазены, такие как дакарбазин; аналоги фолиевой кислоты, такие как метотрексат; аналоги пиримидина, такие как фторурацил, цитарабин и азарибин; аналоги пурина, такие как меркаптопурин и тиогуанин; алкалоиды барвинка, такие как винбластин и винкристин; антибиотики, такие как дактиномицин, даунорубицин, доксорубицин, блеомицин, митрамицин и митомицин; ферменты, такие как L-аспарагиназа; координационные комплексы платины, такие как цисплатин; замещенная мочевина, такая как гидроксимочевина; производные метилгидразина, такие как прокарбазин; адренокортикальные супрессивные средства, такие как митотан; гормоны и антагонисты, такие как адренокортикостероиды (преднизон), прогестины (гидроксипрогестерона капроат, медропрогестерона ацетат и мегестрола ацетат), эстрогены (диэтилстилбестрол и этинилэстрадиол), антиэстрогены (тамоксифен) и андрогены (тестостерона пропионат и флуоксиместерон).
Лекарственные средства, которые препятствуют внутриклеточному синтезу белка, ингибиторы синтеза белка можно также связывать с лигандом; такие лекарственные средства известны специалистам в данной области и включают пуромицин, циклогексимид и рибонуклеазу.
В одном воплощении белок, для которого терапевтический агент действует как ингибитор, включает ферменты, растворимые и сывороточные белки, белки, экспрессируемые на поверхности клетки, неиммуноглобулиновые белки, внутриклеточные белки и сегменты белков, которые являются или могут быть сделаны водорастворимыми, либо по отдельности, либо в их комбинациях, а также любые производные белков, но не ограничивается ими.
В конкретном воплощении белок включает, например, цистеиновые протеазы, глутатион-6-трансферазу, эпоксидгидролазу (ЕН), тиолазу, NAD (никотинамидадениндинуклеотид)/NADP (никотинамидадениндинуклеотидфосфат)-зависимую оксидоредуктазу, еноил-СоА-гидратазу, альдегиддегидрогеназу, гидроксипируватредуктазу, тканевую трансглутаминазу (tTG), формиминотрансферазу циклодезаминазу (FTCD), аминолевулинат-дегидратазу (ADD), креатинкиназу, карбоксилэстеразу (LCE), моноацилглицерин (MAG) липазу, металлопротеазы (МР), фосфатазы (белок-тирозин-фосфатазы, РТР), протеосому, белок, связывающий FK506 (FKBP12), мишень рапамицина млекопитающих (mTOR; в качестве альтернативы известная как FKBP-рапамицин связывающий домен (FRB)), сериновую гидролазу (надсемейство), убиквитин-связывающий белок, галактозидазу, нуклеотидсвязывающие ферменты, протеинкиназы, ОТР(гуанозинтрифосфат)-связывающие белки, кутиназу, аденилосукцинатсинтазу, аденилосукцинатлиазу, глутаматдегидрогеназу, дигидрофолатредуктазу, синтазу жирных кислот, аспартаттранскарбамилазу, ацетилхолинэстеразу, HMG (менопаузальный гонадотропин человека)-холатредуктазу, и циклооксигеназу (СОХ-1 и СОХ-2), или по отдельности, или в их комбинации, но не ограничивается ими. Также включены любые производные любых белков.
В другом примере белок по существу не содержит кофактор. Фраза «по существу не содержит кофактор» подразумевает белки, которые не требуют какого-либо дополнительного кофактора, химического соединения, химической модификации или физической модификации для того, чтобы быть по природе стабильными при физиологических условиях, комнатной температуре и давлении в растворе или в виде твердого вещества, и могут связываться с их соответствующим лигандом in vivo.
В одном воплощении альбуминовый микропузырек может использоваться для переноса терапевтического агента при системной доставке. Затем можно использовать направленную на ткань звуковую энергию ультразвука для кавитации альбуминового микропузырька и доставки терапевтического агента во внутриклеточную среду. Например, комплекс на основе микропузырьков можно вводить внутривенно или в брюшную полость (внутрибрюшинно) субъекта, клетки или ткани которого должны служить в качестве мишени. Как только комплекс на основе микропузырьков переносится у субъекта к клетке-мишени, подается звуковая энергия ультразвука. В определенных воплощениях визуализация клеток-мишеней может происходить до подачи ультразвука, в то время как в других воплощениях визуализацию можно проводить в реальном времени и отслеживать кавитацию.
В определенных воплощениях альбуминовая наружная оболочка микропузырька состоит как из нативного, так и денатурированного альбумина, удерживаемых вместе главным образом посредством связей цистеин-цистеин. В определенных воплощениях первичный состав альбуминовой оболочки главным образом находится в нативной форме, где денатурированная часть обеспечивает усиленное присоединение посредством цистеиновой связи. В определенных воплощениях относительное количество денатурированного альбумина к нативному альбумину варьирует от приблизительно от 0,5% до 30% (масс.). В других воплощениях относительное количество находится в интервале, составляющем приблизительно от 1% до 15% (масс.). Смесь нативного и денатурированного альбумина обеспечивает баланс эластичности оболочки, необходимый для кавитации, с увеличением числа реакционноспособных сайтов связывания на поверхности микропузырьков. Микропузырьки могут быть образованы посредством обработки ультразвуком газа перфторуглерода в присутствии заранее нагретого раствора альбумина, или, в качестве альтернативы, посредством смешивания газа и заранее нагретого альбумина с использованием высокого усилия сдига. Небольшая часть молекул альбумина перестраивается во время обработки ультразвуком заранее нагретого раствора альбумина, и происходит образование поперечных связей посредством дисульфидных связей между молекулами альбумина. Полагают, что данные молекулы альбумина похожи по структуре на F форму альбумина, которая имеет больше поверхностных гидрофобных остатков. Это обеспечивает увеличение числа сайтов связывания для гидрофобных взаимодействий.
В определенных воплощениях микропузырек может быть заполнен нерастворимым газом перфторуглеродом, таким как перфторметан, перфторэтан, перфторпропан, перфторбутан, перфторпентан или их комбинация, но не ограничиваясь ими. В определенных воплощениях микропузырьки имеют диаметр от примерно 1 до примерно 5 микрометров, причем размер оптимизирован так, чтобы обеспечивать циркуляцию в кровотоке.
В определенных воплощениях комплексы терапевтический агент-микропузырек содержат терапевтический агент, модифицированный линкером, имеющим реакционноспособную группу, способную связываться с лигандом, имеющим аффинность к альбумину. Терапевтический агент, как таковой, может быть связан с альбумином посредством лиганда.
Линкер включает любую связывающую группировку, которая присоединяет лиганд к терапевтическому агенту посредством первой группировки. Линкер может быть коротким и содержать один атом углерода или длинным полимерным соединением, таким как полиэтиленгликоль, тетраэтиленгликоль (TEG), полилизин или другие полимерные соединения, обычно используемые в фармацевтической промышленности для модуляции фармакокинетических характеристик и характеристик биораспределения терапевтических агентов. Другие линкеры варьирующей длины включают линкеры длиной С1-С250 с одним или более чем одним гетероатомом, выбранным из О, S, N, Р, и возможно замещенные атомами галогена. В конкретном воплощении линкер содержит по меньшей мере одно из олигомерных или полимерных соединений, полученное из природных или синтетических мономеров, олигомерную или полимерную группировку, выбранную из фармакологически приемлемой олигомерной или полимерной композиции, олиго- или полиаминокислоту, пептид, сахарид, нуклеотид и органическую группировку с 1-250 атомами углерода, либо по отдельности, либо в их комбинации. Органическая группировка с 1-250 атомами углерода может содержать один или более чем один гетероатом, такой как О, S, N или Р, и возможно является замещенной атомами галогена в одном или более чем одном положении.
Первая группировка может просто представлять собой продолжение линкера, образованное посредством взаимодействия реакционноспособной частицы на линкере с реакционноспособной группой на терапевтическом агенте. Примеры реакционноспособной частицы и реакционноспособной группы включают активированные сложные эфиры (такие как N-гидроксисукцинимидный эфир, пентафторфениловый эфир), фосфорамидит, изоцианат, изотиоцианат, альдегид, хлорангидрид, сульфонилхлорид, малеимид, алкилгалогенид, амин, фосфин, фосфат, спирт или тиол, но не ограничиваются ими, при условии, что реакционноспособная частица и реакционноспособная группа подобраны таким образом, что подвергаются взаимодействию с получением ковалентно связанных конъюгатов.
В определенных воплощениях, реакционноспособная группа может представлять собой функциональную группу первичного амина, и модифицированный амином терапевтический агент, как таковой, может быть конъюгирован с аффинным лигандом посредством реакции карбоксильной группировки лиганда. В определенных других воплощениях реакционноспособная группа может представлять собой спирт, присоединенный к лиганду через фосфатную группу.
Лиганд, также называемый здесь аффинный лиганд, включает жирные кислоты, стероиды, небольшие ароматические соединения или их комбинацию. Примеры молекул, связывающих альбумин, можно найти в патентной заявке США с номером публикации 2010/0172844, опубликованной 8 июля 2010.
Например, в определенных воплощениях аффинный лиганд представляет собой жирную кислоту, включая миристоил, литохолевый олеил, докозанил, лауроил, стеороил, пальмитоил, олеоил или линолеоил, но не ограничивается ими. В других воплощениях аффинный лиганд представляет собой липофильную молекулу, такую как стероид или модифицированный стероид, включая холестерин, холевую кислоту, литохолевую кислоту или хенодезоксихолевую кислоту. В других воплощениях аффинный лиганд представляет собой высокоаффинную молекулу, выбранную из 4-пара-йодфенилмасляной кислоты и ее аналогов или производных. В других воплощениях терапевтический агент содержит миРНК, линкер содержит тетраэтиленгликоль, а лиганд содержит холестерин.
В определенных воплощениях, комплексы терапевтический агент-альбумин могут быть получены либо посредством обработки ультразвуком терапевтического агента, модифицированного лигандом, с альбумином или липидом в присутствии перфторуглерода, либо посредством смешивания заранее полученных пузырьков с терапевтическими агентами, модифицированными лигандом. В определенных воплощениях данные молекулы можно присоединять к интересующим терапевтическим агентам во время синтеза терапевтического агента. Например, фосфорамидиты холестерина можно использовать для включения холестерина во время синтеза ДНК или РНК на синтезаторе нуклеиновых кислот или после синтеза посредством включения реакционноспособной группировки.
В определенных воплощениях терапевтический агент представляет собой модифицированный ODN, который может быть получен ферментативно с использованием модифицированных нуклеозидтрифосфатов; модифицированных либо самим лигандом, либо реакционноспособной функциональной группой для модификации лигандом после синтеза. Присоединение лиганда может осуществляться на одном или обоих концах, внутри последовательности нуклеиновой кислоты, или во многих положениях, в зависимости от применения ODN. В определенных воплощениях, когда миРНК представляет собой ODN, присоединение может осуществляться через 3'-ОН положение.
В определенных воплощениях, помимо лиганда, терапевтический агент может быть селективно модифицирован для защиты от нуклеаз, включая случаи, когда терапевтический агент представляет собой ODN. В определенных воплощениях стабилизирующая модификация может включать модификацию фосфотиоатом или модификацию 2'-ОМе.
В определенных воплощениях комплексы на основе микропузырьков можно инкубировать с интересующими клетками или тканью, или инъецировать в организм, предпочтительно внутривенно, и затем подвергать кавитации энергией ультразвука в желательном месте и в заданное время или во время прижизненной визуализации.
В определенных воплощениях комплекс на основе микропузырьков можно наблюдать во время перемещения в большом круге кровообращения при нормальной ультразвуковой диагностической визуализации. Когда пузырек достигает ткани-мишени, в данном случае опухоли, на опухоль направляют серию импульсных волн звуковой энергии. Это создает инерционную кавитацию на микропузырьке, которая разрушает микропузырек. Кавитация микропузырька происходит, когда звуковая энергия является максимально локализованной. Эта направленность достигается на ультразвуковом зонде параметрами, связанными с индексом механической силы, оптимальным звуковым расстоянием ультразвука и величиной звукового диапазона ультразвука. Генерируемая сила может затем потенциально образовывать микропоры внутри плазматической мембраны клетки. Типично воздействуют импульсной энергией с частотой от примерно 0,5 до примерно 5 МГц.
Данные микропоры, вместе с силой микровпрыскивания, создаваемой при инерционной кавитации, могут облегчать поступление ODN в клеточную цитоплазматическую среду. Например, когда ODN представляет собой миРНК, миРНК во внутриклеточной среде будет использовать аппарат хозяина для сайленсинга мРНК и последующего синтеза белка. Аналогично, когда продукт мРНК действует в качестве белков, стимулирующих ангиогенез, включая фактор роста эндотелия сосудов (VEGF), снижение экспрессии VEGF в опухоли может останавливать или замедлять рост опухоли. После кавитации микропузырьков, плотный газ из центральной части микропузырьков удаляется из организма при выдыхании, а альбуминовая оболочка метаболизируется и выделяется посредством печеночного пути элиминации.
В типичном воплощении, болюс комплекса на основе микропузырьков можно смешивать в оптимальном соотношении, определенном из предыдущих терапевтических исследований. Как только получена смесь комплекса, болюс лекарственного средства инъецируют в большой круг кровообращения венозным путем.
Например, при применении болюса миРНК-микропузырька, болюс можно отслеживать в кинетике первого прохождения в крови. Резонанс микропузырьков и, таким образом, повышенный ультразвуковой контраст можно отслеживать ультразвуковым зондом с использованием низких диагностических уровней звуковой энергии. Во время циркуляции болюс достигает органа-мишени. Перфузия сердечно-сосудистой ткани может способствовать доставке болюса в глубокие микрососуды с маленькими диаметрами полости. Путем приложения импульсной звуковой энергии можно обеспечивать достаточную энергию для того, чтобы микропузырек подвергался инерционной кавитации. При завершении кавитации микропузырька, содержимое в виде миРНК может доставляться через плазматическую мембрану в больную клетку. При нахождении в цитоплазматической внутриклеточной среде миРНК может оказывать терапевтическое действие.
Во время кавитации микропузырьков поступление миРНК в клетку может происходить разными механизмами. Например, миРНК может поступать в клетку посредством: микроструйной силы в результате взрыва микропузырька, которая может втолкнуть миРНК в цитоплазму. В качестве альтернативы, механизм может включать микроструйную энергию или сонолюминесцентную энергию, которая создает временные микропоры в плазматической мембране, обеспечивающие пассивную диффузию миРНК в клетку, или во время резонанса микропузырьков до реальной кавитации удары микропузырьков по плазматической мембране могут проталкивать миРНК в клетку.
Механизм доставки микропузырьков, как таковой, имеет потенциальные применения при лечении широкого спектра заболеваний, которые могут включать рак, воспалительные, инфекционные, сердечно-сосудистые, метаболические, аутоиммунные заболевания и заболевания центральной нервной системы. Многие из данных заболеваний в настоящее время нельзя эффективно лечить посредством направленного действия на молекулярные механизмы, не доступные для традиционных низкомолекулярных лекарственных средств и моноклональных антител.
ЭКСПЕРИМЕНТАЛЬНЫЙ РАЗДЕЛ
Пример 1. Комплекс микропузырек-миРНК
ФИГ.1 представляет собой репрезентативную иллюстрацию связывания миРНК с альбуминовыми инкапсулирующими микропузырьками с образованием комплекса микропузырек-миРНК.
миРНК-мишень для сайленсинга VEGF (фактор роста эндотелия сосудов) синтезировали посредством технологий IDTDNA. IDTDNA обеспечивала липидные модификации, такие как холестерил TEG, на миРНК (Хол-миРНК), а также конъюгирование красителя.
Кодирующая нить; 5'-Cy3/GCAUUUGUUUGUCCAAGAUmUmU/3'-липид (SEQ ID NO:1)
Антисмысловая нить: 5'/mAmArArUrCrUrUrGrGrArCrArArArCrArArArUrGrC/3' (SEQ ID NO:2)
Цианиновый краситель, Cy3, на миРНК имеет длину волны возбуждения 550 нм и пик испускания 580 нм. миРНК метили красителем cy3 для легкой визуализации миРНК во время анализов связывания и других методик характеризации. Optison™ (GE Healthcare, Chalfont St. Giles, Великобритания, 10 мг/мл альбумина) центрифугировали; верхний слой отбрасывали, и остаток раствора альбумина на дне использовали для исследований связывания. Порошок лиофилизированного человеческого сывороточного альбумина (HSA) (Sigma Aldrich, St. Louis МО) растворяли в 1Х фосфатно-солевом буферном растворе (PBS) с получением 10 мг/мл маточного раствора. Получали разведения как раствора оптизона, так и нативного альбумина с 1Х PBS. Раствор денатурированного HSA получали путем нагревания раствора нативного HSA до 80°С в течение 20 минут.
Реакция связывания:
Маточные растворы cy3-миРНК и cy3-миРНК-холестерин, 20 мкМ, готовили в воде, не содержащей РНКазы и хранили при -20°С. Растворы 4 пмоль cy3-миРНК и 2 пмоль холестерин-миРНК смешивали с разными количествами раствора оптизона, раствора нативного HSA и денатурированного HSA, варьирующими от 0 до 50 пмоль. Реакционный буфер представлял собой 1Х PBS, рН 7,4. Реакционную смесь инкубировали в темноте при 25°С в течение 45 минут. После инкубации десять мкл смесей миРНК смешивали с 2 мкл буфера для образца Novex® Hi-Density TBE (5X) (Invitrogen, Carlsbad, CA, США).
Гель-электрофорез:
Все реакционные смеси загружали на заранее полимеризованные 6%-ные неденатурирующие полиакриламидные гели (Invitrogen, Carlsbad, CA, США). Разделение на геле осуществляли при 100 В в течение 45 мин в 0,5Х буфере для разделения Novex TBE (Invitrogen, Carlsbad, CA, США). Гели, содержащие ДНК, белок, либо и то, и другое, визуализировали на флуоресценцию cy3 с использованием сканера Typhoon (Typhoon ™9410, GE Healthcare).
Результаты:
Флуоресценцию Cy3, присоединенного к миРНК, можно визуализировать в виде отдельных полос миРНК на геле. При разделении на геле смеси миРНК и раствора альбумина подвижность миРНК, связанной с альбумином, ниже, чем подвижность свободной миРНК, что приводит к двум полосам на геле. В предварительных экспериментах для наблюдения полос альбумина в геле использовали краситель Sypro рубиновый из набора EMSA (Molecular Probes, Eugene, OR, США). Пример показан на ФИГ.2, который представляет собой анализ сдвига в геле для смеси холестерина, конъюгированного с миРНК (2 пмоль), и варьирующих количеств оптизона (0, 9, 22 и 46 пмоль для i, ii, iii и iv соответственно). Флуоресцентная визуализация гелей показывает отличные полосы для миРНК (отрезки с нижними полосами) и альбумина (отрезки с верхними полосами).
Су3-миРНК
При разделении на геле смеси cy3-миРНК и нативного HSA/оптизона для возрастающих концентраций альбумина не было визуализировано связанной миРНК. Отсутствовало значимое связывание cy3-миРНК либо с нативным HSA, либо с раствором оптизона. Это показано на ФИГ.3, которая представляет собой флуоресцентное изображение геля для cy3-миРНК (4 пмоль), смешанной с варьирующими концентрациями либо оптизона, либо нативного HSA, на котором нет сдвига в анализе геля. Темные полосы на геле представляют собой флуоресценцию cy3 на миРНК. Отсутствует значимое связывание cy3-миРНК как с оптизоном, так и с нативным HSA.
Хол-миРНК
На ФИГ.4 показаны изображения гелей для связывания хол-миРНК с оптизоном, нативным HSA и денатурированным HSA. Хол-миРНК связывается как с нативным HSA, так и с раствором оптизона, тогда как связывание значительно уменьшается для такого же количества денатурированного HSA. Интенсивность флуоресценции миРНК в каждой полосе оценивали вручную, рисуя прямоугольник вокруг полос. Фон, эквивалентный значению средней интенсивности геля, вычитали из значения интенсивности каждой полосы миРНК. Рассчитывали интенсивности флуоресценции связанной миРНК в широком диапазоне концентраций альбумина. Относительную флуоресценцию R рассчитывали как:
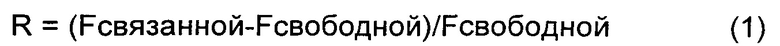
Fсвязанной представляет собой интенсивность флуоресценции полосы связанной миРНК, и Fсвободной представляет собой интенсивность флуоресценции полосы свободной миРНК. Относительную флуоресценцию откладывали на графике относительно концентрации альбумина. Это показано на ФИГ.5, которая представляет собой графическое сравнение свойств связывания холестерин-миРНК с оптизоном и нативным HSA, как описано ниже.
При низкой концентрации альбумина, варьирующей от 0 до 15 мкМ, визуализировали линейную зависимость флуоресценции связанной от концентрации альбумина. На графике А ФИГ.5 показано, что в данном концентрационном интервале количество хол-миРНК, связанной с раствором оптизона, было выше, чем связывание с нативным HSA. Для оценки констант связывания использовали более высокую концентрацию альбумина для обеспечения насыщающего количества миРНК, связанной с альбумином. Долю связанной, х, определяли как:
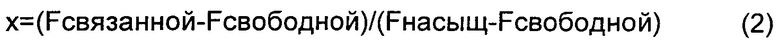
Fнасыщ представляет собой интенсивность флуоресценции максимального количества связанной миРНК при насыщающих условиях.
Долю связанной откладывали на графике относительно возрастающих концентраций альбумина, как показано на графике Б ФИГ.5, и точки данных аппроксимировали следующим равновесным уравнением:
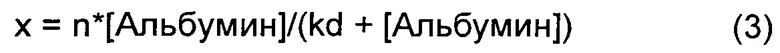
kd представляет собой константу диссоциации, n представляет собой число сайтов связывания, и [Альбумин] представляет собой общую концентрацию альбумина для соответствующих образцов. Уравнение 3 решали с использованием нелинейной аппроксимации для определения kd и n для связывания хол-миРНК как с оптизоном, так и с нативным HSA (Таблица 1). Для этой нелинейной аппроксимации использовали инструмент Solver в Microsoft Excel, и обнаружили, что сумма квадратов ошибок (SSE) составляет 0,07 и 0,06 для оптизона и нативного HSA соответственно. Константа связывания хол-миРНК была аналогичной для оптизона и нативного HSA.
Пример 2. Доставка миРНК в опухолевые клетки
Культура клеток:
Клетки крысиной карциномы молочной железы МАТВ111 и человеческой глиобластомы U-87 культивировали в среде МакКоя 5А (модифицированной) (1Х) (Invitrogen, Carlsbad, CA, США) и минимальной питательной среде Игла (ЕМЕМ) (АТСС, Manassas, VA) соответственно. Оба раствора сред дополняли 10% дезактивированной нагреванием фетальной коровьей сыворотки (FBS) (Fisher Scientific, Springfield, NJ) и 1% пенициллина-стрептомицина (Sigma Aldrich, St Louis, МО). Клетки поддерживали при 37°С в увлажненной атмосфере с 5% CO2.
Обработка ультразвуком клеток, присоединенных к субстрату:
Клетки MATB-III и U-87 выращивали в блоках Opticell 10 мл объема (Nalge Nunc International, Rochester, NY) до 90%-ной конфлюентности. Среды в OptiCell заменяли 10 мл свежих сред, содержащих 40 пмоль либо cy3-миРНК, либо холестерин-миРНК. Opticell оставляли в инкубаторе на 24 часа при 37°С. Клетки по отдельности обрабатывали либо раствором миРНК, смешанным с микропузырьками оптизона (300 мкл), либо липидным трансфицирующим реактивом (90 мкл) (RNAifect, Qiagen, Valencia, CA). Для смесей миРНК/оптизон для разрыва микропузырьков и доставки лекарственного средства на основе миРНК из микропузырьков использовали формирователи изображения Vivid i с зондом секторов сердца (3S). Opticell иммобилизировали в водной бане, и к подвижному рычагу, который охватывал всю длину Opticell, прикрепляли ультразвуковой зонд. Кончик зонда погружали в воду, и расстояние между зондом и поверхностью Opticell составляло 3 см, что обеспечивало обработку ультразвуком всей ширины Opticell. Микропузырьки в Opticell обрабатывали при непрерывном воздействии ультразвука с механическим индексом, MI больше 1,3. Зонд перемещался по всей длине Opticell со скоростью 1 м/с. После обработки ультразвуком клетки инкубировали в течение 24 часов при 37°С. Аналогично, клетки, обработанные RNAifect, также содержали в инкубаторе в течение 24 часов. После инкубации клетки визуализировали с использованием флуоресцентного микроскопа (Zeiss Axio Imager. Z1, Carl Zeiss). Для cy3 использовали фильтр DsRed/Cy3 (возбуждение при 546 нм/испускание при 620 нм). В интересующей области (ROI) флуоресцентных изображений измеряли флуоресценцию клеток и рассчитывали средние значения флуоресценции клеток. Для обработки изображений и расчета интенсивностей флуоресценции использовали ImageJ.
Данные приведены в виде среднего значения плюс 1,0 стандартная ошибка (SE) для N=4. Статистическую значимость различий между группами оценивали с использованием двухвыборочного t-критерия, и статистические анализы проводили с использованием Minitab® 12 (Minitab Inc, State College, PA США).
Результаты:
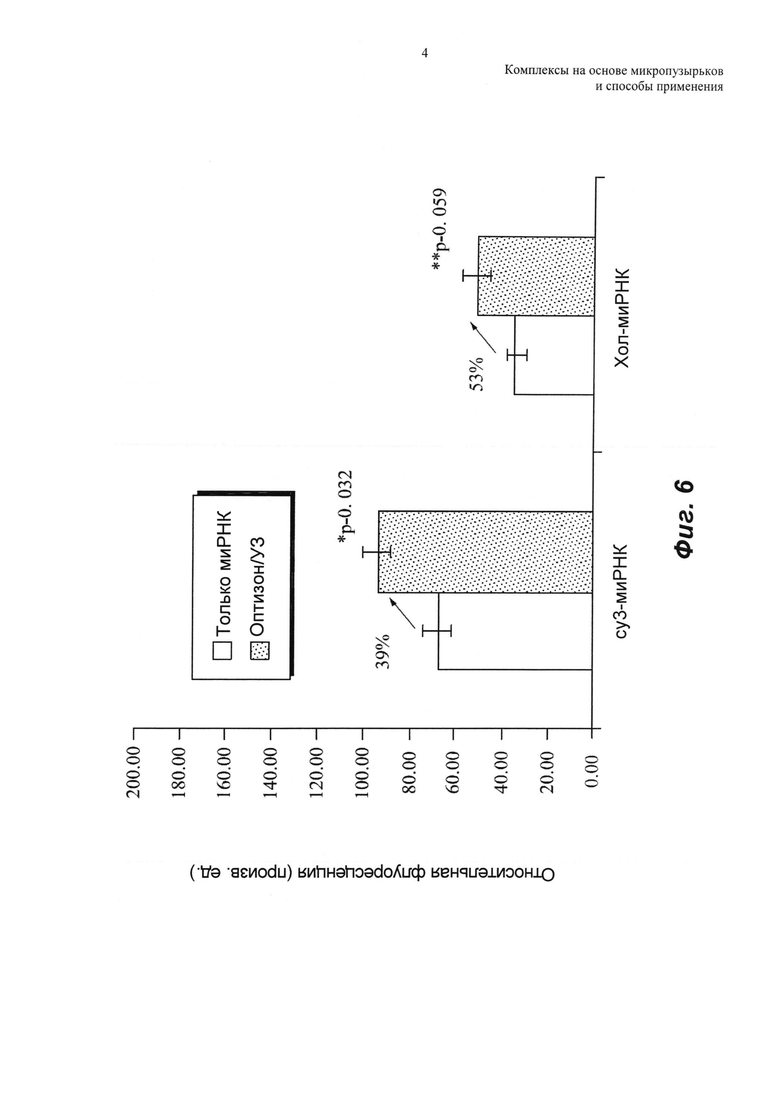
Эффект системы доставки проиллюстрирован на ФИГ.6 для клеток U-87, инкубируемых с cy3-миРНК или с хол-миРНК. Доставка миРНК в опухолевые клетки представлена средней cy3-флуоресценцией клеток. Для каждой группы приведены средние значения флуоресценции и стандартные ошибки. Обработка клеток ультразвуком значительно усиливала проникновение cy3-миРНК в клетку. Благодаря эффектам сонопорации, средняя флуоресценция клеток для клеток, обработанных оптизоном/ультразвуком, была на 39% больше, чем для необработанных клеток. Для холестерин-миРНК происходило 53%-ное увеличение средней флуоресценции клеток после обработки оптизоном/ультразвуком. Значимые различия между группами оценивали с использованием двухвыборочных t-критериев (р равно 0,032 для cy3-миРНК, и р равно 0,059 для холестерин-миРНК).
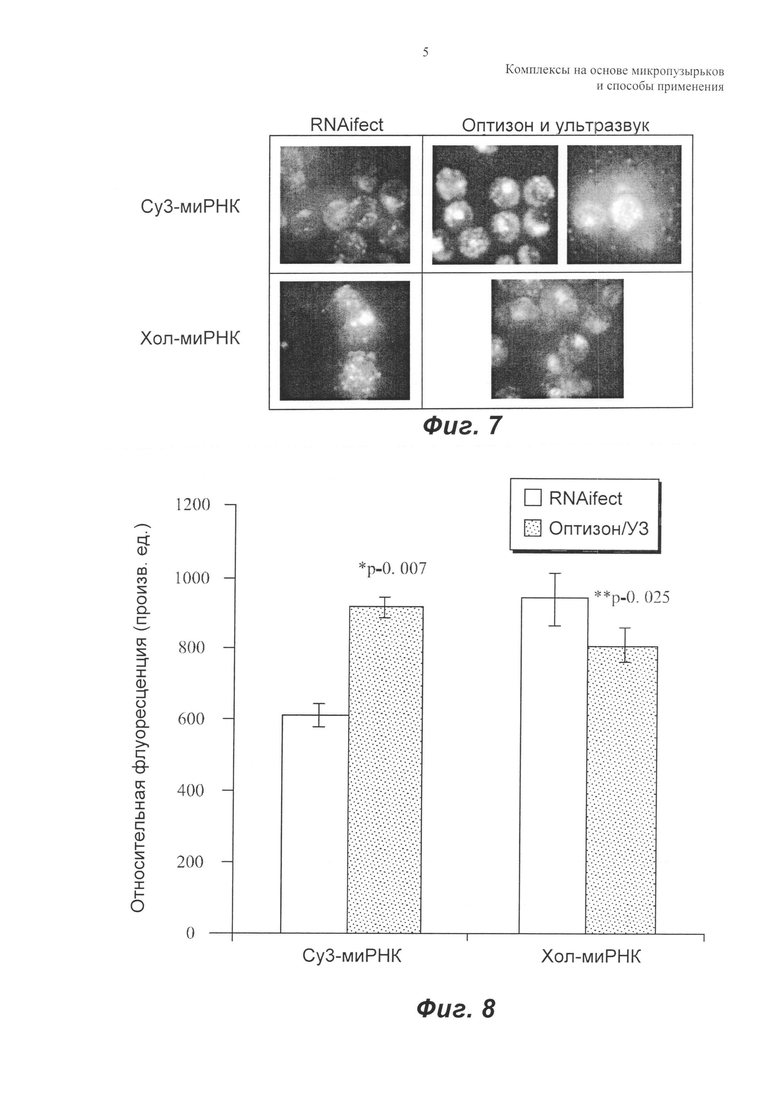
Аналогично, для клеток MATBIII эффект обработки оптизоном/ультразвуком сравнивали с имеющимся в продаже липидым трансфекционным реактивом. Клетки обрабатывали cy3-миРНК или хол-миРНК в комбинации с агентами доставки: либо RNAifect, либо оптизоном/ультразвуком, и результаты показаны на ФИГ.7 и 8. На ФИГ.7 показаны репрезентативные изображения клеток после обработки. На ФИГ.8 приведена средняя флуоресценция клеток для всех групп со стандартными ошибками, представленными в виде планок погрешностей. Для cy3-миРНК средняя флуоресценция клеток была выше для обработки оптизоном/ультразвуком (двухвыборочный t-критерий, р равно 0,007). Это главным образом обусловлено сонопорацией клеток в присутствии микропузырьков. Не было значимого различия между доставкой хол-миРНК в клетки, опосредованной RNAifect и оптизоном/ультразвуком. Несмотря на то, что средняя флуоресценция клеток была аналогичной, обнаружили, что липидный трансфицирующий реактив был токсичным для опухолевых клеток, что доказывается нерегулярной формой клеток на ФИГ.7. Следует отметить, что как с немодифицированной, так и с холестерин-миРНК использовали такие же количества трансфицирующего реактива и миРНК. В то время как трансфицирующий реактив был токсичным в обоих случаях, токсичность была выше для хол-миРНК.
Пример 3. Предварительные исследования связывания конъюгатов терапевтический агент-жирная кислота с микропузырьками оценивали с использованием конъюгатов флуоресцеин-жирная кислота
Способ конъюгирования:
Сложный NHS (N-гидрокси-сукцинимидный) эфир жирной кислоты (2 эквивалента, 5,37 мг сложного NHS эфира миристиновой кислоты или 6,38 мг сложного NHS эфира стеариновой кислоты) брали в смеси 50:50 DMSO (диметилсульфоксид) и дихлорметана (100 мкл) и смешивали с раствором флуоресцеин кадаверина (FL-кадаверин, 5 мг, 1 эквивалент, в 50 мкл DMSO). К данной смеси добавляли диизопропилэтиламин (3,8 эквивалента), и смесь встряхивали с получением прозрачного раствора. Образцы выдерживали в темноте при комнатной температуре. Через 4,5 ч реакцию проверяли ВЭЖХ (высокоэффективная жидкостная хроматография) и обнаружили, что она была завершена. Как и ожидалось, для обоих конъюгатов наблюдали большой сдвиг во времени удерживания (время удерживания FL-кадаверина - 4,7 мин, стеарата FL-кадаверина - 12,1 мин и миристата FL-кадаверина - 9,9 мин, колонка - X-Bridge Shield RP 18, размер колонки - 4,6×50 мм, размер частиц 5 мкм, градиентный способ 0-100% Б за 15 мин и 100% Б за 5 мин, растворитель А - 0,1 М ТЕАА, рН 7,0 и растворитель Б - 100% ацетонитрил, скорость тока 1 мл/мин). Неочищенный продукт разводили DMSO до примерно 2 мл и очищали на установки для очистки АКТА с использованием колонки Xterra MS C18, 19×100 мм и градиента 0-100% Б в 18,75 объемах колонки при скорости тока 10 мл/мин. Растворители А и Б были такими же, как описано выше для аналитического способа. Продукт собирали в многочисленных фракциях, и каждую фракцию анализировали аналитической ВЭЖХ. Для исследований связывания в каждом случае использовали только самую чистую фракцию (чистота примерно 90%) (исходное вещество само имело чистоту примерно 86%, вероятно сохраняя региоизомер с такими же спектральными свойствами). Данную фракцию концентрировали досуха при комнатной температуре. Остаток суспендировали в воде (примерно 2 мл) и экстрагировали дихлорметаном (3×2 мл). Органические экстракты объединяли, сушили над безводным сульфатом натрия и концентрировали досуха.
Флуоресцентный поляризационный анализ
Маточный раствор флуоресцеин-миристата получали в 1Х PBS. Для поляризационного анализа флуоресценции концентрацию флуоресцеина поддерживали на низком уровне, 126 нМ. К раствору флуоресцеин-миристата добавляли варьирующие концентрации либо оптизона, либо растворов HSA с диапазоном концентраций альбумина от 0 до 15 мкМ. Буфер для реакции представлял собой 1Х PBS, рН 7,4. Реакционную смесь инкубировали в темноте при 25°С в течение 15 мин. После инкубации изменения грубых значений анизотропии флуоресцеина измеряли с использованием микропланшет-ридера (SpectraMax 5, Molecular Devices, Sunnyvale, CA).
Образцы измеряли в 96-луночных планшетах Corning (черный планшет с прозрачным дном) (Sigma Aldrich, St Louis, МО). Флуоресцеин возбуждали при 470 нм, и испускание измеряли при 540 нм. Долю связанного (х) рассчитывали с использованием того же самого уравнения, что и ранее (Уравнение 2), но заменяя значения флуоресценции значениями анизотропии. Рассчитанную долю связанного затем откладывали на графике относительно концентрации альбумина, как показано на ФИГ.9. Данные приведены как среднее плюс 1,0 стандартная ошибка (SE) для N равно 3. Уравнение 3 использовали для определения kd и n для связывания флуоресцеин-миристата как с оптизоном, так и нативным HSA (Таблица 2). Это также представлено на ФИГ.10, на которой показано, что флуоресцеин, связанный с оптизоном (0, 8, 40 и 200 пмоль для i, ii, iii и iv соответственно), визуализируется на геле в виде темных полос для флуоресцеин-миристата (ФИГ.10А) (63 пмоль) и флуоресцеин-стеарата (ФИГ.10Б) (180 пмоль).
При тестировании свойств связывания с альбумином флуоресцеина без конъюгирования с миристином, не наблюдали значимых изменений анизотропии. Хорошо известно, что жирные кислоты имеют более сильные связывающие свойства, чем холестерин, и это также подтверждено здесь более низкими константами диссоциации, kd, наблюдаемыми для конъюгата флуоресцеин-миристат (Таблица 1 и Таблица 2).
Следовательно, конъюгирование жирной кислоты, такой как миристат, с терапевтическим соединением может усиливать связывание таких терапевтических соединений с микропузырьками с альбуминовой оболочкой. Константа диссоциации связывания флуоресцеин-миристата с оптизоном была ниже, чем константа диссоциации связывания с нативным HSA. Это свидетельствует о лучших свойствах гидрофобного связывания оболочки микропузырьков, которая содержит как нативный, так и частично денатурированный альбумин.
Пример 4
Стабильность миРНК in vivo:
Стабильность терапевтических соединений, таких как миРНК, при инъекции в организм является очень низкой. Проводили сравнительное исследование подкожной инъекции и инъекции в хвостовую вену смеси альбуминовых микропузырьков и нативной миРНК (без конъюгатов).
Одиннадцати-четырнадцати-недельных мышей nu/nu (масса тела примерно 30 г) приобретали в Charles River Laboratories (Wilmington, MA). Животных содержали согласно руководству по уходу и использованию лабораторных животных, адаптированному Национальными институтами здоровья (США). Клетки карциномы легкого Льюис (LLC) подкожно инокулировали в правый бок мышей под анастезией (3,5×106 клеток/100 мкл/мышь).
На четвертые сутки после инокуляции мышей обрабатывали миРНК против VEGF (Sigma Life Sciences, St. Louis, МО) - смесями микропузырьков, дозой миРНК 1 мг/кг для подкожных инъекций и дозой 2,0 мг/кг для инъекций в хвостовую вену. Инъекционная смесь содержала 100 мкл раствора микропузырьков и 100 мкл миРНК в воде, не содержащей РНКаз. После инъекции опухоли обрабатывали ультразвуком с использованием устройств для визуализации Vivid i с зондом секторов сердца (3S). Энергию доставляли в импульсной форме с пиком Ml 1,3. Контрольная группа не получала каких-либо обработок.
Через 24 часа после обработки мышей умерщвляли и извлекали опухоли. Опухоли немедленно замораживали и хранили при -20°С. Опухоли размораживали при комнатной температуре в сутки измерения VEGF. Затем опухоли лизировали в буфере RIPA (с добавлением ингибиторов протеаз) с использованием пробирки с лизирующей матрицей (пробирка с лизирующей матрицей A, RP Biomedical). Лизат, отобранный из образцов, затем разводили и проводили измерения на общее содержание белка с использованием набора для определения белка (набор реактивов для анализа белка Pierce BCA) и VEGF с использованием набора для ELISA (набор для ELISA для мышиного VEGF, RayBiotech, Norcross, GA).
Результаты приведены в Таблице 3 в виде среднего значения в пг VEGF/мг белка для контрольной группы и разных обработанных групп. Подкожная инъекция 1,0 мг/кг миРНК - смеси микропузырьков приводила к приблизительно 39%-ному снижению VEGF по сравнению с контрольной группой (двухвыборочный t-критерий; р равно 0,0096). При наличии лишь небольшого различия между контрольной группой и инъекцией в хвостовую вену 2,0 мг/кг миРНК-смеси микропузырьков, это может быть обусловлено недостатком или менее эффективным связыванием немодифицированной миРНК с микропузырьком.
Данное изобретение может быть воплощено в других конкретных формах без отступления от его сущности или существенных характеристик. Вышеописанные воплощения, следовательно, во всех отношениях нужно рассматривать как иллюстративные, а не как ограничивающие описанное здесь изобретение. Объем изобретения, таким образом, указан в приложенной формуле изобретения, а не в приведенном выше описании, и, следовательно, подразумевается, что она охватывает все изменения, которые появляются в пределах значений и серии эквивалентов формулы изобретения.


| название | год | авторы | номер документа |
|---|---|---|---|
| СОНОДИНАМИЧЕСКАЯ ТЕРАПИЯ | 2016 |
|
RU2791572C1 |
| Высокопроизводительный скрининг соединений, модулирующих экспрессию клеточных макромолекул | 2012 |
|
RU2612017C2 |
| НОВЫЕ КОНЪЮГАТЫ ОЛИГОНУКЛЕОТИДОВ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2599449C1 |
| Способ получения белковых наночастиц из молекул иммуноглобулинов | 2021 |
|
RU2820320C2 |
| КОВАЛЕНТНО СВЯЗАННЫЕ КОНЪЮГАТЫ ХЕЛИКАР-АНТИТЕЛО ПРОТИВ ХЕЛИКАРА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2694981C2 |
| Способ синтеза трансфецирующего наноагента для генотерапевтических применений (варианты) | 2021 |
|
RU2838201C1 |
| СОЕДИНЕНИЯ ДЛЯ ТРАНС-МЕМБРАННОЙ ДОСТАВКИ МОЛЕКУЛ | 2015 |
|
RU2703416C2 |
| Композиция системы доставки на основе конъюгата для доставки полинуклеотида РНК-интерференции в клетку печени и способ ее получения | 2011 |
|
RU2623160C9 |
| СПОСОБ ОТБОРА И ПОЛУЧЕНИЯ СЕЛЕКТИВНЫХ И МУЛЬТИСПЕЦИФИЧЕСКИХ ТЕРАПЕВТИЧЕСКИХ МОЛЕКУЛ С ЗАДАННЫМИ СВОЙСТВАМИ, ВКЛЮЧАЮЩИХ ПО МЕНЬШЕЙ МЕРЕ ДВЕ РАЗЛИЧНЫЕ НАЦЕЛИВАЮЩИЕ ГРУППИРОВКИ, И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2644263C2 |
| БИСПЕЦИФИЧНЫЕ АНТИТЕЛА ПРОТИВ ГАПТЕНА/ПРОТИВ РЕЦЕПТОРА ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА, ИХ КОМПЛЕКСЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЧЕЛНОКОВ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2014 |
|
RU2693438C2 |
Группа изобретений относится к медицине и касается комплекса на основе микропузырьков для доставки терапевтического агента в ткань-мишень, содержащего микропузырек, имеющий наружную оболочку, содержащую смесь нативного и денатурированного альбумина, и полую сердцевину, инкапсулирующую газ перфторуглерод; терапевтический агент; бифункциональный линкер. Группа изобретений также касается способа доставки указанного комплекса на основе микропузырьков в ткань-мишень. Группа изобретений обеспечивает увеличенное связывание терапевтических агентов с микропузырьками, чтобы минимизировать ненаправленную доставку указанного агента. 2 н. и 15 з.п. ф-лы, 4 пр., 10 ил., 3 табл.
1. Комплекс на основе микропузырьков для доставки терапевтического агента в ткань-мишень, содержащий:
микропузырек, имеющий наружную оболочку, содержащую смесь нативного и денатурированного альбумина, и полую сердцевину, инкапсулирующую газ перфторуглерод;
терапевтический агент, выбранный из группы, содержащей низкомолекулярный химиотерапевтический агент, пептид, углевод, олигонуклеотид, цитотоксин, ингибитор синтеза белка или их комбинацию;
бифункциональный линкер, у которого один конец присоединен к терапевтическому агенту, а другой конец присоединен к лиганду посредством взаимодействия реакционноспособной группы на указанном лиганде; и
где лиганд связан с наружной оболочкой микропузырька посредством гидрофобных взаимодействий.
2. Комплекс по п. 1, где терапевтический агент представляет собой олигонуклеотид.
3. Комплекс по п. 2, где олигонуклеотид представляет собой встречающуюся в природе или модифицированную ДНК или РНК.
4. Комплекс по п. 3, где РНК представляет собой малую интерферирующую РНК.
5. Комплекс по п. 1, где бифункциональный линкер содержит олиго- или полиаминокислоту, пептид, сахарид, нуклеотид, органическую группировку, имеющую приблизительно от 1 до 250 атомов углерода, или их комбинацию.
6. Комплекс по п. 1, где бифункциональный линкер содержит тетраэтиленгликоль (TEG) или полиэтиленгликоль.
7. Комплекс по п. 1, где реакционноспособная группа содержит активированный сложный эфир, фосфорамидит, изоцианат, изотиоцианат, альдегид, хлорангидрид, сульфонилхлорид, малеимид, алкилгалогенид, амин, фосфин, фосфат, спирт или тиол.
8. Комплекс по п. 1, где лиганд представляет собой жирную кислоту, стероид или их комбинацию.
9. Комплекс по п. 1, где лиганд представляет собой 4-йодфенилмасляную кислоту или ее аналог или производное.
10. Комплекс по п. 1, где количество денатурированного альбумина по отношению к нативному находится в интервале приблизительно от 0,5 до 30% масс.
11. Комплекс по п. 1, где терапевтический агент содержит миРНК, линкер содержит тетраэтиленгликоль и лиганд содержит холестерин.
12. Способ доставки комплекса на основе микропузырьков в ткань-мишень, включающий стадии:
обеспечения комплекса на основе микропузырьков, содержащего:
микропузырек, имеющий наружную оболочку, содержащую смесь нативного и денатурированного альбумина, и полую сердцевину, инкапсулирующую газ перфторуглерод;
терапевтический агент, выбранный из группы, содержащей низкомолекулярный химиотерапевтический агент, пептид, углевод, олигонуклеотид, цитотоксин, ингибитор синтеза белка или их комбинацию;
бифункциональный линкер, у которого один конец присоединен к терапевтическому агенту, а другой конец присоединен к лиганду посредством взаимодействия реакционноспособной группы на указанном лиганде; и
где лиганд связан с наружной оболочкой микропузырька посредством гидрофобных взаимодействий;
введения комплекса на основе микропузырьков субъекту, где субъект является источником ткани-мишени; и
введения субъекту ультразвуковой энергии, где указанная энергия является достаточной, чтобы вызвать кавитацию комплекса на основе микропузырьков в ткани-мишени.
13. Способ по п. 12, где ткань-мишень расположена in vivo и введение комплекса на основе микропузырьков включает внутривенную или внутрибрюшинную инъекцию комплекса на основе микропузырьков.
14. Способ по п. 12, дополнительно включающий стадию визуализации комплекса на основе микропузырьков в ткани-мишени до введения ультразвуковой энергии для кавитации комплекса на основе микропузырьков.
15. Способ по п. 12, где визуализацию и введение ультразвуковой энергии проводят в реальном времени.
16. Способ по п. 12, где ткань-мишень находится in vitro.
17. Способ по п. 12, где терапевтический агент содержит миРНК, линкер содержит тетраэтиленгликоль и лиганд содержит холестерин.
| DIJKMANS P.A., et al., Microbubbles and ultrasound: from diagnosis to therapy.Eur J Echocardiogr | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| CHERKAOUI S., et al., Tracking of antibody reduction fragments by capillary gel electrophoresis during the coupling to microparticles surface.J Pharm Biomed Anal | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| WO 00/42988 A1, 27.07.2000 | |||
| NEGISHI Y., et al., Development of novel nucleic acid-loaded Bubble liposomes using cholesterol-conjugated siRNA.J Drug Target | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| BENZINGER P., et al., Targeting of endothelial KDR receptors with 3G2 immunoliposomes in vitro.Biochim Biophys Acta | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2017-03-15—Публикация
2012-09-18—Подача