Изобретение отн6осится к лигандам рецепторов аденозина А3 общей формулы (I), предпочтительно к антагонистам, а также к их солям, сольватам и изомерам (таутомерам, десмотропным формам, оптически активным изомерам), к содержащим их фармацевтическим композициям, к применению соединений общей формулы (I) и их солей, сольватов и изомеров, к получению соединений общей формулы (I) и их солей, сольватов и изомеров, к частично новым промежуточным продуктам общих формул (II"), (III"), (IV"), (V"), (VI"), (VII"), (VIII") и (XIII") и к их получению.
Аденозин является хорошо известным компонентом некоторых эндогенных молекул (АТР, NAD+, нуклеиновых кислот). Он играет важную регулирующую роль во многих физиологических процессах. Влияние аденозина на сердечную деятельность было описано уже в 1929 (Drury and Szentgyorgyi, Physiol. 68:213, 1929). Идентификация возрастающего числа физиологических функций, опосредованных аденозином, и открытие новых подтипов рецепторов аденозина открывает необязательности для терапевтического применения специфических лигандов (Poulse, S.A. and Quinn, R. J. Bioorganic and Medicinal Chemistry 6:619, 1998).
На сегодняшний день рецепторы аденозина классифицированы на три основных класса: А1, А2 и А3. Подтип А1 частично отвечает за ингибирование аденозинциклазы путем присоединения к белку G1 мембраны и частично влияет на другие вторичные сигнальные системы. Подтип рецептора А2 может быть подразделен на два дополнительные подтипа А2а и A2b, которые стимулируют активность аденилатциклазы. Последовательность рецепторов аденозина А3 сначала была идентифицирована из библиотеки кДНК яичка крысы. Позднее было установлено, что она соответствует новому функциональному рецептору аденозина. Активирование рецепторов А3 также связано с некоторыми вторичными сигнальными системами: ингибирование аденилатциклазы, стимулирование фосфолипазы С и D.
Рецепторы аденозина обнаружены в различных органах и (они) регулируют их функции. Оба рецептора А1 и А2а играют важную роль в центральной нервной системе и сердечно-сосудистой системе. В ЦНС аденозин ингибирует высвобождение синаптических медиаторов, действие которых опосредовано рецепторами А1. В сердце рецепторы А1 также опосредуют негативные инотропные, хронотропные и дромотропные эффекты аденозина. Рецепторы аденозина А2а, которые локализованы в относительно большом количестве в полосатом теле, проявляют функциональное взаимодействие с допаминовыми рецепторами при регулировании синаптической передачи. Рецепторы аденозина А2а эндотелиальных и гладких мускульных клеток ответственны за индуцированное аденозином расширение сосудов.
По данным идентификации РНК рецепторы аденозина А2b широко распространены в различных тканях. Они идентифицированы почти во всех типах клеток, но их экспрессия наиболее высока в кишечнике и мочевом пузыре. Указанный подтип, вероятно, также выполняет важную регулирующую функцию в регуляции сосудистого тонуса и играет роль в деятельности тучных клеток.
В противоположность рецепторам А1 и А2а, где распределение в тканях определяли по уровню белка, присутствие рецепторов А2b и А3 определяли на основе их уровня в мРНК. Уровни экспрессии рецепторов аденозина А3 довольно низкие по сравнению с другими подтипами и весьма зависимы от вида ткани. Рецепторы аденозина А3 выражены в первую очередь в центральной нервной системе, в яичке и в иммунной системе и, по-видимому, участвуют в модуляции высвобождения медиатора из тучных клеток при непосредственной аллергической реакции.
Для применения в терапии достаточно обеспечить, чтобы молекула не связывалась или связывалась только в случае очень высокой концентрации с подтипами А1, А2а и А2b рецепторов аденозина.
Наше данное изобретение относится к соединениям общей формулы (I), а также к их солям, сольватам и изомерам, которые обладают высокой селективностью к подтипу А3 рецепторов аденозина.
Антагонисты А3, до сих пор опубликованные в литературе, относятся к группам флавоноидов, производных 1,4-дигидропиридина, триазолохиназолинов, тиазолонафтиридинов и тиазолопиримидинов. Наиболее эффективные и селективные к подтипам аденозина антагонисты проявляют сильные липофильные свойства и поэтому они умеренно растворимы в воде. Указанное свойство затрудняет применимость соединений in vivo. В литературе все больше и больше исследований направлено на нахождение получения необязательно водорастворимых антагонистов рецепторов аденозина А3 (Ch. E. Mueller и др., J. Med. Chem. 45:3440, 2002; A. Maconi и др., J. Med. Chem 45:3579, 2002).
В патентной заявке WO 02/096879 в качестве структурно нового типа эффективных антагонистов А3 предложены производные 2-амино-3-цианохинолина. Соединения формулы (I), описанные в патентной заявке WO 02/096879, являются антагонистами А3 с высокой селективностью.
В общей формуле (I)
R1' представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R2' представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R3' представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, фенильную, тиенильную или фурильную группу, необязательно замещенные одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена; шести- или пятичленное гетероароматическое кольцо, содержащее один, два или три атома азота, или один атом азота и один атом кислорода, или один атом азота и один атом серы, необязательно замещенное одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
R9', R10', R11' и R12' независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу, линейную или разветвленную С1-4алкоксигруппу, гидроксигруппу или атом галогена, или R9' и R12' представляют собой атом водорода, и R10' и R11' вместе образуют метилендиоксигруппу;
R6' представляет собой атом водорода или цианогруппу, аминокарбонильную группу, С1-4алкоксикарбонильную группу или карбоксигруппу;
R7' представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, фенильную, бензильную, тиенильную или фурильную группу, необязательно замещенные метилендиоксигруппой или одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой, гидроксигруппой, трифторметильной группой, цианогруппой или атомом галогена; или шести- или пяти-членное гетероароматическое кольцо, содержащее один, два или три атома азота, или один атом азота и один атом кислорода, или один атом азота и один атом серы, необязательно замещенное одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
Х представляет собой группу -СН2, группу -NH, группу -NR8' или атом серы, атом кислорода, сульфогруппу или сульфоксигруппу, где R8' представляет собой линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
n' равно нулю, 1 или 2.
Указанные соединения также имеют характерный недостаток, так как они только умеренно растворимы, что мешает их переработке в лекарственные средства.
Целью авторов было получить лиганды А3, предпочтительно антагонисты, хинолиновой структуры, которые оказывают сильное антагонистическое действие и высокую селективность для рецепторов А3, то есть ингибируют рецепторы А3 в более низкой концентрации, чем они ингибируют рецепторы А1, А2а и А2b. Дополнительная цель состояла в том, чтобы обеспечить стабильность, биологическую доступность, терапевтический индекс, токсичность и растворимость, которые дают необязательность перерабатывать указанные новые соединения в лекарственные средства, и чтобы новые соединения обладали благоприятным всасыванием в кишечнике, для их перорального введения.
Было обнаружено, что соединения общей формулы (I),
в которой
R1 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R2 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R3 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, С3-6циклоалкильную группу, фенильную, тиенильную или фурильную группу, необязательно замещенные одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена; шести- или пяти-членное гетероароматическое кольцо, содержащее один, два или три атома азота, или один атом азота и один атом кислорода, или один атом азота и один атом серы, необязательно замещенное одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
R4 и R5 независимо друг от друга представляют собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или более линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой; или
R4 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу или бензильную группу, и
R5 представляет собой атом водорода, группу -SO2ОН или линейную или разветвленную С1-4ацильную группу, или
R4 и R5 вместе с атомом азота образуют группу общей формулы а.), где R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
R6 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, фенильную, бензильную, тиенильную или фурильную группу, необязательно замещенные метилендиоксигруппой или одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой, гидроксигруппой, трифторметильной группой, цианогруппой или атомом галогена; или шести- или пятичленное гетероароматическое кольцо, содержащее один, два или три атома азота, или один атом азота и один атом кислорода, или один атом азота и один атом серы, необязательно замещенное одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
Х представляет собой группу -СН2, группу -NH, группу -NR9 или атом серы, атом кислорода, сульфогруппу или сульфоксигруппу, где R9 представляет собой линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
Z представляет собой атом кислорода, атом серы, группу -CHR10 или группу -NR11, где R10 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу, и R11 представляете собой атом водорода, линейную или разветвленную С1-4алкильную группу, С3-6циклоалкильную группу, группу -SO2OH или линейную или разветвленную С1-4ацильную группу;
n равно нулю, 1 или 2;
m равно 1, 2 или 3;
о равно 1, 2 или 3;
р равно нулю или 1;
r равно нулю или 1,
и их соли, сольваты, изомеры (таутомеры, десмотропные формы, оптически активные изомеры), а также их соли и сольваты, удовлетворяют вышеуказанным критериям, показатели их растворимости намного лучше, чем у известных 2-амино-3-цианохинолинов, и помимо этого они высокоактивны.
Как показано исследованием методом жидкофазного ЯМР, в растворе соединений общей формулы (I) существует равновесная смесь таутомерных форм (IA) и (IB). В твердой фазе таутомеры (IA) и (IB) могут быть выделены отдельно как десмотропные формы (IA) и (IB).
Согласно вышеприведенным результатам данное изобретение относится также десмотропным изомерам (IA) и (IB). Значения заместителей в общих формулах (IA) и (IB) являются такими, как определено для общей формулы (I).
Соединения общей формулы (I) могут иметь хиральный центр в зависимости, например, от положения заместителей R1, R2 и R3. Таким образом, изобретение относится также к рацемическим и оптически активным формам соединений общей формулы (I) и их солей, таутомеров и десмотропных форм.
Подробными значениями указанных заместителей являются следующие.
Под линейной или разветвленной С1-4алкильной группой понимают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную или трет-бутильную группу, предпочтительно этильную или метильную группу.
Под линейной или разветвленной С1-4алкоксигруппой понимают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, предпочтительно этоксигруппу или метоксигруппу.
Под С3-6циклоалкильной группой понимают циклопропильную, циклобутильную, циклопентильную или циклогексильную группу.
Под линейной или разветвленной С1-4ацильной группой понимают формильную, ацетильную, пропионильную, 2-метилпропионильную или бутирильную группу.
Под гетероароматическим кольцом, содержащим один, два или три атома азота, понимают пиррольное, имидазольное, пиразольное, 1,2,3-триазольное, 1,2,4-триазольное, пиридиновое, пиримидиновое, пиридазиновое, пиразиновое или 1,2,4-триазиновое кольцо. Кольцо может быть замещено С1-4алкильной группой, С1-4алкоксигруппой или атомом галогена.
Под гетероароматическим кольцом, содержащим один атом азота и один атом кислорода или серы, понимают оксазольное, изоксазольное, тиазольное или изотиазольное кольцо. Кольцо может быть замещено С1-4алкильной группой, С1-4алкоксигруппой или атомом галогена.
Группа а.) предпочтительно представляет собой пирролидино, пиперидино, пиперазино, 4-метилпиперазино, 4-формилпиперазино, 4-сульфонилпиперазино или морфолиногруппу.
Под солями соединений общей формулы (I) мы понимает соли, образованные неорганическими или органическими кислотами и основаниями. Предпочтительные соли образуются с фармацевтически приемлемыми кислотами, такими как, например, хлористоводородная кислота, серная кислота, этансульфоновая кислота, винная кислота, яблочная кислота, лимонная кислота, фумаровая кислота, и с фармацевтически приемлемыми основаниями, как, например, гидроксид натрия, гидроксид калия и этаноламин. Соли, используемые для очистки или выделения, как, например, метансульфонаты или тетрафторбораты, также являются объектом изобретения.
Под сольватами понимают сольваты, образованные с различными растворителями, как, например, вода или этанол.
Предпочтительной группой соединений общей формулы (I) являются соединения, где
R1 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R2 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R3 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, С3-6циклоалкильную группу, фенильную, тиенильную или фурильную группу, необязательно замещенные одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
R4 и R5 независимо друг от друга представляют собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или более линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой; или
R4 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу или бензильную группу, и
R5 представляет собой атом водорода, группу -SO2ОН или линейную или разветвленную С1-4алкильную группу, или
R4 и R5 вместе с атомом азота образуют группу общей формулы а.), где R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
R6 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, фенильную, бензильную, тиенильную или фурильную группу, необязательно замещенные метилендиоксигруппой или одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой, гидроксигруппой, трифторметильной группой, цианогруппой или атомом галогена; или шести- или пятичленное гетероароматическое кольцо, содержащее один, два или три атома азота, или один атом азота и один атом кислорода, или один атом азота и один атом серы, необязательно замещенное одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
Х представляет собой группу -СН2, группу -NH, группу -NR9 или атом серы, атом кислорода, сульфогруппу или сульфоксигруппу, где R9 представляет собой линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
Z представляет собой атом кислорода, атом серы, группу -CHR10 или группу -NR11, где R10 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу, и R11 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу, С3-6циклоалкильную группу, группу -SO2OH или формильную группу;
n равно нулю, 1 или 2;
m равно 1, 2 или 3;
о равно 1, 2 или 3;
р равно нулю или 1;
r равно нулю или 1,
и их соли, сольваты, изомеры (таутомеры, десмотропные формы, оптически активные изомеры), а также их соли и сольваты.
Особенно предпочтительной группой соединений общей формулы (I) являются такие соединения, где
R1 представляет собой атом водорода или метильную группу;
R2 представляет собой атом водорода или метильную группу;
R3 представляет собой фенильную, тиенильную или фурильную группу;
R4 и R5 независимо друг от друга представляют собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой; или
R4 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу или бензильную группу, и
R5 представляет собой атом водорода, группу -SO2ОН или линейную или разветвленную С1-4ацильную группу, или
R4 и R5 вместе с атомом азота образуют группу общей формулы а.), где R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
R6 представляет собой 4-метоксифенильную, 3-метилфенильную, 3-метоксифенильную, 3,4-метилендиоксифенильную группу, 4-фторфенильную, 2-тиенильную или 2-фурильную группу;
Х представляет собой группу -NH или атом кислорода;
Z представляет собой атом кислорода, атом серы, группу -CH2, группу -NH или группу -NR11, где R11 представляет собой линейную или разветвленную С1-4алкильную группу, С3-6циклоалкильную группу, группу -SO2OH или формильную группу; и
n равно 1;
m равно 2;
о равно 2;
р равно нулю;
r равно нулю,
и их соли, сольваты, изомеры (таутомеры, десмотропные формы, оптически активные изомеры), а также их соли и сольваты.
Особенно благоприятны следующие соединения, которые удовлетворяют вышеуказанным критериям:
4-метокси-N-[6-(морфолин-4-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид;
4-метокси-N-[6-(4-метилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид;
4-метокси-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
3,4-метилендиокси-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
4-фтор-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
4-метокси-N-(6-пиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил)бензамид;
4-метокси-N-(6-амино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
N-[4-(бензиламино)-3-циано-6-(4-формилпиперазин-1-ил)хинолин-2-ил]-4-метоксибензамид;
4-{4-(бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}пиперазин-1-сульфоновая кислота;
N-{3-циано-6-(формиламино)-4-[(2-тиенилметил)амино]хинолин-2-ил}-4-метоксибензамид;
N{-3-циано-6-(формиламино)-4-[(2-тиенилметил)амино]хинолин-2-ил}-1,3-бензодиоксол-5-карбоксамид;
N-[4-(бензиламино)-3-циано-6-(формиламино)хинолин-2-ил]-1,3-бензодиоксол-5-карбоксамид;
N-[4-(бензиламино)-3-циано-6-(формиламино)хинолин-2-ил]-4-метоксибензамид;
N-{4-(бензиламино)-3-циано-6-[формил(метил)амино]хинолин-2-ил}-4-метоксибензамид;
N-{3-циано-6-[формил(метил)амино]-4-[(2-тиенилметил)амино]хинолин-2-ил}-4-метоксибензамид;
{3-циано-2-[(4-метоксибензоил)амино]-4-[(2-тиенилметил)амино]хинолин-6-ил}метилсульфаминовая кислота;
{4-(бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}метилсульфаминовая кислота;
{4-(бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}сульфаминовая кислота;
[2-[(1,3-бензодиоксол-5-илкарбонил)амино]4-(бензиламино)-3-цианохинолин-6-ил]сульфаминовая кислота;
{2-[(1,3-бензодиоксо-5-илкарбонил)амино]-3-циано-4-[(2-тиенилметил)амино]хинолин-6-ил}сульфаминовая кислота;
{3-циано-2-[(4-метоксибензоил)амино]4-[(2-тиенилметил)амино]хинолин-6-ил}сульфаминовая кислота
и их соли, сольваты, изомеры (таутомеры, десмотропные формы), а также их соли и сольваты.
Соединения общей формулы (I) согласно данному изобретению, а также их соли, сольваты и изомеры (таутомеры, десмотропные формы, оптически активные изомеры) и их соли, сольваты, проявляют подходящую растворимость и поэтому они подходят для использования в качестве активных веществ фармацевтических композиций.
Значения растворимости в воде и в водных буферных растворах (рН=6,5 и 7,5) для соединений формулы (I) патентной заявке WO 02/096879 составляют менее 1 мг/л, тогда как для соединений общей формулы (I) данного изобретения они равны 1-200 мг/л.
Данное изобретение относится также к фармацевтическим композициям, содержащим в качестве активных компонентов соединения общей формулы (I) или их изомеры (таутомеры, десмотропные формы, оптически активные изомеры), соли или сольваты, которые предпочтительно являются пероральными композициями, однако готовые препаративные формы для ингаляций, парентеральные и трансдермальные формы также являются объектом изобретения. Указанные выше фармацевтические композиции могут быть твердыми или жидкими, такими как таблетки, пеллеты, капсулы, пластинки, растворы, суспензии или эмульсии. Предпочтительны твердые композиции, прежде всего таблетки и капсулы.
Указанные выше фармацевтические композиции получают с применением обычных фармацевтических вспомогательных веществ и с использованием стандартных способов.
Соединения общей формулы (I) могут быть использованы для лечения патологий, при которых рецепторы А3 играют роль в развитии заболевания.
Соединения данного изобретения, обладая селективным действием на рецепторы А3, могут быть использованы в терапевтическом и/или профилактическом лечении дисфункций сердца, почек, респираторной системы, центральной нервной системы. Они ингибируют защитное действие аденозина при росте опухолевых клеток, предупреждают дегрануляцию тучных клеток, ингибируют продуцирование цитокина, снижают внутриглазное давление, ингибируют высвобождение TNFα, ингибируют миграцию эозинофилов, нейтрофилов и других иммунных клеток, ингибируют бронхостеноз и транссудацию плазмы.
На основании указанных эффектов антагонисты рецепторов аденозина А3 данного изобретения могут быть полезны в терапии как противовоспалительные, противоастматические, противоишемические средства, антидепрессанты, антиаритмические, почечно-защитные, противоопухолевые средства, средства против паркинсонизма и средства, повышающие познавательную способность. Они также могут быть полезны при лечении или предупреждении реперфузионных повреждений миокарда, хронического обструктивного легочного заболевания (COPD) и респираторного дистресс-синдрома у взрослых (ARDS), включая хронические бронхиты, эмфизему легких или одышку, аллергических реакций (например, ринита, реакций, индуцированных ядовитым плющом, крапивницы, склеродермии, артрита), других аутоиммунных заболеваний, воспалительных заболеваний кишечника, болезни Аддисона, болезни Крона, псориаза, ревматизма, гипертензии, функциональных неврологических расстройств, глаукомы и диабета (K.N. Klotz, Naunyn-Schmiedberg's Arch. Pharmacol. 362:382, 2000; P.G. Baraldi es P.A. Borea, TiPS 21:456, 2000).
Соединения данного изобретения предпочтительно могут быть использованы для изготовления фармацевтической композиции для лечения заболеваний, таких как астма, COPD и ARDS, глаукома, опухолевые, аллергические и воспалительные заболевания, ишемия, гипоксия, аритмия и почечные заболевания.
Кроме того, данное изобретение относится к применению соединений общей формулы (I) при лечении указанных выше патологий. Предлагаемая суточная доза составляет 0,1-1000 мг активного ингредиента в зависимости от природы и тяжести заболевания и от пола, массы и т.д. пациента.
Дополнительным объектом изобретения является получение соединений общей формулы (I).
Заместители в формулах промежуточных продуктов и реагентов общих формул (I"), (II"), (III"), (IV"), (V"), (VI"), (VII"), (VIII"), (IX"), (X"), (XI"), (XII"), (XIII") и (XIV") имеют следующие значения.
R1" представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R2" представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу;
R3" представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, С3-6циклоалкильную группу, фенильную, тиенильную или фурильную группу, необязательно замещенные одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена; шести- или пятичленное гетероароматическое кольцо, содержащее один, два или три атома азота, или пятичленное гетероароматическое кольцо, содержащее один атом азота и один атом кислорода, или один атом азота и один атом серы, необязательно замещенное одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
R4" и R5" независимо друг от друга представляют собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой, или защитную группу; или
R4" представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу или бензильную группу, и
R5" представляет собой атом водорода, группу -SO2OH или линейную или разветвленную С1-4ацильную группу или защитную группу, или
R4" и R5" вместе с атомом азота образуют нитрогруппу или группу общей формулы а.), в которой R7" и R8" независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
R6" представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу, фенильную, бензильную, тиенильную или фурильную группу, необязательно замещенные метилендиоксигруппой или одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой, гидроксигруппой, трифторметильной группой, цианогруппой или атомом галогена; или шести- или пятичленное гетероароматическое кольцо, содержащее один, два или три атома азота, или один атом азота и один атом кислорода, или один атом азота и один атом серы, необязательно замещенное одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
Х" представляет собой группу -СН2, группу -NH, группу -NR9" или атом серы, атом кислорода, сульфогруппу или сульфоксигруппу, где R9" представляет собой линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
Z" представляет собой атом кислорода, атом серы, группу -CHR10" или группу -NR11", где R10" представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу и R11" представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу, С3-6циклоалкильную группу, группу -SO2OH, линейную или разветвленную С1-4алкильную группу или защитную группу;
R12" представляет собой линейную или разветвленную С1-3алкильную группу;
Y" представляет собой уходящую группу;
n" равно 0, 1 или 2;
m" равно 1, 2 или 3;
о" равно 1, 2 или 3;
р" равно нулю или 1;
r" равно нулю или 1.
Дополнительным объектом изобретения является получение соединений общей формулы (I) и частично новых промежуточных продуктов общих формул (I"), (II"), (III"), (IV"), (V"), (VI"), (VII"), (VIII") и (XIII").
В способе согласно изобретению
v.) бис-карбоксамид общей формулы (II") селективно гидролизуют и при желании удаляют защитную группу, или
v/i.) для получения соединения общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу, и R5 представляет собой линейную или разветвленную С1-4ацильную группу, или R4 и R5 вместе с атомом азота образуют группу общей формулы а.), где Z представляет собой группу -NR11, в которой R11 представляет собой линейную или разветвленную С1-4ацильную группу, и R1, R2, R3, R6, R7, R8, R9, X, n, m, o, p и r имеют значения, определенные выше,
соединение общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой атом водорода или R4 и R5 вместе с атомом азота образуют группу общей формулы а.), где Z представляет собой группу -NH, и R1, R2, R3, R6, R7, R8, R9, X, n, m, o, p и r имеют значения, определенные выше,
ацилируют соединением общей формулы R12"COY", где R12" и Y" имеют значения, определенные выше, или
v/ii.) для получения соединения общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой группу -SO2OH, или R4 и R5 вместе с атомом азота образуют группу общей формулы а.), где Z представляет собой группу -NR11, R11 представляет собой группу -SO2OH, и R1, R2, R3, R6, R7, R8, R9, X, n, m, o, p и r имеют значения, определенные выше,
соединение общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой атом водорода или R4 и R5 вместе с атомом азота образуют группу общей формулы а.), где Z представляет собой группу -NH, и R1, R2, R3, R6, R7, R8, R9, X, n, m, o, p и r имеют значения, определенные выше,
подвергают взаимодействию с комплексом пиридин-SO3 или с ClCO3H, или
v/iii.) для получения соединения общей формулы (I), в котором R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой группу -SO2OH, и R1, R2, R3, R6, R7, R8, R9, X, Z, n, m, o, p и r имеют значения, определенные выше,
соединение общей формулы (XIII"), в которой R1, R2, R3, R6, R9, X, и n имеют значения, определенные выше,
подвергают взаимодействию с Na2S2O4 или NaHSO3,
или
восстанавливают и полученное в результате соединение общей формулы (XIV"), в котором R4" представляет собой атом водорода, и R1", R2", R3", R6", R9", X" и n" имеют значения, определенные выше, сульфатируют комплексом пиридин-SO3 или ClSO3H,
при желании затем R4", представляющий собой атом водорода, преобразуют в линейную или разветвленную С1-4алкильную группу или бензильную группу, или
v/iv.) для получения соединения общей формулы (I), в которой R4 представляет собой атом водорода, С3-6циклоалкильную группу, бензильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или более линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой, и R5 представляет собой атом водорода, или
R4 и R5 вместе с атомом азота образуют группу общей формулы а.), в которой R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу, и Z представляет собой группу -NR11, в которой R11 представляет собой атом водорода,
удаляют защитную группу соединения общей формулы (I"), в которой
R4" представляет собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4-линейную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой, и R5" представляет собой защитную группу, или
R4" и R5" вместе с атомом азота образуют группу общей формулы а".), в которой R7" и R8" независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу, и Z представляет собой группу -NR11", где R11"представляет собой защитную группу,
И, при желании, заместители полученного соединения общей формулы (I) преобразуют друг в друга известными способами и/или полученное соединение общей формулы (I) преобразуют в его соль или сольват, или высвобождают из его соли или сольвата, и, при желании, расщепляют на его оптически активные изомеры, и, при желании, данную десмотропную (форму) преобразуют в другую десмотропную форму.
В качестве агентов селективного гидролиза могут быть использованы гидроксиды щелочных металлов, предпочтительно гидроксид калия и/или гидроксид натрия, растворенные в спирте, предпочтительно в метаноле, но также могут быть использованы и другие агенты, известные в органической химии, способствующие гидролизу амидов.
Селективный гидролиз может быть проведен в широком диапазоне температур, предпочтительно в интервале от 20°С до 100°С.
Реакция v/i.) может быть осуществлена с использованием сложноэфирного производного соответствующей кислоты при повышенной температуре или с использованием активированного производного кислоты (например, галогеноангидрида кислоты) при комнатной температуре или повышенной температуре с использованием подходящего основания (например, триэтиламина).
Реакция v/ii.) может быть осуществлена с использованием комплекса пиридин-SO3 в подходящем растворителе (предпочтительно в пиридине) или с использованием ClSO3H в подходящем растворителе (предпочтительно в пиридине или хлороформе), используя сильное органическое основание (подобное DBU) или неорганическое основание (подобное K2CO3) при комнатной температуре или при повышенной температуре.
Реакция v/iii.) может быть проведена в соответствующем водном щелочном растворе нитросоединения с использованием избытка Na2S2O4 или NaHSO3 в качестве реагента при комнатной температуре или при повышенной температуре (100°С).
Согласно варианту реакции v/iii.) нитропроизводное восстанавливают любым известным способом и полученное аминопроизводное сначала алкилируют или бензилируют в известных условиях восстановительного алкилирования или бензилирования и полученные алкиламино- или бензиламино-производные могут быть сульфатированы, как описано в ii.).
Защитной группой может быть любая известная защитная группа. Примеры защитных групп, а также способы защиты и удаления различных защитных функциональных групп, приведены в "Protective Groups in Organic Synthesis", Green и др., 2-е издание *John Wiley & Sons, Inc, New York., 1991. Предпочтительными защитными группами являются Boc, этоксикарбонил, бензилоксикарбонил и т.д., наиболее предпочтительна бензильная группа.
Заместители соединений общей формулы (I) могут быть трансформированы любым из известных способов (Comprehensive Organic Transformation, R.C. Larock, VCH Publisher, New York, 1989).
Соли могут быть получены добавлением одного эквивалента кислоты к спиртовому, предпочтительно этанольному, раствору основания и разбавлением раствора диэтиловым эфиром и, наконец, отфильтровыванием и сушкой полученных кристаллов.
Соединения общей формулы (II'), в которой R1", R2", R3", R4", R5", R6", R7", R8", X", Z", n", o", p", r" и m" имеют значения, определенные выше, могут быть получены различными известными способами, среди них способом, показанным на схеме реакции 1, путем ацилирования соединений формулы (III") по способу ацилирования, известному в органической химии. В качестве ацилирующего агента предпочтительно может быть использован хлорангидрид кислоты, в качестве агента, связывающего кислоту, триэтиламин и/или пиридин, но также могут быть использованы другие соединения, известные как связующие для кислот.
Соединения общей формулы (III"), в которой R1", R2", R3", R4", R5", R6", R7", R8", X", Z", n", o", p", r" и m" имеют значения, определенные выше, могут быть получены непосредственно из соединений формулы (IV") по известным способам, как таковым, (Nan Zhang, Bioorg. And Med. Chem. Lett., 10, 2825, 2000).
Соединения общей формулы (IV"), в которой R4", R5", R6", R7", R8", X", Z", r", o", p" и m" имеют значения, определенные выше, могут быть получены известными способами, как таковыми, непосредственно из соединений формулы (V") (D.L. Leysen, J. Heterocyclic Chem., 24, 1611, 1987).
Соединения общей формулы (V"), в которой R4", R5", R7", R8", Z", r", o", p" и m" имеют значения, определенные выше, могут быть получены известными способами, как таковыми, непосредственно из соединений формулы (VI") (Pfizer (Inc) USP 4, 175, 193).
Соединения общей формулы (VI"), в которой R4", R5", R7", R8", Z", r", o", p" и m" имеют значения, определенные выше, могут быть получены известными способами, как таковыми, непосредственно из соединений формулы (VII") (D.L. Leusen, J. Heterocyclic Chem., 24, 1611, 1987).
Соединения общей формулы (VII″), в которой R4″, R5″, R7″, R8″, Z″, r″, о″, р″ и m″ имеют значения, определенные выше, могут быть получены известными способами, как таковыми, непосредственно из соединений формулы (VIII″) (D.H.Klaubert and J.H.Sellstedt, J. Med. Chem., 24, 742, 1981) или являются коммерчески доступными продуктами, такими как соединение, где R4″и R5″ вместе с атомом азота образуют нитрогруппу.
Соединения общей формулы (VIII″), в которой R4″, R5″, R7″, R8″, Z″, r″, о″, р″ и m″ имеют значения, определенные выше, могут быть получены известными способами, как таковыми, непосредственно из соединений формулы (IX″) (J.H.Hutchinson and J.J.Cook, J. Med. Chem. 39, 4583, 1996).
Соединения общих формул (I), (I′), (II″), (III″), (IV″), (V″), (VI″), (VII″), (VIII″), (XIII″) и (XIV″) согласно изобретению, а также их получение и биологическая активность продемонстрированы примерами ниже, без ограничения формулы изобретения примерами.
Пример 1
4-Метокси-N-[6-(морфолин-4-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, а.) является морфолиногруппой, R6 является 4-метоксигруппой, Х является -NH- и n является 1.
а.) 2-Нитро-5-(морфолин-4-ил)бензойная кислота.
Смесь 5 г 2-нитро-5-хлорбензойной кислоты и 15 мл морфолина перемешивают при 120°С в течение 6 часов. К реакционной смеси добавляют 150 мл этилацетата. Осажденное желтое кристаллическое вещество отфильтровывают и растворяют в 15 мл воды. Доводят рН смеси до 6 уксусной кислотой. Осажденное вещество отфильтровывают, промывают водой и сушат, получая 4,2 г указанного в заголовке соединения. Т.пл.: 172°С.
1H-ЯМР (ДМСО-d6) 7,85 м.д. (м, 1Н), 7,0-6,9 (м, 2Н), 3,67 (м, 4Н), 2,85 (м, 4Н).
b.) 2-Амино-5-(морфолин-4-ил)бензойная кислота.
Смесь 6 г 2-нитро-5-(морфолин-4-ил)бензойной кислоты, 15 мл циклогексена и 3 г Pd/C (10%-ного) нагревают при кипячении с обратным холодильником в 120 мл этанола в течение 6 часов. Горячую реакционную смесь фильтруют через целитный фильтр. Фильтрат упаривают, получая 4,8 г указанного в заголовке соединения. Т.пл.: 242°С.
1H-ЯМР (ДМСО-d6) 7,25 м.д. (м, 1Н), 6,96 (м, 1Н), 6,62 (м, 1Н), 3,69 (м, 4Н), 2,85 (м, 4Н).
с.) 5-(Морфолин-4-ил)изатоевый ангидрид.
К смеси 8,9 г 2-амино-5-(морфолин-4-ил)бензойной кислоты в 60 мл диоксана при перемешивании и внешнем охлаждении холодной водой добавляют по каплям 10 мл дифосгена. Смесь нагревают при кипячении с обратным холодильником в течение 4 часов. Из охлажденной реакционной смеси твердое вещество отфильтровывают и промывают 50 мл простого эфира. Продукт перемешивают в течение 5 минут в смеси 50 мл метанола и 5 мл триэтиламина, отфильтровывают и промывают 30 мл метанола. После сушки получают 7 г указанного в заголовке продукта, т.пл.: 235°С.
1H-ЯМР (ДМСО-d6) 7,8 м.д. (м, 1Н), 6,78 (м, 1Н), 6,66 (м, 1Н), 3,73 (м, 4Н), 2,92 (м, 4Н).
d.) 2-Амино-3-циано-4-гидрокси-6-(морфолин-4-ил)хинолин.
4 г Малононитрила растворяют в 50 мл диметилформамида. К раствору несколькими порциями добавляют 2,4 г 60%-ной масляной дисперсии гидрида натрия. К прозрачному раствору добавляют 8 г 5-(морфолин-4-ил)изатоевого ангидрида и смесь перемешивают при комнатной температуре в течение 10 часов. Реакционную смесь разбавляют 70 мл воды и экстрагируют 2×30 мл этилацетата. Водную фазу упаривают в вакууме, твердый остаток растворяют в 20 мл воды, и уксусной кислотой доводят рН до 6. Осажденное вещество отфильтровывают и промывают водой. После сушки получают 6,5 г указанного в заголовке соединения, т.пл.: 291°С.
1H-ЯМР (ДМСО-d6) 7,27 м.д. (м, 1Н), 7,14 (м, 1Н), 7,03 (м, 1Н), 3,74 (м, 4Н), 3,12 (м, 4Н).
е.) 2-Амино-3-циано-4-хлор-6-(морфолин-4-ил)хинолин.
Смесь 1,7 г 2-амино-3-циано-4-гидрокси-6-(морфолин-4-ил)хинолина и 3,4 мл фофорилхлорида перемешивают при 120°С в течение 4 часов. Охлажденную реакционную смесь выливают на 30 г льда, доводят рН смеси до 8 10%-ным раствором гидроксида натрия и осажденное вещество отфильтровывают. После сушки получают 1,5 г указанного в заголовке соединения, т.пл.: 206°С.
1H -ЯМР (ДМСО-d6) 7,69 м.д. (м, 1Н), 7,49 (м, 1Н), 7,08 (м, 1Н), 6,83 (с, 2Н), 3,74 (м, 4Н), 3,08 (м, 4Н).
f.) 2-Амино-3-циано-4-бензиламино-6-(морфолин-4-ил)хинолин.
3 г 2-Амино-3-циано-4-хлор-6-(морфолин-4-ил)хинолина и 6 мл бензиламина перемешивают при 125°С в течение 3 часов. Реакционную смесь выливают в 30 мл воды. Осажденное вещество отфильтровывают и промывают 20 мл воды. После сушки получают 2,3 г указанного в заголовке соединения, т.пл.: 202°С.
1H-ЯМР (ДМСО-d6) 8,14 м.д. (м, 1Н), 7,5-7,2 (м, 8Н), 5,85 (с, 2Н), 5,04 (д, 2Н), 3,65 (м, 4Н), 3,1 (м, 4Н).
g.) 4-Метокси-N-(4-метоксибензоил)-N-(6-(морфолин-4-ил)-4-бензиламино-3-цианохинолин-2-ил)бензамид.
К раствору 0,4 г 2-амино-3-циано-4-бензиламино-6-(морфолин-4-ил) хинолина в 2 мл пиридина при перемешивании и охлаждении добавляют 0,4 мл 4-метоксибензоилхлорида. Реакционную смесь перемешивают при 80°С в течение 8 часов и затем выливают в 5 мл воды со льдом. Осажденное вещество отфильтровывают и дважды промывают 3 мл воды. После сушки получают 0,53 г указанного в заголовке соединения, т.пл.: 157°С.
1H -ЯМР (ДМСО-d6) 8,92 м.д. (т, 1Н), 8,32 (м, 4Н), 7,61 (м, 3Н), 7,38 (м, 5Н), 7,12 (м, 4Н), 5,1 (д, 2Н), 3,82 (м, 8Н).
h.) 4-Метокси-N-[(б-морфолин-4-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид.
К раствору 2,3 г 4-метокси-N-(4-метоксибензоил)-N-(6-морфолин-4-ил)-4-бензиламино-3-цианохинолин-2-ил)бензиламида в 20 мл ацетонитрила добавляют 5 мл 1 н. метанольного раствора гидроксида калия. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 10 минут, добавляют 1,5 мл ледяной уксусной кислоты и затем нейтрализуют 15 мл 1 М раствора гидрокарбоната натрия. Осадок отфильтровывают и желтое кристаллическое вещество перекристаллизовывают из смеси 5 мл диметилформамида и 40 мл этанола. После сушки получают 1,3 г указанного в заголовке соединения, т.пл.: 260°С.
1H-ЯМР (ДМСО-d6) 10,5 м.д. (с, 1Н), 8,92 (т, 1Н), 8,4 (м, 2Н), 7,66 (м, ЗН), 7,35 (м, 5Н), 7,05 (, 2Н), 5,1 (д, 2Н), 3,82 (м, 8Н).
Пример 2
4-Метокси-N-[6-(4-метилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, а.) является 4-метилпиперазин-!-ильной группой, R6 является метоксифенильной группой, Х является -NH- и n равен 1.
а.) 2-Нитро-5-(4-метилпиперазин-1-ил)бензойная кислота.
Смесь 10 г 2-нитро-5-хлорбензойной кислоты и 30 мл N-метилпиперазина перемешивают при 120°С в течение 6 часов. К реакционной смеси добавляют 150 мл этилацетата. Осажденное желтое кристаллическое вещество отфильтровывают и растворяют в 15 мл воды. Уксусной кислотой рН смеси доводят до 6. Осажденное вещество отфильтровывают, промывают водой и сушат, получая 11,2 г указанного в заголовке соединения. Т.пл.: 212°С.
1H -ЯМР (ДМСО-d6) 7,89 м.д. (д, 1Н), 7,03-6,93 (м, 2Н), 3,7-3,45 (м, 8Н), 2,25 (с, 3Н).
b.) 2-Амино-5-(4-метилпиперазин-1-ил)бензойная кислота.
Смесь 9 г 2-нитро-5-(4-метилпиперазино)бензойной кислоты, 20 мл циклогексена и 3,5 г Pd/C (10%-ного) нагревают при кипячении с обратным холодильником в 120 мл этанола в течение 6 часов. Горячую реакционную смесь фильтруют через целитный фильтр. Фильтрат упаривают, получая 3,5 г указанного в заголовке соединения. Т.пл.: 212°С.
1H -ЯМР (ДМСО-d6) 7,19 м.д. (д, 1Н), 7,06 (м, 1Н), 6,69 (д, 1Н), 2,9 (м, 4Н), 2,43 (м, 4Н), 2,22 (с, 3Н).
с.) 5-(4-Метилпиперазин-1-ил)изатоевый ангидрид.
К смеси 5,3 г 2-амино-5-(4-метилпиперазино)бензойной кислоты в 30 мл диоксана при перемешивании и внешнем охлаждении холодной водой добавляют по каплям 6 мл дифосгена. Смесь нагревают при кипячении с обратным холодильником в течение 4 часов. Из холодной реакционной смеси отфильтровывают твердое вещество и промывают его 50 мл простого эфира. Продукт перемешивают в течение 5 минут в смеси 50 мл метанола и 5 мл триэтиламина, отфильтровывают и промывают 30 мл метанола. После сушки получают 5,4 г указанного в заголовке соединения, т.пл.: 285°С.
1H -ЯМР (ДМСО-d6) 7,81 м.д. (м, 1Н), 6,73 (м, 1Н), 6,62 (м, 1Н), 3,73-2,92 (м, 8Н), 2,23 (с, 3Н).
d.) 2-Амино-3-циано-4-гидрокси-6-(4-метилпиперазин-1-ил)хинолин.
2 г Малононитрила растворяют в 30 мл диметилформамида. К раствору несколькими порциями добавляют 1,3 г 60%-ной масляной дисперсии гидрида натрия. К прозрачному раствору добавляют 6,5 г ангидрида 5-(4-метилпиперазино)изатоевой кислоты и смесь перемешивают при комнатной температуре в течение 10 часов. Реакционную смесь разбавляют 70 мл воды и экстрагируют 2×30 мл этилацетата. Водную фазу упаривают в вакууме, твердый остаток растворяют в 20 мл воды и уксусной кислотой доводят рН до 6. Осажденное вещество отфильтровывают и промывают водой. После сушки получают 5,2 г указанного в заголовке соединения, т.пл.: 156°С.
1H -ЯМР (ДМСО-d6) 7,23 м.д. (м, 1Н), 7,12 (м, 1Н), 7,03 (м, 1Н), 3,65-2,83 (м, 8Н), 2,1 (с, 3Н).
е.) 2-Амино-3-циано-4-хлор-6-(4-метилпиперазин-1-ил)хинолин.
Смесь 2 г 2-амино-3-циано-4-гидрокси-6-(4-метилпиперазино)хинолина и 4 мл фофорилхлорида перемешивают при 120°С в течение 4 часов. Охлажденную реакционную смесь выливают на 40 г льда, рН смеси доводят до 8 10%-ным раствором гидроксида натрия и осажденное вещество отфильтровывают. После сушки получают 1,5 г указанного в заголовке соединения, т.пл.: 189°С.
1H -ЯМР (ДМСО-d6) 7,69 м.д. (м, 1Н), 7,49 (м, 1Н), 7,08 (м, 1Н), 6,83 (с, 2Н), 3,25-2,57 (м, 8Н), 2,29 (с, 3Н).
f.) 2-Амино-3-циано-4-бензиламино-6-(4-метилпиперазин-1-ил)хинолин.
3 г 2-Амино-3-циано-4-хлор-6-(4-метилпиперазино)хинолина и 6 мл бензиламина перемешивают при 125°С в течение 3 часов. Реакционную смесь выливают в 30 мл воды. Осажденное вещество отфильтровывают и промывают 20 мл воды. После сушки получают 2,3 г указанного в заголовке соединения, т.пл.: 176°С.
1H -ЯМР (ДМСО-d6) 8,5 м.д. (т, 1Н), 7,5-7,15 (м, 8Н), 5,85 (с, 2Н), 5,04 (д, 2Н), 3,65-3,12 (м, 8Н), 2,23 (с, 3Н).
g.) 4-Метокси-N-(4-метоксибензоил)-N-[6-(4-метилпиперазин-1-ил) -4-бензиламино-3-цианохинолин-2-ил]бензамид.
К раствору 0,6 г 2-амино-3-циано-4-бензиламино-6-(4-метилпиперазино)хинолина в 2 мл пиридина при перемешивании и охлаждении добавляют 0,6 мл 4-метоксибензоилхлорида. Реакционную смесь перемешивают при 80°С в течение 8 часов и затем выливают в 5 мл воды со льдом. Осажденное вещество отфильтровывают и дважды промывают 3 мл воды. После сушки получают 0,63 г указанного в заголовке соединения, т.пл.: 176°С.
1H -ЯМР (ДМСО-d6) 8,39 м.д. (м, 1Н), 7,95 (м, 2Н), 7,47 (м, 5Н), 7,32 (м, 5Н), 7,14 (м, 4Н), 5,1 (м, 2Н), 3,82 (с, 3Н), 3,52-2,98 (м, 8Н), 2,25 (с, 3Н).
h.) 4-Метокси-N-[6-(4-метилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид.
К раствору 2,3 г 4-метокси-N-(4-метоксибензоил)-N-(6-(4-метилпиперазино)-4-бензиламино-3-цианохинолин-2-ил)бензамида в 15 мл ацетонитрила добавляют 4 мл 1н. метанольного раствора гидроксида калия. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 10 минут, добавляют 1 мл ледяной уксусной кислоты и затем нейтрализуют 12 мл 1М раствора гидрокарбоната натрия. Осадок отфильтровывают, желтое кристаллическое вещество перекристаллизовывают из смеси 15 мл метанола и 35 мл воды. После сушки получают 1,1 г указанного в заголовке соединения, т.пл. 173°С.
1H -ЯМР (ДМСО-d6) 10,53 м.д. (м, 1Н), 8,39 (м, 1Н), 7,95 (м, 2Н), 7,57 (м, 3Н), 7,34 (м, 5Н), 7,04 (м, 2Н), 5,1 (м, 2Н), 3,82 (с, 3Н), 3,52-2,98 (м, 8Н), 2,25 (с, 3Н).
Пример 3
4-Метокси-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, R4 и R5 являются метильными группами, R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
а.) 2-Нитро-5-диметиламинобензойная кислота.
Смесь 5 г 2-нитро-5-хлорбензойной кислоты и 15 мл 60%-ного водного раствора диметиламина перемешивают при 100°С в течение 6 часов. Реакционную смесь упаривают и остаток растворяют в 15 мл воды. Доводят рН смеси до 6 уксусной кислотой. Осажденное желтое кристаллическое вещество отфильтровывают, промывают водой и сушат, получая 3,4 г указанного в заголовке соединения. Т.пл.: 189°С.
1H -ЯМР (ДМСО-d6) 7,78 м.д. (д, 1Н), 6,59 (м, 1Н), 6,48 (м, 1Н), 3,0 (с, 6Н).
b.) 2-Амино-5-диметиламинобензойная кислота.
Смесь 2,1 г 2-нитро-5-диметиламинобензойной кислоты, 7 мл циклогексена и 1,5 г Pd/C (10%-ного) нагревают при кипячении с обратным холодильником в 60 мл этанола в течение 6 часов. Горячую реакционную смесь фильтруют через целитный фильтр. Фильтрат упаривают, получая 1,1 г указанного в заголовке соединения. Т.пл.: 232°С.
1H-ЯМР (ДМСО-d6) 7,01 м.д. (м, 1Н), 6,84 (м, 1Н), 6,78 (м, 1Н), 2,88 (с, 6Н).
с.) 5-Диметиламиноизатоевый ангидрид.
К смеси 8,9 г 2-амино-5-диметиламинобензойной кислоты в 60 мл диоксана при перемешивании и внешнем охлаждении холодной водой добавляют по каплям 10 мл дифосгена. Смесь нагревают при кипячении с обратным холодильником в течение 4 часов. Из холодной реакционной смеси твердое вещество отфильтровывают и промывают 50 мл простого эфира. Продукт перемешивают в течение 5 минут в смеси 50 мл метанола и 5 мл триэтиламина, отфильтровывают и промывают 30 мл метанола. После сушки получают 7 г указанного в заголовке продукта. Т.пл.: 258°С.
1H -ЯМР (ДМСО-d6) 7,56 м.д. (м, 1Н), 7,42 (м, 1Н), 7,13 (м, 1Н), 2,97 (с, 6Н).
d.) 2-Амино-3-циано-4-гидрокси-6-диметиламинохинолин.
К раствору 4 г малононитрила в 50 мл диметилформамида несколькими порциями добавляют 2,4 г 60%-ной масляной дисперсии гидрида натрия. К прозрачному раствору добавляют 8 г ангидрида 5-диметиламиноизатоевой кислоты и смесь перемешивают при комнатной температуре в течение 10 часов. Смесь разбавляют 70 мл воды и экстрагируют 2×30 мл этилацетата. Водную фазу упаривают в вакууме, твердый остаток растворяют в 20 мл воды и доводят рН до 6 уксусной кислотой. Осажденное вещество отфильтровывают и промывают водой. После сушки получают 6,5 г указанного в заголовке соединения, т.пл.: 360°С.
1H-ЯМР (ДМСО-d6) 7,43 м.д. (м, 1Н), 7,23 (м, 1Н), 7,11 (м, 1Н), 2,95 (с, 6Н).
е.) 2-Амино-3-циано-4-хлор-6-диметиламинохинолин.
Смесь 1,7 г 2-амино-3-циано-4-гидрокси-6-диметиламинохинолина и 3,4 мл фофорилхлорида перемешивают при 120°С в течение 4 часов. Охлажденную реакционную смесь выливают на 30 г льда, рН смеси доводят до 8 10%-ным раствором гидроксида натрия и осажденное вещество отфильтровывают.После сушки получают 1,5 г указанного в заголовке соединения, т.пл.: 285°С.
1H -ЯМР (ДМСО-d6) 7,43 м.д. (мм, 1Н), 7,21 (м, 1Н), 7,05 (м, 1Н), 6,75 (с, 2Н), 2,99 (с, 6Н).
f.) 2-Амино-3-циано-4-бензиламино-6-диметиламинохинолин.
3 г 2-Амино-3-циано-4-хлор-6-диметиламинохинолина и 6 мл бензиламина перемешивают при 125°С в течение 3 часов. Реакционную смесь выливают в 30 мл воды. Осажденное вещество отфильтровывают и промывают 20 мл воды. После сушки получают 2,3 г указанного в заголовке соединения, т.пл.: 265°С.
1H -ЯМР (ДМСО-d6) 8,55-8,45 м.д. (м, 2Н), 7,8 (м, 1Н), 7,5-7,23 (м, 7Н), 6,25 (с, 2Н), 5,08 (д, 2Н), 2,99 (с, 6Н).
g.) 4-Метокси-N-(4-метоксибензоил)-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид.
К раствору 0,4 г 2-амино-3-циано-4-бензиламино-6-диметиламинохинолина в 2 мл пиридина при перемешивании и охлаждении добавляют 0,4 мл 4-метоксибензоилхлорида. Реакционную смесь перемешивают при 80°С в течение 8 часов и затем выливают в 5 мл воды со льдом. Осажденное вещество отфильтровывают и дважды промывают 3 мл воды. После сушки получают 0,53 г указанного в заголовке соединения, т.пл.: 156°С.
1H-ЯМР (ДМСО-d6) 8,35 м.д. (м, 1Н), 7,9 (м, 2Н), 7,47 (м, 5Н), 7,3 (м, 5Н), 7,1 (м, 4Н), 5,12 (м, 2Н), 3,82 (с, 3Н), 3,0 (с, 6Н).
h.) 4-Метокси-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензиламид.
К раствору 2,3 г 4-метокси-N-(4-метоксибензоил)-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамида в 20 мл ацетонитрила добавляют 5 мл 1н. метанольного раствора гидроксида калия. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 10 минут, добавляют 1,5 мл ледяной уксусной кислоты и затем нейтрализуют 15 мл 1М раствора гидрокарбоната натрия. Осадок отфильтровывают, желтое кристаллическое вещество перекристаллизовывают из смеси 5 мл диметилформамида и 40 мл этанола. После сушки получают 1,3 г указанного в заголовке соединения, т.пл.: 185°С.
1H-ЯМР (ДМСО-d6) 10,5 м.д. (м, 1Н), 8,35 (м, 1Н), 7,91 (м, 2Н), 7,53 (м, 3Н), 7,3 (м, 5Н), 7,02 (м, 2Н), 5,1 (м, 2Н), 3,85 (с, 3Н), 3,0 (с, 6Н).
Пример 4
4-Метокси-N-(6-диметиламино-4-[2-фурилметиламино]-3-цианохинолин-2-ил)бензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является 2-фуриламиногруппой, R4 и R5 являются метильными группами, R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
а.) 2-Амино-3-циано-4-[2-фурилметиламино]-6-диметиламинохинолин.
3 г 2-Амино-3-циано-4-хлор-6-диметиламинохинолина и 6 мл фуриламина перемешивают при 125°С в течение 3 часов. Реакционную смесь выливают в 30 мл воды. Осажденное вещество отфильтровывают и промывают 20 мл воды. После сушки получают 2,05 г указанного в заголовке соединения, т.пл.: 235°С.
1H -ЯМР (ДМСО-d6) 8,7 м.д. (м, 1Н), 7,6 (м, 1Н), 7,35-7,23 (м, 3Н), 6,8 (с, 2Н), 6,4 (м, 2Н), 5,06 (д, 2Н), 2,96 (с, 6Н).
b.) 4-Метокси-N-(4-метоксибензоил)-N-(6-диметиламино-4-[2-фурилметиламино]-3-цианохинолин-2-ил)бензамид.
К раствору 0,4 г 2-амино-3-циано-4-[2-фурилметиламино]-6-диметиламинохинолина в 2 мл пиридина при перемешивании и охлаждении добавляют 0,4 мл 4-метоксибензоилхлорида. Реакционную смесь перемешивают при 80°С в течение 8 часов и затем выливают в 5 мл воды со льдом. Осажденное вещество отфильтровывают и дважды промывают 3 мл воды. После сушки получают 0,5 г указанного в заголовке соединения, т.пл.: 143°С.
1H -ЯМР (ДМСО-d6) 8,35 м.д. (м, 1Н), 7,9-7,1 (м, 14Н), 5,12 (м, 2Н), 3,82 (с, 6Н), 3,0 (с, 6Н).
с.) 4-Метокси-N-(6-диметиламино-4-[2-фурилметиламино]-3-цианохинолин-2-ил)бензиламид.
К раствору 2,3 г 4-метокси-N-(4-метоксибензоил)-N-(6-диметиламино-4-[2-фурилметиламино]-3-цианохинолин-2-ил)бензамида в 20 мл ацетонитрила добавляют 5 мл 1н. метанольного раствора гидроксида калия. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 10 минут, добавляют 1,5 мл ледяной уксусной кислоты и затем нейтрализуют 15 мл 1М раствора гидрокарбоната натрия. Осадок отфильтровывают, желтое кристаллическое вещество перекристаллизовывают из смеси 5 мл диметилформамида и 40 мл этанола. После сушки получают 1,1 г указанного в заголовке соединения, т.пл.: 195°С.
1H -ЯМР (ДМСО-d6) 10,5 м.д. (м, 1Н), 8,25 (т, 1Н), 7,98 (м, 2Н), 7,63-7,03 (м, 7Н), 6,42 (д, 1Н), 5,04 (д, 2Н), 3,85 (с, 3Н), 3,05 (с, 6Н).
Пример 5
4-Метокси-N-(6-диметиламино-4-[2-тиенилметиламино]-3-цианохинолин-2-ил)бензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является 2-тиенилгруппой, R4 и R5 являются метильными группами, R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
а.) 2-Амино-3-циано-4-[2-тиенилметиламино]-6-диметиламинохинолин.
3 г 2-Амино-3-циано-4-хлор-6-диметиламинохинолина и 6 мл 2-тиенилметиламина перемешивают при 125°С в течение 3 часов. Реакционную смесь выливают в 30 мл воды. Осажденное вещество отфильтровывают и промывают 20 мл воды. После сушки получают 1,9 г указанного в заголовке соединения, т.пл.: 211°С.
1H -ЯМР (ДМСО-d6) 8,2 м.д. (м, 1Н), 7,46-6,95 (м, 6Н), 6,08 (с, 2Н), 5,18 (д, 2Н), 2,94 (с, 6Н).
b.) 4-Метокси-N-(4-метоксибензоил)-N-(6-диметиламино-4-[2-тиенилметиламино]-3-цианохинолин-2-ил)бензамид.
К раствору 0,4 г 2-амино-3-циано-4-[2-тиенилметиламино]-6-диметиламинохинолина в 2 мл пиридина при перемешивании и охлаждении добавляют 0,4 мл 4-метоксибензоилхлорида. Реакционную смесь перемешивают при 80°С в течение 8 часов и затем выливают в 5 мл воды со льдом. Осажденное вещество отфильтровывают и дважды промывают 3 мл воды. После сушки получают 0,43 г указанного в заголовке соединения, т.пл.: 171°С.
1H -ЯМР (ДМСО-d6) 8,35 м.д. (м, 1Н), 7,9-7,05 (м, 14Н), 5,12 (м, 2Н), 3,82 (с, 6Н), 3,0 (с, 6Н).
с.) 4-Метокси-N-(6-диметиламино-4-[2-тиенилметиламино]-3-цианохинолин-2-ил)бензиламид.
К раствору 2,3 г 4-метокси-Ы-(4-метоксибензоил)-N-(6-диметиламино-4-[2-тиенилметиламино]-3-цианохинолин-2-ил)бензамида в 20 мл ацетонитрила добавляют 5 мл 1н. метанольного раствора гидроксида калия. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 10 минут, добавляют 1,5 мл ледяной уксусной кислоты и затем нейтрализуют 15 мл 1М раствора гидрокарбоната натрия. Осадок отфильтровывают, желтое кристаллическое вещество перекристаллизовывают из смеси 5 мл диметилформамида и 40 мл этанола. После сушки получают 1,15 г указанного в заголовке соединения, т.пл.: 163°С.
1H-ЯМР (ДМСО-d6) 10,5 м.д. (м, 1Н), 8,3 (т, 1Н), 7,98 (м, 2Н), 7,63-6,96 (м, 8Н), 5,2 (д, 2Н), 3,85 (с, 3Н), 3,05 (с, 6Н).
Пример 6
4-Метокси-N-[6-(пиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, группа а.) является пиперазиногруппой, R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
а.) 2-Нитро-5-(4-бензилпиперазин-1-ил)бензойная кислота.
Смесь 20 г 2-нитро-5-хлорбензойной кислоты и 50 мл N-бензилпиперазина перемешивают при 120°С в течение 6 часов. К реакционной смеси добавляют 250 мл этилацетата. Осажденное желтое кристаллическое вещество отфильтровывают и растворяют в 200 мл воды. Доводят рН смеси до 6 уксусной кислотой. Осажденное вещество отфильтровывают и промывают водой, получая 30 г указанного в заголовке соединения. Т.пл.: 172°С.
1H -ЯМР (ДМСО-d6) 7,8-6,7 м.д. (м, 8Н), 3,5 (с, 2Н), 3,5-2,8 (м, 8Н).
b.) 2-Амино-5-(4-бензилпиперазин-1-ил)бензойная кислота.
Смесь 6 г 2-нитро-5-(4-бензилпиперазин-1-ил)бензойной кислоты, 15 мл циклогексена и 3 г Pd/C (10%-ного) нагревают при кипячении с обратным холодильником в 120 мл этанола в течение 6 часов. Горячую реакционную смесь фильтруют через целитный фильтр. Фильтрат упаривают в вакууме, получая 4,8 г указанного в заголовке соединения. Т.пл.: 242°С.
1H -ЯМР (ДМСО-d6) 7,5-6,8 м.д. (м, 8Н), 3,68 (с, 3Н), 3,5-2,95 (м, 8Н).
с.) 5-(4-Бензилпиперазин-1-ил)изатоевый ангидрид.
К смеси 15 г 2-амино-5-(4-бензилпиперазин-1-ил)бензойной кислоты в 90 мл диоксана при перемешивании и внешнем охлаждении холодной водой добавляют по каплям 12,7 мл дифосгена. Смесь нагревают при кипячении с обратным холодильником в течение 4 часов. Из холодной реакционной смеси твердое вещество отфильтровывают и промывают 120 мл простого эфира. Продукт перемешивают в течение 5 минут в смеси 100 мл метанола и 10 мл триэтиламина, отфильтровывают и промывают 50 мл метанола. После сушки получают 17 г указанного в заголовке соединения, т.пл.: 235°С.
1H -ЯМР (ДМСО-d6) 7,68-7,1 м.д. (м, 8Н), 3,6 (с, 2Н), 3,5-2,5 (м, 8Н).
d.) 2-Амино-3-циано-4-гидрокси-6-(4-бензилпиперазин-1-ил)хинолин.
6,1 г Малононитрила растворяют в 100 мл диметилформамида. К раствору несколькими порциями добавляют 3,6 г 60%-ной масляной дисперсии гидрида натрия. К прозрачному раствору добавляют 18 г ангидрида 5-(4-бензилпиперазин-1-ил)изатоевой кислоты и смесь перемешивают при комнатной температуре в течение 10 часов. Реакционную смесь разбавляют 100 мл воды и экстрагируют 2×50 мл этилацетата. Водную фазу упаривают в вакууме, твердый остаток растворяют в 50 мл воды, рН доводят до 6 уксусной кислотой и кипятят с обратным холодильником в течение 5 часов. После охлаждения осажденное вещество отфильтровывают и промывают водой. После сушки получают 14,3 г указанного в заголовке соединения, т.пл.: 291°С.
1H -ЯМР (ДМСО-d6) 7,7-6,5 м.д. (м, 10Н), 4,2 (с, 2Н), 3,5-2,5 (м, 8Н).
е.) 2-Амино-3-циано-4-хлор-6-(4-бензилпиперазин-1-ил)хинолин.
Смесь 14 г 2-амино-3-циано-4-гидрокси-6-(4-бензилпиперазин-1-ил)хинолина и 28 мл фофорилхлорида перемешивают при 120°С в течение 6 часов. Охлажденную реакционную смесь выливают на 500 г льда, рН смеси доводят до 8 10%-ным раствором гидроксида натрия и осажденное вещество отфильтровывают. После сушки получают 14,5 г указанного в заголовке соединения, т.пл.: 206°С.
1H-ЯМР (ДМСО-d6) 7,7-7,14 м.д. (м, 8Н), 6,9 (с, 2Н), 3,7 (с, 2Н), 3,5-2,5 (м, 8Н).
f.) 2-Амино-3-циано-4-бензиламино-6-(4-бензилпиперазин-1-ил)хинолин.
14 г 2-Амино-3-циано-4-хлор-6-(4-бензилпиперазин-1-ил)хинолина и 28 мл бензиламина перемешивают при 125°С в течение 4 часов. Реакционную смесь выливают в 100 мл воды. Осажденное вещество отфильтровывают и промывают 2×50 мл воды. После сушки получают 8 г указанного в заголовке соединения, т.пл.: 202°С.
1H-ЯМР (ДМСО-d6) 8,1 м.д. (м, 1Н), 7,5-7,2 (м, 13Н), 5,8 (с, 2Н), 5,0 (д, 2Н), 3,54 (с, 2Н), 5,5-2,5 (м, 8Н).
g.) 4-Метокси-N-(4-метоксибензоил)-N-(6-(4-бензилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил)бензамид.
К раствору 0,9 г 2-амино-3-циано-4-бензиламино-6-(4-бензилпиперазин-1-ил)хинолина в 5 мл этилацетата, содержащего 0,3 мл триэтиламина, при перемешивании и охлаждении добавляют 0,5 мл 4-метоксибензоилхлорида. Реакционную смесь перемешивают при 80°С в течение 8 часов и затем выливают в 10 мл воды со льдом. Осажденное вещество отфильтровывают и дважды промывают 3 мл воды. После сушки получают 0,53 г указанного в заголовке соединения, т.пл.: 157°С.
1H -ЯМР (ДМСО-d6) 8,92 м.д. (т, 1Н), 8,32 (м, 4Н), 7,61 (м, 3Н), 7,38 (м, 5Н), 7,12 (м, 4Н), 5,1 (д, 2Н), 3,82 (с, 6Н), 3,56 (с, 2Н), 3,25-2,5 (м, 8Н).
h.) 4-Метокси-N-[(6-(4-бензилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензиламид.
К раствору 2,0 г 4-метокси-N-(4-метоксибензоил)-N-(6-(4-бензилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил)бензамида в 20 мл ацетонитрила добавляют 4 мл 1н. метанольного раствора гидроксида калия. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 10 минут, добавляют 1,5 мл ледяной уксусной кислоты и затем нейтрализуют 15 мл 1М раствора гидрокарбоната натрия. Осадок отфильтровывают, желтое кристаллическое вещество перекристаллизовывают из смеси 5 мл диметилформамида и 40 мл этанола. После сушки получают 1,3 г указанного в заголовке соединения, т.пл.: 260°С.
1H -ЯМР (ДМСО-d6) 10,5 м.д. (с, 1Н), 8,92 (т, 1Н), 7,97-7,01 (м, 17Н), 5,1 (д, 2Н), 3,82 (с, 3Н), 3,56 (с, 2Н), 3,5-2,5 (м, 8Н).
i.) 4-Метокси-N-[(6-(пиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид.
1 г 4-Метокси-N-[(6-(4-бензилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамида растворяют в диметилформамиде и воде, содержащей 0,5 мл уксусной кислоты, и гидрируют в присутствии 50 мг Pd/C (10%-ного) в течение 4 часов при 45°С. После отфильтровывания катализатора и упаривания растворителя неочищенный продукт очищают хроматографией, получая 0,65 г указанного в заголовке соединения, т.пл.: 145°С.
1H -ЯМР (ДМСО-d6) 10,5 м.д. (с, 1Н), 8,48 (м, 1Н), 7,94 (м, 2Н), 7,6-7,35 (м, 2Н), 7,33 (с, 5Н), 7,24 (м, 1Н), 7,02 (м, 2Н), 5,08 (д, 2Н), 3,83 (с, 3Н), 3,22 (м, 4Н), 2,86 (м, 4Н).
Пример 7
N-[6-Амино-4-(бензиламино)-3-цианохинолин-2-ил]-4-метоксибензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, NR4R5 представляет собой NH2, R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
а.) 5-Нитроизатоевый ангидрид.
К смеси 37 г 2-амино-5-нитробензойной кислоты в 500 мл диоксана при перемешивании добавляют по каплям 24,5 мл дифосгена. Смесь нагревают при кипячении с обратным холодильником в течение 6 часов и затем упаривают досуха. Остаток суспендируют в 100 мл простого эфира и отфильтровывают, получая 41,4 г указанного в заголовке соединения в виде HCl-соли, т.пл.: 256-259°С. ЖХ-МС: MH+ 209; время удерживания: 5,00 мин.
1H -ЯМР (ДМСО-d6) 8,54 (д, 1Н), 8,46 (дд, 1Н), 7,37 (д, 1Н) м.д.
b.) 2-Амино-3-циано-4-гидрокси-6-нитрохинолин.
К раствору 47,25 г 5-нитроизатоевого ангидрида в 230 мл ДМФА добавляют 15 г малононитрила и 63,3 мл триэтиламина и реакционную смесь перемешивают при 60°С в течение 2 часов. Растворитель упаривают при пониженном давлении, остаток смешивают с 570 мл ацетонитрила и 114 мл конц. HCl и раствор перемешивают при комнатной температуре в течение ночи. Осадок затем отфильтровывают, промывают водой и этанолом и получают 49,7 г продукта, т.пл.: >360°С. ЖХ-МС: МН+ 231; время удерживания: 4,78 мин.
1H -ЯМР (ДМСО-d6) 8,64 (д, 1Н), 8,36 (дд, 1Н), 7,6 (с, 2Н), 7,55 (д, 1Н) м.д.
с.) 2-Амино-3-циано-4-хлор-6-нитрохинолин.
Перемешиваемую смесь 48,5 г 2-амино-3-циано-4-гидрокси-6-нитрохинолина и 550 мл фофорилхлорида кипятят с обратным холодильником в течение 4 часов. Реакционную смесь концентрируют до половины ее объема и остаток выливают на 1500 г льда. Желтый осадок отфильтровывают, промывают водой и получают 60,5 г твердого вещества. 25 г указанного твердого вещества перемешивают при комнатной температуре в 500 мл 0,5н. HCl в течение 6 часов, затем осадок отфильтровывают и промывают водой, получая 18,5 г продукта, т.пл.: >360°С. ЖХ-МС: МН+ 249; время удерживания: 5,94 мин.
1H -ЯМР (ДМСО-d6) 8,73 (д, 1Н), 8,48 (дд, 1Н), 7,92 (д, 1Н) м.д.
d.) 2-амино-3-циано-4-бензиламино-6-нитрохинолин.
Смесь 7 г 2-амино-3-циано-4-хлор-6-нитрохинолина и 30 мл бензиламина перемешивают при 55°С в течение 1,5 часов. Реакционную смесь выливают в 30 мл воды. Осажденное вещество отфильтровывают и промывают водой, получая 7 г указанного в заголовке соединения, т.пл.: 280-283°С. ЖХ-МС: МН+ 2320; время удерживания: 5,19 мин.
1H-ЯМР (ДМСО-d6): 9,28 (д, 1Н), 8,90 (т, 1Н), 8,24 (дд, 1Н), 7,3 (м, 5Н), 6,98 (с, 2Н), 5,04 (д, 2Н) м.д.
е.) 4-Метокси-N-(4-метоксибензоил)-N-(4-бензиламино-3-циано-6-нитрохинолин-2-ил)бензамид.
Суспензию 3,5 г 2-амино-3-циано-4-бензиламино-6-нитрохинолина в 50 мл сухого пиридина кипятят с обратным холодильником с 5,6 г 4-метоксибензоилхлорида в течение 3,5 часов. Растворитель упаривают при пониженном давлении и остаток суспендируют в 30 мл насыщенного раствора Na2CO3 в воде. Суспензию экстрагируют 3×25 мл СН2Cl2. Объединенный органический экстракт упаривают досуха, остаток растворяют в диэтиловом эфире и раствор выдерживают в холодильнике в течение ночи. Осадок отфильтровывают, промывают простым диэтиловым эфиром и получают 6,25 г указанного в заголовке соединения, т.пл.: 145-148°С. ЖХ-МС: MH+ 588; время удерживания: 7,00 мин.
f.) N-[(4-бензиламино-3-циано-6-нитрохинолин-2-ил]-4-метоксибензиламид.
Суспензию 6,2 г N-(4-метоксибензоил)-N-(4-бензиламино-3-циано-6-нитрохинолин-2-ил)-4-метоксибензамида в 75 мл ацетонитрила кипятят с обратным холодильником с 25,2 мл 1н. метанольного раствора гидроксида калия в течение 6 мин. К горячему раствору добавляют по каплям 4,4 мл ледяной уксусной кислоты, охлаждают и нейтрализуют 56,3 мл 1М водного раствора NaHCO3. Осадок отфильтровывают и промывают водой, получая 4,1 г указанного в заголовке соединения, т.пл.: 264-266°С.
1H -ЯМР (ДМСО-d6) 10,9 (с, 1Н), 9,55 (д, 1Н), 9,28 (т, 1Н), 8,77 (д, 1Н), 8,48 (дд, 1Н), 8,00 (д, 2Н), 7,90 (д, 1Н), 7,4 (м, 4Н), 7,29 (м, 1Н), 7,05 (д, 2Н), 5,12 (д, 2Н), 3,84 (с, 3Н) м.д.
g.) N-[6-Амино-4-(бензиламино)-3-цианохинолин-2-ил]-4-метоксибензамид.
Смесь 320 мл этанола, 80 мл воды, 200 мл ТГФ, 7,6 г Fe-порошка и 1 мл конц. HCl кипятят с обратным холодильником в течение 10 мин. Затем добавляют 9 г N-[(4-бензиламино-3-циано-6-нитрохинолин-2-ил]-4-метоксибензамида, реакционную смесь интенсивно кипятят с обратным холодильником в течение 2 часов и охлаждают до 35°С. Осадок отфильтровывают и промывают смесью 1:1 CH2Cl2 и этанола. Объединенный органический раствор фильтруют через активированный уголь и упаривают досуха. Остаток суспендируют в смеси 50 мл воды и 10 мл этанола, твердое вещество отфильтровывают и промывают водой, получая 6,65 г указанного в заголовке соединения, т.пл.: 228-230°С. ЖХ-МС: МН+ 424; время удерживания: 5,33 мин.
1H -ЯМР (ДМСО-d6) 10,44 (с, 1Н), 8,0 (с+д, 3Н), 7,50 (д, 1Н), 7,3-7,1 (м, 7Н), 7,03 (д, 2Н), 5,55 (с, 2Н), 5,04 (д, 2Н), 3,38 (д, 3Н) м.д.
Пример 8
N-{6-Амино-4-[(2-тиенилметил)амино)]-3-цианохинолин-2-ил}-4-метоксибензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3-2-тиенильной группой, NR4R5 представляет собой NH2, R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
а) 2-Амино-3-циано-4-(2-тиенилметил)амино-6-нитрохинолин.
Используя методику, аналогично приведенной в примере 7d с тем изменением, что вместо бензиламина используют (2-тиенилметил)амин, получая 7,1 г указанного в заголовке соединения, т.пл.: 277-280°С. ЖХ-МС: МН+ 326; время удерживания: 5,25 мин.
b.) N-(4-Метоксибензоил)-N-[3-циано-6-нитро-4-(2-тиенилметил)аминохинолин-2-ил]-4-метоксибензамид.
Исходя из 2-амино-3-циано-4-(2-тиенилметил)амино-6-нитрохинолина (3,6 г) и используя методику, аналогично приведенной в примере 7е, получают 6,3 г указанного в заголовке соединения, т.пл.: 174-177°С. ЖХ-МС: МН+ 595; время удерживания: 7,16 мин.
с.) N-[3-Циано-6-нитро-4-(2-тиенилметил)аминохинолин-2-ил]-4-метоксибензамид.
Исходя из N-(4-метоксибензоил)-N-[3-циано-6-нитро-4-(2-тиенилметил)амино]хинолин-2-ил)-4-метоксибензамида (6,2 г) и используя методику, приведенную для примера 7f, получают 4,3 г указанного в заголовке соединения, т.пл.: 217-220°С. ЖХ-МС: МН+ 460; время удерживания: 6,57 мин.
1H -ЯМР (ДМСО-d6): 11,0 (с,1Н), 9,50 (с,1Н), 9,29 (с,1Н), 8,48 (дд, 1Н), 8,02 (д, 2Н), 7,90 (д, 1Н), 7,48 (дд, 1Н), 7,21 (д, 1Н), 7,0 (м, 3Н), 5,27 (с, 2Н), 3,85 (с, 3Н) м.д.
d.) N-{6-Амино-4-[(2-тиенилметил)амино]-3-цианохинолин-2-ил}-4-метоксибензамид.
Исходя из N-[4-(2-тиенилметил)амино-3-циано-6-нитрохинолин-2-ил]-4-метоксибензамида (10 г) и используя методику, приведенную для примера 7g, получают 9,3 г указанного в заголовке соединения, т.пл.: 200-203°С. ЖХ-МС: МН+ 430; время удерживания: 5,52 мин.
1H-ЯМР (ДМСО-d6) 10,48 (с, 1Н), 7,98 (с+д, 3Н), 7,50 (д, 1Н), 7,41 (дд, 1Н), 7,21 (с, 1Н), 7,16 (дд, 1Н), 7,11 (д, 1Н), 7,04 (д, 2Н), 6,98 (дд, 1Н), 5,45 (с, 2Н), 5,18 (д, 2Н), 3,84 (с, 3Н) м.д.
Пример 9
N-{4-(Бензиламино)-3-циано-6-(метиламино)хинолин-2-ил}-4-метоксибензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, R4 представляет собой Me, R5 представляет собой Н и R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
Суспензию 1 г N-{4-(бензиламино)-3-циано-6-аминохинолин-2-ил}-4-метоксибензамида и 0,65 г параформальдегида в смеси 48 мл этанола и 48 мл СН2Cl2 кипятят с обратным холодильником с 0,5 мл 54%-ного раствора HBF4 в простом диэтиловом эфире в течение 1,5 часа. После добавления 0,3 г NaBH4 кипячение с обратным холодильником продолжают еще в течение 1,5 часа с последующим добавлением дополнительного количества 0,3 г NaBH4 и кипячения с обратным холодильником в течение 2 часов. После повторного добавления 0,25 мл 54%-ного раствора HBF4 в диэтиловом эфире и 0,3 г NaBH4 кипячение с обратным холодильником продолжают дополнительно 1,5 часа. Реакционную смесь фильтруют горячей и твердое вещество промывают смесью 1:1 СН2Cl2 и этанола. Объединенный органический раствор концентрируют и остаток хроматографируют на силикагеле со смесью 50:1 CHCl3 и этилацетата, получая неочищенный продукт. Его перекристаллизовывают из смеси 2:1 этанола и ДМФА, получая 0,6 г указанного в заголовке соединения, т.пл.: 237-240°С. ЖХ-МС: МН+ 438; время удерживания: 5,76 мин.
1H-ЯМР (ДМСО-d6) 10,43 (с, 1Н), 8,18 (т, 1Н), 7,94 (д, 2Н), 7,50 (д, 1Н), 7,3-7,0 (м, 9Н), 6,24 (м, 1Н), 5,08 (д, 2Н), 3,83 (с, 3Н), 2,83 (д, 3Н) м.д.
Пример 10
N-{3-Циано-6-(формиламино)-4-[(2-тиенилметил)амино]хинолин-2-ил]-4-метоксибензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является 2-тиенильной группой, R4 представляет собой атом водорода, R5 представляет собой СНО и R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
Суспензию 0,32 г N-{6-амино-4-[(2-тиенилметил)амино]-3-цианохинолин-2-ил}-4-метоксибензамида выдерживают в 60 мл метилформиата при 100°С в закрытом аппарате (внутренне давление: 10 бар) в течение 7 часов. После охлаждения растворитель упаривают и остаток перекристаллизовывают из смеси СН2Cl2/МеОН, получая 0,22 г указанного в заголовке соединения, т.пл.: 223-226°С. ЖХ-МС: МН+ 458; время удерживания: 5,71 мин.
Пример 11
{4-(Бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}сульфаминовая кислота
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, R4 представляет собой Н, R5 представляет собой SO2OH и R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
К раствору 5,2 г Na2S2CO4 (чистота: 85%) в 160 мл воды и 200 мл этанола добавляют 20 мл водного 1н. раствора NaOH. Раствор нагревают до кипения, затем добавляют 2,27 г N-[(4-бензиламино-3-циано-6-нитрохинолин-2-ил]-4-метоксибензамида и продолжают кипячение с обратным холодильником в течение 2 часов. Реакционную смесь оставляют стоять при комнатной температуре в течение ночи и затем концентрируют до половины ее объема. Остаток подщелачивают (рН=8) добавлением 1н. раствора NaOH и экстрагируют СН2Cl2. Водный раствор подкисляют до рН=5 добавлением конц. раствора HCl и осадок отфильтровывают. Твердое вещество хроматографируют на силикагеле, элюируя сначала смесью этилацетат/метанол/25%-ный аммиак=220/30/2, и затем 200/80/2, получая указанное в заголовке соединение в виде соли аммония, т.пл.: 220-222°С. ЖХ-МС: МН+ 504; время удерживания: 5,56 мин.
1H-ЯМР (ДМСО-d6) 10,48 (с, 1Н), 8,21 (с, 1Н), 8,09 (т, 1Н), 7,95 (д, 2Н), 7,70 (с, 1Н), 7,62 (д, 1Н), 7,56 (д, 1Н), 7,3 (м, 4Н), 7,25 (м, 1Н), 7,03 (д, 2Н), 5,05 (д, 2Н), 3,83 (с, 3Н) м.д.
Пример 12
{4-(Бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}метилсульфаминовая кислота
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, R4 представляет собой Me, R5 представляет собой SO2OH и R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
Раствор 110 мг N-{4-(бензиламино)-3-циано-6-(метиламино)хинолин-2-ил}-4-метоксибензамида в 10 мл пиридина перемешивают при комнатной температуре с 0,2 мл DBU и 150 мг комплекса пиридиний-SO3 в течение 2 часов. Реакционную смесь концентрируют досуха, остаток хроматографируют на силикагеле, используя в качестве элюента смесь этилацетат/метанол/25%-ный аммиак=200/80/2, и получают 10 мг указанного в заголовке соединения в виде соли аммония. ЖХ-МС: МН+ 518; время удерживания: 6,22 мин.
Пример 13
N-{4-(Бензиламино)-3-циано-6-[формил(метил)амино]хинолин-2-ил}-4-метоксибензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, R4 представляет собой Me, R5 представляет собой СНО и R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
Суспензию 110 мг N-{4-(бензиламино)-3-циано-6-(метиламине)хинолин-2-ил}-4-метоксибензамида в 10 мл этилформиата кипятят с обратным холодильником в течение 24 часов. После охлаждения выпавшие кристаллы отфильтровывают, промывают этилформиатом и спиртом, получая 30 мг указанного в заголовке соединения, т.пл.: 237-240°С. ЖХ-МС: МН+ 465; время удерживания: 6,11 мин.
Пример 14
4-Метокси-N-[6-(4-формилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, группа а.) является 4-формилпиперазиногруппой, R6 является 4-метоксифенильной группой, Х является -NH- и n равен 1.
Раствор 120 мг 4-метокси-N-[6-(пиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамида в 5 мл этилформиата кипятят с обратным холодильником в течение 2 часов. После охлаждения растворитель упаривают и остаток перекристаллизовывают из метанола, получая 65 мг указанного в заголовке соединения, т.пл.: 243°С.
1H-ЯМР (ДМСО-d6) 10,6 м.д. (с, 1Н), 8,48 (м, 1Н), 8,1 (с, 1Н), 7,94 (м, 2Н), 7,6-7,1 (м, 8Н), 7,05 (м, 2Н), 5,1 (д, 2Н), 3,83 (с, 3Н), 3,7-3,2 (м, 8Н).
Пример 15
4-[2-(Бензоиламино)-4-бензиламино)-3-цианохинолин-6-ил]пиперазин-1-сульфоновая кислота
В общей формуле (I) R1 и R2 являются атомами водорода, R3 является фенильной группой, а.) является 4-сульфонилпиперазиногруппой, R6 является 4-метоксифенильной группой, X является -NH- и n равен 1.
Раствор 50 мг 4-метокси-N-[6-(пиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамида в 0,5 мл пиридина и комплекс пиридиний-SO3 кипятят с обратным холодильником в течение 2 часов и обрабатывают в соответствии с методикой, опубликованной в литературе (G.F.Smith and D.A.Taylor, Tetrahedron, 29, 669, 1973).
ЖХ-МС: МН+ 572; время удерживания: 5,9 мин.
Структура и физические характеристики дополнительных соединений общей формулы (I), в которой R1 и R2 являются атомами водорода, Х представляет собой группу -NH и n равно 1, приведены в таблице I
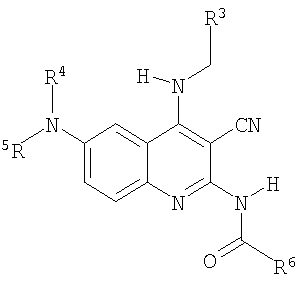



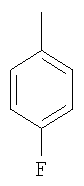
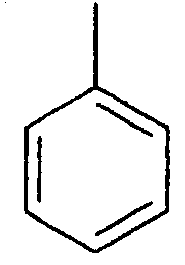
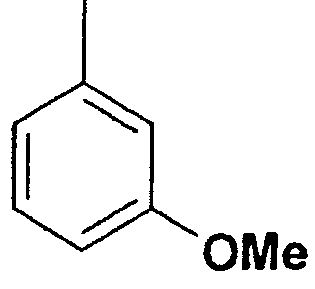

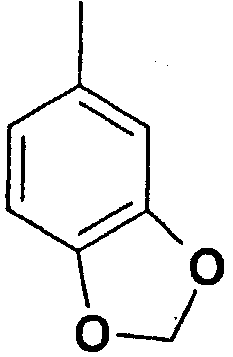

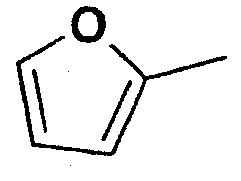
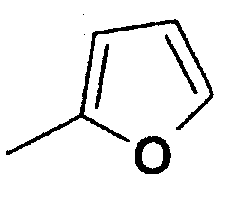





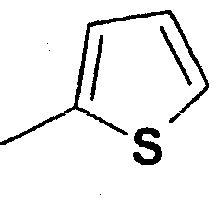














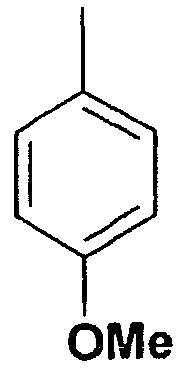

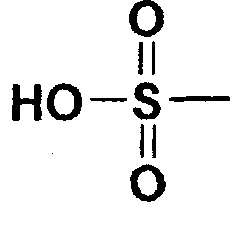


















Пример 40
Известными способами получают таблетки следующего состава:
Биология
Методы
Связывание рецепторов аденозина А3 человека
Приготовление суспензии мембраны: клетки яичника китайского хомячка, экспрессирующие клонированные рецепторы А3 человека (далее: СНО-hA3), соответственно культивируют и выдерживают. После достижения сформировавшегося клеточного слоя среду отделяют от клеток промывкой их 37°С PBS, затем клетки суспендируют в охлажденном льдом PBS, центрифугируют (1000×g 10 мин) (Sigma 3K30) и гомогенизируют, используя тефлоновый гомогенизатор (B. Braun Potter S) при скорости вращения 1500/мин в течение 15 с в следующем буферном растворе: 50мМ Tris, 10мМ MgCl2, 1 мМ EDTA, рН 8,0. Суспензию центрифугируют (43000 g, 10 мин). Клеточные остатки суспендируют в вышеуказанном буферном растворе, концентрация белка 0,1 мг/мл (метод Bradford). Аликвоты препарата мембраны сохраняют при -80°С.
Протокол связывания: инкубируют СНО-hA3, препарат мембраны (содержание белка 2 мкг) в инкубационном буферном растворе (50 мМ Tris, 10 мМ MgCl2, 1 мМ EDTA, 3 U/мл аденозиндезаминазы, рН 8,0) в присутствии 0,5 нМ [125I]AB-MECA (пара-амино-3-иодбензил-5'-N-метилкарбоксамидоаденозина) (100000 cpm) и 100 мкМ R-PIA (N6-[L-2-фенилизопропил]аденозина для определения неспецифического связывания испытуемого соединения в общем объеме 50 мкл за 1 ч при комнатной температуре. Фильтруют через стекловолоконный фильтр Whatman GF/B (предварительно вымоченный в 0,5% полиэтиленимине в течение 3 часов), промывают 4×1 мл охлажденного льдом 50 мМ Tris, 10 мМ MgCl2, 1 мМ EDTA (рН 8,0) на 96-луночном харвестере для клеток Brandel. Определение активности: в гамма-счетчике (1470 Wizard, Wallac.). Ингибирование [%]=100-((активность в присутствии испытуемого соединения-неспецифическая активность)/(общая активность-неспецифическая активность)×100
Связывание рецепторов аденозина А1 человека
Приготовление суспензии мембраны: клетки яичника китайского хомячка, экспрессирующие клонированные рецепторы А1 человека (далее: СНО-hA1), соответственно культивируют и выдерживают. После достижения сформировавшегося клеточного слоя среду удаляют от клеток промывкой их 37°С PBS, затем клетки суспендируют в охлажденном льдом PBS, центрифугируют (1000×g, 10 мин) (Sigma 3K30) и гомогенизируют, используя тефлоновый гомогенизатор (B. Braun Potter S) при скорости вращения 1500/мин в течение 15 с в следующем буферном растворе: 50мМ Tris, 10мМ HCl2, рН 7,4. Суспензию центрифугируют (43000 g, 10 мин). Клеточные остатки суспендируют в вышеуказанном буферном растворе, концентрация белка 5 мг/мл (метод Bradford). Аликвоты препарата мембраны сохраняют при -80°С.
Протокол связывания: инкубируют СНО-hA1, препарат мембраны (содержание белка 50 мкг) в инкубационном буферном растворе (50 мМ Tris, 3 U/мл аденозиндезаминазы, рН 7,4) (в присутствии) 10 нМ [3Н]ССРА (2-хлор-N6циклопентиладенозина) (80000 dpm) и 100 мкМ R-PIA (N6-[L-2-фенилизопропил]аденозина) для определения неспецифического связывания испытуемого соединения в общем объеме 100 мкл за 3 ч при комнатной температуре. Фильтруют через стекловолоконный фильтр Whatman GF/B (предварительно вымоченный в 0,5% полиэтиленимине в течение 3 часов), промывают 4×1 мл охлажденного льдом 50 мМ Tris (рН 7,4) на 96-луночном харвестере для клеток Brandel. Определение активности: в присутствии 200 мкл коктейля HiSafe-3 в бета-счетчике (1450 Microbeta, Wallac.). Ингибирование [%]=100-((активность в присутствии испытуемого соединения-неспецифическая активность)/(общая активность-неспецифическая активность)×100
Связывание рецепторов аденозина А2a человека
Протокол связывания: инкубируют 7 мкг мембран (рецепторы аденозина А2а человека, трансфицированные в клетки НЕК-293, источник: Receptor Biology, Inc.), в буферном растворе (50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ EDTA, 2 U/мл аденозиндезаминазы, рН 7,4) (в присутствии) 20 нМ [3H]CGS-21680 (2-[пара(2-карбонилэтил)фенилэтиламино]-5'-N-этилкарбоксамидоаденозина) (200000 dpm) и 50 мМ NECA (5'-N-этилкарбоксамидоаденозина) для определения неспецифического связывания испытуемого соединения в общем объеме 100 мкл за 90 мин при комнатной температуре. Фильтруют в вакууме через стекловолоконный фильтр Whatman GF/B (предварительно вымоченный в 0,5% полиэтиленимине в течение 3 часов), промывают 4×1 мл охлажденного льдом 50 мМ Tris, 10 мМ MgCl2, 1 мМ EDTA, 0,9% NaCl (рН 7,4) на 96-луночном харвестере для клеток Brandel. Определение активности: в бета-счетчике (1450 Microbeta, Wallac.) в присутствии 200 мкл коктейля HiSafe-3. Ингибирование [%]=100-((активность в присутствии испытуемого соединения-неспецифическая активность)/(общая активность-неспецифическая активность)×100
Связывание рецепторов аденозина А2b человека
Протокол связывания: инкубируют 20,8 мкг мембран (рецепторы аденозина А2b человека, трансфицированные в клетки НЕК-293, источник: Receptor Biology, Inc.) в буферном растворе (50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ EDTA, 1мМ бензамидин, 3 U/мл аденозиндезаминазы, рН 6,5) (в присутствии) 32,4 нМ [3Н]DPCPX (8циклопентил-1,3-дипропилксантина) (800000 dpm) и 100 мМ NECA (5'-N-этилкарбоксамидоаденозина) для определения неспецифического связывания испытуемого соединения в общем объеме 100 мкл за 30 мин при комнатной температуре. Фильтруют в вакууме 25 мм Hg через стекловолоконный фильтр Whatman GF/B (предварительно вымоченный в 0,5% полиэтиленимине в течение 3 часов), промывают 4×1 мл охлажденного льдом 50 мМ Tris-HCl (рН 6,5) на 96-луночном харвестере для клеток Brandel. Определение активности: в присутствии 200 мкл коктейля HiSafe-3 в бета-счетчике (1450 Microbeta, Wallac.). Ингибирование [%]=100-((активность в присутствии испытуемого соединения-неспецифическая активность)/(общая активность-неспецифическая активность)×100
Результаты
Соединения в соответствии с настоящим изобретением считаются биологически активными, если они ингибируют связывание радиолигандов рецепторов аденозина А3 человека с активностью выше 80% при (концентрации) 1 мМ в условиях экспериментов авторов.
Константу диссоциации (Кd) [125I]AB-MECA на мембране СНО-hA3 определяют изучением насыщенности изотопами с помощью анализа Scatchard (G. Scatchard, Ann. N.Y. Acad. Sci. 51:660, 1949). (Значение) IC50 преобразуют в константу сродства (Кi), используя уравнение Cheng-Prusoff (Y.J. Cheng and W.H. Prusoff, Biochem. Pharmacol. 22:3099, 1973).
Ряд соединений общей формулы (I) проявляют заметное биологическое действие. Наиболее активными соединениями общей формулы (I) являются соединения, определенные в пунктах 2-4 формулы изобретения. Особенно предпочтительны соединения, приведенные в примерах, значения Кi которых находятся в интервале от 0,5 нМ до 900 нМ, предпочтительно от 0,5 нМ до 700 нМ. Значения Кi наиболее предпочтительных соединений находятся в интервале от 0,5 нМ до 18 нМ, наиболее предпочтительно от 0,5 до 15 нМ.
Соединения обладают хорошей биологической доступностью и селективностью по меньшей мере величиной 3 порядка по отношению к подтипам рецепторов аденозина А1, А2а и A2b человека.
Дополнительно длительность их действия при внутривенном и пероральном введении велика, значения их ED50 малы и их показатели токсичности и побочного действия благоприятны.
Указанные выше данные благоприятны для терапевтического использования соединений общей формулы (I).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АМИНОХИНОЛИНА И АМИНОПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛИГАНДОВ АДЕНОЗИНА A | 2002 |
|
RU2278112C2 |
| ТРИАЗОЛО[1,5-a]ХИНОЛИНЫ В КАЧЕСТВЕ ЛИГАНДОВ РЕЦЕПТОРА АДЕНОЗИНА А3 | 2008 |
|
RU2489432C2 |
| СПОСОБ ИНГИБИРОВАНИЯ ПРОДУЦИРОВАНИЯ ОСТАТОЧНЫХ ЛИПОПРОТЕИНОВ | 2004 |
|
RU2330682C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛАМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ОБОГАЩЕННОЙ ЛЕЙЦИНОВЫМИ ПОВТОРАМИ КИНАЗЫ 2 (LRRK2) ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ БОЛЕЗНИ ПАРКИНСОНА | 2013 |
|
RU2637948C2 |
| РАЗВЕТВЛЕННЫЕ АЛКИЛАМИНОПРОИЗВОДНЫЕ ТИАЗОЛА ИЛИ ИХ ВОЗМОЖНЫЕ СТЕРЕОИЗОМЕРЫ ИЛИ ИХ СОЛИ ПРИСОЕДИНЕНИЯ С МИНЕРАЛЬНОЙ ИЛИ ОРГАНИЧЕСКОЙ КИСЛОТОЙ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АКТИВНОСТЬЮ В ОТНОШЕНИИ ФАКТОРА ВЫСВОБОЖДЕНИЯ КОРТИКОТРОПНОГО ГОРМОНА, И АЛКИЛАМИНО-ПРОИЗВОДНЫЕ ТИАЗОЛА В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 1993 |
|
RU2102389C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ-3 ГЛИКОГЕНСИНТАЗЫ | 2011 |
|
RU2623427C2 |
| НОВЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2001 |
|
RU2288225C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ АРИЛИМИДАЗОЛА, ИХ ПРЕПАРАТЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2003 |
|
RU2323216C2 |
| 3-ЦИАНОХИНОЛИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ EGF-R И HER2 КИНАЗ | 2002 |
|
RU2309150C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
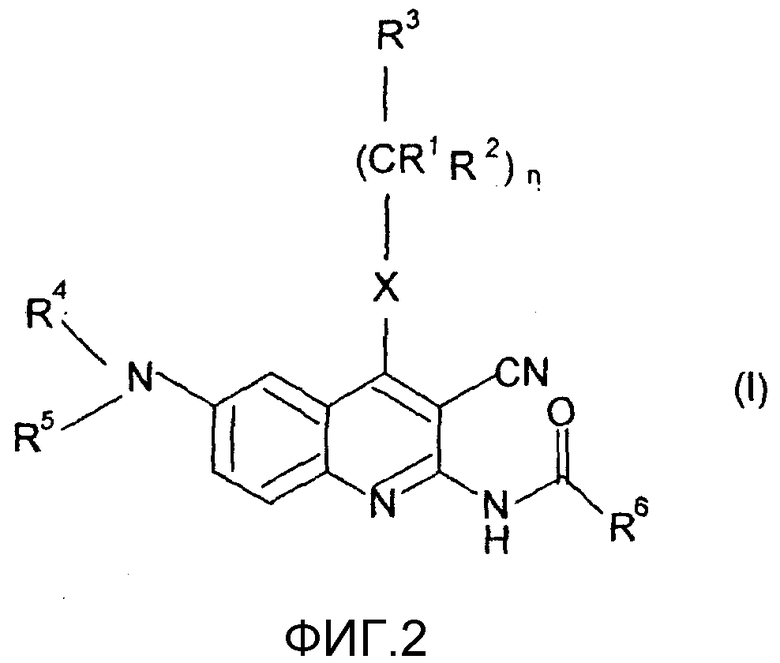
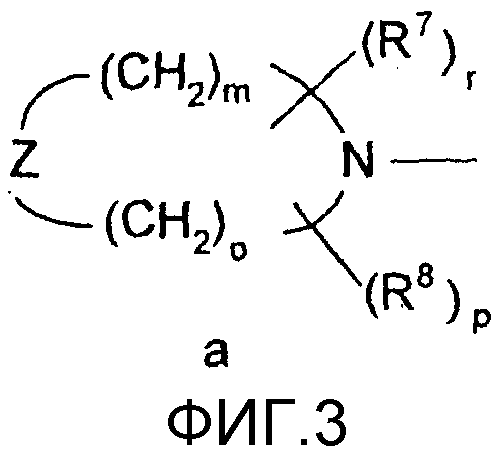
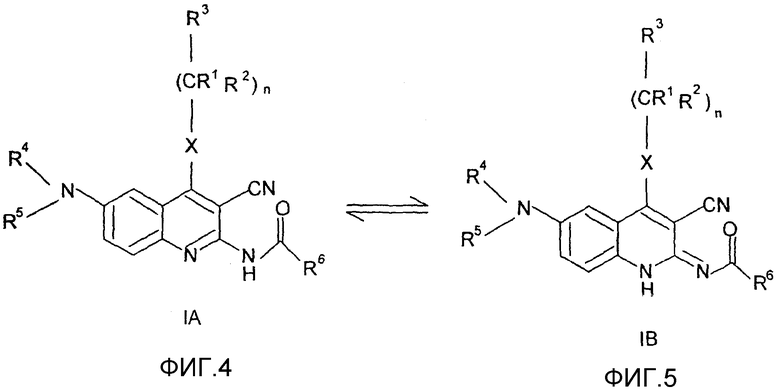
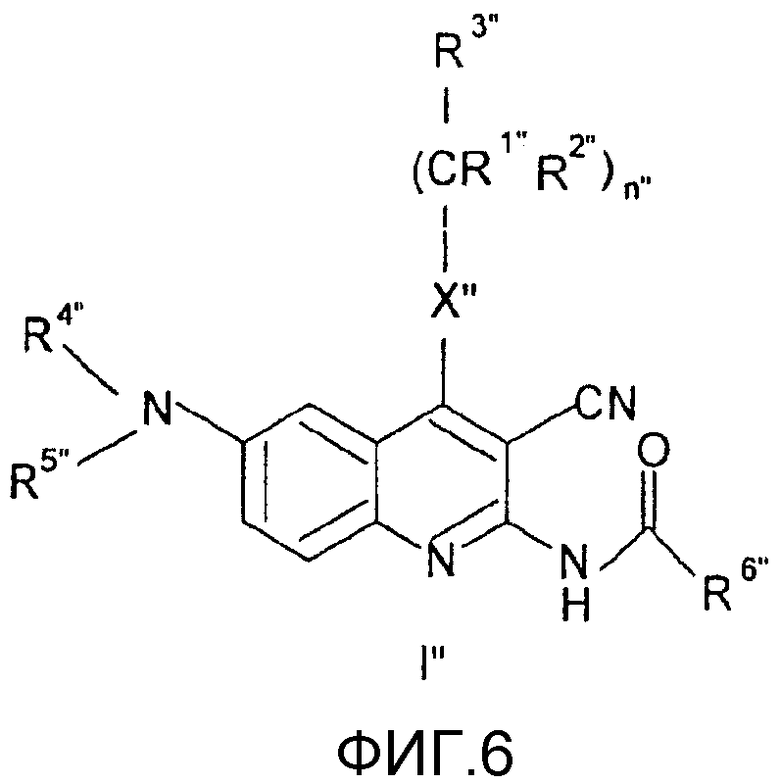
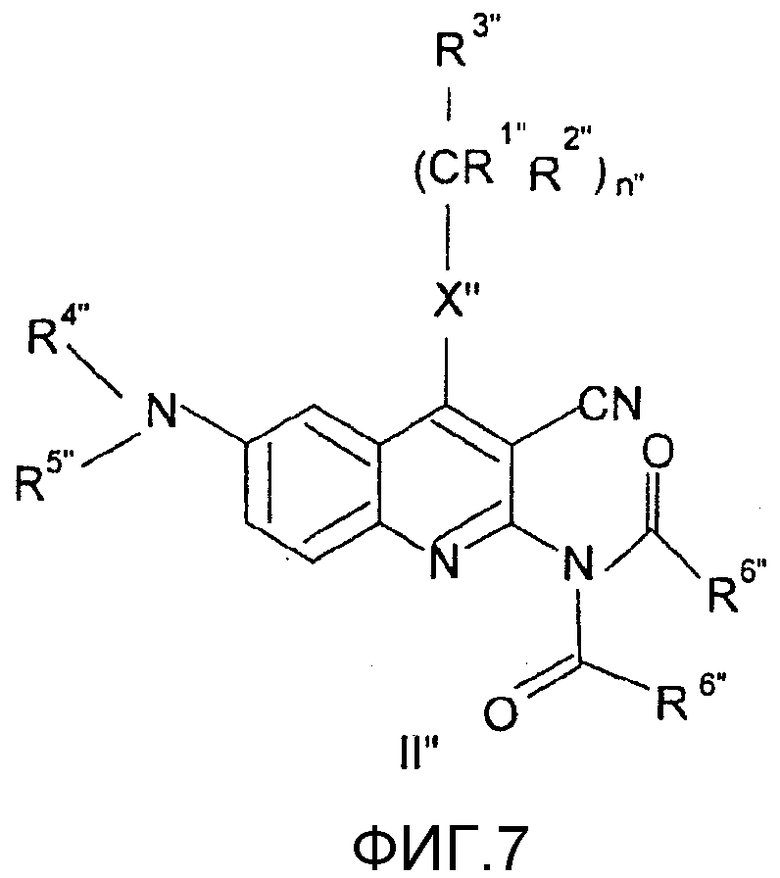
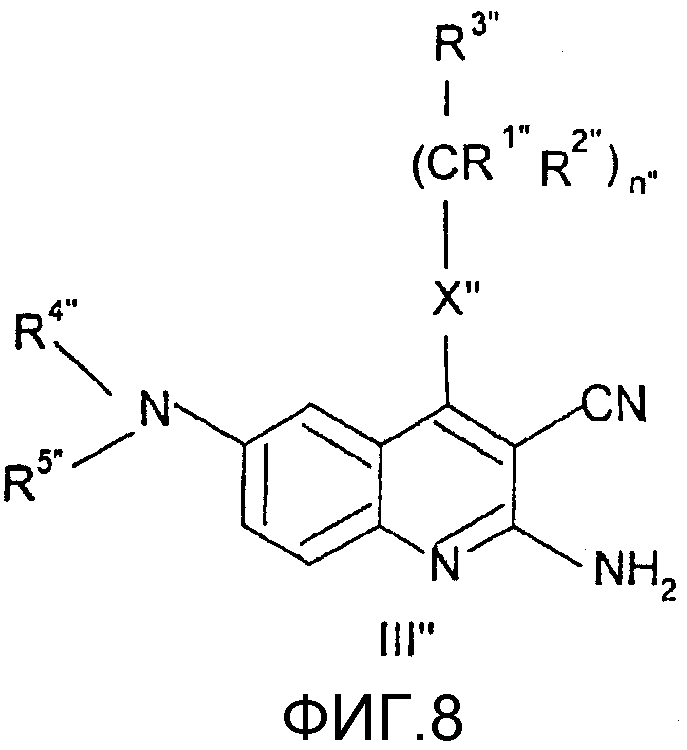
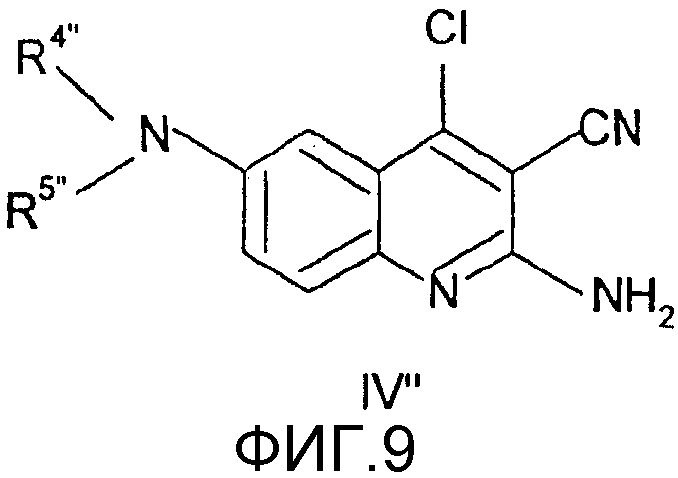
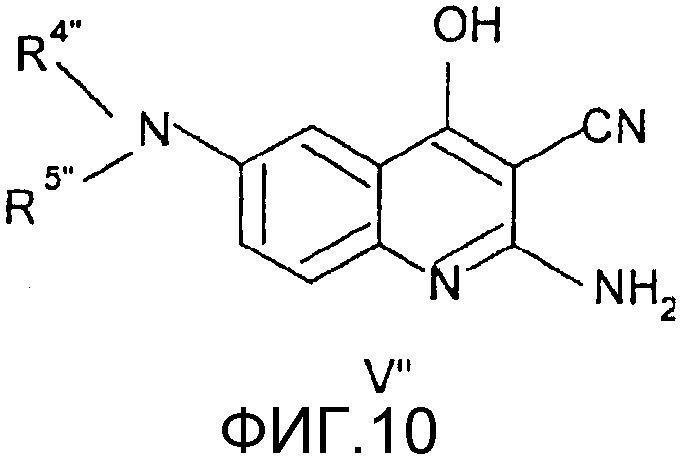
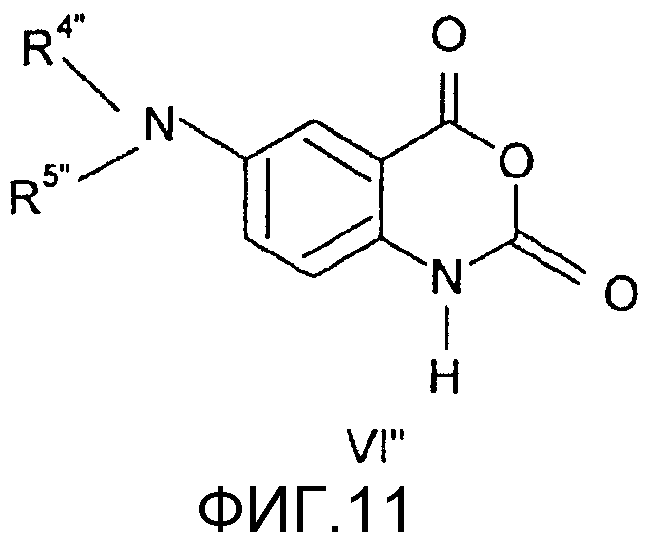
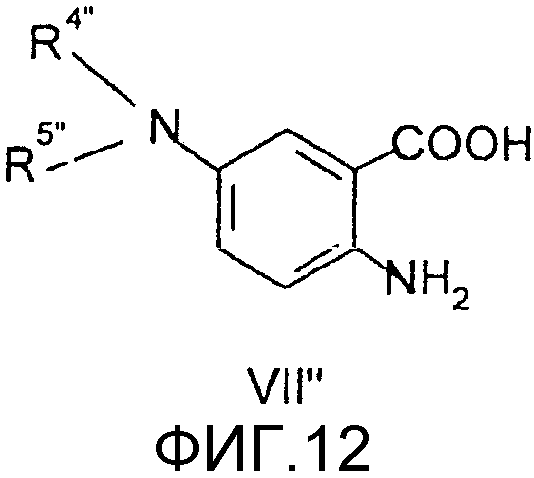
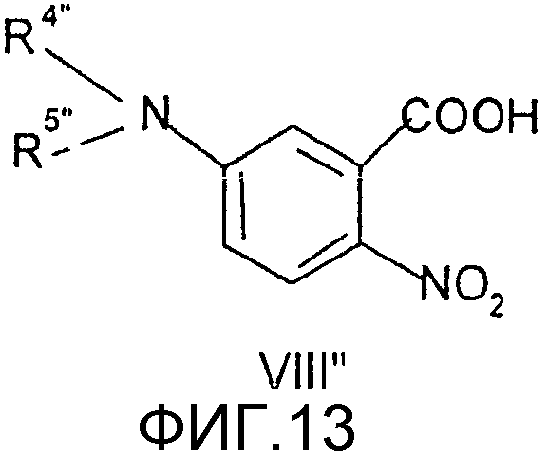
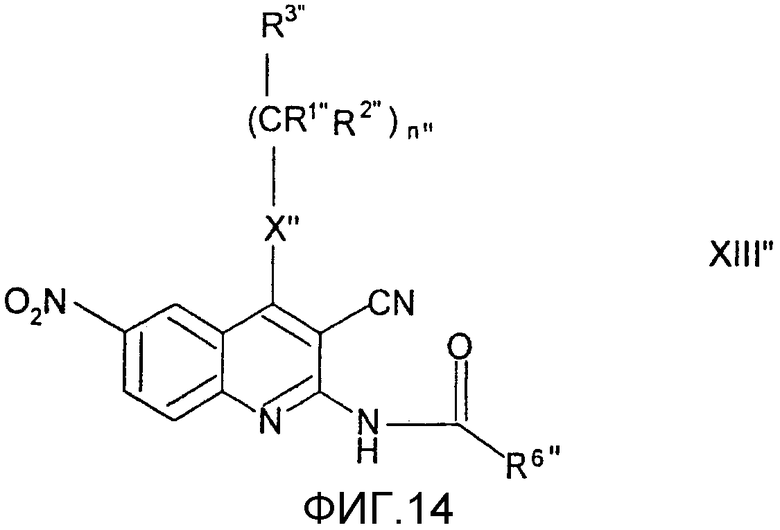
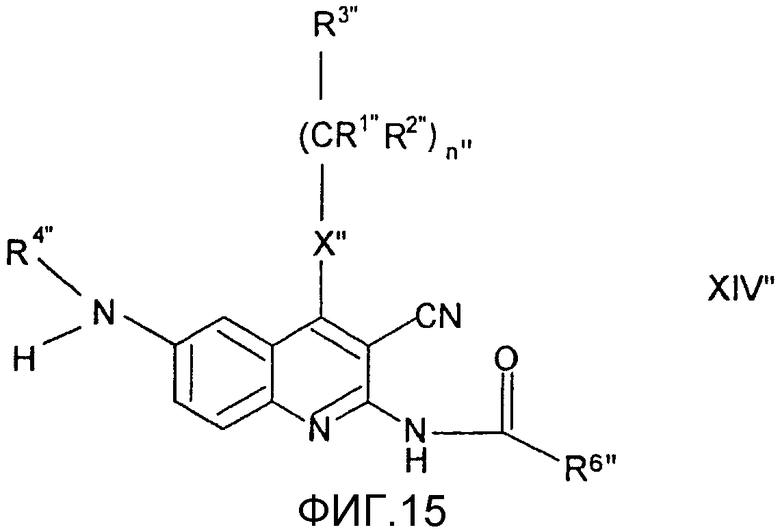
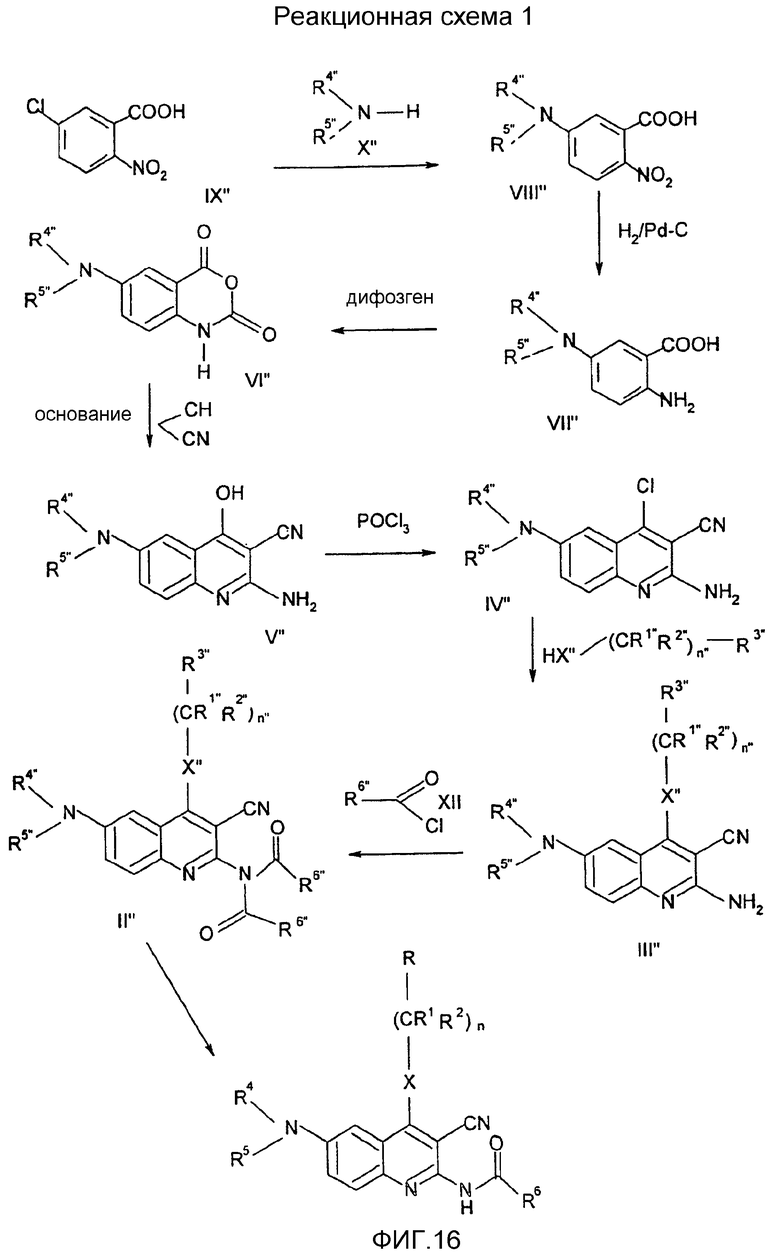
Изобретение относится к новым соединениям общей формулы (I)
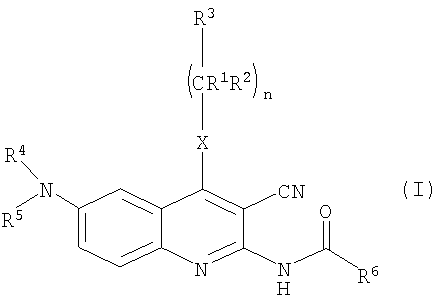 ,
,
в которой R1 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу; R2 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу; R3 представляет собой фенильную, тиенильную или фурильную группу, необязательно замещенные одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена; R4 и R5 независимо друг от друга представляют собой атом водорода, С3-6 циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой; или R4 представляет собой атом водорода или линейную или разветвленную С1-4алкильную группу или бензильную группу, и R5 представляет собой атом водорода, группу -SO2OH или формильную группу, или R4 и R5 вместе с атомом азота образуют группу общей формулы а.)
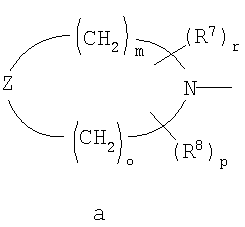
в которой R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу; R6 представляет собой фенильную, бензильную, тиенильную или фурильную группу, необязательно замещенные метилендиоксигруппой или одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой, или атомом галогена; Х представляет собой группу -NH или атом кислорода; Z представляет собой атом кислорода, атом серы, группу -СН2, группу -NH или группу -NR11, в которой R11 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу, группу -SO2OH, линейную или разветвленную C1-4ацильную группу, n равно нулю, 1 или 2; m равно 1, 2 или 3; о равно 1, 2 или 3; р равно нулю или 1; r равно нулю или 1, и их соли и сольваты. Изобретение также относится к способу получения соединений общей формулы (I), к фармацевтической композиции, к применению, к соединениям общей формулы (I″), (II″), (III″), (IV″), (V″) (VI″), (VII″), (VIII″), (XIII″). Технический результат - получение новых биологически активных соединений, которые являются лигандами рецепторов аденозина А3, предпочтительно антагонистами. 13 н. и 7 з.п. ф-лы, 16 ил. 1 табл.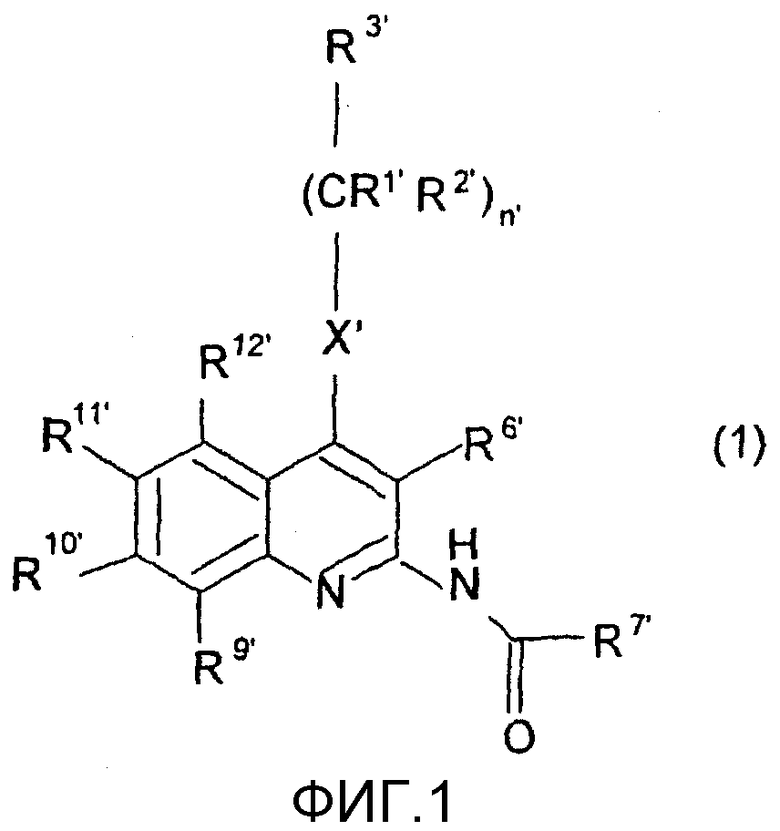
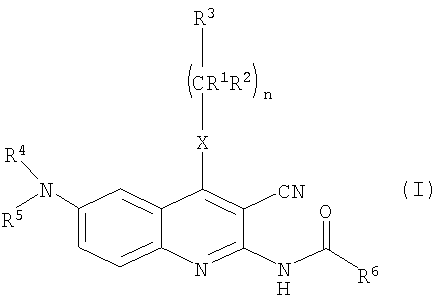 ,
,
в которой R1 представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу;
R2 представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу;
R3 представляет собой фенильную, тиенильную или фурильную группу, необязательно замещенные одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
R4 и R5 независимо друг от друга представляют собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой;
или
R4 представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу или бензильную группу и
R5 представляет собой атом водорода, группу -SO2OH или формильную группу, или
R4 и R5 вместе с атомом азота образуют группу общей формулы а)
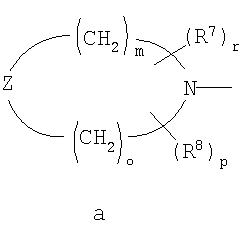
в которой R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу;
R6 представляет собой фенильную, бензильную, тиенильную или фурильную группу, необязательно замещенные метилендиоксигруппой или одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
Х представляет собой группу -NH или атом кислорода;
Z представляет собой атом кислорода, атом серы, группу -СН2, группу -NH или группу -NR11, в которой R11 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу, группу -SO2ОН, линейную или разветвленную С1-4ацильную группу;
n равно нулю, 1 или 2;
m равно 1, 2 или 3;
о равно 1, 2 или 3;
р равно нулю или 1;
r равно нулю или 1,
и их соли и сольваты.
R1 представляет собой атом водорода или метильную группу;
R2 представляет собой атом водорода или метильную группу;
R3 представляет собой фенильную, тиенильную или фурильную группу;
R4 и R5 независимо друг от друга представляют собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой;
или
R4 представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу или бензильную группу и
R5 представляет собой атом водорода, группу -SO2OH или формильную группу, или
R4 и R5 вместе с атомом азота образуют группу общей формулы а), в которой R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу;
R6 представляет собой 4-метоксифенильную, 3-метилфенильную, 3-метоксифенильную, 3,4-метилендиоксифенильную, 4-фторфенильную, 2-тиенильную или 2-фурильную группу;
Х представляет собой группу -NH или атом кислорода;
Z представляет собой атом кислорода, атом серы, группу -СН2, группу -NH или группу -NR11, в которой R11 представляет собой линейную или разветвленную С1-4алкильную группу, группу -SO2OH или формильную группу, и
n равно 1;
m равно 2;
о равно 2;
р равно нулю;
r равно нулю,
и их соли и сольваты.
4-метокси-N-[6-(морфолин-4-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид;
4-метокси-N-[6-(4-метилпиперазин-1-ил)-4-бензиламино-3-цианохинолин-2-ил]бензамид;
4-метокси-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
3,4-метилендиокси-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
4-фтор-N-(6-диметиламино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
4-метокси-N-(6-(пиперазин-1-ил)-4-бензиламино-3 -цианохинолин-2-ил)бензамид;
4-метокси-N-(6-амино-4-бензиламино-3-цианохинолин-2-ил)бензамид;
N-[4-(бензиламино)-3-циано-6-(4-формилпиперазин-1-ил)хинолин-2-ил]-4-метоксибензамид;
4-{4-(бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}пиперазин-1-сульфоновая кислота;
N-{3-циано-6-(формиламино)-4-[(2-тиенилметил)амино]хинолин-2-ил}-4-метоксибензамид;
N-{3-циано-6-(формиламино)-4-[(2-тиенилметил)амино]хинолин-2-ил)-1,3-бензодиоксол-5-карбоксамид;
N-[4-(бензиламино)-3-циано-6-(формиламино)хинолин-2-ил]-1,3-бензодиоксол-5-карбоксамид;
N-[4-(бензиламино)-3-циано-6-(формиламино)хинолин-2-ил]-4-метоксибензамид;
N-{4-(бензиламино)-3-циано-6-[формил(метил)амино]хинолин-2-ил}-4-метоксибензамид;
N-{3-циано-6-[формил(метил)амино]-4-[(2-тиенилметил)амино]хинолин-2-ил}-4-метоксибензамид;
{3-циано-2-[(4-метоксибензоил)амино]-4-[(2-тиенилметил)амино]хинолин-6-ил}метилсульфаминовая кислота;
{4-(бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}метилсульфаминовая кислота;
{4-(бензиламино)-3-циано-2-[(4-метоксибензоил)амино]хинолин-6-ил}сульфаминовая кислота;
[2-[(1,3-бензодиоксол-5-илкарбонил)амино]-4-(бензиламино)-3-цианохинолин-6-ил]сульфаминовая кислота;
{2-[(1,3-бензодиоксол-5-илкарбонил)амино]-3-циано-4-[(2-тиенилметил)амино]хинолин-6-ил}сульфаминовая кислота;
{3-циано-2-[(4-метоксибензоил)амино]-4-[(2-тиенилметил)амино]хинолин-6-ил}сульфаминовая кислота,
и их соли и сольваты.

и их солей, сольватов,
где R1, R2, R3, R4, R5, R6, R7, R8, X, Z, n, о, р, r и m имеют значения, определенные в п.1,
отличающийся тем, что
v) бис-карбоксамид общей формулы (II″), в которой
R1″ представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу;
R2″ представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу;
R3″ представляет собой фенильную, тиенильную или фурильную группу, необязательно замещенные одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
R4″ и R5″ независимо друг от друга представляют собой атом водорода, С3-6циклоалкильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой, или защитную группу; или
R4″ представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу или бензильную группу и
R5″ представляет собой атом водорода, группу -SO2OH, формильную группу или защитную группу, или
R4″ и R5″ вместе с атомом азота образуют нитрогруппу или группу общей формулы а), в которой R7″ и R8″ независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу;
R6″ представляет собой фенильную, бензильную, тиенильную или фурильную группу, необязательно замещенные метилендиоксигруппой или одной или более линейной или разветвленной С1-4алкильной группой, линейной или разветвленной С1-4алкоксигруппой или атомом галогена;
X″ представляет собой группу -NH, атом кислорода,
Z″ представляет собой атом кислорода, атом серы, группу -СН2, группу -NH или группу -NR11, в которой R11 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу, группу -SO2OH, линейную или разветвленную С1-4ацильную группу.
n″ равно нулю, 1 или 2;
m″ равно 1, 2 или 3;
о″ равно 1, 2 или 3;
р″ равно нулю или 1;
r″ равно нулю или 1,
селективно гидролизуют и при желании удаляют защитные группы, или v/i) для получения соединений общей формулы (I), в которой R4 представляет собой атом водорода или линейную или разветвленную C1-4алкильную группу или бензильную группу и R5 представляет собой формильную группу или R4 и R5 вместе с атомом азота образуют группу общей формулы а), в которой Z представляет собой группу -NR11, где R11 представляет собой линейную или разветвленную С1-4ацильную группу, и R1 R2, R3, R6, R7, R8, R9, X, n, m, о, р и r имеют значения, определенные выше,
соединение общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой атом водорода или R4 и R5 вместе с атомом азота образуют группу общей формулы а), в которой Z представляет собой группу -NH, и R1, R2, R3, R6, R7, R8, R9, X, n, m, о, р, и r имеют значения, определенные выше,
ацилируют соединением общей формулы R12″ COY″, в которой R12″представляет собой линейную или разветвленную С1-3алкильную группу и
Y″ представляет собой уходящую группу;
v/ii) для получения соединения общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой группу -SO2OH или R4 и R5 вместе с атомом азота образуют группу общей формулы а), в которой Z представляет собой группу -NR11, где R11 представляет собой группу -SO2OH и R1, R2, R3, R6, R7, R8, R9, X, n, m, о, р и r имеют значения, определенные выше,
соединение общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой атом водорода или R4 и R5 вместе с атомом азота образуют группу общей формулы а), в которой Z представляет собой группу -NH, и R1, R2, R3, R6, R7, R8, R9, X, n, m, о, р и r имеют значения, определенные выше,
подвергают взаимодействию с комплексом пиридин -SO3 или с ClSO3Н, или
v/iii) для получения соединения общей формулы (I), в которой R4 представляет собой атом водорода, линейную или разветвленную С1-4алкильную группу или бензильную группу и R5 представляет собой группу -SO2OH, и R1, R2, R3, R6, R7, R8, R9, X, Z, n, m, о, р и r имеют значения, определенные выше,
соединение общей формулы (XIII″), в которой R1 R2, R3, R6, R9, Х и n имеют значения, определенные выше,
подвергают взаимодействию с Na2S2O4 или NaHSO3,
или
восстанавливают и полученное при этом соединение общей формулы (XIV″), в которой R4″ представляет собой атом водорода, и R1″, R2″, R3″, R6″, R9″, X″ и n″ имеют значения, определенные выше, сульфируют комплексом пиридин -SO3 или ClSO3Н,
и, при желании, затем преобразуют атом водорода R4″ в линейную или разветвленную С1-4алкильную группу или бензильную группу; или
v/iv) для получения соединений общей формулы (I), в которой R4 представляет собой атом водорода, С3-6циклоалкильную группу, бензильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной C1-4алкильной группой, и R5 представляет собой атом водорода или R4 и R5 вместе с атомом азота образуют группу общей формулы а), в которой R7 и R8 независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу и Z представляет собой группу -NR11, в которой R11 представляет собой атом водорода,
удаляют защитную группу соединения общей формулы (I″), в которой
R4″ представляет собой атом водорода, С3-6циклоалкильную группу, бензильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой, и R5 представляет собой защитную группу или R4″ и R5″ вместе с атомом азота образуют группу общей формулы а″), в которой R7″ и R8″ независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу и Z представляет собой группу -NR11″, в которой R11″ представляет собой защитную группу,
и, при желании, заместители в полученном соединении общей формулы (I) и/или полученные таким образом соединения общей формулы (I) преобразуют в их соли или сольваты или высвобождают их из солей или сольватов.
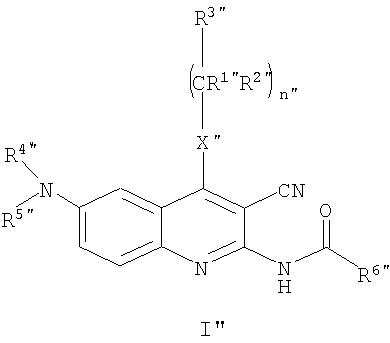
в которой R1″, R2″, R3″, R6″, R7″, R8″, X″, n″, m″, о″, р″ и r″ имеют значения, определенные в п.4, и
R4″ представляет собой атом водорода, С3-6циклоалкильную группу, бензильную группу, линейную или разветвленную С1-4алкильную группу, необязательно содержащую аминогруппу или аминогруппу, замещенную одной или двумя линейными или разветвленными С1-4алкильными группами, гидроксигруппу, карбоксигруппу или алкоксигруппу, замещенную линейной или разветвленной С1-4алкильной группой, и R5″ представляет собой защитную группу, или
R4″ и R5″ вместе с атомом азота образуют группу общей формулы а"), в которой R7″ и R8″ независимо друг от друга представляют собой атом водорода, линейную или разветвленную С1-4алкильную группу или С3-6циклоалкильную группу и Z представляет собой группу -NR11″, где R11″ представляет собой защитную группу.

в которой R1″, R2″, R3″, R4″, R5″, R6″, R7″, R8″, X″, Z″, n″, m″, о″, р″ и r″ имеют значения, определенные в п.4.
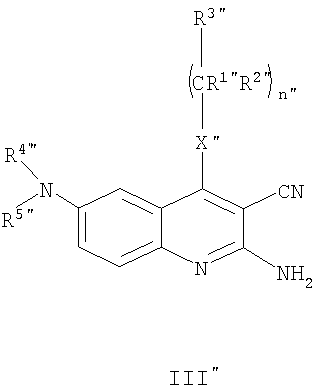
в которой R1″, R2″, R3″, R4″, R5″, R7″, R8″, X″, Z″, n″, m″, о″, р″ и r″ имеют значения, определенные в п.4.
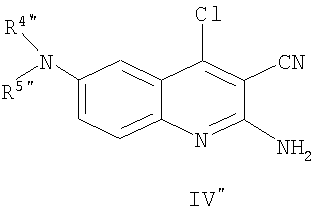
в которой R4″, R5″, R7″, R8″, Z″, m″, о″, р″ и r″ имеют значения, определенные в п.4.

в которой R4″, R5″, R7″, R8″, Z″, m″, о″, р″ и r″ имеют значения, определенные в п.4.
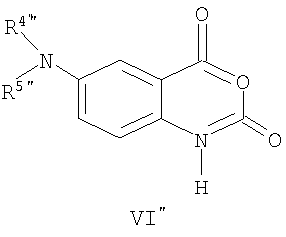
в которой R4″, R5″, R7″, R8″, Z″, m″, о″, р″ и r″ имеют значения, определенные в п.4, при условии, что R4″ и R5″ вместе с атомом азота имеют значения, отличающиеся от диметиламиногруппы, аминогруппы и нитрогруппы.
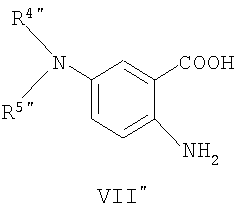
в которой R4″, R5″, R7″, R8″, Z″, m″, о″, р″ и r″ имеют значения, определенные в п.4, при условии, что R4″ и R5″ вместе с атомом азота имеют значения, отличающиеся от диметиламино-, диэтиламино- и аминогруппы, при условии исключения соединения, в котором R4″ представляет собой атом водорода, R5″ представляет собой линейную или разветвленную С1-4ацильную группу.
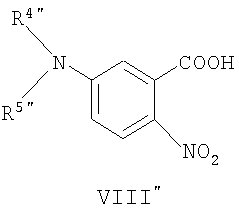
в которой R4″ и R5″ вместе с атомом азота представляют собой морфолино-, N-метилпиперазино-, пиперазино- или 4-бензилпиперазиногруппу.
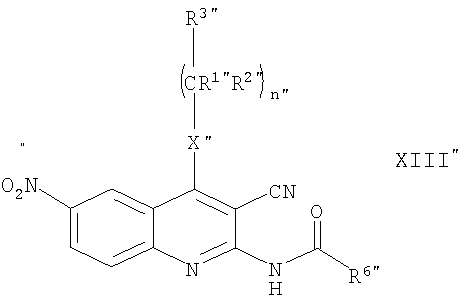
в которой заместители R1″, R2″, R3″, R6″ и n″ имеют значения, определенные в п.4.
Приоритет по пунктам и признакам:
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Hynes J.B | |||
| et al, JOURNAL OF MEDICINAL CHEMISTRY, 1984, vol | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Palle Jakobsen et al, Bioorganic & Medicinal Chemistry, 2000, vol.8 (8), p.2095-2103 | |||
| ЗАМЕЩЕННЫЕ 3-ЦИАНОХИНОЛИНЫ | 1998 |
|
RU2202551C2 |
Авторы
Даты
2008-02-20—Публикация
2004-07-23—Подача