Данное изобретение относится к способу получения индол-3-карбинола гидрата. Более конкретно, настоящее изобретение относится к способу получения индол-3-карбинола гидрата, пригодного для использования в качестве субстанции в фармацевтических композициях и лекарственных препаратах для профилактики и лечения онкологических заболеваний.
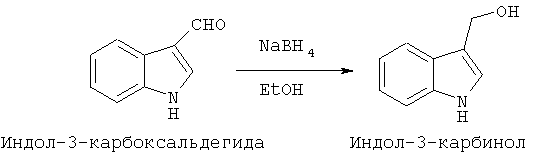
Индол-3-карбинол является природным соединением, выделенным из капусты качанной, броколи, брюссельской капусты и зеленого чая. Его синтетический аналог получают восстановлением индол-3-карбоксальдегида с последующим выделением индол-3-карбинола из реакционной массы и перекристаллизацией из подходящего органического растворителя: диэтилового эфира [Le, B.M.; Pascal, M.; Muriel, D.; Benedicte, D.-S.; Sylvie, P.-R.; et al. Arch. Pharm. (Weinheim Ger.), 1997, 330(5), 141-145], пентана [Henry; Leete. J. Am. Chem. Soc., 1957, 79, 5254], этанола [Thesing, J. Chem. Ber., 1954, 87, 692-696] или бензола [Madinaveitia. Chem. Soc., 1937, 1927-1929. Leete; Marion. Can. J. Chem., 1953, 31, 775-777. Runti.; Gazz. Chim. Ital., 1951, 81, 613-618.].
Однако полученный известными способами индол-3-карбинол не может использоваться в качестве субстанции для получения фармацевтических композиций, так как он сильно лабилен и/или содержит примеси бензола в недопустимых количествах.
Известен способ получения индол-3-карбинол формилированием индола [Плихтяк И.Л.; Ярцева И.В.; Александрова Л.Г.; Подхалюзина Н.Я.; Преображенская М.Н. Хим. Фарм. Ж., 1991, 25 (6), 57-58]. Продукт реакции авторы экстрагируют эфиром и после отгонки эфира получают ИЗК в виде темного масла.
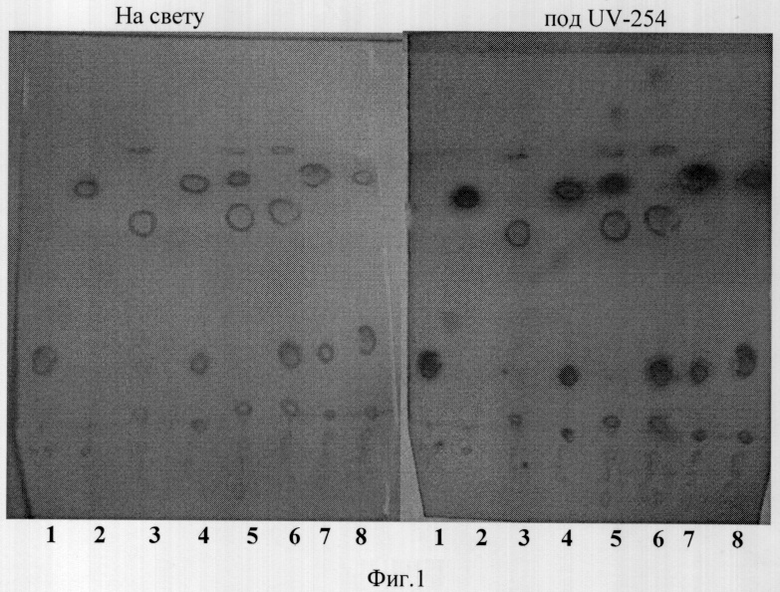
Однако приведенный в данной работе ПМР спектр полученного продукта не соответствует ПМР спектру индол-3-карбинола. Кроме того, мы воспроизвели приведенную в указанной работе методику формилирования индола и получили (как и авторы) маслообразный продукт, содержащий продукты превращения индол-3-карбинола и не содержащий, собственно, индол-3-карбинол. Как видно из этой хроматограммы (фиг.1), продукт реакции не содержит индол-3-карбинол, а содержит продукты его превращения, в частности дииндолилметан.
Известен способ получения индол-3-карбинола (WO 9850357 A2, опубл. 12.11.1998) восстановлением индол-3-карбоксальдегида боргидридом натрия в метаноле с последующим добавлением воды, охлаждением до 0°С, фильтрацией и сушкой в вакуум-эксикаторе при отсутствии света.
При использовании вакуума для осушки индол-3-карбинола происходит частичная или полная потеря воды исходного гидрата, что отрицательно сказывается на хранении вещества и его чистоте.
Недавно было предложено использовать для получения фармацевтических композиций в качестве субстанции индол-3-карбинол гидрат, обладающий повышенной стабильностью по сравнению с безводным индол-3-карбинолом [Заявка РФ №2006130506, приоритет 24.08.06].
Индол-3-карбинол гидрат является коммерческим продуктом (Акрос, Бельгия). Однако продукт этой фирмы не может использоваться в качестве субстанции, так как содержит в качестве примесей заметное количество толуола и бензола, обнаруженного при его исследовании независимой лабораторией (ЕСА, Analytikal Testing Report, 8-15-06). Следует отметить, что в научной и патентной литературе до настоящего времени отсутствовали сведения о способе получения индол-3-карбинол гидрата, пригодного для использования в качестве субстанции при получении фармацевтических композиций.
«Фармацевтическая композиция» обозначает композицию, включающую, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, витамины, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки, и/или активную субстанцию, представляющую собой, по крайней мере, один хемотерапевтический агент (физиологически активное химическое вещество). Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, витамины, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активное начало, одно или в комбинации с другим активным началом, может быть введено животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Целью настоящего изобретения является создание нового способа получения индол-3-карбинола гидрата.
Поставленная цель достигается способом получения индол-3-карбинола гидрата путем восстановления индол-3-карбоксальдегида боргидридом натрия в среде низшего спирта с последующим выделением и перекристаллизацией целевого продукта из воды или водного низшего спирта.
Поставленная цель также достигается способом получения индол-3-карбинола гидрата путем восстановления индол-3-карбоксальдегида боргидридом натрия в среде низшего спирта с последующим прибавлением к реакционной массе воды и выдерживанием образующегося раствора при пониженной температуре, предпочтительно в интервале от плюс 5°С до минус 18°С.
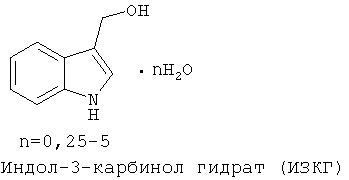
Получаемый по настоящему способу индол-3-карбинола гидрат содержит от 0,2 до 5 молекул воды на одну молекулу индол-3-карбинола, причем количество воды в молекуле зависит от способа сушки, например, моно- (I3C·H2O), ди- (I3C·2H2O) и три-(I3C·3H2O) гидраты, образуются при сушке на воздухе.
Изобретение поясняется чертежами:
на фиг.1 представлена фотография тонкослойной хроматогарафии на силикагеле смесью этилацетет: гексан (1:3): 1-индол-3-карбинола (I3C), 2 - дииндолилметана (DIM), 3 - реакционная масса до нагрева (R-1), 4 - реакционная масса после нагрева (R-2), 5 - смесевая проба (R-1+DIM), 6 - смесевая проба (R-1+I3C), 7 - смесевая проба (R-2+DIM) и 8 - смесевая проба;
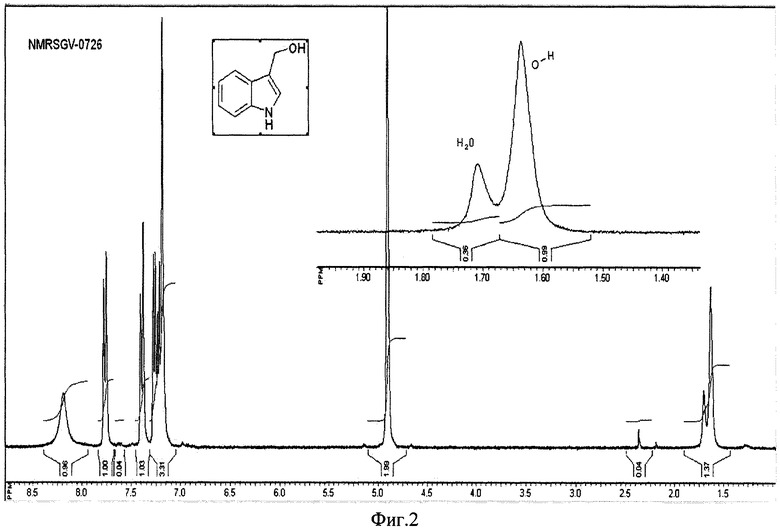
на фиг.2 представлен ПМР спектр (SGV-0726) в CDCl3;
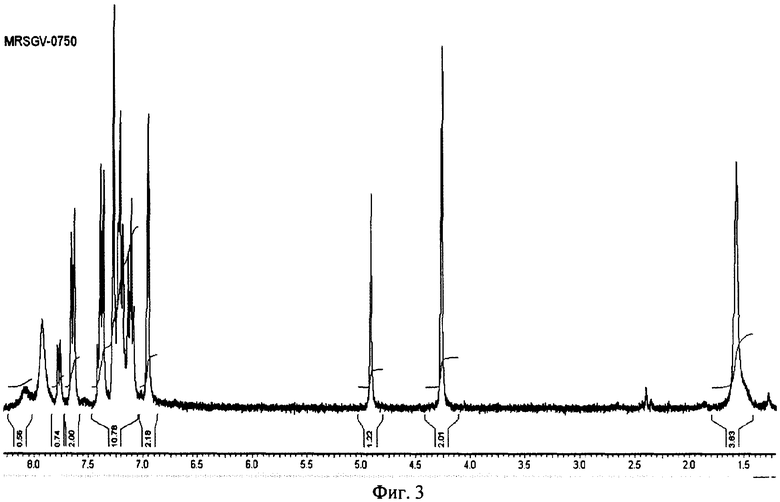
на фиг.3 ПМР спектр (NMRSGV-0750) полученного индол-3-карбинола гидрата;
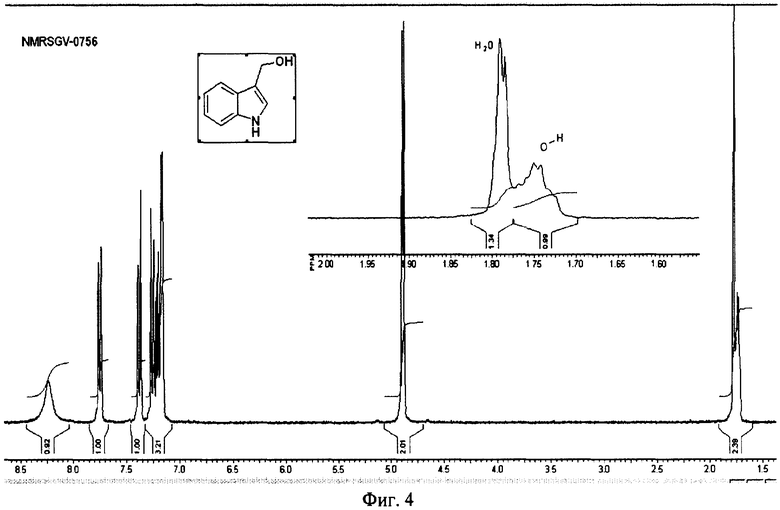
на фиг.4 ПМР спектр (NMRSGV-0756) полученного индол-3-карбинола гидрата;
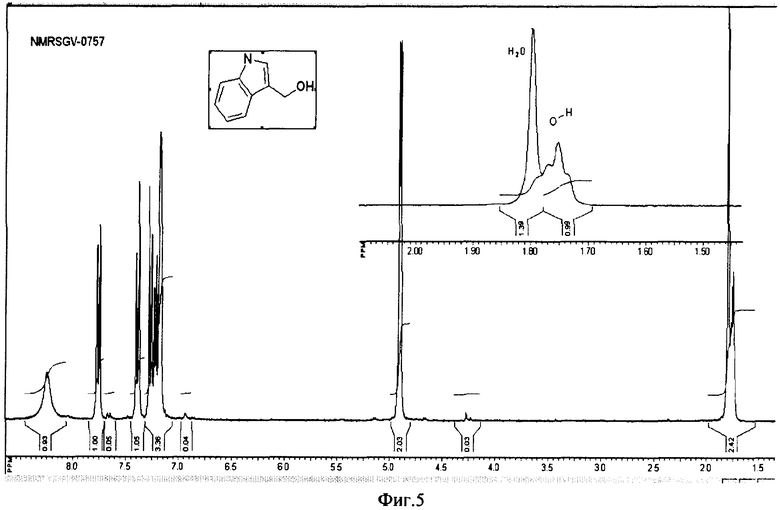
на фиг.5 ПМР спектр (NMRSGV-0757) полученного индол-3-карбинола гидрата;
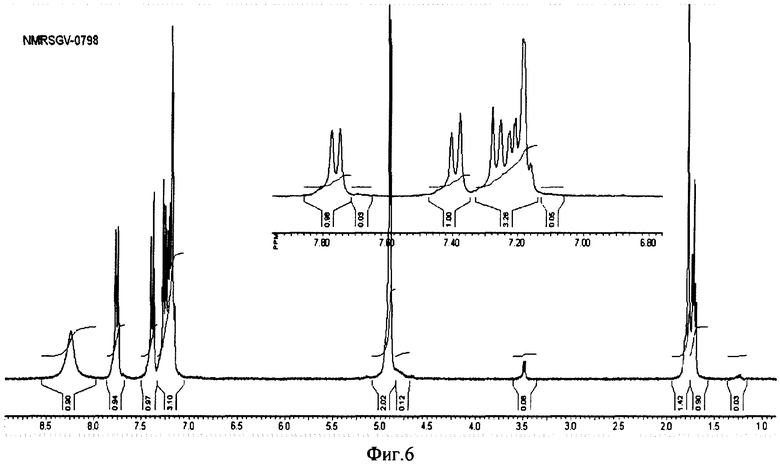
на фиг.6 ПМР спектр (SGV 0798) полученного индол-3-карбинола гидрата;
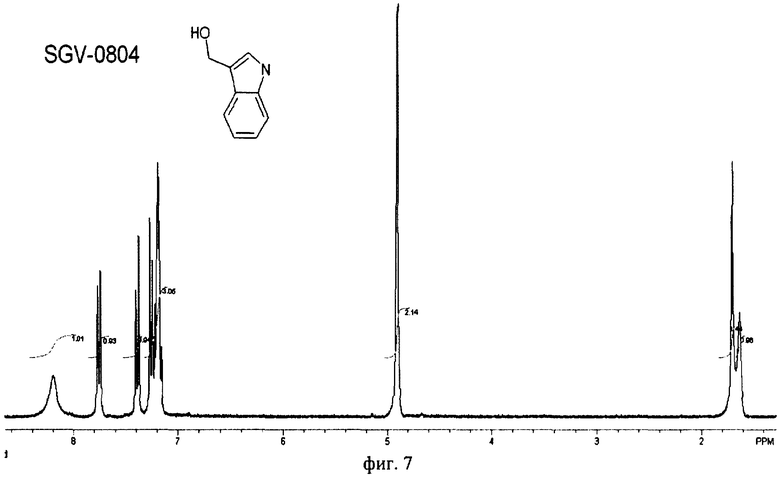
на фиг.7 ПМР спектр (SGV 0804) полученного индол-3-карбинола гидрата.
Ниже приводятся конкретные примеры, которые иллюстрируют, но не ограничивают данное изобретение.
Пример 1. Прибавляют при перемешивании 150 г (3.95 мол) боргидрида натрия к 1000 мл метанола, охлажденного льдом. Затем прибавляют 150 г (1.03 мол) индол-3-ил карбальдегида и выдерживают реакционную массу 2 часа при комнатной температуре. Реакционную массу разбавляют 1000 мл воды и экстрагируют трижды по 800 мл эфиром. Объединенные эфирные вытяжки сушат сульфатом натрия и упаривают в вакууме. Получают 116 г продукта с т.пл. 95-96°С. ПМР спектр (SGV-0726) в CDCl3 (фиг.2) свидетельствует о примерном содержание 0,2 молекулы воды на одну молекулу спирта и содержании основного вещества >97%. Растворяют 27.8 г полученного продукта в 3,4 л воды при температуре ниже 40°С. Полученный раствор охлаждают 4 часа при температуре 3-4°С, выпавшие кристаллы отфильтровывают и получают 1,2 г индол-3-карбинола гидрат с т.пл. 95-96°С. Спектр ПМР (NMRSGV-0748) после высушивания на воздухе в течение 48 часов (фиг.3) свидетельствует о содержание целевого продукта ˜85%.
Пример 2. К суспензии 200 г (1.38 мол) индол-3-карбальдегида в 1400 мл метанола при охлаждении льдом прибавляют в несколько приемов при интенсивном перемешивании 26 г (0.69 мол) боргидрида натрия. Через 10-15 минут после прибавления всего боргидрида натрия и полного перехода осадка альдегида в раствор проводят контроль реакционной массы методом тонкослойной хроматографии на силикагеле (CHCl3:МеОН 19:1). В случаях, когда в реакционной массе присутствовал в небольшом количестве (<10%) исходный альдегид (Rf=0,72 для индол-3-карбоксальдегида, Rf=0,6 для индол-3-карбинола), к реакционной массе добавляют дополнительно 2.6 г (0.07 моль) боргидрида натрия и смесь выдерживают при перемешивании в течение получаса до завершения реакции (контроль ТСХ). Полученную реакционную массу, представляющую собой прозрачный окрашенный в желтый цвет раствор, разбавляют 2000 мл воды и оставляют на сутки в холодильнике (при температуре 3-4°С). Осадок фильтруют и сушат 48 часов на воздухе. Получают 111,4 г (56%) индол-3-карбинола гидрата в виде слегка желтоватых пластинок с т.пл. 96-98°С. ПМР спектр (NMRSGV-0756) полученного индол-3-карбинола гидрата (фиг.4) свидетельствует о примерном содержание 0,5 молекулы воды на одну молекулу спирта и содержании основного вещества >97%.
Пример 3. Синтез проводят, как описано в примере 2. Реакционную массу, полученную после завершения реакции, упаривают досуха в вакууме при температуре ниже 40°С. Получают 402 г кристаллического продукта, который перекристаллизовывают из воды, для чего 15 г полученного продукта растворяют в 2 л воды при слабом нагревании (температура водяной бани не выше 40°С). Полученный раствор выдерживают 4 ч при 3-4°С, выпавший осадок отфильтровывают и сушат на воздухе 48 ч. Получают 4,5 г индол-3-карбинола гидрата (60%) с т.пл. 97-99°С. ПМР спектр (NMRSGV-0757) полученного индол-3-карбинола гидрата (фиг.5) свидетельствует о примерном содержание 0,5 молекулы воды на одну молекулу спирта и содержании основного вещества >95%.
Пример 4. К суспензии 100 г (0,69 мол) индол-3-карбальдегида в 400 мл метанола при охлаждении льдом прибавляют в несколько приемов при интенсивном перемешивании 13 г (0.345 мол) боргидрида натрия. После завершения реакции (контроль ТСХ) в реакционную массу добавляют 600 мл воды, 5 г активированного угля, перемешивают 10 мин и фильтруют. Фильтрат выдерживают 12 ч при -18°С, выпавший осадок отфильтровывают и сушат на воздухе. Получают 96 г (95%) индол-3-карбинола гидрата в виде белых блестящих пластинок с т.пл. 95-96°С. Спектр (SGV 0798) полученного индол-3-карбинола гидрата (фиг.6), свидетельствует о примерном содержание 0,5 молекулы воды на одну молекулу спирта и содержании основного вещества >95%.
Пример 5. К суспензии 100 г (0,69 мол) индол-3-карбальдегида в 400 мл метанола при охлаждении льдом прибавляют в несколько приемов при интенсивном перемешивании 13 г (0.345 мол) боргидрида натрия. После завершения реакции (контроль ТСХ) в реакционную массу добавляют 600 мл воды, 5 г активированного угля, перемешивают 10 мин и фильтруют. Из фильтрата отгоняют в вакууме метанол, а в водном остатке растворяют 120 г NaCl, полученный раствор выдерживают 12 ч при 3°С, отфильтровывают, промывают холодной водой и сушат на воздухе. Получают 77,6 г (76%) индол-3-карбинола гидрата с т.пл. 95-96°С в виде светло-желтых блестящих пластинок.
При необходимости полученный индол-3-карбинола гидрат дополнительно можно очистить способами, приведенными в примерах 6 и 7.
Пример 6. Растворяют 90 г индол-3-карбинола гидрата, полученного по примеру 4, в 13,5 л смеси метанол-вода (2:3, рН 8). Полученный раствор выдерживают 30 мин, отфильтровывают, фильтрат выдерживают 12 ч при -18°С, отфильтровывают и сушат на воздухе. Получают 60,3 г (67%) индол-3-карбинола гидрата с т.пл. 95-96°С в виде белых блестящих пластинок. Спектр ПМР (SGV 0804) полученного индол-3-карбинола гидрата (фиг.7) свидетельствует о примерном содержание 0,5 молекулы воды на одну молекулу спирта и содержании основного вещества >98%.
Пример 7. Растворяют 1 г индол-3-карбинола гидрата, полученного по примеру 4, в 15 мл смеси этанол-вода (1:12, рН 8). Полученный раствор выдерживают 30 мин, отфильтровывают, фильтрат выдерживают 12 ч при -18°С, отфильтровывают и сушат на воздухе. Получают 0,65 г (65%) индол-3-карбинола гидрата с т.пл. 95-96°С в виде белых блестящих пластинок.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения индол-3-карбинола (варианты) | 2021 |
|
RU2772604C1 |
| Способ получения индол-3-карбинола | 2021 |
|
RU2760000C1 |
| Замещенный 3,4,12,12а-тетрагидро-1Н-[1,4]оксазино[3,4-c]пиридо[2,1-f] [1,2,4]триазин-6,8-дион, фармацевтическая композиция, способы их получения и применения | 2019 |
|
RU2720305C1 |
| ЗАМЕЩЕННЫЕ 2-АЛКИЛСУЛЬФАНИЛ-3-СУЛЬФОНИЛ-ПИРАЗОЛО[1,5-а]-ПИРИМИДИНЫ, АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2008 |
|
RU2393159C1 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ИНДОЛ-3-КАРБИНОЛА (I3C) | 2007 |
|
RU2363694C2 |
| Норадренергический и специфически серотонинергический анксиолитик и антидепрессант, способ его получения и применения | 2020 |
|
RU2775772C2 |
| ЗАМЕЩЕННЫЕ 3-АРИЛСУЛЬФОНИЛ-ПИРАЗОЛО[1,5-а]ПИРИМИДИНЫ, АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2008 |
|
RU2393158C1 |
| Ингибитор вируса гепатита В (ВГВ) | 2017 |
|
RU2666727C1 |
| ЗАМЕЩЕННЫЕ 4-СУЛЬФОНИЛ-ПИРАЗОЛЫ И 3-СУЛЬФОНИЛ-ПИРАЗОЛО[1,5-a]ПИРИМИДИНЫ - АНТАГОНИСТЫ СЕРОТОНИНОВЫХ5-HT РЕЦЕПТОРОВ, АКТИВНЫЙ КОМПОНЕНТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2369600C1 |
| ТЕТРАГИДРО-ПИРАЗОЛО[1,5-a]ПИРИДО-ПИРИМИДИНЫ - АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2008 |
|
RU2391343C1 |
Изобретение относится к способам (вариантам) получения стабильной формы индол-3-карбинола гидрата. Индол-3-карбинола гидрат является известным соединением, используемым в фармацевтической промышленности. Способ получения индол-3-карбинол гидрата путем восстановления индол-3-карбоксальдегида боргидридом натрия в среде C1-С3 алкилового спирта. К полученной реакционной массе прибавляют воду и выдерживают при пониженной температуре до полного его выпадения с последующей сушкой при температуре окружающей среды. Либо из полученной после восстановления реакционной массы выделяют продукт и проводят перекристаллизацию из воды или водного C1-С3 алкилового спирта при слабом нагревании с последующим охлаждением и выдержкой полученного раствора при температуре, близкой к нулевой, и сушкой при температуре окружающей среды. При необходимости полученный индол-3-карбинол гидрат дополнительно перекристаллизовывают из воды или водного C1-С3 алкилового спирта с выдержкой полученного раствора при температуре от +3°С до -18°С и сушкой при температуре окружающей среды. Способы позволяют получить продукт с повышенной стабильностью и исключить нежелательные примеси побочных продуктов превращения и растворителей, используемых при перекристаллизации. 2 н. и 1 з.п. ф-лы, 7 ил.
| WO 9850357 A2, 12.11.1998 | |||
| THESING JAN Chemistry of indole | |||
| III | |||
| The effect of alcali on quaternary salts of gramine, Chem | |||
| Ber., 1954, 87, 692-9 | |||
| CHOUDARY BOYAPATI MANORANJAN et al | |||
| Selective reduction of aldehydes to alcohole by calcined Ni-Al hydrocalite J | |||
| of Moleculare Catalisis A:Chemical, 2003, 206 (1-2), 145-151 | |||
| ПЛИХТЯК И.Л | |||
| и др. |
Авторы
Даты
2008-02-27—Публикация
2006-09-13—Подача