Данное изобретение относится к новому норадренергическому и специфически серотонинергическому анксиолитику и антидепрессанту (НаССА, NaSSA), способу его получения и применения в терапии психических расстройств.
Распространенность психических расстройств растет во всем мире. За период с 1990 по 2013 гг. число людей, страдающих от депрессии и/или тревожных расстройств, возросло почти на 50% - с 416 миллионов до 615 миллионов человек. Около 10% населения мира страдает такими заболеваниями, а на психические расстройства приходится 30% глобального бремени несмертельных болезней. Гуманитарные чрезвычайные ситуации и продолжающиеся конфликты обостряют потребности в расширении вариантов лечения. По оценкам ВОЗ, во время чрезвычайных ситуаций от депрессии и тревожных расстройств страдает каждый пятый человек. Депрессия и тревожные расстройства ежегодно обходятся глобальной экономике в один триллион долларов США [https://www.who.int/ru/news-room/detail/13-04-2016-investing-in-treatment-for-depression-and-anxiety-leads-to-fourfold-returnl.
За последние десятилетия психофармакотерапия уверенно шагнула вперед, появились новые препараты для лечения душевных заболеваний. В настоящее время чрезвычайно актуальны вопросы по выбору психотропных средств (ПС) для пациентов не только психиатрических клиник, но и общемедицинской практики. Это связано с широкой распространенностью тревожных и депрессивных состояний среди населения (в России до 6-7%) и неуклонным ее ростом, частым сочетанием психической патологии с соматической, в связи с чем с необходимостью применения ПС сталкиваются врачи самых разных специальностей. Именно они, а не неврологи и психиатры, назначают 2/3 всех ПС. В итоге, по данным ВОЗ, около 1/3 взрослого населения развитых стран принимают психофармакологические препараты (при отсутствии гиподиагностики данный показатель мог быть даже выше) [https://www.rmj.ru/articles/psikhiatriya/Antidepressanty_i_anksiolitiki_preimuschestva_i_nedostatki/].
Тревожные и депрессивные расстройства в высокой степени сопутствуют заболеванию и имеют перекрывающиеся проявления симптомов. Действительно, более половины (58%) всех пациентов с большим депрессивным расстройством (Major depressive disorder, MDD) имеют тревожное расстройство, включая генерализованное тревожное расстройство (generalized anxiety disorder, GAD).
Фармакотерапия для лечения больших депрессивных расстройств была доступна с момента введения трициклических антидепрессантов (ТЦА, ТСА) и ингибиторов моноаминоксидазы (ИМФО, MAOI) в 1950-х годах. Первые селективные ингибиторы обратного захвата серотонина (ИОЗС, SSRIs) были введены в 1980-х годах, и благодаря их улучшенным профилям безопасности и переносимости по сравнению с ТЦА и ИМФО они стали наиболее широко назначаемыми препаратами для лечения депрессии и связанных с ней расстройств. Ингибиторы обратного захвата серотонина и норэпинефрина (ИОЗСН, SNRI) вышли на рынок в 1990-е годы.
ИОЗС и ИОЗСН считаются терапией первой линии и эффективны как при тревожных, так и при депрессивных состояниях. Однако пациенты с депрессией с высоким уровнем тревожности обычно страдают от более тяжелых симптомов, более слабого ответа на лечение и большей чувствительности к побочным эффектам, чем пациенты с депрессией без тревожного расстройства. Эти факторы способствуют повышению частоты прекращения лечения и значительным неудовлетворенным потребностям [Richelson Е. Multi-modality: а new approach for the treatment of major depressive disorder. SSRIs/SNRIs Intern. J. Neuropsychopharmacology 2013, 16(6), 1433-1442].
В 1990-е годы на рынок вышли психиатрические препараты относящиеся к классу норадренергических и специфические серотонинергических анксиолитиков и антидепрессантов (НаССА, NaSSA). Они действуют путем антагонизма адренергических и серотониновых рецепторов.
Типичным и наиболее эффективным представителем НаССА является Миртазапин (Mirtazapine), продаваемый под торговой маркой Remeron, Norset, Avanza, Zispin и др. Миртазапин впервые был одобрен для использования при депрессивных расстройствах в Нидерландах в 1994 году, а в 1996 году в США под торговой маркой Remeron https://en.wikipedia.org/wiki/Mirtazapine], Миртазапин является наиболее эффективным и безопасным препаратом по сравнению с классическими препаратами других классов (TCAs, SSRIs и SNRIs) [S.-M. Wang et al. Addressing the Side Effects of Contemporary Antidepressant Drugs: A Comprehensive Review. Chonnam Med. J. 2018, 54(2), 101-112].
Миртазапин используют при депрессии, осложненной беспокойством или проблемами со сном. [Anttila S.A., Leinonen E.V. A review of the pharmacological and clinical profile of mirtazapine. CNS Drug Rev. 2001, 7 (3), 249-264. Nutt D.J. Tolerability and safety aspects of mirtazapine. Hum. Psychopharmacol. 2002, 17 Suppl 1, S37-41.]. Он также обладает сильным антигистаминным действием [Mirtazapine Monograph for Professionals. Drugs.com. American Society of Health-System Pharmacists. 2018].
Общие побочные эффекты включают увеличение веса, сонливость и головокружение. [8] К серьезным побочным эффектам могут относиться мания, низкий уровень лейкоцитов и повышенное количество самоубийств среди детей. Симптомы отмены могут возникнуть при остановке терапии [British national formulary: BNF 74 (74 ed.). British Medical Association. 2017, p. 354. ISBN 978-0857112989.]. Неясно, безопасно ли использование Миртазапина во время беременности [Mirtazapine Monograph for Professionals. Drugs.com. American Society of Health-System Pharmacists. 2018]. В этой связи создание новых НаССА препаратов, обладающих меньшим количеством побочных эффектов чем Миртазапин является актуальной задачей.
Ниже приведены определения различных терминов, используемых для описания данного изобретения. Эти определения применимы к терминам, как они использованы в данном описании и формуле изобретения, если иным не ограничены в конкретных случаях либо по отдельности, либо как часть большей группы.
Термин «кристаллическая форма» означает структуру вещества, характеризующуюся упаковкой образующих ее молекул в один из видов кристаллической решетки.
Термин «поликристаллическая форма» означает структуру вещества, имеющую поликристаллическое строение, т.е. состоящую из множества мелких монокристаллов с различными видами кристаллической решетки.
Термин «активный компонент» (лекарственное вещество) относится к физиологически активному веществу синтетического или иного происхождения, обладающему фармакологической активностью, которое является активным ингредиентом фармацевтической композиции.
Термин «фармацевтическая композиция» обозначает композицию, включающую в себя активный компонент и, по крайней мере, одно вспомогательное вещество, выбранное из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного компонента, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного компонента, одного или в комбинации с другим активным компонентом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями.
Термин «вспомогательное вещество», используемый в данном описании, относится к соединению, которое используют для получения фармацевтической композиции, и, как правило, безопасному и нетоксичному и включает в себя вещества, которые являются приемлемыми для применения в медицине. Активные компоненты могут вводится индивидуально человеку или животному, но обычно их вводят в смеси с одним или более фармацевтически приемлемыми вспомогательными веществами (эксципиентами, разбавителями или носителями), выбранными с учетом предполагаемого пути введения и стандартной терапии.
Термин «лекарственный препарат» означает вещество (или смесь веществ в виде фармацевтической композиции) в виде готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего. Пригодные стандартные готовые формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Термин «терапевтически эффективное количество», используемый здесь, означает количество активного компонента, необходимое для уменьшения симптомов заболевания у субъекта. Доза активного компонента соответствует индивидуальным требованиям в каждом конкретном случае. Эта доза может варьироваться в широких пределах в зависимости от многочисленных факторов, таких его активность, биодоступность, тяжесть заболевания, подлежащего лечению, возраста и общего состояния здоровья пациента, других лекарственных средств, с помощью которых пациент проходит лечение, способа и формы введения и опыта лечащего врача. Для перорального введения суточная доза составляет приблизительно от 0,01 до 10 г, включая все значения между ними, в день в монотерапии и/или в комбинированной терапии. Предпочтительная суточная доза составляет примерно от 0,01 до 1 г в день.
Термин «субъект» означает млекопитающее, которое включает, но не ограничивается ими, крупный рогатый скот, свиней, овец, куриц, индеек, буйволов, лам, страусов, собак, кошек и человека, предпочтительно субъектом является человек.
Термин «пациент» означает человек, получающий медицинскую помощь, подвергающийся медицинскому наблюдению и/или лечению по поводу какого-либо заболевания, патологического состояния или иного нарушения здоровья и жизнедеятельности, а также пользующийся медицинскими услугами независимо от наличия у него заболевания.
Известно, что 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол (А), его фармацевтически приемлемая соль и/или гидрат является антагонистом 5-НТ6 серотониновых рецепторов, одновременно регулирующий гомеостаз ионов кальция в клетках [Патент RU 2334747, 2008]. Известно также, что спектр биологической активности этого лиганда (А) включает одновременно а-адреноцепторы, допаминовые рецепторы, гистаминовые рецепторы, имидазолиновые рецепторы и серотониновые рецепторы [Патент RU 2407744, 2010. A.V. Ivachtchenko at. al. AVN-101: A Multi-Target Drug Candidate for the Treatment of CNS Disorders. Alzh. Disease 53 (2016) 583-620.].
На основании изучения активности этого лиганда на мышиных моделях предложены лекарственное средство и способ лечения и/или предупреждения болезней и патологических состояний ЦНС, патогенез которых связан с гипер- или гипоактивацией одновременно α-адреноцепторов, допаминовых рецепторов, гистаминовых Н2 рецепторов, имидазолиновых рецепторов и группы 5-НТ1А, 5-НТ1В, 5-НТ2А, 5-НТ2В, 5-НТ2С, 5-НТ7 серотононовых рецепторов, путем введения фармакологически эффективного количества 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола [Патент RU 2407744, 2010].
Однако, в научной и патентной литературе отсутствуют данные о использовании этого лиганда в качестве норадренергическиого и специфически серотонинергического препарата в терапии расстройств центральной нервной системы людей нуждающихся в этом.
Неожиданно, авторы обнаружили, что гидрохлорид 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-6]индола, его полиморфная модификация (ПМ) в людях не обнаруживает побочных эффектов, характерных для лигандов обладающих активностью по отношению к допаминовым, гистаминовым и имидазолиновым рецепторам.
Предметом, данного изобретения является новый норадренергический и специфически серотонинергический препарат для терапии психических расстройств у людей, представляющий собой гидрохлорид 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), его полиморфная модификация, способы их получения и применения.
Предметом, данного изобретения является новый норадренергический и специфически серотонинергический препарат для терапии психических расстройств у людей, представляющий собой полиморфную модификацию (ПМ-1) гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-6]индола (А⋅HCl), в виде ромбических кристаллов характеризующихся кристаллографической группой Pbca.
Предметом, данного изобретения является новый норадренергический и специфически серотонинергический препарат для терапии психических расстройств у людей, представляющий собой полиморфную модификацию (ПМ-2) гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), в виде ромбических кристаллов характеризующихся кристаллографической группой - Pnnn.
Предметом, данного изобретения является неизвестная ранее полиморфная модификация (ПМ-1) гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), которая представляет собой ромбические кристаллы характеризующиеся кристаллографической группой Pbca;
Предметом, данного изобретения является неизвестная ранее полиморфная модификация (ПМ-2) гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), которая представляет собой ромбические кристаллы характеризующиеся кристаллографической группой - Pnnn;
Предметом, данного изобретения являются неизвестные ранее смесь полиморфных модификаций гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), представляющая собой смесь ромбических кристаллов ПМ-1 и/или ПМ-2, и аморфной фазы.
Известен способ получения 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А), включающий:
(a) - синтез 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (A3) с выходом 52% взаимодействием n-толилгидразина (А1) и N-метилпиперидона-4 (А2) в диоксане при 80°С (Схема 1) [WO/2010/051501];
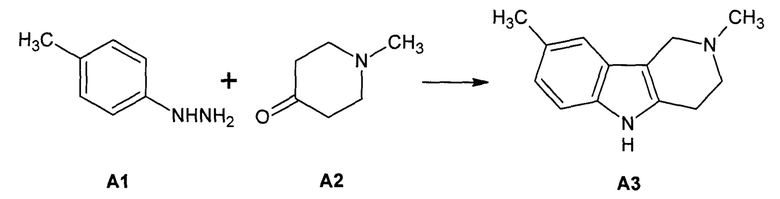
Схема 1. Синтез 2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (A3).
(б) - синтез 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А) взаимодействием карболина A3 с фенилацетиленом (А4) в 1 мл диметилсульфоксида, в присутствии 3 мл 60% водного KOH и 100 мкл 50% водного (Bu4N)2SO4 в течении 6-12 ч при температуре 20-80°С и последующим гидрировании на платиновом катализаторе катализаторе образующегося 2,8-диметил-5-(2-фенилэтенил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А5) и (Схема 2). После окончания реакции реакционную массу фильтруют или центрифугируют, фильтрат упаривают в вакууме, а остаток хроматографируют на силикагеле импрегнированном триэтиламином (элюент смесь хлороформа с триэтиламином или смесь дихлорметан с тетрагидрофураном и триэтиламин) или перекристаллизовывают из подходящего растворителя (растворитель не указан). Способ получения гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) в указанных патентах не приводится. В патентах отсутствуют также данные о фазовой форме полученного 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А) и его солей, а также отсутствуют рентгенофазовые данные подтверждаемые полиморфную модификацию полученных образцов 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола(А) [Патенты RU 2334747 (2008), RU 2407744 (2010)].
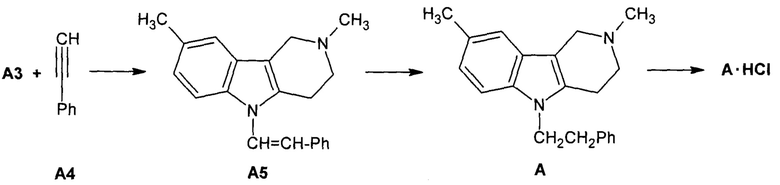
Схема 2. Синтез 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А) и его гидрохлорида А⋅HCl.
Предметом, данного изобретения является способ получения 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А) взаимодействием гидрохлорида 4-метилфенилгидразина (А1⋅HCl) со стиролом (А6) и взаимодействием образующегося гидрохлорида 1-(4-метилфенил)-1-(2-фенилэтил)гидразина (А7⋅HCl) с 1-метилпиперидин-4-оном (А2) с последующим переводом в случае необходимости продукта реакции (А⋅HCl) в основание (А), а затем в случае необходимости в другую фармацевтически приемлемую соль (Схема 3).
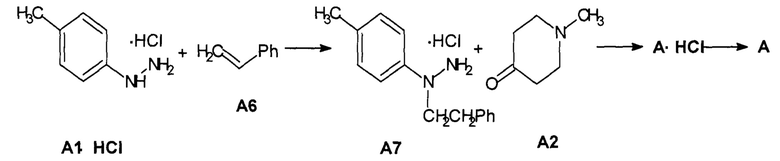
Схема 3. Синтез 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А) и его гидрохлорида А⋅HCl.
Новый способ получения гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) более простой, короче на 1 стадию и не требует использования дорогостоящего платинового катализатора, чем известный [Патенты RU 2334747 (2008), RU 2407744 (2010)].
Предметом, данного изобретения является способ получения полиморфной модификации (ПМ-1) гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), представляющей собой ромбические кристаллы характеризующиеся кристаллографической группой Pbca, перекристаллизацией А⋅HCl из изопропанола.
Предметом, данного изобретения является способ получения полиморфной модификации (ПМ-2) гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), представляющей собой ромбические кристаллы характеризующиеся кристаллографической группой Pnnn, перекристаллизацией А⋅HCl из этанола.
Предметом, данного изобретения является способ получения смеси ПМ-1 и/или ПМ-2 и аморфной фазы гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) представляющего собой смесь ромбических кристаллов, характеризующихся кристаллографическими группами Pbca и/или Pnnn, и аморфной фазой перекристаллизацией А⋅HCl из воды или водного этанола.
Предметом, данного изобретения является новый норадренергический и специфически серотонинергический препарат для терапии психических расстройств у людей, представляющий собой гидрохлорид 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), его полиморфной модификации или смеси полиморфной(ых) модификации(й) и аморфной фазы, в терапевтически эффективном количестве.
Предпочтительным является препарат, представляющий собой ПМ-1, ПМ-2 или смесь ПМ-1 и/или ПМ-2 и аморфной фазы гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) в терапевтически эффективном количестве.
Предметом, данного изобретения является также активный компонент фармацевтических композиций, представляющий собой норадренергический и специфически серотонинергический препарат по данному изобретению, в терапевтически эффективном количестве.
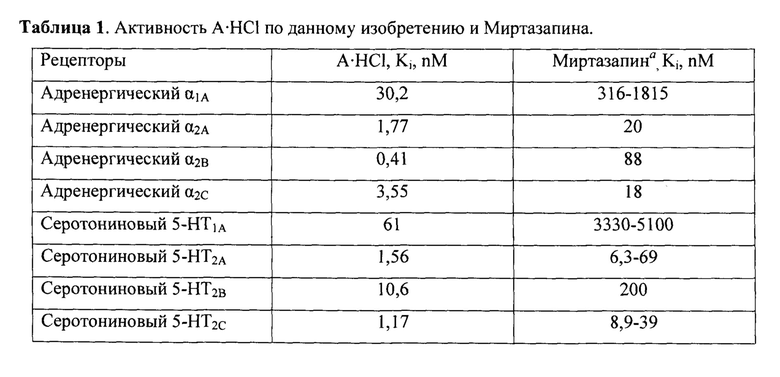
Активный компонент по данному изобретению по сравнению с прототипом препаратом
имеет значительно более высокую активность по отношению к адренергическим и специфическим серотониновым рецепторам (Табл. 1)

Предметом, данного изобретения является также фармацевтическая композиция в форме таблетки, капсулы, пилюли, порошка, гранулы, жевательной резинки, перорального раствора или суспензии, аэрозоля, имплантата, подкожного, внутримышечного, внутривенного, интраназального, содержащая фармацевтически эффективное количество активного компонента по данному изобретению и возможно вспомогательные вещества.
Предметом, данного изобретения является фармацевтическая композиция в форме таблетки, капсулы, пилюли, порошка, гранулы, жевательной резинки, перорального раствора или суспензии, аэрозоля, имплантата, подкожного, внутримышечного, внутривенного, интраназального, содержащая в качестве активного компонента фармацевтически эффективное количество ПМ-1, представляющей собой ромбические кристаллы, характеризующиеся кристаллографической группой Pbca.
Предметом, данного изобретения является фармацевтическая композиция в форме таблетки, капсулы, пилюли, порошка, гранулы, жевательной резинки, перорального раствора или суспензии, аэрозоля, имплантата, подкожного, внутримышечного, внутривенного, интраназального, содержащая в качестве активного компонента фармацевтически эффективное количество ПМ-2, представляющей собой ромбические кристаллы, характеризующиеся кристаллографической группой Pnnn.
Предметом, данного изобретения является фармацевтическая композиция в форме таблетки, капсулы, пилюли, порошка, гранулы, жевательной резинки, перорального раствора или суспензии, аэрозоля, имплантата, подкожного, внутримышечного, внутривенного, интраназального, содержащая в качестве активного компонента фармацевтически эффективное количество смеси ПМ-1 и/или ПМ-2 и аморфной фазы гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl).
Вспомогательные вещества выбирают обычно из фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и фармацевтической композиции. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Преимущественно фармацевтическая композиция по данному изобретению представляет собой капсулу, таблетку, пилюлю, порошок, гранулы, жевательную резинку, раствор или суспензию.
Преимущественно фармацевтическая композиция включает от 2,2% до 17,2% активного компонента по данному изобретению и остальное до 100% фармацевтически приемлемые вспомогательные вещества.
Предметом данного изобретения является фармацевтическая композиция в форме таблетки, содержащая от 2,2% до 11,1% или от 2,2% до 17,2% активного компонента по данному изобретению и остальное до 100% фармацевтически приемлемые вспомогательные вещества.
В качестве вспомогательных веществ фармацевтическая композиция в форме таблетки содержит, например, наполнители (лактозу и микрокристаллическую целлюлозу 101), агент свободного потока (аэросил 200), суспендирующий агент (поливинилпиррролидон) и смазочное вещество (стеарат кальция). Таблетка может быть покрыта акриловой энтеросолюбильной пленкой Colorcon Acryl-EZE с замедленным высвобождением.
Предметом изобретения является фармацевтическая композиция в форме капсулы, содержащая от 2,2% до 17,2% активного компонента по данному изобретению и остальное до 100% фармацевтически приемлемые вспомогательные вещества.
В качестве вспомогательных веществ фармацевтическая композиция в форме капсулы содержит, в качестве вспомогательных веществ, например, наполнители (лактозу и микрокристаллическую целлюлозу 101), агент свободного потока (аэросил 200), суспендирующий агент (поливинилпиррролидон), разрыхлитель (натриевый гликолат крахмала) и смазочное вещество (стеарат кальция) или, например, наполнители (лактозу и микрокристаллическую целлюлозу 101), энтеросорбент (кремния диоксид коллоидный), смазочное вещество (гидрогенизированное касторовое масло и магния стеарат) и разрыхлитель (крахмал картофельный 6%).
Предметом изобретения является применение фармацевтическая композиция в форме таблетки, капсулы, пилюли, порошка, гранулы или жевательной резинки, включающей в терапевтически эффективном количестве активный компонент по данному изобретению, в качестве перорального препарата.
Предметом изобретения является пероральный препарат, представляющий собой фармацевтическую композицию в форме таблетки, капсулы, пилюли, порошка, гранулы или жевательной резинки, включающую, в терапевтически эффективном количестве активный компонент по данному изобретению.
Предметом изобретения является также использование в фармацевтически эффективном количестве активного компонента по данному изобретению и фармацевтических композиций на его основе в терапии заболеваний центральной нервной системы (ЦНС).
Предметом изобретения является применение фармацевтической композиции по данному изобретению в терапии расстройств ЦНС пациентов, нуждающихся в этом, в том числе тревожных расстройств и депрессий.
Предметом изобретения является способ лечения и/или профилактики расстройств ЦНС пациентов, нуждающихся в этом, в том числе тревожных расстройств и депрессий, характеризующийся введением пациенту фармацевтической композиции по данному изобретению в терапевтически эффективном количестве.
Предпочтительный способ лечения и/или профилактики расстройств ЦНС пациентов, нуждающихся в этом, в том числе тревожных расстройств и депрессий, согласно изобретению характеризующийся введением пациенту фармацевтической композиции по данному изобретению в дозе по активному компоненту от 2 мг/день до до 60 мг/день в день (в пересчете на основание А).
Доза активного компонента по настоящему изобретению зависит от состояния заболевания, возраста или веса пациента. Дозу можно вводить один раз в день или можно разделить на несколько суточных доз. Соединение по настоящему изобретению можно использовать в комбинации с другими лекарственными средствами (далее называемые комбинированная терапия) для увеличения активности соединения, уменьшения дозы соединения или тому подобного.
Исследование фармакокинетики и безопасности однократных и многократных возрастающих доз активного компонента (2 мг, 4 мг, 10 мг, 20 мг, в пересчете на основание) и многократных возрастающих доз активного компонента 40 мг и 60 мг (в пересчете на основание) в форме таблеток и капсул в день на здоровых добровольцах продемонстрировало благоприятный профиль безопасности и хорошую переносимость активного компонента по данному изобретению и препарата в целом. В исследовании практически не было выявлено нежелательных явлений (НЯ), связанных с приемом препарата (Примеры 7-9).
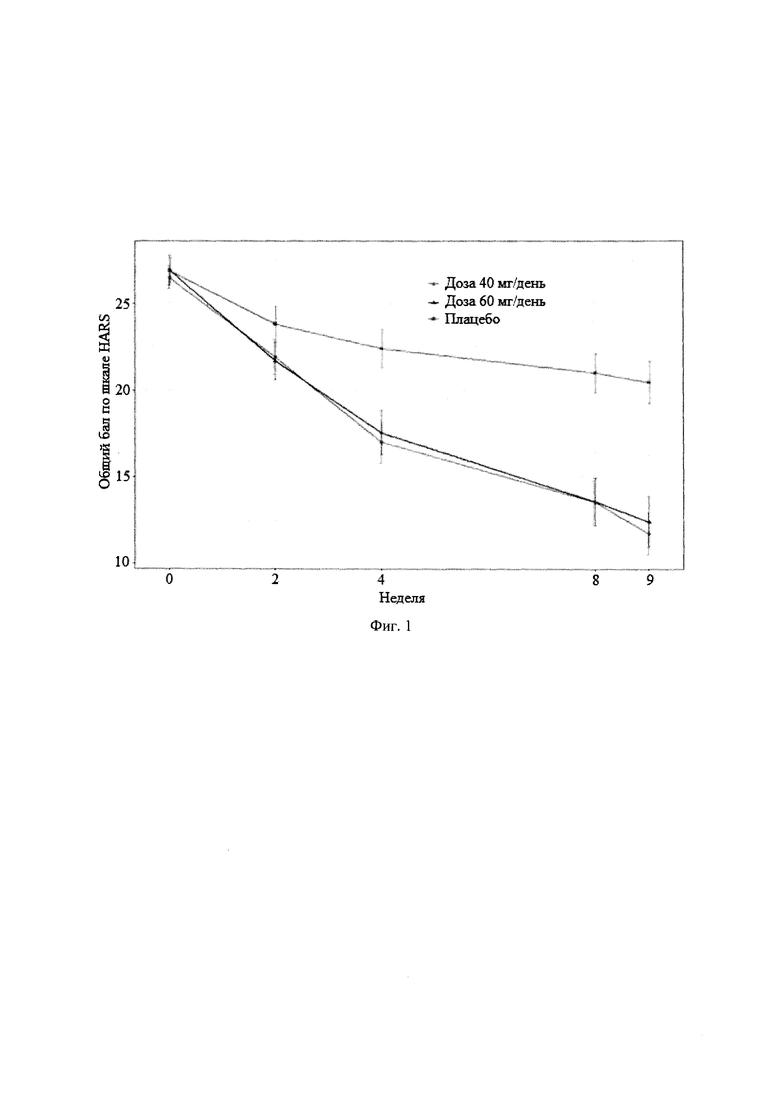
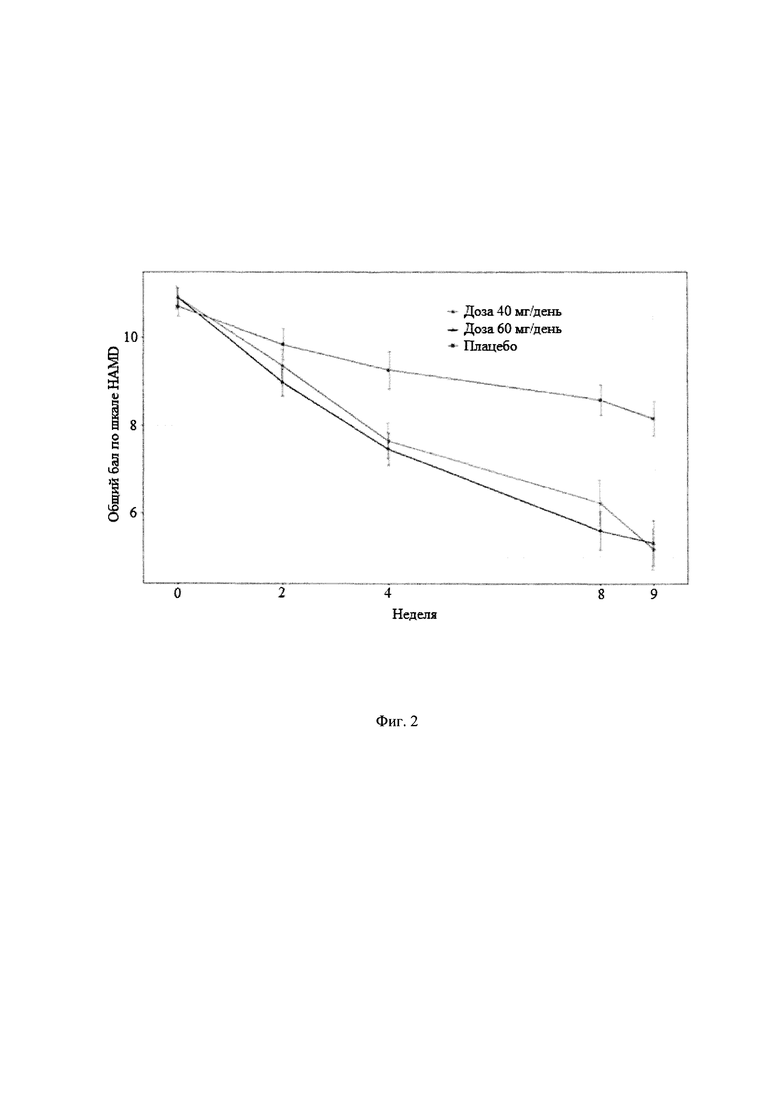
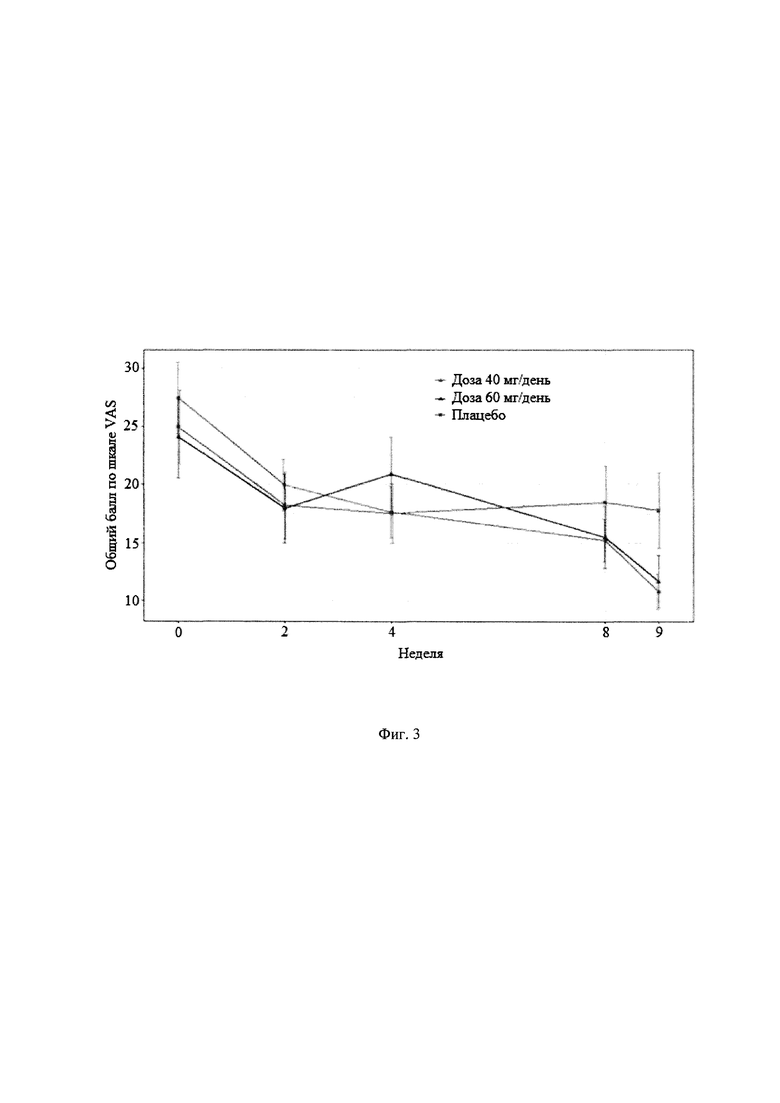
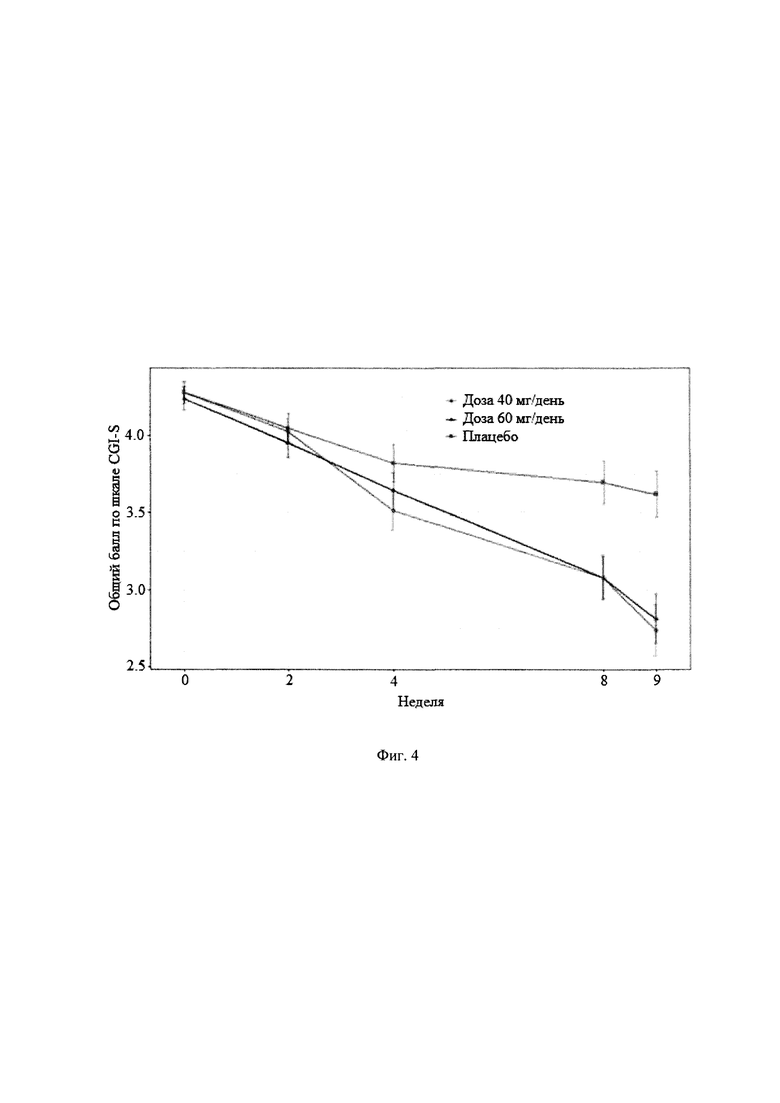
Рандомизированное двойное-слепое плацебо-контролируемое исследование (Пример 9) эффективности и безопасности новой фармацевтической композиции в форме капсул, содержащей активный компонент по данному изобретению, на 129 пациентах с ГТР (группа 1-43 пациента, суточная доза активного компонента 60 мг (в пересчете на основание А); группа 2-43 пациента, суточная доза активного компонента 40 мг (в пересчете на основание А) и группа 3-43 пациента, плацебо) продемонстрировало высокую эффективность (Табл. 2), в том числе по шкале тревоги Гамильтона (HARS) (Табл. 3) и по шкале депрессии Гамильтона (HAMD) (Табл. 4), а также по шкалам визуальной аналоговой шкале (VAS) (Табл. 5), общего клинического впечатления (CGI-S) (Табл. 6) и общего клинического впечатления о динамике состояния (CGI-I) (Табл. 7).
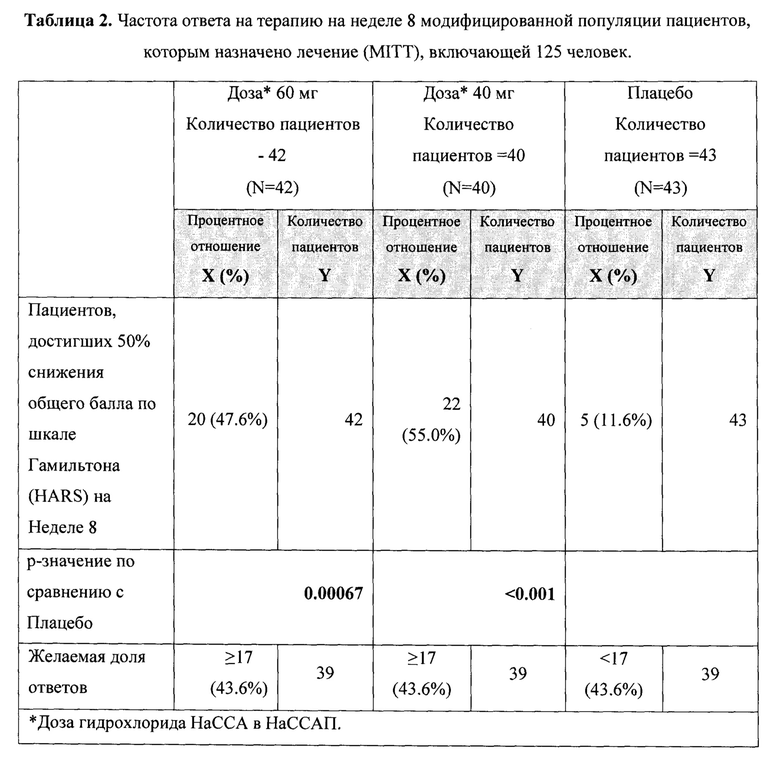
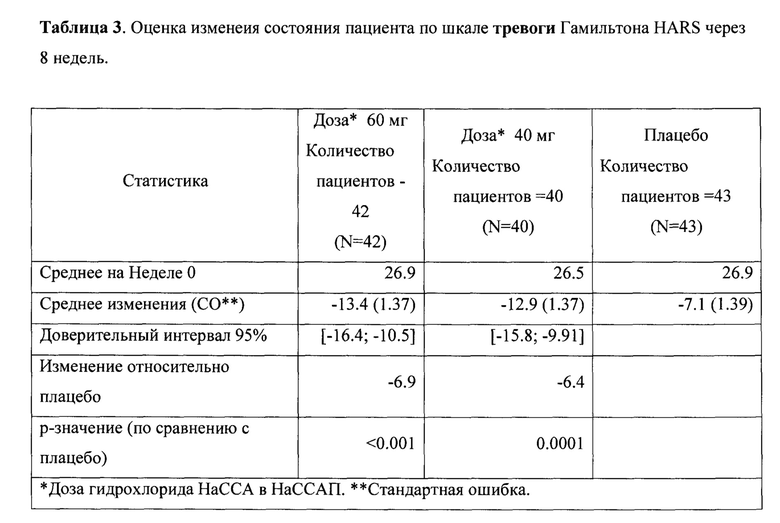
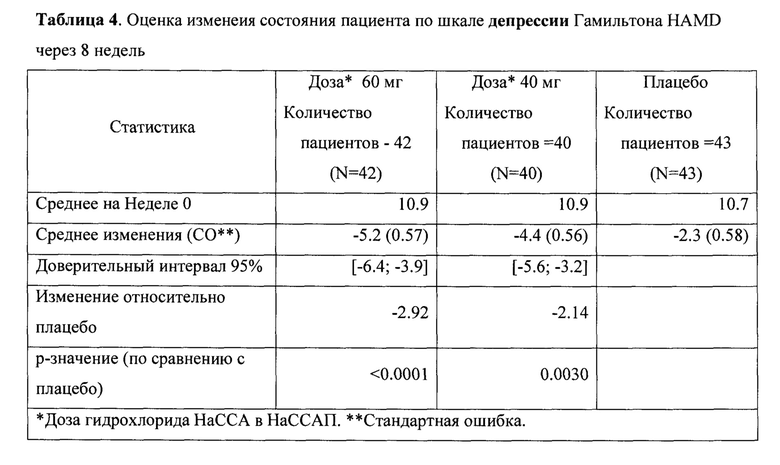
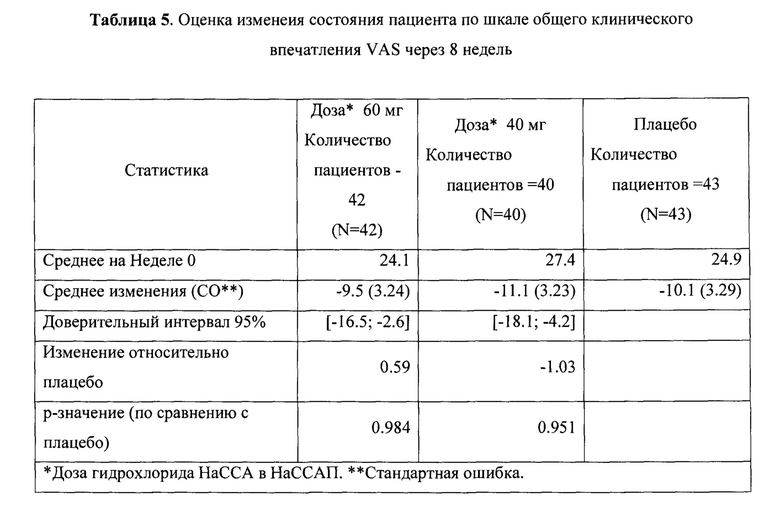
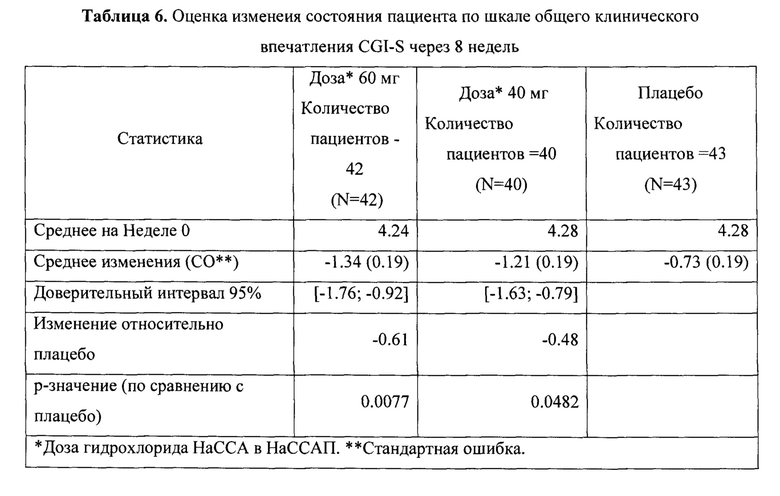
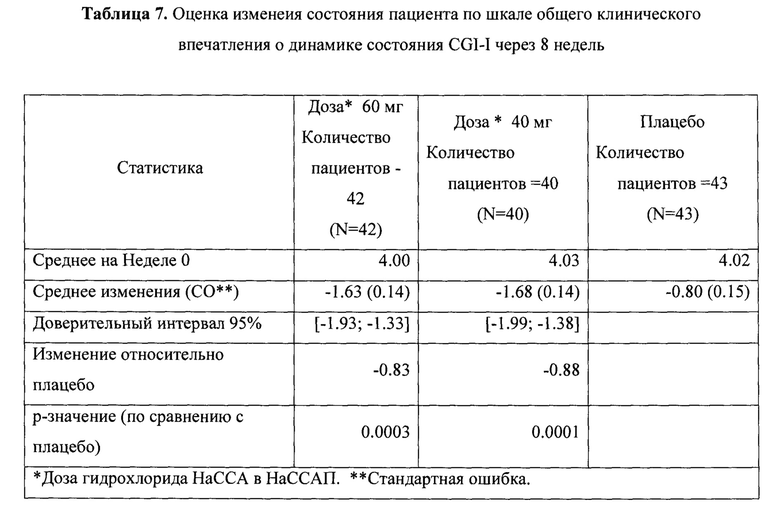
На фигурах 1-5 представлены динамики изменения общего балла по изученным шкалам за время исследования MITT, включающей 125 человек, также подтверждающие высокую эффективность новой фармацевтической композиции в форме капсул, содержащей активный компонент по данному изобретению.
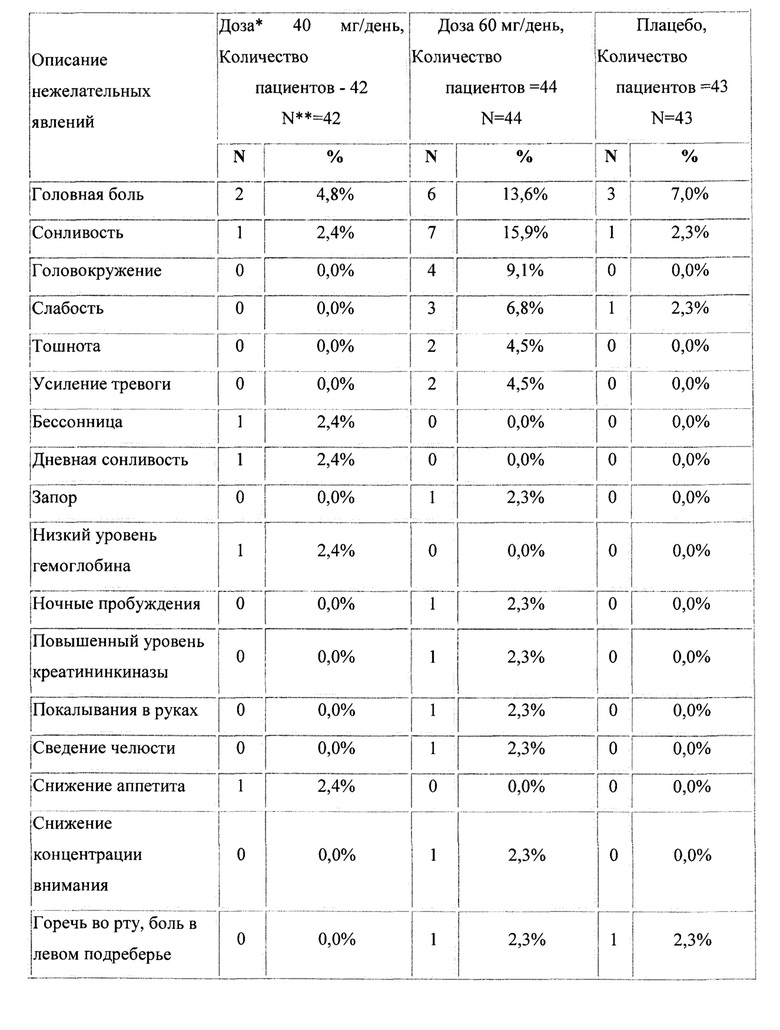
Указанное выше клиническое исследование активного компонента по данному изобретению продемонстрировало у пациентов его благоприятный профиль безопасности и хорошую переносимость (Табл. 8). Доза 40 мг по безопасности близок к плацебо. При дозе 60 мг наблюдаются некоторые побочные эффекты головная боль, сонливость, головокружение, слабость, тошнота, усиление тревоги).


Изобретение иллюстрируется следующими чертежами:
Фиг. 1 Динамика изменения общего балла по шкалам HARS за время исследования MITT, включающей 125 пациентов.
Фиг. 2 Динамика изменения общего балла по шкалам HAMD за время исследования MITT, включающей 125 пациентов.
Фиг. 3 Динамика изменения общего балла по шкалам VAS за время исследования MITT, включающей 125 пациентов.
Фиг. 4 Динамика изменения общего балла по шкалам CGI-S за время исследования MITT, включающей 125 пациентов.
Фиг. 5 Динамика изменения общего балла по шкалам CGI-I за время исследования MITT, включающей 125 пациентов.
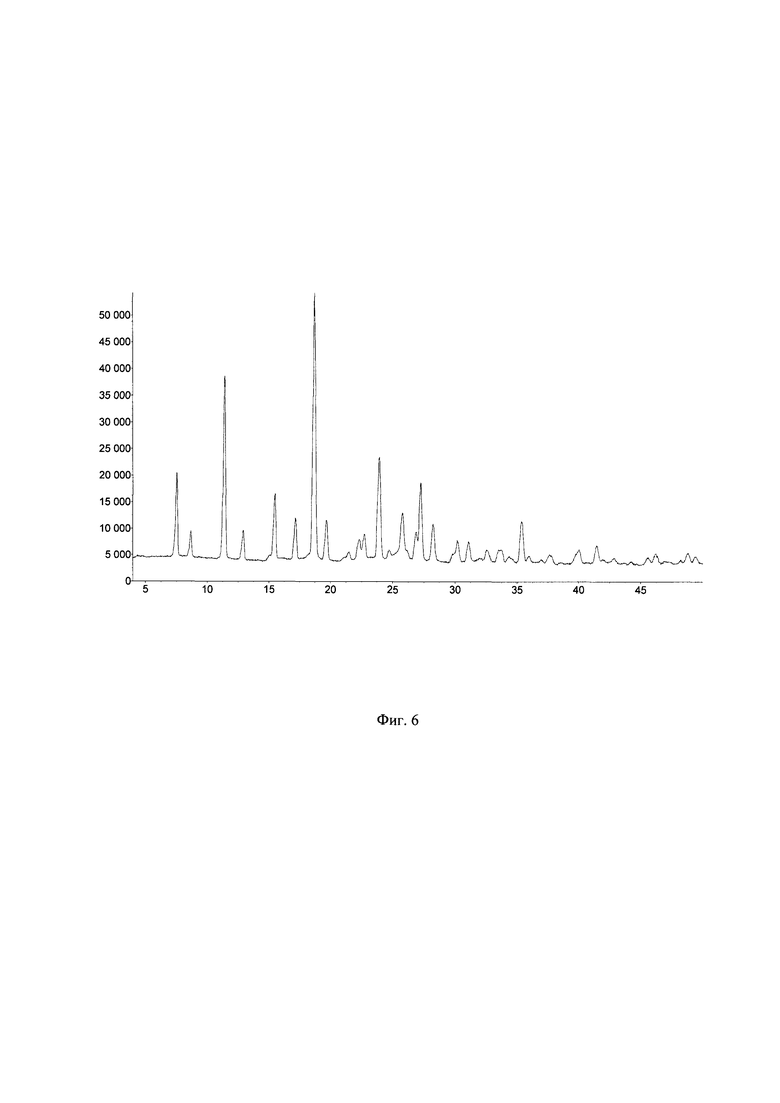
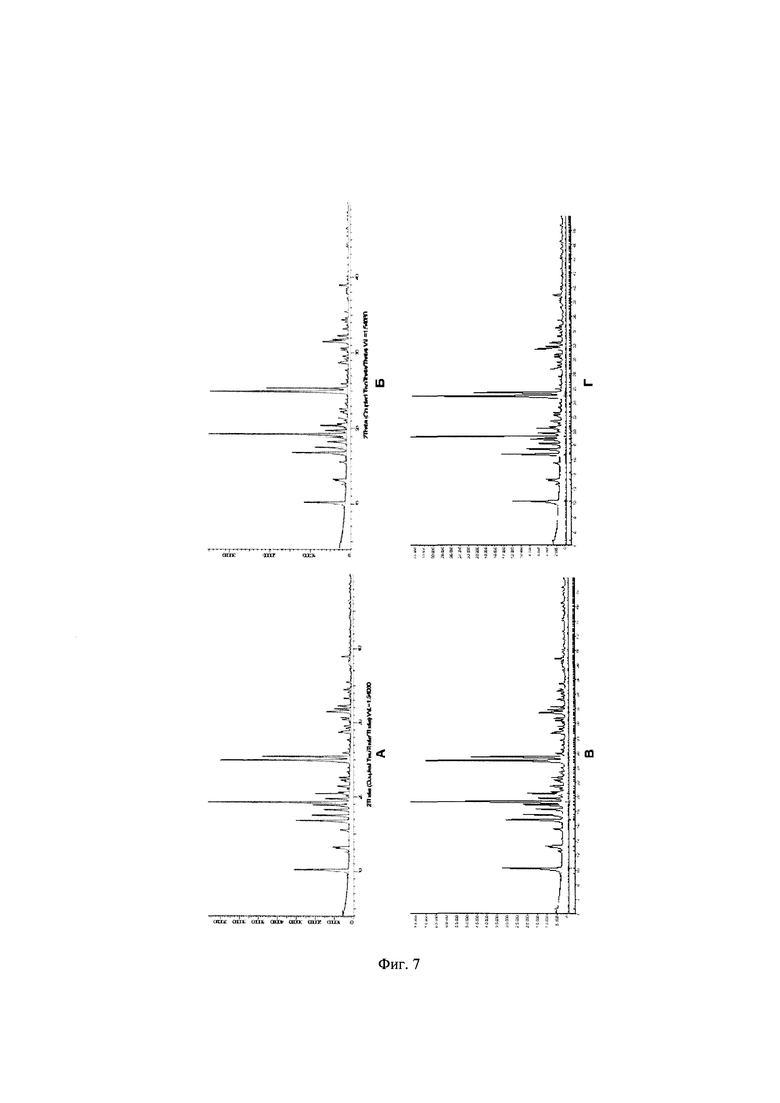
Фиг. 6. Дифрактограмма образца А⋅HCl № 021119А, полученного по примеру 2 перекристаллизацией из смеси соляная кислота - вода в соотношении 1:12.5. Фиг. 7. Общий вид дифрактограмм образцов А⋅HCl №0050120 (А), №050120МП (Б) и теоретические (красная линия) и экспериментальные (синяя линия) дифрактограммы образцов А⋅HCl № 050120 (В) и №050120МП (Г), полученных по примеру 4 перекристаллизацией из изопропанола, и их разность (серая линия).
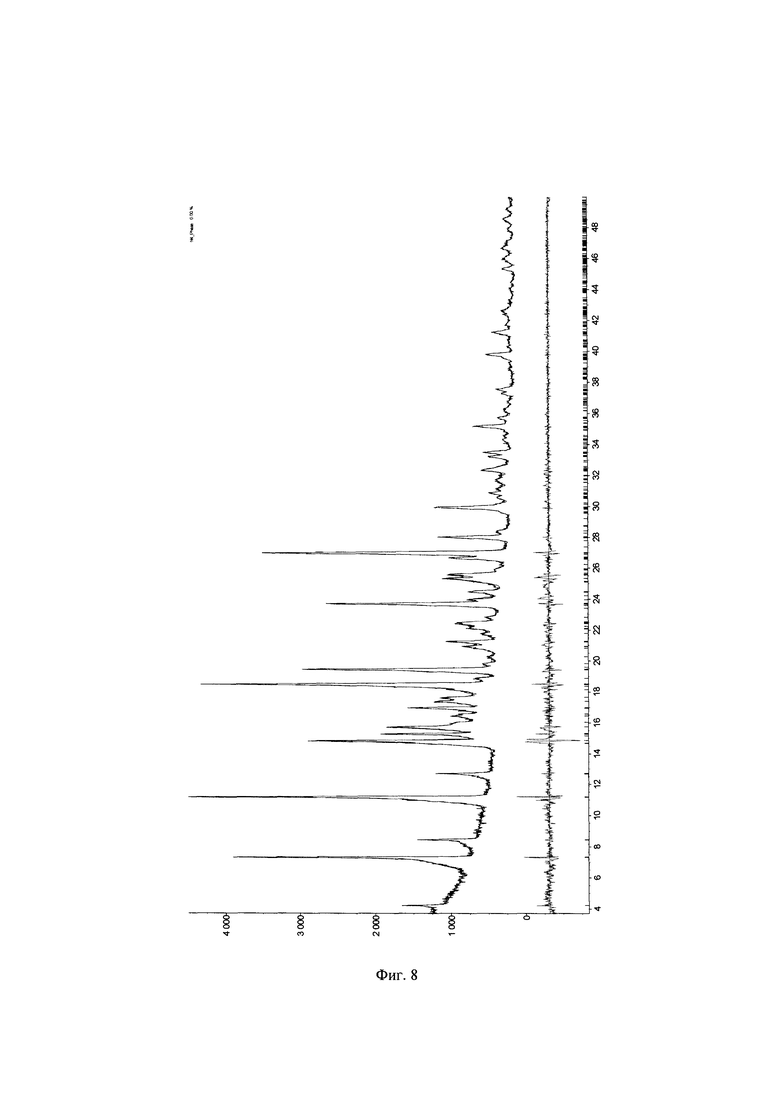
Фиг. 8. Теоретическая и экспериментальная (красная и синяя линии) дифрактограммы кристаллического образца А⋅HCl №041119А полученного по примеру 5 перекристаллизацией из этанола, и их разность (серая линия).
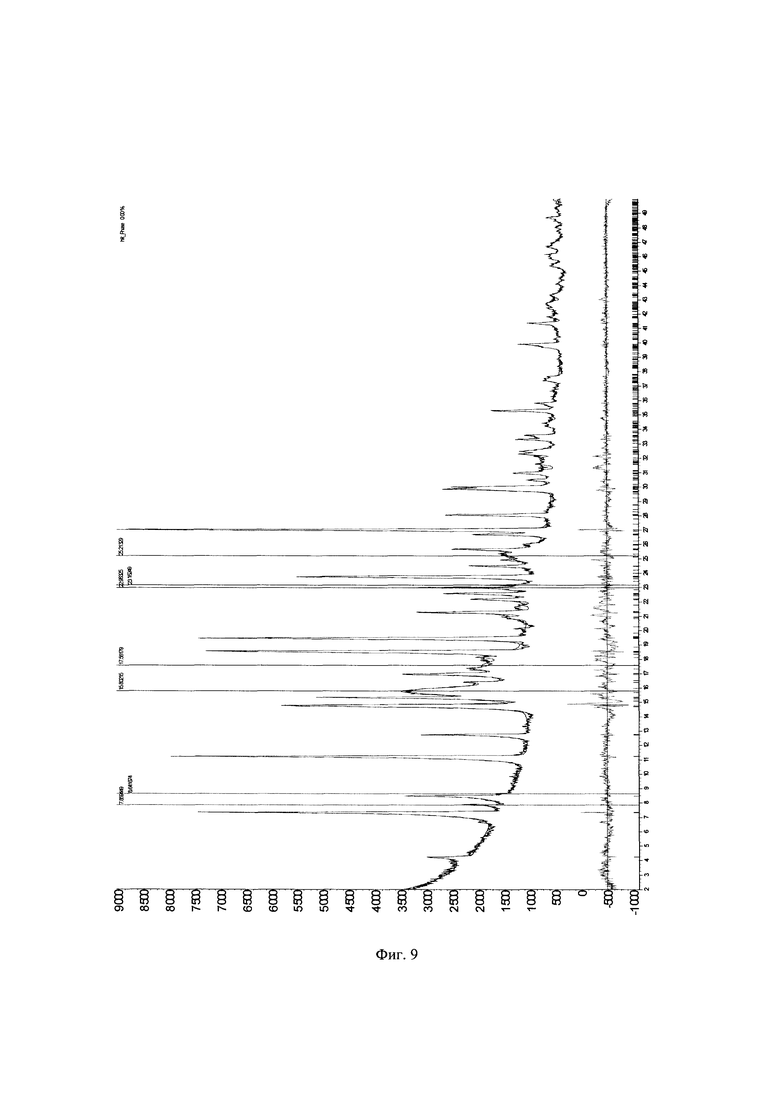
Фиг. 9. Теоретическая и экспериментальная (красная и синяя линии) дифрактограммы образца А⋅HCl №111611 и их разность (серая кривая). Синими вертикальными линиями отображены положения пиков примесей.
Данное изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1. Синтез гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl). 4-Метилфенилгидразин гидрохлорид (А1⋅HCl) (2230 г, 14 моль) загружают в 20- литровый реактор, прибавляют воду (6 л) и метилтретбутиловый эфир (6 л). К полученной суспензии при перемешивании порциями прибавляют гидроксид натрия (843 г, 21 моль). Смесь перемешивают 40 мин. до полного растворения исходного гидрохлорида, перемешивание останавливают, смесь расслаивается. Нижний водный слой сливают через донный кран. Включают нагрев, отгоняют метилтретбутиловый эфир (5 л). Нагрев отключают, к остывшей реакционной массе при перемешивании прибавляют диметилсульфоксид (1,4 л), гексан (2,1 л), предварительно истертый в ступке гидроксид калия (39 г, 0.7 моль) и 2196 г, (21 моль) стирола (А6). Реакционную массу нагревают до кипения и кипятят с насадкой Дина-Старка 20-30 ч. По окончании реакции (исчезновение исходного (А1⋅HCl), контроль ТСХ) сначала отключают нагрев, затем перемешивание. К остывшей реакционной массе прибавляют воду (5-7 объемов) и экстрагируют смесь метилтретбутиловым эфиром (3×5 л). Объединенные органические фракции фильтруют через целит (281 г) и концентрируют в вакууме на роторном испарителе. К остатку при интенсивном перемешивании аккуратно прибавляют концентрированную соляную кислоту (1.27 л), полученный осадок переносят на фильтр, промывают гексаном (4,2 л) и сушат. Получают 2600 г (70%) гидрохлорида 1-(4-метилфенил)-1-(2-фенэтил)гидразина (А7⋅HCl). 1Н ЯМР (400 МГц, ДМСО) δ мд=10.54 (с, 3Н), 7.35-7.04 (м, 9Н), 3.78-3.61 (м, 2Н), 2.85-2.71 (м, 2Н), 2.28 (с, 3Н).
Пример 2. Синтез гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1Н-пиридо[4,3-b]индола (A⋅HCl). Смешивают в 100 л реакторе 10 г гидрохлорида 1-(4-метилфенил)-1-(2-фенэтил)гидразина (А7⋅HCl) и 5.5 г N-метилпиперидона-4 (А2) в 20 мл этанола. Полученную смесь перемешивают до полного растворения, постепенно прибавляют 10 мл концентрированной соляной кислоты и кипятят в течение 4-6 ч, контролируя прохождение реакции по ТСХ. После полной конверсии А7⋅HCl нагрев отключают и прибавляют 125 мл воды. Перемешивание отключают, реакционную массу оставляют при комнатной температуре. Через выпавшие кристаллы отфильтровали и высушили на воздухе. Получали 12 г (88%) целевого продукта А⋅HCl. 1Н ЯМР (400 МГц, ДМСО) δ мд=11.23 (s, 1Н), 7.38 (d, J=8.3 Hz, 1Н), 7.31-7.16 (m, 4H), 7.11 (d, J=6.9 Hz, 2H), 6.98 (d, J=8.1 Hz, 1H), 4.81-3.88 (m, 4H), 3.57 (s, 1H), 3.35 (s, 1H), 3.13-2.78 (m, 6H), 2.67 (s, 1H), 2.38 (s, 3H).
Полученный продукт А⋅HCl (образец №021119А) исследован рентгенофазовым методом на дифрактометре Bruker D8 Advance, оборудованном германиевым монохроматором и системой щелей для монохроматизации и фокусировки (λ[CuKα]=1.5406 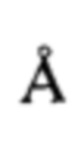 ), а также позиционно-чувствительным детектором LynxEye, в угловом диапазоне 4-50° с шагом 0.02° по углу 2θ. Съемка осуществлялась в режиме пропускания рентгеновского излучения через образец. Навеска образца весом 50 мг растиралась в ступке в течение 1-2 минут, после чего была насыпана на пленку из майлара (Chemplex), после чего тонкий слой образца был зажат в прободержателе между двумя пленками. Далее проводились измерения дифракционной картины в течение ~4 часов. Полученную дифрактограмму (Фигура 6) не удалось проидентифицировать, что свидетельствует о поликристалличности полученного образца.
), а также позиционно-чувствительным детектором LynxEye, в угловом диапазоне 4-50° с шагом 0.02° по углу 2θ. Съемка осуществлялась в режиме пропускания рентгеновского излучения через образец. Навеска образца весом 50 мг растиралась в ступке в течение 1-2 минут, после чего была насыпана на пленку из майлара (Chemplex), после чего тонкий слой образца был зажат в прободержателе между двумя пленками. Далее проводились измерения дифракционной картины в течение ~4 часов. Полученную дифрактограмму (Фигура 6) не удалось проидентифицировать, что свидетельствует о поликристалличности полученного образца.
Пример 3. Синтез гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1Н-пиридо[4,3-b]индола (А⋅HCl). Полученный 1-(4-метилфенил)-1-(2-фенэтил)гидразин гидрохлорид (А7⋅HCl) (2500 г, 9,5 моль) помещают в 100-литровый реактор, снабженный механической мешалкой, прибавляют этанол (5 л) и N-метилпиперидон-4 (А2) (1184 г, 10,5 моль). Смесь перемешивают до полного растворения А7⋅HCl и постепенно прибавляют концентрированную соляную кислоту (1,24 л). Смесь нагревают дл кипения и кипятят, контролируя прохождение реакции по ТСХ. Через 8 часов наблюдали полную конверсию А7⋅HCl. Нагрев отключают, реакционной массе дают остыть до комнатной температуры и прибавляют воду (40 л) при интенсивном перемешивании. Через 30-40 минут начинает выпадает осадок. Реакционную массу оставляют перемешиваться на ночь. Перемешивание отключают, осадок отфильтровывают, промывают небольшим количеством воды и сушат сначала на воздухе, затем в вакууме до постоянной массы. Получают 2987 г (92%) А⋅HCl.
Пример 4. Получение кристаллической формы 1 (КФ1) гидрохлорида 2,8-диметил-5-(2-фенилэтил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (A⋅HCl). Растворяют при интенсивном перемешивании и кипячении 2987 г полученного в примере 3 А-НС1 в 76,2 л изопропанола. Нагрев отключают, реакционную смесь оставляют перемешиваться на 12 ч. Выпавший кристаллический осадок отфильтровывают, промывают небольшим количеством изопропанола и сушат в вакууме при температуре ниже 50°С до постоянной массы. Получают 2021 г (70%) А⋅HCl (кристаллический образец №050120). 1Н ЯМР (400 MHz, ДМСО) δ мд = 11.35 (s, 1H), 7.38 (d, J=8.3 Hz, 1H), 7.32-7.15 (m, 4H), 7.11 (d, J=6.8 Hz, 2H), 6.98 (d, J=8.3 Hz, 1H), 4.63-4.02 (m, 4H), 3.56 (s, 1H), 3.29 (s, 1H), 3.09-2.76 (m, 6H), 2.67 (s, 1H), 2.38 (s, 3Н). Маточный раствор после кристаллизации А⋅HCl упаривают на роторном испарителе, остаток промывают на фильтре изопропиловым спиртом (2 л) и сушат на воздухе до постоянной массы. Получают дополнительно 547 г, который помещают в 30-литровый реактор, прибавляют 14.5 л изопропилового спирта и нагревают смесь до кипения при перемешивании. Нагрев отключают после полного растворения осадка. Реакционную смесь оставляют перемешиваться 12 ч. Выпавший осадок отфильтровывают, промывают небольшим количеством изопропилового спирта и сушат в вакууме при температуре меньше 50°С до постоянной массы. Получают 383 г (70%) А⋅HCl (кристаллический образец №050120) идентичного по данным рентгенофазового анализа основному кристаллическому образецу А⋅HCl №050120, который соответствует ромбической кристаллографической группе Pbca (ПМ-1) с объемом ячейки 3813.4(2)  и параметрами решетки а=10.5074(2)
и параметрами решетки а=10.5074(2) 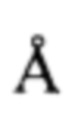 , b=37.360(2)
, b=37.360(2) 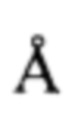 и с=9.7144(2)
и с=9.7144(2) 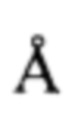 (Фигура 7, Таблица 9). Съемка образцов проведена на порошковом рентгеновском дифрактометре Bruker D8 Advance Vario, оснащенным Ge 111 монохроматором и позиционно-чувствительным детектором LynxEye. Съемка осуществлялась в режиме пропускания рентгеновских лучей через образец, зажатый между двумя майларовыми пленками, с вращением образца. Описание дифрактограмм производилось в программном комплексе TOPAS.
(Фигура 7, Таблица 9). Съемка образцов проведена на порошковом рентгеновском дифрактометре Bruker D8 Advance Vario, оснащенным Ge 111 монохроматором и позиционно-чувствительным детектором LynxEye. Съемка осуществлялась в режиме пропускания рентгеновских лучей через образец, зажатый между двумя майларовыми пленками, с вращением образца. Описание дифрактограмм производилось в программном комплексе TOPAS.
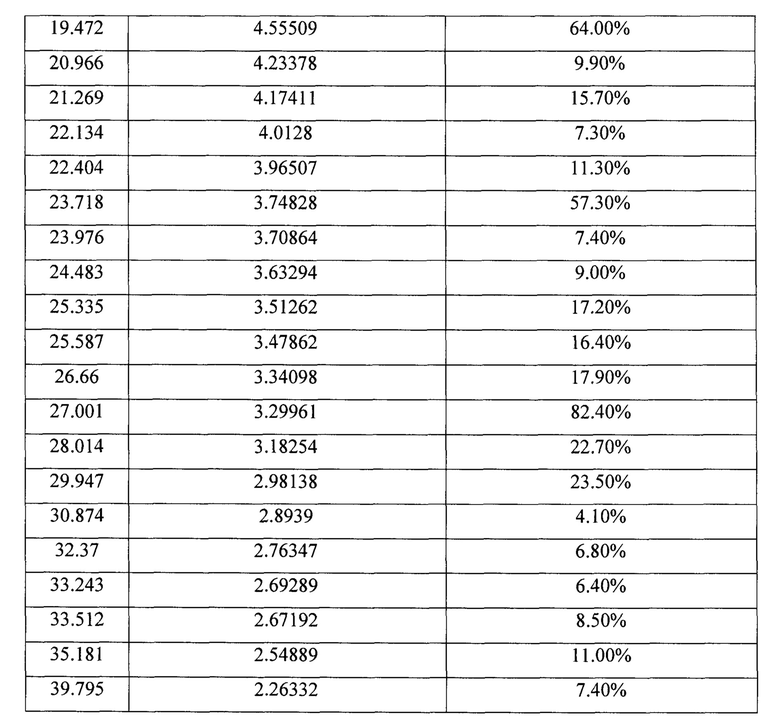
Пример 5. Получение кристаллической формы КФ2 гидрохлорида 2,8-диметил-5-(2-фенилэтил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl). Растворяют при интенсивном перемешивании и кипячении 25 г А⋅HCl1 в 0,66 л этанола. Нагрев отключают, реакционную смесь оставляют перемешиваться на сутки. Выпавший осадок отфильтровывают, промывают небольшим количеством изопропанола и сушат в вакууме при температуре ниже 50°С до постоянной массы. Получают 12,5 г (50%) А⋅HCl (кристаллический образец №041119А). 1Н ЯМР (400 MHz, ДМСО) δ мд=11.39 (с, 1Н), 7.37 (д, J=8.3 Гц, 1Н), 7.30-7.15 (м, 4Н), 7.11 (д, J=6,8 Гц, 2Н), 6.98 (д, J=9.2 Гц, 1H), 4.79-3.85 (м, 4Н), 3.7-3.19 (м, 2Н), 3.17-2.76 (м, 6Н), 2,75-2.55 (м, 1Н), 2.38 (с, 3Н). Полученный кристаллический образец №041119А представляет собой ромбические кристаллы, характеризующиеся кристаллографической группой Pnnn (ПМ-2) с объемом ячейки 6042.4(3)  и параметрами решетки а=41.673(8)
и параметрами решетки а=41.673(8)  , b=24.107(7)
, b=24.107(7) 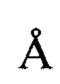 и с=6.0141(17)
и с=6.0141(17) 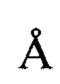 (Фигура 8, Таблица 10). Съемка образцов проведена на порошковом рентгеновском дифрактометре Bruker D8 Advance Vario, оснащенным Ge 111 монохроматором и позиционно-чувствительным детектором LynxEye. Съемка осуществлялась в режиме пропускания рентгеновских лучей через образец, зажатый между двумя майларовыми пленками, с вращением образца. Описание дифрактограмм производилось в программном комплексе TOPAS.
(Фигура 8, Таблица 10). Съемка образцов проведена на порошковом рентгеновском дифрактометре Bruker D8 Advance Vario, оснащенным Ge 111 монохроматором и позиционно-чувствительным детектором LynxEye. Съемка осуществлялась в режиме пропускания рентгеновских лучей через образец, зажатый между двумя майларовыми пленками, с вращением образца. Описание дифрактограмм производилось в программном комплексе TOPAS.

Пример 6. Получение полиморфной смеси, включающего ПМ-2 и аморфную фазу.
Смешивают 394,5 г (1.74 моль) А7⋅HCl, 217 г (1,92 моль) N-метилпиперидона-4 и 0,91 л этанола. Смесь перемешивают до полного растворения А7⋅HCl и прикапывают концентрированную соляную кислоту (370 мл). Реакционную смесь кипятят 4-6 часов, контролируя прохождение реакции по ТСХ. Нагрев отключают, реакционной массе дают остыть до комнатной температуры и прибавляют 8 л воды при интенсивном перемешивании. Через 30-40 минут выпадает осадок. Реакционную массу оставляют перемешиваться на ночь. Перемешивание отключают, осадок отфильтровывают, промывают небольшим количеством воды и сушат сначала на воздухе, затем в вакууме до постоянной массы. Выход А⋅HCl (образец №111611) 529 г (89%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 11.19 (ш. с, 1Н), 7.45-7.34 (м, 1Н), 7.31-7.15 (м, 4Н), 7.14-7.06 (м, 2Н), 7.04-6.93 (м, 1H), 4.58-4.09 (м, 4Н), 3.68-3.50 (м, 1Н), 3.36-3.20 (м, 1H), 3.08-2.79 (м, 6Н), 2.74-2.58 (м, 1H), 2.38 (с, 3Н). Дифрактограммы полученного образца №111611 представлен на фигуре 5. Положения большинства пиков на дифрактограмме образца №111611 (Фигура 5) и на дифрактограмме образца №041119А (Фигура 4) схожи, но для образца №111611 на дифрактограмме также наблюдается несколько пиков примеси. Стоит отметить, что эти пики имеют разную ширину, из чего можно заключить, что в образце присутствуют как минимум две фазы: кристаллическая (ПМ-2) и аморфная. Доля интенсивности пиков аморфной примеси в образце составляет 25%.
Пример 7. Пероральный препарат по данному изобретению, представляющий собой фармацевтическую композицию в виде таблеток. Предварительно просеянный на вибросите активный компонент по данному изобретению, моногидрат лактозы 200, диоксид кремния коллоидный (аэросил), поливинилпирролидон и стеарат кальция в миксере с высоким сдвиговым усилием и спрессовывают в бар. Полученный брусок измельчали в гранулы и просеивали через сито, чтобы собрать гранулы размером 14-16 меш. Полученные таким образом гранулы были спрессованы в форме двойных вогнутых таблетки, которые были покрыты водной акриловой энтеросолюбильной пленкой Colorcon Acryl-EZE с замедленным высвобождением. Полученный пероральный препарат по данному изобретению (Таблица 11) в виде таблеток использовался далее в клинических исследованиях.

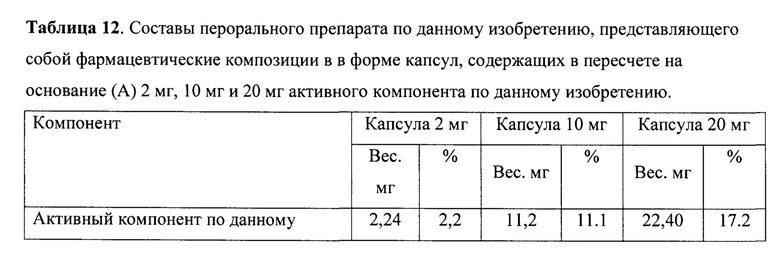
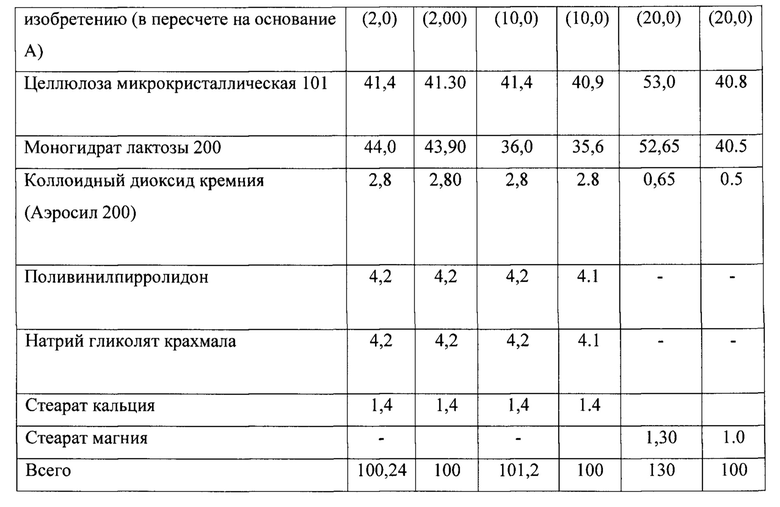
Пример 8. Пероральный препарат по данному изобретению, представляющий собой фармацевтическую композицию в форме капсулы. Активный компонент по данному изобретению, целлюлоза микрокристаллическая 101, моногидрат лактозы 200, диоксид кремния коллоидный (аэросил), стеарат кальция, поливинилпирролидон и натриевый гликолат крахмала просеиваются на вибросите (диаметр ячеек сита 0,5 мм). Просеянные компоненты отвешиваются в отдельные емкости в необходимом соотношении. Целлюлозу микрокристаллическую и гидрохлорид (А⋅HCl) загружаются в миксер с высоким сдвиговым усилием. Проводят перемешивание в течение 60 секунд при скорости вращения основной мешалки 350±100 об/мин и скорости вращения чоппера 900±100 об/мин. По истечении 60 секунд загружают моногидрат лактозы 200 и продолжают перемешивание при тех же параметрах в течение 60 секунд. Затем последовательно загружают кремния диоксид коллоидный, поливинилпирролидон и натриевый гликолат крахмала и продолжают после каждого компонента перемешивание при тех же параметрах в течение 60 секунд. Затем загружают стеарат кальция и проводят перемешивание в течение 40 секунд при скорости вращения основной мешалки 200±100 об/мин. Полученную фармацевтическую композицию капсулируют на капсульной машине в капсулы №4 с корпусом и крышечкой белого цвета. Получают пероральный препарат по данному изобретению в виде фармацевтической композиции в форме капсул (таблица 12), который использовался далее в клинических исследованиях.
Пример 9. Пероральный препарат по данному изобретению, представляющий собой фармацевтическую композицию в форме капсулы. Активный компонент по данному изобретению, лактоза безводная, крахмал картофельный 6%, гидрогенизированное касторовое масло (Kolliwax НСО) - взвешиваются в отдельные емкости и просеиваются на грохоте вибрационном (диаметр ячеек сита 0,5 мм). Просеянные компоненты отвешиваются в отдельные емкости. Затем А⋅HCl в виде кристаллической формы I или II, лактоза безводная, крахмал картофельный 6% загружаются в смеситель Ренское колесо, проводят перемешивание в течение 15 минут. По истечении 15 минут загружают гидрогенизированное касторовое масло и продолжают перемешивание в течение 3 минут. Получают фармацевтическую композицию, которую загружают в роллерный компактер проводят компактирование при скорости питателя 20±10 об/мин, давлении 25±5 кН, скорости вращения роликов 8±2 об/мин, скорости вращения калибратора 150±50 об/мин, диаметр ячеек калибратора 0,6 мм. Полученный гранулят фармацевтической композиции просеивают на вибрационном грохоте через сито с диаметром ячеек 0,5 мм.
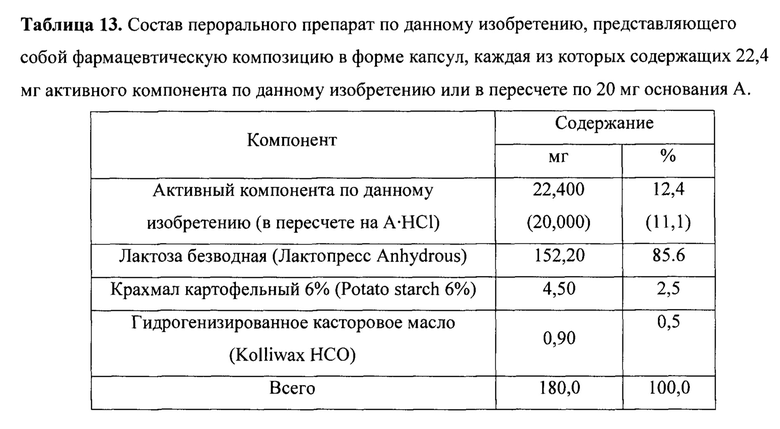
Просеянный гранулят фармацевтической композиции загружают в смеситель Ренское колесо перемешивание в течение 5 минут и капсулируют на капсульной машине в капсулы №4 с корпусом и крышечкой белого цвета. Получают пероральный препарат по данному изобретению, представляющий собой фармацевтическую композицию в форме капсул, состав которой приведен в таблице 13, который использовался далее в клинических исследованиях.
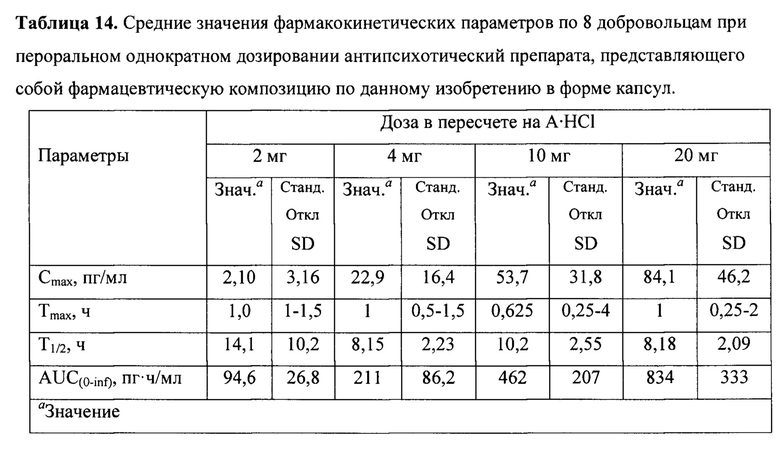
Пример 10. Клиническое исследование безопасности перорального препарат по данному изобретению. Открытое клиническое исследование фармакокинетики антипсихотический препарата, представляющего собой фармацевтическую композицию по данному изобретению в форме капсул проводилось при однократном пероральном введении у 32 здоровых добровольцев в дозах 2 мг/день (когорта 1, 8 добровольцев), 4 мг/день (когорта 1, 8 добровольцев), 10 мг/день (когорта 1, 8 добровольцев) и 20 мг/день (когорта 1, 8 добровольцев), пересчитанных на основание (А), в соответствии с рекомендациями «Надлежащей клинической практикой (GCP)» на физически и психически здоровых мужчинах в возрасте 20-50 лет с индексом массы тела 20-55. Результаты проведенного исследования показывают, что антипсихотический препарат, представляющий собой фармацевтическую композицию по данному изобретению в форме капсул, хорошо переносится в однократных дозах 2, 4, 10 и 20 мг и не оказывает существенного влияния на параметры плазмы и мочи, а также не продлевает интервал QT. Побочные эффекты, такие как сонливость, возбуждение и парестезия, наблюдались в когорте по 20 мг. Среднее время полужизни по гармонике достигло 14 часов с линейным увеличением Cmax и AUC в диапазоне доз от 2 до 20 мг, при этом максимальная концентрация в крови основания (А) достигается примерно через час (Табл. 14).
Пример 11. Исследование безопасности возрастающих доз перорального препарата по данному изобретению, представляющего собой фармацевтическую композицию по данному изобретению в форме капсул. Клиническое исследование безопасности возрастающих доз антипсихотический препарата, представляющего собой фармацевтическую композицию по данному изобретению в форме капсул, при однократном и многократном дозировании. В исследовании была включена одна когорта из 4 добровольцев, принимающих антипсихиатрический препарат однократно в дозе 20 мг, а затем в той же дозе 2 раза в день в течение 4 дней. На основании данных по безопасности в когорте 20 мг при приеме антипсихиатрического препарата 2 раза в день, полученных до Недели 3 (включительно), независимый комитет по мониторингу данных безопасности принял решение о включении второй когорты из 4 добровольцев, в которой исследуемый антипсихиатрический препарат принимался в дозе 20 мг однократно, а затем в той же дозе 3 раза в день в течение 4 дней.
В рамках проведенного исследования, антипсихотический препарат продемонстрировал благоприятный профиль безопасности и хорошую переносимость. В исследовании не было выявлено нежелательных явлений (НЯ), связанных с приемом препарата. Данные НЯ наблюдались только у добровольцев, получавших суточную дозу 60 мг. Остаточная концентрация антипсихотический препарата стабилизировалась через 1 -2 суток после начала регулярного приема препарата. Фактор накопления (Fc) составил 2,5 в когорте 40 мг и 2,1 в когорте 60 мг.
Время пиковой концентрации антипсихотический препарата (Tmax) у большинства добровольцев не резко выражено и варьирует от 0,5 часов до 4 часов (медиана 0,75 часов в когорте 40 мг и 2,3 часа в когорте 60 мг). При многократном применении вариабельность Tmax сохраняется в таких же пределах 0,3-4 часа (медиана 0,38 часов в когорте 40 мг и 1,0 час в когорте 60 мг). Tmax метаболита наблюдается в тех же временных рамках, что свидетельствует о быстром его образовании из исходного вещества. При однократном приеме средний период полувыведения антипсихотический препарата в когорте 40 мг составил 10,3±5,4 часа, в когорте 60 мг - 7,3±2,6 часа. После многократного приема наблюдается тенденция к небольшому увеличению Т1/2 для большинства добровольцев, в среднем - в 1,4 раза.
Пример 12. Эффективность и безопасности перорального препарата по данному изобретению, представляющего собой фармацевтическую композицию по данному изобретению в форме капсул. Многоцентровое рандомизированное двойное-слепое плацебо-контролируемое исследование эффективности и безопасности антипсихиатрического препарата у людей с генерализированным тревожным расстройством (ГТР) проводилось в течение 8 недель в трех когортах из 43 пациентов каждая: когорта 1-40 мг антипсихотического препарата (2 раза по 20 мг) в сутки; когорта 2-60 мг антипсихотического препарата (3 раза по 20 мг) в сутки и когорта 3 - плацебо. За время исследования проведено 3 плановых визита на Неделе 2, Неделе 4 и Неделе 8 для оценки параметров эффективности и безопасности проводимой терапии, а также учета и выдачи препарата. На всех визитах была проведена проверка дневника пациента, учет исследуемого препарата и оценена комплаентность пациентов. Также были оценены нежелательные явления, сопутствующая терапия и жизненные показатели, проведены тесты на запрещенные препараты по моче, оценка по шкале тревоги Гамильтона (HARS), шкале депрессии Гамильтона (HAMD), шкале общего клинического впечатления (CGI-S), шкале общего клинического впечатления о динамике состояния (CGI-I) и визуальной аналоговой шкале (VAS); женщинам, способным к деторождению, будет выполнен тест на беременность по моче. На визитах Неделя 4 и Неделя 8 также было проведено физикальное обследование, измерена масса тела, выполнена ЭКГ в 12 отведениях и получены образцы крови и мочи для лабораторных исследований: общий и биохимический анализ крови, ФК до и через 1 час после приема ИП, общий анализ мочи. На Неделе 4 был также получен образец крови для генотипирования по CYP2D6. На визите Неделя 8 лечение по группам было завершено и всем пациентам было назначено плацебо для приема во время периода наблюдения. Последующее наблюдение за пациентами продлилось 1 неделю. За это время было оценено возможное развитие синдрома отмены ИП на фоне приема плацебо. На визите Неделя 9 была проведена проверка дневника пациента, учет исследуемого препарата и оценена комплаентность пациентов. Также были оценены нежелательные явления, сопутствующая терапия и жизненные показатели, проведен тест на запрещенные препараты по моче, проведена оценка по шкале тревоги Гамильтона (HARS), шкале депрессии Гамильтона (HAMD), шкале общего клинического впечатления (CGI-S), шкале общего клинического впечатления о динамике состояния (CGI-I) и визуальной аналоговой шкале (VAS); женщинам, способным к деторождению, будет выполнен тест на беременность. На этом участие пациентов в исследовании было завершено, и они получили рекомендации по дальнейшему лечению в рамках стандартной терапии ГТР.
Основные результаты эффективности антипсихотического препарата в терапии ГТР представлены в таблицах 2-7, а динамика изменения общих баллов по шкалам тревоги Гамильтона (HARS), депрессии Гамильтона (HAMD), общего клинического впечатления (CGI-S), общего клинического впечатления о динамике состояния (CGI-I) и визуальной аналоговой шкале (VAS) представлены на фигурах 1-5. Эти данные убедительно подтверждают эффективность антипсихотического препарата при лечении ГТР, в том числе по шкале тревоги (HARS) и по шкале депрессии (HAMD), и его благоприятный профиль безопасности и хорошую переносимость (Таблица 8). Доза 40 мг по безопасности близок к плацебо. При дозе 60 мг наблюдаются некоторые нежелательные явления головная боль, сонливость, головокружение, слабость, тошнота, усиление тревоги).
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИГАНДЫ АЛЬФА-АДРЕНОЦЕПТОРОВ, ДОПАМИНОВЫХ, ГИСТАМИНОВЫХ, ИМИДАЗОЛИНОВЫХ И СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2407744C2 |
| ЗАМЕЩЕННЫЕ 2,3,4,5-ТЕТРАГИДРО-1Н-ПИРИДО[4,3-b]ИНДОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2007 |
|
RU2334747C1 |
| ТЕТРАГИДРО-ПИРАЗОЛО[1,5-a]ПИРИДО-ПИРИМИДИНЫ - АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2008 |
|
RU2391343C1 |
| ЗАМЕЩЕННЫЕ 2-АМИНО-3-СУЛЬФОНИЛ-ТЕТРАГИДРО-ПИРАЗОЛО[1,5-a]ПИРИДО-ПИРИМИДИНЫ - АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2008 |
|
RU2384581C2 |
| Сокристаллическая форма 2,8-диметил-5-фенетил-2,3,4,5-тетрагидро-1Н-пиридо[4,3-b]индола | 2022 |
|
RU2806046C1 |
| ЗАМЕЩЕННЫЕ ГИДРИРОВАННЫЕ ТИЕНО-ПИРРОЛО [3,2-c] ПИРИДИНЫ, ЛИГАНДЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2451686C1 |
| БЛОКАТОРЫ ГИСТАМИННОГО РЕЦЕПТОРА ДЛЯ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ, ОБЛАДАЮЩИХ ПРОТИВОАЛЛЕРГИЧЕСКИМ И АУТОИММУННЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2339637C1 |
| ЗАМЕЩЕННЫЕ 2,3,4,5-ТЕТРАГИДРО-1Н-ПИРИДО[4,3-b]ИНДОЛЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2007 |
|
RU2338745C1 |
| (3-АРИЛСУЛЬФОНИЛХИНОЛИН-8-ИЛ)-ДИАЛКИЛ-АМИНЫ - СЕЛЕКТИВНЫЕ АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-HT РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2012 |
|
RU2500672C1 |
| ПРОИЗВОДНЫЕ 1-(3-АМИНОФЕНИЛ)-6,8-ДИМЕТИЛ-5-(4-ИОД-2-ФТОР-ФЕНИЛАМИНО)-3-ЦИКЛОПРОПИЛ-1H,6H-ПИРИДО[4,3-d]ПИРИМИДИН-2,4,7-ТРИОНА В КАЧЕСТВЕ ИНГИБИТОРОВ МЕК1/2 | 2015 |
|
RU2605400C1 |

Изобретение относится к применению гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), обладающего норадренергической и специфически серотонинергической активностью, или фармацевтической композиции на его основе для лечения людей с генерализованным тревожным расстройством (ГТР). Также изобретение относится к фармацевтической композиции на основе соединения (А⋅HCl) и способу лечения людей с генерализованным тревожным расстройством (ГТР). Технический результат заключается в снижении нежелательных побочных явлений при лечении генерализованного тревожного расстройства ГТР. 3 н. и 7 з.п. ф-лы, 9 ил., 14 табл., 12 пр.
1. Применение гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl), обладающего норадренергической и специфически серотонинергической активностью, или фармацевтической композиции на его основе для лечения людей с генерализованным тревожным расстройством (ГТР).
2. Применение по п.1, где гидрохлорид 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) представляет собой полиморфную модификацию (КФ1) в виде ромбических кристаллов характеризующихся кристаллографической группой - Pbcа с объемом ячейки 3813.4(2) Å3 и параметрами решетки a = 10.5074(2) Å, b = 37.360(2) Å и c = 9.7144(2) Å.
3. Применение по п.1, где гидрохлорид 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) представляет собой полиморфную модификацию (КФ2) в виде ромбических кристаллов характеризующихся кристаллографической группой - Pnnn с объемом ячейки 6042.4(3) Å3 и параметрами решетки a = 41.673(8) Å, b = 24.107(7) Å и c = 6.0141(17) Å.
4. Фармацевтическая композиция для перорального введения в виде таблетки или капсулы, содержащая от 2,2 вес% до 17,2 вес% активного компонента, где в качестве активного компонента композиция содержит гидрохлорид 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) или его полиморфную форму по любому из пп.1, 2 или 3, обладающих норадренергической и специфически серотонинергической активностью, остальное до 100 вес% - фармацевтически приемлемые вспомогательные вещества, для лечения людей с генерализованным тревожным расстройством (ГТР).
5. Фармацевтическая композиция по п.4, где в качестве вспомогательных веществ композиция содержит микрокристаллическую целлюлозу, диоксид кремния коллоидный (аэросил) и дополнительно содержит стеарат магния, или стеарат кальция и поливинилпирролидон, или стеарат кальция, поливинилпирролидон и натрий гликолят крахмала, или гидрогенизированное касторовое масло, магния стеарат и крахмал картофельный, или содержит лактозу, гидрогенизированное касторовое масло и крахмал картофельный.
6. Фармацевтическая композиция по п.4 в форме капсулы, содержащая (мг):
7. Фармацевтическая композиция по п.4 в форме таблетки, содержащая (мг):
8. Фармацевтическая композиция по п.4 в форме таблетки, содержащая (мг):
9. Фармацевтическая композиция по любому из пп.4, 5, 7 или 8, где таблетка содержит покрытие, представляющее собой акриловую энтеросолюбильную пленку Colorcon Acryl-EZE с замедленным высвобождением.
10. Способ лечения людей с генерализованным тревожным расстройством (ГТР) путем перорального введения пациенту гидрохлорида 2,8-диметил-5-(2-фенилэтил)-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (А⋅HCl) или его полиморфной формы по любому из пп.1, 2 или 3, обладающих норадренергической и специфически серотонинергической активностью, или фармацевтической композиции по любому из пп.4-9 в дозе по активному компоненту от 2 мг/день до 60 мг/день, в пересчете на основание А, 1-3 раза в день.
| Gambi, F | |||
| и др.: "Mirtazapine treatment of Generalized Anxiety Disorder: a fixed dose, open label study", Journal of Psychopharmacology, 19(5), 2005, с.483-487; | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Р.А | |||
| Беккер и др.: "Каликста® (миртазапин) - ценный терапевтический агент при резистентных депрессиях и не только | |||
| Обзор литературы с комментариями", | |||
Авторы
Даты
2022-07-08—Публикация
2020-03-19—Подача