Изобретение относится к биологии и к технологии получения клеток, используемых в косметических целях (например, с целью омоложения и/или улучшения состояния кожи пациентов). В частности, изобретение касается культивирования фибробластов, выделенных из биоптатов кожи, для последующего использования в качестве средства для регенеративной терапии в косметологии.
Клетки, выращенные in vitro, способны при культивировании в соответствующих условиях сохранять свои физиологические функции и могут использоваться при замещении, восстановлении, корректировке функций поврежденных тканей или в косметических целях для омоложения или улучшения состояния кожи.
Известен способ внутрикожного введения эмбриобласта с целью омоложения и биостимуляции кожи (RU 2197952, 2001). Однако недостатком данного способа является аллогенность вводимого препарата, включающего клеточные экстракты эмбрионов овцы, и соответственно возможность побочных эффектов в виде иммунной реакции в организме пациента.
Известен штамм диплоидных клеток легкого эмбриона человека - штамм ЛЭЧ-4(81) и способ его культивирования. (RU 2213775, 2003). Способ заключается в том, что культура клеток в виде монослоя используется для получения гомогенной взвеси клеток, которую наносят на специально подготовленную рану. Как правило, взвесь клеток стимулирует собственные процессы заживления в ране, а затем отторгается. Недостатком этого способа является недостаточная эффективность в результате невозможности интеграции имплантанта в окружающие ткани из-за аллогенности наносимых клеток.
Также известен способ введения гиалуроновой кислоты внутрикожно (RU 2194512, 2001), который используется для улучшения структуры кожи. Недостатком данного способа является уникальность вводимого компонента внеклеточного матрикса, в то время как в состав компонентов внеклеточного матрикса, который обеспечивает нормальные обменные процессы и поддерживает тургор кожи, входят десятки компонентов. Предлагаемый способ существенно расширяет спектр компонентов внеклеточного матрикса, которые начинают синтезироваться при введении фибробластов.
Наиболее близким по технической сущности и достигаемому результату является способ омоложения кожи (патент WO 2004048557), включающий терапию аутологическими недифференцированными мезенхимальными клетками, кератиноцитами и фибробластами. В данном способе предлагается вводить охарактеризованную культуру фибробластов. Недостатком способа является культивирование клеток в среде, содержащей эмбриональную сыворотку быка, с последующей отмывкой в бессывороточной среде в течение 12 часов перед введением пациенту. Такая кратковременная отмывка не может обеспечивать полноценное избавление от чужеродных белков эмбриональной сыворотки, что может вызывать иммунную реакцию пациента на вводимые клетки.
Технический результат, достигаемый предлагаемым способом, заключается в повышении эффективности и тканеспецифичности получаемого продукта, улучшении качества получаемых клеток, повышении эффективности способа их получения и эффективности терапии в целом.
Для достижения указанного технического результата в способе культивирования фибробластов, включающем выделение клеток и инкубирование в питательной среде, выделение фибробластов осуществляют из биоптатов кожи путем ферментативной обработки. Для этого биоптат кожи после выделения в стерильных условиях обрабатывают раствором DMEM (Sigma)/5% ЭБС/0,2% диспазы (Gibco)/0.1 мг/мл коллагеназы I типа (Worthington Biochemical) и при постоянном помешивании и пипетировании инкубируют кусочки кожи при температуре 37°С в течение 1,5 часов. Полученную суспензию центрифугируют 5 мин при 200 g, супернатант сливают, осевшие клетки ресуспендируют в новой порции стандартной среды для фибробластов (DMEM/10% ЭБС /100 ед/мл пенициллина (Gibco), 100 ед/мл стрептомицина (Gibco), 100 ед/мл фунгизона (Gibco)) и высевают на чашки. После достижения монослоя фибробласты переводят на культивирование в среде с собственной сывороткой крови пациента (ССКП) (DMEM/10% ССКП/100 ед/мл стрептомицина (Gibco), 100 ед/мл фунгизона (Gibco)) или в терапевтической среде AIM-V (Gibco). AIM-V среда предназначена для культивирования клеток и тканей человека ex vivo и не содержит животных эмбриональных добавок, которые могли бы вызывать иммунный ответ при введении клеток пациентам.
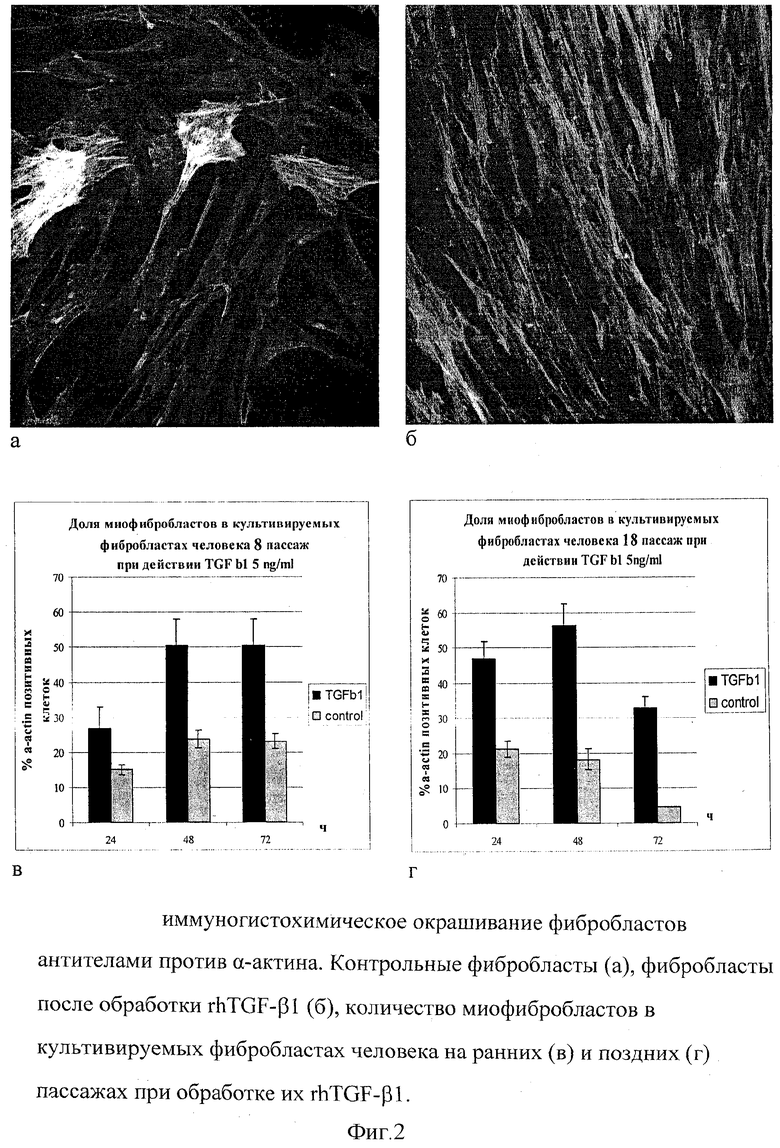
Целесообразно культивированные фибробласты дополнительно обрабатывать путем добавления rhTGF-β1 (R@D Systems) в концентрации 5 нг/мл в среду культивирования.
Известно что часть фибробластов экспрессирует а-актин - сократительный белок, который характерен для миофибробластов - фибробластов сократительного фенотипа. Обычно миофибробласты появляются в коже при ее повреждении и способствуют стягиванию краев раны и ее заживлению. По мере культивирования фибробластов количество а-актин позитивных клеток увеличивается и достигает 30% при монослое, количество а-актин позитивных клеток не зависит от пассажа. Введение миофибробластов в кожу пациентам способствует эффекту подтягивания. Для увеличения количества миофибробластов и увеличения «эффекта подтягивания» при введении в кожу пациентам культуру клеток дополнительно обрабатывали добавлением rhTGF-β1 (R@D Systems) в среду культивирования в концентрации 5 нг/мл, что повышало количество миофибробластов в культуре (фиг.1) и увеличивало эффект подтягивания.
Клетки несколько раз отмывали от среды в буфере Krebs-Ring (Sigma), обрабатывали раствором 0,25% трипсина /0,02% ЭДТА для снятия клеток с подложки, добавляли 1 мл Krebs-Ringer, суспендировали клетки и центрифугировали 5 мин при 200 g. Супернатант сливали, а клетки ресуспендировали в новой порции раствора Krebs-Ringer для введения пациентам.
Длительное культивирование клеток на среде, не содержащей животных эмбриональных добавок (культивирование на среде с собственной сывороткой крови пациента или на терапевтической среде AIM-V (Gibco)), позволяет избежать возможного иммунного ответа, а также достичь лучшей приживаемости клеток при заместительной терапии. Существенным фактором изобретения является характеристики используемых клеток, а именно их фенотип, секреция компонентов внеклеточного матрикса и факторов роста, что подтверждается нижеприведенным примером осуществления изобретения и результатами лабораторных исследований.
Пример.
Культуру дермальных фибробластов получали из биоптатов кожи размером 2×3×4 мм. Используя стерильные инструменты, биоптат кожи после выделения помещали в одноразовую пробирку со средой: DMEM (Sigma)/ 100 ед/мл пенициллина (Gibco), 100 ед/мл стрептомицина (Gibco), 100 ед/мл фунгизона (Gibco). Далее в стерильных условиях культурального бокса биоптат переносили в раствор DMEM/5% ЭСВ/0,2% диспазы (Gibco) 0.1 Мг/мл коллагеназы I типа (Worthington Biochemical) и при постоянном помешивании и пипетировании инкубировали кусочки кожи при 37°C в течение 1,5 часов. Далее полученную суспензию центрифугировали 5 мин при 200 g, супернатант сливали, осевшие клетки ресуспендировали в новой порции стандартной среды для фибробластов стандартной среды для фибробластов (DMEM/10% ЭСБ /100 ед/мл пенициллина (Gibco), 100 ед/мл стрептомицина (Gibco), 100 ед/мл фунгизона (Gibco)) и высевали на чашки. При достижении конфлюента клетки пассировали: монослой клеток обрабатывали раствором 0,25% трипсина/0,02% ЭДТА для снятия с подложки и рассаживали в соотношении 1:3. При достижении монослоя клетки переводили на культивирование в среде, содержащей собственную сыворотку крови пациента (ССКП): DMEM/10% ССКП/100 ед/мл пенициллина (Gibco), 100 ед/мл стрептомицина (Gibco), 100 ед/мл фунгизона (Gibco), или в терапевтической среде AIM-V (Gibco). Клетки несколько раз отмывали от среды в буфере Krebs-Ring (Sigma), обрабатывали раствором 0,25% трипсина/0,02% ЭДТА для снятия клеток с подложки, добавляли 1 мл Krebs-Ringer, суспендировали клетки и центрифугировали 5 мин при 200 g. Супернатант сливали, а клетки ресуспендировали в новой порции раствора Krebs-Ringer для введения пациентам.
Для длительного хранения клетки замораживали в среде культивирования с добавлением 15-20% ЭБС и 10% ДМСО.
Для увеличения количества миофибробластов и увеличения "эффекта подтягивания" культуру клеток дополнительно обрабатывали добавлением rhTGF-β1 в концентрации 5 нг/мл в среду культивирования. Перед введением в кожу пациентам аликвоту клеток в среде культивирования собирали и тестировали на присутствие инфекции методом ОТ-ПЦР и в случае отрицательного результата использовали для подготовки к введению. Клетки несколько раз отмывали от среды в буфере Krebs-Ring (Sigma), обрабатывали раствором 0,25% трипсина/0,02% ЭДТА для снятия клеток с подложки, добавляли 1 мл Krebs-Ringer, суспендировали клетки и центрифугировали 5 мин при 200 g. Супернатант сливали, а клетки ресуспендировали в новой порции раствора Krebs-Ringer для введения пациентам.
При введении фибробластов в кожу пациентам необходимо, чтобы количество вводимых фибробластов, полученных вышеописанным способом, было достаточно для достижения максимального терапевтического эффекта, но не превышало оптимальную дозу и не вызывало их склеивания или травмирования ни в капсуле, ни при прохождении через иглу. Оптимальная концентрация, по нашим данным, соответствует 1 миллиону фибробластов в 1 мл физиологического раствора или буфера Krebs-Ring (Sigma). За один сеанс в соответствии с медицинскими показаниями во избежание побочных явлений объем вводимой жидкости при косметических процедурах не должен превышать 10 мл (физ. раствора). Поэтому при на основании поученных данных оптимальная доза вводимых клеток не должна превышать 10 млн клеток в 10 мл физ. раствора за один сеанс.
Для профилактики и коррекции процесса старения кожи могут использоваться различные способы введения.
Мультиинъекция - интродермальные инъекции с образованием мелкой папулы диаметром 0,1-0,2 мм для создания «депо» фибробластов с целью удержания их в эпидерме и последующим распределением в ней. Подобная микротравма активизирует процессы микровоспаления в эпидерме, которые в свою очередь стимулируют экспрессию и секрецию факторов роста, синтезируемых вводимыми фибробластами, а также стимулируют синтез гликозоамингликанов и, следовательно, гиалуроновой кислоты, рецепция к которой повышена у фибробластов, полученных заявляемым способом. Подобные инъекции можно выполнять на любых участках кожи, где имеются следы возрастных изменений - морщины, дряблость ткани, провисание, а также в местах с тенденцией к образованию морщин для предупреждения их развития. Папулы делаются на расстоянии примерно 0,5 см друг от друга.
Инъекции под мелкие морщины рекомендуется делать с меньшим интервалом между уколами. Папулы должны быть расположены в непосредственной близости друг от друга, практически касаясь одна другой. Подобная частота введения фибробластов сама по себе стимулирует фиброз, который дает эффект «подтирания морщины», что дает дополнительный положительный результат и клинический эффект от вводимых в эту зону фибробластов.
Линейный способ заполнения морщин. Этот способ заключается во введении всей иглы подкожно вдоль морщины и инъекции фибробластов по мере извлечения иглы. Этот способ может быть использован не только при коррекции глубоких мимических морщин, но также при введении фибробластов по контуру овала лица и в местах выраженного прободения ткани.
В местах прободения эпидермы, как правило, в зонах боковых поверхностей лица под скулой, целесообразно вводить фибробласты по параллельным, а затем по перпендикулярным линиями по всей длине иглы, формируя «сетку». Ширина между линиями введения зависит от размера восстанавливаемой области и может быть от 0,2-0,4 мм и более.
Комбинированный метод - это сочетание одновременно нескольких способов введения фибробластов. Такой подход приводит к хорошим результатам при терапии глубоких мимических морщин при терапии в нижней части лица, в местах «провисания» кожи и в области декольте.
Все перечисленные методы введения фибробластов могут применяться для любых участков дермы. Исключения составляют невусы, новообразования, келоидные рубцы.
Введение фибробластов совместно с гиалуроновой кислотой.
При введении в кожу пациентам выращенные заявляемым способом фибробласты могут быть смешаны с гиалуроновой кислотой и физраствором в определенных пропорциях или только с гиалуроновой кислотой или введение фибробластов может сопровождаться инъекциями гиалуроновой кислоты. Культивируемые в условиях in vitro фибробласты обладают повышенной экспрессией рецептора к гиалуроновой кислоте (экспрессируют рецептор CD44 на поверхности мембраны). Гиалуроновая кислота участвует в процессах регуляции клеточной пролиферации, миграции и регенерации тканей, а также является важным регулятором ангиогенеза и участвует в удержании воды в эпидерме. За счет своей вязкости гиалуроновая кислота может «задерживать» фибробласты в зоне инъекции, а также обеспечивать лучшее взаимодействие фибробластов с компонентами внеклеточного матрикса, тем самым повышая выживаемость вводимых клеток в условиях in situ. Совместное введение фибробластов с гиалуроновой кислотой возможно по всем перечисленным выше методикам.
Исследования проводились на добровольцах в возрасте от 35 до 60 лет. Положительный результат при введении фибробластов в кожу пациентов описанным способом с целью предупреждения и коррекции возрастных изменений проявляется не сразу, а спустя 3-5 недель после инъекции. При введении суммарной дозы фибробластов 5-7 млн в объеме 5-7 мл на лицо у большинства пациентов омолаживающий эффект сохранялся в течение 1,5-2 года (общий срок наблюдений составил 2 года). Учитывая особенности биохимических процессов в коже (активность факторов ангиогенеза и интенсивность обменных процессов во внеклеточном матриксе), повторную процедуру введения фибробластов целесообразно проводить не ранее чем через 4 месяца. Процедуру рекомендуется повторять только пациентам с выраженными возрастными изменениями в коже, при глубоких морщинах и выраженной дряблости, используя описанные оптимизированные концентрации фибробластов в соответствующем объеме физ. раствора.
Для подтверждения достигаемого эффекта нами были проведены исследования, при которых клетки выделяли из биоптатов кожи с внутренней поверхности предплечья у 10 здоровых женщин в возрасте от 30 до 60 лет. Выделенные клетки культивировали вышеописанным способом и анализировали на ранних и поздних пассажах. Оценка фенотипа, экспрессии и секреции различных факторов проводилась методом иммуногистохимии с использованием панели специфических антител. Типирование клеток, анализ экспрессионной активности в этих клетках и в среде культивирования проводили на разных пассажах, начиная с 5 и до 15 пассажа.
Перед окрашиванием клетки фиксировали в 4% формалине (Sigma) 4 мин при комнатной температуре, затем обрабатывали 0,2% Triton X100 в течение 10 минут. Затем промывали PBS буфером (137 мМ NaCl, 2,7 мМ KCl, 4,3 мМ Na2HPO4·2H2O, 1,4 мМ KH2PO4) и инкубировали в 1% растворе БСА (бычий сывороточный альбумин), содержащего 10% сыворотки донора вторых антител для забивки неспецифического связывания (60 минут). Далее на клетки наносили соответствующие первые антитела против исследуемого антигена на 60 минут. После отмывки в PBS клетки помещали в раствор вторых антител, конъюгированных с флюорохромом Alexa 595 (Molecular Probes), на 1% растворе БСА и инкубировали в течение 60 мин. Для визуализации ядер клетки докрашивали флюоресцентым красителем DAPI (Dako). После отмывки в PBS клетки заключали в среду Mounting Medium Vectashield (Vector Laboratories Inc.). Готовые препараты хранили при +4°С в темноте. Полученные препараты анализировали при помощи флуоресцентного микроскопа Axiovert 200M (Zeiss). Документирование изображений производили с помощью цифровой видеокамеры Ахюсат HRC (Zeiss, Германия) и обработки изображения в программе Axiovision 3.1.
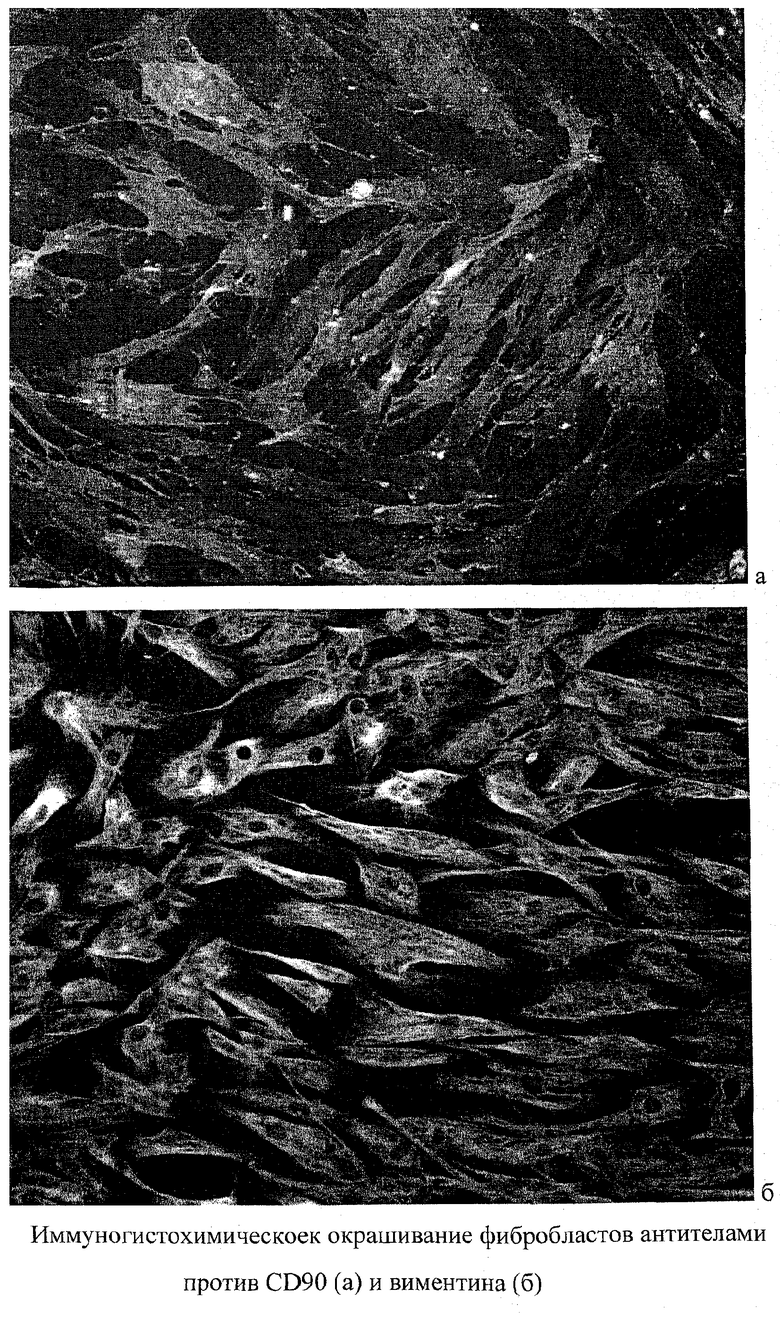
Культивируемые клетки были протестированы с помощью панели маркеров, характерных для разных типов клеток. Основной тип выделяемых клеток соответствует фибробластам клеткам мезенхимального происхождения, так как культивируемые клетки экспрессируют два стандартных маркера фибробластов - CD90 и виментин. Результаты исследований приведены в Таблице и на фиг.2.
Как видно из Таблицы, получаемая популяция является гетерогенной. Анализ клеточных популяций на присутствие зрелых кератиноцитов и стволовых клеток базального слоя эпидермиса показал, что в целом ряде образцов присутствуют β1-интегрин-позитивные клетки, которые представляют собой либо стволовые клетки базального слоя эпидермиса, либо гематопоэтические предшественники.
Тестируя культуру клеток на наличие гемопоэтических и эндотелиальных предшественников разной степени дифференцировки, были проанализированы антигены CD34, CD 105 и VE-кадгерин. В одном случае были обнаружены CD34 и VE-кадгерин-позитивные клетки; клетки из этого образца отличались высокой степенью роста в культуре, а терапия фибробластами была высоко эффективной. Все исследованные образцы были CD105 негативны, то есть не содержали эндотелиальных предшественников, экспрессирующих CD105. Эти данные показывают, что получаемая при длительном пассировании культура клеток гетерогенна и в ней могут присутствовать стволовые клетки базального слоя эпидермиса и гематопоэтические предшественники, а также, возможно, зрелые эндотелиальные клетки.
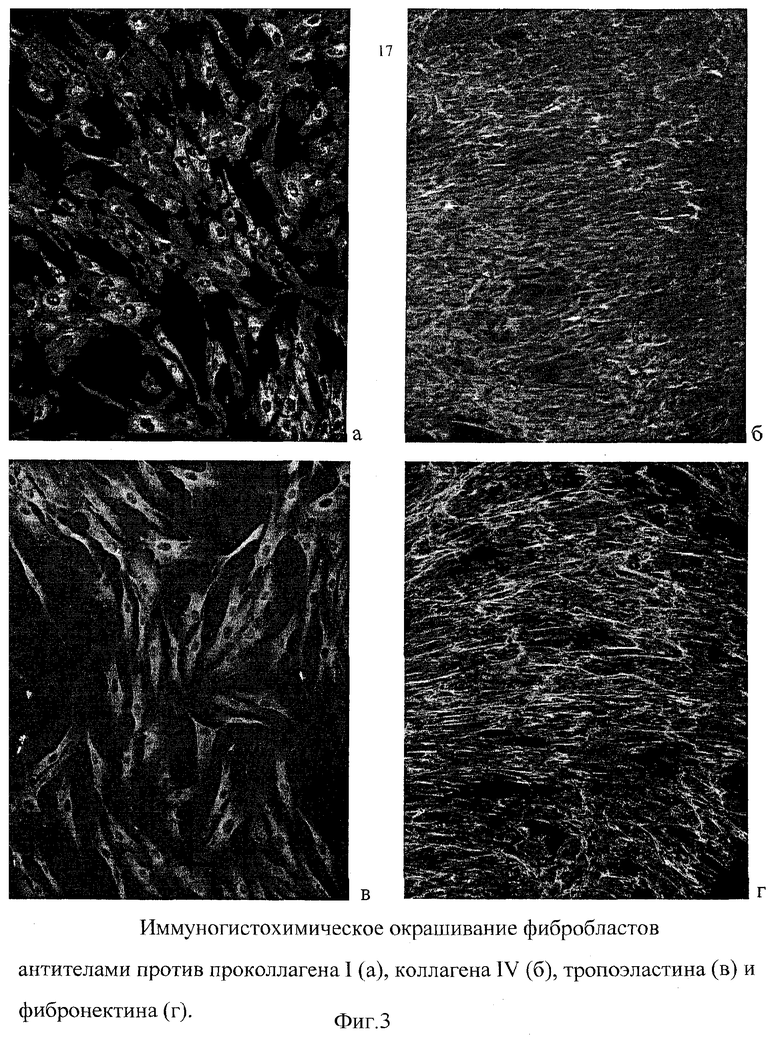
Для характеристики функциональной активности культивируемых клеток фибробласты тестировались на способность продуцировать компоненты внеклеточного матрикса: коллаген I типа, тропоэластин, коллаген IV типа и фибронектин (Таблица).
Нами было выявлено, что культивируемые предлагаемым способом фибробласты активно синтезируют предшественник коллагена I типа - проколлаген I типа (фиг.3). Наиболее интенсивное окрашивание соответствует локализации аппарата Гольджи в цитоплазме и во внеклеточном матриксе. Известно, что старение кожи связанно со старением коллагена, что выражается в увеличении количества поперечных сшивок между фибриллами коллагена. Введение культивированных фибробластов в кожу позволяет активизировать процесс синтеза коллагена, что позитивно влияет на состояние внеклеточного матрикса и упругость кожи.
Широко известно, что синтез эластина постепенно прекращается по мере старения организма, что является одной из причин потери эластичности кожи и сосудов. Тропоэластин является компонентом эластиновых волокон и продуцируется при синтезе эластина de novo. Нами впервые было обнаружено, что культивируемые клетки синтезируют значительные количества тропоэластина (фиг.3). Эти данные свидетельствуют о том, что позитивный эффект, который оказывают фибробласты при введении в кожу, обусловлен также накоплением эластина во внеклеточном матриксе.
Обнаружено, что фибробласты в культуре синтезируют коллаген IV типа (фиг.3), который является основным компонентом базальной мембраны. Старение часто сопровождается нарушением состава или целостности базальной мембраны, поэтому синтез и секреция коллагена IV типа при введении в кожу культивируемых фибробластов способствует поддержанию нормальной организации дермы и эпидермиса.
Из литературы известно, что нарушения синтеза фибронектина возникают при старении кожи, а также в культуре при длительном культивировании фибробластов. Фибробласты, культивируемые до 15 пассажа, синтезируют фибронектин во внеклеточный матрикс Вероятно, фибронектин, синтезируемый во внеклеточный матрикс, стимулирует миграцию макрофагов и лимфоцитов, клеток, секретирующих большое количество цитокинов и факторов роста, что активизирует обменные процессы в коже.
Суммируя полученные данные в Таблице, можно сделать вывод о том. что фибробласты в культуре синтезируют компоненты внеклеточного матрикса: коллагены I и IV типа, фибронектин. Особенно следует подчеркнуть важность синтеза тропоэластина в условиях in vitro, так как синтез тропоэластина de novo в нормальных условиях практически отсутствует и активируется в коже только при повреждении.
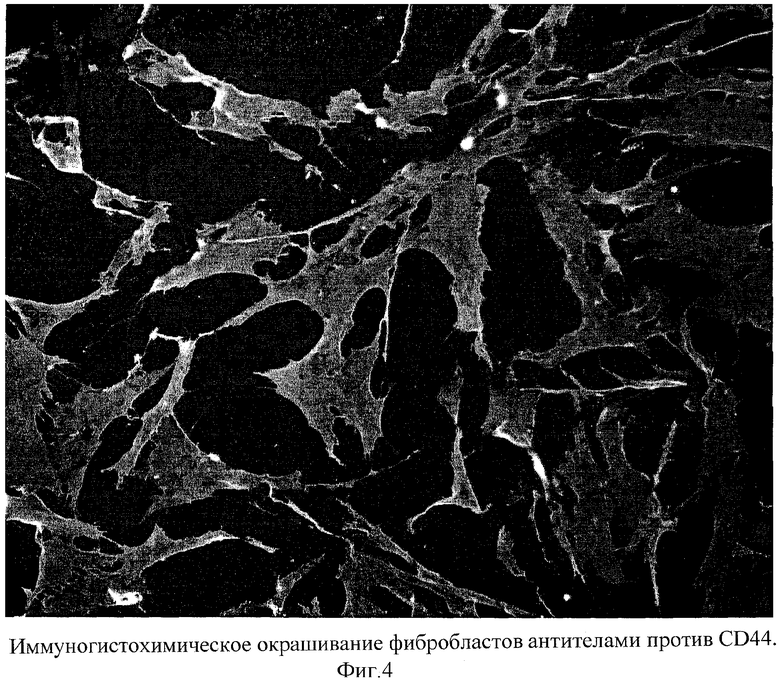
Исследуя далее функциональную активность культивируемых предложенным способом кожных фибробластов, мы оценили их способность экспрессировать рецептор гиалуроновой кислоты CD44. Оказалось, что во всех образцах обнаружена 100% окраска на этот антиген (фиг.4). Известно, что гиалуроновая кислота является важнейшим компонентом внеклеточного матрикса, участвующим в поддержании тургора кожи, и ее содержание в коже снижается по мере старения. Введение клеток, экспрессирующих рецептор к гиалуроновой кислоте, способствует удержанию гиалуроновой кислоты в дерме в зоне введения и увлажнению кожи. Совместное введение культивируемых фибробластов и гиалуроновой кислоты в кожу пациентов повышает выживаемость фибробластов в коже в условиях in situ.
Методом электрофореза с последующим иммуноблоттингом мы оценивали экспрессию рецептора к трансформирующему фактору роста бета (TGF-β1) - ключевому регулятору синтеза белков матрикса. Оказалось, что культивируемы фибробласты не имеют рецептора TGF-β1, что позволяет предполагать, что стимуляция синтеза компонентов внеклеточного матрикса запускается в фибробластах через другой рецептор. Известно, что TGF-β1 стимулирует формирование фиброза в коже. В фетальной коже TGF-β1 практически не обнаруживается, что обуславливает безрубцовое заживление ран. Отсутствие рецептора к TGF-β1 на фибробластах позволяет предполагать, что введение этих клеток в кожу пациентам не будет приводить к осложнениям в виде фиброза.
Обобщая полученные результаты можно заключить, что:
1. Клетки, полученные из кожных биоптатов и культивированные до 5-15 пассажей, по морфологическим характеристикам и экспрессии антигенов в подавляющем большинстве соответствуют фибробластам. Часть клеток имеет выраженный сократительный фенотип и соответствуют миофибробластам. Небольшое количество клеток имеет характеристики клеток-предшественников.
2. Клетки имеют высокий уровень секреторной активности и продуцируют проколлаген I типа, коллаген IV типа, фибронектин и тропоэластин - компоненты адгезивной системы клетки и внеклеточного матрикса, участвующие в поддержании тургора и эластичности кожи.
3. Практически все клетки экспрессируют рецептор гиалуроновой кислоты (CD44).
4. В процессе культивирования, начиная с 5 и по 15 пассаж, изменений в уровне экспрессии изучаемых антигенов нет.
5. Введение аутологических фибробластов, выделенных из кожных биоптатов и культивируемых in vitro в кожу пациентов для коррекции морщин и с целью омоложения, оказывает позитивный эффект и может быть использовано для терапии возрастных изменений кожи в косметологии.
Полученные результаты позволяют предполагать, что терапевтический (омолаживающий) эффект при аутотрансплантации кожных фибробластов обусловлен тем, что в течение определенного времени после введения в кожу фибробласты сохраняют способность синтезировать компоненты внеклеточного матрикса - коллагены, тропоэластин и фибронектин, а также способность удерживать гиалуроновую кислоту за счет высокого уровня экспрессии рецептора CD44 на поверхности. Определенный вклад в терапевтический эффект может вносить и присутствие в культуре клеток-предшественников - стволовых клеток базального слоя эпидермиса и CD34 позитивных клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ АУТОЛОГИЧНЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ И ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2008 |
|
RU2382077C1 |
| СПОСОБ ЛОКАЛЬНОГО ПОДАВЛЕНИЯ АНГИОГЕНЕЗА В ТКАНИ-МИШЕНИ | 2005 |
|
RU2292395C1 |
| СРЕДА КУЛЬТИВИРОВАНИЯ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ КУЛЬТИВИРОВАНИЯ ЭТИХ КЛЕТОК С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2418855C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОГЕНИТОРНЫХ КЛЕТОК МИОКАРДА | 2013 |
|
RU2542964C1 |
| Способ выделения фибробластов из стромы роговицы | 2021 |
|
RU2764077C1 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ КЛЕТОК С ИНДУЦИРОВАННЫМ АНГИОГЕННЫМ ФЕНОТИПОМ, ПРЕДНАЗНАЧЕННОЙ ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ В ЗОНЕ ИШЕМИИ | 2007 |
|
RU2334793C1 |
| ГЕН HGFopt ФАКТОРА РОСТА ГЕПАТОЦИТОВ | 2008 |
|
RU2385936C1 |
| ГЕН VEGFopt ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ ЧЕЛОВЕКА | 2008 |
|
RU2385937C1 |
| ГЕН AGРopt АНГИОПОЭТИНА-1 | 2008 |
|
RU2385938C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ОБЪЕМА КОСТНОЙ ТКАНИ ПРИ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ И ТРАВМАТИЧЕСКИХ ПВОРЕЖДЕНИЯХ КОСТЕЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2530622C2 |
Изобретение относится к биологии и к технологии получения клеток, используемых в косметических целях (например, с целью омоложения и/или улучшения состояния кожи пациентов). В частности, изобретение касается культивирования аутологичных фибробластов для последующего использования в качестве средства для заместительной терапии. Способ включает выделение клеток фибробластов из биоптатов кожи человека путем ферментативной обработки в растворе DMEM/5% ЭБС/0,2% диспазы/0.1 мг/мл коллагеназы I типа, центрифугирование суспензии клеток, ресуспендирование осевших клеток в среде DMEM/10% ЭБС/100 ед/мл пенициллина, 100 ед/мл стрептомицина, 100 ед/мл фунгизона и длительное культивирование фибробластов в среде с собственной сывороткой крови пациента: DMEM/10% ССКП/100 ед/мл стрептомицина, 100 ед/мл фунгизона или в терапевтической среде AIM-V. Изобретение позволяет избежать возможного иммунного ответа, а также достичь лучшей приживаемости клеток при заместительной терапии, 1 з.п. ф-лы, 4 ил., 1 табл.
| WO 2004048557 A1, 10.06.2004 | |||
| Способ культивирования фибробластов | 1984 |
|
SU1691391A1 |
| КЛЕТОЧНАЯ КУЛЬТУРА ДЛЯ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2002 |
|
RU2213775C1 |
| JP 57181694 A, 09.11.1982. | |||
Авторы
Даты
2008-03-27—Публикация
2006-01-25—Подача