Изобретение относится к области биотехнологии, а именно к технологии получения генно-инженерных конструкций для экспрессии трансгенов в клетках млекопитающих in vitro и in vivo с целью их применения в клеточной инженерии и в генной терапии, а именно к фрагменту вектора - модифицированной последовательности гена ангиопоэтина-1 (Ang1), и предназначена для трансфекции клеток млекопитающих с целью экспрессии в них ангиопоэтина-1.
Ангиопоэтин-1 - фактор стабилизации сосуда, который регулирует формирование полноценного зрелого сосуда, привлекая гладкомышечные клетки и уменьшая проницаемость сосудов (Brindle N.P., Saharinen P., Alitalo К. Circ. Res., 2006, Vol.98, p.1014-1023). Ангиопоэтин-1 также подавляет пролиферацию ЭК и способствует привлечению перицитов. Для продуцирования Angl используют ДНК, содержащую природный ген ангиопоэтина-1 человека (Siddiqui AJ, Blomberg P, Wärdell E, Hellgren I, Eskandarpour M, Islam KB, Sylvén C. Biochem Biophys Res Commun. 2003, Oct 24; 310(3): 1002-9).
Технической задачей, решаемой авторами настоящего изобретения, являлась модификация последовательности гена ангиопоэтина-1 таким образом, чтобы при ее включении в состав эукариотического вектора обеспечивался более высокий уровень экспрессии названного белка в клетках, трансфицированных названным вектором.
Технический результат достигался модификацией природной последовательности гена ангиопоэтина-1, в основе которой лежала вырожденность генетического кода. Последовательность модифицировали таким образом, чтобы триплеты нуклеотидов, кодирующие некоторые из аминокислот белковой последовательности ангиопоэтина-1, встречались в генах человека наиболее часто. При этом использовали опубликованные в открытых источниках данные по частотам встречаемости кодонов (http://del.mediaglyphs.org/mg/bf/nucs_aa.html).
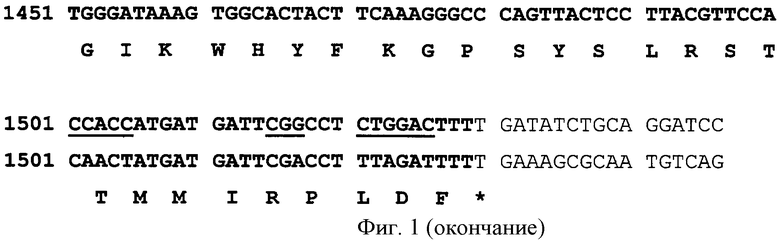
На фиг.1 показана последовательность нуклеотидов гена AGPopt (верхние строчки) в сравнении с последовательностью нуклеотидов природного гена ангиопоэтина-1 человека (средние строчки). Показана также последовательность аминокислот кодируемого белкового продукта (нижние строчки). Жирным шрифтом выделена область, кодирующая белок. Подчеркнуты триплеты нуклеотидов, подвергшиеся оптимизации. Затемнены сигналы разрушения мРНК АТТТА и полиаденилирования ААТААА.
На фиг.2 приведена функциональная карта плазмиды pC4W-AGPopt.
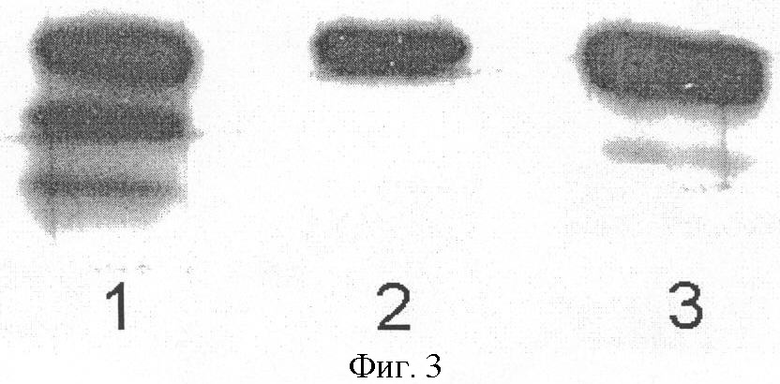
На фиг.3 показан вестерн-блоттинг белков культуральной среды клеток НЕК293, трансфицированных плазмидой pC4W-hAGP (дорожка 2) и плазмидой pC4W-AGPopt (дорожка 3). На дорожку 1 нанесено 20 нг рекомбинантного ангиопоэтина-1 человека.
Синтез гена и плазмиды осуществляли с помощью стандартной технологии и оборудования, применяемых для решения подобных задач в генной инженерии (Watson, J.D., Gilman, M., Witkowski, J., Zoller, M. - Recombinant DNA, Scientific American Books, New York, 1992).
Дизайн оптимизированной последовательности нуклеотидов, кодирующей ангиопоэтин-1 человека, производили следующим образом. Используя частоты встречаемости кодонов, приведенные на вэб-сайте http://del.mediaglyphs.org/mg/bf/nucs_aa.html, среди триплетов нуклеотидов, кодирующих аминокислоты белковой последовательности природного гена ангиопоэтина-1, выявляли такие, которые встречаются в генах человека наиболее редко. Выявленные редкие триплеты, а также соседние с ними триплеты меняли на триплеты, кодирующие ту же аминокислоту, но при этом встречающиеся в генах человека наиболее часто. Кроме того, с целью повышения стабильности матричной РНК ангиопоэтина-1 такими же методами из кодирующей белок области природного гена ангиопоэтина-1 удаляли сигналы разрушения мРНК "АТТТА" и сигналы полиаденилирования "ААТААА" (Barreau С., Paillard L., Osborne B.H. Nucleic Acids Research, 2005, Vol.33, p.7138-7150). В результате благодаря вырожденности генетического кода все аминокислоты природного гена ангиопоэтина-1 остались неизмененными. Полученная последовательность нуклеотидов представлена на фиг.1.
кДНК ангиопоэтина-1 получали методом RT-PCR с использованием в качестве матрицы суммарной РНК из печени человека и клонировали в экспрессионный вектор pcDNA3 (Invitrogen, США) с получением плазмиды pcDNA3-hAGP и в экспрессионный вектор pC4W (ООО "фирма МОНА", РФ) с получением плазмиды pC4W-hAGP. Плазмиду pC4W-AGPopt, несущую оптимизированный ген AGPopt, получали методом генно-инженерного конструирования, как описано ниже.
На первой стадии
- химически синтезированную пару олигонуклеотидов
VEC01 (AGCTTGGCATTCCGGTACTGTTGGTAAAGCCACCATG) и
VEC02 (GTACCATGGTGGCTTTACCAACAGTACCGGAATGCCA) отжигали, смешивали и клонировали в расщепленный рестриктазами HindIII и Асс65I вектор pUC19 с получением промежуточной плазмиды pUC-KNA;
- химически синтезированную пару олигонуклеотидов
VEC05 (AGCTTGGCATTCCGGTACTGTTGGTAAAGCCACCATGG) и
VEC06 (GATCCATGGTGGCTTTACCAACAGTACCGGAATGCCA) отжигали, смешивали и клонировали в расщепленный рестриктазами HindIII и BamHI вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSK-KNB.
На второй стадии проводили серию реакций амплификации с использованием плазмиды pcDNA3-hAGP в качестве матрицы и пар химически синтезированных олигонуклеотидов

В результате получали фрагменты ДНК, соответственно AGP1-2, AGP39-40, AGP41-42, AGP43-44, AGP45-46, AGP47-48, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На третьей стадии проводили реакцию амплификации с использованием фрагментов ДНК AGP39-40 и AGP41-42 в качестве матрицы и олигонуклеотидов AGP39F и AGP42R в качестве праймеров; а также реакцию амплификации с использованием фрагментов ДНК AGP45-46 и AGP47-48 в качестве матрицы и олигонуклеотидов AGP45F и AGP48R в качестве праймеров. В результате получали фрагменты ДНК, соответственно AGP39-42 и AGP45-48, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На четвертой стадии проводили реакцию амплификации с использованием фрагментов ДНК AGP39-42 и AGP43-44 в качестве матрицы и олигонуклеотидов AGP39F и AGP44R в качестве праймеров; а также реакцию амплификации с использованием фрагментов ДНК AGP43-44 и AGP45-48 в качестве матрицы и олигонуклеотидов AGP43F и AGP48R в качестве праймеров. В результате получали фрагменты ДНК, соответственно AGP39-44 и AGP43-48, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На пятой стадии проводили реакцию амплификации с использованием фрагментов ДНК AGP39-44 и AGP43-48 в качестве матрицы и олигонуклеотидов AGP39F и AGP48R в качестве праймеров. В результате получали фрагмент ДНК AGP39-48, который очищали при помощи электрофореза в агарозном геле и электроэлюции.
На шестой стадии фрагмент ДНК AGP1-2 расщепляли рестриктазами ВаmHI и EcoRI и клонировали в расщепленный теми же рестриктазами вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSK-AGP1-2;
химически синтезированные пары олигонуклеотидов:


фрагмент плазмиды pcDNA3-hAGP клонировали в плазмиду pBSK-KNB, расщепленную рестриктазами NcoI и ВаmHI, с получением промежуточной плазмиды pBSK-AGPN-8. Фрагмент ДНК AGP39-48 расщепляли рестриктазами BamHI и SmaI и клонировали в расщепленный теми же рестриктазами вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSK-AGP39-48. Встраивание соответствующих последовательностей ДНК подтверждали секвенированием.
На седьмой стадии


клонировали в плазмиду pBSK-AGP31-34, расщепленную рестриктазами PstI и XbaI, с получением промежуточной плазмиды pBSK-AGP31-38. HindIII - NcoI фрагмент плазмиды pBSK-AGP39-48 клонировали в плазмиду pBSK-AGPN-8, расщепленную рестриктазами HindIII и NcoI, с получением промежуточной плазмиды pBSK-AGP39-8. Встраивание соответствующих последовательностей ДНК подтверждали секвенированием.
На восьмой стадии
- HindIII - EcoRI фрагмент плазмиды pUC-KAGP3-2 и EcoRI - NcoI фрагмент плазмиды pcDNA3-hAGP клонировали в плазмиду pBSK-AGPN-8, расщепленную рестриктазами HindIII и NcoI, с получением промежуточной плазмиды pBSK-KAGP;
- химически синтезированную пару олигонуклеотидов
AGP17S (GGACACCCTGAAGGAGGAGAAGGAGAACCTGCA) и
AGP18A (GGTTCTCCTTCTCCTCCTTCAGGGTGTCCAGCT) и SbfI - HindIII фрагмент плазмиды pUC-AGP19-30 клонировали в плазмиду pUC-AGP9-16, расщепленную рестриктазами SacI и HindIII, с получением промежуточной плазмиды pUC-AGP9-30;
- Acc65I - Есо47III фрагмент плазмиды pBSK-AGP31-38 клонировали в плазмиду pBSK-AGP39-8, расщепленную рестриктазами Acc65I и SmaI, с получением промежуточной плазмиды pBSK-AGP31-8.
Встраивание соответствующих последовательностей ДНК подтверждали рестриктным анализом и секвенированием полученных плазмид.
На девятой стадии EcoRI - BsrGI фрагмент плазмиды pUC-AGP9-30 и Acc65I -ВаmHI фрагмент плазмиды pBSK-AGP31-8 клонировали в плазмиду pBSK-KAGP, расщепленную рестриктазами EcoRI и ВаmHI, с получением промежуточной плазмиды pBSK-KAGPopt. Встраивание соответствующих последовательностей ДНК подтверждали рестриктным анализом полученной плазмиды.
На десятой стадии HindIII - ВаmHI фрагмент плазмиды pBSK-KAGPopt клонировали в высокоэффективный экспрессионный вектор pC4W, расщепленный рестриктазами HindIII и ВаmHI, с получением плазмиды pC4W-AGPopt. Правильность встраивания оптимизированного гена AGPopt и соответствие дизайну его нуклеотидной последовательности подтверждали рестриктным анализом и секвенированием полученной плазмиды. Функциональная карта плазмиды pC4W-AGPopt, предназначенной для экспрессии гена ангиопоэтина-1 человека в клетках млекопитающих, представлена на фиг.2.
Эффективность заявляемого изобретения иллюстрируется следующим примером.
Пример. Клетки НЕК293, высеянные в лунки 24-луночной плашки (50000 клеток на лунку) в среде DMEM, содержащей 2% эмбриональной телячьей сыворотки, трансфицировали плазмидой pC4W-AGPopt, несущей оптимизированный ген ангиопоэтина-1 человека (AGPopt), или контрольной плазмидой pC4W-hAGP, несущей природный ген ангиопоэтина-1 человека (hAGP). Трансфекцию проводили с использованием 1 мкг ДНК и 1 мкл реагента Липофектамин 2000 (Invitrogen) в соответствии с протоколом производителя. Через 24 ч после трансфекции культуральную среду заменяли на свежую. Анализировали накопление ангиопоэтина-1 в культуральной среде за следующие 48 часов.
Для наблюдения экспрессии ангиопоэтина-1 после трансфекции клеток использовали метод вестерн-блоттинга. Электрофорез белков в 13%-ном полиакриламидном геле проводили в денатурирующих условиях в присутствии додецилсульфата натрия без добавления бета-меркаптоэтанола. На дорожки геля наносили по 30 мкл культуральной среды.
Перенос белков из геля на PVDF-мембрану (Millipore) осуществляли в полусухих условиях в стандартном буфере. После переноса мембрану проинкубировали в 5%-ном растворе обезжиренного молока в TBS-буфере (Tris buffer saline) с 0,001%-ным Tween 20 (Pierce) в течение ночи при температуре 4°С. Далее проводили инкубацию с мышиными моноклональными антителами против ангиопоэтина-1 человека фирмы R&D Systems (США), которые разводили в 500 раз в 5%-ном обезжиренном молоке в TBS-буфере с 0,001%-ным Tween 20. Мембрану троекратно отмывали в 5%-ном растворе обезжиренного молока в TBS-буфере с 0,001%-ным Tween 20 в течение 15 минут и инкубировали с меченными пероксидазой крысиными антителами против иммуноглобулинов мыши в 5%-ном обезжиренном молоке с 0,001%-ным Tween 20 при комнатной температуре в течение 60 мин. После этого мембрану обрабатывали набором реактивов двухкомпонентной системы ECL (Pierce), экспонировали с рентгеновской пленкой "Bio Max" (Kodak) и проводили денситометрию. Результаты представлены в таблице и на фиг.3, где показан вестерн-блоттинг белков культуральной среды клеток НЕК293, трансфицированных плазмидой pC4W-hAGP (дорожка 2) и плазмидой pC4W-AGPopt (дорожка 3). (На дорожку 1 нанесено 20 нг рекомбинантного ангиопоэтина-1 человека.)
Полуколичественный денситометрический анализ показал (таблица), что продукция ангиопоэтина-1 в случае использования оптимизированного гена AGPopt в 1,6 раза больше, чем в случае использования природного гена hAGP. Сравнение сигнала от клеток, трансфицированных плазмидой pC4W-AGPopt (фиг.3, дорожка 3), с одной стороны, и сигнала от рекомбинантного ангиопоэтина-1 человека (дорожка 1), с другой, позволяет заключить, что содержание ангиопоэтина-1 в культуральной среде трансфицированных клеток составляет не менее 0,5 мкг/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕН HGFopt ФАКТОРА РОСТА ГЕПАТОЦИТОВ | 2008 |
|
RU2385936C1 |
| ГЕН VEGFopt ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ ЧЕЛОВЕКА | 2008 |
|
RU2385937C1 |
| ГЕН MMP8opt МЕТАЛЛОПРОТЕИНАЗЫ 8 | 2008 |
|
RU2378376C1 |
| ГЕН ММР1opt МЕТАЛЛОПРОТЕИНАЗЫ 1 | 2008 |
|
RU2378377C1 |
| СПОСОБ СТИМУЛЯЦИИ АНГИОГЕНЕЗА В ИШЕМИНИЗИРОВАННЫХ ТКАНЯХ И КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА | 2015 |
|
RU2628706C2 |
| ЭКСПРЕССИОННЫЙ ВЕКТОР ДЛЯ СИНТЕЗА БЕЛКОВ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ | 2007 |
|
RU2364627C2 |
| ГЕМОПОЭТИЧЕСКИЙ БЕЛОК (ВАРИАНТЫ), ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, СПОСОБ ПОЛУЧЕНИЯ ГЕМОПОЭТИЧЕСКОГО БЕЛКА, СПОСОБ СЕЛЕКТИВНОЙ ЭКСПАНСИИ КРОВЕТВОРНЫХ КЛЕТОК, СПОСОБ ПРОДУЦИРОВАНИЯ ДЕНДРИТНЫХ КЛЕТОК, СПОСОБ СТИМУЛЯЦИИ ПРОДУЦИРОВАНИЯ КРОВЕТВОРНЫХ КЛЕТОК У ПАЦИЕНТА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1997 |
|
RU2245887C2 |
| СПОСОБ ЛОКАЛЬНОГО ПОДАВЛЕНИЯ АНГИОГЕНЕЗА В ТКАНИ-МИШЕНИ | 2005 |
|
RU2292395C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PLP-3,1, КОДИРУЮЩАЯ ПОЛИПЕПТИД ПРОИНСУЛИНА LYSPRO ЧЕЛОВЕКА, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI PLP-3-1/TG-1-ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ПРОИНСУЛИНА LYSPRO | 2003 |
|
RU2235776C1 |
| СПОСОБ СТИМУЛИРОВАНИЯ ВОССТАНОВЛЕНИЯ ПЕРИФЕРИЧЕСКОЙ ИННЕРВАЦИИ ТКАНЕЙ С ПОМОЩЬЮ ВЕКТОРНЫХ КОНСТРУКЦИЙ | 2011 |
|
RU2486918C1 |




Изобретение относится к области биотехнологии и получению генно-инженерных конструкций для экспрессии трансгенов в клетках млекопитающих in vitro и in vivo. Предложена модифицированная последовательность гена ангиопоэтина-1 (Ang1). Последовательность предназначена для трансфекции клеток млекопитающих с целью экспрессии в них ангиопоэтина-1. Продукция ангиопоэтина-1 в случае использования оптимизированного гена AGPopt в 1,6 раза больше, чем в случае использования природного гена hAGP. При этом содержание ангиопоэтина-1 в культуральной среде трансфицированных клеток составляет не менее 0,5 мкг/мл. Изобретение может быть использовано в медицине. 3 ил., 1 табл.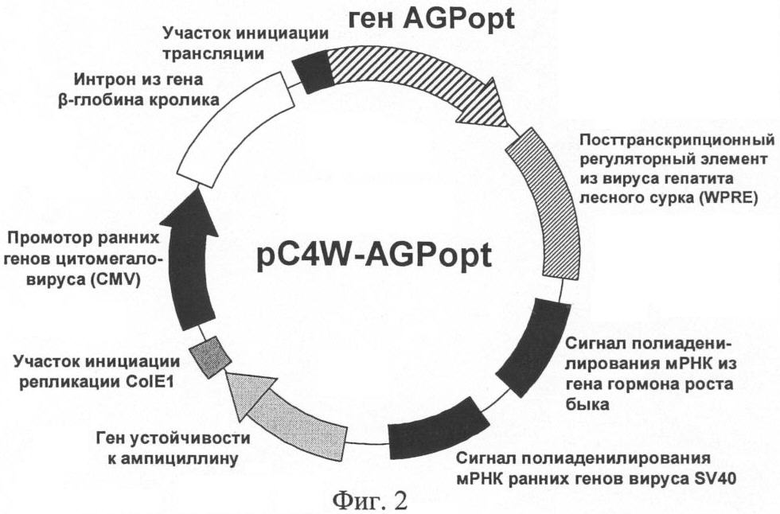
Ген ангиопоэтина-1, обладающий последовательностью нуклеотидов, приведенной на фиг.1.
| SIDDIQUI A.J | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Biochem Biophys Res Commun | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| BRINDLE N.P | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ заправки магнитной ленты в кассетах и трактах лентопротяжных механизмов катушечных магнитофонов | 1987 |
|
SU1520588A1 |
Авторы
Даты
2010-04-10—Публикация
2008-06-25—Подача