Настоящее изобретение относится к области биотехнологии, в частности к генной и клеточной инженерии, и может быть использовано в экспериментальной биологии и медицине. Предлагается способ локального подавления ангиогенеза, заключающийся в обеспечении ткани-мишени эффективным количеством функционально активного Т-кадгерина за счет гиперэкспрессии кодирующего его гена, введенного в защищаемую область (ткань-мишень).
Ангиогенез, процесс образования новых кровеносных сосудов в результате ветвления и разрастания предсуществующего кровеносного русла, сопровождает нормальное формирование органов и тканей человека в эмбриогенезе. Этот процесс можно подразделить на несколько этапов: миграцию и пролиферацию эндотелиальных клеток, формирование ими новых капиллярных отростков, миграцию и пролиферацию субэндотелиальных клеток (перицитов), которые обуславливают формирование нормально функционирующего, зрелого сосудистого русла. Все перечисленные этапы находятся под контролем целого ряда факторов, стимулирующих или подавляющих ангиогенез. К этим факторам относятся растворимые биологически активные вещества (цитокины и факторы роста), а также трансмембранные белки, экспрессирующиеся на поверхности клеток (интегрины и эфрины) (Brantley-Sieders DM и Chen J., 2004). Нарушение баланса положительных и отрицательных модуляторов ангиогенеза в тканях является одной из причин таких заболеваний, как псориаз (Leong T.T., 2005), ретинопатия (Fischer-Colbrie R. et al., 2005), ревматоидный артрит (Pap T. and Distler O., 2005) и атеросклероз (Collett GD и Canfield AE., 2005). И наоборот, введение извне стимулирующих или ингибирующих факторов ангиогенеза позволяет направленно воздействовать на этот процесс и используется при лечении целого ряда заболеваний. Так, введение факторов роста, стимулирующих ангиогенез, применяется для восстановления кровоснабжения ишемизированных тканей, а введение агентов, ингибирующих рост кровеносных сосудов, - в лечении онкологических заболеваний, поскольку рост опухолей зависит от интенсивности их васкуляризации.
Уровень техники
Известны различные природные и синтетические соединения, обладающие способностью подавлять процесс образования новых сосудов. Их действие обычно направлено либо на ингибирование ангиогенных факторов роста (антитела против VEGF, растворимые формы рецепторов VEGF и FGF), либо на подавление чувствительности эндотелиальных клеток к факторам роста (сурамин, пентозан), либо на блокирование проведения внутриклеточных сигналов или на подавление пролиферации и миграции эндотелиальных клеток (Киселев и соавт., 2003). Однако круг этих соединений сегодня весьма ограничен. Кроме того, большинство известных препаратов, применяемых для подавления ангиогенеза, имеет полипептидную природу, что затрудняет получение стабильного направленного воздействия в тканях-мишенях.
Проблема стабилизации и локализации эффекта полипептидных ингибиторов ангиогенеза в последние годы частично разрешается благодаря разработке методов, основанных на введении в область-мишень кодирующих их генов или содержащих эти гены векторных конструкций. В частности, для подавления опухолевого ангиогенеза используют введение репликативно-дефицитных вирусов (адено- и аденоассоциированных) и плазмид, содержащих ДНК, которые кодируют белки-ингибиторы, например фрагмент коллагена 18 эндостатин, фрагмент плазминогена ангиостатин и др. (Seth P., 2005, Ponnazhagan S., 2004). Любой из этих способов может рассматриваться в качестве аналога настоящего изобретения.
Методы этой группы, однако, имеют свои недостатки, ограничивающие их применение. В частности, инъекция вирусных частиц часто сопровождается иммунной реакцией организма, а непосредственное введение в ткань-мишень плазмидных ДНК может обеспечить экспрессию ингибиторов ангиогенеза обычно не более чем в 1% клеток опухоли.
В связи с этим, весьма перспективным направлением в области генной терапии патологического ангиогенеза представляется использование клеток с предварительно введенным геном ингибитора, эффективность которого подтверждена в опытах по введению экспериментальным животным культивируемых фибробластов (Hisaka Y., et al., 2004), генетически трансформированных скелетных миобластов (Suzuki K., et al., 2001) и предшественников эндотелиальных клеток (Iwaguro H., et al., 2002).
Очевидно, что разработка способа, который обеспечил бы эффективное локальное подавление ангиогенеза, в частности, при росте опухолей, остается актуальной проблемой современных биологии и медицины. При этом одним из перспективных направлений в ее решении представляется объединение усилий по поиску новых ингибиторов с использованием современных методических подходов, основанных на технологии рекомбинантных ДНК.
Раскрытие изобретения
Разработан способ локального подавления ангиогенеза, заключающийся в стабильном обеспечении ткани-мишени эффективным количеством функционально активного Т-кадгерина. Предлагаемый способ основан на установленном нами свойстве клеток, активно экспрессирующих на своей поверхности Т-кадгерин, препятствовать прорастанию сосудов в ткани, содержащие эти Т-кадгерин позитивные клетки. Такими клетками могут быть как собственно клетки ткани-мишени, так и клетки, совместимые с клетками этой ткани, внедренные в нее извне.
Т-кадгерин - атипичный член семейства кадгеринов. Кадгерины - семейство мембранных рецепторов, опосредующих Са2+-зависимую гомофильную адгезию во всех твердых тканях взрослого организма и в эмбриогенезе (Angst et al., 2001). Внеклеточная часть Т-кадгерина гомологична соответствующим областям "классических" представителей семейства и состоит из пяти Ca2+-связывающих кадгериновых доменов. Уникальной особенностью Т-кадгерина является отсутствие трансмембранного и цитоплазматического доменов. Т-кадгерин закрепляется на мембране с помощью гликозилфосфатидилинозитольного (ГФИ) "якоря" (Ranscht B, Dours-Zimmermann MT., 1991).
Свойства Т-кадгерина активно исследуются, и к настоящему времени в этой области накоплен большой фактический материал. Однако полученные экспериментальные данные носят весьма противоречивый характер и пока не позволяют дать определенный ответ на вопрос об основных функциях, выполняемых Т-кадгерином.
Есть сведения, что Т-кадгерин обладает слабо выраженной способностью опосредовать Са2+-зависимую гомофильную адгезию клеток в суспензии, но из-за отсутствия трансмембранного и цитоплазматического домена и связи с цитоскелетом (Vestal DJ, Ranscht B. 1992) поддержание стабильной межклеточной адгезии вряд ли можно считать его основной функцией. Тем более, что недавно получены экспериментальные данные, в соответствии с которыми гиперэкспрессия Т-кадгерина в культуре клеток линий НЕК293 и L929 приводит к увеличению клеточной миграции (Rubina K, et al., 2005), а гиперэкспрессия Т-кадгерина в эндотелиальных клетках, культивируемых на подложке, содержащей растворимый Т-кадгерин или антитела к N-терминальному домену Т-кадгерина, вызывает снижение адгезии клеток к субстрату, увеличение клеточной миграции в камере Бойдена и изменения актинового цитоскелета (Inanov D, et al., 2004;. Philippova M, et al., 2003). Эти данные в наибольшей степени согласуются с представлением о Т-кадгерине как о сигнальной молекуле, регулирующей клеточную адгезию и миграцию.
Информация об экспрессии и эффектах Т-кадгерина в опухолях также неоднозначна и не позволяет составить сколько-нибудь определенное мнение относительно выполняемой Т-кадгерином функции.
При исследовании метастазов карциномы Левиса в легких было показано, что Т-кадгерин активно экспрессируется в эндотелии сосудов, прорастающих в опухоль, в то время как в окружающей ткани его экспрессия не выявляется (Wyder L et al., 2002). В нормальной коже Т-кадгерин экспрессируется в базальном слое эпидермиса, в волосяных фолликулах и в сальных и потовых железах (Zhou et al., 2002), тогда как в образцах различных опухолей базальноклеточного рака кожи, сквамозной карциномы кожи, колоректального рака кишечника экспрессия Т-кадгерина в клетках опухоли снижена (Takeuchi T, et al., 2002; Takeuchi T, et al., 2002; Hibi K, et al., 2003). Эти данные позволили высказать предположение, что Т-кадгерин является фактором, подавляющим рост и метастазирование опухолевых клеток во многих типах опухолей: при раке молочной железы, легких, яичников и базальноклеточной карциноме кожи (Takeuchi T, et al., 2002; Yap AS and Kovacs EM, 2003). В то же время на остеосаркомах человека было показано, что экспрессия Т-кадгерина коррелирует с метастазированием опухоли (Takeuchi T and Ohtsuki Y, 2001).
Ранее нами было установлено, что в норме максимальные уровни экспрессии Т-кадгерина наблюдаются в нервной и сердечно-сосудистой системе (кардиомиоцитах, эндотелии, гладкомышечных клетках (ГМК) и перицитах) (Ivanov et al., 2001). При этом известно, что в эмбриональном мозге цыплят Т-кадгерин выполняет функцию молекулы-навигатора, задающей направление прорастающим аксонам мотонейронов (Ranscht B., Dours-Zimmermann M.T., 1991; Fredette and Ranscht, 1994), а в культуре нейронов in vitro ингибирует рост аксонов (Fredette BJ, et al., 1996).
Наши данные об экспрессии Т-кадгерина при атеросклеротических поражениях сосудов, сопровождающихся изменениями клеточной адгезии, миграции и пролиферации, о совпадении максимума экспрессии Т-кадгерина при образовании неоинтимы с пиком миграции и пролиферации клеток, установленном на модели экспериментальной баллонной ангиопластики сонной артерии крысы (Kudrjashova et al., 2002), и некоторые другие факты свидетельствуют о важной роли Т-кадгерина в сердечно-сосудистой системе, которая предположительно связана с регуляцией роста и ремоделирования сосудов.
В процессе создания настоящего изобретения впервые было экспериментально показано негативное влияние экспрессированного на поверхности нормальных клеток Т-кадгерина на процесс образования новых кровеносных сосудов в содержащей такие клетки ткани, что и было положено в основу разработанного нами способа локального подавления ангиогенеза. В связи с тем, что эффект достигается при экспрессии Т-кадгерина как собственно в клетках ткани-мишени, так и в совместимых с этой тканью клетках, внесенных в нее извне, возможны два альтернативных варианта реализации способа по изобретению.
Предлагаемый способ осуществляется путем введения в ткань-мишень либо вектора, пригодного для экспрессии содержащейся в нем последовательности ДНК, которая кодирует Т-кадгерин, либо трансформированных указанным вектором клеток, совместимых с клетками ткани-мишени. В качестве последовательности ДНК, кодирующей Т-кадгерин, может быть использована последовательность гена Т-кадгерина (кадгерина-13) человека, представленная в ГенБанке под номером L34058, или другие нуклеотидные последовательности, кодирующие аминокислотную последовательность Т-кадгерина человека, представленную в ГенБанке под номером AAA 35624.1, а также любые их гомологи и варианты, кодирующие функционально активный Т-кадгерин. Кодирующая Т-кадгерин последовательность ДНК может быть получена известными специалисту методами, в частности путем клонирования соответствующего фрагмента из кДНК- или геномной библиотеки, ПЦР-амплификацей с использованием специфических праймеров или химическим синтезом.
Для введения в ткань-мишень полученный любым из названных способов фрагмент ДНК включают в подходящий экспрессирующий вектор из числа известных специалистам векторов, функционально активных в клетках млекопитающих. Такой вектор может иметь аденовирусную природу, однако предпочтительным представляется использование плазмид, в которых представлены регуляторные области, необходимые для экспрессии гена Т-кадгерина в ткани-мишени. В частности, в одном из конкретных воплощений настоящего изобретения использовалась плазмида pcDNA 3.1 (Invitrogen) с введенным в нее геном Т-кадгерина человека, успешно апробированная нами ранее с целью его экспрессии в различных клетках (Philippova et al., 2003).
При осуществлении предлагаемого способа векторная конструкция с геном Т-кадгерина может быть непосредственно введена путем инъекции в защищаемую область ткани. Однако, как показывает практика, в силу сравнительно низкой эффективности "доставки" генетического материала в клетки ткани-мишени (эффективность трансфекции ткани-мишени при инъекции плазмиды в ткань составляет менее 1%) этот вариант требует значительных количеств плазмидной ДНК для достижения ингибирующей концентрации Т-кадгерина в ткани-мишени. В свете этого, предпочтительным представляется вариант введения в ткань-мишень клеток, трансфицированных вектором для экспрессии Т-кадгерина и предварительно отобранных по уровню его продукции. При выборе клеток-хозяев должно учитываться условие их "совместимости" с клетками ткани-мишени, которая в настоящем изобретении контролировалась путем анализа жизнеспособности клеток в течение 2 недель после инъекции в организм животного. Установлено, что для этой цели применимы различные типы клеток, совместимых с клетками ткани-мишени (в одном из воплощений изобретения в соединительную ткань вводили клетки эпителия эмбриональной почки, "выживаемость" которых по истечении 2 недель составила 10%). Однако с точки зрения получаемого эффекта ингибирования ангиогенеза лучшие результаты достигаются при введении клеток того же типа, что и клетки ткани-мишени (например, вариант использования трансфицированных фибробластов для введения в соединительную ткань).
Количество вводимого вектора или вводимых клеток должны быть таковыми, чтобы создать в защищаемой области концентрацию Т-кадгерина, достаточную для получения эффекта ингибирования роста новых сосудов. Названные количественные показатели будут зависеть от многих факторов, в том числе от эффективности экспрессии, определяемой видом используемого вектора и клетки-хозяина, вида ткани-мишени, размера подлежащей защите области и т.д., и в каждом конкретном случае должны определяться эмпирическим путем.
Таким образом, объектом настоящего изобретения является способ локального подавления ангиогенеза в ткани-мишени, заключающийся в обеспечении ткани-мишени эффективным количеством функционально активного Т-кадгерина путем введения подходящего вектора экспрессии, в который включена последовательность ДНК, кодирующая Т-кадгерин, или совместимых с тканью-мишенью клеток, предварительно трансфицированных указанным вектором и экспрессирующих Т-кадгерин.
Ниже приводятся конкретные примеры, которые подтверждают возможность осуществления изобретения, но при этом не ограничивают его объем.
Краткое описание чертежей
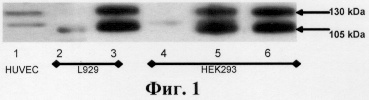
Фиг.1. Экспрессия Т-кадгерина в отобранных позитивных клонах, определенная в лизатах клеток методом иммуноблоттинга.
Дорожка 1 - клетки HUVEC (положительный контроль), в норме экспрессируют зрелый Т-кадгерин (мол. масса 105 kDa) и его предшественник (мол масса 130 kDa).
Дорожка 2 - клетки контрольного клона (К1) линии L929, не экспрессируют Т-кадгерин;
Дорожка 3 - клетки опытного клона (ТС3) линии L929, трансфицированные кДНК, кодирующей ген Т-кадгерина; экспрессируют зрелый Т-кадгерин и его предшественник.
Дорожка 4 - клетки контрольного клона HEK293GFР; не экспрессируют Т-кадгерин.
Дорожка 5 - клетки опытного клона (Th5) линии НЕК293, трансфицированные кДНК, кодирующей ген Т-кадгерина; экспрессируют зрелый Т-кадгерин и его предшественник.
Дорожка 6 - клетки опытного клона (Th8) линии НЕК293, трансфицированные кДНК, кодирующей ген Т-кадгерина; экспрессируют зрелый Т-кадгерин и его предшественник.
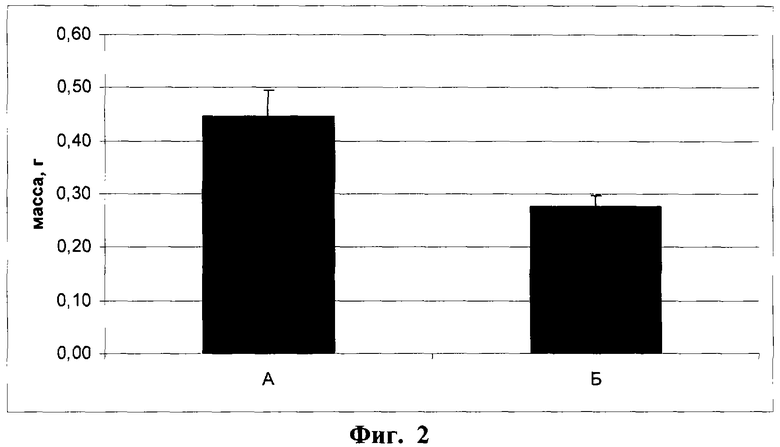
Фиг.2. Масса бляшек Матригеля через 2 недели после имплантации мышам линии NUDE.
А - с контрольными клетками (линия L929, клон К1); Б - с опытными клетками (линия L929, клон ТС3). Различия статистически значимы (p<0,01).
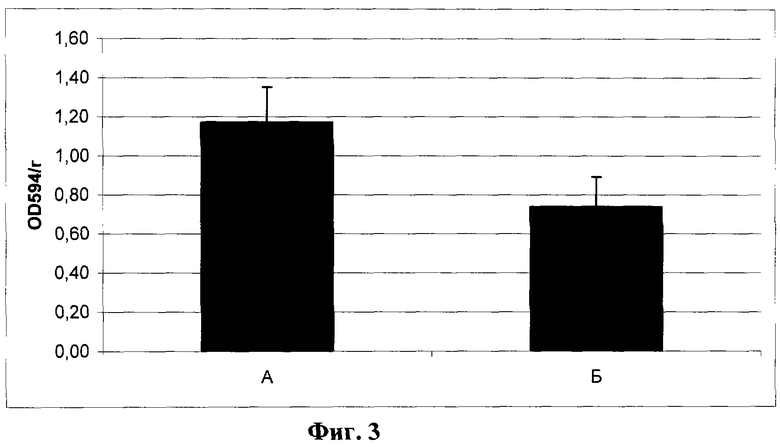
Фиг.3. Уровень гемоглобина в бляшках Матригеля через 2 недели после имплантации мышам линии NUDE. Уровень гемоглобина оценивали по отношению поглощения раствора гемцианида (при 594 нм) к массе образца (в единицах оптической плотности на грамм).
А - с контрольными клетками (линия L929, клон К1); Б - с опытными клетками (линия L929, клон ТС3). Различия статистически значимы (p<0,01).
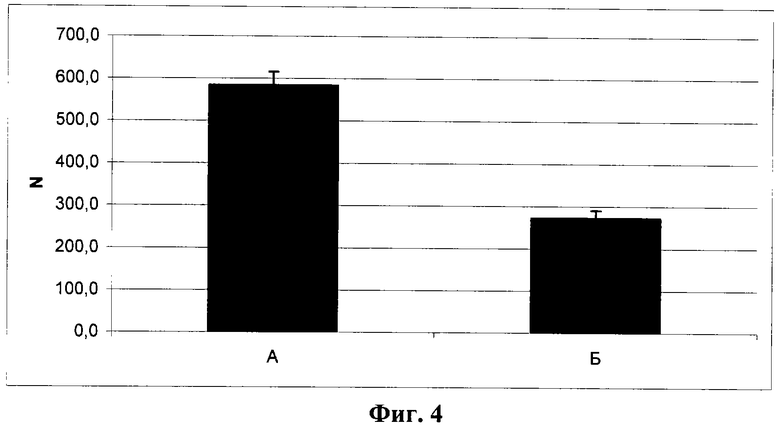
Фиг.4. Количество мелких капилляров в бляшках Матригеля через 2 недели после имплантации мышам линии NUDE. Подсчитывалось количество сосудов без просвета и длиной менее 20 мкм и нормировалось на площадь поля зрения (N).
А - с контрольными клетками (линия L929, клон К1); Б - с опытными клетками (линия L929, клон ТС3).
Различия достоверны (р<0,0001, t-критерий Стьюдента).
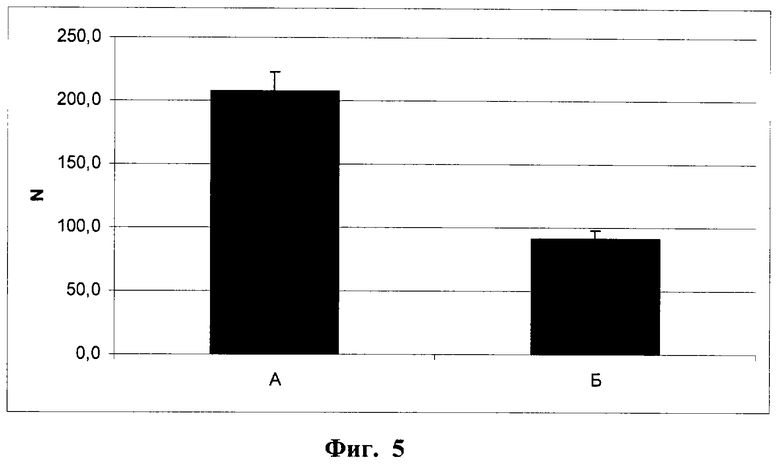
Фиг.5. Количество сосудов среднего размера в бляшках Матригеля через 2 недели после имплантации мышам линии NUDE. Подсчитывалось количество сосудов с просветом или длиной от 20 мкм до 40 мкм, нормировалось на площадь поля зрения (N).
А - с контрольными клетками (линия L929, клон К1); Б - с опытными клетками (линия L929, клон ТС3).
Различия достоверны (р<0,0001, t-критерий Стьюдента).
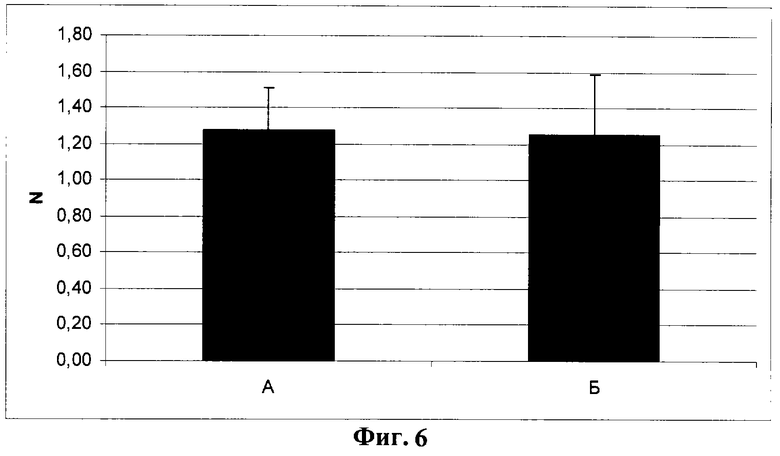
Фиг.6. Количество крупных сосудов в бляшках Матригеля через 2 недели после имплантации мышам линии NUDE. Подсчитывалось количество сосудов диаметром более 40 мкм и нормировалось на площадь поля зрения (N).
Отсутствие различий достоверно (р>0,05, U-критерий Манна-Уитни).
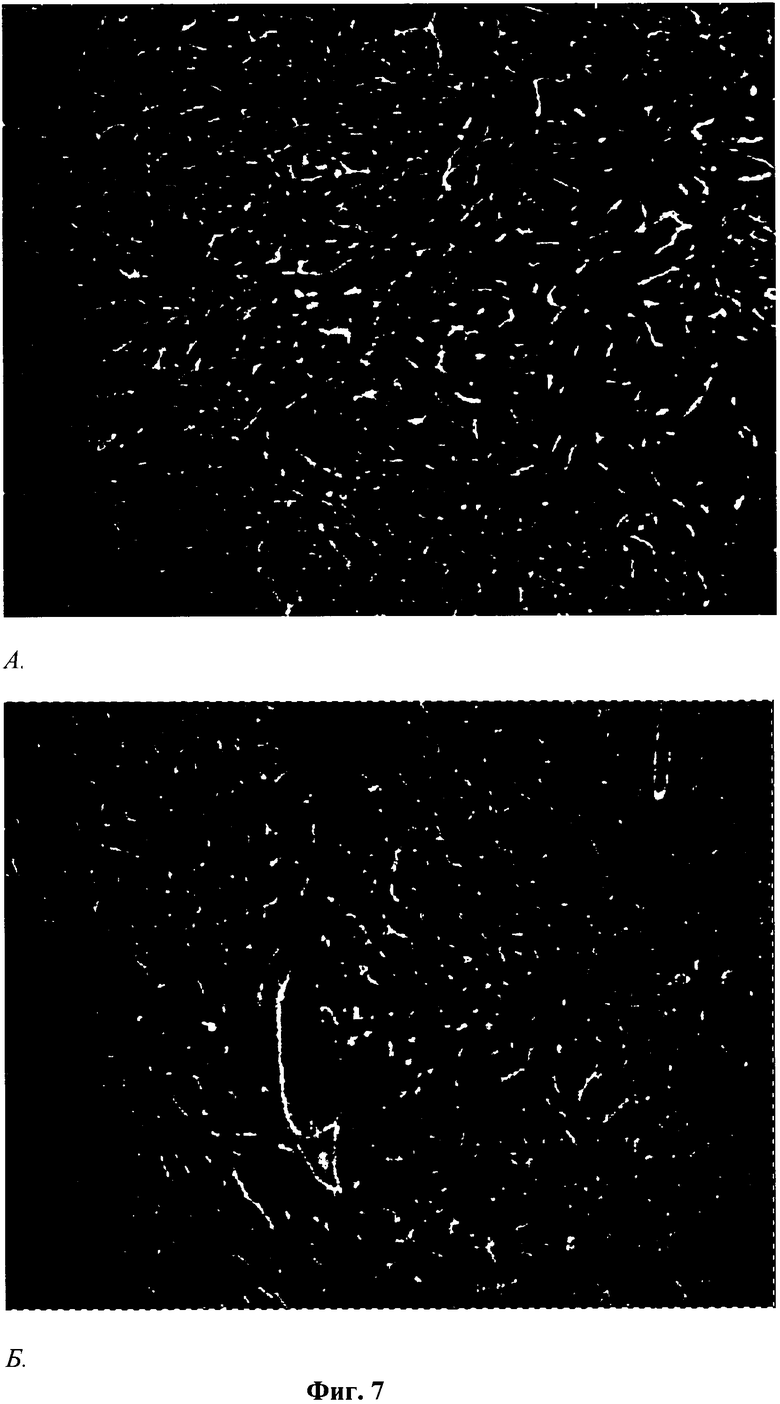
Фиг.7. Выявление сосудов методом двойного иммунофлуоресцентного окрашивания с использованием антител против СD31 на срезах бляшек Матригеля через 2 недели после имплантации мышам линии NUDE.
А - с контрольными клетками (линия L929, клон К1); Б - с опытными клетками (линия L929, клон ТС3).
Осуществление изобретения
Эксперименты проводили на мышах линий BULB С и NUDE, предоставленных биоклиникой РК НПК МЗ РФ и биоклиникой Российского Онкологического Центра соответственно.
Для моделирования процесса ангиогенеза использовали метод имплантации экспериментальным животным Матригеля (Passaniti A et al., 1982).
Пример 1. Получение клонов клеток, стабильно экспрессирующих Т-кадгерин.
В работе использовали клетки эпителия почки эмбриона человека (линии HEK 293) и иммортализованные фибробласты мыши (линии L929). Клетки выращивали в СО2 - инкубаторе (5% СО2; 95% воздуха) на среде Игла, модифицированной Дульбекко (Dulbecco's Modified Eagle's Medium, DMEM, GIBCO BRL), содержащей 10% FBS (фетальной бычьей сыворотки, HyClone), 100 Ед/мл пенициллина и 10 мкг/мл стрептомицина (GIBCO BRL). Смену среды проводили каждые 2-3 дня; при достижении монослоя клетки пассировали.
Трансфекция клеток линии HEK293. Клетки подвергали трансфекции в два этапа, используя трансфекционный агент Lipofectamin 2000 (Invitrogen), и отбирали позитивные клоны в среде, содержащей селективный антибиотик. Сначала клетки были трансфицированы плазмидой pEGFP-C1 (Clontech), содержащей ген зеленого флюоресцентного белка (GFP) и ген устойчивости к генитицину (G418) (GIBCO BRL). Клетки, отобранные на среде с генитицином и экспрессирующие GFP (HEK293GFP), далее трансфицировали двумя плазмидами: плазмидой pcDNA 3.1 (Invitrogen) с включенным в нее геном Т-кадгерина человека (Philippova et al., 2003) и плазмидой pIRESI puro (Clontech), содержащей ген устойчивости к пуромицину. Трансфицированные GFP-позитивные клетки отбирали по устойчивости к пуромицину и подвергали анализу на содержание Т-кадгерина. Клоны HEK293GFP клеток, полученные на первом этапе трансфекции и экспрессирующие ген зеленого флюоресцентного белка (GFP), использовали в дальнейшей работе в качестве контроля. Стабильность конститутивной экспрессии GFP оценивали по флюоресценции клеток в зеленом канале микроскопа Axiovert 200М, Carl Zeiss, Германия.
Трансфекция клеток линии L929. Клетки линии L929 трансфицировали плазмидой pcDNA 3.1 с геном Т-кадгерина (Philippova et al., 2003), используя трансфекционный агент Lipofectamin 2000, и отбирали позитивные клоны в среде, содержащий селективный антибиотик генитицин, которые подвергали анализу на содержание Т-кадгерина.
Для получения контрольных клонов клетки линии L929 трансфицировали плазмидой pcDNA 3.1 (Invitrogen), содержащей фрагмент кДНК люциферазы в антисенсовой ориентации и ген устойчивости к генитицину (Philippova et al., 2003). Для отбора контрольных клонов клетки инкубировали в среде с генитицином. Экспрессию Т-кадгерина в клетках HEK293 (клоны Тh5 и Th8) и L929 (клон TC3) определяли методом иммуноблоттинга.
Пример 2. Анализ экспрессии Т-кадгерина в трансфицированных клетках.
Приготовление лизатов клеток. Все процедуры проводили на льду. Клетки, растущие во флаконах для культивирования, охлаждали в течение 30 мин, затем промывали холодным PBS, соскребали пластиковым шпателем и центрифугировали при 1500-2000 rpm при +4оС в течение 5 мин. Осадок растворяли в лизирующем буфере (100 мМ Tris-HCl, pH 8.1, 1% Triton X-100, 20 мМ HEPES (pH 7.5), 150 мМ NaCl, 1 мМ MgCl2, 1 мМ CaCl2, ингибиторный коктейль протеаз в разведении 1:100 (Inhibitor Proteinase Cocktail, (PIERCE)), инкубировали 15 мин, центрифугировали 20 мин при 16000 rpm и температуре 4оС. Лизаты пропускали через шприц с иглой G21 для разрушения полимерных цепей ДНК, измеряли концентрацию белка, используя метод Bio-Rad Protein Assay (Bio-Rad Laboratories) и БСА в качестве стандарта. Полученные лизаты использовали для электрофореза белков и иммуноблоттинга или хранили при -20оС.
Электрофорез белков и иммуноблоттинг. Электрофорез белков проводили в денатурирующих условиях в присутствии SDS. Анализируемый образец смешивали с буфером для образцов (буфер Леммли (Laemmli) с ?β-меркаптоэтанолом), нагревали до 99оС в течение 5 минут и наносили на 7% ПААГ (полиакриламидный гель) из расчета 30 мкг белка на лунку. Для определения молекулярных масс белков использовали стандартную коммерческую смесь предокрашенных белков (Kaleidoscope Prestained Standards, BioRad Laboratories). Перенос белков из геля на нитроцеллюлозную мембрану (Immobilon, Millipore), предварительно смоченную буфером для электропереноса, осуществляли методом полусухого электроблоттинга.
После переноса белков мембрану промывали в TBS буфере (150 мМ NaCl, 50 мМ Tris/HCl, pH 7.4) и инкубировали в TBS буфере, содержащем 5% обезжиренное молоко и 0,05% Tween 20 в течение 60 мин. Далее мембрану инкубировали в течение ночи при +4оС с антителами кролика против человеческого Т-кадгерина, ранее полученными в нашей лаборатории (Tkachuk et al., 1998). Затем мембрану отмывали в TBS и инкубировали в растворе вторых антител, конъюгированных с пероксидазой хрена (Immune Jackson Research), против антител кролика в течение 60 минут. Для визуализации полос белка, связавшихся антитела, использовали двухкомпонентную ECL-систему (ECLTM Western Blotting Detection Reagents, Amersham Bioscience); мембрану экспонировали на рентгеновской пленке CL-XposureTM (Amersham Bioscience).
В качестве позитивного контроля использовали эндотелиальные клетки пупочной вены человека (HuVEC), которые в норме экспрессируют Т-кадгерин в зрелой форме (мол. масса 105 kDa) и в виде предшественника (мол. масса 130 kDa).
По результатам иммуноблотинга были отобраны два клона трансфицированных клеток линии НЕК 293 (Тh5 и Th8) и один клон трансфицированных клеток линии L929 (ТС3) с наиболее высоким уровнем экспрессии Т-кадгерина (фиг.1). В дальнейшей работе использовали клон Тh5 и клон ТС3.
Пример 3. Подкожная имплантация Матригеля и клеток.
Клетки, экспрессирующие Т-кадгерин, или контрольные клетки вводили мышам подкожно в виде суспензии в Матригеле. Для этого клетки, достигшие 90-95% плотности монослоя, снимали с культуральных чашек 0,25% раствором трипсина на растворе Версена, центрифугировали при 1000g 5 минут и ресуспендировали в небольшом объеме среды; количество клеток считали в камере Горяева. Все манипуляции с клетками проводились в стерильных условиях. Затем приготавливали суспензию клеток в среде так, чтобы в 100 мкл среды находилось 1,7 млн клеток. Далее 400 мкл холодного (+4°C) Матригеля смешивали со 100 мкл суспензии клеток и вводили подкожно мышам. В правый бок вводили суспензию клеток, гиперэкспрессирующих Т-кадгерин (опыт); в левый бок - суспензию контрольных клеток. Инъекции проводились инсулиновым шприцем с иглой толщиной 22G таким образом, чтобы Матригель успевал полимеризоваться под кожей и образовывал плотный, желеобразный имплантант.
Мышам линии BALB C в качестве опытных клеток вводили клетки HEK293GFP клона Th5, мышам линии NUDE - клетки клона ТС3; в качестве контрольных клеток мышам линии BALB C вводили контрольные клетки HEK293GFP, а мышам линии NUDE - клетки контрольного клона К1.
Через 2 недели после подкожного введения клеток в Матригеле мышей умерщвляли изофлюрановым наркозом (Isofluran, Fso FloTM), делали разрез кожи над областью бляшек Матригеля, извлекали Матригель полностью и взвешивали. Далее бляшки Матригеля использовали для измерения гемоглобина или замораживали в жидком азоте для последующего приготовления срезов, иммунофлюоресцентного окрашивания и подсчета сосудов или использовали для выделения клеток из Матригеля с целью оценки их выживаемости.
Пример 4. Выделение клеток из имплантантов Матригеля. Выделенные бляшки измельчали в небольшом объеме стерильного PBS (137 мМ NaCl, 2.7 мМ KCl, 4.3 мМ Na2HPO4*2H2O, 1.4 мМ KH2PO4), далее добавляли растворы диспазы 40 ЕД/1 мл и коллагеназы 200 ЕД/1 мл на стерильном PBS в соотношении 1:1 и инкубировали в течение 40 минут при 37оС при периодическом перемешивании. По окончании инкубации ферменты инактивировали добавлением 2 мл 10% FBS. Клетки осаждали с помощью центрифугирования при 1000g 10 минут. Затем осадок ресуспендировали в 1,5 мл буфера для лизиса эритроцитов (154 mM NH4Cl, 10 mM KHCO3, 0,1 mM EDTA), инкубировали 5 минут, инактивировали добавлением 1,5 мл 10% FBS и центрифугировали при 1000g 10 минут. Осадок ресуспендировали в 1 мл среды DMEM/10% FBS, пропускали через 40-мкм сетку (BD Biosciences) и высаживали на чашку Петри диаметром 60 мм. Выживаемость клеток в Матригеле оценивали на следующий день после выделения их из Матригеля (спустя 2 недели после введения) по отношению количества флюоресцирующих клеток в чашке Петри к количеству вводимых в Матригеле клеток. При этом были получены следующие результаты: BALB C/HEK293GFР - 10%; BALB C/HEK293GFР клон Th5 - 10%; NUDE/ L929 клон K1 - 60%; NUDE/L929 клон ТС3 - 63%.
Пример 5. Измерение гемоглобина в бляшке Матригеля гемцианидным методом. Для измерения гемоглобина бляшки Матригеля гомогенизировали на электрическом гомогенизаторе (Janke & Kunkel, IKA-Labor Technic) в 200 мкл 0,9% NaCl и центрифугировали 7 мин при 5000 rpm. К полученному супернатанту добавили хлороформ из расчета 100 мкл на 50 мкг изначальной массы образца, тщательно перемешали и центрифугировали 3 минуты при 13000 rpm. К супернатанту добавляли 150 мкл гемолитика - концентрированного раствора Драбкина (K3Fe(CN)6, KCN, KH2PO4, Triton X-100) и инкубировали 15 минут при комнатной температуре, затем центрифугировали 2 мин при 13000 rpm. Объем полученного супернатанта доводили до 0,5 мл раствором 0,9% NaCl и в получившемся растворе гемцианида измеряли поглощение при длине волны 594 нм на спектрофотометре (Janako). Полученные данные нормировали по стандартному раствору гемолитика (150 мкл гемолитика +350 мкл 0,9% NaCl).
Пример 6. Окрашивание срезов бляшек Матригеля методом иммунофлюоресценции и подсчет количества капилляров.
Бляшки погружали в среду для заморозки тканей Tissue-Tek (Sacura Finetechnical Co., Ltd.), замораживали в жидком азоте и хранили при температуре -20°С или приготавливали срезы толщиной 7 мкм на криостате (НМ 505 Е, Microm, Германия). Перед окрашиванием срезы фиксировали в 4% формалине (Sigma) 10 мин при комнатной температуре, затем обрабатывали 0,2% Triton X100 в течение 10 минут. Затем срезы промывали PBS и инкубировали в 0,05М растворе ацетата аммония на PBS (10 минут) для снижения уровня аутофлуоресценции и в 1% растворе БСА (бычий сывороточный альбумин), содержащего 10% сыворотки донора вторых антител для забивки неспецифического связывания (60 мин). Далее на срезы наносили антитела крысы против CD31 мыши, специфического маркера эндотелиальных клеток сосудов, на 60 минут. После отмывки в PBS срезы помещали в раствор вторых антител, конъюгированных с флюорохромом Alexa 595 (Molecular Probes) на 60 мин. Для визуализации ядер клеток срезы докрашивали флюоресцентым красителем DAPI. После отмывки в PBS срезы заключали в среду Mounting Medium VectashieldTM (Vector Laboratories Inc.). Готовые препараты хранили при +4оС в темноте. Полученные препараты (фиг.7) анализировали при помощи флуоресцентного микроскопа Axiovert 200 M (Zeiss). Документирование изображений производили с помощью цифровой видеокамеры Axiocam HRC (Zeiss, Германия) и обработки изображения в программе Axiovision 3.1.
Подсчет сосудов проводили на 4-5 срезах с каждого образца Матригеля в 4-5 полях зрения для каждого среза, выделяя капилляры (CD31-положительные образования без просвета или длиной менее 20 мкм), сосуды среднего диаметра (CD31-положительные образования с просветом или длиной более 20 мкм) и крупные сосуды (диаметром более 40 мкм). Полученное количество сосудов в одном поле зрения нормировали на площадь поля зрения, оцененную по окрашиванию ядер с использованием DAPI. Подсчет сосудов проводили, используя объектив с увеличением 10.
Пример 7. Статистический анализ и оценка результатов. Статистический анализ данных проводился в программе Statistica 6.0. При оценке массы имплантантов и при подсчете числа сосудов использовали t-критерий Стьюдента. Содержание гемоглобина в образцах оценивали, используя U-критерий Манна-Уитни. При подтверждении нормальности распределения признака методами Колмогорова-Смирнова и Шапиро-Уилксона использовали t-критерий Стьюдента, для маленьких групп и ненормальных распределений - U-критерий Манна-Уитни.
В обеих модельных системах в целом получены сходные данные, свидетельствующие о подавлении в условиях гиперэкспрессии Т-кадгерина процесса образования новых сосудов в области имплантантов. В результате проведенного статистического анализа для имплантантов Матригеля с клетками опытного клона ТС3 и контрольного клона К1 у мышей NUDE установлено статистически достоверное уменьшение всех основных показателей. Общая масса имплантантов Матригеля, содержащих Т-кадгерин (фиг.2, Б), более чем в 1,5 раза ниже массы контрольных имплантантов (фиг.2, А). Содержание гемоглобина, нормированное по массе бляшек, в опытных имплантантах (фиг.3, Б) в 3 раза меньше, чем в контроле (фиг.3, А). Количество мелких сосудов (капилляров и сосудов среднего диаметра), нормированное по числу клеток, окрашенных ядерным красителем DAPI, на срезе бляшек Матригеля (N на фиг.4 и фиг.5) в опытных имплантантах (Б) достоверно ниже, чем в контрольных (А), в частности число капилляров в имплантантах с клетками опытного клона ТС3 (фиг.4, Б) снижено более чем в 2 раза по сравнению с имплантантами, содержащими контрольные клетки клона К1 (фиг.4, А). Количество сосудов крупного диаметра не зависело от содержания Т-кадгерина в имплантанте (фиг.6).
Список литературы
1. Киселев С.М., Луценко С.В., Северин С.Е., Северин Е.С., Ингибиторы опухолевого ангиогенеза. Биохимия. 2003;68(5): 611-631.
2. Angst B.D., Marcozzi C., Magee A.I. The cadherin superfamily: diversity in form and function. J. Cell. Sci. 114: 629-641. 2001.
3. Brantley-Sieders D.M., Chen J. Eph receptor tyrosine kinases in angiogenesis: from development to disease. Angiogenesis. 2004;7(1):17-28.
4. Collett G.D., Canfield A.E. Angiogenesis and pericytes in the initiation of ectopic calcification. Circ Res. 2005; 96(9): 930-8.
5. Fischer-Colbrie R., Kirchmair R., Kahler C.M., Wiedermann C.J., Saria A. Secretoneurin: a new player in angiogenesis and chemotaxis linking nerves, blood vessels and the immune system. Curr Protein Pept Sci. 2005;6(4):373-85.
6. Fredette B.J., Ranscht B. T-cadherin expression delineates specific regions of the developing motor axon-hindlimb projection pathway. J Neurosci. 1994; 14(12): 7331-46.
7. Fredette B.J., Miller J., Ranscht B. Inhibition of motor axon growth by T-cadherin substrata. Development 122(10): 3163-71. 1996.
8. Hibi K., Nakayama H., Kodera K., Ito K., Akiyama S., Nakao A. CDH13 promoter region is specifically methylated in poorly differentiated colorectal cancer. Brit. J. Cancer. 90: 1030-1033. 2004.
9. Hisaka Y., Ieda M., Nakamura T., Kosai K., Ogawa S., Fukuda K. Powerful and controllable angiogenesis by using gene-modified cells expressing human hepatocyte growth factor and thymidine kinase. J Am Coll Cardiol. 2004; 43(10):1915-22.
10. Ivanov D., Philippova M., Antropova J., Gubaeva F., Iljinskaya O., Tararak E., Bochkov V., Erne P., Resink T., Tkachuk V. Expression of cell adhesion molecule T-cadherin in the human vasculature. Histochem Cell Biol. 2001; 115(3): 231-42.
11. Inanov D., Philippova M., Tkachuk V., Erne P., Resink T. Cell adhesion molecule T-cadherin regulates vascular cell adhesion, phenotype and motility. Exp.Cell Res. 293: 207-218. 2004.
12. Iwaguro H., Yamaguchi J.i., Kalka C., Murosawa S., Masuda H., Hayashi S.i., Silver M., Li T., Isner J.M., Takayuki A. Endothelial progenitor cell vascular endothelial growth factor gene transfer for vascular regeneration. Circulation. 2002; 105: 732-738.
13. Kudrjashova E., Bashtrikov P., Bochkov V., Parfyonova Y., Tkachuk V., Antropova J., Iljinskaya O., Tararak E., Erne P., Ivanov D., Philippova M., Resink TJ. Expression of adhesion molecule T-cadherin is increased during neointima formation in experimental restenosis. Histochem Cell Biol. 2002; 118(4): 281-90.
14. Leong T.T., Fearon U., Veale D.J. Angiogenesis in psoriasis and psoriatic arthritis: clues to disease pathogenesis. Curr Rheumatol Rep. 2005; 7(4): 325-9.
15. Pap T., Distler O. Linking angiogenesis to bone destruction in arthritis. Arthritis Rheum. 2005; 52(5): 1346-8.
16. Passaniti A., Taylor R.M., Pili R., Guo Y., Long P.V., Haney J.A., et al. A simple, quantitative method for assessing angiogenesis and antiangiogenic agents using reconstituted basement membrane, heparin and fibroblast growth factor. Lab Invest 1982; 67:519-528.
17. Philippova M., Ivanov D., Tkachuk V., Erne P. and Resink T.J.: Polarisation of T-cadherin to the leading edge of migrating vascular cells in vitro: a function in vascular cell motility? Histochem Cell Biol 120: 353-360, 2003.
18. Ponnazhagan S., Mahendra G., Kumar S., Shaw D.R., Stockard C.R., Grizzle W.E., Meleth S. Adeno-associated virus 2-mediated antiangiogenic cancer gene therapy: long-term efficacy of a vector encoding angiostatin and endostatin over vectors encoding a single factor. Cancer Res.; 64(5): 1781-7, 2004.
19. Ranscht B., Dours-Zimmermann M.T. T-cadherin, a novel cadherin cell adhesion molecule in the nervous system lacks the conserved cytoplasmic region. Neuron 7(3): 391-402. 1991.
20. Rubina K., Talovskaya K., Cherenkov V., Ivanov D., Stambolsky D., Storozhevikh T., Pinelis V., Shevelev A., Parfyonova Ye., Resink T., Erne P., Tkachuk V. LDL induces intracellular signaling and cell migration via atypical LDL-binding protein T-cadherin. Mol. Cell. Biochemistry. 373: 33-41. 2005.
21. Seth P. Vector-mediated cancer gene therapy: an overview. Cancer Biol Ther. 4(5):512-7. 2005.
22. Suzuki K., Brand N.J., Allen S., Khan M.A., Farrell A.O., Murtuza B., Oakley R.E., Yacoub M.H. Overexpression of connexin 43 in skeletal myoblasts: Relevance to cell transplantation to the heart. J.Thorac Cardiovasc Surg. 122:759-766. 2001.
23. Takeuchi T., Ohtsuki Y. Recent progress in T-cadherin (CDH13, H-cadherin) research. Histol. Histopathol. 16: 1287-1293. 2001.
24. Takeuchi T., Liang S.-B., Ohtsuki Y. Downregulation of expression of a novel cadherin molecule, T-cadherin, in basal cell carcinoma of the skin. Mol. Cancerogen. 35: 173-179. 2002.
25. Takeuchi T., Liang S.-B., Matsuyoshi N., Zhou S., Miyachi Y., Sonobe H., Ohtsuki Y. Loss of T-cadherin (CDH13, H-cadherin) expression in cutaneous squamous cell carcinoma. Lab. Invest. 82(8): 1023-1029. 2002
26. Tkachuk V.A., Bochkov V.N., Philippova M.P., Stambolsky D.V., Kuzmenko E.S., Sidorova M.V., Molokoedov A.S., Spirov V.G. and Resink T.J.: Identification of an atypical lipoprotein-binding protein from human aortic smooth muscle as T-cadherin. FEBS Lett 421: 208-12., 1998.
27. Vestal D.J., Ranscht B. Glycosyl phosphatidylinositol-anchored T-cadherin mediates calcium-dependent, homophilic cell adhesion. J Cell Biol. 119: 451-61. 1992.
28. Wyder L., Vitaliti A., Schneider H., Hebbrand L.W., Moritz D.R., Wittmer M., Ajmo M., Klemenz R. Increased expression of H/T-cadherin in tumor-penetrating vessels. Cancer Res. 60: 4682-4688. 2000.
29. Zhou S., Matsuyoshi N., Liang S.-B., Takeuchi T., Ohtsuki Y., Miyachi Y. Expression of T-cadherin in basal kerationcytes of skin. J. Invest.Derm. 118(6):1080-1096. 2002.
30. Yap A.S., Kovacs E.M. Direct cadherin-activated cell signaling: a view from the plasma membrane. J. Cell. Biol. 160: 11-16. 2003.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КУЛЬТИВИРОВАНИЯ ФИБРОБЛАСТОВ ДЛЯ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2006 |
|
RU2320720C2 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ КЛЕТОК С ИНДУЦИРОВАННЫМ АНГИОГЕННЫМ ФЕНОТИПОМ, ПРЕДНАЗНАЧЕННОЙ ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ В ЗОНЕ ИШЕМИИ | 2007 |
|
RU2334793C1 |
| ГЕН VEGFopt ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ ЧЕЛОВЕКА | 2008 |
|
RU2385937C1 |
| ГЕН AGРopt АНГИОПОЭТИНА-1 | 2008 |
|
RU2385938C1 |
| ГЕН HGFopt ФАКТОРА РОСТА ГЕПАТОЦИТОВ | 2008 |
|
RU2385936C1 |
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ В ИШЕМИЗИРОВАННЫХ ТКАНЯХ | 2011 |
|
RU2497529C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ПОРАЖЕНИЙ ТКАНЕЙ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2012 |
|
RU2522778C2 |
| СПОСОБ СТИМУЛИРОВАНИЯ ВОССТАНОВЛЕНИЯ ПЕРИФЕРИЧЕСКОЙ ИННЕРВАЦИИ ТКАНЕЙ С ПОМОЩЬЮ ВЕКТОРНЫХ КОНСТРУКЦИЙ | 2011 |
|
RU2486918C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ, ИНДУЦИРОВАННЫХ К НЕЙРАЛЬНОЙ ДИФФЕРЕНЦИРОВКЕ | 2008 |
|
RU2396345C1 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
Изобретение относится к области генной и клеточной инженерии и может быть использовано в экспериментальной биологии и медицине. Предложен способ локального подавления ангиогенеза в ткани-мишени, предусматривающий введение в защищаемую область либо вектора, который содержит последовательность ДНК, кодирующую Т-кадгерин, и способен обеспечить ее экспрессию в ткани-мишени, либо клеток, совместимых с клетками ткани-мишени, которые были предварительно трансфицированы названным вектором и отобраны по уровню экспрессии Т-кадгерина. При осуществлении предлагаемого способа в модельной системе, основанной на имплантации Матригеля мышам, у опытных животных, которым были подкожно введены экспрессирующие Т-кадгерин клетки L929 (клон ТС3), через 2 недели после инъекции наблюдалось достоверное снижение массы имплантанта, содержания в имплантанте гемоглобина, а также количества капилляров и сосудов среднего размера по сравнению с контролем. Настоящее изобретение может быть положено в основу новых методов лечения патологических состояний, связанных с необходимостью подавления образования в ткани новых кровеносных сосудов. 6 з.п. ф-лы, 7 ил.
| СПОСОБЫ И КОМПОЗИЦИИ, ПРИМЕНИМЫЕ ДЛЯ МОДУЛЯЦИИ АНГИОГЕНЕЗА С ИСПОЛЬЗОВАНИЕМ ПРОТЕИНКИНАЗЫ RAF И RAS | 2000 |
|
RU2257911C2 |
| US 2003206902, 06.11.2003 | |||
| TAKEUCHI et al | |||
| J | |||
| Neurochem | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| IVANOV D | |||
| et al | |||
| Cardiovasc | |||
| Res | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2007-01-27—Публикация
2005-12-23—Подача