Область техники, к которой относится изобретение
Настоящее изобретение относится к новой терапевтической комбинации таксотера с другими антибластомными средствами, которые являются пригодными для вспомогательной терапии метастатического рака молочной железы и яичников.
Предпосылки создания изобретения
Более конкретно настоящее изобретение относится к применению доцетаксела в комбинации с доксорубицином и циклофосфамидом в качестве вспомогательной терапии при лечении рака после оперативного вмешательства или другой терапии первого выбора.
Определения выбранных терминов, применяемых в описании изобретения и в таблицах 1-36, являются следующими:
термин «вспомогательная терапия» относится к химиотерапии, которую начинают в пределах, но не позднее, 60 суток от момента оперативного вмешательства;
термин «AT» относится к комбинации адриамицина/таксотера;
термин «доцетаксел» относится к активному ингредиенту лекарственного препарата TAXOTERE® или собственно к лекарственному препарату TAXOTERE®;
термин «доксорубицин» относится к активному ингредиенту лекарственного препарата ADRIAMYCIN® или собственно к лекарственному препарату ADRIAMYCIN®;
термин «ER» относится к эстрогенным рецепторам;
термин «FAC» относится к комбинации 5-фторурацила, доксорубицина и циклофосфамида;
термин «HER2» относится к трансмембранному тирозинкиназному рецептору с частичной гомологией с рецептором-2 эпидермального фактора роста, причем оба рецептора принадлежат к суперсемейству тирозинкиназных рецепторов типа 1;
термин «KPS» относится к состоянию работоспособности по Karnovsky, который представляет собой показатель физического состояния больного;
термин «MF» относится к комбинации метотрексата/5-фторурацила;
термин «MV» относится к комбинации митомицина/винбластина;
термин «PR» относится к прогестероновому рецептору;
термин «TAC» относится к комбинации лекарственного препарата TAXOTERE® (доцетаксела), лекарственного препарата ADRIAMYCIN (доксорубицина) и циклофосфамида;
и
термин «лекарственный препарат» или «лекарственные препараты» относится к упомянутым выше активным ингредиентам или лекарственным средствам, или к содержащим их фармацевтическим препаратам.
Ранее исследователями было отмечено, что доцетаксел (TAXOTERE®) и его производные (такие как TAXOL®, паклитаксел) пригодны для лечения злокачественных новообразований, таких как солидные опухоли и другие злокачественные опухоли. В европейском патенте EP 0253738 и в заявке на выдачу международного патента WO 92/09589 описан способ приготовления доцетаксела. Как правило, варьирующая в зависимости от больного дозировка содержит от 60 до 400 мг/м2 доцетаксела. Обычно доцетаксел вводят внутривенно в дозировке от 60 до 100 мг/м2 в течение 1 часа один раз каждые 3 недели (Textbook of Medical Oncology, Franco Cavelli et al., Martin Dunitz Ltd., p.4623 (1997)).
Во многих клинических исследованиях была подтверждена эффективность доцетаксела при лечении многих типов рака, в особенности рака молочной железы, немелкоклеточного рака легких и рака яичников. Эффективность доцетаксела показана и при терапии первого выбора, и при терапии второго выбора. Считается, что механизм действия доцетаксела осуществляется посредством усиления сборки микротрубочек и ингибирования деполимеризации тубулина на клеточном уровне.
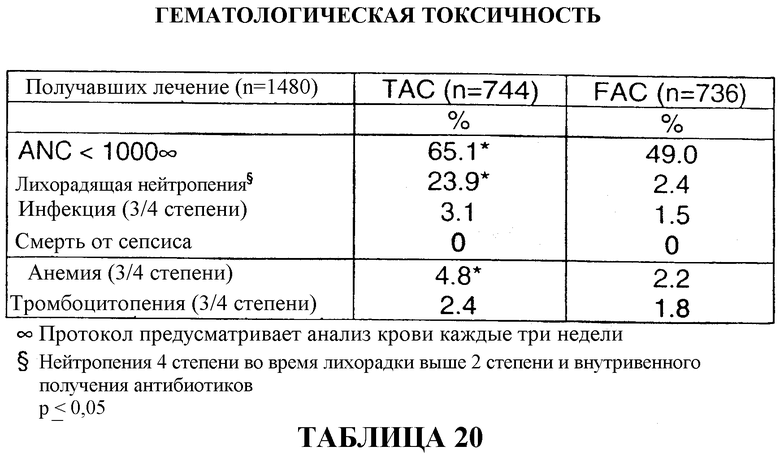
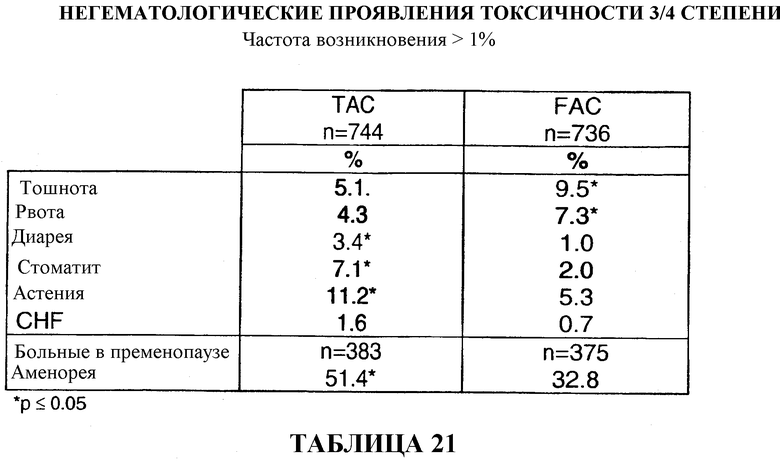
Однако, при всех способах лечения, основанных на применении таксоидных производных, включая доцетаксел, могут наблюдаться серьезные и причиняющие страдания токсические проявления, такие как угнетение деятельности миелоидного ряда костного мозга, нейтропения, гиперчувствительность, периферическая невропатия и, помимо всего прочего, задержка жидкости (Fumoleau et al., Bull. Cancer, (82) 8:629-636 (1995)). В случае возникновения подобных токсических проявлений дозировка лекарственных препаратов может быть ограничена с получающейся в результате этого ограниченной эффективностью лечения.
Следовательно, в данной области техники существует неудовлетворенная потребность в фармацевтических препаратах и способах лечения рака, усиливающих активность доцетаксела без количественного увеличения вводимых доз и без усиления нежелательных побочных эффектов.
В данной области техники также существует неудовлетворенная потребность в лечении рака, распространяющегося за пределы начальной локализации опухоли. Необходимость в эффективной послеоперационной вспомогательной терапии, которая приводила бы к стадии ремиссии или, по крайней мере, к увеличению продолжительности стадии ремиссии, существует в особенности для метастатического рака молочной железы и рака яичников.
В недавних исследованиях было показано, что схемы лекарственного лечения с применением доцетаксела обладают большей эффективностью по сравнению со стандартными схемами лекарственного лечения метастатического рака молочной железы. Схемы лекарственного лечения на основе применения антрациклинов, например, с применением доксорубицина, представляют собой стандартную вспомогательную терапию больных раком молочной железы с регионарными метастазами. Поэтому, учитывая обоюдную эффективность доцетаксела и доксорубицина в лечении прогрессирующего рака молочной железы и потенциальное отсутствие между ними перекрестной резистентности, было решено объединить их вместе с циклофосфамидом в качестве возможной схемы для более эффективной вспомогательной терапии метастатического рака молочной железы. Комбинация доцетаксела, доксорубицина и циклофосфамида (TAC) была протестирована в испытаниях фазы III в 20 странах более чем 112 исследователями. Детально рассмотренные ниже результаты свидетельствуют о том, что применяемая в качестве вспомогательной терапии комбинация усиливает эффект доцетаксела без увеличения его дозировки и приводит к повышенной выживаемости больных метастатическим раком молочной железы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам лечения метастатического рака, в особенности метастатического рака молочной железы и рака яичников, включающим введение доцетаксела, доксорубицина и циклофосфамида (TAC) в количествах, эффективных для подавления или устранения опухоли. Эффективность этой комбинации была продемонстрирована в течение 33-месячного периода времени на более чем 700 больных раком с регионарными метастазами, которые подвергались послеоперационному лечению с применением TAC.
Другой аспект настоящего изобретения относится к новым наборам реагентов для приготовления фармацевтических препаратов и лекарствам, содержащим доцетаксел в комбинации с доксорубицином и циклофосфамидом, для лечения злокачественных опухолей.
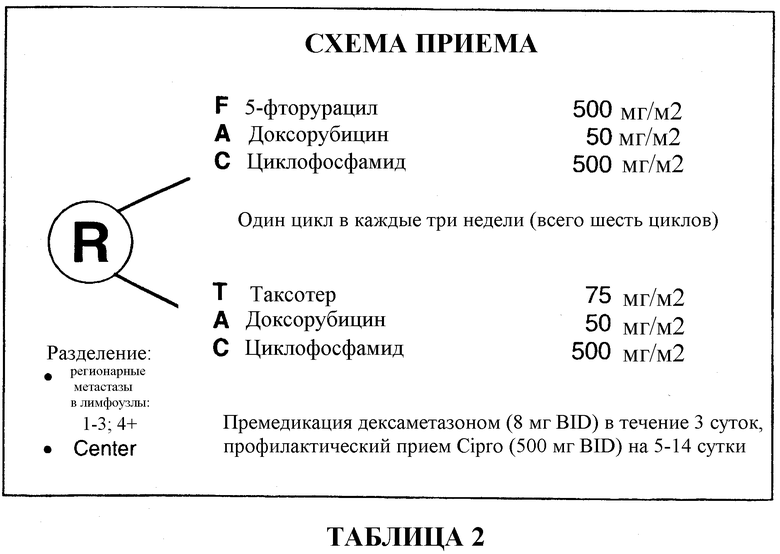
Еще один аспект настоящего изобретения относится к режиму введения TAC для вспомогательной терапии рака, где в течение одного и того же дня проводят раздельную инфузию каждого конкретного лекарственного средства, входящего в состав комбинации TAC, один раз в каждые три недели. Этот цикл повторяют шесть раз.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ
Авторами настоящего изобретения в клинических испытаниях было показано, что дозировки TAC, в частности, обладают неожиданным и сильным терапевтическим эффектом при лечении опухолей, конкретно злокачественных опухолей молочной железы, и более конкретно метастатических злокачественных опухолей молочной железы, при которых ER/PR и HER2 сверхэкспрессированы. Как правило, в соответствии с настоящим изобретением доцетаксел вводят в дозировке 75 мг/м2, доксорубицин в дозировке 50 мг/м2 и циклофосфамид в дозировке 500 мг/м2 один раз в каждые три недели. Этот цикл, как правило, повторяют шесть раз.
Собственно для доцетаксела в нескольких специальных лабораторных исследованиях были показаны предельные показатели эффективности от 40 до 43% (при терапии второго выбора при дозировке 100 мг/м2), 48% (при терапии первого выбора при дозировке 75 мг/м2) и 61% (при терапии первого выбора при дозировке 100 мг/м2).
Для сравнения в нижеприведенном примере 75 мг/м2 доцетаксела вводили в комбинации с 50 мг/м2 доксорубицина и 500 мг/м2 циклофосфамида, в результате чего показатель эффективности составил 82%.
В соответствии с настоящим изобретением новое применение доцетаксела в качестве компонента TAC является очень эффективным для лечения злокачественных опухолей молочной железы, яичников и легких; еще более предпочтительно, новое применение доцетаксела особенно пригодно для лечения метастатического рака молочной железы.
Безопасность и эффективность комбинации доцетаксела, доксорубицина и циклофосфамида были протестированы на больных в соответствии со следующим протоколом:
Больные считались пригодными для исследования, если у них было гистологически доказано наличие рака молочной железы, если была проведена окончательная операция по иссечению подмышечных лимфоузлов (не менее 6 лимфоузлов), если между операцией и рандомизацией прошло не более 60 суток, если рак относился к 1-3 стадии, если имелся по крайней мере один регионарный метастаз в лимфоузел, если возраст больного не превышал 70 лет, если показатель KPS был более или равный 80%, и если у больного отмечалась нормальная деятельность костного мозга, печени, почек и сердца. Смотри таблицу 4.
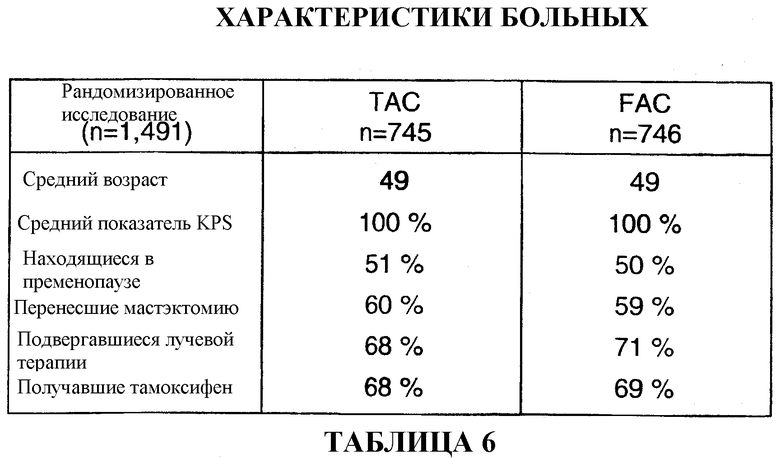
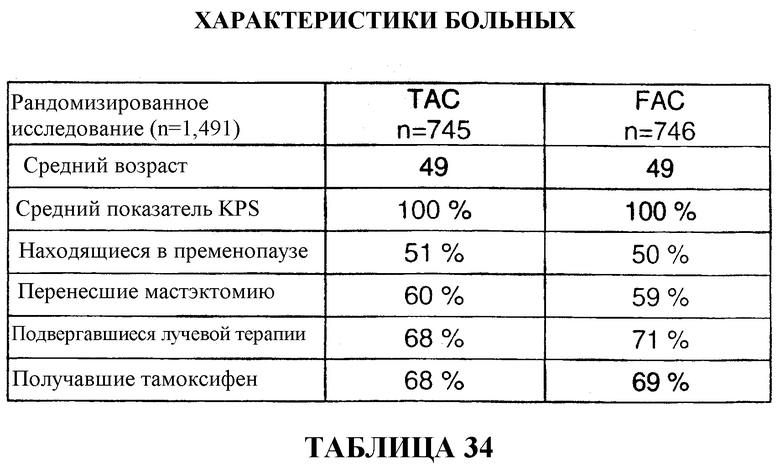
Для исследования был отобран 1491 больной. В качестве вспомогательной терапии 745 больных получали TAC, а 746 больных получали FAC. Средний возраст больных, получавших TAC, составлял 49 лет, 51% больных находился в пременопаузе, и 60% больных перенесли мастэктомию. 68% больных подвергались лучевой терапии, и 68% больных получали тамоксифен. Характеристики группы больных, получавших FAC, были сходными (см. таблицу 6).
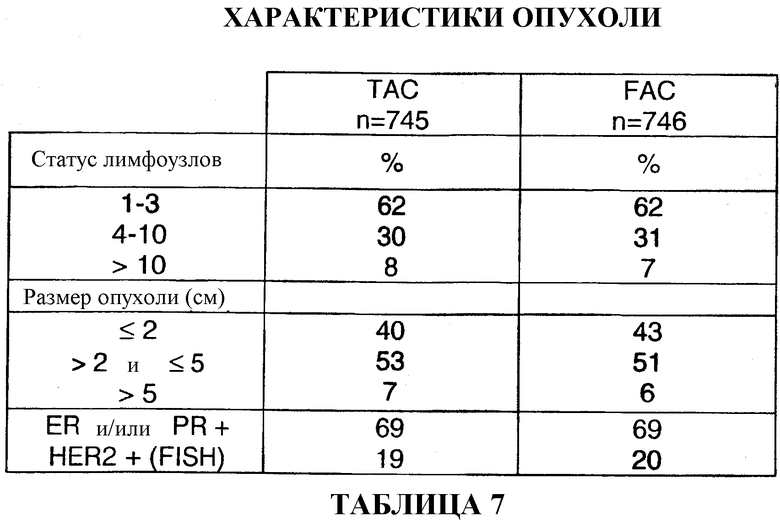
Из 745 больных, получавших TAC, у 62% больных обнаруживали 1-3 регионарных метастаза в лимфоузлы, у 30% больных обнаруживали 4-10 регионарных метастазов в лимфоузлы, а у 8% больных обнаруживали более 10 регионарных метастазов в лимфоузлы. У 40% больных размер опухоли не превышал 2 см, у 53% больных размер опухоли превышал 2 см, но был равным или не превышал 5 см, а у 7% больных размер опухоли превышал 5 см. У 69% больных были диагностированы опухоли со сверхэкспрессией ER или PR, а у 19% больных - опухоли со сверхэкспрессией HER2+(FISH). И в этом случае, характеристики опухоли у больных, получавших FAC, были сопоставимыми (смотри таблицу 7).
Первичным результатом данного испытания фазы III было содействие в достижении стадии ремиссии, в то время как вторичными результатами являлись исследования общей выживаемости, токсичности, качества жизни и мониторинг маркеров патологии и молекулярных маркеров.
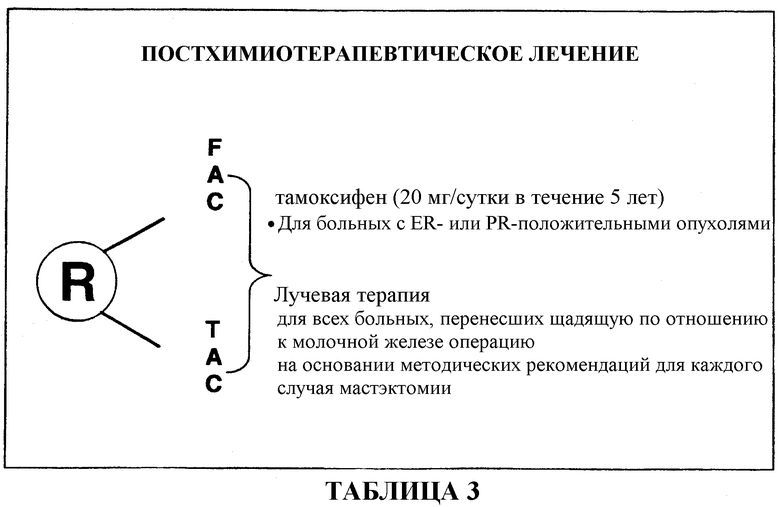
Лечение после применения TAC и FAC включало 1) лучевую терапию для всех больных, перенесших щадящую по отношению к молочной железе операцию, и 2) назначение тамоксифена (20 мг/сутки в течение 5 лет) для больных с ER- или PR-положительными опухолями. Смотри таблицу 3.
Приведенный ниже пример иллюстрирует новое применение доцетаксела в соответствии с настоящим изобретением, не ограничивая его.
ПРИМЕР:
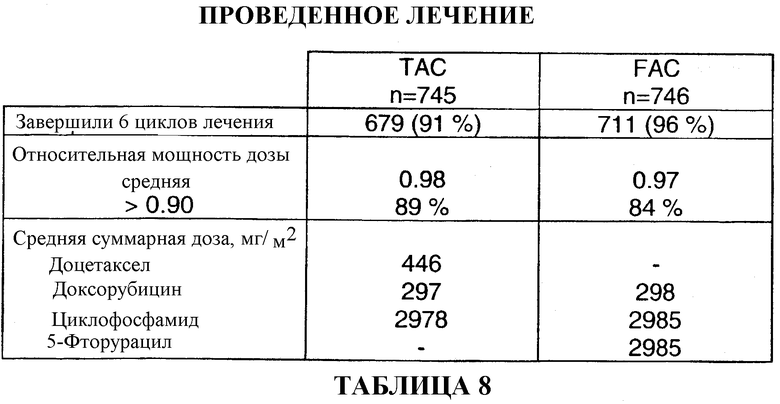
В качестве лекарственного средства для премедикации больные в течение 3 дней получали дексаметазон, 8 мг BID. Затем на 4-й день вводили комбинацию для вспомогательной терапии. Одна группа больных получала доцетаксел, доксорубицин и циклофосфамид (TAC), которые вводили внутривенно в указанном порядке. Другая группа больных получала 5-фторурацил, доксорубицин и циклофосфамид (FAC), которые вводили внутривенно в указанном порядке. Затем на 5-14 сутки больные обеих групп с профилактической целью получали Cipro в дозировке 500 мг BID. Шесть циклов этого курса лекарственных препаратов повторяли каждые три недели. Смотри таблицу 2.
679 больных (91%) завершили шесть циклов вспомогательной терапии TAC с последующей постхимиотерапией, схема которой описана выше. После шести циклов лечения средняя суммарная доза для больного составляла 446 мг/м2 доцетаксела, 297 мг/м2 доксорубицина и 2978 мг/м2 циклофосфамида. Смотри таблицу 8.
711 больных (96%) прошли шесть циклов вспомогательной терапии FAC с последующей постхимиотерапией, схема которой описана выше. После шести циклов лечения средняя суммарная доза для больного составляла 2985 мг/м2 5-фторурацила, 298 мг/м2 доксорубицина и 2985 мг/м2 циклофосфамида. Смотри таблицу 8.
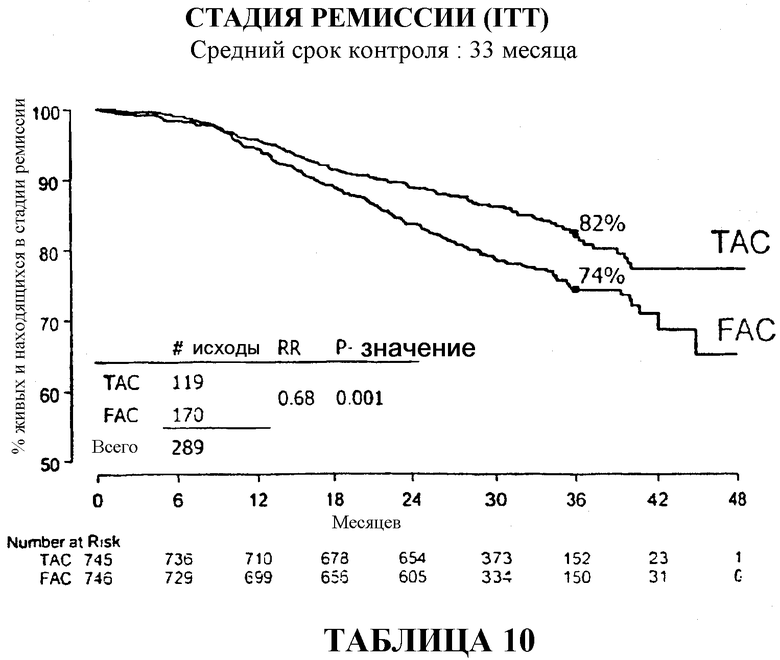
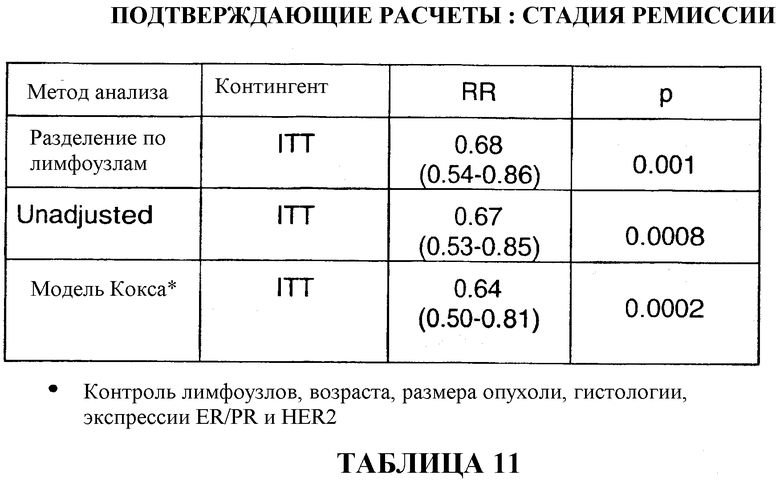
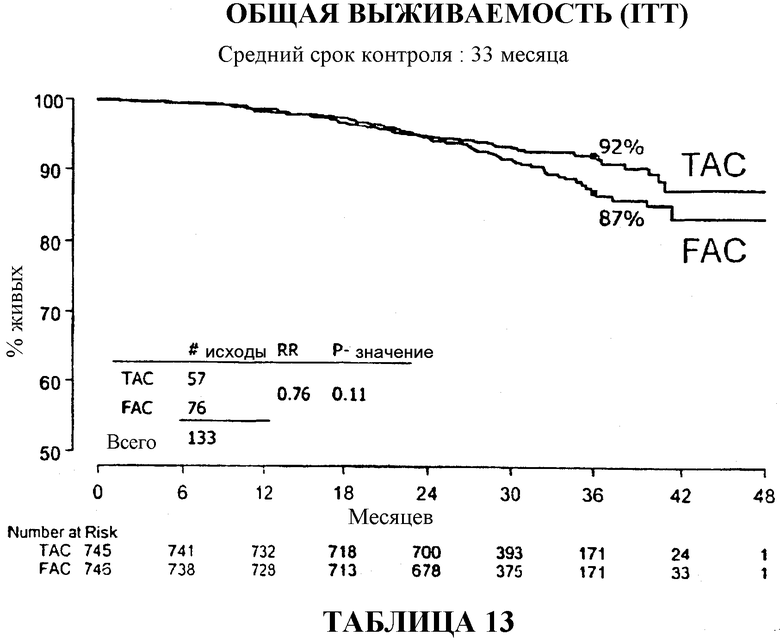
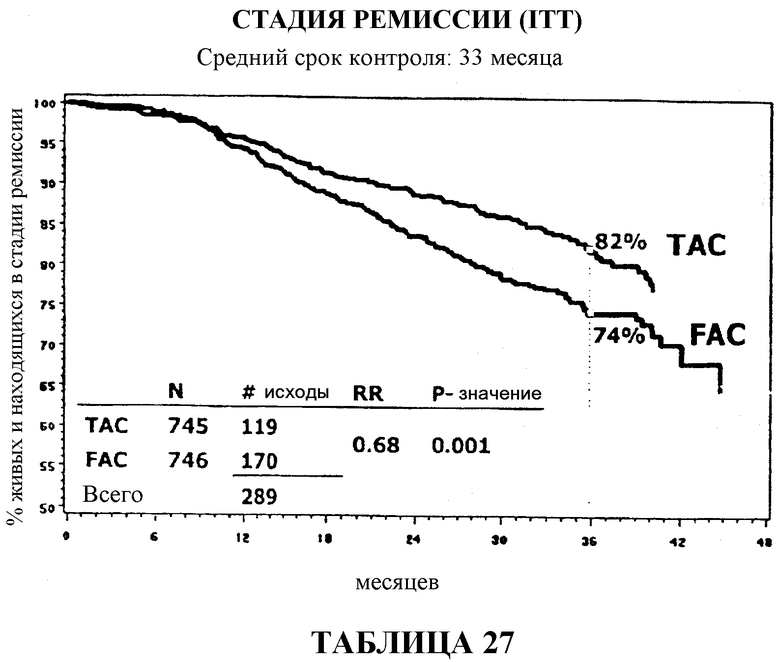
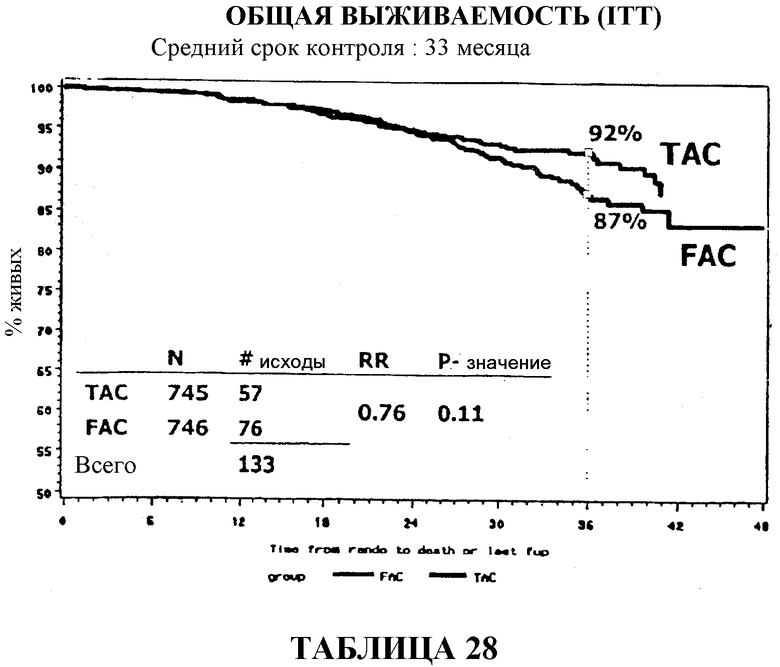
Через 33 месяца после вспомогательной терапии 82% больных, получавших TAC, были живы и находились в стадии ремиссии в сравнении с 74% больных, получавших FAC (таблица 10). В то же время, общая выживаемость в группе больных, получавших TAC, составляла 92% в сравнении с 87% в группе больных, получавших FAC (таблица 13).
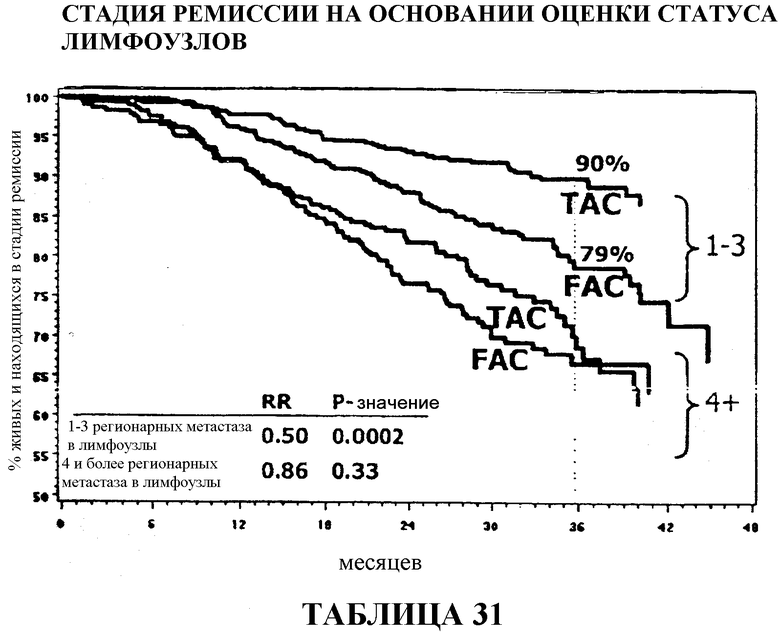
Результаты оценки статуса лимфоузлов
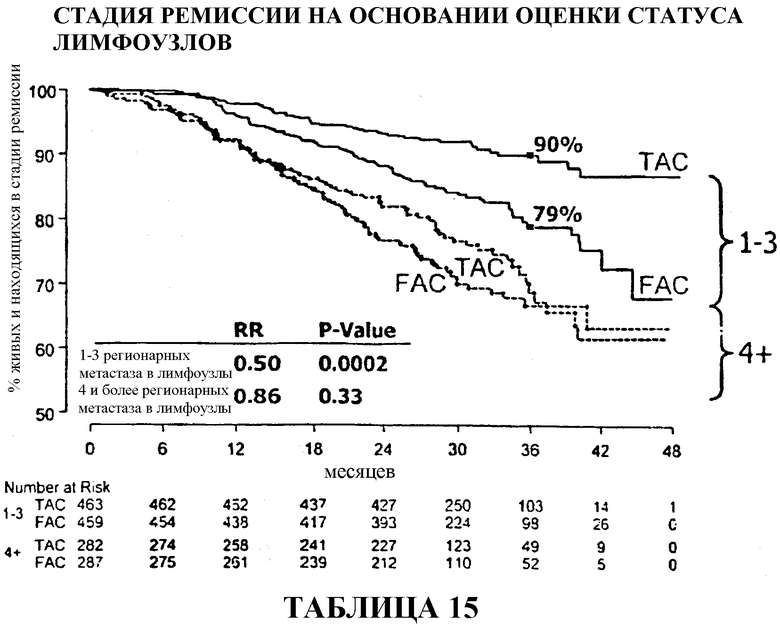
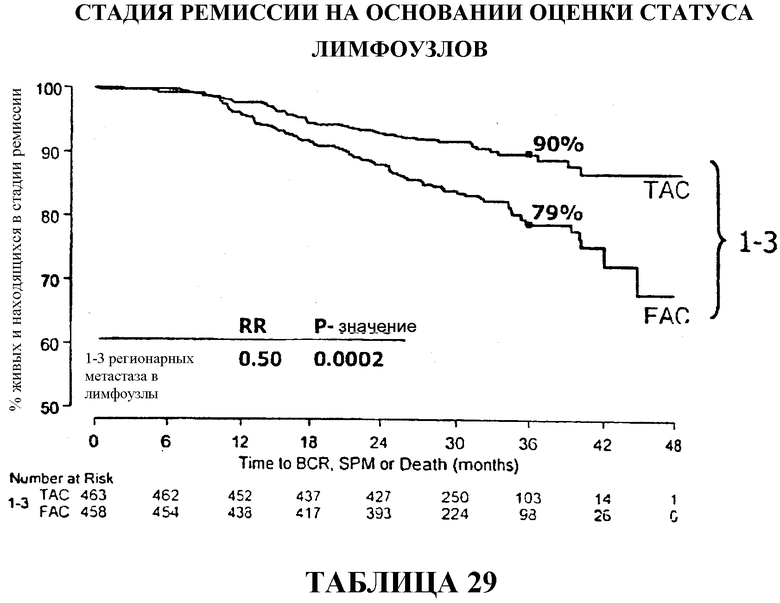
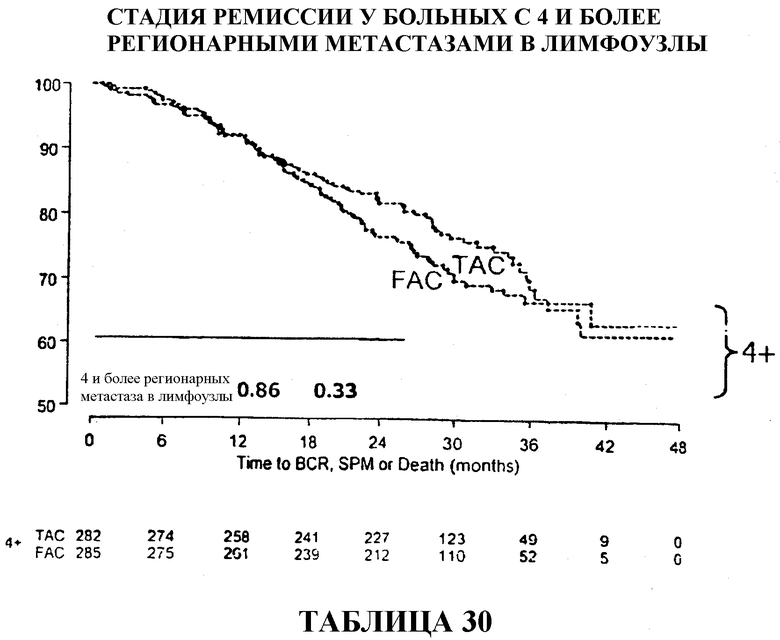
Если стадию ремиссии в группах больных, получавших TAC и FAC, сравнивать по статусу лимфоузлов, то 90% больных с 1-3 регионарными метастазами в лимфоузлы, получавших TAC, были живы и находились в стадии ремиссии через 33 месяца после терапии в сравнении с 79% в группе больных, получавших FAC. У больных с 4 регионарными метастазами в лимфоузлы статистического расхождения между двумя видами вспомогательной терапии не наблюдалось, хотя 69% больных, получавших TAC, были живы и находились в стадии ремиссии через 36 месяцев в сравнении с 67% в группе больных, получавших FAC. Смотри таблицу 15.
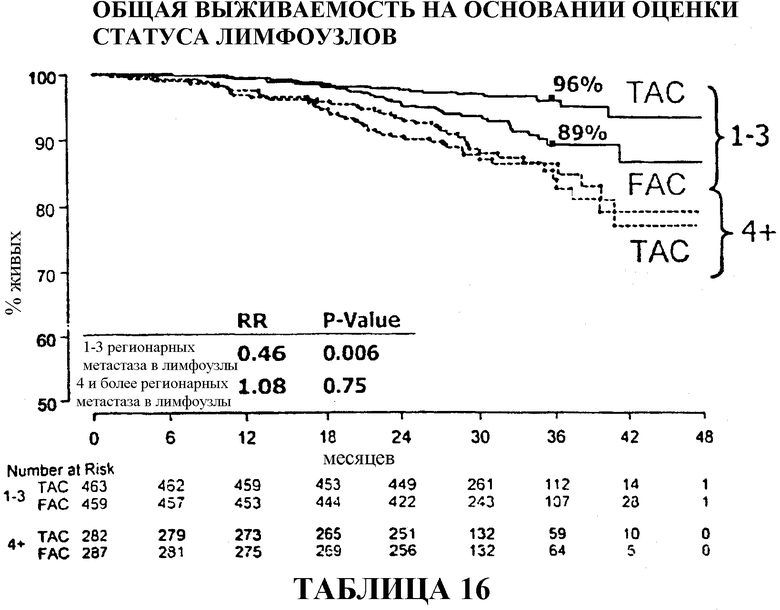
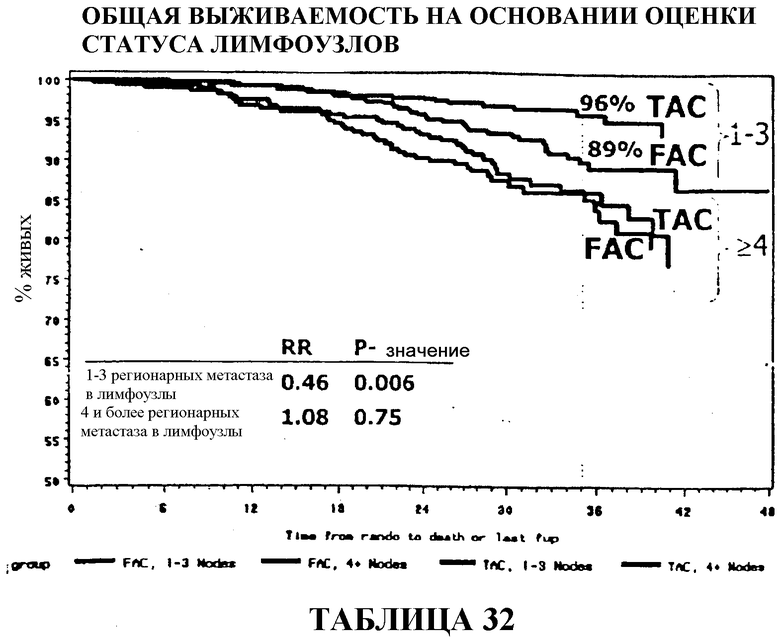
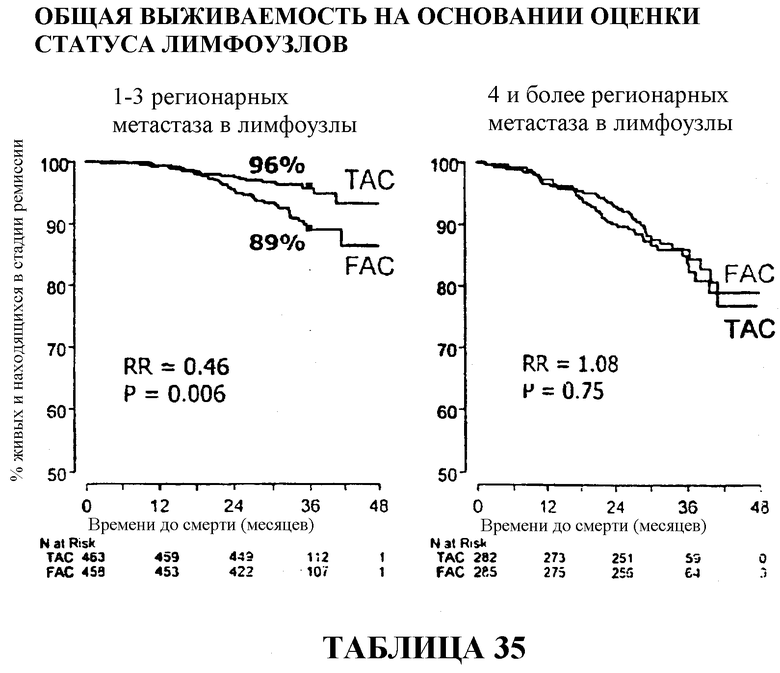
Общий коэффициент выживаемости среди больных с 1-3 регионарными метастазами в лимфоузлы составлял 96% для больных, получавших TAC, и 89% для больных, получавших FAC. И в этом случае, у больных с 4 или более метастазами в лимфоузлы статистического расхождения между двумя видами вспомогательной терапии не наблюдалось, хотя у больных, получавших TAC, снова наблюдалась большая выживаемость (86%) в сравнении с больными, получавшими FAC (84%). Смотри таблицы 16 и 32.
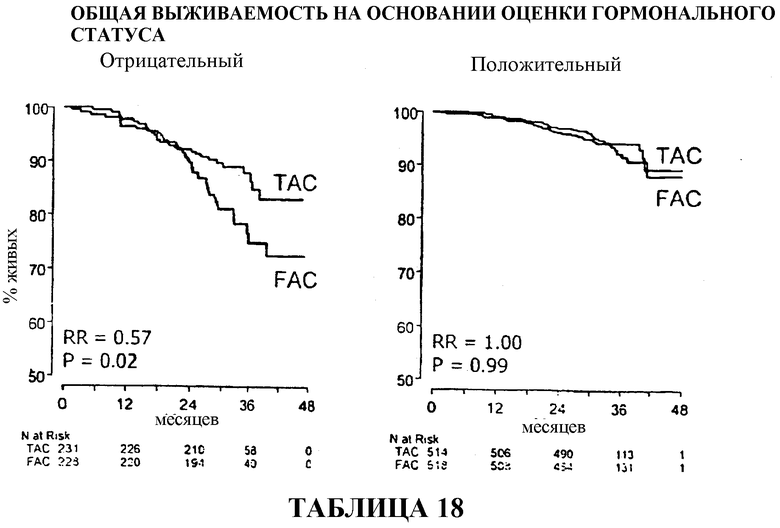
Результаты оценки гормонального статуса
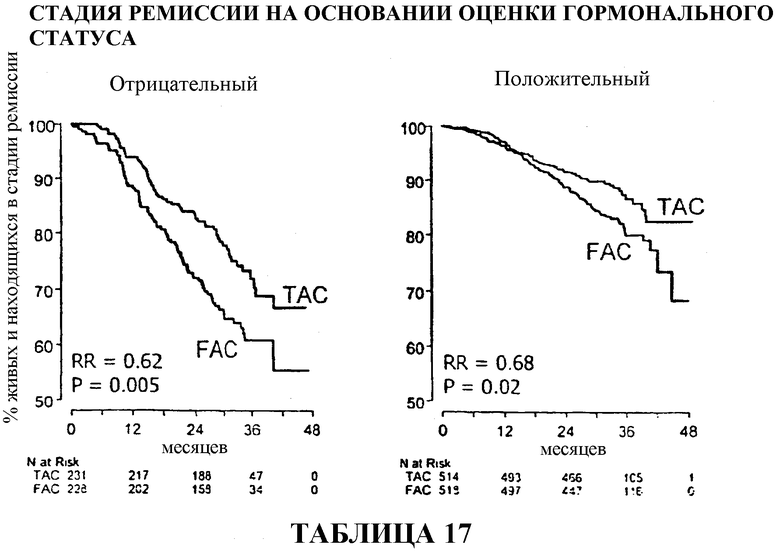
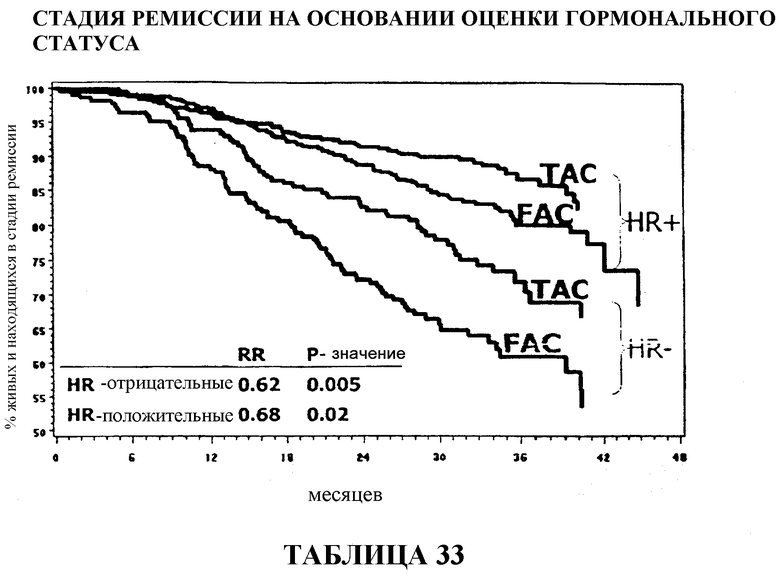
У больных с ER/PR-отрицательными опухолями доля больных, находящихся в стадии ремиссии, составляла приблизительно 70% среди больных, получавших вспомогательную терапию TAC, и приблизительно 62% среди больных, получавших вспомогательную терапию FAC. У больных с ER/PR-положительными опухолями доля больных, находящихся в стадии ремиссии, составляла приблизительно 88% среди больных, получавших TAC, в сравнении с 82% среди больных, получавших FAC. Смотри таблицы 17 и 33.
Если общий процент выживаемости рассчитывать по результатам оценки гормонального статуса, то у больных с ER/PR-отрицательными опухолями, получавших TAC, он составляет приблизительно 83% в сравнении с приблизительно 72% среди больных, получавших FAC. У больных с положительными опухолями выживали приблизительно 90% больных, получавших TAC, в сравнении с приблизительно 88% больных, получавших FAC. Смотри таблицы 18 и 35.
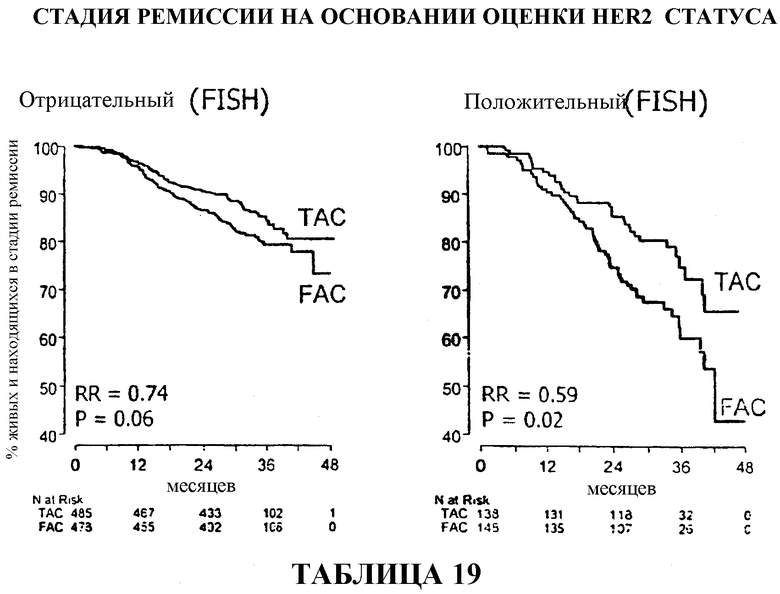
Результаты оценки статуса HER2
У больных с HER2-отрицательными опухолями доля больных, находящихся в стадии ремиссии, через 33 месяца составляла приблизительно 86% среди больных, получавших вспомогательную терапию TAC, и приблизительно 80% среди больных, получавших вспомогательную терапию FAC. У больных с HER2-положительными опухолями доля больных, находящихся в стадии ремиссии, составляла приблизительно 75% среди больных, получавших TAC, в сравнении с 60% среди больных, получавших FAC. Смотри таблицу 19.
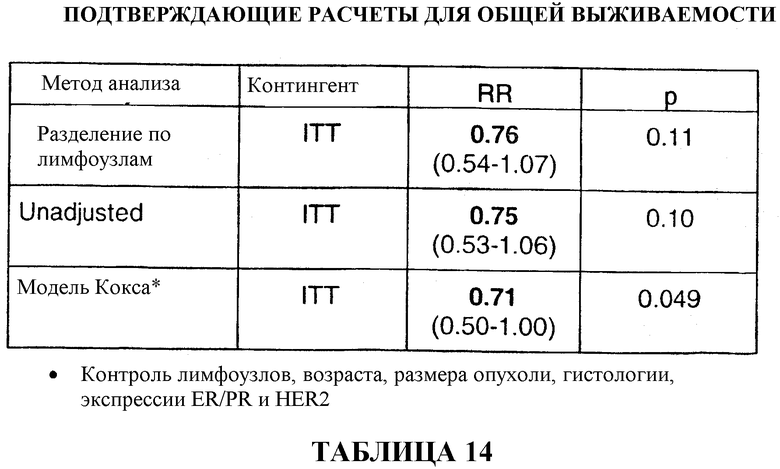
На основании приведенных данных комбинация доцетаксела, доксорубицина и циклофосфамида в качестве вспомогательной терапии является хорошо переносимой, и полученные результаты отражают значительное преимущество этой комбинации в сравнении с комбинацией 5-фторурацила, доксорубицина и циклофосфамида в качестве вспомогательной терапии. Если стадию ремиссии оценивать количественно, то в сравнении с применением FAC через 33 месяца применение TAC приводило к сокращению общей смертности на 32%, к сокращению смертности у больных с 1-3 метастазами в лимфоузлы на 50%, к сокращению смертности у больных с опухолями с отрицательным гормональным статусом на 38% и у больных с опухолями с положительным гормональным статусом на 32%. Смотри таблицу 22.
Если общую выживаемость оценивать количественно, то среди больных, получавших вспомогательную терапию TAC, было отмечено сокращение смертности на 24%, а среди больных с 1-3 метастазами в лимфоузлы было отмечено сокращение смертности на 54%. Смотри таблицу 22.
Комбинация TAC отличается от комбинации FAC содержанием доцетаксела вместо 5-фторурацила. Приведенная статистика объективно доказывает, что наблюдаемый эффект доцетаксела в комбинации с доксорубицином и циклофосфамидом достаточно велик для того, чтобы иметь клиническую ценность при вспомогательной терапии больных раком молочной железы с регионарными метастазами.
Во всех отношениях полагается, что описанные варианты приведены лишь с целью иллюстрации и не являются ограничивающими. Поэтому объем настоящего изобретения в большей мере описывается приложенной формулой изобретения, а не вышеприведенным описанием изобретения. Все изменения, соответствующие смыслу и эквивалентному ряду формулы изобретения, должны охватываться объемом настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРСОНАЛИЗИРОВАННОГО НАЗНАЧЕНИЯ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ БОЛЬНЫМ ЛЮМИНАЛЬНЫМ В РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2015 |
|
RU2594251C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С НАЛИЧИЕМ МЕТАСТАЗОВ В ЛИМФАТИЧЕСКИХ УЗЛАХ И ОЛИГОМЕТАСТАЗОВ В КОСТЯХ СКЕЛЕТА ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2695348C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2393888C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С BRCA-АССОЦИИРОВАННЫМ ТРИЖДЫ НЕГАТИВНЫМ МЕСТНОРАСПРОСТРАНЕННЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2023 |
|
RU2814578C1 |
| СПОСОБЫ ЛЕЧЕНИЯ РАННЕГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ТРАСТУЗУМАБОМ-MCC-DM1 И ПЕРТУЗУМАБОМ | 2015 |
|
RU2725093C2 |
| Способ лечения люминального подтипа рака молочной железы | 2018 |
|
RU2706029C1 |
| ПРИМЕНЕНИЕ ЛИПОСОМЫ МИТОКСАНТРОНА ГИДРОХЛОРИДА ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2021 |
|
RU2806277C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ЗАБОЛЕВАНИЯ У БОЛЬНЫХ ЛЮМИНАЛЬНЫМ В И ТРИЖДЫ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ У ПАЦИЕНТОК, НЕ ПОЛУЧАВШИХ В НЕОАДЪЮВАНТНОМ РЕЖИМЕ ХИМИО- ИЛИ ГОРМОНОТЕРАПИЮ | 2017 |
|
RU2648523C1 |
| ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, НЕГАТИВНОГО ПО ТРЕМ РЕЦЕПТОРАМ | 2007 |
|
RU2448697C2 |
| Способ прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы | 2020 |
|
RU2733697C1 |











Изобретение относится к лекарственным средствам и касается применения доцетаксела в качестве лекарственного препарата вспомогательной терапии для лечения метастатического рака молочной железы в комбинации с доксорубицином и циклофосфамидом, которое обеспечивает повышенный коэффициент выживаемости, у больных со сверхэкспрессироваными железами ER, PR и/или HER2. 5 з.п. ф-лы, 36 табл.
| NABHOLTZ JEAN-MARC "Docetaxel/doxorubicin/cyclophosphamide in the treatment of metastatic breast cancer" Oncology (Williston Park), Aug 1997, vol.11 suppl 8, pp37-41 | |||
| NABHOLTZ JEAN-MARC "Review of docetaxel and doxorubicin-based combinations in the management of breast cancer: from metastatic of adjuvant setting" Seminars in oncology, February |
Авторы
Даты
2008-04-10—Публикация
2003-05-15—Подача