Область изобретения
Настоящее изобретение относится в основном к бактериальным патогенам. В частности, настоящее изобретение относится к молекулярным миметикам эпитопа, экспонированного на поверхности петли 4 PorA Neisseria meningitidis серогруппы В (MenB) P1.2 сероподтипа, и к вырабатываемым против них антителам.
Предпосылки изобретения
Neisseria meningitidis является агентом, вызывающим бактериальный менингит и сепсис. Менингококки подразделяют на серологические группы на основании иммунологических характеристик капсулярных антигенов и антигенов клеточных стенок. Известные в настоящее время серогруппы включают А, В, С, W-135, X, У, Z и 29Е. Полисахариды, ответственные за специфичность серогрупп, были выделены из некоторых из этих групп, включая А, В, С, W-135 и Y.
N. meningitidis серогруппы В (именуемая здесь как "MenB" или "NmB") отвечает за большой процент бактериальных менингитов у младенцев и детей, проживающих в США и Европе. Этот организм вызывает также летальный сепсис у молодых людей. Экспериментальные MenB вакцины, состоящие из пузырьков белка внешней мембраны (ОМР), в некоторой степени защищают подростков. Однако при вакцинации младенцев никакой защиты не наблюдается, и они составляют возрастную группу, подверженную наибольшему риску заболевания. Кроме того, OMP вакцины являются серотип-специфическими и подтип-специфическими, и доминантные MenB штаммы подвержены как географическим, так и временным изменениям, что ограничивает применимость таких вакцин.
Эффективные капсулярные вакцины на основе полисахаридов были разработаны против мениногококковых заболеваний, вызываемых серогруппами A, C, Y и W135. Однако аналогичные попытки создать MenB полисахаридную вакцину потерпели неудачу из-за слабой иммуногенности капсулярного MenB полисахарида (именуемого здесь "MenB PS"). MenB PS является гомополимером (N-ацетил(α2->8) нейраминовой кислоты. Escherichia coli K1 имеет идентичный капсулярный полисахарид. Антитела, вырабатываемые против MenB PS, перекрестно реагируют с полисиаловой кислотой (PSA). PSA в большом количестве экспрессируется в фетальных тканях и в тканях новорожденных, особенно на адгезионных молекулах нервных клеток ("NCAM"), расположенных в тканях головного мозга. PSA также обнаружена, но в меньшей степени, в тканях взрослых индивидуумов, включая ткани почек, сердца и нервные ткани органов обоняния. Таким образом, большинство анти-MenB PS антител являются аутоантителами. Поэтому такие антитела обладают способностью вредно воздействовать на развитие плода или могут привести к аутоиммунному заболеванию.
MenB PS производные были получены в ходе попыток преодолеть недостатки, связанные со слабой иммуногенностью MenB PS. Например, были описаны C3-C8 N-ацил-замещенные производные MenB PS. См. EP публикацию № 504202 B, Jennings et al. Аналогично в патенте США № 4727136 Jennings et al. раскрыта N-пропионилированная молекула MenB PS, обозначаемая здесь как "NPr-MenB PS". Сообщалось, что у мышей, иммунизованных гликоконъюгатами NPr-MenB PS, вырабатываются высокие титры IgG антител. Jennings et al. (1986) J. Immunol. 137:1708. У кроликов, используя эти производные, вырабатывают две различные популяции антител, которые, как предполагают, связаны с двумя различными эпитопами, один из которых используется природным MenB PS, а другой - нет. Бактерицидная активность была обнаружена в популяции антител, которые перекрестно не реагируют с MenB PS. Jennings et al. (1987) J. Exp. Med. 165:1207. Идентичность бактериального поверхностного эпитопа (эпитопов), реагирующего с защитными антителами, которые вырабатываются под действием этого конъюгата, остается неизвестной. Кроме того, из-за того, что подмножество антител, вырабатываемых в ответ на эту вакцину, является аутореактивным в отношении полисиаловой кислоты хозяина (Granoff et al.(1998) J. Immunol 160:5028), безопасность применения этой вакцины для людей остается сомнительной.
Несмотря на эти попытки при использовании обычных подходов не удалось идентифицировать антигены, которые были бы безопасны и были бы способны обеспечить широкую защиту от MenB инфекции.
Существовал значительный интерес к использованию молекулярных миметиков антигенов для индуцирования защитных иммунных реакций в ответ на различные патогены, а также для лечения раковых и аутоиммунных заболеваний. Такой подход к созданию вакцин для профилактики инфекционных заболеваний характеризуется наибольшей применимостью, когда рассматриваемый антиген токсичен, или если его трудно выделить, или если желательно вызвать иммунную реакцию в ответ на ограниченное число эпитопов. Тем не менее, существует относительно небольшое количество исследований, в которых сообщается об успешном применении вакцин с миметиками для выработки защитных антител к патогену. В патенте США 6048527 был раскрыт ряд функционально активных антител, направленных против MenB PS производных. Эти антитела перекрестно не реагируют или реагируют слабо с тканями хозяина, и таким образом, риск вызвать аутоиммунное заболевание сводится к минимуму. В патент США №6030619 раскрыты молекулярные миметики уникальных эпитопов MenB PS, которые были идентифицированы с использованием этих антител. Однако обнаружение пептидомиметиков других MenB антигенов продолжает представлять значительный интерес.
Была описана полная геномная последовательность MenB, штамма MC58. Tettelin et al., Science (2000) 287:1809. Были идентифицированы полные геномные последовательности нескольких белков, которые вызывают реакции бактерицидных антител сыворотки. Эти белки содержат консервативные последовательности, и оказалось, что они экспонированы на поверхности инкапсулированных MenB штаммов. Pizza et al., Science (2000) 287:1816. Один из этих белков представляет GNA33 (полученный из генома антиген). GNA33 является липопротеином, и предсказанная аминокислотная последовательность демонстрирует гомологичность со связанной с мембраной литической мышиной трансгликозилазой (MltA) из E.coli и Synechocystis sp. Lommatzsch et al., J. Bacteriol. (1997) 179:5465-5470. GNA33 является высоко консервативным среди Neisseria meningitidis. Pizza, et al., Science (2000) 287:1816. У мышей, иммунизованных рекомбинантным GNA33, вырабатываются высокие титры сывороточных бактерицидных антител, измеренные против инкапсулированных MenB штамма 2996. Интенсивность гуморального ответа аналогична интенсивности ответа у контрольных животных, иммунизованных OMP пузырьками, полученными из штамма 2996. Однако механизм, с помощью которого GNA33 вызывает выработку защитных антител, не был определен, не был также определен объем защитной реакции в ответ на различные MenB штаммы.
Совершенно очевидно, что было бы весьма желательно получить безопасную и эффективную вакцину против MenB.
Краткое содержание изобретения
Настоящее изобретение основано на неожиданном обнаружении того факта, что GNA33 вызывает выработку защитных антител против MenB, имитируя эпитоп, экспонированный на поверхности петли 4 PorA штаммов сероподтипа P1.2. Функциональная активность таких антител была оценена, как здесь раскрыто, с использованием in vitro и in vivo функциональных анализов, которые предсказывают способность молекулярных агентов защищать человека от менингококковых заболеваний.
Соответственно в одном из вариантов предмет настоящего изобретения относится к пептидам GNA33, которые включают эпитопы, которые можно использовать для выработки антител, которые обладают функциональной активностью против MenB бактерий. Пептиды включают последовательности более короткие, чем полноразмерная последовательность GNA33. В наиболее предпочтительных вариантах пептиды включают аминокислотную последовательность QTP и, необязательно, дополнительные фланкирующие последовательности, предшествующие или следующие после QTP последовательности, предпочтительно содержащие 1-50 или больше аминокислот, но меньше, чем в полноразмерной последовательности, например 1-3, 1-5, или 1-10, или 1-25, или любое целое число в указанных интервалах, располагаясь либо с С-, либо с N-конца QTP последовательности. Пример GNA33 последовательности представлен на ФИГ.3 (SEQ.ID NO:1). QTP занимает положения 106-108 на ФИГ.3. Следует учитывать, что последовательность не ограничена последовательностями, фланкирующими QTP, такими как представлены на ФИГ.3, так как различные MenB штаммы, такие как здесь раскрыты, имеют различные фланкирующие последовательности. Последовательности PorA участка в различных штаммах известны, и некоторые из них представлены в таблице 2.
В некоторых вариантах GNA33 пептид включает аминокислотную последовательность, выбранную из группы, состоящей из FQTPV (SEQ ID NO:2), FQTPVHS (SEQ ID NO:3), AFQTPVHS (SEQ ID NO:4), QAFQTPVHS (SEQ ID NO:5), AQAFQTPVHS (SEQ ID NO:6), AQAFQTPVH (SEQ ID NO:7), AQAFQTPV (SEQ ID NO:8), QAFQTPVHSF (SEQ ID NO:9), AFQTPVHSFQ (SEQ ID NO:10), FQTPVHSFQA (SEQ ID NO:11), QTPVHSFQAK (SEQ ID-NO:12), DVSAQAFQTP (SEQ ID NO:55), VSAQAFQTPV (SEQ ID NO:13) и SAQAFQTPVH (SEQ ID NO:14).
В других вариантах целью изобретения является использование. GNA33 полипептидов в качестве носителей для встраивания других эпитопов серологически отличающихся внешних мембранных белков, а также в качестве обычных носителей.
В другом варианте изобретение относится к полинуклеотидам, кодирующим эти пептиды, а также к рекомбинантным векторам, включающим полинуклеотиды, к клеткам-хозяевам, включающим векторы, и к рекомбинантным способам получения пептидов.
Еще в других вариантах настоящее изобретение относится к антителам, направленным против GNA33 эпитопов, причем эти антитела способны связываться с GNA33 эпитопами и/или демонстрируют функциональную активность против МепВ бактерий. Как будет раскрыто далее, антитело демонстрирует функциональную активность против MenB организма, если молекула антитела проявляет комплемент-опосредованную бактерицидную активность и/или опсоническую активность против MenB, определяемую с помощью описываемых здесь анализов. Репрезентативные GNA33 эпитопы включают QTP, FQTPV (SEQ ID NO:2), FQTPVHS (SEQ ID NO:3), AFQTPVHS (SEQ ID NO:4), QAFQTPVHS (SEQ ID NO:5), AQAFQTPVHS (SEQ ID NO:6), AQAFQTPVH (SEQ ID NO:7), AQAFQTPV (SEQ ID NO:8), QAFQTPVHSF (SEQ ID NO:9), AFQTPVHSFQ (SEQ ID NO:10), FQTPVHSFQA (SEQ ID NO:11), QTPVHSFQAK (SEQ ID NO:12), DVSAQAFQTP (SEQ ID NO:55), VSAQAFQTPV (SEQ ID NO:13) и SAQAFQTPVH (SEQ ID NO:14).
Другой вариант изобретения относится к моноклональным антителам, направленным против GNA33 эпитопов, и к гибридомам, продуцирующим эти моноклональные антитела. Предпочтительно, чтобы моноклональные антитела проявляли функциональную активность против MenB организма.
Еще один вариант рассматриваемого изобретения относится к способам выделения других молекулярных миметиков эпитопов MenB и к молекулярным миметикам, идентифицируемым этими способами. Эти способы включают:
(a) получение популяции молекул, включающей предполагаемый молекулярный миметик эпитопа MenB;
(b) контактирование популяции молекул с описанными здесь антителами в условиях, которые обеспечивают иммунологическое связывание антитела с молекулярным миметиком, если он присутствует, сопровождающееся образованием комплекса; и
(c) выделение комплексов из несвязанных молекул.
В другом варианте рассматриваемое изобретение относится к композиции, включающей GNA33, или пептид GNA33, включающий эпитоп, как указано выше, в комбинации с фармацевтически приемлемым эксципиентом.
В еще одном варианте изобретение относится к композиции, включающей антитело, направленное против GNA33 полипептида в комбинации с фармацевтически приемлемым эксципиентом.
В другом варианте изобретение относится к способу индуцирования у млекопитающих иммунной реакции против Neisseria meningitidis серогруппы B, включающему введение индивидууму GNA33 пептида, как указано выше.
В другом варианте рассматриваемое изобретение относится к способу лечения или профилактики MenB заболевания у млекопитающих, включающему введение индивидууму эффективного количества вышеуказанных композиций.
В другом варианте, изобретение относится к способу детектирования антител против Neisseria meningitidis серогруппы В в биологическом образце, включающему
(a) получение биологического образца;
(b) осуществление взаимодействия указанного биологического образца с GNA33 полипептидом в условиях, которые обеспечивают антителам против Neisseria meningitidis серогруппы В, если они присутствуют в биологическом образце, связываться с GNA33 полипептидом с образованием комплекса антитело/GNA33 полипептид; и
(c) определение присутствия или отсутствия комплекса,
тем самым определяя присутствие или отсутствие в образце антител против Neisseria meninqitidis серогруппы В.
Репрезентативные GNA33 полипептиды включают GNA33 пептид, который включает аминокислотную последовательность, выбранную из группы, состоящей из QTP, FQTPV (SEQ ID NO:2), FQTPVHS (SEQ ID NO:3), AFQTPVHS (SEQ ID NO:4), QAFQTPVHS (SEQ ID NO:5), AQAFQTPVHS (SEQ ID NO:6), AQAFQTPVH (SEQ ID NO:7), AQAFQTPV (SEQ ID NO:8), QAFQTPVHSF (SEQ ID NO:9), AFQTPVHSFQ (SEQ ID NO:10), FQTPVHSFQA (SEQ ID NO:11), QTPVHSFQAK (SEQ ID NO:12), DVSAQAFQTP (SEQ ID NO:55:), VSAQAFQTPV (SEQ ID NO:13) и SAQAFQTPVH (SEQ ID NO:14).
Эти и другие варианты настоящего изобретения будут понятны специалистам на основании приведенного.здесь описания.
Краткое описание чертежей
ФИГ.1 демонстрирует связывание анти-GNA33 антисыворотки (1А) и антител с поверхностью инкапсулированных NmB штаммов. ФИГ.1А демонстрирует связывание поликлональной aHTH-GNA33 антисыворотки и контрольных mAb с живыми инкапсулированными NmB штаммами 2996, M3735, M4207, и MC58 по данным непрямой проточной флуоресцентной цитометрии. Контрольные mAb и антисыворотка включают анти-серогруппы B, капсулярно-специфическое мышиное mAb (SEAM 12, Granoff et al., J.Immunol.(1998) 160:5028-5036), N. meningitidis сероподтип mAb анти-PorA P1.2, и поликлональную антисыворотку мышей, иммунизованных везикулами наружных мембран E.coli. ФИГ.1В демонстрирует связывание анти-GNA33 mAb 25 и контрольных mAb с NmB штаммами М3735, М4207 и МС58. Мышиные контрольные mAb включают mAb, обладающие иной специфичностью (VIG10), и те же антикапсулярные и анти-PorA P1.2 mAb, что раскрыты выше для ФИГ.1A.
ФИГ.2 демонстрирует Вестернблоттинг полных мембранных фракций, полученных из различных MenB штаммов и выделенных с использованием SDS-PAGE. ФИГ.2A демонстрирует реактивность с анти-GNA33 mAb 25. Полоса 1. rGNA33. Полоса 2. Полный белок, полученный из контрольных клеток E.coli. Полосы 3,4 и 5, соответственно: полный белок, полученный из MenB штаммов NG3/88 (P1.1), MC58 (P1.7,16), и мутанта MC58, в котором был инактивирован ген, кодирующий GNA33 (MC58ΔGNA33). Полосы 6,7,8 и 9: полный белок MenB штаммов BZ232, BZ232ΔGNA33, NMB и NMBΔGNA33 соответственно. Все четыре штамма относятся к сероподтипу P1.5,2. ФИГ.2B демонстрирует результаты Вестернблоттинга тех же образцов белка, что раскрыты для ФИГ.2A, но с использованием анти-PorA P1.2 mAb в качестве первично определяемого антитела.
ФИГ.3 (SEQ ID NO:1) демонстрирует полноразмерную аминокислотную последовательность репрезентативного GNA33 полипептида. Подчеркнутые аминокислоты, занимающие положения 1-21, соответствуют лидерной последовательности.
ФИГ.4 демонстрирует связывание анти-GNA33 mAb 25 с прогрессивно уменьшающимися пептидами, соответствующими сегментам (A) GNA33 и (B) PorA P1.2 (Штамм 2996). Соответствующие представленные пептиды были идентифицированы на основании картирования с перекрывающимися 10-мерными пептидами, полученными из каждого белка, и, как показано, содержат эпитоп, распознаваемый mAb 25.
ФИГ.5 демонстрирует связывание мышиных mAb с живыми инкапсулированными NmB штаммами по данным непрямой проточной флуоресцентной цитометрии. Тестированные mAb раскрыты в описании к ФИГ.1B. ФИГ.5A демонстрирует зависящее от концентрации связывание анти-GNA33 mAb 25 со штаммами 8047 (BC50 = 15 мкг/мл с человеческим комплементом) и BZ232 (BC50 >150 мкг/мл с человеческим комплементом). Оба штамма оказались восприимчивы к бактериолизу при тестировании на кроликах (см. текст). ФИГ.5B демонстрирует зависящее от концентрации связывание анти-GNA33 со штаммами M986 (PorA VR2 типа P1.2) и M5682 (PorA VR2 типа P1.2), по сравнению со штаммом 8047 (PorA VR2 типа P1.2-2). M986 был устойчив в отношении анти-GNA33 бактериолиза (человеческий или кроличий), M5682 был восприимчив (кроличий комплемент), и штамм 8047 был восприимчив (человеческий или кроличий).
Подробное описание изобретения
При осуществлении настоящего изобретения на практике используют, если нет других указаний, общепринятые способы иммунологии, микробиологии и молекулярной биологии, известные специалистам. Такие методики подробно описаны в литературе. См. например, Sambrook, et al. Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Sambrook and Russell, Molecular Cloning: A Laboratory Manual (2001); Morrison and Boyd, Organic Chemistry (3rd Edition 1973); Carey and Sundberg, Advanced Organic Chemistry (2nd Edition, 1985); Smith, M. B., Organic Synthesis (1994); Perbal, A Practical Guide to Molecular Cloning (1984); и Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell eds., 1986, Blackwell Scientific Publications).
Как использовано в настоящем описании и прилагаемой формуле изобретения, формы единственного числа включают также формы множественного числа, если в контексте нет других четких указаний.
I. Определения
При описании настоящего изобретения будут использованы следующие термины, и эти определения будут представлены далее.
Под термином "GNA33 полипептид" подразумевают полипептид, полученный из GNA33 белка, который способен вызвать иммунологическую реакцию против MenB, такую как выработка антител, которые демонстрируют функциональную активность против MenB бактерий, как определено далее. Этот термин можно использовать для обозначения отдельных макромолекул или гомогенных или гетерогенных популяций антигенных макромолекул, полученных из GNA33. Для целей настоящего изобретения GNA33 полипептид можно получить из любого из различных известных штаммов MenB. GNA33 последовательность для штамма 2996 представлена на ФИГ.3 (SEQ ID NO:1). Однако известен целый ряд GNA33 последовательностей из других штаммов MenB. См., например, GenBank регистрационные номера C81244, B82023, AF226395, AF226392, AF226390, AF226403, AF226413, AF226412, AF226387, AF226409, AF22641, AF226397, AF226389, AF226393, AF226416, AF226414, AF226402, AF226404, AF235145, AF235144, AF235143, Neisseria meningitidis; E83491, Pseudomonasaeruginosa (штамм PAO1); AF300471, Zymomonas mobilis; AAK85834, Agrobacterium tumefacience; CAC41396, Sinorhizobium meliloti; AAK25702, Caulobacter crescentus; S76334, Synechocystis sp. (штамм PCC 6803); AAK03012, Pasteurella multocida; Q9KPQ4, Vibrio cholerae; AAB40463, AAC45723, P46885, Escherichia coli; P57531, Buchnera aphidicola (Acyrthosiphon pisum); NP143714, Pyrococcus horikoshii.
В том смысле, как здесь использован, термин "GNA33 полипептид" включает также молекулу, полученную из природной GNA33 последовательности, а также полученные рекомбинантно или синтезированные химически GNA33 полипептиды, включая полноразмерную ссылочную GNA33 последовательность, содержащую или не содержащую сигнальную последовательность (аминокислоты 1-21, ФИГ.3), а также GNA33 пептиды, которые остаются иммуногенными, как будет раскрыто далее.
Термин "аналог" относится к производным ссылочной молекулы. Аналог может сохранять биологическую активность, как указано выше, такую как способность вызывать выработку антител с функциональной активностью против MenB. Обычно термин "аналог" относится к соединениям, содержащим последовательность природного полипептида и структуру с одним или более из аминокислотных добавлений, замещений (обычно консервативных по природе) и/или делеций, по сравнению с природной молекулой, до тех пор пока эти модификации не нарушают активности. Предпочтительно аналог должен, по крайней мере, иметь ту же самую биологическую активность, что и исходная молекула, и может даже проявлять повышенную активность по сравнению с активностью исходной молекулы. Способы получения аналогов полипептидов известны специалистам и раскрыты далее.
Например, аналог обычно должен обладать, по крайней мере, около 50% аминокислотной идентичностью к ссылочной молекуле, более предпочтительно около 75-85% идентичностью и наиболее предпочтительно около 90-95% идентичностью или больше в отношении соответствующей части последовательности рассматриваемого природного пептида. Аминокислотная последовательность должна содержать не более чем около 10-75 замещений аминокислот, или не более чем около 5-50 замещений аминокислот, или даже только 1, 2, 3 или вплоть до 5 замещений, или любое число в указанном выше интервале. Наиболее предпочтительными замещениями обычно являются консервативные по своей природе замещения, т.е. такие замещения, которые происходят внутри семейства аминокислот. В этом отношении аминокислоты обычно подразделяют на четыре семейства: (1) кислотные - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) полярные незаряженные аминокислоты - глицин, аспарагин, глутамин, цистин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, небезосновательно предположить, что выделенная замена лейцина изолейцином или валином или наоборот; и аспартата глутаматом или наоборот; треонина серином или наоборот или аналогичные консервативные замены аминокислот структурно родственными аминокислотами не окажут существенного воздействия на активность. Белки, содержащие практически те же аминокислотные последовательности, что и ссылочная молекула, но содержащие небольшие аминокислотные замещения, которые практически не влияют на иммуногенность белка, подпадают поэтому под определение GNA33 полипептида. Специалисты могут легко определить представляющие интерес участки молекулы, которые можно модифицировать с разумным сходством, сохраняя биологическую активность, как здесь определено.
"GNA33 пептид " представляет собой GNA33 полипептид, как здесь раскрыто, который включает менее чем полноразмерная молекула ссылочного GNA33 и который включает, по крайней мере, один эпитоп, как определено далее. Таким образом, композиция, включающая GNA33 пептид, должна включать часть полноразмерной молекулы, но не всю рассматриваемую GNA33 молекулу. Неограничивающие примеры GNA33 пептидов включают QTP, FQTPV (SEQ ID NO:2), FQTPVHS (SEQ ID NO:3), AFQTPVHS (SEQ ID NO:4), QAFQTPVHS (SEQ ID NO:5), AQAFQTPVHS (SEQ ID NO:6), AQAFQTPVH (SEQ ID NO:7), AQAFQTPV (SEQ ID NO:8), QAFQTPVHSF (SEQ ID NO:9), AFQTPVHSFQ (SEQ ID NO: 10), FQTPVHSFQA (SEQ ID NO:11), QTPVHSFQAK (SEQ ID NO:12), DVSAQAFQTP (SEQ ID NO:55), VSAQAFQTPV (SEQ ID NO:13) и SAQAFQTPVH (SEQ ID NO:14).
"Молекулярные миметики" MenB представляют собой молекулы, которые функционально имитируют, по крайней мере, один эпитоп, экспрессируемый в MenB бактерии. Такие молекулярные миметики можно использовать в вакцинных композициях и для индукции антител для диагностических или терапевтических применений, как будет раскрыто далее. Молекулярные миметики включают (но этим не ограничиваются): небольшие органические соединения; нуклеиновые кислоты и производные нуклеиновых кислот; сахариды или блигосахариды; пептидомиметики, включая пептиды, белки и их производные, такие как пептиды, содержащие непептидные органические фрагменты, синтетические пептиды, которые могут содержать (или не содержать) аминокислоты и/или пептидные связи, но при этом сохраняют структурные и функциональные особенности пептидного лиганда; пирролидины; пептоиды и олигопептиоиды, которые представляют собой молекулы, содержащие N-замещенный глицин, такие как те, что раскрыты Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89:9367; и антитела, включая антиидиотипические антитела. Способы идентификации и получения молекулярных миметиков более подробно раскрыты далее.
Термин "антитело" охватывает препараты поликлональных и моноклональных антител, а также препараты, включающие гибридные антитела, измененные антитела, гуманизированные антитела, F(ab')2 фрагменты, F(ab) молекулы, Fv фрагменты, одно-цепочечный фрагмент, вариабельно представленный на фаге (scFv), однодоменные антитела/ химерические антитела и их функциональные фрагменты, которые демонстрируют свойства иммунологического связывания молекул родственных антител.
В том смысле, как здесь использован, термин "моноклональное антитело", он относится к композиции антител, с гомогенной популяцией антител. Термин не ограничивается способом получения антител. Термин включает все молекулы иммуноглобулинов, а также Fab молекулы, F(ab')2 фрагменты, Fv фрагменты, одноцепочечный фрагмент, вариабельно представленный на фаге (scFv), гуманизированные антитела, и другие молекулы, которые демонстрируют свойства иммунологического связывания исходных молекул моноклональных антител. Способы получения поликлональных и моноклональных антител известны специалистам и более подробно раскрыты далее.
Под термином "эпитоп" подразумевают сайт на антигене, которому соответствуют специфические B клетки и T клетки. Термин также используют как взаимозаменяемый с терминами "антигенная детерминанта" или "сайт антигенной детерминанты". Сайты B клеточных эпитопов на белках, полисахаридах или других биомерах могут состоять из фрагментов различных частей макромолекул, которые были собраны вместе в результате укладки. Эпитопы такого типа именуют конформационными или прерывистыми эпитопами, так как в этом случае сайт состоит из сегментов полимера, которые прерывисты в линейной последовательности, но непрерывны в уложенной конформации (конформациях). Эпитопы, которые состоят из одиночных сегментов биополимеров или других молекул, называют непрерывными или линейными эпитопами. Т-клеточные эпитопы обычно ограничены линейными пептидами. Пептидный эпитоп может включать 5 или более аминокислот в пространственной конформации, которая уникальна для эпитопа. Обычно эпитоп состоит из, по крайней мере, 5-8 таких аминокислот и чаще состоит из, по крайней мере, 8-10 таких аминокислот или более. Способы определения пространственной конформации аминокислот известны специалистам и включают, например, кристаллографическое исследование с помощью рентгеновских лучей и двумерную спектроскопию ядерного магнитного резонанса.
Эпитопы можно идентифицировать, используя любое количество методик картирования эпитопов, которые хорошо известны специалистам. См, например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, New Jersey. Например, линейные эпитопы можно определить, одновременно синтезируя большое число пептидов на твердых подложках, пептидов, соответствующих участкам молекулы белка, и осуществляя взаимодействия пептидов с антителами, при этом пептиды должны быть прикреплены к подложкам. Такие методики хорошо известны специалистам и описаны, например, в патенте США № 4708871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1986) Molec. Immunol. 23:709-715, причем все они включены сюда для ссылки. Аналогично конформационные эпитопы можно легко идентифицировать, определяя пространственные конформации аминокислот, например, с помощью кристаллографического исследования с помощью рентгеновских лучей или используя двумерную спектроскопию ядерного магнитного резонанса. См. например, Epitope Mapping Protocols, выше. Для определения антигенных участков конкретной молекулы можно использовать компьютерные программы, которые определяют уровни гидропатии из аминокислотных последовательностей, используя характеристики гидрофобности и гидрофильности каждой из 20 аминокислот, как раскрыто, например Kyte et al., J. Mol Biol (1982) 157:105-132; и Норр and Woods, Proc. Natl. Acad. Sci. USA (1981) 78:3824-3828. Например, в методике Норр и Woods каждой из аминокислот приписывается численная величина гидрофильности, а затем эти значения повторно усредняются по пептидной цепи. Точки наивысших средних значений гидрофильностей являются индикаторами антигенных участков молекулы.
Антитело проявляет "функциональную активность" против MenB организма, если молекула антитела демонстрирует комплемент-опосредованную бактерицидную активность и/или опсоническую активность против MenB при определении с использованием описанных выше анализов.
Под терминами "очищенный" и "выделенный" подразумевают (когда речь идет о полипептиде или полинуклеотиде), что указанная молекула присутствует при практическом отсутствии других биологических макромолекул такого же типа. Термин "очищенный" в том смысле, как здесь использован, предпочтительно означает, что присутствует, по крайней мере, 75% по весу, более предпочтительно, по крайней мере, 85% по весу, еще более предпочтительно, по крайней мере, 95% по весу и наиболее предпочтительно, по крайней мере, 98% по весу биологических макромолекул одного типа. Термин "выделенный" полинуклеотид, который кодирует конкретный полипептид, относится к молекулам нуклеиновой кислоты, которые практически не содержат других молекул нуклеиновой кислоты, которые не кодируют рассматриваемый полипептид; однако молекулы могут включать некоторые дополнительные основания или фрагменты, которые не оказывают вредного воздействия на основные характеристики композиции.
Под термином "рекомбинантный GNA33 полипептид" подразумевают GNA33 полипептид, обладающий биологической активностью, определенной с использованием описанных выше методик, и полученный с помощью методик рекомбинантных ДНК, как здесь раскрыто. Обычно ген, кодирующий нужный GNA33 полипептид, клонируют, а затем эксперссируют в трансформированных организмах, как будет раскрыто далее. Организм-хозяин экспрессирует чужеродный ген с получением GNA33 полипептида в условиях экспрессии. При получении с использованием рекомбинантных методик полипептиды настоящего изобретения можно получить без других молекул, которые обычно присутствуют в клетках. Например, можно легко получить GNA33 полипептидные композиции, которые не содержат даже следовых примесей MenB белка, так как единственным MenB белком, продуцируемым рекомбинантными не-MenB клетками-хозяевами, является рекомбинантный GNA33 полипептид.
Термин "полинуклеотид" или "молекула нуклеиновой кислоты" в том смысле, как здесь использован, относится к полимерной форме нуклеотидов любой длины либо к рибонуклеотидам либо к дезоксирибонуклеотидам. Этот термин относится только к первичной структуре молекулы, и поэтому включает двух- и одноцепочечные ДНК и РНК. Он также включает известные типы модификаций, например метки, которые известны специалистам, метилирование, "кэпы", замещения аналогами одного или более из встречающихся в природе нуклеотидов, внутринуклеотидные модификации, например, такие как незаряженными связями (например, метилфосфонатами, сложными фосфотриэфирами, фосфоамидатами, карбаматами и т.д.) и заряженными связями (например, фосфоротиоатами, фосфородитиоатами и т.д.), такими, которые содержат подвешенные фрагменты, такие как, например, белки (включая, например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин, и т.д.), с такими интеркаляторами (например, акридином, псораленом и т.д.), такими, которые содержат хелаты (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), такими, которые содержат алкилирующие агенты, модифицированные связи (например, альфа-аномерные нуклеиновые кислоты, и т.д.), а также немодифицированные формы полинуклеотида.
Термин "рекомбинантная ДНК молекула" или "рекомбинантный полинуклеотид" используют здесь для обозначения полинуклеотида геномного, кДНК, полусинтетического или синтетического происхождения, который в результате его происхождения или манипуляций: (1) не ассоциирован со всем или частью полинуклеотида, с которым он ассоциирован в природе, (2) связан с полинуклеотидом, который отличается от полинуклеотида, с которым он связан в природе, или (3) не встречается в природе. Таким образом, термин охватывает "полученные синтетически" молекулы нуклеиновой кислоты.
"Кодирующая последовательность" представляет собой молекулу нуклеиновой кислоты, которая транслирована в полипептид, обычно с использованием мРНК, помещенная под контроль соответствующих регуляторных последовательностей. Границы кодирующей последовательности можно определить по кодону начала трансляции у 5'-конца и кодону остановки трансляции у 3'-конца. Кодирующая последовательность может включать, (но этим не ограничивается) кДНК и рекомбинантные нуклеотидные последовательности.
Термин "контрольные последовательности" относится к последовательностям нуклеиновых кислот, которые необходимы для осуществления экспрессии кодирующих последовательностей, к которым они присоединены. Природа таких контрольных последовательностей различается в зависимости от организма-хозяина; в прокариотах такие контрольные последовательности обычно включают промотор, сайт связывания рибосомы и последовательность терминации транскрипции; в эукариотах такие контрольные последовательности обычно включают промоторы и последовательности терминации транскрипции. Термин "контрольные последовательности" должен включать, как минимум, все компоненты, которые необходимы для осуществления экспрессии кодирующей последовательности, и может также включать дополнительные компоненты, например лидерные последовательности и гибридные партнерские последовательности.
Контрольный элемент, такой как промотор, "управляет транскрипцией" кодирующей последовательности в клетке, когда РНК полимераза связывает промотор и транскрибирует кодирующую последовательность в мРНК, которая затем транслируется в полипептид, кодируемый кодирующей последовательностью.
Термин "функционально связанный" относится к непосредственному соседству, когда описываемые таким образом компоненты находятся в таком положении относительно друг друга, которое обеспечивает их функционирование нужным образом. Контрольную последовательность, "функционально связанную" с кодирующей последовательностью, лигируют таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с контрольной последовательностью. Контрольным элементам нет необходимости находиться в непосредственной близости к кодирующей последовательности, если только они функционируют так, чтобы управлять ее экспрессией. Так например, между промотором и кодирующей последовательностью могут находиться встроенные нетранслируемые но все еще транскрибируемые последовательности, и при этом промотор можно рассматривать как "функционально связанный" с кодирующей последовательностью.
В том смысле, как здесь использован, термин "экспрессионная кассета" относится к молекуле, включающей, по крайней мере, одну кодирующую последовательность, функционально связанную с контрольной последовательностью, которая включает все нуклеотидные последовательности, необходимые для транскрипции клонированных копий кодирующей последовательности и трансляции мРНК в соответствующую клетку-хозяина. Такие экспрессионные кассеты можно использовать для экспрессии эукариотических генов в различных хозяев, таких как бактерии, сине-зеленые водоросли, растительные клетки, дрожжевые клетки, клетки насекомых и клетки животных. В рамках настоящего изобретения экспрессионные кассеты могут включать (но этим не ограничивается) векторы клонирования, специфически сконструированные плазмиды, вирусы или вирусные частицы. Кассеты могут дополнительно включать начало репликации для аутономной репликации в клетках-хозяевах, селектируемые маркеры, различные сайты рестрикции, потенциал для большого числа копий, и сильные промоторы.
Под термином "вектор" подразумевают любой генетический элемент, такой как плазмида, фаг, транспозон, космида, хромосома, вирус и т.д., которые способны к репликации, если связаны с соответствующими контрольными элементами, и который может переносить генную последовательность между клетками. Таким образом, термин включает носители для клонирования и экспрессии, а также вирусные векторы.
Клетка была "трансформирована" экзогенным полинуклеотидом, если этот полинуклеотид был введен внутрь клеточной мембраны. Экзогенный полинуклеотид может быть (а может и не быть) интегрирован (ковалентно связан) в хромосомную ДНК, образуя геном клетки. Например, в прокариотах и дрожжах экзогенная ДНК может находиться на эписомальном элементе, таком как плазмида. Что касается эукариотических клеток, стабильно трансформированной клеткой является такая клетка, в которой экзогенная ДНК была интегрирована в хромосому таким образом, что она наследуется дочерними клетками в результате хромосомной репликации. Такая стабильность демонстрируется способностью эукариотической клетки создавать клеточные линии или клоны, состоящие из популяции дочерних клеток, содержащих экзогенную ДНК.
"Клеткой-хозяином" является клетка, которая была трансформирована или способна к трансформации экзогенной молекулой нуклеиновой кислоты.
Термин "гомология" относится к проценту идентичности между двумя полинуклеотидами или двумя полипептидными фрагментами. Две ДНК или две полипептидные последовательности являются "практически гомологичными" друг другу, если последовательности демонстрируют, по крайней мере, около 50%, предпочтительно, по крайней мере, около 75%, более предпочтительно, по крайней мере, около 80%-85%, предпочтительно, по крайней мере, около 90% и наиболее предпочтительно, по крайней мере, около 95%-98% идентичности последовательностей, или любой процент идентичности в указанных интервалах на определенной длине молекул. В том смысле, как здесь использован, термин практически гомологичный относится также к последовательностям, демонстрирующим полную идентичность к конкретной ДНК или полипептидной последовательности.
Обычно термин "идентичность" относится к точному соответствию нуклеотид-нуклеотид или аминокислота-аминокислота для двух полинуклеотидных или полипептидных последовательностей соответственно. Процент идентичности можно определить, непосредственно сравнивая информацию о последовательностях двух молекул, сопоставляя последовательности, подсчитывая точное число совпадений между двумя сопоставляемыми рядом последовательностями, деля на длину более короткой последовательности и умножая результат на 100. Сопоставление можно осуществить с последовательностью, у которой число аминокислот идентично числу аминокислот в представляющей интерес последовательности.
Предпочтительно, чтобы природные или не встречающиеся в природе белковые варианты содержали бы аминокислотные последовательности, которые на, по крайней мере, 70%, 80%, 85%, 90%, 92% или 95% или более были бы идентичны конкретному GNA33 полипептиду, представленному на Фиг.3 (SEQ ID NO:1). Более предпочтительно, чтобы молекулы были идентичны на 98% или 99%. Процент идентичности последовательности определяют, используя алгоритм поиска гомологии по Смиту-Уотерману, в котором используют поиск афинного гэпа со «штрафом» за пробел 12 и «штрафом» за удлинение 2, на матрице BLOSUM 62. Алгоритм поиска гомологии по Смиту-Уотерману раскрыт Smith и Waterman, Adv. Appl Math. 2:482-489 (1981).
В другом варианте гомологичность можно определить, используя гибридизацию полинуклеотидов в условиях, в которых образуются стабильные дуплексы между участками гомологичности, с последующим расщеплением одноцепочечно-специфической нуклеазой (нуклеазами) и определением размеров расщепленных фрагментов. ДНК последовательности, которые практически гомологичны, можно идентифицировать, используя Саузерн-ибридизацию, например, в жестких условиях, которые указаны для конкретной системы. Определение соответствующих условий гибридизации находится в компетенции специалистов. См. например, Sambrook et al., выше; DNA Cloning, выше; Nucleic Acid Hybridization, выше.
Термины "эффективное количество" или " фармацевтически эффективное количество" относятся к нетоксичному, но достаточному количеству агента, которое обеспечивает нужный биологический результат. Этим результатом может быть продуцирование антител с функциональной активностью против MenB, что определяют, используя приведенные здесь анализы. Кроме того, такое количество может быть достаточным, чтобы вызвать уменьшение и/или облегчение признаков, симптомов или причин менингококкового заболевания. Соответствующее "эффективное" количество в каждом конкретном случае может определить специалист, используя рутинные эксперименты.
Под терминами "фармацевтически приемлемый" или "фармакологически приемлемый" подразумевают материал, который не является биологически или каким-либо другим образом нежелательным, т.е. материал, который при введении индивидууму, не вызывает нежелательных биологических эффектов или не взаимодействует вредным образом ни с одним из компонентов композиции, в которую он включен.
Под терминами "физиологическое значение pH" или "pH в физиологическом интервале значений" подразумевают величину pH в интервале примерно от 7,2 до 8,0 включительно, чаще в интервале примерно от 7,2 до 7,6 включительно.
В том смысле, как здесь использован, термин "млекопитающее" включает (но этим не ограничивается) любой из членов класса млекопитающих: людей, приматов, не относящихся к людям, таких как шимпанзе, и других видов обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и т.п. Этот термин используют безотносительно к конкретному возрасту или полу.
В том смысле, как здесь использованы, термины "иммунологическое связывание" и "характеристики иммунологического связывания" относятся к нековалентным взаимодействиям такого типа, который наблюдается при взаимодействии молекулы иммуноглобулина и специфичного для этого иммуноглобулина антигена.
В том смысле, как здесь использован, термин "биологический образец" относится к образцу ткани или жидкости, выделенной из субъекта, включая (но этим не ограничиваясь), например, кровь, плазму, сыворотку, фекалии, мочу, костный мозг, желчь, спинномозговую жидкость, лимфатическую жидкость, образцы кожи, внешней секреции кожи, респираторного, кишечного и мочеполовых каналов, слезы, слюну, молоко, клетки крови, органы, биоптаты и также образцы составляющих клеточных in vitro культур, включая (но этим не ограничиваясь) кондиционную среду, полученную в результате роста клеток и тканей в культуральной среде, например рекомбинантные клетки и компоненты клеток.
В том смысле, как здесь использованы, термины "метка" и "детектируемая метка" относятся к молекуле, которую можно детектировать, включая (но этим не ограничиваясь) радиоактивные изотопы, флюоресцентные агенты, хемилюминесцентные агенты, ферменты, ферментные субстраты, ферментные кофакторы, ингибиторы ферментов, хромофоры, красители, ионы металлов, золи металлов, лиганды (например, биотин или гаптены) и т.п.Термин "флуоресцентный агент" относится к веществу или его части, которые способны проявлять флуоресценцию в детектируемом интервале. Конкретные образцы меток, которые можно использовать в рамках настоящего изобретения, включают флуоресцин, родамин, дансил, умбеллиферон, Texas красный, люминол, NADPH и β-галактозидазу.
II. Способы осуществления настоящего изобретения
Настоящее изобретение основано на обнаружении того факта, что GNA33, липопротеин, гомологичный E.coli мышиной трансгликозидазе, вызывает выработку защитных антител в результате имитирования эпитопа на петле 4 PorA в штаммах сероподтипа P1.2. GNA33 не экспонирован на поверхности живых бактерий, но расположен в периплазмическом пространстве. Картирование эпитопов бактерицидного анти-GNA33 mAb с использованием перекрывающихся пептидов демонстрирует, что mAb распознает пептиды из GNA33 и PorA, которые имеют необходимую для связывания QTP последовательность. По данным проточной цитометрии анти-GNA33 mAb связывается, так же как и контрольное анти-PorA (P 1.2) mAb, с бактериальной поверхностью большинства MenB штаммов P1.2 сероподтипа. Анти-GNA33 антитело придает пассивную защиту детенышам крыс, зараженным P1.2 штаммами. Таким образом, GNA33 является новым миметиком, который вызывает выработку защитных антител, направленных против PorA. В отличие от PorA GNA33 вызывает выработку защитных антител при введении без необходимости ренатурации белка. Авторы настоящего изобретения обнаружили, что GNA33 является одним из наиболее эффективных агентов-миметиков, обнаруженных к настоящему времени.
Обнаружение того факта, что GNA33 демонстрирует иммунологическую мимикрию PorA P1.2 этитопа, доказывает применимость GNA33 для использования в вакцине для профилактики заболевания, вызываемого P1.2 штаммами, которые представляют примерно 8% от изолятов серогруппы B в США (Tondella et al., J. Clin. Microbiol (2000) 38:3323-3328). Кроме того, заменяя другие PorA петли в GNA33 или в субдоменах GNA33, можно создавать иммуногенные миметики других сероподтипов PorA эпитопов, полезных в качестве антигенов в мультивалентной менигококковой вакцине. Такая вакцина имеет множество преимуществ по сравнению с вакцинами на основе рекомбинантных PorA. Например, приготовление такой вакцины значительно упрощается, так как rGNA33 могут быть легко экспрессированы в больших количествах в неинфективных E.coli без необходимости стадий экстрагирования детергентом, рефолдинга или восстановления в липидных носителях. Кроме того, эпитопсодержащие сегменты PorA вариантов из вновь появляющихся NmB штаммов, вызывающих заболевания, можно при необходимости заменить в GNA33.
Так, GNA33 полипептиды, пептиды, антитела и другие MenB миметики можно использовать в качестве диагностических реагентов и/или в композиции для профилактики MenB заболевания. Антитела, полученные против GNA33, проявляют функциональную активность против MenB бактерий, причем функциональная активность важна для придания защиты против MenB заболевания. Эти антитела можно полностью охарактеризовать в отношении их изотипа, антигенной специфичности и функциональной активности.
GNA33 полипептиды для использования в способе настоящего изобретения можно непосредственно выделить из бактерий, которые их продуцируют, используя известные специалистам методики. В другом варианте полипептиды можно синтезировать химически, используя любой из нескольких способов, которые известны специалистам. См, например, J. M. Stewart and J. D. Young, Solid Phase Peptide Synthesis (Pierce Chemical Co., Rockford, IL 1984) и G. Barany and R. B. Merrifield, The Peptides: Analysis, Synthesis, Biology, editory E. Gross and J. Meienhofer, Vol. 2, (Academic Press, New York, 1980), pp. 3-254, для способа твердофазного синтеза пептидов; и M. Bodansky, Principles of Peptide Synthesis, (Springer-Verlag, Berlin 1984) и E. Gross and J. Meienhofer, Eds. The Peptides: Analysis, Synthesis, Biology, Vol. 1, для классического синтеза в растворах. Полипептиды настоящего изобретения можно также получить химическим способом, используя метод одновременного синтеза множества пептидов. См. например, Houghten Proc. Natl. Acad. Sci. USA (1985) 82:5131-5135; патент США № 4631211.
Предпочтительно получать полипептиды рекомбинантно в результате экспрессии кодирующих их полинуклеотидов, используя стандартные методики молекулярной биологии. Например, полинуклеотидные последовательности, кодирующие вышеуказанные молекулы, можно получить, используя рекомбинантные методики, такие как скринирование кДНК и геномных библиотек бактерий, экспрессирующих ген, или получая ген из вектора, о котором известно, что он его содержит. Кроме того, нужный ген можно выделить непосредственно из содержащих его клеток, используя стандартные методики, такие как фенольная экстракция и ПЦР кДНК или геномной ДНК. (См. например, Sambrook et al., выше) для описания методик, которые используют для получения и выделения ДНК. Представляющий интерес ген можно также получить синтетически, а не клонированием. Можно сконструировать молекулы с соответствующими кодонами для конкретной последовательности. Затем полную последовательность собирают из перекрывающихся олигонуклеотидов, полученных стандартными способами, и собирают в полную кодирующую последовательность. См. например, Edge (1981) Nature 292:756; Nambair et al. (1984) Science 223:1299; и Jay et al. (1984) J. Biol. Chem. 259:6311.
Так, конкретные нуклеотидные последовательности можно получить из векторов, содержащих нужные последовательности, или синтезировать полностью или частично, используя различные известные специалистам способы синтеза олигонуклеотидов, такие как способ полимеразной цепной реакции (ПЦР). См. например, Sambrook, выше. В частности, одним из способов получения нуклеотидных последовательностей, кодирующих нужные последовательности, является отжиг комплементарных наборов перекрывающихся синтетических олигонуклотидов, полученных с помощью обычного автоматического синтезатора полинуклеотидов, с последующим лигированием с помощью подходящей ДНК лигазы и амплификацией лигированной нуклеотидной последовательности ПЦР. См. например, Jayaraman et al. (1991) Proc. Natl. Acad. Sci. USA 88:4084-4088. Кроме того, в способах настоящего изобретения для получения молекул, обладающих измененными или усиленными способностями связывания с антигеном, можно использовать направленный синтез олигонуклеотидов (Jones et al. (1986) Nature 54:75-82), олигонуклеотидный направленный мутагенез существовавших ранее нуклеотидных участков (Riechmann et al. (1988) Nature 332:323-327 и Verhoeyen et al. (1988) Science 239:1534-1536) и ферментативное заполнение олигонуклеотидов, содержащих гэпы, используя T4 ДНК полимеразу (Queen et al. (1989) Proc. Natl. Acad. Sci. USA 86: 10029-10033).
После того как кодирующие последовательности получены или выделены, такие последовательности можно клонировать в любой подходящий вектор или репликон. Специалистам известны многочисленные векторы клонирования, и выбор подходящего вектора клонирования остается за ними. Подходящие векторы включают (но этим не ограничиваются) плазмиды, фаги, траспозоны, космиды, хромосомы или вирусы, которые способны к репликации, будучи связанными с подходящими контрольными элементами. Кодирующую последовательность помещают затем под контроль подходящих контрольных элементов, зависящих от системы, которую должны использовать для экспрессии. Так, кодирующую последовательность можно поместить под контроль промотора, сайта связывания рибосомы (для бактериальной экспрессии) и необязательно оператора, так что представляющая интерес ДНК последовательность транскрибируется в РНК в подходящем трансформанте. Кодирующая последовательность может содержать (а может и не содержать) последовательность, кодирующую сигнальный пептид или лидерную последовательность, которая позднее может быть удалена хозяином во время пост-трансляционного процессинга. См. например, патенты США № 4431739; 4425437; 4338397. Если сигнальная последовательность присутствует, она может быть либо нативной последовательностью, либо она может быть гетерологичной сигнальной последовательностью.
В дополнение к контрольным последовательностям может оказаться желательным добавить регуляторные последовательности, которые позволят регулировать экспрессию последовательностей относительно роста клетки-хозяина. Регуляторные последовательности известны специалистам, и их примеры включают те последовательности, которые вызывают экспрессию гена, который должен "включаться или выключаться" в ответ на химические или физические стимулы, включая присутствие регуляторного соединения. В векторе могут также присутствовать и другие типы регуляторных элементов. Например, в настоящем изобретении можно использовать энхансерные элементы для повышения уровней экспресии всей конструкции. Примеры включают энхансер раннего гена SV40 (Dijkema et al. (1985) EMBO J. 4:761), энхансер/промотор, полученный из длинного концнвого повтора (LTR) вируса саркомы Рауса (Gorman et al. (1982) Proc. Natl. Acad. Sci. USA 79:6777) и элементы, полученные из CMV человека (Boshart et al. (1985) Cell 41:521), такие как элементы, включенные в CMV интронную A последовательность (патент США № 5688688). Экспрессионная кассета может дополнительно содержать начало репликации для автономной репликации в подходящей клетке-хозяине, один или более селектируемых маркеров, один или более сайтов рестрикции, потенциал для большого числа копий и сильный промотор.
Вектор экспрессии конструируют таким образом, чтобы конкретная кодирующая последовательность была бы расположена в векторе с соответствующей регуляторной последовательностью, причем положение и ориентация кодирующей последовательности по отношению к контрольной последовательности было бы таким, чтобы кодирующая последовательность была транскрибирована под "контролем" контрольных последовательностей (т.е. РНК полимераза, которая связывается с ДНК молекулой по контрольной последовательности, транскрибирует кодирующую последовательность). Модификация последовательностей, кодирующих представляющий интерес молекулу, может быть желательна для достижения этого конца. Например, в некоторых случаях может оказаться необходимым модифицировать последовательность таким образом, чтобы она могла быть присоединена к контрольной последовательности в соответствующей ориентации; т.е. сохранить рамку считывания. Контрольные последовательности и другие регуляторные последовательности могут быть лигированы с кодирующей последовательностью до встраивания в вектор. В другом варианте кодирующую последовательность можно клонировать непосредственно в вектор экспрессии, который уже содержит контрольные последовательности и соответствующий рестрикционный сайт.
Как разъяснялось выше, может также оказаться желательным получить мутанты или аналоги ссылочного GNA33 полипептида. Мутанты или аналоги можно получить путем делеции части последовательности, кодирующей GNA33 полипептид, встраивания последовательности и/или замещением одного или более нуклеотидов последовательности. Методики модифицирования нуклеотидных последовательностей, такие как сайт-направленный мутагенез и т.п., хорошо известны специалистам. См. например, Sambrook et al., выше; Kunkel, T.A. (1985) Proc. Natl. Acad. Sci. USA (1985) 82:448; Geisselsoder et al, (1987) BioTechniques 5:786; Zoller and Smith (1983) Methods Enzymol 100:468: Dalbadie-McFarland et al. (1982) Proc. Natl. Acad. Sci USA 79:6409.
Молекулы могут быть экспрессированы в широком круге систем, включая экспрессионные системы насекомых, млекопитающих, бактерий, вирусов и дрожжей, причем все они хорошо известны специалистам. Например, экспрессионные системы клеток насекомых, такие как бакуловирусные системы, хорошо известны специалистам и раскрыты, например, Summers and Smith, Texas Agricultural Experiment Station Bulletin № 1555 (1987). Материалы и способы для экспрессионных систем бакуловирус/клетка насекомого коммерчески доступны в форме набора от (наряду с другими) Invitrogen, San Diego CA ("MaxBac" kit). Аналогично экспрессионные системы клеток бактерий и млекопитающих хорошо известны специалистам и раскрыты, например, Sambrook et al., выше. Дрожжевые системы экспрессии также хорошо известны специалистам и раскрыты, например, в Yeast Genetic Engineering (Barr et al., eds., (1989) Butterworths, London).
Хорошо известен специалистам также ряд подходящих клеток-хозяев для использования с вышеуказанными системами. Например, специалистам известны клеточные линии млекопитающих, и они включают иммортализованные клеточные линии, доступные из Американской Коллекции Типовых Культур (ATCC), такие как (но ими не ограничиваются) клетки яичников китайского хомяка (CHO), HeLa клетки, клетки почки детеныша хомяка (BHK), клетки почки обезьяны (COS), клетки почки человеческого эмбриона, клетки гепатоклеточной карциномы человека (например, Hep G2), Madin-Darby клетки почки быка ("MDBK"), а также другие. Аналогично бактериальные хозяева, такие как E.coli, Bacillus subtilis, and Streptococcus spp., можно использовать с рассматриваемыми экспрессионными конструкциями. Клетки дрожжей, которые можно использовать в способах настоящего изобретения, включают (наряду с другими) Saccharomyces cerevisiae, Candida albicans, Candida maltosa, Hansenula polymorpha, Kluyveromyces fragilis, Kluyveromyces lactis, Pichia guillerimondii, Pichia pastoris, Schizosaccharomyces pombe и Yarrowia lipolytica. Клетки насекомых для использования с бакуловирусными векторами экспрессии включают (наряду с другими) Aedes aegypti, Autographa californica, Bombyx mori, Drosophila melanogaster, Spodoptera frugiperda, и Trichoplusia ni.
Молекулы нуклеиновой кислоты, включающие представляющие интерес нуклеотидные последовательности, можно стабильно интегрировать в геном клетки-хозяина, или сохранить на стабильном эписомальном элементе в подходящей клетке-хозяине, используя различные методики доставки генов, хорошо известные специалистам. См. например, Патент США № 5399346.
В зависимости от экспрессионной системы и выбранного хозяина молекулы получают, выращивая клетки-хозяева, трансформированные описанным выше вектором экспрессии, в таких условиях, в которых осуществляется экспрессия белка. Затем экспрессированный белок выделяют из клеток-хозяев и очищают. Если экспрессионная система секретирует белок в ростовую среду, продукт можно выделить непосредственно из этой среды. Если же он не секретируется в среду, его можно выделить из клеточных лизатов. Выбор подходящих условий для роста и способы выделения хорошо известны специалистам.
После получения GNA33 полипептиды можно использовать для получения антител. Так, полипептиды приготовлены в композиции для иммунизации млекопитающих, включая стандартных лабораторных животных, таких как грызуны и кролики. Композиции могут включать подходящий адъювант для того, чтобы вызвать продуцирование поликлональной сыворотки. Группы животных обычно иммунизуют и повторяют это несколько раз, используя композицию. От иммунизованных животных можно получить антисыворотку. GNA33 полипептиды, которые способны вызвать образование бактерицидной антисыворотки, можно использовать для получения моноклональных антител. Эти антитела, в свою очередь, можно использовать для поиска других пептидов MenB антигенов, которые предоставят эпитопы для анти-MenB вакцины.
Так, при осуществлении настоящего изобретения выбранные GNA33 полипептиды используют для получения моноклональных антител и их функциональных эквивалентов. Термин "функциональный эквивалент" в отношении конкретного моноклонального антитела, в том смысле, как здесь использован, означает молекулу, которая: (а) перекрестно блокирует взятое в качестве примера моноклональное антитело; (b) селективно связывается с рассматриваемьм GNA33 полипептидом; (с) и, необязательно, проявляет функциональную активность (например, комплемент-опосредованную бактерицидную и/или опсоническую активность) против MenB бактериальных клеток по данным описанных далее стандартных анализов. Далее, в том смысле, как здесь использован в отношении конкретной продуцирующей моноклональное антитело гибридомы настоящего изобретения, термин "потомство" должен включать все производные, потомки и отпрыски родительской гибридомы, которые продуцируют моноклональное антитело, продуцируемое родителем, независимо от поколения и кариотипической идентичности.
Моноклональные антитела получают, используя стандартные методики, хорошо известные специалистам, такие как способ Kohler и Milstein, Nature (1975) 256:495, или его модификации, такие как описаны Buck et al. (1982) In Vitro 18:377. Обычно мышь или крысу иммунизуют GNA33 полипептидом, конъюгированным с носителем белка, иммунизуют повторно и извлекают селезенку (и необязательно несколько крупных лимфатических узлов) и диссоциируют на отдельные клетки. При желании клетки селезенки можно скринировать (после удаления неспецифически прилипших клеток), нанося клеточную суспензию на планшет или лунку, покрытую антигеном. B-клетки, экспрессирующие связанный с мембраной иммуноглобулин, специфичный для антигена, связываются с планшетом и не смываются вместе с остальной суспензией. Полученные в результате В-клетки, или все диссоциированные клетки селезенки, гибридизуют затем с клетками миеломы с образованием гибридом. Репрезентативные линии мышиной миеломы для использования при гибридизации включают те, которые доступны из Американской Коллекции типовых культур (ATCC).
Более конкретно, гибриды соматических клеток можно получить способом Buck et al., (выше), используя устойчивую к азагуанину, не секретирующую мышиную миеломную клеточную линию P3X63-Ag8.653 (которую можно получить из ATCC). Гибридомные клеточные линии обычно клонируют мимитирующим разведением и анализируют на продуцирование антител, которые связываются специфически с иммунизирующим антигеном и которые не связываются с неродственными антигенами. Выбранные гибридомы, секретирующие моноклональные антитела, затем культивируют либо in vitro (например, в культуральных пробирках для тканей или в реакторах из полых волокон), или in vivo (например, как асциты в мышах).
Затем гибридомную надосадочную жидкость можно проанализировать в отношении анти-MenB-реакционноспособного антитела, используя, например, либо твердофазный анализ ELISA с иммунизирующим GNA33 полипептидом, либо непрямой иммунофлуоресцентный анализ, используя MenB бактерии в качестве антигена-мишени. Селективность моноклональных антител, секретируемых гибридомами, можно оценить, используя конкурентные анализы специфического связывания, такие как ELISA с ингибированием, или т.п. Например, молекулы антител либо разбавляют в буфере либо осуществляют реакцию буфера, содержащего растворимый GNA33 полипептид, в реакторе для ELISA в присутствии связанного GNA33 полипептида. После промывки связанное антитело детектируют по меченому анти-Ig (анти-IgM, IgG и IgA) в качестве вторичного антитела. Антитела, которые ингибированы растворимым GNA33 полипептидом, можно считать специфическими, и поэтому выбрать для дальнейших исследований, включая изотипирование и дополнительное скринирование в отношении MenB связывания и функциональной активности.
Более конкретно, частично очищенные молекулы моноклональных антител можно индивидуально оценить в отношении их способности связываться с поверхностью MenB, используя стандартные анализы, такие как описываемые далее в примерах. Функциональную активность можно определить, оценивая комплемент-опосредованную бактерицидную активность и/или опсоническую активность. В частности, комплемент-опосредованную бактерицидную активность антител можно оценить, используя стандартные анализы, такие как описаны Gold et al. (1970) Infect. Immun. 1:479, Westerink et al. (1988) Infect. Immun. 56:1120, Mandrell et al. (1995) J. Infect. Dis. 172:1279, и Granoff et al. (1995) Clin. Diagn. Laboratory Immunol 2:574. В этих анализах N. meningitidis подвергают взаимодействию с источником комплемента, а также с подлежащим тестированию антителом. Бактериальные оценки проводят в различные моменты отбора образцов. Те антитела, которые демонстрируют комплемент-опосредованную бактерицидную активность, на что указывает минимум 50% уменьшение количества жизнеспособных бактериальных клеток, при определении после шестидесяти минут инкубирования с антителом и комплементом по сравнению с количеством колоний в момент времени ноль, рассматривают как демонстрирующие бактерицидную активность для целей настоящего изобретения и как пригодные для дальнейшего использования.
Считают, что комплемент-опосредованный бактериолиз является основным механизмом, ответственным за защиту хозяина от инвазивного менингококкового заболевания. Однако факты также подтверждают важную защитную роль опсонизации (см. например, Bjerknes et al. (1995) Infect. Immun. 63:160). Соответственно опсоническую активность продуцируемых здесь антител можно оценить как вторую меру или как альтернативную меру для оценки функциональной активности. Результаты, полученные в анализах с опсонизацией, можно использовать для дополнения бактерицидных результатов и для помощи в выборе антител, способных обеспечить защиту. Оценка опсонической активности также особенно полезна здесь для оценки мышиных моноклональных антител настоящего изобретения, которые имеют IgG1 изотип. Мышиный IgG1 (в противоположность человеческому IgG1) является неэффективным для активации комплемента. Так, мышиные IgG1 антитела не активируют комплемент-опосредованный бактериолиз МепВ в вышеуказанных анализах. Однако функциональную активность IgG1 анти-СМА33 моноклональных антител можно оценить по опсонизации в отсутствии комплемента.
Специалистам известны различные методики опсонического анализа, и их можно использовать для оценки функциональной активности моноклональных антител настоящего изобретения. Такие стандартные анализы включают анализы, раскрытые Sjursen et al. (1987) Acta Path. Microbiol. Immunol. Scand., Sec. С 95: 283, Halstensen et al. (1989) Scand. J. Infect. Dis. 21: 267, Lehmann et al. (1991) APMIS 99:769, Halstensen et al.(1991) NIPH Annals 14:157, Fredlund et al. (1992) APMIS 100: 449, Guttormsen et al. (1992) Infect. Immun. 60:2777, Guttormsen et al. (1993) J. Infec. Dis. 167:1314, Bjerknes et al. (1995) Infect. Immun, 63:160, Hayrinen et al. (1995) J. Infect. Dis. 171:1481, de Velasco et al. (1995) J. Infect. Dis. 172:262, and Verheul, A.F.M. (1991) "Meningococcal LPS Derived Oligosaccharide-Protein Conjugate Vaccines, Immunechemical and Immunological Aspects", Thesis, Utrecht University, The Netherlands, pp. 112-135.
Отображенные представляющие интерес моноклональные антитела можно размножить in vitro, используя рутинные методы культуры тканей, или in vivo, используя млекопитающих. Например, пристан-примированные мыши могут быть инокулированы гибридомными клетками в логарифмической фазе, в PBS для получения асцитов. Асцитные жидкости можно хранить при температуре -70°C до дальнейшей очистки.
Может оказаться желательным получить химерные антитела, особенно если эти антитела должны быть использованы в профилактических или терапевтических фармацевтических препаратах, таких как для получения пассивной защиты от MenB, а также для MenB диагностических препаратов. Химерные антитела, состоящие из человеческих и нечеловеческих аминокислотных последовательностей, можно получить из молекул мышиных моноклональных антител для снижения их иммуногенности у людей (Winter et al. (1991) Nature 349:293: Lobuglio et al. (1989) Proc. Nat. Acad. Sci. USA 86:4220; Shaw et al.(1987) J.Immunol. 138:4534; and Brown et al. (1987) Cancer Res. 47:3577; Riechmann et al. (1988) Nature 322:323; Verhoeyen et al. (1988) Science 239:1534; и Jones et al. (1986) Nature 321:522; EP публикация № 519596, опубликованная 23 декабря 1992; и патентная публикация Великобритании № GB 2276169, опубликованная 21 сентября 1994).
Фрагменты молекул антител, например, F(ab')2, Fv и sFv молекулы, которые способны проявлять свойства иммунологического связывания родственных молекул моноклональных антител, можно получить, используя известные методики. Inbar et al.(1972) Proc. Nat. Acad. Sci. USA 69:2659; Hochman et al. (1976) Biochem 15:2706; Ehrlich et al.(1980) Biochem 19:4091; Huston et al. (1988) Proc. Nat. Acad. Sci. USA 85(16):5879; и Патенты США № 5091513 и 5132405 Huston et al.; и 4946778 Ladner et al.
В другом варианте систему представляющую фаг, можно использовать для распространения популяций молекул моноклональных антител in vitro. Saiki, et al. (1986) Nature 324:163; Scharf et al. (1986) Science 221:1076; Патенты США № 4683195 и 4683202; Yang et al.(1995) J. Mol Biol 254:392; Barbas, III et al. (1995) Methods: Comp. Meth Enzymol 8:94; Barbas, III et al. (1991) Proc Natl Acad Sci USA 88:7978.
После создания, представляющую фаг библиотеку можно использовать для повышения афинности иммунологического связывания Fab молекул, используя известные методики. См. например, Figini et al. (1994) J. Mol. Biol. 239:68.
Кодирующие последовательности участков тяжелых и легких цепей Fab молекул, выбранных из представляющей фаг библиотеки, можно выделить или синтезировать и клонировать в любой подходящий вектор или репликон для экспрессии. Можно использовать любую подходящую экспрессионную систему, включая, например, системы бактерий, дрожжей, насекомых, амфибий и млекопитающих. Экспрессионные системы в бактериях включают те, что описаны Chang et al. (1978) Nature 275:615, Goeddel et al. (1979) Nature 281:544, Goeddel et al. (1980) Nucleic Acids Res. 8:4057, европейская заявка EP 36776, патент США № 4551433, de Boer et al. (1983) Proc. Natl. Acad. Sci. USA 80:21-25, и Siebenlist et al. (1980) Cell 20:269.
Экспрессионные системы в дрожжах включают системы, раскрытые Hinnen et al. (1978) Proc. Natl. Acad. Sci. USA 75:1929, Ito et al. (1983) J. Bacteriol 151:163, Kurtz et al. (1986) Mol. Cell. Biol. 6:142, Kunze et al. (1985) J. Basic Microbiol. 25:141, Gleeson et al. (1986) J. Gen. Microbiol. 132:3459, Roggenkamp et al. (1986) Mol.Gen. Genet. 202:302, Das et al. (1984) J. Bacteriol. 158:1165, De Louvencourt et al. (1983) J. Bacteriol. 154:737, Van den Berg et al. (1990) Bio/Technology 8:135, Kunze et al. (1985) J. Basic Microbiol 25:141, Cregg et al. (1985) Mol Cell. Biol. 5:3376, Патенты США № 4837148 и 4929555, Beach et al. (1981) Nature 300:706, Davidow et al. (1985) Curr. Genet. 10:380, Gaillardin et al (1985) Curr. Genet. 10:49, Balance et al. (1983) Biochem. Biophys. Res. Commun. 112:284-289, Tilburn et al. (1983) Gene 26:205-221, Yelton et al. (1984) Proc. Natl Acad. Sci. USA 81:1470-1474, Kelly et al. (1985) EMBO J. 4:475479; Европейская заявка EP 244234 и международная публикация WO 91/00357.
Экспрессию гетерологичных генов в насекомых можно осуществить, как раскрыто в Патенте США № 4745051, Европейских заявках EP 127839 и EP 155476, Vlak et al. (1988) J. Gen. Virol 69:765-776, Miller et al. (1988) Ann. Rev. Microbiol. 42:177, Carbonell et al. (1988) Gene 73:409, Maeda et al. (1985) Nature 311:592-594, Lebacq-Verheyden et al. (1988) Mol. Cell. Biol. 8:3129, Smith et al. (1985) Proc. Natl. Acad. Sci. USA 82:8404, Miyajima et al. (1987) Gene 58:273, and Martin et al. (1988) DNA 7:99. Многочисленные бакуловирусные штаммы и варианты и соответствующие допустимые клетки-хозяева насекомых из хозяев раскрыты Luckow et al. (1988) Bio/Technology 6:47-55, Miller et al. (1986) GENERIC ENGINEERING, Setlow, J.K. et al. eds., Vol. 8, Plenum Publishing, pp. 277-279, и Maeda et al. (1985) Nature 315:592-594.
Экспрессию в млекопитающих можно осуществить, как раскрыто Dijkema et al. (1985) EMBO J. 4:761, Gorman et al. (1982) Proc. Natl. Acad. Sci. USA 72:6777, Boshart et al. (1985) Cell 41:521, и в Патенте США № 4399216. Другие особенности экспрессии в млекопитающих можно использовать, как раскрыто Ham et al. (1979) Meth. Enz. 58:44, Barnes et al. (1980) Anal. Biochem. 102:255, в Патентах США № 4767704, 4657866, 4927762, 4560655 и в переизданном патенте США № RE 30985, и в международных публикациях WO 90/103430, WO 87/00195.
Любые из вышеуказанных молекул антител можно здесь использовать для получения анти-MenB терапевтических или профилактических фармацевтических агентов. Кроме того, используя раскрытые выше методики, можно получить молекулы "гуманизированных" антител, включающих антиген-связывающие сайты, полученные из мышиных моноклональных антител.
Раскрытые выше анти-MenB антитела настоящего изобретения обычно используют в качестве рецепторов для скринирования различных молекулярных библиотек с целью идентификации молекулярных миметиков эпитопов MenB, используя методики, такие как раскрыты в патентах США № 6030619 и 6048527, включенных сюда для ссылки. Способы идентификации миметиков в молекулярных библиотеках обычно включают одну или более из следующих процедур: (1) афинную очистку с использованием иммобилизованного рецептора-мишени; (2) связывание растворимого рецептора со связанными лигандами и (3) тестирование растворимых соединений непосредственно в антигенных конкурентных анализах или на биологическую активность. Молекулы, скринированные в отношении молекулярных миметиков, включают (но этим не ограничиваются) небольшие органические соединения, комбинаторные библиотеки органических соединений, нуклеиновые кислоты, производные нуклеиновых кислот, сахариды или олигосахариды, пептоиды, растворимые пептиды, пептиды, закрепленные на твердой фазе, пептиды, представленные на поверхности белков бактериальных фагов, белки или антитела поверхностей бактерий, и/или пептиды, содержащие не пептидные органические фрагменты.
Например, библиотеки различных видов молекул можно создать, используя комбинаторный органический синтез. См. например, Gordon et al. (1994) J. Med. Chem. 37:1335. Примеры включают (но этим не ограничиваются) пирролидины; олигокарбаматы (Cho et al. (1993) Science 261:1303); пептоиды, такие как полимеры N-замещенного глицина (Simon et al. (1992) Proc. Natl Acad. Sci. USA 89:9367); и винилсодержащие полипептиды (Hagihara et al. (1992) J. Am. Chem. Soc. 114:6568).
Различные известные специалистам подходы можно использовать для того, чтобы проследить за строящимися блоками по мере того, как они добавляются в процессе синтеза, с тем чтобы можно было определить историю индивидуальных членов библиотеки. Такие подходы включают определяемое положение на фотолитографическом чипе (олигокарбаматы), деконволюционную стратегию, при которой "хиты" идентифицируют за счет рекурсивного добавления мономеров к частично синтезированным библиотекам (пептоиды, пирролидины, пептиды), и кодирование комбинаторных библиотек с помощью раздельного синтеза нуклеотидов (Nielsen et al. (1993) J. Am. Chem. Soc. 115:9812) или других органических фрагментов (Ohlmeyer et al. (1993) Proc. Natl Acad. Sci. USA 90:10922) ("метки"). Кодируемые метки, ассоциированные с каждым из членов библиотеки, можно затем расшифровать, после того как миметик был выбран. Например, метки нуклеиновых кислот можно расшифровать с помощью ДНК секвенирования.
Пептоидные комбинаторные библиотеки особенно полезны для идентификации молекулярных миметиков MenB эпитопов. Пептоиды представляют собой олигомеры N-замещенного глицина (Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89:9367), и их можно использовать для создания химически различных библиотек новых молекул. Мономеры могут включать боковые цепи на основе трет-бутила и 9-фторенил-метоксикарбонильную защитную группу для α-амина. Сборку мономеров в пептоидные олигомеры можно осуществить, например, на твердой фазе, используя "субмономерный метод" Zuckermann et al.(1992) J. Am. Chem. Soc. 114:10646. В этом методе синтез ведут, используя амидполистирольную смолу Ринка (Rink et al. (1987) Tetrahedron Lett, 28:3787). Связанные со смолой амины бромацетилируют in situ активацией бромуксусной кислотой диизопропилкарбодиимидом. Затем связанные со смолой бромацетамиды удаляют, добавляя амин. Амины могут включать защитные группы на основе трет-бутила для дополнительных реакционноспособных групп. Такой двухстадийный цикл повторяют до тех пор, пока не добавляют нужное число мономеров. Затем олигопептид освобождают от смолы, обрабатывая смесью 95% трифторуксусной кислоты/5% воды. Синтез ведут, предпочтительно используя автоматический синтезатор. См. например, Zuckermann et al.(1992) Pept. Protein Res. 40:498; и Zuckermann et al. (1996) Methods in Enzymology 267:437. В другом варианте олигомеризацию пептоидных мономеров можно осуществить in situ активацией либо бензотриазол-1-ил-окситрис(пирролидино)фосфоний гексафторфосфатом, либо бромотрис(пирролидино)фосфоний гексафторфосфатом. В этом альтернативном способе остальные стадии идентичны обычному пептидному синтезу с использованием α-(9-фторенилметоксикарбонил)аминокислот (см. например, Simon et al. (1992), выше).
После того как созданы библиотеки пептоидов, их можно скринировать, например, добавляя моноклональные антитела настоящего изобретения наряду с различными пулами комбинаторных пептоидов в лунки микротитровальных планшетов, покрытых MenB полипептидами или MenB бактериями. После периода инкубирования и промывки для удаления несвязанных антител присутствие связанных антител определяют, используя стандартные ELISA анализы. См. например, Harlow & Lane, Antibodies: A Laboratory Manual (1988), Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 553. Лунки, которые не содержат связанных антител, свидетельствуют о присутствии пептоидных миметиков, которые связываются с антителом. Конкретные идентичности пептоидных миметиков в пулах определяют, рекурсивно добавляя обратно мономерные единицы к частично синтезированным членам библиотек. Zuckermann et al. (1994) J. Med. Chem. 37:2678. Другие способы идентификации активных соединений в пулах небольших молекул включают фракционирование пула с помощью ВЭЖХ с обращенной фазой или с помощью комбинации афинной селекции/масс-спектроскопии (Nedved M.L. et al. (1996) Anal. Chem. 68:4228).
После того как предполагаемые молекулярные миметики идентифицированы, их тестируют в отношении их способности вызывать выработку функционально активных (например, бактерицидных и/или опсонических) антител, как раскрыто выше. Молекулярные миметики, которые обладают этими свойствами, пригодны для дальнейшего использования, например в композициях вакцин.
GNA33 антитела, так же как и молекулярные миметики, идентифицированные с использованием функционально активных анти-MenB антител изобретения, можно использовать для создания реагентов антител для использования в диагностических анализах. Например, раскрытые здесь антитела, так же как и другие антитела, реакционные в отношении молекулярных миметиков, можно использовать для определения бактериальных антигенов в биологических образцах, используя иммунодиагностические методики, такие как конкурентный анализ, непосредственная реакция или анализ сэндвичного типа. Такие анализы включают Вестернблоттинг; агглютинационные тесты; иммуноанализ с использованием меченых ферментов и опосредованный иммуноанализ, такие как ELISA; анализы с использованием биотин/авидина; радиоиммуноанализы; иммуноэлектрофорез; иммуноосаждение и т.п. Реакции обычно включают выявление меток, таких как флуоресцентные, хемилюминесцентные, радиоактивные, ферментные метки или молекулы красителей, или другие способы определения образования комплекса между миметиком и антителом, или антителами которые с ним реагируют.
Вышеперечисленные анализы обычно включают удаление несвязанных антител в жидкой фазе из твердой фазы носителя, с которым связаны комплексы антиген-антитело. Твердые носители, которые можно использовать при осуществлении настоящего изобретения, включают такие субстраты, как нитроцеллюлоза (например, в форме мембран или микротитровальных планшетов); поливинилхлорид (например, в форме пластин или микротитровальных планшетов); полистирольный латекс (например, в форме шариков или микротитровальных планшетов); поливинилидинфторид; диазотизированная бумага; нейлоновые мембраны; активированные шарики; магнитные шарики; и т.п.
Обычно твердый носитель вначале подвергают взаимодействию с твердофазным компонентом (например, с одним или более из MenB антигенов или молекулярных миметиков) в подходящих для связывания условиях, так что этот компонент оказывается достаточно иммобилизованным на носителе. Иногда иммобилизацию на носителе можно усилить, вначале присоединяя к белку, который обладает лучшими свойствами связывания. Подходящие для присоединения белки включают (но этим не ограничиваются) макромолекулы, такие как сывороточные альбумины, включая бычий сывороточный альбумин (BSA), гемоцианин лимфы улиток, молекулы иммуноглобулина, тироглобулин, овальбумин и другие белки, которые хорошо известны специалистам. Другие молекулы, которые можно использовать для связывания антигена или миметика с носителем, включают полисахариды, полимолочные кислоты, полимерные аминокислоты, сополимеры аминокислот и т.п. Такие молекулы и способы присоединения таких молекул к антигенам хорошо известны специалистам. См. например, Brinkley, M.A. Bioconjugate Chem. (1992) 3:2-13; Hashida et al., J. Appl Biochem. (1984) 6:56-63; и Anjaneyulu and Staros, International J. of Peptide and Protein Res. (1987) 30:117-124.
После осуществления взаимодействия твердого носителя с компонентом твердой фазы, любые неиммобилизованные на твердой фазе компоненты удаляют с носителя, промывая его, и затем осуществляют контактирование связанного с носителем компонента с биологическим образцом, который, как полагают, содержит фрагменты лиганда (например, MenB антитела) в подходящих для связывания условиях. После промывки для удаления любого несвязанного лиганда добавляют вторичный связующий фрагмент в подходящих для связывания условиях, причем вторичный связующий агент способен селективно ассоциироваться со связанным лигандом. Присутствие вторичного связующего агента можно затем детектировать, используя хорошо известные специалистам методики.
Более конкретно, можно использовать способ ELISA, в котором лунки микротитровального планшета покрыты MenB эпитопом или миметиком настоящего изобретения. Биологический образец, который содержит (или предполагают, что он содержит) молекулы анти-MenB иммуноглобулина, добавляют затем в лунки с нанесенным покрытием. После периода инкубирования, которого достаточно, чтобы обеспечить связывание антител с иммобилизованными молекулами, планшет (планшеты) промывают для удаления несвязанных фрагментов и добавляют детектируемо меченные вторичные связывающие молекулы. Вторичные связывающие молекулы оставляют реагировать с любыми захваченными образцом антителами, планшеты промывают и присутствие вторичных связывающих молекул детектируют, используя методы, которые хорошо известны специалистам.
Так, в одном конкретном варианте присутствие связанных MenB лигандов из биологического образца можно легко определить, используя вторичный связующий агент, включающий антитела, направленные против лигандов антител. Специалистам известно множеств молекул анти-бычьего иммуноглобулина (Ig), которые можно легко конъюгировать с детектируемыми ферментными метками, такими как пероксидаза хрена, щелочная фосфатаза или уреаза, используя способы, которые хорошо известны специалистам. Затем используют подходящий ферментный субстрат для создания детектируемого сигнала. В других родственных вариантах можно использовать ELISA методики конкурентного типа, используя способы, которые хорошо известны специалистам.
Анализы можно также вести в растворе, таким образом, чтобы MenB эпитопы или миметики и антитела, специфические для этих молекул, образовывали комплексы в условиях осаждения. В одном конкретном варианте молекулы можно прикрепить к частицам твердой фазы (например, на агарозные шарики или т.п.), используя известные специалистам методики присоединения, такие как непосредственное химическое или косвенное присоединение. Затем частицы с нанесенным покрытием подвергают контактированию в подходящих для связывания условиях с биологическим образцом, который, как предполагают, содержит антитела к MenB. Сшивка между связанными антителами вызывает образование агрегатов, состоящих из комплексов частица-эпитоп или миметик-антитело, которые можно осадить и выделить из образца, используя промывку и/или центрифугирование. Реакционную смесь можно анализировать для определения присутствия или отсутствия комплексов, используя любой из многочисленных стандартных способов, таких как указанные выше способы иммунодиагностики.
В еще одном варианте можно пролучить иммуноафинную матрицу, где поликлональную популяцию антител биологического образца, который, как предполагают, содержит MenB антитела, иммобилизуют на субстрате. В таком случае начальную афинную очистку образца можно осуществить, используя иммобилизованные антигены. Полученный препарат образца будет содержать при этом только анти-MenB фрагменты, что позволяет избежать свойств потенциального неспецифического связывания у афинного носителя. Специалистам известны многие способы иммобилизации иммуноглобулинов (либо интактных, либо в виде специфических фрагментов) с высоким выходом и хорошими характеристиками сохранения связывающей антиген активности. Не будучи ограничены каким-либо конкретным методом, иммобилизованный белок А или белок G можно использовать для иммобилизации иммуноглобулинов.
Соответственно после того как молекулы иммуноглобулина иммобилизованы для получения иммуноафинной матрицы, осуществляют контактирование меченых молекул со связанными антителами в подходящих для связывания условиях. Затем все несвязанные специфически MenB эпитопы или миметики смывают с иммуноафинной подложки, и присутствие связанного антигена можно определить, оценивая присутствие метки, используя известные специалистам способы.
Вышеописанные аналитические реагенты, включая GNA33 полипептиды и/или пептиды настоящего изобретения или антитела к ним, можно представить в виде наборов с соответствующими инструкциями и другими необходимыми реагентами для проведения иммуноанализов, как указано выше. Набор может также содержать в зависимости от конкретного используемого иммуноанализа соответствующие метки и другие упаковки реагентов и материалов (т.е. промывочные буферы и т.п.). Используя эти наборы, можно проводить стандартные иммуноанализы.
Кроме того, GNA33 полипептиды, молекулярные миметики и антитела можно использовать также для профилактики MenB заболевания у млекопитающих. Более конкретно, вакцинные композиции, содержащие эти молекулы, можно использовать для профилактики MenB заболеваний у вакцинированных субъектов. Вакцины можно вводить в сочетании с другими антигенами и иммунорегулирующими агентами, например иммуноглобулинами, цитокинами, лимфокинами и хемокиинами, включая (но ими не ограничиваясь) IL-2, модифицированные IL-2 (Cys 125 - Ser 125), GM-CSF, IL-12, γ-интерферон, IP-10, MIPlb и RANTES.
Вакцины обычно включают один или более "фармацевтически приемлемых эксципиентов", таких как вода, физиологический раствор, глицерин, этанол и т.д. Кроме того, в таких носителях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, рН буферирующие вещества и т.п.
Адъюванты можно также использовать для повышения эффективности вакцины. Адъюванты можно добавлять непосредственно в вакцинные композиции или их можно вводить отдельно, либо совместно, либо вскоре после введения вакцины. Такие адъюванты включают (но этим не ограничиваются): (1) соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.д.; (2) формы эмульсий типа масло-в-воде (с добавлением или без добавления специфических иммуностимулирующих агентов, таких как мурамил пептиды (см. далее), или компоненты бактериальных клеток), такие как, например (a) MF59 (международная публикация WO 90/14837; Chapter 10 in Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995), содержащая 5% сквалена, 0,5% TWEEN 80ТМ, и 0,5% SPAN 85ТМ (необязательно содержащая различные количества MTP-PE (см. далее), хотя и не требуется), приготовленная в виде субмикронных частиц с использованием микрофлюидизатора, такого как Model 110Y microfluidizer (Microfluidics, Newton, MA), (b) SAF, содержащий 10% сквалена, 0,4% TWEEN 80ТМ, 5% плуроник-блок полимера L121, и thr-MDP либо микрофлюидизированный в субмикронной эиульсии, либо обработанный в центрифуге для получения эмульсии более крупных частиц, и (c) система адъюванта RIBIТМ (RAS), (Ribi Immunochem, Hamilton, MT), содержащая 2% сквалена, 0,2% TWEEN 80ТМ, и один или более компонентов стенок бактериальных клеток из группы, состоящей из монофосфориллипида А, (MPL) трегалоз димиколата (TDM) и скелета клеточных стенок (CWS), предпочтительно MPL+CWS(DETOXTM); (3) адъювантов сапонина, таких как QS21 или STIMULONTM (Cambridge Bioscience, Worcester, MA), можно использовать или полученные из него частицы, такие как ISCOM (иммуностимулирующие комплексы), причем ISCOM могут не содержать дополнительного детергента, (см. например, международную публикацию WO 00/07621; (4) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (5) цитокины, такие как интерлейкины (IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (международная публикация WO 99/44636), и т.д.), интерфероны (например, гамма-интерферон), колониестимулирующий фактор макрофагов (M-CSF), фактор некроза опухоли (TNF), и т.д..; (6) детоксифицированные мутанты бактериального ADP-рибосилирующего токсина, такие как холерный токсин (CT), токсин коклюша (PT), или E.coli термолабильный токсин (LT), в частности LT-K63 (в котором лизин замещает аминокислоту дикого типа в положении 63) LT-R72 (в котором аргинин замещает аминокислоту дикого типа в положении 72), CT-S109 (в котором серин замещает аминокислоту дикого типа в положении 109), и PT-K9/G129 (в котором лизин замещает аминокислоту дикого типа в положении 9, а глицин замещает в положении 129) (см. например, международные публикации WO93/13202 и WO92/19265); (7) MPL или 3-O-деацилированный MPL (3dMPL) (см. например, GB 2220221), EP-A-0689454, необязательно практически в отсутствие квасцов, если его используют с пневмококковыми сахаридами (см. например, международную публикацию WO 00/56358); (8) комбинации 3dMPL с, например, QS21 и/или эмульсиями типа масло-в-воде (см. например, EP-A-0835318, EP-A-0735898, EP-A-0761231; (9) олигонуклеотиды, включающие CpG мотивы (см. например, Roman et al. (1997) Nat. Med. 3:849-854; Weiner et al. (1997) Proc. Natl. Acad. Sci. USA 94:10833-10837; Davis et al. (1998) J. Immunol 160:870-876; Chu et al. (1997); Exp. Med. 186:1623-1631; Lipford et al. (1997) Eur. J. Immunol. 27:2340-2344; Moldoveanu et al. (1988) Vaccine 16:1216-1224; Krieg et al. (1995) Nature 374:546-549; Klinman et al.(1996) Proc. Natl. Acad. Sci. USA 93:2879-2883; Ballas et al. (1996) J. Immunol 157:1840-1845; Cowdery et al. (1996) J. Immunol 156:4570-4575; Halpern et al. (1996) Cell Immunol 167:72-78; Yamamoto et al. (1988) Jpn, J. Cancer Res. 79:866-873; Stacey et al. (1996) J. Immunol. 157:2116-2122; Messina et al. (1991) J. Immunol. 147:1759-1764; Yi et al. (1996) J. Immunol. 152:4918-4925; Yi et al. (1996) J. Immunol. 157:5394-5402; Yi et al. (1998) J. Immunol. 160:4755-4761; Yi et al.(1998) J. Immunol. 160:5898-5906; международные публикации WO 96/02555, WO 98/16247, WO 98/18810, WO 98/40100, WO 98/55495, WO 98/37919 и WO 98/52581), такие, как те, которые содержатся, по крайней мере, на CG динуклеотиде, причем цитозин необязательно замещен 5-метилцитозином; (10) полиоксиэтиленовый эфир или сложный эфир полиоксиэтилена (см. например, международную публикацию WO 99/52549); (11) поверхностно активный агент сложный эфир полиоксиэтиленсорбитана в комбинации с октоксинолом (см. например, международную публикацию № WO 01/21207) поверхностно-активный агент простого или сложного алкилового эфира полиоксиэтилена в комбинации с, по крайней мере, одним дополнительным неионным поверхностно активным агентом, таким как октоксинол (см. например, международную публикацию № WO 01/21152); (12) сапонин и иммуностимуляторный олигонуклеотид, такой как CpG олигонуклеотид (см. например, международную публикацию № WO 00/62800); (13) иммуностимулятор и частицы соли металла (см. например, международную публикацию № WO 00/23105); и (14) другие вещества, которые действуют как иммуностимулирующие агенты, для повышения эффективности композиции.
Мурамил пептиды включают (но этим не ограничиваются) N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), -ацетил-нормурамил-L-аланил-D-изоглутам (nor-MDP), -ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE), и т.д.
Для повышения эффективности композиции может оказаться необходимым конъюгировать активный агент с молекулой-носителем. Такие молекулы-носители сами не должны индуцировать выработку вредных антител. Подходящими носителями являются обычно крупные макромолекулы с медленным метаболизмом, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, агрегаты липидов (такие как капельки масла или липосомы), частицы инактивированных вирусов, CRM197 (нетоксичный мутант дифтерийного токсина), и т.п. Такие носители хорошо известны специалистам.
Обычно вакцинные композиции приготавливают в виде препаратов для инъекций либо в виде жидких растворов, либо в виде суспензий; в виде твердых форм, пригодных для приготовления растворов или суспензий в жидких носителях перед введением инъекцией. Такие препараты можно также эмульгировать или инкапсулировать в липосомы или адсорбировать на частицах для усиленного эффекта адъюванта, как обсуждалось выше.
Вакцины должны содержать эффективное количество активного агента, такого как GNA33 полипептид или антитело против него, и при необходимости любые другие вышеуказанные компоненты. Под "эффективным количеством" подразумевают количество молекул, которое вызовет иммунологическую реакцию у индивидуума, которому его введут. Такая реакция обычно приводит к развитию у субъекта секреторной, клеточной и/или опосредствованной антителами иммунной реакции на вакцину. Обычно такая реакция включает один или более из следующих эффектов: продуцирование антител любого иммунологического класса, таких как иммуноглобулины A, D, E, G или M; пролиферацию B и T лимфоцитов; выработку сигналов активации, роста и дифференциации иммунологических клеток; усиление действия популяций Т-хелперов, Т-супрессоров и/или цитотоксичных Т клеток и/или gd T клеток.
После приготовления вакцины обычно вводят парэнтерально, например, в виде инъекций, либо подкожно, либо внутримышечно. Дополнительные формы, пригодные для других способов введения, включают формы для перорального приема и для легочного введения, суппозитории и трансдермальные введения. Лечебные дозы могут вводиться в виде единичной дозы или в виде множественных доз по схеме.
III Экспериментальная часть
Далее приводятся конкретные варианты осуществления настоящего изобретения. Эти примеры представлены только в качестве иллюстрации, и никоим образом не ограничивают объем настоящего изобретения.
Были предприняты попытки обеспечить точность определения использованных величин (например, количеств, температур, и т.д.), но естественно следует учитывать некоторые экспериментальные ошибки и отклонения.
МАТЕРИАЛЫ И СПОСОБЫ
Штаммы бактерий
Штаммы N.meningitidis серогруппы B, включенные в настоящее исследование, были выделены у пациентов с менингококковым заболеванием, проживающих в различны странах, и собирались в течение более 36 лет. 21 штамм были штаммами серогруппы B, и один штамм относился к серогруппе С. Эти штаммы приведены в таблице 1. По данным электрофоретического типирования (ET), эта коллекция представляет широкий круг генетического разнообразия MenB штаммов, вызывающих заболевание.
Мутанты штаммов MC58, BZ232 и NMB (MC58ΔGNA33, BZ232ΔGNA33, и NMBΔGNA33 соответственно), в которых была осуществлена делеция гена gna33, и он был заменен путем аллельного обмена антибиотической кассетой, были получены в результате трансформации исходного штамма плазмидой pBSUD33ERM. Эта плазмида содержит выше- и нижерасположенные фланкирующие ген участки для аллельного обмена, и ermC ген (устойчивость к эритромицину). Вкратце, вышерасположенный фланкирующий участок (включая стартовый кодон) с -867 до +75 и нижерасположенный фланкирующий участок (включая стоп кодон) с +1268 до +1744, были амплифицированы из MC58, с использованием следующих праймеров:
U33 FOR 5'-GCTCTAGAGATGAGTCGAACACAATGAACAATGTCCTGA-3' (SEQ ID NO:26);
U33REV 5>-TCCCCCGGGCTCTTGCTTTGGCAGGCGGCGA-3' (SEQ ID NO:27);
D33FOR 5'-TCCCCCGGGCACGGGATATGTGTGGC-3' (SEQ ID NO:28),
D33REV 5'-CCCGCTCGAGAGTAGGGACAACCGG-3' (SEQ ID NO:29).
Фрагменты были клонированы в pBluescript (Stratgene, Milan, Italy) и трансформированы в E.coli DH5, с использованием стандартных методик (Sambrook and Russel, Molecular Cloning: A Laboratory Manual (2001)). После завершения всех клонирований природные компетентные штаммы Neisseria MC58, BZ232 и NMB были трансформированы путем отбора нескольких колоний, выращенных на шоколадных агаровых пластинах (Remel, Laztakas, KA), и смешивания их с 20 мкл 10 мМ Tris-HCl pH 6,5 содержащего 1 мкг плазмидной ДНК. Смесь нанесли на шоколадные агаровые планшеты, инкубировали в течение 6 часов при 37°C, 5% CO2, затем разбавили в PBS и нанесли на шоколадные агаровые планшеты, содержащие 7 мкг/мл эритромицина. Отсутствие гена gna33 в геноме устойчивых к эритромицину колоний для каждого из трех штаммов было подтверждено с помощью ПЦР с использованием следующих праймеров:
F33 5'-GCTCTAGAGGGCGACGACAGGCGG-3' (SEQ ID NO:30) и
R33 5'-CCCGCTCGAGTTACGGGCGGTATTCGG-3' (SEQ ID NO:31).
Эти праймеры соответствуют 5'-смысловой и 3'-антисмысовой цепочкам соответственно гена gna33. Отсутствие GNA33 экспрессии было подтверждено с помощью Вестернблоттинга, как раскрыто далее.
Реагенты моноклональных антител (mAb)
Антитела, которые были использованы в проточной цитометрии, бактерицидных экспериментах и в экспериментах по защите in vivo включают следующие: менингококк Por A P1.2-специфически субтипирующий mAb (MN16C13F4, подкласс IgG2a), полученный от Rijksinstituut Voor Volksgezondheid en Mileu, Bilthoven, The Netherlands, или от Wendell Zollinger, Walter Reed Army Institute of Research, Washington DC); анти-полисахаридные mAb, специфические в отношении инкапсулированных серогруппы B, SEAM 12 и SEAM 3 (Granoff et al., J. Immunol (1998) 160:5028-5036), подкласс IgG2a), и серогруппы C (mAb 181.1 (Garcia-Ojeda et al., Infect. Immun. (2000) 68:239-246, подкласс IgG3). MAb 181.1 было предоставлено Kathryn Stein, U.S. Food and Drug Administration. В качестве негативного контроля использовали мышиные IgG mAb (VIG10) иррелевантной специфичности или мышиную поликлональную антисыворотку, полученную против E.coli белков из штамма, который использовали для экспрессии K3NA33.
Экспрессия и выделение GNA33
gna33 OPF амплифицируют, используя ПЦР на хромосомной ДНК штамма 2996 (P.van der Ley and J. T. Poolman, Infect. Immun. (1992) 60:3156,1992), используя в качестве праймеров синтетические олигонуклеотиды. Амплифицированный ДНК фрагмент клонируют в вектор pET-21b+ (Novagen, Madison, WI) для экспрессии белка в виде меченого His (HT-GNA33), или в виде растворимого белка без сигнала и последовательностей липидной модификации (K5NA33). Экспрессию рекомбинантного белка оценивают, используя электрофорез в SDS-полиакриламидном геле, который осуществляют в соответствии с описанием. His-меченый белок очищают с помощью афинной хроматографии на Ni2+ - конъюгированной хелатирующей в быстром потоке сефарозы (Amersham-Pharmacia Biotech, Uppsala, Sweden), и форму без метки очищают, с помощью FPLC, используя моно S ионообменную смолу (Amersham-Pharmacia).
Получение поликлональной анти-GNA33 антисыворотки
Для получения антисыворотки против GNA33 20 мкг очищенного HT-GNA33 или rGNA33 без метки используют для иммунизации шестинедельных самок мышей штамма CDI (от четырех до десяти мышей в группе). Мыши поступили от Charles River (Italia S.P.A., Calco, Italy, или Hollister, California). Рекомбинантный белок вводили внутрибрюшинно вместе с полным адъювантом Фрейнда (CFA) для первой дозы и с неполным адъювантом Фрейнда (IFA) для второй (день 21) и третьей (день 35) бустерных доз. Образцы крови отбирали на 34 и 49 день.
Получение моноклональных антител
Четырех- шестинедельных самок мышей штамма GDI иммунизовали, как указано выше, за исключением того, что третью дозу вводили без адъюванта. Три дня спустя мышей умерщвляли и клетки их селезенок гибридизовали с миеломными клетками P3X63-Ag8.653 в соотношении 5 клеток селезенки к 1 миеломной клетке. После двухнедельного инкубирования в HAT селективной среде, надосадочные гибридомные жидкости скринировали на активность связывания антител с помощью EL1SA, осуществляемого на микротитровальных планшетах, на которые нанесен некапсулированный N.meningitidis штамм, M7 (Stephens et al., Infect. Immun. (1991) 59:4097-4102), который был инактивирован в результате обработки 0,025% параформальдегидом. Гибридомы, секретирующие GNA33-специфическое антитело, дважды клонируют, используя лимитирующее разведение, а затем размножают и замораживают для последующего использования в культуре тканей или для получения асцитов в BALB/c мышах.
Подклассы моноклональных антител определяют, используя набор для изотипирования моноклональных антител (Amersham-Pharmacia.). Среди отобранных mAb, одно IgG2a анти-GNA33mAb, обозначенное mAb 25, было использовано во всех описанных далее исследованиях связывания и функциональной активности. Моноклональное антитело выделяют из мышиных асцитов, используя афинные колонки Hi-Trap (Amersham-Pharmacia), и затем после исчерпывающего диализа в PBS буфере определяют концентрацию очищенного mAb, используя модифицированный способ Lowry, используя BSA в качестве стандарта (DC, Bio-Rad, Rome, Italy). Специфичность связывания для mAb определяли Вестернблоттингом с использованием мембранных белков, полученных из штаммов MC58, BZ232 и NMB, и их соответствующие GNA33 нокауты (MC58ΔGNA33, BZ232ΔGNA33 and NMBΔGNA33; см. далее).
Связывание антисыворотки с поверхностью живых инкапсулированных менингококков
Способность поликлональной анти-GNA33 антисыворотки и mAb связываться с поверхностью живых NmB штаммов была определена с помощью косвенного флуоресцентного анализа и проточного цитометрического детектирования, осуществленного, как было раскрыто ранее (Moe et al., Infect. Immun.(1999) 67:5664-5675). Фиг.1A демонстрирует связывание поликлональной анти-rGNA33 антисыворотки с четырьмя репрезентативными штаммами NmB, исходным штаммом, 2996 (P1.5,2), и тремя другими штаммами M3735, (P1.5,2), M4207 (P1.5) и MC58 (P1.7,16). Анти-GNA33 поликлональная антисыворотка реагирует только со штаммами 2996 и M3735. Антикапсулярное позитивное контрольное mAb связывается со всеми четырьмя штаммами, тогда как негативная контрольная антисыворотка, полученная из животных, иммунизованных E.coli белками, демонстрирует только фоновое связывание. На ФИГ.1B представлены результаты аналогичных экспериментов по измерению связывания анти-GNA33 mAb с поверхностью бактериальных клеток трех штаммов (M3735 [P1.5,2], M4207 [P1.5] и MC58 [P1.7,16]). mAb связывается только со штаммом M3735 (P1.5,2).
В таблице 1 суммированы результаты экспериментов проточной цитометрии по измерению способности анти-GNA33 антисыворотки или mAb связываться с поверхностями живых бактерий из 22 генетически различных инкапсулированных менингококковых штаммов (21 серогруппы B и 1 серогруппы C). Анти-GNA33 антитело связывается только со штаммами с сероподтипами P1.5,2 или P1.2 (9 из 9 по сравнению с 0 из 13 штаммов с другими PorA сероподтипами; P<0,001). Один из девяти позитивных штаммов, M986, демонстрирует более низкую величину связывания по сравнению с остальными восемью штаммами (см. ниже). Не наблюдается связывания с тремя штаммами (M4207, 1000, и BZ83), которые экспрессируют эпитоп, присутствующий на петле 1 PorA, но не P1.2 эпитоп (петля 4). Кроме того, не наблюдается связывания со штаммом M136, который не экспрессирует PorA (т.е. P1-). Эти результаты показывают, что связывание анти-GNA33 антитела с бактериальной поверхностью коррелирует с экспрессией PorA сероподтипа P1,2.
Комплемент-зависимая бактерицидная активность антител
Бактерицидную активность измеряют, как раскрыто ранее (Moe et al., Infect. Immun. (2001) 69:3762-3771). Если нет других указаний, источником комплемента была сыворотка здорового взрослого человека (MAS), в которой по данным ELISA не детектировались антикапсулярные антитела к полисахаридам серогруппы В или С, и не обнаружена детектируемая врожденная бактерицидная активность против штаммов-мишеней при тестировании при конечных концентрациях сыворотки 20% или 40%. В нескольких описанных далее экспериментах бактерицидную активность измеряли, используя сыворотку от пациента с нелеченой α-γ-глобулинэмией (Steele et al., Infect. Immun. (1984) 44:452-458), сыворотку крольченка или сыворотку взрослой крысы в качестве комплемента.
Защита животных
Способность анти-GNA33 антител обеспечивать пассивную защиту против бактерэмии N.meningitidis серогруппы B тестируют у детенышей крыс, зараженных внутрибрюшинно. Анализ осуществляют, как было раскрыто ранее (Moe et al., Infect. Immun. (1999) 67:5664-5675). Вкратце, на утро заражения колонии собирают, инокулируют в культуральном бульоне и выращивают и подготавливают, как указано выше для бактерицидного анализа. Для штамма M986 для максимизации чувствительности животным вводят внутрибрюшинными инъекциями в момент времени 0 100 мкл различных разбавлений тестируемой или контрольной антисыворотки, смешанной с примерно 5×103 зараженного MenB тестового штамма. В экспериментах с другими тестовыми штаммами антитело вводят внутрибрюшинно в момент времени 0, а заражение бактериями осуществляют внутрибрюшинно два часа спустя. В качестве позитивного контроля антикапсулярных mAb используют SEAM 3. Образцы крови отбирают через 18 часов после заражения путем кардиопунктуры, причем игла и шприц содержат примерно 10 мкл гепарина без консерванта (1000 Ед/мл; Fujisawa USA, Deerfield, IL). Аликвоты по 1, 10 и 100 мкл крови помещают на шоколадный агар. CPU на мл крови определяют после инкубирования планшетов в течение ночи при 37°C в 5% CO2. Для расчета среднего геометрического CFR/мл животным со стерильными культурами приписывают значение 1 CFR/мл.
SDS-PAGE и Вестернблоттинг
Полные клеточные экстракты менингококковых штаммов получают следующим образом. Отдельные колонии выращивают в 7 мл бульона Mueller-Hinton (Difco, Detroit, MI), дополненного 0,25% глюкозой до значения А620нм 0,5-0,7. Бактерии собирают центрифугированием при 5000 g в течение 15 минут и снова суспендируют в PBS. После цикла замораживание - оттаивание суспензию бактерий смешивают с образцовым буфером (0,06 M Tris-HCl, pH 6,8, 10% (об./об.) глицерина, 2% (вес./об.) SDS, 5% (об./об.) 2-меркаптоэтанола) и кипятят в течение 10 минут. Очищенные белки (0,5 мкг/полосу), или полные клеточные экстракты (25 мкг), полученные из менингококковых штаммов, помещают на 12,5% SDS-полиакриламидные гели (Laemmli, U.K, Nature (1970) 227:680-685), и переносят на нитроцеллюлозную мембрану (Towbin et al., Proc. Natl Acad. Sci (1979) 76:4350-4354). Перенос осуществляют в течение 2 часов при 150 мА при 4°C, используя буфер для переноса (0,3% Tris основного, 1,44% глицина, 20% (об./об.) метанола). Нитроцеллюлозную мембрану насыщают, используя инкубирование в течение ночи при 4°C в насыщающем буфере (10% снятое молоко, 0,1% Triton X100 в PBS). Мембрану дважды промывают промывочным буфером (3% снятое молоко, 0,1% Triton X100 в PBS), и инкубируют в течение 2 часов при 37°C с мышиной антисывороткой, разбавленной 1:200 в промывочном буфере, mAb 25 в конечной концентрации 6 мкг/мл, или 1:100 разбавлением анти-Por A P1.2 mAb с последующим 1:2000 разбавлением пероксидазы хрена, меченной анти-мышиным Ig (Dako, Glostrup, Denmark). Мембрану дважды промывают 0,1% Triton X100 в PBS и проявляют, используя набор Opti-4CN Substrate Kit (Bio-Rad). Реакцию останавливают, добавляя воду.
Пептидный спот-синтез
Пептидный спот-синтез осуществляют на амино-PEG-целлюлозных мембранах (ABIMED, Langerfeld, Germany), используя модель ASP 222 автоматического спот-синтезатора (ABIMED) и активацию смесью диизопропилкарбодиимид (DIC)/N-гидроксибензотриазол (HOBt) (Frank and Overwin, Methods Mol. Biol. (1996) 66:149-169). Для реакции присоединения используют in situ-приготовленные 0,2 M HOBt сложные эфиры производных фторенилметоксикарбонила (Fmoc)-аминокислоты. Свободные аминофункции на пятнах обрабатывают раствором бромфенола синего в диметилформамиде, что приводит к окрашиванию в синий цвет, обеспечивая визуальный контроль за всеми стадиями синтеза. После финального цикла все пептиды ацетилируют по N-концу 2% уксусным ангидридом. В конце синтеза удаляют защитные группы боковых цепей, используя смесь трифторуксусная кислота/триизобутилсилан/вода/дихлорметан (50/3/2/45).
Анализ пептидного связывания
Связанные на целлюлозе пептиды замачивают в этаноле, чтобы предотвратить гидрофобные взаимодействия между пептидами. Неспецифическое связывание блокируют, инкубируя пластины целлюлозы в течение ночи при 4°C с 10 мл 2% казеина в Tris забуференном солевом растворе (TBS: 50 мМ Tris-HCl, 137 мМ NaCl, 27 мМ KCl, pH 7,0), содержащем 0,05% Tween 20 (T-TBS). Пластины инкубируют в течение 2 часов при 37°C с анти-GNA33 mAb 25 (6 мкг/мл), или анти-PorA 1.2 mAb в разведении 1:100 в T-TBS блокирующем буфере. Затем добавляют козий анти-мышиный IgG, конъюгированный со щелочной фосфатазой (BioRad) в разведении 1:3000 в T-TBS блокирующем буфере в течение 1 часа при 37°C. Пластины трижды промывают T-TBS, и детектируют связывание, инкубируя пластины с бром-4-хлор-3-индолилфосфатом (BCIP) (Sigma, Steinheim, Germany) и 3-(4,5-диметилтиазол-2-ил)-2,5 дифенилтетразолий бромидом (MTT; Sigma) в субстратном буфере (100 мМ Tris, pH 8,9, 100 мМ NaCl, 2 мМ MgCl2). Количественную оценку сигнала получают, используя оптический сканнер Umax Speedy II 2200.
Пример 1
Связывание анти-GNA33 антител с поверхностью бактериальных клеток по данным косвенной флуоресцентной проточной цитометрии
CD1 мышей иммунизуют rGNA33 (кодируемого геном штамма 2996). Полученную поликлональную антисыворотку, содержащую антитело, тестируют в отношении способности связываться с живыми бактериальными клетками различных MenB штаммов по данным проточного цитометрического детектирования в косвенном иммунофлуоресцентном анализе связывания. ФИГ.1A демонстрирует связывание поликлональной анти-rGNA33 антисывороткм с четырьмя репрезентативными MenB штаммами, исходным штаммом 2996 (P1.5,2), и тремя другими штаммами M3735 (P1.5,2), M4207 (P1.5) и MC58 (P1.7,16). Анти-GNA33 поликлональная антисыворотка реагирует только со штаммами 2996 и M3735. Антикапсулярное (позитивный контроль) mAb связывается со всеми четырьмя штаммами, тогда как антисыворотка негативного контроля, полученная из животных, иммунизованных белками E.coli, демонстрирует только фоновое связывание. ФИГ 1А демонстрирует результаты аналогичных экспериментов по измерению связывания анти-GNA33 mAb 25 с поверхностью бактериальных клеток трех штаммов (M3735 (P1.5,2), M4207 (P1.5) и MC58 (P1.7,16). mAb связывается только со штаммом M3735 (P1.5,2).
В таблице 1 суммированы результаты экспериментов проточной цитометрии, в которых измеряют способность анти-GNA33 антитела или mAb 25 связываться с поверхностью живых бактерий 22, генетически отличающихся инкапсулированных менингококковых штаммов (21 серогруппы В и 1 серогруппы С). Анти-GNA33 антитело связывается только со штаммами сероподтипов P1.5,2 или P1.2 (9 из 9 по сравнению с 0 из 13 штаммов других PorA сероподтипов; P<0,001). Один из девяти позитивных штаммов, M986, демонстрирует более низкую степень связывания, нежели другие восемь штаммов (см. ниже). Не происходит связывания с тремя штаммами (M4207, 1000, и BZ83), которые экспрессируют P1.5 эпитоп (присутствует на петле 1 PorA, Sacchi et al., Infect. Dis. (2000) 182:1169-1176), но не Р1.2 эпитоп (петля 4). Кроме того, не происходит связывания со штаммом Ml36, который не экспрессирует PorA (т.е. P1-). Эти результаты показывают, что связывание анти-GNA33 антитела с бактериальной поверхностью коррелирует с экспрессией PorA сероподтипа P1.2.
Пример 2
Вестернблоттинг полных мембранных фракций, полученных из различных штаммов N.meningitidis группы B
Очевидная связь между связыванием анти-GNA33 антитела с бактериальной поверхностью и Р1.2 сероподтипом была неожиданной и была исследована далее с использованием Вестернблоттинга полного белка, полученного из репрезентативных штаммов, и SDS-PAGE. Результаты для четырех штаммов серогруппы, двух негативных для связывания с поверхностью анти-GNA33 (по данным проточной цитометрии) NG3/88 (P1.7,1) и MC58 (P1.17,16), и двух позитивных, BZ232 и NMB (оба P1.5,2), представлены на ФИГ.2. Представлены также результаты для полных мембранных препаратов из трех штаммов (MC58, BZ232 и NMB), в которых были инактивированы гены, кодирующие GNA33.
На ФИГ.2A единственная полоса с кажущейся массой примерно 48 кД была детектирована с помощью анти-GNA33 mAb 25 в мембранных препаратах из двух не Р1.2 штаммов, NG3/88 (полоса 3) и MC58 (полоса 4). Полоса имеет кажущуюся молекулярную массу, ожидаемую для rGNA33 (полоса 1), и она отсутствует в полном белке, полученном из контрольного E.coli штамма (полоса 2), и из GNA33 нокаута в штамме MC58 (полоса 5). Полосы 6 и 8 содержат полные белки, полученные из штаммов BZ232 и NMB соответственно. Оба эти штамма относятся к PorA сероподтипу P1.5,2. В каждой из полос имеются две анти-GNA33-реакционные полосы. Полоса с более высоким значением, 48 кД, отсутствует в GNA33 нокаутах, полученных из BZ232 и NMB (полосы 7 и 9 соответственно), и этот результат подтверждает, что этим белком является GNA33. Полосы с более низкой молекулярной массой, оказалось, что анти-GNA33-реактивные полосы являются PorA на основании реакционноспособности с mAb, реактивным с P1.2 (см. ФИГ.2В).
ФИГ.2В представляет Вестернблоттинг тех же образцов белка, что и на ФИГ.2А, но с использованием анти-PorA P1.2 mAb в качестве первичного детектирующего антитела, как и ожидалось, реактивности анти-PorA mAb с rGNA33 (полоса 1) с негативным контролем E.coli белками (полоса 2) или с полными мембранами, полученными из штаммов, которые не экспрессируют PorA P1.2 (полосы 3, 4 и 5), не наблюдалось. Однако белок с кажущейся массой, ожидаемой для PorA, детектируется в полных мембранных препаратах штаммов BZ232 (полоса 6), BZ232ΔGNA33 (полоса 7), NMB (полоса 8) и NMBΔGNA33 (полоса 9), которые экспрессируют PorA P1.2. Этот белок присутствует также в препаратах из их соответствующих GNA33 нокаутов (полосы 7 и 9 соответственно). Эти результаты подтверждают, что белок с кажущейся массой 41 кД, реагирующий с анти-GNA33 mAb, на ФИГ.2A является PorA. Напротив, анти-PorA P1.2 mAb по данным Вестернблоттинга не реагирует с GNA33.
Пример 3
Пептидное картирование экспонированного на поверхности PorA эпитопа, распознаваемого анти-GNA33 mAb
Известно, что анти-P1.2 mAb распознает эпитоп на PorA, представленный на петле 4. В таблице 2 представлено сравнение аминокислотных последовательностей вариабельного участка петли 4 (VR2) для выбранных MenB штаммов, включенных в настоящее исследование (см. Sacchi et al., Infect. Dis. (2000) 182:1169-1176, или http://mlst.zoo.ox.ac.uk/Meningococcus для недавно пересмотренных PorA VR обозначений). В таблицу 2 включены последовательности двух близко родственных VR2 типов, P1.10 и P1.10-1 из BZ83 (P1.10) и M4207 (P1.10-1) соответственно, которые оказались негативными в отношении поверхностного связывания с анти-GNA33 mAb. Последовательности петли 4 двух негативных штаммов отличаются от анти-GNA33 позитивных штаммов пептидом из шести аминокислот. Позитивные P1.2 штаммы содержат гексапептид QTPKSQ (SEQ ID NO:16) или QTPQSQ (SEQ ID NO:17), тогда как негативные P1.10 или P1.10-1 штаммы содержат гексапептид NKQNQR (SEQ ID NO:18) или NKQNQP (SEQ ID NO:19) соответственно (таблица 2).
В частности, для идентификации специфической аминокислотной последовательности, распознаваемой анти-GNA33 mAb 25, были синтезированы перекрывающиеся линейные декапептиды, включающие все аминокислотные последовательности GNA33 (таблица 3), и петлю 4 PorA (Р1.2-2 из штамма 2996), регистрационный номер в GenBank X57180 [примечание: последовательность, представленная как Х57180, кодирует VR2 с последовательностью QTPE (SEQ ID NO:20). Однако впоследствии было обнаружено, что эта последовательность ошибочна (C. T. Sacchi, CDC, Atlanta, GA, персональное сообщение). Правильной последовательностью является QTPQ (SEQ ID NO:21)]. Пептиды, которые были позитивны (≥ окрашенных единиц) в отношении mAb 25, подробно представлены в таблице 3. Все восемь позитивных GNA33 пептидов содержат трипептид, QTP. QTP последовательность всегда присутствует во всех пяти позитивных PorA P1.2 пептидах, которые реагируют с mAb 25. Однако QTP последовательности недостаточно для анти-GNA33 связывания, так как не наблюдается связывания mAb с тремя петлями 4 пептидов, которые содержат QTP, но в которых отсутствует предшествующая FVQ последовательность.
Для определения минимальной пептидной последовательности для каждого из белков, которой достаточно для анти-GNA mAb 25 связывания, были синтезированы прогрессивно уменьшающиеся пептиды, начиная с AQAFQTPVHS (ФИГ.4A; SEQ ID NO:6), и PorA P1.2 пептиды, начиная с TPAHFVQQTP (ФИГ.4B; SEQ ID NO:22). mAb связывается сильно с GNA33 пептидами, содержащими FQTPV (SEQ ID NO:2), и PorA P1.2 пептидами, содержащими FVQQTP (SEQ ID NO:23), но не с каким-либо из меньших пептидов. Те же самые минимальные эпитопы для каждого из белков были идентифицированы в результате систематических замещений аминокислотами аланином или глицином, содержащимися в родственных пептидах петли 4 PorA и GNA33. См. таблицу 4, в которой суммированы результаты замещения аланином для PorA петли 4 VR типа P1.2-2.
Эти результаты позволяют предположить, что антитела, выработку которых вызывает rGNA33, обладают бактерицидной активностью против Nm штаммов, экспрессирующих P1.2 эпитоп в результате перекрестной реактивности с P1.2 эпитопом PorA, который содержит последовательность QTP.
Пример 4
Сравнительное связывание анти-GNA33 и анти-PorA P1.2 антител с P1.2 NmB штаммами
Неожиданное обнаружение того факта, что анти-rGNA33 антитела перекрестно реагируют с PorA P1.2 эпитопом, предоставило возможность сравнить активность антитела, вырабатываемого на rGNA33, с активностью, проявляемой PorA сероподтипа P1.2. За одним исключением зависящее от концентрации связывание анти-GNA33 mAb было аналогично связыванию контрольных анти-PorA P1.2 mAb для девяти P1.2 тестированных штаммов (см. репрезентативные данные для штаммов 8047 и BZ232 на ФИГ.5А). Исключение, штамм М986, демонстрирует относительно более слабое связывание анти-GNA33 антитела при сравнении со связыванием с другими P1.2 штаммами (ФИГ.5B). Напротив, связывание за счет анти-PorA P1.2 mAb было аналогично для всех P1.2 штаммов, включая M986.
Тип VR2 последовательности штамма M986, как сообщают, является P1.2 (GenBank регистрационный номер U92912), что определено за счет последовательности петли 4, которая включает сегмент FVQQTPK (SEQ ID NO:24), в противоположность FVQQTPQ (SEQ ID NO:25) для штаммов 8047 и BZ232 (тип VR2 P1.2-2; таблица 1). Тип VR2 основан на аминокислотной последовательности конкретного P1.2 эпитопа. Два других штамма, как сообщается, содержат VR2 последовательность типа P1.2 (штаммы M3735 и M5682), демонстрирующую сильное связывание анти-GNA33 антитела, которое в каждом штамме было сопоставимо с соответствующим связыванием контрольного анти-PorA P1.2 mAb (см. например, данные по связыванию со штаммом M3735, ФИГ.1A и M5682, ФИГ.5B). При вторичном нуклеотидном секвенировании было подтверждено, что тип VR2 последовательности PorA петли 4 в M986, M3735, и M5682 является P1.2. Поэтому различия в последовательностях (K-Q), по-видимому, недостаточно, чтобы объяснить уменьшение анти-GNA33 связывающей активности со штаммом M986.
Пример 5
Бактерицидная активность
Сравнивают комплемент-зависимую бактерицидную активность мышиных mAb в отношении PorA P1.2, rGNA33 (mAb 25) и серогрупп B (SEAM 12) и C (mAb 181.1) полисахаридных капсул. За исключением антикапсулярных mAb серогруппы C (подкласс IgG3), которые используют для обработки NmC штамма M5954, подклассом всех других mAb является IgG2a. BC50 для анти-PorA P1.2 mAb в присутствии человеческого комплемента составляет величину <0,5 мкг/мл для всех девяти штаммов. Соответствующие значения BC50 для антикапсулярных mAb серогруппы B были выше и находились в интервале значений от 5 до 12 мкг/мл и для mAb серогруппы С (штамм M5954) <1 мкг/мл. Как представлено в таблице 5, бактерицидная активность анти-GNA33 mAb вариабельна и зависит от использованного источника комплемента. Для трех из штаммов (8047, NMB и M3735) BC50 величины анти-GNA33 mAb в присутствии человеческого комплемента находились в интервале значений от 7 до 15 мкг/мл. Значения для этих штаммов были аналогичны значениям для антикапсулярного антитела. Для остальных шести штаммов (2996, BZ232, М5545, м5682 и М 986), не наблюдалось гибели для анти-GNA33 mAb в присутствии человеческого комплемента. (BC50 >60 мкг/мл при тестировании с сывороткой от здорового взрослого без эндогенной бактерицидной активности (таблица 5), и >30 мкг/мл при тестировании с сывороткой от пациента с агаммаглобулинемией). Когда в качестве источника комплемента использовали сыворотку крольчонка, все, кроме одного, из шести штаммов оказались восприимчивы к индуцируемому анти-GNA33 лизису. Величины BC50 восприимчивых штаммов находятся в интервале значений ≤кг/мл до 8 мкг/мл (таблица 5). И снова исключение составлял штамм M986, в эксперименте с которым не наблюдалось гибели при использовании анти-GNA33 mAb при тестировании с человеческим или кроличьим комплементом (величины BC50 > 150 и >30 мкг/мл соответственно). Отсутствие бактериолиза для этого штамма может быть связано с низкой величиной поверхностного связывания mAb по данным проточной цитометрии (ФИГ.5B). Соответствующие бактериальные титры поликлональной мышиной анти-rGNA33 антисыворотки с человеческим комплементом против пяти тестированных штаммов соответствовали результатам измерений с анти-GNA33 mAb 25 (таблица 5).
Пример 6
Пассивная защита, обеспечиваемая анти-GNA33 антисывороткой
Определяют способность поликлонального мышиного анти-GNA33 антитела обеспечивать пассивную защиту против MenB бактериемии в моделях с крольчатами. Используют три штамма: 8047 - штамм, восприимчивый к анти-GNA33 бактериолизу в присутствии человеческого или кроличьего комплемента; BZ232 - штамм, устойчивый к анти-GNA33 бактериолизу в присутствии человеческого комплемента, но восприимчивый в присутствии кроличьего ли крысиного комплемента; и M986 - штамм, устойчивый к анти-GNA33 бактериолизу в присутствии человеческого, кроличьего или крысиного комплемента. Результаты тестирования пассивной защиты в этой модели суммированы в таблице 6.
В эксперименте 1 100 мкл 1:5 или 1:25 разбавленной поликлональной мышиной анти-GNA33 антисыворотки, смешанной с 5,8×103 CPU штамма 8047 и введенной внутрибрюшинно, полностью защищают крыс против бактериемии при измерении через 18 часов после заражения. В том же самом эксперименте у всех животных, получивших 100 мкл 1:5 или 1:25 разбавленной анти-GNA33 антисыворотки, смешанной с 6,5×103 CPU штамма M986 - штамма, устойчивого к анти-GNA33 бактериолизу, развилась бактериемия. Несмотря на отсутствие бактерицидной активности среднегеометрические значения CFU/мл крови животных, обработанных анти-GNA антисывороткой и зараженных штаммом М986 были в 10-20 раз ниже, чем значения для контрольных животных, обработанных негативной контрольной антисывороткой, приготовленной против E.coli белков (Р=0,02). Аналогичные результаты были получены во втором эксперименте (эксперимент 2) с анти-GNA33 mAb 25. Все шесть крыс, предварительно обработанные 20 мкг mAb 25 внутрибрюшинно, в момент времени 0 и зараженные 2 часа спустя 3,5×103 CFU штамма М986, имели бактерии в образцах крови, отобранных через 18 часов после заражения. Однако среднегеометрическое значение CFU/мл составляло менее чем 0,3% от контрольных животных, предварительно обработанных иррелевантным mAb (Р<0,02). В том же самом эксперименте 20 мкг на крысу анти-Р1.2 mAb оказались полностью защищающими против штамма М986, и 2 мкг на крысу оказали частичное защитное действие (только у 1 из шести обработанных животных развилась бактериемия).
В третьем и четвертом экспериментах (эксперименты 3 и 4) крыс заражали штаммом BZ232 (устойчивым к анти-GNA33 бактериолизу с человеческим комплементом, но восприимчивым с кроличьим или крысиным комплементом). В этом эксперименте защитная активность анти-GNA33 mAb против этого штамма была аналогичной или более высокой, нежели активность контрольного антикапсулярного антитела, и только немного меньше, чем активность анти-Р1.2 mAb.
Как показано выше, мышиные антитела, продуцируемые в результате иммунизации с использованием rGNA33, способны опосредствовать бактериолиз N.meningitidis штаммов в присутствии комплемента благодаря перекрестной реактивности анти-GNA33 антител с Р1.2 эпитопом белка порина, PorA. Этот результат оказался неожиданным, так как GNA33 и PorA, не обладающие значительной гомологичностью последовательностей, структурно и функционально не родственны и физически расположены в различных бактериальных подструктурах. Следовательно, GNA33 можно определить как иммунологический миметик PorA.
Молекулярная мимикрия, демонстрируемая GNA33, исключительна. Во-первых, GNA33 является неиммуноглобулиновым белком, который, как указано выше, не родственен PorA. Во вторых, rGNA33 вызывает гуморальный ответ, который во многих отношениях аналогичен по функциональной активности реакции, которую вызывает нативный PorA в препаратах внешних мембранных везикул. В третьих, описанная выше поликлональная мышиная анти-rGNA33 антисыворотка была получена в двух независимых лабораториях и данные по бактерицидной активности оказались независимо подтвержденными.
В более ранних исследованиях иммунизация пептидами, соответствующими петле 4 PorA P1.2, не смогла вызвать выработку антител, которые связываются с нативным белком, или опосредствуют бактериолиз в присутствии комплемента (McGuinnes et al., J. Exp. Med. (1990) 171:1871-1872). Предположительно, более мелкие пептидные фрагменты оказались не способны стабильно адоптировать конформации, присутствующие в нативном порине. Аналогично в результате иммунизации с использованием rPorA, экспрессированном в E.coli или B.subtilis, не удается вызвать выработку бактерицидных антител, если конформация эпитопов, доступных на поверхности PorA в рекомбинантном белке, не будет снова восстановлена с использованием липосом или детергентов (Christodoulides et al., Microbiolody (1998) 144:3027-3037 и Idänpään-Heikkila et al., Vaccine (1995) 13:1501-1508. Эти результаты предполагают, что эпитопы на PorA, ответственные за выработку бактерицидных антител, являются конформационными. Напротив, как здесь показано, иммунизация миметиками rGNA33 вызывает выработку бактерицидных антител, которые перекрестно реагируют с Р1.2 эпитопом PorA петли 4. В отличие от rPorA это происходит, когда рекомбинантный GNA33 белок используемый в качестве иммуногена, просто смешивают с адъювантом Фрейнда без необходимости в ренатурирования рекомбинантной молекулы.
Таким образом, раскрыты GNA33 полипептиды, эпитопы, антитела, направленные против них, и использование этих молекул. Из вышеизложенного очевидно, что хотя были описаны конкретные варианты настоящего изобретения с целью иллюстрации, различные модификации могут быть осуществлены не выходя за рамки сути и объема, определяемого прилагаемой формулой изобретения.
ТАБЛИЦЫ
Связывание анти-GNA33 антител с поверхностью живых инкапсулированных N.meningitidis штаммов по данным проточной цитометрии в отношении серологической классификации и PorA VR обозначения
GNA33С
B) Основано на пересмотренной номенклатуре обозначения PorA VR, предложенной Sacchi et al., Infect.Dis.(2000) 182:1169-1176 и http://neisseria.mist.net.
C) Измерено с мышиной поликлональной анти-GNA33 антисывороткой и/или mAb 25.
Связывание анти-GNA33 антитела с клеточной поверхностью различных MenB штаммов
(SEQ ID NO:32)
(SEQ ID NO:33)
(SEQ ID NO:33)
(SEQ ID NO:34)
(SEQ ID NO:34)
Бактерицидная активность анти-GNA33 антител против различных Nm штаммов
В) BC50 величины анти-PorA P1.2 mAb с человеческим комплементом в интервале от 0,25 мкг/мл до 0,5 мкг/мл. ВС50 антикапсулярных mAb (SEAM 12) серогруппы В с человеческим комплементом для восьми штаммов серогруппы В в интервале от 5 мкг/мл до 15 мкг/мл. ВС50 для антикапсулярных mAb серогруппы С (181.1) для штамма М5954 с человеческим комплементом было <1 мкг/мл.
С) ND, не проводили.
Анти-GNA33 антитела пассивно защищают детенышей крыс, зараженных штаммами 8047, М986 и BZ232 N.meningitides серогруппы В
через 18 час
(ср.геом.,
103)В
(5,8×103)
(6,5×103)
(3,5×103)
(7,1×103)
(4,7×103)
В) Для расчета среднегеометрических значений CFU/мл животным со стерильными культурами приписывают значение 1 CFU/мл. В эксперименте 1 среднегеометрическое значение CFU/мл для объединенной группы животных, которым ввели 1:5 или 1:25 разбавления анти-GNA33 антисыворотки и заражали штаммом М986 (28,8×103), было меньше, чем для объединенной контрольной группы животных, которым ввели иррелевантное mAb или антисыворотку E.coli (350×103, Р=0,02). В экспериментах 2, 3 и 4 среднегеометрическое значение CFU/мл для животных, которым ввели анти-GNA33 mAb, было меньше, чем для контрольных животных, которым ввели иррелевантный mAb (Р<0,02).
| название | год | авторы | номер документа |
|---|---|---|---|
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, НАПРАВЛЕННОЕ ПРОТИВ GNA33 ПЕПТИДА, И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2355704C2 |
| ВАКЦИНЫ С ИСПОЛЬЗОВАНИЕМ ВЕЗИКУЛ НА ОСНОВЕ GNA 1870 ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ДЛЯ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ NEISSERIA MENINGITIDIS | 2006 |
|
RU2432962C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ИНФЕКЦИИ, ВЫЗВАННОЙ БАКТЕРИЕЙ NEISSERIA | 2000 |
|
RU2244749C2 |
| МОДИФИЦИРОВАННАЯ АДЕНИЛАТЦИКЛАЗА BORDETELLA, СОДЕРЖАЩАЯ ДОМЕН ВЗАИМОДЕЙСТВИЯ CD11B/СD18 ИЛИ ЛИШЕННАЯ ДОМЕНА ВЗАИМОДЕЙСТВИЯ CD11b/CD18, И ЕЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2421241C2 |
| БЕЛОК NMB1125 И ЕГО ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЯХ | 2004 |
|
RU2336900C2 |
| БЕЛОК NMB0928 И ЕГО ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЯХ | 2004 |
|
RU2335505C2 |
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2009 |
|
RU2475496C2 |
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО VISTA И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2746994C2 |
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2012 |
|
RU2567003C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕСЯ С PSL PSEUDOMONAS, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2708977C2 |


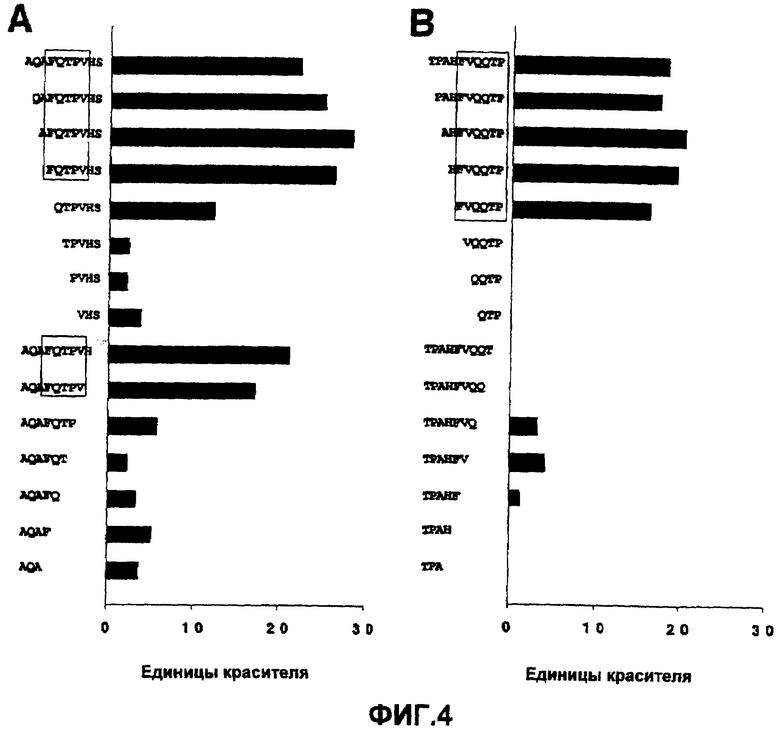

Изобретение раскрывает GNA33 пептиды, представляющие собой миметики эпитопов бактерий Neisseria meningitidis серогруппы В, имеющие определенные аминокислотные последовательности, приведенные в описании, и способные вызывать выработку антител, проявляющих комплемент-опосредованную бактерицидную активность и/или опсоническую активность против указанных бактерий у субъекта - млекопитающего. Указанные пептиды используют в составе композиции, используемой в способе для выработки иммунной реакции против указанных бактерий у субъекта - млекопитающего. Изобретение касается также полинуклеотида, кодирующего указанный пептид, а также рекомбинантного вектора экспрессии, включающего указанный полинуклеотид. Раскрывается способ получения GNA33 пептида путем культивирования клетки-хозяина, включающей рекомбинантный вектор экспрессии, и также определение присутствия антител против менингококков В в биологическом образце с использованием пептида GNA33. Использование изобретения обеспечивает эффективность вакцины против MenB и безопасность ее применения для пациента. 10 н. и 1 з.п. ф-лы, 5 ил., 6 табл.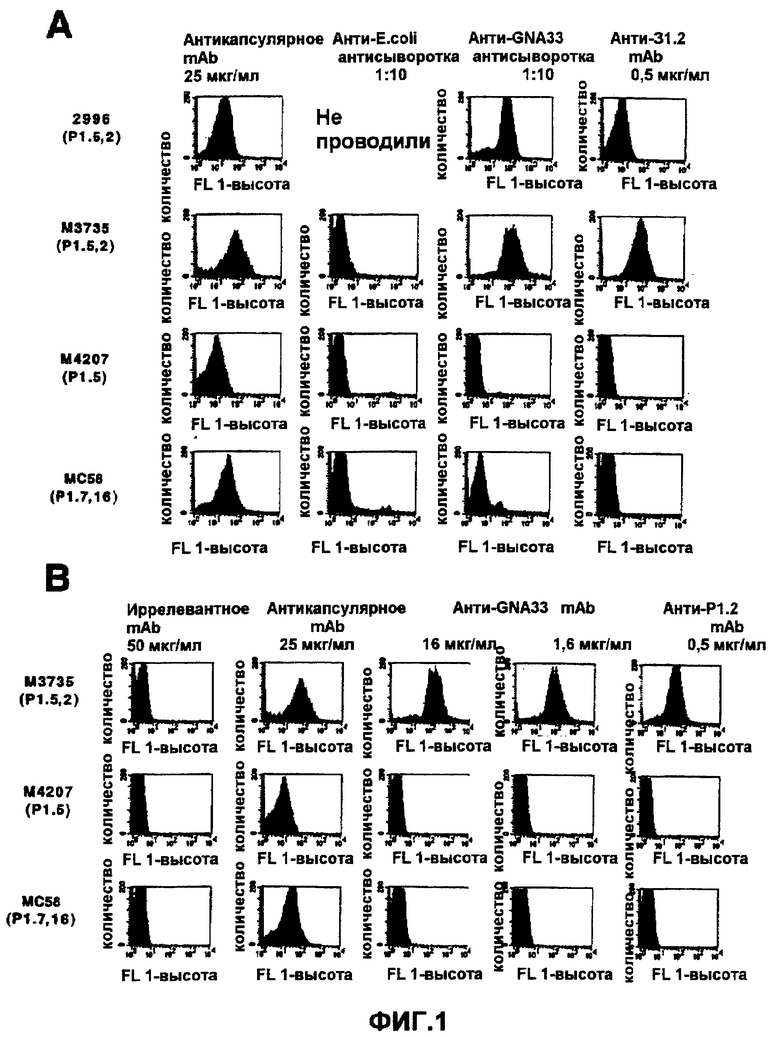
(a) полинуклеотид по п.6; и
(b) по крайней мере, один гетерологичный контрольный элемент, функционально связанный с указанным полинуклеотидом, посредством чего указанный полинуклеотид может быть транскрибирован и транслирован в клетке-хозяине, и, по крайней мере, один из указанных контрольных элементов гетерологичен указанному полинуклеотиду.
(a) получение биологического образца;
(b) взаимодействие биологического образца с GNA33 пептидом по любому из п.1 или 2 в условиях, которые позволяют антителам против Neisseria meningitidis серогруппы В, если они присутствуют в биологическом образце, связываться с GNA33 пептидом с образованием комплекса антитело/GNА33 пептид; и
(с) детектирование присутствия или отсутствия комплекса, позволяя тем самым определить присутствие или отсутствие в образце антител против Neisseria meningitidis серогруппы В.
| М | |||
| PIZZA et al | |||
| Identification of Vaccine Candidates Against Serogroup В Meningococcus by Whole-Genome Sequencing, Science, 10.03.2000, vol.287, p.p.1816-1820 | |||
| Устройство для быстродействующей фильтровой направленной защиты трехфазных линий передачи двустороннего питания | 1945 |
|
SU66791A1 |
| US 5597572 A, 28.01.1997 | |||
| АНТИГЕН МЕНИНГОКОККОВ ГРУППЫ В | 1993 |
|
RU2068270C1 |
| ПОЛИСАХАРИД NEISSERIA MENINGITIDIS С МОДИФИЦИРОВАННОЙ ГРУППОЙ B, КОНЪЮГИРОВАННЫЙ АНТИГЕН, ВАКЦИНА ПРОТИВ МЕНИНГИТА ГРУППЫ B И СПОСОБ ИНДУКЦИИ ОТВЕТА АНТИТЕЛ К МЕНИНГИТУ ГРУППЫ B | 1990 |
|
RU2105568C1 |
| Штамм бактерий NeISSeRIa меNINGIтIDIS серогруппы В - продуцент капсульного полисахарида и полисахаридно-белкового комплекса | 1989 |
|
SU1708846A1 |
Авторы
Даты
2008-04-20—Публикация
2002-04-11—Подача