Изобретение относится к модифицированным аденилатциклазным токсинам Bordetella, которые являются дефектными в отношении связывания CD11b/CD18, и к их применению в приготовлении фармацевтической композиции для лечения коклюша и/или для защиты против инфекции Bordetella. Данное изобретение относится также к специфическим фрагментам аденилатциклазы Bordetella, содержащим домен взаимодействия CD11b/CD18, и к их применению, в частности для нацеливания представляющей интерес молекулы на экспрессирующие CD11b-клетки.
Род Bordetella содержит четыре вида, а именно: Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica и Bordetella avium.
Bordetella являются грамотрицательными коккобациллами, ответственными за респираторные инфекции. Bordetella pertussis и Bordetella parapertussis точно являются патогенами человека. Bordetella bronchiseptica является патогенной для различных млекопитающих, и более редко для людей, и, в отличие от B.pertussis и Bordetella parapertussis, способна выживать вне хозяина. Bordetella avium является патогенной для птиц.
Наиболее вирулентным видом для людей является B.pertussis, которая является этиологическим агентом коклюша, высококонтагиозного респираторного заболевания детей, характеризующегося бронхопневмонией и пароксизмальным кашлем, прерываемым дыхательными судорожными вдохами во время приступа кашля.
Вакцинацию против коклюша до сих пор проводили наиболее часто с использованием инактивированных целых бактерий. Однако такие вакцины не всегда лишены токсичности ввиду того факта, что факторы вирулентности состоят из белков, секретируемых этими бактериями, а не из самих бактерий. Таким образом, эти белки могут проявлять тяжелые патологические действия, даже после гибели этих бактерий.
Европейский патент ЕР 0424158 (Институт Пастера) описывает применение аденилатциклазы Bordetella в качестве защитных антигенов как против Bordetella pertussis, так и против Bordetella bronchiseptica.
Европейский патент ЕР 0338169 (Институт Пастера) описывает также применение препаратов активной аденилатциклазы из Bordetella parapertussis в качестве защитных агентов против коклюша.
Были также разработаны другие стратегии, в том числе приготовление бесклеточной вакцины с использованием иммуногенных детоксифицированных токсинов Bordetella.
Пример вакцины на основе детоксифицированного токсина pertussis описан в Патенте США SN 6040427 (Locht et al., 2000).
Среди различных токсинов, продуцируемых B.pertussis, аденилатциклаза (также называемая далее термином CyaA) является решающим фактором в стратегии вирулентности этих бактерий во время ранних фаз колонизации дыхательных путей (Goodwin and Weiss, 1990; Khelef et al., 1992). Этот токсин позволяет патогену избегать иммунного надзора хозяина, в основном, посредством интоксикации нейтрофилов и макрофагов, вызыванием ослабления фагоцитов и индукцией апоптоза макрофагов (Confer and Eaton, 1982; Gueirard et al., 1998; Harvill et al., 1999; Khelef and Guiso, 1995; Khelef et al., 1993). Роль CyaA в патогенезе B.pertussis была ясно продемонстрирована на мышиной респираторной модели. Действительно, генетически модифицированные штаммы B. Pertussis, дефектные по экспрессии CyaA, были ослабленными в их способности индуцировать легочные повреждения и вызывать летальную инфекцию (Khelef et al., 1994; Weiss and Goodwin, 1989). С другой стороны, было показано, что CyaA индуцирует защитный иммунитет против колонизации легких B.pertussis на мышиной модели (Betsou et al., 1993; Betsou et al., 1995; Hormozi et al., 1999).
CyaA представляет собой полипептид с длиной 1706 аминокислотных остатков, состоящий из четырех функциональных доменов; домена активности аденилатциклазы (АС) (остатки 1-400), гидрофобного каналообразующего домена (остатки 500-700), кальцийсвязывающего богатого повторами глицина/аспартата домена (остатки 1000-1600) и С-концевого домена, несущего сигнал секреции (остатки 1600-1706). CyaA способна внедряться в эукариотические клетки и перемещать ее каталитический домен в цитоплазму, где, после активации эндогенным кальмодулином, он катализирует превращение АТФ в цАМФ (Ladant and Ullman, 1999). Считается, что накопление цАМФ в цитозоле клетки является ответственным за токсическое действие этого токсина (Rogel et al., 1991). Основными последствиями этой интоксикации являются апоптоз клеток и изменение фагоцитарных способностей и продуцирование супероксида (Confer and Eaton, 1982; Friedman et al., 1987; Khelef et al., 1993; Njamkepo et al., 2000; Pearson et al., 1987).
Полная последовательность аденилатциклазы Bordetella pertussis показана в SEQ ID NO:1.
Полная последовательность аденилатциклазы Bordetella bronchiseptica показана в SEQ ID NO:3.
CyaA требуется кальций для приобретения специфической для перемещения конформации, которая делает возможной доставку каталитического домена в цитозоль клетки (Regel and Hanski, 1992; Rose et al., 1995). Первично, CyaA продуцируется в виде неактивного протоксина, proCyaA, который после посттрансляционной модификации ацилтрансферазой, продуктом гена cyaC, становится активным токсином. Это ковалентное посттрансляционное ацилирование (ацилами жирных кислот) требуется для перемещения этого токсина через мембраны клетки-мишени и доставки его каталитического домена АС, а также для образования гемолитических катион-селективных каналов. Ацилирование proCyaA происходит в двух различных положениях, Lys-983 и Lys-860, которые расположены в консервативных сайтах ацилирования RTX (Barry et al., 1991; Hackett et al., 1994). Хотя ацилирование Lys-860, по-видимому, не является необходимым для активности CyaA, было показано, что ацилирование Lys-983 является решающим (Basar et al., 2001).
CyaA может проникать в широкий диапазон типов клеток, в том числе в эритроциты млекопитающих, лишенные мембранного транспорта (Bellalou et al., 1990; Gray et al., 1999; Rogel and Hanski, 1992). В противоположность этому эффекты токсичности CyaA, такие как нейтрализация фагоцитарной способности и индукция апоптоза, были в основном выявлены на иммунных клетках, а именно нейтрофилах и макрофагах (Confer and Eaton, 1982; Khekef et al., 1993). Кроме того, в мышиной респираторной инфекции было показано, что CyaA проявляет специфическую интоксикацию в отношении альвеолярных макрофагов (Gueirard et al., 1998). В Патенте WO 93/21324 (Институт Пастера, 1993) описана также вакцина, содержащая рекомбинантный аденилатциклазный токсин, продуцируемый B.pertussis, прикрепленный к гетерологичным эпитопам. Недавно было продемонстрировано, что CyaA связывается специфически с клетками-мишенями через интегрин αМβ2 (CD11b/CD18). Это связывание было насыщаемым и полностью ингибируемым моноклональными анти-CD11b-антителами. CyaA проявлял селективную токсичность в отношении CD11b+ клеток, показывая, что его взаимодействие с CD11b является необходимым для перемещения каталитического домена и последующего увеличения цАМФ и гибели клеток. Кроме того, чувствительность клеток СНО к цитотоксичности CyaA разительно увеличивалась после экспрессии гетеродимера CD11b/CD18. Кроме того, ионы Са2+, которые требуются для перемещения каталитического домена в клетки, были также строго необходимыми для взаимодействия CyaA с CD11b (Guermonprez et al., 2001). Важность CD11b для взаимодействия CyaA с клетками была дополнительно продемонстрирована в системе, где CyaA использовали в качестве вектора для доставки чужеродных антигенов в антигенпрезентирующие клетки, такие как дендритные клетки. Только дендритные клетки субпопуляции CD11c+ CD8α-CD11bhigh были фактически способны представлять пептидные комплексы МНС класса I, соответствующие эпитопу, инсертированному в рекомбинантный CyaA (Guermonprez et al., 2002).
Белок CD11b является членом большого семейства β2-интегринов, молекул адгезии лейкоцитов, которое содержит LFA1 (CD11a), МАС-1 (CD11b) и р150,95 (CD11c). Члены этого семейства отличаются их α-цепью, которая экспрессируется в виде облигатного гетеродимера с β-цепью (CD18) (Arnaout, 1990). CD11b, также известный как рецептор типа 3 комплемента (CR3), экспрессируется на макрофагах, нейтрофилах, дендритных клетках, НК-клетках, перитонеальных клетках В-1 и субпопуляции CD8+ Т-клеток (Arnaout, 1990; Bell et al., 1999). Он играет ключевую роль в адгезивных функциях лейкоцитов и запускает фагоцитоз покрытых комплементом частиц (Diamond and Springer, 1993). CD11b связывает различные лиганды, такие как молекула внутриклеточной адгезии ICAM-1, фибриноген, коагулянтный фактор Х и компонент C3b инактивированного комплемента (iC3b) (Altieri and Edgington, 1988; Beller et al., 1982; Diamond et al., 1990; Wright et al., 1988).
На основе связывающих свойств CyaA с CD11b/CD18, Европейская заявка на патент ЕР1188446 (Институт Пастера) описывает белковые векторы, содержащие рекомбинантную аденилатциклазу вида Bordetella, для нацеливания представляющей интерес молекулы и, в частности, антигена на дендритные клетки.
Теперь данное изобретение основано на открытии, что один или несколько районов аденилатциклазы Bordetella pertussis, содержащиеся в аминокислотной последовательности, простирающейся от аминокислоты 1166 до аминокислоты 1281 (SEQ ID NO:2) являются решающими для взаимодействия этого токсина с CD11b/CD18. Этот район, необходимый для обеспечения связывающей способности CyaA с CD11b/CD18, может быть дополнительно объединен с другими районами CyaA, действующими в качестве вспомогательных районов.
Это открытие предоставляет возможность получения эффективного и многостороннего вектора доставки молекул, способного нацеливать представляющую интерес молекулу на дендритные клетки. Альтернативно, делеция идентифицированного домена взаимодействия CD11b/CD18- аденилатциклазы может быть использована выгодным образом для конструирования безопасной бесклеточной вакцины для защиты против инфекции Bordetella и, в частности, инфекции Bordetella pertussis.
Данное изобретение обеспечивает также применение идентифицированного домена взаимодействия CD11b/CD18 для получения нейтрализующих антител, способных блокировать взаимодействие нативной аденилатциклазы, продуцируемой инфекционными бактериями, с клеточными рецепторами.
Таким образом, целью данного изобретения является обеспечение белка, состоящего из аденилатциклазы Bordetella, которая модифицирована в домене взаимодействия CD11b/CD18 делецией, заменой или инсерцией одной или нескольких аминокислот, где указанный белок является дефектным в отношении связывания CD11b/CD18, но является специфически реактивным с антисыворотками, узнающими аденилатциклазу Bordetella дикого типа.
Белок данного изобретения может быть использован в качестве активного начала в вакцине против коклюша. Таким образом, мутация (мутации) в домене взаимодействия CD11b/CD18 предохраняет иммунные клетки от потенциально негативных эффектов, таких как передача сигнала после захватывания интегрина токсоидом, и/или некоторой функциональной интерференции вследствие конкуренции за связывание с CD11b с CyaA-токсоидом, который также служит в качестве рецептора CR3-комплемента.
В данном контексте термин «полипептид» обозначает одну цепь аминокислот, связанных пептидными связями, содержащую по меньшей мере 6 аминокислот, предпочтительно по меньшей мере 10 аминокислот и более предпочтительно по меньшей мере 50 аминокислот.
Термин «белок» относится к макромолекуле, которая по существу состоит из одного или нескольких полипептидов.
Термин «аденилатциклаза Bordetella» включает в себя, в данном изобретении, кальмодулинзависимую аденилатциклазу, которая природно синтезируется в видах Bordetella и которая является основным фактором вирулентности, обязательным для начальных фаз бактериальной колонизации в легком.
В одном предпочтительном варианте осуществления белок данного изобретения получают модификацией аденилатциклазы Bordetella pertussis, агента коклюша в человеке.
В Bordetella pertussis эта аденилатциклаза синтезируется и секретируется в форме полипептида из 1706 аминокислот (SEQ ID NO:1). Кальмодулинзависимая каталитическая активность локализована в первых 400 аминокислотах, причем этот домен называют далее «N-концевым каталитическим доменом». Как сообщалось ранее, для того чтобы быть активным, указанный аденилатциклазный токсин делают инвазивным и гемолитическим после посттрансляционной модификации посредством коэкспрессии продукта гена CyaC.
Согласно данному изобретению выражение «домен взаимодействия CD11b/CD18» относится к:
а. домену взаимодействия CD11b/CD18 Bordetella pertussis, простирающемуся от аминокислоты 1166 до аминокислоты 1281 аденилатциклазы Bordetella pertussis (SEQ ID NO:2) или
b. домену аденилатциклазы видов Bordetella, соответствующему домену взаимодействия CD11b/CD18 Bordetella pertussis, как идентифицировано сопоставлением последовательности аденилатциклазы указанных видов Bordetella с последовательностью аденилатциклазы Bordetella pertussis с использованием алгоритма для поиска наилучшего локального сопоставления.
Примером алгоритма для поиска наилучшего локального сопоставления является алгоритм BLAST (Altschul et al., 1990).
Домен взаимодействия CD11b/CD18 Bordetella bronchiseptica представлен SEQ ID NO:4.
В данном контексте выражение “дефектный в отношении связывания CD11b/CD18” означает, что белок данного изобретения не конкурирует с аденилатциклазой дикого типа Bordetella за связывание с экспрессирующими CD11b/CD18 αmβ2 клетками. «CD11b/CD18 αmβ2» или «CD11b/CD18» обозначает клеточный рецептор аденилатциклазы Bordetella (Guermonprez et al., 2001). Примеры анализов связывания для оценки специфического связывания рекомбинантного токсина с экспрессирующими CD11b/CD18 αmβ2 клетками описаны в приведенной ниже экспериментальной части. Белок данного изобретения предпочтительно имеет менее чем 50% связывающей аффинности в отношении CD11b/CD18 αmβ2, в сравнении с аденилатциклазой Bordetella дикого типа. Наиболее предпочтительно, белок данного изобретения имеет менее чем 10% и более предпочтительно - менее чем 5% анализируемой связывающей аффинности.
В данном контексте выражение “экспрессирующие CD11b-клетки” относится к клеткам, которые экспрессируют CD11b/CD18 αmβ2 на их поверхности. В частности, этими клетками являются гранулоциты/нейтрофилы, макрофаги, НК-клетки, субпопуляции CD8+ Т-клеток и В-клеток и миелоидные дендритные клетки.
Для обеспечения белка данного изобретения домен взаимодействия CD11b/CD18-аденилатциклазы Bordetella модифицируют инсерцией, делецией или заменой одной или нескольких аминокислот, причем полученный белок является дефектным в отношении связывания CD11b/CD18.
В одном варианте осуществления данного изобретения домен взаимодействия CD11b/CD18 модифицирован инсерцией в него пептида. Например, последовательность, состоящую из 6-12 остатков, инсертируют в домен взаимодействия CD11b/CD18.
Конкретные варианты осуществления включают в себя аденилатциклазу Bordetella, модифицированную инсерцией между остатками 1166-1167 или между остатками 1281-1282 (число указывает положение этих аминокислот в аденилатциклазе Bordetella pertussis дикого типа) пептида, содержащего 6-12 аминокислот. Примеры инсерций эпитопа FLAG-последовательности в этих положениях описаны в следующей ниже экспериментальной части, и их называют далее CyaA1166/FLAG и CyaA1281/FLAG.
Альтернативно, остатки, которые, как показано, участвуют в связывании CD11b/CD18, могут быть делетированы или заменены нефункциональными остатками.
В одном конкретном варианте осуществления аденилатциклазу Bordetella модифицируют инсерцией, делецией или заменой одной или нескольких аминокислот в районе, простирающемся от остатка 1208 до 1243 в аденилатциклазе Bordetella pertussis или в соответствующих районах аденилатциклаз других видов Bordetella.
Предпочтительные варианты осуществления изобретения относятся к белку и включают в себя аденилатциклазу Bordetella pertussis, содержащую делеции одной или нескольких аминокислот или их замену нефункциональными аминокислотами.
В одном предпочтительном варианте осуществления аденилатциклазу Bordetella модифицируют полной делецией домена взаимодействия CD11b/CD18.
Согласно другому конкретному варианту осуществления данного изобретения аденилатциклазу Bordetella pertussis модифицируют делецией аминокислот, простирающихся от положения 1245 до положения 1273, причем эти аминокислоты необязательно заменены нефункциональными аминокислотами, например октапептидом, как приведено в примере экспериментальной части, и этот белок называют далее CyaAΔ1245-1273.
Дополнительно, для гарантии полной безопасности введения в живой организм белка данного изобретения аденилатциклазу Bordetella модифицируют таким образом, что каталитическая активность удаляется. Согласно одному варианту осуществления данного изобретения аденилатциклазу Bordetella дополнительно модифицируют инсерцией, делецией или заменой одной или нескольких аминокислот в N-концевом каталитическом домене, причем указанная модифицированная аденилатциклаза Bordetella имеет каталитическую активность, которая является уменьшенной в сравнении с каталитической активностью аденилатциклазы Bordetella дикого типа. Предпочтительно эта каталитическая активность составляет менее чем 10% каталитической активности аденилатциклазы Bordetella дикого типа, и более предпочтительно - является незначимой.
Примеры мутантов в N-концевом каталитическом домене описаны в данной области техники (например, в WO 93/21324, Институт Пастера).
Варианты белка данного изобретения включают в себя модифицированную аденилатциклазу вида Bordetella, лишенную по меньшей мере аминокислот 1-300 N-концевого каталитического домена, и предпочтительно лишенную аминокислот 1-373.
Альтернативно, дипептидные инсерции могут быть выполнены в АТФ-связывающий сайт между остатками 188 и 190 аденилатциклазы Bordetella pertussis или соответствующими остатками в аденилатциклазе из других видов Bordetella.
В данном изобретении показано также, что ацилирование аденилатциклазы Bordetella участвует в связывании CD11b/CD18 и последующем перемещении этого токсина в клетку. Таким образом, в одном предпочтительном варианте белка данного изобретения этот белок не является ацилированным. В частности, аденилатциклаза Bordetella дополнительно модифицирована в аминокислотах, которые ацилируются посттрансляционно. Эти аминокислоты соответствуют Lys-983 и Lys-860 аденилатциклазы Bordetella pertussis.
В этом конкретном варианте осуществления этот белок не ацилируется в положении 983 и/или 860 последовательности аденилатциклазы.
В другом варианте осуществления белок данного изобретения является ацилированным.
Белок данного изобретения является предпочтительно иммуногенным, но по существу нетоксичным белком, т.е. белком, который является по меньшей мере дефектным в отношении связывания с рецептором клетки и необязательно в отношении аденилатциклазной активности, но который является все еще специфически узнаваемым антителами против аденилатциклазного токсина.
Данное изобретение относится также к фармацевтической композиции, содержащей определенный выше белок, в комбинации с фармацевтически приемлемым носителем.
Согласно одному варианту осуществления указанная композиция является вакциной, подходящей для применения человеку или животному. Эта вакцина предпочтительно способна индуцировать иммунитет против коклюша. Такая вакцина содержит иммунопротективное и нетоксичное количество белка данного изобретения. Указанная композиция может дополнительно содержать один или несколько подходящих праймирующих адъювантов, соответственно. Другие антигены, о которых известно, что их желательно вводить в конъюгации с белком данного изобретения, могут быть также включены в вакцину данного изобретения. Такие дополнительные компоненты включают в себя другой известный защитный антиген Bordetella, столбнячного токсоида и/или дифтерийного токсоида.
Разумеется, данное изобретение относится также к способу иммунизации человека или животного против инфекции Bordetella и/или симптомов, ассоциированных с заболеванием, вызываемым инфекцией Bordetella, предусматривающему введение вакцины данного изобретения такому человеку или животному.
Способ введения вакцины данного изобретения может быть любым подходящим способом, который доставляет иммунопротективное количество белка данного изобретения хозяину. Однако эту вакцину вводят предпочтительно парентерально с использованием внутримышечного или подкожного способа введения. Другие способы введения также могут быть использованы, когда это желательно, такие как пероральное введение или введение посредством других парентеральных способов, т.е. интрадермально, через нос или внутривенно.
Другой аспект данного изобретения относится к применению белка данного изобретения в приготовлении лекарственного средства для лечения у человека или у животного симптомов заболевания, ассоциированных с коклюшем, и/или для защиты человека или животного от симптомов заболевания, ассоциированных с инфекцией Bordetella.
Разумеется, данное изобретение относится дополнительно к способу лечения человека или животного от инфекции Bordetella и/или симптомов, ассоциированных с заболеванием, вызываемым инфекцией Bordetella, предусматривающему введение лекарственного средства данного изобретения такому человеку или животному.
Другим аспектом данного изобретения является полипептид, способный связываться с интегрином CD11b/CD18, причем указанный полипептид является
а. фрагментом аденилатциклазы Bordetella, имеющим 30-500 аминокислот, предпочтительно 50-300 и более предпочтительно - 50-150 аминокислот, причем указанный фрагмент содержит домен взаимодействия CD11b/CD18 указанной аденилатциклазы Bordetella или содержит фрагмент указанного домена взаимодействия CD11b/CD18 дикого типа, достаточный для сохранения способности связывания с CD11b/CD18, или
b. вариантом указанного фрагмента, имеющим по меньшей мере 70% идентичность, предпочтительно по меньшей мере 80% идентичность и более предпочтительно - по меньшей мере 90% идентичность с указанным фрагментом, причем указанный вариант сохраняет способность связывания CD11b/CD18.
Аденилатциклаза Bordetella выбрана предпочтительно из аденилатциклаз Bordetella pertussis, Bordetella parapertussis и Bordetella bronchiseptica и более предпочтительно является Bordetella pertussis.
Полипептиды данного изобретения будут выбраны из полипептидов, которые принимают подходящую конформацию для связывания с CD11b/CD18.
В конкретных вариантах осуществления полипептиды данного изобретения могут содержать другие вспомогательные районы аденилатциклазы Bordetella, которые участвуют в оптимальном связывании с CD11b/CD18. Эти районы включают в себя, более конкретно, аминокислотные последовательности, содержащие район, простирающийся от аминокислоты 1416 до аминокислоты 1648.
В одном предпочтительном варианте полипептидом данного изобретения является вариант, определенный выше в b., состоящий из одного или нескольких фрагментов из 10-50 аминокислот домена взаимодействия CD11b/CD18. Например, в одном предпочтительном варианте осуществления указанный полипептид содержит по меньшей мере фрагменты из 10-50 аминокислот района аденилатциклазы B.pertussis, простирающегося от аминокислоты 1208 до аминокислоты 1243 аденилатциклазы B.pertussis.
Процентная идентичность соответствует проценту аминокислот вариантной последовательности, которые являются идентичными последовательности дикого типа при сопоставлении с использованием алгоритма BLAST. Выражение «сохраняет способность связывания с CD11b/CD18» означает, что этот вариант сохраняет по меньшей мере 80% связывающей аффинности в отношении CD11b/CD18 в сравнении с соответствующим фрагментом дикого типа, с которым он мог быть сопоставлен, и предпочтительно по меньшей мере 90% связывающей аффинности в отношении CD11b/CD18.
Согласно одному предпочтительному варианту осуществления указанный полипептид является специфически реактивным с антисыворотками, узнающими аденилатциклазу дикого типа Bordetella, предпочтительно аденилатциклазу Bordetella pertussis. Более предпочтительно, указанный полипептид способен, при введении млекопитающему, индуцировать антитела, специфически узнающие аденилатциклазу Bordetella.
В одном конкретном варианте осуществления указанный полипептид является фрагментом аденилатциклазы Bordetella pertussis. В другом конкретном варианте осуществления указанный полипептид по существу состоит из домена взаимодействия CD11b/CD18 и, более конкретно, домена взаимодействия CD11b/CD18 B.pertussis, простирающегося от аминокислоты 1166 до аминокислоты 1281 аденилатциклазы B.pertussis (SEQ ID NO:2).
В других конкретных вариантах осуществления указанный полипептид дополнительно содержит домен ацилирования аденилатциклазы Bordetella и/или гидрофобный домен. Указанные домены ацилирования включены в соответствующие районы, простирающиеся от остатка 700 до остатка 1000 SEQ ID NO:1, как описано в WO 93/21324, и содержат Lys 983 и/или Lys 860. Гидрофобный домен соответствует району, простирающемуся от остатка 500 до остатка 700 SEQ ID NO:1.
Предпочтительно, указанный полипептид не является токсичным при введении in vivo млекопитающему.
Полипептиды данного изобретения конкурируют за связывание интегрина CD11b/CD18 с аденилатциклазой дикого типа.
Таким образом, данное изобретение относится к применению определенного выше полипептида в приготовлении вакцины или лекарственного средства для предупреждения или лечения, в человеке или в животном, симптомов заболевания, ассоциированных с коклюшем, и/или для защиты человека или животного от заболевания, ассоциированного с инфекцией Bordetella.
Более конкретно, данное изобретение относится к применению указанного полипептида данного изобретения для генерирования защитных антител против инфекции Bordetella.
Уже сообщалось, что аденилатциклаза является эффективным вектором доставки молекул, способным нацеливать различные антигены на дендритные клетки, приводя, в частности, к генерированию сильных CD4+, а также CD8+ Т-клеточных реакций (ЕР1188446, Институт Пастера).
Данное изобретение относится также к применению полипептидов данного изобретения в получении вектора для нацеливания представляющей интерес молекулы, в частности, на экспрессирующие CD11b-клетки.
Термин “специфически” обозначает в контексте данного изобретения, что этот полипептид при использовании в качестве вектора для представляющей интерес молекулы направляется преимущественно на экспрессирующие CD11b-клетки в соответствии с высокой аффинностью связывания домена взаимодействия CD11b/CD18 с CD11b/CD18, обеспечивая тем самым средство для нацеливания представляющей интерес молекулы на поверхность указанных клеток или в указанные клетки селективным образом относительно других клеток.
В частности, в одном варианте осуществления нацеливание указанной молекулы или пептида является эффективным in vivo. В других вариантах осуществления нацеливание указанной молекулы является эффективным in vitro или ex vivo. Под “in vitro” имеют в виду, что клетки-мишени являются клетками, которые культивируют in vitro. Под “ex vivo” имеют в виду, что клетки-мишени являются клетками, которые были экстрагированы из живого организма, культивируются in vitro и предназначены для повторного введения в живой организм.
Таким образом, данное изобретение обеспечивает средство, подходящее для создания композиций, подходящих для введения животному- или человеку-хозяину, требующих нацеливания на определенные лейкоциты и, в частности, на миелоидные дендритные клетки, нейтрофилы или макрофаги.
Данное изобретение, более конкретно, относится к вектору для нацеливания представляющей интерес молекулы на экспрессирующие CD11b-клетки, характеризующемуся тем, что указанный вектор содержит полипептид, способный связываться с CD11b/CD18, определенный выше, связанный с указанной представляющей интерес молекулой.
Данное изобретение относится также к способу для нацеливания in vitro представляющей интерес молекулы на экспрессирующие CD11b-клетки, предусматривающему:
а. обеспечение экспрессирующих CD11b-клеток, экстрагированных из живого организма,
b. культивирование указанных экспрессирующих CD11b-клеток с вектором данного изобретения при условиях, подходящих для нацеливания указанного вектора на указанные экспрессирующие CD11b-клетки.
Данное изобретение относится также к экспрессирующим CD11b-клеткам, содержащим представляющую интерес молекулу, получаемым описанным выше способом.
Согласно данному изобретению выражение «представляющая интерес молекула» относится к любой молекуле, предпочтительно к молекуле, которая не является фрагментом аденилатциклазы вида Bordetella.
Представляющие интерес молекулы могут быть также выбраны из нуклеиновых кислот, таких как ДНК, РНК, олигонуклеотиды, антисмысловая ДНК, плазмиды и космиды. Они могут быть также выбраны из пептидов или полипептидов и, в частности, ферментов, коферментов, лигандов рецепторов, гаптенов, антигенов, антител и их фрагментов. Разумеется, специалист в данной области выберет подходящую молекулу в зависимости от желаемого использования.
Представляющие интерес молекулы могут быть выбраны из активного (действующего) начала лекарственного средства, иммунотоксинов, антиоксидантов, антибиотиков, факторов роста, внутриклеточных гормонов, цитокинов, токсинов, нейромедиаторов, антимикробных агентов, в частности антивирусных, антибактериальных, антипаразитарных или противоопухолевых агентов, и, в более общем виде, из любых терапевтических или профилактических представляющих интерес агентов.
В соответствии с одним конкретным вариантом осуществления представляющая интерес молекула выбрана из группы, состоящей из пептидов, гликопептидов, липопептидов, полисахаридов, олигосахаридов, нуклеиновых кислот, липидов и химических веществ.
В конкретных вариантах осуществления представляющей интерес молекулой является гетерологичный антиген или эпитоп, причем термин «гетерологичный» относится к антигену или эпитопу, другому, чем антигенная детерминанта аденилатциклазы, содержащаяся в самом векторе.
Представляющую интерес молекулу связывают с полипептидом данного изобретения с получением вектора данного изобретения.
В данном контексте термин «связанный» обозначает любое взаимодействие, делающее возможным физическую ассоциацию представляющей интерес молекулы и данного полипептида. Предпочтительно, это связывание является ковалентным. Оно может быть прямым ковалентным связыванием или непрямым связыванием, использующим связывающий (линкерный) агент для образования конъюгата. Способы химического связывания хорошо известны в данной области. Химическая связь может быть выбрана, например, из малеимидной, пептидной, дисульфидной или тиоэфирной связи. Например, может быть использована дисульфидная связь, использующая N-пиридилсульфонилактивированный сульфгидрил.
Один конкретный способ состоит в добавлении линкера к полипептиду, причем указанный линкер состоит по меньшей мере из одного цистеина, который может быть легко использован для дисульфидной связи. Другой подход состоит в связывании химически биотинильной части молекулы, которая делает возможным связывание других молекул, ассоциированных со стрептавидином.
Множественные молекулы могут быть химически связаны с полипептидом данного изобретения посредством дисульфидной связи с различными остатками цистеина при условии, что это связывание не препятствует взаимодействию с CD11b/CD18.
Кроме того, функциональные свойства экспрессирующих CD11b-клеток определяют применение указанных полипептидов данного изобретения в приготовлении белкового вектора для нацеливания лекарственного средства на эти конкретные клетки. В этом контексте в одном конкретном варианте осуществления, так называемой представляющей интерес молекулой, является активное (действующее) начало лекарственного средства. Указанное активное начало может быть связано химически или генетически с полипептидом данного изобретения. Предпочтительно, представляющей интерес молекулой является противовоспалительное лекарственное средство, которое при связывании с аденилатциклазным токсином направляется специфически к поверхности клеток, участвующих в воспалительной реакции, таких как нейтрофилы.
Поскольку экспрессирующие CD11b-клетки и, более конкретно, миелоидные дендритные клетки, нейтрофилы и макрофаги участвуют в существенных функциях системы иммунной и природной защиты, в частности в воспалительных и специфических иммунных реакциях, в предпочтительном варианте осуществления данного изобретения вектор данного изобретения конструируют, более конкретно, для праймирования реакции CD4+- и CD8+-клеток, причем указанная реакция следует за нацеливанием представляющей интерес молекулы на экспрессирующие CD11b-клетки, в частности миелоидные дендритные клетки.
В данном контексте представляющая интерес молекула является предпочтительно эпитопом или антигеном или содержит эпитоп или антиген. Более конкретно, представляющая интерес молекула может быть, в частности, антигеном, выбранным из группы, состоящей из антигена полиовируса, антигена вируса ВИЧ, антигена вируса гриппа, вируса лимфоцитарного хориоменингита, эпитопа, антигена папилломавируса человека (HPV), бактериального антигена, например, антигена Mycobacterium tuberculosis.
Таким образом, данное изобретение обеспечивает средство для праймирования реакции CD4+- и CD8+-клеток в пациенте, либо нацеливанием in vivo антигена или эпитопа на экспрессирующие CD11b-клетки, либо нацеливанием ex vivo антигена или эпитопа на экстрагированные экспрессирующие CD11b-клетки и повторным введением полученных клеток указанному пациенту.
Таким образом, данное изобретение относится к способу нацеливания in vitro антигена или эпитопа на экспрессирующие CD11b-клетки, предусматривающему
а. обеспечение экспрессирующих CD11b-клеток, экстрагированных из живого организма, и
b. культивирование указанных экспрессирующих CD11b-клеток с вектором данного изобретения, несущим антиген или эпитоп в качестве представляющей интерес молекулы, при подходящих условиях для нацеливания этого вектора на указанные экспрессирующие CD11b-клетки.
Предпочтительно, экспрессирующими CD11b-клетками, экстрагированными из живого организма, являются миелоидные дендритные клетки.
Данное изобретение обеспечивает также экспрессирующие CD11b-клетки, содержащие гетерологичный антиген или эпитоп, получаемые описанным выше способом.
Таким образом, данное изобретение относится к продукту клеточной терапии для иммунизации человека или животного против антигена, характеризующемуся тем, что он содержит эффективное количество экспрессирующих CD11b-клеток, содержащих гетерологичный антиген или эпитоп, получаемых описанным выше способом, в комбинации с фармацевтически приемлемым носителем.
Далее, данное изобретение относится к применению экспрессирующих CD11b-клеток, содержащих указанный антиген или эпитоп, получаемых описанным выше способом, в получении продукта клеточной терапии для иммунизации человека или животного против антигена.
Более конкретно, данное изобретение относится к способу иммунизации пациента против антигена, предусматривающему
а. экстрагирование экспрессирующих CD11b-клеток из указанного пациента,
b. культивирование in vitro указанных экспрессирующих CD11b-клеток с вектором данного изобретения, несущим антиген или эпитоп в качестве представляющей интерес молекулы, при условиях, подходящих для нацеливания указанного вектора на указанные клетки,
с. повторное введение эффективного количества указанных клеток, содержащих указанный вектор, указанному пациенту для праймирования CD4+ и/или CD8+ реакции,
для иммунизации посредством этого указанного пациента относительно указанного антигена.
Согласно предпочтительному варианту осуществления данного изобретения указанными экспрессирующими CD11b-клетками являются миелоидные дендритные клетки.
Таким образом, данное изобретение относится также к фармацевтической композиции, содержащей вектор данного изобретения, несущий эпитоп или антиген в качестве представляющей интерес молекулы, в комбинации с фармацевтически приемлемым носителем.
Согласно одному варианту осуществления указанной композицией является вакцина, пригодная для введения человеку или животному. Предпочтительно, эта вакцина способна индуцировать иммунитет против полиовируса, ВИЧ или вируса лимфоцитарного хориоменингита. Конечно, тип индуцированного иммунитета будет зависеть от выбранного антигена, который переносится данным вектором. В другом варианте осуществления эта вакцина способна индуцировать иммунитет против коклюша.
Такие вакцины содержат иммунопротективное и нетоксичное количество вектора данного изобретения. Указанная композиция может дополнительно содержать подходящие праймирующие адъюванты, соответственно.
Данное изобретение относится также к способу иммунизации человека или животного против инфекции патогена, предусматривающему введение вакцины, содержащей иммунопротективное и нетоксичное количество вектора данного изобретения, такому человеку или животному.
Данное изобретение относится также к средствам для получения полипептидов, белков или вектора данного изобретения. В частности, эти средства включают в себя нуклеиновую кислоту, кодирующую один из следующих полипептидов:
а. белок данного изобретения, который является дефектным в отношении связывания CD11b/CD18;
b. полипептид данного изобретения, который способен связываться с интегрином CD11b/CD18; или
с. вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b-клетки.
В частности, нуклеиновая кислота данного изобретения может быть получена из ДНК, кодирующей аденилатциклазу дикого типа любого штамма Bordetella, с использованием известных способов, например, выделения гена из банка генов, получения комплементарных или кДНК из матриц мРНК или посредством полимеразной цепной реакции или из изолятов клинических видов. Альтернативно, ДНК, кодирующая аденилатциклазу дикого типа, может быть синтезирована стандартными способами синтеза ДНК. Различные штаммы Bordetella являются публично доступными из коммерческих депозитариев.
Модификации ДНК дикого типа, кодирующей аденилатциклазу Bordetella, могут быть получены генной инженерией ДНК дикого типа с использованием общепринятых технологий молекулярной биологии.
Другим объектом данного изобретения является рекомбинантная нуклеиновая кислота, состоящая из нуклеиновой кислоты, кодирующей полипептид, белок или вектор данного изобретения, клонированной в экспрессирующий вектор, подходящий для экспрессии кодируемого полипептида или белка в клетке-хозяине. Необязательно, эта рекомбинантная молекула ДНК содержит дополнительную кодирующую последовательность полипептида-носителя, который имеет иммуностимулирующие свойства, такого как адъювант, или который является полезным в экспрессии, очистке и/или приготовлении полипептидов данного изобретения. Эта кодирующая последовательность может быть помещена в рамке считывания с кодирующей последовательностью полипептида, белка или вектора для нацеливания молекулы данного изобретения.
Выбор экспрессирующего вектора будет, конечно, зависеть от используемой клетки-хозяина.
Предпочтительно, указанным экспрессирующим вектором является плазмида, космида, фагмида или вирусная ДНК.
Данное изобретение относится также к способу получения белка данного изобретения, дефектного в отношении связывания CD11b/CD18; полипептида, способного связывать CD11b/CD18, описанного выше; или вектора для нацеливания представляющей интерес молекулы на экспрессирующие CD11b-клетки, предусматривающему стадии включения рекомбинантной нуклеиновой кислоты, описанной выше, в подходящую клетку-хозяина для экспрессии соответствующего представляющего интерес полипептида, белка или вектора; культивирования трансформированных рекомбинантных клеток и извлечения синтезированного рекомбинантного полипептида, белка или вектора данного изобретения.
Другим аспектом данного изобретения является клетка-хозяин, трансформированная рекомбинантной нуклеиновой кислотой данного изобретения и, следовательно, содержащая нуклеиновую кислоту или рекомбинантную нуклеиновую кислоту, описанную выше. В одном варианте осуществления рекомбинантная нуклеиновая кислота может быть интегрирована в геном клетки-хозяина общепринятыми способами, в том числе гомологичной рекомбинацией.
Предпочтительные клетки-хозяева данного изобретения включают в себя клетки, принадлежащие к виду E.coli и роду Bordetella. Другие клетки-хозяева, которые могут быть подходящими, включают в себя, но не ограничиваются ими, клетки млекопитающих, клетки насекомых, клетки дрожжей и другие бактериальные клетки.
Данное изобретение включает в себя также поликлональную сыворотку, получаемую иммунизацией животного или человека полипептидом, белком, вектором или композицией данного изобретения.
В одном предпочтительном варианте осуществления поликлональная сыворотка может быть получена иммунизацией животного или человека полипептидом, состоящим из домена взаимодействия CD11b/CD18-аденилатциклазы Bordetella, предпочтительно домена взаимодействия CD11b/CD18-аденилатциклазы Bordetella pertussis, простирающегося от аминокислоты 1166 до аминокислоты 1281.
Данное изобретение относится также к моноклональному антителу, направленному специфически против полипептидов данного изобретения, содержащих домен взаимодействия CD11b/CD18.
В одном предпочтительном варианте осуществления это моноклональное антитело направлено против эпитопа, расположенного в домене взаимодействия CD11b/CD18, предпочтительно против эпитопа, расположенного в домене взаимодействия CD11b/CD18-аденилатциклазы Bordetella pertussis, простирающемся от аминокислоты 1166 до аминокислоты 1281.
Предпочтительно, указанная поликлональная сыворотка или моноклональное антитело способны блокировать связывание аденилатциклазы дикого типа с CD11b/CD18. Это блокирование может быть анализировано оценкой способности смеси указанных поликлональной сыворотки или моноклонального антитела с аденилатциклазой дикого типа связываться с CD11b/CD18 в сравнении со способностью только аденилатциклазы дикого типа.
В одном конкретном варианте осуществления указанное лекарственное средство обеспечивает пассивную иммунизацию против инфекции Bordetella.
Для использования в организме человека антитела данного изобретения могут быть гуманизированы, например, заменой гипервариабельной части иммуноглобулина человека, которая не имеет функции антитела, гипервариабельным районом моноклонального иммуноглобулина, полученного из описанного выше способа.
Например, способы гуманизации антител описаны Waldmann T., June 1991, Science, vol.252, p.1657-1662; Winter G. et al., 1993, Immunology Today, vol.14, No. 6, p.243-246; Carter et al., May 1992, Proc. Natl. Acad. Sci. USA, vol.89, p.4285-4289; Singer et al., 1 April 1993, Journal of Immunology, vol.150, No. 7, p.2844-2857.
Данное изобретение относится также к фармацевтической композиции, содержащей поликлональную сыворотку или моноклональную сыворотку в комбинации с фармацевтически приемлемым носителем.
Данное изобретение относится также к применению поликлональной сыворотки или моноклонального антитела данного изобретения в приготовлении лекарственного средства для лечения у человека или у животного симптомов заболевания, ассоциированных с коклюшем, и/или для защиты человека или животного против симптомов заболевания, ассоциированных с инфекцией Bordetella.
Следующая экспериментальная часть показывает результаты идентификации (i) роли посттрансляционного ацилирования во взаимодействии CyaA с CD11b и (ii) домена взаимодействия CD11b в аденилатциклазе Bordetella pertussis.
ПОДПИСИ К ФИГУРАМ
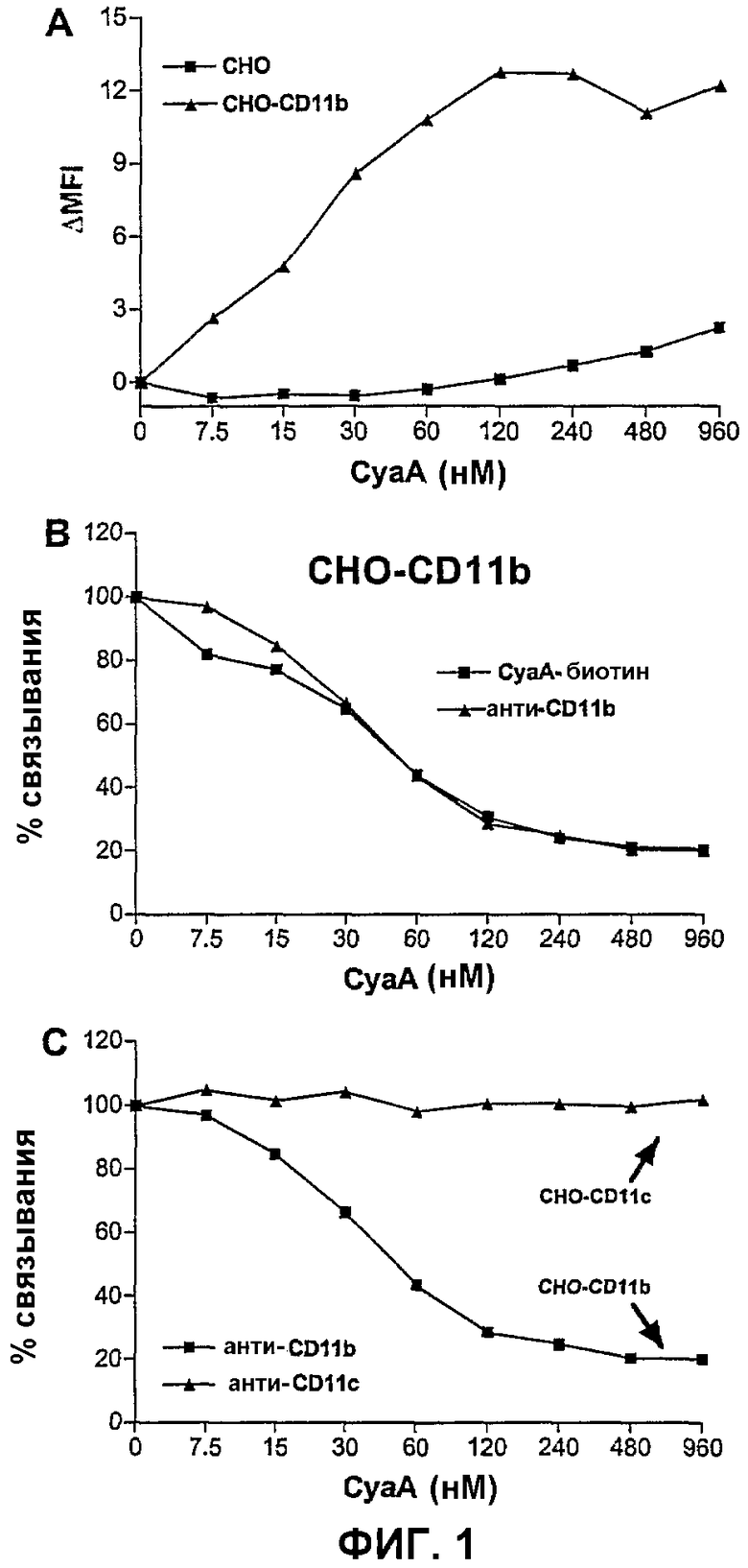
Фиг.1. CyaA связывается специфически с CD11b-клетками и ингибирует связывание как CyaA-биотина, так и моноклонального анти-CD11b-антитела с этими клетками
(А) Клетки СНО или СНО-CD11b инкубировали с указанными концентрациями CyaA. Поверхностно-связанный CyaA детектировали с использованием FACS, с анти-CyaA-Mab (5G12). Результаты выражены в виде ΔMFI = (величина MFI клеток, инкубированных с CyaA) - (величина MFI клеток, инкубированных без CyaA) и представляют по меньшей мере 2 независимых эксперимента.
(В) Клетки СНО-CD11b предынкубировали с указанными концентрациями CyaA. Затем добавляли раздельно CyaA-биотин (30 нМ) или анти-CD11b-Mab (2 мкг/мл) при непрерывном присутствии токсина, и их связывание измеряли при помощи FACS.
(С) После предынкубирования с указанными концентрациями CyaA, клетки СНО-CD11b или клетки СНО-CD11c инкубировали с моноклональным либо анти-CD11b-, либо анти-CD11c-антителом, соответственно, при непрерывном присутствии токсина. Затем связывание антитела определяли при помощи FACS.
Для (В) и (С) результаты выражены в виде процента связывания = (связывание пробы)/(максимальное связывание)×100 и представляют по меньшей мере 2 независимых эксперимента.
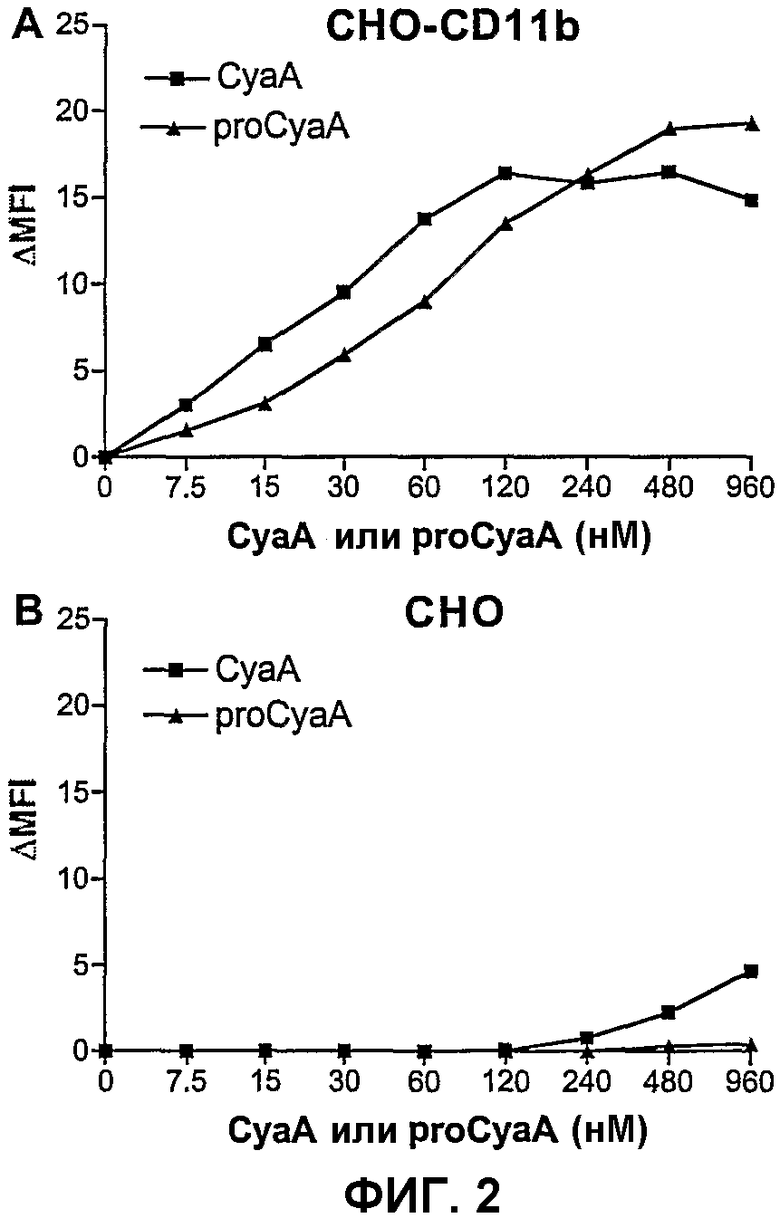
Фиг.2. Прямое связывание CyaA или proCyaA с трансфектантами СНО
Клетки СНО-CD11b (А) или СНО (В) инкубировали с указанными концентрациями CyaA или proCyaA. Поверхностно-связанный CyaA детектировали с использованием анти-CyaA-Mab (5G12). Результаты выражены в виде ΔMFI = (величина MFI клеток, инкубированных с CyaA) - (величина MFI клеток, инкубированных без CyaA) и представляют по меньшей мере 2 независимых эксперимента.
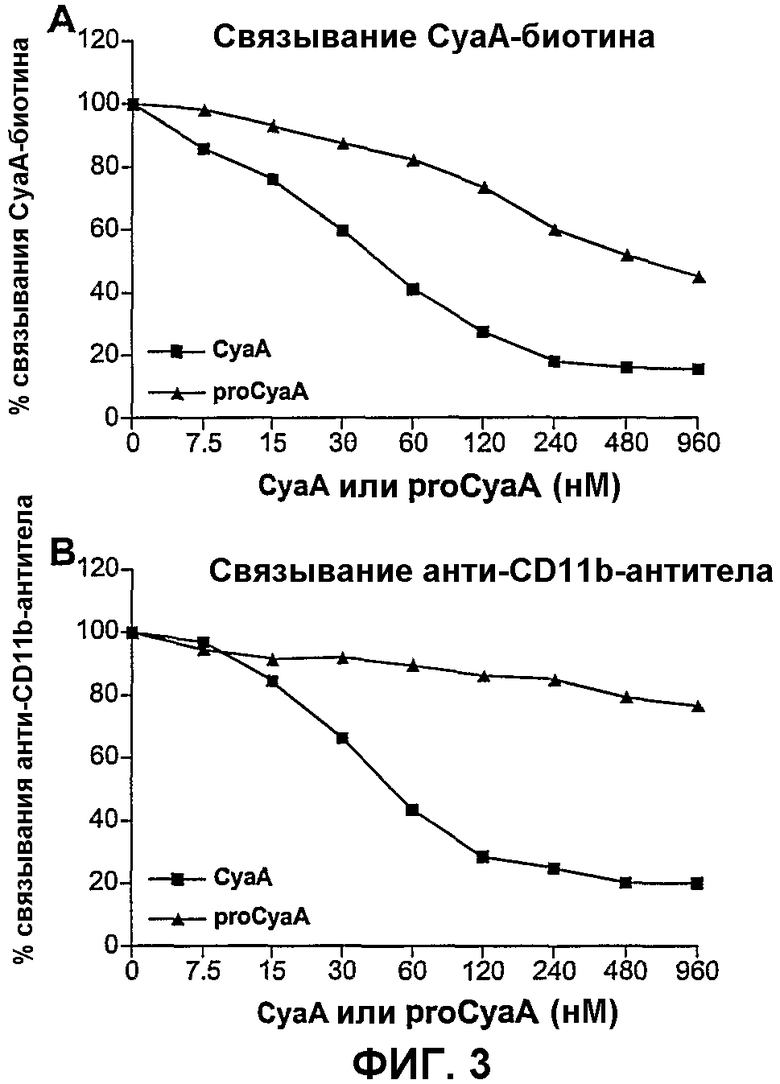
Фиг.3. Ацилирование CyaA является необходимым для стабильной ассоциации с клетками СНО-CD11b
Клетки СНО-CD11b предынкубировали с указанными концентрациями CyaA или proCyaA. Затем добавляли CyaA-биотин (А) или анти-CD11b-Mab (В) при непрерывном присутствии CyaA или proCyaA. Поверхностно-связанные CyaA-биотин или анти-CD11b-Mab измеряли при помощи FACS. Результаты выражены в виде процента связывания = (связывание пробы)/(максимальное связывание)×100 и представляют по меньшей мере 2 независимых эксперимента.
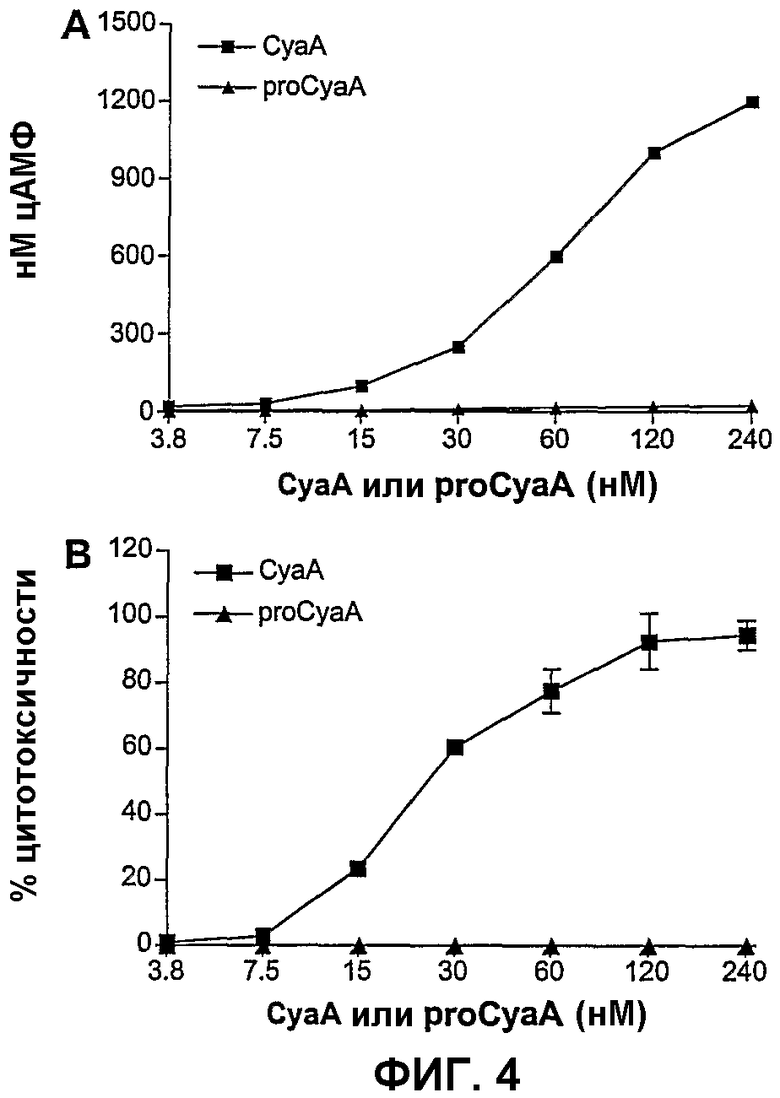
Фиг.4. Ацилирование CyaA является необходимым для CyaA-индуцированного накопления цАМФ и цитотоксичности
Клетки СНО-CD11b предынкубировали либо с CyaA, либо с proCyaA при указанных концентрациях в течение 20 минут при 37°С. Затем клетки лизировали и измеряли цАМФ (А). Параллельно токсичность определяли измерением количества лактатдегидрогеназы, высвобождаемой в среду после инкубации клеток СНО-CD11b в течение 4 часов при 37°С в присутствии указанных концентраций либо CyaA, либо proCyaA (В). Результаты представляют по меньшей мере 2 независимых эксперимента.
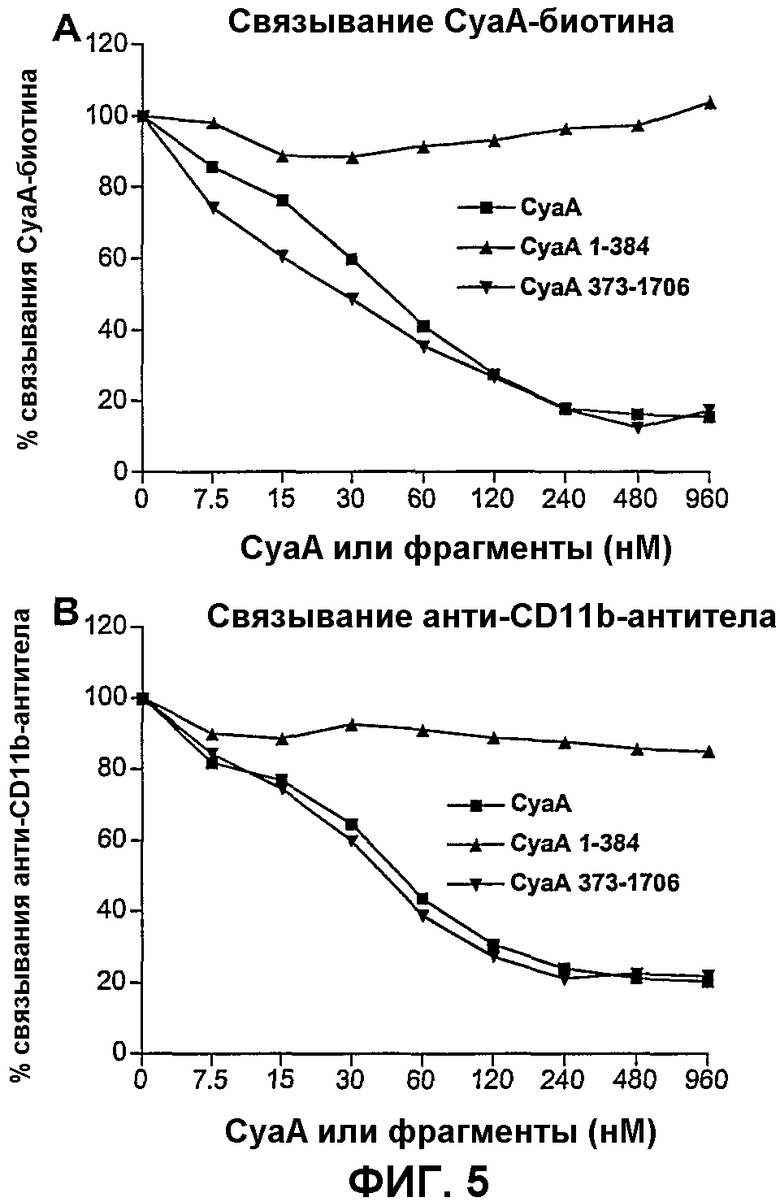
Фиг.5 Каталитический домен не является необходимым для взаимодействия CyaA с CD11b-клетками
Клетки СНО-CD11b предынкубировали с указанными концентрациями CyaA, CyaA 1-384 или CyaA 373-1706. Затем клетки инкубировали либо с CyaA-биотином (А), либо с анти-CD11b-Mab (В). Связывание CyaA-биотина и анти-CD11b-Mab измеряли при помощи FACS. Результаты выражены в виде процента связывания = (связывание пробы)/(максимальное связывание)×100 и представляют по меньшей мере 2 независимых эксперимента.
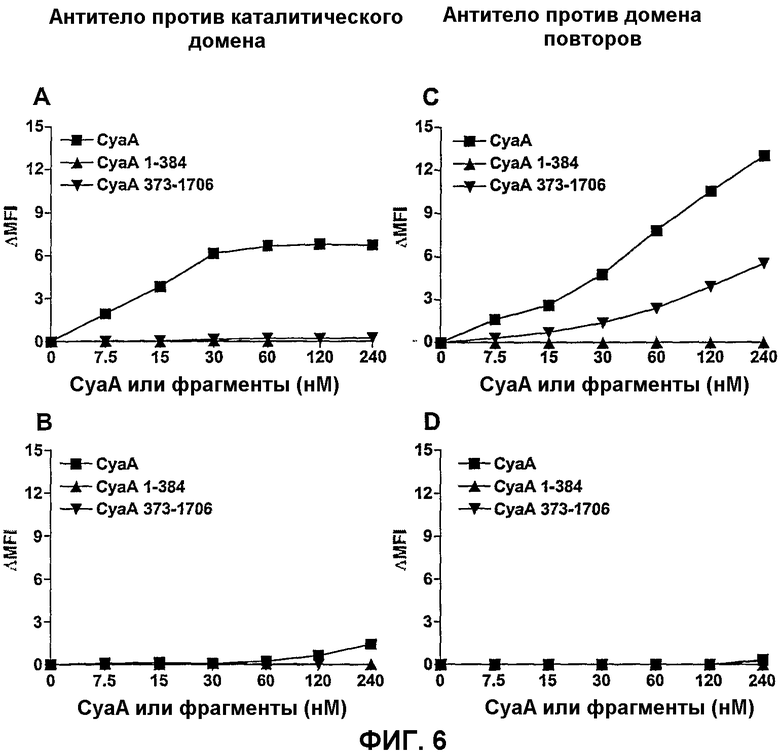
Фиг.6. Прямое связывание фрагментов CyaA с CD11b-клетками
Клетки СНО-CD11b (А, С) или СНО (В, D) инкубировали с указанными концентрациями CyaA, CyaA 1-384 или CyaA 373-1706. Затем поверхностно-связанный CyaA детектировали с анти-CyaA-5G12-Mab, которое узнает каталитический домен (А, В), или с анти-CyaA-6D7-Mab, которое узнает домен повторов (С, D). Результаты выражены виде ΔMFI = (величина MFI клеток, инкубированных с CyaA или фрагментами CyaA) - (величина MFI клеток, инкубированных без CyaA или фрагментов CyaA) и представляют по меньшей мере 2 независимых эксперимента.
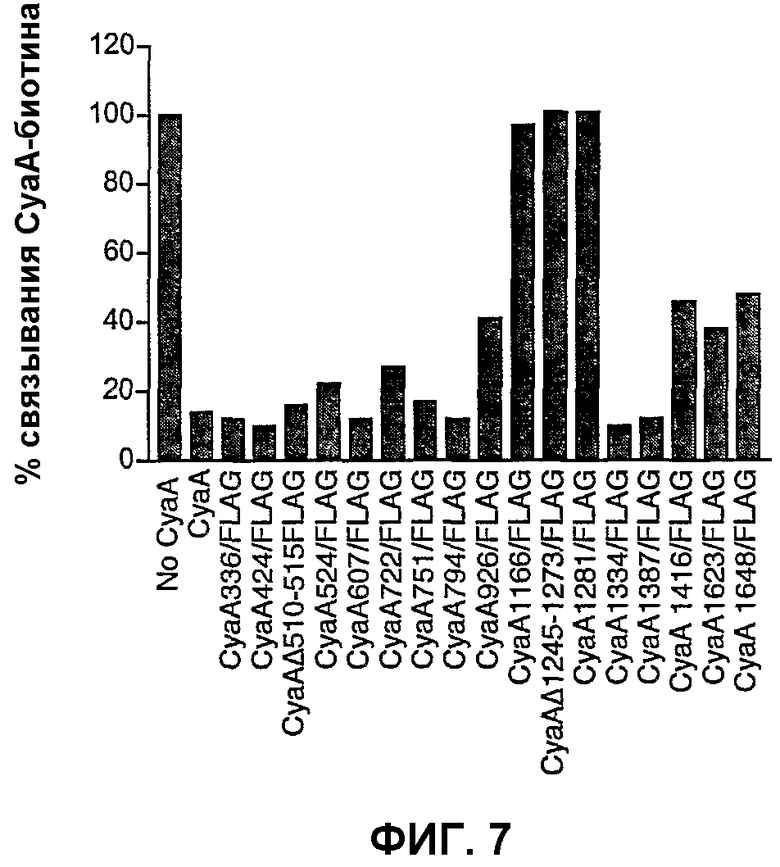
Фиг.7. Связывание CyaA-биотина с клетками СНО-CD11b в присутствии мутантов CyaA-FLAG
Клетки СНО-CD11b предынкубировали с CyaA или мутантами CyaA-FLAG (30 нМ). Затем добавляли CyaA-биотин при непрерывном присутствии CyaA или молекул CyaA-FLAG. Поверхностно-связанный CyaA-биотин детектировали при помощи FACS со стрептавидином-РЕ. Результаты выражены в виде процента связывания = (связывание пробы)/(максимальное связывание)×100 и представляют по меньшей мере 2 независимых эксперимента.
Фиг.8. Анализ с использованием электрофореза в ДСН-ПААГ очищенных препаратов CyaA и их инвазивная активность на эритроцитах
(А) Молекулы CyaA/FLAG вместе с CyaA дикого типа очищали из экстрактов мочевиной при помощи ДЭАЭ- и фенил-сефарозной хроматографии, как описано ранее (Karimova et al., 1998). Приблизительно 3 мкг каждого белка анализировали на 7,5% акриламидном геле, окрашенном Кумасси синим. (В) Инвазивная активность молекул CyaA/FLAG на овечьих эритроцитах. Два микрограмма различных белков CyaA инкубировали с 5×108 промытыми овечьими эритроцитами в течение 30 минут, и количество АС-активности, перемещенное в эти клетки, определяли, как описано ранее (Osicka et al., 2000). Эта величина представляет среднее из трех экспериментов, выполненных в двух повторах (n=6).
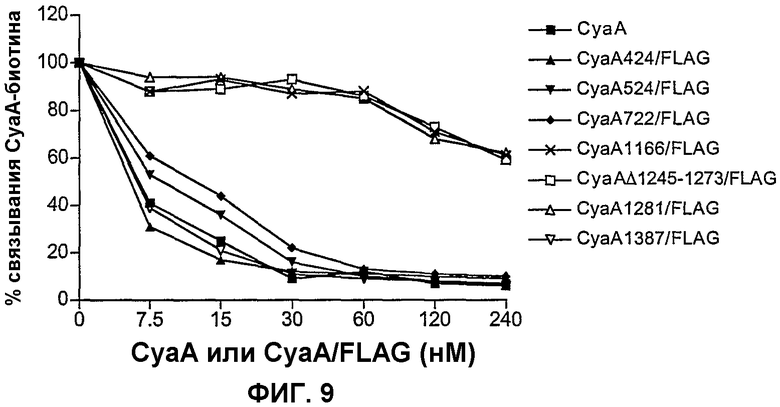
Фиг.9. Связывание CyaA с клетками СНО-CD11b в присутствии выбранных мутантов CyaA-FLAG
Клетки СНО-CD11b предынкубировали с CyaA или мутантами CyaA-FLAG при указанных концентрациях в диапазоне 7,5 нМ-240 нМ. Добавляли CyaA-биотин при непрерывном присутствии молекул CyaA и детектировали поверхностно-связанный CyaA-биотин. Результаты выражены в виде процента связывания = (связывание пробы)/(максимальное связывание)×100 и представляют по меньшей мере 2 независимых эксперимента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
А. Материалы и способы
А.1 Получение, очистка и модификация произведенных из CyaA белков
ДНК-манипуляции выполняли в соответствии со стандартными протоколами (Sambrook et al., 1989) в штамме Escherichia coli XL1-Blue (Stratagene, Amsterdam, Netherlands) в качестве клеток-хозяев. Плазмиды, кодирующие неацилированный proCyaA дикого типа (pACT7), ацилированный CyaA дикого типа (pT7CACT1) и рекомбинантный детоксифицированный CyaA-Е5-CysOVA, несущий уникальный остаток цистеина и эпитоп OVA в его каталитическом домене (pCACT-E5-CysOva), уже были описаны (Gmira et al., 2001; Guermonprez et al., 2001; Osicka et al., 2000; Sebo et al., 1991). Плазмида, кодирующая CyaA 373-1706 (pTRCyaAΔ1-373) является производным pTRCAG (Gmira et al., 2001), в которой ДНК-последовательность, кодирующая каталитический домен этого токсина (содержащийся между сайтами NdeI и BstBI), была делетирована и заменена соответствующим синтетическим двухцепочечным олигонуклеотидом, кодирующим аминокислотную последовательность: Met-Gly-Cys-Gly-Asn.
Протокол для получения CyaA был уже описан в другом месте (Karimova et al., 1998). Все белки экспрессировали в штамме E.coli BLR (Novagen, Merck KG, Darmstadt, Germany) и очищали до гомогенности, большей чем 95% (как определено анализом электрофореза в ДСН-геле) из телец включения двухстадийной процедурой, включающей в себя хроматографию на ДЭАЭ-сефарозе и хроматографию на фенил-сефарозе, как описано в Guermonprez et al., 2000. Очищенный белок CyaA-Е5-CysOVA метили на его уникальном остатке цистеина сульфгидрильным реагентом N-(6-биотинамидо)гексил)-3'-(2'-пиридилдитио)пропионамидом (биотин-HPDP) (Pierce, Bezons, France) в соответствии с инструкциями изготовителя. Биотинилированный CyaA повторно очищали на ДЭАЭ-сефарозе для удаления непрореагировавшего реагента биотин-HPDP. CyaA 1-384 экспрессировали и очищали, как описано в Ladant et al., 1992.
Концентрации токсина определяли спектрофотометрически из поглощения при 278 нм с использованием коэффициента молекулярной экстинкции 141 мМ-1·см-1 для полноразмерных CyaA-токсинов, 113 мМ-1·см-1 для CyaA 373-1706 и 28 мМ-1·см-1 для CyaA 1-384.
Молекулы CyaA-FLAG конструировали с использованием предварительно определенных пермиссивных сайтов инсертирования вдоль молекулы CyaA (Osicka et al., 2000). Авторы создавали серию из 17 CyaA-конструкций, которые несли в индивидуальных пермиссивных положениях синтетический октапептидный инсерт Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys для эпитопа FLAG (Sigma, Saint Quentin Fallavier, France). Для достижения этого три пары двухцепочечных синтетических олигонуклеотидов (5'-GTACTGATTATAAAGATGACGATGACAAATCAC + 5'-GTACGTGATTTGTCATCGTCATCTTTATAATCA, 5'-GTACTTATCGATTATAAAGATGACGATGACAAA + 5'-GTACTTTGTCATCGTCATCTTTATAATCGATAA и 5'-GTACGTGGATTATAAA GATGACGATGACAAAGC + 5'-GTACGCTTTGTCATCGTCATCTTTATAATCCAC, соответственно) (SEQ ID NO:5-10), кодирующие эпитоп FLAG в требующихся рамках считывания, инсертировали в уникальные сайты BsrGI, предварительно введенные в cyaA (Osicka et al., 2000). Правильные инсерции проверяли секвенированием ДНК, рекомбинантные молекулы CyaA экспрессировали в E.coli и очищали. Инвазивную способность выбранных молекул CyaA/FLAG характеризовали с использованием овечьих эритроцитов в качестве клеток-мишеней, как описано ранее (Osicka et al., 2000).
А.2 Получение моноклональных анти-CyaA-антител
Мышей BALB/c сначала иммунизировали внутрибрюшинно токсином CyaA (20 мкг в квасцах). При интервале приблизительно две недели мышей повторно иммунизировали 10 мкг CyaA в квасцах 3 раза. На протяжении протокола иммунизации у мышей брали кровь, и их сыворотки тестировали на присутствие анти-CyaA-антител при помощи ELISA. При детектировании значительных титров сывороток выполняли последнюю бустер-иммунизацию этих мышей и их спленоциты сливали с миеломными клетками Р3Х63 (АТСС, Manassas, USA) спустя 3 дня. Полученные гибридомы подвергали скринингу на продуцирование CyaA-специфических моноклональных антител при помощи ELISA. Затем отбирали высокопродуктивные гибридомы и клонировали посредством лимитирующих разведений одиночных клеток и затем использовали для получения асцитов в голых мышах BALB/c для генерирования больших количеств моноклональных антител. Моноклональные антитела очищали из асцитов с использованием набора для очистки Т-Gel™ (Pierce, Bezone, France) в соответствии с инструкциями изготовителя. Концентрации антител измеряли с использованием анализа белка Bio-Rad (Bio-Rad, Marnes La Coquette, France). Два из этих моноклональных антител использовали в этом исследовании: антитело 5G12, которое реагирует с эпитопом, локализованным в аминокислотах 1-190, и антитело 6D7, которое реагирует с эпитопом, локализованным в аминокислотах 1006-1706.
А.3 Клетки и культивирование
Клетки яичника Китайского хомячка, трансфицированные CD11b/CD18 человека (СНО-CD11b-клетки), CD11c/СНО человека (СНО-CD11c-клетки) или трансфицированные одним вектором (СНО-клетки), были любезным подарком D. Golenbock (Boston University School of Medicine, Boston, MA), и их культивировали в присутствии неомицина, как описано ранее (Ingalls et al., 1998).
А.4 Антитела
Моноклональные антитела, специфические в отношении CD11b (ICRF44, мышиный IgG1, κ) и CD11c человека (B-Ly6, мышиный IgG1, κ), покупали из BD Pharmingen (Le Pont de Claix, France).
А.5 Анализы связывания
Эти анализы выполняли, как описано Guermonprez et al., 2001. Вкратце, 2×105 клеток инкубировали с указанными концентрациями молекул CyaA в среде DMEM, содержащей 4,5 мг/мл глюкозы (Life Technologies, Cergy Pontoise, France) без сыворотки, в 96-луночных культуральных планшетах в течение 30 минут на льду. После промывания добавляли Mab против каталитического домена CyaA (5G12) или Mab против домена повторов CyaA (6D7) при 25 мкг/мл. В некоторых экспериментах клетки предынкубировали с указанными концентрациями молекул CyaA в течение 30 минут на льду. Затем добавляли раздельно CyaA-биотин (30 нМ), анти-CD11b-Mab (2 мкг/мл) или анти-CD11c-Mab (2 мкг/мл) (BD Pharmingen) при непрерывном присутствии токсинов.
После промывания и удаления супернатанта клетки окрашивали козьими антителами против мышиного IgG-РЕ (Caltag, Le Perray en Yvelines, France) или стрептавидином-РЕ (BD Pharmingen) при разведении 1:300. После последней промывки клетки анализировали проточной цитометрией на FACStar™ (Becton Dickinson, Le Pont de Claix, France) в присутствии 5 мкг/мл иодида пропидия. Агрегированные и мертвые клетки вычитали установками дискриминационного окна на основе исключения иодида пропидия. Данные связывания расшифровывали из средней интенсивности флуоресценции (MFI) и выражали в виде ΔMFI = (величина MFI клеток, инкубированных с CyaA) - (величина MFI клеток, инкубированных без CyaA) или в виде процента связывания = (связывание пробы)/(максимальное связывание)×100. Максимальное связывание соответствует (величина MFI клеток, инкубированных с CyaA или анти-CD11b в отсутствие конкурента) - (величина MFI клеток, инкубированных только со средой). Связывание пробы соответствует (величина MFI клеток, инкубированных с CyaA или анти-CD11b в присутствии конкурента) - (величина MFI клеток, инкубированных только со средой).
А.6 Анализ цАМФ
Циклический АМФ, накапливаемый в клетках, подвергаемых действию токсина CyaA, определяли по существу, как описано у Guermonprez et al., 2001. Вкратце, 5×105 клеток инкубировали с указанными концентрациями CyaA в DMEM + глюкоза в течение 20 минут при 37°С. После промывания цАМФ, накапливаемый в цитозоле клетки, высвобождали лизисом 0,1н. HCl и кипячением в течение 5 минут при 120°С. Затем после нейтрализации 0,1н. NaOH пробы добавляли в микротитрационные планшеты, предварительно покрытые конъюгатом цАМФ-БСА, и затем инкубировали с подходящим разведением кроличьей антисыворотки против цАМФ. После промывания анти-цАМФ-антитела обнаруживали антителами против кроличьего Ig, связанными со щелочной фосфатазой. Содержание цАМФ каждой пробы определяли из сравнения со стандартной кривой, полученной добавлением известной концентрации цАМФ.
А.7 Инвазивная активность CyaA
Инвазивную активность молекул CyaA определяли, как описано ранее Osicka et al., 2000. Вкратце, овечьи эритроциты инкубировали с токсином в течение 30 минут, и инвазивную активность измеряли в виде АС-активности, перемещенной в эритроциты и защищенной против расщепления внеклеточно добавленным трипсином.
В. Результаты
В.1 CyaA специфически связывается с CD11b + клетками и ингибирует связывание CyaA-биотина и анти-CD11b-антител с CD11b + клетками
Для исследования роли биологических и структурных свойств CyaA в его взаимодействии с CD11b разработали два дополняющих друг друга анализа: анализ связывания и конкурентный анализ. Анализ связывания состоял в инкубировании молекул CyaA с трансфицированными клетками СНО, экспрессирующими CD11b/CD18 человека (СНО-CD11b-клетки), или с ложно трансфицированными клетками СНО, и последующем детектировании клеточно-ассоциированного токсина с использованием моноклонального анти-CyaA-антитела (5G12), специфического в отношении каталитического домена. Как показано на фиг.1А, с использованием этого анализа, связывание CyaA специфически детектировали на CD11b+-клетках. В конкурентном анализе различные молекулы CyaA (мутанты или фрагменты) могут тестироваться на их способность конкурировать со связыванием с CyaA-биотином или моноклональным анти-CD11b-антителом (Mab) с CD11b+-клетками. В данном случае клетки СНО-CD11b инкубировали с CyaA при различных концентрациях в течение 30 минут на льду. Затем при непрерывном присутствии CyaA добавляли CyaA-биотин (30 нМ) или анти-CD11b-Mab (2 мкг/мл) и их связывание с этими клетками оценивали при помощи FACS. Как показано на фиг.1В, CyaA эффективно ингибировал связывание как CyaA-биотина, так и анти-CD11b-антитела с клетками СНО-CD11b зависимым от дозы образом. Это ингибирующее действие было специфическим в отношении CD11b, так как CyaA был совершенно не способен конкурировать с другим лигандом (анти-CD11c-Mab) за его специфический рецептор (CD11c), экспрессируемый клетками СНО (фиг.1С).
В.2 Отсутствие ацилирования CyaA влияет на его связывание с CD11b + -клетками
Поскольку хорошо установлено, что CyaA нуждается в посттрансляционном пальмитоилировании для выполнения его инвазивной активности и для образования гемолитических мембранных каналов, авторы изобретения испытывали, влияет ли отсутствие ацилирования на взаимодействие CyaA с CD11b+-клетками. В анализе связывания СНО-клетки и СНО-CD11b-клетки инкубировали с CyaA или с неацилированным proCyaA. Связывание оценивали с использованием Mab против каталитического домена CyaA (5G12). Как показано на фиг.2А, при низких концентрациях связывание как молекул CyaA, так и молекул proCyaA c CD11b+-клетками было довольно сравнимым с немного более эффективным связыванием ацилированного CyaA. Это могло быть обусловлено его усиленным взаимодействием с клеточной мембраной, лучшей адаптированной конформацией CyaA для связывания и/или более высокой аффинностью CyaA в отношении CD11b-рецептора. В самом деле, связывание proCyaA достигало насыщения при существенно более высоких концентрациях протоксина в сравнении со связыванием CyaA. Самым простым объяснением этого наблюдения могло быть то, что proCyaA связывает CD11b+-клетки с более низкой аффинностью, чем CyaA. При высоких концентрациях протоксина агрегаты и/или олигомеры proCyaA связывались с этими клетками и, следовательно, более высокие количества proCyaA были обнаружены связанными этой системой детектирования антител. В противоположность этому очень низкое связывание CyaA или proCyaA было обнаружено с контрольными клетками СНО (фиг.2В).
В.3 Ацилирование стабилизирует взаимодействие CyaA и CD11b + -клеток
Для дополнительного анализа роли ацилирования CyaA во взаимодействии этого токсина с CD11b+-клетками авторы изобретения тестировали способность неацилированного proCyaA конкурировать с CyaA за связывание с клетками СНО-CD11b. Как показано на фиг.3А, при сравнении с ацилированным CyaA неацилированный proCyaA проявлял значимо уменьшенную способность конкурировать с биотинилированным CyaA за связывание с CD11b+-клетками. Для определения, было ли отсутствие ингибирования обусловлено неэффективным взаимодействием с CD11b, авторы изобретения оценивали способность proCyaA блокировать связывание анти-CD11b-антитела с клетками СНО-CD11b. Действительно, в сравнении с CyaA proCyaA был не способен ингибировать связывание анти-CD11b-антитела с клетками СНО-CD11b (фиг.3В).
Поскольку сверхфизиологическое продуцирование цАМФ и интоксикация клеток являются следствиями взаимодействия CyaA с CD11b+-клетками, авторы изобретения анализировали затем, с использованием клеток СНО-CD11b, зависят ли эти функции токсина от ацилирования CyaA. Как и ожидалось, в противоположность ацилированному токсину proCyaA не индуцировал никакого увеличения цАМФ в клетках СНО-CD11b (фиг.4А) и не оказывал значимого цитотоксического действия на эти клетки (фиг.4В). Взятые вместе, эти результаты ясно демонстрируют, что ацилирование CyaA является необходимым для функционального взаимодействия этого токсина с CD11b+ клетками и что связывание proCyaA с CD11b является не достаточным для запуска цитотоксических действий на экспрессирующих CD11b-клетках.
В.4 Каталитический домен не является необходимым для взаимодействия CyaA с CD11b
Функционально CyaA состоит из двух основных доменов, несущих независимые активности. N-концевой домен несет аденилатциклазную активность (аминокислоты 1-400), тогда как карбокси-концевая гемолизиновая часть (аминокислоты 400-1706) является ответственной за доставку этого домена АС в клетки-мишени и гемолитическую активность B.pertussis. Для испытания роли этих двух функциональных доменов CyaA в связывании с CD11b+ клетками авторы изобретения испытывали способность каталитического домена, кодируемого остатками 1-384, CyaA 1-384, и гемолитической части молекулы, кодируемой остатками 373-1706, CyaA 373-1706, конкурировать за связывание с клетками СНО-CD11b с CyaA-биотином. Как показано на фиг.5А, каталитический домен был не способен ингибировать связывание CyaA-биотина с клетками СНО-CD11b, тогда как CyaA 373-1706 обнаруживал такое же ингибирование связывания, что и полноразмерный CyaA. Подобным образом, каталитический домен был не способен ингибировать связывание анти-CD11b-Mab с клетками СНО-CD11b (фиг.5В). Кроме того, прямые анализы связывания с анти-CyaA-Mab (5G12), специфическим в отношении каталитического домена, не смогли выявить какой-либо значимой ассоциации CyaA 1-384 с поверхностью клеток СНО-CD11b, тогда как связывание CyaA было легко детектируемым (фиг.6А). Прямое связывание CyaA 373-1706 с клетками СНО-CD11b не могло быть детектировано Mab 5G12, которое узнает эпитоп, расположенный в первых 200 аминокислотах CyaA, но было ясно продемонстрировано с использованием другого анти-CyaA-Mab (6D7), специфического в отношении домена повторов (фиг.6С). Опять, только слабое связывание CyaA или CyaA 373-1706 было детектировано c Mab 6D7 на клетках СНО, лишенных CD11b (фиг. 6В и D). Взятые вместе, эти результаты ясно демонстрируют, что каталитический домен не является необходимым для взаимодействия CyaA с CD11b и что домен взаимодействия CyaA/CD11b локализован во фрагменте CyaA 373-1706.
В.5 Домен CyaA, взаимодействующий с CD11b, локализован в районе повторов CyaA
Для идентификации района CyaA, который взаимодействует с CD11b, авторы изобретения экспрессировали и очищали различные субфрагменты С-концевого района CyaA 373-1706 (включающие в себя остатки 373-1490, или 700-1706, или 700-1490 или 1006-1706), которые испытывали в конкурентном анализе. Однако ни один из этих полипептидов не был способен конкурировать существенным образом со связыванием CyaA-биотина с клетками СНО-CD11b. Это может быть обусловлено тем фактом, что эти выделенные фрагменты принимают измененную конформацию. Таким образом, авторы изобретения использовали мутационный подход к определению местоположения CD11b-связывающего домена CyaA. Семнадцать различных модифицированных молекул CyaA конструировали инсертированием эпитопа FLAG (аминокислотной последовательности: DYKDDDDK) в различных определенных положениях по всему полипептиду токсина, как подробно описано в разделе «Материалы и способы». Авторы выдвинули гипотезу, что встраивание гетерологичного и высокозаряженного пептида в определенных положениях CD11b-связывающего домена может нарушать его способность взаимодействовать с CD11b. Эти 17 FLAG-меченных молекул CyaA экспрессировали и очищали до гомогенности и испытывали на способность связывания CyaA-биотина с клетками СНО-CD11b (следует обратить внимание на то, что в двух случаях, CyaAΔ510-515/FLAG и CyaAΔ1245-1273/FLAG, аминокислоты 510-515 или 1245-1273 CyaA, соответственно, были делетированы и заменены инсертированным FLAG-эпитопом). Как показано на фиг.7, инсерция FLAG-эпитопа в 3 различных сайтах, локализованных между остатками 1166-1281, полностью устраняла взаимодействие с CD11b. Соответствующий модифицированный CyaA был по существу не способен конкурировать с CyaA-биотином за связывание с CD11b при тестировании при концентрациях 30 нМ. В противоположность этому все другие FLAG-меченные рекомбинантные CyaA были способны конкурировать с CyaA-биотином за связывание с CD11b+-клетками, хотя и с варьирующейся эффективностью. Достойно внимания, что эти три рекомбинантные конструкции CyaA с FLAG-эпитопом, инсертированным вблизи карбоксиконцевой стороны белка (т.е. в положении 1416, 1623 и 1648), были частично ухудшенными в их способности конкурировать за связывание CD11b с CyaA-биотином.
Для дополнительной характеристики домена CyaA, который взаимодействует с CD11b, в дополнение к четырем другим молекулам CyaA/FLAG, авторы сосредоточили внимание на трех молекулах CyaA/FLAG, которые не могли ингибировать связывание CyaA-биотина с CD11b+ клетками так же эффективно, как интактный CyaA. Эти молекулы CyaA снова экспрессировали и очищали почти до гомогенности (фиг.8А) и их клеточно-инвазивную активность испытывали анализом их способности проникать через мембраны овечьих эритроцитов (RBC) и доставлять каталитический домен в компартмент, не доступный для добавляемого извне трипсина. Как показано на фиг.8В, за исключением CyaA1387/FLAG, на инвазивную активность всех других испытанных молекул CyaA/FLAG инсерция FLAG-пептида влияла до некоторой степени. Инвазивная активность CyaA524/FLAG, которая отражает способность CyaA перемещать каталитический домен в эритроциты, была полностью устранена инсерцией FLAG-пептида в положении остатка 524. Однако способности других белков, CyaA424/FLAG, CyaA722/FLAG и CyaA1166/FLAG и, до меньшей степени, белков CyaAΔ1245-1273/FLAG и CyaA1281/FLAG проникать в RBC были сравнимыми.
Способность этих молекул конкурировать с CyaA-биотином за связывание с клетками СНО-CD11b испытывали зависимым от дозы образом, как показано на фиг.9. Как и ожидалось, белки CyaA1166/FLAG, CyaAΔ1245-1273/FLAG и CyaA1281/FLAG были не способны ингибировать связывание CyaA-биотина с CD11b+-клетками даже при таких высоких концентрациях, как 240 нМ. В противоположность этому, все другие конструкции CyaA/FLAG ингибировали связывание CyaA-биотина зависимым от дозы образом, подобно интактному CyaA. Таким образом, отсутствие ингибирования связывания CyaA1166/FLAG, CyaAΔ1245-1273/FLAG и CyaA1281/FLAG не могло быть приписано генерализованному конформационному разрушению токсина, обусловленному инсерцией FLAG, так как инвазивная активность этих конструкций на RBC была сравнима с активностью белка CyaA424/FLAG, который очень эффективно взаимодействует с CD11b+-клетками.
Таким образом, эти результаты являются несомненным доказательством того, что часть домена CyaA с повторами RTX, ограниченная 1166 и 1281 остатками и содержащая заявленную петлю, расположенную между двумя консервативными блоками повторов RTX (Osicka et al., 2000), является решающей для взаимодействия CyaA с CD11b+-клетками, и она, наиболее вероятно, представляет главный интегринсвязывающий домен CyaA.
С. Обсуждение
Биологическая активность токсина аденилатциклазы (АСТ или CyaA) полностью зависит от ковалентного посттрансляционного ацилирования (ацилом жирных кислот). В отсутствие ацилирования консервативного остатка Lys-983 CyaA не может доставлять его каталитический домен в цитозоль эритроцитов и не способен образовывать гемолитические каналы (Barry et al., 1991; Basar et al., 2001; Hackett et al., 1994). Показано, что CyaA проникает с детектируемой эффективностью в большое разнообразие эукариотических клеток. Например, было продемонстрировано, что его первичными клетками-мишенями являются миелоидные клетки, такие как нейтрофилы и легочные макрофаги, которые являются особенно чувствительными к CyaA и парализуются и коммитируют до апоптоза после подвергания действию CyaA (Confer and Eaton, 1982; Khelef and Guiso, 1995; Khelef et al., 1993). Авторы изобретения, действительно, показали недавно, что этот токсин имеет специфический клеточный рецептор, αМβ2-интегрин (CD11b/CD18), который экспрессируется исключительно на таких иммунных клетках, как нейтрофилы, макрофаги или дендритные клетки, и что экспрессия CD11b, наиболее вероятно, ответственна за высокую чувствительность этих клеток к CyaA (Guermonprez et al., 2001). В данном исследовании авторы изобретения показали, что активация CyaA играет главную роль в его взаимодействии с CD11b+-клетками. Действительно, хотя неацилированный proCyaA был способен связываться с CD11b+-клетками так же эффективно, как и CyaA, он был неэффективен в конкуренции с ацилированным CyaA за связывание с СНО-CD11b+-клетками и был совершенно не способен блокировать связывание анти-CD11b-Mab с этими клетками. Это предполагает, что, хотя он и взаимодействует все еще с CD11b, природа взаимодействия и, в частности, аффинность и/или стабильность комплекса proCyaA-CD11b отличается существенно от этих свойств, участвующих во взаимодействии с CD11b зрелого CyaA. Кроме того, хотя proCyaA все еще способен связываться с рецептором CD11b, это взаимодействие не позволяет протоксину проникать через мембрану. Таким образом, ацилирование может требоваться для придания компетентной в отношении перемещения конформации CyaA, которая необходима для доставки каталитического домена в клеточный цитозоль, где он может катализировать превращение АТФ в цАМФ.
Функционально CyaA может быть разделен на два основных домена: один обеспеченный аденилатциклазной активностью домен, локализованный между остатками 1-400, и один ответственный за гемолитическую активность домен, локализованный между остатками 400-1706 (Ladant and Ullman, 1999). После взаимодействия токсина с клетками-мишенями каталитический домен может быть прямо перемещен через плазматическую мембрану эритроцитов. Представленные данные показывают, что, хотя каталитический домен играет ключевую роль в цитотоксической активности CyaA посредством катализа превращения АТФ в цАМФ, этот домен не требуется для связывания CyaA с его рецептором. Эти результаты дополнительно показывают, что домен взаимодействия CyaA/CD11b локализован в гемолизиновой части молекулы и, более точно, в части района богатых глицином и аспартатом RTX-повторов, содержащей остатки 1166-1281, определенной сайтами инсерции FLAG-эпитопа в конструкциях с сильно проявляемым связыванием с CD11b+-клетками. В частности, предсказанная структура петли, вставленная между двумя блоками RTX-повторов и содержащая остатки 1208-1243 (Osicka et al., 2000), могла бы играть решающую роль во взаимодействии CyaA с CD11b+-клетками. Утрата взаимодействия с CD11b конструкций CyaA1166/FLAG, CyaAΔ1245-1273 и CyaA1281/FLAG, соответственно, могла бы быть обусловлена структурными изменениями, селективно влияющими на функционально важный сегмент, участвующий специфически во взаимодействии белка CyaA с CD11b. Это кажется очень вероятным, так как все три конструкции, которые не могли связывать CD11b, все еще проявляли существенную клеточно-инвазивную активность (20%-50% активности интактного CyaA) в суррогатной системе анализа на эритроцитах, где активность токсина не зависит от взаимодействия с CD11b. Это свидетельствует о том, что инсерции FLAG в положениях 1166, 1245 и 1281 не нарушают всю структуру CyaA, а скорее селективно элиминируют способность этих конструкций взаимодействовать с CD11b+-клетками. Вместе, эти результаты предполагают, что остатки 1166-1281 CyaA очерчивают существенную часть интегринсвязывающего домена, участвующего во взаимодействии токсина с αМβ2-интегрином (CD11b/CD18).
Этот вывод подтверждается результатами, показывающими, что все варианты CyaA с FLAG-пептидом, инсертированным в первых 800 остатках CyaA, полностью конкурировали за связывание с CD11b с биотинилированным интактным CyaA. В противоположность этому, CD11b-связывающая способность была несколько уменьшена также для белков CyaA1416/FLAG, CyaA/FLAG1623 и CyaA/FLAG1648, что предполагает, что вспомогательный CD11b-взаимодействующий домен CyaA может быть локализован в направлении карбоксиконцевой стороны части RTX-повторов этого токсина.
Приведенные результаты, которые идентифицируют район 1166-1287 как главный CD11b-связывающий мотив CyaA, предоставляют привлекательное объяснение более раннего наблюдения, что связывание CyaA с CD11b было строго кальцийзависимым (Guermonprez et al., 2001). Поскольку RTX-домен участвует в связывании кальция и подвергается большой структурной реаранжировке после связывания кальция (Rose et al., 1995), можно сделать предположение, что CD11b связывающий мотив, расположенный в области 1166-1287, может подвергаться только воздействию кальцийсвязанной конформации RTX-домен. CD11b-связывающий мотив, идентифицированный здесь в районе аминокислот 1166-1287 CyaA, локализован точно между вторым и третьим блоками RTX-повторов. Можно сделать предположение, что α-спиральное структурирование этого сегмента участвует в образовании сайта приема («докинга») для CD11b.
CyaA использовали в нескольких протоколах пассивной и активной защиты в мышиных моделях коклюша. Иммунизация специфическими анти-CyaA-антителами или очищенным CyaA уменьшала временной ход колонизации дыхательных путей B.pertussis и защищала мышей против летальной интраназальной инфекции (Guiso et al., 1989; Guiso et al., 1991). Кроме того, антитела, специфические в отношении CyaA, детектировали в сыворотках детей (человека), инфицированных B.pertussis (Arciniega et al., 1991; Guiso et al., 1993). Приведенные здесь результаты предполагают, что молекула CyaA, лишенная домена взаимодействия CyaA/CD11b, может быть сконструирована для получения безопасной бесклеточной вакцины для защиты против инфекции B.pertussis. Каталитическая активность такой молекулы может быть легко инактивирована инсерциями дипептида в сайте связывания АТФ, локализованном между остатками 188 и 189 CyaA (Fayolle et al., 1996), тогда как делеция в домене взаимодействия CD11b могла бы предотвращать потенциально негативные эффекты иммунных клеток, таких как передача сигнала после связывания интегрина токсоидом и/или некоторое функциональное вмешательство, обусловленное конкуренцией за связывание с CD11b с токсоидом CyaA, который также служит в качестве дополнительного рецептора CR3.
В заключение, авторы считают, что представленные результаты обеспечивают важные способности проникновения в роль ацилирования и различных доменов аденилатциклазы B.pertussis в ее взаимодействии с CD11b+ клетками, а также в последующих биологических активностях, запускаемых этим взаимодействием.




























Группа изобретений относится к медицине, а именно к инфекционным болезням, и может быть использована для лечения коклюша и/или для защиты против инфекции Bordetella. Полипептид по изобретению представляет собой фрагмент аденилатциклазы Bordetella, содержащий домен взаимодействия CD11b/CD18 из последовательности аминокислот, простирающихся от положения 1166 до положения 1281 SEQ ID NO: 1. Данное изобретение относится также к специфическим фрагментам аденилатциклазы Bordetella, содержащим домен взаимодействия CD11b/CD18, и их применению, в частности для нацеливания представляющей интерес молекулы на экспрессирующие CD11b клетки. Использование изобретений позволяет расширить арсенал средств для лечения и предотвращения инфекции, вызываемой Bordetella. 12 н. и 14 з.п. ф-лы, 9 ил.
1. Полипептид, представляющий собой фрагмент аденилатциклазы Bordetella, где указанный полипептид способен связываться с CD11b/CD18 и содержит домен взаимодействия CD11b/CD18 указанной аденилатциклазы Bordetella дикого типа, состоящий из:
(i) последовательности аминокислот, простирающихся от положения 1166 до положения 1281 SEQ ID NO: 1; или
(ii) последовательности аминокислот SEQ ID NO: 4; или
(iii) соответствующего домена аденилатциклазы вида Bordetella, идентифицированного сопоставлением последовательности аденилатциклазы указанного вида Bordetella с последовательностью, простирающейся от аминокислоты 1166 до аминокислоты 1281 SEQ ID NO: 1 до достижения наилучшего локального сопоставления,
где указанный полипептид имеет до 500 аминокислот.
2. Полипептид по п.1, который способен индуцировать антитела, узнающие специфически аденилатциклазу вида Bordetella, предпочтительно аденилатциклазу Bordetella pertussis.
3. Полипептид по п.1, где указанный полипептид:
(i) простирается от аминокислоты 1166 до аминокислоты 1281 SEQ ID NO: 1;
(ii) представляет собой соответствующий домен аденилатциклазы вида Bordetella, идентифицированный сопоставлением последовательности аденилатциклазы указанного вида Bordetella с последовательностью охарактеризованной в (i) до достижения наилучшего локального сопоставления.
4. Полипептид по п.1, который дополнительно содержит домен ацилирования аденилатциклазы и/или гидрофобный домен.
5. Полипептид по п.1, где указанный полипептид является нетоксичным при введении in vivo млекопитающему.
6. Применение полипептида по любому из пп.1-5 в приготовлении вектора для специфического нацеливания на экспрессирующие CD11b клетки представляющей интерес молекулы, связанной с указанным полипептидом.
7. Белковый вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b/CD18 клетки, характеризующийся тем, что указанный вектор содержит полипептид, способный связываться с CD11b/CD18 по п.1, связанный с представляющей интерес молекулой.
8. Белковый вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b/CD18 клетки, характеризующийся тем, что указанный вектор содержит полипептид, способный связываться с CD11b/CD18 по любому из пп.2-5, связанный с представляющей интерес молекулой.
9. Белковый вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b/CD18 клетки по п.7, где указанная представляющая интерес молекула выбрана из группы, состоящей из пептидов, гликопептидов, липопептидов, полисахаридов, олигосахаридов, нуклеиновых кислот, липидов и химических веществ.
10. Белковый вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b/CD18 клетки по п.7, где указанной представляющей интерес молекулой является активное (действующее) начало лекарственного средства.
11. Белковый вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b/CDIS клетки по п.7, где указанная представляющая интерес молекула связана химической связью.
12. Белковый вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b/CD18 клетки по п.7, где указанная представляющая интерес молекула содержит антиген или эпитоп.
13. Белковый вектор для нацеливания представляющей интерес молекулы на экспрессирующие CD11b/CD18 клетки по п.7, где указанной представляющей интерес молекулой является пептид или полипептид, содержащий антиген или эпитоп.
14. Нуклеиновая кислота, которая кодирует один из следующих полипептидов:
а. полипептид по любому из пп.1-5;
b. белковый вектор по п.7.
15. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п.14, подходящий для экспрессии кодируемого полипептида в клетке-хозяине.
16. Экспрессирующий вектор по п.15, который является плазмидой, космидой, фагмидой или вирусной ДНК.
17. Клетка-хозяин, содержащая нуклеиновую кислоту по п.14.
18. Клетка-хозяин, содержащая экспрессирующий вектор по п.16.
19. Композиция, содержащая белковый вектор по п.7, подходящая для введения животному- или человеку-хозяину, которому требуется нацеливание на определенные лейкоциты.
20. Композиция по п.19, где указанные лейкоциты представляют собой миелоидные дендритные клетки, нейтрофилы или макрофаги.
21. Поликлональная сыворотка, получаемая иммунизацией животного или человека полипептидом по п.1 или композицией по п.19 или 20.
22. Поликлональная сыворотка по п.21, которая способна блокировать связывание аденилатциклазы с CD11b/CD18.
23. Способ нацеливания in vitro представляющей интерес молекулы на экспрессирующие CD11b клетки, предусматривающий
а. обеспечение экспрессирующих CD11b клеток, экстрагированных из живого организма, и
b. культивирование указанных экспрессирующих CD11b клеток с белковым вектором по п.7 при подходящих условиях для нацеливания указанного вектора на указанные экспрессирующие CD11b клетки.
24. Способ по п.23, где указанная представляющая интерес молекула содержит антиген или эпитоп.
25. Способ по п.23, где указанными экспрессирующими CD11b клетками являются миелоидные дендритные клетки.
26. Экспрессирующие CD11b клетки, содержащие представляющую интерес молекулу, получаемую способом нацеливания по любому из пп.23-25.
| OSICKA R et al | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| реферат, он-лайн [Найдено в Интернет на www.pubmed.com 21.12.2010], | |||
Авторы
Даты
2011-06-20—Публикация
2004-06-18—Подача