ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет временной заявке США № 61/875933 (поданной 10 сентября 2013 года) и временной заявке США № 61/930754 (поданной 23 января 2014 года). Содержание каждой из этих заявок включено в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Описанное изобретение относится к раку ободочной и прямой кишки, гену опухолевой супрессии APC, укороченным продуктам гена APC, продуцируемым в результате мутации гена, и к лекарственным средствам, нацеленным на клеточные линии рака толстого кишечника и другие клеточные лини злокачественной опухоли человека с укороченными продуктами гена APC.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0003] Рак ободочной и прямой кишки (CRC) является третьей из наиболее часто диагностируемых злокачественных опухолей и третьей из основных причин обусловленной злокачественной опухолью смертности в США, и, согласно оценке, в 2011 году диагностировано 141000 случаев рака рак толстой и прямой кишки. Таким образом, у 1 из 19 американцев будет диагностирован CRC на протяжении их жизни с общим риском 5,4%. К счастью, хирургическое удаление ранних неинвазивных аденом обычно приводит к излечению. Однако существует мало эффективных возможностей лечения для пациентов, страдающих развернутыми формами CRC, и их прогноз часто является плохим. Несмотря на длительную латентную фазу, слишком мало очагов повреждения идентифицируют на стадии, когда они могут быть хирургически удалены (См. Phelps et al. Cell Cycle, 2009; 8:16, 2549-2556).
[0004] Мутации в гене опухолевой супрессии APC человека связаны с семейным аденоматозным полипозом (FAP), наследственным состоянием предрасположенности к злокачественной опухоли, при котором в эпителии толстого кишечника образуются многочисленные полипы (См. Kinzler et al., Science, 1991; 253:661-665; Kinzler и Vogelstein, Cell, 1996; 87:159-170; Half et al., Orphanet Journal of Rare Diseases, 2009; 4:22). Развитие CRC начинается с аберрантного роста аденоматозных полипов из эпителия толстой кишки, которые в итоге развиваются в агрессивные карциномы (См. Kinzler and Vogelstein, Cell, 1996; 87: 159-170). Сообщалось, что приблизительно 85% случаев спорадического рака ободочной и прямой кишки содержат мутации, укорачивающие APC (См. Kinzler and Vogelstein, Cell, 1996; 87:159-170). Рост полипов в большинстве случаев ассоциирован с изменениями в обоих аллелях гена аденоматозного полипоза толстого кишечника (APC). Первое мутационное воздействие происходит приблизительно в середине открытой рамки считывания, создавая укороченную молекулу APC, лишенную C-концевой половины. Такие мутации с укорочением расположены в так называемой кластерной области мутаций (MCR) (См. Schneikert et al., Human Molecular Genetics, 2006; 16: 199-209). Второе мутационное воздействие вовлекает либо делецию второго аллеля, либо мутацию, которая приводит к синтезу укороченного продукта, практически никогда не происходящему после MCR (См. Schneikert et al., Human Molecular Genetics, 2006; 16: 199-209). Таким образом, клетки рака толстого кишечника экспрессируют по меньшей мере укороченную молекулу APC, длина которой определяется положением MCR и, изредка, дополнительным, но более коротким фрагментом.
[0005] Лечение CRC в основном связано с химиотерапевтическими средствами, которые действуют с минимальной специфичностью в отношении исходной генетической основы заболевания. Эти химиотерапевтические средства часто нарушают функцию нормальных клеток одновременно с разрушением злокачественных клеток, вследствие общей зависимости от химической мишени. Таким образом, требуется более специфические лекарственные средства для улучшения лечения пациентов, у которых диагностирован CRC.
Ген аденоматозного полипоза толстого кишечника (APC)
[0006] APC, который не действует как классический опухолевый супрессор, влияет на передачу сигнала Wnt, тем самым, регулируя транскрипцию гена. Wnt представляют собой семейство секретируемых цистеин-богатых гликопротеинов, которые вовлечены в регуляцию поддержания, пролиферации и дифференцировки стволовых клеток в процессе эмбрионального развития. Каноническая передача сигнала Wnt повышает стабильность цитоплазматического β-катенина посредством рецептор-опосредуемой инактивации киназы GSK-3 и ускоряет транслокацию β-катенина в ядро. Канонический каскад передачи сигнала Wnt также функционирует как митоген стволовых клеток через стабилизацию внутриклеточного β-катенина и активацию комплекса транскрипции β-катенин/TCF/LEF, что приводит к активации экспрессии генов, регулирующих клеточный цикл, таких как Myc, циклин D1, EPhrinB (EPhB) и Msx1, которые стимулируют пролиферацию клеток (См. Cayuso and Marti, Journal of Neurobiology, 2005; 64:376-387).
[0007] APC является отрицательным регулятором передачи сигнала Wnt. Без этой отрицательной регуляции каскад Wnt является более активным, и он важен при злокачественной опухоли (См. Polakis, Current Opinion in Genetics & Development, 2007; 17: 45-51). Исследования, сравнивающие опухолевые клетки с мутациями в обоих аллелях APC для сопоставления уровней передачи сигнала Wnt и тяжести заболевания как у человека, так и мышей, помогли установить модель, в которой эффекты дозы генов создают определенное окно усиленной передачи сигнала Wnt, что приводит к образованию полипов в кишечнике. Комбинации "более мягких" мутаций APC, ассоциированных с более слабым усилением передачи сигнала Wnt, дают начало опухолям во внекишечных тканях. Согласно этой модели, природа генеративной мутации в APC определяет тип соматической мутации, которая происходит во втором аллеле (См. Minde et al. Molecular Cancer, 2011; 10:101).
Белок APC
[0008] Продукт гена APC представляет собой белок массой 312 кДа, состоящий из множества доменов, которые связываются с различными белками, включая бета-катенин, аксин, C-концевой связывающий белок (CtBP), APC-стимулируемые факторы обмена гуаниновыми нуклеотидами (Asefs), белок, подобный белку, активирующему GTP-азу Ras (IQGAP1), белок концевого связывания 1 (EB1) и микротрубочки. Исследования с использованием мутантных мышей и культивируемых клеток продемонстрировали, что APC подавляет каноническую передачу сигнала Wnt, которая необходима для образования опухоли, развития и гомеостаза различных типов клеток, включая эпителиальные и лимфоидные клетки. Дальнейшие исследования показали, что белок APC функционирует в нескольких других фундаментальных клеточных процессах. Эти клеточные процессы включают адгезию и миграцию клеток, организацию сетей актина и микротрубочек, образование веретена деления и расхождение хромосом. Нарушение регуляции этих процессов, вызываемое мутациями в APC, вовлечено в инициацию и распространение рака толстого кишечника (См. Aoki and Taketo, Journal of Cell Science, 2007; 120:3327-3335).
[0009] Белок APC выполняет функцию сигнального узла или каркаса, поскольку он физически взаимодействует с рядом белков, связанных с канцерогенезом. Утрата APC влияет на адгезию клеток, миграцию клеток, цитоскелет и расхождение хромосом (См. Aoki and Taketo, Journal of Cell Science, 2007; 120:3327-3335).
[0010] Большинство исследователей полагают, что мутации в APC вызывают изменение с потерей функции при раке толстого кишечника. Миссенс-мутации приводят к точковым мутациям APC, в то время как мутации с укорочением вызывают утрату больших частей белка APC, включая определенные регуляторные домены. Значительное количество миссенс-мутаций APC описано в опухолях, происходящих из различных тканей, и они связаны с худшим исходом заболевания при инвазивных уротелиальных карциномах (См. Kastritis et al., International Journal of Cancer, 2009; 124:103-108), указывая на функциональную значимость белка APC с точковой мутацией в развитии внекишечных опухолей. Молекулярная основа препятствования этими мутациями функции APC остается неустановленной.
[0011] Мутация APC, вызывающая изменение функции, может вызывать нестабильность хромосомы по меньшей мере тремя путями: путем уменьшения взаимодействия кинетохор-микротрубочка, путем утраты функции точки контроля митоза и путем образования полиплоидных клеток. Например, исследования показали, что APC, связанный с микротрубочками, повышал стабильность микротрубочек in vivo и in vitro, указывая на роль APC в стабильности микротрубочек (См. Zumbrunn et al., Current Biology, 2001; 11:44-49). Укороченный APC приводил к нестабильности хромосом в эмбриональных стволовых клетках мыши (См. Fodde et al., Nature Cell Biology, 2001; 3:433-438), препятствовал присоединению к плюс-концу микротрубочек и вызывал значительное увеличение аномалий митоза (См. Green and Kaplan, Journal of Cell Biology, 2003; 163:949-961). Исследования показали, что злокачественные клетки с мутациями APC имеют сниженную способность к коррекции ошибочного связывания кинетохор-микротрубочка, что является причиной широкого распространения нестабильности хромосом в опухолях (См. Bakhoum et al., Current Biology, 2009; 19:1937-1942). Кроме того, сообщалось, что с утратой функции APC происходило устранение функции точки контроля веретена деления. Нокдаун APC с использованием миРНК показал, что утрата APC вызывает утрату функции точки контроля митотического веретена деления путем уменьшения связывания между кинетохором и белками точки контроля Bub1 и Bubr1. Таким образом, утрата APC снижает апоптоз и индуцирует полиплоидию (См. Kaplan et al., Nature Cell Biology, 2001; 3:429-432; Dikovskaya et al., Journal of Cell Biology, 2007; 176:183-195; Rusan and Peifer, Journal of Cell Biology, 2008; 181:719-726). Полиплоидия является основным источником анеуплоидии, поскольку она может приводить к многополюсному митозу (См. Shi and King, Nature, 2005; 437:1038-1042).
[0012] Хотя потеря функции из-за APC может быть частично верной, существуют сообщения, демонстрирующие, что большая часть пациентов с раком толстого кишечника имеют по меньшей мере один продукт гена APC, который является укороченным, и что он имеет приобретенную функцию. Таким образом, укороченные белки APC могут играть активную роль в инициации и прогрессировании рака толстого кишечника в противоположность рецессивности; например, укороченный APC, но не полноразмерный APC, может активировать Asef и стимулировать миграцию клеток.
[0013] Хотя дефекты в APC происходят в высокой доле случаев рака толстого кишечника, в настоящее время отсутствуют терапевтические средства, нацеленные на уязвимость, являющуюся результатом этих дефектов. Описанное изобретение относится к низкомолекулярным ингибиторным соединениям, которые селективно нацелены на укороченный APC в иммортализованных клетках эпителия толстого кишечника человека (HCEC), для лечения рака толстого кишечника.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0014] Согласно одному аспекту, описанное изобретение относится к серии низкомолекулярных соединений, которые селективно ингибируют рост злокачественных клеток человека, которые содержат укороченный белок аденоматозного полипоза толстого кишечника (APC).
[0015] Согласно одному варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение формулы I. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение формулы I-a. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение формулы I-b. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение формулы I-c. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение формулы I-d. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение, выбранное из группы, состоящей из 43 структур, описанных в п.3 формулы изобретения. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение структурной формулы, описанной в п.5 формулы изобретения. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли выбрано из группы, состоящей из 5 структур, описанных в п.7 формулы изобретения. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли представляет собой соединение структурной формулы, описанной в п.9 формулы изобретения. Согласно другому варианту осуществления, IC50 низкомолекулярного соединения против злокачественной опухоли составляет от 0,01 нМ до 5 мкМ. Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли имеет форму фармацевтической композиции, содержащей терапевтическое количество соединения и фармацевтически приемлемый носитель. Согласно другому варианту осуществления, терапевтическое количество низкомолекулярного соединения против злокачественной опухоли является эффективным для ингибирования роста опухоли, ингибирования пролиферации опухоли, индукции клеточной гибели или их комбинации.
[0016] Согласно другому аспекту, описанное изобретение относится к способу лечения рака ободочной и прямой кишки у индивидуума, у которого эпителиальные клетки толстой кишки экспрессируют по меньшей мере один укороченный белок APC, включающему введение индивидууму фармацевтической композиции, содержащей терапевтическое количество по меньшей мере одного низкомолекулярного соединения против злокачественной опухоли по любому из п.п.1-19 формулы изобретения и фармацевтически приемлемый носитель, где терапевтическое количество является эффективным д ля ингибирования роста опухоли, ингибирования пролиферации опухоли, индукции гибели клеток или их комбинации.
[0017] Согласно другому аспекту, описанное изобретение относится к иммортализованной эпителиальной клетке толстого кишечника человека (HCEC), содержащей полноразмерный ген APC дикого типа, где клетка содержит по меньшей мере одно из следующих: эктопически экспрессируемый вектор, содержащий гомолог вирусного онкогена саркомы крыс Кирстен (Krasv12), малая шпилечная РНК против опухолевого белка p53 (shp53) и малая шпилечная РНК против APC (shAPC). Согласно одному варианту осуществления, ген APC содержит соматическую мутацию в кодоне 1450. Согласно другому варианту осуществления, ген APC содержит соматическую мутацию в кодоне 1309. Согласно другому варианту осуществления, клетка экспрессирует белок LacZ. Согласно другому варианту осуществления, клетка экспрессирует гомолог вирусного онкогена саркомы крыс Кирстен (Krasv12) и малую шпилечную РНК против APC (shAPC). Согласно другому варианту осуществления, клетка трансдуцирована ретровирусной циклин-зависимой киназой 4 (Cdk4) и каталитическим компонентом теломеразы человека (hTERT).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0018] На фиг.1 представлена диаграмма крипты толстого кишечника. Крипты толстого кишечника состоят из слоя эпителиальных клеток, которые включают стволовые клетки, претерпевающие митоз, столбчатые всасывающие клетки, продуцирующие муцин бокаловидные клетки и энтероэндокринные клетки. Клетки дифференцируются и мигрируют на поверхность просвета крипты, где они вытесняются в просвет кишечника с помощью процесса запрограммированной клеточной гибели. Полагают, что APC участвует во всех из этих процессов прямо или непрямо путем модулирования профилей транскрипции в эпителиальных клетках кишечника (См. Goss et al., Journal of Clinical Oncology, 2000; 18:1967-1979). APC влияет на передачу сигнала Wnt через бета-катенин/TCF. Полноразмерный APC влияет на контроль клеточного цикла путем остановки клеток в G1/S через каскад ретинобластомы (Rb) и локализации на митотическом веретене деления и цитросомах в процессе M-фазы. APC влияет на миграцию клеток путем стабилизации микротрубочек и активации белка контроля делеция клеток 42 (cdc42). Наконец, полноразмерный APC влияет на дифференцировку и апоптоз клеток.
[0019] На фиг.2 проиллюстрированы возможные гены, вовлеченные в прогрессирование из нормального эпителия толстого кишечника в рак толстого кишечника. Полагают, что мутация APC является частым и ранним событием при раке ободочной и прямой кишки, поскольку мутации APC обнаруживаются более чем в 80% опухолей ободочной и прямой кишки и более 90% мутаций APC приводят к преждевременным стоп-кодонам с образованием укороченных продуктов гена.
[0020] На фиг.3 представлена структура полноразмерного и укороченного APC. Укороченный APC лишен связывающих доменов для бета-катенина и микротрубочек, но в нем сохранены связывающие домены для Asef, что, таким образом, приводит к активации пролиферации, индукции нестабильности хромосом и стимуляции миграции клеток (См. Fodde et al., Nat Rev Cancer, 1:55-67). Мутации A1309 и A1450 присутствуют наиболее часто.
[0021] На фиг.4 проиллюстрировано, что иммортализованные эпителиальные клетки толстого кишечника человека (HCEC) представляют собой нормальные диплоидные клетки и могут дифференцироваться. (A) Небольшие самоорганизующиеся многоклеточные структуры демонстрируют признаки поляризованного виллина и обычного окрашивания ядер. (B) Небольшие самоорганизующиеся многоклеточные структуры (11 сутки) демонстрируют признаки запирающей зоны 1 (ZO-1) и обычного окрашивания ядер. (C) Небольшие самоорганизующиеся многоклеточные структуры (11 сутки) демонстрируют признаки муцина [MUC]2, запирающей зоны 1 (ZO-1) и обычного окрашивания ядер. На (D) показано, что иммортализованные эпителиальные клетки толстого кишечника человека hTERT CDK4 дифференцировались аналогично первичным клеткам кишечника мыши. Клетки hTERT CDK являются на 100% положительными по LGR-5. LGR-5 является общепризнанным биомаркером стволовых клеток толстого кишечника (См. Roig et al. Gastro, 2010; 138:1012-1021).
[0022] На фиг.5 показано, что укорочение APC сообщает туморогенные свойства. Использованные изогенные клетки эпителия эпителия толстого кишечника человека (HCEC) представляли собой: HCEC, иммортализованные с помощью циклин-зависимой киназы 4 (CDK4) и обратной транскриптазы теломеразы человека (hTERT) (1CT); HCEC с генетическими изменениями CDK4, hTERT, гомолога вирусного онкогена саркомы крыс Кирстен (Krasv12), малой шпилечной РНК против APC (shAPC), (1CTRA); HCEC с генетическим изменениями CDK4, hTERT, Krasv12, малой шпилечной РНК против опухолевого белка p53 (shp53), shAPC (1CTRPA); 1CTRPA, экспрессирующие LacZ (1CTRPA LacZ); 1CTRPA, имеющие соматическую мутацию в кодоне 1450 (1CTRPA 1450); и 1CTRPA, имеющие соматическую мутацию в кодоне 1309 (1CTRPA 1309). В то время как 90% случаев потери функции APC не увеличивает туморогенные свойства, изогенное производное клеточной линии, содержащее укороченный APC, демонстрирует признаки трансформации. Это указывает на то, что укороченный APC обеспечивает приобретение функции, отражающее увеличение прогрессирования злокачественной опухоли, и может объяснить, почему у большой доли пациентов с CRC сохраняется укороченный белок APC.
[0023] На фиг.6 представлена блок-схема, демонстрирующая стадии идентификации TASIN-1 (селективный ингибитор укороченного APC) с использованием высокопроизводительного скрининга.
[0024] На фиг.7 показано, что TASIN-1 является селективно токсическим для линий рака ободочной и прямой кишки (CRC) с укорочением APC. (a) Таблица клеточных линий и их генетических изменений (b) Валидация эктопической экспрессии укороченного APC, нокдауна APC WT и p53 и экспрессии онкогенного Krasv12 с использованием вестерн-блоттинга и анализа рестрикционного расщепления. Клеточная линия, использованная в первичном скрининге, выделена красной рамкой. (с) Блок-схема, демонстрирующая стадии идентификации TASIN-1 (селективный ингибитор укороченного APC) с использованием высокопроизводительного скрининга (d) Химическая структура TASIN-1 (e) Кривая доза-эффект для TASIN-1 в клетках HCT116 и DLD1. В таблице (e) приведено значение IC50 для обеих клеточных линий. DLD1 экспрессирует укороченный APC, в то время как HCT116 экспрессирует APC дикого типа. Таким образом, TASIN-1 ингибирует клетки DLD1, экспрессирующие укороченный APC из выживших и формирующихся колоний, но имеет небольшое воздействие или отсутствие воздействия на клетки HCT116. (f) Репрезентативные фотографии и количественное определение клеток HCT116 и DLD1, выращиваемых в мягком агаре в присутствии или в отсутствие TASIN-1 в течение 7 суток. Данные соответствуют среднему значению±s.d., n=3. T-критерий Стьюдента, ***P<0,001.
[0025] На фиг.8 проиллюстрировано, что эктопическая экспрессия укороченного APC сообщает туморогенные свойства. (a) Эктопическая экспрессия укорочения APC увеличивала скорость роста клеток 1CTRPA A1309 по сравнению с 1CTRPA. Кратность изменения эффективности образования колоний в мягком агаре (b) или инвазии через Matrigel® (c) в клетках 1CTRPA A1309 по сравнению с 1CTRPA. Данные соответствуют среднему значению±s.d., n=3. T-критерий Стьюдента, *P<0,05, **P<0,01, ***P<0,001.
[0026] На фиг.9 проиллюстрировано, что нокдаун укороченного APC десенсибилизирует клетки DLD1 в отношении TASIN-1, что доказывает, что APC является мишенью TASIN-1.
[0027] На фиг.10 показано, что укорочение APC требуется для цитотоксических эффектов TASIN-1. (a) Кривая эффекта дозы для клеток DLD1, экспрессирующих не вызывающую сайленсинг (Nsi) кшРНК или кшРНК против APC. В таблице (a) приведена величина IC50 для каждой клеточной линии. (b) Кривая эффекта дозы для клеток HCT116 и HCT116 p53-/-, нуль-мутанта по опухолевому белку 53 (который представляет собой известный опухолевый супрессор), инфицированных лентивирусным вектором, экспрессирующим укороченный APC A1309, который использовали для экспрессии либо бета-галактозидтрансацетилазы (LacA), либо укороченный мутант APC A1309. LacA эктопически экспрессировали в клеточных линиях в качестве отрицательного контроля. Данные соответствуют средним значениям±s.d., n=3. Нокдаун и эктопическую экспрессию демонстрировали с использованием вестерн-блоттинга. (c) На левой столбиковой диаграмме представлена выжившая фракция для каждой клеточной линии, обработанной DMSO, 2,5 M или 5 мкМ TASIN-1 в течение 72 ч. В правой таблице (c) приведены средние значения IC50 для каждой клеточной линии из трех биологических реплик. Статистическую значимость определяли между средними значениями величин IC50 для клеточных линий с WT APC и клеточных линий с укороченным APC. T-критерий Стьюдента, ****P<0,0001. Статус APC в каждой клеточной линии основан на опубликованных данных (Chandra, S.H., Wacker, I. Appelt, U.K., Behrens, J. & Schneikert, J. A common role for various human truncated adenomatous polyposis coli isoforms in the control of beta-catenin activity and cell proliferation. PloS one 7, e34479 (2012)) и the Cancer Genome Project Database (www.sanger.ac.uk/genetics/CGP).
[0028] На фиг.11 показано, что TASIN-1 является селективно токсическим в отношении клеток с укороченным APC. TASIN-1 не влияет на жизнеспособность нормальных клеточных линий (a) и другого типа злокачественных клеток (b) с WT APC, но уничтожает клетки DU4457 с укороченным APC. Данные соответствуют среднему значению±s.d., n=3. T-критерий Стьюдента, ***P<0,001.
[0029] На фиг.12 проиллюстрированы ответы клеточных линий рака ободочной и прямой кишки с различным статусом APC на TASIN-1. Эпителиальные клеточные линии толстого кишечника человека, экспрессирующие укороченный APC: HT-29, DLD1, SW620, SW480, HCT15, Lovo и Caco-2, и клетки, экспрессирующие APC дикого типа: HCT116, HCT116 p53-/-, HCEC, C26Ci, HBEC и BJ, обрабатывали TASIN-1 и оценивали долю выживших клеток. Следует отметить, что HCT116, HCT116 p53-/-, HCEC и C26Ci являются клеточными линиями толстого кишечника, в то время как клеточные линии HBEC и BJ являются клеточными линиями эпителия бронхов и фибробластов крайней плоти, соответственно. В условиях как 2 мкМ, так и 5 мкМ TASIN-1, все клеточные линии, экспрессирующие укороченный APC, продемонстрировали чувствительность к TASIN-1, в то время как клеточные линии, экспрессирующие APC дикого типа, не продемонстрировали чувствительность к TASIN-1. Это указывает на то, что TASIN-1 не влияет на нормальные клетки, содержащие уровни APC, соответствующие дикому типу.
[0030] На фиг.13 показано, что длительная обработка низкой дозой TASIN-1 подавляла независимый от заякоривания рост в клетках DLD1.
[0031] На фиг.14 показано, что TASIN-1 индуцирует апоптоз в клетках DLD1. После инкубации в течение 72 часов клеток HCT116 или DLD1 с DMSO, 2,5 мкМ TASIN-1 или BARD, уровни расщепленного PARP анализировали вестерн-блоттингом. DMSO выступал в качестве отрицательного контроля, не влияющего на количество расщепленного PARP в клеточных линиях. Однако BARD выступал в качестве положительного контроля, способствуя увеличению уровня расщепленного PARP в клеточных линиях HCT116 и DLD1. Клетки DLD1, обработанные TASIN-1, проявляли увеличение уровня расщепленного PARP, в то время как в тех же условиях клетки HCT116 не проявляли его. HCT116 экспрессируют APC дикого типа, в то время как DLD1 экспрессируют укороченный APC. Кроме того, в клетках DLD1, обработанных 2,5 мкМ TASIN-1, активность каспаз была увеличена.
[0032] На фиг.15 проиллюстрировано, что TASIN-1 индуцирует зависимый от N-концевой киназы c-Jun (JNK) апоптоз в клетках DLD1, но не в клетках HCT116. Инкубация с TASIN-1 индуцирует расщепление PARP (a), высвобождение цитохрома c из митохондрий (b) и активацию каспазы 3 в клетках DLD1 (c). В качестве положительного контроля для апоптоза использовали доксорубицин (DOX). В качестве нагрузочного контроля использовали β-актин. Величины на (c) соответствуют кратности индукции активности каспазы 3/7, нормализованной к клеткам, обработанным DMSO. RLU: относительная единица люциферазы. (d) Обработка TASIN-1 индуцирует фосфорилирование JNK в клетках DLD1. (e)-(g) Совместная обработка TASIN-1 с SP600125 обращает вспять эффекты уничтожения TASIN-1 (e), ингибирует фосфорилирование JNK, устраняет расщепление PARP, индуцированное обработкой TASIN-1, (f) и снижает активность каспазы 3/7 (g). Данные соответствуют среднему значению±s.d., n=3. T-критерий Стьюдента, **P<0,01, ***P<0,001.
[0033] На фиг.16 показано, что TASIN-1 индуцировал высвобождение цитохрома C в клетках DLD1. Cyto: цитоплазма; mito: митохондрии. Потенциалзависимый анионный канал (VDAC), встречающийся на наружной мембране митохондрий.
[0034] На фиг.17 представлена метаболическая стабильность TASIN-1 в анализах на S9 и гепатоцитах мыши.
[0035] На фиг.18 показано, что TASIN-1 остается в толстом кишечнике после всасывания из брюшинной полости. LIC: содержимое толстого кишечника.
[0036] На фиг.19 проиллюстрирован способ, посредством которого эффективность и селективность лидирующих соединений была охарактеризована in vivo.
[0037] На фиг.20 показано, что TASIN-1 ингибирует рост опухоли в ксенотрансплантатах DLD1. Схема дозирования представляла собой внутрибрюшинное введение в дозе 40 мг/кг, проводимое два раза в сутки в течение 18 суток. (a) Размеры опухолей в ксенотрансплантатах DLD1, в случае которых вводили TASIN-1 (ниже), являются меньшими, чем у контрольных мышей (выше). Масштабная метка, 10 мм. TASIN-1 значительно снижает скорость роста опухоли DLD1 (b).
[0038] На фиг.21 показано, что TASIN-1 снижает рост опухоли (а) и объем опухоли (b) в ксенорансплантантах колоректальной аденокарциномы (DLD-1) Dukes тип C. TASIN-1 селективно ингибирует рост опухоли в ксенотрансплантатах с укорочением APC (c-d) и снижает туморогенность в генетической модели CRC на мышах (e-g). TASIN-1 значительно снижает скорость роста опухоли из ксенотрансплантатов HT29 (c), но не HCT116 (d). (c)-(d), данные соответствуют средним значениям±s.d. для 8 опухолей. Введение TASIN-1 значительно снижает количество доброкачественных опухолей (полипы) (e) и снижает размер полипов (f) у мышей CPC;Apc. На (e), каждая точка соответствует одной мыши. Среднее значение указано сплошной черной линией. (g) TASIN-1 не ингибировал рост мышей. На (f) и (g) данные соответствуют среднему значению±s.d. у 8-10 мышей. Использовали t-критерий Стьюдента (c)-(e), (g) и множественный t-критерий ((f), FDR=1%). *P<0,05, **P<0,01, ***P<0,001.
[0039] На фиг.22 показано, что TASIN-1 ингибировал рост опухоли в ксенотрансплантатах HT29. Схема дозирования представляла собой внутрибрюшинное введение в дозе 40 мг/кг, проводимое два раза в сутки на протяжении 18 суток.
[0040] На фиг.23 показано, что TASIN-1 не ингибирует рост опухоли в ксенотрансплантатах HCT116. Схема дозирования представляла собой внутрибрюшинное введение в дозе 40 мг/кг, проводимое два раза в сутки на протяжении 18 суток. HCT116 имеют APC дикого типа. Таким образом, TASIN-1 сохраняет селективность в отношении укороченного APC in vivo.
[0041] На фиг.24 показано, что TASIN-1 уменьшает образование опухоли в полученной способами генной инженерии модели CRC на мышах. (a) TASIN-1 в основном остается в ткани толстого кишечника после в/б инъекции. (b) Репрезентативные фотографии толстого кишечника контрольной группы и группы введения TASIN-1. (c) TASIN-1 подавляет экспрессию набора воспалительных генов in vivo. РНК экстрагировали из лизатов опухоли контрольной группы и группы введения TASIN-1, синтезировали кДНК и подвергали ее анализу с использованием q- ПЦР. Данные соответствуют среднему значению±s.d. для 5 мышей. T-критерий Стьюдента, *P<0,05, **P<0,01.
[0042] На фиг.25 показано, что TASIN-1 ингибирует опухоль в
модели ксенотрансплантатов опухоли на мышах путем индукции апоптоза без заметной токсичности. (a) Масса тела до и после введения у контрольных мышей и мышей, которым вводили TASIN-1. (b) Репрезентативные изображения окрашивания H&E и иммуногистохимии расщепленной каспазы 3 в ксенотрансплантатах DLD1, когда вводили TASIN-1 или растворитель. Масштабная метка (слева), 50 мкМ; (справа) 200 мкМ. Опухоли, в случае которых вводили TASIN-1, продемонстрировали области апоптотических опухолевых клеток (обозначаемых рамкой, снизу слева) и имели положительное окрашивание в отношении расщепленной каспазы 3 (снизу справа). (c) Расщепленный PARP обнаруживался в экстрактах образца опухоли, в случае которого вводили контроль или TASIN-1, с использованием вестерн-блоттинга.
[0043] На фиг.26 показан анализ взаимосвязи структура-активность (SAR) для идентификации аналогов TASIN-1. Аналоги исследовали с различными хемотипами. Исследовали 101 аналог и 40 из этих аналогов демонстрируют более высокую эффективность в клетках DLD1, чем TASIN-1.
[0044] На фиг.27 показано, что низкомолекулярные соединения против злокачественной опухоли PDSA-010, PDSA-011, PDSA-013 и PDSA-014 эффективно и селективно уничтожают клетки DLD1 и 1CTRPA A1309.
[0045] На фиг.28 показано, что низкомолекулярное соединение против злокачественной опухоли PDSA-014, вводимое посредством внутрибрюшинной инъекции в дозе 10 мг/кг два раза в сутки, ингибирует рост опухоли в ксенотрансплантатах DLD1.
[0046] На фиг.29 показано, что низкомолекулярное соединение против злокачественной опухоли PDSA-014, введенное посредством внутрибрюшинной инъекции в дозе 10 мг/кг два раза в сутки, не ингибирует роста опухоли в ксенотрансплантатах HCT116.
[0047] На фиг.30 показано, что 2,5 мкМ TASIN-1 индуцирует медленную и обратимую гибель клеток.
[0048] На фиг.31 показано, что TASIN-1 увеличивает митотический индекс в 4 раза относительно контрольных клеток.
[0049] На фиг.32 показано, что TASIN-1 нарушает хромосомную конгрессию аналогично положительному контролю PITSTOP2.
[0050] На фиг.33 показано, что TASIN-1 нарушает митотические веретена, ориентацию хромосом и организацию K-волокон в процессе митоза в клетках DLD1. (a) Ширина метафазной пластинки. (b) Соотношение ширина веретена/общая ширина метафазных клеток. Pitstop2 представляет собой положительный контроль для нарушения веретена. Каждая точка соответствует клетке. Среднее значение указано сплошной черной линией. (c) Репрезентативные изображения синхронизированных в метафазе клеток, окрашенных на α-тубулин (красный), HURP (зеленый) и ДНК (DAPI, синий). На графике показан процент клеток, обработанных TASIN-1, с аномальной локализацией HURP. Данные соответствуют среднему значению±s.e.m. для 50 клеток, оцененных в 3 биологических тройных репликах. T-критерий Стьюдента, **P<0,001. (d) Обработка TASIN-1 индуцирует отставание микросом и анафазные мостики, как указано красной стрелкой. Все метки масштаба: 10 мкм.
[0051] На фиг.34 показано, что TASIN-1 не влияет на активность каскада Wnt в клетках DLD1. Иммунное окрашивание в отношении активного β-катенина (a) и вестерн-блоттинг тотального β-катенина (b) в клетках DLD1, обработанных TASIN-1 в течение 24 часов. (c) TASIN-1 не влиял на активность каскада Wnt при использовании репортера STF. IWR использовали в качестве положительного контроля (Chen, C. et al. Small molecule-mediated disruption of Wnt-dependent signaling in tissue regeneration and cancer. Nature chemical biology 5, 100-107 (2009)). Данные соответствуют среднему значению±s.d., n=3. T-критерий Стьюдента, **P<0,01, ***P<0,001. Все масштабные метки: 10 мкм.
[0052] На фиг.35 показано, что TASIN-1 замедляет вхождение в фазу G1 в клетках DLD-1 после высвобождения при синхронизации с использованием нокодазола.
[0053] На фиг.36 (a-z) и (aa) показаны спектры ЯМР для проиллюстрированных соединений.
ПОДРОБНОЕ ОПИСАНИЕ
[0054] Описанное изобретение может стать более понятным из представленного ниже описания иллюстративных вариантов осуществления, вместе с прилагаемыми фигурами и чертежами. Специалистам в данной области должно быть понятно, что описанные варианты осуществления описанного изобретения, являются только показательными и иллюстративными, и не являются ограничивающими.
Определения:
[0055] Различные термины, используемые на протяжении настоящего описания, имеют определения, указанные далее.
[0056] Термин "ген аденоматозного полипоза толстого кишечника" или "ген APC" или "APC", как используют в рамках изобретения, относится к последовательности ДНК млекопитающих, кодирующей белок APC. Пример гена APC человека расположен на 5q21-q22 хромосомы 5, GenBank: M74088.1. Синоним гена APC человека включает: BTPS2, DP2, DP2.5, DP3, PPP1R46 и "протеинфосфатаза 1, регуляторная субъединица 46". Пример гена APC мыши расположен на хромосоме 18 B1, MGI:88039. Синоним гена APC мыши включает: CC2, Min, mAPC, AI0147805, AU020952 и AW124434.
[0057] Термин "соединения против злокачественной опухоли", как используют в рамках изобретения, относится к низкомолекулярным соединениям, которые селективно нацелены на и ингибируют биологическую активность укороченных APC.
[0058] Термин "белок аденоматозного полипоза толстого кишечника" или "белок APC" или "APC", как используют в рамках изобретения, относится к белковой последовательности млекопитающих из 2843 аминокислот. Примером последовательности APC человека является GenBank: AAA03586. Примером последовательности APC мыши является GenBank: AAB59632.
[0059] Термин "укорочение APC" или "мутант с укорочением APC" или "мутация с укорочением APC" относится к укороченному белковому продукту в результате мутации в гене APC. Укорочение APC может представлять собой, например, но не ограничиваясь ими, продукт из 1309 аминокислот или продукт из 1450 аминокислот.
[0060] Термин "введение", как используют в рамках изобретения, включает введение in vivo, а также введение непосредственно в ткань ex vivo. Как правило, композиции можно вводить системно перорально, буккально, парентерально, местным путем, путем ингаляции или инсуффляции (т.е. через рот или через нос) или ректально в единичных дозированных составах, при желании содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители, или их можно вводить локально путями, такими как, но не ограничиваясь ими, инъекция, имплантация, пересадка, местное применение или парентеральное введение.
[0061] Термины "аналог" и "производное" используют взаимозаменяемо для обозначения соединения, продуцируемого из другого соединения сходной структуры за одну или несколько стадий. "Производное" или "аналог" соединения сохраняет по меньшей мере некоторую степень желаемой функции эталонного соединения. Таким образом, альтернативным термином для "производного" может быть "функциональное производное". Производные может включать химические модификации, такие как алкилирование, ацилирование, карбамилирование, йодирование или любая модификация, которая дериватизирует соединение. Такие дериватизированные молекулы включают, например, молекулы, в которых свободные аминогруппы дериватизированы с образованием гидрохлоридов аминов, п-толуолсульфонильных групп, карбобензоксигрупп, трет-бутилоксикарбонильных групп, хлорацетильных групп или формальдегидных групп. Свободные карбоксильные группы могут быть дериватизированы с образованием солей, сложных эфиров, амидов или гидразидов. Свободные гидроксильные группы могут быть дериватизированы с образованием O-ацильных или O-алкильных производных. Термин "состояние", как используют в рамках изобретения, относится к различным состояниям здоровья и включает нарушения или заболевания, вызываемые любым основополагающим механизмом или повреждением. Заболевания, ассоциированные с APC, включают, но не ограничиваются ими, рак толстого кишечника.
[0062] Термин "заболевание" или "нарушение", как используют в рамках изобретения, относится к нарушению здоровья или состоянию аномального функционирования.
[0063] Термин "лекарственное средство", как используют в рамках изобретения, относится к лекарственному средству или любому веществу, используемому для предупреждения, диагностики, смягчения, лечения или излечения заболевания.
[0064] Как используют в рамках изобретения, термин "ферментативная активность" относится к количеству израсходованного субстрата (или образовавшегося продукта) в данный момент времени в данных условиях. Ферментативная активность также может быть называться "числом оборотов".
[0065] Термин "ингибирование", как используют в рамках изобретения, относится к снижению или модулированию химической или биологической активности вещества или соединения.
[0066] Термин "повреждение", как используют в рамках изобретения, относится к поражению или причинению вреда структуре или функции организма, вызванным внешним агентом или силой, которые могут быть физическими или химическими.
[0067] Термин "синдром", как используют в рамках изобретения, относится к набору симптомов, указывающих на некоторое заболевание или состояние.
[0068] Термин "терапевтическое средство", как используют в рамках изобретения, относится к лекарственному средству, молекуле, нуклеиновой кислоте, белку, метаболиту, композиции или другому веществу, которые обеспечивают терапевтический эффект. Термин "активный", как используют в рамках изобретения, относится к ингредиенту, компоненту или составной части композиции по описанному изобретению, ответственным за заданный терапевтический эффект. Термины "лекарственное средство" и "активное средство" используют в настоящем описании взаимозаменяемо. Активное средство может представлять собой, например, но не ограничиваясь ими, по меньшей мере одно из соединения формулы I или его фармацевтически приемлемой соли.
[0069] Термин "модифицировать", как используют в рамках изобретения, означает изменять, варьировать, корректировать, нормализовать, преобразовывать, влиять или регулировать определенную меру или долю одного или нескольких конкретных показателей.
[0070] Термин "модифицирующий агент", как используют в рамках изобретения, относится к веществу, композиции, экстракту, ботаническому ингредиенту, ботаническому экстракту, ботаническому компоненту, терапевтическому компоненту, активному компоненту, терапевтическому средству, лекарственному средству, метаболиту, активному веществу, белку, нетерапевтическому компоненту, неактивному компоненту, нетерапевтическому средству или неактивному средству, которые снижают, уменьшают степень или меру, или смягчают форму, симптомы, признаки, качества, характер или свойства состояния, статуса, нарушения, заболевания, симптома или синдрома.
[0071] Термин "модулировать", как используют в рамках изобретения, означает регулировать, изменять, адаптировать или корректировать определенную меру или долю.
[0072] Термин "парентеральный", как используют в рамках изобретения, относится к предоставлению организму путем инъекции (т.е. введение путем инъекции), в том числе, например, подкожно (т.е. инъекция под кожу), внутримышечно (т.е. инъекция в мышцу); внутривенно (т.е. инъекция в вену), интратекально (т.е. инъекция в пространство вокруг спинного мозга или под паутинную оболочку головного мозга), посредством внутригрудинной инъекции или способами инфузии. Парентерально вводимую композицию доставляют с использованием иглы, например, хирургической иглы. Термин "хирургическая игла", как используют в рамках изобретения, относится к любой игле, адаптированной для доставки жидкой (т.е. способной течь) композиции в выбранную анатомическую структуру. Инъецируемые препараты, такие как стерильные водные или масляные суспензии, можно составлять в соответствии с известным уровнем техники с использованием иллюстративных диспергирующих или смачивающих веществ и суспендирующих веществ.
[0073] Термин "снижать" или "снижение", как используют в рамках изобретения, относится к ограничению возникновения нарушения у индивидуумов, имеющих риск развития нарушения.
[0074] Как используют в рамках изобретения, термины "субъект", или "индивидуум", или "пациент" используют взаимозаменяемо для обозначения представителя вида животных, имеющего происхождение из млекопитающих, в том числе человека.
[0075] Термин "симптом", как используют в рамках изобретения, относится к явлению, которое является результатом и сопровождает конкретное заболевание или нарушение и служит его признаком.
[0076] Термин "терапевтический компонент", как используют в рамках изобретения, относится к терапевтически эффективной дозировке (т.е. доза и частота введения), которая элиминирует, снижает или предупреждает прогрессирование проявления конкретного заболевания в некотором проценте популяции. Примером широко используемого терапевтического компонента является ED50, которая описывает дозу в конкретной дозировке, которая является терапевтически эффективной для проявлений конкретного заболевания у 50% популяции.
[0077] Термин "терапевтический эффект", как используют в рамках изобретения, относится к последствиям лечения, результаты которого считают желаемыми и благоприятными. Терапевтический эффект может включать, прямо или непрямо, остановку, снижение или устранение проявления заболевания. Терапевтический эффект также может включать, прямо или непрямо, остановку, снижение или устранение прогрессирования проявления заболевания.
[0078] Как используют в рамках изобретения, термин "местный" относится к введению композиции в или непосредственно ниже области применения. Выражение "местное нанесение" описывает нанесение на одну или несколько поверхность(ей), включая эпителиальные поверхности. Хотя местное введение, в противоположность чрескожному введению, обычно обеспечивает локальный, а не системный эффект, термины "местное введение" и "чрескожное введение", как используют в рамках изобретения, если нет иных указаний или не подразумевается иное, используют взаимозаменяемо.
[0079] Как используют в рамках изобретения, термин "мутация" относится к изменению последовательности ДНК в гене или хромосоме организма, приводящей к формированию нового свойства или признака, не встречающихся в родительском типе, или к процессу, посредством которого такое изменение происходит в хромосоме, либо путем изменения нуклеотидной последовательности ДНК, кодирующей ген, либо путем изменения физической организации хромосомы. Три механизма мутации включают замену (изменение одной пары оснований на другую), вставку (встраивание одного или нескольких оснований в последовательность) и делецию (утрата одной или нескольких пар оснований).
[0080] Термины "мутанты" и "варианты" используют в настоящем описании взаимозаменяемо для обозначения нуклеотидных последовательностей со значительной идентичностью с эталонной нуклеотидной последовательностью. Различия в последовательностях могут быть результатом изменений, либо природных, либо намеренных, в последовательности или структуре. Природные изменения могут возникать в процессе нормальной репликации или дупликации в природе конкретной последовательности нуклеиновой кислоты. Намеренные изменения могут быть специально спланированы и внесены в последовательность для определенных целей. Такие конкретные изменения можно вносить in vitro с использованием различных способов.
[0081] Термин "фармацевтическая композиция", как используют в рамках изобретения, относится к препарату, содержащему фармацевтический продукт, лекарственное средство, метаболит или активный ингредиент.
[0082] Как используют в рамках изобретения, термин "лечение" включает устранение, по существу ингибирование, замедление или обращение вспять прогрессирования состояния, по существу смягчение клинических симптомов состояния или по существу предупреждение появления клинических симптомов состояния. Кроме того, лечение относится к осуществлению одного или нескольких из следующих: (a) снижение тяжести нарушения; (b) ограничение развития симптомов, характерных для подвергаемого лечению нарушения(ий); (c) ограничение ухудшения симптомов, характерных для нарушения(ий), подвергаемого лечению; (d) ограничение рецидива нарушения(ий) у пациентов, которые ранее имели нарушение(я); и (e) ограничение рецидива симптомов у пациентов, у которых нарушение(я) ранее было бессимптомным. Термин "состояние", как используют в рамках изобретения, относится к различным состояниям здоровья и включает нарушения или заболевания, вызываемые любым основополагающим механизмом или нарушением, при которых экспрессируется укороченный белок APC. Индивидуум, нуждающийся в этом, представляет собой пациента, имеющего нарушение, обусловленное мутацией APC, или имеющего риск его наличия.
Соединения
[0083] Согласно одному аспекту, описанное изобретение относится к низкомолекулярному соединению против злокачественной опухоли формулы I:

(Формула I)
где
[0084] каждый из Y1 и Y2 независимо представляет собой CH или N;
[0085] L представляет собой SO2, CO, CH2 или CHMe;
[0086] X2 выбран из группы, состоящей из CH2, CHR2, NR3, O, S;
[0087] X1 выбран из группы, состоящей из CH2, CHR4, NR5, O, S;
[0088] n=0, 1, 2
[0089] каждый из R1 и R2 независимо выбран из группы, состоящей из H, C1-4 алкила, C1-4 алкенила, C1-4 алкинила, CH2-арила, CH2-гетероарила;
[0090] каждый из R3, R4 и R5 независимо выбран из группы, состоящей из C1-6 алкила; C1-6 циклоалкила, C1-6 алкенила, C1-6 алкинила, арила, гетероарила, CH2-арила, CH2-гетероарила;
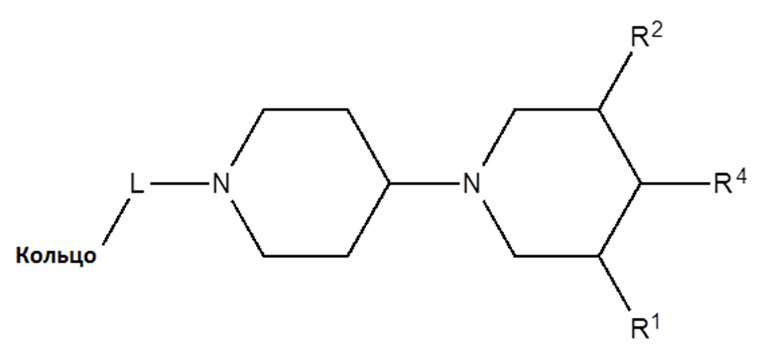
[0091] R3 может образовывать метиленовый или этиленовый мостик с одним из других атомов кольца, таким образом, обеспечивая бициклическую кольцевую структуру; и
[0092] кольцо, связанное с L, может представлять собой арил, гетероарил, гетероциклил, конденсированный циклоалкиларил, конденсированный гетероциклиларил, конденсированный арилгетероциклил, конденсированный циклоалкилгетероарил, конденсированный гетероциклилгетероарил, конденсированный гетероарилгетероциклил;
[0093] так что каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0094] Иллюстративные низкомолекулярные соединения против злокачественной опухоли формулы I представлены в таблице A (SAR). Каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0095] Согласно одному варианту осуществления описанное изобретение относится к низкомолекулярным соединениям против злокачественной опухоли формулы I-a:

(Формула I-a)
где
[0096] каждый из Y1 и Y2 независимо представляет собой CH или N;
[0097] L представляет собой SO2, CO, CH2 или CHMe;
[0098] X1 выбран из группы, состоящей из CH2, CHR4, NR5, O, S;
[0099] каждый из R1 и R2 независимо представляет собой H или Me;
[0100] каждый из R4 и R5 независимо выбран из группы, состоящей из C1-6 алкила; C1-6 циклоалкила, C1-6 алкенила, C1-6 алкинила, арила, гетероарила, CH2-арила, CH2-гетероарила;
[0101] кольцо, связанное с L, может представлять собой арил, гетероарил, конденсированный гетероциклиларил;
[0102] так что каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0103] Согласно другому варианту осуществления, описанное изобретение относится к низкомолекулярному соединению против злокачественной опухоли формулы I-b:
(Формула I-b)
где
[0104] L представляет собой SO2, CO, CH2 или CHMe
[0105] каждый из R1 и R2 независимо представляет собой H или Me;
[0106] R4 выбран из группы, состоящей из C1-6 алкила; C1-6 алкинила, арила, CH2-арила;
[0107] кольцо, связанное с L, может представлять собой арил, гетероарил, конденсированный гетероциклиларил;
[0108] так что каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0109] Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли по описанному изобретению соответствует формуле I-c:

(Формула I-c)
где
[0110] L представляет собой SO2, CH2 или CHMe;
[0111] кольцо, связанное с L, может представлять собой арил, гетероарил, конденсированный гетероциклиларил;
[0112] так что каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0113] Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли по описанному изобретению соответствует формуле I-d:
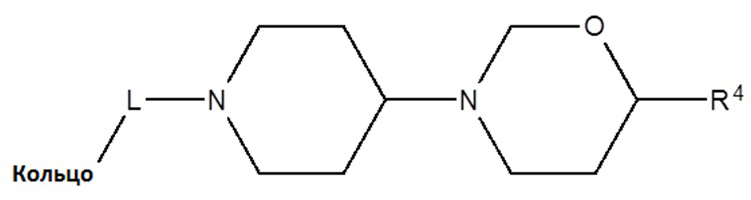
(Формула I-d)
где
[0114] L представляет собой SO2, CH2 или CHMe;
[0115] R4 выбран из группы, состоящей из C1-6 алкила; C1-6 алкинила, арила, CH2-арила;
[0116] кольцо, связанное с L, может представлять собой арил, гетероарил, конденсированный гетероциклиларил;
[0117] так что каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0118] Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли по описанному изобретению соответствует формуле I-e:

(Формула I-e)
где
[0119] каждый из R1 и R2 независимо представляет собой H или Me;
[0120] R4 выбран из группы, состоящей из H, Me, пропаргила, изопропила, циклопропила, CH2-арила;
[0121] каждый из R6-10 независимо выбран из группы, состоящей из H, F, Cl, Br, Me, Et, CF3, циклопропила, изопропила, трет-бутила, арила, OMe, OCF3, OCHF2, O-арила, CN, N3, CO-арила, CO2H, CO2R, CHO, CONH2, CONR2, CONHR. В контексте этого абзаца, R независимо выбран из группы, состоящей из H, C1-4 алкила, C1-4 циклоалкила, арила, CH2-арила, CH2-гетероарила;
[0122] так что каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0123] Согласно одному варианту осуществления низкомолекулярных соединений против злокачественной опухоли, соответствующих формуле I-e, каждый из R1 и R2 независимо представляет собой H или Me; R4 выбран из H, Me, пропаргила, изопропила, циклопропила, CH2-арила; каждый из R6-10 независимо выбран из H, F, Cl, Br, Me, Et, CF3, циклопропила, изопропила, арила, OMe, OCF3, OCHF2, O-арила;
[0124] Согласно другому варианту осуществления низкомолекулярных соединений против злокачественной опухоли, соответствующих формуле I-e, каждый из R1 и R2 независимо представляет собой H или Me; R4 выбран из H, Me, пропаргила, изопропила, циклопропила, CH2-арила; R6 представляет собой арил, каждый из R7-10 независимо выбран из H, F, Cl, CF3, Me, циклопропила, изопропила, OMe, OCF3, OCHF2;
[0125] Согласно другому варианту осуществления низкомолекулярных соединений против злокачественной опухоли, соответствующих формуле I-e, каждый из R1 и R2 независимо представляет собой H или Me; R4 выбран из H, Me, пропаргила, изопропила, циклопропила, CH2-арила; R7 представляет собой арил, каждый из R6, R8, R9 и R10 независимо выбран из H, F, Cl, CF3, Me, циклопропила, изопропила, OMe, OCF3, OCHF2;
[0126] Согласно другому варианту осуществления низкомолекулярных соединений против злокачественной опухоли, соответствующих формуле I-e, каждый из R1 и R2 независимо представляет собой H или Me; R4 выбран из H, Me, пропаргила, изопропила, циклопропила, CH2-арила; R8 представляет собой арил, каждый из R6, R7, R9 и R10 независимо выбран из H, F, Cl, CF3, Me, циклопропила, изопропила, OMe, OCF3, OCHF2;
[0127] Согласно другому варианту осуществления низкомолекулярных соединений против злокачественной опухоли, соответствующих формуле I-e, каждый из R1 и R2 независимо представляет собой H или Me; R4 выбран из H, Me, пропаргила, изопропила, циклопропила, CH2-арила; R7 представляет собой CO-арил, каждый из R6, R8, R9 и R10 независимо выбран из H, F, Cl, CF3, Me, циклопропила, изопропила, OMe, OCF3, OCHF2;
[0128] Согласно другому варианту осуществления, низкомолекулярное соединение против злокачественной опухоли по описанному изобретению соответствует формуле I-f:

(Формула I-f)
где
[0129] каждый из Y1 и Y2 независимо представляет собой CH или N;
[0130] каждый из R1 и R2 независимо представляет собой H или Me;
[0131] R4 выбран из группы, состоящей из C1-6 алкила; C1-6 циклоалкила, C1-6 алкенила, C1-6 алкинила, CH2-арила;
[0132] каждый из R11 и R12 независимо выбран из H, F, Cl, Br, Me, CF3, циклопропила, арила, гетероарила;
[0133] так что каждый раз, когда присутствуют стереогенные центры, включены все возможные стереоизомеры, включая оптически активные изомеры.
[0134] Согласно одному варианту осуществления низкомолекулярных соединений против злокачественной опухоли, соответствующих формуле I-f, Y1 представляет собой CH; Y2 представляет собой N; каждый из R1 и R2 независимо представляет собой H или Me; R4 выбран из H, Me, пропаргила, изопропила, циклопропила, CH2-арила; R11 представляет собой H, Me, CF3, циклопропил, арил; и R12 выбран из H, F, Cl, CF3, арила;
Химические заместители и стереохимия
[0135] Термин "алифатический", как используют в рамках изобретения, обозначает прямую или разветвленную организацию цепи из составляющих ее атомов углерода, включая, но не ограничиваясь ими, парафины (алканы), которые являются насыщенными, олефины (алкены или алкадиены), которые являются ненасыщенными, и ацетилены (алкины), которые содержат тройную связь. В комплексных структурах цепи могут быть разветвленными или сшитыми.
[0136] Термин "низший", как используют в рамках изобретения, относится к группе, имеющей от одного до шести атомов углерода.
[0137] Как используют в рамках изобретения, термин "алкил" относится к углеводороду с прямой или разветвленной цепью, имеющему от 1 до 25 атомов углерода или указанное количество атомов углерода (например, C1-6 алкил) или любые количества в этом диапазоне. В контексте настоящего изобретения косвенно подразумевается, что такие алкильные группы необязательно могут быть замещены заместителями, такими как, но не ограничиваясь ими, галоген, перфторалкил, низший алкил, низший алкенил, низший алкинил, низший циклоалкил, низший алкокси, низший циклоалкокси, низший алкилсульфанил, оксо, гидроксил. Примеры "алкила", как используют в рамках изобретения, включают, но не ограничиваются ими, метил, трифторметил, этил, пропил, н-бутил, трет-бутил, н-пентил, изобутил и изопропил, метоксиметил, метоксиэтил, изопропоксибутил, пропинилоксиэтил и т.п.
[0138] Термин "алкенил", как используют в рамках изобретения, обозначает одновалентную (неразветвленную) или разветвленную углеводородную цепь, имеющую одну или несколько двойных связей, где двойная связь может быть неконъюгированной или конъюгирована с другой ненасыщенной группой (например, полиненасыщенный алкенил), и он может быть замещенным или незамещенным, причем допускается множество степеней замещения. Он может быть необязательно замещен заместителями, такими как, но не ограничиваясь ими, галоген, перфторалкил, низший алкил, низший алкенил, низший алкинил, низший циклоалкил, низший алкокси, низший циклоалкокси, низший алкилсульфанил, оксо, гидроксил. Например, но не ограничиваясь этим, алкенил может представлять собой винил, аллил, бутенил, пентенил, гексенил, бутадиенил, пентадиенил, гексадиенил, 2-этилгексенил, 2-пропил-2-бутенил, 4-(2-метил-3-бутен)пентенил, 6-метоксигексенил, 2-трифторметил-3-бутенил и т.п.
[0139] Как используют в рамках изобретения, термин "алкинил" относится к углеводородному радикалу, имеющему по меньшей мере одну углерод-углеродную тройную связь, необязательно замещенную заместителями, такими как, но не ограничиваясь этим, галоген, перфторалкил, низший алкил, низший алкенил, низший алкинил, низший циклоалкил, низший алкокси, низший циклоалкокси, низший алкилсульфанил, оксо, гидроксил.
[0140] Термин "арил", как используют в рамках изобретения, относится к бензольному кольцу или к необязательно замещенной бензольной кольцевой системе, конденсированной с одним или несколькими необязательно замещенными бензольными кольцами, причем допускается множество степеней замещения. Заместители включают, но не ограничиваются ими, циано, галоген, перфторалкил, арил, гетероарил, гетероциклил, циклоалкил, низший алкил, низший алкокси, низший алкилсульфанил, оксо, гидрокси, амино, необязательно замещенный алкилом, или арилом, или гетероарилом, или гетероциклилом или циклоалкилром, аминокарбонил (-NRC(O)R), необязательно замещенный алкилом, или арилом, или гетероарилом, или гетероциклилом, или циклоалкилом, карбокси, ацил, ацилокси, алкоксикарбонил, арилокси, гетероарилокси, гетероциклилокси, ароилокси, гетероароилокси, гетероциклоилокси, карбамоил, необязательно замещенный алкилом, или циклоалкилом, или арилом, или гетероарилом, или гетероциклилом, аминосульфонил, необязательно замещенный алкилом, или циклоалкилом, или арилом, или гетероарилом, или гетероциклилом. Примеры арила включают, но не ограничиваются ими, фенил, 2-нафтил, 1-нафтил, 1-антраценил и т.п.
[0141] Следует понимать, что, когда термины "алкил" или "арил" или любой из их префиксных корней появляется в названии заместителя, их следует интерпретировать как включающие ограничения, приведенные выше для алкила и арила. Указанные количества атомов углерода (например, C1-10) относятся независимо к количеству атомов углерода в алкиле, алкениле или алкиниле, или в циклической алкильной части, или алкильной части более крупного заместителя, в котором термин "алкил" находится в качестве его префиксного корня.
[0142] Как используют в рамках изобретения, "циклоалкил" (используемый взаимозаменяемо с "алифатическим циклическим" в настоящем описании) относится к неароматической одновалентной, моноциклической или полициклической кольцевой структуре, имеющей всего от 3 до 10 атомов углерода в кольце (но не имеющей гетероатомов), необязательно обладающей одной или несколькими степенями ненасыщенности, необязательно замещенной заместителями, такими как, но не ограничиваясь ими, галоген, перфторалкил, циклоалкил, низший алкил, низший алкокси, низший алкилсульфанил, оксо, гидроксил. "Циклоалкил" включат в качестве примера циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, адамантанил, норборнил, ноборненил, циклогептил или циклооктил, и т.п.
[0143] Термины "гетероцикл" и "гетероциклический", как используют в рамках изобретения, используют взаимозаменяемо для обозначения от трех- до двенадцатичленного гетероциклического кольца, необязательно обладающего одной или несколькими степенями ненасыщенности, содержащего одну или несколько гетероатомных замен, выбранных из -S-, -SO-, -SO2-, -O- или -N-, необязательно замещенных заместителями, включая, но не ограничиваясь ими, нитро, циано, галоген, перфторалкил, арил, гетероарил, гетероциклил, циклоалкил, низший алкил, низший алкокси, низший алкилсульфанил, низший алкилсульфенил, низший алкилсульфонил, оксо, гидрокси, меркапто, амино, необязательно замещенный алкилом, или арилом, или гетероарилом, или гетероциклилом, или циклоалкилом, аминокарбонил (-NRC(O)R), необязательно замещенный алкилом, или арилом, или гетероарилом, или гетероциклилом, или циклоалкилом, карбокси, ацил, ацилокси, алкоксикарбонил, арилокси, гетероарилокси, гетероциклилокси, ароилокси, гетероароилокси, гетероциклоилокси, карбамоил, необязательно замещенный алкилом, или циклоалкилом, или арилом, или гетероарилом, или гетероциклилом, аминосульфонил, необязательно замещенный алкилом, или циклоалкилом, или арилом, или гетероарилом, или гетероциклилом, силилокси, необязательно замещенный алкилом или арилом, силил, необязательно замещенный алкокси, или алкилом, или арилом, причем допускается множество степеней замещения. Такое кольцо необязательно может быть конденсированным с одним или несколькими другим "гетероциклическим" кольцом(ами). Примеры "гетероциклического" включают, но не ограничиваются ими, пиррол, фуран, тиофен, имидазол, оксазол, тиазол, пиразол, 3-пирролин, пирролидин, пиридин, пиримидин, пурин, хинолин, изохинолин, карбазол, тетрагидрофуран, 1,4-диоксан, 1,3-диоксан, пиперидин, пирролидин, морфолин, пиперазин и т.п.
[0144] Примеры гетероциклов включают, но не ограничиваются ими, пиридил, тиазолил, тетрагидротиофенил, окисленный серой тетрагидротиофенил, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадиазинил, 2H,6H-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатиинил, 2H-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4H-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4aH-карбазолил, карбазолил, бета-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил.
[0145] Как используют в рамках изобретения, термин "гетероарил" относится к пяти-семи-членному ароматическому кольцу или к полициклическому гетероциклическому ароматическому кольцу, содержащему один или несколько гетероатомов азота, кислорода или серы, где N-оксиды и монооксиды серы и диоксиды серы являются допустимыми гетероароматическими заместителями, необязательно замещенному заместителями, включающими, но не ограничивающимися ими, нитро, циано, галоген, перфторалкил, арил, гетероарил, гетероциклил, циклоалкил, низший алкил, низший алкокси, низший алкилсульфанил, низший алкилсульфенил, низший алкилсульфонил, оксо, гидрокси, меркапто, амино, необязательно замещенный алкилом, или арилом, или гетероарилом, или гетероциклилом, или циклоалкилом, аминокарбонил (-NRC(O)R), необязательно замещенный алкилом, или арилом, или гетероарилом, или гетероциклилом, или циклоалкилом, карбокси, ацил, ацилокси, алкоксикарбонил, арилокси, гетероарилокси, гетероциклилокси, ароилокси, гетероароилокси, гетероциклоилокси, карбамоил, необязательно замещенный алкилом, или циклоалкилом, или арилом, или гетероарилом, или гетероциклилом, аминосульфонил, необязательно замещенный алкилом, или циклоалкилом, или арилом, или гетероарилом, или гетероциклилом, силилокси, необязательно замещенный алкилом или арилом, силил, необязательно замещенный алкокси, или алкилом или арилом, причем допускается множество степеней замещения. Для полициклических ароматических кольцевых систем одно или несколько из колец могут содержать один или несколько гетероатомов. Примерами "гетероарила", используемого в рамках настоящего изобретения, являются фуран, тиофен, пиррол, имидазол, пиразол, триазол, тетразол, тиазол, оксазол, изоксазол, оксадиазол, тиадиазол, изотиазол, пиридин, пиридазин, пиразин, пиримидин, хинолин, изохинолин, хиназолин, бензофуран, бензотиофен, индол и индазол, и т.п.
[0146] Как используют в рамках изобретения, термин "конденсированный циклоалкиларил" относится к циклоалкильной группе, конденсированной с арильной группой, которые имеют два общих атома, и где арильная группа является точкой замещения. Примеры "конденсированного циклоалкиларила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, 5-инданил, 5,6,7,8-тетрагидро-2-нафтил,
 и т.п.
и т.п.
[0147] Как используют в рамках изобретения, термин "конденсированный арилциклоалкил" относится к арильной группе, конденсированной с циклоалкильной группой, которые имеют два общих атома, и где циклоалкильная группа является точкой замещения. Примеры "конденсированного арилциклоалкила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, 1-инданил, 2-инданил, 1-(1,2,3,4-тетрагидронафтил),  и т.п.
и т.п.
[0148] Как используют в рамках изобретения, термин "конденсированный гетероциклиларил" относится к гетероциклильной группе, конденсированной с арильной группой, которые имеют два общих атома, и где арильная группа является точкой замещения. Примеры "конденсированного гетероциклиларила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, 3,4-метилендиокси-1-фенил,  и т.п.
и т.п.
[0149] Как используют в рамках изобретения, термин "конденсированный арилгетероциклил" относится к арильной группе, конденсированной с гетероциклильной группой, которые имеют два общих атома, и где гетероциклильная группа является точкой замещения. Примеры "конденсированного арилгетероциклила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, 2-(1,3-бензодиоксолил),  и т.п.
и т.п.
[0150] Как используют в рамках изобретения, термин "конденсированный циклоалкилгетероарил" относится к циклоалкильной группе, конденсированной с гетероарильной группой, которые имеют два общих атома, и где гетероарильная группа является точкой замещения. Примеры "конденсированного циклоалкилгетероарила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, 5-аза-6-инданил,  и т.п.
и т.п.
[0151] Как используют в рамках изобретения, термин "конденсированный гетероарилциклоалкил" относится к гетероарильной группе, конденсированной с циклоалкильной группой, которые имеют два общих атома, и где циклоалкильная группа является точкой замещения. Примеры "конденсированного гетероарилциклоалкила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, 5-аза-1-инданил,  и т.п.
и т.п.
[0152] Как используют в рамках изобретения, термин "конденсированный гетероциклилгетероарил" относится к гетероциклильной группе, конденсированной с гетероарильной группой, которые имеют два общих атома, и где гетероарильная группа является точкой замещения. Примеры "конденсированного гетероциклилгетероарила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, 1,2,3,4-тетрагидро-бета-карболин-8-ил,  и т.п.
и т.п.
[0153] Как используют в рамках изобретения, термин "конденсированный гетероарилгетероциклил" относится к гетероарильной группе, конденсированной с гетероциклильной группой, которые имеют два общих атома, и где гетероциклильная группа является точкой замещения. Примеры "конденсированного гетероарилгетероциклила", используемого в рамках настоящего изобретения, включают, но не ограничиваются ими, -5-аза-2,3-дигидробензофуран-2-ил,  и т.п.
и т.п.
[0154] Как используют в рамках изобретения, термин "прямая связь", когда является частью описания структурной переменной, относится к прямому связыванию заместителей, фланкирующих (предшествующих и следующих после) переменную, принимаемую за "прямую связь".
[0155] Как используют в рамках изобретения, термин "O-связанная часть" означает часть, которая связана через атом кислорода. Таким образом, когда группа R представляет собой O-связанную часть, эта R связана через кислород и, таким образом, может представлять собой простой эфир, сложный эфир (например, -O-C(O)-необязательно замещенный алкил), карбонат или карбамат (например, -O-C(O)-NH2 или -O-C(O)-NH-необязательно замещенный алкил). Аналогично, термин "S-связанная часть" означает часть, которая связана через атом серы. Таким образом, когда группа R является S-связанной частью, эта R связана через серу, и, таким образом, она может представлять собой простой тиоэфир (например, -S-необязательно замещенный алкил), сложный тиоэфир (-S-C(O)-необязательно замещенный алкил) или дисульфид (например, -S-S-необязательно замещенный алкил). Термин "N-связанная часть" означает часть, которая связана через атом азота. Таким образом, когда группа R представляет собой N-связанную часть, группа R связана через азот, и, таким образом, одна или несколько из этих групп может представлять собой N-связанную аминокислоту, такую как -NH-CH2-COOH, карбамат, такой как -NH-C(O)-O-необязательно замещенный алкил, амин, такой как -NH-необязательно замещенный алкил, амид, такой как -NH-C(O)-необязательно замещенный алкил или -N3. Термин "C-связанная часть" означает часть, которая связана через атом углерода. Когда одна или несколько групп R связаны через атом углерода, одна или несколько из этих групп, таким образом, могут представлять собой необязательно замещенный алкил, такой как -CH2-CH2-O-CH3, -C(O)-необязательно замещенный алкил, гидроксиалкил, меркаптоалкил, аминоалкил или =CH-необязательно замещенный алкил.
[0156] Термин "алкокси", как используют в рамках изобретения, относится к группе RaO-, где Ra представляет собой алкил.
[0157] Термин "алкенилокси", как используют в рамках изобретения, относится к группе RaO-, где Ra представляет собой алкенил.
[0158] Термин "алкинилокси", как используют в рамках изобретения, относится к группе RaO-, где Ra представляет собой алкинил.
[0159] Термин "алкилсульфанил", как используют в рамках изобретения, относится к группе RaS-, где Ra представляет собой алкил.
[0160] Термин "алкенилсульфанил", как используют в рамках изобретения, относится к группе RaS-, где Ra представляет собой алкенил.
[0161] Термин "алкинилсульфанил", как используют в рамках изобретения, относится к группе RaS-, где Ra представляет собой алкинил.
[0162] Термин "алкилсульфенил", как используют в рамках изобретения, относится к группе RaS(O)-, где Ra представляет собой алкил.
[0163] Термин "алкенилсульфенил", как используют в рамках изобретения, относится к группе RaS(O)-, где Ra представляет собой алкенил.
[0164] Термин "алкинилсульфенил", как используют в рамках изобретения, относится к группе RaS(O)-, где Ra представляет собой алкинил.
[0165] Термин "алкилсульфонил", как используют в рамках изобретения, относится к группе RaSO2-, где Ra представляет собой алкил.
[0166] Термин "алкенилсульфонил", как используют в рамках изобретения, относится к группе RaSO2-, где Ra представляет собой алкенил.
[0167] Термин "алкинилсульфонил", как используют в рамках изобретения, относится к группе RaSO2-, где Ra представляет собой алкинил.
[0168] Термин "ацил", как используют в рамках изобретения, относится к группе RaC(O)-, где Ra представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, гетероарил или гетероциклил.
[0169] Термин "ароил", как используют в рамках изобретения, относится к группе RaC(O)-, где Ra представляет собой арил.
[0170] Термин "гетероароил", как используют в рамках изобретения, относится к группе RaC(O)-, где Ra представляет собой гетероарил.
[0171] Термин "гетероциклоил", как используют в рамках изобретения, относится к группе RaC(O)-, где Ra представляет собой гетероциклил.
[0172] Термин "алкоксикарбонил", как используют в рамках изобретения, относится к группе RaOC(O)-, где Ra представляет собой алкил.
[0173] Термин "ацилокси", как используют в рамках изобретения, относится к группе RaC(O)O-, где Ra представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, гетероарил или гетероциклил.
[0174] Термин "ароилокси", как используют в рамках изобретения, относится к группе RaC(O)O-, где Ra представляет собой арил.
[0175] Термин "гетероароилокси", как используют в рамках изобретения, относится к группе RaC(O)O-, где Ra представляет собой гетероарил.
[0176] Термин "гетероциклоилокси", как используют в рамках изобретения, относится к группе RaC(O)O-, где Ra представляет собой гетероциклил.
[0177] Термин "замещенный", как используют в рамках изобретения, относится к замещению названным заместителем или заместителями, причем допускается множество степеней замещения, если нет иных указаний.
[0178] Термины "содержит" или "содержащий", как используют в рамках изобретения, могут относиться к линейным замещениям в любом положении вдоль определенных выше алкильных, алкенильных, алкинильных или циклоалкильных заместителей на один или несколько из любых из O, S, SO, SO2, N или N-алкила, включая, например, -CH2-O-CH2, -CH2-SO2-CH2, -CH2-NH-CH3 и т.д.
[0179] Термин "оксо", как используют в рамках изобретения, относится к заместителю =O.
[0180] Термин "галоген" или "гало", как используют в рамках изобретения, включает йод, бром, хлор и фтор.
[0181] Термин "меркапто", как используют в рамках изобретения, относится к заместителю -SH.
[0182] Термин "карбокси", как используют в рамках изобретения, относится к заместителю -COOH.
[0183] Термин "циано", как используют в рамках изобретения, относится к заместителю -CN.
[0184] Термин "аминосульфонил", как используют в рамках изобретения, относится к заместителю -SO2NH2.
[0185] Термин "карбамоил", как используют в рамках изобретения, относится к заместителю -C(O)NH2.
[0186] Термин "сульфанил", как используют в рамках изобретения, относится к заместителю -S-.
[0187] Термин "сульфенил", как используют в рамках изобретения, относится к заместителю -S(O)-.
[0188] Термин "сульфонил", как используют в рамках изобретения, относится к заместителю -S(O)2-.
[0189] Термин "этокси", как используют в рамках изобретения, относится к заместителю -O-CH2CH3.
[0190] Термин "метокси", как используют в рамках изобретения, относится к заместителю -O-CH3.
[0191] Как используют в рамках изобретения, термин "необязательно" означает, что описанное после него событие(я) может произойти или может не произойти, и включает как событие(я), которое происходит, так и события, которые не происходят.
[0192] Соединения структурной формулы I и формул Ia-f могут содержать один или несколько асимметричных центров и, таким образом, могут встречаться в качестве рацематов и рацемических смесей, единичных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Подразумевается, что настоящее изобретение охватывает все такие изомерные формы соединений структурной формулы I и формул Ia-f.
[0193] Соединения структурной формулы I и формул Ia-f могут быть разделены на их индивидуальные диастереоизомеры, например, посредством фракционной кристаллизации из подходящего растворителя, например, метанола или этилацетата, или их смеси, или посредством хиральной хроматографии с использованием оптически активной стационарной фазы. Абсолютная стереохимия может быть определена рентгеновской кристаллографией кристаллических продуктов или кристаллических промежуточных соединений, которые дериватизированы, если необходимо, реагентом, содержащим асимметричный центр известной абсолютной конфигурации.
[0194] Альтернативно любой стереоизомер соединения общей структурной формулы I и формул Ia-f может быть получен стереоспецифическим синтезом с использованием оптически чистых исходных материалов или реагентов известной абсолютной конфигурации.
[0195] Если желательно, рацемические смеси соединений можно разделять так, чтобы выделить индивидуальные энантиомеры. Разделение можно проводить способами, хорошо известными в данной области, такими как реакция сочетания рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси с последующим разделением индивидуальных диастереомеров стандартными способами, такими как фракционная кристаллизация или хроматография. Реакция сочетания часто представляет собой образование солей с использованием энантиомерно чистой кислоты или основания. Затем диастереомерные производные можно конвертировать в чистые энантиомеры посредством расщепления добавленного хирального остатка. Рацемическую смесь соединений также можно разделять прямо хроматографическими способами с использованием хиральных стационарных фаз, которые хорошо известны в данной области.
[0196] Некоторые из соединений, описанных в настоящем описании, содержат олефиновые двойные связи, и, если нет иных указаний, включают как E-, так и Z-геометрические изомеры.
[0197] Некоторые из соединений, описанных в настоящем описании, могут существовать в качестве таутомеров, которые имеют различные точки присоединения водорода, что сопровождается одним или несколькими сдвигами двойной связи. Например, кетон и его енольная форма являются кето-енольными таутомерами. Индивидуальные таутомеры, а также их смеси, охватываются соединениями по настоящему изобретению.
[0198] В соединениях общей формулы I и формул Ia-f, атомы могут проявлять их природную изотопную распространенность или один или несколько атомов могут быть искусственно обогащены конкретным изотопом, имеющим то же атомное число, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, преимущественно встречающихся в природе. Подразумевается, что настоящее изобретение включает все подходящие изотопные варианты соединений общей формулы I и формул Ia-g. Например, различные изотопные формы водорода (H) включают протий (1H) и дейтерий (2H). Протий представляет собой преобладающий изотоп водорода, встречающийся в природе. Обогащение дейтерием может обеспечить определенные терапевтические преимущества, такие как увеличение времени полужизни in vivo или снижение требуемых дозировок, или может обеспечить соединение, пригодное в качестве стандарта для охарактеризации биологических образцов. Изотопно обогащенные соединения общей формулы I и формул Ia-f можно получить без излишнего экспериментирования общепринятыми способами, хорошо известными специалистам в данной области или с использованием процессов, аналогичных процессам, описанным на схемах и в примерах настоящего описания с использованием подходящих изотопно обогащенных реагентов и/или промежуточных соединений.
[0199] Будет понятно, что, как используют в рамках изобретения, отсылки к соединениям структурной формулы I и формул Ia-f также включают фармацевтически приемлемые соли, а также соли, которые не являются фармацевтически приемлемыми, когда их используют в качестве предшественников для свободных соединений или их фармацевтически приемлемых солей или в других манипуляциях при синтезе.
Композиции
[0200] Согласно другому аспекту, описанное изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно из низкомолекулярных соединений против злокачественной опухоли и фармацевтически приемлемый носитель.
[0201] Термин "активный", как используют в рамках изобретения, относится к наличию фармакологической или биологической активности или эффекта. Термин "активный ингредиент" ("AI", "активный фармацевтический ингредиент", или "активный ингредиент без вспомогательных веществ") представляет собой вещество в лекарственном средстве, которое является фармацевтически активным.
[0202] Термины "состав" и "композиция" используют в настоящем описании взаимозаменяемо для обозначения продукта по описанному изобретению, который содержит все активные и инертные ингредиенты. Термины "фармацевтический состав" или "фармацевтическая композиция", как используют в рамках изобретения, относятся к составу или композиции, которые используют для предупреждения, снижения интенсивности, излечения или иного лечения заданного состояния или заболевания.
[0203] Как используют в рамках изобретения, термин "связующее вещество" относится к веществам, которые связывают или "склеивают" порошки вместе и делают их сцепленными путем формирования гранул, таким образом, выполняя роль "адгезива" в составе. Связующие вещества добавляют прочность сцепления, уже доступную в разбавителе или наполнителе. Иллюстративные связующие вещества включают сахара, такие как сахароза; крахмалы, происходящие из пшеницы, кукурузы, риса и картофеля; природные камеди, такие как гуммиарабик, желатин и трагакант; производные морских водорослей, такие как альгиновая кислота, альгинат натрия и альгинат аммония кальция; целлюлозные материалы, такие как метилцеллюлоза, и натрий карбоксиметилцеллюлоза, и гидроксипропилметилцеллюлоза; поливинилпирролидон и неорганические вещества, такие как алюмосиликат магния. Количество связующего вещества в композиции может находиться в диапазоне от приблизительно 2 до приблизительно 20% по массе от массы композиции, более предпочтительно, от приблизительно 3 до приблизительно 10% по массе, еще более предпочтительно от приблизительно 3 до приблизительно 6% по массе.
[0204] Как используют в рамках изобретения, термин "биодоступность" относится к скорости и степени, с которыми активный лекарственный ингредиент или терапевтическая часть всасываются в системный кровоток из введенной дозированной формы по сравнению со стандартом или контролем.
[0205] Как используют в рамках изобретения, термин "капсула" относится к специальному контейнеру или оболочке, изготовленным из метилцеллюлозы, поливиниловых спиртов или денатурированных желатинов, или крахмала для содержания или вмещения композиций, содержащих активные ингредиенты. Капсулы с твердой оболочкой, как правило, изготавливают из смесей желатинов костей и кожи свиньи с относительно высокопрочной гелевой структурой. Сама по себе капсула может содержать небольшие количества красителей, замутнителей, пластификаторов и консервантов.
[0206] Как используют в рамках изобретения, термин "красители" относится к эксципиентам, которые обеспечивают окрашивание композиции или дозированной формы. Такие эксципиенты могут включать красители пищевой категории, адсорбированные на иллюстративный адсорбент, такой как глина или оксид алюминия. Количество красителя может варьироваться от приблизительно 0,1 до приблизительно 5% по массе композиции, предпочтительно от приблизительно 0,1 до приблизительно 1%.
[0207] Как используют в рамках изобретения, термин "разбавитель" относится к веществам, которые обычно составляют основную часть композиции или дозированной формы. Иллюстративные разбавители включают сахара, таки как лактоза, сахароза, маннит и сорбит; крахмалы, происходящие из пшеницы, кукурузы, риса и картофеля; и целлюлозы, такие как микрокристаллическая целлюлоза. Количество разбавителя в композиции может находиться в диапазоне от приблизительно 10 до приблизительно 90% по массе от массы всей композиции, предпочтительно от приблизительно 25 до приблизительно 75%, более предпочтительно от приблизительно 30 до приблизительно 60% по массе, еще более предпочтительно от приблизительно 12 до приблизительно 60%.
[0208] Как используют в рамках изобретения, термин "разрыхлитель" относится к материалам, добавляемым к композиции, чтобы способствовать их разъединению (рассредоточению) и высвобождению лекарственных веществ. Иллюстративные разрыхлители включают крахмалы; "растворимые в холодной воде" модифицированные крахмалы, такие как натрий карбоксиметилкрахмал; природные и синтетические камеди, такие как камедь рожкового дерева, камедь карайи, гуаровая камедь, трагакантовая камедь и агар; производные целлюлозы, такие как метилцеллюлоза и натрий карбоксиметилцеллюлоза; микрокристаллические целлюлозы и сшитые микрокристаллические целлюлозы, такие как натрий кроскармеллоза; альгинаты, такие как альгиновая кислота и альгинат натрия; глины, такие как бентониты; и шипучие смеси. Количество дезинтегрирующего средства в композиции может находиться в диапазоне от приблизительно 2 до приблизительно 15% по массе от массы композиции, более предпочтительно от приблизительно 4 до приблизительно 10% по массе.
[0209] Как используют в рамках изобретения, термин "вещество, способствующее скольжению" относится к материалу, который препятствует сгущению и улучает текучесть гранулятов, чтобы поток был гладким и однородным. Иллюстративные вещества, способствующие скольжению, включают диоксид кремния и тальк. Количество вещества, способствующего скольжению, в композиции может находиться в диапазоне от приблизительно 0,1% до приблизительно 5% по массе от массы всей композиции, предпочтительно от приблизительно 0,5 до приблизительно 2% по массе.
[0210] Как используют в рамках изобретения, термин "смазывающее вещество" относится к веществу, добавляемому в дозированную форму, чтобы обеспечить возможность извлечения таблетки, гранул и т.д. после их прессования из формы или заготовки путем уменьшения трения или истирания. Иллюстративные смазывающие вещества включают стеараты металлов, такие как стеарат магния, стеарат кальция или стеарат калия; стеариновую кислоту; высокоплавкие воски; и растворимые в воде смазывающие вещества, такие как хлорид натрия, бензоат натрия, ацетат натрия, олеат натрия, полиэтиленгликоли и d'l-лейцин. Смазывающие вещества обычно добавляют на самой последней стадии перед прессованием, поскольку они должны присутствовать на поверхностях гранул и между ними и частями таблеточного пресса. Количество смазывающего вещества в композиции может находиться в диапазоне от приблизительно 0,2 до приблизительно 5% по массе композиции, предпочтительно от приблизительно 0,5 до приблизительно 2%, более предпочтительно от приблизительно 0,3 до приблизительно 1,5% по массе.
[0211] Как используют в рамках изобретения, термин "пероральный гель" относится к активным ингредиентам, диспергированным или солюбилизированным в гидрофильной полутвердой матрице.
[0212] Как используют в рамках изобретения, термин "таблетка" относится к прессованной или формованной твердой дозированной форме, содержащей активные ингредиенты с подходящими разбавителями. Таблетку можно получать путем прессования смесей или гранулятов, полученных влажным гранулированием, сухим гранулированием или прессованием.
[0213] Как используют в рамках изобретения, термин "терапевтическое количество" относится к количеству низкомолекулярного соединения против злокачественной опухоли, необходимому или достаточному для достижения желаемого биологического эффекта. В сочетании с указаниями, описанными в настоящем описании, путем выбора среди различных активных соединений и взвешивания факторов, таких как эффективность, относительная биодоступность, масса тела пациента, тяжесть неблагоприятных побочных эффектов и предпочтительный способ введения, может быть спланирован эффективный профилактический или терапевтический режим лечения, который не вызывает существенной токсичности и, тем не менее, является эффективным для лечения конкретного индивидуума. Эффективное количество для любого конкретного применения может варьироваться в зависимости от таких факторов, как заболевание или состояние, подвергаемые лечению, конкретное описанное соединение, размер индивидуума или тяжесть заболевания или состояния. Специалист в данной области может эмпирически определить терапевтически эффективное количество конкретного описанного соединения и/или другого лекарственного средства без необходимости в излишнем экспериментировании. Обычно является предпочтительным, чтобы использовалась максимальная доза, т.е. наиболее высокая безопасная доза согласно мнению медицинского специалиста. Термины "доза" и "дозировка" используют в настоящем описании взаимозаменяемо.
[0214] Для любого соединения, описанного в настоящем описании, терапевтически эффективное количество первоначально можно определять из предварительных исследований in vitro и/или моделей на животных. Терапевтически эффективную дозу также можно определять из данных для человека в отношении соединений общей структуры I и структур Ia-f. Используемую дозировку можно корректировать, исходя из относительной биодоступности и эффективности вводимого соединения. Корректирование дозы для достижения максимальной эффективности на основе способов, описанных выше, и других способов, которые хорошо известны в данной области, входит в пределы способностей среднего квалифицированного специалиста в данной области.
[0215] Составы ингибиторов можно вводить в фармацевтически приемлемых растворах, которые обычно содержат фармацевтически приемлемые концентрации солей, буферных средств, консервантов, совместимых носителей, адъювантов и необязательно других лекарственных средств.
[0216] Согласно другому варианту осуществления, композиции по описанному изобретению, кроме того, могут включать один или несколько дополнительных совместимых активных ингредиентов. "Совместимый", как используют в рамках изобретения, означает, что компоненты такой композиции могут быть комбинированы друг с другом так, чтобы не происходило взаимодействия, которое может существенно снизить эффективность композиции в обычных условиях применения. Как используют в рамках изобретения, выражение "дополнительный активный ингредиент" относится к средству, отличному от соединений против злокачественной опухоли описанной композиции, которое проявляет фармакологическую или любую другую полезную активность. Неограничивающие примеры таких дополнительных лекарственных средств включают, но не ограничиваются ими, 5-фторурацил, лейковорин, оксалиплатин капецитабин, лейковорин, иринотекан, капецитабин, оксалиплатин, бевацизумаб, цетуксимаб, панитумумаб или их комбинацию.
Фармацевтически приемлемый носитель
[0217] Термин "фармацевтически приемлемый носитель", как используют в рамках изобретения, относится к одному или нескольким совместимым твердым или жидким наполнителям, разбавителям или инкапсулирующим веществам, которые являются типичными для введения человеку или другому позвоночному животному. Термин "носитель", как используют в рамках изобретения, относится к органическому или неорганическому ингредиенту, природному или синтетическому, с которым комбинируют активный ингредиент для облегчения применения. Согласно некоторым вариантам осуществления, носитель может быть инертным или он может обладать фармацевтической пользой.
[0218] Компоненты фармацевтических композиций также могут быть объединены так, чтобы не было взаимодействия, которое существенно ухудшит желаемую фармацевтическую эффективность.
[0219] Носитель может быть жидким или твердым и его выбирают, учитывая планируемый способ введения, для обеспечения желаемого объема, консистенции и т.д. при комбинировании с активными и другими компонентами данной композиции.
Введение
[0220] Для применения в терапии терапевтическое количество низкомолекулярного соединения против злокачественной опухоли можно вводить индивидууму любым путем. Введение фармацевтической композиции можно проводить любыми способами, известными квалифицированному специалисту. Пути введения включают, но не ограничиваются ими, парентеральный, пероральный, буккальный, местный, посредством ингаляции или инсуффляции (т.е. через рот или через нос) или ректальный.
[0221] Термин "парентеральный", как используют в рамках изобретения, относится к предоставлению организму путем инъекции (т.е. введение путем инъекции), в том числе, например, подкожно (т.е. инъекция под кожу), внутримышечно (т.е. инъекция в мышцу); внутривенно (т.е. инъекция в вену), интратекально (т.е. инъекция в пространство вокруг спинного мозга или под паутинную оболочку головного мозга), посредством внутригрудинной инъекции или способами инфузии. Парентерально вводимую композицию доставляют с использованием иглы, например, хирургической иглы. Термин "хирургическая игла", как используют в рамках изобретения, относится к любой игле, адаптированной для доставки жидкой (т.е. способной течь) композиции в выбранную анатомическую структуру. Инъецируемые препараты, такие как стерильные водные или масляные суспензии, можно составлять в соответствии с известным уровнем техники с использованием иллюстративных диспергирующих или смачивающих веществ и суспендирующих веществ.
[0222] Композиции по настоящему изобретению могут быть в форме стерильного инъекционного водного раствора или масляной суспензии. Раствор обычно считают однородной смесью двух или более веществ; часто, хотя и необязательно, он представляет собой жидкость. В растворе молекулы растворимого вещества (или растворенного вещества) однородно распределены среди молекул растворителя. Суспензия представляет собой дисперсию, в которой тонкоизмельченный компонент комбинируют с другим компонентом, причем первый из них является настолько тонкоизмельченным и смешанным, что не происходит его быстрое оседание. Термин "дисперсия", как используют в рамках изобретения, относится к двухфазной системе, в которой одна фаза распределена в качестве частиц или капель во второй или непрерывной фазе. В этих системах диспергированную фазу часто называют непрерывной или внутренней фазой, и непрерывную фазу называют внешней фазой или дисперсионной средой. Например, в грубых дисперсиях размер частиц составляет 0,5 мм. В коллоидных дисперсиях размер диспергированных частиц находится в диапазоне приблизительно от 1 нм до 0,5 мм. Молекулярная дисперсия представляет собой дисперсию, в которой диспергированная фаза состоит из индивидуальных молекул; если размер молекул является меньшим, чем коллоидный размер, то результатом является истинный раствор.
[0223] Композиции по описанному изобретению также могут иметь форму эмульсии. Эмульсия представляет собой двухфазную систему, полученную путем комбинирования двух несмешивающихся жидких носителей, один из которых распределен однородно в другом и состоит из глобул, которые имеют диаметры, равные или превышающие диаметры наиболее крупных коллоидных частиц. Размер глобул является важным и должен быть таким, чтобы система достигала максимальной стабильности. Обычно разделение двух фаз не происходит, если включено третье вещество - эмульгатор. Таким образом, основная эмульсия содержит по меньшей мере три компонента, два несмешивающихся жидких носителя и эмульгатор, а также активный ингредиент. Большинство эмульсий включают водную фазу в неводной фазе (или наоборот). Однако является возможным получение эмульсий, которые в основном являются неводными, как например, анионные и катионные поверхностно-активные вещества неводной несмешивающейся системы глицерина и оливкового масла. Таким образом, композиции по изобретению могут быть в форме эмульсии типа "масло в воде". Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, вазелиновое масло, или их смесь. Иллюстративные эмульгаторы могут представлять собой встречающиеся в природе камеди, например, гуммиарабик или трагакантовую камедь, встречающиеся в природе фосфатиды, например, соевые, лецитин и сложные эфиры или частичные сложные эфиры, образованные из жирных кислот и ангидридов гексита, например моноолеат сорбитана, и продукты реакции конденсации частичных сложных эфиров с оксидом этилена, например, полиоксиэтилена сорбитана моноолеат.
[0224] Согласно некоторым вариантам осуществления композиция может быть составлена для парентерального введения посредством болюсной инъекции или непрерывной инфузии. Составы для инъекции могут быть предоставлены в единичной дозированной форме, например, в ампулах или в многодозовых контейнерах с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и они могут содержать вещества для составления, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Фармацевтические составы для парентерального введения включают водные растворы активных соединений в растворимой в воде форме. Кроме того, суспензии активных соединений можно при необходимости получать в форме масляных инъекционных суспензий. Иллюстративные липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные инъекционные суспензии могут содержать вещества, которые повышают вязкость суспензии, такие как натрий карбоксиметилцеллюлоза, сорбит или декстран. Необязательно, суспензия также может содержать иллюстративные стабилизаторы или средства, которые повышают растворимость соединений для возможности получения высококонцентрированных растворов. Альтернативно активные соединения могут иметь форму порошка для разбавления иллюстративным носителем, например, стерильной свободной от пирогенов водой, перед применением.
[0225] Фармацевтические композиции также могут содержать иллюстративные твердофазные или гелеобразные носители или эксципиенты. Примеры таких носителей или эксципиентов включают, но не ограничиваются ими, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
[0226] Иллюстративные жидкие или твердые формы фармацевтических препаратов являются, например, микроинкапсулированными и в соответствующих случаях с одним или несколькими эксципиентами, являются заключенными в кохлеаты, являются нанесенными на микроскопические золотые частицы, содержатся в липосомах, гранулах для имплантации в ткани или являются высушенными на объекте для втирания в ткань. Такие фармацевтические композиции также могут иметь форму гранул, шариков, порошков, таблеток, покрытых таблеток, (микро)капсул, суппозиториев, сиропов, эмульсий, суспензий, кремов, капель или препаратов с замедленным высвобождением активных соединений, в которых обычно используются эксципиенты и добавки и/или вспомогательные вещества препаратов, такие как разрыхлители, связующие вещества, средства для покрытия, средства, способствующие набуханию, смазывающие вещества или солюбилизаторы, как описано выше. Фармацевтические композиции являются иллюстративными для применения в различных системах доставки лекарственных средств. Для краткого обзора способов доставки лекарственных средств см. Langer 1990 Science 249, 1527-1533, которая включена в настоящее описание в качестве ссылки.
[0227] В зависимости от структуры, по меньшей мере одно низкомолекулярное соединение против злокачественной опухоли по описанному изобретению и необязательно по меньшей мере одно дополнительное активное вещество можно вводить как есть (в чистом виде) или, в зависимости от структуры ингибитора, в форме фармацевтически приемлемой соли. Ингибиторы по описанному изобретению могут образовывать фармацевтически приемлемые соли с органическими или неорганическими кислотами, или органическими или неорганическими основаниями. При применении в медицине соли должны быть фармацевтически приемлемыми, однако может быть удобным использование не фармацевтически приемлемых солей для получения их фармацевтически приемлемых солей. Такие соли включают, но не ограничиваются ими, соли, полученные из следующих кислот: хлористоводородная, бромистоводородная, серная, азотная, фосфорная, малеиновая, уксусная, салициловая, п-толуолсульфоновая, виннокаменная, лимонная, метансульфоновая, муравьиная, малоновая, янтарная, нафталин-2-сульфоновая и бензолсульфоновая. Также, такие соли можно получать в качестве солей щелочных металлов и щелочноземельных металлов, таких как натриевые, калиевые или кальциевые соли группы карбоновой кислоты.
[0228] Под "фармацевтически приемлемой солью" подразумевают соли, которые по мнению медицинского специалиста являются типичными для применения в контакте с тканями человека и низших животных без чрезмерной токсичности, раздражения, аллергического ответа и т.п. и соответствуют приемлемому соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, P. H. Stahl, et al. подробно описывают фармацевтически приемлемые соли в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" (Wiley VCH, Zurich, Switzerland: 2002).
[0229] Соли можно получать in situ в процессе конечного выделения и очистки соединений, описанных в рамках изобретения, или отдельно путем реакции функциональной группы свободного основания с иллюстративной органической кислотой. Репрезентативные кислотно-аддитивные соли включают, но не ограничиваются ими, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфоросульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат(изетионат), лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Также основные азот-содержащие группы могут быть квартенизированы с использованием таких средств, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, бромиды и йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты; галогениды длинной цепи, такие как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; арилалкилгалогениды, такие как бензил- и фенэтилбромиды, и другие. Таким образом, получают растворимые или диспергируемые в воде или масле продукты. Примеры кислот, которые используют для получения фармацевтически приемлемых кислотно-аддитивных солей, включают такие неорганические кислоты, как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота. Основно-аддитивные соли можно получать in situ в ходе конечного выделения и очистки соединений, описанных в рамках изобретения, путем реакции части, содержащей карбоновую кислоту, с иллюстративным основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, или с аммиком или органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые соли включают, но не ограничиваются ими, катионы щелочных металлов, щелочноземельных металлов, такие как соли лития, натрия, калия, кальция, магния и алюминия и т.п. и нетоксичные катионы аммиака и аминов, включая аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин и т.п. Другие репрезентативные органические амины, пригодные для образования основно-аддитивных солей, включают этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и т.п. Фармацевтически приемлемые соли также можно получать с использованием стандартных методик, хорошо известных в данной области, например, посредством реакции достаточно основного соединения, такого как амин, с иллюстративной кислотой с получением физиологически приемлемого аниона. Также можно получать соли щелочных металлов (например, натрия, калия или лития) или щелочноземельных металлов (например, кальция или магния) с карбоновыми кислотами.
[0230] Составы в целях удобства могут быть предоставлены в единичной дозированное форме, и их можно получать любыми из способов, хорошо известных в области фармацевтики. Все способы включают стадию приведения в контакт композиции или ее фармацевтически приемлемой соли или сольвата ("активное соединение") с носителем, который представляет собой один или несколько вспомогательных средств. Как правило, составы получают путем однородного и тщательного смешения активного агента с жидкими носителями или тонкоизмельченными твердыми носителями или и с теми, и с другими, а затем, если необходимо, придания продукту форму желаемого состава.
[0231] Фармацевтическое средство или его фармацевтически приемлемый сложный эфир, соль, сольват или пролекарство можно смешивать с другими активными материалами, которые не ухудшают желаемого действия, или с материалами, которые дополняют желаемое действие. Растворы или суспензии, используемые для парентерального, внутрикожного, подкожного, интратекального или местного применения, могут включать, но не ограничиваются ими, например, следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для коррекции тоничности, такие как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или многодозовые флаконы, изготовленные из стекла или пластмассы. Для внутривенного введения конкретные носители представляют собой физиологический солевой раствор или фосфатно-солевой буфер (PBS).
[0232] Фармацевтические композиции для парентеральной инъекции содержат фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для восстановления в стерильные инъекционные растворы или дисперсии. Примеры иллюстративных водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и т.п), их иллюстративные смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, с использованием покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и с использованием поверхностно-активных веществ.
[0233] Эти композиции также могут содержать адъюванты, включающие консерванты, смачивающие вещества, эмульгаторы и диспергирующие вещества. Предупреждение воздействия микроорганизмов можно осуществлять с использованием различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть желательным включение обеспечивающих изотоничность средств, например, сахаров, хлорида натрия и т.п. Длительного всасывания инъекционной фармацевтической формы можно достигать с использованием средств, замедляющих всасывание, например, моностеарата алюминия и желатина.
[0234] Суспензии, в дополнение к активным соединениям, могут содержать суспендирующие вещества, например, такие как этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар, трагакант и их смеси.
[0235] Лекарственное средство(ы), включающее композицию(и) по описанному изобретению, может быть предоставлено в виде частиц. Термин "частицы", как используют в рамках изобретения, относится к нано- или микрочастицам (или в некоторых случаях к более крупным частицам), которые могут содержать целиком или частично композицию или другое лекарственное средство(а), как описано в настоящем описании. Частицы могут содержать лекарственное средство(а) в сердцевине, окруженной покрытием. Лекарственное средство(а) также может быть диспергировано в частицах. Лекарственное средство(а) также может быть адсорбировано на частицах. Частицы могут иметь кинетику высвобождения любого порядка, включая нулевой порядок высвобождения, первый порядок высвобождения, второй порядок высвобождения, отсроченное высвобождение, замедленное высвобождение, немедленное высвобождение и т.д. и любую их комбинацию. Частица может включать, в дополнение к лекарственному средству(ам), любой из материалов, обычно используемых в области фармацевтики и медицины, включая, но не ограничиваясь ими, разлагающиеся, неразлагающиеся, биоразлагающиеся и небиоразлагающиеся материалы или их комбинации. Частицы могут представлять собой микрокапсулы, которые содержат композицию в растворе или в полутвердом состоянии. Частицы могут иметь практически любую форму.
[0236] Для изготовления частиц для доставки лекарственного средства(средств) можно использовать как небиоразлагающиеся, так и биоразлагающиеся полимерные материалы. Такие полимеры могут представлять собой природные или синтетические полимеры. Полимер выбирают, исходят из периода времени, в течение которого является желательным высвобождение. Например, биоадгезивные полимеры включают биоразлагающиеся гидрогели, как описано Sawhney et al в Macromolecules (1993) 26, 581-587, указания которой включены в настоящее описание в качестве ссылки. Они включают полигиалуроновые кислоты, казеин, желатин, глютин, полиангидриды, полиакриловую кислоту, альгинат, хитозан, полиметилметакрилаты, полиэтилметакрилаты, полибутилметакрилат, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат и полиоктадецилакрилат.
[0237] Лекарственное средство(а) может содержаться в системах с контролируемым высвобождением. Для продления эффекта лекарственного средства часто является желательным замедление всасывания лекарственного средства после подкожной, интратекальной или внутримышечной инъекции. Это можно осуществлять с использованием жидкой суспензии кристаллического или аморфного материала с низкой растворимостью в воде. Таким образом, скорость всасывания лекарственного средства зависит от скорости его растворения, которая в свою очередь может зависеть от размера кристаллов и кристаллической формы. Термин "контролируемое высвобождение" относится к любому содержащему лекарственное средство составу, в котором характер и профиль высвобождения лекарственного средства из состава контролируются. Это относится к составам с немедленным высвобождением, а также с высвобождением, не являющимся немедленным, причем составы с высвобождением, не являющимся немедленным включают, но не ограничиваются ими, составы с замедленным высвобождением и составы с отсроченным высвобождением. Термин "замедленное высвобождение" (также называемый "пролонгированным высвобождением") используют в рамках настоящего изобретения в его общепринятом значении для обозначения лекарственного состава, который обеспечивает постепенное высвобождение лекарственного средства на протяжении более длительного периода времени, и это может приводить по существу к постоянным уровням лекарственного средства в крови на протяжении длительного периода времени. Альтернативно замедленного всасывания парентерально вводимой лекарственной формы достигают путем растворения или суспендирования лекарственного средства в масляном носителе. Термин "отсроченное высвобождение" используют в рамках настоящего изобретения в его общепринятом значении для обозначения лекарственного состава, в котором существует запаздывание между введением состава и высвобождением лекарственного средства из него. "Отсроченное высвобождение" может вовлекать или может не вовлекать постепенное высвобождение лекарственного средства на протяжении длительного периода времени и, таким образом, оно может быть или может не быть "замедленным высвобождением".
[0238] Согласно некоторым вариантам осуществления, применение имплантата с длительным замедленным высвобождением может быть желательным для лечения хронических состояний. Термин "длительное" высвобождение, как используют в рамках изобретения, означает, что имплантат конструируют и размещают для доставки терапевтических уровней активного ингредиента в течение по меньшей мере 7 суток, и предпочтительно от приблизительно 30 до приблизительно 60 суток. Имплантаты с длительным замедленным высвобождением хорошо известны средним специалистам в данной области и включают некоторые из систем высвобождения, описанных выше.
[0239] Инъекционные депо-формы получают путем формирования микроинкапсулированных матриц описанного ингибитора в биодеградирующих полимерах, таких как полилактид-полигликолид. В зависимости от соотношения ингибитора и полимера и природы конкретного используемого полимера, скорость высвобождения лекарственного средства можно контролировать. Такие составы длительного действия можно составлять с подходящими полимерными или гидрофобными материалами (например, в качестве эмульсии в приемлемом масле) или ионообменными смолами или в качестве умеренно растворимых производных, например, таких как умеренно растворимая соль. Примеры других биодеградирующих полимеров включают сложные полиортоэфиры и полиангидриды. Инъекционные депо-составы также получают путем заключения ингибитора по описанному изобретению в липосомы или микроэмульсии, которые совместимы с тканями организма.
[0240] Инъекционные составы можно стерилизовать, например, путем фильтрации через задерживающий бактерии фильтр или путем включения стерилизующих средств в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде непосредственно перед применением. Инъекционные препараты, например, стерильные инъекционные водные или масляные суспензии, можно составлять в соответствии с уровнем техники с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, как например, раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, находятся вода, раствор Рингера, раствор хлорида натрия U.S.P. и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют жирные масла. Для этой цели можно использовать любое легкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, для получения инъекционных препаратов используют жирные кислоты, такие как олеиновая кислота.
[0241] Составы для парентерального (включая, но не ограничиваясь ими, подкожное, внутрикожное, внутримышечное, внутривенное, интратекальное и внутрисуставное) введения включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворенные вещества, которые сообщают составу изотоничность с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие вещества и загустители. Составы могут быть предоставлены в однодозовых или многодозовых контейнерах, например, запаянных ампулах и флаконах, и они могут храниться в высушенном сублимационной сушкой (лиофилизированном) состоянии, требуя только добавления стерильного жидкого носителя, например, солевого раствора, воды для инъекций, непосредственно перед применением. Растворы и суспензии, приготавливаемые непосредственно перед инъекцией, можно получать из стерильных порошков, гранул и таблеток описанного выше типа.
[0242] Иллюстративные буферные средства включают: уксусную кислоту и соль (1-2% масс./об.); лимонную кислоту и соль (1-3% масс./об.); борную кислоту и соль (0,5-2,5% масс./об.); и фосфорную кислоту и соль (0,8-2% масс./об.). Иллюстративные консерванты включают хлорид бензалкония (0,003-0,03% масс./об.); хлорбутанол (0,3-0,9% масс./об.); парабены (0,01-0,25% масс./об.) и тимеросал (0,004-0,02% масс./об.).
[0243] Для перорального введения в форме таблеток или капсул, активный лекарственный компонент можно комбинировать с любым пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как лактоза, крахмал, сахароза, целлюлоза, стеарат магния, дикальцийфосфат, сульфат кальция, тальк, маннит, этиловый спирт (жидкие формы) и т.п. Более того, когда желательно или необходимо, также в смесь можно включать подходящие связующие вещества, смазывающие вещества, дезинтегрирующие вещества и красители. Порошки и таблетки могут содержать от приблизительно 5 до приблизительно 95 процентов описанной композиции. Иллюстративные связующие вещества включают крахмал, желатин, природные сахара, кукурузные подсластители, природные и синтетические камеди, такие как гуммиарабик, альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль и воски. Среди смазывающих веществ для применения в этих дозированных формах могут быть упомянуты борная кислота, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Разрыхлители включают крахмал, метилцеллюлозу, гуаровую камедь и т.п. Также могут быть включены подсластители и вкусовые добавки, когда это целесообразно.
[0244] Композиции по изобретению также могут быть составлены в качестве сиропов и эликсиров. Сиропы и эликсиры могут быть составлены с подсластителями, например, глицерином, пропиленгликолем, сорбитом или сахарозой. Такие составы также могут содержать успокаивающее средство, консервант и вкусовые добавки и красители. Успокаивающие средства представляют собой защитные средства, используемые в основном для смягчения раздражения, в частности, слизистых оболочек или оцарапанных тканей. Успокаивающими свойствами обладает ряд химических веществ. Эти вещества включают альгинаты, растительные клеи, камеди, декстрины, крахмалы, определенные сахара и полимерные многоатомные гликоли. Другие вещества включают гуммиарабик, агар, бензоин, карбомер, желатин, глицерин, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, пропиленгликоль, альгинат натрия, трагакант, гидрогели и т.п.
[0245] Для буккального введения композиции по настоящему изобретению могут иметь форму таблеток или пастилок, составленных общепринятым способом для этого пути.
[0246] Препараты в жидкой форме включают растворы, суспензии и эмульсии.
[0247] Препараты в жидкой форме также могут включать растворы для интраназального введения.
[0248] Композиции по настоящему изобретению могут быть в форме дисперсного сухого порошка для доставки посредством ингаляции или инсуффляции (либо через рот, либо через нос). Композиции в виде сухого порошка можно получать способами, известными в данной области, такими как лиофилизация и размол на струйной мельнице, как описано в международной публикации патента № WO 91/16038 и как описано в патенте США № 6921527, содержание которого включено в настоящее описание в качестве ссылки. Композицию по настоящему изобретению помещают в иллюстративную емкость для дозировок в количестве, достаточном для обеспечения индивидууму введения единичной дозировки. Емкость для дозировок представляет собой емкость, которая соответствует иллюстративному ингаляционному устройству для обеспечения аэрозолирования сухой порошковой композиции путем диспергирования в потоке газа с образованием аэрозоля, а затем улавливания аэрозоля, полученного таким образом, в камере, имеющей наконечник, подсоединенный для последующей ингаляции индивидуумом, нуждающимся в лечении. Такая емкость для дозировки включает любой контейнер, заключающий в себе композицию, известную в данной области, такую как желатиновые или пластмассовые капсулы с извлекаемой частью, которая позволяет направить поток газа (например, воздуха) в контейнер для диспергирования композиции сухого порошка. Такие контейнеры иллюстрируются контейнерами, представленными в патенте США № 4227522; патенте США № 4192309 и патенте США № 4105027. Иллюстративные контейнеры также включают контейнеры, используемые совместно с ингалятором сухого порошка торговой марки Glaxo's Ventolin® Rotohaler или ингалятором сухого порошка торговой марки Fison's Spinhaler®. Другой иллюстративный контейнер единичной дозировки, который обеспечивает улучшенный барьер от влаги, получают из пластмассового ламината с алюминиевой фольгой. Фармацевтический порошок заполняют по массе или по объему в углубление из формуемой фольги и герметично закрывают, покрывая ламинатом из фольги-пластмассы. Такой контейнер для применения с устройством для ингаляции порошка описан в патенте США № 4778054 и используется с Glaxo's Diskhaler® (патенты США № 4627432; 4811731 и 5035237). Каждая из этих ссылок включена в настоящее описание в качестве ссылки.
[0249] Композиции по настоящему изобретению также могут иметь форму суппозиториев для ректального введения композиции. "Ректальный" или "ректально", как используют в рамках изобретения, относится к введению в организм через прямую кишку, где всасывание происходит через стенки прямой кишки. Эти композиции можно получать путем смешения лекарственного средства с иллюстративным не вызывающим раздражения эксципиентом, таким как масло какао и полиэтиленгликоли, которые являются твердыми при обычных температурах, но жидкими при ректальной температуре и, таким образом, плавятся в прямой кишке и высвобождают лекарственное средство. При составлении в качестве суппозитория композиции по изобретению можно составлять с традиционными связующими веществами и носителями, такими как триглицериды.
[0250] Термин "местный" относится к введению композиции по изобретению в или непосредственно ниже точки применения. Выражение "местное нанесение" описывает нанесение на одну или несколько поверхность(ей), включая эпителиальные поверхности. Хотя местное введение, в противоположность чрескожному введению, обычно обеспечивает локальный, а не системный эффект, термины "местное введение" и "чрескожное введение", как используют в рамках изобретения, если нет иных указаний или не подразумевается иное, используют взаимозаменяемо. Для целей настоящей заявки местное применение включает жидкости для полоскания рта и жидкости для полоскания горла.
[0251] Местное введение также может вовлекать применение чрескожного введения, такого как трансдермальные пластыри или устройства для ионтофореза, которые изготавливают согласно способам и методикам, хорошо известным в данной области. Термины "система для трансдермальной доставки", "трансдермальный пластырь" или "пластырь" относятся к адгезионной системе, помещаемой на кожу для доставки дозы лекарственного средства(средств) с медленным высвобождением посредством прохождения дозированной формы через кожу, чтобы оно было доступным для распределения через системный кровоток. Трансдермальные пластыри представляют собой общепризнанную технологию, используемую для доставки широкого множества фармацевтических препаратов, включая, но не ограничиваясь ими, скополамин против укачивания, нитроглицерин для лечения стенокардии, клонидин против гипертензии, эстрадиол против постменопаузальных симптомов, и никотин для прекращения курения.
[0252] Иллюстративные пластыри для применения в рамках настоящего изобретения включают, но не ограничиваются ими, (1) матриксный пластырь; (2) резервуарный пластырь; (3) многослойный пластырь с лекарственным средством в адгезиве; и (4) монолитный пластырь с лекарственным средством в адгезиве; TRANSDERMAL AND TOPICAL DRUG DELIVERY SYSTEMS, pp. 249-297 (Tapash K. Ghosh et al. eds., 1997), включенная в настоящее описание в качестве ссылки. Эти пластыри хорошо известны в данной области и являются коммерчески общедоступными.
[0253] Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. Хотя для применения на практике или исследования описанного изобретения можно использовать любые способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем описании, предпочтительные способы и материалы описаны в настоящем описании. Все публикации, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок для раскрытия и описания способов и/или материалов, применительно к которым публикации цитируются.
[0254] Когда предоставлен диапазон величин, понятно, что каждая входящая в него величина до десятой доли единицы нижней границы, если контекст явно не указывает на иное, между верхней и нижней границами этого диапазона, и любая другая указанная или входящая в этот указанный диапазон величина охватывается изобретением. Верхние и нижние границы этих меньших диапазонов, которые могут быть независимо включены в меньшие диапазоны, также охватываются изобретением, за исключением какого-либо конкретно исключенного предела в указанном диапазоне. Когда указанный диапазон включает одну или несколько границ, диапазоны, исключающие любую или обе из этих включенных границ, также включены в изобретение.
[0255] Следует отметить, что, как используют в рамках изобретения и в прилагаемой формуле изобретения, форма единственного числа включает множественное число объектов ссылки, если контекст явно не указывает на иное. Все технические и научные термины, используемые в настоящем описании, имеют общепринятое значение.
[0256] Публикации, описанные в настоящем описании, предоставлены только для их раскрытия до даты подачи настоящей заявки. Ничто в настоящем описании не следует истолковывать как допущение того, что описанное изобретение не дает право на противопоставление факта создания изобретения с более ранним приоритетом. Кроме того, даты предоставленные публикации могут отличаться от истинных дат публикации, которые должны быть независимо подтверждены.
ПРИМЕРЫ
[0257] Следующие примеры предоставлены для обеспечения полного раскрытия и описания для специалиста в данной области того, как получать и применять описанное изобретение, и не предполагается, что они ограничивают объем того, что авторы изобретения считают их изобретением, а также они не предназначены для отражения того, что эксперименты, приведенные ниже, представляют собой все или единственные проведенные эксперименты. Были предприняты попытки для обеспечения точности в отношении использованных чисел (например, количества, температуры, и т.д.) однако следует учитывать некоторые экспериментальные ошибки и погрешности. Если нет иных указаний, части приведены по массе, молекулярная масса представляет собой среднюю молекулярную массу, температура представлена в градусах Цельсия и давление равно или приблизительно равно атмосферному.
Пример 1
[0258] Иммортализованные клеточные линии эпителия толстого кишечника человека (HCEC) получали с использованием экзогенно внесенной теломеразы и cdk4 (Fearon, E.R. & Vogelstein, B. A genetic model for colorectal tumorigenesis. Cell 61, 759-767 (1990).). Эти клетки являются нетрансформированными, кариотипически диплоидными и имеют мультипотентные характеристики. Когда их помещают в matrigel® в отсутствие мезенхимного фидерного слоя, индивидуальные клетки делятся и образуют самоорганизущиеся криптоподобные структуры с подгруппой клеток, проявляющих маркеры, ассоциированные со зрелым эпителием.
Ткани толстого кишечника
[0259] Это исследование было одобрено комиссией по биомедицинской этике в Dallas VA Medical center. Биоптаты толстого кишечника (20-30 образцов, ~0,5 см3) из ткани, не вовлеченной в эндоскопически видимые аденомы, получали от пациентов, подвергающихся скрининговой колоноскопии после получения информированного согласия.
Среды для роста и субстрат для культивирования тканей
[0260] Клетки выращивали на базальных средах DMEM, MEM или RPMI (Gibco®, Hyclone, Logan, UT), дополненных EGF (25 нг/мл) (Peprotech, Inc, Rocky Hill, NJ), гидрокортизоном (1 мкг/мл), инсулином (10 мкг/мл), трансферрином (2 мкг/мл), селенитом натрия (5 наномоль/л) (все от Sigma, St Louis, MO), 2% телячьей сывороткой Cosmic calf serum (Hyclone), и гентамицина сульфатом (50 мкг /мл) (Gemini Bio-Products, West Sacramento, CA). Клетки культивировали во флаконах Primaria (BD Biosciences, San Jose, CA) и выращивали в 2%-5% кислороде и 7% диоксиде углерода. HCT 116, фибробласты кожи человека BJ, клетки Hela и иммортализованные фибробластные клетки толстого кишечника человека (C26Ci, удвоение популяции 150) поддерживали в средах DMEM, MEM или RPMI (Gibco®, Hyclone, Logan, UT), дополненных 10% телячьей сывороткой Cosmic calf serum (Hyclone). Клетки C26Ci обрабатывали 10 мкг/мл митомицина c (Sigma) в течение 2 часов и использовали в качестве фидерных слоев от момента первоначального прикрепления крипт до первого пассирования.
[0261] Для обнаружения расщепленного PARP и анализа активности каспазы 3 клетки обрабатывали 2,5 мкМ TASIN-1 в течение 72 часов в присутствии или в отсутствие 12,5 мкМ SP600125 (Millipore) или 5 мкМ доксорубицина (Sigma) отдельно в течение 6 часов в качестве положительных контролей. Для синхронизации митоза клетки синхронизировали на границе G2/M посредством обработки селективным низкомолекулярным ингибитором cdk1 RO-3306 (9 мкМ) в течение 18 часов (Kim, Hyun S. et al. Systematic Identification of Molecular Subtype-Selective Vulnerabilities in Non-Small-Cell Lung cancer. Cell 155, 552-566 (2013).
Плазмиды
[0262] CDK4, hTERT, pSRZ-shTP53 и pBABE-hyg-KRASV12 описаны Vassilev, L.T., и эта статья включена в настоящее описание в качестве ссылки (Vassilev, L.T. Cell cycle synchronization at the G2/M phase border by reversible inhibition of CDK1. Cell cycle 5, 2555-2556 (2006)).
Выделение и иммортализация клеток
[0263] Биоптаты толстого кишечника погружали в холодные среды DMEM, MEM или RPMI (Gibco®, Hyclone, Logan, UT), доставляли в лабораторию в пределах 40-60 минут после колоноскопии, многократно промывали фосфатно-солевым буфером, содержавшим раствор антибиотика/фунгицида (Gemini Bio-Products) и нарезали на множество небольших фрагментов (размером ~1 мм). После ферментативного расщепления коллагеназой (Worthington Biochemical, Lakewood, NJ) в концентрации 150 Е/мл и диспазой (Roche, Germany) в концентрации 40 мкг/мл, крипты ресуспендировали в средах DMEM, MEM или RPMI (Gibco®, Hyclone, Logan, UT) с добавками для роста, включающими 2% сыворотку, и высевали в чашки для культивирования Primaria, в которые за 48 часов до этого были посеяны фидерные слои фибробластов толстого кишечника с 50% смыканием монослоя. В течение первых 10 суток после прикрепления клетки подпитывали каждые 3 суток, уменьшая количество сыворотки на 1% при каждой замене до 0% для предупреждения роста нежелательных клеток, таких как фибробласты. После того, как наблюдались небольшие гнезда увеличивающихся в количестве эпителиальных клеток, клетки трансдуцировали ретровирусными CDK4 и hTERT, как описано выше. Когда наблюдались многочисленные кубовидные клеточные гнезда (через 3-4 недели после первоначального посева крипт), клетки пересевали во флаконы Primaria. Фидерные слои не требовались или использовались для стандартного культивирования тканей после первого пассирования.
Эксперименты с нокдауном APC
[0264] HCEC, выделенные из нормальных биоптатов толстой кишки, иммортализовывали посредством последовательного инфицирования CDK4 и hTERT с последующей селекцией с соответствующими антибиотиками - G418 (250 мкг/мл) и бластоцидином (2,5 мкг/мл). кшРНК против p53 вводили с использованием ретровирусов и эффективность нокдауна p53 подтверждали вестерн-анализом. Клеточные линии рака толстого кишечника человека (HCT116, DLD-1, RKO) и продуцирующие вирус клеточные линии (293FT, Phoenix A) культивировали в базальной среде, дополненной 10% сывороткой. Идентичность всех клеточных линий подтверждали с помощью ДНК-фингерпринтинга. 1 мкг кшРНК вместе с 1 мкг хелперных плазмид (0,4 мкг pMD2G и 0,6 мкг psPAX2) трансфицировали в клетки 293FT с использованием реагента Polyjet (SignaGen). Супернатанты вирусов собирали через 48 часов после трансфекции и очищали через 0,45-мкм фильтр. Клетки инфицировали вирусными супернатантами, содержавшими 4 мкл/мл полибрена (Sigma) при множественности инфекции (MOI) приблизительно 1. Селекцию успешно инфицированных клеток проводили с использованием 1 мкг/мл пуромицина в течение 3 суток, как описано в: Eskiocak U, Kim SB, Ly P, Roig AI, Biglione S, Komurov K, Cornelius C, Wright WE, White MA, Shay JW. Functional parsing of driver mutations in the colorectal cancer genome reveals numerous suppressors of anchorage-independent growth. Cancer Res 2011;71:4359-65, которая включена в настоящее описание в качестве ссылки.
Анализ с использованием вестерн-блоттинга
[0265] После электрофореза через 10% SDS-PAGE, разделенные белки переносили на нитроцеллюлозную (NC) мембрану (Pierce, Rockford, USA). Мембрану инкубировали с первичным антителом против поли(ADP-рибоза)-полимеразы (PARP) (Millipore, Cell Signaling Technology, Santa Cruz, etc.), цитохрома C (Abcam, Cell Signaling Technology, Santa Cruz, etc.), белка потенциалзависимого анион-селективного канала 1 (VDAC) (Cell Signaling Technology, Abcam, Santa Cruz, etc.), фосфо-JNK (Cell Signaling), JNK (Cell Signaling) или актина (Abcam, Santa Cruz, Cell Signaling, etc.) в течение ночи при 4°C. После промывания перед визуализацией с использованием хемилюминесценции мембрану инкубировали с каждым соответствующим вторичным антителом. Моноклональное антитело мыши против GAPDH (Promab, USA, 1:1000) использовали в качестве первичного антитела для контроля.
Активность каспазы 3/7
[0266] Клетки обрабатывали контролем в виде носителя или 2,5 мкМ TASin-1 в течение 72 часов и подвергали анализу Caspase-Glo 3/7 в 96-луночных планшетах (Promega). В частности, 96-луночные планшеты, содержавшие клетки, извлекали из инкубатора и уравновешивали до комнатной температуры. Разбавленный реагент Caspase-Glo также уравновешивали до комнатной температуры. В каждую лунку добавляли объем реагента Caspase-Glo, равный объему среды для культивирования клеток. Смесь осторожно перемешивали с использованием устройства для встряхивания планшетов при 300-500 об/мин в течение 30 секунд, а затем инкубировали при комнатной температуре в течение от 30 минут до 3 часов. Планшет устанавливали в Veritas для начала анализа. Величины RLU измеряли с использованием Veritas™ (Promega; Способ Veritas Microplate Luminometer Method для анализа Caspase-Glo™ 3/7 Prometa).
Иммуноцитохимия
[0267] Клетки фиксировали с использованием 3,7% параформальдегида в течение 10 мин, повышали их проницаемость с использованием 0,5% Triton X-100 в PBS в течение 5 мин и инкубировали с блокирующим раствором (10% сыворотка козы и 3% BSA в PBS, содержавшем 0,1% Triton X-100) в течение 60 мин. Затем клетки инкубировали с первичными антителами, разбавленными блокирующим раствором, в течение одного часа. Использовали следующие антитела: антитело против HURP (Santa Cruz Biotechnology), антитело против α-тубулина (Cell Signaling), антитело против активного β-катенина (EMD Millipore). После инкубации с использованием вторичных антител, меченных Alexa-568 или Alexa-488 (Invitrogen), предметные стекла заливали раствором Mowiol 4-88(Calbiochem) (Eskiocak, U. et al. Functional parsing of driver mutations in the colorectal cancer genome reveals numerous suppressors of anchorage-independent growth. Cancer Res 71, 4359-4365 (2011)). Клетки наблюдали под флуоресцентным микроскопом Axiovert 200M (Carl Zeiss). Ядра подвергали контрастному окрашиванию DAPI (Vectashield, Vector Laboratories). Ширину метафазных пластинок, ширину веретена деления и ширину клеток определяли с использованием устройства для линейного измерения в программном обеспечении ImageJ.
Анализ SuperTopFlash
[0268] Клетки DLD1 временно трансфицировали конструкциями ДНК, кодирующими белки люциферазы светлячка (FL) и люциферазы Gaussia (GL), контролируемые промотором CMV, инкубировали с DMSO или TASIN-1 в течение 18 ч, а затем анализировали в отношении активности GL и FL, соответственно, через 24 ч. (Longin, A., Souchier, C., Ffrench, M. & Bryon, P.A. Comparison of anti-fading agents used in fluorescence microscopy: image analysis and laser confocal microscopy study. J Histochem Cytochem 41, 1833-1840 (1993)).
Количественная ПЦР с обратной транскрипцией (qRT-ПЦР)
[0269] Тотальную РНК выделяли из ткани мыши с использованием набора RNeasy Plus Universal Mini kit (Qiagen) в соответствии с протоколом изготовителя. Затем 1 мкг конвертировали в кДНК с использованием набора First Strand cDNA Synthesis Kit (Roche). Количественные реакции ПЦР в реальном времени проводили в трех экземплярах с использованием смеси Ssofast Master Mix (Biorad) на LightCycler® 480 (Roche). Анализ полиморфизма длин рестрикционных фрагментов (RFLP) для обнаружения мутантного Kras проводился Sato et al., и он включен в настоящее описание в качестве ссылки (Sato, M. et al. Multiple oncogenic changes (K-RAS(V12), p53 knockdown, mutant EGFRs, p16 bypass, telomerase) are not sufficient to confer a full malignant phenotype on human bronchial epithelial cells. Cancer Res 66, 2116-2128 (2006)). Все праймеры (Sigma), использованные в этом исследовании, приведены в таблице данных 3.
Таблица данных 3. Набор праймеров для q-ПЦР для генов воспаления
Таблица данных 2. Последовательность кшРНК против APC.
Анализ фармакокинетики in vivo
[0270] Самкам мышей CD-1 инъецировали в/б 10 мг/кг TASIN-1, 0,2 мл/мышь, составленного в 5% DMSO, 5% кремофоре EL, и 90% D5W, pH 7,4. Проводили взятие цельной крови. Плазму получали из цельной крови центрифугированием крови, обработанной ACD, в течение 10 минут при 10000 об/мин в стандартной центрифуге. Толстый кишечник с содержимым извлекали и содержимое толстого кишечника удаляли для дальнейшего анализа. Все полученные ткани взвешивали и быстро замораживали в жидком азоте. Гомогенат содержимого толстого кишечника (LIC) получали путем размельчения содержимого кишечника и гомогенизации в 4-кратном объеме PBS. 100 микролитров LIC смешивали с 200 микролитрами ацетонитрила, содержавшего 0,15% муравьиную кислоту и 37,5 нг/мл IS (конечная концентрация IS=25 нг/мл). Образцы встряхивали в течение 15 секунд, инкубировали при комнатной температуре в течение 10 минут и центрифугировали 2x 13200 об/мин в стандартной микроцентрифуге. Затем супернатант анализировали с использованием LC/MS/MS. Мышей, которым не проводили введение, использовали для сбора ткани для пустых гомогенатов для получения стандартов и QC.
Окрашивание тканей
Протокол окрашивания гематоксилином и эозином для парафиновых срезов
[0271] Перед окрашиванием предметные стекла подвергали термической обработке в течение по меньшей мере двадцати минут при минимальной температуре 70°C для ингибирования открепления срезов в процессе процедуры окрашивания. Срезы окрашивали в гематоксилине Вейгерта, рабочий раствор, в течение 6 минут, и сушили. Предметные стекла дегидратировали в 70% кислоте-этаноле, pH 2,5, с использованием двух смен, по три быстрых погружения в каждом случае. Предметные стекла дегидратировали в 70% кислоте-DI, pH 2,5, с использованием двух смен, по три быстрых погружения в каждом случае. Предметные стекла промывали в проточной водопроводной воде в течение 15 минут и избыток воды на предметных стеклах осушали, а затем окрашивали в рабочем растворе эозина-флоксина в течение 2 минут и осушали. Предметные стекла дегидратировали в 95% этаноле с использованием двух смен по 30 секунд каждая, полностью дегидратировали в 100% этаноле, с использованием трех смен, по три быстрых погружения в каждом случае, и очищали в Histoclear (National Diagnosics; AGTC Bioproducts, etc.), с использованием двух смен, по одной минуте каждая. Использовали свежий Histoclear и предметные стекла заклеивали покровными стеклам с заливочной средой.
Протокол окрашивания гематоксилином и эозином для замороженных срезов тканей
[0272] Срезы помещали на предметные стекла и сушили воздухом для удаления влаги, окрашивали фильтрованным 0,1% гематоксилином Майера (Sigma; MHS-16) в течение 10 минут и ополаскивали холодной проточной ddH2O в течение 5 минут. Предметные стекла погружали в 0,5% эозин (1,5 г, растворенные в 300 мл 95% EtOH) 12 раз, а затем в дистиллированную H2O до тех пор, пока эозин не переставал оставлять полосы, погружали в 50% EtOH 10 раз, а затем погружали в 70% EtOH 10 раз, уравновешивали в 95% EtOH в течение 30 секунд, уравновешивали в 100% EtOH в течение 1 минуты, погружали в ксилол несколько раз, а затем протирали с использованием Kimwipe и накрывали покровным стеклом с использованием Cytoseal XYL (Stephens Scientific; каталожный № 8312-4).
Стандартный способ иммуногистохимического окрашивания: способ с комплексом авидин-биотин (ABC)
[0273] Предметные стекла, содержавшие депарафинизированные или замороженные срезы, ополаскивали в PBS-Tween 20 в течение 2×2 мин. Срезы инкубировали в нормальной сыворотке того же вида, что и вторичное антитело. Срезы инкубировали в первичном антителе против каспазы 3 (Millipore № AB3623; Sigma-Aldrich № C8487; и т.д.), в разведении 1:100 в разбавителе IHC-TekTM Antibody Diluent (каталожный номер № IW-1000 или IW-1001), или антителе против расщепленной каспазы 3 (Cell signaling) в течение 1 часа при комнатной температуре или в течение ночи, и ополаскивали в PBS-Tween 20 в течение 3×2 мин. Срезы инкубировали в блокирующем растворе с пероксидазой в течение 10 минут при комнатной температуре, ополаскивали в PBS-Tween 20 в течение 3×2 мин, а затем инкубировали в биотинилированном вторичном антителе в PBS в течение 30 минут при комнатной температуре. Срезы ополаскивали в PBS-Tween 20 в течение 3×2 мин, а затем инкубировали в растворе ABC-пероксидаза в течение 30 минут при комнатной температуре. Срезы ополаскивали в PBS-Tween 20 в течение 3× мин, а затем инкубировали в растворе субстрата пероксидазы. Срезы ополаскивали в PBS-Tween 20 в течение 3×2 мин, подвергали контрастному окрашиванию раствором для контрастного окрашивания, промывали в проточной водопроводной воде в течение 2-5 минут, дегидратировали в 95% этаноле в течение 1 минут, 100% этаноле в течение 2×3 мин, очищали в ксилоле в течение 2×5 мин и накрывали покровным стеклом с использованием среды для заливки. Предметные стекла с отрицательным контролем обрабатывали в отсутствие первичного антитела (Ren, Y. et al. Small molecule Wnt inhibitors enhance the efficiency of BMP-4-directed cardiac differentiation of human pluripotent stem cells. Journal of molecular and cellular cardiology 51, 280-287 (2011); Scholl, F.A. et al. Mek 1/2 MAPK kinases are essential for Mammalian development, homeostasis, and Raf-induced hyperplasia. Developmental cell 12, 615-629 (2007)).
Анализ образования колоний в мягком агаре
[0274] Клетки DLD1 или HCT116 высевали в двухслойных культурах с агаром в 35-мм чашках. Для всех культур использовали альфа-модификацию минимальной поддерживающей средой Игла (Flow Laboratories, Invitrogen, Sigma-Aldrich, и т.д.), дополненной 20% эмбриональной телячьей сывороткой (Sigma-Aldrich, Invitrogen, и т.д.). Факторы роста и/или кондиционированные среды включали в подстилающий слой в количестве максимум 13,2% от общего объема культуры 1,5 мл на чашку. Культуры дегазировали смесью 5% O2-10% CO2-85% N2 и инкубировали в течение от 10 до 14 суток. Оценивали только колонии, содержавшие 50 или более клеток.
Анализы инвазии
[0275] 105 клеток не подпитывали сывороткой в течение ночи, суспендировали в базальной среде и высевали на Transwell с Matrigel® с размером пор 8,0 мкм (BD Biosciences). В нижнюю лунку добавляли пятьсот микролитров среды, содержавшей 2% сыворотку и добавки для роста. Немигрирующие клетки соскребали через 24 часа, а мигрирующие клетки окрашивали 4',6-диамидино-2-фенилиндолом (DAPI). Эксперименты проводили в Transwell в трех экземплярах для трех биологических реплик и количественно определяли путем усреднения количества окрашенных клеток на 4x поля зрения, подсчитывая пять полей на камеру.
Проточная цитометрия
[0276] Клетки HCT116, DLD1, 1CTRPA и 1CTRPA A1309 подвергали воздействию низкомолекулярных аналогов против злокачественной опухоли PDSA-010, PDSA-011, PDSA-013 или PDSA-014 и анализировали проточной цитометрией с использованием проточного цитометра EPICS XL Flow Cytometer Beckman Coulter (Hialeah, FL).
Анализ апоптоза по высвобождению цитохрома C
[0277] Термины "апоптоз" или "запрограммированная гибель клеток" относятся к высокорегулируемому и активному процессу, который вносит вклад в биологический гомеостаз, состоящий из серии биохимических событий, которые приводят к различным морфологическим изменениям, включая пузырение, изменение клеточной мембраны, такое как утрата асимметрии мембраны и прикрепления, сморщивание клеток, фрагментацию ядер, конденсацию хроматина и фрагментацию хромосомной ДНК, без повреждения организма.
[0278] Апоптотическая гибель клеток индуцируется множеством различных факторов и вовлекает многочисленные каскады передачи сигналы, некоторые из которых зависят от каспазных протеаз (класс цистеиновых протеаз), а другие из которых не зависят от каспаз. Она может запускаться множеством различных клеточных стимулов, включая рецепторы клеточной поверхности, митохондриальный ответ на стресс и цитотоксические T-клетки, что приводит к активации апоптотических каскадов передачи сигнала.
[0279] Каспазы, вовлеченные в апоптоз, передают апоптотический сигнал в протеолитическом каскаде, причем каспазы расщепляют и активируют другие каспазы, которые затем деградируют другие клеточные мишени, что приводит к клеточной гибели. Каспазы в верхней части каскада включают каспазу-8 и каспазу-9. Каспаза-8 представляет собой первоначальную каспазу, вовлеченную в ответ на рецепторы с доменом смерти (DD), таким как Fas.
[0280] Рецепторы в семействе рецепторов TNF ассоциированы с индукцией апоптоза, а также с воспалительной передачей сигнала. Рецептор Fas (CD95) опосредует апоптотическую передачу сигнала Fas-лигандом, экспрессируемым на поверхности других клеток. Взаимодействие Fas-FasL играет важную роль в иммунной системе и отсутствие этой системы приводит к аутоиммунитету, что указывает на то, что Fas-опосредуемый апоптоз устраняет самореактивные лимфоциты. Передача сигнала Fas также вовлечена в иммунный надзор для удаления трансформированных клеток и инфицированных вирусами клеток. Связывание Fas с олигомеризованным FasL на другой клетке активирует апоптотическую передачу сигнала через цитоплазматический домен, называемый доменом смерти (DD), который взаимодействует с адаптерами передачи сигнала, включающими FAF, FADD и DAX, активируя протеолитический каскад каспаз. Сначала активируются каспаза-8 и каспаза-10, а затем они расщепляют и активируют нижеследующие каспазы и различные клеточные субстраты, которые приводят к клеточной гибели.
[0281] Митохондрии участвуют в апоптотических каскадах передачи сигнала через высвобождение митохондриальных белков в цитоплазму. Цитохром c, ключевой белок в транспорте электронов, высвобождается из митохондрий в ответ на апоптотические сигналы и активирует Apaf-1, протеазу, высвобождаемую из митохондрий. Активированный Apaf-1 активирует каспазу-9 и остальную часть каскада каспаз. Smac/DIABLO высвобождается из митохондрий и ингибирует белки IAP, которые обычно взаимодействуют с каспазой-9, ингибируя апоптоз. Регуляция апоптоза семейством белков Bcl-2 происходит по мере того, как представители семейства формируют комплексы, которые проникают в митохондриальную мембрану, регулируя высвобождение цитохрома c и других белков. Рецепторы семейства TNF, которые вызывают апоптоз, прямо активируют каскад каспаз, но также могут активировать Bid, представитель семейства Bcl-2, который активирует опосредуемый митохондриями апоптоз. Bax, другой представитель семейства Bcl-2, активируется этим каскадом, и локализуется на митохондриальной мембране и повышает ее проницаемость, высвобождая цитохром c и другие митохондриальные белки. Bcl-2 и Bcl-xL препятствуют образованию пор, блокируя апоптоз. Подобно цитохрому c, AIF (апоптоз-индуцирующий фактор) представляет собой белок, встречающийся в митохондриях, который высвобождается из митохондрий посредством апоптотических стимулов. Хотя цитохром C связан с зависимой от каспаз апоптотической передачей сигнала, высвобождение AIF стимулирует зависимый от каспаз апоптоз, перемещаясь в ядро, где он связывается с ДНК. Связывание ДНК посредством AIF стимулирует конденсацию хроматина и фрагментацию ДНК, возможно через привлечение нуклеаз.
[0282] Каскад митохондриального стресса начинается с высвобождения цитохрома c из митохондрий, который затем взаимодействует с Apaf-1, вызывая саморасщепление и активацию каспазы-9. Каспаза-3, -6 и -7 являются нижеследующими каспазами, которые активируются вышележащими протеазами и действуют, самостоятельно расщепляя клеточные мишени.
[0283] Белки гранзим B и перфорин, высвобождающиеся из цитотоксических T-клеток, индуцируют апоптоз в клетках-мишенях, формируя трансмембранные поры и запуская апоптоз, возможно, через расщепление каспаз, хотя предполагаются и независимые от каспаз механизмы опосредуемого гранзимом B апоптоза.
[0284] Фрагментация ядерного генома множеством нуклеаз, активируемых апоптотическими каскадами передачи сигнала с формированием нуклеосомальной лестницы, является клеточным ответом, характерным для апоптоза. Одна нуклеаза, вовлеченная в апоптоз, представляет собой фактор фрагментации ДНК (DFF), активируемую каспазой ДНК-азу (CAD). DFF/CAD активируется через расщепления ассоциированного с ней ингибитора ICAD каспазными протеазами в процессе апоптоза. DFF/CAD взаимодействует с компонентами хроматина, такими как топоизомераза II и гистон H1, для конденсации структуры хроматина и, возможно, привлечения CAD к хроматину. Другой активируемой апоптозом протеазой является эндонуклеаза G (EndoG). EndoG кодируется в ядерном геноме, но локализуется в митохондриях нормальных клеток. EndoG может играть роль в репликации митохондриального генома, а также в апоптозе. Апоптотическая передача сигнала вызывает высвобождение EndoG из митохондрий. Каскады EndoG и DFF/CAD являются независимыми, поскольку каскад EndoG все еще встречается в клетках, лишенных DFF.
[0285] Гипоксия, а также гипоксия после реоксигенации, может запускать высвобождение цитохрома c и апоптоз. Киназа гликогенсинтазы (GSK-3), серин-треониновая киназа, широко экспрессируемая в большинстве типов клеток, по-видимому, опосредует или усиливает апоптоз благодаря множеству стимулов, которые активируют митохондриальный каскад клеточной гибели. Loberg, RD, et al., J. Biol. Chem. 277 (44): 41667-673 (2002). Было продемонстрировано, что она индуцирует активацию каспазы 3 и активирует пропоптотический ген опухолевой супрессии p53. Также было предположено, что GSK-3 стимулирует активацию и транслокацию проапоптотического представителя семейства Bcl-2, Bax, который при агрегации и митохондриальной локализации индуцирует высвобождение цитохрома c. Akt является ключевым регулятором GSK-3, и фосфорилирование и инактивация GSK-3 могут опосредовать некоторые из антиапоптотических эффектов Akt.
[0286] Апоптоз в клетках индуцировали следующим образом. Клетки собирали (5×107) центрифугированием при 600 × g в течение 5 минут при 4°C, промывали 10 мл ледяного PBS, центрифугировали при 600 × g в течение 5 минут при 4°C и супернатант удаляли. Клетки ресуспендировали с использованием 1,0 мл 1 × буферной смеси для экстракции цитозоля, содержавшей DTT и ингибиторы протеаз, и инкубировали на льду в течение 10 минут. Клетки гомогенизировали в ледяном гомогенизаторе тканей Даунса на льду. Гомогенат переносили в 1,5-мл микроцентрифужную пробирку и центрифугировали при 700 × g в течение 10 минут при 4°C. Супернатант собирали в свежую 1,5-мл пробирку и центрифугировали при 10000 × g в течение 30 минут при 4°C. Супернатант собирали в качестве цитозольной фракции. Осадок ресуспендировали в 0,1-мл буферной смеси для экстракции митохондрий, содержавшей DTT и ингибиторы протеаз, и встряхивали в течение 10 секунд и сохраняли в качестве митохондриальной фракции. 10 мкг каждой из цитозольной и митохондриальной фракций, выделенных из неиндуцированных и индуцированных клеток, загружали на 12% SDS-PAGE, и подвергали электрофорезу. Выполняли стандартную методику вестерн-блоттинга и блот исследовали с использованием антитела против цитохрома c (1 мкг/мл). (BioVision; набор Cytochrome C Releasing Apoptosis Assay Kit; каталожный номер № K257-100).
Анализ для определения адсорбции TASIN-1
[0287] Образцы содержимого толстого кишечника, плазмы и толстого кишечника анализировали для определения удержания TASIN-1. Взятие образцов проводили в следующие моменты времени: 200, 400, 600, 800, 1000, 1200, 1400 и 1600 минут. Для оценки присутствия TASIN-1 в каждом из образцов использовали высокоэффективную жидкостную хроматографию (ВЭЖХ).
[0288] Этоксикумарин (2 мМ в DMSO) инкубировали с гепатоцитами самцов мышей ICR/CD-1 (партия HIC) и средой HI в течение 0-240 минут. Реакции гасили 0,2 мл (1:2) метанола, содержавшего 0,2% муравьиную кислоту и 100 нг/нл IS (конечная концентрация IS=25 нг/мл). Образцы встряхивали в течение 15 секунд, инкубировали при RT в течение 10 минут, а затем центрифугировали на настольной центрифуге с охлаждением в течение 5 минут при 13200 об/мин. Супернатант (185 мкл) переносили во флакон для ВЭЖХ (с вставкой). Результаты анализировали с использованием масс-спектрометра Qtrap 4000. Параметры для использования Qtrap 4000 представляли собой: этоксикумарин + IS 050412.dam. Параметры источника ионов/газа были следующими: CUR=45, CAD=низкий, IS=5500, TEM=600, GS1=60 и GS2=60. Буфер A представлял собой: вода + 0,1% муравьиная кислота; буфер B представлял собой: MeOH + 0,1% муравьиная кислота и скорость потока составляла 1,5 мл/мин. Колонка, которую использовали, представляла собой колонку Agilent C18XDB, 5 микрометров с размером заполнения 50×4,6 мм, 0-1,5 мин: 97% A, 1,5-2,0 минуты: градиент до 100% B, 2,0-3,0 минуты: 100% B, 3,0-3,3 минуты: градиент до 97% A, 3,3-4,5 минуты: градиент до 97% A; IS: н-бензилбензамид (sigma-alderich, партия номер #02914LH, изготовленная 11/07/11 в MeOH, переход от 212,1 до 91,1); переход соединения от 191,0 до 163,1. Каждое из соединений (2 мМ в DMSO) инкубировали с фракцией S9 мыши (партия KWB) и кофакторами фазы I (NADPH Regenerating System) в течение 0-240 минут. Реакции гасили 1 мл (1:1) метанолом, содержавшим 0,2% муравьиную кислоту и 100 нг/мл IS (конечная концентрация IS=50 нг/мл). Образцы встряхивали в течение 15 секунд, инкубировали при к.т. в течение 10 минут и центрифугировали в течение 5 минут при 2400 об/мин. Затем супернатант (1 мл) переносили в пробирку Eppendorf и центрифугировали на настольной центрифуге с охлаждением в течение 5 минут при 13200 об/мин. Супернатант (185 мкл) переносили во флакон ВЭЖХ (без вставки). Результаты анализировали с использованием масс-спектрометра Qtrap 4000. Параметры для использования Qtrap 4000 представляли собой: SW142282 + IS053112.dam. Параметры источника ионов/газа были следующими: CUR=45, CAD=низкий, IS=5500, TEM=600, GS1=60 и GS2=60. Буфер A представлял собой: вода + 0,1% муравьиная кислота; буфер B представлял собой: MeOH + 0,1% муравьиная кислота и скорость потока составляла 1,5 мл/мин. Колонка, которую использовали, представляла собой колонку Agilent C18XDB, 5 микрометров с размером заполнения 50×4,6 мм, 0-1,5 мин: 97% A, 1,5-2,0 минуты: градиент до 100% B, 2,0-3,0 минуты: 100% B, 3,0-3,3 минуты: градиент до 97% A, 3,3-4,5 минуты: градиент до 97% A; IS: н-бензилбензамид (sigma-alderich, партия номер #02914LH, изготовленная 11/07/11 в MeOH, переход от 212,1 до 91,1); переход соединения, например, от 400,1 до 146,0, или, например, от 354,2 до 171,0.
Эксперименты на животных
[0289] Подкожные ксенотрансплантаты (п/к) формировали у самок мышей nude (NCI) в возрасте от 5 до 6 недель посредством инокуляции 2×106 клеток CRC в обе дорсальных боковых области каждой мыши. Когда опухоли вырастали до 2-3 мм в диаметре, мышам в/б инъецировали TASIN-1 в дозе 40 мг/кг (растворенный в 0,2 мл растворителя, содержавшего 10% DMSO, 10% кремофор) или растворитель отдельно два раза в сутки или до тех пор, пока опухоли не вырастали до 15 мм в диаметре в контрольной группе. Объемы опухолей измеряли с использованием толщиномеров и вычисляли с использованием формулы l × w2 × 0,5, где l и w представляют собой длину и ширину опухоли, соответственно. Использовали трансгенную модель рака ободочной и прямой кишки мыши CDX2P-NLS Cre;APC+/loxP (CPC;Apc) (Kaplan, K.B. et al. A role for the Adenomatous Polyposis Coli protein in chromosome segregation. Nature cell biology 3, 429-432 (2001). Самцам мышей CPC;Apc в возрасте ~10 суток инъецировали в/б либо растворитель, либо TASIN-1, 20 мг/кг/инъекция, два раза в неделю в течение 90 суток. Массу измеряли каждые 15 суток на протяжении периода введения.
[0290] В кратком изложении, самкам мышей nude (NCI) со сформированными ксенотрансплантатами инъецировали TASIN-1 в/б в дозе 40 мг/кг (растворенный в 0,2 мл растворителя, содержавшего 10% DMSO, 10% кремофор) или только растворитель два раза в сутки. Для экспериментов на мышах CPC; Apc мышам инъецировали в/б либо растворитель, либо TASIN-1, 20 мг/кг/инъекция, два раза в неделю в течение 90 суток.
Формирование опухоли у мышей
[0291] Мышам инъецировали клетки HCT116, клетки DLD1 или HT-29 на 0 сутки и на 8 сутки, а затем им вводили либо носитель, либо соединение в дозе 10-40 мг/кг два раза в сутки. Рост опухоли оценивали путем вырезания и физического измерения размера опухоли. Скорость роста опухоли оценивали путем анализа размера опухоли после следующих моментов времени после инокуляции клеток HCT116, DLD1 или HT-29: 12, 15, 19, 22 и 24 суток.
[0292] Аналоги исследовали в отношении ингибирования опухоли у мышей. Клетки DLD1 или HCT116 инъецировали мышам для выращивания опухолей. На 6 сутки, когда объем опухоли достигал приблизительно 50 мм3, мышам инокулировали либо контроль, либо PDSA-014. PDSA-014 вводили посредством внутрибрюшинных инъекций мышам два раза в сутки в дозе 10 мг/кг. Опухоли извлекали на 9, 12, 15, 18 и 21 сутки. Опухоли измеряли для определения роста опухоли.
Митотический индекс
[0293] Для определения митотического индекса клетки DLD1 фиксировали в метаноле через 24 × после обработки TASIN-1 в количестве 2,5 мкл или 10 мкл или Pitstop2 (abcam, ab120687) в количестве 10 мкл, ДНК визуализировали посредством окрашивания Hoechst 33342 и клетки визуализировали под микроскопом (Axiovert 200M; Carl Zeiss) с использованием объектива LD 40x/NA 0,75/Ph2 Plan-Neofluor. Митотические клетки идентифицировали в УФ-канале по содержанию в них конденсированной ДНК.
[0294] Были получены HCEC с нокдауном TP53, APC, мутацией KRASV12 (1CTRPA) вместе с эктопической экспрессией укороченного APC 1309 (далее "1CTRPA A1309") (таблица 1) (см. Eskiocak U, Kim SB, Ly P, Roig AI, Biglione S, Komurov K, Cornelius C, Wright WE, White MA, Shay JW. Functional parsing of driver mutations in the colorectal cancer genome reveals numerous suppressors of anchorage-independent growth. Cancer Res 2011;71:4359-65; Ly, P. Eskiocak, U., Parker, C.R., Harris, K.J., Wright, W.E. and Shay, J.W. RNAi screening of the human colorectal cancer genome identifies multifunctional tumor suppressors regulating epithelial cell invasion. Cell Res. 22:1605-1608, 2012, PubMed PMID: 23044803; Zhang, L., Komurov, K., Wright, W.E. и Shay, J.W. Identification of novel driver tumor suppressors through functional interrogation of putative passenger mutations in colorectal cancer. Int J Cancer. 132(3):732-7, 2013. doi: 10,1002/ijc.27705. Epub 2012 Jul 21. PMID: 22753261, каждая из которых включен в настоящее описание в качестве ссылки.) Эта мутация APC является строго селективной для рака толстого кишечника и показано, что этот белок является более устойчивым к расщеплению каспазой, чем другие укороченные формы APC. Клеточная линия HCEC 1CTRPA A1309 с укороченным APC проявляет увеличение скорости роста, усиление роста в мягком агаре и инвазии через matrigel® по сравнению с соответствующими родительскими HCEC (1CTRPA). Однако нокдаун wt APC отдельно (1CTRPA) не вызвал приобретения HCEC онкогенных свойств (данные не опубликованы).
[0295] Эти наблюдения выступили в поддержку идеи, что укорочения APC могут приводить к тому, что клетки приобретают онкогенные свойства, например, такие как избыточная клеточная пролиферация или нарушение регуляции клеточной пролиферации.
[0296] Эти изогенные клеточные линии с определенными генетическими изменениями используют в качестве клеточной модели для идентификации низкомолекулярных соединений, которые нацелены на укороченные белки APC.
Обобщение изогенных эпителиальных клеток толстого кишечника человека (HCEC), использованных в скрининге
[0297] Для проведения клеточного высокопроизводительного скрининга, предназначенного для идентификации низкомолекулярных соединений и/или фракций природных продуктов из файла соединений University of Texas Southwestern (UTSW), которые селектвно ингибируют рост клеток HCEC с укороченным APC, использовали изогенные клеточные линии (фиг.6). Эта библиотека соединений охватывает ~200000 синтетических соединений, которые отражают большой объем химических соединений от нескольких коммерческих поставщиков, включая 1200 выпускаемых в продажу лекарственных средств из Prestwick Chemical Library®, и 600 соединений, которые дошли до доклинических испытаний, из библиотеки NIH. Изогенные клеточные линии, использованные в скрининге, приведены в таблице 1.
[0298] Первичный скрининг проводили в 1CTRPA A1309. Для скрининга клетки высевали в качестве монослоя с плотностью 400 клеток/лунка в 384-луночных планшетах [в среде для эпителиальных клеток толстого кишечника (CoEpiCM (ScienCell Research Laboratories; Innoprot, и т.д.)], которые являются коммерчески доступными (Invitrogen; BioRad; Corning и т.д.). Через двадцать четыре часа добавляли соединения-кандидаты в концентрации 2,5 мкМ на лунку и клетки инкубировали в течение 4 суток при физиологических условиях кислорода (~3-5% O2). Люминесцентный анализ Celltiter-Glo® проводили для измерения жизнеспособности клеток с использованием уровней ATP в качестве считываемых данных. В кратком изложении получали многолуночные планшеты с непрозрачными лунками с клетками млекопитающих в культуральной среде (25 мкл на лунку, 384-луночные планшеты). Контрольные лунки, содержавшие среду без клеток, получали для получения величины фоновой люминесценции. В экспериментальные лунки добавляли исследуемые соединения и инкубировали в соответствии с протоколом культивирования. Планшет и его содержимое инкубировали при комнатной температуре в течение приблизительно 30 минут. Стандартную кривую для ATP строили непосредственно перед добавлением реагента CellTiter-Glo®. Добавляли объем реагента CellTiter-Glo®, равный объему среды для культивирования клеток, присутствующей в каждой лунке (25 мкл реагента к 25 мкл среды, содержавшей клетки, для 384-луночного планшета). Содержимое перемешивали в течение 2 минут на орбитальном устройстве для встряхивания для индукции клеточного лизиса. Планшету позволяли инкубироваться при комнатной температуре в течение 10 минут для стабилизации люминесцентного сигнала и люминесценцию регистрировали (например, GloMax ®, Lumistar, SPECTROstar, PHERAstar FS). Первичный скрининг обеспечил 6704 положительных результатов (на основе показателя z <-3, что означает, что показатель z, равный -3, был на 3 стандартных отклонения ниже среднего значения).
[0299] Соединения, которые ингибировали >40% пролиферации нормальных эпителиальных клеток человека, исключали, исходя из базы данных средств скрининга и предшествующего опыта. Остальные 5381 подвергали повторному скринингу против 1CTRPA A1309 (для подтверждения результатов первичного скрининга) и 1CTRPA (для исключения соединений, которые не являются специфическими в отношении укорочений APC). Для устранения возможных свойств общей токсичности этих соединений, соединения также подвергали контрскринингу против нормальных диплоидных HCEC (1CT). Этот контрскрининг идентифицировал 126 соединений, которые ингибируют рост клеток CTRPA A1309 на >50% больше, чем 1CTRPA и 1CT. Дополнительный скрининг этих селективно токсичных соединений проводили против той же панели HCEC в серии разведений концентраций 1:3 в диапазоне от 2,5 мкм до 30 нм. Этот вторичный контрскрининг обеспечил 14 соединений-кандидатов, которые продемонстрировали селективное ингибирование клеток 1CTRPA A1309 в концентрациях 30 нм или 90 нм, но без заметного влияния на клетки 1CTRPA или 1CT. Общая стратегия скрининга представлена на блок-схеме (фиг.6).
[0300] Затем эти 14 соединений получали коммерчески и их IC50 определяли путем проведения исследований доза-эффект с серий полулогарифмических разведений в 12 точках концентраций в двух аутентичных линиях CRC: HCT116 (wt APC) и DLD1 (укороченный APC). Соединения против злокачественной опухоли A и B продемонстрировали селективную токсичность в отношении DLD1 с IC50 63 нм и 131 нм, соответственно, как показано на фиг.7. Эти два соединения служили в качестве исходных лидирующих соединений для разработки аналога и для дополнительных исследований.
Иллюстративные соединения, полученные в результате этих замен, представлены в таблице A.
I. Общая информация
[0301] Спектры 1H и 13C ЯМР получали с использованием спектрометра Varian Inova либо 400 МГц, либо 500 МГц. Сокращения для сопряжений сигналов являются следующими: c, синглет; шир., широкий сигнал; д, дублет; т, триплет, кв, квартет и м, мультиплет. Температуру плавления твердых образцов определяли с использованием устройства Fisher-Johns Melting Point Apparatus. Аналитическую тонкослойную хроматографию (TLC) проводили на предварительно покрытых планшетах, приобретенных от E. Merck (TLC, диоксид кремния 60, PF254, 25 стеклянных планшетов 20×20 см). Хроматограммы визуализировали под УФ-излучением или посредством окрашивания йодидом или KMnO4. Флэш-хроматографию проводили, либо исходя из описания Still et al (Still, W. C. et al. J. Org. Chem. 1978, 43, 2923-2925) с использованием силикагеля 60 E. Merck (размера 230-400), либо на системе Isco Combiflash с использованием флэш-колонки Redisep®Rf размером в диапазоне от 4 грамм до 80 грамм. Все чувствительные к воздуху реакции проводили в атмосфере аргона. Если нет иных указаний, все обычные реагенты и растворители, приобретенные от коммерческих поставщиков, использовали без дальнейшей очистки. Всю стеклянную тару, использованную для чувствительных к влаге реакций, либо сушили в сушильном шкафу в течение ночи, либо сушили пламенем.
II. Общая методика получения сульфонамидов из сульфонилхлоридов и аминов
[0302] Смесь амина (1,0 ммоль), сульфонилхлорида (1,1 ммоль), N,N-диизопропилэтиламина (1,5 ммоль) и CH2Cl2 (5 мл) перемешивали при комнатной температуре в течение ночи. Затем реакционный раствор переливали в насыщенный раствор NaHCO3 (20 мл) и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали либо флэш-хроматографией на силикагеле со смесью MeOH:CH2Cl2 (или MeOH:EtOAc) в качестве элюента, либо посредством перекристаллизации из смеси CH2Cl2 и гексана с получением сульфонамидов.
[0303]  4-метил-1'-(фенилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде светло-желтого твердого вещества (92%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и бензолсульфонилхлоридом. Т.пл. 154-156°C; 1H ЯМР (500 МГц, CDCl3) δ 7,77 (дд, J=8,3, 1,4 Гц, 2H), 7,65-7,58 (м, 1H), 7,54 (дд, J=8,4, 7,0 Гц, 2H), 3,87 (д, J=11,9 Гц, 2H), 2,80 (д, J=11,8 Гц, 2H), 2,26 (м, 3H), 2,14 (т, J=11,4 Гц, 2H), 1,86 (д, J=11,7 Гц, 2H), 1,72-1,59 (м, 4H), 1,40-1,28 (м, 1H), 1,23 (м, 2H), 0,91 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 136,0, 132,7, 129,0, 127,6, 61,3, 49,1, 46,1, 33,9, 30,8, 26,9, 21,7; MS (ESI) m/z 323,2 (100%, [M+H]+).
4-метил-1'-(фенилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде светло-желтого твердого вещества (92%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и бензолсульфонилхлоридом. Т.пл. 154-156°C; 1H ЯМР (500 МГц, CDCl3) δ 7,77 (дд, J=8,3, 1,4 Гц, 2H), 7,65-7,58 (м, 1H), 7,54 (дд, J=8,4, 7,0 Гц, 2H), 3,87 (д, J=11,9 Гц, 2H), 2,80 (д, J=11,8 Гц, 2H), 2,26 (м, 3H), 2,14 (т, J=11,4 Гц, 2H), 1,86 (д, J=11,7 Гц, 2H), 1,72-1,59 (м, 4H), 1,40-1,28 (м, 1H), 1,23 (м, 2H), 0,91 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 136,0, 132,7, 129,0, 127,6, 61,3, 49,1, 46,1, 33,9, 30,8, 26,9, 21,7; MS (ESI) m/z 323,2 (100%, [M+H]+).
[0304]  1'-((4-(дифторметокси)фенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде светло-оранжевого твердого вещества (69%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-(дифторметокси)бензол-1-сульфонилхлоридом. Т.пл. 132-135°C; 1H ЯМР (500 МГц, CDCl3) δ 7,76 (д, J=8,8 Гц, 2H), 7,24 (д, J=8,8 Гц, 2H), 6,61 (т, J=72,6 Гц, 1H), 3,83 (д, J=12,1 Гц, 2H), 2,77 (д, J=11,7 Гц, 2H), 2,33-2,16 (м, 3H), 2,11 (тд, J=11,6, 2,5 Гц, 2H), 1,84 (д, J=13,2 Гц, 2H), 1,64 (м, 4H), 1,30 (дддт, J=13,3, 9,7, 6,5, 3,5 Гц, 1H), 1,16 (квд, J=12,0, 3,8 Гц, 2H), 0,89 (д, J=6,5 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,1 (т, J=2,9 Гц), 132,9, 129,8, 119,3, 115,2 (т, J=262,5 Гц), 61,4, 49,5, 46,1, 34,6, 31,0, 27,3, 21,8; MS (ESI) m/z 389,2 (100%, [M+H]+).
1'-((4-(дифторметокси)фенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде светло-оранжевого твердого вещества (69%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-(дифторметокси)бензол-1-сульфонилхлоридом. Т.пл. 132-135°C; 1H ЯМР (500 МГц, CDCl3) δ 7,76 (д, J=8,8 Гц, 2H), 7,24 (д, J=8,8 Гц, 2H), 6,61 (т, J=72,6 Гц, 1H), 3,83 (д, J=12,1 Гц, 2H), 2,77 (д, J=11,7 Гц, 2H), 2,33-2,16 (м, 3H), 2,11 (тд, J=11,6, 2,5 Гц, 2H), 1,84 (д, J=13,2 Гц, 2H), 1,64 (м, 4H), 1,30 (дддт, J=13,3, 9,7, 6,5, 3,5 Гц, 1H), 1,16 (квд, J=12,0, 3,8 Гц, 2H), 0,89 (д, J=6,5 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,1 (т, J=2,9 Гц), 132,9, 129,8, 119,3, 115,2 (т, J=262,5 Гц), 61,4, 49,5, 46,1, 34,6, 31,0, 27,3, 21,8; MS (ESI) m/z 389,2 (100%, [M+H]+).
[0305]  4-метил-1'-((2,2,4,6,7-пентаметил-2,3-дигидробензофуран-5-ил)сульфонил)-1,4'-бипиперидин: Это соединение получали в виде светло-желтого масла (95%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 2,2,4,6,7-пентаметил-2,3-дигидробензофуран-5-сульфонилхлоридом. 1H ЯМР (400 МГц, CDCl3) δ 3,63 (д, J=12,0 Гц, 2H), 2,97 (c, 2H), 2,89 (c, шир., 2H), 2,75 (дт, J=12,0, 4,0 Гц, 2H), 2,50 (c, 3H), 2,46 (c, 3H), 2,41 (c, шир., 1H), 2,14 (c, шир., 2H), 2,10 (c, 3H), 1,90 (д, J=12,0 Гц, 2H), 1,64 (д, J=12,0 Гц, 2H), 1,51 (м, 2H), 1,48 (c, 6 H), 1,40-1,08 (м, 3H), 0,87 (д, J=4,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 159,9, 140,8, 135,3, 125,8, 125,0, 117,9, 86,8, 61,9, 49,6, 43,9, 43,1, 34,5, 31,0, 28,6, 27,7, 21,8, 19,2, 17,6, 12,5; MS (ESI) m/z 435,3 (100%, [M+H]+).
4-метил-1'-((2,2,4,6,7-пентаметил-2,3-дигидробензофуран-5-ил)сульфонил)-1,4'-бипиперидин: Это соединение получали в виде светло-желтого масла (95%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 2,2,4,6,7-пентаметил-2,3-дигидробензофуран-5-сульфонилхлоридом. 1H ЯМР (400 МГц, CDCl3) δ 3,63 (д, J=12,0 Гц, 2H), 2,97 (c, 2H), 2,89 (c, шир., 2H), 2,75 (дт, J=12,0, 4,0 Гц, 2H), 2,50 (c, 3H), 2,46 (c, 3H), 2,41 (c, шир., 1H), 2,14 (c, шир., 2H), 2,10 (c, 3H), 1,90 (д, J=12,0 Гц, 2H), 1,64 (д, J=12,0 Гц, 2H), 1,51 (м, 2H), 1,48 (c, 6 H), 1,40-1,08 (м, 3H), 0,87 (д, J=4,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 159,9, 140,8, 135,3, 125,8, 125,0, 117,9, 86,8, 61,9, 49,6, 43,9, 43,1, 34,5, 31,0, 28,6, 27,7, 21,8, 19,2, 17,6, 12,5; MS (ESI) m/z 435,3 (100%, [M+H]+).
[0306]  1-((4-метоксифенил)сульфонил)-4-(пирролидин-1-ил)пиперидин: Это соединение получали в виде светло-желтого масла (70%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc, затем 1:9 MeOH:CH2Cl2) после реакции между 4-(пирролидин-1-ил)пиперидином и 4-метоксибензол-1-сульфонилхлоридом. 1H ЯМР (400 МГц, CDCl3) δ 7,68 (д, J =8,0 Гц, 2H), 6,97 (д, J=8,0 Гц, 2H), 3,86 (c, 3H), 3,68 (д, J=12,0 Гц, 2H), 2,51 (c, 4H), 2,36 (дт, J=12,0, 4,0 Гц, 2H), 1,90 (м, 3H), 1,75 (c, 4H), 1,61 (кв, J=12,0 Гц, 1H); 13C ЯМР (100 МГц, CDCl3) δ 162,9, 129,8, 127,8, 114,1, 60,8, 55,6, 51,3, 45,0, 30,4, 23,2; MS (ESI) m/z 325,2 (100%, [M+H]+).
1-((4-метоксифенил)сульфонил)-4-(пирролидин-1-ил)пиперидин: Это соединение получали в виде светло-желтого масла (70%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc, затем 1:9 MeOH:CH2Cl2) после реакции между 4-(пирролидин-1-ил)пиперидином и 4-метоксибензол-1-сульфонилхлоридом. 1H ЯМР (400 МГц, CDCl3) δ 7,68 (д, J =8,0 Гц, 2H), 6,97 (д, J=8,0 Гц, 2H), 3,86 (c, 3H), 3,68 (д, J=12,0 Гц, 2H), 2,51 (c, 4H), 2,36 (дт, J=12,0, 4,0 Гц, 2H), 1,90 (м, 3H), 1,75 (c, 4H), 1,61 (кв, J=12,0 Гц, 1H); 13C ЯМР (100 МГц, CDCl3) δ 162,9, 129,8, 127,8, 114,1, 60,8, 55,6, 51,3, 45,0, 30,4, 23,2; MS (ESI) m/z 325,2 (100%, [M+H]+).
[0307]  1-(мезитилсульфонил)-4-(пирролидин-1-ил)пиперидин: Это соединение получали в виде желтого масла (59%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и 2,4,6-триметилбензол-1-сульфонилхлоридом. 1H ЯМР (400 МГц, CDCl3) δ 6,92 (c, 2H), 3,53 (д, J=12,0 Гц, 2H), 2,80 (тд, J=12,0, 2,6 Гц, 2H), 2,59 (c, 6 H), 2,56 (c, 4H), 2,28 (c, 3H), 2,11 (c, шир., 1H), 1,93 (д, J=12,0 Гц, 2H), 1,77 (c, 4H), 1,50 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,6, 131,9, 131,6, 61,2, 51,4, 42,9, 30,7, 23,2, 22,7, 21,0; MS (ESI) m/z 337,2 (100%, [M+H]+).
1-(мезитилсульфонил)-4-(пирролидин-1-ил)пиперидин: Это соединение получали в виде желтого масла (59%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и 2,4,6-триметилбензол-1-сульфонилхлоридом. 1H ЯМР (400 МГц, CDCl3) δ 6,92 (c, 2H), 3,53 (д, J=12,0 Гц, 2H), 2,80 (тд, J=12,0, 2,6 Гц, 2H), 2,59 (c, 6 H), 2,56 (c, 4H), 2,28 (c, 3H), 2,11 (c, шир., 1H), 1,93 (д, J=12,0 Гц, 2H), 1,77 (c, 4H), 1,50 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,6, 131,9, 131,6, 61,2, 51,4, 42,9, 30,7, 23,2, 22,7, 21,0; MS (ESI) m/z 337,2 (100%, [M+H]+).
[0308]  4-(пирролидин-1-ил)-1-((2,4,6-триизопропилфенил)сульфонил)пиперидин: Это соединение получали в виде желтого твердого вещества (>95%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и 2,4,6-триизопропилбензол-1-сульфонилхлоридом. Т.пл. 118-122°C; 1H ЯМР (400 МГц, CDCl3) δ 7,15 (c, 2H), 4,16 (м, 2H), 3,58 (д, J=12,0 Гц, 2H), 2,85 (м, 3H), 2,62 (c, 4H), 2,16 (c, шир., 1H), 1,98 (д, J=12,0 Гц, 2H), 1,81 (c, 4H)m 1,55 (д, J=12,0 Гц, 2H), 1,24 (м, 18 H); 13C ЯМР (100 МГц, CDCl3) δ 153,2, 151,8, 129,7, 123,9, 61,5, 51,4, 42,9, 34,2, 29,3, 24,9, 23,6, 23,2; MS (ESI) m/z 421,2 (100%, [M+H]+).
4-(пирролидин-1-ил)-1-((2,4,6-триизопропилфенил)сульфонил)пиперидин: Это соединение получали в виде желтого твердого вещества (>95%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и 2,4,6-триизопропилбензол-1-сульфонилхлоридом. Т.пл. 118-122°C; 1H ЯМР (400 МГц, CDCl3) δ 7,15 (c, 2H), 4,16 (м, 2H), 3,58 (д, J=12,0 Гц, 2H), 2,85 (м, 3H), 2,62 (c, 4H), 2,16 (c, шир., 1H), 1,98 (д, J=12,0 Гц, 2H), 1,81 (c, 4H)m 1,55 (д, J=12,0 Гц, 2H), 1,24 (м, 18 H); 13C ЯМР (100 МГц, CDCl3) δ 153,2, 151,8, 129,7, 123,9, 61,5, 51,4, 42,9, 34,2, 29,3, 24,9, 23,6, 23,2; MS (ESI) m/z 421,2 (100%, [M+H]+).
[0309]  1-(нафталин-1-илсульфонил)-4-(пирролидин-1-ил)пиперидин: Это соединение получали в виде белого твердого вещества (67%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и нафталин-1-сульфонилхлоридом. Т.пл. 151-154°C; 1H ЯМР (400 МГц, CDCl3) δ 8,70 (д, J=12,0 Гц, 1H), 8,20 (дд, J=7,3, 1,4 Гц, 1H), 8,05 (д, J=12,0 Гц, 1H), 7,90 (дд, J=7,3, 1,4 Гц, 1H), 7,58 (м, 3H), 3,81 (д, J=12,0 Гц, 2H), 2,65 (м, 6 H), 2,19 (c, шир., 1H), 1,92 (м, 2H), 1,79 (c, 4H), 1,59 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 134,5, 134,3, 132,8, 130,5, 128,9, 128,8, 128,1, 126,9, 125,2, 124,1, 60,8, 51,1, 44,2, 30,0, 23,2; MS (ESI) m/z 345,2 (100%, [M+H]+).
1-(нафталин-1-илсульфонил)-4-(пирролидин-1-ил)пиперидин: Это соединение получали в виде белого твердого вещества (67%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и нафталин-1-сульфонилхлоридом. Т.пл. 151-154°C; 1H ЯМР (400 МГц, CDCl3) δ 8,70 (д, J=12,0 Гц, 1H), 8,20 (дд, J=7,3, 1,4 Гц, 1H), 8,05 (д, J=12,0 Гц, 1H), 7,90 (дд, J=7,3, 1,4 Гц, 1H), 7,58 (м, 3H), 3,81 (д, J=12,0 Гц, 2H), 2,65 (м, 6 H), 2,19 (c, шир., 1H), 1,92 (м, 2H), 1,79 (c, 4H), 1,59 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 134,5, 134,3, 132,8, 130,5, 128,9, 128,8, 128,1, 126,9, 125,2, 124,1, 60,8, 51,1, 44,2, 30,0, 23,2; MS (ESI) m/z 345,2 (100%, [M+H]+).
[0310]  1'-((3-(трет-бутил)фенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (90%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и 3-(трет-бутил)бензол-1-сульфонилхлоридом. Т.пл. 100-102°C; 1H ЯМР (400 МГц, CDCl3) δ 7,73 (c, 1H), 7,57 (м, 2H), 7,43 (м, 1H), 3,84 (д, J=12,0 Гц, 2H), 2,78 (д, J=12,0 Гц, 2H), 2,22 (тд, J=12,0, 2,5 Гц, 3H), 2,12 (т, J=12,0 Гц, 2H), 1,82 (д, J=12,0 Гц, 2H), 1,63 (м, 4H), 1,33 (c, 9 H), 1,28 (м, 1H), 1,19 (м, 2H), 0,88 (д, J=8,0 Гц,3H); 13C ЯМР (100 МГц, CDCl3) δ 152,5, 135,9, 129,7, 128,7, 124,7, 124,4, 61,5, 49,4, 46,0, 35,0, 34,4, 31,1, 31,0, 27,2, 21,8; MS (ESI) m/z 379,2 (100%, [M+H]+).
1'-((3-(трет-бутил)фенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (90%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-(пирролидин-1-ил)пиперидином и 3-(трет-бутил)бензол-1-сульфонилхлоридом. Т.пл. 100-102°C; 1H ЯМР (400 МГц, CDCl3) δ 7,73 (c, 1H), 7,57 (м, 2H), 7,43 (м, 1H), 3,84 (д, J=12,0 Гц, 2H), 2,78 (д, J=12,0 Гц, 2H), 2,22 (тд, J=12,0, 2,5 Гц, 3H), 2,12 (т, J=12,0 Гц, 2H), 1,82 (д, J=12,0 Гц, 2H), 1,63 (м, 4H), 1,33 (c, 9 H), 1,28 (м, 1H), 1,19 (м, 2H), 0,88 (д, J=8,0 Гц,3H); 13C ЯМР (100 МГц, CDCl3) δ 152,5, 135,9, 129,7, 128,7, 124,7, 124,4, 61,5, 49,4, 46,0, 35,0, 34,4, 31,1, 31,0, 27,2, 21,8; MS (ESI) m/z 379,2 (100%, [M+H]+).
[0311]  3-(4-(мезитилсульфонил)пиперазин-1-ил)хинуклидин: Это соединение получали в виде белого твердого вещества (42%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 3-пиперазин-1-илхинуклидина тригидрохлорида гемигидратом (1,0 ммоль) и 2,4,6-триметилбензолсульфонилхлоридом (1,1 ммоль) в CH2Cl2 в присутствии N,N-диизопропилэтиламина (1,5 ммоль). Т.пл. выше 300°C; 1H ЯМР (400 МГц, CDCl3) δ 6,96 (c, 2H), 3,34-3,12 (м, 9 H), 3,04 (дд, J=12,0, 4,0 Гц, 1H), 2,60 (c, 6 H), 2,45 (c, 5 H), 2,30 (c, 4H), 2,05 (м, 2H), 1,79 (м, 1H), 1,68 (м, 1H); 13C ЯМР (100 МГц, CDCl3) δ 142,8, 140,5, 132,0, 131,0, 59,1, 52,8, 50,3, 46,6, 45,6, 44,1, 23,0, 22,9, 22,1, 20,9, 17,7; MS (ESI) m/z 378,2 (100%, [M+H]+).
3-(4-(мезитилсульфонил)пиперазин-1-ил)хинуклидин: Это соединение получали в виде белого твердого вещества (42%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 3-пиперазин-1-илхинуклидина тригидрохлорида гемигидратом (1,0 ммоль) и 2,4,6-триметилбензолсульфонилхлоридом (1,1 ммоль) в CH2Cl2 в присутствии N,N-диизопропилэтиламина (1,5 ммоль). Т.пл. выше 300°C; 1H ЯМР (400 МГц, CDCl3) δ 6,96 (c, 2H), 3,34-3,12 (м, 9 H), 3,04 (дд, J=12,0, 4,0 Гц, 1H), 2,60 (c, 6 H), 2,45 (c, 5 H), 2,30 (c, 4H), 2,05 (м, 2H), 1,79 (м, 1H), 1,68 (м, 1H); 13C ЯМР (100 МГц, CDCl3) δ 142,8, 140,5, 132,0, 131,0, 59,1, 52,8, 50,3, 46,6, 45,6, 44,1, 23,0, 22,9, 22,1, 20,9, 17,7; MS (ESI) m/z 378,2 (100%, [M+H]+).
[0312]  1'-((4-хлорнафталин-1-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (71%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 4-хлорнафталин-1-сульфонилхлоридом. Т.пл. 129-132°C; 1H ЯМР (400 МГц, CDCl3) δ 8,76 (м, 1H), 8,39 (ддд, J=6,5, 3,4, 0,7 Гц, 1H), 8,11 (д, J=8,0 Гц, 1H), 7,69 (дд, J=6,6, 3,3 Гц, 2H), 7,64 (д, J=8,0 Гц, 1H), 3,87 (д, J=12,4 Гц, 2H), 2,75 (д, J=11,0 Гц, 2H), 2,55 (тд, J=12,2, 2,4 Гц, 2H), 2,23 (т, J=12,0 Гц, 1H), 2,06 (т, J=11,3 Гц, 2H), 1,81 (д, J=13,1 Гц, 2H), 1,55 (м, 4H), 1,27 (дд, J=17,6, 9,0 Гц, 1H), 1,15 (дд, J=13,4, 9,6 Гц, 2H), 0,87 (д, J=6,4 Гц, 3H).; 13C ЯМР (100 МГц, CDCl3) δ 138,4, 132,3, 131,5, 130,1, 130,0, 128,7, 127,9, 125,7, 125,4, 124,6, 61,5, 49,5, 45,5, 34,5, 31,0, 27,7, 21,8; MS (ESI) m/z 407,1(100%, [M+H]+).
1'-((4-хлорнафталин-1-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (71%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 4-хлорнафталин-1-сульфонилхлоридом. Т.пл. 129-132°C; 1H ЯМР (400 МГц, CDCl3) δ 8,76 (м, 1H), 8,39 (ддд, J=6,5, 3,4, 0,7 Гц, 1H), 8,11 (д, J=8,0 Гц, 1H), 7,69 (дд, J=6,6, 3,3 Гц, 2H), 7,64 (д, J=8,0 Гц, 1H), 3,87 (д, J=12,4 Гц, 2H), 2,75 (д, J=11,0 Гц, 2H), 2,55 (тд, J=12,2, 2,4 Гц, 2H), 2,23 (т, J=12,0 Гц, 1H), 2,06 (т, J=11,3 Гц, 2H), 1,81 (д, J=13,1 Гц, 2H), 1,55 (м, 4H), 1,27 (дд, J=17,6, 9,0 Гц, 1H), 1,15 (дд, J=13,4, 9,6 Гц, 2H), 0,87 (д, J=6,4 Гц, 3H).; 13C ЯМР (100 МГц, CDCl3) δ 138,4, 132,3, 131,5, 130,1, 130,0, 128,7, 127,9, 125,7, 125,4, 124,6, 61,5, 49,5, 45,5, 34,5, 31,0, 27,7, 21,8; MS (ESI) m/z 407,1(100%, [M+H]+).
[0313]  1'-((2,4-дихлор-5-метилфенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (83%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 2,4-дихлор-5-метилбензол-1-сульфонилхлоридом. Т.пл. 120-123°C; 1H ЯМР (400 МГц, CDCl3) δ 7,89 (c, 1H), 7,49 (c, 1H), 3,87 (д, J=12,9 Гц, 2H), 2,82 (д, J=11,2 Гц, 2H), 2,71 (тд, J=12,4, 2,4 Гц, 2H), 2,38 (c, 3H), 2,34 (м, 1H), 2,15 (т, J=11,2 Гц, 2H), 1,83 (д, J=11,6 Гц, 2H), 1,59 (м, 4H), 1,31 (м, 1H), 1,06 (т, J=12,0 Гц, 2H), 0,89 (д, J=6,0 Гц, 3H);13C ЯМР (100 МГц, CDCl3) δ 139,3, 135,5, 134,6, 133,6, 132,0, 129,9, 61,7, 49,5, 45,6, 34,5, 31,0, 27,7, 21,8, 19,6; MS (ESI) m/z 405,1(100%, [M+H]+).
1'-((2,4-дихлор-5-метилфенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (83%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 2,4-дихлор-5-метилбензол-1-сульфонилхлоридом. Т.пл. 120-123°C; 1H ЯМР (400 МГц, CDCl3) δ 7,89 (c, 1H), 7,49 (c, 1H), 3,87 (д, J=12,9 Гц, 2H), 2,82 (д, J=11,2 Гц, 2H), 2,71 (тд, J=12,4, 2,4 Гц, 2H), 2,38 (c, 3H), 2,34 (м, 1H), 2,15 (т, J=11,2 Гц, 2H), 1,83 (д, J=11,6 Гц, 2H), 1,59 (м, 4H), 1,31 (м, 1H), 1,06 (т, J=12,0 Гц, 2H), 0,89 (д, J=6,0 Гц, 3H);13C ЯМР (100 МГц, CDCl3) δ 139,3, 135,5, 134,6, 133,6, 132,0, 129,9, 61,7, 49,5, 45,6, 34,5, 31,0, 27,7, 21,8, 19,6; MS (ESI) m/z 405,1(100%, [M+H]+).
[0314]  1'-([1,1'-бифенил]-2-илсульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (>95%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и [1,1'-бифенил]-2-сульфонилхлоридом. Т.пл. 106-109°C; 1H ЯМР (400 МГц, CDCl3) δ 8,12 (дд, J=8,0, 1,6 Гц, 1H), 7,56 (тд, J=7,6, 1,6 Гц, 1H), 7,46 (тд, J=7,6, 1,6 Гц, 1H), 7,39 (м, 5 H), 7,30 (дд, J=7,6, 1,6 Гц, 1H), 3,29 (д, J=12,8, 2H), 2,71 (д, J=10,8 Гц, 2H), 2,22 (тд, J=12,6, 2,5 Гц, 3H), 2,09 (т, J=10,4 Гц, 2H), 1,90 -1 49 (м, 4H), 1,21 (м, 5 H), 0,88 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 141,6, 139,7, 137,1, 133,0, 132,2, 130,3, 129,6, 127,7, 127,5, 61,7, 49,3, 44,4, 34,4, 31,0, 27,2, 21,8; MS (ESI) m/z 399,2(100%, [M+H]+).
1'-([1,1'-бифенил]-2-илсульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (>95%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и [1,1'-бифенил]-2-сульфонилхлоридом. Т.пл. 106-109°C; 1H ЯМР (400 МГц, CDCl3) δ 8,12 (дд, J=8,0, 1,6 Гц, 1H), 7,56 (тд, J=7,6, 1,6 Гц, 1H), 7,46 (тд, J=7,6, 1,6 Гц, 1H), 7,39 (м, 5 H), 7,30 (дд, J=7,6, 1,6 Гц, 1H), 3,29 (д, J=12,8, 2H), 2,71 (д, J=10,8 Гц, 2H), 2,22 (тд, J=12,6, 2,5 Гц, 3H), 2,09 (т, J=10,4 Гц, 2H), 1,90 -1 49 (м, 4H), 1,21 (м, 5 H), 0,88 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 141,6, 139,7, 137,1, 133,0, 132,2, 130,3, 129,6, 127,7, 127,5, 61,7, 49,3, 44,4, 34,4, 31,0, 27,2, 21,8; MS (ESI) m/z 399,2(100%, [M+H]+).
[0315]  N-(4-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)нафталин-1-ил)ацетамид: Это соединение получали в виде желтого твердого вещества (64%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-ацетамидонафталин-1-сульфонилхлоридом. Т.пл. 113-117°C; 1H ЯМР (400 МГц, CDCl3) δ 8,51 (д, J=8,8 Гц, 1H), 8,09 (м, 2H), 7,87 (c, 1H), 7,66 (д, J=7,6 Гц, 1H), 7,48 (м, 2H), 3,86 (д, J=9,6 Гц, 2H), 2,80 (д, J=11,6 Гц, 2H), 2,52 (т, J=12,4 Гц, 2H), 2,36 (т, J=12,8 Гц, 1H), 2,31 (c, 3H), 2,15 (т, J=11,6 Гц, 3H), 1,83 (д, J =13,6 Гц, 2H), 1,56 (м, 4H), 1,24 (м, 3H), 0,88 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 169,5, 133,3, 133,2, 130,6, 129,5, 129,4, 128,1, 127,7, 124,3, 123,9,123,4, 61,6, 49,3, 45,3, 33,7, 30,7, 27,2, 24,0, 21,6; MS (ESI) m/z 430,2 (100%, [M+H]+).
N-(4-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)нафталин-1-ил)ацетамид: Это соединение получали в виде желтого твердого вещества (64%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-ацетамидонафталин-1-сульфонилхлоридом. Т.пл. 113-117°C; 1H ЯМР (400 МГц, CDCl3) δ 8,51 (д, J=8,8 Гц, 1H), 8,09 (м, 2H), 7,87 (c, 1H), 7,66 (д, J=7,6 Гц, 1H), 7,48 (м, 2H), 3,86 (д, J=9,6 Гц, 2H), 2,80 (д, J=11,6 Гц, 2H), 2,52 (т, J=12,4 Гц, 2H), 2,36 (т, J=12,8 Гц, 1H), 2,31 (c, 3H), 2,15 (т, J=11,6 Гц, 3H), 1,83 (д, J =13,6 Гц, 2H), 1,56 (м, 4H), 1,24 (м, 3H), 0,88 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 169,5, 133,3, 133,2, 130,6, 129,5, 129,4, 128,1, 127,7, 124,3, 123,9,123,4, 61,6, 49,3, 45,3, 33,7, 30,7, 27,2, 24,0, 21,6; MS (ESI) m/z 430,2 (100%, [M+H]+).
[0316]  5-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)изохинолин: Это соединение получали в виде белого твердого вещества (51%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и изохинолин-5-сульфонилхлоридом. Т.пл. 123-126°C; 1H ЯМР (400 МГц, CDCl3) δ 9,33 (c, 1H), 8,66 (д, J=6,0 Гц, 1H), 8,48 (д, J=6,0 hz, 1H), 8,36 (дд, J=7,6, 1,6 Гц, 1H), 8,19 (д, J=6,0 Гц, 1H), 7,69 (дд, J=8,2, 7,4 Гц, 1H), 3,90 (д, J=12,4 Гц, 2H), 2,74 (д, J=10,8 Гц, 2H), 2,51 (тд, J=12,0, 2,4 Гц, 2H), 2,21 (м, 1H), 2,06 (м, 2H), 1,81 (д, J=11,6 Гц, 2H), 1,56 (м, 4H), 1,27 (м, 1H), 1,15 (м, 2H), 0,86 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 153,2, 145,1, 134,0, 133,7, 132,6, 131,9, 129,1, 125,8, 117,7, 61,4, 49,9, 45,6, 34,5, 31,0, 27,7, 21,6; MS (ESI) m/z 374,2(100%, [M+H]+).
5-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)изохинолин: Это соединение получали в виде белого твердого вещества (51%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и изохинолин-5-сульфонилхлоридом. Т.пл. 123-126°C; 1H ЯМР (400 МГц, CDCl3) δ 9,33 (c, 1H), 8,66 (д, J=6,0 Гц, 1H), 8,48 (д, J=6,0 hz, 1H), 8,36 (дд, J=7,6, 1,6 Гц, 1H), 8,19 (д, J=6,0 Гц, 1H), 7,69 (дд, J=8,2, 7,4 Гц, 1H), 3,90 (д, J=12,4 Гц, 2H), 2,74 (д, J=10,8 Гц, 2H), 2,51 (тд, J=12,0, 2,4 Гц, 2H), 2,21 (м, 1H), 2,06 (м, 2H), 1,81 (д, J=11,6 Гц, 2H), 1,56 (м, 4H), 1,27 (м, 1H), 1,15 (м, 2H), 0,86 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 153,2, 145,1, 134,0, 133,7, 132,6, 131,9, 129,1, 125,8, 117,7, 61,4, 49,9, 45,6, 34,5, 31,0, 27,7, 21,6; MS (ESI) m/z 374,2(100%, [M+H]+).
[0317]  1'-((4-бром-2-этилфенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (92%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 4-бром-2-этилбензол-1-сульфонилхлоридом. Т.пл. 87-91°C; 1H ЯМР (400 МГц, CDCl3) δ 7,73 (д, J=8,4 Гц, 1H), 7,50 (д, J=2,0 Гц, 1H), 7,42 (дд, J=8,4, 2,0 Гц, 1H), 3,75 (д, J=12,4 Гц, 2H), 2,96 (кв, J=7,6 Гц, 2H), 2,83 (д, J=7,6 Гц, 2H), 2,60 (тд, J=12,4, 2,4 Гц, 2H), 2,34 (м, 1H), 2,13 (м, 2H), 1,84 (д, J=7,6 Гц, 2H), 1,57 (м, 4H), 1,25 (м, 6 H), 0,89 (д, J =6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 145,2, 134,8, 133,9, 131,7, 129,0, 127,8, 61,6, 49,5, 45,1, 34,4, 30,9,27,7, 25,9, 21,8, 15,4; MS (ESI) m/z 429,1 (100%, [M+]+), 431,1 (100%, [M+2]+).
1'-((4-бром-2-этилфенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (92%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 4-бром-2-этилбензол-1-сульфонилхлоридом. Т.пл. 87-91°C; 1H ЯМР (400 МГц, CDCl3) δ 7,73 (д, J=8,4 Гц, 1H), 7,50 (д, J=2,0 Гц, 1H), 7,42 (дд, J=8,4, 2,0 Гц, 1H), 3,75 (д, J=12,4 Гц, 2H), 2,96 (кв, J=7,6 Гц, 2H), 2,83 (д, J=7,6 Гц, 2H), 2,60 (тд, J=12,4, 2,4 Гц, 2H), 2,34 (м, 1H), 2,13 (м, 2H), 1,84 (д, J=7,6 Гц, 2H), 1,57 (м, 4H), 1,25 (м, 6 H), 0,89 (д, J =6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 145,2, 134,8, 133,9, 131,7, 129,0, 127,8, 61,6, 49,5, 45,1, 34,4, 30,9,27,7, 25,9, 21,8, 15,4; MS (ESI) m/z 429,1 (100%, [M+]+), 431,1 (100%, [M+2]+).
[0318]  1'-((2,4-дихлор-6-метилфенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (93%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 2,4-дихлор-6-метилбензол-1-сульфонилхлоридом. Т.пл. 89-91°C; 1H ЯМР (400 МГц, CDCl3) δ 7,37 (д, J=2,3 Гц, 1H), 7,19 (дд, J=2,3, 0,9 Гц, 1H), 3,79 (д, J=12,7 Гц, 2H), 2,93-2,73 (м, 4H), 2,67 (c, 3H), 2,45-2,27 (м, 1H), 2,14 (тд, J=11,3, 2,5 Гц, 2H), 1,83 (дд, J=12,3, 3,4 Гц, 2H), 1,57 (дтд, J=24,4, 11,6, 4,0 Гц, 4H), 1,30 (ддт, J=12,8, 6,4, 3,7 Гц, 1H), 1,18 (квд, J=12,0, 3,9 Гц, 2H), 0,89 (д, J=6,9 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 143,7, 137,7, 135,3, 134,2, 131,6, 130,2, 61,7, 49,5, 45,0, 34,6, 31,0, 27,9, 24,0, 21,8; MS (ESI) m/z 405,1 (100%, [M+H]+).
1'-((2,4-дихлор-6-метилфенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (93%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 2,4-дихлор-6-метилбензол-1-сульфонилхлоридом. Т.пл. 89-91°C; 1H ЯМР (400 МГц, CDCl3) δ 7,37 (д, J=2,3 Гц, 1H), 7,19 (дд, J=2,3, 0,9 Гц, 1H), 3,79 (д, J=12,7 Гц, 2H), 2,93-2,73 (м, 4H), 2,67 (c, 3H), 2,45-2,27 (м, 1H), 2,14 (тд, J=11,3, 2,5 Гц, 2H), 1,83 (дд, J=12,3, 3,4 Гц, 2H), 1,57 (дтд, J=24,4, 11,6, 4,0 Гц, 4H), 1,30 (ддт, J=12,8, 6,4, 3,7 Гц, 1H), 1,18 (квд, J=12,0, 3,9 Гц, 2H), 0,89 (д, J=6,9 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 143,7, 137,7, 135,3, 134,2, 131,6, 130,2, 61,7, 49,5, 45,0, 34,6, 31,0, 27,9, 24,0, 21,8; MS (ESI) m/z 405,1 (100%, [M+H]+).
[0319]  1'-((5-бром-2,3-дигидробензофуран-7-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (86%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 5-бром-2,3-дигидробензофуран-7-сульфонилхлоридом. Т.пл. 128-132°C; 1H ЯМР (400 МГц, CDCl3) δ 7,62 (c, 1H), 7,43 (c, 1H), 4,70 (т, J=8,9 H z, 2H), 3,89 (д, J=12,3Гц, 2H), 3,24 (т, J=9,0 Гц, 2H), 2,79 (д, J=11,9 Гц, 2H), 2,50 (т, J=12,4 Гц, 2H), 2,27 (тт, J=11,7, 3,7 Гц, 1H), 2,12 (т, J=11,5 Гц, 2H), 1,82 (д, J=11,2 Гц, 2H), 1,60 (м, 4H), 1,30 (м, 1H), 1,17 (квд, J=11,9, 3,7 Гц, 2H), 0,88 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 156,4, 132,3, 132,2, 130,7, 121,0, 111,8, 73,0, 61,7, 49,5, 46,0, 34,6, 31,0, 29,0, 27,6, 21,9; MS (ESI) m/z 443,1 (90%, [M+]+), 445,1 (100%, [M+2]+).
1'-((5-бром-2,3-дигидробензофуран-7-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (86%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 4-метил-1,4'-бипиперидином и 5-бром-2,3-дигидробензофуран-7-сульфонилхлоридом. Т.пл. 128-132°C; 1H ЯМР (400 МГц, CDCl3) δ 7,62 (c, 1H), 7,43 (c, 1H), 4,70 (т, J=8,9 H z, 2H), 3,89 (д, J=12,3Гц, 2H), 3,24 (т, J=9,0 Гц, 2H), 2,79 (д, J=11,9 Гц, 2H), 2,50 (т, J=12,4 Гц, 2H), 2,27 (тт, J=11,7, 3,7 Гц, 1H), 2,12 (т, J=11,5 Гц, 2H), 1,82 (д, J=11,2 Гц, 2H), 1,60 (м, 4H), 1,30 (м, 1H), 1,17 (квд, J=11,9, 3,7 Гц, 2H), 0,88 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 156,4, 132,3, 132,2, 130,7, 121,0, 111,8, 73,0, 61,7, 49,5, 46,0, 34,6, 31,0, 29,0, 27,6, 21,9; MS (ESI) m/z 443,1 (90%, [M+]+), 445,1 (100%, [M+2]+).
[0320]  3-метил-1'-(фенилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (63%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 3-метил-1,4'-бипиперидином и бензолсульфонилхлоридом. Т.пл. 132-135°C; 1H ЯМР (400 МГц, CDCl3) δ 7,79-7,69 (м, 2H), 7,62-7,55 (м, 1H), 7,55-7,44 (м, 2H), 3,84 (д, J=11,9 Гц, 2H), 2,89-2,51 (м, 2H), 2,36-2,09 (м, 3H), 2,02 (тд, J=11,2, 2,7 Гц, 1H), 1,88-1,76 (м, 2H), 1,75-1,44 (м, 7 H), 0,85-0,73 (м, 1H), 0,81 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 136,3, 132,6, 129,0, 127,6, 61,5, 57,6, 49,5, 46,2, 33,29, 31,5, 27,2, 27,1, 25,9, 19,8; MS (ESI) m/z 323,2 (100%, [M+H]+).
3-метил-1'-(фенилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (63%) с использованием флэш-хроматографии (1:9 MeOH:EtOAc) после реакции между 3-метил-1,4'-бипиперидином и бензолсульфонилхлоридом. Т.пл. 132-135°C; 1H ЯМР (400 МГц, CDCl3) δ 7,79-7,69 (м, 2H), 7,62-7,55 (м, 1H), 7,55-7,44 (м, 2H), 3,84 (д, J=11,9 Гц, 2H), 2,89-2,51 (м, 2H), 2,36-2,09 (м, 3H), 2,02 (тд, J=11,2, 2,7 Гц, 1H), 1,88-1,76 (м, 2H), 1,75-1,44 (м, 7 H), 0,85-0,73 (м, 1H), 0,81 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 136,3, 132,6, 129,0, 127,6, 61,5, 57,6, 49,5, 46,2, 33,29, 31,5, 27,2, 27,1, 25,9, 19,8; MS (ESI) m/z 323,2 (100%, [M+H]+).
[0321] 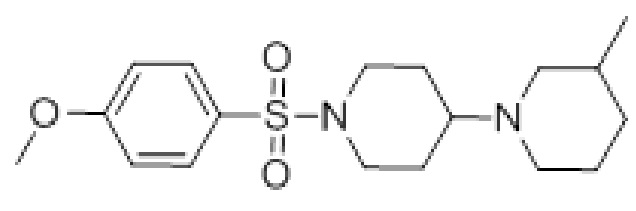 1'-((4-метоксифенил)сульфонил)-3-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (74%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 3-метил-1,4'-бипиперидином и 4-метоксибензол-1-сульфонилхлоридом. Т.пл. 114-117°C; 1H ЯМР (400 МГц, CDCl3) δ 7,69 (д, J=8,8 Гц, 1H), 6,98 (д, J=8,8 Гц, 2H), 3,87 (c, 3H), 3,82 (д, J=12,0 Гц, 2H), 2,87-2,62 (м, 2H), 2,22 (тд, J=12,0, 2,5 Гц, 3H), 2,06 (тд, J=11,8, 10,7, 2,9 Гц, 1H), 1,90-1,79 (д, J=12,4 Гц, 2H), 1,79-1,46 (м, 7H), 0,88-0,75 (м, 1H), 0,83 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 162,9, 129,8, 127,7, 114,1, 61,6, 57,3, 55,6, 49,4, 46,1, 33,1, 31,2, 27,0, 25,6, 19,8.; MS (ESI) m/z 353,2 (100%, [M+H]+).
1'-((4-метоксифенил)сульфонил)-3-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (74%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 3-метил-1,4'-бипиперидином и 4-метоксибензол-1-сульфонилхлоридом. Т.пл. 114-117°C; 1H ЯМР (400 МГц, CDCl3) δ 7,69 (д, J=8,8 Гц, 1H), 6,98 (д, J=8,8 Гц, 2H), 3,87 (c, 3H), 3,82 (д, J=12,0 Гц, 2H), 2,87-2,62 (м, 2H), 2,22 (тд, J=12,0, 2,5 Гц, 3H), 2,06 (тд, J=11,8, 10,7, 2,9 Гц, 1H), 1,90-1,79 (д, J=12,4 Гц, 2H), 1,79-1,46 (м, 7H), 0,88-0,75 (м, 1H), 0,83 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 162,9, 129,8, 127,7, 114,1, 61,6, 57,3, 55,6, 49,4, 46,1, 33,1, 31,2, 27,0, 25,6, 19,8.; MS (ESI) m/z 353,2 (100%, [M+H]+).
[0322]  1'-((5-бром-2-метоксифенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (92%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 5-бром-2-метоксибензол-1-сульфонилхлоридом. Т.пл. 98-102°C; 1H ЯМР (400 МГц, CDCl3) δ 8,01 (д, J=2,6, Гц, 1H), 7,59 (дд, J=8,8, 2,6 Гц, 1H), 6,88 (д, J=8,8 Гц, 1H), 3,96-3,88 (д, J=13,6 Гц, 2H), 3,90 (c, 3H), 2,84 (д, J=10,9 Гц, 2H), 2,64 (тд, J=12,5, 2,5 Гц, 2H), 2,38 (д, J=12,2 Гц, 1H), 2,17 (т, J=11,7 Гц, 2H), 1,85 (д, J=12,7 Гц, 2H), 1,60 (м, 4H), 1,40-1,14 (м, 3H), 0,91 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 155,9, 136,8, 133,8, 128,7, 114,1, 112,3, 61,8, 56,3, 49,5, 45,9, 34,6, 31,0, 28,0, 21,9; MS (ESI) m/z 431,1 (100%, [M+]+), 433,1 (100%, [M+2]+).
1'-((5-бром-2-метоксифенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (92%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 5-бром-2-метоксибензол-1-сульфонилхлоридом. Т.пл. 98-102°C; 1H ЯМР (400 МГц, CDCl3) δ 8,01 (д, J=2,6, Гц, 1H), 7,59 (дд, J=8,8, 2,6 Гц, 1H), 6,88 (д, J=8,8 Гц, 1H), 3,96-3,88 (д, J=13,6 Гц, 2H), 3,90 (c, 3H), 2,84 (д, J=10,9 Гц, 2H), 2,64 (тд, J=12,5, 2,5 Гц, 2H), 2,38 (д, J=12,2 Гц, 1H), 2,17 (т, J=11,7 Гц, 2H), 1,85 (д, J=12,7 Гц, 2H), 1,60 (м, 4H), 1,40-1,14 (м, 3H), 0,91 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 155,9, 136,8, 133,8, 128,7, 114,1, 112,3, 61,8, 56,3, 49,5, 45,9, 34,6, 31,0, 28,0, 21,9; MS (ESI) m/z 431,1 (100%, [M+]+), 433,1 (100%, [M+2]+).
[0323]  4-метил-1'-((1-метил-1H-имидазол-2-ил)сульфонил)-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (51%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 1-метил-1H-имидазол-2-сульфонилхлоридом. Т.пл. 153-156°C; 1H ЯМР (400 МГц, CDCl3) δ 7,03 (д, J=1,1 Гц, 1H), 6,92 (д, J=1,1 Гц, 1H), 3,96 (д, J=12,2 Гц, 2H), 3,89 (c, 3H), 3,05 (т, J=12,5 Гц, 2H), 2,89 (д, J=10,8 Гц, 2H), 2,54 (c, 1H), 2,24 (c, 2H), 1,94 (д, J=12,5 Гц, 2H), 1,81-1,58 (м, 4H), 1,31 (c, 3H), 1,06-0,79 (д, , J=8,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,8, 128,2, 124,4, 61,8, 49,4, 46,6, 34,8, 34,1, 30,9, 27,3, 21,7; MS (ESI) m/z 327,2 (100%, [M+H]+).
4-метил-1'-((1-метил-1H-имидазол-2-ил)сульфонил)-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (51%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 1-метил-1H-имидазол-2-сульфонилхлоридом. Т.пл. 153-156°C; 1H ЯМР (400 МГц, CDCl3) δ 7,03 (д, J=1,1 Гц, 1H), 6,92 (д, J=1,1 Гц, 1H), 3,96 (д, J=12,2 Гц, 2H), 3,89 (c, 3H), 3,05 (т, J=12,5 Гц, 2H), 2,89 (д, J=10,8 Гц, 2H), 2,54 (c, 1H), 2,24 (c, 2H), 1,94 (д, J=12,5 Гц, 2H), 1,81-1,58 (м, 4H), 1,31 (c, 3H), 1,06-0,79 (д, , J=8,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,8, 128,2, 124,4, 61,8, 49,4, 46,6, 34,8, 34,1, 30,9, 27,3, 21,7; MS (ESI) m/z 327,2 (100%, [M+H]+).
[0324]  1'-((2-хлорпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (71%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2-хлорпиридин-3-сульфонилхлоридом. Т.пл. 122-124°C; 1H ЯМР (500 МГц, CDCl3) δ 8,55 (д, J=4,9 Гц, 1H), 8,38 (д, J=7,8 Гц, 1H), 7,40 (дд, J=7,8, 4,8 Гц, 1H), 3,92 (д, J=13,0 Гц, 2H), 2,83 (т, J=12,5 Гц, 4H), 2,38 (т, J=11,5 Гц, 1H), 2,15 (т, J=11,0 Гц, 2H), 1,86 (д, J=12,5 Гц, 2H)., 1,72-1,53 (м, 4H), 1,32 (м, 1H), 1,18 (м, 2H), 0,90 (д, J=6,5 Гц, 3H).; 13C ЯМР (100 МГц, CDCl3) δ 148,4, 144,5, 136,9, 130,5, 118,5, 57,6, 45,6, 41,9, 30,7, 27,1, 24,0, 17,9; MS (ESI) m/z 358,1 (100%, [M+H]+).
1'-((2-хлорпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (71%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2-хлорпиридин-3-сульфонилхлоридом. Т.пл. 122-124°C; 1H ЯМР (500 МГц, CDCl3) δ 8,55 (д, J=4,9 Гц, 1H), 8,38 (д, J=7,8 Гц, 1H), 7,40 (дд, J=7,8, 4,8 Гц, 1H), 3,92 (д, J=13,0 Гц, 2H), 2,83 (т, J=12,5 Гц, 4H), 2,38 (т, J=11,5 Гц, 1H), 2,15 (т, J=11,0 Гц, 2H), 1,86 (д, J=12,5 Гц, 2H)., 1,72-1,53 (м, 4H), 1,32 (м, 1H), 1,18 (м, 2H), 0,90 (д, J=6,5 Гц, 3H).; 13C ЯМР (100 МГц, CDCl3) δ 148,4, 144,5, 136,9, 130,5, 118,5, 57,6, 45,6, 41,9, 30,7, 27,1, 24,0, 17,9; MS (ESI) m/z 358,1 (100%, [M+H]+).
[0325]  1'-((2-фторпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (>95%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2-фторпиридин-3-сульфонилхлоридом. Т.пл. 120-123°C; 1H ЯМР (500 МГц, CDCl3) δ 8,41 (д, J=4,9 Гц, 1H), 8,29 (дд, J=9,2, 7,6 Гц, 1H), 7,37 (дд, J=7,6, 4,9 Гц, 1H), 3,96 (д, J=12,6 Гц, 2H), 2,81 (д, J=11,5 Гц, 2H),, 2,67 (т, J=12,4 Гц, 2H), 2,34 (ддд, J=11,5, 8,0, 3,5 Гц, 1H), 2,15 (т, J=10,4 Гц, 2H), 1,87 (д, J=12,1 Гц, 2H), 1,74-1,55 (м, 4H), 1,32 (ддт, J=10,3, 6,9, 4,1 Гц, 1H), 1,27-1,11 (м, 2H), 0,91 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,75 (д, J=244,0 Гц), 147,68 (д, J=14,3 Гц), 138,2, 118,2, 117,9, 57,5, 45,6, 41,9, 30,7, 27,1, 23,8, 17,9; MS (ESI) m/z 342,2 (100%, [M+H]+).
1'-((2-фторпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (>95%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2-фторпиридин-3-сульфонилхлоридом. Т.пл. 120-123°C; 1H ЯМР (500 МГц, CDCl3) δ 8,41 (д, J=4,9 Гц, 1H), 8,29 (дд, J=9,2, 7,6 Гц, 1H), 7,37 (дд, J=7,6, 4,9 Гц, 1H), 3,96 (д, J=12,6 Гц, 2H), 2,81 (д, J=11,5 Гц, 2H),, 2,67 (т, J=12,4 Гц, 2H), 2,34 (ддд, J=11,5, 8,0, 3,5 Гц, 1H), 2,15 (т, J=10,4 Гц, 2H), 1,87 (д, J=12,1 Гц, 2H), 1,74-1,55 (м, 4H), 1,32 (ддт, J=10,3, 6,9, 4,1 Гц, 1H), 1,27-1,11 (м, 2H), 0,91 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,75 (д, J=244,0 Гц), 147,68 (д, J=14,3 Гц), 138,2, 118,2, 117,9, 57,5, 45,6, 41,9, 30,7, 27,1, 23,8, 17,9; MS (ESI) m/z 342,2 (100%, [M+H]+).
[0326]  3,5-диметил-4-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)изоксазол: Это соединение получали в виде белого твердого вещества (28%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 3,5-диметилизоксазол-4-сульфонилхлоридом. Т.пл. 158-161°C; 1H ЯМР (400 МГц, CDCl3) δ 3,78 (д, J=11,9 Гц, 2H), 2,80 (д, J=11,5 Гц, 2H), 2,61 (c, 3H), 2,50 (т, J=12,0 Гц, 2H), 2,38 (c, 3H), 2,27 (тт, J=11,4, 3,5 Гц, 1H), 2,14-2,06 (м, 2H), 1,87 (д, J=11,6 Гц, 2H), 1,72-1,50 (м, 4H), 1,30 (м, 1H), 1,25-1,09 (м, 2H), 0,89 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 173,5, 158,0, 113,7, 61,3, 49,6, 45,4, 34,6, 31,0, 27,5, 21,9, 13,0, 11,4; MS (ESI) m/z 342,2 (100%, [M+H]+).
3,5-диметил-4-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)изоксазол: Это соединение получали в виде белого твердого вещества (28%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 3,5-диметилизоксазол-4-сульфонилхлоридом. Т.пл. 158-161°C; 1H ЯМР (400 МГц, CDCl3) δ 3,78 (д, J=11,9 Гц, 2H), 2,80 (д, J=11,5 Гц, 2H), 2,61 (c, 3H), 2,50 (т, J=12,0 Гц, 2H), 2,38 (c, 3H), 2,27 (тт, J=11,4, 3,5 Гц, 1H), 2,14-2,06 (м, 2H), 1,87 (д, J=11,6 Гц, 2H), 1,72-1,50 (м, 4H), 1,30 (м, 1H), 1,25-1,09 (м, 2H), 0,89 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 173,5, 158,0, 113,7, 61,3, 49,6, 45,4, 34,6, 31,0, 27,5, 21,9, 13,0, 11,4; MS (ESI) m/z 342,2 (100%, [M+H]+).
[0327]  4-метил-1'-((1-метил-1H-имидазол-4-ил)сульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (61%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 1-метил-1H-имидазол-4-сульфонилхлоридом. Т.пл. 139-142°C; 1H ЯМР (500 МГц, CDCl3) δ 7,48 (c, 1H), 7,42 (c, 1H), 3,90 (д, J=13,0 Гц, 2H), 3,75 (c, 3H), 2,80 (д, J=9,9 Гц, 2H), 2,57 (т, J=12,1 Гц, 2H), 2,26 (т, J=11,5 Гц, 1H), 2,13 (т, J=10,5 Гц, 2H), 1,83 (д, J=12,1 Гц, 2H), 1,64 (м, 4H), 1,31 (c, шир., 1H), 1,26-1,12 (м, 2H), 0,90 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 139,0, 138,3, 124,4, 61,7, 49,5, 46,3, 34,6, 34,0, 31,1, 27,4, 21,9; MS (ESI) m/z 327,2 (100%, [M+H]+).
4-метил-1'-((1-метил-1H-имидазол-4-ил)сульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (61%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 1-метил-1H-имидазол-4-сульфонилхлоридом. Т.пл. 139-142°C; 1H ЯМР (500 МГц, CDCl3) δ 7,48 (c, 1H), 7,42 (c, 1H), 3,90 (д, J=13,0 Гц, 2H), 3,75 (c, 3H), 2,80 (д, J=9,9 Гц, 2H), 2,57 (т, J=12,1 Гц, 2H), 2,26 (т, J=11,5 Гц, 1H), 2,13 (т, J=10,5 Гц, 2H), 1,83 (д, J=12,1 Гц, 2H), 1,64 (м, 4H), 1,31 (c, шир., 1H), 1,26-1,12 (м, 2H), 0,90 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 139,0, 138,3, 124,4, 61,7, 49,5, 46,3, 34,6, 34,0, 31,1, 27,4, 21,9; MS (ESI) m/z 327,2 (100%, [M+H]+).
[0328]  1-(мезитилсульфонил)-4-(1-метилпиперидин-4-ил)пиперазин: Это соединение получали в виде бесцветного геля (>95%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 1-(1-метилпиперидин-4-ил)пиперазином (1,0 ммоль) и 2,4,6-триметилбензолсульфонилхлоридом (1,1 ммоль) в CH2Cl2 в присутствии N,N-диизопропилэтиламина (1,5 ммоль). 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 3,23-3,04 (м, 4H), 2,85 (д, J=12,2 Гц, 2H), 2,59 (c, 6 H), 2,57-2,48 (м, 4H), 2,26 (c, 3H), 2,22 (c, 3H), 2,19 (м, 1H), 1,89 (т, J=12,0 Гц, 2H), 1,69 (д, J=11,0 Гц, 2H), 1,51 (квд, J=12,3, 3,9 Гц, 2H).; 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 131,9, 131,3, 61,4, 55,3, 48,4, 46,1, 44,7, 28,0, 23,0, 21,0.; MS (ESI) m/z 366,2 (60%, [M+H]+), 414,2 (100%, [M+K]+).
1-(мезитилсульфонил)-4-(1-метилпиперидин-4-ил)пиперазин: Это соединение получали в виде бесцветного геля (>95%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 1-(1-метилпиперидин-4-ил)пиперазином (1,0 ммоль) и 2,4,6-триметилбензолсульфонилхлоридом (1,1 ммоль) в CH2Cl2 в присутствии N,N-диизопропилэтиламина (1,5 ммоль). 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 3,23-3,04 (м, 4H), 2,85 (д, J=12,2 Гц, 2H), 2,59 (c, 6 H), 2,57-2,48 (м, 4H), 2,26 (c, 3H), 2,22 (c, 3H), 2,19 (м, 1H), 1,89 (т, J=12,0 Гц, 2H), 1,69 (д, J=11,0 Гц, 2H), 1,51 (квд, J=12,3, 3,9 Гц, 2H).; 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 131,9, 131,3, 61,4, 55,3, 48,4, 46,1, 44,7, 28,0, 23,0, 21,0.; MS (ESI) m/z 366,2 (60%, [M+H]+), 414,2 (100%, [M+K]+).
[0329]  1'-((6-хлорпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (80%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 6-хлорпиридин-3-сульфонилхлоридом. Т.пл. 178-182°C 1H ЯМР (500 МГц, CDCl3) δ 8,75 (c, 1H), 7,99 (дд, J=8,4, 2,3 Гц, 1H), 7,51 (д, J=8,3 Гц, 1H), 3,87 (д, J=12,0 Гц, 2H), 2,81 (д, J=8,5 Гц, 2H), 2,35 (т, J=12,0 Гц, 2H), 2,25 (т, J=11,4 Гц, 1H), 2,14 (т, J=11,3 Гц, 2H), 1,89 (д, J=11,3 Гц, 2H), 1,75-1,58 (м, 4H), 1,33 (c, шир., 1H), 1,21 (м, 2H), 0,91 (д, J=6,6 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 155,6, 148,6, 137,7, 132,1, 124,7, 61,3, 49,5, 46,0, 34,4, 30,9, 27,3, 21,8; MS (ESI) m/z 358,1(100%, [M+H]+).
1'-((6-хлорпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (80%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 6-хлорпиридин-3-сульфонилхлоридом. Т.пл. 178-182°C 1H ЯМР (500 МГц, CDCl3) δ 8,75 (c, 1H), 7,99 (дд, J=8,4, 2,3 Гц, 1H), 7,51 (д, J=8,3 Гц, 1H), 3,87 (д, J=12,0 Гц, 2H), 2,81 (д, J=8,5 Гц, 2H), 2,35 (т, J=12,0 Гц, 2H), 2,25 (т, J=11,4 Гц, 1H), 2,14 (т, J=11,3 Гц, 2H), 1,89 (д, J=11,3 Гц, 2H), 1,75-1,58 (м, 4H), 1,33 (c, шир., 1H), 1,21 (м, 2H), 0,91 (д, J=6,6 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 155,6, 148,6, 137,7, 132,1, 124,7, 61,3, 49,5, 46,0, 34,4, 30,9, 27,3, 21,8; MS (ESI) m/z 358,1(100%, [M+H]+).
[0330]  1'-((5-бромпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (79%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 5-бромпиридин-3-сульфонилхлоридом. Т.пл. 171-173°C; 1H ЯМР (500 МГц, CDCl3) δ 8,81 (c, 2H), 8,18 (т, J=2,0 Гц, 1H), 3,89 (д, J=11,6 Гц, 2H), 2,81 (д, J=11,0 Гц, 2H), 2,39 (тд, J=12,0, 2,5 Гц, 2H), 2,25 (д, J=11,9 Гц, 1H), 2,14 (т, J=11,6 Гц, 2H), 1,90 (д, J=12,8 Гц, 2H), 1,78-1,57 (м, 4H), 1,43-1,29 (м, 1H), 1,20 (м, 2H), 0,91 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,4, 146,2, 137,4, 134,5, 121,0, 61,2, 49,5, 46,0, 34,5, 31,0, 27,3, 21,8; MS (ESI) m/z 402,1 (100%, [M+]+), 404,1 (100%, [M+2]+).
1'-((5-бромпиридин-3-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (79%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 5-бромпиридин-3-сульфонилхлоридом. Т.пл. 171-173°C; 1H ЯМР (500 МГц, CDCl3) δ 8,81 (c, 2H), 8,18 (т, J=2,0 Гц, 1H), 3,89 (д, J=11,6 Гц, 2H), 2,81 (д, J=11,0 Гц, 2H), 2,39 (тд, J=12,0, 2,5 Гц, 2H), 2,25 (д, J=11,9 Гц, 1H), 2,14 (т, J=11,6 Гц, 2H), 1,90 (д, J=12,8 Гц, 2H), 1,78-1,57 (м, 4H), 1,43-1,29 (м, 1H), 1,20 (м, 2H), 0,91 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,4, 146,2, 137,4, 134,5, 121,0, 61,2, 49,5, 46,0, 34,5, 31,0, 27,3, 21,8; MS (ESI) m/z 402,1 (100%, [M+]+), 404,1 (100%, [M+2]+).
[0331]  1,3-диметил-5-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)пиримидин-2,4(1H,3H)-дион: Это соединение получали в виде белого твердого вещества (78%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-сульфонилхлоридом. Т.пл. 212-215°C; 1H ЯМР (500 МГц, CDCl3) δ 8,07 (c, 1H), 3,94 (д, J=12,8 Гц, 2H), 3,50 (c, 3H), 3,35 (c, 3H), 2,93 (д, J=11,6 Гц, 2H), 2,85 (т, J=12,7 Гц, 2H), 2,56 (т, J=11,7 Гц, 1H), 2,26 (т, J=11,9 Гц, 2H), 1,92 (д, J=11,9 Гц, 2H), 1,75-1,58 (м, 4H), 1,48-1,20 (м, 3H), 0,93 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 158,2, 150,8, 148,1, 112,6, 61,6, 49,2, 46,0, 37,9, 33,8, 30,7, 28,3, 27,5, 21,7; MS (ESI) m/z 385,2 (100%, [M+H]+).
1,3-диметил-5-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)пиримидин-2,4(1H,3H)-дион: Это соединение получали в виде белого твердого вещества (78%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-сульфонилхлоридом. Т.пл. 212-215°C; 1H ЯМР (500 МГц, CDCl3) δ 8,07 (c, 1H), 3,94 (д, J=12,8 Гц, 2H), 3,50 (c, 3H), 3,35 (c, 3H), 2,93 (д, J=11,6 Гц, 2H), 2,85 (т, J=12,7 Гц, 2H), 2,56 (т, J=11,7 Гц, 1H), 2,26 (т, J=11,9 Гц, 2H), 1,92 (д, J=11,9 Гц, 2H), 1,75-1,58 (м, 4H), 1,48-1,20 (м, 3H), 0,93 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 158,2, 150,8, 148,1, 112,6, 61,6, 49,2, 46,0, 37,9, 33,8, 30,7, 28,3, 27,5, 21,7; MS (ESI) m/z 385,2 (100%, [M+H]+).
[0332]  1'-(мезитилсульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (>95%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2,4,6-триметилбензол-1-сульфонилхлоридом. Т.пл. 62-65°C; 1H ЯМР (500 МГц, CDCl3) δ 6,94 (c, 2H), 3,62 (д, J=12,5 Гц, 2H), 2,85 (д, J=12,4 Гц, 2H), 2,75 (т, J=12,4 Гц, 2H), 2,61 (c, 6 H), 2,34 (т, J=11,5 Гц, 1H), 2,29 (c, 3H), 2,12 (т, J=11,4 Гц, 2H), 1,86 (д, J=11,1 Гц, 2H), 1,63 (д, J=13,4 Гц, 2H), 1,50 (квд, J=12,3, 4,0 Гц, 2H), 1,39-1,27 (c, шир., 1H), 1,27-1,13 (м, 2H), 0,90 (д, J=6,6 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,7, 61,8, 49,6, 44,0, 34,6, 31,0, 27,7, 22,8, 21,9, 20,9; MS (ESI) m/z 365,2 (100%, [M+H]+).
1'-(мезитилсульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (>95%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2,4,6-триметилбензол-1-сульфонилхлоридом. Т.пл. 62-65°C; 1H ЯМР (500 МГц, CDCl3) δ 6,94 (c, 2H), 3,62 (д, J=12,5 Гц, 2H), 2,85 (д, J=12,4 Гц, 2H), 2,75 (т, J=12,4 Гц, 2H), 2,61 (c, 6 H), 2,34 (т, J=11,5 Гц, 1H), 2,29 (c, 3H), 2,12 (т, J=11,4 Гц, 2H), 1,86 (д, J=11,1 Гц, 2H), 1,63 (д, J=13,4 Гц, 2H), 1,50 (квд, J=12,3, 4,0 Гц, 2H), 1,39-1,27 (c, шир., 1H), 1,27-1,13 (м, 2H), 0,90 (д, J=6,6 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,7, 61,8, 49,6, 44,0, 34,6, 31,0, 27,7, 22,8, 21,9, 20,9; MS (ESI) m/z 365,2 (100%, [M+H]+).
[0333]  2-хлор-4-метил-5-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)тиазол: Это соединение получали в виде белого твердого вещества (64%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2-хлор-4-метилтиазол-5-сульфонилхлоридом. Т.пл. 117-119°C; 1H ЯМР (400 МГц, CDCl3) δ 3,85 (д, J=13,5 Гц, 2H), 2,82 (д, J=11,0 Гц, 2H), 2,60 (c, 3H), 2,53 (т, J=12,0 Гц, 2H), 2,34 (т, J=11,9 Гц, 1H), 2,15 (т, J=11,4 Гц, 2H), 1,91 (д, J=12,7 Гц, 2H), 1,65 (м, 4H), 1,45-1,29 (м, 1H), 1,22 (м, 2H), 0,89 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 155,4, 154,4, 128,9, 61,3, 49,5, 46,0, 34,3, 30,9, 27,3, 21,8, 16,8; MS (ESI) m/z 378,1 (100%, [M+H]+).
2-хлор-4-метил-5-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)тиазол: Это соединение получали в виде белого твердого вещества (64%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 2-хлор-4-метилтиазол-5-сульфонилхлоридом. Т.пл. 117-119°C; 1H ЯМР (400 МГц, CDCl3) δ 3,85 (д, J=13,5 Гц, 2H), 2,82 (д, J=11,0 Гц, 2H), 2,60 (c, 3H), 2,53 (т, J=12,0 Гц, 2H), 2,34 (т, J=11,9 Гц, 1H), 2,15 (т, J=11,4 Гц, 2H), 1,91 (д, J=12,7 Гц, 2H), 1,65 (м, 4H), 1,45-1,29 (м, 1H), 1,22 (м, 2H), 0,89 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 155,4, 154,4, 128,9, 61,3, 49,5, 46,0, 34,3, 30,9, 27,3, 21,8, 16,8; MS (ESI) m/z 378,1 (100%, [M+H]+).
[0334] 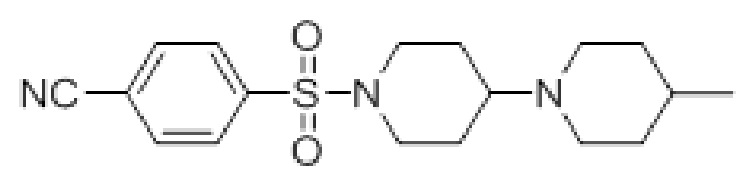 4-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)бензонитрил: Это соединение получали в виде белого твердого вещества (86%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-цианобензол-1-сульфонилхлоридом. Т.пл. 184-186°C; 1H ЯМР (400 МГц, CDCl3) δ 7,84 (кв, J=8,5 Гц, 4H), 3,85 (д, J=12,1 Гц, 2H), 2,77 (д, J=11,6 Гц, 2H), 2,31 (т, J=12,0 Гц, 2H), 2,22 (тт, J=11,6, 3,6 Гц, 1H), 2,11 (т, J=12,2 Гц, 2H), 1,85 (д, J=11,6 Гц, 2H), 1,71-1,55 (м, 4H), 1,31 (м, 1H), 1,25-1,10 (м, 2H), 0,89 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 140,9, 132,8, 128,1, 117,3, 116,4, 61,2, 49,5, 46,1, 34,6, 31,0, 27,4, 21,8; MS (ESI) m/z 348,2 (100%, [M+H]+).
4-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)бензонитрил: Это соединение получали в виде белого твердого вещества (86%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-цианобензол-1-сульфонилхлоридом. Т.пл. 184-186°C; 1H ЯМР (400 МГц, CDCl3) δ 7,84 (кв, J=8,5 Гц, 4H), 3,85 (д, J=12,1 Гц, 2H), 2,77 (д, J=11,6 Гц, 2H), 2,31 (т, J=12,0 Гц, 2H), 2,22 (тт, J=11,6, 3,6 Гц, 1H), 2,11 (т, J=12,2 Гц, 2H), 1,85 (д, J=11,6 Гц, 2H), 1,71-1,55 (м, 4H), 1,31 (м, 1H), 1,25-1,10 (м, 2H), 0,89 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 140,9, 132,8, 128,1, 117,3, 116,4, 61,2, 49,5, 46,1, 34,6, 31,0, 27,4, 21,8; MS (ESI) m/z 348,2 (100%, [M+H]+).
[0335]  4-метил-1'-(пиридин-3-илсульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (86%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и пиридин-3-сульфонилхлоридом. Т.пл. 144-147°C; 1H ЯМР (500 МГц, CDCl3) δ 8,98 (c, 1H), 8,82 (д, J=4,9 Гц, 1H), 8,04 (д, J=8,1 Гц, 1H), 7,49 (дд, J=8,0, 4,9 Гц, 1H), 3,88 (д, J=12,3 Гц, 2H), 2,78 (д, J=11,9 Гц, 2H), 2,32 (тд, J=12,0, 2,4 Гц, 2H), 2,22 (тт, J=11,6, 3,6 Гц, 1H), 2,12 (т, J=11,6 Гц, 2H), 1,86 (д, J=11,9 Гц, 2H), 1,75-1,55 (м, 4H), 1,31 (м, 1H), 1,17 (квд, J=12,0, 3,7 Гц, 2H), 0,89 (д, J=6,5 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 153,3, 148,4, 135,2, 133,1, 123,7, 61,3, 49,5, 46,0, 34,5, 31,0, 27,3, 21,8; MS (ESI) m/z 324,2 (100%, [M+H]+).
4-метил-1'-(пиридин-3-илсульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого твердого вещества (86%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и пиридин-3-сульфонилхлоридом. Т.пл. 144-147°C; 1H ЯМР (500 МГц, CDCl3) δ 8,98 (c, 1H), 8,82 (д, J=4,9 Гц, 1H), 8,04 (д, J=8,1 Гц, 1H), 7,49 (дд, J=8,0, 4,9 Гц, 1H), 3,88 (д, J=12,3 Гц, 2H), 2,78 (д, J=11,9 Гц, 2H), 2,32 (тд, J=12,0, 2,4 Гц, 2H), 2,22 (тт, J=11,6, 3,6 Гц, 1H), 2,12 (т, J=11,6 Гц, 2H), 1,86 (д, J=11,9 Гц, 2H), 1,75-1,55 (м, 4H), 1,31 (м, 1H), 1,17 (квд, J=12,0, 3,7 Гц, 2H), 0,89 (д, J=6,5 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 153,3, 148,4, 135,2, 133,1, 123,7, 61,3, 49,5, 46,0, 34,5, 31,0, 27,3, 21,8; MS (ESI) m/z 324,2 (100%, [M+H]+).
[0336]  6-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)бензо[d]тиазол: Это соединение получали в виде желтого твердого вещества (93%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и бензо[d]тиазол-6-сульфонилхлоридом. Т.пл. 197-199°C; 1H ЯМР (400 МГц, CDCl3) δ 9,19 (c, 1H), 8,41 (д, J=1,8 Гц, 1H), 8,24 (д, J=8,6 Гц, 1H), 7,86 (дд, J=8,5, 1,8 Гц, 1H), 3,89 (д, J=12,3, 2H), 2,75 (д, J=10,7 Гц, 2H), 2,45-2,02 (м, 5 H), 1,84 (д, J=12,4 Гц, 2H), 1,76-1,51 (м, 4H), 1,44-1,05 (м, 3H), 0,87 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 157,8, 155,5, 134,3, 133,5, 125,2, 124,1, 122,4, 61,4, 49,4, 46,2, 34,4, 30,9, 27,3, 21,8; MS (ESI) m/z 380,1 (100%, [M+H]+).
6-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)бензо[d]тиазол: Это соединение получали в виде желтого твердого вещества (93%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и бензо[d]тиазол-6-сульфонилхлоридом. Т.пл. 197-199°C; 1H ЯМР (400 МГц, CDCl3) δ 9,19 (c, 1H), 8,41 (д, J=1,8 Гц, 1H), 8,24 (д, J=8,6 Гц, 1H), 7,86 (дд, J=8,5, 1,8 Гц, 1H), 3,89 (д, J=12,3, 2H), 2,75 (д, J=10,7 Гц, 2H), 2,45-2,02 (м, 5 H), 1,84 (д, J=12,4 Гц, 2H), 1,76-1,51 (м, 4H), 1,44-1,05 (м, 3H), 0,87 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 157,8, 155,5, 134,3, 133,5, 125,2, 124,1, 122,4, 61,4, 49,4, 46,2, 34,4, 30,9, 27,3, 21,8; MS (ESI) m/z 380,1 (100%, [M+H]+).
[0337]  1'-((4-метоксифенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (94%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-метоксибензол-1-сульфонилхлоридом. Т.пл. 109-112°C; 1H ЯМР (400 МГц, CDCl3) δ 7,67 (д, J=8,8 Гц, 2H), 6,97 (д, J=8,8 Гц, 2H), 3,85 (c, 3H), 3,83-3,74 (д, J=12,0 Гц, 2H), 2,76 (д, J=11,7 Гц, 2H), 2,28-2,04 (м, 5H), 1,88-1,75 (д, J=12,9 Гц, 2H), 1,72-1,54 (м, 4H), 1,28 (м, 1H), 1,23-1,08 (м, 2H), 0,87 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 162,9, 129,8, 127,6, 114,1, 61,5, 55,6, 49,5, 46,2, 34,6, 31,0, 27,3, 21,9; MS (ESI) m/z 353,2 (100%, [M+H]+).
1'-((4-метоксифенил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (94%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-метоксибензол-1-сульфонилхлоридом. Т.пл. 109-112°C; 1H ЯМР (400 МГц, CDCl3) δ 7,67 (д, J=8,8 Гц, 2H), 6,97 (д, J=8,8 Гц, 2H), 3,85 (c, 3H), 3,83-3,74 (д, J=12,0 Гц, 2H), 2,76 (д, J=11,7 Гц, 2H), 2,28-2,04 (м, 5H), 1,88-1,75 (д, J=12,9 Гц, 2H), 1,72-1,54 (м, 4H), 1,28 (м, 1H), 1,23-1,08 (м, 2H), 0,87 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 162,9, 129,8, 127,6, 114,1, 61,5, 55,6, 49,5, 46,2, 34,6, 31,0, 27,3, 21,9; MS (ESI) m/z 353,2 (100%, [M+H]+).
[0338]  1'-((4'-хлор-[1,1'-бифенил]-4-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (87%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4'-хлор-[1,1'-бифенил]-4-сульфонилхлоридом. Т.пл. 205-207°C; 1H ЯМР (400 МГц, CDCl3) δ 7,88-7,75 (м, 2H), 7,67 (д, J=8,4 Гц, 2H), 7,51 (д, J=8,5 Гц, 2H), 7,43 (д, J=8,5 Гц, 2H), 3,87 (д, J=12,0 Гц, 2H), 2,76 (д, J=10,9 Гц, 2H), 2,41-2,02 (м, 5 H), 1,83 (дд, J=12,3, 3,6 Гц, 2H), 1,70-1,46 (м, 4H), 1,37-1,05 (м, 3H), 0,87 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 144,2, 137,7, 135,1, 134,7, 129,2, 128,5, 128,3, 127,4, 61,4, 49,5, 46,2, 34,6, 31,0, 27,3, 21,8; MS (ESI) m/z 433,2 (100%, [M+H]+).
1'-((4'-хлор-[1,1'-бифенил]-4-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (87%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4'-хлор-[1,1'-бифенил]-4-сульфонилхлоридом. Т.пл. 205-207°C; 1H ЯМР (400 МГц, CDCl3) δ 7,88-7,75 (м, 2H), 7,67 (д, J=8,4 Гц, 2H), 7,51 (д, J=8,5 Гц, 2H), 7,43 (д, J=8,5 Гц, 2H), 3,87 (д, J=12,0 Гц, 2H), 2,76 (д, J=10,9 Гц, 2H), 2,41-2,02 (м, 5 H), 1,83 (дд, J=12,3, 3,6 Гц, 2H), 1,70-1,46 (м, 4H), 1,37-1,05 (м, 3H), 0,87 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 144,2, 137,7, 135,1, 134,7, 129,2, 128,5, 128,3, 127,4, 61,4, 49,5, 46,2, 34,6, 31,0, 27,3, 21,8; MS (ESI) m/z 433,2 (100%, [M+H]+).
[0339]  1'-((4'-метокси-[1,1'-бифенил]-4-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (92%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4'-метокси-[1,1'-бифенил]-4-сульфонилхлоридом. Т.пл. 195-198°C; 1H ЯМР (400 МГц, CDCl3) δ 7,85-7,72 (м, 2H), 7,66 (д, J=8,5 Гц, 2H), 7,53 (д, J=8,7 Гц, 2H), 7,04-6,88 (м, 2H), 3,88 (д, J=12,0 Гц, 2H), 3,84 (c, 3H), 2,76 (д, J=11,6 Гц, 2H), 2,40-1,95 (м, 5 H), 1,83 (д, J=10,7 Гц, 2H), 1,71-1,48 (м, 4H), 1,29 (м, 1H), 1,23-1,04 (м, 2H), 0,87 (д, J=6,3 Гц, 3H).; 13C ЯМР (100 МГц, CDCl3) δ 160,0, 145,1, 133,9, 131,6, 128,4, 128,2, 126,9, 114,5, 61,5, 55,4, 49,5, 46,2, 34,6, 31,0, 27,4, 21,9; MS (ESI) m/z 429,2 (100%, [M+H]+).
1'-((4'-метокси-[1,1'-бифенил]-4-ил)сульфонил)-4-метил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (92%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4'-метокси-[1,1'-бифенил]-4-сульфонилхлоридом. Т.пл. 195-198°C; 1H ЯМР (400 МГц, CDCl3) δ 7,85-7,72 (м, 2H), 7,66 (д, J=8,5 Гц, 2H), 7,53 (д, J=8,7 Гц, 2H), 7,04-6,88 (м, 2H), 3,88 (д, J=12,0 Гц, 2H), 3,84 (c, 3H), 2,76 (д, J=11,6 Гц, 2H), 2,40-1,95 (м, 5 H), 1,83 (д, J=10,7 Гц, 2H), 1,71-1,48 (м, 4H), 1,29 (м, 1H), 1,23-1,04 (м, 2H), 0,87 (д, J=6,3 Гц, 3H).; 13C ЯМР (100 МГц, CDCl3) δ 160,0, 145,1, 133,9, 131,6, 128,4, 128,2, 126,9, 114,5, 61,5, 55,4, 49,5, 46,2, 34,6, 31,0, 27,4, 21,9; MS (ESI) m/z 429,2 (100%, [M+H]+).
[0340]  2,7-бис((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)нафталин: Это соединение получали в виде белого твердого вещества (92%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции 4-метил-1,4'-бипиперидина (0,39 ммоль) с нафталин-2,7-дисульфонилдихлоридом (0,15 ммоль) в CH2Cl2 (2,5 мл) в присутствии N,N-диизопропилэтиламин (0,52 ммоль). Т.пл. 265-268°C; 1H ЯМР (400 МГц, CDCl3) δ 8,42 (c, 2H), 8,04 (д, J=8,7 Гц, 2H), 7,89 (дд, J=8,6, 1,7 Гц, 2H), 3,92 (д, J=12,3 Гц, 4H), 2,75 (д, J=11,7 Гц, 4H), 2,32 (тд, J=12,1, 2,4 Гц, 4H), 2,25-1,99 (м, 6 H), 1,84 (д, J=11,5 Гц, 4H), 1,72-1,51 (м, 8 H), 1,37-1,21 (м, 2H), 1,21-1,07 (м, 4H), 0,86 (д, J=6,3 Гц, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 136,0, 135,5, 131,3, 129,7, 129,2, 125,8, 61,4, 49,5, 46,2, 34,5, 31,0, 27,4, 21,8; MS (ESI) m/z 617,3 (100%, [M+H]+)
2,7-бис((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)нафталин: Это соединение получали в виде белого твердого вещества (92%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции 4-метил-1,4'-бипиперидина (0,39 ммоль) с нафталин-2,7-дисульфонилдихлоридом (0,15 ммоль) в CH2Cl2 (2,5 мл) в присутствии N,N-диизопропилэтиламин (0,52 ммоль). Т.пл. 265-268°C; 1H ЯМР (400 МГц, CDCl3) δ 8,42 (c, 2H), 8,04 (д, J=8,7 Гц, 2H), 7,89 (дд, J=8,6, 1,7 Гц, 2H), 3,92 (д, J=12,3 Гц, 4H), 2,75 (д, J=11,7 Гц, 4H), 2,32 (тд, J=12,1, 2,4 Гц, 4H), 2,25-1,99 (м, 6 H), 1,84 (д, J=11,5 Гц, 4H), 1,72-1,51 (м, 8 H), 1,37-1,21 (м, 2H), 1,21-1,07 (м, 4H), 0,86 (д, J=6,3 Гц, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 136,0, 135,5, 131,3, 129,7, 129,2, 125,8, 61,4, 49,5, 46,2, 34,5, 31,0, 27,4, 21,8; MS (ESI) m/z 617,3 (100%, [M+H]+)
[0241]  1'-((4-бром-2-(трифторметокси)фенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде желтого твердого вещества (67%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-бром-2-(трифторметокси)бензол-1-сульфонилхлоридом. Т.пл. 108-110°C; 1H ЯМР (400 МГц, CDCl3) δ 7,83 (д, J=8,9 Гц, 1H), 7,58-7,45 (м, 2H), 3,85 (д, J=12,7 Гц, 2H), 2,78 (дт, J=11,9, 3,3 Гц, 2H), 2,59 (тд, J=12,5, 2,5 Гц, 2H), 2,29 (тт, J=11,5, 3,6 Гц, 1H), 2,11 (тд, J=11,5, 2,4 Гц, 2H), 1,82 (дт, J=12,7, 2,7 Гц, 2H), 1,69-1,45 (м, 4H), 1,40-1,24 (м, 1H), 1,23-1,05 (м, 2H), 0,88 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 146,2, 132,7, 130,1, 129,8, 127,9, 123,90, 121,3, 61,5, 49,5, 45,7, 34,59, 31,0, 27,8, 21,8; MS (ESI) m/z 485,1 (100%, [M+H]+).
1'-((4-бром-2-(трифторметокси)фенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде желтого твердого вещества (67%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 4-бром-2-(трифторметокси)бензол-1-сульфонилхлоридом. Т.пл. 108-110°C; 1H ЯМР (400 МГц, CDCl3) δ 7,83 (д, J=8,9 Гц, 1H), 7,58-7,45 (м, 2H), 3,85 (д, J=12,7 Гц, 2H), 2,78 (дт, J=11,9, 3,3 Гц, 2H), 2,59 (тд, J=12,5, 2,5 Гц, 2H), 2,29 (тт, J=11,5, 3,6 Гц, 1H), 2,11 (тд, J=11,5, 2,4 Гц, 2H), 1,82 (дт, J=12,7, 2,7 Гц, 2H), 1,69-1,45 (м, 4H), 1,40-1,24 (м, 1H), 1,23-1,05 (м, 2H), 0,88 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 146,2, 132,7, 130,1, 129,8, 127,9, 123,90, 121,3, 61,5, 49,5, 45,7, 34,59, 31,0, 27,8, 21,8; MS (ESI) m/z 485,1 (100%, [M+H]+).
[0342]  1'-((3-бромфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде белого твердого вещества (65%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 3-бромбензол-1-сульфонилхлоридом. Т.пл. 125-126°C; 1H ЯМР (400 МГц, CDCl3) δ 7,85 (c, 1H), 7,66 (дд, J=13,3, 7,9 Гц, 2H), 7,37 (т, J=7,9 Гц, 1H), 3,80 (д, J=11,7 Гц, 2H), 2,74 (д, J=11,0 Гц, 2H), 2,16 (дт, J=73,4, 11,4 Гц, 5 H), 1,81 (д, J=12,7 Гц, 2H), 1,60 (тд, J=12,4, 8,1 Гц, 4H), 1,27 (дт, J=11,0, 5,9 Гц, 1H), 1,20-1,02 (м, 2H), 0,85 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 138,2, 135,7, 130,5, 130,3, 126,1, 123,1, 61,3, 49,5, 46,1, 34,6, 31,0, 27,4, 21,9; MS (ESI) m/z 401,1 (100%, [M+]+), 403,1 (100%, [M+2]+).
1'-((3-бромфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде белого твердого вещества (65%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 3-бромбензол-1-сульфонилхлоридом. Т.пл. 125-126°C; 1H ЯМР (400 МГц, CDCl3) δ 7,85 (c, 1H), 7,66 (дд, J=13,3, 7,9 Гц, 2H), 7,37 (т, J=7,9 Гц, 1H), 3,80 (д, J=11,7 Гц, 2H), 2,74 (д, J=11,0 Гц, 2H), 2,16 (дт, J=73,4, 11,4 Гц, 5 H), 1,81 (д, J=12,7 Гц, 2H), 1,60 (тд, J=12,4, 8,1 Гц, 4H), 1,27 (дт, J=11,0, 5,9 Гц, 1H), 1,20-1,02 (м, 2H), 0,85 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 138,2, 135,7, 130,5, 130,3, 126,1, 123,1, 61,3, 49,5, 46,1, 34,6, 31,0, 27,4, 21,9; MS (ESI) m/z 401,1 (100%, [M+]+), 403,1 (100%, [M+2]+).
[0343]  1'-((4-хлорфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде белого твердого вещества (67%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 4-хлорбензол-1-сульфонилхлоридом. Т.пл. 152-155°C; 1H ЯМР (400 МГц, CDCl3) δ 7,66 (д, J=8,5 Гц, 2H), 7,47 (д, J=8,5 Гц, 2H), 3,93-3,69 (м, 2H), 2,80 (дт, J=11,6, 3,4 Гц, 2H), 2,23 (тд, J=12,0, 2,5 Гц, 3H), 2,15 (т, J=11,3 Гц, 2H), 1,84 (д, J=12,6 Гц, 2H), 1,71-1,54 (м, 4H), 1,42-1,26 (м, 1H), 1,25-1,12 (м, 2H), 0,87 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 139,3, 134,6, 129,3, 129,0, 61,4, 49,4, 46,0, 34,2, 30,8, 27,2, 21,7; MS (ESI) m/z 357,2 (100%, [M+H]+).
1'-((4-хлорфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде белого твердого вещества (67%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 4-хлорбензол-1-сульфонилхлоридом. Т.пл. 152-155°C; 1H ЯМР (400 МГц, CDCl3) δ 7,66 (д, J=8,5 Гц, 2H), 7,47 (д, J=8,5 Гц, 2H), 3,93-3,69 (м, 2H), 2,80 (дт, J=11,6, 3,4 Гц, 2H), 2,23 (тд, J=12,0, 2,5 Гц, 3H), 2,15 (т, J=11,3 Гц, 2H), 1,84 (д, J=12,6 Гц, 2H), 1,71-1,54 (м, 4H), 1,42-1,26 (м, 1H), 1,25-1,12 (м, 2H), 0,87 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 139,3, 134,6, 129,3, 129,0, 61,4, 49,4, 46,0, 34,2, 30,8, 27,2, 21,7; MS (ESI) m/z 357,2 (100%, [M+H]+).
[0344]  4-метил-1'-тозил-1,4'-бипиперидин получали в виде белого твердого вещества (67%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 4-метилбензол-1-сульфонилхлоридом. Т.пл. 139-142°C; 1H ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=8,2 Гц, 2H), 7,28 (д, J=8,2 Гц, 2H), 3,80 (д, J=11,9 Гц, 2H), 2,79 (д, J=11,1 Гц, 2H), 2,39 (c, 3H), 2,30-2,07 (м, 5 H), 1,84 (д, J=10,9 Гц, 2H), 1,69-1,53 (м, 4H), 1,40-1,09 (м, 3H), 0,86 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 143,5, 132,9, 129,6, 127,7, 61,6, 49,4, 46,0, 34,1, 30,8, 27,1, 21,7, 21,5; MS (ESI) m/z 337,2 (100%, [M+H]+).
4-метил-1'-тозил-1,4'-бипиперидин получали в виде белого твердого вещества (67%) с использованием перекристаллизации в смеси CH2Cl2 и гексана после реакции между 4-метил-1,4'-бипиперидином и 4-метилбензол-1-сульфонилхлоридом. Т.пл. 139-142°C; 1H ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=8,2 Гц, 2H), 7,28 (д, J=8,2 Гц, 2H), 3,80 (д, J=11,9 Гц, 2H), 2,79 (д, J=11,1 Гц, 2H), 2,39 (c, 3H), 2,30-2,07 (м, 5 H), 1,84 (д, J=10,9 Гц, 2H), 1,69-1,53 (м, 4H), 1,40-1,09 (м, 3H), 0,86 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 143,5, 132,9, 129,6, 127,7, 61,6, 49,4, 46,0, 34,1, 30,8, 27,1, 21,7, 21,5; MS (ESI) m/z 337,2 (100%, [M+H]+).
[0345]  1'-((3,4-дихлорфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде светло-коричневого твердого вещества (86%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 3,4-дихлорбензол-1-сульфонилхлоридом. Т.пл. 160-162°C; 1H ЯМР (400 МГц, CDCl3) δ 7,81 (д, J=1,9 Гц, 1H), 7,66-7,44 (м, 2H), 3,81 (д, J=12,1 Гц, 2H), 2,76 (д, J=11,2 Гц, 2H), 2,29 (тд, J=11,9, 2,5 Гц, 2H), 2,20 (тт, J=11,5, 3,5 Гц, 1H), 2,10 (тд, J=11,5, 2,4 Гц, 2H), 1,84 (д, J=11,5 Гц, 2H), 1,62 (ддт, J=16,3, 12,5, 5,6 Гц, 4H), 1,28 (тдд, J=12,8, 10,3, 5,5 Гц, 1H), 1,15 (квд, J=11,8, 11,2, 3,7 Гц, 2H), 0,87 (д, J=6,5 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 137,5, 136,2, 133,8, 131,1, 129,4, 126,6, 61,3, 49,5, 46,1, 34,6, 31,0, 27,4, 21,8; MS (ESI) m/z 391,1 (100%, [M+H]+).
1'-((3,4-дихлорфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде светло-коричневого твердого вещества (86%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции между 4-метил-1,4'-бипиперидином и 3,4-дихлорбензол-1-сульфонилхлоридом. Т.пл. 160-162°C; 1H ЯМР (400 МГц, CDCl3) δ 7,81 (д, J=1,9 Гц, 1H), 7,66-7,44 (м, 2H), 3,81 (д, J=12,1 Гц, 2H), 2,76 (д, J=11,2 Гц, 2H), 2,29 (тд, J=11,9, 2,5 Гц, 2H), 2,20 (тт, J=11,5, 3,5 Гц, 1H), 2,10 (тд, J=11,5, 2,4 Гц, 2H), 1,84 (д, J=11,5 Гц, 2H), 1,62 (ддт, J=16,3, 12,5, 5,6 Гц, 4H), 1,28 (тдд, J=12,8, 10,3, 5,5 Гц, 1H), 1,15 (квд, J=11,8, 11,2, 3,7 Гц, 2H), 0,87 (д, J=6,5 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 137,5, 136,2, 133,8, 131,1, 129,4, 126,6, 61,3, 49,5, 46,1, 34,6, 31,0, 27,4, 21,8; MS (ESI) m/z 391,1 (100%, [M+H]+).
III. Общая методика получения сульфонамидов из сульфонилхлоридов и солей аминов с хлористоводородной кислотой
[0346] Сульфонилхлорид (1,2 ммоль), соль амина с хлористоводородной кислотой (1,0 ммоль), CHCl3 (2 мл), воду (2 мл) и K2CO3 (2,5 ммоль) последовательно добавляли в 15-мл колбу. Двухфазный реакционный раствор перемешивали тщательно при комнатной температуре в течение 20 ч, после чего реакционный раствор переносили в делительную воронку и добавляли 25 мл насыщенного раствора NaHCO3. Полученный двухфазный раствор экстрагировали CH2Cl2 (3×20 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии на силикагеле со смесью гексан:EtOAc (или MeOH:CH2Cl2) в качестве элюента с получением сульфонамидного продукта.
[0347]  1-(фенилсульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (93%) с использованием флэш-хроматографии (1:1 гексан:EtOAc). Т.пл. 105-108°C; 1H ЯМР (400 МГц, CDCl3) δ 7,85-7,73 (м, 2H), 7,66-7,58 (м, 1H), 7,58-7,48 (м, 2H), 3,39 (т, J=6,2 Гц, 4H), 2,52 (т, J=6,2 Гц, 4H); 13C ЯМР (126 МГц, CDCl3) δ 205,6, 136,3, 133,2, 129,3, 127,5, 45,9, 40,7. Аналитические данные согласовывались с литературными данными (Ellis, G. L. et al. J. Med. Chem. 2008, 51, 2170-2177).
1-(фенилсульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (93%) с использованием флэш-хроматографии (1:1 гексан:EtOAc). Т.пл. 105-108°C; 1H ЯМР (400 МГц, CDCl3) δ 7,85-7,73 (м, 2H), 7,66-7,58 (м, 1H), 7,58-7,48 (м, 2H), 3,39 (т, J=6,2 Гц, 4H), 2,52 (т, J=6,2 Гц, 4H); 13C ЯМР (126 МГц, CDCl3) δ 205,6, 136,3, 133,2, 129,3, 127,5, 45,9, 40,7. Аналитические данные согласовывались с литературными данными (Ellis, G. L. et al. J. Med. Chem. 2008, 51, 2170-2177).
[0348]  1-(1-(мезитилсульфонил)пиперидин-4-ил)азепан: Это соединение получали в виде оранжевого геля (90%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2). 1H ЯМР (400 МГц, CDCl3) δ 6,94 (c, 2H), 3,71 (д, J=11,8 Гц, 2H), 3,62 (c, шир., 1H), 3,18-2,89 (c, 4H), 2,77 (т, J=12,7 Гц, 2H), 2,58 (c, 6 H), 2,29 (c, 3H), 2,10 (д, J=12,5 Гц, 2H), 1,82 (c, 4H), 1,76-1,54 (м, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 142,8, 140,3, 132,0, 132,0, 132,0, 131,5, 63,3, 51,2, 43,8, 26,9, 26,6, 26,4, 22,8, 21,0. MS (ESI) m/z 365,2 (100%, [M+H]+).
1-(1-(мезитилсульфонил)пиперидин-4-ил)азепан: Это соединение получали в виде оранжевого геля (90%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2). 1H ЯМР (400 МГц, CDCl3) δ 6,94 (c, 2H), 3,71 (д, J=11,8 Гц, 2H), 3,62 (c, шир., 1H), 3,18-2,89 (c, 4H), 2,77 (т, J=12,7 Гц, 2H), 2,58 (c, 6 H), 2,29 (c, 3H), 2,10 (д, J=12,5 Гц, 2H), 1,82 (c, 4H), 1,76-1,54 (м, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 142,8, 140,3, 132,0, 132,0, 132,0, 131,5, 63,3, 51,2, 43,8, 26,9, 26,6, 26,4, 22,8, 21,0. MS (ESI) m/z 365,2 (100%, [M+H]+).
[0349]  1-(мезитилсульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (95%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 102-105°C; 1H ЯМР (400 МГц, CDCl3) δ 6,95 (c, 2H), 3,50 (т, J=6,2 Гц, 4H), 2,61 (c, 6 H), 2,52 (т, J=6,2 Гц, 4H), 2,29 (c, 3H); 13C ЯМР (100 МГц, CDCl3) δ 201,6, 138,3, 135,6, 127,4, 126,8, 39,6, 36,3, 18,1, 16,2; MS (ESI) m/z 282,1 (100%, [M+H]+).
1-(мезитилсульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (95%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 102-105°C; 1H ЯМР (400 МГц, CDCl3) δ 6,95 (c, 2H), 3,50 (т, J=6,2 Гц, 4H), 2,61 (c, 6 H), 2,52 (т, J=6,2 Гц, 4H), 2,29 (c, 3H); 13C ЯМР (100 МГц, CDCl3) δ 201,6, 138,3, 135,6, 127,4, 126,8, 39,6, 36,3, 18,1, 16,2; MS (ESI) m/z 282,1 (100%, [M+H]+).
[0350]  1-((2-нитрофенил)сульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (88%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 107-109°C; 1H ЯМР (400 МГц, CDCl3) δ 8,13-7,96 (м, 1H), 7,81-7,58 (м, 3H), 3,64 (т, J=6,3 Гц, 4H), 2,63-2,45 (т, J=6,3 Гц, 4H); 13C ЯМР (100 МГц, CDCl3) δ 205,4, 134,1, 131,9, 131,9, 130,9, 124,4, 45,5, 41,2; MS (ESI) m/z 285,0 (100%, [M+H]+).
1-((2-нитрофенил)сульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (88%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 107-109°C; 1H ЯМР (400 МГц, CDCl3) δ 8,13-7,96 (м, 1H), 7,81-7,58 (м, 3H), 3,64 (т, J=6,3 Гц, 4H), 2,63-2,45 (т, J=6,3 Гц, 4H); 13C ЯМР (100 МГц, CDCl3) δ 205,4, 134,1, 131,9, 131,9, 130,9, 124,4, 45,5, 41,2; MS (ESI) m/z 285,0 (100%, [M+H]+).
[0351]  1-((4-нитрофенил)сульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (82%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 192-195°C; 1H ЯМР (400 МГц, CDCl3) δ 8,47-8,33 (м, 2H), 7,98 (д, J=8,8 Гц, 2H), 3,46 (т, J=6,2 Гц, 4H), 2,56 (т, J=6,2 Гц, 4H); 13C ЯМР (100 МГц, CDCl3) δ 204,5, 150,4, 142,7, 128,6, 124,6, 45,8, 40,7; MS (ESI) m/z 285,1 (100%, [M+H]+).
1-((4-нитрофенил)сульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (82%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 192-195°C; 1H ЯМР (400 МГц, CDCl3) δ 8,47-8,33 (м, 2H), 7,98 (д, J=8,8 Гц, 2H), 3,46 (т, J=6,2 Гц, 4H), 2,56 (т, J=6,2 Гц, 4H); 13C ЯМР (100 МГц, CDCl3) δ 204,5, 150,4, 142,7, 128,6, 124,6, 45,8, 40,7; MS (ESI) m/z 285,1 (100%, [M+H]+).
[0352]  1-((3-нитрофенил)сульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (90%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 141-143°C; 1H ЯМР (400 МГц, CDCl3) δ 8,60 (c, 1H), 8,48-8,43 (м, 1H), 8,14-8,07 (м, 1H), 7,78 (т, J=8,0 Гц, 1H), 3,46 (т, J=6,2 Гц, 4H), 2,56 (т, J=6,2 Гц, 4H); 13C ЯМР (100 МГц, CDCl3) δ 204,6, 148,5, 139,1, 132,8, 130,8, 127,6, 122,5, 45,8, 40,7; MS (ESI) m/z 285,1 (100%, [M+H]+).
1-((3-нитрофенил)сульфонил)пиперидин-4-он: Это соединение получали в виде белого твердого вещества (90%) с использованием флэш-хроматографии ((1:19 MeOH:CH2Cl2). Т.пл. 141-143°C; 1H ЯМР (400 МГц, CDCl3) δ 8,60 (c, 1H), 8,48-8,43 (м, 1H), 8,14-8,07 (м, 1H), 7,78 (т, J=8,0 Гц, 1H), 3,46 (т, J=6,2 Гц, 4H), 2,56 (т, J=6,2 Гц, 4H); 13C ЯМР (100 МГц, CDCl3) δ 204,6, 148,5, 139,1, 132,8, 130,8, 127,6, 122,5, 45,8, 40,7; MS (ESI) m/z 285,1 (100%, [M+H]+).
IV. Общая методика метилирования третичных аминов
[0353] Третичный амин (0,1 ммоль) растворяли в ацетонитриле (3 мл) и капельно добавляли CH3I (0,3 ммоль). Полученную смесь перемешивали при температуре кипения с обратным холодильником в течение 4 ч. После выпаривания органического растворителя в вакууме получали соответствующую четвертичную соль аммония без дальнейшей очистки, если не нет иных указаний.
[0354]  1,4-диметил-1-(1-(фенилсульфонил)пиперидин-4-ил)пиперидин-1-ий йодид (N-метил и C-метил находятся в транс-конфигурации): Этот транс-изомер получали в виде желтого твердого вещества (58%) с использованием флэш-хроматографии (1:9 EtOH:CH2Cl2) после метилирования 4-метил-1'-(фенилсульфонил)-1,4'-бипиперидина. Т.пл. 201-204°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,73 (м, 3H), 7,65 (м, 2H), 3,78 (д, J=12,0 Гц, 2H), 3,36 (д, J=12,0 Гц, 3H), 3,07 (т, J=12,0 Гц, 2H), 2,84 (c, 3H), 2,18 (т, J=12,4 Гц, 4H), 1,78 (квд, J=12,0, 3,9 Гц, 2H), 1,67 (д, J=12,0 Гц, 2H), 1,54 (м, 3H), 0,91 (д, J=4,0 Гц, 3H); 13C ЯМР (100 МГц, DMSO-d6) δ 135,1, 133,9, 130,0, 128,0, 72,0, 58,5, 45,6 , 41,1, 27,9, 27,6 , 24,6, 20,7; MS (ESI) m/z 337,2 (100%, [M-I]+).
1,4-диметил-1-(1-(фенилсульфонил)пиперидин-4-ил)пиперидин-1-ий йодид (N-метил и C-метил находятся в транс-конфигурации): Этот транс-изомер получали в виде желтого твердого вещества (58%) с использованием флэш-хроматографии (1:9 EtOH:CH2Cl2) после метилирования 4-метил-1'-(фенилсульфонил)-1,4'-бипиперидина. Т.пл. 201-204°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,73 (м, 3H), 7,65 (м, 2H), 3,78 (д, J=12,0 Гц, 2H), 3,36 (д, J=12,0 Гц, 3H), 3,07 (т, J=12,0 Гц, 2H), 2,84 (c, 3H), 2,18 (т, J=12,4 Гц, 4H), 1,78 (квд, J=12,0, 3,9 Гц, 2H), 1,67 (д, J=12,0 Гц, 2H), 1,54 (м, 3H), 0,91 (д, J=4,0 Гц, 3H); 13C ЯМР (100 МГц, DMSO-d6) δ 135,1, 133,9, 130,0, 128,0, 72,0, 58,5, 45,6 , 41,1, 27,9, 27,6 , 24,6, 20,7; MS (ESI) m/z 337,2 (100%, [M-I]+).
[0355] 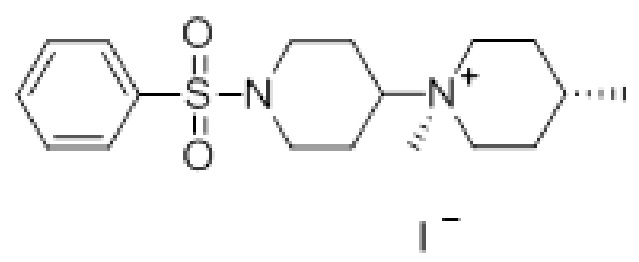 1,4-диметил-1-(1-(фенилсульфонил)пиперидин-4-ил)пиперидин-1-ий йодид (N-метил и C-метил находятся в цис-конфигурации): Этот цис-изомер получали в виде белого твердого вещества (28%) с использованием флэш-хроматографии (1:9 EtOH:CH2Cl2) после метилирования 4-метил-1'-(фенилсульфонил)-1,4'-бипиперидина. Т.пл. 264-266°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,74 (м, 3H), 7,65 (м, 2H), 3,75 (м, 3H), 3,53 (д, J=16,0 Гц, 2H), 3,16 (т, J=12,0 Гц, 2H), 2,81 (c, 3H), 2,40 (т, J=12,0 Гц, 2H), 1,99 (д, J=12,0, 2H), 1,75 (м, 2H), 1,51 (м, 5 H), 0,87 (д, J=4,0 Гц, 3H); 13C ЯМР (100 МГц, DMSO-d6) δ 135,8, 133,8, 130,1, 128,0, 59,8, 58,3, 47,2, 45,0, 28,0, 26,9, 24,0, 20,5; MS (ESI) m/z 337,2 (100%, [M-I]+).
1,4-диметил-1-(1-(фенилсульфонил)пиперидин-4-ил)пиперидин-1-ий йодид (N-метил и C-метил находятся в цис-конфигурации): Этот цис-изомер получали в виде белого твердого вещества (28%) с использованием флэш-хроматографии (1:9 EtOH:CH2Cl2) после метилирования 4-метил-1'-(фенилсульфонил)-1,4'-бипиперидина. Т.пл. 264-266°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,74 (м, 3H), 7,65 (м, 2H), 3,75 (м, 3H), 3,53 (д, J=16,0 Гц, 2H), 3,16 (т, J=12,0 Гц, 2H), 2,81 (c, 3H), 2,40 (т, J=12,0 Гц, 2H), 1,99 (д, J=12,0, 2H), 1,75 (м, 2H), 1,51 (м, 5 H), 0,87 (д, J=4,0 Гц, 3H); 13C ЯМР (100 МГц, DMSO-d6) δ 135,8, 133,8, 130,1, 128,0, 59,8, 58,3, 47,2, 45,0, 28,0, 26,9, 24,0, 20,5; MS (ESI) m/z 337,2 (100%, [M-I]+).
[0356]  1-(1-((4-метоксифенил)сульфонил)пиперидин-4-ил)-1-метилпирролидин-1-ий йодид: Это соединение получали в виде желтого твердого вещества (>95%). Т.пл. 82-85°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,67 (д, J=8,0 Гц, 2H), 7,15 (д, J=8,0 Гц, 2H), 3,82 (c, 3H), 3,72 (д, J=12,0 Гц, 2H), 3,49 (дд, J=12,0, 8,0 Гц, 2H), 3,30 (c, шир., 3H), 2,79 (c, 3H), 2,17 (т, J=12,0 Гц, 2H), 2,02 (м, 6 H), 1,84 (м, 2H); 13C ЯМР (100 МГц, DMSO-d6) δ 163,4, 130,3, 126,6, 115,1, 70,1, 63,5, 56,3, 45,4, 43,3, 26,2, 21,3; MS (ESI) m/z 339,2 (100%, [M-I]+).
1-(1-((4-метоксифенил)сульфонил)пиперидин-4-ил)-1-метилпирролидин-1-ий йодид: Это соединение получали в виде желтого твердого вещества (>95%). Т.пл. 82-85°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,67 (д, J=8,0 Гц, 2H), 7,15 (д, J=8,0 Гц, 2H), 3,82 (c, 3H), 3,72 (д, J=12,0 Гц, 2H), 3,49 (дд, J=12,0, 8,0 Гц, 2H), 3,30 (c, шир., 3H), 2,79 (c, 3H), 2,17 (т, J=12,0 Гц, 2H), 2,02 (м, 6 H), 1,84 (м, 2H); 13C ЯМР (100 МГц, DMSO-d6) δ 163,4, 130,3, 126,6, 115,1, 70,1, 63,5, 56,3, 45,4, 43,3, 26,2, 21,3; MS (ESI) m/z 339,2 (100%, [M-I]+).
[0357]  1-(1-(мезитилсульфонил)пиперидин-4-ил)-1-метилпирролидин-1-ий йодид: Это соединение получали в виде желтого твердого вещества (83%). Т.пл. 263-266°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,07 (c, 2H), 3,60-3,43 (м, 5 H), 3,34 (дд, J=19,2, 8,0 Гц, 2H), 2,80 (c, 3H), 2,73 (тд, J=12,6, 2,1 Гц, 2H), 2,56 (c, 6 H), 2,25 (c, 3H), 2,05 (м, 6 H), 1,71 (м, 2H); 13C ЯМР (100 МГц, DMSO-d6) δ 143,1, 140,1, 132,4, 131,6, 70,6, 63,4, 43,4, 43,2, 26,5, 22,8, 21,2, 20,9; MS (ESI) m/z 351,2 (100%, [M-I]+).
1-(1-(мезитилсульфонил)пиперидин-4-ил)-1-метилпирролидин-1-ий йодид: Это соединение получали в виде желтого твердого вещества (83%). Т.пл. 263-266°C; 1H ЯМР (400 МГц, DMSO-d6) δ 7,07 (c, 2H), 3,60-3,43 (м, 5 H), 3,34 (дд, J=19,2, 8,0 Гц, 2H), 2,80 (c, 3H), 2,73 (тд, J=12,6, 2,1 Гц, 2H), 2,56 (c, 6 H), 2,25 (c, 3H), 2,05 (м, 6 H), 1,71 (м, 2H); 13C ЯМР (100 МГц, DMSO-d6) δ 143,1, 140,1, 132,4, 131,6, 70,6, 63,4, 43,4, 43,2, 26,5, 22,8, 21,2, 20,9; MS (ESI) m/z 351,2 (100%, [M-I]+).
[0358]  1-метил-1-(1-(нафталин-1-илсульфонил)пиперидин-4-ил)пирролидин-1-ий йодид: Это соединение получали в виде желтого твердого вещества (91%). Т.пл. 285-288°C; 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (дд, J=8,4, 1,2 Гц, 1H), 8,29 (дд, J=8,4, 1,2 Гц, 1H), 8,12 (м, 2H), 7,69 (м, 3H), 3,90 (д, J=12,8 Гц, 2H), 3,46 (дд, J=9,6, 4,8 Гц, 2H), 3,26 (м, 3H), 2,75 (c, 3H), 2,42 (c, 1H), 2,02 (м, 7 H), 1,78 (м, 2H); 13C ЯМР (100 МГц, DMSO-d6) δ 135,2, 134,5, 132,1, 130,8, 129,6, 128,8, 128,6, 127,5, 125,2, 125,0, 70,1, 63,4, 45,0, 43,2, 26,6, 21,2; MS (ESI) m/z 359,2 (100%, [M-I]+).
1-метил-1-(1-(нафталин-1-илсульфонил)пиперидин-4-ил)пирролидин-1-ий йодид: Это соединение получали в виде желтого твердого вещества (91%). Т.пл. 285-288°C; 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (дд, J=8,4, 1,2 Гц, 1H), 8,29 (дд, J=8,4, 1,2 Гц, 1H), 8,12 (м, 2H), 7,69 (м, 3H), 3,90 (д, J=12,8 Гц, 2H), 3,46 (дд, J=9,6, 4,8 Гц, 2H), 3,26 (м, 3H), 2,75 (c, 3H), 2,42 (c, 1H), 2,02 (м, 7 H), 1,78 (м, 2H); 13C ЯМР (100 МГц, DMSO-d6) δ 135,2, 134,5, 132,1, 130,8, 129,6, 128,8, 128,6, 127,5, 125,2, 125,0, 70,1, 63,4, 45,0, 43,2, 26,6, 21,2; MS (ESI) m/z 359,2 (100%, [M-I]+).
V. Общая методика для получения хлористоводородных солей третичных аминов
[0359] Третичный амид (0,5 ммоль) растворяли в минимальном количестве DCM и полученный раствор тщательно перемешивали, и в этом время капельно добавляли HCl в 1,4-диоксане (4 M, 2 мл). После удаления растворителя получали указанную в заголовке хлористоводородную соль амина в виде белого твердого вещества без дальнейшей очистки.
[0360]  1-(1-((4-(дифторметокси)фенил)сульфонил)пиперидин-4-ил)-4-метилпиперидин-1-ий хлорид: Это соединение получали в виде белого твердого вещества (>95%). Т.пл. 251-254°C; 1H ЯМР (400 МГц, CDCl3) δ 12,08 (c, 1H), 7,73 (д, J=8,0 Гц, 2H), 7,25 (д, J=7,9 Гц, 2H), 6,63 (т, J=72,4 Гц, 1H), 3,93 (д, J=9,9 Гц, 2H), 3,33 (д, J=9,8 Гц, 2H), 3,03 (c, 1H), 2,70 (c, 2H), 2,35 (д, J=11,7 Гц, 4H), 2,20-1,90 (м, 2H), 1,81 (т, J=15,8 Гц, 4H), 1,55 (c, 1H), 0,99 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,5, 132,4, 129,7, 119,7, 115,2 (триплет), 62,8, 49,5, 45,1, 30,7, 29,7, 25,3, 20,9; MS (ESI) m/z 389,2 (100%, [M-Cl]+).
1-(1-((4-(дифторметокси)фенил)сульфонил)пиперидин-4-ил)-4-метилпиперидин-1-ий хлорид: Это соединение получали в виде белого твердого вещества (>95%). Т.пл. 251-254°C; 1H ЯМР (400 МГц, CDCl3) δ 12,08 (c, 1H), 7,73 (д, J=8,0 Гц, 2H), 7,25 (д, J=7,9 Гц, 2H), 6,63 (т, J=72,4 Гц, 1H), 3,93 (д, J=9,9 Гц, 2H), 3,33 (д, J=9,8 Гц, 2H), 3,03 (c, 1H), 2,70 (c, 2H), 2,35 (д, J=11,7 Гц, 4H), 2,20-1,90 (м, 2H), 1,81 (т, J=15,8 Гц, 4H), 1,55 (c, 1H), 0,99 (д, J=6,0 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 154,5, 132,4, 129,7, 119,7, 115,2 (триплет), 62,8, 49,5, 45,1, 30,7, 29,7, 25,3, 20,9; MS (ESI) m/z 389,2 (100%, [M-Cl]+).
[0361]  1-(1-((4-метоксифенил)сульфонил)пиперидин-4-ил)-4-метилпиперидин-1-ий хлорид: Это соединение получали в виде белого твердого вещества (>95%). Т.пл. 247-250°C; 1H ЯМР (400 МГц, CDCl3) δ 12,03 (c, 1H), 7,63 (д, J=8,8 Гц, 2H), 6,98 (д, J=8,1 Гц, 2H), 3,98-3,87 (c, 2H), 3,85 (c, 3H), 3,30 (c, 2H), 2,99 (c, 1H), 2,72 (c, 2H), 2,30 (c, 4H), 2,10-1,92 (c, 2H), 1,78 (м, 4H), 1,55 (c, 1H), 1,13-0,89 (c, 3H); 13C ЯМР (100 МГц, CDCl3) δ 163,4, 129,8, 126,8, 114,5, 63,0, 55,8, 49,4, 45,2, 30,8, 29,8, 25,3, 20,9; MS (ESI) m/z 353,2 (100%, [M-Cl]+).
1-(1-((4-метоксифенил)сульфонил)пиперидин-4-ил)-4-метилпиперидин-1-ий хлорид: Это соединение получали в виде белого твердого вещества (>95%). Т.пл. 247-250°C; 1H ЯМР (400 МГц, CDCl3) δ 12,03 (c, 1H), 7,63 (д, J=8,8 Гц, 2H), 6,98 (д, J=8,1 Гц, 2H), 3,98-3,87 (c, 2H), 3,85 (c, 3H), 3,30 (c, 2H), 2,99 (c, 1H), 2,72 (c, 2H), 2,30 (c, 4H), 2,10-1,92 (c, 2H), 1,78 (м, 4H), 1,55 (c, 1H), 1,13-0,89 (c, 3H); 13C ЯМР (100 МГц, CDCl3) δ 163,4, 129,8, 126,8, 114,5, 63,0, 55,8, 49,4, 45,2, 30,8, 29,8, 25,3, 20,9; MS (ESI) m/z 353,2 (100%, [M-Cl]+).
[0362]  1-(1-((2,5-диметоксифенил)сульфонил)пиперидин-4-ил)-4-метилпиперидин-1-ий хлорид: Это соединение получали в виде белого твердого вещества (73%). Т.пл. 207-210°C; 1H ЯМР (400 МГц, CDCl3) δ 11,90 (c, 1H), 7,31 (c, 1H), 6,96 (д, J=32,2 Гц, 2H), 4,16-3,90 (c, 2H), 3,83 (c, 3H), 3,73 (c, 3H), 3,24 (д, шир., J=75,5 Гц, 3H), 2,70 (c, 4H), 2,46-2,18 (c, 2H), 2,16-1,90 (c, 2H), 1,88-1,68 (c, 4H), 1,69-1,41 (c, 1H), 0,96 (c, 3H); 13C ЯМР (100 МГц, CDCl3) δ 152,98, 150,81, 126,50, 120,42, 115,98, 114,02, 63,41, 57,05, 56,07, 49,66, 45,11, 30,79, 29,68, 26,09, 20,93; MS (ESI) m/z 383,2 (100%, [M-Cl]+).
1-(1-((2,5-диметоксифенил)сульфонил)пиперидин-4-ил)-4-метилпиперидин-1-ий хлорид: Это соединение получали в виде белого твердого вещества (73%). Т.пл. 207-210°C; 1H ЯМР (400 МГц, CDCl3) δ 11,90 (c, 1H), 7,31 (c, 1H), 6,96 (д, J=32,2 Гц, 2H), 4,16-3,90 (c, 2H), 3,83 (c, 3H), 3,73 (c, 3H), 3,24 (д, шир., J=75,5 Гц, 3H), 2,70 (c, 4H), 2,46-2,18 (c, 2H), 2,16-1,90 (c, 2H), 1,88-1,68 (c, 4H), 1,69-1,41 (c, 1H), 0,96 (c, 3H); 13C ЯМР (100 МГц, CDCl3) δ 152,98, 150,81, 126,50, 120,42, 115,98, 114,02, 63,41, 57,05, 56,07, 49,66, 45,11, 30,79, 29,68, 26,09, 20,93; MS (ESI) m/z 383,2 (100%, [M-Cl]+).
[0363] 1-(1-(мезитилсульфонил)пиперидин-4-ил)-4-метилпиперидин-1-ий хлорид: Это соединение получали в виде белого твердого вещества (69%). Т.пл. 259-262°C; 1H ЯМР (400 МГц, CDCl3) δ 11,73 (c, 1H), 6,85 (c, 2H), 3,93-3,46 (c, шир., 2H), 3,33 (c, шир., 3H), 2,74 (c, 3H), 2,46 (c, 6 H), 2,18 (д, J=4,3 Гц, 5 H), 2,06-1,07 (м, 8 H), 0,89 (c, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,99, 140,20, 132,08, 131,01, 63,44, 49,91, 43,52, 30,77, 29,54, 25,70, 22,85, 20,96; MS (ESI) m/z 365,2 (100%, [M-Cl]+).
[0364] На фиг.30 представлены спектры ЯМР для проиллюстрированных соединений.
VI. Общая методика для восстановительного аминирования
[0365] Смесь кетона (или ацетона) (1,0 ммоль), амина (1,0 ммоль), AcOH (1,0 ммоль) и CH2Cl2 (или DCE) (5 мл) перемешивали при комнатной температуре в течение 15 мин, а затем добавляли NaBH(OAc)3 (1,5 ммоль). Полученную суспензию перемешивали при комнатной температуре с временем реакции в диапазоне от 20 ч до 89 ч. Затем реакцию гасили посредством капельного добавления насыщенного раствора NaHCO3 при 0°C и полученный двухфазный раствор экстрагировали CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии на силикагеле со смесью MeOH:CH2Cl2 (или гексан:EtOAc) в качестве элюента с получением продукта восстановительного аминирования.
[0366]  1-(1-(мезитилсульфонил)пиперидин-4-ил)-4-метилпиперазин: Это соединение получали в виде бесцветного геля (74%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и 1-метилпиперазином с временем реакции 20 ч. 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 3,59 (д, J=12,6 Гц, 2H), 2,73 (т, J=12,3 Гц, 2H), 2,58 (c, 6 H), 2,55 (c, шир., 4H), 2,49-2,35 (c, шир., 4H), 2,36-2,29 (c, 1H), 2,26 (c, 3H), 2,25 (c, 3H), 1,84 (д, J=11,6 Гц, 2H), 1,59-1,34 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 131,8, 131,7, 61,2, 55,3, 48,9, 45,9, 43,7, 27,8, 22,8, 20,9; MS (ESI) m/z 366,2 (100%, [M+H]+).
1-(1-(мезитилсульфонил)пиперидин-4-ил)-4-метилпиперазин: Это соединение получали в виде бесцветного геля (74%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и 1-метилпиперазином с временем реакции 20 ч. 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 3,59 (д, J=12,6 Гц, 2H), 2,73 (т, J=12,3 Гц, 2H), 2,58 (c, 6 H), 2,55 (c, шир., 4H), 2,49-2,35 (c, шир., 4H), 2,36-2,29 (c, 1H), 2,26 (c, 3H), 2,25 (c, 3H), 1,84 (д, J=11,6 Гц, 2H), 1,59-1,34 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 131,8, 131,7, 61,2, 55,3, 48,9, 45,9, 43,7, 27,8, 22,8, 20,9; MS (ESI) m/z 366,2 (100%, [M+H]+).
[0367] 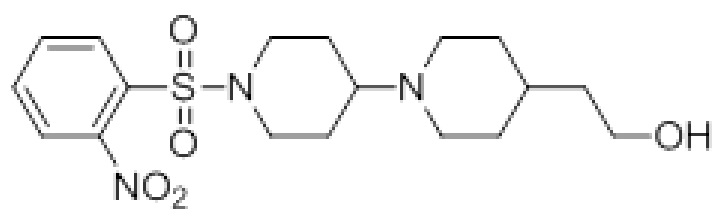 2-(1'-((2-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: Это соединение получали в виде светло-желтого твердого вещества (37%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-((2-нитрофенил)сульфонил)пиперидин-4-оном и 2-(пиперидин-4-ил)этанолом с временем реакции 38 ч. Т.пл. 130-133°C; 1H ЯМР (400 МГц, CDCl3) δ 7,96 (д, J=7,3 Гц, 1H), 7,74-7,61 (м, 2H), 7,61-7,51 (м, 1H), 3,88 (д, J=12,9 Гц, 2H), 3,65 (т, J=6,6 Гц, 2H), 2,82 (д, J=11,6 Гц, 2H), 2,73 (т, J=12,5 Гц, 2H), 2,33 (тт, J=11,5, 3,6 Гц, 1H), 2,14 (т, J=11,6 Гц, 2H), 1,84 (д, J=10,7 Гц, 2H), 1,73-1,65 (м, 2H), 1,59 (квд, J=12,3, 4,2 Гц, 3H), 1,48 (кв, J=6,6 Гц, 2H), 1,38 (м, 1H), 1,20 (квд, J=12,1, 3,8 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 148,3, 133,5, 131,8, 131,5, 130,9, 124,0, 61,4, 60,5, 49,4, 45,9, 39,4, 32,6, 32,6, 27,7; MS (ESI) m/z 398,2 (100%, [M+H]+).
2-(1'-((2-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: Это соединение получали в виде светло-желтого твердого вещества (37%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-((2-нитрофенил)сульфонил)пиперидин-4-оном и 2-(пиперидин-4-ил)этанолом с временем реакции 38 ч. Т.пл. 130-133°C; 1H ЯМР (400 МГц, CDCl3) δ 7,96 (д, J=7,3 Гц, 1H), 7,74-7,61 (м, 2H), 7,61-7,51 (м, 1H), 3,88 (д, J=12,9 Гц, 2H), 3,65 (т, J=6,6 Гц, 2H), 2,82 (д, J=11,6 Гц, 2H), 2,73 (т, J=12,5 Гц, 2H), 2,33 (тт, J=11,5, 3,6 Гц, 1H), 2,14 (т, J=11,6 Гц, 2H), 1,84 (д, J=10,7 Гц, 2H), 1,73-1,65 (м, 2H), 1,59 (квд, J=12,3, 4,2 Гц, 3H), 1,48 (кв, J=6,6 Гц, 2H), 1,38 (м, 1H), 1,20 (квд, J=12,1, 3,8 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 148,3, 133,5, 131,8, 131,5, 130,9, 124,0, 61,4, 60,5, 49,4, 45,9, 39,4, 32,6, 32,6, 27,7; MS (ESI) m/z 398,2 (100%, [M+H]+).
[0368] 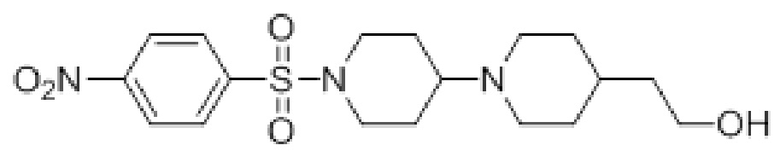 2-(1'-((4-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: Это соединение получали в виде светло-желтого твердого вещества (20%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования 1-((4-нитрофенил)сульфонил)пиперидин-4-она и 2-(пиперидин-4-ил)этанола с временем реакции 71 ч. Т.пл. 126-129°C; 1H ЯМР (400 МГц, CDCl3) δ 8,36 (д, J=8,8 Гц, 2H), 7,92 (д, J=8,9 Гц, 2H), 3,88 (д, J=11,8 Гц, 2H), 3,66 (т, J=6,5 Гц, 2H), 2,82 (д, J=11,0 Гц, 2H), 2,33 (тд, J=11,9, 2,2 Гц, 2H), 2,25 (м, 1H), 2,14 (т, J=11,4 Гц, 2H), 1,87 (д, J=12,7 Гц, 2H), 1,66 (м, 4H), 1,48 (кв, J=6,6 Гц, 2H), 1,40 (м, 1H), 1,32-1,13 (м, 3H); 13C ЯМР (100 МГц, CDCl3) δ 150,1, 142,4, 128,7, 124,3, 61,2, 60,4, 49,4, 46,1, 39,3, 32,5, 27,3; MS (ESI) m/z 398,2 (100%, [M+H]+).
2-(1'-((4-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: Это соединение получали в виде светло-желтого твердого вещества (20%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования 1-((4-нитрофенил)сульфонил)пиперидин-4-она и 2-(пиперидин-4-ил)этанола с временем реакции 71 ч. Т.пл. 126-129°C; 1H ЯМР (400 МГц, CDCl3) δ 8,36 (д, J=8,8 Гц, 2H), 7,92 (д, J=8,9 Гц, 2H), 3,88 (д, J=11,8 Гц, 2H), 3,66 (т, J=6,5 Гц, 2H), 2,82 (д, J=11,0 Гц, 2H), 2,33 (тд, J=11,9, 2,2 Гц, 2H), 2,25 (м, 1H), 2,14 (т, J=11,4 Гц, 2H), 1,87 (д, J=12,7 Гц, 2H), 1,66 (м, 4H), 1,48 (кв, J=6,6 Гц, 2H), 1,40 (м, 1H), 1,32-1,13 (м, 3H); 13C ЯМР (100 МГц, CDCl3) δ 150,1, 142,4, 128,7, 124,3, 61,2, 60,4, 49,4, 46,1, 39,3, 32,5, 27,3; MS (ESI) m/z 398,2 (100%, [M+H]+).
[0369]  2-(1'-((3-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: Это соединение получали в виде светло-желтого твердого вещества (25%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования 1-((3-нитрофенил)сульфонил)пиперидин-4-она и 2-(пиперидин-4-ил)этанола с временем реакции 64 ч. Т.пл. 128 -131°C; 1H ЯМР (500 МГц, CDCl3) δ 8,59 (c, 1H), 8,46 (д, J=8,2 Гц, 1H), 8,09 (д, J=7,8 Гц, 1H), 7,77 (т, J=8,0 Гц, 1H), 3,92 (д, J=11,8 Гц, 2H), 3,68 (т, J=6,6 Гц, 2H), 2,84 (д, J=11,2 Гц, 2H), 2,35 (т, J=12,0 Гц, 2H), 2,27 (тт, J=11,6, 3,5 Гц, 1H), 2,16 (т, J=11,7 Гц, 3H), 1,89 (д, J=11,2 Гц, 2H), 1,69 (м, 4H), 1,50 (кв, J=6,7 Гц, 2H), 1,47-1,35 (м, 1H), 1,23 (квд, J=12,0, 3,8 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 148,3, 138,8, 133,0, 130,5, 127,2, 122,6, 61,2, 60,4, 49,4, 46,1, 39,2, 32,5, 32,4, 27,3; MS (ESI) m/z 398,2 (100%, [M+H]+).
2-(1'-((3-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: Это соединение получали в виде светло-желтого твердого вещества (25%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования 1-((3-нитрофенил)сульфонил)пиперидин-4-она и 2-(пиперидин-4-ил)этанола с временем реакции 64 ч. Т.пл. 128 -131°C; 1H ЯМР (500 МГц, CDCl3) δ 8,59 (c, 1H), 8,46 (д, J=8,2 Гц, 1H), 8,09 (д, J=7,8 Гц, 1H), 7,77 (т, J=8,0 Гц, 1H), 3,92 (д, J=11,8 Гц, 2H), 3,68 (т, J=6,6 Гц, 2H), 2,84 (д, J=11,2 Гц, 2H), 2,35 (т, J=12,0 Гц, 2H), 2,27 (тт, J=11,6, 3,5 Гц, 1H), 2,16 (т, J=11,7 Гц, 3H), 1,89 (д, J=11,2 Гц, 2H), 1,69 (м, 4H), 1,50 (кв, J=6,7 Гц, 2H), 1,47-1,35 (м, 1H), 1,23 (квд, J=12,0, 3,8 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 148,3, 138,8, 133,0, 130,5, 127,2, 122,6, 61,2, 60,4, 49,4, 46,1, 39,2, 32,5, 32,4, 27,3; MS (ESI) m/z 398,2 (100%, [M+H]+).
[0370]  1'-(мезитилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде бесцветного геля (67%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и пиперидином с временем реакции 24 ч. 1H ЯМР (500 МГц, CDCl3) δ 6,93 (c, 2H), 3,62 (д, J=11,7 Гц, 2H), 2,74 (т, J=12,1 Гц, 2H), 2,60 (c, 6 H), 2,52-2,40 (c, 4H), 2,38-2,30 (м, 1H), 2,28 (c, 3H), 1,85 (д, J=11,5 Гц, 2H), 1,56 (м, 4H), 1,52-1,44 (м, 2H), 1,41 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,8, 62,2, 50,2, 44,1, 27,5, 26,3, 24,6, 22,8, 20,9; MS (ESI) m/z 351,2 (100%, [M+H]+).
1'-(мезитилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде бесцветного геля (67%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и пиперидином с временем реакции 24 ч. 1H ЯМР (500 МГц, CDCl3) δ 6,93 (c, 2H), 3,62 (д, J=11,7 Гц, 2H), 2,74 (т, J=12,1 Гц, 2H), 2,60 (c, 6 H), 2,52-2,40 (c, 4H), 2,38-2,30 (м, 1H), 2,28 (c, 3H), 1,85 (д, J=11,5 Гц, 2H), 1,56 (м, 4H), 1,52-1,44 (м, 2H), 1,41 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,8, 62,2, 50,2, 44,1, 27,5, 26,3, 24,6, 22,8, 20,9; MS (ESI) m/z 351,2 (100%, [M+H]+).
[0371]  4-(1-(мезитилсульфонил)пиперидин-4-ил)морфолин: Это соединение получали в виде бесцветного геля (74%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и морфолином с временем реакции 89 ч. 1H ЯМР (500 МГц, CDCl3) δ 6,92 (c, 2H), 3,68 (c, 4H), 3,60 (д, J=12,9 Гц, 2H), 2,75 (т, J=12,3 Гц, 2H), 2,59 (c, 6 H), 2,55-2,45 (c, 4H), 2,27 (c, 4H), 1,87 (д, J=14,5 Гц, 2H), 1,46 (квд, J=11,6, 3,4 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 140,4, 131,9, 131,6, 67,1, 61,5, 49,7, 43,6, 27,7, 22,8, 20,9; MS (ESI) m/z 353,2 (100%, [M+H]+).
4-(1-(мезитилсульфонил)пиперидин-4-ил)морфолин: Это соединение получали в виде бесцветного геля (74%) с использованием флэш-хроматографии (1:9 MeOH:CH2Cl2) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и морфолином с временем реакции 89 ч. 1H ЯМР (500 МГц, CDCl3) δ 6,92 (c, 2H), 3,68 (c, 4H), 3,60 (д, J=12,9 Гц, 2H), 2,75 (т, J=12,3 Гц, 2H), 2,59 (c, 6 H), 2,55-2,45 (c, 4H), 2,27 (c, 4H), 1,87 (д, J=14,5 Гц, 2H), 1,46 (квд, J=11,6, 3,4 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 140,4, 131,9, 131,6, 67,1, 61,5, 49,7, 43,6, 27,7, 22,8, 20,9; MS (ESI) m/z 353,2 (100%, [M+H]+).
[0372] 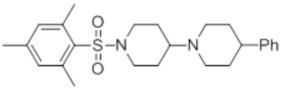 1'-(мезитилсульфонил)-4-фенил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (90%) с использованием флэш-хроматографии (2:1 гексан:EtOAc) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и 4-фенилпиперидином с временем реакции 48 ч. Т.пл. 141-144°C; 1H ЯМР (400 МГц, CDCl3) δ 7,34-7,26 (м, 2H), 7,25-7,16 (м, 3H), 6,95 (c, 2H), 3,66 (д, J=12,5 Гц, 2H), 3,03 (д, J=11,0 Гц, 2H), 2,78 (т, J=12,5 Гц, 2H), 2,62 (c, 6 H), 2,47 (м, 2H), 2,30 (c, 3H), 2,30-2,20 (м, 2H), 1,99-1,66 (м, 6 H), 1,56 (квд, J=12,2, 4,3 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,5, 131,9, 131,7, 128,4, 126,8, 126,2, 61,9, 50,0, 44,0, 42,9, 33,7, 27,7, 22,8, 21,0; MS (ESI) m/z 427,2 (100%, [M+H]+).
1'-(мезитилсульфонил)-4-фенил-1,4'-бипиперидин: Это соединение получали в виде белого твердого вещества (90%) с использованием флэш-хроматографии (2:1 гексан:EtOAc) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и 4-фенилпиперидином с временем реакции 48 ч. Т.пл. 141-144°C; 1H ЯМР (400 МГц, CDCl3) δ 7,34-7,26 (м, 2H), 7,25-7,16 (м, 3H), 6,95 (c, 2H), 3,66 (д, J=12,5 Гц, 2H), 3,03 (д, J=11,0 Гц, 2H), 2,78 (т, J=12,5 Гц, 2H), 2,62 (c, 6 H), 2,47 (м, 2H), 2,30 (c, 3H), 2,30-2,20 (м, 2H), 1,99-1,66 (м, 6 H), 1,56 (квд, J=12,2, 4,3 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,5, 131,9, 131,7, 128,4, 126,8, 126,2, 61,9, 50,0, 44,0, 42,9, 33,7, 27,7, 22,8, 21,0; MS (ESI) m/z 427,2 (100%, [M+H]+).
[0373]  4-бензил-1'-(мезитилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде светло-коричневого масла (68%) с использованием флэш-хроматографии (2:1 гексан:EtOAc) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и 4-бензилпиперидином с временем реакции 48 ч. 1H ЯМР (400 МГц, CDCl3) δ 7,36-7,22 (м, 2H), 7,21-7,06 (м, 3H), 6,92 (c, 2H), 3,61 (д, J=12,4 Гц, 2H), 2,92 (c, 2H), 2,72 (тд, J=12,5, 2,4 Гц, 2H), 2,58 (c, 6 H), 2,50 (д, J=7,0 Гц, 2H), 2,40-2,26(c, шир., 1H), 2,28 (c, 3H), 2,08 (т, J=17,9 Гц, 1H), 1,85 (д, J=12,8 Гц, 2H), 1,64 (д, J=12,8 Гц, 2H), 1,49 (д, J=11,5 Гц, 3H), 1,41-1,12 (c, шир., 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,5, 140,4, 131,9, 131,7, 129,1, 128,2, 125,8, 61,9, 49,6, 44,0, 43,1, 38,1, 32,3, 27,6, 22,8, 21,0; MS (ESI) m/z 441,3 (100%, [M+H]+).
4-бензил-1'-(мезитилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде светло-коричневого масла (68%) с использованием флэш-хроматографии (2:1 гексан:EtOAc) после восстановительного аминирования между 1-(мезитилсульфонил)пиперидин-4-оном и 4-бензилпиперидином с временем реакции 48 ч. 1H ЯМР (400 МГц, CDCl3) δ 7,36-7,22 (м, 2H), 7,21-7,06 (м, 3H), 6,92 (c, 2H), 3,61 (д, J=12,4 Гц, 2H), 2,92 (c, 2H), 2,72 (тд, J=12,5, 2,4 Гц, 2H), 2,58 (c, 6 H), 2,50 (д, J=7,0 Гц, 2H), 2,40-2,26(c, шир., 1H), 2,28 (c, 3H), 2,08 (т, J=17,9 Гц, 1H), 1,85 (д, J=12,8 Гц, 2H), 1,64 (д, J=12,8 Гц, 2H), 1,49 (д, J=11,5 Гц, 3H), 1,41-1,12 (c, шир., 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,5, 140,4, 131,9, 131,7, 129,1, 128,2, 125,8, 61,9, 49,6, 44,0, 43,1, 38,1, 32,3, 27,6, 22,8, 21,0; MS (ESI) m/z 441,3 (100%, [M+H]+).
[0374]  1'-(мезитилсульфонил)-3,5-диметил-1,4'-бипиперидин: Это соединение получали в виде бесцветного масла (36%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после восстановительного аминирования между 3,5-диметилпиперидином и 1-(мезитилсульфонил)пиперидин-4-оном с временем реакции 88 ч. 1H ЯМР (400 МГц, CDCl3) δ 6,92 (c, 2H), 3,61 (д, J=12,4 Гц, 2H), 2,87-2,66 (м, 4H), 2,59 (c, 6 H), 2,47-2,29 (м, 1H), 2,27 (c, 3H), 1,82 (д, J=13,6 Гц, 2H), 1,74-1,39 (м, 7 H), 0,81 (д, J=5,8 Гц, 6 H), 0,47 (кв, J=11,4 Гц, 1H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,8, 61,8, 57,2, 44,1, 42,3, 31,4, 27,5, 22,8, 20,9, 19,7; MS (ESI) m/z 379,3 (100%, [M+H]+).
1'-(мезитилсульфонил)-3,5-диметил-1,4'-бипиперидин: Это соединение получали в виде бесцветного масла (36%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после восстановительного аминирования между 3,5-диметилпиперидином и 1-(мезитилсульфонил)пиперидин-4-оном с временем реакции 88 ч. 1H ЯМР (400 МГц, CDCl3) δ 6,92 (c, 2H), 3,61 (д, J=12,4 Гц, 2H), 2,87-2,66 (м, 4H), 2,59 (c, 6 H), 2,47-2,29 (м, 1H), 2,27 (c, 3H), 1,82 (д, J=13,6 Гц, 2H), 1,74-1,39 (м, 7 H), 0,81 (д, J=5,8 Гц, 6 H), 0,47 (кв, J=11,4 Гц, 1H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,8, 61,8, 57,2, 44,1, 42,3, 31,4, 27,5, 22,8, 20,9, 19,7; MS (ESI) m/z 379,3 (100%, [M+H]+).
[0375]  4-изопропил-1'-(мезитилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого масла (46%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после восстановительного аминирования между 4-изопропилпиперидином и 1-(мезитилсульфонил)пиперидин-4-оном с временем реакции 30 ч. 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 3,60 (д, J=12,7 Гц, 2H), 2,90 (дд, J=11,5 Гц, 2H), 2,72 (т, J=12,4 Гц, 2H), 2,59 (д, J=2,3 Гц, 6 H), 2,38-2,29 (м, 1H), 2,28 (c, 3H), 2,06 (т, J=10,6 Гц, 2H), 1,85 (д, J=11,2 Гц, 2H), 1,63 (д, J=11,3 Гц, 2H), 1,49 (тд, J=12,1, 4,1 Гц, 2H), 1,44-1,32 (м, 1H), 1,30-1,14 (м, 2H), 0,95 (м, 1H), 0,83 (д, J=6,7 Гц, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,7, 61,8, 50,0, 44,0, 42,6, 32,4, 29,6, 27,7, 22,8, 20,9, 19,8; MS (ESI) m/z 393,3(100%, [M+H]+).
4-изопропил-1'-(мезитилсульфонил)-1,4'-бипиперидин: Это соединение получали в виде желтого масла (46%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после восстановительного аминирования между 4-изопропилпиперидином и 1-(мезитилсульфонил)пиперидин-4-оном с временем реакции 30 ч. 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 3,60 (д, J=12,7 Гц, 2H), 2,90 (дд, J=11,5 Гц, 2H), 2,72 (т, J=12,4 Гц, 2H), 2,59 (д, J=2,3 Гц, 6 H), 2,38-2,29 (м, 1H), 2,28 (c, 3H), 2,06 (т, J=10,6 Гц, 2H), 1,85 (д, J=11,2 Гц, 2H), 1,63 (д, J=11,3 Гц, 2H), 1,49 (тд, J=12,1, 4,1 Гц, 2H), 1,44-1,32 (м, 1H), 1,30-1,14 (м, 2H), 0,95 (м, 1H), 0,83 (д, J=6,7 Гц, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 142,4, 140,4, 131,8, 131,7, 61,8, 50,0, 44,0, 42,6, 32,4, 29,6, 27,7, 22,8, 20,9, 19,8; MS (ESI) m/z 393,3(100%, [M+H]+).
VII. Синтез 1'-(фенилсульфонил)-2-(2-(проп-2-ин-1-илокси)этил)-1,4'-бипиперидина и 1'-(фенилсульфонил)-2-(проп-2-ин-1-ил)-1,4'-бипиперидина
[0376]

[0377]  2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-2-ил)этан-1-ол: 1-(фенилсульфонил)пиперидин-4-он (0,6004 г, 2,51 ммоль) и 2-(пиперидин-2-ил)этан-1-ол (0,9701 г, 7,52 ммоль) растворяли в толуоле (5 мл), а затем добавляли AcOH (0,62 мл, 10,84 ммоль). Полученный раствор перемешивали при 80°C в течение 3 ч, а затем охлаждали до комнатной температуры. Капельно добавляли NaCNBH3 (0,2031 г, 3,22 ммоль) в метаноле (5 мл) и реакционную смесь перемешивали в течение 30 мин. Реакцию гасили насыщенным раствором NaHCO3 (20 мл) при 0°C. Полученный двухфазный раствор экстрагировали CH2Cl2 (3×25 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии на силикагель со смесью 1:19 MeOH:CH2Cl2 в качестве элюент с получением продукта восстановительного аминирования в виде желтого масла (0,4445 г, 50%). 1H ЯМР (400 МГц, CDCl3) δ 7,74 (д, J=8,5 Гц, 2H), 7,65-7,57 (м, 1H), 7,56-7,47 (м, 2H), 3,86 (дд, J=11,1, 4,7 Гц, 3H), 3,64 (дт, J=11,1, 5,6 Гц, 1H), 3,05-2,87 (м, 3H), 2,44-2,30 (м, 2H), 2,26 (тд, J=12,1, 2,5 Гц, 1H), 1,88-1,29 (м, 12H); 13C ЯМР (100 МГц, CDCl3) δ 135,9, 132,9, 129,1, 127,6, 60,7, 56,7, 56,0, 46,1, 45,8, 44,9, 31,1, 29,7, 28,5, 25,0, 24,2, 22,4; MS (ESI) m/z 353,2 (100%, [M+H]+).
2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-2-ил)этан-1-ол: 1-(фенилсульфонил)пиперидин-4-он (0,6004 г, 2,51 ммоль) и 2-(пиперидин-2-ил)этан-1-ол (0,9701 г, 7,52 ммоль) растворяли в толуоле (5 мл), а затем добавляли AcOH (0,62 мл, 10,84 ммоль). Полученный раствор перемешивали при 80°C в течение 3 ч, а затем охлаждали до комнатной температуры. Капельно добавляли NaCNBH3 (0,2031 г, 3,22 ммоль) в метаноле (5 мл) и реакционную смесь перемешивали в течение 30 мин. Реакцию гасили насыщенным раствором NaHCO3 (20 мл) при 0°C. Полученный двухфазный раствор экстрагировали CH2Cl2 (3×25 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии на силикагель со смесью 1:19 MeOH:CH2Cl2 в качестве элюент с получением продукта восстановительного аминирования в виде желтого масла (0,4445 г, 50%). 1H ЯМР (400 МГц, CDCl3) δ 7,74 (д, J=8,5 Гц, 2H), 7,65-7,57 (м, 1H), 7,56-7,47 (м, 2H), 3,86 (дд, J=11,1, 4,7 Гц, 3H), 3,64 (дт, J=11,1, 5,6 Гц, 1H), 3,05-2,87 (м, 3H), 2,44-2,30 (м, 2H), 2,26 (тд, J=12,1, 2,5 Гц, 1H), 1,88-1,29 (м, 12H); 13C ЯМР (100 МГц, CDCl3) δ 135,9, 132,9, 129,1, 127,6, 60,7, 56,7, 56,0, 46,1, 45,8, 44,9, 31,1, 29,7, 28,5, 25,0, 24,2, 22,4; MS (ESI) m/z 353,2 (100%, [M+H]+).
[0378]

[0379]  1'-(фенилсульфонил)-2-(2-(проп-2-ин-1-илокси)этил)-1,4'-бипиперидин: 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-2-ил)этан-1-ол (0,0830 г, 0,24 ммоль) растворяли в безводном THF (2 мл), а затем добавляли NaH (60%, 0,0192 г, 0,48 ммоль) при 0°C. Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Реакционный раствор перемешивали при 0°C в течение 15 мин и добавляли пропаргилбромид (80% в толуоле, 0,075 мл, 0,67 ммоль) через шприц. Реакционный раствор перемешивали при 0°C в течение дополнительных 30 мин, и ему позволяли нагреться до комнатной температуры и перемешивали в течение 3 ч, а затем добавляли вторую порцию NaH (60%, 0,0175 г, 0,44 ммоль) в безводном THF (1 мл). Затем реакционный раствор перемешивали в течение 18 ч при комнатной температуре и добавляли воду (10 мл) для гашения реакции, а затем проводили экстракцию CH2Cl2 (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. После очистки флэш-хроматографией на силикагеле (1:19 CH3OH:CH2Cl2), получали продукт в виде желтого геля (0,0132 г, 18%). 1H ЯМР (400 МГц, CDCl3) δ 7,82-7,69 (м, 2H), 7,64-7,56 (м, 1H), 7,53 (м, 2H), 4,06 (д, J=2,4 Гц, 2H), 3,83 (д, J=11,9 Гц, 2H), 3,58-3,37 (м, 2H), 2,73 (дд, J=39,3, 10,5 Гц, 3H), 2,35 (т, J=2,4 Гц, 1H), 2,25 (дтд, J=26,4, 12,1, 11,7, 2,9 Гц, 3H), 1,88-1,70 (м, 4H), 1,69-1,19 (м, 8 H); 13C ЯМР (100 МГц, CDCl3) δ 136,0, 132,8, 129,1, 127,6, 79,6, 74,4, 67,1, 58,2, 55,5, 55,0, 46,4, 45,9, 45,4, 30,3, 29,8, 29,7, 25,6, 24,2, 23,0; MS (ESI) m/z 391,2 (100%, [M+H]+).
1'-(фенилсульфонил)-2-(2-(проп-2-ин-1-илокси)этил)-1,4'-бипиперидин: 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-2-ил)этан-1-ол (0,0830 г, 0,24 ммоль) растворяли в безводном THF (2 мл), а затем добавляли NaH (60%, 0,0192 г, 0,48 ммоль) при 0°C. Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Реакционный раствор перемешивали при 0°C в течение 15 мин и добавляли пропаргилбромид (80% в толуоле, 0,075 мл, 0,67 ммоль) через шприц. Реакционный раствор перемешивали при 0°C в течение дополнительных 30 мин, и ему позволяли нагреться до комнатной температуры и перемешивали в течение 3 ч, а затем добавляли вторую порцию NaH (60%, 0,0175 г, 0,44 ммоль) в безводном THF (1 мл). Затем реакционный раствор перемешивали в течение 18 ч при комнатной температуре и добавляли воду (10 мл) для гашения реакции, а затем проводили экстракцию CH2Cl2 (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. После очистки флэш-хроматографией на силикагеле (1:19 CH3OH:CH2Cl2), получали продукт в виде желтого геля (0,0132 г, 18%). 1H ЯМР (400 МГц, CDCl3) δ 7,82-7,69 (м, 2H), 7,64-7,56 (м, 1H), 7,53 (м, 2H), 4,06 (д, J=2,4 Гц, 2H), 3,83 (д, J=11,9 Гц, 2H), 3,58-3,37 (м, 2H), 2,73 (дд, J=39,3, 10,5 Гц, 3H), 2,35 (т, J=2,4 Гц, 1H), 2,25 (дтд, J=26,4, 12,1, 11,7, 2,9 Гц, 3H), 1,88-1,70 (м, 4H), 1,69-1,19 (м, 8 H); 13C ЯМР (100 МГц, CDCl3) δ 136,0, 132,8, 129,1, 127,6, 79,6, 74,4, 67,1, 58,2, 55,5, 55,0, 46,4, 45,9, 45,4, 30,3, 29,8, 29,7, 25,6, 24,2, 23,0; MS (ESI) m/z 391,2 (100%, [M+H]+).
[0380]  1'-(фенилсульфонил)-2-(проп-2-ин-1-ил)-1,4'-бипиперидин: 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Последовательно через шприц добавляли CH2Cl2 (1 мл) и оксалилхлорид (0,039 мл, 0,45 ммоль). Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон. Добавляли безводный DMSO (0,066 мл, 0,93 ммоль) и раствор перемешивали в течение 1,5 ч при -78°C. Капельно добавляли 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-2-ил)этанол (0,1344 г, 0,38 ммоль) в 1 мл безводного CH2Cl2. Реакционную смесь перемешивали при -78°C в течение 1 ч, а затем добавляли Et3N (0,20 мл, 1,44 ммоль) и через 15 мин реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 2 ч, а затем гасили 6 мл воды. Добавляли насыщенный раствор NaHCO3 (10 мл) и полученный раствор экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением альдегидного промежуточного соединения, которое сразу использовали для следующей стадии без дальнейшей очистки.
1'-(фенилсульфонил)-2-(проп-2-ин-1-ил)-1,4'-бипиперидин: 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Последовательно через шприц добавляли CH2Cl2 (1 мл) и оксалилхлорид (0,039 мл, 0,45 ммоль). Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон. Добавляли безводный DMSO (0,066 мл, 0,93 ммоль) и раствор перемешивали в течение 1,5 ч при -78°C. Капельно добавляли 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-2-ил)этанол (0,1344 г, 0,38 ммоль) в 1 мл безводного CH2Cl2. Реакционную смесь перемешивали при -78°C в течение 1 ч, а затем добавляли Et3N (0,20 мл, 1,44 ммоль) и через 15 мин реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 2 ч, а затем гасили 6 мл воды. Добавляли насыщенный раствор NaHCO3 (10 мл) и полученный раствор экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением альдегидного промежуточного соединения, которое сразу использовали для следующей стадии без дальнейшей очистки.
[0381] К раствору трифенилфосфина (0,4429 г, 1,69 ммоль) в безводном CH2Cl2 (2 мл), капельно добавляли раствор тетрабромида углерода (0,2653 г, 0,80 ммоль) в CH2Cl2 (1 мл) при комнатной температуре и полученный раствор перемешивали в течение 30 мин после чего добавляли Et3N (0,45 мл, 3,39 ммоль) через шприц. Затем раствор охлаждали до -78°C, после чего капельно добавляли вышеуказанное альдегидное промежуточное соединение, растворенное в CH2Cl2(2 мл). Реакционной смеси позволяли нагреться до комнатной температуры и перемешивали в течение ночи, а затем фильтровали через слой целита. Фильтрат концентрировали и очищали флэш-хроматографией (два раза, 1:19 CH3OH:CH2Cl2, затем 1:1 гексан:EtOAc) с получением соответствующего дибромида (0,0505 г) в виде бесцветного масла.
[0382] Описанный выше дибромид растворяли в безводном THF (1 мл) и охлаждали до -78°C. Добавляли n-BuLi (0,090 мл, 2,5 M в гексане, 0,225 ммоль) через шприц. Реакционную смесь перемешивали в течение 2,5 ч при той же температуре и гасили добавлением насыщенного раствора NH4Cl (15 мл). Затем смесь экстрагировали EtOAc (3×15 мл). Объединенные органические слои сушили с помощью Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали флэш-хроматографией (1:1 гексан:EtOAc) с получением конечного алкина (0,0165 г, 12%, три стадии). 1H ЯМР (400 МГц, CDCl3) δ 7,82-7,70 (м, 2H), 7,63-7,57 (м, 1H), 7,57-7,50 (м, 2H), 3,85 (д, J=12,1 Гц, 2H), 2,78-2,57 (м, 3H), 2,36-2,19 (м, 4H), 1,94 (т, J=2,7 Гц, 1H), 1,89-1,39 (м, 9 H), 1,35-1,19 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 136,2, 232,7, 129,0, 127,6, 82,1, 70,0, 56,4, 55,5, 46,5, 46,0, 45,2, 31,8, 30,1, 26,0, 24,2, 23,2, 21,7; MS (ESI) m/z 347,2 (100%, [M+H]+).
VIII. Синтез 1'-(фенилсульфонил)-4-(2-(проп-2-ин-1-илокси)этил)-1,4'-бипиперидина и 1'-(фенилсульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидина
[0383]

[0384]  2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-4-ил)этанол: 1-(фенилсульфонил)пиперидин-4-он (0,4923 г, 2,06 ммоль) и AcOH (0,24 мл, 4,20 ммоль) растворяли в толуоле (4 мл) и полученный раствор перемешивали в условиях кипячения с обратным холодильником в течение 30 мин, а затем добавляли 2-(пиперидин-4-ил)этанол (0,2562 г, 1,99 ммоль). Реакционную смесь перемешивали в течение 2 дополнительных часов в условиях кипячения с обратным холодильником, а затем охлаждали до комнатной температуры. Капельно добавляли NaCNBH3 (0,1590 г, 2,52 ммоль) в метаноле (4 мл) и раствор перемешивали в течение 50 мин. Реакцию гасили насыщенным раствором NaHCO3 (10 мл) при 0°C. Полученный раствор экстрагировали CH2Cl2 (3×15 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (1:19 CH3OH:CH2Cl2) дала желаемый продукт в виде желтого масла (0,1613 г, 21%). 1H ЯМР (400 МГц, CDCl3) δ 7,78-7,72 (м, 2H), 7,62-7,56 (м, 1H), 7,53 (ддт, J=8,4, 6,7, 1,4 Гц, 2H), 3,85 (д, J=12,1 Гц, 2H), 3,66 (т, J=6,6 Гц, 2H), 2,81 (д, J=11,6 Гц, 2H), 2,32-2,04 (м, 5 H), 1,83 (д, J=13,0 Гц, 3H), 1,75-1,54 (м, 4H), 1,49 (кв, J=6,6 Гц, 2H), 1,45-1,32 (м, 1H), 1,29-1,14 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 136,1, 132,7, 129,0, 127,6, 61,4, 60,4, 49,4, 46,1, 39,3, 32,5, 27,3; MS (ESI) m/z 353,2 (100%, [M+H]+).
2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-4-ил)этанол: 1-(фенилсульфонил)пиперидин-4-он (0,4923 г, 2,06 ммоль) и AcOH (0,24 мл, 4,20 ммоль) растворяли в толуоле (4 мл) и полученный раствор перемешивали в условиях кипячения с обратным холодильником в течение 30 мин, а затем добавляли 2-(пиперидин-4-ил)этанол (0,2562 г, 1,99 ммоль). Реакционную смесь перемешивали в течение 2 дополнительных часов в условиях кипячения с обратным холодильником, а затем охлаждали до комнатной температуры. Капельно добавляли NaCNBH3 (0,1590 г, 2,52 ммоль) в метаноле (4 мл) и раствор перемешивали в течение 50 мин. Реакцию гасили насыщенным раствором NaHCO3 (10 мл) при 0°C. Полученный раствор экстрагировали CH2Cl2 (3×15 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (1:19 CH3OH:CH2Cl2) дала желаемый продукт в виде желтого масла (0,1613 г, 21%). 1H ЯМР (400 МГц, CDCl3) δ 7,78-7,72 (м, 2H), 7,62-7,56 (м, 1H), 7,53 (ддт, J=8,4, 6,7, 1,4 Гц, 2H), 3,85 (д, J=12,1 Гц, 2H), 3,66 (т, J=6,6 Гц, 2H), 2,81 (д, J=11,6 Гц, 2H), 2,32-2,04 (м, 5 H), 1,83 (д, J=13,0 Гц, 3H), 1,75-1,54 (м, 4H), 1,49 (кв, J=6,6 Гц, 2H), 1,45-1,32 (м, 1H), 1,29-1,14 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 136,1, 132,7, 129,0, 127,6, 61,4, 60,4, 49,4, 46,1, 39,3, 32,5, 27,3; MS (ESI) m/z 353,2 (100%, [M+H]+).
[0385]

[0386]  1'-(фенилсульфонил)-4-(2-(проп-2-ин-1-илокси)этил)-1,4'-бипиперидин: 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,0585 г, 0,17 ммоль) растворяли в безводном THF (1 мл). Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Добавляли KH (30% в минеральном масле, 0,0275 г, 0,21 ммоль), суспендированный в безводном THF, (0,5 мл) через шприц при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 45 мин и капельно через шприц добавляли пропаргилбромид (80% в толуоле, 0,038 мл, 0,43 ммоль). Раствор перемешивали при комнатной температуре в течение 7,5 ч. После выпаривания растворителя, осадок очищали флэш-хроматографией на силикагеле (1:19 CH3OH:CH2Cl2) с получением желаемого продукта в виде желтого геля (0,0072 г, 11%). 1H ЯМР (400 МГц, CDCl3) δ 7,83-7,69 (м, 2H), 7,63-7,57 (м, 1H), 7,57-7,49 (м, 2H), 4,11 (д, J=2,3 Гц, 2H), 3,95-3,80 (м, 2H), 3,53 (т, J=6,4 Гц, 2H), 2,85 (д, J=10,7 Гц, 2H), 2,41 (т, J=2,4 Гц, 1H), 2,22 (м, 5 H), 1,87 (д, J=12,6 Гц, 2H), 1,79-1,59 (м, 4H), 1,52 (кв, J=6,5 Гц, 2H), 1,45-1,36 (м, 1H), 1,25 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 136,06, 132,74, 129,01, 127,63, 79,89, 74,18, 67,58, 61,57, 58,05, 49,34, 46,08, 35,88, 32,57, 32,15, 27,11; MS (ESI) m/z 391,1 (100%, [M+H]+).
1'-(фенилсульфонил)-4-(2-(проп-2-ин-1-илокси)этил)-1,4'-бипиперидин: 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,0585 г, 0,17 ммоль) растворяли в безводном THF (1 мл). Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Добавляли KH (30% в минеральном масле, 0,0275 г, 0,21 ммоль), суспендированный в безводном THF, (0,5 мл) через шприц при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 45 мин и капельно через шприц добавляли пропаргилбромид (80% в толуоле, 0,038 мл, 0,43 ммоль). Раствор перемешивали при комнатной температуре в течение 7,5 ч. После выпаривания растворителя, осадок очищали флэш-хроматографией на силикагеле (1:19 CH3OH:CH2Cl2) с получением желаемого продукта в виде желтого геля (0,0072 г, 11%). 1H ЯМР (400 МГц, CDCl3) δ 7,83-7,69 (м, 2H), 7,63-7,57 (м, 1H), 7,57-7,49 (м, 2H), 4,11 (д, J=2,3 Гц, 2H), 3,95-3,80 (м, 2H), 3,53 (т, J=6,4 Гц, 2H), 2,85 (д, J=10,7 Гц, 2H), 2,41 (т, J=2,4 Гц, 1H), 2,22 (м, 5 H), 1,87 (д, J=12,6 Гц, 2H), 1,79-1,59 (м, 4H), 1,52 (кв, J=6,5 Гц, 2H), 1,45-1,36 (м, 1H), 1,25 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 136,06, 132,74, 129,01, 127,63, 79,89, 74,18, 67,58, 61,57, 58,05, 49,34, 46,08, 35,88, 32,57, 32,15, 27,11; MS (ESI) m/z 391,1 (100%, [M+H]+).
[0387]  1'-(фенилсульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин: 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Последовательно через шприц добавляли безводный CH2Cl2 (1,5 мл) и оксалилхлорид (0,10 мл, 2 M в CH2Cl2, 0,20 ммоль). Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон. Добавляли безводный DMSO (0,030 мл, 0,42 ммоль) и раствор перемешивали в течение 40 мин при -78°C. Капельно добавляли 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,0570 г, 0,16 ммоль) в 1,5 мл безводного CH2Cl2. Реакционную смесь перемешивали при -78°C в течение 2 ч, а затем добавляли Et3N (0,085 мл, 0,61 ммоль) и реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 2 часов, а затем гасили 25 мл насыщенного раствора NaHCO3. Полученный раствор экстрагировали CH2Cl2 (3×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением альдегидного промежуточного соединения, которое сразу использовали для следующей стадии без дальнейшей очистки.
1'-(фенилсульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин: 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Последовательно через шприц добавляли безводный CH2Cl2 (1,5 мл) и оксалилхлорид (0,10 мл, 2 M в CH2Cl2, 0,20 ммоль). Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон. Добавляли безводный DMSO (0,030 мл, 0,42 ммоль) и раствор перемешивали в течение 40 мин при -78°C. Капельно добавляли 2-(1'-(фенилсульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,0570 г, 0,16 ммоль) в 1,5 мл безводного CH2Cl2. Реакционную смесь перемешивали при -78°C в течение 2 ч, а затем добавляли Et3N (0,085 мл, 0,61 ммоль) и реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 2 часов, а затем гасили 25 мл насыщенного раствора NaHCO3. Полученный раствор экстрагировали CH2Cl2 (3×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением альдегидного промежуточного соединения, которое сразу использовали для следующей стадии без дальнейшей очистки.
[0388] Реагент Бестмана-Охира (диметил(1-диазо-2-оксопропил)фосфонат) получали заранее в соответствии с экспериментальной методикой, описанной в Pietruszka, J. et al. [Pietruszka, J. et al. Synthesis 2006, 24, 4266-4268]. Реагент Бестмана-Охира (0,0441 г, 0,023 ммоль) и метанол (2 мл) смешивали при 0°C, а затем добавляли альдегид (растворенный в 0,5 мл CH2Cl2) и K2CO3 (0,0523 г, 0,38 ммоль). Затем реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение ночи. Взвесь фильтровали и выливали в делительную воронку, разбавляли 25 мл CH2Cl2, промывали 1 Н NaOH (25 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Осадок очищали с использованием флэш-хроматографии на силикагеле (1:9 CH3OH:CH2Cl2) с получением указанного в заголовке продукта в виде желтого твердого вещества (0,0282 г, 50%). Если продукт не был достаточно чистым, его можно было обработать ультразвуком с небольшим количеством гексана и супернатант слоя гексана можно было удалить стеклянный пипеткой для устранения примесей. Т.пл. 109-111°C; 1H ЯМР (500 МГц, CDCl3) δ 7,82-7,73 (м, 2H), 7,67-7,59 (м, 1H), 7,55 (дд, J=8,4, 7,0 Гц, 2H), 3,88 (д, J=12,0 Гц, 2H), 2,84 (c, 2H), 2,35-2,03 (м, 7 H), 1,97 (т, J=2,7 Гц, 1H), 1,92-1,74 (м, 4H), 1,67 (тт, J=15,6, 7,8 Гц, 2H), 1,46 (c, шир., 1H), 1,30 (c, шир., 2H).; 13C ЯМР (100 МГц, CDCl3) δ 136,1, 132,8, 129,0, 127,6, 82,5, 69,5, 61,6, 49,1, 46,0, 35,4, 31,5, 27,0, 25,2; MS (ESI) m/z 347,2 (100%, [M+H]+).
IX. Синтез (3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)-4-(проп-2-ин-1-илокси)фенил)(фенил)метанона
[0389]
[0390]  (4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон: В 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, добавляли 1'-((5-бром-2-метоксифенил)сульфонил)-4-метил-1,4'-бипиперидин (0,3686 г, 0,86 ммоль) и безводный THF (2,5 мл). Колбу продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон, и добавляли n-BuLi (0,68 мл, 2,5 M в гексане, 1,70 ммоль) через шприц. Реакционную смесь перемешивали в течение 50 мин при этой температуре. Добавляли бензальдегид (0,125 мл, 1,23 ммоль) через шприц. Реакционную смесь перемешивали в течение 10 мин, а затем ей позволяли нагреться до комнатной температуры и перемешивали в течение 3 ч. Затем реакцию гасили 20 мл насыщенного раствора NaHCO3 и полученный раствор экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали флэш-хроматографией (1:19 метанол:CH2Cl2) с получением спиртового промежуточного соединения в виде бесцветного геля.
(4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон: В 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, добавляли 1'-((5-бром-2-метоксифенил)сульфонил)-4-метил-1,4'-бипиперидин (0,3686 г, 0,86 ммоль) и безводный THF (2,5 мл). Колбу продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон, и добавляли n-BuLi (0,68 мл, 2,5 M в гексане, 1,70 ммоль) через шприц. Реакционную смесь перемешивали в течение 50 мин при этой температуре. Добавляли бензальдегид (0,125 мл, 1,23 ммоль) через шприц. Реакционную смесь перемешивали в течение 10 мин, а затем ей позволяли нагреться до комнатной температуры и перемешивали в течение 3 ч. Затем реакцию гасили 20 мл насыщенного раствора NaHCO3 и полученный раствор экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали флэш-хроматографией (1:19 метанол:CH2Cl2) с получением спиртового промежуточного соединения в виде бесцветного геля.
[0391] К раствору спиртового промежуточного соединения в CH2Cl2 (7 мл) добавляли диоксид марганца (IV) (2,0087 г, 22,32 ммоль). Суспензию перемешивали при комнатной температуре в течение 36 ч. Затем реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением желаемого продукта в виде белого твердого вещества (0,2329 г, 60% две стадии). Т.пл. 52-56°C; 1H ЯМР (400 МГц, CDCl3) δ 8,33 (д, J=2,2 Гц, 1H), 8,04 (дд, J=8,6, 2,2 Гц, 1H), 7,82-7,67 (м, 2H), 7,67-7,54 (м, 1H), 7,48 (м, 2H), 7,09 (д, J=8,7 Гц, 1H), 4,00 (c, 3H), 3,91 (д, J=12,7 Гц, 2H), 2,79 (д, J=11,1 Гц, 2H), 2,63 (тд, J=12,5, 2,4 Гц, 2H), 2,30 (тт, J=11,6, 3,2 Гц, 1H), 2,12 (т, J=10,2 Гц, 2H), 1,81 (д, J=12,7 Гц, 2H), 1,60-1,48 (м, 4H), 1,29 (м, 1H), 1,18 (квд, J=11,6, 7,9 Гц, 2H), 0,88 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 194,3, 159,9, 137,2, 136,4, 133,8, 132,6, 129,9, 129,8, 128,5, 127,0, 112,0, 61,8, 56,4, 49,5, 45,9, 34,6, 31,0, 28,0, 21,9; MS (ESI) m/z 457,1 (100%, [M+H]+).
[0392]  (4-гидрокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон: LiCl (0,0672 г, 1,6 ммоль) в 15-мл колбе сушили пламенем в вакууме, а затем колбу вновь заполняли аргоном. В колбу добавляли (4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон (0,0733 г, 0,16 ммоль) в безводном DMF (3 мл) через шприц. Затем колбу подсоединяли к обратному холодильнику, оборудованному баллоном с аргоном. Реакцию проводили в условиях кипячения с обратным холодильником в течение 21,5 ч. Реакционную смесь охлаждали до комнатной температуры, а затем суспензию фильтровали через слой целита, промывали CH2Cl2. После выпаривания растворителей осадок очищали флэш-хроматографией на силикагеле (1:19 метанол:CH2Cl2) с получением желаемого продукта в виде оранжевого твердого вещества (0,0560 г, 79%). Т.пл. 153-156°C; 1H ЯМР (400 МГц, CDCl3) δ 8,11 (д, J=2,1 Гц, 1H), 7,91 (дд, J=8,6, 2,2 Гц, 1H), 7,75-7,69 (м, 2H), 7,63-7,55 (м, 1H), 7,48 (ддд, J=8,2, 6,6, 1,3 Гц, 2H), 7,21 (д, J=8,6 Гц, 1H), 3,94 (д, J=12,9 Гц, 2H), 3,32 (д, J=11,3 Гц, 2H), 3,06 (т, J=12,3 Гц, 1H), 2,79-2,50 (м, 4H), 2,25 (д, J=12,3 Гц, 2H), 1,83 (c, шир., 6 H), 1,57 (м, 1H), 0,98 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 194,3, 161,0, 137,4, 136,9, 133,2, 132,5, 129,7, 128,5, 128,1, 122,6, 119,1, 62,7, 49,5, 44,8, 30,9, 29,1, 26,0, 20,7; MS (ESI) m/z 443,1 (100%, [M+H]+).
(4-гидрокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон: LiCl (0,0672 г, 1,6 ммоль) в 15-мл колбе сушили пламенем в вакууме, а затем колбу вновь заполняли аргоном. В колбу добавляли (4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон (0,0733 г, 0,16 ммоль) в безводном DMF (3 мл) через шприц. Затем колбу подсоединяли к обратному холодильнику, оборудованному баллоном с аргоном. Реакцию проводили в условиях кипячения с обратным холодильником в течение 21,5 ч. Реакционную смесь охлаждали до комнатной температуры, а затем суспензию фильтровали через слой целита, промывали CH2Cl2. После выпаривания растворителей осадок очищали флэш-хроматографией на силикагеле (1:19 метанол:CH2Cl2) с получением желаемого продукта в виде оранжевого твердого вещества (0,0560 г, 79%). Т.пл. 153-156°C; 1H ЯМР (400 МГц, CDCl3) δ 8,11 (д, J=2,1 Гц, 1H), 7,91 (дд, J=8,6, 2,2 Гц, 1H), 7,75-7,69 (м, 2H), 7,63-7,55 (м, 1H), 7,48 (ддд, J=8,2, 6,6, 1,3 Гц, 2H), 7,21 (д, J=8,6 Гц, 1H), 3,94 (д, J=12,9 Гц, 2H), 3,32 (д, J=11,3 Гц, 2H), 3,06 (т, J=12,3 Гц, 1H), 2,79-2,50 (м, 4H), 2,25 (д, J=12,3 Гц, 2H), 1,83 (c, шир., 6 H), 1,57 (м, 1H), 0,98 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 194,3, 161,0, 137,4, 136,9, 133,2, 132,5, 129,7, 128,5, 128,1, 122,6, 119,1, 62,7, 49,5, 44,8, 30,9, 29,1, 26,0, 20,7; MS (ESI) m/z 443,1 (100%, [M+H]+).
[0393]  (3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)-4-(проп-2-ин-1-илокси)фенил)(фенил)метанон: (4-гидрокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон (0,1103 г, 0,25 ммоль) растворяли в безводном DMF (1,5 мл), а затем добавляли NaH (95%, 0,0095 г, 0,38 ммоль) при 0°C. Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 30 мин. Затем раствор охлаждали до 0°C и добавляли пропаргилбромид (80% в толуоле, 0,032 мл, 0,29 ммоль) через шприц. Раствору позволяли постепенно нагреться до комнатной температуры и перемешивали в течение 17 ч. Реакционный раствор разбавляли CH2Cl2 (25 мл) и промывали насыщенным раствором NaHCO3 (25 мл) и 20% раствором LiCl (25 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (1:19 метанол:CH2Cl2) дала желаемый продукт в виде желтого масла (0,0290 г, 24%). 1H ЯМР (500 МГц, CDCl3) δ 8,37 (д, J=2,2 Гц, 1H), 8,07 (дд, J=8,6, 2,2 Гц, 1H), 7,76 (дд, J=8,0, 1,5 Гц, 2H), 7,67-7,58 (м, 1H), 7,51 (т, J=7,7 Гц, 2H), 7,24 (д, J=8,6 Гц, 1H), 4,93 (д, J=2,4 Гц, 2H), 3,96 (д, J=12,5 Гц, 2H), 2,89 (д, J=12,7 Гц, 2H), 2,72 (т, J=12,5 Гц, 2H), 2,62 (т, J=2,3 Гц, 1H), 2,46 (c, 1H), 2,24 (т, J=11,4 Гц, 2H), 1,90 (д, J=11,4 Гц, 2H), 1,73-1,56 (м, 4H), 1,44-1,27 (м, 3H), 0,93 (д, J=5,8 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 194,2, 157,6, 137,0, 136,1, 133,9, 132,7, 130,8, 129,8, 128,5, 127,7, 113,5, 77,4, 77,4, 62,0, 56,8, 49,4, 45,9, 34,2, 30,9, 27,8, 21,7; MS (ESI) m/z 481,2 (100%, [M+H]+).
(3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)-4-(проп-2-ин-1-илокси)фенил)(фенил)метанон: (4-гидрокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)(фенил)метанон (0,1103 г, 0,25 ммоль) растворяли в безводном DMF (1,5 мл), а затем добавляли NaH (95%, 0,0095 г, 0,38 ммоль) при 0°C. Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 30 мин. Затем раствор охлаждали до 0°C и добавляли пропаргилбромид (80% в толуоле, 0,032 мл, 0,29 ммоль) через шприц. Раствору позволяли постепенно нагреться до комнатной температуры и перемешивали в течение 17 ч. Реакционный раствор разбавляли CH2Cl2 (25 мл) и промывали насыщенным раствором NaHCO3 (25 мл) и 20% раствором LiCl (25 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (1:19 метанол:CH2Cl2) дала желаемый продукт в виде желтого масла (0,0290 г, 24%). 1H ЯМР (500 МГц, CDCl3) δ 8,37 (д, J=2,2 Гц, 1H), 8,07 (дд, J=8,6, 2,2 Гц, 1H), 7,76 (дд, J=8,0, 1,5 Гц, 2H), 7,67-7,58 (м, 1H), 7,51 (т, J=7,7 Гц, 2H), 7,24 (д, J=8,6 Гц, 1H), 4,93 (д, J=2,4 Гц, 2H), 3,96 (д, J=12,5 Гц, 2H), 2,89 (д, J=12,7 Гц, 2H), 2,72 (т, J=12,5 Гц, 2H), 2,62 (т, J=2,3 Гц, 1H), 2,46 (c, 1H), 2,24 (т, J=11,4 Гц, 2H), 1,90 (д, J=11,4 Гц, 2H), 1,73-1,56 (м, 4H), 1,44-1,27 (м, 3H), 0,93 (д, J=5,8 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 194,2, 157,6, 137,0, 136,1, 133,9, 132,7, 130,8, 129,8, 128,5, 127,7, 113,5, 77,4, 77,4, 62,0, 56,8, 49,4, 45,9, 34,2, 30,9, 27,8, 21,7; MS (ESI) m/z 481,2 (100%, [M+H]+).
X. Синтез 1'-(3-азидо-4-(проп-2-ин-1-илокси)бензил)-4-метил-1,4'-бипиперидина
[0394]

[0395]  1'-(3-азидо-4-(проп-2-ин-1-илокси)бензил)-4-метил-1,4'-бипиперидин: метил 3-азидо-4-(проп-2-ин-1-илокси)бензоат (0,1085 г,0,47 ммоль) растворяли в безводном CH2Cl2 (2 мл) и раствор охлаждали до -78°C. Капельно добавляли DIBAL-H (1,2 M в гексане, 1,1 мл, 1,32 ммоль) через шприц. Затем реакционную смесь перемешивали при -78°C в течение 1 ч, а затем ее гасили медленным добавлением 1,5 мл CH3OH и 15 мл HCl (2,5 M). Полученный раствор экстрагировали CH2Cl2 (4×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением (3-азидо-4-(проп-2-ин-1-илокси)фенил)метанола, который сразу использовали для следующей стадии.
1'-(3-азидо-4-(проп-2-ин-1-илокси)бензил)-4-метил-1,4'-бипиперидин: метил 3-азидо-4-(проп-2-ин-1-илокси)бензоат (0,1085 г,0,47 ммоль) растворяли в безводном CH2Cl2 (2 мл) и раствор охлаждали до -78°C. Капельно добавляли DIBAL-H (1,2 M в гексане, 1,1 мл, 1,32 ммоль) через шприц. Затем реакционную смесь перемешивали при -78°C в течение 1 ч, а затем ее гасили медленным добавлением 1,5 мл CH3OH и 15 мл HCl (2,5 M). Полученный раствор экстрагировали CH2Cl2 (4×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением (3-азидо-4-(проп-2-ин-1-илокси)фенил)метанола, который сразу использовали для следующей стадии.
[0396] К раствору (3-азидо-4-(проп-2-ин-1-илокси)фенил)метанола (выше) в CH2Cl2 (2 мл) добавляли хлорхромат пиридиния (PCC) (0,3103 г, 1,44 ммоль). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре и разбавляли смесью гексан:EtOAc 1:1. Полученную суспензию фильтровали через небольшой слой силикагеля и отфильтрованный осадок промывали смесью Et2O:гексан 1:1 и Et2O. Выпаривание растворителей дало 3-азидо-4-(проп-2-ин-1-илокси)бензальдегид, который подтверждали протонным ЯМР и сразу использовали для следующей стадии.
[0397] Смесь 3-метил-1,4'-бипиперидина (0,0865 г, 0,048 ммоль), 3-азидо-4-(проп-2-ин-1-илокси)бензальдегида (выше), CH2Cl2 (2 мл), AcOH (0,027 мл, 0,47 ммоль) и NaBH(OAc)3 (0,1425 г, 0,67 ммоль) перемешивали при комнатной температуре в течение 28 ч. Затем реакцию гасили насыщенным раствором NaHCO3 (20 мл) при 0°C и полученный двухфазный раствор экстрагировали CH2Cl2 (4×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (1:9 метанол:CH2Cl2) дала желаемый продукт в виде желтого геля (0,0378 г, 22%, на трех стадиях). 1H ЯМР (400 МГц, CDCl3) δ 7,10-6,87 (м, 3H), 4,72 (д, J=2,4 Гц, 2H), 3,38 (c, 2H), 3,03-2,85 (м, 4H), 2,51 (т, J=2,4 Гц, 1H), 2,41 (c, 1H), 2,24 (д, J=11,8 Гц, 2H), 1,93 (тд, J=11,9, 2,2 Гц, 2H), 1,84 (д, J=9,9 Гц, 2H), 1,61 (м, 5 H), 1,37 (c, 2H), 0,91 (д, J=5,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 148,5, 133,0, 128,9, 125,9, 120,9, 114,1, 78,0, 76,1, 62,7, 61,9, 56,9, 53,1, 49,4, 33,8, 30,8, 27,5, 21,7; MS (ESI) m/z 368,2 (100%, [M+H]+).
XI. 1'-((5-азидо-2-(проп-2-ин-1-илокси)фенил)сульфонил)-4-метил-1,4'-бипиперидин
[0398]

[0399]  бензил (4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)карбамат: п-анизидин-3-сульфоновую кислоту (1,2215 г, 6,02 ммоль), воду (10 мл), бензилхлорформиат (1,03 мл, 7,21 ммоль), K2CO3 (2,0854 г, 15,11 ммоль) и CHCl3 (10 мл) последовательно добавляли в колбу. Двухфазный раствор тщательно перемешивали в течение 71 ч. Добавляли 75 мл воды, а затем раствор промывали CHCl3 (2×75 мл) и водный раствор концентрировали в вакууме с получением калиевой соли 5-(((бензилокси)карбонил)амино)-2-метоксибензолсульфоната в виде желтого твердого вещества.
бензил (4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)карбамат: п-анизидин-3-сульфоновую кислоту (1,2215 г, 6,02 ммоль), воду (10 мл), бензилхлорформиат (1,03 мл, 7,21 ммоль), K2CO3 (2,0854 г, 15,11 ммоль) и CHCl3 (10 мл) последовательно добавляли в колбу. Двухфазный раствор тщательно перемешивали в течение 71 ч. Добавляли 75 мл воды, а затем раствор промывали CHCl3 (2×75 мл) и водный раствор концентрировали в вакууме с получением калиевой соли 5-(((бензилокси)карбонил)амино)-2-метоксибензолсульфоната в виде желтого твердого вещества.
[0400] Соль смешивали с DMF (20 мл) и суспензию охлаждали до 0°C. Капельно добавляли SOCl2 (1,80 мл, 25,02 ммоль) в течение 15 мин. Затем реакционной смеси позволяли нагреться до комнатной температуры и перемешивали в течение 3 часов. Реакционный раствор выливали в ледяную воду (50 мл) и экстрагировали CH2Cl2 (3×60 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, с получением бензил-(3-(хлорсульфонил)-4-метоксифенил)карбамата, который использовали без дальнейшей очистки.
[0401] Смесь 4-метил-1,4'-бипиперидина (1,2090 г, 6,64 ммоль), бензил-(3-(хлорсульфонил)-4-метоксифенил)карбамата (выше), N, N-диизопропилэтиламина (3 мл, 18,19 ммоль) и CH2Cl2 (15 мл) перемешивали при комнатной температуре в течение 21 ч. Затем раствор разбавляли CH2Cl2 (20 мл) и промывали насыщенным раствором NaHCO3 (35 мл) и рассолом (35 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали флэш-хроматографией на силикагеле (1:19 метанол:CH2Cl2) с получением желаемого продукта в виде белого твердого вещества (2,3318 г, 77%, три стадии). Т.пл. 124-127°C; 1H ЯМР (400 МГц, CDCl3) δ 7,80 (c, шир., 1H), 7,67 (д, J=2,8 Гц, 1H), 7,43-7,30 (м, 4H), 6,95 (д, J=9,0 Гц, 1H), 6,89 (c, 1H), 5,18 (c, 2H), 3,89 (c, J=3,4 Гц, 1H), 3,87 (c, 3H), 2,79 (д, J=11,5 Гц, 2H), 2,66-2,53 (м, 2H), 2,29 (тт, J=11,6, 3,5 Гц, 1H), 2,19-2,06 (м, 2H), 1,96-1,72 (м, 3H), 1,68-1,48 (м, 4H), 1,31 (ддт, J=14,5, 6,7, 3,7 Гц, 1H), 1,25-1,10 (м, 2H), 0,89 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 153,6, 153,0, 135,9, 130,8, 128,6, 128,4, 128,3, 126,9, 125,1, 122,2, 113,2, 67,2, 61,8, 56,4, 49,5, 45,9, 34,6, 31,1, 27,9, 21,9; MS (ESI) m/z 502,2 (100%, [M+H]+).
[0402]  4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)анилин: В колбу добавляли метанол (6 мл), бензил (4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)карбамат (0,5270 г, 1,05 ммоль) и 3 шаптеля палладия на угле (10 масс.%). Колбу закрывали резиновой мембраной, а затем из нее выкачивали воздух с использованием вакуума и заполняли водородом с использованием баллона с водородом. Реакционную смесь перемешивали в течение 27 часов и фильтровали через слой целита, промывали CH2Cl2. Выпаривание растворителей дало продукт в виде желтого твердого вещества (0,3591 г, 93%). Т.пл. 54-57°C; 1H ЯМР (500 МГц, CDCl3) δ 7,24 (д, J=2,5 Гц, 1H), 6,89-6,79 (м, 2H), 3,91 (д, J=13,0 Гц, 2H), 3,84 (c, 3H), 3,59 (c, 2H), 2,84 (д, J=9,3 Гц, 2H), 2,60 (т, J=12,5 Гц, 2H), 2,36 (т, J=11,9 Гц, 1H), 2,19 (тд, J=11,6, 10,0, 2,7 Гц, 2H), 1,84 (д, J=12,5 Гц, 2H), 1,70-1,50 (м, 4H), 1,35 (c, шир., 1H), 1,26 (м, 2H), 0,92 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 149,6, 140,0, 126,8, 120,8, 117,7, 114,3, 62,7, 56,7, 49,2, 45,4, 32,3, 30,1, 26,8, 21,2; MS (ESI) m/z 502,2 (100%, [M+H]+).
4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)анилин: В колбу добавляли метанол (6 мл), бензил (4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенил)карбамат (0,5270 г, 1,05 ммоль) и 3 шаптеля палладия на угле (10 масс.%). Колбу закрывали резиновой мембраной, а затем из нее выкачивали воздух с использованием вакуума и заполняли водородом с использованием баллона с водородом. Реакционную смесь перемешивали в течение 27 часов и фильтровали через слой целита, промывали CH2Cl2. Выпаривание растворителей дало продукт в виде желтого твердого вещества (0,3591 г, 93%). Т.пл. 54-57°C; 1H ЯМР (500 МГц, CDCl3) δ 7,24 (д, J=2,5 Гц, 1H), 6,89-6,79 (м, 2H), 3,91 (д, J=13,0 Гц, 2H), 3,84 (c, 3H), 3,59 (c, 2H), 2,84 (д, J=9,3 Гц, 2H), 2,60 (т, J=12,5 Гц, 2H), 2,36 (т, J=11,9 Гц, 1H), 2,19 (тд, J=11,6, 10,0, 2,7 Гц, 2H), 1,84 (д, J=12,5 Гц, 2H), 1,70-1,50 (м, 4H), 1,35 (c, шир., 1H), 1,26 (м, 2H), 0,92 (д, J=6,3 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 149,6, 140,0, 126,8, 120,8, 117,7, 114,3, 62,7, 56,7, 49,2, 45,4, 32,3, 30,1, 26,8, 21,2; MS (ESI) m/z 502,2 (100%, [M+H]+).
[0403]  4-азидо-2-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенол: В 25-мл высушенную пламенем колбу, оборудованную обратным холодильником, добавляли 4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)анилин (0,2546 г, 0,69 ммоль), безводный толуол (6 мл), безводный CH2Cl2 (1,5 мл) и BBr3 (1 M в CH2Cl2, 3,5 мл, 3,5 ммоль). Полученный раствор держали при 70°C на масляной бане в течение 3 ч, а затем его охлаждали до 0°C и гасили 6 мл метанола. Раствор фильтровали через слой целита, промывали метанолом. После выпаривания растворителей осадок очищали с использованием флэш-хроматографии на силикагеле (1,5:8,5 метанол:CH2Cl2) с получением деметилированного продукта. 1H ЯМР (400 МГц, метанол-d4) δ 7,79 (д, J=2,7 Гц, 1H), 7,51 (дд, J=8,8, 2,7 Гц, 1H), 7,13 (д, J=8,7 Гц, 1H), 3,95 (д, J=13,2 Гц, 2H), 3,49 (д, J=10,8 Гц, 2H), 3,40 (м, 1H), 3,26 (м, 2H), 3,05 (т, J=13,7 Гц, 2H), 2,82 (т, J=12,5 Гц, 2H), 2,21 (дд, J=11,6, 3,3 Гц, 2H), 1,88 (д, J=14,7 Гц, 2H), 1,75 (д, J=14,2 Гц, 3H), 1,53 (кв, J=12,7 Гц, 2H), 0,94 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, метанол-d4) δ 155,9, 129,3, 125,2, 125,0, 121,6, 118,8, 62,9, 49,8, 44,5, 31,1, 28,5, 26,3, 20,0.
4-азидо-2-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенол: В 25-мл высушенную пламенем колбу, оборудованную обратным холодильником, добавляли 4-метокси-3-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)анилин (0,2546 г, 0,69 ммоль), безводный толуол (6 мл), безводный CH2Cl2 (1,5 мл) и BBr3 (1 M в CH2Cl2, 3,5 мл, 3,5 ммоль). Полученный раствор держали при 70°C на масляной бане в течение 3 ч, а затем его охлаждали до 0°C и гасили 6 мл метанола. Раствор фильтровали через слой целита, промывали метанолом. После выпаривания растворителей осадок очищали с использованием флэш-хроматографии на силикагеле (1,5:8,5 метанол:CH2Cl2) с получением деметилированного продукта. 1H ЯМР (400 МГц, метанол-d4) δ 7,79 (д, J=2,7 Гц, 1H), 7,51 (дд, J=8,8, 2,7 Гц, 1H), 7,13 (д, J=8,7 Гц, 1H), 3,95 (д, J=13,2 Гц, 2H), 3,49 (д, J=10,8 Гц, 2H), 3,40 (м, 1H), 3,26 (м, 2H), 3,05 (т, J=13,7 Гц, 2H), 2,82 (т, J=12,5 Гц, 2H), 2,21 (дд, J=11,6, 3,3 Гц, 2H), 1,88 (д, J=14,7 Гц, 2H), 1,75 (д, J=14,2 Гц, 3H), 1,53 (кв, J=12,7 Гц, 2H), 0,94 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, метанол-d4) δ 155,9, 129,3, 125,2, 125,0, 121,6, 118,8, 62,9, 49,8, 44,5, 31,1, 28,5, 26,3, 20,0.
[0404] В колбу, содержавшую деметилированный продукт (выше) добавляли 6 M HCl (3 мл), THF (3 мл) и DMF (3 мл). Смесь охлаждали до 0°C и капельно добавляли NaNO2 (0,0612 г, 0,89 ммоль) в H2O (1 мл) за 5 мин. Реакционный раствор перемешивали в течение 40 мин при 0°C и капельно добавляли NaN3 (0,0699 г, 1,08 ммоль) в H2O (1 мл). Затем полученному раствору позволяли нагреться до комнатной температуры и перемешивали в течение ночи, после чего реакционный раствор разбавляли водой (10 мл) и подщелачивали 1 M раствором NaOH. Полученный раствор экстрагировали CH2Cl2 (3×25 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали флэш-хроматографией на силикагеле (1:9 метанол:CH2Cl2) с получением желаемого продукта (0,1921 г, 73%, две стадии) в виде зеленого масла. 1H ЯМР (400 МГц, CDCl3) δ 7,15 (дд, J=2,1, 1,0 Гц, 1H), 7,12-7,08 (м, 2H), 3,85 (д, J=12,5 Гц, 2H), 3,05 (д, J=10,9 Гц, 2H), 2,67 (т, J=11,8 Гц, 1H), 2,51 (тд, J=12,4, 2,4 Гц, 2H), 2,40 (т, J=10,4 Гц, 2H), 2,04 (д, J=11,1 Гц, 2H), 1,83-1,61 (м, 4H), 1,46 (дт, J=19,6, 7,8 Гц, 3H), 0,91 (д, J=5,5 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 152,8, 132,1, 125,9, 121,3, 120,5, 118,8, 61,8, 49,4, 45,4, 32,7, 30,1, 26,5, 21,3; MS (ESI) m/z 380,2 (100%, [M+H]+).
[0405] 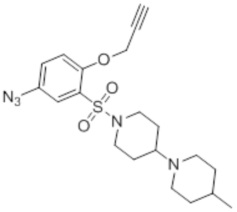 1'-((5-азидо-2-(prop-2-yn-1-илокси)фенил)сульфонил)-4-метил-1,4'-бипиперидин: 4-азидо-2-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенол (0,1190 г, 0,31 ммоль) растворяли в безводном DMF (2,5 мл), а затем добавляли NaH (60%, 0,163 г, 0,41 ммоль) при 0°C. Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Реакционный раствор перемешивали при 0°C в течение 15 мин и добавляли пропаргилбромид (80% в толуоле, 0,035 мл, 0,31 ммоль) через шприц. Раствору позволяли постепенно нагреться до комнатной температуры и перемешивали в течение ночи. Затем реакцию гасили добавлением насыщенного раствора NaHCO3 (20 мл), а затем экстрагировали EtOAc (3×25 мл). Объединенные органические слои промывали водой (40 мл) и рассолом (40 мл), после чего органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (1:19 метанол:CH2Cl2) дала желаемый продукт (0,0442 г, 34%) в виде желтого геля. 1H ЯМР (400 МГц, CDCl3) δ 7,57 (дд, J=2,1, 1,1 Гц, 1H), 7,17-7,07 (м, 2H), 4,77 (д, J=2,4 Гц, 2H), 3,90 (д, J=12,9 Гц, 2H), 2,80 (д, J=11,3 Гц, 2H), 2,66 (тд, J=12,5, 2,4 Гц, 2H), 2,54 (т, J=2,4 Гц, 1H), 2,34 (тт, J=11,6, 3,5 Гц, 1H), 2,15 (тд, J=11,5, 2,7 Гц, 2H), 1,90-1,75 (м, 2H), 1,71-1,52 (м, 4H), 1,42-1,27 (м, 1H), 1,27-1,11 (м, 2H), 0,88 (д, J=6,3 Гц, 3H); 13C ЯМР (125 МГц, CDCl3) δ 151,7, 133,8, 129,5, 124,2, 122,0, 115,9, 77,3, 76,9, 61,9, 57,2, 49,4, 46,0, 34,4, 31,0, 27,8, 21,9; MS (ESI) m/z 418,2 (100%, [M+H]+).
1'-((5-азидо-2-(prop-2-yn-1-илокси)фенил)сульфонил)-4-метил-1,4'-бипиперидин: 4-азидо-2-((4-метил-[1,4'-бипиперидин]-1'-ил)сульфонил)фенол (0,1190 г, 0,31 ммоль) растворяли в безводном DMF (2,5 мл), а затем добавляли NaH (60%, 0,163 г, 0,41 ммоль) при 0°C. Затем колбу сразу продували потоком аргона и закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Реакционный раствор перемешивали при 0°C в течение 15 мин и добавляли пропаргилбромид (80% в толуоле, 0,035 мл, 0,31 ммоль) через шприц. Раствору позволяли постепенно нагреться до комнатной температуры и перемешивали в течение ночи. Затем реакцию гасили добавлением насыщенного раствора NaHCO3 (20 мл), а затем экстрагировали EtOAc (3×25 мл). Объединенные органические слои промывали водой (40 мл) и рассолом (40 мл), после чего органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (1:19 метанол:CH2Cl2) дала желаемый продукт (0,0442 г, 34%) в виде желтого геля. 1H ЯМР (400 МГц, CDCl3) δ 7,57 (дд, J=2,1, 1,1 Гц, 1H), 7,17-7,07 (м, 2H), 4,77 (д, J=2,4 Гц, 2H), 3,90 (д, J=12,9 Гц, 2H), 2,80 (д, J=11,3 Гц, 2H), 2,66 (тд, J=12,5, 2,4 Гц, 2H), 2,54 (т, J=2,4 Гц, 1H), 2,34 (тт, J=11,6, 3,5 Гц, 1H), 2,15 (тд, J=11,5, 2,7 Гц, 2H), 1,90-1,75 (м, 2H), 1,71-1,52 (м, 4H), 1,42-1,27 (м, 1H), 1,27-1,11 (м, 2H), 0,88 (д, J=6,3 Гц, 3H); 13C ЯМР (125 МГц, CDCl3) δ 151,7, 133,8, 129,5, 124,2, 122,0, 115,9, 77,3, 76,9, 61,9, 57,2, 49,4, 46,0, 34,4, 31,0, 27,8, 21,9; MS (ESI) m/z 418,2 (100%, [M+H]+).
XII. Синтез соединения 1'-(фенилсульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидина с арилазидом
[0406]
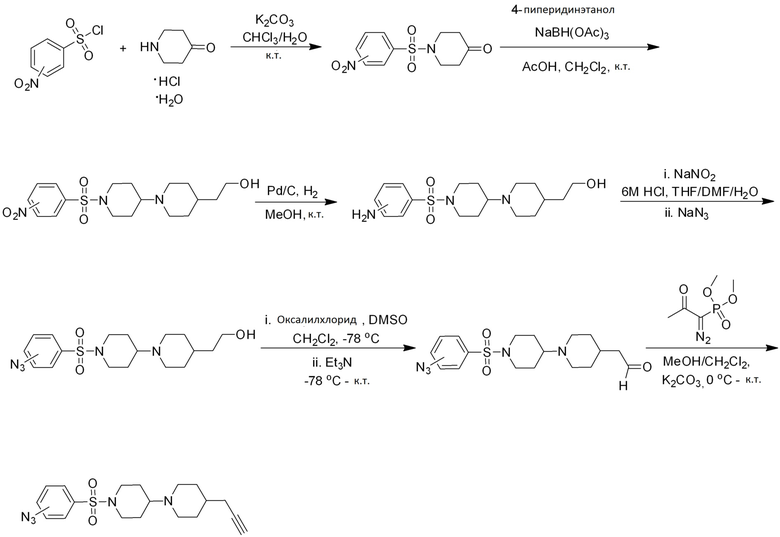
[0407] Экспериментальная методика синтеза отражена получением 1'-((4-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидина.
[0408]  1-((4-нитрофенил)сульфонил)пиперидин-4-он получали согласно общей методике получения сульфонамидов из сульфонилхлоридов и хлористоводородных солей аминов с детальной охарактеризацией, представленной выше.
1-((4-нитрофенил)сульфонил)пиперидин-4-он получали согласно общей методике получения сульфонамидов из сульфонилхлоридов и хлористоводородных солей аминов с детальной охарактеризацией, представленной выше.
[0409]  2-(1'-((4-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали согласно общей методике восстановительного аминирования, детально охарактеризованной выше.
2-(1'-((4-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали согласно общей методике восстановительного аминирования, детально охарактеризованной выше.
[0410]  2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: в 10-мл колбу добавляли 2-(1'-((4-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,1002 г, 0,25 ммоль), метанол (3,5 мл) и 1 шпатель палладия на угле (10 масс.%). Колбу закрывали резиновой мембраной, а затем воздух откачивали с использованием вакуума и заполняли водородом с использованием баллона с водородом. Реакционную смесь перемешивали в течение 21 часов и фильтровали через слой целита, промывали CH2Cl2. Выпаривание растворителей дало продукт в виде желтого твердого вещества (0,0815 г, 88%). Т.пл. 59-62°C; 1H ЯМР (500 МГц, CDCl3) δ 7,53 (д, J=8,6 Гц, 2H), 6,70 (д, J=8,6 Гц, 2H), 4,15 (c, 2H), 3,80 (дт, J=10,9, 3,1 Гц, 2H), 3,68 (т, J=6,7 Гц, 2H), 2,82 (д, J=10,7 Гц, 2), 2,30-2,06 (м, 5 H), 1,83 (д, J=11,8 Гц, 2H), 1,67 (м, 4H), 1,50 (кв, J=6,7 Гц, 2H), 1,45-1,35 (м, 1H), 1,35-1,15 (м, 3H); 13C ЯМР (100 МГц, CDCl3) δ 150,5, 129,8, 124,2, 113,9, 61,6, 60,5, 49,4, 46,1, 39,3, 32,6, 32,5, 27,3; MS (ESI) m/z 368,2 (100%, [M+H]+).
2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: в 10-мл колбу добавляли 2-(1'-((4-нитрофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,1002 г, 0,25 ммоль), метанол (3,5 мл) и 1 шпатель палладия на угле (10 масс.%). Колбу закрывали резиновой мембраной, а затем воздух откачивали с использованием вакуума и заполняли водородом с использованием баллона с водородом. Реакционную смесь перемешивали в течение 21 часов и фильтровали через слой целита, промывали CH2Cl2. Выпаривание растворителей дало продукт в виде желтого твердого вещества (0,0815 г, 88%). Т.пл. 59-62°C; 1H ЯМР (500 МГц, CDCl3) δ 7,53 (д, J=8,6 Гц, 2H), 6,70 (д, J=8,6 Гц, 2H), 4,15 (c, 2H), 3,80 (дт, J=10,9, 3,1 Гц, 2H), 3,68 (т, J=6,7 Гц, 2H), 2,82 (д, J=10,7 Гц, 2), 2,30-2,06 (м, 5 H), 1,83 (д, J=11,8 Гц, 2H), 1,67 (м, 4H), 1,50 (кв, J=6,7 Гц, 2H), 1,45-1,35 (м, 1H), 1,35-1,15 (м, 3H); 13C ЯМР (100 МГц, CDCl3) δ 150,5, 129,8, 124,2, 113,9, 61,6, 60,5, 49,4, 46,1, 39,3, 32,6, 32,5, 27,3; MS (ESI) m/z 368,2 (100%, [M+H]+).
[0411]  2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: в 25-мл колбу, содержавшую 2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,1822 г, 0,50 ммоль), добавляли 6 M HCl (2 мл), THF (2 мл) и DMF (2 мл). Смесь охлаждали до 0°C и капельно добавляли NaNO2 (0,0445 г, 0,64 ммоль) в H2O (0,7 мл) в течение 5 мин. Реакционный раствор перемешивали в течение 20 мин при 0°C и добавляли NaN3 (0,0521 г, 0,80 ммоль). Затем полученному раствору позволяли постепенно нагреться до комнатной температуры и перемешивали в течение ночи. Затем реакцию гасили добавлением 1 M NaOH (30 мл), а затем экстрагировали CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок растворяли в EtOAc (30 мл), промывали 10% раствором LiCl (30 мл) и рассолом (3×30 мл) с получением указанного в заголовке продукта (0,0719 г, 36%) в виде светло-желтого твердого вещества. Т.пл. 165-167°C; 1H ЯМР (400 МГц, CDCl3) δ 7,72 (д, J=8,6 Гц, 2H), 7,12 (д, J=8,6 Гц, 2H), 3,81 (д, J=11,5 Гц, 2H), 3,65 (т, J=6,6 Гц, 2H), 2,80 (д, J=10,9 Гц, 2H), 2,33-2,04 (м, 5 H), 1,82 (д, J=12,1 Гц, 2H), 1,64 (м, 5 H), 1,47 (кв, J=6,6 Гц, 2H), 1,38 (м, 1H), 1,18 (ддд, J=15,4, 10,3, 3,7 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 144,8, 132,3, 129,5, 119,4, 61,4, 60,4, 49,4, 46,1, 39,3, 32,6, 32,5, 27,3; MS (ESI) m/z 394,2 (100%, [M+H]+).
2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол: в 25-мл колбу, содержавшую 2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,1822 г, 0,50 ммоль), добавляли 6 M HCl (2 мл), THF (2 мл) и DMF (2 мл). Смесь охлаждали до 0°C и капельно добавляли NaNO2 (0,0445 г, 0,64 ммоль) в H2O (0,7 мл) в течение 5 мин. Реакционный раствор перемешивали в течение 20 мин при 0°C и добавляли NaN3 (0,0521 г, 0,80 ммоль). Затем полученному раствору позволяли постепенно нагреться до комнатной температуры и перемешивали в течение ночи. Затем реакцию гасили добавлением 1 M NaOH (30 мл), а затем экстрагировали CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок растворяли в EtOAc (30 мл), промывали 10% раствором LiCl (30 мл) и рассолом (3×30 мл) с получением указанного в заголовке продукта (0,0719 г, 36%) в виде светло-желтого твердого вещества. Т.пл. 165-167°C; 1H ЯМР (400 МГц, CDCl3) δ 7,72 (д, J=8,6 Гц, 2H), 7,12 (д, J=8,6 Гц, 2H), 3,81 (д, J=11,5 Гц, 2H), 3,65 (т, J=6,6 Гц, 2H), 2,80 (д, J=10,9 Гц, 2H), 2,33-2,04 (м, 5 H), 1,82 (д, J=12,1 Гц, 2H), 1,64 (м, 5 H), 1,47 (кв, J=6,6 Гц, 2H), 1,38 (м, 1H), 1,18 (ддд, J=15,4, 10,3, 3,7 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 144,8, 132,3, 129,5, 119,4, 61,4, 60,4, 49,4, 46,1, 39,3, 32,6, 32,5, 27,3; MS (ESI) m/z 394,2 (100%, [M+H]+).
[0412]  1'-((4-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин: 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Последовательно через шприц добавляли безводный CH2Cl2 (1,5 мл) и оксалилхлорид (0,30 мл, 2 M в CH2Cl2, 0,60 ммоль). Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон. Добавляли безводный DMSO (0,085 мл, 1,20 ммоль) и раствор перемешивали в течение 25 мин при -78°C. Капельно добавляли 2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,1910 г, 0,49 ммоль) в 2 мл CH2Cl2. Реакционную смесь перемешивали при -78°C в течение 1 ч, а затем добавляли Et3N (0,24 мл, 1,73 ммоль) и реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 1,5 часов, а затем гасили 20 мл насыщенного раствора NaHCO3. Полученный двухфазный раствор экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением альдегидного промежуточного соединения, которое сразу использовали для следующей стадии без дальнейшей очистки.
1'-((4-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин: 25-мл высушенную пламенем колбу, оборудованную магнитной мешалкой, продували аргоном, а затем закрывали резиновой мембраной, через которую был подсоединен баллон с аргоном. Последовательно через шприц добавляли безводный CH2Cl2 (1,5 мл) и оксалилхлорид (0,30 мл, 2 M в CH2Cl2, 0,60 ммоль). Полученный раствор охлаждали до -78°C на бане сухой лед-ацетон. Добавляли безводный DMSO (0,085 мл, 1,20 ммоль) и раствор перемешивали в течение 25 мин при -78°C. Капельно добавляли 2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол (0,1910 г, 0,49 ммоль) в 2 мл CH2Cl2. Реакционную смесь перемешивали при -78°C в течение 1 ч, а затем добавляли Et3N (0,24 мл, 1,73 ммоль) и реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 1,5 часов, а затем гасили 20 мл насыщенного раствора NaHCO3. Полученный двухфазный раствор экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением альдегидного промежуточного соединения, которое сразу использовали для следующей стадии без дальнейшей очистки.
[0413] Полученный альдегид растворяли в 2 мл CH2Cl2 и половину его подвергали реакции с реагентом Бестмана-Охира. Методика реакции с реагентом Бестмана-Охира описана ниже. Реагент Бестмана-Охира (диметил-(1-диазо-2-оксопропил)фосфонат) (0,0570 г, 0,030 ммоль) и метанол (2 мл) смешивали при 0°C, а затем добавляли альдегид (растворенный в 1 мл CH2Cl2) и K2CO3 (0,0670 г, 0,49 ммоль). Затем реакционной суспензии позволяли нагреться до комнатной температуры и перемешивали в течение ночи. Взвесь фильтровали и выливали в делительную воронку, разбавляли 20 мл CH2Cl2, промывали насыщенным раствором NaHCO3 (20 мл) и 1 Н NaOH (20 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Осадок обрабатывали ультразвуковым излучением с небольшим количеством гексана и супернатант слоя гексана удаляли стеклянной пипеткой, а затем очищали с использованием флэш-хроматографии на силикагеле (1:9 CH3OH:CH2Cl2) с получением указанного в заголовке продукта в виде желтого твердого вещества (0,0454 г, 48%). 1H ЯМР (400 МГц, CDCl3) δ 7,74 (д, J=8,7 Гц, 2H), 7,15 (д, J=8,7 Гц, 2H), 3,85 (дд, J=11,5, 3,8 Гц, 2H), 2,87 (c, 2H), 2,39-2,05 (м, 7 H), 1,97 (т, J=2,1 Гц, 1H), 1,85 (м, 4H), 1,67 (кв, J=12,5 Гц, 2H), 1,46 (c, шир., 1H), 1,30 (c, шир., 2H); 13C ЯМР (100 МГц, CDCl3) δ 144,8, 132,3, 129,5, 119,4, 82,6, 69,4, 61,5, 49,2, 46,0, 35,4, 31,7, 27,2, 25,3; MS (ESI) m/z 388,2 (100%, [M+H]+).
[0414]  2-(1'-((3-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде желтого твердого вещества (91%) согласно экспериментальной методике синтеза 2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 61-64°C; 1H ЯМР (400 МГц, CD3OD) δ 7,27 (т, J=7,9 Гц, 1H), 7,03 (c, 1H), 6,97 (д, J=7,7 Гц, 1H), 6,91 (дд, J=8,1, 2,3 Гц, 1H), 3,82 (д, J=12,8 Гц, 2H), 3,60 (т, J=6,4 Гц, 2H), 3,32 (c, 2H), 3,05 (д, J=11,5 Гц, 2H), 2,49 (т, J=11,7 Гц, 1H), 2,45-2,26 (м, 4H), 1,97 (д, J=11,8 Гц, 2H), 1,80 (д, J=13,3 Гц, 2H), 1,62 (квд, J=12,3, 4,1 Гц, 2H), 1,57-1,50 (м, 1H), 1,48 (кв, J=6,4 Гц, 2H), 1,37-1,22 (м, 2H); 13C ЯМР (100 МГц, CD3OD) δ 149,2, 136,3, 129,4, 118,5, 115,4, 112,5, 61,6, 58,9, 49,2, 45,6, 38,4, 31,7, 31,0, 26,6; MS (ESI) m/z 368,2 (100%, [M+H]+).
2-(1'-((3-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде желтого твердого вещества (91%) согласно экспериментальной методике синтеза 2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 61-64°C; 1H ЯМР (400 МГц, CD3OD) δ 7,27 (т, J=7,9 Гц, 1H), 7,03 (c, 1H), 6,97 (д, J=7,7 Гц, 1H), 6,91 (дд, J=8,1, 2,3 Гц, 1H), 3,82 (д, J=12,8 Гц, 2H), 3,60 (т, J=6,4 Гц, 2H), 3,32 (c, 2H), 3,05 (д, J=11,5 Гц, 2H), 2,49 (т, J=11,7 Гц, 1H), 2,45-2,26 (м, 4H), 1,97 (д, J=11,8 Гц, 2H), 1,80 (д, J=13,3 Гц, 2H), 1,62 (квд, J=12,3, 4,1 Гц, 2H), 1,57-1,50 (м, 1H), 1,48 (кв, J=6,4 Гц, 2H), 1,37-1,22 (м, 2H); 13C ЯМР (100 МГц, CD3OD) δ 149,2, 136,3, 129,4, 118,5, 115,4, 112,5, 61,6, 58,9, 49,2, 45,6, 38,4, 31,7, 31,0, 26,6; MS (ESI) m/z 368,2 (100%, [M+H]+).
[0415] 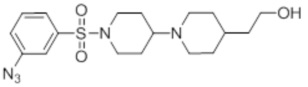 2-(1'-((3-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде светло-желтого твердого вещества (>95%) согласно экспериментальной методике синтеза 2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 168-171°C; 1H ЯМР (400 МГц, CDCl3) δ 7,54-7,45 (м, 2H), 7,36 (c, 1H), 7,24-7,18 (м, 1H), 3,83 (д, J=12,4 Гц, 2H), 3,65 (т, J=6,6 Гц, 2H)), 2,79 (д, J=11,0 Гц, 2H), 2,37-2,07 (м, 5 H), 1,83 (д, J=11,0 Гц, 2H), 1,72-1,54 (м, 5 H), 1,47 (кв, J=6,6 Гц, 2H), 1,43-1,34 (м, 1H), 1,20 (тдд, J=15,5, 9,6, 4,2 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 141,4, 138,2, 130,5, 123,8, 123,0, 118,0, 61,4, 60,4, 49,4, 46,1, 39,3, 32,6, 32,5, 27,3; MS (ESI) m/z 394,2 (100%, [M+H]+).
2-(1'-((3-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде светло-желтого твердого вещества (>95%) согласно экспериментальной методике синтеза 2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 168-171°C; 1H ЯМР (400 МГц, CDCl3) δ 7,54-7,45 (м, 2H), 7,36 (c, 1H), 7,24-7,18 (м, 1H), 3,83 (д, J=12,4 Гц, 2H), 3,65 (т, J=6,6 Гц, 2H)), 2,79 (д, J=11,0 Гц, 2H), 2,37-2,07 (м, 5 H), 1,83 (д, J=11,0 Гц, 2H), 1,72-1,54 (м, 5 H), 1,47 (кв, J=6,6 Гц, 2H), 1,43-1,34 (м, 1H), 1,20 (тдд, J=15,5, 9,6, 4,2 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 141,4, 138,2, 130,5, 123,8, 123,0, 118,0, 61,4, 60,4, 49,4, 46,1, 39,3, 32,6, 32,5, 27,3; MS (ESI) m/z 394,2 (100%, [M+H]+).
[0416] 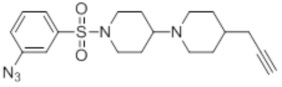 1'-((3-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин получали в виде желтого твердого вещества (49%) согласно экспериментальной методике синтеза 1'-((4-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидина. 1H ЯМР (500 МГц, CDCl3) δ 7,59-7,48 (м, 2H), 7,38 (c, 1H), 7,27-7,23 (м, 1H), 3,90 (д, J=11,8 Гц, 2H), 3,02 (c, 2H), 2,53 (c, шир., 1H), 2,33 (м, 4H), 2,16 (c, 2H), 2,04 (д, J=11,8 Гц, 2H), 1,99 (т, J=2,6 Гц, 1H), 1,89 (д, J=10,7 Гц, 2H), 1,73 (квд, J=12,3, 4,2 Гц, 2H), 1,66-1,46 (c, шир., 3H); 13C ЯМР (100 МГц, CDCl3) δ 141,6, 137,9, 130,6, 123,7, 123,2, 118,0, 82,1, 69,8, 61,8, 49,0, 45,7, 35,0, 30,6, 26,6, 25,0; MS (ESI) m/z 388,1 (100%, [M+H]+).
1'-((3-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин получали в виде желтого твердого вещества (49%) согласно экспериментальной методике синтеза 1'-((4-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидина. 1H ЯМР (500 МГц, CDCl3) δ 7,59-7,48 (м, 2H), 7,38 (c, 1H), 7,27-7,23 (м, 1H), 3,90 (д, J=11,8 Гц, 2H), 3,02 (c, 2H), 2,53 (c, шир., 1H), 2,33 (м, 4H), 2,16 (c, 2H), 2,04 (д, J=11,8 Гц, 2H), 1,99 (т, J=2,6 Гц, 1H), 1,89 (д, J=10,7 Гц, 2H), 1,73 (квд, J=12,3, 4,2 Гц, 2H), 1,66-1,46 (c, шир., 3H); 13C ЯМР (100 МГц, CDCl3) δ 141,6, 137,9, 130,6, 123,7, 123,2, 118,0, 82,1, 69,8, 61,8, 49,0, 45,7, 35,0, 30,6, 26,6, 25,0; MS (ESI) m/z 388,1 (100%, [M+H]+).
[0417]  2-(1'-((2-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде желтого твердого вещества (90%) согласно экспериментальной методике синтеза 2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 204-206°C; 1H ЯМР (400 МГц, CDCl3) δ 7,52 (дд, J=8,1, 1,6 Гц, 1H), 7,37-7,18 (м, 1H), 6,85-6,58 (м, 2H), 5,04 (c, 2H), 3,84 (д, J=12,4 Гц, 2H), 3,64 (т, J=6,4 Гц, 2H), 2,86 (д, J=10,7 Гц, 2H), 2,45 (тд, J=12,3, 2,4 Гц, 2H), 2,34 (т, J=11,8 Гц, 1H), 2,26-2,13 (м, 2H), 1,86 (д, J=13,3 Гц, 2H), 1,70 (д, J=11,4 Гц, 2H), 1,60 (квд, J=12,3, 4,1 Гц, 2H), 1,52-1,20 (м, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 146,2, 134,2, 130,3, 117,8, 117,6, 117,2, 61,7, 60,3, 49,4, 45,8, 39,1, 32,3, 32,0, 27,0; MS (ESI) m/z 368,2 (100%, [M+H]+).
2-(1'-((2-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде желтого твердого вещества (90%) согласно экспериментальной методике синтеза 2-(1'-((4-аминофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 204-206°C; 1H ЯМР (400 МГц, CDCl3) δ 7,52 (дд, J=8,1, 1,6 Гц, 1H), 7,37-7,18 (м, 1H), 6,85-6,58 (м, 2H), 5,04 (c, 2H), 3,84 (д, J=12,4 Гц, 2H), 3,64 (т, J=6,4 Гц, 2H), 2,86 (д, J=10,7 Гц, 2H), 2,45 (тд, J=12,3, 2,4 Гц, 2H), 2,34 (т, J=11,8 Гц, 1H), 2,26-2,13 (м, 2H), 1,86 (д, J=13,3 Гц, 2H), 1,70 (д, J=11,4 Гц, 2H), 1,60 (квд, J=12,3, 4,1 Гц, 2H), 1,52-1,20 (м, 6 H); 13C ЯМР (100 МГц, CDCl3) δ 146,2, 134,2, 130,3, 117,8, 117,6, 117,2, 61,7, 60,3, 49,4, 45,8, 39,1, 32,3, 32,0, 27,0; MS (ESI) m/z 368,2 (100%, [M+H]+).
[0418]  2-(1'-((2-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде светло-желтого твердого вещества (78%) согласно экспериментальной методике синтеза 2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 152-155°C; 1H ЯМР (400 МГц, CDCl3) δ 7,92 (дд, J=7,9, 1,5 Гц, 1H), 7,56 (тд, J=7,7, 1,6 Гц, 1H), 7,38-7,12 (м, 2H), 3,94 (д, J=13,0 Гц, 2H), 3,67 (c, 2H), 2,87 (д, J=10,9 Гц, 2H), 2,66 (тд, J=12,7, 2,4 Гц, 2H), 2,35 (д, J=12,5 Гц, 1H), 2,18 (т, J=11,3 Гц, 2H), 1,87 (д, J=12,6 Гц, 2H), 1,71 (д, J=10,8 Гц, 2H), 1,66-1,54 (м, 2H), 1,54-1,21 (м, 6 H); 13C ЯМР (125 МГц, CDCl3) δ 138,3, 133,9, 131,7, 129,3, 124,6, 119,9, 61,9, 60,4, 49,4, 45,8, 39,2, 32,4, 32,3, 27,8; MS (ESI) m/z 394,2 (100%, [M+H]+).
2-(1'-((2-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанол получали в виде светло-желтого твердого вещества (78%) согласно экспериментальной методике синтеза 2-(1'-((4-азидофенил)сульфонил)-[1,4'-бипиперидин]-4-ил)этанола. Т.пл. 152-155°C; 1H ЯМР (400 МГц, CDCl3) δ 7,92 (дд, J=7,9, 1,5 Гц, 1H), 7,56 (тд, J=7,7, 1,6 Гц, 1H), 7,38-7,12 (м, 2H), 3,94 (д, J=13,0 Гц, 2H), 3,67 (c, 2H), 2,87 (д, J=10,9 Гц, 2H), 2,66 (тд, J=12,7, 2,4 Гц, 2H), 2,35 (д, J=12,5 Гц, 1H), 2,18 (т, J=11,3 Гц, 2H), 1,87 (д, J=12,6 Гц, 2H), 1,71 (д, J=10,8 Гц, 2H), 1,66-1,54 (м, 2H), 1,54-1,21 (м, 6 H); 13C ЯМР (125 МГц, CDCl3) δ 138,3, 133,9, 131,7, 129,3, 124,6, 119,9, 61,9, 60,4, 49,4, 45,8, 39,2, 32,4, 32,3, 27,8; MS (ESI) m/z 394,2 (100%, [M+H]+).
[0419]  1'-((2-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин получали в виде желтого твердого вещества (40%) согласно экспериментальной методике синтеза 1'-((4-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидина. 1H ЯМР (400 МГц, CDCl3) δ 7,94 (дд, J=7,9, 1,6 Гц, 1H), 7,57 (тд, J=7,8, 1,6 Гц, 1H), 7,31-7,27 (м, 1H), 7,23 (тд, J=7,7, 1,1 Гц, 1H), 3,94 (д, J=12,7 Гц, 2H), 2,87 (д, J=11,0 Гц, 2H), 2,67 (тд, J=12,4, 2,4 Гц, 2H), 2,34 (ддт, J=11,5, 7,3, 3,7 Гц, 1H), 2,12 (м, 3H), 1,96 (т, J=2,6 Гц, 1H), 1,82 (т, J=15,2 Гц, 4H), 1,60 (квд, J=12,1, 4,2 Гц, 2H), 1,46 (м, 1H), 1,29 (ддд, J=24,3, 12,1, 3,7 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 138,3, 133,8, 131,7, 129,4, 124,6, 119,9, 82,8, 69,3, 61,6, 49,2, 45,9, 35,6, 32,0, 28,0, 25,4; MS (ESI) m/z 388,1 (100%, [M+H]+).
1'-((2-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидин получали в виде желтого твердого вещества (40%) согласно экспериментальной методике синтеза 1'-((4-азидофенил)сульфонил)-4-(проп-2-ин-1-ил)-1,4'-бипиперидина. 1H ЯМР (400 МГц, CDCl3) δ 7,94 (дд, J=7,9, 1,6 Гц, 1H), 7,57 (тд, J=7,8, 1,6 Гц, 1H), 7,31-7,27 (м, 1H), 7,23 (тд, J=7,7, 1,1 Гц, 1H), 3,94 (д, J=12,7 Гц, 2H), 2,87 (д, J=11,0 Гц, 2H), 2,67 (тд, J=12,4, 2,4 Гц, 2H), 2,34 (ддт, J=11,5, 7,3, 3,7 Гц, 1H), 2,12 (м, 3H), 1,96 (т, J=2,6 Гц, 1H), 1,82 (т, J=15,2 Гц, 4H), 1,60 (квд, J=12,1, 4,2 Гц, 2H), 1,46 (м, 1H), 1,29 (ддд, J=24,3, 12,1, 3,7 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 138,3, 133,8, 131,7, 129,4, 124,6, 119,9, 82,8, 69,3, 61,6, 49,2, 45,9, 35,6, 32,0, 28,0, 25,4; MS (ESI) m/z 388,1 (100%, [M+H]+).
XIII. Синтез 3-(1'-(мезитилсульфонил)-[1,4'-бипиперидин]-4-ил)пропаннитрила
[0420]

[0421]  трет-бутил 4-(2-(тозилокси)этил)пиперидин-1-карбоксилат: 2-(пиперидин-4-ил)этанол (1,3091 г, 10,15 ммоль), Et3N (4,20 мл, 30,19 ммоль) и CHCl3 (10 мл) смешивали и перемешивали при 0°C, а затем капельно добавляли ди-трет-бутилдикарбонат (2,5770 г, 11,81 ммоль) в CHCl3 (4 мл) за 30 мин. Затем реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 9 ч. Реакционный раствор выливали в насыщенный раствор NaHCO3 (30 мл) и экстрагировали CHCl3 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением Boc-защищенного 2-(пиперидин-4-ил)этанола, который использовали для следующей стадии без дальнейшей очистки.
трет-бутил 4-(2-(тозилокси)этил)пиперидин-1-карбоксилат: 2-(пиперидин-4-ил)этанол (1,3091 г, 10,15 ммоль), Et3N (4,20 мл, 30,19 ммоль) и CHCl3 (10 мл) смешивали и перемешивали при 0°C, а затем капельно добавляли ди-трет-бутилдикарбонат (2,5770 г, 11,81 ммоль) в CHCl3 (4 мл) за 30 мин. Затем реакционному раствору позволяли нагреться до комнатной температуры и перемешивали в течение 9 ч. Реакционный раствор выливали в насыщенный раствор NaHCO3 (30 мл) и экстрагировали CHCl3 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением Boc-защищенного 2-(пиперидин-4-ил)этанола, который использовали для следующей стадии без дальнейшей очистки.
[0422] Boc-защищенный 2-(пиперидин-4-ил)этанол перемешивали с тозилхлоридом (3,8988 г, 20,46 ммоль) и DMAP (0,2514 г, 2,06 ммоль) в CH2Cl2 (20 мл), а затем капельно добавляли Et3N (4,25 мл, 30,55 ммоль) за 10 мин. Реакционный раствор перемешивали в течение 14 ч и медленно выливали в насыщенный раствор NaHCO3 (70 мл), экстрагировали CH2Cl2 (3×70 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии (1:4 EtOAc:гексан) с получением указанного в заголовке продукта (2,6127 г, 67%, две стадии) в виде желтого масла. 1H ЯМР (400 МГц, CDCl3) δ 7,76 (д, J=8,3 Гц, 2H), 7,33 (д, J=8,3 Гц, 2H), 4,21-3,86 (м, 4H), 2,58 (т, J=12,8 Гц, 2H), 2,43 (c, 3H), 1,65-1,46 (м, 5 H), 1,46-1,30 (c, 9 H), 1,14-0,87 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 154,7, 144,8, 132,9, 129,8, 127,9, 79,3, 68,0, 43,7, 35,2, 32,1, 31,6, 28,4, 21,6; MS (ESI) m/z 406,2 (100%, [M+H]+).
[0423]  трет-бутил 4-(2-цианоэтил)пиперидин-1-карбоксилат: В 15-мл колбу добавляли трет-бутил 4-(2-(тозилокси)этил)пиперидин-1-карбоксилат (0,4975 г, 1,30 ммоль), KCN (0,6981 г, 10,74 ммоль) и DMF (5 мл). Полученную суспензию тщательно перемешивали при 100°C в течение 4 ч и охлаждали до комнатной температуры. Затем суспензию медленно выливали в насыщенный раствор NaHCO3 (30 мл) и экстрагировали CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (2:1 гексан:EtOAc) дала желаемый продукт (0,2901 г, 94%) в виде бесцветного геля. 1H ЯМР (400 МГц, CDCl3) δ 4,09 (c, 2H), 2,67 (т, J=12,4 Гц, 2H), 2,36 (тд, J=7,1, 0,9 Гц, 2H), 1,80-1,50 (м, 5 H), 1,42 (c, 9 H), 1,08 (квд, J=12,2, 4,2 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 154,7, 119,5, 79,4, 43,6, 34,9, 31,7, 31,4, 28,4, 14,5.
трет-бутил 4-(2-цианоэтил)пиперидин-1-карбоксилат: В 15-мл колбу добавляли трет-бутил 4-(2-(тозилокси)этил)пиперидин-1-карбоксилат (0,4975 г, 1,30 ммоль), KCN (0,6981 г, 10,74 ммоль) и DMF (5 мл). Полученную суспензию тщательно перемешивали при 100°C в течение 4 ч и охлаждали до комнатной температуры. Затем суспензию медленно выливали в насыщенный раствор NaHCO3 (30 мл) и экстрагировали CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (2:1 гексан:EtOAc) дала желаемый продукт (0,2901 г, 94%) в виде бесцветного геля. 1H ЯМР (400 МГц, CDCl3) δ 4,09 (c, 2H), 2,67 (т, J=12,4 Гц, 2H), 2,36 (тд, J=7,1, 0,9 Гц, 2H), 1,80-1,50 (м, 5 H), 1,42 (c, 9 H), 1,08 (квд, J=12,2, 4,2 Гц, 2H); 13C ЯМР (100 МГц, CDCl3) δ 154,7, 119,5, 79,4, 43,6, 34,9, 31,7, 31,4, 28,4, 14,5.
[0424]  3-(1'-(мезитилсульфонил)-[1,4'-бипиперидин]-4-ил)пропаннитрил: трет-бутил 4-(2-цианоэтил)пиперидин-1-карбоксилат (0,3280 г, 1,38 ммоль) смешивали и перемешивали с HCl (1 мл) в 1,4-диоксане (4 мл) при комнатной температуре в течение 2 часов. После выпаривания растворителей полученную хлористоводородную соль 4-(2-цианоэтил)пиперидина нейтрализовывали насыщенным раствором NaHCO3 при 0°C, а затем экстрагировали CH2Cl2 (3×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении (низкий вакуум) с получением 3-(пиперидин-4-ил)пропаннитрила, который использовали для следующей стадии без дальнейшей очистки.
3-(1'-(мезитилсульфонил)-[1,4'-бипиперидин]-4-ил)пропаннитрил: трет-бутил 4-(2-цианоэтил)пиперидин-1-карбоксилат (0,3280 г, 1,38 ммоль) смешивали и перемешивали с HCl (1 мл) в 1,4-диоксане (4 мл) при комнатной температуре в течение 2 часов. После выпаривания растворителей полученную хлористоводородную соль 4-(2-цианоэтил)пиперидина нейтрализовывали насыщенным раствором NaHCO3 при 0°C, а затем экстрагировали CH2Cl2 (3×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении (низкий вакуум) с получением 3-(пиперидин-4-ил)пропаннитрила, который использовали для следующей стадии без дальнейшей очистки.
[0425] 3-(пиперидин-4-ил)пропаннитрил, описанный выше, 1-(мезитилсульфонил)пиперидин-4-он (0,3860 г, 1,37 ммоль), CH2Cl2 (4 мл), AcOH (0,080 мл, 1,40 ммоль) перемешивали при комнатной температуре в течение 25 мин и добавляли NaBH(OAc)3 (0,4298 г, 2,03 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 50 ч. Затем реакцию гасили насыщенным раствором NaHCO3 при 0°C, а затем экстрагировали CH2Cl2 (3×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) с получением желаемого продукта (0,0252 г, 5%, две стадии) в виде белого геля. 1H ЯМР (400 МГц, CDCl3) δ 6,94 (c, 2H), 3,63 (д, J=12,3 Гц, 2H), 2,90 (д, J=10,7 Гц, 2H), 2,74 (тд, J=12,4, 2,4 Гц, 2H), 2,60 (c, 6 H), 2,35 (т, J=7,2 Гц, 3H), 2,29 (c, 3H), 2,14 (т, J=9,6 Гц, 2H), 1,84 (д, J=12,7 Гц, 2H), 1,71 (д, J=12,3 Гц, 2H), 1,63-1,34 (м, 5 H), 1,24 (м, 2H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 131,9, 131,7, 119,7, 61,8, 49,2, 44,0, 34,8, 31,8, 31,7, 27,6, 22,8, 21,0, 14,6; MS (ESI) m/z 404,2 (100%, [M+H]+).
XIV. Синтез 3-(1-(мезитилсульфонил)пиперидин-4-ил)-6-метил-1,3-оксазинана
[0426]
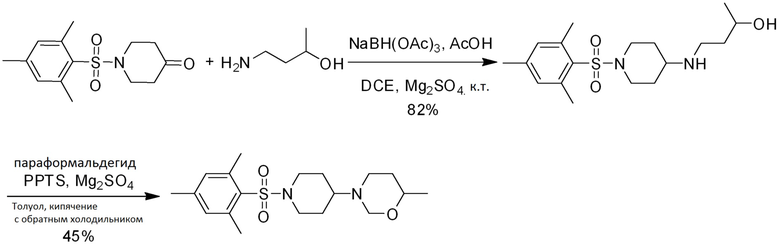
[0427]  4-((1-(мезитилсульфонил)пиперидин-4-ил)амино)бутан-2-ол получали в виде белого твердого вещества (82%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после восстановительного аминирования между 4-аминобутан-2-олом и 1-(мезитилсульфонил)пиперидин-4-оном с временем реакции 27 ч. Т.пл. 105-108°C; 1H ЯМР (500 МГц, CDCl3) δ 6,95 (c, 2H), 3,96 (ддд, J=8,9, 5,8, 2,4 Гц, 1H), 3,55 (д, J=12,5 Гц, 2H), 3,05 (дт, J=11,9, 4,2 Гц, 1H), 2,83 (тт, J=12,5, 3,3 Гц, 2H), 2,76 (тд, J=11,1, 2,9 Гц, 1H), 2,61 (c, 7 H), 2,30 (c, 3H), 1,96 (т, J=12,8 Гц, 2H), 1,63 (д, J=14,9 Гц, 1H), 1,47 (м, 1H), 1,34 (м, 2H), 1,16 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,6, 140,4, 131,9, 131,6, 69,5, 54,4, 45,5, 43,1, 43,0, 37,0, 31,8, 31,5, 23,6, 22,8, 21,0; MS (ESI) m/z 355,2 (100%, [M+H]+).
4-((1-(мезитилсульфонил)пиперидин-4-ил)амино)бутан-2-ол получали в виде белого твердого вещества (82%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после восстановительного аминирования между 4-аминобутан-2-олом и 1-(мезитилсульфонил)пиперидин-4-оном с временем реакции 27 ч. Т.пл. 105-108°C; 1H ЯМР (500 МГц, CDCl3) δ 6,95 (c, 2H), 3,96 (ддд, J=8,9, 5,8, 2,4 Гц, 1H), 3,55 (д, J=12,5 Гц, 2H), 3,05 (дт, J=11,9, 4,2 Гц, 1H), 2,83 (тт, J=12,5, 3,3 Гц, 2H), 2,76 (тд, J=11,1, 2,9 Гц, 1H), 2,61 (c, 7 H), 2,30 (c, 3H), 1,96 (т, J=12,8 Гц, 2H), 1,63 (д, J=14,9 Гц, 1H), 1,47 (м, 1H), 1,34 (м, 2H), 1,16 (д, J=6,2 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,6, 140,4, 131,9, 131,6, 69,5, 54,4, 45,5, 43,1, 43,0, 37,0, 31,8, 31,5, 23,6, 22,8, 21,0; MS (ESI) m/z 355,2 (100%, [M+H]+).
[0428]  3-(1-(мезитилсульфонил)пиперидин-4-ил)-6-метил-1,3-оксазинан: в 15-мл колбу, оборудованную обратным холодильником, добавляли 4-((1-(мезитилсульфонил)пиперидин-4-ил)амино)бутан-2-ол (0,1192 г, 0,34 ммоль), параформальдегид (0,0143 г, 0,48 ммоль), Mg2SO4 (0,2091 г, 1,74 ммоль), п-толуолсульфонат пиридиния (PPTS) (0,0025 г, 0,01 ммоль) и безводный толуол (4 мл). Суспензию перемешивали при кипячении с обратным холодильником в течение 3 ч и ей позволяли остыть до комнатной температуры. Затем суспензию выливали в делительную воронку, содержащую 30 мл насыщенного раствора NaHCO3, а затем экстрагировали CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии на силикагеле (1:19 MeOH:CH2Cl2) с получением желаемого продукта в виде бесцветного геля (0,0555 г, 45%). 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 4,61 (дд, J=10,0, 2,3 Гц, 1H), 4,16 (д, J=10,1 Гц, 1H), 3,57 (м, 3H), 3,11 (ддт, J=13,4, 4,4, 2,2 Гц, 1H), 2,89-2,68 (м, 4H), 2,58 (c, 6 H), 2,27 (c, 3H), 1,92 (дp, J=12,2, 2,8 Гц, 2H), 1,65-1,29 (м, 4H), 1,15 (д, J=6,1 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 131,9, 131,6, 81,6, 73,6, 55,0, 46,5, 43,4, 30,3, 29,8, 29,2, 22,8, 21,8, 20,9; MS (ESI) m/z 367,2 (100%, [M+H]+).
3-(1-(мезитилсульфонил)пиперидин-4-ил)-6-метил-1,3-оксазинан: в 15-мл колбу, оборудованную обратным холодильником, добавляли 4-((1-(мезитилсульфонил)пиперидин-4-ил)амино)бутан-2-ол (0,1192 г, 0,34 ммоль), параформальдегид (0,0143 г, 0,48 ммоль), Mg2SO4 (0,2091 г, 1,74 ммоль), п-толуолсульфонат пиридиния (PPTS) (0,0025 г, 0,01 ммоль) и безводный толуол (4 мл). Суспензию перемешивали при кипячении с обратным холодильником в течение 3 ч и ей позволяли остыть до комнатной температуры. Затем суспензию выливали в делительную воронку, содержащую 30 мл насыщенного раствора NaHCO3, а затем экстрагировали CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали с использованием флэш-хроматографии на силикагеле (1:19 MeOH:CH2Cl2) с получением желаемого продукта в виде бесцветного геля (0,0555 г, 45%). 1H ЯМР (400 МГц, CDCl3) δ 6,91 (c, 2H), 4,61 (дд, J=10,0, 2,3 Гц, 1H), 4,16 (д, J=10,1 Гц, 1H), 3,57 (м, 3H), 3,11 (ддт, J=13,4, 4,4, 2,2 Гц, 1H), 2,89-2,68 (м, 4H), 2,58 (c, 6 H), 2,27 (c, 3H), 1,92 (дp, J=12,2, 2,8 Гц, 2H), 1,65-1,29 (м, 4H), 1,15 (д, J=6,1 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 142,5, 140,4, 131,9, 131,6, 81,6, 73,6, 55,0, 46,5, 43,4, 30,3, 29,8, 29,2, 22,8, 21,8, 20,9; MS (ESI) m/z 367,2 (100%, [M+H]+).
XV. Синтез 1'-([1,1'-бифенил]-4-илсульфонил)-4-метил-1,4'-бипиперидина
[0429]

[0430]  1'-((4-бромфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде белого твердого вещества (83%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции образования сульфонамида между 4-бромбензол-1-сульфонилхлоридом и 4-метил-1,4'-бипиперидином. Т.пл. 165 -1 68°C; 1H ЯМР (400 МГц, CDCl3) δ 7,75-7,45 (м, 4H), 3,81 (д, J=11,9 Гц, 2H), 2,75 (д, J=11,5 Гц, 2H), 2,38-1,96 (м, 5 H), 1,81 (д, J=11,8 Гц, 2H), 1,73-1,52 (м, 4H), 1,28 (м, 1H), 1,22-1,06 (м, 2H), 0,87 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 135,2, 132,3, 129,1, 127,7, 61,3, 49,5, 46,1, 34,6, 31,0, 27,3, 21,9; MS (ESI) m/z 403,1 (100%, [M+H]+).
1'-((4-бромфенил)сульфонил)-4-метил-1,4'-бипиперидин получали в виде белого твердого вещества (83%) с использованием флэш-хроматографии (1:19 MeOH:CH2Cl2) после реакции образования сульфонамида между 4-бромбензол-1-сульфонилхлоридом и 4-метил-1,4'-бипиперидином. Т.пл. 165 -1 68°C; 1H ЯМР (400 МГц, CDCl3) δ 7,75-7,45 (м, 4H), 3,81 (д, J=11,9 Гц, 2H), 2,75 (д, J=11,5 Гц, 2H), 2,38-1,96 (м, 5 H), 1,81 (д, J=11,8 Гц, 2H), 1,73-1,52 (м, 4H), 1,28 (м, 1H), 1,22-1,06 (м, 2H), 0,87 (д, J=6,4 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 135,2, 132,3, 129,1, 127,7, 61,3, 49,5, 46,1, 34,6, 31,0, 27,3, 21,9; MS (ESI) m/z 403,1 (100%, [M+H]+).
[0431]  1'-([1,1'-бифенил]-4-илсульфонил)-4-метил-1,4'-бипиперидин: В высушенную пламенем колбу, оборудованную обратным холодильником, добавляли 1'-((4-бромфенил)сульфонил)-4-метил-1,4'-бипиперидин (0,2200 г, 0,55 ммоль), фенилбороновую кислоту (0,1065 г, 0,87 ммоль), тетракис(трифенилфосфин)палладий (0,0609 г, 0,053 ммоль), THF (8 мл) и Na2CO3 (2 M, 0,8 мл). Смесь дегазировали с помощью циклов замораживания-выкачивания-размораживания и кипятили с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры реакционную суспензию разбавляли водой (25 мл), перемешивали в течение 10 мин и экстрагировали DCM (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали, и осадок очищали с использованием флэш-хроматографии на силикагеле (1:19 MeOH:CH2Cl2) с получением указанного в заголовке продукта в виде белого твердого вещества (0,0433 г, 21%). Т.пл. 178-181°C; 1H ЯМР (400 МГц, CDCl3) δ 7,81 (д, J=8,4 Гц, 2H), 7,72 (д, J=8,4 Гц, 2H), 7,64-7,56 (м, 2H), 7,52-7,45 (м, 2H), 7,45-7,37 (м, 1H), 3,90 (д, J=12,1 Гц, 2H), 2,84 (д, J=10,8 Гц, 2H), 2,32 (тд, J=12,1, 2,5 Гц, 3H), 2,20 (т, J=11,9 Гц, 2H), 1,91 (д, J=12,6 Гц, 2H), 1,77-1,57 (м, 4H), 1,42-1,12 (м, 3H), 0,90 (д, J=5,9 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 145,6, 139,2, 134,6, 129,1, 129,1, 128,5, 128,2, 127,6, 127,3, 61,6, 49,4, 46,1, 34,1, 30,8, 27,1, 21,7; m/z 399,2 (100%, [M+H]+).
1'-([1,1'-бифенил]-4-илсульфонил)-4-метил-1,4'-бипиперидин: В высушенную пламенем колбу, оборудованную обратным холодильником, добавляли 1'-((4-бромфенил)сульфонил)-4-метил-1,4'-бипиперидин (0,2200 г, 0,55 ммоль), фенилбороновую кислоту (0,1065 г, 0,87 ммоль), тетракис(трифенилфосфин)палладий (0,0609 г, 0,053 ммоль), THF (8 мл) и Na2CO3 (2 M, 0,8 мл). Смесь дегазировали с помощью циклов замораживания-выкачивания-размораживания и кипятили с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры реакционную суспензию разбавляли водой (25 мл), перемешивали в течение 10 мин и экстрагировали DCM (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали, и осадок очищали с использованием флэш-хроматографии на силикагеле (1:19 MeOH:CH2Cl2) с получением указанного в заголовке продукта в виде белого твердого вещества (0,0433 г, 21%). Т.пл. 178-181°C; 1H ЯМР (400 МГц, CDCl3) δ 7,81 (д, J=8,4 Гц, 2H), 7,72 (д, J=8,4 Гц, 2H), 7,64-7,56 (м, 2H), 7,52-7,45 (м, 2H), 7,45-7,37 (м, 1H), 3,90 (д, J=12,1 Гц, 2H), 2,84 (д, J=10,8 Гц, 2H), 2,32 (тд, J=12,1, 2,5 Гц, 3H), 2,20 (т, J=11,9 Гц, 2H), 1,91 (д, J=12,6 Гц, 2H), 1,77-1,57 (м, 4H), 1,42-1,12 (м, 3H), 0,90 (д, J=5,9 Гц, 3H); 13C ЯМР (100 МГц, CDCl3) δ 145,6, 139,2, 134,6, 129,1, 129,1, 128,5, 128,2, 127,6, 127,3, 61,6, 49,4, 46,1, 34,1, 30,8, 27,1, 21,7; m/z 399,2 (100%, [M+H]+).
Пример 2. Анализ ингибирования APC in vitro
[0432] Низкомолекулярные соединения против злокачественной опухоли оценивали в отношении способности ингибировать активность APC в анализе in vitro. В таблице A представлена IC50, измеренная для каждого проиллюстрированного соединения.
[0433] Реагенты, требуемые для анализа, представляют собой: бромид (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия; тиазолил синий; RPI corp., каталожный номер № M92050); RPMI-1640 или среда по выбору (т.е. DMEM) без фенолового красного; 1 M Hepes; 100 мМ пируват Na; 1000X гентамицин (50 мг/мл); 100X пенициллин/стрептомицин/фунгизон; 1X PBS; Triton X-100; 1 Н HCl и изопропанол. Для получения раствора MTT (10x), порошок MTT растворяли в полной RPMI (или раствор DMEM) до конечной концентрации 5 мг/мл и стерилизовали фильтрацией через 0,2-мкм m фильтр. Раствор для солюбилизации MTT содержал 10% Triton X-100, 0,1 Н и 80% изопропанол. Раствор MTT разбавляли до 1X полной средой в количестве 12 мл на планшет. Планшеты для культивирования (96 лунок) извлекали из инкубатора и среду удаляли. Планшеты промывали три раза 1x PBS. В каждую лунку добавляли 100 мкл 1X раствора MTT и планшеты инкубировали в инкубаторе для культивирования тканей в течение 2-4 часов, в зависимости от клеточной линии. Клетки извлекали из инкубатора и раствор MTT удаляли. В каждую лунку добавляли 200 мкл 1X раствора для солюбилизации MTT с использованием многоканальной пипетки и клетки помещали в орбитальное устройство для встряхивания на 10 минут. Результаты считывали на устройстве для считывания микропланшетов для титрования (поглощение=570 нм, эталон=700 нм) и данные экспортировали.
[0434] Процентное ингибирование определяли относительно контрольных реакций без ингибитора и величины половинной максимальной ингибиторной концентрации (IC50) определяли с использованием стандартной аппроксимации по четырем параметрам к данным ингибирования. Термин "IC50", как используют в рамках изобретения, относится к количественной мере эффективности соединения в отношении ингибирования биологической или биохимической функции, которая указывает на количество, которое требуется для ингибирования данного биологического ответа (или компонента процесса) на 50%.
Аналоги для лечения рака толстого кишечника. Аналоги с IC50 менее 100 нМ в DLD-1 указаны полужирным шрифтом.

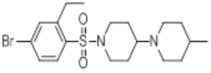





















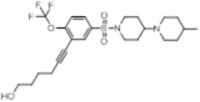














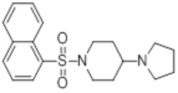


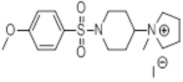


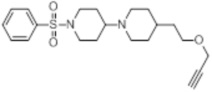
























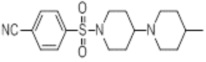

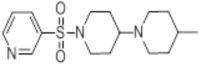






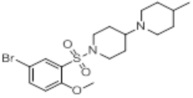




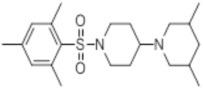















Пример 3. Укороченный селективный в отношении APC ингибитор 1 (TASIN-1) уничтожает линии CRC с укороченными APC, сохраняя нормальные эпителиальные клетки толстого кишечника человека (HCEC) и другие злокачественные клетки с APC дикого типа (WT), препятствует надлежащему образованию митотического веретена деления и индуцирует JNK-зависимую гибель апоптотических клеток в клетках укороченным APC.
[0435] Анализ эффекта дозы в двух аутентичных клеточных линиях CRC: HCT116 (WT APC) и DLD1 (укороченный APC) привел к идентификации лидирующего соединения TASIN-1 (укороченный селективный ингибитор APC) (фиг.7d)). Это соединение проявляло мощную и селективную токсичность в отношении клеток DLD1 (IC50=63 нМ), но не в отношении клеток HCT116 (IC50>10 мкМ) (фиг.7(e)). Длительная обработка TASIN-1 ингибировала рост в мягком агаре клеток DLD1, но не клеток HCT116 (фиг.7(f), 11)
[0436] Для подтверждения зависимости от укорочения APC, получали две независимых стабильных клеточных линии DLD1 с нокдауном, экспрессирующих кшРНК против укороченного APC. Нокдаун экспрессии укороченного APC приводил к десенсибилизации клеток DLD1 в TASIN-1 с уменьшением уровня белка >90% (фиг.8, 9), подтверждая, что APC или белок(белки) в соответствующем APC-зависимом каскаде являются мишенью TASIN-1. Аналогичные эффекты наблюдали в клетках HT29, из которых был устранен белок APC (фиг.10a). Кроме того, эктопическая экспрессия укороченного APC частично сенсибилизирует нуль-клетки по p53 HCT116 и HCT116 к TASIN-1 (фиг.10).
[0437] TASIN-1 исследовали в панели клеточных линий CRC с различающимся статусом APC. Несмотря на высокогетерогенный генетический фон, результаты показали устойчивую корреляцию между чувствительностью к TASIN-1 и статусом APC (фиг.9, 10). TASIN-1 не влиял на жизнеспособность эпителиальных клеток бронхов человека HCEC (HBEC) и фибробластных клеток BJ, которые происходят из нормальных тканей, а также клеток других типов злокачественной опухоли с APC WT. Однако клеточная линия рака молочной железы DU4475, экспрессирующая укороченный APC 15, была чувствительной к TASIN-1, вновь подтверждая зависимость от укорочения APC (фиг.10-12, таблица данных 1).
Таблица данных 1. Статус APC и происхождение других типов злокачественных опухолей.
[0438] TASIN-1 вызывал расщепление поли(ADP-рибоза)-полимеразы 1 (PARP1), высвобождение цитохрома c из митохондрий и индуцировал активность каспазы 3/7 в клетках DLD1, но не в клетках HCT116 (фиг.14, 15 (a-c), 16), что указывает на индукцию апоптоза. Кроме того, обработка TASIN-1 привела к активации JNK через 48 часов в клетках DLD1, но не в клетках HCT116, и эта активация сохранялась в течение 72 часов (фиг.15(d)). Совместная обработка с ингибитором JNK SP600125 (Millipore) ослабляла эффекты TASIN-1, и эффективно ингибировала активацию JNK и устраняла расщепление PARP1, а также активацию каспазы 3/7 (фиг.15 (e-g)). В совокупности, эти данные демонстрируют, что TASIN-1 индуцирует JNK-зависимую апоптотическую гибель клеток DLD1.
Пример 4. Противоопухолевая активность TASIN-1 in vivo в модели с ксенотрансплантатом на мышах.
[0439] Противоопухолевую активность TASIN-1 in vivo исследовали в модели с ксенотрансплантатом опухоли на мышах. Мышам nude, у которых развились опухоли DLD1, инъецировали внутрибрюшинно либо растворитель (контроль), либо или 40 мг/кг TASIN-1 два раза в сутки в течение 18 суток. Введение TASIN-1 уменьшало размер ксенотрансплантатов опухолей (фиг.20) и снижало скорость роста опухоли (фиг.20) по сравнению с контрольными мышами. Не наблюдали чрезмерной токсичности и статистически значимых отличий массы тела у мышей между контрольной группой и группой введения TASIN-1 (фиг.21 (g)). Сходную противоопухолевую активность наблюдали в ксенотрансплантатах HT29, которые также содержали укороченный APC и демонстрировали чувствительность, сходную с DLD1, in vitro (фиг.21(c) и 22). Однако TASIN-1 не ингибировал рост опухоли в ксенотрансплантатах HCT116 (WT APC) (Фигура 21(d) и 23), демонстрируя, что TASIN-1 сохраняет селективность in vivo. Иммуногистохимиический анализ вырезанных опухолей продемонстрировал, что TASIN-1 индуцировал значительное увеличение уровня маркера апоптоза, расщепленной каспазы 3, в опухолях DLD1, когда вводили TASIN-1, по сравнению с контрольными опухолями (фиг.25 (b)). Индукцию апоптоза подтверждали путем обнаружения расщепленного PARP1 в лизатах опухолей из контрольных ксенотрансплантатов DLD1 и ксенотрансплантатов DLD1 после введения TASIN-1 (фиг.25 (c)).
Пример 5. Противоопухолевые эффекты TASIN-1 у мышей CPC;Apc
[0440] Учитывая, что TASIN-1 имеет длительное время удержания в ткани толстого кишечника мыши (фиг.18 и 24(a)), далее исследовали противоопухолевые эффекты у мышей CPC;Apc, модели на модифицированных способами инженерии мышах, у которых преимущественно развиваются опухоли ободочной и прямой кишки. Эти мыши имеют трансген рекомбиназы CDX2P-NLS Cre и нацеленный на loxP аллель Apc, который делетирует экзон 14, что приводит к сдвигу рамки считывания в кодоне 580 и укорочению белка APC (Hinoi, T. et al. Mouse model of colonic adenoma-carcinoma progression based on somatic Apc inactivation. Cancer Res 67, 9721-9730 (2007)). Мышам в возрасте ~110 суток инъецировали внутрибрюшинно либо растворитель, либо 20 мг/кг/инъекция TASIN-1, два раза в неделю в течение 90 суток. Массу измеряли каждые 15 суток в ходе периода лечения. Эти исследования проводили в соответствии с руководствами UT Southwestern Institutional Animal Care and Use Committee.
[0441] Введение TASIN-1 приводило к значительному уменьшению образования опухоли в толстом кишечнике мышей CPC;Apc (фиг.20-22). Доброкачественные опухоли (полипы), которые развивались у мышей CPC;Apc, которым вводили TASIN-1, были значительно меньшими по сравнению с контрольной группой (фиг.21f). Кроме того, у мышей, которым вводили TASIN-1, с меньшей нагрузкой опухоли, увеличение массы тела происходило масса до уровня, сходного с мышами WT, в ходе лечения в течение 90 суток (фиг.21(g)). Наконец, мыши, которым вводили TASIN-1, продемонстрировали подавление экспрессии панели генов воспалительного ответа (Фигура 24(с)) и сниженное окрашивание Ki67 и циклина D1, сопровождающееся увеличенным окрашиванием расщепленной каспазы 3 в срезах опухоли толстого кишечника. Взятые вместе, эти эксперименты in vivo демонстрируют, что TASIN-1 эффективно снижает образование опухоли как в ксенотрансплантатах опухоли человека, так в моделях на модифицированных способами инженерии мышах CRC без заметной токсичности.
[0442] Хотя описанное изобретение описано применительно к его конкретным вариантам осуществления, специалистам в данной области должно быть понятно, что могут быть внесены различные изменения и эквиваленты могут быть заменены без отклонения от истинной сущности и объема изобретения. Кроме того, многие модификации можно проводить для адаптации конкретной ситуации, материала, композиции, процесса, стадии или стадий процесса к объективной сущности и объему описанного изобретения. Подразумевается, что все такие модификации входят в объем прилагаемой формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> UT Southwestern Medical Center
Debrabander, Jef
Shay, Jerry W.
Wang, Wentian
<120> ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА, НАЦЕЛЕННЫЕ НА УКОРОЧЕННЫЕ БЕЛКИ
ДЕНОМАТОЗНОГО ПОЛИПОЗА ТОЛСТОГО КИШЕЧНИКА (APC)
<130> 17541.0006
<140> PCT/US 14/054987
<141> 2014-09-10
<150> US 61/875,933
<151> 2013-09-10
<150> US 61/930,754
<151> 2014-01-23
<160> 26
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 1
ttgtgccaag tctggagatg 20
<210> 2
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 2
ttctcagagc ggatgaaggt 20
<210> 3
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 3
tgaccttgct ccagactgc 19
<210> 4
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 4
ttgacccaga ccttgacctc 20
<210> 5
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 5
atgaacaagt ggctgtgctg 20
<210> 6
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 6
tcacacagga gctgatgacc 20
<210> 7
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 7
tctggtctgc ctgtggagta 20
<210> 8
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 8
caaaggacca aagacctcca 20
<210> 9
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 9
aattgcacca actcctcagc 20
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 10
tcgattgcag ttcacgagag 20
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 11
tgaaatatgg cccactcaca 20
<210> 12
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 12
ctgtcttccc tgtcttggtt g 21
<210> 13
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 13
ggacctaccc ttgcaaacaa 20
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 14
tatcaggacc ctcagcttgg 20
<210> 15
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 15
gagcatccga attgcatca 19
<210> 16
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 16
acagcgtttg ctgaagagga 20
<210> 17
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 17
gtcttcgaac tgcagctgtg 20
<210> 18
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 18
tacccaggtt ccggtttgta 20
<210> 19
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 19
gagactcggg aagccaagat 20
<210> 20
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 20
ggtggtcttg agtggtcgat 20
<210> 21
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 21
cgctgccatt ctcttcctac 20
<210> 22
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 22
tcgatccttg aattcctgct 20
<210> 23
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кшРНК
<400> 23
taatgaacac tacagataga a 21
<210> 24
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кшРНК
<400> 24
ttctatctgt agtgttcatt a 21
<210> 25
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кшРНК
<400> 25
cccagtttgt ttctcaagaa a 21
<210> 26
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кшРНК
<400> 26
tttcttgaga aacaaactgg g 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПИРОПРОИЗВОДНЫЕ ПАРТЕНИНА В КАЧЕСТВЕ НОВЫХ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2009 |
|
RU2499798C2 |
| СПОСОБ СИНТЕЗИРОВАНИЯ НОВОГО ХИРАЛЬНОГО ЛИГАНДА, ХЕЛАТА МЕТАЛЛА, РАЗЛИЧНЫХ НЕПРИРОДНЫХ АМИНОКИСЛОТ, МАРАВИРОКА И ЕГО ОСНОВНЫХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2017 |
|
RU2727723C1 |
| БЕНЗОКСАЗИН-ОКСАЗОЛИДИНОНОВОЕ СОЕДИНЕНИЕ, ЗАМЕЩЕННОЕ АЗОТСОДЕРЖАЩИМ ГЕТЕРОЦИКЛОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2018 |
|
RU2744784C1 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ, АКТИВИРУЮЩИЕ ФЕРМЕНТЫ | 2013 |
|
RU2652989C2 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ПИКОЛИНАМИДА В КАЧЕСТВЕ ФУНГИЦИДОВ | 2015 |
|
RU2702088C2 |
| СОЕДИНЕНИЯ ПИКОЛИНАМИДА С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2708392C2 |
| СОЕДИНЕНИЯ ПИКОЛИНАМИДА С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2797810C2 |
| ИСПОЛЬЗОВАНИЕ ПИКОЛИНАМИДНЫХ СОЕДИНЕНИЙ С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2702697C2 |
| ПИКОЛИНАМИДЫ С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2703402C2 |
| ЛЕЧЕНИЕ ИНФЕКЦИЙ H. PYLORI С ПРИМЕНЕНИЕМ ИНГИБИТОРОВ MTAN | 2015 |
|
RU2663803C2 |


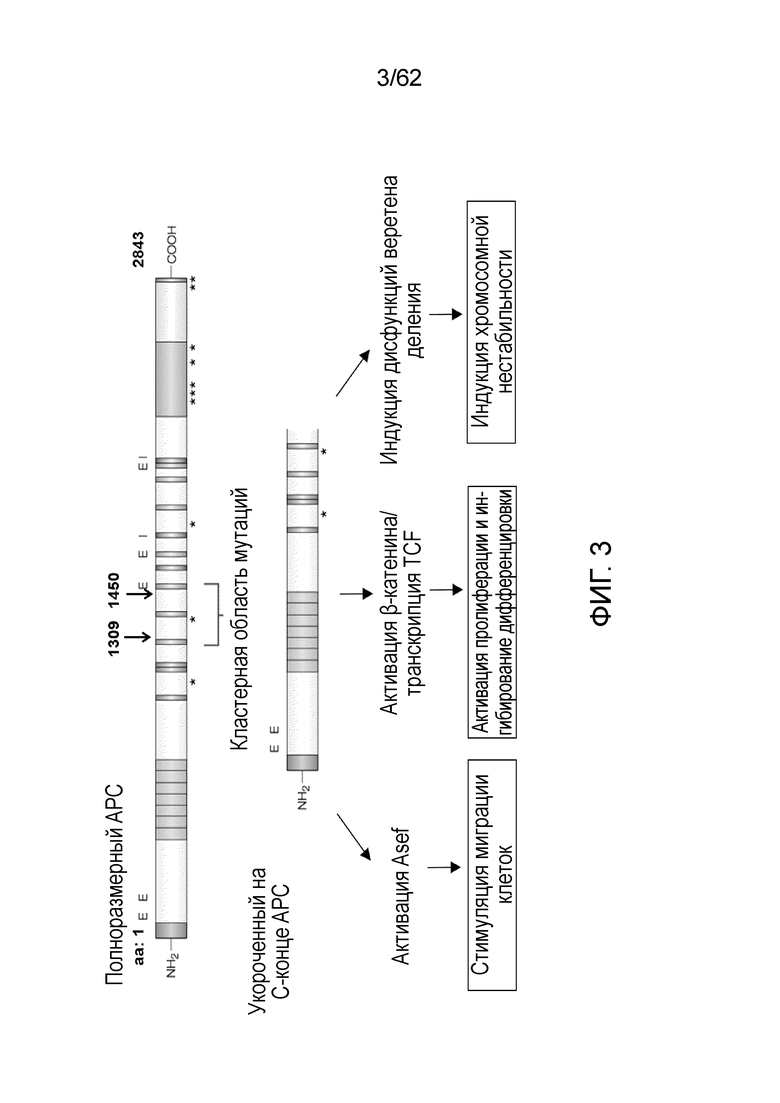




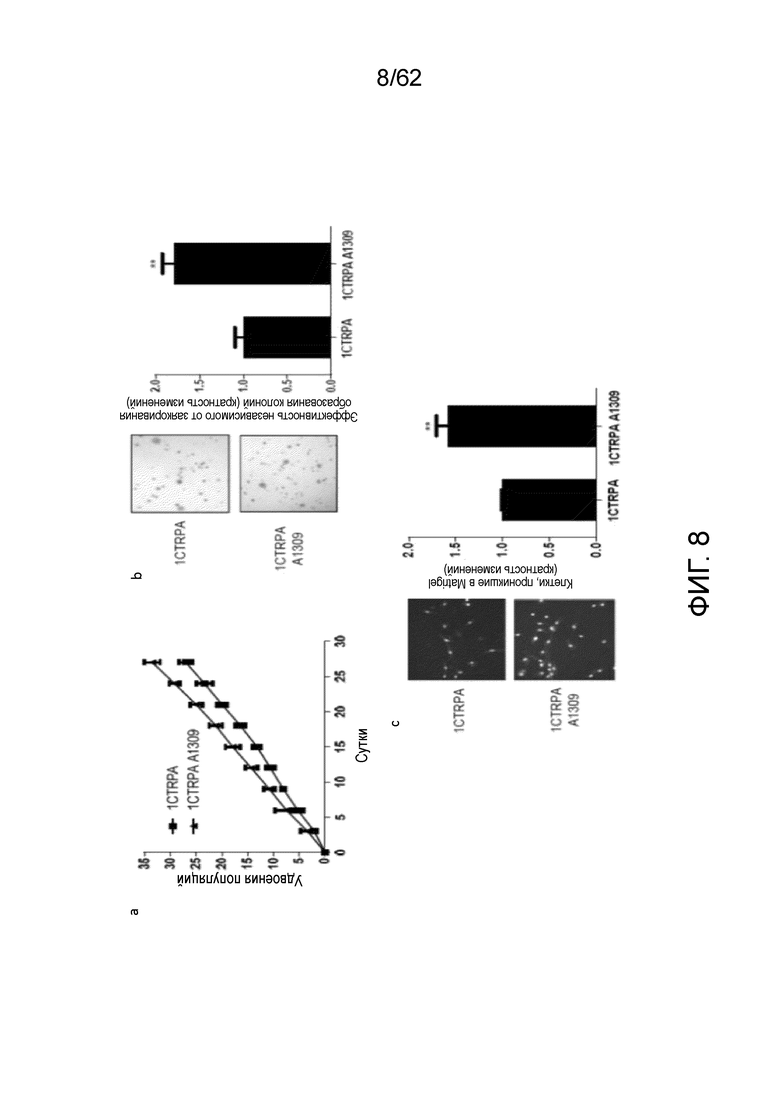


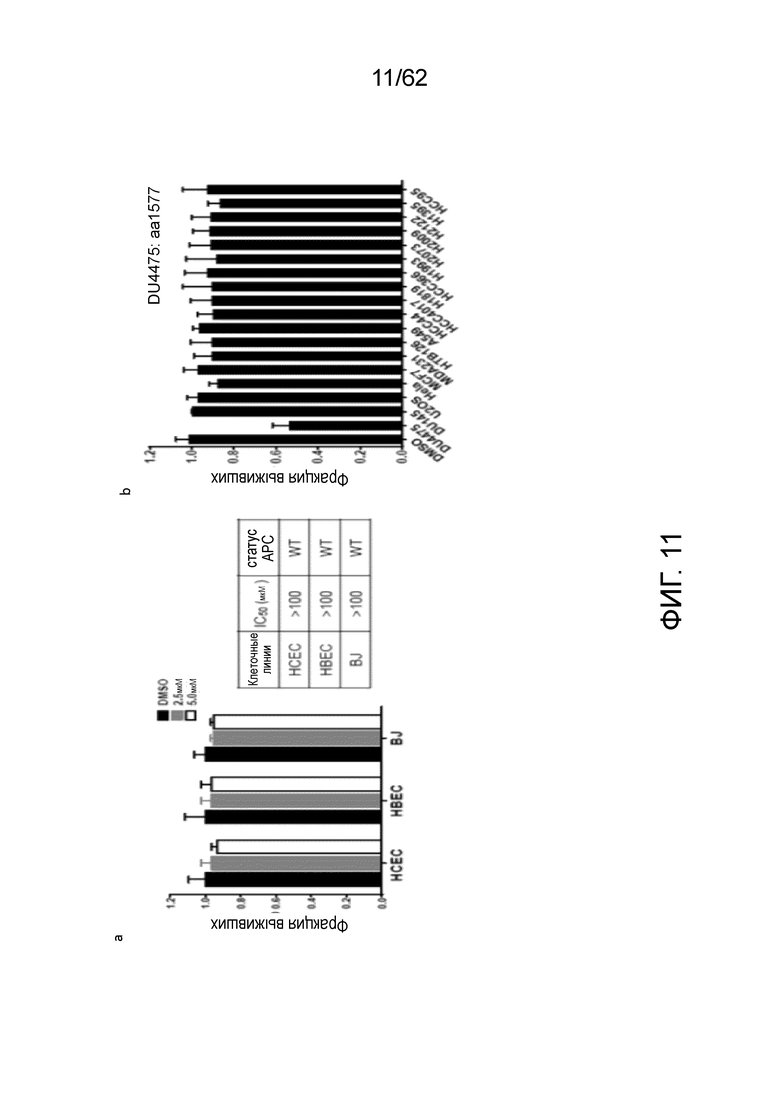





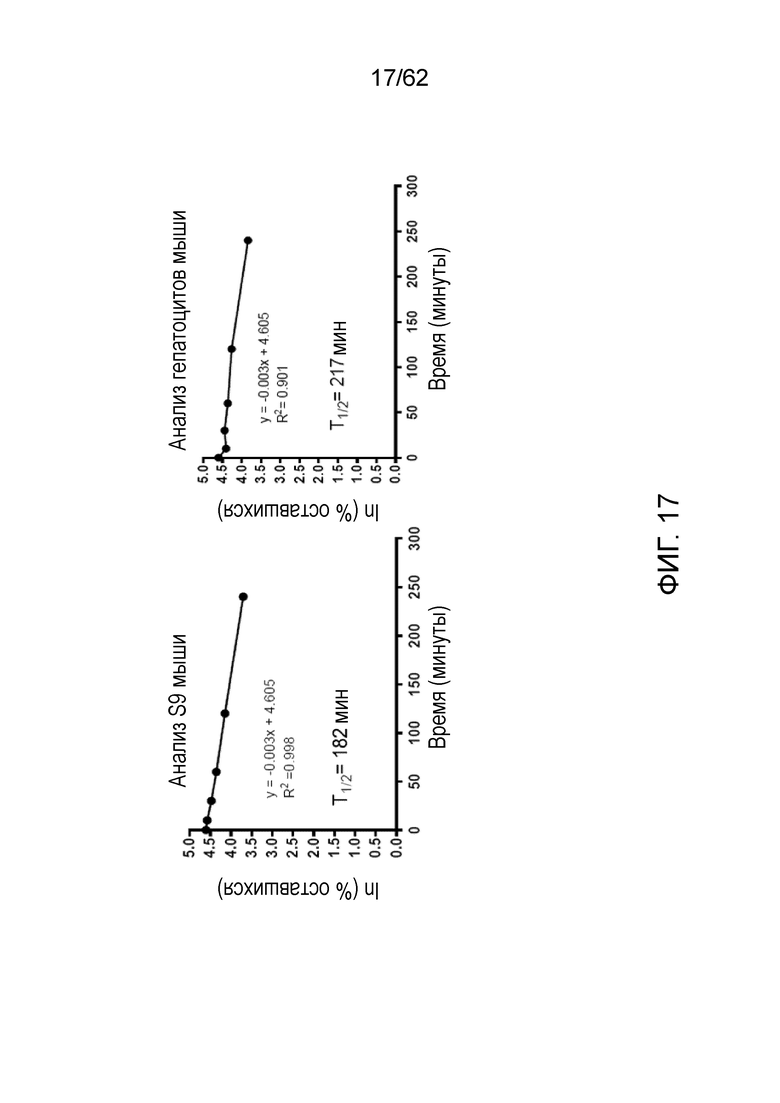



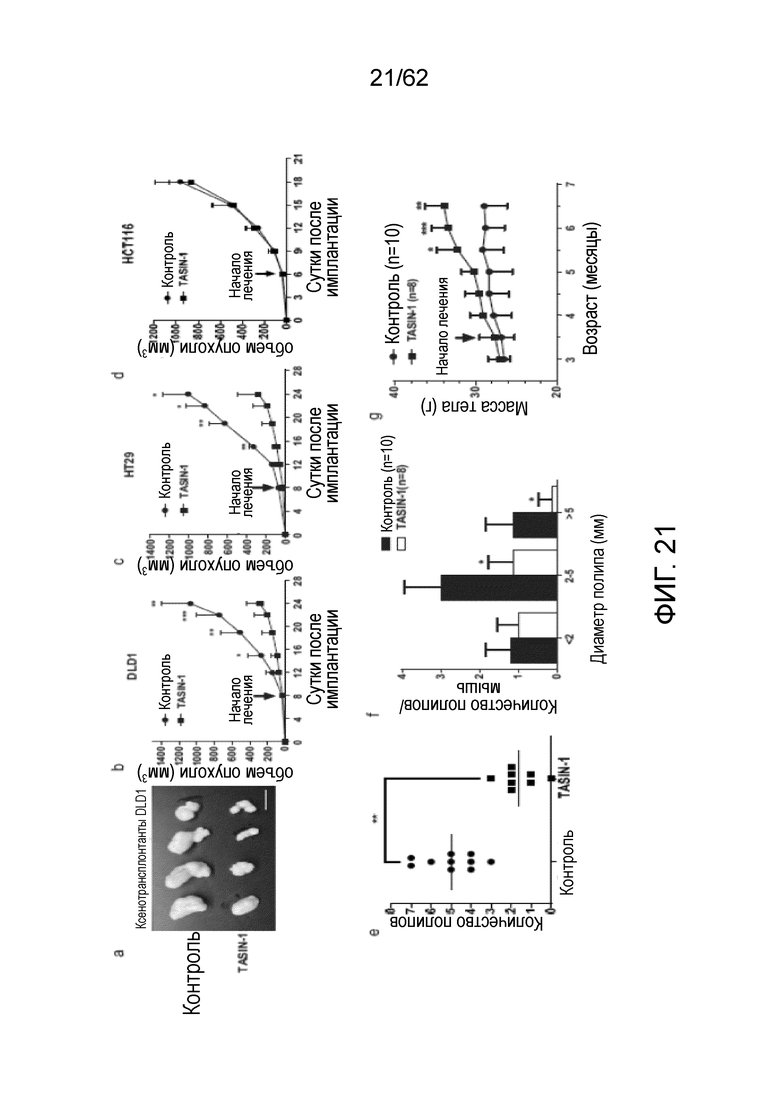


























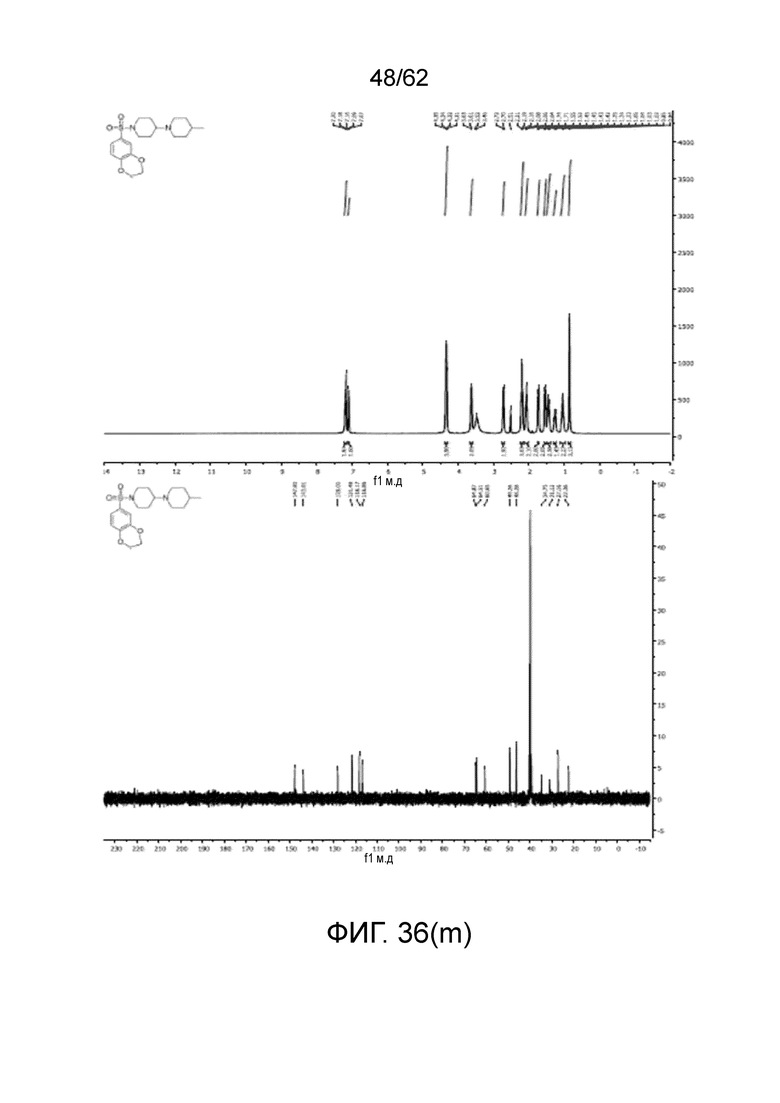









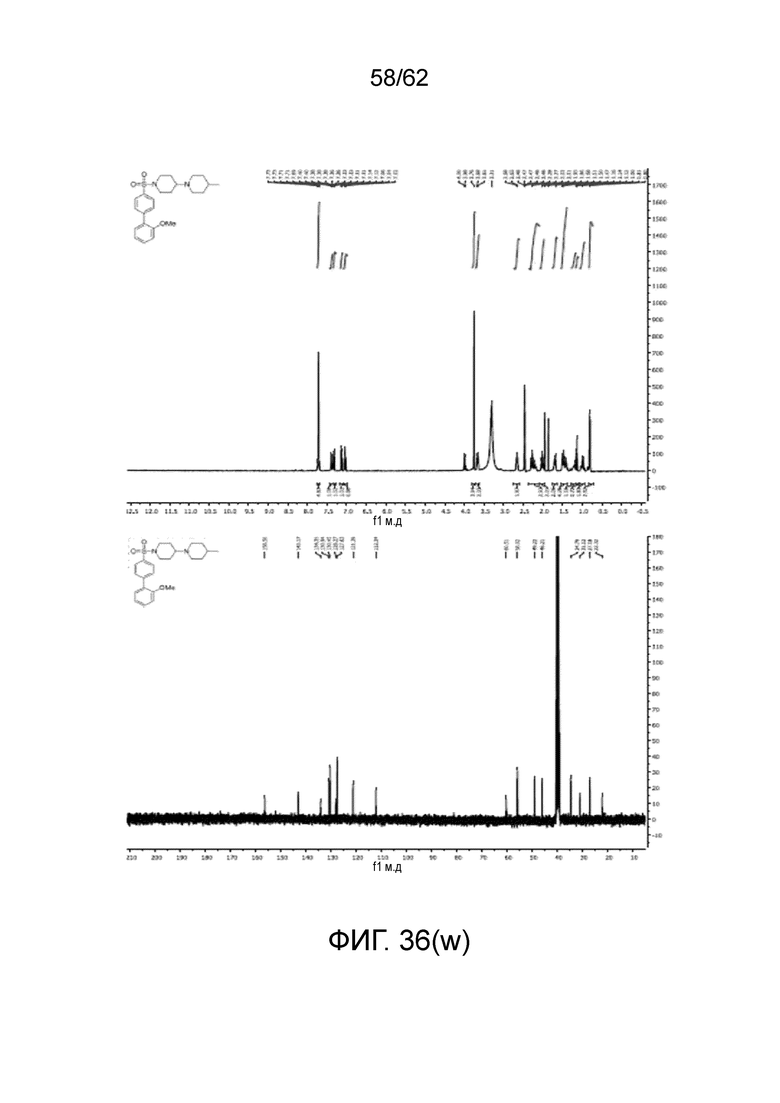




Изобретение относится к соединению формулы I-b:

(Формула I-b) ,
где L представляет собой SO2, каждый R1 и R2 независимо выбран из группы, состоящей из H и C1-4 алкила; R3 выбран из группы, состоящей из C1-3 алкила, необязательно замещенного R21; кольцо выбрано из группы, состоящей из
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  , и
, и  ;
;
каждый R4, R5, R7 и R8 независимо выбран из группы, состоящей из H, F, Cl, Br, C1-4 алкила, N3, NH2, CF3, OCHF2, OCF3, OC1-4 алкила, бензоила, —OCH2C≡CH, CN, и NO2;
R6 выбран из группы, состоящей из H, Br и R17; R9 представляет собой H; R10 представляет собой H или Br; каждый R11, R12 и R13 независимо представляет собой H, F, Cl или Br; каждый R14, R15 и R16 независимо представляет собой H, метил или этил; R17 представляет собой фенил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей NO2 и — NR18CO—(C1-4алкил); каждый R18 независимо представляет собой H; каждый R21 независимо выбран из группы, состоящей из H, CN и OR22; каждый R22 независимо представляет собой H; и к соединениям сходной структуры, представленным конкретными химическими формулами, а также к фармацевтической композиции для лечения рака толстого кишечника, включающей терапевтически эффективное количество таких соединений, и к способу лечения рака толстого кишечника. 6 н. и 3 з.п. ф-лы, 62 ил., 1 табл., 3 пр.
1. Соединение, выбранное из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
, 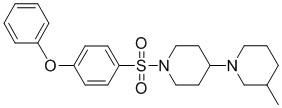 ,
,  ,
,  ,
,  ,
, 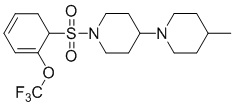 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
, 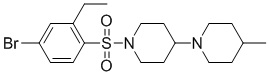 ,
, 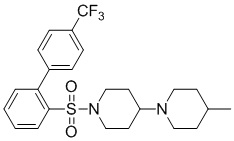 ,
,  ,
,  ,
, 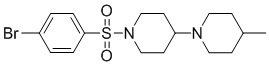 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 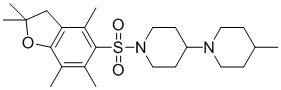 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 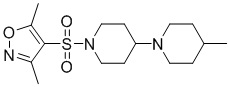 ,
, ,
, 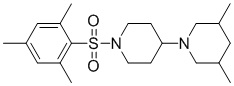 ,
,  ,
, 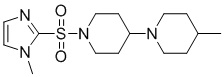 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 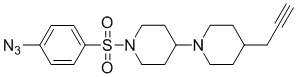 ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 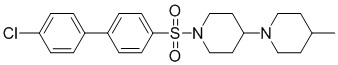 ,
,  ,
,  ,
, ,
,  ,
, 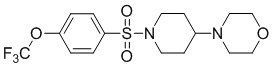 ,
, 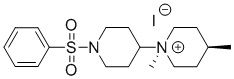 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  , и
, и
или его фармацевтически приемлемая соль.
2. Соединение по п.1, выбранное из группы, состоящей из:


или его фармацевтически приемлемая соль.
3. Соединение по п.1, где IC50 соединения составляет от 0,01 нМ до 5 мкМ.
4. Соединение формулы I-b:

(Формула I-b) ,
где
L представляет собой SO2,
каждый R1 и R2 независимо выбран из группы, состоящей из H и C1-4 алкила;
R3 выбран из группы, состоящей из C1-3 алкила, необязательно замещенного R21;
кольцо выбрано из группы, состоящей из
 ,
, 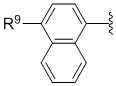 ,
,  ,
,  ,
,  ,
, 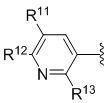 ,
, 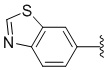 ,
,  ,
,  ,
,  , и
, и  ;
;
каждый R4, R5, R7 и R8 независимо выбран из группы, состоящей из H, F, Cl, Br, C1-4 алкила, N3, NH2, CF3, OCHF2, OCF3, OC1-4 алкила, бензоила, —OCH2C≡CH, CN и NO2;
R6 выбран из группы, состоящей из H, Br и R17;
R9 представляет собой H;
R10 представляет собой H или Br;
каждый R11, R12 и R13 независимо представляет собой H, F, Cl или Br;
каждый R14, R15 и R16 независимо представляет собой H, метил или этил;
R17 представляет собой фенил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей NO2 и —NR18CO—(C1-4алкил);
каждый R18 независимо представляет собой H;
каждый R21 независимо выбран из группы, состоящей из H, CN, и OR22;
каждый R22 независимо представляет собой H.
5. Фармацевтическая композиция для лечения рака толстого кишечника, включающая терапевтически эффективное количество соединения по п.1 или п.4 и фармацевтически приемлемый носитель.
6. Фармацевтическая композиция по п.5, где терапевтическое количество является эффективным для ингибирования роста опухоли, ингибирования пролиферации опухоли, для индукции гибели клеток или их комбинации.
7. Стереоизомер, диастереомер или энантиомер соединения по любому из пп. 1 или 4.
8. Фармацевтическая композиция для лечения рака толстого кишечника, включающая терапевтически эффективное количество соединения по п.7 и фармацевтически приемлемый носитель.
9. Способ лечения рака толстого кишечника у субъекта, эпителиальные клетки толстого кишечника которого экспрессируют по меньшей мере один укороченный белок APC, включающий введение субъекту фармацевтической композиции, включающей терапевтическое количество по меньшей мере одной малой молекулы соединения по пп. 1 или 4 и фармацевтически приемлемый носитель, где терапевтическое количество эффективно для ингибирования роста опухоли, ингибирования пролиферации опухоли, для индукции гибели клеток или их комбинации.
| PUBCHEM | |||
| Compound Summary for CID 47305059 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| PUBCHEM | |||
| Compound Summary for CID 2911561 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| PUBCHEM | |||
| Compound Summary for CID 22721249 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| PUBCHEM | |||
| Compound Summary for CID 57290202 | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| RU 2003127116 A 27.03.2005 | |||
| RU 2011134052 A 20.02.2013. | |||
Авторы
Даты
2020-07-22—Публикация
2014-09-10—Подача