Настоящее изобретение относится к новым фотосенсибилизирующим агентам и их использованию в фотохимической интернализации молекул и в фотодинамической терапии.
Из области техники известно большое количество фотосенсибилизирующих агентов. Под воздействием света они могут становиться токсичными или же могут высвобождать токсические вещества, такие как синглетный кислород и другие радикалы-окислители, которые способны повреждать клеточное вещество или биомолекулы, включая клеточные мембраны и клеточные структуры, и подобное повреждение клеток или мембран может, в конечном счете, убить клетки. Указанное цитотоксическое воздействие использовали при лечении различных аномалий или расстройств, включая болезни, относящиеся к опухолям. Подобное лечение известно как фотодинамическая терапия (ФДТ) и включает введение фотосенсибилизирующих (фотохимиотерапевтических) агентов в пораженный участок тела с последующим облучением активирующим светом с целью активировать фотосенсибилизирующие агенты и перевести их в цитотоксическую форму, при этом подвергнутые воздействию клетки погибают или же их способность к размножению понижается.
Совсем недавно фотодинамический эффект был предложен в качестве средства для введения молекул, которые иным образом не обладают способностью проникать сквозь мембраны, в цитозоль клетки таким образом, что это необязательно приводит к разрушению или смерти клетки. В указанном методе, известном как "фотохимическая интернализация", или ФХИ, молекулу, которую необходимо интернализировать или доставить, вводят в клетку в сочетании с фотосенсибилизирующим агентом. Воздействие на клетки света с подходящей длиной волны активирует фотосенсибилизирующее соединение, которое, в свою очередь, вызывает разрушение внутриклеточных ячеек мембраны и последующее высвобождение молекулы в цитозоль.
Фотосенсибилизирующие агенты могут проявлять свое действие посредством различных механизмов, прямо или косвенно. Так, например, некоторые фотосенсибилизаторы могут при активации светом непосредственно становиться токсическими, в то время как другие генерируют токсические частицы, например окислительные агенты, такие как синглетный кислород или образующиеся под действие кислорода свободные радикалы, которые обладают чрезвычайно сильным разрушительным воздействием по отношению к клеточному веществу и биомолекулам, таким как липиды, белки и нуклеиновые кислоты.
Известные фотосенсибилизирующие агенты включают, например, псоралены, порфирины, хлорины и фталоцианины. Порфириновые фотосенсибилизаторы оказывают прямое воздействие путем генерирования токсических кислородных частиц, и их рассматривают как наиболее подходящих кандидатов для использования в ФДТ. Порфирины встречаются в природе как предшественники в синтезе гема. В частности, гем образуется в том случае, когда железо (Fe2+) включается в состав фотопорфирина IX (PpIX) под действием фермента феррохелатазы. PpIX является весьма мощным фотосенсибилизатором, в то время как гем не проявляет фотосенсибилизирующих свойств.
Большое количество фотосенсибилизаторов на основе порфирина или относящихся к порфиринам соединений известно из данной области техники, а также описано в литературе. Примеры подобных агентов включают Photofrin®, который недавно был разрешен в качестве фотосенсибилизатора при лечении некоторых видов рака. Однако поскольку Photofrin® должен вводиться парентерально (например, внутривенно), то это вызывает неудобство, заключающееся в том, что такой способ приводит к продолжительной фотосенсибилизации кожи, которая может продолжаться в течение нескольких недель. Поскольку Photofrin® состоит из больших олигомеров порфирина, он также плохо проникает сквозь кожу, когда его наносят местно. Похожие проблемы возникают с другими фотосенсибилизаторами на основе порфирина, такими как так называемое "производное гематопорфирина" (HpD), которое также описано для использования в химиотерапии рака.
Недавно для использования в качестве фотосенсибилизирующих агентов были исследованы сульфированные мезотетрафенилпорфирины (TPPSns), такие как дисульфированные мезотетрафенилпорфины TPPS2a и TPPS2o и тетрасульфированный мезотетрафенилпорфин TPPS4, и было показано, что они обладают рядом важных преимуществ по сравнению с HpD и Photofrin®. В частности, они обладают высоким значением отношения опухолевая ткань : нормальная ткань, а потому представляют интерес для использования в фотохимиотерапии (Peng et al., Cancer Lett. 36: 1-10, 1987; Eversen et al., Photodynamic therapy of tumors and other diseases (Ed. G.Jori and C.Perria), p.215-219, Libreria Prongetto Publ., Padova; и Winkelman, Cancer Res. 22: 589-596, 1962). Недавно было также обнаружено, что TPPS2a подходит для использования в качестве фотосенсибилизатора для фотохимической интернализации макромолекул (Berg et al., Cancer Res. 59: 1180-1183, 1999: Högset et al., Hum. Gene Ther. 11: 869-880, 2000: и Selbo et al., Int. J. Cancer 87: 853-859, 2000).
Однако основным недостатком при использовании TPPS2a в клинических целях является низкое поглощение им красного света. В самом деле, основным ограничением при клиническом использовании всех известных производных порфирина является то, что наибольшая длина волны света, к которому они чувствительны, имеет лишь относительно низкое поглощение в диапазоне приблизительно 620-630 нм. При такой длине волны свет способен проникать в живые ткани лишь на небольшое расстояние, а следовательно, не может достигать глубоко расположенных клеток или тканей, например раковых клеток. Поэтому желательно найти альтернативные тетрапиррольные соединения, которое все еще обладали бы преимущественными свойствами известных фотосенсибилизаторов на основе порфирина, но, кроме того, обладали бы более высоким поглощением света с большей длиной волны, который лучше проникает в ткани.
Целью настоящего изобретения является решение указанной проблемы и, в частности, целью изобретения являются агенты, которые обладают повышенным фотосенсибилизирующим воздействием по сравнению с теми производными порфирина, которые известны из данной области техники.
Было обнаружено, что восстановление одной двойной связи в порфириновом макроцикле сульфированного мезотетрафенилпорфирина (например, дисульфированного мезотетрафенилпорфирина) приводит к соединениям, которые неожиданно проявляют фотосенсибилизирующие свойства. В частности, такие соединения обладают по сравнению с соответствующими порфиринами улучшенными спектральными характеристиками и, как было показано, имеют неожиданно высокий коэффициент экстинкции при экспонировании красным светом, например, в области от 630 до 680 нм. Таким образом, эти соединения рассматривают в качестве наиболее подходящих для использования не только в обычных методах фотодинамической терапии, но также и в методах фотохимической интернализации макромолекул.
Одним аспектом настоящего изобретения является фотосенсибилизирующий агент, который представляет собой сульфированный мезотетрафенилхлорин, например дисульфированный мезотетрафенилхлорин, или его фармацевтически приемлемую соль. В подобных соединениях по крайней мере одно из четырех фенильных колец обычно содержит 1, 2 или 3, предпочтительно 1, сульфогруппу. Предпочтительными соединениями в соответствии с изобретением являются такие соединения, в которых два фенильных кольца содержат по одной сульфогруппе в каждом из колец.
Еще одним аспектом настоящего изобретения является фотосенсибилизирующий агент, который может быть получен восстановлением одной двойной связи в порфириновом макроцикле сульфированного мезотетрафенилпорфирина, в частности агент, который может быть получен восстановлением двойной связи в порфириновом макроцикле дисульфированного мезотетрафенилпорфирина, таком как TPPS2a. Фармацевтически приемлемые соли такого соединения являются еще одним аспектом настоящего изобретения.
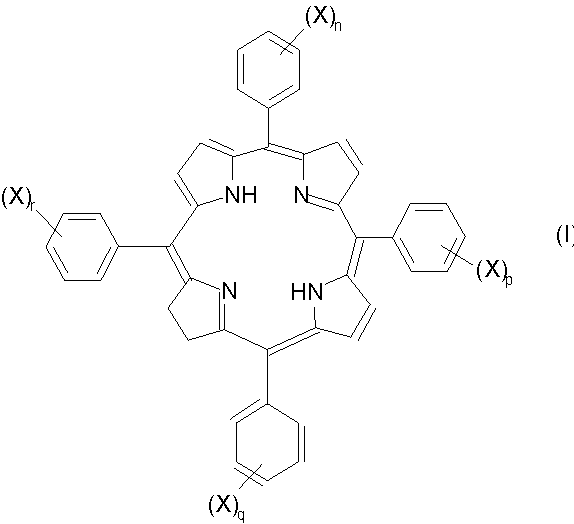
Примеры фотосенсибилизирующих агентов по изобретению включают такие соединения формулы I:
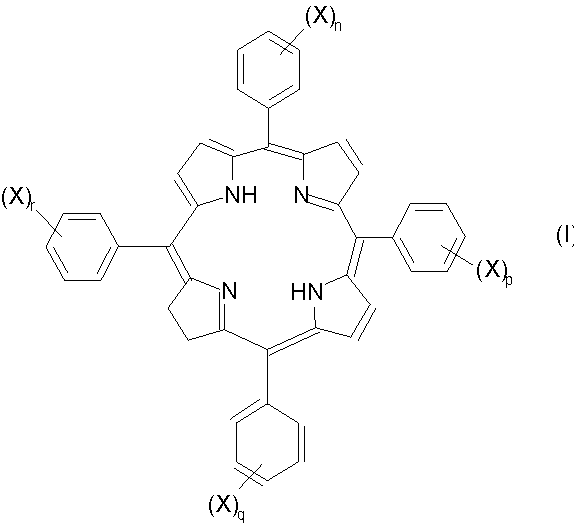
(где X означает -SO3H;
n, p, q и r каждый независимо обозначает 0 или 1, при этом сумма n, p, q и r является целым числом от 1 до 4, предпочтительно по крайней мере 2, например 2 или 4) и их фармацевтически приемлемые соли.
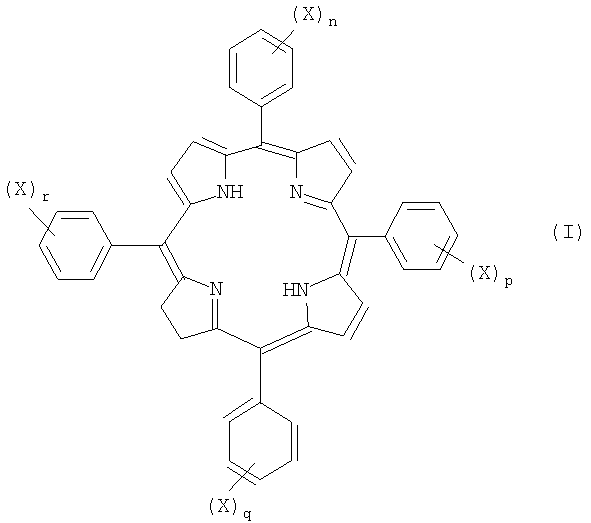
Изомерные формы соединений формулы I, например такие соединения, в которых восстановленная двойная связь расположена в любом из трех оставшихся пиррольных колец, авторы также рассматривают как часть настоящего изобретения. Любые смеси изомеров, включающие по крайней мере одно соединение формулы I или его изомер, рассматривают как часть настоящего изобретения. Примеры изомеров соединений формулы I, которые наиболее подходят для использования по изобретению, включают следующие соединения формул Ia-Ic:
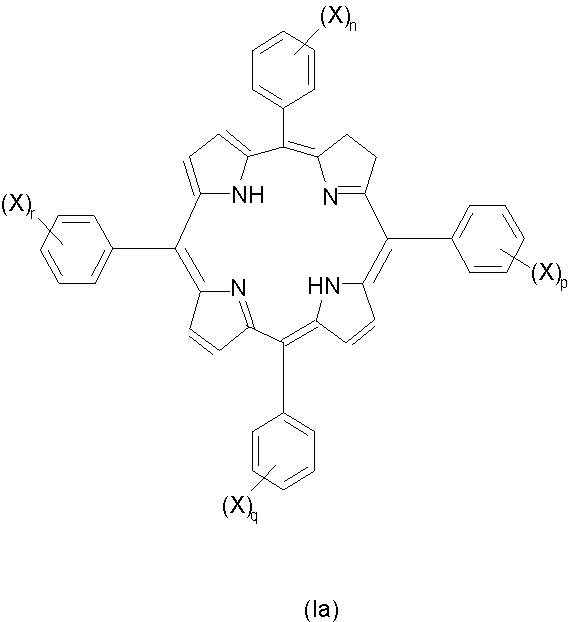
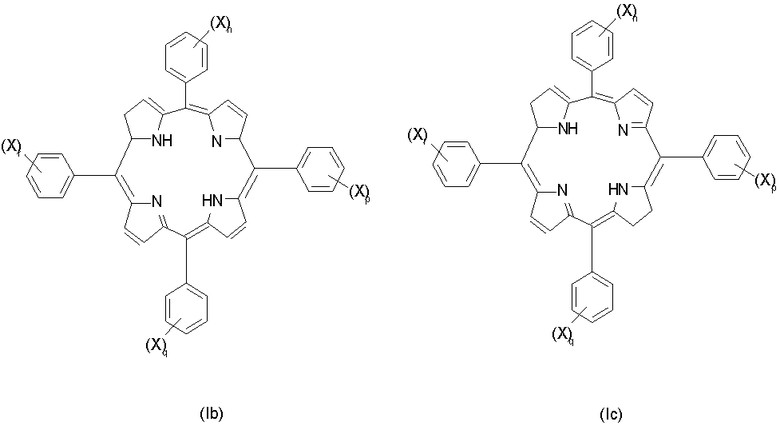
(где значения X, n, p, q и r указаны выше).
Для соединений формул I, Ia, Ib и Ic, в которых любой из n, p, q и r равен 1, это означает присутствие единственной сульфогруппы, которая присоединена к фенильной группе в любом положении кольца (например, орто-, мета- или пара-). В тех случаях, когда присутствует более одной сульфогруппы, указанные сульфогруппы могут находиться в одинаковых или в разных положениях каждого фенильного кольца. Предпочтительно указанные группы находятся в одинаковых положениях кольца, более предпочтительно в мета- или пара-положении. Если любой из n, p, q или r равен 0, то это означает отсутствие любых заместителей в кольце; примером является незамещенный фенил.
Особенно предпочтительными соединениями формул I, Ia, Ib или Ic, являются такие соединения, в которых сумма n, p, q и r равна 2. Наиболее предпочтительными являются такие соединения, в которых замещенные фенильные кольца расположены по соседству друг с другом, в частности примыкают к восстановленному пиррольному кольцу, например, такие соединения формулы I, в которых n=0, p=0, q=1 и r=1. Альтернативные предпочтительные соединения формул I, Ia, Ib или Ic включают такие соединения, в которых сумма n, p, q и r равна 2, а замещенные фенильные кольца расположены напротив друг друга, например соединения формулы I, в которых n=0, p=1, q=0 и r=1.
Независимо, в каждом фенильном кольце сульфогруппа X может находиться в орто-, мета- или пара-положении. Предпочтительно она находится в мета- или пара-положении, наиболее предпочтительно в пара-положении. Предпочтительные соединения по настоящему изобретению включают соединения формулы II:
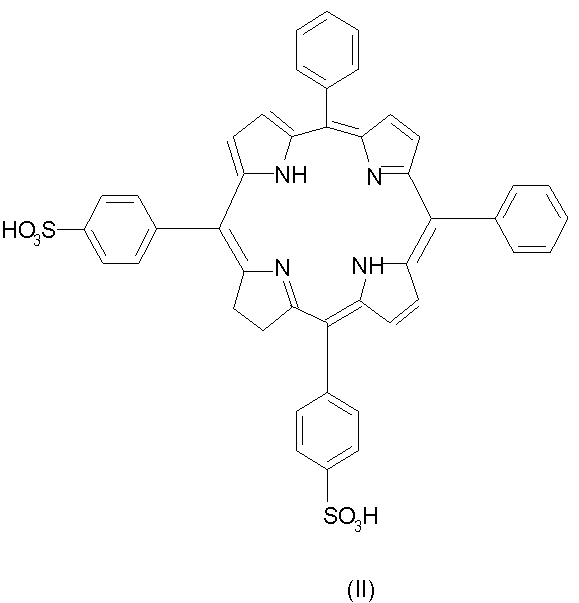
Изомерные формы соединений формулы II, например такие, в которых восстановленная двойная связь расположена в одном из трех оставшихся пиррольных колец, также являются частью изобретения. Частью настоящего изобретения является любая смесь изомеров, включающая по крайней мере одно соединение формулы II и его изомеры.
Особенно предпочтительным соединением формулы II является такое соединение, в котором рассматриваемые два замещенных фенильных кольца примыкают к восстановленной двойной связи.
Соединения по настоящему изобретению могут быть получены с помощью стандартных способов и методов, хорошо известных из данной области техники. Наиболее удобно указанные соединения получать восстановлением соответствующего порфирина.
Таким образом, еще одним аспектом настоящего изобретения является способ получения соединений по изобретению, при этом указанный способ включает, по крайней мере, одну из следующих стадий:
(a) восстановление сульфированного тетрафенилпорфирина или его хелатного комплекса с железом, например восстановление тетрафенилпорфирина формулы III:
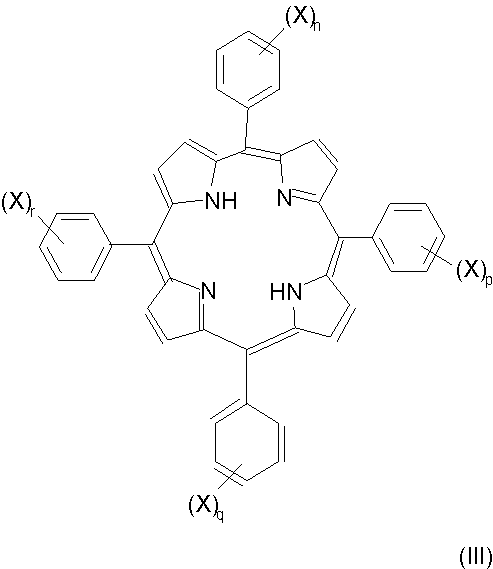
или его хелатного комплекса с железом (где значения X, n, p, q и r указаны ранее);
(b) разделение, в случае необходимости, смеси соединений, полученной на стадии (a), с использованием известных способов разделения; и
(c) превращение соединения, полученного на стадии (a) или на стадии (b), например соединения формулы I, в его фармацевтически приемлемую соль.
Производное порфирина, которое используют в качестве исходного продукта на стадии (a), доступно на рынке или же может быть получено с помощью методов, известных из данной области техники. Сульфированные порфирины, в том числе TPPS2a (дисульфированный тетрафенилпорфин), например, могут быть получены от компании Porphyrin Products (Логан, Юта, США).
Химическое превращение производного порфирина формулы III в соответствующий хлорин на стадии (a) можно химически осуществить несколькими разными способами, например с использованием п-толуолсульфонилгидразина в качестве предшественника диимида при восстановлении свободного основания порфирина (см., например, Whitlock et al., J. Am. Chem. Soc. 91: 7485-7489, 1969). Иначе получение требуемого хлорина можно осуществить восстановлением соответствующего железопорфирина, например, натрием в кипящем изоамиловом спирте (см. Eisner, J. Chem. Soc. 3461-3469, 1957; и Eisner et al., J. Chem. Soc. 733-739, 1957).
Наиболее предпочтительным для получения соединений по настоящему изобретению является фотохимическое восстановление порфиринов, необязательно в присутствии третичного аминового основания. Например, свободное основание порфирина можно фотохимически восстановить в хлорин в присутствии амина, в частности третичного амина (см., например, Harel et al., Photochem. Photobiol. 23: 337-341, 1976).
Восстановление молекулы порфирина в присутствии диимида за счет восстановления двух двойных связей в порфириновом макроцикле может привести к получению бактериохлоринов. Поэтому способ фотовосстановления с использованием амина, в частности преимущественно третичного амина, является предпочтительным для использования при получении требуемого производного хлорина по настоящему изобретению. Примеры подходящих третичных аминов для использования в указанном способе включают триэтиламин (ТЭА), N-метилпирролидон, три-н-бутиламин, триоктиламин и т.п., при этом восстановление обычно осуществляют в присутствии видимого света (т.е. проводят фотовосстановление).
Фотохимическое восстановление порфирина можно осуществить в растворителе или смеси растворителей, таких как бензол, пиридин, диметилсульфоксид и т.п.при температуре в диапазоне от 10 до 30°С, предпочтительно при комнатной температуре (например, от 20 до 25°С, в частности, 22°С).
Фотовосстановление можно осуществить с использованием света в видимом диапазоне, например, света с длиной волны в диапазоне от 400 до 640 нм, предпочтительно от 500 до 640 нм, например, приблизительно 545±15 нм. Облучение обычно проводят с интенсивностью от 1 до 50 Вт/м2, например приблизительно 15 Вт/м2, в течение времени от 1 до 90 мин, например от 5 до 40 мин. Образование любых нежелательных бактериохлоринов можно снизить путем сокращения времени, в течение которого порфириновый макроцикл подвергают воздействию света. Способы облучения порфиринов, например, с помощью ламп или лазеров хорошо известны из области техники. Для этой цели особенно подходят ксеноновая лампа высокого давления или иодновольфрамовая лампа, например лампы, которые поставляет компания Philips. Реакцию обычно проводят в анаэробных условиях, например, смесь исходного продукта и растворителя можно насыщать азотом перед тем, как подвергать воздействию света, и по выбору во время облучения светом.
Соединение по настоящему изобретению может быть в форме смеси изомеров и может быть использовано в таком виде. Если необходимо, соединения по настоящему изобретению, например соединения формулы I, можно разделить на их изомеры за счет разницы их физических/химических свойств с помощью методов, хорошо известных из данной области техники, например хроматографией и/или дробной кристаллизацией.
Как указано выше, соединения по настоящему изобретению могут принимать форму фармацевтически приемлемых солей. Указанные соли преимущественно представляют собой кислотно-аддитивные соли с физиологически приемлемыми органическими или неорганическими кислотами. Подходящими кислотами являются, например, соляная, бромистоводородная, серная, фосфорная, уксусная, молочная, лимонная, винная, янтарная, малеиновая, фумаровая и аскорбиновая кислоты. Гидрофобные соли удобно получать, например, осаждением. Подходящие соли включают, например, ацетат, бромид, хлорид, цитрат, гидрохлорид, малеат, мезилат, нитрат, фосфат, сульфат, тартрат, олеат, стеарат, тозилат, а также соли кальция, меглумина, калия и натрия. Методы получения солей хорошо известны из области техники.
Как указано ранее, соединения по настоящему изобретению и их соли обладают ценными фармакологическими свойствами, а именно: проявляют фотосенсибилизирующие свойства, которые делают их полезными для фотохимической интернализации макромолекул и в качестве фотохимиотерапевтических агентов.
Таким образом, еще одним аспектом настоящего изобретения является фармацевтическая композиция, включающая вышеуказанный фотосенсибилизирующий агент, в частности соединение формулы I или его фармацевтически приемлемую соль, вместе с по крайней мере одним фармацевтически приемлемым носителем или наполнителем.
Еще одним аспектом изобретения является вышеуказанный фотосенсибилизирующий агент, в частности соединение формулы I или его фармацевтически приемлемая соль, для применения в качестве лекарства, например в качестве фотосенсибилизирующего агента, который используют в методе фотохимической интернализации, фотохимиотерапии или диагностике.
Еще одним аспектом настоящего изобретения является применение вышеуказанного фотосенсибилизирующего агента, в частности, соединения формулы I или его фармацевтически приемлемой соли, для получения терапевтического средства, которое используют в способе фотохимической интернализации, фотохимиотерапии или диагностике, например при лечении расстройств или аномалий внешних или внутренних поверхностей тела, чувствительных к фотохимиотерапевтическому воздействию.
Термин "интернализация", используемый по тексту данной заявки, относится к доставке молекул в цитозоль и включает стадию высвобождения молекулы из внутриклеточных или связанных с мембранами ячеек в цитозоль клеток. Термин "клетка", используемый по тексту данной заявки, включает все эукариотные клетки (в том числе клетки насекомых и грибковые клетки). Таким образом, представители "клеток" включают все типы клеток млекопитающих и немлекопитающих, клетки растений, клетки насекомых, клетки грибков и простейших.
Способы введения молекул в цитозоль живых клеток полезны для управления и изучения биологических процессов. Особый интерес представляют методы, в которых клетки после интернализации остаются жизнеспособными и/или функциональноспособными. Использование фотосенсибилизирующих агентов для введения в цитозоль клетки молекул, которые иначе неспособны проникать сквозь мембраны, таким образом, что это необязательно приводит к разрушению или смерти значительного количества клеток, было предложено, например, в заявках WO 96/07432 или WO 00/54802. В указанном методе молекула, которую необходимо интернализовать, и фотосенсибилизирующий агент вводят в клетки одновременно или последовательно, после чего фотосенсибилизирующий агент и молекулу подвергают эндоцитозу или иным образом осуществляют транслокацию в цитоплазматические тельца, лизосомы или другие ограниченные мембранами внутриклеточные ячейки. Молекулу, которую необходимо подвергнуть транслокации в ячейки внутри клеток, и фотосенсибилизирующий агент вводят в клетку совместно или последовательно, и они накапливаются клеткой во внутриклеточных ячейках. Молекула, которую необходимо интернализовать в клетку, высвобождается под действием на клетку света с подходящей длиной волны, активирующего фотосенсибилизирующий агент, который, в свою очередь, приводит к разрушению мембран внутриклеточных ячеек и к последующему высвобождению молекулы внутрь цитозоля. Данный метод, в котором клетки подвергают воздействию света с целью высвободить представляющую интерес молекулу из внутриклеточной ячейки, в которой она содержится, за счет воздействия фотосенсибилизирующего агента, называют "фотохимической интернализацией" или ФХИ.
Таким образом, еще одним аспектом настоящего изобретения является способ введения молекулы (т.е. доставляемой молекулы) в цитозоль клетки как in vitro, так и in vivo, при этом указанный способ включает контактирование указанной клетки с вышеуказанным фотосенсибилизирующим агентом, в частности соединением формулы I или его фармацевтически приемлемой солью, контактирование указанной клетки с молекулой, которую необходимо ввести, и облучение указанной клетки светом с длиной волны, эффективной для активирования фотосенсибилизирующего агента, например светом с длиной волны в диапазоне 300-800 нм.
Точное время введения молекулы, которую необходимо доставить (т.е. доставляемой молекулы), и фотосенсибилизирующего агента и время облучения с целью добиться указанных ранее эффектов должно учитывать различные факторы, включая тип подвергаемых воздействию клеток, тип доставляемой молекулы, окружение клеток, а также учитывать, осуществляется ли способ in vitro или in vivo, осуществляется ли введение непосредственно в ткань-мишень или же осуществляют нанесение на периферическом участке. Если принять все эти факторы во внимание, то подходящее время может быть легко определено специалистами в данной области техники. Как правило, доставляемую молекулу и фотосенсибилизирующий агент вводят в клетки до облучения. Например, их можно вводить как одновременно, так и раздельно за период от 1 до 72 час до облучения, предпочтительно от 4 до 48 часов, в частности, от 4 до 24 часов до облучения.
В некоторых случаях доставляемую молекулу вводят одновременно с фотосенсибилизирующим агентом. Таким образом, еще одним аспектом настоящего изобретения является фармацевтическая композиция, включающая вышеуказанный фотосенсибилизирующий агент вместе с доставляемой молекулой. Дополнительно может присутствовать фармацевтически приемлемый носитель или наполнитель.
Еще одним аспектом настоящего изобретения является фармацевтическая композиция, включающая вышеуказанный фотосенсибилизирующий агент вместе с доставляемой молекулой для использования в терапии, в частности в терапии рака или генной терапии.
Еще одним аспектом настоящего изобретения является применение вышеуказанного фотосенсибилизирующего агента и/или доставляемой молекулы для приготовления лекарства для использования в терапии, в частности терапии рака или генной терапии, при осуществлении которой указанный фотосенсибилизирующий агент или указанная доставляемая молекула контактируют (либо отдельно, либо одновременно, либо последовательно) с клетками или тканями пациента, а указанные клетки или ткани облучают светом с длиной волны, эффективной для активирования указанного фотосенсибилизирующего агента. Способы лечения, включающие указанные способы, являются еще одним аспектом настоящего изобретения.
Фотосенсибилизирующий агент по изобретению может быть, таким образом, использован для переноса или трансфекции любой молекулы в цитозоль живой клетки как in vitro (т.е. в культуре) или in vivo. Это можно использовать не только для доставки молекул (или частей или фрагментов молекул) внутрь клетки, но в некоторых случаях и для презентирования или экспрессии их на поверхности клетки. Так, после транспортирования и высвобождения доставляемой молекулы в цитозоль клетки, если рассматриваемые клетки являются специализированными клетками, такими как, например, клетки, презентирующие антиген, молекула или ее фрагмент может быть перенесена на поверхность клетки, где она может быть презентирована вне клетки, т.е. на поверхности клетки. Указанный способ особенно полезен для вакцинации, при этом компоненты вакцины, т.е. антигены и иммуногены могут вводиться в клетку для презентирования на поверхности этой клетки с тем, чтобы вызвать, облегчить или усилить иммунный отклик. Дальнейшие детали, касающиеся полезности молекул, способных к экспрессии на поверхности клетки, приведены в заявке WO 00/54802.
Доставляемые молекулы, которые можно ввести в цитозоль клеток с помощью фотосенсибилизирующих агентов по настоящему изобретению, включают молекулы, которые с трудом проникают сквозь клеточные мембраны. Кроме того, вышеуказанные агенты могут облегчать доставку в цитозоль и усиливать активность молекул, которые лишь частично способны проникать сквозь мембрану клетки или мембраны внутриклеточных везикул. Доставляемые молекулы могут быть органическими соединениями, белками или фрагментами белков, такими как, например, пептиды, антитела или антигены или их фрагменты. Другим классом доставляемых молекул, которые можно вводить с помощью агентов по настоящему изобретению, являются цитотоксические лекарства, такие как белковые токсины или цитотоксические органические соединения. Молекулы, которые могут представлять клинический интерес для лечения рака, но применение которых ограничено вследствие низкой усвояемости или вследствие отсутствия усвояемости цитозолем, при использовании вышеуказанного способа могут быть введены в цитозоль и направлены в специфические клетки. Примером такой молекулы является гелонин.
В зависимости от типа доставляемой молекулы вышеуказанные способы могут быть использованы для лечения различных расстройств, таких как ревматоидный артрит, атеросклероз и сердечно-сосудистые заболевания, вирусные и другие инфекции, псориаз, солнечный кератоз, раны, переломы, бородавки и наследственные генетические расстройства, такие как фиброзно-кистозная дегенерация, синдром Горлина и синдром Луи-Бар.
Еще одним классом подходящих доставляемых молекул являются нуклеиновые кислоты. Нуклеиновые кислоты могут быть использованы в форме генов, кодирующих, например, терапевтические белки, десенсибилизирующих молекул РНК, рибозимов, ДНК-аптамеров и триплекс-образующих олигонуклеотидов. Иным образом нуклеиновые кислоты могут быть использованы в форме некодирующих молекул, таких как, например, синтетические десенсибилизирующие молекулы ДНК или РНК, рибозимы, аптамеры, триплекс-образующие олигонуклеотиды, пептиды нуклеиновых кислот (PNAs), фактор транскрипции ДНК-"ловушки" или химерные олигонуклеотиды для исправления специфических мутаций у пациента. Там, где это возможно, молекулы нуклеиновой кислоты могут быть в форме полного гена или фрагментов нуклеиновой кислоты, необязательно встроенных в векторную молекулу, в частности вектор плазмиды. Последняя форма особенно пригодна в том случае, когда доставляемую молекулу предполагают использовать в методе генной терапии, в котором гены терапевтически доставляются в клетки пациента. Она может быть использована при лечении многих заболеваний, таких как рак, сердечно-сосудистые заболевания, вирусные инфекции и моногенные расстройства, такие как фиброзно-кистозная дегенерация.
По выбору, фотосенсибилизирующий агент или доставляемая молекула, которую необходимо ввести в клетку, раздельно или же фотосенсибилизирующий агент и доставляемая молекула вместе могут быть присоединены, связаны или сопряжены с молекулами-носителями, нацеливающими молекулами или векторами, которые облегчают или ускоряют усвоение фотосенсибилизирующего агента или доставляемой молекулы или же могут нацеливать или доставлять указанные объекты в клетку определенного типа, ткань или внутриклеточную ячейку. Примеры систем-носителей включают полилизин и другие поликатионы, сульфат декстрана, различные катионогенные липиды, липосомы, реконструированные лектинзависимым лизисом (LDL) частицы или стерически стабилизированные липосомы. Указанные системы-носители обычно могут улучшать фармакокинетику и усиливать усвоение клетками доставляемой молекулы и/или фотосенсибилизирующего агента, а также могут направлять доставляемую молекулу и/или фотосенсибилизирующий агент во внутриклеточные ячейки, которые особенно полезны для достижения фотохимической интернализации, однако обычно не в состоянии нацелить доставляемую молекулу и/или фотосенсибилизирующий агент в специфические клетки (в частности, раковые клетки) или ткани. Тем не менее, для достижения указанного специфического или селективного нацеливания молекул-носителей доставляемая молекула и/или фотосенсибилизирующий агент могут быть связаны, присоединены или сопряжены со специфическими нацеливающими молекулами, которые способствуют усвоению доставляемой молекулы специфическими клетками в нужных клетках или тканях. Подобные нацеливающие молекулы могут также направлять доставляемую молекулу во внутриклеточные ячейки, которые особенно полезны для осуществления фотохимической интернализации.
Можно использовать большое количество нацеливающих молекул, в частности можно использовать молекулы, описанные в Curiel, D.T. (1999), Ann. New York Acad. Sci. 886, 158-171; Bilbao, G. et al. (1998) в Gene Therapy of Cancer (Walden et al., eds., Plenum Press, New York), Peng K.W. and Russell S.J. (1999), Curr. Opin. Biotechnol. 10, 454-457, Wickham T.J. (2000), Gene Ther. 7, 110-114.
Молекулы-носители и/или нацеливающие молекулы могут быть связаны, соединены или сопряжены с доставляемой молекулой, с фотосенсибилизирующим агентом или же с обоими вместе, при этом могут быть использованы одни и те же или же различные молекулы-носители и нацеливающие молекулы. Подобные нацеливающие молекулы или носители или могут также использоваться для того, чтобы направить доставляемую молекулу в конкретные внутриклеточные ячейки, которые особенно полезны для осуществления ФХИ, например в лизосомы или эндосомы.
Как указано ранее, фотосенсибилизирующий агент по настоящему изобретению может быть использован в фотодинамической терапии, в частности фотохимиотерапии или диагностике. Указанные способы хорошо описаны в патентной и научной литературе, например, в заявках WO 96/28412 и WO 98/30242.
В том случае когда фотосенсибилизаторы используют для проведения ФДТ, аномалии и расстройства, которые можно лечить, включают любые злокачественные, предзлокачественные и незлокачественные аномалии или расстройства, чувствительные к действию фотохимиотерапии, в частности опухоли или другие новообразование, кожные расстройства, такие как псориаз или старческий кератоз и прыщи, ссадины на коже, и другие заболевания или инфекции, в частности бактериальные, вирусные или грибковые инфекции, например вирусные герпесные инфекции.
Внутренние или внешние поверхности тела, которые можно лечить, используя соединения по настоящему изобретению, включают кожу и другие эпителиальные и серозные поверхности, включая, например, слизистые оболочки, выстилку органов, в частности, дыхательного, желудочно-кишечного и генитально-мочеиспускательного трактов, и железы, протоки которых могут выходить на эти поверхности (в частности, печень, волосяные фолликулы с сальными железами, молочные железы, слюнные железы и семенные везикулы). Помимо кожи, указанные поверхности включают, например, выстилку влагалища, эндометрия и уротелия. Эти поверхности могут также включать полости, образованные в теле после иссечения больных или раковых тканей, в частности, полости в мозгу после иссечения опухолей, таких как глиомы.
Таким образом, примеры поверхностей включают: (i) кожу и конъюнктиву; (ii) выстилку рта, глотки, кишечника, желудка, кишок и кишечных придатков, прямой кишки и заднепроходного канала; (iii) выстилку носовых ходов, носовой пазухи, носоглотки, трахеи, бронхов и бронхиол; (iv) выстилку мочеточников, мочевого пузыря и мочеиспускательного канала; (v) выстилку влагалища, шейки матки и матки; (vi) пристеночную и висцеральную плевру; (vii) выстилку брюшной и тазовой полости и выстилку поверхности органов, которые находятся внутри этих полостей; (viii) твердую мозговую оболочку и менинги; (ix) любые опухоли в твердых тканях, которые можно сделать доступными для фотоактивирующего света, в частности, как непосредственно во время проведения операции, так и с помощью оптического волновода, помещенного внутрь иглы.
Композицию по изобретению можно приготовить известным способом с использованием одного или большего количества физиологически приемлемых носителей или наполнителей в соответствии с методами, хорошо известными из данной области техники. Тип композиции и типы носителей или наполнителей, дозировки и т.п. могут быть выбраны обычным образом в соответствии с выбором и требуемым путем введения, целью лечения и т.д. Дозировки можно также определить обычным путем, и они могут зависеть от типа доставляемой молекулы (там, где она имеется), цели лечения, возраста пациента, способа назначения лекарства и т.п.
Композиции можно вводить местно, орально или системно. Для использования в ФДТ предпочтительны композиции для местного нанесения, и они включают гели, кремы, суспензии, спреи, лосьоны, целебные мази, палочки, мыла, порошки, вагинальные суппозитории, аэрозоли, капли, растворы и любые другие обычные фармацевтические формы, известные из области техники. Местное нанесение на недоступный участок может быть достигнуто с использованием методов, известных из области техники, в частности с помощью катетеров и других подходящих систем доставки лекарств.
В качестве альтернативы композиции могут быть приготовлены в форме, приспособленной для орального или парентерального введения, например путем внутрикожной, подкожной, внутрибрюшинной или внутривенной инъекции. Таким образом, альтернативные фармацевтические формы включают обыкновенные или покрытые оболочкой таблетки, капсулы, суспензии и растворы, содержащие активный компонент по выбору вместе с одним или большим количеством обычных инертных носителей и/или разбавителей.
Концентрация рассматриваемых в настоящем изобретении соединений в составе композиции зависит от предполагаемого использования соединения, типа композиции, способа введения композиции, состояния, лечение которого проводят, и от пациента и могут варьировать или регулироваться в соответствии со сделанным выбором. Однако в общем случае для использования в ФДТ диапазон концентрации фотосенсибилизатора может составлять от 0,01 до 50 мас.%, в частности, от 0,05 до 20 мас.%, например, 1-10 мас.%. При использовании для осуществления фотохимической интернализации важно, чтобы концентрация фотосенсибилизирующего агента была такой, чтобы после того, как агент попал в клетку, в частности оказался внутри или же оказался связан с одной из ячеек внутри клетки и был активирован облучением, произошло разрушение одной или большего количества клеточных структур, в частности одна или большее количество внутриклеточных ячеек претерпевает лизис или разрушается. Например, фотосенсибилизирующие агенты могут применяться с концентрацией от 10 до 50 мкг/мл. Для использования in vitro диапазон может быть значительно расширен, в частности до 0,05-500 мкг/мл. Для применения in vivo при лечении людей фотосенсибилизирующий агент может быть использован в количестве в диапазоне 0,05-20 мг на 1 кг массы тела при назначении системно или с концентрацией 0,1-20% в растворителе для местного нанесения. При использовании рассматриваемых соединений для осуществления фотохимической интернализации время взаимодействия клеток с фотосенсибилизирующим агентом в инкубаторе (т.е. время "контактирования") может варьировать от нескольких минут до нескольких часов, в частности, до 48 час и более. Инкубационное время должно быть таким, чтобы фотосенсибилизирующий агент усвоился соответствующими клетками. После обработки клеток в инкубаторе вместе с фотосенсибилизирующим агентом может по выбору последовать обработка их в инкубаторе не содержащей фотосенсибилизирующий агент средой, а уже затем на клетки действуют светом и/или добавляют доставляемую молекулу.
Определение подходящих доз молекул-мишеней для использования по настоящему изобретению является обычной процедурой для специалиста в данной области техники. В тех случаях, когда доставляемой молекулой является белок или пептид, для применения in vitro доставляемые молекулы обычно используют в дозах менее чем 5 мг/мл (в частности, 0,1-5 мг/мл), а для применения in vivo доставляемые молекулы обычно используют в дозах менее чем 5 мг/кг (в частности, 0,1-5 мг/кг). В тех случаях, когда доставляемой молекулой является нуклеиновая кислота, для применения in vitro примерная доза доставляемых молекул приблизительно составляет 0,1-50 мкг нуклеиновой кислоты на 104 клеток, а для применения in vivo - приблизительно 10-6-1 г нуклеиновой кислоты на одну инъекцию для человека.
После введения соединения или композиции по настоящему изобретению (в частности, на поверхность тела) на обработанную поверхность действуют светом с целью достижения необходимого эффекта, в частности фотохимической интернализации или фотохимиотерапевтического эффекта. Стадию облучения светом для активирования фотосенсибилизирующего агента можно осуществлять в соответствии с методиками и процедурами, хорошо известными из области техники. Подходящие источники света, способные излучать свет в нужном диапазоне длин волн и с нужной интенсивностью, хорошо известны из данной области техники. Время, в течение которого поверхность тела или клетки подвергают воздействию света в соответствии со способом настоящего изобретения, может варьировать. Например, оказывается, что при осуществлении ФХИ эффективность интернализации доставляемой молекулы в цитозоль возрастает с увеличением времени экспонирования светом. В общем случае продолжительность стадии облучения светом составляет от нескольких минут до нескольких часов, в частности предпочтительно в пределах 60 минут, например, от 1 до 30 мин, в частности от 0,5 до 3 мин, или от 1 до 5 мин, или от 1 до 10 мин, в частности от 3 до 7 мин и предпочтительно приблизительно 3 мин, например, от 2,5 до 3,5 мин. Приблизительная доза света может быть подобрана специалистом и зависит от количества фотосенсибилизатора, накопленного в клетках-мишенях или тканях. Доза облучения обычно составляет от 40 до 200 Дж/см2, например, 100 Дж/см2 при интегральной плотности потока менее 200 мВт/см2. Облучение светом с длиной волны в диапазоне 500-750 нм, в частности в интервале от 550 до 700 нм, особенно пригодно для in vivo использования рассматриваемых в настоящем изобретении методов.
Еще одним аспектом настоящего изобретения является способ фотохимиотерапевтического лечения расстройств и аномалий внешних или внутренних поверхностей тела, при этом указанный способ заключается в нанесении на пораженные поверхности фотосенсибилизирующего агента по настоящему изобретению, в частности соединения формулы I или его фармацевтически приемлемой соли, и облучении указанной поверхности светом, предпочтительно светом с длиной волны в диапазоне 300-800 нм, например, 500-700 нм.
Способы облучения различных поверхностей тела, в частности, лампами или лазерами хорошо известны из области техники (см., например, Van den Bergh, Chemistry in Britain, May 1986 p.430-439). Для недоступных участков этого можно обычно достичь с помощью оптических волокон.
Соединения по изобретению могут смешиваться или вводиться вместе с другими фотосенсибилизирующими агентами, например, ALA или Photofrin®, или с другими активными компонентами, которые могут усилить фотохимиотерапевтическое воздействие. Например, могут включаться агенты, способные образовать хелатные соединения, такие как аминополикарбоновые кислоты (в частности, ЭДТК), с целью усилить накопление Pp и, таким образом, усилить фотосенсибилизирующее воздействие. Агенты, способные образовать хелатные соединения, могут обычно использоваться с концентрацией от 0,05 до 20 мас.%, в частности, от 0,1 до 10 мас.%.
С целью усиления фотохимиотерапевтического воздействия могут также использоваться агенты, облегчающие проникновение сквозь кожу, в частности диалкилсульфоксиды, такие как диметилсульфоксид (ДМСО). Агенты, облегчающие проникновение сквозь кожу, могут обычно использоваться с концентрацией в интервале от 0,2 до 50 мас.%, в частности, приблизительно 10 мас.%.
В зависимости от состояния, лечение которого проводят, и типа композиции соединение, которое используют по настоящему изобретению, может вводиться совместно с другими агентами по выбору, например вводиться в виде совместной композиции или же они могут вводиться последовательно или раздельно. В самом деле, во многих случаях особенно благотворное фотохимиотерапевтическое воздействие может быть достигнуто с помощью предварительной обработки агентом, облегчающим проникновение сквозь кожу, которое осуществляют на специальной стадии перед введением соединений, используемых по настоящему изобретению.
Еще одним аспектом настоящего изобретения, таким образом, является продукт, включающий вышеуказанный фотосенсибилизирующий агент, в частности соединение формулы I или его фармацевтически приемлемую соль, вместе с по крайней мере одним агентом, облегчающим проникновение сквозь кожу, и по выбору с одним или более агентов, способных образовать хелатные соединения, в виде комбинированного препарата для одновременного, раздельного или последовательного использования для лечения расстройств или аномалий внешних или внутренних поверхностей тела, которые чувствительны к действию фотохимиотерапии.
Еще одним аспектом изобретения является набор для применения в фотохимиотерапии расстройств или аномалий внешних или внутренних поверхностей тела, включающий:
a) первый контейнер, содержащий рассматриваемый в настоящем изобретении фотосенсибилизирующий агент, в частности соединение формулы I или его фармацевтически приемлемую соль,
b) второй контейнер, содержащий по крайней мере один агент, облегчающий проникновение сквозь кожу; и по выбору
c) один или более агентов, способных образовать хелатные соединения, которые содержатся либо внутри указанного первого контейнера, либо в третьем контейнере.
Станет понятным, что терапевтический способ, использующий описываемые в настоящем изобретении соединения, неизбежно вызывает флуоресценцию расстройства или аномалии, лечение которого проводят. Помимо того что интенсивность этой флуоресценции может быть использована для удаления анормальных клеток, локализация указанной флуоресценции может быть использована для визуализации размера, протяженности и местоположения аномалии или расстройства.
Указанным образом идентифицированную или подтвержденную в изучаемом месте аномалию или расстройство затем можно лечить с помощью альтернативной терапевтического метода, в частности хирургическим или химическим методом лечения, или терапевтическим способом по настоящему изобретению путем продолжительного усиления флуоресценции или дальнейшим применением в соответствующем месте соединений по настоящему изобретению. Станет понятным, что для визуализации в методах диагностики могут потребоваться более низкие уровни флуоресценции, чем те, которые используются при терапевтическом лечении. Так, в общем случае пригодны концентрации в диапазоне от 0,2 до 30%, в частности 1-5% (мас./мас.). Места, методы и способы введения были рассмотрены ранее в связи с терапевтическим использованием и также применимы для диагностического использования, как это описывается в настоящем изобретении.
Соединения по настоящему изобретению могут также использоваться в методах in vitro диагностики, например, для исследования клеток, содержащихся в жидкостях, взятых из организма. Более сильная флуоресценция, связанная с ненормальными тканями, может быть удобным индикатором аномалии или расстройства. Указанный метод является высокочувствительным и может использоваться для раннего распознавания аномалий или расстройств, например, карциномы мочевого пузыря или легких путем изучения клеток эпителия соответственно в образцах мочи или мокроты. Другие полезные жидкости, взятые из организма, которые могут использоваться в диагностике, помимо мочи и мокроты, включают кровь, семенную жидкость, слезы, цереброспинальную жидкость и т.д. Можно исследовать образцы или препараты тканей, например образцы биопсии ткани или образцы костного мозга. Таким образом, настоящее изобретение распространяется на использование соединений по изобретению или их солей для диагностики при проведении фотохимиотерапии в соответствии с вышеуказанными способами, на продукты и наборы для проведения указанной диагностики.
Следующий аспект изобретения касается способа in vitro диагностики аномалий или расстройств, заключающийся в исследовании образца жидкости или ткани, взятой из тела пациента, при этом указанный способ включает по крайней мере следующие стадии:
i) смешивание указанной взятой из тела жидкости или ткани с фотосенсибилизирующим агентом, рассматриваемым в настоящем изобретении, в частности соединением формулы I или его фармацевтически приемлемой солью,
(ii) экспонирование указанной смеси светом, например светом с длиной волны в диапазоне 300-800 нм,
(iii) определение уровня флуоресценции и
(iv) сопоставление уровня флуоресценции с контрольными значениями.
Настоящее изобретение поясняется более подробно в следующих примерах, которые не ограничивают изобретение, и дается ссылка на сопроводительные чертежи.
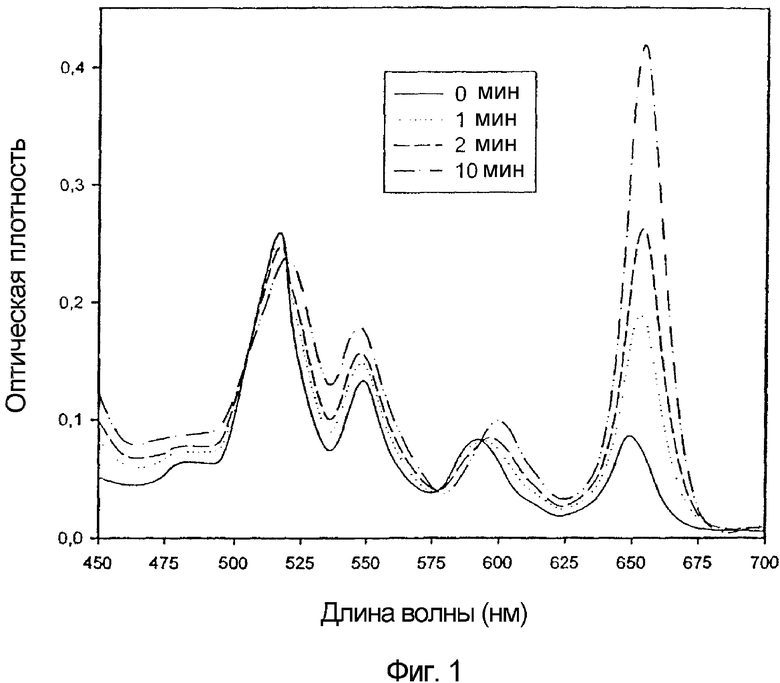
На фигуре 1 приведен спектр поглощения TPPS2a в присутствии триэтиламина (ТЭА) в бензоле до и после экспонирования монохроматическим светом в течение различных интервалов времени.
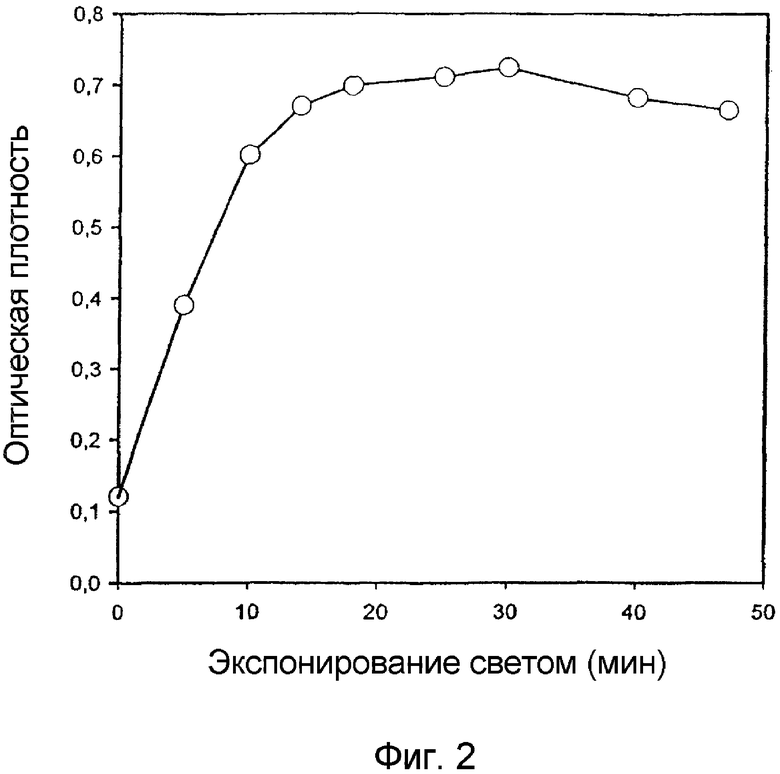
Фигура 2 представляет собой график, на котором показано влияние экспонирования светом на максимальную оптическую плотность пика TPPS2a в полосе 646-655 нм. Раствор TPPS2a в бензоле в присутствии триэтиламина экспонируют монохроматическим светом и измеряют оптическую плотность.
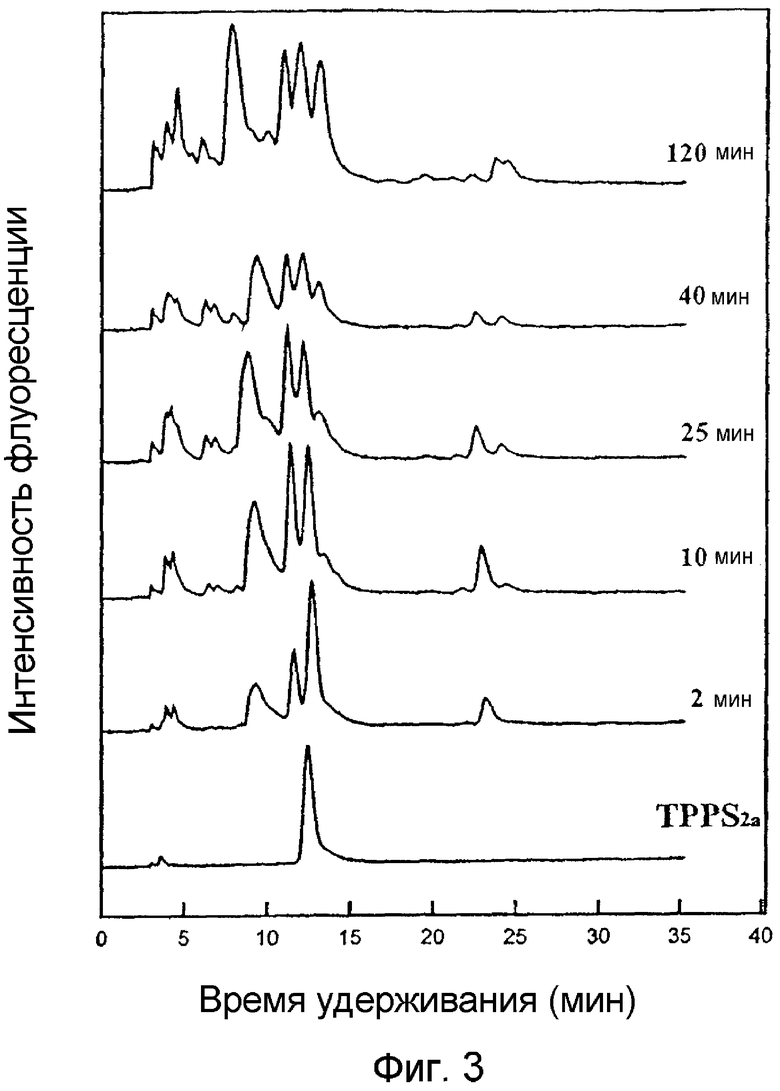
На фигуре 3 приведены ВЭЖХ-хроматограммы производных, полученных при облучении TPPS2a светом. TPPS2a в присутствии триэтиламина в бензоле экспонируют светом и анализируют образование флуоресцентных производных с помощью ВЭЖХ с обращенной фазой. Раствор экспонируют светом и отбирают образцы для проведения измерений.
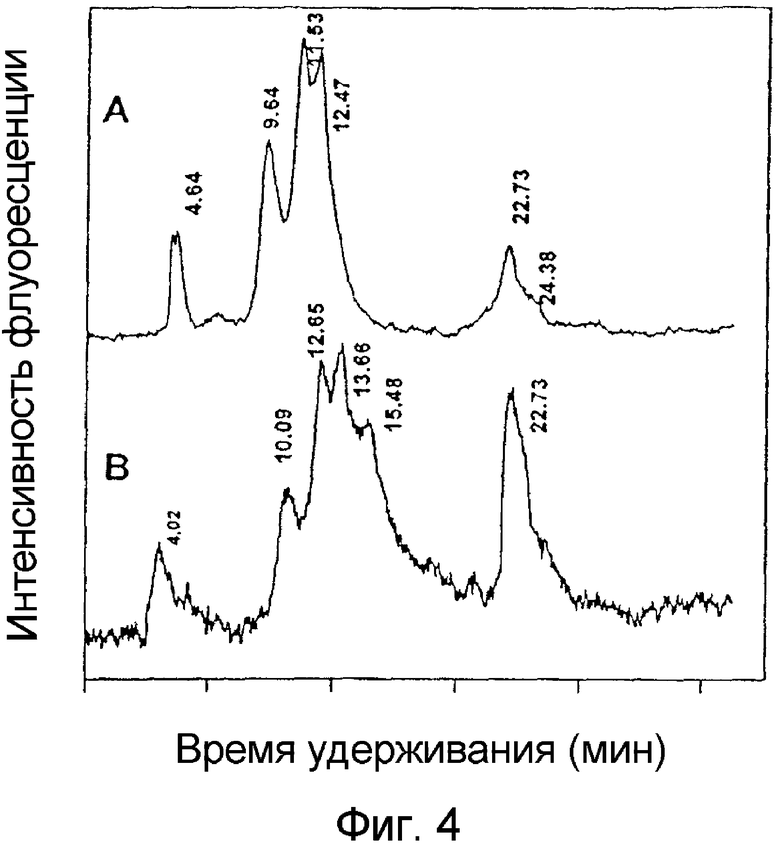
На фигуре 4 приведены ВЭЖХ-хроматограммы TPCS2a и клеточных экстрактов клеток V79, обработанных с помощью TPCS2a. Клетки V79 обрабатывают 1 мкг/мл TPCS2a, образовавшегося после 10 мин экспонирования светом (a) в соответствии с фигурой 3. TPCS2a экстрагируют из клеток после 18 час выдерживания в инкубаторе и оценивают методом ВЭЖХ (b). Времена удерживания пиков указаны на фигуре.
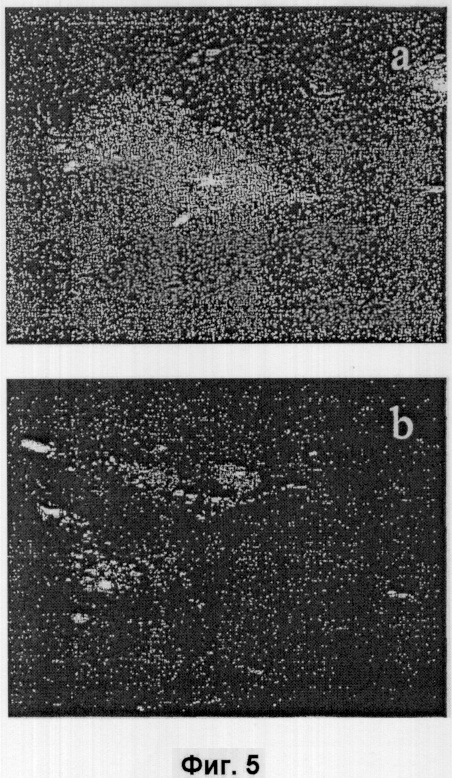
На фигуре 5 приведены микрофотографии флуоресценции клеток V79, обработанных с помощью TPPS2a и TPCS2a. Клетки выращивают в инкубаторе вместе с (a) 1 мкг/мл TPPS2a или (b) 1 мкг/мл TPCS2a в течение 18 час с последующим выдерживанием до экспонирования красным светом в инкубаторе в течение 1 час в не содержащей сенсибилизатор среде.
На фигуре 6 приведены кривые зависимости ответного сигнала от интегральной плотности потока для подавления активности β-AGA в клетках V79, обработанных 1 мг/мл TPCS2a в течение 18 час с последующим выдерживанием до экспонирования красным светом, в инкубаторе в течение 1 час в не содержащей сенсибилизатор среде.
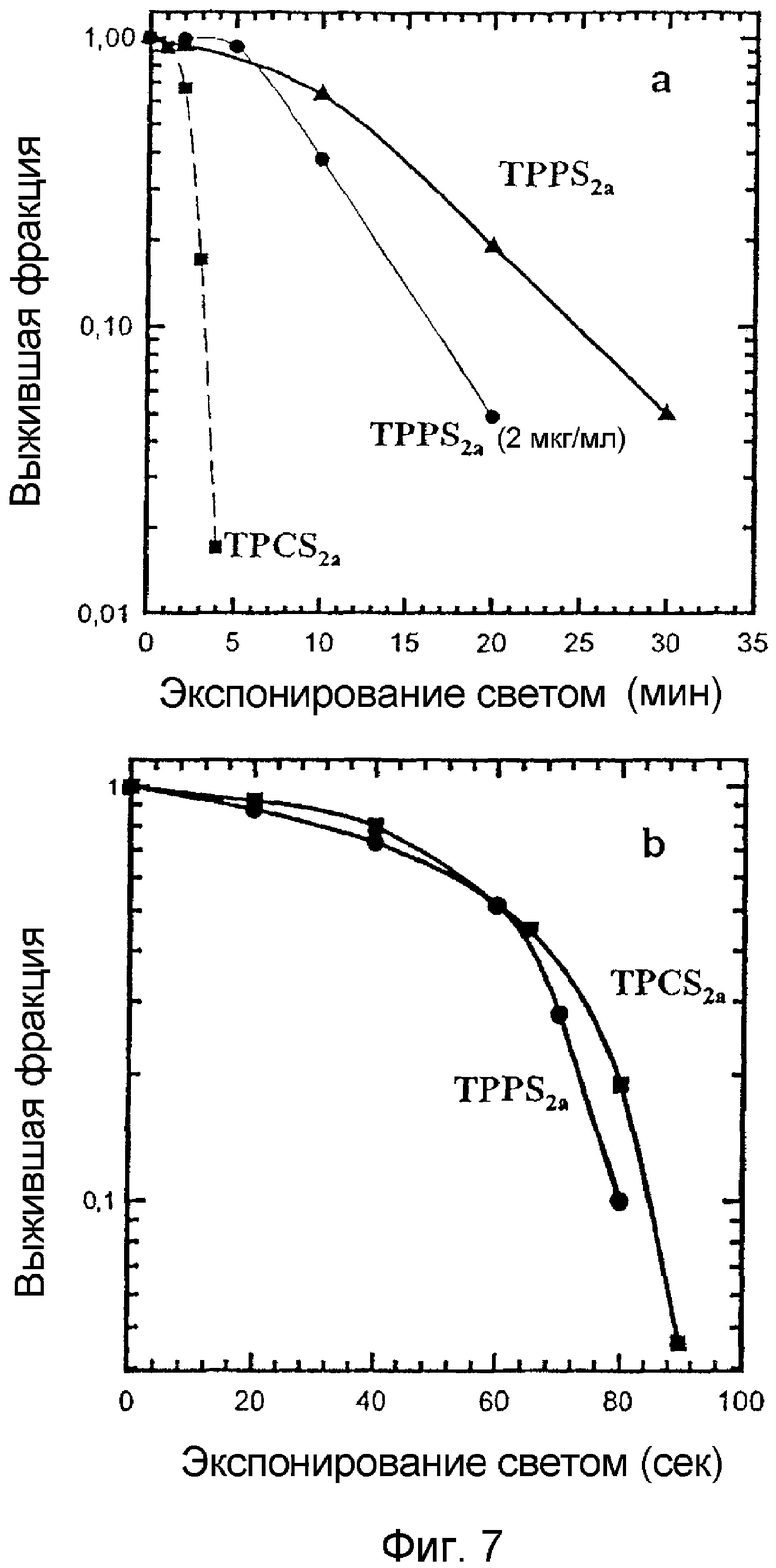
На фигуре 7 приведены кривые зависимости ответного сигнала от дозы для клеток V79, выращенных вместе с TPPS2a и TPCS2a и экспонированных (a) красным светом или (b) голубым светом. Клетки выращивают с 1 или 2 мкг/мл TPPS2a или 1 мкг/мл в течение 18 час с последующим выдерживанием до экспонирования светом в инкубаторе в течение 1 час в не содержащей сенсибилизатор среде.
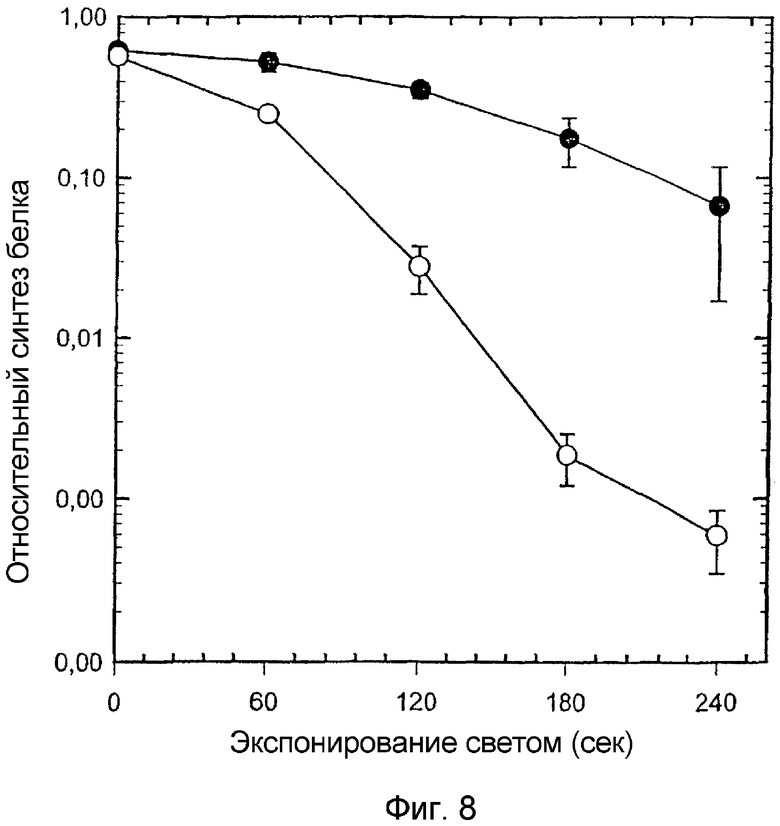
На фигуре 8 показан синтез белков в клетках V79 после комбинированного воздействия светом и гелонином. Клетки обрабатывают 1 мкг/мл TPCS2a в отсутствие (заполненные кружки) или в присутствии (незаполненные кружки) 1 мкг/мл гелонина и экспонируют красным светом. Полосы с интервалами на этой и предыдущих фигурах обозначают стандартное отклонение, рассчитанное в результате проведения трех одинаковых экспериментов.
Примеры
Материалы и методы
Материалы
Фотосенсибилизатор TPPS2a получают от компании Porphyrin Products (Логан, Юта, США). Исходный раствор (2 мг/мл) TPPS2a растворяют в ДМСО, который получают от компании Sigma (Сент-Луис, Миссури, США). Гелонин покупают у компании Sigma. Исходный раствор токсина (2 мг/мл) получают растворением порошка гелонина в забуференном фосфатом физиологическом растворе с рН 8,5 и хранят до использования при температуре минус 20°С.
п-Нитрофенил-N-ацетил-D-глюкозаминид приобретают у компании Sigma (Сент-Луис, Миссури, США).
Получение дисульфоната тетрафенилхлорина - TPCS2a
Дисульфонат тетрафенилхлорина (TPCS2a) получают из TPPS2a полностью в соответствии с методикой, описанной Harel et a. (Photochem. Photobiol. 23: 337-341, 1976).
Готовят смесь 950 мкл бензол/триэтиламин (ТЭА) (18:7), 32 мкл диметилсульфоксида (ДМСО) и 18 мкл TPPS2a (из раствора с концентрацией 1 мг/мл в ДМСО) и насыщают ее азотом в течение 5 мин в кювете емкостью 1 мл. Смесь экспонируют светом ксеноновой лампы высокого давления мощностью 500 Вт, которой оснащен монохроматор с дифракционной решеткой Бауша и Ломба. Кювету экспонируют светом с длиной волны 545±15 нм и плотностью потока 15 Вт/м2. Интегральную плотность потока контролируют с помощью фотодетектора UDT 11A, снабженного 223 радиометрическим фильтром. Спектры поглощения регулярно измеряют с помощью спектрофотометра Perkin-Elmer Lambda 15 UV/VIS. Оптический путь составляет 1 см.
Для получения TPCS2a в большем количестве (для исследования клеток) смесь готовят в покрытой полимерной пленкой колбе, которую постоянно продувают азотом в процессе экспонирования светом. Величину оптического пути поддерживают на уровне не более 1 см. Смесь облучают с помощью блока ламп TL'/03 и осторожно встряхивают в процессе экспонирования. После облучения смесь подвергают сублимационной сушке и растворяют в ДМСО.
Выращивание клеток
Используют клетки установленной линии V79 (ATCC CCL-93), выделенные из легочных фибробластов китайского хомячка. Клетки выращивают в минимально поддерживающей среде, содержащей 10% сыворотки плода коровы (FCS от компании Gibco, Пейсли, Великобритания), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина (Gibco), при температуре 37°С в инкубаторе, который продувают смесью 5% углекислого газа в воздухе. Клетки в течение недели дважды пересевают.
Формирование метки с помощью фотосенсибилизатора
Клетки высевают в колбы 25 см2 (Nuclon, Дания) с минимально поддерживающей средой, содержащей 10% сыворотки плода коровы, и оставляют на 4-5 час при температуре 37°С для более полного закрепления с субстратом. Затем клетки трижды промывают средой и обрабатывают в течение 18 час с помощью 1 мкг/мл TPPS2a или TPCS2a в среде, содержащей сыворотку. Далее клетки трижды промывают не содержащей фотосенсибилизатор средой и перед экспонированием светом выдерживают в течение 1 час. Затем экспонируют красным светом (Phillips TL 20 W/09), который пропускают через фильтр Cinemoid 35, или синим светом (Appl. Photophysics, Nood. 3026, London). Интегральная плотность потока, достигающая клеток, составляет для лампы красного света и лампы синего света 1,35 мВт/см2 и 1,5 мВт/см2 соответственно.
Исследования токсичности
Выживание клеток определяют по тесту на колониеобразование, как это описано у Berg et al. (Photochem. Photobiol. 53: 203-210, 1991). 1500 клеток высевают в 25 см2 пластиковые колбы с тканью-культурой и обрабатывают фотосенсибилизатором и облучают светом, как описано ранее. После фотохимической обработки клетки V79 оставляют на 5 дней при температуре 37°С в содержащей сыворотку среде с культурой, чтобы образовались колонии. Затем клетки осаждают этанолом, подкрашивают метиленовым голубым и подсчитывают количество колоний. Ингибирование синтеза белка анализируют по количеству включений в белок [3H]-лейцина, которое определяют через 24 час после экспонирования светом, как это описано у Llorente et al. (FEBS Lett. 431: 200-204, 1998).
ВЭЖХ
Порфирины экстрагируют из клеток путем соскобов клеток в подкисленном метаноле (5 мкл концентрированной HCl в 10 мл метанола), как описано у Berg et al. (Br. J. Cancer 74: 688-697, 1996). Клеточный дебрис гранулируют, а жидкость над осадком отделяют. Порфирины концентрируют, продувая через экстракты азот до тех пор, пока их объем не уменьшится приблизительно до 150-200 мкл, и гранулируют дополнительно выделившееся количество белка. 100 мкл жидкости над осадком смешивают с 235 мкл 10 мМ раствора Na2PO4, доводят рН приблизительно до 10,5 с помощью 5М раствора КОН и непосредственно используют для анализа методом ВЭЖХ. Указанная методика позволяет количественно экстрагировать порфирины из клеток. Исходные растворы фотосенсибилизаторов разбавляют прямо в стартовом буферном растворе.
Система ВЭЖХ включает насос (Spectra Physics 8800), колонку с обращенной фазой (Supelcosil LC-18-T (4,6×250 мл), Supelco, S.A., Гланд, Швейцария), флуоресцентный детектор (LDC Fluoromonitor III) и интегратор (Spectra Physics Data-jet), подсоединенный к компьютеру. Растворитель A представляет собой смесь метанола и воды (30:70 по объему), содержащий 1,5 мМ фосфата, рН которого доводят до 7,0. Растворитель B представляет собой смесь метанола и воды (95:5 по объему), содержащий 1,5 мМ фосфата, рН которого доводят до 7,5. Устанавливают 30-минутный линейный градиент между 40% и 20% растворителя A с последующим 5-минутным линейным градиентом до 100% растворителя B. Флуоресценцию определяют по возбуждению в области длин волн 330-400 нм. Рассеянный свет отделяют от флуоресценции с помощью фильтра отсечки, который пропускает лишь свет с длиной волны более 410 нм.
Флуоресцентная микроскопия
Для проведения микроскопических исследований используют кюветы 28 см2 (Falcon 3002, Becton Dickinson, Плимут, Великобритания). Клетки промывают один раз забуференным фосфатом физиологическим раствором и поверх слоя забуференного фосфатом физиологического раствора осторожно помещают покровное стекло. Далее клетки исследуют с помощью микроскопа Zeiss Axioplan (Zeiss, Оберкохен, Германия), оснащенного эпифлуореценцией. Для возбуждения используют ртутную лампу HBO/100 W. Клетки и флуоресценцию клеток изучают с помощью охлаждаемой ПЗС (прибор с зарядовой связью) камеры (TE2, Astromed, Кембридж, Великобритания). Работа камеры контролируется с помощью компьютера, который используют для цифровой обработки изображения и хранения информации. Микроскоп оснащают фильтром с полосой пропускания возбуждения в диапазоне 390-440 нм, 470 нм дихроичным светоделителем и 610 нм длинноволновым фильтром.
Ферментный анализ
Фотохимическую инактивацию фермента лизосомы β-AGA определяют по методике, приведенной в Beaufay et al. (J. Cell Biol. 61: 188-200, 1974). Метод основан на образовании п-нитрофенола (из субстрата п-нитрофенил-N-ацетил-D-глюкозамида), который можно определить спектрофотометрически при 420 нм. Клетки после облучения светом немедленно отделяют и подготавливают для проведения ферментного анализа.
Пример 1
Фотохимическое восстановление TPPS2a
В соответствии со способом, приведенным в Harel et al. (Photochem. Photobiol. 23: 337-341, 1976), TPPS2a облучают светом в растворе триэтиламина (ТЭА) в бензоле, насыщенном азотом. Раствор облучают светом с длиной волны 545 нм в кювете, которая описана ранее в разделе "Материалы и методы".
На фигуре 1 показано изменение спектра поглощения при облучении светом и спектр конечного продукта, который является типичным для хлоринов. Пик I-линии Q-полос сдвигается с 646 нм до 655 нм, а его максимальная интенсивность возрастает в 5,8 раз (фигура 2). Изобестические точки наблюдаются при 593 нм, а также при 505 нм, 518 нм и 577 нм. Полосы поглощения после облучения являются типичными для хлоринов.
Для увеличения количества хлоринов для исследования клеток облучению светом подвергают бóльшие объемы растворов TPPS2a, которые получают, как описано ранее в разделе "Материалы и методы". Масштаб времени для увеличения пика поглощения 655 нм аналогичен тому, как описано ранее и показано на фигуре 2. За процессом образованием хлорина следят с помощью ВЭЖХ, как это приведено на фигуре 3, которая показывает, что образуется несколько изомеров хлорина. Растворы, которые облучают светом в течение 10 мин, затем используют для обработки клеток в культуре. Приблизительно 23% продукта после 10 мин облучения имеет такое же время удерживания, что и TPPS2a, однако пик имеет спектр поглощения, типичный для хлорина.
Пример 2
Фотобиологическое исследование TPCS2a
Для биологического изучения фотохимического воздействия хлорина, TPCS2a, используют легочные фибробласты клеточной линии V79 китайского хомячка. Клетки выращивают в течение ночи с хлорином, фотосенсибилизатор экстрагируют из клеток и экстракты исследуют методом ВЭЖХ. Как показано на фигуре 4, форма пиков флуоресценции экстрактов клеток аналогична той, которую имеет маточный раствор. Для проведения хроматографии используют колонку C-18 с обращенной фазой, в которой, как правило, время удерживания возрастает с увеличением гидрофобности соединений. Было установлено, что усвоение хлорина клетками увеличивается с ростом гидрофобности изомеров.
Как было предварительно установлено, фотосенсибилизатор TPPS2a локализуется в эндоцитных везикулах клеток, выращенных вместе с указанным соединением (Berg et al. Photochem. Photobiol. 52: 481-487, 1990). Было показано, что локализация TPCS2a внутри клетки аналогична локализации TPPS2a, что указывает на то, что TPCS2a также локализуется в эндоцитных везикулах (см. фигуру 5). Это позднее подтверждают фотохимическим инактивированием фермента лизосом β-N-ацетилглюкозоамидазы (см. фигуру 6). Таким образом, путем сравнения картины внутриклеточной флуоресценции локализующегося в лизосомах фотосенсибилизатора TPPS2a косвенно методом флуоресцентной микроскопии и прямо путем измерения фотохимической инактивации фермента лизосом β-AGA было показано, что TPCS2a локализуется в эндоцитных везикулах клеток V79.
Преимуществом использования хлорина вместо порфирина при проведении фотодинамической терапии является больший коэффициент экстинкции в области волн красной области спектра. Это было надежно показано путем сравнения экспонирования клеток, обработанных с помощью TPPS2a и TPCS2a, синим и красным светом (см. фигуру 7). Из фигуры 7b видно, что клетки, обработанные с помощью TPPS2a или TPCS2a, были одинаково чувствительны к действию синего света, в то время как клетки, обработанные с помощью TPCS2a, были приблизительно в 6 раз более чувствительны к действию красного света, чем клетки, обработанные порфирином TPPS2a (фигура 7a).
Внутримолекулярную локализацию TPCS2a в эндоцитных везикулах и, следовательно, его возможное использование для фотохимической интернализации макромолекул оценивают с помощью интернализации инактивирующего рибосомы типа I белкового токсина гелонина. Было показано, что гелонин сам по себе или в сочетании со светом обладает слабой токсичностью (Berg et al. Cancer Res. 59: 1180-1183, 1999). Синтез белка в клетках, обработанных в течение 18 час 1 мкг/мл гелонином, снижается приблизительно на 10%. Однако, как показано на фигуре 8, TPCS2a и свет значительно усиливают цитотоксичность гелонина, что определяют путем синтеза белка через 24 час после экспонирования светом. Отмечают некоторое снижение (20%) синтеза белка, вызванное действием самого TPCS2a, которое не наблюдали при изучении клоногенности. Результаты показывают, что гелонин интернализуется в клетки во время фотохимической обработки с помощью TPCS2a.
Обсуждение результатов
В настоящем исследовании показано, что дисульфированный тетрафенилпорфин можно восстановить в его хлориновую форму путем фотохимического восстановления в анаэробных условиях в присутствии триэтиламина. Фотохимическое восстановление приводит к 5,8-кратному возрастанию коэффициента экстинкции I-линии Q-полос вследствие образования нескольких изомеров хлорина. Сравнение с исходным порфирином, TPPS2a, показывает, что фотосенсибилизирующая способность хлорина TPCS2a в клетках V79 одинаково эффективна для сенсибилизации клеток к фотоинактивированию голубым светом и в 6 раз более эффективна для красного света.
Методом флуоресцентной микроскопии было косвенно показано, что TPCS2a локализуется в эндоцитных везикулах клеток V79. Это было подтверждено непосредственным измерением фотохимической инактивации фермента лизосом β-AGA. Было установлено, что скорость инактивации β-AGA в сравнении с выживаемостью клеток аналогична той, что была ранее установлена для TPPS2a (Berg et al., Int. J. Cancer 59: 814-822, 1994), что указывает на одинаковый характер распределения указанных соединений между мембранами эндоцитных везикул и их полостями.
На примере фотохимической интернализации гелонина было также показано, что TPCS2a может быть использован в качестве фотосенсибилизатора для фотохимической интернализации макромолекул.
Дополнительный пример композиции 1.
Приготовление фармацевтической композиции, содержащей фотосенсибилизирующий агент, например TPSC2α, и, по меньшей мере, один фармацевтически приемлемый носитель или эксципиент.
При растирании пестиком в ступке смешивают 500 мг TPSC2α, с 10 г основы Unguentum Merck. Полученный крем помещают в закрывающийся контейнер подходящего объема. Крем, содержащий 5% TPSC2α, готов к местному применению.
Дополнительный пример композиции 2.
Приготовление фармацевтической композиции, содержащей фотосенсибилизирующий агент, молекулы переносчика, и, по меньшей мере, один фармацевтически приемлемый носитель или эксципиент.
В емкость для автоклавирования помещают навеску 100 мг TPSC2α и автоклавируют в течение 20 минут при 121°С. Стерильный Кремофор EL (производство BASF) нагревают до 60-70°С и 0,4 мл Кремофора при перемешивании в стерильных условиях добавляют к автоклавированному TPSC2α. Смесь перемешивают приблизительно 5 минут при 60-70°С, после чего к ней медленно добавляют требуемое количество (3,6 мл) стерильной воды для инъекций, предварительно нагретой до 60-70°С, вводят 0,3 мл раствора блеомицина (45000 ед./мл), получая композицию для внутривенного введения, содержащую 25 мг/мл TPSC2α в 10% Кремофоре EL.
Дополнительный пример композиции 3.
Приготовление комбинированного препарата, содержащего фотосенсибилизирующий агент, и агент, способствующей чрескожному введению, или хелатирующий агент.
20 мг TPSC2α растворяют в 1 мл ДМСО. Воду добавляют до требуемой концентрации, но из расчета не более 40% (об.). Полученный раствор помещают в закрывающиеся контейнеры. Раствор готов для местного применения.
Дополнительный пример композиции 4.
Изготовление набора, состоящего из первого контейнера, содержащего фотосенсибилизирующий агент, и второго контейнера, содержащего агент, способствующей чрескожному введению.
1 мл Раствора, содержащего 20 мг/мл TPSC2α в метаноле подвергают сушке вымораживанием в контейнере 1. Контейнер герметизируют. В контейнер 2 помещают 1 мг ДМСО, контейнер 2 герметизируют. Для местного применения содержимое контейнера 2 вводят в контейнер 1, герметизируют и встряхивают до полного растворения. Смесь готова к местному применению. Для получения требуемой более низкой концентрации в контейнер добавляют воду из расчета не более 40% (об.) и перемешиваю встряхиванием.
Дополнительный пример применения 1.
Крем, полученный в соответствии с дополнительным примером композиции 1, наносят на участок, пораженный раком кожи. Через 3 часа покрытый кремом участок облучают диодным лазером при длине волны 652 нм и удельной мощности светового потока 90 Вт/см2 в течение 1-10 минут в зависимости от терапевтических показаний, учитывающих вид и толщину опухоли.
Дополнительный пример применения 2.
Композицию, полученную в соответствии с дополнительным примером композиции 2, внутривенно вводят пациенту с раком ротовой полости из расчета 1 мг/кг массы тела. Через 72 часа раковую опухоль облучают диодным лазером при длине волны 652 нм и удельной мощности светового потока 90 Вт/см2, обеспечивая удельную мощность дозы 20 Дж/см2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОТОСЕНСИБИЛИЗИРУЮЩИЕ КОМПОЗИЦИИ | 2010 |
|
RU2574019C2 |
| ФОТОХИМИЧЕСКАЯ ИНТЕРНАЛИЗАЦИЯ ДЛЯ ДОСТАВКИ МОЛЕКУЛ В ЦИТОЗОЛЬ | 2001 |
|
RU2333246C2 |
| КОНЪЮГАТ ФОТОСЕНСИБИЛИЗАТОРА И ХИТОЗАНА И ЕГО ПРИМЕНЕНИЕ | 2013 |
|
RU2675830C2 |
| ФОТОХИМИЧЕСКАЯ ИНТЕРНАЛИЗАЦИЯ ДЛЯ ОПОСРЕДОВАННОЙ ВИРУСОМ ДОСТАВКИ МОЛЕКУЛЫ В ЦИТОЗОЛЬ | 2001 |
|
RU2317827C2 |
| СПОСОБ ВВЕДЕНИЯ МОЛЕКУЛЫ ПНК, КОНЪЮГИРОВАННОЙ С ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫМ ПЕПТИДОМ, В ЦИТОЗОЛЬ И/ИЛИ ЯДРО ФОТОХИМИЧЕСКОЙ ИНТЕРНАЛИЗАЦИЕЙ(PCI) | 2005 |
|
RU2435859C2 |
| СПОСОБ ВВЕДЕНИЯ siRNA В КЛЕТКИ ФОТОХИМИЧЕСКОЙ ИНТЕРНАЛИЗАЦИЕЙ | 2007 |
|
RU2510826C2 |
| ФОТОХИМИОТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1998 |
|
RU2194532C2 |
| СЛОЖНЫЕ ЭФИРЫ 5-АМИНОЛЕВУЛИНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ ФОТОСЕНСИБИЛИЗАТОРОВ В ФОТОХИМИОТЕРАПИИ | 1996 |
|
RU2191010C2 |
| НИЗКОМОЛЕКУЛЯРНЫЕ ПРОИЗВОДНЫЕ КАРБОКСАМИДНЫХ ГАЛОГЕНИРОВАННЫХ ПОРФИРИНОВ, А ИМЕННО ХЛОРИНОВ И БАКТЕРИОХЛОРИНОВ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2718923C2 |
| ЭФИРЫ 5-АМИНОЛЕВУЛИНОВОЙ КИСЛОТЫ КАК ФОТОЧУВСТВИТЕЛЬНЫЕ АГЕНТЫ В ФОТОХИМИОТЕРАПИИ | 2001 |
|
RU2246483C2 |

Изобретение касается фотосенсибилизирующих агентов, получаемых восстановлением одной двойной связи в порфириновом макроцикле сульфированного мезотетрафенилпорфирина, предпочтительно дисульфированного мезотетрафенилпорфирина, такого как TPPS2a. Полученные сульфированные мезотетрафенилхлорины предстваляют собой соединения формулы (I)
(где X означает -SO3H; n, p, q и r каждый независимо обозначает 0 или 1; а сумма n, p, q и r является целым числом от 1 до 4, предпочтительно по крайней мере 2, в частности 2 или 4), изомеры или смеси их изомеров. Соединения по настоящему изобретению и их фармацевтически приемлемые соли обладают высоким коэфицентом экстинкции в области излучения от 630 до 680 нм, благодаря чему находят широкое применение в качестве фотосенсибилизирующих агентов для фотохимической интернализации молекул и фотодинамической терапии. 14 н. и 14 з.п. ф-лы, 8 ил.
где X означает -SO3H;
n, p, q и r каждый независимо обозначает 0 или 1; а сумма n, p, q и r является целым числом от 1 до 4, предпочтительно по крайней мере 2, в частности 2 или 4; его изомер или фармацевтически приемлемую соль любого из указанных соединений.
изомер или фармацевтически приемлемую соль любого из указанных соединений.
(a) восстановление сульфированного мезотетрафенилпорфирина или его хелатного комплекса с железом,
(b) разделение в случае необходимости смеси соединений, полученной на стадии (а); и
(c) превращение соединения, полученного на стадии (а) или на стадии (b), в его фармацевтически приемлемую соль.
(а) контактирование указанной клетки с фотосенсибилизирующим агентом по любому из пп.1-9 или его фармацевтически приемлемой солью;
(b) контактирование указанной клетки с указанной доставляемой молекулой и
(c) облучение указанной клетки светом с длиной волны, эффективной для активирования фотосенсибилизирующего агента.
(a) нанесение на пораженные поверхности фотосенсибилизирующего агента по любому из пп.1-9 или его фармацевтически приемлемой соли и
(b) облучение указанной поверхности светом с длиной волны в диапазоне 300-800 нм.
(a) первый контейнер, содержащий фотосенсибилизирующий агент по любому из пп.1-9 или его фармацевтически приемлемую соль;
(b) второй контейнер, содержащий по крайней мере один агент, облегчающий проникновение сквозь кожу; и по выбору
с) один или более агентов, способных образовать хелатные соединения, которые содержатся либо внутри указанного первого контейнера, либо в третьем контейнере.
i) смешивание указанной взятой из тела жидкости или ткани с фотосенсибилизирующим агентом по любому из пп.1-9 или его фармацевтически приемлемой солью;
(ii) экспонирование указанной смеси светом;
(iii) определение уровня флуоресценции и
(iv) сопоставление уровня флуоресценции с контрольными значениями.
| BERG К | |||
| et al | |||
| «Photochemical internalization: a novel technology for delivery of macromolecules into cytosol» Cancer Res | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| HAREL Y | |||
| et al "Photoreduction of porphyrins to chlorins by tertiary amines in the visible spectral range | |||
| Optical and EPR studies.", Photochem Photobiol | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2008-05-10—Публикация
2002-08-30—Подача