Настоящее изобретение относится к способу введения короткой интерферирующей РНК (siRNA) в клетки, предпочтительно в цитозоль клеток, с использованием фотосенсибилизирующего вещества и молекулы носителя и облучения клеток светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества, и к применению этого способа для изменения активности генов, например, для подавления генов in vitro или in vivo.
Процесс РНК-интерференции протекает во многих организмах и в этом процессе двухцепочечная некодирующая РНК посттрансляционно со специфичностью к последовательности подавляет экспрессию гена. В природе этот феномен защищает геном организма от чужеродных внедряющихся нуклеиновых кислот, таких как транспозоны, трансгены и вирусные гены.
Введение двухцепочечной РНК (dsRNA) в клетку запускает этот процесс подавления РНК, и любая мРНК в клетке с последовательностью, соответствующей введенной dsRNA, подвергается деградации. Каскады подавления РНК вовлекают превращение dsRNA в короткие интерферирующие РНК (siRNA), которые направляют рибонуклеазы на гомологичные мРНК-мишени. Фермент Dicer преобразуют dsRNA в siRNA, длина которых, как правило, составляет 20-25 нуклеотидов. Затем siRNA собираются в содержащие эндорибонуклеазу комплексы, известные как РНК-индуцированные комплексы подавления (RISC), которые направляются к комплементарным молекулам РНК, где они расщепляют и уничтожают мРНК-мишень. Небольшие количества dsRNA могут подавлять большое количество мРНК-мишени благодаря усиливающему компоненту подавления РНК (рассмотрено в Hannon and Rossi (2004), Nature 431, 371-378).
Знание о том, что молекулы siRNA являются ключевыми компонентами каскада, привело к тестированию химически синтезированных молекул siRNA длиной приблизительно от 20 до 22 пар оснований, соответствующих РНК- или ДНК-последовательностям-мишеням. Было показано, что эти молекулы действуют, нарушая экспрессию последовательностей-мишеней в клетках млекопитающих (Elbashir S.M. et al., (2001) Nature 411, 494-498). Как правило, siRNA длиной 20 нуклеотидов является достаточно длинной для индукции ген-специфичного подавления, но достаточно короткой для уклонения от ответа хозяина. Снижение экспрессии продуктов генов-мишеней может быть значительным с 90% подавлением, индуцированным несколькими молекулами siRNA.
Таким образом, технология siRNA была разработана в качестве общего способа, специфичного к последовательности подавления генов. Подавление генов имеет множество применений, как in vitro, так и in vivo, как в качестве инструмента исследования, так и в качестве терапевтической стратегии. Высокая эффективность и специфичность, которые можно наблюдать при применении технологии siRNA, делает эту технологию особенно привлекательной.
Во всех случаях, доставка молекул siRNA в клетки является большой проблемой, поскольку для того, чтобы произошло подавление гена, необходимо, чтобы молекулы siRNA проникли в клетку в достаточных концентрациях, чтобы они были пригодными. На силу подавляющего ответа и его длительность влияет количество siRNA, которое доставляют в клетку, и было показано, что посредством предоставления siRNA в достаточно высоких концентрациях, даже относительно слабая молекула siRNA молекула может подавлять свою мишень. Однако противовесом этого является тот факт, что известно, что введение больших количеств siRNA в клетку может приводить к нежелательным эффектам, таким как "не намеченные" эффекты (т.е. нежелательные изменения уровней экспрессии белка) или активация врожденных каскадов иммунной системы.
Как правило, siRNA доставляют в клетки с использованием стандартных протоколов трансфекции для нуклеиновых кислот, таких как протоколы с применением липосом, катионных липидов, анионных липидов и микроинъекции. siRNA представляет собой двухцепочечную молекулу и, по существу, доставка и клеточный захват молекулы являются более сложными, чем в случае антисмысловой молекулы, которая связывается с сывороточными белками для захвата клетками. Используют различные стратегии, и для этой цели существуют коммерчески доступные наборы. Как указано выше, эффективная трансфекция является высоко желательной, поскольку эффективность подавления гена по меньшей мере частично зависит от концентрации siRNA в клетке, однако введение в клетки в высоких концентрациях также может вызывать нежелательные побочные эффекты.
Введение на высоких уровнях часто требует высокой концентрации реагентов для трансфекции, и это может оказывать неблагоприятные эффекты на клетки, включающие сниженную жизнеспособность клеток и различные другие побочные эффекты, как фенотипические, так и нефенотипические. Более того, когда используют высокие концентрации реагентов, не достигают специфичной доставки.
Нацеленная доставка молекул нуклеиновых кислот, таких как siRNA, как правило, не является достаточно надежной. Для этой цели можно использовать вирусы, однако в случае этого подхода существует проблема безопасности, и системную вирусную доставку трудно достигнуть.
siRNA действует в цитозоле клеток, и для того, чтобы молекула действовала, необходимо, чтобы молекула достигала цитозоля. С учетом указанных выше соображений, может быть желательной разработка усовершенствованного способа доставки siRNA в цитозоль клетки. Желательные свойства такого усовершенствованного способа включают i) способность обеспечивать специфичную по времени и месту доставку молекул siRNA в место их действия, ii) избегание применения высоких концентраций реагента для трансфекции и/или siRNA и/или iii) усиленное siRNA-подавление в клеточных линиях. В частности, такие способы могут снизить общее количество комплексов siRNA:липид, требуемых для достижения определенного уровня подавления генов или его улучшения. В таких способах соотношение siRNA:реагент для трансфекции может быть изменено при сохранении определенной степени подавления гена или его улучшения. Повышение соотношения siRNA:липид является полезным, поскольку оно может минимизировать ингибиторные эффекты, которые наблюдают при применении высоких концентраций реагентов для трансфекции.
В целом, целью улучшенного способа альтернативно можно назвать желание сбалансировать необходимость в эффективной и контролируемой доставке siRNA в цитозоль со снижением неблагоприятных побочных эффектов, вызванных либо высокими концентрациями реагентов для трансфекции, либо неспецифичными эффектами, например, в конкретных типах клеток. Как указано выше, снижение общего количества комплексов siRNA:липид и/или повышение соотношения siRNA:липид может привести к достижению этой цели.
Для достижения этих целей, авторы изобретения объединили применение носителя (реагента для трансфекции) со способом фотохимической интернализации (PCI). Конкретный выбранный носитель доставляет молекулу siRNA во внутриклеточные компартменты клетки, например, эндоцитарные везикулы, такие как эндосома и/или лизосома клетки. Альтернативные внутриклеточные компартменты, в которые может захватываться комплекс siRNA:липид, включают аппарат Гольджи и эндоплазматическую сеть.
В результате способа PCI происходит высвобождение молекулы siRNA из внутриклеточной везикулы. Это зависит от воздействия на клетку фотосенсибилизирующего соединения и последующего облучения, и можно наблюдать, что высвобождение молекулы siRNA происходит только после облучения клетки и, по существу, это высвобождение в цитозоль, где опосредуются ее эффекты, можно подвергать пространственному или временному контролю. Только клетки, которые i) содержат siRNA в их внутриклеточных везикулах, ii) подвергнуты воздействию фотохимического интернализующего вещества и iii) подвергнуты облучению, будут высвобождать молекулу siRNA в цитозоль клетки, чтобы она действовала на мРНК в этой клетке.
Как правило, для оптимизации доставки siRNA в цитозоль реагенты для трансфекции необходимо использовать в высоких концентрациях. Авторы изобретения неожиданно обнаружили, что с использованием низких концентраций реагентов для трансфекции (и фотохимического интернализующего вещества), для направления siRNA во внутриклеточные везикулы, такие как эндосома, где она содержится до запуска ее высвобождения посредством применения облучения, можно использовать стадию трансфекции. Таким образом, способ позволяет siRNA достигать ее области действия без необходимости применения высоких концентраций реагента для трансфекции или siRNA. Более того, с использованием способа PCI можно контролировать время и место высвобождения молекулы siRNA из внутриклеточных везикул, таких как эндосома.
Таким образом, в первом аспекте, это изобретение относится к способу введения молекулы siRNA в цитозоль клетки, включающему контактирование указанной клетки с молекулой siRNA, носителем и фотосенсибилизирующим веществом и облучение клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества. После активации, внутриклеточные компартменты в указанной клетке, содержащие указанное фотосенсибилизирующее вещество, высвобождают siRNA, содержащуюся в этих компартментах, в цитозоль.
PCI представляет собой способ, в котором используется фотосенсибилизирующее вещество в сочетании со стадией облучения для активации этого вещества, и он обеспечивает высвобождение молекул, совместно введенных в клетку, в цитозоль клетки. Способ позволяет молекулам, которые захватываются в органеллы клетки, такие как эндосомы, после облучения высвобождаться из этих органелл в цитозоль.
Этот основной способ фотохимической интернализации (PCI) описан в WO 96/07432 и WO 00/54802, которые включены в настоящий документ в качестве ссылок. Как указано выше, молекула, подлежащая интернализации (которая для применения в соответствии с настоящим изобретением представляет собой молекулу siRNA), в этом случае с молекулой носителя, и фотосенсибилизирующее вещество подвергают контактированию с клеткой. Фотосенсибилизирующее вещество, молекула носителя и молекула, подлежащая интернализации, захватываются клеточным мембраносвязанным субкомпартментом в клетке. При воздействии на клетку света с соответствующей длиной волны активируется фотосенсибилизирующее вещество, которое прямо или непрямо создает активные частицы, которые разрушают мембраны внутриклеточного компартмента. Это позволяет интернализованной молекуле высвобождаться в цитозоль.
В этих способах используется фотохимический эффект в качестве механизма введения молекул, в ином случае не проникающих (или плохо проникающих) через мембрану в цитозоль клетки, который, таким образом, не приводит к распространенному разрушению клеток или гибели клеток, если способ пригодным образом скорректирован для избежания избыточной продукции токсичных частиц, например, посредством снижения времени освещения или дозы фотосенсибилизирующего вещества.
Этот способ является особенно преимущественным для введения siRNA в клетки, поскольку он позволяет применение более низких концентраций носителя или реагента для трансфекции и/или siRNA, чем необходимо в случае общепринятой трансфекции siRNA, достигая при этом ингибирования гена. Более того, время и место облучения для высвобождения молекулы siRNA можно контролировать так, чтобы она высвобождалась только в то время и в том месте, которые являются желательными для достижения требуемых эффектов. По существу, воздействие на клетки siRNA и носителя минимизируется, и минимизируются нежелательные побочные эффекты. Это является противоположностью стандартным способам введения siRNA в клетки, где невозможно контролировать время и место высвобождения siRNA и требуются высокие концентрации реагента для трансфекции. Посредством уменьшения количества носителя (изменения соотношения siRNA:носитель) по сравнению с количеством, которое принято применять, или посредством снижения общего количества комплексов siRNA:носитель, которые применяют для клетки, также можно минимизировать выход siRNA из внутриклеточных компартментов до облучения PCI.
Далее, было показано, что с использованием для доставки siRNA носителей, как определено в настоящем документе, с PCI, можно достигать существенных эффектов в отношении подавления гена, не вызывая одновременно с этим цитотоксичность. Например, при использовании PEI (ММ 25000) в количестве 1 мкг/мл с 100 нМ siRNA и доз света вплоть до 40 секунд, не было выявлено цитотоксических эффектов (см. фиг.11B). В этих условиях были выявлены значительные эффекты в отношении подавления гена (см. фиг.10).
РНК представляет собой полимер из рибонуклеотидов, каждый из которых содержит сахар рибозу совместно с фосфатной группой и азотистым основанием (как правило, аденином, гуанином, цитозином или урацилом). Как и в случае ДНК, РНК может образовывать комплементарные водородные связи, и РНК может быть двухцепочечной (dsRNA), одноцепочечной (ssRNA) или двухцепочечной с одноцепочечным выступающим концом. "Малые интерферирующие РНК" (siRNA) относятся к двухцепочечным молекулам РНК длиной от приблизительно 10 до приблизительно 30 нуклеотидов, которые специфично препятствуют экспрессии белка посредством связывания с молекулами мРНК. Предпочтительно, молекулы siRNA имеют длину 12-28 нуклеотидов, более предпочтительно 15-25 нуклеотидов, более предпочтительно 19-23 нуклеотидов и наиболее предпочтительно 21-23 нуклеотидов. Таким образом, длина предпочтительных молекул siRNA составляет 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29 нуклеотидов.
Длина одной цепи определяет длину молекулы siRNA. Например, siRNA, которая описана как siRNA длиной 21 рибонуклеотидов (21-мер), может содержать две противоположные цепи РНК, которые гибридизуются вместе с образованием 19 непрерывных пар. Два оставшихся рибонуклеотида на каждой цепи образуют выступающий конец. Когда siRNA содержит две цепи различной длины, длину siRNA определяет более длинная из цепей. Например, dsRNA, содержащая одну цепь длиной 21 нуклеотидов и вторую цепь длиной 20 нуклеотидов, составляет 21-мер.
Желательными являются siRNA, которые содержат выступающий конец. Выступающий конец может находиться на 5'- или 3'-конце цепи. Предпочтительно он находится на 3'-конце цепи РНК. Длина выступающего конца может варьировать, однако предпочтительно она составляет от приблизительно 1 до приблизительно 5 нуклеотидов, и более предпочтительно длина составляет приблизительно 2 нуклеотида. Предпочтительно, siRNA по настоящему изобретению будет содержать 3'-выступающий конец приблизительно из от 2 до 4 нуклеотидов. Более предпочтительно, 3'-выступающий конец имеет длину 2 рибонуклеотида. Более предпочтительно, 2 рибонуклеотида, содержащих 3'-выступающий конец, обладают урациловыми (U) основаниями.
siRNA конструируют для взаимодействия с рибонуклеотидной последовательностью-мишенью, иными словами они комплементарны последовательности-мишени, чтобы они связывались с последовательностью-мишенью, т.е. одна цепь siRNA комплементарна участку последовательности-мишени.
Также были созданы молекулы siRNA, имеющие модифицированные остовы для повышения их времени полужизни (например, как описано в Chiu et al., (2003), RNA. 9(9), 1034-48 и Czauderna et al., (2003), Nucleic Acids Research 31, 2705-2716). Таким образом, термин "siRNA" также включает такие модифицированные молекулы. Указание на siRNA, таким образом, охватывает производные или варианты siRNA, которые проявляют ту же функцию, т.е. взаимодействие с последовательностью мРНК-мишени. Предпочтительные варианты включают варианты, в которых используют модифицированный остов (как указано выше) или одно или несколько не встречающихся в природе оснований.
Способ можно использовать для внесения более чем одного типа молекулы siRNA в клетку. Иными словами, одновременно в клетку можно вводить молекулы siRNA, имеющие различные последовательности. Если введению подлежит множество молекул siRNA, его можно осуществлять одновременным связыванием более чем одной молекулы siRNA с носителем. Альтернативно, каждый тип молекулы siRNA можно отдельно связывать с носителем.
Существует несколько способов получения siRNA, таких как химический синтез, транскрипция in vitro, экспрессирующие siRNA векторы и экспрессирующие кассеты ПЦР. Такие способы хорошо известны в данной области. См., например, Pon et al., (2005) Nucleosides Nucleotides Nucleic Acids. 24(5-7): 777-81, Du et al., (2006), Biochem. Biophys. Res. Commun. 345(1):99-105 и Katoh et al., (2003), Nucleic Acids Res Suppl. (3): 249-50.
Аналогично способы конструирования молекул siRNA для достижения требуемого результата хорошо документированы. Сначала необходимо выбрать участок-мишень siRNA. Это можно сделать с использованием различных способов (см., например, Jagla et al., (2005), RNA. 11(6):864-72 и Takasaki et al., (2006), Comput. Biol. Chem. 30(3):169-78).
Способ по этому изобретению обеспечивает перемещение молекулы siRNA в цитозоль. Однако будет понятно, что захват каждой молекулы, контактирующей с клеткой, недостижим. Однако является достижимым значительный и повышенный захват относительно фоновых уровней, когда не используют PCI или носитель.
Предпочтительно способы по этому изобретению позволяют захват молекул siRNA на достаточных уровнях, так что их эффект очевиден в экспрессируемых продуктах этих клеток. Для достижения этой цели, можно корректировать соответствующую концентрацию siRNA, подлежащей контакту с клеткой, например, для достижения снижения экспрессии гена-мишени по меньшей мере на 10%, например, снижения по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90% (например, в экспрессии одного или нескольких белков, кодируемых геном-мишенью) после инкубации с клетками в течение, например, 24, 48, 72 или 96 часов (например, от 24 до 48 часов). Аналогично, для достижения снижения, указанного выше, можно корректировать тип и/или концентрацию носителя, тип и/или концентрацию фотосенсибилизирующего вещества и время облучения.
Его можно измерять посредством определения уровня белка в клетке с использованием стандартных способов, известных в данной области, таких как Вестерн-блоттинг. Уровень снижения белка зависит от времени полужизни белка, т.е. ранее существующий белок будет удален в соответствии с его временем полужизни. Таким образом, достигают снижения экспрессии по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80 или 90% относительно экспрессии в тот же момент времени без siRNA с учетом времени полужизни.
Альтернативно его можно измерять с точки зрения эффекта молекулы siRNA на количество мРНК, которое присутствует в клетке, например, способ можно проводить для достижения снижения уровней мРНК по меньшей мере на 10%, например, снижения по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90% после инкубации с клетками в течение, например, 24, 48, 72 или 96 часов, например, от 24 до 48 часов, относительно уровней мРНК последовательности-мишени в тот же момент времени без siRNA. Также его можно измерять с использованием стандартных способов, известных в данной области, таких как способы гибридизации или блоттинга и ОТ-ПЦР.
Поскольку настоящие способы требуют применения значительно меньшего количества носителя или вещества для трансфекции (и/или меньшего количества siRNA, в зависимости от того, подлежит ли снижению общее количество комплексов, или подлежит модификации соотношение siRNA:носитель или вещество для трансфекции, или оба из них), чем в стандартных способах трансфекции молекул siRNA, также улучшение трансфекции можно выражать с использованием способа по этому изобретению с точки зрения количества носителя или вещества для трансфекции, которые требуются для достижения определенной степени снижения экспрессии белка или уровней мРНК. Например, способ по этому изобретению предпочтительно позволяет определенное снижение экспрессии белка-мишени или уровней мРНК (например, по меньшей мере на 10%, например, по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90%, как описано выше) с использованием концентрации носителя и/или концентрации siRNA, которые, например, по меньшей мере на 10, 20, 30, 40, 50 или 60% ниже количества носителя, которое требуется для достижения того же уровня снижения экспрессии белка-мишени или уровней мРНК без PCI.
Сравнения также можно проводить между уровнями снижения экспрессии белка или уровнями мРНК, которые наблюдают при определенной концентрации siRNA и носителя, в присутствии и отсутствие PCI. Например, способ по этому изобретению предпочтительно позволяет снижение экспрессии белка-мишени или уровней мРНК по меньшей мере на 10%, например, по меньшей мере на 20, 30, 40, 50, 60, 70, 80 или 90%, как описано выше, по сравнению с экспрессией белка или уровнями мРНК, обеспечиваемыми проведением способа в отсутствие стадии облучения технологии PCI.
Термин "клетка" используют в настоящем документе с включением всех эукариотических клеток (в том числе клеток насекомых и клеток грибов). Таким образом, репрезентативные "клетки" включают все типы относящихся и не относящихся к млекопитающим клеток животных, клеток растений, клеток насекомых, клеток грибов и простейших. Однако предпочтительно клетки представляют собой клетки млекопитающих, например, клетки кошек, собак, лошадей, ослов, овец, свиней, коз, коров, мышей, крыс, кроликов, морских свинок, но наиболее предпочтительно человека.
Как используют в настоящем документе, "контактирование" относится к осуществлению физического контакта клеток и фотосенсибилизирующего вещества и/или siRNA и носителя друг с другом в условиях, пригодных для интернализации в клетки, например, предпочтительно при 37ºC в соответствующей питательной среде, например, при 25-39ºC.
Фотосенсибилизирующее вещество представляет собой вещество, которое активируется при освещении с соответствующей длиной волны и интенсивностью с образованием активированных частиц. Удобно, чтобы такое вещество могло представлять собой вещество, которое локализуется во внутриклеточных компартментах, в частности, в эндосомах или лизосомах. Ряд таких фотосенсибилизирующих веществ известен в данной области, и они описаны в литературе, в том числе в WO 96/07432, которая включена в настоящий документ в качестве ссылки. В этом отношении можно упомянуть ди- и тетрасульфонированный фталоцианин алюминия (например, AlPcS2a), сульфонированные тетрафенилпорфины (TPPSn), "нильский голубой", производные хлорина e6, уропорфирин I, филлоэритрин, гематопорфирин и метиленовый синий, которые, как было показано, локализуются в эндосомах и лизосомах клеток в культуре. В большинстве случаев это является следствием эндоцитарного захвата фотосенсибилизирующего вещества. Таким образом, фотосенсибилизирующее вещество предпочтительно представляет собой вещество, которое захватывается во внутренние компартменты клетки, например, лизосомы и/или эндосомы. Дальнейшие соответствующие фотосенсибилизирующие вещества для применения в этом изобретении описаны в WO 03/020309, которая также включена в настоящий документ в качестве ссылки, а именно сульфурированные мезотетрафенилхлорины, предпочтительно TPCS2a.
Однако также можно использовать другие фотосенсибилизирующие вещества, которые расположены в других внутриклеточных компартментах, например, в эндоплазматической сети или аппарате Гольджи. Также удобно, чтобы могли функционировать механизмы, в которых эффекты фотохимической обработки оказываются на другие компоненты клетки (т.е. на компоненты, отличные от ограниченных мембраной, т.е. заключенных в мембрану компартментов). Таким образом, например, одна возможность может состоять в том, чтобы фотохимическая обработка разрушала молекулы, важные для внутриклеточного транспорта или слияния везикул. Такие молекулы необязательно могут быть расположены в ограниченных мембраной компартментах, однако фотохимическое повреждение таких молекул, тем не менее, может привести к фотохимической интернализации комплексов носитель:siRNA, например, посредством механизма, в котором фотохимические эффекты на такие молекулы приводят к сниженному транспорту молекулы, подлежащей интернализации (т.е. молекулы siRNA), в деградирующие везикулы, такие как лизосомы, так что молекула, подлежащая интернализации, может быть выделена в цитозоль до деградации.
Примерами молекул, необязательно расположенных в ограниченных мембраной компартментах, являются несколько молекул системы транспорта микротрубочек, такие как динеины и компоненты динактина; и, например, rab5, rab7, чувствительный к N-этилмалеинимиду фактор (NSF), растворимый белок присоединения NSF (SNAP) и т.д.
Классы пригодных фотосенсибилизирующих веществ, которые можно упомянуть, таким образом, включают порфирины, фталоцианины, пурпурины, хлорины (в частности, производные хлорина с порфиринами, описанные ниже), бензопорфирины, лизосомотропные слабые основания, нафталоцианины, катионные красители и тетрациклины или их производные (Berg et al., (1997), J. Photochemistry and Photobiology, 65, 403-409). Другие пригодные фотосенсибилизирующие вещества включают тексафирины, феофорбиды, порфицены, бактериохлорины, кетохлорины, производные гематопорфирина и их производные, эндогенные фотосенсибилизирующие вещества, индуцируемые 5-аминолевулиновой кислотой и их производные, димеры или другие конъюгаты между фотосенсибилизирующими веществами.
Предпочтительные фотосенсибилизирующие вещества включают TPPS4, TPPS2а, AlPcS2а, TPCS2a и другие амфофильные фотосенсибилизирующие вещества. Другие пригодные фотосенсибилизирующие вещества включают соединение 5-аминолевулиновой кислоты или сложные эфиры 5-аминолевулиновых кислот или их фармацевтически приемлемые соли.
"Облучение" клетки для активации фотосенсибилизирующего вещества относится к применению света прямо или непрямо, как описано в настоящем документе далее. Таким образом, клетки можно освещать с помощью источника света, например, прямо (например, на отдельных клетках in vitro) или непрямо, например, in vivo, когда клетки расположены под поверхностью кожи или находятся в форме слоя клеток, не все из которых прямо освещаются, т.е. без экрана из других клеток.
В этом способе, молекулу siRNA, подлежащую введению в клетку, связывают или ассоциируют или конъюгируют с одной или несколькими молекулами носителя или веществами для трансфекции, которые действуют, облегчая или повышая захват фотосенсибилизирующего вещества или молекулы siRNA в клетку. Это присоединение, ассоциацию или конъюгацию можно проводить перед контактированием молекулы siRNA и ее носителя с клеткой или во время указанного контакта посредством контактирования этих молекул.
Термины носитель и вещество для трансфекции используют в настоящем документе взаимозаменяемо.
Молекула носителя может быть ассоциирована, связана или конъюгирована с молекулой siRNA или как с siRNA, так и с фотосенсибилизирующим веществом. Таким образом, например, siRNA может быть присоединена к носителю посредством заряд-зарядных взаимодействий. Как упоминалось выше, одновременно можно использовать более одного носителя, и носитель может быть ассоциирован, связан или конъюгирован более чем с одной молекулой siRNA, или более чем с одним типом молекулы siRNA.
Предпочтительно носитель содержит соединение, предпочтительно в нелипосомальном составе, которое содержит две или более групп аминов, т.е. является полиамином и которое является катионным и предпочтительно протонируемым (т.е. может быть протонировано, чтобы оно имело один или несколько дополнительных атомов водорода в пригодных условиях реакции) при различных значениях pH. Различные значения pH приводят к различным величинам протонируемых атомов в отдельных молекулах и/или в различных молекулах.
Термин "протонируемый" используют в настоящем документе для обозначения того, что группа способна акцептировать атом водорода, т.е. протонируемая группа представляет собой акцептирующую водород группу. Очевидно, что способность группы акцептировать водород зависит не только от структуры группы, но и также от значения pH, которое воздействует на группу. Предпочтительно, указанная протонируемая группа содержит атом азота и он представляет собой атом, который акцептирует атом водорода.
Как обозначают в настоящем документе, "катионный" означает, что общий, или суммарный, заряд молекулы составляет +1 или более. Его предпочтительно измеряют при физиологическом значении pH, т.е. при pH 7,2. Молекула может иметь более высокий заряд, например, +2 или более, +3 или более, +4 или более, +5 или более, +6 или более, +7 или более, +8 или более, +9 или более, +10 или более, +11 или более, +12 или более, +13 или более, +14 или более, +15 или более, +20 или более, +25 или более, +50 или более, +75 или более, +100 или более, +150 или более, +200 или более, +250 или более, +300 или более, +400 или более, +500 или более, +750 или более, или +1000 или более.
Катионные полиамины для применения в соответствии со способами по этому изобретению являются такими, как определено ниже, и они включают
(a) липополиамин в нелипосомальном составе,
(b) полиэтиленимин (PEI), имеющий значение Mn 500-20000 по GPC,
(c) полимер бетациклодекстринамина формулы
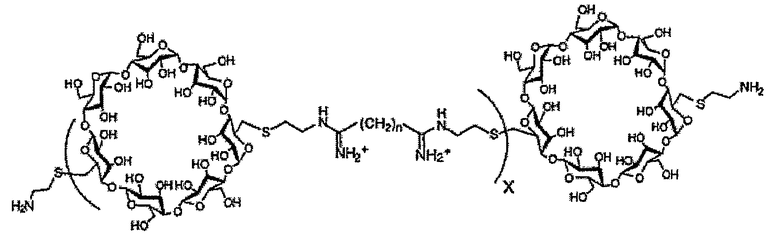
где X представляет собой целое число от 1 до 100, включительно, и n представляет собой целое число от 4 до 10, включительно,
(d) дендример, содержащий группу амина, и
(e) катионный пептид.
Предпочтительно, полиамин, как обозначают в настоящем документе, содержит группы первичных или вторичных аминов, или их смесь (например, по меньшей мере две группы первичных аминов). Предпочтительно, участок полиамина имеет по меньшей мере 2, 3, 4, 5 или 6 атомов азота и заряд по меньшей мере +1, +2, +3, +4 или +5 (или по меньшей мере +6, +7, +8, +9, +10, +11, +12, +13, +14, +15, +20, +25, +50, +75, +100, +150, +200, +250, +300, +400, +500, +750 или +1000) при физиологических значениях pH, например, некоторые или все из аминогрупп являются заряженными. Предпочтительно по меньшей мере одна (например, по меньшей мере 2, 3 или 4) азотсодержащая группа, например, NH, является незаряженной при физиологических значениях pH. Значение pKa, при котором последний амин полиамина является протонированным, например, липополиамина, предпочтительно составляет приблизительно 5,5, т.е. при снижении pH, или добавлении кислых соединений, последний амин, подлежащий протонированию, протонируется при pH, меньшем или равном 5,5.
В одном варианте осуществления носитель содержит липополиамин в нелипосомальном составе. Под липополиамином подразумевают амфифильную молекулу, содержащую по меньшей мере одну гидрофильную область полиамина (т.е. которая содержит две или более групп аминов) и одну липофильную область. Липофильная область может содержать одну или несколько липофильных цепей.
Область полиамина в липополиамине предпочтительно имеет формулу (I)
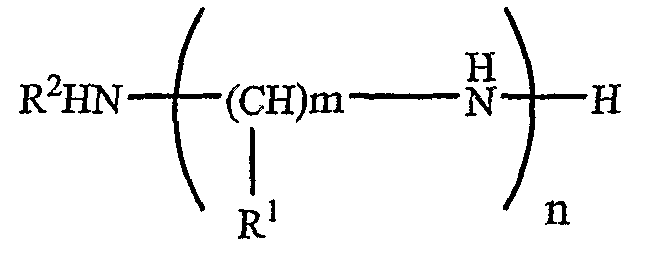
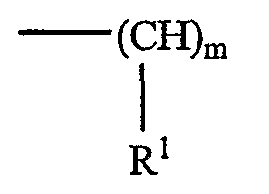
в которой m представляет собой целое число, превышающее или равное 2, и n представляет собой целое число, превышающее или равное 1, возможно, чтобы m варьировало между различными углеродсодержащими группами, включенными между двумя аминами, т.е. каждая группа (CH)m-NH может иметь отличающуюся величину m, и m может быть одинаковым или может отличаться, когда оно встречается в указанной формуле. В каждом положении R1 представляет собой водород или соединительную группу для липо-части липополиамина или саму липо-часть, как описано в настоящем документе далее, и он может быть одинаковым или может отличаться у каждого атома углерода. R2 представляет собой водород или соединительную группу для липо-части липополиамина или саму липо-часть, как описано в настоящем документе далее. Предпочтительно, m составляет между 2 и 6, включительно, более предпочтительно 3 или 4, и n составляет между 1 и 5, включительно, более предпочтительно 3.
Предпочтительно только один из R1 и R2 является соединительной группой, соединительной группой, присоединенной к липо-части полиамина, или липо-частью полиамина. Предпочтительно только одна группа R1 представляет собой соединительную группу, соединительную группу, присоединенную к липо-части полиамина, или липо-часть полиамина. R2 предпочтительно представляет собой H.
Когда R1 или R2 представляет собой саму липо-часть или представляет собой соединительную группу, которая присоединена к липо-части полиамина, формула (I) представляет собой липополиамин. Таким образом формула (I) представляет собой область полиамина, только когда R1 или R2 представляют собой не липо-часть или не соединительную группу, к которой присоединена липо-часть.
Более предпочтительно, область полиамина соответствует следующей формуле
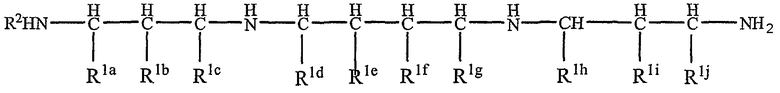
где R2 и от R1a до R1j являются такими, как R1, определенный выше, и предпочтительно R1a представляет собой соединительную группу и остальные группы R1 и R2 представляют собой водород.
Соединительная группа содержит связи, которые стабильны при нормальных условиях.
Предпочтительно R1 или R2 представляют собой атом водорода или радикал общей формулы II:
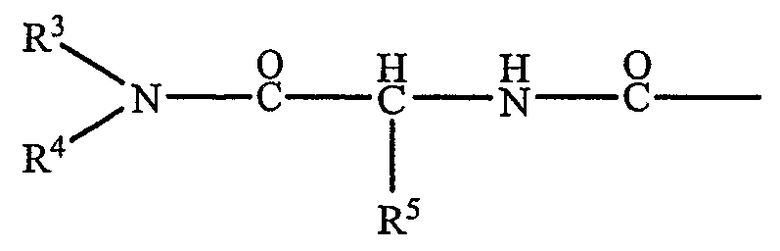
в которой каждый R3 и R4, которые могут быть идентичными или могут отличаться, представляет собой насыщенный алифатический радикал Cp H2p+2 или ненасыщенный алифатический радикал Cp H2p или Cp H2p-2, причем p представляет собой целое число между 12 и 22, включительно, и R5 представляет собой атом водорода или алкильный радикал, содержащий от 1 до 4 атомов углерода, необязательно замещенных фенильным радикалом.
Альтернативно каждый R1 или R2 может представлять собой радикал общей формулы III:
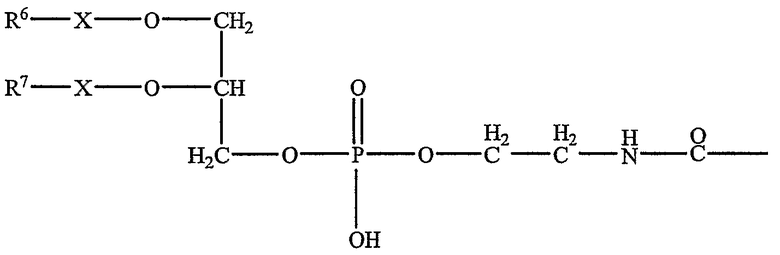
в которой X представляет собой группу метилена (-CH2-) или карбонильную группу (-CO-), и каждый R6 и R7, которые могут быть идентичными или могут отличаться, представляет собой насыщенный алифатический радикал Cp' H2p'+2 или ненасыщенный алифатический радикал Cp' H2p' или Cp' H2p'-2, причем p' представляет собой целое число между 11 и 21, включительно.
Независимо от величин m и n, только один из символов R1 и R2 может представлять собой радикал общей формулы (II) или (III).
Когда n составляет между 2 и 5, значения m в различных фрагментах
могут быть идентичными или могут отличаться.
В предпочтительном варианте осуществления формулы (I) n равно 3, и значения m во фрагментах
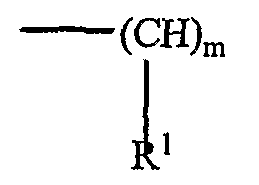
являются идентичными или отличаются и составляют 3 или 4, и либо R1, либо R2 представляет собой: либо радикал общей формулы (II), в котором каждый R3 и R4 представляет собой алкильный радикал, содержащий от 12 до 22 атомов углерода, и R5 представляет собой атом водорода, или либо R1, либо R2 представляет собой радикал общей формулы (III), в котором каждый R6-X- и R7-X- представляет собой алканоильный радикал, содержащий от 12 до 22 атомов углерода.
Особенно предпочтительными являются 5-карбоксиспермилглициндиоктадециламид (DOGS) и 5-карбоксиспермиламид дипальмитоилфосфатидилэтаноламина (DPPES).
Синтез указанных выше липополиаминов описан в US 5476962.
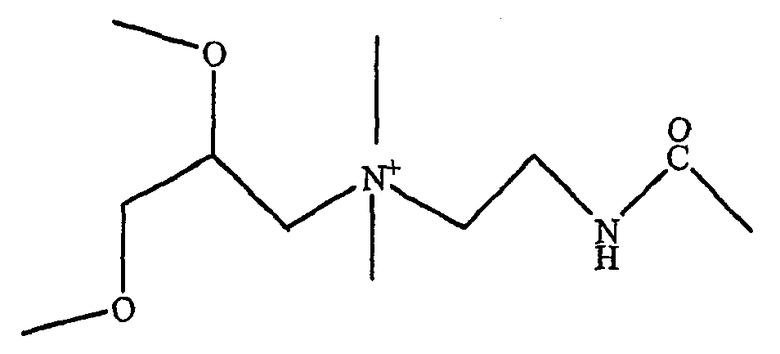
Следующие примеры липополиаминов для применения в соответствии с этим изобретением включают трифторацетат 2,3-диолеилокси-N-[2-сперминкарбоксииламидо]этил-N,N-диметил-1-пропанаминия (DOSPA), 1,3-диолеилокси-2-(6-карбоксиспермин) пропиламида (DOSPER) и RPR-120535 (Ahmed et al. (2005) Pharmaceutical Research 22 (6), 972-980). Структуры предпочтительных липополиаминов указаны на фиг.7.
В DOSPA соединительная группа представляет собой
В DOSPER соединительная группа представляет собой
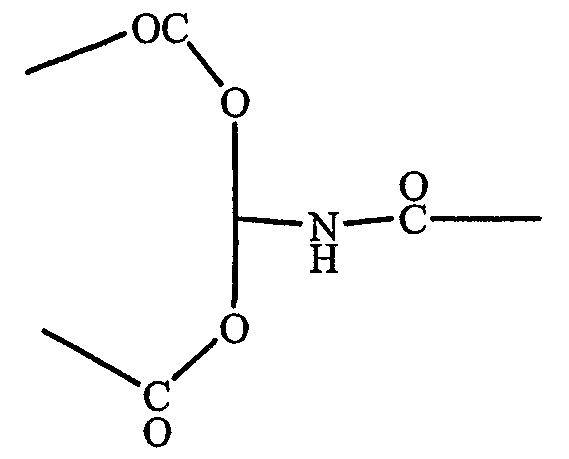
И указанные выше структуры, таким образом, представляют собой дальнейшие пригодные примеры соединительных групп.
Липофильная область может быть такой, как определено выше для R3, R4, R5 или R6, или она может представлять собой любую насыщенную или ненасыщенную углеводородную цепь, холестерин или другой стероид, природный липид или синтетический липид, способный образовывать ламеллярную или гексагональную фазы. Длина углеводородной цепи может составлять от 10 до 30 атомов углерода, например, 12-28, 14-26, 16-24, 18-22 атомов углерода.
Носитель предпочтительно представляет собой JetSITM или JetSI-ENDOTM, оба из которых доступны от Polyplus transfection. Альтернативно, носитель может представлять собой Transfectam®, доступный от Promega.
Под липосомальным составом подразумевают, что катионное заряженное амфифильное соединение (т.е. липополиамин) комбинировано с нейтральным вспомогательным липидом, таким как DOPE (диолеилфосфатидилэтаноламин), с образованием липосом. По существу, нелипосомальный состав липополиамина представляет собой содержащий липополиамин состав, в котором липополиамин не представлен в форме липосомы. Иными словами, такие составы не содержат, в дополнение к липополиамину, какие-либо нейтральные вспомогательные липиды. Примерами вспомогательных липидов являются нейтральные фосфолипиды, холестерин, глицерофосфоэтаноламины и диацилглицерин. Предпочтительно состав липополиамина содержит только липополиамин, описанный в настоящем документе.
Известно, что, как правило, комбинирование веществ для трансфекции со вспомогательными липидами, такими как DOPE, будет повышать эффективность трансфекции, и, таким образом, удивительно, что улучшенную, и более селективную степень ингибирования можно достигать, не включая эти соединения в состав при применении в способах по этому изобретению.
Носитель предпочтительно представляет собой не липофектамин 2000, липофектин, jet PEI, или носитель, имеющий состав из этих коммерчески доступных реагентов для трансфекции. Композиция липофектамина 2000 представляет собой 3:1 (об./об.) липосомальный состав из поликатионного липида трифторацетата 2,3-диолеилокси-N-[2(сперминкарбоксамидо)этил]-N,N-диметил-1-пропанаминия (DOSPA) (название Chemical Abstracts Registry: трифторацетат N-[2-(2,5-бис[(3-аминопропил)амино]-1-оксипентиламино)этил]-N,N-диметил-2,3-бис(9-октадеценилокси)-1-пропанаминия), и нейтрального липида диолеилфосфатидилэтаноламина (DOPE).
Композиция липофектина представляет собой смесь 1:1 DOTMA (бромида 1,2-диолеилоксипропил-3-триметиламмония) и DOPE (диолеилфосфатидилэтаноламина).
Носитель также предпочтительно представляет собой не siPORT или носитель, имеющий в составе этот коммерчески доступный реагент для трансфекции.
В альтернативном варианте осуществления, носитель представляет собой соединение полиамина, которое является катионным (и предпочтительно протонируемым) при физиологических значениях pH, например, полиэтиленимин (PEI). PEI существует во многих различных структурных вариантах, однако наибольший интерес представляют варианты, имеющие значение Mn (среднечисловую молекулярную массу) 600 или более по GPC (гель-проникающая хроматография). Например, PEI может иметь значение Mn 500-700, 500-750, 750-1000, 100-1250, 1000-1250, 1250-1500, 1000-20000, 1100-15000, 1200-12500, 1250-10000, 1500-7500, 1750-5000, 2000-4000 или 2500-3500.
Среднечисловая молекулярная масса представляет собой путь для определения молекулярной массы полимера. Полимерные молекулы, даже молекулы одного типа, обладают различными размерами (длины цепей, для линейных полимеров), так что средняя молекулярная масса будет зависеть от способа усреднения. Среднечисловая молекулярная масса представляет собой общее, усредненное, среднее значение молекулярных масс отдельных полимеров. Ее определяют посредством измерения молекулярной массы n полимерных молекул, суммирования масс и деления на n.
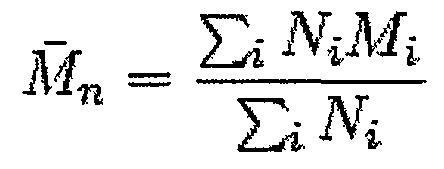
Можно использовать линейные формы PEI или нелинейные, например, разветвленные PEI (которые, например, могут обладать низкой молекулярной массой со значениями ММ, описанными в настоящем документе).
Под разветвленным PEI подразумевают PEI, который содержит группы третичных аминов, а также группы первичных и вторичных аминов. Количество групп третичных аминов, относительно групп первичных и/или вторичных аминов указывает на показатель или степень ветвления в полимере. Как правило, разветвленный PEI содержит группы первичных, вторичных и третичных аминов в соотношении 0,5-1,5:1,5-2,5:0,5-1,5, например, 1:2:1 (т.е. соотношение 2:1 для групп вторичных и третичных аминов), однако также существуют разветвленные PEI с ветвящейся структурой, так что они содержат относительно большее или меньшее количество групп третичных аминов и их можно использовать в настоящем изобретении. Примерами альтернативных соотношений являются от 1:1 до 3:1 (группы от вторичных до третичных аминов), например, от 1,2:1 до 2,8:1, от 1,4:1 до 2,6:1, от 1,6:1 до 2,4:1, от 1,8:1 до 2,2:1.
Молекулярная масса PEI предпочтительно составляет менее 30 кДа или 25 кДа, например, менее 15, 10, 5 или 2 кДа.
Пример пригодного PEI доступен от Sigma (408719 полиэтиленимин (средняя ММ ~800 Да по LS, среднее значение Mn ~600 по GPC, низкомолекулярный, не содержит воды). Другие коммерчески доступные реагенты на основе PEI включают Poly Sciences, Inc PEI (разветвленный, ММ 10000), US Biological Exgen 500, Polyplus transfection jetPEITM, Sigma ESCORTTM Transfection reagent, и Mirus TransIT-TKO®.
Как описано выше, в предпочтительном варианте осуществления, в качестве молекулы носителя можно использовать один или несколько полимеров бетациклодекстринамина, т.е. соединение полиамина представляет собой полимер бетациклодекстринамина. Пригодные полимеры бетациклодекстринамина и способы синтеза таких молекул описаны в Hwang et al., (2001) Bioconjugate Chem, 12, 280-90.
Пригодные полимеры бетациклодекстринамина и схема, показывающая их синтез из соответствующих мономеров, указаны ниже:
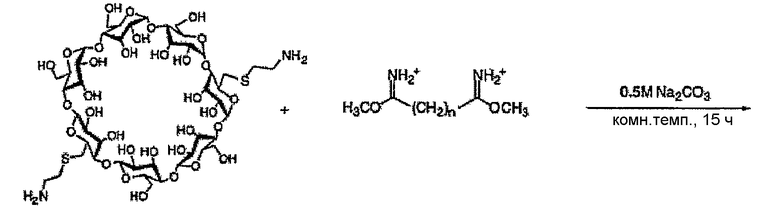
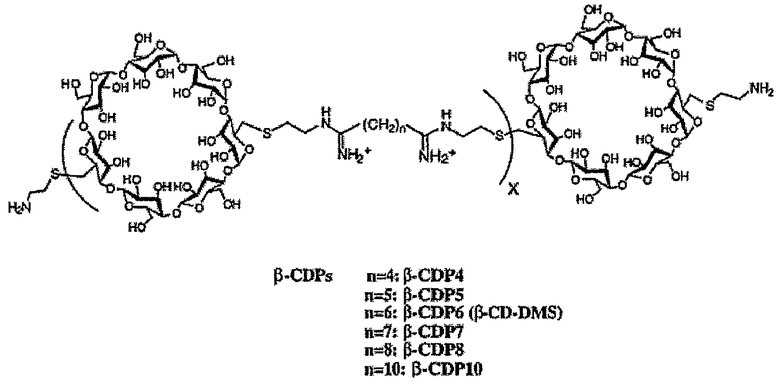
Как указано выше, n может представлять собой целое число от 4 до 10, включительно, предпочтительно от 5 до 8, включительно, или от 6 до 7, включительно. Наиболее предпочтительно оно представляет собой 4, 6 или 8. X может представлять собой любое целое число. X предпочтительно представляет собой от 1 до 100, от 10 до 50, от 15 до 25, от 1 до 20, например, от 2 до 15, от 3 до 12, от 4 до 10, от 5 до 8 или от 6 до 7, включительно. Наиболее предпочтительно X представляет собой 4 или 5.
В следующем предпочтительном варианте осуществления, в качестве молекулы носителя можно использовать один или несколько дендримеров, содержащих группы аминов (например, полиамидоамидный (PAMAM) дендример), т.е. соединение полиамина представляет собой дендример, содержащий группу амина. Дендримеры представляют собой класс с макромолекулярной структурой, называемый "dense star"-полимерами.
В отличие от классических полимеров, дендримеры имеют высокую степень молекулярного единообразия, узкое распределение молекулярной массы, конкретные характеристики размера и формы и высоко функционализированную концевую поверхность. Таким образом, дендримеры представляют собой искусственно полученные или синтезированные молекулы, которые получают из разветвленных единиц или мономеров, с образованием монодисперсной, древообразной или генерационной структуры. Синтез монодисперсных полимеров требует высокого уровня контроля синтеза, который достигают посредством пошаговых реакций, выстраивающих один слой мономеров дендримера, или "поколение", единовременно. Каждый дендример состоит из многофункциональной центральной молекулы с древообразным клином, присоединенным к каждому функциональному участку. Центральную молекулу называют "0 поколением". Каждая последующая повторяющаяся единица вдоль всех ветвей формирует следующее поколение, "поколение 1", "поколение 2" и так далее до завершающего поколения.
Процесс изготовления, таким образом, представляет собой серию повторяющихся стадий, начинающихся с центральной инициирующей сердцевины. Каждая последующая стадия роста представляет собой новое "поколение" полимера с более крупным диаметром молекулы, удвоенным количеством реакционных поверхностных участков и приблизительно с удвоенной молекулярной массой относительно предшествующего поколения. Например, поколение дендримера PAMAM описано в Esfand et al., (2001) Drug Discovery Today, 6(8), 427-36 и в Kukowska-Latallo et al., (1996), 93(10), 4897-902.
Пригодные дендримеры включают все дендримеры, содержащие группы аминов, например; дендримеры с центрами из триэтаноламина, NH3 или этилендиамина, к которым присоединены содержащие амин мономеры. Особенно предпочтительными являются дендримеры PAMAM. Предпочтительно, дендример состоит из мономеров полиамина, например, имеющих общую формулу H2N-(CH2)m-NH-(CO)n-(CH2)o, где m и o представляют собой числа от 1 до 10, предпочтительно 1 или 2 и n представляет собой 0 или 1.
Дендримеры PAMAM показаны на фиг.14. Каждое "поколение" представляет собой добавление двух новых групп H2N-CH2-CH2-NH-CO-CH2-CH2- к каждой из концевых аминогрупп предшествующего поколения; как также проиллюстрировано на фигуре.
В таблице, представленной ниже, показаны вычисленные свойства функциональных дендримеров PAMAM с поверхностными аминами по поколениям.
Предпочтительно дендример PAMAM обладает молекулярной массой 1000-235000 или 3000-117000, например, 6000-60000 или 14000-30000 Да.
Дендримеры также можно определить с учетом их поколения, и по существу дендример (например, дендример PAMAM) предпочтительно представляет собой дендример 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 поколения, в частности, 2-6 поколения.
Как упоминалось выше, в следующем альтернативном варианте осуществления в качестве молекулы носителя можно использовать один или несколько катионных полипептидов, т.е. соединение полиамина представляет собой катионный полипептид. Различные катионные пептиды известны в данной области.
Как определено в настоящем документе, "пептид" включает любую молекулу, содержащую любое количество аминокислот, т.е. одну или несколько аминокислот. Однако предпочтительно пептид представляет собой полимер из последовательно расположенных аминокислот.
Пептиды можно получать любым удобным способом, например, прямым химическим синтезом или рекомбинантными способами посредством экспрессии в клетке молекулы нуклеиновой кислоты с соответствующей последовательностью.
Как обозначают в настоящем документе в отношении пептидов, "катионный" означает, что общий, или суммарный, заряд пептида составляет +1 или более при физиологических значениях pH, т.е. pH 7,2. Считают, что аминокислота имеет +1, если ее преобладающая разновидность при физиологических значениях pH является положительно заряженной, когда присутствует в последовательности пептида. Каждая такая аминокислота в пептиде обеспечивает дополнительный положительный заряд при вычислении конечного заряда пептида. Пептид может содержать один или несколько отрицательно заряженных аминокислотных остатков, а также нейтральные остатки, при условии, что суммарный заряд пептида (вычисленный посредством сложения зарядов, свойственных каждой аминокислоте) является положительным.
Таким образом, заряд пептида зависит от его аминокислотного состава. Некоторые аминокислоты являются заряженными при нормальных физиологических значениях pH. Положительно заряженными аминокислотами являются лизин (K), аргинин (R) и гистидин (H), и считают, что они имеют +1 по описанной выше шкале. Аспарагиновая кислота (D) и глутаминовая кислота (E) обладают отрицательным зарядом при большинстве физиологических значений pH, и считают, что они имеют -1 по указанной выше шкале. Считают, что другие встречающиеся в природе аминокислоты не обладают зарядом. Может присутствовать любое количество положительно заряженных или отрицательно заряженных аминокислот, при условии, что общий заряд пептида составляет +1 или более.
Аминокислоты, используемые в пептидах для применения в этом изобретении, необязательно должны представлять собой встречающиеся в природе аминокислоты. Одна или несколько из аминокислот в пептиде могут быть замещены не встречающейся в природе, например, производной аминокислотой. Такие аминокислоты аналогично можно оценивать, исходя из их вклада в заряд пептида. Таким образом, как и в случае встречающихся в природе аминокислот, преобладающая разновидность является положительной при физиологических значениях pH, независимо от того, является ли источником заряда производная часть (например, введенная группа амина) или часть, также присутствующая в природной аминокислоте, при условии, что общий заряд представляет собой +1 или более.
Заряд пептида составляет >1, предпочтительно от +1 до +1000, от +1 до +500, от +1 до +250 или от +1 до +100, например, от +2 до +80, например, от +3 до +60 или от +4 до +50, от +5 до +30, от +6 до +20, например, +10 или +15.
Предпочтительно, катионный пептид содержит остатки L- или D-лизина, L- или D-аргинина, L- или D-гистидина и/или орнитина. Более предпочтительно пептид обогащен по одному или нескольким из этих остатков, например, он содержит 10-100%, 20-80%, 30-70%, 40-60% или 50% положительно заряженных остатков. Примеры таких пептидов включают поли-L-лизин, поли-D-лизин, полигистидин, гистидинилированный полилизин и полиорнитин или сополимеры остатков L или D лизина, L или D аргинина, L или D гистидина и/или орнитина с другими аминокислотами, например, с одной или несколькими из аланина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, изолейцина, лейцина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина.
Указанные катионные полипептиды могут быть определены с точки зрения их молекулярной массы. По существу, они предпочтительно имеют массу по меньшей мере 1000 Да, 1500 Да, 2000 Да, 2500 Да, 5000 Да, 7500 Да, 10000 Да, 15000 Да, 20000 Да, 25000 Да, 30000 Да, 40000 Да, 50000 Да, 60000 Да, 70000 Да, 80000 Да, 90000 Да или 100000 Да.
Альтернативно катионные полипептиды могут быть определены с точки зрения их длины. Предпочтительные катионные полипептиды обладают длиной по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 200, 250, 300, 350, 400, 450, 500 аминокислот.
Высоко предпочтительным катионным пептидом является полиаргинин, в частности, полиаргинин с ММ по меньшей мере 15000 кДа.
Без связи с теорией, полагают, что ассоциация носителя с молекулой siRNA основана на взаимодействии положительно заряженного носителя с отрицательно заряженной молекулой siRNA, что ведет к образованию комплекса siRNA-носитель. Комплексы siRNA-носитель взаимодействуют с анионными протеогликанами на клеточной поверхности и захватываются эндоцитозом.
Как правило, ассоциации, связывания или конъюгации носителя с молекулой siRNA или как с siRNA, так и с фотосенсибилизирующим веществом, достигают простым смешиванием двух компонентов в соответствующих условиях и концентрациях и позволяя компонентам взаимодействовать. Таким образом, в предпочтительном варианте осуществления, способ включает дополнительную стадию контактирования указанной siRNA с указанным носителем. Условия, при которых проводят эту стадию контактирования, и соответствующие концентрации для каждого из носителя и молекулы siRNA может легко определить специалист в данной области проведением общепринятого тестирования. Примеры пригодных условий являются такими, как указано в примерах. Например, молекулу siRNA и молекулу носителя можно смешивать, например, встряхиванием, и позволяя стоять, например, при комнатной температуре. Затем молекулу siRNA и молекулу носителя можно оставлять приблизительно на 10-20, 10-30 или 20-40 минут, перед контактированием с клеткой.
Для трансфекции, например, в лунке стандартного 6-луночного планшета используют предпочтительно 10 нМ-200 нМ, например, 15-150 нМ, 20-100 нМ, 20-100 нМ, 30-90 нМ, 40-80 нМ или 50-70 нМ siRNA, хотя можно тестировать другие концентрации. Определение оптимальной концентрации siRNA для применения в способе является вопросом практики.
Клетки, на которые наносят siRNA и носитель, получают с использованием стандартных способов культивирования клеток. Если клетки являются прикрепляющимися клетками, они предпочтительно обладают 50-70% или 25-50% смыканием монослоя.
Носитель и молекулу siRNA можно смешивать в различных соотношениях, исходя из стандартных протоколов. Например, как указано в примерах с 1 по 6, 8,4 мкл 2 мМ носителя, изготовленного в водном растворе, можно смешивать с 2,8 мкг siRNA в 2 мл среды для нанесения в 6-луночный планшет. Аналогично, 4,2 мкл 2 мМ носителя, изготовленные в водном растворе, можно смешивать с 1,4 мкг siRNA в 1 мл среды для нанесения в 6-луночный планшет. Носитель необязательно должен находиться в концентрации 2 мМ, пригодные диапазоны включают 0,5-5 мМ, 1-3 мМ, 1,5-2,5 мМ (например, изготовленный в водном растворе). Для каждого нг siRNA, можно использовать количество, эквивалентное всего приблизительно 6 наномолям носителя (например, 1-10, 2-8) в растворе с фотосенсибилизирующим веществом.
Для PEI, предпочтительные концентрации составляют 1 мкг/мл и 10 мкг/мл (например, 0,5-20 или 1-15 мкг/мл) со 100 нМ siRNA, например, в 1 мл среды для нанесения на 6-луночный планшет. Было показано, что это является особенно эффективным для PEI с молекулярной массой 1200-25000 Дальтон (например, 1300-2000 Дальтон), как указано в примере 9. Концентрацию используемого PEI можно модифицировать для достижения соотношения зарядов и/или соотношения N/P, которое достигают с использованием условий, указанных в примере 9.
Для полимеров бетациклодекстринамина, пригодная концентрация составляет 100 мкг/мл (например, 10-1000, 20-800, 30-600, 40-400, 50-200 мкг/мл) с 50 нМ siRNA, например, в 1 мл среды для нанесения в 6-луночный планшет. Это основано на применении полимера, как описано в примере 11. Значения n и X будут влиять на заряд молекулы и, по существу, могут быть пригодными различные концентрации. Используемую концентрацию полимера бетациклодекстринамина можно модифицировать для достижения соотношения зарядов и/или соотношения N/P, которое достигают с использованием условий, указанных в примере 11.
Для группы амина, содержащей дендримеры, пригодная концентрация составляет 100 мкг/мл (например, 10-1000, 20-800, 30-600, 40-400, 50-200 мкг/мл) со 100 нМ siRNA, например, в 1 мл среды для нанесения в 6-луночный планшет. Концентрацию используемой группы амина, содержащей дендример, можно модифицировать для достижения соотношения зарядов и/или соотношения N/P, которое достигают с использованием условий, указанных в примере 12.
Для катионных пептидов, пригодная концентрация составляет 0,35 мкг/мл или 0,7 мкг/мл (например, 0,1-20, 0,2-15, 0,3-10 мкг/мл) со 100 нМ siRNA, например, в 1 мл среды для нанесения в 6-луночный планшет. Как указано в примере 13, эти концентрации использовали последовательно с носителем на основе полиаргинина с молекулярной массой 15000-70000 и >70000. Молекулярная масса и аминокислотный состав пептида будут влиять на заряд молекулы, и, по существу, могут быть пригодными различные концентрации. Используемую концентрацию катионного пептида можно модифицировать для достижения соотношения зарядов и/или соотношения N/P, как достигают с использованием условий, указанных в примере 13.
Соотношение двух компонентов можно выражать в качестве соотношения зарядов, и это также необходимо учитывать. Предпочтительно, соотношение зарядов между носителем и siRNA составляет по меньшей мере 1+/- (т.е. 1 положительный заряд на отрицательный заряд), 5+/-, 10+/-, 20+/-, 30+/-, 40+/-, 50+/-, 60+/-, 70+/-, 80+/-, 90+/-, 100+/-; 200+/-, 300+/-, 400+/- или 500+/-.
Соотношение зарядов зависит от заряда каждого компонента (т.е. от siRNA и носителя) и от количества каждого компонента, который присутствует.
Альтернативно, соотношение двух компонентов можно выражать в качестве соотношения N/P, т.е. соотношения остатков азота к фосфату олигонуклеотида. Поскольку не каждый атом азота носителя всегда представляет собой катион, соотношение N/P не является таким же, как соотношение зарядов. Соотношение N/P зависит от химического состава каждого соединения и от количества каждого соединения, которое присутствует. Пригодные значения для соотношения N/P включают 1-500, например, 2-450, 3-400, 4-350, 5-300, 6-250, 7-200, 8-150, 9-100, 10-80, 15-60, 20-50, 30-40, 1-25, 1-20, 1-15, 1-10, 1-5.
Предпочтительно носитель является таким, что в концентрации, которую выбирают для применения, не происходит высвобождение из внутриклеточных компартментов без стадии облучения PCI, и высвобождение из внутриклеточных компартментов наблюдают после стадии облучения PCI. Пригодные концентрации и соотношения siRNA и носителя упомянуты выше.
Носитель, как правило, изготавливают для трансфекции в водном растворе (например, в воде). Затем исходный раствор (например, 20 мМ в этаноле) можно разбавлять (например, в воде) до соответствующей концентрации для применения. В US5476962 описан состав липополиаминов.
Как упоминалось выше, носитель siRNA также можно использовать в качестве носителя для фотосенсибилизирующего вещества. Однако альтернативно фотосенсибилизирующее вещество можно использовать без носителя или с альтернативным носителем, не используемым в соответствии с этим изобретением для siRNA. Такие альтернативные носители обозначают в настоящем документе как носители для фотосенсибилизирующего вещества, и они включают поликатионы, такие как полилизин (например, поли-L-лизин или поли-D-лизин), полиэтиленимин или дендримеры (например, катионные дендримеры, такие как SuperFect7); катионные липиды, такие как DOTAP или липофектин, и пептиды.
В целях нацеливания молекулы siRNA и/или фотосенсибилизирующего вещества на конкретные клетки (например, на злокачественные клетки) или ткани, молекулу siRNA и/или фотосенсибилизирующее вещество и/или носитель можно связывать или конъюгировать со специфичными нацеливающими молекулами, которые будут обеспечивать специфичный клеточный захват молекулы siRNA в требуемые клетки или ткани.
Можно использовать много различных нацеливающих молекул, например, как описано в Curiel (1999), Ann. New York Acad. Sci. 886, 158-171; Bilbao et al., (1998), in Gene Therapy of Cancer (Walden et al., eds., Plenum Press, New York); Peng and Russell (1999), Curr. Opin. Biotechnol. 10, 454-457; Wickham (2000), Gene Ther. 7, 110-114.
Нацеливающая молекула может быть ассоциирована, связана или конъюгирована с молекулой siRNA, с носителем, с фотосенсибилизирующим веществом или с двумя (например, siRNA и носителем или siRNA и фотосенсибилизирующим веществом или носителем и фотосенсибилизирующим веществом) или со всеми тремя из этих групп, и можно использовать одинаковые или отличающиеся нацеливающие молекулы. Как упоминалось выше, можно использовать более одной нацеливающей молекулы одновременно.
Способ по этому изобретению можно применять на практике, как описано ниже. В способе по этому изобретению, молекулу siRNA, совместно с ее носителем и фотосенсибилизирующим соединением (необязательно с тем же носителем или с носителем фотосенсибилизирующего вещества) наносят одновременно или последовательно на клетки, после чего фотосенсибилизирующее соединение, носитель и молекула siRNA подвергаются эндоцитозу или иными способами перемещаются в эндосомы, лизосомы или другие внутриклеточные ограниченные мембраной компартменты.
siRNA, носитель и фотосенсибилизирующее соединение можно наносить на клетки совместно или последовательно. Как правило, siRNA смешивают с носителем, как описано выше, чтобы происходило образование комплекса, который затем вводят в клетку одновременно с фотосенсибилизирующим соединением. Альтернативно комплекс siRNA:носитель и фотосенсибилизирующее соединение можно вводить последовательно. Комплекс siRNA-носитель и фотосенсибилизирующее соединение могут захватываться клеткой в один или в различные внутриклеточные компартменты (например, они могут совместно перемещаться).
Затем siRNA высвобождается под воздействием на клетки света с длиной волны, пригодной для активации фотосенсибилизирующего соединения, которая в свою очередь приводит к разрушению мембран внутриклеточных компартментов и последующему высвобождению siRNA, которая может находиться в том же компартменте, что и фотосенсибилизирующее вещество, в цитозоль. Таким образом, в этих способах конечная стадия воздействия на клетки света приводит к высвобождению siRNA из того же внутриклеточного компартмента, в котором находится фотосенсибилизирующее вещество, и к его попаданию в цитозоль.
В WO 02/44396 (которая включена в настоящий документ в качестве ссылки) описан способ, в котором порядок стадий может быть изменен так, чтобы, например, фотосенсибилизирующее вещество контактировало с клетками и активировалось облучением до того, как молекулы, подлежащие интернализации (и носитель), контактируют с клетками. Этот адаптированный способ имеет преимущество, заключающееся в отсутствии необходимости в том, чтобы молекула, подлежащая интернализации, присутствовала в том же клеточном субкомпартменте, что и фотосенсибилизирующее вещество во время облучения.
Таким образом, в предпочтительном варианте осуществления, указанное фотосенсибилизирующее вещество, указанный носитель и указанную молекулу siRNA (например, в качестве комплекса носитель:siRNA) наносят на клетку совместно, или указанное фотосенсибилизирующее вещество наносят отдельно от указанного носителя и указанной молекулы siRNA. В результате этого, они могут захватываться клеткой в один внутриклеточный компартмент и затем можно проводить указанное облучение. Фотосенсибилизирующее вещество, носитель и молекула siRNA могут быть отдельными, или они могут быть изготовлены в качестве дендримерной молекулы (см., например, Nishiyama N et al., (2005) Nat Mater. 4(12):934-41).
В альтернативном варианте осуществления, указанный способ можно проводить посредством контактирования указанной клетки с фотосенсибилизирующим веществом, контактирования указанной клетки с носителем и молекулой siRNA, подлежащей введению, и облучения указанной клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества, где указанное облучение проводят до клеточного захвата указанной молекулы siRNA и указанного носителя во внутриклеточный компартмент, содержащий указанное фотосенсибилизирующее вещество, предпочтительно до клеточного захвата указанной молекулы и указанного носителя в какой-либо внутриклеточный компартмент.
Указанное облучение можно проводить после клеточного захвата молекулы и молекулы носителя во внутриклеточный компартмент, независимо от того, локализованы ли указанная молекула siRNA и фотосенсибилизирующее вещество в одних внутриклеточных компартментах во время воздействия света. Однако в одном предпочтительном варианте осуществления облучение проводят до клеточного захвата молекулы, подлежащей интернализации.
Как используют в настоящем документе, "интернализация" относится к доставке молекул в цитозоль. В данном случае, "интернализация", таким образом, включает стадию высвобождения молекул из внутриклеточных/мембраносвязанных компартментов в цитозоль клеток.
Как используют в настоящем документе, "клеточный захват" или "транслокация" относится к одной из стадий интернализации, в которой молекулы, находящиеся снаружи клеточной мембраны, захватываются в клетку, чтобы они находились с внутренней стороны от лежащей снаружи клеточной мембраны, например, посредством эндоцитоза или других механизмов захвата, например, во внутриклеточные ограниченные мембраной компартменты, например, эндоплазматическую сеть, тельце Гольджи, лизосомы, эндосомы и т.д., или совместно с ними.
Стадию контактирования клеток с фотосенсибилизирующим веществом и с молекулой siRNA и носителем можно проводить любым удобным или желательным способом. Таким образом, если стадию контактирования надлежит проводить in vitro, клетки удобным образом можно поддерживать в водной среде, такой как, например, соответствующая среда для культивирования клеток, и в соответствующий момент времени фотосенсибилизирующее вещество и/или молекулу siRNA и носитель можно просто добавлять к среде в соответствующих условиях, например, при соответствующей концентрации и в течение соответствующего периода времени. Например, клетки можно подвергать контактированию с молекулой siRNA и носителем в присутствии бессывороточной среды.
Фотосенсибилизирующее вещество подвергают контактированию с клетками в соответствующей концентрации и в течение соответствующего периода времени, которые легко может определить квалифицированный специалист с использованием общепринятых способов и они будут зависеть от таких факторов, как конкретное используемое фотосенсибилизирующее вещество и тип и расположение клетки-мишени. Концентрация фотосенсибилизирующего вещества должна быть такой, чтобы после захвата в клетку, например, в один или несколько из ее внутриклеточных компартментов, или совместно с ними, и активации посредством облучения, одна или несколько клеточных структур разрушались, например, чтобы один или несколько внутриклеточных компартментов подвергались лизису или разрушались. Например, фотосенсибилизирующие вещества, как описано в настоящем документе, можно использовать в концентрации, например, от 10 до 50 мкг/мл. Для применения in vitro, диапазон может быть значительно более широким, например, 0,05-500 мкг/мл. Для лечения человека in vivo, фотосенсибилизирующее вещество можно использовать в диапазоне 0,05-20 мг/кг массы тела, при системном введении или 0,1-20% в растворителе для местного применения. У животных меньших размеров, диапазон концентраций может отличаться и его можно корректировать соответствующим образом.
Время инкубации клеток с фотосенсибилизирующим веществом (т.е. время "контакта") может варьировать от нескольких минут до нескольких часов, например, даже вплоть до 48 часов или более, например, от 12 до 20 или 24 часов. Время инкубации должно быть таким, чтобы фотосенсибилизирующее вещество захватывалось соответствующими клетками, например, во внутриклеточные компартменты указанных клеток.
После инкубации клеток с фотосенсибилизирующим веществом может необязательно следовать период инкубации с не содержащей фотосенсибилизирующее вещество средой, перед тем как клетки подвергают воздействию света или добавляют молекулы siRNA и носитель, например, в течение от 10 минут до 8 часов, главным образом, от 1 до 4 часов.
Молекулу siRNA и носитель (например, в качестве предварительно сформированного комплекса siRNA:носитель) подвергают контакту с клетками в соответствующей концентрации и в течение соответствующего периода времени.
Определение пригодных доз молекул siRNA для применения в способах по настоящему изобретению является общепринятой практикой для специалиста в данной области. Для применений in vitro, иллюстративная доза молекул siRNA будет составлять приблизительно 1-100 нМ siRNA, и для применений in vivo она будет составлять приблизительно 10-6 - 1 г siRNA на инъекцию у человека. Например, молекулы siRNA можно вводить на уровнях менее 500 нМ, например, менее 300 нМ, особенно предпочтительно менее 100 нМ или 50 нМ, например, от 1 до 100 нМ, или от 5 до 50 нМ, где указанная концентрация отражает уровни при контакте с клеткой.
Как упоминалось выше, было выявлено, что контактирование можно начинать даже через несколько часов после добавления фотосенсибилизирующего вещества и проведения облучения.
Соответствующую концентрацию можно определять в зависимости от эффективности захвата представляющей интерес молекулы siRNA в представляющие интерес клетки и конечной концентрации, которую желательно достигнуть в клетках. Таким образом "время трансфекции" или "время захвата клетками" т.е. время, в течение которого молекулы контактируют с клетками, может составлять от нескольких минут вплоть до нескольких часов, например, можно использовать время трансфекции от 10 минут до 24 часов, например, от 30 до 10 часов или, например, от 30 вплоть до 2 часов или 6 часов. Также можно использовать более длительное время инкубации, например, от 24 до 96 часов или более, например, 5-10 суток.
Увеличенное время трансфекции, как правило, приводит к повышенному захвату представляющей интерес молекулы. Однако более короткое время инкубации, например, от 30 минут до 1 часа, также может приводить к повышенной специфичности захвата молекулы. Таким образом, при выборе времени трансфекции для любого способа, необходимо найти соответствующий баланс между получением достаточного захвата молекулы при сохранении достаточной специфичности обработки PCI.
In vivo, соответствующий способ и время инкубации, посредством которых молекулу siRNA, носитель и фотосенсибилизирующие вещества подвергают контакту с клетками-мишенями, будет зависеть от факторов, таких как способ введения и тип молекулы siRNA, носителя и фотосенсибилизирующих веществ. Например, если молекулу siRNA и носитель инъецируют в опухоль, ткань или орган, которые подлежат лечению, клетки вблизи точки инъекции будут контактировать и, таким образом, иметь тенденцию к захвату молекулы siRNA более быстро, чем клетки, расположенные на большем расстоянии от точки инъекции, которые, вероятно, будут контактировать с молекулой siRNA в более позднее время и в более низкой концентрации.
Кроме того, для молекулы siRNA, введенной внутривенной инъекцией, может потребоваться некоторое время для достижения клеток-мишеней и, таким образом, накопление достаточного или оптимального количества молекулы siRNA в клетке-мишени или ткани-мишени может отнимать больший период времени после введения, например, несколько суток. Те же соображения, безусловно, применимы ко времени введения, требуемому для захвата фотосенсибилизирующего вещества в клетки. Время введения, требующееся для отдельных клеток, in vivo, таким образом, вероятно, будет варьировать, в зависимости от этих и других параметров.
Тем не менее, несмотря на то, что ситуация in vivo является более сложной, чем in vitro, основополагающая концепция настоящего изобретения является, тем не менее, такой же, т.е. время, через которое молекулы контактируют с клетками-мишенями, должно быть таким, чтобы до облучения соответствующее количество фотосенсибилизирующего вещества было захвачено клетками-мишенями и либо: (i) до или в процессе облучения молекула siRNA была или захвачена, или подлежала захвату после достаточного контакта с клетками-мишенями, в одинаковые или в различные внутриклеточные компартменты, либо (ii) после облучения молекула siRNA находилась в контакте с клетками в течение периода времени, достаточного для обеспечения ее захвата в клетки. Предоставленная молекула siRNA захватывается во внутриклеточные компартменты, поврежденные активацией фотосенсибилизирующего вещества (например, компартменты, в которых присутствует вещество), молекула siRNA может захватываться до или после облучения.
Стадия облучения светом для активации фотосенсибилизирующего вещества может происходить в соответствии со способами и процессами, хорошо известными в данной области. Например, длину волны и интенсивность света можно выбирать в соответствии с используемым фотосенсибилизирующим веществом. Пригодные источники света хорошо известны в данной области.
Время, в течение которого клетки подвергают воздействию света в способах по настоящему изобретению, может варьировать. Эффективность интернализации молекулы siRNA в цитозоль повышается с повышением воздействия света до максимума, после которого возрастает повреждение клеток и, таким образом, гибель клеток.
Предпочтительная длительность стадии облучения зависит от факторов, таких как мишень, фотосенсибилизирующее вещество, количество фотосенсибилизирующего вещества, накопившегося в клетках-мишенях или в ткани-мишени, и перекрывание между спектром поглощения фотосенсибилизирующего вещества и спектром испускания источника света. Как правило, длительность времени для стадии облучения составляет порядка от нескольких минут до нескольких часов, например, предпочтительно вплоть до 60 минут, например, от 0,5 или 1 до 30 минут, например, от 0,5 до 3 минут или от 1 до 5 минут или от 1 до 10 минут, например, от 3 до 7 минут, и предпочтительно приблизительно 3 минуты, например, от 2,5 до 3,5 минут. Также можно использовать более короткое время облучения, например, от 1 до 60 секунд, например, 10-50, 20-40 или 25-35 секунд.
Соответствующие дозы света могут быть выбраны специалистом в данной области, и они также будут зависеть от фотосенсибилизирующего вещества и от количества фотосенсибилизирующего вещества, накопленного в клетках-мишенях или тканях-мишенях. Например, доза света, обычно используемая для фотодинамического лечения злокачественных опухолей с фотосенсибилизирующим веществом фотофрином и предшественником протопорфирина 5-аминолевулиновой кислотой, находится в диапазоне 50-150 Дж/см2 с диапазоном плотности потока менее 200 мВт/см2 в целях избежания гипертермии. Дозы света, как правило, являются более низкими, когда используют фотосенсибилизирующие вещества с более высокими коэффициентами экстинкции в красной области видимого спектра. Однако для лечения незлокачественных тканей с меньшим количеством накапливающегося фотосенсибилизирующего вещества, общее требуемое количество света может быть по существу более высоким, чем в случае лечения злокачественных опухолей. Более того, если необходимо сохранить жизнеспособность клетки, необходимо избегать образования чрезмерных уровней токсичных частиц и соответствующие параметры можно корректировать пригодным образом.
Способы по этому изобретению неизбежно могут приводить к уничтожению некоторого количества клеток посредством фотохимической обработки, т.е. посредством образования токсичных частиц при активации фотосенсибилизирующего вещества. В зависимости от предполагаемого применения, эта клеточная гибель может быть не следствием и, в действительности, она может быть преимущественной для некоторых применений (например, при лечении злокачественной опухоли). Однако предпочтительно гибели клеток избегают, и, как отмечено в настоящем документе, способ можно проводить так, чтобы вызывать строгое ингибирование экспрессии (т.е. строгий эффект siRNA) в отсутствие клеточной токсичности. Является высоко преимущественным достижение строгого ингибирования экспрессии в отсутствие общей клеточной токсичности или эффекта на жизнеспособность клеток. Способы по этому изобретению можно модифицировать таким образом, чтобы часть или доля выживших клеток регулировалась посредством выбора дозы света в зависимости от концентрации фотосенсибилизирующего вещества. Также, такие способы известны в данной области.
В способах применения, в которых жизнеспособные клетки являются желательными, по существу все из клеток, или значительное большинство (например, по меньшей мере 50%, более предпочтительно по меньшей мере 60, 70, 80 или 90% клеток) не уничтожаются. Жизнеспособность клеток после обработки посредством PCI можно определять стандартными способами, известными в данной области, такими как тест MTS (см. примеры).
Независимо от величины гибели клеток, индуцируемой активацией фотосенсибилизирующего вещества, для наличия эффекта siRNA в клетках, важно, чтобы доза света регулировалась так, чтобы некоторые из отдельных клеток, где проявляется эффект PCI, не уничтожались посредством фотохимической обработки отдельно (хотя они могут после этого уничтожаться молекулами, введенными в клетки, если эти молекулы имеют цитотоксический эффект).
Цитотоксические эффекты можно достигать с использованием, например, генной терапии, в которой молекула siRNA интернализуется в опухолевую клетку способом по этому изобретению, например, для подавления гена.
Способы по этому изобретению можно применять in vitro или in vivo, например, либо для обработки in situ, либо для лечения ex vivo, с последующим введением обработанных клеток в организм, для различных целей, включая ингибирование экспрессии определенных продуктов генов, например, в способах генной терапии, и создание скрининговых анализов.
Таким образом, настоящее изобретение относится к способу ингибирования экспрессии гена-мишени посредством введения молекулы siRNA в клетку, содержащую указанный ген-мишень, способом, как описано в настоящем документе выше, где указанная молекула siRNA специфично ингибирует экспрессию указанного гена-мишени.
"Специфичное ингибирование" относится к зависимому от последовательности ингибированию гена-мишени. Экспрессия генов, которые содержат последовательность, которая является достаточно идентичной на уровне нуклеиновых кислот используемой молекуле siRNA, будет нарушаться молекулой siRNA. Как отмечалось выше, были разработаны способы, которые позволяют квалифицированному специалисту сконструировать молекулы siRNA с соответствующей последовательностью, для того чтобы вызвать специфичное к последовательности ингибирование экспрессии.
"Ген-мишень" относится к гену, экспрессию которого подавляют и который является мишенью исследования или манипулирования.
Эти способы можно использовать для изменения профиля экспрессии клеток, например, для исследования клеточных каскадов, или для определения влияния экспрессии конкретного гена, или для терапевтических целей.
Способы по этому изобретению также можно применять для лечения любого заболевания, при котором полезно подавление, репарация или мутация одного или нескольких генов. Например, гены, которые сверхэкспрессируются при злокачественной опухоли, можно подавлять введением соответствующей молекулы siRNA (Lage (2005) Future Oncol 1(1):103-13). Альтернативные заболевания, которые можно лечить, включают нейродегенеративные заболевания, такие как болезнь Гентингтона и болезнь Альцгеймера и вирусные инфекции, такие как гепатит (например, B и C) и HIV.
Таким образом, следующий аспект этого изобретения относится к композиции, содержащей молекулу siRNA, молекулу носителя (предпочтительно в качестве комплекса с указанной молекулой siRNA) и необязательно отдельно также фотосенсибилизирующее вещество, как описано в настоящем документе. В следующем аспекте это изобретение относится к указанной композиции для применения в терапии.
Альтернативно настоящее изобретение относится к набору, содержащему молекулу siRNA, молекулу носителя и необязательно также фотосенсибилизирующее вещество, как описано в настоящем документе. Предпочтительно указанный набор (или продукт) предназначен для одновременного, раздельного или последовательного применения в медикаментозной терапии.
Альтернативно описанное, настоящее изобретение относится к применению молекулы siRNA и носителя, как описано в настоящем документе, для получения лекарственного средства для лечения или профилактики заболевания, нарушения или инфекции посредством изменения экспрессии одного или нескольких генов-мишеней у указанного пациента. Необязательно указанное лекарственное средство может содержать только одно из указанной молекулы siRNA или носителя и его можно использовать в способах, в которых указанная молекула siRNA или носитель, не присутствующие в указанном лекарственном средстве, предназначены для введения указанному пациенту при лечении или профилактике указанного заболевания, нарушения или инфекции. Необязательно указанное лекарственное средство может содержать фотосенсибилизирующее вещество. Предпочтительно указанное лекарственное средство предназначено для генной терапии, т.е. для лечения заболевания или нарушения, которое характеризуется аномальной экспрессией гена или при котором является полезным подавление одного или нескольких генов. Указанное изменение включает подавление указанной экспрессии.
В соответствии с вариантами осуществления, отличающимися от указанных выше, указанное фотосенсибилизирующее вещество и указанная молекула siRNA и носитель подвергают контактированию с клетками или тканями пациента одновременно или последовательно и указанные клетки облучают светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества, и облучение проводят перед, в процессе или после клеточного захвата указанной молекулы siRNA и носителя во внутриклеточный компартмент, содержащий указанное фотосенсибилизирующее вещество, предпочтительно перед клеточным захватом указанной перемещаемой молекулы в любой внутриклеточный компартмент.
Таким образом, в альтернативном аспекте это изобретение относится к способу лечения или профилактики заболевания, нарушения или инфекции у пациента, включающему введение молекулы siRNA и носителя в одну или несколько клеток in vitro, in vivo или ex vivo в соответствии со способами, как описано в настоящем документе выше, и где необходимо (т.е. когда трансфекцию проводят in vitro или ex vivo) введение указанных клеток указанному пациенту.
Как определено в настоящем документе, "лечение" относится к снижению, смягчению или устранению одного или нескольких симптомов заболевания, нарушения или инфекции, которые подвергают лечению, относительно симптомов до лечения. "Профилактика" относится к замедлению или предотвращению появления симптомов заболевания, нарушения или инфекции.
Композиции по настоящему изобретению также могут содержать клетку, содержащую молекулу siRNA, которая интернализована в цитозоль указанной клетки способом по этому изобретению. Это изобретение далее распространяется на такие композиции для применения в терапии, в частности, в терапии злокачественной опухоли или в генной терапии.
Таким образом, другой аспект этого изобретения относится к клетке или популяции клеток, содержащей молекулу siRNA, которая интернализована в цитозоль указанной клетки, причем эту клетку получают способом по настоящему изобретению.
Следующий аспект этого изобретения относится к применению такой клетки или популяции клеток для получения композиции или лекарственного средства для применения в терапии, как описано в настоящем документе выше, предпочтительно в терапии злокачественной опухоли или в генной терапии.
Кроме того, это изобретение относится к способу лечения пациента, включающему введение указанному пациенту клеток или композиций по настоящему изобретению, т.е. к способу, включающему стадии введения молекулы siRNA в клетку, как описано в настоящем документе выше, и введения указанной клетки, полученной таким образом, указанному пациенту. Предпочтительно указанные способы используют для лечения злокачественной опухоли и в генной терапии.
In vivo, можно использовать любой способ введения, распространенный или стандартный в данной области, например, инъекцию, инфузию, местное введение, как на внутреннюю, так и на наружную поверхности тела и т.д. Для применения in vivo, это изобретение можно применять в отношении любой ткани, которая содержит клетки, в которые помещают фотосенсибилизирующее вещество и молекулу siRNA, включая области расположения жидкостей организма, а также твердые ткани. Можно подвергать лечению все ткани при условии, что фотосенсибилизирующее вещество захватывается клетками-мишенями, и свет может быть надлежащим образом доставлен.
Таким образом, композиции по этому изобретению можно изготавливать любым удобным способом в соответствии с технологиями и процессами, известными в фармацевтической области, например, с использованием одного или нескольких фармацевтически приемлемых носителей или эксципиентов. Как обозначают в настоящем документе, "фармацевтически приемлемый" относится к ингредиентам, которые совместимы с другими ингредиентами композиций, а также являются физиологически приемлемыми для реципиента. Тип композиции и носителей или материалов эксципиентов, дозировок и т.д. можно выбирать общепринятым образом в соответствии с выбранным и требуемым способом введения, целью лечения и т.д. Дозировки аналогично можно определять общепринятым способом, и они могут зависеть от типа молекулы, цели лечения, возраста пациента, способа введения и т.д. В отношении фотосенсибилизирующего вещества, также следует учитывать эффективность/способность разрушать мембраны при облучении.
Способы, описанные выше, альтернативно можно использовать для создания скринингового инструмента для высокопроизводительных способов скрининга, в частности, для анализа эффектов подавления конкретного гена. siRNA, направленную на один или несколько конкретных генов, можно создавать и использовать в способе по этому изобретению, как описано выше. Таким образом, siRNA можно использовать для снижения экспрессии гена в популяции клеток. Затем полученную популяцию клеток можно использовать в качестве скринингового инструмента для идентификации последующих эффектов подавления гена, со стандартными способами.
Предшествующие попытки снизить экспрессию генов с нормальными и химически модифицированными антисмысловыми олигонуклеотидами были ограничены проблемами, связанными с деградацией нуклеазами антисмысловых олигонуклеотидов, возникновением неспецифичных эффектов и/или недостаточной аффинностью к мишени. С использованием способа по этому изобретению для введения siRNA, эти проблемы можно преодолеть.
Таким образом, в следующем аспекте, это изобретение относится к способу модификации паттерна экспрессии гена клетки (например, популяции клеток) для получения клетки (или популяции клеток) для применения в качестве скринингового инструмента (например, для высокопроизводительного скрининга), включающему контактирование молекулы siRNA, способной ингибировать или снижать экспрессию гена, носителя и фотосенсибилизирующего вещества, с клеткой (например, популяцией клеток) и облучение клетки (например, популяции клеток) светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества. Кроме того, это изобретение распространяется на такие клетки и способ скрининга таких клеток, где исследуют конкретные свойства таких клеток, например, уровни экспрессии мРНК таких клеток, например, в микроматрицах. Под "модифицированным паттерном экспрессии генов" подразумевают, что в результате наличия указанной молекулы siRNA в клеточном ядре нарушается транскрипция или трансляция гена, на который она направлена.
В результате этого изменения экспрессии гена можно влиять на экспрессию других генов. Таким образом, посредством влияния на нормальную экспрессию исследуемого гена, можно определить изменения паттерна экспрессии других генов. Идентификация этих генов и влияние, которое экспрессия исследуемого гена оказывает на них, позволяет исследователю сделать выводы о функциях гена, например, об его последующих функциях. Гены, на которые влияет изменение нормальной экспрессии исследуемого гена, можно активировать или подавлять, однако общее изменение паттерна экспрессии указывает на роль гена в нормальном функционировании клеток и на последствия нарушений его регуляции.
С использованием стандартных способов, хорошо известных в данной области, можно исследовать эффект подавления или устранения экспрессии представляющего интерес гена. Например, это можно проводить посредством поиска функциональных изменений в клетках (или в популяции клеток), таких как изменения клеточной адгезии, секреции белка, или морфологические изменения. Альтернативно профиль экспрессии гена можно исследовать непосредственно анализом паттернов мРНК и/или экспрессии белка, также с использованием стандартных способов, которые хорошо известны в данной области.
Под ингибированием или снижением экспрессии гена следует понимать, что экспрессия представляющего интерес гена снижается по сравнению с клеткой, которую не подвергали способу, т.е. с клеткой дикого типа или с нормальной клеткой. Изменение уровня экспрессии гена можно определять стандартными способами, известными в данной области.
Может происходить полное ингибирование экспрессии, так что отсутствует поддающаяся детекции экспрессия гена, т.е. отсутствует поддающаяся детекции мРНК или белок, или может происходить частичное ингибирование экспрессии, т.е. снижение, посредством которого величина экспрессии гена является более низкой, чем в клетке дикого типа или в нормальной клетке. Это можно оценивать и контролировать посредством сравнения эффекта siRNA с конкретной последовательностью с эффектом siRNA с рандомизированной последовательностью, т.е. с тем же составом нуклеотидов, но с отличающимся порядком последовательности. Предпочтительно для того, чтобы этот способ был пригодным, снижение экспрессии составляет менее или 80% от контрольных уровней, например, <50%, предпочтительно <20, 10 или 5% от контрольных уровней. Используемая клетка(и) предпочтительно будет представлять собой клеточную популяцию, отдельные клетки которой являются генетически идентичными. Клетки могут представлять собой любые клетки, как рассмотрено выше.
Клетку или популяцию клеток, полученную в соответствии со способами по этому изобретению, можно использовать для получения библиотеки, которая формирует следующий аспект этого изобретения.
Это изобретение далее будет описано более подробно в следующих не ограничивающих примерах со ссылкой на следующие чертежи, в которых:
На фиг.1 представлены результаты эксперимента по подавлению генов с использованием клеточной лини OHS с различными реагентами для трансфекции с (черные столбцы) и без (белые столбцы) обработки PCI с использованием siRNA9. На графике представлены уровни белка S100A4, слева направо; 1) липид siPORT, 2) FuGene 6, 3) липофектамин 2000, 4) липофектин, 5) jetSI и 6) jetSI-ENDO. Результаты представлены в качестве процентной доли от необработанных контрольных клеток. Столбцы представляют собой средние значения для трех отдельных экспериментов. Планки погрешностей показывают стандартную ошибку среднего значения (SEM).
На фиг.2 представлены результаты эксперимента подавления гена, где клетки различных типов трансфицировали siRNA с использованием jetSI-ENDO, с обработкой посредством PCI и без нее. Результаты в (A) показывают уровни белка S100A4 в четырех клеточных линиях при обработке siRNA. Серыми столбцами показана рандомизированная контрольная siRNA с PCI, черными столбцами показана эффекторная siRNA без PCI и белыми столбцами показана эффекторная siRNA с PCI. Клеточные линии слева направо: HCT-116, SW620, OHS и RMS. Столбцы представляют собой среднее значение для трех отдельных экспериментов. Планки погрешностей показывают стандартную ошибку среднего значения (SEM). Результаты в (B) показывают Вестерн-блот, показывающий различные клеточные линии сверху вниз, HCT-116, SW620, OHS и RMS. На верхней панели показан нагрузочный контроль с α-тубулином и на нижней панели показаны уровни S100A4. В каждой нижней панели, дорожки 1-3 показывают уровни белка без обработки PCI: необработанный контроль (C), рандомизированный контроль (siRNA11) и эффектор (siRNA9). На дорожках 4-6 показаны уровни белка с обработкой PCI: необработанный контроль (C), рандомизированный контроль (siRNA11) и эффектор (siRNA9).
На фиг.3 показаны результаты эксперимента подавления гена в клетках OHS a) зависимое от дозы подавление (1-5 нМ siRNA) через 96 ч после облучения, b) зависимое от времени подавление (24, 48 и 96 ч) с siRNA9. Результаты представлены в качестве процентной доли от необработанных контрольных клеток. Столбцы представляют собой среднее значение для трех отдельных экспериментов. Планками погрешностей показана стандартная ошибка среднего значения (SEM).
На фиг.4 показаны результаты подавления гена посредством siRNA, трансфицированной с jetSI, с обработкой PCI через 96 ч после облучения и без нее. Результаты показывают уровень белка S100A4 (A) и уровни РНК (B) после обработки клеточной линии OHS 100 нМ siRNA, как указано ниже. Черные столбцы представляют собой образцы без PCI, и белые столбцы представляют собой образцы, подвергаемые PCI. Необработанный контроль без обработки PCI использовали в качестве контроля для всех образцов (не представлено). Образцы: 1 и 4) рандомизированный контроль (siRNA11), 2 и 5) эффектор (siRNA9), 3) необработанный контроль. Столбцы представляют собой среднее значение для трех отдельных экспериментов. Планками погрешностей показана стандартная ошибка среднего значения (SEM).
На фиг.5 показано распределение флуоресцентно меченной siRNA в OHS после трансфекции (200 нМ) с jetSI-ENDO, с обработкой PCI и без нее: a) доставка siRNA без обработки PCI, слева направо: фазовый контраст, флуоресценция и соответствующее поглощение, b) доставка siRNA с обработкой PCI: слева направо: фазовый контраст, флуоресценция и соответствующее поглощение, c) флуоресцентные картины без обработки PCI, показывающие слева направо: флуоресценция, заключенная в эндосомах (левый прямоугольник), и выход флуоресценции из эндосом (правый прямоугольник), увеличение изображения в левом прямоугольнике и увеличение изображения в правом прямоугольнике.
На фиг.6 показаны результаты подавления гена с использованием jetSI после обработки OHS посредством 100 нМ siRNA и jetSI при 50% от рекомендованного уровня, по сравнению со стандартным протоколом. Столбцы представляют собой: 1) рандомизированную контрольную siRNA без PCI, 2) эффекторную siRNA без PCI, 3) необработанный контроль с PCI, 4) рандомизированный контроль siRNA с PCI, 5) эффекторную контрольную siRNA с PCI. Столбцы представляют собой среднее значение для трех отдельных экспериментов.
На фиг.7 представлена структура предпочтительных липополиаминов. (См. также Ahmed et al., выше, и Behr et al. (1989) PNAS, 86, 6982-6).
На фиг.8 показаны результаты подавления генов с использованием PEI в качестве носителя. Вестерн-блот отображает нагрузочный контроль (альфа-тубулин) в верхней панели и уровни белка S100A4 в нижней панели. Дорожка 1 = необработанный контроль (без PEI), 2 = 1 мкл PEI + эффекторная siRNA, 3 = 10 мкл PEI + эффекторная siRNA, 4 = необработанный контроль (без PEI), 5 = 1 мкл PEI + эффекторная siRNA, 6 = 10 мкл PEI + эффекторная siRNA. Дорожки 1-3 представлены без PCI, и дорожки 4-6 представлены с PCI.
На фиг.9 представлены результаты подавления гена с использованием PEI массой 25 кДа в качестве носителя. Используемые образцы указаны на фигуре. A. Уровень белка S100A4, количественно определенный посредством сканирования Вестерн-блотов (с использованием siRNA S100A4 с или без PCI, среднее значение для 3 отдельных экспериментов, где планки погрешностей представляют собой SEM). B. Пример Вестерн-блота.
На фиг.10 показан эффект PCI на активность siRNA с различными носителями PEI, используемыми в различных концентрациях. Уровни белка S100A4 количественно определяли посредством сканирования Вестерн-блотов. Черные столбцы соответствуют трансфекции без PCI, в то время как белые столбцы соответствуют трансфекции с PCI. Результаты представляют собой среднее значение для 3 отдельных экспериментов.
На фиг.11 показаны результаты экспериментов в целях определения токсичности PEI отдельно и в сочетании с PCI и siRNA. Указаны количества PEI и дозы света, используемые в экспериментах с PCI. A. Токсичность PEI без PCI. Указана ММ различных (разветвленных) тестируемых носителей PEI (среднее значение для 5 отдельных экспериментов). B. Токсичность сочетания PCI, PEI (1 мкг) и siRNA при различных дозах света. Показаны тестируемые образцы и дозы света. Контроль - = необработанный контроль (без PEI но без PCI), Рандомизированный - = рандомизированный контроль siRNA (с PEI но без PCI), siRNA - = siRNA S100A4 (с PEI но без PCI). Контроль +, Рандомизированный + и siRNA + являются такими же, как Контроль -, Рандомизированный - и siRNA -, но с PCI (среднее значение для 5 отдельных экспериментов).
На фиг.12 показана индуцированная PCI доставка молекул siRNA с использованием бета-циклодекстринамина в качестве носителя. Дорожки 1 и 4 = контроль без siRNA, дорожки 2 и 5 = контрольная рандомизированная siRNA, дорожки 3 и 6 = siRNA S100A4. Полоса контроля тубулина и полоса S100A4 являются такими, как показано.
На фиг.13 показана индуцированная PCI доставка молекул siRNA с использованием полиамидоамидных (PAMAM) дендримеров (G2-7) с центром из этилендиамина. (A) Вестерн-блот, в котором верхние полосы представляют собой нагрузочный контроль (альфа-тубулин), нижние полосы представляют собой уровни S100A4. Образцы в различных дорожках представляют собой: 1. PAMAM G6 с PCI. 2. PAMAM G1 с PCI. 3. Контроль с PCI. 4. PAMAM G6 без PCI. 5. PAMAM G1 без PCI. 6. Контроль без PCI. (B). Уровень белка S100A4, количественно определенный посредством сканирования Вестерн-блотов. Черные столбцы представляют собой трансфекции без PCI, в то время как белые столбцы представляют собой трансфекцию с PCI. Результаты представляют собой среднее значение для 3 отдельных экспериментов. На фигуре указаны различные формы используемого PAMAM.
На фиг.14 показана структурная формула GO, G1 и G2 дендримеров PAMAM.
На фиг.15 показан эффект PCI на опосредуемую полиаргинином доставку siRNA. Уровень белка S100A4 анализировали посредством Вестерн-блоттинга. Верхняя дорожка соответствует нагрузочному контролю (альфа-тубулин), нижняя дорожка представляет собой уровни S100A4. Образцы на геле были следующими: C+ = контроль с PCI, S+ = контрольная рандомизированная siRNA с PCI, R+ = siRNA S100A4 с PCI, C = контроль без PCI, S = контрольная рандомизированная siRNA без PCI, R = siRNA S100A4 без PCI. 1 = полиаргинин ММ 15000-70000 в количестве 0,35 мкг, 2 = полиаргинин ММ 15000-70000 в количестве 0,7 мкг, 3 = полиаргинин ММ >70000 в количестве 0,35 мкг, 4 = полиаргинин ММ >70000 в количестве 0,7 мкг.
ПРИМЕРЫ
Материалы и методы
Клеточные линии и условия культивирования
HCT-116 (колоректальная аденокарцинома) и SW620 (колоректальная аденокарцинома) получали из Американской коллекции типовых культур (Manassas, VA, USA). OHS (остеосаркома) и клеточная линии RMS были получены в Norwegian Radium Hospital. Все клеточные линии культивировали с использованием среды RPMI-1640 (Bio Whittaker, Verviers, Belgium или GibcoBRL, Paisley, UK), без антибиотиков, но дополненной 10% эмбриональной телячьей сывороткой (FCS; PAA Laboratories, Linz, Austria) и 2 мМ L-глутамином (Bio Whittaker, Verviers, Belgium). Клетки выращивали и инкубировали при 37ºC в увлажненной атмосфере, содержащей 5% CO2. Все клеточные линии тестировали, и было выявлено, что они являются отрицательными в отношении инфекции Mycoplasma перед экспериментами.
Источник света и фотосенсибилизирующее вещество
Lumisource® (PCI Biotech AS, Oslo, Norway) использовали в качестве источника света. Lumisource® представляет собой ряд из четырех флуоресцентных трубок, предназначенных для обеспечения гомогенного освещения обработанной области, испускающих, главным образом, синий свет с пиком при 420 нм. Фотосенсибилизирующее вещество, дисульфурированный тетрафенилпорфин (TPPS2a) приобретали от Porphyrin Products (Logan, UT, USA). TPPS2a сначала растворяли в 0,1M NaOH, а после этого разбавляли в фосфатно-солевом буфере (PBS), pH 7,5, до концентрации 5 мг/мл и до конечной концентрации 0,002M NaOH. Фотосенсибилизирующее вещество защищали от света и хранили при -20ºC до применения.
Трансфекция siRNA без PCI
Различные реагенты для трансфекции для доставки siRNA оценивали с использованием: LipofectinTM Reagent от Life Technologies Inc. (Gaithersburg, MD, USA), LipofectamineTM 2000 из Invitrogen (Carlsbad, CA, USA), FuGene 6 от Roche Diagnostics (Mannheim, Germany), siPORTTM Lipid Transfection Agent от Ambion (Austin, TX, USA), jetSITM и jetSITM-ENDO от Polyplus transfection (Illkirch, France). Все реагенты для трансфекции обрабатывали в соответствии с описаниями изготовителя. Все клеточные линии культивировали, как описано в разделе "Клеточные линии и условия культивирования", и культивировали в течение 24 ч в 6-луночных планшетах до 50-70% смыкания монослоя перед трансфекцией в течение 24, 48 или 96 ч. Реагент для трансфекции отдельно наносили на клетки в качестве необработанного контроля, в дополнение к рандомизированной siRNA с реагентами для трансфекции.
Протокол, используемый для jetSI/jetSI-ENDO, был следующим для стандартного 6-луночного планшета:
- Стадия 1: Для каждой лунки, разбавить 4,2 (8,4) мкл раствора jetSI/jetSI-ENDO в 100 мкл среды. Встряхнуть энергично (важно: не пипетировать до смеси) и ждать в течение 10 мин (важно: не превышать 30 минут).
- Стадия 2: Для каждой лунки, разбавить 1,4 мкг (100 нМ) дуплекса siRNA и в 100 мкл среды. Осторожно встряхнуть.
- Добавить 100 мкл раствора среды jetSI в 100 мкл раствора siRNA и сразу смешать раствор (важно: не смешивать растворы в обратном порядке).
- Сразу встряхнуть-смешать раствор в течение 10 секунд.
- Инкубировать в течение 30 минут при комнатной температуре для обеспечения образования комплексов (важно: не превышать 1 часа).
- В процессе образования комплекса, удалить среду для роста из планшетов и добавить 0,8 мл свежей содержащей сыворотку среды (и фотосенсибилизирующее вещество, если его используют), предварительно нагретой при 37ºC.
- Добавить 200 мкл раствора jetSI/siRNA в каждую лунку и гомогенизировать смесь осторожным вращением планшета.
- Инкубировать планшет в требуемых условиях культивирования клеток в течение 18 ч, затем промыть планшет три раза свежей средой и повторно инкубировать с 2-4 мл среды.
Трансфекция siRNA с PCI
Клетки культивировали и трансфицировали как в случае "трансфекции siRNA без PCI", за исключением нескольких модификаций. К среде при трансфекции добавляли фотосенсибилизирующее вещество TPPS2a (0,5 мкг/мл). После 18 ч инкубации клетки промывали 3 раза свежей средой и инкубировали в течение 4 ч перед обработкой светом. Через 4 ч клетки подвергали воздействию синего света (7 мВ/см2) в течение различных периодов времени (60-90 с), в зависимости от клеточной линии, и повторно инкубировали в течение 24, 48 и 96 ч, а затем собирали. Для измерения эффекта PCI, эффекторную siRNA, рандомизированную siRNA и реагент для трансфекции отдельно наносили в различные лунки того же планшета, с фотосенсибилизирующим веществом или без него, и проводили ту же обработку. Клетки защищали от света алюминиевой фольгой в ходе этих экспериментов.
ПЦР с обратной транскриптазой с детекцией в реальном времени для S100A4
Общую клеточную РНК выделяли с помощью набора GenElute Mammalian Total RNA Miniprep Kit (Sigma-Aldrich, Steinheim, GER) и для обратной транскрипции использовали набор для синтеза кДНК iScript (BioRad, Hercules, CA). Оба набора использовали в соответствии с руководствами изготовителя. Все ПЦР проводили параллельно, детекцию в реальном времени проводили с применением SYBR Green I. Для каждой ПЦР, 10 мкл кДНК, 30 мкл iQ SYBRGreen Supermix (BioRad), 300 нМ каждого праймера и не содержащую нуклеазы воду добавляли до конечного объема 60 мкл. Затем по 25 мкл каждого образца наносили на планшет для ПЦР. Этот способ обеспечивает, чтобы параллели были истинными параллелями, и чтобы для всех повторений количество смеси ПЦР было достаточным. Конструирование праймеров проводили с использованием программного обеспечения Primer Express от Applied Biosystems (Applied Biosystems, Foster City, CA). Используемый набор праймеров (прямой праймер 5'-AAGTTCAAGCTCAACAAGTCAGAAC-3' и обратный праймер 5'-CATCTGTCCTTTTCCCCAAGA-3') амплифицирует сегмент из 79 п.н. в 2 и 3 экзоне последовательности S100A4.
Реакции с детекцией в реальном времени проводили на iCycler (Bio-Rad) со следующим протоколом амплификации: исходная денатурация в течение 3 мин при 95ºС, 50 циклов денатурации в течение 10 с при 95ºC и отжиг/удлинение в течение 35 с при 60ºC, одно выдерживание при 95ºC в течение 20 с, с последующим выдерживанием в течение 1 мин при 55ºC, и в завершение анализа кривой отжига из 80 стадий, каждая по 10 с, с повышением 0,5ºC до конечной температуры 95ºC. Качество образцов РНК подтверждали посредством амплификации генов домашнего хозяйства, TBP (прямой праймер 5'-GCCCGAAACGCCGAATAT-3 и обратный праймер 5'-CGTGGCTCTCTTATCCTCATGA-3') и RPLPO (прямой праймер 5'-CGCTGCTGAACATGCTCAAC-3' и обратный праймер 5'-TCGAACACCTGCTGGATGAC-3'). Для количественных вычислений использовали Gene Expression Macro, version 1.1 (Biorad). Программа проводит вычисления на основе способа ∆∆ CT, который позволяет сравнение пороговых значений цикла, полученных с использованием различных наборов праймеров на одном наборе образцов.
Микроскопические исследования
Клетки инкубировали с комплексами siRNA/jetSI-ENDO как описано (трансфекция siRNA с PCI и без нее) и анализировали с обработкой PCI или без нее через 48 ч с помощью инвертного микроскопа Zeiss, Axiovert 200, оборудованного фильтрами для FITC (фильтр возбуждения BP 450-490 нм, расщепитель луча FT 510 нм и эмисссионный фильтр LP 515-565 нм), и родамина (фильтр возбуждения BP 546/12 нм, расщепитель луча FT 580 нм и эмиссионный фильтр LP 590 нм). Картины получали с использованием Carl Zeiss AxioCam HR, Version 5.05.10 и программного обеспечения AxioVision 3.1.2.1. Изображения получали с помощью Adobe Photoshop 7.0 (Adobe, San Jose, CA) и Zeiss LSM Image Browser (Version 3).
Вестерн-иммуноблоттинг
Белковые лизаты получали в 50 мМ Tris-HCl (pH 7,5), содержащем 150 мМ NaCl и 0,1% NP-40 с 2 г/мл пепстатина, апротинина (Sigma Chemical Company, St Louis, MO) и лейпептина (Roche Diagnostics, Mannheim, Germany). Общий белковый лизат (30 мкг) от каждого образца разделяли 12% SDS-полиакриламидным гель-электрофорезом и переносили на мембраны Immobilon-P (Millipore, Bedford, MA) в соответствии с руководством изготовителя. В качестве нагрузочного контроля и контроля перемещения, мембраны окрашивали 0,1% амидовым черным. После этого мембраны инкубировали в 20 мМ Tris-HCl (pH 7,5), содержащем 0,5M NaCl и 0,25% Tween 20 (TBST) с 10% сухим молоком (блокирующий раствор) перед инкубацией с кроличьим поликлональным антителом против S100A4 (разбавленным 1:300, DAKO, Glostrup, Denmark) и мышиным моноклональным антителом против α-тубулина (разбавленным 1:250, Amersham Life Science, Buckinghamshire, England) в TBST, содержащем 5% сухое молоко. После промывания, иммунореактивные белки визуализировали с использованием конъюгированных с пероксидазой хрена вторичных антител (разбавленных 1:5000 DAKO, Glostrup, Denmark), и усиленной хемилюминесцентной системы (Amersham Pharmacia Biotech, Buckinghamshire, England). Уровни белка S100A4 записывали в виде процентных долей от контрольного образца и в качестве нагрузочного контроля использовали α-тубулин.
Пример 1
Подавление гена в клеточной линии OHS
Клетки OHS трансфицировали сконструированной молекулой для нацеливания на экспрессию белка S100A4 с использованием различных систем для трансфекции. В каждом случае использовали стандартный протокол трансфекции, в соответствии с инструкциями изготовителя. Когда использовали фотосенсибилизирующее вещество, оно представляло собой TPPS2a (0,5 мкг в объеме трансфекции 1 мл, исключая jetSI, где использовали объем трансфекции 2 мл). Время облучения в каждом случае составляло 60 секунд.
Исходный 20 мкМ раствор siRNA смешивали с каждым из различных реагентов для трансфекции и трансфицировали в 6-луночных планшетах с конечным объемом 1 мл (за исключением jetSI и jetSI-ENDO, где конечный объем составлял 2 мл).
Липид siPORT = тестировали 2 и 4 мкл, в сочетании с 1,4 мкг siRNA в 1000 мкл
FuGene 6 = тестировали 4,2 мкл и 8,4 мкл, в сочетании с 1,4 мкг siRNA в 1000 мкл
Lipofectamine 2000 = тестировали 4,2 и 7 мкл, в сочетании с 1,4 мкг siRNA в 1000 мкл
Lipofectin = тестировали 4,2 и 7 мкл, в сочетании с 1,4 мкг siRNA в 1000 мкл
jetSI = 8,4 мкл, в сочетании с 2,8 мкг siRNA в 2000 мкл
jetSI-ENDO = 4,2 мкл, в сочетании с 1,4 мкг siRNA в 2000 мкл.
Используемая молекула siRNA представляла собой молекулу против последовательности мРНК S100A4 (регистрационный номер GenBank NM_002961). Конкретную siRNA, имеющую последовательность
5'-UGAGCAAGUUCAAUAAAGA-3'
3'-ACUCGUUCAAGUUAUUUCU-5'
конструировали в соответствии с Elbashir et al., ((2001), Genes Dev. 15, 188-200). В дополнение к siRNA, сконструированной против выбранного гена-мишени, конструировали контрольную siRNA получением рандомизированной siRNA (5'-CGCAUAAGUGAAAUAGAAU-5', 3'-GCGUAUUCACUUUAUCUUA-5') и проводили поиск BLAST для исключения ложной гибридизации. Содержание GC в дуплексах поддерживали в диапазоне 30-70%, и все молекулы siRNA синтезировали с выступающими концами dTdT на их 3'-концах для оптимальной стабильности дуплексов siRNA. Молекулы siRNA заказывали в Eurogentec (Seraing, Belgium).
Высушенные олигонуклеотиды siRNA ресуспендировали в количестве 100 мкМ в обработанной DEPC воде и хранили при -20ºC. Отжиг проводили посредством разделения на отдельные аликвоты и разбавления каждого олигонуклеотида РНК до концентрации 50 мкМ. Затем 30 мкл каждого раствора олигонуклеотида РНК и 15 мкл 5X буфера для отжига объединяли до конечной концентрации 50 мМ Tris, pH 7,5, 100 мМ NaCl в обработанной DEPC воде. Затем раствор инкубировали в течение 3 мин на водяной бане при 95ºС, с последующим постепенным охлаждением в течение 45 мин на рабочем столе. После этого отжиг подтверждали посредством гель-электрофореза в 4% агарозном геле NuSieve (данные не представлены).
На фиг.1 можно видеть, что зависимое от PCI подавление гена может быть достигнуто посредством применения средств для трансфекции jetSI и jetSI-ENDO. Когда эти два средства для трансфекции используют в отсутствие PCI (т.е. облучения, но в отсутствие фотосенсибилизирующего вещества), экспрессия генов составляет приблизительно 75% от контроля на основе измерения уровней белка с использованием вестерн-блоттинга, однако когда, кроме того, используют PCI, экспрессия генов снижается приблизительно до 15% от контроля.
В противоположность этому, применение липида SIPORT или Fugene 6 в качестве средства для трансфекции не достигло какого-либо значимого снижения экспрессии гена, и применение липофектамина 2000 и липофектина приводило к ингибированию экспрессии генов, независимо от того, применяли ли также PCI.
Пример 2
Подавление генов в различных клеточных линиях
Четыре различные клеточные линии, клетки HCT 116, SW620, OHS и RMS трансфицировали 50 нМ siRNA (jetSI-ENDO = 4,2 мкл, вместе с 1,4 мкг siRNA), сконструированной для подавления экспрессии S100A4 (см. пример 1) с использованием стандартного протокола jetSI-ENDO, в присутствии и отсутствие фотосенсибилизирующего вещества (0,5 мкг/мл TPPS2a). Клетки подвергали облучению и уровни белка S100A4 определяли посредством проведения вестерн-блотов через 96 часов после облучения (условия облучения были следующими, OHS = 60 с, SW620 = 80 с, HCT116 = 90 с, RMS = 70 с).
Примеры результатов представлены на фиг.2B, и результаты представлены графически на фиг.2A. В каждом типе клеток воздействие на трансфицированные клетки посредством обработки PCI приводило к высоким уровням подавления генов, в то время как клетки, которые были трансфицированы siRNA S100A4, но которые не подвергали обработке PCI, показали значимо меньшее подавление гена. Было показано, что эффект является специфичным, поскольку рандомизированная siRNA не оказывала эффекта на экспрессию гена, как в присутствии, так и в отсутствие PCI. Не было значимых отличий в эффекте подавления гена между различными клеточными линиями, которые тестировали.
Пример 3
Эффект концентрации siRNA и времени
Молекулу siRNA, сконструированную для подавления экспрессии белка S100A4, трансфицировали в клетки OHS в концентрациях от 1 до 5 нМ, с использованием 4,2 мкл jetSI-ENDO, и подвергали обработке PCI, как описано выше.
Уровни белка в клеточных лизатах измеряли с использованием Вестерн-блоттинга и они показаны в качестве процентной доли от уровней белка в необработанных контрольных клетках на фиг.3A.
Эффект подавления гена возрастал с концентрацией siRNA, воздействию которой подвергали клетки, хотя существует небольшое отличие между эффектами подавления, выявленными в случае 4 нМ и 5 нМ siRNA.
Рандомизированную молекулу siRNA также использовали во всех экспериментах, и было показано, что она не влияет на экспрессию гена. По существу, эффект ингибирования гена является специфичным.
На фиг.2B показан эффект времени на подавление гена посредством изменения периода времени между облучением клеток и сбором клеточных лизатов для анализа. Можно видеть, что на чем более длительное время клетки оставляют после облучения и перед сбором, тем большее ингибирование экспрессии гена наблюдают.
Пример 4
Подавление гена в клетках OHS после обработки siRNA PCI
Клетки OHS трансфицировали 100 нМ siRNA или рандомизированной siRNA, как описано выше, и определяли эффект обработки PCI на уровни белка и мРНК через 96 ч после облучения посредством Вестерн-блоттинга и ОТ-ПЦР и сравнивали с уровнями белка и мРНК в необработанных контролях.
Результаты, показанные на фиг.4, указывают на то, что в отношении уровней как белка, так и мРНК, большие величины подавления гена для гена S100A4 наблюдают, когда siRNA, специфичную к этому гену, трансфицируют с jetSI ENDO и клетки подвергают обработке PCI (дорожка 5 фиг.3A и B). Небольшая величина снижения уровней белка и РНК выявлена без обработки PCI (дорожка 2 фиг.3A и B), однако оно значительно усиливается посредством обработки PCI.
Пример 5
Цитозольная доставка меченой siRNA
Клетки OHS трансфицировали 200 нМ FITC, меченой siRNA с использованием jetSI ENDO ((jetSI-ENDO = 8,4 мкл, совместно с 2,8 мкг siRNA в объеме трансфекции 1000 мкл = 200 нМ раствор siRNA), с фотосенсибилизирующим веществом и без него. Затем трансфицированные клетки подвергали облучению.
Клетки исследовали с использованием фазово-контрастной микроскопии и флуоресцентной микроскопии. Посредством сравнения изображений, было выявлено, что в отсутствие обработки PCI, siRNA остается в виде точечного распределения, которое соответствует распределению в эндоцитарных везикулах (фиг.5a и c). Также выявлен небольшой выход (правый прямоугольник на фиг.5c). В противоположность этому, после обработки PCI наблюдают, что меченая siRNA распределяется по всей цитоплазме и в ядре (см. фиг.5b).
Это демонстрирует, что обработка PCI требуется для доставки siRNA в требуемый компартмент клетки, и что доставка зависит от обработки PCI.
Пример 6
Подавление гена с использованием siRNA-PCI требует применения меньшего количества носителя, чем стандартная трансфекция
Клетки OHS трансфицировали 100 нМ siRNA с использованием jetSI. В противоположность экспериментам, описанным выше, jetSI использовали в более низкой концентрации, т.е. в 50% от концентрации, рекомендованной в стандартном протоколе. Стандартный протокол для 6-луночного планшета представляет собой: 2,8 мкг siRNA + 8,4 мкл jetSI в 2000 мкл среды, с получением 100 нМ siRNA в каждой лунке.
В противоположность этому, для 6-луночного планшета, 1,4 мкг siRNA смешивали с 4,2 мкл jetSI в 1000 мкл среды, с получением 100 нМ siRNA в каждой лунке. Общее количество комплексов, таким образом, было снижено на 50%.
После трансфекции, клетки либо подвергали обработке PCI (доза света для этого эксперимента составляла 30 с, с 0,5 мкг/мл TPPS2a) или оставляли необработанными, и подавление гена определяли с использованием ОТ-ПЦР. Эффекторная siRNA была способна снижать экспрессию гена S100A4 менее чем до 20% от необработанного контроля, в то время как без PCI, и с применением рандомизированной siRNA (либо с обработкой PCI, либо без нее) было выявлено небольшое снижение.
Это демонстрирует, что комбинированное применение носителей с PCI не только обеспечивает преимущество селективного высвобождения молекулы siRNA, но и что с использованием более низких концентраций средств для трансфекции можно достигать высоких уровней подавления генов, при комбинировании с PCI. Посредством сравнения 5 дорожки фигуры 6 с 5 дорожкой фигуры 1 можно видеть, что даже с использованием только 50% средства для трансфекции, которое используют в примере 1, когда также используют PCI, степень ингибирования гена является значительно более высокой.
Пример 7
Трансфекция с использованием PEI в качестве носителя
siRNA-мишень выбирали против последовательности мРНК S100A4 (регистрационный номер Gene Bank NM_002961). siRNA 481-499 использовали в качестве эффектора (для последовательности, см. пример 1).
Полиэтиленимин (PEI) оценивали в отношении индуцируемой PCI доставки. Клеточные линии культивировали (RPMI-1640, дополненная 10% FBS, 10 мл L-глутаматом, 10 мл Hepes) в 6-луночных планшетах до 50-80% смыкания монослоя перед трансфекцией. В качестве стандартной концентрации использовали 100 нМ siRNA.
Используемый PEI был от Sigma и его разбавляли в стерильной воде и получали исходный раствор, содержащий 1000 мкл PEI и 9000 мкл стерильной воды. Из исходного раствора 1 и 10 мкл использовали для трансфекции клеток 1,4 мкг siRNA (100 нМ в каждой лунке).
Использовали PEI от Sigma (408719 полиэтиленимин (средняя ММ ~800 по LS, средняя Mn ~600 посредством GPC, разветвленный, низкомолекулярный, безводный)).
Для трансфекции, получали два раствора, раствор A: siRNA разбавляли в 100 мкл бессывороточной (OPTI-MEM I) среды. Раствор B: PEI разбавляли в 100 мкл бессывороточной среды. Растворы A и B смешивали посредством осторожного перемешивания и инкубировали при комнатной температуре в течение 30 мин. Затем перемешанный раствор добавляли к клеткам (1 мл 100 нМ siRNA).
Обработку PCI проводили, как описано выше для jetSI. Доза света для эксперимента PEI составляла 40 с. Уровни белка измеряли посредством Вестерн-блоттинга через 96 ч после облучения.
Из фиг.8 можно видеть, что экспрессия белка S100A4 снижается в образцах, показанных на дорожках 5 и 6, т.е. в образцах, которые подвергали трансфекции с PEI и обработке PCI.
Пример 8
Эффект PCI на активность siRNA с использованием носителя PEI массой 25 кДа
Трансфекция siRNA. Все клеточные линии культивировали, как описано в разделе "Клеточные линии и условия культивирования", и высевали в 6-луночные планшеты при 25-50% смыкании монослоя перед трансфекцией. Проводили образование комплекса siRNA и носителя осторожным перемешиванием и инкубировали в течение 30 мин перед добавлением к клеткам. Клетки трансфицировали siRNA, носителем и либо с фотосенсибилизирующим веществом (TPPS2a = 0,5 мкг/мл), либо без него, и инкубировали в течение 18 ч, затем промывали 3 раза свежей средой и перед обработкой светом повторно инкубировали в течение 4 ч. Через 4 ч клетки подвергали воздействию синего света (7 мВ/см2) в течение различных промежутков времени (0-60 с), в зависимости от эксперимента, и перед сбором повторно инкубировали в течение 96 ч. Для измерения эффекта PCI на подавление гена, специфичную siRNA, рандомизированную siRNA и реагент для трансфекции отдельно наносили в различные лунки одного планшета, с фотосенсибилизирующим веществом или без него, и проводили точно такую же обработку. В ходе экспериментов клетки защищали от света алюминиевой фольгой.
Опосредуемое siRNA S100A4 подавление гена измеряли на белковом уровне с обработкой PCI и без нее с использованием разветвленного полиэтиленимина (PEI) массой 25 кДа (1 мкг/мл) и siRNA, нацеленной на ген S100A4, в концентрации 100 нМ. Следовали описанному выше протоколу, с использованием дозы света 30 с, как с образованием комплексов, так и с трансфекцией в содержащей сыворотку среде. На фиг.9A показано, что при применении PCI, S100A4 siRNA, как правило, снижала уровень S100A4 до 5-15% от уровня необработанных контролей (обработанных с PEI, но без siRNA). В противоположность этому, S100A4 siRNA без PCI была способна только снижать уровень S100A4 до 100-80% от контроля. Уровни необработанного контроля были сравнимы с контролями, где вместо специфичной к S100A4 siRNA использовали siRNA (данные не представлены). На фиг.9B эксперимент показан посредством Вестерн-блотов. Верхние полосы соответствуют нагрузочному контролю (альфа-тубулин), и нижняя полоса соответствует уровням S100A4, как указано на фигуре. Как видно из этих блотов, siRNA значимо подавляет S100A4 при применении PCI, по сравнению со случаем для клеток, в которые вводили S100A4 siRNA, которые не были обработаны PCI, где нельзя было выявить значимое подавление генов.
Пример 9
Эффект PCI на активность siRNA с различными носителями PEI, используемыми в различных концентрациях
Эффекты PCI на активность S100A4 siRNA исследовали для применения различных составов разветвленных PEI в различных концентрациях (0,1 мкг/мл, 1 мкг/мл, 10 мкг/мл и 100 мкг/мл, использовали 1 мл среды на лунку). Тестируемые образцы PEI (все разветвленные) были следующими: PEI ММ (Да)
1. 800
2. 1200
3. 1300
4. 1800
5. 2000
6. 25000
Следовали протоколу, описанному в разделе "Материалы и способы", с использованием дозы света 30 с, как с образованием комплексов, так и с трансфекцией, в содержащей сыворотку среде. siRNA использовали в концентрации 100 нМ. Как можно видеть из фиг.10, применение PCI может значимо усилить эффект подавления гена посредством S100A4 siRNA с различными носителями PEI. Этот эффект особенно выражен при более низких количествах PEI (1 и 10 мкг/мл), где эффект без PCI был очень невысоким, за исключением PEI 4 (ММ 1800) в концентрации 10 мкг/мл. При этих двух концентрациях PEI PCI значительно усиливала эффект подавления гена для всех тестируемых образцов PEI, за исключением PEI 1 (ММ 800).
Без PCI степень подавления гена возрастает с повышением концентрации PEI, с PCI этот эффект не является таким выраженным, за исключением того, что нельзя видеть никакого подавления гена (ни с PCI, ни без нее) с 0,1 мкг/мл PEI. Одним возможным объяснением этого является то, что количество PEI не является достаточно высоким для образования комплекса со всей siRNA, что приводит к отрицательно заряженным комплексам, которые не захватываются клетками. Без PCI, по-видимому, существует тенденция в направлении повышенного подавления гена при повышении молекулярной массы носителя PEI; с PCI этот эффект не является настолько очевидным, также за исключением PEI 1 (ММ 800). Эффект PEI без PCI при более высоких ММ и более высоких количествах, вероятно, является следствием описанных эндосомолитических свойств PEI, действующих только при высоких концентрациях PEI.
Это показывает, что PCI может замещать этот эффект, давая возможность применять низкие количества и низкие ММ полиэтиленимина, это свойство является высоко преимущественным для избежания токсичности и других проблем с носителями PEI.
Пример 10
Исследования токсичности
Сначала оценивали токсичность различных составов PEI (ММ 800-25000) отдельно (без обработки PCI). В этом анализе, клетки OHS высевали в 96-луночные планшеты и позволяли им прикрепляться в течение ночи в содержащей сыворотку среде. Затем среду удаляли и клетки инкубировали со средой и различными составами PEI в различных концентрациях в течение 20 ч. Затем содержащую PEI среду удаляли, и к каждой лунке добавляли раствор MTS (разведение 1:6, 100 мкл/лунка) (от Promega, Madison, WI, USA), и планшеты повторно инкубировали в течение дополнительных 4 ч. Измеряли поглощение при 490 нм.
Как можно видеть из фиг.11A, токсичность возрастала с увеличением молекулярной массы состава PEI (например, 25000 PEI против 800 PEI) и с повышением количеств PEI. Важно, что составы PEI в количестве 1 мкг/мл (не показано) и 10 мкг/мл не показывают значимую токсичность. Для этих образцов, значительный биологический эффект siRNA мог быть достигнут с PCI, в то время как эффект без PCI был очень невысоким (см. пример 9).
Также оценивали токсичность PEI с обработкой siRNA/PCI. Клетки OHS высевали в 6-луночные планшеты и им позволяли прикрепляться в течение ночи в содержащей сыворотку среде. Затем среду удаляли, и клетки в 6-луночных планшетах трансфицировали PEI отдельно, рандомизированной siRNA и специфичной siRNA, с фотосенсибилизирующим веществом или без него. Затем клетки инкубировали в течение ночи и после этого промывали и обрабатывали синим светом (PCI), как описано в разделе "трансфекция siRNA". После повторной инкубации в течение 44 ч, к каждой лунке добавляли 166,6 мкл раствора MTS и планшеты повторно инкубировали в течение других 4 ч. Измеряли поглощение при 490 нм. На фиг.11B показана токсичность сочетанной обработки с PEI (ММ 25000) в концентрации 1 мкг/мл, 100 нМ siRNA и PCI при различных дозах света. Как можно видеть из графика, во всех экспериментах с подавлением гена с PEI обработка PCI не индуцировала значимую токсичность при используемой дозе света (30 с), которая представляет собой дозу света, при которой посредством PCI индуцировался сильный эффект подавления гена (см. фиг.10). Даже при более высокой дозе света, составляющей 40 с, нельзя было выявить цитотоксичность обработки PCI, что показывает, что PCI может индуцировать полностью усиленную доставку siRNA без цитотоксических эффектов.
Пример 11
Индуцируемая PCI доставка молекул siRNA с использованием β-циклодекстринамина в качестве носителя
Исследовали эффект PCI на опосредуемую бета-циклодекстринамином доставку siRNA. В этих экспериментах использовали дозу света 60 с, и следовали протоколу, описанному в разделе "Материалы и способы". Бета-циклодекстринамин, как описано выше, с n=6 и X=4 разбавляли в стерильной воде и проводили образование комплексов и трансфекции в бессывороточной среде. Как можно видеть из Вестерн-блота (фиг.12), бета-циклодекстринамин в концентрации 100 мкг/мл (использовали 1 мл на лунку), который образовывал комплексы с 50 нМ (0,7 мкг) siRNA, был эффективен для индуцируемой PCI доставки siRNA (3 дорожка), в то время как в этих условиях доставка без PCI была неэффективной (дорожка 6). Бета-циклодекстринамин, используемый в этом исследовании, состоит из молекул бета-циклодекстрина, конъюгированных через мостик амина, ответственный за связывание с siRNA, и описан в Hwang SJ. et al. (2001, Bioconjugate Chem. 12, 280-290).
Пример 12
Индуцируемая PCI доставка молекул siRNA с использованием полиамидоамидных (PAMAM) дендримеров (G2-7) с центром из этилендиамина
Полиамидоамидные (PAMAM) дендримеры оценивали в отношении индуцируемой PCI доставки siRNA. PAMAM разбавляли в стерильной воде и трансфекции проводили в содержащей сыворотку среде. Различные типы дендримеров PAMAM (G2-7) в концентрации 100 мкг/мл (использовали 1 мл на лунку) подвергали образованию комплексов с 100 нМ (1,4 мкг) siRNA и трансфекцию проводили в соответствии со способами, описанными выше. В этих экспериментах использовали дозу света 30 с. Как можно видеть из Вестерн-блота, (фиг.13A) PCI может значительно усиливать активность siRNA (дорожки 1 и 2) в условиях, где siRNA/PAMAM отдельно был неэффективным в отношении подавления гена (дорожки 4 и 5). Как можно видеть на фиг.13B, этот эффект был также очевиден для нескольких других типов дендримеров PAMAM, указывая на то, что PCI может, главным образом, усиливать доставку siRNA посредством дендримеров на основе полиамина.
Различные типы PAMAM, используемых в исследовании, содержащие различные количества поверхностных групп аминов, являются следующими:
G2 = Молекулярная формула: [NH2(CH2)2NH2]:(G=2);dendri PAMAM(NH2)16
G3 = Молекулярная формула: [NH2(CH2)2NH2]:(G=3);dendri PAMAM(NH2)32
G4 = Молекулярная формула: [NH2(CH2)2NH2]:(G==4);dendri PAMAM(NH2)64
G5 = Молекулярная формула: [NH2(CH2)2NH2]:(G=5);dendri PAMAM(NH2)128
G6 = Молекулярная формула: [NH2(CH2)2NH2]:(G=6);dendri PAMAM(NH2)256
G7 = Молекулярная формула: [NH2(CH2)2NH2]:(G=7);dendri PAMAM(NH2)512
Пример 13
Индуцированная PCI доставка siRNA с использованием гидрохлорида поли-L-аргинина в качестве носителя
Полиаргинин разбавляли в стерильной воде и проводили трансфекции в бессывороточной среде. Тестировали два типа носителей на основе полиаргинина (молекулярная масса 15000-70000 и >70000). Полиаргинин в количестве 0,35 или 0,7 мкг/мл (использовали 1 мл на лунку) подвергали образованию комплексов со 100 нМ (1,4 мкг) siRNA и следовали протоколу, описанному выше, оценивая экспрессию S1004A посредством Вестерн-блоттинга после дозы света 30 с. Как можно видеть из фиг.15, существует значимое отличие в эффективности подавления гена между обработанными и необработанными посредством PCI образцами. Таким образом, несмотря на то, что все обработанные посредством PCI образцы (R+-образцы на фиг.15) показывают значимое подавление гена, нельзя было наблюдать эффект подавления в соответствующих образцах, не обработанных PCI (R-образцы на фиг.15). Таким образом, PCI является эффективной в отношении подавления гена с обоими различным тестируемыми носителями на основе полиаргинина и при обеих используемых концентрациях, показывая, что PCI может значимо усиливать доставку siRNA посредством носителя на основе катионного пептида.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВВЕДЕНИЯ МОЛЕКУЛЫ ПНК, КОНЪЮГИРОВАННОЙ С ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫМ ПЕПТИДОМ, В ЦИТОЗОЛЬ И/ИЛИ ЯДРО ФОТОХИМИЧЕСКОЙ ИНТЕРНАЛИЗАЦИЕЙ(PCI) | 2005 |
|
RU2435859C2 |
| ФОТОХИМИЧЕСКАЯ ИНТЕРНАЛИЗАЦИЯ ДЛЯ ДОСТАВКИ МОЛЕКУЛ В ЦИТОЗОЛЬ | 2001 |
|
RU2333246C2 |
| Способ введения диэлектрического микроконтейнера в клетку млекопитающего с использованием фемто-пикосекундных импульсов лазерного излучения | 2015 |
|
RU2614269C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ РЕЦЕПТОРА P2Х7 | 2005 |
|
RU2410430C2 |
| КОМПОЗИЦИЯ ДЛЯ ВВЕДЕНИЯ НУКЛЕИНОВОЙ КИСЛОТЫ В КЛЕТКИ | 2015 |
|
RU2715227C2 |
| БИОЛОГИЧЕСКИ АКТИВНЫЕ И/ИЛИ ЦЕЛЕВЫЕ ДЕНДРИМЕРНЫЕ КОНЪЮГАТЫ | 1995 |
|
RU2127125C1 |
| Пептиды для внутриклеточной доставки нуклеиновых кислот | 2020 |
|
RU2771605C2 |
| БИОДЕГРАДИРУЕМЫЕ КАТИОННЫЕ ПОЛИМЕРЫ | 2005 |
|
RU2440380C2 |
| ДНК-КОНСТРУКЦИИ ДЛЯ СПЕЦИФИЧЕСКОГО ИНГИБИРОВАНИЯ ЭКСПРЕССИИ ГЕНОВ ПОСРЕДСТВОМ РНК-ИНТЕРФЕРЕНЦИИ | 2006 |
|
RU2410431C2 |
| МОДУЛЯЦИЯ RSV, PIV И ДРУГИХ РЕСПИРАТОРНЫХ ВИРУСОВ С ПОМОЩЬЮ RNAI И ЕЕ ПРИМЕНЕНИЕ | 2005 |
|
RU2409666C2 |
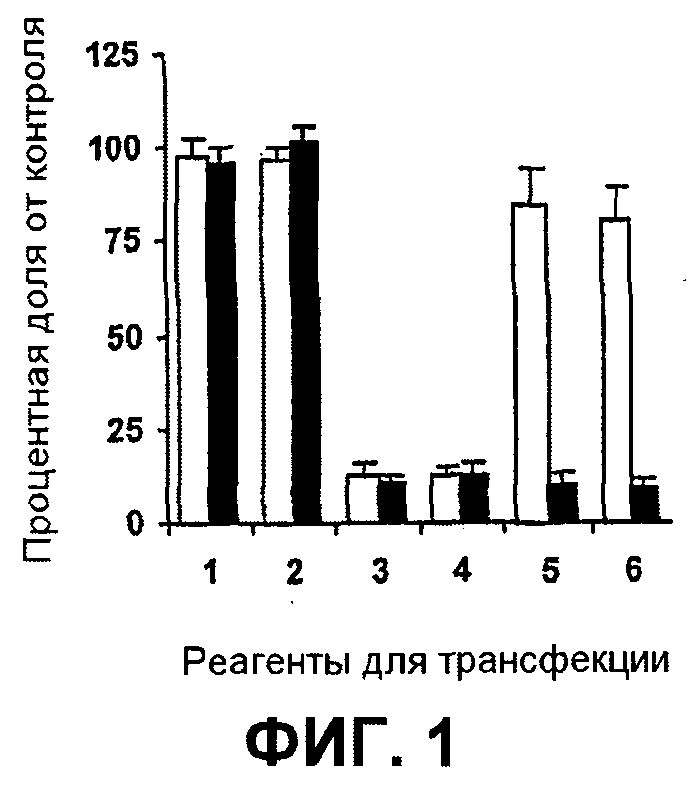
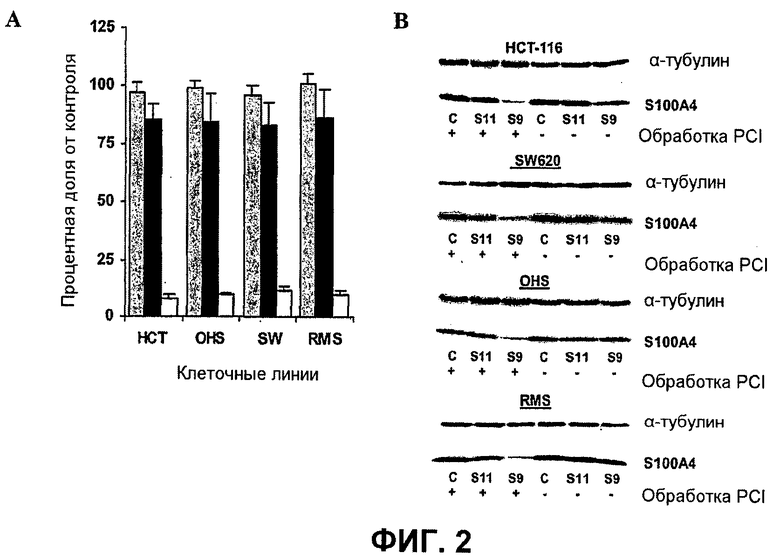
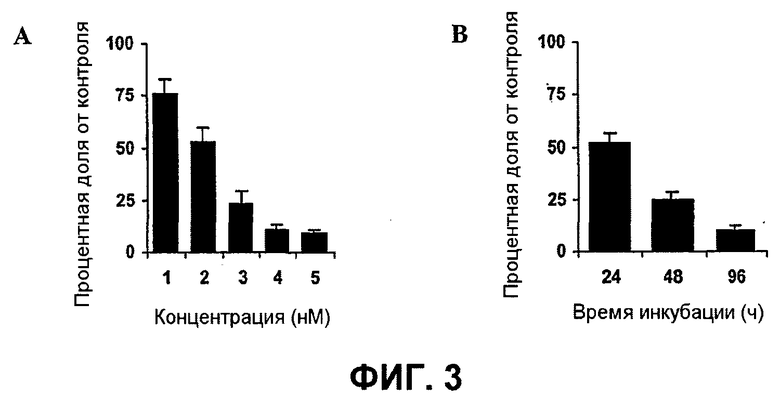
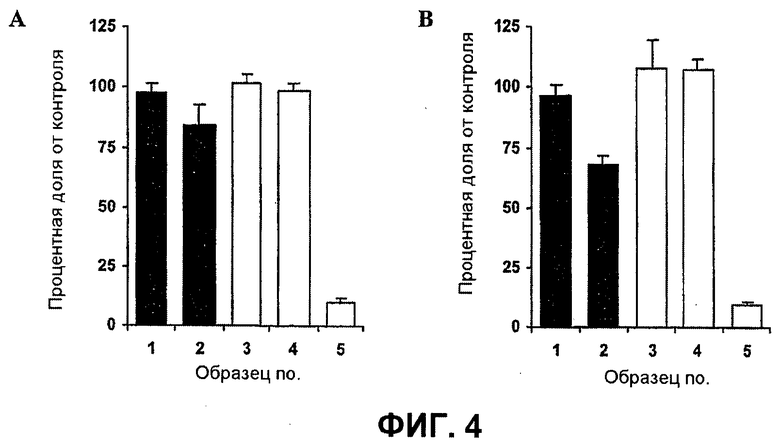
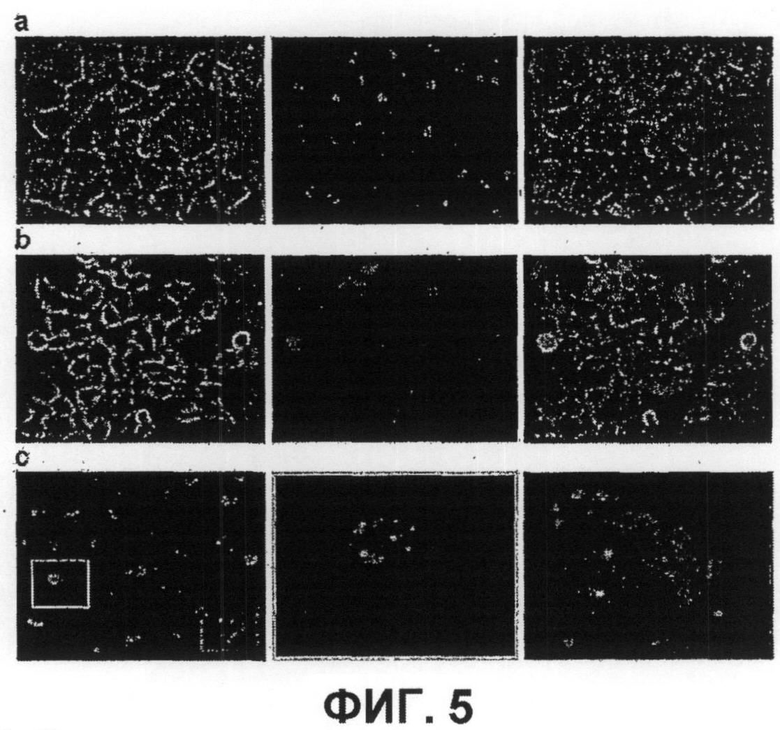
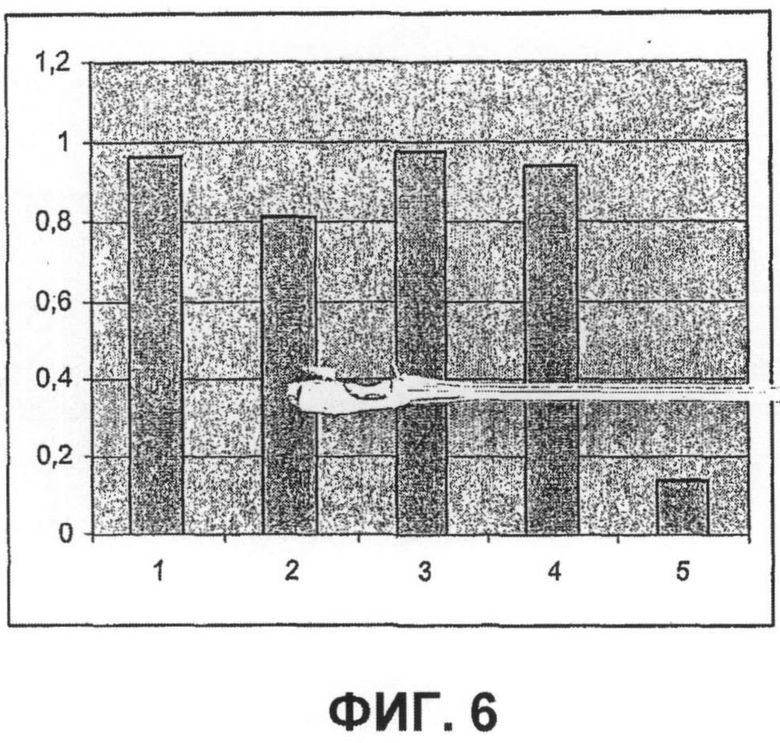
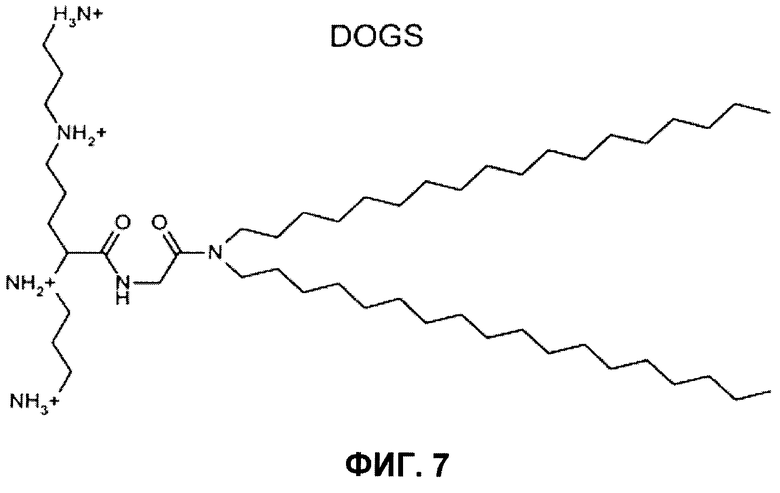
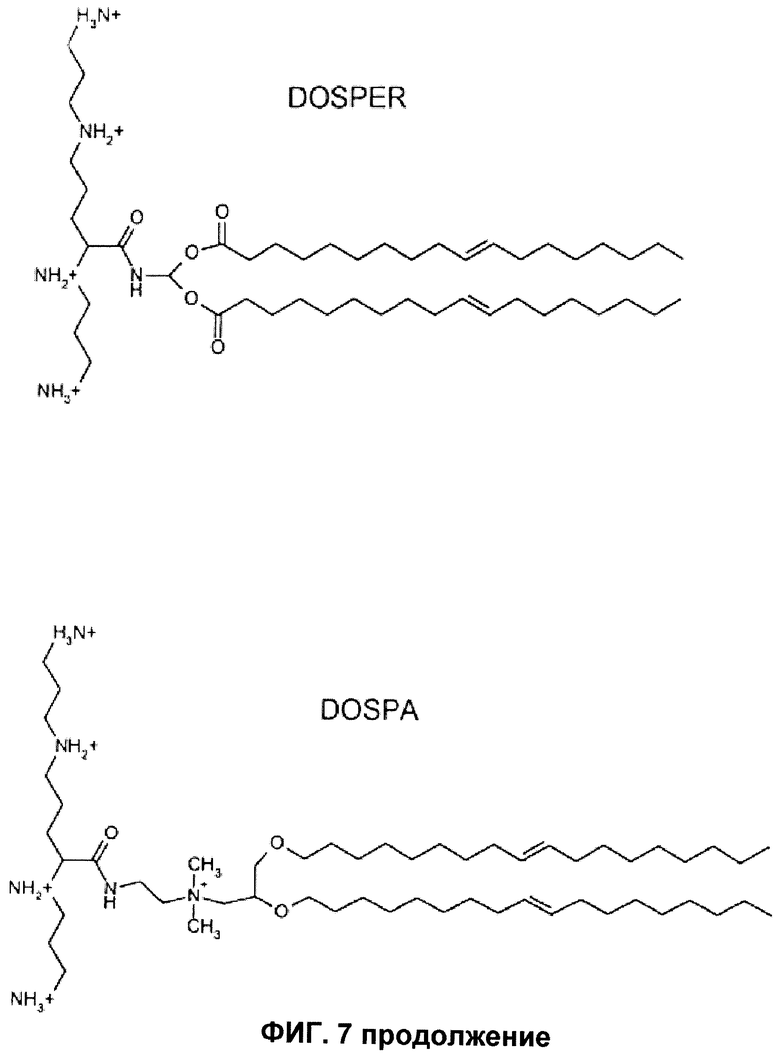
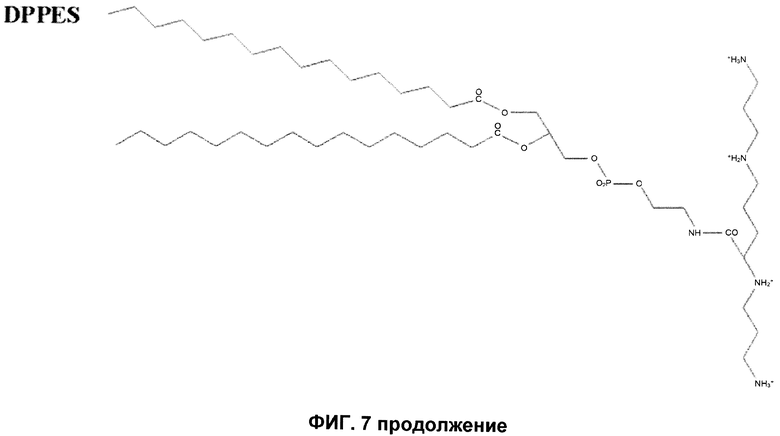
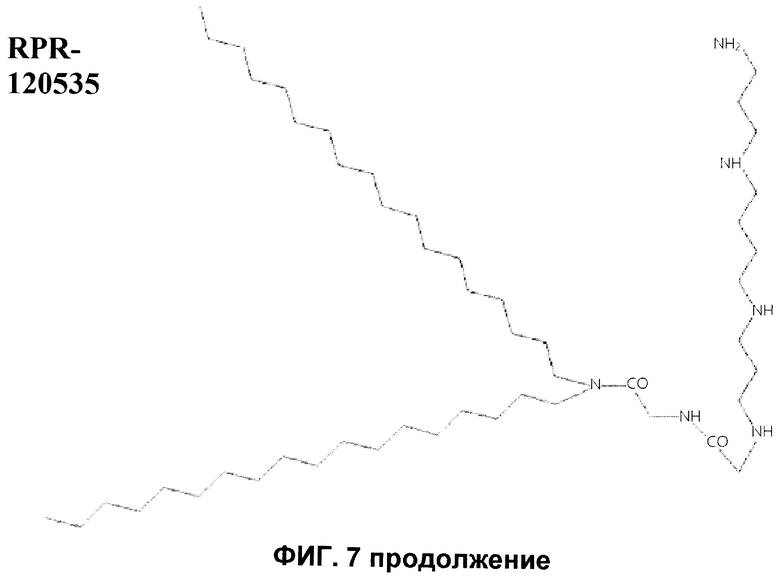
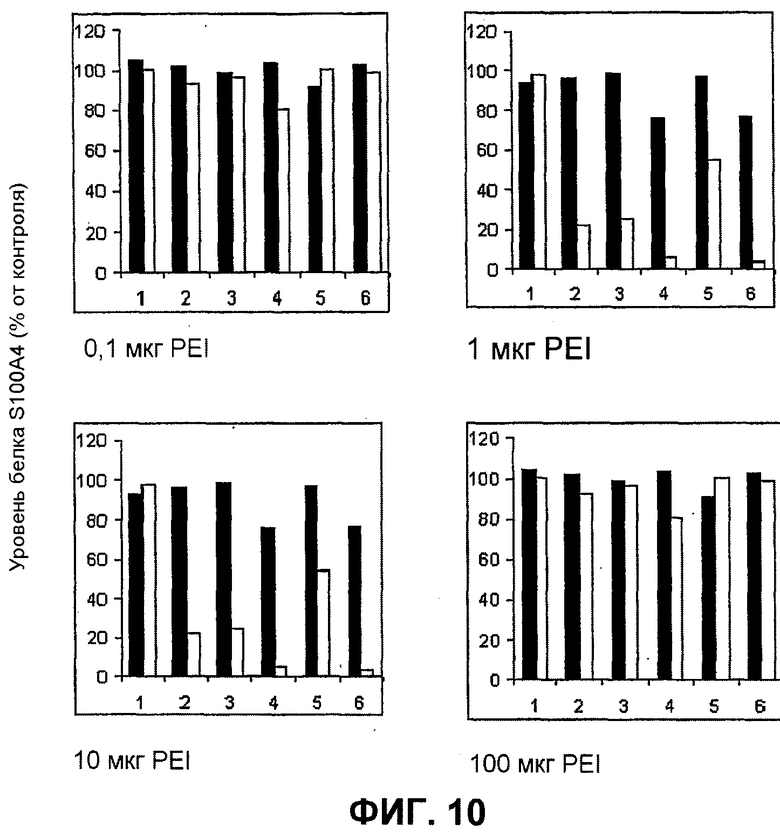
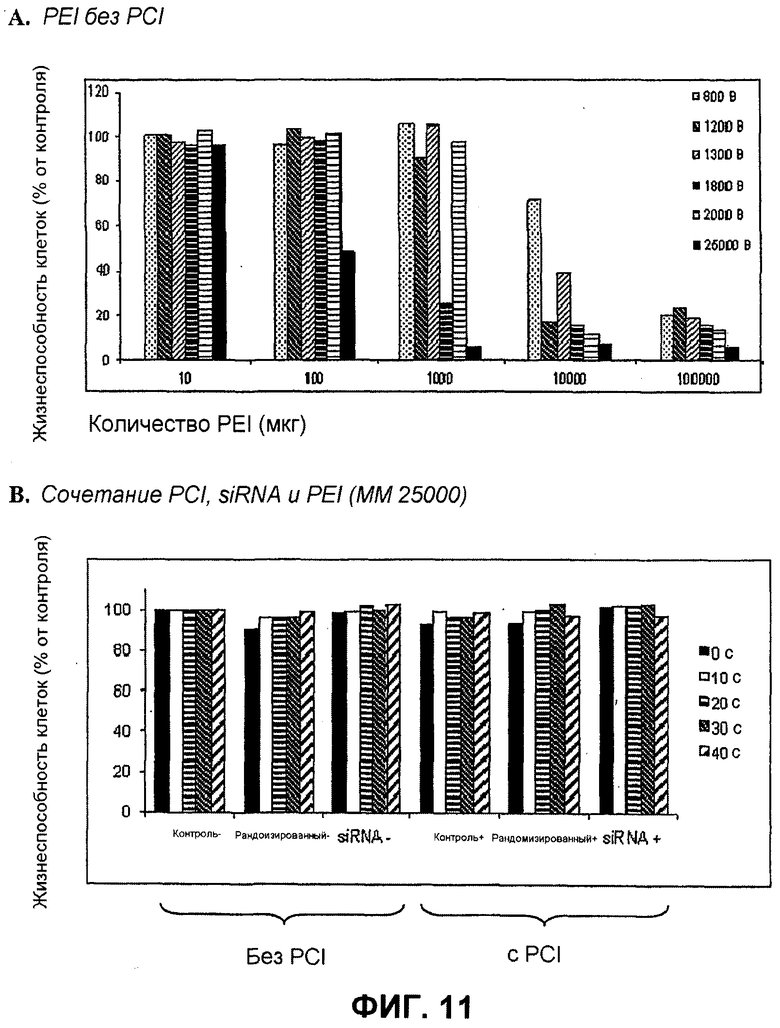
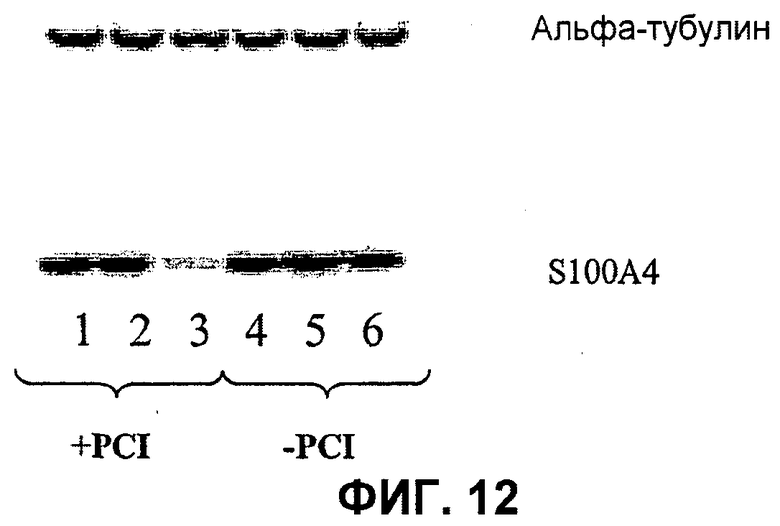
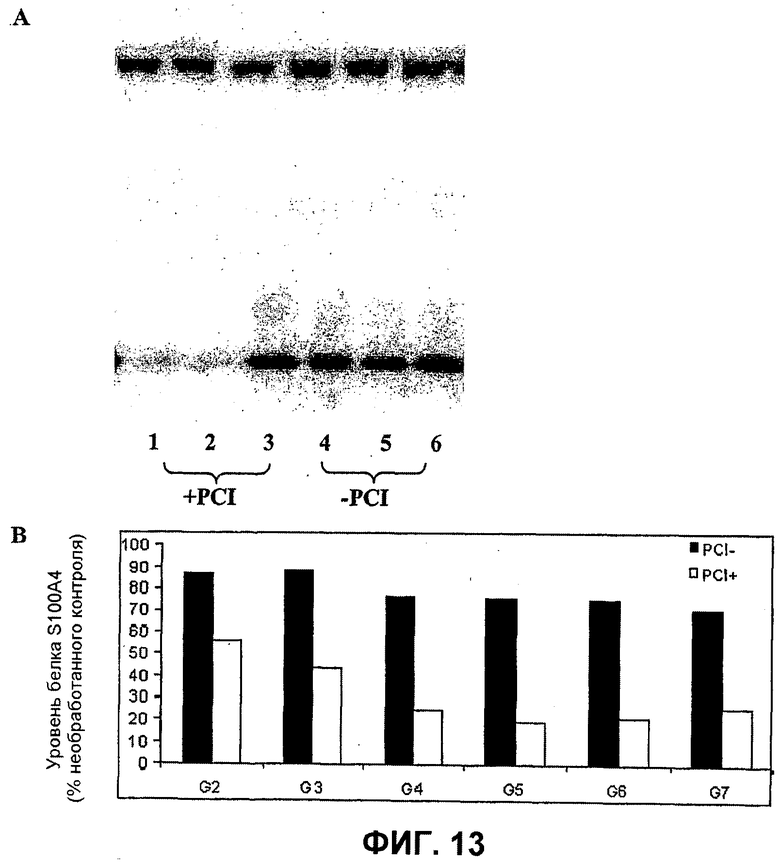
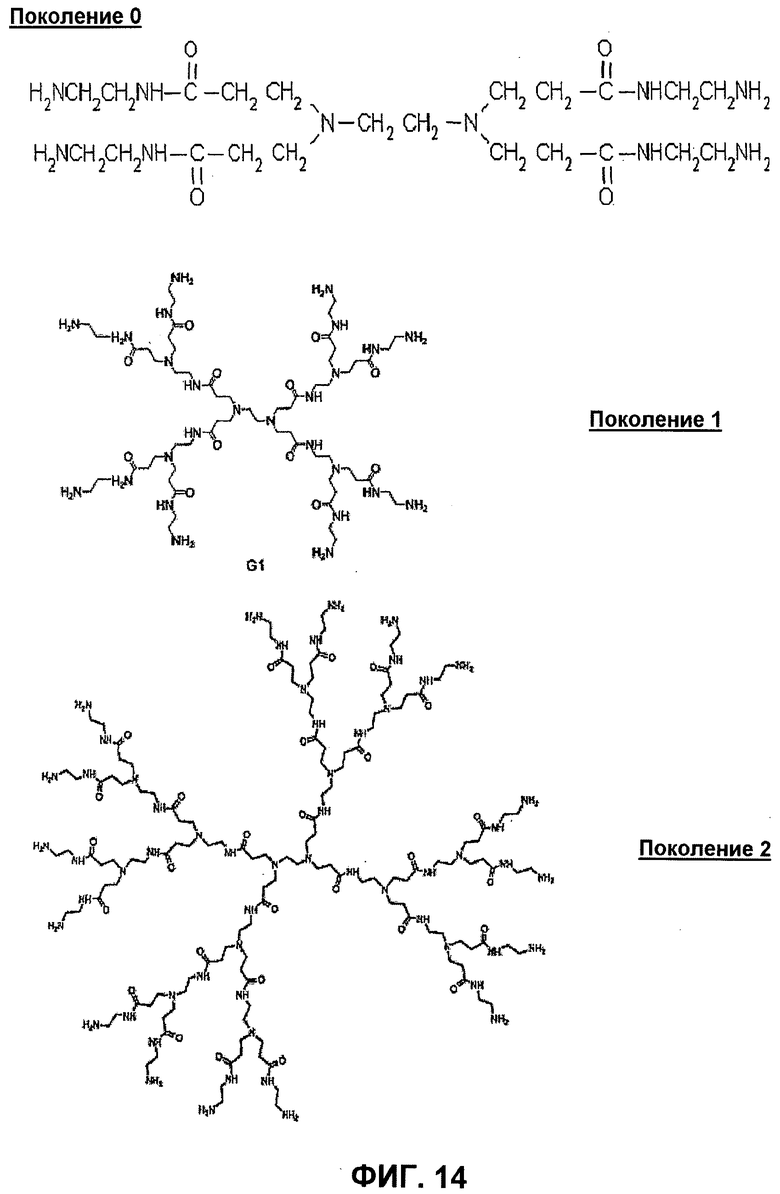
Изобретение относится к области биотехнологии, конкретно к способу введения молекулы siRNA в цитозоль клетки, и может быть использовано в медицине. Способ включает контактирование указанной клетки с молекулой siRNA, носителем и фотосенсибилизирующим веществом и облучение клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества. Носитель содержит катионный полиамин, выбранный из липополиамина в нелипосомальном составе, разветвленного полиэтиленимина (PEI), полимера бетациклодекстринамина, молекулы дендримера PAMAM и катионного пептида, выбранного из полиаргинина или сополимеры L- или D-аргинина. Способ используют для ингибирования экспрессии гена-мишени, получения клетки или популяции клеток, содержащей молекулы siRNA, а также для лечения или профилактики заболевания, в случае которого может быть полезным подавление одного или нескольких генов, в том числе для лечения злокачественной опухоли. Изобретение позволяет осуществить PCI-опосредованную сайт-специфическую доставку миРНК в цитозоль клетки. 9 н. и 18 з.п. ф-лы, 15 ил., 1 табл., 13 пр.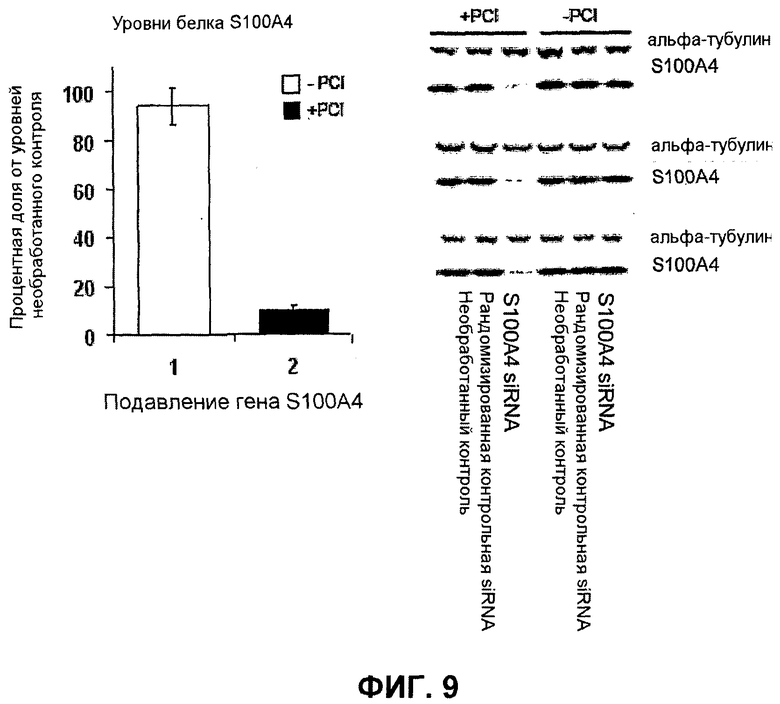
1. Способ введения молекулы siRNA в цитозоль клетки, где указанный способ включает:
i) контактирование указанной клетки с молекулой siRNA, носителем и фотосенсибилизирующим веществом, и
ii) облучение клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества,
где указанный носитель содержит катионный полиамин, выбранный из
(a) липополиамина в нелипосомальном составе, где указанный липополиамин представляет собой 5-карбоксиспермилглициндиоктадециламид (DOGS), JetSI™ или JetSI-ENDO™,
(b) разветвленного полиэтиленимина (PEI) с молекулярной массой от 1,2 кДа до 25 кДа,
(c) полимера бетациклодекстринамина формулы
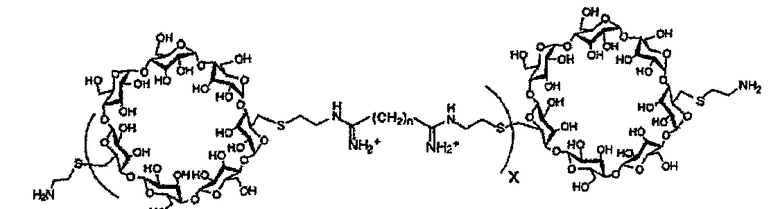
где X представляет собой целое число от 1 до 20, включительно, и n представляет собой целое число от 4 до 10, включительно,
(d) молекулу дендримера РАМАМ, и
(e) катионного пептида, выбранного из полиаргинина или сополимера L или D аргинина.
2. Способ по п.1, где молекулярная масса PEI составляет менее или равна 25 кДа.
3. Способ по п.1, где молекулярная масса PEI составляет менее 25 кДа.
4. Способ по п.1, где указанный PEI имеет величину Мn 500-20000 по GPC.
5. Способ по п.4, где указанный PEI имеет величину Мn 500-1500 по GPC.
6. Способ по п.1, где указанная молекула носителя представляет собой молекулу дендримера РАМАМ поколения 2-6.
7. Способ по п.1, где длина молекулы siRNA составляет 12-28 нуклеотидов.
8. Способ по п.1, где указанная клетка представляет собой клетку млекопитающего.
9. Способ по п.1, где фотосенсибилизирующее вещество выбрано из порфирина, фталоцианина, пурпурина, хлорина, бензопорфирина, лизосомотропного слабого основания, нафталоцианина, катионного красителя, тетрациклина или производного любого из указанных веществ, 5-аминолевулиновой кислоты и/или ее сложных эфиров.
10. Способ по п.9, где фотосенсибилизирующее вещество выбрано из TPPS4, TPPS2a, AlPcS2a, TPCS2a, 5 - аминолевулиновой кислоты или сложных эфиров 5-аминолевулиновых кислот, или их фармацевтически приемлемых солей.
11. Способ по п.1, далее включающий дополнительную стадию контактирования указанной siRNA с указанным носителем.
12. Способ по п.1, где молекула siRNA и молекула носителя контактируют друг с другом в течение 20-40 минут перед контактированием с клеткой.
13. Способ по п.1, где для трансфекции используют 10 нМ-200 нМ siRNA.
14. Способ по п.1, где, кроме того, присутствует носитель фотосенсибилизирующего вещества, выбранный из поликатиона, полиэтиленимина, дендримера, катионного липида и пептида.
15. Способ по п.1, где siRNA смешивают с носителем так, чтобы образовывался комплекс, который затем вводят в клетку одновременно или последовательно с фотосенсибилизирующим веществом.
16. Способ по п.1, где указанный способ проводят посредством контактирования указанной клетки с фотосенсибилизирующим веществом, контактирования указанной клетки с носителем и молекулой siRNA, подлежащей введению, и облучения указанной клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего вещества, где указанное облучение проводят перед клеточным захватом указанной молекулы siRNA и указанного носителя во внутриклеточный компартмент, содержащий указанное фотосенсибилизирующее вещество.
17. Способ по п.16, где указанное облучение осуществляют перед клеточным захватом указанной молекулы siRNA и указанного носителя в любой внутриклеточный компартмент.
18. Способ ингибирования экспрессии гена-мишени посредством введения молекулы siRNA в клетку, содержащую указанный ген-мишень, способом, как определено в любом из пп.1-17, где указанная молекула siRNA специфично ингибирует экспрессию указанного гена-мишени.
19. Композиция, содержащая молекулу siRNA и молекулу носителя, и также фотосенсибилизирующее вещество, необязательно присутствующее отдельно, для использования для лечения или профилактики заболевания, в случае которого может быть полезным подавление одного или нескольких генов путем in vivo введения молекулы siRNA и носителя в одну или более клеток, как определено в способе по любому из пп.1-17, где указанный носитель содержит катионный полиамин, выбранный из
(a) липополиамина в нелипосомальном составе, где указанный липополиамин представляет собой 5-карбоксиспермилглициндиоктадециламид (DOGS), JetSI™ или JetSI-ENDO™,
(b) разветвленного полиэтиленимина (PEI) с молекулярной массой от 1,2 кДа до 25 кДа,
(c) полимера бетациклодекстринамина формулы
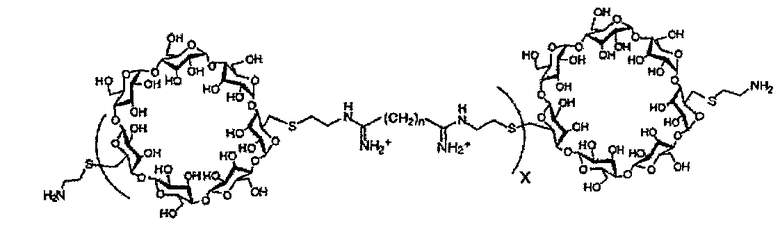
где X представляет собой целое число от 1 до 20, включительно, и n представляет собой целое число от 4 до 10, включительно,
(d) молекулу дендримера РАМАМ, и
(e) катионного пептида, выбранного из полиаргинина или сополимера L или D аргинина.
20. Способ получения клетки или популяции клеток, содержащей молекулы siRNA в цитозоле каждой клетки, где указанный способ включает осуществление способа по любому из пп.1-17 в клетке или популяции клеток.
21. Композиция для лечения заболевания или нарушения, которое характеризуется аномальной экспрессией гена или при котором является полезным подавление одного или нескольких генов, содержащая клетку или популяцию клеток, содержащих молекулу siRNA, которая интернализована в цитозоль указанной клетки, причем клетка получена способом по п.20.
22. Набор, содержащий молекулу siRNA, молекулу носителя и фотосенсибилизирующее вещество, для применения для лечения или профилактики заболевания, в случае которого может быть полезным подавление одного или нескольких генов путем in vivo введения молекулы siRNA и носителя в одну или более клеток, как определено в способе по любому из пп.1-17, где указанный носитель содержит катионный полиамин, выбранный из
(a) липополиамина в нелипосомальном составе, где указанный липополиамин представляет собой 5-карбоксиспермилглициндиоктадециламид (DOGS), JetSI™ или JetSI-ENDO™,
(b) разветвленного полиэтиленимина (PEI) с молекулярной массой от 1,2 кДа до 25 кДа,
(c) полимера бетациклодекстринамина формулы
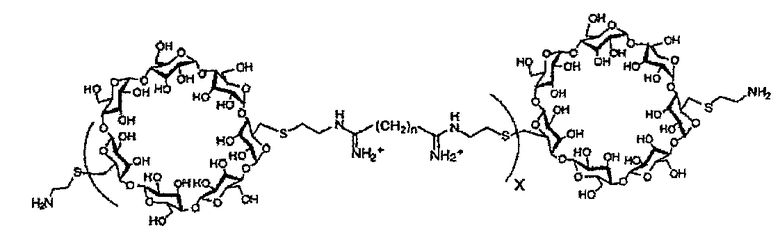
где X представляет собой целое число от 1 до 20, включительно, и n представляет собой целое число от 4 до 10, включительно,
(d) молекулу дендримера РАМАМ, и
(e) катионного пептида, выбранного из полиаргинина или сополимера L или D аргинина.
23. Применение молекулы siRNA, носителя и необязательно фотосенсибилизирующего вещества для получения лекарственного средства для лечения или профилактики заболевания, в случае которого может быть полезным подавление одного или нескольких генов, посредством изменения экспрессии одного или нескольких генов-мишеней у указанного пациента способом, при котором указанная молекулы siRNA вводится в клетку, содержащую один или более генов-мишеней, способом, определенным в любом из пп.1-17, где указанная молекула siRNA специфично изменяет экспрессию указанного одного или более генов-мишеней, и где указанный носитель содержит катионный полиамин, выбранный из
(a) липополиамина в нелипосомальном составе, где указанный липополиамин представляет собой 5-карбоксиспермилглициндиоктадециламид (DOGS), JetSI™ или JetSI-ENDO™,
(b) разветвленного полиэтиленимина (PEI) с молекулярной массой от 1,2 кДа до 25 кДа,
(с) полимера бетациклодекстринамина формулы
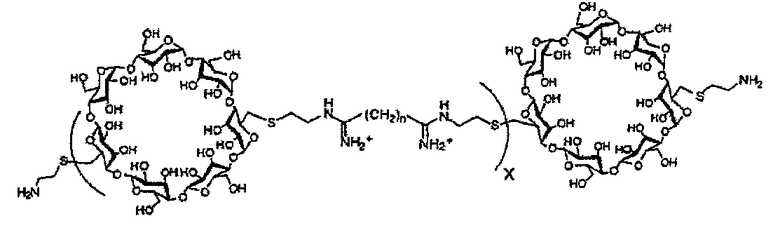
где X представляет собой целое число от 1 до 20, включительно, и n представляет собой целое число от 4 до 10, включительно,
(d) молекулу дендримера РАМАМ, и
(e) катионного пептида, выбранного из полиаргинина или сополимера L или D аргинина.
24. Применение клетки или популяции клеток, содержащих молекулу siRNA, которая интернализована в цитозоль указанной клетки, причем клетка получена способом по п.20, для получения лекарственного средства для лечения или профилактики заболевания, в случае которого может быть полезным подавление одного или нескольких генов, посредством изменения экспрессии одного или нескольких генов-мишеней у указанного пациента.
25. Применение по п.24, где указанное лекарственное средство предназначено для лечения злокачественной опухоли.
26. Способ лечения или профилактики заболевания, нарушения или инфекции, в случае которых может быть полезным подавление одного или нескольких генов у пациента, включающий введение молекулы siRNA и носителя в одну или несколько клеток in vivo в соответствии со способами по любому из пп.1-17.
27. Способ по п.26, который применяют для лечения злокачественной опухоли.
| HOGSET A | |||
| et al, Photochemical internalization in drug and gene delivery, Adv | |||
| Drug Deliv | |||
| Rev., 2004, v.56, n | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| US 20050075268 A1, 07.04.2005 | |||
| KULKARNI R.P | |||
| et al, Single cell kinetics of intracellular, nonviral, nucleic acid delivery vehicle acidification and trafficking, Bioconjugate Chem., 2005, v.16, n | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Приспособление к колунам для подачи к ним и раскалывания кругляков | 1920 |
|
SU986A1 |
| ZHOU J | |||
| et | |||
Авторы
Даты
2014-04-10—Публикация
2007-07-11—Подача