Изобретение относится к медицине, в том числе лечебной косметике, и предназначено для профилактического и лечебного применения в домашних, амбулаторных и клинических условиях.
В конце 90-х годов был разработан новый отечественный препарат «Пантогематоген сухой» (регистрационное удостоверение МЗ РФ NP N00051/01-200 от 12.10.2000 г., ФСП 42-0148-0391-00), который представляет собой концентрат, полученный из натурального природного сырья - крови алтайского марала (Cervus elaphus sibiricus), взятой из крупных сосудов головы в период резки пантов. За счет производства препарата с использованием современных технологий в стерильных условиях при низкотемпературном вакуумном обезвоживании он характеризуется высокой сохранностью биологически активных веществ и по данным ряда клинических испытаний превосходит по своей активности пантокрин и такие известные растительные адаптогены, как настойка женьшеня, экстракты элеутерококка и родиолы розовой. Данный препарат применяется для приготовления капсул, растворов для приема внутрь, лечебных ванн и микроклизм. Недавно были разработаны препараты для местного применения с применением пантогематогена.
Известен КРЕМ ДЛЯ МАССАЖА (RU 2197942). содержащий пантогематоген и биологически активные компоненты растительного происхождения при следующем соотношении компонентов, мас.%: воск прополисный 14,0-16,0, масло подсолнечное 20,0-22,0, масло калины 4,0-6,0, масло пихтовое 16,0-18,0, масло мяты перечной 7,0-9,0, вода очищенная 8,0-10,0, мумие или пантогематоген 0,5-2,0, ланолин - остальное.
Известна лекарственная форма на основе пантогематогена для наружного применения, включающая пантогематоген в виде 3%-ного водно-спиртового раствора с содержанием 8-14% этилового спирта 5-35, полимерная гелеобразующая композиция на основе редкосшитого полимера акриловой кислоты и/или поливинилпирролидона 0,5-15 и вода остальное (RU 2200564).
Недостатком данной лекарственной формы является недостаточная терапевтическая эффективность, что ограничивает ее применение профилактической медициной.
Целью изобретения является получение лечебно-косметического средства с высокой терапевтической эффективностью, предназначенного для лечения и профилактики заболеваний опорно-двигательного аппарата и оздоровления кожных покровов.
Повышение эффективности и стабильности лечения и получение косметического эффекта достигается подбором компонентов лечебно-косметического средства оптимальным образом для достижения максимального и стабильного результата.
Лечебно-косметическое средство для наружного применения на гелевой основе, включающая пантогематоген, воду, полимерную гелеобразующую композицию, отличается тем, что в состав композиции входит диметилсульфоксид при следующем соотношении компонентов, мас.%:
- Полимерный гелеобразующий компонент 0.5-20%;
- Пантогематоген 0.5-20%;
- Диметилсульфоксид 1-50%;
- Вода - остальное.
Технический результат изобретения заключается в создании высокоэффективной лечебно-косметического средства на гелевой основе.
С целью определения оптимального соотношения ингредиентов было проведено плацебо-контролируемое исследование предлагаемого средства в сравнении с гелем, содержащим диметилсульфоксид (далее ДМСО), и гелем, содержащим пантогематоген (далее ПГ), проведенное двойным слепым методом ГУ НИИКИ СО РАМН.
В исследование вошли группы пациентов с остеоартритами и с дорсопатиями смешанного генеза, а также женщины с косметическими дефектами кожных покровов (раннее «увядание» кожи и др.). Каждая группа состояла из 80 амбулаторных больных, получала монотерапию гелевыми препаратами ПГ, ДМСО или плацебо. У больных остеоартритами и дорсопатиями во время исследования было исключено применение медикаментозных средств или нелекарственных методов лечения, которые могли бы повлиять на течение заболевания. По этическим соображениям больные имели возможность принимать в качестве вспомогательного анальгетика парацетамол до 3 раз в сутки в дозе до 1000 мг; т.о., группа плацебо при необходимости не оставалась без лечения.
Перед началом лечения все пациенты были проинформированы о цели исследования и дали согласие на участие. В группу остеоартритов вошли женщины в возрасте 45-65 лет без тяжелых сопутствующих заболеваний с остеоартритом коленного и/или голеностопного сустава I-III рентгенологической стадии, осложненным периартритом и/или синовиитом. Диагноз подтверждался физикальными данными, рентгенологическим исследованием, клиническими и биохимическими анализами. В группу дорсопатий вошли мужчины и женщины 45-65 лет без тяжелых сопутствующих заболеваний с остеохондрозом поясничного отдела позвоночника, осложненным рефлекторным и/или компрессионно-корешковым синдромом. Критериями исключения были деструктивные, травматические и первично-воспалительные поражения позвоночника. Кроме того, исходя из этических норм и учитывая, что монотерапия наружным средством считается неэффективной при значительных компрессионных поражениях, из исследования исключались пациенты с выраженными радикулопатиями, спинальными и корешково-спинальными синдромами. Диагноз верифицировался физикальным обследованием и рентгенологически. Лабораторные исследования проводили по показаниям.
Схема лечения: Препараты ПГ применялись в виде накожных аппликаций 2-3 мл геля, которые наносились на область поражения ежедневно 3 раза в день в течение 2-х недель. В качестве плацебо аналогичным образом использовали метаболически нейтральный гель Элкогель (Гельтек). Непосредственно перед назначением курса с целью исключения острой аллергической реакции больным предлагали оценить возможное изменение своего самочувствия в ответ на запах препарата; затем с той же целью мазок препарата наносили на кожу внутренней поверхности предплечья. При отсутствии неприятных ощущений от запаха, а также покраснения, отека, жжения и пр. на коже препараты назначались к применению.
Обследование проводили до, в середине и после курса лечения. Эффективность лечения оценивалась количественно путем анализа субъективных данных, данных физикального обследования и результатов лабораторных тестов.
В группе остеоартритов учитывали выраженность болевого синдрома, явлений периартрита, периартикулярного отека, синовиита и ограничения объема движений, в группе остеохондрозов - болевого синдрома, рефлекторной и компрессионно-корешковой симптоматики, нейродистрофических и вегетативных нарушений.
В группе остеоартритов болевой синдром оценивали согласно визуальной аналоговой шкале; периартрит - по 4-балльной шкале (0 - отсутствует; 1 - незначительная болезненность одного-двух энтезисов при пальпации; 2 - умеренная болезненность 1-3-х энтезисов при пальпации; 3 - выраженная болезненность 2-х и более энтезисов при пальпации и ходьбе); периартикулярный отек - по индексу припухлости (0 - отсутствует; 1 - сомнительная или слабо выраженная; 2 - явная; 3-сильная); синовиит - по степени экссудации (0 - отсутствует; 1 - в КС сглаженность перипателлярных контуров, в ГСС - сглаженность контуров медиальной лодыжки; 2- в КС слабо или умеренно выраженное баллотирование надколенника, в ГСС - экссудация по передней поверхности сустава, определяемая при пальпации; 3 - в КС выраженная флюктуация надколенника, часто жидкость в надпателлярной синовиальной сумке, в ГСС - экссудация по передней поверхности сустава определяется визуально). Ограничение объема движений у больных с остеоартритами оценивали гониометрически по 4-балльной шкале (0 - отсутствие ограничений; 1 - в КС сгибание 110-130°, в ГСС сгибание 10-20°, разгибание 20-30°; 2 - в КС сгибание 90-110°, в ГСС сгибание меньше 10°, разгибание 10-20°; 3 - в КС сгибание меньше 90°, в ГСС - сгибание отсутствует, разгибание меньше 10°).
В группе остеохондрозов болевой синдром оценивали по 5-балльной шкале (0 - отсутствие боли; 1 - незначительная боль, исчезающая в покое; 2 - умеренная боль в покое, нарастающая при движении; 3 - постоянная боль с периодическим усилением и сенестопатическим оттенком; 4 - резкая постоянная боль с вынужденным положением тела больного). Рефлекторные синдромы учитывали по миотоническому, нейрососудистому и нейродистрофическому синдромам. Миотонический синдром оценивался по 4-балльной шкале (0 - Мышечный тонус не изменен, мышца мягкая, палец легко погружается в ее толщу; 2 - мышца умеренной плотности, для погружения в уплотнение требуется умеренное усилие; 3 - мышца каменистой плотности, ее невозможно деформировать). Нейрососудистый синдром оценивался по 2-балльной шкале (отсутствие-присутствие вазомоторных нарушений, связанных с охлаждением или погодой жгучих или зудяще-колющих болей, трофических расстройств кожи). Нейродистрофический синдром оценивали по 3-балльной шкале (0 - отсутствует, 1 - умеренно болезненные при пальпации очаги остеомиофиброза в 1-2-х анатомических областях, 2 - очень болезненные очаги в 2-х и более областях).
Компрессионные корешковые синдромы (радикулопатии сегментов L5 (L4-L5) и S1 (L5-S1)) включали в исследование при их незначительной выраженности. При этом для их характеристики пользовались общеупотребительной для чувствительных, рефлекторных и двигательных нарушений 4-балльной шкалой (0 - отсутствуют, 1 - слабые в зоне иннервации одного корешка, 2 - умеренные в зоне 1-2 корешков, 3- сильные в зоне 1-2 и более корешков).
В группах остеоартритов и дорсопатий у каждого больного до лечения, в середине курса лечения и после окончания курса лечения подсчитывался индекс тяжести (ИТ) и коэффициент клинической эффективности (Э). ИТ подсчитывался по выраженности симптоматики как сумма баллов всех учитывающихся симптомов, а Э - как частное от деления разницы (ИТ при поступлении - ИТ на момент учета) на ИТ при поступлении.
Статистическую обработку данных проводили методами вариационной статистики, достоверность различий оценивали с использованием t-критерия Стьюдента при принятой доверительной вероятности Р<0.05.
Результаты исследования.
Всего в группах остеартритов и дорсопатий было обследовано 160 больных - по 80 пациентов в каждой. Между подгруппами, получавшими разные препараты ПГ и плацебо, не было достоверных различий по тяжести заболевания, возрасту, распределению полов, индексу массы тела.
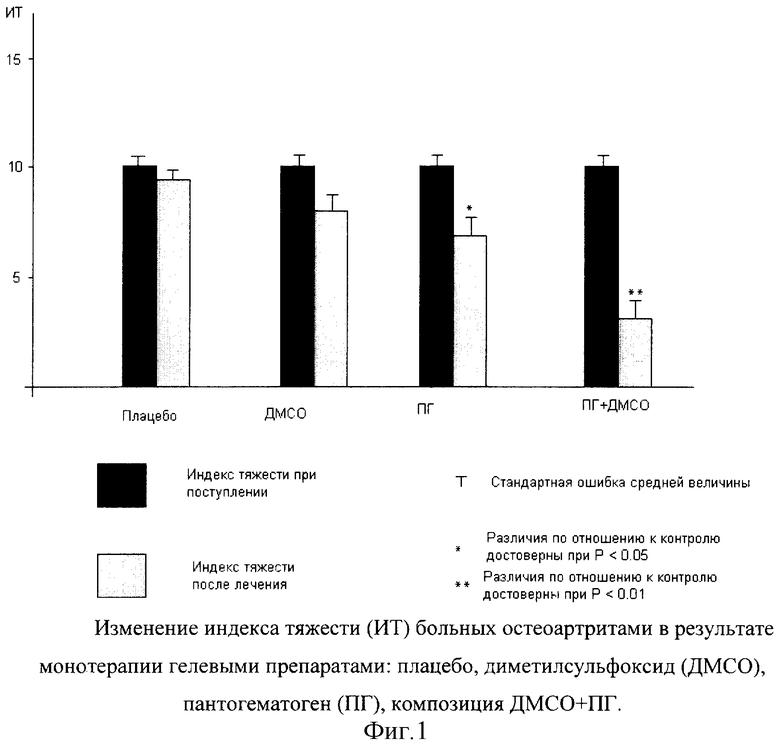
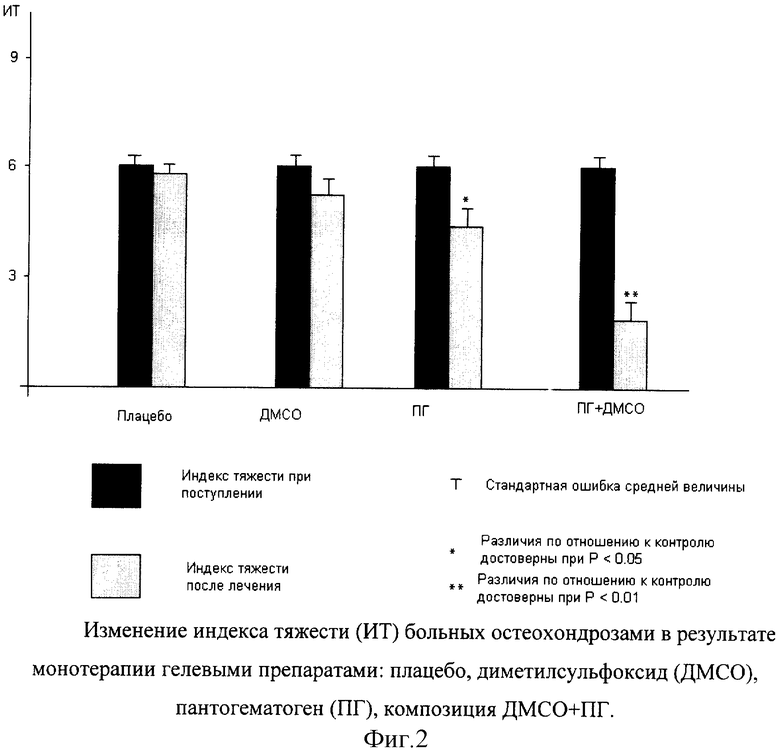
Терапевтическая эффективность средств, вычисляемая на основе изменения индекса тяжести больных в результате лечения, на фиг.1 и 2 для наглядности представлена в виде изменения индексов тяжести.
Из чертежей видно, что гелевые средства, содержащие ДМСО или ПГ, обладают значительно менее выраженной эффективностью, чем препарат, содержащий композицию из ПГ+ДМСО. Очевидно, что сочетание ПГ и ДМСО приводит к синергетическому эффекту, обусловленному изменением механизма действия препарата. Синергетический эффект связан с тем, что:
1. Наиболее эффективные компоненты ПГ плохо растворяются в спиртоводяной смеси, используемой при приготовлении препаратов-прототипов, содержащих ПГ, но легко растворяются в смеси ДМСО с водой в процессе приготовления предлагаемого средства.
2. ДМСО, присутствующий в составе средства, усиливает трансдермальный перенос растворимых лечебных компонент ПГ.
3. ДМСО оказывает собственное антивоспалительное действие.
4. В свою очередь ПГ, очевидно, обладает способностью усиливать антивоспалительное действие ДМСО, поскольку ПГ обладает способностью стимулировать локальное кровообращение на капиллярном уровне и усиливать лимфодренаж тканей, тем самым дополнительно повышая биодоступность ДМСО.
Косметическая эффективность препарата изучалась в отдельном исследовании у женщин 25-45 летнего возраста при аппликации тех же препаратов, что и в основном исследовании, и оценивалась по 10-балльной шкале. Оценка производилась по субъективным впечатлениям женщин о состоянии кожи с использованием 10-балльной шкалы эффективности. Было показано, что препараты, содержащие предлагаемую композицию, обладают наиболее выраженным косметическим эффектом по сравнению с другими исследуемыми препаратами.
Выводы:
1. Гелевые препараты ПГ для наружного применения хорошо переносятся и не имеют местного или системного побочного действия.
2. Терапевтическая эффективность аппликаций исследованных препаратов располагается в порядке возрастания следующим образом: Плацебо, ДМСО, ПГ, ПГ + ДМСО.
3. Гелевые ДМСО-содержащие препараты ПГ для наружного применения в качестве монотерапии остеоартрозов, остеохондрозов позвоночника и в качестве косметического средства обладают выраженной лечебно-косметической эффективностью.
Общий вывод проведенного исследования: фармацевтическая композиция, соответствующая предлагаемому в изобретении лечебно-косметическому средству, обладает высокой стабильной эффективностью при лечении остеоартроза и остеохондрозов позвоночника, может применяться в клинической фармакологии и обладает косметическим эффектом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ И ДЕГЕНЕРАТИВНО-ДИСТРОФИЧЕСКИХ ЗАБОЛЕВАНИЙ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА | 2006 |
|
RU2346681C2 |
| СРЕДСТВО КОРРЕКЦИИ МУЖСКИХ СЕКСУАЛЬНЫХ ДИСФУНКЦИЙ | 2008 |
|
RU2421211C2 |
| СПОСОБ ПЕРЕРАБОТКИ, КОНСЕРВИРОВАНИЯ И ХРАНЕНИЯ ПАНТОВОГО СЫРЬЯ | 2011 |
|
RU2466537C1 |
| ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКАЯ ПИЩЕВАЯ КОМПОЗИЦИЯ | 2014 |
|
RU2571815C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЕВОГО КОРЕШКОВОГО СИНДРОМА НА ПОЯСНИЧНОМ УРОВНЕ | 2012 |
|
RU2475238C1 |
| Способ бальнеотерапии больных остеоартритом с сопутствующей гипертонической болезнью | 2021 |
|
RU2817309C2 |
| ЛЕЧЕБНО-КОСМЕТИЧЕСКОЕ СРЕДСТВО | 2012 |
|
RU2500409C2 |
| СПОСОБ ВОЗДЕЙСТВИЯ НА ПСИХИАТРИЧЕСКИЕ И ПСИХОНЕВРОЛОГИЧЕСКИЕ СПОСОБНОСТИ ОРГАНИЗМА | 1996 |
|
RU2081637C1 |
| СПОСОБ ФИЗИЧЕСКОЙ РЕАБИЛИТАЦИИ | 2019 |
|
RU2722936C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАГИНАЛЬНЫХ ПАНТОВЫХ СУППОЗИТОРИЕВ ДЛЯ ЖЕНЩИН | 2018 |
|
RU2740655C1 |
Изобретение относится к области медицины и предназначено для профилактического и лечебного применения в домашних, амбулаторных и клинических условиях. Лечебно-косметическое средство для наружного применения содержит пантогематоген, воду, полимерный гелеобразующий компонент, дополнительно содержит диметилсульфоксид и воду. Компоненты берут в определенном количественном содержании. Средство обладает стабильной эффективностью при лечении остеоартроза и остеохондрозов позвоночника, может применяться в клинической фармакологии. 6 з.п. ф-лы, 2 ил.
| ЛЕКАРСТВЕННАЯ ФОРМА ПАНТОГЕМАТОГЕНА НА ГЕЛЕВОЙ ОСНОВЕ | 2002 |
|
RU2200564C1 |
| КРЕМ ДЛЯ МАССАЖА | 2001 |
|
RU2197942C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С НЕВРОЛОГИЧЕСКИМИ ПРОЯВЛЕНИЯМИ ОСТЕОХОНДРОЗА ПОЗВОНОЧНИКА | 1996 |
|
RU2120289C1 |
| Машковский М.Д | |||
| Лекарственные средства, изд 14 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2008-05-20—Публикация
2005-11-28—Подача