Область, к которой относится изобретение
Настоящее изобретение относится к производному 2,3-дигидро-6-нитроимидазо[2,1-B]оксазола.
Предпосылки создания изобретения
Из кислотоустойчивых бактерий широко известной является человеческая Mycobacteriumtuberculosis. Известно, что одна треть человечества инфицирована указанной бактерией. Кроме того, известно также, что кроме Mycobacteriumtuberculosis к группе Mycobacteriumtuberculosis относятся Mycobacteriumafricanum и Mycobacteriumbovis. Указанные бактерии известны как микобактерии, обладающие сильной патогенностью по отношению к людям.
Лечение туберкулеза, вызываемого указанными микобактериями, проводят с использованием трех средств: рифампицина, изониазида и этамбутола (или стрептомицина), считающихся средствами первого ряда, или с использованием четырех средств, таких как указанные выше три средства и пиразинамид.
Однако, поскольку лечение туберкулеза требует очень длительного применения указанных средств, это может привести к несогласию пациента с предписанным режимом лечения, что часто приводит к отказу от лечения.
Кроме того, в отношении указанных выше средств были сообщения о том, что рифампицин вызывает гепатопатию, гриппозный синдром, лекарственную аллергию, и его совместное применение с другими лекарственными средствами противопоказано из-за ферментативной индукции, связанной с Р450; изониазид вызывает расстройство периферической нервной системы, а также серьезные заболевания печени при использовании в сочетании с рифампицином; этамбутол приводит к нарушению зрения из-за расстройства работы зрительного нерва; стептомицин приводит к снижению способности слышать из-за нарушения 8-го черепного нерва, и пиразинамид вызывает вредные реакции, такие как гепатопатия, приступ подагры, связанный с повышением уровня мочевой кислоты, рвота (A Clinician's Guide To Tuberculosis, Michael D. Iseman 2000 by Lippincott Williams & Wilkins, printed in the USA, ISBN 0-7817-1749-3, Tuberculosis, 2nd edition, Fumiyuki Kuze and Takahide Izumi, Igaku-Shoin Ltd., 1992).
Действительно, было сообщение о том, что количество случаев, когда стандартную химиотерапию нельзя было осуществить из-за вредных реакций указанных средств, составляло до 70% (приблизительно 23%, 52 случая) от общего количества случаев прекращения применения указанных средств (всего было подвергнуто исследованию 228 госпитализированных пациентов) (Kekkaku, Vol. 74, 77-82, 1999).
В частности, гепатотоксичность, вызываемая рифампицином, изониазидом и этамбутолом из 5 средств, используемых в комбинации для лечения препаратами первого ряда, известна как вредная реакция, возникающая наиболее часто. В то же самое время появляется все больше бактерий Mycobacteriumtuberculosis, устойчивых к противотуберкулезным средствам, полирезистентных к лекарственным средствам бактерий Mycobacteriumtuberculosis и подобного, и наличие указанных разновидностей Mycobacteriumtuberculosis делает лечение более трудным.
Согласно исследованию, проведенному ВОЗ (1996-1999 гг.), доля Mycobacteriumtuberculosis, устойчивой к какому-нибудь из существующих противотуберкулезных средств, относительно всех типов Mycobacteriumtuberculosis, уже выделенных в мире, достигает 19%, и, как было опубликовано, доля бактерий Mycobacteriumtuberculosis, устойчивых ко многим лекарственным средствам, составляет 5,1%. Число носителей, инфицированных такими полирезистентными к лекарственным средствам бактериями Mycobacteriumtuberculosis, составляет по некоторым оценкам 60000000, и растет озабоченность тем, что оно будет расти в будущем (апрель 2001, приложение к журналу Tuberculosis, the "Scientific Blueprint for TB Drug Development").
Кроме того, основной причиной смерти больных СПИДом является туберкулез. Уже сообщалось, что число людей, страдающих от туберкулеза и от ВИЧ, к 1997 г. достигло 10700000 (Global Alliance for TB drug development). Считается также, что смешанная инфекция туберкулезом и ВИЧ по меньшей мере в 30 раз увеличивает опасность развития туберкулеза по сравнению с обычными случаями.
С учетом описанной выше текущей ситуации требуемое противотуберкулезное средство должно представлять собой следующее: (1) средство, эффективное даже против полирезистентных к лекарственным средствам бактерий Mycobacteriumtuberculosis, (2) средство, обеспечивающее возможность кратковременной химиотерапии, (3) средство с незначительными побочными реакциями, (4) средство, эффективное против латентного инфицирования бактериями Mycobacteriumtuberculosis (т.е. латентной Mycobacterium tuberculosis), и (5) перорально вводимое средство.
Примеры бактерий, обладающих, как известно, патогенностью к человеку, включают бактерии-возбудители с недавних пор растущей МАС-инфекции (инфекция комплексом Mycobacterium avium-intracellulare), такие как Mycobacteriumavium и Mycobacteriumintracellulare, и атипичные кислотоустойчивые бактерии, такие как Mycobacteriumkansasii, Mycobacteriummarinum, Mycobacteriumsimiae, Mycobacteriumscrofulaceum, Mycobacteriumszulgai, Mycobacteriumxenopi, Mycobacteriummalmoense, Mycobacteriumhaemophilum, Mycobacteriumulcerans, Mycobacteriumshimoidei, Mycobacteriumfortuitum, Mycobacteriumchelonae, Mycobacteriumsmegmatis и Mycobacteriumaurum.
В настоящее время существует несколько лекарственных средств, эффективных в отношении инфекций, вызванных указанными атипичными кислотоустойчивыми бактериями. В данных обстоятельствах используют в комбинации противотуберкулезные средства, такие как рифампицин, изониазид, этамбутол, стрептомицин и канамицин, ньюхинолоновое средство, которое является лекарственным средством против обычных бактериальных инфекций, макролидные антибиотики, аминогликозидные антибиотики и тетрациклиновые антибиотики.
Однако по сравнению с лечением обычных бактериальных инфекций лечение инфекции, вызванной атипичными кислотоустойчивыми бактериями, требует длительного применения лекарственных средств, и, как сообщалось, есть случаи преобразования инфекции в неизлечимую форму, что в конечном счете приводит к смерти. Чтобы переломить описанную выше текущую ситуацию, требуется создание средства с более высокой эффективностью.
Например, в национальной публикации международной заявки № 11-508270 (WO97/01562) раскрыто, что 6-нитро-1,2,3,4-тетрагидро[2,1-b]имидазопиран обладает бактерицидным действием in vitro в отношении Mycobacteriumtuberculosis (штамм H37Rv) и полирезистентной к лекарственным средствам Mycobacteriumtuberculosis и что указанное соединение оказывает терапевтическое действие на инфицированную туберкулезом животную модель при пероральном введении и, следовательно, полезно в качестве противотуберкулезного средства.
Однако соединение, описанное в указанной выше публикации, отличается от соединения по настоящему изобретению по основному скелету и не является соединением, подобным предлагаемому соединению.
Kuppsuwamy Nagarajan et al. сообщили в European Journal of Medicinal Chemistry, 1989, Vol. 24, pp.631-633, что соединения, представленные следующей общей формулой (I):

где R1 представляет собой атом водорода или метильную группу и -(СН2)nR2 представляет собой хлорметильную группу, С1-С7алкильную группу, изопропоксиметильную группу, 3-пропенилоксиметильную группу или незамещенную феноксиметильную группу, и соединения, представленные приведенной выше общей формулой (I), где R1 и -(СН2)nR2 связаны друг с другом с образованием циклопентанового или циклогексанового кольца (итого 16 типов соединений), обладают бактерицидным действием на Mycobacteriumtuberculosis (штамм H37Rv).
Однако в вышеописанной публикации сказано, что лишь 4 типа указанных выше соединений эффективны при их пероральном введении. Описано также, что соединение, обладающее наивысшей активностью, то есть соединение (CGI-17341), представленное приведенной выше общей формулой (I), где R1 представляет собой атом водорода и -(СН2)nR2 представляет собой этил, обладает, как было установлено, мутагенностью, и потому разработка указанной серии соединений как лекарственных средств была прекращена.
Кроме того, Dilip R. Astekar et al. сообщили в Antimicrobial Agents and Chemotherapy, Feb. 1993, pp. 183-186 о противомикробной особенности указанного выше соединения CGI-17341. Согласно сообщению соединение CGI-17341 обладает бактерицидным действием в отношении Mycobacteriumtuberculosis (штамм H37Rv) и полирезистентной к лекарственным средствам Mycobacteriumtuberculosis, но не обладает активностью в отношении атипичных кислотоустойчивых бактерий, M.avium, M.intracellulare и M.fortuitum при его использовании с концентрацией 250 мкг/мл или менее.
Описание изобретения
Целью настоящего изобретения является создание соединения, обладающего превосходным бактерицидным действием в отношении Mycobacteriumtuberculosis и полирезистентной к лекарственным средствам Mycobacteriumtuberculosis.
Другой целью настоящего изобретения является создание соединения, обладающего превосходным бактерицидным действием в отношении атипичных кислотоустойчивых бактерий.
В результате интенсивных исследований авторы настоящего изобретения достигли успеха в синтезе нового производного 2,3-дигидро-6-нитроимидазо[2,1-B]оксазола, которое обладает превосходным бактерицидным действием в отношении Mycobacteriumtuberculosis, полирезистентной к лекарственным средствам Mycobacteriumtuberculosis и атипичных кислотоустойчивых бактерий. На основе указанных находок и было создано настоящее изобретение.
В соответствии с настоящим изобретением предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, представленное следующей общей формулой (1), его оптически активная форма или фармацевтически приемлемая соль:
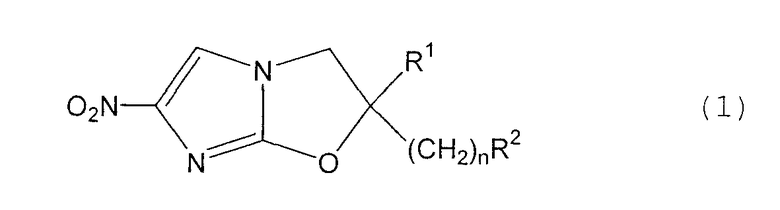
где R1 представляет собой атом водорода или С1-6алкильную группу, n представляет собой целое число от 0 до 6 и R2 представляет собой группу, представленную общей формулой (А), (B), (C), (D), (E), (F) или (G), показанной ниже, причем R1 и -(СН2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н), показанной ниже.
Общие формулы (А)-(Н) описаны далее следующим образом:
группа, представленная следующей общей формулой (А):

где R3 представляет собой:
А1) атом водорода;
А2) С1-6алкильную группу;
А3) С1-6алкокси-С1-6алкильную группу;
А4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы, которая может иметь в качестве заместителя по крайней мере одну галогензамещенную или незамещенную С1-6алкоксигруппу в фенильном кольце);
А5) бифенилил-С1-6алкильную группу;
А6) фенил-С2-6алкенильную группу;
А7) С1-6алкилсульфонильную группу;
А8) бензолсульфонильную группу, которая может быть замещена С1-6алкильной группой;
А9) С1-6алканоильную группу;
А10) группу, представленную следующей общей формулой (Аа):

где R4 представляет собой С1-6алкоксикарбонильную группу, фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
А11) бифенилил-С1-6алкоксикарбонильную группу;
А12) бензоксазолил-С1-6алкильную группу (которая может быть замещена в бензоксазольном кольце по крайней мере одной оксогруппой в качестве заместителя);
А13) бензоксазолильную группу или
А14) оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенильной группы и С1-6алкильной группы, в качестве заместителя),
группа, представленная следующей общей формулой (В):

где R5 представляет собой тетразолильную группу (которая может быть замещена в тетразольном кольце С1-6алкильной группой или фенильной группой, которая может содержать атом галогена в качестве заместителя) или бензоксазолильную группу,
группа, представленная следующей общей формулой (С):

где R6 представляет собой С1-6алкильную группу,
карбамоилоксигруппа, представленная следующей общей формулой (D):

где R7 и R8, одинаковые или различные, каждый представляет собой любое из следующего:
D1) атом водорода;
D2) С1-8алкильную группу;
D3) галогензамещенную С1-6алкильную группу;
D4) С1-6алкоксикарбонил-С1-6алкильную группу;
D5) С3-8циклоалкильную группу;
D6) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
D7) фенильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, С1-6алканоильной группы, карбоксильной группы, С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, карбамоильной группы, С1-6алкилкарбамоильной группы, аминосульфонильной группы и морфолиногруппы);
D8) нафтильную группу;
D9) пиридильную группу, и
D10) R7 и R8 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием насыщенной гетероциклической группы, показанной в любом из пунктов (D10-1)-(D10-3), представленных ниже, или конденсированной с бензолом гетероциклической группы, показанной в любом из пунктов (D10-4)-(D10-7), представленных ниже:
(D10-1) пиперазинильная группа, представленная следующей общей формулой (Da):

где R9 представляет собой:
(Da1) атом водорода;
(Da2) С1-6алкильную группу;
(Da3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Da4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Da5) С1-6алкоксикарбонильную группу;
(Da6) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Da7) фенил-С3-6алкенилоксикарбонильную группу (которая может иметь по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце); или
(Da8) замещенную фенил-С1-6алкилиденом аминогруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя),
(D10-2) группа, представленная следующей общей формулой (Db):
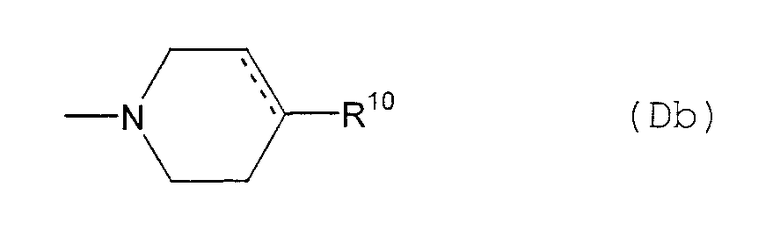
где пунктирная указывает на то, что связь может быть двойной связью, и R10 представляет собой:
(Db1) атом водорода;
(Db2) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Db3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой); или
(Db4) фениламиногруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой),
(D10-3) морфолиногруппа;
(D10-4) индолинильная группа (которая может быть замещена в индолиновом кольце по крайней мере одним атомом галогена в качестве заместителя);
(D10-5) изоиндолинильная группа (которая может быть замещена в изоиндолиновом кольце по крайней мере одним атомом галогена в качестве заместителя);
(D10-6) 1,2,3,4-тетрагидрохинолильная группа (которая может быть замещена в 1,2,3,4-тетрагидрохинолиновом кольце по крайней мере одним атомом галогена в качестве заместителя); и
(D10-7) 1,2,3,4-тетрагидроизохинолильная группа (которая может быть замещена в 1,2,3,4-тетрагидроизохинолиновом кольце по крайней мере одним атомом галогена в качестве заместителя),
феноксигруппа, представленная следующей общей формулой (Е):

где Х представляет собой атом галогена или аминозамещенную С1-6алкильную группу, которая может содержать С1-6алкильную группу в качестве заместителя, m представляет собой целое число от 0 до 3 и R11 представляет собой:
Е1) атом водорода;
Е2) галогензамещенную или незамещенную С1-6алкильную группу;
Е3) галогензамещенную или незамещенную С1-6алкоксигруппу;
Е4) группу, представленную следующей общей формулой (Еа):

где W представляет собой группу -СО- или С1-6алкиленовую группу, о представляет собой целое число 0 или 1 и R12 и R13, одинаковые или различные, каждый представляет собой любое из следующего:
(Еа1) атом водорода;
(Еа2) С1-6алкильную группу;
(Еа3) С1-6алканоильную группу;
(Еа4) С1-6алкоксикарбонильную группу;
(Еа5) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), и алкильная часть которой может быть замещена С1-6алкоксиаминогруппой);
(Еа6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Еа7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Еа8) пиридильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одним атомом галогена в качестве заместителя);
(Еа9) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Еа10) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); и
(Еа11) бензоил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы),
Е5) имидазолильную группу;
Е6) триазолильную группу;
Е7) морфолиногруппу;
Е8) тиоморфолиногруппу;
Е9) s-оксид тиоморфолиногруппу;
Е10) пиперидильную группу, представленную следующей общей формулой (Еаа):
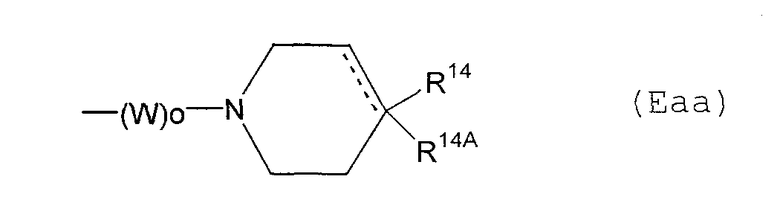
где W и о являются такими, как определено выше, R14А представляет собой атом водорода, гидроксильную группу, С1-6алкоксигруппу или фенильную группу (которая может быть замещена в фенильном кольце атомом галогена), пунктирная указывает на то, что связь может быть двойной связью, и когда пунктирная линия представляет собой двойную связь, это означает, что замещенным является только лишь R14, R14 и R14А могут быть связаны друг с другом вместе со смежными с ними атомами углерода с образованием С1-4алкилендиоксигруппы и R14 представляет собой:
(Еаа1) атом водорода;
(Еаа2) С1-6алкоксикарбонильную группу;
(Еаа3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; С1-4алкилендиоксигруппы; С1-6алкоксикарбонильной группы; цианогруппы; С2-6алкенильной группы; нитрогруппы; фенильной группы; аминогруппы, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из фенильной группы, С1-6алкильной группы, карбамоильной группы и С1-6алканоильной группы; С1-6алканоилзамещенной С1-6алкильной группы; гидроксильной группы; С1-6алкоксикарбонилзамещенной С1-6алкильной группы; фенил-С1-6алкильной группы; С1-6алканоильной группы; С1-6алкилтиогруппы; 1,2,4-триазолильной группы; изоксазолильной группы; имидазолильной группы; бензотриазолильной группы; 2Н-бензотриазолильной группы; пирролильной группы; бензоксазолильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя); пиперидинильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из аминогруппы (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя); и карбамоильной группы));
(Еаа4) гидроксильную группу;
(Еаа5) карбоксигруппу;
(Еаа6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя);
(Еаа7) С1-6алкоксигруппу;
(Еаа8) С3-8циклоалкил-С1-6алкоксигруппу;
(Еаа9) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Еаа10) тетрагидропиранилоксигруппу;
(Еаа11) 1,3-диоксоланильную группу;
(Еаа12) оксогруппу;
(Еаа13) нафтилоксигруппу (которая может быть замещена в нафталиновом кольце по крайней мере одной С1-6алкильной группой в качестве заместителя);
(Еаа14) 2,3-дигидробензофурилоксигруппу (которая может быть замещена в 2,3-дигидробензофурановом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и оксогруппы);
(Еаа15) бензотиазолилоксигруппу (которая может быть замещена в бензотиазольном кольце по крайней мере одной С1-6алкильной группой);
(Еаа16) 1,2,3,4-тетрагидронафтилоксигруппу (которая может быть замещена в 1,2,3,4-тетрагидронафталиновом кольце по крайней мере одной оксогруппой в качестве заместителя);
(Еаа17) 1,3-бензоксатиоланилоксигруппу (которая может быть замещена в 1,3-бензоксатиолановом кольце по крайней мере одной оксогруппой в качестве заместителя);
(Еаа18) изохинолилоксигруппу;
(Еаа19) пиридилоксигруппу;
(Еаа20) хинолилоксигруппу (которая может быть замещена в хинолиновом кольце по крайней мере одной С1-6алкильной группой в качестве заместителя);
(Еаа21) дибензофурилоксигруппу;
(Еаа22) 2Н-хроменилоксигруппу (которая может быть замещена в 2Н-хроменовом кольце по крайней мере одной оксогруппой в качестве заместителя);
(Еаа23) бензизоксазолилоксигруппу;
(Еаа24) хиноксалилоксигруппу;
(Еаа25) 2,3-дигидро-1Н-инденилоксигруппу (которая может быть замещена в 2,3-дигидро-1Н-инденовом кольце по крайней мере одной оксогруппой в качестве заместителя);
(Еаа26) бензофуразанилоксигруппу; или
(Еаа27) фенил-С1-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы),
Е11) группу, представленную следующей общей формулой (Eab):
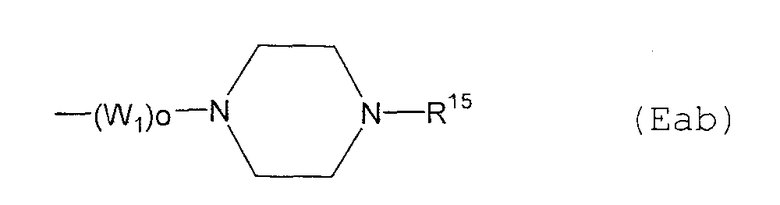
где о является таким, как определено выше, W1 представляет собой С1-6алкиленовую группу и R15 представляет собой:
(Eab1) атом водорода;
(Eab2) С1-6алкильную группу (где алкильная группа может быть замещена морфолиногруппой, бензоильной группой, карбамоильной группой, которая может содержать С1-6алкильную группу в качестве заместителя, или цианогруппой);
(Eab3) С3-8циклоалкильную группу;
(Eab4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, фенильной группы, нитрогруппы, С1-6алкилтиогруппы, С1-6алкилсульфонильной группы, фенил-С1-6алкоксигруппы, С2-6алканоилоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и 1,2,3-тиадиазолильной группы);
(Eab5) С2-6алкенильную группу;
(Eab6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eab7) С1-6алканоильную группу;
(Eab8) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eab9) бензоильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eab10) С1-20алкоксикарбонильную группу (которая может быть замещена в алкоксигруппе по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, и С1-6алкоксизамещенной С1-6алкоксигруппы);
(Eab11) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, нитрогруппы, галогензамещенной или незамещенной С1-6алкилтиогруппы, аминогруппы, которая может содержать С1-6алканоильную группу, фенил-С1-6алкоксигруппы, С1-6алкоксикарбонильной группы и 1,2,3-тиадиазолильной группы);
(Eab12) фенил-С3-6алкенилоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eab13) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eab14) фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eab15) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eab16) бензофурилзамещенную С1-6алкоксикарбонильную группу, которая может быть замещена по крайней мере одним атомом галогена в бензофурановом кольце;
(Eab17) бензотиенил-С1-6алкоксикарбонильную группу (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя);
(Eab18) нафтилзамещенную С1-6алкоксикарбонильную группу;
(Eab19) пиридилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одним атомом галогена в качестве заместителя);
(Eab20) фурилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в фурановом кольце по крайней мере одной нитрогруппой в качестве заместителя);
(Eab21) тиенилзамещенную С1-6алкоксикарбонильную группу (которая может содержать по крайней мере один атом галогена в качестве заместителя в тиофеновом кольце);
(Eab22) тиазолилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой));
(Eab23) тетразолилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в тетразольном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может содержать по крайней мере один атом галогена в качестве заместителя в фенильном кольце) в качестве заместителя);
(Eab24) 2,3-дигидро-1Н-инденилоксикарбонильную группу;
(Eab25) адамантанзамещенную С1-6алкоксикарбонильную группу;
(Eab26) фенил-С3-6алкинилоксикарбонильную группу;
(Eab27) фенилтио-С1-6алкоксикарбонильную группу;
(Eab28) фенил-С1-6алкоксизамещенную С1-6алкоксикарбонильную группу;
(Eab29) С2-6алкенилоксикарбонильную группу;
(Eab30) С2-6алкинилоксикарбонильную группу;
(Eab31) С3-8циклоалкилзамещенную С1-6алкоксикарбонильную группу или
(Eab32) бензоилзамещенную С1-6алкоксикарбонильную группу,
Е12) группу, представленную следующей общей формулой (Eb):

где пунктирная указывает на то, что связь может быть двойной связью, и R16 является таким, как определено выше для R15;
Е13) группу, представленную следующей общей формулой (Ес):

где R17 представляет собой:
(Ес1) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Ес2) С1-6алкоксикарбонильную группу или
(Ес3) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы),
Е14) пиридильную группу;
Е15) группу, представленную следующей общей формулой (Ее):
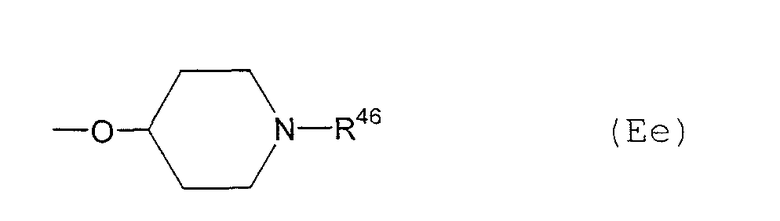
где R46 представляет собой фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, в качестве заместителя); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); или С1-6алкоксикарбонильную группу,
Е16) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
Е17) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
Е18) 8-азабицикло[3,2,1]октильную группу (которая может быть замещена в 8-азабицикло[3,2,1]октановом кольце по крайней мере одной феноксигруппой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя);
Е19) группу, представленную следующей общей формулой (Ef):

где каждый из R47 и R48, одинаковых или разных, представляет собой атом водорода, С1-6алкильную группу, фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или пиридильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя); и, кроме того, R47 и R48 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы с образованием 5-7-членного насыщенного гетероциклического кольца, которое может быть замещенным в гетероциклическом кольце по крайней мере одной фенильной группой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя);
Е20) фенил-С1-6алкоксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
Е21) аминозамещенную С2-6алкенильную группу (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)) или
Е22) оксазолидинильную группу (которая может быть замещена в оксазолидиновом кольце по крайней мере одной оксогруппой в качестве заместителя),
группа, представленная следующей общей формулой (F):

где R19 и R20, одинаковые или различные, каждый представляет собой любое из следующего:
F1) атом водорода;
F2) С1-6алкильную группу;
F3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать по крайней мере одну группу, выбранную из группы, состоящей из С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной фенил-С1-6алкильной группой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя); и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной аминогруппой, которая может содержать группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы в качестве заместителя);
F4) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F5) амино-С1-6алкильную группу (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, С1-6алкоксикарбонильной группы и фенильной группы, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы);
F6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкоксикарбонильной группы);
F7) С1-6алкоксикарбонильную группу;
F8) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F9) группу, представленную следующей общей формулой (Fa):

где R21 представляет собой С1-6алкоксикарбонильную группу; фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы) или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F10) 1-замещенную-4-пиперидильную группу, представленную следующей общей формулой (Fb):
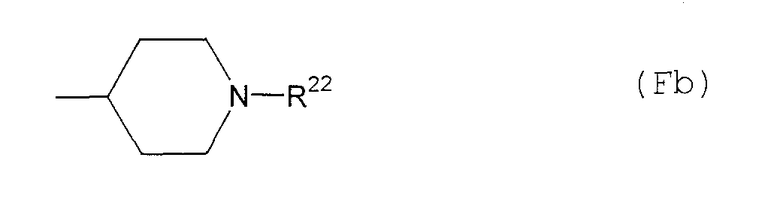
где R22 представляет собой С1-6алкоксикарбонильную группу; фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F11) пиперидил-С1-6алкильную группу (которая может содержать по крайней мере одну феноксигруппу (которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в качестве заместителя) в качестве заместителя);
F12) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием гетероциклического кольца, показанного в любом из пунктов (F12-1)-(F12-10), представленных ниже:
(F12-1) пиперазинильная группа, представленная следующей общей формулой (Fc):
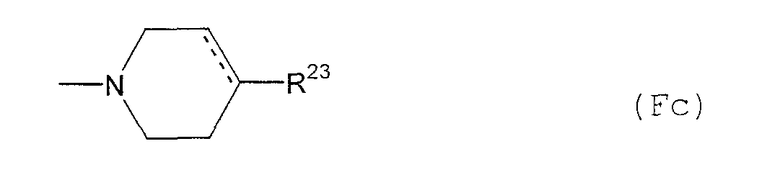
где пунктирная указывает на то, что связь может быть двойной связью, и R23 представляет собой:
(Fc1) С1-6алкильную группу;
(Fc2) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc3) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); и пиперидильной группы (которая может содержать в пиперидиновом кольце в качестве заместителя по крайней мере одну аминогруппу, которая может содержать группу, выбранную из группы, состоящей из фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы));
(Fc4) фенил-С1-6алкоксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc5) бифенилил-С1-6алкоксигруппу;
(Fc6) фенил-С3-6алкенилоксигруппу, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена;
(Fc7) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc8) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc9) С1-6алкоксикарбонильную группу;
(Fc10) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc11) фенил-С1-6алкилкарбамоильную группу, в которой по крайней мере один атом галогена может быть замещенным в фенильном кольце;
(Fc12) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc13) фенилтиогруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc14) фенилсульфоксид (который может быть замещен в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc15) пиридил-С1-6алкоксигруппу или
(Fc16) группу, представленную следующей общей формулой (Fca):

где о - такой же, как определенный выше, и каждый из R24 и R25 представляет собой:
(Fca1) атом водорода;
(Fca2) С1-6алкильную группу;
(Fca3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca5) С1-6алканоильную группу;
(Fca6) фенил-С2-6алканоильную группу, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена;
(Fca7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca8) С1-6алкоксикарбонильную группу;
(Fca9) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca10) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
(Fca11) пиперидилоксикарбонильную группу (которая может быть замещена в пиперидиновом кольце по крайней мере одной фенильной группой (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) в качестве заместителя); или
(Fca12) R24 и R25 могут образовывать через смежные с ними атомы азота 5-6-членное насыщенное гетероциклическое кольцо, которое может быть замещено в гетероциклическом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы; бензоильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкоксикарбонильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С2-6алкенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы),
(F12-2) 4-замещенная-1-пиперазинильная группа, представленная следующей общей формулой (Fd):

где R26 представляет собой:
(Fd1) атом водорода;
(Fd2) С1-6алкильную группу;
(Fd3) С3-8циклоалкильную группу;
(Fd4) С3-8циклоалкил-С1-6алкильную группу;
(Fd5) С1-6алкоксикарбонил-С1-6алкильную группу;
(Fd6) фенил-С2-6алкенильную группу;
(Fd7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена; цианогруппы; галогензамещенной или незамещенной С1-6алкильной группы; С3-8циклоалкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя; С1-6алкоксикарбонильной группы; феноксигруппы; фенил-С1-6алкильной группы; фенил-С2-6алкенильной группы; пиридильной группы; имидазолильной группы и пиперидильной группы);
(Fd8) бифенилил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя);
(Fd9) нафтил-С1-6алкильную группу;
(Fd10) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; цианогруппы; аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; С1-6алкоксикарбонильной группы; карбоксильной группы; феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); амино-С1-6алкильной группы (которая может содержать в аминогруппе по крайней мере одну группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы); и фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы));
(Fd11) бифенилильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
(Fd12) аминогруппу, замещенную С1-6алкоксикарбонильной группой, фенил-С1-6алкиламиногруппой (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) или фениламиногруппой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и атома галогена);
(Fd13) бензоильную С1-6алкильную группу (которая может содержать в фенильном кольце по крайней мере один атом галогена в качестве заместителя);
(Fd14) фенилкарбамоил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
(Fd15) тиазолил-С1-6алкильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы);
(Fd16) оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы);
(Fd17) индолил-С1-6алкильную группу;
(Fd18) фурил-С1-6алкильную группу (которая может быть замещена в фурановом кольце по крайней мере одной галогензамещенной или незамещенной фенильной группой);
(Fd19) имидазолил-С1-6алкильную группу (которая может быть замещена в имидазольном кольце фенильной группой);
(Fd20) хинолил-С1-6алкильную группу;
(Fd21) тетразолильную группу (которая может быть замещена в тетразольном кольце фенильной группой);
(Fd22) пиримидильную группу, которая может быть замещена фенильной группой;
(Fd23) пиридильную группу;
(Fd24) бензоксазолильную группу;
(Fd25) бензотиазолильную группу;
(Fd26) бензоксазолил-С1-6алкильную группу (которая может содержать в бензоксазольном кольце по крайней мере одну оксогруппу в качестве заместителя);
(Fd27) фенокси-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd28) фенилтио-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd29) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fd30) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя);
(Fd31) бифенилилкарбонильную группу;
(Fd32) пиридилкарбонильную группу;
(Fd33) фенил-С2-6алкенилкарбонильную группу, которая может быть замещена атомом галогена в фенильном кольце;
(Fd34) фенил-С1-6алкилсульфонильную группу, которая может быть замещена атомом галогена в фенильном кольце;
(Fd35) бензолсульфонильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и С1-6алкильной группы);
(Fd36) группу, представленную следующей общей формулой (Fda):

где R27 представляет собой:
(Fda1) галогензамещенную или незамещенную С1-8алкильную группу;
(Fda2) С3-8циклоалкильную группу;
(Fda3) С3-8циклоалкил-С1-6алкильную группу;
(Fda4) С1-6алкокси-С1-6алкильную группу;
(Fda5) амино-С1-6алкильную группу, которая может содержать С1-6алкильную группу;
(Fda6) группу, представленную следующей общей формулой (Fdb):
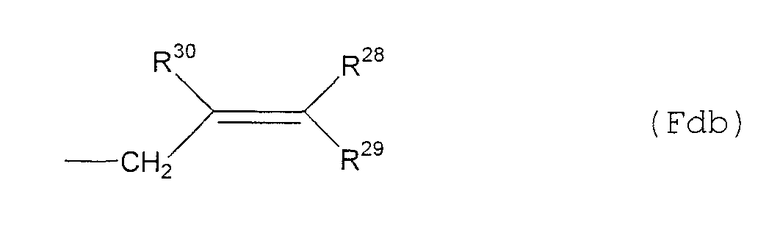
где R28, R29 и R30 представляют собой атом водорода, С1-6алкильную группу или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) соответственно;
(Fda7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5 группами, выбранными из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; галогензамещенной или незамещенной С1-6алкилтиогруппы; фенил-С1-6алкоксигруппы; гидроксигруппы; С1-6алкилсульфинильной группы; С1-6алкилсульфонильной группы; С1-6алкилсульфонилоксигруппы; цианогруппы; С1-6алканоильной группы; бензоильной группы; фенил-С1-6алкильной группы, которая может содержать С1-6алкоксигруппу в алкильной части; аминогруппы; нитрогруппы; карбамоильной группы; С1-6алканоиламиногруппы; С1-6алкоксикарбонильной группы; С1-6алкиламинокарбонильной группы; С1-6алкоксикарбониламиногруппы; три-С1-6алкилсилоксигруппы; пирролильной группы; тетрагидропиранилоксигруппы и имидазолильной группы);
(Fda8) бифенилил-С1-6алкильную группу;
(Fda9) бензгидрильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, трифторметильной группы и трифторметоксигруппы);
(Fda10) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fda11) фенил-С2-6алкинильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя);
(Fda12) пиридил-С1-6алкильную группу;
(Fda13) группу, представленную следующей общей формулой (Fdc):

где R31 представляет собой фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fda14) пиперидино-С1-6алкильную группу (которая может быть замещена в пиперидиновом кольце феноксигруппой, которая может содержать по крайней мере одну галогензамещенную или незамещенную алкильную группу в качестве заместителя в фенильном кольце);
(Fda15) амино-С1-6алкильную группу, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из С1-6алкильной группы и фенильной группы, которая может содержать в качестве заместителя галогензамещенную или незамещенную С1-6алкоксигруппу в фенильном кольце;
(Fda16) 1,2,3,6-тетрагидропиридил-С1-6алкильную группу, которая может быть замещена в 1,2,3,6-тетрагидропиридиновом кольце по крайней мере одной фенильной группой, которая может содержать в качестве заместителя по крайней мере одну галогензамещенную или незамещенную С1-6алкоксигруппу в фенильном кольце;
(Fda17) нафтил-С1-6алкильную группу;
(Fda18) флуоренил-С1-6алкильную группу;
(Fda19) пиридил-С1-6алкильную группу;
(Fda20) фурил-С1-6алкильную группу (которая может быть замещена в фурановом кольце галогензамещенной или незамещенной фенильной группой);
(Fda21) тиенил-С1-6алкильную группу;
(Fda22) оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце атомом галогена или галогензамещенной или незамещенной С1-6 фенильной группой);
(Fda23) оксадиазолил-С1-6алкильную группу (которая может быть замещена в оксадиазольном кольце галогензамещенной или незамещенной С1-6 фенильной группой);
(Fda24) пиразолил-С1-6алкильную группу (которая может быть замещена в пиразольном кольце галогензамещенной или незамещенной С1-6 фенильной группой);
(Fda25) бензотиенил-С1-6алкильную группу (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fda26) тиенил-С1-6алкильную группу, которая может быть замещена в тиофеновом кольце атомом галогена;
(Fda27) бензтиазолил-С1-6алкильную группу;
(Fda28) бензофурил-С1-6алкильную группу, которая может быть замещена в бензофурановом кольце атомом галогена;
(Fda29) индолинил-С1-6алкильную группу (которая может быть замещена в индолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и оксогруппы);
(Fda30) бензоксазолил-С1-6алкильную группу (которая может быть замещена в бензоксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, С1-6алкильной группы и оксогруппы);
(Fda31) хроменил-С1-6алкильную группу;
(Fda32) 1,2,3,4-тетрагидрохинолил-С1-6алкильную группу (которая может быть замещена в хинолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и оксогруппы);
(Fda33) тиазолил-С1-6алкильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы) или
(Fda34) тетразолил-С1-6алкильную группу (которая может быть замещена в тетразольном кольце группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы);
(Fd37) группу, представленную следующей общей формулой (Fe):

где Z представляет собой -С=О или -C=S и R32 и R33, одинаковые или различные, представляют собой любое из следующего:
(Fe1) атом водорода;
(Fe2) С1-6алкильную группу;
(Fe3) С3-8циклоалкильную группу;
(Fe4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fe5) фенил-С2-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fe6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); и
(Fe7) R32 и R33 могут быть связаны друг с другом вместе со смежными с ними атомами азота через другие атомы углерода с образованием пиперидинового кольца или 1,2,3,6-тетрагидропиридинового кольца, который может быть замещен в пиперидиновом или 1,2,3,6-тетрагидропиридиновом кольце фенильной группой, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы,
(Fd38) группу, представленную следующей общей формулой (Ff):

где R34 представляет собой атом водорода или С1-6 низшую алкильную группу и R35 представляет собой:
(Ff1) С3-8циклоалкильную группу;
(Ff2) С3-8циклоалкенильную группу;
(Ff3) группу, представленную следующей общей формулой (Ffa):

где каждый из R36, R37 и R38 представляет собой атом водорода; С1-6алкильную группу; фенильную группу (которая может быть замещена в фенильном кольце по крайней мере 1-5 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, С1-4алкилендиоксигруппы, С1-6алкилсульфонильной группы, галогензамещенной или незамещенной С1-6алкилтиогруппы, нитрогруппы и аминогруппы, которая может содержать С1-6алканоильную группу в качестве заместителя); бензофурильную группу (которая может быть замещена в бензофурановом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); бифенилильную группу; фурильную группу (которая может быть замещена в фурановом кольце фенильной группой, которая может содержать в качестве заместителя атом галогена) или тиазолильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной фенильной группой, которая может содержать атом галогена в качестве заместителя);
(Ff4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; С3-8циклоалкильной группы; гидроксильной группы; галогензамещенной или незамещенной С1-8алкоксигруппы; С3-8циклоалкоксигруппы; С1-4алкилендиоксигруппы; цианогруппы; нитрогруппы; фенил-С2-6алкенильной группы; С2-6алканоилоксигруппы; аминогруппы, которая может содержать С1-6алканоильную группу в качестве заместителя; С1-6алкилсульфониламиногруппы; фенил-С1-6алкоксигруппы; феноксигруппы; аминогруппы, которая может содержать по крайней мере одну С1-6алкильную группу в качестве заместителя; аминогруппы, которая может содержать по крайней мере одну фенильную группу в качестве заместителя; амино-С1-6алкоксигруппы, которая может содержать по крайней мере одну С1-6алкильную группу в качестве заместителя; С1-6алкоксикарбонильной группы; С1-6алкоксикарбонил-С1-6алкоксигруппы; С1-6алкилтиогруппы; пирролильной группы; имидазолильной группы; пиперидильной группы; морфолиногруппы; пирролидинильной группы; тиенильной группы; бензофурильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, фенил-С1-6алкильной группы и бензоильной группы, которая может содержать по крайней мере одну С1-6алкильную группу в качестве заместителя); хинолильной группы, которая может быть замещена в хинолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы и оксогруппы; пиперидилкарбонильной группы, которая может быть замещена в пиперидиновом кольце карбостирильной группой; и триазолильной группы);
(Ff5) нафтильную группу, которая может быть замещена в нафталиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя;
(Ff6) бифенилильную группу (которая может быть замещена в бифенилильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-9алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Ff7) флуоренильную группу; пиренильную группу;
(Ff8) бензофурильную группу (которая может быть замещена в бензофурановом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Ff9) бензотиенильную группу (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Ff10) пиридильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), фурильной группы и тиенильной группы);
(Ff11) фурильную группу (которая может быть замещена в фурановом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы, нитрогруппы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и нитрогруппы));
(Ff12) бензотиазольную группу (которая может содержать в бензотиазольном кольце по крайней мере одну фенильную группу, которая может содержать в качестве заместителя С1-6алкоксигруппу в фенильном кольце);
(Ff13) тиенильную группу (которая может содержать в тиофеновом кольце по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, нитрогруппы, С1-6алкильной группы, пиразолильной группы, которая может быть замещена в пиразольном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя, и тиенильной группы, которая может содержать атом галогена в тиофеновом кольце);
(Ff14) индолильную группу (которая может быть замещена в индольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенилсульфонильной группы, которая может содержать С1-6алкильную группу в качестве заместителя, фенил-С1-6алкильной группы, С1-6алкоксикарбонильной группы и фенильной группы);
(Ff15) пирролильную группу (которая может быть замещена в пиррольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенильной группы, которая может быть замещена по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой, и С1-6алкильной группы);
(Ff16) кумарильную группу;
(Ff17) бензимидазолильную группу (которая может быть замещена в бензимидазольном кольце по крайней мере одной тиенильной группой в качестве заместителя);
(Ff18) оксазолильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной фенильной группой, которая может содержать атом галогена в качестве заместителя);
(Ff19) тиазолильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной фенильной группой, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, нитрогруппы и фенильной группы);
(Ff20) хинолильную группу;
(Ff21) 3,4-дигидрокарбостирильную группу (которая может быть замещена в 3,4-дигидрокарбостирильном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы, С1-6алкильной группы и фенил-С1-6алкоксигруппы) или карбостирильную группу (которая может быть замещена в карбостирильном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы, С1-6алкильной группы и фенил-С1-6алкоксигруппы);
(Ff22) имидазо[2,1-b]тиазолильную группу;
(Ff23) имидазо[2,1-а]пиридильную группу;
(Ff24) хроманильную группу (которая может быть замещена в хромановом кольце по крайней мере одной С1-6алкильной группой) или
(Ff25) 2,3-дигидробензофуранильную группу, или
(Fd39) группу, представленную следующей общей формулой (Ffb):
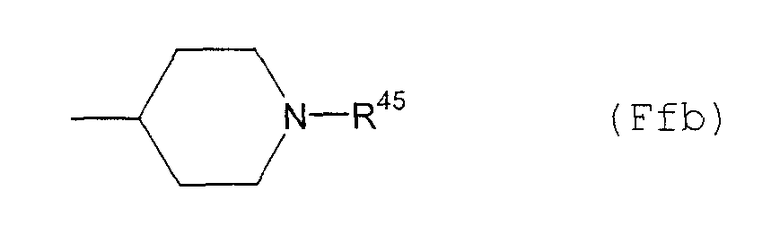
где R45 представляет собой: С1-6алкоксикарбонильную группу; фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); аминозамещенную С1-6алкильную группу, которая может содержать в аминогруппе группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы в качестве заместителя; бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или фенил-С2-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы),
(F12-3) морфолиногруппа;
(F12-4) имидазолильная группа;
(F12-5) 1,4-диоксаазаспиро[4,5]децильная группа (которая может быть замещена в 1,4-диоксаазаспиро[4,5]декановом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F12-6) гомопиперазинильная группа (которая может быть замещена в гомопиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы и фенилзамещенной или незамещенной фенильной группы, в качестве заместителя);
(F12-7) пиперазинильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой));
(F12-8) пиперидильная группа (которая может быть замещена в пиперидиновом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F12-9) пирролидинильная группа (которая может быть замещена в пирролидиновом кольце по крайней мере одной фенокси-С1-6алкильной группой, которая может содержать галогензамещенную или незамещенную С1-6алкоксигруппу в качестве заместителя);
(F12-10) изоиндолинильная группа, и
F13) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через гетероатомы с образованием циклического имида или амида, показанного в любом из пунктов (F13-1)-(13-11), представленных ниже:
(F13-1) сукцинимидная группа;
(F13-2) оксазолидинильная группа (которая может быть замещена в оксазолидиновом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F13-3) бензо-1,3-оксазолидинильная группа (которая может быть замещена в бензо-1,3-оксазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, атома галогена и фенильной группы в качестве заместителя);
(F13-4) имидазолидинильная группа (которая может быть замещена в имидазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и С1-6алкоксигруппы) и фенильной группы);
(F13-5) бензимидазолидинильная группа (которая может быть замещена в бензимидазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы; атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя; С1-6алкоксикарбонильной группы; и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, фенильной группы, которая может быть замещена 1-3 атомами галогена в фенильном кольце, С1-6алкоксикарбонильной группы и фенил-С1-6алкоксикарбонильной группы, в качестве заместителя));
(F13-6) фталимидная группа;
(F13-7) индолинильная группа (которая может содержать в индолиновом кольце по крайней мере одну группу, выбранную из группы, состоящей из С1-6алкильной группы, атома галогена и оксогруппы, в качестве заместителя);
(F13-8) 2,3-дигидробензотиазолильная группа (которая может содержать по крайней мере одну оксогруппу в 2,3-дигидробензотиазольном кольце);
(F13-9) 1Н-2,4-бензоксазинильная группа (которая может быть замещена в 1Н-2,4-бензоксазиновом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F13-10) группа, представленная следующей общей формулой (Fga):
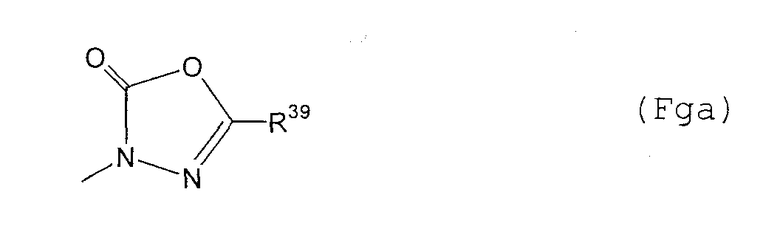
где R39 представляет собой атом водорода; фенил-С1-6алкильную группу, которая может содержать в качестве заместителя атом галогена в фенильном кольце; фенокси-С1-6алкильную группу, которая может содержать в качестве заместителя атом галогена в фенильном кольце; фенил-С2-6алкенильную группу, которая может содержать в качестве заместителя атом галогена в фенильном кольце; фенильную группу, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и фенильной группы, в качестве заместителя; пиридильную группу или пиразинильную группу, и
(F13-11) 1,3-тиазолидинильная группа (которая может быть замещена в 1,3-тиазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы и фенил-С1-6алкилиденовой группы, которая может содержать галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце в качестве заместителя),
группа, представленная следующей общей формулой (G):
где R40 представляет собой С1-6алкильную группу или галогензамещенную или незамещенную фенильную группу,
циклическая спирогруппа, представленная следующей общей формулой (Н):

где R41 представляет собой:
Н1) атом водорода;
Н2) С1-6алкильную группу;
Н3) фенил-С1-6алкильную группу, которая может содержать фенильную группу в качестве заместителя в фенильном кольце;
Н4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)); феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигрупп (которые могут быть замещены в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), в качестве заместителя);
Н5) пиперазинил-С1-6алкильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и фенильной группы);
Н6) пиперазинилкарбонил-С1-6алкильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы; фенил-С1-6алкоксикарбонильной группы, которая может содержать в качестве заместителя галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце; и фенил-С1-6алкильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и фенильной группы, в фенильном кольце);
Н7) фенилкарбамоил-С1-6алкильную группу, которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в качестве заместителя в фенильном кольце;
Н8) бензоксазолил-С1-6алкильную группу (которая может содержать по крайней мере одну оксогруппу в качестве заместителя в бензоксазольном кольце);
Н9) бензотиазолильную группу;
Н10) тетразолильную группу (которая может содержать одну фенильную группу в качестве заместителя в тетразольном кольце);
Н11) С1-6алкилсульфонильную группу;
Н12) фенилсульфонильную группу, которая может содержать по крайней мере одну С1-6алкильную группу в качестве заместителя в фенильном кольце;
Н13) фенилтиокарбамоильную группу, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена в качестве заместителя;
Н14) С1-8алкоксикарбонильную группу;
Н15) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, С1-6алкоксикарбонильной группы, аминогруппы, которая может содержать С1-6алкоксикарбонильную группу в качестве заместителя, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, нитрогруппы и С1-6алкилтиогруппы);
Н16) бензгидрилоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена);
Н17) С1-6алкоксикарбонильную группу, которая может содержать фенилзамещенную или незамещенную фенильную группу;
Н18) нафтил-С1-6алкоксикарбонильную группу;
Н19) пиридил-С1-6алкоксикарбонильную группу;
Н20) С1-6алкоксизамещенную С1-6алкоксикарбонильную группу;
Н21) пиперазинил-С1-6алкоксикарбонильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (которая может содержать по крайней мере один атом галогена в качестве заместителя в фенильном кольце), в качестве заместителя);
Н22) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и С1-6алкоксигруппы);
Н23) С1-6алканоильную группу;
Н24) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
Н25) фенил-С1-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
Н26) фенокси-С1-6алканоильную группу (в которой фенильное кольцо может быть замещено 1-3 атомами галогена);
Н27) пиперазинил-С2-6алканоильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алканоильной группы; фенил-С1-6алкильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из фенильной группы, атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, в фенильном кольце; фенил-С1-6алкоксикарбонильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, в фенильном кольце; фенилкарбамоил-С1-6алкильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, в фенильном кольце; фенилкарбамоильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, в фенильном кольце; и бензоксазолильной группы);
Н28) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, карбоксильной группы, С1-6алкоксикарбонильной группы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, пиперазинильной группы, которая может содержать С1-6алкильную группу в качестве заместителя в пиперазиновом кольце, и морфолиногруппы);
Н29) фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или
Н30) пиперазинилкарбонильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце, и фенил-С1-6алкильной группы, которая может содержать галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце),
при условии, что в указанной выше формуле (1), когда R1 представляет собой атом водорода и R2 представляет собой группу, представленную выше общей формулой (А), R3 не может быть изопропильной группой; когда R1 представляет собой атом водорода, R2 представляет собой группу, представленную выше общей формулой (Е), и m равно 0, R11 не может быть атомом водорода; и, кроме того, когда R1 представляет собой атом водорода и R2 представляет собой группу, представленную выше общей формулой (F), нельзя, чтобы R19 представлял собой атом водорода и R20 представлял собой трет-бутоксикарбонильную группу.
Далее, в соответствии с настоящим изобретением предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, представленное следующей общей формулой (1'), его оптически активная форма или фармацевтически приемлемая соль:
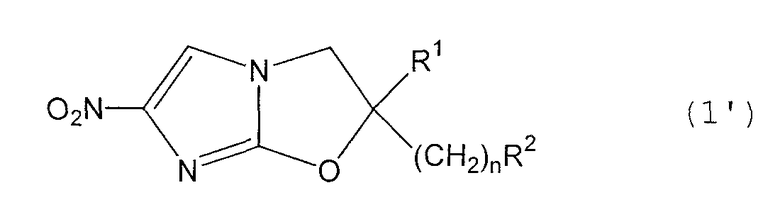
где R1 представляет собой атом водорода или С1-6алкильную группу, n представляет собой целое число от 0 до 6 и R2 представляет собой группу, представленную общей формулой (А'), (B'), (C'), (D'), (E'), (F') или (G'), показанной ниже, причем R1 и -(СН2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н'), показанной ниже.
Общие формулы (А')-(Н') описаны далее следующим образом:
группа, представленная следующей общей формулой (А'):

где R3 представляет собой:
А1) атом водорода;
А2) С1-6алкильную группу;
А3) С1-6алкокси-С1-6алкильную группу;
А4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из бензилоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
А5) бифенилил-С1-6алкильную группу;
А6) циннамильную группу;
А7) метансульфонильную группу;
А8) бензолсульфонильную группу, которая может быть замещена метильной группой;
А9) С1-6алканоильную группу;
А10) группу, представленную следующей общей формулой (Аа'):

где R4 представляет собой С1-6алкоксикарбонильную группу, фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из бензилоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из бензилоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
А11) бифенилил-С1-6алкоксикарбонильную группу;
А12) 2-(2-оксо-3-бензоксазолил)этильную группу;
А13) 2-бензоксазолильную группу или
А14) 2-фенил-5-метил-4-оксазолилметильную группу;
группа, представленная следующей общей формулой (В'):

где R5 представляет собой 5-(1H)-тетразолильную группу (положение 1 в которой может быть замещено С1-6алкильной группой или галогензамещенной или незамещенной фенильной группой) или 2-бензоксазолильную группу,
группа, представленная следующей общей формулой (С'):

где R6 представляет собой С1-6алкильную группу,
карбамоилоксигруппа, представленная следующей общей формулой (D'):

где R7 и R8, одинаковые или различные, каждый представляет собой любое из следующего:
D1) атом водорода;
D2) С1-8алкильную группу;
D3) галогензамещенную С1-6алкильную группу;
D4) С1-6алкоксикарбонил-С1-6алкильную группу;
D5) С5-8циклоалкильную группу;
D6) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
D7) фенильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, С1-6алканоильной группы, карбоксильной группы, С1-6алкоксикарбонильной группы, бензилоксикарбонильной группы, карбамоильной группы, С1-6алкилкарбамоильной группы, аминосульфонильной группы и морфолиногруппы);
D8) 1-нафтильную группу;
D9) 4-пиридильную группу; и
D10) R7 и R8 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием насыщенной гетероциклической группы, показанной в любом из пунктов (D10-1)-(D10-3), представленных ниже, или конденсированной с бензолом гетероциклической группы, показанной в любом из пунктов (D10-4)-(D10-7), представленных ниже:
(D10-1) пиперазинильная группа, представленная следующей общей формулой (Da'):
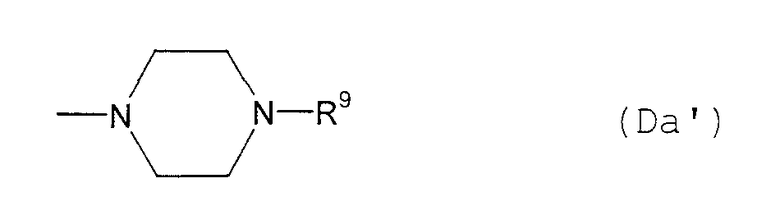
где R9 представляет собой:
(Da1) атом водорода;
(Da2) С1-6алкильную группу;
(Da3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Da4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Da5) С1-6алкоксикарбонильную группу;
(Da6) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Da7) 4-трифторметилциннамилоксикарбонильную группу или
(Da8) 4-трифторметилбензилиденаминогруппу,
(D10-2) группа, представленная следующей общей формулой (Db'):

где пунктирная указывает на то, что связь может быть двойной связью, и R10 представляет собой:
(Db1) атом водорода;
(Db2) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Db3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой); или
(Db4) фениламиногруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой), и
(D10-3) морфолиногруппа;
(D10-4) галогензамещенная или незамещенная 1-индолинильная группа;
(D10-5) галогензамещенная или незамещенная 2-изоиндолинильная группа;
(D10-6) галогензамещенная или незамещенная 1,2,3,4-тетрагидро-1-хинолильная группа и
(D10-7) галогензамещенная или незамещенная 1,2,3,4-тетрагидро-2-изохинолильная группа,
феноксигруппа, представленная следующей общей формулой (Е'):
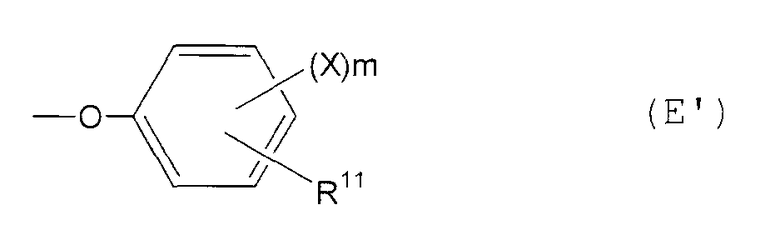
где Х представляет собой атом галогена, m представляет собой целое число от 0 до 3 и R11 представляет собой:
Е1) атом водорода;
Е2) галогензамещенную или незамещенную С1-6алкильную группу;
Е3) галогензамещенную или незамещенную С1-6алкоксигруппу;
Е4) морфолиногруппу;
Е5) тиоморфолиногруппу;
Е6) S-оксид тиоморфолиногруппу;
Е7) 1-имидазолильную группу;
Е8) 1-триазолильную группу;
Е9) пиперидинильную группу, представленную следующей общей формулой (Еа'):

где R12 представляет собой:
(Еа1) атом водорода;
(Еа2) С1-6алкоксикарбонильную группу или
(Еа3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы),
Е10) группу, представленную следующей общей формулой (Eb'):
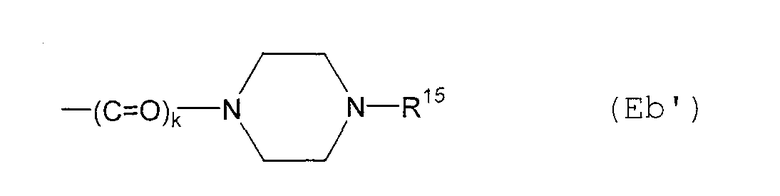
где k представляет собой целое число 0 или 1 и R15 представляет собой:
(Eb1) атом водорода;
(Eb2) С1-6алкильную группу;
(Eb3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb5) С1-6алканоильную группу;
(Eb6) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb8) С1-8алкоксикарбонильную группу (которая может быть замещена в алкоксигруппе по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, ди(С1-6алкил)аминогруппы и С1-6алкоксигруппы);
(Eb9) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb10) фенил-С3-6алкенилоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb11) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb12) фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb13) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); или
(Eb14) 2-бензофуранилметилоксикарбонильную группу, которая может быть замещена атомом галогена в бензольном кольце;
Е11) группу, представленную следующей общей формулой (Ес'):

где пунктирная указывает на то, что связь может быть двойной связью, и R16 представляет собой:
(Ес1) атом водорода;
(Ес2) С1-6алкильную группу;
(Ес3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Ес4) С1-8алкоксикарбонильную группу; или
(Ес5) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы),
группа, представленная следующей общей формулой (F'):

где R19 и R20, одинаковые или различные, каждый представляет собой любое из следующего:
F1) атом водорода;
F2) С1-6алкильную группу;
F3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и диметиламиногруппы);
F4) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F5) N-метиламино-С1-6алкильную группу (где положение N может быть замещено С1-6алкоксикарбонильной группой или фенильной группой, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы);
F6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и С1-6алкоксикарбонильной группы);
F7) С1-6алкоксикарбонильную группу;
F8) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F9) группу, представленную следующей общей формулой (Fa'):

где R21 представляет собой С1-6алкоксикарбонильную группу; фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы) или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F10) 1-замещенная-4-пиперидильную группу, представленную следующей общей формулой (Fb'):

где R22 представляет собой С1-6алкоксикарбонильную группу; фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F11) 2-[4-(4-трифторметилфенокси)-1-пиперидинил]этильную группу;
F12) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием гетероциклического кольца, показанного в любом из пунктов (F12-1)-(F12-10), представленных ниже:
(F12-1) пиперазинильная группа, представленная следующей общей формулой (Fc'):

где пунктирная указывает на то, что связь может быть двойной связью, и R23 представляет собой:
(Fc1) С1-6алкильную группу;
(Fc2) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc3) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc4) фенил-С1-6алкоксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc5) 4-бифенилил-С1-6алкоксигруппу;
(Fc6) фенил-С3-6алкенилоксигруппу, которая может быть замещена в фенильном кольце атомом галогена;
(Fc7) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc8) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc9) С1-6алкоксикарбонильную группу;
(Fc10) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc11) фенил-С1-6алкилкарбамоильную группу, в которой фенильное кольцо может быть замещено атомом галогена;
(Fc12) фенилкарбамоильную группу, в которой фенильное кольцо может быть замещено атомом галогена;
(Fc13) фенилтиогруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc14) фенилсульфоксидную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc15) пиридилметоксигруппу или
(Fc16) группу, представленную следующей общей формулой (Fca'):

где каждый из R24 и R25 представляет собой:
(Fca1) атом водорода;
(Fca2) С1-6алкильную группу;
(Fca3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca5) С1-6алканоильную группу;
(Fca6) фенилацетильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fca7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca8) С1-6алкоксикарбонильную группу;
(Fca9) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca10) фенилкарбамоильную группу (которая может быть замещена по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в фенильном кольце);
(Fca11) 1-(4-трифторметилфенил)-4-пиперидинилоксикарбонильную группу; или
(Fca12) R24 и R25 могут образовывать пиперидиновое кольцо через смежный с ними атом азота,
(F12-2) 4-замещенная-1-пиперазинильная группа, представленная следующей общей формулой (Fd'):
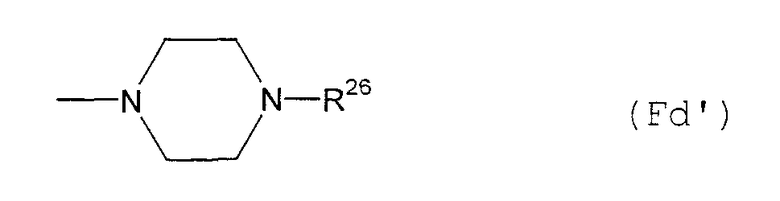
где R26 представляет собой:
(Fd1) атом водорода;
(Fd2) С1-6алкильную группу;
(Fd3) С5-8циклоалкильную группу;
(Fd4) С5-8циклоалкил-С1-6алкильную группу;
(Fd5) С1-6алкоксикарбонил-С1-6алкильную группу;
(Fd6) циннамильную группу;
(Fd7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена; цианогруппы; галогензамещенной или незамещенной С1-6алкильной группы; циклогексильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; диметиламиногруппы; С1-6алкоксикарбонильной группы; феноксигруппы; фенил-С1-6алкильной группы; стирильной группы; 3-пиридильной группы; 1-имидазолильной группы и 1-пиперидиногруппы);
(Fd8) бифенилилметильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и диметиламиногруппы);
(Fd9) 1- или 2-нафтилметильную группу;
(Fd10) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; цианогруппы; диметиламиногруппы; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; С1-6алкоксикарбонильной группы и карбоксильной группы);
(Fd11) бифенилильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенных или незамещенных С1-6алкильных групп);
(Fd12) аминогруппу, замещенную С1-6алкоксикарбонильной группой, бензиламиногруппой, трифторметилбензиламиногруппой или фениламиногруппой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и атома галогена);
(Fd13) 4-хлорбензоилметильную группу;
(Fd14) фенилкарбамоилметильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
(Fd15) 4- или 5-тиазолилметильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы);
(Fd16) 4-оксазолилметильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы);
(Fd17) 2-индолилметильную группу;
(Fd18) 2-фурилметильную группу (которая может быть замещена в фурановом кольце по крайней мере одной галогензамещенной или незамещенной фенильной группой);
(Fd19) 4- или 5-имидазолилметильную группу (которая может быть замещена в имидазольном кольце фенильной группой);
(Fd20) 2-хинолилметильную группу;
(Fd21) 5-(1Н)-тетразолильную группу (где положение 1 в тетразольном кольце может быть замещено фенильной группой);
(Fd22) 2- или 4-пиримидильную группу, которая может быть замещена фенильной группой;
(Fd23) 2-, 3- или 4-пиридильную группу;
(Fd24) 2-бензоксазолильную группу;
(Fd25) 2-бензотиазолильную группу;
(Fd26) 2-оксо-3-бензоксазолил-С1-6алкильную группу;
(Fd27) фенокси-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd28) фенилтио-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd29) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fd30) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и С1-6алкиламиногруппы);
(Fd31) 4-бифенилилкарбонильную группу;
(Fd32) 2-, 3- или 4-пиридилкарбонильную группу;
(Fd33) циннамоильную группу, в которой фенильное кольцо может быть замещено атомом галогена;
(Fd34) фенил-С1-6алкилсульфонильную группу, которая может быть замещена атомом галогена в фенильном кольце;
(Fd35) бензолсульфонильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома хлора и метильной группы);
(Fd36) группу, представленную следующей общей формулой (Fda'):

где R27 представляет собой:
(Fda1) галогензамещенную или незамещенную С1-8алкильную группу;
(Fda2) С5-8циклоалкильную группу;
(Fda3) С5-8циклоалкил-С1-6алкильную группу;
(Fda4) С1-6алкокси-С1-6алкильную группу;
(Fda5) С1-6алкиламино-С1-6алкильную группу;
(Fda6) группу, представленную следующей общей формулой (Fdb'):

где R28, R29 или R30 соответственно представляют собой атом водорода, С1-6алкильную группу или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fda7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5 группами, выбранными из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; галогензамещенной или незамещенной С1-6алкилтиогруппы; фенил-С1-6алкоксигруппы; гидроксигруппы; метилсульфинильной группы; метансульфонильной группы; метансульфонилоксигруппы; цианогруппы; ацетильной группы; бензоильной группы; α,α-диметоксибензильной группы; аминогруппы; нитрогруппы; карбамоильной группы; ацетиламиногруппы; С1-6алкоксикарбонильной группы; С1-6алкиламинокарбонильной группы; С1-6алкоксикарбониламиногруппы; три-С1-6алкилсилоксигруппы; пирролильной группы; тетрагидропиранилоксигруппы и 1-имидазолильной группы);
(Fda8) бифенилил-С1-6алкильную группу;
(Fda9) бензгидрильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, трифторметильной группы и трифторметоксигруппы);
(Fda10) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fda11) 3-(4-трифторметил)фенил-2-пропинильную группу;
(Fda12) 2-, 3- или 4-пиридилметильную группу;
(Fda13) группу, представленную следующей общей формулой (Fdc'):
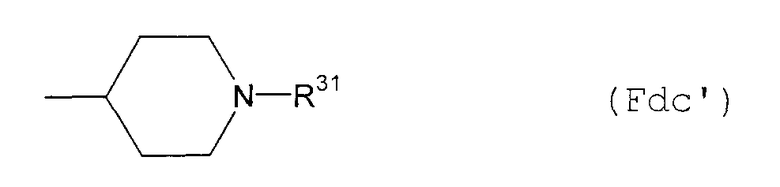
где R31 представляет собой фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fda14) 1-пиперидиноэтильную группу (где положение 4 в пиперидиновом кольце может быть замещено 4-трифторметилфеноксигруппой);
(Fda15) N-метил-N-(4-трифторметокси)фениламиноэтильную группу;
(Fda16) 4-(4-трифторметоксифенил)-1,2,3,6-тетрагидро-1-пиридинилэтильную группу;
(Fda17) 1- или 2-нафтилметильную группу;
(Fda18) 1-, 2-, 3-, 4- или 9-флуоренилметильную группу;
(Fda19) 2-, 3- или 4-пиридилметильную группу;
(Fda20) 2-фурилметильную группу (где положение 4 в фурановом кольце может быть замещено галогензамещенной или незамещенной фенильной группой);
(Fda21) 3-тиенилметильную группу;
(Fda22) 4-оксазолилметильную группу (где положение 2 в оксазолиновом кольце может быть замещено атомом галогена или хлорфенильной группой);
(Fda23) 4-тиазолилметильную группу, которая может быть замещена атомом галогена;
(Fda24) 5-оксадиазолилметильную группу, где положение 2 в оксадиазолиновом кольце может быть замещено галогензамещенной или незамещенной фенильной группой;
(Fda25) 3-пиразолилметильную группу, где положение 1 в пиразолиновом кольце может быть замещено галогензамещенной или незамещенной С1-6 фенильной группой;
(Fda26) 2- или 3-бензотиофенилметильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fda27) бензоксазол-2-илметильную группу, которая может быть замещена атомом галогена в бензольном кольце;
(Fda28) 2-тиенилметильную группу, которая может быть замещена атомом галогена;
(Fda29) 2-бензтиазолилметильную группу;
(Fda30) 2-(5-хлор)бензофуранилметильную группу;
(Fda31) 3,3-диметил-2-оксо-5-индолинилметильную группу (где положение 1 в индолиновом кольце может быть замещено С1-6алкильной группой);
(Fda32) 2-оксо-6-бензоксазолилметильную группу (где положение 1 в бензоксазолиновом кольце может быть замещено С1-6алкильной группой);
(Fda33) 7-хлорфенилметильную группу;
(Fda34) 2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу (где положение 1 в хинолиновом кольце может быть замещено С1-6алкильной группой);
(Fda35) 5-тиазолилметильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы) или
(Fda36) 5-(1Н)-тетразолил-С1-6алкильную группу (где положение 1 в тетразольном кольце может быть замещено группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы),
(Fd37) группу, представленную следующей общей формулой (Fe'):

где Z представляет собой -С=О или -C=S и R32 и R33, одинаковые или различные, представляют собой любое из следующего:
(Fe1) атом водорода;
(Fe2) С1-6алкильную группу;
(Fe3) С5-8циклоалкильную группу;
(Fe4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fe5) фенил-С2-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fe6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); и
(Fe7) R32 и R33 могут быть связаны друг с другом вместе со смежными с ними атомами азота через другие атомы углерода с образованием пиперидинового кольца или 1,2,3,6-тетрагидропиридинового кольца, где положение 4 в пиперидиновом кольце или 1,2,3,6-тетрагидропиридиновом кольце может быть замещено фенильной группой, причем фенильная группа может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы, или
(Fd38) группу, представленную следующей общей формулой (Ff'):

где R34 представляет собой атом водорода или С1-6 низшую алкильную группу и R35 представляет собой:
(Ff1) С5-8циклоалкильную группу;
(Ff2) С5-8циклоалкенильную группу;
(Ff3) группу, представленную следующей общей формулой (Ffa'):

где каждый из R36, R37 и R38 представляет собой атом водорода; С1-6алкильную группу; фенильную группу (которая может быть замещена в фенильном кольце по крайней мере 1-5 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, метилендиоксигруппы, метансульфонильной группы, галогензамещенной или незамещенной С1-6алкилтиогруппы, нитрогруппы и ацетиламиногруппы); 2-бензофуранильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); 4-бифенилильную группу; 2-фурильную группу, которая может быть замещена 4-хлорфенильной группой; или 2-(4-хлорфенил)-4-тиазолильную группу;
(Ff4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; С5-8циклоалкильной группы; гидроксигруппы; галогензамещенной или незамещенной С1-8алкоксигруппы; С5-8циклоалкоксигруппы; метилендиоксигруппы; этилендиоксигруппы; цианогруппы; нитрогруппы; циннамильной группы; С1-6алканоилоксигруппы; С1-6алкиламиногруппы; метансульфониламиногруппы; фенил-С1-6алкоксигруппы; феноксигруппы; ди(С1-6алкил)аминогруппы; дифениламиногруппы; ди(С1-6алкил)амино-С1-6алкоксигруппы; метоксикарбонильной группы; С1-6алкоксикарбонил-С1-6алкоксигруппы; С1-6алкилтиогруппы; пирролильной группы; 1-имидазолильной группы; пиперидиногруппы; морфолиногруппы; пирролидинильной группы; 2-тиенильной группы; 2-бензофурильной группы; 4-пиперазинильной группы, где положение 1 может быть замещено группой, выбранной из группы, состоящей из С1-6алкильной группы, фенил-С1-6алкильной группы, бензоильной группы и бензоильной группы, замещенной С1-6алкильной группой; 2-оксо-3-хинолильной группы, которая может быть замещена в бензольном кольце С1-6алкоксигруппой; 4-(карбостирил-1-ил)пиперидинил-1-карбонильной группы; и триазолильной группы);
(Ff5) 1- или 2-нафтильную группу, замещенную атомом галогена, галогензамещенной или незамещенной С1-6алкоксигруппой или диметиламиногруппой;
(Ff6) 3- или 4-бифенилильную группу (которая может быть замещена в бифенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-9алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Ff7) 2-флуоренильную группу; 3-пиренильную группу;
(Ff8) 2-бензофуранильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Ff9) 2- или 3-бензотиофенильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; или положение 3 или 2 в тиофеновом кольце может быть замещено С1-6алкильной группой);
(Ff10) 2-, 3- или 4-пиридильную группу (которая может быть замещена в пиридильной группе по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), 2-фурильной группы, 3-фурильной группы, 2-тиенильной группы и 3-тиенильной группы);
(Ff11) 2- или 3-фурильную группу (которая может быть замещена в фурановом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы, нитрогруппы и фенильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и нитрогруппы));
(Ff12) 2-(2-метоксифенил)бензотиазол-5-ильную группу;
(Ff13) 2-тиенильную группу; 3-тиенильную группу;
4-бром-2-тиенильную группу; 5-хлор-2-тиенильную группу;
5-этил-2-тиенильную группу; 3-метил-2-тиенильную группу;
5-нитро-2-тиенильную группу;
5-(1-метил-3-трифторметил-5-пиразолил)-2-тиенильную группу;
5-(1-метил-5-трифторметил-3-пиразолил)-2-тиенильную группу;
2,2'-битиен-5-ильную группу;
5'-бром-2,2'-битиен-5-ильную группу;
(Ff14) 1-(4-метилбензолсульфонил)индол-3-ильную группу; 1-бензилиндол-3-ильную группу; 6-метоксикарбонилиндол-3-ильную группу; 2-фенилиндол-3-ильную группу;
(Ff15) 1-(3-трифторметил)фенил-2,5-диметил-3-пирролильную группу;
(Ff16) 6-кумарильную группу;
(Ff17) 2-(2-тиенил)-5-бензимидазолильную группу; 6-бензимидазолильную группу;
(Ff18) 2-(4-хлорфенил)-4-оксазолильную группу;
(Ff19) 2-фенил-4-тиазолильную группу;
2-(4-хлорфенил)-4-тиазолильную группу;
2-(4-нитрофенил)-4-тиазолильную группу;
2-(4-бифенилил)-4-тиазолильную группу;
(Ff20) 2-тиазолильную группу;
(Ff21) 2- или 4-хинолинильную группу;
(Ff22) 8-метокси-3,4-дигидрокарбостирил-5-ильную группу;
8-метокси-1-метил-3,4-дигидрокарбостирил-5-ильную группу;
8-бензилокси-3,4-дигидрокарбостирил-5-ильную группу;
8-метоксикарбостирил-5-ильную группу;
8-метокси-1-метилкарбостирил-5-ильную группу;
8-бензилоксикарбостирил-5-ильную группу;
8-метокси-3,4-дигидрокарбостирил-6-ильную группу;
8-метокси-1-метил-3,4-дигидрокарбостирил-6-ильную группу;
8-бензилокси-3,4-дигидрокарбостирил-6-ильную группу;
8-метоксикарбостирил-6-ильную группу;
8-метокси-1-метилкарбостирил-6-ильную группу;
8-бензилоксикарбостирил-6-ильную группу;
(Ff23) 6-имидазо[2,1-b]тиазолильную группу;
(Ff24) 2-имидазо[2,1-а]пиридильную группу;
(Ff25) 2,2-диметил-6-хроманильную группу или
(Ff26) 2,3-дигидро-5-бензофуранильную группу,
(F12-3) морфолиногруппа;
(F12-4) 1-имидазолильная группа;
(F12-5) 1,4-диокса-8-азаспиро[4,5]-8-децильная группа;
(F12-6) 4-трет-бутоксикарбонил-1-гомопиперазинильная группа; 4-бензилоксикарбонил-1-гомопиперазинильная группа;
4-(4бифенилил)-1-гомопиперазинильная группа;
(F12-7) 1-трет-бутил-2-пиперазинон-4-ильная группа;
1-(4-трифторметилбензил)-2-пиперазинон-4-ильная группа;
(F12-8) 4-оксо-1-пиперидинильная группа;
(F12-9) 2-(4-трифторметоксифеноксиметил)пирролидин-1-ильная группа и
(F12-10) 2-изоиндолинильная группа, и
F13) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через гетероатомы с образованием циклического имида или амида, показанного в любом из пунктов (F13-1)-(13-11), представленных ниже:
(F13-1) 2-сукцинимидная группа;
(F13-2) 2-оксооксазолин-3-ильная группа;
(F13-3) 2-оксобензо-1,3-оксазолидин-3-ильная группа; 5-бром-2-оксобензо-1,3-оксазолидин-3-ильная группа; 5-хлор-2-оксобензо-1,3-оксазолидин-3-ильная группа; 5-фенил-2-оксобензо-1,3-оксазолидин-3-ильная группа;
(F13-4) 2-оксоимидазолидин-1-ильная группа (где положение 3 в 2-оксоимидазолидин-1-ильной группе может быть замещено фенил-С1-6алкильной группой (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и метоксигруппы) или фенильной группой);
(F13-5) 2-оксобензимидазолидин-1-ильная группа (которая может быть замещена в бензольном кольце атомом галогена, галогензамещенной или незамещенной С1-6алкильной группой, диметиламиногруппой или этоксикарбонильной группой; или положение 3 в имидазолидиновом кольце может быть замещено 4-пиперидильной группой, которая может быть замещена группой, выбранной из группы, состоящей из С1-6алкильной группы, фенильной группы, которая может быть замещена 1-3 атомами галогена в фенильном кольце, трет-бутоксикарбонильной группы и бензилоксикарбонильной группы);
(F13-6) фталимид-2-ильная группа;
(F13-7) оксоиндол-1-ильная группа (где положение 3 может быть замещено 2 метильными группами или атомами фтора);
(F13-8) бензосульфимид-2-ильная группа;
(F13-9) 1Н-2,4-бензоксазин-3(4Н)-он-4-ильная группа;
(F13-10) группа, представленная следующей общей формулой (Fga'):
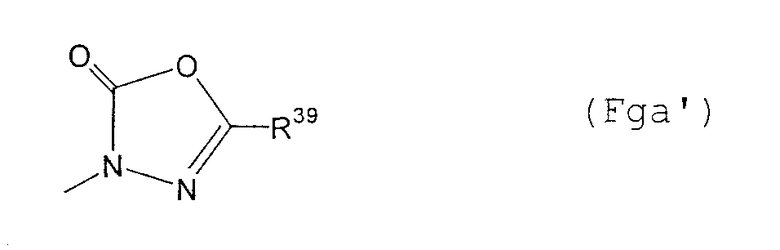
где R39 представляет собой атом водорода; галогензамещенную или незамещенную фенил-С1-6алкильную группу, галогензамещенную или незамещенную феноксиметильную группу; галогензамещенную или незамещенную стирильную группу; фенильную группу, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; бифенилильную группу; 4-пиридильную группу или 2-пиразинильную группу, и
(F13-11) 5-(4-трифторметилбензилиден)-1,3-тиазолидин-2,4-дион-3-ильная группа;
группа, представленная следующей общей формулой (G'):

где R40 представляет собой С1-6алкильную группу или галогензамещенную или незамещенную фенильную группу,
циклическая спирогруппа, представленная следующей общей формулой (Н'):

где R41 представляет собой:
Н1) атом водорода;
Н2) С1-6алкильную группу;
Н3) фенил-С1-6алкильную группу или 4-бифенилил-С1-6алкильную группу;
Н4) фенильную группу (которая может быть замещена галогензамещенной или незамещенной С1-6алкильной группой;
Н5) 4-замещенную-1-пиперазинил-С1-6алкильную группу (где заместителем в положении 4 является С1-6алкоксикарбонильная группа, 4-бифенилилметоксикарбонильная группа или бензилоксикарбонильная группа, причем бензилоксикарбонильная группа может быть замещена в бензольном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
Н6) 4-замещенную-1-пиперазинилкарбонил-С1-6алкильную группу, где положение 4 замещено С1-6алкоксикарбонильной группой, 4-трифторметилбензилоксикарбонильной группой или бифенилилметильной группой;
Н7) 4-трифторметилфенилкарбамоил-С1-6алкильную группу;
Н8) 2-бензоксазолон-1-илпропильную группу;
Н9) 2-бензотиазолильную группу;
Н10) 1-фенил-5-тетразолильную группу;
Н11) метансульфонильную группу;
Н12) бензолсульфонильную или п-толуолсульфонильную группу;
Н13) фенилтиокарбамоильную группу, где положение 4 в фенильном кольце может быть замещено атомом галогена;
Н14) С1-8алкоксикарбонильную группу;
Н15) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, С1-6алкоксикарбонильной группы, С1-6алкоксикарбониламиногруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, нитрогруппы и метилтиогруппы);
Н16) бензгидрилоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-4 атомами галогена);
Н17) 4-бифенилилметоксикарбонильную группу;
Н18) нафтилметоксикарбонильную группу;
Н19) пиридилметоксикарбонильную группу;
Н20) метоксиэтоксикарбонильную группу;
Н21) 2-(1-пиперазинил)этоксикарбонильную группу, где положение 4 может быть замещено С1-6алкоксикарбонильной группой или галогензамещенной или незамещенной фенил-С1-6алкоксикарбонильной группой;
Н22) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и С1-6алкоксигруппы);
Н23) С1-6алканоильную группу;
Н24) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
Н25) фенил-С1-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
Н26) фенокси-С2-6алканоильную группу (которая может быть замещена 1-3 атомами галогена в фенильном кольце);
Н27) 4-замещенную-1-пиперазинил-С2-6алканоильную группу (где заместителем в положении 4 является С1-6алканоильная группа, фенил-С1-6алкильная группа, 4-бифенилилметильная группа, фенил-С1-6алкоксикарбонильная группа, фенилкарбамоилметильная группа, фенилкарбамоильная группа или 2-бензоксазолильная группа, причем фенильное кольцо каждой из указанных фенил-С1-6алкильной группы, фенил-С1-6алкоксикарбонильной группы, фенилкарбамоилметильной группы и фенилкарбамоильной группы может быть замещено 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
Н28) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, диметиламиногруппы, карбоксильной группы, С1-6алкоксикарбонильной группы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, 4-метил-1-пиперазинильной группы и морфолиногруппы);
Н29) бензилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или
Н30) 4-замещенную-1-пиперазинилкарбонильную группу, где положение 4 замещено трет-бутоксикарбонильной группой, 4-трифторметилбензилоксикарбонильной группой или 4-трифторметилбензильной группой,
при условии, что в приведенной выше формуле (1'), когда R1 представляет собой атом водорода и R2 представляет собой группу, представленную выше общей формулой (А'), R3 не может быть изопропильной группой; когда R1 представляет собой атом водорода, R2 представляет собой группу, представленную выше общей формулой (Е'), и m равно 0, R11 не может быть атомом водорода; и, кроме того, когда R1 представляет собой атом водорода и R2 представляет собой группу, представленную выше общей формулой (F'), нельзя, чтобы R19 представлял собой атом водорода и R20 представлял собой трет-бутоксикарбонильную группу.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (А).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (В).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (С).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (D).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (E).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (G).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R1 и -(СН2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где n равно 0 и R2 представляет собой группу, представленную любой из формул (А)-(G), или R1 и -(СН2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где n представляет собой целое число от 1 до 6 и R2 представляет собой группу, представленную любой из формул (А)-(G), или R1 и -(СН2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R1 представляет собой атом водорода и R2 представляет собой группу, представленную любой из формул (А)-(G), или R1 и -(СН2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R1 представляет собой С1-6алкильную группу и R2 представляет собой группу, представленную любой из формул (А)-(G), или R1 и -(СН2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой любое из (Е1)-(Е3).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой (Е4).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой любое из (Е5)-(Е9).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой (Е10).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой (Е11).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой (Е12).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой (Е13).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой любое из (Е14)-(Е17) и (Е19)-(Е22).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), и R11 представляет собой (Е18).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), и каждый из R19 и R20, одинаковых или разных, представляет собой любое из (F1)-(F11).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), и R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в любом из (F12-3)-(F12-10) и (F13), непосредственно или через другие гетероатомы или углеродные атомы.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), и R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-1), непосредственно или через другие гетероатомы или углеродные атомы.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), и R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), R11 представляет собой (Е10) и о равно 0.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), R11 представляет собой (Е10), о равно 1 и W представляет собой группу -СО-.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), R11 представляет собой (Е10), о равно 1 и W представляет собой С1-6алкиленовую группу.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), R11 представляет собой (Е10) и R14 представляет собой любое из (Еаа1)-(Еаа2) и (Еаа4)-(Еаа27).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), R11 представляет собой (Е10) и R14 представляет собой (Еаа3).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), R11 представляет собой (Е11) и о равно 0.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (Е), R11 представляет собой (Е11) и о равно 1.
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы и R26 представляет собой любое из (Fd1)-(Fd35), (Fd37) и (Fd39).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы и R26 представляет собой (Fd36).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы и R26 представляет собой (Fd38).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы, R26 представляет собой (Fd36) и R27 представляет собой любое из (Fda1)-(Fda5) и (Fda7)-(Fda34).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы, R26 представляет собой (Fd36) и R27 представляет собой (Fda6).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы, R26 представляет собой (Fd38) и R35 представляет собой любое из (Ff1)-(Ff3), (Ff5)-(Ff7) и (Ff9)-(Ff26).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы, R26 представляет собой (Fd38) и R35 представляет собой (Ff4).
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активная форма или фармацевтически приемлемая соль в соответствии с общей формулой (1), где R2 представляет собой группу, представленную общей формулой (F), R19 и R20 вместе со смежными с ними атомами азота образуют гетероциклическое кольцо, показанное в (F12-2), непосредственно или через другие гетероатомы или углеродные атомы, R26 представляет собой (Fd38) и R35 представляет собой (Ff8).
Из соединений по настоящему изобретению, представленных общей формулой (1) или (1'), особенно предпочтительными являются следующие:
3-(4-трифторметилфенил)-2-пропенил-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат,
3-(4-трифторметилфенил)-2-пропенил-(S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат,
3-(4-трифторметилфенил)-2-пропенил-(R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат,
2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
4-толуолсульфонат (R)-2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола,
2-метил-6-нитро-2-[4-(4-трифторметоксибензилиденамино)пиперазин-1-ил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметоксибензилиденамино)пиперазин-1-ил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4-трифторметоксибензилиденамино)пиперазин-1-ил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-[4-(5-хлорбензофуран-2-илметиленамино)пиперазин-1-ил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(5-хлорбензофуран-2-илметиленамино)пиперазин-1-ил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-[4-(5-хлорбензофуран-2-илметиленамино)пиперазин-1-ил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-ил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-ил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-ил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-[4-(4-трифторметоксифенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(4-трифторметоксифенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-[4-(4-трифторметоксифенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-хлорбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-хлорбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-хлорбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-хлорфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-хлорфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-хлорфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(3,4-дихлорбензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(3,4-дихлорбензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(3,4-дихлорбензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4-трифторметоксифенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметоксифенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4-трифторметоксифенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4-трифторметилфенил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметилфенил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4-трифторметилфенил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(5-трифторметоксилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(5-трифторметоксилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(5-трифторметоксилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-хлорфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-хлорфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-хлорфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметилфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[1-(4-хлорбензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[1-(4-хлорбензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол или
(R)-2-метил-6-нитро-2-{4-[1-(4-хлорбензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.
В настоящем изобретении предлагается фармацевтическая композиция, которая является противотуберкулезным средством, содержащая в качестве активного компонента производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, его оптически активную форму или фармацевтически приемлемую соль в соответствии с общей формулой (1) или (1').
В частности, в настоящем изобретении предлагается фармацевтическая композиция, которая является противотуберкулезным средством, содержащая в качестве активного компонента по крайней мере одно соединение, выбранное из производных 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, которые являются предпочтительными соединениями, перечисленными выше.
В настоящем изобретении предлагается способ получения соединения, представленного следующей общей формулой (1а):
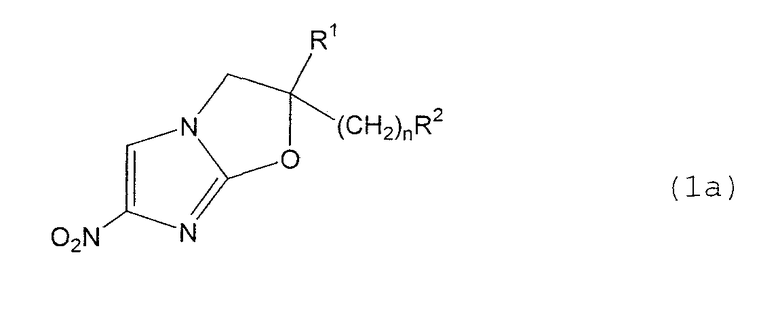
где R1, R2 и n являются такими, как определено в пункте 1,
указанный способ включает реакцию производного 4-нитроимидазола, представленного следующей общей формулой (2):

где Х1 представляет собой атом галогена или нитрогруппу,
с эпоксидным соединением, представленным следующей общей формулой (3а):

где R1, R2 и n являются такими, как определено в пункте 1,
с получением соединения, представленного следующей общей формулой (4а):
где R1, R2 и n являются такими, как определено в пункте 1, и Х1 представляет собой атом галогена или нитрогруппу,
и последующее замыкание кольца полученного соединения, представленного выше общей формулой (4а).
В настоящем изобретении предлагается способ получения соединения, представленного следующей общей формулой (1b):
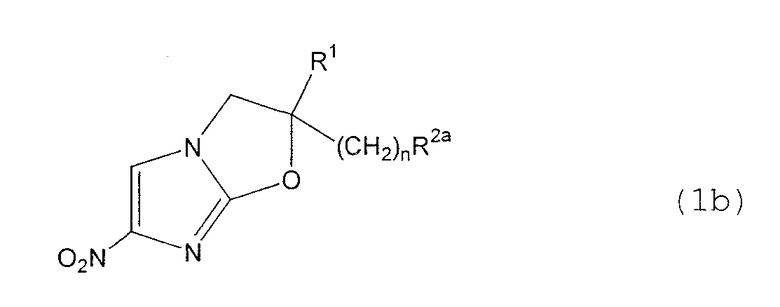
где R1 является таким, как определено в пункте 1, и R2а представляет собой группу, представленную общей формулой (А), (B), (E) или (F) по пункту 1,
указанный способ включает реакцию соединения, представленного следующей общей формулой (3b):

где R1 является таким, как определено в пункте 1, и Х1 представляет собой атом галогена или нитрогруппу,
с соединением (5), представленным следующей общей формулой R2аН (5), или его солью, где R2а означает группу, представленную общей формулой (А), (B), (E) или (F) по пункту 1, с получением соединения, представленного следующей общей формулой (4b):
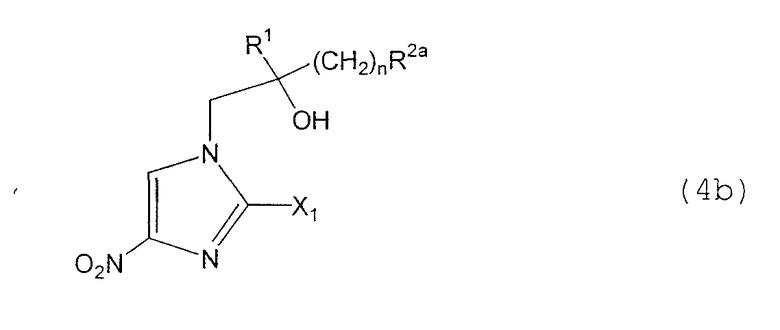
где R1 является таким, как определено в пункте 1, R2а представляет собой группу, представленную общей формулой (А), (B), (E) или (F) по пункту 1, и Х1 представляет собой атом галогена или нитрогруппу,
и последующее замыкание кольца полученного соединения, представленного выше общей формулой (4b).
В настоящем изобретении предлагается способ получения соединения, представленного следующей общей формулой (1c):
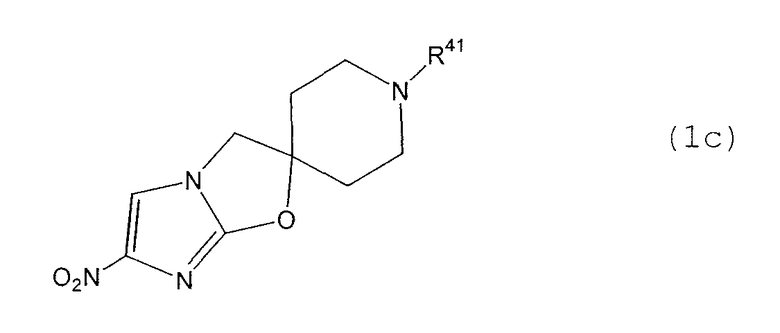
где R41 является таким, как определено в пункте 1,
указанный способ включает реакцию соединения, представленного следующей общей формулой (2):

где Х1 представляет собой атом галогена или нитрогруппу,
с соединением, представленным следующей общей формулой (3с):

где R41 является таким, как определено в пункте 1,
с получением соединения, представленного следующей общей формулой (4с):

где R41 является таким, как определено в пункте 1, и Х1 представляет собой атом галогена или нитрогруппу,
и последующее замыкание кольца полученного соединения, представленного выше общей формулой (4с).
Наилучший способ осуществления изобретения
В данном описании каждая группа, представленная R1, R2, R3 или тому подобное, конкретно означает следующее.
Примерами атомов галогена являются, например, атом фтора, атом хлора, атом брома и атом иода.
С1-6алкильная группа представляет собой линейную или разветвленную алкильную группу, содержащую 1-6 углеродных атомов, примеры которой включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, неопентильную группу, н-гексильную группу, изогексильную группу, 3-метилпентильную группу или тому подобное.
С1-6алкиленовая группа представляет собой линейную или разветвленную алкиленовую группу, содержащую 1-6 углеродных атомов, примеры которой включают метиленовую группу, этиленовую группу, триметиленовую группу, 2-метилтриметиленовую группу, 2,2-диметилтриметиленовую группу, 1-метилтриметиленовую группу, метилметиленовую группу, этилметиленовую группу, тетраметиленовую группу, пентаметиленовую группу, гексаметиленовую группу или тому подобное.
С1-6алкоксигруппа представляет собой группу, содержащую определенную выше С1-6алкильную группу и атом кислорода, примеры которой включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, втор-бутоксигруппу, н-пентоксигруппу, неопентоксигруппу, н-гексилоксигруппу, изогексилоксигруппу, 3-метилпентоксигруппу или тому подобное.
С1-6алкокси-С1-6алкильная группа представляет собой группу, содержащую описанные выше С1-6алкильную группу и С1-6алкоксигруппу, и примеры ее включают метоксиметильную группу,
2-метоксиэтильную группу, 3-метоксипропильную группу,
4-метоксибутильную группу, 5-метоксипентильную группу,
6-метоксигексильную группу, этоксиметильную группу,
2-этоксиэтильную группу, 3-этоксипропильную группу,
2-изопропоксиэтильную группу, трет-бутоксиметильную группу,
2-(трет-бутокси)этильную группу,
3-(трет-бутокси)пропильную группу,
6-(трет-бутокси)гексильную группу,
4-(трет-бутокси)бутильную группу или тому подобное.
Галогензамещенная или незамещенная С1-6алкильная группа представляет собой описанную выше линейную или разветвленную алкильную группу, содержащую 1-6 углеродных атомов и необязательно замещенную 1-7 атомами галогена, и примеры ее включают метильную группу, этильную группу, н-пропильную группу,
изопропильную группу, н-бутильную группу, изобутильную группу,
трет-бутильную группу, втор-бутильную группу,
н-пентильную группу, неопентильную группу, н-гексильную группу,
изогексильную группу, 3-метилпентильную группу,
фторметильную группу, дифторметильную группу,
трифторметильную группу, хлорметильную группу,
дихлорметильную группу, трихлорметильную группу,
бромметильную группу, дибромметильную группу,
дихлорфторметильную группу, 2,2,2-трифторэтильную группу,
пентафторэтильную группу, 2-хлорэтильную группу,
3,3,3-трифторпропильную группу, гептафторпропильную группу,
гептафторизопропильную группу, 3-хлорпропильную группу,
2-хлорпропильную группу, 3-бромпропильную группу,
4,4,4-трифторбутильную группу,
4,4,4,3,3-пентафторбутильную группу, 4-хлорбутильную группу,
4-бромбутильную группу, 2-хлорбутильную группу,
5,5,5-трифторпентильную группу, 5-хлорпентильную группу,
6,6,6-трифторгексильную группу, 6-хлоргексильную группу или тому подобное.
Галогензамещенная или незамещенная С1-6алкоксигруппа представляет собой определенную выше С1-6алкоксигруппу и алкоксигруппу, замещенную 1-7 атомами галогена, и примеры ее включают метоксигруппу, этоксигруппу, н-пропоксигруппу,
изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу,
трет-бутоксигруппу, втор-бутоксигруппу, н-пентоксигруппу,
неопентоксигруппу, н-гексилоксигруппу, изогексилоксигруппу,
3-метилпентоксигруппу, фторметоксигруппу, дифторметоксигруппу,
трифторметоксигруппу, хлорметоксигруппу, дихлорметоксигруппу,
трихлорметоксигруппу, бромметоксигруппу, дибромметоксигруппу,
дихлорфторметоксигруппу, 2,2,2-трифторэтоксигруппу,
пентафторэтоксигруппу, 2-хлорэтоксигруппу,
3,3,3-трифторпропоксигруппу, гептафторпропоксигруппу,
гептафторизопропоксигруппу, 3-хлорпропоксигруппу,
2-хлорпропоксигруппу, 3-бромпропоксигруппу,
4,4,4-трифторбутоксигруппу, 4,4,4,3,3-пентафторбутоксигруппу,
4-хлорбутоксигруппу, 4-бромбутоксигруппу, 2-хлорбутоксигруппу,
5,5,5-трифторпентоксигруппу, 5-хлорпентоксигруппу,
6,6,6-трифторгексилоксигруппу, 6-хлоргексилоксигруппу или тому подобное.
Примеры фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы, которая может содержать в фенильном кольце по крайней мере одну галогензамещенную или незамещенную С1-6алкоксигруппу в качестве заместителя) включают фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы, которая может содержать в фенильном кольце 1-3 галогензамещенные или незамещенные С1-6алкоксигруппы в качестве заместителя), например бензильную группу, 1-фенетильную группу,
2-фенетильную группу, 3-фенетилпропильную группу,
2-фенетилпропильную группу, 3-фенилпропильную группу,
2-фенилпропильную группу, 4-фенилбутильную группу,
5-фенилпентильную группу, 4-фенилпентильную группу,
6-фенилгексильную группу, 2-бензилоксибензильную группу,
3-бензилоксибензильную группу, 4-бензилоксибензильную группу,
2,4-дибензилоксибензильную группу,
2,4,6-трибензилоксибензильную группу,
2-(2-фенетилокси)бензильную группу,
3-(2-фенетилокси)бензильную группу,
4-(2-фенетилокси)бензильную группу,
2-(3-фенилпропокси)бензильную группу,
3-(3-фенилпропокси)бензильную группу,
4-(3-фенилпропокси)бензильную группу,
2-(4-фенилбутокси)бензильную группу,
3-(4-фенилбутокси)бензильную группу,
4-(4-фенилбутокси)бензильную группу,
2-(5-фенилпентилокси)бензильную группу,
3-(5-фенилпентилокси)бензильную группу,
4-(5-фенилпентилокси)бензильную группу,
2-(6-фенилгексилокси)бензильную группу,
3-(6-фенилгексилокси)бензильную группу,
4-(6-фенилгексилокси)бензильную группу,
2-метилбензильную группу, 2,3-диметилбензильную группу,
3,4-диметилбензильную группу, 3,5-диметилбензильную группу,
2,6-диметилбензильную группу, 2,4-диметилбензильную группу,
2,5-диметилбензильную группу, 2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
2,4,6-трифторметилбензильную группу,
2-трифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу,
3-метоксибензильную группу, 2,3-диметоксибензильную группу,
3,4-диметоксибензильную группу, 3,5-диметоксибензильную группу,
2,6-диметоксибензильную группу, 2,4-диметоксибензильную группу,
2,5-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
2,6-дитрифторметоксибензильную группу,
2,3,4-трифторметоксибензильную группу,
1-(4-бензилоксифенил)этильную группу,
1-(3-бензилоксифенил)этильную группу,
1-(2-бензилоксифенил)этильную группу,
1-(2-трифторметилфенил)этильную группу,
1-(3-трифторметилфенил)этильную группу,
1-(4-трифторметилфенил)этильную группу,
1-(2-трифторметоксифенил)этильную группу,
1-(3-трифторметоксифенил)этильную группу,
1-(4-трифторметоксифенил)этильную группу,
2-(4-бензилоксифенил)этильную группу,
2-(3-бензилоксифенил)этильную группу,
2-(2-бензилоксифенил)этильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-(2-трифторметоксифенил)этильную группу,
2-(3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
3-(4-бензилоксифенил)пропильную группу,
3-(3-бензилоксифенил)пропильную группу,
3-(2-бензилоксифенил)пропильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
4-(3-трифторметилфенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
2-феноксибензильную группу, 3-феноксибензильную группу,
4-феноксибензильную группу, 2,5-дифеноксибензильную группу,
2,4,6-трифеноксибензильную группу,
1-(4-феноксифенил)этильную группу,
1-(3-феноксифенил)этильную группу,
1-(2-феноксифенил)этильную группу,
3-(4-феноксифенил)пропильную группу,
3-(3-феноксифенил)пропильную группу,
3-(2-феноксифенил)пропильную группу,
2-(4-трифторметоксифенокси)-бензильную группу,
3-(4-трифторметоксифенокси)бензильную группу,
4-(4-трифторметоксифенокси)бензильную группу,
1-(4-(4-трифторметоксифенокси)фенил)этильную группу,
1-(3-(4-трифторметоксифенокси)фенил)этильную группу,
1-(2-(4-трифторметоксифенокси)фенил)этильную группу,
3-(4-(4-трифторметоксифенокси)фенил)пропильную группу,
3-(3-(4-трифторметоксифенокси)фенил)пропильную группу,
3-(2-(4-трифторметоксифенокси)фенил)пропильную группу,
2-трифторметил-3-трифторметоксибензильную группу,
2-бензиокси-3-трифторметоксибензильную группу,
3-фенокси-4-трифторметилбензильную группу или тому подобное.
Примеры бифенилил-С1-6алкильной группы включают фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы, которая может содержать в фенильном кольце по крайней мере одну галогензамещенную или незамещенную С1-6алкоксигруппу в качестве заместителя), например 2-бифенилилметильную группу, 2-(2-бифенилил)этильную группу,
3-(2-бифенилил)пропильную группу,
4-(2-бифенилил)бутильную группу,
5-(2-бифенилил)пентильную группу,
6-(2-бифенилил)гексильную группу, 3-бифенилилметильную группу,
2-(3-бифенилил)этильную группу,
3-(3-бифенилил)пропильную группу,
4-(3-бифенилил)бутильную группу,
5-(3-бифенилил)пентильную группу,
6-(3-бифенилил)гексильную группу, 4-бифенилилметильную группу,
2-(4-бифенилил)этильную группу,
3-(4-бифенилил)пропильную группу,
4-(4-бифенилил)бутильную группу,
5-(4-бифенилил)пентильную группу,
6-(4-бифенилил)гексильную группу или тому подобное.
Фенил-С2-6алкенильная группа означает группу, содержащую фенильную группу и алкенильную группу, имеющую 2-6 углеродных атомов и 1-3 двойные связи. Данные группы могут существовать в транс- или цис-форме, которые, разумеется, охватывает указанная группа, включающая, например, 3-фенил-2-пропенильную группу (тривиальное название: циннамильная группа),
4-фенил-2-бутенильную группу, 4-фенил-3-бутенильную группу,
5-фенил-4-пентенильную группу, 5-фенил-3-пентенильную группу,
6-фенил-5-гексенильную группу, 6-фенил-4-гексенильную группу,
6-фенил-3-гексенильную группу,
4-фенил-1,3-бутадиенильную группу,
6-фенил-1,3,5-гексатриенильную группу или тому подобное.
С1-6алкилсульфонильная группа представляет собой группу, содержащую алкильную группу, содержащую 1-6 углеродных атомов, и сульфонильную группу, примеры которой включают метансульфонильную группу, этансульфонильную группу, пропансульфонильную группу, бутансульфонильную группу, пентансульфонильную группу, гексансульфонильную группу или тому подобное.
Примеры бензолсульфонильной группы, которая может быть замещена С1-6алкильной группой, включают бензолсульфонильную группу, которая может быть замещена 1-3 С1-6алкильными группами, например бензолсульфонильную группу,
о-толуолсульфонильную группу, м-толуолсульфонильную группу,
п-толуолсульфонильную группу, 2-этилбензолсульфонильную группу,
3-этилбензолсульфонильную группу,
4-этилбензолсульфонильную группу,
2-пропилбензолсульфонильную группу,
3-пропилбензолсульфонильную группу,
4-пропилбензолсульфонильную группу,
2,3-диметилбензолсульфонильную группу,
2,4-диметилбензолсульфонильную группу,
2,4,6-триметилбензолсульфонильную группу или тому подобное.
С1-6алканоильная группа представляет собой группу, производную от алифатической карбоновой кислоты, содержащей 1-6 углеродных атомов, примеры которой включают формильную группу, ацетильную группу, пропионильную группу, бутирильную группу, пентаноильную группу, гексаноильную группу или тому подобное.
С1-6алкоксикарбонильная группа представляет собой группу, содержащую С1-6алкоксигруппу, определенную выше, и карбонильную группу, примеры которой включают метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, трет-бутоксикарбонильную группу, втор-бутоксикарбонильную группу, н-пентоксикарбонильную группу, неопентоксикарбонильную группу, н-гексилоксикарбонильную группу, изогексилкарбонильную группу, 3-метилпентоксикарбонильную группу или тому подобное.
Фенил-С1-6алкоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой группу, содержащую фенил-С1-6алкоксигруппу, которая может быть замещена в фенильном кольце, как определено выше, 1-3 группами, выбранными из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, и карбонильную группу, примеры которой включают бензилоксикарбонильную группу,
1-фенилэтоксикарбонильную группу,
2-фенилэтоксикарбонильную группу,
3-фенилпропоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентоксикарбонильную группу,
4-фенилпентоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-бензилоксибензилоксикарбонильную группу,
3-бензилоксибензилоксикарбонильную группу,
4-бензилоксибензилоксикарбонильную группу,
2,4-дибензилоксибензилоксикарбонильную группу,
3,4,5-бензилоксибензилоксикарбонильную группу,
2-трифторметилбензилоксикарбонильную группу,
2-метилбензилоксикарбонильную группу,
3-метилбензилоксикарбонильную группу,
4-метилбензилоксикарбонильную группу,
2,6-диметилбензилоксикарбонильную группу,
2,4,6-триметилбензилоксикарбонильную группу,
2,3-дитрифторметилбензилоксикарбонильную группу,
2,4,6-три(трифторметил)бензилоксикарбонильную группу,
2-метоксибензилоксикарбонильную группу,
3-метоксибензилоксикарбонильную группу,
4-метоксибензилоксикарбонильную группу,
2,4-диметоксибензилоксикарбонильную группу,
3,4,5-триметоксибензилоксикарбонильную группу,
2,5-дитрифторметоксибензилоксикарбонильную группу,
2,4,6-три(трифторметокси)бензилоксикарбонильную группу,
3-трифторметилбензилоксикарбонильную группу,
4-трифторметилбензилоксикарбонильную группу,
2-трифторметоксибензилоксикарбонильную группу,
3-трифторметоксибензилоксикарбонильную группу,
4-трифторметоксибензилоксикарбонильную группу,
2-(2-трифторметилфенил)этоксикарбонильную группу,
2-(3-трифторметилфенил)этоксикарбонильную группу,
2-(4-трифторметилфенил)этоксикарбонильную группу,
2-(2-трифторметоксифенил)этоксикарбонильную группу,
2-(3-трифторметоксифенил)этоксикарбонильную группу,
2-(4-трифторметоксифенил)этоксикарбонильную группу,
3-(4-бензилоксифенил)пропоксикарбонильную группу,
3-(3-бензилоксифенил)пропоксикарбонильную группу,
3-(2-бензилоксифенил)пропоксикарбонильную группу,
3-(2-трифторметилфенил)пропоксикарбонильную группу,
3-(3-трифторметилфенил)пропоксикарбонильную группу,
3-(4-трифторметилфенил)пропоксикарбонильную группу,
3-(2-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-трифторметоксифенил)пропоксикарбонильную группу,
4-(3-бензилоксифенил)бутоксикарбонильную группу,
4-(4-бензилоксифенил)бутоксикарбонильную группу,
4-(3-трифторметилфенил)бутоксикарбонильную группу,
4-(4-трифторметилфенил)бутоксикарбонильную группу,
5-(3-бензилоксифенил)пентоксикарбонильную группу,
5-(4-бензилоксифенил)пентоксикарбонильную группу,
5-(4-трифторметилфенил)пентоксикарбонильную группу,
4-(4-трифторметилфенил)пентоксикарбонильную группу,
4-(4-трифторметоксифенил)пентоксикарбонильную группу,
6-(3-бензилоксифенил)гексилоксикарбонильную группу,
6-(4-бензилоксифенил)гексилоксикарбонильную группу,
6-[3-(2-фенетилокси)фенил]гексилоксикарбонильную группу,
6-[4-(2-фенетилокси)фенил]гексилоксикарбонильную группу,
6-[3-(3-фенилпропокси)фенил]гексилоксикарбонильную группу,
6-[4-(4-фенилбутокси)фенил]гексилоксикарбонильную группу,
6-[4-(5-фенилпентилокси)фенил]гексилоксикарбонильную группу,
6-[4-(6-фенилгексилокси)фенил]гексилоксикарбонильную группу,
6-(3-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметоксифенил)гексилоксикарбонильную группу,
2-трифторметил-4-бензилоксибензилоксикарбонильную группу,
3-трифторметокси-5-бензилоксибензилоксикарбонильную группу,
2-трифторметил-3-трифтороксибензилоксикарбонильную группу или тому подобное.
Примеры фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включают фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например бензильную группу,
1-фенетильную группу, 2-фенетильную группу,
3-фенилпропильную группу, 2-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
4-фенилпентильную группу, 6-фенилгексильную группу,
2-бензилоксибензильную группу, 3-бензилоксибензильную группу,
4-бензилоксибензильную группу,
2,4-дибензилоксибензильную группу,
2,4,6-трибензилоксибензильную группу,
2-(2-фенетилокси)бензильную группу,
3-(2-фенетилокси)бензильную группу,
4-(2-фенетилокси)бензильную группу,
2-(3-фенилпропокси)бензильную группу,
3-(3-фенилпропокси)бензильную группу,
4-(3-фенилпропокси)бензильную группу,
2-(4-фенилбутокси)бензильную группу,
3-(4-фенилбутокси)бензильную группу,
4-(4-фенилбутокси)бензильную группу,
2-(5-фенилпентилокси)бензильную группу,
3-(5-фенилпентилокси)бензильную группу,
4-(5-фенилпентилокси)бензильную группу,
2-(6-фенилгексилокси)бензильную группу,
3-(6-фенилгексилокси)бензильную группу,
4-(6-фенилгексилокси)бензильную группу,
2-метилбензильную группу, 2,3-диметилбензильную группу,
3,4-диметилбензильную группу, 3,5-диметилбензильную группу,
2,6-диметилбензильную группу, 2,4-диметилбензильную группу,
2,5-диметилбензильную группу, 2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
2,4,6-трифторметилбензильную группу,
2-трифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу, 3-метоксибензильную группу,
2,3-диметоксибензильную группу, 3,4-диметоксибензильную группу,
3,5-диметоксибензильную группу, 2,6-диметоксибензильную группу,
2,4-диметоксибензильную группу, 2,5-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
2,6-дитрифторметоксибензильную группу,
2,3,4-трифторметоксибензильную группу,
1-(4-бензилоксифенил)этильную группу,
1-(3-бензилоксифенил)этильную группу,
1-(2-бензилоксифенил)этильную группу,
1-(2-трифторметилфенил)этильную группу,
1-(3-трифторметилфенил)этильную группу,
1-(4-трифторметилфенил)этильную группу,
1-(2-трифторметоксифенил)этильную группу,
1-(3-трифторметоксифенил)этильную группу,
1-(4-трифторметоксифенил)этильную группу,
2-(4-бензилоксифенил)этильную группу,
2-(3-бензилоксифенил)этильную группу,
2-(2-бензилоксифенил)этильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
3-(4-бензилоксифенил)пропильную группу,
3-(3-бензилоксифенил)пропильную группу,
3-(2-бензилоксифенил)пропильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
4-(3-трифторметилфенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
2-трифторметил-3-трифторметоксибензильную группу,
2-бензилокси-3-трифторметоксибензильную группу,
3-фенокси-4-трифторметоксибензильную группу или тому подобное.
Бифенилил-С1-6алкоксикарбонильная группа включает, например, 2-бифенилилметоксикарбонильную группу,
2-(2-бифенилил)этоксикарбонильную группу,
3-(2-бифенилил)пропоксикарбонильную группу,
4-(2-бифенилил)бутоксикарбонильную группу,
5-(2-бифенилил)пентоксикарбонильную группу,
6-(2-бифенилил)гексилоксикарбонильную группу,
3-бифенилилметоксикарбонильную группу,
2-(3-бифенилил)этоксикарбонильную группу,
3-(3-бифенилил)пропоксикарбонильную группу,
4-(3-бифенилил)бутоксикарбонильную группу,
5-(3-бифенилил)пентоксикарбонильную группу,
6-(3-бифенилил)гексилоксикарбонильную группу,
4-бифенилилметоксикарбонильную группу,
2-(4-бифенилил)этоксикарбонильную группу,
3-(4-бифенилил)пропоксикарбонильную группу,
4-(4-бифенилил)бутоксикарбонильную группу,
5-(4-бифенилил)пентоксикарбонильную группу,
6-(4-бифенилил)гексилоксикарбонильную группу или тому подобное.
Примеры бензоксазолил-С1-6алкильной группы (которая может быть замещена в бензоксазольном кольце по крайней мере одной оксогруппой в качестве заместителя) включают, например, бензоксазол-2-илметильную группу,
бензоксазол-4-илметильную группу,
бензоксазол-5-илметильную группу,
бензоксазол-6-илметильную группу,
бензоксазол-7-илметильную группу,
2-(бензоксазол-4-ил)этильную группу,
1-(бензоксазол-5-ил)этильную группу,
3-(бензоксазол-6-ил)пропильную группу,
4-(бензоксазол-7-ил)бутильную группу,
5-(бензоксазол-2-ил)пентильную группу,
6-(бензоксазол-4-ил)гексильную группу,
2-метил-3-(бензоксазол-5-ил)пропильную группу,
1,1-диметил-2-(бензоксазол-2-ил)этильную группу,
(2,3-дигидро-2-оксобензоксазол-3-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-4-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-5-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-6-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-7-ил)метильную группу,
2-(бензоксазол-7-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-3-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-4-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-5-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-6-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-7-ил)этильную группу,
3-(бензоксазол-2-ил)пропильную группу,
3-(бензоксазол-4-ил)пропильную группу,
3-(бензоксазол-5-ил)пропильную группу,
3-(бензоксазол-7-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-3-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-4-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-5-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-6-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-7-ил)пропильную группу,
4-(бензоксазол-2-ил)бутильную группу,
4-(бензоксазол-4-ил)бутильную группу,
4-(бензоксазол-5-ил)бутильную группу,
4-(бензоксазол-6-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-3-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-4-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-5-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-6-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-7-ил)бутильную группу,
5-(бензоксазол-4-ил)пентильную группу,
5-(бензоксазол-5-ил)пентильную группу,
5-(бензоксазол-6-ил)пентильную группу,
5-(бензоксазол-7-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-3-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-4-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-5-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-6-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-7-ил)пентильную группу,
6-(бензоксазол-2-ил)гексильную группу,
6-(бензоксазол-5-ил)гексильную группу,
6-(бензоксазол-6-ил)гексильную группу,
6-(бензоксазол-7-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-3-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-4-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-5-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-6-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-7-ил)гексильную группу или тому подобное.
Бензоксазолильная группа включает, например, бензоксазол-2-ильную группу, бензоксазол-4-ильную группу, бензоксазол-5-ильную группу, бензоксазол-6-ильную группу, бензоксазол-7-ильную группу или тому подобное.
Примеры оксазолил-С1-6алкильной группы (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенильной группы и С1-6алкильной группы в качестве заместителя) включают оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце 1-3 группами, выбранными из группы, состоящей из фенильной группы и С1-6алкильной группы в качестве заместителя), например оксазол-2-илметильную группу,
оксазол-4-илметильную группу, оксазол-5-илметильную группу,
2-(оксазол-2-ил)этильную группу,
1-(оксазол-4-ил)этильную группу,
3-(оксазол-5-ил)пропильную группу,
4-(оксазол-2-ил)бутильную группу,
5-(оксазол-4-ил)пентильную группу,
6-(оксазол-5-ил)гексильную группу,
2-метил-3-(оксазол-2-ил)пропильную группу,
1,1-диметил-2(оксазол-5-ил)этильную группу,
(4-метилоксазол-2-ил)метильную группу,
(5-метилоксазол-2-ил)метильную группу,
(4-этилоксазол-2-ил)метильную группу,
(5-этилоксазол-2-ил)метильную группу,
(4-н-пропилоксазол-2-ил)метильную группу,
(5-н-пропилоксазол-2-ил)метильную группу,
(4-н-бутилоксазол-2-ил)метильную группу,
(5-н-бутилоксазол-2-ил)метильную группу,
(4-н-пентилоксазол-2-ил)метильную группу,
(5-н-пентилоксазол-2-ил)метильную группу,
(4-н-гексилоксазол-2-ил)метильную группу,
(5-н-гексилоксазол-2-ил)метильную группу,
2-(оксазол-4-ил)этильную группу,
2-(оксазол-5-ил)этильную группу,
2-(4-метилоксазол-2-ил)этильную группу,
2-(5-метилоксазол-2-ил)этильную группу,
2-(4-этилоксазол-2-ил)этильную группу,
2-(5-этилоксазол-2-ил)этильную группу,
2-(4-н-пропилоксазол-2-ил)этильную группу,
2-(5-н-пропилоксазол-2-ил)этильную группу,
2-(4-н-бутилоксазол-2-ил)этильную группу,
2-(5-н-бутилоксазол-2-ил)этильную группу,
2-(4-н-пентилоксазол-2-ил)этильную группу,
2-(5-н-пентилоксазол-2-ил)этильную группу,
2-(4-н-гексилоксазол-2-ил)этильную группу,
2-(5-н-гексилоксазол-2-ил)этильную группу,
3-(оксазол-2-ил)пропильную группу,
3-(оксазол-4-ил)пропильную группу,
3-(4-метилоксазол-2-ил)пропильную группу,
3-(5-метилоксазол-2-ил)пропильную группу,
3-(4-этилоксазол-2-ил)пропильную группу,
3-(5-этилоксазол-2-ил)пропильную группу,
3-(4-н-пропилоксазол-2-ил)пропильную группу,
3-(5-н-пропилоксазол-2-ил)пропильную группу,
3-(4-н-бутилоксазол-2-ил)пропильную группу,
3-(5-н-бутилоксазол-2-ил)пропильную группу,
3-(4-н-пентилоксазол-2-ил)пропильную группу,
3-(5-н-пентилоксазол-2-ил)пропильную группу,
3-(4-н-гексилоксазол-2-ил)пропильную группу,
3-(5-н-гексилоксазол-2-ил)пропильную группу,
4-(оксазол-4-ил)бутильную группу,
4-(оксазол-5-ил)бутильную группу,
4-(4-метилоксазол-2-ил)бутильную группу,
4-(5-метилоксазол-2-ил)бутильную группу,
4-(4-этилоксазол-2-ил)бутильную группу,
4-(5-этилоксазол-2-ил)бутильную группу,
4-(4-н-пропилоксазол-2-ил)бутильную группу,
4-(5-н-пропилоксазол-2-ил)бутильную группу,
4-(4-н-бутилоксазол-2-ил)бутильную группу,
4-(5-н-бутилоксазол-2-ил)бутильную группу,
4-(4-н-пентилоксазол-2-ил)бутильную группу,
4-(5-н-пентилоксазол-2-ил)бутильную группу,
4-(4-н-гексилоксазол-2-ил)бутильную группу,
4-(5-н-гексилоксазол-2-ил)бутильную группу,
5-(оксазол-2-ил)пентильную группу,
5-(оксазол-5-ил)пентильную группу,
6-(оксазол-2-ил)гексильную группу,
6-(оксазол-4-ил)гексильную группу,
(5-фенилоксазол-2-ил)метильную группу,
(2-фенилоксазол-4-ил)метильную группу,
(2-фенилоксазол-5-ил)метильную группу,
2-(5-фенилоксазол-2-ил)этильную группу,
2-(2-фенилоксазол-4-ил)этильную группу,
2-(2-фенилоксазол-5-ил)этильную группу,
3-(5-фенилоксазол-2-ил)пропильную группу,
3-(2-фенилоксазол-4-ил)пропильную группу,
3-(2-фенилоксазол-5-ил)пропильную группу,
4-(5-фенилоксазол-2-ил)бутильную группу,
4-(2-фенилоксазол-4-ил)бутильную группу,
4-(2-фенилоксазол-5-ил)бутильную группу,
5-(5-фенилоксазол-2-ил)пентильную группу,
5-(2-фенилоксазол-4-ил)пентильную группу,
5-(2-фенилоксазол-5-ил)пентильную группу
(2-фенил-4-метилоксазол-5-ил)метильную группу,
(2,4-диметилоксазол-5-ил)метильную группу,
(2,5-дифенилоксазол-4-ил)метильную группу или тому подобное.
Примеры тетразолильной группы (которая может быть замещена в тетразольном кольце фенильной группой, которая может содержать С1-6алкильную группу(ы) или атом(ы) галогена в качестве заместителя) включают тетразолильную группу (которая может быть замещена в тетразольном кольце фенильной группой, которая может содержать 1-3 С1-6алкильные группы или атомы галогена в качестве заместителя(ей)), например 5-(1Н)-тетразолильную группу,
1-метил-5-(1Н)-тетразолильную группу,
1-этил-5-(1Н)-тетразолильную группу,
1-н-пропил-5-(1Н)-тетразолильную группу,
1-изопропил-5-(1Н)-тетразолильную группу,
1-н-бутил-5-(1Н)-тетразолильную группу,
1-(2-метилпропил)-5-(1Н)-тетразолильную группу,
1-н-пентил-5-(1Н)-тетразолильную группу,
1-н-гексил-5-(1Н)-тетразолильную группу,
1-фенил-5-(1Н)-тетразолильную группу,
1-(4-хлорфенил)-5-(1Н)-тетразолильную группу,
1-(4-фторфенил)-5-(1Н)-тетразолильную группу,
1-(4-бромфенил)-5-(1Н)-тетразолильную группу,
1-(3,4-дифторфенил)-5-(1Н)-тетразолильную группу,
1-(3,4-дихлорфенил)-5-(1Н)-тетразолильную группу,
1-(3,4,5-трихлорфенил)-5-(1Н)-тетразолильную группу или тому подобное.
С1-8алкильная группа представляет собой линейную или разветвленную алкильную группу, содержащую 1-8 углеродных атомов, примеры которой включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, неопентильную группу, н-гексильную группу, изогексильную группу, 3-метилпентильную группу, н-гептильную группу, 6-метилгептильную группу, н-октильную группу, 3,5-диметилгексильную группу или тому подобное.
Примеры С1-6алкильной группы, замещенной атомом(ами) галогена, включают С1-6алкильную группу, замещенную 1-7 атомами галогена, например фторметильную группу, дифторметильную группу, трифторметильную группу, хлорметильную группу, дихлорметильную группу, трихлорметильную группу, бромметильную группу, дибромметильную группу, дихлорфторметильную группу, 2,2,2-трифторэтильную группу, пентафторэтильную группу, 2-хлорэтильную группу, 3,3,3-трифторпропильную группу, гептафторпропильную группу, гептафторизопропильную группу, 3-хлорпропильную группу, 2-хлорпропильную группу, 3-бромпропильную группу, 4,4,4-трифторбутильную группу, 4,4,4,3,3-пентафторбутильную группу, 4-хлорбутильную группу, 4-бромбутильную группу, 2-хлорбутильную группу, 5,5,5-трифторпентильную группу, 5-хлорпентильную группу, 6,6,6-трифторгексильную группу, 6-хлоргексильную группу или тому подобное.
С1-6алкоксикарбонил-С1-6алкильная группа представляет собой определенную выше С1-6алкильную группу, замещенную С1-6алкоксикарбонильной группой, определенной выше, примеры которой включают метоксикарбонилметильную группу,
этоксикарбонилметильную группу,
пропоксикарбонилметильную группу,
изопропоксикарбонилметильную группу,
н-бутоксикарбонилметильную группу,
трет-бутоксикарбонилметильную группу,
пентоксикарбонилметильную группу,
н-гексилоксикарбонилметильную группу,
2-(метоксикарбонил)этильную группу,
2-(этоксикарбонил)этильную группу,
2-(1-пропоксикарбонил)этильную группу,
2-(изопропоксикарбонил)этильную группу,
2-(н-бутоксикарбонил)этильную группу,
2-(трет-бутоксикарбонил)этильную группу,
2-(2-пентоксикарбонил)этильную группу,
2-(н-гексилоксикарбонил)этильную группу,
3-(метоксикарбонил)пропильную группу,
3-(этоксикарбонил)пропильную группу,
3-(1-пропоксикарбонил)пропильную группу,
3-(изопропоксикарбонил)пропильную группу,
3-(н-бутоксикарбонил)пропильную группу,
3-(трет-бутоксикарбонил)пропильную группу,
3-(3-пентоксикарбонил)пропильную группу,
3-(н-гексилоксикарбонил)пропильную группу,
4-(метоксикарбонил)бутильную группу,
4-(этоксикарбонил)бутильную группу,
4-(1-пропоксикарбонил)бутильную группу,
4-(изопропоксикарбонил)бутильную группу,
4-(н-бутоксикарбонил)бутильную группу,
4-(трет-бутоксикарбонил)бутильную группу,
5-(метоксикарбонил)пентильную группу,
5-(этоксикарбонил)пентильную группу,
5-(пропоксикарбонил)пентильную группу,
5-(изопропоксикарбонил)пентильную группу,
5-(н-бутоксикарбонил)пентильную группу,
5-(трет-бутоксикарбонил)пентильную группу,
6-(метоксикарбонил)гексильную группу,
6-(этоксикарбонил)гексильную группу,
6-(пропоксикарбонил)гексильную группу,
6-(изопропоксикарбонил)гексильную группу,
6-(н-бутоксикарбонил)гексильную группу,
6-(трет-бутоксикарбонил)гексильную группу или тому подобное.
С3-8циклоалкильную группа представляет собой 3-членную, 4-членную, 5-членную, 6-членную, 7-членную или 8-членную циклическую алкильную группу, содержащую 3-8 углеродных атомов, примеры которой включают циклопропильную группу,
циклобутильную группу, циклопентильную группу,
циклогексильную группу, циклогептильную группу,
циклооктильную группу, 3,4-диметилциклопентильную группу,
3,3-диметилциклогексильную группу или тому подобное.
Фенил-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой фенил-С1-6алкильную группу, незамещенную или замещенную в фенильном кольце 1-5 группами, предпочтительно 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, примеры которой включают бензильную группу, 1-фенетильную группу, 2-фенетильную группу, 3-фенилпропильную группу, 2-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
4-фенилпентильную группу, 6-фенилгексильную группу,
2-фторбензильную группу, 3-фторбензильную группу,
4-фторбензильную группу, 2-хлорбензильную группу,
3-хлорбензильную группу, 4-хлорбензильную группу,
2-бромбензильную группу, 3-бромбензильную группу,
4-бромбензильную группу, 2-иодбензильную группу,
3-иодбензильную группу, 4-иодбензильную группу,
2,3-дифторбензильную группу, 3,4-дифторбензильную группу,
3,5-дифторбензильную группу,
2,4-дифторбензильную группу, 2,6-дифторбензильную группу,
2,3-дихлорбензильную группу, 3,4-дихлорбензильную группу,
3,5-дихлорбензильную группу, 2,4-дихлорбензильную группу,
2,6-дихлорбензильную группу, 2-фтор-4-бромбензильную группу,
4-хлор-3-фторбензильную группу, 2,3,4-трихлорбензильную группу,
3,4,5-трифторбензильную группу, 2,4,6-трихлорбензильную группу,
4-изопропилбензильную группу, 4-н-бутилбензильную группу,
4-метилбензильную группу, 2-метилбензильную группу,
3-метилбензильную группу, 2,4-диметилбензильную группу,
2,3-диметилбензильную группу, 2,6-диметилбензильную группу,
3,5-диметилбензильную группу, 2,5-диметилбензильную группу,
2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
2,3,4,5,6-пентафторбензильную группу,
4-изопропоксибензильную группу, 4-н-бутоксибензильную группу,
4-метоксибензильную группу, 2-метоксибензильную группу,
3-метоксибензильную группу, 2,4-диметоксибензильную группу,
2,3-диметоксибензильную группу, 2,6-диметоксибензильную группу,
3,5-диметоксибензильную группу, 2,5-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
3,5-дитрифторметоксибензильную группу,
2-изопропоксибензильную группу,
3-хлор-4-метоксибензильную группу,
2-хлор-4-трифторметоксибензильную группу,
3-метил-4-фторбензильную группу,
4-бром-3-трифторметилбензильную группу,
2-трифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
2-пентафторэтилбензильную группу,
3-пентафторэтилбензильную группу,
4-пентафторэтилбензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу,
2-пентафторэтоксибензильную группу,
3-пентафторэтоксибензильную группу,
4-пентафторэтоксибензильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-(2-трифторметоксифенил)этильную группу,
3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
2-(2-пентафторэтоксифенил)этильную группу,
2-(3-пентафторэтоксифенил)этильную группу,
2-(4-пентафторэтоксифенил)этильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
3-(3-пентафторэтоксифенил)пропильную группу,
3-(4-пентафторэтоксифенил)пропильную группу,
4-(3-пентафторэтоксифенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце 1-3-группами, выбранными из группы, состоящей из атома(ов) галогена, С1-6алкильной группы, замещенной или незамещенной атомом(ами) галогена, галогензамещенной или незамещенной С1-6алкоксигруппы, С1-6алканоильной группы, карбоксильной группы, С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, карбамоильной группы, С1-6алкилкарбамоильной группы, аминосульфонильной группы и морфолиногруппы) включает, например, фенильную группу,
2-фторфенильную группу, 3-фторфенильную группу,
4-фторфенильную группу, 2-хлорфенильную группу,
3-хлорфенильную группу, 4-хлорфенильную группу,
2-бромфенильную группу, 3-бромфенильную группу,
4-бромфенильную группу, 2-иодфенильную группу,
3-иодфенильную группу, 4-иодфенильную группу,
2,3-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,6-дифторфенильную группу, 2,3-дихлорфенильную группу,
3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,6-дихлорфенильную группу,
3,4,5-трифторфенильную группу, 3,4,5-трихлорфенильную группу,
2,4,6-трифторфенильную группу, 2,4,6-трихлорфенильную группу,
2-фтор-4-бромфенильную группу, 4-хлор-3-фторфенильную группу,
2,3,4-трихлорфенильную группу, 4-изопропилфенильную группу,
4-н-бутилфенильную группу, 2,4-диметилфенильную группу,
2,3-диметилфенильную группу, 2,6-диметилфенильную группу,
3,5-диметилфенильную группу, 2,5-диметилфенильную группу,
2,4,6-триметилфенильную группу,
3,5-дитрифторметилфенильную группу, 4-н-бутоксифенильную группу,
2,4-диметоксифенильную группу, 2,3-диметоксифенильную группу,
2,6-диметоксифенильную группу, 3,5-диметоксифенильную группу,
2,5-диметоксифенильную группу,
3,5-дитрифторметоксифенильную группу,
3-хлор-4-метоксифенильную группу,
2-хлор-4-трифторметоксифенильную группу,
3-метил-4-фторфенильную группу,
4-бром-3-трифторметилфенильную группу, 2-метилфенильную группу,
3-метилфенильную группу, 4-метилфенильную группу,
2-трифторметилфенильную группу, 3-трифторметилфенильную группу,
4-трифторметилфенильную группу, 2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 2-трет-бутилфенильную группу,
3-трет-бутилфенильную группу, 4-трет-бутилфенильную группу,
2-втор-бутилфенильную группу, 3-втор-бутилфенильную группу,
4-втор-бутилфенильную группу,
2-н-гептафторпопилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-н-пентилфенильную группу,
4-н-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
2,3-диметоксифенильную группу, 3-фтор-2-метоксифенильную группу,
2-фтор-3-метоксифенильную группу,
2-хлор-4-метоксифенильную группу,
2,3,4-триметоксифенильную группу,
3,4,5-триметоксифенильную группу,
2,4,6-триметоксифенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-пентоксифенильную группу, 4-гексилоксифенильную группу,
2-формилфенильную группу, 3-формилфенильную группу,
4-формилфенильную группу, 2-ацетилфенильную группу,
3-ацетилфенильную группу, 4-ацетилфенильную группу,
2-пропионилфенильную группу, 3-пропионилфенильную группу,
4-пропионилфенильную группу, 2-бутирилфенильную группу,
3-бутирилфенильную группу, 4-бутирилфенильную группу,
2-пентаноилфенильную группу, 3-пентаноилфенильную группу,
4-пентаноилфенильную группу, 2-гексаноилфенильную группу,
3-гексаноилфенильную группу, 4-гексаноилфенильную группу,
2-метоксикарбонилфенильную группу,
3-метоксикарбонилфенильную группу,
4-метоксикарбонилфенильную группу,
2-этоксикарбонилфенильную группу,
3-этоксикарбонилфенильную группу,
4-этоксикарбонилфенильную группу,
2-пропоксикарбонилфенильную группу,
3-пропоксикарбонилфенильную группу,
4-пропоксикарбонилфенильную группу,
2-бутоксикарбонилфенильную группу,
3-бутоксикарбонилфенильную группу,
4-бутоксикарбонилфенильную группу,
2-трет-бутоксикарбонилфенильную группу,
3-трет-бутоксикарбонилфенильную группу,
4-трет-бутоксикарбонилфенильную группу,
2-пентоксикарбонилфенильную группу,
3-пентоксикарбонилфенильную группу,
4-пентоксикарбонилфенильную группу,
2-гексилоксикарбонилфенильную группу,
3-гексилоксикарбонилфенильную группу,
4-гексилоксикарбонилфенильную группу,
2-бензилоксикарбонилфенильную группу,
3-бензилоксикарбонилфенильную группу,
4-бензилоксикарбонилфенильную группу,
2-карбоксилфенильную группу, 3-карбоксилфенильную группу,
4-карбоксилфенильную группу, 2-аминосульфонилфенильную группу,
3-аминосульфонилфенильную группу,
4-аминосульфонилфенильную группу, 2-карбамоилфенильную группу,
3-карбамоилфенильную группу, 4-карбамоилфенильную группу,
2-метилкарбамоилфенильную группу,
3-метилкарбамоилфенильную группу,
4-метилкарбамоилфенильную группу,
2-этилкарбамоилфенильную группу,
3-этилкарбамоилфенильную группу,
4-этилкарбамоилфенильную группу,
2-диметилкарбамоилфенильную группу,
3-диметилкарбамоилфенильную группу,
4-диметилкарбамоилфенильную группу,
2-диэтилкарбамоилфенильную группу,
3-диэтилкарбамоилфенильную группу,
4-диэтилкарбамоилфенильную группу, 4-морфолинофенильную группу,
3-морфолинофенильную группу, 4-морфолинофенильную группу или тому подобное.
С1-6алкилкарбамоильная группа представляет собой группу, в которой один или два атома водорода в карбамоильной (-CONH2) группе являются замещенными С1-6алкильной группой, определенной выше, примеры которой включают N-метилкарбамоильную группу,
N,N-диметилкарбамоильную группу, N-этилкарбамоильную группу,
N-н-пропилкарбамоильную группу, N-изопропилкарбамоильную группу,
N-н-бутилкарбамоильную группу, N-трет-бутилкарбамоильную группу,
N-н-пентилкарбамоильную группу, N-н-гексилкарбамоильную группу,
N-метил-N-этилкарбамоильную группу,
N-метил-N-н-пропилкарбамоильную группу,
N-метил-N-изопропилкарбамоильную группу,
N-метил-N-н-бутилкарбамоильную группу,
N-метил-N-трет-бутилкарбамоильную группу,
N-метил-N-н-пентилкарбамоильную группу,
N-метил-N-н-гексилкарбамоильную группу,
N-этил-N-изопропилкарбамоильную группу,
N-этил-N-трет-бутилкарбамоильную группу,
N-пропил-N-трет-бутилкарбамоильную группу,
N-изопропил-N-трет-бутилкарбамоильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой фенильную группу, незамещенную или замещенную 1-5, предпочтительно 1-3, заместителями, выбранными из группы, состоящей из атома(ов) галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, определенных выше, примеры которой включают фенильную группу,
2-фторфенильную группу, 3-фторфенильную группу,
4-фторфенильную группу, 2-хлорфенильную группу,
3-хлорфенильную группу, 4-хлорфенильную группу,
2-бромфенильную группу, 3-бромфенильную группу,
4-бромфенильную группу, 2-иодфенильную группу,
3-иодфенильную группу, 4-иодфенильную группу,
2,3-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,6-дифторфенильную группу, 2,3-дихлорфенильную группу,
3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,6-дихлорфенильную группу,
3,4,5-трифторфенильную группу, 3,4,5-трихлорфенильную группу,
2,4,6-трифторфенильную группу, 2,4,6-трихлорфенильную группу,
2-фтор-4-бромфенильную группу, 4-хлор-3-фторфенильную группу,
2,3,4-трихлорфенильную группу, 2,3,4-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
2,4,6-триметилфенильную группу, 4-н-бутилфенильную группу,
2,4-диметилфенильную группу, 2,3-диметилфенильную группу,
2,6-диметилфенильную группу, 3,5-диметилфенильную группу,
2,5-диметилфенильную группу, 3,5-дитрифторметилфенильную группу,
4-н-бутоксифенильную группу, 2,4-диметоксифенильную группу,
2,3-диметоксифенильную группу, 2,6-диметоксифенильную группу,
3,5-диметоксифенильную группу, 2,5-диметоксифенильную группу,
2,4,6-триметоксифенильную группу,
3,5-дитрифторметоксифенильную группу,
3-хлор-4-метоксифенильную группу,
2-хлор-4-трифторметоксифенильную группу,
3-метил-4-фторфенильную группу,
4-бром-3-трифторметилфенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2-метил-3-хлорфенильную группу,
3-метил-4-хлорфенильную группу, 2-хлор-4-метилфенильную группу,
2-метил-3-фторфенильную группу, 2-трифторметилфенильную группу,
3-трифторметилфенильную группу, 4-трифторметилфенильную группу,
2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
3-хлор-2-метоксифенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 3,4-диметоксифенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
3-фтор-2-трифторметоксифенильную группу,
2-фтор-3-трифторметоксифенильную группу,
3-фтор-4-трифторметоксифенильную группу,
3-хлор-2-трифторметоксифенильную группу,
2-хлор-3-трифторметоксифенильную группу,
3-хлор-4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
3-хлор-2-пентафторэтоксифенильную группу,
2-хлор-3-пентафторэтоксифенильную группу,
3-хлор-4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-н-пентоксифенильную группу, 4-н-гексилоксифенильную группу или тому подобное.
Фенил-С1-6алкоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома(ов) галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой группу, содержащую фенил-С1-6алкоксигруппу, которая может быть замещена 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома(ов) галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, и карбонильную группу, примеры которой включают бензилоксикарбонильную группу, 2-фенилэтоксикарбонильную группу,
3-фенилпропоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентоксикарбонильную группу,
4-фенилпентоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-фторбензилоксикарбонильную группу,
3-фторбензилоксикарбонильную группу,
4-фторбензилоксикарбонильную группу,
2-(2-фторфенил)этоксикарбонильную группу,
2-(3-фторфенил)этоксикарбонильную группу,
2-(4-фторфенил)этоксикарбонильную группу,
2-хлорбензилоксикарбонильную группу,
3-хлорбензилоксикарбонильную группу,
4-хлорбензилоксикарбонильную группу,
2-фтор-4-бромбензилоксикарбонильную группу,
4-хлор-3-фторбензилоксикарбонильную группу,
2,3,4-трихлорбензилоксикарбонильную группу,
3,4,5-трифторбензилоксикарбонильную группу,
2,3,4,5,6-пентафторбензилоксикарбонильную группу,
2,4,6-трихлорбензилоксикарбонильную группу,
4-изопропоксибензилоксикарбонильную группу,
4-н-бутилбензилоксикарбонильную группу,
4-метилбензилоксикарбонильную группу,
2-метилбензилоксикарбонильную группу,
3-метилбензилоксикарбонильную группу,
2,4-диметилбензилоксикарбонильную группу,
2,3-диметилбензилоксикарбонильную группу,
2,6-диметилбензилоксикарбонильную группу,
3,5-диметилбензилоксикарбонильную группу,
2,5-диметилбензилоксикарбонильную группу,
2,4,6-триметилбензилоксикарбонильную группу,
3,5-дитрифторметилбензилоксикарбонильную группу,
4-изопропоксибензилоксикарбонильную группу,
4-н-бутоксибензилоксикарбонильную группу,
4-метоксибензилоксикарбонильную группу,
2-метоксибензилоксикарбонильную группу,
3-метоксибензилоксикарбонильную группу,
2,4-диметоксибензилоксикарбонильную группу,
2,3-диметоксибензилоксикарбонильную группу,
2,6-диметоксибензилоксикарбонильную группу,
3,5-диметоксибензилоксикарбонильную группу,
2,5-диметоксибензилоксикарбонильную группу,
2,4,6-триметоксибензилоксикарбонильную группу,
3,5-дитрифторметоксибензилоксикарбонильную группу,
2-изопропоксибензилоксикарбонильную группу,
3-хлор-4-метоксибензилоксикарбонильную группу,
2-хлор-4-трифторметоксибензилоксикарбонильную группу,
3-метил-4-фторметоксибензилоксикарбонильную группу,
4-бром-3-трифторметилбензилоксикарбонильную группу,
2-(2-хлорфенил)этилоксикарбонильную группу,
2-(3-хлорфенил)этоксикарбонильную группу,
2-(4-хлорфенил)этоксикарбонильную группу,
2-трифторметилбензилоксикарбонильную группу,
3-трифторметилбензилоксикарбонильную группу,
4-трифторметилбензилоксикарбонильную группу,
2-трифторметоксибензилоксикарбонильную группу,
3-трифторметоксибензилоксикарбонильную группу,
4-трифторметоксибензилоксикарбонильную группу,
2-(2-трифторметилфенил)этоксикарбонильную группу,
2-(3-трифторметилфенил)этоксикарбонильную группу,
2-(4-трифторметилфенил)этоксикарбонильную группу,
2-(2-трифторметоксифенил)этоксикарбонильную группу,
2-(3-трифторметоксифенил)этоксикарбонильную группу,
2-(4-трифторметоксифенил)этоксикарбонильную группу,
3-(2-трифторметилфенил)пропоксикарбонильную группу,
3-(3-трифторметилфенил)пропоксикарбонильную группу,
3-(4-трифторметилфенил)пропоксикарбонильную группу,
3-(2-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-трифторметоксифенил)пропоксикарбонильную группу,
4-(3-трифторметилфенил)бутоксикарбонильную группу,
5-(4-трифторметилфенил)пентоксикарбонильную группу,
4-(4-трифторметилфенил)пентоксикарбонильную группу,
4-(4-трифторметоксифенил)пентоксикарбонильную группу,
6-(3-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметоксифенил)гексилоксикарбонильную группу или тому подобное.
Фенил-С3-6алкенилоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) представляет собой группу, содержащую фенильную группу, незамещенную или замещенную 1-3 группами, выбранными из группы, состоящей из С1-6алкильных групп, замещенных или незамещенных атомом(ами) галогена, алкенилоксигруппу с 1-3 двойными связями, содержащую 3-6 углеродных атомов, и карбонильную группу. Данные группы могут существовать в транс- или цис-форме, которые, разумеется, охватывает указанная группа. Примеры ее включают
3-фенил-2-пропенилоксикарбонильную группу (тривиальное название: циннамилоксикарбонильная группа),
4-фенил-2-бутенилоксикарбонильную группу,
4-фенил-3-бутенилоксикарбонильную группу,
5-фенил-2-пентенилоксикарбонильную группу,
5-фенил-4-пентенилоксикарбонильную группу,
5-фенил-3-пентенилоксикарбонильную группу,
6-фенил-5-гексенилоксикарбонильную группу,
6-фенил-4-гексенилоксикарбонильную группу,
6-фенил-3-гексенилоксикарбонильную группу,
6-фенил-2-гексенилоксикарбонильную группу,
4-фенил-1,3-бутадиенилоксикарбонильную группу,
6-фенил-1,3,5-гексатриенилоксикарбонильную группу,
3-(2-метилфенил)-2-пропенилоксикарбонильную группу,
3-(3-метилфенил)-2-пропенилоксикарбонильную группу,
3-(4-метилфенил)-2-пропенилоксикарбонильную группу,
3-(2-трифторметилфенил)-2-пропенилоксикарбонильную группу,
3-(3-трифторметилфенил)-2-пропенилоксикарбонильную группу,
3-(4-трифторметилфенил)-2-пропенилоксикарбонильную группу,
4-(2-трифторметилфенил)-3-бутенилоксикарбонильную группу,
4-(3-трифторметилфенил)-3-бутенилоксикарбонильную группу,
4-(4-трифторметилфенил)-3-бутенилоксикарбонильную группу,
3-(3,5-дитрифторметилфенил)-2-пропенилоксикарбонильную группу,
3-[2,4,6-три(трифторметил)фенил]-2-пропенилоксикарбонильную группу,
3-(2,4-диметилфенил)-2-пропенилоксикарбонильную группу или тому подобное.
Фенил-С1-6алкилидензамещенная аминогруппа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя) представляет собой С1-6алкилидензамещенную аминогруппу, замещенную фенильной группой, которая может быть замещена 1-3 галогензамещенными или незамещенными С1-6алкильными группами, примеры которой включают бензилиденаминогруппу,
2-фенилэтилиденаминогруппу, 3-фенилпропилиденаминогруппу,
4-фенилбутилиденаминогруппу, 5-фенилпентилиденаминогруппу,
6-фенилгексилиденаминогруппу, 2-метилбензилиденаминогруппу,
2-трифторметилбензилиденаминогруппу,
3-метилбензилиденаминогруппу,
3-трифторметилбензилиденаминогруппу,
4-метилбензилиденаминогруппу,
4-трифторметилбензилиденаминогруппу,
3,4-диметилбензилиденаминогруппу,
3,4,5-триметилбензилиденаминогруппу,
3,5-дитрифторметилбензилиденаминогруппу или тому подобное.
Феноксигруппа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) представляет собой феноксигруппу, незамещенную или замещенную 1-3 С1-6алкильными группами, замещенными или незамещенными атомом(ами) галогена, определенными выше, примеры которой включают феноксигруппу,
2-метилфеноксигруппу, 3-метилфеноксигруппу,
4-метилфеноксигруппу, 2-этилфеноксигруппу, 3-этилфеноксигруппу,
4-этилфеноксигруппу, 4-н-пропилфеноксигруппу,
4-трет-бутилфеноксигруппу, 4-н-бутилфеноксигруппу,
2-трифторметилфеноксигруппу, 3-трифторметилфеноксигруппу,
4-трифторметилфеноксигруппу, 2-пентафторэтилфеноксигруппу,
3-пентафторэтилфеноксигруппу, 2,3-диметилфеноксигруппу,
3,4,5-триметилфеноксигруппу, 4-н-пентилфеноксигруппу,
4-н-гексилфеноксигруппу, 3,5-дитрифторметилфеноксигруппу или тому подобное.
Фениламиногруппа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) представляет собой фениламиногруппу, незамещенную (другое название: анилиногруппа) или замещенную 1-3 С1-6алкильными группами, замещенными или незамещенными атомом(ами) галогена, определенными выше, примеры которой включают фениламиногруппу, 2-метилфениламиногруппу,
3-метилфениламиногруппу, 4-метилфениламиногруппу,
2-этилфениламиногруппу, 3-этилфениламиногруппу,
4-этилфениламиногруппу, 4-пропилфениламиногруппу,
4-трет-бутилфениламиногруппу, 4-бутилфениламиногруппу,
2-трифторметилфениламиногруппу, 3-трифторметилфениламиногруппу,
4-трифторметилфениламиногруппу, 2-пентафторэтилфениламиногруппу,
3-пентафторэтилфениламиногруппу, 2,3-диметилфениламиногруппу,
3,4,5-триметилфениламиногруппу, 4-н-пентилфениламиногруппу,
4-н-гексилфениламиногруппу, 3,5-дитрифторметилфениламиногруппу или тому подобное.
Индолинильная группа, которая может быть замещена по крайней мере одним атомом галогена, представляет собой индолинильную группу, незамещенную или замещенную 1-3 атомами фтора, хлора, брома или иода в положении 2, 3, 4, 5, 6 или 7, примеры которой включают 1-индолинильную группу,
2-фтор-1-индолинильную группу, 3-бром-1-индолинильную группу,
4,5-дихлор-1-индолинильную группу,
4-фтор-1-индолинильную группу,
4,5,6-трифтор-1-индолинильную группу,
5-фтор-1-индолинильную группу, 6-фтор-1-индолинильную группу,
7-фтор-1-индолинильную группу, 4-хлор-1-индолинильную группу,
5-хлор-1-индолинильную группу, 6-хлор-1-индолинильную группу,
7-хлор-1-индолинильную группу, 4-бром-1-индолинильную группу,
5-бром-1-индолинильную группу, 6-бром-1-индолинильную группу,
7-бром-1-индолинильную группу, 4-иод-1-индолинильную группу,
5-иод-1-индолинильную группу, 6-иод-1-индолинильную группу,
7-иод-1-индолинильную группу или тому подобное.
Изоиндолинильная группа, которая может быть замещена по крайней мере одним атомом галогена, представляет собой индолинильную группу, незамещенную или замещенную 1-3 атомами фтора, хлора, брома или иода в положении 1, 3, 4, 5, 6 или 7, примеры которой включают 2-изоиндолинильную группу,
1-фтор-2-изоиндолинильную группу,
3-бром-2-изоиндолинильную группу,
4,5-дихлор-2-изоиндолинильную группу,
4,5,6-трифтор-2-изоиндолинильную группу,
4-фтор-2-изоиндолинильную группу,
5-фтор-2-изоиндолинильную группу,
6-фтор-2-изоиндолинильную группу,
7-фтор-2-изоиндолинильную группу,
4-хлор-2-изоиндолинильную группу,
5-хлор-2-изоиндолинильную группу,
6-хлор-2-изоиндолинильную группу,
7-хлор-2-изоиндолинильную группу,
4-бром-2-изоиндолинильную группу,
5-бром-2-изоиндолинильную группу,
6-бром-2-изоиндолинильную группу,
7-бром-2-изоиндолинильную группу,
4-иод-2-изоиндолинильную группу,
5-иод-2-изоиндолинильную группу,
6-иод-2-изоиндолинильную группу,
7-иод-2-изоиндолинильную группу или тому подобное.
1,2,3,4-Тетрагидрохинолильная группа, которая может быть замещена по крайней мере одним атомом галогена, представляет собой 1,2,3,4-тетрагидрохинолильную группу, незамещенную или замещенную 1-3 атомами фтора, хлора, брома или иода в положении 2, 3, 4, 5, 6, 7 или 8, примеры которой включают
1,2,3,4-тетрагидро-1-хинолильную группу,
5-фтор-1,2,3,4-тетрагидро-1-хинолильную группу,
2-бром-1,2,3,4-тетрагидро-1-хинолильную группу,
3-иод-1,2,3,4-тетрагидро-1-хинолильную группу,
4-хлор-1,2,3,4-тетрагидро-1-хинолильную группу,
3,4-дихлор-1,2,3,4-тетрагидро-1-хинолильную группу,
4,5,6-трихлор-1,2,3,4-тетрагидро-1-хинолильную группу,
6-фтор-1,2,3,4-тетрагидро-1-хинолильную группу,
5-фтор-1,2,3,4-тетрагидро-1-хинолильную группу,
7-фтор-1,2,3,4-тетрагидро-1-хинолильную группу,
8-фтор-1,2,3,4-тетрагидро-1-хинолильную группу,
5-хлор-1,2,3,4-тетрагидро-1-хинолильную группу,
6-хлор-1,2,3,4-тетрагидро-1-хинолильную группу,
7-хлор-1,2,3,4-тетрагидро-1-хинолильную группу,
8-хлор-1,2,3,4-тетрагидро-1-хинолильную группу,
5-бром-1,2,3,4-тетрагидро-1-хинолильную группу,
6-бром-1,2,3,4-тетрагидро-1-хинолильную группу,
7-бром-1,2,3,4-тетрагидро-1-хинолильную группу,
8-бром-1,2,3,4-тетрагидро-1-хинолильную группу,
5-иод-1,2,3,4-тетрагидро-1-хинолильную группу,
6-иод-1,2,3,4-тетрагидро-1-хинолильную группу,
7-иод-1,2,3,4-тетрагидро-1-хинолильную группу,
8-иод-1,2,3,4-тетрагидро-1-хинолильную группу или тому подобное.
1,2,3,4-Тетрагидроизохинолильная группа, которая может быть замещена по крайней мере одним атомом галогена, представляет собой 1,2,3,4-тетрагидроизохинолильную группу, незамещенную или замещенную 1-3 атомами фтора, хлора, брома или иода в положении 1, 3, 4, 5, 6, 7 или 8, примеры которой включают
1,2,3,4-тетрагидро-2-изохинолильную группу,
1-бром-1,2,3,4-тетрагидро-2-изохинолильную группу,
3-иод-1,2,3,4-тетрагидро-2-изохинолильную группу,
4-хлор-1,2,3,4-тетрагидро-2-изохинолильную группу,
3,4-дихлор-1,2,3,4-тетрагидро-2-изохинолильную группу,
4,5,6-трихлор-1,2,3,4-тетрагидро-2-изохинолильную группу,
6-фтор-1,2,3,4-тетрагидро-2-изохинолильную группу,
7-фтор-1,2,3,4-тетрагидро-2-изохинолильную группу,
8-фтор-1,2,3,4-тетрагидро-2-изохинолильную группу,
5-хлор-1,2,3,4-тетрагидро-2-изохинолильную группу,
6-хлор-1,2,3,4-тетрагидро-2-изохинолильную группу,
7-хлор-1,2,3,4-тетрагидро-2-изохинолильную группу,
8-хлор-1,2,3,4-тетрагидро-2-изохинолильную группу,
5-бром-1,2,3,4-тетрагидро-2-изохинолильную группу,
6-бром-1,2,3,4-тетрагидро-2-изохинолильную группу,
7-бром-1,2,3,4-тетрагидро-2-изохинолильную группу,
8-бром-1,2,3,4-тетрагидро-2-изохинолильную группу,
5-иод-1,2,3,4-тетрагидро-2-изохинолильную группу,
6-иод-1,2,3,4-тетрагидро-2-изохинолильную группу,
7-иод-1,2,3,4-тетрагидро-2-изохинолильную группу,
8-иод-1,2,3,4-тетрагидро-2-изохинолильную группу или тому подобное.
Фенил-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома(ов) галогена, галогензамещенной или незамещенной С1-6алкильной группы или галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома(ов) галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), причем С1-6алкильная часть замещена С1-6алкоксииминогруппой) представляет собой группу, содержащую незамещенную фенильную группу или фенильную группу, замещенную 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, С1-6алкильной группы, замещенной или незамещенной атомом(ами) галогена, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), и алкильную группу с 1-6 углеродными атомами, примеры которой включают бензильную группу, 1-фенетильную группу, 2-фенетильную группу, 3-фенилпропильную группу, 2-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
4-фенилпентильную группу, 6-фенилгексильную группу,
2-фторбензильную группу, 3-фторбензильную группу,
4-фторбензильную группу, 2-хлорбензильную группу,
3-хлорбензильную группу, 4-хлорбензильную группу,
2-бромбензильную группу, 3-бромбензильную группу,
4-бромбензильную группу, 2-иодбензильную группу,
3-иодбензильную группу, 4-иодбензильную группу,
2,3-дифторбензильную группу, 3,4-дифторбензильную группу,
3,5-дифторбензильную группу, 2,4-дифторбензильную группу,
2,6-дифторбензильную группу, 2,3-дихлорбензильную группу,
3,4-дихлорбензильную группу, 3,5-дихлорбензильную группу,
2,4-дихлорбензильную группу, 2,6-дихлорбензильную группу,
2-фтор-4-бромбензильную группу, 4-хлор-3-фторбензильную группу,
2,3,4-трихлорбензильную группу, 3,4,5-трифторбензильную группу,
2,3,4,5,6-пентафторбензильную группу,
2,4,6-трихлорбензильную группу, 4-изопропилбензильную группу,
4-н-бутилбензильную группу, 4-метилбензильную группу,
2-метилбензильную группу, 3-метилбензильную группу,
2,4-диметилбензильную группу, 2,3-диметилбензильную группу,
2,6-диметилбензильную группу, 3,5-диметилбензильную группу,
2,5-диметилбензильную группу, 2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
4-изопропоксибензильную группу, 4-н-бутоксибензильную группу,
4-метоксибензильную группу, 2-метоксибензильную группу,
3-метоксибензильную группу, 2,4-диметоксибензильную группу,
2,3-диметоксибензильную группу, 2,6-диметоксибензильную группу,
3,5-диметоксибензильную группу, 2,5-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
3,5-дитрифторметоксибензильную группу,
2-изопропоксибензильную группу,
3-хлор-4-метоксибензильную группу,
2-хлор-4-трифторметоксибензильную группу,
3-метил-4-фторбензильную группу,
4-бром-3-трифторметилбензильную группу,
2-трифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
2-пентафторэтилбензильную группу,
3-пентафторэтилбензильную группу,
4-пентафторэтилбензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу,
2-пентафторэтоксибензильную группу,
3-пентафторэтоксибензильную группу,
4-пентафторэтоксибензильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-(2-трифторметоксифенил)этильную группу,
2-(3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
2-(2-пентафторэтоксифенил)этильную группу,
2-(3-пентафторэтоксифенил)этильную группу,
2-(4-пентафторэтоксифенил)этильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
3-(3-пентафторэтоксифенил)пропильную группу,
3-(4-пентафторэтоксифенил)пропильную группу,
4-(3-пентафторэтоксифенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
(4-пентафторэтоксифенил)пропильную группу,
4-(3-пентафторэтоксифенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
3-феноксибензильную группу, 4-феноксибензильную группу,
2-(4-феноксифенил)этильную группу,
3-(4-феноксифенил)пропильную группу,
2-(4-феноксифенил)пропильную группу,
4-(4-феноксифенил)бутильную группу,
5-(4-феноксифенил)пентильную группу,
4-(4-феноксифенил)пентильную группу,
6-(4-феноксифенил)гексильную группу,
2-феноксибензильную группу, 2-(3-феноксифенил)этильную группу,
3-(2-феноксифенил)пропильную группу,
2-(2-феноксифенил)пропильную группу,
4-(3-феноксифенил)бутильную группу,
5-(2-феноксифенил)пентильную группу,
4-(3-феноксифенил)пентильную группу,
6-(3-феноксифенил)гексильную группу,
4-(2-хлорфенокси)бензильную группу,
4-(3-хлорфенокси)бензильную группу,
4-(4-хлорфенокси)бензильную группу,
4-(2-трифторметилфенокси)бензильную группу,
4-(3-трифторметилфенокси)бензильную группу,
4-(4-трифторметилфенокси)бензильную группу,
4-(2-трифторметоксифенокси)бензильную группу,
4-(3-трифторметоксифенокси)бензильную группу,
4-(4-трифторметоксифенокси)бензильную группу,
2-[4-(4-хлорфенокси)фенил]этильную группу,
2-[4-(4-трифторметилфенокси)фенил]этильную группу,
3-[4-(4-хлорфенокси)фенил]пропильную группу,
3-[4-(4-трифторметилфенокси)фенил]пропильную группу,
3-[4-(4-трифторметоксифенокси)фенил]пропильную группу,
2-[4-(4-хлорфенокси)фенил]пропильную группу,
4-[4-(4-хлорфенокси)фенил]бутильную группу,
4-[4-(4-трифторметилфенокси)фенил]бутильную группу,
4-[4-(4-трифторметоксифенокси)фенил]бутильную группу,
5-[4-(4-хлорфенокси)фенил]пентильную группу,
4-[4-(4-хлорфенокси)фенил]пентильную группу,
6-[4-(4-хлорфенокси)фенил]гексильную группу,
6-[4-(4-трифторметилфенокси)фенил]гексильную группу,
6-[4-(4-трифторметоксифенокси)фенил]гексильную группу,
(2-фтор-4-бромфенокси)бензильную группу,
(4-хлор-3-фторфенокси)бензильную группу,
(2,3,4-трихлорфенокси)бензильную группу,
(3,4,5-трифторфенокси)бензильную группу,
(2,4,6-трихлорфенокси)бензильную группу,
(4-изопропилфенокси)бензильную группу,
(4-н-бутилфенокси)бензильную группу,
(4-метилфенокси)бензильную группу,
(2-метилфенокси)бензильную группу,
(3-метилфенокси)бензильную группу,
(2,4-диметилфенокси)бензильную группу,
(2,3-диметилфенокси)бензильную группу,
(2,6-диметилфенокси)бензильную группу,
(3,5-диметилфенокси)бензильную группу,
(2,5-диметилфенокси)бензильную группу,
(2,4,6-триметилфенокси)бензильную группу,
(3,5-дитрифторметилфенокси)бензильную группу,
(4-изопропоксифенокси)бензильную группу,
(4-н-бутоксифенокси)бензильную группу,
(4-метоксифенокси)бензильную группу,
(2-метоксифенокси)бензильную группу,
(3-метоксифенокси)бензильную группу,
(2,4-диметоксифенокси)бензильную группу,
(2,3-диметоксифенокси)бензильную группу,
(2,6-диметоксифенокси)бензильную группу,
(3,5-диметоксифенокси)бензильную группу,
(2,5-диметоксифенокси)бензильную группу,
(2,4,6-триметоксифенокси)бензильную группу,
(3,5-дитрифторметоксифенокси)бензильную группу,
(2-изопропоксифенокси)бензильную группу,
(3-хлор-4-метоксифенокси)бензильную группу,
(2-хлор-4-трифторметоксифенокси)бензильную группу,
(3-метил-4-фторфенокси)бензильную группу,
(4-бром-3-трифторметилфенокси)бензил или тому подобное.
Бензоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает бензоильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома(ов) галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например бензоильную группу, 2-фторбензоильную группу, 3-фторбензоильную группу, 4-фторбензоильную группу,
2,3-дифторбензоильную группу,
2,3,4,5,6-пентафторбензоильную группу,
3,4-дифторбензоильную группу, 2-хлорбензоильную группу,
3-хлорбензоильную группу, 4-хлорбензоильную группу,
2,3-дихлорбензоильную группу, 3,4-дихлорбензоильную группу,
2-бромбензоильную группу, 3-бромбензоильную группу,
4-бромбензоильную группу, 2,3-дибромбензоильную группу,
3,4-дибромбензоильную группу, 2-фтор-4-бромбензоильную группу,
4-хлор-3-фторбензоильную группу,
2,3,4-трифторбензоильную группу,
2,4,6-трихлорбензоильную группу, 4-изопропилбензоильную группу,
4-н-бутилбензоильную группу, 2,4-диметилбензоильную группу,
2,3-диметилбензоильную группу, 2,6-диметилбензоильную группу,
3,5-диметилбензоильную группу, 2,5-диметилбензоильную группу,
2,4,6-триметилбензоильную группу,
3,5-дитрифторметилбензоильную группу,
4-н-бутоксибензоильную группу, 2,4-диметоксибензоильную группу,
2,3-диметоксибензоильную группу,
2,6-диметоксибензоильную группу,
3,5-диметоксибензоильную группу,
2,5-диметоксибензоильную группу,
3,5-дитрифторметоксибензоильную группу,
3-хлор-4-метоксибензоильную группу,
2-хлор-4-трифторметоксибензоильную группу,
3-метил-4-фторбензоильную группу,
4-бром-3-трифторметилбензоильную группу,
2-метилбензоильную группу, 3-метилбензоильную группу,
4-метилбензоильную группу, 3,4-диметилбензоильную группу,
2-иодбензоильную группу, 3-иодбензоильную группу,
4-иодбензоильную группу, 2-трифторметилбензоильную группу,
3-трифторметилбензоильную группу,
4-трифторметилбензоильную группу,
2,3-дитрифторметилбензоильную группу,
3,4-дитрифторметилбензоильную группу,
2-метоксибензоильную группу, 3-метоксибензоильную группу,
4-метоксибензоильную группу, 2-трифторметоксибензоильную группу,
3-трифторметоксибензоильную группу,
4-трифторметоксибензоильную группу или тому подобное.
Примеры пиридильной группы (которая может быть замещена в пиридиновом кольце по крайней мере одним атомом галогена в качестве заместителя) включают пиридильную группу (которая может быть замещена в пиридиновом кольце 1-3 атомами галогена в качестве заместителя), например 2-пиридильную группу,
3-пиридильную группу, 4-пиридильную группу,
2-хлорпиридин-3-ильную группу, 2-хлорпиридин-4-ильную группу,
2-хлорпиридин-5-ильную группу, 5-хлорпиридин-2-ильную группу,
4-хлорпиридин-2-ильную группу, 3-хлорпиридин-2-ильную группу,
2-фторпиридин-3-ильную группу, 2-фторпиридин-4-ильную группу,
2-фторпиридин-5-ильную группу, 5-фторпиридин-2-ильную группу,
4-фторпиридин-2-ильную группу, 3-фторпиридин-2-ильную группу,
2-бромпиридин-3-ильную группу, 2-бромпиридин-4-ильную группу,
2-бромпиридин-5-ильную группу, 5-бромпиридин-2-ильную группу,
4-бромпиридин-2-ильную группу, 3-бромпиридин-2-ильную группу,
2-бром-4-хлорпиридин-4-ильную группу,
2,6-дихлорпиридин-4-ильную группу,
2,4,6-трихлорпиридин-3-ильную группу или тому подобное.
Фенокси-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома(ов) галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой группу, содержащую феноксигруппу, незамещенную или замещенную 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, определенных выше, и С1-6алкильную группу, примеры которой включают феноксиметильную группу, 2-феноксиэтильную группу,
3-феноксипропильную группу, 4-феноксибутильную группу,
5-феноксипентильную группу, 6-феноксигексильную группу,
4-фторфеноксиметильную группу,
2-фтор-4-бромфеноксиметильную группу,
4-хлор-3-фторфеноксиметильную группу,
2,3,4-трихлорфеноксиметильную группу,
3,4,5-трихлорфеноксиметильную группу,
2,4,6-трихлорфеноксиметильную группу,
4-изопропилфеноксиметильную группу,
4-н-бутилфеноксиметильную группу,
4-метилфеноксиметильную группу, 2-метилфеноксиметильную группу,
3-метилфеноксиметильную группу,
2,4-диметилфеноксиметильную группу,
2,3-диметилфеноксиметильную группу,
2,6-диметилфеноксиметильную группу,
3,5-диметилфеноксиметильную группу,
2,5-диметилфеноксиметильную группу,
2,4,6-триметилфеноксиметильную группу,
3,5-дитрифторметилфеноксиметильную группу,
2,3,4,5,6-пентафторфеноксиметильную группу,
4-изопропоксифеноксиметильную группу,
4-н-бутоксифеноксиметильную группу,
4-метоксифеноксиметильную группу,
2-метоксифеноксиметильную группу,
3-метоксифеноксиметильную группу,
2,4-диметоксифеноксиметильную группу,
2,3-диметоксифеноксиметильную группу,
2,6-диметоксифеноксиметильную группу,
3,5-диметоксифеноксиметильную группу,
2,5-диметоксифеноксиметильную группу,
2,4,6-триметоксифеноксиметильную группу,
3,5-дитрифторметоксифеноксиметильную группу,
2-изопропоксифеноксиметильную группу,
3-хлор-4-метоксифеноксиметильную группу,
2-хлор-4-трифторметоксифеноксиметильную группу,
3-метил-4-фторфеноксиметильную группу,
4-бром-3-трифторметилфеноксиметильную группу,
2-(4-фторфенокси)этильную группу,
3-(4-фторфенокси)пропильную группу,
4-(4-фторфенокси)бутильную группу,
5-(4-фторфенокси)пентильную группу,
6-(4-фторфенокси)гексильную группу,
4-хлорфеноксиметильную группу, 2-(4-хлорфенокси)этильную группу,
3-(4-хлорфенокси)пропильную группу,
4-(4-хлорфенокси)бутильную группу,
5-(4-хлорфенокси)пентильную группу,
6-(4-хлорфенокси)гексильную группу,
4-метилфеноксиметильную группу,
2-(4-метилфенокси)этильную группу,
3-(4-метилфенокси)пропильную группу,
4-(4-метилфенокси)бутильную группу,
5-(4-метилфенокси)пентильную группу,
6-(4-метилфенокси)гексильную группу,
4-трифторметилфеноксиметильную группу,
2-(4-трифторметилфенокси)этильную группу,
3-(4-трифторметилфенокси)пропильную группу,
4-(4-трифторметилфенокси)бутильную группу,
5-(4-трифторметилфенокси)пентильную группу,
6-(4-трифторметилфенокси)гексильную группу,
4-трифторметоксифеноксиметильную группу,
2-(4-трифторметоксифенокси)этильную группу,
3-(4-трифторметоксифенокси)пропильную группу,
4-(4-трифторметоксифенокси)бутильную группу,
5-(4-трифторметоксифенокси)пентильную группу,
6-(4-трифторметоксифенокси)гексильную группу,
2-(4-метоксифенокси)этильную группу,
3-(4-метоксифенокси)пропильную группу,
4-(4-метоксифенокси)бутильную группу,
5-(4-метоксифенокси)пентильную группу,
6-(4-метоксифенокси)гексильную группу или тому подобное.
Бензоил-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает бензоил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например бензоилметильную группу, 2-бензоилэтильную группу,
1-бензоилэтильную группу, 3-бензоилпропильную группу,
4-бензоилбутильную группу, 5-бензоилпентильную группу,
6-бензоилгексильную группу, 2-метил-3-бензоилпропильную группу,
1,1-диметил-2-бензоилэтильную группу,
2-фторбензоилметильную группу, 3-фторбензоилметильную группу,
4-фторбензоилметильную группу, 2-хлорбензоилметильную группу,
3-хлорбензоилметильную группу, 4-хлорбензоилметильную группу,
2-бромбензоилметильную группу, 3-бромбензоилметильную группу,
4-бромбензоилметильную группу,
2-фтор-4-бромбензоилметильную группу,
4-хлор-3-фторбензоилметильную группу,
2,3,4-трихлорбензоилметильную группу,
2,4,6-трихлорбензоилметильную группу,
4-изопропилбензоилметильную группу,
4-н-бутилбензоилметильную группу,
2,4-диметилбензоилметильную группу,
2,3-диметилбензоилметильную группу,
2,6-диметилбензоилметильную группу,
3,5-диметилбензоилметильную группу,
2,5-диметилбензоилметильную группу,
2,4,6-триметилбензоилметильную группу,
3,5-дитрифторметилбензоилметильную группу,
2,3,4,5,6-пентафторбензоилметильную группу,
4-н-бутоксибензоилметильную группу,
2,4-диметоксибензоилметильную группу,
2,3-диметоксибензоилметильную группу,
2,6-диметоксибензоилметильную группу,
3,5-диметоксибензоилметильную группу,
2,5-диметоксибензоилметильную группу,
3,5-дитрифторметоксибензоилметильную группу,
3-хлор-4-метоксибензоилметильную группу,
2-хлор-4-трифторметоксибензоилметильную группу,
3-метил-4-фторбензоилметильную группу,
4-бром-3-трифторметилбензоилметильную группу,
2-трифторметилбензоилметильную группу,
3-трифторметилбензоилметильную группу,
4-трифторметилбензоилметильную группу,
2-трифторметоксибензоилметильную группу,
3-трифторметоксибензоилметильную группу,
4-трифторметоксибензоилметильную группу,
2-(2-фторбензоил)этильную группу,
2-(3-фторбензоил)этильную группу,
2-(4-фторбензоил)этильную группу,
2-(2-хлорбензоил)этильную группу,
2-(3-хлорбензоил)этильную группу,
2-(4-хлорбензоил)этильную группу,
2-(2-бромбензоил)этильную группу,
2-(3-бромбензоил)этильную группу,
2-(4-бромбензоил)этильную группу,
2-(2-трифторметилбензоил)этильную группу,
2-(3-трифторметилбензоил)этильную группу,
2-(4-трифторметилбензоил)этильную группу,
2-(2-трифторметоксибензоил)этильную группу,
2-(3-трифторметоксибензоил)этильную группу,
2-(4-трифторметоксибензоил)этильную группу,
3-(2-хлорбензоил)пропильную группу,
3-(3-хлорбензоил)пропильную группу,
3-(4-хлорбензоил)пропильную группу,
3-(2-трифторметилбензоил)пропильную группу,
3-(3-трифторметилбензоил)пропильную группу,
3-(4-трифторметилбензоил)пропильную группу,
3-(2-трифторметоксибензоил)пропильную группу,
3-(3-трифторметоксибензоил)пропильную группу,
3-(4-трифторметоксибензоил)пропильную группу,
4-(2-хлорбензоил)бутильную группу,
4-(3-хлорбензоил)бутильную группу,
4-(4-хлорбензоил)бутильную группу,
4-(2-трифторметилбензоил)бутильную группу,
4-(3-трифторметилбензоил)бутильную группу,
4-(4-трифторметилбензоил)бутильную группу,
4-(2-трифторметоксибензоил)бутильную группу,
4-(3-трифторметоксибензоил)бутильную группу,
4-(4-трифторметоксибензоил)бутильную группу,
5-(2-хлорбензоил)пентильную группу,
5-(3-хлорбензоил)пентильную группу,
5-(4-хлорбензоил)пентильную группу,
5-(2-трифторметилбензоил)пентильную группу,
5-(3-трифторметилбензоил)пентильную группу,
5-(4-трифторметилбензоил)пентильную группу,
5-(2-трифторметоксибензоил)пентильную группу,
5-(3-трифторметоксибензоил)пентильную группу,
5-(4-трифторметоксибензоил)пентильную группу,
6-(2-хлорбензоил)гексильную группу,
6-(3-хлорбензоил)гексильную группу,
6-(4-хлорбензоил)гексильную группу,
6-(2-трифторметилбензоил)гексильную группу,
6-(3-трифторметилбензоил)гексильную группу,
6-(4-трифторметилбензоил)гексильную группу,
6-(2-трифторметоксибензоил)гексильную группу,
6-(3-трифторметоксибензоил)гексильную группу,
6-(4-трифторметоксибензоил)гексильную группу или тому подобное.
Феноксигруппа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; С1-4алкилендиоксигруппы; С1-6алкоксикарбонильной группы; цианогруппы; С2-6алкенильной группы; нитрогруппы; фенильной группы; аминогруппы, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из фенильной группы, С1-6алкильной группы, карбамоильной группы и С1-6алканоильной группы; С1-6алкильной группы, замещенной С1-6алканоильной группой; гидроксильной группы; С1-6алкильной группы, замещенной С1-6алкоксикарбонильной группой; фенил-С1-6алкильной группы; С1-6алканоильной группы; С1-6алкилтиогруппы; 1,2,4-триазолильной группы; изоксазолильной группы; имидазолильной группы; бензотриазолильной группы; 2Н-бензотриазолильной группы; пирролильной группы; бензоксазолильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя); пиперидинильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной аминогруппой (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя); и карбамоильной группы)) включает феноксигруппу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; С1-4алкилендиоксигруппы; С1-6алкоксикарбонильной группы; цианогруппы; С2-6алкенильной группы; нитрогруппы; фенильной группы; аминогруппы, которая может содержать в качестве заместителя 1-2 группы, выбранные из группы, состоящей из фенильной группы, С1-6алкильной группы, карбамоильной группы и С1-6алканоильной группы; С1-6алкильной группы, замещенной С1-6алканоильной группой; гидроксильной группы; С1-6алкильной группы, замещенной С1-6алкоксикарбонильной группой; фенил-С1-6алкильной группы; С1-6алканоильной группы; С1-6алкилтиогруппы; 1,2,4-триазолильной группы; изоксазолильной группы; имидазолильной группы; бензотриазолильной группы; 2Н-бензотриазолильной группы; пирролильной группы; бензоксазолильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя); пиперидинильной группы (которая может быть замещена в пиперидиновом кольце 1-3 группами, выбранными из группы, состоящей из аминогруппы (которая может быть замещена в аминогруппе 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя); и карбамоильной группы), например феноксигруппу,
2-фторфеноксигруппу, 3-фторфеноксигруппу,
4-фторфеноксигруппу, 2-хлорфеноксигруппу, 3-хлорфеноксигруппу,
4-хлорфеноксигруппу, 2-бромфеноксигруппу, 3-бромфеноксигруппу,
4-бромфеноксигруппу, 2-иодфеноксигруппу, 3-иодфеноксигруппу,
4-иодфеноксигруппу, 2,3-дифторфеноксигруппу,
3,4-дифторфеноксигруппу, 3,5-дифторфеноксигруппу,
2,4-дифторфеноксигруппу, 2,6-дифторфеноксигруппу,
2,3-дихлорфеноксигруппу, 3,4-дихлорфеноксигруппу,
3,5-дихлорфеноксигруппу, 2,4-дихлорфеноксигруппу,
2,6-дихлорфеноксигруппу, 2,3,4-трифторфеноксигруппу,
3,4,5-трифторфеноксигруппу, 3,4,5-трихлорфеноксигруппу,
2,4,6-трифторфеноксигруппу, 2,3,4,5,6-пентафторфеноксигруппу,
2,4,6-трихлорфеноксигруппу, 2-фтор-4-хлорфеноксигруппу,
2-фтор-4-бромфеноксигруппу, 3-фтор-4-хлорфеноксигруппу,
2-метилфеноксигруппу, 3-метилфеноксигруппу,
4-метилфеноксигруппу, 2,6-диметилфеноксигруппу,
2,4,6-триметилфеноксигруппу, 2-метил-3-хлорфеноксигруппу,
3-метил-4-хлорфеноксигруппу, 2-хлор-4-метилфеноксигруппу,
2-метил-3-фторфеноксигруппу, 2-трифторметилфеноксигруппу,
3-трифторметилфеноксигруппу, 4-трифторметилфеноксигруппу,
3,5-ди(трифторметил)феноксигруппу,
3,4-ди(трифторметил)феноксигруппу,
2,4-ди(трифторметил)феноксигруппу, 2-пентафторэтилфеноксигруппу,
3-пентафторэтилфеноксигруппу, 4-пентафторэтилфеноксигруппу,
2-изопропилфеноксигруппу, 3-изопропилфеноксигруппу,
4-изопропилфеноксигруппу, 2-трет-бутилфеноксигруппу,
3-трет-бутилфеноксигруппу, 4-трет-бутилфеноксигруппу,
2-втор-бутилфеноксигруппу, 3-втор-бутилфеноксигруппу,
4-втор-бутилфеноксигруппу, 4-н-бутилфеноксигруппу,
4-н-пентилфеноксигруппу, 4-н-гексилфеноксигруппу,
2-н-гептафторпропилфеноксигруппу,
3-н-гептафторпропилфеноксигруппу,
4-н-гептафторпропилфеноксигруппу, 4-пентилфеноксигруппу,
4-гексилфеноксигруппу, 2-метоксифеноксигруппу,
3-метоксифеноксигруппу, 4-метоксифеноксигруппу,
2-метокси-3-хлорфеноксигруппу, 2-фтор-3-метоксифеноксигруппу,
2-фтор-4-метоксифеноксигруппу, 2-фтор-4-бромфеноксигруппу,
2,4-диметилфеноксигруппу, 2,3-диметилфеноксигруппу,
3,5-диметилфеноксигруппу, 2,5-диметилфеноксигруппу,
4-изопропоксифеноксигруппу, 4-н-бутоксифеноксигруппу,
2,4-диметоксифеноксигруппу, 2,3-диметоксифеноксигруппу,
3,5-диметоксифеноксигруппу, 2,5-диметоксифеноксигруппу,
2,4,6-триметоксифеноксигруппу,
3,5-дитрифторметоксифеноксигруппу, 2-изопропоксифеноксигруппу,
3-хлор-4-метоксифеноксигруппу,
2-хлор-4-трифторметоксифеноксигруппу,
3-метил-4-фторфеноксигруппу, 4-бром-3-трифторметилфеноксигруппу,
2,6-диметоксифеноксигруппу, 2-трифторметоксифеноксигруппу,
3-трифторметоксифеноксигруппу, 4-трифторметоксифеноксигруппу,
2,3-ди(трифторметокси)феноксигруппу,
3,5-ди(трифторметокси)феноксигруппу,
2,4-ди(трифторметокси)феноксигруппу,
2-пентафторэтоксифеноксигруппу, 3-пентафторэтоксифеноксигруппу,
4-пентафторэтоксифеноксигруппу, 3-изопропоксифеноксигруппу,
2-трет-бутоксифеноксигруппу, 3-трет-бутоксифеноксигруппу,
4-трет-бутоксифеноксигруппу, 2-втор-бутоксифеноксигруппу,
3-втор-бутоксифеноксигруппу, 4-втор-бутоксифеноксигруппу,
4-н-гексилоксифеноксигруппу, 2-н-гептафторпропоксифеноксигруппу,
3-н-гептафторпропоксифеноксигруппу,
4-н-гептафторпропоксифеноксигруппу,
2,3-метилендиоксифеноксигруппу, 3,4-метилендиоксифеноксигруппу,
2,3-этилендиоксифеноксигруппу, 3,4-этилендиоксифеноксигруппу,
2-метоксикарбонилфеноксигруппу, 3-метоксикарбонилфеноксигруппу,
4-метоксикарбонилфеноксигруппу, 2-этоксикарбонилфеноксигруппу,
3-этоксикарбонилфеноксигруппу, 4-этоксикарбонилфеноксигруппу,
4-пропоксикарбонилфеноксигруппу, 4-бутоксикарбонилфеноксигруппу,
4-пентоксикарбонилфеноксигруппу,
4-гексилоксикарбонилфеноксигруппу, 2-цианофеноксигруппу,
3-цианофеноксигруппу, 4-цианофеноксигруппу,
2,3-дицианофеноксигруппу, 2,4,6-трицианофеноксигруппу,
2-винилфеноксигруппу, 3-винилфеноксигруппу,
4-винилфеноксигруппу, 2-аллилфеноксигруппу,
3-аллилфеноксигруппу, 4-аллилфеноксигруппу,
2-(3-бутенил)феноксигруппу, 3-(3-бутенил)феноксигруппу,
4-(3-бутенил)феноксигруппу, 2-(4-пентенил)феноксигруппу,
3-(4-пентенил)феноксигруппу, 4-(4-пентенил)феноксигруппу,
2-(5-гексенил)феноксигруппу, 3-(5-гексенил)феноксигруппу,
4-(5-гексенил)феноксигруппу, 2-нитрофеноксигруппу,
3-нитрофеноксигруппу, 4-нитрофеноксигруппу,
2,3-динитрофеноксигруппу, 2,4-динитрофеноксигруппу,
2,4,6-тринитрофеноксигруппу, 2-бифенилилоксигруппу,
3-бифенилилоксигруппу, 4-бифенилилоксигруппу,
2-диметиламинофеноксигруппу, 3-диметиламинофеноксигруппу,
4-диметиламинофеноксигруппу, 2-диэтиламинофеноксигруппу,
3-диэтиламинофеноксигруппу, 4-диэтиламинофеноксигруппу,
2-ди(н-пропил)аминофеноксигруппу,
3-ди(н-пропил)аминофеноксигруппу,
4-ди(н-пропил)аминофеноксигруппу, 2-дифениламинофеноксигруппу,
3-дифениламинофеноксигруппу, 4-дифениламинофеноксигруппу,
2-ацетиламинофеноксигруппу, 3-ацетиламинофеноксигруппу,
4-ацетиламинофеноксигруппу, 2-пропиониламинофеноксигруппу,
3-пропиониламинофеноксигруппу, 4-пропиониламинофеноксигруппу,
2-бутириламинофеноксигруппу, 3-бутириламинофеноксигруппу,
4-бутириламинофеноксигруппу, 4-пентаноиламинофеноксигруппу,
4-гексаноиламинофеноксигруппу,
3-(N-метил-N-фениламино)феноксигруппу,
2-(N-ацетил-N-метиламино)феноксигруппу,
2-карбамоиламинофеноксигруппу, 3-карбамоиламинофеноксигруппу,
4-карбамоиламинофеноксигруппу,
4-(N-ацетил-N-фениламино)феноксигруппу,
4-ацетилметилфеноксигруппу, 4-пропионилметилфеноксигруппу,
4-н-бутирилметилфеноксигруппу, 4-(2-ацетилэтил)феноксигруппу,
4-(3-ацетилпропил)феноксигруппу, 4-(4-ацетилбутил)феноксигруппу,
4-(5-ацетилпентил)феноксигруппу,
4-(6-ацетилгексил)феноксигруппу, 2-гидроксифеноксигруппу,
3-гидроксифеноксигруппу, 4-гидроксифеноксигруппу,
2,4-дигидроксифеноксигруппу, 2,4,6-тригидроксифеноксигруппу,
2-гидрокси-3-хлорфеноксигруппу, 2-фтор-3-гидроксифеноксигруппу,
2-фтор-4-гидроксифеноксигруппу,
4-метоксикарбонилметилфеноксигруппу,
4-этоксикарбонилметилфеноксигруппу,
4-н-пропоксикарбонилметилфеноксигруппу,
4-(2-этоксикарбонилэтил)феноксигруппу,
4-(3-этоксикарбонилпропил)феноксигруппу,
4-(4-этоксикарбонилбутил)феноксигруппу,
4-(5-этоксикарбонилпентил)феноксигруппу,
4-(6-этоксикарбонилгексил)феноксигруппу, 2-бензилфеноксигруппу,
3-бензилфеноксигруппу, 4-бензилфеноксигруппу,
2-(2-фенилэтил)феноксигруппу, 3-(2-фенилэтил)феноксигруппу,
4-(2-фенилэтил)феноксигруппу, 2-(3-фенилпропил)феноксигруппу,
3-(3-фенилпропил)феноксигруппу, 4-(3-фенилпропил)феноксигруппу,
2-(4-фенилбутил)феноксигруппу, 3-(4-фенилбутил)феноксигруппу,
4-(4-фенилбутил)феноксигруппу, 2-(5-фенилпентил)феноксигруппу,
3-(5-фенилпентил)феноксигруппу, 4-(5-фенилпентил)феноксигруппу,
2-(6-фенилгексил)феноксигруппу, 3-(6-фенилгексил)феноксигруппу,
4-(6-фенилгексил)феноксигруппу, 2-ацетилфеноксигруппу,
3-ацетилфеноксигруппу, 4-ацетилфеноксигруппу,
4-н-пропионилфеноксигруппу, 4-н-бутирилфеноксигруппу,
4-н-пентаноилфеноксигруппу, 4-н-гексаноилфеноксигруппу,
2-метилтиофеноксигруппу, 3-метилтиофеноксигруппу,
4-метилтиофеноксигруппу, 4-этилтиофеноксигруппу,
4-н-пропилтиофеноксигруппу, 4-изопропилтиофеноксигруппу,
4-н-бутилтиофеноксигруппу, 4-трет-бутилтиофеноксигруппу,
4-н-пентилтиофеноксигруппу, 4-н-гексилтиофеноксигруппу,
2,4-диметилтиофеноксигруппу, 3,4,5-диметилтиофеноксигруппу,
2-(1,2,4-триазол-1-ил)феноксигруппу,
3-(1,2,4-триазолил-1-ил)феноксигруппу,
4-(1,2,4-триазол-1-ил)феноксигруппу,
2-(3-изоксазолил)феноксигруппу, 3-(4-изоксазолил)феноксигруппу,
4-(5-изоксазолил)феноксигруппу, 2-(1-имидазолил)феноксигруппу,
3-(1-имидазолил)феноксигруппу, 4-(1-имидазолил)феноксигруппу,
2-(2-бензотиазолил)феноксигруппу,
3-(2-бензотиазолил)феноксигруппу,
4-(2-бензотиазолил)феноксигруппу,
2-(2H-бензотриазол-2-ил)феноксигруппу,
3-(2H-бензотриазол-2-ил)феноксигруппу,
4-(2H-бензотриазол-2-ил)феноксигруппу,
2-(1-пирролил)феноксигруппу, 3-(1-пирролил)феноксигруппу,
4-(1-пирролил)феноксигруппу, 2-(2-бензоксазолил)феноксигруппу,
3-(2-бензоксазолил)феноксигруппу,
4-(2-бензоксазолил)феноксигруппу,
2-(1-пиперазинил)феноксигруппу, 3-(1-пиперазинил)феноксигруппу,
4-(1-пиперазинил)феноксигруппу,
4-(4-метоксикарбонил-1-пиперазинил)феноксигруппу,
4-(4-этоксикарбонил-1-пиперазинил)феноксигруппу,
4-(4-н-пропоксикарбонил-1-пиперазинил)феноксигруппу,
4-(4-н-бутоксикарбонил-1-пиперазинил)феноксигруппу,
4-(4-н-пентилоксикарбонил-1-пиперазинил)феноксигруппу,
4-(4-н-гексилоксикарбонил-1-пиперазинил)феноксигруппу,
4-(4-бензил-1-пиперазинил)феноксигруппу,
4-(4-(2-фенетил)-1-пиперазинил)феноксигруппу,
4-(4-(3-фенилпропил)-1-пиперазинил)феноксигруппу,
4-(4-(4-фенилбутил)-1-пиперазинил)феноксигруппу,
4-(4-(5-фенилпентил)-1-пиперазинил)феноксигруппу,
4-(4-(6-фенилгексил)-1-пиперазинил)феноксигруппу,
4-[4-(2-фторбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3-фторбензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-фторбензил)-1-пиперазинил]феноксигруппу,
4-[4-(2-хлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3-хлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-хлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(2,3-дихлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(2,4-дихлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3,4-дихлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3,5-дихлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3,4,5-трихлорбензил)-1-пиперазинил]феноксигруппу,
4-[4-(2-трифторметилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3-трифторметилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-трифторметилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-метилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3,4-диметилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(2,4,6-триметилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(2-пентафторэтилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(3-пентафторэтилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-пентафторэтилбензил)-1-пиперазинил]феноксигруппу,
4-[4-(2-трифторметоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(3-трифторметоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-трифторметоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-метоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(3,4-диметоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(2,4,6-триметоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(2-пентафторэтоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(3-пентафторэтоксибензил)-1-пиперазинил]феноксигруппу,
4-[4-(4-пентафторэтоксибензил)-1-пиперазинил]феноксигруппу,
4-{4-[2-(4-трифторметоксифенил)этил]-1-пиперазинил}феноксигруппу,
4-{4-[3-(4-трифторметоксифенил)пропил]-1-пиперазинил}феноксигруппу,
4-{4-[4-(4-трифторметоксифенил)бутил]-1-пиперазинил}феноксигруппу,
4-{4-[5-(4-трифторметоксифенил)пентил]-1-пиперазинил}феноксигруппу,
4-{4-[6-(4-трифторметоксифенил)гексил]-1-пиперазинил}феноксигруппу,
4-{4-[2-(4-трифторметилфенил)этил]-1-пиперазинил}феноксигруппу,
4-{4-[3-(4-трифторметилфенил)пропил]-1-пиперазинил}феноксигруппу,
4-{4-[4-(4-трифторметилфенил)бутил]-1-пиперазинил}феноксигруппу,
4-{4-[5-(4-трифторметилфенил)пентил]-1-пиперазинил}феноксигруппу,
4-{4-[6-(4-трифторметилфенил)гексил]-1-пиперазинил}феноксигруппу, 2-пиперидинофеноксигруппу,
3-пиперидинофеноксигруппу, 4-пиперидинофеноксигруппу,
2-(4-амино-1-пиперидил)феноксигруппу,
3-(4-амино-1-пиперидил)феноксигруппу,
4-(4-амино-1-пиперидил)феноксигруппу,
4-(4-метиламино-1-пиперидил)феноксигруппу,
4-(4-этиламино-1-пиперидил)феноксигруппу,
4-(4-н-пропиламино-1-пиперидил)феноксигруппу,
4-(4-диметиламино-1-пиперидил)феноксигруппу,
4-(4-диэтиламино-1-пиперидил)феноксигруппу,
4-(4-ди-н-пропиламино-1-пиперидил)феноксигруппу,
4-(4-фениламино-1-пиперидил)феноксигруппу,
4-[4-(N-фенил-N-метиламино)-1-пиперидил]феноксигруппу,
4-[4-(2-фторфениламино)-1-пиперидил]феноксигруппу,
4-[4-(3-фторфениламино)-1-пиперидил]феноксигруппу,
4-[4-(4-фторфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-хлорфениламино)-1-пиперидил]феноксигруппу,
4-[4-(3-хлорфениламино)-1-пиперидил)]феноксигруппу,
4-[4-(4-хлорфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2,3-дихлорфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2,4-дихлорфениламино)-1-пиперидил]феноксигруппу,
4-[4-(3,4-дихлорфениламино)-1-пиперидил]феноксигруппу,
4-[4-(3,5-дихлорфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-трифторметилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-метилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2,3-диметилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-трифторметилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2,4,6-триметилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(4-трифторметилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-пентафторэтилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(3-пентафторэтилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(4-пентафторэтилфениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-трифторметоксифениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-метоксифениламино)-1-пиперидил]феноксигруппу,
4-[4-(2,3-диметоксифениламино)-1-пиперидил]феноксигруппу,
4-[4-(2,4,6-триметоксифениламино)-1-пиперидил]феноксигруппу,
4-{4-[N-метил-N-(2,4,6-триметоксифениламино)]-1-пиперидил}феноксигруппу,
4-{4-[N-метил-N-(3,4-диметилфениламино)]-1-пиперидил}феноксигруппу,
4-[4-(3-трифторметоксифениламино)-1-пиперидил]феноксигруппу,
4-[4-(4-трифторметоксифениламино)-1-пиперидил]феноксигруппу,
4-[4-(2-пентафторэтоксифениламино)-1-пиперидил]феноксигруппу,
4-[4-(3-пентафторэтоксифениламино)-1-пиперидил]феноксигруппу,
4-[4-(4-пентафторэтоксифениламино)-1-пиперидил]феноксигруппу,
2-карбамоилфеноксигруппу, 3-карбамоилфеноксигруппу,
4-карбамоилфеноксигруппу или тому подобное.
Примеры фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включают фенильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), например фенильную группу,
2-фторфенильную группу, 3-фторфенильную группу,
4-фторфенильную группу, 2-хлорфенильную группу,
3-хлорфенильную группу, 4-хлорфенильную группу,
2-бромфенильную группу, 3-бромфенильную группу,
4-бромфенильную группу, 2-иодфенильную группу,
3-иодфенильную группу, 4-иодфенильную группу,
2,3-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,6-дифторфенильную группу, 2,3-дихлорфенильную группу,
3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,6-дихлорфенильную группу,
2,3,4-трифторфенильную группу, 3,4,5-трифторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
2,4,6-трихлорфенильную группу, 2-фтор-4-хлорфенильную группу,
2-фтор-4-бромфенильную группу, 3-фтор-4-хлорфенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2-метил-3-хлорфенильную группу,
3-метил-4-хлорфенильную группу, 2-хлор-4-метилфенильную группу,
2-метил-3-фторфенильную группу,
2-трифторметилфенильную группу, 3-трифторметилфенильную группу,
4-трифторметилфенильную группу, 2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-фтор-4-бромфенильную группу,
4-хлор-3-фторфенильную группу, 2,3,4-трихлорфенильную группу,
4-н-бутилфенильную группу, 2,4-диметилфенильную группу,
2,3-диметилфенильную группу, 2,4-диметилфенильную группу,
2,6-диметилфенильную группу, 3,5-диметилфенильную группу,
2,5-диметилфенильную группу, 2,4,6-триметилфенильную группу,
3,5-дитрифторметилфенильную группу, 4-н-бутоксифенильную группу,
2,4-диметоксифенильную группу, 2,3-диметоксифенильную группу,
2,6-диметоксифенильную группу, 3,5-диметоксифенильную группу,
2,5-диметоксифенильную группу,
3,5-дитрифторметоксифенильную группу,
2,4,6-триметоксифенильную группу,
3-хлор-4-метоксифенильную группу,
2-хлор-4-трифторметоксифенильную группу,
3-метил-4-фторфенильную группу,
4-бром-3-трифторметилфенильную группу, 2-метилфенильную группу,
3-метилфенильную группу, 4-метоксифенильную группу,
2-метокси-3-хлорфенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 2,6-диметоксифенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-пентилоксифенильную группу, 4-гексилоксифенильную группу,
2-феноксифенильную группу, 3-феноксифенильную группу,
4-феноксифенильную группу, 2-(2-хлорфенокси)фенильную группу,
2-(3-хлорфенокси)фенильную группу,
2-(4-хлорфенокси)фенильную группу,
3-(2-хлорфенокси)фенильную группу,
3-(3-хлорфенокси)фенильную группу,
3-(4-хлорфенокси)фенильную группу,
4-(2-хлорфенокси)фенильную группу,
4-(3-хлорфенокси)фенильную группу,
4-(4-хлорфенокси)фенильную группу,
2-(2-трифторметилфенокси)фенильную группу,
2-(2-метилфенокси)фенильную группу,
2-(3-трифторметилфенокси)фенильную группу,
2-(4-трифторметилфенокси)фенильную группу,
3-(2-трифторметилфенокси)фенильную группу,
3-(3-трифторметилфенокси)фенильную группу,
3-(4-трифторметилфенокси)фенильную группу,
4-(2-трифторметилфенокси)фенильную группу,
4-(3-трифторметилфенокси)фенильную группу,
4-(4-трифторметилфенокси)фенильную группу,
2-(2-трифторметоксифенокси)фенильную группу,
2-(3-трифторметоксифенокси)фенильную группу,
2-(4-трифторметоксифенокси)фенильную группу,
2-(4-метоксифенокси)фенильную группу,
2-(2,4-диметилфенокси)фенильную группу,
2-(2,4,6-триметилфенокси)фенильную группу,
2-(3,4-диметоксифенокси)фенильную группу,
2-(3,4,5-триметоксифенокси)фенильную группу,
3-(2-трифторметоксифенокси)фенильную группу,
3-(3-трифторметоксифенокси)фенильную группу,
3-(4-трифторметоксифенокси)фенильную группу,
4-(2-трифторметоксифенокси)фенильную группу,
4-(3-трифторметоксифенокси)фенильную группу,
4-(4-трифторметоксифенокси)фенильную группу или тому подобное.
С3-8циклоалкил-С1-6алкоксигруппа представляет собой группу, содержащую циклическую алкильную группу, содержащую 3-8 углеродных атомов, алкоксигруппу, содержащую 1-6 углеродных атомов, примеры которой включают циклопропилметоксигруппу,
2-циклопропилэтоксигруппу, 3-циклопропилпропоксигруппу,
4-циклопропилбутоксигруппу, 5-циклопропилпентилоксигруппу,
6-циклопропилгексилоксигруппу, циклобутилметоксигруппу,
2-циклобутилэтоксигруппу, 3-циклобутилпропоксигруппу,
4-циклобутилбутоксигруппу, 5-циклобутилпентилоксигруппу,
6-циклобутилгексилоксигруппу, циклопентилметоксигруппу,
2-циклопентилэтоксигруппу, 3-циклопентилпропоксигруппу,
4-циклопентилбутоксигруппу, 5-циклопентилпентилоксигруппу,
6-циклопентилгексилоксигруппу, циклогексилметоксигруппу,
2-циклогексилэтоксигруппу, 3-циклогексилпропоксигруппу,
4-циклогексилбутоксигруппу, 5-циклогексилпентилоксигруппу,
6-циклогексилгексилоксигруппу, циклогептилметоксигруппу,
2-циклогептилэтоксигруппу, 3-циклогептилпропоксигруппу,
4-циклогептилбутоксигруппу, 5-циклогептилпентилоксигруппу,
6-циклогептилгексилоксигруппу, циклооктилметоксигруппу,
2-циклооктилэтоксигруппу, 3-циклооктилпропоксигруппу,
4-циклооктилбутоксигруппу, 5-циклооктилпентилоксигруппу,
6-циклооктилгексилоксигруппу или тому подобное.
Фенилкарбамоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой группу, содержащую анилин, N-С1-6алкиланилин или N-фенил-С1-6алкиланилин, который может быть замещен в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, и карбонильную группу, примеры которой включают
фенилкарбамоильную группу, 2-фторфенилкарбамоильную группу,
3-фторфенилкарбамоильную группу,
4-фторфенилкарбамоильную группу,
2-хлорфенилкарбамоильную группу,
3-хлорфенилкарбамоильную группу,
4-хлорфенилкарбамоильную группу,
2-бромфенилкарбамоильную группу,
3-бромфенилкарбамоильную группу,
4-бромфенилкарбамоильную группу, 2-иодфенилкарбамоильную группу,
3-иодфенилкарбамоильную группу, 4-иодфенилкарбамоильную группу,
2,3-дифторфенилкарбамоильную группу,
3,4-дифторфенилкарбамоильную группу,
3,5-дифторфенилкарбамоильную группу,
2,4-дифторфенилкарбамоильную группу,
2,6-дифторфенилкарбамоильную группу,
2,3-дихлорфенилкарбамоильную группу,
3,4-дихлорфенилкарбамоильную группу,
3,5-дихлорфенилкарбамоильную группу,
2,4-дихлорфенилкарбамоильную группу,
2,6-дихлорфенилкарбамоильную группу,
3,4,5-трифторфенилкарбамоильную группу,
2,3,4,5,6-пентафторфенилкарбамоильную группу,
3,4,5-трихлорфенилкарбамоильную группу,
2,4,6-трифторфенилкарбамоильную группу,
2,4,6-трихлорфенилкарбамоильную группу,
2-метилфенилкарбамоильную группу,
3-метилфенилкарбамоильную группу,
4-метилфенилкарбамоильную группу,
2-метил-3-хлорфенилкарбамоильную группу,
3-метил-4-хлорфенилкарбамоильную группу,
2-хлор-4-метилфенилкарбамоильную группу,
2-метил-3-фторфенилкарбамоильную группу,
2-трифторметилфенилкарбамоильную группу,
3-трифторметилфенилкарбамоильную группу,
N-метил-N-фенилкарбамоильную группу,
N-(2-фторфенил)-N-метилкарбамоильную группу,
N-(3-фторфенил)-N-метилкарбамоильную группу,
N-(4-фторфенил)-N-метилкарбамоильную группу,
N-(2-хлорфенил)-N-метилкарбамоильную группу,
N-(3-хлорфенил)-N-метилкарбамоильную группу,
N-(4-хлорфенил)-N-метилкарбамоильную группу,
N-(4-бромфенил)-N-метилкарбамоильную группу,
N-(2-иодфенил)-N-метилкарбамоильную группу,
N-(3-иодфенил)-N-метилкарбамоильную группу,
N-(4-иодфенил)-N-метилкарбамоильную группу,
N-(2,3-дифторфенил)-N-метилкарбамоильную группу,
N-(3,4-дифторфенил)-N-метилкарбамоильную группу,
N-(3,5-дифторфенил)-N-метилкарбамоильную группу,
N-(2,4-дифторфенил)-N-метилкарбамоильную группу,
N-(2,6-дифторфенил)-N-метилкарбамоильную группу,
N-(2,3-дихлорфенил)-N-метилкарбамоильную группу,
N-(3,4-дихлорфенил)-N-метилкарбамоильную группу,
N-(3,5-дихлорфенил)-N-метилкарбамоильную группу,
N-(2,4-дихлорфенил)-N-метилкарбамоильную группу,
N-(2,6-дихлорфенил)-N-метилкарбамоильную группу,
N-(3,4,5-трифторфенил)-N-метилкарбамоильную группу,
N-(3,4,5-трихлорфенил)-N-метилкарбамоильную группу,
N-(2,4,6-трифторфенил)-N-метилкарбамоильную группу,
N-(2,4,6-трихлорфенил)-N-метилкарбамоильную группу,
N-(2-метилфенил)-N-метилкарбамоильную группу,
N-(3-метилфенил)-N-метилкарбамоильную группу,
N-(4-метилфенил)-N-метилкарбамоильную группу,
N-(2-метил-3-хлорфенил)-N-метилкарбамоильную группу,
N-(3-метил-4-хлорфенил)-N-метилкарбамоильную группу,
N-(2-хлор-4-метилфенил)-N-метилкарбамоильную группу,
N-(2-метил-3-фторфенил)-N-метилкарбамоильную группу,
N-(2-трифторметилфенил)-N-метилкарбамоильную группу,
N-(4-трифторметилфенил)-N-метилкарбамоильную группу,
N-бензил-N-фенилкарбамоильную группу,
N-бензил-N-(2-фторфенил)карбамоильную группу,
N-бензил-N-(3-фторфенил)карбамоильную группу,
N-бензил-N-(4-фторфенил)карбамоильную группу,
N-бензил-N-(2-хлорфенил)карбамоильную группу,
N-бензил-N-(3-хлорфенил)карбамоильную группу,
N-бензил-N-(4-хлорфенил)карбамоильную группу,
N-бензил-N-(2-бромфенил)карбамоильную группу,
N-бензил-N-(3-бромфенил)карбамоильную группу,
N-бензил-N-(4-бромфенил)карбамоильную группу,
N-бензил-N-(2-иодфенил)карбамоильную группу,
N-бензил-N-(3-иодфенил)карбамоильную группу,
N-бензил-N-(4-иодфенил)карбамоильную группу,
N-бензил-N-(2,3-дифторфенил)карбамоильную группу,
N-бензил-N-(3,4-дифторфенил)карбамоильную группу,
N-бензил-N-(3,5-дифторфенил)карбамоильную группу,
N-бензил-N-(2,4-дифторфенил)карбамоильную группу,
N-бензил-N-(2,6-дифторфенил)карбамоильную группу,
N-бензил-N-(2,3-дихлорфенил)карбамоильную группу,
N-бензил-N-(3,4-дихлорфенил)карбамоильную группу,
N-бензил-N-(3,5-дихлорфенил)карбамоильную группу,
N-бензил-N-(2,4-дихлорфенил)карбамоильную группу,
N-бензил-N-(2,6-дихлорфенил)карбамоильную группу,
N-бензил-N-(3,4,5-трифторфенил)карбамоильную группу,
N-бензил-N-(3,4,5-трихлорфенил)карбамоильную группу,
N-бензил-N-(2,4,6-трифторфенил)карбамоильную группу,
N-бензил-N-(2,4,6-трихлорфенил)карбамоильную группу,
N-бензил-N-(2-метилфенил)карбамоильную группу,
N-бензил-N-(3-метилфенил)карбамоильную группу,
N-бензил-N-(4-метилфенил)карбамоильную группу,
N-бензил-N-(2-метил-3-хлорфенил)карбамоильную группу,
N-бензил-N-(3-метил-4-хлорфенил)карбамоильную группу,
N-бензил-N-(2-хлор-4-метилфенил)карбамоильную группу,
N-бензил-N-(2-метил-3-фторфенил)карбамоильную группу,
N-бензил-N-(2-трифторметилфенил)карбамоильную группу,
N-бензил-N-(3-трифторметилфенил)карбамоильную группу,
N-бензил-N-(4-трифторметилфенил)карбамоильную группу,
2-пентафторэтилфенилкарбамоильную группу,
3-пентафторэтилфенилкарбамоильную группу,
4-пентафторэтилфенилкарбамоильную группу,
2-изопропилфенилкарбамоильную группу,
3-изопропилфенилкарбамоильную группу,
4-изопропилфенилкарбамоильную группу,
2-трет-бутилфенилкарбамоильную группу,
3-трет-бутилфенилкарбамоильную группу,
4-трет-бутилфенилкарбамоильную группу,
2-втор-бутилфенилкарбамоильную группу,
3-втор-бутилфенилкарбамоильную группу,
4-втор-бутилфенилкарбамоильную группу,
2-н-гептафторпропилфенилкарбамоильную группу,
3-н-гептафторпропилфенилкарбамоильную группу,
4-н-гептафторпропилфенилкарбамоильную группу,
4-пентилфенилкарбамоильную группу,
4-гексилфенилкарбамоильную группу,
2,4-диметилфенилкарбамоильную группу,
2,4,6-триметилфенилкарбамоильную группу,
3,4-диметоксифенилкарбамоильную группу,
3,4,5-триметоксифенилкарбамоильную группу,
2-метоксифенилкарбамоильную группу,
3-метоксифенилкарбамоильную группу,
4-метоксифенилкарбамоильную группу,
2-метокси-3-хлорфенилкарбамоильную группу,
2-фтор-3-метоксифенилкарбамоильную группу,
2-фтор-4-метоксифенилкарбамоильную группу,
2,6-диметоксифенилкарбамоильную группу,
2,3,4-трифторфенилкарбамоильную группу,
3,4,5-трифторфенилкарбамоильную группу,
2-трифторметоксифенилкарбамоильную группу,
3-трифторметоксифенилкарбамоильную группу,
4-трифторметоксифенилкарбамоильную группу,
2-пентафторэтоксифенилкарбамоильную группу,
3-пентафторэтоксифенилкарбамоильную группу,
4-пентафторэтоксифенилкарбамоильную группу,
2-изопропоксифенилкарбамоильную группу,
3-изопропоксифенилкарбамоильную группу,
4-изопропоксифенилкарбамоильную группу,
2-трет-бутоксифенилкарбамоильную группу,
3-трет-бутоксифенилкарбамоильную группу,
4-трет-бутоксифенилкарбамоильную группу,
2-втор-бутоксифенилкарбамоильную группу,
3-втор-бутоксифенилкарбамоильную группу,
4-втор-бутоксифенилкарбамоильную группу,
2-н-гептафторпропоксифенилкарбамоильную группу,
3-н-гептафторпропоксифенилкарбамоильную группу,
4-н-гептафторпропоксифенилкарбамоильную группу,
4-н-пентилоксифенилкарбамоильную группу,
4-н-гексилоксифенилкарбамоильную группу или тому подобное.
Примеры нафтилоксигруппы (которая может быть замещена в нафталиновом кольце по крайней мере одной С1-6алкильной группой в качестве заместителя) включают нафтилоксигруппу (которая может быть замещена 1-3 С1-6алкильными группами в качестве заместителя), например 1-нафтилоксигруппу, 2-нафтилоксигруппу,
2-метил-1-нафтилоксигруппу, 3-метил-1-нафтилоксигруппу,
4-метил-1-нафтилоксигруппу, 5-метил-1-нафтилоксигруппу,
6-метил-1-нафтилоксигруппу, 7-метил-1-нафтилоксигруппу,
8-метил-1-нафтилоксигруппу, 1-метил-2-нафтилоксигруппу,
5-метил-2-нафтилоксигруппу, 4-этил-1-нафтилоксигруппу,
5-этил-1-нафтилоксигруппу, 6-этил-1-нафтилоксигруппу,
1-этил-2-нафтилоксигруппу, 5-этил-2-нафтилоксигруппу,
5-н-пропил-1-нафтилоксигруппу, 6-н-пропил-1-нафтилоксигруппу,
1-н-пропил-2-нафтилоксигруппу, 5-н-пропил-2-нафтилоксигруппу,
5-н-бутил-1-нафтилоксигруппу, 6-н-бутил-1-нафтилоксигруппу,
1-н-бутил-2-нафтилоксигруппу, 5-н-бутил-1-нафтилоксигруппу,
5-н-пентил-1-нафтилоксигруппу, 6-н-пентил-1-нафтилоксигруппу,
1-н-пентил-2-нафтилоксигруппу, 5-н-пентил-2-нафтилоксигруппу,
5-н-гексил-1-нафтилоксигруппу, 6-н-гексил-1-нафтилоксигруппу,
1-н-гексил-2-нафтилоксигруппу, 5-н-гексил-2-нафтилоксигруппу,
2,4-диметил-1-нафтилоксигруппу,
4,6,7-триметил-2-нафтилоксигруппу или тому подобное.
Примеры 2,3-дигидробензофурилоксигруппы (которая может быть замещена в 2,3-дигидробензофурановом кольце по крайней мере одной группой, выбранной из С1-6алкильной группы и оксогруппы) включают 2,3-дигидробензофурилоксигруппу (которая может быть замещена в 2,3-дигидробензофурановом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы и оксогруппы), например 2,3-дигидробензофуран-3-илоксигруппу,
2,3-дигидробензофуран-4-илоксигруппу,
2,3-дигидробензофуран-5-илоксигруппу,
2,3-дигидробензофуран-6-илоксигруппу,
2,3-дигидробензофуран-7-илоксигруппу,
2-оксо-2,3-дигидробензофуран-3-илоксигруппу,
2-оксо-2,3-дигидробензофуран-4-илоксигруппу,
2-оксо-2,3-дигидробензофуран-5-илоксигруппу,
2-оксо-2,3-дигидробензофуран-6-илоксигруппу,
2-оксо-2,3-дигидробензофуран-7-илоксигруппу,
3-оксо-2,3-дигидробензофуран-2-илоксигруппу,
3-оксо-2,3-дигидробензофуран-4-илоксигруппу,
3-оксо-2,3-дигидробензофуран-5-илоксигруппу,
3-оксо-2,3-дигидробензофуран-6-илоксигруппу,
3-оксо-2,3-дигидробензофуран-7-илоксигруппу,
2-метил-2,3-дигидробензофуран-3-илоксигруппу,
2-метил-2,3-дигидробензофуран-4-илоксигруппу,
2-метил-2,3-дигидробензофуран-5-илоксигруппу,
2-метил-2,3-дигидробензофуран-6-илоксигруппу,
2-метил-2,3-дигидробензофуран-7-илоксигруппу,
2-этил-2,3-дигидробензофуран-3-илоксигруппу,
2-этил-2,3-дигидробензофуран-4-илоксигруппу,
2-этил-2,3-дигидробензофуран-5-илоксигруппу,
2-этил-2,3-дигидробензофуран-6-илоксигруппу,
2-этил-2,3-дигидробензофуран-7-илоксигруппу,
4-метил-2,3-дигидробензофуран-3-илоксигруппу,
5-метил-2,3-дигидробензофуран-4-илоксигруппу,
4-метил-2,3-дигидробензофуран-5-илоксигруппу,
4-метил-2,3-дигидробензофуран-6-илоксигруппу,
4-метил-2,3-дигидробензофуран-7-илоксигруппу,
6-метил-2,3-дигидробензофуран-3-илоксигруппу,
6-метил-2,3-дигидробензофуран-4-илоксигруппу,
6-метил-2,3-дигидробензофуран-5-илоксигруппу,
6-метил-2,3-дигидробензофуран-7-илоксигруппу,
7-метил-2,3-дигидробензофуран-3-илоксигруппу,
7-метил-2,3-дигидробензофуран-4-илоксигруппу,
7-метил-2,3-дигидробензофуран-5-илоксигруппу,
7-метил-2,3-дигидробензофуран-6-илоксигруппу,
2-н-пропил-2,3-дигидробензофуран-5-илоксигруппу,
2-н-пропил-2,3-дигидробензофуран-6-илоксигруппу,
2-н-бутил-2,3-дигидробензофуран-5-илоксигруппу,
2-н-бутил-2,3-дигидробензофуран-6-илоксигруппу,
2-н-пентил-2,3-дигидробензофуран-5-илоксигруппу,
2-н-пентил-2,3-дигидробензофуран-6-илоксигруппу,
2-н-гексил-2,3-дигидробензофуран-5-илоксигруппу,
2-н-гексил-2,3-дигидробензофуран-6-илоксигруппу,
2,2-диметил-2,3-дигидробензофуран-5-илоксигруппу,
2,2,4-триметил-2,3-дигидробензофуран-5-илоксигруппу,
3-оксо-4-метил-2,3-дигидробензофуран-5-илоксигруппу,
2,2-диметил-3-оксо-2,3-дигидробензофуран-5-илоксигруппу или тому подобное.
Примеры бензотиазолилоксигруппы (которая может быть замещена в бензотиазольном кольце по крайней мере одной С1-6алкильной группой) включают бензотиазолилоксигруппу (которая может быть замещена в бензотиазольном кольце 1-3 С1-6алкильными группами), например 2-бензотиазолилоксигруппу,
4-бензотиазолилоксигруппу, 5-бензотиазолилоксигруппу,
6-бензотиазолилоксигруппу, 7-бензотиазолилоксигруппу,
2-метил-5-бензотиазолилоксигруппу,
4-метил-5-бензотиазолилоксигруппу,
6-метил-5-бензотиазолилоксигруппу,
7-метил-5-бензотиазолилоксигруппу,
4-этил-2-бензотиазолилоксигруппу,
5-этил-2-бензотиазолилоксигруппу,
6-этил-4-бензотиазолилоксигруппу,
7-этил-6-бензотиазолилоксигруппу,
4-н-пропил-7-бензотиазолилоксигруппу,
5-н-пропил-2-бензотиазолилоксигруппу,
6-н-пропил-2-бензотиазолилоксигруппу,
7-н-пропил-5-бензотиазолилоксигруппу,
4-н-бутил-5-бензотиазолилоксигруппу,
5-н-бутил-2-бензотиазолилоксигруппу,
6-н-бутил-2-бензотиазолилоксигруппу,
7-н-бутил-4-бензотиазолилоксигруппу,
4-н-пентил-6-бензотиазолилоксигруппу,
5-н-пентил-7-бензотиазолилоксигруппу,
6-н-пентил-2-бензотиазолилоксигруппу,
7-н-пентил-2-бензотиазолилоксигруппу,
4-н-гексил-2-бензотиазолилоксигруппу,
5-н-гексил-2-бензотиазолилоксигруппу,
6-н-гексил-2-бензотиазолилоксигруппу,
7-н-гексил-2-бензотиазолилоксигруппу,
2,4-диметил-5-бензотиазолилоксигруппу,
2,4,6-триметил-5-бензотиазолилоксигруппу или тому подобное.
Примеры 1,2,3,4-тетрагидронафтилоксигруппы (которая может быть замещена в 1,2,3,4-тетрагидронафталиновом кольце по крайней мере одной оксогруппой в качестве заместителя) включают
1,2,3,4-тетрагидро-1-нафтилоксигруппу,
1,2,3,4-тетрагидро-2-нафтилоксигруппу,
1,2,3,4-тетрагидро-6-нафтилоксигруппу,
1,2,3,4-тетрагидро-5-нафтилоксигруппу,
1,2,3,4-тетрагидро-1-оксо-5-нафтилоксигруппу,
1,2,3,4-тетрагидро-2-оксо-3-нафтилоксигруппу,
1,2,3,4-тетрагидро-1-оксо-6-нафтилоксигруппу,
1,2,3,4-тетрагидро-3-оксо-5-нафтилоксигруппу,
1,2,3,4-тетрагидро-4-оксо-6-нафтилоксигруппу,
1,2,3,4-тетрагидро-2-оксо-7-нафтилоксигруппу,
1,2,3,4-тетрагидро-1-оксо-8-нафтилоксигруппу или тому подобное.
Примеры 1,3-бензоксатиоланилоксигруппы (которая может быть замещена в 1,3-бензоксатиолановом кольце по крайней мере одной оксогруппой в качестве заместителя) включают
1,3-бензоксатиолан-4-илоксигруппу,
1,3-бензоксатиолан-5-илоксигруппу,
1,3-бензоксатиолан-6-илоксигруппу,
1,3-бензоксатиолан-7-илоксигруппу,
2-оксо-1,3-бензоксатиолан-5-илоксигруппу,
2-оксо-1,3-бензоксатиолан-6-илоксигруппу,
2-оксо-1,3-бензоксатиолан-7-илоксигруппу или тому подобное.
Примеры изохинолилоксигруппы включают
изохинолин-1-илоксигруппу, изохинолин-3-илоксигруппу,
изохинолин-4-илоксигруппу, изохинолин-5-илоксигруппу,
изохинолин-6-илоксигруппу, изохинолин-7-илоксигруппу,
изохинолин-8-илоксигруппу или тому подобное.
Примеры пиридилоксигруппы включают 2-пиридилоксигруппу, 3-пиридилоксигруппу или 4-пиридилоксигруппу.
Примеры хинолилоксигруппы (которая может быть замещена в хинолиновом кольце по крайней мере одной С1-6алкильной группой в качестве заместителя) включают хинолилоксигруппу (которая может быть замещена в хинолиновом кольце 1-3 С1-6алкильными группами в качестве заместителя), например 2-хинолилоксигруппу,
3-хинолилоксигруппу, 4-хинолилоксигруппу, 5-хинолилоксигруппу,
6-хинолилоксигруппу, 7-хинолилоксигруппу, 8-хинолилоксигруппу,
3-метил-2-хинолилоксигруппу, 4-метил-2-хинолилоксигруппу,
5-метил-2-хинолилоксигруппу, 6-метил-2-хинолилоксигруппу,
7-метил-2-хинолилоксигруппу, 2-метил-3-хинолилоксигруппу,
4-метил-3-хинолилоксигруппу, 5-метил-3-хинолилоксигруппу,
6-метил-3-хинолилоксигруппу, 7-метил-3-хинолилоксигруппу,
8-метил-3-хинолилоксигруппу, 2-метил-4-хинолилоксигруппу,
3-метил-4-хинолилоксигруппу, 5-метил-4-хинолилоксигруппу,
6-метил-4-хинолилоксигруппу, 7-метил-4-хинолилоксигруппу,
8-метил-4-хинолилоксигруппу, 2-метил-5-хинолилоксигруппу,
4-метил-5-хинолилоксигруппу, 3-метил-5-хинолилоксигруппу,
6-метил-5-хинолилоксигруппу, 7-метил-5-хинолилоксигруппу,
8-метил-5-хинолилоксигруппу, 2-метил-6-хинолилоксигруппу,
4-метил-6-хинолилоксигруппу, 5-метил-6-хинолилоксигруппу,
3-метил-6-хинолилоксигруппу, 7-метил-6-хинолилоксигруппу,
8-метил-6-хинолилоксигруппу, 2-метил-7-хинолилоксигруппу,
4-метил-7-хинолилоксигруппу, 5-метил-7-хинолилоксигруппу,
6-метил-7-хинолилоксигруппу, 3-метил-7-хинолилоксигруппу,
8-метил-7-хинолилоксигруппу, 2-метил-8-хинолилоксигруппу,
4-метил-8-хинолилоксигруппу, 5-метил-8-хинолилоксигруппу,
6-метил-8-хинолилоксигруппу, 7-метил-8-хинолилоксигруппу,
3-метил-8-хинолилоксигруппу, 2,5-диметил-8-хинолилоксигруппу,
6,7-диметил-4-хинолилоксигруппу,
4,6,7-триметил-5-хинолилоксигруппу, соединения, замещенные этильной группой, н-пропильной группой, н-бутильной группой, н-пентильной группой или н-гексильной группой вместо метильной группы данных соединений или тому подобное.
Примеры дибензофурилоксигруппы включают
1-дибензофурилоксигруппу, 2-дибензофурилоксигруппу,
3-дибензофурилоксигруппу, 4-дибензофурилоксигруппу,
5-дибензофурилоксигруппу, 6-дибензофурилоксигруппу,
7-дибензофурилоксигруппу, 8-дибензофурилоксигруппу или
9-дибензофурилоксигруппу.
Примеры 2H-хроменилоксигруппы (которая может быть замещена в 2H-хроменовом кольце по крайней мере одной оксогруппой в качестве заместителя) включают 4-(2H)-хроменилоксигруппу,
5-(2H)-хроменилоксигруппу, 6-(2H)-хроменилоксигруппу,
7-(2H)-хроменилоксигруппу, 8-(2H)-хроменилоксигруппу,
2-оксо-4-(2H)-хроменилоксигруппу,
2-оксо-5-(2H)-хроменилоксигруппу,
2-оксо-6-(2H)-хроменилоксигруппу,
2-оксо-7-(2H)-хроменилоксигруппу,
2-оксо-8-(2H)-хроменилоксигруппу или тому подобное.
Примеры бензизоксазолилоксигруппы включают
3-бензизоксазолилоксигруппу, 4-бензизоксазолилоксигруппу,
5-бензизоксазолилоксигруппу, 6-бензизоксазолилоксигруппу,
7-бензизоксазолилоксигруппу или тому подобное.
Примеры хиноксалилоксигруппы включают
2-хиноксалилоксигруппу, 5-хиноксалилоксигруппу,
6-хиноксалилоксигруппу или тому подобное.
Примеры 2,3-дигидро-1H-инденилоксигруппы (которая может быть замещена в 2,3-дигидро-1H-инденовом кольце по крайней мере одной оксогруппой в качестве заместителя) включают
2,3-дигидро-1H-инден-1-илоксигруппу,
2,3-дигидро-1H-инден-2-илоксигруппу,
2,3-дигидро-1H-инден-3-илоксигруппу,
2,3-дигидро-1H-инден-4-илоксигруппу,
2,3-дигидро-1H-инден-5-илоксигруппу,
2,3-дигидро-1H-инден-6-илоксигруппу,
2,3-дигидро-1H-инден-7-илоксигруппу,
2,3-дигидро-1-оксо-1H-инден-2-илоксигруппу,
2,3-дигидро-1-оксо-1H-инден-3-илоксигруппу,
2,3-дигидро-1-оксо-1H-инден-4-илоксигруппу,
2,3-дигидро-1-оксо-1H-инден-5-илоксигруппу,
2,3-дигидро-1-оксо-1H-инден-6-илоксигруппу,
2,3-дигидро-1-оксо-1H-инден-7-илоксигруппу или тому подобное.
Примеры бензофуразанилоксигруппы включают, например, 4-бензофуразанилоксигруппу, 5-бензофуразанилоксигруппу или тому подобное.
Фенил-С2-6алкенильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой группу, содержащую фенильную группу, незамещенную или замещенную 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы. Указанные группы могут существовать в транс- или цис-форме, и данная группа, разумеется, включает обе эти формы. Данные фенил-С2-6алкенильные группы включают, например, 3-(2-фторфенил)-2-пропенильную группу,
3-(3-фторфенил)-2-пропенильную группу,
3-(4-фторфенил)-2-пропенильную группу,
3-(2,3-дифторфенил)-2-пропенильную группу,
3-(2,3,4,5,6-пентафторфенил)-2-пропенильную группу,
3-(2,4-дифторфенил)-2-пропенильную группу,
3-(3,4-дифторфенил)-2-пропенильную группу,
3-(3,5-дифторфенил)-2-пропенильную группу,
3-(2-хлорфенил)-2-пропенильную группу,
3-(3-хлорфенил)-2-пропенильную группу,
3-(4-хлорфенил)-2-пропенильную группу,
3-(2,3-дихлорфенил)-2-пропенильную группу,
3-(2,4-дихлорфенил)-2-пропенильную группу,
3-(3,4-дихлорфенил)-2-пропенильную группу,
3-(3,5-дихлорфенил)-2-пропенильную группу,
3-(2-бромфенил)-2-пропенильную группу,
3-(3-бромфенил)-2-пропенильную группу,
3-(4-бромфенил)-2-пропенильную группу,
3-(2-метилфенил)-2-пропенильную группу,
3-(3-метилфенил)-2-пропенильную группу,
3-(4-метилфенил)-2-пропенильную группу,
3-(2-трифторметилфенил)-2-пропенильную группу,
3-(2-фтор-4-бромфенил)-2-пропенильную группу,
3-(4-хлор-3-фторфенил)-2-пропенильную группу,
3-(2,3,4-трихлорфенил)-2-пропенильную группу,
3-(2,4,6-трихлорфенил)-2-пропенильную группу,
3-(4-изопропилфенил)-2-пропенильную группу,
3-(4-н-бутилфенил)-2-пропенильную группу,
3-(2,4-диметилфенил)-2-пропенильную группу,
3-(2,3-диметилфенил)-2-пропенильную группу,
3-(2,6-диметилфенил)-2-пропенильную группу,
3-(3,5-диметилфенил)-2-пропенильную группу,
3-(2,5-диметилфенил)-2-пропенильную группу,
3-(2,4,6-триметилфенил)-2-пропенильную группу,
3-(3,5-дитрифторметилфенил)-2-пропенильную группу,
3-(4-н-бутоксифенил)-2-пропенильную группу,
3-(2,4-диметоксифенил)-2-пропенильную группу,
3-(2,3-диметоксифенил)-2-пропенильную группу,
3-(2,6-диметоксифенил)-2-пропенильную группу,
3-(3,5-диметоксифенил)-2-пропенильную группу,
3-(2,5-диметоксифенил)-2-пропенильную группу,
3-(3,5-дитрифторметоксифенил)-2-пропенильную группу,
3-(3-хлор-4-метоксифенил)-2-пропенильную группу,
3-(2-хлор-4-трифторметоксифенил)-2-пропенильную группу,
3-(3-метил-4-фторфенил)-2-пропенильную группу,
3-(4-бром-3-трифторметилфенил)-2-пропенильную группу,
3-(3-трифторметилфенил)-2-пропенильную группу,
3-(4-трифторметилфенил)-2-пропенильную группу,
3-(2-трифторметоксифенил)-2-пропенильную группу,
3-(3-трифторметоксифенил)-2-пропенильную группу,
3-(4-трифторметоксифенил)-2-пропенильную группу,
3-(2-метоксифенил)-2-пропенильную группу,
3-(3-метоксифенил)-2-пропенильную группу,
3-(4-метоксифенил)-2-пропенильную группу,
3-(3,4-диметоксифенил)-2-пропенильную группу,
4-(4-хлорфенил)-2-бутенильную группу,
4-(4-хлорфенил)-3-бутенильную группу,
5-(4-хлорфенил)-2-пентенильную группу,
5-(4-хлорфенил)-4-пентенильную группу,
5-(4-хлорфенил)-3-пентенильную группу,
6-(4-хлорфенил)-5-гексенильную группу,
6-(4-хлорфенил)-4-гексенильную группу,
6-(4-хлорфенил)-3-гексенильную группу,
6-(4-хлорфенил)-3-гексенильную группу или тому подобное.
Примеры С1-6алкильной группы (алкильная группа может быть замещена морфолиногруппой, бензоильной группой и карбамоильной группой, которая может содержать С1-6алкильную группу в качестве заместителя или цианогруппу) включают метильную группу,
этильную группу, н-пропильную группу, н-бутильную группу,
н-пентильную группу, н-гексильную группу,
морфолинометильную группу, 2-морфолиноэтильную группу,
3-морфолинопропильную группу, 4-морфолинобутильную группу,
5-морфолинопентильную группу, 6-морфолиногексильную группу,
бензоилметильную группу, 2-бензоилэтильную группу,
1-бензоилэтильную группу, 3-бензоилпропильную группу,
4-бензоилбутильную группу, 5-бензоилпентильную группу,
6-бензоилгексильную группу, карбамоилметильную группу,
2-карбамоилэтильную группу, 1-карбамоилэтильную группу,
3-карбамоилпропильную группу,
4-карбамоилбутильную группу, 5-карбамоилпентильную группу,
6-карбамоилгексильную группу,
2-метил-3-карбамоилпропильную группу,
1,1-диметил-2-карбамоилэтильную группу,
метилкарбамоилметильную группу, 2-метилкарбамоилэтильную группу,
3-метилкарбамоилпропильную группу,
4-метилкарбамоилбутильную группу,
5-метилкарбамоилпентильную группу,
6-метилкарбамоилгексильную группу,
диметилкарбамоилметильную группу,
2-диметилкарбамоилэтильную группу,
3-диметилкарбамоилпропильную группу,
4-диметилкарбамоилбутильную группу,
5-диметилкарбамоилпентильную группу,
6-диметилкарбамоилгексильную группу,
диэтилкарбамоилметильную группу,
2-диэтилкарбамоилэтильную группу,
3-диэтилкарбамоилпропильную группу,
4-диэтилкарбамоилбутильную группу,
5-диэтилкарбамоилпентильную группу,
6-диэтилкарбамоилгексильную группу,
н-пропилкарбамоилметильную группу,
2-н-пропилкарбамоилэтильную группу,
3-н-пропилкарбамоилпропильную группу,
4-н-пропилкарбамоилбутильную группу,
5-н-пропилкарбамоилпентильную группу,
6-н-пропилкарбамоилгексильную группу,
н-бутилкарбамоилметильную группу,
2-н-бутилкарбамоилэтильную группу,
3-н-бутилкарбамоилпропильную группу,
4-н-бутилкарбамоилбутильную группу,
5-н-бутилкарбамоилпентильную группу,
6-н-бутилкарбамоилгексильную группу,
н-гексилкарбамоилметильную группу,
2-н-гексилкарбамоилэтильную группу,
3-н-гексилкарбамоилпропильную группу,
4-н-гексилкарбамоилбутильную группу,
5-н-гексилкарбамоилпентильную группу,
6-н-гексилкарбамоилгексильную группу, цианометильную группу,
2-цианоэтильную группу, 1-цианоэтильную группу,
3-цианопропильную группу, 4-цианобутильную группу,
5-цианопентильную группу, 6-цианогексильную группу или тому подобное.
Примеры фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, фенильной группы, нитрогруппы, С1-6алкилтиогруппы, С1-6алкилсульфонильной группы, фенил-С1-6алкоксигруппы, С2-6алканоилоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и 1,2,3-тиадиазолильной группы) включают фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, цианогруппы, фенильной группы, нитрогруппы, С1-6алкилтиогруппы, С1-6алкилсульфонильной группы, фенил-С1-6алкоксигруппы, С2-6алканоилоксигруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и 1,2,3-тиадиазолильной группы), например бензильную группу,
1-фенетильную группу, 2-фенетильную группу,
3-фенилпропильную группу, 2-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
4-фенилпентильную группу, 6-фенилгексильную группу,
4-бифенилилметильную группу, 2-(4-бифенилил)этильную группу,
3-(4-бифенилил)пропильную группу,
2-(4-бифенилил)пропильную группу,
4-(4-бифенилил)бутильную группу,
5-(4-бифенилил)пентильную группу,
4-(4-бифенилил)пентильную группу,
6-(4-бифенилил)гексильную группу, 2-фторбензильную группу,
3-фторбензильную группу, 4-фторбензильную группу,
2-хлорбензильную группу, 3-хлорбензильную группу,
4-хлорбензильную группу, 2-бромбензильную группу,
3-бромбензильную группу, 4-бромбензильную группу,
2-иодбензильную группу, 3-иодбензильную группу,
4-иодбензильную группу, 2,3-дифторбензильную группу,
3,4-дифторбензильную группу, 3,5-дифторбензильную группу,
2,4-дифторбензильную группу, 2,6-дифторбензильную группу,
2,4,6-трифторбензильную группу, 3,4,5-трифторбензильную группу,
2,3-дихлорбензильную группу, 3,4-дихлорбензильную группу,
3,5-дихлорбензильную группу, 2,4-дихлорбензильную группу,
2,6-дихлорбензильную группу, 2,4,6-трихлорбензильную группу,
3,4,5-трихлорбензильную группу, 2-дифторметилбензильную группу,
3-дифторметилбензильную группу, 4-дифторметилбензильную группу,
4-хлор-3-дифторметилбензильную группу,
3-хлор-4-дифторметилбензильную группу,
3-бром-4-дифторметилбензильную группу,
3,5-дифтор-4-дифторметилбензильную группу,
2-фтор-4-бромбензильную группу, 4-хлор-3-фторбензильную группу,
2,3,4-трихлорбензильную группу, 4-изопропилбензильную группу,
4-н-бутилбензильную группу, 4-метилбензильную группу,
2-метилбензильную группу, 3-метилбензильную группу,
2,4-диметилбензильную группу, 2,3-диметилбензильную группу,
2,6-диметилбензильную группу, 3,5-диметилбензильную группу,
2,5-диметилбензильную группу, 2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
4-изопропоксибензильную группу, 4-н-бутоксибензильную группу,
4-метоксибензильную группу, 2-метоксибензильную группу,
3-метоксибензильную группу, 2,4-диметоксибензильную группу,
2,3-диметоксибензильную группу, 2,6-диметоксибензильную группу,
3,5-диметоксибензильную группу, 2,5-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
3,5-дитрифторметоксибензильную группу,
2,3,4,5,6-пентафторбензильную группу,
2-изопропоксибензильную группу,
3-хлор-4-метоксибензильную группу,
2-хлор-4-трифторметоксибензильную группу,
3-метил-4-фторбензильную группу,
4-бром-3-трифторметилбензильную группу,
2-трифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
4-фтор-3-трифторметилбензильную группу,
3-фтор-4-трифторметилбензильную группу,
4-хлор-3-пентафторэтилбензильную группу,
3-хлор-4-пентафторэтилбензильную группу,
2-пентафторэтилбензильную группу,
3-пентафторэтилбензильную группу,
4-пентафторэтилбензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу,
4-фтор-3-трифторметоксибензильную группу,
3-фтор-4-трифторметоксибензильную группу,
2-пентафторэтоксибензильную группу,
3-пентафторэтоксибензильную группу,
4-пентафторэтоксибензильную группу,
3-хлор-4-трифторметоксибензильную группу,
3-хлор-4-пентафторэтоксибензильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-(2-трифторметоксифенил)этильную группу,
2-(3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
2-(2-пентафторэтоксифенил)этильную группу,
2-(3-пентафторэтоксифенил)этильную группу,
2-(4-пентафторэтоксифенил)этильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
3-(3-пентафторэтоксифенил)пропильную группу,
3-(4-пентафторэтоксифенил)пропильную группу,
4-(3-пентафторэтоксифенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
2-метилтиобензильную группу, 3-метилтиобензильную группу,
4-метилтиобензильную группу, 2,3-диметилтиобензильную группу,
2,4,6-триметилтиобензильную группу,
2-(2-метилтиофенил)этильную группу,
2-(3-метилтиофенил)этильную группу,
2-(4-метилтиофенил)этильную группу,
3-(4-метилтиофенил)пропильную группу,
4-(4-метилтиофенил)бутильную группу,
5-(4-метилтиофенил)пентильную группу,
6-(4-метилтиофенил)гексильную группу,
2-бензилоксибензильную группу, 3-бензилоксибензильную группу,
4-бензилоксибензильную группу,
2-(2-бензилоксифенил)этильную группу,
2-(3-бензилоксифенил)этильную группу,
2-(4-бензилоксифенил)этильную группу,
3-(4-бензилоксифенил)пропильную группу,
4-(4-бензилоксифенил)бутильную группу,
5-(4-бензилоксифенил)пентильную группу,
6-(4-бензилоксифенил)гексильную группу,
2-(2-фенилэтокси)бензильную группу,
3-(2-фенилэтокси)бензильную группу,
4-(2-фенилэтокси)бензильную группу,
2-(2-(2-фенилэтокси)фенил)этильную группу,
2-(3-(2-фенилэтокси)фенил)этильную группу,
2-(4-(2-фенилэтокси)фенил)этильную группу,
3-(4-(2-фенилэтокси)фенил)пропильную группу,
4-(4-(2-фенилэтокси)фенил)бутильную группу,
5-(4-(2-фенилэтокси)фенил)пентильную группу,
6-(4-(2-фенилэтокси)фенил)гексильную группу,
2-(3-фенилпропокси)бензильную группу,
3-(3-фенилпропокси)бензильную группу,
4-(3-фенилпропокси)бензильную группу,
2-(4-фенилбутокси)бензильную группу,
3-(4-фенилбутокси)бензильную группу,
4-(4-фенилбутокси)бензильную группу,
2-ацетилоксибензильную группу, 3-ацетилоксибензильную группу,
4-ацетилоксибензильную группу,
2-(2-ацетилоксифенил)этильную группу,
2-(3-ацетилоксифенил)этильную группу,
2-(4-ацетилоксифенил)этильную группу,
3-(4-ацетилоксифенил)пропильную группу,
4-(4-ацетилоксифенил)бутильную группу,
5-(4-ацетилоксифенил)пентильную группу,
6-(4-ацетилоксифенил)гексильную группу,
2-метансульфонилбензильную группу,
3-метансульфонилбензильную группу,
4-метансульфонилбензильную группу,
3,4-диметансульфонилбензильную группу,
3,4,5-триметансульфонилбензильную группу,
2-(2-метансульфонилфенил)этильную группу,
2-(3-метансульфонилфенил)этильную группу,
2-(4-метансульфонилфенил)этильную группу,
3-(4-метансульфонилфенил)пропильную группу,
4-(4-метансульфонилфенил)бутильную группу,
5-(4-метансульфонилфенил)пентильную группу,
6-(4-метансульфонилфенил)гексильную группу,
2-цианобензильную группу, 3-цианобензильную группу,
4-цианобензильную группу,
2,4-дицианобензильную группу, 3,4,5-трицианобензильную группу,
2-(2-цианофенил)этильную группу,
2-(3-цианофенил)этильную группу,
2-(4-цианофенил)этильную группу,
3-(4-цианофенил)пропильную группу,
4-(4-цианофенил)бутильную группу,
5-(4-цианофенил)пентильную группу,
6-(4-цианофенил)гексильную группу, 2-нитробензильную группу,
3-нитробензильную группу, 4-нитробензильную группу,
2,6-динитробензильную группу, 3,4,5-тринитробензильную группу,
2-(2-нитрофенил)этильную группу,
2-(3-нитрофенил)этильную группу,
2-(4-нитрофенил)этильную группу,
3-(4-нитрофенил)пропильную группу,
4-(4-нитрофенил)бутильную группу,
5-(4-нитрофенил)пентильную группу,
6-(4-нитрофенил)гексильную группу,
2-(1,2,3-тиадиазол-4-ил)бензильную группу,
3-(1,2,3-тиадиазол-4-ил)бензильную группу,
4-(1,2,3-тиадиазол-4-ил)бензильную группу или тому подобное.
Примеры С2-6алкенильной группы включают винильную группу,
2-пропенильную группу, 3-бутенильную группу, 2-бутенильную группу, 4-пентенильную группу, 3-пентенильную группу, 5-гексенильную группу, 4-гексенильную группу, 3-гексенильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогрупы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает фенильную группу, незамещенную или замещенную 1-5, предпочтительно 1-3, заместителями, выбранными из группы, состоящей из атома галогена, цианогрупы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, определенных выше, включают фенильную группу, 2-фторфенильную группу, 3-фторфенильную группу,
4-фторфенильную группу, 2-хлорфенильную группу,
3-хлорфенильную группу, 4-хлорфенильную группу,
2-бромфенильную группу, 3-бромфенильную группу,
4-бромфенильную группу, 2-иодфенильную группу,
3-иодфенильную группу, 4-иодфенильную группу,
2,3-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу, 2,6-дифторфенильную группу,
2,3-дихлорфенильную группу, 3,4-дихлорфенильную группу,
3,5-дихлорфенильную группу, 2,4-дихлорфенильную группу,
2,6-дихлорфенильную группу, 3,4,5-трифторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,4,6-трихлорфенильную группу, 2-метилфенильную группу,
3-метилфенильную группу, 4-метилфенильную группу,
2-метил-3-хлорфенильную группу, 3-метил-4-хлорфенильную группу,
2-хлор-4-метилфенильную группу, 2-метил-3-фторфенильную группу,
2-трифторметилфенильную группу, 3-трифторметилфенильную группу,
4-трифторметилфенильную группу, 2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
3-хлор-2-метоксифенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 2,6-диметоксифенильную группу,
2,3,4-трифторфенильную группу, 2-фтор-4-бромфенильную группу,
4-хлор-3-фторфенильную группу, 2,3,4-трихлорфенильную группу,
4-н-бутилфенильную группу, 2,4-диметилфенильную группу,
2,3-диметилфенильную группу, 2,6-диметилфенильную группу,
3,5-диметилфенильную группу, 2,5-диметилфенильную группу,
2,4,6-триметилфенильную группу,
2,4,6-триметоксифенильную группу,
3,5-дитрифторметилфенильную группу, 4-н-бутоксифенильную группу,
2,4-диметоксифенильную группу, 2,3-диметоксифенильную группу,
3,5-диметоксифенильную группу, 2,5-диметоксифенильную группу,
3,5-дитрифторметоксифенильную группу,
3-хлор-4-метоксифенильную группу,
2-хлор-4-трифторметоксифенильную группу,
3-метил-4-фторфенильную группу,
4-бром-3-трифторметилфенильную группу, 2-цианофенильную группу,
3-цианофенильную группу, 4-цианофенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
3-фтор-2-трифторметоксифенильную группу,
2-фтор-3-трифторметоксифенильную группу,
3-фтор-4-трифторметоксифенильную группу,
3-хлор-2-трифторметоксифенильную группу,
2-хлор-3-трифторметоксифенильную группу,
3-хлор-4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
3-хлор-2-пентафторэтоксифенильную группу,
2-хлор-3-пентафторэтоксифенильную группу,
3-хлор-4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-н-пентоксифенильную группу, 4-н-гексилоксифенильную группу или тому подобное.
Фенил-С2-6алканоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, заместителями, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например фенилацетильную группу,
3-фенилпропионильную группу, 4-фенилбутирильную группу,
5-фенилпентаноильную группу, 6-фенилгексаноильную группу,
4-фторфенилацетильную группу,
3-(4-фторфенил)пропионильную группу,
4-(4-фторфенил)бутирильную группу,
5-(4-фторфенил)пентаноильную группу,
6-(4-фторфенил)гексаноильную группу,
2-хлорфенилацетильную группу,
2,3,4,5,6-пентафторфенилацетильную группу,
3-(2-хлорфенил)пропионильную группу,
4-(2-хлорфенил)бутирильную группу,
5-(2-хлорфенил)пентаноильную группу,
6-(2-хлорфенил)гексаноильную группу,
3-хлорфенилацетильную группу,
3-(3-хлорфенил)пропионильную группу,
4-(3-хлорфенил)бутирильную группу,
5-(3-хлорфенил)пентаноильную группу,
6-(3-хлорфенил)гексаноильную группу,
4-хлорфенилацетильную группу,
3-(4-хлорфенил)пропионильную группу,
4-(4-хлорфенил)бутирильную группу,
5-(4-хлорфенил)пентаноильную группу,
6-(4-хлорфенил)гексаноильную группу,
3,4-дихлорфенилацетильную группу,
3-(3,4-дихлорфенил)пропионильную группу,
4-(3,4-дихлорфенил)бутирильную группу,
5-(3,4-дихлорфенил)пентаноильную группу,
6-(3,4-дихлорфенил)гексаноильную группу,
2-метилфенилацетильную группу, 3-метилфенилацетильную группу,
4-метилфенилацетильную группу,
(2,4,6-триметилфенил)ацетильную группу,
(2,6-диметоксифенил)ацетильную группу,
(2,4,5-триметоксифенил)ацетильную группу,
(3,5-дитрифторметилфенил)ацетильную группу,
(3,5-дитрифторметоксифенил)ацетильную группу,
2-трифторметилфенилацетильную группу,
3-трифторметилфенилацетильную группу,
4-трифторметилфенилацетильную группу,
2-фенилпропионильную группу,
3-(2-метилфенил)пропионильную группу,
3-(3-метилфенил)пропионильную группу,
3-(4-метилфенил)пропионильную группу,
3-(2-трифторметилфенил)пропионильную группу,
3-(3-трифторметилфенил)пропионильную группу,
3-(4-трифторметилфенил)пропионильную группу,
3-(3,5-диметилфенил)пропионильную группу,
4-(4-трифторметилфенил)бутирильную группу,
5-(4-трифторметилфенил)пентаноильную группу,
6-(4-трифторметилфенил)гексаноильную группу,
4-(4-пентафторэтилфенил)бутирильную группу,
5-(4-пентафторэтилфенил)пентаноильную группу,
6-(4-пентафторэтилфенил)гексаноильную группу,
2-метоксифенилацетильную группу,
3-метоксифенилацетильную группу,
4-метоксифенилацетильную группу,
2-трифторметоксифенилацетильную группу,
3-трифторметоксифенилацетильную группу,
4-трифторметоксифенилацетильную группу,
3-(2-метоксифенил)пропионильную группу,
3-(3-метоксифенил)пропионильную группу,
3-(4-метоксифенил)пропионильную группу,
3-(2-трифторметоксифенил)пропионильную группу,
3-(3-трифторметоксифенил)пропионильную группу,
3-(4-трифторметоксифенил)пропионильную группу,
3-(3,5-диметоксифенил)пропионильную группу,
4-(4-трифторметоксифенил)бутирильную группу,
5-(4-трифторметоксифенил)пентаноильную группу,
6-(4-трифторметоксифенил)гексаноильную группу,
4-(4-трифторметоксифенил)бутирильную группу,
5-(4-пентафторэтоксифенил)пентаноильную группу,
6-(4-пентафторэтоксифенил)гексаноильную группу или тому подобное.
С1-20алкоксикарбонильная группа (которая может быть замещена в алкоксигруппе по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, и С1-6алкоксигруппы, замещенной С1-6алкоксигруппой) представляет собой группу, содержащую алкоксигруппу, имеющую 1-20 углеродных атомов, которая может иметь 1-7 групп, выбранных из группы, состоящей из атома галогена, аминогруппы, которая может содержать С1-6алкильную группу и С1-6алкоксигруппу, замещенную С1-6алкоксигруппой, в качестве заместителя, и карбонильную группу, примеры которой включают метоксикарбонильную группу,
этоксикарбонильную группу, н-пропоксикарбонильную группу,
н-бутоксикарбонильную группу, н-пентилоксикарбонильную группу,
н-гексилоксикарбонильную группу,
н-гептилоксикарбонильную группу, н-октилоксикарбонильную группу,
н-нонилоксикарбонильную группу, н-децилоксикарбонильную группу,
н-ундецилоксикарбонильную группу,
н-додецилоксикарбонильную группу,
н-тридецилоксикарбонильную группу,
н-тетрадецилоксикарбонильную группу,
н-пентадецилоксикарбонильную группу,
н-гексадецилоксикарбонильную группу,
н-гептадецилоксикарбонильную группу,
н-октадецилоксикарбонильную группу,
н-нонадецилоксикарбонильную группу,
н-икозилоксикарбонильную группу, хлорметоксикарбонильную группу,
трихлорметоксикарбонильную группу,
2-бромэтоксиоксикарбонильную группу,
2,2-бромэтоксикарбонильную группу,
3-фторпропоксикарбонильную группу,
4-иодбутоксикарбонильную группу,
5,5,5,4,4,3,3-гептафторпентилоксикарбонильную группу,
4,4,4,3,3,2,2-гептафторбутоксикарбонильную группу,
5-хлорпентилоксикарбонильную группу,
6-бромгексилоксикарбонильную группу,
7-хлоргептилоксикарбонильную группу,
8-иодоктилоксикарбонильную группу,
9-хлорнонилоксикарбонильную группу,
10-бромдецилоксикарбонильную группу,
11-фторундецилоксикарбонильную группу,
12-иоддодецилоксикарбонильную группу,
12-хлордодецилоксикарбонильную группу,
13-фтортридецилоксикарбонильную группу,
14-бромтетрадецилоксикарбонильную группу,
15-иодпентадецилоксикарбонильную группу,
16-хлоргексадецилоксикарбонильную группу,
17-бромгептадецилоксикарбонильную группу,
18-фтороктадецилоксикарбонильную группу,
19-хлорнонадецилокси карбонильную группу,
20-хлорикозилоксикарбонильную группу,
аминометоксикарбонильную группу,
диэтиламинометоксикарбонильную группу,
2-диэтиламиноэтоксикарбонильную группу,
3-диэтиламинопропоксикарбонильную группу,
4-диэтиламинобутоксикарбонильную группу,
5-диэтиламинопентилоксикарбонильную группу,
6-диэтиламиногексилоксикарбонильную группу,
7-диэтиламиногептилоксикарбонильную группу,
8-диэтиламинооктилоксикарбонильную группу,
9-диэтиламинононилоксикарбонильную группу,
10-диэтиламинодецилоксикарбонильную группу,
11-диэтиламиноундецилоксикарбонильную группу,
12-диэтиламинододецилоксикарбонильную группу,
13-диэтиламинотридецилоксикарбонильную группу,
14-диэтиламинотетрадецилоксикарбонильную группу,
15-диэтиламинопентадецилоксикарбонильную группу,
16-диэтиламиногексадецилоксикарбонильную группу,
17-диэтиламиногептадецилоксикарбонильную группу,
18-диэтиламинооктадецилоксикарбонильную группу,
19-диэтиламинононадецилоксикарбонильную группу,
20-диэтиламиноикозилоксикарбонильную группу,
метоксиэтоксиметоксикарбонильную группу,
2-(2-этоксиэтокси)этоксикарбонильную группу,
2-(2-пропоксиэтокси)этоксикарбонильную группу,
2-(2-бутоксиэтокси)этоксикарбонильную группу,
2-(2-пентилоксиэтокси)этоксикарбонильную группу,
2-(2-гексилоксиэтокси)этоксикарбонильную группу,
2-метоксиэтоксиэтоксикарбонильную группу,
3-(3-метоксипропокси)пропоксикарбонильную группу,
4-(4-метоксибутокси)бутоксикарбонильную группу,
5-(5-метоксипентилокси)пентилоксикарбонильную группу,
6-(6-метоксигексилокси)гексилоксикарбонильную группу,
7-(2-метоксиэтокси)гептилоксикарбонильную группу,
8-(1-метоксиэтокси)октилоксикарбонильную группу,
9-(1-метоксиэтокси)нонилоксикарбонильную группу,
10-(2-метоксиэтокси)децилоксикарбонильную группу,
11-(2-метоксиэтокси)ундецилоксикарбонильную группу,
12-(2-метоксиэтокси)додецилоксикарбонильную группу,
12-(1-метоксиэтокси)додецилоксикарбонильную группу,
13-(2-метоксиэтокси)тридецилоксикарбонильную группу,
14-(1-метоксиэтокси)тетрадецилоксикарбонильную группу,
15-(2-метоксиэтокси)пентадецилоксикарбонильную группу,
16-(1-метоксиэтокси)гексадецилоксикарбонильную группу,
17-(2-метоксиэтокси)гептадецилоксикарбонильную группу,
18-(1-метоксиэтокси)октадецилоксикарбонильную группу,
19-(2-метоксиэтокси)нонадецилоксикарбонильную группу,
20-(1-метоксиэтокси)икозилоксикарбонильную группу,
диметиламинометоксикарбонильную группу,
2-метиламиноэтоксикарбонильную группу,
3-(N-метил-N-бутиламино)пропоксикарбонильную группу,
4-пропиламинобутоксикарбонильную группу,
5-гексиламинопентилоксикарбонильную группу,
6-пентиламиногексилоксикарбонильную группу,
7-(N-этил-N-пропиламино)гептилоксикарбонильную группу,
8-(N-пропил-N-гексил)аминооктилоксикарбонильную группу,
9-(N-пентил-N-метиламино)нонилоксикарбонильную группу,
10-дипропиламинодецилоксикарбонильную группу,
11-дипентиламиноундецилоксикарбонильную группу,
12-дигексиламинододецилоксикарбонильную группу,
12-дибутиламинододецилоксикарбонильную группу,
13-(N-этил-N-бутиламино)тридецилоксикарбонильную группу,
14-(N-метил-N-гексиламино)тетрадецилоксикарбонильную группу,
15-диметиламинопентадецилоксикарбонильную группу,
16-диметиламиногексадецилоксикарбонильную группу,
17-диметиламиногептадецилоксикарбонильную группу,
18-диметиламинооктадецилоксикарбонильную группу,
19-диметиламинононадецилоксикарбонильную группу,
20-диметиламиноикозилоксикарбонильную группу или тому подобное.
Примеры фенил-С1-6алкоксикарбонильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, нитрогруппы, галогензамещенной или незамещенной С1-6алкилтиогруппы, аминогруппы, которая может содержать С1-6алканоильную группу, фенил-С1-6алкоксигруппы, С1-6алкоксикарбонильной группы и 1,2,3-тиадиазолильной группы) включают фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, нитрогруппы, галогензамещенной или незамещенной С1-6алкилтиогруппы, аминогруппы, которая может содержать 1-2 алканоильные группы, фенил-С1-6алкоксигруппы, С1-6алкоксикарбонильной группы и 1,2,3-тиадиазолильной группы), например бензилоксикарбонильную группу,
1-фенетилоксикарбонильную группу,
2-фенетилоксикарбонильную группу,
3-фенилпропоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентилоксикарбонильную группу,
4-фенилпентилоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-фторбензилоксикарбонильную группу,
3-фторбензилоксикарбонильную группу,
4-фторбензилоксикарбонильную группу,
2-хлорбензилоксикарбонильную группу,
3-хлорбензилоксикарбонильную группу,
4-хлорбензилоксикарбонильную группу,
2-бромбензилоксикарбонильную группу,
3-бромбензилоксикарбонильную группу,
4-бромбензилоксикарбонильную группу,
2-иодбензилоксикарбонильную группу,
3-иодбензилоксикарбонильную группу,
4-иодбензилоксикарбонильную группу,
2,3-дифторбензилоксикарбонильную группу,
3,4-дифторбензилоксикарбонильную группу,
3,5-дифторбензилоксикарбонильную группу,
2,4-дифторбензилоксикарбонильную группу,
2,6-дифторбензилоксикарбонильную группу,
2,4,6-трифторбензилоксикарбонильную группу,
3,4,5-трифторбензилоксикарбонильную группу,
2,3-дихлорбензилоксикарбонильную группу,
3,4-дихлорбензилоксикарбонильную группу,
3,5-дихлорбензилоксикарбонильную группу,
2,4-дихлорбензилоксикарбонильную группу,
2,6-дихлорбензилоксикарбонильную группу,
2,4,6-трихлорбензилоксикарбонильную группу,
3,4,5-трихлорбензилоксикарбонильную группу,
2,3,4,5,6-пентафторбензилоксикарбонильную группу,
2-дифторметилбензилоксикарбонильную группу,
3-дифторметилбензилоксикарбонильную группу,
4-дифторметилбензилоксикарбонильную группу,
4-хлор-3-дифторметилбензилоксикарбонильную группу,
3-хлор-4-дифторметилбензилоксикарбонильную группу,
3-бром-4-дифторметилбензилоксикарбонильную группу,
3,5-дифтор-4-дифторметилбензилоксикарбонильную группу,
2-трифторметилбензилоксикарбонильную группу,
2-фтор-4-бромбензилоксикарбонильную группу,
4-хлор-3-фторбензилоксикарбонильную группу,
2,3,4-трихлорбензилоксикарбонильную группу,
4-изопропилбензилоксикарбонильную группу,
4-н-бутилбензилоксикарбонильную группу,
4-метилбензилоксикарбонильную группу,
2-метилбензилоксикарбонильную группу,
3-метилбензилоксикарбонильную группу,
2,4-диметилбензилоксикарбонильную группу,
2,3-диметилбензилоксикарбонильную группу,
2,6-диметилбензилоксикарбонильную группу,
3,5-диметилбензилоксикарбонильную группу,
2,5-диметилбензилоксикарбонильную группу,
2,4,6-триметилбензилоксикарбонильную группу,
3,5-дитрифторметилбензилоксикарбонильную группу,
4-изопропоксибензилоксикарбонильную группу,
4-н-бутоксибензилоксикарбонильную группу,
4-метоксибензилоксикарбонильную группу,
2-метоксибензилоксикарбонильную группу,
3-метоксибензилоксикарбонильную группу,
2,4-диметоксибензилоксикарбонильную группу,
2,3-диметоксибензилоксикарбонильную группу,
2,6-диметоксибензилоксикарбонильную группу,
3,5-диметоксибензилоксикарбонильную группу,
2,5-диметоксибензилоксикарбонильную группу,
2,4,6-триметоксибензилоксикарбонильную группу,
3,5-дитрифторметоксибензилоксикарбонильную группу,
2-изопропоксибензилоксикарбонильную группу,
3-хлор-4-метоксибензилоксикарбонильную группу,
2-хлор-4-фторметоксибензилоксикарбонильную группу,
3-метил-4-фторбензилоксикарбонильную группу,
4-бром-3-трифторметилбензилоксикарбонильную группу,
3-трифторметилбензилоксикарбонильную группу,
4-трифторметилбензилоксикарбонильную группу,
4-фтор-3-трифторметилбензилоксикарбонильную группу,
3-фтор-4-трифторметилбензилоксикарбонильную группу,
2-пентафторэтилбензилоксикарбонильную группу,
4-хлор-3-пентафторэтилбензилоксикарбонильную группу,
3-хлор-4-пентафторэтилбензилоксикарбонильную группу,
3-пентафторэтилбензилоксикарбонильную группу,
4-пентафторэтилбензилоксикарбонильную группу,
2-трифторметоксибензилоксикарбонильную группу,
3-трифторметоксибензилоксикарбонильную группу,
4-трифторметоксибензилоксикарбонильную группу,
4-фтор-3-трифторметоксибензилоксикарбонильную группу,
3-фтор-4-трифторметоксибензилоксикарбонильную группу,
2-пентафторэтоксибензилоксикарбонильную группу,
3-пентафторэтоксибензилоксикарбонильную группу,
4-пентафторэтоксибензилоксикарбонильную группу,
3-хлор-4-трифторметоксибензилоксикарбонильную группу,
3-хлор-4-пентафторэтоксибензилоксикарбонильную группу,
2-(2-трифторметилфенил)этоксикарбонильную группу,
2-(3-трифторметилфенил)этоксикарбонильную группу,
2-(4-трифторметилфенил)этоксикарбонильную группу,
(2-трифторметоксифенил)метоксикарбонильную группу,
(3-трифторметоксифенил)метоксикарбонильную группу,
2-(4-трифторметоксифенил)этоксикарбонильную группу,
2-(2-пентафторэтоксифенил)этоксикарбонильную группу,
2-(3-пентафторэтоксифенил)этоксикарбонильную группу,
2-(4-пентафторэтоксифенил)этоксикарбонильную группу,
3-(2-трифторметилфенил)пропоксикарбонильную группу,
3-(3-трифторметилфенил)пропоксикарбонильную группу,
3-(4-трифторметилфенил)пропоксикарбонильную группу,
3-(2-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-пентафторэтоксифенил)пропоксикарбонильную группу,
3-(4-пентафторэтоксифенил)пропоксикарбонильную группу,
4-(3-пентафторэтоксифенил)бутоксикарбонильную группу,
5-(4-трифторметилфенил)пентилоксикарбонильную группу,
4-(4-трифторметилфенил)пентилоксикарбонильную группу,
4-(4-трифторметоксифенил)пентилоксикарбонильную группу,
6-(3-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметоксифенил)гексилоксикарбонильную группу,
2-метилтиобензилоксикарбонильную группу,
3-метилтиобензилоксикарбонильную группу,
4-метилтиобензилоксикарбонильную группу,
2-(2-метилтиофенил)этоксикарбонильную группу,
2-(3-метилтиофенил)этоксикарбонильную группу,
2-(4-метилтиофенил)этоксикарбонильную группу,
3-(4-метилтиофенил)пропоксикарбонильную группу,
4-(4-метилтиофенил)бутоксикарбонильную группу,
5-(4-метилтиофенил)пентилоксикарбонильную группу,
6-(4-метилтиофенил)гексилоксикарбонильную группу,
2-трифторметилтиобензилоксикарбонильную группу,
3-трифторметилтиобензилоксикарбонильную группу,
4-трифторметилтиобензилоксикарбонильную группу,
2-(2-трифторметилтиофенил)этоксикарбонильную группу,
2-(3-трифторметилтиофенил)этоксикарбонильную группу,
2-(4-трифторметилтиофенил)этоксикарбонильную группу,
3-(4-трифторметилтиофенил)пропоксикарбонильную группу,
4-(4-трифторметилтиофенил)бутоксикарбонильную группу,
5-(4-трифторметилтиофенил)пентилоксикарбонильную группу,
6-(4-трифторметилтиофенил)гексилоксикарбонильную группу,
2-бензилоксибензилоксикарбонильную группу,
3-бензилоксибензилоксикарбонильную группу,
4-бензилоксибензилоксикарбонильную группу,
2-(2-бензилоксифенил)этоксикарбонильную группу,
2-(3-бензилоксифенил)этоксикарбонильную группу,
2-(4-бензилоксифенил)этоксикарбонильную группу,
3-(4-бензилоксифенил)пропоксикарбонильную группу,
4-(4-бензилоксифенил)бутоксикарбонильную группу,
5-(4-бензилоксифенил)пентилоксикарбонильную группу,
6-(4-бензилоксифенил)гексилоксикарбонильную группу,
2-(2-фенилэтокси)бензилоксикарбонильную группу,
3-(2-фенилэтокси)бензилоксикарбонильную группу,
4-(2-фенилэтокси)бензилоксикарбонильную группу,
2-[2-(2-фенилэтокси)фенил]этоксикарбонильную группу,
2-[3-(2-фенилэтокси)фенил]этоксикарбонильную группу,
2-[4-(2-фенилэтокси)фенил]этоксикарбонильную группу,
3-(4-(2-фенилэтоксифенил))пропоксикарбонильную группу,
4-(4-(2-фенилэтоксифенил))бутоксикарбонильную группу,
5-(4-(2-фенилэтоксифенил))пентилоксикарбонильную группу,
6-(4-(2-фенилэтоксифенил))гексилоксикарбонильную группу,
2-(3-фенилпропокси)бензилоксикарбонильную группу,
3-(3-фенилпропокси)бензилоксикарбонильную группу,
4-(3-фенилпропокси)бензилоксикарбонильную группу,
2-(4-фенилбутокси)бензилоксикарбонильную группу,
3-(4-фенилбутокси)бензилоксикарбонильную группу,
4-(4-фенилбутокси)бензилоксикарбонильную группу,
2-метоксикарбонилбензилоксикарбонильную группу,
3-метоксикарбонилбензилоксикарбонильную группу,
4-метоксикарбонилбензилоксикарбонильную группу,
2-(2-метоксикарбонилфенил)этоксикарбонильную группу,
2-(3-метоксикарбонилфенил)этоксикарбонильную группу,
2-(4-метоксикарбонилфенил)этоксикарбонильную группу,
3-(4-метоксикарбонилфенил)пропоксикарбонильную группу,
4-(4-метоксикарбонилфенил)бутоксикарбонильную группу,
5-(4-метоксикарбонилфенил)пентилоксикарбонильную группу,
6-(4-метоксикарбонилфенил)гексилоксикарбонильную группу,
2-бутириламинобензилоксикарбонильную группу,
3-бутириламинобензилоксикарбонильную группу,
4-бутириламинобензилоксикарбонильную группу,
2-(2-бутириламинофенил)этоксикарбонильную группу,
2-(3-бутириламинофенил)этоксикарбонильную группу,
2-(4-бутириламинофенил)этоксикарбонильную группу,
3-(4-бутириламинофенил)пропоксикарбонильную группу,
4-(4-бутириламинофенил)бутоксикарбонильную группу,
5-(4-бутириламинофенил)пентилоксикарбонильную группу,
6-(4-бутириламинофенил)гексилоксикарбонильную группу,
2-нитробензилоксикарбонильную группу,
3-нитробензилоксикарбонильную группу,
4-нитробензилоксикарбонильную группу,
2-(2-нитрофенил)этоксикарбонильную группу,
2-(3-нитрофенил)этоксикарбонильную группу,
2-(2,4-динитрофенил)этоксикарбонильную группу,
2-(2,4,6-тринитрофенил)метоксикарбонильную группу,
2-(4-нитрофенил)этоксикарбонильную группу,
3-(4-нитрофенил)пропоксикарбонильную группу,
4-(4-нитрофенил)бутоксикарбонильную группу,
5-(4-нитрофенил)пентилоксикарбонильную группу,
6-(4-нитрофенил)гексилоксикарбонильную группу,
2-аминобензилоксикарбонильную группу,
3-аминобензилоксикарбонильную группу,
4-аминобензилоксикарбонильную группу,
2-(2-аминофенил)этоксикарбонильную группу,
2-(3-аминофенил)этоксикарбонильную группу,
2-(4-аминофенил)этоксикарбонильную группу,
3-(4-аминофенил)пропоксикарбонильную группу,
4-(4-аминофенил)бутоксикарбонильную группу,
5-(4-аминофенил)пентилоксикарбонильную группу,
6-(4-аминофенил)гексилоксикарбонильную группу,
2-ацетиламинобензилоксикарбонильную группу,
3-пропиониламинобензилоксикарбонильную группу,
4-пентаноиламинобензилоксикарбонильную группу,
2-(2-гексаноиламинофенил)этоксикарбонильную группу,
2-(3-ацетиламинофенил)этоксикарбонильную группу,
2-(4-ацетиламинофенил)этоксикарбонильную группу,
3-(4-ацетиламинофенил)пропоксикарбонильную группу,
4-(4-ацетиламинофенил)бутоксикарбонильную группу,
5-(4-ацетиламинофенил)пентилоксикарбонильную группу,
6-(4-ацетиламинофенил)гексилоксикарбонильную группу,
2-этоксикарбонилбензилоксикарбонильную группу,
3-этоксикарбонилбензилоксикарбонильную группу,
4-этоксикарбонилбензилоксикарбонильную группу,
2-(2-этоксикарбонилфенил)этоксикарбонильную группу,
2-(3-бутоксикарбонилфенил)этоксикарбонильную группу,
2-(4-пропоксикарбонилфенил)этоксикарбонильную группу,
3-(4-этоксикарбонилфенил)пропоксикарбонильную группу,
4-(4-пентилоксикарбонилфенил)бутоксикарбонильную группу,
5-(4-гексилоксикарбонилфенил)пентилоксикарбонильную группу,
6-(4-этоксикарбонилфенил)гексилоксикарбонильную группу,
2-(1,2,3-тиадиазол-4-ил)бензилоксикарбонильную группу,
3-(1,2,3-тиадиазол-4-ил)бензилоксикарбонильную группу,
4-(1,2,3-тиадиазол-4-ил)бензилоксикарбонильную группу или тому подобное.
Фенил-С3-6алкенилоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) представляет собой группу, содержащую фенильную группу, незамещенную или замещенную 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галоген-С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, алкенилоксигруппу, содержащую 3-6 углеродных атомов и 1-3 двойные связи, и карбонильную группу. Указанные группы могут существовать в транс- или цис-форме, и данная группа, разумеется, включает обе эти формы. Данная группа включает, например, незамещенную 3-фенил-2-пропенилоксикарбонильную группу (тривиальное название: циннамилоксикарбонильная группа),
4-фенил-2-бутенилоксикарбонильную группу,
4-фенил-3-бутенилоксикарбонильную группу,
5-фенил-2-пентенилоксикарбонильную группу,
5-фенил-4-пентенилоксикарбонильную группу,
5-фенил-3-пентенилоксикарбонильную группу,
6-фенил-5-гексенилоксикарбонильную группу,
6-фенил-4-гексенилоксикарбонильную группу,
6-фенил-3-гексенилоксикарбонильную группу,
4-фенил-1,3-бутадиенилоксикарбонильную группу,
6-фенил-1,3,5-гексатриенилоксикарбонильную группу,
6-фенил-3-гексенилоксикарбонильную группу,
3-(2-фторфенил)-2-пропенилоксикарбонильную группу,
3-(3-фторфенил)-2-пропенилоксикарбонильную группу,
3-(4-фторфенил)-2-пропенилоксикарбонильную группу,
3-(2,3-дифторфенил)-2-пропенилоксикарбонильную группу,
3-(2,4-дифторфенил)-2-пропенилоксикарбонильную группу,
3-(3,4-дифторфенил)-2-пропенилоксикарбонильную группу,
3-(3,5-дифторфенил)-2-пропенилоксикарбонильную группу,
3-(2-хлорфенил)-2-пропенилоксикарбонильную группу,
3-(3-хлорфенил)-2-пропенилоксикарбонильную группу,
3-(4-хлорфенил)-2-пропенилоксикарбонильную группу,
3-(2,3-дихлорфенил)-2-пропенилоксикарбонильную группу,
3-(2,4-дихлорфенил)-2-пропенилоксикарбонильную группу,
3-(3,4-дихлорфенил)-2-пропенилоксикарбонильную группу,
3-(3,5-дихлорфенил)-2-пропенилоксикарбонильную группу,
3-(2-бромфенил)-2-пропенилоксикарбонильную группу,
3-(3-бромфенил)-2-пропенилоксикарбонильную группу,
3-(4-бромфенил)-2-пропенилоксикарбонильную группу,
3-(2-фтор-4-бромфенил)-2-пропенилоксикарбонильную группу,
3-(2,3,4,5,6-пентафторфенил)-2-пропенилоксикарбонильную группу,
3-(4-хлор-3-фторфенил)-2-пропенилоксикарбонильную группу,
3-(2,3,4-трихлорфенил)-2-пропенилоксикарбонильную группу,
3-(2,4,6-трихлорфенил)-2-пропенилоксикарбонильную группу,
3-(4-изопропилфенил)-2-пропенилоксикарбонильную группу,
3-(4-н-бутилфенил)-2-пропенилоксикарбонильную группу,
3-(2,4-диметилфенил)-2-пропенилоксикарбонильную группу,
3-(2,3-диметилфенил)-2-пропенилоксикарбонильную группу,
3-(2,6-диметилфенил)-2-пропенилоксикарбонильную группу,
3-(3,5-диметилфенил)-2-пропенилоксикарбонильную группу,
3-(2,5-диметилфенил)-2-пропенилоксикарбонильную группу,
3-(2,4,6-триметилфенил)-2-пропенилоксикарбонильную группу,
3-(3,5-дитрифторметилфенил)-2-пропенилоксикарбонильную группу,
3-(4-н-бутоксифенил)-2-пропенилоксикарбонильную группу,
3-(2,4-диметоксифенил)-2-пропенилоксикарбонильную группу,
3-(2,3-диметоксифенил)-2-пропенилоксикарбонильную группу,
3-(2,6-диметоксифенил)-2-пропенилоксикарбонильную группу,
3-(3,5-диметоксифенил)-2-пропенилоксикарбонильную группу,
3-(2,5-диметоксифенил)-2-пропенилоксикарбонильную группу,
3-(3,5-дитрифторметоксифенил)-2-пропенилоксикарбонильную группу,
3-(3-хлор-4-метоксифенил)-2-пропенилоксикарбонильную группу,
3-(2-хлор-4-трифторметоксифенил)-2-пропенилоксикарбонильную группу,
3-(3-метил-4-фторфенил)-2-пропенилоксикарбонильную группу,
3-(4-бром-3-трифторметилфенил)-2-пропенилоксикарбонильную группу,
3-(2-метилфенил)-2-пропенилоксикарбонильную группу,
3-(3-метилфенил)-2-пропенилоксикарбонильную группу,
3-(4-метилфенил)-2-пропенилоксикарбонильную группу,
3-(2-трифторметилфенил)-2-пропенилоксикарбонильную группу,
3-(3-трифторметилфенил)-2-пропенилоксикарбонильную группу,
3-(4-трифторметилфенил)-2-пропенилоксикарбонильную группу,
3-(2-трифторметоксифенил)-2-пропенилоксикарбонильную группу,
3-(3-трифторметоксифенил)-2-пропенилоксикарбонильную группу,
3-(4-трифторметоксифенил)-2-пропенилоксикарбонильную группу,
3-(2-метоксифенил)-2-пропенилоксикарбонильную группу,
3-(3-метоксифенил)-2-пропенилоксикарбонильную группу,
3-(4-метоксифенил)-2-пропенилоксикарбонильную группу,
3-(3,4-диметоксифенил)-2-пропенилоксикарбонильную группу,
4-(4-хлорфенил)-2-бутенилоксикарбонильную группу,
4-(4-хлорфенил)-3-бутенилоксикарбонильную группу,
5-(4-хлорфенил)-2-пентенилоксикарбонильную группу,
5-(4-хлорфенил)-4-пентенилоксикарбонильную группу,
5-(4-хлорфенил)-3-пентенилоксикарбонильную группу,
6-(4-хлорфенил)-5-гексенилоксикарбонильную группу,
6-(4-хлорфенил)-4-гексенилоксикарбонильную группу,
6-(4-хлорфенил)-3-гексенилоксикарбонильную группу,
6-(4-хлорфенил)-2-гексенилоксикарбонильную группу или тому подобное.
Феноксикарбонильную группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает феноксикарбонильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например феноксикарбонильную группу,
2-фторфеноксикарбонильную группу,
3-фторфеноксикарбонильную группу,
2,3,4,5,6-пентафторфеноксикарбонильную группу,
4-фторфеноксикарбонильную группу,
2-хлорфеноксикарбонильную группу,
3-хлорфеноксикарбонильную группу,
4-хлорфеноксикарбонильную группу,
2,3-дихлорфеноксикарбонильную группу,
3,4-дихлорфеноксикарбонильную группу,
3,5-дихлорфеноксикарбонильную группу,
2-бромфеноксикарбонильную группу,
3-бромфеноксикарбонильную группу,
4-бромфеноксикарбонильную группу,
2-метилфеноксикарбонильную группу,
3-метилфеноксикарбонильную группу,
4-метилфеноксикарбонильную группу,
2-этилфеноксикарбонильную группу,
3-этилфеноксикарбонильную группу,
4-этилфеноксикарбонильную группу,
4-пропилфеноксикарбонильную группу,
4-трет-бутилфеноксикарбонильную группу,
4-бутилфеноксикарбонильную группу,
2,3-диметилфеноксикарбонильную группу,
3,4,5-триметилфеноксикарбонильную группу,
4-пентилфеноксикарбонильную группу,
4-гексилфеноксикарбонильную группу,
2-фтор-4-бромфеноксикарбонильную группу,
4-хлор-3-фторфеноксикарбонильную группу,
2,3,4-трихлорфеноксикарбонильную группу,
2,4,6-трихлорфеноксикарбонильную группу,
4-изопропилфеноксикарбонильную группу,
4-н-бутилфеноксикарбонильную группу,
2,4-диметилфеноксикарбонильную группу,
2,6-диметилфеноксикарбонильную группу,
3,5-диметилфеноксикарбонильную группу,
2,5-диметилфеноксикарбонильную группу,
2,4,6-триметилфеноксикарбонильную группу,
3,5-дитрифторметилфеноксикарбонильную группу,
4-н-бутоксифеноксикарбонильную группу,
2,4-диметоксифеноксикарбонильную группу,
2,3-диметоксифеноксикарбонильную группу,
2,6-диметоксифеноксикарбонильную группу,
3,5-диметоксифеноксикарбонильную группу,
2,5-диметоксифеноксикарбонильную группу,
3,5-дитрифторметоксифеноксикарбонильную группу,
3-хлор-4-метоксифеноксикарбонильную группу,
2-хлор-4-трифторметоксифеноксикарбонильную группу,
3-метил-4-фторфеноксикарбонильную группу,
4-бром-3-трифторметилфеноксикарбонильную группу,
2-трифторметилфеноксикарбонильную группу,
3-трифторметилфеноксикарбонильную группу,
4-трифторметилфеноксикарбонильную группу,
2-пентафторэтилфеноксикарбонильную группу,
3-пентафторэтилфеноксикарбонильную группу,
4-пентафторэтилфеноксикарбонильную группу,
2-метоксифеноксикарбонильную группу,
3-метоксифеноксикарбонильную группу,
4-метоксифеноксикарбонильную группу,
2-этоксифеноксикарбонильную группу,
3-этоксифеноксикарбонильную группу,
4-этоксифеноксикарбонильную группу,
4-пропоксифеноксикарбонильную группу,
4-трет-бутоксифеноксикарбонильную группу,
4-н-бутоксифеноксикарбонильную группу,
3,4,5-триметоксифеноксикарбонильную группу,
4-пентоксифеноксикарбонильную группу,
4-гексилоксифеноксикарбонильную группу,
2-трифторметоксифеноксикарбонильную группу,
3-трифторметоксифеноксикарбонильную группу,
4-трифторметоксифеноксикарбонильную группу,
2-пентафторэтоксифеноксикарбонильную группу,
3-пентафторэтоксифеноксикарбонильную группу,
4-пентафторэтоксифеноксикарбонильную группу или тому подобное.
Фенил С1-6алкилкарбамоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например бензилкарбамоильную группу, 2-фенетилкарбамоильную группу,
3-фенилпропилкарбамоильную группу,
2-фенилпропилкарбамоильную группу,
4-фенилбутилкарбамоильную группу,
5-фенилпентилкарбамоильную группу,
4-фенилпентилкарбамоильную группу,
6-фенилгексилкарбамоильную группу,
2-фторбензилкарбамоильную группу,
3-фторбензилкарбамоильную группу,
4-фторбензилкарбамоильную группу,
2-хлорбензилкарбамоильную группу,
3-хлорбензилкарбамоильную группу,
4-хлорбензилкарбамоильную группу,
2-бромбензилкарбамоильную группу,
3-бромбензилкарбамоильную группу,
4-бромбензилкарбамоильную группу,
2-иодбензилкарбамоильную группу,
3-иодбензилкарбамоильную группу,
4-иодбензилкарбамоильную группу,
N-бензил-N-метилкарбамоильную группу,
N-метил-N-(2-фенетил)карбамоильную группу,
N-метил-N-(3-фенилпропил)карбамоильную группу,
N-метил-N-(2-фенилпропил)карбамоильную группу,
N-метил-N-(4-фенилбутил)карбамоильную группу,
N-метил-N-(5-фенилпентил)карбамоильную группу,
N-метил-N-(4-фенилпентил)карбамоильную группу,
N-метил-N-(6-фенилгексил)карбамоильную группу,
N-(2-фторбензил)-N-метилкарбамоильную группу,
N-(3-фторбензил)-N-метилкарбамоильную группу,
N-(4-фторбензил)-N-метилкарбамоильную группу,
N-(2-хлорбензил)-N-метилкарбамоильную группу,
N-(3-хлорбензил)-N-метилкарбамоильную группу,
N-(4-хлорбензил)-N-метилкарбамоильную группу,
N-(2-бромбензил)-N-метилкарбамоильную группу,
N-(3-бромбензил)-N-метилкарбамоильную группу,
N-(4-бромбензил)-N-метилкарбамоильную группу,
N,N-дибензилкарбамоильную группу,
N-бензил-N-(2-фенетил)карбамоильную группу,
N-бензил-(3-фенилпропил)карбамоильную группу,
N-бензил-N-(2-фенилпропил)карбамоильную группу,
N-бензил-N-(4-фенилбутил)карбамоильную группу,
N-бензил-N-(5-фенилпентил)карбамоильную группу,
N-бензил-N-(4-фенилпентил)карбамоильную группу,
N-бензил-N-(6-фенилгексил)карбамоильную группу,
N-бензил-N-(2-фторбензил)карбамоильную группу,
N-бензил-N-(3-фторбензил)карбамоильную группу,
N-бензил-N-(4-фторбензил)карбамоильную группу,
N-бензил-N-(2-хлорбензил)карбамоильную группу,
N-бензил-N-(3-хлорбензил)карбамоильную группу,
N-бензил-N-(4-хлорбензил)карбамоильную группу,
N-бензил-N-(2-бромбензил)карбамоильную группу,
N-бензил-N-(3-бромбензил)карбамоильную группу,
N-бензил-N-(4-бромбензил)карбамоильную группу,
2,3-дифторбензилкарбамоильную группу,
3,4-дифторбензилкарбамоильную группу,
3,5-дифторбензилкарбамоильную группу,
2,4-дифторбензилкарбамоильную группу,
2,6-дифторбензилкарбамоильную группу,
2,3-дихлорбензилкарбамоильную группу,
3,4-дихлорбензилкарбамоильную группу,
3,5-дихлорбензилкарбамоильную группу,
2,4-дихлорбензилкарбамоильную группу,
2,6-дихлорбензилкарбамоильную группу,
2-фтор-4-бромбензилкарбамоильную группу,
4-хлор-3-фторбензилкарбамоильную группу,
2,3,4-трихлорбензилкарбамоильную группу,
3,4,5-трифторбензилкарбамоильную группу,
2,4,6-трихлорбензилкарбамоильную группу,
4-изопропилбензилкарбамоильную группу,
4-н-бутилбензилкарбамоильную группу,
4-метилбензилкарбамоильную группу,
2-метилбензилкарбамоильную группу,
3-метилбензилкарбамоильную группу,
2,4-диметилбензилкарбамоильную группу,
2,3-диметилбензилкарбамоильную группу,
2,6-диметилбензилкарбамоильную группу,
3,5-диметилбензилкарбамоильную группу,
2,5-диметилбензилкарбамоильную группу,
2,4,6-триметилбензилкарбамоильную группу,
3,5-дитрифторметилбензилкарбамоильную группу,
4-изопропилбензилкарбамоильную группу,
4-н-бутоксибензилкарбамоильную группу,
4-метоксибензилкарбамоильную группу,
2-метоксибензилкарбамоильную группу,
3-метоксибензилкарбамоильную группу,
2,4-диметоксибензилкарбамоильную группу,
2,3-диметоксибензилкарбамоильную группу,
2,6-диметоксибензилкарбамоильную группу,
3,5-диметоксибензилкарбамоильную группу,
2,5-диметоксибензилкарбамоильную группу,
2,4,6-триметоксибензилкарбамоильную группу,
3,5-дитрифторметоксибензилкарбамоильную группу,
2-изопропоксибензилкарбамоильную группу,
3-хлор-4-метоксибензилкарбамоильную группу,
2-хлор-4-трифторметоксибензилкарбамоильную группу,
3-метил-4-фторбензилкарбамоильную группу,
4-бром-3-трифторметилбензилкарбамоильную группу,
2-трифторметоксибензилкарбамоильную группу,
3-трифторметилбензилкарбамоильную группу,
4-трифторметилбензилкарбамоильную группу,
2-пентафторэтилбензилкарбамоильную группу,
3-пентафторэтилбензилкарбамоильную группу,
4-пентафторэтилбензилкарбамоильную группу,
2-трифторметоксибензилкарбамоильную группу,
3-трифторметоксибензилкарбамоильную группу,
4-трифторметоксибензилкарбамоильную группу,
2-пентафторэтоксибензилкарбамоильную группу,
3-пентафторэтоксибензилкарбамоильную группу,
4-пентафторэтоксибензилкарбамоильную группу,
2-(2-трифторметилфенил)этилкарбамоильную группу,
2-(3-трифторметилфенил)этилкарбамоильную группу,
2-(4-трифторметилфенил)этилкарбамоильную группу,
2-(2-трифторметоксифенил)этилкарбамоильную группу,
2-(3-трифторметоксифенил)этилкарбамоильную группу,
2-(4-трифторметоксифенил)этилкарбамоильную группу,
2-(2-пентафторэтоксифенил)этилкарбамоильную группу,
2-(3-пентафторэтоксифенил)этилкарбамоильную группу,
2-(4-пентафторэтоксифенил)этилкарбамоильную группу,
3-(2-трифторметилфенил)пропилкарбамоильную группу,
3-(3-трифторметилфенил)пропилкарбамоильную группу,
3-(4-трифторметилфенил)пропилкарбамоильную группу,
3-(2-трифторметоксифенил)пропилкарбамоильную группу,
3-(3-трифторметоксифенил)пропилкарбамоильную группу,
3-(4-трифторметоксифенил)пропилкарбамоильную группу,
3-(3-пентафторэтоксифенил)пропилкарбамоильную группу,
3-(4-пентафторэтоксифенил)пропилкарбамоильную группу,
4-(3-пентафторэтоксифенил)бутилкарбамоильную группу,
5-(4-трифторметилфенил)пентилкарбамоильную группу,
4-(4-трифторметилфенил)пентилкарбамоильную группу,
4-(4-трифторметоксифенил)пентилкарбамоильную группу,
6-(3-трифторметилфенил)гексилкарбамоильную группу,
6-(4-трифторметилфенил)гексилкарбамоильную группу,
6-(4-трифторметоксифенил)гексилкарбамоильную группу или тому подобное.
Бензофурилзамещенная С1-6алкоксикарбонильная группа, которая может быть замещена в бензофурановом кольце по крайней мере одним атомом галогена включает бензофурилзамещенную С1-6алкоксикарбонильную группу, которая может быть замещена в бензофурановом кольце 1-3 атомами галогена, например
2-бензофурилметоксикарбонильную группу,
1-(2-бензофурил)этоксикарбонильную группу,
2-(4-бензофурил)этоксикарбонильную группу,
3-(5-бензофурил)пропоксикарбонильную группу,
4-(6-бензофурил)бутоксикарбонильную группу,
5-(7-бензофурил)пентилоксикарбонильную группу,
6-(2-бензофурил)гексилоксикарбонильную группу,
4-фтор-2-бензофурилметоксикарбонильную группу,
5-фтор-2-бензофурилметоксикарбонильную группу,
6-фтор-2-бензофурилметоксикарбонильную группу,
7-фтор-2-бензофурилметоксикарбонильную группу,
4-хлор-2-бензофурилметоксикарбонильную группу,
5-хлор-2-бензофурилметоксикарбонильную группу,
6-хлор-2-бензофурилметоксикарбонильную группу,
7-хлор-2-бензофурилметоксикарбонильную группу,
4-бром-2-бензофурилметоксикарбонильную группу,
5-бром-2-бензофурилметоксикарбонильную группу,
6-бром-2-бензофурилметоксикарбонильную группу,
7-бром-2-бензофурилметоксикарбонильную группу,
4-иод-2-бензофурилметоксикарбонильную группу,
5-иод-2-бензофурилметоксикарбонильную группу,
6-иод-2-бензофурилметоксикарбонильную группу,
7-иод-2-бензофурилметоксикарбонильную группу,
4-фтор-3-бензофурилметоксикарбонильную группу,
5-фтор-3-бензофурилметоксикарбонильную группу,
6-фтор-3-бензофурилметоксикарбонильную группу,
7-фтор-3-бензофурилметоксикарбонильную группу,
4-хлор-3-бензофурилметоксикарбонильную группу,
5-хлор-3-бензофурилметоксикарбонильную группу,
6-хлор-3-бензофурилметоксикарбонильную группу,
7-хлор-3-бензофурилметоксикарбонильную группу,
4-бром-3-бензофурилметоксикарбонильную группу,
5-бром-3-бензофурилметоксикарбонильную группу,
6-бром-3-бензофурилметоксикарбонильную группу,
7-бром-3-бензофурилметоксикарбонильную группу,
4-иод-3-бензофурилметоксикарбонильную группу,
5-иод-3-бензофурилметоксикарбонильную группу,
6-иод-3-бензофурилметоксикарбонильную группу,
7-иод-3-бензофурилметоксикарбонильную группу,
2-(4-фтор-2-бензофурил)этоксикарбонильную группу,
2-(5-фтор-2-бензофурил)этоксикарбонильную группу,
2-(6-фтор-2-бензофурил)этоксикарбонильную группу,
2-(7-фтор-2-бензофурил)этоксикарбонильную группу,
2-(4-хлор-2-бензофурил)этоксикарбонильную группу,
2-(5-хлор-2-бензофурил)этоксикарбонильную группу,
2-(6-хлор-2-бензофурил)этоксикарбонильную группу,
2-(7-хлор-2-бензофурил)этоксикарбонильную группу,
2-(4-фтор-3-бензофурил)этоксикарбонильную группу,
2-(5-фтор-3-бензофурил)этоксикарбонильную группу,
2-(6-фтор-3-бензофурил)этоксикарбонильную группу,
2-(7-фтор-3-бензофурил)этоксикарбонильную группу,
2-(4-хлор-3-бензофурил)этоксикарбонильную группу,
2-(5-хлор-3-бензофурил)этоксикарбонильную группу,
2-(6-хлор-3-бензофурил)этоксикарбонильную группу,
2-(7-хлор-3-бензофурил)этоксикарбонильную группу,
6-(4-фтор-2-бензофурил)гексилоксикарбонильную группу,
6-(5-фтор-2-бензофурил)гексилоксикарбонильную группу,
6-(6-фтор-2-бензофурил)гексилоксикарбонильную группу,
6-(7-фтор-2-бензофурил)гексилоксикарбонильную группу,
6-(4-хлор-2-бензофурил)гексилоксикарбонильную группу,
6-(5-хлор-2-бензофурил)гексилоксикарбонильную группу,
6-(6-хлор-2-бензофурил)гексилоксикарбонильную группу,
6-(7-хлор-2-бензофурил)гексилоксикарбонильную группу,
6-(4-фтор-3-бензофурил)этоксикарбонильную группу,
6-(5-фтор-3-бензофурил)гексилоксикарбонильную группу,
6-(6-фтор-3-бензофурил)гексилоксикарбонильную группу,
6-(7-фтор-3-бензофурил)гексилоксикарбонильную группу,
6-(4-хлор-3-бензофурил)гексилоксикарбонильную группу,
6-(5-хлор-3-бензофурил)гексилоксикарбонильную группу,
6-(6-хлор-3-бензофурил)гексилоксикарбонильную группу,
6-(7-хлор-3-бензофурил)гексилоксикарбонильную группу,
(2,4-дибром-3-бензофурил)метоксикарбонильную группу,
(4,5,6-трихлор-3-бензофурил)метоксикарбонильную группу или тому подобное.
Бензотиенил-С1-6алкоксикарбонильная группа (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя) включает бензотиенил-С1-6алкоксикарбонильную группу (которая может быть замещена в бензотиофеновом кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), например 2-бензотиенилметоксикарбонильную группу, 3-бензотиенилметоксикарбонильную группу,
4-бензотиенилметоксикарбонильную группу,
5-бензотиенилметоксикарбонильную группу,
6-бензотиенилметоксикарбонильную группу,
7-бензотиенилметоксикарбонильную группу,
2-(2-бензотиенил)этоксикарбонильную группу,
3-(2-бензотиенил)пропоксикарбонильную группу,
4-(2-бензотиенил)бутоксикарбонильную группу,
5-(2-бензотиенил)пентилоксикарбонильную группу,
6-(2-бензотиенил)гексилоксикарбонильную группу,
5-трифторметокси-2-бензотиенилметоксикарбонильную группу,
5-трифторметокси-3-бензотиенилметоксикарбонильную группу,
5-трифторметокси-4-бензотиенилметоксикарбонильную группу,
4-трифторметокси-5-бензотиенилметоксикарбонильную группу,
3-трифторметокси-6-бензотиенилметоксикарбонильную группу,
2-трифторметокси-7-бензотиенилметоксикарбонильную группу,
2-метокси-7-бензотиенилметоксикарбонильную группу,
5,6-диметокси-3-бензотиенилметоксикарбонильную группу,
2,5,6-триметокси-3-бензотиенилметоксикарбонильную группу,
5-хлор-6-метокси-3-бензотиенилметоксикарбонильную группу,
2-(4-этокси-2-бензотиенил)этоксикарбонильную группу,
5-хлор-3-бензотиенилметоксикарбонильную группу,
3,4-дибром-2-бензотиенилметоксикарбонильную группу,
4,5,6-трихлор-2-бензотиенилметоксикарбонильную группу,
5-трифторметокси-2-хлор-7-бензотиенилметоксикарбонильную группу или тому подобное.
Примеры нафтилзамещенной С1-6алкоксикарбонильной группы включают 1-нафтилметоксикарбонильную группу,
2-нафтилметоксикарбонильную группу,
2-(1-нафтил)этоксикарбонильную группу,
2-(2-нафтил)этоксикарбонильную группу,
3-(1-нафтил)пропоксикарбонильную группу,
3-(2-нафтил)пропоксикарбонильную группу,
4-(1-нафтил)бутоксикарбонильную группу,
4-(2-нафтил)бутоксикарбонильную группу,
5-(1-нафтил)пентоксикарбонильную группу,
5-(2-нафтил)пентоксикарбонильную группу,
6-(1-нафтил)гексилоксикарбонильную группу,
6-(2-нафтил)гексилоксикарбонильную группу или тому подобное.
Пиридилзамещенная С1-6алкоксикарбонильная группа (которая может быть замещена в пиридиновом кольце по крайней мере одним атомом галогена) включает пиридилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в пиридиновом кольце 1-3 атомами галогена), например
2-пиридилметоксикарбонильную группу,
3-пиридилметоксикарбонильную группу,
4-пиридилметоксикарбонильную группу,
2-(2-пиридил)этоксикарбонильную группу,
2-(3-пиридил)этоксикарбонильную группу,
2-(4-пиридил)этоксикарбонильную группу,
3-(2-пиридил)пропоксикарбонильную группу,
3-(3-пиридил)пропоксикарбонильную группу,
3-(4-пиридил)пропоксикарбонильную группу,
4-(2-пиридил)бутоксикарбонильную группу,
4-(3-пиридил)бутоксикарбонильную группу,
4-(4-пиридил)бутоксикарбонильную группу,
5-(2-пиридил)пентилоксикарбонильную группу,
5-(3-пиридил)пентилоксикарбонильную группу,
5-(4-пиридил)пентилоксикарбонильную группу,
6-(2-пиридил)гексилоксикарбонильную группу,
6-(3-пиридил)гексилоксикарбонильную группу,
6-(4-пиридил)гексилоксикарбонильную группу,
2-хлор-3-пиридилметоксикарбонильную группу,
3-бром-2-пиридилметоксикарбонильную группу,
4-фтор-2-пиридилметоксикарбонильную группу,
2-(2-хлор-4-пиридил)этоксикарбонильную группу,
2-(3-хлор-5-пиридил)этоксикарбонильную группу,
2-(4-иод-3-пиридил)этоксикарбонильную группу,
3-(2-бром-5-пиридил)пропоксикарбонильную группу,
3-(3-фтор-4-пиридил)пропоксикарбонильную группу,
3-(4-хлор-2-пиридил)пропоксикарбонильную группу,
4-(2-иод-5-пиридил)бутоксикарбонильную группу,
4-(3-бром-5-пиридил)бутоксикарбонильную группу,
4-(4-хлор-5-пиридил)бутоксикарбонильную группу,
5-(2-хлор-5-пиридил)пентилоксикарбонильную группу,
5-(3-фтор-2-пиридил)пентилоксикарбонильную группу,
5-(4-бром-2-пиридил)пентилоксикарбонильную группу,
6-(2-хлор-5-пиридил)гексилоксикарбонильную группу,
6-(3-фтор-4-пиридил)гексилоксикарбонильную группу,
6-(4-бром-2-пиридил)гексилоксикарбонильную группу,
(2,6-дихлор-4-пиридил)метоксикарбонильную группу,
(2,3,4-трихлор-6-пиридил)метоксикарбонильную группу или тому подобное.
Фурилзамещенная С1-6алкоксикарбонильная группа (которая может быть замещена в фурановом кольце по крайней мере одной нитрогруппой в качестве заместителя) включает фурилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в фурановом кольце 1-3 нитрогруппами в качестве заместителя), например 2-фурилметоксикарбонильную группу,
3-фурилметоксикарбонильную группу,
2-(2-фурил)этоксикарбонильную группу,
3-(2-фурил)пропоксикарбонильную группу,
3-(3-фурил)пропоксикарбонильную группу,
4-(2-фурил)бутоксикарбонильную группу,
4-(3-фурил)бутоксикарбонильную группу,
5-(2-фурил)пентилоксикарбонильную группу,
5-(3-фурил)пентилоксикарбонильную группу,
6-(2-фурил)гексилоксикарбонильную группу,
6-(3-фурил)гексилоксикарбонильную группу,
5-нитро-2-фурилметоксикарбонильную группу,
5-нитро-3-фурилметоксикарбонильную группу,
2-(5-нитро-2-фурил)этоксикарбонильную группу,
3-(5-нитро-2-фурил)пропоксикарбонильную группу,
4-(5-нитро-2-фурил)бутоксикарбонильную группу,
4-(5-нитро-3-фурил)бутоксикарбонильную группу,
5-(5-нитро-2-фурил)пентилоксикарбонильную группу,
5-(5-нитро-3-фурил)пентилоксикарбонильную группу,
6-(5-нитро-2-фурил)гексилоксикарбонильную группу,
6-(5-нитро-3-фурил)гексилоксикарбонильную группу,
(4,5-динитро-2-фурил)метоксикарбонильную группу,
(2,4,5-тринитро-3-фурил)метоксикарбонильную группу или тому подобное.
Тиенилзамещенная С1-6алкоксикарбонильная группа (которая может быть замещена в тиофеновом кольце по крайней мере одним атомом галогена в качестве заместителя) включает тиенилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в тиофеновом кольце 1-3 атомами галогена в качестве заместителя), например 2-тиенилметоксикарбонильную группу,
3-тиенилметоксикарбонильную группу,
2-(2-тиенил)этоксикарбонильную группу,
3-(2-тиенил)пропоксикарбонильную группу,
3-(3-тиенил)пропоксикарбонильную группу,
4-(2-тиенил)бутоксикарбонильную группу,
4-(3-тиенил)бутоксикарбонильную группу,
5-(2-тиенил)пентилоксикарбонильную группу,
5-(3-тиенил)пентилоксикарбонильную группу,
6-(2-тиенил)гексилоксикарбонильную группу,
6-(3-тиенил)гексилоксикарбонильную группу,
5-хлор-2-тиенилметоксикарбонильную группу,
5-хлор-3-тиенилметоксикарбонильную группу,
2-(4-бром-2-тиенил)этоксикарбонильную группу,
3-(3-фтор-2-тиенил)пропоксикарбонильную группу,
4-(5-иод-2-тиенил)бутоксикарбонильную группу,
4-(4-хлор-3-тиенил)бутоксикарбонильную группу,
5-(3-хлор-2-тиенил)пентилоксикарбонильную группу,
5-(2-хлор-3-тиенил)пентилоксикарбонильную группу,
6-(3-хлор-2-тиенил)гексилоксикарбонильную группу,
6-(5-хлор-3-тиенил)гексилоксикарбонильную группу,
(4,5-дихлор-2-тиенил)метоксикарбонильную группу,
(2,4,5-трихлор-3-тиенил)метоксикарбонильную группу или тому подобное.
Тиазолилзамещенная С1-6алкоксикарбонильная группа (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце галогензамещенной или незамещенной С1-6алкильной группой)) включает тиазолилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в тиазольном кольце 1-2 группами, выбранными из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, галогензамещенными или незамещенными С1-6алкильными группами)), например
2-тиазолилметоксикарбонильную группу,
2-(2-тиазолил)этоксикарбонильную группу,
3-(2-тиазолил)пропоксикарбонильную группу,
4-(2-тиазолил)бутоксикарбонильную группу,
5-(2-тиазолил)пентилоксикарбонильную группу,
6-(2-тиазолил)гексилоксикарбонильную группу,
4-тиазолилметоксикарбонильную группу,
5-тиазолилметоксикарбонильную группу,
2-метил-4-тиазолилметоксикарбонильную группу,
2-метил-5-тиазолилметоксикарбонильную группу,
5-метил-2-тиазолилметоксикарбонильную группу,
4-метил-2-тиазолилметоксикарбонильную группу,
5-метил-4-тиазолилметоксикарбонильную группу,
4-метил-5-тиазолилметоксикарбонильную группу,
2-этил-4-тиазолилметоксикарбонильную группу,
2-этил-5-тиазолилметоксикарбонильную группу,
5-этил-2-тиазолилметоксикарбонильную группу,
5-пропил-2-тиазолилметоксикарбонильную группу,
4-н-бутил-2-тиазолилметоксикарбонильную группу,
5-этил-4-тиазолилметоксикарбонильную группу,
4-н-пентил-5-тиазолилметоксикарбонильную группу,
2-н-гексил-4-тиазолилметоксикарбонильную группу,
2-н-гексил-5-тиазолилметоксикарбонильную группу,
4-н-пентил-2-тиазолилметоксикарбонильную группу,
5-н-гексил-2-тиазолилметоксикарбонильную группу,
4-н-гексил-2-тиазолилметоксикарбонильную группу,
5-н-гексил-4-тиазолилметоксикарбонильную группу,
4-н-гексил-5-тиазолилметоксикарбонильную группу,
2-фенил-4-тиазолилметоксикарбонильную группу,
2-фенил-5-тиазолилметоксикарбонильную группу,
2-фенил-4-тиазолилметоксикарбонильную группу,
4-фенил-2-тиазолилметоксикарбонильную группу,
5-фенил-2-тиазолилметоксикарбонильную группу,
2-(4-фенил-2-тиазолил)этоксикарбонильную группу,
5-фенил-4-тиазолилметоксикарбонильную группу,
4-фенил-5-тиазолилметоксикарбонильную группу,
5-(2-фторфенил)-2-тиазолилметоксикарбонильную группу,
5-(2-фторфенил)-4-тиазолилметоксикарбонильную группу,
4-(2-фторфенил)-5-тиазолилметоксикарбонильную группу,
2-(2-бромфенил)-4-тиазолилметоксикарбонильную группу,
2-(2-фторфенил)-5-тиазолилметоксикарбонильную группу,
2-(3-хлорфенил)-4-тиазолилметоксикарбонильную группу,
2-(2,3-дифторфенил)-5-тиазолилметоксикарбонильную группу,
2-(2,4-дибромфенил)-4-тиазолилметоксикарбонильную группу,
4-(2,5-дихлорфенил)-5-тиазолилметоксикарбонильную группу,
2-(2-хлорфенил)-4-тиазолилметоксикарбонильную группу,
2-(2,4,6-трихлорфенил)-5-тиазолилметоксикарбонильную группу,
2-(4-хлорфенил)-4-тиазолилметоксикарбонильную группу,
2-(2-фторфенил)-5-тиазолилметоксикарбонильную группу,
2-(4-хлорфенил)-5-тиазолилметоксикарбонильную группу,
2-(2,4-дихлорфенил)-5-тиазолилметоксикарбонильную группу,
4-(2-метилфенил)-5-тиазолилметоксикарбонильную группу,
2-(2-этилфенил)-4-тиазолилметоксикарбонильную группу,
2-(2-н-пропилфенил)-5-тиазолилметоксикарбонильную группу,
2-(3-изопропилфенил)-4-тиазолилметоксикарбонильную группу,
2-(3-н-бутилфенил)-5-тиазолилметоксикарбонильную группу,
2-(4-н-пентилфенил)-4-тиазолилметоксикарбонильную группу,
4-(2-н-гексилфенил)-5-тиазолилметоксикарбонильную группу,
2-(2,4-диметилфенил)-4-тиазолилметоксикарбонильную группу,
2-(2,3-диметилфенил)-5-тиазолилметоксикарбонильную группу,
2-(2,4,6-триметилфенил)-4-тиазолилметоксикарбонильную группу,
2-(2-метилфенил)-4-метил-5-тиазолилметоксикарбонильную группу,
2-(4-хлорфенил)-5-метил-4-тиазолилметоксикарбонильную группу,
2,4-диметил-5-тиазолилметоксикарбонильную группу,
5-(2-трифторметилфенил)-2-тиазолилметоксикарбонильную группу,
5-(2-трифторметилфенил)-4-тиазолилметоксикарбонильную группу,
4-(2-трифторметилфенил)-5-тиазолилметоксикарбонильную группу,
2-(2-трифторметилфенил)-4-тиазолилметоксикарбонильную группу,
2-(2-трифторметилфенил)-5-тиазолилметоксикарбонильную группу,
2-(3-трифторметилфенил)-4-тиазолилметоксикарбонильную группу,
2-(3-трифторметилфенил)-5-тиазолилметоксикарбонильную группу,
2-(4-трифторметилфенил)-4-тиазолилметоксикарбонильную группу или тому подобное.
Тетразолилзамещенная С1-6алкоксикарбонильная группа (которая может быть замещена в тетразольном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы, которая может иметь в качестве заместителя по крайней мере один атом галогена в фенильном кольце, в качестве заместителя) включает тетразолилзамещенную С1-6алкоксикарбонильную группу (которая может быть замещена в тетразольном кольце группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы, которая может содержать
1-5, предпочтительно 1-3, атома галогена в качестве заместителя в фенильном кольце, в качестве заместителя), например
5-(1H)-тетразолилметоксикарбонильную группу,
2-(5-(1H)-тетразолил)этоксикарбонильную группу,
3-(5-(1H)-тетразолил)пропоксикарбонильную группу,
4-(5-(1H)-тетразолил)бутоксикарбонильную группу,
5-(5-(1H)-тетразолил)пентилоксикарбонильную группу,
6-(5-(1H)-тетразолил)гексилоксикарбонильную группу,
1-метил-5-(1H)-тетразолилметоксикарбонильную группу,
1-этил-5-(1H)-тетразолилметоксикарбонильную группу,
1-н-пропил-5-(1H)-тетразолилметоксикарбонильную группу,
1-н-бутил-5-(1H)-тетразолилметоксикарбонильную группу,
1-н-пентил-5-(1H)-тетразолилметоксикарбонильную группу,
1-н-гексил-5-(1H)-тетразолилметоксикарбонильную группу,
1-фенил-5-(1H)-тетразолилметоксикарбонильную группу,
1-(2-фторфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(3-фторфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(4-фторфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(2-хлорфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(3-хлорфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(4-хлорфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(2-бромфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(3-бромфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
1-(4-бромфенил)-5-(1H)-тетразолилметоксикарбонильную группу,
2-(1-метил-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-этил-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-пропил-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-бутил-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-пентил-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-гексил-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-фенил-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(2,4-дифторфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(3-фторфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(4-фторфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(2,4,6-трихлорфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(3-хлорфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(4-хлорфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(2-бромфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(3-бромфенил)-5-(1H)-тетразолил)этоксикарбонильную группу,
2-(1-(4-бромфенил)-5-(1H)-тетразолил)этоксикарбонильную группу или тому подобное.
Примеры 2,3-дигидро-1H-инденилоксикарбонильной группы включают 2,3-дигидро-1H-инден-1-илоксикарбонильную группу, 2,3-дигидро-1H-инден-2-илоксикарбонильную группу или тому подобное.
Примеры адамантанзамещенной С1-6алкоксикарбонильной группы включают адамантан-1-илметоксикарбонильную группу,
2-(адамантан-1-ил)этоксикарбонильную группу,
3-(адамантан-1-ил)пропоксикарбонильную группу,
4-(адамантан-1-ил)бутоксикарбонильную группу,
5-(адамантан-1-ил)пентилоксикарбонильную группу,
6-(адамантан-1-ил)гексилоксикарбонильную группу или тому подобное.
Примеры фенил-С3-6алкинилоксикарбонильной группы включают
2-фенилэтинилоксикарбонильную группу,
3-фенил-2-пропинилоксикарбонильную группу,
4-фенил-3-бутин-1-илоксикарбонильную группу,
4-фенил-3-бутин-2-илоксикарбонильную группу,
5-фенил-4-пентин-1-илоксикарбонильную группу,
6-фенил-5-гексин-1-илоксикарбонильную группу или тому подобное.
Примеры фенилтио-С1-6алкоксикарбонильной группу включают фенилтиометоксикарбонильную группу,
2-фенилтиоэтоксикарбонильную группу,
1-фенилтиоэтоксикарбонильную группу,
3-(фенилтио)пропоксикарбонильную группу,
4-(фенилтио)бутоксикарбонильную группу,
5-(фенилтио)пентилоксикарбонильную группу,
6-(фенилтио)гексилоксикарбонильную группу или тому подобное.
Примеры фенил С1-6алкоксизамещенной С1-6алкоксикарбонильной группы включают бензилоксиметоксикарбонильную группу,
2-бензилоксиэтоксикарбонильную группу,
3-(бензилокси)пропоксикарбонильную группу,
4-(бензилокси)бутоксикарбонильную группу,
5-(бензилокси)пентилоксикарбонильную группу,
6-(бензилокси)гексилоксикарбонильную группу,
2-фенилэтоксиметоксикарбонильную группу,
2-фенилэтоксиэтоксикарбонильную группу,
3-(2-фенилэтокси)пропоксикарбонильную группу,
4-(2-фенилэтокси)бутоксикарбонильную группу,
5-(2-фенилэтокси)пентилоксикарбонильную группу,
6-(2-фенилэтокси)гексилоксикарбонильную группу,
3-фенилпропоксиметоксикарбонильную группу,
3-фенилпропоксиэтоксикарбонильную группу,
3-(3-фенилпропокси)пропоксикарбонильную группу,
4-(3-фенилпропокси)бутоксикарбонильную группу,
5-(3-фенилпропокси)пентилоксикарбонильную группу,
6-(3-фенилпропокси)гексилоксикарбонильную группу,
4-фенилбутоксиметоксикарбонильную группу,
4-фенилбутоксиэтоксикарбонильную группу,
3-(4-фенилбутокси)пропоксикарбонильную группу,
4-(4-фенилбутокси)бутоксикарбонильную группу,
5-(4-фенилбутокси)пентилоксикарбонильную группу,
6-(4-фенилбутокси)гексилоксикарбонильную группу,
5-фенилпентилоксиметоксикарбонильную группу,
5-фенилпентилоксиэтоксикарбонильную группу,
3-(5-фенилпентилокси)пропоксикарбонильную группу,
4-(5-фенилпентилокси)бутоксикарбонильную группу,
5-(5-фенилпентилокси)пентилоксикарбонильную группу,
6-(5-фенилпентилокси)гексилоксикарбонильную группу,
6-фенилгексилоксиметоксикарбонильную группу,
6-фенилгексилоксиэтоксикарбонильную группу,
3-(6-фенилгексилокси)пропоксикарбонильную группу,
4-(6-фенилгексилокси)бутоксикарбонильную группу,
5-(6-фенилгексилокси)пентилоксикарбонильную группу,
6-(6-фенилгексилокси)гексилоксикарбонильную группу или тому подобное.
Примеры С2-6алкенилоксикарбонильной группы включают винилоксикарбонильную группу, 2-пропенилоксикарбонильную группу (тривиальное название: аллилоксикарбонильная группа),
2-бутен-1-илоксикарбонильную группу,
3-бутен-1-илоксикарбонильную группу,
4-пентен-1-илоксикарбонильную группу,
3-пентен-1-илоксикарбонильную группу,
5-гексен-1-илоксикарбонильную группу,
4-гексен-1-илоксикарбонильную группу,
3-гексен-1-илоксикарбонильную группу или тому подобное.
Примеры С2-6алкинилоксикарбонильной группы включают ацетиленоксикарбонильную группу,
2-пропинилоксикарбонильную группу,
2-бутин-1-илоксикарбонильную группу,
3-бутин-1-илоксикарбонильную группу,
4-пентин-1-илоксикарбонильную группу,
3-пентин-1-илоксикарбонильную группу,
5-гексин-1-илоксикарбонильную группу,
4-гексин-1-илоксикарбонильную группу,
3-гексин-1-илоксикарбонильную группу или тому подобное.
Примеры С3-8циклоалкилзамещенной С1-6алкоксикарбонильной группы включают циклопропилметоксикарбонильную группу,
циклобутилметоксикарбонильную группу,
циклопентилметоксикарбонильную группу,
циклогексилметоксикарбонильную группу,
циклогептилметоксикарбонильную группу,
циклооктилметоксикарбонильную группу,
2-циклопропилэтоксикарбонильную группу,
2-циклобутилэтоксикарбонильную группу,
2-циклопентилэтоксикарбонильную группу,
2-циклогексилэтоксикарбонильную группу,
2-циклогептилэтоксикарбонильную группу,
3-циклопропилпропоксикарбонильную группу,
3-циклобутилпропоксикарбонильную группу,
3-циклопентилпропоксикарбонильную группу,
3-циклогексилпропоксикарбонильную группу,
3-циклогептилпропоксикарбонильную группу,
3-циклооктилпропоксикарбонильную группу,
4-циклопропилбутоксикарбонильную группу,
4-циклобутилбутоксикарбонильную группу,
4-циклогексилбутоксикарбонильную группу,
5-циклогексилпентилоксикарбонильную группу,
6-циклогексилгексилоксикарбонильную группу или тому подобное.
Примеры бензоилзамещенной С1-6алкоксикарбонильной группы включают бензоилметоксикарбонильную группу,
2-бензоилэтоксикарбонильную группу,
1-бензоилэтоксикарбонильную группу,
3-(бензоил)пропоксикарбонильную группу,
4-(бензоил)бутоксикарбонильную группу,
5-(бензоил)пентилоксикарбонильную группу,
6-(бензоил)гексилоксикарбонильную группу или тому подобное.
Примеры феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включают феноксигруппу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например феноксигруппу, 2-фторфеноксигруппу, 3-фторфеноксигруппу,
4-фторфеноксигруппу, 2-хлорфеноксигруппу, 3-хлорфеноксигруппу,
4-хлорфеноксигруппу, 2-бромфеноксигруппу, 3-бромфеноксигруппу,
4-бромфеноксигруппу, 2-иодфеноксигруппу, 3-иодфеноксигруппу,
4-иодфеноксигруппу, 2,3-дифторфеноксигруппу,
3,4-дифторфеноксигруппу, 3,5-дифторфеноксигруппу,
2,4-дифторфеноксигруппу, 2,6-дифторфеноксигруппу,
2,3-дихлорфеноксигруппу, 3,4-дихлорфеноксигруппу,
3,5-дихлорфеноксигруппу, 2,4-дихлорфеноксигруппу,
2,6-дихлорфеноксигруппу, 2,3,4-трифторфеноксигруппу,
3,4,5-трифторфеноксигруппу, 3,4,5-трихлорфеноксигруппу,
2,4,6-трифторфеноксигруппу, 2,3,4,5,6-пентафторфеноксигруппу,
2,4,6-трихлорфеноксигруппу, 2-фтор-4-хлорфеноксигруппу,
2-фтор-4-бромфеноксигруппу, 3-фтор-4-хлорфеноксигруппу,
2-метилфеноксигруппу, 3-метилфеноксигруппу,
4-метилфеноксигруппу, 2,6-диметилфеноксигруппу,
2,4,6-триметилфеноксигруппу, 2-метил-3-хлорфеноксигруппу,
3-метил-4-хлорфеноксигруппу, 2-хлор-4-метилфеноксигруппу,
2-метил-3-фторфеноксигруппу, 2-трифторметилфеноксигруппу,
3-трифторметилфеноксигруппу, 4-трифторметилфеноксигруппу,
3,5-ди(трифторметил)феноксигруппу,
3,4-ди(трифторметил)феноксигруппу,
2,4-ди(трифторметил)феноксигруппу, 2-пентафторэтилфеноксигруппу,
3-пентафторэтилфеноксигруппу, 4-пентафторэтилфеноксигруппу,
2-изопропилфеноксигруппу, 3-изопропилфеноксигруппу,
4-изопропилфеноксигруппу, 2-трет-бутилфеноксигруппу,
3-трет-бутилфеноксигруппу, 4-трет-бутилфеноксигруппу,
2-втор-бутилфеноксигруппу, 3-втор-бутилфеноксигруппу,
4-втор-бутилфеноксигруппу, 4-н-бутилфеноксигруппу,
4-н-пентилфеноксигруппу, 4-н-гексилфеноксигруппу,
2-н-гептафторпропилфеноксигруппу,
3-н-гептафторпропилфеноксигруппу,
4-н-гептафторпропилфеноксигруппу, 4-пентилфеноксигруппу,
4-гексилфеноксигруппу, 2-метоксифеноксигруппу,
3-метоксифеноксигруппу, 4-метоксифеноксигруппу,
2-метокси-3-хлорфеноксигруппу, 2-фтор-3-метоксифеноксигруппу,
2-фтор-4-метоксифеноксигруппу, 2-фтор-4-бромфеноксигруппу,
4-хлор-3-фторфеноксигруппу, 2,3,4-трихлорфеноксигруппу,
3,4,5-трифторфеноксигруппу, 2,4,6-трихлорфеноксигруппу,
2,4-диметилфеноксигруппу, 2,3-диметилфеноксигруппу,
3,5-диметилфеноксигруппу, 2,5-диметилфеноксигруппу,
4-изопропоксифеноксигруппу, 4-н-бутоксифеноксигруппу,
2,4-диметоксифеноксигруппу, 2,3-диметоксифеноксигруппу,
3,5-диметоксифеноксигруппу, 2,5-диметоксифеноксигруппу,
2,4,6-триметоксифеноксигруппу,
3,5-ди(трифторметокси)феноксигруппу,
3-хлор-4-метоксифеноксигруппу,
2-хлор-4-трифторметоксифеноксигруппу,
3-метил-4-фторфеноксигруппу, 4-бром-3-трифторметилфеноксигруппу,
2,6-диметоксифеноксигруппу, 2-трифторметоксифеноксигруппу,
3-трифторметоксифеноксигруппу, 4-трифторметоксифеноксигруппу,
2,3-ди(трифторметокси)феноксигруппу,
2,4-ди(трифторметокси)феноксигруппу,
2-пентафторэтоксифеноксигруппу, 3-пентафторэтоксифеноксигруппу,
4-пентафторэтоксифеноксигруппу, 2-изопропоксифеноксигруппу,
3-изопропоксифеноксигруппу, 4-изопропоксифеноксигруппу,
2-трет-бутоксифеноксигруппу, 3-трет-бутоксифеноксигруппу,
4-трет-бутоксифеноксигруппу, 2-втор-бутоксифеноксигруппу,
3-втор-бутоксифеноксигруппу, 4-втор-бутоксифеноксигруппу,
4-н-гексилоксифеноксигруппу, 2-н-гептафторпропоксифеноксигруппу,
3-н-гептафторпропоксифеноксигруппу,
4-н-гептафторпропоксифеноксигруппу или тому подобное.
Примеры 8-азабицикло[3,2,1]октильной группы (которая может быть замещена в 8-азабицикло[3,2,1]октановом кольце по крайней мере одной феноксигруппой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)) включают 8-азабицикло[3,2,1]октильную группу (которая может быть замещена в 8-азабицикло[3,2,1]октановом кольце по крайней мере одной феноксигруппой (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)), например
8-азабицикло[3,2,1]октан-8-ильную группу,
3-фенокси-8-азабицикло[3,2,1]октан-8-ильную группу,
3-(3-хлорфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(4-бромфенокси)-8-азабицикло[3,2,1]октан-8-ильную группу,
3-(2-фторфенокси)-8-азабицикло[3,2,1]октан-8-ильную группу,
3-(3-иодфенокси)-8-азабицикло[3,2,1]октан-8-ильную группу,
3-(3-трифторметилфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(3-метилфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(4-метоксифенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(3,5-дитрифторметилфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(3-трифторметил-4-фторфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(2-трифторметокси-3-хлорфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(2,4-дифторфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(2,4,6-трихлорфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(4-трифторметилфенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(3-трифторметоксифенокси)-8-азабицикло[3,2,1]октан-1-ильную группу,
3-(4-трифторметоксифенокси)-8-азабицикло[3,2,1]октан-1-ильную группу или тому подобное.
Примеры группы, представленной пиридильной группой (которая может быть замещена в пиридиновом кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя) включают пиридильную группу (которая может быть замещена в пиридиновом кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами в качестве заместителя), например пиридин-3-ильную группу, пиридин-2-ильную группу, пиридин-4-ильную группу, 4-трифторметилпиридин-2-ильную группу, 4-трифторметилпиридин-3-ильную группу, 5-трифторметилпиридин-2-ильную группу, 5-трифторметилпиридин-3-ильную группу, 2-трифторметилпиридин-3-ильную группу, 2,4-диметилпиридин-3-ильную группу, 3,4,5-триметилпиридин-2-ильную группу, 4-этилпиридин-2-ильную группу, 3-н-бутилпиридин-2-ильную группу, 5-н-пентилпиридин-2-ильную группу, 4-н-гексилпиридин-2-ильную группу или тому подобное.
R47 и R48 могут образовывать 5-7-членное насыщенное гетероциклическое кольцо связыванием друг с другом вместе со смежным атомом азота непосредственно или через другие гетероатомы. Гетероцикл может быть замещен по крайней мере одной фенильной группой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя) и включают гетероцикл (который может быть замещен в гетерокольце 1-3 фенильными группами (которые могут быть замещены в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя), примеры которого включают пирролидинильную группу, морфолиногруппу,
тиоморфолиногруппу, пиперазильную группу, пиперидильную группу,
гомопиперазильную группу, 4-фенилпиперазин-1-ильную группу,
4-фенилпиперидин-1-ильную группу,
4-(3-хлорфенил)пиперазин-1-ильную группу,
4-(4-хлорфенил)пиперазин-1-ильную группу,
4-(3,4-дихлорфенил)пиперазин-1-ильную группу,
4-(3-трифторметилфенил)пиперазин-1-ильную группу,
4-(4-трифторметилфенил)пиперазин-1-ильную группу,
4-(3-трифторметоксифенил)пиперазин-1-ильную группу,
4-(4-трифторметоксифенил)пиперазин-1-ильную группу,
4-фенилпиперидин-1-ильную группу,
4-(3-хлорфенил)пиперидин-1-ильную группу,
4-(4-хлорфенил)пиперидин-1-ильную группу,
4-(3,4-дихлорфенил)пиперидин-1-ильную группу,
4-(3-трифторметилфенил)пиперидин-1-ильную группу,
4-(4-трифторметилфенил)пиперидин-1-ильную группу,
4-(3-трифторметоксифенил)пиперидин-1-ильную группу,
4-(4-трифторметоксифенил)пиперидин-1-ильную группу,
4-(2,4,6-трифторфенил)пиперазин-1-ильную группу,
4-(4-метилфенил)пиперазин-1-ильную группу,
4-(3-метоксифенил)пиперазин-1-ильную группу,
4-(3,4-диметоксифенил)пиперазин-1-ильную группу,
4-(2,4-диметилфенил)пиперазин-1-ильную группу,
4-(2,4,6-триметоксифенил)пиперазин-1-ильную группу,
4-(3,4,5-триметилфенил)пиперазин-1-ильную группу,
4-(2,4,6-трифторфенил)пиперидин-1-ильную группу,
4-(2,3,4,5,6-пентафторфенил)пиперидин-1-ильную группу,
4-(4-метилфенил)пиперидин-1-ильную группу,
4-(3-метоксифенил)пиперидин-1-ильную группу,
4-(3,4-диметоксифенил)пиперидин-1-ильную группу,
4-(2,4-диметилфенил)пиперидин-1-ильную группу,
4-(2,4,6-триметоксифенил)пиперидин-1-ильную группу,
4-(3,4,5-триметилфенил)пиперидин-1-ильную группу,
3-(4-метилфенил)морфолиногруппу,
3-(3-метоксифенил)пирролидинил-1-ильную группу,
2-(4-метилфенил)пирролидинил-1-ильную группу,
4-(2,4,6-триметоксифенил)гомопиперазин-1-ильную группу,
4-(3,4,5-триметилфенил)тиоморфолиногруппу,
2,4-дифенилпиперазин-1-ильную группу,
2,4,6-трифенилпиперазин-1-ильную группу,
4-фенилпиперазин-1-ильную группу,
4-фенилпиперидин-1-ильную группу,
3-(3-хлорфенил)пирролидин-1-ильную группу,
3-(4-хлорфенил)морфолиногруппу,
4-(3,4-дихлорфенил)гомопиперазин-1-ильную группу,
3-(3-трифторметилфенил)тиоморфолиногруппу,
2-(4-трифторметилфенил)пирролидин-1-ильную группу,
2-(3-трифторметоксифенил)морфолиногруппу,
3-(4-трифторметоксифенил)гомопиперазин-1-ильную группу,
3-фенилпирролидин-1-ильную группу,
4-(3-хлорфенил)морфолиногруппу,
4-(4-хлорфенил)гомопиперидин-1-ильную группу,
3-(3,4-дихлорфенил)тиоморфолиногруппу,
3-(3-трифторметилфенил)пирролидин-1-ильную группу,
4-(4-трифторметилфенил)гомопиперазин-1-ильную группу,
3-фенилтиоморфолиногруппу, 4-фенилморфолиногруппу или тому подобное.
Примеры аминозамещенной С2-6алкенильной группы (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)) включают аминозамещенную С2-6алкенильную группу (которая может быть замещена в аминогруппе 1-2 группами, выбранными из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)), например аминовинильную группу, 3-амино-2-пропенильную группу,
3-амино-1-пропенильную группу, 4-амино-3-бутенильную группу,
4-амино-3-бутенильную группу, 5-амино-4-пентенильную группу,
6-амино-5-гексенильную группу, метиламиновинильную группу,
3-метиламино-2-пропенильную группу,
3-метиламино-1-пропенильную группу,
4-метиламино-3-бутенильную группу,
4-метиламино-3-бутенильную группу,
5-метиламино-4-пентенильную группу,
6-метиламино-5-гексенильную группу, метиламиновинильную группу,
3-метиламино-2-пропенильную группу,
3-диметиламино-2-пропенильную группу,
3-этиламино-1-пропенильную группу,
3-диэтиламино-1-пропенильную группу,
4-этиламино-3-бутенильную группу,
4-диметиламино-3-бутенильную группу,
4-диэтиламино-3-бутенильную группу,
5-этиламино-4-пентенильную группу,
6-этиламино-5-гексенильную группу,
н-пропиламиновинильную группу,
3-н-пропиламино-2-пропенильную группу,
3-н-пропиламино-1-пропенильную группу,
4-н-пропиламино-3-бутенильную группу,
4-н-пропиламино-3-бутенильную группу,
5-н-пропиламино-4-пентенильную группу,
6-н-пропиламино-5-гексенильную группу,
н-бутиламиновинильную группу,
3-н-бутиламино-2-пропенильную группу,
3-н-бутиламино-1-пропенильную группу,
4-н-бутиламино-3-бутенильную группу,
4-н-бутиламино-3-бутенильную группу,
5-н-бутиламино-4-пентенильную группу,
6-н-бутиламино-5-гексенильную группу,
n-пентиламиновинильную группу,
3-н-пентиламино-2-пропенильную группу,
3-н-гексиламино-1-пропенильную группу,
4-н-гексиламино-3-бутенильную группу,
4-н-гексиламино-3-бутенильную группу,
5-н-гексиламино-4-пентенильную группу,
6-н-пентиламино-5-гексенильную группу,
фениламиновинильную группу, 3-фениламино-2-пропенильную группу,
3-фениламино-1-пропенильную группу,
4-фениламино-3-бутенильную группу,
4-фениламино-3-бутенильную группу,
5-фениламино-4-пентенильную группу,
6-фениламино-5-гексенильную группу,
4-хлорфениламиновинильную группу,
3-(4-бромфенил)амино-2-пропенильную группу,
3-(2,4-дихлорфенил)амино-1-пропенильную группу,
4-(2,4,6-трихлорфенил)амино-3-бутенильную группу,
4-(2,3,4,5,6-пентафторфенил)амино-3-бутенильную группу,
4-(4-фторфенил)амино-3-бутенильную группу,
5-(4-иодфенил)амино-4-пентенильную группу,
6-(4-хлорфенил)амино-5-гексенильную группу,
(3-метилфенил)аминовинильную группу,
(4-трифторметилфенил)аминовинильную группу,
3-(4-трифторметилфенил)амино-2-пропенильную группу,
3-(4-трифторметилфенил)амино-1-пропенильную группу,
4-(4-трифторметилфенил)амино-3-бутенильную группу,
5-(3,4-диметилфенил)амино-4-пентенильную группу,
6-(3,4,5-триметилфенил)амино-5-гексенильную группу,
(2-метоксифенил)аминовинильную группу,
(4-трифторметоксифенил)аминовинильную группу,
3-(4-трифторметоксифенил)амино-2-пропенильную группу,
3-(3,5-диметоксифенил)амино-1-пропенильную группу,
4-(2,5-диметоксифенил)амино-3-бутенильную группу,
4-(2,4,6-триметоксифенил)амино-3-бутенильную группу,
5-[N-метил-N-(4-трифторметилфенил)амино]-4-пентенильную группу,
6-[N-этил-N-(4-трифторметоксифенил)амино]-5-гексенильную группу или тому подобное.
Примеры оксазолидинильной группы (которая может быть замещена в оксазолидиновом кольце по крайней мере одной оксогруппой в качестве заместителя) включают оксазолидин-4-ильную группу, оксазолидин-5-ильную группу, 2-оксазолидин-4-ильную группу, 2-оксооксазолидин-5-ильную группу или тому подобное.
Примеры фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать по крайней мере одну группу, выбранную из группы, состоящей из С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной фенил-С1-6алкильной группой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя) и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной аминогруппой, которая может содержать группу, выбранную из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя в пиперидиновом кольце) включают фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать 1-2 группы, выбранные из группы, состоящей из С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); пиперазинильной группы (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя) и пиперидильной группы (которая может содержать 1-3 аминогруппы, могущие содержать 1-2 группы, выбранных из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно, 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя в пиперидиновом кольце)), например бензильную группу, 1-фенетильную группу, 2-фенетильную группу,
3-фенилпропильную группу, 2-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
4-фенилпентильную группу, 6-фенилгексильную группу,
2-фторбензильную группу, 3-фторбензильную группу,
4-фторбензильную группу, 2-хлорбензильную группу,
3-хлорбензильную группу, 4-хлорбензильную группу,
2-бромбензильную группу, 3-бромбензильную группу,
4-бромбензильную группу, 2-иодбензильную группу,
3-иодбензильную группу, 4-иодбензильную группу,
2,3-дифторбензильную группу, 3,4-дифторбензильную группу,
3,5-дифторбензильную группу,
2,3,4,5,6-пентафторбензильную группу,
2,4-дифторбензильную группу, 2,6-дифторбензильную группу,
2,3-дихлорбензильную группу, 3,4-дихлорбензильную группу,
3,5-дихлорбензильную группу, 2,4-дихлорбензильную группу,
2,6-дихлорбензильную группу, 2-фтор-4-бромбензильную группу,
4-хлор-3-фторбензильную группу, 2,3,4-трихлорбензильную группу,
3,4,5-трифторбензильную группу, 2,4,6-трихлорбензильную группу,
4-изопропилбензильную группу, 4-н-бутилбензильную группу,
4-метилбензильную группу, 2-метилбензильную группу,
3-метилбензильную группу, 2,4-диметилбензильную группу,
2,3-диметилбензильную группу, 2,6-диметилбензильную группу,
3,5-диметилбензильную группу, 2,5-диметилбензильную группу,
2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
2,3,4,5,6-пентафторбензильную группу,
4-изопропоксибензильную группу, 4-н-бутоксибензильную группу,
4-метоксибензильную группу, 2-метоксибензильную группу,
3-метоксибензильную группу, 2,4-диметоксибензильную группу,
2,3-диметоксибензильную группу, 2,6-диметоксибензильную группу,
3,5-диметоксибензильную группу, 2,5-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
3,5-дитрифторметоксибензильную группу,
2-изопропоксибензильную группу,
3-хлор-4-метоксибензильную группу,
2-хлор-4-трифторметоксибензильную группу,
3-метил-4-фторбензильную группу,
4-бром-3-трифторметилбензильную группу,
2-трифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
2-пентафторэтилбензильную группу,
3-пентафторэтилбензильную группу,
4-пентафторэтилбензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу,
2-пентафторэтоксибензильную группу,
3-пентафторэтоксибензильную группу,
4-пентафторэтоксибензильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-(2-трифторметоксифенил)этильную группу,
2-(3-(трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
2-(2-пентафторэтоксифенил)этильную группу,
2-(3-пентафторэтоксифенил)этильную группу,
2-(4-пентафторэтоксифенил)этильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
3-(3-пентафторэтоксифенил)пропильную группу,
3-(4-пентафторэтоксифенил)пропильную группу,
4-(3-пентафторэтоксифенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
2-аминобензильную группу, 2,4-диаминобензильную группу,
2,4,6-триаминобензильную группу, 2-метиламинобензильную группу,
2-бензиламинобензильную группу,
2-фторбензиламинобензильную группу,
3-фторбензиламинобензильную группу,
4-фторбензиламинобензильную группу, 2-хлорбензильную группу,
3-хлорбензиламинобензильную группу,
4-хлорбензиламинобензильную группу,
2-бромбензиламинобензильную группу,
3-бромбензиламинобензильную группу,
4-бромбензиламинобензильную группу,
2-иодбензиламинобензильную группу,
3-иодбензиламинобензильную группу,
4-иодбензиламинобензильную группу,
2,3-дифторбензиламинобензильную группу,
3,4-дифторбензиламинобензильную группу,
3,5-дифторбензиламинобензильную группу,
2,3,4,5,6-пентафторбензиламинобензильную группу,
2,4-дифторбензиламинобензильную группу,
2,6-дифторбензиламинобензильную группу,
2,3-дихлорбензиламинобензильную группу,
3,4-дихлорбензиламинобензильную группу,
3,5-дихлорбензиламинобензильную группу,
2,4-дихлорбензиламинобензильную группу,
2,6-дихлорбензиламинобензильную группу,
2-фтор-4-бромбензиламинобензильную группу,
4-хлор-3-фторбензиламинобензильную группу,
2,3,4-трихлорбензиламинобензильную группу,
3,4,5-трифторбензиламинобензильную группу,
2,4,6-трихлорбензиламинобензильную группу,
4-изопропилбензиламинобензильную группу,
4-н-бутилбензиламинобензильную группу,
4-метилбензиламинобензильную группу,
2-метилбензиламинобензильную группу,
3-метилбензиламинобензильную группу,
2,4-диметилбензиламинобензильную группу,
2,3-диметилбензиламинобензильную группу,
2,6-диметилбензиламинобензильную группу,
3,5-диметилбензиламинобензильную группу,
2,5-диметилбензиламинобензильную группу,
2,4,6-триметилбензиламинобензильную группу,
3,5-дитрифторметилбензиламинобензильную группу,
2,3,4,5,6-пентафторбензиламинобензильную группу,
4-изопропоксибензиламинобензильную группу,
4-н-бутоксибензиламинобензильную группу,
4-метоксибензиламинобензильную группу,
2-метоксибензиламинобензильную группу,
3-метоксибензиламинобензильную группу,
2,4-диметоксибензиламинобензильную группу,
2,3-диметоксибензиламинобензильную группу,
2,6-диметоксибензиламинобензильную группу,
3,5-диметоксибензиламинобензильную группу,
2,5-диметоксибензиламинобензильную группу,
2,4,6-триметоксибензиламинобензильную группу,
3,5-дитрифторметоксибензиламинобензильную группу,
2-изопропоксибензиламинобензильную группу,
3-хлор-4-метоксибензиламинобензильную группу,
2-хлор-4-трифторметоксибензиламинобензильную группу,
3-метил-4-фторбензиламинобензильную группу,
4-бром-3-трифторметилбензиламинобензильную группу,
2-трифторметилбензиламинобензильную группу,
3-трифторметилбензиламинобензильную группу,
4-трифторметилбензиламинобензильную группу,
2-пентафторэтоксибензиламинобензильную группу,
3-пентафторэтоксибензиламинобензильную группу,
4-пентафторэтоксибензиламинобензильную группу,
2-трифторметоксибензиламинобензильную группу,
3-трифторметоксибензиламинобензильную группу,
4-трифторметоксибензиламинобензильную группу,
2-пентафторэтоксибензиламинобензильную группу,
3-пентафторэтоксибензиламинобензильную группу,
4-пентафторэтоксибензиламинобензильную группу,
3-(N-метил-N-бензиламино)бензильную группу,
4-(дибензиламино)бензильную группу,
2-диметиламинобензильную группу,
3-диметиламинобензильную группу,
4-диметиламинобензильную группу,
2-(2-диметиламинофенил)этильную группу,
2-(3-диметиламинофенил)этильную группу,
2-(4-диметиламинофенил)этильную группу,
3-(2-диметиламинофенил)пропильную группу,
3-(3-диметиламинофенил)пропильную группу,
3-(4-диметиламинофенил)пропильную группу,
2-феноксибензильную группу, 2,3-дифеноксибензильную группу,
2,4,6-трифеноксибензильную группу,
2-(2-фторфенокси)бензильную группу,
3-(3-фторфенокси)бензильную группу,
4-(4-фторфенокси)бензильную группу,
2-(2-хлорфенокси)бензильную группу,
3-(3-хлорфенокси)бензильную группу,
4-(4-хлорфенокси)бензильную группу,
2-(2-бромфенокси)бензильную группу,
3-(3-бромфенокси)бензильную группу,
4-(4-бромфенокси)бензильную группу,
2-(2-иодфенокси)бензильную группу,
3-(3-иодфенокси)бензильную группу,
4-(4-иодфенокси)бензильную группу,
3-(2,3-дифторфенокси)бензильную группу,
4-(3,4-дифторфенокси)бензильную группу,
2-(3,5-дифторфенокси)бензильную группу,
4-(2,3,4,5,6-пентафторфенокси)бензильную группу,
2-(2,4-дифторфенокси)бензильную группу,
4-(2,6-дифторфенокси)бензильную группу,
3-(2,3-дихлорфенокси)бензильную группу,
2-(3,4-дихлорфенокси)бензильную группу,
4-(3,5-дихлорфенокси)бензильную группу,
3-(2,4-дихлорфенокси)бензильную группу,
4-(2,6-дихлорфенокси)бензильную группу,
4-(2-фтор-4-бромфенокси)бензильную группу,
3-(4-хлор-3-фторфенокси)бензильную группу,
4-(2,3,4-трихлорфенокси)бензильную группу,
4-(3,4,5-трифторфенокси)бензильную группу,
4-(2,4,6-трихлорфенокси)бензильную группу,
2-(4-изопропилфенокси)бензильную группу,
3-(4-н-бутилфенокси)бензильную группу,
4-(4-метилфенокси)бензильную группу,
3-(2-метилфенокси)бензильную группу,
2-(3-метилфенокси)бензильную группу,
2-(2,4-диметилфенокси)бензильную группу,
3-(2,3-диметилфенокси)бензильную группу,
4-(2,6-диметилфенокси)бензильную группу,
2-(3,5-диметилфенокси)бензильную группу,
3-(2,5-диметилфенокси)бензильную группу,
2-(2,4,6-триметилфенокси)бензильную группу,
3-(3,5-дитрифторметилфенокси)бензильную группу,
4-(2,3,4,5,6-пентафторфенокси)бензильную группу,
2-(4-изопропоксифенокси)бензильную группу,
2-(4-н-бутоксифенокси)бензильную группу,
2-(4-метоксифенокси)бензильную группу,
3-(2-метоксифенокси)бензильную группу,
4-(3-метоксифенокси)бензильную группу,
2-(2,4-диметоксифенокси)бензильную группу,
3-(2,3-диметоксифенокси)бензильную группу,
4-(2,6-диметоксифенокси)бензильную группу,
2-(3,5-диметоксифенокси)бензильную группу,
3-(2,5-диметоксифенокси)бензильную группу,
4-(2,4,6-триметоксифенокси)бензильную группу,
2-(3,5-дитрифторметоксифенокси)бензильную группу,
3-(2-изопропоксифенокси)бензильную группу,
4-(3-хлор-4-метоксифенокси)бензильную группу,
3-(2-хлор-4-трифторметоксифенокси)бензильную группу,
2-(3-метил-4-фторфенокси)бензильную группу,
3-(4-бром-3-трифторметилфенокси)бензильную группу,
4-(2-трифторметилфенокси)бензильную группу,
2-(3-трифторметилфенокси)бензильную группу,
3-(4-трифторметилфенокси)бензильную группу,
4-(2-пентафторметилфенокси)бензильную группу,
2-(3-пентафторэтилфенокси)бензильную группу,
3-(4-пентафторэтилфенокси)бензильную группу,
4-(2-трифторметоксифенокси)бензильную группу,
2-(3-трифторметоксифенокси)бензильную группу,
3-(4-трифторметоксифенокси)бензильную группу,
4-(2-пентафторэтоксифенокси)бензильную группу,
2-(3-пентафторэтоксифенокси)бензильную группу,
3-(4-пентафторэтоксифенокси)бензильную группу,
2-[3-(2-трифторметилфенокси)фенил]этильную группу,
2-[3-(3-трифторметилфенокси)фенил]этильную группу,
2-[4-(4-трифторметилфенокси)фенил]этильную группу,
3-[4-(2-трифторметилфенокси)фенил]пропильную группу,
4-[3-(3-пентафторэтоксифенокси)фенил]бутильную группу,
5-[4-(4-трифторметилфенокси)фенил]пентильную группу,
6-[2-(3-трифторметилфенокси)фенил]гексильную группу,
4-(1-пиперазинил)бензильную группу,
4-(1-пиперидинил)бензильную группу,
4-(4-бензил-1-пиперазинил)бензильную группу,
4-(4-(3-хлорбензил)-1-пиперазинил)бензильную группу,
4-(4-(2,4-диметилбензил)-1-пиперазинил)бензильную группу,
4-(4-(2,4-диметилбензил)-1-пиперазинил)бензильную группу,
4-(2,4-дибензил-1-пиперазинил)бензильную группу,
4-(2,3,4-трибензил-1-пиперазинил)бензильную группу,
4-(4-(4-трифторметилбензил)-1-пиперазинил)бензильную группу,
4-(4-анилино-1-пиперидинил)бензильную группу,
4-(4-(3-трифторметилбензил)-1-пиперазинил)бензильную группу,
4-[4-(N-метиланилино)-1-пиперидинил]бензильную группу,
4-[4-(N-метил-3-хлоранилино)-1-пиперидинил)бензильную группу,
4-[4-(2,4-диметиланилино)-1-пиперидинил]бензильную группу,
4-[4-(N-метил-2,4,6-триметоксианилино)-1-пиперидинил]бензильную группу,
4-[4-(4-трифторметоксианилино)-1-пиперидинил]бензильную
группу,
4-[4-(N-метил-3-трифторметиланилино)-1-пиперидинил]бензильную группу,
4-(3,4-дианилино-1-пиперидинил)бензильную группу,
4-(3,4,5-трианилино-1-пиперидинил)бензильную группу или тому подобное.
Примеры амино-С1-6алкильной группы (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, С1-6алкоксикарбонильной группы и фенильной группы, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы) включают амино-С1-6алкильную группу (которая может быть замещена в аминогруппе 1-2 группами, выбранными из группы, состоящей из С1-6алкильной группы, С1-6алкоксикарбонильной группы и фенильной группы, которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы), например аминометильную группу,
2-аминоэтильную группу, 1-аминоэтильную группу,
3-аминопропильную группу, 4-аминобутильную группу,
5-аминопентильную группу, 6-аминогексильную группу,
2-метил-3-аминопропильную группу,
1,1-диметил-2-аминоэтильную группу,
2-(метиламино)этильную группу, 3-(метиламино)пропильную группу,
4-(метиламино)бутильную группу, 5-(метиламино)пентильную группу,
6-(метиламино)гексильную группу,
2-(N-метил-N-метоксикарбониламино)этильную группу,
3-(N-метил-N-метоксикарбониламино)пропильную группу,
4-(N-метил-N-метоксикарбониламино)бутильную группу,
5-(N-метил-N-метоксикарбониламино)пентильную группу,
6-(N-метил-N-метоксикарбониламино)гексильную группу,
2-(N-этоксикарбонил-N-метиламино)этильную группу,
3-(N-этоксикарбонил-N-метиламино)пропильную группу,
4-(N-этоксикарбонил-N-метиламино)бутильную группу,
5-(N-этоксикарбонил-N-метиламино)пентильную группу,
6-(N-этоксикарбонил-N-метиламино)гексильную группу,
2-[N-метил-N-(н-пропоксикарбониламино)]этильную группу,
3-[N-метил-N-(н-пропоксикарбониламино)]пропильную группу,
4-[N-метил-N-(н-пропоксикарбониламино)]бутильную группу,
5-[N-метил-N-(н-пропоксикарбониламино)]пентильную группу,
6-[N-метил-N-(н-пропоксикарбониламино)]гексильную группу,
2-[N-(трет-бутоксикарбонил)-N-метиламино)]этильную группу,
3-[N-(трет-бутоксикарбонил)-N-метиламино)]пропильную группу,
4-[N-(трет-бутоксикарбонил)-N-метиламино)]бутильную группу,
5-[N-(трет-бутоксикарбонил)-N-метиламино)]пентильную группу,
6-[N-(трет-бутоксикарбонил)-N-метиламино)]гексильную группу,
2-[N-метил-N-(н-пентоксикарбонил)амино]этильную группу,
2-[N-метил-N-(н-гексилоксикарбонил)амино]этильную группу,
2-(N-метиланилино)этильную группу,
3-(N-метиланилино)пропильную группу,
4-(N-метиланилино)бутильную группу,
2-(N-метил-4-хлоранилино)этильную группу,
3-(N-метил-4-хлоранилино)пропильную группу,
4-(N-метил-4-хлоранилино)бутильную группу,
2-(4-фтор-N-метиланилино)этильную группу,
3-(4-фтор-N-метиланилино)пропильную группу,
2-(3-фтор-N-метиланилино)этильную группу,
3-(3-фтор-N-метиланилино)пропильную группу,
4-(3-фтор-N-метиланилино)бутильную группу,
2-(2-фтор-N-метиланилино)этильную группу,
3-(2-фтор-N-метиланилино)пропильную группу,
4-(2-фтор-N-метиланилино)бутильную группу,
2-(2-хлор-N-метиланилино)этильную группу,
3-(2-хлор-N-метиланилино)пропильную группу,
4-(2-хлор-N-метиланилино)бутильную группу,
2-(3-хлор-N-метиланилино)этильную группу,
3-(3-хлор-N-метиланилино)пропильную группу,
4-(3-хлор-N-метиланилино)бутильную группу,
2-(4-трифторметил-N-метиланилино)этильную группу,
2-(4-метиланилино)этильную группу,
2-(3,5-дитрифторметил-N-этоксикарбониланилино)этильную группу,
2-(3,5-дитрифторметил-N-метиланилино)этильную группу,
2-(2,4-диметил-N-метиланилино)этильную группу,
2-(3,5-диметокси-N-метиланилино)этильную группу,
2-(2,4,6-триметиланилино)этильную группу,
2-(3,4,5-триметоксианилино)этильную группу,
3-(4-трифторметил-N-метиланилино)пропильную группу,
4-(4-трифторметил-N-метиланилино)бутильную группу,
2-(3-трифторметил-N-метиланилино)этильную группу,
3-(3-трифторметил-N-метиланилино)пропильную группу,
2-(2-трифторметил-N-метиланилино)этильную группу,
3-(2-трифторметил-N-метиланилино)пропильную группу,
4-(2-трифторметил-N-метиланилино)бутильную группу,
2-(4-трифторметокси-N-метиланилино)этильную группу,
3-(4-трифторметокси-N-метиланилино)пропильную группу,
4-(4-трифторметокси-N-метиланилино)бутильную группу,
2-(3-трифторметокси-N-метиланилино)этильную группу,
3-(3-трифторметокси-N-метиланилино)пропильную группу,
4-(3-трифторметокси-N-метиланилино)бутильную группу,
2-(2-трифторметокси-N-метиланилино)этильную группу,
3-(2-трифторметокси-N-метиланилино)пропильную группу,
4-(2-трифторметокси-N-метиланилино)бутильную группу,
2-(4-метокси-N-метиланилино)этильную группу,
3-(4-метокси-N-метиланилино)пропильную группу,
4-(4-метокси-N-метиланилино)бутильную группу,
2-(3-метокси-N-метиланилино)этильную группу,
3-(3-метокси-N-метиланилино)пропильную группу,
4-(3-метокси-N-метиланилино)бутильную группу,
2-(2-метокси-N-метиланилино)этильную группу,
3-(2-метокси-N-метиланилино)пропильную группу,
4-(2-метокси-N-метиланилино)бутильную группу или тому подобное.
Примеры фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкоксикарбонильной группы) включают фенильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, феноксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкоксикарбонильной группы), например фенильную группу, 2-фторфенильную группу,
3-фторфенильную группу, 4-фторфенильную группу,
2-хлорфенильную группу,
3-хлорфенильную группу, 4-хлорфенильную группу,
2-бромфенильную группу, 3-бромфенильную группу,
4-бромфенильную группу, 2-иодфенильную группу,
3-иодфенильную группу, 4-иодфенильную группу,
2,3-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,6-дифторфенильную группу, 2,3-дихлорфенильную группу,
3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,6-дихлорфенильную группу,
2,3,4-трифторфенильную группу, 3,4,5-трифторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
2,4,6-трихлорфенильную группу, 2-фтор-4-хлорфенильную группу,
2-фтор-4-бромфенильную группу, 3-фтор-4-хлорфенильную группу,
2-метоксикарбонилфенильную группу,
3-метоксикарбонилфенильную группу,
4-метоксикарбонилфенильную группу,
2,4-диметоксикарбонилфенильную группу,
2,4,6-триметоксикарбонилфенильную группу,
2-этоксикарбонилфенильную группу,
3-этоксикарбонилфенильную группу,
4-этоксикарбонилфенильную группу,
2-пропоксикарбонилфенильную группу,
3-пропоксикарбонилфенильную группу,
4-пропоксикарбонилфенильную группу,
2-бутоксикарбонилфенильную группу,
3-бутоксикарбонилфенильную группу,
4-бутоксикарбонилфенильную группу,
4-пентоксикарбонилфенильную группу,
4-гексилоксикарбонилфенильную группу,
2-феноксифенильную группу, 3-феноксифенильную группу,
4-феноксифенильную группу,
2-(2-хлорфенокси)фенильную группу,
2-(3-хлорфенокси)фенильную группу,
2-(4-хлорфенокси)фенильную группу,
3-(2-хлорфенокси)фенильную группу,
3-(3-хлорфенокси)фенильную группу,
3-(4-хлорфенокси)фенильную группу,
4-(2-хлорфенокси)фенильную группу,
4-(2,4-дихлорфенокси)фенильную группу,
4-(2,4,6-трихлорфенокси)фенильную группу,
4-(3-хлорфенокси)фенильную группу,
4-(4-хлорфенокси)фенильную группу,
2-(2-трифторметилфенокси)фенильную группу,
2-(3-трифторметилфенокси)фенильную группу,
2-(4-трифторметилфенокси)фенильную группу,
3-(2-трифторметилфенокси)фенильную группу,
3-(2-метилфенокси)фенильную группу,
3-(2,4-диметилфенокси)фенильную группу,
3-(2,4,6-триметилфенокси)фенильную группу,
3-(2-метоксифенокси)фенильную группу,
3-(2,4-диметоксифенокси)фенильную группу,
3-(2,4,6-триметоксифенокси)фенильную группу,
2-(3,5-дитрифторметилфенокси)фенильную группу,
2-(3,5-дитрифторметоксифенокси)фенильную группу,
3-(3-трифторметилфенокси)фенильную группу,
3-(4-трифторметилфенокси)фенильную группу,
4-(2-трифторметилфенокси)фенильную группу,
4-(3-трифторметилфенокси)фенильную группу,
4-(4-трифторметилфенокси)фенильную группу,
2-(2-трифторметоксифенокси)фенильную группу,
2-(3-трифторметоксифенокси)фенильную группу,
2-(4-трифторметоксифенокси)фенильную группу,
3-(2-трифторметоксифенокси)фенильную группу,
3-(3-трифторметоксифенокси)фенильную группу,
3-(4-трифторметоксифенокси)фенильную группу,
4-(2-трифторметоксифенокси)фенильную группу,
4-(3-трифторметоксифенокси)фенильную группу,
4-(4-трифторметоксифенокси)фенильную группу или тому подобное.
Фенил-С1-6алкоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например
бензилоксикарбонильную группу, 1-фенетилоксикарбонильную группу,
2-фенетилоксикарбонильную группу,
3-фенилпропоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентилоксикарбонильную группу,
4-фенилпентилоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-фторбензилоксикарбонильную группу,
3-фторбензилоксикарбонильную группу,
4-фторбензилоксикарбонильную группу,
2-хлорбензилоксикарбонильную группу,
3-хлорбензилоксикарбонильную группу,
4-хлорбензилоксикарбонильную группу,
2-бромбензилоксикарбонильную группу,
3-бромбензилоксикарбонильную группу,
4-бромбензилоксикарбонильную группу,
2-иодбензилоксикарбонильную группу,
3-иодбензилоксикарбонильную группу,
4-иодбензилоксикарбонильную группу,
2,3-дифторбензилоксикарбонильную группу,
3,4-дифторбензилоксикарбонильную группу,
3,5-дифторбензилоксикарбонильную группу,
2,4-дифторбензилоксикарбонильную группу,
2,6-дифторбензилоксикарбонильную группу,
2,4,6-трифторбензилоксикарбонильную группу,
2,3,4,5,6-пентафторбензилоксикарбонильную группу,
3,4,5-трифторбензилоксикарбонильную группу,
2,3-дихлорбензилоксикарбонильную группу,
3,4-дихлорбензилоксикарбонильную группу,
3,5-дихлорбензилоксикарбонильную группу,
2,4-дихлорбензилоксикарбонильную группу,
2,6-дихлорбензилоксикарбонильную группу,
2,4,6-трихлорбензилоксикарбонильную группу,
3,4,5-трихлорбензилоксикарбонильную группу,
перфторбензилоксикарбонильную группу,
2-дифторметилбензилоксикарбонильную группу,
3-метилбензилоксикарбонильную группу,
3,5-диметилбензилоксикарбонильную группу,
2,4,6-триметилбензилоксикарбонильную группу,
3-метоксибензилоксикарбонильную группу,
3,5-диметоксибензилоксикарбонильную группу,
2,4,6-триметоксибензилоксикарбонильную группу,
3-дифторметилбензилоксикарбонильную группу,
4-дифторметилбензилоксикарбонильную группу,
4-хлор-3-дифторметилбензилоксикарбонильную группу,
3-хлор-4-дифторметилбензилоксикарбонильную группу,
3-бром-4-дифторметилбензилоксикарбонильную группу,
3,5-дифтор-4-дифторметилбензилоксикарбонильную группу,
2-трифторметилбензилоксикарбонильную группу,
3-трифторметилбензилоксикарбонильную группу,
4-трифторметилбензилоксикарбонильную группу,
4-фтор-3-трифторметилбензилоксикарбонильную группу,
3-фтор-4-трифторметилбензилоксикарбонильную группу,
4-хлор-3-пентафторэтилбензилоксикарбонильную группу,
3-хлор-4-пентафторэтилбензилоксикарбонильную группу,
2-пентафторэтилбензилоксикарбонильную группу,
3-пентафторэтилбензилоксикарбонильную группу,
4-пентафторэтилбензилоксикарбонильную группу,
2-трифторметоксибензилоксикарбонильную группу,
3-трифторметоксибензилоксикарбонильную группу,
4-трифторметоксибензилоксикарбонильную группу,
4-фтор-3-трифторметоксибензилоксикарбонильную группу,
3-фтор-4-трифторметоксибензилоксикарбонильную группу,
2-пентафторэтоксибензилоксикарбонильную группу,
3-пентафторэтоксибензилоксикарбонильную группу,
4-пентафторэтоксибензилоксикарбонильную группу,
3-хлор-4-трифторметоксибензилоксикарбонильную группу,
3-хлор-4-пентафторэтоксибензилоксикарбонильную группу,
2-(2-трифторметилфенил)этоксикарбонильную группу,
2-(3-трифторметилфенил)этоксикарбонильную группу,
2-(4-трифторметилфенил)этоксикарбонильную группу,
(2-трифторметоксифенил)метоксикарбонильную группу,
(3-трифторметоксифенил)метоксикарбонильную группу,
2-(4-трифторметоксифенил)этоксикарбонильную группу,
2-(2-пентафторэтоксифенил)этоксикарбонильную группу,
2-(3-пентафторэтоксифенил)этоксикарбонильную группу,
2-(4-пентафторэтоксифенил)этоксикарбонильную группу,
3-(2-трифторметилфенил)пропоксикарбонильную группу,
3-(3-трифторметилфенил)пропоксикарбонильную группу,
3-(4-трифторметилфенил)пропоксикарбонильную группу,
3-(2-трифторметилфенил)пропоксикарбонильную группу,
3-(3-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-пентафторэтоксифенил)пропоксикарбонильную группу,
3-(4-пентафторэтоксифенил)пропоксикарбонильную группу,
4-(3-пентафторэтоксифенил)бутоксикарбонильную группу,
5-(4-трифторметилфенил)пентилоксикарбонильную группу,
4-(4-трифторметилфенил)пентилоксикарбонильную группу,
4-(4-трифторметоксифенил)пентилоксикарбонильную группу,
6-(3-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметоксифенил)гексилоксикарбонильную группу или тому подобное.
Фенил-С1-6алкоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например бензилоксикарбонильную группу, фенилэтоксикарбонильную группу,
3-фенилпропоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентоксикарбонильную группу,
4-фенилпентоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-фторбензилоксикарбонильную группу,
3-фторбензилоксикарбонильную группу,
4-фторбензилоксикарбонильную группу,
2-(2-фторфенил)этоксикарбонильную группу,
1-(3-фторфенил)этоксикарбонильную группу,
2-(4-фторфенил)этоксикарбонильную группу,
2-хлорбензилоксикарбонильную группу,
3-хлорбензилоксикарбонильную группу,
4-хлорбензилоксикарбонильную группу,
2-(2-бромфенил)этоксикарбонильную группу,
1-(3-хлорфенил)этоксикарбонильную группу,
2-(4-иодфенил)этоксикарбонильную группу,
2-(2,3-дихлорфенил)этоксикарбонильную группу,
(2,4,6-трихлорфенил)метоксикарбонильную группу,
(2,3,4,5,6-пентафторфенил)метоксикарбонильную группу,
2-цианобензилоксикарбонильную группу,
3-цианобензилоксикарбонильную группу,
4-цианобензилоксикарбонильную группу,
2,4-дицианобензилоксикарбонильную группу,
3,4,5-трицианобензилоксикарбонильную группу,
2-цианофенилэтоксикарбонильную группу,
3-цианофенилэтоксикарбонильную группу,
4-цианофенилэтоксикарбонильную группу,
2-метилбензилоксикарбонильную группу,
2,4-диметилбензилоксикарбонильную группу,
2,4,6-триметилбензилоксикарбонильную группу,
2-трифторметилбензилоксикарбонильную группу,
3-трифторметилбензилоксикарбонильную группу,
4-трифторметилбензилоксикарбонильную группу,
2-метоксибензилоксикарбонильную группу,
2,4-диметоксибензилоксикарбонильную группу,
2,4,6-триметоксибензилоксикарбонильную группу,
2-трифторметоксибензилоксикарбонильную группу,
3-трифторметоксибензилоксикарбонильную группу,
4-трифторметоксибензилоксикарбонильную группу,
2-(2-трифторметилфенил)этоксикарбонильную группу,
2-(3-трифторметилфенил)этоксикарбонильную группу,
2-(4-трифторметилфенил)этоксикарбонильную группу,
2-(2-трифторметоксифенил)этоксикарбонильную группу,
2-(3-трифторметоксифенил)этоксикарбонильную группу,
2-(4-трифторметоксифенил)этоксикарбонильную группу,
3-(2-трифторметилфенил)пропоксикарбонильную группу,
3-(3-трифторметилфенил)пропоксикарбонильную группу,
3-(4-трифторметилфенил)пропоксикарбонильную группу,
3-(2-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-бифенилил)пропоксикарбонильную группу,
4-(4-бифенилил)бутоксикарбонильную группу,
5-(4-бифенилил)пентоксикарбонильную группу,
4-(3-трифторметилфенил)бутоксикарбонильную группу,
5-(4-трифторметилфенил)пентилоксикарбонильную группу,
4-(4-трифторметилфенил)пентоксикарбонильную группу,
4-(4-трифторметоксифенил)пентоксикарбонильную группу,
6-(3-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметоксифенил)гексилоксикарбонильную группу или тому подобное.
Фенил-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы) представляет собой фенил С1-6алкильную группу, незамещенную или замещенную в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы, примеры которой включают бензильную группу,
1-фенетильную группу, 2-фенетильную группу,
3-фенилпропильную группу, 2-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
4-фенилпентильную группу, 6-фенилгексильную группу,
2-фторбензильную группу, 3-фторбензильную группу,
4-фторбензильную группу, 2-хлорбензильную группу,
3-хлорбензильную группу, 4-хлорбензильную группу,
2-бромбензильную группу, 3-бромбензильную группу,
4-бромбензильную группу, 2-иодбензильную группу,
3-иодбензильную группу, 4-иодбензильную группу,
2,3-дифторбензильную группу, 3,4-дифторбензильную группу,
3,5-дифторбензильную группу, 2,4-дифторбензильную группу,
2,6-дифторбензильную группу,
2,3,4,5,6-пентафторбензильную группу,
2,3-дихлорбензильную группу, 3,4-дихлорбензильную группу,
3,5-дихлорбензильную группу, 2,4-дихлорбензильную группу,
2,6-дихлорбензильную группу, 2-трифторметил бензильную группу,
3-трифторметил бензильную группу,
4-трифторметилбензильную группу,
2-метилбензильную группу, 2,3-диметилбензильную группу,
2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметилфенил)пропильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу или тому подобное.
Пиперидинил-С1-6алкильная группа (которая может быть замещена в пиперидиновом кольце по крайней мере одной феноксигруппой (которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце в качестве заместителя) в качестве заместителя) включает пиперидинил-С1-6алкильную группу (которая может быть замещена в пиперидиновом кольце по крайней мере одной феноксигруппой (которая может содержать 1-5, предпочтительно 1-3, галогензамещенные или незамещенные алкильные группы в фенильном кольце в качестве заместителя) в качестве заместителя), например пиперидин-1-илметильную группу,
пиперидин-2-илэтильную группу, пиперидин-3-илпропильную группу,
пиперидин-4-илбутильную группу, пиперидин-1-илпентильную группу,
пиперидин-2-ил-н-гексильную группу,
4-феноксипиперидин-1-илметильную группу,
2-(4-феноксипиперидин-1-ил)этильную группу,
3-(4-феноксипиперидин-1-ил)пропильную группу,
4-(4-феноксипиперидин-1-ил)бутильную группу,
5-(4-феноксипиперидин-1-ил)пентильную группу,
6-(4-феноксипиперидин-1-ил)гексильную группу,
4-(3-метилфенокси)пиперидин-1-илметильную группу,
4-(2,5-диметилфенокси)пиперидин-1-илметильную группу,
4-(2,4,6-триметилфенокси)пиперидин-1-илметильную группу,
4-(3,5-дитрифторметилфенокси)пиперидин-1-илметильную группу,
4-(2-трифторметилфенокси)пиперидин-1-илметильную группу,
2-[4-(2-трифторметилфенокси)пиперидин-1-ил]этильную группу,
3-[4-(2-трифторметилфенокси)пиперидин-1-ил]пропильную группу,
4-[4-(2-трифторметилфенокси)пиперидин-1-ил]бутильную группу,
5-[4-(2-трифторметилфенокси)пиперидин-1-ил]пентильную группу,
6-[4-(2-трифторметилфенокси)пиперидин-1-ил]гексильную группу,
4-(3-трифторметилфенокси)пиперидин-1-илметильную группу,
2-[4-(3-трифторметилфенокси)пиперидин-1-ил]этильную группу,
3-[4-(3-трифторметилфенокси)пиперидин-1-ил]пропильную группу,
4-[4-(3-трифторметилфенокси)пиперидин-1-ил]бутильную группу,
5-[4-(3-трифторметилфенокси)пиперидин-1-ил]пентильную группу,
6-[4-(3-трифторметилфенокси)пиперидин-1-ил]гексильную группу,
4-(4-трифторметилфенокси)пиперидин-1-илметильную группу,
2-[4-(4-трифторметилфенокси)пиперидин-1-ил]этильную группу,
3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропильную группу,
4-[4-(4-трифторметилфенокси)пиперидин-1-ил]бутильную группу,
5-[4-(4-трифторметилфенокси)пиперидин-1-ил]пентильную группу,
6-[4-(4-трифторметилфенокси)пиперидин-1-ил]гексильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и пиперидильной группы (которая может содержать в пиперидиновом кольце по крайней мере одну аминогруппу, которая может содержать группу, выбранную из группы, состоящей из фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы)) включает фенильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать в качестве заместителя 1-2 группы, выбранные из группы, состоящей из С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); феноксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно, 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и пиперидильной группы (которая может содержать в пиперидиновом кольце по крайней мере одну аминогруппу, которая может содержать 1-2 группы, выбранные из группы, состоящей из фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы)), например фенильную группу,
2-фторфенильную группу,
3-фторфенильную группу, 4-фторфенильную группу,
2-хлорфенильную группу, 3-хлорфенильную группу,
4-хлорфенильную группу, 2-бромфенильную группу,
3-бромфенильную группу, 4-бромфенильную группу,
2-иодфенильную группу, 3-иодфенильную группу,
4-иодфенильную группу, 2,3-дифторфенильную группу,
3,4-дифторфенильную группу, 3,5-дифторфенильную группу,
2,4-дифторфенильную группу, 2,6-дифторфенильную группу,
2,3-дихлорфенильную группу, 3,4-дихлорфенильную группу,
3,5-дихлорфенильную группу, 2,4-дихлорфенильную группу,
2,6-дихлорфенильную группу, 3,4,5-трифторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
2,4,6-трихлорфенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2,4-диметилфенильную группу,
3,4,5-триметилфенильную группу,
3,5-дитрифторметилфенильную группу,
2-метил-3-хлорфенильную группу, 3-метил-4-хлорфенильную группу,
2-хлор-4-метилфенильную группу, 2-метил-3-фторфенильную группу,
2-трифторметилфенильную группу, 3-трифторметилфенильную группу,
4-трифторметилфенильную группу, 2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
2-метокси-3-хлорфенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 2,6-диметоксифенильную группу,
2,4,6-триметоксифенильную группу,
3,5-дитрифторметоксифенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-пентилоксифенильную группу, 4-гексилоксифенильную группу,
3-аминофенильную группу, 3-метиламинофенильную группу,
3-диметиламинофенильную группу,
4-метиламинофенильную группу, 4-диметиламинофенильную группу,
4-этиламинофенильную группу, 4-диэтиламинофенильную группу,
4-н-пропиламинофенильную группу,
4-ди-н-пропиламинофенильную группу,
4-н-бутиламинофенильную группу,
4-ди-н-бутиламинофенильную группу,
4-н-пентиламинофенильную группу,
4-ди-н-пентиламинофенильную группу,
4-н-гексиламинофенильную группу,
4-ди-н-гексиламинофенильную группу,
4-бензиламинофенильную группу,
4-(2-фторбензиламино)фенильную группу,
4-(3-фторбензиламино)фенильную группу,
4-(4-фторбензиламино)фенильную группу,
4-(2,3-дифторбензиламино)фенильную группу,
4-(2,4-дифторбензиламино)фенильную группу,
4-(3,4-дифторбензиламино)фенильную группу,
4-(3,5-дифторбензиламино)фенильную группу,
4-(2-хлорбензиламино)фенильную группу,
4-(3-хлорбензиламино)фенильную группу,
4-(4-хлорбензиламино)фенильную группу,
4-(2-бромбензиламино)фенильную группу,
4-(3-бромбензиламино)фенильную группу,
4-(4-бромбензиламино)фенильную группу,
4-(2,3-дихлорбензиламино)фенильную группу,
4-(2,4-дихлорбензиламино)фенильную группу,
4-(3,4-дихлорбензиламино)фенильную группу,
4-(3,5-дихлорбензиламино)фенильную группу,
4-(2-метилбензиламино)фенильную группу,
4-(3-метилбензиламино)фенильную группу,
4-(4-метилбензиламино)фенильную группу,
4-(2-этилбензиламино)фенильную группу,
4-(3-этилбензиламино)фенильную группу,
4-(4-этилбензиламино)фенильную группу,
4-(4-н-пропилбензиламино)фенильную группу,
4-(4-трет-бутилбензиламино)фенильную группу,
4-(4-н-бутилбензиламино)фенильную группу,
4-(2-трифторметилбензиламино)фенильную группу,
4-(3-трифторметилбензиламино)фенильную группу,
4-(4-трифторметилбензиламино)фенильную группу,
4-(2-пентафторэтилбензиламино)фенильную группу,
4-(3-пентафторэтилбензиламино)фенильную группу,
4-(2,3-диметилбензиламино)фенильную группу,
4-(3,4,5-триметилбензиламино)фенильную группу,
4-(4-пентилбензиламино)фенильную группу,
4-(4-гексилбензиламино)фенильную группу,
4-(3-метоксибензиламино)фенильную группу,
4-(3,5-диметоксибензиламино)фенильную группу,
4-(2,4,6-триметоксибензиламино)фенильную группу,
4-(2-трифторметоксибензиламино)фенильную группу,
4-(3-трифторметоксибензиламино)фенильную группу,
4-(4-трифторметоксибензиламино)фенильную группу,
4-(2-пентафторэтоксибензиламино)фенильную группу,
4-(3-пентафторэтоксибензиламино)фенильную группу,
4-(4-пентафторэтоксибензиламино)фенильную группу,
(фенетиламино)фенильную группу,
4-(2-фторфенетиламино)фенильную группу,
4-(3-фторфенетиламино)фенильную группу,
4-(4-фторфенетиламино)фенильную группу,
4-(2,3-дифторфенетиламино)фенильную группу,
4-(2,4-дифторфенетиламино)фенильную группу,
4-(3,4-дифторфенетиламино)фенильную группу,
4-(3,5-дифторфенетиламино)фенильную группу,
4-(2-хлорфенетиламино)фенильную группу,
4-(3-хлорфенетиламино)фенильную группу,
4-(4-хлорфенетиламино)фенильную группу,
4-(2-бромфенетиламино)фенильную группу,
4-(3-бромфенетиламино)фенильную группу,
4-(4-бромфенетиламино)фенильную группу,
4-(2,3-дихлорфенетиламино)фенильную группу,
4-(2,4-дихлорфенетиламино)фенильную группу,
4-(3,4-дихлорфенетиламино)фенильную группу,
4-(3,5-дихлорфенетиламино)фенильную группу,
4-(2-метилфенетиламино)фенильную группу,
4-(3-метилфенетиламино)фенильную группу,
4-(4-метилфенетиламино)фенильную группу,
4-(4-этилфенетиламино)фенильную группу,
4-(4-пропилфенетиламино)фенильную группу,
4-(4-трет-бутилфенетиламино)фенильную группу,
4-(2-трифторметилфенетиламино)фенильную группу,
4-(3-трифторметилфенетиламино)фенильную группу,
4-(4-трифторметилфенетиламино)фенильную группу,
4-(2-пентафторэтилфенетиламино)фенильную группу,
4-(3-пентафторэтилфенетиламино)фенильную группу,
4-(2,3-диметилфенетиламино)фенильную группу,
4-(2-трифторметоксифенетиламино)фенильную группу,
4-(3-трифторметоксифенетиламино)фенильную группу,
4-(4-трифторметоксифенетиламино)фенильную группу,
4-(2-пентафторэтоксифенетиламино)фенильную группу,
4-(3-пентафторэтоксифенетиламино)фенильную группу,
4-(4-пентафторэтоксифенетиламино)фенильную группу,
4-(3-фенилпропиламино)фенильную группу,
4-[3-(2-фторфенил)пропиламино]фенильную группу,
4-[3-(3-фторфенил)пропиламино]фенильную группу,
4-[3-(4-фторфенил)пропиламино]фенильную группу,
4-[3-(2,3-дифторфенил)пропиламино]фенильную группу,
4-[3-(2,4-дифторфенил)пропиламино]фенильную группу,
4-[3-(3,4-дифторфенил)пропиламино]фенильную группу,
4-[3-(3,5-дифторфенил)пропиламино]фенильную группу,
4-[3-(2-хлорфенил)пропиламино]фенильную группу,
4-[3-(3-хлорфенил)пропиламино]фенильную группу,
4-[3-(4-хлорфенил)пропиламино]фенильную группу,
4-[3-(2-бромфенил)пропиламино]фенильную группу,
4-[3-(3-бромфенил)пропиламино]фенильную группу,
4-[3-(4-бромфенил)пропиламино]фенильную группу,
4-[3-(2,3-дихлорфенил)пропиламино]фенильную группу,
4-[3-(2,4-дихлорфенил)пропиламино]фенильную группу,
4-[3-(3,4-дихлорфенил)пропиламино]фенильную группу,
4-[3-(3,5-дихлорфенил)пропиламино]фенильную группу,
4-[3-(2-метилфенил)пропиламино]фенильную группу,
4-[3-(3-метилфенил)пропиламино]фенильную группу,
4-[3-(4-метилфенил)пропиламино]фенильную группу,
4-[3-(2-этилфенил)пропиламино]фенильную группу,
4-[3-(3-этилфенил)пропиламино]фенильную группу,
4-[3-(4-этилфенил)пропиламино]фенильную группу,
4-[3-(4-пропилфенил)пропиламино]фенильную группу,
4-[3-(4-трет-бутилфенил)пропиламино]фенильную группу,
4-[3-(4-бутилфенил)пропиламино]фенильную группу,
4-[3-(2-трифторметилфенил)пропиламино]фенильную группу,
4-[3-(3-трифторметилфенил)пропиламино]фенильную группу,
4-[3-(4-трифторметилфенил)пропиламино]фенильную группу,
4-[3-(2-пентафторэтилфенил)пропиламино]фенильную группу,
4-[3-(3-пентафторэтилфенил)пропиламино]фенильную группу,
4-[3-(2,3-диметилфенил)пропиламино]фенильную группу,
4-[3-(3,4,5-триметилфенил)пропиламино]фенильную группу,
4-[3-(4-пентилфенил)пропиламино]фенильную группу,
4-[3-(4-гексилфенил)пропиламино]фенильную группу,
4-[3-(2-трифторметоксифенил)пропиламино]фенильную группу,
4-[3-трифторметоксифенилпропиламино]фенильную группу,
4-[3-(4-трифторметоксифенил)пропиламино]фенильную группу,
4-[3-(2-пентафторэтоксифенил)пропиламино]фенильную группу,
4-[3-(3-пентафторэтоксифенил)пропиламино]фенильную группу,
4-[3-(4-пентафторэтоксифенил)пропиламино]фенильную группу,
2-феноксифенильную группу, 3-феноксифенильную группу,
4-феноксифенильную группу, 2-(2-хлорфенокси)фенильную группу,
2-(3-хлорфенокси)фенильную группу,
2-(4-хлорфенокси)фенильную группу,
3-(2-хлорфенокси)фенильную группу,
3-(3-хлорфенокси)фенильную группу,
3-(4-хлорфенокси)фенильную группу,
4-(2-хлорфенокси)фенильную группу,
4-(3-хлорфенокси)фенильную группу,
4-(4-хлорфенокси)фенильную группу,
3-(4-метилфенокси)фенильную группу,
3-(3,4-диметилфенокси)фенильную группу,
4-(2,4,6-триметилфенокси)фенильную группу,
2-(2-трифторметилфенокси)фенильную группу,
2-(3-трифторметилфенокси)фенильную группу,
2-(4-трифторметилфенокси)фенильную группу,
3-(2-трифторметилфенокси)фенильную группу,
3-(3-трифторметилфенокси)фенильную группу,
3-(4-трифторметилфенокси)фенильную группу,
4-(2-трифторметилфенокси)фенильную группу,
4-(3-трифторметилфенокси)фенильную группу,
4-(4-трифторметилфенокси)фенильную группу,
3-(4-метоксифенокси)фенильную группу,
2-(3,4-диметоксифенокси)фенильную группу,
4-(2,4,6-триметоксифенокси)фенильную группу,
2-(2-трифторметоксифенокси)фенильную группу,
2-(3-трифторметоксифенокси)фенильную группу,
2-(4-трифторметоксифенокси)фенильную группу,
3-(2-трифторметоксифенокси)фенильную группу,
3-(3-трифторметоксифенокси)фенильную группу,
3-(4-трифторметоксифенокси)фенильную группу,
4-(2-трифторметоксифенокси)фенильную группу,
4-(3-трифторметоксифенокси)фенильную группу,
4-(4-трифторметоксифенокси)фенильную группу,
4-бензилоксифенильную группу, 4-(2-фенилэтокси)фенильную группу,
4-(3-фенилпропокси)фенильную группу,
4-(4-фенилбутокси)фенильную группу,
4-(5-фенилпентокси)фенильную группу,
4-(6-фенилгексилокси)фенильную группу,
4-(4-фторбензилокси)фенильную группу,
4-(3-фторбензилокси)фенильную группу,
4-(2-фторбензилокси)фенильную группу,
4-(4-хлорбензилокси)фенильную группу,
4-(3-хлорбензилокси)фенильную группу,
4-(2-хлорбензилокси)фенильную группу,
3-(4-метилбензилокси)фенильную группу,
2-(2,4-диметилбензилокси)фенильную группу,
4-(2,4,6-триметилбензилокси)фенильную группу,
4-(2-трифторметилбензилокси)фенильную группу,
4-(3-трифторметилбензилокси)фенильную группу,
4-(4-трифторметилбензилокси)фенильную группу,
3-(4-метоксибензилокси)фенильную группу,
2-(2,4-диметоксибензилокси)фенильную группу,
4-(2,4,6-триметоксибензилокси)фенильную группу,
4-(2-трифторметоксибензилокси)фенильную группу,
4-(3-трифторметоксибензилокси)фенильную группу,
4-(4-трифторметоксибензилокси)фенильную группу,
4-(4-фторфенилэтокси)фенильную группу,
4-(3-фторфенилэтокси)фенильную группу,
4-(2-фторфенилэтокси)фенильную группу,
4-(4-хлорфенилэтокси)фенильную группу,
4-(3-хлорфенилэтокси)фенильную группу,
4-(2-хлорфенилэтокси)фенильную группу,
4-(2-трифторметилфенилэтокси)фенильную группу,
4-(3-трифторметилфенилэтокси)фенильную группу,
4-(4-трифторметилфенилэтокси)фенильную группу,
4-(2-трифторметоксифенилэтокси)фенильную группу,
4-(3-трифторметоксифенилэтокси)фенильную группу,
4-(4-трифторметоксифенилэтокси)фенильную группу,
4-(3-трифторметоксифенилэтокси)фенильную группу,
4-(4-трифторметоксифенилэтокси)фенильную группу,
4-[3-(4-фторфенил)пропокси]фенильную группу,
4-[3-(3-фторфенил)пропокси]фенильную группу,
4-[3-(2-фторфенил)пропокси]фенильную группу,
4-[3-(2-трифторметилфенил)пропокси]фенильную группу,
4-[3-(3-трифторметилфенил)пропокси]фенильную группу,
4-[3-(4-трифторметилфенил)пропокси]фенильную группу,
4-[3-(2-трифторметилфенил)пропокси]фенильную группу,
4-[3-(3-трифторметоксифенил)пропокси]фенильную группу,
3-(4-трифторметоксифенил)пропокси]фенильную группу,
4-[4-(3-трифторметилфенил)бутокси]фенильную группу,
4-[5-(4-трифторметилфенил)пентокси]фенильную группу,
4-[4-(4-трифторметоксифенил)пентокси]фенильную группу,
4-[6-(3-трифторметилфенил)гексилокси]фенильную группу,
4-[6-(4-трифторметилфенил)гексилокси]фенильную группу,
4-[6-(4-трифторметоксифенил)гексилокси]фенильную группу,
3-(пиперидин-1-ил)фенильную группу,
2-(4-бензиламинопиперидин-1-ил)фенильную группу,
2-(3-бензиламинопиперидин-1-ил)фенильную группу,
2-(4-бензиламинопиперидин-1-ил)фенильную группу,
2-(4-бензиламинопиперидин-1-ил)фенильную группу,
2-(4-бензиламинопиперидин-1-ил)фенильную группу,
2-[4-(4-хлорбензил)аминопиперидин-1-ил]фенильную группу,
2-[2-(2,4-дихлорбензил)аминопиперидин-1-ил]фенильную группу,
2-[4-(2,4,6-трихлорбензил)аминопиперидин-1-ил]фенильную группу,
2-[4-(4-метилбензил)аминопиперидин-1-ил]фенильную группу,
2-[4-(2,4-диметилбензил)аминопиперидин-1-ил]фенильную группу,
2-[4-(2,4,6-триметилбензил)аминопиперидин-1-ил]фенильную группу,
2-[4-(4-трифторметилбензил)аминопиперидин-1-ил]фенильную группу,
2-{4-[2,4-ди(трифторметил)бензил]пиперидин-1-ил}фенильную группу,
2-{4-[2,4,6-три(трифторметил)бензил]аминопиперидин-1-ил}фенильную группу,
2-[4-(4-метоксибензил)аминопиперидин-1-ил]фенильную группу,
2-[4-(2,4-диметоксибензил)аминопиридин-1-ил]фенильную группу,
2-[4-(2,4,6-триметоксибензил)аминопиперидин-1-ил]фенильную группу,
2-[4-(4-трифторметоксибензил)аминопиперидин-1-ил]фенильную группу,
2-{4-[2,4,6-три(трифторметокси)бензил]аминопиперидин-1-ил}фенильную группу,
2-{4-[3,5-ди(трифторметокси)бензил]аминопиперидин-1-ил}фенильную группу,
4-(4-метиламинопиперидин-1-ил)фенильную группу,
4-(4-диметиламинопиперидин-1-ил)фенильную группу,
4-(4-этиламинопиперидин-1-ил)фенильную группу,
4-(4-диэтиламинопиперидин-1-ил)фенильную группу,
4-(4-н-пропиламинопиперидин-1-ил)фенильную группу,
4-(4-(ди-н-пропиламино)пиперидин-1-ильную группу,
4-(4-н-бутиламинопиперидин-1-ил)фенильную группу,
4-[4-(N-этил-N-метиламино)пиперидин-1-ил]фенильную группу,
4-[4-(N-бензил-N-метиламино)пиперидин-1-ил]фенильную группу,
4-(4-н-пентиламинопиперидин-1-ил)фенильную группу,
4-(4-н-гексиламинопиперидин-1-ил)фенильную группу или тому подобное.
Примеры бифенилил-С1-6алкоксигруппы включают
1,1'-бифенил-4-илметоксигруппу,
2-(1,1'-бифенил-4-ил)этоксигруппу,
3-(1,1'-бифенил-4-ил)пропоксигруппу,
4-(1,1'-бифенил-4-ил)бутоксигруппу,
5-(1,1'-бифенил-4-ил)пентилоксигруппу,
6-(1,1'-бифенил-4-ил)гексилоксигруппу или тому подобное.
Фенил-С1-6алкенилоксигруппа, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена, включает фенил-С1-6алкенилоксигруппу, которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, атомами галогена, например 3-фенил-2-пропенилоксигруппу (тривиальное название: циннамилоксигруппа), 4-фенил-2-бутенилоксигруппу,
4-фенил-3-бутенилоксигруппу,
3-(2-фторфенил)-2-пропенилоксигруппу,
3-(3-фторфенил)-2-пропенилоксигруппу,
3-(4-фторфенил)-2-пропенилоксигруппу,
3-(2,3-дифторфенил)-2-пропенилоксигруппу,
3-(2,4-дифторфенил)-2-пропенилоксигруппу,
3-(3,4-дифторфенил)-2-пропенилоксигруппу,
3-(3,5-дифторфенил)-2-пропенилоксигруппу,
3-(2-хлорфенил)-2-пропенилоксигруппу,
3-(3-хлорфенил)-2-пропенилоксигруппу,
3-(4-хлорфенил)-2-пропенилоксигруппу,
3-(2,4,6-трихлорфенил)-2-пропенилоксигруппу,
3-(2,3,4,5,6-пентафторфенил)-2-пропенилоксигруппу,
3-(2,3-дихлорфенил)-2-пропенилоксигруппу,
3-(2,4-дихлорфенил)-2-пропенилоксигруппу,
3-(3,4-дихлорфенил)-2-пропенилоксигруппу,
3-(3,5-дихлорфенил)-2-пропенилоксигруппу,
3-(2-бромфенил)-2-пропенилоксигруппу,
3-(3-бромфенил)-2-пропенилоксигруппу,
3-(4-бромфенил)-2-пропенилоксигруппу,
4-(4-хлорфенил)-3-бутенилоксигруппу,
4-(2,3-дихлорфенил)-3-бутенилоксигруппу,
4-(2,4-дихлорфенил)-3-бутенилоксигруппу,
4-(3,4-дихлорфенил)-3-бутенилоксигруппу,
4-(3,5-дихлорфенил)-3-бутенилоксигруппу,
5-(4-хлорфенил)-4-пентенилоксигруппу,
5-(2,3-дихлорфенил)-4-пентенилоксигруппу,
5-(2,4-дихлорфенил)-4-пентенилоксигруппу,
5-(3,4-дихлорфенил)-4-пентенилоксигруппу,
5-(3,5-дихлорфенил)-4-пентенилоксигруппу,
6-(4-хлорфенил)-5-гексенилоксигруппу,
6-(2,3-дихлорфенил)-5-гексенилоксигруппу,
6-(2,4-дихлорфенил)-5-гексенилоксигруппу,
6-(3,4-дихлорфенил)-5-гексенилоксигруппу,
6-(3,5-дихлорфенил)-5-гексенилоксигруппу или тому подобное.
Феноксигруппа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает феноксигруппу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например феноксигруппу, 2-фторфеноксигруппу,
3-фторфеноксигруппу, 4-фторфеноксигруппу, 2-хлорфеноксигруппу,
3-хлорфеноксигруппу, 4-хлорфеноксигруппу, 2-бромфеноксигруппу,
3-бромфеноксигруппу, 4-бромфеноксигруппу,
2,3-дихлорфеноксигруппу, 3,4-дихлорфеноксигруппу,
2,4-дихлорфеноксигруппу, 3,4,5-трихлорфеноксигруппу,
2,4,6-трихлорфеноксигруппу, 2,3,4,5,6-пентафторфеноксигруппу,
2-цианофеноксигруппу, 3-цианофеноксигруппу,
4-цианофеноксигруппу, 2-метилфеноксигруппу,
2,4,6-трицианофеноксигруппу, 2,3-дицианофеноксигруппу,
3-метилфеноксигруппу, 4-метилфеноксигруппу, 2-этилфеноксигруппу,
3-этилфеноксигруппу, 4-этилфеноксигруппу,
4-н-пропилфеноксигруппу, 4-трет-бутилфеноксигруппу,
4-н-бутилфеноксигруппу, 2-трифторметилфеноксигруппу,
3-трифторметилфеноксигруппу, 4-трифторметилфеноксигруппу,
2-пентафторэтилфеноксигруппу, 3-пентафторэтилфеноксигруппу,
2,3-диметилфеноксигруппу, 3,4,5-триметилфеноксигруппу,
4-н-пентилфеноксигруппу, 4-н-гексилфеноксигруппу,
2-метоксифеноксигруппу, 3-метоксифеноксигруппу,
4-метоксифеноксигруппу, 2-этоксифеноксигруппу,
3-этоксифеноксигруппу, 4-этоксифеноксигруппу,
4-н-пропоксифеноксигруппу, 4-трет-бутоксифеноксигруппу,
4-н-бутоксифеноксигруппу, 2-трифторметоксифеноксигруппу,
3-трифторметоксифеноксигруппу, 4-трифторметоксифеноксигруппу,
2-пентафторэтоксифеноксигруппу, 3-пентафторэтоксифеноксигруппу,
2,3-диметоксифеноксигруппу, 3,4,5-триметоксифеноксигруппу,
4-н-пентилоксифеноксигруппу, 4-н-гексилоксифеноксигруппу или тому подобное.
Фенил-С1-6алкоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой) включает фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкоксигруппами), например бензилоксикарбонильную группу,
фенилэтоксиоксикарбонильную группу,
3-фенилпропоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентоксикарбонильную группу,
4-фенилпентоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-метоксибензилоксикарбонильную группу,
2,4-диметоксибензилоксикарбонильную группу,
2,4,6-триметоксибензилоксикарбонильную группу,
2-трифторметоксибензилоксикарбонильную группу,
3-трифторметоксибензилоксикарбонильную группу,
4-трифторметоксибензилоксикарбонильную группу,
2-(2-трифторметоксифенил)этоксикарбонильную группу,
2-(3-трифторметоксифенил)этоксикарбонильную группу,
2-(4-трифторметоксифенил)этоксикарбонильную группу,
3-(3-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-трифторметоксифенил)пропоксикарбонильную группу,
4-(4-трифторметоксифенил)пентоксикарбонильную группу,
6-(4-трифторметоксифенил)гексилоксикарбонильную группу или тому подобное.
Фенил С1-6алкилкарбамоильная группа, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена, включает фенил-С1-6алкилкарбамоильную группу, которая может быть замещена в фенильном кольце 1-5 атомами галогена, например бензилкарбамоильную группу,
2-фенетилкарбамоильную группу,
3-фенилпропилкарбамоильную группу,
2-фенилпропилкарбамоильную группу,
4-фенилбутилкарбамоильную группу,
5-фенилпентилкарбамоильную группу,
4-фенилпентилкарбамоильную группу,
6-фенилгексилкарбамоильную группу,
2-фторбензилкарбамоильную группу,
3-фторбензилкарбамоильную группу,
2,4,6-трихлорбензилкарбамоильную группу,
2,3,4,5,6-пентафторбензилкарбамоильную группу,
4-фторбензилкарбамоильную группу,
2-хлорбензилкарбамоильную группу,
3-хлорбензилкарбамоильную группу,
4-хлорбензилкарбамоильную группу,
2-бромбензилкарбамоильную группу,
3-бромбензилкарбамоильную группу,
4-бромбензилкарбамоильную группу,
2-иодбензилкарбамоильную группу,
3-иодбензилкарбамоильную группу,
4-иодбензилкарбамоильную группу,
2,3-дифторбензилкарбамоильную группу,
3,4-дифторбензилкарбамоильную группу,
3,5-дифторбензилкарбамоильную группу,
2,4-дифторбензилкарбамоильную группу,
2,6-дифторбензилкарбамоильную группу,
2,3-дихлорбензилкарбамоильную группу,
3,4-дихлорбензилкарбамоильную группу,
3,5-дихлорбензилкарбамоильную группу,
2,4-дихлорбензилкарбамоильную группу,
2,6-дихлорбензилкарбамоильную группу или тому подобное.
Фенилтиогруппа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой) включает фенилтиогруппу (которая может быть замещена в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкоксигруппами), например фенилтиогруппу,
2-метоксифенилтиогруппу, 3-метоксифенилтиогруппу,
4-метоксифенилтиогруппу, 2,4-диметоксифенилтиогруппу,
2,4,6-триметоксифенилтиогруппу,
3,5-дитрифторметоксифенилтиогруппу,
2-трифторметоксифенилтиогруппу, 3-трифторметоксифенилтиогруппу,
4-трифторметоксифенилтиогруппу, 4-этоксифенилтиогруппу,
4-пентафторэтоксифенилтиогруппу, 4-пропоксифенилтиогруппу,
4-бутоксифенилтиогруппу, 4-пентилоксифенилтиогруппу,
4-гексилоксифенилтиогруппу или тому подобное.
Фенилсульфоксидная группа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой) включает фенилсульфоксидную группу (которая может быть замещена фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкоксигруппами), например фенилсульфоксидную группу, 2-метоксифенилсульфоксидную группу, 3-метоксифенилсульфоксидную группу,
4-метоксифенилсульфоксидную группу,
2,4-диметоксифенилсульфоксидную группу,
2,4,6-триметоксифенилсульфоксидную группу,
3,5-дитрифторметоксифенилсульфоксидную группу,
2-трифторметоксифенилсульфоксидную группу,
3-трифторметоксифенилсульфоксидную группу,
4-трифторметоксифенилсульфоксидную группу или тому подобное.
Пиридил-С1-6алкоксигруппа включает, например,
2-пиридилметоксигруппу, 3-пиридилметоксигруппу,
4-пиридилметоксигруппу, 2-(2-пиридил)этоксигруппу,
2-(3-пиридил)этоксигруппу, 2-(4-пиридил)этоксигруппу,
3-(2-пиридил)пропоксигруппу, 3-(3-пиридил)пропоксигруппу,
3-(4-пиридил)пропоксигруппу, 4-(2-пиридил)бутоксигруппу,
4-(3-пиридил)бутоксигруппу, 4-(4-пиридил)бутоксигруппу,
5-(2-пиридил)пентилоксигруппу, 5-(3-пиридил)пентилоксигруппу,
5-(4-пиридил)пентилоксигруппу, 6-(2-пиридил)гексилоксигруппу,
6-(3-пиридил)гексилоксигруппу, 6-(4-пиридил)гексилоксигруппу или тому подобное.
Фенил-С2-6алканоильная группа, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена, включает фенил-С2-6алканоильную группу, которая может быть замещена в фенильном кольце 1-5 атомами галогена, например фенилацетильную группу, 3-фенилпропионильную группу, 4-фенилбутирильную группу,
5-фенилпентаноильную группу, 6-фенилгексаноильную группу,
2-фторфенилацетильную группу, 3-фторфенилацетильную группу,
4-фторфенилацетильную группу, 2-хлорфенилацетильную группу,
3-хлорфенилацетильную группу, 4-хлорфенилацетильную группу,
2-бромфенилацетильную группу, 3-бромфенилацетильную группу,
4-бромфенилацетильную группу, 2,3-дихлорфенилацетильную группу,
2,4,6-трихлорфенилацетильную группу,
2,3,4,5,6-пентафторфенилацетильную группу,
3-(2-фторфенил)пропионильную группу,
3-(3-фторфенил)пропионильную группу,
3-(4-фторфенил)пропионильную группу,
3-(2-хлорфенил)пропионильную группу,
3-(3-хлорфенил)пропионильную группу,
3-(4-хлорфенил)пропионильную группу,
3-(2-бромфенил)пропионильную группу,
3-(3-бромфенил)пропионильную группу,
3-(4-бромфенил)пропионильную группу,
4-(4-фторфенил)бутирильную группу,
4-(3-хлорфенил)бутирильную группу,
4-(4-хлорфенил)бутирильную группу,
5-(4-фторфенил)пентаноильную группу,
5-(3-хлорфенил)пентаноильную группу,
5-(4-хлорфенил)пентаноильную группу,
6-(4-фторфенил)гексаноильную группу,
5-(3-хлорфенил)гексаноильную группу,
6-(4-хлорфенил)гексаноильную группу или тому подобное.
Фенилкарбамоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) включает фенилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами), причем аминофрагмент карбамоильной группы может быть дополнительно замещен С1-6алкильной группой или фенил-С1-6алкильной группой, например фенилкарбамоильную группу,
2-метилфенилкарбамоильную группу,
3-метилфенилкарбамоильную группу,
4-метилфенилкарбамоильную группу,
3,4-диметилфенилкарбамоильную группу,
2,4,6-триметилфенилкарбамоильную группу,
4-н-пропилфенилкарбамоильную группу,
4-н-бутилфенилкарбамоильную группу,
3-н-пентилфенилкарбамоильную группу,
2-н-гексилфенилкарбамоильную группу,
2-трифторметилфенилкарбамоильную группу,
3-трифторметилфенилкарбамоильную группу,
4-трифторметилфенилкарбамоильную группу,
N-метил-N-фенилкарбамоильную группу,
N-(2-метилфенил)-N-метилкарбамоильную группу,
N-(3-этилфенил)-N-метилкарбамоильную группу,
N-(4-н-гексилфенил)-N-метилкарбамоильную группу,
N-(2-изопропилфенил)-N-метилкарбамоильную группу,
N-(3-н-бутилфенил)-N-метилкарбамоильную группу,
N-(4-трет-бутилфенил)-N-метилкарбамоильную группу,
N-(4-н-пентилфенил)-N-метилкарбамоильную группу,
N-бензил-N-фенилкарбамоильную группу,
N-бензил-N-(2-трифторметилфенил)карбамоильную группу,
N-бензил-N-(2,3-диметилфенил)карбамоильную группу,
N-бензил-N-(2,4,6-триметилфенил)карбамоильную группу,
N-бензил-N-(3,5-дитрифторметилфенил)карбамоильную группу,
N-бензил-N-(3-метилфенил)карбамоильную группу,
N-бензил-N-(4-трет-бутилфенил)карбамоильную группу,
N-бензил-N-(2-изопропилфенил)карбамоильную группу,
N-бензил-N-(3-н-пропилфенил)карбамоильную группу,
N-бензил-N-(4-этилфенил)карбамоильную группу или тому подобное.
Пиперидинилоксикарбонильная группа (которая может быть замещена в пиперидиновом кольце по крайней мере одной фенильной группой (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) в качестве заместителя) включает пиперидинилоксикарбонильную группу (которая может быть замещена в пиперидиновом кольце 1-3 фенильными группами (которые могут быть замещены в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами) в качестве заместителя), например пиперидин-1-илоксикарбонильную группу,
пиперидин-2-илоксикарбонильную группу,
пиперидин-3-илоксикарбонильную группу,
пиперидин-4-илоксикарбонильную группу,
1-фенилпиперидин-4-илоксикарбонильную группу,
1,2-дифенилпиперидин-4-илоксикарбонильную группу,
1,3,4-трифенилпиперидин-4-илоксикарбонильную группу,
1-(2-метилфенил)пиперидин-4-илоксикарбонильную группу,
1-(3-метилфенил)пиперидин-4-илоксикарбонильную группу,
1-(4-метилфенил)пиперидин-4-илоксикарбонильную группу,
1-(2,4-диметилфенил)пиперидин-4-илоксикарбонильную группу,
1-(2,4,6-триметилфенил)пиперидин-4-илоксикарбонильную группу,
1-(2-трифторметилфенил)пиперидин-4-илоксикарбонильную группу,
1-(3-трифторметилфенил)пиперидин-4-илоксикарбонильную группу,
1-(3,5-дитрифторметилфенил)пиперидин-4-илоксикарбонильную группу,
1-(4-трифторметилфенил)пиперидин-4-илоксикарбонильную группу,
1-(2-пентафторэтилфенил)пиперидин-4-илоксикарбонильную группу,
1-(3-пентафторэтилфенил)пиперидин-4-илоксикарбонильную группу,
1-(4-пентафторэтилфенил)пиперидин-4-илоксикарбонильную группу,
1-(2-н-пропилфенил)пиперидин-4-илоксикарбонильную группу,
1-(3-н-пропилфенил)пиперидин-4-илоксикарбонильную группу,
1-(4-н-пропилфенил)пиперидин-4-илоксикарбонильную группу или тому подобное.
5-6-Членный насыщенный гетероцикл, образованный связыванием R24 и R25 друг с другом через смежный атом азота представляет собой гетероцикл, образованный связыванием R24 и R25 друг с другом через или не через атом азота, атом кислорода или атом серы вместе со смежным атомом азота, примеры которого включают пирролидинильную группу, пиперазильную группу, пиперидильную группу, морфолиногруппу, тиоморфолиногруппу или тому подобное.
С3-8циклоалкил-С1-6алкильная группа включает, например, циклопропилметильную группу, 2-циклопропилэтильную группу,
3-циклопропилпропильную группу, 4-циклопропилбутильную группу,
4-циклопропилпентильную группу, 6-циклопропилгексильную группу,
циклобутилметильную группу, 2-циклобутилэтильную группу,
3-циклобутилпропильную группу, 4-циклобутилбутильную группу,
4-циклобутилпентильную группу, 6-циклобутилгексильную группу,
циклопентилметильную группу, 2-циклопентилэтильную группу,
3-циклопентилпропильную группу, 4-циклопентилбутильную группу,
4-циклопентилпентильную группу, 6-циклопентилгексильную группу,
циклогексилметильную группу, 2-циклогексилэтильную группу,
3-циклогексилпропильную группу, 4-циклогексилбутильную группу,
4-циклогексилпентильную группу, 6-циклогексилгексильную группу,
циклогептилметильную группу, 2-циклогептилэтильную группу,
3-циклогептилпропильную группу, 4-циклогептилбутильную группу,
4-циклогептилпентильную группу, 6-циклогептилгексильную группу,
циклооктилметильную группу, 2-циклооктилэтильную группу,
3-циклооктилпропильную группу, 4-циклооктилбутильную группу,
4-циклооктилпентильную группу, 6-циклооктилгексильную группу или тому подобное.
Фенил-С1-6алкильная группа (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена; цианогруппы; галогензамещенной или незамещенной С1-6алкильной группы; С3-8циклоалкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя; С1-6алкоксикарбонильной группы; феноксигруппы; фенил-С1-6алкильной группы; фенил-С2-6алкенильной группы; пиридильной группы; имидазолильной группы и пиперидильной группы) включает, например, бензильную группу,
1-фенетильную группу, 2-фенетильную группу,
3-фенилпропильную группу, 2-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
4-фенилпентильную группу, 6-фенилгексильную группу,
4-цианобензильную группу, 2,3-дицианобензильную группу,
2,4,6-трицианобензильную группу,
2-(4-цианофенил)этильную группу,
3-(4-цианофенил)пропильную группу,
2-(4-цианофенил)пропильную группу,
4-(4-цианофенил)бутильную группу,
5-(4-цианофенил)пентильную группу,
4-(4-цианофенил)пентильную группу,
6-(4-цианофенил)гексильную группу, 2-цианобензильную группу,
2-(3-цианофенил)этильную группу,
3-(2-цианофенил)пропильную группу,
2-(2-цианофенил)пропильную группу,
4-(3-цианофенил)бутильную группу,
5-(2-цианофенил)пентильную группу,
4-(3-цианофенил)пентильную группу,
6-(3-цианофенил)гексильную группу, 2-фторбензильную группу,
3-фторбензильную группу, 4-фторбензильную группу,
2-хлорбензильную группу, 3-хлорбензильную группу,
4-хлорбензильную группу, 2-бромбензильную группу,
3-бромбензильную группу, 4-бромбензильную группу,
2-иодбензильную группу, 3-иодбензильную группу,
4-иодбензильную группу, 2,3-дифторбензильную группу,
3,4-дифторбензильную группу, 3,5-дифторбензильную группу,
2,4-дифторбензильную группу, 2,6-дифторбензильную группу,
2,3-дихлорбензильную группу, 3,4-дихлорбензильную группу,
3,5-дихлорбензильную группу, 2,4,6-трихлорбензильную группу,
2,4-дихлорбензильную группу, 2,6-дихлорбензильную группу,
2-трифторбензильную группу, 2-метилбензильную группу,
2,4-диметилбензильную группу,
2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
2-пентафторэтилбензильную группу,
3-пентафторэтилбензильную группу,
4-пентафторэтилбензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу,
2-пентафторэтоксибензильную группу,
3-пентафторэтоксибензильную группу,
4-пентафторэтоксибензильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-метоксибензильную группу, 2,4-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
3,5-дитрифторметоксибензильную группу,
2-хлор-4-трифторметилбензильную группу,
3-фтор-4-трихлорметоксибензильную группу,
2-(2-трифторметоксифенил)этильную группу,
2-(3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
2-(2-пентафторэтоксифенил)этильную группу,
2-(3-пентафторэтоксифенил)этильную группу,
2-(4-пентафторэтоксифенил)этильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
3-(3-пентафторэтоксифенил)пропильную группу,
3-(4-пентафторэтоксифенил)пропильную группу,
4-(3-пентафторэтоксифенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
2-циклогексилбензильную группу, 3-циклогексилбензильную группу,
4-циклогексилбензильную группу,
2-(2-циклогексилфенил)этильную группу,
2-(3-циклогексилфенил)этильную группу,
2-(4-циклогексилфенил)этильную группу,
3-(2-циклогексилфенил)пропильную группу,
3-(3-циклогексилфенил)пропильную группу,
3-(4-циклогексилфенил)пропильную группу,
3-аминобензильную группу, 2,4-диаминобензильную группу,
2,4,6-триаминобензильную группу,
2-диметиламинобензильную группу,
3-диметиламинобензильную группу,
4-диметиламинобензильную группу,
2-(2-диметиламинофенил)этильную группу,
2-(3-диметиламинофенил)этильную группу,
2-(4-диметиламинофенил)этильную группу,
3-(2-диметиламинофенил)пропильную группу,
3-(3-диметиламинофенил)пропильную группу,
3-(4-диметиламинофенил)пропильную группу,
2-метоксикарбонилбензильную группу,
3-метоксикарбонилбензильную группу,
4-метоксикарбонилбензильную группу,
2-(2-метоксикарбонилфенил)этильную группу,
2-(3-метоксикарбонилфенил)этильную группу,
2-(4-метоксикарбонилфенил)этильную группу,
3-(2-метоксикарбонилфенил)пропильную группу,
3-(3-метоксикарбонилфенил)пропильную группу,
3-(4-метоксикарбонилфенил)пропильную группу,
2-этоксикарбонилбензильную группу,
3-этоксикарбонилбензильную группу,
4-этоксикарбонилбензильную группу,
2-(2-этоксикарбонилфенил)этильную группу,
2-(3-этоксикарбонилфенил)этильную группу,
2-(4-этоксикарбонилфенил)этильную группу,
3-(2-этоксикарбонилфенил)пропильную группу,
3-(3-этоксикарбонилфенил)пропильную группу,
3-(4-этоксикарбонилфенил)пропильную группу,
2-феноксибензильную группу, 3-феноксибензильную группу,
4-феноксибензильную группу, 2-стирилбензильную группу,
3-стирилбензильную группу, 4-стирилбензильную группу,
2-(2-феноксифенил)этильную группу,
2-(3-феноксифенил)этильную группу,
2-(4-феноксифенил)этильную группу,
3-(2-феноксифенил)пропильную группу,
3-(3-феноксифенил)пропильную группу,
3-(4-феноксифенил)пропильную группу, 2-бензилбензильную группу,
3-бензилбензильную группу, 4-бензилбензильную группу,
2-(2-бензилфенил)этильную группу,
2-(3-бензилфенил)этильную группу,
2-(4-бензилфенил)этильную группу,
3-(2-бензилфенил)пропильную группу,
3-(3-бензилфенил)пропильную группу,
3-(4-бензилфенил)пропильную группу,
2-(2-фенетил)бензильную группу, 3-(2-фенетил)бензильную группу,
4-(2-фенетил)бензильную группу,
2-(2-(1-фенетил)фенил)этильную группу,
2-(3-(2-фенетил)фенил)этильную группу,
2-(4-(2-фенетил)фенил)этильную группу,
2-(3-(2-фенетил)фенил)пропильную группу,
3-(2-(2-фенетил)фенил)пропильную группу,
3-(4-(1-фенетил)фенил)пропильную группу,
2-(3-пиридил)бензильную группу, 3-(3-пиридил)бензильную группу,
4-(3-пиридил)бензильную группу,
2-(1-имидазолил)бензильную группу,
3-(1-имидазолил)бензильную группу,
4-(1-имидазолил)бензильную группу,
2-(1-пиперидино)бензильную группу,
3-(1-пиперидино)бензильную группу,
4-(1-пиперидино)бензильную группу или тому подобное.
Бифенилил-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя) включает бифенилил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать 1-2 С1-6алкильные группы в качестве заместителя), например 2-бифенилилметильную группу,
3-бифенилилметильную группу, 4-бифенилилметильную группу,
2-(2-бифенилил)этильную группу, 2-(3-бифенилил)этильную группу,
2-(4-бифенилил)этильную группу,
3-(2-бифенилил)пропильную группу,
3-(3-бифенилил)пропильную группу,
3-(4-бифенилил)пропильную группу,
4-(4-бифенилил)бутильную группу,
5-(4-бифенилил)пентильную группу,
6-(4-бифенилил)гексильную группу,
2'-фтор-2-бифенилилметильную группу,
2'-фтор-3-бифенилилметильную группу,
2'-фтор-4-бифенилилметильную группу,
3'-фтор-2-бифенилилметильную группу,
3'-фтор-3-бифенилилметильную группу,
3'-фтор-4-бифенилилметильную группу,
4'-фтор-2-бифенилилметильную группу,
4'-фтор-3-бифенилилметильную группу,
4'-фтор-4-бифенилилметильную группу,
2'-хлор-2-бифенилилметильную группу,
2'-хлор-3-бифенилилметильную группу,
2'-хлор-4-бифенилилметильную группу,
3'-хлор-2-бифенилилметильную группу,
3'-хлор-3-бифенилилметильную группу,
3'-хлор-4-бифенилилметильную группу,
4'-хлор-2-бифенилилметильную группу,
4'-хлор-3-бифенилилметильную группу,
4'-хлор-4-бифенилилметильную группу,
2',4'-дихлор-4-бифенилилметильную группу,
2',4',6'-трихлор-3-бифенилилметильную группу,
3',5'-дитритрифторметил-4-бифенилилметильную группу,
2',3',4',5',6'-пентафтор-3-бифенилилметильную группу,
2'-метил-2-бифенилилметильную группу,
2'-метил-3-бифенилилметильную группу,
2'-метил-4-бифенилилметильную группу,
3'-метил-2-бифенилилметильную группу,
3'-метил-3-бифенилилметильную группу,
3'-метил-4-бифенилилметильную группу,
4'-метил-2-бифенилилметильную группу,
4'-метил-3-бифенилилметильную группу,
4'-метил-4-бифенилилметильную группу,
2'-трифторметил-2-бифенилилметильную группу,
2'-трифторметил-3-бифенилилметильную группу,
2'-трифторметил-4-бифенилилметильную группу,
3'-трифторметил-2-бифенилилметильную группу,
3'-трифторметил-3-бифенилилметильную группу,
3'-трифторметил-4-бифенилилметильную группу,
4'-трифторметил-2-бифенилилметильную группу,
4'-трифторметил-3-бифенилилметильную группу,
4'-трифторметил-4-бифенилилметильную группу,
2'-метокси-2-бифенилилметильную группу,
2'-метокси-3-бифенилилметильную группу,
2'-метокси-4-бифенилилметильную группу,
3'-метокси-2-бифенилилметильную группу,
3'-метокси-3-бифенилилметильную группу,
2',4'-диметокси-3-бифенилилметильную группу,
2',4',6'-триметокси-4-бифенилилметильную группу,
2'-метокси-4'-трифторметил-2-бифенилилметильную группу,
3'-метил-4'-трифторметокси-2-бифенилилметильную группу,
2'-хлор-4'-трифторметокси-3-бифенилилметильную группу,
3'-метокси-4-бифенилилметильную группу,
4'-метокси-2-бифенилилметильную группу,
4'-метокси-3-бифенилилметильную группу,
4'-метокси-4-бифенилилметильную группу,
2'-трифторметокси-2-бифенилилметильную группу,
2'-трифторметокси-3-бифенилилметильную группу,
2'-трифторметокси-4-бифенилилметильную группу,
3'-трифторметокси-2-бифенилилметильную группу,
3'-трифторметокси-3-бифенилилметильную группу,
3'-трифторметокси-4-бифенилилметильную группу,
4'-трифторметокси-2-бифенилилметильную группу,
4'-трифторметокси-3-бифенилилметильную группу,
4'-трифторметокси-4-бифенилилметильную группу,
2-(4'-трифторметокси-4-бифенилил)этильную группу,
3-(4'-трифторметокси-4-бифенилил)пропильную группу,
3-(4'-трифторметокси-4-бифенилил)пропильную группу,
4-(4'-трифторметокси-4-бифенилил)бутильную группу,
5-(4'-трифторметокси-4-бифенилил)пентильную группу,
6-(4'-трифторметокси-4-бифенилил)гексильную группу,
4'-диметиламино-3-бифенилилметильную группу,
4'-диметиламино-4-бифенилилметильную группу или тому подобное.
Нафтил-С1-6алкильная группа включает, например,
1-нафтилметильную группу, 2-нафтилметильную группу,
2-(1-нафтил)этильную группу, 1-(2-нафтил)этильную группу,
3-(1-нафтил)пропильную группу, 3-(2-нафтил)пропильную группу,
4-(1-нафтил)бутильную группу, 4-(2-нафтил)бутильную группу,
5-(1-нафтил)пентильную группу, 5-(2-нафтил)пентильную группу,
6-(1-нафтил)гексильную группу, 6-(2-нафтил)гексильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; цианогруппы; аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; С1-6алкоксикарбонильной группы; карбоксильной группы; феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); амино-С1-6алкильной группы (которая может содержать в аминогруппе по крайней мере одну группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы) и фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)) включает фенильную группу (которая может быть замещена в фенильном 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена; цианогруппы; аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной С1-6алкоксигруппы; С1-6алкоксикарбонильной группы; карбоксильной группы; феноксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); амино-С1-6алкильной группы (которая может содержать в аминогруппе 1-2 группы, выбранные из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы) и фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например фенильную группу,
2-фторфенильную группу,
3-фторфенильную группу, 4-фторфенильную группу,
2-хлорфенильную группу, 3-хлорфенильную группу,
4-хлорфенильную группу, 2-бромфенильную группу,
3-бромфенильную группу, 4-бромфенильную группу,
2-иодфенильную группу, 3-иодфенильную группу,
4-иодфенильную группу, 2,3-дифторфенильную группу,
3,4-дифторфенильную группу, 3,5-дифторфенильную группу,
2,4-дифторфенильную группу, 2,6-дифторфенильную группу,
2,3-дихлорфенильную группу, 3,4-дихлорфенильную группу,
3,5-дихлорфенильную группу, 2,4-дихлорфенильную группу,
2,6-дихлорфенильную группу, 3,4,5-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,4,6-трихлорфенильную группу, 2-цианофенильную группу,
3-цианофенильную группу, 4-цианофенильную группу,
2,4-дицианофенильную группу, 2,4,6-трицианофенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2,3-диметилфенильную группу,
2,4,6-триметилфенильную группу, 2-метил-3-хлорфенильную группу,
3-метил-4-хлорфенильную группу, 2-хлор-4-метилфенильную группу,
2-метил-3-фторфенильную группу, 2-трифторметилфенильную группу,
3-трифторметилфенильную группу, 4-трифторметилфенильную группу,
2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
2,4-диметоксифенильную группу, 2,4,6-триметоксифенильную группу,
2-метокси-3-хлорфенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 2,6-диметоксифенильную группу,
2,3,4-трифторфенильную группу, 2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-пентилоксифенильную группу, 4-гексилоксифенильную группу,
3-аминофенильную группу, 4-метиламинофенильную группу,
2-диметиламинофенильную группу, 3-диметиламинофенильную группу,
4-диметиламинофенильную группу,
2-метоксикарбонилфенильную группу,
3-метоксикарбонилфенильную группу,
4-метоксикарбонилфенильную группу, 2-карбоксифенильную группу,
3-карбоксифенильную группу, 4-карбоксифенильную группу,
2,3-дикарбоксифенильную группу,
2,4,6-трикарбоксифенильную группу,
2-этоксикарбонилфенильную группу,
3-этоксикарбонилфенильную группу,
4-этоксикарбонилфенильную группу,
2,3-диэтоксикарбонилфенильную группу,
2,4,6-триметоксикарбонилфенильную группу,
2-феноксифенильную группу, 3-феноксифенильную группу,
4-феноксифенильную группу, 2-(2-хлорфенокси)фенильную группу,
2-(3-хлорфенокси)фенильную группу,
2-(4-хлорфенокси)фенильную группу,
3-(2-хлорфенокси)фенильную группу,
3-(3-хлорфенокси)фенильную группу,
3-(4-хлорфенокси)фенильную группу,
4-(2-хлорфенокси)фенильную группу,
4-(3-хлорфенокси)фенильную группу,
4-(4-хлорфенокси)фенильную группу,
2-(2-трифторметилфенокси)фенильную группу,
2-(3-трифторметилфенокси)фенильную группу,
2-(3-метилфенокси)фенильную группу,
2-(2,3-диметилфенокси)фенильную группу,
2-(3,4,5-триметилфенокси)фенильную группу,
2-(4-трифторметилфенокси)фенильную группу,
3-(2-трифторметилфенокси)фенильную группу,
3-(3-трифторметилфенокси)фенильную группу,
3-(4-трифторметилфенокси)фенильную группу,
4-(2-трифторметилфенокси)фенильную группу,
4-(3-трифторметилфенокси)фенильную группу,
4-(4-трифторметилфенокси)фенильную группу,
2-(3-метоксифенокси)фенильную группу,
2-(2,3-диметоксифенокси)фенильную группу,
2-(3,4,5-триметоксифенокси)фенильную группу,
2-(2-трифторметоксифенокси)фенильную группу,
2-(3-трифторметоксифенокси)фенильную группу,
2-(4-трифторметоксифенокси)фенильную группу,
3-(2-трифторметоксифенокси)фенильную группу,
3-(3-трифторметоксифенокси)фенильную группу,
3-(4-трифторметоксифенокси)фенильную группу,
4-(2-трифторметоксифенокси)фенильную группу,
4-(3-трифторметоксифенокси)фенильную группу,
4-(4-трифторметоксифенокси)фенильную группу,
4-аминометилфенильную группу, 4-метиламинометилфенильную группу,
4-диметиламинометилфенильную группу,
4-диэтиламинометилфенильную группу,
4-ди(н-пропил)аминометилфенильную группу,
4-(фениламинометил)фенильную группу,
4-(2-фениламиноэтил)фенильную группу,
4-(3-фениламинопропил)фенильную группу,
4-(N-метил-N-фениламинометил)фенильную группу,
4-(2-N-метил-N-фениламиноэтил)фенильную группу,
4-(3-N-этил-N-фениламинопропил)фенильную группу,
4-(4-хлорфениламинометил)фенильную группу,
4-[2-(4-хлорфениламино)этил]фенильную группу,
4-[3-(4-хлорфениламино)пропил]фенильную группу,
4-[N-метил-N-4-хлорфениламинометил]фенильную группу,
4-[2-(N-метил-N-4-хлорфениламино)этил]фенильную группу,
4-[3-(N-этил-N-4-хлорфениламино)пропил]фенильную группу,
4-(4-трифторметилфениламинометил)фенильную группу,
4-[2-(4-трифторметилфениламино)этил]фенильную группу,
4-[2-(4-метилфениламино)метил]фенильную группу,
4-[2-(2,4-диметилфениламино)метил]фенильную группу,
4-[2-(2,4,6-триметилфениламино)метил]фенильную группу,
4-[3-(3,5-дитрифторметилфениламино)пропил]фенильную группу,
4-[N-метил-N-4-трифторметилфениламинометил]фенильную группу,
4-[2-(N-метил-N-4-трифторметилфениламино)этил]фенильную группу,
4-[3-(N-этил-N-4-трифторметилфениламино)пропил]фенильную группу,
4-[2-(3-метоксифениламино)метил]фенильную группу,
4-[2-(2,4-диметоксифениламино)метил]фенильную группу,
4-[2-(2,4,6-триметоксифениламино)метил]фенильную группу,
4-(4-трифторметоксифениламинометил)фенильную группу,
4-[2-(3,5-дитрифторметоксифениламино)этил]фенильную группу,
4-[3-(4-трифторметоксифениламино)пропил]фенильную группу,
4-[N-метил-N-4-трифторметоксифениламинометил]фенильную группу,
4-[2-(N-метил-N-4-трифторметоксифениламино)этил]фенильную группу,
4-[3-(N-этил-N-4-трифторметоксифениламино)пропил]фенильную группу, 4-бензилоксифенильную группу,
4-(4-хлорбензилокси)фенильную группу,
4-[2-(2,3-дихлорфенил)этокси]фенильную группу,
4-[3-(4-хлорфенил)пропокси]фенильную группу,
4-[4-(2,4,6-трихлорфенил)бутокси]фенильную группу,
4-(4-метилбензилокси)фенильную группу,
4-(3,4-диметилбензилокси)фенильную группу,
4-(2,4,6-триметилбензилокси)фенильную группу,
4-(4-трифторметилбензилокси)фенильную группу,
4-[2-(4-трифторметилфенил)этокси]фенильную группу,
4-[3-(4-трифторметилфенил)пропокси]фенильную группу,
4-[4-(4-трифторметилфенил)бутокси]фенильную группу,
4-(4-трифторметоксибензилокси)фенильную группу,
4-(4-метоксибензилокси)фенильную группу,
4-(3,4-диметоксибензилокси)фенильную группу,
4-(2,4,6-триметоксибензилокси)фенильную группу,
4-[2-(4-трифторметоксифенил)этокси]фенильную группу,
4-[3-(4-трифторметоксифенил)пропокси]фенильную группу,
4-[4-(4-трифторметоксифенил)бутокси]фенильную группу или тому подобное.
Бифенилильная группа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) включает бифенилильную группу (которая может быть замещена в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами), например 2-бифенилильную группу, 3-бифенилильную группу,
4-бифенилильную группу, 2'-метил-2-бифенилильную группу,
2'-метил-3-бифенилильную группу,
2'-метил-4-бифенилильную группу,
3'-метил-2-бифенилильную группу,
3'-метил-3-бифенилильную группу,
3'-метил-4-бифенилильную группу,
4'-метил-2-бифенилильную группу,
4'-метил-3-бифенилильную группу,
4'-метил-4-бифенилильную группу,
3',4'-диметил-2-бифенилильную группу,
2',4',6'-триметил-3-бифенилильную группу,
2'-трифторметил-4',6'-диметил-3-бифенилильную группу,
2'-трифторметил-2-бифенилильную группу,
2'-трифторметил-3-бифенилильную группу,
2'-трифторметил-4-бифенилильную группу,
3'-трифторметил-2-бифенилильную группу,
3'-трифторметил-3-бифенилильную группу,
3'-трифторметил-4-бифенилильную группу,
4'-трифторметил-2-бифенилильную группу,
4'-трифторэтил-3-бифенилильную группу,
4'-трифторметил-4-бифенилильную группу или тому подобное.
Аминогруппа, замещенная С1-6алкоксикарбонильной группой, включает аминогруппу, которая является замещенной С1-6алкоксикарбонильной группой и может содержать С1-6алкильную группу в качестве другого заместителя в аминогруппе, например метоксикарбониламиногруппу, этоксикарбониламиногруппу,
н-пропоксикарбониламиногруппу, изопропоксикарбониламиногруппу,
трет-бутоксикарбониламиногруппу, н-пентоксикарбониламиногруппу,
н-гексилоксикарбониламиногруппу,
N-метил-N-метоксикарбониламиногруппу,
N-этоксикарбонил-N-метиламиногруппу,
N-метил-N-(н-пропоксикарбонил)аминогруппу,
N-метил-N-(изопропоксикарбонил)аминогруппу,
N-(трет-бутоксикарбонил)-N-метиламиногруппу,
N-метил-N-(н-пентоксикарбонил)аминогруппу,
N-(н-гексилоксикарбонил)-N-метиламиногруппу,
N-этил-N-метоксикарбониламиногруппу,
N-этил-N-этоксикарбониламиногруппу,
N-этил-N-(н-пропоксикарбонил)аминогруппу,
N-этил-N-изопропоксикарбониламиногруппу,
N-(трет-бутоксикарбонил)-N-этиламиногруппу,
N-этил-N-(н-пентоксикарбонил)аминогруппу,
N-этил-N-(н-гексилоксикарбонил)аминогруппу или тому подобное.
Фениламиногруппа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы) включает аминогруппу, содержащую 1-2 фенильные группы (которые могут быть замещены в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы), например фениламиногруппу,
2-метилфениламиногруппу, 3-метилфениламиногруппу,
4-метилфениламиногруппу, 2-этилфениламиногруппу,
3-этилфениламиногруппу, 4-этилфениламиногруппу,
4-пропилфениламиногруппу, 4-трет-бутилфениламиногруппу,
4-бутилфениламиногруппу, 2-трифторметилфениламиногруппу,
3-трифторметилфениламиногруппу, 4-трифторметилфениламиногруппу,
2-пентафторэтилфениламиногруппу,
3-пентафторэтилфениламиногруппу, 2,3-диметилфениламиногруппу,
3,4,5-триметилфениламиногруппу, 4-пентилфениламиногруппу,
4-гексилфениламиногруппу, N-фенил-N-(2-фторфенил)аминогруппу,
2-фторфениламиногруппу, 3-фторфениламиногруппу,
4-фторфениламиногруппу, 2-хлорфениламиногруппу,
3-хлорфениламиногруппу, 4-хлорфениламиногруппу,
2-бромфениламиногруппу, 3-бромфениламиногруппу,
4-бромфениламиногруппу, 2-иодфениламиногруппу,
3-иодфениламиногруппу, 4-иодфениламиногруппу,
2,3-дифторфениламиногруппу, 3,4-дифторфениламиногруппу,
3,5-дифторфениламиногруппу, 2,4-дифторфениламиногруппу,
2,6-дифторфениламиногруппу, 2,3-дихлорфениламиногруппу,
3,4-дихлорфениламиногруппу, 3,5-дихлорфениламиногруппу,
2,4-дихлорфениламиногруппу, 2,6-дихлорфениламиногруппу,
3,4,5-трифторфениламиногруппу,
2,3,4,5,6-пентафторфениламиногруппу,
3,4,5-трихлорфениламиногруппу, 2,4,6-трифторфениламиногруппу,
2,4,6-трихлорфениламиногруппу или тому подобное.
Бензоил-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена в качестве заместителя) включает бензоил-С1-6алкильную группу (которая может содержать 1-5 атомов галогена в качестве заместителя в фенильном кольце), например
бензоилметильную группу, 2-фторбензоилметильную группу,
3-фторбензоилметильную группу, 4-фторбензоилметильную группу,
2-хлорбензоилметильную группу,
(2,3-дихлорбензоил)метильную группу,
(2,4,6-трихлорбензоил)метильную группу,
(2,3,4,5,6-пентафторбензоил)метильную группу,
3-хлорбензоилметильную группу, 4-хлорбензоилметильную группу,
2-бромбензоилметильную группу, 3-бромбензоилметильную группу,
4-бромбензоилметильную группу, 2-бензоилэтильную группу,
2-(2-фторбензоил)этильную группу,
2-(3-фторбензоил)этильную группу,
2-(4-фторбензоил)этильную группу,
2-(2-хлорбензоил)этильную группу,
2-(3-хлорбензоил)этильную группу,
2-(4-хлорбензоил)этильную группу,
3-(2-хлорбензоил)пропильную группу,
3-(3-хлорбензоил)пропильную группу,
3-(4-хлорбензоил)пропильную группу,
4-(2-хлорбензоил)бутильную группу,
4-(3-хлорбензоил)бутильную группу,
4-(4-хлорбензоил)бутильную группу,
5-(2-хлорбензоил)пентильную группу,
5-(3-хлорбензоил)пентильную группу,
5-(4-хлорбензоил)пентильную группу,
6-(2-хлорбензоил)гексильную группу,
6-(3-хлорбензоил)гексильную группу,
6-(4-хлорбензоил)гексильную группу или тому подобное.
Фенилкарбамоил-С1-6алкильная группа (которая может быть замещена в фенильном кольце по крайней мере одной из галогензамещенных или незамещенных С1-6алкильных групп) включает фенилкарбамоил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами из галогензамещенных или незамещенных С1-6алкильных групп), например фенилкарбамоилметильную группу,
2-метилфенилкарбамоилметильную группу,
3-метилфенилкарбамоилметильную группу,
4-метилфенилкарбамоилметильную группу,
2,3-диметилфенилкарбамоилметильную группу,
2,4-диметилфенилкарбамоилметильную группу,
2,6-диметилфенилкарбамоилметильную группу,
2,4,6-триметилфенилкарбамоилметильную группу,
2-трифторметилфенилкарбамоилметильную группу,
3-трифторметилфенилкарбамоилметильную группу,
4-трифторметилфенилкарбамоилметильную группу,
2,3-дитрифторметилфенилкарбамоилметильную группу,
2,4-дитрифторметилфенилкарбамоилметильную группу,
2,6-дитрифторметилфенилкарбамоилметильную группу,
2-пентафторэтилфенилкарбамоилметильную группу,
3-пентафторэтилфенилкарбамоилметильную группу,
4-пентафторэтилфенилкарбамоилметильную группу,
2-(н-пропилфенил)карбамоилметильную группу,
3-(н-пропилфенил)карбамоилметильную группу,
4-(н-пропилфенил)карбамоилметильную группу,
2-(фенилкарбамоил)этильную группу,
2-(3-трифторметилфенилкарбамоил)этильную группу,
2-(4-трифторметилфенилкарбамоил)этильную группу,
2-(2,3-дитрифторметилфенилкарбамоил)этильную группу,
2-(2,4-дитрифторметилфенилкарбамоил)этильную группу,
2-(2,6-дитрифторметилфенилкарбамоил)этильную группу,
2-(2-пентафторэтилфенилкарбамоил)этильную группу,
2-(3-пентафторэтилфенилкарбамоил)этильную группу,
2-(4-пентафторэтилфенилкарбамоил)этильную группу,
3-(фенилкарбамоил)пропильную группу,
3-(3-трифторметилфенилкарбамоил)пропильную группу,
3-(4-трифторметилфенилкарбамоил)пропильную группу,
3-(2,3-дитрифторметилфенилкарбамоил)пропильную группу,
3-(2,4-дитрифторметилфенилкарбамоил)пропильную группу,
3-(2,6-дитрифторметилфенилкарбамоил)пропильную группу,
3-(2-пентафторэтилфенилкарбамоил)пропильную группу,
3-(3-пентафторэтилфенилкарбамоил)пропильную группу,
3-(4-пентафторэтилфенилкарбамоил)пропильную группу,
4-(4-трифторметилфенилкарбамоил)бутильную группу,
5-(4-трифторметилфенилкарбамоил)пентильную группу,
6-(4-трифторметилфенилкарбамоил)гексильную группу или тому подобное.
Тиазолил-С1-6алкильная группа (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы) включает тиазолил-С1-6алкильную группу (которая может быть замещена в тиазольном кольце 1-2 группами, выбранными из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы), например 4-тиазолилметильную группу,
5-тиазолилметильную группу, 2-метил-4-тиазолилметильную группу,
2-метил-5-тиазолилметильную группу,
2,5-диметил-4-тиазолилметильную группу,
2,4-диметил-5-тиазолилметильную группу,
2-метил-5-фенил-4-тиазолилметильную группу,
2-метил-4-фенил-5-тиазолилметильную группу,
2-фенил-4-тиазолилметильную группу,
2-фенил-5-тиазолилметильную группу,
2-фенил-5-метил-4-тиазолилметильную группу,
2-фенил-4-метил-5-тиазолилметильную группу,
2-метил-5-(2-фторфенил)-4-тиазолилметильную группу,
2-метил-4-(2-фторфенил)-5-тиазолилметильную группу,
2-(2-хлорфенил)-4-тиазолилметильную группу,
2-(2-бромфенил)-5-тиазолилметильную группу,
2-(2-фторфенил)-5-метил-4-тиазолилметильную группу,
2-(2-фторфенил)-4-метил-5-тиазолилметильную группу,
2-метил-5-(3-иодфенил)-4-тиазолилметильную группу,
2-метил-4-(3-фторфенил)-5-тиазолилметильную группу,
2-(2,3-дифторфенил)-4-тиазолилметильную группу,
2-(3-фторфенил)-5-тиазолилметильную группу,
2-(3-фторфенил)-5-метил-4-тиазолилметильную группу,
2-(3-фторфенил)-4-метил-5-тиазолилметильную группу,
2-метил-5-(2,4,6-трихлорфенил)-4-тиазолилметильную группу,
2-метил-4-(2,3,4,5,6-пентафторфенил)-5-тиазолилметильную группу,
2-(4-фторфенил)-4-тиазолилметильную группу,
4-(2-фторфенил)-5-тиазолилметильную группу,
2-(4-фторфенил)-5-метил-4-тиазолилметильную группу,
2-(4-фторфенил)-4-метил-5-тиазолилметильную группу,
2-метил-5-(2-хлорфенил)-4-тиазолилметильную группу,
2-метил-4-(2-хлорфенил)-5-тиазолилметильную группу,
2-(2-хлорфенил)-4-тиазолилметильную группу,
2-(2-хлорфенил)-5-тиазолилметильную группу,
2-(2-хлорфенил)-5-метил-4-тиазолилметильную группу,
2-(2-хлорфенил)-4-метил-5-тиазолилметильную группу,
2-метил-5-(3-хлорфенил)-4-тиазолилметильную группу,
2-метил-4-(3-хлорфенил)-5-тиазолилметильную группу,
2-(3-хлорфенил)-4-тиазолилметильную группу,
2-(2-фторфенил)-5-тиазолилметильную группу,
2-(3-хлорфенил)-5-метил-4-тиазолилметильную группу,
2-(3-хлорфенил)-4-метил-5-тиазолилметильную группу,
2-метил-5-(4-хлорфенил)-4-тиазолилметильную группу,
2-метил-4-(4-хлорфенил)-5-тиазолилметильную группу,
2-(4-хлорфенил)-4-тиазолилметильную группу,
2-(4-хлорфенил)-5-тиазолилметильную группу,
2-(4-хлорфенил)-5-метил-4-тиазолилметильную группу,
2-(4-хлорфенил)-4-метил-5-тиазолилметильную группу,
2-(2-тиазолил)этильную группу, 2-(4-тиазолил)этильную группу,
2-(5-тиазолил)этильную группу,
2-(2-метил-4-тиазолил)этильную группу,
2-(2-метил-5-тиазолил)этильную группу,
2-(2,5-диметил-4-тиазолил)этильную группу,
2-(2,4-диметил-5-тиазолил)этильную группу,
2-(2-метил-5-фенил-4-тиазолил)этильную группу,
2-(2-метил-4-фенил-5-тиазолил)этильную группу,
2-(2-фенил-4-тиазолил)этильную группу,
2-(2-фенил-5-тиазолил)этильную группу,
2-(2-фенил-5-метил-4-тиазолил)этильную группу,
3-(2-тиазолил)пропильную группу,
2-(4-тиазолил)пропильную группу,
3-(5-тиазолил)пропильную группу,
3-(2-метил-4-тиазолил)пропильную группу,
2-(2-метил-5-тиазолил)пропильную группу,
3-(2,5-диметил-4-тиазолил)пропильную группу,
3-(2,4-диметил-5-тиазолил)пропильную группу,
3-(2-метил-5-фенил-4-тиазолил)пропильную группу,
3-(2-метил-4-фенил-5-тиазолил)пропильную группу,
2-(2-фенил-4-тиазолил)пропильную группу,
3-(3-фенил-5-тиазолил)пропильную группу,
3-(2-фенил-5-метил-4-тиазолил)пропильную группу,
4-(2-тиазолил)бутильную группу, 4-(4-тиазолил)бутильную группу,
3-(5-тиазолил)бутильную группу,
4-(2-метил-4-тиазолил)бутильную группу,
4-(2-метил-5-тиазолил)бутильную группу,
4-(2,5-диметил-4-тиазолил)бутильную группу,
4-(2,4-диметил-5-тиазолил)бутильную группу,
4-(2-метил-5-фенил-4-тиазолил)бутильную группу,
4-(2-метил-4-фенил-5-тиазолил)бутильную группу,
4-(2-фенил-4-тиазолил)бутильную группу,
4-фенил-5-тиазолил)бутильную группу,
4-(2-фенил-5-метил-4-тиазолил)бутильную группу,
5-(2-тиазолил)пентильную группу,
5-(4-тиазолил)пентильную группу,
5-(5-тиазолил)пентильную группу,
5-(2-метил-4-тиазолил)пентильную группу,
5-(2-метил-5-тиазолил)пентильную группу,
5-(2,5-диметил-4-тиазолил)пентильную группу,
5-(2,4-диметил-5-тиазолил)пентильную группу,
5-(2-метил-5-фенил-4-тиазолил)пентильную группу,
5-(2-метил-4-фенил-5-тиазолил)пентильную группу,
5-(2-фенил-4-тиазолил)пентильную группу,
5-(4-фенил-5-тиазолил)пентильную группу,
5-(2-фенил-5-метил-4-тиазолил)пентильную группу,
5-(2-тиазолил)гексильную группу,
5-(4-тиазолил)гексильную группу,
5-(5-тиазолил)гексильную группу,
5-(2-метил-4-тиазолил)гексильную группу,
5-(2-метил-5-тиазолил)гексильную группу,
5-(2,5-диметил-4-тиазолил)гексильную группу,
5-(2,4-диметил-5-тиазолил)гексильную группу,
5-(2-метил-5-фенил-4-тиазолил)гексильную группу,
5-(2-метил-4-фенил-5-тиазолил)гексильную группу,
5-(2-фенил-4-тиазолил)гексильную группу,
5-(4-фенил-5-тиазолил)гексильную группу,
5-(2-фенил-5-метил-4-тиазолил)гексильную группу или тому подобное.
Оксазолил-С1-6алкильная группа (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы) включает оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце 1-2 группами, выбранными из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы), например 4-оксазолилметильную группу,
5-оксазолилметильную группу,
2-метил-4-оксазолилметильную группу,
2-метил-5-оксазолилметильную группу,
2,5-диметил-4-оксазолилметильную группу,
2,5-дифенил-4-оксазолилметильную группу,
2,4-диметил-5-оксазолилметильную группу,
2-метил-5-фенил-4-оксазолилметильную группу,
2-метил-4-фенил-5-оксазолилметильную группу,
2-фенил-4-оксазолилметильную группу,
2-фенил-5-оксазолилметильную группу,
2-фенил-5-метил-4-оксазолилметильную группу,
2-фенил-4-метил-5-оксазолилметильную группу,
2-метил-5-(2,3,4,5,6-пентафторфенил)-4-оксазолилметильную группу,
2-метил-4-(2-фторфенил)-5-оксазолилметильную группу,
2-(2,4-дифторфенил)-4-оксазолилметильную группу,
2-(2-фторфенил)-5-оксазолилметильную группу,
2-(2-фторфенил)-5-метил-4-оксазолилметильную группу,
2-(2-фторфенил)-4-метил-5-оксазолилметильную группу,
2-метил-5-(3-фторфенил)-4-оксазолилметильную группу,
2-метил-4-(3-фторфенил)-5-оксазолилметильную группу,
2-(3-фторфенил)-4-оксазолилметильную группу,
2-(3-фторфенил)-5-оксазолилметильную группу,
2-(3-фторфенил)-5-метил-4-оксазолилметильную группу,
2-(3-фторфенил)-4-метил-5-оксазолилметильную группу,
2-метил-5-(4-фторфенил)-4-оксазолилметильную группу,
2-метил-4-(4-фторфенил)-5-оксазолилметильную группу,
2-(4-фторфенил)-4-оксазолилметильную группу,
2-(4-фторфенил)-5-оксазолилметильную группу,
2-(4-фторфенил)-5-метил-4-оксазолилметильную группу,
2-(4-бромфенил)-4-метил-5-оксазолилметильную группу,
2-метил-5-(2-хлорфенил)-4-оксазолилметильную группу,
2-метил-4-(2-хлорфенил)-5-оксазолилметильную группу,
2-(2-хлорфенил)-4-оксазолилметильную группу,
2-(2-иодфенил)-5-оксазолилметильную группу,
2-(2-хлорфенил)-5-метил-4-оксазолилметильную группу,
2-(2-хлорфенил)-4-метил-5-оксазолилметильную группу,
2-метил-5-(3-хлорфенил)-4-оксазолилметильную группу,
2-метил-4-(3-хлорфенил)-5-оксазолилметильную группу,
2-(3-хлорфенил)-4-оксазолилметильную группу,
2-(2,4,6-трихлорфенил)-5-оксазолилметильную группу,
2-(3-хлорфенил)-5-метил-4-оксазолилметильную группу,
2-(3-хлорфенил)-4-метил-5-оксазолилметильную группу,
2-метил-5-(4-хлорфенил)-4-оксазолилметильную группу,
2-метил-4-(4-хлорфенил)-5-оксазолилметильную группу,
2-(4-хлорфенил)-4-оксазолилметильную группу,
2-(4-хлорфенил)-5-оксазолилметильную группу,
2-(4-хлорфенил)-5-метил-4-оксазолилметильную группу,
2-(4-хлорфенил)-4-метил-5-оксазолилметильную группу,
2-(4-оксазолил)этильную группу, 2-(5-оксазолил)этильную группу,
2-(2-метил-4-оксазолил)этильную группу,
2-(2-метил-5-оксазолил)этильную группу,
2-(2-фенил-5-метил-4-оксазолил)этильную группу,
2-[2-(4-хлорфенил)-5-метил-4-оксазолил]этильную группу,
3-(4-оксазолил)пропильную группу,
3-(5-оксазолил)пропильную группу,
3-(2-метил-4-оксазолил)пропильную группу,
3-(2-метил-5-оксазолил)пропильную группу,
3-(2-фенил-5-метил-4-оксазолил)пропильную группу,
3-[2-(4-хлорфенил)-5-метил-4-оксазолил]пропильную группу,
4-(4-оксазолил)бутильную группу,
4-(5-оксазолил)бутильную группу,
4-(2-метил-4-оксазолил)бутильную группу,
4-(2-метил-5-оксазолил)бутильную группу,
4-(2-фенил-5-метил-4-оксазолил)бутильную группу,
4-[2-(4-хлорфенил)-5-метил-4-оксазолил]бутильную группу,
5-(4-оксазолил)пентильную группу,
5-(5-оксазолил)пентильную группу,
5-(2-метил-4-оксазолил)пентильную группу,
5-(2-метил-5-оксазолил)пентильную группу,
5-(2-фенил-5-метил-4-оксазолил)пентильную группу,
5-[2-(4-хлорфенил)-5-метил-4-оксазолил]пентильную группу,
6-(4-оксазолил)гексильную группу,
6-(5-оксазолил)гексильную группу,
6-(2-метил-4-оксазолил)гексильную группу,
6-(2-метил-5-оксазолил)гексильную группу,
6-(2-фенил-5-метил-4-оксазолил)гексильную группу,
6-[2-(4-хлорфенил)-6-метил-4-оксазолил]гексильную группу или тому подобное.
Примеры индолил-С1-6алкильной группы включают
индолин-1-илметильную группу, индолин-2-илметильную группу,
индолин-3-илметильную группу, индолин-4-илметильную группу,
индолин-5-илметильную группу, индолин-6-илметильную группу,
индолин-7-илметильную группу, 2-(индолин-3-ил)этильную группу,
3-(индолин-3-ил)пропильную группу,
4-(индолин-3-ил)бутильную группу,
5-(индолин-3-ил)пентильную группу,
6-(индолин-3-ил)гексильную группу,
2-(индолин-4-ил)этильную группу,
3-(индолин-4-ил)пропильную группу,
4-(индолин-4-ил)бутильную группу,
5-(индолин-4-ил)пентильную группу,
6-(индолин-4-ил)гексильную группу,
2-(индолин-5-ил)этильную группу,
3-(индолин-5-ил)пропильную группу,
4-(индолин-5-ил)бутильную группу,
5-(индолин-5-ил)пентильную группу,
6-(индолин-5-ил)гексильную группу,
2-(индолин-6-ил)этильную группу,
3-(индолин-6-ил)пропильную группу,
4-(индолин-6-ил)бутильную группу,
5-(индолин-6-ил)пентильную группу,
6-(индолин-6-ил)гексильную группу,
2-(индолин-7-ил)этильную группу,
3-(индолин-7-ил)пропильную группу,
4-(индолин-7-ил)бутильную группу,
5-(индолин-7-ил)пентильную группу,
6-(индолин-7-ил)гексильную группу или тому подобное.
Фурил-С1-6алкильная группа (которая может быть замещена в фурановом кольце по крайней мере одной галогензамещенной или незамещенной фенильной группой) включает фурил-С1-6алкильную группу (которая может быть замещена в фурановом кольце 1-3 галогензамещенными или незамещенными фенильными группами), например 2-фурилметильную группу, 1-(3-фурил)этильную группу,
2-(2-фурил)этильную группу, 3-(3-фурил)пропильную группу,
4-(3-фурил)бутильную группу, 5-(2-фурил)пентильную группу,
6-(2-фурил)гексильную группу,
2-метил-3-(3-фурил)пропильную группу,
1,1-диметил-2-(2-фурил)этильную группу,
3,4-дифенил-2-фурилметильную группу,
3,4,5-трифенил-2-фурилметильную группу,
5-фенил-2-фурилметильную группу,
5-(2-фторфенил)-2-фурилметильную группу,
5-(3-фторфенил)-2-фурилметильную группу,
5-(4-фторфенил)-2-фурилметильную группу,
5-(2-хлорфенил)-2-фурилметильную группу,
5-(3-хлорфенил)-2-фурилметильную группу,
5-(4-хлорфенил)-2-фурилметильную группу,
5-(2-бромфенил)-2-фурилметильную группу,
5-(3-бромфенил)-2-фурилметильную группу,
5-(4-бромфенил)-2-фурилметильную группу,
4-фенил-2-фурилметильную группу,
4-(2,3,4,5,6-пентафторфенил)-2-фурилметильную группу,
4-(3,4-дифторфенил)-2-фурилметильную группу,
4-(4-иодфенил)-2-фурилметильную группу,
4-(2,3-дихлорфенил)-2-фурилметильную группу,
4-(3-хлорфенил)-2-фурилметильную группу,
4-(2,4,6-трихлорфенил)-2-фурилметильную группу,
4-(2-бромфенил-2-фурилметильную группу,
4-(3-бромфенил)-2-фурилметильную группу,
4-(4-бромфенил)-2-фурилметильную группу,
5-фенил-2-фурилметильную группу, 2-(2-фурил)этильную группу,
3-(2-фурил)пропильную группу, 4-(2-фурил)бутильную группу,
5-(2-фурил)пентильную группу, 6-(2-фурил)гексильную группу,
2-[5-(4-хлорфенил)-2-фурил]этильную группу,
3-[5-(4-хлорфенил)-2-фурил]пропильную группу,
4-[5-(4-хлорфенил)-2-фурил]бутильную группу,
5-(2-фурил)пентильную группу,
6-[5-(4-хлорфенил)-2-фурил]гексильную группу или тому подобное.
Имидазолил-С1-6алкильная группа (которая может быть замещена в имидазольном кольце фенильной группой) включает имидазолил-С1-6алкильную группу (которая может быть замещена в имидазольном кольце 1-2 фенильными группами), например
4-имидазолилметильную группу, 2-(4-имидазолил)этильную группу,
3-(2-имидазолил)пропильную группу,
4-(1-имидазолил)бутильную группу,
5-(5-имидазолил)пентильную группу,
6-(4-имидазолил)гексильную группу,
2,5-дифенил-1-имидазолилметильную группу,
2-фенил-4-имидазолилметильную группу,
2-(2-фенил-4-имидазолил)этильную группу,
3-(2-фенил-4-имидазолил)пропильную группу,
4-(2-фенил-5-имидазолил)бутильную группу,
5-(2-фенил-4-имидазолил)пентильную группу,
6-(2-фенил-4-имидазолил)гексильную группу или тому подобное.
Примеры хинолил-С1-6алкильной группы включают
4-хинолилметильную группу, 2-(4-хинолил)этильную группу,
3-(4-хинолил)пропильную группу, 4-(4-хинолил)бутильную группу,
5-(4-хинолил)пентильную группу, 6-(4-хинолил)гексильную группу,
5-хинолилметильную группу, 2-(5-хинолил)этильную группу,
3-(5-хинолил)пропильную группу, 4-(5-хинолил)бутильную группу,
5-(5-хинолил)пентильную группу, 6-(5-хинолил)гексильную группу,
6-хинолилметильную группу, 2-(6-хинолил)этильную группу,
3-(6-хинолил)пропильную группу, 4-(6-хинолил)бутильную группу,
5-(6-хинолил)пентильную группу, 6-(6-хинолил)гексильную группу,
7-хинолилметильную группу, 2-(7-хинолил)этильную группу,
3-(7-хинолил)пропильную группу, 4-(7-хинолил)бутильную группу,
5-(7-хинолил)пентильную группу, 6-(7-хинолил)гексильную группу,
8-хинолилметильную группу, 2-(8-хинолил)этильную группу,
3-(8-хинолил)пропильную группу, 4-(8-хинолил)бутильную группу,
5-(8-хинолил)пентильную группу, 6-(8-хинолил)гексильную группу
или тому подобное.
Примеры тетразолильной группы (которая может быть замещена в тетразольном кольце фенильной группой) включают 5-(1H)-тетразолильную группу и 1-фенил-5-(1H)-тетразолильную группу.
Примеры пиримидильной группы, которая может быть замещена фенильной группой, включают 2-пиримидильную группу,
3-пиримидильную группу, 4-пиримидильную группу,
4-фенил-2-пиримидильную группу, 2-фенил-4-пиримидильную группу,
4,6-дифенил-2-пиримидильную группу или тому подобное.
Примеры бензоксазолильной группы включают
2-бензоксазолильную группу, 4-бензоксазолильную группу,
5-бензоксазолильную группу, 6-бензоксазолильную группу,
7-бензоксазолильную группу или тому подобное.
Примеры бензотиазолильной группы включают бензотиазол-2-ильную группу, бензотиазол-4-ильную группу, бензотиазол-5-ильную группу, бензотиазол-6-ильную группу, бензотиазол-7-ильную группу или тому подобное.
Фенокси-С1-6алканоильная группа, которая может быть замещена в фенильном кольце атомом галогена, включает фенокси-С1-6алканоильную группу, которая может быть замещена в фенильном кольце 1-5 атомами галогена, например феноксиацетильную группу, 3-феноксипропионильную группу, 4-феноксибутирильную группу,
5-феноксипентаноильную группу, 6-феноксигексаноильную группу,
4-(4-хлорфенокси)бутирильную группу,
5-(4-хлорфенокси)пентаноильную группу,
6-(4-хлорфенокси)гексаноильную группу,
2-фторфеноксиацетильную группу, 3-фторфеноксиацетильную группу,
4-фторфеноксиацетильную группу, 2-хлорфеноксиацетильную группу,
3-хлорфеноксиацетильную группу, 4-хлорфеноксиацетильную группу,
4-бромфеноксиацетильную группу,
2,3-дифторфеноксиацетильную группу,
2-фтор-4-хлорфеноксиацетильную группу,
3,5-дифторфеноксиацетильную группу,
2,3,4,5,6-пентафторфеноксиацетильную группу,
2,4,6-трихлорфеноксиацетильную группу,
3-(2-фторфенокси)пропионильную группу,
3-(3-фторфенокси)пропионильную группу,
3-(4-фторфенокси)пропионильную группу,
3-(2-хлорфенокси)пропионильную группу,
3-(3-хлорфенокси)пропионильную группу,
3-(4-хлорфенокси)пропионильную группу,
3-(4-бромфенокси)пропионильную группу,
3-(2,3-дифторфенокси)пропионильную группу,
3-(2-фтор-4-хлорфенокси)пропионильную группу,
3-(3,5-дифторфенокси)пропионильную группу или тому подобное.
Фенилтио-С1-6алканоильная группа, которая может быть замещена атомом галогена, представляет собой группу, содержащую 1-5 галогензамещенных или незамещенных фенилтиогрупп и С1-6алканоильную группу, примеры которой включают фенилтиоацетильную группу, 3-фенилтиопропионильную группу,
4-фенилтиобутирильную группу, 5-фенилтиопентаноильную группу,
6-фенилтиогексаноильную группу,
4-(4-хлорфенил)тиобутирильную группу,
5-(4-хлорфенил)тиопентаноильную группу,
6-(4-хлорфенил)тиогексаноильную группу,
2-фторфенилтиоацетильную группу,
3-фторфенилтиоацетильную группу,
4-фторфенилтиоацетильную группу,
2-хлорфенилтиоацетильную группу,
2,4-дихлорфенилтиоацетильную группу,
2,4,6-трихлорфенилтиоацетильную группу,
2,3,4,5,6-пентафторфенилтиоацетильную группу,
3-хлорфенилтиоацетильную группу,
4-хлорфенилтиоацетильную группу,
4-бромфенилтиоацетильную группу,
2,3-дифторфенилтиоацетильную группу,
2-фтор-4-хлорфенилтиоацетильную группу,
3,5-дифторфенилтиоацетильную группу,
3-(2-фторфенил)тиопропионильную группу,
3-(3-фторфенил)тиопропионильную группу,
3-(4-фторфенил)тиопропионильную группу,
3-(2-хлорфенил)тиопропионильную группу,
3-(3-хлорфенил)тиопропионильную группу,
3-(4-хлорфенил)тиопропионильную группу,
3-(4-бромфенил)тиопропионильную группу,
3-(2,3-дифторфенил)тиопропионильную группу,
3-(2-фтор-4-хлорфенил)тиопропионильную группу,
3-(3,5-дифторфенил)тиопропионильную группу или тому подобное.
Бензоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя) включает бензоильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать 1-2 С1-6алкильные группы в качестве заместителя), например бензоильную группу, 2-фторбензоильную группу,
3-фторбензоильную группу,
4-фторбензоильную группу, 2,3-дифторбензоильную группу,
3,4-дифторбензоильную группу, 2-хлорбензоильную группу,
3-хлорбензоильную группу, 4-хлорбензоильную группу,
2,3-дихлорбензоильную группу, 3,4-дихлорбензоильную группу,
2,4,6-трихлорбензоильную группу, 4-иодбензоильную группу,
2,3,4,5,6-пентафторбензоильную группу, 2-бромбензоильную группу,
3-бромбензоильную группу, 4-бромбензоильную группу,
2,3-дибромбензоильную группу, 3,4-дибромбензоильную группу,
2-метилбензоильную группу, 3-метилбензоильную группу,
4-метилбензоильную группу, 2,3-диметилбензоильную группу,
3,4-диметилбензоильную группу, 3,4,5-триметилбензоильную группу,
2-трифторметилбензоильную группу,
3-трифторметилбензоильную группу,
4-трифторметилбензоильную группу,
2,3-дитрифторметилбензоильную группу,
3,4-дитрифторметилбензоильную группу,
2-метоксибензоильную группу, 3-метоксибензоильную группу,
4-метоксибензоильную группу, 3,4-диметоксибензоильную группу,
2,4,6-триметоксибензоильную группу,
2-трифторметоксибензоильную группу,
3-трифторметоксибензоильную группу,
4-трифторметоксибензоильную группу, 2-аминобензоильную группу,
3-аминобензоильную группу, 4-аминобензоильную группу,
2-метиламинобензоильную группу, 3-метиламинобензоильную группу,
4-метиламинобензоильную группу, 2-этиламинобензоильную группу,
3-этиламинобензоильную группу, 4-этиламинобензоильную группу,
2-пропиламинобензоильную группу,
3-пропиламинобензоильную группу,
4-пропиламинобензоильную группу, 4-бутиламинобензоильную группу,
4-пентиламинобензоильную группу,
4-гексиламинобензоильную группу,
2-диметиламинобензоильную группу,
3-диметиламинобензоильную группу,
4-диметиламинобензоильную группу,
2-диэтиламинобензоильную группу,
3-диэтиламинобензоильную группу,
4-диэтиламинобензоильную группу,
2-дипропиламинобензоильную группу,
3-дипропиламинобензоильную группу,
4-дипропиламинобензоильную группу,
4-дибутиламинобензоильную группу,
4-дипентиламинобензоильную группу,
4-дигексиламинобензоильную группу или тому подобное.
Примеры бифенилилкарбонильной группы включают 2-бифенилилкарбонильную группу, 3-бифенилилкарбонильную группу, 4-бифенилилкарбонильную группу или тому подобное.
Примеры пиридилкарбонильной группы включают 2-пиридилкарбонильную группу, 3-пиридилкарбонильную группу, 4-пиридилкарбонильную группу или тому подобное.
Примеры фенил-С2-6алкенилоксикарбонильной группы, которая может быть замещена в фенильном кольце атомом галогена, включают фенил-С2-6алкенилоксикарбонильную группу, которая может быть замещена в фенильном кольце 1-5 атомами галогена, например 3-фенил-2-пропенилкарбонильную группу (тривиальное название: циннамоильная группа), 4-фенил-2-бутенилкарбонильную группу,
4-фенил-3-бутенилкарбонильную группу,
5-фенил-2-пентенилкарбонильную группу,
5-фенил-4-пентенилкарбонильную группу,
5-фенил-3-пентенилкарбонильную группу,
6-фенил-5-гексенилкарбонильную группу,
6-фенил-4-пентенилкарбонильную группу,
6-фенил-3-гексенилкарбонильную группу,
4-фенил-1,3-бутадиенилкарбонильную группу,
6-фенил-1,3,5-гексатриенилкарбонильную группу,
3-(2-фторфенил)-2-пропенилкарбонильную группу (которая имеет также тривиальное название 2-фторциннамоильная группа),
3-(3-фторфенил)-2-пропенилкарбонильную группу,
3-(4-фторфенил)-2-пропенилкарбонильную группу,
2,4-дифторциннамоильную группу,
3-(2,5-дифторфенил)-2-пропенилкарбонильную группу,
3-(3,5-дифторфенил)-2-пропенилкарбонильную группу,
3-(3,4-дифторфенил)-2-пропенилкарбонильную группу,
3-(2,3,4,5,6-пентафторфенил)-2-пропенилкарбонильную группу,
3-(2-хлорфенил)-2-пропенилкарбонильную группу,
3-(3-хлорфенил)-2-пропенилкарбонильную группу,
3-(4-хлорфенил)-2-пропенилкарбонильную группу,
3-(2,4-дихлорфенил)-2-пропенилкарбонильную группу,
3-(2,5-дихлорфенил)-2-пропенилкарбонильную группу,
3-(3,5-дихлорфенил)-2-пропенилкарбонильную группу,
3-(3,4-дихлорфенил)-2-пропенилкарбонильную группу,
3-(2,4,6-трихлорфенил)-2-пропенилкарбонильную группу,
3-(2-бромфенил)-2-пропенилкарбонильную группу,
3-(3-бромфенил)-2-пропенилкарбонильную группу,
3-(4-бромфенил)-2-пропенилкарбонильную группу,
3-(2,4-дибромфенил)-2-пропенилкарбонильную группу,
3-(2,5-дибромфенил)-2-пропенилкарбонильную группу,
3-(3,5-дибромфенил)-2-пропенилкарбонильную группу,
3-(3,4-дибромфенил)-2-пропенилкарбонильную группу или тому подобное.
Фенил-С1-6алкилсульфонильная группа, которая может быть замещена в фенильном кольце атомами галогена, представляет собой группу, содержащую определенную выше фенил-С1-6алкильную группу, которая может быть замещена в фенильном кольце 1-5 атомами галогена, и сульфонильную группу, примеры которой включают бензилсульфонильную группу, фенетилсульфонильную группу,
3-фенилпропилсульфонильную группу,
4-фенилбутилсульфонильную группу,
5-фенилпентилсульфонильную группу,
6-фенилгексилсульфонильную группу,
2-фторбензилсульфонильную группу,
3-фторбензилсульфонильную группу,
4-фторбензилсульфонильную группу,
2-хлорбензилсульфонильную группу,
3-хлорбензилсульфонильную группу,
4-хлорбензилсульфонильную группу,
2,3-дихлорбензилсульфонильную группу,
3,4-дихлорбензилсульфонильную группу,
3,5-дихлорбензилсульфонильную группу,
2,4-дихлорбензилсульфонильную группу,
3,4,5-трифторбензилсульфонильную группу,
2,3,4,5,6-пентафторбензилсульфонильную группу,
2-(2-фтор)фенетилсульфонильную группу,
2-(3-фтор)фенетилсульфонильную группу,
2-(4-фтор)фенетилсульфонильную группу,
2-(2-хлор)фенетилсульфонильную группу,
2-(3-хлор)фенетилсульфонильную группу,
2-(4-хлор)фенетилсульфонильную группу,
2-(2,3-дихлор)фенетилсульфонильную группу,
2-(3,4-дихлор)фенетилсульфонильную группу,
2-(3,5-дихлор)фенетилсульфонильную группу,
2-(2,4-дихлор)фенетилсульфонильную группу,
2-(3,4,5-трифтор)фенетилсульфонильную группу,
3-(2-фторфенил)пропилсульфонильную группу,
3-(3-фторфенил)пропилсульфонильную группу,
3-(4-фторфенил)пропилсульфонильную группу,
3-(2-хлорфенил)пропилсульфонильную группу,
3-(3-хлорфенил)пропилсульфонильную группу,
3-(4-хлорфенил)пропилсульфонильную группу,
2-(2,3-дихлорфенил)пропилсульфонильную группу,
3-(3,4-дихлорфенил)пропилсульфонильную группу,
3-(3,5-дихлорфенил)пропилсульфонильную группу,
3-(2,4-дихлорфенил)пропилсульфонильную группу,
3-(3,4,5-трифторфенил)пропилсульфонильную группу или тому подобное.
Галогензамещенная или незамещенная С1-8алкильная группа включает С1-8алкильную группу, незамещенную или замещенную 1-7 атомами галогена, например метильную группу, этильную группу,
н-пропильную группу, изопропильную группу, н-бутильную группу,
изобутильную группу, трет-бутильную группу, втор-бутильную группа, н-пентильную группу, неопентильную группу,
3-метилпентильную группу, н-гексильную группу,
изогексильную группу, 1,3,5-триметилгексильную группу,
н-гептильную группу, 6-метилгептильную группу,
1-метилгептильную группу, н-октильную группу,
фторметильную группу, дифторметильную группу,
трифторметильную группу, хлорметильную группу,
дихлорметильную группу, трихлорметильную группу,
бромметильную группу, дибромметильную группу,
дихлорфторметильную группу, 2,2,2-трифторэтильную группу,
пентафторэтильную группу, 2-хлорэтильную группу,
3,3,3-трифторпропильную группу, гептафторпропильную группу,
гептафторизопропильную группу, 3-хлорпропильную группу,
2-хлорпропильную группу, 3-бромпропильную группу,
4,4,4-трифторбутильную группу,
4,4,4,3,3-пентафторбутильную группу, 4-хлорбутильную группу,
4-бромбутильную группу, 2-хлорбутильную группу,
5,5,5-трифторпентильную группу, 5-хлорпентильную группу,
6,6,6-трифторгексильную группу, 6-хлоргексильную группу,
7-хлоргептильную группу, 8-хлороктильную группу или тому подобное.
Амино-С1-6алкильная группа, которая может содержать С1-6алкильную группу, включает амино-С1-6алкильную группу, которая может содержать 1-2алкильные группы, например аминометильную группу, 2-аминоэтильную группу, 1-аминоэтильную группу,
3-аминопропильную группу, 4-аминобутильную группу,
5-аминопентильную группу, 6-аминогексильную группу,
2-метил-3-аминопропильную группу,
1,1-диметил-2-аминоэтильную группу, этиламинометильную группу,
1-(пропиламино)этильную группу, 2-(метиламино)этильную группу,
3-(изопропиламино)пропильную группу,
4-(н-бутиламино)бутильную группу,
5-(н-пентиламино)пентильную группу,
6-(н-гексиламино)гексильную группу,
диметиламинометильную группу,
(N-метил-N-пропиламино)метильную группу,
2-(N-метил-N-гексиламино)этильную группу или тому подобное.
Примеры фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-5 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, галогензамещенной или незамещенной С1-6алкилтиогруппы, фенил-С1-6алкоксигруппы, гидроксигруппы; С1-6алкилсульфинильной группы, С1-6алкилсульфонильной группы, С1-6алкилсульфонилоксигруппы, цианогруппы, С1-6алканоильной группы, бензоильной группы, фенил-С1-6алкильной группы (которая может содержать С1-6алкоксигруппу в алкильной части), аминогруппы, нитрогруппы, карбамоильной группы, С1-6алканоиламиногруппы, С1-6алкоксикарбонильной группы, С1-6алкиламинокарбонильной группы, С1-6алкоксикарбониламиногруппы, три-С1-6алкилсилоксигруппы, пирролильной группы, тетрагидропиранилоксигруппы и имидазолильной группы) включают бензильную группу, 1-фенетильную группу, 2-фенетильную группу, 3-фенилпропильную группу,
2-фенилпропильную группу, 4-фенилбутильную группу,
5-фенилпентильную группу, 4-фенилпентильную группу,
6-фенилгексильную группу, 2-фторбензильную группу,
3-фторбензильную группу, 4-фторбензильную группу,
2-хлорбензильную группу, 3-хлорбензильную группу,
4-хлорбензильную группу, 2-бромбензильную группу,
3-бромбензильную группу, 4-бромбензильную группу,
2-иодбензильную группу, 3-иодбензильную группу,
4-иодбензильную группу, 2,3-дифторбензильную группу,
3,4-дифторбензильную группу, 3,5-дифторбензильную группу,
2,3,4,5,6-пентафторбензильную группу,
2,4-дифторбензильную группу, 2,6-дифторбензильную группу,
2,4,6-трифторбензильную группу, 3,4,5-трифторбензильную группу,
2,3-дихлорбензильную группу, 3,4-дихлорбензильную группу,
3,5-дихлорбензильную группу, 2,4-дихлорбензильную группу,
2,6-дихлорбензильную группу, 2,4,6-трихлорбензильную группу,
3,4,5-трихлорбензильную группу, перфторбензильную группу,
2-дифторметилбензильную группу, 3-дифторметилбензильную группу,
4-дифторметилбензильную группу,
4-хлор-3-дифторметилбензильную группу,
3-хлор-4-дифторметилбензильную группу,
3-бром-4-дифторметилбензильную группу,
3,5-дифтор-4-дифторметилбензильную группу,
2-метилбензильную группу, 3-метилбензильную группу,
4-метилбензильную группу, 2,3-диметилбензильную группу,
2,4,6-триметилбензильную группу,
3,5-дитрифторметилбензильную группу,
2-трифторметилбензильную группу,
3-трифторметилбензильную группу,
4-трифторметилбензильную группу,
4-фтор-3-трифторметилбензильную группу,
3-фтор-4-трифторметилбензильную группу,
2-пентафторэтилбензильную группу,
4-хлор-3-пентафторэтилбензильную группу,
3-хлор-4-пентафторэтилбензильную группу,
2-пентафторэтилбензильную группу,
3-пентафторэтилбензильную группу,
4-пентафторэтилбензильную группу, 2-метоксибензильную группу,
3-метоксибензильную группу, 4-метоксибензильную группу,
2,3-диметоксибензильную группу,
2,4,6-триметоксибензильную группу,
3,5-дитрифторметоксибензильную группу,
2-трифторметоксибензильную группу,
3-трифторметоксибензильную группу,
4-трифторметоксибензильную группу,
4-фтор-3-трифторметоксибензильную группу,
3-фтор-4-трифторметоксибензильную группу,
2-пентафторэтоксибензильную группу,
3-пентафторэтоксибензильную группу,
4-пентафторэтоксибензильную группу,
3-хлор-4-трифторметоксибензильную группу,
3-хлор-4-пентафторэтоксибензильную группу,
2-(2-трифторметилфенил)этильную группу,
2-(3-трифторметилфенил)этильную группу,
2-(4-трифторметилфенил)этильную группу,
2-трифторметоксифенил)этильную группу,
3-трифторметоксифенил)этильную группу,
2-(4-трифторметоксифенил)этильную группу,
2-(2-пентафторэтоксифенил)этильную группу,
2-(3-пентафторэтоксифенил)этильную группу,
2-(4-пентафторэтоксифенил)этильную группу,
3-(2-трифторметилфенил)пропильную группу,
3-(3-трифторметилфенил)пропильную группу,
3-(4-трифторметилфенил)пропильную группу,
3-(2-трифторметоксифенил)пропильную группу,
3-(3-трифторметоксифенил)пропильную группу,
3-(4-трифторметоксифенил)пропильную группу,
3-(3-пентафторэтоксифенил)пропильную группу,
3-(4-пентафторэтоксифенил)пропильную группу,
4-(3-пентафторэтоксифенил)бутильную группу,
5-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметилфенил)пентильную группу,
4-(4-трифторметоксифенил)пентильную группу,
6-(3-трифторметилфенил)гексильную группу,
6-(4-трифторметилфенил)гексильную группу,
6-(4-трифторметоксифенил)гексильную группу,
2-метилтиобензильную группу, 3-метилтиобензильную группу,
4-метилтиобензильную группу, 2,3-диметилтиобензильную группу,
2,4,6-триметилтиобензильную группу,
2-(2-метилтиофенил)этильную группу,
2-(3-метилтиофенил)этильную группу,
2-(4-метилтиофенил)этильную группу,
3-(4-метилтиофенил)пропильную группу,
4-(4-метилтиофенил)бутильную группу,
5-(4-метилтиофенил)пентильную группу,
6-(4-метилтиофенил)гексильную группу,
2-трифторметилтиобензильную группу,
3-трифторметилтиобензильную группу,
4-трифторметилтиобензильную группу,
2-(2-трифторметилтиофенил)этильную группу,
2-(3-трифторметилтиофенил)этильную группу,
2-(4-трифторметилтиофенил)этильную группу,
3-(4-трифторметилтиофенил)пропильную группу,
4-(4-трифторметилтиофенил)бутильную группу,
5-(4-трифторметилтиофенил)пентильную группу,
6-(4-трифторметилтиофенил)гексильную группу,
2-бензилоксибензильную группу, 3-бензилоксибензильную группу,
4-бензилоксибензильную группу,
2-(2-бензилоксифенил)этильную группу,
2-(3-бензилоксифенил)этильную группу,
2-(4-бензилоксифенил)этильную группу,
3-(4-бензилоксифенил)пропильную группу,
4-(4-бензилоксифенил)бутильную группу,
5-(4-бензилоксифенил)пентильную группу,
6-(4-бензилоксифенил)гексильную группу,
2-(2-фенилэтокси)бензильную группу,
3-(2-фенилэтокси)бензильную группу,
4-(2-фенилэтокси)бензильную группу,
2-[2-(2-фенилэтоксифенил)]этильную группу,
2-[3-(2-фенилэтоксифенил)]этильную группу,
2-[4-(2-фенилэтоксифенил)]этильную группу,
3-[4-(2-фенилэтоксифенил)]пропильную группу,
4-[4-(2-фенилэтоксифенил)]бутильную группу,
5-[4-(2-фенилэтоксифенил)]пентильную группу,
6-[4-(2-фенилэтоксифенил)]гексильную группу,
2-(3-фенилпропокси)бензильную группу,
3-(3-фенилпропокси)бензильную группу,
4-(3-фенилпропокси)бензильную группу,
2-(4-фенилбутокси)бензильную группу,
3-(4-фенилбутокси)бензильную группу,
4-(4-фенилбутокси)бензильную группу,
2-метоксикарбонилбензильную группу,
3-метоксикарбонилбензильную группу,
4-метоксикарбонилбензильную группу,
2-(2-метоксикарбонилфенил)этильную группу,
2-(3-метоксикарбонилфенил)этильную группу,
2-(4-метоксикарбонилфенил)этильную группу,
3-(4-метоксикарбонилфенил)пропильную группу,
4-(4-метоксикарбонилфенил)бутильную группу,
5-(4-метоксикарбонилфенил)пентильную группу,
6-(4-метоксикарбонилфенил)гексильную группу,
2-гидроксибензильную группу, 3-гидроксибензильную группу,
4-гидроксибензильную группу, 2,3-дигидроксибензильную группу,
2,4,6-тригидроксибензильную группу,
2-(2-гидроксифенил)этильную группу,
2-(3-гидроксифенил)этильную группу,
2-(4-гидроксифенил)этильную группу,
3-(4-гидроксифенил)пропильную группу,
4-(4-гидроксифенил)бутильную группу,
5-(4-гидроксифенил)пентильную группу,
6-(4-гидроксифенил)гексильную группу,
2-метилсульфинилбензильную группу,
3-метилсульфинилбензильную группу,
4-метилсульфинилбензильную группу,
2,3-диметилсульфинилбензильную группу,
2,4,6-триметилсульфинилбензильную группу,
2-(2-метилсульфинилфенил)этильную группу,
2-(3-метилсульфинилфенил)этильную группу,
2-(4-метилсульфинилфенил)этильную группу,
3-(4-метилсульфинилфенил)пропильную группу,
4-(4-метилсульфинилфенил)бутильную группу,
5-(4-метилсульфинилфенил)пентильную группу,
6-(4-метилсульфинилфенил)гексильную группу,
2-метансульфонилбензильную группу,
3-метансульфонилбензильную группу,
4-метансульфонилбензильную группу,
2,3-диметансульфонилбензильную группу,
2,4,6-триметансульфонилбензильную группу,
2-(2-метансульфонилфенил)этильную группу,
2-(3-метансульфонилфенил)этильную группу,
2-(4-метансульфонилфенил)этильную группу,
3-(4-метансульфонилфенил)пропильную группу,
4-(4-метансульфонилфенил)бутильную группу,
5-(4-метансульфонилфенил)пентильную группу,
6-(4-метансульфонилфенил)гексильную группу,
2-метансульфонилоксибензильную группу,
3-метансульфонилоксибензильную группу,
4-метансульфонилоксибензильную группу,
2,3-диметансульфонилоксибензильную группу,
2,4,6-триметансульфонилоксибензильную группу,
2-(2-метансульфонилоксифенил)этильную группу,
2-(3-метансульфонилоксифенил)этильную группу,
2-(4-метансульфонилоксифенил)этильную группу,
3-(4-метансульфонилоксифенил)пропильную группу,
4-(4-метансульфонилоксифенил)бутильную группу,
5-(4-метансульфонилоксифенил)пентильную группу,
6-(4-метансульфонилоксифенил)гексильную группу,
2-цианобензильную группу, 3-цианобензильную группу,
4-цианобензильную группу, 2,3-дицианобензильную группу,
2,4,6-трицианобензильную группу,
2-(2-цианофенил)этильную группу,
2-(3-цианофенил)этильную группу,
2-(4-цианофенил)этильную группу,
3-(4-цианофенил)пропильную группу,
4-(4-цианофенил)бутильную группу,
5-(4-цианофенил)пентильную группу,
6-(4-цианофенил)гексильную группу, 2-ацетилбензильную группу,
3-ацетилбензильную группу, 4-ацетилбензильную группу,
2-(2-ацетилфенил)этильную группу,
2-(3-ацетилфенил)этильную группу,
2-(4-ацетилфенил)этильную группу,
3-(4-ацетилфенил)пропильную группу,
4-(4-ацетилфенил)бутильную группу,
5-(4-ацетилфенил)пентильную группу,
6-(4-ацетилфенил)гексильную группу,
2-бензоилбензильную группу, 3-бензоилбензильную группу,
4-бензоилбензильную группу, 2-(2-бензоилфенил)этильную группу,
2-(3-бензоилфенил)этильную группу,
2-(4-бензоилфенил)этильную группу,
3-(4-бензоилфенил)пропильную группу,
4-(4-бензоилфенил)бутильную группу,
5-(4-бензоилфенил)пентильную группу,
6-(4-бензоилфенил)гексильную группу,
2-α,α-диметоксибензилбензильную группу,
3-α,α-диметоксибензилбензильную группу,
4-α,α-диметоксибензилбензильную группу,
2-(2-α,α-диметоксибензилфенил)этильную группу,
2-(3-(α,α-диметоксибензил)фенил)этильную группу,
2-(4-(α,α-диметоксибензил)фенил)этильную группу,
3-(4-(α,α-диметоксибензил)фенил)пропильную группу,
4-(4-(α,α-диметоксибензил)фенил)бутильную группу,
5-(4-(α,α-диметоксибензил)фенил)пентильную группу,
6-(4-(α,α-диметоксибензил)фенил)гексильную группу,
2-аминобензильную группу, 3-аминобензильную группу,
4-аминобензильную группу, 2,3-диаминобензильную группу,
2,4,6-триаминобензильную группу,
2-(2-аминофенил)этильную группу,
2-(3-аминофенил)этильную группу,
2-(4-аминофенил)этильную группу,
3-(4-аминофенил)пропильную группу,
4-(4-аминофенил)бутильную группу,
5-(4-аминофенил)пентильную группу,
6-(4-аминофенил)гексильную группу, 2-нитробензильную группу,
3-нитробензильную группу, 4-нитробензильную группу,
2,4-динитробензильную группу, 2,4,6-тринитробензильную группу,
2-(2-нитрофенил)этильную группу,
2-(3-нитрофенил)этильную группу,
2-(4-нитрофенил)этильную группу,
3-(4-нитрофенил)пропильную группу,
4-(4-нитрофенил)бутильную группу,
5-(4-нитрофенил)пентильную группу,
6-(4-нитрофенил)гексильную группу, 2-карбамоилбензильную группу,
3-карбамоилбензильную группу, 4-карбамоилбензильную группу,
2-(2-карбамоилфенил)этильную группу,
2-(3-карбамоилфенил)этильную группу,
2-(4-карбамоилфенил)этильную группу,
3-(4-карбамоилфенил)пропильную группу,
4-(4-карбамоилфенил)бутильную группу,
5-(4-карбамоилфенил)пентильную группу,
6-(4-карбамоилфенил)гексильную группу,
2-ацетиламинобензильную группу, 3-ацетиламинобензильную группу,
4-ацетиламинобензильную группу,
2-(2-ацетиламинофенил)этильную группу,
2-(3-ацетиламинофенил)этильную группу,
2-(4-ацетиламинофенил)этильную группу,
3-(4-ацетиламинофенил)пропильную группу,
4-(4-ацетиламинофенил)бутильную группу,
5-(4-ацетиламинофенил)пентильную группу,
6-(4-ацетиламинофенил)гексильную группу,
2-этоксикарбонилбензильную группу,
3-этоксикарбонилбензильную группу,
4-этоксикарбонилбензильную группу,
2-(2-этоксикарбонилфенил)этильную группу,
2-(3-этоксикарбонилфенил)этильную группу,
2-(4-этоксикарбонилфенил)этильную группу,
3-(4-этоксикарбонилфенил)пропильную группу,
4-(4-этоксикарбонилфенил)бутильную группу,
5-(4-этоксикарбонилфенил)пентильную группу,
6-(4-этоксикарбонилфенил)гексильную группу,
2-метиламинокарбонилбензильную группу,
3-метиламинокарбонилбензильную группу,
4-метиламинокарбонилбензильную группу,
2-диметиламинокарбонилбензильную группу,
3-диметиламинокарбонилбензильную группу,
2-этиламинокарбонилбензильную группу,
3-этиламинокарбонилбензильную группу,
4-этиламинокарбонилбензильную группу,
4-диметиламинокарбонилбензильную группу,
2-диэтиламинокарбонилбензильную группу,
3-диэтиламинокарбонилбензильную группу,
4-диэтиламинокарбонилбензильную группу,
2-(ди-н-пропиламинокарбонил)бензильную группу,
3-(ди-н-пропиламинокарбонил)бензильную группу,
4-(ди-н-пропиламинокарбонил)бензильную группу,
2-метоксикарбониламинобензильную группу,
3-метоксикарбониламинобензильную группу,
4-метоксикарбониламинобензильную группу,
2-этоксикарбониламинобензильную группу,
3-этоксикарбониламинобензильную группу,
4-этоксикарбониламинобензильную группу,
2-(трет-бутоксикарбониламино)бензильную группу,
3-(трет-бутоксикарбониламино)бензильную группу,
4-(трет-бутоксикарбониламино)бензильную группу,
4-триметилсилоксибензильную группу,
4-триэтилсилоксибензильную группу, 2-пирролилбензильную группу,
3-пирролилбензильную группу, 4-пирролилбензильную группу,
2-(1-имидазолил)бензильную группу,
3-(1-имидазолил)бензильную группу,
4-(1-имидазолил)бензильную группу,
2-(2-тетрагидропиранилокси)бензильную группу,
3-(2-тетрагидропиранилокси)бензильную группу,
4-(2-тетрагидропиранилокси)бензильную группу или тому подобное.
Примеры бензгидрильной группы (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, трифторметильной группы и трифторметоксигруппы) включают бензгидрильную группу, 4,4'-дихлорбензгидрильную группу, 4,4'-дифторбензгидрильную группу, 4,4'-дитрифторметилбензгидрильную группу, 4,4'-дитрифторметоксибензгидрильную группу или тому подобное.
Фенил-С2-6алкинильная группа (которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в качестве заместителя в фенильном кольце) включает фенил С2-6алкинильную группу (которая может содержать 1-3 галогензамещенные или незамещенные С1-6алкильные группы в качестве заместителя в фенильном кольце), например
2-фенилэтинильную группу, 3-фенил-2-пропинильную группу,
4-фенил-3-бутинильную группу, 4-фенил-2-бутинильную группу,
5-фенил-4-пентинильную группу, 6-фенил-5-гексинильную группу,
2-метилфенил-2-пропинильную группу,
3-метилфенил-3-бутинильную группу,
4-метилфенил-2-бутинильную группу,
2,4-диметилфенил-4-пентинильную группу,
2,4,6-триметилфенил-5-гексинильную группу,
3,5-дитрифторметилфенил-2-пропинильную группу,
2-трифторметилфенил-3-бутинильную группу,
3-трифторметилфенил-2-бутинильную группу,
4-трифторметилфенил-2-пропинильную группу или тому подобное.
Примеры пиридил-С1-6алкильной группы включают
2-пиридилметильную группу, 2-(3-пиридил)этильную группу,
1-(4-пиридил)этильную группу, 3-(2-пиридил)пропильную группу,
4-(3-пиридил)бутильную группу, 5-(4-пиридил)пентильную группу,
6-(2-пиридил)гексильную группу,
2-метил-3-(3-пиридил)пропильную группу,
1,1-диметил-2-(2-пиридил)этильную группу или тому подобное.
Пиперидино-С1-6алкильная группа (которая может быть замещена в пиперидиновом кольце феноксигруппой, которая может содержать по крайней мере одну галогензамещенную или незамещенную алкильную группу в качестве заместителя в фенильном кольце) включает пиперидино-С1-6алкильную группу (которая может быть замещена в пиперидиновом кольце феноксигруппой, которая может содержать 1-3 галогензамещенные или незамещенные алкильные группы в качестве заместителя в фенильном кольце), например пиперидин-1-илметильную группу, 2-(пиперидин-2-ил)этильную группу,
3-(пиперидин-3-ил)пропильную группу,
4-(пиперидин-4-ил)бутильную группу,
5-(пиперидин-1-ил)пентильную группу,
6-(пиперидин-1-ил)гексильную группу,
4-(4-трифторметилфенокси)пиперидин-1-илметильную группу,
4-феноксипиперидин-1-илметильную группу,
4-(4-метилфенокси)пиперидин-1-илметильную группу,
4-(2,4-диметилфенокси)пиперидин-1-илметильную группу,
4-(2,4,6-триметилфенокси)пиперидин-1-илметильную группу,
2-[4-(4-трифторметилфенокси)пиперидин-1-ил]этильную группу,
3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропильную группу,
4-[4-(4-трифторметилфенокси)пиперидин-1-ил]бутильную группу,
5-[4-(4-трифторметилфенокси)пиперидин-1-ил]пентильную группу,
6-[4-(4-трифторметилфенокси)пиперидин-1-ил]гексильную группу или тому подобное.
Амино-С1-6алкильная группа, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из С1-6алкильной группы и фенильной группы, которая может содержать в качестве заместителя галогензамещенную или незамещенную С1-6алкоксигруппу в фенильном кольце, включает амино-С1-6алкильную группу, которая может содержать в качестве заместителя 1-2 группы, выбранные из группы, состоящей из С1-6алкильной группы и фенильной группы, которая может содержать 1-3 галогензамещенные или незамещенные С1-6алкоксигруппы в качестве заместителя в фенильном кольце, например аминометильную группу, 2-аминоэтильную группу,
2-аминопропильную группу,
3-аминопропильную группу, 3-аминобутильную группу,
4-аминобутильную группу, 5-аминопентильную группу,
6-аминогексильную группу, 2-метиламиноэтильную группу,
2-метиламинопропильную группу, 3-метиламинопропильную группу,
3-метиламинобутильную группу, 4-метиламинобутильную группу,
5-метиламинопентильную группу, 6-метиламиногексильную группу,
2-(этиламино)этильную группу, 3-(этиламино)пропильную группу,
4-(этиламино)бутильную группу, 5-(этиламино)пентильную группу,
6-(этиламино)гексильную группу,
2-(н-пропиламино)этильную группу,
3-(н-пропиламино)пропильную группу,
4-(н-пропиламино)бутильную группу,
5-(н-пропиламино)пентильную группу, 6-(н-пропиламино)гексильную группу, 2-(н-бутиламино)этильную группу,
3-(н-бутиламино)пропильную группу,
2-(н-пентиламино)этильную группу,
3-(н-пентиламино)пропильную группу,
2-(н-гексиламино)этильную группу,
3-(н-гексиламино)пропильную группу,
2-диметиламиноэтильную группу, 2-диметиламинопропильную группу,
3-диметиламинопропильную группу, 3-диметиламинобутильную группу,
4-диметиламинобутильную группу, 5-диметиламинопентильную группу,
6-диметиламиногексильную группу, 2-(диэтиламино)этильную группу,
3-(диэтиламино)пропильную группу,
4-(диэтиламино)бутильную группу,
5-(диэтиламино)пентильную группу,
6-(диэтиламино)гексильную группу,
2-(ди-н-пропиламино)этильную группу,
3-(ди-н-пропиламино)пропильную группу,
4-(ди-н-пропиламино)бутильную группу,
5-(ди-н-пропиламино)пентильную группу,
6-(ди-н-пропиламино)гексильную группу,
2-(фениламино)этильную группу, 3-(фениламино)пропильную группу,
4-(фениламино)бутильную группу, 5-(фениламино)пентильную группу,
6-(фениламино)гексильную группу,
2-(N-метил-N-фениламино)этильную группу,
3-(N-метил-N-фениламино)пропильную группу,
4-(N-метил-N-фениламино)бутильную группу,
5-(N-метил-N-фениламино)пентильную группу,
6-(N-метил-N-фениламино)гексильную группу,
(4-метоксифенил)аминометильную группу,
(3,4-диметоксифенил)аминометильную группу,
(2,4,6-триметоксифенил)аминометильную группу,
2-(4-трифторметоксифениламино)этильную группу,
3-(4-трифторметоксифениламино)пропильную группу,
4-(4-трифторметоксифениламино)бутильную группу,
5-(4-трифторметоксифениламино)пентильную группу,
6-(4-трифторметоксифениламино)гексильную группу,
2-(N-метил-N-4-трифторметоксифениламино)этильную группу,
3-(N-метил-N-4-трифторметоксифениламино)пропильную группу,
4-(N-метил-N-4-трифторметоксифениламино)бутильную группу,
5-(N-метил-N-4-трифторметоксифениламино)пентильную группу,
6-(N-метил-N-4-трифторметоксифениламино)гексильную группу или тому подобное.
1,2,3,6-Тетрагидропиридил-С1-6алкильная группа, которая может быть замещена в 1,2,3,6-тетрагидропиридиновом кольце по крайней мере одной фенильной группой, которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкоксигруппу в качестве заместителя в фенильном кольце, включает 1,2,3,6-тетрагидропиридил-С1-6алкильную группу (которая может быть замещена в 1,2,3,6-тетрагидропиридиновом кольце 1-3 фенильными группами, которые могут содержать 1-3 галогензамещенные или незамещенные С1-6алкоксигруппы в качестве заместителя в фенильном кольце), например
(1,2,3,6-тетрагидропиридин-1-ил)метильную группу,
1-(1,2,3,6-тетрагидропиридин-2-ил)этильную группу,
2-(1,2,3,6-тетрагидропиридин-3-ил)этильную группу,
3-(1,2,3,6-тетрагидропиридин-4-ил)пропильную группу,
4-(1,2,3,6-тетрагидропиридин-1-ил)бутильную группу,
5-(1,2,3,6-тетрагидропиридин-2-ил)пентильную группу,
6-(1,2,3,6-тетрагидропиридин-3-ил)гексильную группу,
2-метил-3-(1,2,3,6-тетрагидропиридин-1-ил)пропильную группу,
1,1-диметил-2-(1,2,3,6-тетрагидропиридин-4-ил)этильную группу,
4-фенил-1,2,3,6-тетрагидропиридин-1-илметильную группу,
3,4,5-трифенил-1,2,3,6-тетрагидропиридин-1-илметильную группу,
3,4-дифенил-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(2-метоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(3-метоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(2,4-диметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
3-(2,4,6-триметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(2-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(3-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(3,5-дитрифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметильную группу,
2-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)этильную группу,
2-[4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]этильную группу,
2-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]этильную группу,
3-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)пропильную группу,
3-[4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]пропильную группу,
3-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]пропильную группу,
4-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)бутильную группу,
4-[4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]бутильную группу,
4-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]бутильную группу,
5-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)пентильную группу,
5-[4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]пентильную группу,
5-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]пентильную группу,
6-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)гексильную группу,
6-[4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]гексильную группу,
6-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]гексильную группу или тому подобное.
Примеры флуоренил-C1-6алкильную группу включают
1-флуоренилметильную группу, 2-флуоренилметильную группу,
3-флуоренилметильную группу, 4-флуоренилметильную группу,
9-флуоренилметильную группу, 2-(1-флуоренил)этильную группу,
2-(2-флуоренил)этильную группу, 2-(3-флуоренил)этильную группу,
2-(4-флуоренил)этильную группу, 2-(9-флуоренил)этильную группу,
3-(1-флуоренил)пропильную группу,
3-(2-флуоренил)пропильную группу,
3-(3-флуоренил)пропильную группу,
3-(4-флуоренил)пропильную группу,
3-(9-флуоренил)пропильную группу,
4-(1-флуоренил)бутильную группу,
4-(2-флуоренил)бутильную группу,
5-(1-флуоренил)пентильную группу,
5-(2-флуоренил)пентильную группу,
6-(1-флуоренил)гексильную группу,
6-(2-флуоренил)гексильную группу или тому подобное.
Фурил-С1-6алкильная группа (которая может быть замещена в фурановом кольце галогензамещенной или незамещенной фенильной группой) включает фурил-С1-6алкильную группу (которая может быть замещена в фурановом кольце фенильной группой, незамещенной или замещенной 1-5 атомами галогена), например
2-фурилметильную группу, 3-фурилметильную группу,
2-(2-фурил)этильную группу,
1-(3-фурил)этильную группу, 3-(2-фурил)пропильную группу,
3-(3-фурил)пропильную группу, 4-(2-фурил)бутильную группу,
4-(3-фурил)бутильную группу, 5-(2-фурил)пентильную группу,
5-(3-фурил)пентильную группу, 6-(2-фурил)гексильную группу,
6-(3-фурил)гексильную группу, 4-фенил-2-фурилметильную группу,
4-(2-фторфенил)-2-фурилметильную группу,
4-(3-фторфенил)-2-фурилметильную группу,
4-(4-фторфенил)-2-фурилметильную группу,
4-(2,3,4,5,6-пентафторфенил)-2-фурилметильную группу,
4-(2-хлорфенил)-2-фурилметильную группу,
4-(3-хлорфенил)-2-фурилметильную группу,
4-(4-хлорфенил)-2-фурилметильную группу,
4-(2-бромфенил)-2-фурилметильную группу,
4-(3-бромфенил)-2-фурилметильную группу,
4-(4-бромфенил)-2-фурилметильную группу,
4-фенил-3-фурилметильную группу,
4-(2,3-дихлорфенил)-3-фурилметильную группу,
4-(4-хлорфенил)-3-фурилметильную группу,
4-(2-бромфенил)-3-фурилметильную группу,
4-(3-бромфенил)-3-фурилметильную группу,
4-(4-бромфенил)-3-фурилметильную группу,
4-фенил-3-фурилэтильную группу,
2-[4-(3-хлорфенил)-3-фурил]этильную группу,
2-[4-(4-хлорфенил)-3-фурил]этильную группу,
2-[4-(2-бромфенил)-3-фурил]этильную группу,
2-[4-(3-бромфенил)-3-фурил]этильную группу,
2-[4-(2,4-дибромфенил)-3-фурил]этильную группу,
2-(4-фенил-2-фурил)этильную группу,
2-[4-(3-хлорфенил)-2-фурил]этильную группу,
2-[4-(4-хлорфенил)-2-фурил]этильную группу,
2-[4-(4-бромфенил)-2-фурил]этильную группу,
3-(4-фенил-3-фурил)пропильную группу,
3-[4-(3-хлорфенил)-3-фурил]пропильную группу,
3-[4-(2,4,6-трихлорфенил)-3-фурил]пропильную группу,
3-[4-(4-бромфенил)-3-фурил]пропильную группу,
3-(4-фенил-2-фурил)пропильную группу,
3-[4-(3-хлорфенил)-2-фурил]пропильную группу,
3-[4-(4-хлорфенил)-2-фурил]пропильную группу,
3-[4-(4-бромфенил)-2-фурил]пропильную группу,
4-(4-фенил-3-фурил)бутильную группу,
4-[4-(3-хлорфенил)-3-фурил]бутильную группу,
4-[4-(4-хлорфенил)-3-фурил]бутильную группу,
4-[4-(4-бромфенил)-3-фурил]бутильную группу,
4-(4-фенил-2-фурил)бутильную группу,
4-[4-(3-хлорфенил)-2-фурил]бутильную группу,
4-[4-(4-хлорфенил)-2-фурил]бутильную группу,
4-[4-(4-бромфенил)-2-фурил]бутильную группу,
5-(4-фенил-3-фурил)пентильную группу,
5-[4-(3-хлорфенил)-3-фурил]пентильную группу,
5-[4-(4-хлорфенил)-3-фурил]пентильную группу,
5-[4-(4-бромфенил)-3-фурил]пентильную группу,
5-(4-фенил-2-фурил)пентильную группу,
5-[4-(3-хлорфенил)-2-фурил]пентильную группу,
5-[4-(4-хлорфенил)-2-фурил]пентильную группу,
5-[4-(4-бромфенил)-2-фурил]пентильную группу,
6-(4-фенил-3-фурил)гексильную группу,
6-[4-(3-хлорфенил)-3-фурил]гексильную группу,
6-[4-(4-хлорфенил)-3-фурил]гексильную группу,
6-[4-(4-бромфенил)-3-фурил]гексильную группу,
6-(4-фенил-2-фурил)гексильную группу,
6-[4-(3-хлорфенил)-2-фурил]гексильную группу,
6-[4-(4-хлорфенил)-2-фурил]гексильную группу,
6-[4-(4-бромфенил)-2-фурил]гексильную группу или тому подобное.
Примеры тиенилзамещенной С1-6алкильной группы включают
2-тиенилметильную группу, 3-тиенилметильную группу,
2-(2-тиенил)этильную группу, 1-(3-тиенил)этильную группу,
4-(2-тиенил)бутильную группу, 4-(3-тиенил)бутильную группу,
5-(2-тиенил)пентильную группу, 5-(3-тиенил)пентильную группу,
6-(2-тиенил)гексильную группу, 6-(3-тиенил)гексильную группу или тому подобное.
Оксазолил-С1-6алкильная группа (которая может быть замещена в оксазольном кольце атомом галогена или галогензамещенной или незамещенной фенильной группой) включает оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце атомом галогена или 1-2 фенильными группами, которые могут быть замещены в фенильном кольце 1-5 атомами галогена), например
2-оксазолилметильную группу,
4-оксазолилметильную группу, 5-оксазолилметильную группу,
2-(2-оксазолил)этильную группу, 1-(4-оксазолил)этильную группу,
3-(2-оксазолил)пропильную группу,
4-(2-оксазолил)бутильную группу,
5-(2-оксазолил)пентильную группу,
6-(2-оксазолил)гексильную группу,
2-(4-оксазолил)этильную группу,
3-(4-оксазолил)пропильную группу,
4-(4-оксазолил)бутильную группу,
5-(4-оксазолил)пентильную группу,
6-(4-оксазолил)гексильную группу,
2-хлор-4-оксазолилметильную группу,
2,5-дихлор-4-оксазолилметильную группу,
2,5-дифенил-4-оксазолилметильную группу,
2-(2-хлор-4-оксазолил)этильную группу,
3-(2-хлор-4-оксазолил)пропильную группу,
4-(2-иод-4-оксазолил)бутильную группу,
5-(2-бром-4-оксазолил)пентильную группу,
6-(2-фтор-4-оксазолил)гексильную группу,
2-(4-хлорфенил)-4-оксазолилметильную группу,
2-(2,3,4,5,6-пентафторфенил)-4-оксазолилметильную группу,
2-[2-(4-хлорфенил)-4-оксазолил]этильную группу,
3-[2-(4-хлорфенил)-4-оксазолил]пропильную группу,
4-[2-(2,4,6-трихлорфенил)-4-оксазолил]бутильную группу,
5-[2-(4-хлорфенил)-4-оксазолил]пентильную группу,
6-[2-(4-хлорфенил)-4-оксазолил]гексильную группу,
[2-хлор-4-(3-хлорфенил)-5-оксазолил]метильную группу или тому подобное.
Оксадиазолил-С1-6алкильная группа (которая может быть замещена в оксадиазольном кольце галогензамещенной или незамещенной фенильной группой) включает оксадиазолил-С1-6алкильную группу (которая может быть замещена в оксадиазольном кольце фенильной группой, незамещенной или замещенной 1-5 атомами галогена), например
5-оксадиазолилметильную группу,
2-(5-оксадиазолил)этильную группу,
1-(2-оксадиазолил)этильную группу,
3-(5-оксадиазолил)пропильную группу,
4-(2-оксадиазолил)бутильную группу,
5-(5-оксадиазолил)пентильную группу,
6-(2-оксадиазолил)гексильную группу,
2-метил-3-(2-оксадиазолил)пропильную группу,
1,1-диметил-2-(5-оксадиазолил)этильную группу,
2-фенил-5-оксадиазолилметильную группу,
2-(2-фторфенил)-5-оксадиазолилметильную группу,
2-(3-фторфенил)-5-оксадиазолилметильную группу,
2-(2,3,4,5,6-пентафторфенил)-5-оксадиазолилметильную группу,
2-(2,4-дихлорфенил)-5-оксадиазолилметильную группу,
2-(3-хлорфенил)-5-оксадиазолилметильную группу,
2-(4-хлорфенил)-5-оксадиазолилметильную группу,
2-(2-бромфенил)-5-оксадиазолилметильную группу,
2-(2,4,6-трибромфенил)-5-оксадиазолилметильную группу,
2-(4-бромфенил)-5-оксадиазолилметильную группу,
2-(5-оксадиазолил)этильную группу,
3-(5-оксадиазолил)пропильную группу,
4-(5-оксадиазолил)бутильную группу,
5-(5-оксадиазолил)пентильную группу,
6-(5-оксадиазолил)гексильную группу,
2-(2-фенил-5-оксадиазолил)этильную группу,
3-(2-фенил-5-оксадиазолил)пропильную группу,
4-(2-фенил-5-оксадиазолил)бутильную группу,
5-(2-фенил-5-оксадиазолил)пентильную группу,
6-(2-фенил-5-оксадиазолил)гексильную группу,
2-[2-(4-хлорфенил)-5-оксадиазолил]этильную группу,
3-[2-(4-хлорфенил)-5-оксадиазолил]пропильную группу,
4-[2-(4-хлорфенил)-5-оксадиазолил]бутильную группу,
5-[2-(4-хлорфенил)-5-оксадиазолил]пентильную группу,
6-[2-(4-хлорфенил)-5-оксадиазолил]гексильную группу или тому подобное.
Пиразолил-С1-6алкильная группа (которая может быть замещена в пиразольном кольце галогензамещенной или незамещенной фенильной группой) включает пиразолил-С1-6алкильную группу (которая может быть замещена в пиразольном кольце 1-3 фенильными группами, незамещенными или замещенными 1-5 атомами галогена), например 3-пиразолилметильную группу, 2-(4-пиразолил)этильную группу,
1-(5-пиразолил)этильную группу,
3-(3-пиразолил)пропильную группу,
4-(4-пиразолил)бутильную группу,
5-(1-пиразолил)пентильную группу,
6-(5-пиразолил)гексильную группу,
2-метил-3-(1-пиразолил)пропильную группу,
1,1-диметил-2-(3-пиразолил)этильную группу,
1-(1-фенил)-3-пиразолилметильную группу,
1-(2-фторфенил)-4-пиразолилметильную группу,
1-(3-фторфенил)-3-пиразолилметильную группу,
3-фенил-1-пиразолилметильную группу,
3,4,5-трифенил-1-пиразолилметильную группу,
3,4-дифенил-1-пиразолилметильную группу,
1-(4-фторфенил)-3-пиразолилметильную группу,
1-(2,3,4,5,6-пентафторфенил)-3-пиразолилметильную группу,
1-(2-хлорфенил)-5-пиразолилметильную группу,
1-(3-хлорфенил)-3-пиразолилметильную группу,
1-(4-хлорфенил)-3-пиразолилметильную группу,
1-(2-бромфенил)-3-пиразолилметильную группу,
1-(3-бромфенил)-3-пиразолилметильную группу,
1-(4-бромфенил)-3-пиразолилметильную группу,
2-(3-пиразолил)этильную группу,
3-(3-пиразолил)пропильную группу,
4-(3-пиразолил)бутильную группу,
5-(3-пиразолил)пентильную группу,
6-(3-пиразолил)гексильную группу, 2-[1-(4-хлорфенил)-3-
пиразолил]этильную группу, 3-[1-(2,4-дихлорфенил)-3-
пиразолил]пропильную группу, 4-[1-(4-хлорфенил)-3-
пиразолил]бутильную группу, 5-[1-(4-хлорфенил)-3-
пиразолил]пентильную группу, 6-[1-(2,4,6-трихлорфенил)-3-
пиразолил]гексильную группу или тому подобное.
Бензотиенил-С1-6алкильная группа (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкоксигруппы) включает бензотиенил-С1-6алкильную группу (которая может быть замещена в бензотиофеновом кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкоксигруппы), например 2-бензотиенилметильную группу,
2-(3-бензотиенил)этильную группу,
1-(4-бензотиенил)этильную группу,
3-(5-бензотиенил)пропильную группу,
4-(6-бензотиенил)бутильную группу,
5-(7-бензотиенил)пентильную группу,
6-(2-бензотиенил)гексильную группу,
2-метил-3-(3-бензотиенил)пропильную группу,
1,1-диметил-2-(2-бензотиенил)этильную группу,
4-фтор-2-бензотиенилметильную группу,
5-фтор-2-бензотиенилметильную группу,
6-фтор-2-бензотиенилметильную группу,
7-фтор-2-бензотиенилметильную группу,
4-хлор-2-бензотиенилметильную группу,
5-хлор-2-бензотиенилметильную группу,
6-хлор-2-бензотиенилметильную группу,
7-хлор-2-бензотиенилметильную группу,
4-бром-2-бензотиенилметильную группу,
5-бром-2-бензотиенилметильную группу,
6-бром-2-бензотиенилметильную группу,
7-бром-2-бензотиенилметильную группу,
4-метокси-2-бензотиенилметильную группу,
5-метокси-2-бензотиенилметильную группу,
6-метокси-2-бензотиенилметильную группу,
6,7-диметокси-2-бензотиенилметильную группу,
3,6,7-триметокси-2-бензотиенилметильную группу,
7-метокси-2-бензотиенилметильную группу,
4-трифторметокси-2-бензотиенилметильную группу,
5-трифторметокси-2-бензотиенилметильную группу,
6-трифторметокси-2-бензотиенилметильную группу,
7-трифторметокси-2-бензотиенилметильную группу,
4-этокси-2-бензотиенилметильную группу,
5-этокси-2-бензотиенилметильную группу,
6-этокси-2-бензотиенилметильную группу,
7-этокси-2-бензотиенилметильную группу,
4-хлор-5-трифторметокси-2-бензотиенилметильную группу,
6-хлор-5-трифторметокси-2-бензотиенилметильную группу,
7-хлор-5-трифторметокси-2-бензотиенилметильную группу,
3-бензотиенилметильную группу,
4-фтор-3-бензотиенилметильную группу,
5-фтор-3-бензотиенилметильную группу,
6-фтор-3-бензотиенилметильную группу,
7-фтор-3-бензотиенилметильную группу,
4-хлор-3-бензотиенилметильную группу,
5-хлор-3-бензотиенилметильную группу,
6-хлор-3-бензотиенилметильную группу,
7-хлор-3-бензотиенилметильную группу,
4-бром-3-бензотиенилметильную группу,
5-бром-3-бензотиенилметильную группу,
6-бром-3-бензотиенилметильную группу,
7-бром-3-бензотиенилметильную группу,
4-метокси-3-бензотиенилметильную группу,
5-метокси-3-бензотиенилметильную группу,
6-метокси-3-бензотиенилметильную группу,
7-метокси-3-бензотиенилметильную группу,
4-трифторметокси-3-бензотиенилметильную группу,
5-трифторметокси-3-бензотиенилметильную группу,
6-трифторметокси-3-бензотиенилметильную группу,
7-трифторметокси-3-бензотиенилметильную группу,
4-этокси-3-бензотиенилметильную группу,
5-этокси-3-бензотиенилметильную группу,
6-этокси-3-бензотиенилметильную группу,
7-этокси-3-бензотиенилметильную группу,
4-хлор-5-трифторметокси-3-бензотиенилметильную группу,
6-хлор-5-трифторметокси-3-бензотиенилметильную группу,
7-хлор-5-трифторметокси-3-бензотиенилметильную группу,
2-(2-бензотиенил)этильную группу,
3-(2-бензотиенил)пропильную группу,
4-(2-бензотиенил)бутильную группу,
5-(2-бензотиенил)пентильную группу,
6-(2-бензотиенил)гексильную группу,
2-(3-бензотиенил)этильную группу,
3-(3-бензотиенил)пропильную группу,
4-(3-бензотиенил)бутильную группу,
5-(3-бензотиенил)пентильную группу,
6-(3-бензотиенил)гексильную группу,
2-(5-хлор-2-бензотиенил)этильную группу,
3-(5-хлор-2-бензотиенил)пропильную группу,
4-(5-хлор-2-бензотиенил)бутильную группу,
5-(5-хлор-2-бензотиенил)пентильную группу,
6-(5-хлор-2-бензотиенил)гексильную группу,
2-(5-хлор-3-бензотиенил)этильную группу,
3-(5-хлор-3-бензотиенил)пропильную группу,
4-(5-хлор-3-бензотиенил)бутильную группу,
5-(5-хлор-3-бензотиенил)пентильную группу,
6-(5-хлор-3-бензотиенил)гексильную группу или тому подобное.
Тиенил-С1-6алкильная группа, которая может быть замещена в тиофеновом кольце атомом галогена, включает тиенил-С1-6алкильную группу (которая может быть замещена в тиофеновом кольце 1-3 атомами галогена), например 2-тиенилметильную группу,
2-(3-тиенил)этильную группу, 1-(2-тиенил)этильную группу,
3-(2-тиенил)пропильную группу, 4-(3-тиенил)бутильную группу,
5-(2-тиенил)пентильную группу, 6-(2-тиенил)гексильную группу,
2-метил-3-(3-тиенил)пропильную группу,
1,1-диметил-2-(2-тиенил)этильную группу,
3-фтор-2-тиенилметильную группу,
4-фтор-2-тиенилметильную группу,
3,4-дифтор-2-тиенилметильную группу,
3,4,5-трихлор-2-тиенилметильную группу,
5-фтор-2-тиенилметильную группу,
3-хлор-2-тиенилметильную группу,
4-хлор-2-тиенилметильную группу,
5-хлор-2-тиенилметильную группу,
3-бром-2-тиенилметильную группу,
4-бром-2-тиенилметильную группу,
5-бром-2-тиенилметильную группу, 3-тиенилметильную группу,
2-фтор-3-тиенилметильную группу,
4-фтор-3-тиенилметильную группу,
5-фтор-3-тиенилметильную группу,
2-хлор-3-тиенилметильную группу,
4-хлор-3-тиенилметильную группу,
5-хлор-3-тиенилметильную группу,
2-бром-3-тиенилметильную группу,
4-бром-3-тиенилметильную группу, 5-иод-3-тиенилметильную группу,
2-(5-хлор-2-тиенил)этильную группу,
3-(5-хлор-2-тиенил)пропильную группу,
4-(5-хлор-2-тиенил)бутильную группу,
5-(5-хлор-2-тиенил)пентильную группу,
6-(5-хлор-2-тиенил)гексильную группу,
2-(5-хлор-3-тиенил)этильную группу,
3-(5-хлор-3-тиенил)пропильную группу,
4-(5-хлор-3-тиенил)бутильную группу,
5-(5-хлор-3-тиенил)пентильную группу,
6-(5-хлор-3-тиенил)гексильную группу или тому подобное.
Примеры бензотиазолил-С1-6алкильной группы включают бензотиазол-2-илметильную группу,
бензотиазол-4-илметильную группу,
бензотиазол-5-илметильную группу,
бензотиазол-6-илметильную группу,
бензотиазол-7-илметильную группу,
2-(бензотиазол-4-ил)этильную группу,
(бензотиазол-5-ил)метильную группу,
2-(бензотиазол-6-ил)этильную группу,
2-(бензотиазол-7-ил)этильную группу,
3-(бензотиазол-4-ил)пропильную группу,
3-(бензотиазол-5-ил)пропильную группу,
3-(бензотиазол-6-ил)пропильную группу,
3-(бензотиазол-7-ил)пропильную группу,
4-(бензотиазол-2-ил)бутильную группу,
4-(бензотиазол-4-ил)бутильную группу,
4-(бензотиазол-5-ил)бутильную группу,
4-(бензотиазол-6-ил)бутильную группу,
4-(бензотиазол-7-ил)бутильную группу,
5-(бензотиазол-2-ил)пентильную группу,
5-(бензотиазол-4-ил)пентильную группу,
5-(бензотиазол-5-ил)пентильную группу,
5-(бензотиазол-6-ил)пентильную группу,
5-(бензотиазол-7-ил)пентильную группу,
6-(бензотиазол-2-ил)гексильную группу,
6-(бензотиазол-4-ил)гексильную группу,
6-(бензотиазол-5-ил)гексильную группу,
6-(бензотиазол-6-ил)гексильную группу,
6-(бензотиазол-7-ил)гексильную группу или тому подобное.
Бензофурил-С1-6алкильная группа, которая может быть замещена в бензофурановом кольце атомом галогена в качестве заместителя, включает бензофурил-С1-6алкильную группу, которая может быть замещена в бензофурановом кольце 1-3 атомами галогена в качестве заместителя, например 2-бензофурилметильную группу,
2-(3-бензофурил)этильную группу,
1-(4-бензофурил)этильную группу,
3-(5-бензофурил)пропильную группу,
4-(6-бензофурил)бутильную группу,
5-(7-бензофурил)пентильную группу,
6-(2-бензофурил)гексильную группу,
2-метил-3-(3-бензофурил)пропильную группу,
1,1-диметил-2-(2-бензофурил)этильную группу,
4-фтор-2-бензофурилметильную группу,
5-фтор-2-бензофурилметильную группу,
6-фтор-2-бензофурилметильную группу,
7-фтор-2-бензофурилметильную группу,
4-хлор-2-бензофурилметильную группу,
5-хлор-2-бензофурилметильную группу,
6-хлор-2-бензофурилметильную группу,
7-хлор-2-бензофурилметильную группу,
4-бром-2-бензофурилметильную группу,
5-бром-2-бензофурилметильную группу,
6-бром-2-бензофурилметильную группу,
7-бром-2-бензофурилметильную группу,
4-иод-2-бензофурилметильную группу,
5-иод-2-бензофурилметильную группу,
6-иод-2-бензофурилметильную группу,
7-иод-2-бензофурилметильную группу,
4-фтор-3-бензофурилметильную группу,
5-фтор-3-бензофурилметильную группу,
5,6-дифтор-2-бензофурилметильную группу,
7-фтор-3-бензофурилметильную группу,
4-хлор-3-бензофурилметильную группу,
3,5,6-трихлор-3-бензофурилметильную группу,
6-хлор-3-бензофурилметильную группу,
7-хлор-3-бензофурилметильную группу,
4-бром-3-бензофурилметильную группу,
5-бром-3-бензофурилметильную группу,
6-бром-3-бензофурилметильную группу,
7-бром-3-бензофурилметильную группу,
4-иод-3-бензофурилметильную группу,
5-иод-3-бензофурилметильную группу,
6-иод-3-бензофурилметильную группу,
7-иод-3-бензофурилметильную группу или тому подобное.
Индолинил-С1-6алкильная группа (которая может быть замещена в индолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и оксогруппы) включает индолинил-С1-6алкильную группу (которая может быть замещена в индолиновом кольце 1-5 группами, выбранными из группы, состоящей из С1-6алкильной группы и оксогруппы), например 2-индолинилметильную группу, 2-(3-индолинил)этильную группу,
1-(4-индолинил)этильную группу,
3-(5-индолинил)пропильную группу,
4-(6-индолинил)бутильную группу,
5-(7-индолинил)пентильную группу,
6-(1-индолинил)гексильную группу,
2-метил-3-(3-индолинил)пропильную группу,
1,1-диметил-2-(2-индолинил)этильную группу,
3,3-диметил-5-индолинилметильную группу,
1,3,3-триметил-5-индолинилметильную группу,
1-этил-3,3-диметил-5-индолинилметильную группу,
1-метил-5-индолинилметильную группу,
1,3-диметил-5-индолинилметильную группу,
1,3,3,6,7-пентаметил-5-индолинилметильную группу,
3,3-диметил-1-(н-пропил)-5-индолинилметильную группу,
3,3-диметил-1-(изопропил)-5-индолинилметильную группу,
1-(н-бутил)-3,3-диметил-5-индолинилметильную группу,
1-(втор-бутил)-3,3-диметил-5-индолинилметильную группу,
1-(трет-бутил)-3,3-диметил-5-индолинилметильную группу,
1-(н-пентил)-3,3-диметил-5-индолинилметильную группу,
1-(н-гексил)-3,3-диметил-5-индолинилметильную группу,
3,3-диметил-2-оксо-5-индолинилметильную группу,
1,3,3-триметил-2-оксо-5-индолинилметильную группу,
1-этил-3,3-диметил-2-оксо-5-индолинилметильную группу,
3,3-диметил-2-оксо-1-(н-пропил)-5-индолинилметильную группу,
3,3-диметил-2-оксо-1-(изопропил)-5-индолинилметильную группу,
1-(н-бутил)-3,3-диметил-2-оксо-5-индолинилметильную группу,
1-(втор-бутил)-3,3-диметил-2-оксо-5-индолинилметильную группу,
1-(трет-бутил)-3,3-диметил-2-оксо-5-индолинилметильную группу,
1-(н-пентил)-3,3-диметил-2-оксо-5-индолинилметильную группу,
1-(н-гексил)-3,3-диметил-2-оксо-5-индолинилметильную группу,
2-оксо-5-индолинилметильную группу или тому подобное.
Бензоксазолил-С1-6алкильная группа (которая может быть замещена в бензоксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, С1-6алкильной группы и оксогруппы) включает бензоксазолил-С1-6алкильную группу (которая может быть замещена в бензоксазольном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, С1-6алкильной группы и оксогруппы), например бензоксазол-2-илметильную группу, бензоксазол-4-илметильную группу,
бензоксазол-5-илметильную группу,
бензоксазол-6-илметильную группу,
бензоксазол-7-илметильную группу,
2-(бензоксазол-2-ил)этильную группу,
1-(бензоксазол-4-ил)этильную группу,
3-(бензоксазол-5-ил)пропильную группу,
4-(бензоксазол-6-ил)бутильную группу,
5-(бензоксазол-7-ил)пентильную группу,
6-(бензоксазол-2-ил)гексильную группу,
2-метил-3-(бензоксазол-4-ил)пропильную группу,
1,1-диметил-2-(бензоксазол-5-ил)этильную группу,
2,5-диметилбензоксазол-4-илметильную группу,
2,5,6-триметилбензоксазол-4-илметильную группу,
4,5-дихлорбензоксазол-4-илметильную группу,
2,4,5-трихлорбензоксазол-4-илметильную группу,
(2,3-дигидро-2-оксобензоксазол-3-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-4-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-5-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-6-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-7-ил)метильную группу,
2-(бензоксазол-4-ил)этильную группу,
(бензоксазол-5-ил)метильную группу,
2-(бензоксазол-6-ил)этильную группу,
2-(бензоксазол-7-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-3-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-4-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-5-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-6-ил)этильную группу,
2-(2,3-дигидро-2-оксобензоксазол-7-ил)этильную группу,
3-(бензоксазол-2-ил)пропильную группу,
3-(бензоксазол-4-ил)пропильную группу,
3-(бензоксазол-6-ил)пропильную группу,
3-(бензоксазол-7-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-3-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-4-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-5-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-6-ил)пропильную группу,
3-(2,3-дигидро-2-оксобензоксазол-7-ил)пропильную группу,
4-(бензоксазол-2-ил)бутильную группу,
4-(бензоксазол-4-ил)бутильную группу,
4-(бензоксазол-5-ил)бутильную группу,
4-(бензоксазол-7-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-3-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-4-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-5-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-6-ил)бутильную группу,
4-(2,3-дигидро-2-оксобензоксазол-7-ил)бутильную группу,
5-(бензоксазол-2-ил)пентильную группу,
5-(бензоксазол-4-ил)пентильную группу,
5-(бензоксазол-5-ил)пентильную группу,
5-(бензоксазол-6-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-3-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-4-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-5-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-6-ил)пентильную группу,
5-(2,3-дигидро-2-оксобензоксазол-7-ил)пентильную группу,
6-(бензоксазол-4-ил)гексильную группу,
6-(бензоксазол-5-ил)гексильную группу,
6-(бензоксазол-6-ил)гексильную группу,
6-(бензоксазол-7-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-3-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-4-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-5-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-6-ил)гексильную группу,
6-(2,3-дигидро-2-оксобензоксазол-7-ил)гексильную группу,
2-метилбензоксазол-4-илметильную группу,
2-метилбензоксазол-5-илметильную группу,
2-метилбензоксазол-6-илметильную группу,
4-метилбензоксазол-2-илметильную группу,
5-метилбензоксазол-2-илметильную группу,
6-метилбензоксазол-2-илметильную группу,
7-метилбензоксазол-2-илметильную группу,
2-этилбензоксазол-4-илметильную группу,
2-этилбензоксазол-5-илметильную группу,
2-этилбензоксазол-6-илметильную группу,
2-н-пропилбензоксазол-4-илметильную группу,
2-н-пропилбензоксазол-5-илметильную группу,
2-н-пропилбензоксазол-6-илметильную группу,
4-фторбензоксазол-2-илметильную группу,
5-фтор-2-бензоксазолилметильную группу,
6-фтор-2-бензоксазолилметильную группу,
7-фторбензоксазол-2-илметильную группу,
4-хлорбензоксазол-2-илметильную группу,
5-хлор-2-бензоксазол-2-илметильную группу,
6-хлор-2-бензоксазол-2-илметильную группу,
7-хлор-2-бензоксазол-2-илметильную группу,
4-бром-2-бензоксазол-2-илметильную группу,
5-бром-2-бензоксазол-2-илметильную группу,
6-бром-2-бензоксазол-2-илметильную группу,
7-бром-2-бензоксазол-2-илметильную группу,
4-фтор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
5-фтор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
6-фтор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
7-фтор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
4-хлор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
5-хлор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
6-хлор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
7-хлор-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
4-бром-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
5-бром-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
6-бром-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
7-бром-2-оксо-2,3-дигидробензоксазол-3-илметильную группу,
4-фтор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
5-фтор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
6-фтор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
7-фтор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
4-хлор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
5-хлор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
6-хлор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
7-хлор-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
4-бром-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
5-бром-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
6-бром-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
7-бром-2-оксо-2,3-дигидробензоксазол-5-илметильную группу,
4-фтор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
5-фтор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
6-фтор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
7-фтор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
4-хлор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
5-хлор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
6-хлор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
7-хлор-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
4-бром-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
5-бром-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
6-бром-2-оксо-2,3-дигидробензоксазол-6-илметильную группу,
7-бром-2-оксо-2,3-дигидробензоксазол-6-илметильную группу или тому подобное.
Примеры хроменил-С1-6алкильной группы включают
2-хроменилметильную группу, 3-хроменилметильную группу,
4-хроменилметильную группу, 5-хроменилметильную группу,
6-хроменилметильную группу, 7-хроменилметильную группу,
8-хроменилметильную группу, 2-(2-хроменил)этильную группу,
1-(3-хроменил)этильную группу, 3-(4-хроменил)пропильную группу,
4-(5-хроменил)бутильную группу, 5-(6-хроменил)пентильную группу,
6-(7-хроменил)гексильную группу,
2-метил-3-(8-хроменил)пропильную группу,
1,1-диметил-2-(6-хроменил)этильную группу или тому подобное.
Примеры 1,2,3,4-тетрагидрохинолил-С1-6алкильной группы (которая может быть замещена в хинолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и оксогруппы) включают
1,2,3,4-тетрагидрохинолил-С1-6алкильную группу (которая может быть замещена в хинолиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы и оксогруппы), например (1,2,3,4-тетрагидро-6-хинолил)метильную группу,
2-(1,2,3,4-тетрагидро-2-хинолил)этильную группу,
1-(1,2,3,4-тетрагидро-1-хинолил)этильную группу,
3-(1,2,3,4-тетрагидро-3-хинолил)пропильную группу,
4-(1,2,3,4-тетрагидро-4-хинолил)бутильную группу,
5-(1,2,3,4-тетрагидро-5-хинолил)пентильную группу,
6-(1,2,3,4-тетрагидро-6-хинолил)гексильную группу,
2-метил-3-(1,2,3,4-тетрагидро-7-хинолил)пропильную группу,
1,1-диметил-2-(1,2,3,4-тетрагидро-8-хинолил)этильную группу,
2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
4-метил-1,2,3,4-тетрагидро-6-хинолилметильную группу,
4-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
4,6-диметил-1,2,3,4-тетрагидро-5-хинолилметильную группу,
1,4,8-триметил-1,2,3,4-тетрагидро-6-хинолилметильную группу,
1-метил-2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
1-этил-2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
2-оксо-1-(н-пропил)-1,2,3,4-тетрагидро-6-хинолилметильную группу,
2-оксо-1-(изопропил)-1,2,3,4-тетрагидро-6-хинолилметильную группу,
1-(н-бутил)-2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
1-(втор-бутил)-2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
1-(трет-бутил)-2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
1-(н-пентил)-2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
1-(н-гексил)-2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу,
2-(2-оксо-1,2,3,4-тетрагидро-6-хинолил)этильную группу,
3-(2-оксо-1,2,3,4-тетрагидро-6-хинолил)пропильную группу,
4-(2-оксо-1,2,3,4-тетрагидро-6-хинолил)бутильную группу,
5-(2-оксо-1,2,3,4-тетрагидро-6-хинолил)пентильную группу,
6-(2-оксо-1,2,3,4-тетрагидро-6-хинолил)гексильную группу,
2-(1-метил-2-оксо-1,2,3,4-тетрагидро-6-хинолил)этильную группу,
3-(1-метил-2-оксо-1,2,3,4-тетрагидро-6-хинолил)пропильную группу,
4-(1-метил-2-оксо-1,2,3,4-тетрагидро-6-хинолил)бутильную группу,
5-(1-метил-2-оксо-1,2,3,4-тетрагидро-6-хинолил)пентильную группу,
6-(1-метил-2-оксо-1,2,3,4-тетрагидро-6-хинолил)гексильную группу или тому подобное.
Тиазолил-С1-6алкильная группа (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы) включает тиазолил-С1-6алкильную группу (которая может быть замещена в тиазольном кольце 1-2 группами, выбранными из группы, состоящей из атома галогена, 1-5 галогензамещенных или незамещенных фенильных групп и С1-6алкильной группы), например
2-тиазолилметильную группу, 4-тиазолилметильную группу,
5-тиазолилметильную группу, 2-(2-тиазолил)этильную группу,
1-(4-тиазолил)этильную группу, 3-(5-тиазолил)пропильную группу,
4-(2-тиазолил)бутильную группу, 5-(4-тиазолил)пентильную группу,
6-(5-тиазолил)гексильную группу,
2-метил-3-(2-тиазолил)пропильную группу,
1,1-диметил-2-(4-тиазолил)этильную группу,
2-хлор-4-тиазолилметильную группу,
2,5-дихлор-4-тиазолилметильную группу,
2-хлор-5-тиазолилметильную группу,
2-хлор-6-тиазолилметильную группу,
6-хлор-2-тиазолилметильную группу,
5-хлор-2-тиазолилметильную группу,
4-хлор-2-тиазолилметильную группу,
5-хлор-4-тиазолилметильную группу,
4-хлор-5-тиазолилметильную группу,
2-этил-4-тиазолилметильную группу,
2,5-диметил-4-тиазолилметильную группу,
2-метил-4-тиазолилметильную группу,
2-метил-5-тиазолилметильную группу,
2-метил-6-тиазолилметильную группу,
6-метил-2-тиазолилметильную группу,
5-метил-2-тиазолилметильную группу,
4-метил-2-тиазолилметильную группу,
5-метил-4-тиазолилметильную группу,
4-метил-5-тиазолилметильную группу,
2-этил-4-тиазолилметильную группу,
2-этил-5-тиазолилметильную группу,
2-этил-6-тиазолилметильную группу,
6-этил-2-тиазолилметильную группу,
5-этил-2-тиазолилметильную группу,
4-этил-2-тиазолилметильную группу,
5-этил-4-тиазолилметильную группу,
4-этил-5-тиазолилметильную группу,
2-фенил-4-тиазолилметильную группу,
2-фенил-5-тиазолилметильную группу,
2-фенил-6-тиазолилметильную группу,
6-фенил-2-тиазолилметильную группу,
5-фенил-2-тиазолилметильную группу,
4-фенил-2-тиазолилметильную группу,
5-фенил-4-тиазолилметильную группу,
4-фенил-5-тиазолилметильную группу,
5-(2-фторфенил)-2-тиазолилметильную группу,
5-(2,4-дифторфенил)-4-тиазолилметильную группу,
4-(2-фторфенил)-5-тиазолилметильную группу,
2-(2-фторфенил)-4-тиазолилметильную группу,
2-(2-фторфенил)-5-тиазолилметильную группу,
2-(3-фторфенил)-4-тиазолилметильную группу,
2-(3-фторфенил)-5-тиазолилметильную группу,
2-(4-фторфенил)-4-тиазолилметильную группу,
4-(2-фторфенил)-5-тиазолилметильную группу,
2-(2-хлорфенил)-4-тиазолилметильную группу,
2-(2-хлорфенил)-5-тиазолилметильную группу,
2-(3-хлорфенил)-4-тиазолилметильную группу,
2-(2-фторфенил)-5-тиазолилметильную группу,
2-(4-хлорфенил)-4-тиазолилметильную группу,
2-(4-хлорфенил)-5-тиазолилметильную группу или тому подобное.
Тетразолил-С1-6алкильная группа (которая может быть замещена в тетразольном кольце группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и С1-6алкильной группы) включает тетразолил-С1-6алкильную группу (которая может быть замещена в тетразольном кольце группой, выбранной из группы, состоящей из фенильной группы, незамещенной или замещенной 1-5 атомами галогена, и С1-6алкильной группы), например 5-(1H)-тетразолилметильную группу,
2-(5-(1H)-тетразолил)этильную группу,
1-(5-(1H)-тетразолил)этильную группу,
3-(5-(1H)-тетразолил)пропильную группу,
4-(5-(1H)-тетразолил)бутильную группу,
5-(5-(1H)-тетразолил)пентильную группу,
6-(5-(1H)-тетразолил)гексильную группу,
2-метил-3-(5-(1H)-тетразолил)пропильную группу,
1,1-диметил-2-(5-(1H)-тетразолил)этильную группу,
1-метил-5-(1H)-тетразолилметильную группу,
1-этил-5-(1H)-тетразолилметильную группу,
1-пропил-5-(1H)-тетразолилметильную группу,
1-бутил-5-(1H)-тетразолилметильную группу,
1-пентил-5-(1H)-тетразолилметильную группу,
1-гексил-5-(1H)-тетразолилметильную группу,
1-фенил-5-(1H)-тетразолилметильную группу,
1-(2-фторфенил)-5-(1H)-тетразолилметильную группу,
1-(3-фторфенил)-5-(1H)-тетразолилметильную группу,
1-(2,3,4,5,6-пентафторфенил)-5-(1H)-тетразолилметильную группу,
1-(2-хлорфенил)-5-(1H)-тетразолилметильную группу,
1-(3-хлорфенил)-5-(1H)-тетразолилметильную группу,
1-(2,4,6-трихлорфенил)-5-(1H)-тетразолилметильную группу,
1-(2-бромфенил)-5-(1H)-тетразолилметильную группу,
1-(2,3-дибромфенил)-5-(1H)-тетразолилметильную группу,
1-(4-бромфенил)-5-(1H)-тетразолилметильную группу,
2-(1-метил-5-(1H)-тетразолил)этильную группу,
2-(1-этил-5-(1H)-тетразолил)этильную группу,
2-(1-пропил-5-(1H)-тетразолил)этильную группу,
2-(1-бутил-5-(1H)-тетразолил)этильную группу,
2-(1-пентил-5-(1H)-тетразолил)этильную группу,
2-(1-гексил-5-(1H)-тетразолил)этильную группу,
2-(1-фенил-5-(1H)-тетразолил)этильную группу,
2-(1-(2-фторфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(3-фторфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(4-фторфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(2-хлорфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(3-хлорфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(4-хлорфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(2-бромфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(3-бромфенил)-5-(1H)-тетразолил)этильную группу,
2-(1-(4-бромфенил)-5-(1H)-тетразолил)этильную группу или тому подобное.
Пиперидиновое кольцо или 1,2,3,6-тетрагидропиридиновое кольцо, которое образуется объединением R32 и R33 вместе со смежным атомом азота через другой атом углерода (пиперидиновое кольцо или 1,2,3,6-тетрагидропиридиновое кольцо может содержать фенильную группу в качестве заместителя, а фенильная группа может содержать по крайней мере один заместитель, выбранный из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы в качестве заместителя), включает пиперидиновое кольцо и 1,2,3,6-тетрагидропиридиновое кольцо, которое может быть замещено фенильной группой в кольце, которая может быть замещена 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы в качестве заместителя, например пиперидиновую группу, 4-фенилпиперидиновую группу,
4-(2-фторфенил)пиперидиновую группу,
4-(3-фторфенил)пиперидиновую группу,
4-(3-фтор-4-трифторметилфенил)пиперидиновую группу,
4-(3,4,5-трихлорфенил)пиперидиновую группу,
4-(2,3,4,5,6-пентафторфенил)пиперидиновую группу,
4-(2,4-диметилфенил)пиперидиновую группу,
4-(2,4,6-триметилфенил)пиперидиновую группу,
4-(2-трифторметил-4-метилфенил)пиперидиновую группу,
4-(4-фторфенил)пиперидиновую группу,
4-(3,4-дифторфенил)пиперидиновую группу,
4-(2-хлорфенил)пиперидиновую группу,
4-(3-хлорфенил)пиперидиновую группу,
4-(4-хлорфенил)пиперидиновую группу,
4-(3,4-дихлорфенил)пиперидиновую группу,
4-(2-метилфенил)пиперидиновую группу,
4-(3-метилфенил)пиперидиновую группу,
4-(4-метилфенил)пиперидиновую группу,
4-(2-трифторметилфенил)пиперидиновую группу,
4-(3-трифторметилфенил)пиперидиновую группу,
4-(4-трифторметилфенил)пиперидиновую группу,
4-фенил-1,2,3,6-тетрагидропиридиновую группу,
4-(2-фторфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3-фторфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(4-фторфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3,4-дифторфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(2-хлорфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3-хлорфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(4-хлорфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3,4-дихлорфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(2-метилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3-метилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(4-метилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(2-трифторметилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3-фтор-4-трифторметилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(3,4,5-трихлорфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(2,3,4,5,6-пентафторфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(2,4-диметилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(2,4,6-триметилфенил)-1,2,3,6-тетрагидропиридиновую группу,
4-(2-трифторметил-4-метилфенил)-1,2,3,6-тетрагидропиридиновую группу или тому подобное.
Примеры С3-8циклоалкенильной группы включают циклопропенильную группу, циклобутенильную группу, циклопентенильную группу, циклогексенильную группу, циклогептенильную группу, циклооктенильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце по крайней мере 1-5 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, С1-4алкилендиоксигруппы, С1-6алкилсульфонильной группы, галогензамещенной или незамещенной С1-6алкилтиогруппы, нитрогруппы и аминогруппы, которая может содержать С1-6алканоильную группу в качестве заместителя) включает фенильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, С1-4алкилендиоксигруппы, С1-6алкилсульфонильной группы, галогензамещенной или незамещенной С1-6алкилтиогруппы, нитрогруппы и аминогруппы, которая может содержать 1-2 С1-6алканоильные группы в качестве заместителя (в случае С1-4алкилендиоксигруппы в качестве заместителя предпочтительными являются 1-3 заместителя)), например фенильную группу,
2-фторфенильную группу, 3-фторфенильную группу,
4-фторфенильную группу, 2-хлорфенильную группу,
3-хлорфенильную группу, 4-хлорфенильную группу,
2-бромфенильную группу, 3-бромфенильную группу,
4-бромфенильную группу, 2-иодфенильную группу,
3-иодфенильную группу, 4-иодфенильную группу,
2,3-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,6-дифторфенильную группу, 2,3-дихлорфенильную группу,
3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,6-дихлорфенильную группу,
3,4,5-трифторфенильную группу, 3,4,5-дихлорфенильную группу,
2,4,6-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
2,4,6-трихлорфенильную группу, 2-метилфенильную группу,
3-метилфенильную группу, 4-метилфенильную группу,
2,4-диметилфенильную группу, 2,4,6-триметилфенильную группу,
2-метил-3-хлорфенильную группу, 3-метил-4-хлорфенильную группу,
2-хлор-4-метилфенильную группу, 2-метил-3-фторфенильную группу,
2-трифторметилфенильную группу, 3-трифторметилфенильную группу,
4-трифторметилфенильную группу, 2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
2-метокси-3-хлорфенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 2,6-диметоксифенильную группу,
2,4,6-триметоксифенильную группу, 2,3,4-трифторфенильную группу,
3,4,5-трифторфенильную группу, 2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-пентоксифенильную группу, 4-гексилоксифенильную группу,
2,3-метилендиоксифенильную группу,
3,4-метилендиоксифенильную группу, 3-нитрофенильную группу,
2,3-динитрофенильную группу, 2,4,6-тринитрофенильную группу,
4-нитрофенильную группу, 3-метилтиофенильную группу,
4-метилтиофенильную группу, 3-трифторметилтиофенильную группу,
4-трифторметилтиофенильную группу,
3-метансульфонилфенильную группу,
4-метансульфонилфенильную группу,
2-метансульфонилфенильную группу, 2-аминофенил,
2,4-диаминофенил, 2,4,6-триаминофенил,
2-ацетиламинофенильную группу, 3-ацетиламинофенильную группу,
4-ацетиламинофенильную группу или тому подобное.
Бензофурильная группа (которая может быть замещена в бензофурановом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает бензофурильную группу (которая может быть замещена в бензофурановом кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например незамещенную 2-бензофурильную группу,
4-фтор-2-бензофурильную группу, 5-фтор-2-бензофурильную группу,
6-фтор-2-бензофурильную группу, 7-фтор-2-бензофурильную группу,
4-хлор-2-бензофурильную группу, 5-хлор-2-бензофурильную группу,
6-хлор-2-бензофурильную группу, 7-хлор-2-бензофурильную группу,
4-бром-2-бензофурильную группу, 5-бром-2-бензофурильную группу,
6-бром-2-бензофурильную группу, 7-бром-2-бензофурильную группу,
4-метил-2-бензофурильную группу,
5-метил-2-бензофурильную группу,
6-метил-2-бензофурильную группу,
7-метил-2-бензофурильную группу,
4-трифторметил-2-бензофурильную группу,
5-трифторметил-2-бензофурильную группу,
6-трифторметил-2-бензофурильную группу,
7-трифторметил-2-бензофурильную группу,
4-этил-2-бензофурильную группу, 5-этил-2-бензофурильную группу,
6-этил-2-бензофурильную группу, 7-этил-2-бензофурильную группу,
4-пентафторэтил-2-бензофурильную группу,
5-пентафторэтил-2-бензофурильную группу,
6-пентафторэтил-2-бензофурильную группу,
7-пентафторэтил-2-бензофурильную группу,
4-метокси-2-бензофурильную группу,
5-метокси-2-бензофурильную группу,
6-метокси-2-бензофурильную группу,
7-метокси-2-бензофурильную группу,
4-трифторметокси-2-бензофурильную группу,
5-трифторметокси-2-бензофурильную группу,
6-трифторметокси-2-бензофурильную группу,
7-трифторметокси-2-бензофурильную группу,
4-изопропил-2-бензофурильную группу,
5-изопропил-2-бензофурильную группу,
6-изопропил-2-бензофурильную группу,
7-изопропил-2-бензофурильную группу,
4-гексил-2-бензофурильную группу,
5-гексил-2-бензофурильную группу,
6-гексил-2-бензофурильную группу,
7-гексил-2-бензофурильную группу,
4-этокси-2-бензофурильную группу,
5-этокси-2-бензофурильную группу,
6-этокси-2-бензофурильную группу,
7-этокси-2-бензофурильную группу,
4-фтор-5-трифторметил-2-бензофурильную группу,
6-фтор-5-трифторметил-2-бензофурильную группу,
7-фтор-5-трифторметил-2-бензофурильную группу,
4-хлор-5-трифторметил-2-бензофурильную группу,
6-хлор-5-трифторметил-2-бензофурильную группу,
7-хлор-5-трифторметил-2-бензофурильную группу,
4-хлор-5-трифторметокси-2-бензофурильную группу,
6-хлор-5-трифторметокси-2-бензофурильную группу,
7-хлор-5-трифторметокси-2-бензофурильную группу,
3-бензофурильную группу, 4-фтор-3-бензофурильную группу,
5-фтор-3-бензофурильную группу, 6-фтор-3-бензофурильную группу,
7-фтор-3-бензофурильную группу, 4-хлор-3-бензофурильную группу,
5-хлор-3-бензофурильную группу, 6-хлор-3-бензофурильную группу,
7-хлор-3-бензофурильную группу, 4-бром-3-бензофурильную группу,
5-бром-3-бензофурильную группу, 6-бром-3-бензофурильную группу,
7-бром-3-бензофурильную группу, 4-метил-3-бензофурильную группу,
5-метил-3-бензофурильную группу,
6-метил-3-бензофурильную группу,
7-метил-3-бензофурильную группу,
4-трифторметил-3-бензофурильную группу,
5-трифторметил-3-бензофурильную группу,
6-трифторметил-3-бензофурильную группу,
7-трифторметил-3-бензофурильную группу,
4-этил-3-бензофурильную группу, 5-этил-3-бензофурильную группу,
6-этил-3-бензофурильную группу, 7-этил-3-бензофурильную группу,
4-пентафторэтил-3-бензофурильную группу,
5-пентафторэтил-3-бензофурильную группу,
6-пентафторэтил-3-бензофурильную группу,
7-пентафторэтил-3-бензофурильную группу,
4-метокси-3-бензофурильную группу,
5-метокси-3-бензофурильную группу,
6-метокси-3-бензофурильную группу,
7-метокси-3-бензофурильную группу,
4-трифторметокси-3-бензофурильную группу,
5-трифторметокси-3-бензофурильную группу,
6-трифторметокси-3-бензофурильную группу,
7-трифторметокси-3-бензофурильную группу,
4-изопропил-3-бензофурильную группу,
5-изопропил-3-бензофурильную группу,
6-изопропил-3-бензофурильную группу,
7-изопропил-3-бензофурильную группу,
4-гексил-3-бензофурильную группу,
5-гексил-3-бензофурильную группу,
6-гексил-3-бензофурильную группу,
7-гексил-3-бензофурильную группу,
4-этокси-3-бензофурильную группу,
5-этокси-3-бензофурильную группу,
6-этокси-3-бензофурильную группу,
7-этокси-3-бензофурильную группу,
4-фтор-5-трифторметил-3-бензофурильную группу,
6-фтор-5-трифторметил-3-бензофурильную группу,
7-фтор-5-трифторметил-3-бензофурильную группу,
4-хлор-5-трифторметил-3-бензофурильную группу,
6-хлор-5-трифторметил-3-бензофурильную группу,
7-хлор-5-трифторметил-3-бензофурильную группу,
4-хлор-5-трифторметокси-3-бензофурильную группу,
6-хлор-5-трифторметокси-3-бензофурильную группу,
6,7-дихлор-5-трифторметокси-3-бензофурильную группу,
5,6,7-трихлор-2-бензофурильную группу,
7-хлор-5-трифторметокси-3-бензофурильную группу или тому подобное.
Фурильная группа (которая может быть замещена в фурановом кольце фенильной группой, которая может содержать атом галогена в качестве заместителя) включает фурильную группу (которая может быть замещена в фурановом кольце 1-3 фенильными группами, которые могут содержать 1-5 атомов галогена в качестве заместителя), например 2-фурильную группу,
3,5-дифенил-2-фурильную группу,
2,4,5-трифенил-3-фурильную группу,
5-(4-хлорфенил)-2-фурильную группу,
4-(4-фторфенил)-2-фурильную группу,
4-(2,3,4,5,6-пентафторфенил)-2-фурильную группу,
3-(4-бромфенил)-2-фурильную группу, 3-фурильную группу,
5-(2,4-дихлорфенил)-3-фурильную группу,
4-(2,4,6-трихлорфенил)-3-фурильную группу,
3-(4-иодфенил)-3-фурильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; С3-8циклоалкильной группы; гидроксильной группы; галогензамещенной или незамещенной С1-8алкоксигруппы; С3-8циклоалкоксигруппы; С1-4алкилендиоксигруппы; цианогруппы; нитрогруппы; фенил-С2-6алкенильной группы; С2-6алканоилоксигруппы; аминогруппы, содержащей С1-6алканоильную группу в качестве заместителя; С1-6алкилсульфониламиногруппы; фенил-С1-6алкоксигруппы; феноксигруппы; аминогруппы, содержащей по крайней мере одну С1-6алкильную группу в качестве заместителя; аминогруппы, которая может содержать по крайней мере одну фенильную группу в качестве заместителя; амино-С1-6алкоксигруппы, которая может содержать по крайней мере одну С1-6алкильную группу в качестве заместителя; С1-6алкоксикарбонильной группы; С1-6алкоксикарбонил-С1-6алкоксигруппы; С1-6алкилтиогруппы; пирролильной группы; имидазолильной группы; пиперидильной группы; морфолиногруппы; пирролидинильной группы; тиенильной группы; бензофурильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, фенил-С1-6алкильной группы и бензоильной группы, которая может содержать по крайней мере одну С1-6алкильную группу в качестве заместителя); хинолильной группы, которая может быть замещена в хинолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы и оксогруппы; пиперидилкарбонильной группы, которая может быть замещена в пиперидиновом кольце карбостирильной группой; и триазолильной группы) включает фенильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена; галогензамещенной или незамещенной С1-6алкильной группы; С3-8циклоалкильной группы; гидроксильной группы; галогензамещенной или незамещенной С1-8алкоксигруппы; С3-8циклоалкоксигруппы; С1-4алкилендиоксигруппы; цианогруппы; нитрогруппы; фенил-С2-6алкенильной группы; С2-6алканоилоксигруппы; аминогруппы, которая может содержать 1-2 С1-6алканоильные группы в качестве заместителя; С1-6алкилсульфониламиногруппы; фенил-С1-6алкоксигруппы; феноксигруппы; аминогруппы, содержащей 1-2 С1-6алкильные группы в качестве заместителя; аминогруппы, содержащей 1-2 фенильные группы в качестве заместителя; амино-С1-6алкоксигруппы, которая может содержать 1-2 С1-6алкильные группы в качестве заместителя; С1-6алкоксикарбонильной группы; С1-6алкоксикарбонил-С1-6алкоксигруппы; С1-6алкилтиогруппы; пирролильной группы; имидазолильной группы; пиперидильной группы; морфолиногруппы; пирролидинильной группы; тиенильной группы; бензофурильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, фенил-С1-6алкильной группы и бензоильной группы, которая может содержать 1-3 С1-6алкильные группы в качестве заместителя); хинолильной группы, которая может быть замещена в хинолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы и оксогруппы; пиперидилкарбонильной группы, которая может быть замещена в пиперидиновом кольце карбостирильной группой; и триазолильной группы (в случае 1-3 С1-4алкилендиоксигрупп в качестве заместителя предпочтительными являются 1-3 заместителя)), например фенильную группу,
2-фторфенильную группу, 3-фторфенильную группу,
4-фторфенильную группу, 2-хлорфенильную группу,
3-хлорфенильную группу, 4-хлорфенильную группу,
2-бромфенильную группу, 3-бромфенильную группу,
4-бромфенильную группу, 2-иодфенильную группу,
3-иодфенильную группу, 4-иодфенильную группу,
2,3-дифторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,6-дифторфенильную группу, 2,3-дихлорфенильную группу,
3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,6-дихлорфенильную группу,
2,3,4-трифторфенильную группу, 3,4,5-трифторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
2,4,6-трихлорфенильную группу, 2-фтор-4-хлорфенильную группу,
2-фтор-4-бромфенильную группу, 3-фтор-4-хлорфенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2,6-диметилфенильную группу,
2,4,6-триметилфенильную группу,
2-метил-3-хлорфенильную группу, 3-метил-4-хлорфенильную группу,
2-хлор-4-метилфенильную группу, 2-метил-3-фторфенильную группу,
2-трифторметилфенильную группу, 3-трифторметилфенильную группу,
4-трифторметилфенильную группу,
3,5-ди(трифторметил)фенильную группу,
3,4-ди(трифторметил)фенильную группу,
2,4-ди(трифторметил)фенильную группу,
2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
4-н-бутилфенильную группу, 4-н-пентилфенильную группу,
4-н-гексилфенильную группу, 2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
2-метокси-3-хлорфенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 4-циклопропилфенильную группу,
4-циклобутилфенильную группу, 4-циклопентилфенильную группу,
4-циклогексилфенильную группу, 4-циклогептилфенильную группу,
4-циклооктилфенильную группу, 2,6-диметоксифенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
2,3-ди(трифторметокси)фенильную группу,
3,5-ди(трифторметокси)фенильную группу,
2,4-ди(трифторметокси)фенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу, 4-н-гексилоксифенильную группу,
4-н-гептилоксифенильную группу, 4-н-октилоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-циклопропоксифенильную группу, 4-циклобутоксифенильную группу,
4-циклопентоксифенильную группу,
4-циклогексилоксифенильную группу,
4-циклогептилоксифенильную группу,
4-циклооктилоксифенильную группу, 4-пентоксифенильную группу,
4-гексилоксифенильную группу, 2-гидроксифенильную группу,
3-гидроксифенильную группу, 4-гидроксифенильную группу,
2,4-дигидроксифенильную группу,
2,4,6-тригидроксифенильную группу,
2-метокси-3-хлорфенильную группу,
2-фтор-3-гидроксифенильную группу,
2-фтор-4-гидроксифенильную группу,
2,3-метилендиоксифенильную группу,
3,4-метилендиоксифенильную группу,
2,3-этилендиоксифенильную группу,
3,4-этилендиоксифенильную группу, 2-цианофенильную группу,
3-цианофенильную группу,
4-цианофенильную группу, 2,3-дицианофенильную группу,
2,4,6-трицианофенильную группу, 2-нитрофенильную группу,
3-нитрофенильную группу, 4-нитрофенильную группу,
2,4-динитрофенильную группу, 2,4,6-тринитрофенильную группу,
2-циннамилфенильную группу, 3-циннамилфенильную группу,
4-циннамилфенильную группу, 2-ацетилоксифенильную группу,
3-ацетилоксифенильную группу, 2-аминофенильную группу,
2,4-диаминофенильную группу, 2,4,6-триаминофенильную группу,
4-ацетилоксифенильную группу, 2-пропионилоксифенильную группу,
3-пропионилоксифенильную группу,
4-пропионилоксифенильную группу, 2-бутирилоксифенильную группу,
3-бутирилоксифенильную группу, 4-бутирилоксифенильную группу,
4-пентаноилоксифенильную группу,
4-гексаноилоксифенильную группу, 2-ацетиламинофенильную группу,
3-ацетиламинофенильную группу, 4-ацетиламинофенильную группу,
2-пропиониламинофенильную группу,
3-пропиониламинофенильную группу,
4-пропиониламинофенильную группу,
2-бутириламинофенильную группу, 3-бутириламинофенильную группу,
4-бутириламинофенильную группу,
4-пентаноиламинофенильную группу,
4-гексаноиламинофенильную группу,
2-метансульфониламинофенильную группу,
3-метансульфониламинофенильную группу,
4-метансульфониламинофенильную группу,
2-бензилоксифенильную группу, 3-бензилоксифенильную группу,
4-бензилоксифенильную группу, 2-(2-фенилэтокси)фенильную группу,
3-(2-фенилэтокси)фенильную группу,
4-(2-фенилэтокси)фенильную группу,
2-(3-фенилпропокси)фенильную группу,
3-(3-фенилпропокси)фенильную группу,
4-(3-фенилпропокси)фенильную группу,
2-(4-фенилбутокси)фенильную группу,
3-(4-фенилбутокси)фенильную группу,
4-(4-фенилбутокси)фенильную группу,
2-(5-фенилпентокси)фенильную группу,
3-(5-фенилпентокси)фенильную группу,
4-(5-фенилпентокси)фенильную группу,
2-(6-фенилгексилокси)фенильную группу,
3-(6-фенилгексилокси)фенильную группу,
4-(6-фенилгексилокси)фенильную группу,
2-феноксифенильную группу, 3-феноксифенильную группу,
4-феноксифенильную группу, 2-метиламинофенильную группу,
3-этиламинофенильную группу, 4-пропиламинофенильную группу,
2-н-бутиламинофенильную группу, 3-н-пентиламинофенильную группу,
4-н-гексиламинофенильную группу, 2-диметиламинофенильную группу,
3-диметиламинофенильную группу, 4-диметиламинофенильную группу,
2-диэтиламинофенильную группу, 3-диэтиламинофенильную группу,
4-диэтиламинофенильную группу,
2-ди(н-пропил)аминофенильную группу,
3-ди(н-пропил)аминофенильную группу,
4-ди(н-пропил)аминофенильную группу,
3-фениламинофенильную группу, 2-дифениламинофенильную группу,
3-дифениламинофенильную группу, 4-дифениламинофенильную группу,
2-(2-метиламиноэтокси)фенильную группу,
3-этиламинометоксифенильную группу,
2-(2-диметиламиноэтокси)фенильную группу,
3-(2-диметиламиноэтокси)фенильную группу,
4-(2-диметиламиноэтокси)фенильную группу,
2-(3-диметиламинопропокси)фенильную группу,
3-(3-диметиламинопропокси)фенильную группу,
4-(3-диметиламинопропокси)фенильную группу,
4-(4-диметиламинобутокси)фенильную группу,
4-(5-диметиламинопентокси)фенильную группу,
4-(6-диметиламиногексилокси)фенильную группу,
2-(2-диэтиламиноэтокси)фенильную группу,
3-(2-диэтиламиноэтокси)фенильную группу,
4-(2-диэтиламиноэтокси)фенильную группу,
2-(3-диэтиламинопропокси)фенильную группу,
3-(3-диэтиламинопропокси)фенильную группу,
4-(3-диэтиламинопропокси)фенильную группу,
4-(4-диэтиламинобутокси)фенильную группу,
4-(5-диэтиламинопентокси)фенильную группу,
4-(6-диэтиламиногексилокси)фенильную группу,
2-метоксикарбонилфенильную группу,
3-метоксикарбонилфенильную группу,
4-метоксикарбонилфенильную группу,
2-этоксикарбонилфенильную группу,
3-этоксикарбонилфенильную группу,
4-этоксикарбонилфенильную группу,
4-(3-пропоксикарбонил)фенильную группу,
4-(4-бутоксикарбонил)фенильную группу,
4-(5-пентоксикарбонил)фенильную группу,
4-(6-гексилоксикарбонил)фенильную группу,
2-метоксикарбонилметоксифенильную группу,
3-метоксикарбонилметоксифенильную группу,
4-метоксикарбонилметоксифенильную группу,
2-этоксикарбонилметоксифенильную группу,
3-этоксикарбонилметоксифенильную группу,
4-этоксикарбонилметоксифенильную группу,
4-(3-пропоксикарбонил)метоксифенильную группу,
4-(4-бутоксикарбонил)метоксифенильную группу,
4-(5-пентоксикарбонил)метоксифенильную группу,
4-(6-гексилоксикарбонил)метоксифенильную группу,
4-(2-метоксикарбонил)этоксифенильную группу,
4-(2-этоксикарбонил)этоксифенильную группу,
4-(2-(3-пропоксикарбонил)этокси)фенильную группу,
4-(2-(4-бутоксикарбонил)этокси)фенильную группу,
4-(2-(5-пентоксикарбонил)этокси)фенильную группу,
4-(2-(6-гексилоксикарбонил)этокси)фенильную группу,
4-(3-метоксикарбонилпропокси)фенильную группу,
4-(3-(2-этоксикарбонил)пропокси)фенильную группу,
4-(3-(3-пропоксикарбонил)пропокси)фенильную группу,
4-(3-(4-бутоксикарбонил)пропокси)фенильную группу,
4-(3-(5-пентоксикарбонил)пропокси)фенильную группу,
4-(3-(6-гексилоксикарбонил)пропокси)фенильную группу,
4-(4-метоксикарбонилбутокси)фенильную группу,
4-(4-(2-этоксикарбонил)бутокси)фенильную группу,
4-(5-метоксикарбонилпентокси)фенильную группу,
4-(5-(2-этоксикарбонил)пентокси)фенильную группу,
4-(6-(2-этоксикарбонил)гексилокси)фенильную группу,
2-метилтиофенильную группу, 3-метилтиофенильную группу,
4-метилтиофенильную группу, 4-этилтиофенильную группу,
4-н-пропилтиофенильную группу, 4-изопропилтиофенильную группу,
4-н-бутилтиофенильную группу, 4-трет-бутилтиофенильную группу,
4-н-пентилтиофенильную группу, 4-н-гексилтиофенильную группу,
2-(1-пирролил)фенильную группу, 3-(1-пирролил)фенильную группу,
4-(1-пирролил)фенильную группу,
2-(1-имидазолил)фенильную группу,
3-(1-имидазолил)фенильную группу,
4-(1-имидазолил)фенильную группу, 2-пиперидинофенильную группу,
3-пиперидинофенильную группу, 4-пиперидинофенильную группу,
4-морфолинофенильную группу, 3-морфолинофенильную группу,
2-морфолинофенильную группу, 2-(1-пирролидинил)фенильную группу,
3-(1-пирролидинил)фенильную группу,
4-(1-пирролидинил)фенильную группу,
2-(2-тиенил)фенильную группу, 3-(2-тиенил)фенильную группу,
4-(2-тиенил)фенильную группу, 2-(2-бензофурил)фенильную группу,
3-(2-бензофурил)фенильную группу,
4-(2-бензофурил)фенильную группу,
2-(1-пиперазинил)фенильную группу,
3-(1-пиперазинил)фенильную группу,
4-(1-пиперазинил)фенильную группу,
2-(4-метил-1-пиперазинил)фенильную группу,
3-(4-метил-1-пиперазинил)фенильную группу,
4-(4-метил-1-пиперазинил)фенильную группу,
4-(4-этил-1-пиперазинил)фенильную группу,
4-(4-н-пропил-1-пиперазинил)фенильную группу,
4-(4-изопропил-1-пиперазинил)фенильную группу,
4-(4-н-бутил-1-пиперазинил)фенильную группу,
4-(4-трет-бутил-1-пиперазинил)фенильную группу,
4-(4-н-пентил-1-пиперазинил)фенильную группу,
4-(4-н-гексил-1-пиперазинил)фенильную группу,
4-(4-бензил-1-пиперазинил)фенильную группу,
4-(4-(2-фенетил)-1-пиперазинил)фенильную группу,
4-(4-(3-фенилпропил)-1-пиперазинил)фенильную группу,
4-(4-(4-фенилбутил)-1-пиперазинил)фенильную группу,
4-(4-(5-фенилпентил)-1-пиперазинил)фенильную группу,
4-(4-(6-фенилгексил)-1-пиперазинил)фенильную группу,
4-(4-бензоил-1-пиперазинил)фенильную группу,
4-(4-(2-метилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(2,3-диметилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(2,4,6-триметилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(3-метилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(4-метилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(4-этилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(4-изопропилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(4-н-бутилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(4-н-пентилбензоил)-1-пиперазинил)фенильную группу,
4-(4-(4-н-гексилбензоил)-1-пиперазинил)фенильную группу,
3-(2-хинолил)фенильную группу,
4-(4,5,6-триметокси-3-хинолил)фенильную группу,
4-(6-метокси-2-хинолил)фенильную группу,
2-(5,6-диметокси-4-хинолил)фенильную группу,
3-(2-оксо-3-хинолил)фенильную группу,
4-(2-оксо-3-хинолил)фенильную группу,
3-(5-метокси-2-оксо-3-хинолил)фенильную группу,
4-(5-метокси-2-оксо-3-хинолил)фенильную группу,
3-(6-метокси-2-оксо-7-хинолил)фенильную группу,
4-(6-метокси-2-оксо-3-хинолил)фенильную группу,
3-(7-метокси-2-оксо-6-хинолил)фенильную группу,
4-(7-метокси-2-оксо-8-хинолил)фенильную группу,
3-(8-метокси-2-оксо-3-хинолил)фенильную группу,
4-(8-метокси-2-оксо-3-хинолил)фенильную группу,
3-(5,6-диэтокси-2-оксо-4-хинолил)фенильную группу,
4-(5-этокси-2-оксо-3-хинолил)фенильную группу,
3-(6-этокси-2-оксо-5-хинолил)фенильную группу,
4-(6-этокси-2-оксо-3-хинолил)фенильную группу,
3-(7-этокси-2-оксо-3-хинолил)фенильную группу,
4-(7-этокси-2-оксо-3-хинолил)фенильную группу,
3-(8-этокси-2-оксо-3-хинолил)фенильную группу,
4-(8-этокси-2-оксо-3-хинолил)фенильную группу,
3-(1-пиперидинилкарбонил)фенильную группу,
4-(4-(карбостирил-1-ил)пиперидинил-1-карбонил)фенильную группу, 4-(1,2,4-триазол-1-ил)фенильную группу или тому подобное.
Нафтильная группа, которая может быть замещена в нафталиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, включает нафтильную группу, которая может быть замещена в нафталиновом кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать 1-2 С1-6алкильные группы в качестве заместителя, например 1-нафтилметильную группу,
2-(2-нафтил)этильную группу, 1-(3-нафтил)этильную группу,
3-(4-нафтил)пропильную группу, 4-(5-нафтил)бутильную группу,
5-(6-нафтил)пентильную группу, 6-(7-нафтил)гексильную группу,
2-метил-3-(8-нафтил)пропильную группу,
1,1-диметил-2-(3-нафтил)этильную группу,
2-фтор-1-нафтильную группу, 2-хлор-1-нафтильную группу,
2-бром-1-нафтильную группу, 3-фтор-1-нафтильную группу,
3-хлор-1-нафтильную группу, 3-бром-1-нафтильную группу,
4-фтор-1-нафтильную группу, 4-хлор-1-нафтильную группу,
4-бром-1-нафтильную группу, 5-фтор-1-нафтильную группу,
5-хлор-1-нафтильную группу, 5-бром-1-нафтильную группу,
6-фтор-1-нафтильную группу, 6-хлор-1-нафтильную группу,
6-бром-1-нафтильную группу, 7-фтор-1-нафтильную группу,
7-хлор-1-нафтильную группу, 7-бром-1-нафтильную группу,
1-фтор-2-нафтильную группу, 8-фтор-1-нафтильную группу,
8-хлор-1-нафтильную группу, 8-бром-1-нафтильную группу,
1-фтор-2-нафтильную группу, 1-хлор-2-нафтильную группу,
1-бром-2-нафтильную группу, 3-фтор-2-нафтильную группу,
3-хлор-2-нафтильную группу, 3-бром-2-нафтильную группу,
4-фтор-2-нафтильную группу, 4-хлор-2-нафтильную группу,
4-бром-2-нафтильную группу, 4-диметиламино-1-нафтильную группу,
2-метокси-1-нафтильную группу, 3-метокси-1-нафтильную группу,
4-метокси-1-нафтильную группу, 5-метокси-1-нафтильную группу,
6-метокси-1-нафтильную группу, 7-метокси-1-нафтильную группу,
8-метокси-1-нафтильную группу,
2-трифторметокси-1-нафтильную группу,
3-трифторметокси-1-нафтильную группу,
4-трифторметокси-1-нафтильную группу,
5-трифторметокси-1-нафтильную группу,
6-трифторметокси-1-нафтильную группу,
7-трифторметокси-1-нафтильную группу,
8-трифторметокси-1-нафтильную группу,
3-амино-2-нафтильную группу, 2-метиламино-1-нафтильную группу,
4-этиламино-2-нафтильную группу,
5-пропиламино-1-нафтильную группу,
6-н-бутиламино-2-нафтильную группу,
7-н-пентиламино-1-нафтильную группу,
8-гексиламино-2-нафтильную группу,
2,3-дихлор-1-нафтильную группу,
2,4,6-трихлор-1-нафтильную группу,
2-хлор-4-трифторметокси-1-нафтильную группу,
2-хлор-6-диметиламино-1-нафтильную группу,
2-диметиламино-1-нафтильную группу,
3-диметиламино-1-нафтильную группу,
4-диметиламино-1-нафтильную группу,
5-диметиламино-1-нафтильную группу,
6-диметиламино-1-нафтильную группу,
7-диметиламино-1-нафтильную группу,
8-диметиламино-1-нафтильную группу,
1-метокси-2-нафтильную группу, 3-метокси-2-нафтильную группу,
4-метокси-2-нафтильную группу, 5-метокси-2-нафтильную группу,
6-метокси-2-нафтильную группу, 7-метокси-2-нафтильную группу,
8-метокси-2-нафтильную группу,
1-трифторметокси-2-нафтильную группу,
3-трифторметокси-2-нафтильную группу,
4-трифторметокси-2-нафтильную группу,
5-трифторметокси-2-нафтильную группу,
6-трифторметокси-2-нафтильную группу,
7-трифторметокси-2-нафтильную группу,
8-трифторметокси-2-нафтильную группу,
1-диметиламино-2-нафтильную группу,
3-диметиламино-2-нафтильную группу,
4-диметиламино-2-нафтильную группу,
5-диметиламино-2-нафтильную группу,
6-диметиламино-2-нафтильную группу,
7-диметиламино-2-нафтильную группу,
8-диметиламино-2-нафтильную группу или тому подобное.
Бифенилильная группа (которая может быть замещена в бифенилильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-9алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает бифенилильную группу (которая может быть замещена в бифенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-9алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например 3-бифенилильную группу,
4-бифенилильную группу,
2'-фтор-3-бифенилильную группу, 3'-фтор-3-бифенилильную группу,
4'-фтор-3-бифенилильную группу,
3',4'-дифтор-3-бифенилильную группу,
3',4',5'-трихлор-3-бифенилильную группу,
2',3',4',5',6'-пентафтор-4-бифенилильную группу,
2'-фтор-3',4'-дитрифторметил-3-бифенилильную группу,
2',4'-дитрифтор-3-бифенилильную группу,
3',5'-дифтор-3-бифенилильную группу,
2'-хлор-3-бифенилильную группу, 3'-хлор-3-бифенилильную группу,
4'-хлор-3-бифенилильную группу,
3',4'-дихлор-3-бифенилильную группу,
2',4'-дихлор-3-бифенилильную группу,
3',5'-дихлор-3-бифенилильную группу,
2'-метил-3-бифенилильную группу,
3'-метил-3-бифенилильную группу,
4'-метил-3-бифенилильную группу,
3',4'-диметил-3-бифенилильную группу,
2',4'-диметил-3-бифенилильную группу,
3',5'-диметил-3-бифенилильную группу,
2'-трифторметил-3-бифенилильную группу,
3'-трифторметил-3-бифенилильную группу,
4'-трифторметил-3-бифенилильную группу,
3',4'-дитрифторметил-3-бифенилильную группу,
2',4'-дитрифторметил-3-бифенилильную группу,
3',5'-дитрифторметил-3-бифенилильную группу,
2'-метокси-3-бифенилильную группу,
3'-метокси-3-бифенилильную группу,
4'-метокси-3-бифенилильную группу,
3',4'-диметокси-3-бифенилильную группу,
2',4'-диметокси-3-бифенилильную группу,
3',4',5'-триметокси-3-бифенилильную группу,
3',5'-диметокси-3-бифенилильную группу,
2'-трифторметокси-3-бифенилильную группу,
3'-трифторметокси-3-бифенилильную группу,
4'-трифторметокси-3-бифенилильную группу,
3',4'-дитрифторметокси-3-бифенилильную группу,
2',4'-дитрифторметокси-3-бифенилильную группу,
3',5'-дитрифторметокси-3-бифенилильную группу,
2'-фтор-4-бифенилильную группу, 3'-фтор-4-бифенилильную группу,
4'-фтор-4-бифенилильную группу,
3',4'-дифтор-4-бифенилильную группу,
2',4'-дифтор-4-бифенилильную группу,
3',5'-дифтор-4-бифенилильную группу,
2'-хлор-4-бифенилильную группу, 3'-хлор-4-бифенилильную группу,
4'-хлор-4-бифенилильную группу,
3',4'-дихлор-4-бифенилильную группу,
2',4'-дихлор-4-бифенилильную группу,
3',5'-дихлор-4-бифенилильную группу,
2'-метил-4-бифенилильную группу,
3'-метил-4-бифенилильную группу,
4'-метил-4-бифенилильную группу, 4'-этил-4-бифенилильную группу,
4'-н-пропил-4-бифенилильную группу,
4'-н-бутил-4-бифенилильную группу,
4'-н-пентил-4-бифенилильную группу,
4'-н-гексил-4-бифенилильную группу,
4'-н-гептил-4-бифенилильную группу,
4'-н-октил-4-бифенилильную группу,
4'-н-нонил-4-бифенилильную группу,
3',4'-диметил-4-бифенилильную группу,
2',4'-диметил-4-бифенилильную группу,
3',5'-диметил-4-бифенилильную группу,
3',4',5'-триметил-4-бифенилильную группу,
2'-трифторметил-4-бифенилильную группу,
3'-трифторметил-4-бифенилильную группу,
4'-трифторметил-4-бифенилильную группу,
3',4'-дитрифторметил-4-бифенилильную группу,
2',4'-дитрифторметил-4-бифенилильную группу,
3',5'-дитрифторметил-4-бифенилильную группу,
2'-метокси-4-бифенилильную группу,
3'-метокси-4-бифенилильную группу,
4'-метокси-4-бифенилильную группу,
3',4'-диметокси-4-бифенилильную группу,
2',4'-диметокси-4-бифенилильную группу,
3',4'-диметокси-2'-хлор-4-бифенилильную группу,
3',5'-диметокси-4-бифенилильную группу,
2'-трифторметокси-4-бифенилильную группу,
3'-трифторметокси-4-бифенилильную группу,
4'-трифторметокси-4-бифенилильную группу,
3',4'-дитрифторметокси-4-бифенилильную группу,
2',4'-дитрифторметокси-4-бифенилильную группу,
3',5'-дитрифторметокси-4-бифенилильную группу или тому подобное.
Бензотиенильная группа (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает бензотиенильную группу (которая может быть замещена в бензотиофеновом кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например 2-бензотиенильную группу, 3-бензотиенильную группу,
3-метил-2-бензотиенильную группу,
2-метил-3-бензотиенильную группу,
4-фтор-2-бензотиенильную группу,
5-фтор-2-бензотиенильную группу,
4,5,6-трихлор-2-бензотиенильную группу,
6-фтор-2-бензотиенильную группу,
7-фтор-2-бензотиенильную группу,
4-хлор-2-бензотиенильную группу,
5-хлор-2-бензотиенильную группу,
6-хлор-2-бензотиенильную группу,
7-хлор-2-бензотиенильную группу,
4-бром-2-бензотиенильную группу,
5-бром-2-бензотиенильную группу,
6-бром-2-бензотиенильную группу,
7-бром-2-бензотиенильную группу,
5-метил-2-бензотиенильную группу,
6-метил-2-бензотиенильную группу,
7-метил-2-бензотиенильную группу,
4-трифторметил-2-бензотиенильную группу,
5-трифторметил-2-бензотиенильную группу,
6-трифторметил-2-бензотиенильную группу,
7-трифторметил-2-бензотиенильную группу,
4-этил-2-бензотиенильную группу,
5-этил-2-бензотиенильную группу,
6-этил-2-бензотиенильную группу,
7-этил-2-бензотиенильную группу,
4-пентафторэтил-2-бензотиенильную группу,
5-пентафторэтил-2-бензотиенильную группу,
6-пентафторэтил-2-бензотиенильную группу,
7-пентафторэтил-2-бензотиенильную группу,
4-метокси-2-бензотиенильную группу,
5-метокси-2-бензотиенильную группу,
6-метокси-2-бензотиенильную группу,
7-метокси-2-бензотиенильную группу,
4-трифторметокси-2-бензотиенильную группу,
5-трифторметокси-2-бензотиенильную группу,
6-трифторметокси-2-бензотиенильную группу,
7-трифторметокси-2-бензотиенильную группу,
4-фтор-3-метил-2-бензотиенильную группу,
5-фтор-3-метил-2-бензотиенильную группу,
6-фтор-3-метил-2-бензотиенильную группу,
7-фтор-3-метил-2-бензотиенильную группу,
4-хлор-3-метил-2-бензотиенильную группу,
5-хлор-3-метил-2-бензотиенильную группу,
6-хлор-3-метил-2-бензотиенильную группу,
7-хлор-3-метил-2-бензотиенильную группу,
4-бром-3-метил-2-бензотиенильную группу,
5-бром-3-метил-2-бензотиенильную группу,
6-бром-3-метил-2-бензотиенильную группу,
7-бром-3-метил-2-бензотиенильную группу,
5-метил-3-метил-2-бензотиенильную группу,
6-метил-3-метил-2-бензотиенильную группу,
7-метил-3-метил-2-бензотиенильную группу,
3,4,6-триметил-2-бензотиенильную группу,
4,5,6-триметокси-2-бензотиенильную группу,
4-трифторметил-3-метил-2-бензотиенильную группу,
5-трифторметил-3-метил-2-бензотиенильную группу,
6-трифторметил-3-метил-2-бензотиенильную группу,
7-трифторметил-3-метил-2-бензотиенильную группу,
4-этил-3-метил-2-бензотиенильную группу,
5-этил-3-метил-2-бензотиенильную группу,
6-этил-3-метил-2-бензотиенильную группу,
7-этил-3-метил-2-бензотиенильную группу,
4-пентафторэтил-3-метил-2-бензотиенильную группу,
5-пентафторэтил-3-метил-2-бензотиенильную группу,
6-пентафторэтил-3-метил-2-бензотиенильную группу,
7-пентафторэтил-3-метил-2-бензотиенильную группу,
4-метокси-3-метил-2-бензотиенильную группу,
5-метокси-3-метил-2-бензотиенильную группу,
6-метокси-3-метил-2-бензотиенильную группу,
7-метокси-3-метил-2-бензотиенильную группу,
4-трифторметокси-3-метил-2-бензотиенильную группу,
5-трифторметокси-3-метил-2-бензотиенильную группу,
6-трифторметокси-3-метил-2-бензотиенильную группу,
7-трифторметокси-3-метил-2-бензотиенильную группу,
4-изопропил-2-бензотиенильную группу,
5-изопропил-3-метил-2-бензотиенильную группу,
6-изопропил-2-бензотиенильную группу,
7-изопропил-2-бензотиенильную группу,
4-гексил-2-бензотиенильную группу,
5-гексил-2-бензотиенильную группу,
6-гексил-2-бензотиенильную группу,
7-гексил-2-бензотиенильную группу,
4-этокси-2-бензотиенильную группу,
5-этокси-2-бензотиенильную группу,
6-этокси-2-бензотиенильную группу,
7-этокси-2-бензотиенильную группу,
4-фтор-5-трифторметил-2-бензотиенильную группу,
6-фтор-5-трифторметил-2-бензотиенильную группу,
7-фтор-5-трифторметил-2-бензотиенильную группу,
4-хлор-5-трифторметил-2-бензотиенильную группу,
6-хлор-5-трифторметил-2-бензотиенильную группу,
7-хлор-5-трифторметил-2-бензотиенильную группу,
4-хлор-5-трифторметокси-2-бензотиенильную группу,
6-хлор-5-трифторметокси-2-бензотиенильную группу,
7-хлор-5-трифторметокси-2-бензотиенильную группу,
4-фтор-3-бензотиенильную группу,
5-фтор-3-бензотиенильную группу,
6-фтор-3-бензотиенильную группу,
7-фтор-3-бензотиенильную группу,
4-хлор-3-бензотиенильную группу,
5-хлор-3-бензотиенильную группу,
6-хлор-3-бензотиенильную группу,
7-хлор-3-бензотиенильную группу,
4-бром-3-бензотиенильную группу,
5-бром-3-бензотиенильную группу,
6-бром-3-бензотиенильную группу,
7-бром-3-бензотиенильную группу,
4-фтор-3-бензотиенильную группу,
5-метил-3-бензотиенильную группу,
6-метил-3-бензотиенильную группу,
7-метил-3-бензотиенильную группу,
4-трифторметил-3-бензотиенильную группу,
5-трифторметил-3-бензотиенильную группу,
6-трифторметил-3-бензотиенильную группу,
7-трифторметил-3-бензотиенильную группу,
4-фтор-2-метил-3-бензотиенильную группу,
5-фтор-2-метил-3-бензотиенильную группу,
6-фтор-2-метил-3-бензотиенильную группу,
7-фтор-2-метил-3-бензотиенильную группу,
4-хлор-2-метил-3-бензотиенильную группу,
5-хлор-2-метил-3-бензотиенильную группу,
6-хлор-2-метил-3-бензотиенильную группу,
7-хлор-2-метил-3-бензотиенильную группу,
4-бром-2-метил-3-бензотиенильную группу,
5-бром-2-метил-3-бензотиенильную группу,
6-бром-2-метил-3-бензотиенильную группу,
7-бром-2-метил-3-бензотиенильную группу,
4-фтор-2-метил-3-бензотиенильную группу,
5-метил-2-метил-3-бензотиенильную группу,
6-метил-2-метил-3-бензотиенильную группу,
7-метил-2-метил-3-бензотиенильную группу,
4-трифторметил-2-метил-3-бензотиенильную группу,
5-трифторметил-2-метил-3-бензотиенильную группу,
6-трифторметил-2-метил-3-бензотиенильную группу,
7-трифторметил-2-метил-3-бензотиенильную группу,
4-этил-3-бензотиенильную группу,
5-этил-3-бензотиенильную группу,
6-этил-3-бензотиенильную группу,
7-этил-3-бензотиенильную группу,
4-пентафторэтил-3-бензотиенильную группу,
5-пентафторэтил-3-бензотиенильную группу,
6-пентафторэтил-3-бензотиенильную группу,
7-пентафторэтил-3-бензотиенильную группу,
4-метокси-3-бензотиенильную группу,
5-метокси-3-бензотиенильную группу,
6-метокси-3-бензотиенильную группу,
7-метокси-3-бензотиенильную группу,
4-трифторметокси-3-бензотиенильную группу,
5-трифторметокси-3-бензотиенильную группу,
6-трифторметокси-3-бензотиенильную группу,
7-трифторметокси-3-бензотиенильную группу,
4-изопропил-3-бензотиенильную группу,
5-изопропил-3-бензотиенильную группу,
6-изопропил-3-бензотиенильную группу,
7-изопропил-3-бензотиенильную группу,
4-гексил-3-бензотиенильную группу,
5-гексил-3-бензотиенильную группу,
6-гексил-3-бензотиенильную группу,
7-гексил-3-бензотиенильную группу,
4-этокси-3-бензотиенильную группу,
5-этокси-3-бензотиенильную группу,
6-этокси-3-бензотиенильную группу,
7-этокси-3-бензотиенильную группу,
4-фтор-5-трифторметил-3-бензотиенильную группу,
6-фтор-5-трифторметил-3-бензотиенильную группу,
7-фтор-5-трифторметил-3-бензотиенильную группу,
4-хлор-5-трифторметил-3-бензотиенильную группу,
6-хлор-5-трифторметил-3-бензотиенильную группу,
7-хлор-5-трифторметил-3-бензотиенильную группу,
4-хлор-5-трифторметокси-3-бензотиенильную группу,
6-хлор-5-трифторметокси-3-бензотиенильную группу,
7-хлор-5-трифторметокси-3-бензотиенильную группу или тому подобное.
Пиридильная группа (которая может быть замещена в пиридиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), фурильной группы и тиенильной группы) включает пиридильную группу (которая может быть замещена в пиридиновом кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), фурильной группы и тиенильной группы), например незамещенную 2-пиридильную группу,
3-пиридильную группу, 4-пиридильную группу,
3-фтор-2-пиридильную группу,
4-фтор-2-пиридильную группу, 5-фтор-2-пиридильную группу,
6-фтор-2-пиридильную группу, 3-хлор-2-пиридильную группу,
4-хлор-2-пиридильную группу, 5-хлор-2-пиридильную группу,
6-хлор-2-пиридильную группу,
6-хлор-4-метил-2-пиридильную группу,
3,4,5-трихлор-2-пиридильную группу,
3-метил-2-пиридильную группу, 4-метил-2-пиридильную группу,
5-метил-2-пиридильную группу, 6-метил-2-пиридильную группу,
3-этил-2-пиридильную группу, 4-этил-2-пиридильную группу,
5-этил-2-пиридильную группу, 6-этил-2-пиридильную группу,
3-н-пропил-2-пиридильную группу,
4-н-пропил-2-пиридильную группу,
5-н-пропил-2-пиридильную группу,
6-н-пропил-2-пиридильную группу,
5-трет-бутил-2-пиридильную группу,
4-н-пентил-2-пиридильную группу,
5-н-гексил-2-пиридильную группу,
6-н-гексил-2-пиридильную группу, 2-хлор-3-пиридильную группу,
4-хлор-3-пиридильную группу, 5-хлор-3-пиридильную группу,
6-хлор-3-пиридильную группу, 3-пиридильную группу,
4-пиридильную группу, 3-метил-3-пиридильную группу,
4-метил-3-пиридильную группу, 5-метил-3-пиридильную группу,
6-метил-3-пиридильную группу, 2-этил-3-пиридильную группу,
4-этил-3-пиридильную группу, 5-этил-3-пиридильную группу,
6-этил-3-пиридильную группу, 2-пропил-3-пиридильную группу,
4-пропил-3-пиридильную группу, 5-пропил-3-пиридильную группу,
6-пропил-3-пиридильную группу,
5-трет-бутил-3-пиридильную группу,
4-пентил-3-пиридильную группу, 5-гексил-3-пиридильную группу,
6-гексил-3-пиридильную группу, 3-хлор-4-пиридильную группу,
2-хлор-4-пиридильную группу, 3-метил-4-пиридильную группу,
2-метил-4-пиридильную группу,
3-трифторметил-4-пиридильную группу,
3-этил-4-пиридильную группу, 2-этил-4-пиридильную группу,
3-пропил-4-пиридильную группу, 6-н-пропил-4-пиридильную группу,
5-трет-бутил-4-пиридильную группу,
2-н-гексил-4-пиридильную группу, 3-фенил-2-пиридильную группу,
4-фенил-2-пиридильную группу, 5-фенил-2-пиридильную группу,
6-фенил-2-пиридильную группу, 2-фенил-3-пиридильную группу,
2-фенил-4-пиридильную группу, 2-фенил-5-пиридильную группу,
3-(4-фторфенил)-2-пиридильную группу,
3-(3-фтор-4-хлорфенил)-2-пиридильную группу,
3-(3-фторфенил)-2-пиридильную группу,
3-(4-бромфенил)-4-пиридильную группу,
3-(3-фторфенил)-4-пиридильную группу,
4-(2,3,4,5,6-пентафторфенил)-2-пиридильную группу,
4-(3-фтор-4-хлорфенил)-2-пиридильную группу,
4-(3-фторфенил)-2-пиридильную группу,
3-(4-хлорфенил)-2-пиридильную группу,
4-(4-хлорфенил)-2-пиридильную группу,
5-(4-хлорфенил)-2-пиридильную группу,
6-(2,4,6-трихлорфенил)-2-пиридильную группу,
2-(4-хлорфенил)-3-пиридильную группу,
2-(4-хлорфенил)-4-пиридильную группу,
6-(4-хлорфенил)-3-пиридильную группу,
4-(3-фтор-4-хлорфенил)-2-пиридильную группу,
5-(4-иод-3-хлорфенил)-2-пиридильную группу,
6-(4-фтор-3-хлорфенил)-2-пиридильную группу,
2-(4-фтор-3-хлорфенил)-3-пиридильную группу,
2-(4-фтор-3-хлорфенил)-4-пиридильную группу,
6-(4-фтор-3-хлорфенил)-3-пиридильную группу,
5-(4-трифторметилфенил)-2-пиридильную группу,
6-(4-трифторметилфенил)-2-пиридильную группу,
2-(4-трифторметилфенил)-3-пиридильную группу,
2-(4-трифторметилфенил)-4-пиридильную группу,
6-(4-трифторметилфенил)-3-пиридильную группу,
5-(4-метилфенил)-2-пиридильную группу,
6-(4-метилфенил)-2-пиридильную группу,
2-(4-метилфенил)-3-пиридильную группу,
2-(4-метилфенил)-4-пиридильную группу,
6-(4-метилфенил)-3-пиридильную группу,
4-фтор-2-(4-метоксифенил)-3-пиридильную группу,
4-метил-5-фенил-3-хлор-2-пиридильную группу,
5-(4-метоксифенил)-2-пиридильную группу,
6-(4-метоксифенил)-2-пиридильную группу,
2-(4-метоксифенил)-3-пиридильную группу,
2-(4-метоксифенил)-4-пиридильную группу,
6-(4-метоксифенил)-3-пиридильную группу,
5-(4-трифторметоксифенил)-2-пиридильную группу,
6-(4-трифторметоксифенил)-2-пиридильную группу,
2-(4-трифторметоксифенил)-3-пиридильную группу,
2-(4-трифторметоксифенил)-4-пиридильную группу,
6-(4-трифторметоксифенил)-3-пиридильную группу,
5-(3-хлор-4-трифторметоксифенил)-2-пиридильную группу,
6-(3-хлор-4-трифторметоксифенил)-2-пиридильную группу,
2-(3-хлор-4-трифторметоксифенил)-3-пиридильную группу,
2-(3-хлор-4-трифторметоксифенил)-4-пиридильную группу,
6-(3-хлор-4-трифторметоксифенил)-3-пиридильную группу,
5-(3-фтор-4-трифторметоксифенил)-2-пиридильную группу,
6-(3-фтор-4-трифторметоксифенил)-2-пиридильную группу,
2-(3-фтор-4-трифторметоксифенил)-3-пиридильную группу,
2-(3-фтор-4-трифторметоксифенил)-4-пиридильную группу,
6-(3-фтор-4-трифторметоксифенил)-3-пиридильную группу,
5-(3,4-диметоксифенил)-2-пиридильную группу,
6-(3,4-диметоксифенил)-2-пиридильную группу,
2-(3,4-диметоксифенил)-3-пиридильную группу,
2-(3,4-диметоксифенил)-4-пиридильную группу,
6-(3,4-диметоксифенил)-3-пиридильную группу,
5-(3,4-дифторфенил)-2-пиридильную группу,
6-(3,4-дифторфенил)-2-пиридильную группу,
2-(3,4-дифторфенил)-3-пиридильную группу,
2-(3,4-дифторфенил)-4-пиридильную группу,
6-(3,4-дифторфенил)-3-пиридильную группу,
5-(3,4-дихлорфенил)-2-пиридильную группу,
6-(3,4-дихлорфенил)-2-пиридильную группу,
2-(3,4-дихлорфенил)-3-пиридильную группу,
2-(3,4-дихлорфенил)-4-пиридильную группу,
6-(3,4-дихлорфенил)-3-пиридильную группу,
5-(2-фурил)-2-пиридильную группу,
6-(2-фурил)-2-пиридильную группу,
5-(2-фурил)-3-пиридильную группу,
6-(2-фурил)-3-пиридильную группу,
5-(3-фурил)-2-пиридильную группу,
6-(3-фурил)-2-пиридильную группу,
5-(3-фурил)-3-пиридильную группу,
6-(3-фурил)-3-пиридильную группу,
5-(2-тиенил)-2-пиридильную группу,
6-(2-тиенил)-2-пиридильную группу,
5-(2-тиенил)-3-пиридильную группу,
6-(2-тиенил)-3-пиридильную группу,
5-(3-тиенил)-2-пиридильную группу,
6-(3-тиенил)-2-пиридильную группу,
5-(3-тиенил)-3-пиридильную группу,
6-(3-тиенил)-3-пиридильную группу или тому подобное.
Фурильная группа (которая может быть замещена в фурановом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы, нитрогруппы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и нитрогруппы)) включает фурильную группу (которая может быть замещена в фурановом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы, нитрогруппы и фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и нитрогруппы)), например 2-фурильную группу,
3-фурильную группу, 3-метил-2-фурильную группу,
3,4-диметил-2-фурильную группу,
3,4,5-триметил-2-фурильную группу, 4-метил-2-фурильную группу,
5-метил-2-фурильную группу, 3-этил-2-фурильную группу,
4-этил-2-фурильную группу, 5-этил-2-фурильную группу,
3-н-пропил-2-фурильную группу, 4-н-пропил-2-фурильную группу,
5-н-пропил-2-фурильную группу, 3-н-бутил-2-фурильную группу,
4-н-бутил-2-фурильную группу, 5-н-бутил-2-фурильную группу,
3-н-пентил-2-фурильную группу, 4-н-пентил-2-фурильную группу,
5-н-пентил-2-фурильную группу, 3-н-гексил-2-фурильную группу,
4-н-гексил-2-фурильную группу, 5-н-гексил-2-фурильную группу,
2-метил-3-фурильную группу, 4-метил-3-фурильную группу,
5-метил-3-фурильную группу, 2-этил-3-фурильную группу,
4-этил-3-фурильную группу, 5-этил-3-фурильную группу,
2-н-пропил-3-фурильную группу, 4-н-пропил-3-фурильную группу,
5-н-пропил-3-фурильную группу, 2-н-бутил-3-фурильную группу,
4-н-бутил-3-фурильную группу, 5-н-бутил-3-фурильную группу,
2-н-пентил-3-фурильную группу, 4-н-пентил-3-фурильную группу,
5-н-пентил-3-фурильную группу, 2-н-гексил-3-фурильную группу,
4-н-гексил-3-фурильную группу, 5-н-гексил-3-фурильную группу,
3-нитро-2-фурильную группу, 4-нитро-2-фурильную группу,
5-нитро-2-фурильную группу, 2-нитро-3-фурильную группу,
4-нитро-3-фурильную группу, 3-фенил-2-фурильную группу,
4-фенил-2-фурильную группу, 5-фенил-2-фурильную группу,
3-фенил-4-фурильную группу, 4-фенил-3-фурильную группу,
3-(3-фторфенил)-2-фурильную группу,
4-(3-фторфенил)-2-фурильную группу,
5-(3-фторфенил)-2-фурильную группу,
2-(3-фторфенил)-3-фурильную группу,
3-(2-фторфенил)-2-фурильную группу,
4-(2-фторфенил)-2-фурильную группу,
5-(2-фторфенил)-2-фурильную группу,
2-(2-фторфенил)-3-фурильную группу,
4-нитро-3-фурильную группу, 3-(4-фторфенил)-2-фурильную группу,
4-(4-фторфенил)-2-фурильную группу,
5-(4-фторфенил)-2-фурильную группу,
2-(4-фторфенил)-3-фурильную группу,
4-(4-фторфенил)-3-фурильную группу,
3-(3,4-дифторфенил)-2-фурильную группу,
4-(2,3,4,5,6-пентафторфенил)-2-фурильную группу,
5-(3,4-дифторфенил)-2-фурильную группу,
2-(3,4-дифторфенил)-3-фурильную группу,
4-(3,4-дифторфенил)-3-фурильную группу,
3-(4-хлорфенил)-2-фурильную группу,
4-(4-хлорфенил)-2-фурильную группу,
5-(4-хлорфенил)-2-фурильную группу,
2-(4-хлорфенил)-3-фурильную группу,
4-(4-хлорфенил)-3-фурильную группу,
3-(2-хлорфенил)-2-фурильную группу,
4-(2-хлорфенил)-2-фурильную группу,
5-(2-хлорфенил)-2-фурильную группу,
2-(2-хлорфенил)-3-фурильную группу,
4-(2-хлорфенил)-3-фурильную группу,
5-(2-хлорфенил)-3-фурильную группу,
3-(3-хлорфенил)-2-фурильную группу,
4-(3-хлорфенил)-2-фурильную группу,
5-(3-хлорфенил)-2-фурильную группу,
2-(3-хлорфенил)-3-фурильную группу,
4-(3-хлорфенил)-3-фурильную группу,
3-(3,4,5-трихлорфенил)-2-фурильную группу,
4-(3,4-дихлорфенил)-2-фурильную группу,
5-(3,4-дихлорфенил)-2-фурильную группу,
2-(3,4-хлорфенил)-3-фурильную группу,
4-(3,4-дихлорфенил)-3-фурильную группу,
3-(4-метилфенил)-2-фурильную группу,
4-(4-метилфенил)-2-фурильную группу,
5-(4-метилфенил)-2-фурильную группу,
2-(4-метилфенил)-3-фурильную группу,
4-(4-метилфенил)-3-фурильную группу,
3-(4-трифторметилфенил)-2-фурильную группу,
4-(4-трифторметилфенил)-2-фурильную группу,
5-(4-трифторметилфенил)-2-фурильную группу,
2-(4-трифторметилфенил)-3-фурильную группу,
4-(4-трифторметилфенил)-3-фурильную группу,
3-(2-трифторметилфенил)-2-фурильную группу,
4-(2-трифторметилфенил)-2-фурильную группу,
5-(2-трифторметилфенил)-2-фурильную группу,
2-(2-трифторметилфенил)-3-фурильную группу,
4-(2-трифторметилфенил)-3-фурильную группу,
3-(3-трифторметилфенил)-2-фурильную группу,
4-(3-трифторметилфенил)-2-фурильную группу,
5-(4-трифторметилфенил)-2-фурильную группу,
2-(3-трифторметилфенил)-3-фурильную группу,
4-(3-трифторметилфенил)-3-фурильную группу,
3-(2-хлор-5-трифторметилфенил)-2-фурильную группу,
4-(2-хлор-5-трифторметилфенил)-2-фурильную группу,
5-(2-хлор-5-трифторметилфенил)-2-фурильную группу,
2-(2-хлор-5-трифторметилфенил)-3-фурильную группу,
4-(2-хлор-5-трифторметилфенил)-3-фурильную группу,
3-(4-метоксифенил)-2-фурильную группу,
4-(4-метоксифенил)-2-фурильную группу,
5-(4-метоксифенил)-2-фурильную группу,
3-(4-метоксифенил)-4-фурильную группу,
4-(4-метоксифенил)-3-фурильную группу,
3-(2-метоксифенил)-2-фурильную группу,
4-(2-метоксифенил)-2-фурильную группу,
5-(2-метоксифенил)-2-фурильную группу,
2-(2-метоксифенил)-3-фурильную группу,
4-(2-метоксифенил)-3-фурильную группу,
3-(2-трифторметоксифенил)-2-фурильную группу,
4-(2-трифторметоксифенил)-2-фурильную группу,
5-(2-трифторметоксифенил)-2-фурильную группу,
3-(4-трифторметоксифенил)-2-фурильную группу,
4-(4-трифторметоксифенил)-2-фурильную группу,
5-(4-трифторметоксифенил)-2-фурильную группу,
2-(4-трифторметоксифенил)-3-фурильную группу,
4-(4-трифторметоксифенил)-3-фурильную группу,
3-(3,4-диметоксифенил)-2-фурильную группу,
4-(3,4-диметоксифенил)-2-фурильную группу,
5-(3,4-диметоксифенил)-2-фурильную группу,
3-(3,4-диметоксифенил)-3-фурильную группу,
4-(3,4-диметоксифенил)-3-фурильную группу,
3-(4-нитрофенил)-2-фурильную группу,
4-(4-нитрофенил)-2-фурильную группу,
5-(4-нитрофенил)-2-фурильную группу,
2-(4-нитрофенил)-3-фурильную группу,
4-(4-нитрофенил)-3-фурильную группу,
3-(3-нитрофенил)-2-фурильную группу,
4-(3-нитрофенил)-2-фурильную группу,
5-(3-нитрофенил)-2-фурильную группу,
2-(3-нитрофенил)-3-фурильную группу,
4-(3-нитрофенил)-3-фурильную группу,
4-метил-5-нитро-2-фурильную группу,
4-фенил-3,5-диметил-2-фурильную группу или тому подобное.
Бензотиазольная группа (которая может содержать в бензотиазольном кольце по крайней мере фенильную группу, которая может содержать С1-6алкоксигруппу в качестве заместителя в фенильном кольце) включает бензотиазольную группу (которая может содержать в бензотиазольном кольце 1-3 фенильные группы, которые могут содержать 1-3 С1-6алкоксигруппы в качестве заместителя в фенильном кольце), например бензотиазол-2-ильную группу,
бензотиазол-4-ильную группу, бензотиазол-5-ильную группу,
бензотиазол-6-ильную группу, бензотиазол-7-ильную группу,
2-фенилбензотиазол-4-ильную группу,
2,5-дифенилбензотиазол-4-ильную группу,
4,5,6-трифенилбензотиазол-2-ильную группу,
2-фенилбензотиазол-5-ильную группу,
2-фенилбензотиазол-6-ильную группу,
2-фенилбензотиазол-7-ильную группу,
2-(3-этоксифенил)бензотиазол-7-ильную группу,
2-(4-пропоксифенил)бензотиазол-4-ильную группу,
2-(4-н-бутоксифенил)бензотиазол-5-ильную группу,
2-(4-н-гексилоксифенил)бензотиазол-6-ильную группу,
2-(4-н-пентилоксифенил)бензотиазол-7-ильную группу,
4-фенилбензотиазол-2-ильную группу,
5-фенилбензотиазол-2-ильную группу,
6-фенилбензотиазол-2-ильную группу,
7-фенилбензотиазол-2-ильную группу,
4-(3,4-диметоксифенил)бензотиазол-2-ильную группу,
5-(3,4,5-триметоксифенил)бензотиазол-2-ильную группу,
7-(3-метоксифенил)бензотиазол-2-ильную группу,
4-(4-метоксифенил)бензотиазол-2-ильную группу,
5-(4-метоксифенил)бензотиазол-2-ильную группу,
6-(4-метоксифенил)бензотиазол-2-ильную группу,
7-(4-метоксифенил)бензотиазол-2-ильную группу или тому подобное.
Тиенильная группа (которая может содержать в тиофеновом кольце по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, нитрогруппы, С1-6алкильной группы, пиразолильной группы, которая может быть замещена в пиразольном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя, и тиенильной группы, которая может содержать атом галогена в тиофеновом кольце) включает тиенильную группу (которая может содержать в тиофеновом кольце 1-3 группы, выбранные из группы, состоящей из атома галогена, нитрогруппы, С1-6алкильной группы, пиразолильной группы, которая может быть замещена в пиразольном кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами в качестве заместителя, и тиенильной группы, которая может содержать 1-3 атома галогена в тиофеновом кольце), например 2-тиенильную группу, 3-фтор-2-тиенильную группу,
4-фтор-2-тиенильную группу, 5-фтор-2-тиенильную группу,
3-хлор-2-тиенильную группу, 4-хлор-2-тиенильную группу,
5-хлор-2-тиенильную группу, 3-бром-2-тиенильную группу,
4-бром-2-тиенильную группу, 5-бром-2-тиенильную группу,
3-тиенильную группу, 2-фтор-3-тиенильную группу,
4-фтор-3-тиенильную группу, 5-фтор-3-тиенильную группу,
2-хлор-3-тиенильную группу, 4-хлор-3-тиенильную группу,
5-хлор-3-тиенильную группу, 2-бром-3-тиенильную группу,
4-бром-3-тиенильную группу, 5-бром-3-тиенильную группу,
3-нитро-2-тиенильную группу, 4-нитро-2-тиенильную группу,
5-нитро-2-тиенильную группу, 2-нитро-3-тиенильную группу,
4-нитро-3-тиенильную группу, 5-нитро-3-тиенильную группу,
3-метил-2-тиенильную группу, 4-метил-2-тиенильную группу,
5-метил-2-тиенильную группу, 5-этил-2-тиенильную группу,
2-метил-3-тиенильную группу, 4-метил-3-тиенильную группу,
5-метил-3-тиенильную группу, 2,5-диметил-3-тиенильную группу,
2,4,5-триметил-3-тиенильную группу,
2,4-диметил-3-тиенильную группу,
3-(пиразол-1-ил)-2-тиенильную группу,
4-(пиразол-1-ил)-2-тиенильную группу,
5-(пиразол-1-ил)-2-тиенильную группу,
2-(пиразол-1-ил)-3-тиенильную группу,
4-(пиразол-1-ил)-3-тиенильную группу,
5-(пиразол-1-ил)-3-тиенильную группу,
3-(3-трифторметилпиразол-1-ил)-2-тиенильную группу,
4-(3-трифторметилпиразол-1-ил)-2-тиенильную группу,
5-(1-метил-3-трифторметилпиразол-5-ил)-2-тиенильную группу,
2-(1,4,5-триметилпиразол-3-ил)-3-тиенильную группу,
4-(1,5-диметилпиразол-3-ил)-3-тиенильную группу,
5-(1-метилпиразол-3-ил)-3-тиенильную группу,
5-(1-н-пентилпиразол-5-ил)-2-тиенильную группу,
5-(1-н-гексилпиразол-5-ил)-2-тиенильную группу,
3-(5-трифторметилпиразол-1-ил)-2-тиенильную группу,
4-(5-н-пропилпиразол-1-ил)-2-тиенильную группу,
5-(5-н-бутилпиразол-1-ил)-2-тиенильную группу,
2-(5-трифторметилпиразол-1-ил)-3-тиенильную группу,
4-(5-этилпиразол-1-ил)-3-тиенильную группу,
5-(5-трифторметилпиразол-1-ил)-3-тиенильную группу,
3-(2-тиенил)-2-тиенильную группу,
4-(2-тиенил)-2-тиенильную группу,
3-хлор-4-(2-тиенил)-2-тиенильную группу,
5-(2-тиенил)-2-тиенильную группу,
2-(2-тиенил)-3-тиенильную группу,
4-(2-тиенил)-3-тиенильную группу,
5-(2-тиенил)-3-тиенильную группу,
3-(5-хлор-2-тиенил)-2-тиенильную группу,
4-(5-бром-2-тиенил)-2-тиенильную группу,
5-(5-хлор-2-тиенил)-2-тиенильную группу,
2-(5-хлор-2-тиенил)-3-тиенильную группу,
4-(5-хлор-2-тиенил)-3-тиенильную группу,
5-(5-хлор-2-тиенил)-3-тиенильную группу,
3-(4-хлор-2-тиенил)-2-тиенильную группу,
4-(3,4-дихлор-2-тиенил)-2-тиенильную группу,
5-(3,4,5-трихлор-2-тиенил)-2-тиенильную группу,
2-(4-бром-2-тиенил)-3-тиенильную группу,
4-(4-хлор-2-тиенил)-3-тиенильную группу,
5-(4-бром-2-тиенил)-3-тиенильную группу или тому подобное.
Индолильная группа (которая может быть замещена в индольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенилсульфонильной группы, которая может содержать С1-6алкильную группу в качестве заместителя, фенил-С1-6алкильной группы, С1-6алкоксикарбонильной группы и фенильной группы) включает индолильную группу (которая может быть замещена в индольном кольце 1-3 группами, выбранными из группы, состоящей из фенилсульфонильной группы, которая может содержать 1-3 С1-6алкильные группы в качестве заместителя, фенил-С1-6алкильной группы, С1-6алкоксикарбонильной группы и фенильной группы), например индол-1-ил, индол-2-ил, индол-3-ил,
индол-4-ил, индол-5-ил, индол-6-ил, индол-7-ил,
1-(бензолсульфонил)индол-3-ильную группу,
1-(4-метилбензенсульфонил)индол-3-ильную группу,
1-(3,4-диметилбензенсульфонил)индол-3-ильную группу,
1-(3,4,6-триметилбензенсульфонил)индол-3-ильную группу,
1-бензилиндол-3-ильную группу,
1-(2-фенетил)индол-3-ильную группу,
1-(1-фенетил)индол-3-ильную группу,
1-(3-фенилпропил)индол-3-ильную группу,
1-(4-фенилбутил)индол-3-ильную группу,
1-(5-фенилпентил)индол-3-ильную группу,
1-(6-фенилгексил)индол-3-ильную группу,
6-метоксикарбонилиндол-3-ильную группу,
6-этоксикарбонилиндол-3-ильную группу,
6-н-пропоксикарбонилиндол-3-ильную группу,
6-н-бутоксикарбонилиндол-3-ильную группу,
6-н-пентилоксикарбонилиндол-3-ильную группу,
6-н-гексилоксикарбонилиндол-3-ильную группу,
2-фенилиндол-3-ильную группу,
1-бензил-6-фенил-6-метоксикарбонилиндол-3-ильную группу,
1-бензил-6-метоксикарбонилиндол-3-ильную группу,
2-фенил-1-(4-метилбензенсульфонил)индол-3-ильную группу или тому подобное.
Пирролильная группа (которая может быть замещена в пиррольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенильной группы, которая может быть замещена по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой, и С1-6алкильной группы) включает пирролильную группу (которая может быть замещена в пиррольном кольце 1-3 группами, выбранными из группы, состоящей из фенильной группы, которая может быть замещена 1-3 галогензамещенными или незамещенными С1-6алкильными группами, и С1-6алкильной группы), например 2-пирролильную группу,
1-метил-2-пирролильную группу, 1-этил-2-пирролильную группу,
1-н-пропил-2-пирролильную группу,
1-н-бутил-2-пирролильную группу,
1-н-пентил-2-пирролильную группу,
1-н-гексил-2-пирролильную группу, 3-пирролильную группу,
1-метил-3-пирролильную группу, 1-этил-3-пирролильную группу,
1-н-пропил-3-пирролильную группу,
1-н-бутил-3-пирролильную группу,
1-н-пентил-3-пирролильную группу,
1-н-гексил-3-пирролильную группу,
2,5-диметил-3-пирролильную группу,
1-(3-метилфенил)-2,5-диметил-3-пирролильную группу,
1-(4-метилфенил)-2,5-диметил-3-пирролильную группу,
1-(3-трифторметилфенил)-2,5-диметил-3-пирролильную группу,
1-(4-трифторметилфенил)-2,5-диметил-3-пирролильную группу,
1-(2,3-диметилфенил)-3-пирролильную группу,
1-(4-метилфенил)-3-пирролильную группу,
1-(3-трифторметилфенил)-3-пирролильную группу,
1-(4-трифторметилфенил)-3-пирролильную группу,
1-(3-метилфенил)-3,5-диметил-2-пирролильную группу,
1-(4-метилфенил)-3,5-диметил-2-пирролильную группу,
1-(3-трифторметилфенил)-3,5-диметил-2-пирролильную группу,
1-(4-трифторметилфенил)-3,5-диметил-2-пирролильную группу,
1-(3-метилфенил)-2-пирролильную группу,
1-(2,4,6-триметилфенил)-2-пирролильную группу,
1-(3,5-дитрифторметилфенил)-2-пирролильную группу,
1-(4-трифторметилфенил)-2-пирролильную группу или тому подобное.
Кумарильная группа включает 4-кумарильную группу, 5-кумарильную группу, 6-кумарильную группу, 7-кумарильную группу или 8-кумарильную группу.
Примеры бензимидазолильной группы (которая может быть замещена в бензимидазольном кольце по крайней мере одной тиенильной группой в качестве заместителя) включают
2-бензимидазолильную группу, 4-бензимидазолильную группу,
5-бензимидазолильную группу, 6-бензимидазолильную группу,
2-(2-тиенил)-4-бензимидазолильную группу,
2-(2-тиенил)-5-бензимидазолильную группу,
2-(2-тиенил)-6-бензимидазолильную группу,
2-(2-тиенил)-7-бензимидазолильную группу,
2-(3-тиенил)-4-бензимидазолильную группу,
2-(3-тиенил)-5-бензимидазолильную группу,
2-(3-тиенил)-6-бензимидазолильную группу,
2-(3-тиенил)-7-бензимидазолильную группу или тому подобное.
Оксазолильная группа (которая может быть замещена в оксазольном кольце по крайней мере одной фенильной группой, которая может содержать атом галогена в качестве заместителя) включает оксазолильную группу (которая может быть замещена в оксазольном кольце 1-2 фенильными группами, которые могут содержать 1-5 атомов галогена в качестве заместителя), например 2-оксазолильную группу, 4-оксазолильную группу,
5-оксазолильную группу, 2-фенил-4-оксазолильную группу,
2-(4-фторфенил)-4-оксазолильную группу,
2,4-ди(4-хлорфенил)-5-оксазолильную группу,
2-(4-хлорфенил)-4-оксазолильную группу,
2-(4-бромфенил)-4-оксазолильную группу,
2-(4-иодфенил)-4-оксазолильную группу,
2-(4-фторфенил)-5-оксазолильную группу,
2-(4-хлорфенил)-5-оксазолильную группу,
2-(4-бромфенил)-5-оксазолильную группу,
2-(4-иодфенил)-5-оксазолильную группу,
2-(4-фторфенил)-4-оксазолильную группу,
2-(3,4-хлорфенил)-4-оксазолильную группу,
2-(4-бромфенил)-5-оксазолильную группу,
2-(4-иодфенил)-5-оксазолильную группу,
2-(2,3,4,5,6-пентафторфенил)-4-оксазолильную группу,
2-(2,4,6-трихлорфенил)-4-оксазолильную группу,
2-(4-бромфенил)-5-оксазолильную группу,
2-(4-иодфенил)-5-оксазолильную группу или тому подобное.
Тиазолильная группа (которая может быть замещена в тиазольном кольце по крайней мере одной фенильной группой, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, нитрогруппы и фенильной группы) включает тиазолильную группу (которая может быть замещена в тиазольном кольце 1-2 фенильными группами, которые могут быть замещены 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, нитрогруппы и фенильной группы), например 2-тиазолильную группу, 4-тиазолильную группу, 5-тиазолильную группу,
2-фенил-4-тиазолильную группу, 2-фенил-5-тиазолильную группу,
2,4-дифенил-5-тиазолильную группу,
2,5-дифенил-4-тиазолильную группу,
2-(4-хлорфенил)-4-тиазолильную группу,
2-(4-фторфенил)-5-тиазолильную группу,
2-(2,3,4,5,6-пентафторфенил)-4-тиазолильную группу,
2-(4-бромфенил)-4-тиазолильную группу,
2-(3,4-дихлорфенил)-4-тиазолильную группу,
2-(3,4-дихлорфенил)-5-тиазолильную группу,
2-(3,4-дифторфенил)-5-тиазолильную группу,
2-(2,4,6-трихлорфенил)-4-тиазолильную группу,
2-(3-хлор-4-нитрофенил)-4-тиазолильную группу,
2-(4-фенил-3-бромфенил)-4-тиазолильную группу,
2-(4-нитрофенил)-4-тиазолильную группу,
2-(4-нитрофенил)-5-тиазолильную группу,
2-(2,4,6-тринитрофенил)-5-тиазолильную группу,
2-(2,4-динитрофенил)-4-тиазолильную группу,
2-(4-бифенилил)-4-тиазолильную группу,
2-(4-бифенилил)-5-тиазолильную группу,
4-(4-бифенилил)-2-тиазолильную группу,
2-(4-бифенилил)-4-тиазолильную группу или тому подобное.
Примеры хинолильной группы включают 2-хинолильную группу, 3-хинолильную группу, 4-хинолильную группу, 5-хинолильную группу, 6-хинолильную группу, 7-хинолильную группу или 8-хинолильную группу.
Примеры 3,4-дигидрокарбостирильной группы (которая может быть замещена в 3,4-дигидрокарбостирильном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы, С1-6алкильной группы и фенил-С1-6алкоксигруппы) или карбостирильной группы (которая может быть замещена в карбостирильном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы, С1-6алкильной группы и фенил-С1-6алкоксигруппы) включают 3,4-дигидрокарбостирильную группу (которая может быть замещена в 3,4-дигидрокарбостирильном кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксигруппы, С1-6алкильной группы и фенил-С1-6алкоксигруппы) или карбостирильную группу (которая может быть замещена в карбостирильном кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксигруппы, С1-6алкильной группы и фенил-С1-6алкоксигруппы), например
3,4-дигидрокарбостирил-1-ильную группу,
3,4-дигидрокарбостирил-3-ильную группу,
3,4-дигидрокарбостирил-4-ильную группу,
3,4-дигидрокарбостирил-5-ильную группу,
3,4-дигидрокарбостирил-6-ильную группу,
3,4-дигидрокарбостирил-7-ильную группу,
3,4-дигидрокарбостирил-8-ильную группу,
карбостирил-1-ильную группу, карбостирил-3-ильную группу,
карбостирил-4-ильную группу, карбостирил-5-ильную группу,
карбостирил-6-ильную группу, карбостирил-7-ильную группу,
карбостирил-8-ильную группу,
6-метокси-3,4-дигидрокарбостирил-5-ильную группу,
7-метокси-3,4-дигидрокарбостирил-5-ильную группу,
8-метокси-3,4-дигидрокарбостирил-5-ильную группу,
8-метокси-1-метил-3,4-дигидрокарбостирил-5-ильную группу,
8-бензилокси-3,4-дигидрокарбостирил-5-ильную группу,
8-метоксикарбостирил-5-ильную группу,
8-метокси-1-метилкарбостирил-5-ильную группу,
8-бензилоксикарбостирил-5-ильную группу,
8-метокси-3,4-дигидрокарбостирил-6-ильную группу,
6-метил-3,4-дигидрокарбостирил-5-ильную группу,
6,7-диметил-3,4-дигидрокарбостирил-5-ильную группу,
1,5,6-триметил-3,4-дигидрокарбостирил-7-ильную группу,
6-метилкарбостирил-5-ильную группу,
6,7-диметилкарбостирил-5-ильную группу,
1,5,6-триметилкарбостирил-7-ильную группу,
8-метокси-1-метил-3,4-дигидрокарбостирил-6-ильную группу,
8-бензилокси-3,4-дигидрокарбостирил-6-ильную группу,
8-метоксикарбостирил-6-ильную группу,
8-метокси-1-метилкарбостирил-6-ильную группу,
8-бензилоксикарбостирил-6-ильную группу,
8-метокси-3,4-дигидрокарбостирил-7-ильную группу,
8-метокси-1-метил-3,4-дигидрокарбостирил-7-ильную группу,
8-бензилокси-3,4-дигидрокарбостирил-7-ильную группу,
8-этоксикарбостирил-7-ильную группу,
8-метокси-1-пропилкарбостирил-7-ильную группу,
8-(2-фенилэтокси)карбостирил-7-ильную группу или тому подобное.
Примеры имидазо[2,1-b]тиазолильной группы включают такие, как 6-имидазо[2,1-b]тиазолильную группу, 5-имидазо[2,1-b]тиазолильную группу, 3-имидазо[2,1-b]тиазолильную группу и 2-имидазо[2,1-b]тиазолильную группу или тому подобное.
Примеры имидазо[2,1-a]пиридильной группы включают 2-имидазо[2,1-a]пиридильную группу, 3-имидазо[2,1-a]пиридильную группу, 5-имидазо[2,1-a]пиридильную группу, 6-имидазо[2,1-a]пиридильную группу, 7-имидазо[2,1-a]пиридильную группу или тому подобное.
Хроманильная группа (которая может быть замещена в хромановом кольце по крайней мере одной С1-6алкильной группой) включает хроманильную группу (которая может быть замещена в хромановом кольце 1-3 С1-6алкильными группами), например
2-метил-5-хроманильную группу,
2,2-диметил-5-хроманильную группу,
2-метил-6-хроманильную группу, 2-этил-6-хроманильную группу,
2-н-пропил-6-хроманильную группу,
2-н-бутил-6-хроманильную группу,
2-н-пентил-6-хроманильную группу,
2-н-гексил-6-хроманильную группу,
2,2-диметил-6-хроманильную группу,
2,2-диэтил-6-хроманильную группу, 2-метил-7-хроманильную группу,
2,2-диметил-7-хроманильную группу,
2,2,4-триметил-6-хроманильную группу,
2-метил-8-хроманильную группу,
2,2-диметил-8-хроманильную группу или тому подобное.
Примеры 2,3-дигидробензофурильной группы включают 2,3-дигидро-4-бензофурильную группу, 2,3-дигидро-5-бензофурильную группу, 2,3-дигидро-6-бензофурильную группу, 2,3-дигидро-7-бензофурильную группу или тому подобное.
Аминозамещенная С1-6алкильная группа (которая может содержать по крайней мере одну группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы в качестве заместителя) включает аминозамещенную С1-6алкильную группу (которая может содержать 1-2 группы, выбранные из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и С1-6алкильной группы в качестве заместителя), например аминометильную группу, 2-аминоэтильную группу,
1-аминоэтильную группу, 3-аминопропильную группу,
4-аминобутильную группу, 5-аминопентильную группу,
6-аминогексильную группу, 2-метил-3-аминопропильную группу,
1,1-диметил-2-аминоэтильную группу,
2-(метиламино)этильную группу, 3-(метиламино)пропильную группу,
4-(метиламино)бутильную группу, 5-(метиламино)пентильную группу,
6-(метиламино)гексильную группу, диметиламинометильную группу,
2-(диэтиламино)этильную группу,
3-(ди-н-пропиламино)пропильную группу,
4-(ди-н-бутиламино)бутильную группу,
5-(ди-н-пентиламино)пентильную группу,
2-(ди-н-гексиламино)гексильную группу, анилинометильную группу,
2-(N-метиланилино)этильную группу,
3-(N-метиланилино)пропильную группу, 4-анилинобутильную группу,
2-(N-метил-4-хлоранилино)этильную группу,
3-(N-метил-4-хлоранилино)пропильную группу,
4-(N-метил-4-хлоранилино)бутильную группу,
2-(N-метил-4-фторанилино)этильную группу,
3-(N-метил-2,3,4,5,6-пентафторанилино)пропильную группу,
2-(3-фторанилино)этильную группу,
3-(N-метил-3-фторанилино)пропильную группу,
4-(3-фторанилино)бутильную группу,
2-(N-метил-2-фторанилино)этильную группу,
3-(2-фторанилино)пропильную группу,
4-(N-метил-2-фторанилино)бутильную группу,
2-(N-метил-2-хлоранилино)этильную группу,
3-(N-метил-2-хлоранилино)пропильную группу,
4-(N-метил-2-хлоранилино)бутильную группу,
2-(N-метил-2,3-дихлоранилино)этильную группу,
3-(N-метил-2,4,6-трихлоранилино)пропильную группу,
4-(N-метил-3-хлоранилино)бутильную группу,
2-(N-метил-4-трифторметиланилино)этильную группу,
2-(4-метиланилино)этильную группу,
2-(N-этил-3,5-дитрифторметиланилино)этильную группу,
2-(N-метил-3,5-дитрифторметиланилино)этильную группу,
2-(N-метил-2,4-диметиланилино)этильную группу,
2-(N-метил-3,5-диметоксианилино)этильную группу,
2-(2,4,6-триметиланилино)этильную группу,
2-(3,4,5-триметоксианилино)этильную группу,
3-(N-метил-4-трифторметиланилино)пропильную группу,
4-(N-метил-4-трифторметиланилино)бутильную группу,
2-(N-метил-3-трифторметиланилино)этильную группу,
3-(N-метил-3-трифторметиланилино)пропильную группу,
2-(N-метил-2-трифторметиланилино)этильную группу,
3-(N-метил-2-трифторметиланилино)пропильную группу,
4-(N-метил-2-трифторметиланилино)бутильную группу,
2-(N-метил-4-трифторметоксианилино)этильную группу,
3-(N-метил-4-трифторметоксианилино)пропильную группу,
4-(4-трифторметоксианилино)бутильную группу,
2-(N-метил-3-трифторметоксианилино)этильную группу,
3-(N-метил-3-трифторметоксианилино)пропильную группу,
4-(N-метил-3-трифторметоксианилино)бутильную группу,
2-(N-метил-2-трифторметоксианилино)этильную группу,
3-(N-метил-2-трифторметоксианилино)пропильную группу,
4-(N-метил-2-трифторметоксианилино)бутильную группу,
2-(N-метил-4-метоксианилино)этильную группу,
3-(N-метил-4-метоксианилино)пропильную группу,
4-(N-метил-4-метоксианилино)бутильную группу,
2-(N-метил-3-метоксианилино)этильную группу,
3-(N-метил-3-метоксианилино)пропильную группу,
4-(3-метоксианилино)бутильную группу,
2-(2-метоксианилино)этильную группу,
3-(N-метил-2-метоксианилино)пропильную группу,
4-(N-метил-2-метоксианилино)бутильную группу или тому подобное.
Примеры 1,4-диоксаазаспиро[4,5]децильной группы (которая может быть замещена в 1,4-диоксоазаспиро[4,5]декановом кольце по крайней мере одной оксогруппой в качестве заместителя) включают 1,4-диокса-8-азаспиро[4,5]дец-8-ильную группу, 7-оксо-1,4-диокса-8-азаспиро[4,5]дец-8-ильную группу, 6-оксо-1,4-диокса-8-азаспиро[4,5]дец-8-ильную группу или тому подобное.
Гомопиперазинильная группа (которая может быть замещена в гомопиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы и фенилзамещенной или незамещенной фенильной группы) включает гомопиперазинильную группу (которая может быть замещена в гомопиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы и фенилзамещенной или незамещенной фенильной группы), например 1-гомопиперазинильную группу,
2-гомопиперазинильную группу, 3-гомопиперазинильную группу,
4-гомопиперазинильную группу, 5-гомопиперазинильную группу,
6-гомопиперазинильную группу, 7-гомопиперазинильную группу,
4-метоксикарбонил-1-гомопиперазинильную группу,
4-этоксикарбонил-1-гомопиперазинильную группу,
4-н-пропоксикарбонил-1-гомопиперазинильную группу,
4-трет-бутоксикарбонил-1-гомопиперазинильную группу,
4-н-пентилоксикарбонил-1-гомопиперазинильную группу,
4-н-гексилоксикарбонил-1-гомопиперазинильную группу,
4-бензилоксиоксикарбонил-1-гомопиперазинильную группу,
4-(2-фенилэтоксикарбонил)-1-гомопиперазинильную группу,
4-(3-фенилпропоксикарбонил)-1-гомопиперазинильную группу,
4-(4-фенилбутоксикарбонил)-1-гомопиперазинильную группу,
4-(5-фенилпентилоксикарбонил)-1-гомопиперазинильную группу,
4-(6-фенилгексилоксикарбонил)-1-гомопиперазинильную группу,
4-(4-бифенилил)-1-гомопиперазинильную группу,
3,4-дифенил-1-гомопиперазинильную группу,
3,4,5-трифенил-1-гомопиперазинильную группу,
3-фенил-4-метоксикарбонил-1-гомопиперазинильную группу или тому подобное.
Пиперазинильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой)) включает пиперазинильную группу (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из оксогруппы, С1-6алкильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами)), например
пиперазин-1-ильную группу, пиперазин-2-ильную группу,
пиперазин-3-ильную группу, пиперазин-4-ильную группу,
1-метилпиперазин-4-ильную группу,
1-бензилпиперазин-4-ильную группу,
1,2-диметилпиперазин-4-ильную группу,
1-бензил-2,6-диметилпиперазин-4-ильную группу,
1-этил-2-оксопиперазин-4-ильную группу,
1-н-пропил-2-оксопиперазин-4-ильную группу,
1-изопропил-2-оксопиперазин-4-ильную группу,
1-н-бутил-2-оксопиперазин-4-ильную группу,
1-трет-бутил-2-оксопиперазин-4-ильную группу,
1-н-пентил-2-оксопиперазин-4-ильную группу,
1-н-гексил-2-оксопиперазин-4-ильную группу,
1-(4-бензил)-2-оксопиперазин-4-ильную группу,
1-(2,4-диметилбензил)пиперазин-4-ильную группу,
1-(2,4,6-триметилбензил)пиперазин-4-ильную группу,
1-(3,5-дитрифторметилбензил)пиперазин-4-ильную группу,
1-(4-метилбензил)-2-оксопиперазин-4-ильную группу,
1-(4-трифторметилбензил)-2-оксопиперазин-4-ильную группу,
1-[2-(4-трифторметилфенил)этил]-2-оксопиперазин-4-ильную группу,
1-[3-(4-трифторметилфенил)пропил]-2-оксопиперазин-4-ильную группу,
1-[4-(4-трифторметилфенил)бутил]-2-оксопиперазин-4-ильную группу,
1-[5-(4-трифторметилфенил)пентил]-2-оксопиперазин-4-ильную группу,
1-[6-(4-трифторметилфенил)гексил]-2-оксопиперазин-4-ильную группу или тому подобное.
Примеры пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной оксогруппой в качестве заместителя) включает 1-пиперидильную группу, 2-пиперидильную группу, 3-пиперидильную группу, 4-пиперидильную группу, 2-оксо-1-пиперидильную группу, 3-оксо-1-пиперидильную группу, 4-оксо-1-пиперидильную группу или тому подобное.
Пирролидинильная группа (которая может быть замещена в пирролидиновом кольце по крайней мере одной фенокси-С1-6алкильной группой, которая может содержать галогензамещенную или незамещенную С1-6алкоксигруппу в качестве заместителя) включает пирролидинильную группу (которая может быть замещена в пирролидиновом кольце 1-3 фенокси-С1-6алкильными группами, которые могут содержать 1-3 галогензамещенные или незамещенные С1-6алкоксигруппы в качестве заместителя), например пирролидин-1-ильную группу, пирролидин-2-ильную группу, пирролидин-3-ильную группу, 2-феноксиметилпирролидин-1-ильную группу,
3-феноксиметилпирролидин-1-ильную группу,
2-(2,4-диметоксифеноксиметил)пирролидин-1-ильную группу,
2-(2,4,6-триметоксифеноксиметил)пирролидин-1-ильную группу,
2,3-дифеноксиметилпирролидин-1-ильную группу,
1,3,4-феноксиметилпирролидин-2-ильную группу,
2-(4-метоксифеноксиметил)пирролидин-1-ильную группу,
2-(4-трифторметоксифеноксиметил)пирролидин-1-ильную группу,
2-[2-(3-трифторметоксифенокси)этил]пирролидин-1-ильную группу,
2-[3-(4-трифторметоксифенокси)пропил]пирролидин-1-ильную группу,
2-[4-(4-трифторметоксифенокси)бутил]пирролидин-1-ильную группу,
2-[5-(4-трифторметоксифенокси)пентил]пирролидин-1-ильную группу,
2-[6-(4-трифторметоксифенокси)гексил]пирролидин-1-ильную группу,
3-(4-метоксифеноксиметил)пирролидин-1-ильную группу,
3-(3-трифторметоксифеноксиметил)пирролидин-1-ильную группу,
3-(4-трифторметоксифеноксиметил)пирролидин-1-ильную группу или тому подобное.
Примеры изоиндолинильной группы включают 2-изоиндолинильную группу, 1-изоиндолинильную группу, 3-изоиндолинильную группу, 4-изоиндолинильную группу, 5-изоиндолинильную группу, 6-изоиндолинильную группу или тому подобное.
Примеры оксазолидинильной группы (которая может быть замещена в оксазолидиновом кольце по крайней мере одной оксогруппой в качестве заместителя) включают 2-оксазолидинильную группу, 3-оксазолидинильную группу, 4-оксазолидинильную группу, 5-оксазолидинильную группу, 2-оксо-3-оксазолидинильную группу или тому подобное.
Бензо-1,3-оксазолидинильная группа (которая может быть замещена в бензо-1,3-оксазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, атома галогена и фенильной группы в качестве заместителя) включает бензо-1,3-оксазолидинильную группу (которая может быть замещена в бензо-1,3-оксазолидиновом кольце 1-3 группами, выбранными из группы, состоящей из оксогруппы, атома галогена и фенильной группы в качестве заместителя), например
бензо-1,3-оксазолидин-2-ильную группу,
бензо-1,3-оксазолидин-3-ильную группу,
бензо-1,3-оксазолидин-4-ильную группу,
бензо-1,3-оксазолидин-5-ильную группу,
бензо-1,3-оксазолидин-6-ильную группу,
бензо-1,3-оксазолидин-7-ильную группу,
2-оксобензо-1,3-оксазолидин-3-ильную группу,
4-хлор-2-оксобензо-1,3-оксазолидин-3-ильную группу,
5-хлор-2-оксобензо-1,3-оксазолидин-3-ильную группу,
5-бром-2-оксобензо-1,3-оксазолидин-3-ильную группу,
5-фторбензо-1,3-оксазолидин-3-ильную группу,
6-фенилбензо-1,3-оксазолидин-3-ильную группу,
5-бром-6-фенил-2-оксобензо-1,3-оксазолидин-3-ильную группу,
6-хлор-2-оксобензо-1,3-оксазолидин-3-ильную группу,
7-хлор-2-оксобензо-1,3-оксазолидин-3-ильную группу,
5-бром-2-оксобензо-1,3-оксазолидин-3-ильную группу,
4-фенил-2-оксобензо-1,3-оксазолидин-3-ильную группу,
5-фенил-2-оксобензо-1,3-оксазолидин-3-ильную группу,
6-фенил-2-оксобензо-1,3-оксазолидин-3-ильную группу,
7-фенил-2-оксобензо-1,3-оксазолидин-3-ильную группу или тому подобное.
Имидазолидинильная группа (которая может быть замещена в имидазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и С1-6алкоксигруппы) и фенильной группы) включает имидазолидинильную группу (которая может быть замещена в имидазолидиновом кольце 1-3 группами, выбранными из группы, состоящей из оксогруппы, фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и С1-6алкоксигруппы) и фенильной группы), например имидазолидин-1-ильную группу,
имидазолидин-2-ильную группу, имидазолидин-3-ильную группу,
имидазолидин-4-ильную группу, имидазолидин-5-ильную группу,
3-бензилимидазолидин-1-ильную группу,
3,4-дибензил-2-оксоимидазолидин-1-ильную группу,
2-оксоимидазолидин-1-ильную группу,
3-бензил-2-оксоимидазолидин-1-ильную группу,
3-(2-фторбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3-фторбензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-фторбензил)-2-оксоимидазолидин-1-ильную группу,
3-фенил-2-оксоимидазолидин-1-ильную группу,
3-(3,4-дифторбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3,5-дифторбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3,4,5-трифторбензил)-2-оксоимидазолидин-1-ильную группу,
3-(2-хлорбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3-хлорбензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-хлорбензил)-2-оксоимидазолидин-1-ильную группу,
3-(2,3-дихлорбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3,4-дихлорбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3,5-дихлорбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3,4,5-трихлорбензил)-2-оксоимидазолидин-1-ильную группу,
3-(2-бромбензил)-2-оксоимидазолидин-1-ильную группу,
3-(3-бромбензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-бромбензил)-2-оксоимидазолидин-1-ильную группу,
3-(2-метоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(3-метоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-метоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(2,4-диметоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(2,4,6-триметоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(3,5-диметоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-этоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-изопропоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-н-бутоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-н-пентилоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-(4-гексилоксибензил)-2-оксоимидазолидин-1-ильную группу,
3-[2-(3-метокси-4-хлорфенил)этил]-2-оксоимидазолидин-1-ильную группу,
3-[3-(4-хлорфенил)пропил]-2-оксоимидазолидин-1-ильную группу,
3-[4-(4-хлорфенил)бутил]-2-оксоимидазолидин-1-ильную группу,
3-[5-(4-хлорфенил)пентил]-2-оксоимидазолидин-1-ильную группу,
3-[6-(4-хлорфенил)гексил]-2-оксоимидазолидин-1-ильную группу,
2-фенилидазолидин-1-ильную группу,
3-фенил-2-бензилидазолидин-1-ильную группу,
3-фенил-4-бензил-2-оксоидазолидин-1-ильную группу,
3-фенил-5-бензил-2-оксоидазолидин-1-ильную группу,
4-фенил-2-оксоидазолидин-1-ильную группу или тому подобное.
Бензимидазолидинильная группа (которая может быть замещена в бензимидазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, С1-6алкоксикарбонильной группы, и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, фенильной группы, которая может быть замещена в фенильном кольце 1-3 атомами галогена, С1-6алкоксикарбонильной группы и фенил-С1-6алкоксикарбонильной группы, в качестве заместителя) включает бензимидазолидинильную группу (которая может быть замещена в бензимидазолидиновом кольце 1-3 группами, выбранными из группы, состоящей из оксогруппы, атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, аминогруппы, которая может содержать 1-2 С1-6алкильные группы в качестве заместителя, С1-6алкоксикарбонильной группы и пиперидильной группы (которая может быть замещена в пиперидиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы, фенильной группы, которая может быть замещена в фенильном кольце 1-3 атомами галогена, С1-6алкоксикарбонильной группы и фенил-С1-6алкоксикарбонильной группы, в качестве заместителя), например бензимидазолидин-1-ильную группу,
бензимидазолидин-2-ильную группу,
бензимидазолидин-3-ильную группу,
бензимидазолидин-4-ильную группу,
бензимидазолидин-5-ильную группу,
бензимидазолидин-6-ильную группу,
бензимидазолидин-7-ильную группу,
2-оксобензимидазолидин-1-ильную группу,
3-метил-2-оксобензимидазолидин-1-ильную группу,
3-метилбензимидазолидин-1-ильную группу,
6-диметиламинобензимидазолидин-1-ильную группу,
6-этоксикарбонилбензимидазолидин-1-ильную группу,
3-(4-фенилпиперидин-4-ил)бензимидазолидин-1-ильную группу,
4-фторбензимидазолидин-1-ильную группу,
3-этил-2-оксобензимидазолидин-1-ильную группу,
3-н-пропил-2-оксобензимидазолидин-1-ильную группу,
3-н-бутил-2-оксобензимидазолидин-1-ильную группу,
3-н-пентил-2-оксобензимидазолидин-1-ильную группу,
3-н-гексил-2-оксобензимидазолидин-1-ильную группу,
3-метил-6-фтор-2-оксобензимидазолидин-1-ильную группу,
3-метил-4-фтор-2-оксобензимидазолидин-1-ильную группу,
3-метил-5-фтор-2-оксобензимидазолидин-1-ильную группу,
3-метил-7-фтор-2-оксобензимидазолидин-1-ильную группу,
3-метил-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-метил-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-метил-4-хлор-2-оксобензимидазолидин-1-ильную группу,
3-метил-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-метил-7-хлор-2-оксобензимидазолидин-1-ильную группу,
3-метил-6-бром-2-оксобензимидазолидин-1-ильную группу,
3-метил-4-бром-2-оксобензимидазолидин-1-ильную группу,
3-метил-5-бром-2-оксобензимидазолидин-1-ильную группу,
3-метил-7-бром-2-оксобензимидазолидин-1-ильную группу,
3-этил-6-фтор-2-оксобензимидазолидин-1-ильную группу,
3-изопропил-6-фтор-2-оксобензимидазолидин-1-ильную группу,
3-н-гексил-6-фтор-2-оксобензимидазолидин-1-ильную группу,
3-этил-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-изопропил-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-н-гексил-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-этил-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-изопропил-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-трет-бутил-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-метил-6-этоксикарбонил-2-оксобензимидазолидин-1-ильную группу,
3-изопропил-6-этоксикарбонил-2-оксобензимидазолидин-1-ильную группу,
3-н-пропил-6-этоксикарбонил-2-оксобензимидазолидин-1-ильную группу,
3-метил-6-трифторметил-2-оксобензимидазолидин-1-ильную группу,
5-трифторметил-2-оксобензимидазолидин-1-ильную группу,
3-метил-5-трифторметил-2-оксобензимидазолидин-1-ильную группу,
3-изопропил-5-трифторметил-2-оксобензимидазолидин-1-ильную группу,
3-(4-фенилпиперидин-1-ил)-2-оксобензимидазолидин-1-ильную группу,
3-(4-фенилпиперидин-1-ил)-5-трифторметил-2-оксобензимидазолидин-1-ильную группу,
3-(4-фенилпиперидин-1-ил)-6-трифторметил-2-оксобензимидазолидин-1-ильную группу,
3-метил-6-диметиламино-2-оксобензимидазолидин-1-ильную группу,
3-этил-6-диметиламино-2-оксобензимидазолидин-1-ильную группу,
3-метил-6-амино-2-оксобензимидазолидин-1-ильную группу,
3-изопропил-6-диметиламино-2-оксобензимидазолидин-1-ильную группу,
3-[4-(3-фторфенил)пиперидин-1-ил]-2-оксобензимидазолидин-1-ильную группу,
3-[4-(4-фторфенил)пиперидин-1-ил]-2-оксобензимидазолидин-1-ильную группу,
3-[4-(3-хлорфенил)пиперидин-1-ил]-2-оксобензимидазолидин-1-ильную группу,
3-[4-(4-хлорфенил)пиперидин-1-ил]-2-оксобензимидазолидин-1-ильную группу,
3-[4-(2,3-дифторфенил)пиперидин-1-ил]-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-[4-(4-фторфенил)пиперидин-1-ил]-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-[4-(2,4,6-трихлорфенил)пиперидин-1-ил]-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-[4-(4-хлорфенил)пиперидин-1-ил]-5-хлор-2-оксобензимидазолидин-1-ильную группу,
3-[4-(3-фторфенил)пиперидин-1-ил]-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-[4-(4-иодфенил)пиперидин-1-ил]-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-[4-(3-бромфенил)пиперидин-1-ил]-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-[1-метилпиперидин-4-ил]-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-(пиперидин-4-ил)-2-оксобензимидазолидин-1-ильную группу,
3-(1-трет-бутоксикарбонилпиперидин-4-ил)-2-оксобензимидазолидин-1-ильную группу,
3-(бензилоксикарбонилпиперидин-4-ил)-2-оксобензимидазолидин-1-ильную группу,
3-(пиперидин-4-ил)-6-фтор-2-оксобензимидазолидин-1-ильную группу,
3-(1-трет-бутоксикарбонилпиперидин-4-ил)-6-фтор-2-оксобензимидазолидин-1-ильную группу,
3-(1-бензилоксикарбонилпиперидин-4-ил)-6-фтор-2-оксобензимидазолидин-1-ильную группу,
3-(пиперидин-4-ил)-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-(1-трет-бутоксикарбонилпиперидин-4-ил)-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-(1-бензилоксикарбонил-4-пиперидин-4-ил)-6-хлор-2-оксобензимидазолидин-1-ильную группу,
3-(1,2-диметилпиперидин-4-ил)бензимидазолидин-1-ильную группу,
3-(1-бензилоксикарбонил-2-метилпиперидин-4-ил)бензимидазолидин-1-ильную группу,
3-(1,2,6-триметилпиперидин-4-ил)бензимидазолидин-1-ильную группу или тому подобное.
Фталимидная группа включает, например, фталимид-2-ильную группу или тому подобное.
Индолинильная группа (которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, атома галогена и оксогруппы в качестве заместителя в индолиновом кольце) включает индолинильную группу (которая может содержать 1-3 группы, выбранных из группы, состоящей из С1-6алкильной группы, атома галогена и оксогруппы в качестве заместителя в индолиновом кольце), например индолин-1-ильную группу, индолин-2-ильную группу, индолин-3-ильную группу, индолин-4-ильную группу, индолин-5-ильную группу, индолин-6-ильную группу, индолин-7-ильную группу, 3-метилиндолин-1-ильную группу, 3,8-диброминдолин-1-ильную группу, 2-оксоиндолин-1-ильную группу (другое название: оксииндол-1-ильная группа), 3-метил-2-оксоиндолин-1-ильную группу, 3,3-диметил-2-оксоиндолин-1-ильную группу, 3-этил-2-оксоиндолин-1-ильную группу, 3-н-пропил-2-оксоиндолин-1-ильную группу, 3-н-бутил-2-оксоиндолин-1-ильную группу, 3-н-пентил-2-оксоиндолин-1-ильную группу, 3-фтор-2-оксоиндолин-1-ильную группу, 3,3-дифтор-2-оксоиндолин-1-ильную группу, 3-хлор-2-оксоиндолин-1-ильную группу, 3,3-дихлор-2-оксоиндолин-1-ильную группу или тому подобное.
Пример 2,3-дигидробензизотиазолильной группы (которая может содержать по крайней мере одну оксогруппу в качестве заместителя в 2,3-дигидробензизотиазольном кольце) включает 3-бензизотиазолидинон-1,1-диоксид-2-ильную группу или тому подобное.
Примеры 1H-2,4-бензоксазинильной группы (которая может содержать по крайней мере одну оксогруппу в качестве заместителя в 1H-2,4-бензоксазиновом кольце) включают 1H-2,4-бензоксазин-3(4H)-он-4-ильную группу, 1H-2,4-бензоксазин-1,3(4H)-дион-4-ильную группу или тому подобное.
Фенокси-С1-6алкильная группа, которая может содержать атом галогена в качестве заместителя в фенильном кольце, включает фенокси-С1-6алкильную группу, которая может содержать 1-5 атомов галогена, например феноксиметильную группу,
2-фторфеноксиметильную группу, 3-фторфеноксиметильную группу,
3,4-дифторфеноксиметильную группу,
3,5-дифторфеноксиметильную группу,
2,3,4,5,6-пентафторфеноксиметильную группу,
2-хлорфеноксиметильную группу, 3-хлорфеноксиметильную группу,
4-хлорфеноксиметильную группу,
3,4-дихлорфеноксиметильную группу,
3,5-дихлорфеноксиметильную группу, 2-феноксиэтильную группу,
1-феноксиэтильную группу, 3-феноксипропильную группу,
4-феноксибутильную группу, 5-феноксипентильную группу,
6-феноксигруппу, 2-(2,4,6-хлорфенокси)этильную группу,
3-(4-иодфенокси)пропильную группу,
4-(4-бромфенокси)бутильную группу,
5-(4-хлорфенокси)пентильную группу,
6-(4-хлорфенокси)гексильную группу или тому подобное.
Фенил-С1-6алкенильная группа, которая может содержать атом галогена в качестве заместителя в фенильном кольце, включает фенил-С1-6алкенильную группу, которая содержит 1-2 двойные связи, может содержать 1-5 атомов галогена в качестве заместителя в фенильном кольце, например 3-фенил-2-пропенильную группу (тривиальное название: циннамильная группа),
4-фенил-2-бутенильную группу, 4-фенил-3-бутенильную группу,
4-фенил-1,3-бутадиенильную группу,
5-фенил-1,3,5-гексатриенильную группу,
3-(2-фторфенил)-2-пропенильную группу,
3-(3-фторфенил)-2-пропенильную группу,
3-(4-фторфенил)-2-пропенильную группу,
3-(2,3-дифторфенил)-2-пропенильную группу,
3-(2,3,4,5,6-пентафторфенил)-2-пропенильную группу,
3-(3,4-дифторфенил)-2-пропенильную группу,
3-(3,5-дифторфенил)-2-пропенильную группу,
3-(2,4,6-трихлорфенил)-2-пропенильную группу,
3-(3-хлорфенил)-2-пропенильную группу,
3-(4-хлорфенил)-2-пропенильную группу,
3-(2,3-дихлорфенил)-2-пропенильную группу,
3-(2,4-дихлорфенил)-2-пропенильную группу,
3-(3,4-дихлорфенил)-2-пропенильную группу,
3-(3,5-дихлорфенил)-2-пропенильную группу,
3-(2-бромфенил)-2-пропенильную группу,
3-(3-бромфенил)-2-пропенильную группу,
3-(4-бромфенил)-2-пропенильную группу,
4-(4-хлорфенил)-2-бутенильную группу,
4-(4-хлорфенил)-3-бутенильную группу,
5-(4-хлорфенил)-2-пентенильную группу,
5-(4-хлорфенил)-4-пентенильную группу,
5-(4-хлорфенил)-3-пентенильную группу,
6-(4-хлорфенил)-5-гексенильную группу,
6-(4-хлорфенил)-4-гексенильную группу,
6-(4-хлорфенил)-3-гексенильную группу или тому подобное.
Фенильная группа, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и фенильной группы в качестве заместителя, включает фенильную группу, которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и фенильной группы в качестве заместителя, например фенильную группу, 2-фторфенильную группу,
3-фторфенильную группу, 4-фторфенильную группу,
2-хлорфенильную группу, 3-хлорфенильную группу,
4-хлорфенильную группу, 2-бромфенильную группу,
3-бромфенильную группу, 4-бромфенильную группу,
2-иодфенильную группу, 3-иодфенильную группу,
4-иодфенильную группу, 2,3-дифторфенильную группу,
3,4-дифторфенильную группу, 3,5-дифторфенильную группу,
2,4-дифторфенильную группу, 2,6-дифторфенильную группу,
2,3-дихлорфенильную группу, 3,4-дихлорфенильную группу,
3,5-дихлорфенильную группу, 2,4-дихлорфенильную группу,
2,6-дихлорфенильную группу, 3,4,5-трифторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,4,6-трихлорфенильную группу, 2-фтор-4-бромфенильную группу,
4-хлор-3-фторфенильную группу, 2,3,4-трихлорфенильную группу,
3,4,5-трифторфенильную группу, 2,4,6-трибромфенильную группу,
4-н-бутилфенильную группу, 2,4-диметилфенильную группу,
2,3-диметилфенильную группу, 2,6-диметилфенильную группу,
3,5-диметилфенильную группу, 2,5-диметилфенильную группу,
2,4,6-триметилфенильную группу,
3,5-дитрифторметилфенильную группу, 4-н-бутоксифенильную группу,
2,4-диметоксифенильную группу, 2,3-диметоксифенильную группу,
2,6-диметоксифенильную группу, 3,5-диметоксифенильную группу,
2,5-диметоксифенильную группу, 2,4,6-триметоксифенильную группу,
3,5-дитрифторметоксифенильную группу,
3-хлор-4-метоксифенильную группу,
2-хлор-4-трифторметоксифенильную группу,
3-метил-4-фторфенильную группу,
4-бром-3-трифторметилфенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2-метил-3-хлорфенильную группу,
3-метил-4-хлорфенильную группу, 2-хлор-4-метилфенильную группу,
2-метил-3-фторфенильную группу, 2-трифторметилфенильную группу,
3-трифторметилфенильную группу, 4-трифторметилфенильную группу,
2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
3-хлор-2-метоксифенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 2,6-диметоксифенильную группу,
2,3,4-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
3-фтор-2-трифторметоксифенильную группу,
2-фтор-3-трифторметоксифенильную группу,
3-фтор-4-трифторметоксифенильную группу,
3-хлор-2-трифторметоксифенильную группу,
2-хлор-3-трифторметоксифенильную группу,
3-хлор-4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
3-хлор-2-пентафторэтоксифенильную группу,
2-хлор-3-пентафторэтоксифенильную группу,
3-хлор-4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-н-пентоксифенильную группу, 4-н-гексилоксифенильную группу,
4-бифенилильную группу, 3-бифенилильную группу, 2-бифенилильную группу или тому подобное.
1,3-Тиазолидинильная группа (которая может быть замещена в 1,3-тиазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы и фенил-С1-6алкилиденовой группы, которая может содержать галогензамещенную или незамещенную С1-6алкильную группу в фенильной группе в качестве заместителя) включает 1,3-тиазолидинил (который может быть замещенным в 1,3-тиазолидиновом кольце 1-3 группами, выбранными из группы, состоящей из оксогруппы и фенил-С1-6алкилиденовой группы, которая может содержать 1-3 галогензамещенные или незамещенные С1-6алкильные группы в качестве заместителя в фенильной группе), например
1,3-тиазолидин-2-ильную группу, 1,3-тиазолидин-3-ильную группу,
1,3-тиазолидин-4-ильную группу, 1,3-тиазолидин-5-ильную группу,
1,3-тиазолидин-2,4-дион-3-ильную группу,
5-бензилиден-1,3-тиазолидин-3-ильную группу,
5-бензилиден-1,3-тиазолидин-2-он-3-ильную группу,
5-бензилиден-1,3-тиазолидин-4-он-3-ильную группу,
5-(2-метилбензилиден)-1,3-тиазолидин-3-ильную группу,
5-(2,4-диметилбензилиден)-1,3-тиазолидин-3-ильную группу,
5-(2,4,6-триметилбензилиден)-1,3-тиазолидин-3-ильную группу,
5-бензилиден-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-(2-трифторметилбензилиден)-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-(3,5-дитрифторметилбензилиден)-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-(4-тритрифторметилбензилиден)-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-[2-(4-тритрифторметилфенил)этилиден]-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-[3-(4-тритрифторметилфенил)пропилиден]-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-[4-(4-тритрифторметилфенил)бутилиден]-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-[5-(4-тритрифторметилфенил)пентилиден]-1,3-тиазолидин-2,4-дион-3-ильную группу,
5-[6-(4-трифторметилфенил)гексилиден]-1,3-тиазолидин-2,4-дион-3-ильную группу или тому подобное.
Галогензамещенная или незамещенная фенильная группа включает фенильную группу, которая может быть замещена 1-5 атомами галогена, например фенильную группу, 2-фторфенильную группу,
3-фторфенильную группу, 4-фторфенильную группу,
2-хлорфенильную группу, 3-хлорфенильную группу,
4-хлорфенильную группу, 2-бромфенильную группу,
3-бромфенильную группу, 4-бромфенильную группу,
2-иодфенильную группу, 3-иодфенильную группу,
4-иодфенильную группу, 2,3-дифторфенильную группу,
3,4-дифторфенильную группу, 3,5-дифторфенильную группу,
2,4-дифторфенильную группу, 2,6-дифторфенильную группу,
2,3-дихлорфенильную группу, 3,4-дихлорфенильную группу,
3,5-дихлорфенильную группу, 2,4-дихлорфенильную группу,
2,6-дихлорфенильную группу, 3,4,5-трифторфенильную группу,
3,4,5-трихлорфенильную группу, 2,4,6-трифторфенильную группу,
2,4,6-трихлорфенильную группу, 2-фтор-4-бромфенильную группу,
4-хлор-3-фторфенильную группу, 2,3,4-трихлорфенильную группу,
3,4,5-трифторфенильную группу, 2,4,6-трифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу или тому подобное.
Фенил-С1-6алкильная группа, которая может содержать фенильную группу в качестве заместителя в фенильном кольце, включает фенил-С1-6алкильную группу, которая может содержать 1-3 фенильные группы в качестве заместителя в фенильном кольце, например бензильную группу, 2-фенилэтильную группу,
1-фенилэтильную группу, 3-фенилпропильную группу,
4-фенилбутильную группу, 5-фенилпентильную группу,
6-фенилгексильную группу, 2-метил-3-фенилпропильную группу,
1,1-диметил-2-фенилэтильную группу, 3-фенилбензильную группу,
2-фенилбензильную группу, 4-фенилбензильную группу,
2,4-дифенилбензильную группу, 2,4,6-трифенилбензильную группу или тому подобное.
Фенильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, аминогруппы (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)), феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной феноксигруппой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)) включает фенильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, аминогруппы (которая может быть замещена в аминогруппе 1-2 группами, выбранными из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)), феноксигруппы (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) и пиперидильной группы (которая может быть замещена в пиперидиновом кольце 1-3 феноксигруппами в качестве заместителя (которые могут быть замещены 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы)), например фенильную группу, 2-фторфенильную группу,
3-фторфенильную группу, 4-фторфенильную группу,
2-хлорфенильную группу, 3-хлорфенильную группу,
4-хлорфенильную группу, 2-бромфенильную группу,
3-бромфенильную группу, 4-бромфенильную группу,
2-иодфенильную группу, 3-иодфенильную группу,
4-иодфенильную группу, 2,3-дифторфенильную группу,
2,3,4,5,6-пентафторфенильную группу, 3,4-дифторфенильную группу,
3,5-дифторфенильную группу, 2,4-дифторфенильную группу,
2,6-дифторфенильную группу, 2,3-дихлорфенильную группу,
3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу,
2,4-дихлорфенильную группу, 2,6-дихлорфенильную группу,
3,4,5-трифторфенильную группу, 3,4,5-трихлорфенильную группу,
2,4,6-трифторфенильную группу, 2,4,6-трихлорфенильную группу,
2-метилфенильную группу, 3-метилфенильную группу,
4-метилфенильную группу, 2,4-диметилфенильную группу,
2,4,6-триметилфенильную группу, 2-метил-3-хлорфенильную группу,
3-метил-4-хлорфенильную группу, 2-хлор-4-метилфенильную группу,
2-метил-3-фторфенильную группу, 2-трифторметилфенильную группу,
3-трифторметилфенильную группу,
3,5-ди(трифторметил)фенильную группу,
4-трифторметилфенильную группу,
2-пентафторэтилфенильную группу,
3-пентафторэтилфенильную группу,
4-пентафторэтилфенильную группу, 2-изопропилфенильную группу,
3-изопропилфенильную группу, 4-изопропилфенильную группу,
2-трет-бутилфенильную группу, 3-трет-бутилфенильную группу,
4-трет-бутилфенильную группу, 2-втор-бутилфенильную группу,
3-втор-бутилфенильную группу, 4-втор-бутилфенильную группу,
2-н-гептафторпропилфенильную группу,
3-н-гептафторпропилфенильную группу,
4-н-гептафторпропилфенильную группу, 4-пентилфенильную группу,
4-гексилфенильную группу, 2-метоксифенильную группу,
3-метоксифенильную группу, 4-метоксифенильную группу,
2-метокси-3-хлорфенильную группу,
2-фтор-3-метоксифенильную группу,
2-фтор-4-метоксифенильную группу, 2,6-диметоксифенильную группу,
2,4,6-триметоксифенильную группу,
2-трифторметоксифенильную группу,
3-трифторметоксифенильную группу,
4-трифторметоксифенильную группу,
3,5-дитрифторметоксифенильную группу,
4-трифторметоксифенильную группу,
2-пентафторэтоксифенильную группу,
3-пентафторэтоксифенильную группу,
4-пентафторэтоксифенильную группу,
2-изопропоксифенильную группу, 3-изопропоксифенильную группу,
4-изопропоксифенильную группу, 2-трет-бутоксифенильную группу,
3-трет-бутоксифенильную группу, 4-трет-бутоксифенильную группу,
2-втор-бутоксифенильную группу, 3-втор-бутоксифенильную группу,
4-втор-бутоксифенильную группу,
2-н-гептафторпропоксифенильную группу,
3-н-гептафторпропоксифенильную группу,
4-н-гептафторпропоксифенильную группу,
4-пентилоксифенильную группу, 4-гексилоксифенильную группу,
2-аминофенильную группу, 3-аминофенильную группу,
4-аминофенильную группу, 3-метиламинофенильную группу,
3-диметиламинофенильную группу, 4-метиламинофенильную группу,
4-диметиламинофенильную группу, 4-этиламинофенильную группу,
4-диэтиламинофенильную группу,
4-ди-н-пропиламинофенильную группу, 4-н-пропиламинофенильную группу, 4-н-бутиламинофенильную группу,
4-ди-н-бутиламинофенильную группу,
4-н-пентиламинофенильную группу,
4-ди-н-пентиламинофенильную группу,
4-н-гексиламинофенильную группу,
4-ди-н-гексиламинофенильную группу,
4-фениламинофенильную группу,
4-(2-фторфениламино)фенильную группу,
4-(3-фторфениламино)фенильную группу,
4-(4-фторфениламино)фенильную группу,
4-(2,3,4,5,6-пентафторфениламино)фенильную группу,
4-(2,4-дифторфениламино)фенильную группу,
4-(3,4-дифторфениламино)фенильную группу,
4-(3,5-дифторфениламино)фенильную группу,
4-(2-хлорфениламино)фенильную группу,
4-(3-хлорфениламино)фенильную группу,
4-(4-хлорфениламино)фенильную группу,
4-(2-бромфениламино)фенильную группу,
4-(3-бромфениламино)фенильную группу,
4-(4-бромфениламино)фенильную группу,
4-(2,3-дихлорфениламино)фенильную группу,
4-(2,4-дихлорфениламино)фенильную группу,
4-(2,4,6-трихлорфениламино)фенильную группу,
4-(3,5-дихлорфениламино)фенильную группу,
4-(2-метилфениламино)фенильную группу,
4-(3-метилфениламино)фенильную группу,
4-(4-метилфениламино)фенильную группу,
4-(2-этилфениламино)фенильную группу,
4-(3-этилфениламино)фенильную группу,
4-(4-этилфениламино)фенильную группу,
4-(4-н-пропилфениламино)фенильную группу,
4-(4-трет-бутилфениламино)фенильную группу,
4-(4-н-бутилфениламино)фенильную группу,
4-(2-трифторметилфениламино)фенильную группу,
4-(3-трифторметилфениламино)фенильную группу,
4-(4-трифторметилфениламино)фенильную группу,
4-(2-пентафторэтилфениламино)фенильную группу,
4-(3-пентафторэтилфениламино)фенильную группу,
4-(2,3-диметилфениламино)фенильную группу,
4-(3,4,5-триметилфениламино)фенильную группу,
4-(4-пентилфениламино)фенильную группу,
4-(4-гексилфениламино)фенильную группу,
4-(2-трифторметоксифениламино)фенильную группу,
4-(3-трифторметоксифениламино)фенильную группу,
4-(3-метоксифениламино)фенильную группу,
4-(2,4-диметоксифениламино)фенильную группу,
4-(2,4,6-триметоксифениламино)фенильную группу,
4-(4-трифторметоксифениламино)фенильную группу,
4-(2-пентафторэтоксифениламино)фенильную группу,
4-(3-пентафторэтоксифениламино)фенильную группу,
4-(4-пентафторэтоксифениламино)фенильную группу,
3-(N-метил-N-фениламино)фенильную группу,
2-феноксифенильную группу, 3-феноксифенильную группу,
4-феноксифенильную группу, 2-(2-хлорфенокси)фенильную группу,
2,4-дифеноксифенильную группу,
2-(3-хлорфенокси)фенильную группу,
2-(4-хлорфенокси)фенильную группу,
3-(2-хлорфенокси)фенильную группу,
3-(3-хлорфенокси)фенильную группу,
3-(4-хлорфенокси)фенильную группу,
4-(2-хлорфенокси)фенильную группу,
4-(2,3-дихлорфенокси)фенильную группу,
4-(2,4,6-трихлорфенокси)фенильную группу,
2-(2-трифторметилфенокси)фенильную группу,
2-(3-трифторметилфенокси)фенильную группу,
2-(4-трифторметилфенокси)фенильную группу,
3-(2-трифторметилфенокси)фенильную группу,
3-(3-трифторметилфенокси)фенильную группу,
3-(2,3,4,5,6-пентафторметилфенокси)фенильную группу,
4-(2-трифторметилфенокси)фенильную группу,
4-(3-трифторметилфенокси)фенильную группу,
4-(2,4-диметилфенокси)фенильную группу,
4-(2,4,6-триметилфенокси)фенильную группу,
4-(3-трифторметилфенокси)фенильную группу,
4-(4-трифторметилфенокси)фенильную группу,
2-(2-трифторметоксифенокси)фенильную группу,
2-(3-трифторметоксифенокси)фенильную группу,
2-(4-трифторметоксифенокси)фенильную группу,
2-(4-метоксифенокси)фенильную группу,
2-(2,4-диметоксифенокси)фенильную группу,
2-(2,4,6-триметоксифенокси)фенильную группу,
3-(2-трифторметоксифенокси)фенильную группу,
3-(3-трифторметоксифенокси)фенильную группу,
3-(4-трифторметоксифенокси)фенильную группу,
4-(2-трифторметоксифенокси)фенильную группу,
4-(3-трифторметоксифенокси)фенильную группу,
4-(4-трифторметоксифенокси)фенильную группу,
2-(4-феноксипиперидин-1-ил)фенильную группу,
3-(4-феноксипиперидин-1-ил)фенильную группу,
4-(4-феноксипиперидин-1-ил)фенильную группу,
2-[4-(4-хлорфенокси)пиперидин-1-ил]фенильную группу,
4-[4-(4-хлорфенокси)пиперидин-1-ил]фенильную группу,
3-[4-(2,4,6-трихлорфенокси)пиперидин-1-ил]фенильную группу,
4-[4-(3,4-дихлорфенокси)пиперидин-1-ил]фенильную группу,
4-[4-(2,3,4,5,6-пентафторфенокси)пиперидин-1-ил]фенильную группу, 4-[4-(4-бромфенокси)пиперидин-1-ил]фенильную группу,
3-[4-(4-хлорфенокси)пиперидин-1-ил]фенильную группу,
2-[4-(4-метилфенокси)пиперидин-1-ил]фенильную группу,
2-[4-(3,4-диметилфенокси)пиперидин-1-ил]фенильную группу,
2-[4-(3,4,5-триметилфенокси)пиперидин-1-ил]фенильную группу,
3-[4-(4-трифторметилфенокси)пиперидин-1-ил]фенильную группу,
4-[4-(4-трифторметилфенокси)пиперидин-1-ил]фенильную группу,
3-[4-(4-пентафторэтилфенокси)пиперидин-1-ил]фенильную группу,
4-[4-(4-пентафторэтилфенокси)пиперидин-1-ил]фенильную группу,
2-[4-(4-трифторметоксифенокси)пиперидин-1-ил]фенильную группу,
3-[4-(4-трифторметоксифенокси)пиперидин-1-ил]фенильную группу,
4-[4-(4-метоксифенокси)пиперидин-1-ил]фенильную группу,
4-[4-(2,4-диметоксифенокси)пиперидин-1-ил]фенильную группу,
4-[4-(2,4,6-триметоксифенокси)пиперидин-1-ил]фенильную группу,
4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]фенильную группу,
2-[4-(4-пентафторэтоксифенокси)пиперидин-1-ил]фенильную группу,
4-[4-(4-пентафторэтоксифенокси)пиперидин-1-ил]фенильную группу,
(3,4-дифеноксипиперидин-1-ил)фенильную группу,
пиперидин-1-илфенильную группу,
(3,4,5-трифеноксипиперидин-1-ил)фенильную группу,
пиперидин-4-илфенильную группу или тому подобное.
Пиперазинил-С1-6алкильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы, которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и фенильной группы) включает пиперазинил-С1-6алкильную группу (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкоксикарбонильной группы, которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и фенильной группы), например 1-пиперазинилметильную группу,
2-(2-пиперазинил)этильную группу,
1-(3-пиперазинил)этильную группу,
3-(4-пиперазинил)пропильную группу,
4-(1-пиперазинил)бутильную группу,
5-(2-пиперазинил)пентильную группу,
6-(3-пиперазинил)гексильную группу,
4-метоксикарбонил-1-пиперазинилметильную группу,
2-(4-метоксикарбонил-1-пиперазинил)этильную группу,
3-(4-метоксикарбонил-1-пиперазинил)пропильную группу,
4-(4-метоксикарбонил-1-пиперазинил)бутильную группу,
5-(4-метоксикарбонил-1-пиперазинил)пентильную группу,
6-(4-метоксикарбонил-1-пиперазинил)гексильную группу,
4-этоксикарбонил-1-пиперазинилметильную группу,
2-(4-этоксикарбонил-1-пиперазинил)этильную группу,
3-(4-этоксикарбонил-1-пиперазинил)пропильную группу,
4-(4-этоксикарбонил-1-пиперазинил)бутильную группу,
5-(4-этоксикарбонил-1-пиперазинил)пентильную группу,
6-(4-этоксикарбонил-1-пиперазинил)гексильную группу,
4-трет-бутоксикарбонил-1-пиперазинилметильную группу,
2-(4-трет-бутоксикарбонил-1-пиперазинил)этильную группу,
3-(4-трет-бутоксикарбонил-1-пиперазинил)пропильную группу,
4-(4-трет-бутоксикарбонил-1-пиперазинил)бутильную группу,
5-(4-трет-бутоксикарбонил-1-пиперазинил)пентильную группу,
6-(4-трет-бутоксикарбонил-1-пиперазинил)гексильную группу,
2-(4-бифенилилметоксикарбонил-1-пиперазинил)этильную группу,
3-(4-бифенилилметоксикарбонил-1-пиперазинил)пропильную группу,
4-(4-бифенилилметоксикарбонил-1-пиперазинил)бутильную группу,
5-(4-бифенилилметоксикарбонил-1-пиперазинил)пентильную группу,
6-(4-бифенилилметоксикарбонил-1-пиперазинил)гексильную группу,
2-(4-бензилоксикарбонил-1-пиперазинил)этильную группу,
3-(4-бензилоксикарбонил-1-пиперазинил)пропильную группу,
4-(4-бензилоксикарбонил-1-пиперазинил)бутильную группу,
5-(4-бензилоксикарбонил-1-пиперазинил)пентильную группу,
6-(4-(4-бензилоксикарбонил)-1-пиперазинил)гексильную группу,
2-(4-(2-фторбензилоксикарбонил)-1-пиперазинил)этильную группу,
3-(4-(2-фторбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(2,3-дифторбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(2-фторбензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)гексильную группу,
3-(4-(3-фторбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(3-фторбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(3-фторбензилоксикарбонил)-1-пиперазинил)пентильную группу,
3-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)гексильную группу,
2-(4-(2,3-дихлорбензилоксикарбонил)-1-пиперазинил)этильную группу,
3-(4-(2-хлорбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(2-хлорбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(2,4,6-трихлорбензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-(2-хлорбензилоксикарбонил)-1-пиперазинил)гексильную группу,
2-(4-(3-хлорбензилоксикарбонил)-1-пиперазинил)этильную группу,
3-(4-(3-хлорбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(3-трихлорбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(3-хлорбензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(3-хлор-4-метилбензилоксикарбонил-1-пиперазинил)гексильную группу,
2-(4-(4-хлорбензилоксикарбонил)-1-пиперазинил)этильную группу,
3-(4-(4-хлорбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(4-хлор-3-метоксибензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(4-хлорбензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-хлорбензилоксикарбонил-1-пиперазинил)гексильную группу,
2-(4-(2-метилбензилоксикарбонил)-1-пиперазинил)метильную группу,
2-(4-(2,4-диметилбензилоксикарбонил)-1-пиперазинил)метильную группу,
2-(4-(2,4,6-триметилбензилоксикарбонил)-1-пиперазинил)метильную группу,
2-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)этильную группу,
3-(4-(3,5-дитрифторметилбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)гексильную группу,
3-(4-(3-трифторметилбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(3-трифторметилбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(3-трифторметилбензилоксикарбонил)-1-пиперазинил)пентильную группу,
3-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)гексильную группу,
2-(4-(3,5-дитрифторметилбензилоксикарбонил)-1-пиперазинил)этильную группу,
2-(4-(2-метоксибензилоксикарбонил)-1-пиперазинил)метильную группу,
2-(4-(2,4-диметоксибензилоксикарбонил)-1-пиперазинил)метильную группу,
2-(4-(2,4,6-триметоксибензилоксикарбонил)-1-пиперазинил)метильную группу,
3-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)гексильную группу,
3-(4-(3-трифторметоксибензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(3-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(3-трифторметоксибензилоксикарбонил)-1-пиперазинил)пентильную группу,
3-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)пропильную группу,
4-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутильную группу,
5-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)пентильную группу,
6-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)гексильную группу,
(3,4-диэтоксикарбонил-1-пиперазинил)метильную группу,
(4-фенилметоксикарбонил-2,5-диметоксикарбонил-1-пиперазинил)метильную группу или тому подобное.
Пиперазинилкарбонил-С1-6алкильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, которая может содержать в качестве заместителя галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце, и фенил-С1-6алкильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и фенильной группы, в фенильном кольце) включает пиперазинилкарбонил-С1-6алкильную группу (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, которая может содержать 1-3 галогензамещенные или незамещенные С1-6алкильные группы в фенильном кольце, и фенил-С1-6алкильной группы, которая может содержать в качестве заместителя 1-3 группы, выбранные из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и фенильной группы, в качестве заместителя в фенильном кольце), например
1-пиперазинилкарбонилметильную группу,
2-(2-пиперазинилкарбонил)этильную группу,
1-(3-пиперазинилкарбонил)этильную группу,
3-(4-пиперазинилкарбонил)пропильную группу,
4-(1-пиперазинилкарбонил)бутильную группу,
5-(2-пиперазинилкарбонил)пентильную группу,
6-(3-пиперазинилкарбонил)гексильную группу,
4-трет-бутоксикарбонил-1-пиперазинилкарбонилметильную группу,
2-(4-трет-бутоксикарбонил-1-пиперазинилкарбонил)этильную группу,
3-(4-трет-бутоксикарбонил-1-пиперазинилкарбонил)пропильную группу,
4-(4-трет-бутоксикарбонил-1-пиперазинилкарбонил)бутильную группу,
5-(4-трет-бутоксикарбонил-1-пиперазинилкарбонил)пентильную группу,
6-(4-трет-бутоксикарбонил-1-пиперазинилкарбонил)гексильную группу,
4-этоксикарбонил-1-пиперазинилкарбонилметильную группу,
2-(4-этоксикарбонил-1-пиперазинилкарбонил)этильную группу,
3-(4-н-пропоксикарбонил-1-пиперазинилкарбонил)пропильную группу,
4-(4-этоксикарбонил-1-пиперазинилкарбонил)бутильную группу,
5-(4-н-пентилоксикарбонил-1-пиперазинилкарбонил)пентильную группу,
6-(4-н-гексилоксикарбонил-1-пиперазинилкарбонил)гексильную группу,
4-(бензилоксикарбонил)-1-пиперазинилкарбонилметильную группу,
2-(4-(бензилоксикарбонил)-1-пиперазинилкарбонил)этильную группу,
3-(4-(бензилоксикарбонил)-1-пиперазинилкарбонил)пропильную группу,
4-(4-(бензилоксикарбонил)-1-пиперазинилкарбонил)бутильную группу,
5-(4-(бензилоксикарбонил)-1-пиперазинилкарбонил)пентильную группу,
6-(4-(бензилоксикарбонил)-1-пиперазинилкарбонил)гексильную группу,
4-(4-метилбензилоксикарбонил)-1-пиперазинилкарбонилметильную группу,
4-(2,4-диметилбензилоксикарбонил)-1-пиперазинилкарбонилметильную группу,
4-(2,4,6-триметилбензилоксикарбонил)-1-пиперазинилкарбонилметильную группу,
4-(4-трифторметилбензилоксикарбонил)-1-пиперазинилкарбонилметильную группу,
2-(4-(3,5-дитрифторметилбензилоксикарбонил)-1-пиперазинилкарбонил)этильную группу,
3-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинилкарбонил)пропильную группу,
4-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинилкарбонил)бутильную группу,
5-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинилкарбонил)пентильную группу,
6-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинилкарбонил)гексильную группу,
4-(2-фенилэтоксикарбонил)-1-пиперазинилкарбонилметильную группу,
2-{4-[2-(4-трифторметилфенил)этоксикарбонил]-1-пиперазинилкарбонил}этильную группу,
3-{4-[2-(4-трифторметилфенил)этоксикарбонил]-1-пиперазинилкарбонил}пропильную группу,
4-{4-[2-(4-метилфенил)этоксикарбонил]-1-пиперазинилкарбонил}бутильную группу,
5-{4-[2-(2,4,6-триметилфенил)этоксикарбонил]-1-пиперазинилкарбонил}пентильную группу,
6-{4-[2-(4-трифторметилфенил)этоксикарбонил]-1-пиперазинилкарбонил}гексильную группу,
4-бензил-1-пиперазинилкарбонилметильную группу,
4-(4-трифторметилбензил)-1-пиперазинилкарбонилметильную группу,
2-(4-(4-трифторметилбензил)-1-пиперазинилкарбонил)этильную группу,
3-(4-(4-трифторметилбензил)-1-пиперазинилкарбонил)пропильную группу,
4-(4-метилбензил)-1-пиперазинилкарбонилметильную группу,
4-(2,4-диметилбензил)-1-пиперазинилкарбонилметильную группу,
4-(2,4,6-триметилбензил)-1-пиперазинилкарбонилметильную группу,
4-(4-(4-трифторметилбензил)-1-пиперазинилкарбонил)бутильную группу,
5-(4-(3,5-дитрифторметилбензил)-1-пиперазинилкарбонил)пентильную группу,
6-(4-(4-трифторметилбензил)-1-пиперазинилкарбонил)гексильную группу,
4-(4-бифенилилметил)-1-пиперазинилкарбонилметильную группу,
2-(4-(4-бифенилилметил)-1-пиперазинилкарбонил)этильную группу,
3-(4-(4-бифенилилметил)-1-пиперазинилкарбонил)пропильную группу,
4-(4-(4-бифенилилметил)-1-пиперазинилкарбонил)бутильную группу,
5-(4-(4-бифенилилметил)-1-пиперазинилкарбонил)пентильную группу,
6-(4-(4-бифенилилметил)-1-пиперазинилкарбонил)гексильную группу,
2,4-дибензил-1-пиперазинилкарбонилметильную группу,
4-бензилоксикарбонил-3-бензил-1-пиперазинилкарбонилметильную группу,
4-этоксикарбонил-2,6-дибензил-1-пиперазинилкарбонилметильную группу или тому подобное.
Фенилкарбамоил-С1-6алкильная группа, которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в качестве заместителя в фенильном кольце, включает фенилкарбамоил-С1-6алкильную группу, которая может содержать 1-3 галогензамещенные или незамещенные С1-6алкильные группы в качестве заместителя в фенильном кольце, например
4-метилфенилкарбамоилметильную группу,
2,4-диметилфенилкарбамоилметильную группу,
2,4,6-триметилфенилкарбамоилметильную группу,
3-этилфенилкарбамоилметильную группу,
2-н-пропилфенилкарбамоилметильную группу,
4-н-бутилфенилкарбамоилметильную группу,
4-н-пентилфенилкарбамоилметильную группу,
4-н-гексилфенилкарбамоилметильную группу,
4-трифторметилфенилкарбамоилметильную группу,
2-(4-трифторметилфенилкарбамоил)этильную группу,
3-(3,5-дитрифторметилфенилкарбамоил)пропильную группу,
4-(4-трифторметилфенилкарбамоил)бутильную группу,
5-(4-трифторметилфенилкарбамоил)пентильную группу,
6-(4-трифторметилфенилкарбамоил)гексильную группу или тому подобное.
Примеры бензоксазолил-С1-6алкильной группы (которая может содержать по крайней мере одну оксогруппу в качестве заместителя в бензоксазольном кольце) включают бензоксазол-2-илметильную группу, бензоксазол-4-илметильную группу,
бензоксазол-5-илметильную группу,
бензоксазол-6-илметильную группу,
бензоксазол-7-илметильную группу,
2-(бензоксазол-2-ил)этильную группу,
1-(бензоксазол-4-ил)этильную группу,
3-(бензоксазол-5-ил)пропильную группу,
4-(бензоксазол-6-ил)бутильную группу,
5-(бензоксазол-7-ил)пентильную группу,
6-(бензоксазол-2-ил)гексильную группу,
2-метил-3-(бензоксазол-4-ил)пропильную группу,
1,1-диметил-2-(бензоксазол-5-ил)этильную группу,
(2,3-дигидро-2-оксобензоксазол-3-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-4-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-5-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-6-ил)метильную группу,
(2,3-дигидро-2-оксобензоксазол-7-ил)метильную группу или тому подобное.
Фенилтиокарбамоильная группа, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена в качестве заместителя, включает фенилтиокарбамоильную группу, которая может быть замещена в фенильном кольце 1-5 атомами галогена в качестве заместителя, например фенилтиокарбамоильную группу, 4-фторфенилтиокарбамоильную группу,
4-хлорфенилтиокарбамоильную группу,
4-бромфенилтиокарбамоильную группу,
3,4-дихлорфенилтиокарбамоильную группу,
3,4,6-трихлорфенилтиокарбамоильную группу,
2,3,4,5,6-пентафторфенилтиокарбамоильную группу или тому подобное.
Примеры С1-8алкоксикарбонильной группы включают метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, н-пентилоксикарбонильную группу, н-гексилоксикарбонильную группу, н-гептилоксикарбонильную группу, н-октилоксикарбонильную группу или тому подобное.
Фенил-С1-6алкоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, С1-6алкоксикарбонильной группы, аминогруппы, которая может содержать С1-6алкоксикарбонильную группу в качестве заместителя, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, нитрогруппы и С1-6алкилтиогруппы) включает фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, С1-6алкоксикарбонильной группы, аминогруппы, которая может содержать С1-6алкоксикарбонильную группу в качестве заместителя, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, нитрогруппы и С1-6алкилтиогруппы), например бензилоксикарбонильную группу,
1-фенетилоксиоксикарбонильную группу,
2-фенетилоксиоксикарбонильную группу,
3-фенилпропоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентилоксикарбонильную группу,
4-фенилпентилоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-фторбензилоксикарбонильную группу,
3-фторбензилоксикарбонильную группу,
4-фторбензилоксикарбонильную группу,
2-хлорбензилоксикарбонильную группу,
3-хлорбензилоксикарбонильную группу,
4-хлорбензилоксикарбонильную группу,
2-бромбензилоксикарбонильную группу,
3-бромбензилоксикарбонильную группу,
4-бромбензилоксикарбонильную группу,
2-иодбензилоксикарбонильную группу,
3-иодбензилоксикарбонильную группу,
4-иодбензилоксикарбонильную группу,
2,3-дифторбензилоксикарбонильную группу,
3,4-дифторбензилоксикарбонильную группу,
3,5-дифторбензилоксикарбонильную группу,
2,4-дифторбензилоксикарбонильную группу,
2,6-дифторбензилоксикарбонильную группу,
2,4,6-трифторбензилоксикарбонильную группу,
2,3,4,5,6-пентафторбензилоксикарбонильную группу,
3,4,5-трифторбензилоксикарбонильную группу,
2,3-дихлорбензилоксикарбонильную группу,
3,4-дихлорбензилоксикарбонильную группу,
3,5-дихлорбензилоксикарбонильную группу,
2,4-дихлорбензилоксикарбонильную группу,
2,6-дихлорбензилоксикарбонильную группу,
2,4,6-трихлорбензилоксикарбонильную группу,
3,4,5-трихлорбензилоксикарбонильную группу,
2-трифторметилбензилоксикарбонильную группу,
3-метилбензилоксикарбонильную группу,
2,4-диметилбензилоксикарбонильную группу,
2,4,6-триметилбензилоксикарбонильную группу,
3-дифторметилбензилоксикарбонильную группу,
4-дифторметилбензилоксикарбонильную группу,
4-хлор-3-дифторметилбензилоксикарбонильную группу,
3-хлор-4-дифторметилбензилоксикарбонильную группу,
3-бром-4-дифторметилбензилоксикарбонильную группу,
3,5-дифтор-4-дифторметилбензилоксикарбонильную группу,
3,5-дитрифторметилбензилоксикарбонильную группу,
3-трифторметилбензилоксикарбонильную группу,
4-трифторметилбензилоксикарбонильную группу,
4-фтор-3-трифторметилбензилоксикарбонильную группу,
3-фтор-4-трифторметилбензилоксикарбонильную группу,
2-пентафторэтилбензилоксикарбонильную группу,
4-хлор-3-пентафторэтилбензилоксикарбонильную группу,
3-хлор-4-пентафторэтилбензилоксикарбонильную группу,
2-пентафторэтилбензилоксикарбонильную группу,
3-пентафторэтилбензилоксикарбонильную группу,
4-пентафторэтилбензилоксикарбонильную группу,
3-метоксибензилоксикарбонильную группу,
2,4-диметоксибензилоксикарбонильную группу,
2,4,6-триметоксибензилоксикарбонильную группу,
2-трифторметоксибензилоксикарбонильную группу,
3-трифторметоксибензилоксикарбонильную группу,
4-трифторметоксибензилоксикарбонильную группу,
4-фтор-3-трифторметоксибензилоксикарбонильную группу,
3-фтор-4-трифторметоксибензилоксикарбонильную группу,
2-пентафторэтоксибензилоксикарбонильную группу,
3-пентафторэтоксибензилоксикарбонильную группу,
4-пентафторэтоксибензилоксикарбонильную группу,
3-хлор-4-трифторметоксибензилоксикарбонильную группу,
3-хлор-4-пентафторэтоксибензилоксикарбонильную группу,
2-(2-трифторметилфенил)этоксикарбонильную группу,
2-(3-трифторметилфенил)этоксикарбонильную группу,
2-(4-трифторметилфенил)этоксикарбонильную группу,
2-(4-трифторметоксифенил)этоксикарбонильную группу,
2-(2-пентафторэтоксифенил)этоксикарбонильную группу,
2-(3-пентафторэтоксифенил)этоксикарбонильную группу,
2-(4-пентафторэтоксифенил)этоксикарбонильную группу,
3-(2-трифторметилфенил)пропоксикарбонильную группу,
3-(3-трифторметилфенил)пропоксикарбонильную группу,
3-(4-трифторметилфенил)пропоксикарбонильную группу,
3-(2-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-трифторметоксифенил)пропоксикарбонильную группу,
3-(4-трифторметоксифенил)пропоксикарбонильную группу,
3-(3-пентафторэтоксифенил)пропоксикарбонильную группу,
3-(4-пентафторэтоксифенил)пропоксикарбонильную группу,
4-(3-пентафторэтоксифенил)бутоксикарбонильную группу,
5-(4-трифторметилфенил)пентилоксикарбонильную группу,
4-(4-трифторметилфенил)пентилоксикарбонильную группу,
4-(4-трифторметоксифенил)пентилоксикарбонильную группу,
6-(3-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметилфенил)гексилоксикарбонильную группу,
6-(4-трифторметоксифенил)гексилоксикарбонильную группу,
2-метилтиобензилоксикарбонильную группу,
3-метилтиобензилоксикарбонильную группу,
4-метилтиобензилоксикарбонильную группу,
2-(2-метилтиофенил)этоксикарбонильную группу,
2-(3-метилтиофенил)этоксикарбонильную группу,
2-(4-метилтиофенил)этоксикарбонильную группу,
3-(4-метилтиофенил)пропоксикарбонильную группу,
4-(4-метилтиофенил)бутоксикарбонильную группу,
5-(4-метилтиофенил)пентилоксикарбонильную группу,
6-(4-метилтиофенил)гексилоксикарбонильную группу,
2-метоксикарбонилбензилоксикарбонильную группу,
3-метоксикарбонилбензилоксикарбонильную группу,
4-метоксикарбонилбензилоксикарбонильную группу,
2-(2-метоксикарбонилфенил)этоксикарбонильную группу,
2-(3-метоксикарбонилфенил)этоксикарбонильную группу,
2-(4-метоксикарбонилфенил)этоксикарбонильную группу,
3-(4-метоксикарбонилфенил)пропоксикарбонильную группу,
4-(4-метоксикарбонилфенил)бутоксикарбонильную группу,
5-(4-метоксикарбонилфенил)пентилоксикарбонильную группу,
6-(4-метоксикарбонилфенил)гексилоксикарбонильную группу,
4-н-пентилоксикарбониламинобензилоксикарбонильную группу,
4-этоксикарбониламинобензилоксикарбонильную группу,
4-пропоксикарбониламинобензилоксикарбонильную группу,
4-трет-бутоксикарбониламинобензилоксикарбонильную группу,
2-(н-гексилоксикарбониламинофенил)этоксикарбонильную группу,
3-(4-трет-бутоксикарбониламинофенил)пропоксикарбонильную группу, 4-(4-трет-бутоксикарбониламинофенил)бутоксикарбонильную группу, 5-(4-трет-бутоксикарбониламинофенил)пентилоксикарбонильную группу,
6-(4-трет-бутоксикарбониламинофенил)гексилоксикарбонильную группу, 2-нитробензилоксикарбонильную группу,
3-нитробензилоксикарбонильную группу,
4-нитробензилоксикарбонильную группу,
2-(2-нитрофенил)этоксикарбонильную группу,
2-(3-нитрофенил)этоксикарбонильную группу,
2-(4-нитрофенил)этоксикарбонильную группу,
3-(2,4-динитрофенил)пропоксикарбонильную группу,
4-(4-нитрофенил)бутоксикарбонильную группу,
5-(4-нитрофенил)пентилоксикарбонильную группу,
6-(2,4,6-тринитрофенил)гексилоксикарбонильную группу,
2-аминобензилоксикарбонильную группу,
3-аминобензилоксикарбонильную группу,
4-аминобензилоксикарбонильную группу,
2-(2-аминофенил)этоксикарбонильную группу,
2-(2,3-диаминофенил)этоксикарбонильную группу,
2-(4-аминофенил)этоксикарбонильную группу,
3-(2,4,6-триаминофенил)пропоксикарбонильную группу,
4-(4-аминофенил)бутоксикарбонильную группу,
5-(4-аминофенил)пентилоксикарбонильную группу,
6-(4-аминофенил)гексилоксикарбонильную группу,
2-этоксикарбонилбензилоксикарбонильную группу,
3-этоксикарбонилбензилоксикарбонильную группу,
4-метоксикарбонилбензилоксикарбонильную группу,
2-(2-этоксикарбонилфенил)этоксикарбонильную группу,
2-(3-этоксикарбонилфенил)этоксикарбонильную группу,
2-(4-этоксикарбонилфенил)этоксикарбонильную группу,
3-(4-н-бутоксикарбонилфенил)пропоксикарбонильную группу,
4-(4-н-пентилоксикарбонилфенил)бутоксикарбонильную группу,
5-(4-н-гексилоксикарбонилфенил)пентилоксикарбонильную группу,
6-(4-н-этоксикарбонилфенил)гексилоксикарбонильную группу или тому подобное.
Бензгидрилоксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена) включает бензгидрилоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-4 атомами галогена), например бензгидрилоксикарбонильную группу,
3-фторбензгидрилоксикарбонильную группу,
4-фторбензгидрилоксикарбонильную группу,
3,3'-дифторбензгидрилоксикарбонильную группу,
3,4'-дифторбензгидрилоксикарбонильную группу,
4,4'-дифторбензгидрилоксикарбонильную группу,
3,4,4'-трифторбензгидрилоксикарбонильную группу,
3,3',4,4'-тетрафторбензгидрилоксикарбонильную группу,
2,2',4,4'-тетрафторбензгидрилоксикарбонильную группу,
3,3',5,5'-тетрафторбензгидрилоксикарбонильную группу,
3-хлорбензгидрилоксикарбонильную группу,
4-хлорбензгидрилоксикарбонильную группу,
3,3'-дихлорбензгидрилоксикарбонильную группу,
3,4'-дихлорбензгидрилоксикарбонильную группу,
4,4'-дихлорбензгидрилоксикарбонильную группу,
3,4,4'-трихлорбензгидрилоксикарбонильную группу,
3,3',4,4'-тетрахлорбензгидрилоксикарбонильную группу,
2,2',4,4'-тетрахлорбензгидрилоксикарбонильную группу,
3,3',5,5'-тетрахлорбензгидрилоксикарбонильную группу или тому подобное.
Примеры фенилзамещенной или незамещенной фенил-С1-6алкоксикарбонильной группы включают бензилоксикарбонильную группу, 1-фенилэтоксикарбонильную группу,
2-фенилэтоксикарбонильную группу,
3-фенилэтоксикарбонильную группу,
2-фенилпропоксикарбонильную группу,
4-фенилбутоксикарбонильную группу,
5-фенилпентоксикарбонильную группу,
4-фенилпентоксикарбонильную группу,
6-фенилгексилоксикарбонильную группу,
2-бифенилилметоксикарбонильную группу,
2-(2-бифенилил)этоксикарбонильную группу,
3-(2-бифенилил)пропоксикарбонильную группу,
4-(2-бифенилил)бутоксикарбонильную группу,
5-(2-бифенилил)пентоксикарбонильную группу,
6-(2-бифенилил)гексилоксикарбонильную группу,
3-бифенилилметоксикарбонильную группу,
2-(3-бифенилил)этоксикарбонильную группу,
3-(3-бифенилил)пропоксикарбонильную группу,
4-(3-бифенилил)бутоксикарбонильную группу,
5-(3-бифенилил)пентоксикарбонильную группу,
6-(3-бифенилил)гексилоксикарбонильную группу,
4-бифенилилметоксикарбонильную группу,
2-(4-бифенилил)этоксикарбонильную группу,
3-(4-бифенилил)пропоксикарбонильную группу,
4-(4-бифенилил)бутоксикарбонильную группу,
5-(4-бифенилил)пентоксикарбонильную группу,
6-(4-бифенилил)гексилоксикарбонильную группу или тому подобное.
Примеры пиридил-С1-6алкоксикарбонильной группы включают 2-пиридилметоксикарбонильную группу,
3-пиридилметоксикарбонильную группу,
4-пиридилметоксикарбонильную группу,
2-(2-пиридил)этоксикарбонильную группу,
2-(3-пиридил)этоксикарбонильную группу,
2-(4-пиридил)этоксикарбонильную группу,
3-(2-пиридил)пропоксикарбонильную группу,
3-(3-пиридил)пропоксикарбонильную группу,
3-(4-пиридил)пропоксикарбонильную группу,
4-(2-пиридил)бутоксикарбонильную группу,
4-(3-пиридил)бутоксикарбонильную группу,
4-(4-пиридил)бутоксикарбонильную группу,
5-(2-пиридил)пентилоксикарбонильную группу,
5-(3-пиридил)пентилоксикарбонильную группу,
5-(4-пиридил)пентилоксикарбонильную группу,
6-(2-пиридил)гексилоксикарбонильную группу,
6-(3-пиридил)гексилоксикарбонильную группу,
6-(4-пиридил)гексилоксикарбонильную группу или тому подобное.
Примеры С1-6алкоксизамещенной С1-6алкоксикарбонильной группы включают метоксиметоксикарбонильную группу,
метоксиэтоксикарбонильную группу,
1-этоксиэтоксикарбонильную группу,
н-пропоксиметоксикарбонильную группу,
н-бутоксиметоксикарбонильную группу,
н-пентилоксиметоксикарбонильную группу,
н-гексилоксиметоксикарбонильную группу,
1-метоксиэтоксикарбонильную группу,
2-этоксиэтоксикарбонильную группу,
2-н-пропоксиэтоксикарбонильную группу,
н-бутоксиметоксикарбонильную группу,
н-пентилоксиметоксикарбонильную группу,
н-гексилоксиметоксикарбонильную группу,
3-метоксипропоксикарбонильную группу,
4-метоксибутоксикарбонильную группу,
5-метоксипентилоксикарбонильную группу,
6-метоксигексилоксикарбонильную группу или тому подобное.
Пиперазинил-С1-6алкоксикарбонильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкоксикарбонильной группы, которая может содержать в качестве заместителя по крайней мере один атом галогена в фенильном кольце, в качестве заместителя) включает пиперазинил-С1-6алкоксикарбонильную группу (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкоксикарбонильной группы, которая может содержать в качестве заместителя 1-5 атомов галогена в фенильном кольце, в качестве заместителя), например (1-пиперазинил)метоксикарбонильную группу,
2-(2-пиперазинил)этоксикарбонильную группу,
1-(3-пиперазинил)этоксикарбонильную группу,
3-(4-пиперазинил)пропоксикарбонильную группу,
4-(1-пиперазинил)бутоксикарбонильную группу,
5-(2-пиперазинил)пентилоксикарбонильную группу,
6-(3-пиперазинил)гексилоксикарбонильную группу,
2-метил-3-(1-пиперазинил)пропоксикарбонильную группу,
1,1-диметил-2-(4-пиперазинил)этоксикарбонильную группу,
2-(1-пиперазинил)этоксикарбонильную группу,
2-(4-метоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-этоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-н-пропоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-трет-бутоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-втор-бутоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-н-пентилоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-н-гексилоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-бензилоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-фенилэтоксикарбонил-1-пиперазинил)этоксикарбонильную группу,
2-(4-(3-фенилпропоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(2-фторбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(4-фторбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(4-хлорбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(3-хлорбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(2-бромбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(2-хлорбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(3,4-дифторбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(2,3,4,5,6-пентафторбензилоксикарбонил-1-пиперазинил)метокси)карбонильную группу,
2-(4-(2,4-дихлорбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
2-(4-(2,4,6-трихлорбензилоксикарбонил-1-пиперазинил)этокси)карбонильную группу,
(3,4-метоксикарбонил-1-пиперазинил)метоксикарбонильную группу,
(2,5-метоксикарбонил-4-бензилоксикарбонил-1-пиперазинил)метоксикарбонильную группу или тому подобное.
Феноксикарбонильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и С1-6алкоксигруппы) включает феноксикарбонильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкильной группы и С1-6алкоксигруппы), например феноксикарбонильную группу, 2-метилфеноксикарбонильную группу,
3-метилфеноксикарбонильную группу,
4-метилфеноксикарбонильную группу,
2-этилфеноксикарбонильную группу,
3-этилфеноксикарбонильную группу,
4-этилфеноксикарбонильную группу,
4-пропилфеноксикарбонильную группу,
4-трет-бутилфеноксикарбонильную группу,
4-бутилфеноксикарбонильную группу,
2,3-диметилфеноксикарбонильную группу,
3,4,5-триметилфеноксикарбонильную группу,
4-пентилфеноксикарбонильную группу,
4-гексилфеноксикарбонильную группу,
2-метоксифеноксикарбонильную группу,
3-метоксифеноксикарбонильную группу,
4-метоксифеноксикарбонильную группу,
2-этоксифеноксикарбонильную группу,
3-этоксифеноксикарбонильную группу,
4-этоксифеноксикарбонильную группу,
4-пропоксифеноксикарбонильную группу,
4-трет-бутоксифеноксикарбонильную группу,
4-н-бутоксифеноксикарбонильную группу,
2,3-диметоксифеноксикарбонильную группу,
3,4,5-триметоксифеноксикарбонильную группу,
4-пентоксифеноксикарбонильную группу,
4-гексилоксифеноксикарбонильную группу,
2-метил-4-метоксифеноксикарбонильную группу или тому подобное.
Бензоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) включает бензоильную группу (которая может быть замещена в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами), например
бензоильную группу, 2-метилбензоильную группу,
3-метилбензоильную группу, 4-метилбензоильную группу,
2-этилбензоильную группу, 3-этилбензоильную группу,
4-этилбензоильную группу, 4-н-пропилбензоильную группу,
4-трет-бутилбензоильную группу, 4-н-пентилбензоильную группу,
4-н-гексилбензоильную группу, 2,3-диметилбензоильную группу,
3,4-диметилбензоильную группу, 2,4,6-триметилбензоильную группу,
2-трифторметилбензоильную группу,
3-трифторметилбензоильную группу,
4-трифторметилбензоильную группу,
4-пентафторэтилбензоильную группу,
2,3-дифторметилбензоильную группу,
3,4-трифторметилбензоильную группу или тому подобное.
Фенил С2-6алканоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой) включает фенил С2-6алканоильную группу (которая может быть замещена в фенильном кольце 1-3 галогензамещенными или незамещенными С1-6алкильными группами), например фенилацетильную группу,
3-фенилпропионильную группу, 4-фенилбутирильную группу,
5-фенилпентаноильную группу, 6-фенилгексаноильную группу,
2-метилфенилацетильную группу,
3-метилфенилацетильную группу, 4-метилфенилацетильную группу,
2-трифторметилфенилацетильную группу,
3-трифторметилфенилацетильную группу,
4-трифторметилфенилацетильную группу,
3-(2,4-диметилфенил)пропионильную группу,
(2,4,6-триметилфенил)ацетильную группу,
3-(2-метилфенил)пропионильную группу,
3-(3-метилфенил)пропионильную группу,
3-(4-метилфенил)пропионильную группу,
3-(2-трифторметилфенил)пропионильную группу,
3-(3-трифторметилфенил)пропионильную группу,
3-(4-трифторметилфенил)пропионильную группу,
3-(3,5-диметилфенил)пропионильную группу,
4-(4-трифторметилфенил)бутирильную группу,
5-(4-трифторметилфенил)пентаноильную группу,
6-(3,5-дитрифторметилфенил)гексаноильную группу,
4-(4-трифторметилфенил)бутирильную группу,
5-(4-пентафторэтилфенил)пентаноильную группу,
6-(4-пентафторэтилфенил)гексаноильную группу или тому подобное.
Примеры фенокси-С2-6алканоильной группы (которая может быть замещена в фенильном кольце 1-3 атомами галогена) включают феноксиацетильную группу, 3-феноксипропионильную группу,
4-феноксипропионильную группу, 5-феноксипропионильную группу,
6-феноксипропионильную группу,
4-(4-хлорфенокси)бутирильную группу,
5-(4-хлорфенокси)пентаноильную группу,
6-(4-хлорфенокси)гексаноильную группу,
2-фторфеноксиацетильную группу, 3-фторфеноксиацетильную группу,
4-фторфеноксиацетильную группу, 2-хлорфеноксиацетильную группу,
3-хлорфеноксиацетильную группу, 4-хлорфеноксиацетильную группу,
4-бромфеноксиацетильную группу,
2,3-дифторфеноксиацетильную группу,
2-фтор-4-хлорфеноксиацетильную группу,
3,5-дифторфеноксиацетильную группу,
2,4,6-трихлорфеноксиацетильную группу,
3-(2-фторфенокси)пропионильную группу,
3-(3-фторфенокси)пропионильную группу,
3-(4-фторфенокси)пропионильную группу,
3-(2-хлорфенокси)пропионильную группу,
3-(3-хлорфенокси)пропионильную группу,
3-(4-хлорфенокси)пропионильную группу,
3-(4-бромфенокси)пропионильную группу,
3-(2,3-дифторфенокси)пропионильную группу,
3-(2-фтор-4-хлорфенокси)пропионильную группу,
3-(3,5-дифторфенокси)пропионильную группу,
4-(4-фторфенокси)бутирильную группу,
5-(4-бромфенокси)пентаноильную группу,
6-(4-хлорфенокси)гексаноильную группу,
4-(4-хлорфенокси)бутирильную группу,
5-(4-иодфенокси)пентаноильную группу,
6-(4-хлорфенокси)гексаноильную группу или тому подобное.
Пиперазинил-С2-6алканоильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алканоильной группы; фенил-С1-6алкильной группы, которая может содержать в фенильном кольце в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; фенил-С1-6алкоксикарбонильной группы, которая может содержать в фенильном кольце в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; фенилкарбамоил-С1-6алкильной группы, которая может содержать в фенильном кольце в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; фенилкарбамоильной группы, которая может содержать в фенильном кольце в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; и бензоксазолильной группы) включает пиперазинил-С2-6алканоильную группу (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алканоильной группы; фенил-С1-6алкильной группы, которая может содержать в фенильном кольце в качестве заместителя 1-5, предпочтительно 1-3, группы, выбранные из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; фенил-С1-6алкоксикарбонильной группы, которая может содержать в фенильном кольце в качестве заместителя 1-5, предпочтительно 1-3, группы, выбранные из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; фенилкарбамоил-С1-6алкильной группы, которая может содержать в фенильном кольце в качестве заместителя 1-5, предпочтительно 1-3, группы, выбранные из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; фенилкарбамоильной группы, которая может содержать в фенильном кольце в качестве заместителя 1-5, предпочтительно 1-3, группы, выбранные из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы; и бензоксазолильной группы), например
1-пиперазинилацетильную группу,
3-(2-пиперазинил)пропаноильную группу,
4-(3-пиперазинил)бутирильную группу,
4-(4-пиперазинил)пентаноильную группу,
5-(1-пиперазинил)пентаноильную группу,
6-(2-пиперазинил)гексаноильную группу,
4-ацетил-1-пиперазинилацетильную группу,
3-(4-пропионил-1-пиперазинил)пропионильную группу,
3-(4-бутирил-1-пиперазинил)бутирильную группу,
4-(4-пентаноил-1-пиперазинил)бутирильную группу,
5-(4-гексаноил-1-пиперазинил)пентаноильную группу,
6-(4-ацетил-1-пиперазинил)гексаноильную группу,
4-бензил-1-пиперазинилацетильную группу,
3-[(4-(2-фенилэтил)-1-пиперазинил]пропионильную группу,
(4-ацетил-3-бензил-1-пиперазинил)ацетильную группу,
(4-бензилоксикарбонил-2-бензил-1-пиперазинил)ацетильную группу,
(4-фенилкарбамоил-2,6-дибензил-1-пиперазинил)ацетильную группу,
4-[4-(1-фенилэтил)-1-пиперазинил]бутирильную группу,
[4-(3-фенилпропил)-1-пиперазинил]бутирильную группу,
5-[4-(5-фенилпентил)-1-пиперазинил]пентаноильную группу,
6-[4-(6-фенилгексил)-1-пиперазинил]гексаноильную группу,
4-(4-фенилбензил)-1-пиперазинилацетильную группу,
3-[4-(3-фторбензил)-1-пиперазинил]пропионильную группу,
4-[4-(2,3,4,5,6-пентафторбензил)-1-пиперазинил]бутирильную группу,
4-[4-(2,4-дихлорбензил)-1-пиперазинил]бутирильную группу,
5-[4-(2,4,6-трихлорбензил)-1-пиперазинил]пентаноильную группу,
6-[4-(4-метилбензил)-1-пиперазинил]гексаноильную группу,
[4-(4-трифторметилбензил)-1-пиперазинил]ацетильную группу,
[4-(3,5-дитрифторметилбензил)-1-пиперазинил]ацетильную группу,
[4-(2,3-диметилбензил)-1-пиперазинил]ацетильную группу,
[4-(2,4,6-триметилбензил)-1-пиперазинил]ацетильную группу,
6-[4-(4-метоксибензил)-1-пиперазинил]гексаноильную группу,
[4-(4-трифторметоксибензил)-1-пиперазинил]ацетильную группу,
[4-(3,5-дитрифторметоксибензил)-1-пиперазинил]ацетильную группу,
[4-(2,3-диметоксибензил)-1-пиперазинил]ацетильную группу,
[4-(2,4,6-триметоксибензил)-1-пиперазинил]ацетильную группу,
3-(4-бензилоксикарбонил-1-пиперазинил)пропионильную группу,
(4-(2,4-дихлорбензилоксикарбонил)-1-пиперазинил)ацетильную группу,
3-(4-бензилоксикарбонил-1-пиперазинил)бутирильную группу,
4-(4-бензилоксикарбонил-1-пиперазинил)бутирильную группу,
5-(4-бензилоксикарбонил-1-пиперазинил)пентаноильную группу,
6-(4-бензилоксикарбонил-1-пиперазинил)гексаноильную группу,
3-(4-(2-фторбензилоксикарбонил)-1-пиперазинил)пропионильную группу,
3-(4-(2-фторбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(2-фторбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(2,3,4,5,6-пентафторбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(4-фторбензилоксикарбонил-1-пиперазинил)гексаноильную группу,
3-(4-(2,3-дифторбензилоксикарбонил-1-пиперазинил)бутирильную группу,
4-(4-(3-фторбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(3-фторбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
3-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(4-(4-фторбензилоксикарбонил)-1-пиперазинил)гексаноильную группу,
3-(4-(2-хлорбензилоксикарбонил)-1-пиперазинил)пропионильную группу,
3-(4-(2-хлорбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(2-хлорбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(2-хлорбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(2,4,6-трихлорбензилоксикарбонил-1-пиперазинил)гексаноильную группу,
3-(4-(3-хлорбензилоксикарбонил)-1-пиперазинил)пропионильную группу,
3-(4-(3-хлорбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(3-хлорбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(3-хлорбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(3-хлорбензилоксикарбонил-1-пиперазинил)гексаноильную группу,
2-(4-(4-хлорбензилоксикарбонил)-1-пиперазинил)пропионильную группу,
3-(4-(4-хлорбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(4-хлорбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(4-хлорбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(4-хлорбензилоксикарбонил-1-пиперазинил)гексаноильную группу,
(4-(2-метилбензилоксикарбонил)-1-пиперазинил)ацетильную группу,
(4-(2,4-диметилбензилоксикарбонил)-1-пиперазинил)ацетильную группу,
(4-(2,4,6-триметилбензилоксикарбонил)-1-пиперазинил)ацетильную группу,
4-(2-метоксибензилоксикарбонил-1-пиперазинил)ацетильную группу,
(4-(2,4-диметоксибензилоксикарбонил)-1-пиперазинил)ацетильную группу,
(4-(2,4,6-триметоксибензилоксикарбонил)-1-пиперазинил)ацетильную группу,
(4-(3,5-дитрифторметилбензилоксикарбонил)-1-пиперазинил)ацетильную группу,
(4-(3,5-дитрифторметоксибензилоксикарбонил)-1-пиперазинил)ацетильную группу,
3-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)пропионильную группу,
3-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(2-трифторметилбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(4-трифторметилбензилоксикарбонил-1-пиперазинил)гексаноильную группу,
3-(4-(3-трифторметилбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(3-трифторметилбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(3-трифторметилбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
3-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(4-(4-трифторметилбензилоксикарбонил)-1-пиперазинил)гексаноильную группу,
2-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)пропионильную группу,
3-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(2-трифторметоксибензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(4-трифторметоксибензилоксикарбонил-1-пиперазинил)гексаноильную группу,
3-(4-(3-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(3-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(3-трифторметоксибензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
3-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутирильную группу,
4-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)бутирильную группу,
5-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)пентаноильную группу,
6-(4-(4-трифторметоксибензилоксикарбонил)-1-пиперазинил)гексаноильную группу,
4-фенилкарбамоилметил-1-пиперазинилацетильную группу,
3-(4-фенилкарбамоилметил-1-пиперазинил)пропионильную группу,
(4-(4-фторфенилкарбамоилметил)-1-пиперазинил)ацетильную группу,
3-(4-(2,3,4,5,6-пентафторфенилкарбамоилметил)-1-пиперазинил)пропионильную группу,
4-(4-хлорфенилкарбамоилметил)-1-пиперазинилацетильную группу,
3-(4-(3,4-дихлорфенилкарбамоилметил)-1-пиперазинил)пропионильную группу,
4-(4-метилфенилкарбамоилметил)-1-пиперазинилацетильную группу,
3-(4-(2,4-диметилфенилкарбамоилметил)-1-пиперазинил)пропионильную группу,
4-(4-метоксифенилкарбамоилметил)-1-пиперазинилацетильную группу,
3-(4-(2,4,6-триметоксифенилкарбамоилметил)-1-пиперазинил)пропионильную группу,
3-(4-(4-трифторметилфенилкарбамоилметил)-1-пиперазинил)пропионильную группу,
4-(4-трифторметоксифенилкарбамоилметил)-1-пиперазинилацетильную группу,
3-(4-(4-трифторметоксифенилкарбамоилметил)-1-пиперазинил)пропионильную группу,
4-фенилкарбамоил-1-пиперазинилацетильную группу,
3-(4-фенилкарбамоил-1-пиперазинил)пропионильную группу,
4-(4-фторфенилкарбамоил-1-пиперазинил)ацетильную группу,
3-(4-(2,3,4,5,6-пентафторфенилкарбамоил)-1-пиперазинил)пропионильную группу,
4-(4-хлорфенилкарбамоил)-1-пиперазинилацетильную группу,
4-(2,4-дихлорфенилкарбамоил)-1-пиперазинилацетильную группу,
4-(2,6-дихлорфенилкарбамоил)-1-пиперазинилацетильную группу,
3-(4-(4-хлорфенилкарбамоил)-1-пиперазинил)пропионильную группу,
4-(4-метилфенилкарбамоил)-1-пиперазинилацетильную группу,
3-(4-(3,4-диметилфенилкарбамоил)-1-пиперазинил)пропионильную группу,
4-(4-метоксифенилкарбамоил)-1-пиперазинилацетильную группу,
3-[4-(2,4,6-триметоксифенилкарбамоил)-1-пиперазинил]пропионильную группу,
3-(4-(4-трифторметилфенилкарбамоил)-1-пиперазинил)пропионильную группу,
4-(3,5-дитрифторметоксифенилкарбамоил)-1-пиперазинилацетильную группу,
3-(4-(4-трифторметоксифенилкарбамоил)-1-пиперазинил)пропионильную группу,
3-(4-(4-фторфенилкарбамоил)-1-пиперазинил)пропионильную группу,
3-(4-(4-метилфенилкарбамоил)-1-пиперазинил)пропионильную группу,
3-(4-(4-метоксифенилкарбамоил)-1-пиперазинил)пропионильную группу,
4-(2-бензоксазолинил)-1-пиперазинилацетильную группу,
3-(4-(2-бензоксазолинил)-1-пиперазинил)пропионильную группу,
4-(4-(2-бензоксазолинил)-1-пиперазинил)бутирильную группу,
5-(4-(2-бензоксазолинил)-1-пиперазинил)пентаноильную группу,
6-(4-(2-бензоксазолинил)-1-пиперазинил)гексаноильную группу или тому подобное.
Фенилкарбамоильная группа (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, карбоксильной группы, С1-6алкоксикарбонильной группы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, пиперазинильной группы, которая может содержать С1-6алкильную группу в качестве заместителя в пиперазиновом кольце, и морфолиногруппы) включает фенилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, аминогруппы, которая может содержать 1-2 С1-6алкильные группы в качестве заместителя, карбоксильной группы, С1-6алкоксикарбонильной группы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, пиперазинильной группы, которая может содержать 1-3 С1-6алкильные группы в качестве заместителя в пиперазиновом кольце, и морфолиногруппы, причем фрагмент аминогруппы может быть замещен другой С1-6алкильной группой или фенил-С1-6алкильной группой), например фенилкарбамоильную группу, 2-фторфенилкарбамоильную группу,
3-фторфенилкарбамоильную группу,
4-фторфенилкарбамоильную группу,
2-хлорфенилкарбамоильную группу,
3-хлорфенилкарбамоильную группу,
4-хлорфенилкарбамоильную группу,
2-бромфенилкарбамоильную группу,
3-бромфенилкарбамоильную группу,
4-бромфенилкарбамоильную группу, 2-иодфенилкарбамоильную группу,
3-иодфенилкарбамоильную группу, 4-иодфенилкарбамоильную группу,
2,3-дифторфенилкарбамоильную группу,
3,4-дифторфенилкарбамоильную группу,
3,5-дифторфенилкарбамоильную группу,
2,4-дифторфенилкарбамоильную группу,
2,6-дифторфенилкарбамоильную группу,
2,3-дихлорфенилкарбамоильную группу,
3,4-дихлорфенилкарбамоильную группу,
3,5-дихлорфенилкарбамоильную группу,
2,4-дихлорфенилкарбамоильную группу,
2,6-дихлорфенилкарбамоильную группу,
3,4,5-трифторфенилкарбамоильную группу,
2,3-дифторфенилкарбамоильную группу,
3,4,5-трихлорфенилкарбамоильную группу,
2,4,6-трифторфенилкарбамоильную группу,
2,4,6-трихлорфенилкарбамоильную группу,
2-метилфенилкарбамоильную группу,
3-метилфенилкарбамоильную группу,
4-метилфенилкарбамоильную группу,
2-метил-3-хлорфенилкарбамоильную группу,
3-метил-4-хлорфенилкарбамоильную группу,
2-хлор-4-метилфенилкарбамоильную группу,
2-метил-3-фторфенилкарбамоильную группу,
2-трифторметилфенилкарбамоильную группу,
3-трифторметилфенилкарбамоильную группу,
4-трифторметилфенилкарбамоильную группу,
N-метил-N-фенилкарбамоильную группу,
N-(2-фторфенил)-N-метилкарбамоильную группу,
N-(3-фторфенил)-N-метилкарбамоильную группу,
N-(4-фторфенил)-N-метилкарбамоильную группу,
N-(2-хлорфенил)-N-метилкарбамоильную группу,
N-(3-хлорфенил)-N-метилкарбамоильную группу,
N-(4-хлорфенил)-N-метилкарбамоильную группу,
N-(4-бромфенил)-N-метилкарбамоильную группу,
N-(2-иодфенил)-N-метилкарбамоильную группу,
N-(3-иодфенил)-N-метилкарбамоильную группу,
N-(4-иодфенил)-N-метилкарбамоильную группу,
N-(2,3-дифторфенил)-N-метилкарбамоильную группу,
N-(3,4-дифторфенил)-N-метилкарбамоильную группу,
N-(3,5-дифторфенил)-N-метилкарбамоильную группу,
N-(2,4-дифторфенил)-N-метилкарбамоильную группу,
N-(2,6-дифторфенил)-N-метилкарбамоильную группу,
N-(2,3-дихлорфенил)-N-метилкарбамоильную группу,
N-(3,4-дихлорфенил)-N-метилкарбамоильную группу,
N-(3,5-дихлорфенил)-N-метилкарбамоильную группу,
N-(2,4-дихлорфенил)-N-метилкарбамоильную группу,
N-(2,6-дихлорфенил)-N-метилкарбамоильную группу,
N-(3,4,5-трифторфенил)-N-метилкарбамоильную группу,
N-(3,4,5-трихлорфенил)-N-метилкарбамоильную группу,
N-(2,4,6-трифторфенил)-N-метилкарбамоильную группу,
N-(2,4,6-трихлорфенил)-N-метилкарбамоильную группу,
N-(2-метилфенил)-N-метилкарбамоильную группу,
N-(3-метилфенил)-N-метилкарбамоильную группу,
N-(4-метилфенил)-N-метилкарбамоильную группу,
N-(2-метил-3-хлорфенил)-N-метилкарбамоильную группу,
N-(3-метил-4-хлорфенил)-N-метилкарбамоильную группу,
N-(2-хлор-4-метилфенил)-N-метилкарбамоильную группу,
N-(2-метил-3-фторфенил)-N-метилкарбамоильную группу,
N-(2-трифторметилфенил)-N-метилкарбамоильную группу,
N-(4-трифторметилфенил)-N-метилкарбамоильную группу,
N-бензил-N-фенилкарбамоильную группу,
N-бензил-N-(2-фторфенил)карбамоильную группу,
N-бензил-N-(3-фторфенил)карбамоильную группу,
N-бензил-N-(4-фторфенил)карбамоильную группу,
N-бензил-N-(2-хлорфенил)карбамоильную группу,
N-бензил-N-(3-хлорфенил)карбамоильную группу,
N-бензил-N-(4-хлорфенил)карбамоильную группу,
N-бензил-N-(2-бромфенил)карбамоильную группу,
N-бензил-N-(3-бромфенил)карбамоильную группу,
N-бензил-N-(4-бромфенил)карбамоильную группу,
N-бензил-N-(2-иодфенил)карбамоильную группу,
N-бензил-N-(3-иодфенил)карбамоильную группу,
N-бензил-N-(4-иодфенил)карбамоильную группу,
N-бензил-N-(2,3-дифторфенил)карбамоильную группу,
N-бензил-N-(3,4-дифторфенил)карбамоильную группу,
N-бензил-N-(3,5-дифторфенил)карбамоильную группу,
N-бензил-N-(2,4-дифторфенил)карбамоильную группу,
N-бензил-N-(2,6-дифторфенил)карбамоильную группу,
N-бензил-N-(2,3-дихлорфенил)карбамоильную группу,
N-бензил-N-(3,4-дихлорфенил)карбамоильную группу,
N-бензил-N-(3,5-дихлорфенил)карбамоильную группу,
N-бензил-N-(2,4-дихлорфенил)карбамоильную группу,
N-бензил-N-(2,6-дихлорфенил)карбамоильную группу,
N-бензил-N-(3,4,5-трифторфенил)карбамоильную группу,
N-бензил-N-(3,4,5-трихлорфенил)карбамоильную группу,
N-бензил-N-(2,3-дифторфенил)карбамоильную группу,
N-бензил-N-(2,4,6-трихлорфенил)карбамоильную группу,
N-бензил-N-(2-метилфенил)карбамоильную группу,
N-бензил-N-(3-метилфенил)карбамоильную группу,
N-бензил-N-(4-метилфенил)карбамоильную группу,
N-бензил-N-(2-метил-3-хлорфенил)карбамоильную группу,
N-бензил-N-(3-метил-4-хлорфенил)карбамоильную группу,
N-бензил-N-(2-хлор-4-метилфенил)карбамоильную группу,
N-бензил-N-(2-метил-3-фторфенил)карбамоильную группу,
N-бензил-N-(2-трифторметилфенил)карбамоильную группу,
N-бензил-N-(3-трифторметилфенил)карбамоильную группу,
N-бензил-N-(4-трифторметилфенил)карбамоильную группу,
2-пентафторэтилфенилкарбамоильную группу,
3-пентафторэтилфенилкарбамоильную группу,
4-пентафторэтилфенилкарбамоильную группу,
2-изопропилфенилкарбамоильную группу,
3-изопропилфенилкарбамоильную группу,
4-изопропилфенилкарбамоильную группу,
2-трет-бутилфенилкарбамоильную группу,
3-трет-бутилфенилкарбамоильную группу,
4-трет-бутилфенилкарбамоильную группу,
2-втор-бутилфенилкарбамоильную группу,
3-втор-бутилфенилкарбамоильную группу,
4-втор-бутилфенилкарбамоильную группу,
2-н-гептафторпропилфенилкарбамоильную группу,
3-н-гептафторпропилфенилкарбамоильную группу,
4-н-гептафторпропилфенилкарбамоильную группу,
4-пентилфенилкарбамоильную группу,
4-гексилфенилкарбамоильную группу,
2-метоксифенилкарбамоильную группу,
3-метоксифенилкарбамоильную группу,
4-метоксифенилкарбамоильную группу,
2-метокси-3-хлорфенилкарбамоильную группу,
2-фтор-3-метоксифенилкарбамоильную группу,
2-фтор-4-метоксифенилкарбамоильную группу,
2,6-диметоксифенилкарбамоильную группу,
2,3,4-трифторфенилкарбамоильную группу,
3,4,5-трифторфенилкарбамоильную группу,
2-трифторметоксифенилкарбамоильную группу,
3-трифторметоксифенилкарбамоильную группу,
4-трифторметоксифенилкарбамоильную группу,
2-пентафторэтоксифенилкарбамоильную группу,
3-пентафторэтоксифенилкарбамоильную группу,
4-пентафторэтоксифенилкарбамоильную группу,
2-изопропоксифенилкарбамоильную группу,
3-изопропоксифенилкарбамоильную группу,
4-изопропоксифенилкарбамоильную группу,
2-трет-бутоксифенилкарбамоильную группу,
3-трет-бутоксифенилкарбамоильную группу,
4-трет-бутоксифенилкарбамоильную группу,
2-втор-бутоксифенилкарбамоильную группу,
3-втор-бутоксифенилкарбамоильную группу,
4-втор-бутоксифенилкарбамоильную группу,
2-н-гептафторпропоксифенилкарбамоильную группу,
3-н-гептафторпропоксифенилкарбамоильную группу,
4-н-гептафторпропоксифенилкарбамоильную группу,
4-пентилоксифенилкарбамоильную группу,
4-гексилоксифенилкарбамоильную группу,
2-диметиламинофенилкарбамоильную группу,
2,4-диметиламинофенилкарбамоильную группу,
2,4,6-триметиламинофенилкарбамоильную группу,
3-диметиламинофенилкарбамоильную группу,
4-метиламинофенилкарбамоильную группу,
2-карбоксифенилкарбамоильную группу,
3-карбоксифенилкарбамоильную группу,
4-карбоксифенилкарбамоильную группу,
2,3-дикарбоксифенилкарбамоильную группу,
2,4,6-трикарбоксифенилкарбамоильную группу,
2-метоксикарбонилфенилкарбамоильную группу,
3-метоксикарбонилфенилкарбамоильную группу,
4-метоксикарбонилфенилкарбамоильную группу,
2-этоксикарбонилфенилкарбамоильную группу,
3-этоксикарбонилфенилкарбамоильную группу,
4-этоксикарбонилфенилкарбамоильную группу,
2-пропоксикарбонилфенилкарбамоильную группу,
3-пропоксикарбонилфенилкарбамоильную группу,
4-пропоксикарбонилфенилкарбамоильную группу,
2-(1-пиперазинил)фенилкарбамоильную группу,
2-(2,4-диметил-1-пиперазинил)фенилкарбамоильную группу,
2-(2,3,4-триметил-1-пиперазинил)фенилкарбамоильную группу,
2-(4-метил-1-пиперазинил)фенилкарбамоильную группу,
3-(4-метил-1-пиперазинил)фенилкарбамоильную группу,
4-(4-метил-1-пиперазинил)фенилкарбамоильную группу,
2-морфолинофенилкарбамоильную группу,
3-морфолинофенилкарбамоильную группу,
4-морфолинофенилкарбамоильную группу или тому подобное.
Фенил-С1-6алкилкарбамоильная группа (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) включает фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы), например бензилкарбамоильную группу, 1-фенилэтилкарбамоильную группу,
2-фенилэтилкарбамоильную группу,
3-фенилпропилкарбамоильную группу,
4-фенилбутилкарбамоильную группу,
5-фенилпентилкарбамоильную группу,
6-фенилгексилкарбамоильную группу,
2-метил-3-фенилпропилкарбамоильную группу,
1,1-диметил-2-фенилэтилкарбамоильную группу,
2-метилбензилкарбамоильную группу,
3-метилбензилкарбамоильную группу,
4-метилбензилкарбамоильную группу,
2,4-диметилбензилкарбамоильную группу,
2,4,6-триметилбензилкарбамоильную группу,
4-трифторметил-3-метоксибензилкарбамоильную группу,
2-этилбензилкарбамоильную группу,
3-этилбензилкарбамоильную группу,
4-этилбензилкарбамоильную группу,
2-изопропилбензилкарбамоильную группу,
3-изопропилбензилкарбамоильную группу,
4-изопропилбензилкарбамоильную группу,
2,4-диметоксибензилкарбамоильную группу,
2,4,6-триметоксибензилкарбамоильную группу,
4-трифторметокси-3-метилбензилкарбамоильную группу,
4-метоксибензилкарбамоильную группу,
2-этоксибензилкарбамоильную группу,
3-этоксибензилкарбамоильную группу,
4-этоксибензилкарбамоильную группу,
2-изопропоксибензилкарбамоильную группу,
3-изопропоксибензилкарбамоильную группу,
4-изопропоксибензилкарбамоильную группу,
4-трифторметилбензилкарбамоильную группу,
4-пентафторэтилбензилкарбамоильную группу,
4-н-гептафторпропилбензилкарбамоильную группу,
4-трифторметоксибензилкарбамоильную группу,
4-пентафторэтоксибензилкарбамоильную группу,
4-н-гептафторпропоксибензилкарбамоильную группу или тому подобное.
Пиперазинилкарбонильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, которая может содержать по крайней мере одну галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце, и фенил-С1-6алкильной группы, которая может содержать галогензамещенную или незамещенную С1-6алкильную группу в фенильном кольце) включает пиперазинилкарбонильную группу (которая может быть замещена в пиперазиновом кольце 1-3 группами, выбранными из группы, состоящей из С1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, которая может содержать 1-3 галогензамещенные или незамещенные С1-6алкильные группы в фенильном кольце, и фенил-С1-6алкильной группы, которая может содержать 1-3 галогензамещенные или незамещенные С1-6алкильные группы в фенильном кольце), например
1-пиперазинилкарбонильную группу,
2-пиперазинилкарбонильную группу,
3-пиперазинилкарбонильную группу,
4-пиперазинилкарбонильную группу,
4-трет-бутоксикарбонил-1-пиперазинилкарбонильную группу,
4-(4-метилбензилоксикарбонил)-1-пиперазинилкарбонильную группу,
4-(2,4-диметилбензилоксикарбонил)-1-пиперазинилкарбонильную группу,
4-(2,4,6-триметилбензилоксикарбонил)-1-пиперазинилкарбонильную группу,
4-(4-трифторметилбензилоксикарбонил)-1-пиперазинилкарбонильную группу,
4-(4-метилбензил)-1-пиперазинилкарбонильную группу,
4-(3,4-диметилбензил)-1-пиперазинилкарбонильную группу,
4-(3,4,5-триметилбензил)-1-пиперазинилкарбонильную группу,
4-(4-трифторметилбензил)-1-пиперазинилкарбонильную группу,
4-метоксикарбонил-3-бензил-1-пиперазинилкарбонильную группу,
4-бензилоксикарбонил-3,5-диметоксикарбонил-1-пиперазинилкарбонильную группу или тому подобное.
Фенил-С1-6алкоксигруппа (фенильная группа может содержать по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя в фенильном кольце) представляет собой фенил-С1-6алкоксигруппу, которая может быть замещена 1-5, предпочтительно 1-3, группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, определенных выше, примеры которой включают бензилоксигруппу,
2-фенилэтоксигруппу, 3-фенилпропоксигруппу,
2-фенилпропоксигруппу, 4-фенилбутоксигруппу,
5-фенилпентоксигруппу, 4-фенилпентоксигруппу,
6-фенилгексилоксигруппу, 2-фторбензилоксигруппу,
3-фторбензилоксигруппу, 4-фторбензилоксигруппу,
2-(2-фторфенил)этоксигруппу, 2-(3-фторфенил)этоксигруппу,
2-(4-фторфенил)этоксигруппу, 2-хлорбензилоксигруппу,
3-хлорбензилоксигруппу, 4-хлорбензилоксигруппу,
2-фтор-4-бромбензилоксигруппу, 4-хлор-3-фторбензилоксигруппу,
2,3,4-трихлорбензилоксигруппу, 3,4,5-трифторбензилоксигруппу,
2,3,4,5,6-пентафторбензилоксигруппу,
2,4,6-трихлорбензилоксигруппу, 4-изопропилбензилоксигруппу,
4-н-бутилбензилоксигруппу, 4-метилбензилоксигруппу,
2-метилбензилоксигруппу, 3-метилбензилоксигруппу,
2,4-диметилбензилоксигруппу, 2,3-диметилбензилоксигруппу,
2,6-диметилбензилоксигруппу, 3,5-диметилбензилоксигруппу,
2,5-диметилбензилоксигруппу, 2,4,6-триметилбензилоксигруппу,
3,5-ди(трифторметил)бензилоксигруппу,
4-изопропоксибензилоксигруппу, 4-н-бутоксибензилоксигруппу,
4-метоксибензилоксигруппу, 2-метоксибензилоксигруппу,
3-метоксибензилоксигруппу, 2,4-диметоксибензилоксигруппу,
2,3-диметоксибензилоксигруппу, 2,6-диметоксибензилоксигруппу,
3,5-диметоксибензилоксигруппу, 2,5-диметоксибензилоксигруппу,
2,4,6-триметоксибензилоксигруппу,
3,5-ди(трифторметокси)бензилоксигруппу,
2-изопропоксибензилоксигруппу, 3-хлор-4-метоксибензилоксигруппу,
2-хлор-4-трифторметоксибензилоксигруппу,
3-метил-4-фторбензилоксигруппу,
4-бром-3-трифторметилбензилоксигруппу,
2-(2-хлорфенил)этоксигруппу, 2-(3-хлорфенил)этоксигруппу,
2-(4-хлорфенил)этоксигруппу, 2-трифторметилбензилоксигруппу,
3-трифторметилбензилоксигруппу, 4-трифторметилбензилоксигруппу,
2-трифторметоксибензилоксигруппу,
3-трифторметоксибензилоксигруппу,
4-трифторметоксибензилоксигруппу,
2-(2-трифторметилфенил)этоксигруппу,
2-(3-трифторметилфенил)этоксигруппу,
2-(4-трифторметилфенил)этоксигруппу,
2-(2-трифторметоксифенил)этоксигруппу,
2-(3-трифторметоксифенил)этоксигруппу,
2-(4-трифторметоксифенил)этоксигруппу,
3-(2-трифторметилфенил)пропоксигруппу,
3-(3-трифторметилфенил)пропоксигруппу,
3-(4-трифторметилфенил)пропоксигруппу,
3-(2-трифторметоксифенил)пропоксигруппу,
3-(3-трифторметоксифенил)пропоксигруппу,
3-(4-трифторметоксифенил)пропоксигруппу,
4-(3-трифторметилфенил)бутоксигруппу,
5-(4-трифторметилфенил)пентоксигруппу,
4-(4-трифторметилфенил)пентоксигруппу,
4-(4-трифторметоксифенил)пентоксигруппу,
6-(3-трифторметилфенил)гексилоксигруппу,
6-(4-трифторметилфенил)гексилоксигруппу,
6-(4-трифторметоксифенил)гексилоксигруппу или тому подобное.
С3-8циклоалкил-С1-6алкильная группа представляет собой группу, состоящую из циклической алкильной группы, содержащей 3-8 углеродных атомов, и алкильной группы, содержащей 1-6 углеродных атомов, примеры которой включают циклопропилметильную группу,
2-циклопропилэтильную группу, 3-циклопропилпропильную группу,
4-циклопропилбутильную группу, 5-циклопропилпентильную группу, 6-циклопропилгексильную группу, циклобутилметильную группу,
2-циклобутилэтильную группу, 3-циклобутилпропильную группу,
4-циклобутилбутильную группу, 5-циклобутилпентильную группу,
6-циклобутилгексильную группу, циклопентилметильную группу,
2-циклопентилэтильную группу, 3-циклопентилпропильную группу,
4-циклопентилбутильную группу, 5-циклопентилпентильную группу,
6-циклопентилгексильную группу, циклогексилметильную группу,
2-циклогексилэтильную группу, 3-циклогексилпропильную группу,
4-циклогексилбутильную группу, 5-циклогексилпентильную группу,
6-циклогексилгексильную группу, циклогептилметильную группу,
2-циклогептилэтильную группу, 3-циклогептилпропильную группу,
4-циклогептилбутильную группу, 5-циклогептилпентильную группу,
6-циклогептилгексильную группу, циклооктилметильную группу,
2-циклооктилэтильную группу, 3-циклооктилпропильную группу,
4-циклооктилбутильную группу, 5-циклооктилпентильную группу,
6-циклооктилгексильную группу или тому подобное.
Далее описаны способы получения соединений по настоящему изобретению.
Схема 1 реакций

где R1, R2 и n являются такими, как определено выше, и Х1 представляет собой атом галогена или нитрогруппу.
Согласно схеме 1 соединение по настоящему изобретению, представленное общей формулой (1а), получают реакцией производного 4-нитроимидазола, представленного общей формулой (2), с эпоксидным соединением, представленным общей формулой (3а), в присутствии или в отсутствие основания с получением соединения, представленного общей формулой (4а), и затем подвергая полученное соединение реакции замыкания кольца.
Молярное отношение соединения общей формулы (2) к соединению общей формулы (3а) обычно может находиться в пределах от 1:0,5 до 1:5 и предпочтительно от 1:0,5 до 1:3.
В качестве основания в настоящем изобретении могут быть широко использованы известные соединения. Примеры таких оснований включают неорганические основания, такие как гидрид металла, алкоголят металла, гидроксид, карбонат или гидрокарбонат, и органические основания, такие как ацетат.
Конкретные примеры гидрида металла включают гидрид натрия и гидрид калия. Конкретные примеры алкоголята металла включают метоксид натрия, этоксид натрия и трет-бутоксид калия. Конкретные примеры гидроксида включают гидроксид натрия и гидроксид калия. Конкретные примеры карбоната включают карбонат натрия и карбонат калия. Конкретные примеры гидрокарбоната включают гидрокарбонат натрия и гидрокарбонат калия. Кроме указанных выше соединений, к неорганическим основаниям можно отнести также амид натрия и тому подобное.
Конкретные примеры ацетата включают ацетат натрия и ацетат калия. Кроме указанных соединений, конкретные примеры органических оснований включают триэтиламин, триметиламин, диизопропилэтиламин, пиридин, диметиланилин, 1-метилпирролидин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нонен-5 (DBN), 1,8-диазабицикло[5.4.0]ундецен-7 (DBU) и 1,4-диазабицикло[2.2.2]октан (DABCO).
Молярное отношение указанного основания к соединению общей формулы (2) обычно может находиться в пределах от 0,1:1 до 2:1, предпочтительно от 0,1:1 до 1:1 и более предпочтительно от 0,1:1 до 0,5:1.
Реакцию соединения общей формулы (2) с соединением общей формулы (3а) обычно осуществляют в подходящем растворителе.
В качестве указанного растворителя можно широко использовать общеизвестные растворители, лишь бы они не влияли на реакцию. Примеры такого растворителя включают апротонные полярные растворители, такие как диметилформамид (ДМФА), диметилсульфоксид (ДМСО) или ацетонитрил, кетоновые растворители, такие как ацетон или метилэтилкетон, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, спиртовые растворители, такие как метанол, этанол, изопропанол, н-бутанол или трет-бутанол, простые эфирные растворители, такие как тетрагидрофуран (ТГФ), диоксан, дипропиловый эфир, диэтиловый эфир или диглим, сложноэфирные растворители, такие как этилацетат или метилацетат, и смешанные растворители, состоящие из указанных выше растворителей. Указанные растворители могут содержать воду.
Реакцию соединения общей формулы (2) с соединением общей формулы (3а) осуществляют, например, следующим образом. Соединение общей формулы (2) растворяют в растворителе для реакции и при перемешивании добавляют основание к смеси, охлаждаемой на льду или при комнатной температуре (30°С). Затем смесь перемешивают при температуре от комнатной температуры до 80°С в течение от 30 минут до 1 часа и затем добавляют к смеси соединение общей формулы (3а). Далее смесь еще перемешивают обычно при температуре от комнатной температуры до 100°С, предпочтительно от 50°С до 80°С, в течение обычно от 30 минут до 60 часов, предпочтительно 1-50 часов.
Соединение (2), используемое в качестве исходного вещества, является известным соединением. Соединение (3а) является новым соединением, и способ получения указанного соединения будет пояснен ниже.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение общей формулы (4а) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Соединение по настоящему изобретению, представленное общей формулой (1а), получают, подвергая соединение, представленное общей формулой (4а), реакции замыкания кольца. Реакцию замыкания кольца осуществляют растворением полученного описанным выше образом соединения, представленного общей формулой (4а), в растворителе для данной реакции и затем добавлением к полученному раствору основания с последующим перемешиванием.
При этом в качестве растворителя и основания можно использовать такие же растворитель и основание, которые были использованы для описанного выше взаимодействия соединения общей формулы (2) с соединением общей формулы (3а).
Молярное отношение основания к соединению общей формулы (4а) обычно составляет 1:1 или выше, предпочтительно от 1:1 до 5:1 и более предпочтительно от 1:1 до 2:1.
Температура реакции замыкания кольца обычно составляет от 0°С до 150°С, предпочтительно от комнатной температуры до 120°С и более предпочтительно от 50°С до 100°С. Время реакции обычно составляет от 30 минут до 48 часов, предпочтительно 1-24 часа и более предпочтительно 1-12 часов.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение общей формулы (1а) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
В настоящем изобретении реакционная смесь может быть непосредственно подвергнута последующей реакции замыкания кольца без выделения соединения общей формулы (4а), образованного в результате взаимодействия соединения общей формулы (2) с соединением общей формулы (3а). Например, соединение общей формулы (2) подвергают взаимодействию с соединением общей формулы (3а) при температуре от комнатной температуры до 80°С и затем к полученной реакционной смеси добавляют основание с последующим перемешиванием при 50°С-100°С. В соответствии с другим вариантом после взаимодействия соединения общей формулы (2) с соединением общей формулы (3а) при температуре от комнатной температуры до 80°С полученную реакционную смесь концентрируют и остаток растворяют в высококипящем растворителе. Затем к полученному раствору добавляют основание с последующим перемешиванием при 50°С-100°С с получением представляющего интерес соединения, представленного общей формулой (1а).
Альтернативно, в реакции соединения общей формулы (2) с соединением общей формулы (3а) основание используют с молярным отношением основания к соединению (2) от 0,9:1 до 2:1. Перемешивание осуществляют при 50°С-100°С, в результате чего взаимодействие соединения общей формулы (2) с соединением общей формулы (3а) проводится в одну стадию с получением требуемого соединения, представленного общей формулой (1а).
Схема 2 реакций

где R1 и Х1 являются такими, как определено выше, и R2а представляет собой группу, представленную общей формулой (А), (В), (Е) или (F).
Согласно схеме 2 соединение по настоящему изобретению, представленное общей формулой (1b), получают реакцией соединения, представленного общей формулой (3b) с соединением, представленным общей формулой (5), или его солью с получением соединения, представленного общей формулой (4b), и затем подвергая полученное соединение реакции замыкания кольца в присутствии основания.
Соединение (3b) является новым соединением, и способ получения данного соединения описан далее (схема 13 реакций). Соединение (5), в котором R2а представляет собой группу, представленную общей формулы (Е), является новым соединением. Пример способов получения указанного соединения описан ниже в ссылочных примерах 182, 186-188 и 192.
Молярное отношение соединения общей формулы (3b) к соединению общей формулы (5) обычно может находиться в пределах от 0,1:1 до 3:1 и предпочтительно от 1:0,5 до 1:2.
Взаимодействие соединения общей формулы (13b) с соединением общей формулы (5) осуществляют в присутствии основания в подходящем растворителе.
В качестве основания и растворителя для реакции можно использовать такие же растворитель и основание, которые были использованы для описанного выше взаимодействия соединения общей формулы (2) с соединением общей формулы (3а). Молярное отношение основания к соединению общей формулы (3b) равно обычно каталитическому количеству, предпочтительно составляет от 0,1:1 до 3:1 и более предпочтительно от 0,1:1 до 2:1.
В случае соединения (5), в котором R2а представляет собой группу, представленную общей формулой (В) или (Е), вместо соединения (5) и основания можно использовать соль соединения (5). Примеры указанной соли включают соли щелочных металлов, такие как натриевая соль или калиевая соль соединения (5).
Взаимодействие соединения общей формулы (3b) с соединением общей формулы (5) обычно осуществляют при температуре от комнатной температуры до 150°С, предпочтительно от комнатной температуры до 120°С и более предпочтительно от комнатной температуры до 80°С. Время реакции обычно составляет от 10 минут до 48 часов, предпочтительно от 10 минут до 24 часов и более предпочтительно от 10 минут до 2 часов.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение общей формулы (4b) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Соединение по настоящему изобретению, представленное общей формулой (1b), получают, подвергая соединение, представленное общей формулой (4b), реакции замыкания кольца. Реакцию замыкания кольца осуществляют растворением полученного описанным выше образом соединения, представленного общей формулой (4b), в растворителе для данной реакции и затем добавлением основания к полученному раствору с последующим перемешиванием при определенной температуре.
При этом в качестве растворителя и основания можно использовать такие же растворитель и основание, которые были использованы для описанного выше взаимодействия соединения общей формулы (3b) с соединением общей формулы (5).
Молярное отношение основания к соединению общей формулы (4b) обычно составляет 1:1 или выше, предпочтительно от 1:1 до 5:1 и более предпочтительно от 1:1 до 2:1.
Температура реакции замыкания кольца обычно составляет от 0°С до 150°С, предпочтительно от комнатной температуры до 120°С и более предпочтительно от 50°С до 100°С. Время реакции обычно составляет от 10 минут до 48 часов, предпочтительно от 10 минут до 24 часа и более предпочтительно от 20 минут до 4 часов.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение общей формулы (1b) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
В настоящем изобретении реакционная смесь может быть непосредственно подвергнута последующей реакции замыкания кольца без выделения соединения общей формулы (4b), образованного в результате взаимодействия соединения общей формулы (3b) с соединением общей формулы (5), с получением представляющего интерес соединения, которое является соединением по настоящему изобретению, представленным общей формулой (1b).
В частности, в случае соединения (5), в котором R2а представляет собой группу, представленную общей формулой (В) или (Е), если основание используют в молярном отношении к соединению (5), равным 1:1 или выше, и если реакцию проводят при 50°С-100°С, соединение по настоящему изобретению, представленное общей формулой (1b), может быть получено в одну стадию без выделения промежуточного соединения (4). Это можно отнести и к случаю использования соли щелочного металла (например, натриевой соли или калиевой соли) соединения (5), где R2а представляет собой группу, представленную общей формулой (В) или (Е).
Схема 3 реакций

где R41 и Х1 являются такими, как определено выше.
Согласно схеме 3 соединение по настоящему изобретению, представленное общей формулой (1с), получают реакцией соединения общей формулы (2), с соединением, представленным общей формулой (3с), с получением соединения, представленного общей формулой (4с), и затем подвергая полученное соединение реакции замыкания кольца в присутствии основания.
Соединение (3с) является новым соединением, и способ получения данного соединения описан ниже (схема 14 реакций).
Молярное отношение соединения общей формулы (2) к соединению общей формулы (3с) обычно может находиться в пределах от 0,1:1 до 2:1, предпочтительно от 0,1:1 до 1:1 и более предпочтительно от 0,1:1 до 0,5:1.
Взаимодействие соединения общей формулы (2) с соединением общей формулы (3с) осуществляют в присутствии основания в подходящем растворителе.
В качестве основания и растворителя для реакции можно использовать такие же растворитель и основание, которые были использованы для описанного выше взаимодействия соединения общей формулы (2) с соединением общей формулы (3а). Молярное отношение основания к соединению общей формулы (2) обычно составляет 0,1:1 или выше, предпочтительно от 1:1 до 5:1 и более предпочтительно от 1:1 до 2:1.
Взаимодействие соединения общей формулы (2) с соединением общей формулы (3с) осуществляют, например, следующим образом. Соединение общей формулы (2) растворяют в растворителе для реакции и при перемешивании добавляют основание к смеси, охлаждаемой на льду, или при комнатной температуре (30°С). Затем смесь перемешивают при температуре от комнатной до 80°С в течение от 30 минут до 1 часа и затем добавляют к смеси соединение общей формулы (3с). Далее смесь еще перемешивают обычно при температуре от комнатной до 100°С, предпочтительно от 50°С до 80°С, в течение обычно от 30 минут до 24 часов, предпочтительно 1-12 часов и более предпочтительно 1-8 часов.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение общей формулы (4с) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Соединение по настоящему изобретению, представленное общей формулой (1с), получают, подвергая соединение, представленное общей формулой (4с), реакции замыкания кольца. Реакцию замыкания кольца осуществляют растворением полученного описанным выше образом соединения, представленного общей формулой (4с), в растворителе для данной реакции и затем добавлением к полученному раствору основания с последующим перемешиванием при определенной температуре.
При этом в качестве растворителя и основания можно использовать такие же растворитель и основание, которые были использованы для описанного выше взаимодействия соединения общей формулы (2) с соединением общей формулы (3с).
Молярное отношение основания к соединению общей формулы (4с) обычно составляет 1:1 или выше, предпочтительно от 1:1 до 5:1 и более предпочтительно от 1:1 до 2:1.
Температура реакции замыкания кольца обычно составляет от 0°С до 150°С, предпочтительно от комнатной температуры до 120°С и более предпочтительно от 50°С до 100°С. Время реакции обычно составляет от 30 минут до 48 часов, предпочтительно 1-24 часа и более предпочтительно 1-12 часов.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение общей формулы (1с) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
В настоящем изобретении реакционная смесь может быть непосредственно подвергнута последующей реакции замыкания кольца без выделения соединения общей формулы (4с), образованного в результате взаимодействия соединения общей формулы (2) с соединением общей формулы (3с), таким образом может быть получено требуемое соединение по настоящему изобретению, представленное общей формулой (1с).
Схема 4 реакций

где R1 и n являются такими, как определено выше, R3а представляет собой С1-6алкокси-С1-6алкильную группу и R3b представляет собой С1-6алканоильную группу.
Соединение, в общей формуле (1) которого R2 представляет собой группу, представленную общей формулой (А), и R3 представляет собой А1) атом водорода (далее называемое как соединение (1-А-А1)), получают гидролизом соответствующего соединения, в котором R3 представляет собой А3) С1-6алкокси-С1-6алкильную группу (далее называемого как соединение (1-А-А3)), или соответствующего соединения, в котором R3 представляет собой А9) С1-6алканоильную группу (далее называемого как соединение (1-А-А9)).
Гидролиз соединения (1-А-А3) осуществляют в кислых условиях. Гидролиз осуществляют, например, суспендируя или растворяя соединение (1-А-А3) в подходящем растворителе и добавляя кислоту к полученному раствору с последующим перемешиванием при 0°С-120°С. Пример используемого растворителя может включать воду, спиртовой растворитель, такой как метанол, этанол, изопропанол или этиленгликоль, ацетонитрил, ацетон, толуол, ДМФА, ДМСО, уксусную кислоту, трифторуксусную кислоту и смешанные растворители из указанных растворителей. Примеры используемой кислоты могут включать органические кислоты, такие как трифторуксусная кислота или уксусная кислота, и неорганические кислоты, такие как хлористоводородная кислота, бромноватая кислота, бромистоводородная кислота или серная кислота. Органические кислоты, такие как трифторуксусная кислота или уксусная кислота, могут быть также использованы в качестве растворителей для данных реакций. Температура реакции обычно составляет от 0°С до 120°С, предпочтительно от комнатной температуры до 100°С и более предпочтительно от комнатной температуры до 80°С. Время реакции обычно составляет от 30 минут до 24 часов, предпочтительно от 30 минут до 12 часов и более предпочтительно 1-8 часов.
Гидролиз соединения (1-А-А9) осуществляют в оснóвных условиях. Гидролиз осуществляют, например, суспендируя или растворяя соединение (1-А-А9) в подходящем растворителе и добавляя основание к полученному раствору с последующим перемешиванием при 0°С-120°С. Пример используемого растворителя может включать воду, спиртовой растворитель, такой как метанол, этанол, изопропанол или этиленгликоль и смешанные растворители из указанных растворителей. Примеры используемого основания могут включать гидроксиды щелочных металлов, такие как гидроксид натрия или гидроксид калия, карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия, и ацетаты, такие как ацетат натрия. Температура реакции обычно составляет от 0°С до 120°С, предпочтительно от комнатной температуры до 100°С и более предпочтительно от комнатной температуры до 80°С. Время реакции обычно составляет от 30 минут до 24 часов, предпочтительно от 30 минут до 12 часов и более предпочтительно 1-8 часов.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение (1-А-А1) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Схема 5 реакции

где R1 и n являются такими, как определено выше, Х1 представляет собой атом галогена и R3аа представляет собой С1-6алкильную группу или фенильную группу, которая может быть замещена С1-6алкильной группой.
Соединение, в общей формуле (1) которого R2 представляет собой группу, представленную общей формулой (А), и R3 представляет собой сульфонильную группу, определенную как А7) или А8) (далее называемое как соединение (1-А-А7)), получают сульфонилированием соответствующего соединения, в котором R3 представляет собой А1) атом водорода (соединение (1-А-А1)).
Для сульфонилирования соединения (1-А-А1) могут быть широко использованы условия реакции обычного сульфонилирования спирта. Например, соединение (1-А-А1) растворяют в подходящем растворителе и к полученному раствору добавляют соединение, представленное общей формулой R3ааSO2X2, в присутствии основания с последующим перемешиванием при 0°С-150°С, в результате чего может быть получено соединение (1-А-А7).
При этом может быть использован любой растворитель, лишь бы он не препятствовал реакции сульфонилирования. Примеры такого растворителя включают галогенированные углеводородные растворители, такие как метиленхлорид или хлороформ, апротонные полярные растворители, такие как ДМФА, ДМСО или ацетонитрил, ароматические углеводородные растворители, такие как бензол, толуол или ксилол, углеводородные растворители, такие как тетралин, жидкий парафин или циклогексан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, этилацетат, ацетон, и смешанные растворители из указанных растворителей.
Молярное отношение соединения, представленного общей формулой R3ааSO2X2, к соединению (1-А-А1) обычно составляет 1:1 или выше, предпочтительно от 1:1 до 2:1 и более предпочтительно от 1:1 до 1,1:1.
В качестве основания можно использовать такое же основание, которое было использовано для описанного выше взаимодействия соединения общей формулы (2) с соединением общей формулы (3а).
Молярное отношение основания к соединению общей формулы R3ааSO2X2 обычно составляет 1:1 или выше, предпочтительно от 1:1 до 5:1 и более предпочтительно от 1:1 до 2:1.
В данной реакции сульфонилирования можно использовать в качестве катализатора 4-диметиламинопиридин, 4-(1-пирролидинил)пиридин или тому подобное.
Температура реакции обычно составляет от 0°С до 150°С, предпочтительно от 0°С до 100°С и более предпочтительно от 0°С до 60°С. Время реакции обычно составляет от 30 минут до 48 часов, предпочтительно 1-24 часа и более предпочтительно 1-4 часа.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение (1-А-А7) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Схема 6 реакции

где R1, R2а, R3аа и n являются такими, как определено выше.
Соединение, в общей формуле (1) которого R2 представляет собой группу, представленную общей формулой (А), (В), (Е) или (F) (далее называемое как соединение (1b)), также получают реакцией соответствующего соединения, в котором R2 представляет собой группу, представленную общей формулой (А), и R3 представляет собой сульфонильную группу, определенную как А7) или А8) (соединение (1-А-А7)) с соединением, представленным общей формулой (5).
Взаимодействие соединения (1-А-А7) с соединением, представленным общей формулой (5), осуществляют в подходящем растворителе в присутствии основания.
При этом может быть использован любой растворитель, лишь бы он не препятствовал реакции. Примеры такого растворителя включают воду, апротонные полярные растворители, такие как ДМФА, ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин, жидкий парафин или циклогексан, спиртовые растворители, такие как этанол, изопропанол, н-бутанол или трет-бутанол, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, этилацетат, ацетон, и смешанные растворители из указанных растворителей.
В качестве основания можно использовать такое же основание, которое было использовано для описанного выше взаимодействия соединения общей формулы (2) с соединением общей формулы (3а).
Молярное отношение основания к соединению (1-А-А7) обычно составляет 1:1 или выше, предпочтительно от 1:1 до 5:1 и более предпочтительно от 1:1 до 2:1.
Молярное отношение соединения, представленного общей формулы (5), к соединению (1-А-А7) обычно составляет от 1:1 или выше, предпочтительно от 0,9:1 до 2:1 и более предпочтительно от 0,9:1 до 1,5:1.
Температура реакции обычно составляет от комнатной температуры до 150°С, предпочтительно от комнатной температуры до 100°С и более предпочтительно от 60°С до 100°С. Время реакции обычно составляет от 10 минут до 24 часов, предпочтительно от 10 минут до 12 часа и более предпочтительно от 20 минут до 7 часов.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого представляющее интерес соединение может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Схема 7 реакции
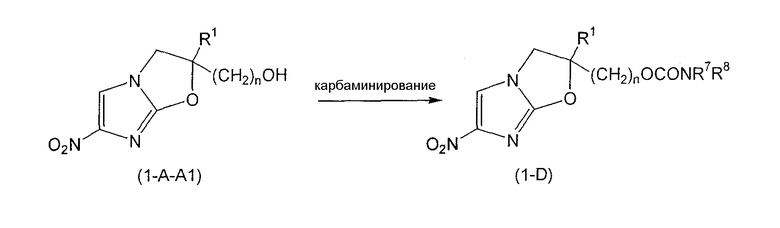
где R1, n, R7 и R8 являются такими, как определено выше.
Соединение, в общей формуле (1) которого R2 представляет собой группу, представленную общей формулой (D) (далее называемое как соединение (1-D)), получают карбаминированием соединения, где R2 представляет собой группу, представленную общей формулой (А), и R3 представляет собой А1) атом водорода (1-А-А1)).
Для карбаминирования соединения (1-А-А1) можно широко использовать условия обычной реакции карбаминирования спирта. Примеры такого метода включают: (1) метод с использованием амина, представленного общей формулой R7R8NH (где R7 и R8 являются такими, как определено выше), и трифосгена, (2) реакцию с использованием амина, представленного общей формулой R7R8NH (где R7 и R8 являются такими, как определено выше), и карбодиимидазола и (3) метод с использованием производного изоцианата.
(1) Метод с использованием амина и трифосгена
Амин, представленный общей формулой R7R8NH (где R7 и R8 являются такими, как определено выше), подвергают взаимодействию с трифосгеном с получением карбамоилхлорида, представленного общей формулой ClCONR7R8 (где R7 и R8 являются такими, как определено выше). Карбамоилхлорид можно выделить. Но, поскольку он обычно неустойчив, его сразу же используют на следующей стадии без выделения.
К метиленхлоридному раствору, содержащему трифосген, добавляют основание и указанный выше амин, охлаждая при этом раствор и перемешивая его. Затем смесь перемешивают при 0°С-30°С в течение от 30 минут до 4 часов с получением карбамоилхлорида. Молярное отношение трифосгена к амину обычно составляет от 0,3:1 до 1,5:1, предпочтительно от 0,3:1 до 0,6:1 и более предпочтительно от 0,3:1 до 0,4:1.
Примеры основания, используемого в реакции между амином и трифосгеном, включают триэтиламин, N-этилдиизопропиламин и N-метилморфолин. Молярное отношение основания к трифосгену 3:1 или выше, предпочтительно от 3:1 до 4,5:1 и более предпочтительно от 3:1 до 3,3:1.
Температура реакции обычно составляет от 0°С до 60°С и предпочтительно от 0°С до комнатной температуры (30°С). Время реакции обычно составляет от 30 минут до 8 часов, предпочтительно от 1-4 часа и более предпочтительно 1-2 часа.
Полученный описанным выше образом реакционный раствор карбамоилхлорида можно использовать непосредственно. Однако более целесообразно удалить нерастворимые продукты фильтрованием до концентрирования фильтрата.
Затем соединение (1-А-А1) растворяют в подходящем растворителе и к раствору добавляют при перемешивании и охлаждении льдом карбамоилхлорид, полученный так, как описано выше. Далее к смеси добавляют еще хлорид меди и перемешивают смесь при определенной температуре в течение определенного времени с получением соединения (1-D).
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ДМФА, ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат, и смешанные растворители из указанных растворителей.
Молярное отношение карбамоилхлорида к соединению (1-А-А1) может составлять обычно от 1:1 до 5:1, предпочтительно от 1:1 до 3:1 и более предпочтительно от 1:1 до 2:1.
Кроме того, молярное отношение хлорида меди к соединению (1-А-А1) может составлять обычно от 0,1:1 до 5:1, предпочтительно от 0,5:1 до 2:1 и более предпочтительно от 0,5:1 до 1:1.
Температура реакции обычно составляет от 0°С до 60°С, предпочтительно от 10°С до 50°С и более предпочтительно от 20°С до 35°С. Время реакции обычно составляет от 30 минут до 48 часов, предпочтительно 1-30 часов и более предпочтительно 2-24 часа.
(2) Реакция с использованием амина и карбодиимидазола
Амин, представленный общей формулой R7R8NH (где R7 и R8 являются такими, как определено выше), растворяют в подходящем растворителе. К полученному раствору добавляют при перемешивании на льду 1,1'-карбонилдиимидазол. Полученную смесь перемешивают при определенной температуре в течение определенного времени с получением аминопроизводного карбонилимидазола.
Молярное отношение 1,1'-карбонилдиимидазола к амину обычно составляет от 0,9:1 до 2:1, предпочтительно от 1:1 до 1,5:1 и более предпочтительно от 1:1 до 1,2:1.
Примеры используемого растворителя могут включать апротонные полярные растворители, такие как ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат и смешанные растворители из указанных растворителей.
Температура реакции обычно составляет от 0°С до 60°С и, предпочтительно от 0°С до комнатной температуры. Время реакции обычно составляет от 30 минут до 8 часов, предпочтительно 1-4 часа и более предпочтительно 1-2 часа.
Заранее растворяют в подходящем растворителе соединение (1-А-А1). Затем к раствору добавляют при перемешивании на льду полученное описанным выше образом аминопроизводное карбонилимидазола. Далее к смеси добавляют еще хлорид меди и перемешивают смесь при определенной температуре в течение определенного времени с получением соединения (1-D).
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ДМФА, ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат, и смешанные растворители из указанных растворителей.
Молярное отношение аминопроизводного карбонилимидазола к соединению (1-А-А1) может составлять обычно от 1:1 до 5:1, предпочтительно от 1:1 до 3:1 и более предпочтительно от 1:1 до 2:1.
Кроме того, молярное отношение хлорида меди к соединению (1-А-А1) может составлять обычно от 0,9:1 до 5:1, предпочтительно от 1:1 до 2:1 и более предпочтительно от 1:1 до 1,2:1.
Температура реакции обычно составляет от 0°С до 60°С, предпочтительно от 10°С до 50°С и более предпочтительно от 20°С до 35°С. Время реакции обычно составляет от 30 минут до 48 часов, предпочтительно 1-30 часов и более предпочтительно 1-3 часа.
(3) Метод с использованием изоцианата
Соединение (1-А-А1) растворяют в подходящем растворителе. Затем к раствору добавляют при перемешивании на льду изоцианат. Далее к смеси добавляют еще хлорид меди и перемешивают смесь при определенной температуре в течение определенного времени с получением соединения (1-D), в котором R7 или R8 представляет собой атом водорода.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ДМФА, ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат, и смешанные растворители из указанных растворителей.
Молярное отношение изоцианата к соединению (1-А-А1) может составлять обычно от 1:1 до 5:1, предпочтительно от 1:1 до 3:1 и более предпочтительно от 1:1 до 2:1.
Кроме того, молярное отношение хлорида меди к соединению (1-А-А1) может составлять обычно от 0,9:1 до 5:1, предпочтительно от 1:1 до 2:1 и более предпочтительно от 1:1 до 1,2:1.
Температура реакции обычно составляет от 0°С до 60°С, предпочтительно от 10°С до 50°С и более предпочтительно от 20°С до 35°С. Время реакции обычно составляет от 30 минут до 48 часов, предпочтительно 1-30 часов и более предпочтительно 1-3 часа.
Реакционную смесь, полученную описанным выше методом (1), (2) или (3), например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение общей формулы (1-D) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Соединение, имеющее гетероцикл, содержащий атом азота в молекуле и содержащий С1-6алкоксикарбонильную группу, замещенную у атома азота указанного гетероцикла, выбранное из соединений по настоящему изобретению, представленных общей формулой (1), может быть превращено снятием защиты в соединение, содержащее атом водорода, которое является замещенным у атома азота соответствующего гетероцикла.
Согласно этому методу, например, исходное вещество, освобождаемое от защиты, растворяют в подходящем растворителе с последующим гидролизом с использованием кислоты, получая таким образом требуемое соединение.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать воду, спиртовые растворители, такие как метанол или этанол, апротонные полярные растворители, такие как ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат, и смешанные растворители из указанных растворителей.
Примеры кислот включают неорганические кислоты, такие как хлористоводородная кислота, бромноватая кислота или бромистоводородная кислота, и органические кислоты, такие как уксусная кислота, трифторуксусная кислота или трихлоруксусная кислота. Из них выгодно использовать трифторуксусную кислоту.
Молярное отношение такой кислоты к исходному веществу обычно составляет 1:1 или выше и предпочтительно от 2:1 до 10:1. Однако такая кислота может быть также использована в намного большем количестве в качестве растворителя для реакции. Температура реакции обычно составляет от комнатной температуры до 100°С, но может быть подходящим образом отрегулирована в зависимости от вида используемой кислоты. При использовании трифторуксусной кислоты достаточной является комнатная температура. Время реакции обычно составляет 1-24 часа, предпочтительно 1-12 часов.
Полученную описанным выше образом реакционную смесь концентрируют и, если необходимо, добавляют кислоту, такую как хлористоводородная кислота, для кристаллизации, чтобы требуемое соединение можно было выделить в форме гидрохлорида или трифторацетата перекристаллизацией или тому подобное.
Требуемое соединение со снятой защитой может быть выделено, как описано выше. Альтернативно, без выделения его, к реакционной смеси добавляют оснóвное соединение, такое как триэтиламин, в результате чего требуемое соединение превращается в свободное соединение, которое может быть использовано в следующей реакции.
Например, требуемое указанное выше свободное оснóвное соединение, подвергают взаимодействию с галогенангидридом кислоты, ангидридом кислоты или смешанным ангидридом кислоты, в результате чего можно получить соответствующий амид или карбамат. Взаимодействие требуемого указанного выше свободного основания с сульфонилхлоридом позволяет получить соответствующий сульфонамид. Кроме того, реакция получения мочевины из требуемого указанного свободного основания с использованием амина позволяет получить соответствующую мочевину. Далее, восстановительное аминирование указанного свободного требуемого основания альдегидом или алкилирование алкилгалогенидом позволяет получить N-алкилированное производное указанного требуемого соединения.
Соединение, имеющее гетероцикл, содержащий атом азота в молекуле и содержащий атом водорода, замещенный у атома азота указанного гетероцикла, выбранное из соединений по настоящему изобретению, представленных общей формулой (1), может быть превращено карбаминированием в соединение, содержащее группу -COOR27 (где R27 является таким, как определено выше), которое замещено у атома азота соответствующего гетероцикла.
Примеры метода карбаминирования включают (1) метод с использованием различных типов галогенированных формиатов и (2) метод с использованием активного промежуточного соединения, полученного взаимодействием спирта с карбонилдиимидазолом.
(1) Метод с использованием галогенированного формиата
Исходное вещество подвергают взаимодействию с галогенированным формиатом в растворителе для данной реакции в присутствии основания с получением требуемого соединения.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат, и смешанные растворители из указанных растворителей.
В качестве основания могут быть широко использованы известные соединения. Примеры таких оснований включают неорганические основания, такие как гидроксид, карбонат или гидрокарбонат, и органические основания, такие как ацетат.
Конкретные примеры гидроксида включают гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития. Конкретные примеры карбоната включают карбонат натрия, карбонат калия, карбонат цезия и карбонат лития. Конкретные примеры гидрокарбоната включают гидрокарбонат натрия, гидрокарбонат калия, гидрокарбонат цезия и гидрокарбонат лития.
Конкретные примеры ацетата включают ацетат натрия и ацетат калия. В дополнение к указанным соединениям конкретные примеры других органических оснований включают триэтиламин, триметиламин, диизопропилэтиламин, пиридин, диметиланилин, 1-метилпирролидин, N-метилморфолин, DBN, DBU и DABCO.
Молярное отношение указанного основания к исходному веществу обычно может находиться в пределах от 1:1 до 4:1, предпочтительно от 1:1 до 1,5:1 и более предпочтительно от 1:1 до 1,1:1.
Молярное отношение галогенированного формиата к исходному веществу может составлять обычно 1:1 или выше, предпочтительно от 1:1 до 1,5:1 и более предпочтительно от 1:1 до 1,1:1.
Температура реакции обычно составляет от 0°С до 100°С, предпочтительно от 0°С до 60°С и более предпочтительно от 10°С до 30°С. Время реакции обычно составляет от 30 минут до 12 часов, предпочтительно 1-6 часов и более предпочтительно 1-2 часа.
(2) Метод с использованием активного промежуточного соединения
Спирт, представленный общей формулой R27ОН (R27 - такой как определенный выше), подвергают взаимодействию с 1,1'-карбонилдиимидазолом в подходящем растворителе с получением активного промежуточного соединения (первая стадия) и затем полученное промежуточное соединение подвергают взаимодействию с исходным веществом (вторая стадия), в результате чего может быть получено требуемое соединение.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ДМФА, ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат, и смешанные растворители из указанных растворителей.
Молярное отношение 1,1'-карбонилдиимидазола к спирту, представленному показанной выше общей формулой, может составлять обычно 1:1 или выше, предпочтительно от 1:1 до 1,5:1 и более предпочтительно от 1:1 до 1,1:1.
На первой стадии температура реакции обычно составляет от 0°С до 100°С, предпочтительно от 0°С до 60°С и более предпочтительно от 10°С до 30°С. Время реакции обычно составляет от 30 минут до 12 часов, предпочтительно 1-6 часов и более предпочтительно 1-2 часа.
Молярное отношение активного промежуточного соединения к исходному веществу может составлять обычно 1:1 или выше, предпочтительно от 1:1 до 1,5:1 и более предпочтительно от 1:1 до 1,1:1.
На второй стадии температура реакции обычно составляет от 0°С до 100°С, предпочтительно от 0°С до 60°С и более предпочтительно от 10°С до 30°С. Время реакции обычно составляет от 30 минут до 12 часов, предпочтительно 1-6 часов и более предпочтительно 1-2 часа.
Полученную описанным выше методом (1) или (2) реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого требуемый карбамат может быть выделен из реакционной смеси и очищен обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Соединение, имеющее гетероцикл, содержащий атом азота в молекуле и содержащий группу R32R33NCO (где R32 и R33 являются такими, как определено выше), расположенную у атома азота указанного гетероцикла, выбранное из соединений по настоящему изобретению, представленных общей формулой (1), может быть получено взаимодействием соединения, содержащего атом водорода у атома азота соответствующего гетероцикла.
Для указанного получения мочевины можно использовать, например, (1) метод с использованием амина, представленного общей формулой R32R33NH (где R32 и R33 являются такими, как определено выше), и трифосгена, (2) реакцию с использованием амина, представленного общей формулой R32R33NH (где R32 и R33 являются такими, как определено выше), и карбодиимидазола и (3) метод с использованием производного изоцианата.
Указанные реакции (1), (2) и (3) осуществляют, например, в таких же условиях реакций, как описано выше для реакций с соединением (1-А-А1) в (1), (2) и (3).
Полученную описанным выше методом (1), (2) или (3) реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого требуемое соединение может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Что касается соединений, представленных общей формулой (1), соединение, имеющее гетероцикл, содержащий атом азота в молекуле и содержащий группу R38а у атома азота указанного гетероцикла (где R38 представляет собой С1-6алканоильную группу, фенил-С2-6алканоильную группу (где в фенильном кольце по крайней мере один тип группы, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может быть замещенным), фенокси-С2-6алканоильную группу, где атом галогена может быть замещенным в фенильном кольце, фенилтио-С2-6алканоильную группу, где атом галогена может быть замещенным в фенильном кольце, бензоильную группу (где в фенильном кольце по крайней мере один тип группы, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и С1-6алкиламиногруппы, может быть замещенным), 4-бифенилкарбонильную группу, пиридинилкарбонильную группу или фенил-С2-6алкенилкарбонильную группу, где фенильное кольцо может быть замещено атомом галогена), может быть получено взаимодействием соединения, содержащего атом водорода у атома азота соответствующего гетероцикла, с карбоновой кислотой, представленной общей формулой R38аОН (где R38а является таким, как определено выше).
Указанная выше реакция может быть осуществлена в таких же условиях реакции, как при взаимодействии соединения (Еа-2) с соединением (18), представленным на схеме 19 реакций, которая будет описана ниже.
Полученную описанным выше методом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого требуемое соединение может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Соединение, имеющее гетероцикл, содержащий атом азота в молекуле и содержащий группу R39аSO2 у атома азота указанного гетероцикла (где R39а представляет собой фенильную группу, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и С1-6алкильной группы), выбранное из соединений, представленных общей формулой (1), может быть получено взаимодействием соединения, содержащего атом водорода у атома азота соответствующего гетероцикла, с сульфонилгалогенидом, представленным общей формулой R39аSO2Х2 (где R39а и Х2 являются такими, как определено выше).
Указанная выше реакция может быть осуществлена в таких же условиях реакции, как при взаимодействии соединения (Fd-1) с соединением (15), представленным на схеме 18 реакций, которая будет описана ниже.
Полученную описанным выше методом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого требуемое соединение может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Что касается соединений, представленных общей формулой (1), соединение, имеющее гетероцикл, содержащий атом азота в молекуле и содержащий группу R40а-CH-R52 у атома азота указанного гетероцикла (где R52 является таким, как описано выше, и R40а представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы, циклогексильной группы, аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, С1-6алкоксикарбонильной группы, феноксигруппы, фенил-С2-6алкенильной группы, пиридильной группы, имидазолильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, и пиперидильной группы, может быть замещена), 4-бифенилильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и аминогруппы, которая может содержать С1-6алкильную группу в качестве заместителя, может быть замещена), нафтильную группу, фурильную группу или тиенильную группу), может быть получено, подвергая соединение, содержащее атом водорода у атома азота соответствующего гетероцикла, реакции восстановительного алкилирования.
Указанную реакцию восстановительного алкилирования проводят, например, взаимодействием исходного вещества с альдегидом или кетоном, представленным общей формулой  (R40a является таким, как определено выше, и R52 представляет собой атом водорода или С1-6алкильную группу), в подходящем растворителе в присутствии восстановителя.
(R40a является таким, как определено выше, и R52 представляет собой атом водорода или С1-6алкильную группу), в подходящем растворителе в присутствии восстановителя.
Указанная выше реакция может быть осуществлена в таких же условиях реакции, как при взаимодействии соединения (Е-2) с соединением (13), представленном на схеме 16 реакций, которая будет описана ниже.
Полученную описанным выше методом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого требуемое соединение может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Схема 8 реакций

где R1, Х2 и n являются такими, как определено выше, R24а представляет собой группу, представленную каждым из (Fca1)-(Fca11), R42а представляет собой С1-6алкильную группу, R42 представляет собой группу, представленную (Fca5), (Fca6) или (Fca7), R42с представляет собой группу, представленную (Fca2), (Fca3), (Fca4), (Fca8) или (Fca9), и 42b представляет собой фенильную группу (где по крайней мере одна группа, выбранная из галогензамещенных или незамещенных С1-6алкильных групп, может замещать фенильное кольцо).
Реакция преобразования соединения (1-F-Fc16a) в соединение (1-F-Fc16b) может быть осуществлена в таких же условиях, как при реакции преобразования соединения (Е-1) в соединение (Е-2), представленной на схеме 16 реакций, которая будет описана ниже.
Полученную описанным выше образом реакционную смесь концентрируют и, если необходимо, добавляют для кристаллизации кислоту, такую как хлористоводородная кислота, в результате чего требуемое соединение может быть выделено в форме гидрохлорида или трифторацетата перекристаллизацией или тому подобное.
Соединение (1-F-Fc16c) получают взаимодействием соединения (1-F-Fc16b) с R42cX2. Данная реакция может быть осуществлена в таких же условиях, как при взаимодействии соединения (Fd-1) с соединением (15), представленном на схеме 18, которая описана ниже.
Соединение (1-F-Fc16d) получают взаимодействием соединения (1-F-Fc16b) с R42cОН. Данная реакция может быть осуществлена в таких же условиях, как при взаимодействии соединения (Еа-2) с соединением (18), представленном на схеме 19, которая описана ниже.
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого требуемое соединение может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Соединение (1-F-Fc16e) получают взаимодействием соединения (1-F-Fc16b) с R42b-NCO. Данная реакция может быть осуществлена в присутствии или в отсутствие, предпочтительно в отсутствие, основания в подходящем инертном растворителе или без растворителя. В данной реакции в качестве растворителя и основания можно использовать такие растворитель и основание, как следующие. Примеры основания включают органические основания, такие как триэтиламин, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин,
1,5-диазабицикло[4.3.0]нонен-5 (DBN),
1,8-диазабицикло[5.4.0]ундецен-7 (DBU) или
1,4-диазабицикло[2.2.2]октан (DABCO); неорганические основания, включающие карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия или гидрокарбонат калия, гидроксиды металлов, такие как гидроксид натрия, гидроксид калия или гидроксид кальция, гидрид калия, гидрид натрия, калий, натрий, амид натрия, и алкоголяты металла, такие как метилат натрия или этилат натрия. Далее, примеры растворителя включают галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан или тетрахлорид углерода, ароматические углеводороды, такие как бензол, толуол или ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диметоксиэтан, сложные эфиры, такие как метилацетат, этилацетат или изопропилацетат, спирты, такие как метанол, этанол, изопропанол, пропанол, бутанол, 3-метокси-1-бутанол, этилцеллозольв или метилцеллозольв, ацетонитрил, пиридин, ацетон, воду, апротонные полярные растворители, такие как N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид или триамид гексаметилфосфорной кислоты и смешанные растворители, состоящие из указанных выше растворителей. Молярное отношение соединения R42b-NCO к соединению (1-F-Fc16b) может составлять обычно от 1:1 до 5:1 и предпочтительно от 1:1 и 3:1. Реакцию осуществляют обычно при температуре от 0°C до 200°C и предпочтительно от комнатной температуры до 150°C, обычно в течение от 5 минут до 30 часов. При осуществлении данной реакции может быть добавлено соединение бора, такое как комплекс трифторида бора с диэтиловым эфиром, или галогенированное соединение меди, такое как хлорид меди(1).
Полученную описанным выше образом реакционную смесь, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого требуемое соединение может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Схема 9 реакции

где R42а, R1 и n являются такими, как определено выше.
Соединение (1-Fdb) получают снятием защиты с соединения (1-Fda). Например, соединение (1-Fda) растворяют в подходящем растворителе с последующим гидролизом с использованием кислоты, получая таким образом соединение (1-Fdb).
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать воду, спиртовые растворители, такие как метанол или этанол, апротонные полярные растворители, такие как ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат и смешанные растворители из указанных растворителей.
Примеры кислот включают неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота или бромноватая кислота, и органические кислоты, такие как уксусная кислота, трифторуксусная кислота или трихлоруксусная кислота. Из них выгодно использовать трифторуксусную кислоту.
Молярное отношение такой кислоты к соединению (1-Fda) обычно составляет 1:1 или выше и предпочтительно от 2:1 до 10:1. Однако такая кислота может быть также использована в намного большем количестве в качестве растворителя для реакции. Температура реакции обычно составляет от комнатной температуры до 100°С, но может быть подходящим образом отрегулирована в зависимости от вида используемой кислоты. При использовании трифторуксусной кислоты достаточной является комнатная температура. Время реакции обычно составляет 1-24 часа, предпочтительно 1-12 часов.
Полученную описанным выше образом реакционную смесь концентрируют и, если необходимо, добавляют для кристаллизации кислоту, такую как хлористоводородная кислота, чтобы соединение (1-Fdb) можно было выделить в форме гидрохлорида или трифторацетата перекристаллизацией или тому подобное.
Схема 10 реакции

где R42а, R1, n, R34 и R35 являются такими, как определено выше.
Соединение (1-Fdc) получают взаимодействием соединения (1-Fda) с альдегидом или кетоном, представленным общей формулой R34COR35 (где R34 и R35 являются такими, как определено выше).
Данную реакцию осуществляют в присутствии кислоты в подходящем растворителе.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать воду, спиртовые растворители, такие как метанол или этанол, апротонные полярные растворители, такие как ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат и смешанные растворители из указанных растворителей.
Примеры кислот включают неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота или бромноватая кислота, и органические кислоты, такие как уксусная кислота, трифторуксусная кислота или трихлоруксусная кислота. Из них выгодно использовать трифторуксусную кислоту.
Молярное отношение такой кислоты к соединению (1-Fda) обычно составляет 0,5:1 или выше и предпочтительно от 0,5:1 до 1,5:1. Однако такая кислота может быть также использована в намного большем количестве в качестве растворителя для реакции.
Молярное отношение альдегида или кетона к соединению (1-Fda) обычно составляет от 0,9:1 до 3:1, предпочтительно от 1:1 до 1,5:1 и предпочтительно от 1:1 до 1,3:1.
Температура реакции обычно составляет от комнатной температуры до 100°С, но может быть подходящим образом отрегулирована в зависимости от вида используемой кислоты. Время реакции обычно составляет 1-12 часов, предпочтительно 1-3 часа.
Полученную описанным выше образом реакционную смесь концентрируют и, если необходимо, добавляют для кристаллизации кислоту, такую как хлористоводородная кислота, чтобы соединение (1-Fdc) можно было выделить в форме гидрохлорида или трифторацетата перекристаллизацией или тому подобное.
Далее объясняется способ получения исходного материала и промежуточного соединения, используемого для получения соединения по настоящему изобретению.
Схема 11 реакций

где R1, R7, R8, Х2 и n являются такими, как определено выше, и R3с представляет собой С1-6алкокси-С1-6алкильную группу, С1-6алканоильную группу или п-нитробензоильную группу.
Реакцию преобразования соединения (4d) в соединение (4е) осуществляют, например, в таких же условиях, как при реакции преобразования соединения (1-А-А3) или соединения (1-А-А9) в соединение (1-А-А1), как показано на схеме 4 реакций. Например, в случае соединения (4d), где R3с представляет собой С1-6алкокси-С1-6алкильную группу, может быть достаточным осуществлять реакцию в таких же условиях, как при реакции преобразования соединения (1-А-А3) в соединение (1-А-А1). В случае соединения (4d), где R3с представляет собой С1-6алканоильную или п-нитробензоильную группу, может быть достаточным осуществлять реакцию в таких же условиях, как при реакции преобразования соединения (1-А-А9) в соединение (1-А-А1).
Реакцию преобразования соединения (4е) в соединение (4f) осуществляют, например, в таких же условиях, как при реакции преобразования соединения (1-А-А1) в соединение (1-D), как показано на схеме 7.
Схема 12 реакций

где R1, R2а, R3аа, Х1 и n являются такими, как определено выше.
Реакцию преобразования соединения (4е) в соединение (4g) осуществляют, например, в таких же условиях, как при реакции преобразования соединения (1-А-А1) в соединение (1-А-А7), как показано на схеме 5 реакций.
Реакцию преобразования соединения (4g) в соединение (4h) осуществляют, например, в таких же условиях, как при реакции преобразования соединения (1-А-А7) в соединение (1b), как показано на схеме 6.
Схема 13 реакции

где R1 и Х1 являются такими, как определено выше, и R2е представляет собой атом галогена, С1-6алкилсульфонилоксигруппу или фенилсульфонилоксигруппу, которая может содержать С1-6алкильную группу в качестве заместителя в фенильном кольце.
Реакцию преобразования соединения (41) в соединение (3b) осуществляют в подходящем растворителе в присутствии основания.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат и смешанные растворители из указанных растворителей.
В данной реакции может быть использовано такое же основание, как при осуществлении взаимодействия соединения, представленного выше общей формулой (2), с соединением, представленным выше общей формулой (3а).
Молярное отношение такого основания к соединению (41) может составлять обычно 1:1 или выше, предпочтительно от 1:1 до 5:1 и более предпочтительно от 1:1 до 2:1.
Температура реакции обычно составляет от 0°С до 150°С, предпочтительно от 0°С до 100°С и более предпочтительно от 0°С до 60°С. Время реакции обычно составляет от 30 минут до 48 часов, предпочтительно 1-24 часа и более предпочтительно 1-4 часа.
Реакционную смесь, полученную описанным выше методом, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение (3b) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Схема 14 реакции

где R1, R2 и n являются такими, как определено выше.
Реакцию преобразования соединения (5) в соединение (3f) осуществляют, например, обработкой соединения (5) иодидом триметилсульфоксония в подходящем растворителе в присутствии основания.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин или жидкий парафин, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, ацетон, этилацетат и смешанные растворители из указанных растворителей.
Примеры основания могут включать гидрид натрия, амид натрия, алкоголяты металлов, такие как метоксид натрия, этоксид натрия или трет-бутоксид калия.
Молярное отношение такого основания к соединению (5) может составлять обычно 1:1 или выше, предпочтительно от 1:1 до 3:1 и более предпочтительно от 1:1 до 1,5:1.
Кроме того, молярное отношение иодида триметилсульфоксония к соединению (5) может составлять обычно 1:1 или выше, предпочтительно от 1:1 до 3:1 и более предпочтительно от 1:1 до 1,5:1.
Температура реакции обычно составляет от 0°С до 80°С, предпочтительно от 10°С до 50°С и более предпочтительно от 20°С до 35°С. Время реакции обычно составляет от 1 до 24 часов, предпочтительно 1-12 часов и более предпочтительно 1-4 часа.
Реакционную смесь, полученную описанным выше методом, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение (3f) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Реакцию преобразования соединения (6) в соединение (3f) осуществляют, например, обработкой соединения (6) пероксидом в подходящем растворителе.
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать воду, спиртовые растворители, такие как метанол или этанол, апротонные полярные растворители, такие как ДМФА, ДМСО или ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин, жидкий парафин или циклогексан, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, и смешанные растворители из указанных растворителей.
Примеры пероксида могут включать метахлорпербензойную кислоту (mCPBA), пербензойную кислоту, перуксусную кислоту и пероксид водорода.
Молярное отношение такого пероксида к соединению (6) может составлять обычно от 1:1 до 2:1, предпочтительно от 1:1 до 1,5:1 и более предпочтительно от 1:1 до 1,3:1.
Температура реакции обычно составляет от 0°С до 80°С, предпочтительно от 0°С до 50°С и более предпочтительно от 20°С до 35°С. Время реакции обычно составляет от 10 минут до 24 часов, предпочтительно 1-12 часов и более предпочтительно 1-8 часов.
Реакционную смесь, полученную описанным выше методом, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение (3f) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
Например, один тип соединений (3f), являющийся оптически активным, получают из соединения (6) следующим образом.
Указанное оптически активное соединение (3f) может быть получено методом, называемым эпоксидированием по Шарплессу. То есть соединение может быть получено эпоксидированием кумолгидропероксидом или трет-бутилгидропероксидом в сочетании с Ti(O-изо-С3Н7)4 и оптически активным С1-6алкилтартратом, таким как диэтилтартрат (D- или L-форма), в качестве катализаторов в вышеуказанной реакции преобразования соединения (6) в соединение (3f).
Любой растворитель может быть использован в широких пределах, лишь бы он не влиял на реакцию. Примеры такого растворителя могут включать апротонные полярные растворители, такие как ацетонитрил, углеводородные растворители, такие как бензол, толуол, ксилол, тетралин, жидкий парафин или циклогексан, галогенированные углеводородные растворители, такие как метиленхлорид, хлороформ или дихлорэтан, простые эфирные растворители, такие как ТГФ, диоксан, дипропиловый эфир, диэтиловый эфир или диглим, и смешанные растворители из указанных растворителей.
Молярное отношение гидропероксида кумола или трет-бутилгидропероксида к соединению (6) может составлять обычно от 0,1:1 до 2:1, предпочтительно от 0,1:1 до 1,5:1 и более предпочтительно от 0,1:1 до 1:1.
Молярное отношение Ti (O-изо-С3Н7)4 к соединению (6) может составлять обычно от 0,1:1 до 2:1, предпочтительно от 0,1:1 до 1,5:1 и более предпочтительно от 0,1:1 до 1:1.
Молярное отношение оптически активных С1-6алкилтартратов (D- или L-формы) к соединению (6) может составлять обычно от 1:1 до 2:1, предпочтительно от 1:1 до 1,5:1 и более предпочтительно от 1:1 до 1,3:1.
Температура реакции обычно составляет от -50°С до 30°С, предпочтительно от -20°С до 20°С и более предпочтительно от -20°С до 5°С. Время реакции обычно составляет от 1 до 48 часов, предпочтительно 4-24 часа и более предпочтительно 4-12 часов.
Соединение (5) или (6), где R1 и -(CH2)nR2a вместе со смежными с ними атомами углерода связаны друг с другом через атомы азота с образованием пиперидинового кольца, превращают в соединение (3f) таким же образом, как указано выше для соединения (3с), где R1 и -(CH2)nR2a вместе со смежными с ними атомами углерода связаны друг с другом через атомы азота с образованием пиперидинового кольца.
Реакционную смесь, полученную описанным выше методом, например, охлаждают и затем отделяют неочищенный продукт реакции таким методом, как фильтрование, концентрирование или экстрагирование. После этого соединение (3f) может быть выделено из реакционной смеси и очищено обычным методом очистки, таким как колоночная хроматография или перекристаллизация.
2,3-Дигидро-6-нитроимидазо[2,1-b]оксазол, представленный соединением (1) по настоящему изобретению, и его промежуточные соединения, представленные выше различными формулами, включают стереоизомеры и оптические изомеры.
Схема 15 реакции

где R3аа, R1, R2а и n являются такими, как определено выше.
Реакцию преобразования соединения (3g) в соединение (3h) осуществляют, например, в таких же условиях, как при реакции преобразования соединения (1-А-А7) в соединение (1b), как показано на схеме 6 реакций.
Схема 16 реакции

где R1, Х, n и m являются такими, как определено выше,
R11a представляет собой группу 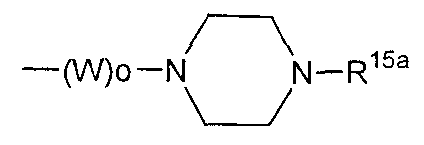
(где W и o являются такими, как определено выше, R15a представляет собой С1-20алкоксикарбонильную группу за исключением того, что, когда W представляет собой группу C=O, R15a представляет собой С1-6алкоксикарбонильную группу) или группу 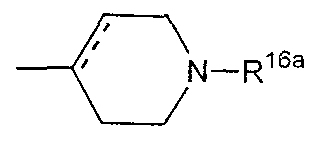
(где R16a представляет собой С1-8алкокосикарбонильную группу),
R11b представляет собой группу 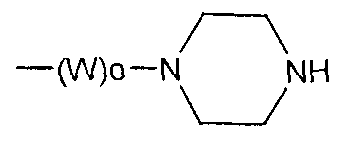 или группу
или группу 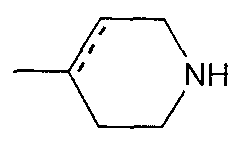 ,
,
R11c представляет собой группу  или группу
или группу  (где каждый из R15b и R16b представляет собой С3-8циклоалкильную группу), и
(где каждый из R15b и R16b представляет собой С3-8циклоалкильную группу), и
RA представляет собой С3-8циклоалкильную группу.
Реакция преобразования соединения (Е-1) в соединение (Е-2) может быть осуществлена гидролизом соединения (Е-1).
Указанная реакция гидролиза может быть осуществлена в подходящем растворителе или без растворителя в присутствии кислоты или основания. Примеры используемого растворителя могут включать воду, низшие спирты, такие как метанол, этанол, изопропанол или трет-бутанол, кетоны, такие как ацетон или метилэтилкетон, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, моноглим или диглим, кислоты жирного ряда, такие как уксусная кислота или муравьиная кислота, сложные эфиры, такие как метилацетат или этилацетат, галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан или тетрахлорид углерода, диметилсульфоксид, N,N-диметилформамид, триамид гексаметилфосфорной кислоты, и смешанные растворители из указанных растворителей. Примеры кислоты могут включать неорганические кислоты, такие как хлористоводородная кислота, серная кислота или бромистоводородная кислота, и органические кислоты, включающие муравьиную кислоту, уксусную кислоту, трифторуксусную кислоту или сульфоновую кислоту, такую как п-толуолсульфоновая кислота. Примеры основания могут включать карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия или гидрокарбонат калия, и гидроксиды металлов, такие как гидроксид натрия, гидроксид калия, гидроксид кальция или гидроксид лития. Данную реакцию осуществляют обычно при 0°С-200°С, предпочтительно при 0°С-150°С, обычно в течение от 10 минут до 30 часов.
Молярное отношение кислоты или основания к соединению (Е-1) может составлять по меньшей мере 1:1, предпочтительно от 1:1 до 10:1, однако кислоту можно использовать в намного большем количестве в качестве растворителя.
По окончании гидролиза реакцию можно проводить дополнительно в подходящем растворителе в присутствии основания, обычно при 0°С-100°С и предпочтительно при температуре в пределах от комнатной температуры до 70°С, в течение примерно 1-30 минут, с тем чтобы завершить реакцию. В данной реакции можно использовать растворитель и основание, указанные ниже. Примеры такого основания включают органические основания, такие как триэтиламин, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нонен-5 (DBN),
1,8-диазабицикло[5.4.0]ундецен-7 (DBU) или
1,4-диазабицикло[2.2.2]октан (DABCO); неорганические основания, включающие карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия или гидрокарбонат калия, гидроксиды металлов, такие как гидроксид натрия, гидроксид калия или гидроксид кальция, гидрид калия, гидрид натрия, калий, натрий, амид натрия и алкоголяты металлов, такие как метилат натрия или этилат натрия. Далее, примеры растворителя включают галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан или тетрахлорид углерода, ароматические углеводороды, такие как бензол, толуол или ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диметоксиэтан, сложные эфиры, такие как метилацетат, этилацетат или изопропилацетат, спирты, такие как метанол, этанол, изопропанол, пропанол, бутанол, 3-метокси-1-бутанол, этилцеллозольв или метилцеллозольв, ацетонитрил, пиридин, ацетон, воду, апротонные полярные растворители, такие как N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид или триамид гексаметилфосфорной кислоты, и смешанные растворители, состоящие из указанных выше растворителей.
Взаимодействие соединения (Е-2) с соединением (13) осуществляют без растворителя или в подходящем растворителе в присутствии восстановителя.
Примеры используемого в данной реакции растворителя могут включать воду, низшие спирты, такие как метанол, этанол, изопропанол, бутанол, трет-бутанол или этиленгликоль, ацетонитрил, кислоты жирного ряда, такие как муравьиная кислота, уксусная кислота или трифторуксусная кислота, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, моноглим или диглим, ароматические углеводороды, такие как бензол, толуол или ксилол, галогенированные углеводороды, такие как дихлорметан, дихлорэтан, хлороформ или тетрахлорид углерода, и смешанные растворители из указанных растворителей. Примеры восстановителя включают муравьиную кислоту, соли щелочных металлов жирных кислот, такие как формиат натрия или ацетат натрия, и металлогидридные восстановители, такие как борогидрид натрия, цианборогидрид натрия, триацетилоксиборогидрид натрия, литийалюминийгидрид или их смесь, и восстановители для каталитического гидрирования, такие как палладиевая чернь, палладий на углероде, оксид платины, платиновая чернь или никель Ренея.
При использовании муравьиной кислоты в качестве восстановителя температура реакции находится в пределах обычно от комнатной температуры до 200°С, предпочтительно от 50°С до 150°С. Реакцию проводят в течение от 10 минут до 10 часов. Может быть предпочтительным использовать намного большее количество муравьиной кислоты относительно соединения (Е-2).
При использовании восстановителя для гидрирования температура реакции обычно составляет от -80°С до 100°С, предпочтительно от -80°С до 70°С. Реакцию проводят в течение от 30 минут до 100 часов. Восстановитель для гидрирования используют относительно соединения (Е-2) в молярном отношении обычно от 1:1 до 20:1, предпочтительно от 1:1 до 6:1. В частности, когда в качестве восстановителя используют литийалюминийгидрид, является предпочтительным использовать в качестве растворителя простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, моноглим или диглим, или ароматические углеводороды, такие как бензол, толуол или ксилол. Кроме того, к реакционной смеси можно также добавлять амины, такие как триметиламин, триэтиламин, N-этилдиизопропиламин. И можно также добавлять молекулярные сита, такие как молекулярные сита 3А (MS-3A) или молекулярные сита 4А (MS-4A).
При использовании восстановителя для каталитического гидрирования реакцию проводят в атмосфере водорода, обычно при нормальном атмосферном давлении до 20 атмосфер, предпочтительно при нормальном атмосферном давлении до 10 атмосфер, в присутствии источника водорода, такого как муравьиная кислота, аммонийформиат, циклогексан или гидратированный гидразин, при температуре обычно от -30°С до 100°С и предпочтительно от 0°С до 60°С. Реакцию осуществляют обычно в течение 1-12 часов. Восстановитель для каталитического гидрирования используют по отношению к соединению (Е-2) обычно 0,1-40% по массе, предпочтительно 1-20% по массе.
Соединение (13) используют относительно соединения (Е-2) в молярном отношении обычно по меньшей мере 1:1, предпочтительно 1:1 или намного выше.
Схема 17 реакции

где R1, Х, n, m, W и о являются такими, как определено выше, R14b представляет собой С1-6алкоксикарбонильную группу и R14Аа представляет собой атом водорода, С1-6алкоксигруппу, гидроксильную группу или фенильную группу (фенильная группа может содержать атомы галогена в фенильном кольце).
Реакция преобразования соединения (Еаа 6-1) в соединение (Еаа 5-1) может быть осуществлена в таких же условиях, как при реакции преобразования соединения (Е-1) в соединение (Е-2), показанной выше на схеме 16.
Схема 18 реакций
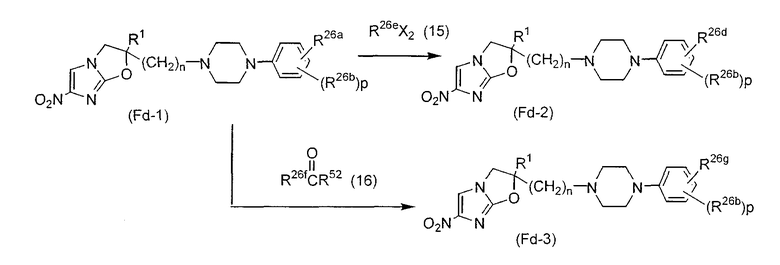
где R1, n и Х2 являются такими, как определено выше, R52 представляет собой атом водорода или С1-6алкильную группу,
R26b представляет собой атом галогена, цианогруппу, аминогруппу, которая может содержать С1-6алкильную группу в качестве заместителя, галогензамещенную или незамещенную С1-6алкильную группу, галогензамещенную или незамещенную С1-6алкоксигруппу, С1-6алкоксикарбонильную группу, карбоксильную группу, феноксигруппу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), амино-С1-6алкильную группу (где в аминогруппе по крайней мере одна группа, выбранная из группы, состоящей из С1-6алкильной группы и фенильной группы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), может присутствовать в качестве заместителя) или фенил-С1-6алкоксигруппу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя),
p представляет собой целое число от 0 до 4,
R26a представляет собой группу -NHR26h (где R26h представляет собой атом водорода или С1-6алкильную группу) или группу -W1-NHR26c (где W1 представляет собой С1-6алкиленовую группу, R26c представляет собой атом водорода, С1-6алкильную группу или фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя)),
R26d представляет собой группу -N(R26e')R26h или группу -W1-N(R26c)R26e,
R26e представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или С1-6алкильную группу,
R26e' представляет собой С1-6алкильную группу,
R26f представляет собой С1-6алкильную группу, и
R26g представляет собой группу -N(R26h)CH(R52)R26f или группу -W1-N(R26c)CH(R52)R26f, при условии, что общее число углеродных атомов в подчеркнутых частях не превышает 6.
Взаимодействие соединения (Fd-1) с соединением (15) обычно осуществляют в подходящем растворителе в присутствии или в отсутствие основания.
Примеры инертного растворителя для данной реакции могут включать ароматические углеводороды, такие как бензол, толуол или ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, моноглим или диглим, галогенированные углеводороды, такие как дихлорметан, дихлорэтан, хлороформ или тетрахлорид углерода, низшие спирты, такие как метанол, этанол, изопропанол, бутанол, трет-бутанол или этиленгликоль, кислоты жирного ряда, такие как уксусная кислота, сложные эфиры, такие как этилацетат или метилацетат, кетоны, такие как ацетон или метилэтилкетон, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид или триамид гексаметилфосфорной кислоты, и смешанные растворители из указанных растворителей. Примеры основания включают карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия или карбонат цезия, гидроксиды металлов, такие как гидроксид натрия, гидроксид калия или гидроксид кальция, гидрид натрия, гидрид калия, калий, натрий, амид натрия, алкоголяты металлов, такие как метилат натрия, этилат натрия, н-бутоксид натрия, органические основания, такие как пиридин, имидазол, N-этилдиизопропиламин, диметиламинопиридин, триэтиламин, триметиламин, диметиланилин, N-метилморфолин,
1,5-диазабицикло[4.3.0]нонен-5 (DBN),
1,8-диазабицикло[5.4.0]ундецен-7 (DBU) или
1,4-диазабицикло[2.2.2]октан (DABCO), и их смеси. Соединение (15) может быть использовано относительно соединения (Fd-1) в молярном отношении по меньшей мере 1:1, предпочтительно от 1:1 до 10:1. Основание может быть использовано относительно соединения (Fd-1) в молярном отношении по меньшей мере 1:1, предпочтительно от 1:1 до 10:1. Реакцию проводят обычно при 0°С-200°С, предпочтительно при 0°С-150°С. Обычно реакцию осуществляют в течение времени от 5 минут до 80 часов.
В реакционную систему могут быть добавлены галогениды щелочных металлов, такие как иодид натрия или иодид калия, или в нее может быть добавлен также межфазный катализатор. Примеры такого межфазного катализатора включают соли четвертичного аммония, в которых группа, выбранная из группы, состоящей из линейной или разветвленной алкильной группы, содержащей 1-18 углеродных атомов, фенил-С1-6алкильной группы и фенильной группы, является замещенной, такие как тетрабутиламмонийхлорид,
тетрабутиламмонийбромид, тетрабутиламмонийфторид,
тетрабутиламмонийиодид, тетрабутиламмонийгидроксид,
тетрабутиламмонийбисульфит, трибутилметиламмонийхлорид,
трибутилбензиламмонийхлорид, тетрапентиламмонийхлорид,
тетрапентиламмонийбромид, тетрагексиламмонийхлорид,
бензилдиметилоктиламмонийхлорид, метилтригексиламмонийхлорид,
бензилдиметилоктадеканиламмонийхлорид,
метилтридеканиламмонийхлорид, бензилтрипропиламмонийхлорид,
бензилтриэтиламмонийхлорид, фенилтриэтиламмонийхлорид,
тетраэтиламмонийхлорид или тетраметиламмонийхлорид; соли фосфония, такие как тетрабутилфосфонийхлорид, в котором линейная или разветвленная алкильная группа, содержащая 1-18 углеродных атомов, является замещенной; и соли пиридиния, такие как 1-додеканилпиридинийхлорид, в котором линейная или разветвленная алкильная группа, содержащая 1-18 углеродных атомов, является замещенной. Межфазный катализатор может быть использован относительно соединения (Fd-1) в молярном отношении, составляющем обычно от 0,1:1 до 1:1, предпочтительно от 0,1:1 до 0,5:1.
Взаимодействие соединения (Fd-1) с соединением (16) может быть осуществлено в таких же условиях, как при описанном выше взаимодействии соединения (Е-2) с соединением (13), показанном на представленной выше схеме 16.
Схема 19 реакций
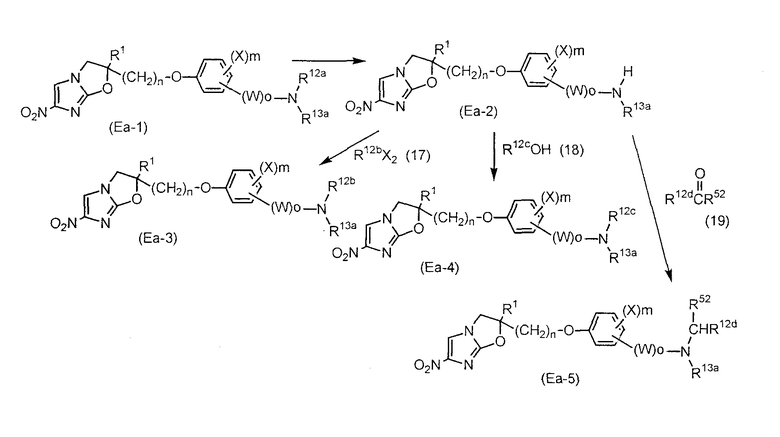
где R1, n, W, X, m, o, R52 и X2 являются такими, как определено выше,
R12a представляет собой С1-6алкоксикарбонильную группу,
R13a представляет собой атом водорода, С1-6алкильную группу, С1-6алканоильную группу, С1-6алкоксикарбонильную группу, фенил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), может быть в качестве заместителя, и алкильная часть может быть замещена С1-6алкоксиаминогруппой), фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), бензоильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), пиридильную группу (где в пиридиновом кольце по крайней мере один из атомов галогена может быть замещенным в качестве заместителя), фенокси-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или бензоил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя),
R12b представляет собой С1-6алкильную группу, С1-6алкоксикарбонильную группу, фенил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), может быть в качестве заместителя, и алкильная часть может быть замещена С1-6алкоксиаминогруппой), фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), пиридильную группу (где в пиридиновом кольце по крайней мере один из атомов галогена может быть замещенным в качестве заместителя), фенокси-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или бензоил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя),
R12с представляет собой С1-6алканоильную группу или бензоильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя),
R12d представляет собой атом водорода, С1-6алкильную группу, фенил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), может быть в качестве заместителя), фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и феноксигруппы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), может быть в качестве заместителя), фенокси-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или бензоил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), и
в группе -(W)o-N(R13a)CH(R52)R12d в общей формуле (Ea-5) общее число углеродных атомов в подчеркнутой части не превышает 6.
Реакция преобразования соединения (Еа-1) в соединение (Еа-2) может быть осуществлена в таких же условиях, как при реакции преобразования соединения (Еа-1) в соединение (Еа-2), представленной на схеме 16.
Взаимодействие соединения (Еа-2) с соединением (17) может быть осуществлено в таких же условиях, как и взаимодействие соединения (Fd-1) в соединение (15), представленное на схеме 18.
Взаимодействие соединения (Еа-2) с соединением (18) осуществляют взаимодействием соединения (Еа-2) с карбоновой кислотой соединения (18) с использованием обычной реакции образования амидной связи. В данном случае можно легко применить условия известной реакции образования амидной связи. Примеры такой реакции образования амидной связи включают (а) метод с использованием смешанного ангидрида кислоты, то есть метод взаимодействия карбоновой кислоты (18) с алкилгалогенформиатом с получением смешанного ангидрида кислоты и взаимодействия смешанного ангидрида кислоты с амином (Еа-2), (b) метод с использованием активного сложного эфира, то есть метод преобразования карбоновой кислоты (18) в активный сложный эфир, такой как фениловый эфир, п-нитрофениловый эфир, сложный эфир имида N-гидроксиянтарной кислоты или сложный 1-гидроксибензотриазоловый эфир, или в активный амид, такой как бензоксазолин-2-тион, и последующее взаимодействие полученного соединения с амином (Еа-2), (с) карбодиимидный метод, то есть метод конденсации карбоновой кислоты (18) с амином (Еа-2) в присутствии активатора, такого как дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид (WSC) или карбонилдиимидазол, и (d) другие методы, включающие метод преобразования карбоновой кислоты (18) в ангидрид карбоновой кислоты с использованием обезвоживающего вещества, такого как уксусный ангидрид с последующим взаимодействием ангидрида карбоновой кислоты с амином (Еа-2), метод взаимодействия сложного эфира карбоновой кислоты (18) и низшего спирта с амином (Еа-2) при высоком давлении и высокой температуре и метод взаимодействия галогенангидрида карбоновой кислоты (18) с амином (Еа-2).
Смешанный ангидрид кислоты для (а) метода с использованием ангидрида кислоты, описанного выше, получают обычной реакцией Шоттена-Баумана. Смешанный ангидрид кислоты подвергают взаимодействию с амином (Еа-2), обычно без выделения, получая в результате соединение по настоящему изобретению, представленное общей формулой (Еа-4). Указанную реакцию Шоттена-Баумана осуществляют в присутствии основания. Соединения, которые обычно используют для реакции Шоттена-Баумана, можно использовать в виде оснований. Примеры такого основания включают органические основания, такие как триэтиламин, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нонен-5 (DBN),
1,8-диазабицикло[5.4.0]ундецен-7 (DBU) или
1,4-диазабицикло[2.2.2]октан (DABCO); неорганические основания, включающие карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия или гидрокарбонат калия, гидроксиды металлов, такие как гидроксид натрия, гидроксид калия или гидроксид кальция, гидрид калия, гидрид натрия, калий, натрий, амид натрия и алкоголяты металлов, такие как метилат натрия или этилат натрия. Реакцию осуществляют при температуре обычно от -20°С до 100°С, предпочтительно от 0°С до 50°С. Время реакции обычно составляет от 5 минут до 10 часов, предпочтительно от 5 минут до 2 часов. Взаимодействие полученного смешанного ангидрида с амином (Еа-2) осуществляют при температуре обычно от -20°С до 150°С, предпочтительно от 10°С до 50°С. Время реакции обычно составляет от 5 минут до 10 часов, предпочтительно от 5 минут до 5 часов. Метод с использованием смешанного ангидрида обычно осуществляют в растворителе. В данной реакции может быть использован любой растворитель, обычно используемый в методе с использованием смешанного ангидрида. Примеры такого растворителя включают галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан или тетрахлорид углерода, ароматические углеводороды, такие как бензол, толуол или ксилол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран или диметоксиэтан, сложные эфиры, такие как метилацетат, этилацетат или изопропилацетат, апротонные полярные растворители, такие как N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид или триамид гексаметилфосфорной кислоты, и смешанные растворители, состоящие из указанных выше растворителей. Примеры алкилгалогенформиата, используемого в методе с использованием смешанного ангидрида, включают метилхлорформиат, метилбромформиат, этилхлорформиат, этилбромформиат и изобутилхлорформиат. Молярное отношение между карбоновой кислотой (18), алкилгалогенформиатом и амином (Еа-2) обычно может составлять 1:1. Каждый из алкилгалогенформиата и карбоновой кислоты (18) также может быть использован относительно амина (Еа-2) в молярном отношении в пределах от 1:1 до 1,5:1.
Указанный выше метод (с), включающий реакцию конденсации в присутствии указанного выше активатора, может быть осуществлен в подходящем растворителе в присутствии или в отсутствие основания. В качестве растворителя и основания в данной реакции можно использовать любой растворитель, используемый при взаимодействии галогенангидрида карбоновой кислоты с амином (Еа-2), описанного выше в других методах (d). Молярное отношение активатора к соединению (Еа-2) может составлять по меньшей мере 1:1, предпочтительно от 1:1 до 5:1. При использовании WSC в качестве активатора реакция протекает благоприятно, если в реакционную систему добавляют 1-гидроксибензотриазол. Реакцию осуществляют при температуре в пределах обычно от -20°С до 180°С, предпочтительно от 0°С до 150°С. Время реакции обычно находится в пределах от 5 минут до 90 часов.
Когда из описанных выше других методов (d) используют метод взаимодействия галогенангидирида карбоновой кислоты с амином (Еа-2), реакцию проводят в присутствии основания в подходящем растворителе. В данном методе могут быть широко использованы известные основания. Например, может быть использовано любое основание, используемое в указанной выше реакции Шоттена-Баумана. Примеры используемого растворителя могут включать спирты, такие как метанол, этанол, изопропанол, пропанол, бутанол, 3-метокси-1-бутанол, этилцеллозольв или метилцеллозольв, ацетонитрил, пиридин, ацетон, воду, а также растворители, используемые в указанном выше методе с использованием смешанного ангидрида кислоты. Молярное отношение амина (Еа-2) к галогенангидриду карбоновой кислоты особо не ограничивают, и оно может быть выбрано из широкого диапазона. Молярное отношение указанных соединений может составлять по меньшей мере обычно 1:1, предпочтительно от 1:1 до 1:5. Реакцию осуществляют при температуре в пределах обычно от -20°С до 180°С, предпочтительно от 0°С до 150°С. Время реакции обычно находится в пределах от 5 минут до 50 часов.
Реакция образования амидной связи, представленная на показанной выше схеме 19 реакций, может быть также выполнена взаимодействием карбоновой кислоты (18) с амином (Еа-2) в присутствии фосфорного конденсирующуего агента, такого как дифенилфосфинхлорид, хлоридат фенил-N-фенилфосфорамида, диэтилхлорфосфат, диэтилцианофосфат, азиддифенилфосфат или бис(2-оксо-3-оксазолидинил)фосфинхлорид.
Реакцию проводят в присутствии растворителя и основания, используемых в указанном выше методе взаимодействия галогенангидрида карбоновой кислоты с амином (Еа-2), при температуре в пределах обычно от -20°С до 150°С, предпочтительно от 0°С до 100°С. Время реакции обычно находится в пределах от 5 минут до 30 часов. Каждый из реагентов, включающих конденсирующий агент и карбоновую кислоту (18), используют относительно амина (Еа-2) в молярном отношении по меньшей мере 1:1, предпочтительно от 1:1 до 2:1.
Взаимодействие соединения (Еа-2) с соединением (19) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Е-2) с соединением (13), представленном на показанной выше схеме 16 реакций.
Схема 20 реакций

где R1, n, R52, p, W1 и X2 являются такими, как определено выше,
R19a представляет собой группу, представленную каждым из (F1)-(F11),
R53 представляет собой феноксигруппу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), атом галогена, галогензамещенную или незамещенную С1-6алкильную группу, галогензамещенную или незамещенную С1-6алкоксигруппу, аминогруппу, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из С1-6алкильной группы и фенил-С1-6алкильной группы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), пиперазинильную группу (где в пиперазиновом кольце по крайней мере одна группа, выбранная из группы, состоящей из фенил-С1-6алкильной группы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя)) или пиперидинильную группу (где в пиперидиновом кольце по крайней мере одна аминогруппа может присутствовать в качестве заместителя и в аминогруппе по крайней мере одна группа, выбранная из группы, состоящей из фенильной группы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) и С1-6алкильной группы, может быть в качестве заместителя),
R54 представляет собой фенил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя),
R55 представляет собой фенил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) и
общее число углеродных атомов группы СН(R52)R55 в общей формуле (F3-3) не превышает 6.
Взаимодействие соединения (F3-1) с соединением (20) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Fd-1) с соединением (15), представленном на показанной выше схеме 18 реакций.
Взаимодействие соединения (F3-1) с соединением (21) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Е-2) с соединением (13), представленном на показанной выше схеме 16 реакций.
Схема 21 реакции
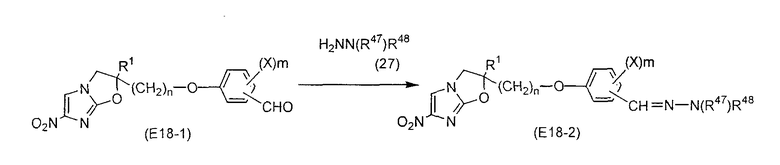
где R1, n, X, R47, R48 и m являются такими, как определено выше.
Взаимодействие соединения (27) с соединением (Е18-1) может быть осуществлено в подходящем инертном растворителе в присутствии или в отсутствие основания.
Примеры используемого основания могут включать неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид кальция, карбонат натрия или карбонат калия, соли щелочных металлов жирных кислот, такие как ацетат натрия, и органические основания, такие как пиперидин, триэтиламин, триметиламин, пиридин, диметиланилин, N-этилдиизопропиламин, диметиламинопиридин, N-метилморфолин,
1,5-диазабицикло[4.3.0]нонен-5 (DBN),
1,8-диазабицикло[5.4.0]ундецен-7 (DBU) или
1,4-диазабицикло[2.2.2]октан (DABCO). В данной реакции можно использовать любой растворитель, лишь бы он не влиял на реакцию. Примеры такого растворителя включают воду, ароматические углеводороды, такие как бензол, толуол или ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, моноглим или диглим, галогенированные углеводороды, такие как дихлорметан, дихлорэтан, хлороформ, или тетрахлорид углерода, низшие спирты, такие как метанол, этанол, изопропанол, пропанол, бутанол, трет-бутанол или этиленгликоль, жирные кислоты, такие как уксусная кислота, сложные эфиры, такие как этилацетат или метилацетат, кетоны, такие как ацетон или метилэтилкетон, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, триамид гексаметилфосфорной кислоты, и смешанные растворители из указанных выше растворителей. Молярное отношение соединения (27) относительно соединения (Е18-1) может составлять по крайней мере обычно 1:1, предпочтительно от 1:1 до 5:1. Температура реакции обычно находится в пределах от комнатной до 200°С, предпочтительно от комнатной температуры до 150°С. Время реакции обычно находится в пределах от 5 минут до 30 часов.
Схема 22 реакций
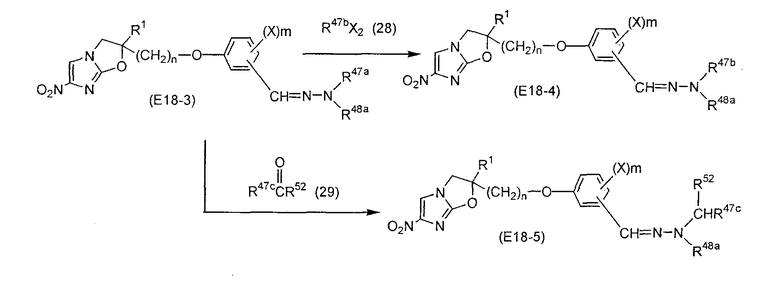
где R1, n, X, m, X2 и R52 являются такими, как определено выше,
R47a представляет собой атом водорода,
R48a представляет собой атом водорода, С1-6алкильную группу, фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или пиридильную группу (где в пиридиновом кольце по крайней мере одна галогензамещенная или незамещенная С1-6алкильная группа может присутствовать в качестве заместителя),
R47b представляет собой С1-6алкильную группу, фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или пиридильную группу (где в пиридиновом кольце по крайней мере одна галогензамещенная или незамещенная С1-6алкильная группа может присутствовать в качестве заместителя) и
R47с представляет собой атом водорода или С1-6алкильную группу, при условии, что в группе -CH=N-N(R48a)CH(R52)R47с в общей формуле (Ea 18-5) общее число углеродных атомов в подчеркнутой части не превышает 6.
Взаимодействие соединения (Е18-3) с соединением (28) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Fd-1) с соединением (15), представленном на показанной выше схеме 18 реакций.
Взаимодействие соединения (Е18-3) с соединением (29) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Е-2) с соединением (13), представленном на показанной выше схеме 16 реакций.
Схема 23 реакции

где R1, n, X, m, W и o являются такими, как определено выше, каждый из R14Аb и R14с представляет собой С1-6алкоксигруппу.
Реакция преобразования соединения (Еаа 17-6) в соединение (Еаа 17-7) может быть осуществлена в таких же условиях, как при преобразовании соединения (Е-1) в соединение (Е-2), представленном на показанной выше схеме 16.
Схема 24 реакции

где R1, n, X, m, W, o и R14Аа являются такими, как определено выше,
пунктирная линия в пиперидиновом кольце указывает на то, что связь может быть двойной связью и, когда пунктирная линия представляет собой двойную связь, это означает, что гидроксильная группа является замещенной,
R57 представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы, С1-4алкилендиоксигруппы, С1-6алкоксикарбонильной группы, цианогруппы, С2-6алкенильной группы, нитрогруппы, фенильной группы, аминогруппы, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из фенильной группы, С1-6алкильной группы, карбамоильной группы и С1-6алканоильной группы, С1-6алканоильной группы, замещенной С1-6алкильной группой, гидроксильной группы, С1-6алкоксикарбонильной группы, замещенной С1-6алкильной группой, С1-6алкилтиогруппы, 1,2,4-триазолильной группы, изоксазолильной группы, имидазолильной группы, бензотиазолильной группы, 2Н-бензотриазолильной группы, пирролильной группы, бензоксазолильной группы, пиперазинильной группы (где в пиперазиновом кольце по крайней мере одна группа, выбранная из группы, состоящей из С1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) может присутствовать в качестве заместителя), пиперидинильной группы (где в пиперидиновом кольце по крайней мере одна аминогруппа может присутствовать в качестве заместителя и в аминогруппе по крайней мере одна группа, выбранная из группы, состоящей из С1-6алкильной группы и фенильной группы (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) может присутствовать в качестве заместителя) и карбамоильной группы, может присутствовать в качестве заместителя).
Взаимодействие соединения (Еаа 4-1) с соединением (31) может быть осуществлено в подходящем растворителе в присутствии конденсирующего агента.
В данной реакции можно использовать растворитель, указанный ниже. Примеры такого растворителя включают галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан или тетрахлорид углерода, ароматические углеводороды, такие как бензол, толуол или ксилол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран или диметоксиэтан, сложные эфиры, такие как метилацетат, этилацетат или изопропилацетат, спирты, такие как метанол, этанол, изопропанол, пропанол, бутанол, 3-метокси-1-бутанол, этилцеллозольв или метилцеллозольв, ацетонитрил, пиридин, ацетон, воду, апротонные полярные растворители, такие как N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид или триамид гексаметилфосфорной кислоты, и смешанные растворители, состоящие из указанных выше растворителей.
Примеры конденсирующего агента, используемого в данной реакции, могут включать азокарбоксилаты, такие как диэтилазодикарбоксилат или трет-бутилазодикарбоксилат, и фосфорсодержащие смеси, такие как трифенилфосфин или трифенилфосфин, нанесенный на полимер. Данную реакцию осуществляют при температуре в пределах обычно от 0°С до 200°С, предпочтительно от 0°С до 150°С. Реакцию обычно осуществляют в течение 1-10 часов. Молярное отношение конденсирующего агента к соединению (Еаа 4-1) может составлять по крайней мере 1:1, предпочтительно от 1:1 до 3:1. Молярное отношение соединения (31) к соединению (Еаа 4-1) может составлять по крайней мере 1:1, предпочтительно от 1:1 до 2:1.
Схема 25 реакций
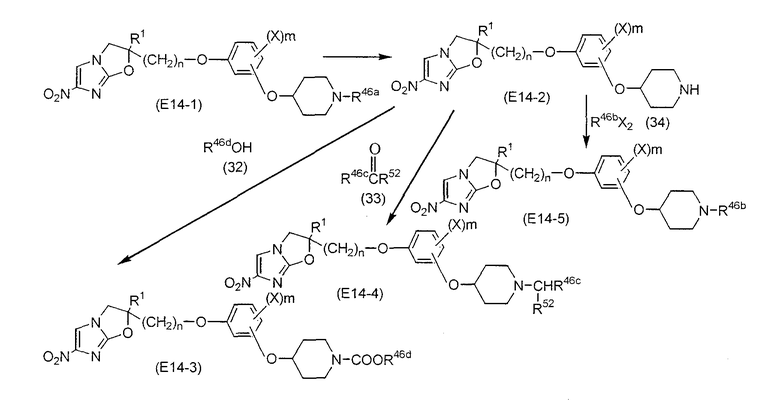
где R1, n, X, m, X2 и R52 являются такими, как определено выше,
R46а представляет собой С1-6алкоксикарбонильную группу,
R46b представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), фенил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя), фенил-С1-6алкрксикарбонильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или С1-6алкоксикарбонильную группу,
R46с представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или фенил-С1-6алкильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) и
R46d представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) или С1-6алкильную группу.
Реакция преобразования соединения (Е14-1) в соединение (Е14-2) может быть осуществлена в таких же условиях, как при преобразовании соединения (Е-1) в соединение (Е-2), представленном на показанной выше схеме 16.
Взаимодействие соединения (Е14-2) с соединением (34) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Fd-1) с соединением (15), представленном на показанной выше схеме 18.
Взаимодействие соединения (Е14-2) с соединением (33) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Е-2) с соединением (13), представленном на показанной выше схеме 16.
Взаимодействие соединения (Е14-2) с соединением (32) может быть осуществлено в подходящем растворителе в присутствии конденсирующего агента. В данной реакции может быть использован любой растворитель, используемый в методе взаимодействий соединения (Еаа 4-1) с соединением (31), представленном на показанной выше схеме 24. Примером конденсирующуего агента, используемого в данной реакции, является N,N'-карбонилдиимидазол. Каждый из реагентов, включающих соединение (32) и конденсирующий агент, используют относительно соединения (Е14-2) в молярном отношении, составляющем по крайней мере 1:1, предпочтительно от 1:1 до 2:1. Данную реакцию осуществляют при температуре обычно от 0°С до 150°С, предпочтительно от 0°С до 100°С, в течение приблизительно 1-30 часов.
Схема 26 реакций

где R1, n и о являются такими, как определено выше,
R24а и R25а образуют пиперазиновое кольцо через смежный с ними атом азота, причем пиперазиновое кольцо, которое образуют R24а и R25а, может содержать в качестве заместителя по крайней мере один заместитель, описанный выше в связи с заместителями 5-6-членного насыщенного гетероцикла, который R24 и R25 образуют через смежные с ними атомы азота, и пиперазиновое кольцо, которое образуют R24а и R25а, содержит С1-6алкоксикарбонильную группу у атома азота в пиперазиновом кольце,
R58 представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя),
R24b и R25b образуют пиперазиновое кольцо через смежный с ними атом азота, причем пиперазиновое кольцо, которое образуют R24b и R25b, может содержать в качестве заместителя по крайней мере один заместитель, описанный выше в связи с заместителями 5-6-членного насыщенного гетероцикла, который R24 и R25 образуют через смежные с ними атомы азота, и пиперазиновое кольцо, которое образуют R24b и R25b, содержит атом водорода у атома азота в пиперазиновом кольце, и
R24с и R25с образуют пиперазиновое кольцо через смежный с ними атом азота, причем пиперазиновое кольцо, которое образуют R24с и R25с, может содержать в качестве заместителя по крайней мере один заместитель, описанный выше в связи с заместителями 5-6-членного насыщенного гетероцикла, который R24 и R25 образуют через смежные с ними атомы азота, и пиперазиновое кольцо, которое образуют R24с и R25с, содержит фенил-С1-6алкоксикарбонильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя) у атома азота в пиперазиновом кольце.
Реакция преобразования соединения (Fca 12-1) в соединение (Fca 12-2) может быть осуществлена в таких же условиях, как при преобразовании соединения (Е-1) в соединение (Е-2), представленном на показанной выше схеме 16.
Взаимодействие соединения (Fca 12-2) с соединением (36) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Е14-2) с соединением (32), представленном на показанной выше схеме 25.
Схема 27 реакций

где R1 и n являются такими, как определено выше, и
R46а представляет собой фенильную группу (где в фенильном кольце по крайней мере одна группа, выбранная из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы, может присутствовать в качестве заместителя).
Реакция преобразования соединения (Fd 39-1) в соединение (Fd 39-2) может быть осуществлена в таких же условиях, как при преобразовании соединения (Е-1) в соединение (Е-2), представленном на показанной выше схеме 16.
Взаимодействие соединения (Fd 39-2) с соединением (37) может быть осуществлено в таких же условиях, как при взаимодействии соединения (Е14-2) с соединением (32), представленном на показанной выше схеме 25.
Соединение по настоящему изобретению включает фармацевтически приемлемую соль. Примеры такой соли включают неорганические соли, такие как гидрохлорид, гидробромид, нитрат, сульфат или фосфат, и органические соли, такие как метансульфонат, п-толуолсульфонат, ацетат, цитрат, тартрат, малеат, фумарат, малат или лактат.
Далее описан лекарственный препарат, содержащий соединение по настоящему изобретению в качестве активного компонента.
Указанный лекарственный препарат получают из соединения по настоящему изобретению в форме обычной фармацевтической композиции. Ее изготавливают, используя обычно применяемые разбавители или эксципиенты, такие как наполнитель, набухающее вещество, связывающее вещество, смачивающее вещество, вещество, дезинтегратор, поверхностно-активное вещество или смазывающее вещество.
Такая фармацевтическая композиция может быть выбрана из различных форм в зависимости от терапевтических целей. Типичные примеры формы фармацевтической композиции включают таблетку, пилюлю, порошок, жидкость, суспензию, эмульсию, гранулу, капсулу, суппозиторий и средство для инъекции (жидкость, суспензия и т.д.).
Для изготовления фармацевтической композиции в форме таблетки могут быть широко использованы известные носители. Примеры такого носителя включают эксципиенты, такие как лактоза, сахароза, хлорид натрия, глюкоза, мочевина, крахмал, карбонат кальция, каолин или кристаллическая целлюлоза; связывающие вещества, такие как вода, этанол, пропанол, простой сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия или поливинилпирролидон; дезинтеграторы, такие как сухой крахмал, альгинат натрия, порошок агара, порошок ламинарана, гидрокарбонат натрия, карбонат кальция, полиоксиэтиленсорбитановые сложные эфиры жирных кислот, лаурилсульфат натрия, стеарат моноглицерида, крахмал или лактоза; регуляторы распадаемости, такие как сахароза, стеарин, масло какао или гидрогенизированное масло; усилители всасываемости, такие как основание четвертичного аммония или лаурилсульфат натрия; смачивающие вещества, такие как глицерин или крахмал, адсорбенты, такие как крахмал, лактоза, каолин, бентонит или коллоидальный диоксид кремния, и смазывающие вещества, такие как очищенный тальк, стеарат, порошок борной кислоты или полиэтиленгликоль.
Кроме того, указанные таблетки могут быть изготовлены в виде таблеток с обычным для них покрытием, таких как таблетки с сахарным покрытием, таблетки с желатиновым покрытием, таблетки с энтеросолюбильным покрытием, таблетки с пленочным покрытием, таблетки с двойным покрытием или таблетки с многослойным покрытием.
Для изготовления фармацевтической композиции в форме пилюли могут быть широко использованы известные носители. Примеры такого носителя включают эксципиенты, такие как глюкоза, лактоза, крахмал, масло какао, гидрогенизированное растительное масло, каолин или тальк, связывающие вещества, такие как порошок аравийской камеди, порошок трагаканта, желатин или этанол, и дезинтеграторы, такие как агар или ламинаран.
Для изготовления фармацевтической композиции в форме суппозитория могут быть широко использованы известные носители. Примеры такого носителя включают полиэтиленгликоль, масло какао, высший спирт, сложные эфиры высших спиртов, желатин и полусинтетический глицерид.
В случае, когда фармацевтическую композицию изготавливают в виде раствора для инъекции, такого как жидкость, эмульсия или суспензия, указанные растворы предпочтительно стерилизуют и изготавливают их изотоническими по отношению к крови. Для изготовления фармацевтической композиции в указанной жидкой, эмульсионной или суспензионной форме могут быть широко использованы известные разбавители. Примеры такого разбавителя включают воду, этанол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт и полиоксиэтиленсорбитановые сложные эфиры жирных кислот. Кроме того, в случае использования фармацевтической композиции в качестве раствора для инъекции к фармацевтической композиции может быть добавлено некоторое количество обычных солей, глюкозы или глицерина, достаточное для получения изотонического раствора. К фармацевтической композиции можно также добавить обычное солюбилизирующее средство, буфер, успокоительное средство или тому подобное. И еще, при необходимости к фармацевтической композиции можно также добавить красящее вещество, консервант, отдушку, корригент, подслащивающее вещество или другие фармацевтические вещества.
Количество соединения по настоящему изобретению, содержащегося в фармацевтической композиции, особо не ограничивают и его можно подходящим образом выбрать из широкого диапазона. Как правило, в фармацевтической композиции предпочтительно содержится 1-70% по массе соединения по настоящему изобретению.
Способ введения фармацевтической композиции по настоящему изобретению особо не ограничивают. Ее вводят в зависимости от различных форм фармацевтической композиции, возраста пациента, пола, состояний болезни или других условий. Например, когда фармацевтическую композицию применяют в форме таблетки, пилюли, жидкости, суспензии, эмульсии, гранулы или капсулы, ее вводят перорально. В случае инъекции она может быть введена внутривенно, в отдельности или в сочетании с обычной вспомогательной жидкостью, такой как глюкоза или аминокислота. Кроме того, если необходимо, его можно вводить в отдельности внутримышечно, внутрикожно, подкожно или внутрибрюшинно. В случае суппозитория его можно вводить интраректально.
Доза указанной фармацевтической композиции может быть надлежащим образом подобрана в зависимости от применения, возраста пациента, пола, тяжести заболевания или других условий. Вводят за один прием или раздельно за несколько приемов в сутки обычно 0,01-100 мг, предпочтительно 0,1-50 мг, на кг массы тела фармацевтической композиции.
Поскольку указанная доза изменяется в зависимости от различных условий, то в некоторых случаях может быть достаточной доза, меньшая, чем указанный диапазон, а в других случаях может потребоваться большая доза, чем указанный диапазон.
Соединение по настоящему изобретению обладает специфическим эффектом против Mycobacterium tuberculosis, такой как кислотоустойчивые бактерии (Mycobacterium, атипичные кислотоустойчивые бактерии). Соединение по настоящему изобретению обладает превосходным эффектом против Mycobacterium tuberculosis, устойчивой ко многим лекарственным средствам. Соединение по настоящему изобретению обладает противомикробным действием в отношении анаэробных бактерий.
Соединение по настоящему изобретению демонстрирует указанные выше активности не только in vitro, но и при пероральном введении.
Соединение по настоящему изобретению не вызывает диарею, как известные противомикробные средства широкого спектра в отношении обычных бактерий, таких как грамположительные бактерии или грамотрицательные бактерии. Кроме того, у него меньше побочных реакций, чем у существующих средств. Следовательно, оно может быть лекарственным средством, которое можно применять длительное время.
Соединение по настоящему изобретению может хорошо распределяться в тканях легкого, основного органа, инфицируемого кислотоустойчивыми бактериями, и обладает такими свойствами, как длительная эффективность и высокая безопасность. Следовательно, от данного соединения можно ожидать высокого терапевтического эффекта.
По сравнению с существующими противотуберкулезными средствами соединение по настоящему изобретению проявляет сильное бактерицидное действие даже в отношении цитозойных бактерий, таких как Mycobacterium tuberculosis, присутствующих в человеческом макрофаге. Следовательно, оно обеспечивает возможность снижения частоты рецедивов туберкулеза и возможность реализации кратковременной химиотерапии. Ожидается, таким образом, что соединение по настоящему изобретению будет также полезно в качестве основного профилактического средства против смешанной инфекции ВИЧ и туберкулеза, считающейся серьезной проблемой.
ПРИМЕРЫ
Далее описаны пример изготовления фармацевтической композиции, ссылочные примеры, примеры и примеры испытаний.
Пример 1 изготовления фармацевтической композиции
Смешивали и размалывали 100 г соединения по настоящему изобретению, 40 г Avicel (торговое название, производитель Asahi Kasei Corporation), 30 г кукурузного крахмала и 2 г стеарата магния и затем смесь формовали в таблетки R10 мм пестиком с опудриванием сахаром.
Для покрытия полученных таблеток использовали средство для пленочного покрытия, содержащее 10 г ТС-5 (торговое название, гидроксипропилметилцеллюлоза, производитель Shin-Etsu Chemical Co., Ltd.), 3 г полиэтиленгликоля-6000, 40 г касторового масла и подходящее количество этанола, получая таблетку с пленочным покрытием, имеющую описанный выше состав.
Ссылочный пример 1
Получение бензил 4-(2-оксопропил)пиперазин-1-карбоксилата
Карбонат калия (1,27 г, 9,22 ммоль), N-этилдиизопропиламин (0,80 мл, 4,61 ммоль) и хлорацетон (1,22 мл, 13,83 ммоль) добавляли к раствору бензилпиперазин-1-карбоксилата (2,03 г, 90,22 ммоль) в ацетонитриле (20 мл) и смесь кипятили с обратным холодильником в течение 2 часов. Нерастворимые вещества удаляли фильтрованием и промывали этилацетатом. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением бензил 4-(2-оксопропил)пиперазин-1-карбоксилата (2,24 г, выход 88%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,15 (3H, с), 2,35-2,50 (4H, м), 3,21 (2H, с), 3,50-3,62 (4H, м), 5,13 (2H, с), 7,27-7,42 (5H, м).
Ссылочный пример 2
Получение трет-бутил 4-(3-оксобутил)пиперазин-1-карбоксилата
Раствор трет-бутилпиперазин-1-карбоксилата (6 г, 32,3 ммоль) в ТГФ (50 мл) постепенно добавляли по каплям к раствору метилвинилкетона (2,3 г, 32,9 ммоль) в ТГФ (25 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением трет-бутил 4-(3-оксобутил)пиперазин-1-карбоксилата (7,2 г, выход 87%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 2,17 (3H, с), 2,30-2,42 (4H, м), 2,53-2,70 (4H, м), 3,33-3,47 (4H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 3-10 получали способом, подобно описанному в ссылочном примере 1.
Ссылочный пример 3
1-[4-(4-трифторметилфенил)пиперазин-1-ил]пропан-2-он
выход 99%
1H-ЯМР (CDCl3) δ м.д.:
2,18 (3H, с), 2,63-2,68 (4H, м), 3,27 (2H, с), 3,30-3,45 (4H, м), 6,92 (2H, д, J=8,7 Гц), 7,48 (2H, д, J=8,7 Гц).
Ссылочный пример 4
1-(4-фенилпиперазин-1-ил)пропан-2-он
выход 95%
1H-ЯМР (CDCl3) δ м.д.:
2,19 (3H, с), 2,65-2,70 (4H, м), 3,27-3,32 (6H, м), 6,97-7,01 (2H, м), 7,24-7,31 (1H, м), 7,37-7,43 (2H, м).
Ссылочный пример 5
1-[4-(4-хлорфенил)пиперазин-1-ил]пропан-2-он
выход 99%
1H-ЯМР (CDCl3) δ м.д.:
2,17 (3H, с), 2,63-2,67 (4H, м), 3,18-3,23 (4H, м), 3,26 (2H, с), 6,80-6,87 (2H, м), 7,17-7,23 (2H, м).
Ссылочный пример 6
1-[4-(4-трифторметоксифенил)пиперазин-1-ил]пропан-2-он
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,18 (3H, с), 2,63-2,68 (4H, м), 3,20-3,25 (4H, м), 3,26 (2H, с), 6,85-6,92 (2H, м), 7,09-7,13 (2H, м).
Ссылочный пример 7
1-[4-(2-пиридил)пиперазин-1-ил]пропан-2-он
выход 97%
1H-ЯМР (CDCl3) δ м.д.:
2,19 (3H, с), 2,58-2,63 (4H, м), 3,25 (2H, с), 3,57-3,62 (4H, м), 6,60-6,66 (2H, м), 7,44-7,51 (1H, м), 8,17-8,20 (1H, м).
Ссылочный пример 8
1-[4-(2-пиримидил)пиперазин-1-ил]пропан-2-он
выход 88%
1H-ЯМР (CDCl3) δ м.д.:
2,19 (3H, с), 2,53-2,57 (4H, м), 3,25 (2H, с), 3,86-3,90 (4H, м), 6,49 (1H, т, J=4,8 Гц), 8,30 (2H, д, J=4,8 Гц).
Ссылочный пример 9
трет-бутил-N-метил-[1-(2-оксопропил)пиперидин-4-ил]карбамат
выход 79%
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 1,57-1,63 (2H, м), 1,70-1,91 (2H, м), 2,04-2,18 (2H, м), 2,14 (3H, с), 2,71-2,74 (1H, м), 2,74 (3H, с), 2,90-2,95 (2H, м), 3,19 (2H, с).
Ссылочный пример 10
трет-бутил 4-(2-оксопропил)гомопиперазин-1-карбоксилат
выход 58%
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 1,75-1,93 (2H, м), 2,14 (3H, с), 2,64-2,76 (4H, м), 3,32 (2H, с), 3,38-3,58 (4H, м).
Ссылочный пример 11
Получение 1-(4-трифторметилбензоил)-4-гидроксипиперидина
4-(Трифторметил)бензоилхлорид (1,5 мл, 9,89 ммоль) добавляли к раствору 4-гидроксипиперидина (1 г, 9,89 ммоль) и триэтиламина (1,7 мл, 11,9 ммоль) в метиленхлориде (20 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=2/1) с получением 1-(4-трифторметилбензоил)-4-гидроксипиперидина (2,07 г, выход 77%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,36-2,07 (4H, м), 3,07-3,70 (3H, м), 3,91-4,32 (2H, м), 7,51 (2H, д, J=8,0 Гц), 7,68 (2H, д, J=8,0 Гц).
Используя соответствующее исходное вещество, соединение ссылочного примера 12 получали способом, подобно описанному в ссылочном примере 11.
Ссылочный пример 12
1-(4-трифторметоксибензоил)-4-гидроксипиперидин
бесцветный кристаллический порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,34-2,07 (4H, м), 3,09-3,80 (3H, м), 3,91-4,32 (2H, м), 7,25 (2H, д, J=7,9 Гц), 7,45 (2H, д, J=7,9 Гц).
Ссылочный пример 13
Получение 1-[2-(тетрагидропиран-2-илокси)этил]-4-(4-трифторметилфенокси)пиперидина
Смесь 4-(4-трифторметилфенокси)пиперидина (1,87 г, 7,63 ммоль), 2-(2-бромэтокси)тетрагидропирана (1,75 г, 8,4 ммоль), карбоната калия (1,16 г, 8,38 ммоль), иодида натрия (1,2 г, 8,01 ммоль) в ДМФА (30 мл) перемешивали при 100°C в течение 1 часа. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом два раза. Экстракт промывали водой два раза и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением 1-[2-(тетрагидропиран-2-илокси)этил]-4-(4-трифторметилфенокси)пиперидина (1,69 г, выход 59%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,39-2,12 (10H, м), 2,36-2,53 (2H, м), 2,68 (2H, т, J=6,1 Гц), 2,71-2,92 (2H, м), 3,43-3,63 (2H, м), 3,78-3,94 (2H, м), 4,31-4,47 (1H, м), 4,57-4,67 (1H, м), 6,96 (2H, д, J=8,7 Гц), 7,52 (2H, д, J=8,7 Гц).
Ссылочный пример 14
Получение 2-[4-(4-трифторметилфенокси)пиперидин-1-ил]этанола
Смесь 1-[2-(тетрагидропиран-2-илокси)этил]-4-(4-трифторметилфенокси)пиперидина (1,69 г, 4,53 ммоль), полученного в ссылочном примере 13, и п-толуолсульфоната пиридиния (114 мг, 0,45 ммоль) в этаноле (50 мл) перемешивали при 60-70°C в течение 6 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали ее при пониженном давлении. К остатку добавляли 10% водный раствор гидроксида и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением 2-[4-(4-трифторметилфенокси)пиперидин-1-ил]этанола (1,19 г, выход 91%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,73-2,10 (4H, м), 2,31-2,47 (2H, м), 2,58 (2H, т, J=5,5 Гц), 2,69-3,00 (3H, м), 3,63 (2H, т, J=5,5 Гц), 4,33-4,48 (1H, м), 6,95 (2H, д, J=8,6 Гц), 7,53 (2H, д, J=8,6 Гц).
Ссылочный пример 15
Получение 2-[2-(4-трифторметилфенокси)этокси]тетрагидропирана
Смесь 4-гидроксибензотрифторида (2,08 г, 12,83 ммоль), 2-(2-бромэтокси)тетрагидропирана (3 г, 14,11 ммоль), карбоната калия (1,95 г, 14,11 ммоль) и иодида натрия (2 г, 13,47 ммоль) в ДМФА (15 мл) перемешивали при 100°C в течение 3 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом два раза. Экстракт промывали водой два раза и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением 2-[2-(4-трифторметилфенокси)этокси]тетрагидропирана (2,47 г, выход 66%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,41-1,90 (6H, м), 3,45-3,66 (1H, м), 3,76-3,96 (2H, м), 4,02-4,24 (3H, м), 4,63-4,76 (1H, м), 6,98 (2H, д, J=8,6 Гц), 7,53 (2H, д, J=8,6 Гц).
Ссылочный пример 16
Получение 2-(4-трифторметилфенокси)этанола
Используя 2-[2-(4-трифторметилфенокси)этокси]тетрагидропиран (2,47 г, 8,51 ммоль), полученный в ссылочном примере 15, 2-(4-трифторметилфенокси)этанол (1,32 г, выход 79%) в виде бесцветного кристаллического порошка получали способом, подобно описанному в ссылочном примере 14.
1H-ЯМР (CDCl3) δ м.д.:
3,88-4,14 (4H, м), 6,98 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц).
Ссылочный пример 17
Получение 1-[2-(тетрагидропиран-2-илокси)этил]-4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридина
Используя моногидрохлорид 4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридина (680 мг, 2,43 ммоль) и 2-(2-бромэтокси)тетрагидропиран (610 мг, 2,92 ммоль), 1-[2-(тетрагидропиран-2-илокси)этил]-4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин (425 мг, выход 47%) в виде бледно-коричневого масла получали способом, подобно описанному в ссылочном примере 15.
1H-ЯМР (CDCl3) δ м.д.:
1,41-1,92 (6H, м), 2,45-2,59 (2H, м), 2,67-2,86 (4H, м), 3,18-3,31 (2H, м), 3,43-3,65 (2H, м), 3,80-4,00 (2H, м), 4,55-4,65 (1H, м), 5,98-6,10 (1H, м), 7,15 (2H, дд, J=2,1 Гц, 8,8 Гц), 7,38 (2H, дд, J=2,1 Гц, 8,8 Гц).
Ссылочный пример 18
Получение 2-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]этанола
Используя 1-[2-(тетрагидропиран-2-илокси)этил]-4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин (425 мг, 1,14 ммоль), полученный в ссылочном примере 17, 2-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-ил]этанол (222 мг, выход 68%) в виде бледно-коричневого масла получали способом, подобно описанному в ссылочном примере 14.
1H-ЯМР (CDCl3) δ м.д.:
2,47-2,59 (2H, м), 2,68 (2H, т, J=5,5 Гц), 2,79 (2H, т, J=5,5 Гц), 3,16-3,25 (2H, м), 3,70 (2H, т, J=5,5 Гц), 6,00-6,10 (1H, м), 7,17 (2H, дд, J=2,1 Гц, 6,7 Гц), 7,40 (2H, дд, J=2,1 Гц, 6,7 Гц).
Ссылочный пример 19
Получение 3-(4-трифторметилфенил)-2-пропин-1-ола
Смесь 4-бромбензотрифторида (6,5 г, 28,89 ммоль), пропаргилового спирта (2,35 мл, 40,45 ммоль), триэтиламина (5,64 мл, 40,45 ммоль), трифенилфосфина (230 мг, 0,87 ммоль), иодида меди(1) (110 мг, 0,58 ммоль) и дихлорбис(трифенилфосфин)палладия (210 мг, 0,29 ммоль) в толуоле (100 мл) перемешивали при 100°С в атмосфере азота в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры и фильтровали через Целит. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением
3-(4-трифторметилфенил)-2-пропин-1-ола (3,47 г, выход 60%) в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
4,52 (2H, д, J=6,2 Гц), 7,53 (2H, д, J=8,7 Гц), 7,58 (2H, д, J=8,7 Гц).
Ссылочный пример 20
Получение 2-[N-метил(4-трифторметоксифенил)амино]этанола
Смесь N-метил(4-трифторметоксифенил)амина (4,83 г, 24,24 ммоль), 2-(2-бромэтокси)тетрагидропирана (6,1 г, 29,03 ммоль) и карбоната калия (3,84 г, 27,76 ммоль) в ДМФА (20 мл) перемешивали при 100°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом два раза. Экстракт промывали водой два раза и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением 2-[N-метил(4-трифторметоксифенил)амино]этанола (3,1 г, выход 53%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,96 (3H, с), 3,46 (2H, т, J=5,7 Гц), 3,81 (2H, кв. J=5,7 Гц), 6,74 (2H, д, J=8,7 Гц), 7,08 (2H, д, J=8,7 Гц).
Ссылочный пример 21
Получение 8-(4-трифторметоксифенил)-1,4-диокса-8-азаспиро[4.5]декана
Смесь 1-бром-4-(трифторметокси)бензола (6,3 г, 26,14 ммоль), 1,4-диокса-8-азаспиро[4,5]декана (3,35 мл, 26,14 ммоль), ацетата палладия (60 мг, 0,26 ммоль), (S)-(-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (BINAP) (244 мг, 0,39 ммоль) и трет-бутоксида натрия (3,77 г, 39,23 ммоль) в толуоле (50 мл) перемешивали при 80°С в течение 1 часа. Реакционной смеси давали остыть до комнатной температуры, добавляли этилацетат (50 мл) и полученную смесь затем фильтровали. Фильтрат промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=50/1) с получением 8-(4-трифторметоксифенил)-1,4-диокса-8-азаспиро[4,5]декана (6,54 г, выход 83%) в виде бледно-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,83 (4H, т, J=5,8 Гц), 3,31 (4H, т, J=5,8 Гц), 3,99 (4H, с), 6,90 (2H, д, J=8,8 Гц), 7,09 (2H, д, J=8,8 Гц).
Ссылочный пример 22
Получение 1-(4-трифторметоксифенил)пиперидин-4-она
Смесь 8-(4-трифторметоксифенил)-1,4-диокса-8-азаспиро[4.5]декана (1,23 г, 4,06 ммоль), полученного в ссылочном примере 21, концентрированной хлористоводородной кислоты (5 мл), воды (10 мл) и этанола (30 мл) кипятили с обратным холодильником в течение в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли 10% водный раствор гидроксида и смесь экстрагировали метиленхлоридом. Экстракт промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) с получением 1-(4-трифторметоксифенил)пиперидин-4-она (848 мг, выход 81%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
2,56 (4H, т, J=6,2 Гц), 3,59 (4H, т, J=6,2 Гц), 6,94 (2H, д, J=8,5 Гц), 7,14 (2H, д, J=8,5 Гц).
Ссылочный пример 23
Получение 1-(4-трифторметоксифенил)пиперидин-4-ола
Борогидрид натрия (324 мг, 8,56 ммоль) добавляли к раствору 1-(4-трифторметоксифенил)пиперидин-4-она (1,11 г, 4,28 ммоль), полученного в ссылочном примере 22, в метаноле (30 мл) при охлаждении на бане со льдом и смесь перемешивали в течение 30 минут. К смеси добавляли 10% хлористоводородную кислоту и полученную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) с получением
1-(4-трифторметоксифенил)пиперидин-4-ола (1,08 г, выход 97%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,59-1,76 (2H, м), 1,90-2,06 (2H, м), 2,82-2,98 (2H, м), 3,43-3,57 (2H, м), 3,75-3,91 (1H, м), 6,89 (2H, д, J=7,1 Гц), 7,09 (2H, д, J=7,1 Гц).
Соединения ссылочных примеров 24 и 25 получали способом, подобно описанному в примере 23.
Ссылочный пример 24
1-(4-трифторметилфенил)пиперидин-4-ол
белый порошок, выход 76%
1H-ЯМР (CDCl3) δ м.д.:
1,53-1,71 (2H, м), 1,89-2,04 (2H, м), 2,91-3,11 (2H, м), 3,56-3,71 (2H, м), 3,80-4,00 (1H, м), 6,93 (2H, д, J=8,7 Гц), 7,46 (2H, д, J=8,7 Гц).
Ссылочный пример 25
1-(4-метоксифенил)пиперидин-4-ол
белый порошок, выход 5%
1H-ЯМР (CDCl3) δ м.д.:
1,64-1,79 (2H, м), 1,92-2,08 (2H, м), 2,74-2,88 (2H, м), 3,32-3,47 (2H, м), 3,70-3,85 (4H, м), 6,84 (2H, дд, J=2,4 Гц, 6,8 Гц), 6,93 (2H, дд, J=2,4 Гц, 6,8 Гц).
Ссылочный пример 26
Получение 1-(4-хлорфенил)пиперидин-4-ола
Смесь 8-(4-хлорфенил)-1,4-диокса-8-азаспиро[4,5]декана (2,6 г, 10,25 ммоль), концентрированной хлористоводородной кислоты (12 мл), воды (10 мл) и этанола (50 мл) кипятили с обратным холодильником в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли 10% водный раствор гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток растворяли в метаноле (50 мл) и раствору добавляли борогидрид натрия (388 мг, 10,25 ммоль) при охлаждении на бане со льдом и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли 10% хлористоводородную кислоту и смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали водой и насыщенным раствором соли сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) с получением 1-(4-хлорфенил)пиперидин-4-ола (1,73 г, выход 80%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,55-1,74 (2H, м), 1,89-2,08 (2H, м), 2,79-3,00 (2H, м), 3,43-3,57 (2H, м), 3,75-3,92 (1H, ушир.), 6,89 (2H, д, J=7,1 Гц), 7,09 (2H, д, J=7,1 Гц).
Используя соответствующее исходное вещество, соединение ссылочного пример 27 получали способом, подобно описанному в ссылочном примере 26.
Ссылочный пример 27
1-(4-фторфенил)пиперидин-4-ол
белый порошок, выход 66%
1H-ЯМР (CDCl3) δ м.д.:
1,57-1,79 (2H, м), 1,92-2,08 (2H, м), 2,75-2,92 (2H, м), 3,36-3,50 (2H, м), 3,74-3,89 (1H, м), 6,77-7,00 (4H, м).
Ссылочный пример 28
Получение 4-[4-(трет-бутилдиметилсилокси)пиперидин-1-ил]бензонитрила
Смесь 4-бромбензонитрила (2,76 г, 15,16 ммоль), 4-(трет-бутилдиметилсиокси)пиперидина (2,9 г, 13,79 ммоль), ацетата палладия (62 мг, 0,28 ммоль), (S)-(-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (BINAP) (258 мг, 0,41 ммоль) и трет-бутоксида натрия (1,99 г, 20,68 ммоль) в толуоле (60 мл) перемешивали при 80°С в течение 1 часа. Реакционной смеси давали остыть до комнатной температуры, добавляли этилацетат (60 мл) и смесь фильтровали. Фильтрат промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/метиленхлорид=1/1) с получением 4-[4-(трет-бутилдиметилсилокси)пиперидин-1-ил]бензонитрила (2,8 г, выход 66%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
0,90 (9H, с), 1,50-1,69 (8H, м), 1,73-1,90 (2H, м), 3,18-3,31 (2H, м), 3,50-3,65 (2H, м), 3,90-4,04 (1H, м), 6,85 (2H, д, J=7,0 Гц), 7,47 (2H, д, J=7,0 Гц).
Ссылочный пример 29
Получение 4-(4-гидроксипиперидин-1-ил)бензонитрила
Раствор (1М) тетра-н-бутиламмонийфторида (10,6 мл, 10,2 ммоль) добавляли к смеси 4-[4-(трет-бутилдиметилсилокси)пиперидин-1-ил]бензонитрила (2,8 г, 8,85 ммоль), полученного в ссылочном примере 28, в ТГФ (30 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и смесь экстрагировали этилацетатом два раза. Экстракт промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/2) с получением 4-(4-гидроксипиперидин-1-ил)бензонитрила (1,52 г, выход 85%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,50-1,73 (2H, м), 1,90-2,04 (2H, м), 3,00-3,20 (2H, м), 3,59-3,76 (2H, м), 3,84-4,04 (1H, м), 6,86 (2H, дд, J=2,0 Гц, 7,1 Гц), 7,48 (2H, дд, J=2,0 Гц, 7,1 Гц).
Ссылочный пример 30
Получение этил 1-(4-трифторметилфенил)пиперидин-4-карбоксилата
Используя 4-бромбензотрифторид (3,15 г, 13,99 ммоль) и этилизонипекотат (2,2 г, 13,99 ммоль), этил 1-(4-трифторметилфенил)пиперидин-4-карбоксилат (3,18 г, выход 74%) в виде бледно-коричневого кристаллического порошка получали способом, подобно описанному в ссылочном примере 21.
1H-ЯМР (CDCl3) δ м.д.:
1,27 (3H, т, J=7,2 Гц), 1,71-2,10 (4H, м), 2,41-2,55 (1H, м), 2,82-2,98 (2H, м), 3,65-3,80 (2H, м), 4,16 (2H, кв., J=7,2 Гц), 6,92 (2H, д, J=6,9 Гц), 7,63 (2H, д, J=6,9 Гц).
Ссылочный пример 31
Получение [1-(4-трифторметилфенил)пиперидин-4-ил]метанола
Литийалюминийгидрид (1,58 г, 41,64 ммоль) суспендировали в ТГФ (30 мл), к суспензии добавляли по каплям раствор этил 1-(4-трифторметилфенил)пиперидин-4-карбоксилата, полученного в ссылочном примере 30, (3,18 г, 10,41 ммоль) в ТГФ (10 мл) при охлаждении на бане со льдом в атмосфере азота. Смесь перемешивали в течение 30 минут. Воду и 10% водный раствор гидроксида натрия добавляли к реакционной смеси, которую фильтровали через Целит. Фильтрат экстрагировали этилацетатом два раза. Экстракт промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением [1-(4-трифторметилфенил)пиперидин-4-ил]метанола (2,64 г, выход 98%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,31-1,47 (2H, м), 1,61-1,90 (3H, м), 2,74-2,90 (2H, м), 3,45-3,61 (2H, м), 3,83 (2H, д, J=12,6 Гц), 6,92 (2H, д, J=8,8 Гц), 7,46 (2H, д, J=8,8 Гц).
Ссылочный пример 32
Получение 1-(4-трифторметоксибензил)пиперидин-4-ола
Триацетоксиборогидрид натрия (1,67 г, 7,89 ммоль) добавляли к раствору 4-(трифторметокси)бензальдегида (1 г, 5,26 ммоль) и 4-гидроксипиперидина (798 мг, 7,89 ммоль) в ацетонитриле (2 мл) при охлаждении на бане со льдом, смесь перемешивали в течение 30 минут и затем при комнатной температуре в течение ночи. Реакционную смесь выливали в 7,5% водный раствор бикарбоната натрия и экстрагировали этилацетатом два раза. Экстракт промывали водой и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением 1-(4-трифторметоксибензил)пиперидин-4-ола (1,21 г, выход 84%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,50-1,74 (2H, м), 1,80-1,98 (2H, м), 2,08-2,24 (2H, м), 2,63-2,84 (2H, м), 3,49 (2H, с), 3,61-3,80 (1H, м), 7,15 (2H, д, J=8,5 Гц), 7,34 (2H, д, J=8,5 Гц).
Соединения ссылочных примеров 33 и 34 получали способом, подобно описанному в ссылочном примере 32.
Ссылочный пример 33
1-(4-хлорбензил)пиперидин-4-ол
белый порошок, выход 87%
1H-ЯМР (CDCl3) δ м.д.:
1,48-1,63 (2H, м), 1,76-1,91 (2H, м), 2,04-2,20 (2H, м), 2,61-2,76 (2H, м), 3,45 (2H, с), 3,57-3,72 (1H, м), 7,24 (2H, д, J=8,8 Гц), 7,28 (2H, д, J=8,8 Гц).
Ссылочный пример 34
1-(4-трифторметилбензил)пиперидин-4-ол
белый порошок, выход 83%
1H-ЯМР (CDCl3) δ м.д.:
1,43-1,67 (2H, м), 1,80-1,94 (2H, м), 2,06-2,24 (2H, м), 2,63-2,78 (2H, м), 3,67 (2H, с), 3,61-3,72 (1H, м), 7,44 (2H, д, J=8,0 Гц), 7,57 (2H, д, J=8,0 Гц).
Ссылочный пример 35
Получение трет-бутил(4-бензилпиперазин-1-ил)карбамата
4-Бензилпиперазин-1-иламин (36,03 г, 188 ммоль) растворяли в метаноле (260 мл) и раствор охлаждали на бане со льдом, добавляя к нему по каплям в течение 20 минут раствор ди-трет-бутилдикарбоната (61,66 г, 283 ммоль) в метаноле (100 мл). Смеси давали остыть до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/1). Изопропиловый эфир (IPE) (60 мл) и н-гексан (20 мл) добавляли к полученному твердому веществу и смесь перемешивали и затем фильтровали с получением первичных кристаллов. Фильтрат концентрировали при пониженном давлении, к остатку добавляли изопропиловый эфир (10 мл) и н-гексан (10 мл), смесь перемешивали и затем фильтровали с получением вторичных кристаллов. Полученные кристаллы объединяли и сушили при пониженном давлении с получением трет-бутил(4-бензилпиперазин-1-ил)карбамата (42,22 г, выход 77%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 2,55-2,58 (4H, м), 2,80 (4H, ушир.), 3,51 (2H, с), 5,35 (1H, ушир.), 7,24-7,31 (5H, м).
Ссылочный пример 36
Получение трет-бутилпиперазин-1-илкарбамата
Трет-бутил(4-бензилпиперазин-1-ил)карбамат (42,22 г, 145 ммоль), полученный в ссылочном примере 35, растворяли в этаноле (300 мл). К раствору добавляли 20% гидроксид палладия на углероде (6,0 г) и смесь перемешивали при комнатной температуре при атмосферном давлении водорода в течение 20 минут и затем при 50°С в течение 30 минут. Катализатор удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Полученное при этом твердое вещество промывали IPE, отфильтровывали и сушили при пониженном давлении с получением трет-бутилпиперазин-1-илкарбамата (28,9 г, выход 99%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 2,74-2,77 (4H, м), 2,95-2,99 (4H, м), 5,45 (1H, ушир.).
Ссылочный пример 37
Получение трет-бутил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилата
Трет-бутил 4-гидроксипиперидин-1-карбоксилат (2,22 г, 10,0 ммоль), 4-гидроксибензотрифторид (1,21 г, 7,45 ммоль), три-н-бутилфосфин (2,26 г, 11,2 ммоль) и 1,1'-(азодикарбонил)дипиперидин (2,82 г, 11.2 ммоль) растворяли в бензоле (20 мл) и смесь перемешивали при комнатной температуре в течение 2 дней. К смеси добавляли воду и экстрагировали смесь этилацетатом. Экстракт сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=5/1) с получением трет-бутил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилата (1,13 г, выход 44%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 1,65-1,82 (2H, м), 1,87-1,97 (2H, м), 3,34-3,44 (2H, м), 3,63-3,74 (2H, м), 4,47-4,58 (1H, м), 6,89-6,97 (2H, м), 7,47-7,55 (2H, м).
Ссылочный пример 38
Получение 4-(4-трифторметилфенокси)пиперидина
Трет-бутил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилат (1,13 г, 3,27 ммоль), полученный в ссылочном примере 37, растворяли в метиленхлориде (10 мл). К раствору добавляли по каплям трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и затем остаток опять растворяли в метиленхлориде. Раствор нейтрализовали водным раствором гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 4-(4-трифторметилфенокси)пиперидина (727 мг, выход 91%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,63-1,75 (2H, м), 1,97-2,06 (2H, м), 2,69-2,80 (2H, м), 3,10-3,20 (2H, м), 4,38-4,49 (1H, м), 6,94-6,98 (2H, м), 7,50-7,55 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 39-43 получали способом, подобно описанному в ссылочном примере 38.
Ссылочный пример 39
4-(4-фторфенокси)пиперидин
белый порошок, выход 76%
1H-ЯМР (CDCl3) δ м.д.:
1,61-1,74 (2H, м), 1,96-2,06 (2H, м), 2,50 (1H, ушир.с), 2,70-2,80 (2H, м), 3,11-3,20 (2H, м), 4,23-4,33 (1H, м), 6,80-6,89 (2H, м), 6,91-7,00 (2H, м).
Ссылочный пример 40
4-(3-трифторметилфенокси)пиперидин
белый порошок, выход 48%
1H-ЯМР (CDCl3) δ м.д.:
1,62-1,76 (2H, м), 1,80 (1H, ушир.с), 1,97-2,08 (2H, м), 2,71-2,81 (2H, м), 3,11-3,20 (2H, м), 4,37-4,47 (1H, м), 7,05-7,20 (3H, м), 7,34-7,41 (1H, м).
Ссылочный пример 41
4-(4-трифторметоксифенокси)пиперидин
белый порошок, выход 88%
1H-ЯМР (CDCl3) δ м.д.:
1,59-1,73 (3H, м), 1,97-2,04 (2H, м), 2,68-2,78 (2H, м), 3,10-3,19 (2H, м), 4,29-4,36 (1H, м), 6,85-6,92 (2H, м), 7,10-7,14 (2H, м).
Ссылочный пример 42
4-(4-цианфенокси)пиперидин
белый порошок, выход 83%
1H-ЯМР (CDCl3) δ м.д.:
1,63-1,77 (3H, м), 1,98-2,08 (2H, м), 2,72-2,82 (2H, м), 3,12-3,21 (2H, м), 4,42-4,51 (1H, м), 6,92-6,98 (2H, м), 7,55-7,61 (2H, м).
Ссылочный пример 43
4-(4-хлорфенокси)пиперидин
белый порошок, выход 62%
1H-ЯМР (CDCl3) δ м.д.:
1,50 (1H, ушир.с), 1,56-1,71 (2H, м), 1,94-2,04 (2H, м), 2,66-2,76 (2H, м), 3,08-3,18 (2H, м), 4,25-4,35 (1H, м), 6,80-6,86 (2H, м), 7,18-7,25 (2H, м).
Ссылочный пример 44
Получение 1-этил-5-(3-метил-3-бутенил)-1H-тетразола
Гексановый раствор (1,53M) н-бутиллития (6,5 мл, 9,98 ммоль) добавляли по каплям к раствору 1-этил-5-метил-1H-тетразола (0,80 г, 7,13 ммоль) в ТГФ (15 мл) при перемешивании при -70°C и затем смесь перемешивали в течение 1,5 часов. Раствор 3-хлор-2-метил-1-пропена (0,77 мл, 7,84 ммоль) в ТГФ (5 мл) добавляли к смеси и полученную смесь перемешивали в течение 2 часов. Воду добавляли к реакционной смеси, полученную смесь экстрагировали этилацетатом и экстракт сушили над сульфатом магния и затем концентрировали при пониженном давлении с получением 1-этил-5-(3-метил-3-бутенил)-1H-тетразола (0,95 г, выход 80%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,56 (3H, т, J=7,3 Гц), 1,80 (3H, с), 2,44-2,67 (2H, м), 2,90-3,06 (2H, м), 4,32 (2H, кв. J=7,3 Гц), 4,65-4,77 (1H, м), 4,77-4,87 (1H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 45 и 46 получали способом, подобно описанному в ссылочном примере 44.
Ссылочный пример 45
1-фенил-5-(3-метил-3-бутенил)-1H-тетразол
белый порошок, выход 45%
1H-ЯМР (CDCl3) δ м.д.:
1,67 (3H, с), 2,49 (2H, т, J=8,1 Гц), 3,04 (2H, т, J=8,1 Гц), 4,58-4,65 (1H, м), 4,71-4,77 (1H, м), 7,43-7,47 (2H, м), 7,59-7,62 (3H, м).
Ссылочный пример 46
1-(4-хлорфенил)-5-(3-метил-3-бутенил)-1H-тетразол
белый порошок, выход 55%
1H-ЯМР (CDCl3) δ м.д.:
1,68 (3H, с), 2,50 (2H, т, J=8,1 Гц), 3,03 (2H, т, J=8,1 Гц), 4,58-4,63 (1H, м), 4,71-4,77 (1H, м), 7,38-7,44 (2H, м), 7,56-7,62 (2H, м).
Ссылочный пример 47
Получение 3-(4-метил-4-пентенил)-3H-бензоксазол-2-она
трет-Бутоксид калия (3,5 г, 31,2 ммоль) постепенно добавляли к смеси метилтрифенилфосфонийбромида (11 г, 30,8 ммоль) в ТГФ (100 мл) при охлаждении на бане со льдом и смесь перемешивали в течение 20 минут. К смеси постепенно добавляли по каплям раствор 3-(4-оксопентил)-3H-бензоксазол-2-она (5,6 г, 25,6 ммоль) в ТГФ (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом два раза. Экстракт промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) с получением 3-(4-метил-4-пентенил)-3H-бензоксазол-2-она (3,4 г, выход 61%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,73 (3H, с), 1,84-2,16 (4H, м), 3,83 (2H, т, J=7,3 Гц), 4,75 (2H, д, J=12,7 Гц), 6,97 (1H, д, J=8,2 Гц), 7,02-7,28 (3H, м).
Ссылочный пример 48
Получение 3-(5-метил-5-гексенил)-3H-бензоксазол-2-она
Используя 3-(5-оксогексил)-3H-бензоксазол-2-он (1,4 г, 6 ммоль), 3-(5-метил-5-гексенил)-3H-бензоксазол-2-он (1,1 г, выход 79%) в виде бесцветного масла получали способом, подобно описанному в ссылочном примере 47.
1H-ЯМР (CDCl3) δ м.д.:
1,42-1,60 (2H, м), 1,65-1,83 (5H, м), 2,00-2,16 (2H, м), 3,84 (2H, т, J=6,9 Гц), 4,69 (2H, д, J=11,7 Гц), 6,97 (1H, д, J=7,9 Гц), 7,02-7,23 (3H, м).
Ссылочный пример 49
Получение 5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она
Триэтиламин (3,52 мл, 25,28 ммоль) и 1,1'-карбонилдиимидазол (4,84 г, 29,87 ммоль) добавляли к раствору 4-трифторметоксибензойного гидразида (5,06 г, 22,98 ммоль) в ТГФ (150 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду. Смесь экстрагировали этилацетатом, экстракт сушили над сульфатом магния и затем концентрировали при пониженном давлении с получением 5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (5,34 г, выход 94%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
7,01 (1H, с), 7,47-7,59 (2H, м), 7,86-7,98 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 50-61 получали способом, подобно описанному в ссылочном примере 49.
Ссылочный пример 50
5-(4-трифторметилфенил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 97%
1H-ЯМР (ДМСО-d6) δ м.д.:
7,90 (2H, д, J=8,5 Гц), 7,99 (2H, д, J=8,5 Гц).
Ссылочный пример 51
5-(4-бифенилил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 97%
1H-ЯМР (ДМСО-d6) δ м.д.:
7,35-7,52 (3H, м), 7,68-7,73 (2H, м), 7,76-7,87 (4H, м).
Ссылочный пример 52
5-фенил-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 92%
1H-ЯМР (CDCl3) δ м.д.:
7,40-7,58 (3H, м), 7,77-7,91 (2H, м).
Ссылочный пример 53
5-(4-хлорфенил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 80%
1H-ЯМР (ДМСО-d6) δ м.д.:
7,61 (2H, дд, J=1,9 Гц, 6,6 Гц), 7,80 (2H, дд, J=1,9 Гц, 6,6 Гц).
Ссылочный пример 54
5-(4-фторфенил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 74%
1H-ЯМР (ДМСО-d6) δ м.д.:
7,30-7,49 (2H, м), 7,78-7,92 (2H, м).
Ссылочный пример 55
5-(4-бромфенил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 87%
1H-ЯМР (ДМСО-d6) δ м.д.:
7,65-7,78 (4H, м).
Ссылочный пример 56
5-(4-хлорбензил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 83%
1H-ЯМР (ДМСО-d6) δ м.д.:
3,94 (2H, с), 7,31 (2H, дд, J=2,1 Гц, 6,4 Гц), 7,41 (2H, дд, J=2,1 Гц, 6,4 Гц).
Ссылочный пример 57
5-[2-(4-хлорфенил)этил]-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 78%
1H-ЯМР (ДМСО-d6) δ м.д.:
2,76-3,00 (4H, м), 7,27 (2H, д, J=8,5 Гц), 7,35 (2H, д, J=8,5 Гц), 12,03 (1H, с).
Ссылочный пример 58
5-(4-хлорстирил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 88%
1H-ЯМР (ДМСО-d6) δ м.д.:
6,99 (1H, д, J=16,5 Гц), 7,32 (1H, д, J=16,5 Гц), 7,47 (2H, д, J=8,6 Гц), 7,75 (2H, д, J=8,6 Гц), 12,06 (1H, с).
Ссылочный пример 59
5-(4-хлорфеноксиметил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 68%
1H-ЯМР (ДМСО-d6) δ м.д.:
5,07 (2H, с), 7,07 (2H, д, J=6,8 Гц), 7,37 (2H, д, J=6,8 Гц), 12,41 (1H, ушир.).
Ссылочный пример 60
5-(4-пиридил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 40%
1H-ЯМР (ДМСО-d6) δ м.д.:
7,72 (2H, дд, J=1,6 Гц, 4,6 Гц), 8,76 (2H, дд, J=1,6 Гц, 4,6 Гц), 12,90 (1H, с).
Ссылочный пример 61
5-(2-пиримидил)-3H-[1,3,4]оксадиазол-2-он
белый порошок, выход 70%
1H-ЯМР (ДМСО-d6) δ м.д.:
8,68-8,86 (2H, м), 9,12 (1H, д, J=1,4 Гц), 12,97 (1H, с).
Ссылочный пример 62
Получение трет-бутил (S)-2-(4-трифторметоксифеноксиметил)пирролидин-1-карбоксилата
Смесь 4-(трифторметокси)фенола (2,1 г, 11,8 ммоль), трет-бутил (S)-2-гидроксиметилпирролидин-1-карбоксилата (2 г, 9,8 ммоль), диэтилазодикарбоксилата (2,3 мл, 14,7 ммоль) и трифенилфосфина (3,86 г, 14,7 ммоль) в ТГФ (30 мл) кипятили с обратным холодильником в течение 1 часа. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=10/1) с получением трет-бутил (S)-2-(4-трифторметоксифеноксиметил)пирролидин-1-карбоксилата (2,96 г, выход 65%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 1,78-2,10 (4H, м), 3,27-3,49 (2H, м), 3,73-3,98 (1H, м), 4,04-4,20 (2H, м), 6,90 (2H, дд, J=2,2 Гц, 7,0 Гц), 7,12 (2H, дд, J=2,2 Гц, 7,0 Гц).
Ссылочный пример 63
Получение (S)-2-(4-трифторметоксифеноксиметил)пирролидина
Смесь трет-бутил (S)-2-(4-трифторметоксифеноксиметил)-пирролидин-1-карбоксилата (2,31 г, 6,39 ммоль), полученного в ссылочном примере 62, трифторуксусной кислоты (20 мл) и метиленхлорида (20 мл) перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток нейтрализовали 10% водным раствором гидроксида натрия, смесь экстрагировали метиленхлоридом и экстракт сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением (S)-2-(4-трифторметоксифеноксиметил)пирролидина (1,65 г, выход 99%) в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,45-1,63 (1H, м), 1,65-2,04 (3H, м), 2,70 (1H, ушир.с), 2,88-3,08 (2H, м), 3,43-3,59 (1H, м), 3,78-3,96 (2H, м), 6,88 (2H, дд, J=2,3 Гц, 8,4 Гц), 7,11 (2H, дд, J=2,3 Гц, 8,4 Гц).
Ссылочный пример 64
Получение трет-бутил 3-оксо-4-(4-
трифторметилбензил)пиперазин-1-карбоксилата
Гидрид натрия (840 мг, 24,5 ммоль) постепенно добавляли к раствору трет-бутил 3-оксопиперазин-1-карбоксилата (4,1 г, 20,4 ммоль) в ДМФА (30 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 30 минут. Раствор 4-трифторметилбензилхлорида (5 г, 20,9 ммоль) в ДМФА (5 мл) добавляли по каплям к смеси при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом два раза. Экстракт промывали водой два раза и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид) с получением трет-бутил 3-оксо-4-(4-трифторметилбензил)пиперазин-1-карбоксилата (6,7 г, выход 91%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 3,27 (2H, т, J=5,7 Гц), 3,62 (2H, т, J=5,7 Гц), 4,18 (2H, с), 4,67 (2H, с), 7,39 (2H, д, J=8,1 Гц), 7,61 (2H, д, J=8,1 Гц).
Ссылочный пример 65
Получение 1-(4-трифторметилбензил)пиперазин-2-она
Используя трет-бутил 3-оксо-4-(4-трифторметилбензил)пиперазин-1-карбоксилат (6,7 г, 18,7 ммоль), полученный в ссылочном примере 64, 1-(4-трифторметилбензил)пиперазин-2-он (4,5 г, выход 93%) в виде бледно-желтого порошка получали способом, подобно описанному в ссылочном примере 63.
1H-ЯМР (CDCl3) δ м.д.:
3,06 (2H, т, J=5,2 Гц), 3,24 (2H, т, J=5,2 Гц), 3,62 (2H, с), 4,60 (2H, с), 7,39 (2H, д, J=8,1 Гц), 7,59 (2H, д, J=8,1 Гц).
Ссылочный пример 66
Получение 4'-трифторметоксибифенил-4-карбальдегида
Смесь 1-бром-4-(трифторметокси)бензола (1,53 г, 6,35 ммоль), 4-формилбензолбороновой кислоты (1 г, 6,67 ммоль), тетракис(трифенилфосфин)палладия (147 мг, 0,13 ммоль) и фосфата калия (2,02 г, 9,53 ммоль) в ДМФА (10 мл) перемешивали при 100°С в течение 5 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом и экстракт промывали водой три раза и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/метиленхлорид=3/1) с получением 4'-трифторметоксибифенил-4-карбальдегида (1,56 г, выход 92%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
7,33 (2H, д, J=8,8 Гц), 7,60-7,80 (4H, м), 7,97 (2H, д, J=8,2 Гц), 10,07 (1H, с).
Соединения ссылочных примеров 67-73 получали из соответствующего иодбензола или бромбензола и формилбензолбороновых кислот способом, подобно описанному в ссылочном примере 66.
Ссылочный пример 67
4'-трифторметилбифенил-4-карбальдегид
бесцветный кристаллический порошок, выход 27%
1H-ЯМР (CDCl3) δ м.д.:
7,68-7,81 (6H, м), 7,99 (2H, дд, J=1,7 Гц, 6,5 Гц), 10,09 (1H, с).
Ссылочный пример 68
4'-трифторметилбифенил-3-карбальдегид
желтое масло, выход 83%
1H-ЯМР (CDCl3) δ м.д.:
7,33 (2H, д, J=8,8 Гц), 7,60-7,80 (4H, м), 7,97 (2H, д, J=8,2 Гц), 10,07 (1H, с).
Ссылочный пример 69
4'-диметиламинобифенил-4-карбальдегид
желтый порошок, выход 46%
1H-ЯМР (CDCl3) δ м.д.:
3,03 (6H, с), 6,81 (2H, дд, J=2,1 Гц, 6,8 Гц), 7,58 (2H, дд, J=2,1 Гц, 6,8 Гц), 7,71 (2H, дд, J=1,8 Гц, 6,6 Гц), 7,90 (2H, дд, J=1,8 Гц, 6,6 Гц), 10,00 (1H, с).
Ссылочный пример 70
4'-хлорбифенил-4-карбальдегид
бледно-желтый кристаллический порошок, выход 47%
1H-ЯМР (CDCl3) δ м.д.:
7,45 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,73 (2H, д, J=8,4 Гц), 7,96 (2H, д, J=8,4 Гц), 10,06 (1H, с).
Ссылочный пример 71
2'-хлорбифенил-4-карбальдегид
бесцветный кристаллический порошок, выход 46%
1H-ЯМР (CDCl3) δ м.д.:
7,30-7,40 (3H, м), 7,38-7,58 (1H, м), 7,63 (2H, д, J=8,1 Гц), 7,96 (2H, д, J=8,1 Гц), 10,08 (1H, с).
Ссылочный пример 72
3',4'-дихлорбифенил-4-карбальдегид
бесцветный кристаллический порошок, выход 24%
1H-ЯМР (CDCl3) δ м.д.:
7,46 (1H, дд, J=2,1 Гц, 8,4 Гц), 7,56 (1H, д, J=8,4 Гц), 7,70-7,80 (3H, м), 7,97 (2H, дд, J=1,8 Гц, 6,6 Гц), 10,07 (1H, с).
Ссылочный пример 73
4'-метоксибифенил-4-карбальдегид
бесцветный кристаллический порошок, выход 45%
1H-ЯМР (CDCl3) δ м.д.:
3,87 (3H, с), 7,01 (2H, д, J=6,8 Гц), 7,59 (2H, д, J=6,8 Гц), 7,72 (2H, д, J=8,3 Гц), 7,93 (2H, д, J=8,3 Гц), 10,04 (1H, с).
Ссылочный пример 74
Получение 4-(пиридин-3-ил)бензальдегида
Смесь 4-бромбензальдегида (2 г, 10,8 ммоль), диэтил(3-пиридил)борана (1,75 г, 11,9 ммоль), тетракис(трифенилфосфин)палладия (375 мг, 0,32 ммоль) и 2 н. водного раствора карбоната натрия (10,8 мл, 21,6 ммоль) в толуоле (40 мл) кипятили с обратным холодильником в атмосфере азота в течение ночи. Реакционной смеси давали остыть до комнатной температуры и разбавляли этилацетатом. Смесь промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением 4-(пиридин-3-ил)бензальдегида (1,43 г, выход 72%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
7,33-7,50 (1H, м), 7,76 (2H, дд, J=1,8 Гц, 6,6 Гц), 7,89-8,06 (3H, м), 8,56-8,69 (1H, м), 8,90 (1H, дд, J=0,7 Гц, 1,7 Гц), 10,09 (1H, с).
Ссылочный пример 75
Получение 4-(имидазол-1-ил)бензальдегида
Смесь 4-фторбензальдегида (4,96 г, 40 ммоль), имидазол (2,86 г, 42 ммоль) и карбоната калия (6,08 г, 44 ммоль) в ДМСО (40 мл) перемешивали при 110°C в течение ночи. Реакционной смеси давали остыть до комнатной температуры и выливали в ледяную воду (100 мл). Полученные осадки отфильтровывали, промывали водой и затем этилацетатом с получением 4-(имидазол-1-ил)бензальдегида (2,33 г, выход 34%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
7,20-7,30 (1H, м), 7,38 (1H, дд, J=1,3 Гц, 1,4 Гц), 7,58 (2H, дд, J=1,8 Гц, 6,8 Гц), 7,98-8,10 (3H, м), 10,05 (1H, с).
Используя соответствующее исходное вещество, соединение ссылочного примера 76 получали способом, подобно описанному в ссылочном примере 75.
Ссылочный пример 76
4-(пиперидин-1-ил)бензальдегид
желтый кристаллический порошок, выход 46%
1H-ЯМР (CDCl3) δ м.д.:
1,58-1,75 (6H, м), 3,33-3,50 (4H, м), 6,89 (2H, дд, J=1,9 Гц, 7,0 Гц), 7,73 (2H, дд, J=1,9 Гц, 7,0 Гц), 9,75 (1H, с).
Ссылочный пример 77
Получение трет-бутил 4-(4-трифторметилфенил)пиперазин-1-карбоксилата
Смесь 4-бромбензотрифторида (3,0 г, 13,3 ммоль), трет-бутилпиперазин-1-карбоксилата (2,9 г, 15,3 ммоль), бис(дибензилиденацетон)палладия (306 мг, 0,53 ммоль), три-o-толилфосфина (162 мг, 0,53 ммоль) и трет-бутоксида натрия (2,2 г, 22,7 ммоль) в толуоле (60 мл) кипятили с обратным холодильником в атмосфере азота в течение 4 часов. К реакционной смеси добавляли этилацетат и воду, перемешивали смесь некоторое время, нерастворимые вещества удаляли фильтрованием через Целит и фильтрат затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/метиленхлорид=2/1) с получением трет-бутил 4-(4-трифторметилфенил)пиперазин-1-карбоксилата (3,8 г, выход 87%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 3,21-3,26 (4H, м), 3,56-3,61 (4H, м), 6,90-6,93 (2H, м), 7,47-7,51 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 78-84 получали способом, подобно описанному в ссылочном примере 77.
Ссылочный пример 78
трет-бутил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилат
белый порошок, выход 95%
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 3,09-3,13 (4H, м), 3,55-3,60 (4H, м), 6,87-6,91 (2H, м), 7,10-7,14 (2H, м).
Ссылочный пример 79
трет-бутил 4-(4-бифенилил)пиперазин-1-карбоксилат
белый порошок, выход 95%
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 3,16-3,21 (4H, м), 3,58-3,62 (4H, м), 6,97-7,01 (2H, м), 7,27-7,32 (1H, м), 7,37-7,44 (2H, м), 7,50-7,58 (4H, м).
Ссылочный пример 80
трет-бутил 4-(4-диметиламинофенил)пиперазин-1-карбоксилат
белый порошок, выход 79%
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 2,87 (6H, с), 2,96-3,00 (4H, м), 3,54-3,59 (4H, м), 6,72-6,77 (2H, м), 6,87-6,92 (2H, м).
Ссылочный пример 81
трет-бутил 4-(3-пиридил)пиперазин-1-карбоксилат
белый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 3,14-3,19 (4H, м), 3,57-3,62 (4H, м), 7,17-7,19 (2H, м), 8,12-8,14 (1H, м), 8,31-8,33 (1H, м).
Ссылочный пример 82
трет-бутил 4-(4-этоксикарбонилфенил)пиперазин-1-карбоксилат
белый порошок, выход 42%
1H-ЯМР (CDCl3) δ м.д.:
1,37 (3H, т, J=7,1 Гц), 1,48 (9H, с), 3,27-3,32 (4H, м), 3,56-3,60 (4H, м), 4,33 (2H, кв. J=7,1 Гц), 6,84-6,88 (2H, м), 7,92-7,96 (2H, м).
Ссылочный пример 83
трет-бутил 4-(4-метилфенил)пиперазин-1-карбоксилат
белый порошок, выход 55%
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 2,27 (3H, с), 3,04-3,09 (4H, м), 3,55-3,59 (4H, м), 6,82-6,87 (2H, м), 7,06-7,10 (2H, м).
Ссылочный пример 84
трет-бутил 4-(4-цианофенил)пиперазин-1-карбоксилат
белый порошок, выход 86%
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 3,28-3,33 (4H, м), 3,56-3,60 (4H, м), 6,83-6,87 (2H, м), 7,49-7,53 (2H, м).
Ссылочный пример 85
Получение 1-(4-трифторметилфенил)пиперазина
Трет-бутил 4-(4-трифторметилфенил)пиперазин-1-карбоксилат (3,8 г, 11,5 ммоль), полученный в ссылочном примере 77, растворяли в метиленхлориде (40 мл), к раствору добавляли по каплям трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, остаток нейтрализовали насыщенным водным раствором гидрокарбоната натрия и смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 1-(4-трифторметилфенил)пиперазина (2,5 г, выход 96%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
3,01-3,06 (4H, м), 3,21-3,26 (4H, м), 6,92 (2H, д, J=8,6 Гц), 7,48 (2H, д, J=8,6 Гц).
Используя соответствующие исходные вещества, соединения ссылочных примеров 86-89 получали способом, подобно описанному в ссылочном примере 85.
Ссылочный пример 86
1-(4-трифторметоксифенил)пиперазин
белый порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,61 (1H, с), 3,00-3,05 (4H, м), 3,10-3,15 (4H, м), 6,85-6,92 (2H, м), 7,08-7,13 (2H, м).
Ссылочный пример 87
1-(4-диметиламинофенил)пиперазин
белый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,60 (1H, ушир.), 2,86 (6H, с), 3,01 (8H, ушир.), 6,71-6,78 (2H, м), 6,87-6,92 (2H, м).
Ссылочный пример 88
1-(3-пиридил)пиперазин
белый порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,09 (1H, с), 3,03-3,09 (4H, м), 3,14-3,20 (4H, м), 7,16-7,18 (2H, м), 8,09-8,11 (1H, м), 8,31 (1H, с).
Ссылочный пример 89
1-(4-этоксикарбонилфенил)пиперазин
белый порошок, выход 95%
1H-ЯМР (CDCl3) δ м.д.:
1,37 (3H, т, J=7,1 Гц), 1,84 (1H, с), 3,00-3,04, (4H, м), 3,26-3,31 (4H, м), 4,33 (2H, кв. J=7,1 Гц), 6,83-6,89 (2H, м), 7,89-7,96 (2H, м).
Ссылочный пример 90
Получение трет-бутил 4-(пиперазин-1-ил)бензоата
Смесь трет-бутил 4-бромбензоата (4,8 г, 18,8 ммоль), пиперазина (9,7 г, 0,11 моль), ацетата палладия (85 мг, 0,38 ммоль), (S)-(-)-BINAP (352 мг, 0,57 ммоль) и трет-бутоксида натрия (2,7 г, 28,2 ммоль) в толуоле (50 мл) кипятили с обратным холодильником в атмосфере азота в течение 2 часов. К реакционной смеси добавляли этилацетат и воду, нерастворимые вещества удаляли фильтрованием через Целит и фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=5/1) с получением трет-бутил 4-(пиперазин-1-ил)бензоата (3,8 г, выход 77%) в виде серого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,57 (9H, с), 3,00-3,04 (4H, м), 3,24-3,29 (4H, м), 6,83-6,87 (2H, м), 7,85-7,89 (2H, м).
Ссылочный пример 91
Получение 4-трифторметоксибензилпиперазин-1-карбоксилата
К раствору 4-трифторметоксибензилового спирта (25 г, 130,11 ммоль) и фенилхлорформиата (20,37 г, 130,11 ммоль) в этилацетате (125 мл) добавляли по каплям раствор пиридина (11,6 мл, 143,12 ммоль) в этилацетате (50 мл) ниже 15°C в течение 35 минут. Смесь перемешивали 30 минут. Реакционную смесь промывали водой, 3 н. хлористоводородной кислотой, 10% водным раствором карбоната калия и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением карбоната в виде бесцветного масла. К раствору пиперазина (33,62 г, 390,34 ммоль) в метаноле (125 мл) добавляли по каплям раствор карбоната в этилацетате (50 мл) ниже 10°C в течение 25 минут. Полученную смесь перемешивали в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением 4-трифторметоксибензилпиперазин-1-карбоксилата (35,33 г, выход 89%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
2,57-2,96 (4H, м), 3,42-3,63 (4H, м), 5,13 (2H, с), 7,21 (2H, д, J=8,5 Гц), 7,39 (2H, д, J=8,5 Гц).
Ссылочный пример 92
Получение 3-(4-трифторметилфенил)-2-пропенилпиперазин-1-карбоксилата
Раствор пиридина (0,5 мл, 6,18 ммоль) в этилацетате (2 мл) постепенно добавляли по каплям к раствору 3-(4-трифторметилфенил)-2-пропен-1-ола (1 г, 4,95 ммоль) и фенилхлорформиата (0,72 мл, 5,69 ммоль) в этилацетате (5 мл) при охлаждении на бане со льдом. Смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой, 3 н. хлористоводородной кислотой, 10% водным раствором карбоната калия и насыщенным раствором соли в указанном порядке и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением карбоната в виде бесцветного масла. К раствору пиперазина (1,28 г, 14,84 ммоль) в метаноле (5 мл) постепенно добавляли по каплям при охлаждении на бане со льдом раствор карбоната в этилацетате (5 мл). Смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением
3-(4-трифторметилфенил)-2-пропенилпиперазин-1-карбоксилата (1,4 г, выход 90%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
2,75-2,95 (4H, м), 3,43-3,57 (4H, м), 4,78 (2H, дд, J=1,2 Гц, 6,0 Гц), 6,33-6,43 (1H, м), 6,66 (1H, д, 16,0 Гц), 7,48 (2H, д, J=8,4 Гц), 7,57 (2H, д, J=8,4 Гц).
Используя соответствующее исходное вещество, соединение ссылочного примера 93 получали способом, подобно описанному в ссылочном примере 92.
Ссылочный пример 93
3-(4-Трифторметоксифенил)-2-пропенилпиперазин-1-карбоксилат
бесцветное масло, выход 90%
1H-ЯМР (CDCl3) δ м.д.:
2,75-2,88 (4H, м), 3,44-3,52 (4H, м), 4,75 (2H, дд, J=1,3 Гц, 6,2 Гц), 6,29 (1H, дт, J=6,2 Гц, 15,9 Гц), 6,62 (1H, д, J=15,9 Гц), 7,15-7,18 (2H, м), 7,38-7,42 (2H, м).
Ссылочный пример 94
Получение 4-(4-хлорфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорида
Смесь гидрохлорида 4-(4-хлорфенил)-1,2,3,6-тетрагидропиридина (1 г, 4,3 ммоль), пиридина (680 мг, 8,6 ммоль) и трифосгена (430 мг, 1,45 ммоль) в толуоле (20 мл) кипятили с обратным холодильником в течение 3 часов. Реакционной смеси давали остыть до комнатной температуры и разбавляли диэтиловым эфиром. Смесь промывали 10% хлористоводородной кислотой, водой и насыщенным раствором соли в указанном порядке и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 4-(4-хлорфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорида (1 г, выход 90%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,51-2,72 (2H, м), 3,81-4,00 (2H, м), 4,26-4,40 (2H, м), 5,93-6,09 (1H, м), 7,16-7,35 (4H, м).
Ссылочный пример 95
Получение 1-бензил-4-(4-трифторметилфенил)пиперидин-4-ола
4-Бромбензотрифторид (1 г, 4,44 ммоль) растворяли в ТГФ (15 мл), к раствору добавляли по каплям гексановый раствор (1,5M) н-бутиллития (3,1 мл, 4,67 ммоль) при 70°C. Затем к смеси добавляли по каплям раствор 1-бензил-4-пиперидона в ТГФ (15 мл), полученную смесь перемешивали в течение 2 часов и затем при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=2/1) с получением 1-бензил-4-(4-трифторметилфенил)пиперидин-4-ола (692 мг, выход 46%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,60-1,78 (2H, м), 2,07-2,25 (2H, м), 2,38-2,54 (2H, м), 2,74-2,87 (2H, м), 3,59 (2H, с), 7,20-7,38 (5H, м), 7,51-7,67 (4H, м).
Ссылочный пример 96
Получение 1-бензил-4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридина
Смесь 1-бензил-4-(4-трифторметилфенил)пиперидин-4-ола (692 мг, 2,06 ммоль), полученного в ссылочном примере 95, концентрированной хлористоводородной кислоты (4,5 мл) и уксусной кислоты (10 мл) кипятили с обратным холодильником в течение ночи. Реакционной смеси давали остыть до комнатной температуры и разбавляли метиленхлоридом. Смесь промывали водой, 10% водным раствором гидроксида натрия и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=4/1) с получением 1-бензил-4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридина (528 мг, выход 80%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,50-2,60 (2H, м), 2,62-2,76 (2H, м), 3,11-3,22 (2H, м), 3,65 (2H, с), 6,10-6,20 (1H, м), 7,20-7,54 (9H, м).
Ссылочный пример 97
Получение гидрохлорида 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридина
1-Бензил-4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин (2 г, 6,3 ммоль), полученный в ссылочном примере 96, растворяли в метиленхлориде (20 мл), к раствору добавляли по каплям 2-хлорэтилхлорформиат (1,67 г, 11,68 ммоль) в атмосфере азота при охлаждении на бане со льдом и смесь перемешивали при той же температуре в течение 3 часов. К смеси добавляли метанол (20 мл) и кипятили с обратным холодильником в течение 1 часа. Реакционной смеси давали остыть до комнатной температуры, добавляли диэтиловый эфир и полученные осадки отфильтровывали с получением гидрохлорида 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридина (1,44 г, выход 87%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,64-2,80 (2H, м), 3,18-3,34 (2H, м), 3,68-3,80 (2H, м), 6,25-6,39 (1H, м), 7,61-7,80 (4H, м).
Ссылочный пример 98
Получение 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорида
Используя гидрохлорид 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридина (300 мг, 1,14 ммоль), полученный в ссылочном примере 97, пиридин (0,18 мл, 2,28 ммоль) и трифосген (112 мг, 0,38 ммоль), 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорид (220 мг, выход 67%) в виде желтого масла получали способом, подобно описанному в ссылочном примере 94.
1H-ЯМР (CDCl3) δ м.д.:
2,57-2,75 (2H, м), 3,82-4,00 (2H, м), 4,25-4,40 (2H, м), 6,05-6,16 (1H, м), 7,47 (2H, д, J=8,2 Гц), 7,59 (2H, д, J=8,2 Гц).
Ссылочный пример 99
Получение гидрохлорида 4-(4-хлорфенил)пиперидина
Смесь гидрохлорида 4-(4-хлорфенил)-1,2,3,6-тетрагидропиридина (2 г, 8,7 ммоль) и оксида платины (100 мг) в этаноле (100 мл) перемешивали при комнатной температуре при атмосферном давлении водорода. Реакционную смесь фильтровали через Целит и фильтрат концентрировали при пониженном давлении. Осадки, полученные при обработке остатка диэтиловым эфиром, отфильтровывали с получением гидрохлорида 4-(4-хлорфенил)пиперидина (1,9 г, выход 94%) в виде бледно-серого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,75-1,95 (4H, м), 2,74-3,05 (3H, м), 3,25-3,44 (2H, м), 7,25 (2H, д, J=8,5 Гц), 7,38 (2H, д, J=8,5 Гц).
Ссылочный пример 100
Получение 4-(4-трифторметилфенил)пиперидина
Смесь 1-бензил-4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридина (528 мг, 1,66 ммоль), полученного в ссылочном примере 96, и 10% палладия на углероде (50 мг) в уксусной кислоте (5 мл) перемешивали при комнатной температуре при атмосферном давлении водорода. Реакционную смесь фильтровали через Целит и фильтрат концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде и смесь промывали водой, 10% водным раствором гидроксида натрия и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением 4-(4-трифторметилфенил)пиперидина (400 мг, количественный) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,72-2,00 (4H, м), 2,61-2,84 (3H, м), 3,07-3,27 (2H, м), 7,32 (2H, д, J=8,2 Гц), 7,56 (2H, д, J=8,2 Гц).
Ссылочный пример 101
Получение 4-(4-трифторметилфенил)пиперидин-1-карбонилхлорида
Используя 4-(4-трифторметилфенил)пиперидин (760 мг, 3,32 ммоль), полученный в ссылочном примере 100, 4-(4-трифторметилфенил)пиперидин-1-карбонилхлорид (неочищенный продукт) в виде бледно-коричневого масла получали способом, подобно описанному в ссылочном примере 94.
1H-ЯМР (CDCl3) δ м.д.:
1,65-1,84 (2H, м), 1,86-2,02 (2H, м), 2,77-3,28 (3H, м), 4,42-4,60 (2H, м), 7,32 (2H, д, J=8,1 Гц), 7,59 (2H, д, J=8,1 Гц).
Ссылочный пример 102
Получение 2-[3-(4-трифторметилфенил)-2-пропенил]фталимида
4-(Трифторметил)циннамиловый спирт (3 г, 14,84 ммоль) растворяли в ТГФ (60 мл) и к раствору добавляли фталимид (2,84 г, 19,29 ммоль) и трифенилфосфин (5,84 г, 22,26 ммоль), затем к полученной смеси постепенно добавляли по каплям раствор диэтилазодикарбоксилата (3,87 г, 22,26 ммоль) в ТГФ (20 мл). Смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/метиленхлорид=1/1) с получением
2-[3-(4-трифторметилфенил)-2-пропенил]фталимида (4,57 г, выход 93%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
4,47 (2H, дд, J=1,2 Гц, 6,3 Гц), 6,27-6,41 (1H, м), 6,68 (1H, д, J=15,9 Гц), 7,44 (2H, д, J=8,4 Гц), 7,54 (2H, д, J=8,4 Гц), 7,74 (2H, дд, J=2,0 Гц, 7,0 Гц), 7,85 (2H, дд, J=2,0 Гц, 7,0 Гц).
Ссылочный пример 103
Получение 3-(4-трифторметилфенил)-2-пропениламина
Смесь 2-[3-(4-трифторметилфенил)-2-пропенил]фталимида (4,57 г, 13,79 ммоль), полученного в ссылочном примере 102, и гидрата гидразина (897 мг, 17,93 ммоль) в этаноле (80 мл) кипятили с обратным холодильником в течение 3 часов. Реакционной смеси давали остыть до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении. К остатку добавляли этилацетат и полученную смесь промывали 1 н. водным раствором гидроксида натрия и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 3-(4-трифторметилфенил)-2-пропениламина (2,78 г, количественный) в виде бледно-коричневого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
3,51 (2H, д, J=4,7 Гц), 6,31-6,47 (1H, м), 6,55 (1H, д, J=16,0 Гц), 7,45 (2H, д, J=8,3 Гц), 7,55 (2H, д, J=8,3 Гц).
Ссылочный пример 104
Получение пиперазин-1-ил(5-хлорбензофуран-2-илметилен)амина
1-Аминопиперазин (29 г, 287 ммоль) растворяли в изопропиловом спирте (173 мл), к полученному раствору добавляли 5-хлорбензофуран-2-альдегид (34,52 г, 191 ммоль) и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем с получением пиперазин-1-ил(5-хлорбензофуран-2-илметилен)амина (49,49 г, выход 98%) в виде желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,95-3,10 (4H, м), 3,17-3,29 (4H, м), 6,70 (1H, с), 7,20 (1H, дд, J=2,1 Гц, 8,7 Гц), 7,38-7,52 (3H, м).
Ссылочный пример 105
Получение пиперазин-1-ил(4-трифторметилбензилиден)амина
Трет-бутилпиперазин-1-илкарбамат (403 мг, 2,0 ммоль) суспендировали в метиленхлориде (4 мл), к полученной суспензии добавляли трифторуксусную кислоту (1,6 мл) и смесь перемешивали при комнатной температуре в течение 5 минут. Добавляли к смеси 4-(трифторметил)бензальдегид (0,3 мл, 2,2 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=9/1) с получением пиперазин-1-ил(4-трифторметилбензилиден)амина (432 мг, выход 84%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
3,00-3,29 (8H, м), 7,43-7,62 (3H, м), 7,68 (2H, д, J=8,2 Гц).
Ссылочный пример 106
Получение пиперазин-1-ил(4-трифторметоксибензилиден)амина
К раствору 4-бензилпиперазин-1-иламина (43,18 г, 225 ммоль) в этаноле (400 мл) добавляли суспензию 20% гидроксида палладия на углероде (6,50 г) в этаноле (30 мл) и смесь перемешивали при комнатной температуре при атмосферном давлении водорода в течение 3 часов и затем при 50°С в течение 2 часов. Реакционную смесь фильтровали через Целит, 4-(трифторметокси)бензальдегид (42,92 г, 225 ммоль) добавляли к фильтрату и смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением пиперазин-1-ил(4-трифторметоксибензилиден)амина (56,88 г, выход 93%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
3,00-3,23 (8H, м), 7,18 (2H, д, J=8,7 Гц), 7,58 (1H, с), 7,62 (2H, д, J=8,7 Гц).
Используя соответствующее исходное вещество, соединение ссылочного примера 107 получали способом, подобно описанному в ссылочном примере 106.
Ссылочный пример 107
пиперазин-1-ил(5-трифторметилбензофуран-2-илметилен)амин
бледно-желтый кристаллический порошок, выход 77%
1H-ЯМР (CDCl3) δ м.д.:
3,00-3,14 (4H, м), 3,23-3,32 (4H, м), 6,79 (1H, с), 7,41-7,59 (3H, м), 7,82 (1H, с).
Ссылочный пример 108
Получение (4-бензилпиперазин-1-ил)-(4-трифторметилфенил)амина
Смесь 4-бромбензотрифторида (3,00 г, 13,3 ммоль), 4-бензилпиперазин-1-иламина (3,06 г, 16,0 ммоль), ацетата палладия (60 мг, 0,267 ммоль), (S)-(-)-BINAP (174 мг, 0,280 ммоль) и трет-бутоксида натрия (1,92 г, 20,0 ммоль) в толуоле (60 мл) кипятили с обратным холодильником в атмосфере азота в течение 7 часов. Воду добавляли к реакционной смеси и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток затем очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=4/1) с получением (4-бензилпиперазин-1-ил)-(4-трифторметилфенил)амина (2,666 г, выход 59%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,58 (4H, ушир.), 2,76 (4H, ушир.), 3,55 (2H, с), 4,65 (1H, ушир.), 6,90 (2H, д, J=8,6 Гц), 7,23-7,35 (5H, м), 7,41 (2H, д, J=8,6 Гц).
Ссылочный пример 109
Получение пиперазин-1-ил(4-трифторметилфенил)амина
Смесь (4-бензилпиперазин-1-ил)-(4-трифторметилфенил)амина, полученного в ссылочном примере 108, и 10% палладия на углероде (0,53 г) в этаноле (50 мл) перемешивали при комнатной температуре при атмосферном давлении водорода в течение 6 часов и затем при 60°С в течение 10 часов. Затем удаляли катализатор фильтрованием через Целит, 10% палладий на углероде (0,53 г) добавляли к фильтрату и смесь перемешивали при 60°C при атмосферном давлении водорода в течение 8 часов. Затем удаляли катализатор фильтрованием через Целит и фильтрат концентрировали при пониженном давлении. Полученное твердое вещество сушили в вакууме с получением пиперазин-1-ил(4-трифторметилфенил)амина (1,76 г, выход 90%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,71 (4H, ушир.), 3,00 (4H, т, J=4,8 Гц), 4,71 (1H, ушир.), 6,92 (2H, д, J=8,5 Гц), 7,42 (2H, д, J=8,5 Гц).
Ссылочный пример 110
Получение трет-бутил 4-(3-фенил-2-пропенилокси)пиперидин-1-карбоксилата
Трет-бутил 4-гидроксипиперидин-1-карбоксилат (0,396 г, 1,97 ммоль) растворяли в ДМФА (5 мл), к полученному раствору добавляли гидрид натрия (0,086 г, 2,16 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Циннамилхлорид (0,300 г, 1,97 ммоль) добавляли к смеси при охлаждении на бане со льдом и полученную смесь перемешивали в течение ночи. Реакционную смесь разбавляли этилацетатом и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=6/1) с получением трет-бутил 4-(3-фенил-2-пропенилокси)пиперидин-1-карбоксилата (0,314 г, выход 50%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 1,48-1,59 (2H, м), 1,81-1,93 (2H, м), 3,01-3,15 (2H, м), 3,50-3,61 (1H, м), 3,74-3,87 (2H, м), 4,19 (2H, д, J=5,9 Гц), 6,29 (1H, ддд, J=5,9 Гц, 5,9 Гц, 15,9 Гц), 6,61 (1H, д, J=15,9 Гц), 7,18-7,43 (5H, м).
Ссылочный пример 111
Получение 4-(3-фенил-2-пропенилокси)пиперидина
Трет-бутил 4-(3-фенил-2-пропенилокси)пиперидин-1-карбоксилат (0,314 г, 0,989 ммоль), полученный в ссылочном примере 110, растворяли в этаноле (10 мл), к полученному раствору добавляли 6 н. водный раствор хлористоводородной кислоты (3 мл, 18 ммоль) и смесь перемешивали при 60°С в течение 1 часа. Реакционную смесь нейтрализовали водным раствором гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток сушили в вакууме с получением 4-(3-фенил-2-пропенилокси)пиперидина (0,198 г, выход 92%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,40-1,57 (2H, м), 1,91-2,02 (2H, м), 2,56-2,70 (2H, м), 3,12 (2H, ддд, J=4,2 Гц, 4,2 Гц, 12,8 Гц), 3,42-3,52 (1H, м), 4,19 (2H, д, J=5,9 Гц), 6,30 (1H, ддд, J=5,9 Гц, 5,9 Гц, 15,9 Гц), 6,57 (1H, д, J=15,9 Гц), 7,20-7,43 (5H, м).
Ссылочный пример 112
Получение трет-бутил 4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин-1-карбоксилата
Трет-бутил 4-гидроксипиперидин-1-карбоксилат (3,58 г, 17,8 ммоль) растворяли в ДМФА (30 мл), к полученному раствору добавляли гидрид натрия (0,71 г, 17,8 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов.
С другой стороны, 4-хлорциннамиловый спирт (3,00 г, 17,8 ммоль) растворяли в метиленхлориде (60 мл), к полученному раствору добавляли по каплям триэтиламин (5 мл, 35,6 ммоль) и метансульфонилхлорид (2,1 мл, 26,7 ммоль) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 1,5 часов. Воду добавляли к смеси, смесь экстрагировали метиленхлоридом и экстракт промывали разбавленным раствором хлористоводородной кислоты, водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в ДМФА (10 мл).
Оба раствора в ДМФА объединяли при охлаждении на бане со льдом и смесь перемешивали в течение ночи. Затем реакционную смесь разбавляли этилацетатом и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=6/1) с получением трет-бутил 4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин-1-карбоксилата (0,759 г, выход 12%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 1,50-1,62 (2H, м), 1,83-1,94 (2H, м), 3,03-3,14 (2H, м), 3,53-3,58 (1H, м), 3,77-3,83 (2H, м), 4,17 (1H, д, J=5,7 Гц), 4,18 (1H, д, J=5,7 Гц), 6,27 (1H, ддд, J=5,7 Гц, 5,7 Гц, 15,9 Гц), 6,57 (1H, д, J=15,9 Гц), 7,20-7,33 (4H, м).
Ссылочный пример 113
Получение 4-[3-(4-хлорфенил)-2-пропенилокси]пиперидина
Используя трет-бутил 4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин-1-карбоксилат (0,350 г, 0,995 ммоль), полученный в ссылочном примере 112, 4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин (0,291 г, количественный) в виде коричневого масла получали способом, подобно описанному в ссылочном примере 111.
1H-ЯМР (CDCl3) δ м.д.:
1,38-1,56 (2H, м), 1,91-2,01 (2H, м), 2,55-2,69 (2H, м), 3,11 (2H, ддд, J=4,0 Гц, 4,0 Гц, 13,0 Гц), 3,39-3,51 (1H, м), 4,18 (2H, д, J=5,8 Гц), 6,28 (1H, ддд, J=5,8 Гц, 5,8 Гц, 15,9 Гц), 6,57 (1H, д, J=15,9 Гц), 7,25-7,35 (4H, м).
Ссылочный пример 114
Получение трет-бутил 4-[3-(4-хлорфенил)пропокси]пиперидин-1-карбоксилата
Смесь трет-бутил 4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин-1-карбоксилата (0,37 г, 1,05 ммоль), полученного в ссылочном примере 112, и оксида платины (37 мг) в этаноле (10 мл) перемешивали при комнатной температуре при атмосферном давлении водорода. Реакционную смесь фильтровали через Целит и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=4/1) с получением трет-бутил 4-[3-(4-хлорфенил)пропокси]пиперидин-1-карбоксилата (0,151 г, выход 40%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,40-1,51 (2H, м), 1,46 (9H, с), 1,77-1,90 (4H, м), 2,67 (2H, т, J=7,9 Гц), 3,02-3,12 (2H, м), 3,38-3,45 (3H, м), 3,73-3,79 (2H, м), 7,11 (2H, д, J=8,4 Гц), 7,24 (1H, д, J=8,4 Гц).
Ссылочный пример 115
Получение 4-[3-(4-хлорфенил)пропокси]пиперидина
Трет-бутил 4-[3-(4-хлорфенил)пропокси]пиперидин-1-карбоксилат (0,151 г, 0,427 ммоль), полученный в ссылочном примере 114, растворяли в метиленхлориде (4 мл), к полученному раствору добавляли трифторуксусную кислоту и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь нейтрализовали водным раствором гидроксида натрия и экстрагировали метиленхлоридом два раза. Экстракты объединяли и промывали насыщенным раствором соли. Органический слой сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток сушили в вакууме с получением 4-[3-(4-хлорфенил)пропокси]пиперидина (0,109 г, выход 92%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,35-1,51 (2H, м), 1,83-1,94 (4H, м), 2,54-2,70 (4H, м), 3,03-3,14 (2H, м), 3,22-3,38 (1H, м), 3,43 (2H, т, J=6,3 Гц), 7,12 (2H, д, J=8,4 Гц), 7,25 (2H, д, J=8,4 Гц).
Ссылочный пример 116
Получение трет-бутил 4-[2-(4-хлорфенил)этокси]пиперидин-1-карбоксилата
(4-Хлорбензил)трифенилхлорид фосфония(1,191 г, 2,81 ммоль) растворяли в ДМСО (20 мл), к полученному раствору добавляли при охлаждении на бане со льдом гидрид натрия (0,118 г, 2,95 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Трет-бутил 4-формилоксипиперидин-1-карбоксилат (0,500 г, 2,34 ммоль) добавляли к смеси и полученную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь разбавляли этилацетатом и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/гексан=9/1) с получением бесцветного масла.
Используя полученное описанным образом масло, трет-бутил 4-[2-(4-хлорфенил)этокси]пиперидин-1-карбоксилат (0,127 г, выход 16%) в виде бесцветного масла получали способом, подобно описанному в ссылочном примере 114.
1H-ЯМР (CDCl3) δ м.д.:
1,40-1,51 (2H, м), 1,45 (9H, с), 1,71-1,79 (2H, м), 2,83 (2H, т, J=6,9 Гц), 3,02-3,13 (2H, м), 3,38-3,44 (1H, м), 3,62-3,75 (4H, м), 7,15 (2H, д, J=8,5 Гц), 7,25 (2H, д, J=8,5 Гц).
Ссылочный пример 117
Получение 4-[2-(4-хлорфенил)этокси]пиперидин
Используя трет-бутил 4-[2-(4-хлорфенил)этокси]пиперидин-1-карбоксилат (0,127 г, 0,374 ммоль), полученный в ссылочном примере 116, 4-[2-(4-хлорфенил)этокси]пиперидин (0,080 г, выход 89%) в виде бесцветного масла получали способом, подобно описанному в ссылочном примере 115.
1H-ЯМР (CDCl3) δ м.д.:
1,37-1,48 (2H, м), 1,84-1,91 (2H, м), 2,53-2,63 (2H, м), 2,83 (2H, т, J=7,0 Гц), 3,01-3,09 (2H, м), 3,25-3,41 (1H, м), 3,64 (2H, т, J=7,0 Гц), 7,15 (2H, д, J=8,4 Гц), 7,25 (2H, д, J=8,4 Гц).
Ссылочный пример 118
Получение 1-(2-нитровинил)-4-трифторметилбензола
4-Трифторметилбензальдегид (3,00 г, 17,2 ммоль) растворяли в нитрометане (10 мл), к полученному раствору добавляли ацетат аммония (1,341 г, 17,4 ммоль) и смесь кипятили с обратным холодильником в течение 2 часов. Воду добавляли к смеси, смесь экстрагировали метиленхлоридом два раза, экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=9/1) с получением 1-(2-нитровинил)-4-трифторметилбензола (1,596 г, выход 43%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
7,58-7,74 (5H, м), 8,02 (1H, д, J=13,8 Гц).
Ссылочный пример 119
Получение 2-(4-трифторметилфенил)этиламина
Литийалюминийгидрид (0,558 г, 14,7 ммоль) суспендировали в ТГФ (10 мл), к полученной суспензии добавляли по каплям при охлаждении на бане со льдом раствор 1-(2-нитровинил)-4-трифторметилбензола (1,596 г, 7,35 ммоль), полученного в ссылочном примере 118, в ТГФ (10 мл) и смесь кипятили с обратным холодильником в течение 2 часов. Метанол медленно добавляли к смеси до тех пор, пока она больше не пенилась. Воду (0,6 мл), 15% водный раствор гидроксида натрия (0,6 мл) и воду (1,8 мл) добавляли в указанном порядке и нерастворимые вещества удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с обработанной амином поверхностью (Fuji Silysia; NH-DM1020, растворитель; метиленхлорид/н-гексан=4/1) с получением 2-(4-трифторметилфенил)этиламин (0,431 г, выход 31%) в виде оранжевого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,81 (2H, т, J=6,9 Гц), 3,03 (2H, т, J=6,9 Гц), 7,32 (2H, д, J=8,0 Гц), 7,56 (2H, д, J=8,0 Гц).
Ссылочный пример 120
Получение трет-бутил-N-(1-бензилпиперидин-4-ил)-N-[2-(4-трифторметилфенил)этил]карбамата
2-(4-Трифторметилфенил)этиламин (0,431 г, 2,28 ммоль), полученный в ссылочном примере 119, и 1-бензил-4-пиперидон (0,517 г, 2,73 ммоль) растворяли в метаноле (15 мл), к полученному раствору добавляли цианборогидрид натрия (0,429 г, 6,83 ммоль) и уксусную кислоту (0,52 мл, 9,11 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в этилацетате. Смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в метаноле (5 мл), к раствору добавляли ди-трет-бутилдикарбонат (0,597 г, 2,74 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом и смесь промывали насыщенным раствором соли. Органический слой сушили над сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) с получением трет-бутил-N-(1-бензилпиперидин-4-ил)-N-[2-(4-трифторметилфенил)этил]карбамата (0,437 г, выход 41%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,55 (9H, с), 1,59-1,73 (4H, м), 1,90-2,10 (2H, м), 2,82-2,96 (4H, м), 3,24-3,28 (2H, м), 3,49 (2H, с), 4,00 (1H, ушир.с), 7,26-7,31 (7H, м), 7,54 (2H, д, J=8,0 Гц).
Ссылочный пример 121
Получение трет-бутил-N-(пиперидин-4-ил)-N-[2-(4-трифторметилфенил)этил]карбамата
Смесь трет-бутил-N-(1-бензилпиперидин-4-ил)-N-[2-(4-трифторметилфенил)этил]карбамата (0,437 г, 0,944 ммоль), полученного в ссылочном примере 120, и 20% гидроксида палладия на углероде (100 мг) в этаноле (20 мл) перемешивали при комнатной температуре при атмосферном давлении водорода. Реакционную смесь фильтровали через Целит и фильтрат концентрировали при пониженном давлении с получением трет-бутил-N-(пиперидин-4-ил)-N-[2-(4-трифторметилфенил)этил]карбамата (0,332 г, выход 94%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 1,51-1,80 (4H, м), 2,62-3,49 (9H, м), 7,28-7,31 (2H, м), 7,54 (2H, д, J=8,0 Гц).
Ссылочный пример 122
Получение трет-бутил 4-(4-трифторметилбензилокси)пиперидин-1-карбоксилата
Трет-бутил 4-гидроксипиперидин-1-карбоксилат (1,88 г, 9,34 ммоль) растворяли в ТГФ (20 мл). К полученному раствору добавляли при охлаждении на бане со льдом гидрид натрия (411 мг, 10,3 ммоль) и смесь перемешивали в течение 1 часа. 4-(Трифторметил)бензилбромид (2,23 г, 9,34 ммоль) добавляли к смеси, которую перемешивали при комнатной температуре в течение 2 часов. Воду добавляли к реакционной смеси и смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 4-(4-трифторметилбензилокси)пиперидин-1-карбоксилата (2,56 г, выход 76%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 1,51-1,67 (2H, м), 1,83-1,91 (2H, м), 3,07-3,18 (2H, м), 3,52-3,63 (1H, м), 3,73-3,83 (2H, м), 4,61 (2H, м), 7,46 (2H, д, J=8,2 Гц), 7,60 (2H, д, J=8,2 Гц).
Используя соответствующее исходное вещество, соединение ссылочного примера 123 получали способом, подобно описанному в ссылочном примере 122.
Ссылочный пример 123
трет-бутил 4-(4-трифторметоксибензилокси)пиперидин-1-карбоксилат
бледно-желтое масло, выход 74%
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 1,51-1,65 (2H, м), 1,82-1,90 (2H, м), 3,06-3,17 (2H, м), 3,52-3,62 (1H, м), 3,73-3,83 (2H, м), 4,54 (2H, с), 7,17-7,20 (2H, м), 7,35-7,38 (2H, м).
Ссылочный пример 124
Получение 4-(4-трифторметилбензилокси)пиперидина
Трет-бутил 4-(4-трифторметилбензилокси)пиперидине-1-карбоксилат (2,56 г, 7,12 ммоль), полученный в ссылочном примере 122, растворяли в метиленхлориде (20 мл), к полученному раствору добавляли по каплям трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток затем растворяли в метиленхлориде. Полученный раствор нейтрализовали водным раствором гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 4-(4-трифторметилбензилокси)пиперидина (1,85 г, выход 99%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,46-1,60 (2H, м), 1,87 (1H, с), 1,93-2,01 (2H, м), 2,58-2,69 (2H, м), 3,07-3,16 (2H, м), 3,43-3,54 (1H, м), 4,61 (2H, с), 7,44-7,48 (2H, м), 7,57-7,61 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 125-128 получали способом, подобно описанному в ссылочном примере 124.
Ссылочный пример 125
4-(4-трифторметоксибензилокси)пиперидин
белый порошок, выход 74%
1H-ЯМР (CDCl3) δ м.д.:
1,45-1,60 (2H, м), 1,92-2,02 (2H, м), 2,11 (1H, с), 2,59-2,70 (2H, м), 3,07-3,17 (2H, м), 3,43-3,54 (1H, м), 4,55 (2H, с), 7,17-7,20 (2H, м), 7,35-7,40 (2H, м).
Ссылочный пример 126
4-(4-хлорбензилокси)пиперидин
белый порошок, выход 94%
1H-ЯМР (CDCl3) δ м.д.:
1,39-1,56 (3H, м), 1,90-1,99 (2H, м), 2,55-2,66 (2H, м), 3,06-3,11 (2H, м), 3,39-3,51 (1H, м), 4,52 (2H, с), 7,25-7,33 (4H, м).
Ссылочный пример 127
4-(3,4-дихлорбензилокси)пиперидин
белый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,45-1,60 (2H, м), 1,91-2,01 (2H, м), 2,19 (1H, с), 2,59-2,70 (2H, м), 3,07-3,16 (2H, м), 3,42-3,52 (1H, м), 4,50 (2H, с), 7,17 (1H, дд, J=1,9 Гц, 8,2 Гц), 7,40 (1H, д, J=8,2 Гц), 7,45 (1H, д, J=1,9 Гц).
Ссылочный пример 128
4-(4-фенилбензилокси)пиперидин
белый порошок, выход 16%
1H-ЯМР (CDCl3) δ м.д.:
1,45-1,60 (2H, м), 1,72 (1H, с), 1,95-2,02 (2H, м), 2,57-2,68 (2H, м), 3,07-3,16 (2H, м), 3,45-3,56 (1H, м), 4,60 (2H, с), 7,25-7,60 (9H, м).
Ссылочный пример 129
Получение (1-бензилпиперидин-4-ил)-(4-трифторметоксифенил)амина
Смесь 1-бром-4-трифторметоксибензола (2,0 г, 8,3 ммоль), 4-амино-1-бензилпиперидина (1,73 г, 9,13 ммоль), ацетата палладия (37 мг, 0,17 ммоль), (R)-(+)-BINAP (155 мг, 0,25 ммоль) и трет-бутоксида натрия (1,2 г, 11,6 ммоль) в толуоле (30 мл) кипятили с обратным холодильником в атмосфере азота в течение 5 часов. К реакционной смеси добавляли этилацетат и воду при перемешивании, нерастворимые вещества удаляли фильтрованием через Целит и фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением (1-бензилпиперидин-4-ил)-(4-трифторметоксифенил)амина (3,0 г, выход 99%) в виде темного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,39-1,55 (2H, м), 1,98-2,05 (2H, м), 2,09-2,20 (2H, м), 2,80-2,89 (2H, м), 3,21-3,28 (1H, м), 3,52 (2H, с), 3,52-3,59 (1H, м), 6,48-6,55 (2H, м), 6,98-7,02 (2H, м), 7,22-7,33 (5H, м).
Ссылочный пример 130
Получение пиперидин-4-ил(4-трифторметоксифенил)амин
Смесь (1-бензилпиперидин-4-ил)-(4-трифторметоксифенил)амина (3,0 г, 8,3 ммоль), полученного в ссылочном примере 129, и каталитического количества 10% палладия на углероде в этаноле (30 мл) кипятили с обратным холодильником при атмосферном давлении водорода в течение 20 часов. Реакционную смесь фильтровали через Целит и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением пиперидин-4-ил(4-трифторметоксифенил)амина (2,02 г, выход 94%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,24-1,39 (2H, м), 2,03-2,08 (2H, м), 2,65-2,77 (2H, м), 3,08-2,16 (2H, м), 3,24-3,41 (1H, м), 3,59 (1H, ушир.), 6,50-6,58 (2H, м), 6,99-7,03 (2H, м).
Ссылочный пример 131
Получение трет-бутил 4-(4-хлорфениламино)пиперидин-1-карбоксилата
Смесь п-бромхлорбензола (1,91 г, 9,99 ммоль), трет-бутил 4-аминопиперидин-1-карбоксилата (2,0 г, 9,99 ммоль), ацетата палладия (45 мг, 0,2 ммоль), (R)-(+)-BINAP (187 мг, 0,3 ммоль) и трет-бутоксида натрия (1,35 г, 14,0 ммоль) в толуоле (20 мл) кипятили с обратным холодильником в атмосфере азота в течение 1 часа. К реакционной смеси добавляли этилацетат и воду при перемешивании, нерастворимые вещества удаляли фильтрованием через Целит и затем фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 4-(4-хлорфениламино)пиперидин-1-карбоксилата (2,67 г, выход 86%) в виде желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,21-1,54 (2H, м) 1,46 (9H, с), 1,99-2,05 (2H, м), 2,85-2,97 (2H, м), 3,37 (1H, ушир.), 3,51 (1H, ушир.), 4,01-4,07 (2H, м), 6,48-6,54 (2H, м), 7,07-7,14 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 132-133 получали способом, подобно описанному в ссылочном примере 131.
Ссылочный пример 132
трет-бутил 4-(4-трифторметилфениламино)пиперидин-1-карбоксилат
желтый порошок, выход 93%
1H-ЯМР (CDCl3) δ м.д.:
1,21-1,58 (2H, м), 1,47 (9H, с), 2,00-2,06 (2H, м), 2,88-2,99 (2H, м), 3,47 (1H, ушир.), 3,88 (1H, ушир.с), 4,03-4,09 (1H, м), 6,56 (2H, д, J=8,6 Гц), 7,39 (2H, д, J=8,6 Гц).
Ссылочный пример 133
трет-бутил 4-(4-цианофениламино)пиперидин-1-карбоксилат
желтый порошок, выход 92%
1H-ЯМР (CDCl3) δ м.д.:
1,26-1,54 (2H, м), 1,47 (9H, с), 1,99-2,05 (2H, м), 2,87-2,99 (2H, м), 3,41-3,53 (1H, ушир.), 4,02-4,14 (3H, м), 6,52-6,58 (2H, м), 7,39-7,45 (2H, м).
Ссылочный пример 134
Получение 4-(4-хлорфениламино)пиперидина
Трет-бутил 4-(4-хлорфениламино)пиперидин-1-карбоксилат (2,67 г, 8,59 ммоль), полученный в ссылочном примере 131, растворяли в метиленхлориде (20 мл), к полученному раствору добавляли по каплям трифторуксусную кислоту (15 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток затем растворяли в метиленхлориде. Полученный раствор нейтрализовали водным раствором гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 4-(4-хлорфениламино)пиперидина в виде бледно-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,22-1,38 (2H, м), 2,02-2,07 (2H, м), 2,65-2,76 (2H, м), 3,08-3,16 (2H, м), 3,25-3,38 (1H, м), 3,50-3,54 (1H, м), 6,48-6,55 (2H, м), 7,06-7,26 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 135-136 получали способом, подобно описанному в ссылочном примере 134.
Ссылочный пример 135
4-(4-трифторметилфениламино)пиперидин
желтый порошок, выход 97%
1H-ЯМР (CDCl3) δ м.д.:
1,26-1,42 (2H, м), 2,04-2,09 (2H, м), 2,67-2,78 (2H, м), 3,09-3,17 (2H, м), 3,34-3,46 (1H, м), 3,86-3,90 (1H, м), 6,59 (2H, д, J=8,6 Гц), 7,38 (2H, д, J=8,6 Гц).
Ссылочный пример 136
4-(4-цианофениламино)пиперидин
желтый порошок, выход 98%
1H-ЯМР (CDCl3) δ м.д.:
1,27-1,45 (2H, м), 2,02-2,07 (2H, м), 2,67-2,78 (2H, м), 3,09-3,17 (2H, м), 3,34-3,46 (1H, м), 4,09-4,13 (1H, м), 6,51-6,57 (2H, м), 7,38-7,44 (2H, м).
Ссылочный пример 137
Получение трет-бутил 4-(толуол-4-сульфонилокси)пиперидин-1-карбоксилата
Трет-бутил 4-гидроксипиперидин-1-карбоксилат (2,22 г, 10,0 ммоль) растворяли в ацетонитриле (40 мл), к полученному раствору добавляли триэтиламин (2,74 мл, 19,7 ммоль) и N,N,N',N'-тетраметил-1,6-диаминогексан (0,57 мл, 2,64 ммоль) и смесь охлаждали на бане со льдом. п-Толуолсульфонилхлорид (2,75 г, 14,4 ммоль) добавляли к полученной смеси, которой давали вернуться к комнатной температуре, и перемешивали в течение ночи. В реакционную смесь выливали воду и смесь экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 4-(толуол-4-сульфонилокси)пиперидин-1-карбоксилата (4,16 г, выход 89%) в виде бледно-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,44 (9H, с), 1,64-1,82 (4H, м), 2,44 (3H, с), 3,19-3,30 (2H, м), 3,54-3,64 (2H, м), 4,63-4,72 (1H, м), 7,31-7,37 (2H, м), 7,78-7,82 (2H, м).
Ссылочный пример 138
Получение трет-бутил 4-(4-трифторметоксифенилсульфанил)пиперидин-1-карбоксилата
4-(Трифторметокси)тиофенол (2,0 г, 10,3 ммоль) растворяли в ТГФ (30 мл) и полученный раствор охлаждали на бане со льдом. Затем к полученной смеси добавляли гидрид натрия (453 мг, 11,3 ммоль) и смесь перемешивали в течение 30 минут. Затем к полученной смеси добавляли трет-бутил 4-(толуол-4-сульфонилокси)пиперидин-1-карбоксилат (3,66 г, 10,3 ммоль), полученный в ссылочном примере 137, полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем кипятили с обратным холодильником в течение 1 часа. Воду добавляли к реакционной смеси и смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилхлорид=20/1) с получением трет-бутил 4-(4-трифторметоксифенилсульфанил)пиперидин-1-карбоксилата (3,12 г, выход 80%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 1,46-1,60 (2H, м), 1,87-1,95 (2H, м), 2,86-2,98 (2H, м), 3,14-3,23 (1H, м), 3,94-4,00 (2H, м), 7,13-7,17 (2H, м), 7,40-7,47 (2H, м).
Ссылочный пример 139
Получение 4-(4-трифторметоксифенилсульфанил)пиперидина
Используя трет-бутил 4-(4-трифторметоксифенилсульфанил)пиперидин-1-карбоксилат, полученный в ссылочном примере 138, 4-(4-трифторметоксифенилсульфанил)пиперидин (выход 92%) в виде бесцветного масла получали способом, подобно описанному в ссылочном примере 134.
1H-ЯМР (CDCl3) δ м.д.:
1,43-1,59 (2H, м), 1,91-1,98 (2H, м), 2,59-2,70 (2H, м), 3,06-3,20 (3H, м), 7,12-7,16 (2H, м), 7,40-7,46 (2H, м).
Ссылочный пример 140
Получение трет-бутил 4-(4-трифторметоксибензил)пиперидин-1-карбоксилата
Трифенил(4-трифторметоксибензил)фосфонийбромид (2,0 г, 3,87 ммоль) растворяли в ДМСО (20 мл), к полученному раствору добавляли гидрид натрия (168 мг, 4,2 ммоль) и смесь перемешивали в течение 30 минут. Трет-бутил 4-оксопиперидин-1-карбоксилат (700 мг, 3,51 ммоль) добавляли к смеси и полученную смесь перемешивали при 60°С в течение 2 часов. Реакционную смесь выливали в воду и экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением бесцветного кристаллического порошка.
Смесь полученного промежуточного соединения и каталитического количества 10% Pd/C в метаноле (30 мл) перемешивали при комнатной температуре при атмосферном давлении водорода в течение 3 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением трет-бутил 4-(4-трифторметоксибензил)пиперидин-1-карбоксилата (1,28 г, выход 60%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,06-1,21 (2H, м), 1,45 (9H, с), 1,57-1,70 (3H, м), 2,52-2,69 (4H, м), 4,08 (2H, ушир.), 7,09-7,17 (4H, м).
Ссылочный пример 141
Получение 4-(4-трифторметоксибензил)пиперидина
Используя трет-бутил 4-(4-трифторметоксибензил)пиперидин-1-карбоксилат, полученный в ссылочном примере 140, 4-(4-трифторметоксибензил)пиперидин получали способом, подобно описанному в ссылочном примере 134.
Бесцветное твердое вещество, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,06-1,22 (2H, м), 1,50 (1H, с), 1,53-1,68 (3H, м), 2,48-2,60 (4H, м), 3,02-3,08 (2H, м), 7,09-7,17 (4H, м).
Ссылочный пример 142
Получение 1-бензил-4-(4-трифторметоксибензилиден)пиперидина
Трифенил(4-трифторметоксибензил)фосфонийбромид (21,6 г, 41,75 ммоль) растворяли в ДМСО (110 мл), к полученному раствору добавляли гидрид натрия (1,82 г, 45,52 ммоль) и смесь перемешивали в течение 30 минут. 1-Бензил-4-пиперидон (7,18 г, 37,96 ммоль) добавляли к смеси и полученную смесь перемешивали при 60°С в течение 2 часов. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) с получением 1-бензил-4-(4-трифторметоксибензилиден)пиперидина (9,75 г, выход 74%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,36-2,55 (8H, м), 3,53 (2H, с), 6,23 (1H, с), 7,11-7,34 (9H, м).
Используя соответствующее исходное вещество, соединение ссылочного примера 143 получали способом, подобно описанному в ссылочном примере 142.
Ссылочный пример 143
1-бензил-4-(4-трифторметилбензилиден)пиперидин
желтое масло, выход 52%
1H-ЯМР (CDCl3) δ м.д.:
2,38-2,57 (8H, м), 3,53 (2H, с), 6,28 (1H, м), 7,24-7,56 (9H, м).
Ссылочный пример 144
Получение 4-(4-трифторметоксибензил)пиперидина (альтернативный способ синтеза соединения ссылочного примера 141)
Смесь 1-бензил-4-(4-трифторметилбензилиден)пиперидина (9,7 г, 27,92 ммоль), полученного в ссылочном примере 142, 6 н. хлористоводородной кислоты (9,3 мл) и 10% палладия на углероде (970 мг) в этаноле (100 мл) перемешивали при 50°C при атмосферном давлении водорода в течение 5 часов. Реакционную смесь фильтровали через Целит и фильтрат концентрировали при пониженном давлении. Воду и 10% водный раствор гидроксида натрия добавляли к остатку и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 4-(4-трифторметоксибензил)пиперидина (6,77 г, выход 94%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,06-1,22 (2H, м), 1,50 (1H, с), 1,53-1,68 (3H, м), 2,48-2,60 (4H, м), 3,02-3,08 (2H, м), 7,09-7,17 (4H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 145 и 146 получали способом, подобно описанному в ссылочном примере 144.
Ссылочный пример 145
4-(4-трифторметилбензил)пиперидин
бесцветный кристаллический порошок, выход 94%
1H-ЯМР (CDCl3) δ м.д.:
1,06-1,29 (2H, м), 1,50-1,69 (4H, м), 2,48-2,60 (4H, м), 3,02-3,09 (2H, м), 7,23-7,29 (2H, м), 7,51-7,54 (2H, м).
Ссылочный пример 146
4-(4-хлорбензил)пиперидин
бесцветный кристаллический порошок, выход 94%
1H-ЯМР (CDCl3) δ м.д.:
1,07-1,21 (2H, м), 1,53-1,82 (4H, м), 2,47-2,59 (4H, м), 3,02-3,08 (2H, м), 7,04-7,08 (2H, м), 7,22-7,27 (2H, м).
Ссылочный пример 147
Получение N-метил-N-метоксиамида 1-бензилпиперидин-4-карбоновой кислоты
Гидрохлорид 1-бензилпиперидин-4-карбоновой кислоты (21 г, 82,3 ммоль) суспендировали в хлороформе, к полученной суспензии добавляли при комнатной температуре ДМФА (1 мл) и тионилхлорид (30 мл) и смесь кипятили с обратным холодильником в течение 2 часов. Смесь концентрировали при пониженном давлении с получением хлорангидрида кислоты.
В другом сосуде растворяли гидрохлорид N,O-диметилгидроксиламина (12 г, 0,12 моль) в смеси ацетон (200 мл)-вода (20 мл), к полученному раствору добавляли карбонат калия (34,12 г, 246, 9 ммоль) и смесь перемешивали при охлаждении на бане со льдом. Раствор предварительно полученного хлорангидрида кислоты в ацетоне (120 мл) добавляли по каплям к полученной смеси, которую перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, добавляли воду и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением N-метил-N-метоксиамида 1-бензилпиперидин-4-карбоновой кислоты (16,8 г, выход 78%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,65-1,92 (4H, м), 1,97-2,07 (2H, м), 2,62-2,68 (1H, м), 2,91-2,96 (2H, м), 3,17 (3H, с), 3,51 (2H, с), 3,69 (3H, с), 7,20-7,32 (5H, м).
Ссылочный пример 148
Получение 1-бензил-4-(4-трифторметоксибензоил)пиперидина
1-Бром-4-трифторметоксибензол (5,3 г, 22,0 ммоль) растворяли в сухом ТГФ (70 мл) в атмосфере азота и полученный раствор охлаждали до 60°C. К раствору добавляли по каплям гексановый раствор (1,6М) н-бутиллития (15 мл, 24,0 ммоль), смеси давали возможность достичь температуры -30°C и перемешивали в течение 1 часа. Полученную смесь опять охлаждали до -60°C, затем добавляли по каплям раствор N-метил-N-метоксиамида 1-бензилпиперидин-4-карбоновой кислоты (4,1 г, 15,6 ммоль), полученного в ссылочном примере 147, в ТГФ (10 мл), смесь перемешивали в течение 1 часа и затем при 0°С в течение 3 часов. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=4/1) с получением 1-бензил-4-(4-трифторметоксибензоил)пиперидина (4,8 г, выход 85%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,80-1,89 (4H, м), 2,04-2,18 (2H, м), 2,94-3,01 (2H, м), 3,15-3,24 (1H, м), 3,55 (2H, с), 7,19-7,34 (7H, м), 7,95-8,01 (2H, м).
Используя соответствующее исходное вещество, соединение ссылочного примера 149 получали способом, подобно описанному в ссылочном примере 148.
Ссылочный пример 149
1-бензил-4-(4-трифторметилбензоил)пиперидин
бледно-желтое масло, выход 66%
1H-ЯМР (CDCl3) δ м.д.:
1,78-1,89 (4H, м), 2,09-2,19 (2H, м), 2,94-3,02 (2H, м), 3,16-3,29 (1H, м), 3,55 (2H, м), 7,26-7,34 (5H, м), 7,70-7,74 (2H, м), 8,00-8,04 (2H, м).
Ссылочный пример 150
Получение 4-(4-трифторметоксибензоил)пиперидина
1-Бензил-4-(4-трифторметоксибензоил)пиперидин (4,8 г, 13,22 ммоль), полученный в ссылочном примере 148, растворяли в метиленхлориде (60 мл) и полученный раствор охлаждали на бане со льдом. К раствору добавляли по каплям 2-хлорэтилхлорформиат (2,9 мл, 26,4 ммоль) и смесь перемешивали при той же температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли метанол (100 мл) и полученную смесь кипятили с обратным холодильником в течение 15 минут. Воду добавляли к реакционной смеси, которую перемешивали в течение 30 минут, и нейтрализовали смесь водным раствором гидроксида натрия. Смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением 4-(4-трифторметоксибензоил)пиперидина (1,3 г, выход 36%) в виде бледно-оранжевого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,57-1,88 (5H, м), 2,71-2,81 (2H, м), 3,15-3,23 (2H, м), 3,29-3,42 (1H, м), 7,27-7,28 (2H, м), 7,95-8,05 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 151 и 152 получали способом, подобно описанному в ссылочном примере 150.
Ссылочный пример 151
4-(4-трифторметилбензоил)пиперидин
бесцветный кристаллический порошок, выход 68%
1H-ЯМР (CDCl3) δ м.д.:
1,61-1,76 (3H, м), 1,82-1,89 (2H, м), 2,72-2,83 (2H, м), 3,16-3,24 (2H, м), 3,32-3,44 (1H, м), 7,72-7,76 (2H, м), 8,01-8,05 (2H, м).
Ссылочный пример 152
4-(4-хлорбензоил)пиперидин
бесцветный кристаллический порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,60-1,84 (5H, м), 2,72-2,83 (2H, м), 3,16-3,24 (2H, м), 3,30-3,40 (1H, м), 7,41-7,47 (2H, м), 7,85-7,91 (2H, м).
Ссылочный пример 153
Получение N-{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}фталимида
Смесь 1-(4-трифторметилфенил)пиперазина (5,2 г, 22,59 ммоль), N-(2-бромэтил)фталимида (5,22 г, 20,53 ммоль) и карбоната калия (3,36 г, 24,28 ммоль) в ДМФА (30 мл) перемешивали при 100°С в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=50/1), полученное твердое вещество промывали метанолом и затем сушили в вакууме с получением N-{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}фталимида (4,85 г, выход 53%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,64-2,72 (6H, м), 3,18-3,23 (4H, м), 3,86 (2H, т, J=6,4 Гц), 6,89 (2H, д, J=8,7 Гц), 7,45 (2H, д, J=8,7 Гц), 7,70-7,75 (2H, м), 7,81-7,86 (2H, м).
Ссылочный пример 154
Получение 2-[4-(4-трифторметилфенил)пиперазин-1-ил]этиламина
N-{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}фталимид (4 г, 9,92 ммоль), полученный в ссылочном примере 153, суспендировали в этаноле (30 мл), к полученной суспензии добавляли моногидрат гидразина (0,53 мл, 10,91 ммоль) и смесь кипятили с обратным холодильником в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры и полученные осадки отфильтровывали. Их очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=100/1) с получением 2-[4-(4-трифторметилфенил)пиперазин-1-ил]этиламина (2,87 г, выход 100%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,33 (2H, ушир.с), 2,49 (2H, т, J=6,1 Гц), 2,59-2,63 (4H, м), 2,84 (2H, т, J=6,1 Гц), 3,26-3,31 (4H, м), 6,92 (2H, д, J=8,7 Гц), 7,48 (2H, д, J=8,7 Гц).
Ссылочный пример 155
Получение N-{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}формамида
Смесь 2-[4-(4-трифторметилфенил)пиперазин-1-ил]этиламина (906 мг, 3,32 ммоль), полученного в ссылочном примере 154, и этилформиата (10 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением N-{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}формамида (942 мг, выход 94%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,53-2,65 (6H, м), 3,26-3,31 (4H, м), 3,42-3,49 (2H, м), 6,05 (1H, ушир.с), 6,92 (2H, д, J=8,7 Гц), 7,49 (2H, д, J=8,7 Гц), 8,21 (1H, с).
Ссылочный пример 156
Получение N-метил{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}амина
Литийалюминийгидрид (237 мг, 6,25 ммоль) суспендировали в ТГФ (20 мл) и полученную суспензию перемешивали при охлаждении на бане со льдом. Затем к полученной суспензии добавляли по каплям раствор N-{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}формамида (942 мг, 3,13 ммоль), полученного в ссылочном примере 155, в ТГФ (10 мл), смесь перемешивали при комнатной температуре в течение 2 часов и затем кипятили с обратным холодильником в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры, затем осторожно добавляли воду и 15% водный раствор гидроксида натрия. К смеси добавляли сульфат натрия и полученную смесь энергично перемешивали и фильтровали через Целит. Фильтрат концентрировали при пониженном давлении с получением N-метил{2-[4-(4-трифторметилфенил)пиперазин-1-ил]этил}амина (900 мг, выход 100%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,47 (3H, с), 2,52-2,74 (8H, м), 3,26-3,30 (4H, м), 3,71-3,77 (1H, м), 6,91 (2H, д, J=8,7 Гц), 7,47 (2H, д, J=8,7 Гц).
Ссылочный пример 157
Получение трет-бутил 4-(2-метиламиноэтил)пиперазин-1-карбоксилата
Трет-бутил 4-(2-хлорэтил)пиперазин-1-карбоксилат (3,13 г, 12,58 ммоль) растворяли в метаноле (20 мл), к полученному раствору добавляли 40% метанольный раствор метиламина (30 мл) и смесь кипятили с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде. Смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении с получением трет-бутил 4-(2-метиламиноэтил)пиперазин-1-карбоксилата (3,0 г, выход 98%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, м), 1,66 (1H, с), 2,36-2,41 (4H, м), 2,45 (3H, с), 2,46-2,53 (2H, м), 2,65-2,70 (2H, м), 3,40-3,44 (4H, м).
Ссылочный пример 158
Получение N-[2-(4-трифторметилфенокси)этил]фталимида
Смесь N-(2-гидроксиэтил)фталимида (3,59 г, 18,75 ммоль), 4-гидроксибензотрифторида (3,04 г, 18,75 ммоль), диэтилазодикарбоксилата (4,37 мл, 28,13 ммоль) и трифенилфосфина (7,38 г, 28,13 ммоль) в ТГФ (50 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=5/1) с получением N-[2-(4-трифторметилфенокси)этил]фталимида (4,05 г, выход 69%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
4,11-4,16 (2H, м), 4,25-4,30 (2H, м), 6,92-6,96 (2H, м), 7,48-7,52 (2H, м), 7,72-7,77 (2H, м), 7,83-7,89 (2H, м).
Ссылочный пример 159
Получение 2-(4-трифторметилфенокси)этиламина
Используя N-[2-(4-трифторметилфенокси)этил]фталимид, полученный в ссылочном примере 158, 2-(4-трифторметилфенокси)этиламин получали способом, подобно описанному в ссылочном примере 154.
бесцветное масло, выход 95%
1H-ЯМР (CDCl3) δ м.д.:
1,36 (2H, с), 3,11 (2H, т, J=5,1 Гц), 4,03 (2H, т, J=5,1 Гц), 6,97 (2H, д, J=8,6 Гц), 7,54 (2H, д, J=8,6 Гц).
Ссылочный пример 160
Получение N-[2-(4-трифторметилфенокси)этил]формамида
Смесь 2-(4-трифторметилфенокси)этиламина (1,38 г, 6,72 ммоль), полученного в ссылочном примере 159, и этилформиата (10 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением N-[2-(4-трифторметилфенокси)этил]формамида (1,51 г, выход 97%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
3,72-3,78 (2H, м), 4,09-4,13 (2H, м), 6,02 (1H, ушир.с), 6,96 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 8,24 (1H, с).
Ссылочный пример 161
Получение N-метил-N-[2-(4-трифторметилфенокси)этил]амина
N-[2-(4-трифторметилфенокси)этил]формамид (2,02 г, 8,66 ммоль), полученный в ссылочном примере 160, растворяли в ТГФ (20 мл). Раствор (1М) в ТГФ комплекса боран-ТГФ (21,7 мл, 21,7 ммоль) добавляли по каплям к полученному раствору при охлаждении на бане со льдом и смесь перемешивали в течение ночи. Реакционную смесь охлаждали, добавляли воду и 6 н. хлористоводородную кислоту и смесь перемешивали в течение 20 минут. Реакционную смесь нейтрализовали водным раствором гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) с получением N-метил-N-[2-(4-трифторметилфенокси)этил]амина (1,05 г, выход 55%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,68 (3H, д, J=5,8 Гц), 3,05-3,28 (2H, м), 4,06 (1H, ушир.), 4,10-4,18 (1H, м), 4,45-4,54 (1H, м), 6,98 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц).
Ссылочный пример 162
Получение N-метил-N-[2-(4-трифторметоксифенокси)этил]амина
1-(2-Бромэтокси)-4-(трифторметокси)бензол (2,2 г, 7,72 ммоль) растворяли в метаноле (20 мл), к полученному раствору добавляли 40% метанольный раствор метиламина (20 мл) и смесь кипятили с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении, остаток растворяли в метиленхлориде и смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении с получением N-метил-N-[2-(4-трифторметоксифенокси)этил]амина (1,44 г, выход 79%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,54 (1H, с), 2,51 (3H, с), 2,97 (2H, т, J=5,1 Гц), 4,06 (2H, т, J=5,1 Гц), 6,85-6,92 (2H, м), 7,10-7,17 (2H, м).
Ссылочный пример 163
Получение N-метил-N-[2-(4-трифторметилфенокси)этил]амина
Используя 1-(2-бромэтокси)-4-(трифторметил)бензол, N-метил-N-[2-(4-трифторметилфенокси)этил]амин получали способом, подобно описанному в ссылочном примере 162.
белый порошок, выход 82%
1H-ЯМР (CDCl3) δ м.д.:
2,68 (3H, д, J=5,8 Гц), 3,02-3,28 (2H, м), 3,92-4,18 (2H, м), 4,41-4,54 (1H, м), 6,98 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц)
Ссылочный пример 164
Получение N,N'-диметил-N-[4-(трифторметил)фенил]-1,2-этилендиамина
Смесь 4-бромбензотрифторида (3,0 г, 13,3 ммоль), N,N'-диметилэтилендиамина (9,4 г, 0,11 моль), ацетата палладия (60 мг, 0,27 ммоль), BINAP (250 мг, 0,40 ммоль) и трет-бутоксида натрия (1,80 г, 18,7 ммоль) в толуоле (20 мл) кипятили с обратным холодильником в атмосфере азота в течение 3 часов. Добавляли к реакционной смеси этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и затем фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением N,N'-диметил-N-[4-(трифторметил)фенил]-1,2-этилендиамина (650 мг, выход 21%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,53 (1H, с), 2,47 (3H, с), 2,82 (2H, т, J=6,7 Гц), 3,02 (3H, с), 3,52 (2H, т, J=6,7 Гц), 6,74 (2H, д, J=8,8 Гц), 7,43 (2H, д, J=8,8 Гц).
Ссылочный пример 165
Получение трет-бутил-N-[1-(4-хлорфенил)пиперидин-4-ил]-N-метилкарбамата
Смесь п-бромхлорбензола (3,13 г, 16,3 ммоль), трет-бутил-(пиперидин-4-ил)-N-метилкарбамата (3,5 г, 10,8 ммоль), ацетата палладия (73 мг, 0,33 ммоль), (S)-(-)-BINAP (305 мг, 0,49 ммоль) и трет-бутоксида натрия (2,2 г, 22,9 ммоль) в толуоле (30 мл) кипятили с обратным холодильником в атмосфере азота в течение 3 часов. Добавляли к реакционной смеси этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) с получением трет-бутил-N-[1-(4-хлорфенил)пиперидин-4-ил]-N-метилкарбамата (4,7 г, выход 89%) в виде желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 1,70-1,90 (4H, м), 2,73-2,82 (2H, м), 2,74 (3H, с), 3,64-3,71 (2H, м), 4,08 (1H, ушир.), 6,81-6,87 (2H, м), 7,15-7,22 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 166-168 получали способом, подобно описанному в ссылочном примере 165.
Ссылочный пример 166
трет-бутил-N-[1-(4-трифторметоксифенил)пиперидин-4-ил]-N-метилкарбамат
выход 88%
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 1,72-1,91 (4H, м), 2,76 (3H, с), 2,79-2,85 (2H, м), 3,67-3,73 (2H, м), 4,10 (1H, ушир.), 6,86-6,93 (2H, м), 7,07-7,11 (2H, м).
Ссылочный пример 167
трет-бутил-N-[1-(4-трифторметилфенил)пиперидин-4-ил]-N-метилкарбамат
выход 91%
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 1,72-1,87 (4H, м), 2,74 (3H, с), 2,82-2,94 (2H, м), 3,83-3,89 (2H, м), 4,12 (1H, ушир.), 6,92 (2H, д, J=8,7 Гц), 7,46 (2H, д, J=8,7 Гц).
Ссылочный пример 168
трет-бутил-N-[1-(4-цианофенил)пиперидин-4-ил]-N-метилкарбамат
выход 73%
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 1,69-1,77 (4H, м), 2,73 (3H, с), 2,87-3,00 (2H, м), 3,89-3,97 (2H, м), 4,16 (1H, ушир.), 6,84-6,89 (2H, м), 7,45-7,51 (2H, м).
Ссылочный пример 169
Получение N-[1-(4-хлорфенил)пиперидин-4-ил]-N-метиламина
Трет-бутил-N-[1-(4-хлорфенил)пиперидин-4-ил]-N-метилкарбамат (4,71 г, 14,5 ммоль), полученный в ссылочном примере 165, растворяли в метиленхлориде (30 мл), к полученному раствору добавляли по каплям трифторуксусную кислоту (20 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и затем остаток растворяли в метиленхлориде. Раствор нейтрализовали водным раствором гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением N-[1-(4-хлорфенил)пиперидин-4-ил]-N-метиламина (3,1 г, выход 95%) в виде бледно-коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
0,99 (1H, с), 1,38-1,54 (2H, м), 1,95-2,00 (2H, м), 2,44-2,54 (1H, м), 2,46 (3H, с), 2,71-2,82 (2H, м), 3,55-3,63 (2H, м), 6,81-6,87 (2H, м), 7,14-7,21 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 170-172 получали способом, подобно описанному в ссылочном примере 169.
Ссылочный пример 170
N-[1-(4-трифторметоксифенил)пиперидин-4-ил]-N-метиламин
бледно-коричневый порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
0,96 (1H, с), 1,39-1,55 (2H, м), 1,96-2,02 (2H, м), 2,44-2,57 (1H, м), 2,47 (3H, с), 2,73-2,84 (2H, м), 3,58-3,66 (2H, м), 6,86-6,92 (2H, м), 7,05-7,10 (2H, м).
Ссылочный пример 171
N-[1-(4-трифторметилфенил)пиперидин-4-ил]-N-метиламин
бледно-коричневый порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
0,96 (1H, с), 1,36-1,52 (2H, м), 1,96-2,02 (2H, м), 2,47 (3H, с), 2,50-2,62 (1H, м), 2,82-2,94 (2H, м), 3,72-3,80 (2H, м), 6,92 (2H, д, J=8,8 Гц), 7,45 (2H, д, J=8,8 Гц).
Ссылочный пример 172
N-[1-(4-цианофенил)пиперидин-4-ил]-N-метиламин
бледно-коричневый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,05 (1H, с), 1,34-1,49 (2H, м), 1,95-2,02 (2H, м), 2,47 (3H, с), 2,55-2,67 (1H, м), 2,90-3,01 (2H, м), 3,76-3,84 (2H, м), 6,82-6,90 (2H, м), 7,43-7,50 (2H, м).
Ссылочный пример 173
Получение бензил-N-(2-метил-2-пропенил)карбамата
2-Металлиламингидрохлорид (21,52 г, 0,2 моль) растворяли в воде (200 мл), к полученному раствору добавляли бензилхлорформиат (37,53 г, 0,22 моль) и смесь охлаждали на бане со льдом. К полученной смеси постепенно добавляли карбонат натрия (46,63 г, 0,44 моль) и смесь перемешивали при комнатной температуре в течение 3 часов. Затем реакционную смесь экстрагировали метиленхлоридом два раза, экстракты объединяли, сушили над сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=7/1) с получением бензил-N-(2-метил-2-пропенил)карбамата (41,58 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,74 (3H, с), 3,75 (2H, д, J=6,2 Гц), 4,69-4,94 (2H, м), 5,13 (2H, с), 7,26-7,39 (5H, м).
Ссылочный пример 174
Получение 4-хлорбензил-N-(2-метил-2-пропенил)карбамата
4-Хлорбензиловый спирт (3,00 г, 21,0 ммоль) и трифосген (3,12 г, 10, 5 ммоль) растворяли в толуоле (15 мл), к полученному раствору добавляли при охлаждении на бане со льдом N-этилдиизопропиламин (3,6 мл, 21,0 ммоль) и смесь перемешивали в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали метиленхлоридом два раза. Экстракты объединяли и сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли раствор 2-металлиламингидрохлорида (2,49 г, 23,1 ммоль) в воде (40 мл), к полученному раствору добавляли при охлаждении на бане со льдом карбонат натрия (5,15 г, 48,6 ммоль) и смесь перемешивали в течение 15 минут. Реакционную смесь экстрагировали метиленхлоридом два раза и экстракты объединяли, сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=10/1) с получением 4-хлорбензил-N-(2-метил-2-пропенил)карбамата (4,06 г, выход 80%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) δ м.д.:
1,74 (3H, с), 3,74 (2H, д, J=5,8 Гц), 4,73-4,91 (2H, м), 5,08 (2H, с), 7,26-7,41 (4H, м).
Ссылочный пример 175
Получение 4-фторбензил-N-(2-метил-2-пропенил)карбамата
4-Фторбензиловый спирт (3,00 г, 23,8 ммоль) растворяли в ТГФ (60 мл), к полученному раствору добавляли при охлаждении на бане со льдом 1,1'-карбонилдиимидазол (4,05 г, 25,0 ммоль) и смесь перемешивали в течение 30 минут. Гидрохлорид 2-металлиламина (2,81 г, 26,2 ммоль) и триэтиламин (3,98 г, 28,5 ммоль) добавляли к смеси, которую перемешивали в течение 2 часов. Затем реакционную смесь концентрировали при пониженном давлении, к остатку добавляли воду и смесь экстрагировали метиленхлоридом два раза. Экстракты объединяли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=10/1) с получением 4-фторбензил-N-(2-метил-2-пропенил)карбамата (4,69 г, выход 88%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,73 (3H, с), 3,74 (2H, д, J=5,8 Гц), 4,55-4,95 (3H, м), 5,08 (2H, с), 6,95-7,14 (2H, м), 7,27-7,41 (2H, м).
Ссылочный пример 176
Получение 3-метоксиметокси-2-метил-1-пропена
Хлорметилметиловый эфир (105 мл, 1386 ммоль) и N-этилдиизопропиламин (265 мл, 1525 ммоль) добавляли при охлаждении на бане со льдом к раствору 2-метил-2-пропен-1-ола (50 г, 693 ммоль) в ТГФ (500 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали, промывали диэтиловым эфиром и фильтрат концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире, промывали водой, насыщенным водным раствором гидрокарбоната натрия, затем водой и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 3-метоксиметокси-2-метил-1-пропена (9,7 г, выход 12%) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) δ м.д.:
1,76 (3H, с), 3,39 (3H, с), 3,97 (2H, с), 4,65 (2H, с), 4,85-4,94 (1H, м), 4,98-5,06 (1H, м).
Ссылочный пример 177
Получение 2-метоксиметоксиметил-2-метилоксирана
м-Хлорпербензойную кислоту (22,7 г, 92 ммоль) постепенно добавляли к раствору 3-метоксиметокси-2-метил-1-пропена (9,7 г, 84 ммоль), полученного в ссылочном примере 176, в метиленхлориде (200 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 6 часов. К реакционной смеси добавляли гидрокарбонат натрия, воду и метиленхлорид и смесь перемешивали в течение некоторого времени. Органический слой отделяли, промывали водным раствором гидрокарбоната натрия, водным раствором тиосульфата натрия, затем водным раствором гидрокарбоната натрия и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 2-метоксиметоксиметил-2-метилоксирана (6,8 г, выход 62%) в виде масла зеленого цвета.
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, С), 2,65 (1H, д, J=4,9 Гц), 2,78 (1H, д, J=4,9 Гц), 3,38 (3H, с), 3,53 (1H, д, J=11,1 Гц), 3,62 (1H, д, J=11,1 Гц), 4,65 (2H, с).
Ссылочный пример 178
Получение трет-бутил 4-(4-хлорбензил)пиперазин-1-карбоксилата
Карбонат калия (1,45 г, 10,47 ммоль) и 4-хлорбензилхлорид (1,82 г, 8,86 ммоль) добавляли к раствору трет-бутилпиперазин-1-карбоксилата (1,5 г, 8,05 ммоль) в ДМФА (10 мл) и смесь перемешивали при 50°С в течение 1 часа. Реакционную смесь разбавляли этилацетатом, смесь промывали водой и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением трет-бутил 4-(4-хлорбензил)пиперазин-1-карбоксилата (2,50 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 2,36 (4H, т, J=5,0 Гц), 3,42 (4H, т, J=5,0 Гц), 3,46 (2H, с), 7,23-7,31 (4H, м).
Ссылочный пример 179
Получение 1-(4-хлорбензил)пиперазина
Трифторуксусную кислоту (8 мл) добавляли к раствору трет-бутил 4-(4-хлорбензил)пиперазин-1-карбоксилата (2,50 г, 8,05 ммоль), полученного в ссылочном примере 178, в метиленхлориде (16 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли водный раствор гидроксида натрия и смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 1-(4-хлорбензил)пиперазина (1,70 г, количественный) в виде бесцветного масла.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,55-2,74 (4H, м), 3,57-3,76 (6H, м), 7,35-7,45 (4H, м), 8,55-8,88 (1H, ушир.).
Ссылочный пример 180
Получение 1-(4-трифторметилбензил)пиперазина
Используя трет-бутил 4-(4-трифторметилбензил)пиперазин-1-карбоксилат, 1-(4-трифторметилбензил)пиперазин получали способом, подобно описанному в ссылочном примере 179.
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,72 (4H, т, J=4,9 Гц), 3,16-3,26 (4H, м), 3,62 (2H, с), 7,44 (2H, д, J=8,1 Гц), 7,59 (2H, д, J=8,1 Гц).
Ссылочный пример 181
Получение 1-(4-трифторметоксибензил)пиперазина
Используя трет-бутил 4-(4-трифторметоксибензил)пиперазин-1-карбоксилат, 1-(4-трифторметоксибензил)пиперазин получали способом, подобно описанному в ссылочном примере 179.
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,70 (4H, т, J=4,9 Гц), 3,19 (4H, т, J=4,9 Гц), 3,56 (2H, с), 7,17 (2H, д, J=7,9 Гц), 7,33 (2H, д, J=7,9 Гц).
Ссылочный пример 182
Получение 4-[4-(4-трифторметоксибензил)пиперазин-1-ил]фенола
4-(4-Гидроксифенил)пиперазин (3 г, 16,8 ммоль) и 4-трифторметоксибензальдегид (3,36 г, 17,7 ммоль) растворяли в метаноле (60 мл) и метиленхлориде (15 мл). Цианборогидрид натрия (1,59 г, 25,3 ммоль) и уксусную кислоту (1,6 мл) добавляли к полученному раствору при охлаждении на бане со льдом и смесь перемешивали в течение 2 часов. Насыщенный водный раствор гидрокарбоната натрия и метиленхлорид добавляли к реакционной смеси и экстрагировали смесь метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением 4-[4-(4-трифторметоксибензил)пиперазин-1-ил]фенола (3,36 г, выход 57%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,59-2,64 (4H, м), 3,05-3,10 (4H, м), 3,56 (2H, с), 4,90-5,40 (1H, ушир.), 6,69-6,75 (2H, м), 6,79-6,85 (2H, м), 7,16 (2H, д, J=8,4 Гц), 7,37 (2H, д, J=8,4 Гц).
Ссылочный пример 183
Получение 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенил)пиперазина
Смесь 1-(4-трифторметоксифенил)пиперазина (4,4 г, 17,8 ммоль), 2-(4-бромфенокси)тетрагидропирана (4,6 г, 17,8 ммоль), ацетата палладия (159 мг, 0,71 ммоль), BINAP (666 мг, 1,07 ммоль) и трет-бутоксида натрия (2,2 г, 23,1 ммоль) в толуоле (40 мл) кипятили с обратным холодильником в атмосфере азота в течение 5 часов. Добавляли к реакционной смеси этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и затем фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=20/1) с получением 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенил)пиперазина (2,7 г, выход 35%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,54-2,05 (6H, м), 3,21-3,34 (8H, м), 3,55-3,64 (1H, м), 3,89-3,99 (1H, м), 5,31-5,34 (1H, м), 6,90-7,03 (6H, м), 7,11-7,16 (2H, м).
Указанное в заголовке соединение также получали способом, описанным в ссылочном примере 185.
Ссылочный пример 184
Получение 1-[4-(тетрагидропиран-2-илокси)фенил]пиперазина
Смесь 2-(4-бромфенокси)тетрагидропирана (7,8 г, 30,3 ммоль), пиперазина (15,7 г, 180 ммоль), ацетата палладия (136 мг, 0,61 ммоль), BINAP (567 мг, 0,91 ммоль) и трет-бутоксида натрия (3,8 г, 39,4 ммоль) в толуоле (50 мл) кипятили с обратным холодильником в атмосфере азота в течение 2 часов. К реакционной смеси добавляли этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=20/1) с получением 1-[4-(тетрагидропиран-2-илокси)фенил]пиперазина (6,8 г, выход 85%) в виде бледно-серого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,57-2,04 (6H, м), 3,00-3,06 (8H, м), 3,53-3,66 (1H, м), 3,89-3,99 (1H, м), 5,29-5,32 (1H, м), 6,84-6,90 (2H, м), 6,95-7,02 (2H, м).
Ссылочный пример 185
Получение 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенил)пиперазина (альтернативный способ синтеза соединения ссылочного примера 183)
Смесь 1-[4-(тетрагидропиран-2-илокси)фенил]пиперазина (2,1 г, 8,05 ммоль), полученного в ссылочном примере 184, 4-трифторметокси-1-бромбензола (1,9 г, 8,05 ммоль), ацетата палладия (72 мг, 0,32 ммоль), BINAP (300 мг, 0,48 ммоль) и трет-бутоксида натрия (1,0 г, 10,5 ммоль) в толуоле (30 мл) кипятили с обратным холодильником в атмосфере азота в течение 5 часов. К реакционной смеси добавляли этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=20/1) с получением 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенил)пиперазина (3,1 г, выход 90%) в виде белого порошка.
Ссылочный пример 186
Получение 4-[4-(4-трифторметоксифенил)пиперазин-1-ил]фенола
Смесь 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенил)пиперазина (2,65 г, 6,27 ммоль), полученного в ссылочном примере 185, и п-толуолсульфоната пиридиния (473 мг, 1,88 ммоль) в этаноле (50 мл) перемешивали при 70°С в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли метиленхлорид и насыщенный водный раствор гидрокарбоната натрия и смесь перемешивали в течение некоторого времени. Смесь экстрагировали метиленхлоридом, экстракт сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) с получением 4-[4-(4-трифторметоксифенил)пиперазин-1-ил]фенола (1,95 г, выход 92%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
3,19-3,24 (4H, м), 3,29-3,34 (4H, м), 4,50 (1H, с), 6,76-6,80 (2H, м), 6,87-6,97 (4H, м), 7,11-7,15 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 187 и 188 получали способом, подобно описанному в ссылочном примере 186.
Ссылочный пример 187
4-[4-(4-трифторметилфенил)пиперазин-1-ил]фенол
белый порошок, выход 82%
1H-ЯМР (CDCl3) δ м.д.:
3,18-3,23 (4H, м), 3,41-3,45 (4H, м), 4,47 (1H, с), 6,76-6,82 (2H, м), 6,87-7,00 (4H, м), 7,48-7,52 (2H, м).
Ссылочный пример 188
4-[4-(4-хлорфенил)пиперазин-1-ил]фенол
белый порошок, выход 23%
1H-ЯМР (CDCl3) δ м.д.:
3,18-3,23 (4H, м), 3,28-3,32 (4H, м), 4,45 (1H, с), 6,77-6,81 (2H, м), 6,87-6,92 (4H, м), 7,21-7,24 (2H, м).
Ссылочный пример 189
Получение трет-бутил 4-(4-трифторметоксифенокси)пиперидин-1-карбоксилата
Трет-бутил 4-гидроксипиперидин-1-карбоксилат (56,5 г, 0,28 моль), 4-трифторметоксифенол (50 г, 0,28 моль) и трифенилфосфин (108 г, 0,42 моль) растворяли в ТГФ (500 мл). Диэтилазодикарбоксилат (65 мл, 0,42 моль) добавляли по каплям к полученному раствору при кипячении с обратным холодильником и смесь кипятили с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=5/1) с получением трет-бутил 4-(4-трифторметоксифенокси)пиперидин-1-карбоксилата (92 г, выход 91%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 1,69-1,80 (2H, м), 1,85-1,96 (2H, м), 3,28-3,39 (2H, м), 3,64-3,75 (2H, м), 4,40-4,46 (1H, м), 6,85-6,92 (2H, м), 7,11-7,15 (2H, м).
Ссылочный пример 190
Получение 4-(4-трифторметоксифенокси)пиперидина
Трет-бутил 4-(4-трифторметоксифенокси)пиперидин-1-карбоксилат (92 г, 254,59 ммоль), полученный в ссылочном примере 189, растворяли в метиленхлориде (100 мл). Трифторуксусную кислоту (200 мл) добавляли по каплям к полученному раствору при комнатной температуре и смесь перемешивали в течение ночи. Реакционную смесь концентрировали при пониженном давлении, затем остаток растворяли в метиленхлориде и раствор нейтрализовали водным раствором гидроксида натрия. Смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и затем остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=5/1) с получением 4-(4-трифторметоксифенокси)пиперидина (55 г, выход 83%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,65-1,78 (2H, м), 2,00-2,07 (2H, м), 2,73-2,83 (2H, м), 3,12-3,21 (2H, м), 4,32-4,38 (2H, м), 6,85-6,92 (2H, м), 7,10-7,15 (2H, м).
Ссылочный пример 191
Получение 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенокси)пиперидина
Смесь 4-(4-трифторметоксифенокси) пиперидина (30,3 г, 0,116 моль), полученного в ссылочном примере 190, 2-(4-бромфенокси)тетрагидропирана (30 г, 0,116 моль), ацетата палладия (1,0 г, 4,64 ммоль), BINAP (4,3 г, 6,96 ммоль) и карбоната цезия (49 г, 0,151 моль) в толуоле (300 мл) кипятили с обратным холодильником в атмосфере азота в течение 30 часов. К реакционной смеси добавляли этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и затем фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=20/1) с получением 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенокси)пиперидина (32,6 г, выход 64%) в виде желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,55-1,75 (3H, м), 1,81-2,20 (7H, м), 2,95-3,04 (2H, м), 3,38-3,42 (2H, м), 3,55-3,66 (1H, м), 3,87-3,99 (1H, м), 4,36-4,45 (1H, м), 5,29-5,32 (1H, м), 6,89-7,01 (6H, м), 7,11-7,16 (2H, м).
Ссылочный пример 192
Получение 4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]фенола
Смесь 1-[4-(тетрагидропиран-2-илокси)фенил]-4-(4-трифторметоксифенокси)пиперидина (30,1 г, 68,8 ммоль), полученного в ссылочном примере 191, и п-толуолсульфоната пиридиния (5,2 г, 20,6 ммоль) в этаноле (450 мл) перемешивали при 70°С в течение 24 часов. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли метиленхлорид и насыщенный водный раствор гидрокарбоната натрия и смесь перемешивали в течение некоторого времени. Смесь экстрагировали метиленхлоридом, экстракт сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) с получением 4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]фенола (22,9 г, выход 94%) в виде бледно-коричневого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,88-2,02 (2H, м), 2,06-2,16 (2H, м), 2,92-3,02 (2H, м), 3,30-3,39 (2H, м), 4,36-4,44 (1H, м), 4,74 (1H, с), 6,71-6,78 (2H, м), 6,85-6,94 (4H, м), 7,10-7,16 (2H, м).
Ссылочный пример 193
Получение трет-бутил 4-[2-хлор-4-(тетрагидропиран-2-илокси)фенил]пиперазин-1-карбоксилата
Смесь трет-бутилпиперазин-1-карбоксилата (3,94 г, 21,6 ммоль), 2-(4-бром-3-хлорфенокси)тетрагидропирана (5,61 г, 19,2 моль), ацетата палладия (86, 4 мг, 0,39 ммоль), BINAP (172 мг, 0,58 ммоль) и трет-бутоксида натрия (2,4 г, 25,0 ммоль) в толуоле (40 мл) кипятили с обратным холодильником в атмосфере азота в течение 2 часов. К реакционной смеси добавляли этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=20/1) с получением трет-бутил 4-[2-хлор-4-(тетрагидропиран-2-илокси)фенил]пиперазин-1-карбоксилата (4,72 г, выход 62%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 1,51-2,04 (6H, м), 2,88-2,93 (4H, м), 3,56-3,63, (5H, м), 3,83-3,94 (1H, м), 5,31-5,34 (1H, м), 6,88-6,96 (2H, м), 7,10-7,13 (1H, м).
Ссылочный пример 194
Получение трет-бутил 4-(2-хлор-4-гидроксифенил)пиперазин-1-карбоксилата
Смесь трет-бутил 4-[2-хлор-4-(тетрагидропиран-2-илокси)фенил]пиперазин-1-карбоксилата (4,73 г, 11,9 ммоль), полученного в ссылочном примере 193, и каталитического количества п-толуолсульфоната пиридиния в этаноле (50 мл) перемешивали при 70°С в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли метиленхлорид и насыщенный водный раствор гидрокарбоната натрия и смесь перемешивали в течение некоторого времени. Полученные осадки отфильтровывали и сушили в вакууме с получением трет-бутил 4-(2-хлор-4-гидроксифенил)пиперазин-1-карбоксилата (2,68 г, выход 72%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 2,87-2,91 (4H, м), 3,55-3,60 (4H, м), 5,19 (1H, ушир.), 6,68-6,74 (1H, м), 6,88-6,93 (2H, м).
Ссылочный пример 195
Получение трет-бутил 4-(4-ацетоксибензоил)пиперазин-1-карбоксилата
п-Ацетоксибензойную кислоту (11 г, 61,1 ммоль) растворяли в метиленхлориде (100 мл), к полученному раствору добавляли ДМФА (3 капли) и тионилхлорид (5,54 мл, 76,3 ммоль) и смесь кипятили с обратным холодильником в течение 2 часов. Смесь охлаждали на бане со льдом, затем к полученной смеси добавляли по каплям раствор трет-бутилпиперазин-1-карбоксилата (10,3 г, 55,5 ммоль) и пиридина (12 мл, 0,15 моль) в метиленхлориде (100 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли метиленхлоридом и смесь промывали водой, 10% хлористоводородной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением трет-бутил 4-(4-ацетоксибензоил)пиперазин-1-карбоксилата (18,5 г, выход 87%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 2,31 (3H, с), 3,46 (8H, ушир.), 7,12-7,18 (2H, м), 7,41-7,46 (2H, м).
Ссылочный пример 196
Получение трет-бутил 4-(4-гидроксибензоил)пиперазин-1-карбоксилата
Смесь трет-бутил 4-(4-ацетоксибензоил)пиперазин-1-карбоксилата (18,5 г, 53,1 ммоль), полученного в ссылочном примере 195, и карбоната калия (370 мг, 2,65 ммоль) в метаноле (200 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, добавляли к остатку 5% хлористоводородную кислоту и метиленхлорид и смесь энергично перемешивали. Полученные осадки отфильтровывали, промывали водой и метиленхлоридом и затем сушили в вакууме с получением трет-бутил 4-(4-гидроксибензоил)пиперазин-1-карбоксилата (14,9 г, выход 92%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 3,46 (4H, ушир.), 3,60 (4H, ушир.), 6,75-6,79 (2H, м), 7,22-7,28 (2H, м).
Ссылочный пример 197
Получение 1-бензил-4-[4-(тетрагидропиран-2-илокси)фенил]пиперидин-4-ола
Раствор 2-(4-бромфенокси)тетрагидропирана (7,2 г, 28 ммоль) в ТГФ (70 мл) охлаждали до -60°C, добавляли по каплям гексановый раствор (1,53M) н-бутиллития (20 мл, 30,8 ммоль) и смесь перемешивали в течение 30 минут. Затем раствор 1-бензил-4-пиперидона (5,3 г, 28 ммоль) в ТГФ (20 мл) добавляли по каплям к полученной смеси и смесь перемешивали в течение 3 часов, давая ей достичь температуры 0°C. Добавляли к реакционной смеси насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=20/1) с получением 1-бензил-4-[4-(тетрагидропиран-2-илокси)фенил]пиперидин-4-ола (5,27 г, выход 51%) в виде масла оранжевого цвета.
1H-ЯМР (CDCl3) δ м.д.:
1,52-2,21 (11H, м), 2,41-2,52 (2H, м), 2,74-2,78 (2H, м), 3,57 (2H, с), 3,56-3,63 (1H, м), 3,83-3,96 (1H, м), 5,39-5,42 (1H, м), 6,98-7,04 (2H, м), 7,20-7,44 (7H, м).
Ссылочный пример 198
Получение трет-бутил 4-(4-гидроксифенил)пиперидин-1-карбоксилата
Раствор 1-бензил-4-[4-(тетрагидропиран-2-илокси)фенил]пиперидин-4-ола (1,67 г, 4,55 ммоль), полученного в ссылочном примере 197, в ацетонитриле (45 мл) охлаждали до -10°C, затем добавляли триэтилсилан (2,9 мл, 18,2 ммоль) и комплекс трифторид бора-диэтиловый эфир (1,1 мл, 9,1 ммоль) и смесь перемешивали при комнатной температуре в течение 2 суток. Воду добавляли к реакционной смеси и смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в этаноле (50 мл) и к полученному раствору добавляли каталитическое количество 20% гидроксида палладия на углероде. Смесь перемешивали при комнатной температуре при атмосферном давлении водорода в течение ночи. Реакционную смесь фильтровали через Целит, добавляли к фильтрату ди-трет-бутилдикарбонат (1,1 мл, 4,78 ммоль) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением трет-бутил 4-(4-гидроксифенил)пиперидин-1-карбоксилата (1,07 г, выход 85%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,41-1,63 (2H, м), 1,49 (9H, с), 1,73-1,80 (2H, м), 2,50-2,62 (1H, м), 2,73-2,83 (2H, м), 4,19-4,24 (2H, м), 5,87 (1H, ушир.с), 6,76-6,81 (2H, м), 7,02-7,08 (2H, м).
Ссылочный пример 199
Получение трет-бутил 4-[3-(тетрагидропиран-2-илокси)фенил]пиперазин-1-карбоксилата
Смесь трет-бутилпиперазин-1-карбоксилата (2,94 г, 15,8 ммоль), 2-(3-бромфенокси)тетрагидропирана (3,69 г, 14,4 ммоль), ацетата палладия (64 мг, 0,29 ммоль), BINAP (285 мг, 0,43 ммоль) и трет-бутоксида натрия (1,8 г, 18,7 ммоль) в толуоле (40 мл) кипятили с обратным холодильником в атмосфере азота в течение 2 часов. К реакционной смеси добавляли этилацетат и воду и смесь перемешивали в течение некоторого времени. Нерастворимые вещества удаляли фильтрованием через Целит и затем фильтрат экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=20/1) с получением трет-бутил 4-[3-(тетрагидропиран-2-илокси)фенил]пиперазин-1-карбоксилата (5,3 г, выход 99%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 1,52-2,04 (6H, м), 3,10-3,15 (4H, м), 3,53-3,64 (5H, м), 3,87-3,94 (1H, м), 5,38-5,41 (1H, м), 6,53-6,63 (3H, м), 7,12-7,19 (1H, м).
Ссылочный пример 200
Получение трет-бутил 4-(3-гидроксифенил)пиперазин-1-карбоксилата
Смесь трет-бутил 4-[3-(тетрагидропиран-2-илокси)фенил]пиперазин-1-карбоксилата (5,20 г, 14,4 ммоль), полученного в ссылочном примере 199, и каталитического количества п-толуолсульфоната пиридиния в этаноле (100 мл) перемешивали при 70°С в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении, добавляли к остатку метиленхлорид и насыщенный водный раствор гидрокарбоната натрия и смесь перемешивали в течение некоторого времени. Полученные осадки отфильтровывали и затем сушили в вакууме с получением трет-бутил 4-(3-гидроксифенил)пиперазин-1-карбоксилата (3,73 г, выход 93%) в виде бледно-коричневого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 3,09-3,14 (4H, м), 3,54-3,59 (4H, м), 5,38 (1H, ушир.), 6,33-6,41 (2H, м), 6,47-6,52 (1H, м), 7,08-7,15 (1H, м).
Ссылочный пример 201
Получение 3-метил-2-метиленбутилальдегида
3-Метил-2-метиленбутилальдегид получали по методу, описанному в Journal of American Chemical Society, 1957, p. 3267 (J. Am. Chem. Soc., 3267, 1957), то есть смесь изовалеральдегида (100 мл, 932 ммоль), 37% формалина (83,8 мл, 1120 ммоль) и диметиламингидрохлорида (91,2 г, 1120 ммоль) перемешивали при 70°С в течение 30 часов. Смесь перегоняли с водяным паром для отделения фракции и полученный при этом водный слой экстрагировали диэтиловым эфиром. Экстракты объединяли, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток перегоняли с получением 3-метил-2-метиленбутилальдегида (65,5 г, выход 72%) в виде бесцветного масла.
температура кипения: 105-115°C
1H-ЯМР (CDCl3) δ м.д.:
1,08 (6H, д, J=6,9 Гц), 2,75-2,89 (1H, м), 5,95 (1H, с), 6,24 (1H, с), 9,53 (1H, с).
Ссылочный пример 202
Получение 3-метил-2-метиленбутан-1-ола
Раствор 3-метил-2-метиленбутилальдегида (65 г, 668 ммоль), полученного в ссылочном примере 201, в ТГФ (30 мл) добавляли по каплям к суспензии литийалюминийгидрида (14,15 г, 373 ммоль) в ТГФ (1000 мл) при охлаждении на бане со льдом, смеси давали возможность вернуться к комнатной температуре и перемешивали в течение 2 часов. К реакционной смеси добавляли при охлаждении воду, 15% водный раствор гидроксида натрия и затем воду и смесь фильтровали. Фильтрат сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением 3-метил-2-метиленбутан-1-ола (61,5 г, выход 93%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,07 (6H, д, J=6,9 Гц), 1,42 (1H, т, J=6,1 Гц), 2,25-2,43 (1H, м), 4,13 (2H, д, J=6,1 Гц), 4,84-4,93 (1H, м), 4,98-5,05 (1H, м).
Ссылочный пример 203
Получение 2-метоксиметоксиметил-3-метил-1-бутена
Хлорметилметиловый эфир (98 мл, 1292 ммоль) и N-этилдиизопропиламин (234 мл, 1344 ммоль) добавляли к раствору 3-метил-2-метиленбутан-1-ола (61,5 г, 615 ммоль), полученного в ссылочном примере 202, в ТГФ (500 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире, смесь промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением 2-метоксиметоксиметил-3-метил-1-бутена (89 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,07 (6H, д, J=6,9 Гц), 2,25-2,41 (1H, м), 3,39 (3H, с), 4,05 (2H, с), 4,65 (2H, с), 4,87-4,95 (1H, м), 5,00-5,05 (1H, м).
Ссылочный пример 204
Получение 2-метиленбутилальдегида
Смесь бутилальдегида (100 мл, 1110 ммоль), 37% формалина (99,8 мл, 1330 ммоль) и диметиламингидрохлорида (108,6 г, 1330 ммоль) перемешивали при 70°С в течение 23 часов. Смесь перегоняли с водяным паром для отделения фракции и полученный при этом водный слой экстрагировали диэтиловым эфиром. Экстракты объединяли, сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток перегоняли с получением 2-метиленбутилальдегида (66,9 г, выход 72%) в виде бесцветного масла.
температура кипения: 70-93°C
1H-ЯМР (CDCl3) δ м.д.:
1,08 (3H, т, J=7,5 Гц), 2,27 (2H, кв. J=7,5 Гц), 5,98 (1H, с), 6,25 (1H, с), 9,56 (1H, с).
Ссылочный пример 205
Получение 2-метилен-1-бутанола
2-Метиленбутилальдегид (66,9 г, 796 ммоль), полученный в ссылочном примере 204, добавляли по каплям к суспензии литийалюминийгидрида (15,1 г, 398 ммоль) в ТГФ (1000 мл) при охлаждении на бане со льдом и смесь перемешивали в течение 1 часа. Воду, 15% водный раствор гидроксида натрия и затем воду добавляли к реакционной смеси, смесь фильтровали и фильтрат сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением 2-метилен-1-бутанола (65,1 г, выход 95%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,07 (3H, т, J=7,5 Гц), 1,44 (1H, т, J=6,0 Гц), 2,13 (2H, кв. J=7,5 Гц), 4,09 (2H, д, J=6,0 Гц), 4,82-4,93 (1H, м), 4,98-5,07 (1H, м).
Ссылочный пример 206
Получение 2-метоксиметоксиметил-1-бутена
Хлорметилметиловый эфир (103,4 мл, 1363 ммоль) и N-этилдиизопропиламин (247,2 мл, 1419 ммоль) добавляли к раствору 2-метилен-1-бутанола (65,1 г, 757 ммоль), полученного в ссылочном примере 205, в ТГФ (750 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 3 суток. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире и смесь промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 2-метоксиметоксиметил-1-бутена (98 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,07 (3H, т, J=7,5 Гц), 2,09 (2H, кв. J=7,5 Гц), 3,38 (3H, с), 4,01 (2H, с), 4,64 (2H, с), 4,86-4,95 (1H, м), 5,00-5,05 (1H, м).
Ссылочный пример 207
Получение трет-бутил 4-[2-оксо-2-(4-оксопиперидин-1-ил)этил]пиперазин-1-карбоксилата
1-(2-Хлорацетил)пиперидин-4-он (5,17 г, 29,4 ммоль) растворяли в ацетонитриле (50 мл). К полученному раствору добавляли трет-бутилпиперазин-1-карбоксилат (5,48 г, 29,4 ммоль) и N-этилдиизопропиламин (6,2 мл, 35,3 ммоль) и смесь кипятили с обратным холодильником в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры, затем добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 4-[2-оксо-2-(4-оксопиперидин-1-ил)этил]пиперазин-1-карбоксилата (6,49 г, выход 68%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 2,44-2,54 (8H, м), 3,28 (2H, с), 3,42-3,47 (4H, м), 3,85-3,90 (4H, м).
Ссылочный пример 208
Получение 4-метил-4-пентенилацетата
трет-Бутоксид калия (9,4 г, 84 ммоль) добавляли к смеси метилтрифенилфосфонийбромида (30 г, 84 ммоль) в ТГФ (300 мл) и смесь перемешивали при комнатной температуре в течение 40 минут. К смеси постепенно добавляли по каплям при охлаждении на бане со льдом раствор 4-оксопентилацетата (9,9 г, 68,8 ммоль) в ТГФ (30 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром два раза. Экстракты объединяли, промывали насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=4/1) с получением 4-метил-4-пентенилацетата (5,9 г, выход 60,4%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,70-1,86 (5H, м), 2,00-2,14 (5H, м), 4,07 (2H, т, J=6,7 Гц), 4,69 (1H, с), 4,74 (1H, с).
Ссылочный пример 209
Получение бензил 4-(2-метил-2-оксиранилметил)пиперазин-1-карбоксилата
Иодид триметилсульфоксония (1,96 г, 8,91 ммоль) добавляли к суспензии гидрида натрия (0,37 г, 9,32 ммоль) в ДМСО (20 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 30 минут. К смеси добавляли раствор бензил 4-(2-оксопропил)пиперазин-1-карбоксилата (2,24 г, 8,10 ммоль) в ДМСО (10 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Экстракт промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении с получением бензил 4-(2-метил-2-оксиранилметил)пиперазин-1-карбоксилата (1,51 г, выход 64%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,37 (3H, с), 2,27-2,63 (8H, м), 3,44-3,63 (4H, м), 5,13 (2H, с), 7,29-7,44 (5H, м).
Ссылочный пример 210
Получение трет-бутил 4-(2-метил-2-оксиранилметил)гомопиперазин-1-карбоксилата
Иодид триметилсульфоксония (22,95 г, 104 ммоль) постепенно добавляли к суспензии гидрида натрия (4,3 г, 109 ммоль) в ДМСО (200 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. К полученной смеси постепенно добавляли по каплям раствор трет-бутил 4-(2-оксопропил)гомопиперазин-1-карбоксилата (24,3 г, 94,8 ммоль), полученного в ссылочном примере 10, в ДМСО (25 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Экстракт промывали водой и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 4-(2-метил-2-оксиранилметил)гомопиперазин-1-карбоксилата (15,38 г, выход 60%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 1,43 (9H, с), 1,69-1,90 (2H, м), 2,40-2,75 (8H, м), 3,36-3,55 (4H, м).
Ссылочный пример 211
Получение трет-бутил 4-[2-(2-метил-2-оксиранил)этил]пиперазин-1-карбоксилата
Иодид триметилсульфоксония (7,8 г, 35 ммоль) постепенно добавляли к суспензии гидрида натрия (1,2 г, 35 ммоль) в ДМСО (120 мл) в атмосфере азота и смесь перемешивали при комнатной температуре в течение 2 часов. Затем к полученной смеси постепенно добавляли по каплям раствор трет-бутил 4-(3-оксобутил)пиперазин-1-карбоксилата (6,1 г, 23,8 ммоль) в ДМСО (10 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов и затем при 50-60°С в течение 1,5 часов. Реакционной смеси давали возможность вернуться к комнатной температуре, выливали в ледяную воду и экстрагировали этилацетатом три раза. Экстракты объединяли, промывали водой три раза, затем промывали насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением трет-бутил 4-[2-(2-метил-2-оксиранил)этил]пиперазин-1-карбоксилата (5,6 г, 87%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,33 (3H, с), 1,46 (9H, с), 1,66-1,85 (2H, м), 2,28-2,50 (6H, м), 2,55-2,66 (2H, м), 3,34-3,47 (4H, м).
Ссылочный пример 212
Получение 1-(2-метил-2-оксиранилметил)-4-(4-трифторметилфенил)пиперазина
Иодид триметилсульфоксония (2,5 г, 11,6 ммоль) постепенно добавляли к суспензии гидрида натрия (484 мг, 12,1 ммоль) в диметилсульфоксиде (30 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Затем к полученной смеси добавляли раствор 1-{4-(4-трифторметилфенил)пиперазин-1-ил}пропан-2-она (3,4 г, 11,9 ммоль) в диметилсульфоксиде (20 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением 1-(2-метил-2-оксиранилметил)-4-(4-трифторметилфенил)пиперазина (3,2 г, выход 98%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, с), 2,33 (1H, д, J=13,0 Гц), 2,53-2,73 (7H, м), 3,26-3,30 (4H, м), 6,91 (2H, д, J=8,7 Гц), 7,47 (2H, д, J=8,7 Гц).
Соединения ссылочных примеров 213-217 получали способом, подобно описанному в ссылочном примере 212.
Ссылочный пример 213
1-(2-метил-2-оксиранилметил)-4-(4-бифенилил)пиперазин
бледно-желтый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,41 (3H, с), 2,37 (1H, д, J=12,9 Гц), 2,58-2,76 (7H, м), 3,23-3,28 (4H, м), 6,97-7,01 (2H, м), 7,24-7,30 (1H, м), 7,37-7,43 (2H, м), 7,49-7,58 (4H, м).
Ссылочный пример 214
1-(2-метил-2-оксиранилметил)-4-(4-хлорфенил)пиперазин
бледно-желтый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,39 (3H, с), 2,34 (1H, д, J=12,9 Гц), 2,54-2,73 (7H, м), 3,14-3,18 (4H, м), 6,81-6,87 (2H, м), 7,16-7,22 (2H, м).
Ссылочный пример 215
1-(2-метил-2-оксиранилметил)-4-(4-трифторметоксифенил)пиперазин
бледно-желтый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, с), 2,34 (1H, д, J=12,9 Гц), 2,54-2,73 (7H, м), 3,16-3,20 (4H, м), 6,85-6,92 (2H, м), 7,08-7,13 (2H, м).
Ссылочный пример 216
1-(2-метил-2-оксиранилметил)-4-(пиридин-2-ил)пиперазин
бледно-желтый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,41 (3H, с), 2,35 (1H, д, J=12,9 Гц), 2,50-2,69 (7H, м), 3,48-3,60 (4H, м), 6,59-6,66 (2H, м), 7,43-7,50 (1H, м), 8,17-8,20 (1H, м).
Ссылочный пример 217
1-(2-метил-2-оксиранилметил)-4-(пиримидин-2-ил)пиперазин
бледно-желтый порошок, выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,41 (3H, с), 2,36 (1H, д, J=12,9 Гц), 2,45-2,64 (7H, м), 3,81-3,85 (4H, м), 6,47 (1H, т, J=4,8 Гц), 8,30 (2H, д, J=4,8 Гц).
Ссылочный пример 218
Получение трет-бутил-N-метил-[1-(2-метил-2-оксиранилметил)пиперидин-4-ил]карбамата
Иодид триметилсульфоксония (1,96 г, 8,89 ммоль) постепенно добавляли к суспензии гидрида натрия (372 мг, 9,32 ммоль) в диметилсульфоксиде (20 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Затем к полученной смеси добавляли раствор трет-бутил-N-метил-[1-(2-оксопропил)пиперидин-4-ил]карбамата (2,3 г, 8,5 ммоль) в диметилсульфоксиде (20 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил-N-метил-[1-(2-метил-2-оксиранилметил)пиперидин-4-ил]карбамата (2,1 г, выход 86%) в виде светло-желтого маслянистого вещества.
1H-ЯМР (CDCl3) δ м.д.:
1,36 (3H, с), 1,46 (9H, с), 1,55-1,79 (5H, м), 1,97-2,13 (2H, м), 2,30 (1H, д, J=12,9 Гц), 2,49 (1H, д, J=12,9 Гц), 2,59 (2H, с), 2,74 (3H, с), 2,88-3,06 (2H, м).
Ссылочный пример 219
Получение 3-(2-метил-2-оксиранил)пиридина
Используя 3-ацетилпиридин (8 г, 66,1 ммоль), 3-(2-метил-2-оксиранил)пиридин (7 г, выход 78,4%) в виде светло-коричневого масла получали способом, подобно описанному в ссылочном примере 218.
1H-ЯМР (CDCl3) δ м.д.:
1,74 (3H, с), 2,82 (1H, д, J=5,2 Гц), 3,02 (1H, д, J=5,2 Гц), 7,21-7,33 (1H, м), 7,58-7,70 (1H, м), 8,54 (1H, дд, 1,6 Гц, 4,8 Гц), 8,65 (1H, д, J=2,3 Гц).
Ссылочный пример 220
Получение трет-бутил 1-окса-6-азаспиро[2,5]октан-6-карбоксилата
Иодид триметилсульфоксония (70 г, 0,32 моль) постепенно добавляли к суспензии гидрида натрия (13,3 г, 0,33 моль) в диметилсульфоксиде (600 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Затем к полученной смеси постепенно добавляли трет-бутил 4-оксопиперидин-1-карбоксилат (58 г, 0,291 моль) и смесь перемешивали при 55°С в течение 1 часа. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток кристаллизовали из н-гексана с получением трет-бутил 1-окса-6-азаспиро[2,5]октан-6-карбоксилата (61,7 г, выход 96%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,40-1,53 (2H, м), 1,47 (9H, с), 1,72-1,85 (2H, м), 2,69 (2H, с), 3,37-3,48 (2H, м), 3,67-3,77 (2H, м).
Ссылочный пример 221
Получение трет-бутил 4-[2-(1-окса-6-азаспиро[2,5]октан-6-ил)-2-оксоэтил]пиперазин-1-карбоксилата
Иодид триметилсульфоксония (2,02 г, 9,20 ммоль) постепенно добавляли к суспензии гидрида натрия (385 мг, 9,64 ммоль) в диметилсульфоксиде (50 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли трет-бутил 4-[2-оксо-2-(4-оксопиперидин-1-ил)этил]пиперазин-1-карбоксилат (2,85 г, 8,76 ммоль) в ДМСО (10 мл) и смесь перемешивали при комнатной температуре в течение 2 часов и при 55°С в течение 1 часа. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении с получением трет-бутил 4-[2-(1-окса-6-азаспиро[2,5]октан-6-ил)-2-оксоэтил]пиперазин-1-карбоксилата (2,97 г, выход 99%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ м.д.:
1,45-1,54 (1H, м), 1,48 (9H, с), 1,78-1,93 (1H, м), 2,44-2,49 (4H, м), 2,62 (2H, с), 2,73 (2H, с), 3,42-3,47 (2H, м), 3,52-3,68 (1H, м), 3,77-3,88 (1H, м).
Ссылочный пример 222
Получение 6-(4-трифторметилфенил)-1-окса-6-азаспиро[2,5]октана
Иодид триметилсульфоксония (2,00 г, 9,02 ммоль) постепенно добавляли к суспензии гидрида натрия (361 мг, 9,02 ммоль) в диметилсульфоксиде (30 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К полученной смеси добавляли раствор 1-(4-трифторметилфенил)пиперидин-4-она (2,00 г, 8,2 ммоль) в ДМСО (10 мл) и смесь перемешивали в течение ночи. Реакционную смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=5/1) с получением 6-(4-трифторметилфенил)-1-окса-6-азаспиро[2,5]октана (1,51 г, выход 72%) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,54-1,65 (2H, м), 1,91-2,04 (2H, м), 2,54-2,59 (2H, м), 2,73 (2H, с), 3,38-3,48 (1H, м), 3,52-3,62 (1H, м), 6,95 (2H, д, J=8,7 Гц), 7,48 (2H, д, J=8,7 Гц).
Ссылочный пример 223
Получение 3-(2-метил-2-оксиранил)пропилацетата
м-Хлорпербензойную кислоту (12,3 г, 71,30 ммоль) постепенно добавляли к раствору 4-метил-4-пентенилацетата (5,9 г, 41,5 ммоль), полученного в ссылочном примере 208, в метиленхлориде (60 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 2 часов. Насыщенный водный раствор сульфита натрия и насыщенный водный раствор карбоната натрия добавляли к смеси при охлаждении на бане со льдом, смесь перемешивали в течение 30 минут и отделяли органический слой. Водный слой экстрагировали метиленхлоридом. Экстракты объединяли, промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением 3-(2-метил-2-оксиранил)пропилацетата (6,9 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,33 (3H, с), 1,56-1,79 (4H, м), 2,05 (3H, с), 2,56-2,70 (2H, м), 4,08 (2H, т, J=6,5 Гц).
Ссылочный пример 224
Получение 1-этил-5-[2-(2-метил-2-оксиранил)этил]-1H-тетразола
м-Хлорпербензойную кислоту (1,97 г, 7,99 ммоль) постепенно добавляли к раствору 1-этил-5-(3-метил-3-бутенил)-1H-тетразола (0,95 г, 5,71 ммоль) в метиленхлориде (20 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 21 часа. К реакционной смеси добавляли водный раствор тиосульфата натрия и водный раствор гидрокарбоната натрия и полученную смесь фильтровали. Органический слой отделяли, промывали водным раствором гидрокарбоната натрия, сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 1-этил-5-[2-(2-метил-2-оксиранил)этил]-1H-тетразола (1,2 г, количественный) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, с), 1,55 (3H, т, J=7,3 Гц), 2,00-2,16 (1H, м), 2,20-2,37 (1H, м), 2,66 (2H, с), 2,78-2,98 (2H, м), 4,32 (2H, кв. J=7,3 Гц).
Используя соответствующие исходные вещества, соединения ссылочных примеров 225 и 226 получали способом, подобно описанному в ссылочном примере 224.
Ссылочный пример 225
1-фенил-5-[2-(2-метил-2-оксиранил)этил]-1H-тетразол
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,32 (3H, с), 2,01-2,28 (2H, м), 2,59 (2H, с), 2,92-2,99 (2H, м), 7,43-7,47 (2H, м), 7,58-7,63 (3H, м).
Ссылочный пример 226
1-(4-хлорфенил)-5-[2-(2-метил-2-оксиранил)этил]-1H-тетразол
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,33 (3H, с), 2,00-2,12 (1H, м), 2,19-2,31 (1H, м), 2,60 (2H, с), 2,90-2,97 (2H, м), 7,39-7,45 (2H, м), 7,56-7,62 (2H, м).
Ссылочный пример 227
Получение 1-(2-метил-2-оксиранилметил)-1,4-дигидробензо[d][1,3]оксазин-2-она
м-Хлорпербензойную кислоту (13,76 г, 55,81 ммоль) добавляли к раствору 1-(2-метил-2-пропенил)-1,4-дигидробензо[d][1,3]оксазин-2-она (7,09 г, 34,88 ммоль) в метиленхлориде (150 мл) и смесь перемешивали при комнатной температуре в течение 24 часов. К смеси добавляли водный раствор тиосульфата натрия и водный раствор гидрокарбоната натрия и полученную смесь фильтровали. Органический слой отделяли, промывали водным раствором гидрокарбоната натрия, сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=4/1) с получением 1-(2-метил-2-оксиранилметил)-1,4-дигидробензо[d][1,3]оксазин-2-она (5,13 г, 67%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,39 (3H, с), 2,70 (1H, д, J=4,4 Гц), 2,78 (1H, д, J=4,4 Гц), 3,79 (1H, д, J=15,5 Гц), 4,51 (1H, д, J=15,5 Гц), 5,23 (2H, с), 7,04-7,13 (2H, м), 7,21-7,27 (1H, м), 7,29-7,38 (1H, м).
Ссылочный пример 228
Получение 3-(2-метил-2-оксиранилметил)-3H-бензоксазол-2-она
м-Хлорпербензойную кислоту (1,66 г, 9,65 ммоль) добавляли к смеси 3-(2-метил-2-пропенил)-3H-бензоксазол-2-она (1,66 г, 8,77 ммоль) в метиленхлориде (30 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат промывали 20% водным раствором сульфита натрия, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток обрабатывали смесью метиленхлорид/н-гексан и полученные осадки отфильтровывали с получением 3-(2-метил-2-оксиранилметил)-3H-бензоксазол-2-она (1,78 г, выход 99%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 2,73 (1H, д, J=4,3 Гц), 2,81 (1H, д, J=4,3 Гц), 3,68 (1H, д, J=15,0 Гц), 4,26 (1H, д, J=15,0 Гц), 7,09-7,29 (4H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 229-232 получали способом, подобно описанному в ссылочном примере 228.
Ссылочный пример 229
5-хлор-3-(2-метил-2-оксиранилметил)-3H-бензоксазол-2-он
выход 93%
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 2,75 (1H, д, J=4,2 Гц), 2,79 (1H, д, J=4,2 Гц), 3,60 (1H, д, J=15,1 Гц), 4,28 (1H, д, J=15,1 Гц), 7,05-7,16 (2H, м), 7,20-7,27 (1H, м).
Ссылочный пример 230
5-фтор-3-(2-метил-2-оксиранилметил)-3H-бензоксазол-2-он
выход 97%
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 2,75 (1H, д, J=4,3 Гц), 2,80 (1H, д, J=4,3 Гц), 3,60 (1H, д, J=15,1 Гц), 4,29 (1H, д, J=15,1 Гц), 6,75-6,85 (1H, м), 7,01 (1H, дд, J=2,6 Гц, 7,9 Гц), 7,13 (1H, дд, J=4,2 Гц, 8,8 Гц).
Ссылочный пример 231
5-фенил-3-(2-метил-2-оксиранилметил)-3H-бензоксазол-2-он
выход 92%
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, с), 2,74 (1H, д, J=4,3 Гц), 2,82 (1H, д, J=4,3 Гц), 3,70 (1H, д, J=15,0 Гц), 4,32 (1H, д, J=15,0 Гц), 7,25 (1H, д, J=8,4 Гц), 7,29-7,49 (5H, м), 7,57 (2H, дд, J=1,6 Гц, 8,5 Гц).
Ссылочный пример 232
5-бром-3-(2-метил-2-оксиранилметил)-3H-бензоксазол-2-он
выход 80%
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 2,75 (1H, д, J=4,2 Гц), 2,79 (1H, д, J=4,2 Гц), 3,61 (1H, д, J=15,1 Гц), 4,27 (1H, д, J=15,1 Гц), 7,08 (1H, д, J=8,5 Гц), 7,18-7,31 (1H, м), 7,38 (1H, д, J=1,9 Гц).
Ссылочный пример 233
Получение 1-(2-метил-2-оксиранилметил)-3-фенил-1,3-дигидробензимидазол-2-она
Используя 1-(2-метил-2-пропенил)-3-фенил-1,3-дигидробензимидазол-2-он (720 мг, 2,72 ммоль), 1-(2-метил-2-оксиранилметил)-3-фенил-1,3-дигидробензимидазол-2-он (758 мг, выход 99%) в виде бледно-желтого масла получали способом, подобно описанному в ссылочном примере 228.
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, с), 2,73 (1H, д, J=4,5 Гц), 2,86 (1H, д, J=4,5 Гц), 3,82 (1H, д, J=15,0 Гц), 4,38 (1H, д, J=15,0 Гц), 7,02-7,30 (4H, м), 7,34-7,45 (1H, м), 7,50-7,57 (4H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 234-245 получали способом, подобно описанному в ссылочном примере 233.
Ссылочный пример 234
1-(4-фторфенил)-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 96%
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, с), 2,73 (1H, д, J=4,5 Гц), 2,85 (1H, д, J=4,5 Гц), 3,81 (1H, д, J=15,0 Гц), 4,38 (1H, д, J=15,0 Гц), 7,00-7,30 (6H, м), 7,43-7,57 (2H, м).
Ссылочный пример 235
1-(1-трет-бутоксикарбонилпиперидин-4-ил)-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 40%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 1,54 (9H, с), 1,71-1,87 (2H, м), 2,20-2,42 (2H, м), 2,70 (1H, д, J=4,5 Гц), 2,71-2,89 (3H, м), 3,75 (1H, д, J=15,0 Гц), 4,20-4,53 (4H, м), 7,00-7,13 (3H, м), 7,15-7,25 (1H, м).
Ссылочный пример 236
1-метил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 68%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,69 (1H, д, J=4,5 Гц), 2,78 (1H, д, J=4,5 Гц), 3,44 (3H, с), 3,76 (1H, д, J=15,0 Гц), 4,31 (1H, д, J=15,0 Гц), 6,91-7,00 (1H, м), 7,05-5,25 (3H, м).
Ссылочный пример 237
5-хлор-1-метил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 89%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,70 (1H, д, J=4,4 Гц), 2,76 (1H, д, J=4,4 Гц), 3,42 (3H, с), 3,69 (1H, д, J=15,1 Гц), 4,28 (1H, д, J=15,1 Гц), 6,88 (1H, д, J=8,3 Гц), 7,09 (1H, дд, J=1,9 Гц, 8,3 Гц), 7,22 (1H, д, J=1,9 Гц).
Ссылочный пример 238
1-метил-3-(2-метил-2-оксиранилметил)-5-трифторметил-1,3-дигидробензимидазол-2-он
выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,36 (3H, с), 2,71 (1H, д, J=4,4 Гц), 2,77 (1H, д, J=4,4 Гц), 3,47 (3H, с), 3,74 (1H, д, J=15,1 Гц), 4,38 (1H, д, J=15,1 Гц), 7,04 (1H, д, J=8,2 Гц), 7,39 (1H, дд, J=1,9 Гц, 8,2 Гц), 7,45 (1H, д, J=1,9 Гц).
Ссылочный пример 239
6-хлор-1-метил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,32 (3H, с), 2,69 (1H, д, J=4,6 Гц), 2,75 (1H, д, J=4,6 Гц), 3,41 (3H, с), 3,68 (1H, д, J=15,1 Гц), 4,33 (1H, д, J=15,1 Гц), 6,97 (1H, д, J=1,9 Гц), 7,07 (1H, дд, J=1,9 Гц, 8,4 Гц), 7,13 (1H, д, J=8,4 Гц).
Ссылочный пример 240
5-фтор-1-метил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 66%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,70 (1H, д, J=4,4 Гц), 2,77 (1H, д, J=4,4 Гц), 3,42 (3H, с), 3,77 (1H, д, J=15,0 Гц), 4,33 (1H, д, J=15,0 Гц), 6,74-6,91 (2H, м), 7,00 (1H, дд, J=2,2 Гц, 8,6 Гц).
Ссылочный пример 241
5-хлор-1-этил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,25-1,39 (6H, м), 2,70 (1H, д, J=4,4 Гц), 2,76 (1H, д, J=4,4 Гц), 3,69 (1H, д, J=15,1 Гц), 3,93 (2H, кв. J=7,3 Гц), 4,30 (1H, д, J=15,1 Гц), 6,90 (1H, д, J=8,3 Гц), 7,07 (1H, дд, J=2,0 Гц, 8,3 Гц), 7,23 (1H, д, J=2,0 Гц).
Ссылочный пример 242
5-хлор-1-изопропил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 1,53 (6H, дд, J=2,1 Гц, 6,7 Гц), 2,70 (1H, д, J=4,5 Гц), 2,75 (1H, д, J=4,5 Гц), 3,68 (1H, д, J=15,1 Гц), 4,28 (1H, д, J=15,1 Гц), 4,65-4,79 (1H, м), 7,04 (2H, с), 7,22 (1H, с).
Ссылочный пример 243
5-диметиламино-1-метил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 100%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,33 (3H, с), 2,69 (1H, д, J=4,5 Гц), 2,79 (1H, д, J=4,5 Гц), 2,92 (6H, с), 3,39 (3H, с), 3,67 (1H, д, J=15,0 Гц), 4,32 (1H, д, J=15,0 Гц), 6,55 (1H, дд, J=2,4 Гц, 8,6 Гц), 6,71 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,6 Гц).
Ссылочный пример 244
5-хлор-1-(н-гексил)-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
0,87 (3H, т, J=6,9 Гц), 1,18-1,43 (9H, м), 1,64-1,80 (2H, м), 2,70 (1H, д, J=4,4 Гц), 2,75 (1H, д, J=4,4 Гц), 3,69 (1H, д, J=15,0 Гц), 3,86 (2H, т, J=7,4 Гц), 4,30 (1H, д, J=15,0 Гц), 6,88 (1H, д, J=8,4 Гц), 7,06 (1H, дд, J=1,9 Гц, 8,4 Гц), 7,22 (1H, д, J=1,9 Гц).
Ссылочный пример 245
5-этоксикарбонил-1-метил-3-(2-метил-2-оксиранилметил)-1,3-дигидробензимидазол-2-он
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,32-1,43 (6H, м), 2,69 (1H, д, J=4,5 Гц), 2,78 (1H, д, J=4,5 Гц), 3,47 (3H, с), 3,87 (1H, д, J=15,0 Гц), 4,28 (1H, д, J=15,0 Гц), 4,39 (2H, кв. J=7,2 Гц), 7,00 (1H, д, J=8,2 Гц), 7,85 (1H, д, J=1,5 Гц), 7,90 (1H, дд, J=1,5 Гц, 8,2 Гц).
Ссылочный пример 246
Получение 1-бензил-3-(2-метил-2-оксиранилметил)имидазолидин-2-она
Используя 1-бензил-3-(2-метил-2-пропенил)имидазолидин-2-он (1,63 г, 7,05 ммоль), 1-бензил-3-(2-метил-2-оксиранилметил)имидазолидин-2-он (680 мг, выход 39%) в виде бледно-желтого масла получали способом, подобно описанному в ссылочном примере 228.
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 2,62 (1H, д, J=4,7 Гц), 2,69 (1H, д, J=4,7 Гц), 3,05-3,25 (3H, м), 3,27-3,49 (2H, м), 3,61 (1H, д, J=14,6 Гц), 4,39 (2H, с), 7,20-7,34 (5H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 247-250 получали способом, подобно описанному в ссылочном примере 246.
Ссылочный пример 247
1-(2-метил-2-оксиранилметил)-3-фенилимидазолидин-2-он
выход 58%
1H-ЯМР (CDCl3) δ м.д.:
1,37 (3H, с), 2,65 (1H, д, J=4,6 Гц), 2,72 (1H, д, J=4,6 Гц), 3,18 (1H, д, J=14,7 Гц), 3,48-3,61 (2H, м), 3,64 (1H, д, J=14,7 Гц), 3,77-3,91 (2H, м), 7,03 (1H, т, J=7,3 Гц), 7,25-7,36 (2H, м), 7,56 (2H, д, J=7,9 Гц).
Ссылочный пример 248
1-(4-фторбензил)-3-(2-метил-2-оксиранилметил)имидазолидин-2-он
выход 34%
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 2,62 (1H, д, J=4,7 Гц), 2,68 (1H, д, J=4,7 Гц), 3,12 (1H, д, J=14,6 Гц), 3,16-3,20 (2H, м), 3,27-3,45 (2H, м), 3,61 (1H, д, J=14,6 Гц), 4,35 (2H, с), 6,89-7,07 (2H, м), 7,14-7,27 (2H, м).
Ссылочный пример 249
1-(4-бромбензил)-3-(2-метил-2-оксиранилметил)имидазолидин-2-он
выход 51%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,62 (1H, д, J=4,7 Гц), 2,67 (1H, д, J=4,7 Гц), 3,12 (1H, д, J=14,7 Гц), 3,16-3,25 (2H, м), 3,27-3,50 (2H, м), 3,61 (1H, д, J=14,7 Гц), 4,33 (2H, с), 7,15 (2H, д, J=8,4 Гц), 7,45 (2H, д, J=8,4 Гц).
Ссылочный пример 250
1-(4-метоксибензил)-3-(2-метил-2-оксиранилметил)имидазолидин-2-он
выход 43%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,61 (1H, д, J=4,7 Гц), 2,67 (1H, д, J=4,7 Гц), 3,07-3,23 (3H, м), 3,27-3,50 (2H, м), 3,58 (1H, д, J=14,6 Гц), 3,80 (3H, с), 4,32 (2H, с), 6,86 (2H, д, J=8,4 Гц), 7,19 (2H, д, J=8,4 Гц).
Ссылочный пример 251
1-(4-хлорбензил)-3-(2-метил-2-оксиранилметил)имидазолидин-2-он
Гидрид натрия (99 мг, 2,49 ммоль) добавляли к раствору 2-метил-2-оксиранилметилтолуол-4-сульфоната (500 мг, 2,37 ммоль) в ДМФА (5 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 1 часа. К полученной смеси добавляли при охлаждении на бане со льдом раствор 1-(4-хлорбензил)имидазолидин-2-она (633 мг, 2,61 ммоль) в ДМФА (5 мл) и смесь перемешивали при комнатной температуре в течение ночи. Воду добавляли к реакционной смеси и смесь экстрагировали диэтиловым эфиром два раза. Экстракты объединяли, промывали водой два раза, затем насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/1) с получением 1-(4-хлорбензил)-3-(2-метил-2-оксиранилметил)имидазолидин-2-она (399 мг, 60%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 2,62 (1H, д, J=4,7 Гц), 2,68 (1H, д, J=4,7 Гц), 3,05-3,25 (3H, м), 3,27-3,49 (2H, м), 3,61 (1H, д, J=14,7 Гц), 4,35 (2H, с), 7,21 (2H, дд, J=2,0 Гц, 6,7 Гц), 7,30 (2H, дд, J=2,0 Гц, 6,7 Гц).
Используя соответствующие исходные вещества, соединения ссылочных примеров 252 и 253 получали способом, подобно описанному в ссылочном примере 251.
Ссылочный пример 252
1-(1-бензилпиперидин-4-ил)-3-(2-метил-2-оксиранилметил)имидазолин-2-он
выход 54%
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 1,59-1,80 (4H, м), 2,00-2,16 (2H, м), 2,60 (1H, д, J=4,7 Гц), 2,66 (1H, д, J=4,7 Гц), 2,84-3,00 (2H, м), 3,07 (1H, д, J=14,7 Гц), 3,22-3,43 (4H, м), 3,50 (2H, с), 3,54 (1H, д, J=14,7 Гц), 3,68-3,86 (1H, м), 7,16-7,34 (5H, м).
Ссылочный пример 253
1-(2,4-диметоксибензил)-3-(2-метил-2-оксиранилметил)имидазолин-2-он
выход 40%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,60 (1H, д, J=4,7 Гц), 2,67 (1H, д, J=4,7 Гц), 3,10 (1H, д, J=14,6 Гц), 3,14-3,34 (4H, м), 3,56 (1H, д, J=14,6 Гц), 3,80 (6H, с), 4,35 (2H, с), 6,32-6,43 (2H, м), 7,18 (1H, д, J=8,9 Гц).
Ссылочный пример 254
Получение 1-(2-метил-2-оксиранилметил)пирролидин-2,5-диона
Используя 1-(2-метил-2-пропенил)пирролидин-2,5-дион, 1-(2-метил-2-оксиранилметил)пирролидин-2,5-дион получали способом, подобно описанному в ссылочном примере 228.
выход 86%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,34 (3H, с), 2,58 (1H, д, J=4,6 Гц), 2,67-2,79 (5H, м), 3,56 (1H, д, J=13,9 Гц), 3,84 (1H, д, J=13,9 Гц).
Ссылочный пример 255
Получение 2-(2-метил-2-оксиранилметил)фталимида
Используя 2-(2-метил-2-пропенил)фталимид, 2-(2-метил-2-оксиранилметил)фталимид получали способом, подобно описанному в ссылочном примере 228.
выход 98%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,38 (3H, с), 2,62 (1H, д, J=4,6 Гц), 2,82 (1H, д, J=4,6 Гц), 3,71 (1H, д, J=14,3 Гц), 4,01 (1H, д, J=14,3 Гц), 7,73 (2H, дд, J=2,9 Гц, 8,6 Гц), 7,87 (2H, дд, J=2,9 Гц, 8,6 Гц).
Ссылочный пример 256
Получение 1-(2-метил-2-оксиранилметил)-1H-бензимидазола
Используя 1-(2-метил-2-пропенил)-1H-бензимидазол, 1-(2-метил-2-оксиранилметил)-1H-бензимидазол получали способом, подобно описанному в ссылочном примере 228.
выход 11%
1H-ЯМР (CDCl3) δ м.д.:
1,32 (3H, с), 2,60 (1H, д, J=4,4 Гц), 2,71 (1H, д, J=4,4 Гц), 4,17 (1H, д, J=15,1 Гц), 4,44 (1H, д, J=15,1 Гц), 7,23-7,41 (2H, м), 7,48 (1H, дд, J=2,2 Гц, 7,8 Гц), 7,80 (1H, дд, J=2,2 Гц, 7,8 Гц), 7,93 (1H, с).
Ссылочный пример 257
Получение 1-(2-метил-2-оксиранилметил)-1H-имидазола
Используя 1-(2-метил-2-пропенил)-1H-имидазол, 1-(2-метил-2-оксиранилметил)-1H-имидазол получали способом, подобно описанному в ссылочном примере 228.
выход 53%
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 2,57 (1H, д, J=4,4 Гц), 2,69 (1H, д, J=4,4 Гц), 3,94 (1H, д, J=14,7 Гц), 4,16 (1H, д, J=14,7 Гц), 6,97 (1H, с), 7,08 (1H, с), 7,49 (1H, с).
Ссылочный пример 258
Получение 3-[3-(2-метил-2-оксиранил)пропил]-3H-бензоксазол-2-она
Используя 3-(4-метил-4-пентенил)-3H-бензоксазол-2-он (3,4 г, 15,65 ммоль), 3-[3-(2-метил-2-оксиранил)пропил]-3H-бензоксазол-2-он (3,8 г, количественный) в виде бесцветного кристаллического порошка получали способом, подобно описанному в ссылочном примере 228.
1H-ЯМР (CDCl3) δ м.д.:
1,33 (3H, с), 1,56-1,77 (2H, м), 1,80-1,95 (2H, м), 2,59 (1H, д, J=4,8 Гц), 2,63 (1H, д, J=4,8 Гц), 3,85 (2H, т, J=7,4 Гц), 6,99 (1H, д, J=7,9 Гц), 7,05-7,23 (3H, м).
Ссылочный пример 259
Получение 3-[4-(2-метил-2-оксиранил)бутил]-3H-бензоксазол-2-она
Используя 3-(5-метил-5-гексенил)-3H-бензоксазол-2-он (1,1 г, 4,8 ммоль), 3-[4-(2-метил-2-оксиранил)бутил]-3H-бензоксазол-2-он (1,2 г, количественный) в виде бесцветного масла получали способом, подобно описанному в ссылочном примере 228.
1H-ЯМР (CDCl3) δ м.д.:
1,30 (3H, с), 1,42-1,67 (4H, м), 1,74-1,88 (2H, м), 2,57 (1H, д, J=4,9 Гц), 2,60 (1H, д, J=4,9 Гц), 3,84 (2H, т, J=7,2 Гц), 6,98 (1H, д, J=8,1 Гц), 7,02-7,30 (3H, м).
Ссылочный пример 260
Получение 3-(2-метил-2-оксиранилметил)оксазолидин-2-она
Используя 3-(2-метил-2-пропенил)оксазолидин-2-он (4,28 г, 30,35 ммоль), 3-(2-метил-2-оксиранилметил)оксазолидин-2-он (2,87 г, выход 62%) в виде бесцветного масла получали способом, описанным в ссылочном примере 228.
1H-ЯМР (CDCl3) δ м.д.:
1,36 (3H, с), 2,66 (1H, д, J=4,5 Гц), 2,70 (1H, д, J=4,5 Гц), 3,15 (1H, д, J=14,7 Гц), 3,57-3,75 (3H, м), 4,25-4,39 (2H, м).
Ссылочный пример 261
Получение 3,3-дифтор-1-(2-метил-2-оксиранилметил)-1,3-дигидроиндол-2-она
Используя 3,3-дифтор-1-(2-метил-2-пропенил)-1,3-дигидроиндол-2-он (1,08 г, 4,83 ммоль), 3,3-дифтор-1-(2-метил-2-оксиранилметил)-1,3-дигидроиндол-2-он (1,14 г, выход 99%) в виде бледно-желтого порошка получали способом, подобно описанному в ссылочном примере 228.
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 2,71 (1H, д, J=4,3 Гц), 2,77 (1H, д, J=4,3 Гц), 3,46 (1H, д, J=15,0 Гц), 4,26 (1H, д, J=15,0 Гц), 7,12-7,24 (2H, м), 7,45-7,61 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 262 и 263 получали способом, подобно описанному в ссылочном примере 261.
Ссылочный пример 262
3,3-диметил-1-(2-метил-2-оксиранилметил)-1,3-дигидроиндол-2-он
1H-ЯМР (CDCl3) δ м.д.:
1,31 (3H, с), 1,39 (6H, с), 2,67 (1H, д, J=4,5 Гц), 2,74 (1H, д, J=4,5 Гц), 3,53 (1H, д, J=14,0 Гц), 4,22 (1H, д, J=14,0 Гц), 7,00-7,10 (2H, м), 7,16-7,31 (2H, м).
Ссылочный пример 263
1-(2-метил-2-оксиранилметил)-1,3-дигидроиндол-2-он
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,67 (1H, д, J=4,5 Гц), 2,76 (1H, д, J=4,5 Гц), 3,49-3,61 (3H, м), 4,22 (1H, д, J=14,9 Гц), 7,00-7,10 (2H, м), 7,18-7,35 (2H, м).
Ссылочный пример 264
Получение бензил(2-метил-2-оксиранилметил)карбамата
Бензил-N-(2-метил-2-пропенил)карбамат (3,90 г, 19,0 ммоль), полученный в ссылочном примере 173, растворяли в метиленхлориде (80 мл), к полученному раствору добавляли м-хлорпербензойную кислоту (5,15 г, 20,9 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Водный раствор тиосульфата натрия и насыщенный водный раствор гидрокарбоната натрия добавляли к реакционной смеси и смесь перемешивали в течение некоторого времени. Органический слой отделяли, промывали насыщенным водным раствором гидрокарбоната натрия, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением бензил(2-метил-2-оксиранилметил)карбамата (4,31 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 2,61 (1H, д, J=4,5 Гц), 2,72 (1H, д, J=4,5 Гц), 3,28-3,53 (2H, м), 4,90 (1H, ушир.), 5,11 (2H, с), 7,26-7,44 (5H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 265-276 получали способом, подобно описанному в ссылочном примере 264.
Ссылочный пример 265
Бензил-N-метил-N-(2-метил-2-оксиранилметил)карбамат
выход 42%
1H-ЯМР (CDCl3) δ м.д.:
1,26 (1,5H, с), 1,31 (1,5H, с), 2,57 (1H, с), 2,61 (1H, с), 2,99 (3H, с), 3,24 (1H, д, J=15,1 Гц), 3,62 (0,5H, д, J=15,1 Гц), 3,72 (0,5H, д, J=15,1 Гц), 5,14 (2H, с), 7,27-7,41 (5H, м).
Ссылочный пример 266
4-хлорбензил(2-метил-2-оксиранилметил)карбамат
выход 98%
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 2,62 (1H, д, J=4,4 Гц), 2,71 (1H, д, J=4,4 Гц), 3,27-3,50 (2H, м), 4,88 (1H, ушир.), 5,06 (2H, с), 7,23-7,41 (4H, м).
Ссылочный пример 267
4-фторбензил(2-метил-2-оксиранилметил)карбамат
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,34 (3H, с), 2,61 (1H, д, J=4,5 Гц), 2,71 (1H, д, J=4,5 Гц), 3,32-3,50 (2H, м), 4,86 (1H, ушир.), 5,06 (2H, с), 6,95-7,09 (2H, м), 7,27-7,41 (2H, м).
Ссылочный пример 268
этил(2-метил-2-оксиранилметил)карбамат
выход 82%
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, т, J=7,1 Гц), 1,35 (3H, с), 2,62 (1H, д, J=4,5 Гц), 2,74 (1H, д, J=4,5 Гц), 3,27-3,50 (2H, м), 4,12 (2H, кв. J=7,1 Гц), 4,78 (1H, ушир.).
Ссылочный пример 269
4-трифторметоксибензил(2-метил-2-оксиранилметил)карбамат
выход 99%
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 2,62 (1H, д, J=4,4 Гц), 2,71 (1H, д, J=4,4 Гц), 3,42 (2H, д, J=5,6 Гц), 4,90 (1H, ушир.), 5,10 (2H, с), 7,20 (2H, д, J=8,3 Гц), 7,38 (2H, д, J=8,3 Гц).
Ссылочный пример 270
4-фторбензил-N-метил-N-(2-метил-2-оксиранилметил)карбамат
выход 73%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (1,5H, с), 1,30 (1,5H, с), 2,56 (1H, с), 2,61 (1H, с), 2,97 (3H, с), 3,22 (1H, д, J=14,8 Гц), 3,61 (0,5H, д, J=14,8 Гц), 3,72 (0,5H, д, J=14,8 Гц), 5,10 (2H, с), 6,95-7,09 (2H, м), 7,27-7,41 (2H, м).
Ссылочный пример 271
4-хлорбензилоксиранилметилкарбамат
выход 97%
1H-ЯМР (CDCl3) δ м.д.:
2,59 (1H, дд, J=2,6 Гц, 4,6 Гц), 2,79 (1H, т, J=4,3 Гц), 3,11 (1H, ушир.), 3,20-3,32 (1H, м), 3,50-3,73 (1H, м), 4,93 (1H, ушир.), 5,07 (2H, с), 7,23-7,41 (4H, м).
Ссылочный пример 272
4-фторбензилоксиранилметилкарбамат
выход 89%
1H-ЯМР (CDCl3) δ м.д.:
2,59 (1H, дд, J=2,6 Гц, 4,6 Гц), 2,79 (1H, т, J=4,3 Гц), 3,11 (1H, ушир.), 3,21-3,32 (1H, м), 3,45-3,73 (1H, м), 4,92 (1H, ушир.), 5,07 (2H, с), 6,95-7,09 (2H, м), 7,27-7,41 (2H, м).
Ссылочный пример 273
4-фторбензил-N-метил-N-оксиранилметилкарбамат
выход 34%
1H-ЯМР (CDCl3) δ м.д.:
2,51 (1H, ушир.), 2,76 (1H, ушир.), 3,01 (3H, с), 3,02-3,27 (2H, м), 3,55-3,91 (1H, м), 5,10 (2H, с), 6,95-7,09 (2H, м), 7,27-7,41 (2H, м).
Ссылочный пример 274
трет-бутилоксиранилметилкарбамат
выход 83%
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 2,59 (1H, дд, J=2,6 Гц, 4,6 Гц), 2,78 (1H, т, J=4,4 Гц), 3,09 (1H, ушир.), 3,16-3,28 (1H, м), 3,38-3,66 (1H, ушир.), 4,53-4,91 (1H, ушир.).
Ссылочный пример 275
бензилоксиранилметилкарбамат
выход 72%
1H-ЯМР (ДМСО-d6) δ м.д.:
2,67 (1H, т, J=4,5 Гц), 2,91-3,32 (4H, м), 4,91-5,09 (3H, м), 7,23-7,55 (5H, м).
Ссылочный пример 276
фенилоксиранилметилкарбамат
выход 90%
1H-ЯМР (ДМСО-d6) δ м.д.:
2,57 (1H, дд, J=2,5 Гц, 5,0 Гц), 2,73 (1H, т, J=4,5 Гц), 3,00-3,45 (3H, м), 7,10 (2H, д, J=7,6 Гц), 7,20 (1H, т, J=7,6 Гц), 7,38 (2H, т, J=7,6 Гц), 7,94 (1H, ушир.).
Ссылочный пример 277
Получение (2-метил-2-оксиранилметил)(4-хлорфенил)карбамата
м-Хлорпербензойную кислоту (1,6 г, 6,6 ммоль) добавляли к раствору 2-метил-2-пропенил(4-хлорфенил)карбамата (1,0 г, 4,4 ммоль) в метиленхлориде (20 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 4 часов. К полученной смеси добавляли водный раствор тиосульфата натрия, смесь фильтровали и к фильтрату добавляли водный раствор гидрокарбоната натрия. Органический слой отделяли, сушили над сульфатом магния и концентрировали при пониженном давлении с получением (2-метил-2-оксиранилметил)(4-хлорфенил)карбамата (1,1 г, количественный) в виде бледно-желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,42 (3H, с), 2,71 (1H, д, J=4,6 Гц), 2,82 (1H, д, J=4,6 Гц), 4,01 (1H, д, J=11,9 Гц), 4,37 (1H, д, J=11,9 Гц), 6,79 (1H, ушир.), 7,23-7,37 (4H, м).
Ссылочный пример 278
Получение (2-метил-2-оксиранилметил)-N-(4-хлорфенил)-N-метилкарбамата
м-Хлорпербензойную кислоту (2,5 г, 10,1 ммоль) добавляли к раствору 2-метил-2-пропенил=N-(4-хлорфенил)-N-метилкарбамата (1,78 г, 6,7 ммоль) в метиленхлориде (20 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 6,5 часов. К полученной смеси добавляли водный раствор тиосульфата натрия, смесь фильтровали и к фильтрату добавляли водный раствор гидрокарбоната натрия. Органический слой отделяли, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением (2-метил-2-оксиранилметил)-N-(4-хлорфенил)-N-метилкарбамата (1,7 г, количественный) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,32 (3H, с), 2,62 (1H, д, J=4,6 Гц), 2,69 (1H, д, J=4,6 Гц), 3,30 (3H, с), 3,99 (1H, д, J=11,8 Гц), 4,30 (1H, д, J=11,8 Гц), 7,15-7,25 (2H, м), 7,31-7,38 (2H, м).
Ссылочный пример 279
Получение трет-бутил 4-оксиранилметилпиперазин-1-карбоксилата
Смесь трет-бутилпиперазин-1-карбоксилата (6,2 г, 33,29 ммоль), эпибромгидрина (5,4 г, 39,42 ммоль) и карбоната калия (5,5 г, 39,79 ммоль) в ацетонитриле (70 мл) кипятили с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду. Смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом натрия, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением трет-бутил 4-оксиранилметилпиперазин-1-карбоксилата (6,2 г, выход 77%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 2,21-2,60 (6H, м), 2,70-2,81 (2H, м), 3,05-3,12 (1H, м), 3,35-3,56 (4H, м).
Ссылочный пример 280
Получение трет-бутил[4-(2-метил-2-оксиранилметил)пиперазин-1-ил]карбамата
Смесь (2-метил-2-оксиранилметил)толуол-4-сульфоната (9,75 г, 40,3 ммоль), трет-бутилпиперазин-1-илкарбамата (6,75 г, 33,5 ммоль), полученного в ссылочном примере 36, триэтиламина (7 мл, 50,3 ммоль) и иодида калия (6,68 г, 33,5 ммоль) в ДМФА (70 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (гексан/ацетон=4/1) с получением трет-бутил[4-(2-метил-2-оксиранилметил)пиперазин-1-ил]карбамата (4,66 г, выход 51%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 1,46 (9H, с), 2,31 (1H, д, J=12,9 Гц), 2,49-2,84 (11H, м), 5,37 (1H, ушир.).
Ссылочный пример 281
Получение 3-(2-метил-2-оксиранилметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она
Смесь 5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (3,18 г, 12,92 ммоль), полученного в ссылочном примере 49, (2-метил-2-оксиранилметил)толуол-4-сульфоната (4,80 г, 19,38 ммоль), карбоната калия (2,14 г, 15,50 ммоль) и иодида натрия (2,90 г, 19,38 ммоль) в ДМФА (30 мл) перемешивали при комнатной температуре в течение 24 часов и затем при 60°С в течение 4 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Экстракт промывали водой, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (гексан/этилацетат=9/1) с получением 3-(2-метил-2-оксиранилметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (2,37 г, выход 58%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,43 (3H, с), 2,72 (1H, д, J=4,4 Гц), 2,86 (1H, д, J=4,4 Гц), 3,93 (2H, дд, J=14,8 Гц, 22,2 Гц), 7,28-7,41 (2H, м), 7,83-7,98 (2H, м).
Используя 5-замещенный-3H-[1,3,4]оксадиазол-2-он и (2-метил-2-оксиранилметил)толуол-4-сульфонат, соединения ссылочных примеров 282-289 получали способом, подобно описанному в ссылочном примере 281.
Ссылочный пример 282
3-(2-метил-2-оксиранилметил)-5-фенил-3H-[1,3,4]оксадиазол-2-он
выход 41%
1H-ЯМР (CDCl3) δ м.д.:
1,44 (3H, с), 2,72 (1H, д, J=4,5 Гц), 2,88 (1H, д, J=4,5 Гц), 3,87 (1H, д, J=14,7 Гц), 3,99 (1H, д, J=14,7 Гц), 7,40-7,57 (3H, м), 7,79-7,87 (2H, м).
Ссылочный пример 283
3-(2-метил-2-оксиранилметил)-5-(4-трифторметилфенил)-3H-[1,3,4]оксадиазол-2-он
выход 34%
1H-ЯМР (CDCl3) δ м.д.:
1,45 (3H, с), 2,73 (1H, д, J=4,5 Гц), 2,87 (1H, д, J=4,5 Гц), 3,92 (1H, д, J=14,8 Гц), 4,00 (1H, д, J=14,8 Гц), 7,75 (2H, д, J=8,3 Гц), 8,01 (2H, д, J=8,3 Гц).
Ссылочный пример 284
3-(2-метил-2-оксиранилметил)-5-(4-бифенилил)-3H-[1,3,4]оксадиазол-2-он
выход 38%
1H-ЯМР (CDCl3) δ м.д.:
1,45 (3H, с), 2,73 (1H, д, J=4,5 Гц), 2,89 (1H, д, J=4,5 Гц), 3,89 (1H, д, J=14,8 Гц), 4,00 (1H, д, J=14,8 Гц), 7,33-7,50 (3H, м), 7,57-7,75 (4H, м), 7,93 (2H, д, J=8,6 Гц).
Ссылочный пример 285
3-(2-метил-2-оксиранилметил)-5-(4-хлорфенил)-3H-[1,3,4]оксадиазол-2-он
выход 52%
1H-ЯМР (CDCl3) δ м.д.:
1,44 (3H, с), 2,72 (1H, д, J=4,4 Гц), 2,86 (1H, д, J=4,4 Гц), 3,89 (1H, д, J=14,8 Гц), 3,97 (1H, д, J=14,8 Гц), 7,46 (2H, д, J=8,7 Гц), 7,80 (2H, д, J=8,7 Гц).
Ссылочный пример 286
3-(2-метил-2-оксиранилметил)-5-(4-фторфенил)-3H-[1,3,4]оксадиазол-2-он
выход 72%
1H-ЯМР (CDCl3) δ м.д.:
1,43 (3H, с), 2,72 (1H, д, J=4,5 Гц), 2,87 (1H, д, J=4,5 Гц), 3,88 (1H, д, J=14,7 Гц), 3,96 (1H, д, J=14,7 Гц), 7,11-7,21 (2H, м), 7,74-7,89 (2H, м).
Ссылочный пример 287
3-(2-метил-2-оксиранилметил)-5-[2-(4-хлорфенил)этил]-3H-[1,3,4]оксадиазол-2-он
выход 78%
1H-ЯМР (CDCl3) δ м.д.:
1,32 (3H, с), 2,64 (1H, д, J=4,5 Гц), 2,72 (1H, д, J=4,5 Гц), 2,79-2,90 (2H, м), 2,93-3,04 (2H, м), 3,74 (1H, д, J=14,8 Гц), 3,79 (1H, д, J=14,8 Гц), 7,12 (2H, д, J=8,6 Гц), 7,27 (2H, д, J=8,6 Гц).
Ссылочный пример 288
3-(2-метил-2-оксиранилметил)-5-[2-(4-хлорфенил)винил]-3H-[1,3,4]оксадиазол-2-он
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,41 (3H, с), 2,71 (1H, д, J=4,4 Гц), 2,83 (1H, д, J=4,4 Гц), 3,88 (2H, с), 6,60 (1H, д, J=16,4 Гц), 7,28-7,47 (5H, м).
Ссылочный пример 289
3-(2-метил-2-оксиранилметил)-5-(4-хлорфеноксиметил)-3H-[1,3,4]оксадиазол-2-он
выход 59%
1H-ЯМР (CDCl3) δ м.д.:
1,37 (3H, с), 2,68 (1H, д, J=4,4 Гц), 2,78 (1H, д, J=4,4 Гц), 3,86 (2H, с), 4,90 (2H, с), 6,91 (2H, дд, J=2,3 Гц, 6,9 Гц), 7,29 (2H, дд, J=2,3 Гц, 6,9 Гц).
Ссылочный пример 290
Получение 2-(2-метил-2-оксиранилметил)-1,1-диоксо-1,2-дигидробензо[d]изотиазол-3-она
Используя сахарин и (2-метил-2-оксиранилметил)толуол-4-сульфонат, 2-(2-метил-2-оксиранилметил)-1,1-диоксо-1,2-дигидробензо[d]изотиазол-3-он получали способом, подобно описанному в ссылочном примере 281.
бесцветный кристаллический порошок, выход 43%
1H-ЯМР (CDCl3) δ м.д.:
1,49 (3H, с), 2,74 (1H, д, J=4,5 Гц), 2,96 (1H, д, J=4,5 Гц), 3,73 (1H, д, J=15,5 Гц), 4,04 (1H, д,, J=15,5 Гц), 7,81-8,00 (3H, м), 8,09 (1H, дд, J=2,4 Гц, 6,6 Гц).
Ссылочный пример 291
Получение 1-(2-метил-2-оксиранилметил)пиперидин-4-она
Используя моногидрат-гидрат 4-пиперидонгидрохлорида, 1-(2-метил-2-оксиранилметил)пиперидин-4-он получали способом, подобно описанному в ссылочном примере 281.
бесцветное масло, выход 50%
1H-ЯМР (CDCl3) δ м.д.:
1,43 (3H, с), 2,35-2,51 (5H, м), 2,58-2,93 (7H, м).
Ссылочный пример 292
Получение 4-(2-метил-2-оксиранилметил)-1-(4-трифторметилбензил)пиперазин-2-она
Используя 1-(4-трифторметилбензил)пиперазин-2-он, 4-(2-метил-2-оксиранилметил)-1-(4-трифторметилбензил)пиперазин-2-он получали способом, подобно описанному в ссылочном примере 281.
бесцветный кристаллический порошок, выход 63%
1H-ЯМР (CDCl3) δ м.д.:
1,37 (3H, с), 2,34 (1H, д, J=12,9 Гц), 2,53-2,67 (4H, м), 2,77-2,91 (1H, м), 3,14-3,37 (4H, м), 4,62 (1H, д, J=15,1 Гц), 4,69 (1H, д, J=15,1 Гц), 7,38 (2H, д, J=8,2 Гц), 7,60 (2H, д, J=8,2 Гц).
Ссылочный пример 293
Получение 4-(2-метил-2-оксиранилметил)-1-(трет-бутил)пиперазин-2-она
Используя 1-(трет-бутил)пиперазин-2-он, 4-(2-метил-2-оксиранилметил)-1-(трет-бутил)пиперазин-2-он получали способом, подобно описанному в ссылочном примере 281.
бесцветный кристаллический порошок, выход 39%
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 1,45 (9H, с), 2,31 (1H, д, J=12,9 Гц), 2,42-2,55 (4H, м), 2,74-2,88 (1H, м), 3,02 (1H, д, J=16,1 Гц), 3,20 (1H, д, J=16,1 Гц), 3,28-3,37 (2H, м).
Ссылочный пример 294
Получение (S)-1-(2-метил-2-оксиранилметил)-4-(4-трифторметоксифенил)пиперазина
Раствор (2-метил-2-оксиранилметил)-(R)-толуол-4-сульфоната (0,80 г, 3,30 ммоль), 1-(4-трифторметоксифенил)пиперазина (0,91 г, 3,36 ммоль) и триэтиламина (0,55 мл, 3,96 ммоль) в ДМФА (8 мл) перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением (S)-1-(2-метил-2-оксиранилметил)-4-(4-трифторметоксифенил)пиперазина (0,46 г, выход 44%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,40 (3H, с), 2,34 (1H, д, J=12,9 Гц), 2,52-2,77 (7H, м), 3,10-3,27 (4H, м), 6,81-6,94 (2H, м), 7,06-7,17 (2H, м).
Ссылочный пример 295
Получение этил-(S)-1-(2-метил-2-оксиранилметил)пиперидин-4-карбоксилата
Раствор (2-метил-2-оксиранилметил)-(R)-толуол-4-сульфоната (13,5 г, 55,8 ммоль), этилпиперидин-4-карбоксилата (8,9 г, 50,9 ммоль) и триэтиламина (6,5 г, 64,4 ммоль) в ДМФА (70 мл) перемешивали при комнатной температуре в течение 2 суток. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) с получением этил-(S)-1-(2-метил-2-оксиранилметил)пиперидин-4-карбоксилата (5,4 г, выход 47%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, т, J=7,1 Гц), 1,36 (3H, с), 1,67-1,93 (4H, м), 1,97-2,08 (2H, м), 2,19-2,37 (2H, м), 2,48 (1H, д, J=11,5 Гц), 2,58 (2H, с), 2,78-2,97 (2H, м), 4,13 (2H, кв. J=7,1 Гц).
Используя соответствующие исходные вещества, соединения ссылочных примеров 296-299 получали способом, подобно описанному в ссылочном примере 295.
Ссылочный пример 296
4-трифторметилбензил-(S)-1-(2-метил-2-оксиранилметил)пиперидин-4-карбоксилат
бесцветное масло, выход 18%
1H-ЯМР (CDCl3) δ м.д.:
1,35 (3H, с), 1,69-2,10 (6H, м), 2,25-2,37 (1H, м), 2,28 (1H, д, J=12,9 Гц), 2,48 (1H, д, J=12,9 Гц), 2,58 (2H, с), 2,81-3,00 (2H, м), 5,11 (2H, с), 7,20 (2H, д, J=8,0 Гц), 7,38 (2H, д, J=8,0 Гц).
Ссылочный пример 297
4-хлорбензил-(S)-1-(2-метил-2-оксиранилметил)пиперидин-4-карбоксилат
бесцветное масло, выход 26%
1H-ЯМР (CDCl3) δ м.д.:
1,36 (3H, с), 1,75-2,16 (7H, м), 2,27 (1H, д, J=12,9 Гц), 2,50 (1H, д, J=12,9 Гц), 2,58 (2H, с), 2,87-3,09 (2H, м), 5,13 (2H, с), 7,17-7,21 (2H, м), 7,27-7,31 (2H, м).
Ссылочный пример 298
N-(4-хлорбензил)-(S)-1-(2-метил-2-оксиранилметил)пиперидин-4-карбоксамид
бесцветное масло, выход 26%
1H-ЯМР (CDCl3) δ м.д.:
1,36 (3H, с), 1,75-2,16 (7H, м), 2,27 (1H, д, J=12,9 Гц), 2,50 (1H, д, J=12,9 Гц), 2,58 (2H, с), 2,87-3,09 (2H, м), 4,41 (2H, д, J=5,8 Гц), 5,78 (1H, ушир.), 7,17-7,21 (2H, м), 7,27-7,31 (2H, м).
Ссылочный пример 299
N-(4-хлорфенил)-(S)-1-(2-метил-2-оксиранилметил)пиперидин-4-карбоксамид
бесцветное масло, выход 33%
1H-ЯМР (CDCl3) δ м.д.:
1,37 (3H, с), 1,82-2,08 (6H, м), 2,13-2,27 (1H, м), 2,30 (1H, д, J=13,0 Гц), 2,53 (1H, д, J=13,0 Гц), 2,60 (2H, с), 2,93-3,12 (2H, м), 7,16 (1H, ушир.с), 7,26-7,31 (2H, м), 7,45-7,49 (2H, м).
Ссылочный пример 300
Получение 5-(2-метил-2-оксиранилметилсульфанил)-1-фенил-1H-тетразола
Смесь 1-фенил-5-меркапто-1H-тетразола (3,5 г, 19,64 ммоль), (2-метил-2-оксиранилметил)толуол-4-сульфоната (5 г, 20,64 ммоль), карбоната калия (3 г, 21,71 ммоль) и иодида натрия (4,5 г, 30,02 ммоль) в ДМФА (30 мл) перемешивали при 60°С в течение 6 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом два раза. Экстракты объединяли, промывали 5% водным раствором гидроксида натрия и затем водой три раза и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=2/1) с получением 5-(2-метил-2-оксиранилметилсульфанил)-1-фенил-1H-тетразола (1,9 г, выход 39%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (3H, с), 2,73 (1H, д, J=4,5 Гц), 2,91 (1H, д, J=4,5 Гц), 3,61 (1H, д, J=13,9 Гц), 3,77 (1H, д, J=13,9 Гц), 7,50-7,65 (5H, м).
Ссылочный пример 301
Получение трет-бутил 3-(2-метил-2-оксиранил)пропионата
Иодид триметилсульфоксония (19,54 г, 88,78 ммоль) добавляли к суспензии гидрида натрия (3,71 г, 92,82 ммоль) в ДМСО (50 мл) при охлаждении на бане со льдом и смесь перемешивали в течение 2,5 часов. К полученной смеси добавляли раствор трет-бутил 4-оксопентаноата (13,90 г, 80,71 ммоль) в ДМСО (20 мл) и смесь перемешивали при комнатной температуре в течение 15 часов. Смесь выливали в ледяную воду и экстрагировали диэтиловым эфиром. Экстракт промывали водой, сушили над сульфатом магния и концентрировали при пониженном давлении с получением трет-бутил 3-(2-метил-2-оксиранил)пропионата (10,1 г, выход 67%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,32 (3H, с), 1,44 (9H, с), 1,85-1,94 (2H, м), 2,27-2,33 (2H, м), 2,58 (1H, д, J=4,7 Гц), 2,63 (1H, д, J=4,7 Гц).
Ссылочный пример 302
Получение 2-изопропил-2-метоксиметоксиметилоксирана
м-Хлорпербензойную кислоту (213 г, 861 ммоль) постепенно добавляли к раствору 2-метоксиметоксиметил-3-метил-1-бутена (89 г, 615 ммоль) в метиленхлориде (800 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь промывали 10% водным раствором сульфида калия и водным раствором гидрокарбоната натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении с получением 2-изопропил-2-метоксиметоксиметилоксирана (98 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
0,95 (3H, д, J=7,0 Гц), 1,02 (3H, д, J=7,0 Гц), 1,84-2,05 (1H, м), 2,66 (1H, д, J=4,9 Гц), 2,75 (1H, д, J=4,9 Гц), 3,37 (3H, с), 3,63 (1H, д, J=11,3 Гц), 3,70 (1H, д, J=11,3 Гц), 4,62 (2H, с).
Ссылочный пример 303
Получение 2-этил-2-метоксиметоксиметилоксирана
м-Хлорпербензойную кислоту (143,7 г, 833 ммоль) постепенно добавляли к раствору 2-метоксиметоксиметил-1-бутена (98 г, 757 ммоль), полученного в ссылочном примере 206, в метиленхлориде (8800 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали водой, 10% водным раствором сульфида натрия и водным раствором гидрокарбоната натрия, сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением 2-этил-2-метоксиметоксиметилоксирана (111 г, количественный) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
0,96 (3H, т, J=7,5 Гц), 1,60-1,73 (1H, м), 1,77-1,93 (1H, м), 2,66 (1H, д, J=4,8 Гц), 2,74 (1H, д, J=4,8 Гц), 3,37 (3H, с), 3,56 (1H, д, J=11,2 Гц), 3,65 (1H, д, J=11,2 Гц), 4,64 (2H, с).
Ссылочный пример 304
Получение 2-(2-метоксиметоксиэтил)оксирана
м-Хлорпербензойную кислоту (20,6 г, 95,6 ммоль) постепенно добавляли к раствору 4-метоксиметокси-1-бутена (10,46 г, 90,1 ммоль) в метиленхлориде (250 мл) при охлаждении на бане со льдом и смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь фильтровали и фильтрат промывали 10% водным раствором сульфида натрия и водным раствором гидрокарбоната натрия и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 2-(2-метоксиметоксиэтил)оксирана (10,3 г, 86%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,69-1,96 (2H, м), 2,53 (1H, дд, J=2,7 Гц, 4,9 Гц), 2,79 (1H, т, J=4,9 Гц), 3,02-3,08 (1H, м), 3,38 (3H, с), 3,68 (2H, т, J=5,9 Гц), 4,64 (2H, с).
Ссылочный пример 305
Получение 4-(4-трифторметилфенокси)пиперидин-1-карбонилхлорида
Смесь 4-(4-трифторметилфенокси)пиперидина (0,6 г, 2,45 ммоль), трифосгена (0,25 г, 0,86 ммоль) и пиридина (0,4 мл, 4,90 ммоль) в толуоле (6 мл) кипятили с обратным холодильником в течение 2,5 часов. К полученной смеси добавляли этилацетат и смесь промывали 10% хлористоводородной кислотой и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 4-(4-трифторметилфенокси)пиперидин-1-карбонилхлорида (0,72 г, выход 96%) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,79-2,10 (4H, м), 3,50-3,96 (4H, м), 4,58-4,75 (1H, м), 6,97 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц).
Ссылочный пример 306
Получение 4-(4-трифторметилфениламино)пиперидин-1-карбонилхлорида
Смесь (4-трифторметилфениламино)пиперидина (1,14 г, 4,67 ммоль), трифосгена (0,55 г, 1,87 ммоль) и триэтиламина (0,98 мл, 7,01 ммоль) в метиленхлориде (10 мл) перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь промывали водой и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 4-(4-трифторметилфениламино)пиперидин-1-карбонилхлорида (1,43 г, количественный) в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,33-1,65 (2H, м), 2,09-2,24 (2H, м), 3,02-3,22 (1H, м), 3,22-3,41 (1H, м), 3,48-3,70 (1H, м), 4,20-4,35 (2H, м), 6,66 (2H, д, J=8,5 Гц), 7,43 (2H, д, J=8,5 Гц).
Как показано в ссылочном примере 305 или 306, аминам, циклическим аминам и конденсированным с бензолом гетероциклическим соединениям давали возможность взаимодействовать в присутствии трифосгена и триэтиламина или пиридина с получением соединения ссылочных примеров 307-324.
Ссылочный пример 307
5-хлор-2,3-дигидроиндол-1-карбонилхлорид
бледно-желтый кристаллический порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
3,19 (2H, т, J=8,3 Гц), 4,28 (2H, т, J=8,3 Гц), 7,18-7,22 (2H, м), 7,80 (1H, д, J=9,5 Гц).
Ссылочный пример 308
6-хлор-3,4-дигидро-1H-изохинолин-2-карбонилхлорид
бледно-желтое масло, выход 100%
2,83-3,00 (2H, м), 3,83 (1H, т, J=6,0 Гц), 3,90 (1H, т, J=6,0 Гц), 4,71 (1H, с), 4,80 (1H, с), 7,06 (1H, д, J=8,0 Гц), 7,13-7,28 (2H, м).
Ссылочный пример 309
6-хлор-3,4-дигидро-2H-хинолин-1-карбонилхлорид
желтое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,99-2,09 (2H, м), 2,79 (2H, т, J=6,5 Гц), 3,94 (2H, т, J=6,3 Гц), 7,14-7,20 (2H, м), 7,62 (1H, д, J=8,5 Гц).
Ссылочный пример 310
5-хлор-1,3-дигидроизоиндол-2-карбонилхлорид
желтое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
3,19 (2H, т, J=8,3 Гц), 4,28 (2H, т, J=8,3 Гц), 7,18-7,22 (2H, м), 7,80 (1H, д, J=9,5 Гц).
Ссылочный пример 311
трет-бутил 4-хлоркарбонилпиперазин-1-карбоксилат
бледно-желтый кристаллический порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 3,16-3,29 (2H, м), 3,37-3,55 (4H, м), 3,55-3,78 (2H, м).
Ссылочный пример 312
4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-карбонилхлорид
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
3,43-3,80 (8H, м), 5,15 (2H, с), 7,15-7,25 (2H, м), 7,33-7,45 (2H, м).
Ссылочный пример 313
4-[3-(4-трифторметилфенил)-2-пропенилоксикарбонил]пиперазин-1-карбонилхлорид
выход 100%
1H-ЯМР (CDCl3) δ м.д.:
3,54-3,65 (4H, м), 3,65-3,72 (2H, м), 3,72-3,83 (2H, м), 4,80 (2H, дд, J=1,1 Гц, 6,1 Гц), 6,39 (1H, дт, J=6,1 Гц, 15,9 Гц), 6,68 (1H, д, J=15,9 Гц), 7,49 (2H, д, J=8,4 Гц), 7,59 (2H, д, J=8,4 Гц).
Ссылочный пример 314
4-(4-хлорбензил)пиперазин-1-карбонилхлорид
коричневое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,65-2,96 (4H, м), 3,67-4,08 (6H, м), 7,36-7,39 (4H, м).
Ссылочный пример 315
4-(4-трифторметилбензил)пиперазин-1-карбонилхлорид
коричневое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,97-3,12 (4H, м), 3,91-4,06 (2H, м), 4,06-4,21 (2H, м), 4,15 (2H, с), 7,58-7,73 (4H, м).
Ссылочный пример 316
4-(4-трифторметоксибензил)пиперазин-1-карбонилхлорид
коричневое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,58-2,85 (4H, м), 3,58-3,90 (6H, м), 7,17-7,25 (2H, м), 7,35-7,46 (2H, м).
Ссылочный пример 317
4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорид
бледно-коричневое масло, выход 57%
1H-ЯМР (CDCl3) δ м.д.:
2,54-2,67 (2H, м), 3,85 (1H, т, J=5,7 Гц), 3,94 (1H, т, J=5,7 Гц), 4,28 (1H, д, J=2,7 Гц), 4,36 (1H, д, J=2,7 Гц), 5,94-6,06 (1H, м), 7,16-7,21 (2H, м), 7,36-7,41 (2H, м).
Ссылочный пример 318
4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорид
бледно-коричневое масло, выход 60%
1H-ЯМР (CDCl3) δ м.д.:
2,54-2,67 (2H, м), 3,51 (1H, т, J=5,6 Гц), 3,81 (3H, с), 3,92-4,02 (1H, м), 4,23-4,31 (1H, м), 4,31-4,37 (1H, м), 5,87-5,96 (1H, м), 6,85-6,90 (2H, м), 7,29-7,35 (2H, м).
Ссылочный пример 319
4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорид
бледно-коричневое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,58-2,71 (2H, м), 3,87 (1H, т, J=5,7 Гц), 3,96 (1H, т, J=5,7 Гц), 4,31 (1H, д, J=2,8 Гц), 4,39 (1H, д, J=2,8 Гц), 6,04-6,15 (1H, м), 7,45-7,63 (4H, м).
Ссылочный пример 320
4-(4-бромфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорид
бледно-коричневое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,52-2,67 (2H, м), 3,84 (1H, т, J=5,7 Гц), 3,93 (1H, т, J=5,7 Гц), 4,27 (1H, д, J=2,6 Гц), 4,35 (1H, д, J=2,6 Гц), 5,94-6,06 (1H, м), 7,21-7,24 (2H, м), 7,43-7,49 (2H, м).
Ссылочный пример 321
4-(4-фторфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорид
бледно-коричневое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,54-2,67 (2H, м), 3,84 (1H, т, J=5,7 Гц), 3,93 (1H, т, J=5,7 Гц), 4,27 (1H, д, J=2,6 Гц), 4,35 (1H, д, J=2,6 Гц), 5,90-6,00 (1H, м), 7,00-7,07 (2H, м), 7,24-7,35 (2H, м).
Ссылочный пример 322
N-(4-хлорфенил)-N-циклогексилкарбамилхлорид
бледно-желтый кристаллический порошок, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
0,79-1,06 (1H, м), 1,14 (2H, т, J=3,5 Гц, 12,5 Гц), 1,23-1,44 (2H, м), 1,50-65 (1H, м), 1,67-1,81 (2H, м), 1,87-2,00 (2H, м), 4,78 (1H, м), 7,06-7,10 (2H, м), 7,36-7,41 (2H, м).
Ссылочный пример 323
N-метил-N-(4-трифторметоксибензил)карбамилхлорид
желтое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
3,09 (3H, с), 4,58 (2H, с), 7,16-7,33 (4H, м).
Ссылочный пример 324
4-[(4-трифторметилбензилиден)амино]пиперазин-1-карбонилхлорид
коричневое масло, выход 100%
1H-ЯМР (CDCl3) δ м.д.:
3,17-3,39 (4H, м), 3,74-4,02 (4H, м), 7,56 (1H, с), 7,60 (2H, д, J=8,3 Гц), 7,69 (2H, д, J=8,3 Гц).
Ссылочный пример 325
Получение 4-(4-трифторметоксифенил)пиперазин-1-карбонилхлорида
Смесь 1-(4-трифторметоксифенил) пиперазина (1,0 г, 4,1 ммоль), трифосгена (0,42 г, 1,4 ммоль) и пиридина (0,66 мл, 8,2 ммоль) в толуоле (20 мл) перемешивали при 100°С в течение 4,5 часов. Затем добавляли этилацетат и смесь промывали водой и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением 4-(4-трифторметоксифенил)пиперазин-1-карбонилхлорида (1,3 г, количественный) в виде коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
3,08-3,30 (4H, м), 3,67-4,00 (4H, м), 6,79-6,98 (2H, м), 7,08-7,17 (2H, м).
Используя соответствующие исходные вещества, соединения ссылочных примеров 326-332 получали количественно способом, подобно описанному в ссылочном примере 325.
Ссылочный пример 326
4-(4-трифторметилфенил)пиперазин-1-карбонилхлорид
1H-ЯМР (CDCl3) δ м.д.:
3,26-3,39 (4H, м), 3,76-3,87 (2H, м), 3,87-3,98 (2H, м), 6,87-6,98 (2H, м), 7,48-7,59 (2H, м).
Ссылочный пример 327
4-(4-метоксифенил)пиперазин-1-карбонилхлорид
1H-ЯМР (CDCl3) δ м.д.:
3,04-3,15 (4H, м), 3,52-3,75 (2H, м), 3,75-3,92 (2H, м), 3,78 (3H, с), 6,81-6,98 (4H, м).
Ссылочный пример 328
4-(4-хлорфенил)пиперазин-1-карбонилхлорид
1H-ЯМР (CDCl3) δ м.д.:
3,10-3,25 (4H, м), 3,37-3,52 (2H, м), 3,73-3,90 (2H, м), 6,83-6,88 (2H, м), 7,20-7,25 (2H, м).
Ссылочный пример 329
4-(3-хлорфенил)пиперазин-1-карбонилхлорид
1H-ЯМР (CDCl3) δ м.д.:
3,15-3,29 (4H, м), 3,73-3,94 (4H, м), 6,77-6,81 (1H, м), 6,88-6,91 (2H, м), 7,20 (1H, т, J=8,3 Гц).
Ссылочный пример 330
4-(3,4-дихлорфенил)пиперазин-1-карбонилхлорид
1H-ЯМР (CDCl3) δ м.д.:
3,08-3,27 (4H, м), 3,37-3,48 (2H, м), 3,60-3,73 (1H, м), 3,73-3,90 (1H, м), 6,75 (1H, дд, J=2,9 Гц, 9,0 Гц), 6,96-6,98 (1H, м), 7,30 (1H, дд, J=5,1 Гц, 9,0 Гц).
Ссылочный пример 331
4-(4-фторфенил)пиперазин-1-карбонилхлорид
1H-ЯМР (CDCl3) δ м.д.:
3,04-3,19 (4H, м), 3,40-3,50 (2H, м), 3,62-3,75 (1H, м), 3,75-3,92 (1H, м), 6,86-7,03 (4H, м).
Ссылочный пример 332
4-(3-трифторметилфенил)пиперазин-1-карбонилхлорид
1H-ЯМР (CDCl3) δ м.д.:
3,21-3,35 (4H, м), 3,42-3,54 (2H, м), 3,77-3,96 (2H, м), 7,02-7,19 (3H, м), 7,31-7,46 (1H, м).
Ссылочный пример 333
Получение трет-бутил 4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-карбоксилата
Смесь трет-бутил 4-пиперидин-4-илпиперазин-1-карбоксилата (1,5 г, 5,67 ммоль), 4-(трифторметокси)бромбензола (3,36 г, 13,92 ммоль), ацетата палладия (25 мг, 0,11 ммоль), BINAP (87 мг, 0,14 ммоль) и трет-бутоксида натрия (1,07 г, 11,14 ммоль) в толуоле (20 мл) перемешивали при 80°C в атмосфере азота в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры, затем добавляли этилацетат (10 мл) и насыщенный раствор соли (20 мл) и смесь фильтровали. Органический слой отделяли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением трет-бутил 4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-карбоксилата (1,01 г, 42%) в виде желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 1,52-1,75 (2H, м), 1,83-1,99 (2H, м), 2,31-2,52 (5H, м), 2,64-2,81 (2H, м), 3,36-3,49 (4H, м), 3,62-3,75 (2H, м), 6,86 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц).
Ссылочный пример 334
Получение 1-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазина
Трет-бутил 4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-карбоксилат (1 г, 2,33 ммоль) растворяли в метиленхлориде (10 мл), к полученному раствору добавляли при охлаждении на бане со льдом трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали 25% водным раствором гидроксида натрия (40 мл) и насыщенным раствором соли (10 мл) и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали с получением 1-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазина (770 мг, количественный) в виде желтой аморфной формы.
1H-ЯМР (CDCl3) δ м.д.:
1,52-1,75 (2H, м), 1,83-1,99 (2H, м), 2,25-2,38 (1H, м), 2,48-2,76 (6H, м), 2,79-2,99 (4H, м), 3,56-3,75 (2H, м), 6,89 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц).
Следующие соединения получали способом, подобно описанному в ссылочном примере 334.
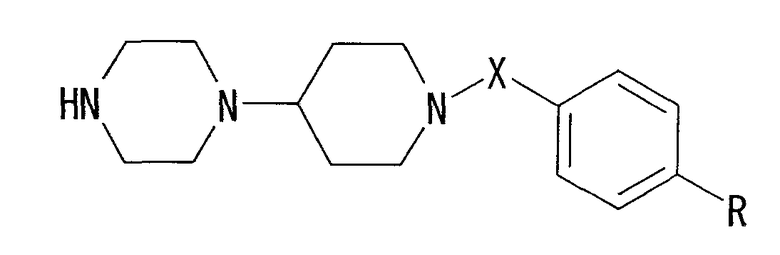
пример
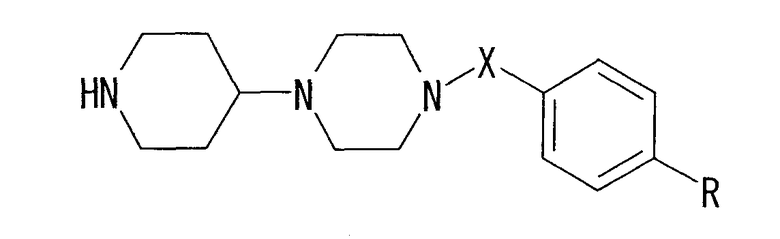
пример
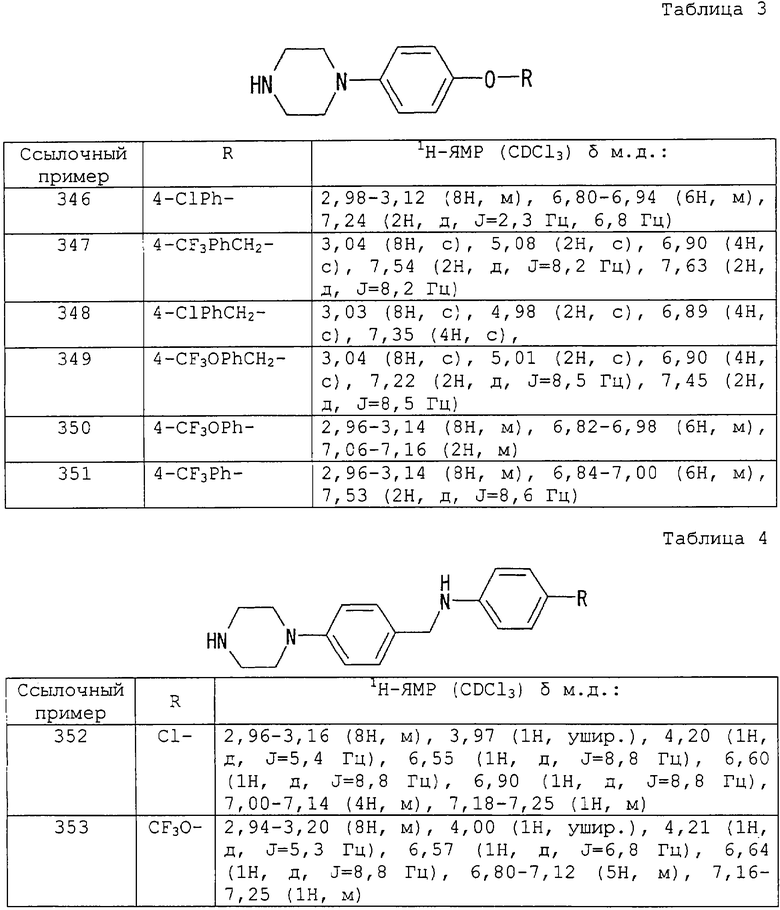

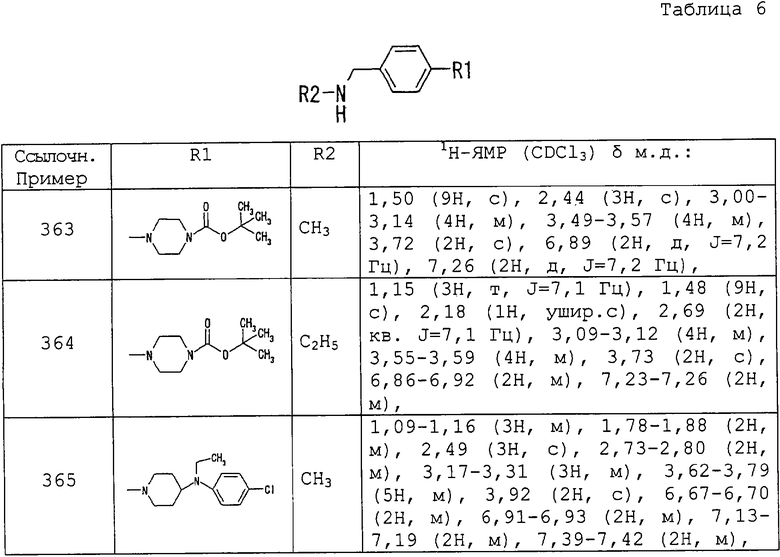



Следующие соединения получали способом, подобно описанному в ссылочном примере 186.
Ссылочный пример 372
1-(4-Гидроксифенил)-4-фенилпиперидин-4-ол
МС: 269(M+)
Ссылочный пример 373
4-(4-хлорфенил)-1-(4-гидроксифенил)пиперидин-4-ол
МС: 349(M+-1)
Ссылочный пример 374
1-(4-гидроксифенил)-4-(4-трифторметоксифенил)пиперидин-4-ол
МС: 353(M+)
Ссылочный пример 375
(4-гидроксифенил)-[4-(4-трифторметоксифенокси)пиперидин-1-ил]метанон
МС: 381(M+)
Ссылочный пример 376
трет-бутил 1-(4-гидроксифенил)пиперидин-4-карбоксилат
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 1,76-2,05 (4H, м), 2,23-2,34 (1H, м), 2,62-2,73 (2H, м), 3,39-3,48 (2H, м), 4,39-4,49 (1H, м), 4,78 (1H, с), 6,72-6,78 (2H, м), 6,82-6,89 (2H, м).
Ссылочный пример 377
4-(4-фенилпиперидин-1-ил)фенол
МС: 253(M+)
Ссылочный пример 378
4-(4,4-диэтоксипиперидин-1-ил)фенол
МС: 265(M+)
Ссылочный пример 379
2-диметиламинометил-4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]фенол
МС: 410(M+)
Ссылочный пример 380
4-(4-[1,3]диоксолан-2-илпиперидин-1-ил)фенол
1H ЯМР (CDCl3) δ м.д.:
1,51-1,70 (2H, м), 1,80-1,92 (2H, м), 2,53-2,66 (2H, м), 3,48-3,57 (2H, м), 3,84-3,92 (2H, м), 3,92-4,02 (2H, м), 4,63 (1H, ушир.с), 4,69 (1H, д, J=4,9 Гц), 6,70-6,78 (2H, м), 6,83-6,91 (2H, м).
Ссылочный пример 381
4-[4-(4-трифторметоксифенил)пиперазин-1-ил]фенол
МС: 337(M+)
Ссылочный пример 382
трет-бутил 4-(4-гидроксифенокси)пиперидин-1-карбоксилат
МС: 293(M+)
Ссылочный пример 383
4-[1-(4-трифторметилфенил)пиперидин-4-илокси]фенол
МС: 337(M+)
Ссылочный пример 384
4-(1,4-диокса-8-азаспиро[4,5]декан-8-ил)фенол
1H ЯМР (CDCl3) δ м.д.:
1,87 (4H, т, J=5,7 Гц), 3,18 (4H, т, J=5,7 Гц), 3,99 (4H, с), 6,74 (2H, д, J=8,9 Гц), 6,88 (2H, д, J=8,9 Гц).
Ссылочный пример 385
4-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)фенол
МС: 251(M+)
Ссылочный пример 386
трет-бутил 4-(4-гидроксифенил)пиперазин-1-карбоксилат
1H ЯМР (CDCl3) δ м.д.:
1,49 (9H, с), 2,95-3,00 (4H, м), 3,55-3,60 (4H, м), 5,77 (1H, с), 6,74-6,86 (4H, м).
Ссылочный пример 387
4-[4-(4-трифторметоксифенил)пиперазин-1-ил]фенол
1H ЯМР (CDCl3) δ м.д.:
3,19-3,24 (4H, м), 3,29-3,34 (4H, м), 4,51 (1H, с), 6,76-6,82 (2H, м), 6,87-6,97 (4H, м), 7,11-7,16 (2H, м).
Ссылочный пример 388
4-{4-[(4-трифторметоксибензилиден)амино]пиперазин-1-ил}фенол
МС: 349(M+-1)
Ссылочный пример 389
4-[4-(4-хлорбензил)пиперазин-1-ил]фенол
1H ЯМР (CDCl3) δ м.д.:
2,60 (4H, т, J=4,8 Гц), 3,08 (4H, т, J=4,8 Гц), 3,53 (2H, с), 6,71-6,78 (2H, м), 6,81-6,89 (2H, м), 7,27-7,42 (4H, м).
Ссылочный пример 390
3-(4-гидроксифенил)оксазолидин-2-он
1H ЯМР (CDCl3) δ м.д.:
3,94-4,01 (2H, м), 4,35-4,42 (2H, м), 6,73-6,80 (2H, м), 7,29-7,36 (2H, м), 9,34 (1H, с).
Ссылочный пример 391
4-(4-пиридил)фенол
1H ЯМР (CDCl3) δ м.д.:
6,87-6,93 (2H, м), 7,60-7,70 (4H, м), 8,54-8,57 (2H, м), 9,85 (1H, с).
Ссылочный пример 392
4-гидрокси-N-(4-трифторметоксифенил)бензамид
1H ЯМР (CDCl3) δ м.д.:
6,84-6,87 (2H, м), 7,31-7,34 (2H, м), 7,83-7,87 (4H, м), 10,11 (1H, ушир.с), 10,15 (1H, ушир.с).
Ссылочный пример 393
(4-гидроксифенил)-(4-трифторметоксифенил)метанон
1H ЯМР (CDCl3) δ м.д.:
6,08 (1H, с), 6,92-6,96 (2H, м), 7,30-7,33 (2H, м), 7,76-7,83 (4H, м).
Ссылочный пример 394
(4-гидроксифенил)-(4-трифторметилфенил)метанон
МС: 266(M+)
Ссылочный пример 395
4-(4-трифторметоксифенокси)фенол
1H ЯМР (CDCl3) δ м.д.:
4,67 (1H, ушир.с), 6,81-6,85 (2H, м), 6,90-6,96 (4H, м), 7,13-7,16 (2H, м).
пример

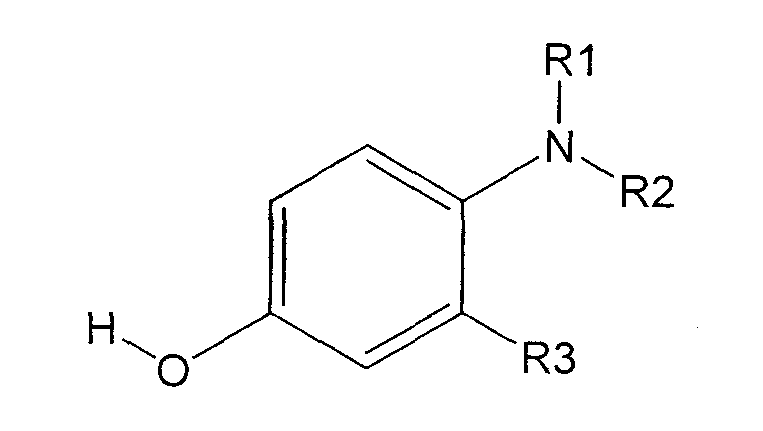

пример
пример







Пример 1
Получение 2-хлор-1-(3-хлор-2-гидроксипропил)-4-нитроимидазола
Гидрокарбонат натрия (1,25 г, 14,91 ммоль) добавляли к раствору 2-хлор-4-нитро-1H-имидазола (2 г, 13,56 ммоль) и эпихлоргидрина (1,38 г, 14,91 ммоль) в ацетонитриле (60 мл) и полученную смесь перемешивали при кипячении с обратным холодильником в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду (20 мл), полученную смесь экстрагировали метиленхлоридом (15 мл) два раза, экстракты сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (этилацетат/н-гексан=1/1) с получением 2-хлор-1-(3-хлор-2-гидроксипропил)-4-нитроимидазола (2,04 г, выход 63%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
3,51-3,70 (2H, м), 4,02-4,35 (4H, м), 7,92 (1H, с).
Пример 2
Получение 2-хлор-4-нитро-1-(оксиран-2-илметил)имидазола
2-Хлор-1-(3-хлор-2-гидроксипропил)-4-нитроимидазол, полученный в примере 1, (2,04 г, 8,5 ммоль) растворяли в метиленхлориде (20 мл) и 1,8-диазабицикло[5,4,0]-7-ундецен (DBU) (2,04 мл, 13,67 ммоль) добавляли к раствору. Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали 3 н. хлористоводородной кислотой (20 мл) и насыщенным раствором соли (20 мл) в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением 2-хлор-4-нитро-1-(оксиран-2-илметил)имидазола (190 мг, выход 11%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
2,55-2,69 (1H, м), 2,97 (1H, т, J=4,2 Гц), 3,26-3,43 (1H, м), 3,94 (1H, дд, J=6,4 Гц, 15,0 Гц), 4,52 (1H, дд, J=2,6 Гц, 15,0 Гц), 7,88 (1H, с).
Пример 3
Получение 2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола
2-Хлор-4-нитро-1H-имидазол (6,78 г, 46 ммоль) и 2-метилоксиран-2-илметил-4-нитробензоат (12 г, 51 ммоль) растворяли в этилацетате (24 мл) и триэтиламин (1,3 мл, 9,2 ммоль) добавляли к раствору. Полученную смесь перемешивали при кипячении с обратным холодильником в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении и метиленхлорид (40 мл) добавляли к остатку. Полученные осадки отфильтровывали и растворяли в метаноле (120 мл). К раствору добавляли карбонат калия (318 мг, 2,3 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. К полученной смеси 6 н. хлористоводородную кислоту (0,8 мл) и сульфат магния (8 г) добавляли в указанном порядке при охлаждении на бане со льдом и полученную смесь перемешивали в течение 30 минут. Нерастворимые вещества удаляли фильтрованием через Целит и фильтрат концентрировали при пониженном давлении. К остатку добавляли этилацетат (6 мл) и толуол (60 мл). Полученные осадки отфильтровывали и сушили при 50°C с получением 2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола (7,88 г, выход 72%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,02 (3H, с), 3,25 (2H, д, J=5,3 Гц), 4,04 (2H, с), 4,98 (1H, с), 5,10 (1H, т, J=5,4 Гц), 8,29 (1H, с).
Пример 4
Получение 2-хлор-1-(2-гидрокси-3-метансульфонилокси-2-метилпропил)-4-нитроимидазол
Метансульфонилхлорид (2,01 мл, 25,72 ммоль) добавляли к раствору 2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола, полученного в примере 3, (5,05 г, 21,43 ммоль) в пиридине (10 мл) при охлаждении на бане со льдом и полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. К смеси добавляли 6 н. хлористоводородную кислоту и полученную смесь экстрагировали этилацетатом. Органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении с получением 2-хлор-1-(2-гидрокси-3-метансульфонилокси-2-метилпропил)-4-нитроимидазола (6,72 г, количественный) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,31 (3H, с), 2,10 (1H, с), 3,11 (3H, с), 4,08-4,23 (4H, м), 8,02 (1H, с).
Пример 5
Получение 2-хлор-1-[2-гидрокси-2-метил-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазола
2-Хлор-4-нитро-1H-имидазол (1 г, 6,78 ммоль), 2-метилоксиран-2-илметилпаратолуолсульфонат (2,46 г, 10,15 ммоль), бензил(триэтил)аммонийхлорид (1,50 мг, 0,66 ммоль) и ацетонитрил (10 мл) перемешивали при кипячении с обратным холодильником в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали насыщенным водным раствором бикарбоната натрия два раза, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=6/1) с получением 2-хлор-1-[2-гидрокси-2-метил-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазола (1,86 г, выход 70%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 2,46 (3H, с), 2,80 (1H, с), 3,91 (1H, д, J=10,4 Гц), 3,95 (1H, д, J=10,4 Гц), 4,04-4,16 (2H, м), 7,38 (2H, д, J=8,0 Гц), 7,76 (2H, д, J=8,0 Гц), 7,93 (1H, с).
Пример 6
Получение 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола
2-Хлор-1-(2-гидрокси-3-метансульфонилокси-2-метилпропил)-4-нитроимидазол, полученный в примере 4, (6,72 г, 21,43 ммоль) обрабатывали способом, подобно описанному в примере 2 с получением 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (5,6 г, выход 94%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,39 (3H, с), 2,62 (2H, д, J=4,0 Гц), 2,78 (1H, д, J=4,0 Гц), 4,00 (1H, д, J=14,9 Гц), 4,38 (1H, д, J=14,9 Гц), 7,87 (1H, с).
Пример 7
Получение 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитро-1H-имидазола
Используя 2-хлор-1-[2-гидрокси-2-метил-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазол (1,11 г, 2,84 ммоль), полученный в примере 5, получали 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитро-1H-имидазол (523 мг, выход 85%) в виде светло-желтого порошка способом, подобно описанному в примере 2.
Свойства полученного соединения были такими же, как у соединения, полученного в примере 6.
Пример 8
Получение (R)-2-хлор-1-[2-гидрокси-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазола
2-Хлор-4-нитро-1H-имидазол (10 г, 67,79 ммоль) и (R)-(-)-глицидилтозилат (17,02 г, 74,58 ммоль) растворяли в ацетонитриле (50 мл), к раствору добавляли гидрокарбонат натрия (6,26 г, 74,15 ммоль) и полученную смесь перемешивали при кипячении с обратным холодильником в течение 3,5 часов. Реакционной смеси давали остыть до комнатной температуры. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат/н-гексан=1/2) с получением (R)-2-хлор-1-[2-гидрокси-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазола (16,9 г, выход 66%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
2,47 (3H, с), 3,65 (1H, д, J=5,8 Гц), 3,93-4,33 (5H, м), 7,38 (2H, д, J=8,3 Гц), 7,70 (2H, д, J=8,3 Гц), 7,86 (1H, с).
Пример 9
Получение (R)-2-хлор-4-нитро-1-(оксиран-2-илметил)имидазола
2-Хлор-4-нитро-1H-имидазол (1 г, 6,78 ммоль) и (R)-(-)-глицидилтозилат (1,7 г, 7,45 ммоль) растворяли в тетрагидрофуране (ТГФ) (10 мл), к раствору добавляли гидрокарбонат натрия (600 мг, 7,14 ммоль) и полученную смесь перемешивали при кипячении с обратным холодильником в течение 11 часов. Реакционную смесь концентрировали при пониженном давлении, к раствору добавляли воду и полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали и остаток очищали хроматографией на колонке с силикагелем (этилацетат/н-гексан=1/1) с получением (R)-2-хлор-4-нитро-1-(оксиран-2-илметил)имидазола (1,45 г, выход 57%) в виде светло-желтого масла.
Оптическая чистота 79,2% e.e.
[α]D 27=42,55° (концентрация: 1,262, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
2,61 (1H, т, J=2,5 Гц, 4,3 Гц), 2,97 (1H, т, J=4,3 Гц), 3,25-3,34 (1H, м), 3,95 (1H, дд, J=6,4 Гц, 15,0 Гц), 4,51 (1H, дд, J=2,6 Гц, 15,0 Гц), 7,88 (1H, с).
Пример 10
Получение (R)-2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола
2-Хлор-4-нитро-1H-имидазол (600 г, 4,07 моль) и (R)-2-метилоксиран-2-илметил-4-нитробензоат (1060 г, 4,47 моль) растворяли в этилацетате (2124 мл), триэтиламин (113,64 мл, 0,82 моль) добавляли к раствору и полученную смесь перемешивали при кипячении с обратным холодильником в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли этилацетат (530 мл) и толуол (5300 мл). Полученные осадки отфильтровывали и растворяли в метаноле (10,6 л). Карбонат калия (55,4 г, 0,4 моль) добавляли к раствору, полученную смесь перемешивали при комнатной температуре в течение 1 часа, концентрированную хлористоводородную кислоту (66 мл) и сульфат магния (671 г) добавляли в указанном порядке при охлаждении на бане со льдом и полученную смесь перемешивали в течение 30 минут. Нерастворимые вещества удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. К остатку добавляли этилацетат (530 мл) и толуол (5300 мл). Полученные осадки отфильтровывали и сушили при 50°C с получением (R)-2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола (879,1 г, выход 92%) в виде светло-коричневого порошка.
Оптическая чистота 99,0% e.e.
[α]D 27=17,38° (концентрация: 1,03, ДМСО)
1H-ЯМР (ДМСО-d6) δ м.д.:
1,01 (3H, с), 3,25 (2H, д, J=5,3 Гц), 4,05 (2H, с), 5,01 (1H, с), 5,11 (1H, т, J=5,4 Гц), 8,32 (1H, с).
Пример 11
Получение (R)-2-хлор-1-(2-гидрокси-3-метансульфонилокси-2-метилпропил)-4-нитроимидазола
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (879 г, 3,73 моль), полученный в примере 10, растворяли в пиридине (1778 мл) и охлаждали до 5°C. К полученному раствору добавляли по каплям при температуре ниже 15°C метансульфонилхлорид (432,7 мл, 5,59 моль) и полученную смесь перемешивали при той же температуре в течение 1 часа. К смеси добавляли при температуре ниже 30°C 6 н. хлористоводородную кислоту (5500 мл) и полученную смесь перемешивали в течение 40 минут при охлаждении на бане со льдом. Осадки отфильтровывали и промывали водой и толуолом в указанном порядке с получением первичных кристаллов. В дополнение, фильтрат экстрагировали этилацетатом (5 литров) два раза. Органическую фазу промывали водой, сушили над сульфатом магния и фильтровали с получением твердого вещества. Фильтрат концентрировали при пониженном давлении. К остатку добавляли толуол и осадки отфильтровывали с получением твердого вещества. Твердые вещества объединяли и сушили при 60°C с получением (R)-2-хлор-1-(2-гидрокси-3-метансульфонилокси-2-метилпропил)-4-нитроимидазола (942,6 г, выход 81%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,12 (3H, с), 3,23 (3H, с), 4,09 (2H, с), 4,13 (2H, с), 5,60 (1H, ушир.), 8,34 (1H, с).
Пример 12
Получение (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола
(R)-2-Хлор-1-(2-гидрокси-3-метансульфонилокси-2-метилпропил)-4-нитроимидазол (942,6 г, 3 моль), полученный в примере 11, суспендировали в этилацетате (9426 мл). DBU (494 мл, 3,3 моль) добавляли к суспензии и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой (5 литров). Водный слой экстрагировали этилацетатом (5 литров) два раза. Органические фазы объединяли вместе и смесь промывали насыщенным раствором соли (5 литров), сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (этилацетат/н-гексан=1/2) с получением (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (600,7 г, выход 92%) в виде белого порошка.
Оптическая чистота 98,8% e.e.
[α]D 26=31,11° (концентрация: 2,02, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 2,62 (1H, д, J=4,0 Гц), 2,78 (1H, д, J=4,0 Гц), 4,00 (1H, д, J=14,9 Гц), 4,38 (1H, д, J=14,9 Гц), 7,87 (1H, с).
Пример 13
Получение (R)-2-хлор-1-[2-гидрокси-2-метил-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазола
2-Хлор-4-нитро-1H-имидазол (18,4 г, 125 ммоль) и (R)-2-метилоксиран-2-илметил-4-метилбензолсульфонат (36,2 г, 149 ммоль) суспендировали в ацетонитриле (150 мл). Бензил(триэтил)аммонийхлорид (5,7 г, 25 ммоль) добавляли к суспензии и полученную смесь перемешивали при кипячении с обратным холодильником в течение 8 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением (R)-2-хлор-1-[2-гидрокси-2-метил-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазола (20,1 г, 43%) в виде белой аморфной формы.
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 2,47 (3H, с), 2,81 (1H, с), 3,90 (1H, д, J=10,4 Гц), 3,95 (1H, д, J=10,4 Гц), 4,04-4,14 (2H, м), 7,39 (2H, д, J=8,0 Гц), 7,76 (2H, д, J=8,0 Гц), 7,91 (1H, с).
Пример 14
Получение (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (другой способ синтеза соединения примера 12)
2-Хлор-4-нитро-1H-имидазол (1,51 г, 10,17 ммоль) и (R)-2-метилоксиран-2-илметил-4-метилбензолсульфонат (3,70 г, 15,25 ммоль) суспендировали в ацетонитриле (150 мл). К полученной суспензии добавляли бензил(триэтил)аммонийхлорид (0,23, 1,02 ммоль) и полученную смесь перемешивали при кипячении с обратным холодильником в течение 10 часов. Затем реакционной смеси давали остыть до комнатной температуры и добавляли к раствору этилацетат. Полученную смесь промывали водным раствором гидрокарбоната натрия, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и растворяли в этилацетате (40 мл). DBU (1,57 мл, 10,17 ммоль) добавляли к раствору при охлаждении на бане со льдом и полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=7/3) с получением (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (1,50 г, выход 68%) в виде светло-желтого масла.
Пример 15
Получение (S)-2-хлор-4-нитро-1-[2-гидрокси-3-(4-нитробензоилокси)-2-метилпропил]имидазола
2-Хлор-4-нитро-1H-имидазол (3 г, 20,34 ммоль) и (S)-2-метилоксиран-2-илметил 4-нитробензоат (5,31 г, 22,37 ммоль) растворяли в этилацетате (10 мл). Триэтиламин (0,57 мл, 4,07 ммоль) добавляли к раствору и полученную смесь перемешивали при 60-65°С в течение 10 часов. Реакционную смесь концентрировали при пониженном давлении. Этилацетат (3 мл) и толуол (30 мл) добавляли к остатку и полученные осадки отфильтровывали с получением (S)-2-хлор-4-нитро-1-[2-гидрокси-3-(4-нитробензоилокси)-2-метилпропил]имидазола (6,82 г, выход 87%) в виде желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,23 (3H, с), 4,11-4,33 (4H, м), 5,61 (1H, с), 8, 25 (2H, д, J=8,9 Гц), 8,31-8,45 (3H, м).
Пример 16
Получение (S)-2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола
(S)-2-Хлор-4-нитро-1-[2-гидрокси-3-(4-нитробензоилокси)-2-метилпропил]имидазол (6,8 г, 17,67 ммоль), полученный в примере 15, растворяли в метаноле (68 мл). Карбонат калия (122 мг, 0,88 ммоль) добавляли к раствору и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь охлаждали на бане со льдом, 6 н. хлористоводородную кислоту (0,3 мл) и сульфат магния (3 г) добавляли к смеси в указанном порядке и смесь перемешивали в течение 30 минут. Нерастворимые вещества удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Этилацетат (3,4 мл) и толуол (34 мл) добавляли к остатку и полученные осадки отфильтровывали с получением (S)-2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола (4,09 г, выход 97%) в виде желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,02 (3H, с), 3,25 (2H, д, J=5,3 Гц), 4,05 (2H, с), 4,98 (1H, с), 5,11 (1H, т, J=5,2 Гц), 8,30 (1H, с).
Пример 17
Получение (S)-2-хлор-1-(2-гидрокси-2-метил-3-метансульфонилоксипропил)-4-нитроимидазола
(S)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (4,05 г, 16,9 ммоль), полученный в примере 16, растворяли в пиридине (8 мл) и полученный раствор охлаждали до 4°C. Метансульфонилхлорид (1,6 мл, 20,28 ммоль) добавляли по каплям к раствору при температуре ниже 15°C с последующим перемешиванием при той же температуре в течение 1 часа. К смеси при температуре ниже 30°C добавляли 6 н. хлористоводородную кислоту (33 мл). Реакционную смесь экстрагировали метиленхлоридом (20 мл) три раза. Органические фазы объединяли, промывали водой (20 мл) и насыщенным раствором соли (20 мл), сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Толуол (10 мл) добавляли к остатку и полученные осадки отфильтровывали с получением (S)-2-хлор-1-(2-гидрокси-2-метил-3-метансульфонилоксипропил)-4-нитроимидазола (3,04 г, выход 57%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,12 (3H, с), 3,24 (3H, с), 4,09 (2H, с), 4,13 (2H, с), 5,62 (1H, ушир.), 8,34 (1H, с).
Пример 18
Получение (S)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола
(S)-2-Хлор-1-(2-гидрокси-2-метил-3-метансульфонилоксипропил)-4-нитроимидазол (3,02 г, 9,51 ммоль), полученный в примере 17, растворяли в метиленхлориде (30 мл). DBU (1,7 мл, 11,41 ммоль) добавляли к раствору и полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь промывали 3 н. хлористоводородной кислотой (30 мл) и насыщенным раствором соли (20 мл) в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением (S)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (1,89 г, выход 91%) в виде светло-желтого твердого вещества.
Оптическая чистота 93,2% e.e.
[α]D 27=-29,15° (концентрация: 1,18, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,39 (3H, с), 2,63 (1H, д, J=4,0 Гц), 2,79 (1H, д, J=4,0 Гц), 4,00 (1H, д, J=14,9 Гц), 4,38 (1H, д, J=14,9 Гц), 7,88 (1H, с).
Пример 19
Получение 2-трет-бутоксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
2,4-Динитро-1H-имидазол (10 г, 63,3 ммоль), 2-трет-бутоксиметилоксиран (27 мл, 189 ммоль) и ацетат натрия (5,19 г, 189 ммоль) суспендировали в этаноле (100 мл) с последующим перемешиванием при кипячении с обратным холодильником в течение 17 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. Воду добавляли к остатку и полученную смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением 2-трет-бутоксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (3,2 г, выход 21%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,18 (9H, с), 3,63-3,80 (2H, м), 4,22-4,36 (2H, м), 5,27-5,42 (1H, м), 7,53 (1H, с).
Используя 2-метил-2-(2-метоксиметоксиэтил)оксиран, 2-этил-2-метоксиметоксиметилоксиран или 2-изопропил-2-метоксиметоксиметилоксиран, получали соединения примеров 20-22 способом, подобно описанному в примере 19.
Пример 20
2-(2-Метоксиметоксиэтил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Белый порошок, выход 48%, МС=257
Пример 21
2-Этил-2-метоксиметоксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Светло-желтый порошок, выход 49%
1H-ЯМР (ДМСО-d6) δ м.д.:
0,91 (3H, т, J=7,5 Гц), 1,91 (2H, кв. J=7,5 Гц), 3,24 (3H, с), 3,72 (1H, д, J=11,2 Гц), 3,78 (1H, д, J=11,2 Гц), 4,15 (1H, д, J=11,2 Гц), 4,23 (1H, д, J=11,2 Гц), 4,59 (2H, с), 8,10 (1H, с).
Пример 22
2-Изопропил-2-метоксиметоксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Светло-желтый порошок, выход 90%
1H-ЯМР (ДМСО-d6) δ м.д.:
0,94 (6H, д, J=6,9 Гц), 2,16-2,32 (1H, м), 3,24 (3H, с), 3,76 (1H, д, J=13,0 Гц), 3,82 (1H, д, J=13,0 Гц), 4,18 (1H, д, J=13,0 Гц), 4,25 (1H, д, J=13,0 Гц), 4,59 (2H, с), 8,09 (1H, с).
Пример 23
Получение 2-хлор-1-(2-гидрокси-4-метоксиметоксибутил)-4-нитроимидазола
Ацетат натрия (3,51 г, 42,82 ммоль) и 2-(2-метоксиметоксиэтил)оксиран (10,3 г, 77,86 ммоль) добавляли к 2-хлор-4-нитро-1H-имидазолу (5,74 г, 38,93 ммоль) в этаноле (60 мл) и полученную смесь перемешивали при кипячении с обратным холодильником в течение 13,5 часов. Реакционную смесь концентрировали при пониженном давлении. Воду добавляли к остатку и полученную смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния, затем концентрировали при пониженном давлении, остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и затем кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 2-хлор-1-(2-гидрокси-4-метоксиметоксибутил)-4-нитроимидазола (8,51 г, выход 78%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,67 (2H, м), 3,38 (3H, с), 3,46 (1H, д, J=2,4 Гц), 3,78-3,83 (2H, м), 4,00 (1H, дд, J=7,6 Гц, 14,3 Гц), 4,11-4,21 (2H, м), 4,63 (2H, с), 7,96 (1H, с).
Используя 2-метил-2-метоксиметоксиметилоксиран, получали соединение примера 24 способом, подобно описанному в примере 23.
Пример 24
2-Хлор-1-(2-гидрокси-3-метоксиметоксипропил)-4-нитроимидазол
Бесцветная жидкость, выход 63%
1H-ЯМР (CDCl3) δ м.д.:
1,20 (3H, с), 3,08 (1H, с), 3,42 (3H, с), 3,53 (2H, дд, J=10,4 Гц, 13,8 Гц), 4,67 (2H, с), 8,01 (1H, с).
Пример 25
Получение 2-(2-метоксиметоксиэтил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Гидрид натрия (1,33 г, 33,23 ммоль) добавляли к раствору 2-хлор-1-(2-гидрокси-4-метоксиметоксибутил)-4-нитроимидазола (8,45 г, 30,21 ммоль), полученного в примере 23, в 1,4-диоксане (100 мл) при охлаждении на бане со льдом с последующим перемешиванием при кипячении с обратным холодильником в течение 40 часов. Реакционную смесь концентрировали при пониженном давлении и охлаждали на бане со льдом. Воду добавляли к остатку и полученную смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 2-(2-метоксиметоксиэтил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (3,4 г, выход 47%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
2,11-2,35 (2H, м), 3,36 (3H, с), 3,75 (2H, дд, J=4,8 Гц, 6,8 Гц), 4,08 (1H, дд, J=7,6 Гц, 10,3 Гц), 4,40 (1H, дд, J=7,6 Гц, 10,3 Гц), 4,61 (2H, с), 5,43-5,54 (1H, м), 7,53 (1H, с).
Используя 2-хлор-1-(2-гидрокси-3-метоксиметоксипропил)-4-нитроимидазол, полученный в примере 24, получали соединение примера 26 способом, подобно описанному в примере 25.
Пример 26
2-Метоксиметоксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Светло-желтый порошок, выход 38%
1H-ЯМР (CDCl3) δ м.д.:
1,66 (3H, с), 3,34 (3H, с), 3,63 (1H, д, J=11,0 Гц), 3,84 (1H, д, J=11,0 Гц), 3,93 (1H, д, J=9,9 Гц), 4,37 (1H, д, J=9,9 Гц), 4,62 (2H, с), 7,52 (1H, с).
Пример 27
Получение (R)-2-хлор-1-(2-гидрокси-3-метоксиметокси-2-метилпропил)-4-нитроимидазола
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (7,4 г, 31 ммоль), полученный в примере 10, растворяли в метиленхлориде (120 мл). N,N-диизопропилэтиламин (13,1 мл, 74 ммоль) и хлорметилметиловый эфир (7,1 мл, 74 ммоль) добавляли к раствору с последующим перемешиванием при комнатной температуре в течение 46 часов. Реакционную смесь промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-2-хлор-1-(2-гидрокси-3-метоксиметокси-2-метилпропил)-4-нитроимидазола (6,0 г, выход 69%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,20 (3H, с), 3,08 (1H, с), 3,42 (3H, с), 3,50 (1H, д, J=10,4 Гц), 3,55 (1H, д, J=10,4 Гц), 4,05 (1H, д, J=14,4 Гц), 4,15 (1H, д, J=14,4 Гц), 4,67 (2H, с), 8,01 (1H, с).
Пример 28
Получение (R)-2-метоксиметоксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Гидрид натрия (1,0 г, 25 ммоль) добавляли к раствору (R)-2-хлор-1-(2-гидрокси-3-метоксиметокси-2-метилпропил)-4-нитроимидазола (6,0 г, 21 ммоль), полученного в примере 27, в ДМФА (30 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Ледяную воду добавляли к реакционной смеси, осадки отфильтровывали и промывали водой с получением (R)-2-метоксиметоксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (3,1 г, выход 59%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ м.д.:
1,66 (3H, с), 3,34 (3H, с), 3,63 (1H, д, J=11,0 Гц), 3,84 (1H, д, J=11,0 Гц), 3,93 (1H, д, J=10,0 Гц), 4,42 (1H, д, J=10,0 Гц), 4,63 (2H, с), 7,52 (1H, с).
Пример 29
Получение 2-хлор-1-(5-ацетокси-2-гидрокси-2-метилпентил)-4-нитроимидазола
2-Хлор-4-нитро-1H-имидазол (6,8 г, 43 ммоль), 2-(3-ацетоксипропил)-2-метилоксиран (5,8 г, 39,3 ммоль) и ацетат натрия (3,9 г, 47,6 ммоль) суспендировали в этаноле (60 мл) с последующим перемешиванием при кипячении с обратным холодильником в течение ночи. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. Воду добавляли к остатку и полученную смесь экстрагировали метиленхлоридом два раза. Органические фазы объединяли, промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 2-хлор-1-(5-ацетокси-2-гидрокси-2-метилпентил)-4-нитроимидазола (9,5 г, выход 79%) в виде светло-коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,21 (3H, с), 1,50-1,81 (4H, м), 2,05 (3H, с), 3,91-4,12 (4H, м), 8,02 (1H, с).
Пример 30
Получение 2-(3-ацетоксипропил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Используя 2-хлор-1-(5-ацетокси-2-гидрокси-2-метилпентил)-4-нитроимидазол (9,5 г, 31,1 ммоль), полученный в примере 29, получали 2-(3-ацетоксипропил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (5,2 г, выход 62%) в виде порошка светло-оранжевого цвета способом, подобно описанному в примере 25.
1H-ЯМР (CDCl3) δ м.д.:
1,67 (3H, с), 1,67-2,00 (4H, м), 2,05 (3H, с), 3,91-4,14 (4H, м), 7,52 (1H, с).
Пример 31
Получение 2-(2-гидроксиэтил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Трифторуксусную кислоту (2 мл) добавляли к раствору 2-(2-метоксиметоксиэтил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,2 г, 0,822 ммоль), полученного в примере 25, в метиленхлориде (10 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Смесь концентрировали при пониженном давлении, остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метанол-диизопропиловый эфир с получением 2-(2-гидроксиэтил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,11 г, выход 65%) в виде светло-желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,92-2,14 (2H, м), 3,52-3,63 (2H, м), 4,05 (1H, дд, J=7,6 Гц, 10,6 Гц), 4,43 (1H, дд, J=7,6 Гц, 10,6 Гц), 4,72 (1H, т, J=2,7 Гц), 5,38-5,53 (1H, м), 8,12 (1H, с).
Пример 32
Получение 2-гидроксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Используя 2-трет-бутоксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (5,82 г, 24,1 ммоль), полученный в примере 19, получали 2-гидроксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (4,25 г, выход 95%) в виде белого порошка способом, подобно описанному в примере 31.
1H-ЯМР (ДМСО-d6) δ м.д.:
3,55-3,67 (1H, м), 3,72-3,88 (1H, м), 4,12 (1H, дд, J=6,5 Гц, 10,5 Гц), 4,36 (1H, т, J=10,4 Гц), 5,25-5,50 (2H, м), 8,11 (1H, с).
Пример 33
Получение 2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Используя 2-метоксиметоксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (4,14 г, 38 ммоль), полученный в примере 26, получали 2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (2,17 г, выход 64%) в виде светло-желтого порошка способом, подобно описанному в примере 31.
Температура плавления 166-168°C
1H-ЯМР (ДМСО-d6) δ м.д.:
1,51 (3H, с), 3,53 (1H, д, J=12,1 Гц), 3,64 (1H, д, J=12,1 Гц), 4,03 (1H, д, J=10,6 Гц), 4,24 (1H, д, J=10,6 Гц), 5,40 (1H, ушир.), 8,10 (1H, с).
Пример 34
Получение 2-(2-гидроксиэтил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Используя 2-(2-метоксиметоксиэтил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (13,4 г, 52,1 ммоль), полученный в примере 20, получали 2-(2-гидроксиэтил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (2,32 г, выход 21%) в виде светло-желтого порошка способом, подобно описанному в примере 31.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,58 (3H, с), 1,93-2,17 (2H, м), 3,59 (2H, т, J=6,4 Гц), 4,04 (1H, д, J=10,9 Гц), 4,33 (д, 1H, J=10,9 Гц), 8,11 (1H, с).
Пример 35
Получение 2-этил-2-гидроксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
2-Этил-2-метоксиметоксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (21,5 г, 83,7 ммоль), полученный в примере 21, суспендировали в метаноле (430 мл). Концентрированную хлористоводородную кислоту (2,15 мл) добавляли к полученной суспензии с последующим перемешиванием при кипячении с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и осадки отфильтровывали с получением 2-этил-2-гидроксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (7,14 г, выход 40%) в виде светло-желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
0,89 (3H, т, J=7,4 Гц), 1,95 (2H, кв. J=7,4 Гц), 3,53-3,69 (2H, м), 4,08 (1H, д, J=10,8 Гц), 4,21 (1H, д, J=10,8 Гц), 5,39 (т, 1H, J=5,6 Гц), 8,09 (1H, с).
Используя соответствующие исходные вещества, получали соединение примера 36 способом, подобно описанному в примере 35.
Пример 36
2-Гидроксиметил-2-изопропил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Светло-желтый порошок, выход 50%
1H-ЯМР (ДМСО-d6) δ м.д.:
0,91 (6H, д, J=6,9 Гц), 2,12-2,23 (1H, м), 3,60-3,77 (2H, м), 4,16 (2H, с), 5,35 (1H, т, J=5,6 Гц), 8,08 (1H, с).
Пример 37
Получение (R)-2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Трифторуксусную кислоту (15 мл) добавляли к раствору (R)-2-метоксиметоксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (3,1 г, 13 ммоль), полученного в примере 28, в метиленхлориде (30 мл) с последующим перемешиванием при комнатной температуре в течение 25 часов. Реакционную смесь концентрировали при пониженном давлении. Метанол добавляли к раствору и полученную смесь концентрировали при пониженном давлении. К остатку добавляли 2-пропанол, осадки отфильтровывали и промывали 2-пропаном с получением (R)-2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (1,2 г, выход 46%) в виде светло-желтого порошка.
Температура плавления 162-163°C
Оптическая чистота 97% e.e.
[α]D 26=-19,01° (концентрация: 0,526, ДМСО)
Пример 38
Получение 2-метил-2-(3-гидроксипропил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь 2-(3-ацетоксипропил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (3,2 г, 11,88 ммоль), полученного в примере 30, карбоната калия (320 мг, 2,32 ммоль) и метанола (35 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=25/1) с получением 2-метил-2-(3-гидроксипропил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (2,1 г, 78%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,67-1,72 (5H, м), 1,91-2,07 (2H, м), 3,51-3,65 (2H, м), 4,01 (1H, д, J=10,5 Гц), 4,15 (1H, д, J=10,5 Гц), 7,66 (1H, с).
Пример 39
Получение 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропилметансульфоната
Метансульфонилхлорид (1,4 мл, 18,09 ммоль) в метиленхлориде (10 мл) добавляли по каплям к смеси 2-метил-2-(3-гидроксипропил)-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (2,1 г, 9,24 ммоль), полученного в примере 38, триэтиламина (2,8 г, 20,09 ммоль), 4-диметиламинопиридина (50 мг, 0,41 ммоль) и метиленхлорида (80 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрировали. К остатку добавляли 10% хлористоводородную кислоту и полученную смесь перемешивали в течение 30 минут при охлаждении на бане со льдом. Осадки отфильтровывали и промывали водой с получением 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропилметансульфоната (2,6 г, выход 92%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,58 (3H, с), 1,65-2,02 (4H, м), 3,17 (3H, с), 4,05-4,26 (4H, м), 8,12 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 40-42 способом, подобно описанному в примере 39.
Пример 40
6-Нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилметансульфонат
Светло-желтый порошок, выход 82%
1H-ЯМР (ДМСО-d6) δ м.д.:
3,25 (3H, с), 4,11 (1H, дд, J=6,6 Гц, 11,0 Гц), 4,47 (1H, т, J=9,1 Гц), 4,55-4,70 (2H, м), 5,60-5,75 (1H, м), 8,14 (1H, с).
Пример 41
2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилметансульфонат
Светло-желтый порошок, выход 87%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,64 (3H, с), 3,24 (3H, с), 4,17 (1H, д, J=11,2 Гц), 4,27 (1H, д, J=11,2 Гц), 4,52 (2H, ушир.), 8,14 (1H, с).
Пример 42
2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилметансульфонат
Светло-желтый порошок, выход 87%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,61 (3H, с), 2,38 (2H, т, J=6,5 Гц), 3,19 (3H, с), 4,11 (1H, д, J=11,0 Гц), 4,25 (1H, д, J=11,0 Гц), 4,36 (2H, т, J=6,5 Гц), 8,14 (1H, с).
Пример 43
Получение трет-бутил 5-(2-хлор-4-нитроимидазол-1-ил)-4-гидрокси-4-метилпентаноата
Ацетат натрия (0,59 г, 7,18 ммоль) добавляли к суспензии трет-бутил 3-(2-метилоксиран-2-ил)пропионата (1,00 г, 5,39 ммоль) и 2-хлор-4-нитро-1H-имидазола (0,53 г, 3,59 ммоль) в этаноле (5 мл) с последующим перемешиванием при кипячении с обратным холодильником в течение 6 часов. Нерастворимые вещества удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 5-(2-хлор-4-нитроимидазол-1-ил)-4-гидрокси-4-метилпентаноата (0,94 г, выход 78%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,17 (3H, с), 1,45 (9H, с), 1,78-1,87 (2H, м), 2,43-2,54 (2H, м), 3,59 (1H, ушир.), 3,99 (2H, с), 8,06 (1H, с).
Пример 44
Получение трет-бутил 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропионата
Гидрид натрия (0,12 г, 3,07 ммоль) добавляли к раствору трет-бутил 5-(2-хлор-4-нитроимидазол-1-ил)-4-гидрокси-4-метилпентаноата (0,93 г, 2,79 ммоль), полученного в примере 43, в 1,4-диоксане (10 мл) при охлаждении на бане со льдом с последующим перемешиванием при кипячении с обратным холодильником в течение 7,5 часов. Реакционную смесь концентрировали при пониженном давлении. Воду добавляли к раствору и полученную смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток обрабатывали диэтиловым эфиром с получением трет-бутил 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропионата (0,35 г, 42%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 1,65 (3H, с), 2,12-2,25 (2H, м), 2,37-2,46 (2H, м), 3,98 (1H, д, J=10,3 Гц), 4,10 (1H, д, J=10,3 Гц), 7,52 (1H, с).
Пример 45
Получение 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропионовой кислоты
Трифторуксусную кислоту (2 мл) добавляли к раствору трет-бутил 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропионата (0,72 г, 2,42 ммоль), полученного в примере 44, в метиленхлориде (14 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении. Остаток кристаллизовали из смеси этанол-метиленхлорид с получением 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропионовой кислоты (0,30 г, 51%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,32 (3H, с), 1,91-2,09 (1H, м), 2,12-2,26 (1H, м), 2,41-2,74 (2H, м), 3,89 (2H, с), 7,96 (1H, с), 12,19 (1H, ушир.).
Пример 46
Получение 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоксазола
Гидрид натрия (77 мг, 1,9 ммоль) добавляли к раствору 2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,32 г, 1,6 ммоль), полученного в примере 33, в ДМФА (3 мл) при охлаждении на бане со льдом с последующим перемешиванием при 0°С в течение 30 минут. К реакционной смеси добавляли 2-хлорбензоксазол (0,30 г, 1,9 ммоль) в ДМФА (3 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 44 часов. Ледяную воду добавляли к реакционной смеси и полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и перекристаллизовывали из смеси ацетонитрил-изопропанол с получением 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоксазола (0,20 г, 39%) в виде светло-желтого твердого вещества.
Температура плавления 200-203°C
Пример 47
Получение (R)-2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоксазола
Гидрид натрия (0,1 г, 2,4 ммоль) добавляли к раствору (R)-2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,40 г, 2,0 ммоль), полученного в примере 37, в ДМФА (4 мл) с последующим перемешиванием в течение 30 минут при охлаждении на бане со льдом. К реакционной смеси добавляли 2-хлорбензоксазол (0,38 г, 2,4 ммоль) в ДМФА (4 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 48 часов. Ледяную воду добавляли к реакционной смеси. Осадки отфильтровывали, промывали водой и затем перекристаллизовывали из смеси ацетонитрил-изопропанол с получением (R)-2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоксазола (0,15 г, выход 24%) в виде светло-желтого твердого вещества.
Температура плавления 232-233°C
Оптическая чистота > 99,5% e.e.
[α]D 26=+11,20° (концентрация: 0,518, ДМСО)
Пример 48
Получение 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилтио)бензоксазола
Гидрид натрия (50 мг, 1,25 ммоль) добавляли к смеси 2-меркаптобензоксазола (200 мг, 1,3 ммоль) и ДМФА (3 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилметансульфонат (330 мг, 1,2 ммоль), полученный в примере 41, и полученную смесь перемешивали при 60-70°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры. Воду добавляли к раствору и полученную смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали 5% раствором гидроксида натрия и водой три раза, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем(н-гексан/этилацетат=1/1) с получением 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилтио)бензоксазола (37 мг, выход 9%) в виде белого порошка.
Температура плавления 163-166°C
Пример 49
Получение 2-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилтио]бензоксазола
Используя 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилметансульфонат (300 мг, 1 ммоль), полученный в примере 42, получали 2-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилтио]бензоксазол (296 мг, выход 83%) в виде белого порошка способом, подобно описанному в примере 48.
Температура плавления 174-175°C
Пример 50
Получение 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-(1-фенил-1H-тетразол-5-илтио)пропан-2-ола
Смесь 2-хлор-4-нитро-1H-имидазола (1,2 г, 8,13 ммоль), 5-(2-метилоксиран-2-илметилтио)-1-фенил-1H-тетразола (1,9 г, 7,65 ммоль), ацетата натрия (700 мг, 8,53 ммоль) и этанола (20 мл) перемешивали при кипячении с обратным холодильником в течение ночи. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и полученную смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали насыщенным водным раствором бикарбоната натрия два раза, затем промывали водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-(1-фенил-1H-тетразол-5-илтио)пропан-2-ола (2,1 г, выход 69%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,38 (3H, с), 3,54 (1H, д, J=14,8 Гц), 3,62 (1H, д, J=14,8 Гц), 4,19 (2H, с), 4,58 (1H, с), 7,50-7,67 (5H, м), 8,08 (1H, с).
Пример 51
Получение 2-метил-6-нитро-2-(1-фенил-1H-тетразол-5-илтиометил)-2,3-дигидроимидазо[2,1-b]оксазола
Гидрид натрия (220 мг, 5,5 ммоль) добавляли к смеси 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-(1-фенил-1H-тетразол-5-илтио)пропан-2-ола (2,1 г, 5,3 ммоль), полученного в примере 50, и 1,4-диоксана (40 мл) и полученную смесь перемешивали при кипячении с обратным холодильником в течение 24 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. Воду добавляли к остатку и полученную смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением 2-метил-6-нитро-2-(1-фенил-1H-тетразол-5-илтиометил)-2,3-дигидроимидазо[2,1-b]оксазола (500 мг, выход 26%) в виде светло-коричневого порошка.
Температура плавления 140-147°C
Пример 52
Получение трет-бутил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметоксикарбониламино)ацетата
Моногидрохлорид сложного трет-бутилового эфира глицина (0,52 г, 2,27 ммоль) в метиленхлориде (5 мл) и N,N-диизопропилэтиламин (1,05 мл, 4,53 ммоль) добавляли к трифосгену (0,30 г, 0,76 ммоль) в метиленхлориде (10 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 2 часов. Нерастворимые вещества удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток добавляли к раствору 2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,30 г, 1,51 ммоль), полученного в примере 33, в ДМФА (3 мл) при охлаждении на бане со льдом. Затем хлорид меди (1) (75 мг, 0,76 ммоль) добавляли к полученной смеси с последующим перемешиванием при комнатной температуре в течение 22 часов. Воду добавляли к реакционной смеси, полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/2) с получением трет-бутил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметоксикарбониламино)ацетата (40 мг, выход 7%) в виде белого твердого вещества.
Температура плавления 104-106°C
Пример 53
Получение 6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил(4-морфолинофенил)карбамата
1,1'-Карбонилдиимидазол (0,44 г, 2,69 ммоль) добавляли к раствору 4-морфолиноанилина (0,40 г, 2,24 ммоль) в ТГФ (4 мл) с последующим перемешиванием в течение 2 часов при охлаждении на бане со льдом. Реакционную смесь фильтровали и промывали диэтиловым эфиром. Фильтрат добавляли к раствору 2-гидроксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,30 г, 1,62 ммоль) в ДМФА (3 мл) при охлаждении на бане со льдом. Затем хлорид меди (1) (75 мг, 0,76 ммоль) добавляли к полученной смеси с последующим перемешиванием при комнатной температуре в течение 2 часов. Воду добавляли к реакционной смеси, полученную смесь экстрагировали этилацетатом и экстракт промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/ацетон=9/1) и промывали смесью метиленхлорид-этилацетат с получением 6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил(4-морфолинофенил)карбамата (34 мг, выход 5%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,93-3,09 (4H, м), 3,64-3,80 (4H, м), 4,13 (1H, дд, J=6,8 Гц, 10,9 Гц), 4,34-4,55 (3H, м), 5,55-5,73 (1H, м), 6,77-6,95 (2H, м), 7,18-7,41 (2H, м), 8,15 (1H, с), 9,52 (1H, ушир.).
Пример 54
Получение 2-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил-4-хлорфенилкарбамата
4-Хлорфенилизоцианат (169 мл, 1,1 ммоль) и хлорид меди (1) (50 мг, 0,5 ммоль) добавляли к раствору 2-гидроксиэтил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,2 г, 1,0 ммоль), полученного в примере 31, в ДМФА (5 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 4 часов. Смесь охлаждали на бане со льдом и добавляли 10% хлористоводородную кислоту. Полученную смесь экстрагировали этилацетатом и экстракт промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 2-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил-4-хлорфенилкарбамата (0,16 г, выход 45%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,16-2,38 (2H, м), 4,08 (1H, дд, J=7,4 Гц, 10,6 Гц), 4,16-4,36 (2H, м), 4,47 (1H, дд, J=7,4 Гц, 10, 6 Гц), 5,44-5,55 (1H, м), 7,30-7,36 (2H, м), 7,46-7,52 (2H, м), 8,14 (1H, с), 9,83 (1H, ушир.).
Используя фенилизоцианат и 2-гидроксиэтил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол, 2-этил-2-гидроксиметил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол или 2-гидроксиметил-2-изопропил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол, получали соединения примеров 55-57 способом, подобно описанному в примере 54. Кроме того, используя 2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол и 3-фторфенилизоцианат или 4-трет-бутоксикарбонилфенилизоцианат, получали соединения примеров 58 и 59 способом, подобно описанному в примере 54.
Пример 55
2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилфенилкарбамат
Желтое твердое вещество, выход 17%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,63 (3H, с), 2,30 (2H, т, J=6,9 Гц), 4,13 (1H, д, J=10,9 Гц), 4,21-4,32 (3H, м), 6,96-7,02 (1H, м), 7,24-7,27 (2H, м), 7,43-7,46 (2H, м), 8,12 (1H, с), 9,60 (1H, ушир.).
Пример 56
2-Этил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилфенилкарбамат
Белое твердое вещество, выход 60%
1H-ЯМР (ДМСО-d6) δ м.д.:
0,93 (3H, т, J=7,4 Гц), 1,89-2,11 (2H, м), 4,19-4,29 (2H, м), 4,39-4,50 (2H, м), 6,99 (1H, т, J=7,2 Гц), 7,23-7,29 (2H, м), 7,34-7,55 (2H, м), 8,14 (1H, с), 9,70 (1H, ушир.).
Пример 57
2-Изопропил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилфенилкарбамат
Белое твердое вещество, выход 73%
1H-ЯМР (ДМСО-d6) δ м.д.:
0,97 (6H, дд, J=2,7 Гц, 6,9 Гц), 2,25-2,39 (1H, м), 4,20 (1H, д, J=11,4 Гц), 4,30 (1H, д, J=11,4 Гц), 4,48 (2H, с), 6,99 (1H, т, J=7,1 Гц), 7,23-7,29 (2H, м), 7,32-7,52 (2H, м), 8,13 (1H, с), 9,67 (1H, ушир.).
Пример 58
2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-3-фторфенилкарбамат
Белое твердое вещество, выход 71%
Температура плавления 168-169°C
Пример 59
Трет-бутил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметоксикарбониламино)бензоат
Белое твердое вещество, выход 32%
Температура плавления 177-178°C
Пример 60
Получение 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметоксикарбониламино)бензойной кислоты
Трифторуксусную кислоту (1 мл) добавляли к суспензии трет-бутил 4-(2-метил-6-нитро-2,2-дигидроимидазо[2,1-b]оксазол-2-илметоксикарбониламино)бензоата (185 мл, 0,44 ммоль), полученного в примере 59, в метиленхлориде (10 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в этилацетате. Раствор промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток промывали этилацетатом с получением 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметоксикарбониламино)бензойной кислоты (50 мг, выход 31%) в виде белого твердого вещества.
Температура плавления 248°C (разложение)
Пример 61
Получение 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-4-хлорфенилкарбамата
2-Метилоксиран-2-илметил-4-хлорфенилкарбамат (1,1 г, 4,4 ммоль) и 2,4-динитро-1H-имидазол (0,35 г, 2,2 ммоль) суспендировали в этаноле (1 мл) и полученную смесь перемешивали при комнатной температуре в течение 24 часов. Затем ацетат натрия (0,36 г, 4,4 ммоль) и этанола (2 мл) добавляли к смеси с последующим перемешиванием при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток кристаллизовали из смеси метиленхлорид-диэтиловый эфир с получением 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-4-хлорфенилкарбамата (0,17 г, выход 22%) в виде светло-желтого твердого вещества.
Температура плавления 179-181°C
Пример 62
Получение 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-(4-хлорфенил)-N-метилкарбамата
2-Метилоксиран-2-илметил-N-(4-хлорфенил)-N-метилкарбамат (1,7 г, 6,6 ммоль) и 2-хлор-4-нитро-1H-имидазол (0,98 г, 6,6 ммоль) суспендировали в этаноле (10 мл) и добавляли ацетат натрия (0,85 г, 10 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный гидрокарбонат натрия и полученную смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-(4-хлорфенил-N-метилкарбамата (2,7 г, количественный) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, ушир.), 3,28 (3H, с), 3,78-4,28 (4H, м), 7,11-7,24 (2H, м), 7,30-7,41 (2H, м), 7,90 (1H, ушир.).
Пример 63
Получение 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-(4-хлорфенил)-N-метилкарбамата
Гидрид натрия (0,32 г, 7,9 ммоль) добавляли к раствору 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-(4-хлорфенил)-N-метилкарбамата (2,7 г, 6,6 ммоль), полученного в примере 62, в 1,4-диоксане (30 мл) при охлаждении на бане со льдом с последующим перемешиванием при кипячении с обратным холодильником в течение 12 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток охлаждали на бане со льдом, добавляли воду и полученный раствор экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат) и кристаллизовали из смеси метиленхлорид-этанол с получением 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-(4-хлорфенил)-N-метилкарбамата (0,88 г, выход 36%) в виде белого твердого вещества.
Температура плавления 146-148°C
Пример 64
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-хлорфенилкарбамата
Раствор в ТГФ (15 мл) 4-хлорфенилизоцианата (1,3 г, 85 ммоль) и триэтиламина (0,1 мл) добавляли к суспензии (R)-2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола (1,5 г, 6,5 ммоль), полученного в примере 10, в ТГФ (30 мл) с последующим перемешиванием при комнатной температуре в течение 19 часов. Нерастворимые вещества удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-хлорфенилкарбамата (2,1 г, выход 83%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,15 (3H, с), 3,99 (2H, с), 4,07 (2H, с), 7,29-7,39 (2H, м), 7,45-7,58 (2H, м), 8,33 (1H, с), 9,86 (1H, ушир.).
Используя различные виды соответствующих фенилизоцианатов, получали соединения примеров 65-69 способом, подобно описанному в примере 64. Кроме того, используя бензилизоцианат или метилизоцианат получали соединения примеров 70 и 71 способом, подобно описанному в примере 64.
Пример 65
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-3-хлорфенилкарбамат
Выход 41%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,15 (3H, с), 4,00 (2H, с), 4,13 (2H, с), 5,41 (1H, с), 7,04-7,09 (1H, м), 7,29-7,41 (2H, м), 7,55-7,66 (1H, м), 8,33 (1H, с), 9,93 (1H, ушир.).
Пример 66
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-бромфенилкарбамат
Выход 62%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,15 (3H, с), 3,99 (2H, с), 4,13 (2H, с), 5,40 (1H, с), 7,34-7,53 (4H, м), 8,33 (1H, с), 9,86 (1H, ушир.).
Пример 67
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-трифторметилфенилкарбамат
Выход 83%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,16 (3H, с), 4,02 (2H, с), 4,14 (2H, с), 5,42 (1H, с), 7,58-7,74 (4H, м), 8,34 (1H, с), 10,14 (1H, ушир.).
Пример 68
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-трифторметоксифенилкарбамат
Выход 58%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,15 (3H, с), 3,99 (2H, с), 4,13 (2H, с), 5,41 (1H, с), 7,31 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц), 8,33 (1H, с), 9,92 (1H, ушир.).
Пример 69
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-фторфенилкарбамат
Выход 95%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,15 (3H, с), 3,98 (2H, с), 4,12 (2H, с), 5,39 (1H, с), 7,10-7,17 (2H, м), 7,45-7,51 (2H, м), 8,33 (1H, с), 9,73 (1H, ушир.).
Пример 70
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропилбензилкарбамат
Выход 72%
1H-ЯМР (CDCl3) δ м.д.:
1,20 (3H, с), 3,61 (1H, ушир.), 3,97-4,04 (3H, м), 4,23 (1H, д, J=12,0 Гц), 4,70-4,89 (1H, м), 7,13-7,39 (5H, м), 8,01 (1H, с).
Пример 71
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропилметилкарбамат
Выход 73%
1H-ЯМР (CDCl3) δ м.д.:
1,21 (3H, с), 2,80 (3H, д, J=4,8 Гц), 3,57 (1H, ушир.), 3,98-4,16 (3H, м), 4,24 (1H, д, J=12,3 Гц), 4,72-4,91 (1H, м), 8,03 (1H, с).
Пример 72
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-метил-N-(4-трифторметоксибензил)карбамата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (2,16 г, 9,18 ммоль), полученный в примере 10, N,N-диизопропилэтиламин (2,67 мл, 15,30 ммоль) и 4-диметиламинопиридин (0,19 г, 1,53 ммоль) добавляли к суспензии N-метил-N-(4-трифторметоксибензил)карбамоилхлорида (2,05 г, 7,65 ммоль) в толуоле (40 мл) с последующим перемешиванием при 100°С в течение 3,5 часов. Реакционную смесь разбавляли этилацетатом и раствор промывали 10% хлористоводородной кислотой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-метил-N-(4-трифторметоксибензил)карбамата (2,74 г, выход 77%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 2,83 (3H, с), 3,87-4,17 (4H, м), 4,44 (2H, с), 7,18-7,25 (4H, м), 8,05 (1H, с).
Пример 73
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-метил-N-(4-трифторметоксибензил)карбамата
Гидрид натрия (0,28 г, 7,04 ммоль) добавляли к раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-метил-N-(4-трифторметоксибензил)карбамата (2,74 г, 5,87 ммоль), полученного в примере 72, в ДМФА (20 мл) с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и осадки отфильтровывали, промывали водой и затем перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-метил-N-(4-трифторметоксибензил)карбамата (1,40 г, выход 55%) в виде белого твердого вещества.
Температура плавления 123-124°C
Пример 74
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-(4-хлорфенил)-N-циклогексилкарбамата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (0,95 г, 4,03 ммоль), полученный в примере 10, N,N-диизопропилэтиламин (1,45 мл, 8,06 ммоль) и 4-диметиламинопиридин (0,10 г, 0,81 ммоль) добавляли к суспензии N-(4-хлорфенил)-N-циклогексилкарбамоилхлорида (1,56 г, 6,05 ммоль) в толуоле (10 мл) с последующим перемешиванием при 100°С в течение 3 часов. Реакционную смесь разбавляли этилацетатом и раствор промывали 10% хлористоводородной кислотой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-(4-хлорфенил)-N-циклогексилкарбамата (0,75 г, выход 40%) в виде белой аморфной формы.
1H-ЯМР (CDCl3) δ м.д.:
0,78-1,22 (6H, м), 1,24-1,48 (2H, м), 1,54-1,67 (1H, м), 1,70-1,93 (4H, м), 2,87-3,13 (1H, м), 3,72-3,98 (3H, м), 4,00-4,24 (2H, м), 7,00-7,06 (2H, м), 7,35-7,41 (2H, м), 7,80 (1H, ушир.).
Пример 75
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-(4-хлорфенил)-N-циклогексилкарбамата
Гидрид натрия (76 мг, 1,91 ммоль) добавляли к раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-(4-хлорфенил)-N-циклогексилкарбамата (0,75 г, 1,59 ммоль), полученного в примере 74, в ДМФА (7 мл) с последующим перемешиванием в течение 0,5 часов при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-(4-хлорфенил)-N-циклогексилкарбамата (0,53 г, выход 77%) в виде белого твердого вещества.
Температура плавления 175-177°C
Пример 76
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-метил-N-(4-трифторметоксифенил)карбамата
N-Метил-N-(4-трифторметоксифенил)карбамоилхлорид (1,33 г, 5,23 ммоль), N,N-диизопропилэтиламин (1,2 мл, 6,97 ммоль) и 4-диметиламинопиридин (85 мг, 0,70 ммоль) добавляли к суспензии (R)-2-хлор-1-(2,3-дигидрокси-2-метил)пропил-4-нитроимидазола (0,82 г, 3,48 ммоль), полученного в примере 10, в толуоле (10 мл) с последующим перемешиванием при 100°С в течение 5 часов. Реакционную смесь разбавляли этилацетатом и раствор промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=2/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-метил-N-(4-трифторметоксифенил)карбамата (1,04 г, выход 65%) в виде светло-желтой аморфной формы.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,02 (3H, с), 3,26 (3H, с), 3,80-4,00 (4H, м), 5,39 (1H, с), 7,37-7,40 (2H, м), 7,47-7,52 (2H, м), 8,25 (1H, с).
Пример 77
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-метил-N-(4-трифторметоксифенил)карбамата
Гидрид натрия (0,48 г, 11,9 ммоль) добавляли к раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-N-метил-N-(4-трифторметоксифенил)карбамата (4,50 г, 9,94 ммоль), полученного в примере 76, в ДМФА (13,5 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 1 часа. Воду и этилацетат добавляли к реакционной смеси и осадки отфильтровывали. Осадки перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-метил-N-(4-трифторметоксифенил)карбамата (2,95 г, выход 71%) в виде светло-желтого твердого вещества.
Температура плавления 144-145°C
Оптическая чистота 99,8% e.e.
[α]D 24=7,68° (концентрация: 0,938, CHCl3)
Используя соответствующие исходные вещества, получали соединения примеров 78 и 79 способом, подобно описанному в примере 77.
Пример 78
(R)-2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилметилкарбамат
Выход 26%, температура плавления 175-178°C
Пример 79
(R)-2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилдиэтилкарбамат
Выход 27%, температура плавления 196-197°C
Пример 80
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-(4-хлорфенил)-N-метилкарбамата
Иодметан (0,71 мл, 11,4 ммоль) и гидроксид калия (0,64 г, 11,4 ммоль) добавляли к раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-хлорфенилкарбамата (1,5 г, 3,8 ммоль), полученного в примере 64, в ДМСО (40 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. Смесь охлаждали на бане со льдом и добавляли 10% хлористоводородную кислоту. Полученную смесь экстрагировали этилацетатом и экстракт промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) и перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-N-(4-хлорфенил)-N-метилкарбамата (0,67 г, 60%) в виде белого твердого вещества.
Температура плавления 131-133°C
Оптическая чистота 99,8% e.e.
[α]D 26=22,86° (концентрация: 1,028, CHCl3)
Пример 81
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-бис(4-хлорфенил)карбамата
Пиридин (0,37 мл, 4,5 ммоль) и трифосген (0,16 г, 0,5 ммоль) добавляли к суспензии (R)-2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,30 г, 1,5 ммоль), полученного в примере 37, в метиленхлориде (15 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли бис(4-хлорфенил)амин (0,39 г, 1,6 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь охлаждали на бане со льдом и добавляли 10% хлористоводородную кислоту. Полученную смесь экстрагировали метиленхлоридом, экстракт сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=19/1) и перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-бис(4-хлорфенил)карбамата (82 мг, выход 12%) в виде белого твердого вещества.
Температура плавления 200-201°C
Пример 82
Получение 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилпиперидин-1-карбоксилата
Пиридин (0,37 мл, 4,5 ммоль) и трифосген (0,18 г, 0,6 ммоль) добавляли к суспензии 2-гидроксиметил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (0,3 г, 1,5 ммоль), полученного в примере 33, в метиленхлориде (15 мл) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали на бане со льдом и добавляли пиперидин (0,16 мл, 1,7 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь охлаждали на бане со льдом и добавляли 10% хлористоводородную кислоту и нерастворимые вещества удаляли фильтрованием. Фильтрат экстрагировали метиленхлоридом и органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/2) и перекристаллизовывали из смеси метиленхлорид-диизопропиловый эфир с получением 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилпиперидин-1-карбоксилата (65 мг, выход 14%) в виде белого твердого вещества.
Температура плавления 152-154°C
Пример 83
Получение 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил-4-(4-трифторметоксифенил)пиперазин-1-карбоксилата
4-(4-Трифторметоксифенил)пиперазин-1-карбонилхлорид (0,26 г, 0,85 ммоль), N,N-диизопропилэтиламин (0,30 мл, 1,7 ммоль) и 4-диметиламинопиридин (21 мг, 0,17 ммоль) добавляли к суспензии 2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола (0,30 г, 1,3 ммоль), полученного в примере 3, в толуоле (5 мл) с последующим перемешиванием при 100°С в течение 2,5 часов. Смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата (0,24 г, выход 55%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 3,02-3,17 (4H, м), 3,39-3,72 (4H, м), 3,91 (1H, с), 3,99-4,18 (3H, м), 4,34 (1H, д, J=12,3 Гц), 6,85-6,98 (2H, м), 7,09-7,22 (2H, м), 8,05 (1H, с).
Пример 84
Получение 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата
Гидрид натрия (23 мг, 0,56 ммоль) добавляли к раствору 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата (0,24 г, 0,47 ммоль), полученного в примере 83, в ДМФА (2 мл) с последующим перемешиванием при 0°С в течение 1 часа. Ледяную воду добавляли к реакционной смеси и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат) и затем промывали диизопропиловым эфиром с получением 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата (0,13 г, выход 58%) в виде белого твердого вещества.
Температура плавления 138-140°C
Пример 85
Получение 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата
2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (0,13 г, 0,57 ммоль), полученный в примере 3, N,N-диизопропилэтиламин (0,13 мл, 0,76 ммоль) и 4-диметиламинопиридин (10 мг, 0,08 ммоль) добавляли к суспензии 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорида (0,10 г, 0,38 ммоль) в толуоле (3 мл) с последующим перемешиванием при 100°С в течение 2,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата (0,11 г, выход 59%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 2,43-2,50 (2H, м), 3,50-3,78 (2H, м), 3,93-4,24 (5H, м), 7,46 (1H, д, J=8,3 Гц), 7,60 (1H, д, J=8,3 Гц), 8,05 (1H, с).
Пример 86
Получение 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата
Гидрид натрия (11 мг, 0,28 ммоль) добавляли к раствору 3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил
4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата (0,11 г, 0,23 ммоль), полученного в примере 85, в ДМФА (1 мл) с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. Ледяную воду добавляли к реакционной смеси, полученную смесь экстрагировали этилацетатом. Экстракт промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=4/1) и затем промывали диизопропиловым эфиром с получением 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата (0,04 г, выход 39%) в виде белого твердого вещества.
Температура плавления 113-115°C
Пример 87
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-трет-бутоксикарбонилпиперазин-1-карбоксилата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (4,43 г, 18,79 ммоль), полученный в примере 10, N,N-диизопропилэтиламин (4,68 мл, 26,84 ммоль) и 4-диметиламинопиридин (0,33 г, 2,68 ммоль) добавляли к суспензии трет-бутил 4-хлоркарбонилпиперазин-1-карбоксилата (3,34 г, 13,42 ммоль) в толуоле (70 мл) и полученную смесь перемешивали при 100°С в течение 4,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/метиленхлорид/этилацетат=45/45/10) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-трет-бутоксикарбонилпиперазин-1-карбоксилата (4,12 г, выход 69%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 1,47 (9H, с), 3,33-3,50 (8H, м), 3,91 (1H, с), 3,99-4,16 (3H, м), 4,30 (1H, д, J=12,1 Гц), 8,04 (1H, с).
Используя 4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-карбонилхлорид или 4-[3-(4-трифторметилфенил)-2-пропенилоксикарбонил]пиперазин-1-карбонилхлорид, получали соединения примеров 88 и 89 способом, подобно описанному в примере 87.
Пример 88
(R)-2-Хлор-1-{3-[4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-илкарбонилокси]-2-гидрокси-2-метилпропил}-4-нитроимидазол
Выход 81%
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 3,28-3,61 (8H, м), 3,89 (1H, с), 4,00-4,20 (3H, м), 4,31 (1H, д, J=12,5 Гц), 5,14 (2H, с), 7,22 (2H, д, J=8,7 Гц), 7,39 (2H, д, J=8,7 Гц), 8,04 (1H, с).
Пример 89
(R)-2-Хлор-1-{3-[4-[3-(4-трифторметилфенил)-2-пропенилкарбонил]пиперазин-1-илкарбонилокси]-2-гидрокси-2-метилпропил}-4-нитроимидазол
Выход 95%
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 3,33-3,61 (8H, м), 3,90 (1H, с), 3,99-4,17 (3H, м), 4,31 (1H, д, J=12,1 Гц), 4,79 (2H, д, J=6,1 Гц), 6,39 (1H, дт, J=6,1 Гц, 15,9 Гц), 6,67 (1H, д, J=15,9 Гц), 7,39 (2H, д, J=8,3 Гц), 7,49 (2H, д, J=8,3 Гц), 8,04 (1H, с).
Пример 90
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-хлорбензил)пиперазин-1-карбоксилата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метил)пропил-4-нитроимидазол (2,28 г, 9,66 ммоль), полученный в примере 10, N,N-диизопропилэтиламин (2,81 мл, 16,10 ммоль) и 4-диметиламинопиридин (0,20 г, 1,61 ммоль) добавляли к суспензии 4-(4-хлорбензил)пиперазин-1-карбонилхлорида (2,20 г, 8,05 ммоль) в толуоле (30 мл) с последующим перемешиванием при 100°С в течение 3 часов. Реакционную смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-хлорбензил)пиперазин-1-карбоксилата (1,82 г, выход 48%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 2,17-2,50 (4H, м), 2,55 (1H, с), 3,26-3,52 (6H, м), 3,98-4,20 (3H, м), 4,30 (1H, д, J=12,4 Гц), 7,23-7,32 (4H, м), 8,05 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 91 и 92 способом, подобно описанному в примере 90.
Пример 91
(R)-2-Хлор-1-{3-[4-(4-трифторметилбензил)пиперазин-1-илкарбонилокси]-2-гидрокси-2-метилпропил}-4-нитроимидазол
Выход 31%
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 2,24-2,54 (4H, м), 3,24-3,50 (4H, м), 3,56 (2H, с), 3,97-4,20 (3H, м), 4,32 (1H, д, J=12,4 Гц), 7,45 (2H, д, J=8,0 Гц), 7,58 (2H, д, J=8,0 Гц), 8,05 (1H, с).
Пример 92
(R)-2-Хлор-1-{3-[4-(4-трифторметоксибензил)пиперазин-1-илкарбонилокси]-2-гидрокси-2-метилпропил}-4-нитроимидазол
Выход 47%
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 2,22-2,54 (4H, м), 3,30-3,54 (4H, м), 3,50 (2H, с), 3,97-4,16 (3H, м), 4,32 (1H, д, J=12,5 Гц), 7,15-7,18 (2H, м), 7,32-7,36 (2H, м), 8,05 (1H, с).
Пример 93
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата
4-(4-Трифторметоксифенил)пиперазин-1-карбонилхлорид (1,25 г, 4,2 ммоль), N,N-диизопропилэтиламин (0,96 мл, 5,6 ммоль) и 4-диметиламинопиридин (67 мг, 0,56 ммоль) добавляли к суспензии (R)-2-хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазола (0,65 г, 2,8 ммоль), полученного в примере 10, в толуоле (13 мл) с последующим перемешиванием при 100°С в течение 8,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=19/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата (1,29 г, выход 92%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 3,02-3,17 (4H, м), 3,39-3,72 (4H, м), 3,91 (1H, с), 3,99-4,18 (3H, м), 4,34 (1H, д, J=12,3 Гц), 6,85-6,98 (2H, м), 7,09-7,22 (2H, м), 8,05 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 94-102 способом, подобно описанному в примере 93.
Пример 94
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенил)пиперазин-1-карбоксилат
Выход 48%
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 3,13-3,35 (4H, м), 3,48-3,72 (4H, м), 3,94 (1H, с), 4,00-4,18 (3H, м), 4,33 (1H, д, J=12,3 Гц), 6,93 (2H, д, J=8,6 Гц), 7,50 (2H, д, J=8,6 Гц), 8,05 (1H, с).
Пример 95
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-метоксифенил)пиперазин-1-карбоксилат
Выход 54%
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 2,93-3,09 (4H, м), 3,52-3,63 (4H, м), 3,77 (3H, с), 3,96 (1H, с), 4,00-4,19 (3H, м), 4,32 (1H, д, J=12,3 Гц), 6,82-6,92 (4H, м), 8,05 (1H, с).
Пример 96
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-хлорфенил)пиперазин-1-карбоксилат
Выход 81%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 3,00-3,13 (4H, м), 3,52-3,65 (4H, м), 3,93 (1H, с), 4,00-4,17 (3H, м), 4,33 (1H, д, J=12,5 Гц), 6,82-6,86 (2H, м), 7,20-7,25 (2H, м), 8,05 (1H, с).
Пример 97
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(3-хлорфенил)пиперазин-1-карбоксилат
Выход 87%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 3,04-3,22 (4H, м), 3,43-3,70 (4H, м), 3,89 (1H, с), 4,00-4,17 (3H, м), 4,33 (1H, д, J=12,3 Гц), 6,78 (1H, ддд, J=1,6 Гц, 2,4 Гц, 8,4 Гц), 6,85-6,88 (2H, м), 7,19 (1H, т, J=8,4 Гц), 8,05 (1H, с).
Пример 98
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(3,4-дихлорфенил)пиперазин-1-карбоксилат
Выход 47%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,12 (3H, с), 3,15-3,26 (4H, м), 3,39-3,61 (4H, м), 3,88 (1H, д, J=11,0 Гц), 3,93 (1H, д, J=11,0 Гц), 4,07 (1H, д, J=14,7 Гц), 4,15 (1H, д, J=14,7 Гц), 6,96 (1H, дд, J=2,9 Гц, 9,1 Гц), 7,16 (1H, д, J=2,9 Гц), 7,42 (1H, д, J=9,1 Гц), 8,34 (1H, с).
Пример 99
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-фторфенил)пиперазин-1-карбоксилат
Выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 2,96-3,09 (4H, м), 3,50-3,67 (4H, м), 3,98 (1H, с), 4,05-4,16 (3H, м), 4,33 (1H, д, J=12,3 Гц), 6,85-7,02 (4H, м), 8,05 (1H, с).
Пример 100
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(3-трифторметилфенил)пиперазин-1-карбоксилат
Выход 83%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 3,11-3,26 (4H, м), 3,48-3,70 (4H, м), 3,91 (1H, с), 4,00-4,24 (3H, м), 4,33 (1H, д, J=12,3 Гц), 7,02-7,20 (3H, м), 7,38 (1H, т, J=8,0 Гц), 8,05 (1H, с).
Пример 101
(R)-2-Хлор-1-(3-диэтиламинокарбонилокси-2-гидрокси-2-метилпропил)-4-нитроимидазол
Выход 37%
1H-ЯМР (CDCl3) δ м.д.:
1,11 (6H, т, J=7,1 Гц), 1,20 (3H, с), 3, 16 (4H, кв. J=7,1 Гц), 3,76 (1H, ушир.), 4,06-4,11 (3H, м), 4,26 (1H, д, J=11,1 Гц), 8,05 (1H, с).
Пример 102
2-Хлор-1-(3-морфолинокарбонилокси-2-гидрокси-2-метилпропил)-4-нитроимидазол
Выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 3,35-3,52 (4H, м), 3,61-3,72 (4H, м), 3,99-4,16 (3H, м), 4,31 (1H, д, J=12,3 Гц), 8,05 (1H, с).
Пример 103
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилбензилиденамино)пиперазин-1-карбоксилата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (2,75 г, 11,66 ммоль), полученный в примере 10, N,N-диизопропилэтиламин (2,71 мл, 15,54 ммоль) и 4-диметиламинопиридин (0,19 г, 1,55 ммоль) добавляли к суспензии 4-(4-трифторметилбензилиденамино)пиперазин-1-карбонилхлорида (2,48 г, 7,77 ммоль) в толуоле (40 мл) с последующим перемешиванием при 100°С в течение 2,5 часов. Реакционную смесь разбавляли этилацетатом, промывали 10% хлористоводородной кислотой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилбензилиденамино)пиперазин-1-карбоксилата (4,03 г, количественный) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 3,04-3,33 (4H, м), 3,48-3,76 (4H, м), 3,83 (1H, с), 4,00-4,17 (3H, м), 4,33 (1H, д, J=12,3 Гц), 7,55 (1H, с), 7,59 (2H, д, J=8,4 Гц), 7,69 (2H, д, J=8,4 Гц), 8,04 (1H, с).
Пример 104
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (1,16 г, 4,68 ммоль), полученный в примере 10, и триэтиламин (1,63 мл, 11,70 ммоль) добавляли к суспензии 4-(4-трифторметилфенокси)пиперидин-1-карбонилхлорида (0,72 г, 2,34 ммоль) в толуоле (40 мл) с последующим перемешиванием при 100°С в течение 2,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилата (184 мг, выход 16%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 1,72-1,98 (4H, м), 3,33-3,67 (4H, м), 3,91-4,20 (3H, м), 4,24-4,39 (1H, м), 4,52-4,65 (1H, м), 6,96 (2H, д, J=8,7 Гц), 7,55 (2H, д, J=8, 7 Гц), 8,05 (1H, с).
Пример 105
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфениламино)пиперидин-1-карбоксилата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метилпропил)-4-нитроимидазол (1,54 г, 7,01 ммоль), полученный в примере 10, N,N-диизопропилэтиламин (1,63 мл, 9,34 ммоль) и 4-диметиламинопиридин (0,11 г, 0,93 ммоль) добавляли к суспензии 4-(4-трифторметилфениламино)пиперидин-1-карбонилхлорида (1,43 г, 4,67 ммоль) в толуоле (30 мл) с последующим перемешиванием при 100°С в течение 2,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфениламино)пиперидин-1-карбоксилата (1,44 г, выход 61%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 1,30-1,48 (2H, м), 1,98-2,13 (2H, м), 2,83-3,13 (2H, м), 3,37-3,61 (1H, м), 3,83-3,96 (2H, м), 3,96-4,22 (4H, м), 4,34 (1H, д, J=11,8 Гц), 7,40 (2H, д, J=8,5 Гц), 7,60 (2H, д, J=8,5 Гц), 8,07 (1H, с).
Пример 106
Получение (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата
(R)-2-Хлор-1-(2,3-дигидрокси-2-метил)пропил-4-нитроимидазол (0,74 г, 3,11 ммоль), полученный в примере 10, и триэтиламин (1,74 мл, 12,42 ммоль) добавляли к суспензии 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорида (0,60 г, 2,07 ммоль) в толуоле (36 мл) с последующим перемешиванием при 100°С в течение 16 часов. Смесь разбавляли этилацетатом, промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата (0,32 г, выход 31%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 2,43-2,50 (2H, м), 3,50-3,78 (2H, м), 3,93-4,24 (5H, м), 7,46 (2H, д, J=8,3 Гц), 7,60 (2H, д, J=8,3 Гц), 8,05 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 107-112 способом, подобно описанному в примере 106.
Пример 107
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-хлорфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилат
Выход 94%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 2,41-2,59 (2H, м), 3,50-3,78 (2H, м), 3,93-4,22 (6H, м), 4,35 (1H, д, J=12,3 Гц), 5,87-6,13 (1H, м), 7,26-7,37 (4H, м), 8,05 (1H, с).
Пример 108
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-карбоксилат
Выход 92%
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 2,46-2,59 (2H, м), 3,13-3,37 (1H, м), 3,50-3,74 (2H, м), 4,00-4,14 (6H, м), 4,36 (1H, д, J=12,4 Гц), 7,19 (2H, д, J=8,0 Гц), 7,37 (2H, д, J=8,0 Гц), 8,05 (1H, с).
Пример 109
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин-1-карбоксилат
Выход 63%
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 2,43-2,61 (2H, м), 3,52-3,74 (2H, м), 3,82 (3H, с), 4,01-4,16 (5H, м), 4,34 (1H, д, J=12,6 Гц), 5,83-6,00 (1H, м), 6,88 (2H, д, J=8,8 Гц), 7,30 (2H, д, J=8,8 Гц), 8,05 (1H, с).
Пример 110
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилат
Выход 54%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 2,46-2,70 (2H, м), 3,50-3,78 (2H, м), 4,00-4,32 (6H, м), 4,35 (1H, д, J=12,6 Гц), 5,98-6,22 (1H, м), 7,39-7,67 (4H, м), 8,06 (1H, с).
Пример 111
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-бромфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилат
Выход 80%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 2,41-2,63 (2H, м), 3,50-3,76 (2H, м), 3,96-4,20 (6H, м), 4,35 (1H, д, J=12,3 Гц), 5,87-6,13 (1H, м), 7,15-7,26 (2H, м), 7,43-7,48 (2H, м), 8,05 (1H, с).
Пример 112
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-фторфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилат
Выход 57%
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, с), 2,41-2,63 (2H, м), 3,50-3,76 (2H, м), 3,89-4,22 (6H, м), 4,35 (1H, д, J=12,6 Гц), 5,83-6,04 (1H, м), 6,99-7,06 (2H, м), 7,29-7,35 (2H, м), 8,05 (1H, с).
Используя 5-хлор-2,3-дигидроиндол-1-карбонилхлорид, 5-хлор-1,3-дигидроизоиндол-2-карбонилхлорид, 6-хлор-3,4-дигидро-1H-изохинолин-2-карбонилхлорид или 6-хлор-3,4-дигидро-2H-хинолин-1-карбонилхлорид, получали соединения примеров 113-116 способом, подобно описанному в примере 106.
Пример 113
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 5-хлориндолинил-1-карбоксилат
Светло-желтая аморфная форма, выход 50%
1H-ЯМР (CDCl3) δ м.д.:
1,27 (3H, с), 3,14 (2H, т, J=8,5 Гц), 3,42 (1H, ушир.), 3,91-4,28 (5H, м), 4,37 (1H, д, J=11,8 Гц), 7,04-7,24 (2H, м), 7,73 (1H, д, J=8,3 Гц), 8,04 (1H, с).
Пример 114
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 5-хлоризоиндолинил-2-карбоксилат
Коричневое твердое вещество, выход 19%
1H-ЯМР (CDCl3) δ м.д.:
1,27 (3H, с), 3,93 (1H, д, J=7,8 Гц), 4,04-4,24 (7H, м), 4,32 (1H, д, J=11,8 Гц), 7,16-7,29 (3H, м), 8,07 (1H, с).
Пример 115
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 6-хлор-3,4-дигидро-1H-изохинолин-2-карбоксилат
Светло-желтое масло, выход 63%
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 2,83 (2H, т, J=5,8 Гц), 3,46-3,76 (2H, м), 3,90 (1H, д, J=5,3 Гц), 4,01-4,15 (3H, м), 4,34 (1H, д, J=12,3 Гц), 4,43-4,65 (2H, м), 6,93-7,09 (1H, м), 7,09-7,22 (2H, м), 8,04 (1H, с).
Пример 116
(R)-3-(2-Хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 6-хлор-3,4-дигидро-2H-хинолин-1-карбоксилат
Светло-желтое масло, выход 70%
1H-ЯМР (CDCl3) δ м.д.:
1,26 (3H, с), 1,87-2,00 (2H, м), 2,76 (2H, т, J=6,5 Гц), 3,27 (1H, ушир.), 3,57-3,83 (2H, м), 3,98-4,17 (3H, м), 4,33 (1H, д, J=12,0 Гц), 7,12-7,16 (2H, м), 7,41-7,61 (1H, ушир.), 7,98 (1H, с).
Пример 117
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-трет-бутоксикарбонилпиперазин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-трет-бутоксикарбонилпиперазин-1-карбоксилата (4,12 г, 9,20 ммоль), полученного в примере 87, в ДМФА (30 мл) гидрид натрия (0,44 г, 11,04 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. Ледяную воду добавляли к реакционной смеси и осадки отфильтровывали, очищали хроматографией на колонке с силикагелем (этилацетат) и затем промывали изопропанолом с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-трет-бутоксикарбонилпиперазин-1-карбоксилата (2,24 г, выход 59%) в виде белого твердого вещества.
Температура плавления 211-212°C.
Пример 118
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата (1,29 г, 2,5 ммоль), полученного в примере 93, в ДМФА (13 мл) гидрид натрия (0,12 г, 3 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и осадки отфильтровывали, промывали водой и перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметоксифенил)пиперазин-1-карбоксилата (0,70 г, выход 59%) в виде белого твердого вещества.
Оптическая чистота 99,6% e.e.
[α]D 25=0,99° (концентрация: 0,704, CHCl3)
Температура плавления 168-169°C.
Пример 119
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-хлорбензил)пиперазин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-хлорбензил)пиперазин-1-карбоксилата (1,82 г, 3,85 ммоль), полученного в примере 90, в ДМФА (10 мл) гидрид натрия (0,31 г, 7,70 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и осадки отфильтровывали и промывали изопропанолом с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-хлорбензил)пиперазин-1-карбоксилата (0,46 г, выход 28%) в виде светло-желтого твердого вещества.
Температура плавления 161-163°C.
Пример 120
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилбензилиденамино)пиперазин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилбензилиденамино)пиперазин-1-карбоксилата (4,03 г, 7,77 ммоль), полученного в примере 103, в ДМФА (20 мл) гидрид натрия (0,37 г, 9,32 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и осадки отфильтровывали, промывали водой и перекристаллизовывали из ацетонитрилизопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилбензилиденамино)пиперазин-1-карбоксилата (2,60 г, выход 69%) в виде белого твердого вещества.
Температура плавления 176-178°C.
Пример 121
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфениламино)пиперидин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфениламино)пиперидин-1-карбоксилата, полученного в примере 105, (1,44 г, 2,85 ммоль) в ДМФА (10 мл) гидрид натрия (0,14 г, 3,42 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат) и перекристаллизовывали из ацетонитрилизопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфениламино)пиперидин-1-карбоксилата (0,42 г, выход 31%) в виде белого твердого вещества.
Температура плавления 137-140°C.
Пример 122
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилата (0,18 г, 0,36 ммоль), полученного в примере 104, в ДМФА (2 мл) гидрид натрия (19 мг, 0,47 ммоль) добавляли с последующим перемешиванием в течение 1,5 часов при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) и перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфенокси)пиперидин-1-карбоксилата (0,08 г, выход 47%) в виде белого твердого вещества.
Температура плавления 165-166°C.
Пример 123
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата, полученного в примере 106, в ДМФА (3 мл) гидрид натрия (31 мг, 0,78 ммоль) добавляли с последующим перемешиванием в течение 1,5 часов при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) и перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата (0,14 г, выход 49%) в виде белого твердого вещества.
Оптическая чистота 98,4% e.e.
[α]D 26=2,50° (концентрация: 0,560, CHCl3).
Температура плавления 169-171°C.
Пример 124
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 5-хлор-2,3-дигидроиндол-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 5-хлор-2,3-дигидроиндол-1-карбоксилата (0,60 г, 1,44 ммоль), полученного в примере 113, в ДМФА (6 мл) гидрид натрия (70 мг, 1,73 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и осадки отфильтровывали, промывали водой и перекристаллизовывали из ацетонитрилизопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 5-хлор-2,3-дигидроиндол-1-карбоксилата (0,30 г, выход 55%) в виде белого твердого вещества.
Температура плавления 189-191°C.
Пример 125
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 5-хлор-1,3-дигидроизоиндол-2-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 5-хлор-1,3-дигидроизоиндол-2-карбоксилата (0,13 г, 0,31 ммоль), полученного в примере 114, в ДМФА (2 мл) гидрид натрия (15 мг, 0,37 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 5-хлор-1,3-дигидроизоиндол-2-карбоксилата (7 мг, выход 6%) в виде светло-желтого твердого вещества.
Температура плавления 182°C (разложение).
Пример 126
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 6-хлор-3,4-дигидро-1H-изохинолин-2-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 6-хлор-3,4-дигидро-1H-изохинолин-2-карбоксилата (0,26 г, 0,61 ммоль), полученного в примере 115, в ДМФА (2 мл) гидрид натрия (30 мг, 0,73 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния, концентрировали при пониженном давлении и перекристаллизовывали из изопропанола с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 6-хлор-3,4-дигидро-1H-изохинолин-2-карбоксилата (0,12 г, 49%) в виде светло-желтого твердого вещества.
Температура плавления 180-182°C.
Пример 127
Получение (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 6-хлор-3,4-дигидро-2H-хинолин-1-карбоксилата
К раствору (R)-3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил 6-хлор-3,4-дигидро-2H-хинолин-1-карбоксилата (1,84 г, 4,29 ммоль), полученного в примере 116, в ДМФА (10 мл) гидрид натрия (0,21 г, 5,15 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду, раствор экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) и перекристаллизовывали из смеси ацетонитрил-изопропанол с получением (R)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил 6-хлор-3,4-дигидро-2H-хинолин-1-карбоксилата (0,68 г, выход 40%) в виде белого твердого вещества.
Температура плавления 172-174°C.
Пример 128
Получение 2-метил-6-нитро-2-(4-трифторметоксифеноксиметил)-2,3-дигидроимидазо[2,1-b]оксазола
4-Трифторметоксифенол (198 мг, 1,11 ммоль) растворяли в ДМФА (5 мл). К раствору добавляли гидрид натрия (48 мг, 1,21 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут 80°C. К полученному раствору добавляли при охлаждении на бане со льдом 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (220 мг, 1,01 ммоль), полученный в примере 6, и раствор перемешивали в течение 15 минут при 80°C. Реакционную смесь выливали в ледяную воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и затем кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 2-метил-6-нитро-2-(4-трифторметоксифеноксиметил)-2,3-дигидроимидазо[2,1-b]оксазола (170 мг, выход 47%) в виде белого порошка.
Температура плавления 126,8-127,9°C
МС 358(M-1)+
Пример 129
Получение 2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
4-[4-(4-Трифторметоксифенокси)пиперидин]-1-илфенол (244 мг, 0,69 ммоль) растворяли в ДМФА (10 мл). К раствору добавляли гидрид натрия (33 мг, 0,83 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (150 мг, 0,69 ммоль), полученный в примере 6, и раствор перемешивали при 80°С в течение 20 минут. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и затем кристаллизовали из смеси метиленхлорид/этилацетат с получением 2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (103 мг, выход 28%) в виде белого порошка.
Температура плавления 165,4-166,3°C.
Пример 130
Получение 2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
4-[4-(4-Трифторметилфенил)пиперазин-1-ил]фенол (296 мг, 0,92 ммоль) растворяли в ДМФА (10 мл). К раствору добавляли гидрид натрия (44 мг, 1,1 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (200 мг, 0,92 ммоль), полученный в примере 6, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и затем кристаллизовали из смеси метиленхлорид/этилацетат с получением 2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (178 мг, выход 38%) в виде белого порошка.
Температура плавления 230,7-233,1°C.
Пример 131
Получение трет-бутил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата
Трет-бутил 4-(4-гидроксифенил)пиперазин-1-карбоксилат (2,01 г, 7,23 ммоль) растворяли в ДМФА (20 мл). К раствору добавляли гидрид натрия (320 мг, 8 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 70°C. К раствору добавляли при охлаждении на бане со льдом 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (1,5 г, 7,23 ммоль), полученный в примере 6, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) и затем кристаллизовали из смеси метиленхлорид/этилацетат с получением трет-бутил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (1,5 г, выход 45%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 1,77 (3H, с), 2,99-3,03 (4H, м), 3,55-3,59 (4H, м), 4,02 (1H, д, J=10,2 Гц), 4,04 (1H, д, J=10,1 Гц), 4,18 (1H, д, J=10,1 Гц), 4,49 (1H, д, J=10,2 Гц), 6,76-6,81 (2H, м), 6,84-6,89 (2H, м), 7,55 (1H, с).
Температура плавления 212,0-214,5°C
МС 459(M+).
Пример 132
Получение трет-бутил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилата
Трет-бутил 4-(4-гидроксифенил)пиперидин-1-карбоксилат (364 мг, 1,31 ммоль) растворяли в ДМФА (10 мл). К раствору добавляли гидрид натрия (58 мг, 1,44 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (300 мг, 1,38 ммоль), полученный в примере 6, с последующим перемешиванием в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и затем кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением трет-бутил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилата (248 мг, выход 41%) в виде белого порошка.
Температура плавления 207,8-209,1°C.
Пример 133
Получение 3,4-дихлорбензил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата
Трет-бутил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (118 мг, 0,26 ммоль), полученный в примере 131, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (2 мл) и триэтиламин (2 мл). Раствор перемешивали при комнатной температуре в течение 5 минут и затем концентрировали при пониженном давлении. Остаток растворяли в ДМФА (15 мл) и к раствору добавляли раствор 3,4-дихлорбензилового спирта (136 мг, 0,77 ммоль) и 1,1'-карбонилдиимидазола (125 мг, 0,77 ммоль) в ДМФА (5 мл), перемешанный при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 3,4-дихлорбензил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (101 мг, выход 70%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,77 (3H, с), 3,01-3,06 (4H, м), 3,62-3,67 (4H, м), 4,02 (1H, д, J=10,2 Гц), 4,04 (1H, д, J=10,2 Гц), 4,18 (1H, д, J=10,2 Гц), 4,49 (1H, д, J=10,2 Гц), 5,09 (2H, с), 6,76-6,81 (2H, м), 6,84-6,89 (2H, м), 7,18-7,22 (1H, м), 7,41-7,47 (2H, м), 7,55 (1H, с).
Пример 134
Получение 2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
Трет-бутил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (88 мг, 0,19 ммоль), полученный в примере 131, растворяли в трифторуксусной кислоте (5 мл) и раствор перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (2 мл) и триэтиламин (2 мл). Раствор перемешивали при комнатной температуре в течение 5 минут и затем концентрировали при пониженном давлении. Остаток растворяли в дихлорэтане и добавляли 4-трифторметилбензальдегид (40 мкл, 0,29 ммоль) и триацетоксиборогидрид натрия (82 мг, 0,38 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. К раствору добавляли насыщенный раствор гидрокарбоната натрия и метиленхлорид. Смесь экстрагировали метиленхлоридом и органическую фазу сушили над сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-этилацетат с получением 2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (53 мг, выход 53%) в виде белого порошка.
Температура плавления 171,8-173,1°C.
Используя трет-бутил 4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилат, полученный в примере 132, получали соединение примера 135 способом, подобно описанному в примере 134.
Пример 135
2-Метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Выход 45%, температура плавления 160,6-161,1°C.
Пример 136
Получение (R)-2-метил-6-нитро-2-(4-трифторметоксифеноксиметил)-2,3-дигидроимидазо[2,1-b]оксазола
4-Трифторметоксифенол (1,1 г, 6,17 ммоль) растворяли в ДМФА (20 мл). К раствору добавляли гидрид натрия (260 мг, 6,45 ммоль) при комнатной температуре и раствор перемешивали в течение 15 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (1,22 г, 5,61 ммоль), полученный в примере 12, и раствор перемешивали в течение еще 2 часов при 80°C. Реакционную смесь выливали в ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и затем кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (R)-2-метил-6-нитро-2-(4-трифторметоксифеноксиметил)-2,3-дигидроимидазо[2,1-b]оксазол (1,03 г, выход 51%) в виде белого порошка.
Оптическая чистота >99% e.e.
[α]D 28=7,67° (концентрация: 1,030, CHCl3)
МС 359(M+)
Температура плавления 176,5-178,0°C.
Используя соответствующие исходные вещества, получали соединения примеров 137-139 способом, подобно описанному в примере 136.
Пример 137
(R)-2-Метил-6-нитро-2-[4-(тиоморфолин-4-ил)феноксиметил]-2,3-дигидроимидазо[2,1-b]оксазол
Выход 38%, температура плавления 227,5-229,0°C, МС 376(M+).
Пример 138
(R)-2-Метил-6-нитро-2-[4-(имидазол-1-ил)феноксиметил]-2,3-дигидроимидазо[2,1-b]оксазол
Выход 44%, температура плавления 172-175°C.
Пример 139
(R)-2-Метил-6-нитро-2-[4-(1,2,4-триазол-1-ил)феноксиметил]-2,3-дигидроимидазо[2,1-b]оксазол
Выход 53%, температура плавления 236,0-238,7°C.
Используя этил 1-(4-гидроксифенил)пиперидин-4-карбоксилат, получали соединение примера 140 способом, подобно описанному в примере 136.
Пример 140
Этил (R)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-4-карбоксилат
Выход 30%, температура плавления 208,2-211,5°C.
Пример 141
Получение (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
4-[4-(4-Трифторметоксифенокси)пиперидин-1-ил]фенол (17,4 г, 49,0 ммоль) растворяли в ДМФА (150 мл). К раствору добавляли гидрид натрия (2,15 г, 53,8 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (14,9 г, 68,6 ммоль), полученный в примере 12, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и смесь энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и затем кристаллизовали из смеси метиленхлорид/этилацетат с получением (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (14,3 г, выход 55%) в виде светло-желтого порошка.
МС 535(M+1)+
Оптическая чистота 99,9% e.e.
[α]D 28=-9,94° (концентрация: 1,006, CHCl3)
Температура плавления 194,5-196°C
1H-ЯМР (CDCl3) δ м.д.:
1,77 (3H, с), 1,87-2,00 (2H, м), 2,05-2,16 (2H, м), 2,95-3,05 (2H, м), 3,32-3,41 (2H, м), 4,02 (1H, д, J=10,2 Гц), 4,04 (1H, д, J=10,2 Гц), 4,18 (1H, д, J=10,2 Гц), 4,36-4,45 (1H, м), 4,49 (1H, д, J=10,2 Гц), 6,74-6,81 (2H, м), 6,87-6,94 (4H, м), 7,11-7,16 (2H, м), 7,55 (1H, с).
Пример 142
Получение (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
4-[4-(4-Трифторметоксифенил)пиперазин-1-ил]фенол (1,7 г, 5,02 ммоль) растворяли в ДМФА (20 мл). К раствору добавляли гидрид натрия (221 мг, 5,53 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (1,2 г, 5,53 ммоль), полученный в примере 12, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и затем перекристаллизовывали из этилацетата с получением (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (1,02 г, выход 39%) в виде светло-желтого порошка.
МС 519(M+)
Оптическая чистота >99% e.e.
[α]D 28=-18,02° (концентрация: 1,160, CHCl3)
Температура плавления 262,5-265°C.
Пример 143
Получение трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилата
Трет-бутил 4-(4-гидроксифенил)пиперидин-1-карбоксилат (1,07 г, 3,86 ммоль) растворяли в ДМФА (10 мл). К раствору добавляли гидрид натрия (185 мг, 4,63 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (923 мг, 4,24 ммоль), полученный в примере 12, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и затем кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилата (857 мг, выход 48%) в виде белого порошка.
МС 458(M+)
Оптическая чистота >99% e.e.
[α]D 28=-1,07° (концентрация: 1,028, CHCl3)
Температура плавления 227,5-228,3°C (разложение).
Используя соответствующие исходные вещества, получали соединение примера 144 способом, подобно описанному в примере 143.
Пример 144
Трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]-1,2,3,6-тетрагидропиридин-1-карбоксилат
Температура плавления 183,0-189,0°C (разложение).
Пример 145
Получение трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоил]пиперазин-1-карбоксилата
Трет-бутил 4-(4-гидроксибензоил)пиперазин-1-карбоксилат (6,6 г, 21,5 ммоль) растворяли в ДМФА (50мл). К раствору добавляли гидрид натрия (991 мг, 24,8 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (5,16 мг, 23,7ммоль), полученный в примере 12, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой, растворяли в метиленхлориде. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и затем кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоил]пиперазин-1-карбоксилата (7,35 г, выход 70%) в виде белого порошка.
МС 488(M+1)+
Температура плавления 222,5-224,0°C.
Пример 146
Получение трет-бутил (R)-4-[2-хлор-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата
Трет-бутил 4-(2-хлор-4-гидроксифенил)пиперазин-1-карбоксилат (2,7 г, 8,63 ммоль) растворяли в ДМФА (20мл). К раствору добавляли гидрид натрия (397 мг, 9,92 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (2,1 г, 9,50 ммоль), полученный в примере 12, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и затем кристаллизовали из смеси метиленхлорид-этилацетат с получением трет-бутил (R)-4-[2-хлор-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (2,34 г, выход 55%) в виде белого порошка.
МС 493(M+)
Температура плавления 207,0-209,5°C.
Пример 147
Получение трет-бутил (R)-4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата
Трет-бутил 4-(3-гидроксифенил)пиперазин-1-карбоксилат (3,23 г, 11,6 ммоль) растворяли в ДМФА (40мл). К раствору добавляли гидрид натрия (557 мг, 13,9 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 80°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (2,78г, 12,8 ммоль), полученный в примере 12, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и затем кристаллизовали из смеси метиленхлорид-этилацетат с получением трет-бутил (R)-4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (1,4 г, выход 26%) в виде белого порошка.
МС 459(M+)
Температура плавления 179,5-182,0°C.
Пример 148
Получение трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата
Трет-бутил 4-(4-гидроксифенил)пиперазин-1-карбоксилат (13,5 г, 48,8 ммоль) растворяли в ДМФА (100мл). К раствору добавляли гидрид натрия (2,15 г, 53,7 ммоль) при комнатной температуре и раствор перемешивали в течение 20 минут при 70°C. К раствору добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (10,6 г, 48,8 ммоль), полученный в примере 12, и раствор перемешивали в течение еще 20 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и затем кристаллизовали из смеси метиленхлорид-этилацетат с получением трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (9,9 г, выход 44%) в виде белого порошка.
Оптическая чистота >99,5% e.e.
[α]D 28=-10,85° (концентрация: 1,014, CHCl3)
МС 459(M+)
Температура плавления 230-232°C
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 1,76 (3H, с), 2,99-3,03 (4H, м), 3,54-3,59 (4H, м), 4,02 (1H, д, J=10,2 Гц), 4,04 (1H, д, J=10,1 Гц), 4,18 (1H, д, J=10,1 Гц), 4,49 (1H, д, J=10,2 Гц), 6,76-6,81 (2H, м), 6,85-6,89 (2H, м), 7,58 (1H, с).
Пример 149
Получение дигидрохлорида (R)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазина
Трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (300 мг, 0,65 ммоль), полученный в примере 148, растворяли в трифторуксусной кислоте (5мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метаноле. К раствору добавляли насыщенный хлористый водород (5мл) в этилацетате и осадки отфильтровывали и сушили при пониженном давлении с получением дигидрохлорида (R)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазина (279 мг, выход 99%) в виде светло-желтого порошка.
МС 359(M+)
Температура плавления 212-220°C (разложение)
1H-ЯМР (ДМСО-d6) δ м.д.:
1,67 (3H, с), 3,22-3,31 (8H, м), 4,18 (1H, д, J=10,9 Гц), 4,23 (2H, с), 4,37 (1H, д, J=10,9 Гц), 6,85 (2H, д, J=9,1 Гц), 7,00 (2H, д, J=9,1 Гц), 8,16 (1H, с), 9,37 (3H, ушир.).
Пример 150
Получение (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (800 мг, 1,74 ммоль), полученного в примере 148, и трифторуксусной кислоты (3 мл) перемешивали при комнатной температуре в течение 7 часов. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (10мл). К раствору добавляли триэтиламин (3 мл, 21,52 ммоль) с последующим перемешиванием при комнатной температуре в течение 5 минут. Смесь концентрировали при пониженном давлении и остаток растворяли в метаноле (10мл). К раствору добавляли 4-трифторметилбензальдегид (910 мг, 5,23 ммоль), цианотригидроборат натрия (328 мг, 5,23 ммоль) и уксусную кислоту (0,33 мл, 5,23 ммоль) с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия и метиленхлорид, раствор перемешивали и затем экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) с получением (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (667 мг, выход 74%) в виде светло-желтого порошка.
Температура плавления 205,5-207°C.
Пример 151
Получение этил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата
Трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (300 мг, 0,65 ммоль), полученный в примере 148, растворяли в метиленхлориде (5мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и затем добавляли метиленхлорид (5мл), триэтиламин (2мл) и этилхлорформиат (0,11 мл, 1,31 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением этил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (182 мг, выход 65%) в виде белого порошка.
[α]D 28=-9,86° (концентрация: 1,014, CHCl3).
МС 431(M+)
Температура плавления 210,5-212,0°C.
Пример 152
Получение 4-хлорбензил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата
Трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (300 мг, 0,65 ммоль), полученный в примере 148, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и затем добавляли метиленхлорид (2 мл) и триэтиламин (2 мл). После перемешивания при комнатной температуре в течение 5 минут раствор концентрировали при пониженном давлении и остаток растворяли в ДМФА (15 мл). К раствору добавляли смесь 4-хлорбензилового спирта (186 мг, 1,31 ммоль) и 1,1'-карбонилдиимидазола (212 мг, 1,31 ммоль) в ДМФА (5 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду, экстрагировали этилацетат и органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 4-хлорбензил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилата (313 мг, выход 91%) в виде светло-желтого порошка.
[α]D 28=-10,84° (концентрация: 1,006, CHCl3)
МС 527(M+)
Температура плавления 184,5-187,5°C.
Используя соответствующие исходные вещества, получали соединение примера 153 способом, подобно описанному в примере 152.
Пример 153
5-Хлорбензофуран-2-илметил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат
Выход 79%, температура плавления 195-197°C.
Используя трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилат, полученный в примере 143, трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]-1,2,3,6-тетрагидропиридин-1-карбоксилат, полученный в примере 144, трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоил]пиперазин-1-карбоксилат, полученный в примере 145, или трет-бутил (R)-4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат, полученный в примере 147, получали соединения 154-158 способом, подобно описанному в примере 152.
Пример 154
4-Трифторметоксибензил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилат
Выход 54%, температура плавления 202,5-204°C.
Пример 155
4-Трифторметоксибензил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]-1,2,3,6-тетрагидропиридин-1-карбоксилат
Выход 67%, температура плавления 174,3-174,8°C.
Пример 156
4-Трифторметоксибензил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоил]пиперазин-1-карбоксилат
Выход 86%, температура плавления 168,5-172°C.
Пример 157
Этил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоил]пиперазин-1-карбоксилат
Выход 85%, температура плавления 132-135°C.
Пример 158
4-Трифторметоксибензил (R)-4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат
Выход 50%, температура плавления 136,5-138°C.
Пример 159
Получение (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
Трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (4,22 г, 9,60 ммоль), полученный в примере 148, растворяли в метиленхлориде (10 мл). К раствору добавляли трифторуксусную кислоту (30 мл) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (10мл) и триэтиламин (10 мл). Раствор перемешивали при комнатной температуре в течение 5 минут и затем концентрировали при пониженном давлении. Остаток растворяли в дихлорэтане. К раствору добавляли 4-трифторметоксибензальдегид (1,64 мл, 11,5 ммоль) и триацетоксиборогидрид натрия (3,05 г, 14,4 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия и метиленхлорид и раствор перемешивали и экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и затем кристаллизовали из смеси метиленхлорид-этилацетат с получением (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (3,23 г, выход 63%) в виде светло-желтого порошка.
Оптическая чистота >99,5% e.e.
[α]D 28=-8,25° (концентрация: 1,018, CHCl3)
МС 533(M+)
Температура плавления 213,5-217°C.
Соединение примера 159 получали также в соответствии со следующим примером 160.
Пример 160
Получение (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
4-[4-(4-Трифторметоксибензил)пиперазин-1-ил]фенол (3,36г, 9,54 ммоль) растворяли в ДМФА (20мл). К раствору добавляли гидрид натрия (420 мг, 10,5 ммоль) при комнатной температуре и раствор перемешивали в течение 15 минут при 80°C. К реакционной смеси добавляли при охлаждении на бане со льдом (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (2,18г, 10,0 ммоль), полученный в примере 12, с последующим перемешиванием в течение еще 15 минут при 80°C. К реакционной смеси добавляли ледяную воду и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и растворяли в метиленхлориде. Раствор промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и затем кристаллизовали из смеси метиленхлорид-этилацетат с получением (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (2,0 г, выход 40%) в виде светло-желтого порошка.
Используя трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперидин-1-карбоксилат, полученный в примере 143, трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]-1,2,3,6-тетрагидропиридин-1-карбоксилат, полученный в примере 144, или трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоил]пиперазин-1-карбоксилат, полученный в примере 145, получали соединения примеров 161-163 способом, подобно описанному в примере 159.
Пример 161
(R)-2-Метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Выход 45%, температура плавления 186-188°C.
Пример 162
(R)-2-Метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)-1,2,3,6-тетрагидропиридин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Выход 61%, температура плавления 168-174°C.
Пример 163
(R)-4-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)бензоил]-1-(4-трифторметоксибензил)пиперазин
Выход 83%, температура плавления 155-156°C.
Пример 164
Получение 4-трифторметоксибензиламида (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоновой кислоты
Трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (120 мг, 0,26 ммоль), полученный в примере 148, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, затем добавляли метиленхлорид (2 мл) и триэтиламин (2 мл). Раствор перемешивали при комнатной температуре в течение 5 минут и затем концентрировали при пониженном давлении. Остаток растворяли в ДМФА (10 мл). К раствору добавляли смесь 4-трифторметоксибензиламина (125 мг, 0,65 ммоль) и 1,1'-карбонилдиимидазола (110 мг, 0,68 ммоль) в ДМФА (5 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 4-трифторметоксибензиламида (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоновой кислоты (48 мг, выход 32%) в виде белого порошка.
МС 558(M-18)+
Температура плавления 166,5-168,5°C.
Пример 165
Получение (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензоил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
Трет-бутил (R)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)фенил]пиперазин-1-карбоксилат (300 мг, 0,65 ммоль), полученный в примере 148, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (10 мл), триэтиламин (2 мл) и 4-трифторметоксибензоилхлорид (0,15 мл, 0,98 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем выливали в воду и экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензоил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола (263 мг, выход 74%) в виде белого порошка.
МС 547(M+)
Температура плавления 201,5-203,2°C.
Пример 166
Получение (R)-2-метил-6-нитро-2-[4-(1-оксотиоморфолин-4-ил)феноксиметил]-2,3-дигидроимидазо[2,1-b]оксазола
(R)-2-Метил-6-нитро-2-[4-(тиоморфолин-4-ил)феноксиметил]-2,3-дигидроимидазо[2,1-b]оксазол (85 мг, 0,23 ммоль), полученный в примере 137, растворяли в метиленхлориде (5 мл). К раствору добавляли м-хлорпербензойную кислоту (59 мг, 0,24 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 минут. Реакционную смесь разбавляли метиленхлоридом. Раствор промывали раствором тиосульфата натрия, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением (R)-2-метил-6-нитро-2-[4-(1-оксотиоморфолин-4-ил)феноксиметил]-2,3-дигидроимидазо[2,1-b]оксазола (59 мг, выход 67%) в виде белого порошка.
МС 392 (M+)
Температура плавления 198-200°C.
Пример 167
Получение N-метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-(4-трифторметоксифенокси)этиламина
Смесь 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (84 мг, 0,39 ммоль), полученного в примере 6, N-метил-2-(4-трифторметоксифенокси)этиламина (100 мг, 0,43 ммоль) и ДМФА (1 мл) перемешивали при 65-70°С в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением желтого масла.
Желтое масло растворяли в ДМФА (1 мл). К раствору добавляли гидрид натрия (11 мг, 0,28 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли ледяную воду и раствор экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением N-метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-(4-трифторметоксифенокси)этиламина (34 мг, выход 21%) в виде белого порошка.
Температура плавления 86,4-89,2°C.
Пример 168
Получение трет-бутил-N-метил-N-{2-[N-метил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)амино]этил}карбамата
Смесь 2-хлор-4-нитро-1H-имидазола (5,97 г, 27,43 ммоль), трет-бутил-N-метил-{2-[N-метил(2-метилоксиран-2-илметил)амино]этил}карбамата (10,53 г, 40,76 ммоль), триэтиламина (0,76 мл, 5,49 ммоль) и 1-пропанола (60 мл) перемешивали при кипячении с обратным холодильником в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением желтого масла.
Желтое масло растворяли в 1,4-диоксане (200 мл). К раствору гидрид натрия (500 мг, 12,5 ммоль) добавляли с последующим перемешиванием при кипячении с обратным холодильником в течение ночи. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли ледяную воду и раствор экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением трет-бутил-N-метил-N-{2-[N-метил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)амино]этил}карбамата (1,94 г, выход 13%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 1,58 (3H, с), 2,38 (3H, с), 2,57-2,69 (3H, м), 2,79 (3H, с), 2,89 (1H, д, J=14,9 Гц), 3,15-3,25 (2H, ушир.м), 3,85 (1H, д, J=14,9 Гц), 4,33 (1H, ушир.), 7,52 (1H, с).
Пример 169
Получение (S)-N-метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-{4-[4-(трифторметил)фенил]пиперазин-1-ил}этиламина
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (523 мг, 2,41 ммоль), полученный в примере 12, и N-метил-2-[4-(4-трифторметилфенил)пиперазин-1-ил]этиламин (900 мг, 3,13 ммоль) добавляли к ДМФА (15 мл) с последующим перемешиванием при 70-80°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением желтого масла.
Желтое масло растворяли в ДМФА (15 мл). К раствору добавляли гидрид натрия (115 мг, 2,89 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли ледяную воду и раствор экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (S)-N-метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-{4-[4-(трифторметил)фенил]пиперазин-1-ил}этиламина (173 мг, выход 15%) в виде белого порошка.
МС 468(M+)
Температура плавления 148,0-150,5°C.
Используя соответствующие исходные вещества, получали соединения примеров 170-177 способом, подобно описанному в примере 169.
Пример 170
(S)-N-Метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-(4-трифторметилфенокси)этиламин
Белый порошок, выход 12%
МС 399(M-H)+
Температура плавления 123,0-126,0°C.
Пример 171
(S)-N-Метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-(4-трифторметоксифенокси)этиламин
Белый порошок, выход 45%
МС 416(M+)
Температура плавления 112,5-115,0°C.
Пример 172
(S)-N,N'-Диметил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-N'-(4-трифторметилфенил)-1,2-этилендиамин
Белый порошок, выход 24%
МС 413(M+)
Температура плавления 135,5-137,5°C.
Пример 173
Трет-бутил (S)-4-[2-(N-метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламино)этил]пиперазин-1-карбоксилат
Белый порошок, выход 30%
МС 425(M+H)+
Температура плавления 149,5-151,8°C.
Пример 174
(S)-N-Бензил-N-[2-(4-трифторметоксифенокси)этил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламин
Белый порошок, выход 25%
Температура плавления 96,5-97°C.
Пример 175
(S)-N-Метил-N-[3-(4-трифторметоксифенокси)пропил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламин
Белый порошок, выход 50%
Температура плавления 92-95°C.
Пример 176
(S)-N-Метил-N-[2-(4-хлорфенокси)этил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламин
Белый порошок, выход 27%
Температура плавления 130,5-132°C.
Пример 177
(S)-N-Метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-[4-(4-трифторметилфенокси)пиперидин-1-ил]этиламин
Светло-коричневый порошок, выход 26%
1H-ЯМР (CDCl3) δ м.д.:
1,58 (3H, с), 1,70-1,85 (2H, м), 1,98 (2H, ушир.), 2,37 (3H, с), 2,25-2,50 (4H, м), 2,50-2,80 (5H, м), 2,90 (1H, д, J=14,9 Гц), 3,85 (1H, д, J=9,5 Гц), 4,37 (1H, м), 4,52 (1H, д, J=14,9 Гц), 7,42 (2H, д, J=8,7 Гц), 7,52 (1H, с), 7,53 (2H, д, J=8,7 Гц).
Пример 178
Получение N-(2-этоксикарбонилфенил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламина
Смесь 2-хлор-4-нитро-1H-имидазола (891 мг, 6,04 ммоль), 1-(2-метилоксиран-2-илметил)-1H-бензо[d][1,3]оксазин-2,4-диона (1,41 г, 6,04 ммоль), ацетата натрия (545 мг, 6,64 ммоль) и этанола (10 мл) перемешивали при кипячении с обратным холодильником в течение 10 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и остаток растворяли в 1,4-диоксане (20 мл). К раствору добавляли гидрид натрия (219 мг, 5,48 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли ледяную воду и осадки отфильтровывали и очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением N-(2-этоксикарбонилфенил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламина (1,15 г, выход 55%) в виде белого порошка.
Температура плавления 162,5-163,2°C.
Пример 179
Получение (S)-1-[2-гидрокси-3-(N-метилбензиламино)-2-метилпропил]-2-хлор-4-нитроимидазола
Смесь (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (500 мг, 2,3 ммоль), полученного в примере 12, N-метилбензиламина (334 мг, 2,76 ммоль) и ДМФА (2,5 мл) перемешивали при 60°С в течение 9 часов. Реакционной смеси давали остыть до комнатной температуры и добавляли воду с последующим экстрагированием этилацетатом два раза. Органические фазы объединяли, промывали водой три раза и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением (S)-1-[2-гидрокси-3-(N-метил-N-бензиламино)-2-метилпропил]-2-хлор-4-нитроимидазола (712 мг, выход 91%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 2,37-2,57 (5H, м), 3,51 (1H, д, J=12,9 Гц), 3,72 (1H, д, J=12,9 Гц), 3,85 (2H, с), 7,16-7,39 (5H, м), 7,87 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 180-187 способом, подобно описанному в примере 179.
Пример 180
(S)-1-{2-Гидрокси-3-[N-метил(3-хлорбензил)]амино-2-метил}пропил-2-хлор-4-нитроимидазол
Выход 98%
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, с), 2,35-2,57 (5H, м), 3,53 (1H, д, J=13,3 Гц), 3,67 (1H, д, J=13,3 Гц), 3,92 (2H, с), 7,10-7,31 (4H, м), 7,95 (1H, с).
Пример 181
(S)-1-[2-Гидрокси-3-(N-метил-4-хлорбензиламино)-2-метилпропил]-2-хлор-4-нитроимидазол
Выход 86%
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 2,33-2,59 (5H, м), 3,53 (1H, д, J=13,2 Гц), 3,68 (1H, д, J=13,2 Гц), 3,92 (2H, с), 7,19 (2H, д, J=8,4 Гц), 7,31 (2H, д, J=8,4 Гц), 7,96 (1H, с).
Пример 182
(S)-1-[2-Гидрокси-3-(N-метил-4-трифторметоксибензиламино)-2-метилпропил]-2-хлор-4-нитроимидазол
Выход 98%
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 2,37 (3H, с), 2,47 (1H, д, J=13,9 Гц), 2,58 (1H, д, J=13,9 Гц), 3,58 (1H, д, J=13,3 Гц), 3,72 (1H, д, J=13,3 Гц), 3,94 (2H, с), 7,19 (2H, д, J=8,6 Гц), 7,31 (2H, д, J=8,6 Гц), 7,99 (1H, с).
Пример 183
(S)-1-[2-Гидрокси-3-(N-метил-4-трифторметилбензиламино)-2-метилпропил]-2-хлор-4-нитроимидазол
Выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, с), 2,38 (3H, с), 2,50 (1H, д, J=13,9 Гц), 2,60 (1H, д, J=13,9 Гц), 3,65 (1H, д, J=13,6 Гц), 3,79 (1H, д, J=13,6 Гц), 3,97 (2H, с), 7,41 (2H, д, J=8,2 Гц), 7,61 (2H, д, J=8,2 Гц), 8,00 (1H, с).
Пример 184
(S)-1-[2-Гидрокси-3-(N-метил-4-метоксибензиламино)-2-метилпропил]-2-хлор-4-нитроимидазол
Выход 85%
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 2,36-2,50 (5H, м), 3,45 (1H, д, J=12,8 Гц), 3,64 (1H, д, J=12,8 Гц), 3,80 (3H, с), 3,84 (2H, с), 6,84 (2H, дд, J=1,9 Гц, 8,6 Гц), 7,13 (2H, дд, J=1,9 Гц, 8,6 Гц), 7,89 (1H, с).
Пример 185
(S)-1-[2-Гидрокси-3-(N-метил-4-диметиламинобензиламино)-2-метилпропил]-2-хлор-4-нитроимидазол
Выход 94%
1H-ЯМР (CDCl3) δ м.д.:
1,11 (3H, с), 2,34-2,47 (5H, м), 2,93 (s, 6H), 3,39 (1H, д, J=12,8 Гц), 3,60 (1H, д, J=12,8 Гц), 3,81 (2H, с), 6,65 (2H, д, J=8,7 Гц), 7,03 (2H, д, J=8,7 Гц), 7,87 (1H, с).
Пример 186
(S)-1-[2-Гидрокси-3-(N-метилфениламино)-2-метилпропил]-2-хлор-4-нитроимидазол
Выход 92%
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 3,06 (3H, с), 3,40 (2H, с), 4,05 (1H, д, J=14,2 Гц), 4,13 (1H, д, J=14,2 Гц), 6,74-6,89 (3H, м), 7,17-7,34 (2H, м), 8,04 (1H, с).
Пример 187
(S)-1-[2-Гидрокси-3-(N-метил-4-хлорфениламино)-2-метилпропил]-2-хлор-4-нитроимидазол
Выход 92%
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 3,04 (3H, с), 3,38 (2H, с), 4,08 (2H, с), 6,74 (2H, дд, J=2,1 Гц, 7,2 Гц), 7,19 (2H, дд, J=2,1 Гц, 7,2 Гц), 8,02 (1H, с).
Пример 188
Получение (S)-2-(N-бензил-N-метил)аминометил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
К смеси (S)-1-[2-гидрокси-3-(N-метилбензиламино)-2-метилпропил]-2-хлор-4-нитроимидазола (710 мг, 2,1 ммоль), полученного в примере 179, и ДМФА (2,1 мл) гидрид натрия (101 мг, 2,51 ммоль) добавляли с последующим перемешиванием в течение 2 часов при охлаждении на бане со льдом. К реакционной смеси добавляли этилацетат (0,7 мл) и воду (5 мл) в указанном порядке. Осадки отфильтровывали и растворяли в изопропиловом спирте (10 мл) с перемешиванием при кипячении с обратным холодильником. К раствору добавляли активированный уголь (28 мг) с последующим перемешиванием при кипячении с обратным холодильником в течение 20 минут. После фильтрования изопропиловый эфир (3 мл) добавляли к раствору и смеси давали постоять. Собирали осадки с получением (S)-2-(N-бензил-N-метил)аминометил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (248 мг, выход 39%) в виде желтого порошка.
Температура плавления 132,5-133°C.
Используя соответствующие исходные вещества, получали соединения примеров 189-196 способом, подобно описанному в примере 188.
Пример 189
(S)-2-[N-(4-Хлорбензил)-N-метиламино]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 44%, температура плавления 129-129,5°C.
Пример 190
(S)-2-[N-(3-Хлорбензил)-N-метиламино]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 65%, температура плавления 177,5-178,5°C.
Пример 191
(S)-2-[N-(4-Трифторметоксибензил)-N-метиламино]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 53%, температура плавления 145-146°C.
Пример 192
(S)-2-[N-(4-Трифторметилбензил)-N-метиламино]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 49%, температура плавления 130-132°C.
Пример 193
(S)-2-[N-(4-Мэтоксибензил)-N-метиламино]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 59%, температура плавления 144-147°C.
Пример 194
(S)-2-[N-(4-Диметиламинобензил)-N-метиламино]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 47%, температура плавления 168-169°C.
Пример 195
(S)-2-(N-Фенил-N-метиламино)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 55%, температура плавления 147-148°C.
Пример 196
(S)-2-[N-(4-Хлорфенил)-N-метиламино]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 34%, температура плавления 174-175°C.
Пример 197
Получение 4-трифторметилбензил (S)-4-[2-(N-метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламино)этил]пиперазин-1-карбоксилата
Трет-бутил (S)-4-[2-(N-метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламино)этил]пиперазин-1-карбоксилат (300 мг, 0,71 ммоль), полученный в примере 173, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (2 мл) и триэтиламин (2 мл). После перемешивания в течение 5 минут при комнатной температуре раствор концентрировали при пониженном давлении. Остаток растворяли в ДМФА (15 мл). К раствору добавляли смесь 4-трифторметилбензилового спирта (373 мг, 2,12 ммоль) и 1,1'-карбонилдиимидазола (344 мг, 2,12 ммоль) в ДМФА (5 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и сушили над сульфатом магния. После фильтрования полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 4-трифторметилбензил (S)-4-[2-(N-метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламино)этил]пиперазин-1-карбоксилата (196 мг, выход 53%) в виде белого порошка.
МС 509(M-H2O)+
Температура плавления 77,2-76,9°C.
Пример 198
Получение (S)-N-метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-[4-(4-трифторметилбензил)пиперазин-1-ил]этиламина
Трет-бутил (S)-4-[2-(N-метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламино)этил]пиперазин-1-карбоксилат (400 мг, 0,94 ммоль), полученный в примере 173, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (2мл) и триэтиламин (2 мл). После перемешивания в течение 5 минут при комнатной температуре раствор концентрировали при пониженном давлении. Остаток растворяли в метаноле (10 мл). К раствору добавляли 4-(трифторметил)бензальдегид (0,4 мл, 2,83 ммоль), цианотригидроборат натрия (178 мг, 2,83 ммоль) и уксусную кислоту (0,2 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. К раствору добавляли насыщенный раствор гидрокарбоната натрия и метиленхлорид с последующим перемешиванием и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния. После фильтрования полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением (S)-N-метил-N-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-[4-(4-трифторметилбензил)пиперазин-1-ил]этиламина (307 мг, выход 68%) в виде белого порошка.
МС 482(M+)
Температура плавления 102,0-104,5°C.
Пример 199
Получение этил(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата
2,4-Динитро-1H-имидазол (0,678 г, 3,92 ммоль) и фенилоксиран-2-илметилкарбамат (1,04 г, 5,87 ммоль) растворяли в этаноле (20 мл). К раствору добавляли ацетат натрия (0,386 г, 4,70 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение ночи. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия и метиленхлорид и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) и обрабатывали диизопропиловым эфиром с получением этил(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата (0,116 г, выход 11,6%) в виде светло-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,15 (3H, т, J=7,1 Гц), 3,41-3,51 (2H, м), 3,93-4,11 (3H, м), 4,38 (1H, дд, J=8,6 Гц, 10,7 Гц), 5,31-5,47 (1H, м), 7,52 (1H, ушир.), 8,13 (1H, с).
Пример 200
Получение бензил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата
2,4-Динитро-1H-имидазол (3 г, 19 ммоль) и бензил(2-метилоксиран-2-илметил)карбамат (4,31 г, 19 ммоль) растворяли в этаноле (20 мл). К раствору добавляли ацетат натрия (1,56 г, 19,0 ммоль) с последующим перемешиванием при 70°C в течение ночи. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия и метиленхлорид и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1, метиленхлорид/метанол=50/1) и перекристаллизовывали из смеси этилацетат-метиленхлорид с получением бензил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата (0,298 г, выход 4,7%) в виде бесцветного твердого вещества.
Температура плавления 171,3-172,2°C
1H-ЯМР (ДМСО-d6) δ м.д.:
1,55 (3H, с), 3,46 (2H, д, J=6,3 Гц), 4,06 (1H, д, J=11,0 Гц), 4,25 (1H, д, J=11,0 Гц), 5,03 (2H, с), 7,19-7,41 (5H, м), 7,76 (1H, т, J=6,3 Гц), 8,13 (1H, с).
Пример 201
Получение 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламинтрифторацетата
Смесь бензил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата (190 мг, 0,57 ммоль), полученного в примере 200, трифторуксусной кислоты (4 мл) и метиленхлорида (5 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток обрабатывали диэтиловым эфиром с получением 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламинтрифторацетата (120 мг, выход 67%) в виде светло-желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,35 (3H, с), 3,23 (1H, д, J=9,6 Гц), 3,49 (1H, д, J=9,6 Гц), 3,82-3,98 (2H, м), 7,98 (1H, с), 12,22 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 202-204 способом, подобно описанному в примере 200.
Пример 202
Бензил-N-метил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 14%, температура плавления 150,3-151,6°C.
Пример 203
Бензил(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 11%
1H-ЯМР (ДМСО-d6) δ м.д.:
3,45-3,59 (2H, м), 4,07 (1H, дд, J=6,6 Гц, 10,8 Гц), 4,39 (1H, дд, J=8,6 Гц, 10,8 Гц), 5,04 (2H, с), 5,32-5,50 (1H, м), 7,23-7,41 (5H, м), 7,71 (1H, ушир.), 8,13 (1H, с).
Пример 204
Трет-бутил(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 27%
1H-ЯМР (CDCl3) δ м.д.:
1,43 (9H, с), 3,65 (2H, дд, J=4,3 Гц, 6,2 Гц), 4,20 (1H, дд, 7,0 Гц, 10,5 Гц), 4,36 (1H, дд, J=8,6 Гц, 10,5 Гц), 5,20 (1H, т, J=6,2 Гц), 5,35-5,48 (1H, м), 7,56 (1H, с).
Пример 205
Получение 4-хлорбензил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата
2,4-Динитро-1H-имидазол (0,518 г, 3,28 ммоль) и 4-хлорбензил(2-метилоксиран-2-илметил)карбамат (2,097 г, 8,20 ммоль) и ацетат натрия (0,538 г, 6,56 ммоль) в этаноле (6 мл) перемешивали при кипячении с обратным холодильником в течение 1 часа. К раствору добавляли воду и осадки отфильтровывали. Полученное твердое вещество обрабатывали диэтиловым эфиром с получением 4-хлорбензил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата (0,197 г, выход 16%) в виде бесцветного твердого вещества.
Температура плавления 221,0-221,8°C.
Используя бензил-N-метил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат, полученный в примере 202, получали соединение примера 206 способом, подобно описанному в примере 201.
Пример 206
N-Метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметиламинтрифторацетат
Температура плавления 176,2-178,8°C.
Используя соответствующие исходные вещества, получали соединения примеров 207-211 способом, подобно описанному в примере 205.
Пример 207
4-Фторбензил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 25%, температура плавления 200,4-202,1°C.
Пример 208
Этил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 26%, температура плавления 182,5-183,4°C.
Пример 209
4-Трифторметоксибензил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 17%, температура плавления 182,3-184,4°C.
Пример 210
4-Хлорбензил(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 17%, температура плавления 182,6-182,9°C.
Пример 211
4-Фторбензил(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамат
Выход 17%, температура плавления 164,6-165,1°C.
Пример 212
Получение 4-фторбензил [3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-N-метилкарбамата
2-Хлор-4-нитро-1H-имидазол (0,953 г, 6,46 ммоль) и 4-фторбензил-N-метил(2-метилоксиран-2-илметил)карбамат (1,964 г, 7,75 ммоль) растворяли в этаноле (20 мл). К раствору добавляли ацетат натрия (0,583 г, 7,11 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат и воду и раствор экстрагировали этилацетатом. Органическую фазу сушили над сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением 4-фторбензил[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-N-метилкарбамата (1,683 г, выход 65%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ м.д.:
1,17 (3H, с), 3,06 (3H, с), 3,25 (1H, д, J=14,7 Гц), 3,51 (1H, д, J=14,7 Гц), 4,00 (2H, с), 5,12 (2H, с), 6,95-7,09 (2H, м), 7,27-7,41 (2H, м), 8,07 (1H, с).
Используя 4-фторбензил-N-метил(оксиран-2-илметил)карбамат, получали соединение примера 213 способом, подобно описанному в примере 212.
Пример 213
4-Фторбензил[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]-N-метилкарбамат
Выход 51%
1H-ЯМР (CDCl3) δ м.д.:
3,04 (3H, с), 3,27-3,55 (2H, м), 3,73-4,23 (4H, м), 5,11 (2H, с), 7,00-7,14 (2H, м), 7,27-7,41 (2H, м), 7,96 (1H, с).
Пример 214
Получение 4-фторбензил-N-метил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата
4-Фторбензил[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-N-метилкарбамат 212 (1,683 г, 4,20 ммоль) растворяли в 1,4-диоксане (30 мл). К раствору добавляли гидрид натрия (0,185 г, 4,62 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа и затем перемешивали при кипячении с обратным холодильником в течение 7 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и осадки отфильтровывали и очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=2/1). Полученное твердое вещество обрабатывали смесью н-гексана и этилацетата с получением 4-фторбензил-N-метил(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)карбамата (0,381 г, выход 25%) в виде бесцветного твердого вещества.
Температура плавления 168,9-169,9°C.
Используя 4-фторбензил[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]-N-метилкарбамат, полученный в примере 213, получали соединение примера 215 способом, подобно описанному в примере 214.
Пример 215
4-Фторбензил-N-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилкарбамат
Выход 16%, температура плавления 124,5-128,1°C.
Используя соответствующие исходные вещества, получали соединения примеров 216-220 способом, подобно описанному в примере 179.
Пример 216
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-{[1-(4-хлорфенил)пиперидин-4-ил]-N-метиламино}-2-гидрокси-2-метилпропан
Желтое масло, выход 98%
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 1,57-1,82 (4H, м), 2,38-2,71 (4H, м), 2,40 (3H, м), 3,65-3,71 (2H, м), 3,82 (1H, с), 3,89-4,01 (2H, м), 6,81-6,86 (2H, м), 7,16-7,22 (2H, м), 8,06 (1H, с).
Пример 217
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-{[1-(4-трифторметоксифенил)пиперидин-4-ил]-N-метиламино}-2-гидрокси-2-метилпропан
Желтое масло, выход 91%
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 1,59-1,83 (4H, м), 2,41 (3H, с), 2,43-2,73 (5H, м), 3,66-3,73 (2H, м), 3,84 (1H, с), 3,93 (1H, д, J=14,2 Гц), 4,00 (1H, д, J=14,2 Гц), 6,86-6,91 (2H, м), 7,07-7,12 (2H, м), 8,06 (1H, с).
Пример 218
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-{[1-(4-трифторметилфенил)пиперидин-4-ил]-N-метиламино}-2-гидрокси-2-метилпропан
Желтое масло, выход 96%
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 1,54-1,70 (2H, м), 1,77-1,84 (2H, м), 2,40 (3H, с), 2,42-2,60 (3H, м), 2,72-2,82 (2H, м), 3,79 (1H, с), 3,84-3,89 (2H, м), 3,92 (1H, д, J=14,2 Гц), 3,99 (1H, д, J=14,2 Гц), 6,91 (2H, д, J=8,7 Гц), 7,46 (2H, д, J=8,7 Гц), 8,06 (1H, с).
Пример 219
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-{[1-(4-цианофенил)пиперидин-4-ил]-N-метиламино}-2-гидрокси-2-метилпропан
Желтое масло, выход 89%
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 1,51-1,65 (2H, м), 1,77-1,84 (2H, м), 2,39 (3H, с), 2,42-2,62 (3H, м), 2,76-2,88 (2H, м), 3,75 (1H, с), 3,88-4,03 (4H, м), 6,81-6,88 (2H, м), 7,45-7,53 (2H, м), 8,05 (1H, с).
Пример 220
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]-N-метиламино}-2-гидрокси-2-метилпропан
Желтое масло
1H-ЯМР (CDCl3) δ м.д.:
1,11 (3H, с), 1,46 (9H, с), 1,50-1,80 (4H, м), 2,37 (3H, с), 2,40-2,75 (5H, м), 3,90 (1H, д, J=14,2 Гц), 3,99 (1H, д, J=14,2 Гц), 4,22 (2H, ушир.), 8,05 (1H, с).
Используя соединения, полученные в примерах 216-220, получали соединения примеров 221-225 способом, подобно описанному в примере 188.
Пример 221
(S)-2-{[1-(4-Хлорфенил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Белый порошок, выход 47%
МС 406(M+1)+
Температура плавления 179,2-182,1°C.
Пример 222
(S)-2-{[1-(4-Трифторметоксифенил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 127,2-129,7°C.
Пример 223
(S)-2-{[1-(4-Трифторметилфенил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 131,5-133,6°C.
Пример 224
(S)-2-{[1-(4-Цианофенил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 149-152°C.
Пример 225
(S)-2-{[1-(Трет-бутоксикарбонил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Светло-желтый порошок, выход 37%
Температура плавления 138,5-140,3°C.
Пример 226
Получение (S)-2-{[1-(4-трифторметилбензилоксикарбонил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
(S)-2-{[1-(Трет-бутоксикарбонил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (400 мг, 1,01 ммоль), полученный в примере 225, растворяли в метиленхлориде (1 мл). К раствору добавляли трифторуксусную кислоту (1 мл) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (1 мл) и триэтиламин (2 мл). Раствор перемешивали при комнатной температуре в течение 5 минут, затем концентрировали при пониженном давлении и остаток растворяли в ДМФА (8 мл). К раствору добавляли смесь 4-(трифторметил)бензилового спирта (267 мг, 1,51 ммоль) и 1,1'-карбонилдиимидазола (246 мг, 1,51 ммоль) в ДМФА (2 мл), перемешанную при комнатной температуре в течение 4 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением (S)-2-{[1-(4-трифторметилбензилоксикарбонил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (341 мг, выход 68%) в виде светло-желтого порошка.
Температура плавления 110,6-113,1°C.
Используя соответствующие исходные вещества, получали соединения примеров 227 и 228 способом, подобно описанному в примере 226.
Пример 227
(S)-2-{[1-(4-Трифторметоксибензилоксикарбонил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 84,2-86,8°C.
Пример 228
(S)-2-{[1-(4-Хлорбензилоксикарбонил)пиперидин-4-ил]-N-метиламинометил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 116,2-116,6°C.
Пример 229
Получение 2-метил-6-нитро-2-[4-(4-трифторметилбензилокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (122 мг, 0,56 ммоль), полученный в примере 6, и 4-[4-(трифторметил)бензилокси]пиперидин (188 мг, 4,86 моль) растворяли в ДМФА (10 мл) с последующим перемешиванием при 70-75°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду, экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и сушили над сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением желтого масла.
Желтое масло растворяли в ДМФА (10 мл). К раствору добавляли гидрид натрия (134 мг, 3,36 ммоль) при охлаждении на бане со льдом и раствор перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду, экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением 2-метил-6-нитро-2-[4-(4-трифторметилбензилокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (41 мг, выход 17%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,45-1,70 (2H, м), 1,60 (3H, с), 1,75-1,88 (2H, м), 2,26-2,40 (1H, м), 2,45-2,55 (2H, м), 2,72-2,95 (3H, м), 3,38 (1H, м), 3,89 (1H, д, J=9,6 Гц), 4,31 (1H, д, J=9,6 Гц), 4,54 (2H, с), 7,43 (2H, д, J=8,2 Гц), 7,53 (1H, с), 7,79 (2H, д, J=8,2 Гц).
Пример 230
Получение 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропан-2-ола
К раствору 2-хлор-1-[2-гидрокси-2-метил-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазола (0,30 г, 0,77 ммоль), полученного в примере 5, и 4-(4-трифторметилфенокси)пиперидина (0,21 г, 0,85 ммоль) в ДМФА (6 мл) добавляли иодид натрия (0,13 г, 0,77 ммоль) и триэтиламин (0,12 мл, 0,77 ммоль) с последующим перемешиванием при 80°С в течение 7 часов. К реакционной смеси добавляли воду и полученный раствор экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропан-2-ола (0,23 г, выход 63%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,14 (3H, с), 1,76-2,04 (4H, м), 2,36 (1H, д, J=14,0 Гц), 2,43-2,72 (3H, м), 2,76-3,00 (2H, м), 3,46-3,52 (1H, ушир.), 3,98 (2H, с), 4,37-4,50 (1H, м), 6,91-7,00 (2H, м), 7,48-7,61 (2H, м), 8,05 (1H, с).
Используя соответствующие исходные вещества, получали соединение примера 231 способом, подобно описанному в примере 230.
Пример 231
1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифенокси)пиперидин-1-ил]пропан-2-ол
Выход 61%
1H-ЯМР (CDCl3) δ м.д.:
1,14 (3H, с), 1,74-2,04 (4H, м), 2,35 (1H, д, J=13,9 Гц), 2,40 (1H, д, J=13,9 Гц), 2,43-2,70 (2H, м), 2,74-3,00 (2H, м), 3,98 (2H, с), 4,25-4,41 (1H, м), 6,86-6,92 (2H, м), 7,11-7,15 (2H, м), 8,05 (1H, с).
Пример 232
Получение 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифениламино)пиперидин-1-ил]пропан-2-ола
Раствор 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (0,3 г, 1,38 ммоль), полученного в примере 6, и N-(пиперидин-4-ил)-4-трифторметоксианилина (0,43 г, 1,66 ммоль) в ДМФА (8 мл) перемешивали при 80°С в течение 2 часов. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифениламино)пиперидин-1-ил]пропан-2-ола (0,37 г, выход 56%) в виде желтого масла.
1,13 (3H, с), 1,39-1,63 (2H, м), 1,96-2,09 (2H, м), 2,47 (1H, д, J=13,9 Гц), 2,43-2,63 (3H, м), 2,67-2,83 (1H, м), 2,87-3,02 (1H, м), 3,15-3,39 (1H, м), 3,41-3,72 (2H, м), 3,97 (2H, с), 6,46-6,59 (2H, м), 6,96-7,09 (2H, м), 8,05 (1H, с).
Пример 233
Получение 2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
К раствору 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропан-2-ола (225 мг, 0,49 ммоль), полученного в примере 230, в ДМФА (2,5 мл), гидрид натрия (23 мг, 0,59 ммоль) добавляли с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли ледяную воду и этилацетат. Осадки отфильтровывали, промывали водой, перекристаллизовывали из смеси метиленхлорид-диизопропиловый эфир и затем промывали н-гексаном с получением 2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (80 мг, выход 39%) в виде светло-желтого твердого вещества.
Температура плавления 113-114°C.
Используя соответствующие исходные вещества, получали соединение примера 234 способом, подобно описанному в примере 233.
Пример 234
2-Метил-6-нитро-2-[4-(4-трифторметоксифенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 117-119°C.
Пример 235
Получение 2-[4-(4-трифторметоксифенил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Используя 1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифениламино)пиперидин-1-ил]пропан-2-ол (369 мг, 0,77 ммоль), полученный в примере 233, получали 2-[4-(4-трифторметоксифениламино)пиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (25 мг, выход 7%) в виде желтого порошка способом, подобно описанному в примере 232.
1H-ЯМР (CDCl3) δ м.д.:
1,11-1,40 (2H, м), 1,61 (3H, с), 1,85-2,01 (2H, м), 2,37 (1H, дт, J=2,7 Гц, 11,4 Гц), 2,46-2,59 (2H, м), 2,76-2,84 (1H, м), 2,87 (1H, д, J=14,9 Гц), 2,95-3,03 (1H, м), 3,10-3,25 (1H, м), 3,50 (1H, д, J=7,8 Гц), 3,90 (1H, д, J=9,7 Гц), 4,29 (1H, д, J=9,7 Гц), 6,46-6,52 (2H, м), 6,98-7,01 (2H, м), 7,50 (1H, с).
Пример 236
Получение трет-бутил-N-метил-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамата
2-Хлор-4-нитро-1H-имидазол (1,08 г, 7,31 ммоль), трет-бутил-N-метил-[1-(2-метилоксиран-2-илметил)пиперидин-4-ил]карбамат (2,08 г, 7,31 ммоль) и ацетат натрия (660 мг, 8,04 ммоль) в 1-пропаноле (15 мл) перемешивали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1), кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением трет-бутил-N-метил-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамата (348 мг, выход 12%) в виде белого порошка.
МС 396(M+1)+
Температура плавления 198,8-201,1°C.
Пример 237
Получение бензил-N-метил-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамата
Трет-бутил-N-метил-{1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил}карбамат (207 мг, 0,52 ммоль), полученный в примере 236, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли метиленхлорид (5 мл), триэтиламин (1 мл) и бензилхлоркарбонат (0,15 мл, 1,05 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь выливали в воду, экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси этилацетат-изопропиловый эфир с получением бензил-N-метил-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамата (184 мг, выход 82%) в виде белого порошка.
МС 430(M+H)+
Температура плавления 138,7-139,2°C.
Используя 4-хлорбензилхлоркарбонат, получали соединение примера 238 способом, подобно описанному в примере 237. Кроме того, используя 4-хлорфенилацетилхлорид, получали соединение примера 239 способом, подобно описанному в примере 237.
Пример 238
4-Хлорбензил-N-метил-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат
Температура плавления 147,2-149,2°C.
Пример 239
2-{4-[N-(4-Хлорфенилацетил)-N-метил]аминопиперидин-1-ил}метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 206,8-208°C.
Пример 240
Получение 2-метил-2-{4-[N-метил-N-(4-трифторметоксифенил)]аминопиперидин-1-ил}метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
К раствору 2-[4-(4-трифторметоксифенил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (60 мг, 0,14 ммоль), полученного в примере 235, в метаноле (2 мл) добавляли 37% раствор формальдегида (51 мкл, 0,70 ммоль) и цианотригидроборат натрия (26 мг, 0,42 ммоль) с последующим перемешиванием при комнатной температуре в течение еще 30 минут. К реакционной смеси добавляли уксусную кислоту (23 мкл, 0,42 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа при охлаждении на бане со льдом. К реакционной смеси добавляли раствор гидрокарбоната натрия и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=1/1) и кристаллизовали из диизопропилового эфира с получением 2-метил-2-{4-[N-метил-N-(4-трифторметоксифенил)]аминопиперидин-1-ил}метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (40 мг, выход 65%) в виде светло-желтого твердого вещества.
Температура плавления 135-136°C.
Пример 241
Получение 2-[4-(4-хлорбензил)оксипиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь 2-хлор-4-нитро-1H-имидазола (1,5 г, 10,17 ммоль), 4-(4-хлорбензилокси)-1-(2-метилоксиран-2-илметил)пиперидина (2,5 г, 8,45 ммоль), гидрокарбоната натрия (0,86 г, 10,24 ммоль) и этанола (15 мл) перемешивали при кипячении с обратным холодильником в течение 15 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) с получением 2-[4-(4-хлорбензил)оксипиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (662 мг, выход 16%) в виде белого порошка.
Температура плавления 129-130°C.
Пример 242
Получение 2-{4-[N-(4-хлорфенил)-N-метил]аминопиперидин-1-ил}метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (350 мг, 1,61 ммоль), полученного в примере 6, 4-[N-(4-хлорфенил)-N-метиламино]пиперидина (373 мг, 1,66 ммоль) и ДМФА (15 мл) перемешивали при 70°С в течение 5 часов. К реакционной смеси добавляли гидрид натрия (77 мг, 1,93 ммоль) с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза, промывали насыщенным раствором соли, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=1/1) с получением 2-{4-[N-(4-хлорфенил)-N-метил]аминопиперидин-1-ил}метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (307 мг, выход 47%) в виде светло-желтого порошка.
Температура плавления 186-187,8°C.
Используя 4-(4-трифторметоксибензил)пиперидин, 4-(4-трифторметилбензил)пиперидин, 4-(4-хлорбензил)пиперидин и 4-(хлорбензоил)пиперидин, получали соединения примеров 243-246 способом, подобно описанному в примере 242.
Пример 243
2-Метил-6-нитро-2-[4-(4-трифторметоксибензил)пиперидин-1-ил]метил-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 143,5-145°C.
Пример 244
2-Метил-6-нитро-2-[4-(4-трифторметилбензил)пиперидин-1-ил]метил-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 125-126°C.
Пример 245
2-[4-(4-Хлорбензил)пиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 109-110,5°C
Пример 246
2-[4-(4-Хлорбензоил)пиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 165-167°C.
Пример 247
Получение 2-метил-6-нитро-2-[4-(4-трифторметилбензоил)пиперидин-1-ил]метил-2,3-дигидроимидазо[2,1-b]оксазола
Смесь 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (80 мг, 0,37 ммоль), полученного в примере 6, 4-(4-трифторметилбензоил)пиперидина (95 мг, 0,37 ммоль), ацетата натрия (150 мг, 1,83 ммоль) и ДМФА (2 мл) перемешивали при 80°C в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза, промывали насыщенным раствором соли, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат/н-гексан=1/1) с получением 2-метил-6-нитро-2-[4-(4-трифторметилбензоил)пиперидин-1-ил]метил-2,3-дигидроимидазо[2,1-b]оксазола (46 мг, выход 29%) в виде белого порошка.
Температура плавления 172-174°C.
Используя соответствующие исходные вещества, получали соединение примера 248 способом, подобно описанному в примере 247.
Пример 248
2-Метил-6-нитро-2-[4-(4-трифторметоксибензоил)пиперидин-1-ил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 165-167°C.
Пример 249
Получение (S)-2-[4-(3,4-дихлорбензилокси)пиперидин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (396 мг, 1,82 ммоль), полученный в примере 12, и 4-(3,4-дихлорбензилокси)пиперидин (614 мг, 2,36 моль) в ДМФА (15 мл) перемешивали при 70-75°С в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением желтого масла.
Желтое масло растворяли в ДМФА (15 мл). К раствору добавляли гидрид натрия (87 мг, 2,18 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (S)-2-[4-(3,4-дихлорбензилокси)пиперидин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (431 мг, выход 44%) в виде белого порошка.
МС 441(M+)
Температура плавления 132,0-136,0°C.
Пример 250
Получение (S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-(4-трифторметоксифенил)метанона
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (1,0 г, 4,6 ммоль), полученный в примере 12, и 4-(4-трифторметоксибензоил)пиперидин (1,3 г, 4,8 ммоль), получали (S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-(4-трифторметоксифенил)метанон (771 мг, выход 37%) в виде светло-желтого порошка.
Температура плавления 113,0-115,0°C.
Пример 251
Получение этил-(S)-1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-карбоксилата
2-Хлор-4-нитро-1H-имидазол (3,7 г, 25,1 ммоль), этил-(S)-1-(2-метилоксиран-2-илметил)пиперидин-4-карбоксилат (4,8 г, 21,1 ммоль) и гидрокарбонат натрия (2,2 г, 25,1 ммоль) в этаноле (25 мл) перемешивали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) и кристаллизовали из диэтилового эфира с получением этил-(S)-1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-карбоксилата (1,4 г, выход 20%) в виде белого порошка.
Температура плавления 101,0-103,0°C.
Пример 252
Получение (S)-2-метил-6-нитро-2-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
4-(4-Трифторметоксифенил)-1,2,3,6-тетрагидропиридин (0,985 г, 4,05 ммоль) и (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,839 г, 3,86 ммоль), полученный в примере 12, добавляли к ДМФА (15 мл) и раствор перемешивали при 60°С в течение 8 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органические фазы промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=4/1) с получением в виде масла. Масло растворяли в ДМФА (20 мл) и гидрид натрия (94 мг, 2,35 ммоль) добавляли при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением (S)-2-метил-6-нитро-2-[4-(4-трифторметоксифенил)-1,2,3,6-тетрагидропиридин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (0,192 г, выход 23%) в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ м.д.:
1,68 (3H, с), 2,46-3,39 (8H, м), 3,95 (1H, д, J=10,2 Гц), 4,49 (1H, ушир.), 5,98 (1H, с), 7,16 (2H, д, J=8,3 Гц), 7,35 (2H, д, J=8,3 Гц), 7,53 (1H, с).
Пример 253
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропан-2-ола
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (500 мг, 2,30 ммоль), полученный в примере 12, и 4-(4-трифторметилфенокси)пиперидин (730 мг, 3,0 ммоль) в ДМФА (10 мл) перемешивали при 70-75°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропан-2-ола (1,06 г, выход 99%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,14 (3H, с), 1,80-2,04 (4H, м), 2, 38 (1H, д, J=14,0 Гц), 2,48-2,68 (2H, м), 2,52 (1H, д, J=14,0 Гц), 2,77-2,95 (2H, м), 3,73 (1H, с), 4,01 (2H, с), 4,39-4,46 (1H, м), 6,93-6,97 (2H, м), 7,49-7,55 (2H, м), 8,08 (1H, с).
Пример 254
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилбензилокси)пиперидин-1-ил]пропан-2-ола
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (700 мг, 3,22 ммоль), полученный в примере 12, и 4-(4-трифторметилбензилокси)пиперидин (1,09 г, 4,86 моль) в ДМФА (10 мл) перемешивали при 70-75°С в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилбензилокси)пиперидин-1-ил]пропан-2-ола (1,36 г, выход 87%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 1,61-1,78 (2H, м), 1,88-1,96 (2H, м), 2,32 (1H, д, J=13,9 Гц), 2,35-2,56 (2H, м), 2,47 (1H, д, J=13,9 Гц), 2,72-2,81 (1H, м), 2,86-2,95 (1H, м), 3,44-3,51 (1H, м), 3,63 (1H, ушир.с), 3,97 (2H, с), 4,59 (2H, с), 7,43-7,47 (2H, м), 7,58-7,62 (2H, м), 8,05 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 255-260, показанные в следующей таблице, способом, подобно описанному в примере 254.


Пример 261
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(3-фенил-2-пропенилокси)пиперидин-1-ил]пропан-2-ола
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,198 г, 0,910 ммоль), полученный в примере 12, и 4-(3-фенил-2-пропенилокси)пиперидин (0,198 г, 0,910 ммоль), получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(3-фенил-2-пропенилокси)пиперидин-1-ил]пропан-2-ол (0,192 г, выход 49%) в виде коричневого масла способом, подобно описанному в примере 254.
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 1,55-1,98 (4H, м), 2,28-2,94 (6H, м), 3,41-3,49 (1H, м), 3,62 (1H, ушир.), 3,95 (2H, с), 4,16 (1H, д, J=6,0 Гц), 4,17 (1H, д, J=6,0 Гц), 6,28 (1H, ддд, J=6,0 Гц, 6,0 Гц, 15,9 Гц), 6,60 (1H, д, J=15,9 Гц), 7,21-7,42 (5H, м), 8,05 (1H, с).
Пример 262
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-3-{4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин-1-ил}-2-метилпропан-2-ола
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,217 г, 1,00 ммоль), полученный в примере 12, и 4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин (0,250 г, 0,995 ммоль), получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-3-{4-[3-(4-хлорфенил)-2-пропенилокси]пиперидин-1-ил}-2-метилпропан-2-ол (0,263 г, выход 56%) в виде коричневой жидкости способом, подобно описанному в примере 254.
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 1,55-2,01 (4H, м), 2,28-2,99 (6H, м), 3,40-3,51 (1H, м), 3,60 (1H, ушир.), 3,96 (2H, с), 4,13-4,16 (2H, м), 6,20-6,31 (1H, м), 6,56 (1H, д, J=15,7 Гц), 7,19-7,34 (4H, м), 8,05 (1H, с).
Пример 263
Получение (S)-2-{4-[3-(4-хлорфенил)пропокси]пиперидин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,103 г, 0,473 ммоль), полученный в примере 12, и 4-[3-(4-хлорфенил)пропокси]пиперидин (0,109 г, 0,430 ммоль) растворяли в ДМФА (10 мл) и раствор перемешивали при 60°С в течение 4 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=2/3) с получением масла. Масло растворяли в ДМФА (2 мл). К раствору добавляли гидрид натрия (15 мг, 0,375 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и осадки отфильтровывали, очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=6/1) и затем перекристаллизовывали из смеси этилацетат/н-гексан=1/3 (6 мл) с получением (S)-2-{4-[3-(4-хлорфенил)пропокси]пиперидин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (36 мг, выход 19%) в виде белого порошка.
Температура плавления 88,8-91,9°C.
Пример 264
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-3-{4-[2-(4-хлорфенил)этокси]пиперидин-1-ил}-2-метилпропан-2-ола
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,076 г, 0,350 ммоль), полученный в примере 12, и 4-[2-(4-хлорфенил)этокси]пиперидин (0,080 г, 0,334 ммоль), получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-3-{4-[2-(4-хлорфенил)этокси]пиперидин-1-ил}-2-метилпропан-2-ол (0,109 г, выход 71%) в виде светло-желтого масла способом, подобно описанному в примере 254.
1H-ЯМР (CDCl3) δ м.д.:
1,10 (3H, с), 1,51-1,72 (2H, м), 1,78-1,92 (2H, м), 2,24-2,50 (4H, м), 2,55-2,88 (4H, м), 3,29-3,39 (1H, м), 3,58-3,66 (3H, м), 3,94 (2H, с), 7,15 (2H, д, J=8,5 Гц), 7,24 (2H, д, J=8,5 Гц), 8,04 (1H, с).
Пример 265
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{4-[2-(4-трифторметилфенил)этокси]пиперидин-1-ил}пропан-2-ола
Трифенил(4-трифторметилбензил)фосфонийбромид (3,00 г, 5,98 ммоль) растворяли в ДМСО (50 мл). К раствору добавляли гидрид натрия (0,239 г, 5,98 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 1 часа. К раствору добавляли по каплям раствор бензил 4-формилоксипиперидин-1-карбоксилата (1,497 г, 5,69 ммоль) в ДМСО (10 мл) с последующим перемешиванием при 60°С в течение 7 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=4/1) и затем очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением бензил 4-[2-(4-трифторметилфенил)винилокси]пиперидин-1-карбоксилата в виде бесцветного масла.
Полученный бензил 4-[2-(4-трифторметилфенил)винилокси]пиперидин-1-карбоксилат растворяли в этаноле (10 мл) и восстанавливали каталитическим гидрированием над 10%Pd/C (90 мг) при комнатной температуре при пониженном давлении. Реакционную смесь фильтровали через Целит. Фильтрат концентрировали при пониженном давлении с получением 4-[2-(трифторметилфенил)этокси]пиперидина в виде коричневой жидкости.
Используя полученный 4-[2-(трифторметилфенил)этокси]пиперидин и (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,184 г, 0,844 ммоль), полученный в примере 12, получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{4-[2-(4-трифторметилфенил)этокси]пиперидин-1-ил}пропан-2-ол (0,088 г, выход 3%) в виде коричневого масла способом, подобно описанному в примере 254.
1H-ЯМР (CDCl3) δ м.д.:
1,10 (3H, с), 1,49-1,92 (4H, м), 2,24-2,81 (6H, м), 2,92 (2H, т, J=6,8 Гц), 3,30-3,35 (1H, м), 3,65 (2H, т, J=6,8 Гц), 3,94 (2H, с), 7,34 (2H, д, J=8,2 Гц), 7,54 (2H, д, J=8,2 Гц), 8,04 (1H, с).
Пример 266
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифениламино)пиперидин-1-ил]пропан-2-ола
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол, полученный в примере 12, и N-(пиперидин-4-ил)-4-трифторметоксианилин, получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифениламино)пиперидин-1-ил]пропан-2-ол (1,36 г, выход 88%) в виде желтого масла способом, подобно описанному в примере 254.
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 1,41-1,57 (2H, м), 2,03-2,08 (2H, м), 2,34 (1H, д, J=13,9 Гц), 2,49-2,59 (3H, м), 2,65-2,77 (2H, м), 3,08-2,16 (2H, м), 3,24-3,41 (1H, м), 3,97 (2H, с), 6,47-6,55 (2H, м), 6,98-7,04 (2H, м), 8,05 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 267-269, показанные в следующей таблице, способом, подобно описанному в примере 266.

Пример 270
Получение (S)-1-(4-пиперидинопиперидин-1-ил)-3-(2-хлор-4-нитроимидазол-1-ил)-2-метилпропан-2-ола
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,500 г, 2,29 ммоль), полученный в примере 12, и 4-пиперидинопиперидин (0,425 г, 2,53 ммоль) растворяли в ДМФА (5 мл) и раствор перемешивали при 70°С в течение 5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/2), используя оснóвный силикагель, с получением (S)-1-(4-пиперидинопиперидин-1-ил)-3-(2-хлор-4-нитроимидазол-1-ил)-2-метилпропан-2-ола (0,656 г, выход 74%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,11 (3H, с), 1,38-1,89 (10H, м), 2,18-2,55 (9H, м), 2,70-2,81 (1H, м), 2,89-3,01 (1H, м), 3,67 (1H, ушир.), 3,94 (1H, с), 8,05 (1H, с).
Пример 271
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{[4-(4-трифторметоксифенил)сульфанил]пиперидин-1-ил}пропан-2-ола
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол, полученный в примере 12, и 4-[4-(трифторметокси)фенилсульфанил]пиперидин, получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{[4-(4-трифторметоксифенил)сульфанил]пиперидин-1-ил}пропан-2-ол (3,4 г, выход 99%) в виде желтого масла способом, подобно описанному в примере 270.
1H-ЯМР (CDCl3) δ м.д.:
1,11 (3H, с), 1,58-1,73 (2H, м), 1,91-1,99 (2H, м), 2,32 (1H, д, J=13,9 Гц), 2,41-2,50 (2H, м), 2,46 (1H, д, J=13,9 Гц), 2,75-3,09 (4H, м), 3,97 (2H, с), 7,11-7,17 (2H, м), 7,36-7,53 (2H, м), 8,04 (1H, с).
Пример 272
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксибензил)пиперидин-1-ил]пропан-2-ола
Используя 4-(4-трифторметоксибензил)пиперидин и (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол, полученный в примере 12, получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксибензил)пиперидин-1-ил]пропан-2-ол (неочищенный) в виде желтого масла способом, подобно описанному в примере 270.
1H-ЯМР (CDCl3) δ м.д.:
1,10 (3H, м), 1,22-1,71 (5H, м), 2,26-2,55 (6H, м), 2,66-2,96 (3H, м), 3,94 (2H, с), 7,09-7,18 (4H, м), 8,06 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 273 и 274, показанные в следующей таблице, способом, подобно описанному в примере 272.

Пример 275
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)пропан-2-ола
Гидрохлорид 4-фенил-1,2,3,6-тетрагидропиридина (0,495 г, 2,53 ммоль) добавляли к раствору гидроксида натрия и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,5 г, 2,29 ммоль), полученный в примере 12, и ДМФА (5 мл) с последующим перемешиванием при 70°С в течение 5 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=2/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)пропан-2-ола (0,492 г, выход 57%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,17 (3H, с), 2,47 (1H, д, J=13,9 Гц), 2,58-2,64 (3H, м), 2,78-3,00 (2H, м), 3,27-3,40 (2H, м), 3,62 (1H, ушир.), 4,01 (2H, с), 6,02-6,05 (1H, м), 7,23-7,41 (5H, м), 8,07 (1H, с).
Пример 276
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-(4-фенилпиперидин-1-ил)пропан-2-ола
Гидрохлорид 4-фенилпиперидина (0,522 г, 2,64 ммоль) добавляли к раствору гидроксида натрия и экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,5 г, 2,29 ммоль), полученный в примере 12, и ДМФА (5 мл) с последующим перемешиванием при 70°С в течение 5 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=2/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-(4-фенилпиперидин-1-ил)пропан-2-ола (0,703 г, выход 81%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,14 (3H, с), 1,76-1,89 (4H, м), 2,36 (1H, д, J=13,9 Гц), 2,48-2,61 (4H, м), 2,75-2,89 (1H, м), 2,98-3,09 (1H, м), 3,75 (1H, ушир.), 3,98 (2H, с), 7,18-7,35 (5H, м), 8,08 (1H, с).
Пример 277
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенил)пиперидин-1-ил]пропан-2-ола
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,329 г, 1,51 ммоль), полученный в примере 12, и 4-(4-трифторметилфенил)пиперидин (0,40 г, 1,66 ммоль) растворяли в ДМФА (5 мл) с последующим перемешиванием при 70°С в течение 3 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=2/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенил)пиперидин-1-ил]пропан-2-ола (0,361 г, выход 54%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с) 1,71-1,93 (4H, м), 2,36 (1H, д, J=14,0 Гц), 2,48-2,65 (4H, м), 2,77-2,90 (1H, м), 3,01-3,14 (1H, м), 3,64 (1H, ушир.), 3,99 (2H, с), 7,32 (2H, д, J=8,1 Гц), 7,57 (2H, д, J=8,1 Гц), 8,07 (1H, с).
Пример 278
Получение трет-бутил-(S)-{1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперидин-4-ил}карбамата
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол, полученный в примере 12, и трет-бутилпиперидин-4-илкарбамат, получали трет-бутил-(S)-{1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперидин-4-ил}карбамат (выход 92%) в виде желтого масла способом, подобно описанному в примере 277.
1H-ЯМР (CDCl3) δ м.д.:
1,11 (3H, с), 1,32-1,51 (2H, м), 1,44 (9H, м), 1,90-1,96 (2H, м), 2,32 (1H, д, J=13,9 Гц), 2,39-2,55 (2H, м), 2,46 (1H, д, J=13,9 Гц), 2,67-2,96 (3H, м), 3,44 (1H, ушир.), 3,59 (1H, с), 3,96 (2H, с), 8,05 (1H, с).
Пример 279
Получение трет-бутил-(S)-{1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперидин-4-ил}-N-[2-(4-трифторметилфенил)этил]карбамата
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,332 г, 0,891 ммоль), полученный в примере 12, и трет-бутилпиперидин-4-ил-N-[2-(4-трифторметилфенил)этил]карбамат (0,194 г, 0,891 ммоль), получали трет-бутил-(S)-{1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперидин-4-ил}-N-[2-(4-трифторметилфенил)этил]карбамат (0,370 г, выход 70%) в виде светло-желтого масла способом, подобно описанному в примере 277.
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 1,49 (9H, с), 1,55-1,80 (4H, м), 2,17-2,57 (4H, м), 2,70-2,98 (4H, м), 3,21-3,30 (2H, м), 3,50 (1H, с), 3,95 (2H, с), 7,31 (2H, д, J=8,2 Гц), 7,57 (2H, д, J=8,2 Гц), 8,05 (1H, с).
Пример 280
Получение (S)-2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфенокси)пиперидин-1-ил]пропан-2-ол (1,06 г, 2,3 ммоль), полученный в примере 253, растворяли в ДМФА (15 мл). К раствору добавляли гидрид натрия (110 мг, 2,76 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=5/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (S)-2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (431 мг, выход 44%) в виде белого порошка.
МС 427(M+1)+
Оптическая чистота 97,8% e.e.
[α]D 27=-2,07° (концентрация: 1,064, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,61 (3H, с), 1,67-1,92 (4H, м), 2,41-2,51 (1H, м), 2,57 (1H, д, J=14,9 Гц), 2,58-2,67 (1H, м), 2,88 (1H, д, J=14,9 Гц), 2,74-2,98 (2H, м), 3,91 (1H, д, J=9,7 Гц), 4,31 (1H, д, J=9,7 Гц), 4,28-4,36 (1H, м), 6,91 (2H, д, J=8,7 Гц), 7,51 (2H, д, J=8,7 Гц), 7,54 (1H, с).
Пример 281
Получение (S)-2-метил-6-нитро-2-[4-(4-трифторметилбензилокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилбензилокси)пиперидин-1-ил]пропан-2-ол, полученный в примере 254, (1,36 г, 2,8 ммоль) растворяли в ДМФА (15 мл). К раствору добавляли гидрид натрия (134 мг, 3,36 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (S)-2-метил-6-нитро-2-[4-(4-трифторметилбензилокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (431 мг, выход 44%) в виде белого порошка.
МС 440(M-1)+
Температура плавления 91-92°C
Оптическая чистота 99,6% e.e.
[α]D 27=-8,63° (концентрация: 1,066, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,44-1,66 (2H, м), 1,60 (3H, с), 1,71-1,85 (2H, м), 2,28-2,38 (1H, м), 2,44-2,56 (1H, м), 2,52 (1H, д, J=14,9 Гц), 2,72-2,81 (1H, м), 2,84 (1H, д, J=14,9 Гц), 2,87-2,94 (1H, м), 3,33-3,41 (1H, м), 3,88 (1H, д, J=9,6 Гц), 4,31 (1H, д, J=9,6 Гц), 4,54 (2H, с), 7,41-7,44 (2H, м), 7,52 (1H, с), 7,56-7,60 (2H, м).
Пример 282
Получение (S)-2-[4-(4-трифторметоксифенил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Используя (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифениламино)пиперидин-1-ил]пропан-2-ол, полученный в примере 266, получали (S)-2-[4-(4-трифторметоксифенил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (выход 73%) в виде белого порошка способом, подобно описанному в примере 281.
Температура плавления 107,5-109,0°C
МС 441(M+)
Оптическая чистота 99,8% e.e.
[α]D 27=19,19° (концентрация: 1,006, CHCl3).
Пример 283
Получение трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамата
Используя трет-бутил-(S)-{1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперидин-4-ил}карбамат, полученный в примере 278, получали трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат (выход 49%) в виде белого порошка способом, подобно описанному в примере 281.
МС 381(M+)
Температура плавления 158,5-160,7°C.
Пример 284
Получение трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-N-[2-(4-трифторметилфенил)этил]карбамата
Используя трет-бутил-(S)-{1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперидин-4-ил}-N-[2-(4-трифторметилфенил)этил]карбамат (0,37 г, 0,627 ммоль), полученный в примере 279, получали трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-N-[2-(4-трифторметилфенил)этил]карбамат (0,211 г, выход 63%) в виде светло-желтого порошка способом, подобно описанному в примере 281.
Температура плавления 206,8-208,6°C.
Пример 285
Получение (S)-2-метил-6-нитро-2-{4-[4-(трифторметоксифенил)сульфанил]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазола
Используя (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{[4-(4-трифторметоксифенил)сульфанил]пиперидин-1-ил}пропан-2-ол, полученный в примере 271, получали (S)-2-метил-6-нитро-2-{4-[4-(трифторметоксифенил)сульфанил]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазол (выход 62%) в виде белого порошка способом, подобно описанному в примере 281.
МС 458(M+)
Температура плавления 133,0-137,4°C.
Пример 286
Получение (S)-2-метил-6-нитро-2-[4-(4-трифторметоксибензил)пиперидин-1-ил]метил-2,3-дигидроимидазо[2,1-b]оксазола
Используя (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксибензил)пиперидин-1-ил]пропан-2-ол, полученный в примере 272, получали (S)-2-метил-6-нитро-2-[4-(4-трифторметоксибензил)пиперидин-1-ил]метил-2,3-дигидроимидазо[2,1-b]оксазол (выход 55%) в виде белого порошка способом, подобно описанному в примере 281.
Температура плавления 111,0-112,5°C
МС: 440(M+)
Оптическая чистота 99,0% e.e.
[α]D 27=5,38° (концентрация: 1,004, CHCl3).
Пример 287
Получение (S)-2-метил-6-нитро-2-(4-фенил-1,2,3,6-тетрагидропиридин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-(4-фенил-1,2,3,6-тетрагидропиридин-1-ил)пропан-2-ол (0,492 г, 1,31 ммоль), полученный в примере 275, растворяли в ДМФА (8 мл). К раствору добавляли при охлаждении на бане со льдом гидрид натрия (63 мг, 1,57 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду. После экстрагирования этилацетатом органическую фазу промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=4/1) и перекристаллизовывали из смеси метиленхлорид-этилацетат с получением (S)-2-метил-6-нитро-2-(4-фенил-1,2,3,6-тетрагидропиридин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (0,059 г, выход 13%) в виде светло-желтого твердого вещества.
Температура плавления 200,1-201°C.
Пример 288
Получение (S)-2-метил-6-нитро-2-(4-фенилпиперидин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-(4-фенилпиперидин-1-ил)пропан-2-ол (0,703 г, 1,86 ммоль), полученный в примере 276, растворяли в ДМФА (5 мл). К раствору добавляли при охлаждении на бане со льдом гидрид натрия (89 мг, 2,23 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду. Осадки отфильтровывали, очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/1) и перекристаллизовывали из этилацетата с получением (S)-2-метил-6-нитро-2-(4-фенилпиперидин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (0,230 г, выход 36%) в виде белого порошка.
Температура плавления 158,8-163,9°C.
Используя соответствующие исходные вещества, получали соединения примеров 289-294 способом, подобно описанному в примере 288.
Пример 289
(S)-1'-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-[1,4']бипиперидинил
Температура плавления 163,4-164,9°C.
Пример 290
(S)-2-Метил-6-нитро-2-[4-(4-трифторметилфенил)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 138,7-139,9°C.
Пример 291
(S)-2-Метил-6-нитро-2-[4-(3-фенил-2-пропенилокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 91,3-92,7°C.
Пример 292
(S)-2-{4-[3-(4-Хлорфенил)-2-пропенилокси]пиперидин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 140,6-142,8°C.
Пример 293
(S)-2-Метил-6-нитро-2-{4-[2-(4-трифторметилфенил)этокси]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 84,6-86,8°C.
Пример 294
(S)-2-{4-[2-(4-Хлорфенил)этокси]пиперидин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 92,5-94°C.
Пример 295
Получение (S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-N-метил-4-трифторметоксианилина
(S)-2-[4-(4-Трифторметоксифенил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (400 мг, 0,90 ммоль), полученный в примере 282, растворяли в метаноле (10 мл). К раствору добавляли 37% раствор формальдегида (0,13 мл, 4,52 ммоль), цианотригидроборат натрия (170 мг, 2,71 ммоль) и уксусную кислоту (0,17 мл, 2,71 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь выливали в насыщенный раствор гидрокарбоната натрия и экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и перекристаллизовывали из смеси метиленхлорид-диизопропиловый эфир с получением (S)-N-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-N-метил-4-трифторметоксианилина (309 мг, выход 78%) в виде светло-желтых кристаллов.
Оптическая чистота 99,9% e.e.
[α]d 17=7,77 (концентрация: 1,042, CHCl3)
МС 455(M+)
Температура плавления 133,2-134,4°C.
Пример 296
Получение (S)-N-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-N-(4-трифторметоксифенил)ацетамида
(S)-2-[4-(4-Трифторметоксифенил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (153 мг, 0,35 ммоль), полученный в примере 282, растворяли в метиленхлориде (5 мл). К раствору добавляли триэтиламин (30 мкл) и ацетилхлорид (30 мкл) с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Реакционную смесь выливали в воду и экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (S)-N-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-N-(4-трифторметоксифенил)ацетамида (82 мг, выход 49%) в виде белого порошка.
МС 484(M+1)+
Температура плавления 137,0-138,7°C.
Пример 297
Получение (S)-2-{4-N-[(4-трифторметилфенил)ацетил]аминопиперидин-1-ил}метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат (0,1 г, 0,262 ммоль), полученный в примере 283, растворяли в этаноле (4 мл). К раствору добавляли 6 н. хлористоводородную кислоту (3 мл) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли метиленхлорид (4 мл) и триэтиламин (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 5 минут и затем концентрировали. К остатку добавляли толуол (10 мл). Раствор концентрировали для азеотропного удаления воды. К остатку добавляли 4-трифторметилфенилуксусную кислоту (0,064 г, 0,315 ммоль), метиленхлорид (4 мл), триэтиламин (0,06 мл, 0,393 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSCD) (0,065 г, 0,341 ммоль) с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали метиленхлоридом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/2) и перекристаллизовывали из смеси этилацетат (3 мл) с получением (S)-2-{4-N-[(4-трифторметилфенил)ацетил]аминопиперидин-1-ил}метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (32 мг, выход 26%) в виде белого порошка.
Температура плавления 152,7-154,3°C.
Пример 298
Получение 4-трифторметилбензил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамата
Трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат (0,300 г, 0,787 ммоль), полученный в примере 283, растворяли в метиленхлориде (4 мл). К раствору добавляли трифторуксусную кислоту (2 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (4 мл) и триэтиламин (4 мл). Смесь перемешивали при комнатной температуре в течение 5 минут и концентрировали при пониженном давлении. Остаток растворяли в ДМФА (6 мл). К раствору добавляли смесь 4-(трифторметил)бензилового спирта (0,166 г, 0,944 ммоль) в ДМФА (4 мл) и 1,1'-карбонилдиимидазола (0,153 г, 0,944 ммоль), перемешанную при комнатной температуре в течение 4 часов, с последующим перемешиванием при комнатной температуре в течение ночи и затем при 65°С в течение 8 часов. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=2/1) и перекристаллизовывали из этилацетата с получением 4-трифторметилбензил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамата (0,107 г, выход 28%) в виде светло-желтого порошка.
Температура плавления 141,2-144°C.
Используя соответствующие исходные вещества, получали соединения примеров 299 и 300 способом, подобно описанному в примере 298.
Пример 299
1-(4-Трифторметилфенил)пиперидин-4-ил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат
Температура плавления 134,4-136,9°C.
Пример 300
4-Трифторметоксибензил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат
Температура плавления 156,2-158,5°C.
Пример 301
Получение (S)-N-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-4-трифторметилбензиламина
Трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат (0,300 г, 0,787 ммоль), полученный в примере 283, растворяли в метиленхлориде (4 мл). К раствору добавляли трифторуксусную кислоту (2 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (4 мл) и триэтиламин (4 мл). Смесь перемешивали при комнатной температуре в течение 20 минут и затем концентрировали при пониженном давлении. Остаток растворяли в метаноле (5 мл). К раствору добавляли 4-трифторметилбензальдегид (0,164 г, 0,945 ммоль), цианотригидроборат натрия (0,099 г, 1,57 ммоль) и уксусную кислоту (0,09 мл, 1,57 ммоль) с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органические фазы объединяли, промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) и перекристаллизовывали из изопропилового спирта с получением (S)-N-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-4-трифторметилбензиламина (0,078 г, выход 22%) в виде светло-желтого порошка.
Температура плавления 148,6-152,9°C.
Пример 302
Получение (S)-1-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-3-(4-трифторметилфенил)мочевины
Трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат (0,300 г, 0,787 ммоль), полученный в примере 283, растворяли в метиленхлориде (4 мл). К раствору добавляли трифторуксусную кислоту (2 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (4 мл) и триэтиламин (4 мл). Смесь перемешивали при комнатной температуре в течение 5 минут и концентрировали при пониженном давлении. Остаток называли как "остаток 1".
С другой стороны, 4-(трифторметил)анилин (0,139 г, 0,865 ммоль) и пиридин (0,07 мл, 0,865 ммоль) растворяли в ТГФ (4 мл). К раствору добавляли при охлаждении на бане со льдом фенилхлорформиат (0,108 мл, 0,865 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой, 10% хлористоводородной кислотой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении.
Полученный остаток растворяли в диметилсульфоксиде (6 мл). К раствору добавляли "остаток 1" с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=2/1) и перекристаллизовывали из смеси изопропиловый спирт-н-гексан (1:1) (6 мл) с получением (S)-1-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-3-(4-трифторметилфенил)мочевины (0,064 г, выход 17%) в виде светло-желтого порошка.
Температура плавления 136,8-139,9°C.
Пример 303
Получение (S)-2-[4-N-(4-трифторметилбензоил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]карбамат (360 мг, 0,92 ммоль), полученный в примере 283, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (10 мл) и триэтиламин (2 мл). К раствору добавляли 4-трифторметилбензоилхлорид (0,3 мл, 1,85 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) и кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением (S)-2-[4-N-(4-трифторметилбензоил)аминопиперидин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (232 мг, выход 55%) в виде белого порошка.
МС 454(M+H)+
Температура плавления 170,5-171,7°C.
Пример 304
Получение (S)-N-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-2-(4-трифторметилфенил)этиламина
Трет-бутил-(S)-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-N-[2-(4-трифторметилфенил)этил]карбамат (0,196 г, 0,354 ммоль), полученный в примере 284, растворяли в метиленхлориде (2 мл). К раствору добавляли трифторуксусную кислоту (1 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия и раствор экстрагировали метиленхлоридом два раза. Органические фазы объединяли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и обрабатывали изопропиловым эфиром с получением (S)-N-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]-2-(4-трифторметилфенил)этиламина (0,020 г, выход 12%) в виде светло-желтого порошка.
Температура плавления 80,7-84,2°C.
Пример 305
Получение (S)-2-метил-6-нитро-2-{4-[4-(трифторметокси)бензолсульфинил]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазола
(S)-2-Метил-6-нитро-2-{4-[4-(трифторметоксифенил)сульфанил]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазол (300 мг, 0,65 ммоль), полученный в примере 285, растворяли в метиленхлориде (5 мл). К раствору добавляли м-хлорпербензойную кислоту (169 мг, 0,69 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь разбавляли метиленхлоридом. Раствор промывали раствором тиосульфата натрия, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) и кристаллизовали из смеси этилацетат-изопропиловый эфир с получением (S)-2-метил-6-нитро-2-{4-[4-(трифторметокси)бензолсульфинил]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазола (219 мг, выход 71%) в виде белого порошка.
МС 475(M+H)+
Температура плавления 107-109°C.
Пример 306
Получение 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
2-Хлор-4-нитро-1H-имидазол (3,19 г, 21,6 ммоль), трет-бутил 4-(2-метилоксиран-2-илметил)пиперазин-1-карбоксилат (5,53 г, 21,6 ммоль) и ацетат натрия (1,95 г, 23,8 ммоль) растворяли в 1-пропаноле (50 мл) с последующим перемешиванием при кипячении с обратным холодильником в течение 48 часов. Реакционную смесь разбавляли метиленхлоридом. Раствор промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и обрабатывали смесью метиленхлорид-диизопропиловый эфир с получением 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (1,85 г, выход 23%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,43 (9H, с), 1,62 (3H, с), 2,45-2,68 (5H, м), 2,87 (1H, д, J=14,9 Гц), 3,30 (4H, ушир.), 3,93 (1H, д, J=9,7 Гц), 4,30 (1H, д, J=9,7 Гц), 7,54 (1H, с).
Используя соответствующие исходные вещества, получали соединение примера 307 способом, подобно описанному в примере 306.
Пример 307
2-[4-(4-Цианофенил)пиперазин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 18%
1H-ЯМР (CDCl3) δ м.д.:
1,67 (3H, с), 2,60-2,80 (3H, м), 2,80-3,00 (3H, м), 3,22 (4H, ушир.), 3,97 (1H, д, J=9,8 Гц), 4,35-4,50 (1H, м), 6,78-6,85 (2H, м), 7,46-7,51 (2H, м), 7,55 (1H, с).
Пример 308
Получение 2-[4-(4-трифторметилфенил)пиперазин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
К раствору 2-хлор-4-нитро-1H-имидазола (1,59 г, 10,8 ммоль) и 1-(2-метилоксиран-2-илметил)-4-(4-трифторметилфенил)пиперазина (3,23 г, 10,8 ммоль) в 1-пропаноле (20 мл) добавляли гидрокарбонат натрия (1,95 г, 23,8 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 2-[4-(4-трифторметилфенил)пиперазин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (1,34 г, выход 29%) в виде светло-желтого порошка.
МС 411(M+)
Температура плавления 159-160°C.
Кроме того, указанная выше очистка хроматографией на колонке с силикагелем дала промежуточное соединение, 2-хлор-1-{3-[4-(4-трифторметилфенил)пиперазин-1-ил]-2-гидрокси-2-метил}пропил-4-нитроимидазол (697 мг, выход 15%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,17 (3H, с), 2,32-2,91 (6H, с), 3,26-3,31 (4H, м), 4,03 (2H, с), 6,71 (1H, с), 6,89-6,93 (2H, м), 7,45-7,51 (2H, м), 8,06 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 309-311 способом, подобно описанному в примере 308.
Пример 309
2-[4-(Бифенил-4-ил)пиперазин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 32%, температура плавления 223-227,8°C.
Пример 310
2-[4-(4-Хлорфенил)пиперазин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 14%, температура плавления 196,6-197,3°C.
Пример 311
2-[4-(4-Трифторметоксифенил)пиперазин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 18%
1H-ЯМР (CDCl3) δ м.д.:
1,61 (3H, с), 2,61 (1H, д, J=14,8 Гц), 2,65-2,73 (2H, м), 2,82-2,95 (2H, м), 2,93 (1H, д, J=14,8 Гц), 2,99-3,09 (4H, м), 3,94 (1H, д, J=9,7 Гц), 4,34 (1H, д, J=9,7 Гц), 6,78-6,86 (2H, м), 7,06-7,11 (2H, м), 7,53 (1H, с).
Пример 312
Получение 1-[3-(4-трет-бутоксикарбонилпиперазин-1-ил)-2-гидрокси-2-метил]пропил-2-хлор-4-нитроимидазола
2-Хлор-4-нитро-1H-имидазол (863 мг, 5,85 ммоль) и трет-бутил 4-(2-метилоксиран-2-илметил)пиперазин-1-карбоксилат (1,5 г, 5,85 ммоль) растворяли в 1-пропаноле (10 мл) с последующим перемешиванием при кипячении с обратным холодильником в течение 6 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением 1-[3-(4-трет-бутоксикарбонилпиперазин-1-ил)-2-гидрокси-2-метил]пропил-2-хлор-4-нитроимидазола (705 мг, выход 29,8%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, с), 1,45 (9H, с), 2,35 (1H, д, J=13,9 Гц), 2,45-2,65 (5H, м), 3,25 (1H, с), 3,42 (4H, т, J=4,3 Гц), 4,00 (2H, с), 8,05 (1H, с).
Используя 2-хлор-4-нитро-1H-имидазол и трет-бутил 4-(оксиран-2-илметил)пиперазин-1-карбоксилат, трет-бутил 4-[2-(2-метилоксиран-2-ил)этил]пиперазин-1-карбоксилат или бензил 4-(2-метилоксиран-2-илметил)пиперазин-1-карбоксилат, получали соединения примеров 313-315 способом, подобно описанному в примере 312.
Пример 313
Трет-бутил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилат
Светло-желтый порошок, выход 43%
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 2,16-2,50 (4H, м), 2,55-2,70 (2H, м), 3,40-3,51 (4H, м), 3,64 (1H, с), 3,91-4,09 (2H, м), 4,17 (1H, дд, J=2,0 Гц, 13,5 Гц), 8,00 (1H, с).
Пример 314
Трет-бутил 4-[4-(2-хлор-4-нитроимидазол-1-ил)-3-гидрокси-3-метилбутил]пиперазин-1-карбоксилат
Белый порошок, выход 17%
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 1,40-1,74 (11H, м), 2,23-2,58 (5H, м), 2,81-2,95 (1H, м), 3,26-3,51 (4H, м), 3,91 (1H, д, J=14,0 Гц), 3,99 (1H, д, J=14,0 Гц), 6,94 (1H, с), 8,07 (1H, с).
Пример 315
Бензил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат
Светло-желтое масло, выход 81%
1H-ЯМР (CDCl3) δ м.д.:
1,14 (3H, с), 2,35-2,76 (6H, м), 3,43-3,61 (4H, м), 4,01 (2H, с), 5,13 (2H, с), 7,28-7,43 (5H, м), 8,04 (1H, с).
Пример 316
Получение изобутил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата
Смесь 1-[3-(4-трет-бутоксикарбонилпиперазин-1-ил)-2-гидрокси-2-метил]пропил-2-хлор-4-нитроимидазола (150 мг, 0,37 ммоль), полученного в примере 312, и трифторуксусной кислоты (5 мл) перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (5 мл). К раствору добавляли триэтиламин (0,23 мл, 1,63 ммоль) и изобутилхлорформиат (112 мг, 0,82 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь промывали водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением изобутил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата, который использовали на следующей стадии без очистки.
1H-ЯМР (CDCl3) δ м.д.:
0,93 (6H, д, J=6,7 Гц), 1,14 (3H, с), 1,82-2,00 (1H, м), 2,39 (1H, д, J=13,9 Гц), 2,47-2,73 (5H, м), 3,11 (1H, д, J=7,3 Гц), 3,17 (1H, д, J=7,3 Гц), 3,41-3,55 (4H, м), 3,87 (2H, с), 4,04 (1H, с), 8,10 (1H, с).
Пример 317
Получение бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К смеси бензил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (55,22 г, 126,11 ммоль), полученного в примере 315, и 1,4-диоксана (550 мл) добавляли гидрид натрия (6,05 г, 151,25 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 14 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом два раза. Органические фазы промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (26,54 г, выход 52%) в виде белого порошка.
Температура плавления 130,5-132,1°C
1H-ЯМР (CDCl3) δ м.д.:
1,61 (3H, с), 2,38-2,69 (5H, м), 2,86 (1H, д, J=14,8 Гц), 3,10-3,50 (4H, м), 3,92 (1H, д, J=9,9 Гц), 4,33 (1H, д, J=9,9 Гц), 5,11 (2H, с), 7,23-7,38 (5H, м), 7,53 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 318-320 способом, подобно описанному в примере 317.
Пример 318
Изобутил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Светло-желтый порошок, выход 39%, температура плавления 176,5-177,3°C.
Пример 319
Трет-бутил 4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Белый порошок, выход 45%.
Температура плавления 185-188°C (разложение)
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 2,48-2,58 (4H, м), 2,85 (2H, д, J=5,1 Гц), 3,31-3,45 (4H, м), 4,20 (1H, дд, J=6,9 Гц, 10,3 Гц), 4,34 (1H, дд, J=8,4 Гц, 10,3 Гц), 5,35-5,48 (1H, м), 7,55 (1H, с).
Пример 320
Трет-бутил 4-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]пиперазин-1-карбоксилат
Светло-желтый порошок, выход 70%, температура плавления 190-191°C (разложение).
Пример 321
Получение трет-бутил 4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]пиперазин-1-карбоксилата
Смесь 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропилметансульфоната (2 г, 6,6 ммоль), трет-бутилпиперазин-1-карбоксилата (1,4 г, 7,5 ммоль), триэтиламина (1,3 г, 12,85 ммоль), иодида калия (1,8 г, 10,8 ммоль) и ДМФА (15 мл) перемешивали при 60°C в течение ночи. Реакционной смеси давали остыть до комнатной температуры и затем добавляли воду и полученный раствор экстрагировали этилацетатом три раза. Органические фазы объединяли, промывали водой два раза и затем насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением трет-бутил 4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]пиперазин-1-карбоксилата (1,9 г, выход 73%) в виде белого порошка.
Температура плавления 166-167°C.
Пример 322
Получение дигидрохлорида 2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола
2-(4-Трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (1,19 г, 3,24 ммоль), полученный в примере 306, растворяли в трифторуксусной кислоте (30 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метаноле (30 мл) и медленно добавляли раствор хлористого водорода в этилацетате с последующим перемешиванием в течение 30 минут при охлаждении на бане со льдом. Осадки отфильтровывали с получением дигидрохлорида 2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (1,06 г, выход 96%) в виде желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,68 (3H, с), 3,00-3,59 (6H, м), 4,14 (1H, д, J=11,1 Гц), 4,36 (1H, д, J=11,1 Гц), 4,50-6,12 (4H, ушир.), 8,17 (1H, с), 9,62 (2H, ушир.).
Пример 323
Получение 2-[4-(бифенил-4-илметил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил 4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (400 мг, 1,13 ммоль), полученного в примере 319, и трифторуксусной кислоты (10 мл) перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали. Остаток растворяли в метиленхлориде (10 мл) и нейтрализовали триэтиламином (2 мл, 14,35 ммоль). Полученный раствор концентрировали при пониженном давлении и остаток растворяли в метаноле (10 мл). К раствору добавляли 4-фенилбензальдегид (515 мг, 2,83 ммоль), цианотригидроборат натрия (214 мг, 3,41 ммоль) и уксусную кислоту (0,21 мг, 3,67 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрировали. К остатку добавляли воду и раствор экстрагировали метиленхлоридом два раза. Органические фазы объединяли, промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением 2-[4-(бифенил-4-илметил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (188 мг, выход 40%) в виде белого порошка.
Температура плавления 183-185°C (разложение).
Используя соответствующие исходные вещества, получали соединения примеров 324-329 способом, подобно описанному в примере 323.
Пример 324
2-{2-[4-(4-Трифторметилбензил)пиперазин-1-ил]этил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Белый порошок, выход 36%, температура плавления 148-149°C.
Пример 325
2-Метил-6-нитро-2-{3-[4-(4-трифторметилбензил)пиперазин-1-ил]пропил}-2,3-дигидроимидазо[2,1-b]оксазол
Белый порошок, выход 57%.
Температура плавления 154-156°C.
Пример 326
2-{2-[4-(Бифенил-4-илметил)пиперазин-1-ил]этил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Белый порошок, выход 53%.
Температура плавления 181-182°C.
Пример 327
2-{3-[4-(Бифенил-4-илметил)пиперазин-1-ил]пропил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Белый порошок, выход 65%.
Температура плавления 176-178°C.
Пример 328
4-(N,N-Диметиламино)-4'-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-илметил]бифенил
Белый порошок, выход 68%
1H-ЯМР (CDCl3) δ м.д.:
1,58 (3H, с), 2,36 (4H, ушир.), 2,50-2,60 (2H, м), 2,54 (1H, д, J=14,8 Гц), 2,67-2,76 (2H, м), 2,84 (1H, д, J=14,8 Гц), 2,99 (6H, с), 3,41 (1H, д, J=12,9 Гц), 3,48 (1H, д, J=12,9 Гц), 3,87 (1H, д, J=9,7 Гц), 4,30 (1H, д, J=9,7 Гц), 6,76-6,82 (2H, м), 7,25-7,29 (2H, м), 7,46-7,51 (4H, м), 7,53 (1H, с).
Пример 329
2-Метил-6-нитро-2-[4-(2-фенил-1H-имидазол-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Белый порошок, выход 93%
1H-ЯМР (ДМСО-d6) δ м.д.:
1,52 (3H, с), 2,10-2,64 (6H, м), 2,67 (1H, д, J=15,4 Гц), 2,74 (1H, д, J=15,4 Гц), 3,10-3,70 (4H, ушир.), 4,04 (1H, д, J=10,7 Гц), 4,21 (1H, д, J=10,7 Гц), 6,97 (1H, ушир.), 7,27-7,34 (1H, м), 7,38-7,45 (2H, м), 7,88-7,93 (2H, м), 8,12 (1H, с).
Пример 330
Получение 2-(3,4-дихлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона
Смесь 3,4-(дихлорфенил)уксусной кислоты (418 мг, 2,04 ммоль) и тионилхлорида (3 мл) перемешивали при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении с получением соответствующего хлорангидрида кислоты.
С другой стороны, смесь 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (300 мг, 0,816 ммоль), полученного в примере 306, и трифторуксусной кислоты (6 мл) перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (10 мл) и добавляли триэтиламин (2 мл, 14,35 ммоль). К раствору добавляли при охлаждении на бане со льдом раствор полученного выше хлорангидрида кислоты в метиленхлориде (5 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением 2-(3,4-дихлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона (255 мг, выход 69%) в виде белого порошка.
Температура плавления 189-191°C.
Используя соответствующие исходные вещества, получали соединения примеров 331 и 332 способом, подобно описанному в примере 330.
Пример 331
1-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-2-(4-трифторметилфенил)этанон
Температура плавления 168-171,4°C.
Пример 332
2-(3,4-Дихлорфенокси)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанон
Температура плавления 209-211°C.
Пример 333
Получение 2-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилфенил)ацетамида
Смесь 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (500 мг, 1,36 ммоль), полученного в примере 306, и трифторуксусной кислоты (15 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (10 мл) и добавляли триэтиламин (2 мл, 14,35 ммоль). Раствор концентрировали при пониженном давлении и остаток растворяли в ДМФА (10 мл). К раствору добавляли 2-бром-N-(4-трифторметилфенил)ацетамид (423 мг, 1,5 ммоль), карбонат калия (207 мг, 1,5 ммоль) и иодид натрия (204 мг, 1,36 ммоль) с последующим перемешиванием при комнатной температуре в течение 5 часов. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением 2-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилфенил)ацетамида (389 мг, выход 61%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,62 (3H, с), 2,53-2,84 (9H, м), 2,88 (1H, д, J=14,8 Гц), 3,06 (1H, д, J=16,7 Гц), 3,14 (1H, д, J=16,7 Гц), 3,93 (1H, д, J=9,7 Гц), 4,30 (1H, д, J=9,7 Гц), 7,55 (1H, с), 7,55-7,59 (2H, м), 7,65-7,71 (2H, м), 9,20 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 334-336 способом, подобно описанному в примере 333.
Пример 334
Этил[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]ацетат
1H-ЯМР (CDCl3) δ м.д.:
1,25 (3H, т, J=7,1 Гц), 1,60 (3H, с), 2,45-2,64 (6H, м), 2,55 (1H, д, J=14,8 Гц), 2,72-2,81 (2H, м), 2,87 (1H, д, J=14,8 Гц), 3,14 (2H, с), 3,90 (1H, д, J=9,7 Гц), 4,16 (2H, кв. J=7,1 Гц), 4,31 (1H, д, J=9,7 Гц), 7,57 (1H, с).
Пример 335
3-{3-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пропил}-3H-бензоксазол-2-он
Температура плавления 123-126°C.
Пример 336
1-(4-Хлорфенил)-2-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанон
1H-ЯМР (CDCl3) δ м.д.:
1,60 (3H, с), 2,47 (4H, ушир.), 2,53 (1H, д, J=14,9 Гц), 2,57-2,65 (2H, м), 2,74-2,84 (2H, м), 2,87 (1H, д, J=14,9 Гц), 3,64 (1H, д, J=16,7 Гц), 3,75 (1H, д, J=16,7 Гц), 3,90 (1H, д, J=9,7 Гц), 4,30 (1H, д, J=9,7 Гц), 7,42 (2H, д, J=8,6 Гц), 7,54 (1H, с), 7,92 (2H, д, J=8,6 Гц).
Пример 337
Получение бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Смесь 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (130 мг, 0,35 ммоль), полученного в примере 306, трифторуксусной кислоты (3 мл) и метиленхлорида (5 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (5 мл) и добавляли триэтиламин (107,5 мг, 1,06 ммоль). К раствору добавляли при охлаждении на бане со льдом бензилхлорформиат (120 мг, 0,71 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением желтого масла. Масло растворяли в этилацетате (5 мл). К раствору добавляли насыщенный раствор хлористого водорода в этилацетате и осадки отфильтровывали с получением гидрохлорида бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (46,8 мг, выход 30%) в виде белого порошка.
Температура плавления 130,5-132,1°C.
Используя соответствующие исходные вещества, получали соединения примеров 338-340 способом, подобно описанному в примере 337.
Пример 338
Фенил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Температура плавления 81-85°C.
Пример 339
Изопропил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Температура плавления 158,3-159,8°C.
Пример 340
н-Октил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Температура плавления 138-139,4°C.
Пример 341
Получение 4-трифторметилбензил 4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К раствору трет-бутил 4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (400 мг, 1,13 ммоль), полученного в примере 319, в метиленхлориде (2 мл), добавляли трифторуксусную кислоту (1 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в ДМФА (1 мл) и нейтрализовали триэтиламином (1 мл).
К раствору добавляли смесь 4-трифторметилбензилового спирта (297 мг, 1,69 ммоль), 1,1'-карбонилдиимидазола (274 мг, 1,69 ммоль) и ДМФА (1 мл), перемешанную при комнатной температуре в течение 1 часа, с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь разбавляли водой и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и затем насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением 4-трифторметилбензил 4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (322 мг, выход 63%) в виде светло-желтого порошка.
Температура плавления 120-122°C.
Используя соответствующие исходные вещества, получали соединения примеров 342 и 343 способом, подобно описанному в примере 341.
Пример 342
4-Трифторметилбензил 4-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]пиперазин-1-карбоксилат
Светло-желтый порошок, выход 68%, температура плавления 139-140°C.
Пример 343
4-Трифторметилбензил 4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]пиперазин-1-карбоксилат
Светло-желтый порошок, выход 57%, температура плавления 130-133°C.
Пример 344
Получение 3-(4-трифторметилфенил)-2-пропинил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилатмалеата
Смесь 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (220 мг, 0,6 ммоль), полученного в примере 306, трифторуксусной кислоты (1 мл) и метиленхлорида (2 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (2 мл) и нейтрализовали триэтиламином (1 мл, 7,17 ммоль). Полученный раствор концентрировали при пониженном давлении и остаток растворяли в ДМФА (2 мл).
К раствору добавляли смесь 3-(4-трифторметилфенил)-2-пропин-1-ола (110 мл, 0,55 ммоль), 1,1'-карбонилдиимидазола (90 мг, 0,55 ммоль) и ДМФА (2 мл), перемешанную при комнатной температуре в течение 2 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и затем насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=5/1).
Полученную свободную форму растворяли в этаноле (5 мл) и к раствору добавляли раствор малеиновой кислоты (96 мг, 0,83 ммоль) в этаноле (5 мл). Осадки отфильтровывали с получением 3-(4-трифторметилфенил)-2-пропинил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилатмалеата (227 мг, выход 68%) в виде белого порошка.
Температура плавления 166°C (разложение).
Пример 345
Получение 4-метилсульфанилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Смесь 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (900 мг, 2,4 ммоль), полученного в примере 306, и трифторуксусной кислоты (20 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (20 мл) и нейтрализовали триэтиламином (6 мл, 43,05 ммоль). Полученную смесь концентрировали при пониженном давлении и остаток растворяли в ДМФА (5 мл).
К раствору добавляли смесь 4-метилсульфанилбензилового спирта (470 мг, 3 ммоль), 1,1'-карбонилдиимидазол (500 мг, 3,1 ммоль) и ДМФА (10 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и затем насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением 4-метилсульфанилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (860 мг, выход 79%) в виде белого порошка.
Температура плавления 118-120°C.
Пример 346
Получение 4-метансульфинилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К смеси 4-метилсульфанилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (300 мг, 0,67 ммоль), полученного в примере 345, и метиленхлорида (10 мл) добавляли м-хлорпербензойную кислоту (210 мг, 0,85 ммоль) с последующим перемешиванием в течение 2 часов при охлаждении на бане со льдом. Реакционную смесь промывали насыщенным раствором сульфита натрия, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток перекристаллизовывали из смеси изопропиловый спирт-эфир с получением 4-метансульфинилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (203 мг, выход 65%) в виде белого порошка.
Температура плавления 117-121°C.
Пример 347
Получение 4-гидроксибензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К смеси 4-(трет-бутилдиметилсиланилокси)бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (400 мг, 0,75 ммоль) и ТГФ (10 мл) добавляли 1M раствор тетрабутиламмонийфторида в ТГФ (0,8 мл, 0,8 ммоль) с последующим перемешиванием в течение 20 минут при охлаждении на бане со льдом. К реакционной смеси добавляли этилацетат и раствор промывали насыщенным раствором хлорида аммония, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир и осадки отфильтровывали с получением 4-гидроксибензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (95 мг, выход 30%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,59 (3H, с), 2,30-2,70 (4H, м), 2,56 (1H, д, J=15,0 Гц), 2,86 (1H, д, J=15,0 Гц), 3,10-3,55 (4H, м), 3,91 (1H, д, J=10,0 Гц), 4,28 (1H, д, J=10,0 Гц), 5,03 (2H, с), 5,30 (1H, ушир.с), 6,84 (2H, д, J=8,0 Гц), 7,24 (2H, д, J=8,0 Гц), 7,53 (1H, с).
Пример 348
Получение 4-ацетилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Смесь 4-(1,1-диметоксиэтил)бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (600 мг, 1,23 ммоль), 1 н. хлористоводородной кислоты (10 мл, 10 ммоль) и ТГФ (15 мл) перемешивали при комнатной температуре в течение 2 часов, затем нейтрализовали насыщенным раствором гидрокарбоната натрия и полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой и затем насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир и осадки отфильтровывали с получением 4-ацетилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (558 мг, выход 99%) в виде белого порошка.
Температура плавления 101-102°C.
Пример 349
Получение 4-бензоилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Используя 4-[диметокси(фенил)метил]бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (800 мг, 1,45 ммоль), получали 4-бензоилбензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (630 мг, выход 86%) в виде белого порошка способом, подобно описанному в примере 348.
Температура плавления 105-107°C.
Пример 350
Получение 4-аминобензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Смесь 4-(трет-бутоксикарбониламино)бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (340 мг, 0,66 ммоль), трифторуксусной кислоты (2 мл) и метиленхлорида (10 мл) перемешивали при комнатной температуре в течение 2 часов и затем нейтрализовали насыщенным раствором гидрокарбоната натрия. Органическую фазу промывали водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир и осадки отфильтровывали с получением 4-аминобензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (100 мг, выход 37%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,61 (3H, с), 2,35-2,70 (4H, м), 2,56 (1H, д, J=15,0 Гц), 2,85 (1H, д, J=15,0 Гц), 3,05-3,55 (4H, м), 3,69 (2H, ушир.с), 3,91 (1H, д, J=10,0 Гц), 4,28 (1H, д, J=10,0 Гц), 4,98 (2H, с), 6,55 (2H, д, J=8,0 Гц), 7,14 (2H, д, J=8,0 Гц), 7,53 (1H, с).
Пример 351
Получение гидрохлорида фениламида 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Смесь 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (130 мг, 0,35 ммоль), полученного в примере 306, и трифторуксусной кислоты (3 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (3 мл), затем нейтрализовали триэтиламином (2 мл, 14,35 ммоль). К раствору добавляли фенилизоцианат (63 мг, 0,53 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут и затем разбавляли его водой. Раствор экстрагировали метиленхлоридом и органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением аморфной формы.
Аморфную форму растворяли в этилацетате. К раствору добавляли насыщенный раствор хлористоводородной кислоты в этилацетате и полученные осадки отфильтровывали с получением гидрохлорида фениламида 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты (124 мг, выход 55%) в виде светло-желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,55 (3H, с), 2,50-2,56 (4H, м), 2,75 (2H, с), 3,21-3,40 (4H, м), 4,05 (1H, д, J=10,7 Гц), 4,24 (1H, д, J=10,7 Гц), 6,92-6,99 (1H, м), 7,21-7,28 (2H, м), 7,44-7,48 (2H, м), 8,13 (1H, с), 8,59 (1H, с).
Пример 352
Получение изопропиламида 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Смесь трет-бутил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (140 мг, 0,38 ммоль), полученного в примере 306, и трифторуксусной кислоты (3 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (3 мл), затем нейтрализовали триэтиламином (2 мл, 14,35 ммоль). К раствору добавляли изопропилизоцианат (75 мкл, 0,76 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа, затем разбавляли его водой. Раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением изопропиламида 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты (90 мг, выход 67%) в виде белого порошка.
Температура плавления 175-176,3°C.
Используя соответствующие исходные вещества, получали соединения примеров 353 и 354 способом, подобно описанному в примере 352.
Пример 353
(3-Хлорфенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
1H-ЯМР (ДМСО-d6) δ м.д.:
1,56 (3H, с), 2,50-2,56 (4H, м), 2,77 (2H, с), 3,21-3,40 (4H, м), 4,08 (1H, д, J=10,7 Гц), 4,26 (1H, д, J=10,7 Гц), 6,95 (1H, ушир.д, J=8,0 Гц), 7,23 (1H, т, J=8,0 Гц), 7,36 (1H, ушир.д, J=8,0 Гц), 7,61 (1H, т, J=2,0 Гц), 8,13 (1H, с), 8,61 (1H, с).
Пример 354
Циклогексиламид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 216,5-218,5°C.
Пример 355
Получение (4-хлорфенил)амида 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карботиокислоты
Дигидрохлорид 2-Метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (196 мг, 0,73 ммоль), полученный в примере 322, суспендировали в метиленхлориде (10 мл), затем нейтрализовали триэтиламином (0,27 мл, 1,94 ммоль). К раствору добавляли 4-хлорфенилизотиоцианат (140 мг, 0,83 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=30/1) с получением (4-хлорфенил)амида 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карботиокислоты (128 мг, выход 40%) в виде светло-коричневого порошка.
Температура плавления 204-206°C (разложение).
Используя соответствующие исходные вещества, получали соединения примеров 356 и 357 способом, подобно описанному в примере 355.
Пример 356
Фениламид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карботиокислоты
Температура плавления 164-165°C (разложение).
Пример 357
4-Метоксифенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карботиокислоты
Температура плавления 189-191°C (разложение).
Пример 358
Получение 2-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]бензоксазол
2-(4-трет-Бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (500 мг, 1,36 ммоль), полученный в примере 306, растворяли в трифторуксусной кислоте (10 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (1 мл) и триэтиламин (1 мл). Раствор перемешивали при комнатной температуре в течение 5 минут и затем концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде. К раствору добавляли 2-хлорбензоксазол (0,19 мл, l,63 ммоль) и триэтиламин (0,23 мл, 1,63 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 2-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]бензоксазола (325 мг, выход 62%) в виде белого порошка.
МС 384(M+)
Температура плавления 228,0-229,5°C.
Используя соответствующие исходные вещества, получали соединения примеров 359-361 способом, подобно описанному в примере 358.
Пример 359
2-[4-(6-Нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]бензоксазол
Белый порошок, выход 74%
МС 370(M+)
Температура плавления 206-209°C (разложение).
Пример 360
2-{4-[2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]пиперазин-1-ил}бензоксазол
Белый порошок, выход 73%
МС 398(M+)
Температура плавления 187,6-189,6°C.
Пример 361
2-{4-[3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]пиперазин-1-ил}бензоксазол
Белый порошок, выход 90%
МС 412(M+)
Температура плавления 172,0-174,4°C.
Пример 362
Получение трет-бутил-(S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилата
(R)-2-Хлор-1-[2-гидрокси-3-(4-метилбензолсульфонилокси)пропил]-4-нитроимидазол (16,86 г, 44,86 ммоль), полученный в примере 8, и трет-бутилпиперазин-1-карбоксилат (8,36 г, 44,89 ммоль) растворяли в ацетонитриле (100 мл). К раствору добавляли триэтиламин (6,3 мл, 45,2 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 6 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду (100 мл) и смесь экстрагировали этилацетатом (100 мл) два раза. Органические фазы объединяли, промывали водой (100 мл) и насыщенным раствором соли (100 мл) в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=40/1) и затем перекристаллизовывали из смеси этилацетат/н-гексан с получением трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилата (11,61 г, выход 66%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,46 (9H, с), 2,21-2,50 (4H, м), 2,54-2,70 (2H, м), 3,39-3,48 (4H, м), 3,65 (1H, с), 3,89-4,10 (2H, м), 4,20 (1H, дд, J=1,9 Гц, 13,5 Гц), 8,00 (1H, с).
Пример 363
Получение трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилата (альтернативный синтез соединения примера 362)
Смесь (R)-2-хлор-1-(оксиран-2-илметил)-4-нитроимидазола (1 г, 4,91 ммоль), полученного в примере 9, трет-бутилпиперазин-1-карбоксилата (1,01 г, 5,40 ммоль) и ДМФА (3 мл) перемешивали при 70°С в течение 6 часов. Реакционной смеси давали остыть до комнатной температуры и добавляли воду (7 мл). Осадки отфильтровывали и очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=40/1) с получением трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилата (967 мг, 51%) в виде светло-желтого порошка.
Пример 364
Получение трет-бутил (R)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилата
Смесь 2-хлор-4-нитро-1H-имидазола (6,1 г, 41,35 ммоль), (S)-(+)-глицидилтозилата (12,27 г, 53,75 ммоль) и гидрокарбоната натрия (7,3 г, 86,89 ммоль) в этаноле (30 мл) перемешивали при кипячении с обратным холодильником в течение 9 часов. Реакционной смеси давали остыть до комнатной температуры, затем разбавляли водой и раствор экстрагировали метиленхлоридом два раза. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали с получением пены. Полученную пену растворяли в ДМФА (60 мл). К раствору добавляли трет-бутилпиперазин-1-карбоксилат (8,47 г, 45,48 ммоль), триэтиламин (6,92 мл, 49,64 ммоль) и иодид натрия (6,82 г, 45,5 ммоль) с последующим перемешиванием при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением трет-бутил (R)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилата (6,43 г, выход 40%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,48 (9H, с), 2,16-2,50 (4H, м), 2,55-2,69 (2H, м), 3,37-3,50 (4H, м), 3,65 (1H, с), 3,90-4,25 (3H, м), 8,00 (1H, с).
Пример 365
Получение трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата
Смесь (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (7,00 г, 32,2 ммоль), полученного в примере 12, трет-бутилпиперазин-1-карбоксилата (6,29 г, 33,8 ммоль) и ДМФА (70 мл) перемешивали при 70°С в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры, затем разбавляли водой и затем раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир. Осадки отфильтровывали и сушили при комнатной температуре при пониженном давлении с получением трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (10,25 г, выход 79%) в виде светло-желтого порошка.
Оптическая чистота >98,4% e.e.
[α]D 27=25,488 (концентрация: 1,024, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,14 (3H, с), 1,46 (9H, с), 2,34 (1H, д, J=13,9 Гц), 2,47-2,67 (5H, м), 3,26 (1H, с), 3,44 (4H, т, J=4,4 Гц), 3,99 (2H, с), 8,04 (1H, с).
Пример 366
Получение трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (альтернативный синтез соединения примера 365)
К раствору 2-хлор-4-нитро-1H-имидазола (89,4 г, 606 ммоль) и трет-бутил (S)-4-(2-метилоксиран-2-илметил)пиперазин-1-карбоксилата (119 г, 466 ммоль) в этаноле (475 мл) добавляли гидрокарбонат натрия (58,7 г, 699 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду. Смесь экстрагировали этилацетатом и экстракт сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток диспергировали в этилацетате и отфильтровали с получением твердого вещества. Фильтрат концентрировали и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/1) с получением твердого вещества. Твердые вещества объединяли и сушили при пониженном давлении с получением трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (84,7 г, выход 45%) в виде белого порошка.
Пример 367
Получение (R)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата
Смесь (S)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (440 мг, 2,02 ммоль), полученного в примере 18, трет-бутилпиперазин-1-карбоксилата (414 мг, 2,22 ммоль) и ДМФА (4 мл) перемешивали при 55-60°С в течение 9 часов. Реакционной смеси давали остыть до комнатной температуры, затем разбавляли водой (24 мл) и раствор экстрагировали этилацетатом (10 мл) два раза. Органические фазы объединяли, промывали водой (20 мл) три раза и насыщенным раствором соли (10 мл), сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток обрабатывали диэтиловым эфиром с получением трет-бутил (R)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (662 мг, выход 81%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, с), 1,45 (9H, с), 2,34 (1H, д, J=13,9 Гц), 2,48-2,67 (5H, м), 3,27 (1H, с), 3,44 (4H, т, J=4,4 Гц), 3,99 (2H, с), 8,04 (1H, с).
Используя 2-хлор-4-нитро-1H-имидазол и трет-бутил (R)-4-(2-метилоксиран-2-илметил)пиперазин-1-карбоксилат, получали соединение примера 368 способом, подобно описанному в примере 366.
Пример 368
Трет-бутил (R)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат (альтернативный синтез соединения примера 367)
Белый порошок, выход 20%.
Пример 369
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифенил)пиперазин-1-ил]пропан-2-ола
К суспензии (S)-1-(2-метилоксиран-2-илметил)-4-(4-трифторметоксифенил)пиперазина (0,43 г, 1,37 ммоль) и 2-хлор-4-нитро-1H-имидазола (0,22 г, 1,51 ммоль) в ацетонитриле (4 мл) добавляли гидрокарбонат натрия (0,17 г, 2,06 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 9 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=3/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифенил)пиперазин-1-ил]пропан-2-ола (0,20 г, выход 31%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,18 (3H, с), 2,41 (1H, д, J=13,8 Гц), 2,56 (1H, д, J=13,8 Гц), 2,67-2,80 (2H, м), 2,85-2,96 (2H, м), 3,13-3,25 (4H, м), 4,03 (2H, с), 6,83-6,93 (2H, м), 7,07-7,17 (2H, м), 8,07 (1H, с).
Пример 370
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-хлорфенил)пиперазин-1-ил]пропан-2-ола
(R)-2-Хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (20 г, 91,9 ммоль), полученный в примере 12, и 1-(4-хлорфенил)пиперазин (20,8 г, 0,11 моль) добавляли к ДМФА (200 мл) с последующим перемешиванием при 70-75°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-хлорфенил)пиперазин-1-ил]пропан-2-ола (33,0 г, выход 87%) в виде желтой аморфной формы.
1H-ЯМР (CDCl3) δ м.д.:
1,53 (3H, с), 2,42 (1H, д, J=13,9 Гц), 2,55 (1H, д, J=13,9 Гц), 2,67-2,76 (2H, м), 2,81-2,90 (2H, м), 3,13-3,17 (4H, м), 3,43 (1H, с), 4,03 (2H, с), 6,78-6,85 (2H, м), 7,16-7,23 (2H, м), 8,06 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 371-384, показанные в следующей таблице, способом, подобно описанному в примере 370.

Используя соответствующие исходные вещества, получали соединения примеров 385 и 386 способом, подобно описанному в примере 370.
Пример 385
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-пиридил)пиперазин-1-ил]пропан-2-ол
Выход 100%
1H-ЯМР (CDCl3) δ м.д.:
1,18 (3H, с), 2,44 (1H, д, J=13,9 Гц), 2,56 (1H, д, J=13,9 Гц), 2,63-2,73 (2H, м), 2,77-2,91 (2H, м), 3,31-3,35 (4H, м), 3,54 (1H, с), 4,03-4,12 (2H, м), 6,63-6,66 (2H, м), 8,09 (1H, с), 8,23-8,27 (2H, м).
Пример 386
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(3-пиридил)пиперазин-1-ил]пропан-2-ол
Выход 81%
1H-ЯМР (CDCl3) δ м.д.:
1,17 (3H, с), 2,44 (1H, д, J=13,9 Гц), 2,57 (1H, д, J=13,9 Гц), 2,67-2,79 (2H, м), 2,84-2,93 (2H, м), 3,20-3,25 (4H, м), 3,85 (1H, ушир.с), 4,06 (2H, с), 7,16-7,19 (2H, м), 8,07-8,11 (2H, м), 8,26-8,28 (1H, м).
Используя (R)-2-хлор-4-нитро-1-(оксиран-2-илметил)имидазол, полученный в примере 9, получали соединения примеров 387-389 способом, подобно описанному в примере 370.
Пример 387
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-[4-(4-фторфенил)пиперазин-1-ил]пропан-2-ол
Выход 86%
1H-ЯМР (CDCl3) δ м.д.:
2,27-2,36 (1H, м), 2,49-2,63 (3H, м), 2,78-2,88 (2H, м), 2,97-3,18 (4H, м), 3,74 (1H, ушир.), 3,96-4,08 (2H, м), 4,18-4,24 (1H, м), 6,84-7,01 (4H, м), 8,02 (1H, с).
Пример 388
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-[4-(4-трифторметилфенил)пиперазин-1-ил]пропан-2-ол
Выход 49%
1H-ЯМР (CDCl3) δ м.д.:
2,27-2,36 (1H, м), 2,49-2,63 (3H, м), 2,78-2,87 (2H, м), 3,28-3,31 (4H, м), 3,62 (1H, ушир.), 3,95-4,11 (2H, м), 4,19-4,25 (1H, м), 6,92 (2H, д, J=8,6 Гц), 7,49 (2H, д, J=8,6 Гц), 8,02 (1H, с).
Пример 389
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-3-[4-(4-цианофенил)пиперазин-1-ил]пропан-2-ол
Выход 100%
1H-ЯМР (CDCl3) δ м.д.:
2,28-2,37 (1H, м), 2,49-2,63 (3H, м), 2,76-2,85 (2H, м), 3,28-3,36 (4H, м), 3,58 (1H, ушир.), 3,96-4,12 (2H, м), 4,19-4,25 (1H, м), 6,87 (2H, д, J=8,9 Гц), 7,51 (2H, д, J=8,9 Гц), 8,01 (1H, с).
Пример 390
Получение 4-трифторметоксибензил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата
Смесь (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (15 г, 68,93 ммоль), полученного в примере 12, и 4-трифторметоксибензилпиперазин-1-карбоксилата (25,17 г, 82,72 ммоль) в ДМФА (75 мл) перемешивали при 65-70°С в течение 20 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду (475 мл) и смесь экстрагировали этилацетатом (150 мл). Водный слой опять экстрагировали этилацетатом (150 мл). Органические фазы объединяли, промывали водой (400 мл) 3 раза и насыщенным раствором соли (100 мл), сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат/н-гексан=1/2) с получением 4-трифторметоксибензил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (29,98 г, выход 83%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, с), 2,36 (1H, д, J=14,0 Гц), 2,42-2,75 (5H, м), 3,18 (1H, с), 3,42-3,58 (4H, м), 4,00 (2H, с), 5,12 (2H, с), 7,21 (2H, д, J=8,6 Гц), 7,38 (2H, д, J=8,6 Гц), 8,03 (1H, с).
Пример 391
Получение 3-(4-трифторметилфенил)-2-пропенил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата
Смесь (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (4,24 г, 19,48 ммоль), полученного в примере 12, и 3-(4-трифторметилфенил)-2-пропенилпиперазин-1-карбоксилата (6,73 г, 21,41 ммоль) в ДМФА (21 мл) перемешивали при 50-55°С в течение 24 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду (90 мл) и смесь экстрагировали этилацетатом (60 мл). Водный слой вновь экстрагировали этилацетатом (60 мл). Органические фазы объединяли, промывали водой (90 мл) 3 раза и насыщенным раствором соли (60 мл), сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (этилацетат/н-гексан=1/1) с получением 3-(4-трифторметилфенил)-2-пропенил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (9,29 г, выход 90%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,16 (3H, с), 2,36 (1H, д, J=14,0 Гц), 2,43-2,76 (5H, м), 3,17 (1H, с), 3,48-3,67 (4H, м), 4,00 (2H, с), 4,78 (2H, дд, J=1,0 Гц, 6,1 Гц), 6,33-6,48 (1H, м), 6,66 (1H, д, J=15,9 Гц), 7,48 (2H, д, J=8,3 Гц), 7,58 (2H, д, J=8,3 Гц), 8,04 (1H, с).
Используя соответствующие исходные вещества, получали соединение примера 392 способом, подобно описанному в примере 391.
Пример 392
3-(4-Трифторметоксифенил)-2-пропенил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, с), 2,36 (1H, д, J=13,9 Гц), 2,51 (1H, д, J=13,9 Гц), 2,48-2,63 (2H, м), 2,63-2,78 (2H, м), 3,17 (1H, с), 3,39-3,63 (4H, м), 4,00 (2H, с), 4,75 (2H, дд, J=1,1 Гц, 6,3 Гц), 6,28 (1H, дт, J=6,3 Гц, 15,9 Гц), 6,62 (1H, д, J=15,9 Гц), 7,15-7,18 (2H, м), 7,38-7,42 (2H, м), 8,03 (1H, с).
Пример 393
Получение трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат (10,25 г, 25,4 ммоль), полученный в примере 365, растворяли в ДМФА (30 мл). К раствору добавляли гидрид натрия (1,12 г, 27,9 ммоль) с последующим перемешиванием в течение 2 часов при охлаждении на бане со льдом. К реакционной смеси добавляли этилацетат (10 мл) и воду (70 мл). Осадки отфильтровывали и промывали водой. Неочищенные твердые частицы перекристаллизовывали из этилацетата (70 мл) с получением трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (6,62 г, выход 71%) в виде светло-желтого порошка.
Оптическая чистота >99,5% e.e.
1H-ЯМР (CDCl3) δ м.д.:
[α]D 27=-20,953° (концентрация: 0,492, CHCl3)
1,44 (9H, с), 1,62 (3H, с), 2,45-2,66 (5H, м), 2,87 (1H, д, J=14,9 Гц), 3,29 (4H, ушир.), 3,92 (1H, д, J=9,7 Гц), 4,30 (1H, д, J=9,7 Гц), 7,53 (1H, с).
Пример 394
Получение трет-бутил (S)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Используя трет-бутил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилат (11 г, 28,22 ммоль), полученный в примере 363, получали трет-бутил (S)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (7,5 г, выход 75%) в виде светло-желтого порошка способом, подобно описанному в примере 393.
Оптическая чистота 96,6% e.e.
[α]D 22=-11,91° (концентрация: 1,016, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 2,49-2,59 (4H, м), 2,85 (2H, д, J=5,2 Гц), 3,33-3,44 (4H, м), 4,19 (1H, дд, J=6,9 Гц, 10,2 Гц), 4,35 (1H, дд, J=6,9 Гц, 10,2 Гц), 5,36-5,49 (1H, м), 7,55 (1H, с).
Пример 395
Получение трет-бутил (R)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Трет-бутил (R)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидроксипропил]пиперазин-1-карбоксилат (6,43 г, 16,49 ммоль), полученный в примере 364, растворяли в 1,4-диоксане (35 мл). К раствору добавляли гидрид натрия (730 мг, 18,25 ммоль) при охлаждении на бане со льдом и полученный раствор перемешивали при комнатной температуре в течение ночи и затем перемешивали при кипячении с обратным холодильником в течение 24 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку медленно добавляли воду, смесь экстрагировали метиленхлоридом два раза, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением трет-бутил (R)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (1,23 г, выход 21%) в виде белого порошка.
Оптическая чистота >99% e.e.
[α]D 27=11,635° (концентрация: 1,004, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 2,50-2,61 (4H, м), 2,85 (2H, д,,J=5,3 Гц), 3,31-3,50 (4H, м), 4,18 (1H, дд, J=6,9 Гц, 10,2 Гц), 4,35 (1H, дд, J=8,4 Гц, 10,2 Гц), 5,35-5,50 (1H, м), 7,55 (1H, с).
Пример 396
Получение трет-бутил (R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Трет-бутил (R)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат (376 мг, 0,93 ммоль), полученный в примере 368, растворяли в 1,4-диоксане (10 мл). К раствору добавляли гидрид натрия (45 мг, 1,12 ммоль) при охлаждении на бане со льдом и полученный раствор перемешивали при комнатной температуре в течение 30 минут и затем перемешивали при кипячении с обратным холодильником в течение 24 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку медленно добавляли воду и раствор экстрагировали этилацетатом два раза. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/1) с получением трет-бутил (R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (239 мг, выход 70%) в виде белого порошка.
Оптическая чистота 99,2% e.e.
[α]D 27=21,073° (концентрация: 0,522, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 1,61 (3H, с), 2,45-2,64 (5H, м), 2,87 (1H, д, J=14,9 Гц), 3,29 (4H, ушир.), 3,92 (1H, д, J=9,7 Гц), 4,33 (1H, д, J=9,7 Гц), 7,52 (1H, с).
Пример 397
Получение (S)-2-[4-(4-трифторметоксифенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
К раствору (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметоксифенил)пиперазин-1-ил]пропан-2-ола (5,85 г, 12,61 ммоль), полученного в примере 369, в ТГФ (150 мл) добавляли гидрид натрия (0,66 г, 18,92 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду и этилацетат. Осадки отфильтровывали, очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) и перекристаллизовывали из изопропанола с получением (S)-2-[4-(4-трифторметоксифенил)пиперазин-1-ил]метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (2,58 г, выход 48%) в виде светло-желтого твердого вещества.
Оптическая чистота 99,8% e.e.
[α]D 26=8,80° (концентрация: 1,000, CHCl3)
Температура плавления 129-130°C.
Пример 398
Получение (S)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-хлорфенил)пиперазин-1-ил]пропан-2-ол (33,0 г, 79,7 ммоль), полученный в примере 370, растворяли в ДМФА (300 мл). К раствору добавляли гидрид натрия (3,7 г, 91,6 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли ледяную воду и этилацетат и раствор энергично перемешивали. Осадки отфильтровывали, промывали водой и этилацетатом и сушили при пониженном давлении с получением 23,2 г неочищенного светло-желтого порошка. Неочищенный порошок объединяли с другим неочищенным порошком, синтезированным таким же образом (50 г), смесь очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=50/1) и кристаллизовали из смеси метиленхлорид-этилацетат с получением (S)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (45 г, выход 90%) в виде белого порошка.
Оптическая чистота 99,6% e.e.
[α]D 22=-10,20° (концентрация: 0,5, CHCl3)
Температура плавления 218-219,6°C.
Используя соответствующие исходные вещества, получали соединения примеров 399-403 способом, подобно описанному в примере 398.
Пример 399
(S)-2-[4-(4-Фторфенил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 42%, [α]D 28=2,10° (концентрация: 0,5, CHCl3)
Температура плавления 178,5-179,5°C.
Пример 400
(S)-2-[4-(3-Пиридил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 42%, температура плавления 145-147,7°C.
Пример 401
(S)-2-[4-(4-Пиридил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 3%
1H-ЯМР (CDCl3) δ м.д.:
1,65 (3H, с), 2,62 (1H, д, J=14,8 Гц), 2,64-2,71 (2H, м), 2,79-2,89 (2H, м), 2,92 (1H, д, J=14,8 Гц), 3,15-3,30 (4H, м), 3,95 (1H, д, J=9,7 Гц), 4,33 (1H, д, J=9,7 Гц), 6,60 (2H, д, J=6,2 Гц), 7,53 (1H, с), 8,26 (2H, д, J=6,2 Гц).
Пример 402
(S)-2-[4-(4-Трифторметилфенил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 175,8-176,6°C.
Пример 403
(S)-2-[4-(4-Цианофенил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 211-211,5°C.
Пример 404
Получение (S)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Дигидрохлорид 1-(4-хлорфенил)пиперазина (1,31 г, 4,86 ммоль) добавляли к раствору гидроксида натрия и полученную смесь экстрагировали метиленхлоридом. Экстракт сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 1-(4-хлорфенил)пиперазина.
Затем смесь полученного 1-(4-хлорфенил)пиперазина, (R)-2-хлор-1-(оксиран-2-илметил)-4-нитроимидазола (763 мг, 3,75 ммоль), полученного в примере 9, и ДМФА (5 мл) перемешивали при 70°С в течение 6 часов. К раствору добавляли гидрид натрия (219 мг, 5,48 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционной смеси добавляли ледяную воду и осадки отфильтровывали. Полученные твердые частицы перекристаллизовывали из смеси ацетон/вода с получением (S)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (250 мг, выход 18%) в виде светло-желтого порошка.
Температура плавления 183-183,5°C.
Пример 405
Получение 4-трифторметоксибензил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
4-Трифторметоксибензил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат (4,3 г, 8,24 ммоль), полученный в примере 390, растворяли в ДМФА (13 мл). К раствору добавляли гидрид натрия (430 мг, 10,7 ммоль) с последующим перемешиванием при той же температуре в течение 2 часов при охлаждении на бане со льдом. К реакционной смеси добавляли этилацетат (4,3 мл) и воду (30 мл) в указанном порядке и раствор перемешивали в течение 30 минут. Осадки отфильтровывали и промывали водой. Полученные твердые частицы перекристаллизовывали из смеси этилацетат/изопропиловый эфир и затем перекристаллизовывали из изопропилового спирта с получением 4-трифторметоксибензил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (3,15 г, выход 79%) в виде белого порошка.
Температура плавления 139,5-140,5°C
Оптическая чистота >99,5% e.e.
[α]D 27=18,04° (концентрация: 1,020, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,60 (3H, с), 2,39-2,75 (5H, м), 2,87 (1H, д, J=14,9 Гц), 3,14-3,56 (4H, м), 3,93 (1H, д, 9,7 Гц), 4,29 (1H, д, J=9,7 Гц), 5,10 (2H, с), 7,19 (2H, д, J=8,6 Гц), 7,36 (2H, д, J=8,6 Гц), 7,54 (1H, с).
Пример 406
Получение 3-(4-трифторметилфенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
3-(4-Трифторметилфенил)-2-пропенил (S)-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат (13,2 г, 24,81 ммоль), полученный в примере 391, растворяли в ДМФА (40 мл). К раствору добавляли гидрид натрия (1,19 г, 29,78 ммоль) с последующим перемешиванием в течение 1,5 часов при охлаждении на бане со льдом. К реакционной смеси добавляли этилацетат (13 мл) и воду (92 мл) в указанном порядке с последующим перемешиванием в течение 30 минут. Осадки отфильтровывали, промывали водой и очищали хроматографией на колонке с силикагелем (этилацетат) с получением 3-(4-трифторметилфенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (10,17 г, выход 83%) в виде светло-желтого порошка.
Температура плавления 132-133°C
Оптическая чистота 99,0% e.e.
[α]D 27=-21,73° (концентрация: 0,866, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,62 (3H, с), 2,48-2,75 (5H, м), 2,88 (1H, д, J=14,9 Гц), 3,15-3,57 (4H, м), 3,94 (1H, д, J=9,7 Гц), 4,29 (1H, д, J=9,7 Гц), 4,75 (2H, д, J=1,15 Гц, 6,0 Гц), 6,29-6,42 (1H, м), 6,64 (1H, д, J=15,9 Гц), 7,47 (2H, д, J=8,4 Гц), 7,52-7,62 (3H, м).
Используя соответствующие исходные вещества, получали соединение примера 407 способом, подобно описанному в примере 406.
Пример 407
3-(4-Трифторметоксифенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Температура плавления 91-93°C
[α]D 27=-21,88° (концентрация: 0,786, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,54 (3H, с), 2,38-2,71 (5H, м), 2,84 (1H, д, J=14,9 Гц), 3,13-3,54 (4H, м), 3,92 (1H, д, J=9,7 Гц), 4,29 (1H, д, J=9,7 Гц), 4,73 (2H, дд, J=1,2 Гц, 6,2 Гц), 6,15-6,33 (1H, м), 6,60 (1H, д, J=16,0 Гц), 7,16 (2H, д, J=8,7 Гц), 7,40 (2H, д, J=8,7 Гц), 7,53 (1H, с).
Пример 408
Получение (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазолдигидрохлорида
Трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (1,46 г, 3,98 ммоль), полученный в примере 393, растворяли в трифторуксусной кислоте (30 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метаноле (30 мл). К раствору добавляли раствор насыщенного хлористого водорода в этилацетате с последующим перемешиванием в течение 30 минут при охлаждении на бане со льдом. Осадки отфильтровывали с получением (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазолдигидрохлорида (994 мг, выход 73%) в виде желтого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,63 (3H, с), 2,80-3,36 (6H, м), 4,11 (1H, д, J=11,0 Гц), 4,25-4,98 (5H, м), 8,15 (1H, с), 9,31 (2H, ушир.).
Пример 409
Получение (S)-6-нитро-2-[4-(4-трифторметилбензил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил (S)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (100 мг, 0,27 ммоль), полученного в примере 394, и трифторуксусной кислоты (2 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (5 мл) и нейтрализовали триэтиламином (1 мл, 7,17 ммоль) и затем раствор концентрировали при пониженном давлении. Остаток растворяли в метаноле (5 мл) и к раствору добавляли 4-трифторметилбензальдегид (148 мг, 0,85 ммоль), цианотригидроборат натрия (53 мг, 0,85 ммоль) и уксусную кислоту (49 мкл, 0,85 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор гидрокарбоната натрия и раствор экстрагировали метиленхлоридом два раза. Органические фазы объединяли, промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=1/1) с получением (S)-6-нитро-2-[4-(4-трифторметилбензил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (53 мг, выход 46%) в виде светло-желтого порошка.
Температура плавления 149-150°C.
Пример 410
Получение (S)-2-[4-(бифенил-4-илметил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил (S)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (7,2 г, 20,26 ммоль), полученного в примере 394, трифторуксусной кислоты (24 мл) и метиленхлорида (72 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (100 мл), затем нейтрализовали триэтиламином (20 мл, 143,49 ммоль). Раствор концентрировали при пониженном давлении и остаток растворяли в метаноле (72 мл). К раствору добавляли 4-фенилбензальдегид (7,38 г, 40,52 ммоль), цианотригидроборат натрия (3,82 г, 60,78 ммоль) и уксусную кислоту (3,48 мл, 60,78 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение 24 часов. Осадки отфильтровывали, промывали метанолом и очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением (S)-2-[4-(бифенил-4-илметил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (5,52 г, выход 65%) в виде желтого порошка.
Оптическая чистота >99,0% e.e.
[α]D 28=-28,261° (концентрация: 0,046, ДМСО)
Температура плавления 207-208°C.
Пример 411
Получение (R)-2-[4-(бифенил-4-илметил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил (R)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (101,5 мг, 0,29 ммоль), полученного в примере 395, и трифторуксусной кислоты (2 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (5 мл) и нейтрализовали триэтиламином (2 мл, 14,35 ммоль) и затем раствор концентрировали при пониженном давлении. Остаток растворяли в метаноле (5 мл). К раствору добавляли 4-фенилбензальдегид (156 мг, 0,86 ммоль), цианотригидроборат натрия (53 мг, 0,84 ммоль) и уксусную кислоту (0,05 мл, 0,87 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор гидрокарбоната натрия и раствор экстрагировали метиленхлоридом два раза. Органические фазы объединяли, промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением (R)-2-[4-(бифенил-4-илметил)пиперазин-1-илметил]-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (56 мг, выход 46%) в виде белого порошка.
[α]D 28=28,261° (концентрация: 0,046, ДМСО).
Температура плавления 224-225°C
Используя соответствующие исходные вещества, получали соединение примера 412 способом, подобно описанному в примере 411.
Пример 412
(R)-6-Нитро-2-[4-(4-трифторметилбензил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Выход 48%, температура плавления 141-143°C.
Пример 413
Получение (S)-2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (1,7 г, 4,6 ммоль), полученного в примере 393, трифторуксусной кислоты (10 мл) и метиленхлорида (30 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метаноле (30 мл). К раствору добавляли 4'-трифторметилбифенил-4-карбоальдегид (2,3 г, 9,19 ммоль), цианотригидроборат натрия (580 мг, 9,23 ммоль) и уксусную кислоту (0,55 мл, 9,62 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор гидрокарбоната натрия и раствор экстрагировали метиленхлоридом два раза. Органические фазы объединяли, промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением (S)-2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (1,47 г, выход 63%) в виде белого порошка.
[α]D 28=1,831° (концентрация: 0,71, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,60 (3H, с), 2,20-2,45 (4H, м), 2,45-2,65 (4H, м), 2,50 (1H, д, J=15,0 Гц), 2,86 (1H, д, J=15,0 Гц), 3,48 (2H, с), 3,89 (1H, д, J=10,0 Гц), 4,31 (1H, д, J=10,0 Гц), 7,37 (2H, д, J=8,0 Гц), 7,50-7,56 (3H, м), 7,68 (4H, с).
Используя соответствующие исходные вещества, получали соединения примеров 414-417 способом, подобно описанному в примере 413.
Пример 414
(S)-2-Метил-6-нитро-2-[4-(4-трифторметилбензил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 110-112°C.
Пример 415
(S)-2-[4-(Бифенил-4-илметил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 182-184°C.
Пример 416
(S)-2-Метил-6-нитро-2-[4-(4-трифторметоксибензил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 137-138°C.
Пример 417
(S)-2-{4-[2-(4-Хлорфенил)-4-метилтиазол-5-илметил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 174,3-175,5°C.
Пример 418
Получение (R)-2-[4-(бифенил-4-илметил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил (R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (100 мг, 0,27 ммоль), полученного в примере 396, и трифторуксусной кислоты (2 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (5 мл) и нейтрализовали триэтиламином (1 мл, 7,17 ммоль) и затем раствор концентрировали при пониженном давлении. Остаток растворяли в метаноле (5 мл). К раствору добавляли 4-фенилбензальдегид (149 мг, 0,82 ммоль), цианотригидроборат натрия (51 мг, 0,82 ммоль) и уксусную кислоту (48 мкл, 0,82 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли насыщенный раствор гидрокарбоната натрия. Осадки отфильтровывали и очищали хроматографией на колонке с силикагелем (этилацетат) с получением (R)-2-(бифенил-4-илметил)пиперазин-1-илметил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (67 мг, выход 57%) в виде светло-желтого порошка.
Температура плавления 112-114°C.
Используя соответствующие исходные вещества, получали соединение примера 419 способом, подобно описанному в примере 418.
Пример 419
(R)-2-Метил-6-нитро-2-[4-(4-трифторметилбензил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 93-95°C.
Пример 420
Получение (S)-2-хлор-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона
Смесь трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (1,5 г, 4,1 ммоль), полученного в примере 393, и трифторуксусной кислоты (20 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (20 мл) и к раствору добавляли триэтиламин (3 мл) и 4-диметиламинопиридин (100 мг, 0,82 ммоль) в указанном порядке. К смеси медленно добавляли при охлаждении на бане со льдом раствор хлорацетилхлорида (0,49 мл, 6,2 ммоль) в метиленхлориде (2 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь промывали водой два раза, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением (S)-2-хлор-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона (600 мг, выход 43%) в виде светло-коричневого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,64 (3H, с), 2,50-2,70 (3H, м), 2,61 (1H, д, J=15,0 Гц), 2,70-2,90 (1H, м), 2,89 (1H, д, J=15,0 Гц), 3,15-3,55 (3H, м), 3,60-3,75 (1H, м), 3,97 (1H, д, J=10,0 Гц), 4,03 (2H, с), 4,30 (1H, д, J=10,0 Гц), 7,55 (1H, с).
Пример 421
Получение (S)-2-(4-хлорфенокси)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона
Смесь (S)-2-хлор-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона (300 мг, 0,87 ммоль), полученного в примере 420, 4-хлорфенола (170 мг, 1,32 ммоль), карбоната калия (180 мг, 1,3 ммоль) и ДМФА (5 мл) перемешивали при 60°С в течение 3 часов. Реакционной смеси давали остыть до комнатной температуры, затем разбавляли водой. Раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали раствором гидроксида натрия, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток перекристаллизовывали из этанола с получением (S)-2-(4-хлорфенокси)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона (260 мг, выход 68%) в виде светло-коричневого порошка.
Температура плавления 179-180°C.
Пример 422
Получение (S)-2-(4-хлорфенилсульфанил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона
Используя смесь (S)-2-хлор-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона (300 мг, 0,87 ммоль), полученного в примере 420, и 4-хлортиофенола (190 мг, 1,32 ммоль), получали (S)-2-(4-хлорфенилсульфанил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанон (80 мг, выход 20%) в виде белого порошка способом, подобно описанному в примере 421.
Температура плавления 142-145°C.
Пример 423
Получение (S)-(4-хлорфенил)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанона
Смесь трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (300 мг, 0,82 ммоль), полученного в примере 393, и трифторуксусной кислоты (6 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (15 мл) и к раствору добавляли триэтиламин (2 мл, 14,35 ммоль). К раствору добавляли при охлаждении на бане со льдом 4-хлорбензоилхлорид (150,7 мг, 0,86 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток обрабатывали смесью диэтиловый эфир-этилацетат с получением (S)-(4-хлорфенил)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанона (282 мг, выход 85%) в виде желтого порошка.
Температура плавления 173-174°C.
Используя соответствующие исходные вещества, получали соединение примера 424 способом, подобно описанному в примере 423.
Пример 424
(Бифенил-4-ил)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанон
Температура плавления 116-118°C.
Пример 425
Получение [4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]фенилметанона
Смесь 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (142 мг, 0,39 ммоль), полученного в примере 306, трифторуксусной кислоты (1 мл) и метиленхлорида (1 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (2 мл). К смеси добавляли триэтиламин (2 мл, 14,35 ммоль). К раствору добавляли при охлаждении на бане со льдом бензоилхлорид (54 мкл, 0,46 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли метиленхлоридом, промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток обрабатывали диэтиловым эфиром с получением [4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]фенилметанона (72 мг, выход 50%) в виде желтого порошка.
Температура плавления 145-148,7°C.
Используя соответствующие исходные вещества, получали соединения примеров 426-433 способом, подобно описанному в примере 425.
Пример 426
(4-Хлорфенил)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанон
Температура плавления 150,0-155,2°C.
Пример 427
[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил](пиридин-4-ил)метанон
1H-ЯМР (CDCl3) δ м.д.:
1,62 (3H, с), 2,25-2,75 (4H, м), 2,61 (1H, д, J=14,9 Гц), 2,88 (1H, д, J=14,9 Гц), 3,00-3,93 (4H, ушир.), 3,95 (1H, д, J=9,8 Гц), 4,30 (1H, д, J=9,8 Гц), 7,26-7,55 (2H, м), 7,59 (1H, с), 8,67-8,72 (2H, м).
Пример 428
1-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-2-фенилэтанон
Температура плавления 175,2-175,9°C.
Пример 429
1-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-3-фенилпропан-1-он
Температура плавления 166,8-169,1°C.
Пример 430
1-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-2-феноксиэтанон
Температура плавления 158-160,6°C.
Пример 431
2-(4-Хлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанон
Температура плавления 184-187°C.
Пример 432
(Бифенил-4-ил)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанон
1H-ЯМР (CDCl3) δ м.д.:
1,63 (3H, с), 2,45-2,80 (4H, м), 2,62 (1H, д, J=14,9 Гц), 2,90 (1H, д, J=14,9 Гц), 3,28-3,81 (4H, ушир.), 3,95 (1H, д, J=9,8 Гц), 4,31 (1H, д, J=9,8 Гц), 7,34-7,50 (5H, м), 7,55 (1H, с), 7,56-7,63 (4H, м).
Пример 433
[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-(4-трифторметилфенил)метанон
Температура плавления 161-162°C.
Пример 434
Получение (S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-(4-трифторметилфенил)метанона
Дигидрохлорид (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (2,36 мг, 0,882 ммоль), полученный в примере 408, суспендировали в метиленхлориде (10 мл). К суспензии добавляли триэтиламин (1 мл, 7,17 ммоль). К раствору добавляли при охлаждении на бане со льдом 4-(трифторметил)бензоилхлорид (193 мг, 0,926 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением (S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-(4-трифторметилфенил)метанона (264 мг, выход 68%) в виде белого порошка.
Температура плавления 183-184°C.
Используя соответствующие исходные вещества, получали соединения примеров 435-438 способом, подобно описанному в примере 434. (Соединения в примерах 435-437 получали с использованием дигидрохлорида 2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола, полученного в примере 322).
Пример 435
[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-(4-метоксифенил)метанон
Температура плавления 135-137°C.
Пример 436
[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-(4-метилфенил)метанон
Температура плавления 121-122°C.
Пример 437
[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-(3-трифторметилфенил)метанон
Температура плавления 122-124°C.
Пример 438
(S)-2-(4-Хлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанон
Температура плавления 189-190°C.
Пример 439
Получение (S)-2-(3,4-дихлорфенокси)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона
Смесь 3,4-(дихлорфенокси)уксусной кислоты (234 мг, 1,06 ммоль) и тионилхлорида (5 мл) перемешивали при кипячении с обратным холодильником в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении с получением соответствующего хлорангидрида кислоты. Полученный хлорангидрид растворяли в метиленхлориде (5 мл).
Раствор добавляли к смеси дигидрохлорида (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (236 мг, 0,88 ммоль), полученного в примере 408, метиленхлорида (10 мл) и триэтиламина (1 мл, 7,17 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением (S)-2-(3,4-дихлорфенокси)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]этанона (183 мг, выход 44%) в виде белого порошка.
Температура плавления 164-166°C.
Используя соответствующие исходные вещества, получали соединение примера 440 способом, подобно описанному в примере 439.
Пример 440
(S)-1-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-4-(4-трифторметилфенил)бутан-1-он
Температура плавления 145-146°C.
Пример 441
Получение (S)-3-(4-хлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пропенона
К смеси 4-хлоркоричной кислоты (300 мг, 1,64 ммоль), 1-гидроксибензотриазола (HOBT) (240 мг, 1,77 ммоль), WSCD (350 мг, 1,83 ммоль) и метиленхлорида (10 мл), перемешанной при комнатной температуре в течение 30 минут, добавляли смесь дигидрохлорида (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (434 мг, 1,64 ммоль), полученного в примере 408, метиленхлорида (10 мл) и триэтиламина (3,3 мл, 2,37 ммоль) при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением (S)-3-(4-хлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пропенона (180 мг, выход 26%) в виде белого порошка.
Температура плавления 220-222°C.
Используя соответствующие исходные вещества, получали соединения примеров 442-445 способом, подобно описанному в примере 441.
Пример 442
(S)-3-(Хлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пропан-1-он
Температура плавления 177-178°C.
Пример 443
(S)-4-(4-Хлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]бутан-1-он
Температура плавления 146-147°C.
Пример 444
(S)-3-(3,4-Дихлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пропенон
Температура плавления 213-215°C.
Пример 445
(S)-5-(4-Хлорфенил)-1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пентан-1-он
Температура плавления 108-111°C.
Пример 446
Получение 1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-2-(4-толил)этанона
К смеси дигидрохлорида 2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (240 мг, 0,79 ммоль), полученного в примере 322, ДМФА (5 мл) и триэтиламина (0,22 мл, 1,58 ммоль) добавляли п-толилуксусную кислоту (140 мг, 0,93 ммоль) и WSCD (180 мг, 0,93 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом, промывали водой два раза, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток обрабатывали диэтиловым эфиром с получением 1-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-2-(4-толил)этанона (172 мг, выход 64%) в виде белого порошка.
Температура плавления 213-214°C.
Используя соответствующие исходные вещества, получали соединение примера 447 способом, подобно описанному в примере 446.
Пример 447
(4-Диметиламинофенил)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанон
Температура плавления 204-207°C.
Пример 448
Получение (S)-2-{4-[3-(4-хлорфенил)пропан-1-сульфонил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (300 мг, 0,82 ммоль), полученного в примере 393, и трифторуксусной кислоты (10 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (10 мл). К раствору добавляли триэтиламин (3 мл, 21,52 ммоль) с последующим перемешиванием при комнатной температуре в течение 10 минут и затем добавляли 3-(4-хлорфенил)пропан-1-сульфонилхлорид (300 мг, 1,19 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 суток. Реакционную смесь промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением (S)-2-{4-[3-(4-хлорфенил)пропан-1-сульфонил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (330 мг, выход 84%) в виде белого порошка.
Температура плавления 150-151°C.
Используя 2-(4-трет-бутоксикарбонилпиперазин-1-илметил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол, полученный в примере 306, получали соединения примеров 449 и 450 способом, подобно описанному в примере 448.
Пример 449
2-[4-(4-Хлорбензолсульфонил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 202-204°C.
Пример 450
2-[4-(4-Хлорфенилметансульфонил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 215-217°C.
Пример 451
Получение (S)-2-{4-[2-(4-хлорфенил)этансульфонил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
К смеси дигидрохлорида (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (236 мг, 0,88 ммоль), полученного в примере 408, и ДМФА (3 мл) добавляли карбонат калия (500 мг, 3,62 ммоль) и 2-(4-хлорфенил)этансульфонилхлорид (240 мг, 1 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой три раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением (S)-2-{4-[2-(4-хлорфенил)этансульфонил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (100 мг, выход 26%) в виде белого порошка.
Температура плавления 192-193°C.
Используя дигидрохлорид (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола, полученный в примере 408, получали соединения примеров 452-454 способом, подобно описанному в примере 45. Кроме того, используя дигидрохлорид 2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола, полученный в примере 322, получали соединение примера 455 способом, подобно описанному в примере 451.
Пример 452
(S)-2-[4-(4-Хлорбензолсульфонил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 216-218°C.
Пример 453
(S)-2-[4-(4-Хлорфенилметансульфонил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 204-206°C.
Пример 454
(S)-2-{4-[4-(4-Хлорфенил)бутан-1-сульфонил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 176-177°C.
Пример 455
2-{4-[2-(4-Хлорфенил)этансульфонил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 182-184°C.
Пример 456
Получение 4-трифторметилбензил (S)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К смеси трет-бутил (S)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (300 мг, 0,84 ммоль), полученного в примере 394, и метиленхлорида (2 мл) добавляли трифторуксусную кислоту (1 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в ДМФА (1 мл) и нейтрализовали триэтиламином (1 мл).
К раствору добавляли смесь 4-(трифторметил)бензилового спирта (297 мг, 1,69 ммоль), ДМФА (1 мл) и 1,1'-карбонилдиимидазола (274 мг, 1,69 ммоль), перемешанную при комнатной температуре в течение 1 часа, с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением 4-трифторметилбензил (S)-4-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (273 мг, выход 71%) в виде белого порошка.
[α]D 28=-14,851° (концентрация: 0,404, CHCl3)
Температура плавления 125-125,5°C.
Пример 457
Получение 4-трифторметилбензил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К смеси трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (1,87 г, 5,09 ммоль), полученного в примере 393, и метиленхлорида (20 мл) добавляли трифторуксусную кислоту (20 мл) с последующим перемешиванием в течение 5 минут и затем смесь концентрировали при пониженном давлении. Остаток растворяли в ДМФА (20 мл). К раствору добавляли смесь 1,1'-карбонилдиимидазола (1,76 г, 10,9 ммоль), 4-(трифторметил)бензилового спирта (1,92 г, 10,9 ммоль) и ДМФА (20 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь экстрагировали этилацетатом. Органические фазы объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/1) и перекристаллизовывали из изопропилового спирта. Полученные твердые частицы отфильтровывали и затем сушили при пониженном давлении с получением 4-трифторметилбензил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (1,48 г, выход 53%) в виде светло-желтого порошка.
Температура плавления 140,4-141,6°C
Оптическая чистота 99,9% e.e.
1H-ЯМР (CDCl3) δ м.д.:
1,62 (3H, с), 2,52-2,69 (5H, м), 2,88 (1H, д, J=14,9 Гц), 3,43 (4H, ушир.), 3,93 (1H, д, J=9,7 Гц), 4,28 (1H, д, J=9,7 Гц), 5,16 (2H, с), 7,44 (2H, д, J=8,1 Гц), 7,53 (1H, с), 7,61 (2H, д, J=8,1 Гц).
Пример 458
Получение 1,3,3-триметил-2-оксо-2,3-дигидро-1H-индол-5-илметил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К смеси 3,3-диметил-2-оксо-2,3-дигидро-1H-индол-5-илметил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (300 мг, 0,62 ммоль) и ДМФА (3 мл) гидрид натрия (27 мг, 0,68 ммоль) добавляли с последующим перемешиванием в течение 30 минут при охлаждении на бане со льдом. К реакционной смеси добавляли метилиодид (97 мг, 0,68 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением 1,3,3-триметил-2-оксо-2,3-дигидро-1H-индол-5-илметил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (140 мг, 45%) в виде светло-желтого порошка.
Температура плавления 80-100°C (разложение).
Используя соответствующие исходные вещества, получали соединение примера 459 способом, подобно описанному в примере 458.
Пример 459
1-Метил-2-оксо-1,2,3,4-тетрагидрохинолин-6-илметил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Температура плавления 189-190°C.
Пример 460
Получение 3,5-дихлорбензил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
К смеси дигидрохлорида (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (300 мг, 0,88 ммоль), полученного в примере 408, и ДМФА (3 мл) добавляли триэтиламин (270 мг, 2,67 ммоль) для нейтрализации. К раствору добавляли смесь 3,5-дихлорбензилового спирта (180 мг, 1,02 ммоль), ДМФА (3 мл) и 1,1'-карбонилдиимидазола (180 мг, 1,11 ммоль), перемешанную при комнатной температуре в течение 2 часов, с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (этилацетат) с получением 3,5-дихлорбензил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (220 мг, выход 53%) в виде белого порошка.
Температура плавления 129-130°C.
Пример 461
Получение малеата 3-(3-трифторметилфенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Используя трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (1,09 г, 2,97 ммоль), полученный в примере 393, получали 3-(3-трифторметилфенил)-2-пропенил малеат (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (945 мг, 63%) в виде белого порошка способом, подобно описанному в примере 344.
Температура плавления 136-138°C.
Используя соответствующие исходные вещества, получали соединения примеров 462-465 способом, подобно описанному в примере 461.
Пример 462
Малеат [(E)-3-метил-3-(3-трифторметилфенил)]-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат
Температура плавления 142-143°C.
Пример 463
Малеат 3-(3-Хлорфенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилатмалеата
Температура плавления 150-151°C.
Пример 464
Малеат 3-(2,4,6-трифторфенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилатмалеата
Температура плавления 158-159°C.
Пример 465
Малеат [(Z)-3-метил-3-(3-трифторметилфенил)]-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилатмалеата
Температура плавления 124-125°C.
Пример 466
Получение 4-фторбензил (R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
Используя трет-бутил (R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (106 мг, 0,29 ммоль), полученный в примере 396, получали 4-фторбензил (R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (79 мг, выход 66%) в виде белого порошка способом, подобно описанному в примере 457.
[α]D 28=19,70° (концентрация: 1,066, CHCl3)
Температура плавления 167-169°C.
Пример 467
Получение [3-(4-трифторметилфенил)-2-пропенил]амида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Смесь трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (926 мг, 2,52 ммоль), полученного в примере 393, трифторуксусной кислоты (10 мл) и метиленхлорида (3 мл) перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в ДМФА (3 мл) и нейтрализовали триэтиламином (2 мл, 14,35 ммоль). К раствору добавляли смесь 3-(4-трифторметилфенил)-2-пропениламина (761 мг, 3,78 ммоль), 1,1'-карбонилдиимидазола (613 мг, 3,78 ммоль) и ДМФА (3 мл), перемешанную при комнатной температуре в течение ночи, с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и затем экстрагировали этилацетатом. Экстракт промывали водой три раза и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением [3-(4-трифторметилфенил)-2-пропенил]амида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты (1,2 г, выход 96%) в виде светло-желтого порошка.
Температура плавления 105-107°C.
Используя 2-(4-трет-бутоксикарбонилпиперазин-1-ил)метил-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол, полученный в примере 306, получали соединения примеров 468-470 способом, подобно описанному в примере 467.
Пример 468
(4-Трифторметилбензил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 201-202,5°C.
Пример 469
(4-Трифторметилфенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 216-217°C.
Пример 470
(4-Хлор-3-трифторметилфенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 222-224°C.
Пример 471
Получение циклогексиламида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Дигидрохлорид (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (236 мг, 0,88 ммоль), полученный в примере 408, растворяли в смеси метиленхлорида (15 мл) и триэтиламина (2 мл, 14,35 ммоль). К раствору добавляли циклогексилизоцианат (120 мг, 0,96 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением циклогексиламида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты (164 мг, 47%) в виде светло-желтого порошка.
Температура плавления 98-101°C.
Используя дигидрохлорид 2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола, полученный в примере 322, получали соединения примеров 472-476 способом, подобно описанному в примере 471.
Пример 472
(4-Метоксифенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 167-168°C.
Пример 473
(4-Хлорфенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 185-188°C (разложение).
Пример 474
(3-Трифторметилфенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 183-184°C.
Пример 475
(3,4-Дихлорфенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 212-214°C (разложение).
Пример 476
(4-Метилфенил)амид 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 202-203°C (разложение).
Пример 477
Получение (4-трифторметилфенил)амида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Дигидрохлорид (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (236 мг, 0,88 ммоль), полученный в примере 408, растворяли в смеси метиленхлорида (5 мл) и триэтиламина (2 мл, 14,35 ммоль). К раствору добавляли смесь 4-аминобензотрифторида (142 мг, 0,882 ммоль), 1,1'-карбонилдиимидазола (143 мг, 0,882 ммоль) и ДМФА (6 мл), перемешанную при комнатной температуре в течение ночи, с последующим перемешиванием при комнатной температуре в течение 6 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой три раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=30/1) с получением (4-трифторметилфенил)амида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты (90 мг, выход 23%) в виде белого порошка.
Температура плавления 150-152,5°C.
Используя соответствующие исходные вещества, получали соединения примеров 478-481 способом, подобно описанному в примере 477.
Пример 478
(4-Метоксифенил)амид (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 185,5-187,5°C.
Пример 479
(4-Трифторметилбензил)амид (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 101-103,6°C.
Пример 480
(4-Хлорфенил)амид (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 156-159°C (разложение).
Пример 481
(4-Метилфенил)амид (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Температура плавления 207-210°C (разложение).
Пример 482
Получение N-метил-N-(4-трифторметилфенил)амида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты
Смесь (4-трифторметилфенил)амида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты (200 мг, 0,44 ммоль), полученного в примере 477, ДМФА (4 мл) и гидрида натрия (26 мг, 0,66 ммоль) перемешивали при комнатной температуре в течение 1,5 часов. К смеси добавляли метилиодид (0,5 мл, 0,76 ммоль) с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой три раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) с получением N-метил-N-(4-трифторметилфенил)амида (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоновой кислоты (35 мг, выход 17%) в виде белого порошка.
Температура плавления 100,4-102,4°C.
Пример 483
Получение (S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-[4-(4-трифторметилфенил)пиперидин-1-ил]метанона
Смесь трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (1,17 г, 3,32 ммоль), полученного в примере 393, трифторуксусной кислоты (5 мл) и метиленхлорида (10 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (10 мл). К полученному раствору добавляли триэтиламин (5 мл, 35,87 ммоль) с последующим перемешиванием при комнатной температуре в течение 10 минут. Раствор концентрировали при пониженном давлении, остаток растворяли в ДМФА (15 мл). К смеси медленно добавляли при охлаждении на бане со льдом карбонат калия (920 мг, 6,64 ммоль) и раствор 4-(4-трифторметилфенил)пиперидин-1-карбонилхлорида (1,07 г, 3,65 ммоль) в ДМФА (10 мл) с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и затем смесь экстрагировали этилацетатом. Экстракт промывали водой три раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=30/1) с получением (S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-[4-(4-трифторметилфенил)пиперидин-1-ил]метанона (575 мг, выход 33%) в виде белого порошка.
Температура плавления 179,1-181,9°C.
Пример 484
Получение (S)-[4-(4-хлорфенил)-1,2,3,6-тетрагидропиридин-1-ил]-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанона
Смесь дигидрохлорида (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола (401 мг, 1,5 ммоль), полученного в примере 408, ДМФА (8 мл) и карбоната калия (750 мг, 5,4 ммоль) перемешивали при комнатной температуре в течение 10 минут. К реакционной смеси медленно добавляли при охлаждении на бане со льдом раствор 4-(4-хлорфенил)-1,2,3,6-тетрагидропиридин-1-карбонилхлорида (400 мг, 1,56 ммоль) в ДМФА (3 мл) с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом. Органическую фазу промывали водой три раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток перекристаллизовывали из этанола с получением (S)-[4-(4-хлорфенил)-1,2,3,6-тетрагидропиридин-1-ил]-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанона (380 мг, выход 53%) в виде светло-желтого порошка.
Температура плавления 161-162°C.
Используя дигидрохлорид (S)-2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола, полученный в примере 408, получали соединения примеров 485 и 486 способом, подобно описанному в примере 484. Кроме того, используя дигидрохлорид 2-метил-6-нитро-2-(пиперазин-1-илметил)-2,3-дигидроимидазо[2,1-b]оксазола, полученный в примере 322, получали соединение примера 487 способом, подобно описанному в примере 484.
Пример 485
(S)-[4-(4-Хлорфенил)пиридин-1-ил]-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанон
Температура плавления 156-159°C.
Пример 486
(S)-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-[4-(4-трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-ил]метанон
Температура плавления 168,4-171,7°C.
Пример 487
[4-(4-Хлорфенил)пиперидин-1-ил]-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]метанон
Температура плавления 186-187°C.
Пример 488
Получение (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]бензойной кислоты
Трет-бутил (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]бензоат (300 мг, 0,68 ммоль) в трифторуксусной кислоте (10 мл) перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении, нейтрализовали триэтиламином и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) и кристаллизовали из смеси метанол-диизопропиловый эфир с получением (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]бензойной кислоты (186 мг, выход 71%) в виде белого порошка.
МС 387(M+)
Температура плавления 248-252°C.
Пример 489
Получение (S)-2-[4-(2,6-дифенилпиримидин-4-ил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Трет-бутил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат (500 мг, 1,36 ммоль), полученный в примере 393, растворяли в метиленхлориде (2 мл). К раствору добавляли трифторуксусную кислоту (10 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли метиленхлорид (4 мл) и триэтиламин (4 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 минут и затем концентрировали при пониженном давлении и остаток растворяли в ДМФА (5 мл). К раствору добавляли 4-хлор-2,6-дифенилпиримидин (400 мг, 1,50 ммоль) и DBU (0,2 мл, 1,36 ммоль) с последующим перемешиванием при 100°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры, выливали в воду и затем смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением (S)-2-[4-(2,6-дифенилпиримидин-4-ил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (113 мг, выход 17%) в виде белого порошка.
МС 498(M+H)+
Температура плавления 202,5-205,4°C.
Используя соответствующие исходные вещества, получали соединение примера 490 способом, подобно описанному в примере 489.
Пример 490
(S)-2-[4-(4,6-Дифенилпиримидин-2-ил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 7%, температура плавления 201,2-205,4°C.
Пример 491
Получение трет-бутил{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамата
2-Хлор-4-нитро-1H-имидазол (2,05 г, 13,9 ммоль), трет-бутил-4-(2-метилоксиран-2-илметил)пиперазин-1-ил)карбамат (3,14 г, 11,6 ммоль) и гидрокарбонат натрия (1,46 г, 17,4 ммоль) в 1-пропаноле (13 мл) перемешивали при нагревании в течение 6 часов. Реакционную смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=2/1) с получением трет-бутил{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамата (1,55 г, выход 32%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 1,46 (9H, с), 2,36 (1H, д, J=13,9 Гц), 2,50 (1H, д, J=13,9 Гц), 2,64-2,84 (8H, м), 3,32 (1H, с), 3,96 (2H, с), 5,46 (1H, ушир.), 8,03 (1H, с).
Пример 492
Получение трет-бутил{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамата (альтернативный синтез соединения примера 491)
Используя 2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (4,36 г, 20,0 ммоль), полученный в примере 6, и трет-бутилпиперазин-1-илкарбамат (4,44 г, 22,0 ммоль), получали трет-бутил{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамат (6,08 г, выход 72%) в виде белого порошка способом, подобно описанному в примере 365.
Пример 493
Получение трет-бутил[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата
Используя трет-бутил{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамат (6,87 г, 16,4 ммоль), полученный в примере 492, получали трет-бутил[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамат (2,71 г, выход 43%) в виде белого порошка способом, подобно описанному в примере 393.
1H-ЯМР (CDCl3) δ м.д.:
1,43 (9H, с), 1,60 (3H, с), 2,36 (1H, д, J=14,0 Гц), 2,52-2,90 (9H, м), 3,90 (1H, д, J=9,7 Гц), 4,27 (1H, д, J=9,7 Гц), 5,35 (1H, ушир.), 7,53 (1H, с).
Пример 494
Получение бензил[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата
Смесь трет-бутил[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата (150 мг, 0,39 ммоль), полученного в примере 493, и трифторуксусной кислоты (4 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (4 мл) и нейтрализовали триэтиламином (4 мл, 28,7 ммоль). Затем к раствору добавляли при охлаждении на бане со льдом бензилхлорформиат (100 мг, 0,59 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия. Смесь экстрагировали метиленхлоридом. Экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=1/1) с получением бензил[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата (6,5 мг, выход 4%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,60 (3H, с), 2,53-2,90 (10H, м), 3,89 (1H, д, J=9,6 Гц), 4,27 (1H, д, J=9,6 Гц), 5,11 (2H, с), 5,88 (1H, ушир.), 7,25-7,34 (5H, м), 7,52 (1H, с).
Пример 495
Получение N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметоксибензилиден)амина
Смесь трет-бутил[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата (40 мг, 0,11 ммоль), полученного в примере 493, 4-трифторметоксибензальдегида (24 мг, 0,13 ммоль), трифторуксусной кислоты (0,08 мл) и метиленхлорида (1 мл) перемешивали при комнатной температуре в течение 3 часов. К смеси добавляли насыщенный раствор гидрокарбоната натрия для нейтрализации и затем экстрагировали метиленхлоридом. Раствор промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=3/1) с получением N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметоксибензилиден)амина (19 мг, выход 40%) в виде белого порошка.
Температура плавления 189,2-190,9°C.
Пример 496
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{4-[(4-трифторметилбензилиден)амино]пиперазин-1-ил}пропан-2-ола
Смесь (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (218 мг, 1 ммоль), полученного в примере 12, N-(пиперазин-1-ил)-N-(4-трифторметилбензилиден)амина (283 мг, 1,1 ммоль) и ДМФА (2 мл) перемешивали при 70-80°С в течение 7 часов. Реакционной смеси давали остыть до комнатной температуры и затем добавляли воду и полученный раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой 3 раза и насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=1/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{4-[(4-трифторметилбензилиден)амино]пиперазин-1-ил}пропан-2-ола (402 мг, выход 85%) в виде светло-желтого порошка.
[α]D 27=19,01° (концентрация: 1,010, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,18 (3H, с), 2,42 (1H, д, J=13,9 Гц), 2,57 (1H, д, J=13,9 Гц), 2,71-2,95 (4H, м), 3,10-3,33 (5H, м), 4,02 (2H, с), 7,51 (1H, с), 7,58 (2H, д, J=8,4 Гц), 7,68 (2H, д, J=8,4 Гц), 8,05 (1H, с).
Пример 497
Получение трет-бутил-(S)-{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамата
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (29,8 г, 137 ммоль), полученный в примере 12, и трет-бутилпиперазин-1-илкарбамат (28,9 г, 144 ммоль) получали трет-бутил-(S)-{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамат (36,68 г, выход 64%) в виде белого порошка способом, подобно описанному в примере 496.
[α]D 27=17,793° (концентрация: 1,006, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 1,45 (9H, с), 2,36 (1H, д, J=14,0 Гц), 2,50 (1H, д, J=14,0 Гц), 2,64-2,84 (8H, м), 3,32 (1H, с), 3,97 (2H, с), 5,47 (1H, ушир.), 8,04 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 498-500 способом, подобно описанному в примере 497.
Пример 498
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-{4-[(4-трифторметоксибензилиден)амино]пиперазин-1-ил}пропан-2-ол
[α]D 27=12,326° (концентрация: 1,006, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,17 (3H, с), 2,41 (1H, д, J=13,9 Гц), 2,56 (1H, д, J=13,9 Гц), 2,71-2,95 (4H, м), 3,14-3,29 (5H, м), 4,01 (2H, с), 7,19 (2H, д, J=8,0 Гц), 7,50 (1H, с), 7,62 (2H, д, J=8,0 Гц), 8,05 (1H, с).
Пример 499
(S)-1-(2-Хлор-4-нитроимидазол-1-ил)-2-метил-3-{4-[(5-трифторметилбензофуран)-2-илметилен)амино]пиперазин-1-ил}пропан-2-ол
1H-ЯМР (CDCl3) δ м.д.:
1,18 (3H, с), 2,43 (1H, д, J=14,0 Гц), 2,58 (1H, д, J=14,0 Гц), 2,73-2,82 (2H, м), 2,86-2,95 (2H, м), 3,17 (1H, с), 3,31 (4H, с), 4,03 (2H, с), 6,82 (1H, с), 7,46 (1H, с), 7,52 (1H, д, J=8,7 Гц), 7,59 (1H, д, J=8,7 Гц), 7,83 (1H, с), 8,05 (1H, с).
Пример 500
(S)-1-{4-[(5-Хлорбензофуран)-2-илметилен)амино]пиперазин-1-ил}-3-(2-хлор-4-нитроимидазол-1-ил)-2-метилпропан-2-ол
1H-ЯМР (CDCl3) δ м.д.:
1,18 (3H, с), 2,42 (1H, д, J=14,0 Гц), 2,57 (1H, д, J=14,0 Гц), 2,71-3,00 (4H, м), 3,17 (1H, с), 3,23-3,38 (4H, м), 4,02 (2H, с), 6,71 (1H, с), 7,22 (1H, дд, J=2,1 Гц, 8,7 Гц), 7,33-7,43 (2H, м), 7,50 (1H, д, J=2,1 Гц), 8,05 (1H, с).
Пример 501
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфениламино)пиперазин-1-ил]пропан-2-ола
Используя (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазол (0,610 г, 2,82 ммоль), полученный в примере 12, и N-(пиперазин-1-ил)-4-трифторметиланилин (0,760 г, 3,09 ммоль), получали (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфениламино)пиперазин-1-ил]пропан-2-ол (1,125 г, выход 86%) в виде бесцветного твердого вещества способом, подобно описанному в примере 496.
1H-ЯМР (CDCl3) δ м.д.:
1,15 (3H, с), 2,39 (1H, д, J=14,0 Гц), 2,54 (1H, д, J=14,0 Гц), 2,60-2,95 (8H, м), 3,25 (1H, с), 3,99 (2H, с), 4,67 (1H, с), 6,90 (2H, д, J=8,6 Гц), 7,43 (2H, д, J=8,6 Гц), 8,04 (1H, с).
Пример 502
Получение (S)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-4-трифторметиланилина
Используя (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-[4-(4-трифторметилфениламино)пиперазин-1-ил]пропан-2-ол (1,125 г, 2,43 ммоль), полученный в примере 501, получали (S)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-4-трифторметиланилин (0,715 г, выход 69%) в виде белого твердого вещества способом, подобно описанному в примере 493.
Температура плавления 192,1-195,3°C.
Пример 503
Получение трет-бутил-(S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата
Используя трет-бутил-(S)-{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}карбамат (36,68 г), полученный в примере 497, получали трет-бутил-(S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамат (19,51 г, выход 58%) в виде белого порошка способом, подобно описанному в примере 493.
Оптическая чистота >99,5% e.e.
[α]D 27=9,84° (концентрация: 1,016, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,43 (9H, с), 1,60 (3H, с), 2,35 (1H, д, J=14,0 Гц), 2,52-2,92 (9H, м), 3,89 (1H, д, J=9,7 Гц), 4,27 (1H, д, J=9,7 Гц), 5,35 (1H, с), 7,53 (1H, с).
Пример 504
Получение (S)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилбензилиден)амина
К смеси (S)-1-(2-хлор-4-нитроимидазол-1-ил)-2-метил-3-{4-[(4-трифторметилбензилиден)амино]пиперазин-1-ил}пропан-2-ола (847 мг, 0,85 ммоль), полученного в примере 496, и ДМФА (4 мл) гидрид натрия (69 мг, 1,73 ммоль) добавляли с последующим перемешиванием в течение 2,5 часов при охлаждении на бане со льдом. К реакционной смеси добавляли воду и осадки отфильтровывали. Полученное твердое вещество промывали метанолом и перекристаллизовывали из смеси ацетон/вода с получением (S)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилбензилиден)амина (248 мг, выход 69%) в виде светло-желтого порошка.
Температура плавления 201-202,3°C (разложение)
Оптическая чистота >99,5% e.e.
[α]D 27=-64,64° (концентрация: 1,018, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,64 (3H, с), 2,55-2,79 (3H, м), 2,80-3,20 (7H, м), 3,94 (1H, д, J=9,7 Гц), 4,33 (1H, д, J=9,7 Гц), 7,44 (1H, с), 7,48-7,67 (5H, м).
Используя соответствующие исходные вещества, получали соединения примеров 505-507 способом, подобно описанному в примере 504.
Пример 505
(S)-N-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилбензилиден)амин
Температура плавления 188,4-191,2°C
Оптическая чистота >99,0% e.e.
[α]D 27=-58,30° (концентрация: 1,024, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,64 (3H, с), 2,55-2,77 (3H, м), 2,82-3,18 (7H, м), 3,94 (1H, д, J=9,7 Гц), 4,33 (1H, д, J=9,7 Гц), 7,16 (2H, д, J=8,2 Гц), 7,43 (1H, с), 7,55 (1H, с), 7,58 (2H, д, J=8,2 Гц).
Пример 506
(S)-N-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(5-трифторметилбензофуран-2-илметилен)амин
Температура плавления 190,2-191,8°C
Оптическая чистота 99,8% e.e.
[α]D 27=-81,05° (концентрация: 0,992, CHCl3)
1H-ЯМР (CDCl3) δ м.д.:
1,64 (3H, с), 2,59-2,77 (3H, м), 2,86-3,00 (3H, м), 3,05-3,26 (4H, м), 3,96 (1H, д, J=9,7 Гц), 4,33 (1H, д, J=9,7 Гц), 6,79 (1H, с), 7,39 (1H, с), 7,41-7,57 (3H, м), 7,82 (1H, с).
Пример 507
(S)-N-(5-Хлорбензофуран-2-илметилен)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амин
Оптическая чистота >99,0% e.e.
[α]D 27=-84,48° (концентрация: 1,018, CHCl3)
Температура плавления 213,8-215,7°C
1H-ЯМР (CDCl3) δ м.д.:
1,63 (3H, с), 2,57-2,76 (3H, м), 2,81-2,95 (3H, м), 3,00-3,24 (4H, м), 3,94 (1H, д, J=9,7 Гц), 4,32 (1H, д, J=9,7 Гц), 6,67 (1H, с), 7,17-7,23 (1H, м), 7,30-7,43 (2H, м), 7,48 (1H, д, J=2, 1 Гц), 7,53 (s, 1H).
Пример 508
Получение (S)-N-(5-хлорбензофуран-2-илметилен)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амин (альтернативный синтез соединения примера 507)
К смеси трет-бутил-(S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата 503 (0,20 г, 0,523 ммоль), полученного в примере 503, и 5-хлорбензофуран-2-карбальдегида (0,113 г, 0,628 ммоль) и метиленхлорида (4 мл) добавляли трифторуксусную кислоту (0,4 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия и затем смесь экстрагировали метиленхлоридом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=4/1) с получением (S)-N-(5-хлорбензофуран-2-илметилен)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амина (0,137 г, выход 59%) в виде светло-желтого порошка.
Пример 509
Получение (S)-N-[1-(4-хлорфенил)этилиден]-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амина
Смесь трет-бутил-(S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата (200 мг, 0,52 ммоль), полученного в примере 503, трифторуксусной кислоты (2 мл) и метиленхлорида (4 мл) перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении, остаток растворяли в метиленхлориде (4 мл) и затем нейтрализовали триэтиламином (4 мл, 28,7 ммоль). К нейтрализованному раствору добавляли раствор 4-хлорацетофенона (97 мг, 0,63 ммоль) в этаноле (4 мл) с последующим перемешиванием при кипячении с обратным холодильником в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=3/1) с получением (S)-N-[1-(4-хлорфенил)этилиден]-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амина (39 мг, выход 18%) в виде светло-желтого порошка.
Температура плавления 164,6-166,5°C
Используя соответствующие исходные вещества, получали соединения примеров 510-513 способом, подобно описанному в примере 509.
Пример 510
(S)-N-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-[1-(4-трифторметилфенил)этилиден]амин
Температура плавления 167,9-169,4°C
Пример 511
(S)-N-[4-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-[1-(4-трифторметоксифенил)этилиден]амин
Температура плавления 177,8-180,1°C
Пример 512
(S)-N-Циклогексилиден-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амин
Температура плавления 178,6-179,3°C
Пример 513
N-(2-Бензилиденгептилиден)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амин
Температура плавления 166,6-169,6°C.
Пример 514
Получение (S)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилбензил)амина
К смеси (S)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилбензилиден)амина (100 мг, 0,23 ммоль), полученного в примере 504, и ТГФ (4 мл) добавляли при охлаждении на бане со льдом борогидрид натрия (13 мг, 0,34 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси добавляли метанол (1 мл) и раствор концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=2/1) с получением (S)-N-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]-N-(4-трифторметилбензил)амина (32 мг, выход 31%) в виде светло-желтого порошка.
Температура плавления 131,3-135,5°C.
Пример 515
Получение дигидрохлорида (S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амина
Смесь трет-бутил-(S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]карбамата (300 мг, 0,78 ммоль), полученного в примере 503, концентрированной хлористоводородной кислоты (2 мл) и метанола (4 мл) перемешивали при 50°С в течение 30 минут. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси метанол/эфир с получением дигидрохлорида (S)-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]амина (265 мг, выход 91%) в виде желтого порошка.
Температура плавления 176°C (разложение).
Пример 516
Получение 3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-5-(4-трифторметоксифенил)-3H-1,3,4]оксадиазол-2-она
К суспензии 2-хлор-4-нитро-1H-имидазола (2,21 г, 14,98 ммоль) и 3-(2-метилоксиран-2-илметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (2,37 г, 7,49 ммоль) в этаноле (25 мл) добавляли гидрокарбонат натрия (1,32 г, 15,73 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 8 часов. К реакционной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении с получением 3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (3,27 г, выход 94%) в виде светло-желтой аморфной формы.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,53 (3H, с), 3,67 (1H, д, J=8,8 Гц), 3,81 (1H, д, J=8,8 Гц), 4,49 (2H, с), 7,42-7,66 (2H, м), 7,86-8,09 (2H, м), 8,54 (1H, с), 10,98 (1H, ушир.).
Используя соответствующие исходные вещества, получали соединения примеров 517-523, показанные в следующей таблице, способом, подобно описанному в примере 516.




Пример 524
Получение 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она
К раствору 3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (3,27 г, 7,05 ммоль), полученного в примере 516, в 1,4-диоксане (70 мл) добавляли при охлаждении на бане со льдом гидрид натрия (0,37 г, 9,17 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К раствору добавляли при охлаждении на бане со льдом воду и смесь экстрагировали этилацетатом. Экстракт сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=4/1) и перекристаллизовывали из смеси ацетонитрил-этанол с получением 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (1,43 г, выход 48%) в виде белого твердого вещества.
Температура плавления 190-191°C.
Используя соответствующие исходные вещества, получали соединения примеров 525-531 способом, подобно описанному в примере 524.
Пример 525
3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-трифторметилфенил)-3H-[1,3,4]оксадиазол-2-он
Температура плавления 230-231°C.
Пример 526
3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(бифенил-4-ил)-3H-[1,3,4]оксадиазол-2-он
Температура плавления 248-249°C.
Пример 527
3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-хлорфенил)-3H-[1,3,4]оксадиазол-2-он
Температура плавления 221-222°C.
Пример 528
3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-фторфенил)-3H-[1,3,4]оксадиазол-2-он
Температура плавления 188-191°C.
Пример 529
3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-[2-(4-хлорфенил)винил]-3H-[1,3,4]оксадиазол-2-он
Температура плавления 249-252°C.
Пример 530
3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-[2-(4-хлорфенил)этил]-3H-[1,3,4]оксадиазол-2-он
Температура плавления 139-140°C.
Пример 531
3-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-хлорфеноксиметил)-3H-[1,3,4]оксадиазол-2-он
Температура плавления 64-66°C.
Пример 532
Получение 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-фенил-3H-[1,3,4]оксадиазол-2-она
Смесь 2-хлор-4-нитро-1H-имидазола (170 мг, 1,15 ммоль), 3-(2-метилоксиран-2-илметил)-5-фенил-3H-[1,3,4]оксадиазол-2-она (310 мг, 0,9 ммоль), гидрокарбоната натрия (120 мг, 1,43 ммоль) и этанола (2 мл) перемешивали при кипячении с обратным холодильником в течение 2,5 часов. Реакционной смеси давали остыть до комнатной температуры, затем разбавляли водой. Раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток растворяли в 1,4-диоксане (10 мл). К раствору добавляли гидрид натрия (55 мг, 1,38 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа и затем перемешиванием при кипячении с обратным холодильником в течение 1,5 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли воду и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток перекристаллизовывали из этанола с получением 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-фенил-3H-[1,3,4]оксадиазол-2-она (127 мг, выход 32%) в виде светло-коричневого порошка.
Температура плавления 225-227°C.
Пример 533
Получение 5-(4-хлорбензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-[1,3,4]оксадиазол-2-она
Смесь 2-метилоксиран-2-илметил-4-метилбензолсульфоната (3,98 г, 18,9 ммоль), 5-(4-хлорбензил)-3H-[1,3,4]оксадиазол-2-она (5,5 г, 26,11 ммоль), карбоната калия (3,4 г, 24,6 ммоль), иодида натрия (3,4 г, 22,68 ммоль) и ДМФА (40 мл) перемешивали при комнатной температуре в течение 21 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением желтого масла (5,47 г).
Смесь 2,3 г желтого масла (11,02 ммоль), 2,4-динитро-1H-имидазола (2,26 г, 14,3 ммоль), ацетата натрия (1,81 г, 22,07 ммоль) и этанола (22 мл) перемешивали при кипячении с обратным холодильником в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором гидрокарбоната натрия, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=3/1) с получением 5-(4-хлорбензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-[1,3,4]оксадиазол-2-она (240 мг, 9%) в виде белого твердого вещества.
Температура плавления 151-153°C.
Пример 534
Получение 5-(4-бромфенил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-[1,3,4]оксадиазол-2-она
Смесь 2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилметансульфоната (1,02 г, 3,67 ммоль), полученного в примере 41, 5-(4-бромфенил)-3H-[1,3,4]оксадиазол-2-она (680 мг, 2,82 ммоль), карбоната калия (580 мг, 4,2 ммоль), иодида натрия (890 мг, 5,94 ммоль) и ДМФА (15 мл) перемешивали при 100°С в течение 3 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли воду и полученный раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) с получением 5-(4-бромфенил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-[1,3,4]оксадиазол-2-она (17,4 мг, выход 2%) в виде светло-желтого порошка.
Температура плавления 231-233°C.
Пример 535
Получение 5-(4-бромфенил)-3-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-[1,3,4]оксадиазол-2-она
Используя 6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметилметансульфонат (3,28 г, 12,46 ммоль), полученный в примере 40, и 5-(4-бромфенил)-3H-[1,3,4]оксадиазол-2-он (1,5 г, 6,22 ммоль), получали 5-(4-бромфенил)-3-(6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-[1,3,4]оксадиазол-2-он (312 мг, выход 12%) в виде светло-коричневого порошка способом, подобно описанному в примере 534.
Температура плавления 264°C (разложение).
Используя соответствующие исходные вещества, получали соединение примера 536 способом, подобно описанному в примере 535.
Пример 536
3-(6-Нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-он
Температура плавления 204-207°C.
Пример 537
Получение 3-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-5-(пиридин-4-ил)-3H-[1,3,4]оксадиазол-2-она
Смесь 5-(пиридин-4-ил)-3H-[1,3,4]оксадиазол-2-она (150 мг, 0,92 ммоль), гидрида натрия (41 мг, 1,03 ммоль) и ДМФА (1,5 мл) перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилметансульфонат (200 мг, 0,69 ммоль), полученный в примере 42, и иодид натрия (140 мг, 0,93 ммоль) в указанном порядке с последующим перемешиванием при 50-60°С в течение 6 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли воду и полученный раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой три раза, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=25/1) с получением 3-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-5-(пиридин-4-ил)-3H-[1,3,4]оксадиазол-2-она (137 мг, выход 56%) в виде белого порошка.
Температура плавления 147-149°C.
Используя соответствующие исходные вещества, получали соединение примера 538 способом, подобно описанному в примере 537.
Пример 538
3-[2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-5-(пиразин-2-ил)-3H-[1,3,4]оксадиазол-2-он
Температура плавления 209-212°C.
Пример 539
Получение (R)-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она
К раствору 5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (0,68 г, 2,76 ммоль) и (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (0,50 г, 2,30 ммоль), полученного в примере 12, в ДМФА (5 мл) добавляли карбонат калия (0,38 г, 2,76 ммоль) с последующим перемешиванием при комнатной температуре в течение 16 часов и затем добавляли воду. Раствор экстрагировали этилацетатом, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=4/1) с получением (R)-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (1,06 г, количественный выход) в виде белой аморфной формы.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,53 (3H, с), 3,67 (1H, д, J=8,8 Гц), 3,81 (1H, д, J=8,8 Гц), 4,49 (2H, с), 7,42-7,66 (2H, м), 7,86-8,09 (2H, м), 8,54 (1H, с), 10,98 (1H, ушир.).
Пример 540
Получение (R)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она
К раствору (R)-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (0,87 г, 1,88 ммоль), полученного в примере 539, в 1,4-диоксане (18 мл) добавляли при охлаждении на бане со льдом гидрид натрия (98 мг, 2,44 ммоль). Смесь перемешивали при кипячении с обратным холодильником в течение 5 часов, концентрировали при пониженном давлении, затем добавляли воду при охлаждении на бане со льдом. Раствор экстрагировали этилацетатом и органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=9/1) и перекристаллизовывали из смеси ацетонитрил/изопропанол с получением (R)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-(4-трифторметоксифенил)-3H-[1,3,4]оксадиазол-2-она (0,32 г, выход 40%) в виде белого порошка.
Оптическая чистота 98,2% e.e.
[α]D 26=-12,43° (концентрация: 0,668, CHCl3)
Температура плавления 146-148°C.
Пример 541
Получение 3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3H-бензоксазол-2-она
К суспензии 2-хлор-4-нитро-1H-имидазола (503 мг, 3,41 ммоль), 3-(2-метилоксиран-2-илметил)-3H-бензоксазол-2-она (700 мг, 3,41 ммоль) в этаноле (7 мл) добавляли ацетат натрия (336 мг, 4,1 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры. К смеси добавляли воду и полученный раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=30/1) с получением 3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3H-бензоксазол-2-она (616 мг, выход 51%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,31 (3H, с), 3,04 (1H, с), 3,87 (1H, д, J=14,7 Гц), 3,98 (1H, д, J=14,7 Гц), 4,13 (1H, д, J=12,5 Гц), 4,24 (1H, д, J=14,5 Гц), 7,08-7,31 (4H, м), 8,04 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 542 и 543, показанные в следующей таблице, способом, подобно описанному в примере 541.

Пример 544
Получение 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-бензоксазол-2-она
Смесь 3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3H-бензоксазол-2-она (615 мг, 1,74 ммоль), полученного в примере 541, гидрида натрия (76,6 мг, 1,91 ммоль) и 1,4-диоксана (15 мл) перемешивали при кипячении с обратным холодильником в течение 1 часа. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=30/1) с получением 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-бензоксазол-2-она (209 мг, выход 38%) в виде белого порошка.
Температура плавления 222,7-224,3°C.
Используя соответствующие исходные вещества, получали соединения примеров 545 и 546 способом, подобно описанному в примере 544.
Пример 545
5-Хлор-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-бензоксазол-2-он
Температура плавления 207,6-207,9°C.
Пример 546
5-Фтор-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-бензоксазол-2-он
Температура плавления 246,2-246,8°C.
Пример 547
Получение 5-бром-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-бензоксазол-2-она
Смесь 2-хлор-4-нитро-1H-имидазола (3,22 г, 21,8 ммоль), 5-бром-3-(2-метилоксиран-2-илметил)-3H-бензоксазол-2-она (6,2 г, 21,8 ммоль), ацетата натрия (1,97 г, 24 ммоль) и этанола (50 мл) перемешивали при кипячении с обратным холодильником в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и полученный раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток растворяли в 1,4-диоксане (60 мл). К раствору добавляли гидрид натрия (528 мг, 13,21 ммоль) с последующим перемешиванием при 70-80°С в течение 17 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду, экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=30/1) с получением 5-бром-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3H-бензоксазол-2-она (1,82 г, выход 37%) в виде белого порошка.
Температура плавления 243-245,5°C.
Пример 548
Получение 5-(2-хлор-4-нитроимидазол-1-илметил)-3-(4-гидроксибифенил-3-ил)-5-метилоксазолидин-2-она
Смесь 2-хлор-4-нитро-1H-имидазола (1,3 г, 8,78 ммоль), 5-фенил-3-(2-метилоксиран-2-илметил)-3H-бензоксазол-2-она (2,47 г, 8,78 ммоль), ацетата натрия (792 мг, 9,66 ммоль) и этанола (30 мл) перемешивали при кипячении с обратным холодильником в течение 10 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и полученный раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) с получением 5-(2-хлор-4-нитроимидазол-1-илметил)-3-(4-гидроксибифенил-3-ил)-5-метилоксазолидин-2-она (1,82 г, выход 61%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,55 (3H, с), 3,85 (1H, д, J=9,5 Гц), 3,98 (1H, д, J=9,5 Гц), 4,46 (1H, д, J=14,9 Гц), 4,56 (1H, д, J=14,9 Гц), 6,99 (1H, д, J=8,4 Гц), 7,27 (1H, т, J=7,3 Гц), 7,36-7,57 (6H, м), 8,52 (1H, с), 10,06 (1H, с).
Пример 549
Получение 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-фенил-3H-бензоксазол-2-она
Смесь 5-(2-хлор-4-нитроимидазол-1-илметил)-3-(4-гидроксибифенил-3-ил)-5-метилоксазолидин-2-она (1,23 г, 2,88 ммоль), полученного в примере 548, гидрида натрия (127 мг, 3,16 ммоль) и ДМФА (10 мл) перемешивали при 100°С в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-фенил-3H-бензоксазол-2-она (172 мг, выход 15%) в виде желтовато-коричневого порошка.
Температура плавления 254-254,6°C.
Пример 550
Получение 3-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-3H-бензоксазол-2-она
Смесь 2-бензоксазолинона (240 мг, 1,8 ммоль), гидрида натрия (67 мг, 1,95 ммоль) и ДМФА (10 мл) перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилметансульфонат (500 мг, 1,7 ммоль), полученный в примере 42, с последующим перемешиванием при 50-60°С в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры и выливали в ледяную воду. Осадки отфильтровывали и перекристаллизовывали из этанола с получением 3-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-3H-бензоксазол-2-она (320 мг, выход 56%) в виде светло-коричневого порошка.
Температура плавления 193-195°C.
Пример 551
Получение 3-[5-(2-хлор-4-нитроимидазол-1-ил)-4-гидрокси-4-метилпентил]-3H-бензоксазол-2-она
Используя 3-[3-(2-метилоксиран-2-ил)пропил]-3H-бензоксазол-2-он (3,8 г, 16,3 ммоль), получали 3-[5-(2-хлор-4-нитроимидазол-1-ил)-4-гидрокси-4-метилпентил]-3H-бензоксазол-2-он (3,5 г, 68%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,20 (3H, с), 1,49-1,70 (2H, м), 1,88-2,07 (2H, м), 2,68 (1H, с), 3,81-3,93 (2H, м), 4,00 (2H, с), 6,98 (1H, д, J=7,3 Гц), 7,09-7,26 (3H, м), 8,00 (1H, с).
Пример 552
Получение 3-[6-(2-хлор-4-нитроимидазол-1-ил)-5-гидрокси-5-метилгексил]-3H-бензоксазол-2-она
Используя 3-[4-(2-метилоксиран-2-ил)бутил]-3H-бензоксазол-2-он (1,2 г, 4,86 ммоль), получали 3-[6-(2-хлор-4-нитроимидазол-1-ил)-5-гидрокси-5-метилгексил]-3H-бензоксазол-2-он (1,2 г, 62%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,16 (3H, с), 1,38-1,58 (4H, м), 1,67-1,86 (2H, м), 2,15 (1H, с), 3,87 (2H, т, J=6,6 Гц), 3,98 (2H, с), 6,98 (1H, д, J=7,8 Гц), 7,08-7,26 (3H, м), 8,01 (1H, с).
Пример 553
Получение 3-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]-3H-бензоксазол-2-она
Используя 3-[5-(2-хлор-4-нитроимидазол-1-ил)-4-гидрокси-4-метилпентил]-3H-бензоксазол-2-он (3,5 г, 9,2 ммоль), полученный в примере 551, получали 3-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]-3H-бензоксазол-2-он (2,4 г, выход 76%) в виде светло-желтого порошка способом, подобно описанному в примере 544.
Температура плавления 180-181°C.
Пример 554
Получение 3-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)бутил]-3H-бензоксазол-2-она
Используя 3-[6-(2-хлор-4-нитроимидазол-1-ил)-5-гидрокси-5-метилгексил]-3H-бензоксазол-2-он (1,2 г, 3 ммоль), полученный в примере 552, получали 3-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)бутил]-3H-бензоксазол-2-он (780 мг, выход 72%) в виде светло-желтого порошка способом, подобно описанному в примере 544.
Температура плавления 155-158°C.
Пример 555
Получение 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3-метил-1,3-дигидробензимидазол-2-она
Используя 1-метил-3-(2-метилоксиран-2-илметил)-1,3-дигидробензимидазол-2-он (1,41 г, 6,46 ммоль), получали 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3-метил-1,3-дигидробензимидазол-2-он (1,23 г, выход 63%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 3,47 (3H, с), 3,94 (1H, д, J=12,4 Гц), 4,03 (1H, д, J=12,4 Гц), 4,06 (1H, д, J=11,9 Гц), 4,17 (1H, д, J=11,9 Гц), 4,79 (1H, с), 7,00-7,21 (4H, м), 8,09 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 556-565, показанные в следующей таблице, способом, подобно описанному в примере 555.


Пример 566
Получение 1-метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-она
Используя 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3-метил-1,3-дигидробензимидазол-2-он (1,23 г, 3,37 ммоль), полученный в примере 555, получали 1-метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он (563 мг, выход 51%) в виде белого порошка способом, подобно описанному в примере 544.
Температура плавления 203,2-204,4°C.
Используя соответствующие исходные вещества, получали соединения примеров 567-576 способом, подобно описанному в примере 566.
Пример 567
1-(1-Трет-бутоксикарбонилпиперидин-4-ил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 218-219,1°C.
Пример 568
5-Хлор-1-метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 261,9-265,4°C (разложение).
Пример 569
1-Метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-5-трифторметил-1,3-дигидробензимидазол-2-он
Температура плавления 232,4-234,7°C.
Пример 570
6-Хлор-1-метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 261,3-263,3°C.
Пример 571
5-Фтор-1-метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 244,2-249,8°C (разложение).
Пример 572
5-Хлор-1-этил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 240,9-245,6°C.
Пример 573
5-Хлор-1-изопропил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 240,5-244,8°C.
Пример 574
5-Диметиламино-1-метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 264,6-268,3°C (разложение).
Пример 575
5-Хлор-1-(н-гексил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 168,1-169,3°C.
Пример 576
5-Этоксикарбонил-1-метил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 265,8-266,7°C.
Пример 577
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3-фенил-1,3-дигидробензимидазол-2-она
Используя 1-(2-метилоксиран-2-илметил)-3-фенил-1,3-дигидробензимидазол-2-он (758 мг, 2,7 ммоль), получали 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3-фенил-1,3-дигидробензимидазол-2-он (70 мг, выход 13%) в виде белого порошка способом, подобно описанному в примере 200.
Температура плавления 234,5-234,7°C.
Используя соответствующие исходные вещества, получали соединение примера 578 способом, подобно описанному в примере 577.
Пример 578
1-(4-Фторфенил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-он
Температура плавления 254,1-254,7°C.
Пример 579
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-(3-пиперидин-4-ил)-1,3-дигидробензимидазол-2-она
Смесь 1-(1-трет-бутоксикарбонилпиперидин-4-ил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидробензимидазол-2-она (371 мг, 0,74 ммоль), полученного в примере 567, трифторуксусной кислоты (1 мл) и метиленхлорида (10 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор гидрокарбоната натрия и осадки отфильтровывали. Осадки промывали водой несколько раз с получением 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-(3-пиперидин-4-ил)-1,3-дигидробензимидазол-2-она (255 мг, выход 86%) в виде светло-желтого порошка.
Температура плавления 192,3-198,8°C (разложение).
Пример 580
Получение бензил 4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-оксо-2,3-дигидробензимидазол-1-ил]пиперидин-1-карбоксилата
К смеси 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-(3-пиперидин-4-ил)-1,3-дигидробензимидазол-2-она (90 мг, 0,23 ммоль), полученного в примере 579, и метиленхлорида (5 мл) добавляли триэтиламин (75 мг, 0,74 ммоль) и бензилхлорформиат (126 мг, 0,74 ммоль) в указанном порядке при охлаждении на бане со льдом с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь промывали водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/ацетон=1/1) с получением бензил 4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2-оксо-2,3-дигидробензимидазол-1-ил]пиперидин-1-карбоксилата (25 мг, выход 21%) в виде белого порошка.
Температура плавления 181,7-184,6°C.
Пример 581
Получение 1-бензил-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]имидазолидин-2-она
Используя 1-бензил-3-(2-метилоксиран-2-илметил)имидазолидин-2-он (680 мг, 2,76 ммоль), получали 1-бензил-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]имидазолидин-2-он (580 мг, выход 59%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,18 (3H, с), 3,17-3,54 (6H, м), 4,07 (2H, с), 4,37 (2H, с), 7,17-7,40 (5H, м), 8,13 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 582-587, показанные в следующей таблице, способом, подобно описанному в примере 581.

(растворитель)
CDCl3
CDCl3
ДМСО-d6
ДМСО-d6
CDCl3
ДМСО-d6
Пример 588
Получение 1-бензил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-она
Используя 1-бензил-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]имидазолидин-2-он (580 мг, 1,47 ммоль), полученный в примере 581, получали 1-бензил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-он (395 мг, выход 75%) в виде белого порошка способом, подобно описанному в примере 544.
Температура плавления 180,2-180,9°C.
Используя соответствующие исходные вещества, получали соединения примеров 589-594 способом, подобно описанному в примере 588.
Пример 589
1-(4-Фторбензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-он
Температура плавления 182,5-183,3°C.
Пример 590
1-(4-Бромбензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-он
Температура плавления 205,7-208,1°C.
Пример 591
1-(4-Метоксибензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-он
Температура плавления 158,6-160,5°C.
Пример 592
1-(4-Хлорбензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-он
Температура плавления 208,7-209,8°C.
Пример 593
1-(1-Бензилпиперидин-4-ил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-он
1H-ЯМР (CDCl3) δ м.д.:
1,41-1,72 (7H, м), 1,97-2,10 (2H, м), 2,88-2,95 (2H, м), 3,08-3,30 (4H, м), 3,43-3,70 (4H, м), 3,81 (1H, д, J=15,0 Гц), 3,91 (1H, д, J=10,3 Гц), 4,51 (1H, д, J=10,3 Гц), 7,13-7,31 (5H, м), 7,47 (1H, с).
Пример 594
1-(2,4-Диметоксибензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-он
Температура плавления 175-175,4°C.
Пример 595
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3-фенилимидазолидин-2-она
Используя 1-(2-метилоксиран-2-илметил)-3-фенилимидазолидин-2-он (300 мг, 1,29 ммоль), получали 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-3-фенилимидазолидин-2-он (59 мг, выход 26%) в виде белого порошка способом, подобно описанному в примере 200.
Температура плавления 194,8-197,4°C.
Пример 596
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-она
Смесь 1-(2,4-диметоксибензил)-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-она (100 мг, 0,24 ммоль), полученного в примере 594, трифторуксусной кислоты (2 мл) и метиленхлорида (2 мл) перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли насыщенный раствор гидрокарбоната натрия для нейтрализации. Полученный раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток обрабатывали диэтиловым эфиром с получением 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазолидин-2-она (50 мг, выход 78%) в виде белого порошка.
Температура плавления 224,8-229,1°C (разложение).
Пример 597
Получение 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)оксазолидин-2-она
Смесь 3-(2-метилоксиран-2-илметил)оксазолидин-2-она (2,87 г, 18,23 ммоль), 2-хлор-4-нитро-1H-имидазола (2,7 г, 18,23 ммоль), ацетата натрия (1,64 г, 20,05 ммоль) и этанола (30 мл) перемешивали при кипячении с обратным холодильником в течение 10 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли метиленхлорид и полученный раствор промывали водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток растворяли в 1,4-диоксане (50 мл). К раствору добавляли гидрид натрия (610 мг, 15,25 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение ночи. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)оксазолидин-2-она (1,54 г, выход 40%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,59 (3H, с), 3,46-3,71 (4H, м), 4,11-4,30 (4H, м), 8,15 (1H, с).
Пример 598
Получение 5-азидометил-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]оксазолидин-2-она
Смесь 2-хлор-4-нитро-1H-имидазола (350 мг, 2,37 ммоль), 5-азидометил-3-(2-метилоксиран-2-илметил)оксазолидин-2-она (500 мг, 2,37 ммоль), ацетата натрия (214 мг, 2,61 ммоль) и этанола (5 мл) перемешивали при 70°С в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/2) с получением 5-азидометил-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]оксазолидин-2-она (640 мг, выход 75%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 3,17-3,35 (2H, м), 3,43-3,61 (2H, м), 3,67-3,84 (2H, м), 4,01-4,16 (2H, м), 4,68-4,81 (1H, м), 8,04 (1H, с).
Пример 599
Получение 5-азидометил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)оксазолидин-2-она
5-Азидометил-3-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]оксазолидин-2-он (1 г, 2,78 ммоль), полученный в примере 598, растворяли в 1,4-диоксане (10 мл). К раствору добавляли гидрид натрия (130 мг, 3,25 ммоль) с последующим перемешиванием при 80°С в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры и добавляли воду. Полученный раствор концентрировали при пониженном давлении. К остатку добавляли воду и раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=20/1) с получением 5-азидометил-3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)оксазолидин-2-она (46 мг, выход 5%) в виде светло-коричневого порошка.
МС 323(M+)
Пример 600
Получение 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-1,4-дигидробензо[d][1,3]оксазин-2-она
Используя 1-(2-метилоксиран-2-илметил)-1,4-дигидробензо[d][1,3]оксазин-2-он (5,13 г, 23,04 ммоль), получали 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-1,4-дигидробензо[d][1,3]оксазин-2-он (1,54 г, выход 36%) в виде светло-желтого масла способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,23 (3H, с), 3,96 (1H, ушир.), 4,04-4,20 (4H, м), 5,28 (2H, с), 7,00-7,07 (1H, м), 7,11-7,24 (2H, м), 7,30-7,43 (1H, м), 8,07 (1H, с).
Пример 601
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,4-дигидробензо[d][1,3]оксазин-2-она
Используя 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-1,4-дигидробензо[d][1,3]оксазин-2-он (1,54 г, 4,20 ммоль), полученный в примере 600, получали 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил-1,4-дигидробензо[d][1,3]оксазин-2-он (0,58 г, выход 42%) в виде светло-рыжевато-коричневого твердого вещества способом, подобно описанному в примере 544.
Температура плавления 230-231°C.
Пример 602
Получение 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3,3-дифтор-1,3-дигидроиндол-2-она
Используя 3,3-дифтор-1-(2-метилоксиран-2-илметил)-1,3-дигидроиндол-2-он (1,14 г, 4,76 ммоль), получали 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3,3-дифтор-1,3-дигидроиндол-2-он (968 мг, выход 53%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,09 (3H, с), 3,73 (1H, д, J=14,5 Гц), 3,87 (1H, д, J=14,5 Гц), 4,13 (1H, д, J=14,4 Гц), 4,21 (1H, д, J=14,4 Гц), 5,39 (1H, с), 7,20-7,26 (1H, м), 7,33-7,37 (1H, м), 7,57-7,64 (1H, м), 7,67-7,71, (1H, м).
Используя соответствующие исходные вещества, получали соединения примеров 603 и 604, показанные в следующей таблице, способом, подобно описанному в примере 602.

Пример 605
Получение 3,3-дифтор-1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидроиндол-2-она
Используя 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-3,3-дифтор-1,3-дигидроиндол-2-он (903 мг, 2,34 ммоль), полученный в примере 602, получали 3,3-дифтор-1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидроиндол-2-он (77 мг, выход 9%) в виде белого порошка способом, подобно описанному в примере 544.
Температура плавления 202-206°C.
Используя соответствующие исходные вещества, получали соединение примера 606 способом, подобно описанному в примере 605.
Пример 606
3,3-Диметил-1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,3-дигидроиндол-2-он
1H-ЯМР (ДМСО-d6) δ м.д.:
1,25 (3H, с), 1,37 (3H, с), 1,78 (3H, с), 3,96 (1H, д, J=15,1 Гц), 4,00 (1H, д, J=10,7 Гц), 4,22 (1H, д, J=15,1 Гц), 4,57 (1H, д, J=10,7 Гц), 7,04-7,17 (3H, м), 7,24-7,31 (1H, м), 7,44 (1H, с).
Пример 607
Получение 1-(2-хлор-4-нитроимидазол-1-ил)-4-(1-этил-1H-тетразол-5-ил)-2-метилбутан-2-ола
Используя 1-этил-5-[2-(2-метилоксиран-2-ил)этил]-1H-тетразол (1,04 г, 5,59 ммоль), получали 1-(2-хлор-4-нитроимидазол-1-ил)-4-(1-этил-1H-тетразол-5-ил)-2-метилбутан-2-ол (1,15 г, выход 69%) в виде светло-желтого масла способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,29 (3H, с), 1,56 (3H, т, J=7,3 Гц), 2,04-2,22 (2H, м), 2,91-3,11 (2H, м), 4,10 (2H, с), 4,24 (1H, ушир.), 4,34 (2H, кв. J=7,3 Гц), 8,09 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 608 и 609, показанные в следующей таблице, способом, подобно описанному в примере 607.
Пример 610
Получение 2-[2-(1-этил-1H-тетразол-5-ил)этил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Используя 1-(2-хлор-4-нитроимидазол-1-ил)-4-(1-этил-1H-тетразол-5-ил)-2-метилбутан-2-ол (1,15 г, 3,49 ммоль), полученный в примере 607, получали 2-[2-(1-этил-1H-тетразол-5-ил)этил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (68 мг, выход 7%) в виде светло-желтого порошка способом, подобно описанному в примере 544.
Температура плавления 135-137°C.
Используя соответствующие исходные вещества, получали соединения примеров 611 и 612 способом, подобно описанному в примере 610.
Пример 611
2-Метил-6-нитро-2-[2-(1-фенил-1H-тетразол-5-ил)этил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 158-159°C.
Пример 612
2-{2-[1-(4-Хлорфенил)-1H-тетразол-5-ил]этил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 198-200°C.
Пример 613
Получение 3-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-5-(4-трифторметилбензилиден)тиазолидин-2,4-диона
Используя 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилметансульфонат (280 мг, 0,96 ммоль), полученный в примере 42, и 5-(4-трифторметилбензилиден)тиазолидин-2,4-дион (320 мг, 1,17 ммоль), получали 3-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-5-(4-трифторметилбензилиден)тиазолидин-2,4-дион (260 мг, выход 58%) в виде светло-желтого порошка способом, подобно описанному в примере 537.
Температура плавления 257-258,5°C.
Пример 614
Получение 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пирролидин-2,5-диона
Используя 1-(2-метилоксиран-2-илметил)пирролидин-2,5-дион (1,96 г, 11 ммоль), получали 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пирролидин-2,5-дион (589 мг, выход 16%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (ДМСО-d6) δ м.д.:
0,96 (3H, с), 2,68 (4H, с), 3,48 (2H, с), 4,02 (2H, с), 5,19 (1H, с), 8,34 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 615 и 616, показанные в следующей таблице, способом, подобно описанному в примере 614.


Пример 617
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пирролидин-2,5-диона
Используя 1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пирролидин-2,5-дион (589 мг, 1,86 ммоль), полученный в примере 614, получали 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пирролидин-2,5-дион (232 мг, выход 34%) в виде белого порошка способом, подобно описанному в примере 544.
Температура плавления 202,5-203,4°C.
Используя соответствующие исходные вещества, получали соединения примеров 618 и 619 способом, подобно описанному в примере 617.
Пример 618
2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)изоиндол-1,3-дион
Температура плавления 264,6-268,3°C.
Пример 619
2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,1-диоксо-1,2-дигидро[d]бензотиазол-3-он
Температура плавления 243-245°C (разложение).
Пример 620
Получение 1-(2-хлор-4-нитроимидазол-1-ил)-2-(пиридин-3-ил)пропан-2-ола
Используя 3-(2-метилоксиран-2-ил)пиридин (7,4 г, 54,75 ммоль), получали 1-(2-хлор-4-нитроимидазол-1-ил)-2-(пиридин-3-ил)пропан-2-ол (3,3 г, выход 24%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,65 (3H, с), 4,19 (1H, д, J=14,2 Гц), 4,27 (1H, д, J=14,2 Гц), 5,82 (1H, с), 7,24-7,30 (1H, м), 7,68-7,72 (1H, м), 8,50-8,53 (1H, м), 8,68 (1H, д, J=2,3 Гц).
Пример 621
Получение 2-метил-6-нитро-2-(пиридин-3-ил)-2,3-дигидроимидазо[2,1-b]оксазола
Используя 1-(2-хлор-4-нитроимидазол-1-ил)-2-(пиридин-3-ил)пропан-2-ол (3,3 г, 11,7 ммоль), полученный в примере 620, получали 2-метил-6-нитро-2-(пиридин-3-ил)-2,3-дигидроимидазо[2,1-b]оксазол (1,8 г, выход 63%) в виде светло-коричневого порошка способом, подобно описанному в примере 544.
Температура плавления 212-214°C.
Пример 622
Получение 2-метил-6-нитро-2-(1-оксипиридин-3-ил)-2,3-дигидроимидазо[2,1-b]оксазола
К смеси 2-метил-6-нитро-2-(пиридин-3-ил)-2,3-дигидроимидазо[2,1-b]оксазола (800 мг, 3,3 ммоль), полученного в примере 621, и метиленхлорида (25 мл) добавляли при охлаждении на бане со льдом м-хлорпербензойную кислоту (1 г, 4,06 ммоль) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат промывали 20% водным раствором сульфита натрия, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли в указанном порядке, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 2-метил-6-нитро-2-(1-оксипиридин-3-ил)-2,3-дигидроимидазо[2,1-b]оксазола (330 мг, 39%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,92 (3H, с), 4,51 (2H, с), 7,42-7,53 (2H, м), 8,14 (1H, с), 8,20-8,24 (1H, м), 8,42 (1H, с).
Пример 623
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-она
Используя 1-(2-метилоксиран-2-илметил)пиперидин-4-он (2,2 г, 13 ммоль), получали 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-он (50 мг, выход 1%) в виде светло-желтого порошка способом, подобно описанному в примере 597.
Температура плавления 124-126°C.
Пример 624
Получение 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-1-(4-трифторметилбензил)пиперазин-2-она
Используя 4-(2-метилоксиран-2-илметил)-1-(4-трифторметилбензил)пиперазин-2-он (1,6 г, 4,9 ммоль), получали 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-1-(4-трифторметилбензил)пиперазин-2-он (1 г, выход 43%) в виде светло-желтого порошка способом, подобно описанному в примере 541.
1H-ЯМР (CDCl3) δ м.д.:
1,18 (3H, с), 2,45 (1H, д, J=13,9 Гц), 2,57 (1H, д, J=13,9 Гц), 2,72-2,98 (2H, м), 3,19-3,44 (3H, м), 3,55 (1H, д, J=16,5 Гц), 4,00 (1H, д, J=14,3 Гц), 4,10 (1H, д, J=14,3 Гц), 4,64 (2H, с), 7,37 (2H, д, J=8,2 Гц), 7,61 (2H, д, J=8,2 Гц), 8,02 (1H, с).
Используя соответствующие исходные вещества, получали соединение примера 625 способом, подобно описанному в примере 624.
Пример 625
1-Трет-бутил-4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-2-он
1H-ЯМР (CDCl3) δ м.д.:
1,16 (3H, с), 1,44 (9H, с), 2,41 (1H, д, J=13,8 Гц), 2,51 (1H, д, J=13,8 Гц), 2,65-2,88 (3H, м), 2,93-3,09 (1H, м), 3,12-3,28 (2H, м), 3,99 (1H, д, J=14,3 Гц), 4,08 (1H, д, J=14,3 Гц), 8,05 (1H, с).
Пример 626
Получение 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1-(4-трифторметилбензил)пиперазин-2-она
Используя 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]-1-(4-трифторметилбензил)пиперазин-2-он (1 г, 2,1 ммоль), полученный в примере 624, получали 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1-(4-трифторметилбензил)пиперазин-2-он (206 мг, выход 22%) в виде светло-желтого порошка способом, подобно описанному в примере 544.
Температура плавления 88-93°C.
Используя соответствующие исходные вещества, получали соединение примера 627 способом, подобно описанному в примере 626.
Пример 627
1-Трет-бутил-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-2-он
Температура плавления 193-194°C.
Пример 628
Получение 1-трет-бутил-4-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]пиперазин-2-она
Смесь 2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этилметансульфоната (290 мг, 1 ммоль), полученного в примере 42, гидрохлорида 1-трет-бутилпиперазин-2-она (200 мг, 1,28 ммоль), триэтиламина (242 мг, 2,39 ммоль), иодида калия (250 мг, 1,5 ммоль) и ДМФА (3 мл) перемешивали при 70°С в течение 4 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли воду и полученный раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением 1-трет-бутил-4-[2-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]пиперазин-2-она (27 мг, выход 8%) в виде белого порошка.
Температура плавления 153-154°C.
Используя соответствующие исходные вещества, получали соединение примера 629 способом, подобно описанному в примере 628.
Пример 629
4-[2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)этил]-1-фенилпиперазин-2-он
Температура плавления 199-202°C (разложение).
Пример 630
Получение 1-трет-бутил-4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]пиперазин-2-она
Используя 3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропилметансульфонат (300 мг, 0,98 ммоль), полученный в примере 39, получали 1-трет-бутил-4-[3-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил)пропил]пиперазин-2-он (150 мг, выход 42%) в виде белого порошка способом, подобно описанному в примере 628.
Температура плавления 147-149°C (разложение).
Пример 631
Получение 1-(бензимидазол-1-ил)-3-(2-хлор-4-нитроимидазол-1-ил)-2-метилпропан-2-ола
Используя 1-(2-метилоксиран-2-илметил)-1H-бензимидазол (350 мг, 1,86 ммоль), получали 1-(бензимидазол-1-ил)-3-(2-хлор-4-нитроимидазол-1-ил)-2-метилпропан-2-ол (135 мг, выход 22%) в виде белого порошка способом, подобно описанному в примере 541.
1H-ЯМР (ДМСО-d6) δ м.д.:
0,99 (3H, с), 4,06 (1H, д, J=14,2 Гц), 4,23-4,45 (3H, м), 5,44 (1H, с), 7,14-7,32 (2H, м), 7,57-7,77 (2H, м), 8,15 (1H, с), 8,36 (1H, с).
Используя соответствующие исходные вещества, получали соединение примера 632 способом, подобно описанному в примере 631.
Пример 632
1-(Имидазол-1-ил)-3-(2-хлор-4-нитроимидазол-1-ил)-2-метилпропан-2-ол
1H-ЯМР (CDCl3) δ м.д.:
1,19 (3H, с), 3,86-4,05 (3H, м), 4,13 (1H, д, J=14,2 Гц), 6,87 (1H, с), 6,89 (1H, с), 7,47 (1H, с), 8,08 (1H, с).
Пример 633
Получение 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1H-бензимидазола
Используя 1-(бензимидазол-1-ил)-3-(2-хлор-4-нитроимидазол-1-ил)-2-метилпропан-2-ол (135 мг, 0,4 ммоль), полученный в примере 631, получали 1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1H-бензимидазол (72 мг, выход 60%) в виде белого порошка способом, подобно описанному в примере 544.
Температура плавления 250,3-251,9°C (разложение).
Используя соответствующие исходные вещества, получали соединение примера 634 способом, подобно описанному в примере 633.
Пример 634
1-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)имидазол
Температура плавления 245,5-247,8°C.
Пример 635
Получение (S)-1-(2-хлор-4-нитроимидазол-1-ил)-3-(3,4-дигидро-2H-хинолин-1-ил)-2-метилпропан-2-ола
Смесь (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (100 мг, 0,46 ммоль), полученного в примере 12, 1,2,3,4-тетрагидрохинолина (122 мг, 0,92 ммоль) и ДМФА (1 мл) перемешивали при 80°С в течение 8 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли воду и полученный раствор экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/1) с получением (S)-1-(2-хлор-4-нитроимидазол-1-ил)-3-(3,4-дигидро-2H-хинолин-1-ил)-2-метилпропан-2-ола (134 мг, выход 83%) в виде оранжевого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,24 (3H, с), 1,94-2,04 (2H, м), 2,39 (1H, м), 2,79-2,85 (2H, м), 3,27-3,42 (4H, м), 6,66-6,72 (2H, м), 6,97-7,08 (2H, м), 8,04 (1H, с).
Используя соответствующие исходные вещества, получали соединения примеров 636-638, показанные в следующей таблице, способом, подобно описанному в примере 635.



Пример 639
Получение (S)-1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,2,3,4-тетрагидрохинолина
Используя (S)-1-(2-хлор-4-нитроимидазол-1-ил)-3-(3,4-дигидро-2H-хинолин-1-ил)-2-метилпропан-2-ола (134 мг, 0,38 ммоль), полученный в примере 635, получали (S)-1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,2,3,4-тетрагидрохинолин (64 мг, 54%) в виде белого порошка способом, подобно описанному в примере 393.
Температура плавления 168-172°C.
Используя соответствующие исходные вещества, получали соединения примеров 640-642 способом, подобно описанному в примере 639.
Пример 640
(S)-2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,2,3,4-тетрагидроизохинолин
Температура плавления 153-155,3°C.
Пример 641
(S)-2-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-2,3-дигидро-1H-изоиндол
1H-ЯМР (CDCl3) δ м.д.:
1,68 (3H, с), 3,01 (1H, д, J=14,5 Гц), 3,24 (1H, д, J=14,5 Гц), 3,92 (1H, д, J=9,6 Гц), 4,08 (4H, с), 4,50 (1H, д, J=9,6 Гц), 7,13-7,21 (4H, м), 7,50 (1H, с).
Пример 642
(S)-8-(2-Метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-1,4-диокса-8-азаспиро[4,5]декан
Температура плавления 166,5-168,2°C.
Пример 643
Получение (2S)-метил-6-нитро-2-[(2S)-(4-трифторметоксифеноксиметил)пирролидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
Смесь (R)-2-хлор-1-(2-метилоксиран-2-илметил)-4-нитроимидазола (645 мг, 2,97 ммоль), полученного в примере 12, (S)-2-(4-трифторметоксифеноксиметил)пирролидина (930 мг, 3,56 ммоль) и ДМФА (15 мл) перемешивали при 80°С в течение 8 часов. К реакционной смеси добавляли гидрид натрия (154 мг, 3,86 ммоль) с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. Реакционную смесь выливали в ледяную воду и смесь экстрагировали этилацетатом два раза. Органические фазы объединяли, промывали водой два раза и насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид) и перекристаллизовывали из смеси метиленхлорид-изопропиловый эфир с получением (2S)-метил-6-нитро-2-[(2S)-(4-трифторметоксифеноксиметил)пирролидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (505 мг, выход 41%) в виде белого порошка.
1H-ЯМР (CDCl3) δ м.д.:
1,42-1,52 (1H, м), 1,59 (3H, с), 1,61-1,79 (2H, м), 1,87-1,99 (1H, м), 2,50-2,61 (1H, м), 3,03-3,17 (2H, м), 3,06 (1H, д, J=14,7 Гц), 3,20 (1H, д, J=14,7 Гц), 3,72-3,79 (2H, м), 3,92 (1H, дд, J=9,2 Гц, 3,7 Гц), 4,58 (1H, д, J=9,5 Гц), 6,80-6,88 (2H, м), 7,15-7,19 (1H, м), 7,42 (1H, с).
Пример 644
Получение трет-бутил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]гомопиперазин-1-карбоксилата
Смесь 2-хлор-4-нитро-1H-имидазола (8,39 г, 56,88 ммоль), трет-бутил 4-(2-метилоксиран-2-илметил)гомопиперазин-1-карбоксилата (15,38 г, 56,88 ммоль) и ацетата натрия (5,13 г, 62,57 ммоль) в 1-пропаноле (100 мл) перемешивали при кипячении с обратным холодильником в течение 10 часов. Реакционной смеси давали остыть до комнатной температуры и затем концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде. Раствор промывали водой, сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=5/1) с получением трет-бутил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]гомопиперазин-1-карбоксилата (6,25 г, выход 27%) в виде красновато-желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,14 (3H, с), 1,48 (9H, с), 1,69-1,90 (2H, м), 2,40-2,55 (1H, м), 2,66 (1H, д, J=14,1 Гц), 2,75-2,98 (5H, м), 3,30-3,59 (4H, м), 3,96 (2H, с), 8,06 (1H, с).
Пример 645
Получение трет-бутил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)гомопиперазин-1-карбоксилата
Используя трет-бутил 4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]гомопиперазин-1-карбоксилат (6,25 г, 14,96 ммоль), полученный в примере 644, получали трет-бутил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)гомопиперазин-1-карбоксилат (3,07 г, выход 54%) в виде белого порошка способом, подобно описанному в примере 544.
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 1,59 (3H, с), 1,68-1,79 (2H, м), 2,63-2,90 (5H, м), 3,06 (1H, д, J=15,1 Гц), 3,25-3,50 (4H, м), 3,91 (1H, д, J=9,7 Гц), 4,33 (1H, д, J=9,7 Гц), 7,54 (1H, с).
Пример 646
Получение гидрохлорида бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)гомопиперазин-1-карбоксилата
Смесь трет-бутил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)гомопиперазин-1-карбоксилата (250 мг, 0,655 ммоль), полученного в примере 645, и трифторуксусной кислоты (10 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, Остаток растворяли в метиленхлориде (10 мл). К раствору добавляли триэтиламин (0,27 мл, 1,96 ммоль) и бензилхлорформиат (0,19 мл, 1,31 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=1/1) с получением светло-желтого масла. Полученное масло растворяли в этилацетате. К раствору добавляли насыщенный раствор хлористоводородной кислоты в этилацетате и осадки отфильтровывали с получением гидрохлорида бензил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)гомопиперазин-1-карбоксилата (246 мг, выход 83%) в виде белого порошка.
Температура плавления 115-117°C.
Пример 647
Получение 2-[4-(бифенил-4-илметил)гомопиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола
Смесь трет-бутил 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)гомопиперазин-1-карбоксилата 645 (346 мг, 0,91 ммоль), полученного в примере 645, и трифторуксусной кислоты (10 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метиленхлориде (10 мл). К раствору добавляли триэтиламин (0,27 мл, 1,96 ммоль). Раствор концентрировали при пониженном давлении и остаток растворяли в метаноле (10 мл). К раствору добавляли 4-фенилбензальдегид (496 мг, 2,72 ммоль), цианотригидроборат натрия (171 мг, 2,72 ммоль) и уксусную кислоту (0,17 мл, 2,72 ммоль) в указанном порядке с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в насыщенный раствор гидрокарбоната натрия, затем экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=5/1) с получением 2-[4-(бифенил-4-илметил)гомопиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазола (251 мг, выход 62%) в виде белого порошка.
Температура плавления 138-142,2°C.
Пример 648
Получение 1'-трет-бутоксикарбонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,4-Динитро-1H-имидазол (1,0 г, 6,3 ммоль), трет-бутил 1-окса-6-азаспиро[2,5]октан-6-карбоксилат (2,0 г, 9,5 ммоль) и ацетат натрия (612 мг, 7,5 ммоль) в этаноле (7 мл) перемешивали при кипячении с обратным холодильником в течение 10 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор гидрокарбоната натрия и метиленхлорид с последующим энергичным перемешиванием и затем смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 1'-трет-бутоксикарбонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (586 мг, выход 29%) в виде белого порошка.
Температура плавления 230-232°C.
Пример 649
Получение трет-бутил 4-(2-хлор-4-нитроимидазол-1-илметил)-4-гидроксипиперидин-1-карбоксилата
2-Хлор-4-нитро-1H-имидазол (3,1 г, 21,0 ммоль), трет-бутил 1-окса-6-азаспиро[2,5]октан-6-карбоксилат (4,4 г, 21,0 ммоль) и гидрокарбонат натрия (1,94 г, 23,1 ммоль) в этаноле (20 мл) перемешивали при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду. Полученный раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 4-(2-хлор-4-нитроимидазол-1-илметил)-4-гидроксипиперидин-1-карбоксилата (5,4 г, выход 72%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,45-1,71 (5H, м), 1,46 (9H, с), 3,03-3,14 (2H, м), 3,90-4,03 (2H, м), 4,02 (2H, с), 7,91 (1H, с).
Пример 650
Получение трет-бутил 4-{2-[4-(2-хлор-4-нитроимидазол-1-илметил)-4-гидроксипиперидин-1-ил]-2-оксоэтил}пиперазин-1-карбоксилата
2-Хлор-4-нитро-1H-имидазол (1,29 г, 8,76 ммоль), трет-бутил 4-{2-(1-окса-6-азаспиро[2,5]октан-6-ил)-2-оксоэтил}пиперазин-1-карбоксилат (2,97 г, 8,76 ммоль) и гидрокарбонат натрия (809 мг, 9,64 ммоль) в этаноле (10 мл) перемешивали при кипячении с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли насыщенный раствор гидрокарбоната натрия. Раствор экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) с получением трет-бутил 4-{2-[4-(2-хлор-4-нитроимидазол-1-илметил)-4-гидроксипиперидин-1-ил]-2-оксоэтил}пиперазин-1-карбоксилата (2,58 г, выход 61%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,45 (9H, с), 1,53-1,71 (4H, м), 2,44 (4H, ушир.), 2,96-3,04 (1H, м), 3,10-3,27 (2H, м), 3,35-3,48 (4H, м), 3,90-3,96 (2H, м), 4,05 (2H, с), 4,32-4,37 (2H, м), 8,04 (1H, с).
Используя 6-(4-трифторметилфенил)-1-окса-6-азаспиро[2,5]октан, получали соединение примера 651 способом, подобно описанному в примере 650.
Пример 651
4-(2-Хлор-4-нитроимидазол-1-илметил)-1-(4-трифторметилфенил)пиперидин-4-ол
Светло-розовый порошок, выход 54%
1H-ЯМР (CDCl3) δ м.д.:
1,60-1,66 (2H, м), 1,82-1,93 (3H, м), 3,10-3,22 (2H, м), 3,62-3,67 (2H, м), 4,07 (2H, с), 6,95 (2H, д, J=8,7 Гц), 7,50 (2H, д, J=8,7 Гц), 7,99 (1H, с).
Пример 652
Получение 1'-трет-бутоксикарбонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (альтернативный способ синтеза соединения примера 648)
Трет-бутил 4-(2-хлор-4-нитроимидазол-1-илметил)-4-гидроксипиперидин-1-карбоксилат (26,7 г, 74,0 ммоль), полученный в примере 649, растворяли в 1,4-диоксане (200 мл). К раствору добавляли при охлаждении на бане со льдом гидрид натрия (3,6 г, 88,8 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение 8 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли ледяную воду и метиленхлорид с последующим энергичным перемешиванием. Осадки отфильтровывали, промывали водой и метанолом, сушили при пониженном давлении с получением твердого вещества (16,4 г). Затем фильтрат экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Органическую фазу концентрировали при пониженном давлении. Остаток кристаллизовали из метанола с получением твердого вещества (2,7 г). Твердые вещества объединяли с получением 1'-трет-бутоксикарбонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин] (19,1 г, выход 79%) в виде белого порошка.
Температура плавления 230-232°C.
Пример 653
Получение трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилата
Трет-бутил 4-{2-[4-(2-хлор-4-нитроимидазол-1-илметил)-4-гидроксипиперидин-1-ил]-2-оксоэтил}пиперазинкарбоксилат (2,58 г, 5,3 ммоль), полученный в примере 650, растворяли в диоксане (30 мл). К раствору добавляли при охлаждении на бане со льдом гидрид натрия (254 мг, 6,36 ммоль) с последующим перемешиванием при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли ледяную воду и этилацетат с последующим энергичным перемешиванием. Осадки отфильтровывали, промывали водой и этилацетатом и затем сушили при пониженном давлении с получением трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилата (996 мг, выход 42%) в виде белого порошка.
Температура плавления 211,0-213,0°C.
Используя соответствующие исходные вещества, получали соединение примера 654 способом, подобно описанному в примере 653.
Пример 654
2,3-Дигидро-6-нитро-1'-(4-трифторметилфенил)спиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]
Белый порошок, выход 79%
МС: 368(M+)
Температура плавления 249,2-250,1°C.
Пример 655
Получение 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетата
1'-Трет-бутоксикарбонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин] (42 г, 0,13 моль), полученный в примере 652, суспендировали в метиленхлориде (100 мл). К суспензии медленно добавляли при охлаждении на бане со льдом трифторуксусную кислоту (60 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток кристаллизовали из метанола. Твердые частицы отфильтровывали, промывали метанолом и этилацетатом и затем сушили при пониженном давлении с получением 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетата (43,6 г, выход 99%) в виде светло-коричневого порошка.
МС: 224(M+)
Температура плавления 196-198°C (разложение)
1H-ЯМР (ДМСО-d6) δ м.д.:
2,06-2,32 (4H, м), 3,12-3,35 (4H, м), 4,24 (2H, с), 8,21 (1H, с), 8,88 (2H, ушир.с).
Пример 656
Получение 1'-ацетил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (85,5 мг, 0,25 ммоль), полученный в примере 655, суспендировали в метиленхлориде (5 мл). К суспензии добавляли триэтиламин (74 мкл) и ацетилхлорид (20 мкл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли метанол и воду с последующим энергичным перемешиванием. Осадки отфильтровывали, промывали водой и изопропиловым эфиром и затем сушили при пониженном давлении с получением 1'-ацетил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (37,8 мг, выход 56%) в виде белого порошка.
МС: 266(M+)
Температура плавления 232,0-234,0°C.
Пример 657
Получение 1'-(4-трифторметилфенилацетил)-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (300 мг, 0,89 ммоль), полученный в примере 655, суспендировали в метиленхлориде (5 мл). К суспензии добавляли триэтиламин (0,4 мл, 2,66 ммоль) и (α,α,α-трифтор-п-толил)ацетилхлорид (2,7 мл, 1,33 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь выливали в насыщенный раствор гидрокарбоната натрия и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 1'-(4-трифторметилфенилацетил)-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (143 мг, выход 39%) в виде белого порошка.
МС: 410(M+)
Температура плавления 185,0-187,0°C.
Пример 658
Получение 1'-(3,4-дихлорфеноксиацетил)-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (300 мг, 0,89 ммоль), полученный в примере 655, (3,4-дихлорфенил)уксусную кислоту (294 мг, 1,24 ммоль) и WSCD (255 мг, 1,24 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли воду и диэтиловый эфир с последующим энергичным перемешиванием. Осадки отфильтровывали, промывали водой и диэтиловым эфиром и затем сушили при пониженном давлении с получением 1'-(3,4-дихлорфеноксиацетил)-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (96 мг, выход 25%) в виде белого порошка.
Температура плавления 218,0-220,0°C.
Пример 659
Получение 2,3-дигидро-1'-метил-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин] (250 мг, 1,12 ммоль), полученный нейтрализацией 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетата, полученного в примере 655, суспендировали в метаноле (5 мл). К суспензии добавляли 37% раствор формальдегида (0,25 мл, 3,35 ммоль), цианотригидроборат натрия (210 мг, 3,35 ммоль) и уксусную кислоту (0,19 мл, 3,35 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь выливали в насыщенный раствор гидрокарбоната натрия и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом натрия и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 2,3-дигидро-1'-метил-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (160 мг, выход 60%) в виде белого порошка.
МС: 238(M+)
Температура плавления 237,0-239,0°C (разложение).
Пример 660
Получение 1'-бензолсульфонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (197 мг, 0,88 ммоль), полученный в примере 655, суспендировали в метиленхлориде (5 мл). К суспензии добавляли триэтиламин (0,36 мл, 2,64 ммоль) и бензолсульфонилхлорид (0,28 мл, 2,10 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси добавляли диизопропиловый эфир и воду с последующим энергичным перемешиванием. Осадки отфильтровывали, промывали водой и диизопропиловым эфиром и затем сушили при пониженном давлении с получением 1'-бензолсульфонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (210 мг, выход 66%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,99-2,18 (4H, м), 2,49-2,63 (2H, м), 3,40-3,54 (2H, м), 4,10 (2H, с), 7,65-7,81 (5H, м), 8,21 (1H, с).
Используя соответствующие исходные вещества, получали соединение примера 661 способом, подобно описанному в примере 660.
Пример 661
1'-Метансульфонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]
1H-ЯМР (ДМСО-d6) δ м.д.:
1,98-2,22 (4H, м), 2,94 (3H, с), 3,04-3,13 (2H, м), 3,43-3,51 (2H, м), 4,16 (2H, с), 8,17 (1H, с).
Пример 662
Получение 1'-бензилоксикарбонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (250 мг, 0,74 ммоль), полученный в примере 655, суспендировали в метиленхлориде (5 мл). К суспензии добавляли триэтиламин (0,40 мл, 2,96 ммоль) и бензилхлорформиат (0,32 мл, 2,22 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 1'-бензилоксикарбонил-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (224 мг, выход 84%) в виде белого порошка.
Температура плавления 175,0-177,0°C.
Пример 663
Получение 1'-(4-трифторметилбензилоксикарбонил)-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина]
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (33 г, 97,6 ммоль), полученный в примере 655, суспендировали в ДМФА (200 мл). К суспензии добавляли триэтиламин (20 мл, 0,15 моль) с последующим перемешиванием. К раствору добавляли смесь 4-трифторметилбензилового спирта (25,8 г, 0,15 моль), 1,1'-карбонилдиимидазола (23,7 г, 0,15 моль) и ДМФА (100 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при 70°С в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и осадки отфильтровывали. Осадки очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=10/1) и перекристаллизовывали из смеси этилацетат-изопропиловый эфир с получением 1'-(4-трифторметилбензилоксикарбонил)-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидина] (37,2 г, выход 90%) в виде белого порошка.
Температура плавления 189-190°C.
Используя соответствующие исходные вещества, получали соединения примеров 664 и 665 способом, подобно описанному в примере 663.
Пример 664
1'-[(4-Трифторметокси)бензилоксикарбонил]-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]
1H-ЯМР (CDCl3) δ м.д.:
1,80-1,93 (2H, м), 2,13-2,19 (2H, м), 3,32-3,42 (2H, м), 4,00-4,20 (2H, м), 4,03 (2H, с), 5,14 (2H, с), 7,20-7,23 (2H, м), 7,38-7,46 (2H, м), 7,54 (1H, с).
Пример 665
1'-(4-Формиламинобензилоксикарбонил)-2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]
1H-ЯМР (ДМСО-d6) δ м.д.:
1,85-2,10 (4H, м), 3,15-3,40 (2H, м), 3,65-3,85 (2H, м), 4,16 (2H, с), 5,03 (2H, с), 7,33 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц), 8,15 (1H, с), 8,27 (1H, с).
Пример 667
Получение фениламида 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (100 мг, 0,30 ммоль), полученный в примере 655, суспендировали в ДМФА (5 мл). К суспензии добавляли триэтиламин (43 мкл, 0,31 ммоль) и фенилизоцианат (34 мкл, 0,31 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду с последующим перемешиванием и осадки отфильтровывали. Осадки очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1), перекристаллизовывали из этилацетата и отфильтровывали с получением фениламида 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты (90 мг, выход 88%) в виде белого порошка.
МС: 343(M+)
Температура плавления 229-232°C (разложение).
Используя пиридин 4-изоцианат или бензилизоцианат, получали соединения примеров 668 и 669 способом, подобно описанному в примере 667.
Пример 668
4-Пиридинамид 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты
Температура плавления 217-219°C.
Пример 669
Бензиламид 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты
Температура плавления 244-247°C (разложение).
Пример 670
Получение трет-бутил 4-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илкарбонил)пиперазин-1-карбоксилата
Трифосген (227 мг, 0,77 ммоль) растворяли в толуоле (10 мл). К раствору добавляли трет-бутилпиперазин-1-карбоксилат (425 мг, 2,28 ммоль) и диизопропилэтиламин (0,4 мл, 2,28 ммоль) с последующим перемешиванием в течение 1 часа при охлаждении на бане со льдом. К раствору добавляли 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (700 мг, 2,07 ммоль), полученный в примере 655. Раствор перемешивали при комнатной температуре в течение 1 часа и затем перемешивали при кипячении с обратным холодильником в течение 1 часа. Реакционную смесь выливали в воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/ацетон=10/1) и затем кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением трет-бутил 4-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илкарбонил)пиперазин-1-карбоксилата (342 мг, выход 38%) в виде белого порошка.
Температура плавления 260,0-265,0°C (разложение).
1H-ЯМР (CDCl3) δ м.д.:
1,47 (9H, с), 1,90-2,02 (2H, м), 2,10-2,16 (2H, м), 3,23-3,47 (10H, м), 3,60-3,66 (2H, м), 3,96 (2H, с), 7,54 (1H, с).
Используя 4-трифторметилбензилпиперазин-1-карбоксилат или 1-(4-трифторметилбензил)пиперазин, получали соединения примеров 671 и 672 способом, подобно описанному в примере 670.
Пример 671
4-Трифторметилбензил 4-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илкарбонил)пиперазин-1-карбоксилат
Температура плавления 221-223°C.
Пример 672
1-(2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илкарбонил)-4-(4-трифторметилбензил)пиперазин
Температура плавления 226-230°C (разложение).
Пример 673
Получение 4-(диметиламино)фениламида 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (200 мг, 0,59 ммоль), полученный в примере 655, суспендировали в ДМФА (5 мл). К суспензии добавляли триэтиламин (0,1 мл, 0,72 ммоль) с последующим перемешиванием. К раствору добавляли смесь N,N-диметил-п-фенилендиамина (132 мг, 0,98 ммоль), 1,1'-карбонилдиимидазола (82,7 мг, 1,02 ммоль) и ДМФА (5 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду с последующим перемешиванием и осадки отфильтровывали. Осадки очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из этилацетата с получением 4-(диметиламино)фениламида 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты (181 мг, выход 79%) в виде белого порошка.
МС 386(M+)
Температура плавления 244-247°C (разложение).
Используя 4-трифторметилбензиламин или 4-трифторметоксибензиламин, получали соединения примеров 674 и 675 способом, подобно описанному в примере 673.
Пример 674
4-Трифторметилбензиламид 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты
Температура плавления 215-217°C.
Пример 675
4-Трифторметоксибензиламид 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карбоновой кислоты
Температура плавления 223-225°C.
Пример 676
Получение 4-хлорфениламида 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карботиокислоты
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (200 мг, 0,59 ммоль), полученный в примере 655, суспендировали в ДМФА (5 мл). К суспензии добавляли триэтиламин (0,24 мл, 1,77 ммоль) и 4-хлорфенилизотиоцианат (200 мг, 1,18 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду с последующим перемешиванием и осадки отфильтровывали, очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 4-хлорфениламида 2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-карботиокислоты (222 мг, выход 87%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,02-2,19 (4H, м), 3,59-3,69 (2H, м), 4,19 (2H, с), 4,40-4,54 (2H, м), 7,30-7,37 (4H, м), 8,18 (1H, с), 9,48 (1H, с).
Пример 677
Получение 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илкарбонил]аминобензойной кислоты
Трет-бутил 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илкарбонил]аминобензоат (150 мг, 0,68 ммоль) растворяли в метиленхлориде (1 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток кристаллизовали из смеси метанол-этилацетат с получением 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илкарбонил]аминобензойной кислоты (59 мг, выход 45%) в виде белого порошка.
Температура плавления >300°C.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,92-2,12 (4H, м), 3,32-3,39 (2H, м), 3,86-3,95 (2H, м), 4,17 (2H, с), 7,45 (2H, д, J=8,8 Гц), 7,82 (2H, д, J=8,8 Гц), 8,17 (1H, с), 8,97 (1H, с), 12,54 (1H, с).
Пример 678
Получение 2-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-ил]бензотиазола
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (84 мг, 0,25 ммоль), полученный в примере 655, суспендировали в ДМФА (3 мл). К суспензии добавляли триэтиламин (76 мкл, 0,55 ммоль) и 2-хлорбензотиазол (40 мкл, 0,30 ммоль) с последующим перемешиванием при 80°С в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и осадок отфильтровывали, кристаллизовали из смеси метиленхлорид-метанол с получением 2-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-ил]бензотиазола (55 мг, выход 62%) в виде белого порошка.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,05-2,23 (4H, м), 3,52-3,63 (2H, м), 3,89-3,97 (2H, м), 4,18 (2H, с), 7,05-7,12 (1H, м), 7,26-7,32 (1H, м), 7,46-7,49 (1H, м), 7,76-7,80 (1H, м), 8,18 (1H, с).
Используя 5-хлор-1-фенил-1H-тетразол, получали соединение примера 679 способом, подобно описанному в примере 678.
Пример 679
5-[(2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-ил]-1-фенил-1H-тетразол
1H-ЯМР (ДМСО-d6) δ м.д.:
2,05-2,09, (4H, м), 3,24-3,40 (4H, м), 4,14 (2H, с), 7,59-7,72 (5H, м), 8,15 (1H, с).
Пример 680
Получение трет-бутил 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илацетил]пиперазин-1-карбоксилата
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (700 мг, 2,07 ммоль), полученный в примере 655, суспендировали в ДМФА (20 мл). К суспензии добавляли трет-бутил 4-(хлорацетил)пиперазин-1-карбоксилат (599 мг, 2,28 ммоль), N,N-диизопропилэтиламин (0,8 мл, 4,57 ммоль) и иодид натрия (310 мг, 2,07 ммоль) с последующим перемешиванием при 100°С в течение 3 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли этилацетат и воду с последующим энергичным перемешиванием. Осадки отфильтровывали, промывали водой и этилацетатом и затем сушили при пониженном давлении с получением трет-бутил 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илацетил]пиперазин-1-карбоксилата (688 мг, выход 74%) в виде белого порошка.
Температура плавления >300°C.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,41 (9H, с), 1,95-2,01 (4H, м), 2,43-2,64 (4H, м), 3,21 (2H, с), 3,26-3,42 (6H, м), 3,50-3,52 (2H, м), 4,12 (2H, с), 8,14 (1H, с).
Используя 2-хлор-N-(4-трифторметилфенил)ацетамид или 3-(3-хлорпропил)-3H-бензоксазол-2-он, получали соединения примеров 681 и 682 способом, подобно описанному в примере 680.
Пример 681
(4-Трифторметилфенил)амид (2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илуксусной кислоты
Температура плавления 273-275°C (разложение).
Пример 682
3-[3-(2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-ил]пропил-3H-бензоксазол-2-он
Температура плавления 190-192°C.
Пример 683
Получение трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илэтил]пиперазин-1-карбоксилата
2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]трифторацетат (200 мг, 0,59 ммоль), полученный в примере 655, суспендировали в ДМФА (5 мл). К суспензии добавляли трет-бутил 4-(2-хлорэтил)пиперазин-1-карбоксилат (150 мг, 0,60 ммоль), триэтиламин (0,25 мл, 1,79 ммоль) и иодид натрия (108 мг, 0,72 ммоль) с последующим перемешиванием при 50°С в течение 5 часов. Реакционной смеси давали остыть до комнатной температуры. К раствору добавляли этилацетат и воду с последующим энергичным перемешиванием. Осадки отфильтровывали, промывали водой и этилацетатом и затем сушили при пониженном давлении с получением трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илэтил]пиперазин-1-карбоксилата (80 мг, выход 31%) в виде белого порошка.
Температура плавления 214-215°C.
Пример 684
Получение 4-трифторметилбензил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилата
Трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилат (300 мг, 0,67 ммоль), полученный в примере 653, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли метиленхлорид (1 мл) и триэтиламин (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 минут, концентрировали при пониженном давлении и остаток растворяли в ДМФА (15 мл). К раствору добавляли смесь 4-трифторметилбензилового спирта (293 мг, 1,67 ммоль), 1,1'-карбонилдиимидазола (270 мг, 1,67 ммоль) и ДМФА (5 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь выливали в воду, экстрагировали этилацетатом, органическую фазу промывали насыщенным раствором соли и сушили над сульфатом магния. После фильтрования полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением 4-трифторметилбензил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилата (324 мг, выход 88%) в виде светло-розового порошка.
МС 553(M+H)+
Температура плавления 139,0-141,0°C.
Используя соответствующие исходные вещества, получали соединение примера 685 способом, подобно описанному в примере 684.
Пример 685
4-Трифторметоксибензил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилат
Температура плавления 137-139°C.
Используя трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илэтил]пиперазин-1-карбоксилат, полученный в примере 683, получали соединения примеров 686-689 способом, подобно описанному в примере 684.
Пример 686
4-Хлорбензил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илэтил]пиперазин-1-карбоксилат
Температура плавления 178-179°C.
Пример 687
4-Трифторметилбензил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илэтил]пиперазин-1-карбоксилат
Температура плавления 174-175°C.
Пример 688
4-Трифторметоксибензил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илэтил]пиперазин-1-карбоксилат
Температура плавления 176-177°C.
Пример 689
Бифенил-4-илметил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илэтил]пиперазин-1-карбоксилат
1H-ЯМР (CDCl3) δ м.д.:
1,90-2,05 (2H, м), 2,15-2,20 (2H, м), 2,40-2,80 (12H, м), 3,45-3,60 (4H, м), 3,99 (2H, с), 5,17 (2H, с), 7,31-7,62 (10H, м).
Используя трет-бутил 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илацетил)пиперазин-1-карбоксилат, полученный в примере 680, получали соединение примера 690 способом, подобно описанному в примере 684.
Пример 690
4-Трифторметилбензил 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-илацетил]пиперазин-1-карбоксилат
Температура плавления 137-139°C.
Пример 691
Получение 1-((2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-ил)-2-[4-(4-трифторметилбензил)пиперазин-1-ил]этанона
Трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилат (300 мг, 0,67 ммоль), полученный в примере 653, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (10 мл) с последующим перемешиванием при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении. К раствору добавляли метиленхлорид (1 мл) и триэтиламин (1 мл) с последующим перемешиванием при комнатной температуре в течение 5 минут. Раствор концентрировали при пониженном давлении и остаток растворяли в метаноле (10 мл). К раствору добавляли при охлаждении на бане со льдом 4-трифторметилбензальдегид (0,23 мл, 1,67 ммоль), цианотригидроборат натрия (105 мг, 1,67 ммоль) и уксусную кислоту (0,1 мл) с последующим перемешиванием при комнатной температуре в течение ночи. К раствору добавляли насыщенный водный раствор гидрокарбоната натрия и метиленхлорид с последующим перемешиванием. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=50/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 1-((2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин])-1'-ил)-2-[4-(4-трифторметилбензил)пиперазин-1-ил]этанона (226 мг, выход 67%) в виде белого порошка.
МС 508(M)+
Температура плавления 145-147°C.
Используя соответствующие исходные вещества, получали соединение примера 692 способом, подобно описанному в примере 691.
Пример 692
1-(2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-[(4-фенилбензил)пиперазин-1-ил]этанон
Температура плавления 187-188°C.
Используя трет-бутил 4-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илацетил)пиперазин-1-карбоксилат, полученный в примере 680, получали соединения примеров 693 и 694 способом, подобно описанному в примере 691.
Пример 693
1-(2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илацетил)-4-(4-трифторметилбензил)пиперазин
Температура плавления 195-197°C (разложение).
Пример 694
1-(2,3-Дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-илацетил)-4-(4-фенилбензил)пиперазин
Температура плавления 226-227°C (разложение).
Пример 695
Получение (4-трифторметилфенил)амида 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоновой кислоты
Трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилат (300 мг, 0,67 ммоль), полученный в примере 653, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (10 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. К раствору добавляли метиленхлорид (1 мл) и триэтиламин (1 мл) с последующим перемешиванием при комнатной температуре в течение 5 минут. Раствор концентрировали при пониженном давлении и остаток растворяли в ДМФА (10 мл). К раствору добавляли смесь 4-аминобензотрифторида (0,17 мл, 1,33 ммоль) и 1,1'-карбонилдиимидазола (220 мг, 1,33 ммоль) и ДМФА (5 мл), перемешанную при комнатной температуре в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду, экстрагировали этилацетатом и органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=200/1) и кристаллизовали из смеси метиленхлорид-изопропиловый эфир с получением (4-трифторметилфенил)амида 4-[(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоновой кислоты (213 мг, выход 59%) в виде белого порошка.
Температура плавления 153,0-155,0°C.
Пример 696
Получение 2-{4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-ил}-N-(4-трифторметилфенил)ацетамида
Трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилат (300 мг, 0,67 ммоль), полученный в примере 653, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (10 мл) с последующим перемешиванием при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли метиленхлорид (1 мл) и триэтиламин (1 мл) с последующим перемешиванием при комнатной температуре в течение 5 минут и затем раствор концентрировали при пониженном давлении. Остаток растворяли в ДМФА (10 мл). К раствору добавляли 2-бром-N-(4-трифторметилфенил)ацетамид (207 мг, 0,73 ммоль) и триэтиламин (0,28 мл, 2,0 ммоль) с последующим перемешиванием при 100°С в течение 2 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении, остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=100/1) и кристаллизовали из смеси метиленхлорид-диизопропиловый эфир с получением 2-{4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-ил}-N-[4-трифторметилфенил]ацетамида (275 мг, выход 75%) в виде белого порошка.
МС 552(M+1)+
Температура плавления 133,0-135,0°C.
Пример 697
Получение 2-[4-(бензоксазол-2-ил)пиперазин-1-ил]-1-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)этанона
Трет-бутил 4-[2-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)-2-оксоэтил]пиперазин-1-карбоксилат (227 мг, 0,50 ммоль), полученный в примере 653, растворяли в метиленхлориде (5 мл). К раствору добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли метиленхлорид (1 мл) и триэтиламин (1 мл) с последующим перемешиванием при комнатной температуре в течение 5 минут и затем раствор концентрировали при пониженном давлении. Остаток растворяли в ДМФА (5 мл). К раствору добавляли триэтиламин (0,21 мл, 1,52 ммоль) и 2-хлорбензоксазол (86 мкл, 0,76 ммоль) с последующим перемешиванием при 80°С в течение 2 часов. К реакционной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органическую фазу сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении. Остаток кристаллизовали из смеси метиленхлорид-этилацетат с получением 2-[4-(бензоксазол-2-ил)пиперазин-1-ил]-1-(2,3-дигидро-6-нитроспиро[имидазо[2,1-b]оксазол-2,4'-пиперидин]-1'-ил)этанона (99 мг, 42%) в виде светло-желтого порошка.
МС 467(M+)
Температура плавления 260,0-263,0°C (разложение).
Соединения, полученные из соответствующих исходных веществ способами, подобно описанным выше в примерах 1-697, показаны в следующих таблицах 26-77.
Таблица 26
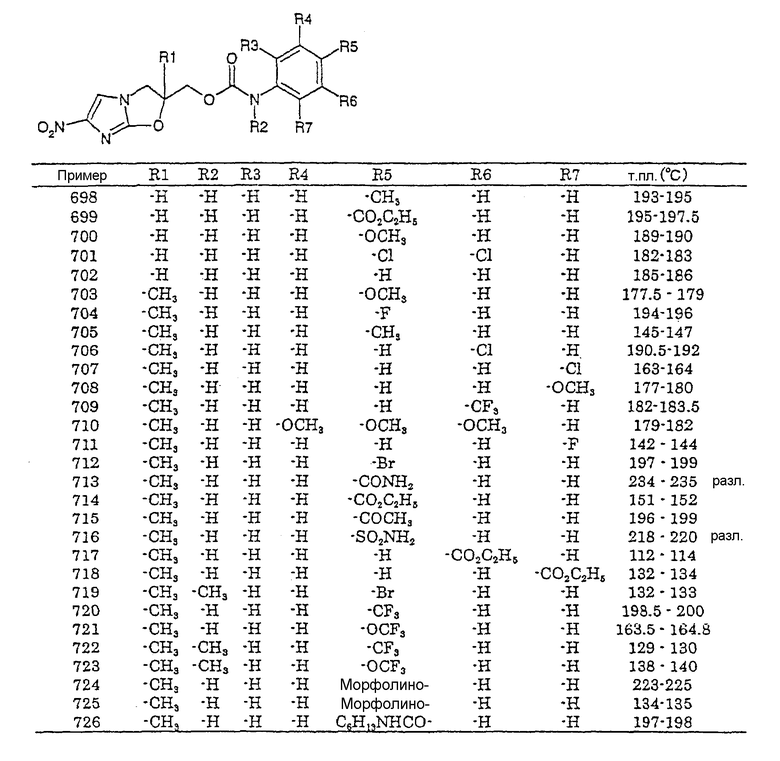
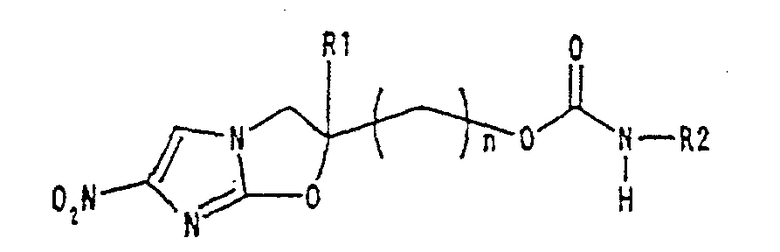
Таблица 28

Таблица 29

Таблица 30
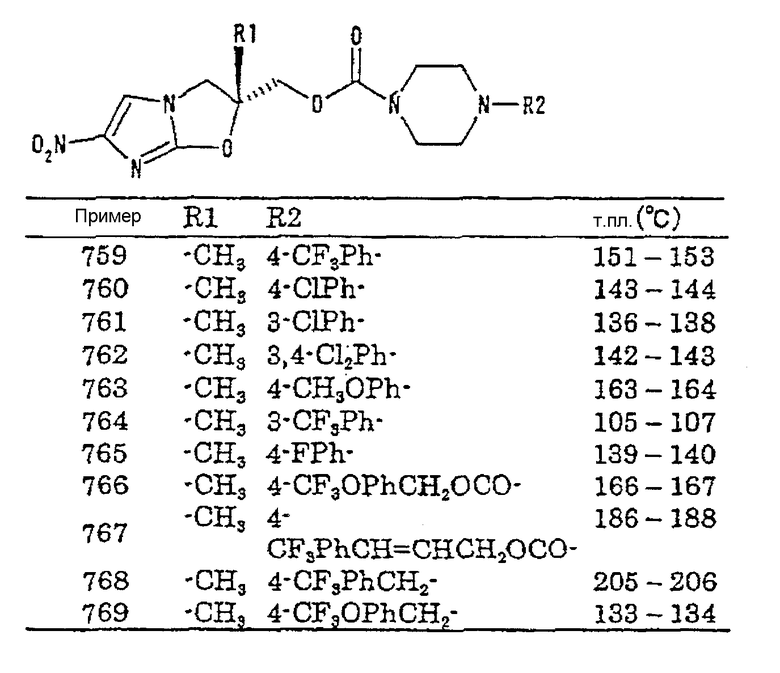

Таблица 32





Таблица 38

Таблица 39


Таблица 41

Таблица 43

Таблица 44


Таблица 46
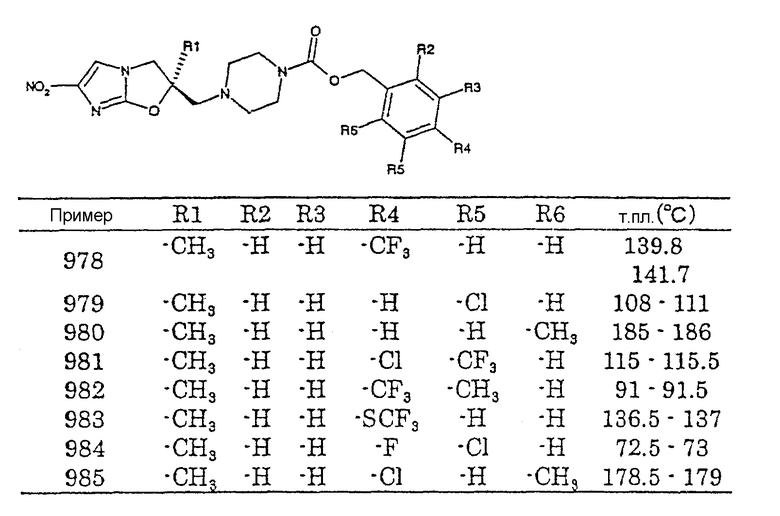

Таблица 48

Таблица 49

Таблица 50

Таблица 51

Таблица 52

Таблица 53

Таблица 54

Таблица 55

Таблица 56

Таблица 57

Таблица 58

Таблица 59
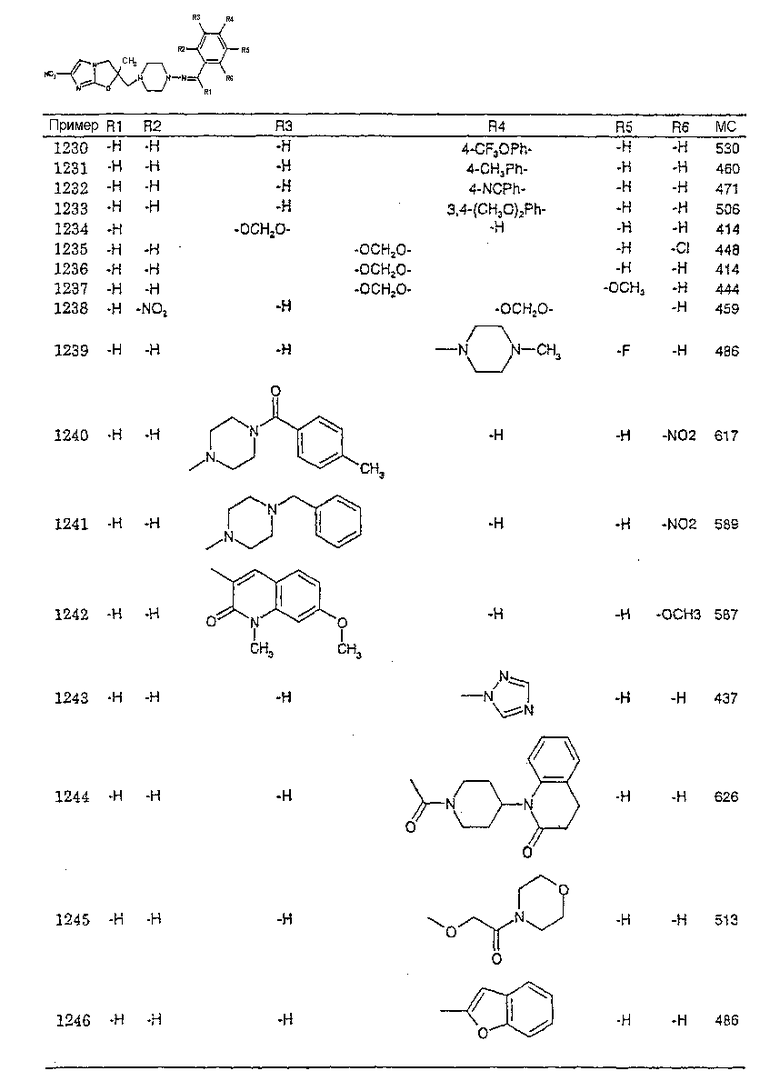
Таблица 60
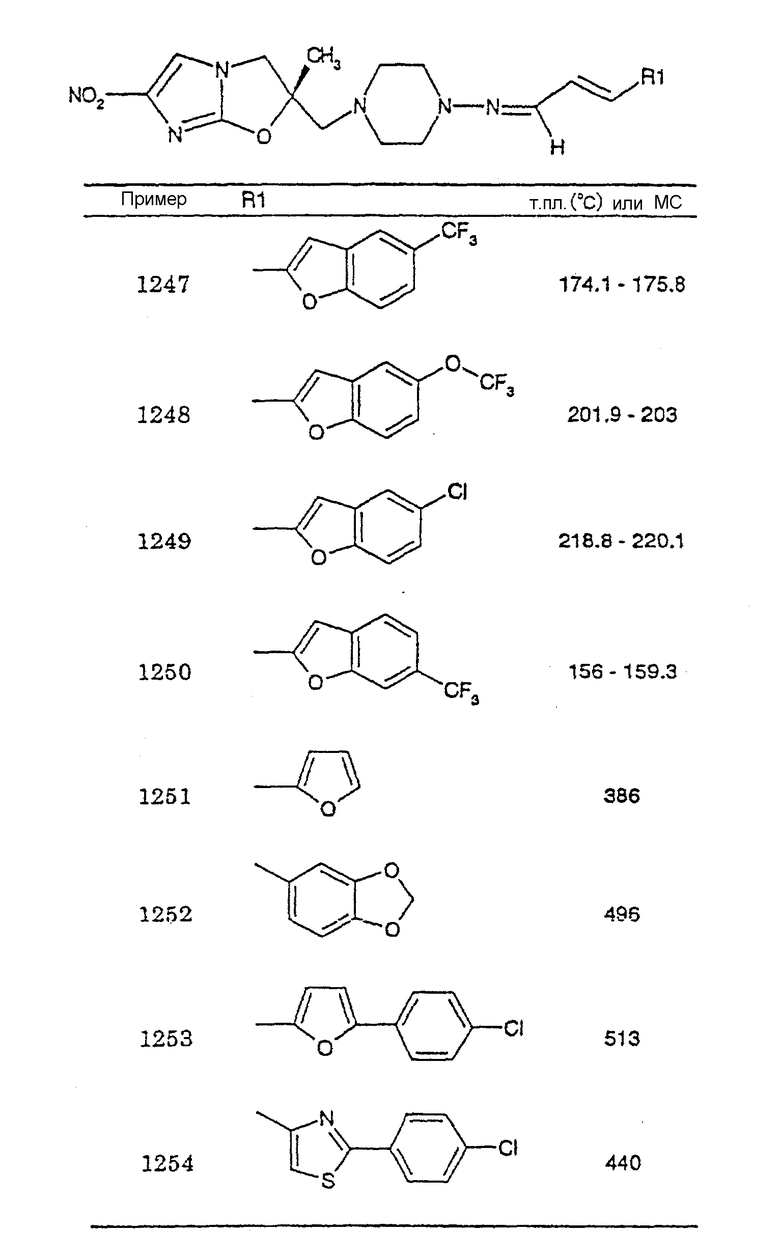
Таблица 61

Таблица 62
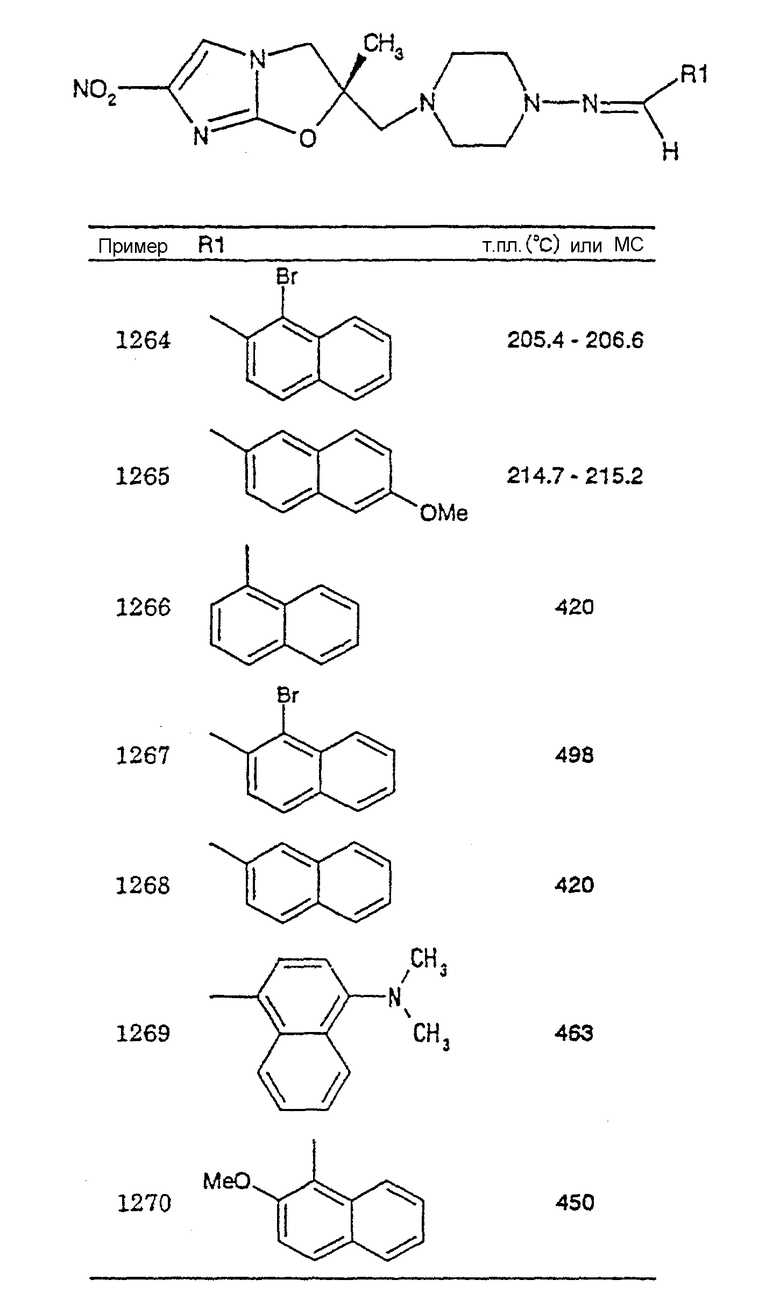
Таблица 63

Таблица 64

Таблица 65
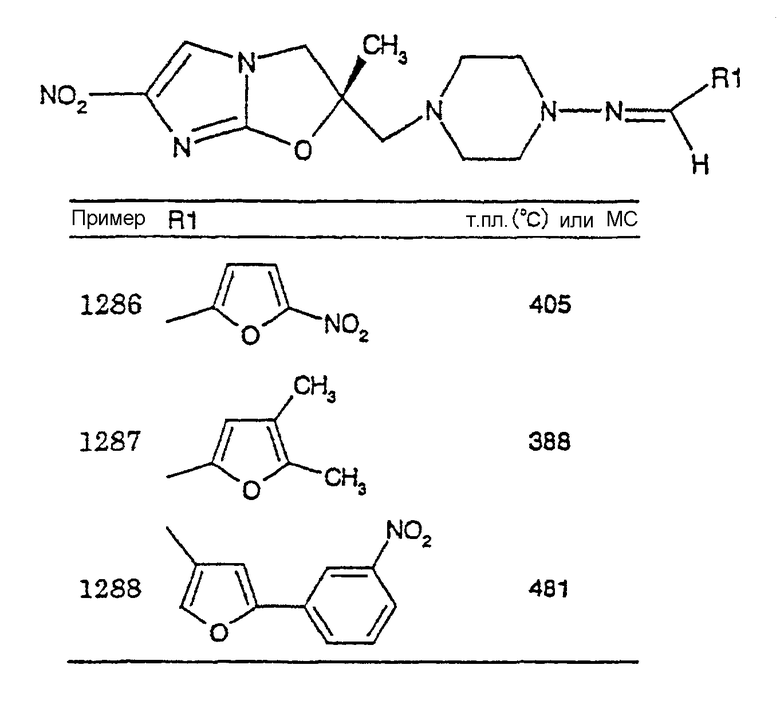
Таблица 66
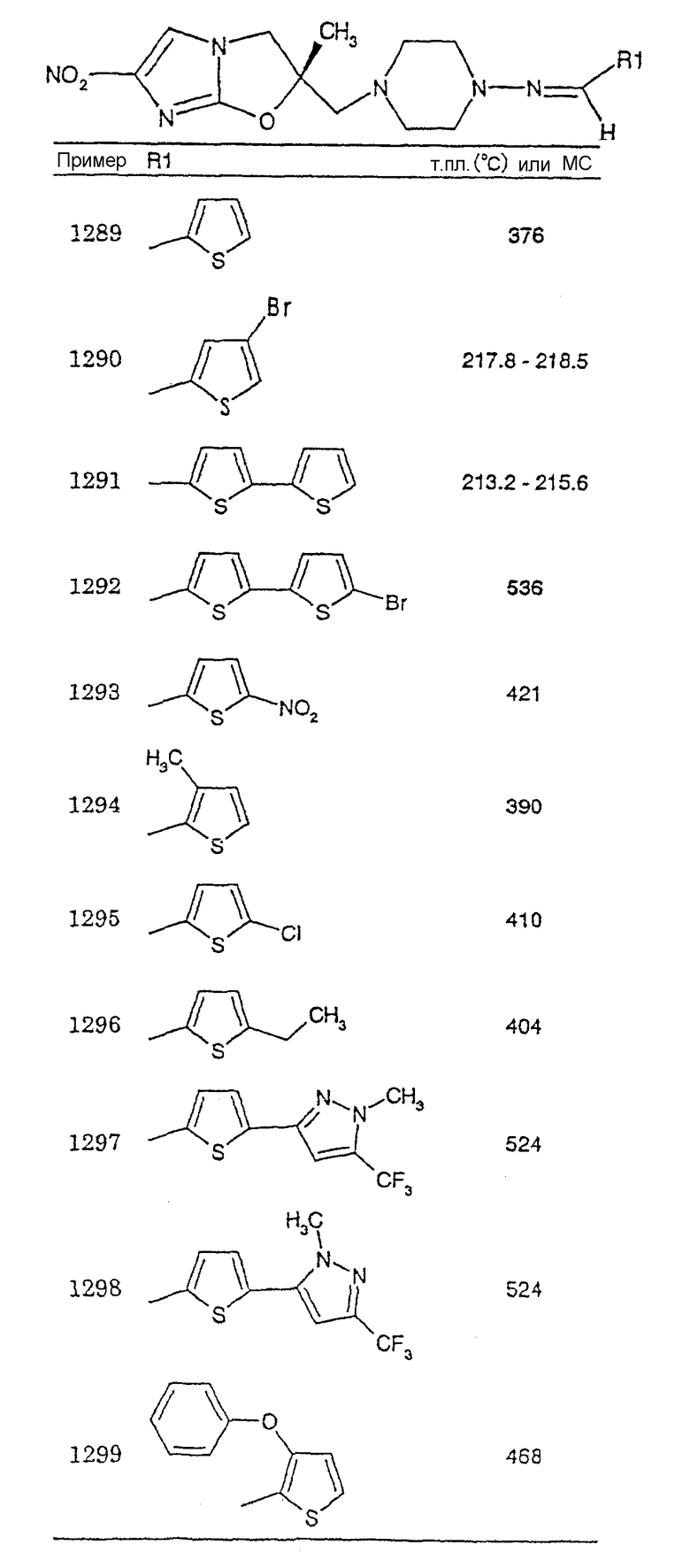
Таблица 67
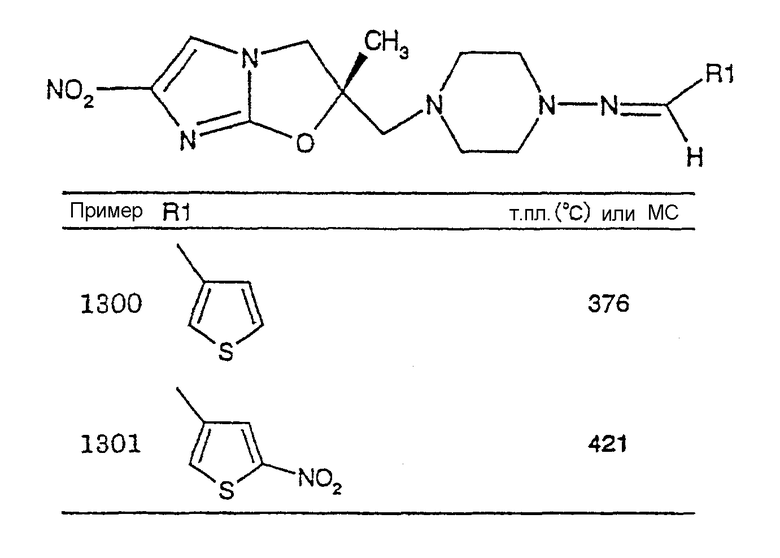
Таблица 68
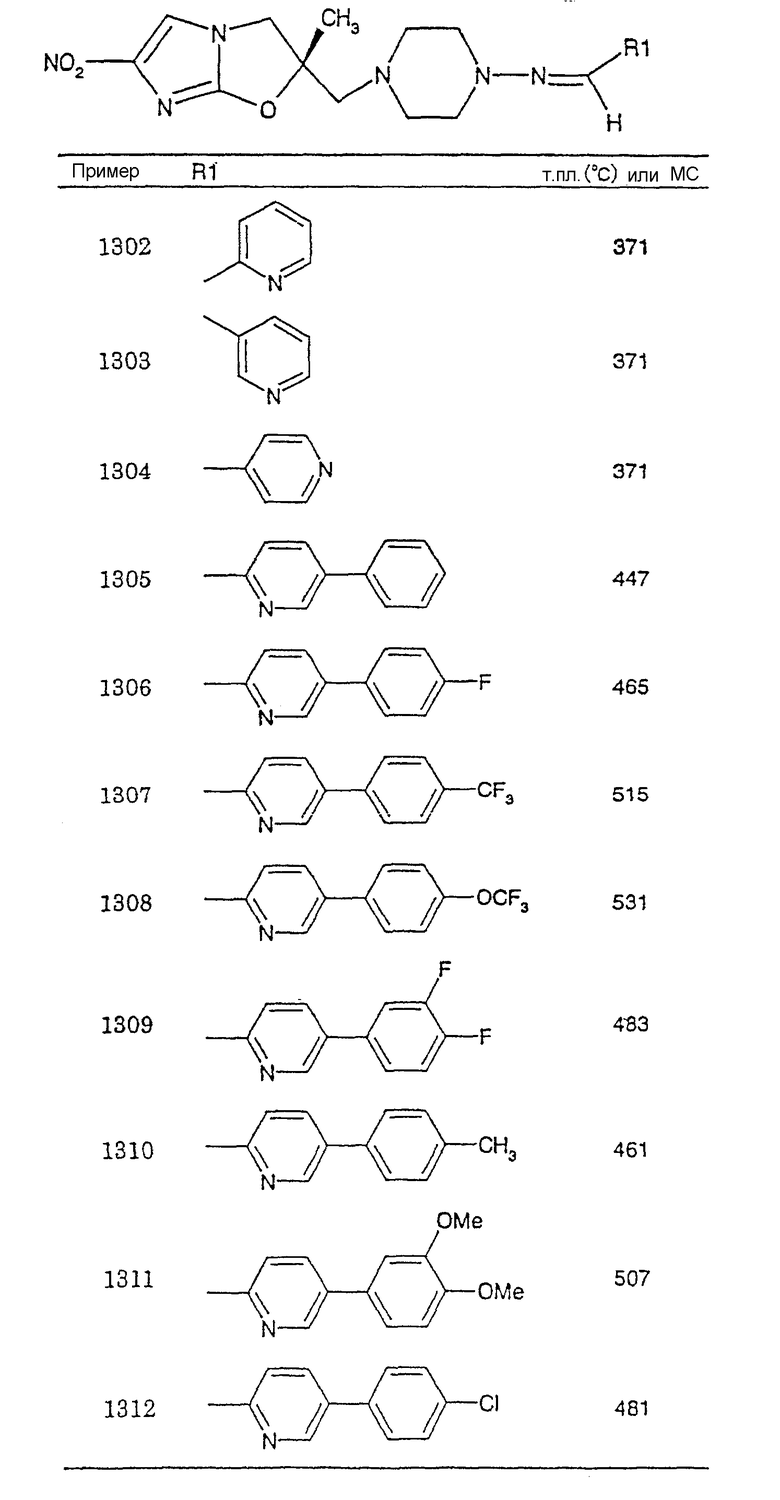
Таблица 69

Таблица 70

Таблица 71

Таблица 72

Таблица 73
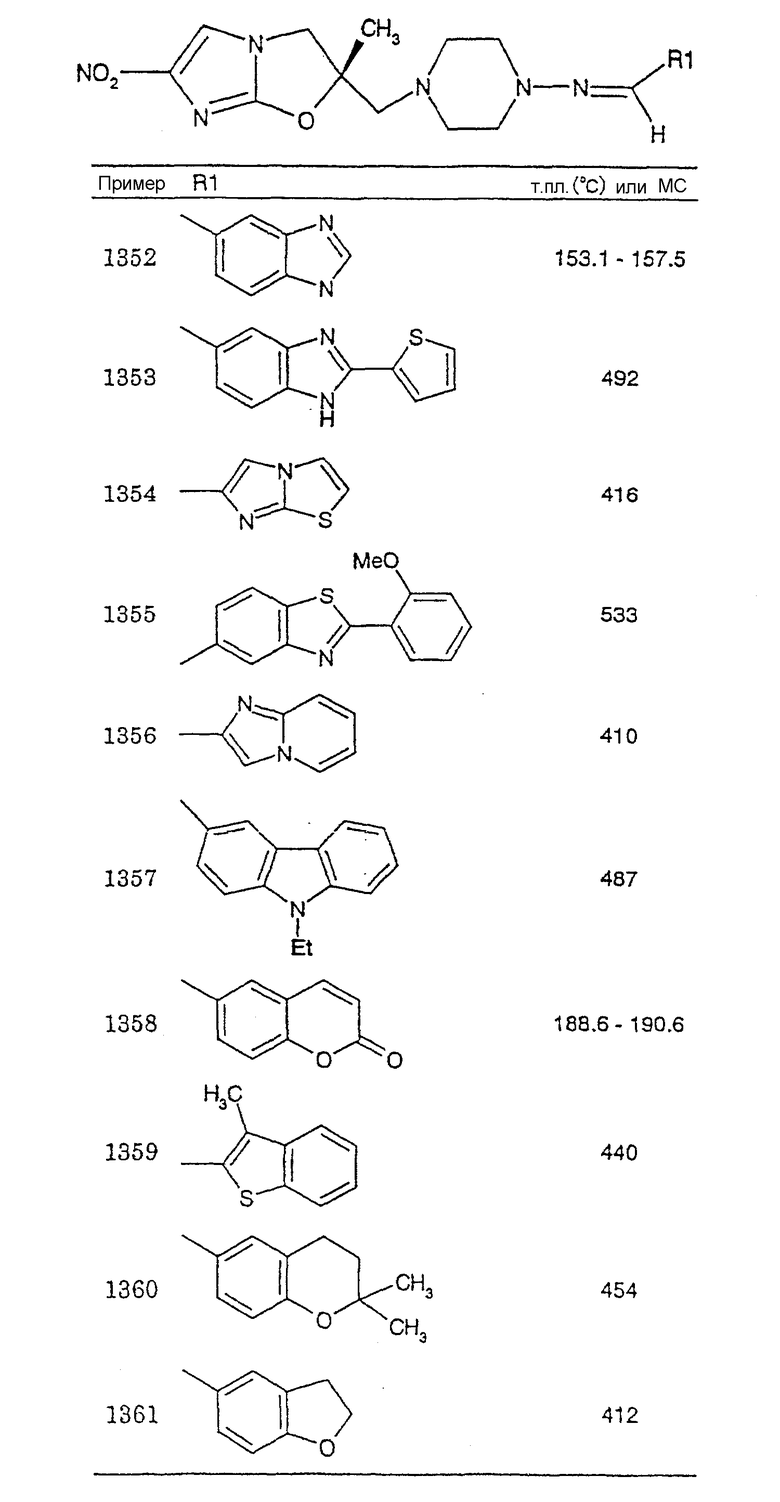
Таблица 74
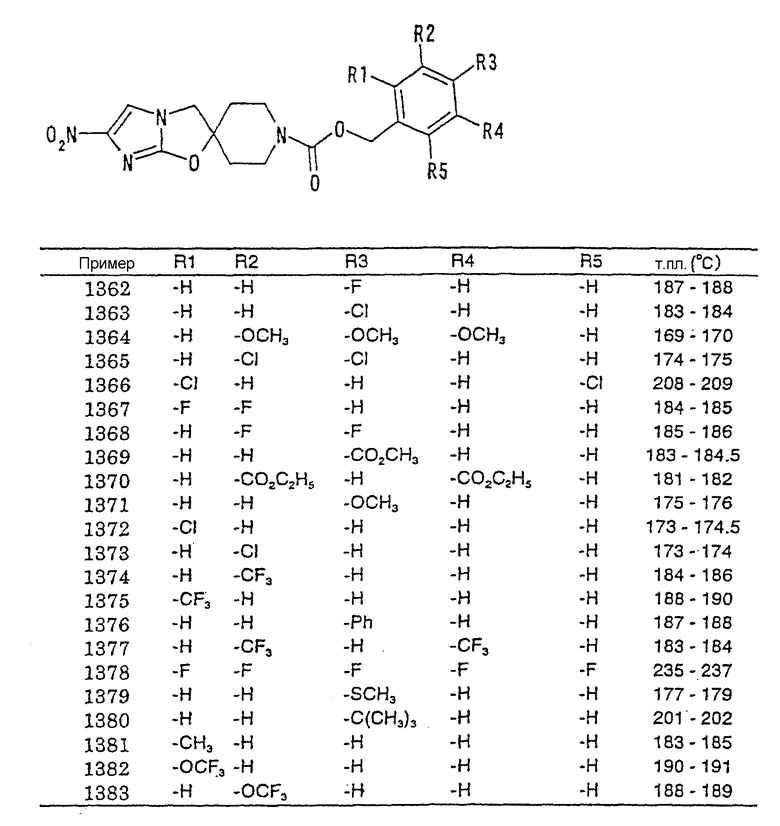
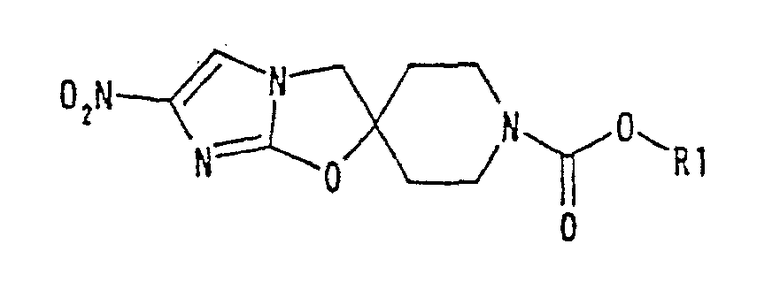


Таблица 76

Таблица 77
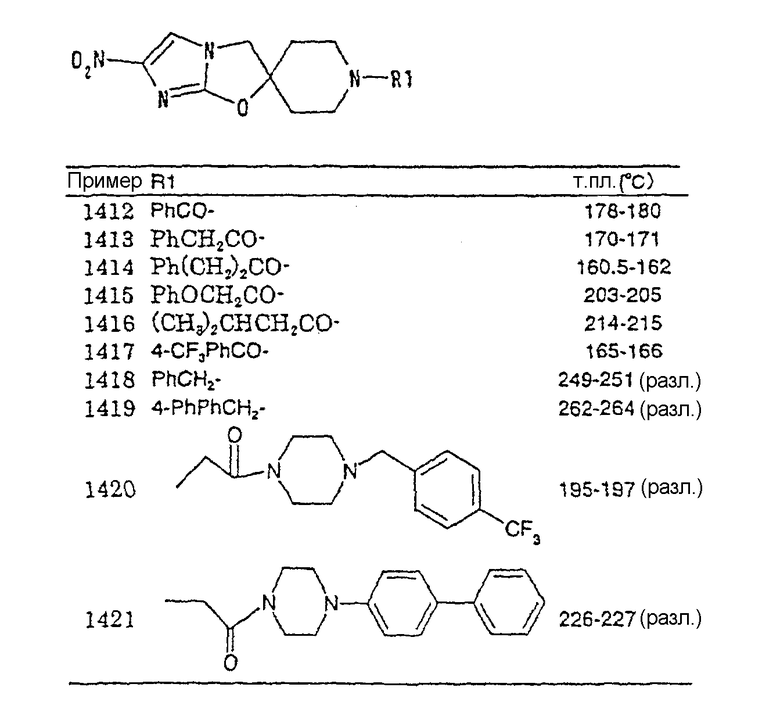
Пример 1422
Получение (S)-1-(2-бром-4-нитроимидазол-1-ил)-2-метил-3-{4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-ил}пропан-2-ола
Смесь (R)-2-бром-4-нитро-1-(2-метил-2-оксиранилметил)имидазола (485 мг, 1,75 ммоль), 1-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазина (720 мг, 2,19 ммоль) и этанола (10 мл) перемешивали при 50°С в течение 8 часов. Реакционную смесь концентрировали и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=20/1) с получением (S)-1-(2-бром-4-нитроимидазол-1-ил)-2-метил-3-{4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-ил}пропан-2-ола (792 мг, выход 77%) в виде желтой аморфной формы.
1H-ЯМР (CDCl3) δ м.д.:
1,13 (3H, с), 1,50-1,75 (2H, м), 1,81-2,00 (2H, м), 2,35 (1H, д, J=13,9 Гц), 2,40-2,86 (12H, м), 3,57-3,76 (2H, м), 3,98 (2H, с), 6,89 (2H, д, J=8,5 Гц), 7,09 (2H, д, J=8,5 Гц), 8,12 (1H, с).
Следующие соединения получали таким же образом.
Пример 1423
Трет-бутил (S)-4-{4-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-ил}пиперидин-1-карбоксилат
1H-ЯМР (CDCl3) δ м.д.:
1,12 (3H, с), 1,29-1,48 (11H, м), 1,67-1,81 (2H, м), 2,34 (1H, д, J=13,8 Гц), 2,38-2,74 (12H, м), 3,97 (2H, с), 4,02-4,14 (2H, м), 8,05 (1H, с).
Пример 1424
Трет-бутил (S)-4-{1-[3-(2-хлор-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперидин-4-ил}пиперазин-1-карбоксилат
1H-ЯМР (CDCl3) δ м.д.:
1,11 (3H, с), 1,38-1,57 (11H, м), 1,69-1,86 (2H, м), 2,24-2,50 (9H, м), 2,67-2,79 (1H, м), 2,86-3,00 (1H, м), 3,31-3,43 (4H, м), 3,95 (2H, с), 8,04 (1H, с).
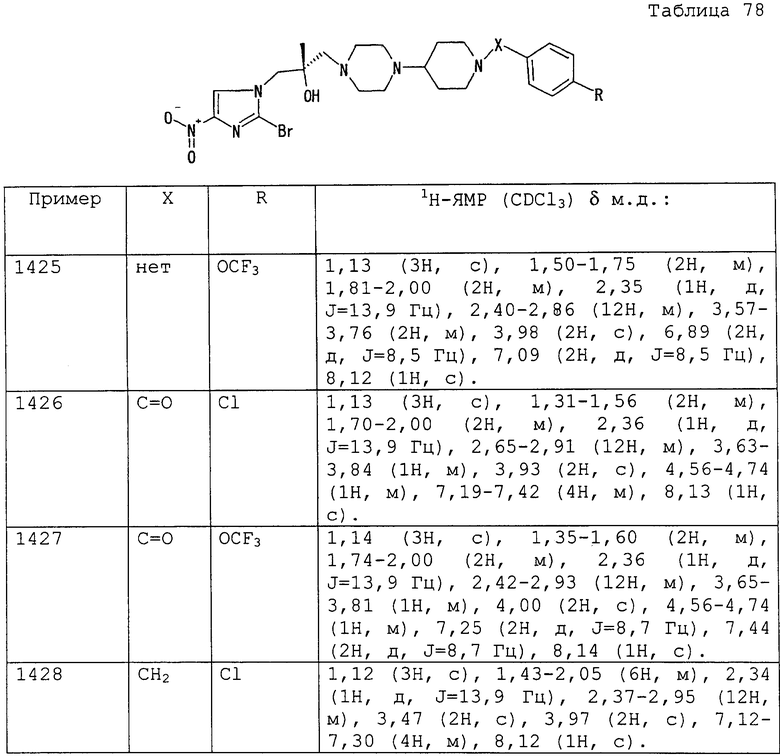
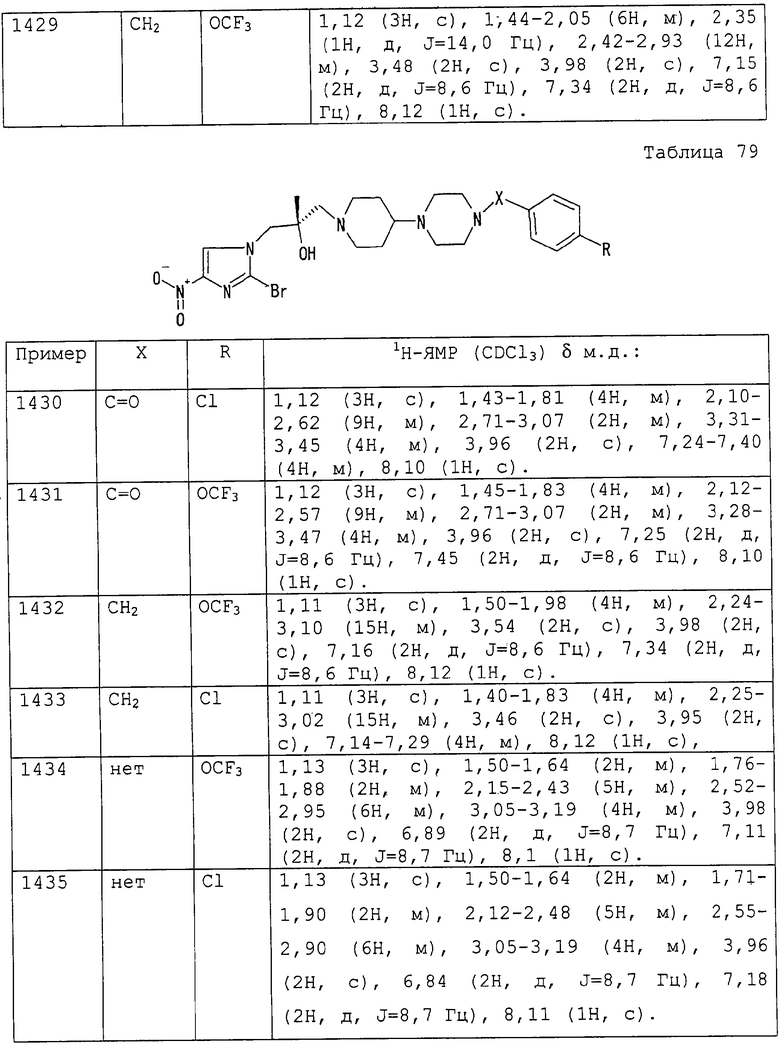
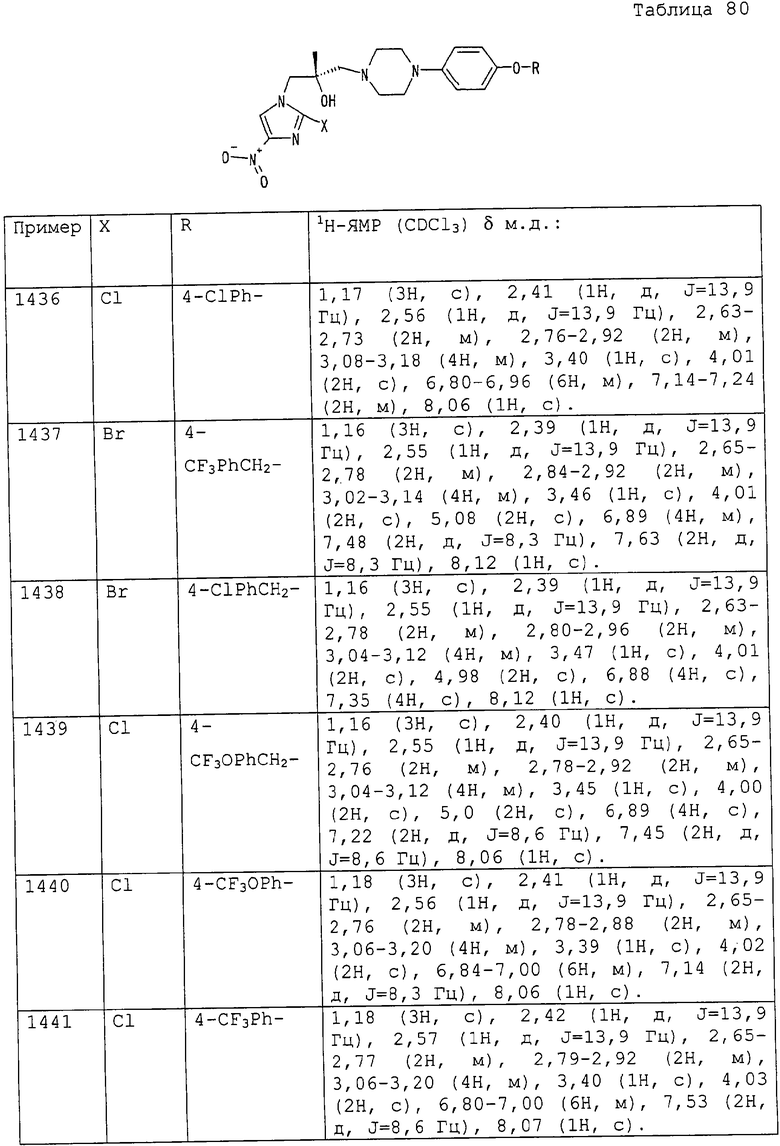





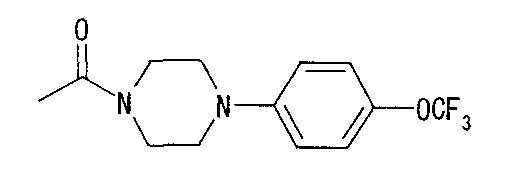







Пример 1454
Получение (S)-2-метил-6-нитро-2-{4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазола
(S)-1-(2-бром-4-нитроимидазол-1-ил)-2-метил-3-{4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-ил}пропан-2-ол (790 мг, 1,34 ммоль) растворяли в N,N-диметилформамиде (4 мл), добавляли при охлаждении на льду гидрид натрия (69 мг, 1,74 ммоль) и раствор перемешивали при той же температуре в течение 1 часа. К реакционной смеси добавляли этилацетат (1,3 мл) и воду (10 мл) в указанном порядке, выпавшие в осадок кристаллы отфильтровывали и промывали водой. Кристаллы очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) и перекристаллизовывали из смеси этилацетат-изопропиловый эфир с получением (S)-2-метил-6-нитро-2-{4-[1-(4-трифторметоксифенил)пиперидин-4-ил]пиперазин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазола (270 мг, выход 40%) в виде белого порошка.
Температура плавления 180-181,5°C.
Следующие соединения получали таким же образом.
Пример 1455
(S)-2-{4-[4-(4-хлорфенил)пиперазин-1-ил]пиперидин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 34%
Температура плавления 226-228°C.
Пример 1456
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенил)пиперазин-1-ил]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазол
Выход 23%
Температура плавления 193-194°C.
Пример 1457
(S)-2-{4-[4-(4-хлорбензил)пиперазин-1-ил]пиперидин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 25%
Температура плавления 148-149°C.
Пример 1458
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]пиперидин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазол
Выход 21%
Температура плавления 142-143°C.
Пример 1459
(S)-(4-хлорфенил)-{4-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]пиперазин-1-ил}метанон
Выход 29%
Температура плавления 174-175°C.
Пример 1460
(S)-{4-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]пиперазин-1-ил}-(4-трифторметоксифенил)метанон
Выход 29%
Температура плавления 137-138°C.
Пример 1461
(S)-2-{4-[1-(4-хлорбензил)пиперидин-4-ил]пиперазин-1-илметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол
Выход 24%
Температура плавления 168-169°C.
Пример 1462
(S)-2-метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)пиперидин-4-ил]пиперазин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазол
Выход 27%
Температура плавления 140-141°C.
Пример 1463
(S)-(4-хлорфенил)-{4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-ил}метанон
Выход 30%
Температура плавления 218-220°C.
Пример 1464
(S)-{4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-ил}-(4-трифторметоксифенил)метанон
Выход 27%
Температура плавления 133-134°C.
Пример 1465
(S)-1'-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)-4-(4-трифторметоксифенокси)-[1,4']бипиперидинил
Выход 41%
Температура плавления 131-132°C.
Пример 1466
Получение трет-бутил (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-карбоксилата
Смесь (R)-2-хлор-4-нитро-1-(2-метил-2-оксиранилметил)имидазола (3 г, 13,79 ммоль), трет-бутил 4-пиперазин-1-илпиперидин-1-карбоксилата (3,9 г, 14,48 ммоль) и этанола (30 мл) перемешивали при 50°С в течение 9 часов. Реакционную смесь концентрировали и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1 с получением желтой аморфной формы. Аморфную форму растворяли в N,N-диметилформамиде (18 мл), добавляли гидрид натрия (651 мг, 16,28 ммоль) при охлаждении на льду и полученный раствор перемешивали при той же температуре в течение 1 часа. К реакционной смеси добавляли этилацетат (6 мл) и воду (42 мл) в указанном порядке, выпавшие кристаллы отфильтровывали и промывали водой. Фильтрат перекристаллизовывали из смеси 2-пропанол (20 мл)-вода (60 мл) с получением трет-бутил (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-карбоксилата (4,08 г, 66%) в виде светло-желтого порошка.
Температура плавления 181-182°C.
Следующее соединение получали таким же образом.
Пример 1467
Трет-бутил (S)-4-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]пиперазин-1-карбоксилат
Выход 56%
Температура плавления 184-185°C.
Пример 1468
Получение 4-трифторметоксибензил (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-карбоксилата
Смесь 4-(трифторметокси)бензилового спирта (480 мг, 2,50 ммоль), 1,1'-карбонилбис-1H-имидазола (405 мг, 2,50 ммоль) и N,N-диметилформамида (3 мл) перемешивали при комнатной температуре в течение 14 часов.
Тем временем трет-бутил (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-карбоксилат (750 мг, 1,66 ммоль) растворяли в метиленхлориде (5 мл), добавляли трифторуксусную кислоту (5 мл) и полученный раствор перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь концентрировали. К остатку добавляли метанол (5 мл) и триэтиламин (5 мл), смесь перемешивали при комнатной температуре в течение 10 минут и затем концентрировали. Остаток растворяли в N,N-диметилформамиде (5 мл). Раствор добавляли к описанному выше N,N-диметилформамидному раствору с последующим перемешиванием при 50°С в течение 3 часов.
Реакционной смеси давали остыть до комнатной температуры, выливали в воду (40 мл) и экстрагировали этилацетатом (30 мл) два раза. Органические фазы объединяли, промывали водой (40 мл) два раза, затем насыщенным раствором соли (30 мл) и затем сушили над сульфатом натрия. После фильтрования фильтрат концентрировали, остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) и затем перекристаллизовывали из смеси этилацетат-изопропиловый эфир с получением 4-трифторметоксибензил (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-карбоксилата (545 мг, 58%) в виде светло-коричневого порошка.
Температура плавления 105-106°C.
Следующее соединение получали таким же образом.
Пример 1469
4-Трифторметоксибензил (S)-4-[1-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперидин-4-ил]пиперазин-1-карбоксилат
Выход 64%
Температура плавления 110-111°C.
Пример 1470
Получение (S)-2-метил-6-нитро-2-[4-{1-[3-(4-трифторметоксифенил)-2-пропенил]пиперидин-4-ил}пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола
Трет-бутил (S)-4-[4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-ил]пиперидин-1-карбоксилат (750 мг, 1,66 ммоль) растворяли в метиленхлориде (5 мл), добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Реакционную смесь концентрировали. К остатку добавляли метиленхлорид (5 мл) и триэтиламин (5 мл), смесь перемешивали при комнатной температуре в течение 10 минут и затем концентрировали. Остаток растворяли в 1,2-дихлорэтане (20 мл), добавляли 3-(4-трифторметоксифенил)пропеналь (396 мг, 1,83 ммоль) и триацетоксиборогидрид натрия (564 мг, 2,66 ммоль) с последующим перемешиванием при комнатной температуре в течение 3,5 часов. Полученный раствор промывали насыщенным раствором гидрокарбоната натрия (15 мл), водой (20 мл) и насыщенным раствором соли (20 мл) в указанном порядке и затем сушили над сульфатом натрия. После фильтрования фильтрат концентрировали, остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/метанол=10/1) и затем перекристаллизовывали из смеси метанол-вода с получением (S)-2-метил-6-нитро-2-[4-{1-[3-(4-трифторметоксифенил)-2-пропенил]пиперидин-4-ил}пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазола (446 мг, 49%) в виде светло-желтого порошка.
Температура плавления 157-158°C.
Следующие соединения получали таким же образом.
Пример 1471
(S)-2-метил-6-нитро-2-[4-{4-[3-(4-трифторметоксифенил)-2-пропенил]пиперазин-1-ил}пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 174-175°C.
Пример 1472
4-толуолсульфонат (S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)фенил]пиперазин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазола
Температура плавления 146,1-148,6°C.
Пример 1473
Гидрохлорид (S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)фенил]пиперазин-1-илметил}-2,3-дигидроимидазо[2,1-b]оксазола
Температура плавления 133-137°C.





1,56-1,71 (7H, м), 2,16 (3H, м), 2,57 (1H, д, J=14,9 Гц), 2,76-3,10 (3H, м), 3,93 (1H, д, J=9,8 Гц), 4,36 (1H, д, J=9,8 Гц), 7,12 (2H, д, J=8,5 Гц), 7,55-7,68 (3H, м), 9,04 (1H, с).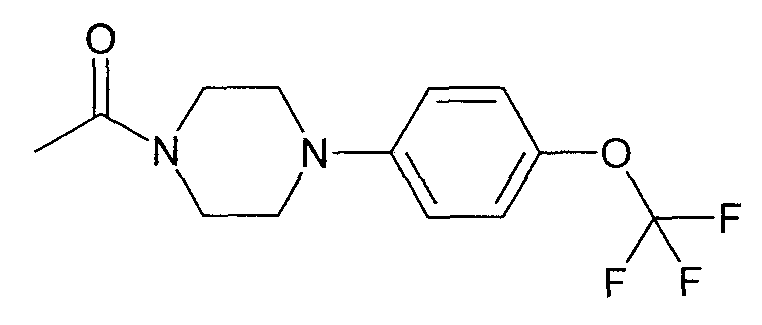
1,48-1,68 (4H, м), 1,75-1,95 (1H, м), 2,19-2,56 (4H, м), 2,75-3,19 (9H, м), 3,53-3,77 (4H, м), 3,88 (1H, д, J=9,7 Гц), 4,36 (1H, д, J=9,7 Гц), 6,89 (2H, д, J=8,5 Гц), 7,13 (2H, д, J=8,5 Гц), 7,68 (1H, с).
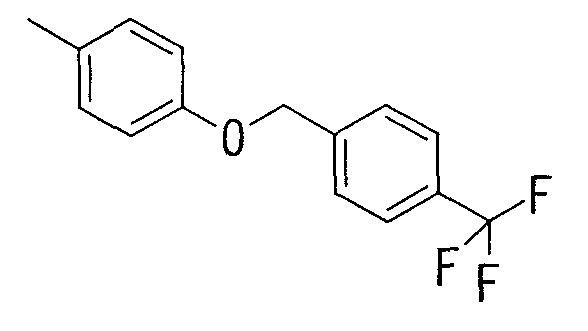




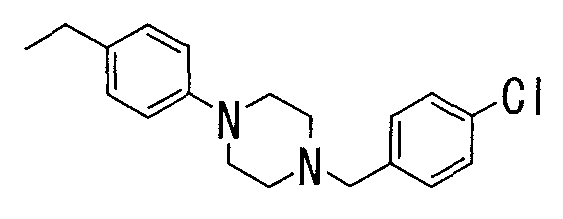
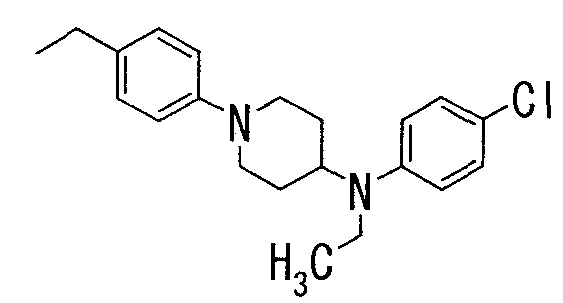
Следующие соединения получали способом, подобно описанному в примере 649.
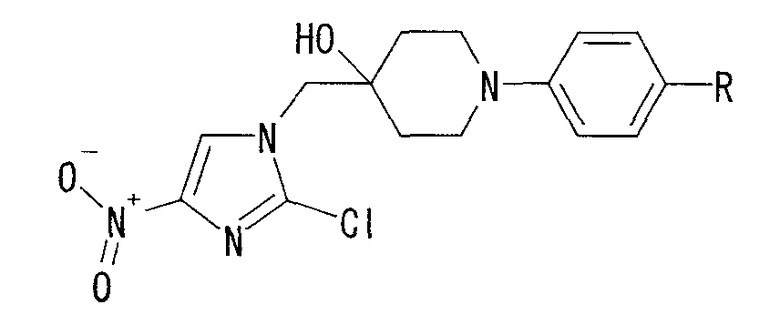



Следующие соединения получали способом, подобно описанному в примере 652.
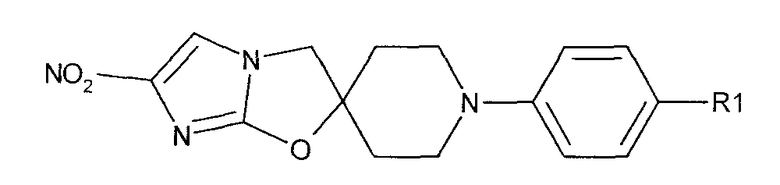



Следующие соединения получали способом, подобно описанному в примере 128.
Пример 1510
(R)-2-метил-6-нитро-2-{4-[1-(4-трифторметоксибензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 186-188°C.
Пример 1511
(R)-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 157-160°C.
Пример 1512
4-Толуолсульфонат (R)-2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3,2,1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
Температура плавления 207,2-208,0°C (разложение).
Пример 1513
2-Метил-6-нитро-2-[4-(4-трифторметоксифенокси)бензилоксиметил]-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 107,9-109,3°C.
Пример 1514
6-Нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 173,2-177,3°C.
Пример 1515
2-Метил-6-нитро-2-{4-[4-(4-хлорфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 151,0-152,3°C.
Пример 1516
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол
Температура плавления 199,0-200,5°C.
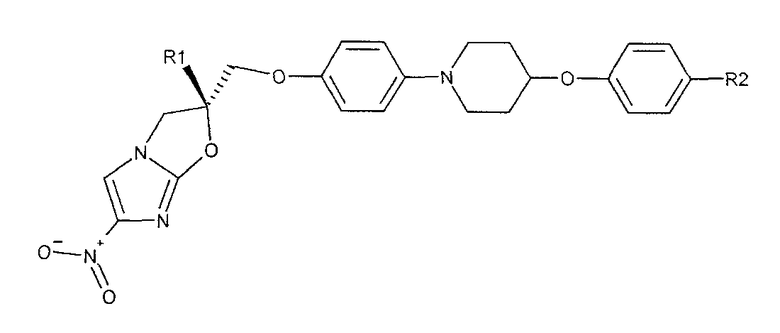


Таблица 94

Таблица 95
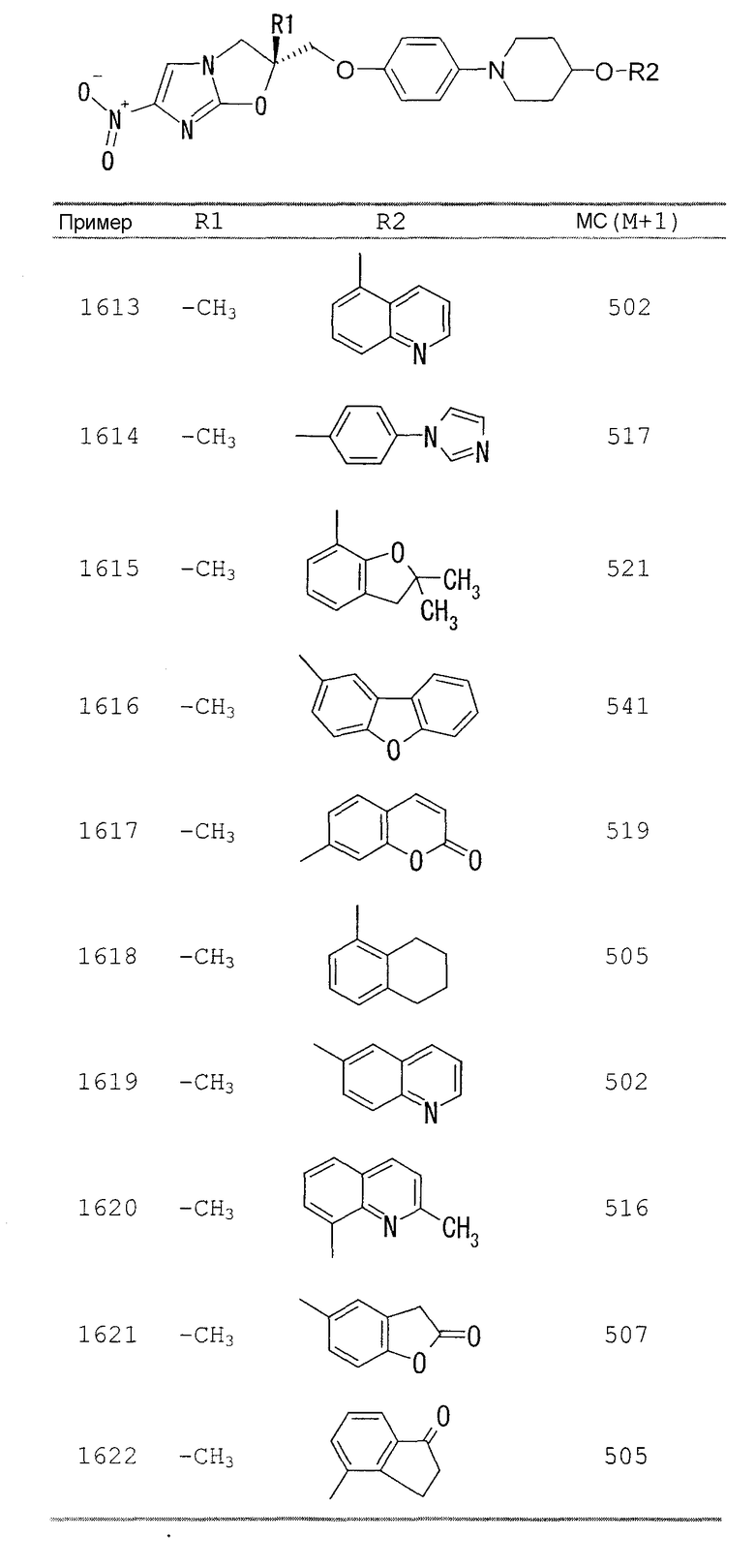
Таблица 96

Таблица 97

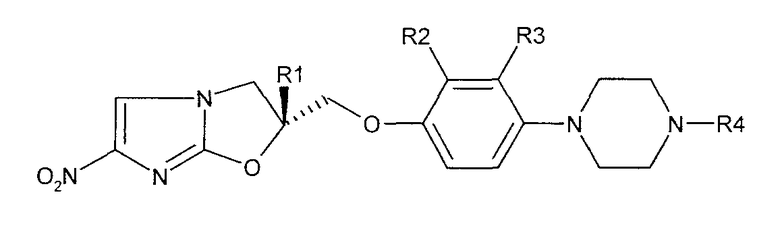
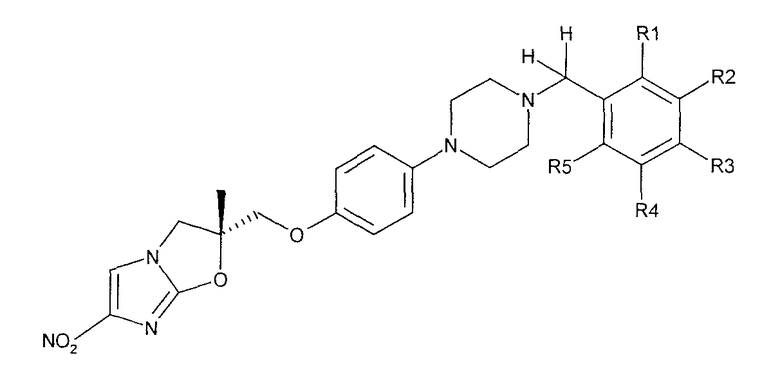
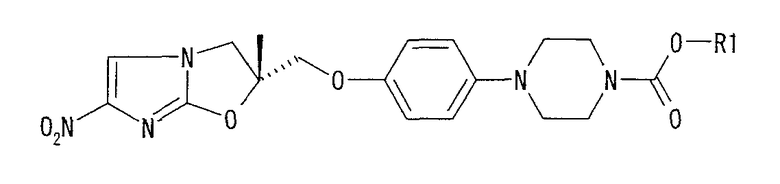
Таблица 101
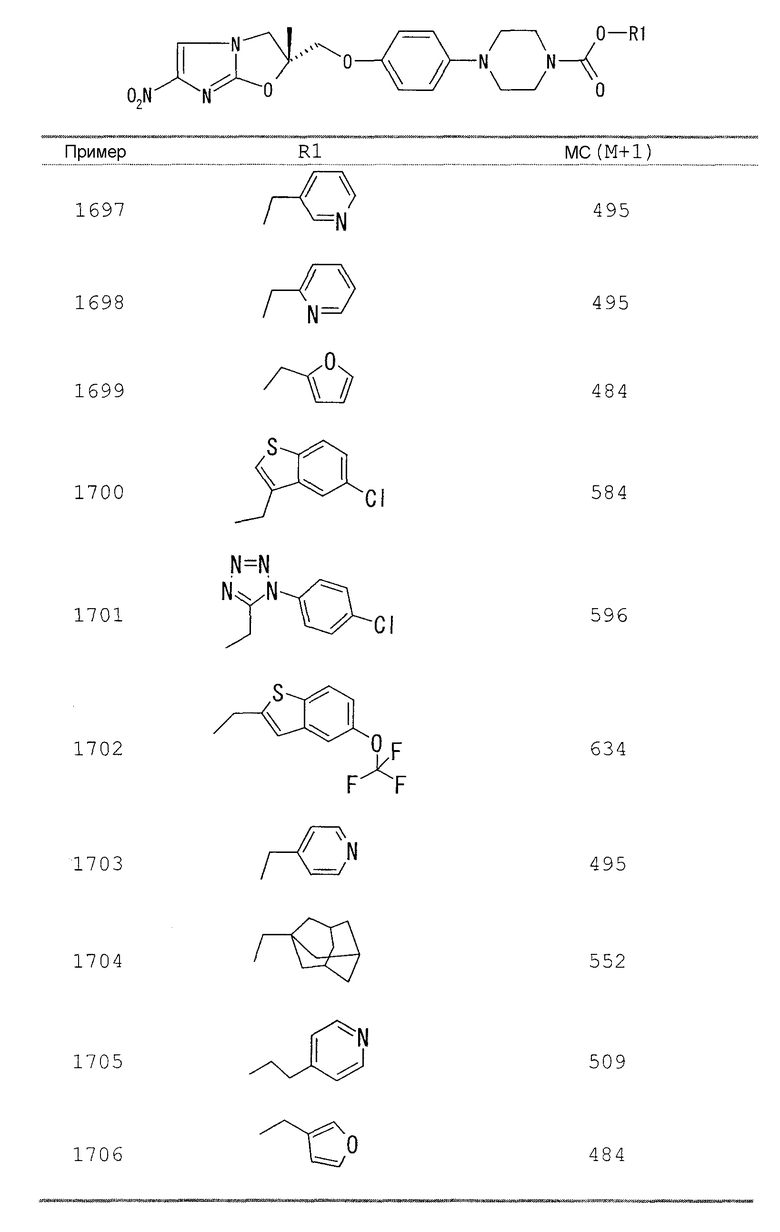
Таблица 102
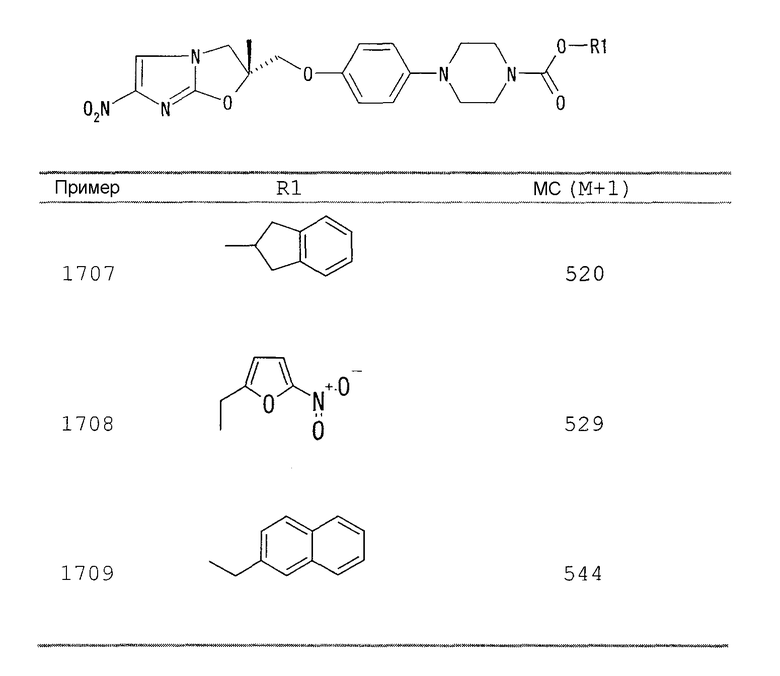
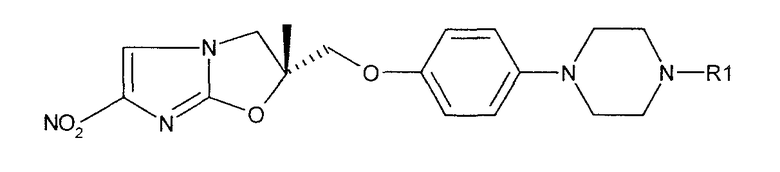


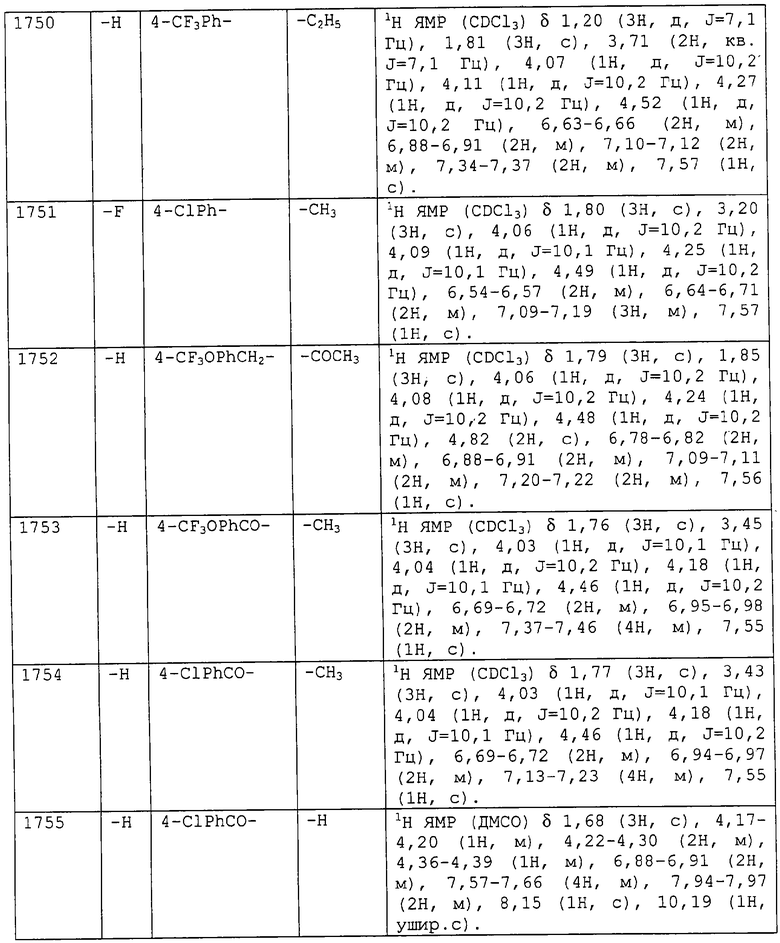
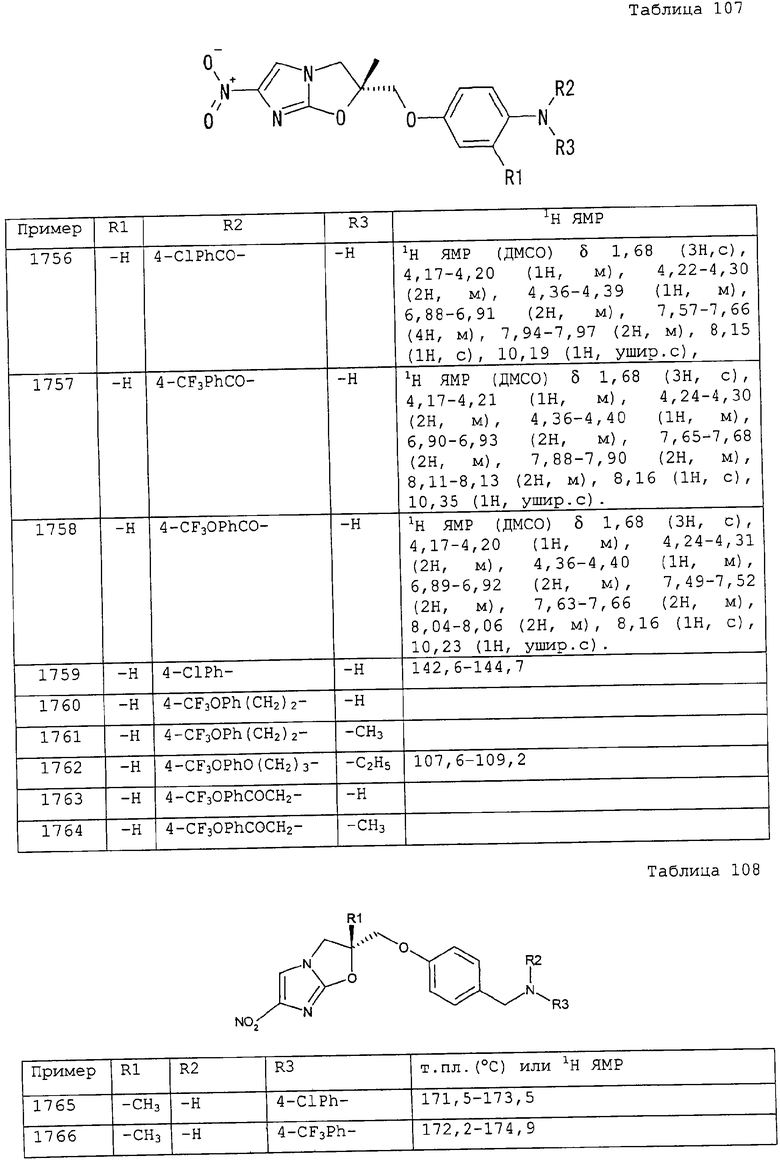
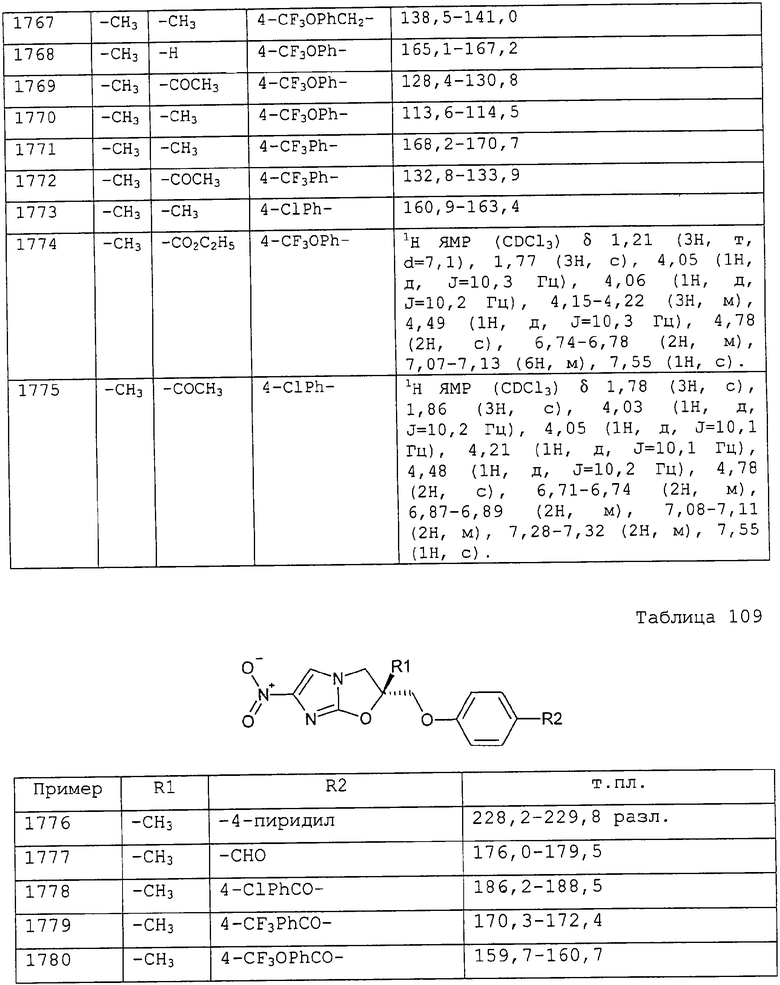

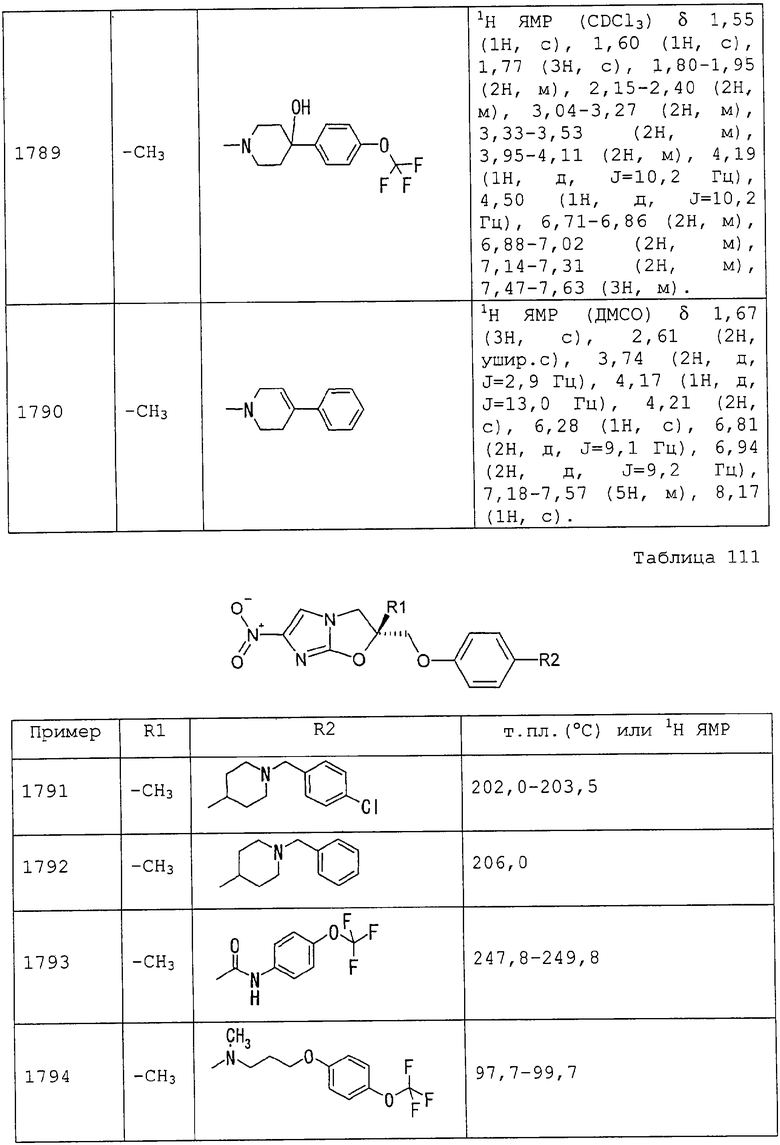

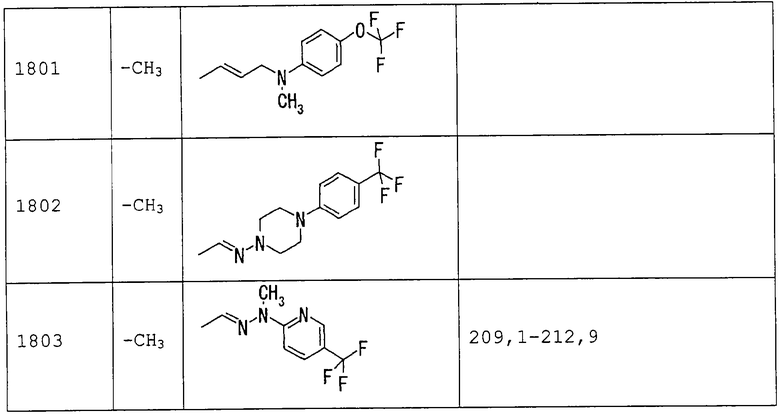


Таблица 115




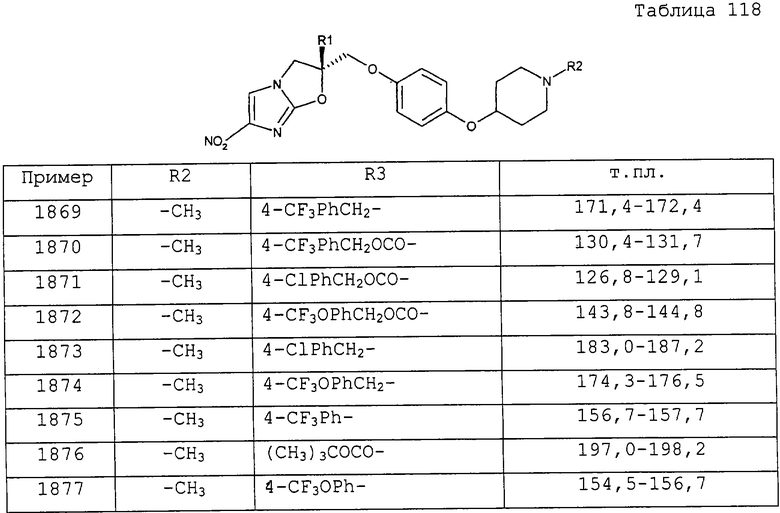

Пример 1884
Получение (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола
4-[4-(4-Трифторметоксифенокси)пиперидин-1-ил]фенол (693 мг, 1,96 ммоль) растворяли в N,N'-диметилформамиде (3 мл) и гидрид натрия (86 мг, 2,16 ммоль) добавляли при охлаждении на льду с последующим перемешиванием при 70-75°С в течение 20 минут. Смесь охлаждали на льду. К раствору добавляли раствор, полученный растворением (R)-2-бром-4-нитро-1-(2-метил-2-оксиранилметил)имидазола (720 мг, 2,75 ммоль) в N,N'-диметилформамиде (3 мл) с последующим перемешиванием при 70-75°С в течение 20 минут. Реакционной смеси давали остыть до комнатной температуры, добавляли ледяную воду (25 мл) и полученный раствор экстрагировали метиленхлоридом (50 мл) три раза. Органические фазы объединяли, промывали водой 3 раза и сушили над сульфатом магния. После фильтрования фильтрат концентрировали и остаток очищали хроматографией на колонке с силикагелем (метиленхлорид/этилацетат=3/1). Перекристаллизация из смеси этилацетат-изопропиловый эфир давала (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (343 мг, 33%) в виде светло-желтого порошка.
Пример 1885
(1) Получение 3-(4-трифторметилфенил)-2-пропенил (S)-4-[3-(2-бром-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата
Смесь (R)-2-бром-4-нитро-1-(2-метил-2-оксиранилметил)имидазола (2,04 г, 7,78 ммоль), 3-(4-трифторметилфенил)-2-пропенилпиперазин-1-карбоксилата (2,69 г, 8,56 ммоль) и N,N'-диметилформамида (10 мл) перемешивали при 50°С в течение 20 часов. Реакционному раствору давали остыть до комнатной температуры, добавляли воду и полученный раствор экстрагировали этилацетатом (15 мл) два раза. Органические фазы объединяли, промывали водой три раза и сушили над сульфатом натрия. После фильтрования фильтрат концентрировали и остаток очищали хроматографией на колонке с силикагелем (н-гексан/этилацетат=1/2) с получением 3-(4-трифторметилфенил)-2-пропенил (S)-4-[3-(2-бром-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилата (3,77 г, 84%) в виде желтого масла.
1H-ЯМР (CDCl3) δ м.д.:
1,16 (3H, с), 2,36 (1H, д, J=14,0 Гц), 2,43-2,76 (5H, м), 3,21 (1H, с), 3,41-3,57 (4H, м), 4,01 (2H, с), 4,78 (2H, дд, J=1,0 Гц, 6,1 Гц), 6,29-6,43 (1H, м), 6,66 (1H, д, J=16,0 Гц), 7,48 (2H, д, J=8,3 Гц), 7,58 (2H, д, J=8,3 Гц), 8,10 (1H, с).
(2) Получение 3-(4-трифторметилфенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата
3-(4-Трифторметилфенил)-2-пропенил (S)-4-[3-(2-бром-4-нитроимидазол-1-ил)-2-гидрокси-2-метилпропил]пиперазин-1-карбоксилат (3,5 г, 6,07 ммоль) растворяли в N,N'-диметилформамиде (10,5 мл) и добавляли гидрид натрия (316 мг, 7,89 ммоль) при охлаждении на льду с последующим перемешиванием при той же температуре в течение 1,5 часов. К реакционному раствору добавляли этилацетат (3,5 мл) и воду (24,5 мл) с последующим перемешиванием в течение 30 минут. Выпавшие в осадок кристаллы отфильтровывали, промывали водой и очищали хроматографией на колонке с силикагелем (этилацетат). Перекристаллизация из смеси 2-пропанол-вода давала светло-желтый порошок 3-(4-трифторметилфенил)-2-пропенил (S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилата (2,07 г, 69%).
Пример 1 испытания
Противомикробный анализ (метод агарового разведения)
Используя среду 7Н11 (производства BBL), определяли минимальную ингибирующую концентрацию производного 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, полученного в примере 397, против Mycobacterium tuberculosis (M. tuberculosis H37Rv). Указанный штамм предварительно культивировали в среде 7Н11 (производства BBL), подсчитывали число жизнеспособных клеток и приготавливали клеточную суспензию с конечным числом жизнеспособных клеток приблизительно 106 КОЕ/мл, используя клеточную суспензию, хранимую замороженной при -80°С. 5 мкл приготовленной клеточной суспензии высевали на агаровую среду 7Н11, содержавшую испытуемое соединение, и затем культивировали при 37°С в течение 14 суток. После этого культуру подвергали испытанию для определения минимальной ингибирующей концентрации.
Минимальная ингибирующая концентрация указанного соединения против M. tuberculosis H37Rv составляла 0,024 мкг/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-6-НИТРОИМИДАЗО [2,1-b] ОКСАЗОЛА ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2004 |
|
RU2365593C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-6-НИТРОИМИДАЗО[2,1-b]ОКСАЗОЛА | 2006 |
|
RU2413504C2 |
| ПРОИЗВОДНОЕ 1-ЗАМЕЩЕННОГО 4-НИТРОИМИДАЗОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2324682C2 |
| КАРБОСТИРИЛЬНОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2430920C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЕДИНЕНИЯ ОКСАЗОЛА | 2011 |
|
RU2560676C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЕДИНЕНИЯ ОКСАЗОЛА | 2006 |
|
RU2434632C2 |
| БИЦИКЛИЧЕСКИЕ НИТРОИМИДАЗОЛЫ, КОВАЛЕНТНО СОЕДИНЕННЫЕ С ЗАМЕЩЕННЫМИ ФЕНИЛОКСАЗОЛИДИНОНАМИ | 2009 |
|
RU2504547C2 |
| ЭПОКСИСОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2459822C2 |
| ПРОИЗВОДНЫЕ 4-ПИПЕРАЗИН-1-ИЛ-4-БЕНЗО[b]ТИОФЕНА, ПОДХОДЯЩИЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2006 |
|
RU2415854C2 |
| НОВОЕ ПРОИЗВОДНОЕ АМИНОПИРИДИНА С ИНГИБИТОРНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ SYK. | 2006 |
|
RU2363699C2 |
В настоящем изобретении предлагается производное 2,3-дигидро-6-нитроимидазо[2,1-b]оксазола, представленное следующей общей формулой (1):

где R1 представляет собой атом водорода или C1-6алкильную группу, n представляет собой целое число от 0 до 6, R2 представляет собой группу -OR3 или тому подобное, и R3 представляет собой атом водорода, С1-6алкильную группу или тому подобное, причем R1 и -(CH2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н):

где R41 представляет собой атом водорода, С1-6алкильную группу или тому подобное. Технический результат - данное соединение обладает бактерицидным действием против Mycobacterium tuberculosis, полирезистентной к лекарственным средствам Mycobacterium tuberculosis и атипичных кислотоустойчивых бактерий. 7 н. и 41 з.п. ф-лы, 119 табл.

где R1 представляет собой атом водорода или C1-6алкильную группу, n представляет собой целое число от 0 до 6 и R2 представляет собой группу, представленную общей формулой (А), (В), (С), (D), (Е), (F) или (G), показанной ниже, причем R1 и -(CH2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н), показанной ниже:
группа, представленная следующей общей формулой (А):

где R3 представляет собой A3) С1-6алкокси-С1-6алкильную группу; А4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-C1-6алкоксигруппы, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и феноксигруппы, которая может иметь в качестве заместителя по крайней мере одну галогензамещенную или незамещенную C1-6алкоксигруппу в фенильном кольце);
А5) бифенилил-С1-6алкильную группу;
А6) фенил-С2-6алкенильную группу;
А7) C1-6алкилсульфонильную группу;
А8) бензолсульфонильную группу, которая может быть замещена C1-6алкильной группой;
А9) C1-6алканоильную группу;
А10) группу, представленную следующей общей формулой (Аа)

где R4 представляет собой C1-6алкоксикарбонильную группу, фенил-C1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-C1-6алкоксигруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) или фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенил-С1-6алкоксигруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
А11) бифенилил-C1-6алкоксикарбонильную группу;
А12) бензоксазолил-С1-6алкильную группу (которая может быть замещена в бензоксазольном кольце по крайней мере одной оксогруппой в качестве заместителя);
А13) бензоксазолильную группу или
А14) оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенильной группы и C1-6алкильной группы, в качестве заместителя),
группа, представленная следующей общей формулой (В):

где R5 представляет собой тетразолильную группу (которая может быть замещена в тетразольном кольце C1-6алкильной группой или фенильной группой, которая может содержать атом галогена в качестве заместителя) или бензоксазолильную группу, группа, представленная следующей общей формулой (С):

где R6 представляет собой C1-6алкильную группу,
карбамоилоксигруппа, представленная следующей общей формулой (D):

где R7 и R8, одинаковые или различные, каждый представляет собой любое из следующего: D1) атом водорода; D2) C1-8алкильную группу; D3) галогензамещенную C1-6алкильную группу; D4) С1-6алкоксикарбонил-С1-6алкильную группу; D5) С3-8циклоалкильную группу; D6) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); D7) фенильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, C1-6алканоильной группы, карбоксильной группы, C1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, карбамоильной группы, C1-6алкилкарбамоильной группы, аминосульфонильной группы и морфолиногруппы); D8) нафтильную группу; D9) пиридильную группу и D10) R7 и R8 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием насыщенной гетероциклической группы, показанной в любом из пунктов (D10-1)-(D10-3), представленных ниже, или конденсированной с бензолом гетероциклической группы, показанной в любом из пунктов (D10-4)-(D10-7), представленных ниже:
(D10-1) пиперазинильная группа, представленная следующей общей формулой (Da):

где R9 представляет собой (Da1) атом водорода; (Da2) C1-6алкильную группу; (Da3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Da4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Da5) C1-6алкоксикарбонильную группу; (Da6) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Da7) фенил-С3-6алкенилоксикарбонильную группу (которая может иметь по крайней мере одну галогензамещенную или незамещенную C1-6алкильную группу в фенильном кольце); или (Da8) замещенную фенил-С1-6алкилиденом аминогруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой в качестве заместителя),
(D10-2) группа, представленная следующей общей формулой (Db):
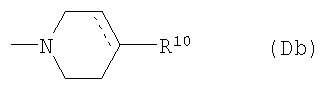
где пунктирная линия указывает на то, что связь может быть двойной связью, и R10 представляет собой (Db1) атом водорода; (Db2) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Db3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой); или
(Db4) фениламиногруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой),
(D10-3) морфолиногруппа;
(D10-4) индолинильная группа (которая может быть замещена в индолиновом кольце по крайней мере одним атомом галогена в качестве заместителя);
(D10-5) изоиндолинильная группа (которая может быть замещена в изоиндолиновом кольце по крайней мере одним атомом галогена в качестве заместителя);
(D10-6) 1,2,3,4-тетрагидрохинолильная группа (которая может быть замещена в 1,2,3,4-тетрагидрохинолиновом кольце по крайней мере одним атомом галогена в качестве заместителя); и
(D10-7) 1,2,3,4-тетрагидроизохинолильная группа (которая может быть замещена в 1,2,3,4-тетрагидроизохинолиновом кольце по крайней мере одним атомом галогена в качестве заместителя),
феноксигруппа, представленная следующей общей формулой (Е):
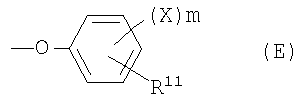
где Х представляет собой атом галогена или аминозамещенную C1-6алкильную группу, которая может содержать C1-6алкильную группу в качестве заместителя, m представляет собой целое число от 0 до 3 и R11 представляет собой Е2) галогензамещенную или незамещенную C1-6алкильную группу;
Е3) галогензамещенную или незамещенную C1-6алкоксигруппу;
Е4) группу, представленную следующей общей формулой (Еа):

где W представляет собой группу -СО- или C1-6алкиленовую группу, о представляет собой целое число 0 или 1 и R12 и R13, одинаковые или различные, каждый представляет собой любое из следующего: (Еа1) атом водорода; (Еа2) C1-6алкильную группу; (Еа3) C1-6алканоильную группу; (Еа4) C1-6алкоксикарбонильную группу; (Еа5) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы в качестве заместителя), и алкильная часть которой может быть замещена C1-6алкоксиаминогруппой); (Еа6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Еа7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Еа8) пиридильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одним атомом галогена в качестве заместителя); (Еа9) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Еа10) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); и (Еа11) бензоил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы), Е5) имидазолильную группу; Е6) триазолильную группу; Е7) морфолиногруппу; Е8) тиоморфолиногруппу; Е9) s-оксид тиоморфолиногруппу; Е10) пиперидильную группу, представленную следующей общей формулой (Eaa):

где W и o являются такими, как определено выше, R14A представляет собой атом водорода, гидроксильную группу, C1-6алкоксигруппу или фенильную группу (которая может быть замещена в фенильном кольце атомом галогена), пунктирная линия указывает на то, что связь может быть двойной связью, и когда пунктирная линия представляет собой двойную связь, это означает, что замещенным является только лишь R14, R14 и R14A могут быть связаны друг с другом вместе со смежными с ними атомами углерода с образованием C1-4алкилендиоксигруппы и R14 представляет собой (Eaa1) атом водорода; (Еаа2) C1-6алкоксикарбонильную группу; (Еаа3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена;
галогензамещенной или незамещенной C1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; С1-4алкилендиокси группы; C1-6алкоксикарбонильной группы; цианогруппы; С2-6алкенильной группы; нитрогруппы; фенильной группы;
аминогруппы, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из фенильной группы, C1-6алкильной группы, карбамоильной группы и C1-6алканоильной группы; C1-6алканоилзамещенной C1-6алкильной группы; гидроксильной группы; C1-6алкоксикарбонилзамещенной C1-6алкильной группы; фенил-С1-6алкильной группы; C1-6алканоильной группы; C1-6алкилтиогруппы; 1,2,4-триазолильной группы; изоксазолильной группы; имидазолильной группы; бензотриазолильной группы; 2Н-бензотриазолильной группы; пирролильной группы; бензоксазолильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) в качестве заместителя); пиперидинильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из аминогруппы (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) в качестве заместителя); и карбамоильной группы)); (Еаа4) гидроксильную группу; (Еаа5) карбоксигруппу; (Еаа6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы в качестве заместителя), атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы в качестве заместителя); (Еаа7) C1-6алкоксигруппу; (Еаа8) С3-8циклоалкил-С1-6алкоксигруппу; (Еаа9) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Eaa10) тетрагидропиранилоксигруппу; (Eaa11) 1,3-диоксоланильную группу; (Eaa12) оксогруппу; (Еаа13) нафтилоксигруппу (которая может быть замещена в нафталиновом кольце по крайней мере одной C1-6алкильной группой в качестве заместителя); (Eaa14) 2,3-дигидробензофурилоксигруппу (которая может быть замещена в 2,3-дигидробензофурановом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и оксогруппы); (Eaa15) бензтиазолилоксигруппу (которая может быть замещена в бензотиазольном кольце по крайней мере одной C1-6алкильной группой); (Eaa16) 1,2,3,4-тетрагидронафтилоксигруппу (которая может быть замещена в 1,2,3,4-тетрагидронафталиновом кольце по крайней мере одной оксогруппой в качестве заместителя); (Eaa17) 1,3-бензоксатиоланилоксигруппу (которая может быть замещена в 1,3-бензоксатиолановом кольце по крайней мере одной оксогруппой в качестве заместителя); (Eaa18) изохинолилоксигруппу; (Еаа19) пиридилоксигруппу; (Еаа20) хинолиллоксигруппу (которая может быть замещена в хинолиновом кольце по крайней мере одной C1-6алкильной группой в качестве заместителя); (Еаа21) дибензофурилоксигруппу; (Еаа22) 2Н-хроменилоксигруппу (которая может быть замещена в 2Н-хроменовом кольце по крайней мере одной оксогруппой в качестве заместителя); (Еаа23) бензизоксазолилоксигруппу; (Еаа24) хиноксалилоксигруппу; (Еаа25) 2,3-дигидро-1Н-инденилоксигруппу (которая может быть замещена в 2,3-дигидро-1H-инденовом кольце по крайней мере одной оксогруппой в качестве заместителя);
(Еаа26) бензофуразанилоксигруппу или
(Еаа27) фенил-С1-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы),
Е11) группу, представленную следующей общей формулой (Eab):

где о является таким, как определено выше, W1 представляет собой C1-6алкиленовую группу и R15 представляет собой (Eab1) атом водорода; (Еаb2) C1-6алкильную группу (где алкильная группа может быть замещена морфолиногруппой, бензоильной группой, карбамоильной группой, которая может содержать C1-6алкильную группу в качестве заместителя, или цианогруппой);
(Еаb3) С3-8циклоалкильную группу;
(Еаb4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, фенильной группы, нитрогруппы, C1-6алкилтиогруппы, C1-6алкилсульфонильной группы, фенил-С1-6алкоксигруппы, С2-6алканоилоксигруппы, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и 1,2,3-тиадиазолильной группы); (Еаb5) С2-6алкенильную группу; (Еаb6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Еаb7) C1-6алканоильную группу; (Еаb8) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Еаb9) бензоильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Eab10) С1-20алкоксикарбонильную группу (которая может быть замещена в алкоксигруппе по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя, и C1-6алкоксизамещенной C1-6алкоксигруппы); (Eab11) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, нитрогруппы, галогензамещенной или незамещенной C1-6алкилтиогруппы, аминогруппы, которая может содержать C1-6алканоильную группу, фенил-C1-6алкоксигруппы, C1-6алкоксикарбонильной группы и 1,2,3-тиадиазолильной группы); (Eab12) фенил-С3-6алкенилоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Еаb13) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Eab14) фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); (Еаb15) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Еаb16) бензофурилзамещенную C1-6алкоксикарбонильную группу, которая может быть замещена по крайней мере одним атомом галогена в бензофурановом кольце;
(Еаb17) бензотиенил-С1-6алкоксикарбонильную группу (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкоксигруппы в качестве заместителя);
(Еаb18) нафтилзамещенную C1-6алкоксикарбонильную группу;
(Еаb19) пиридилзамещенную C1-6алкоксикарбонильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одним атомом галогена в качестве заместителя);
(Еаb20) фурилзамещенную C1-6алкоксикарбонильную группу (которая может быть замещена в фурановом кольце по крайней мере одной нитрогруппой в качестве заместителя);
(Еаb21) тиенилзамещенную C1-6алкоксикарбонильную группу (которая может содержать по крайней мере один атом галогена в качестве заместителя в тиофеновом кольце);
(Еаb22) тиазолилзамещенную C1-6алкоксикарбонильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой));
(Еаb23) тетразолилзамещенную C1-6алкоксикарбонильную группу (которая может быть замещена в тетразольном кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и фенильной группы (которая может содержать по крайней мере один атом галогена в качестве заместителя в фенильном кольце) в качестве заместителя);
(Еаb24) 2,3-дигидро-1Н-инденилоксикарбонильную группу;
(Еаb25) адамантанзамещенную C1-6алкоксикарбонильную группу;
(Еаb26) фенил-С3-6алкинилоксикарбонильную группу;
(Eab27) фенилтио-С1-6алкоксикарбонильную группу;
(Eab28) фенил-С1-6алкоксизамещенную C1-6алкоксикарбонильную группу;
(Еаb29) С2-6алкенилоксикарбонильную группу;
(Еаb30) С2-6алкинилоксикарбонильную группу;
(Еаb31) С3-8циклоалкилзамещенную C1-6алкоксикарбонильную группу; или
(Еаb32) бензоилзамещенную C1-6алкоксикарбонильную группу,
Е12) группу, представленную следующей общей формулой (Eb):

где пунктирная линия указывает на то, что связь может быть двойной связью, и R16 является таким, как определено для R15;
Е13) группу, представленную следующей общей формулой (Ec):

где R17 представляет собой:
(Ec1) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Ес2) C1-6алкоксикарбонильную группу или
(Ес3) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы),
Е14) пиридильную группу;
Е15) группу, представленную следующей общей формулой (Ее):

где R46 представляет собой фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы, в качестве заместителя); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или C1-6алкоксикарбонильную группу,
Е16) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
Е17) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
Е18) 8-азабицикло[3,2,1]октильную группу (которая может быть замещена в 8-азабицикло[3,2,1]октановом кольце по крайней мере одной феноксигруппой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) в качестве заместителя);
Е19) группу, представленную следующей общей формулой (Ef):
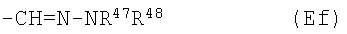
где каждый из R47 и R48, одинаковых или разных, представляет собой атом водорода, C1-6алкильную группу, фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы) или пиридильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой в качестве заместителя); и, кроме того, R47 и R48 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы с образованием 5-7-членного насыщенного гетероциклического кольца, которое может быть замещено в гетероциклическом кольце по крайней мере одной фенильной группой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) в качестве заместителя);
Е20) фенил-С1-6алкоксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С 1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
Е21) аминозамещенную С2-6алкенильную группу (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или
Е22) оксазолидинильную группу (которая может быть замещена в оксазолидиновом кольце по крайней мере одной оксогруппой в качестве заместителя),
группа, представленная следующей общей формулой (F):

где R19 и R20, одинаковые или различные, каждый представляет собой любое из следующего:
F1) атом водорода;
F2) C1-6алкильную группу;
F3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); атома галогена; галогензамещенной или незамещенной C1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; аминогруппы, которая может содержать по крайней мере одну группу, выбранную из группы, состоящей из C1-6алкильной группы и фенил-C1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной фенил-C1-6алкильной группой (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) в качестве заместителя); и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной аминогруппой, которая может содержать группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) и C1-6алкильной группы в качестве заместителя);
F4) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F5) амино-С1-6алкильную группу (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, C1-6алкоксикарбонильной группы и фенильной группы, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной С1-6алкильной группы);
F6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) и C1-6алкоксикарбонильной группы);
F7) C1-6алкоксикарбонильную группу;
F8) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
F9) группу, представленную следующей общей формулой (Fa):

где R21 представляет собой C1-6алкоксикарбонильную группу; фенил-C1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкильной группы); или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
F10) 1-замещенная-4-пиперидильную группу, представленную следующей общей формулой (Fb):
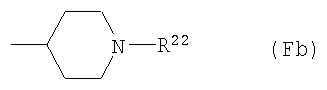
где R22 представляет собой С1-6алкоксикарбонильную группу; фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
F11) пиперидил-С1-6алкильную группу (которая может содержать по крайней мере одну феноксигруппу (которая может содержать по крайней мере одну галогензамещенную или незамещенную C1-6алкильную группу в качестве заместителя) в качестве заместителя);
F12) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием гетероциклического кольца, показанного в любом из пунктов (F12-1)-(F12-10), представленных ниже:
(F12-1) пиперазинильная группа, представленная следующей общей формулой (Fc):

где пунктирная линия указывает на то, что связь может быть двойной связью, и R23 представляет собой:
(Fc1) C1-6алкильную группу;
(Fc2) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена,
галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fc3) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена;
галогензамещенной или незамещенной C1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; аминогруппы, которая может содержать в качестве заместителя группу, выбранную из группы, состоящей из C1-6алкильной группы и фенил-C1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); и пиперидильной группы (которая может содержать в пиперидиновом кольце в качестве заместителя по крайней мере одну аминогруппу, которая может содержать группу, выбранную из группы, состоящей из фенил-C1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) и C1-6алкильной группы));
(Fc4) фенил-С1-6алкоксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fc5) бифенилил-С1-6алкоксигруппу;
(Fc6) фенил-С3-6алкенилоксигруппу, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена;
(Fc7) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fc8) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fc9) C1-6алкоксикарбонильную группу;
(Fc10) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкоксигруппой);
(Fc11) фенил-С1-6алкилкарбамоильную группу, в которой по крайней мере один атом галогена может быть в качестве заместителя в фенильном кольце;
(Fc12) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fc13) фенилтиогруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc14) фенилсульфоксид (который может быть замещен в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкоксигруппой);
(Fc15) пиридил-С1-6алкоксигруппу; или
(Fc16) группу, представленную следующей общей формулой (Fca):
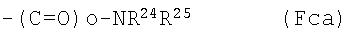
где о является таким, как определено выше, и каждый из R24 и R25 представляет собой
(Fca1) атом водорода;
(Fca2) C1-6алкильную группу;
(Fca3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fca4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fca5) C1-6алканоильную группу;
(Fca6) фенил-С2-6алканоильную группу, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена;
(Fca7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fca8) C1-6алкоксикарбонильную группу;
(Fca9) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fca10) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой);
(Fca11) пиперидилоксикарбонильную группу (которая может быть замещена в пиперидиновом кольце по крайней мере одной фенильной группой (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой) в качестве заместителя); или
(Fca12) R24 и R25 могут образовывать через смежные с ними атомы азота 5-6-членное насыщенное гетероциклическое кольцо, которое может быть замещено в гетероциклическом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксикарбонильной группы; бензоильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-С1-6 алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-C1-6алкоксикарбонильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-С2-6алкенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы),
(F12-2) 4-замещенная-1-пиперазинильная группа, представленная следующей общей формулой (Fd):

где R26 представляет собой; (Fd1) атом водорода; (Fd2) C1-6алкильную группу; (Fd3) С3-8циклоалкильную группу; (Fd4) С3-8циклоалкил-С1-6алкильную группу; (Fd5) С1-6алкоксикарбонил-С1-6алкильную группу; (Fd6) фенил-С2-6алкенильную группу; (Fd7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена; цианогруппы;
галогензамещенной или незамещенной C1-6алкильной группы; С3-8циклоалкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя; C1-6алкоксикарбонильной группы; феноксигруппы; фенил-С1-6алкильной группы; фенил-С2-6алкенильной группы; пиридильной группы; имидазолильной группы и пиперидильной группы);
(Fd8) бифенилил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя);
(Fd9) нафтил-С1-6алкильную группу;
(Fd10) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; цианогруппы; аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя; галогензамещенной или незамещенной C1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; C1-6алкоксикарбонильной группы; карбоксильной группы; феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); амино-С1-6алкильной группы (которая может содержать в аминогруппе по крайней мере одну группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) и C1-6алкильной группы)); и фенил-С1-6алкоксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы));
(Fd11) бифенилильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой);
(Fd12) аминогруппу, аминогруппу, замещенную C1-6алкоксикарбонильной группой, фенил-С1-6алкиламиногруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой) или фениламиногруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной C1-6алкильной группы и атома галогена);
(Fd13) бензоильную C1-6алкильную группу (которая может содержать в фенильном кольце по крайней мере один атом галогена в качестве заместителя);
(Fd14) фенилкарбамоил-C1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой);
(Fd15) тиазолил-С1-6алкильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы);
(Fd16) оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы);
(Fd17) индолил-С1-6алкильную группу;
(Fd18) фурил-С1-6алкильную группу (которая может быть замещена в фурановом кольце по крайней мере одной галогензамещенной или незамещенной фенильной группой);
(Fd19) имидазолил-С1-6алкильную группу (которая может быть замещена в имидазольном кольце фенильной группой);
(Fd20) хинолил-С1-6алкильную группу;
(Fd21) тетразолильную группу (которая может быть замещена в тетразольном кольце фенильной группой);
(Fd22) пиримидильную группу, которая может быть замещена фенильной группой;
(Fd23) пиридильную группу;
(Fd24) бензоксазолильную группу;
(Fd25) бензотиазолильную группу;
(Fd26) бензоксазолил-С1-6алкильную группу (которая может содержать в бензоксазольном кольце по крайней мере одну оксогруппу в качестве заместителя);
(Fd27) фенокси-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd28) фенилтио-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd29) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fd30) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя);
(Fd31) бифенилилкарбонильную группу;
(Fd32) пиридилкарбонильную группу;
(Fd33) фенил-С2-6алкенилкарбонильную группу, в которой фенильное кольцо может быть замещено атомом галогена;
(Fd34) фенил-С1-6алкилсульфонильную группу, в которой фенильное кольцо может быть замещено атомом галогена;
(Fd35) бензолсульфонильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и C1-6алкильной группы);
(Fd36) группу, представленную следующей общей формулой (Fda):

где R27 представляет собой (Fda1) галогензамещенную или незамещенную С1-8алкильную группу; (Fda2) С3-8циклоалкильную группу; (Fda3) С3-8циклоалкил-С1-6алкильную группу; (Fda4) С1-6алкокси-С1-6алкильную группу; (Fda5) амино-С1-6алкильную группу, которая может содержать C1-6алкильную группу;
(Fda6) группу, представленную следующей общей формулой (Fdb):

где R28, R29 и R30 представляют собой атом водорода, C1-6алкильную группу или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) соответственно;
(Fda7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5 группами, выбранными из группы, состоящей из атома галогена; галогензамещенной или незамещенной C1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; галогензамещенной или незамещенной С1-6алкилтиогруппы; фенил-C1-6алкоксигруппы; гидроксигруппы; C1-6алкилсульфинильной группы; C1-6алкилсульфонильной группы; C1-6алкилсульфонилоксигруппы; цианогруппы; C1-6алканоильной группы; бензоильной группы; фенил-С1-6алкильной группы, которая может содержать C1-6алкоксигруппу в алкильной части; аминогруппы; нитрогруппы; карбамоильной группы; C1-6алканоиламиногруппы; C1-6алкоксикарбонильной группы; C1-6алкиламинокарбонильной группы; С1-6алкоксикарбониламиногруппы; три-C1-6алкилсилоксигруппы; пирролильной группы; тетрагидропиранилоксигруппы; и имидазолильной группы);
(Fda8) бифенилил-С1-6алкильную группу;
(Fda9) бензгидрильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, трифторметильной группы и трифторметоксигруппы);
(Fda10) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fda11) фенил-С2-6алкинильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной С1-6алкильной группой в качестве заместителя);
(Fda12) пиридил-С1-6алкильную группу;
(Fda13) группу, представленную следующей общей формулой (Fdc):

где R31 представляет собой фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-C1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена,
галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fda14) пиперидино-С1-6алкильную группу (которая может быть замещена в пиперидиновом кольце феноксигруппой, которая может содержать по крайней мере одну галогензамещенную или незамещенную алкильную группу в качестве заместителя в фенильном кольце);
(Fda15) амино-С1-6алкильную группу, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из С1-6алкильной группы и фенильной группы, которая может содержать в качестве заместителя галогензамещенную или незамещенную C1-6алкоксигруппу в фенильном кольце);
(Fda16) 1,2,3,6-тетрагидропиридил-С1-6алкильную группу, которая может быть замещена в 1,2,3,6-тетрагидропиридиновом кольце по крайней мере одной фенильной группой, которая может содержать в качестве заместителя по крайней мере одну галогензамещенную или незамещенную C1-6алкоксигруппу в фенильном кольце);
(Fda17) нафтил-С1-6алкильную группу;
(Fda18) флуоренил-С1-6алкильную группу;
(Fda19) пиридил-С1-6алкильную группу;
(Fda20) фурил-С1-6алкильную группу (которая может быть замещена в фурановом кольце галогензамещенной или незамещенной фенильной группой);
(Fda21) тиенил-С1-6алкильную группу;
(Fda22) оксазолил-С1-6алкильную группу (которая может быть замещена в оксазольном кольце атомом галогена или галогензамещенной или незамещенной C1-6фенильной группой);
(Fda23) оксадиазолил-С1-6алкильную группу (которая может быть замещена в оксадиазольном кольце галогензамещенной или незамещенной C1-6фенильной группой);
(Fda24) пиразолил-С1-6алкильную группу (которая может быть замещена в пиразольном кольце галогензамещенной или незамещенной C1-6фенильной группой);
(Fda25) бензотиенил-С1-6алкильную группу (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fda26) тиенил-С1-6алкильную группу, которая может быть замещена в тиофеновом кольце атомом галогена;
(Fda27) бензтиазолил-С1-6алкильную группу;
(Fda28) бензофурил-С1-6алкильную группу, которая может быть замещена в бензофурановом кольце атомом галогена;
(Fda29) индолинил-С1-6алкильную группу (которая может быть замещена в индолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и оксогруппы);
(Fda30) бензоксазолил-С1-6алкильную группу (которая может быть замещена в бензоксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, C1-6алкильной группы и оксогруппы);
(Fda31) хроменил-С1-6алкильную группу;
(Fda32) 1,2,3,4-тетрагидрохинолил-С1-6алкильную группу (которая может быть замещена в хинолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и оксогруппы);
(Fda33) тиазолил-С1-6алкильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы);или
(Fda34) тетразолил-С1-6алкильную группу (которая может быть замещена в тетразольном кольце группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы);
(Fd37) группу, представленную следующей общей формулой (Fe):

где Z представляет собой -С=O или -C=S и R32 и R33, одинаковые или различные, представляют собой любое из следующего: (Fe1) атом водорода; (Fe2) C1-6алкильную группу; (Fe3) С3-8циклоалкильную группу; (Fe4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fe5) фенил-С2-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fe6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); и
(Fe7) R32 и R33 могут быть связаны друг с другом вместе со смежными с ними атомами азота через другие атомы углерода с образованием пиперидинового кольца или 1,2,3,6-тетрагидропиридинового кольца, которое может быть замещено в пиперидиновом или 1,2,3,6-тетрагидропиридиновом кольце фенильной группой, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкильной группы,
(Fd38) группу, представленную следующей общей формулой (Ff):
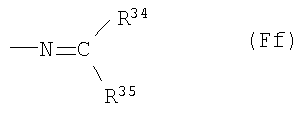
где R34 представляет собой атом водорода или C1-6 низшую алкильную группу и R35 представляет собой (Ff1) С3-8циклоалкильную группу; (Ff2) С3-8циклоалкенильную группу; (Ff3) группу, представленную следующей общей формулой (Ffa):
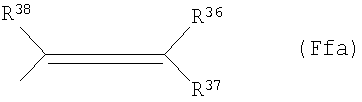
где каждый из R36, R37 и R38 представляет собой атом водорода; C1-6алкильную группу; фенильную группу (которая может быть замещена в фенильном кольце по крайней мере 1-5 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, С1-6алкилендиоксигруппы, C1-6алкилсульфонильной группы, галогензамещенной или незамещенной C1-6алкилтиогруппы, нитрогруппы и аминогруппы, которая может содержать C1-6алканоильную группу в качестве заместителя);
бензофурильную группу (которая может быть замещена в бензофурановом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); бифенилильную группу; фурильную группу (которая может быть замещена в фурановом кольце фенильной группой, которая может содержать в качестве заместителя атом галогена); или тиазолильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной фенильной группой, которая может содержать атом галогена в качестве заместителя);
(Ff4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной C1-6алкильной группы; С3-8циклоалкильной группы; гидроксильной группы; галогензамещенной или незамещенной С1-8алкоксигруппы; С3-8циклоалкоксигруппы; С1-4алкилендиоксигруппы; цианогруппы; нитрогруппы; фенил-С2-6алкенильной группы; С2-6алканоилоксигруппы; аминогруппы, которая может содержать C1-6алканоильную группу в качестве заместителя; С1-6алкилсульфониламиногруппы; фенил-С1-6алкоксигруппы; феноксигруппы; аминогруппы, которая может содержать по крайней мере одну C1-6алкильную группу в качестве заместителя; аминогруппы, которая может содержать по крайней мере одну фенильную группу в качестве заместителя; амино-C1-6алкоксигруппы, которая может содержать по крайней мере одну C1-6алкильную группу в качестве заместителя; C1-6алкоксикарбонильной группы; С1-6алкоксикарбонил-С1-6алкоксигруппы; C1-6алкилтиогруппы; пирролильной группы; имидазолильной группы; пиперидильной группы; морфолиногруппы; пирролидинильной группы; тиенильной группы; бензофурильной группы; пиперазинильной группы (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы, фенил-C1-6алкильной группы и бензоильной группы, которая может содержать по крайней мере одну C1-6алкильную группу в качестве заместителя); хинолильной группы, которая может быть замещена в хинолиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкоксигруппы и оксогруппы; пиперидилкарбонильной группы, которая может быть замещена в пиперидиновом кольце карбостирильной группой; и триазолильной группы);
(Ff5) нафтильную группу, которая может быть замещена в нафталиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкоксигруппы и аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя;
(Ff6) бифенилильную группу (которая может быть замещена в бифенилильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-9алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Ff7) флуоренильную группу; пиренильную группу;
(Ff8) бензофурильную группу (которая может быть замещена в бензофурановом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Ff9) бензотиенильную группу (которая может быть замещена в бензотиофеновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Ff10) пиридильную группу (которая может быть замещена в пиридиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы), фурильной группы и тиенильной группы);
(Ff11) фурильную группу (которая может быть замещена в фурановом кольце 1-3 группами, выбранными из группы, состоящей из C1-6алкильной группы, нитрогруппы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и нитрогруппы));
(Ff12) бензотиазольную группу (которая может содержать в бензотиазольном кольце по крайней мере одну фенильную группу, которая может содержать в качестве заместителя C1-6алкоксигруппу в фенильном кольце);
(Ff13) тиенильную группу (которая может содержать в тиофеновом кольце по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, нитрогруппы, C1-6алкильной группы, пиразолильной группы, которая может быть замещена в пиразольном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой в качестве заместителя, и тиенильной группы, которая может содержать атом галогена в тиофеновом кольце);
(Ff14) индолильную группу (которая может быть замещена в индольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенилсульфонильной группы, которая может содержать C1-6алкильную группу в качестве заместителя, фенил-C1-6алкильной группы, C1-6алкоксикарбонильной группы и фенильной группы);
(Ff15) пирролильную группу (которая может быть замещена в пиррольном кольце по крайней мере одной группой, выбранной из группы, состоящей из фенильной группы, которая может быть замещена по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой, и C1-6алкильной группы);
(Ff16) кумарильную группу;
(Ff17) бензимидазолильную группу (которая может быть замещена в бензимидазольном кольце по крайней мере одной тиенильной группой в качестве заместителя);
(Ff18) оксазолильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной фенильной группой, которая может содержать атом галогена в качестве заместителя);
(Ff19) тиазолильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной фенильной группой, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, нитрогруппы и фенильной группы);
(Ff20) хинолильную группу;
(Ff21) 3,4-дигидрокарбостирильную группу (которая может быть замещена в 3,4-дигидрокарбостирильном кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксигруппы, C1-6алкильной группы и фенил-С1-6алкоксигруппы) или карбостирильную группу (которая может быть замещена в карбостирильном кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксигруппы, C1-6алкильной группы и фенил-С1-6алкоксигруппы);
(Ff22) имидазо[2,1-b]тиазолильную группу;
(Ff23) имидазо[2,1-а]пиридильную группу;
(Ff24) хроманильную группу (которая может быть замещена в хромановом кольце по крайней мере одной C1-6алкильной группой); или
(Ff25) 2,3-дигидробензофуранильную группу или
(Fd39) группу, представленную следующей общей формулой (Ffb):

где R45 представляет собой C1-6алкоксикарбонильную группу; фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); аминозамещенную C1-6алкильную группу, которая может содержать в аминогруппе группу, выбранную из группы, состоящей из фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) и C1-6алкильной группы в качестве заместителя; бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-C1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или фенил-С2-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы),
(F12-3) морфолиногруппа;
(F12-4) имидазолильная группа;
(F12-5) 1,4-диоксаазаспиро[4,5]децильная группа (которая может быть замещена в 1,4-диоксаазаспиро[4,5]декановом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F12-6) гомопиперазинильная группа (которая может быть замещена в гомопиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы и фенилзамещенной или незамещенной фенильной группы, в качестве заместителя);
(F12-7) пиперазинильная группа (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, C1-6алкильной группы и фенил-C1-6алкильной группы (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой));
(F12-8) пиперидильная группа (которая может быть замещена в пиперидиновом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F12-9) пирролидинильная группа (которая может быть замещена в пирролидиновом кольце по крайней мере одной фенокси-C1-6алкильной группой, которая может содержать галогензамещенную или незамещенную С1-6алкоксигруппу в качестве заместителя);
(F12-10) изоиндолинильная группа, и
F13) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через гетероатомы с образованием циклического имида или амида, показанного в любом из пп.(F13-1)-(13-11), представленных ниже:
(F13-1) сукцинимидная группа;
(F13-2) оксазолидинильная группа (которая может быть замещена в оксазолидиновом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F13-3) бензо-1,3-оксазолидинильная группа (которая может быть замещена в бензо-1,3-оксазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, атома галогена и фенильной группы в качестве заместителя);
(F13-4) имидазолидинильная группа (которая может быть замещена в имидазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы, фенил-C1-6алкильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и C1-6алкоксигруппы) и фенильной группы);
(F13-5) бензимидазолидинильная группа (которая может быть замещена в бензимидазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы; атома галогена; галогензамещенной или незамещенной C1-6алкильной группы; аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя; C1-6алкоксикарбонильной группы; и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы, фенильной группы, где 1-3 атома галогена могут быть в фенильном кольце в качестве заместителя, C1-6алкоксикарбонильной группы и фенил-С1-6алкоксикарбонильной группы, в качестве заместителя);
(F13-6) фталимидная группа;
(F13-7) индолинильная группа (которая может содержать в индолиновом кольце по крайней мере одну группу, выбранную из группы, состоящей из C1-6алкильной группы, атома галогена и оксогруппы, в качестве заместителя);
(F13-8) 2,3-дигидробензотиазолильная группа (которая может содержать по крайней мере одну оксогруппу в 2,3-дигидробензотиазольном кольце);
(F13-9) 1Н-2,4-бензоксазинильная группа (которая может быть замещена в 1Н-2,4-бензоксазиновом кольце по крайней мере одной оксогруппой в качестве заместителя);
(F13-10) группа, представленная следующей общей формулой (Fga):
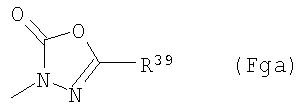
где R39 представляет собой атом водорода; фенил-C1-6алкильную группу, которая может содержать в качестве заместителя атом галогена в фенильном кольце; фенокси-C1-6алкильную группу, которая может содержать в качестве заместителя атом галогена в фенильном кольце; фенил-С2-6алкенильную группу, которая может содержать в качестве заместителя атом галогена в фенильном кольце; фенильную группу, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и фенильной группы, в качестве заместителя; пиридильную группу или пиразинильную группу, и
(F13-11) 1,3-тиазолидинильная группа (которая может быть замещена в 1,3-тиазолидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из оксогруппы и фенил-С1-6алкилиденовой группы, которая может содержать галогензамещенную или незамещенную C1-6алкильную группу в фенильном кольце в качестве заместителя), группа, представленная следующей общей формулой (G):

где R40 представляет собой C1-6алкильную группу или галогензамещенную или незамещенную фенильную группу,
циклическая спирогруппа, представленная следующей общей формулой (Н):

где R41 представляет собой H1) атом водорода; Н2) C1-6алкильную группу; Н3) фенил-С1-6алкильную группу, которая может содержать фенильную группу в качестве заместителя в фенильном кольце; Н4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной C1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; аминогруппы (которая может быть замещена в аминогруппе по крайней мере одной группой, выбранной из группы, состоящей из С1-6алкильной группы и фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы)); феноксигруппы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); и пиперидильной группы (которая может быть замещена в пиперидиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из феноксигрупп (которые могут быть замещены в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы), в качестве заместителя);
Н5) пиперазинил-С1-6алкильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксикарбонильной группы и фенил-C1-6алкильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и фенильной группы);
Н6) пиперазинилкарбонил-C1-6алкильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксикарбонильной группы; фенил-C1-6алкоксикарбонильной группы, которая может содержать в качестве заместителя галогензамещенную или незамещенную C1-6алкильную группу в фенильном кольце; и фенил-С1-6алкильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из галогензамещенной или незамещенной C1-6алкильной группы и фенильной группы, в фенильном кольце);
Н7) фенилкарбамоил-С1-6алкильную группу, которая может содержать по крайней мере одну галогензамещенную или незамещенную C1-6алкильную группу в качестве заместителя в фенильном кольце;
Н8) бензоксазолил-С1-6алкильную группу (которая может содержать по крайней мере одну оксогруппу в качестве заместителя в бензоксазольном кольце);
Н9) бензотиазолильную группу;
Н10) тетразолильную группу (которая может содержать одну фенильную группу в качестве заместителя в тетразольном кольце);
H11) C1-6алкилсульфонильную группу;
H12) фенилсульфонильную группу, которая может содержать по крайней мере одну C1-6алкильную группу в качестве заместителя в фенильном кольце;
Н13) фенилтиокарбамоильную группу, которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена в качестве заместителя);
H14) С1-8алкоксикарбонильную группу;
H15) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, C1-6алкоксикарбонильной группы, аминогруппы, которая может содержать C1-6алкоксикарбонильную группу в качестве заместителя, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, нитрогруппы и C1-6алкилтиогруппы);
H16) бензгидрилоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одним атомом галогена);
H17) C1-6алкоксикарбонильную группу, которая может содержать фенилзамещенную или незамещенную фенильную группу;
H18) нафтил-С1-6алкоксикарбонильную группу;
H19) пиридил-С1-6алкоксикарбонильную группу;
Н20) C1-6алкоксизамещенную C1-6алкоксикарбонильную группу;
Н21) пиперазинил-С1-6алкоксикарбонильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксикарбонильной группы и фенил-С1-6алкильной группы (которая может содержать по крайней мере один атом галогена в качестве заместителя в фенильном кольце), в качестве заместителя);
Н22) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и C1-6алкоксигруппы);
Н23) C1-6алканоильную группу;
Н24) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой);
Н25) фенил-С1-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой);
Н26) фенокси-С1-6алканоильную группу (в которой 1-3 атома галогена в фенильном кольце могут быть в качестве заместителя);
Н27) пиперазинил-С2-6алканоильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алканоильной группы; фенил-C1-6алкильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из фенильной группы, атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы, в фенильном кольце; фенил-С1-6алкоксикарбонильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы, в фенильном кольце; фенилкарбамоил-С1-6алкильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы, в фенильном кольце; фенилкарбамоильной группы, которая может содержать в качестве заместителя по крайней мере одну группу, выбранную из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы, в фенильном кольце;
и бензоксазолильной группы);
Н28) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, аминогруппы, которая может содержать C1-6алкильную группу в качестве заместителя, карбоксильной группы, C1-6алкоксикарбонильной группы, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, пиперазинильной группы, которая может содержать C1-6алкильную группу в качестве заместителя в пиперазиновом кольце, и морфолиногруппы);
Н29) фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или
Н30) пиперазинилкарбонильную группу (которая может быть замещена в пиперазиновом кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкоксикарбонильной группы, фенил-С1-6алкоксикарбонильной группы, которая может содержать по крайней мере одну галогензамещенную или незамещенную C1-6алкильную группу в фенильном кольце, и фенил-С1-6алкильной группы, которая может содержать галогензамещенную или незамещенную C1-6алкильную группу в фенильном кольце), при условии, что в указанной выше формуле (1), когда R1 представляет собой атом водорода и R2 представляет собой группу, представленную выше общей формулой (F), нельзя, чтобы R19 представлял собой атом водорода и R20 представлял собой третбутоксикарбонильную группу.
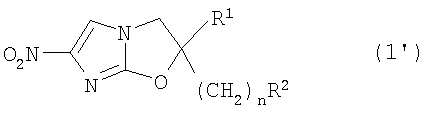
где R1 представляет собой атом водорода или C1-6алкильную группу, n представляет собой целое число от 0 до 6 и R2 представляет собой группу, представленную общей формулой (А'), (В'), (С'), (D'), (Е'), (F') или (G'), показанной ниже, причем R1 и -(CH2)nR2 могут быть связаны друг с другом вместе со смежными с ними атомами углерода через атомы азота с образованием спирокольца, представленного общей формулой (Н'), показанной ниже:
группа, представленная следующей общей формулой (А'):

где R3 представляет собой A3) С1-6алкокси-С1-6алкильную группу; А4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из бензилоксигруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); А5) бифенилил-С1-6алкильную группу; А6) циннамильную группу; А7) метансульфонильную группу; А8) бензолсульфонильную группу, которая может быть замещена метильной группой; А9) C1-6алканоильную группу; А10) группу, представленную следующей общей формулой (Аа'):
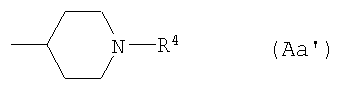
где R4 представляет собой C1-6алкоксикарбонильную группу, фенил-C1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из бензилоксигруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы) или фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из бензилоксигруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
А11) бифенилил-C1-6алкоксикарбонильную группу;
А12) 2-(2-оксо-3-бензоксазолил)этильную группу;
А 13) 2-бензоксазолильную группу или
А14) 2-фенил-5-метил-4-оксазолилметильную группу;
группа, представленная следующей общей формулой (В'):

где R5 представляет собой 5-(1Н)-тетразолильную группу (положение 1 в которой может быть замещено C1-6алкильной группой или галогензамещенной или незамещенной фенильной группой, или 2-бензоксазолильную группу, группа, представленная следующей общей формулой (С'):

где R6 представляет собой C1-6алкильную группу,
карбамоилоксигруппа, представленная следующей общей формулой (D'):
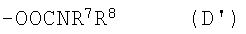
где R7 и R8, одинаковые или различные, каждый представляет собой любое из следующего:
D1) атом водорода;
D2) С1-8алкильную группу;
D3) галогензамещенную C1-6алкильную группу;
D4) С1-6алкоксикарбонил-С1-6алкильную группу;
D5) С5-8циклоалкильную группу;
D6) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
D7) фенильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, C1-6алканоильной группы, карбоксильной группы, C1-6алкоксикарбонильной группы, бензилоксикарбонильной группы, карбамоильной группы, C1-6алкилкарбамоильной группы, аминосульфонильной группы и морфолиногруппы);
D8) 1-нафтильную группу;
D9) 4-пиридильную группу и
D10) R7 и R8 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием насыщенной гетероциклической группы, показанной в любом из пп. (D10-1)-(D10-3), представленных ниже, или конденсированной с бензолом гетероциклической группы, показанной в любом из пп. (D10-4)-(D10-7), представленных ниже:
(D10-1) пиперазинильная группа, представленная следующей общей формулой (Da'):
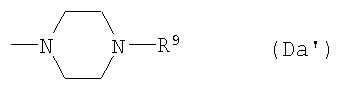
где R представляет собой
(Da1) атом водорода;
(Da2) C1-6алкильную группу;
(Da3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Da4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Da5) C1-6алкоксикарбонильную группу;
(Da6) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Da7) 4-трифторметилциннамилоксикарбонильную группу или
(Dа8)4-трифторметилбензилиденаминогруппу,
(D10-2) группа, представленная следующей общей формулой (Db'):
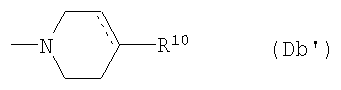
где пунктирная линия указывает на то, что связь может быть двойной связью, и R10 представляет собой
(Db1) атом водорода;
(Db2) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Db3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой); или
(Db4) фениламиногруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой), и (D10-3) морфолиногруппа;
(D10-4) галогензамещенная или незамещенная 1-индолинильная группа;
(D10-5) галогензамещенная или незамещенная 2-изоиндолинильная группа;
(D10-6) галогензамещенная или незамещенная
1,2,3,4-тетрагидро-1-хинолильная группа и
(D10-7) галогензамещенная или незамещенная
1,2,3,4-тетрагидро-2-изохинолильная группа,
феноксигруппа, представленная следующей общей формулой (Е'):
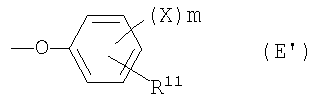
где Х представляет собой атом галогена, m представляет собой целое число от 0 до 3 и R11 представляет собой:
Е2) галогензамещенную или незамещенную C1-6алкильную группу;
ЕЗ) галогензамещенную или незамещенную C1-6алкоксигруппу;
Е4) морфолиногруппу;
Е5) тиоморфолиногруппу;
Е6) S-оксид тиоморфолиногруппу;
Е7) 1-имидазолильную группу;
Е8) 1-триазолильную группу;
Е9) пиперидинильную группу, представленную следующей общей формулой (Еа'):

где R12 представляет собой:
(Еа1) атом водорода;
(Еа2) C1-6алкоксикарбонильную группу или
(Еа3) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы,
галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы),
Е10) группу, представленную следующей общей формулой (Eb'):
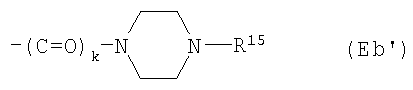
где k представляет собой целое число 0 или 1 и R15 представляет собой
(Eb1) атом водорода;
(Eb2) C1-6алкильную группу;
(Eb3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Eb4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Eb5) C1-6алканоильную группу;
(Eb6) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Eb7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb8) С1-8алкоксикарбонильную группу (которая может быть замещена в алкоксигруппе по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, ди(С1-6алкил)аминогруппы и C1-6алкоксигруппы);
(Eb9) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb10) фенил-С3-6алкенилоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Eb11) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Eb12) фенил-С1-6алкилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Eb13) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или
(Eb14) 2-бензофуранилметилоксикарбонильную группу, которая может быть замещена атомом галогена в бензольном кольце;
Е11) группу, представленную следующей общей формулой (Ec'):
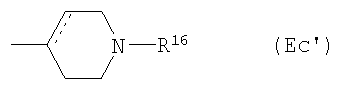
где пунктирная линия указывает на то, что связь может быть двойной связью, и R16 представляет собой
(Ec1) атом водорода;
(Ес2) C1-6алкильную группу;
(Ес3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Ес4) С1-8алкоксикарбонильную группу или
(Ес5) фенил-C1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы), группа, представленная следующей общей формулой (F'):

где R19 и R20, одинаковые или различные, каждый представляет собой любое из следующего:
F1) атом водорода;
F2) C1-6алкильную группу;
F3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и диметиламиногруппы);
F4) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
F5) N-метиламино-С1-6алкильную группу (где положение N может быть замещено С1-6алкоксикарбонильной группой или фенильной группой, которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкильной группы);
F6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и C1-6алкоксикарбонильной группы);
F7) C1-6алкоксикарбонильную группу;
F8) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
F9) группу, представленную следующей общей формулой (Fa'):
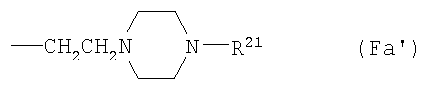
где R21 представляет собой C1-6алкоксикарбонильную группу; фенил-C1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкильной группы); или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
F10) 1-замещенную-4-пиперидильную группу, представленную следующей общей формулой (Fb'):

где R22 представляет собой C1-6алкоксикарбонильную группу; фенил-C1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
F11) 2-[4-(4-трифторметилфенокси)-1-пиперидинил]этильную группу;
F12) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через другие гетероатомы или атомы углерода с образованием гетероциклического кольца, показанного в любом из пп. (F12-1)-(F12-10), представленных ниже:
(F12-1) пиперазинильная группа, представленная следующей общей формулой (Fc'):
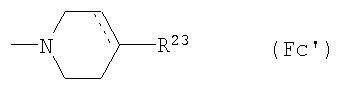
где пунктирная линия указывает на то, что связь может быть двойной связью, и R23 представляет собой:
(Fc1) C1-6алкильную группу;
(Fc2) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fc3) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc4) фенил-С1-6алкоксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fс5) 4-бифенилил-С1-6алкоксигруппу;
(Fc6) фенил-С3-6алкенилоксигруппу, которая может быть замещена в фенильном кольце атомом галогена;
(Fc7) феноксигруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc8) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fc9) C1-6алкоксикарбонильную группу;
(Fc10) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкоксигруппой);
(Fc11) фенил-С1-6алкилкарбамоильную группу, в которой атом галогена может быть в качестве заместителя в фенильном кольце;
(Fc12) фенилкарбамоильную группу, в которой атом галогена может быть в качестве заместителя в фенильном кольце;
(Fc13) фенилтиогруппу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкоксигруппой);
(Fc14) фенилсульфоксидную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкоксигруппой);
(Fc15) пиридилметоксигруппу; или
(Fc16) группу, представленную следующей общей формулой (Fca'):

где каждый из R24 и R25 представляет собой
(Fca1) атом водорода;
(Fca2) C1-6алкильную группу;
(Fca3) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы);
(Fca5) C1-6алканоильную группу;
(Fca6) фенилацетильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fca7) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fca8) C1-6алкоксикарбонильную группу;
(Fca9) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fca10) фенилкарбамоильную группу (которая может быть замещена по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой в фенильном кольце);
(Fca11) 1-(4-трифторметилфенил)-4-пиперидинилоксикарбонильную группу; или
(Fca12) R24 и R25 могут образовывать пиперидиновое кольцо через смежный с ними атом азота,
(F12-2) 4-замещенная-1-пиперазинильная группа, представленная следующей общей формулой (Fd'):
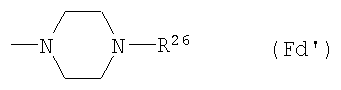
где R26 представляет собой
(Fd1) атом водорода;
(Fd2) C1-6алкильную группу;
(Fd3) С5-8циклоалкильную группу;
(Fd4) С5-8циклоалкил-С1-6алкильную группу;
(Fd5) С1-6алкоксикарбонил-С1-6алкильную группу;
(Fd6) циннамильную группу;
(Fd7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена; цианогруппы; галогензамещенной или незамещенной C1-6алкильной группы; циклогексильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; диметиламиногруппы; C1-6алкоксикарбонильной группы; феноксигруппы; фенил-С1-6алкильной группы; стирильной группы; 3-пиридильной группы; 1-имидазолильной группы и 1-пиперидиногруппы);
(Fd8) бифенилилметильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и диметиламиногруппы);
(Fd9) 1- или 2-нафтилметильную группу;
(Fd10) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; цианогруппы; диметиламиногруппы; галогензамещенной или незамещенной С1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; С1-6алкоксикарбонильной группы и карбоксильной группы);
(Fd11) бифенилильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенных или незамещенных C1-6алкильных групп);
(Fd12) аминогруппу, аминогруппу, замещенную С1-6алкоксикарбонильной группой, бензиламиногруппой, трифторметилбензиламиногруппу или фениламиногруппу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной C1-6алкильной группы и атома галогена);
(Fd13) 4-хлорбензоилметильную группу;
(Fd14) фенилкарбамоилметильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой);
(Fd15) 4- или 5-тиазолилметильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы);
(Fd16) 4-оксазолилметильную группу (которая может быть замещена в оксазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы);
(Fd17) 2-индолилметильную группу;
(Fd18) 2-фурилметильную группу (которая может быть замещена в фурановом кольце по крайней мере одной галогензамещенной или незамещенной фенильной группой);
(Fd19) 4- или 5-имидазолилметильную группу (которая может быть замещена в имидазольном кольце фенильной группой);
(Fd20) 2-хинолилметильную группу;
(Fd21) 5-(1Н)-тетразолильную группу (где положение 1 в тетразольном кольце может быть замещено фенильной группой);
(Fd22) 2- или 4-пиримидильную группу, которая может быть замещена фенильной группой;
(Fd23) 2-, 3- или 4-пиридильную группу;
(Fd24) 2-бензоксазолильную группу;
(Fd25) 2-бензотиазолильную группу;
(Fd26) 2-оксо-3-бензоксазолил-С1-6алкильную группу;
(Fd27) фенокси-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd28) фенилтио-С2-6алканоильную группу, которая может быть замещена в фенильном кольце атомом галогена;
(Fd29) фенил-С2-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fd30) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной С1-6алкоксигруппы и C1-6алкиламиногруппы);
(Fd31) 4-бифенилилкарбонильную группу;
(Fd32) 2-, 3- или 4-пиридилкарбонильную группу;
(Fd33) циннамоильную группу, в которой атом галогена может быть в качестве заместителя в фенильном кольце;
(Fd34) фенил-С1-6алкилсульфонильную группу, которая может быть замещена атомом галогена в фенильном кольце;
(Fd35) бензолсульфонильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома хлора и метильной группы);
(Fd36) группу, представленную следующей общей формулой (Fda'):

где R27 представляет собой
(Fda1) галогензамещенную или незамещенную С1-8алкильную группу;
(Fda2) С5-8циклоалкильную группу;
(Fda3) С5-8циклоалкил-С1-6алкильную группу;
(Fda4) С1-6алкокси-С1-6алкильную группу;
(Fda5) С1-6алкиламино-С1-6алкильную группу;
(Fda6) группу, представленную следующей общей формулой (Fdb'):
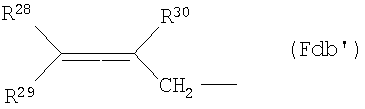
где R28, R29 или R30 соответственно представляет собой атом водорода, C1-6алкильную группу или фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fda7) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце 1-5 группами, выбранными из группы, состоящей из атома галогена; галогензамещенной или незамещенной C1-6алкильной группы; галогензамещенной или незамещенной C1-6алкоксигруппы; галогензамещенной или незамещенной С1-6алкилтиогруппы; фенил-С1-6алкоксигруппы; гидроксигруппы; метилсульфинильной группы; метансульфонильной группы; метансульфонилоксигруппы; цианогруппы; ацетильной группы; бензоильной группы; α,α-диметоксибензильной группы; аминогруппы; нитрогруппы; карбамоильной группы; ацетиламиногруппы; C1-6алкоксикарбонильной группы; C1-6алкиламинокарбонильной группы; C1-6алкоксикарбониламиногруппы; три-C1-6алкилсилоксигруппы; пирролильной группы; тетрагидропиранилоксигруппы и 1-имидазолильной группы);
(Fda8) бифенилил-С1-6алкильную группу;
(Fda9) бензгидрильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, трифторметильной группы и трифторметоксигруппы);
(Fda10) фенокси-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной С1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fda11) 3-(4-трифторметил)фенил-2-пропинильную группу;
(Fda12) 2-, 3- или 4-пиридилметильную группу;
(Fda13) группу, представленную следующей общей формулой (Fdc'):

где R31 представляет собой фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, цианогруппы, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); фенил-C1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fda14) 1-пиперидиноэтильную группу (где положение 4 в пиперидиновом кольце может быть замещено 4-трифторметилфеноксигруппой);
(Fda15) N-метил-N-(4-трифторметокси)фениламиноэтильную группу;
(Fda16) 4-(4-трифторметоксифенил)-1,2,3,6-тетрагидро-1-пиридинилэтильную группу;
(Fda17) 1- или 2-нафтилметильную группу;
(Fda18) 1-, 2-, 3-, 4- или 9-флуоренилметильную группу;
(Fda19) 2-, 3- или 4-пиридилметильную группу;
(Fda20) 2-фурилметильную группу (где положение 4 в фурановом кольце может быть замещено галогензамещенной или незамещенной фенильной группой);
(Fda21) 3-тиенилметильную группу;
(Fda22) 4-оксазолилметильную группу (где положение 2 в оксазолиновом кольце может быть замещено атомом галогена или хлорфенильной группой);
(Fda23) 4-тиазолилметильную группу, которая может быть замещена атомом галогена;
(Fda24) 5-оксадиазолилметильную группу, где положение 2 в оксадиазолиновом кольце может быть замещено галогензамещенной или незамещенной фенильной группой;
(Fda25) 3-пиразолилметильную группу, где положение 1 в пиразолиновом кольце может быть замещено галогензамещенной или незамещенной C1-6 фенильной группой;
(Fda26) 2- или 3-бензотиофенилметильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fda27) бензоксазол-2-илметильную группу, которая может быть замещена атомом галогена в бензольном кольце;
(Fda28) 2-тиенилметильную группу, которая может быть замещена атомом галогена;
(Fda29) 2-бензтиазолилметильную группу;
(Fda30) 2-(5-хлор)бензофуранилметильную группу;
(Fda31) 3,3-диметил-2-оксо-5-индолинилметильную группу (где положение 1 в индолиновом кольце может быть замещено C1-6алкильной группой);
(Fda32) 2-оксо-6-бензоксазолилметильную группу (где положение 1 в бензоксазолиновом кольце может быть замещено C1-6алкильной группой);
(Fda33) 7-хроменилметильную группу;
(Fda34) 2-оксо-1,2,3,4-тетрагидро-6-хинолилметильную группу (где положение 1 в хинолиновом кольце может быть замещено C1-6алкильной группой);
(Fda35) 5-тиазолилметильную группу (которая может быть замещена в тиазольном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы); или
(Fda36) 5-(1Н)-тетразолил-С1-6алкильную группу (где положение 1 в тетразольном кольце может быть замещено группой, выбранной из группы, состоящей из галогензамещенной или незамещенной фенильной группы и C1-6алкильной группы),
(Fd37) группу, представленную следующей общей формулой (Fe'):

где Z представляет собой -С=O или -C=S и R32 и R33, одинаковые или различные, представляют собой любое из следующего:
(Fe1) атом водорода;
(Fe2) C1-6алкильную группу;
(Fe3) С5-8циклоалкильную группу;
(Fe4) фенил-С1-6алкильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fe5) фенил-С2-6алкенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Fe6) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); и
(Fe7) R32 и R33 могут быть связаны друг с другом вместе со смежными с ними атомами азота через другие атомы углерода с образованием пиперидинового кольца или 1,2,3,6-тетрагидропиридинового кольца, где положение 4 в пиперидиновом кольце или 1,2,3,6-тетрагидропиридиновом кольце может быть замещено фенильной группой, причем фенильная группа может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена и галогензамещенной или незамещенной C1-6алкильной группы, или
(Fd38) группу, представленную следующей общей формулой (Ff'):

где R34 представляет собой атом водорода или C1-6 низшую алкильную группу и R35 представляет собой
(Ff1) С5-8циклоалкильную группу;
(Ff2) С5-8циклоалкенильную группу;
(Ff3) группу, представленную следующей общей формулой (Ffa'):

где каждый из R36, R37 и R38 представляет собой атом водорода; C1-6алкильную группу; фенильную группу (которая может быть замещена в фенильном кольце по крайней мере 1-5 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, метилендиоксигруппы, метансульфонильной группы, галогензамещенной или незамещенной C1-6алкилтиогруппы, нитрогруппы и ацетиламиногруппы); 2-бензофуранильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной С1-6алкоксигруппы); 4-бифенилильную группу; 2-фурильную группу, которая может быть замещена 4-хлорфенильной группой; или 2-(4-хлорфенил)-4-тиазолильную группу;
(Ff4) фенильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена; галогензамещенной или незамещенной C1-6алкильной группы; С5-8циклоалкильной группы; гидроксигруппы; галогензамещенной или незамещенной С1-8алкоксигруппы; С5-8циклоалкоксигруппы; метилендиоксигруппы; этилендиоксигруппы; цианогруппы; нитрогруппы; циннамильной группы; C1-6алканоилоксигруппы; C1-6алкиламиногруппы; метансульфониламиногруппы; фенил-C1-6алкоксигруппы; феноксигруппы; ди(С1-6алкил)аминогруппы; дифениламиногруппы; ди(С1-6алкил)амино-С1-6алкоксигруппы; метоксикарбонильной группы; С1-6алкоксикарбонил-С1-6алкоксигруппы; C1-6алкилтиогруппы; пирролильной группы; 1-имидазолильной группы; пиперидиногруппы; морфолиногруппы; пирролидинильной группы; 2-тиенильной группы; 2-бензофурильной группы; 4-пиперазинильной группы, где положение 1 может быть замещено группой, выбранной из группы, состоящей из C1-6алкильной группы, фенил-С1-6алкильной группы, бензоильной группы и бензоильной группы, замещенной C1-6алкильной группой; 2-оксо-3-хинолильной группы, которая может быть замещена в бензольном кольце C1-6алкоксигруппой; 4-(карбостирил-1-ил)пиперидинил-1-карбонильной группы; и триазолильной группы);
(Ff5) 1- или 2-нафтильную группу, замещенную атомом галогена, галогензамещенной или незамещенной C1-6алкоксигруппой или диметиламиногруппой;
(Ff6) 3- или 4-бифенилильную группу (которая может быть замещена в бифенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы)
(Ff7) 2-флуоренильную группу; 3-пиренильную группу;
(Ff8) 2-бензофуранильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
(Ff9) 2- или 3-бензотиофенильную группу (которая может быть замещена в бензольном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы; или положение 3 или 2 в тиофеновом кольце может быть замещено C1-6алкильной группой);
(Ff10) 2-, 3- или 4-пиридильную группу (которая может быть замещена в пиридильной группе по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, фенильной группы (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы), 2-фурильной группы, 3-фурильной группы, 2-тиенильной группы и 3-тиенильной группы);
(Ff11) 2- или 3-фурильную группу (которая может быть замещена в фурановом кольце 1-3 группами, выбранными из группы, состоящей из C1-6алкильной группы, нитрогруппы и фенильной группы (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы и нитрогруппы));
(Ff12) 2-(2-метоксифенил)бензотиазол-5-ильную группу;
(Ff13) 2-тиенильную группу; 3-тиенильную группу; 4-бром-2-тиенильную группу; 5-хлор-2-тиенильную группу; 5-этил-2-тиенильную группу; 3-метил-2-тиенильную группу; 5-нитро-2-тиенильную группу; 5-(1-метил-3-трифторметил-5-пиразолил)-2-тиенильную группу; 5-(1-метил-5-трифторметил-3-пиразолил)-2-тиенильную группу; 2,2'-битиен-5-ильную группу; 5'-бром-2,2'-битиен-5-ильную группу;
(Ff14) 1-(4-метилбензолсульфонил)индол-3-ильную группу; 1-бензилиндол-3-ильную группу; 6-метоксикарбонилиндол-3-ильную группу; 2-фенилиндол-3-ильную группу;
(Ff15) 1-(3-трифторметил)фенил-2,5-диметил-3-пирролильную группу;
(Ff16) 6-кумарильную группу;
(Ff17) 2-(2-тиенил)-5-бензимидазолильную группу; 6-бензимидазолильную группу;
(Ff18) 2-(4-хлорфенил)-4-оксазолильную группу;
(Ff19) 2-фенил-4-тиазолильную группу; 2-(4-хлорфенил)-4-тиазолильную группу; 2-(4-нитрофенил)-4-тиазолильную группу; 2-(4-бифенилил)-4-тиазолильную группу;
(Ff20) 2-тиазолильную группу;
(Ff21) 2- или 4-хинолинильную группу;
(Ff22) 8-метокси-3,4-дигидрокарбостирил-5-ильную группу;
8-метокси-1-метил-3,4-дигидрокарбостирил-5-ильную группу;
8-бензилокси-3,4-дигидрокарбостирил-5-ильную группу;
8-метоксикарбостирил-5-ильную группу;
8-метокси-1-метилкарбостирил-5-ильную группу;
8-бензилоксикарбостирил-5 -ильную группу;
8-метокси-3,4-дигидрокарбостирил-6-ильную группу;
8-метокси-1-метил-3,4-дигидрокарбостирил-6-ильную группу;
8-бензилокси-3,4-дигидрокарбостирил-6-ильную группу;
8-метоксикарбостирил-6-ильную группу;
8-метокси-1-метилкарбостирил-6-ильную группу;
8-бензилоксикарбостирил-6-ильную группу;
(Ff23) 6-имидазо[2,1-b]тиазолильную группу;
(Ff24) 2-имидазо[2,1-а]пиридильную группу;
(Ff25) 2,2-диметил-6-хроманильную группу или
(Ff26) 2,3-дигидро-5-бензофуранильную группу,
(F12-3) морфолиногруппа;
(F12-4) 1-имидазолильная группа;
(F12-5) 1,4-диокса-8-азаспиро[4,5]-8-децильная группа;
(F12-6) 4-третбутоксикарбонил-1-гомопиперазинильная группа;
4-бензилоксикарбонил-1-гомопиперазинильная группа;
4-(4-бифенилил)-1-гомопиперазинильная группа;
(F12-7) 1-третбутил-2-пиперазинон-4-ильная группа;
1-(4-трифторметилбензил)-2-пиперазинон-4-ильная группа;
(F12-8) 4-оксо-1-пиперидинильная группа;
(F12-9) 2-(4-трифторметоксифеноксиметил)пирролидин-1-ильная группа; и
(F12-10) 2-изоиндолинильная группа, и
F13) кроме того, R19 и R20 могут быть связаны друг с другом вместе со смежными с ними атомами азота непосредственно или через гетероатомы с образованием циклического имида или амида, показанного в любом из пп.(F13-1)-(13-11), представленных ниже:
(F13-1) 2-сукцинимидная группа;
(F13-2) 2-оксооксазолин-3-ильная группа;
(F13-3) 2-оксобензо-1,3-оксазолидин-3-ильная группа;
5-бром-2-оксобензо-1,3-оксазолидин-3-ильная группа;
5-хлор-2-оксобензо-1,3-оксазолидин-3-ильная группа;
5-фенил-2-оксобензо-1,3-оксазолидин-3-ильная группа;
(F13-4) 2-оксоимидазолидин-1-ильная группа (где положение 3 в 2-оксоимидазолидин-1-ильной группе может быть замещено фенил-С1-6алкильной группой (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена и метоксигруппы) или фенильной группой);
(F13-5) 2-оксобензимидазолидин-1-ильная группа (которая может быть замещена в бензольном кольце атомом галогена, галогензамещенной или незамещенной C1-6алкильной группой, диметиламиногруппой или этоксикарбонильной группой; или положение 3 в имидазолидиновом кольце может быть замещено 4-пиперидильной группой, которая может быть замещена группой, выбранной из группы, состоящей из C1-6алкильной группы, фенильной группы, где 1-3 атома галогена могут быть в фенильном кольце в качестве заместителя, третбутоксикарбонильной группы и бензилоксикарбонильной группы);
(F13-6) фталимид-2-ильная группа;
(F13-7) оксоиндол-1-ильная группа (где положение 3 может быть замещено 2 метильными группами или атомами фтора;
(F13-8) бензосульфимид-2-ильная группа;
(F13-9) 1Н-2,4-бензоксазин-3(4Н)-он-4-ильная группа;
(F13-10) группа, представленная следующей общей формулой (Fga'):

где R39 представляет собой атом водорода; галогензамещенный или незамещенный фенил-С1-6алкильную группу, галогензамещенную или незамещенную феноксиметильную группу; галогензамещенную или незамещенную стирильную группу; фенильную группу, которая может быть замещена по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы; бифенилильную группу; 4-пиридильную группу или 2-пиразинильную группу, и
(F13-11) 5-(4-трифторметилбензилиден)-1,3-тиазолидин-2,4-дион-3-ильная группа;
группа, представленная следующей общей формулой (G'):
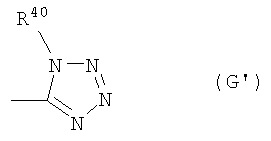
где R40 представляет собой C1-6алкильную группу или галогензамещенную или незамещенную фенильную группу,
циклическая спирогруппа, представленная следующей общей формулой (H'):
где R41 представляет собой
H1) атом водорода;
Н2) C1-6алкильную группу;
Н3) фенил-С1-6алкильную группу или 4-бифенилил-С1-6алкильную группу;
Н4) фенильную группу (которая может быть замещена галогензамещенной или незамещенной C1-6алкильной группой;
Н5) 4-замещенный-1-пиперазинил-С1-6алкильную группу (где заместителем в положении 4 является C1-6алкоксикарбонильная группа, 4-бифенилилметоксикарбонильная группа или бензилоксикарбонильная группа, причем бензилоксикарбонильная группа может быть замещена в бензольном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
Н6) 4-замещенный-1-пиперазинилкарбонил-С1-6алкильную группу, где положение 4 замещено C1-6алкоксикарбонильной группой, 4-трифторметилбензилоксикарбонильной группой или бифенилилметильной группой;
Н7) 4-трифторметилфенилкарбамоил-С1-6алкильную группу;
Н8) 2-бензоксазолон-1-илпропильную группу;
Н9) 2-бензотиазолильную группу;
Н10) 1-фенил-5-тетразолильную группу;
H11) метансульфонильную группу;
H12) бензолсульфонильную или п-толуолсульфонильную группу;
Н13) фенилтиокарбамоильную группу, где положение 4 в фенильном кольце может быть замещено атомом галогена;
H14) С1-8алкоксикарбонильную группу;
H15) фенил-С1-6алкоксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из атома галогена, C1-6алкоксикарбонильной группы, С1-6алкоксикарбониламиногруппы, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, нитрогруппы и метилтиогруппы);
H16) бензгидрилоксикарбонильную группу (которая может быть замещена в фенильном кольце 1-4 атомами галогена);
H17) 4-бифенилилметоксикарбонильную группу;
H18) нафтилметоксикарбонильную группу;
H19) пиридилметоксикарбонильную группу;
Н20) метоксиэтоксикарбонильную группу;
Н21) 2-(1-пиперазинил)этоксикарбонильную группу, где положение 4 может быть замещено C1-6алкоксикарбонильной группой или галогензамещенный или незамещенный фенил-С1-6алкоксикарбонильной группой;
Н22) феноксикарбонильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из C1-6алкильной группы и C1-6алкоксигруппы);
Н23) C1-6алканоильную группу;
Н24) бензоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой);
Н25) фенил-С1-6алканоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной галогензамещенной или незамещенной C1-6алкильной группой);
Н26) фенокси-С2-6алканоильную группу (которая может быть замещена 1-3 атомами галогена в фенильном кольце);
Н27) 4-замещенный-1-пиперазинил-С2-6алканоильную группу (где заместителем в положении 4 является C1-6алканоильная группа, фенил-С1-6алкильная группа, 4-бифенилилметильная группа, фенил-С1-6алкоксикарбонильная группа, фенилкарбамоилметильная группа, фенилкарбамоильная группа или 2-бензоксазолильная группа, причем фенильное кольцо каждой из указанных фенил-С1-6алкильной группы, фенил-С1-6алкоксикарбонильной группы, фенилкарбамоилметильной группы и фенилкарбамоильной группы может быть замещено 1-3 группами, выбранными из группы, состоящей из атома галогена, галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы);
Н28) фенилкарбамоильную группу (которая может быть замещена в фенильном кольце 1-3 группами, выбранными из группы, состоящей из атома галогена, диметиламиногруппы, карбоксильной группы, C1-6алкоксикарбонильной группы, галогензамещенной или незамещенной C1-6алкильной группы, галогензамещенной или незамещенной C1-6алкоксигруппы, 4-метил-1-пиперазинильной группы и морфолиногруппы);
Н29) бензилкарбамоильную группу (которая может быть замещена в фенильном кольце по крайней мере одной группой, выбранной из группы, состоящей из галогензамещенной или незамещенной C1-6алкильной группы и галогензамещенной или незамещенной C1-6алкоксигруппы); или
Н30) 4-замещенную-1-пиперазинилкарбонильную группу, где положение 4 замещено третбутоксикарбонильной группой, 4-трифторметилбензилоксикарбонильной группой или 4-трифторметилбензильной группой,
при условии, что в указанной выше формуле (1'), когда R1 представляет собой атом водорода и R2 представляет собой группу, представленную выше общей формулой (F'),
нельзя, чтобы R19 представлял собой атом водорода и R20 представлял собой третбутоксикарбонильную группу.
3-(4-трифторметилфенил)-2-пропенил-(S)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат,
3-(4-трифторметилфенил)-2-пропенил-(R)-4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметил)пиперазин-1-карбоксилат,
2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо [2,1-b] оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b] оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b] оксазол,
6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1 -Ь]оксазол,
2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
4-толуолсульфонат(R)-2-метил-6-нитро-2-{4-[3-(4-трифторметоксифенокси)-8-азабицикло[3.2.1]октан-8-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола,
2-метил-6-нитро-2-[4-(4-трифторметоксибензилиденамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметоксибензилиденамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-[4-(5-хлорбензофуран-2-илметиленамино)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(5-хлорбензофуран-2-илметиленамино)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4-трифторметилфенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-[4-(4-трифторметоксифенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(4-трифторметоксифенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-[4-(4-трифторметоксифенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-[4-(4-хлорфенил)пиперазин-1-илметил]-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4'-трифторметилбифенил-4-илметил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-хлорбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-хлорбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-хлорбензил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-Ь]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(3,4-дихлорбензилоксикарбонил)пиперазин-1-ил]феноксиметил}2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(3,4-дихлорбензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(3,4-дихлорбензилоксикарбонил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4-трифторметоксифенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметоксифенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4-трифторметоксифенокси)пиперидин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(4-трифторметилфенил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(4-трифторметилфенил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(4-трифторметилфенил)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(5-трифторметоксилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(5-трифторметоксилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(5-трифторметоксилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-[4-(5-трифторметилбензофуран-2-илметиленамино)пиперазин-1-илметил]-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-хлорфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-хлорфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-хлорфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[4-(4-трифторметилфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
2-метил-6-нитро-2-{4-[1-(4-хлорбензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол,
(S)-2-метил-6-нитро-2-{4-[1-(4-хлорбензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол или
(R)-2-метил-6-нитро-2-{4-[1-(4-хлорбензил)пиперидин-4-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.

где R1, R2 и n являются такими, как определено в п.1,
указанный способ включает реакцию производного 4-нитроимидазола, представленного следующей общей формулой (2):
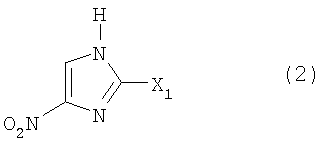
где X1 представляет собой атом галогена или нитрогруппу,
с эпоксидным соединением, представленным следующей общей формулой (3а):

где R1, R2 и n являются такими, как определено в п.1,
с получением соединения, представленного следующей общей формулой (4а):

где R1, R2 и n являются такими, как определено в п.1, и X1 представляет собой атом галогена или нитрогруппу,
и последующее замыкание кольца полученного соединения, представленного выше общей формулой (4а).

где R1 является таким, как определено в п.1, и R2a представляет собой группу, представленную общей формулой (А), (В), (Е) или (F) по п.1,
указанный способ включает реакцию соединения, представленного следующей общей формулой (3b):
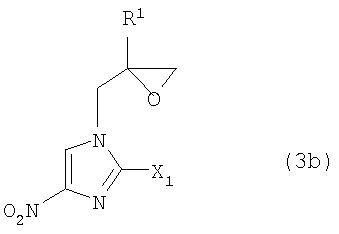
где R1 является таким, как определено в п.1, и X1 представляет собой атом галогена или нитрогруппу,
с соединением (5), представленным следующей общей формулой R2aH (5), или его солью, где R2a означает группу, представленную общей формулой (А), (В), (Е) или (F) по п.1, с получением соединения, представленного следующей общей формулой (4b):

где R1 является таким, как определено в п.1, R2a представляет собой группу, представленную общей формулой (А), (В), (Е) или (F) по п.1, и X1 представляет собой атом галогена или нитрогруппу,
и последующее замыкание кольца полученного соединения, представленного выше общей формулой (4b).
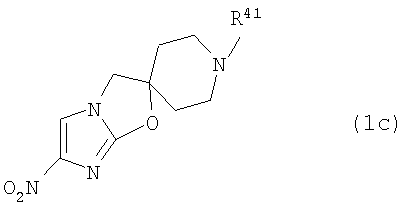
где R41 является таким, как определено в п.1,
указанный способ включает реакцию соединения, представленного следующей общей формулой (2):

где X1 представляет собой атом галогена или нитрогруппу,
с соединением, представленным следующей общей формулой (3с):

где R41 является таким, как определено в п.1, с получением соединения, представленного следующей общей формулой (4с):
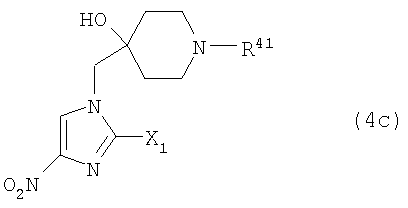
где R41 является таким, как определено в п.1, и X1 представляет собой атом галогена или нитрогруппу,
и последующее замыкание кольца полученного соединения, представленного выше общей формулой (4с).
| SEHGAL RAJ К; ЕТ AL, POTENTIAL RADIOSENSITIZING AGENTS | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| SYNTHESIS AND BIOLOGICAL ACTIVITY OF DERIVATIVES OF DINITRO IMIDAZOLE WITH OXIRANES, JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY, US - ISSN 0022-2623,1981, Vol: 24, Nr.5, Pages: 601-604 | |||
| NAGARAJAN К; ЕТ AL, NITROIMIDAZOLES | |||
| XXI | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2008-06-10—Публикация
2003-10-10—Подача