Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим композициям.
Предшествующий уровень техники
Известно, что 2,3-дигидро-6-нитро[2,1-b]оксазольные соединения, представленные нижеприведенной общей формулой (1), их оптически активные изомеры и их фармацевтически приемлемые соли (которые все далее просто называются «оксазольные соединения»), проявляют превосходное бактерицидное действие против туберкулезной микробактерии, мультирезистентной туберкулезной микробактерии и атипичной кислотоустойчивой бактерии (см. публикацию не прошедшей экспертизы заявки на патент Японии No. 2004-149527 и WO 2005-042542):
Общая формула (1):
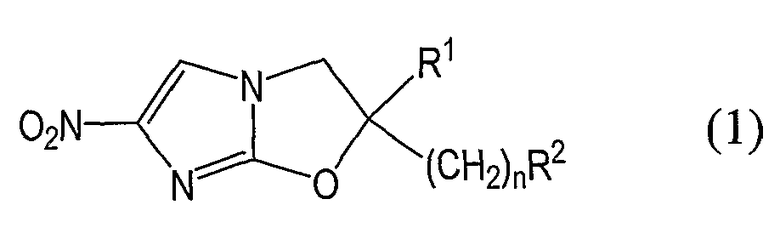
где R1 означает атом водорода или С1-6алкильную группу; n является целым числом от 0 до 6; и R2 означает любую из групп, которые представлены далее общими формулами от (А) до (F):
группы, представленные общей формулой (А):
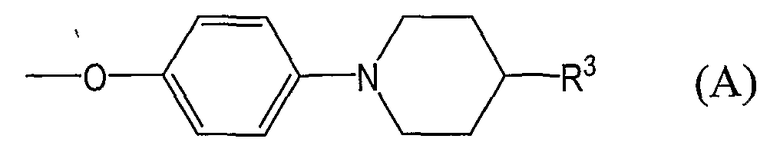
где R3 означает любую из групп от (1) до (6), указанных далее:
(1) феноксигруппы, необязательно замещенные на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(2) фенил-С1-6алкоксигруппы, необязательно замещенные на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(3) -NR4R5 группы, где R4 означает C1-6алкильную группу и R5 означает фенильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(4) фенил-С1-6алкильные группы, необязательно замещенные на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(5) фенокси С1-6алкильные группы, необязательно замещенные на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп; и
(6) бензофурил-С1-6алкильные группы, необязательно замещенные на бензофурановом кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (В):
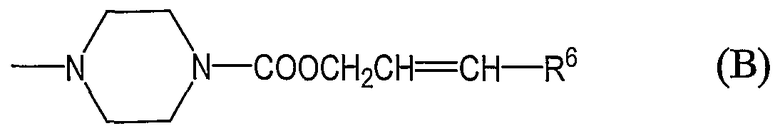
где R6 означает фенильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (С):
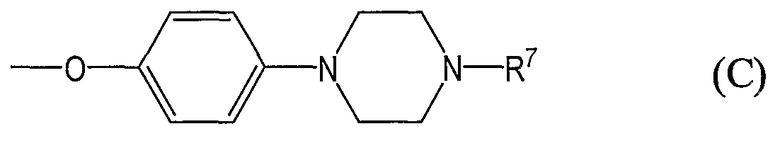
где R7 означает фенил С2-10алкенильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп или означает бифенил-С1-6алкильную группу, необязательно замещенную на одном или обоих фенильных кольцах одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (D):
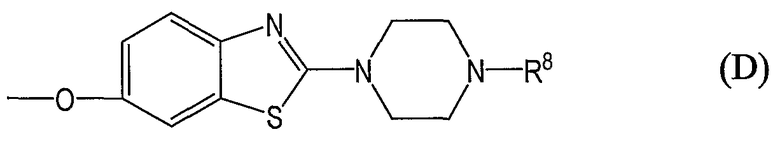
где R8 означает фенил-С1-6алкильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (Е):
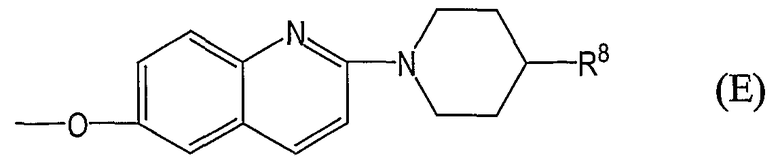
где R8 аналогичен вышеуказанному; и
группы, представленные общей формулой (F):
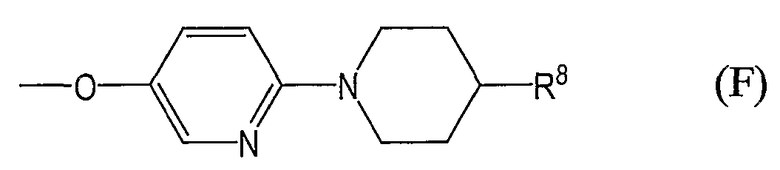
где R8 аналогичен вышеуказанному.
Оксазольные соединения, представленные выше общей формулой (1), имеет низкую растворимость в воде и, следовательно, существует потребность в улучшении их растворимости.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧА, НА РЕШЕНИЕ КОТОРОЙ НАПРАВЛЕННО НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Задача настоящего изобретения состоит в обеспечении фармацевтической композиции с улучшенной растворимостью в воде представленного выше оксазольного соединения.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЗАДАЧИ
Авторы настоящего изобретения провели обширные исследования, направленные на решение указанной задачи и обнаружили, что растворимость в воде оксазольных соединений может быть улучшена с помощью добавления к ним определенного соединения целлюлозы, обеспечивая, таким образом, желаемые композиции. Настоящее изобретение было выполнено основываясь на данных результатах.
Настоящее изобретение обеспечивает фармацевтические композиции, как указано далее в пунктах 1-15:
Пункт 1. Фармацевтическая композиция, содержащая:
(I) по крайней мере, одно оксазольное соединение, которое выбрано из группы, состоящей из 2,3-дигидро-6-нитроимидазо[2,1-b]оксазольных соединений, представленных общей формулой (1), их оптически активных изомеров и их фармацевтически приемлемых солей:
общая формула (1):

где R1 означает атом водорода или С1-6алкильную группу; n является целым числом от 0 до 6; и R2 означает любую из групп, которые представлены далее общими формулами от (А) до (F):
группы, представленные общей формулой (А):

где R3 означает любую из групп от (1) до (6), указанных далее:
(1) феноксигруппы, необязательно замещенные на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(2) фенил-С1-6алкоксигруппы, необязательно замещенные на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(3) -NR4R5 группы, где R4 означает C1-6алкильную группу и R5 означает фенильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(4) фенил-С1-6алкильные группы, необязательно замещенные на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
(5) фенокси-С1-6алкильные группы, необязательно замещенные на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп; и
(6) бензофурил-С1-6алкильные группы, необязательно замещенные на бензофурановом кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (В):
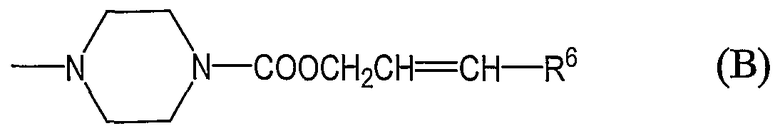
где R6 означает фенильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (С):

где R7 означает фенил-С2-10алкенильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп или означает бифенил-С1-6алкильную группу, необязательно замещенную на одном или обоих фенильных кольцах одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (D):

где R8 означает фенил-С1-6алкильную группу, необязательно замещенную на фенильном кольце одним или более заместителями, предпочтительно от 1 до 3, выбранными из группы, состоящей из атомов галогена, галогензамещенных или незамещенных С1-6алкильных групп и галогензамещенных или незамещенных С1-6алкоксигрупп;
группы, представленные общей формулой (Е):

где R8 аналогичен вышеуказанному; и
группы, представленные общей формулой (F):

где R8 аналогичен вышеуказанному; и
(II) по крайней мере, одно соединение целлюлозы, выбранное из группы, состоящей из фталата гидроксипропилметилцеллюлозы и ацетата сукцината гидроксипропилметилцеллюлозы.
Пункт 2. Фармацевтическая композиция по п.1, где оксазольным соединением является 2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.
Пункт 3. Фармацевтическая композиция по п.1, где оксазольным соединением является 6-нитро-2-{4-[4-(4-трифторметоксибензилокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.
Пункт 4. Фармацевтическая композиция по п.1, где оксазольным соединением является 2-метил-6-нитро-2-(4-{4-[3-(4-трифторметоксифенил)-2-пропенил]пиперазин-1-ил}феноксиметил)-2,3-дигидроимидазо[2,1-b]оксазол.
Пункт 5. Фармацевтическая композиция по п.1, где оксазольным соединением является 2-метил-6-нитро-2-{4-[4-(4-трифторметилфеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.
Пункт 6. Фармацевтическая композиция по п.1, дополнительно содержащая витамин Е.
Пункт 7. Фармацевтическая композиция по п.6, где витамином Е является dl-α-токоферол.
Пункт 8. Фармацевтическая композиция по п.2, дополнительно содержащая витамин Е.
Пункт 9. Фармацевтическая композиция по п.8, где витамином Е является dl-α-токоферол.
Пункт 10. Фармацевтическая композиция по п.3, дополнительно содержащая витамин Е.
Пункт 11. Фармацевтическая композиция по п.10, где витамином Е является dl-α-токоферол.
Пункт 12. Фармацевтическая композиция по п.4, дополнительно содержащая витамин Е.
Пункт 13. Фармацевтическая композиция по п.12, где витамином Е является dl-α-токоферол.
Пункт 14. Фармацевтическая композиция по п.5, дополнительно содержащая витамин Е.
Пункт 15. Фармацевтическая композиция по п.14, где витамином Е является dl-α-токоферол.
Оксазольным соединением, используемым в фармацевтической композиции по настоящему изобретению, является 2,3-дигидро-6-нитроимидазо[2,1-b]оксазольное соединение, представленное вышеуказанной общей формулой (1).
Оксазольные соединения, представленные выше общей формулой (1), включают следующие соединения:
2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение А»);
3-(4-трифторметилфенил)-2-пропениловый эфир 4-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-ил-метил)пиперазин-1-карбоновой кислоты (в дальнейшем «соединение В»);
2-(4-{4-[N-(4-хлорфенил)-N-метил-амино]пиперидин-1-ил}феноксиметил)-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение С»);
2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение D»);
2-{4-[4-(3,4-дихлорбензил)пиперидин-1-ил]феноксиметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение Е»);
6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение F»);
6-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)-2-[4-(4-трифторметоксифенокси)пиперазин-1-ил]бензотиазол (в дальнейшем «соединение G»);
6-нитро-2-{4-[4-(4-трифторметоксибензилокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение H»);
2-метил-6-нитро-2-(4-{4-[2-(4-трифторметоксифенил)этил]пиперидин-1-ил}феноксиметил)-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение I»);
2-{4-[4-(4-хлорфеноксиметил)пиперидин-1-ил]феноксиметил}-2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение J»);
6-нитро-2-{4-[4-(4-трифторметоксифеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение K»);
6-нитро-2-{4-[4-(4-трифторметоксибензил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение L»);
2-метил-6-нитро-2-{4-[4-(4-трифторметоксибензилокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение M»);
2-метил-6-нитро-2-(4-{4-[3-(4-трифторметоксифенил)-2-пропенил]пиперазин-1-ил}феноксиметил)-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение N»);
2-{4-[4-(4-хлорфеноксиметил)пиперидин-1-ил]феноксиметил}-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение O»);
6-нитро-2-{4-[4-(4-трифторметилфеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение P»);
2-метил-6-нитро-2-{4-[4-(4-трифторметилфеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение Q»);
2-метил-6-нитро-2-{4-[4-(4-трифторметоксифеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение R»);
6-нитро-2-(4-{4-[4-(4-трифторметоксифенил)пропил]пиперидин-1-ил}феноксиметил)-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение S»);
5-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)-2-[4-(4-трифторметоксибензил)пиперидин-1-ил]пиридин (в дальнейшем «соединение T»);
2-метил-6-нитро-2-{4-[4-(5-трифторметилбензофуран-2-илметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение U»);
6-(2-метил-6-нитро-2,3-дигидроимидазо[2,1-b]оксазол-2-илметокси)-2-[4-(4-трифторметоксибензил)пиперидин-1-ил]хинолин (в дальнейшем «соединение V»);
6-нитро-2-{4-[4-(4`-трифторметилбифенил-4-илметил)пиперазин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол (в дальнейшем «соединение W»).
В настоящем изобретении предпочтительно используется, по крайней мере, одно соединение, выбранное из группы, состоящей из вышеуказанных оксазольных соединений, их оптически активных изомеров и их фармацевтически приемлемых солей.
Оптически активные изомеры оксазольных соединений включают соединения в R- и S-конфигурации.
Примеры фармацевтически приемлемых солей включают гидрохлориды, цитраты, сукцинаты, фумараты и т.п.
Предпочтительным оксазольным соединением является, по крайней мере, одно соединение, выбранное из группы, состоящей из соединения А, соединения Н, соединения N и соединения Q, а также в виде их оптически активных изомеров и их фармацевтически приемлемых солей.
Соединение целлюлозы, которое используется в настоящей фармацевтической композиции, представляет собой, по крайней мере, одно соединение, выбранное из группы, состоящей из фталата гидроксипропилметилцеллюлозы и ацетата сукцината гидроксипропилметилцеллюлозы. Добавление такого соединения целлюлозы позволяет значительно улучшить растворимость в воде оксазольного соединения.
Фталат гидроксипропилметилцеллюлозы является полимером, полученным полуэтерификацией фталевой кислоты гидроксипропилцеллюлозой. Фталат гидроксипропилметилцеллюлозы является известным соединением и, например, доступно от Shin-Etsu Chemical Co., Ltd. под торговыми названиями НР-55, HP-55S и HP-50. Все эти коммерческие продукты могут быть использованы в настоящем изобретении. Фталат гидроксипропилметилцеллюлозы замещен по гидроксильным группам от 18 до 24% метоксигруппами; от 5 до 10% гидроксипропильными группами; и от 21 до 35% карбоксибензоильными группами.
Ацетат сукцинат гидроксипропилметилцеллюлозы является полимером, полученным этерификацией уксусной кислоты и янтарной кислоты гидроксипропилцеллюлозой. Ацетат сукцинат гидроксипропилметилцеллюлозы является известным соединением и, например, доступно от Shin-Etsu Chemical Co., Ltd. под торговыми названиями AS-L, AS-M и AS-H. Все эти коммерческие продукты могут быть использованы в настоящем изобретении. Ацетат сукцинат гидроксипропилметилцеллюлозы замещен по гидроксильным группам от 20 до 26% метоксигруппами; от 5 до 10% гидроксипропильными группами; от 5 до 14% ацетильными группами; и от 4 до 18% сукцинильными группами.
Среди вышеуказанных соединений целлюлозы предпочтительными являются такие соединения, которые растворимы в буферных растворах McIlavaine с рН от 5 до 5,5. Такие соединения целлюлозы включают продукты НР-55, НР-55S, НР-50 и AS-L.
Среди таких соединений целлюлозы наиболее предпочтительными являются такие соединения, которые растворимы в буферных растворах McIlavaine с рН 5. Такие соединения целлюлозы включают продукт НР-50.
Для достижения исключительного эффекта настоящего изобретения соотношение ингредиента (II) к ингредиенту (I) в настоящей фармацевтической композиции таково, что ингредиент (II) обычно используется в количестве, составляющим примерно 0,5 массовых долей или более, предпочтительно примерно 1 массовую долю или более и более предпочтительно примерно 1,5 массовых долей на массовую долю ингредиента (I). Рассматривая дозированные формы настоящих фармацевтических композиций, ингредиент (II) обычно используется в количестве примерно 15 массовых долей или менее, предпочтительно примерно 10 массовых долей или менее, более предпочтительно примерно 5 массовых долей и еще более предпочтительно примерно 3 массовых доли на массовую долю ингредиента (I).
Фармацевтическая композиция может также включать витамин Е.
Примеры форм витамина Е включают природные и синтетические формы витамина Е, например, такие как d-α-токоферол, d-δ-токоферол, d-α-токоферол ацетат, d-α-токоферол сукцинат, dl-α-токоферол, dl-α-токоферол ацетат, dl-α-токоферол сукцинат, dl-α-токоферол сукцинат кальция, dl-α-токоферол никотинат и т.п. Предпочтительными формами витамина Е являются dl-α-токоферол, dl-α-токоферол ацетат, dl-α-токоферол сукцинат и dl-α-токоферол никотинат; и особенно предпочтительным является dl-α-токоферол.
Настоящая фармацевтическая композиция предпочтительно включает витамин Е. Добавление витамина Е позволяет значительно улучшить стабильность фармацевтической композиции. При использовании вместо витамина Е соединений, с аналогичными витамину Е антиоксидантными свойствами, таких как дибутилгидрокситолуол, бутилгидроксианизол, соевый лецитин, аскорбилпальмитат, гидрохлорид цистеина, аскорбиновая кислота, лимонная кислота, эриторбиновая кислота, нитрит натрия, сульфит натрия, тиогликолят натрия, тиомалат натрия и т.п., стабильность фармацевтической композиции не может быть значительно улучшена, данный факт был исследован настоящими изобретателями.
Добавление такого витамина Е, особенно dl-α-токоферола, значительно увеличивает стабильность фармацевтической композиции без отрицательного влияния на растворимость в воде оксазольных соединений.
Количество витамина Е, добавленного к фармацевтической композиции, обычно составляет от примерно 0,001 до примерно 1 массовой доли, предпочтительно от примерно 0,01 до примерно 0,08 массовых долей и более предпочтительно от примерно 0,03 до примерно 0,5 массовых долей на массовую долю ингредиента (I).
Фармацевтические композиции по настоящему изобретению также содержат различные подходящие вспомогательные ингредиенты, такие как рН-независимые водорастворимые полимеры, пластификаторы и т.п.
Примеры рН-независимых водорастворимых полимеров включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, полиэтиленгликоль, циклодекстрины и т.п.
Примеры пластификаторов включают триэтилцитрат, глицерол, сложные эфиры жирных кислот и глицерина, триглицериды со средней цепью, триацетин, касторовое масло, пропиленгликоль, полисорбаты и т.п.
Фармацевтическая композиция настоящего изобретения может быть выполнена в форме обычного фармацевтического препарата с помощью известных способов, при необходимости, используя носители, такие как вспомогательные вещества, дезинтегранты, связывающие вещества, флюидизаторы, лубриканты, покрывающие агенты, красители, суспендирующие агенты, подсластители и поверхностно-активные вещества. Примеры фармацевтических препаратов включают порошки, таблетки, пилюли, капсулы и т.п.
Примеры вспомогательных веществ включают лактозу, безводную лактозу, рафинированный сахар, белый сахар, D-маннит, D-сорбит, ксилит, эритрит, декстрин, кристаллическую целлюлозу, микрокристаллическую целлюлозу, кукурузный крахмал, картофельный крахмал, безводный гидрофосфат кальция и т.п.
Примеры дезинтегрантов включают натрий карбоксиметил крахмал, кармеллозу, кармеллозу кальция, кармеллозу натрия, кроскармеллозу натрия, кросповидон, гидроксипропилцеллюлозу низкого уровня замещения, частично пептизированный крахмал и т.п.
Примеры связывающих веществ включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, пептизированный крахмал, сиропы, крахмальный сироп и т.п.
Примеры флюидизаторов включают не полностью безводную кремниевую кислоту, синтетические алюмосиликаты, гидраты диоксида кремния, стеарат кальция, метасиликат алюминат магния, тальк и т.п.
Примеры смазывающих веществ включают стеарат магния, стеарат кальция, силикат магния, оксид магния, тальк, гидрогенизированное масло, сложные эфиры сахарозы и жирных кислот, стеарилфумарат натрия и т.п.
Примеры покрывающих агентов включают гидроксипропилметилцеллюлозу, поливиниловый спирт, полисорбаты, макроголь, тальк и т.п.
Примеры красителей включают желтый железнооксидный краситель, коричневый железнооксидный краситель, красный железнооксидный краситель, оксид титана, пищевой голубой краситель № 1, пищевой красный краситель № 2, пищевой красный краситель № 3, пищевой желтый краситель № 4 и т.п.
Примеры суспендирующих агентов включают полисорбаты, полиэтиленгликоль, гуммиарабик, глицерол, желатин и т.п.
Примеры подсластителей включают аспартам, сахарин, сахарин натрия, крахмальный сироп, фруктозу и т.п.
Примеры поверхностно-активных веществ включают лаурилсульфат натрия, полисорбаты, полиоксиэтилен, гидрогенизированное касторовое масло и т.п.
Капсулы могут быть получены в соответствии с известным процессом, посредством смешивания ингредиентов (I), (II) и, возможно, любого из вышеуказанных носителей, и загрузки такой смеси в твердые капсулы, сделанные из желатина, гидроксипропилметилцеллюлозы, поливинилового спирта и т.п. или в мягкие капсулы, основанные на желатине.
РЕЗУЛЬТАТЫ ИЗОБРЕТЕНИЯ
Настоящее изобретение позволяет существенно улучшить растворимость в воде оксазольного соединения посредством добавления фталата гидроксипропилметилцеллюлозы и/или ацетата сукцината гидроксипропилметилцеллюлозы к оксазольному соединению. Таким образом, обеспечивается фармацевтическая композиция, в которой улучшена растворимость оксазольного соединения в воде. Стабильность такой фармацевтической композиции может быть значительно улучшена дополнительным добавлением витамина Е к оксазольному соединению и вышеуказанному соединению(ям) целлюлозы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
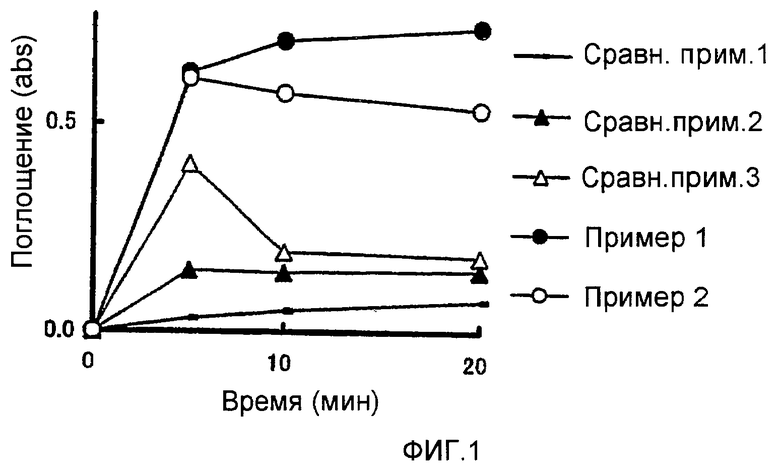
На фиг.1 представлен график зависимости поглощения от времени для растворов, содержащих фармацевтическую композицию, полученную в примере 1 или 2, или в сравнительном примере 1, 2 или 3.
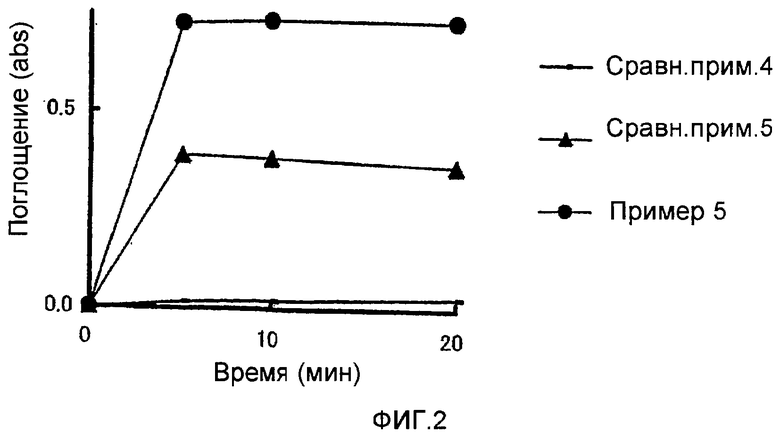
Фиг.2 представлен график зависимости поглощения от времени для растворов, содержащих фармацевтическую композицию, полученную в примере 5 или в сравнительном примере 4 или 5.
НАИЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет более ясным исходя из следующих примеров.
Состав примера 1
Соединение А 50 мг
Фталат гидроксипропилметилцеллюлозы (НР-50, производства Shin-Etsu Chemical Co., Ltd.) 150 мг
Лактоза (SuperTab НР-01, производства Lactose Company of NZ) 100 мг
Кристаллическая целлюлоза (CEOLUS РН 301, производства Asahi Kasei Corporation)
Карбоксиметил крахмал натрия (Primogel, производства DMV) 40 мг
Кармеллоза кальция (E. C.G. -505, производства Gotoku Chemical Company Ltd.) 40 мг
Слегка обезвоженная кремниевая кислота (Adsolider 101, производства Freund Corporation) 6 мг
Стеарат магния (производства Taihei Chemical Industrial Co., Ltd.) 6 мг
Были получены таблетки, содержащие вышеуказанный состав ингредиентов в таблетке.
Состав примера 2
Соединение А 50 мг
Фталат гидроксипропилметилцеллюлозы (НР-50, производства Shin-Etsu Chemical Co., Ltd.) 150 мг
Слегка обезвоженная кремниевая кислота (Adsolider 101, производства Freund Corporation) 20 мг
Стеарат магния (производства Taihei Chemical Industrial Co., Ltd.) 6 мг
Были получены капсулы, содержащие вышеуказанный состав ингредиентов в капсуле.
Пример 1
1 г соединения А (R-конфигурация) и 3 г фталата гидроксипропилметилцеллюлозы (НР-50, производства Shin-Etsu Chemical Co., Ltd.) растворяют в 100 мл смеси /этанол (метиленхлорид/этанол=8:2 по массе). Затем смесь подвергают распылительной сушке с использованием распылительной сушки (GS-310, производства Yamato Scientific Co., Ltd.). Полученный высушенный продукт далее сушат при 60°С более 12 часов, используя вакуумную сушку (LCV-323, производства Tabai Espec Corp.) с целью получения фармацевтической композиции настоящего изобретения в виде порошка.
Пример 2
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием ацетата сукцината гидроксипропилметилцеллюлозы (AS-L, производства Shin-Etsu Chemical Co., Ltd.) вместо фталата гидроксипропилметилцеллюлозы.
Сравнительный пример 1
1 г соединения А (R-конфигурации) измельчают с использованием струйной мельницы (А-О, SEISHIN ENTERPRISE CO., LTD) с целью получения фармацевтической композиции для сравнения.
Сравнительный пример 2
Фармацевтическая композиция в виде порошка, полученная как в примере 1, только с использованием гидроксипропилцеллюлозы (HPC-SL, Nippon Soda Co., Ltd.) вместо фталата гидроксипропилметилцеллюлозы.
Сравнительный пример 3
Фармацевтическая композиция в виде порошка, полученная как в примере 1, только с использованием гидроксипропилметилцеллюлозы (TC-5E, Nippon Soda Co., Ltd.) вместо фталата гидроксипропилметилцеллюлозы.
Пример теста 1
Растворимость фармацевтических композиций, полученных в примере 1 и 2, и сравнительных примерах 1-3, была исследована как указанно далее.
Сначала раствор 100 мл 0,3 мас.% водного лаурилсульфата натрия выливают в мерный стакан объемом 100 мл и перемешивают с помощью магнитной мешалки (число оборотов:500 оборотов/мин).
Отдельно взвешивают каждую из вышеуказанных фармацевтических композиций таким образом, чтобы содержалось 5 мг соединения А, и помещают в агатовую ступку, после чего к фармацевтической композиции добавляют несколько мл тестируемого раствора из мерного стакана. После диспергирования в течение 1 минуты, смесь выливают в мерный стакан. Спустя 5, 10 и 20 минут после перенесения дисперсии в мерный стакан отбирают образец 6 мл раствора из мерного стакана и фильтруют через мембранный фильтр с диаметром пор 0,5 мкм или менее. Первые 2 мл каждого фильтрата отбрасывают, и следующие 4 мл используют в качестве образца раствора.
Поглощение каждого образца раствора измеряют при 335 нм с помощью УФ-видимой абсорбционной спектроскопии с использованием 10 мм кювет.
Результаты приведены на фиг.1.
Фиг.1 показывает, что растворимость в воде фармацевтических композиций, полученных в примере 1 и 2, значительно улучшена.
Пример 3
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 2 г фталата гидроксипропилметилцеллюлозы вместо 3 г фталата гидроксипропилметилцеллюлозы.
Пример 4
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1,5 г фталата гидроксипропилметилцеллюлозы вместо 3 г фталата гидроксипропилметилцеллюлозы.
Растворимость в воде фармацевтических композиций, полученных в примерах 3 и 4, была также исследована, как в тест примере 1. В результате, было обнаружено, что растворимость в воде данных фармацевтических композиций находится примерно на таком же уровне, как у фармацевтической композиции в примере 1. Результаты показывают, что эффект настоящего изобретения достигается во всех случаях, при которых количество фталата гидроксипропилметилцеллюлозы находится в диапазоне от 1,5 до 3 г на 1 г соединения А.
Пример 5
1 г соединения Q (R-конфигурация) и 3 г фталата гидроксипропилметилцеллюлозы (НР-50, производства Shin-Etsu Chemical Co., Ltd.) растворяют в 100 мл смеси метиленхлорид/этанол (метиленхлорид/этанол=8:2 по массе). Затем смесь подвергают распылительной сушке с использованием распылительной сушки (GS-310, производства Yamato Scientific Co., Ltd.). Полученный высушенный продукт далее сушат при 60°С более 12 часов, используя вакуумную сушку (LCV-323, производства Tabai Espec Corp.) с целью получения фармацевтической композиции настоящего изобретения в виде порошка.
Сравнительный пример 4
1 г соединения Q (R-конфигурации) измельчают с использованием струйной мельницы (А-О, производства SEISHIN ENTERPRISE CO., LTD) с целью получения фармацевтической композиции для сравнения.
Сравнительный пример 5
Фармацевтическая композиция в виде порошка, полученная как в примере 5, только с использованием гидроксипропилцеллюлозы (HPC-SL, Nippon Soda Co., Ltd.) вместо фталата гидроксипропилметилцеллюлозы.
Пример теста 2
Растворимость фармацевтических композиций, полученных в примере 5, сравнительном примере 4 и сравнительном примере 5, была исследована, как в тест примере 1.
Результаты приведены на фиг.2.
Фиг.2 показывает, что растворимость в воде фармацевтической композиции примера 5 значительно улучшена.
Пример 6
2 г соединения А (R-конфигурация), 3 г фталата гидроксипропилметилцеллюлозы (НР-50, производства Shin-Etsu Chemical Co., Ltd.) и 0,08 г dl-α-токоферола (антиоксидантного агента, производства Wako Pure Chemical Industries, Ltd.) растворяют в 100 мл смеси метиленхлорид/этанол (метиленхлорид/этанол=8:2 по массе). Затем смесь подвергают распылительной сушке с использованием распылительной сушки (GS-310, производства Yamato Scientific Co., Ltd.). Полученный высушенный продукт далее сушат при 60°С более 12 часов, используя вакуумную сушку (LCV-323, производства Tabai Espec Corp.) с целью получения фармацевтической композиции настоящего изобретения в виде порошка.
Пример 7
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 6, только с использованием 0,04 г дибутилгидрокситолуола (антиоксидантного агента) вместо dl-α-токоферола.
Пример 8
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 6, только с использованием 0,004 г бутилгидроксианизола (антиоксидантного агента) вместо dl-α-токоферола.
Пример 9
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 6, только без использования антиоксидантного агента.
Пример теста 3
После выдерживания фармацевтических композиций, полученных в примерах 6-9 при 40° в течение недели, была определена чистота соединения А, содержащегося в каждой композиции. Чистота соединения А была определена в процентном содержании.
Результаты приведены в таблице далее.
Таблица показывает, что стабильность соединения А значительно улучшена с помощью добавления dl-α-токоферола.
Пример 10
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения В (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 11
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения С (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 12
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения D (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 13
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения G (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 14
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения H (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 15
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения N (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 16
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения T (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 17
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения U (R-конфигурация) вместо соединения А (R-конфигурация).
Пример 18
Фармацевтическая композиция настоящего изобретения в виде порошка, полученная как в примере 1, только с использованием 1 г соединения V (R-конфигурация) вместо соединения А (R-конфигурация).
Пример теста 3
Растворимость фармацевтических композиций, полученных в примерах 10-18, была исследована аналогично примеру теста 1. Результаты показывают, что растворимость в воде всех композиции, полученных в примерах 10-18, значительно улучшена.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-6-НИТРОИМИДАЗО [2, 1-b] ОКСАЗОЛА | 2003 |
|
RU2326121C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЕДИНЕНИЯ ОКСАЗОЛА | 2011 |
|
RU2560676C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЕДИНЕНИЯ ОКСАЗОЛА | 2006 |
|
RU2434632C2 |
| ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-6-НИТРОИМИДАЗО [2,1-b] ОКСАЗОЛА ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2004 |
|
RU2365593C2 |
| ЭПОКСИСОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2459822C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА И ИНГИБИТОР БЕЛКА СЛИЯНИЯ RSV | 2005 |
|
RU2388476C2 |
| ИММУНОДЕПРЕССАНТНЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ | 2004 |
|
RU2405768C2 |
| ПРОИЗВОДНОЕ 1-ЗАМЕЩЕННОГО 4-НИТРОИМИДАЗОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2324682C2 |
| БИЦИКЛИЧЕСКИЕ НИТРОИМИДАЗОЛЫ, КОВАЛЕНТНО СОЕДИНЕННЫЕ С ЗАМЕЩЕННЫМИ ФЕНИЛОКСАЗОЛИДИНОНАМИ | 2009 |
|
RU2504547C2 |
| АМИДНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2271361C2 |
Изобретение относится к области медицины и фармакологии и касается фармацевтической композиции для лечения туберкулеза, содержащей по крайней мере одно оксазольное соединение, выбранное из 2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола и 2-метил-6-нитро-2-{4-[4-(4-трифторметилфеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола, и по крайней мере, одно соединение целлюлозы, выбранное из группы, состоящей из фталата гидроксипропилметилцеллюлозы и ацетата сукцината гидроксипропилметилцеллюлозы. Настоящая фармацевтическая композиция обладает улучшенной растворимостью оксазольного соединения в воде. 6 з.п. ф-лы, 2 ил., 1 табл.
1. Фармацевтическая композиция для лечения туберкулеза, содержащая:
(I) по крайней мере, одно оксазольное соединение, выбранное из группы, состоящей из 2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола и 2-метил-6-нитро-2-{4-[4-(4-трифторметилфеноксиметил)пиперидин-1-ил]феноксиметил1-2,3-дигидроимидазо[2,1-b]оксазола, их оптически активных изомеров и их фармацевтически приемлемых солей; и
(II) по крайней мере, одно соединение целлюлозы, выбранное из группы, состоящей из фталата гидроксипропилметилцеллюлозы и ацетата сукцината гидроксипропилметилцеллюлозы,
причем соотношение ингредиента (II) к ингредиенту (I) таково, что ингредиент (II) используется в количестве, составляющем примерно от 0,5 до 15 массовых долей на массовую долю ингредиента (I).
2. Фармацевтическая композиция по п.1, где оксазольным соединением является 2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.
3. Фармацевтическая композиция по п.1, где оксазольным соединением является (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметоксифенокси)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазола.
4. Фармацевтическая композиция по п.1, где оксазольным соединением является 2-метил-6-нитро-2-{4-[4-(4-трифторметилфеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.
5. Фармацевтическая композиция по п.1, где оксазольным соединением является (R)-2-метил-6-нитро-2-{4-[4-(4-трифторметилфеноксиметил)пиперидин-1-ил]феноксиметил}-2,3-дигидроимидазо[2,1-b]оксазол.
6. Фармацевтическая композиция по п.1, дополнительно содержащая витамин Е.
7. Фармацевтическая композиция по п.6, где витамином Е является dl-α-токоферол.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Устройство для плавки многокомпонентных сплавов и лигатур | 1980 |
|
SU901786A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2011-03-10—Публикация
2006-07-19—Подача