Изобретение относится к биотехнологии и может быть использовано для получения резвератрола - ценного биологически активного вещества.
Резвератрол обнаружен во многих растениях, однако виноград - это основной его источник. Резвератрол - это постоянная составляющая полифенольной фракции красных вин. Одно из его самых ценных свойств - мощная противоопухолевая активность, поскольку резвератрол эффективно действует против многих видов рака и предотвращает возникновение рака. Резвератрол также является известным антимутагеном, антиоксидантом, обладает противовоспалительным, антибактериальным, противовирусным и противогрибковым действием [Aggarwal et al., Role of resveratrol in prevention and therapy of cancer: preclinical and clinical studies. Anticancer Res. 2004. 24(5A):2783-2840]. Многочисленные исследования свидетельствуют о способности резвератрола положительно влиять на сердечно-сосудистую, нервную системы, печень [Fremont L. Biological effects of resveratrol. Life Sci. 2000. 66(8):663-673]. Недавно появились данные о мощном положительном эффекте резвератрола на продолжительность жизни многих живых организмов, таких как дрожжи Saccharomyces cerevisiae, нематода Caenorhabditis elegans и дрозофила Drosophila melanogaster [Howitz et al. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature. 2003. 425(6954); 191-196. Wood et al. Sirtuin activators mimic caloric restriction and delay ageing in metazoans. Nature. 2004. 430(7000):686-689].
В настоящее время нет эффективного способа получения резвератрола. Возможно получение резвератрола из дикорастущих растений винограда, но содержание его в растениях невелико, 0,01-0,05% от сухой биомассы. Кроме того, ресурсоведческие исследования показывают, что интенсивные заготовки дикорастущих лекарственных растений приводят к повсеместному истощению их запасов, исчезновению популяций и некоторых видов растений. Поскольку культурные сорта винограда Vitis vinifera выращиваются в больших масштабах во многих странах мира, предпринимались попытки получения резвератрола из ягод и листьев, В листьях растений культурных сортов винограда содержание резвератрола составляет 0,00012-0,00033% от сухой массы, в ягодах 0,000069-0,001%. В связи с таким низким выходом растения обрабатывались различными элиситорами, повышающими синтез вторичных метаболитов. Использование метилжасмоната и облучение ультрафиолетом, а также сочетание этих методов не повлияло на выход резвератрола в ягодах, а содержание его в листьях повысилось до 0,023-0,028% [Larronde et al. Airborne methyl jasmonate induces stilbene accumulation in leaves and berries of grapevine plants. Am. J. Enol. Vitricult. 2003. 54(1):63-66].
Однако такой выход резвератрола является недостаточным для его промышленного получения. Поэтому поиск альтернативных сырьевых источников является актуальной проблемой. Применение биотехнологического приема, заключающегося в культивировании клеток с целью получения биологически активных веществ, позволяет решить эту проблему.
Известны культуры клеток винограда, содержащие резвератрол. Однако во всех описанных культурах резвератрол либо не обнаруживается [Sgabi et al., Phenol metabolism is differentially affected by ozone in two cell lines from grape (Vitis vinifera L.) leaf. Plant Science. 2003. 165:951-957], либо содержится в очень небольших количествах (0,00023-0,00046% от сухой массы клеток) [Tassoni et al. Jasmonates and Na-orthovanadate promote resveratrol production in Vitis vinifera cv. Barbera cell cultures. New Phytol. 2005. 166(3):895-905]. Для клеточных культур других видов растений максимальное содержание резвератрола найдено в каллусах арахиса 0,01% [Ku et al., Production of stilbenoids from the callus of Arachis hypogaea: a novel source of the anticancer compound piceatannol. J. Agric. Food Chem. 2005. 53(10):3877-3881].
При воздействии различных индукторов вторичного метаболизма на каллусные или суспензионные культуры клеток удалось повысить выход резвератрола. Клетки суспензионной клеточной культуры V. vinifera отвечали на обработку метилжасмонатом и ортованадатом натрия 5-6-кратным увеличением продукции резвератрола, что составило 0,0023-0,0092% [Tassoni et al. Jasmonates and Na-orthovanadate promote resveratrol production in Vilis vinifera cv. Barbera cell cultures. New Phytol. 2005. 166(3):895-905]. Клеточные культуры Arachis hypogaea отвечали трехкратным увеличением продукции резвератрола на обработку клеток ультрафиолетовым излучением, но содержание резвератрола не превысило 0,03% от сухого веса клеток, и при этом эффект исчезал через 24 часа после обработки. Метаболическая инженерия дрожжей Saccharomyces cerevisiae не привела к ожидаемому авторами высокому содержанию резвератрола в среде, максимальный выход резвератрола составил 1,5 мкг/л [Becker et al. Metabolic engineering of Saccharomyces cerevisiae for the synthesis of the wine-related antioxidant resveratrol. FEMS Yeast Res. 2003. 4(1):79-85].
Недавно получены самые интересные на сегодня данные с точки зрения практической биотехнологии, где выход резвератрола составил 100 мг/л в метаболически модифицированной Escherichia coli, экспрессирующей растительную стильбенсинтазу и 4-кумарил СоА лигазу [Watts et al. Biosynthesis of plant-specific stilbene polyketides in metabolically engineered Escherichia coli. 2006. BMC Biotechnol. 6:22]. Применение этой модельной системы для промышленного производства резвератрола возможно, однако и этот метод имеет определенные недостатки: дело в том, что бактерии способны быстро мутировать, поэтому высока вероятность быстрого сбоя в продукции резвератрола используемыми клетками.
В качестве прототипа выбран способ получения резвератрола из культуры клеток дикорастущего винограда Vitis amurensis Rupr., [Zamboni et al., Elicitor-induced resveratrol production in cell cultures of different grape genotypes (Vitis spp.). VITIS. 2006. 45 (2):63-68]. Каллусы этого вида винограда продуцируют резвератрол в количествах, превышающих его содержание в каллусах культурных сортов винограда Vitis vinifera.
Каллусы Vitis amurensis экстрагируют метанолом 12 ч в темноте при комнатной температуре. Экстракт центрифугируют и резвератрол определяют методом ВЭЖХ. Количество транс-резвератрола в каллусах составляет 0,012% от сухой массы каллусов.
Недостатком этого способа является низкий выход целевого продукта, который хотя и превышает содержание резвератрола в каллусах культурных сортов (0,00023-0,00046%), но является недостаточным для практических целей.
Задача изобретения - создание нового, экономически выгодного способа получения резвератрола.
Технический результат, обеспечиваемый изобретением, заключается в повышении выхода резвератрола.
Поставленная задача решена тем, что в известном способе получения резвератрола из клеточной культуры винограда амурского (Vitis amurensis Rupr.) согласно изобретению клеточную культуру трансформируют агробактериальным вектором, содержащим ген rolB, с последующим выделением целевого продукта.
Целевой продукт выделяют из полученной трансгенной культуры клеток V. Amurensis стандартным хроматографическим методом.
Ген rolB выделен ранее из плазмид Agrobaclerium rhizogenes и встроен под контроль сильного промотора 35S [Spena et al. Independent and synergistic activity of rol А, В and С loci in stimulating abnormal growth in plants. EMBO J. 1987. 6(13):3891- 3899]. Ген кодирует тирозин-фосфатазу и используется для модуляции процессов вторичного метаболизма в культурах растительных клеток. В одних случаях он существенно стимулирует синтез вторичных метаболитов [Bulgakov et al. Effect of salicylic acid, methyl jasmonate, ethephon and cantharidin on anthraquinone production by Rubia cordifolia callus cultures transformed with the rolB and rolC genes. J. Biotechnol. 2002. 97: 213-221], в других - ингибирует [Bulgakov et al. The impact of plant rolC oncogene on ginsenoside production by ginseng hairy root cultures. Phytochemistry. 1998. 49:1929-1934]. Причина этого явления неизвестна, так как действие тиризин-фосфатаз в целом на вторичный метаболизм не изучено. Поэтому не является очевидным то, что генная трансформация клеточных культур растений однозначно приведет к увеличению выхода того или иного продукта.
Культуру каллусов растения V. amurensis Rupr., экспрессирующих ген rolB, получают следующим образом. Побеги дикорастущей лианы V. amurensis стерилизуют в 0,2% растворе диоцида (этанолмеркурия хлорид и цетилпиридиния хлорид) в течение 5-8 мин. После трехкратного отмывания в стерильной дистиллированной воде из побегов вычленяют экспланты диаметром 3-5 мм и толщиной 1-2 мм. Экспланты помещают в пробирки 200×20 мм, содержащие по 15 мл стандартной питательной среды WB/A [Bulgakov et al. J. Biotechnol. 2002. 97: 213-221]. Через 10 дней культивирования в темноте при 23-26°С и относительной влажности воздуха 60-70% из эксплантов образуются первичные каллусы. Через месяц со дня посадки каллусы отделяют от экспланта и пассируют на свежие питательные среды WB/A для получения устойчивых каллусных линий и достижения необходимого масштаба размножения каллусов. Полученные каллусные линии содержат 0,020-0,026% резвератрола от сухой массы.
Затем активируют синтез резвератрола путем встройки гена rolB в ДНК клеток каллуса винограда. Для этого в ДНК каллусов винограда переносят ген rolB путем агробактериальной трансформации, выполняемой стандартным методом [Драйпер и др., и др. Генная инженерия растений. М.: Мир, 1991 г., 458 с.].
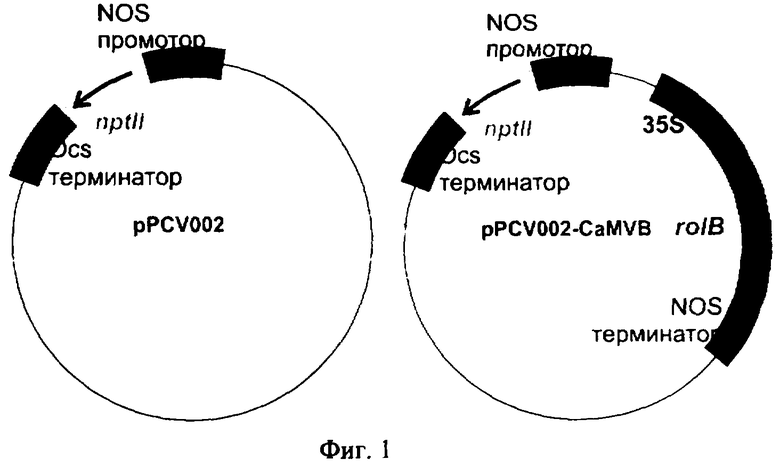
Используют известный агробактериальный трансформирующий вектор GV3101/pMP90RK/pPCV002-CaMVB [Spena et al., 1987. Independent and synergistic activity of rol А, В and С loci in stimulating abnormal growth in plants. EMBO J. 6(13):3891-3899], содержащий плазмиду pPCV002-CaMVB с генами nptII и rolB (фиг.1).
Штаммы агробактерий получали путем трансформацией плазмидами по описанной ранее методике [Bulgakov et al., 2002. J. Biotechnol 97: 213-221]. Плазмиды были любезно предоставлены профессором А. Спена (Германия). Используемый штамм агробактерий поддерживается в коллекционной культуре микроорганизмов группы биоинженерии Биолого-почвенного института ДВО РАН.
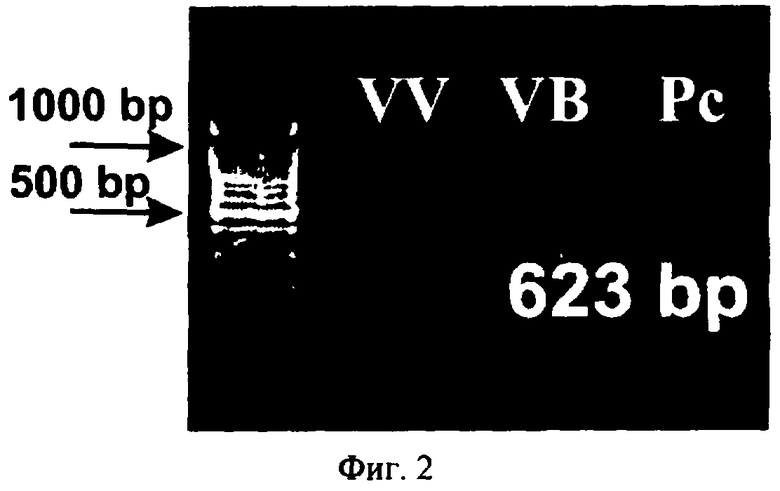
Наличие встройки гена rolB в ДНК клеток винограда и экспрессия гена проверяются стандартным методом, т.е. при помощи обратно-транскриптазной полимеразной цепной реакции [McPherson M.J., Moller S.G. PCR, Bios Scientific Publishers, 2000, p.288.] (фиг.2).
После получения трансгенной культуры ее выращивают на питательной среде WB/A в темноте при относительной влажности воздуха 50-70% и температуре 23-26°С в течение 30-40 суток. После указанного периода каллусы извлекают из культуральных сосудов и высушивают. Сухая каллусная ткань служит источником резвератрола, который можно выделить из нее стандартным хроматографическим методом.
Продуктивность резвератрола - параметр, который объединяет рост культуры и содержание в ней биологически активных веществ, - таким способом увеличилась более чем в 60 раз по сравнению с ранее полученными нетрансгенными клетками винограда амурского.
Для доказательства, что увеличение содержания резвератрола в VB культуре является действием гена rolB, получают векторную культуру VV. Для этого каллусы трансформируют путем кокультивации агробактерий GV3101/pMP90RK/pPCV002, в которых отсутствует ген rolB (фиг.1) с каллусными клетками винограда амурского. Успешность встройки доказывают с помощью ПЦР на наличие гена nptII по описанной ранее методике [Bulgakov et al., 2002 Effect of salicylic acid, methyl jasmonate, ethephon and cantharidin on anthraquinone production by Rubia cordifolia callus cultures transformed with the rolB and rolC genes. J. Biotechnol 97: 213-221].
В полученной культуре VV содержание резвератрола осталось на низком уровне, как и в нетрансгенных культурах клеток, в то время как содержание резвератрола в культуре VB составило 3%.
Содержание и продуктивность резвератрола в клеточных культурах винограда амурского.
Таким образом, перенос гена rolB в культуру клеток винограда и его экспрессия вызвали увеличение продукции резвератрола.
На фиг.1 представлены схематические карты плазмид, используемых в работе. NOS промотор - промотор нопалинсинтазного гена; Ocs терминатор - терминатор октапинсинтазного гена; NOS терминатор - терминатор нопалинсинтазного гена; 35S - промотор вируса мозаики цветной капусты; nptII - ген неомицинфосфотрансферазы,; rolB - ген rolB.
На фиг.2 представлено доказательство экспрессии гена rolB в культуре Vitis amurensis с помощью ПЦР. VV - отсутствие сигнала на РНК, выделенной из культуры Vitis amurensis, не содержащей ген rolB; VB - сигнал гена rolB на РНК, выделенной из rolB трансгенной культуры; Рс - позитивный контроль, сигнал гена rolB с плазмиды pPCV002-CaMVB.
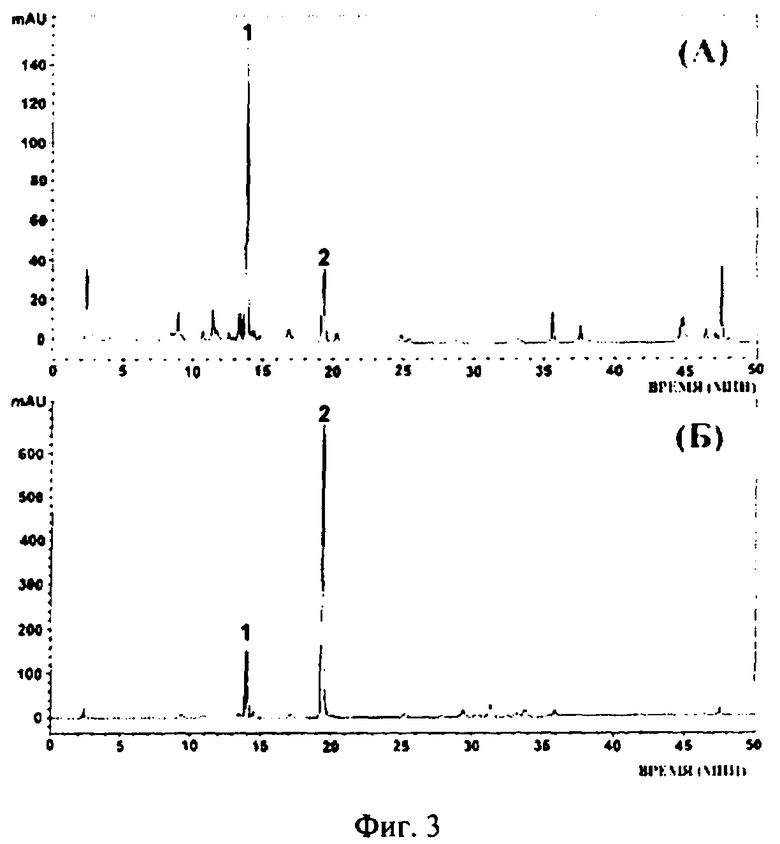
На фиг.3 представлены спектры ВЭЖХ экстрактов из каллусных культур Vitis amurensis. А - нормальные каллусы; Б - трансформированные геном rolB каллусы. 1 - дигидрокверцетин (внутренний стандарт), 2 - резвератрол.
Способ иллюстрируется следующими примерами.
Пример 1. Каллусы винограда массой 1 г помещают в 250 мл колбы с 40 мл жидкой питательной среды WB/A [Bulgakov et al., 2002. J. Biotechnol 97: 213-221]. Суспензию каллусов культивируют в темноте при 24°С, относительной влажности воздуха 60% и перемешивании 60 об/мин. Через 3 суток в колбы добавляют по 50 мкл агробактерий A. tumefaciens (штамм GV3101/pMP90RK/pPCV002-CaMVB) в суспензионной среде LB (NaCl 10 г/л; пептон 10 г/л; дрожжевой экстракт 5 г/л; рН 7,5), оптическая плотность бактерий OD260=0,65. Клетки V. amurensis инкубируют с агробактериями 2 суток, затем добавляют антибиотик цефотаксим в концентрации 250 мг/л для удаления агробактерий. Спустя 2 недели после добавления цефотаксима суспензию растительных клеток высаживают на твердую питательную среду WB/A, содержащую антибиотики: цефотоксим 250 мг/л и канамицин 10 мг/л, для отбора трансгенных клеток. Через месяц активно растущие агрегаты пересаживают на свежие питательные среды с содержанием канамицина 20 мг/л и цефотоксима 250 мг/л. Таким путем отбор трансгенных клеток осуществляют с помощью селекции в присутствии канамицина в концентрации 20 мг/л в течение 5 месяцев. Далее отбирают активно растущие канамицин-устойчивые агрегаты, из которых получают пассируемые линии, которые далее культивируют на агаризованной среде без антибиотиков с 30-дневным интервалом. По истечении периода культивирования каллусы извлекают из культуральных сосудов, высушивают при 60°С в течение 24 ч и взвешивают.
Получают 6,4±0,5 г сухих каллусов с одной колбы. Чистый резвератрол получают из спиртового экстракта 6,4 г трансгенных клеток V. amurensis путем его упаривания и последующего хроматографирования на силикагеле (хлороформ - этиловый спирт 6:1). Получают целевой продукт в количестве 0,18 г.Таким образом, выход сухого остатка с содержанием резвератрола 98-99% составляет около 3% от веса сухой массы клеток V. amurensis.
Содержание резвератрола в нетрансформированных каллусах V. amurensis составляет 0,026±0,30% от сухой массы клеток (фиг.3А), в трансформированных геном rolB каллусах V. amurensis - 3,15±0,30 от сухой массы клеток (фиг.3Б).
Аналитическую ВЭЖХ проводят на хроматографе Agilent Technologies (серия 1100), снабженного системой насосов высокого давления QuatPump G 1311 А, дегазатором DEGASSER G1322A, инжектором G1328B и детектором VWD G1314A. Результаты анализов обрабатывались программой ChemStation® program var. 09. Условия хроматографирования: колонка (250×4 мм), заполненная сорбентом Hypersil BDS-C18, 5 мкм; градиентное элюирование: раствор 1% уксусной кислоты - 0-25 min, 5-50% В; 25-30 min, 50-90% В; 30-35 min, 90-95% В при λ - 280 нм.
Образец (100 мг) сухих каллусов экстрагируют этиловым спиртом (3 мл) при нагревании (60°С) в течение 2 часов. Экстракт отфильтровывают через фильтр с диаметром пор 4,5Å. Экстракт (450 мкл) смешивают с 50 мкл дигидрокверцитина (1 мг/мл), используемого в качестве внутреннего стандарта. В хроматограф вводят аликвоту 5 мкл испытуемого раствора. Расшифровку хроматограмм, определение относительного времени удерживания резвератрола осуществляют с помощью модельного соединения, выделенного и идентифицированного методом ЯМР-спектроскопии из растения V. amurensis.
Пример 2. Способ осуществляют, как описано в примере 1, но выделение целевого продукта осуществляют на сефадексе LH-20 (хлороформ - этиловый спирт 7:1). Получают резвератрол в количестве 0,18 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ МЕТАЛЛОВ | 2011 |
|
RU2477172C1 |
| Способ увеличения устойчивости растений к воздействию ультрафиолета | 2020 |
|
RU2733119C1 |
| ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО | 2003 |
|
RU2244553C1 |
| СПОСОБ ЭЛИМИНАЦИИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ ПРИ КУЛЬТИВИРОВАНИИ КЛЕТОЧНЫХ КУЛЬТУР РАСТЕНИЙ С ИСПОЛЬЗОВАНИЕМ НАНОЧАСТИЦ СЕРЕБРА | 2014 |
|
RU2577995C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК РАСТЕНИЙ RUBIA CORDIFOLIA L., ПРОДУЦЕНТ АНТРАХИНОНОВ | 1998 |
|
RU2141525C1 |
| Способ получения генетически модифицированных древесных растений | 2015 |
|
RU2619175C1 |
| Способ выращивания каллусных тканей Mertensia maritima (L.) S.F.Gray | 2024 |
|
RU2830878C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛАНТОИНА | 2012 |
|
RU2484093C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСФОРМИРОВАННЫХ РАСТИТЕЛЬНЫХ КЛЕТОК, СОДЕРЖАЩИХ РЕКОМБИНАНТНУЮ ЩЕЛОЧНУЮ ФОСФАТАЗУ ЧЕЛОВЕКА, И ПРИМЕНЕНИЕ ТРАНСФОРМИРОВАННЫХ РАСТИТЕЛЬНЫХ КЛЕТОК, СОДЕРЖАЩИХ РЕКОМБИНАНТНУЮ ЩЕЛОЧНУЮ ФОСФАТАЗУ ЧЕЛОВЕКА | 2018 |
|
RU2698397C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОЙ СУСПЕНЗИОННОЙ КУЛЬТУРЫ ТРАНСГЕННОГО ТАБАКА Nicotiana tabacum L., СОДЕРЖАЩЕГО ГЕН UIDA | 2012 |
|
RU2519652C2 |
Изобретение относится к биотехнологии. Клеточную культуру винограда амурского Vitis amurensis Rupr. трансформируют агробактериальным вектором, содержащим ген rolB, с последующим выделением целевого продукта. Способ обеспечивает существенное повышение выхода резвератрола. 3 ил., 1 табл.
Способ получения резвератрола из клеточной культуры винограда амурского (Vitis amurensis Rupr.), отличающийся тем, что клеточную культуру трансформируют агробактериальным вектором, содержащим ген rolB, с последующим выделением целевого продукта.
| CN 1748472 А, 22.03.2006 | |||
| KR 20040011625, 11.02.2004 | |||
| СПОСОБ ПОЛУЧЕНИЯ РАСТИТЕЛЬНОГО ПОЛИФЕНОЛЬНОГО ЭКСТРАКТА | 1997 |
|
RU2133621C1 |
Авторы
Даты
2008-06-10—Публикация
2006-10-05—Подача