Изобретение относится к средствам для превентивной противоинфекционной терапии после острого инсульта с целью снижения летальности и заболеваемости после инсульта путем предотвращения инфекций после острого инсульта. Инфекциями являются тяжелые осложнения, которые, как правило, появляются в ранней фазе после острого инсульта и оказывают прогностически негативное влияние. В случае используемых в фармацевтических композициях согласно изобретению средств речь идет о противоинфекционных средствах, прежде всего антибиотиках, которые используют для профилактики и лечения пневмоний, мочеполовых инфекций и сепсиса в случае млекопитающих, в особенности в случае домашних и комнатных животных, а также в особенности в случае человека. Изобретение также относится к средствам для иммуномодуляторной терапии после острого инсульта с целью предотвращения инфекций после инсульта. В случае используемых в фармацевтических композициях согласно изобретению средств речь идет о веществах, которые обладают иммуномодуляторными свойствами.
Больной с острым инсультом, наряду с прямыми последствиями инсульта, которые могут простираться от транзиторных до постоянных неврологических потерь вплоть до смерти вследствие внутричерепного давления, в особенности в острой и ранней фазе ремиссии, прежде всего, подвергается опасности инфекций. Инфекции, и в особенности пневмонии, представляют собой главную причину летальности при инсульте (Henon et al. 1995; см. указатель литературы, приведенный после примеров). Так, в случае 21-65% больных с острым инсультом обнаруживаются инфекции, а в случае 10-22% пневмонии (Davenport et al. 1996; Castillo et al. 1998; Johnston et al. 1998; Grau et al. 1999; Georgilis et al. 1999; Langhorne et al. 2000). По сравнению с частотой внутрибольничных инфекций, которые появляются в среднем у 7-10% всех больных (Bucher, 2000) и имеются в случае 3% послеоперационных больных (Smyth & Emmerson, 2000), особенно заметна очень высокая частота инфекций в случае больных с острым инсультом. При систематическом исследовании удалось выявить, что на первые и вторые сутки после инфаркта более всего существует опасность инфекции (Grau et al. 1999).
Предотвращение индуцируемых инсультом инфекций путем иммуномодуляторной и в особенности также превентивной противоинфекционной терапии представляет собой новую постановку задачи. В противоположность прямому нейрозащитному применению тетрациклина миноциклина (Yrjanheikki et al. 1998, 1999), которое в особенности требует непосредственного использования после инсульта (вплоть до 4 часов после инсульта), в случае описанного применения речь идет о замедленной схеме лечения (от 12 до 72 часов), что за счет предотвращения тяжелых индуцируемых инсультом инфекций приводит к снижению летальности и заболеваемости. Тетрациклины, кроме того, непригодны для предотвращения обычно появляющихся после тяжелого инсульта инфекций.
Моксифлоксацин относится к классу фторхинолонов и содержит биологически активное вещество 1-циклопропил-6-фтор-1,4-дигидро-8-метокси-7-[(4aS,7aS)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил]-4-оксохинолин-3-карбоновую кислоту; он до сих пор используется, прежде всего, для лечения инфекций дыхательных путей (Zhanel et al. 2002).
Мезлоциллин относится к классу ациламинопенициллинов и содержит биологически активное вещество (2S,5R,6R)-3,3-диметил-6-((R)-2-[3-(метилсульфонил)-2-оксо-1-имидазолидинкарбоксамидо]-2-фенилацетамидо)-7-оксо-4-тиа-1-азабицикло[3,2,0]гептан-2-карбоновую кислоту.
Сулбактам относится к классу ингибиторов β-лактамазы и содержит биологически активное вещество 4,4-диоксид (2S,5R)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3,2,0]гептан-2-карбоновой кислоты.
Мезлоциллин в сочетании с сулбактамом до сих пор используют, прежде всего, для лечения системных или локальных (смешанных) инфекций, а также для периоперативной кратковременной профилактики (Wright, 1999).
В основу изобретения положена задача получения средств для медицинской практики, которые пригодны для превентивной терапии после острого инсульта. Эта задача решается, согласно первому аспекту, за счет целенаправленного применения противоинфекционных средств. В основу изобретения также положена задача получения средств для медицинской практики, которые пригодны для противодействия быстро начинающейся после острого инсульта иммунодепрессии с последующей восприимчивостью к инфекции.
Эта задача согласно изобретению решается за счет целенаправленного применения иммуномодуляторных веществ, например, цитокинов, ингибиторов симпатической нервной системы (SNS), инактивированных частиц овечьего парапоксвируса, связующих эндотоксинов (rBPI21). Получены предлагаемые согласно изобретению средства для иммуномодуляторной терапии после острого инсульта, которые в качестве активных компонентов содержат, например, цитокины или ингибиторы симпатической нервной системы, инактивированные частицы овечьего парапоксвируса, rBPI21.
Получены предлагаемые согласно изобретению средства для превентивной терапии после острого инсульта, которые в качестве активных компонентов в фармацевтических композициях содержат противоинфекционные средства и/или иммуномодуляторные вещества для профилактики и лечения пневмоний, мочеполовых инфекций и сепсиса, прежде всего из классов бета-лактамных антибиотиков, тетрациклинов, аминогликозидов, линкозаминов, гликопептидов, макролидов, карбапенемов, оксазолидинонов, стрептограминов, а также фторхинолонов (и в данном случае в особенности моксифлоксацин), а также цитокинов (таких как интерлейкины, интерфероны), ингибиторов симпатической нервной системы (таких как бета-блокаторы, альфа-симпатомиметики), связующих эндотоксинов (таких как липополисахаридсвязывающий протеин = LBP, BPI, rBPI21) и инактивированных частиц овечьего парапоксвируса.
К тому же выявлено, что прежде всего через посредство симпатической нервной системы после инсульта развивается клеточно-функциональная иммунодепрессия, которая может проявляться в тяжелой форме до такой степени, что она может приводить к спонтанному возникновению тяжелых, определяющих прогноз инфекций. За счет фармакологического ингибирования симпатической нервной системы, связывания эндотоксинов, иммуностимуляции или введения цитокинов (в течение первых 0-7 суток) можно устранять иммунодепрессию и предотвращать появление инфекций; ранняя превентивная противоинфекционная терапия (в течение первых 0-7 суток) может приводить также к снижению летальности и заболеваемости при остром инсульте.
Согласно изобретению на общепризнанной животной модели инсульта (мышь; окклюзия средней мозговой артерии (A. cerebri media (MCAO), Hata et al. 1998) исследовали рано начинающуюся (в течение первых 12 часов) и затяжную тяжелую иммуносупрессию. Иммуносупрессия проявляется на клеточном уровне, с одной стороны, в форме лимфопении Т-клеток, В-клеток и естественных клеток-киллеров, а также, с другой стороны, в функциональных дефицитах моноцитов и лимфоцитов, в том числе, в пониженной секреции провоспалительного цитокина гамма-интерферона (IFN-γ). Иммуносупрессия опосредуется прежде всего за счет сверхактивации симпатической нервной системы.
В течение 2-4 суток после инсульта спонтанно развивается тяжелая инфекция в случае животных. При этом речь идет о бактериальном сепсисе и пневмонии, которые протекают с летальным исходом примерно у 60% животных. За счет предлагаемого согласно изобретению раннего превентивного введения противоинфекционных средств (моксифлоксацин в течение первых 24 часов) сильно снижаются летальность и неврологический дефицит. Согласно следующему аспекту изобретения блокирование симпатической нервной системы с помощью бета-блокаторов или за счет введения гамма-интерферона также можно предотвращать возникновение инфекций. К тому же, благодаря ранней блокаде симпатической нервной системы с помощью бета-блокатора можно сильно снижать летальность после острого инсульта.
Превентивная терапия с помощью противоинфекционных средств (например, моксифлоксацин) в течение первых 7 суток после начала болезни представляет собой нового рода терапевтический подход к лечению больных с инсультом, который пригоден для снижения летальности и заболеваемости в случае этой болезни. Благодаря этому, в особенности имеется эффективный терапевтический подход для предотвращения частых инфекционных осложнений.
Эти осложнения приводят к затяжному течению болезни в стационаре скорой помощи и вместе с тем препятствуют необходимой и эффективной реабилитации на ранней стадии заболевания. Они обусловливают большую часть относительно высокой летальности после острого инсульта (Henon et al. 1995). Эти осложнения приводят к лихорадке, независимому фактору риска в отношении неблагоприятного течения болезни после острого инсульта (Castillo et al. 1998). Поэтому лечение этих осложнений снижает летальность и заболеваемость после острого инсульта.
Больным с острым инсультом в течение 72 часов после появления симптоматики согласно изобретению, превентивно вводят антибиотик (моксифлоксацин) или несколько противоинфекционных средств и таким образом защищают от инфекций (таких как, например, пневмонии, мочеполовые инфекции и сепсис). Тем самым предотвращают прямую и непрямую летальность и заболеваемость. Превентивную противоинфекционную терапию нужно проводить в течение 1-7 суток.
Сущность изобретения заключается в применении известных средств для новой цели и в комбинации известных элементов (противоинфекционных средств/антибиотиков) и новом действии - их использовании для влияния на инфекционные осложнения за счет ранней превентивной противоинфекционной терапии после острого инсульта, которые в соответствии со своим новым общим действием обеспечивают преимущество и достижение ожидаемого результата, который состоит в том, что теперь имеются средства для превентивной терапии, которые приводят к снижению летальности и заболеваемости, в особенности также для улучшения неврологических функций в случае острого инсульта.
Изобретение также относится к применению противоинфекционных средств/антибиотиков для превентивной противоинфекционной терапии после острого инсульта, а также к получению средств и/или фармацевтических композиций для превентивной противоинфекционной терапии после острого инсульта.
Кроме того, оно относится к их применению для получения лекарственных средств для превентивной терапии пневмоний, мочеполовых инфекций и сепсиса после острого инсульта.
Под ранней превентивной противоинфекционной терапией после острого инсульта понимают то, что проводят лечение в течение 72 часов после инсульта.
Следующим аспектом изобретения является иммуномодуляторная терапия с помощью цитокинов (таких как, например, гамма-интерферон), инактивированных парапоксвирусов (например, инактивированный овечий парапоксвирус), связывания эндотоксинов (например, с помощью rВР121) или блокады симпатической нервной системы (например, бета-блокаторы, например, пропранолол) или активации парасимпатической нервной системы (например, CNI-1493) в течение первых 7 суток после начала заболевания, представляющая собой нового рода терапевтический подход к лечению больных с инсультом, который пригоден для снижения летальности и заболеваемости в случае этой болезни. В особенности благодаря этому имеется эффективный терапевтический подход для предотвращения частых инфекционных осложнений. Эти осложнения приводят к затяжному течению болезни в стационаре скорой помощи и вместе с тем препятствуют необходимой и эффективной реабилитации на ранней стадии заболевания. Эти осложнения обусловливают большую часть относительно высокой летальности после острого инсульта (Henon et al. 1995). Эти осложнения обусловливают дальнейшую лихорадку, независимый фактор риска в отношении неблагоприятного течения болезни после острого инсульта (Castillo et al. 1998). Поэтому предотвращение этих осложнений снижает летальность и заболеваемость после острого инсульта. В особенности благодаря этому иммуномодуляторная терапия уменьшает неврологический дефицит.
Больным с острым инсультом в течение 72 часов после появления симптоматики согласно изобретению превентивно вводят цитокин и/или проводят фармакологическую блокаду симпатической нервной системы, и/или фармакологическое связывание эндотоксина, и/или активацию парасимпатической нервной системы, и/или иммуностимуляцию и, таким образом, устраняют риск возникновения иммунодепрессии и обеспечивают защиту от инфекций (таких как, например, пневмонии, мочеполовые инфекции и сепсис). Тем самым снижают прямую и непрямую летальность и заболеваемость. Эту иммуномодуляторную терапию нужно проводить в течение 0-7 суток после острого инсульта, в зависимости от конкретного случая осуществляемого клинического исследования.
Сущность изобретения заключается в применении известных средств для новой цели и в комбинации известных элементов (цитокинов, иммуностимуляторов, антисимпатикотонических средств и активаторов парасимпатической нервной системы) и новом действии - их использовании для предотвращения иммуннодепрессии после острого инсульта, которые в соответствии со своим новым общим воздействием обеспечивают преимущество и достижение ожидаемого результата, который состоит в том, что теперь имеются средства для превентивной терапии, которые приводят к снижению летальности и заболеваемости в случае острого инсульта.
Изобретение относится также к применению цитокинов и фармацевтических средств для блокады симпатической нервной системы, связующих эндотоксинов и иммуностимуляторов для иммуномодуляторной терапии после острого инсульта, а также к получению средств и/или фармацевтических композиций для иммуномодуляторной терапии после острого инсульта.
Кроме того, оно относится к их применению для получения лекарственных средств для облегчения или устранения иммунодепрессии после острого инсульта. Под ранней иммуномодуляторной терапией после острого инсульта понимают то, что лечение осуществляют в течение 1 недели после инсульта.
Подробное описание изобретения
Изобретение относится к применению противоинфекционного средства и/или иммуномодулятора для получения средства, и/или фармацевтической композиции для превентивной противоинфекционной терапии после острого инсульта. Получены согласно изобретению средства и фармацевтические композиции для превентивной терапии после острого инсульта, которые в качестве активных компонентов в фармацевтических композициях содержат противоинфекционные средства для профилактики и лечения пневмоний, мочеполовых инфекций и сепсиса, прежде всего из классов бета-лактамных антибиотиков, тетрациклинов, аминогликозидов, линкозаминов, гликопептидов, макролидов, карбапенемов, оксазолидинонов, стрептограминов, а также фторхинолонов (и в данном случае в особенности моксифлоксацин), а также цитокинов (таких как интерлейкины, интерфероны), ингибиторов симпатической нервной системы (таких как бета-блокаторы, альфа-симпатомиметики), активаторов парасимпатической нервной системы, связующих эндотоксинов (таких как липополисахаридсвязывающий протеин = LBP, BPI, rBPI21) и инактивированных частиц овечьего парапоксвируса.
Превентивная терапия с помощью противоинфекционных средств (таких как, например, моксифлоксацин) в течение первых 7 суток после начала болезни представляет собой нового рода терапевтический подход к лечению больных с инсультом, который пригоден для снижения летальности и заболеваемости в случае этой болезни.
Часто возникающие инфекционные осложнения приводят к затяжному течению болезни в стационаре скорой помощи и вместе с тем препятствуют необходимой и эффективной реабилитации на ранней стадии заболевания. К тому же они обусловливают большую часть относительно высокой летальности после острого инсульта (Henon et al. 1995) и вызывают дальнейшую лихорадку, которая в качестве независимого фактора риска вызывает неблагоприятное течение болезни после острого инсульта (Castillo et al. 1998). Поэтому лечение этих осложнений снижает летальность и заболеваемость после острого инсульта.
Больным с острым инсультом по возможности незамедлительно, самое позднее в течение 72 часов после появления симптоматики, согласно изобретению вводят противоинфекционное средство, в особенности антибиотик широкого спектра действия, в особенности антибиотик (такой как моксифлоксацин) или несколько противоинфекционных средств. Таким образом уменьшают прямую или непрямую летальность и заболеваемость. Превентивную противоинфекционную терапию нужно проводить в течение 1-7 суток. Предпочтительная дозировка соответствует, смотря по обстоятельствам, обычной эффективной суточной дозе противоинфекционного средства или противоинфекционных средств для лечения вышеуказанных инфекций. Противоинфекционное средство предпочтительно вводят перорально или парентерально. Моксифлоксацин вводят в дозе 400 мг один раз в сутки перорально или парентерально.
Применяемое противоинфекционное средство может содержать один или несколько антибиотиков в фармацевтической композиции. Согласно особому варианту осуществления изобретения комбинируют несколько разных противоинфекционных средств.
Предпочтительны антибиотики из классов бета-лактамных антибиотиков, тетрациклинов, аминогликозидов, линкозаминов, гликопептидов, макролидов, карбапенемов, оксазолидинонов, стрептограминов, а также фторхинолонов. Из них особенно предпочтительны антибиотики широкого спектра действия, в особенности бета-лактамные антибиотики, фторхинолоны и карбапенемы. Предпочтительнее всего используют моксифлоксацин (1-циклопропил-6-фтор-1,4-дигидро-8-метокси-7-[(4aS,7aS)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил]-4-оксохинолин-3-карбоновая кислота), так как моксифлоксацин борется с появляющимися у пациента с инсультом возбудителями инфекционных болезней и его нужно вводить только один раз в сутки.
Предлагаемое согласно изобретению применение противоинфекционного средства для получения средств и/или фармацевтических композиций для превентивной противоинфекционной терапии после острого инсульта полезно для млекопитающих, особенно в случае домашних и комнатных животных, в особенности для человека. Вместе с основным применением в области медицины равным образом можно получать продукты, соответственно, лекарственные средства для ветеринарии.
Предпочтительно применение противоинфекционного средства для защиты от инфекций, таких как пневмонии, мочеполовые инфекции и/или сепсис, после острого инсульта.
Согласно настоящему изобретению для получения фармацевтической композиции используют иммуномодулятор, отличающийся тем, что он может быть выбран из группы, состоящей из цитокинов и/или ингибиторов симпатической нервной системы и/или активаторов парасимпатической нервной системы. Они обладают способностью предотвращать или компенсировать иммунодепрессию, в особенности так называемый Th1/Th2-сдвиг. Предпочтительно используют интерфероны, интерлейкины и бета-блокаторы рецепторов. Самыми предпочтительными являются β-блокатор пропранолол, интерферон IFN-γ, связующее эндотоксинов rBPI-21, липополисахаридсвязывающий протеин = LBP, а также инактивированная частица овечьего парапоксвируса.
Для получения лекарственного средства или фармацевтической композиции согласно изобретению используют иммуномодулятор или иммуномодуляторы, которые могут служить для превентивной противоинфекционной терапии после острого инсульта в случае млекопитающих, особенно в случае домашних и комнатных животных, в особенности в случае человека.
Изобретение относится также к применению одного или нескольких противоинфекционных средств и одного или нескольких иммуномодуляторов для получения фармацевтических композиций для превентивной противоинфекционной терапии после острого инсульта, причем противоинфекционное средство может быть выбрано из группы, состоящей из антибиотиков широкого спектра действия, и иммуномодулятор выбирают из группы, состоящей из ингибиторов симпатической нервной системы, цитокинов, связующих эндотоксинов и инактивированных частиц овечьего парапоксвируса. Предпочтительным является противоинфекционное средство моксифлоксацин, а иммуномодулятором гамма-интерферон.
Изобретение можно представить также в виде набора, который включает, в раздельной или комбинированной форме, фармацевтическую композицию, содержащую иммуномодулятор, который может быть выбран из группы, состоящей из цитокинов и/или ингибиторов симпатической нервной системы, и противоинфекционное средство, которое может быть выбрано из группы, состоящей из бета-лактамных антибиотиков, тетрациклинов, аминогликозидов, линкозаминов, гликопептидов, макролидов, карбапенемов, оксазолидинонов, стрептограминов, а также фторхинолонов.
Изобретение относится также к способу лечения больных после острого инсульта с целью снижения летальности, причем также нужно предотвращать инфекции после инсульта. При этом больному, нуждающемуся в таком лечении, следовательно, перенесшему инсульт, вводят эффективную дозу противоинфекционного средства и/или иммуномодулятора. Пациенту предпочтительно вводят дозу непосредственно после инсульта. Можно также вводить комбинации из одного или нескольких противоинфекционных средств и одного или нескольких иммуномодуляторов. Предпочтительны следующие комбинации из одного или нескольких антибиотиков широкого спектра действия, а также из одного или нескольких цитокинов и/или связующих эндотоксинов и/или частиц овечьего парапоксвируса. В следующие 1-7 суток нужно применять, соответственно, обычные суточные дозы вышеуказанных противоинфекционных средств (от 1 мг до 100 г) и иммуномодуляторов (от 1 мкг до 100 г).
Предлагаемое согласно изобретению применение средств можно осуществлять благодаря известным лекарственным формам, следовательно, лекарственным формам, которые по сей день используют для соответствующих биологически активных веществ. Однако изобретение относится также к разработке новых лекарственных форм, которые в особенности пригодны для больных с инфарктом, например, для внутриоболочечного, назального, внутримышечного, интратрахеального, интрабронхиального, подкожного, внутривенного, внутриартериального, через слизистую оболочку, энтерального и перорального введения.
Предлагаемое согласно изобретению применение средств можно осуществлять путем переведения известным образом в обычные лекарственные формы, такие как таблетки, драже, пилюли, грануляты, аэрозоли, эмульсии, суспензии и растворы, при использовании инертных, нетоксичных, фармацевтически приемлемых носителей или растворителей. При этом терапевтически эффективная средняя концентрация должна представлять собой, соответственно, концентрацию, которая обычно применялась до сих пор для этих средств, соответственно, от примерно 0,1 мас.% до 95 мас.%, предпочтительно от примерно 0,5 мас.% до 90 мас.%, по отношению к общей массе смеси, то есть при использовании количеств, которые достаточны для достижения указанного диапазона дозировки. Лекарственные формы получают, например, путем смешения средств с растворителями и/или носителями, в случае необходимости, при применении эмульгаторов и/или диспергаторов, причем, например, при использовании воды в качестве разбавителя, в случае необходимости, можно использовать органические растворители в качестве вспомогательных веществ.
В качестве вспомогательных веществ следует указать, например, воду, нетоксичные растворители, такие как парафин (например, нефтяные фракции), растительные масла (например, арахисовое масло, кунжутное масло), спирты (например, этиловый спирт, глицерин), носители, такие как, например, природная каменная мука (например, каолин, глинозем, тальк, мел), синтетическая каменная мука (например, высокодисперсная кремниевая кислота, силикаты), сахара (например, тростниковый, молочный и виноградный сахар), эмульгаторы (например, полиоксиэтиленированные эфиры жирных кислот, простые полиоксиэтиленированные эфиры жирных спиртов), диспергаторы (например, лигнин, сульфитные щелоки, метилцеллюлоза, крахмал и поливинилпирролидон) и лубрификаторы (например, стеарат магния, тальк, стеариновая кислота и сульфат натрия). Введение осуществляют обычным образом, предпочтительно перорально или парентерально, в особенности чрезязычно или внутривенно. В случае перорального введения предлагаемых согласно изобретению лекарственных средств, таблетки, само собой разумеется, кроме указанных носителей, могут также содержать добавки, такие как цитрат натрия, карбонат кальция и дикальцийфосфат, вместе с различными наполнителями, такими как крахмалы, предпочтительно картофельный крахмал, желатин и т.п. Далее, для таблетирования можно совместно использовать лубрификаторы, такие как стеарат магния, лаурилсульфат натрия и тальк. В случае водных суспензий биологически активные вещества, кроме вышеуказанных вспомогательных веществ, можно смешивать с различными, улучшающими неприятный вкус лекарства, веществами или красителями. В случае парентерального введения можно использовать растворы биологически активных веществ при использовании пригодных жидких носителей.
Изобретение относится также к набору, включающему в раздельной форме фармацевтическую композицию, содержащую иммуномодулятор, который может быть выбран из вышеуказанной группы иммуномодуляторов, и противоинфекционное средство, которое может быть выбрано из вышеуказанной группы противоинфекционных средств.
Изобретение относится также к применению иммуномодуляторов и противоинфекционных средств для получения фармацевтической композиции или лекарственного средства, которая (которое) содержит оба вещества. Равным образом, веществ обеих активных групп может быть несколько. Предпочтительны антибиотики широкого спектра действия, а также ингибиторы симпатической нервной системы и/или активаторы парасимпатической нервной системы, и/или цитокины, и/или связующие эндотоксинов, и/или частицы овечьего парапоксвируса.
Более предпочтительными комбинациями являются бета-лактамные антибиотики, фторхинолоны и карбапенемы и/или цитокины. Самыми предпочтительными являются моксифлоксацин и гамма-интерферон.
Изобретение должно быть пояснено подробнее с помощью примеров осуществления, без ограничения его объема охраны этими примерами.
Примеры осуществления в отношении противоинфекционного средства
Пример 1А
Церебральная ишемия на модели мышей
Согласно мышиной модели церебральной ишемии, общепринятой модели ишемического инсульта, мышей подвергали МСАО-операции. При этом среднюю мозговую артерию подвергают окклюзии в течение примерно 60 минут, и возникает типичный для модели церебральный инфаркт. В качестве контроля служит так называемая ложная (Sham) операция, при которой животных равным образом подвергают МСАО-операции, однако, среднюю мозговую артерию подвергают окклюзии только примерно в течение 1 минуты. В остальном обе парадигмы идентичны. Таким образом, периоперативный стресс в качестве систематической ошибки для последующих результатов можно считать надежно исключенным.
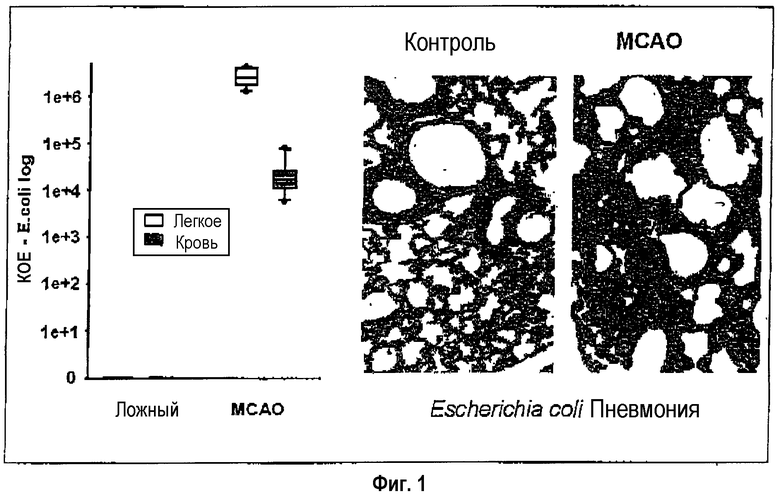
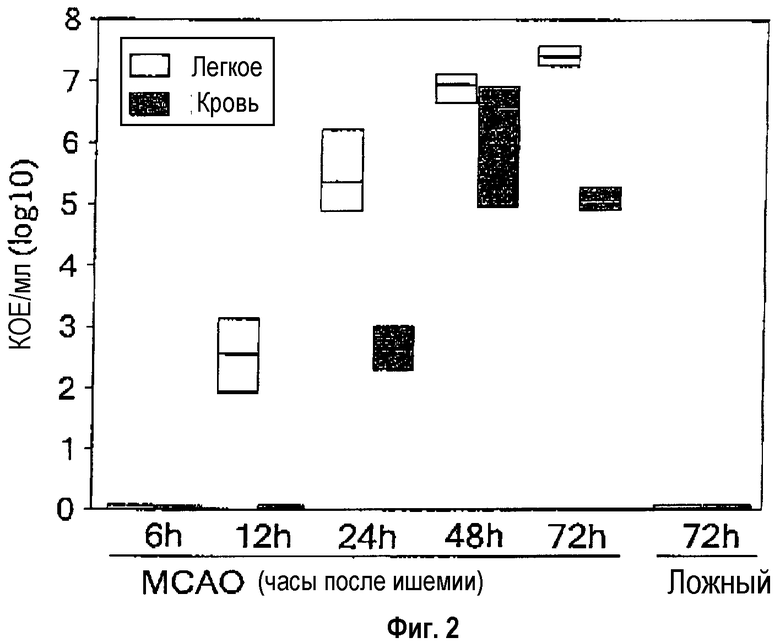
На фиг.1 показано, что спустя 3 суток после инсульта у мышей наблюдают бактериемию и пневмонию с бактериальной инфекционной «нагрузкой» (более чем 95% Escherichia coli) 2·104, соответственно, 4·106 колониеобразующих единиц/мл (КОЕ/мл). В противоположность этому, никакой инфекции у контрольных животных (подвергнутых ложной операции) не находят. На фиг.2 представлено типичное течение во времени спонтанных бактериальных инфекций, индуцируемых инсультом. Значительная бактериальная инфекционная «нагрузка» наблюдается спустя примерно 24 часа после инсульта.
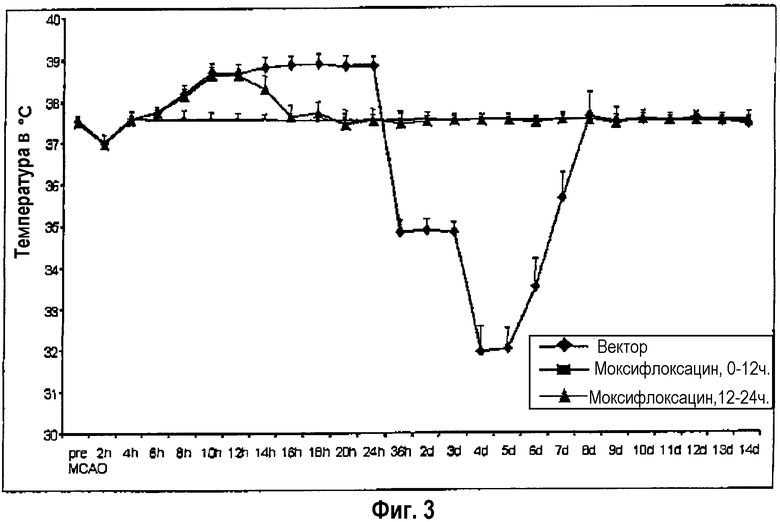
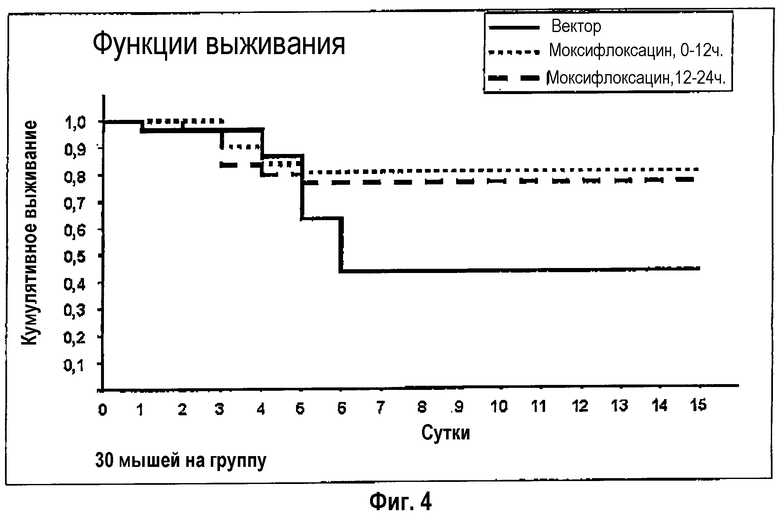
У животных с инсультом в течение первых 12 часов после инсульта появляется лихорадка, и спустя следующие 12 часов они начинают приобретать гипотермическую температуру тела (фиг.3, вектор-группа). При дальнейшем течении болезни из сочетания бактериемии и пневмонии возникает картина сепсиса, от которого животные умирают спустя 4-6 суток (фиг.4, вектор-группа).
Пример 2А
Применение противоинфекционного средства
Благодаря превентивной терапии с помощью противоинфекционного средства мезлоциллина плюс сулбактам, с помощью очень ранней схемы лечения (спустя 0-12 часов после острого инсульта) были предотвращены инфекции (данные не представлены), а также значительно снижены лихорадка и гипертермия и в особенности летальность после инсульта.
Пример 3А
Применение мезлоциллина плюс сулбактам
Благодаря превентивной терапии, следуя примеру 2, при использовании мезлоциллина плюс сулбактам, с помощью более поздней схемы лечения (спустя 12-24 часа после острого инсульта) были предотвращены инфекции (данные не представлены), а также значительно снижены лихорадка и гипертермия и в особенности летальность после инсульта.
Пример 4А
Применение имипенема плюс циластатин
Благодаря превентивной терапии, следуя примеру 2, при использовании имипинема плюс циластатин, с помощью очень ранней схемы лечения (спустя 0-16 часов после острого инсульта) были предотвращены инфекции (данные не представлены), а также значительно снижены лихорадка и гипертермия и в особенности летальность после инсульта.
Пример 5А
Применение моксифлоксацина
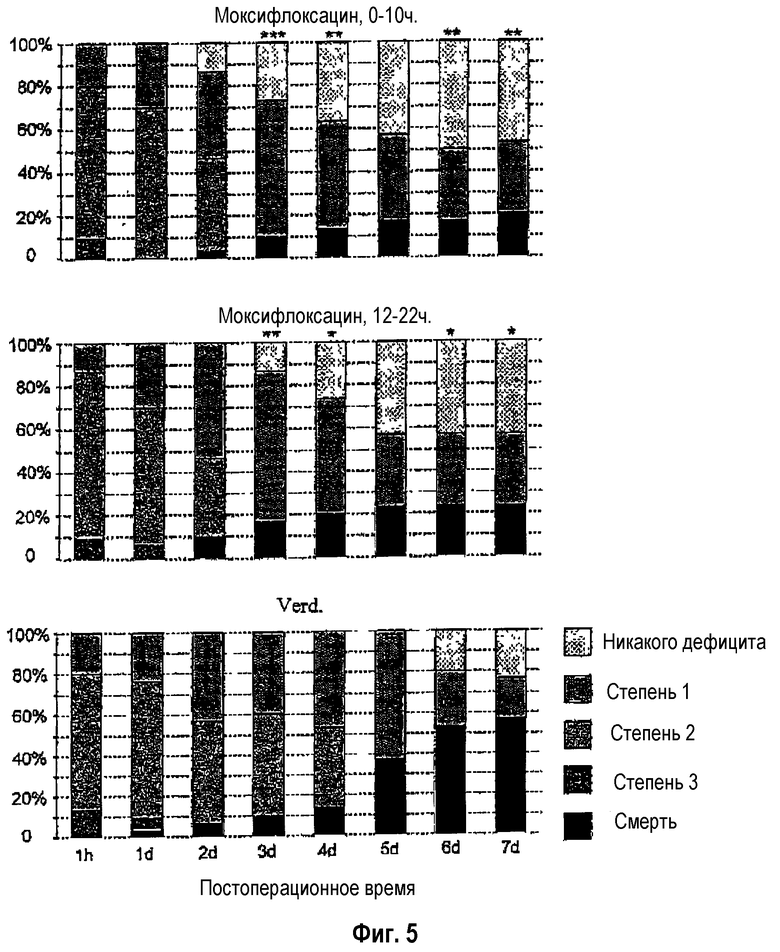
Благодаря превентивной терапии с помощью моксифлоксацина при использовании очень ранней (спустя 0-12 часов после острого инсульта), а также немного более поздней (спустя 12-24 часа после острого инсульта) схемы лечения, после инсульта были предотвращены инфекции (данные не представлены), а также значительно снижены лихорадка и гипертермия, летальность и в особенности также неврологический дефицит (фиг.3-5).
Примеры осуществления в отношении иммуномодуляции
Пример 1В
Церебральная ишемия на модели мышей
Согласно мышиной модели церебральной ишемии мышей подвергали МСАО-операции, причем среднюю мозговую артерию подвергают окклюзии в течение примерно 60 минут и возникает типичный для модели церебральный инфаркт. В качестве контроля служит так называемая ложная (Sham) операция, при которой животных равным образом подвергают МСАО-операции, однако, среднюю мозговую артерию подвергают окклюзии только примерно в течение 1 минуты. В остальном обе парадигмы идентичны. Таким образом, периоперативный стресс в качестве систематической ошибки для следующих результатов можно считать надежно исключенным.
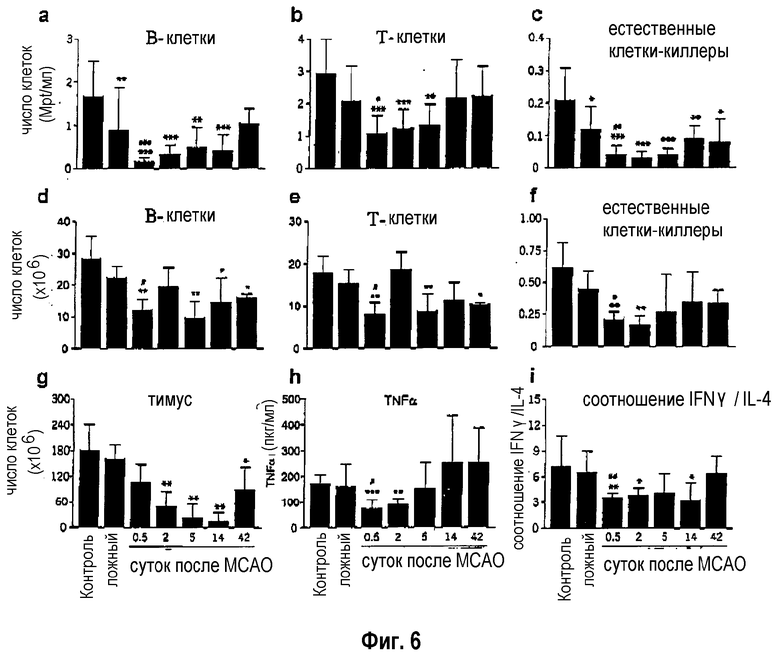
На фиг.6 показано, что у мышей в течение половины суток после инсульта происходит заметное уменьшение количества циркулирующих в крови лимфоцитов (подробно: В-клетки, Т-клетки и естественные клетки-киллеры) (фиг.6: а-с). Эта тяжелая лимфопения сохраняется по меньшей мере 14 суток и затрагивает также селезенку и тимус (фиг.6: d-g), которые являются иммунологически важными органами. Наряду с уменьшением в чисто числовом отношении также обнаруживают функциональное ухудшение с нарушением способности секреции цитокинов после стимуляции (фиг.6: h и j). Наряду с нарушением функции моноцитов, которое выражается в нарушении секреции α-фактора некроза опухоли (TNF-α) спустя 2 суток после LPS-стимуляции, обнаружено изменение лимфоцитов после ConA-стимуляции, которое продолжается в течение 14 суток после инсульта и по существу обусловливает сдвиг от Th1 к Th2 (измененное соотношение гамма-интерферон/интерлейкин-4), что означает потерю провоспалительной способности. Подвергнутые ложной операции животные также демонстрируют изменения вышеуказанных параметров, однако, эти изменения менее выражены. В-Клетки и естественные клетки-киллеры после операционного стресса немного убывают только в крови. В селезенке и в тимусе не происходит никаких существенных изменений, обусловленных стрессом, и функциональные параметры моноцитов и лимфоцитов остаются на уровне контроля. На фиг.1 и 2 показано, что спустя 3 суток после инсульта у мышей наблюдают бактериемию и пневмонию с бактериальной инфекционной «нагрузкой» (более чем 95% Escherichia coli) 2·105, соответственно, 4·107 колониеобразующих единиц/мл (КОЕ/мл). В противоположность этому, никакой инфекции у контрольных животных (подвергнутых ложной операции) не находят.
Пример 2В
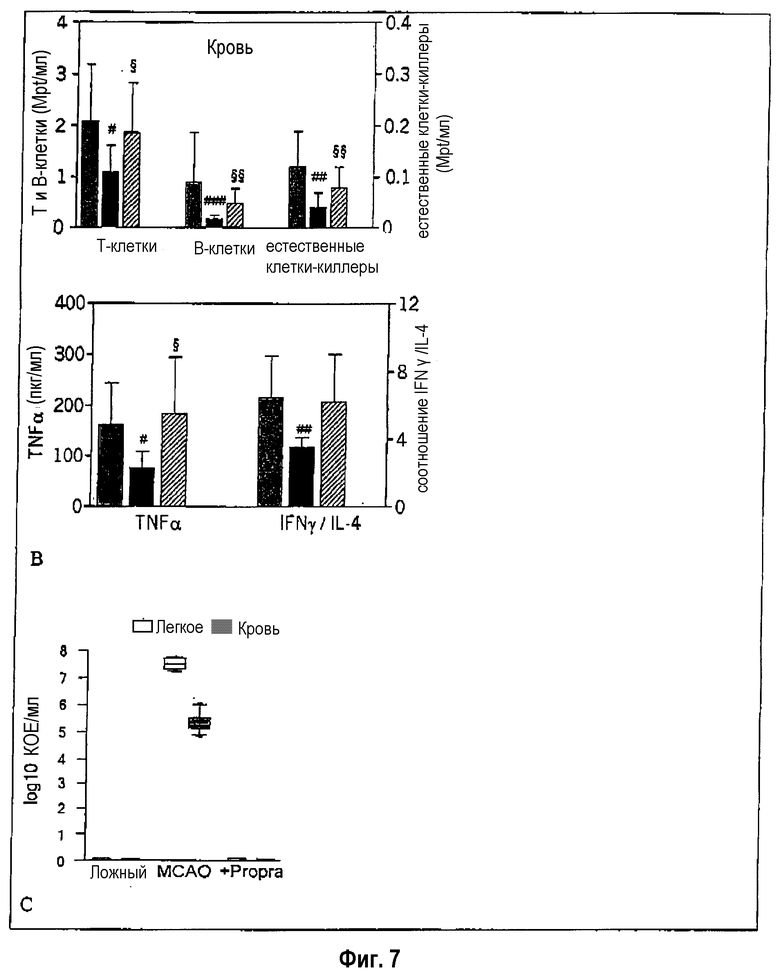
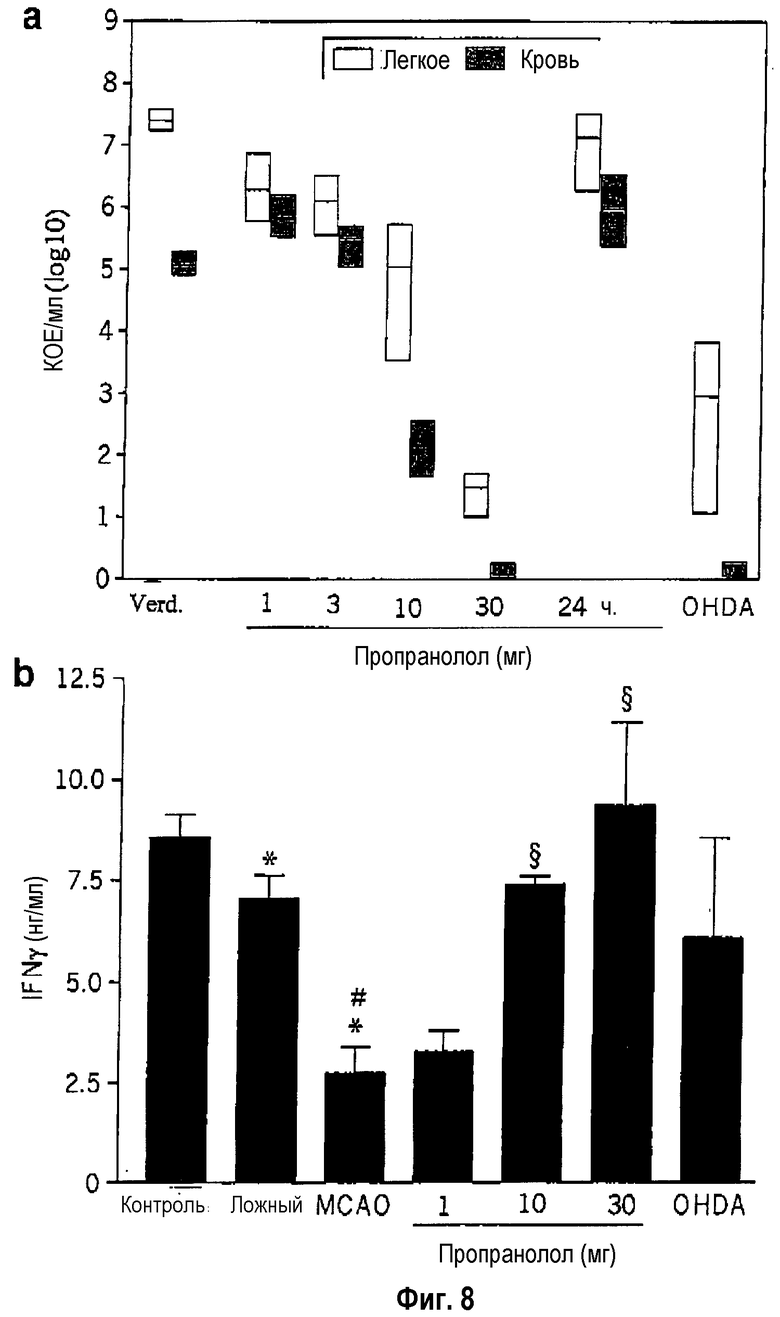
Блокада симпатической нервной системы путем введения пропранолола (неспецифический бета-блокатор), согласно экспериментальному инсульту у мыши, может предотвращать уменьшение Т-клеток и естественных клеток-киллеров и значительно снижать уровень В-клеточной лимфопении (фиг.7). Кроме того, блокада симпатической нервной системы за счет пропранолола (30 мг/кг массы тела) также предотвращает нарушение функции остающихся моноцитов (секреция TNF-α) и лимфоцитов (соотношение гамма интерферон/интерлейкин-4) (фиг.7). Блокада симпатической нервной системы также может предотвращать возникновение инфекций в легком (пневмония) и крови (сепсис) (фиг.7). Доза пропранолола (данные в мг/кг массы тела), которая необходима для предотвращения или сильного снижения бактериальных инфекций, также предотвращает нарушенную секрецию гамма-интерферона лимфоцитами (фиг.8). При этом необходимо очень раннее (непосредственно до 12 часов после инсульта) введение пропранолола. Введение спустя 24 часа после инсульта не оказывает действия (фиг.8). Ранний (до инсульта) химический симпатиколиз за счет 6-гидроксидопамина (6-OHDA) также предотвращает индуцируемую инсультом нарушенную функцию гамма-интерферона лимфоцитов и блокирует тяжелые бактериальные инфекции (фиг.8).
Пример 3В
Введение цитокинов
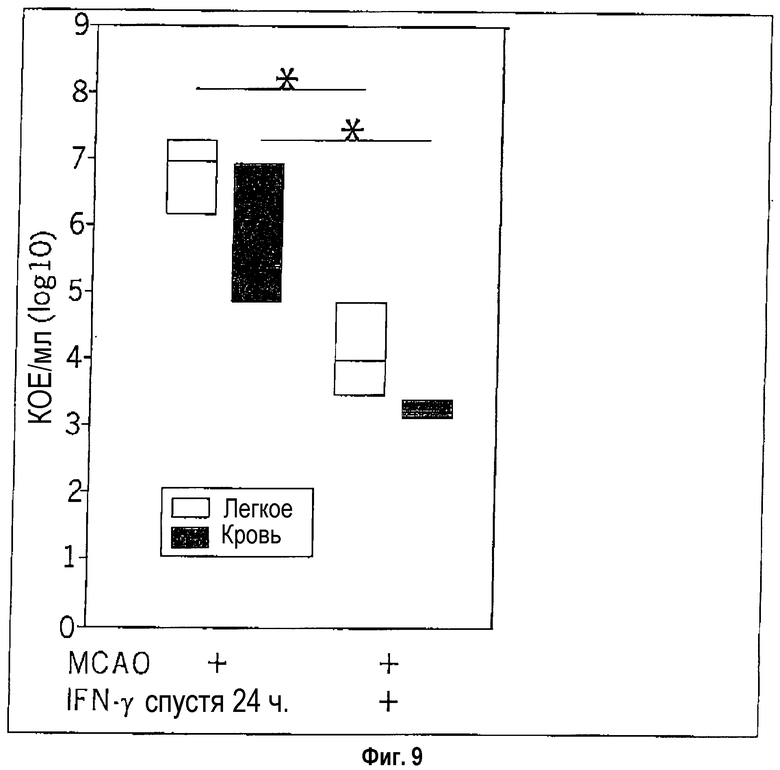
Путем введения гамма-интерферона (2 мкг) можно как снижать количество микроорганизмов в легком, так и уменьшать количество микроорганизмов в крови (фиг.9).
Пример 4В
Введение β-блокатора
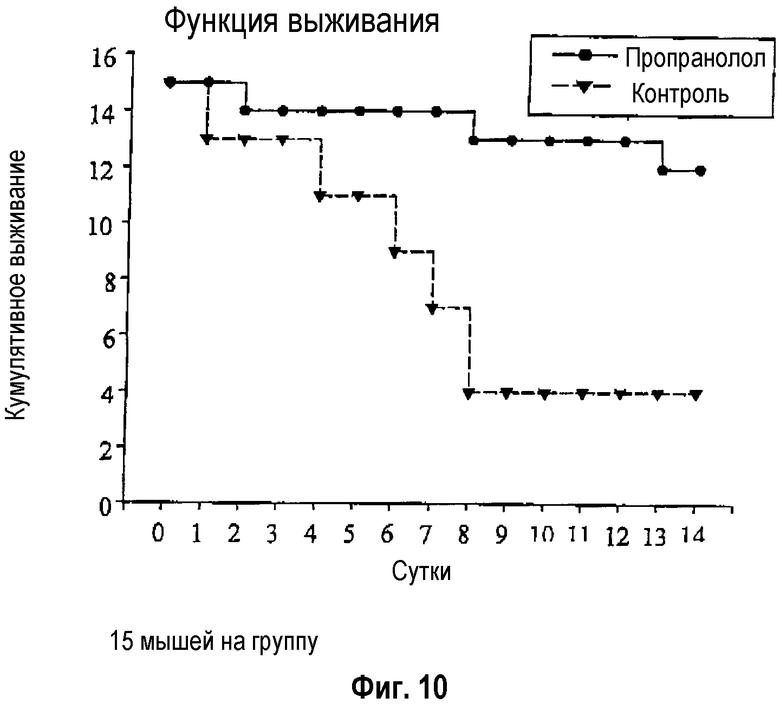
Путем введения пропранолола (30 мг/кг массы тела) можно не только предотвращать инфекции (фиг.7 и 8), но и также сильно повышать выживаемость после инсульта (фиг.10).
Пояснение к фигурам
Фиг.1: Бактериемия и пневмония спустя 3 суток после экспериментального инсульта.
Фиг.2: Раннее протекание бактериемии и пневмонии после экспериментального инсульта.
Фиг.3: Гипер- и гипотермия после экспериментального инсульта и их эффективное предотвращение путем ранней превентивной терапии с помощью противоинфекционного средства.
Фиг.4: Летальность согласно экспериментальному инсульту и ее эффективное предотвращение путем ранней превентивной терапии с помощью противоинфекционного средства.
Фиг.5: Неврологический дефицит после экспериментального инсульта и его эффективное предотвращение путем ранней превентивной терапии с помощью противоинфекционного средства.
Фиг.6: Клеточная дифференцировка посредством FACS-анализа (с помощью клеточного сортера с возбуждением флуоресценции) из крови (а-с), селезенки (d-f) и тимуса (g) и лимфоцитного функционального теста моноцитов (h) и Т-клеток (i).
Фиг.7: Предотвращение лимфопении (а), нарушения функции лимфоцитов (b) и возникновения тяжелых инфекций (с) путем фармакологической блокады симпатической нервной системы.
Фиг.8: Зависимое от дозы и времени предотвращение возникновения тяжелых бактериальных инфекций (а) и нарушения функции лимфоцитов (b) путем фармакологической блокады симпатической нервной системы.
Фиг.9: Аттенуирование тяжести инфекции в легком и крови (число КОЕ) путем введения цитокина (гамма-интерферон).
Фиг.10: Летальность после экспериментального инсульта и ее эффективное предотвращение путем ранней иммуномодуляции с помощью β-блокатора
Источники информации
Bucher А (2000). Hand hygiene-is hand disinfection the best solution. Tidsskr Nor Laegeforen 120:472-5.
Castillo J, Davalos A, Marrugat J, Noya M (1998). Timing for fever-related brain damage in acute ischemic stroke. Stroke 29:2455-2460.
Davenport RJ, Dennis MS, Wellwood I, Warlow CP (1996). Complications after acute stroke. Stroke 27:415-20.
Georgilis K, Plomaritoglou A, Dafni U, Bassiakos Y, Vemmos К (1999). Aetiology of fever in patients with acute stroke. J Intern Med 246:203-9.
Grau AJ, Buggle F, Schnitzler P, Spiel M, Lichy C. Hacke W (1999). Fever and infection early after ischemic stroke. J Neurol Sci 171:115-20.
Hata R, Mies G, Wiessner C, Fritze K, Hesselbarth D, Brinker G, Hossmann KA (1998). A reproducible model of middle cerebral artery occlusion in mice: hemodynamic, biochemical, and magnetic resonance imaging. J Cereb Blood Flow Metab 18:367-75.
Henon H, Godefroy 0, Leys D, Mounier-Vehier F, Lucas C, Rondepierre P, Duhamel A, Pruvo JP (1995), Early predictors of death and disability after acute cerebral ischemic event. Stroke 26:392-8.
Johnston КС, Li JY, Lyden PD, Hanson SK, Feasby ТЕ, Adams RJ, Faught RE Jr, Haley EC Jr (1998). Medical and neurological complications of ischemic stroke: experience from the RANTTAS trial. RANTTAS Investigators. Stroke 29:447-53.
Langhorne P, Stott DJ, Robertson L, MacDonald J, Jones L, McAlpine C, Dick F, Taylor GS, Murray G (2000). Medical complications after stroke: a multicenter study. Stroke 31:1223-9.
Smyth ET, Emmerson AM (2000). Surgical site infection surveillance. J Hosp Infect 45:173-84.
Wright AJ (1999).The penicillins. Mayo Clin Proc 74:290-307.
Yrjanheikki J, Keinanen R, Pellikka M, Hokfelt T, Koistinaho J. (1998). Tetracyclines inhibit microglial activation and are neuroprotective in global brain ischemia. Proc Nati Acad Sci USA 95:15769-74.
Yrjanheikki J, Tikka T, Keinanen R, Goldsteins G, Chan PH, Koistinaho J. (1999). A tetracycline derivative, minocycline, reduces inflammation and protects against focal cerebral ischemia with a wide therapeutic window. Proc Nati Acad Sci USA 96:13496-500.
Zhanel GO, Ennis K, Vercaigne L, Walkty A, Gin AS, Embil J, Smith H, Hoban DJ (2002). A critical review of the fluoroquinolones: focus on respiratory infections. Drugs 62:13-59.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ДИМЕРА ЛИЗОЦИМА В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА И СОДЕРЖАЩИЕ ЕГО КОМПОЗИЦИИ | 1993 |
|
RU2145875C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНСУЛЬТА | 2014 |
|
RU2571282C1 |
| Способ прогнозирования инфекционных осложнений критических состояний | 2020 |
|
RU2743453C1 |
| СПОСОБ СОПРОВОДИТЕЛЬНОГО ЛЕЧЕНИЯ ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗА | 2006 |
|
RU2320367C1 |
| СПОСОБ ЗАЩИТЫ ОТ КОРОНАВИРУСНОЙ ИНФЕКЦИИ | 2020 |
|
RU2747467C1 |
| СПОСОБ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ ЛОР-ОРГАНОВ И ОРГАНОВ ДЫХАТЕЛЬНОЙ СИСТЕМЫ, ОБУСЛОВЛЕННЫХ ВИРУСНОЙ И НЕСПЕЦИФИЧЕСКОЙ БАКТЕРИАЛЬНОЙ ФЛОРОЙ У ДЕТЕЙ РАННЕГО ВОЗРАСТА, РОЖДЕННЫХ ОТ ВИЧ-ИНФИЦИРОВАННЫХ МАТЕРЕЙ | 2004 |
|
RU2289425C2 |
| СПОСОБ ПРОФИЛАКТИКИ ОСТРЫХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ В ПОСТВАКЦИНАЛЬНОМ ПЕРИОДЕ У ДЕТЕЙ, СТРАДАЮЩИХ ХРОНИЧЕСКИМ ГЛОМЕРУЛОНЕФРИТОМ И ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ | 2005 |
|
RU2325182C2 |
| ПРИМЕНЕНИЕ ЛЕВОЦЕТИРИЗИНА И МОНТЕЛУКАСТА ПРИ ЛЕЧЕНИИ ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЙ | 2014 |
|
RU2672871C2 |
| СПОСОБ АДАПТИВНОЙ ИММУНОТЕРАПИИ | 1994 |
|
RU2098125C1 |
| КОМПОЗИЦИЯ С ПРОТИВОИНФЕКЦИОННОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2476205C1 |
Предложены средства для предотвращения инфекций после острого инсульта. В качестве таковых предложены мезлоциллин, моксифлоксацин, циластатин, имипенем и сульбактам или гамма-интерферон. При этом превентивная терапия начинается через 12-72 час после инсульта. Также выявлены свойства иммуномодулятора у пропранолола и предложено его использование для предотвращения инфекций начиная до 12 час после инсульта. Изобретение позволяет предотвратить возникновение тяжелых бактериальных инфекций (пневмония, сепсис) и повысить выживаемость после инсульта. 2 н. и 6 з.п. ф-лы, 10 ил.
| НАВАШИН С.М | |||
| и др | |||
| Рациональная антибиотикотерапия М., «Медицина», 1982, с.333 | |||
| Yrjanheikki J et al | |||
| A tetracycline derivative, minocycline, reduces inflammation and protects against focal cerebral ischemia with a wide therapeutic window | |||
| Proc Natl Acad Sci USA | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Yrjanheikki J et al Tetracyclines inhibit microglial | |||
Авторы
Даты
2008-06-27—Публикация
2003-03-05—Подача