Область техники, к которой относится изобретение
Настоящее изобретение относится к вакцинам, включающим, по меньшей мере, один антиген и иммуностимулирующее вещество.
Уровень техники
В защите хозяина от поражающих его патогенов участвуют клеточные и гуморальные эффекторы при согласованной работе неадаптивного (врожденного) и адаптивного (приобретенного) иммунитета. Последний основывается на специфическом иммунологическом распознавании при помощи рецепторов, является недавним приобретением иммунной системы и имеется только у позвоночных. Первый возник еще до развития адаптивного иммунитета и состоит из целого ряда клеток и молекул, распределенных по всему организму с целью держать под контролем вероятные патогены (Boman Н. (2000), Zanetti M. (1997)).
В- и Т-лимфоциты являются носителями приобретенного антигенспецифичного адаптивного иммунитета, включая выработку иммунологической памяти, что является главной целью создания хорошей вакцины (Schijns V. (2000)). Антигенпрезентирующие клетки (АПК) - это высокоспециализированные клетки, которые обрабатывают антигены и презентируют их обработанные фрагменты на поверхности клетки вместе с молекулами, необходимыми для активации лимфоцитов. Это означает, что АПК имеют важное значение для запуска специфических иммунных реакций. Основные виды АПК для активации Т-лимфоцитов - дендритные клетки (ДК), макрофаги и В-клетки, тогда как основные виды АПК для В-клеток - это фолликулярные дендритные клетки. В общем, ДК являются самыми мощными из АПК в отношении запуска иммунных реакций, стимулирующих покоящиеся "наивные" и "обладающие памятью" В- и Т-лимфоциты.
Естественной задачей АПК на периферии (к примеру, ДК или клеток Лангерганса) является захват и обработка антигенов, при этом, будучи активированными, они начинают экспрессировать костимулирующие лимфоциты молекулы, мигрируют в лимфоидные органы, выделяют цитокины и презентируют антигены различным популяциям лимфоцитов, инициируя антигенспецифичные иммунные реакции. Они не только активируют лимфоциты, но в определенных обстоятельствах также индуцируют толерантность Т-клеток к антигенам (Banchereau J. (1998)).
Распознавание антигенов Т-лимфоцитами ограничивается главным комплексом гистосовместимости (МНС) по принципу МНС-рестрикции. Конкретный Т-лимфоцит распознает антиген только тогда, когда данный пептид связан с определенной молекулой МНС. В общем, Т-лимфоциты стимулируются только в присутствии собственных молекул МНС, а антигены распознаются лишь в виде пептидов, связанных с собственными молекулами МНС. Рестрикция по МНС определяет специфичность Т-лимфоцитов в отношении узнаваемого антигена и в отношении молекулы МНС, связывающей его пептидный фрагмент.
Внутриклеточные и внеклеточные антигены ставят весьма разные задачи перед иммунной системой, как в отношении распознавания, так и соответствующего ответа. Презентация антигенов Т-клеткам осуществляется двумя разными классами молекул - молекулами I класса МНС (MHC-I) и II класса МНС (MHC-II), которые используют различные пути обработки антигенов. В основном можно выделить два главных пути обработки антигенов, возникших в процессе эволюции. Пептиды, происходящие из внутриклеточных антигенов, презентируются Т-клеткам CD8+ молекулами I класса МНС, которые экспрессируются практически на всех клетках, тогда как пептиды, происходящие из внеклеточных антигенов, презентируются Т-клеткам CD4+ молекулами II класса МНС (Monaco J. (1992); Harding С. (1995)). Однако имеются определенные исключения из этого дихотолического механизма. Некоторые исследования показали, что пептиды, образовавшиеся из подвергшихся эндоцитозу, находящихся в виде частиц или растворимых белков, презентируются на молекулах MHC-I макрофагов, а также дендритных клеток (Harding С. (1996); Brossart P. (1997)). Таким образом, АПК, такие как дендритные клетки, находящиеся на периферии, обладающие высокой способностью к захвату и обработке внеклеточных антигенов и презентации их Т-лимфоцитам на молекулах MHC-I, представляют интерес как мишени для "нагрузки" их внеклеточными антигенами in vitro и in vivo.
Важная и уникальная роль АПК, включая стимулирование активности различных типов лейкоцитов, отражает их центральное положение как мишеней для соответствующих подходов при разработке хороших вакцин. Теоретически один из путей к этому состоит в усилении или стимулировании их естественной функции - захвата антигенов. После захвата соответствующих антигенов, против которых направлена вакцина, АПК должны приступить к обработке захваченных антигенов, при этом они активируются, экспрессируют молекулы, костимулирующие лимфоциты, мигрируют в лимфоидные органы, секретируют цитокины и презентируют антигены различным популяциям лимфоцитов, инициируя таким образом иммунные реакции.
Активированные Т-клетки обычно секретируют ряд эффекторных цитокинов хорошо регулируемым образом, а именно: интерлейкин 2 (IL-2), IL-4, IL-5, IL-10 и γ-интерферон (γ-IFN). Функциональный анализ ответов цитотоксических Т-лимфоцитов на специфические антигены (к примеру, раковые антигены и вообще антигены, вводимые с вакциной) обычно осуществляется методом ELISpot (точечного иммуноферментного анализа), которым можно анализировать продукцию цитокинов на уровне одной клетки. В настоящем изобретении определение стимулирующего клеточный иммунитет цитокина γ-IFN методом ELISpot применялось для слежения за специфичной активацией Т-клеток пептидами.
Ранее было показано, что поликатионы эффективно усиливают захват связанных с MHC-I пептидов раковыми клетками, и такой процесс "загрузки" пептидов или белков получил название "нагрузки антигеном, или загрузки антигена" (TRANSloading) (Buschle М. (1997)). Далее мы показали, что поликатионы способны "загружать" (TRANSload) пептиды или белки в антигенпрезентирующие клетки in vivo и in vitro (Buschle M. (1998)). Кроме того, совместное введение смеси поли-L-аргинина или поли-L-лизина вместе с соответствующим пептидом в качестве вакцины защищает животных от роста опухолей на мышиных моделях (Schmidt W. (1997)). Такая химически охарактеризованная вакцина способна индуцировать большое число специфичных к антигену/пептиду Т-клеток. Было показано, что это, по крайней мере частично, объясняется усиленным захватом пептидов в АПК, опосредованным поликатионом (Buschle М. (1998)), а это означает, что при "нагрузке" in viro антигеном АПК могут индуцировать Т-клеточный иммунитет на введенный антиген.
В отличие от адаптивного иммунитета, характеризующегося высокоспецифичным, но относительно медленным ответом, врожденный иммунитет основывается на эффекторных механизмах, которые запускаются различиями в структуре компонентов микроорганизмов по сравнению с хозяином. Такие механизмы могут вызывать достаточно быстрый первоначальный ответ, который в основном ведет к нейтрализации вредных агентов. Реакции врожденного иммунитета являются единственной оборонительной стратегией низших таксонов и сохраняются у позвоночных в качестве первой линии защиты хозяина до мобилизации адаптивной иммунной системы.
У высших позвоночных эффекторными клетками врожденного иммунитета служат нейтрофилы, макрофаги и клетки действенных киллеров (NK), а также, вероятно, дендритные клетки (Mizukawa N. (1999)), тогда как гуморальными компонентами этого пути являются белки каскада комплемента и различные другие связывающие белки (Boman H. (2000)).
Быстрым и действенным элементом врожденного иммунитета является выработка большого числа антимикробных пептидов, длина которых обычно составляет от 12 до 100 аминокислотных остатков. Уже выделено несколько сотен различных антимикробных пептидов из целого ряда организмов, от губок и насекомых до животных и человека, что указывает на широкое распростанение этих молекул. Антимикробные пептиды также вырабатываются бактериями как антагонистические соединения против конкурентов.
В ЕР 0905141 А1 раскрыт пептидный фрагмент фактора анти-LPS мечехвоста Limulus (LALF), обладающий антивирусным действием. Этот пептид LALF не повышает специфические иммунные ответы, а усиливает неспецифические защитные механизмы мононуклеарных клеток и может применяться для профилактики, кроме того, этот пептид можно местно наносить на раневые поверхности для усиления излечивания и заживления ран.
Главными источниками антимикробных пептидов являются гранулы нейтрофилов и эпителиальных клеток, выстилающих дыхательный, желудочно-кишечный и мочеполовой тракты. Обычно они находятся в анатомических структурах, наиболее подверженных вторжению микробов, и секретируются в жидкие среды организма или хранятся в цитоплазматических гранулах иммунокомпетентных фагоцитов (нейтрофилов) (Ganz Т. (1997); Ganz Т. (1998); Ganz Т. (1999); Boman H. (2000); Gudmundsson G.H. (1999)).
Ранее было показано (патентная заявка Австрии А 1416/2000), что природные антимикробные пептиды - производные кателицидина или их производные обладают иммуностимулирующим действием и поэтому являются высокоэффективными адъювантами.
Целью настоящего изобретения является получение адъюванта/ пептида-носителя, способного сильно повышать иммунные ответы на вводимые вместе с ним специфические антигены и поэтому являющегося высокоэффективным адъювантом.
Эта задача решается с помощью вакцины, включающей, по меньшей мере, один антиген и пептид, имеющий последовательность R1-XZXZNXZX-R2, где:
- N означает целое число от 3 до 7, предпочтительно 5,
- Х означает остаток положительно заряженной природной и/или неприродной аминокислоты,
- Z означает остаток аминокислоты, выбранной из числа L, V, I, F и/или W,
- R1 и R2 выбраны независимо друг от друга из группы, состоящей из -Н, -NH2, -СОСН3, -СОН, пептидов, состоящих из 20 и меньше аминокислотных остатков, реакционноспособных групп пептидов, пептидных линкеров с пептидом или без него; X-R2 также может представлять собой амид, эфир или тиоэфир остатка С-концевой аминокислоты.
Помимо природных антимикробных пептидов, были получены и исследованы синтетические антимикробные пептиды. Оказалось, что синтетический антимикробный пептид KLKLLLLLKLK-NH2 обладает значительной химиотерапевтической активностью на мышах, зараженных Staphylococcus aureus; нейтрофилы человека активировались и вырабатывали анион супероксида (О2 -) при посредстве кальретикулина на поверхности клеток. Точное число и положение К и L оказались критическими для антимикробной активности синтетического пептида (Nakajima Y. (1997); Cho J-H. (1999)).
Неожиданно в ходе настоящего изобретения было показано, что пептиды по настоящему изобретению, имеющие последовательность R1-XZXZNXZX-R2, где:
- N означает целое число от 3 до 7, предпочтительно 5,
- Х означает остаток положительно заряженной природной и/или неприродной аминокислоты,
- Z означает остаток аминокислоты, выбранной из числа L, V, I, F и/или W,
- R1 и R2 выбраны независимо друг от друга из группы, состоящей из -Н, -NH2, -СОСН3, -СОН, пептидов, состоящих из 20 и меньше аминокислотных остатков, реагирующих с пептидами групп, пептидных линкеров с пептидом или без него; X-R2, также может представлять собой амид, эфир или тиоэфир остатка С-концевой аминокислоты (в дальнейшем именуемые "пептидами А"), загружают (TRANSload) антигенные пептиды или белки в АПК намного эффективнее, чем известные адъюванты, включая природные антимикробные пептиды. Кроме того, они обладают сильной иммуностимулирующей активностью и поэтому являются высокоэффективными адъювантами.
Предпочтительно С-концевая аминокислота не модифицирована (СООН или COO-), так как эта форма даже лучше, чем амидированная форма пептида.
В рамках настоящего изобретения последовательность может быть амидирована на С-конце или нести дополнительную аминокислотную последовательность, однако предпочтительно С-конец остается свободным.
Кроме того, в рамках настоящего изобретения все Х в пептидах А могут быть представлены одним и тем же аминокислотным остатком. Однако в каждом конкретном пептиде А предпочтительно Х представлен только одним специфическим аминокислотным остатком, к примеру К или R. Тот же принцип применим в отношении Z: все Z в пептидах А могут быть представлены одной аминокислотой или же разными аминокислотами, к примеру либо L, или V. Это особенно применимо в отношении участка ZN в середине формулы, который может представлять собой, например, L5 или L3, а также LVIFW, LILFLLIW, WIF, W3L2 или любую другую комбинацию этого мотива длиной от 3 до 7 аминокислотных остатков, предпочтительно от 4 до 6 аминокислотных остатков, особенно предпочтительно 5 аминокислотных остатков. Эти остатки также предпочтительны для участков R1 и R2 (например, когда более 50%, предпочтительно более 80%, особенно предпочтительно более 90% R1 и/или R2 составляют L, I, F, V и/или W, если R1 и/или R2 являются пептидами). Предпочтительно R1 и R2 одинаковы, наиболее предпочтительно они оба представлены Н (то есть N- и С-концы свободны).
В рамках настоящего изобретения термин "неприродные" охватывает все аминокислотные остатки, которые не встречаются в природе и не встречаются в природных белках, соответственно.
Особенно предпочтителен пептид R1-KLKL5KLK-R2, однако предпочтительны также и R1-KIKL5KIK-R2, R1-KVKL5KVK-R2, R1-KFKL5KVK-R2, R1-KLKL6KLK-R2, R1-KWKW5KLK-R2, R1-KWKWL3WKWK-R2, R1-KLKL4KLK-R2 или любые перестановки в отношении положения I, F, V, W и L.
Конечно, вакцина может включать два или несколько антигенов в зависимости от требуемого иммунного ответа. Антигены могут быть модифицированы с тем, чтобы еще больше усилить иммунный ответ.
Предпочтительно в качестве антигенов используют белки или пептиды, происходящие из вирусных или бактериальных патогенов, из грибов или паразитов, а также опухолевые антигены (противораковые вакцины) или антигены, играющие вероятную роль в аутоиммунных заболеваниях (включая такие производные, как гликозилированные, липидированные, гликолипидированные или гидроксилированные антигены). Кроме того, в качестве собственно антигенов можно использовать углеводы, липиды или гликолипиды. Процесс получения производных может включать очистку данного белка или пептида из патогена, инактивацию патогена, а также протеолитическую или химическую обработку или стабилизацию такого белка или пептида. С другой стороны, в качестве антигена можно также использовать и сам патоген. Антигены предпочтительно представлены пептидами или белками, углеводами, липидами, гликолипидами или их смесями.
В предпочтительном воплощении в качестве антигена используют эпитопы Т-клеток. С другой стороны, предпочтительной может быть и комбинация из эпитопов Т-клеток и эпитопов В-клеток.
Не имеет решающего значения, какой антиген будет применяться в настоящем изобретении. Конечно, можно использовать и смеси разных антигенов по настоящему изобретению. Предпочтительно в качестве таких антигенов используют белки или пептиды, происходящие из вирусных или бактериальных патогенов, либо из грибов или паразитов (включая производные антигенов, гликозилированные или липидированные антигены, полисахариды или липиды). Другим предпочтительным источником антигенов являются опухолевые антигены. Предпочтительно патогены выбирают из числа вируса иммунодефицита человека (ВИЧ), вирусов гепатита А и В, вируса гепатита С (HCV), вируса саркомы Рауса (RSV), вируса Эпштейна-Барра (EBV), вируса гриппа, ротавируса, Staphylococcus aureus, Chlamydia pneumonia, Chlamydia trachomatis, Mycobacterium tuberculosis, Streptococcus pneumonia, Bacillus anthracis. Vibrio cholerae, Plasmodium sp. (PI. falciparum, PI. vivax и др.), Aspergillus sp. и Candida albicans. Антигенами также могут быть молекулы, экспрессируемые раковыми клетками (опухолевые антигены). Процесс получения производных может включать очистку специфического белка или пептида из клеток патогена или раковых клеток, инактивацию патогена, а также протеолитическую или химическую обработку или стабилизацию такого белка. Точно так же можно использовать опухолевые антигены (противораковые вакцины) или аутоиммунные антигены в фармацевтической композиции по настоящему изобретению. С помощью таких композиций можно проводить вакцинацию против рака или лечение аутоиммунных заболеваний.
В случае пептидных антигенов данное изобретение включает применение пептидных мимотопов/агонистов/суперагонистов/антагонистов или пептидов, модифицированных по определенным положениям без изменения иммунологических свойств, либо непептидных мимотопов/агонистов/суперагонистов/антагонистов. Пептидные антигены также могут содержать удлинения на С-конце или N-конце пептидного антигена, которые облегчают взаимодействие с поликатионными соединениями или иммуностимуляторами. Для лечения аутоиммунных заболеваний могут применяться пептидные антагонисты.
Антигены также могут быть модифицированы включением молекул, усиливающих презентацию и таргетинг антигенов к антигенпрезентирующим клеткам.
В одном из воплощений изобретения фармацевтическая композиция служит для придания толерантности к белкам или белковым фрагментам и пептидам, вовлеченным в аутоиммунные заболевания. Используемые в этом воплощении антигены служат для индукции толерантности иммунной системы или понижающей регуляции (down-regulation) иммунных реакций против эпитопов, вовлеченных в аутоиммунные процессы.
Предпочтительно антиген представляет собой пептид, состоящий из 5-60, предпочтительно из 6-30, особенно предпочтительно из 8-11 аминокислотных остатков. Антигены такой длины оказались особенно пригодными для активации Т-клеток. К антигенам может быть присоединен дополнительный фрагмент ("хвост"), к примеру, согласно А 657/2000, US 5726292 или WO 98/01558.
Антиген может быть смешан с пептидами настоящего изобретения или представлен в виде другой специфической рецептуры, например липосом, состава для замедленного выделения и т.п. Антиген также может быть ковалентно или нековалентно связан с пептидом по настоящему изобретению. Предпочтительно антигены ковалентно связывают с пептидом как остатки R1 или R2, либо с боковыми цепями аминокислотных остатков пептида, в особенности с боковой цепью К или R.
Относительные количества ингредиентов данной композиции сильно зависят от назначения данной композиции. Предпочтительно используют от 10 нг до 1 г антигена и пептида А. Предпочтительные количества антигена/пептида А находятся в пределах от 0,1 до 1000 мкг антигена на вакцинацию и от 0,1 до 1000 мкг пептида А. Композиция по настоящему изобретению может дополнительно содержать вспомогательные вещества: буфера, соли, стабилизаторы, иммуностимуляторы, антиоксиданты или другие эффективные вещества, например противовоспалительные или обезболивающие лекарства.
Настоящие композиции можно вводить пациентам, к примеру, проходящим вакцинацию, в эффективном количестве, например, один раз в неделю, в две недели или в месяц. Пациенты, получающие данную композицию, могут подвергаться вакцинации несколько раз или только один раз. Предпочтительное применение настоящего изобретения - активная иммунизация, особенно людей или животных, не имеющих иммунитета против конкретного антигена.
Настоящую композицию можно вводить подкожно, внутримышечно, ректально, внутривенно, интрадермально, интрапиннально (в мочку уха), трансдермально, а также принимать внутрь.
Конечно, вакцина по настоящему изобретению может включать и другие вещества, например любые фармацевтически приемлемые носители и др. Вакцина по настоящему изобретению может быть представлена лекарственной формой, согласно известным методам, например, в виде ДНК-вакцин, вакцин для внутривенного, трансдермального, местного, интраназального применения и в виде комбинированных вакцин. Дозировку вакцин подбирают стандартными методами, исходя из известных вакцин, однако меньшие дозы могут давать ту же степень защиты, что и известные вакцины, поэтому они предпочтительны.
Предпочтительно вакцина представляется в форме, устойчивой при хранении, к примеру лиофилизованной, и необязательно в комбинации с подходящим раствором для разведения.
Аминокислотные остатки по настоящему изобретению могут представлять собой D- или L-аминокислоты. Предпочтительно все или, по меньшей мере, 80% остатков принадлежат какому-то одному виду (D или L). Наиболее предпочтительно, чтобы все аминокислоты в пептиде по настоящему изобретению были одного вида (D или L). Некоторые разновидности пептидов по настоящему изобретению также могут включать дополнительные аминокислотные остатки, встроенные в последовательность пептида А, однако гидрофобная область (Z, ZN) пептида не должна содержать остатков A, G и Т.
Предпочтительно в последовательности пептида Х означает аминокислотный остаток, выбранный из группы, состоящей из К, R, орнитина и/или гомоаргинина. Опять же Х в одном пептиде А может быть представлен различными аминокислотными остатками, выбранными из этой группы, однако предпочтительно Х представляет собой либо К, либо R, либо орнитин, либо гомоаргинин в данном пептиде А.
В предпочтительном воплощении настоящего изобретения Х в последовательности пептида является К. Было показано, что пептид А, содержащий эту аминокислоту в качестве X, вызывает особенно сильный иммунный ответ.
Предпочтительно в последовательности пептида Z выбирают из группы, состоящей из L, V, I, F и/или W. Как указано для X, также и Z в одном пептиде А может быть представлен различными аминокислотными остатками. Однако предпочтительно Z в данном пептиде А представлен остатком только одной аминокислоты, например либо L, либо V, либо I, либо F либо W, причем остатки L и I наиболее предпочтительны, а за ними следуют F, V и W (L>I>F>V>W).
Более предпочтительно Z в последовательности пептида А представляет собой L (или I, но более предпочтительно - L). При этом пептид А способен вызвать особенно сильный иммунный ответ.
Наиболее предпочтительно пептид А представляет собой H-KLKLLLLLKLK-H. Безусловно, следует иметь в виду, что эта формула охватывает и физиологические формы этого пептида (с протонированным N-концом (NH3 +) и депротонированным С-концом (СОО-)), и это относится ко всем пептидам по настоящему изобретению.
В следующем предпочтительном воплощении R1 и/или R2 в последовательности пептида состоит из 10-20 аминокислотных остатков. При этом получается пептид А такой длины, при которой индуцируется или усиливается особенно сильный иммунный ответ.
В предпочтительном воплощении настоящего изобретения аминокислотные остатки в R1 и/или R2 не являются отрицательно заряженными остатками аминокислот.
Опять же, эти аминокислотные остатки могут быть остатками природных и/или неприродных аминокислот. При добавлении не несущих отрицательный заряд остатков аминокислот на одном или на обоих концах пептида А он проявляет выраженную способность к усилению или к индуцированию иммунного ответа.
Предпочтительно R1 и/или R2 образуют гидрофобный "хвост" у пептида А. Поэтому аминокислотные остатки в R1 и/или R2 предпочтительно выбирают из группы, состоящей из L, V, I, F и/или W. Более предпочтительно аминокислотные остатки в R1 и/или R2 выбирают из группы, состоящей из L, I и/или F. Наиболее предпочтительно добавочные аминокислотные остатки представляют собой L. Такие пептиды А проявляют особенно большую способность к индуцированию сильного иммунного ответа.
В предпочтительном воплощении настоящего изобретения аминокислотные остатки в R1 и/или R2 представляют собой остатки положительно заряженных природных и/или неприродных аминокислот. Предпочтительно добавочные аминокислотные остатки выбирают из группы, состоящей из К, R, орнитина и/или гомоаргинина. Более предпочтительно аминокислотные остатки в R1 и/или R2 представляют собой К. Такие пептиды А тоже проявляют особенно большую способность к усилению иммунного ответа.
Предпочтительно аминокислотные остатки в R1 и/или R2 выбирают из первой группы (состоящей из L, V, I, F и/или W) или из второй группы (состоящей из остатков положительно заряженных аминокислот). Однако аминокислотные остатки в R1 и/или R2 также можно выбирать из обеих групп для одного и того же пептида А.
Пептид может быть соединен с сердцевинной частью пептида А настоящего изобретения посредством обычных пептидных связей либо через реагирующие с пептидами группы или пептидные линкеры. Реагирующие с пептидами группы - это химические группы, пригодные для связывания пептидов или белков. Таким образом, N- или С-конец данного пептида А может быть химически модифицирован так, чтобы он содержал химическую модификацию (например, иминотиоат, 3-меркаптопропионил), позволяющую ковалентное присоединение пептида или антигена соответственно. С другой стороны, пептид А может содержать подходящий пептидный линкер, то есть линкерную молекулу, способную образовать связь между сердцевинной частью пептида А (пептидом без R1 и/или R2) и, к примеру, присоединенным или могущим быть присоединенным к ней антигеном. Пептид по настоящему изобретению может содержать или не содержать пептид/антиген, связанный с реагирующей с пептидами группой и/или пептидным линкером. Такие химические модификации и подходящие пептидные линкеры хорошо известны специалистам в этой области.
Предпочтительно вакцина содержит еще, по меньшей мере, одно вещество, стимулирующее иммунные ответы. В качестве вещества, стимулирующего иммунные ответы, могут применяться любые вещества или молекулы, известные как активные адъюванты. Такие вещества раскрыты в WO 93/19768. Могут быть и другие вещества, например поликатионы типа полилизина или полиаргинина. Другие адъюванты могут находиться в виде частиц, например гранул силикагеля или декстрана, настолько маленьких, что они могут проникать в клетки. Включение этого дополнительного вещества, стимулирующего иммунные ответы, сделает вакцину еще более эффективной.
Предпочтительно фармацевтическая композиция по настоящему изобретению, особенно в виде вакцины, дополнительно содержит поликатионный полимер, предпочтительно поликатионный пептид, в особенности полиаргинин, полилизин или антимикробный пептид.
Поликатионным соединением для использования в соответствии с настоящим изобретением может служить любое поликатионное соединение, обладающее характерным действием в соответствии с WO 97/30721. Предпочтительно поликатионные соединения выбирают из числа основных полипептидов, органических поликатионов, основных полиаминокислот и их смесей. Длина цепи таких полиаминокислот должна составлять не менее 4 аминокислотных остатков. Особенно предпочтительны вещества, содержащие пептидные связи, такие как полилизин, полиаргинин и полипептиды содержащие более 20%, в особенности более 50% основных аминокислот, в диапазоне более 8, в особенности более 20 аминокислотных остатков, либо их смеси. Другие предпочтительные поликатионы и их фармацевтические композиции описаны в WO 97/30721 (к примеру, полиэтиленимин) и WO 99/38528. Предпочтительно эти поликатионы содержат от 20 до 500 аминокислотных остатков, в особенности от 30 до 200 остатков.
Такие поликатионные соединения могут быть получены химическим путем или рекомбинантным методом либо могут происходить из природных источников.
Катионными (поли)пептидами также могут быть поликатионные антибактериальные пептиды из микроорганизмов. Эти (поли)пептиды могут иметь прокариотическое или эукариотическое происхождение либо могут быть получены химическим путем или рекомбинантным методом. Пептиды также могут принадлежать к классу природных антимикробных пептидов. Такие пептиды защитной системы хозяина также являются предпочтительной формой поликатионных полимеров по настоящему изобретению. В общем, в качестве поликатионных полимеров используют соединения, способствующие в конечном счете активации (или понижающей регуляции) адаптивной иммунной системы, предпочтительно опосредованной АПК (включая дендритные клетки).
Особенно предпочтительны в качестве поликатионных веществ по настоящему изобретению происходящие из кателицидина антимикробные пептиды или их производные (А 1416/2000, включенный в настоящее изобретение в качестве ссылки), в особенности антимикробные пептиды, происходящие из кателицидинов млекопитающих, предпочтительно человека, быка или мышей.
Кроме того, в качестве иммуностимуляторов также можно использовать нейроактивные соединения типа гормона роста (человека), как описано в WO 01/24822.
К поликатионным соединениям природного происхождения относятся катионные пептиды, происходящие из HIV-REV и HIV-TAT, пептиды Antennapedia, хитозан и другие производные хитина, а также другие пептиды, полученные из этих пептидов или белков биохимическим или рекомбинантным способом. Другие предпочтительные поликатионные соединения - кателин либо родственные или производные вещества от кателицидина, особенно кателицидина мышей, быка и особенно человека, и/или кателицидины. Родственные вещества и производные кателицидина содержат всю последовательность кателицида или ее часть с по меньшей мере 15-20 аминокислотными остатками. Получение производных может включать замещения или модификации природных аминокислот такими аминокислотами, которые не встречаются среди 20 стандартных аминокислот. Более того, в такие молекулы кателицидинов можно вводить дополнительные катионные остатки. Предпочтительно такие молекулы кателицидинов применяются в комбинации с антигеном/ вакцинной композицией по настоящему изобретению. Однако неожиданно эти молекулы кателинов также оказались эффективными как адъюванты для антигенов без добавления других адъювантов. Поэтому такие молекулы кателицидинов можно использовать в качестве эффективных адъювантов в вакцинных композициях вместе с другими иммуноактивирующими веществами и без них.
Предпочтительно веществом, стимулирующим иммунные ответы, является цитокин. Цитокины играют важную роль в активации и стимуляции В-клеток, Т-клеток и NK-клеток, макрофагов, дендритных клеток и других клеток, принимающих участие в индукции иммунного ответа. Можно использовать любые цитокины, которые способны усиливать иммунные ответы на антигены.
Предпочтительно вакцина по настоящему изобретению дополнительно содержит иммуностимуляторную/иммуногенную нуклеиновую кислоту, предпочтительно олигодезоксинуклеотид, содержащий дезоксиинозин, олигодезоксинуклеотид, содержащий дезоксиуридин, олигодезоксинуклеотид, содержащий метилированный или неметилированный мотив CG, либо содержащую инозин и цитидин молекулу нуклеиновой кислоты.
Иммуногенная нуклеиновая кислота, используемая в соответствии с настоящим изобретением, может быть синтетической или происходить из прокариот либо эукариот. В случае эукариотического источника ДНК должна происходить в соответствии с филогенетическим древом из менее эволюционно продвинутого вида (к примеру, насекомых, но можно и других). В предпочтительном воплощении изобретения иммуногенным олигодезоксинуклеотидом (ОДН) является полученная синтетическим путем молекула ДНК или смесь таких молекул. Также подходят производные или модификации ОДН типа замещенных тиофосфатом аналогов (остатки тиофосфата замещают фосфат), например, как описано в патентах США 5723335 и 5663153, а также другие производные или модификации, которые предпочтительно стабилизируют иммуностимулирующие композиции, но не изменяют их иммунологические свойства. Предпочтительно мотивом последовательности является мотив из 6 оснований ДНК, содержащий (неметилированный) динуклеотид CpG, фланкированный с 5′-конца двумя пуринами и с 3′-конца двумя пиримидинами (5′-Pur-Pur-C-G-Pyr-Pyr-3′). Мотивы CpG, содержащиеся в ОДН по настоящему изобретению, более распространены в ДНК микроорганизмов, чем в ДНК высших позвоночных, и проявляют отличия в профиле метилирования. Неожиданно последовательности, стимулирующие АПК мышей, не очень эффективны для клеток человека. Предпочтительные палиндромные и непалиндромные ОДН, которые можно использовать в настоящем изобретении, раскрыты в патентных заявках Австрии А 1973/2000, А 805/2001, ЕР 0468520 А2, WO 96/02555, WO 98/16247, WO 98/18810, WO 98/37919, WO 98/40100, WO 98/52581, WO 98/52962, WO 99/51259 и WO 99/56755, которые все включены в настоящее изобретение в качестве ссылок. Помимо стимуляции иммунной системы, определенные ОДН нейтрализируют некоторые иммунные реакции. Эти последовательности также включены в настоящее изобретение, к примеру, для лечения аутоиммунных заболеваний. ОДН/ДНК можно получить химическим путем или рекомбинантным методом либо они могут происходить из природных источников. Предпочтительными природными источниками являются насекомые.
С другой стороны, также можно использовать нуклеиновые кислоты на основе инозина и цитозина (как описано в РСТ/ЕР 01/06437) или дезоксинуклеиновые кислоты, содержащие остатки дезоксиинозина и/или дезоксиуридина (описано в патентных заявках Австрии А 1973/2000 и А 805/2001, включенных в настоящее изобретение в качестве ссылок), в качестве иммуностимуляторных нуклеиновых кислот настоящего изобретения.
Конечно, также можно использовать смеси различных иммуногенных нуклеиновых кислот в соответствии с настоящим изобретением.
Другой аспект настоящего изобретения заключается в применении пептида, содержащего последовательность R1-XZXZNXZX-R2 (пептид А), определенную выше, для получения адъюванта для усиления иммунного ответа по меньшей мере на один антиген.
В предпочтительном воплощении изобретения адъювант добавляют в вакцину. Конечно, можно вводить адъювант млекопитающим непосредственно, предпочтительно перед вакцинацией. Однако проще для введения добавить адъювант в вакцину, которую после этого вводят млекопитающему в один прием.
Следующий аспект настоящего изобретения касается способа вакцинации млекопитающих, включая человека, против конкретного антигена или группы антигенов, который включает введение вакцинируемому млекопитающему, включая человека, эффективного количества вакцины по настоящему изобретению. В качестве альтернативы способ включает введение эффективного количества адъюванта, содержащего описанный выше пептид А, после чего вводится вакцина.
Изобретение будет раскрыто более подробно на следующих примерах и фигурах, однако оно не ограничивается ими.
Перечень фигур
На фигуре 1 показана способность к "нагрузке" антигеном (TRANSloading) (синтетического антимикробного) пептида KLKLLLLLKLK (SEQ ID NO 1) в сравнении с различными, описанными ранее, "пептидами-носителями".
На фигуре 2 показана эффективность вариантов пептида по настоящему изобретению в сравнении с другими пептидами.
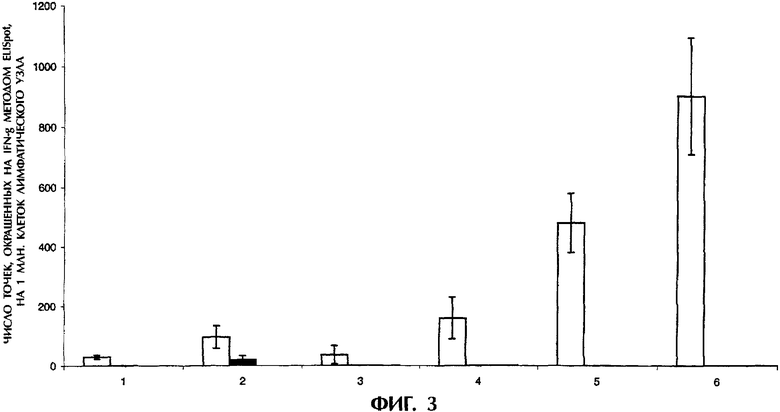
На фигуре 3 показано содержание γ-IFN-продуцирующих клеток у мышей, вакцинированных антигенным пептидом в комбинации с (синтетическим антимикробным) пептидом KLKLLLLLKLK.
Сведения, подтверждающие возможность осуществления изобретения
ПРИМЕРЫ
Пример 1
"Нагрузка" антигеном (TRANSloading) макрофагов мышей с помощью синтетического антимикробного пептида в качестве "пептида-носителя"
Для проверки того, способен ли (синтетический антимикробный) пептид KLKLLLLLKLK функционировать в качестве "пептида-носителя" для антигенов и "нагружать" АПК in vitro, то есть усиливать захват антигена АПК, в качестве антигенного пептида использовали флуоресцентно меченный пептид. Его смешивали с KLKLLLLLKLK и другими описанными ранее "пептидами-носителями" в различных концентрациях, как указано.
Для сравнения эффективности доставки пептида этими различными "пептидами-носителями" измеряли захват пептида АПК, инкубируя клетки P388D1 (клеточная линия антигенпрезентирующих моноцитов-макрофагов мышей, приобретенная у АТСС (TIB-63)) в течение 1 часа при 37°С в присутствии постоянного количества меченного флуоресцеином пептида, одного или в комбинации с различными "пептидами-носителями" в указанных концентрациях. Перед анализом клеток методом проточной цитометрии их многократно отмывали для удаления свободного пептида. Измеряли относительное количество захваченного клетками меченного флуоресцеином пептида методом проточной цитометрии.
В качестве антигенного пептида использовали пептид, происходящий из гемагглютинина вируса гриппа, связывающий МНС I класса (Kd) (Buschle M. (1997)). Смешивали 2 мкг этого антигенного пептида (FL-LFEAIEGFI) с 3 различными количествами каждого из пептидов-носителей, которые тестировали в концентрациях, соответствующих 101,7, 50,9 и 5,09 нмоль положительных зарядов. На фигуре 1 показано, во сколько раз повышается захват пептида по сравнению с одним только пептидом:
пептид FL-LFEAIEGFI в смеси с:
(1) поли-L-аргинином (pR60, 60-мер)
(2) происходящим из кателицидина мышей антимикробным пептидом (mCRAMP), SEQ ID NO 2
(3) LL-37, SEQ ID NO 3
(4) L-индолицидином, SEQ ID NO 4
(5) KLKLLLLLKLK (свободный С-конец), SEQ ID NO 1
(6) линейным додекапептидом быка, SEQ ID NO 5
(7) циклическим додекапептидом быка.
Поскольку известно, что в клетках, обработанных одним только пептидом, флуоресценция очень слабая (как показано ранее), то интенсивная флуоресценция "нагруженных" антигеном (TRANSloaded) клеток была особенно заметна в клетках, подвергавшихся "загрузке" с помощью синтетического антимикробного пептида KLKLLLLLKLK в качестве "пептида-носителя", что свидетельствует о том, что он способен очень эффективно "загружать" АПК антигенным пептидом.
Пример 2
"Нагрузка" антигеном макрофагов мышей с помощью различных синтетических антимикробных пептидов в качестве "пептидов-носителей"
Тестировали, как различные синтетические антимикробные пептиды с последовательностью R1-XZXZNXZX-R2 функционируют в качестве "пептидов-носителей" для антигенов и "нагружают" антигеном (TRANSloaded) АПК in vitro, то есть усиливают захват антигена АПК. Для этого в качестве антигенного пептида использовали флуоресцентно меченный пептид. Его смешивали с пептидами, содержащими последовательность R1-XZXZNXZX-R2, и другими описанными ранее "пептидами-носителями" в различных концентрациях, как указано.
Для сравнения эффективности доставки пептида этими различными "пептидами-носителями" измеряли захват пептида АПК, инкубируя клетки P388D1 (клеточная линия антигенпрезентирующих моноцитов-макрофагов мышей, приобретенная у АТСС (TIB-63)) в течение 1 часа при 37°С в присутствии постоянного количества меченного флуоресцеином пептида, одного или в комбинации с различными "пептидами-носителями" в указанных концентрациях. Перед анализом клеток методом проточной цитометрии их многократно отмывали для удаления свободного пептида. Измеряли относительное количество захваченного клетками меченного флуоресцеином пептида методом проточной цитометрии.
В качестве антигенного пептида использовали пептид, происходящий из гемагглютинина вируса гриппа, связывающий МНС I класса (Kd) (Buschle M. (1997)). Смешивали 3 мкг этого антигенного пептида (FL-LFEAIEGFI) с 3 различными количествами каждого из пептидов-носителей, которые тестировали в концентрациях, соответствующих 101,7, 50,9 и 5,09 нмоль положительных зарядов. На фигуре 2 показано, во сколько раз повышается захват пептида по сравнению с одним только пептидом: пептид FL-LFEAIEGFI в смеси с:
(1) поли-L-аргинином (60-мер)
(2) Нр(2-20), цекропинподобным антибактериальным пептидом, происходящим из рибосомного белка LI Helicobacter pylori, SEQ ID NO 6
(3) LALF-пептидом, SEQ ID NO 7
(4) происходящим из кателицидина мышей антимикробным пептидом, SEQ ID NO 2
(5) KAKAAAAAKAK-NH2, SEQ ID NO 8
(6) KGKGGGGGKGK-NH2, SEQ ID NO 9
(7) KTKTTTTTKTK-NH2, SEQ ID NO 10
(8) KLKLVIFWKLK-NH2, SEQ ID NO 11
(9) KVKVVVVVKVK-NH2, SEQ ID NO 12
(10) KWKWWWWWKWK-NH2, SEQ ID NO 13
(11) KFKFFFFFKFK-NH2, SEQ ID NO 14
(12) RLKLLLLLKLR-NH2, SEQ ID NO 15
(13) RLRLLLLLRLR-NH2, SEQ ID NO 16
(14) KLKLLLLLKLK-NH2, SEQ ID NO 17
(15) KLKLLLLLKLK-COOH (свободный С-конец), SEQ ID NO 1.
Поскольку известно, что в клетках, обработанных одним только пептидом, флуоресценция очень слабая (как показано ранее), то интенсивная флуоресценция "нагруженных" антигеном клеток была особенно заметна в клетках, подвергавшихся "загрузке" с помощью пептидов, содержащих последовательность R1-XZXZNXZX-R2 (включая указанные выше предпочтительные воплощения) в качестве "пептида-носителя", что свидетельствует о том, что пептиды по настоящему изобретению способны очень эффективно "загружать" АПК антигенным пептидом.
Пример 3
Проверка способности усиливать индукцию пептид-специфичных ответов Т-клеток in vivo
Для проверки способности (синтетического антимикробного) пептида KLKLLLLLKLK усиливать индукцию пептид-специфичных ответов Т-клеток in vivo группам из 4 мышей (C57BL/6, самки в возрасте 8 недель, Н-2b) вводили подкожно в бок 3 раза (дни 0, 28, 56) антигенный пептид меланомы (100 мкг), происходящий из TRP-2 (родственный тирозиназе белок-2 мышей), один или в комбинации с поли-L-аргинином или синтетическим антимикробным пептидом KLKLLLLLKLK в качестве "пептида-носителя". (Синтетический антимикробный) пептид KLKLLLLLKLK использовали в 4 разных количествах, которые по концентрации соответствуют: равному количеству поли-L-аргинина по весу (100 мкг), равному (168 мкг), двойному (336 мкг) и тройному (504 мкг) количеству поли-L-аргинина по положительным зарядам. Группам мышей вводили следующие количества (на 1 мышь):
(1) 100 мкг пептида
(2) 100 мкг пептида +100 мкг поли-L-аргинина (pR 60)
(3) 100 мкг пептида + 100 мкг KLKLLLLLKLK
(4) 100 мкг пептида +168 мкг KLKLLLLLKLK
(5) 100 мкг пептида + 336 мкг KLKLLLLLKLK
(6) 100 мкг пептида + 504 мкг KLKLLLLLKLK.
Через 12 дней после 3-й вакцинации удаляли паховые лимфатические узлы, клетки лимфатических узлов (фиг.3) ex vivo активировали пептидом-производным TRP-2 (родственный тирозиназе белок-2 мышей) и определяли содержание специфических γ-IFN-продуцирующих клеток методом ELISpot (число точек "окрашенных" на γ-IFN, на 1 млн клеток лимфатических узлов).
Фиг.3 показывает, что введение мышам пептида вместе с возрастающими дозами KLKLLLLLKLK давало гораздо больше специфических γ-IFN-продуцирующих клеток, чем введение мышам одного пептида или в комбинации с поли-L-аргинином. При этом также подтверждается, что пептид KLKLLLLLKLK не вызывает образования пептид-специфичных γ-IFN-продуцирующих Т-клеток (по результатам ELISpot), то есть в данных экспериментах были получены лишь Т-клетки, не обладающие специфичностью к KLKLLLLLKLK.
Этот пример четко показывает, что (синтетический антимикробный) пептид KLKLLLLLKLK усиливает индукцию пептид-специфичных Т-клеточных ответов in vivo.
Резюмируя, (синтетический антимикробный) пептид KLKLLLLLKLK проявляет высокую эффективность в "нагрузке" антигеном (TRANSloading) и иммуностимуляции, что свидетельствует о том, что пептиды А способны "загружать" АПК антигенными пептидами in vitro и in vivo с большой эффективностью и служат хорошими адъювантами/ "пептидами-носителями" для антигенных пептидов при индукции адаптивных иммунных ответов.
ЛИТЕРАТУРА
Banchereau et al. (1998), "Dendritic cells and the control of immunity", Nature 392 (6673): 245-52.
Boman (2000), "Innate immunity and the normal microflora", Immunol. Rev. 173: 5-16.
Brossart et al. (1997), "Presentation of exogenous protein antigens on major histocompatibility complex class I molecules by dendritic cells: pathway of presentation and regulation by cytokines", Blood 90 (4): 1594-9.
Buschle et al. (1998), "Chemically defined, cell-free cancer vaccines: use of tumor antigen-derived peptides or polyepitope proteins for vaccination". Gene Therapy and Molecular Biology 1: 309-21.
Buschle et al. (1997), "Transloading of tumor antigen-derived peptides into antigen-presenting cells", Proc. Natl. Acad. Sci. USA 94 (7): 3256-61.
Cho et al. (1999), "Activation of human neutrophils by a synthetic anti-microbial peptide, KLKLLLLLKLK-NH2, via cell surface calreticulin", Eur. J. Biochem. 266: 878-85.
Ganz et al. (1997), "Anti-microbial peptides of leukocytes", Curr. Opin. Hematol. 4 (I): 53-8.
Ganz T. (1998), " Anti-microbial peptides of vertebrates", Curr. Opin. Hematol. 10 (I): 41-4.
Ganz et al. (1999), "Antibiotic peptides from higher euckaryotes: biology and applications", Mol. Med. Today 5 (7): 292-7.
Gudmundsson et al. (1999), "Neutrophil antibacterial peptides, multifunctional effector molecules in the mammalian immune system", J. Immunol. Methods 232 (1-2): 45-54.
Harding (1995), "Phagocytic processing of antigens for presentation by MHC molecules", Trends in Cell Biology 5 (3): 105-09.
Harding (1996), "Class I MHC presentation of exogenous antigens", J. Clin. Immunol. 16 (2): 90-6.
Mizukawa et al. (1999), "Presence of defensin in epithelial Langerhans cells adjacent to oral carcinomas and precancerous lesions", Anticancer Res. 19 (4B): 2669-71.
Monaco (1992), "A molecular model of MHC class-I-restricted antigen processing", Immunol. Today 13 (5): 173-9.
Nakajima et al. (1997), "Chemotherapuetic activity of synthetic antimicrobial peptides: correlation between chemotherapeutic activity and neutrophil-activating activity", FEBS Lett. 415: 64-66.
Schijns (2000), "Immunological concepts of vaccine adjuvant activity", Curr. Opin. Immunol. 12(4): 456-63.
Schmidt et al. (1997), "Cell-free tumor antigen peptide-based cancer vaccines", Proc. Natl. Acad. Sci. USA 94 (7): 3262-7.
Zanetti et al. (1997), "The cathelicidin family of antimicrobial peptide precursors: a component of the oxygen-independent defense mechanisms of neutrophils", Ann. N.Y. Acad. Sc. 832: 147-62.






Изобретение относится к медицине и касается пептида, включающего последовательность R1-XZXZN-XZX-R2, где: N означает целое число от 3 до 7, предпочтительно 5; X означает остаток положительно заряженной обычной и/или необычной аминокислоты; Z означает остаток аминокислоты, выбранной из числа L, V, I, F и/или W; R1 и R2 выбраны независимо друг от друга из группы, состоящей из -Н, - NH2, -СОСН3, -СОН, пептидов, состоящих из 20 и меньше аминокислотных остатков, реакционноспособных групп пептидов, пептидных линкеров с пептидом или без него; X-R2 также может представлять собой амид, эфир или тиоэфир остатка С-концевой аминокислоты в качестве адъюванта для усиления иммунного ответа, по меньшей мере, на один антиген. Преимущество изобретения заключается в способности повышать иммунные ответы на антигены. 15 з.п. ф-лы, 3 ил.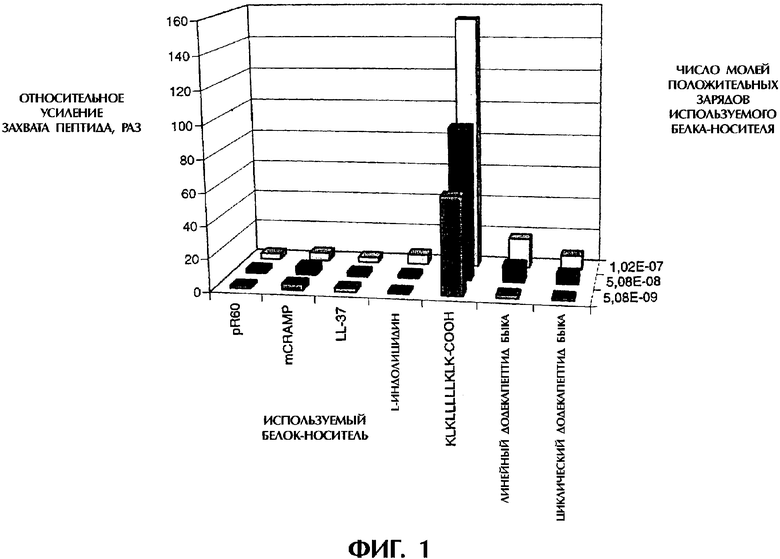
N означает целое число от 3 до 7, предпочтительно 5,
X означает остаток положительно заряженной природной или неприродной аминокислоты,
Z означает остаток аминокислоты, выбранной из группы, состоящей из L, V, I, F и/или W,
R1 и R2 выбраны независимо друг от друга из группы, состоящей из -Н, -NH2, - СОСН3, -СОН, пептидов, состоящих из 20 и меньше аминокислотных остатков, реагирующих с пептидами групп, пептидных линкеров с пептидом или без него; X-R2 также может представлять собой амид, эфир или тиоэфир остатка С-концевой аминокислоты,
в качестве адъюванта или белка-носителя для усиления иммунного ответа по меньшей мере на один антиген.
| BUSCHLE M | |||
| et al., Development of defined synthetic vaccines by in vivo charging of antigen presenting cell with antigen, J | |||
| Invest dermatology, 2000, v.114, №1, p.235 | |||
| ALVAREZ-BRAVO J | |||
| et al., Novel synthetic antimicrobial peptides effective against methicillin-resistant Staphylococcus aureus, Biochemical J., 1994, v.302, №2, pp.535-538 | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2008-07-10—Публикация
2001-10-18—Подача