Данное изобретение относится к производным индола, их получению и их применению для лечения патологических состояний, расстройств или заболеваний, связанных с андрогеновыми рецепторами, и другого лечения, связанного с андрогенами.
Соединения, обладающие андрогенной активностью, полезны для лечения мужчин с низким эндогенным уровнем циркулирующих андрогенных гормонов или мужчин с подавленными андрогенными эффектами. Такое лечение прописывают пожилым мужчинам, мужчинам с гипогонадизмом или мужчинам, которые получали прогестагены для мужской контрацепции. Кроме того, сильные андрогены угнетают сперматогенез и могут быть использованы в качестве мужских контрацептивов.
Таким образом, важно получить соединения с высокой аффинностью по отношению к андрогеновым рецепторам. Особенно полезны нестероидные соединения с высокой аффинностью по отношению к андрогеновым рецепторам, так как они могут обладать иными характеристиками распределения в ткани, чем стероидные андрогены, и могут быть разработаны путем надлежащего подбора заместителей, чтобы быть более или менее селективными в отношении определенных тканей. Например, действие на мозг обычно предотвращается, когда соединения являются сильно гидрофильными или несут ионный заряд.
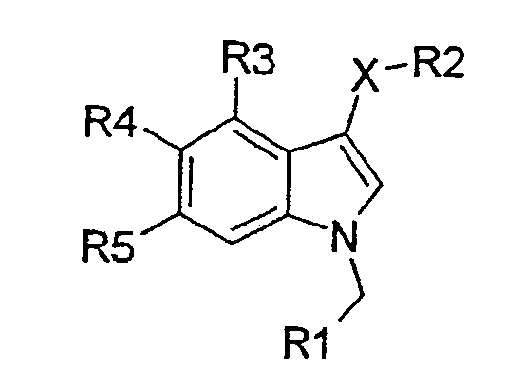
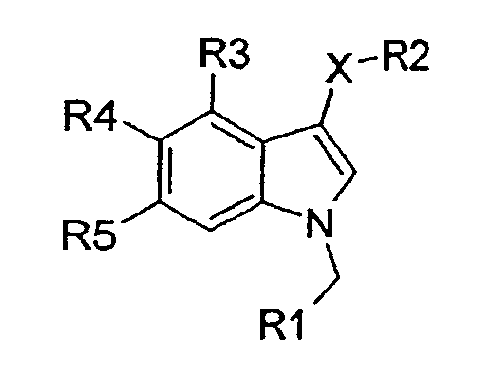
Рассматриваемое изобретение представляет нестероидные соединения с аффинностью по отношению к андрогеновым рецепторам. Эти соединения потенциально полезны для лечения заболеваний, связанных с андрогеновыми рецепторами, или заболеваний, которые можно лечить андрогенами. Соединения рассматриваемого изобретения имеют структуру, соответствующую формуле I:
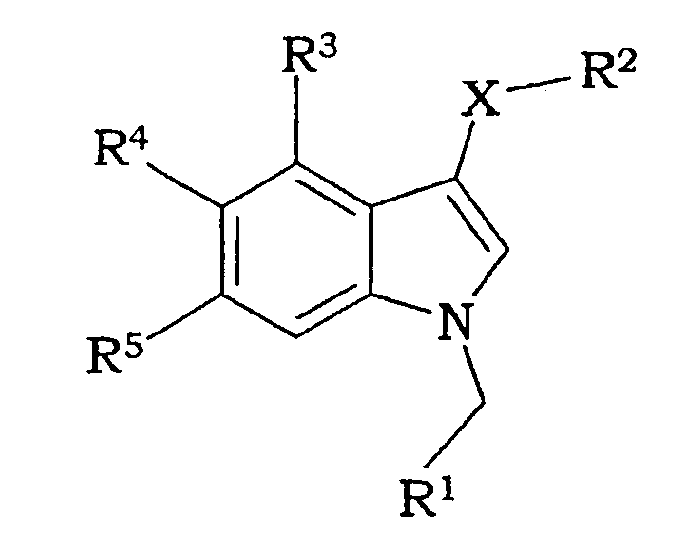
где
Х представляет S, SO или SO2;
R1 представляет 5- или 6-членную моноциклическую, гетеро- или гомоциклическую, насыщенную или ненасыщенную кольцевую структуру, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, CN, (1С-4С)фторалкила, нитро, (1С-4С)алкила, (1С-4С)алкокси или (1С-4С)фторалкокси;
R2 представляет 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамид, метиловый эфир 2-бензойной кислоты или 2-метоксифенил;
R3 представляет Н, галоген или (1С-4С)алкил;
R4 представляет Н, ОН, (1С-4С)алкокси или галоген;
R5 представляет Н, ОН, (1С-4С)алкокси, NH2, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, СО2Н, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(О)2(1С-4С)алкил или S(О)2арил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, или R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-6С)циклоалкил или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С0-4С)алкил)аминокарбонил или 3-, 4-, 5- или 6-членное моноциклическое, гомо- или гетероциклическое, ароматическое или неароматическое кольцо, или где R8 и R9 образуют вместе с N 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно замещенное (1С-4С)алкилом;
их солевую или гидратную форму.
В одном из воплощений R1 представляет 5- или 6-членную моноциклическую, гетеро- или моноциклическую насыщенную или ненасыщенную кольцевую структуру, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, CN, CF3, нитро, метокси, трифторметокси или метила; R2 представляет 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамил, метиловый эфир 2-бензойной кислоты или 2-метоксифенил; R3 представляет Н, галоген или (1С-2С)алкил; R4 представляет Н или F.
В другом воплощении R5 представляет Н, ОН, (1С-4С)алкокси, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(О)2(1С-4С)алкил или S(О)2арил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, или R5 представляет собой С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-6С)циклоалкил или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил или 3-, 4-, 5- или 6-членное моноциклическое, гомо- или гетероциклическое, ароматическое или неароматическое кольцо, или где R8 и R9, вместе образуют с N 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно замещенное (1С-4С)алкилом.
В еще одном воплощении R3 представляет Н или галоген; R4 представляет Н; R5 представляет Н, ОН, (1С-4С)алкокси, CN, F, Cl, CF3, NO2, гидрокси(1С-4С)алкил, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет (1С-3С)ацил, необязательно замещенный одним или более галогенами, или R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-5С)циклоалкил или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, сложный (1С-2С)алкиловый эфир карбокси(1С-2С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил, (3С-5С)циклоалкил или 5-членное гетероциклическое кольцо.
В еще одном воплощении Х представляет S или SO2; R2 представляет 2-нитрофенил, 2-гидроксиметилфенил, 2-бензамид, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н или F; R5 представляет Н, ОН, (1С-2С)алкокси, CN, F, Cl, CF3, NO2, гидрокси(1С-4С)алкил, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил, или R5 представляет С(О)N(R8,R9), где R8 представляет Н, и R9 представляет Н, циклопропил, или R9 представляет СН2R10, где R10 представляет Н, (1С-2С)алкил, гидрокси(1С-2С)алкил, метокси(1С-2С)алкил, циклопропил.
В еще одном воплощении Х представляет S; R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил, пиримидин-4-ил, пиразин-2-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил; R2 представляет 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н; R5 представляет ОН, (1С-2С)алкокси, CN, CF3, NO2, гидрокси(1С-4С)алкил или NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил.
В еще одном воплощении R1 представляет собой 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил, пиримидин-4-ил или пиразин-3-ил; R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил; R5 представляет ОН, (1С-2С)алкокси, CN, гидрокси(1С-4С)алкил или NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил.
В еще одном воплощении R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил или пиримидин-4-ил; R2 представляет собой 2-нитрофенил; R5 представляет ОН, (1С-2С)алкокси, CN или NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил.
В конкретном воплощении рассматриваемое изобретение представляет соединения:
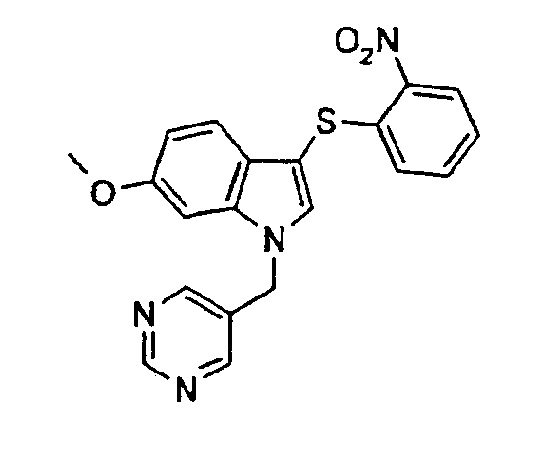
6-метокси-3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол,
гидрохлорид 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрила,
3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрил,
3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-карбонитрил,
3-(2-нитрофенилсульфанил)-1-пиримидин-4-илметил-1Н-индол-6-карбонитрил,
N-[1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]-2-фторацетамид и
N-[3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-ил]формамид.
В другом воплощении Х является S; R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил; R2 представляет собой 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н; R5 представляет С(О)N(R8,R9), где R8 представляет Н, и R9 представляет Н или СН2R10, где R10 представляет Н, (1С-2С)алкил, гидрокси(1С-2С)алкил или метокси(1С-2С)алкил.
В еще одном воплощении R1 представляет 3,5-дифторфенил, пиридин-2-ил или пиридин-3-ил; R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил; R5 представляет С(О)N(R8,R9), где R8 представляет Н, и R9 представляет СН2R10, где R10 представляет Н или (1С-2С)алкил.
В конкретном воплощении рассматриваемое изобретение представляет соединение: метиламид 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты.
В еще одном воплощении Х является S; R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил; R2 представляет собой 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н; R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, (1С-3С)алкокси(1С-3С)алкил или (моно- или ди(1С-4С)алкил)аминометил.
В еще одном воплощении R1 представляет 3,5-дифторфенил, пиридин-2-ил или пиридин-3-ил; R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил; R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н или СН2R10, где R10 представляет Н, (1С-5С)алкил, гидрокси(1С-3С)алкил, или (1С-3С)алкокси(1С-3С)алкил.
В конкретном воплощении рассматриваемое изобретение представляет соединение: диметиламид 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты.
В тех случаях, когда соединение данного изобретения содержит основную аминную функцию, данное соединение может быть использовано в виде свободного основания или в виде фармацевтически приемлемой соли, такой как гидрохлорид, ацетат, оксалат, тартрат, цитрат, фосфат, малеат или фумарат.
Соединение по данному изобретению является соединением, которому дано определение выше, его солью, его гидратом или его пролекарством.
Термины, используемые в данном описании, имеют следующее значение:
алкил представляет собой разветвленную или неразветвленную алкильную группу, например метил, этил, пропил, изопропил, бутил, вторичный бутил, трет-бутил, гексил и тому подобное;
фторалкил представляет собой алкильную группу, замещенную одним или более атомами фтора;
циклоалкил представляет собой циклическую неразветвленную алкильную группу, такую как циклопропил, циклобутил, циклопентил и тому подобное;
алкенил представляет собой разветвленную или неразветвленную алкенильную группу, такую как этенил, 2-бутенил и т.д.;
алкокси представляет собой разветвленную или неразветвленную алкилоксигруппу, например, метилокси, этилокси, пропилокси, изопропилокси, бутилокси, вторичный бутилокси, трет-бутилокси и тому подобное;
фторалкокси представляет собой алкоксигруппу, замещенную одним или более атомами фтора;
арил представляет собой моно- или полициклическую, гомо- или гетероциклическую ароматическую кольцевую систему, такую как фенил, нафтил или пиридил; моноциклическое кольцо из 6 атомов является предпочтительным для использования;
ацил представляет собой (заместитель)карбонильную группу, такую как ароил или алканоил;
ароил является арилкарбонилом, таким как бензоильная группа;
алканоил означает формильную или алкилкарбонильную группу, такую как формил, ацетил и пропаноил;
карбокси представляет собой -СООН заместитель, делающий соединение органической кислотой;
карбоксилат представляет собой соль карбоксильного заместителя;
префиксы (1С-4С), (2С-4С) и т.д. имеют обычное значение для ограничения значения указанной группы группами с 1-4, 2-4 атомами углерода;
галоген относится к фтору, хлору, брому и йоду.
Аффинность по отношению к андрогеновым рецепторам и эффективность соединений по данному изобретению делает их полезными для применения при лечении связанных с андрогеновыми рецепторами заболеваний, заболеваний, которые можно лечить андрогенами, и для диагностических методов, нацеленных на определение количества и/или локализации андрогеновых рецепторов в различных тканях. Для последней цели может быть предпочтительно получать меченые варианты соединений по данному изобретению. Обычным лечением связанных с андрогеновыми рецепторами заболеваний является применение для мужской контрацепции и гормональной заместительной терапии мужчин и женщин. Таким образом, данное изобретение относится также к способу лечения недостаточности андрогенов введением мужчинам или женщинам или самцам и самкам животных эффективного количества любого из соединений рассматриваемого изобретения. Рассматриваемое изобретение также относится к применению любого из этих соединений для получения лекарственного средства для лечения недостаточности андрогенов. В контексте данного изобретения термин «недостаточность андрогенов» нужно понимать как относящийся ко всем видам заболеваний, расстройств и симптомов, при которых мужчина или женщина страдает от слишком низкого уровня тестостерона, таких как гипогонадизм у мужчин и мальчиков. В частности, андрогеновая недостаточность, которую нужно лечить соединением данного изобретения, представляет собой снижение уровня тестостерона, которое проявляется у мужского индивидуума с возрастом (соединение данного изобретения затем используют для гормонозаместительной терапии у мужчин), или когда он подвергается мужской контрацепции. В контексте мужской контрацепции соединение данного изобретения служит специально для нейтрализации эффекта режимов мужской гормональной контрацепции, при которых стерилизующее средство, такое как прогестерон или LHRH (релизинг-гормон лютеинизирующего гормона), вводят регулярно, например каждый день, или применяют в качестве единственного мужского контрацептивного вещества.
Таким образом, рассматриваемое изобретение представляет любое из соединений рассматриваемого изобретения для применения в терапии.
Рассматриваемое изобретение, кроме того, охватывает и фармацевтическую композицию, содержащую соединение рассматриваемого изобретения и фармацевтически приемлемый носитель. В воплощении рассматриваемого изобретения фармацевтическая композиция предназначена для лечения заболевания, выбранного из группы, состоящей из связанного с андрогеновыми рецепторами заболевания, связанного с андрогенами заболевания и недостаточностью андрогенов.
Рассматриваемое изобретение, кроме того, представляет применение соединения данного изобретения для производства лекарственного средства для лечения связанных с андрогеновыми рецепторами заболеваний, связанных с андрогенами заболеваний и недостаточностью андрогенов.
Рассматриваемое изобретение, кроме того, представляет способ лечения заболевания, выбранного из группы, состоящей из связанного с андрогеновыми рецепторами заболевания, связанного с андрогенами заболевания и недостаточностью андрогенов, включающий введение фармацевтически эффективного количества соединения по данному изобретению субъекту, нуждающемуся в этом.
Соединения данного изобретения могут быть, кроме того, полезны при лечении остеопороза, а также других заболеваний костей, при восстановлении при переломе кости, лечении саркопении, слабости, старения кожи, гипогонадизма у мужчин, половой дисфункции у женщин, симптомов постменопаузы, атеросклероза, апластической анемии, атрофии мышц, липодистрофии, сниженной мышечной силы и функции, побочных эффектов химиотерапии, хронического синдрома усталости, доброкачественной гиперплазии простаты (ДГП), кахексии, хронического катаболического состояния, нарушения познавательной способности, контрацепции у мужчин и других.
Соединения данного изобретения можно вводить в сочетании с эстрогенами, прогестероном и другими андрогенами.
Соединения данного изобретения можно получить разными способами, в основном известными в области органической химии. Более конкретно, можно использовать пути синтеза, которые проиллюстрированы на следующих схемах и в примерах. На схемах и в примерах использованы следующие сокращения:
ДМФА = диметилформамид
mCPBA = мета-хлорпербензойная кислота
ТГФ = тетрагидрофуран
TBTU = тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
DIPEA = диизопропилэтиламин
EDCI = гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида
HOBt = 1-гидроксибензотриазол
NMM = N-метилморфолин
SPE = твердофазное экстрагирование
RP-SPE = твердофазное экстрагирование с обращенной фазой
ДМСО = диметилсульфоксид
ДХМ = дихлорметан
DHT = 5α-дигидротестостерон
NMP = 1-метил-2-пирролидинон
DMS = диметилсульфид
Что касается номенклатуры, взаимозаменяемо использованы следующие обычные наименования для заместителей R1 и R2:
На каждой из схем I-VII значения символов соответствуют обозначениям, представленным в предыдущих разделах.
Замещенные индольные соединения структуры 3 получали в две стадии из соответственно замещенных индолов структуры 1 двумя разными путями. По первому пути соответственно замещенный индол структуры 1 является N-алкилированным галогенидом типа R1СН2Y, где Y является галогеном, мезилатом или тозилатом, с NaH или CsCO3 в качестве основания в ДМФА или NMP при 0°С при комнатной температуре с получением соединения структуры 2. Соединение структуры 2 затем сульфанилировали в положении С-3 индольного кольца реакцией с сульфенилхлоридом или в СН2Cl2 или диэтиловом эфире при комнатной температуре с получением соединения структуры 3. По второму пути две стадии первого пути идут в обратном порядке: соответственно замещенный индол структуры 1 сначала сульфанилируют в положении 3 индола с получением соединения структуры 4 с последующим N-алкилированием с помощью R1-СН2Y и получением соединения структуры 3 (схема I).
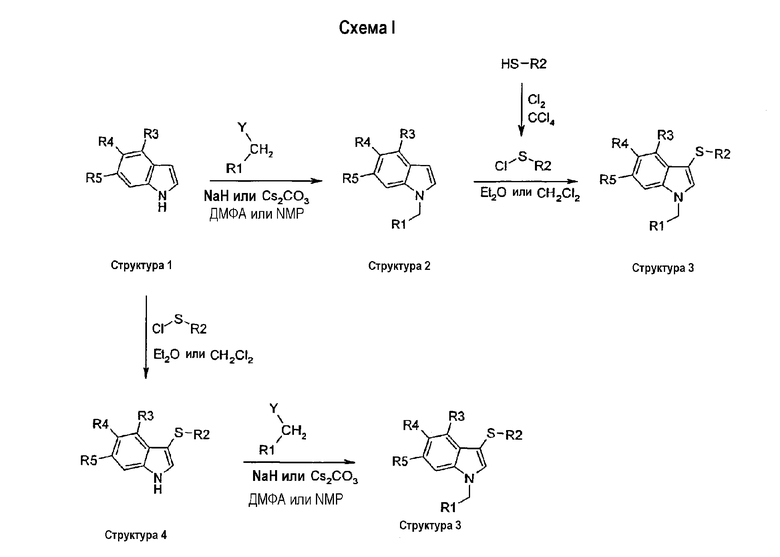
Сульфоксиды структуры 5 можно получить окислением соответствующего сульфида (структура 3) реакцией, например, с 0,9 эквивалента mCPBA. Сульфоны структуры 6 можно получить окислением соответствующего сульфида (структура 3) реакцией, например, с 3 эквивалентами mCPBA (схема II).
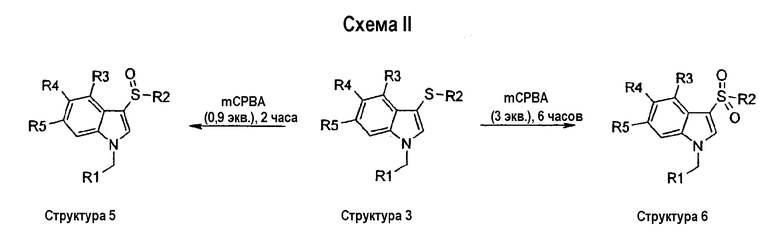
На схеме III описан синтез соединений структуры 3, у которых группа R2 является фенильным кольцом, замещенным в положении 2 или СО2Ме (структура 7), СН2ОН (структура 8), СО2Н (структура 9), CONHMe (структура 10), CONH2 (структура 11) или CN (структура 12).
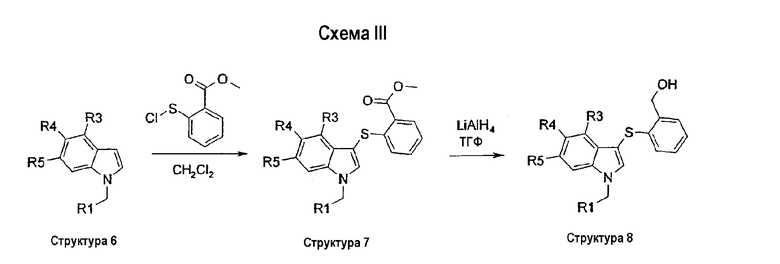
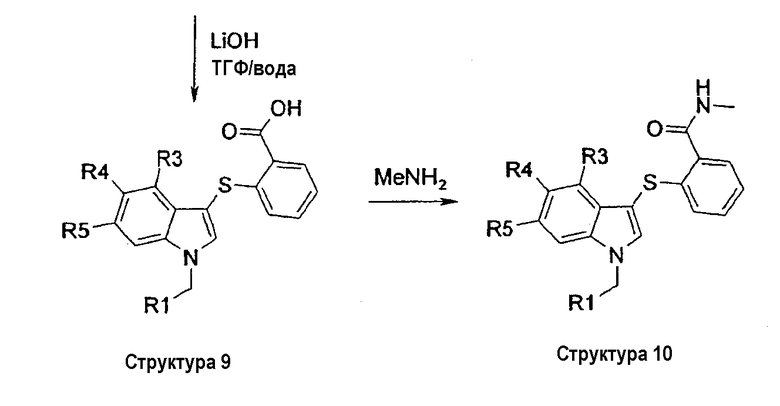
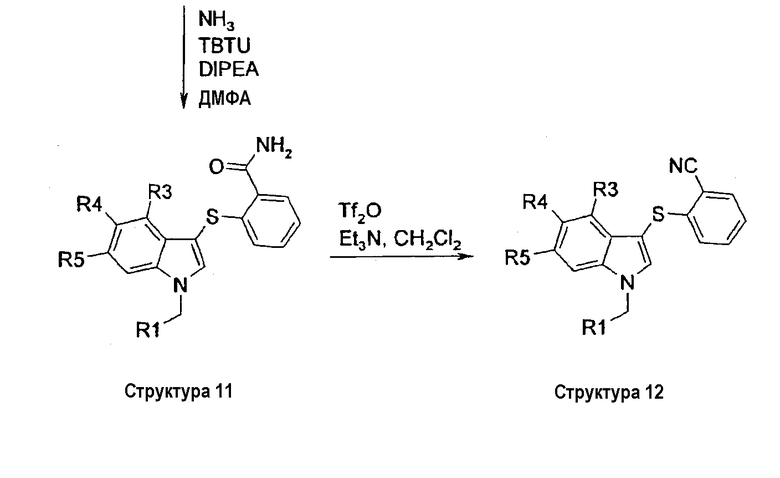
На первой стадии замещенный индол структуры 6 сульфанилируют в положении 3 2-(карбоксиметил)фенилсульфенилхлоридом, который получали из метилтиосалицилата и газообразного хлора, с получением соединения структуры 7. Восстановление метильной сложноэфирной группы соединений структуры 7 с помощью LiAlH4 давало соответствующие гидроксиметильные соединения структуры 8. Омыление метильной сложноэфирной группы соединений структуры 7 с помощью гидроксида лития давало соответствующие соединения карбоновой кислоты структуры 9. Группа карбоновой кислоты структуры 9 может быть превращена в соответствующий карбоксамид по реакции с амином, TBTU и DIPEA в ДМФА при комнатной температуре. По этому способу соединение структуры 10 получали, когда в качестве амина использовали метиламин, и соединение структуры 11 получали, когда в качестве амина использовали NH3. Дегидратация бензамидной группы соединения структуры 11 с помощью Tf2О и триэтиламина в СН2Cl2 давала соответствующее бензонитрильное соединение структуры 12 (схема III).
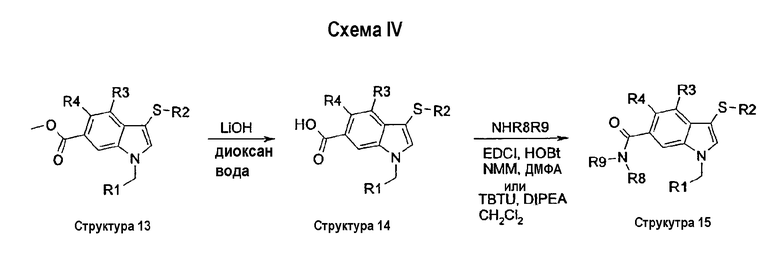
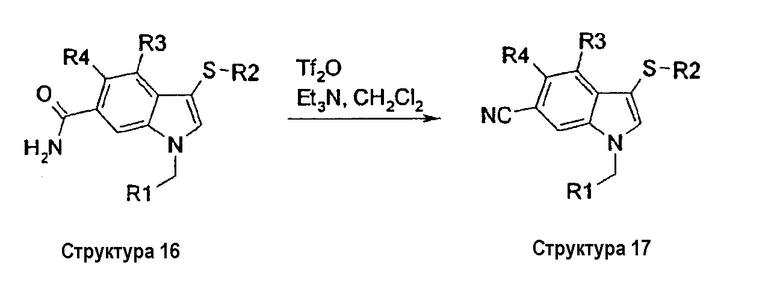
На схеме IV описан синтез соединений структуры 3, в которых индольное кольцо замещено в положении 6 или СО2Ме (структура 13), СО2Н (структура 14), CONR8R9 (структура 15), CONH2 (структура 16) или CN (структура 17). Омыление метильной сложноэфирной группы структуры 13 гидроксидом лития давало соответствующую карбоновую кислоту структуры 14. Группу карбоновой кислоты структуры 14 можно превратить в соответствующие карбоксамиды структур 15 и 16 по реакции с амином или солью амина в присутствии EDCI и HOBt в смеси NMM и ДМФА или в присутствии TBTU и DIPEA в СН2Cl2 при комнатной температуре. Дегидратация бензамидной группы структуры 16 с помощью Tf2О и триэтиламина в СН2Cl2 давала соответствующее бензонитрильное соединение структуры 17 (схема IV).
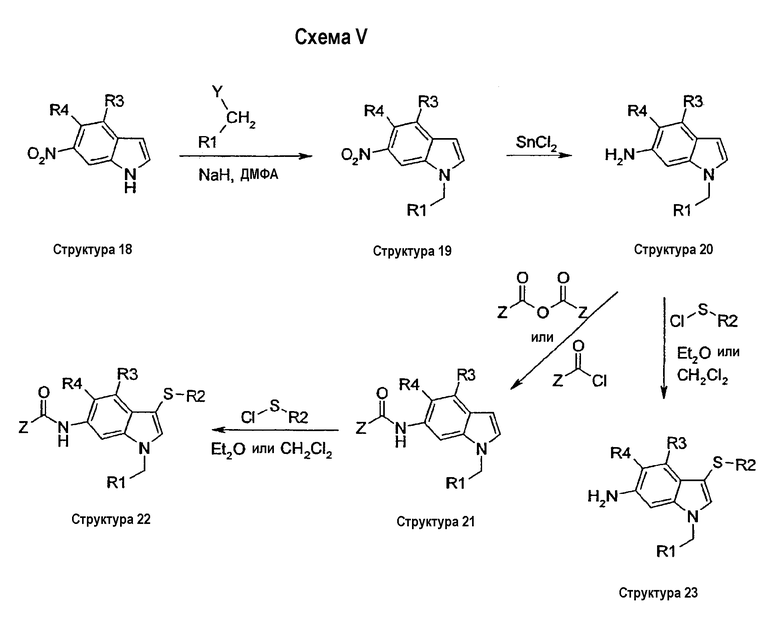
На схеме V описан синтез соединений структуры 22, содержащих ацилированную аминную функциональную группу в положении 6 индольного кольца. Эти соединения могут быть синтезированы из 6-нитроиндолов структуры 18 в 4 стадии. На первой стадии индол структуры 18 алкилируют по атому азота реакцией галогенида типа R1СН2Y, в котором Y является галогеном, мезилатом или тозилатом, с NaH в качестве основания в ДМФА с получением соединений структуры 19. На второй стадии нитрогруппу соединения структуры 19 восстанавливают до аминогруппы с помощью SnCl2 с получением соединения структуры 20. Последующее ацилирование аминогруппы хлорангидридом кислоты типа ZCOCl давало соединение структуры 21, которое затем сульфанилировали в положении 3 индольного кольца реакцией сульфенилхлорида в СН2Cl2 или Et2О в качестве растворителя при комнатной температуре с получением соединений структуры 22. Прямое сульфанилирование соединения структуры 20 сульфенилхлоридом давало соединение структуры 23.
На схеме VI описано, как метиловые простые эфиры структуры 24 можно расщепить с помощью, например, BF3·DMS в ТГФ при комнатной температуре до гидрокси-соединений структуры 25.
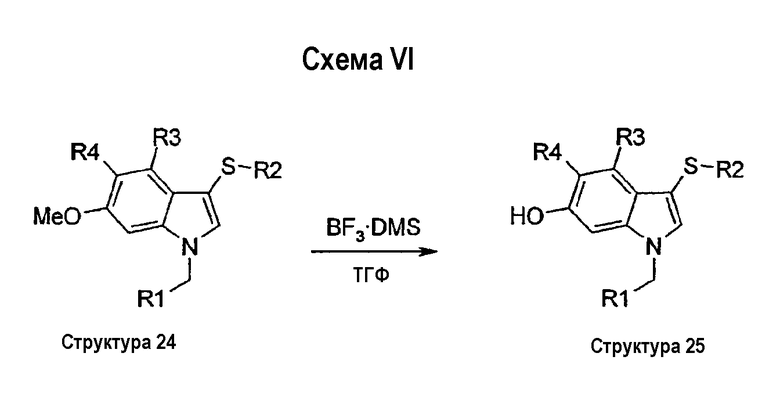
На схеме VII описан синтез соединений, содержащих или ацилированную аминную функциональную группу (структура 28) или сульфонамидную функциональную группу (структура 29) в положении 6 индольного кольца. Эти соединения могут быть получены из 6-нитроиндолов структуры 18 в 6 стадий. На первой стадии индол структуры 18 алкилируют по N-1 реакцией галогенида типа R1СН2Y, в котором Y является галогеном, мезилатом или тозилатом, с NaH или Cs2СО3 в качестве основания в NMP или ДМФА с получением соединений структуры 19. На второй стадии нитрогруппу соединения структуры 19 восстанавливают до аминогруппы с помощью Fe и NH4Cl с получением соединения структуры 20. Последующее ацилирование аминогруппы ди-трет-бутилдикарбонатом давало соединение структуры 26, которое затем сульфанилировали в положении 3 индольного кольца реакцией с сульфенилхлоридом в СН2Cl2 или Et2О с получением соединений структуры 27. Затем амидную функциональную группу в положении 6 индола отщепляли с помощью трифторуксусной кислоты или НСООН с получением аминов структуры 23. Эти амины можно превратить в амиды структуры 28 реакцией или с триэтиламином и хлорангидридом кислоты в СН2Cl2 (способ а), или с кислотой, TBTU и DIPEA в СН2Cl2 (способ b). Сульфонамиды структуры 29 можно получить по реакции аминов структуры 23 с сульфонилхлоридами (способ с).
Данное изобретение относится также к фармацевтической композиции, содержащей нестероидное соединение по данному изобретению, смешанное с фармацевтически приемлемым вспомогательными веществами, такими как описано в стандартном справочнике Gennaro et al., Remmington: The Science and Practice of Pharmacy, (20th ed., Lippencott Williams & Wilkins, 2000, см., в частности, Part 5: Pharmaceutical Manufacturing). Подходящие вспомогательные вещества представлены, например, в Handbook of Pharmaceutical Excipients (2nd Edition, Editors A. Wade and P.J. Weller; American Pharmaceutical Association; Washington; The Pharmaceutical Press; London, 1994). Смесь соединения по данному изобретению и фармацевтически приемлемых вспомогательных веществ может быть спрессована в твердые дозированные единицы, такие как пилюли, таблетки, или может быть переработана в капсулы или суппозитории. С помощью фармацевтически подходящих жидкостей данные соединения могут также применяться в виде инъекционного препарата в форме раствора, суспензии, эмульсии или аэрозоля, например, назального аэрозоля. Для изготовления дозированных единиц, например, таблеток, предполагается использование общепринятых добавок, таких как наполнители, красители, полимерные связывающие вещества и тому подобное. В общем, можно использовать любую фармацевтически приемлемую добавку, которая не влияет на функцию активных соединений. Соединения данного изобретения можно также включить в имплантат, вагинальное кольцо, пластырь, гель и любой другой препарат для длительного высвобождения.
Подходящие носители, с которыми можно вводить данные композиции, включают лактозу, крахмал, производные целлюлозы и тому подобное, или их смеси, используемые в подходящих количествах.
Дозированные количества данных соединений будут обычного порядка для фармацевтически активных соединений, например, порядка от 0,001 до 50 мг/кг массы тела реципиента на введение. Реципиент может быть человеком или животным, нуждающимся в лечении, связанном с андрогеновыми рецепторами или в лечении андрогенами.
Данное изобретение иллюстрируется следующими примерами.
ПРИМЕРЫ
Пример 1
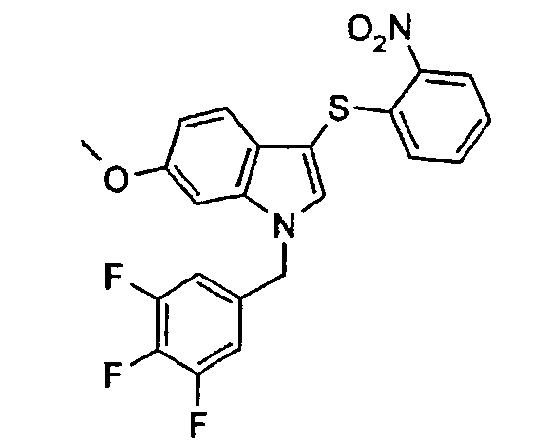
1-(3,5-Дифторбензил)-6-метокси-3-(2-нтрофенилсульфанил)-1Н-индол (соединение 63, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, R5=Оме)
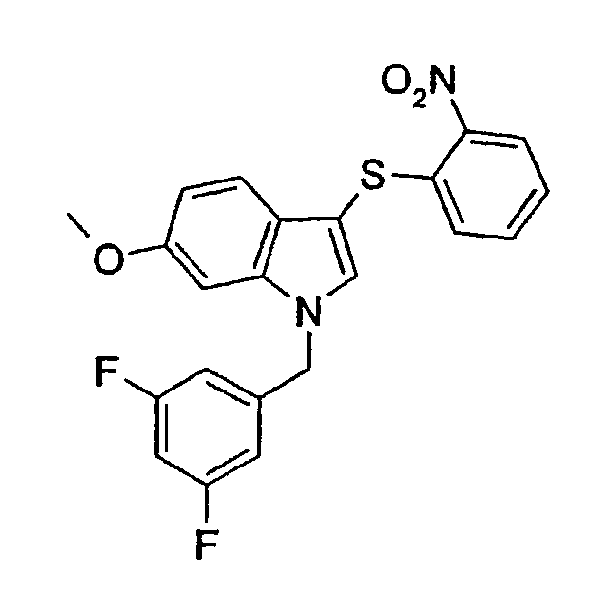
Общий способ 1: N-алкилирование (не)замещенного индола структуры 1 с получением N-алкилированного индола структуры 2, с последующим 3-сульфанилированием с получением замещенных индолов структуры 3 (схема I).
(а) 1-3,5-Дифторбензил)-6-метокси-1Н-индол (структура 2 со схемы I, где R1=3,5-дифторфенил, R3=R4=Н, R5=Оме)
В атмосфере азота к охлажденному (0°) раствору 6--метоксииндола (863 мг, 5,86 ммоль) в ДМФА (40 мл) добавляли NaH (60% в масле; 281 мг, 7,03 ммоль) небольшими порциями за 3-минутный период. Полученную зеленую суспензию перемешивали при 0°С в течение 10 минут. Затем добавляли 3,5-дифторбензилбромид (0,91 мл, 7,03 ммоль). Смесь перемешивали при 0°С в течение 1 часа и затем при комнатной температуре в течение еще 21 часа. Добавляли этилацетат (50 мл) и смесь промывали 3% водным раствором лимонной кислоты (3·50 мл) и насыщенным раствором соли (50 мл). Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением зеленого масла (1,43 г). Неочищенный продукт очищали на SPE картридже с 20 г диоксида кремния (этилацетат/гептан 1:9) с получением указанного в заголовке соединения в виде бесцветного масла (1,23 г, выход=77%).
ЖХМС: 4,01 мин (96,3%, МН+=274); ТСХ (этилацетат/гептан 1:4): Rf=0,46; 1Н ЯМР (CDCl3): 3,80 (с, 3Н, ОСН3), 5,24 (с, 2H, NCH2Ar), 6,51 (дд, 1H, J1=3,5 Гц, J2=0,8 Гц), 6,57-6,60 (м, 2H), 6,65 (д, 1H, J=3,1 Гц), 6,66-6,72 (м, 1H), 6,81 (дд, 1H, J1=8,6 Гц, J2=3,1 Гц), 7,01 (д, 1H, J=3,5 Гц), 7,53 (д, 1H, J=8,6 Гц).
(b) 1-(3,5-Дифторбензил)-6-метокси-3-(2-нитрофенилсульфанил)-1Н-индол (Соединение 63, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н; R5=Оме)
К раствору 1-(3,5-дифторбензил)-6-метокси-1Н-индола (900 мг, 3,29 ммоль) в диэтиловом эфире (20 мл) добавляли по каплям при комнатной температуре суспензию 2-нитробензолсульфенилхлорида (627 мг, 3,31 ммоль) в диэтиловом эфире (10 мл) за 2-минутный период. После перемешивания при комнатной температуре в течение 1 часа добавляли этилацетат (50 мл) и смесь промывали насыщенным раствором NaHCO3 (2·50 мл) и насыщенным раствором соли (50 мл). Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением оранжево-красного масла (1,54 г). Неочищенный продукт кристаллизовали из смеси толуол/ацетон с получением указанного в заголовке соединения в виде оранжево-красного кристаллического твердого вещества (900 мг, выход=64%).
ЖХМС: 4,25 мин (100%, МН+=427); ВЭЖХ: 4,86 мин (98,7%); 1Н ЯМР (CDCl3) δ: 3,82 (с, 3Н, ОСН3), 5,32 (с, 2Н, NCH2Ar), 6,63-6,69 (м, 2H), 6,72-6,79 (м, 1H), 6,75 (д, 1H, J=2,7 Гц), 6,85 (дд, 1H, J1=8,2 Гц, J2=2,7 Гц), 6,98 (дд, 1H, J1=6,7 Гц, J2=1,2 Гц), 7,16-7,20 (м, 1H), 7,26-7,30 (м, 1H), 7,34 (с, 1H), 7,39 (д, 1H, J=8,2 Гц), 8,27 (дд, 1H, J1=8,2 Гц, J2=1,6 Гц).
По общему способу 1 получали следующие соединения:
Соединения, синтезированные по общему способу 1
соед.
(МН+)
Время
удерживания
(мин)
с) М+Cl н.о.=не определяли. d) =[М-S(PhNO2)]Н+.
Пример 2
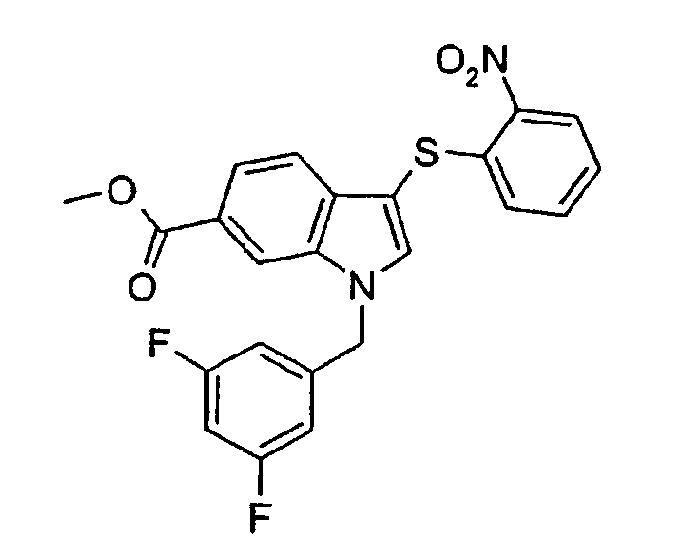
Метиловый эфир 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (соединение 31, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, R5=СО2Ме)
(а) Метиловый эфир 1Н-индол-6-карбоновой кислоты (структура 1 со схемы 1, где R3=R4=Н, R5=СО2Ме)
К раствору 1Н-индол-6-карбоновой кислоты (1500 г, 9,31 ммоль) в метаноле (50 мл) добавляли концентрированную Н2SO4 (550 мкл, 10,24 ммоль). Смесь перемешивали в течение ночи при температуре кипения с обратным холодильником. Смесь затем нейтрализовали до рН 7 добавлением насыщенного водного раствора NaHCO3 и смесь дважды экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме с получением желтого порошка. Данный продукт перекристаллизовывали из смеси гептан/этилацетат с получением указанного в заголовке соединения в виде зелено/желтых кристаллов (688 мг, выход 53%).
1Н-ЯМР (CDCl3) δ: 3,94 (с, 3Н, СН3ОСО), 6,60 (м, 1Н), 7,37 (т, 1Н, J=4,7 Гц), 7,66 (д, 1Н, J=8,2 Гц), 7,82 (дд, 1Н, J1=8,2 Гц, J2=1,0 Гц), 8,18 (с, 1Н), 8,73 (с, 1Н, NH).
(b) Метиловый эфир 1-(3,5-дифторбензил)-1Н-индол-6-карбоновой кислоты (структура 2 со схемы I, где R1=3,5-дифторфенил, R3=R4=Н, R5=СО2Ме)
В атмосфере азота к раствору метилового эфира 1Н-индол-6-карбоновой кислоты (367 мг, 2,09 ммоль) в ДМФА (10 мл) добавляли NaH (60% в масле, 101 мг, 2,52 ммоль) при комнатной температуре. После перемешивания в течение 15 минут добавляли 1-бромметил-3,5-дифторбензол (325 мкл, 2,51 ммоль) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь гасили 3% водным раствором лимонной кислоты (10 мл) и добавляли этилацетат (30 мл). Смесь промывали 3% водным раствором лимонной кислоты (3·20 мл) и насыщенным раствором соли (20 мл). Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением бледно-желтого масла (702 мг). Неочищенный продукт очищали на картридже SPE с 20 г диоксида кремния (этилацетат/гептан 1:9) с получением указанного в заголовке соединения в виде бесцветного масла, которое медленно кристаллизовалось при стоянии (530 мг, выход=84%).
ЖХМС: 4,08 мин (99%, МН+=302); 1Н ЯМР (CDCl3) δ: 3,92 (3, 3Н, СО2СН3), 5,37 (с, 2H, NCH2Ar), 6,54-6,60 (м, 2H), 6,64 (д, 1H, J=3,1 Гц), 6,67-6,74 (м, 1H), 7,27 (д, 1H, J=3,1 Гц), 7,68 (д, 1H, J=8,6 Гц), 7,83 (д, 1H, J=8,6 Гц), 8,01 (с, 1H).
(с) Метиловый эфир 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (соединение 31, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=H, R5=CO2Me)
К раствору метилового эфира 1-(3,5-дифторбензил)-1Н-индол-6-карбоновой кислоты (330 мг, 1,10 ммоль) в дихлорметане (30 мл) при комнатной температуре добавляли раствор 2-нитробензолсульфенилхлорида (210 мг, 1,11 ммоль) в дихлорметане (10 мл). Смесь перемешивали при комнатной температуре 4 дня. Реакционную смесь концентрировали и неочищенный продукт очищали на картридже SPE c 20 г диоксида кремния (этилацетат/гептан 1:5-1:2) с получением указанного в заголовке соединения в виде твердого желтого цвета (392 мг, выход=78%).
ЖХМС: 4,60 мин (97,8%); 1Н ЯМР (CDCl3) δ: 3,93 (с, 3Н, СО2СН3), 5,45 (с, 2H, NCH2Ar), 6,63-6,69 (м, 2H), 6,74-6,80 (м, 1H), 6,88 (дд, 1H, J1=8,2 Гц, J2=1,2 Гц), 7,18-7,23 (м, 1H), 7,26-7,30 (м, 1H), 7,57 (д, 1H, J=7,8 Гц), 7,58 (с, 1H), 7,89 (дд, 1H, J1=7,8 Гц, J2=1,2 Гц), 8,12 (с, 1H), 8,28 (дд, 1H, J1=7,8 Гц, J2=1,2 Гц).
Пример 3
1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновая кислота (соединение 30, структура 14 со схемы IV, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н)
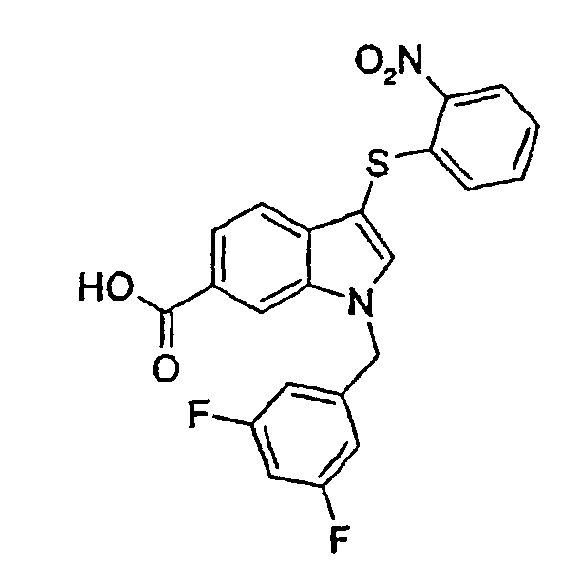
К раствору метилового эфира 1-(3,5-дифторбензил)-1Н-индол-6-карбоновой кислоты (150,0 мг, 0,33 ммоль) в диоксане (20 мл) и воде (15 мл) добавляли LiOH·Н2О (83,1 мг, 0,33 ммоль) в 5 мл воды. Реакционную смесь перемешивали в течение ночи при 60°С. Затем смесь подкисляли до рН 4 добавлением 15% водного раствора HCl и смесь дважды экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме с получением желтого порошка. Продукт перекристаллизовывали из смеси гептан/этилацетат с получением указанного в заголовке соединения в виде желто/оранжевых кристаллов (129,3 мг, выход=89%).
1Н-ЯМР (ДМСО) δ: 5,62 (с, 2H, CH2Ar), 6,85 (дд, 1H, J1=8,6 Гц, J2=шир), 7,05 (м, 2H, шир), 7,20 (м, 1H, шир), 7,32-7,38 (м, 1H), 7,40 (д, 1H, J=8,2 Гц), 7,44-7,50 (м, 1H), 7,68 (дд, 1H, J1=8,6 Гц, J2=шир), 7,97 (с, 1H, COOH), 8,20 (с, 1H), 8,26 (с, 1H), 8,28 (д, 1H, J=8,2).
Пример 4
Метиламид 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (соединение 47, структура 15 со схемы IV, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=R8=Н, R9=Ме)
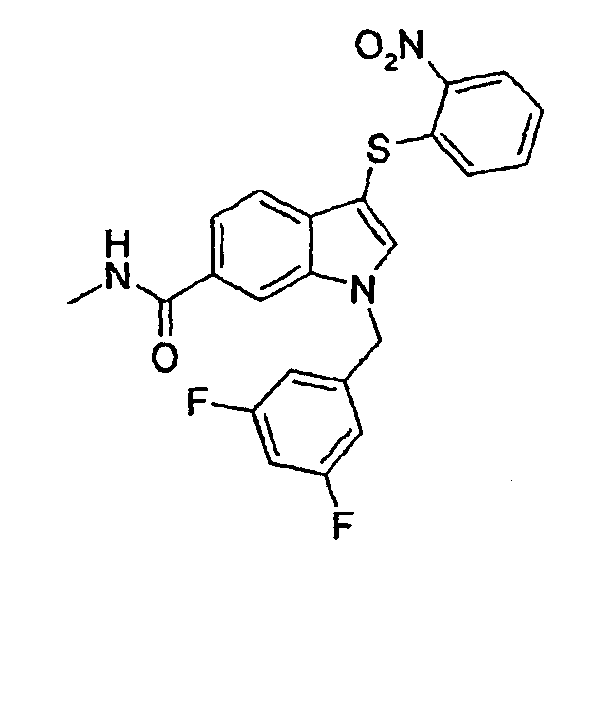
Общий способ 2: амидирование 6-карбоксилиндолов структуры 14 с получением 6-карбоксамидиндолов структуры 15 (схема IV)
В атмосфере азота к раствору 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (25,1 мг, 57,0 мкмоль) в сухом ДМФА (10 мл) добавляли NMM (1 мл), HOBt (9,60 мг, 62,7 мкмоль), EDCI (12,1 мг, 62,7 мкмоль) и хлорид метиламмония (19,2 мг, 285 мкмоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем выливали в ледяную воду. Полученный осадок отфильтровывали и остаток промывали избытком воды с последующим промыванием небольшим количеством гептана. Продукт сушили в вакууме при 40°С с получением указанного в заголовке соединения в виде твердого желтого вещества (15,2 мг, выход=60%).
ЖХМС: 4,31 мин (100,0%, МН+=454); 1Н ЯМР (ДМСО) δ: 2,80 (д, 3H, J=4,3, CH3NHCO), 5,63 (с, 2H, CH2Ar), 6,86 (дд, 1H, J1=8,2 Гц, J2=1,0 Гц), 7,04 (м, 2H), 7,20 (м, 1H), 7,33-7,37 (м, 1H), 7,41 (д, 1H, 8,6 Гц), 7,46-7,50 (м, 1H), 7,64 (дд, 1H, J1=8,2 Гц, J2=1,0 Гц), 8,15 (с, 1H), 8,25 (с, 1H), 8,27 (дд, 1H, J1=8,6 Гц, J2=1,0 Гц), 8,40 (м, 1H, MeNHCO).
По общему способу 2 получали следующие соединения:
Соединения, синтезированные по общему способу 2
соед.
масса
(МН+)
Времяа
удерживания
(мин)
Пример 5
Амид 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (соединение 33, структура 16 со схемы IV, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н)
Указанное в заголовке соединение получали по общему способу 2, используя 51,1 мг (116 мкмоль) карбоновой кислоты, 19,5 мг (128 мкмоль) HOBt, 24,6 мг (128 мкмоль) EDCI и 31,1 мг (581 мкмоль) хлорида аммония. Указанное в заголовке соединение получали в виде твердого желтого вещества (9,0 мг, 18%).
ЖХМС: 4,16 мин (100,0%, МН+=440); 1Н-ЯМР (CDCl3) δ: 5,46 (с, 2H, CH2Ar), 6,65 (м, 2H), 6,77 (м, 1H), 6,88 (дд, 1H, J1=8,2 Гц, J2=1,0 Гц), 7,21 (м, 1H), 7,29 (м, 1H), 7,51 (дд, 1H, J1=7,8 Гц, J2=1,0 Гц), 7,57 (д, 1H, J=7,7 Гц), 7,58 (с, 1H), 8,05 (с, 1H), 8,29 (дд, 1H, J1=8,2 Гц, J2=1,0 Гц).
Пример 6
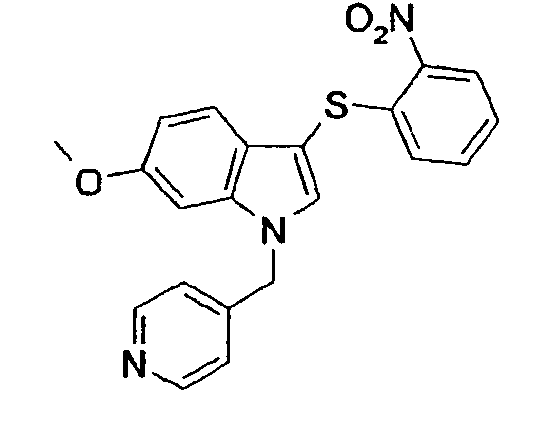
6-метокси-3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол (соединение 9, структура 3 со схемы I, где R1=2-пиридил, R2=2-нитрофенил, R3=R4=Н, R5=ОМе)
Общий способ 3: 3-сульфанилирование (не)замещенного индола структуры 1 с получением замещенных индолов структуры 4, с последующим индол-N-алкилированием с получением N-алкилированного индола структуры 3 (схема I)
(а) 6-Метокси-3-(2-нитрофенилсульфанил)-1Н-индол (структура 4 со схемы I, где R2=2-нитрофенил, R1=R3=R4=Н, R5=ОМе)
К раствору 6-метоксииндола (1,5 г, 10,2 ммоль) в Et2О (100 мл) по каплям добавляли раствор 2-нитробензолсульфенилхлорида (1,93 г, 10,2 ммоль) в 50 мл Et2О за 4-минутный период. Полученный желтый раствор перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали и неочищенный продукт очищали на колонке с диоксидом кремния (гептан/этилацетат 9:1) с получением указанного в заголовке соединения (3,054 г, выход=97%).
ВЭЖХ: 3,72 мин, чистота 96,7%, ТСХ (гептан/этилацетат 1:1): Rf=0,6;
1Н-ЯМР (CDCl3) δ: 3,87 (с, 3Н, ОСН3), 6,84 (дд, 1H, J1=7,8 Гц, J2=3,13 Гц), 6,97 (м, 2H), 7,16 (т, 1H, J=7,8 Гц), 7,25 (т, 1H, J=7,8 Гц), 7,35 (д, 1H, J=7,8 Гц), 7,44 (д, 1H, J=2,0 Гц), 8,26 (д, 1H, J=7,8 Гц), 8,45 (с, 1H, NH).
(b) 6-Метокси-3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол (соединение 9, структура 3 со схемы I, где R1=2-пиридил, R2=2-нитрофенил, R3=R4=Н, R5=ОМе)
К раствору 6-метокси-3-(2-нитрофенилсульфанил)-1Н-индола (1,5 г, 5 ммоль) в ДМФА (150 мл) добавляли NaH (60% в масле; 500 мг, 12,5 ммоль) небольшими порциями за 4-минутный период. Полученный темный раствор перемешивали в течение 5 минут при комнатной температуре. Затем небольшими порциями добавляли гидрохлорид 2-пиколилхлорида (984 мг, 6 ммоль) за 2-минутный период. Во время перемешивания при комнатной температуре (2 часа) цвет раствора слегка менялся от темного до желтого. Добавляли этилацетат (100 мл) и смесь промывали 2% водным раствором лимонной кислоты (2·100 мл) и водой (100 мл). Органическую фазу сушили (MgSO4) и растворитель выпаривали. Неочищенный продукт очищали кристаллизацией (этилацетат/гептан) с получением указанного в заголовке соединения (1,437 г, выход=74%).
ВЭЖХ: 10,3 мин, чистота 99,6%, ТСХ (гептан/этилацетат 1:1): Rf=0,3;
1Н-ЯМР (CDCl3) δ: 3,80 (с, 3Н, ОСН3), 5,47 (с, 2H, NCH2), 6,82 (м, 2H), 6,88 (д, 1H, J=7,8 Гц), 7,01 (дд, 1H, J1=7,8 Гц, J2=1,6 Гц), 7,15-7,19 (м, 1H), 7,25 (м, 2Н), 7,37 (д, 1H, J=8,6 Гц), 7,60-7,64 (м, 1H), 8,26 (дд, 1H, J1=7,8 Гц, J2=1,6 Гц), 8,63 (д, 1H, J=5,88 Гц).
По общему способу 3 получали следующие соединения:
Соединения, синтезированные по общему способу 3
соед.
(МН+)
Времяа
удерживания
(мин)
Пример 7
1-(3,5-Дифторбензил)-6-метокси-3-(пиридин-2-илсульфанил)-1Н-индол (соединение 65, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-пиридил, R3=R4=Н, R5=ОМе)
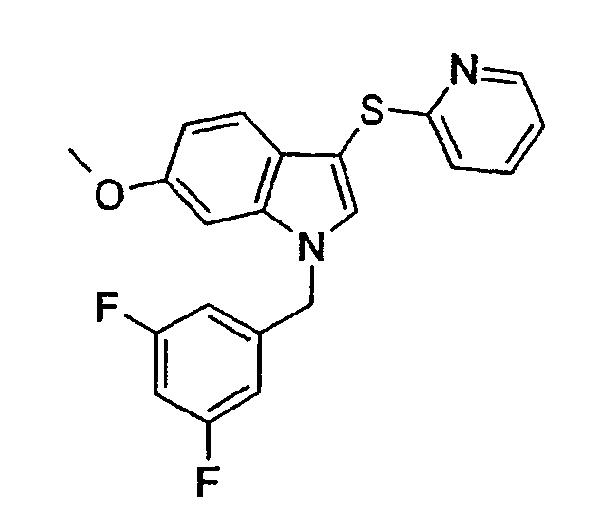
В атмосфере азота в охлажденный (-10°С) раствор 2-меркаптопиридина (25 мг, 0,22 ммоль) в CCl4 (2 мл) пропускали газ Cl2 в течение 1 минуты. Растворитель выпаривали и по каплям добавляли раствор 1-(3,5-дифторбензил)-6-метокси-1Н-индола (25 мг, 0,09 ммоль) в Et2О (2 мл). Реакционную смесь концентрировали и неочищенный продукт очищали препаративной ЖХМС с получением указанного в заголовке соединения (7,77 мг, выход=23%).
ЖХМС: 3,95 мин (100,0%, МН+=383); ТСХ (гептан/этилацетат 1:1): Rf=0,6.
1Н-ЯМР (CDCl3) δ: 2,23 (с, 1H, NH), 3,82 (с, 1H, ОСН3), 6,65 (м, 2H), 6,73 (д, 1H, J=2,7 Гц), 6,73-6,78 (м, 1H), 6,80 (д, 1H, J=7,8 Гц), 6,87 (дд, 1H, J1=7,8 Гц, J2=1,6 Гц), 7,00 (ддд, 1H, J1=9,8 Гц, J2=4,7 Гц, J3=0,8 Гц), 7,35 (с, 1H), 7,42 (ддд, 1H, J1=J2=7,8 Гц, J3=1,6 Гц), 7,50 (д, 1H, 8,6 Гц), 8,46 (д, 1H, J=4,7 Гц).
Пример 8
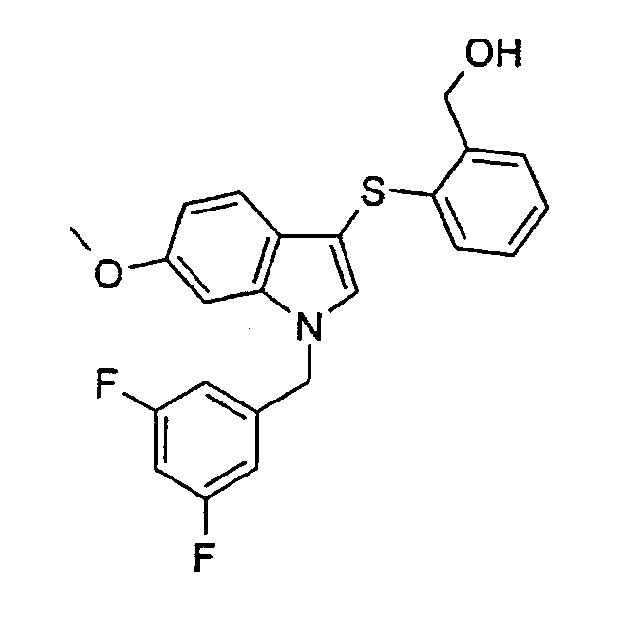
{2-[1-(3,5-Дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]фенил}метанол (соединение 16, структура 8 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
(а) Метиловый эфир 2-[1-(3,5-дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензойной кислоты (соединение 19, структура 7 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
Газообразный хлор пропускали через CCl4 (5 мл) при -10°С в течение 3 мин. Затем добавляли раствор метилтиосалицилата (91 мкл, 0,66 моль) в CCl4 (2 мл). Смесь перемешивали при -10°С в течение 5 минут и затем при комнатной температуре в течение 15 минут. Смесь концентрировали и снова растворяли в СН2Cl2 (5 мл). К раствору по каплям добавляли раствор 1-(3,5-дифторбензил)-6-метокси-1Н-индола (121 мг, 0,443 ммоль) в СН2Cl2 (3 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и концентрировали. Неочищенный продукт очищали колоночной хроматографией (этилацетат/гептан 1:9 с получением указанного в заголовке соединения в виде белого твердого вещества (161 мг, выход 83%).
ЖХМС: 4,72 мин (МН+=440); 1Н-ЯМР (CDCl3) δ: 3,82 (с, 3Н, ArOCH3), 3,99 (с, 3Н, СО2СН3), 5,30 (с, 2H, CH2Ar), 6,62-6,69 (м, 2H), 6,71-6,77 (м, 2H), 6,83 (дд, 1H, J1=8,6 Гц, J2=2,4 Гц), 6,87 (дд, 1H, J1=8,4 Гц, J2=1,2 Гц), 7,06-7,11 (м, 1H), 7,15-7,20 (м, 1H), 7,30 (с, 1H), 7,44 (д, 1H, J=8,6 Гц), 8,02 (дд, 1H, J1=8,0 Гц, J2=1,2 Гц).
(b) {2-[1-(3,5-Дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]фенил}метанол (соединение 16, структура 8 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
В атмосфере азота к раствору метилового эфира 2-[1-(3,5-дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензойной кислоты (13,5 мг, 0,031 ммоль) в ТГФ (2 мл) добавляли LiAlH4 (1,0М в ТГФ, 0,040 мл, 0,040 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли этилацетат (25 мл) и смесь промывали 3% водным раствором лимонной кислоты (2·25 мл) и насыщенным раствором соли (25 мл). Органическую фазу сушили (MgSO4) и концентрировали с получением бесцветного масла (15 мг). Неочищенный продукт очищали препаративной ВЭЖХ с получением указанного в заголовке соединения в виде бесцветного масла (5,6 мг, 44% выход).
ЖХМС: 4,47 мин (95,6%, МН+=412); 1Н-ЯМР (CDCl3) δ: 3,49 (с, 1H, ОН), 3,81 (3, 3Н, ОСН3), 4,92 (с, 2Н, СН2ОН), 5,28 (с, 2H, CH2Ar), 6,62-6,66 (м, 2H), 6,70-6,77 (м, 2H), 6,83 (дд, 1H, J1=8,8 Гц, J2=2,4 Гц), 6,89 (дд, 1H, J1=8,0 Гц, J2=1,2 Гц), 7,02-7,07 (м, 1H), 7,08-7,13 (м, 1H), 7,29 (с, 1H), 7,38 (дд, 1H, J1=8,0 Гц, J2=1,2 Гц), 7,44 (д, 1H, J=8,8 Гц).
Пример 9
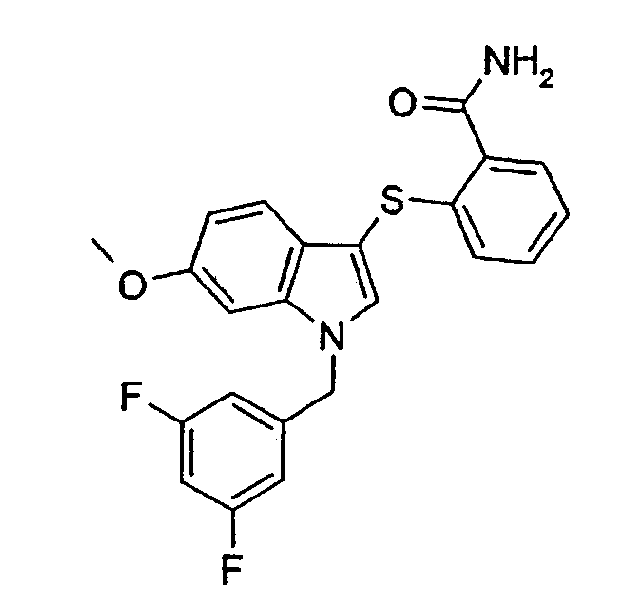
2-[1-(3,5-Дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензамид (соединение 18, структура 11 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
(а) 2-[1-(3,5-Дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензойная кислота (структура 9 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
К раствору метилового эфира 2-[1-(3,5-дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензойной кислоты (97 мг, 0,221 ммоль) в ТГФ (10 мл) добавляли раствор LiOH·Н2О (71 мг, 1,69 ммоль) в воде (10 мл). Смесь перемешивали при комнатной температуре в течение 17 часов, затем при 60°С в течение 24 часов и затем подкисляли 3% водным раствором лимонной кислоты. Добавляли этилацетат (50 мл) и смесь промывали 3% водным раствором лимонной кислоты (2·50 мл) и насыщенным раствором соли (50 мл). Органическую фазу сушили (MgSO4) и концентрировали с получением желтого твердого вещества (104 мг). Неочищенный продукт перекристаллизовывали из смеси этилацетат/гексан с получением указанного в заголовке соединения в виде желтого порошка (49 мг, 52% выход).
ЖХМС: 4,37 мин (МН+=426); 1Н-ЯМР (CDCl3) δ: 3,77 (с, 3Н, ОСН3), 5,51 (с, 2H, СН3Ar), 6,69 (д, 1H, J=8,0 Гц), 6,76 (дд, 1H, J1=8,4 Гц, J2=2,4 Гц), 6,98-7,04 (м, 2H), 7,11-7,15 (м, 1H), 7,16-7,25 (м, 4H), 7,83 (с, 1H), 7,92 (дд, 1H, J1=8,0 Гц, J2=1,6 Гц).
Общий способ 4: Реакция амина с карбоновой кислотой структуры 9, с TBTU и DIPEA с получением амидов структуры 3, в которой R2=фенил-2-карбоксамид, примерами которых являются соединения структуры 10 и 11 (схема III).
b) 2-[1-(3,5-Дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензамид (соединение 18, структура 11 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
Через раствор 2-[1-(3,5-дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензойной кислоты (36 мг, 0,085 ммоль), TBTU (28 мг, 0,087 ммоль) и DIPEA (30 мкл, 0,172 ммоль) в ДМФА (1 мл) барбатировали газ NH3 в течение 10 мин. Затем смесь перемешивали при комнатной температуре в течение 3 дней. Затем добавляли 3% водный раствор лимонной кислоты (0,4 мл) и неочищенную реакционную смесь очищали на картридже RP-SPE (2 г сорбента; от 25% водного раствора метанола до 100% метанола) с получением белого твердого вещества (34 мг). Неочищенный продукт очищали колоночной хроматографией (этилацетат) с получением указанного в заголовке соединения в виде бесцветного масла, которое отверждалось при стоянии (31 мг, выход: 86%).
ЖХМС: 4,20 мин (МН+=425); 1Н-ЯМР (CDCl3) δ: 3,81 (с, 3Н, ОСН3), 5,39 (с, 2Н, СН2Ar), 6,05 (с, шир, 1H, NH), 6,28 (с, шир, 1H, NH), 6,61-6,67 (м, 2H), 6,70-6,72 (м, 1H), 6,73-6,77 (м, 1H), 6,83 (дд, 1H, J1=8,8 Гц, J2=2,0 Гц), 6,92 (дд, 1H, J1=8 Гц, J2=1,2 Гц), 7,07-7,17 (м, 2H), 7,31 (с, 1H), 7,45 (д, 1H, J=8,8 Гц), 7,60 (дд, 1H, J1=8,0 Гц, J2=1,2 Гц).
Пример 10
2-[1-(3,5-Дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]-N-метилбензамид (соединение 17, структура 10 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
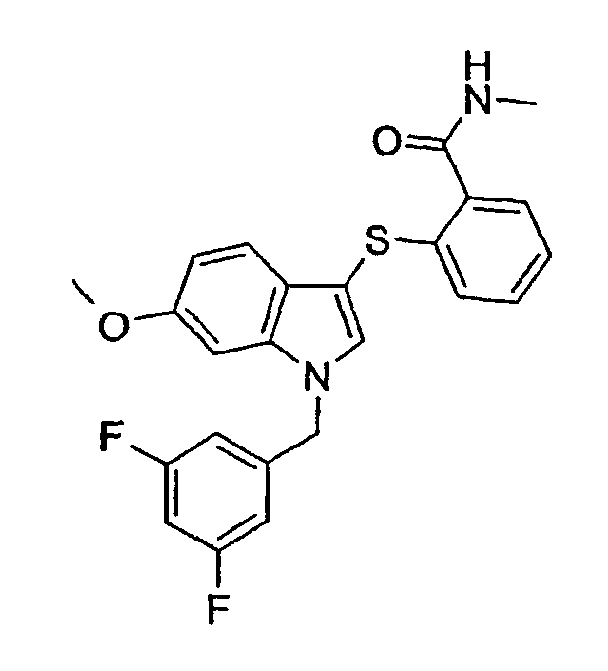
Соединение 17 синтезировали из метиламина по общему способу 4.
ЖХМС: 4,07 мин (МН+=439).
Пример 11
2-[1-(3,5-Дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензонитрил (соединение 20, структура 12 со схемы III, где R1=3,5-дифторфенил, R3=R4=Н, R5=ОМе)
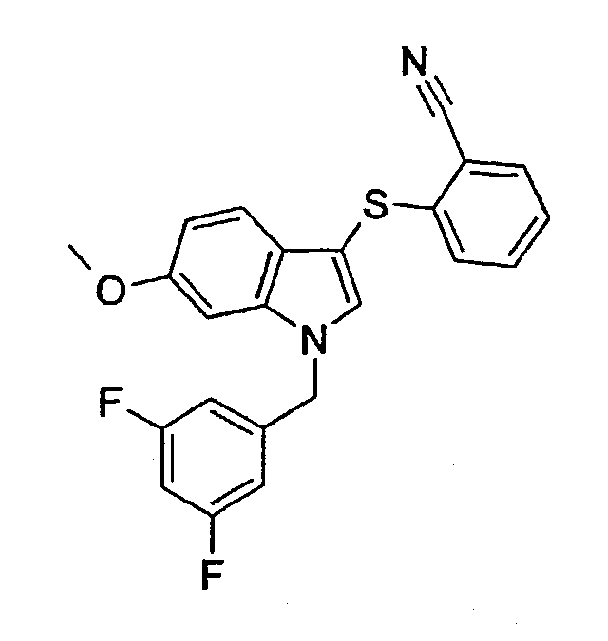
К охлажденному (0°С) раствору 2-[1-(3,5-дифторбензил)-6-метокси-1Н-индол-3-илсульфанил]бензамида (8 мг, 0,019 ммоль) и Et3N (10 мкл, 0,072 ммоль) в СН2Cl2 (1,5 мл)добавляли Tf2О (6 мкл, 0,036 ммоль). Смесь перемешивали при 0°С в течение 2 часов и затем при комнатной температуре в течение 22 часов. Добавляли воду и смесь экстрагировали СН2Cl2 (2·25 мл). Объединенные органические фазы сушили (Na2SO4) и концентрировали с получением коричневого масла (25 мг). Неочищенный продукт очищали колоночной хроматографией (этилацетат/гептан 1:2) с получением указанного в заголовке соединения в виде бледно-розового масла (3 мг, выход: 39%).
ЖХМС: 4,57 мин (МН+=407); 1Н-ЯМР (CDCl3) δ: 3,82 (с, 3Н, ОСН3), 5,30 (с, 2H, СН3Ar), 6,62-6,67 (м, 2H), 6,71-6,73 (м, 1H), 6,74-6,78 (м, 1H), 6,86 (дд, 1H, J1=8,8 Гц, J2=2,0 Гц), 6,91 (д, 1H, J=8,4 Гц), 7,11-7,15 (м, 1H), 7,26-7,30 (м, 1H), 7,37 (с, 1H), 7,46 (д, 1H, J=8,8 Гц), 7,57-7,60 (м, 1H).
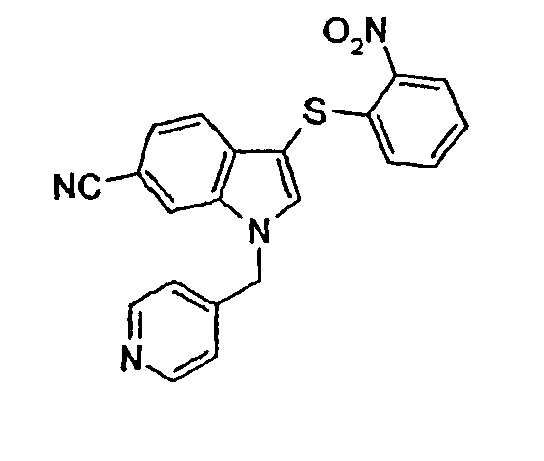
Пример 12
1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбонитрил (соединение 26, структура 17 со схемы IV, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н)
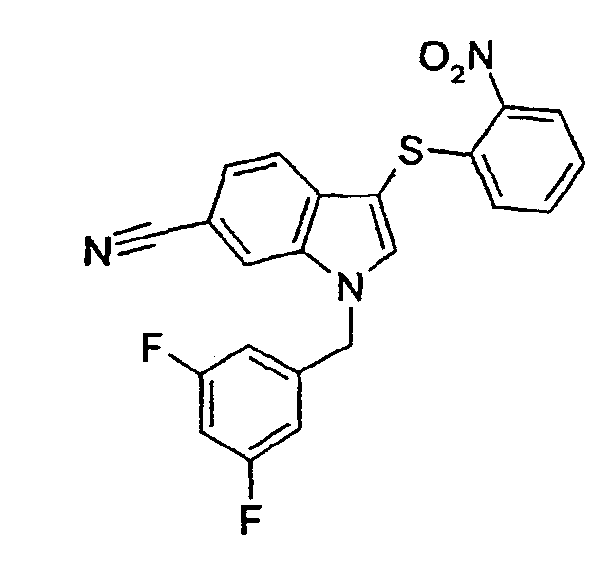
К охлажденной (0°С) суспензии амида 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (15 мг, 0,034 ммоль) и Et3N (10 мкл, 0,072 ммоль) в СН2Cl2 (1,5 мл) добавляли Tf2О (13 мкл, 0,077 ммоль). Смесь перемешивали при 0°С в течение 2 часов и затем при комнатной температуре в течение 20 часов. Добавляли воду (25 мл) и смесь экстрагировали СН2Cl2 (2·25 мл). Объединенные органические фазы сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения в виде твердого желтого вещества (13 мг, выход: 91%).
ЖХМС: 4,55 мин (МН+=не поддается обнаружению); 1Н-ЯМР (CDCl3) δ: 5,42 (с, 2H, СН3Ar), 6,63-6,69 (м, 2H), 6,78-6,85 (м, 2H), 7,21-7,25 (м, 1H), 7,28-7,33 (м, 1H), 7,44 (дд, 1H, J1=8,4 Гц, J2=1,2 Гц), 7,62 (д, 1H, J=8,4 Гц), 7,66 (с, 1H), 8,29 (дд, 1H, J1=8,4 Гц, J2=1,6 Гц).
Пример 13
1-(3,5-Дифторбензил)-6-метокси-3-(2-нитрофенилсульфинил)-1Н-индол (соединение 64, структура 5 со схемы II, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, R5=ОМе)
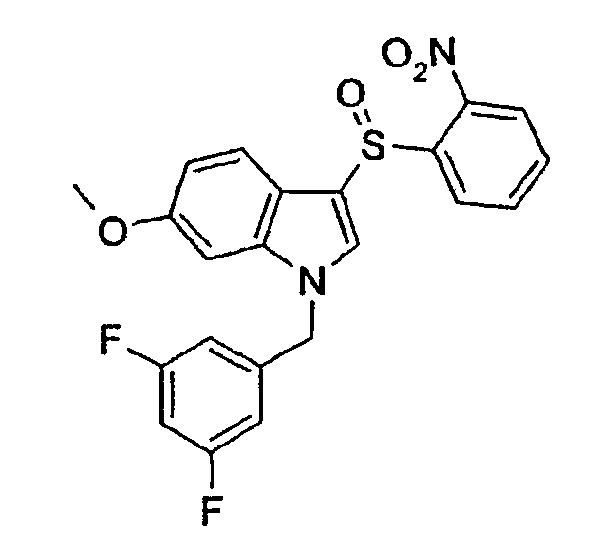
К раствору 1-(3,5-дифторбензил)-6-метокси-3-(2-нитрофенилсульфанил)-1Н-индола (40 мг, 0,09 ммоль) в СН2Cl2 (4 мл) добавляли метахлорпербензойную кислоту (14,5, 0,08 ммоль). Раствор перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали и неочищенный продукт очищали препаративной ЖХ-МС с получением указанного в заголовке соединения (14,3 мг, выход=34%).
ВЭЖХ: 4,13 мин, чистота 100%; ТСХ (гептан/этилацетат 1:1): Rf=0,4; 1Н-ЯМР (CDCl3) δ: 3,66 (с, 3H, OCH3), 5,12 (с, 2H), 6,57 (м, 3H), 6,75 (м, 2H), 7,47 (д, 1H, J=7,8 Гц), 7,52 (с, 1H), 7,66-7,70 (м, 1H), 8,28-8,32 (м, 1H), 8,23 (дд, 1H, J1=7,8 Гц, J2=1,9 Гц), 8,80 (дд, 1H, J1=7,8 Гц, J2=3,1 Гц).
Пример 14
1-(3,5-Дифторбензил)-6-метокси-3-(2-нитрофенилсульфонил)-1Н-индол (соединение 62, структура 6 со схемы II, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, R5=ОМе)
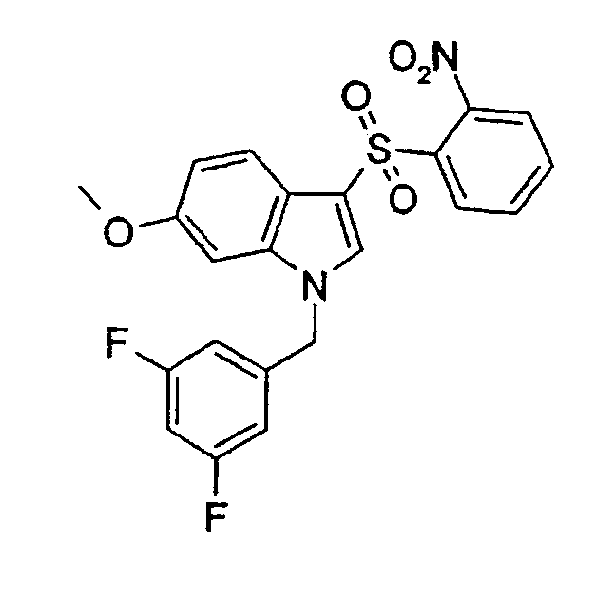
К раствору 1-(3,5-дифторбензил)-6-метокси-3-(2-нитрофенилсульфанил)-1Н-индола (40 мг, 0,09 ммоль) в СН2Cl2 (4 мл) добавляли метахлорпербензойную кислоту (46,5 мг, 0,08 ммоль). Раствор перемешивали при комнатной температуре в течение 6 часов. Растворитель выпаривали и неочищенный продукт очищали ЖХ-МС с получением указанного в заголовке соединения (14,5 мг, выход=34%).
ВЭЖХ: 4,38 мин, чистота 100%; ТСХ (гептан/этилацетат 1:1): Rf=0,6; 1Н-ЯМР (CDCl3) δ: 3,71 (с, 3Н, ОСН3), 5,25 (с, 2Н), 6,58 (д, 1H, J=3,1), 6,62 (м, 1H), 6,07-6,11 (м, 1H), 6,88 (дд, 1H, J1=7,8 Гц, J2=3,1 Гц), 7,63 (м, 4H), 7,72 (д, 1H, J=7,8 Гц), 7,83 (с, 1H), 8,37 (дд, 1H, J1=7,8 Гц, J2=1,9 Гц).
Пример 15
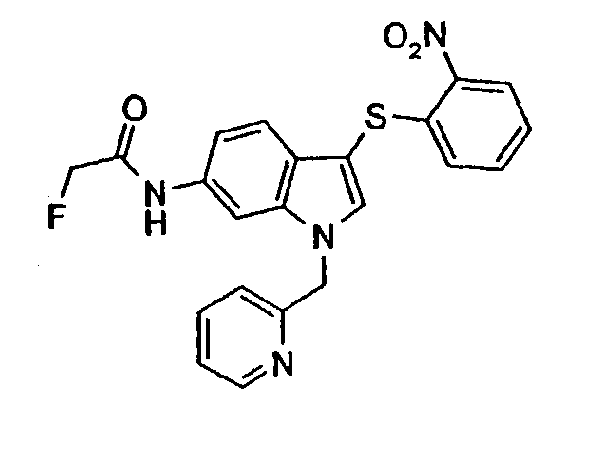
Моногидрохлорид 6-метокси-3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индола (соединение 10)
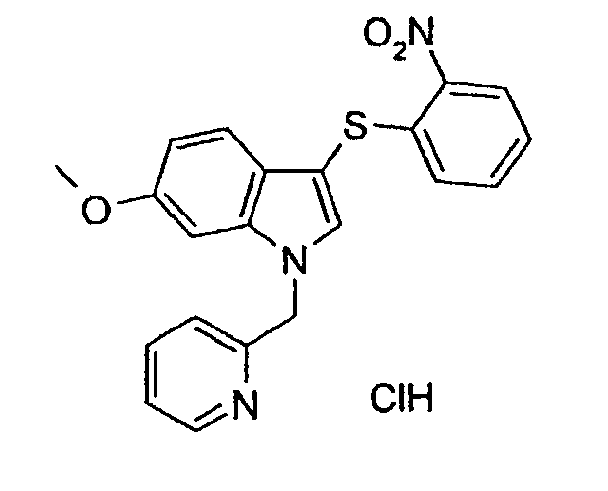
В раствор 6-метокси-3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индола в метиленхлориде пропускали газ HCl до тех пор, пока не выкристаллизовывалась органическая соль. Указанное в заголовке соединение выделяли фильтрованием.
ЖХМС: 4,04 мин (МН+=392); 1Н-ЯМР (ДМСО-d6) δ: 3,78 (с, 3Н, ОСН3), 5,78 (с, 2H, NCH2), 6,77 (дд, 1H, J1=7,8 Гц, J2=2,0 Гц), 6,93 (дд, 1H, J1=7,8 Гц, J2=0,8 Гц), 7,22 (д, 1H, J=7,8 Гц), 7,26 (д, 1H, J=2,0 Гц), 7,34 (м, 2H), 7,48-7,52 (м, 1H), 7,59 (т, 1H, J=7,0 Гц), 7,96 (с, 1H), 8,08 (т, 1H, J=7,0 Гц), 8,27 (дд, 1H, J1=7,8 Гц, J2=1,6 Гц), 8,74 (д, 1H, J=6,7 Гц).
Пример 16
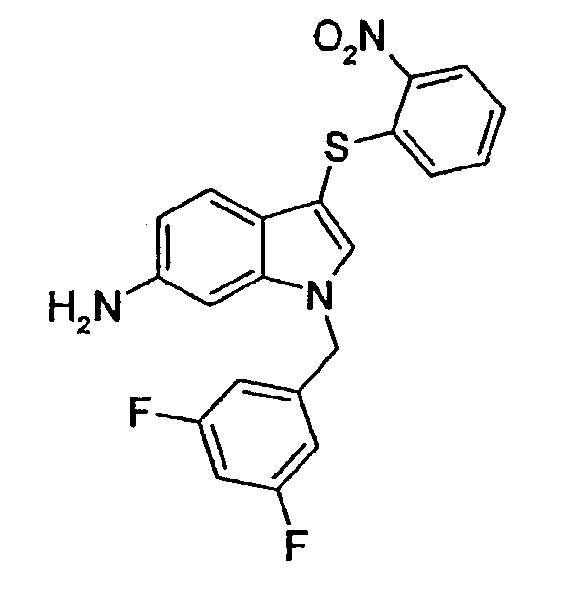
1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-иламин (соединение 57, структура 23 со схемы V, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н)
а) 1-(3,5-Дифторбензил)-6-нитро-1Н-индол (структура 19 со схемы V, где R1=3,5-дифторфенил, R3=R4=Н)
К раствору 6-нитроиндола (162 мг, 1,0 ммоль) в ДМФА (4 мл) добавляли NaH (60% дисперсия в масле; 80 мг, 2,0 ммоль). Полученный темный раствор перемешивали при комнатной температуре в течение 15 минут. Добавляли 3,5-дифторбензилбромид (129 мкл, 1,1 ммоль). Реакционную смесь перемешивали в течение ночи, выливали в подкисленную воду и дважды экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме.
Продукт очищали на колонке с SiO2 (гептан/этилацетат 9:1) с получением указанного в заголовке соединении в виде твердого желтого вещества (270 мг, выход=94%).
ЖХМС: 5,54 мин (100,0%, МН+=289); 1Н-ЯМР (CDCl3) δ: 5,40 (с, 2H, CH2Ar), 6,58 (м, 2H), 6,71 (д, 1H, J=3,5 Гц), 6,75 (м, 1H), 7,26 (с, 1H), 7,41 (д, 1H, J=3,5 Гц), 7,71 (д, 1H, J=8,3 Гц), 8,05 (дд, 1H, J1=8,3 Гц, J2=2,0 Гц), 8,21 (д, 1H, J=2,0 Гц).
b) 1-(3,5-Дифторбензил)-1Н-индол-6-иламин (структура 20 со схемы V, где R1=3,5-дифторфенил, R3=R4=Н)
К раствору 1-(3,5-дифторбензил)-6-нитро-1Н-индола (144 мг, 0,5 ммоль) в этаноле (20 мл) добавляли хлористоводородную кислоту, 37% (80 мкл) и SnCl2·2Н2О (600 мг). Реакционную смесь перемешивали при 60°С в течение 40 часов и затем концентрировали в вакууме. Остаток выливали в этилацетат и добавляли концентрированный раствор NaHCO3. Двухслойную систему фильтровали через декалит, чтобы освободиться от солей олова, и фильтрат дважды экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме. Продукт очищали на колонке SiO2 (гептан/этилацетат 9:1) с получением указанного в заголовке соединения в виде бесцветного масла (89 мг, выход=69%).
ЖХМС: 3,20 мин (97,7%, МН+=259); 1Н-ЯМР (CDCl3) δ: 5,12 (с, 2H, СН2Ar), 6,52 (м, 2H), 6,56 (д, 1H, J=3,5 Гц), 6,63 (м, 1H), 7,97 (дд, 1H, J1=8,3 Гц, J2=2,0 Гц), 7,13 (д, 1H, J=3,5 Гц), 7,17 (д, 1H, J=2,0 Гц), 7,55 (д, 1H, J=8,3 Гц).
с) 1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-иламин (соединение 57, структура 23 со схемы V, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н)
К раствору 1-(3,5-дифторбензил)-1Н-индол-6-иламина (25 мг, 0,1 ммоль) в ДХМ (4 мл) добавляли 2-нитробензолсульфенилхлорид. Полученный желтый раствор перемешивали при комнатной температуре в течение 1 часа. Смесь концентрировали в вакууме и очищали на колонке с SiO2 (гептан/этилацетат 9:1) с получением указанного в заголовке соединения в виде твердого оранжевого вещества (11,6 мг, выход=28%).
ЖХМС: 5,11 мин (100,0%, МН+=412); 1Н-ЯМР (CDCl3) δ: 5,22 (с, 2H, CH2Ar), 6,56 (м, 2H), 6,65 (м, 1H), 6,84 (дд, 1H, J1=8,2 Гц, J2=1,2 Гц), 7,00 (дд, 1H, J1=8,2 Гц, J2=1,2 Гц ), 7,19 (м, 1H), 7,30 (д, 1H, J=1,2 Гц), 7,31 (с, 1H), 7,37 (д, 1H, J=8,2 Гц), 7,49 (м, 1H), 8,27 (дд, 1H, J1=8,2 Гц, J2=1,2 Гц).
Пример 17
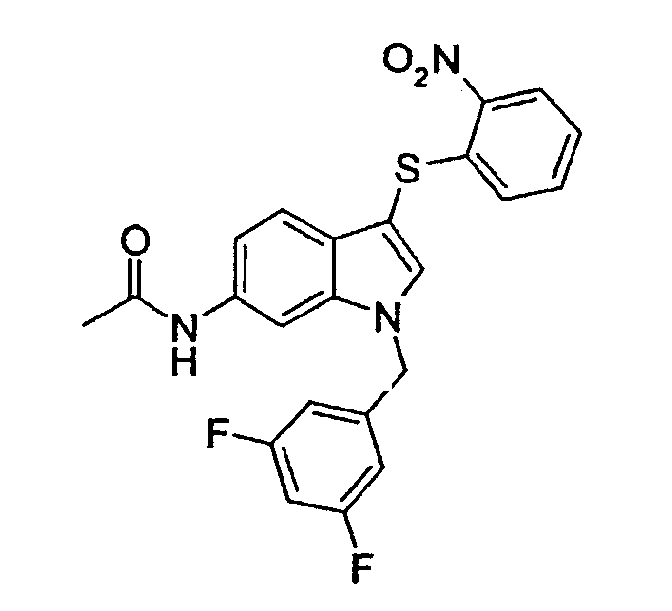
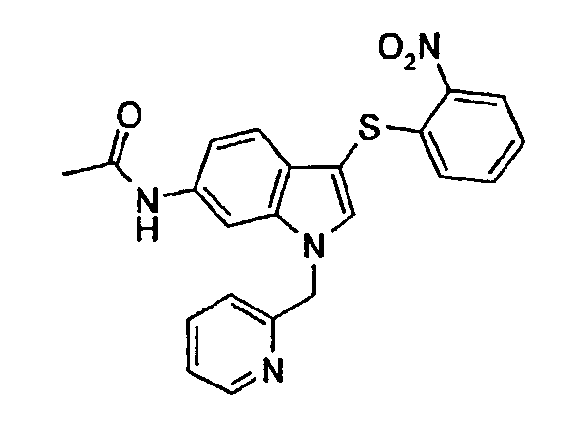
N-[1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]ацетамид (соединение 58, структура 22 со схемы V, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, Z=метил)
Общий способ 5: Реакция ангидрида кислоты с 6-аминоиндолом структуры 20 с получением соединений структуры 21 с последующим сульфанилированием индола в положении 3 с получением соединений структуры 22 (схема V).
а) N-[1-(3,5-Дифторбензил)-1Н-индол-6-ил]ацетамид (структура 21 со схемы V, где R1=3,5-дифторфенил, R3=R4=Н, Z=метил)
К раствору 1-(3,5-дифторбензил)-1Н-индол-6-иламина (25 мг, 0,1 ммоль) в ДХМ (4 мл) добавляли пиридин (25 мкл) и уксусный ангидрид (9,8 мкл, 0,11 ммоль) и перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в 10 мл воды, нейтрализовали NaHCO3 и дважды экстрагировали ДХМ. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме с получением неочищенного соединения в виде не совсем белого твердого вещества (23,3 мг, выход=84%). Продукт использовали без дополнительной очистки.
ЖХМС: 4,10 мин (97,4%, МН+ =301); 1Н-ЯМР (CDCl3) δ: 2,18 (с, 3H, CH3CON), 5,28 (с, 2H, CH2Ar), 6,53 (д, 1H, J=3,1), 6,58 (м, 2H), 6,68 (м, 1H), 6,87 (дд, 1H, J1=8,3 Гц, J2=1,6 Гц), 7,07 (д, 1H, J=3,1 Гц), 7,55 (д, 1H, J=8,3 Гц), 7,90 (с, 1H).
b) N-[1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]ацетамид (соединение 58, структура 22 со схемы V, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, Z=метил)
К раствору N-[1-(3,5-дифторбензил)-1Н-индол-6-ил]ацетамида (23,3 мг, 0,08 ммоль) в диэтиловом эфире (4 мл) добавляли 2-нитробензолсульфанилхлорид (14,7 мг, 0,09 ммоль). Полученный желтый раствор перемешивали в течение ночи при комнатной температуре. Смесь концентрировали в вакууме и очищали на колонке с SiO2 (гептан/этилацетат 9:1) с получением указанного в заголовке соединения в виде твердого желтого вещества (35,0 мг, выход=96%).
ЖХМС: 4,26 мин (98,6%, МН+=454); 1Н-ЯМР (ДМСО-d6) δ: 2,03 (с, 3H, CH3CON), 5,51 (с, 2H, СН2Ar), 6,89 (дд, 1Н, J=8,3 Гц, J2=1,2 Гц), 6,95 (м, 2H), 7,17 (дд, 1H, J1=8,3 Гц, J2=2,0 Гц), 7,19 (м, 1H), 7,27 (д, 1H, J=8,3 Гц), 7,34 (м, 1H), 7,49 (м, 1H), 7,97 (д, 1H, J=1,2 Гц), 8,02 (с, 1H), 8,27 (дд, 1H, J1=8,3 Гц, J2=1,2 Гц).
Пример 18
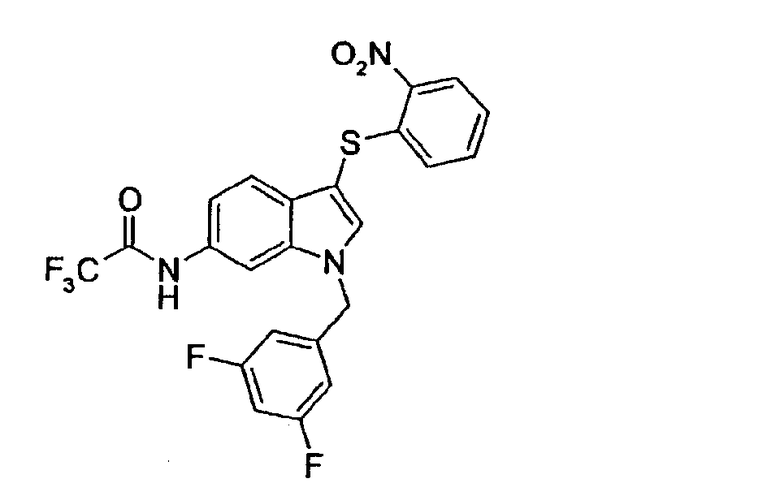
N-[1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]-2,2,2-трифторацетамид (соединение 59, структура 22 со схемы V, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, Z=трифторметил)
По общему способу 5, стадия а), получали N-[1-(3,5-дифторбензил)-1Н-индол-6-ил]-2,2,2-трифторацетамид, используя 1-(3,5-дифторбензил)-1Н-индол-6-иламин (17,7 мг, 69 мкмоль), пиридин (17 мкл) и трифторуксусный ангидрид (9,68 мкл, 70 мкмоль). Соединение очищали на колонке с SiO2 (гептан/этилацетат 9:1) с получением указанного в заголовке соединения в виде белого твердого вещества (10,9 мг, выход=61%).
ЖХМС: 4,41 мин (82,1%, МН+=355).
По общему способу 5, стадия b), N-[1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]-2,2,2-трифторацетамид получали, используя N-[1-(3,5-дифторбензил)-1Н-индол-6-ил]-2,2,2-трифторацетамид (10,9 мг, 31 мкмоль) и 2-нитробензолсульфенилхлорид (5,7 мг, 37 мкмоль). Соединение очищали на колонке для ВЭЖХ (MeCN/Н2О) с получением указанного в заголовке соединения в виде желтого твердого вещества (10,2 мг, выход=65%).
ЖХМС: 4,65 мин (89,0%, МН+=508); 1Н-ЯМР (ДМСО) δ: 5,56 (с, 2H, CH2Ar), 6,87 (дд, 1H, J=8,3 Гц, J2=1,2 Гц), 7,01 (м, 2H), 7,20 (м, 1H), 7,35 (м, 1H), 7,37 (дд, 1H, J1=8,3 Гц, J2=2,0 Гц), 7,39 (д, 1H, J=8,3 Гц), 7,49 (м, 1H), 7,50 (д, 1H, J=2,0 Гц), 8,15 (с, 1H), 8,28 (дд, 1H, J1=8,3 Гц, J2=2,0 Гц).
Пример 19
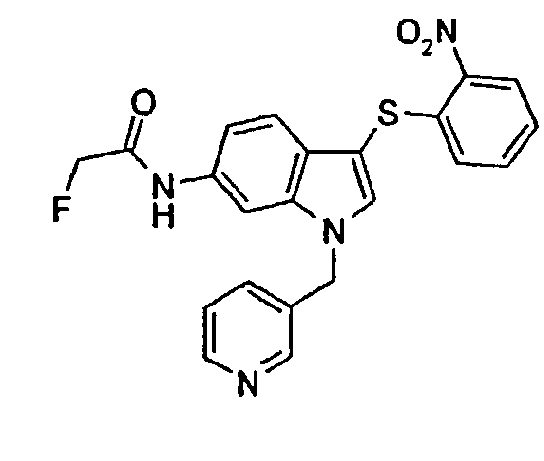
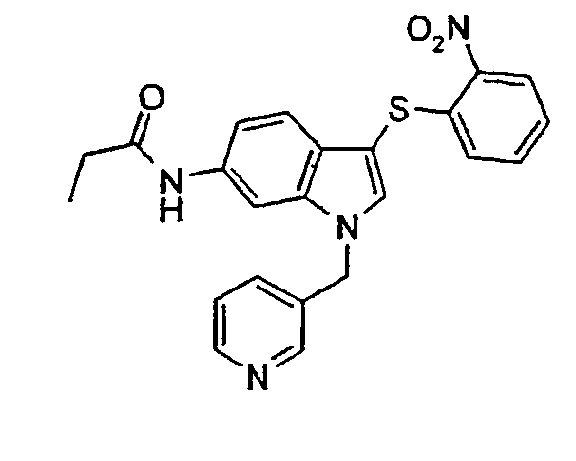
Соединение 97: N-[1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]-2-фторацетамид, структура 28 со схемы VII, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, Z1=монофторметил
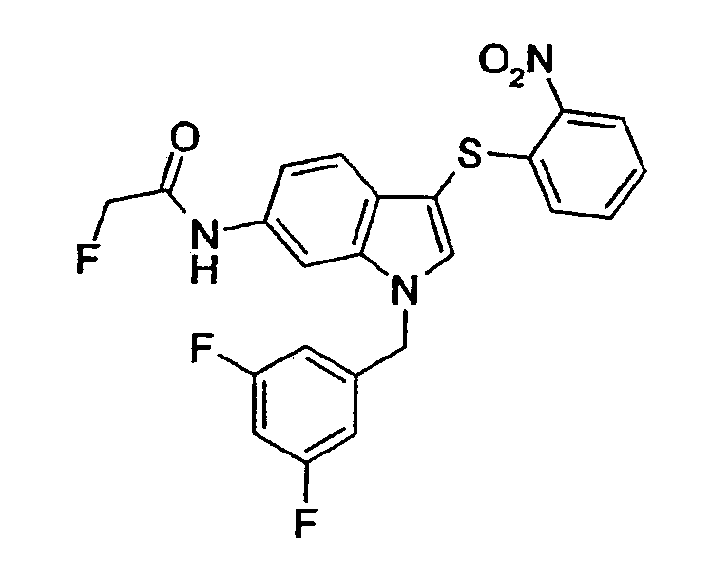
а) 1-(3,5-Дифторбензил)-6-нитро-1Н-индол, структура 19 со схемы VII, где R1=3,5-дифторфенил, R2=R3=R4=Н
К раствору 6-нитро-1Н-индола (19,5 г, 120 ммоль) в NMP (500 мл) добавляли при 0°С карбонат цезия (39,1 г, 120 ммоль). После перемешивания в течение 30 минут при 0°С добавляли 3,5-дифторбензилбромид (30,0 г, 144 ммоль), смеси давали нагреться до комнатной температуры и перемешивали в течение 18 часов. Смесь выливали в насыщенный водный раствор хлорида аммония (1 л) и экстрагировали этилацетатом (2·500 мл). Объединенные органические слои промывали Н2О (2·500 мл) и насыщенным раствором соли (500 мл), сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения (65 г, желтое твердое вещество), которое использовали без дополнительной очистки.
b) 1-(3,5-Дифторбензил)-1Н-индол-6-иламин, структура 20 со схемы VII, где R1=3,5-дифторфенил, R2=R3=R4=Н
96% EtOH (1 л) добавляли к 1-(3,5-дифторбензил)-6-нитро-1Н-индолу и смесь перемешивали при 60°С до тех пор, пока не растворялось все вещество. Добавляли 37% HCl (37 мл) с последующим добавлением дигидрата хлорида олова(II) (268 г, 1,19 моль) и перемешивание продолжали при 60°С в течение 18 часов. После того как смесь охлаждали до комнатной температуры, растворитель удаляли при пониженном давлении. Добавляли этилацетат (800 мл), смесь выливали в насыщенный водный NaHCO3 (1 л) и фильтровали через кизельгур. Слои разделяли, органический слой промывали Н2О (2·500 мл) и насыщенным раствором соли, сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения (54 г, коричневое масло/твердое вещество), которое использовали без дополнительной очистки.
с) трет-Бутиловый эфир [1-(3,5-дифторбензил)-1Н-индол-6-ил]карбаминовой кислоты, структура 26 со схемы VII, где R1=3,5-дифторфенил, R2=R3=R4=Н
1-(3,5-Дифторбензил)-1Н-индол-6-иламин растворяли в NMP (1 л) и добавляли триэтиламин (34 мл, 242 ммоль) с последующим добавлением ди-трет-бутилдикарбоната (53 г, 242 ммоль) и смесь перемешивали при комнатной температуре в течение 18 часов. Смесь выливали в насыщенный водный раствор NaHCO3 (1,5 л) и экстрагировали этилацетатом (3·750 мл). Объединенные органические слои промывали Н2О (1 л) и насыщенным раствором соли (1 л), сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали, используя колоночную хроматографию (гептан/этилацетат 4:1), с получением указанного в заголовке соединения (39 г, 109 ммоль, 91% (три стадии), белое твердое вещество).
d) трет-Бутиловый эфир [1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]карбаминовой кислоты, структура 27 со схемы VII, где R1=3,5-дифторфенил, R2=2-нитрофенил; R3=R4=Н
К раствору трет-бутилового эфира [1-(3,5-дифторбензил)-1Н-индол-6-ил]карбаминовой кислоты (39 г, 109 ммоль) в диэтиловом эфире (750 мл) добавляли 2-нитробензолсульфенилхлорид (20,4 г, 109 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Смесь выливали в насыщенный водный раствор NaHCO3 (1 л) и экстрагировали этилацетатом (2·300 мл). Объединенные органические слои промывали Н2О (400 мл) и насыщенным раствором соли (400 мл), сушили и концентрировали с получением указанного в заголовке соединения (56 г, желтое твердое вещество), которое использовали без дополнительной очистки.
е) 1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-иламин, структура 23 со схемы VII, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н
трет-Бутиловый эфир [1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]карбаминовой кислоты растворяли в СН2Cl2 (1 л) и в атмосфере азота по каплям при комнатной температуре добавляли трифторуксусную кислоту (48 мл, 624 ммоль). После перемешивания в течение 1 часа добавляли еще одну порцию трифторуксусной кислоты (48 мл, 624 ммоль) и реакционную смесь перемешивали в течение еще одного часа. Смесь разбавляли СН2Cl2 (500 мл) и Н2О (1 л) и добавляли 3н раствор NaOH до тех пор, пока рН смеси не становился равным 11-12. Слои разделяли, органический слой промывали Н2О (500 мл) и насыщенным раствором соли (500 мл), сушили (Na2SO4) и концентрировали с получением неочищенного продукта. Продукт очищали, используя колоночную хроматографию (гептан/этилацетат 1:1), с получением указанного в заголовке соединения (28 г, 68 ммоль, 63% (две стадии), красно/коричневое твердое вещество).
Общий способ 6: Реакция хлорангидрида кислоты (способ а), карбоновой кислоты (способ b) или сульфонилхлорида (способ с) с 6-аминоиндолом структуры 23 с получением соединений структуры 28 и 29 (схема VII)
Способ а, b и с, все могут быть осуществлены с использованием методики, примером которой является способ а, представленный ниже.
К раствору 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-иламина (300 мг, 0,73 ммоль) в СН2Cl2 (7 мл) добавляли при 0°С триэтиламин (0,12 мл, 0,87 ммоль). Затем добавляли монофторацетилхлорид (50 мкл, 0,73 ммоль) и смесь перемешивали при комнатной температуре в течение 18 часов. Смесь концентрировали и очищали, используя колоночную хроматографию (СН2Cl2/МеОН 99:1), с получением соединения 97 (317 мг, 0,67 ммоль, 92%, желтое твердое вещество).
1Н-ЯМР (ДМСО) δ: 4,82 (с, 1H), 5,03 (с, 1H), 5,52 (с, 2H), 6189 (дд, 1H, J1=7,6 Гц, J2=1,1 Гц), 6,98-7,01 (м, 2H), 7,20 (тт, 1H, J1=9,5 Гц, J2=3,0 Гц), 7,28-7,32 (м, 2H), 7,33-7,37 (м, 1H), 7,46-7,51 (м, 1H), 7,98 (с, 1H), 8,08 (с, 1H), 8,27 (дд, 1H, J1=7,6 Гц, J2=1,1 Гц), 10,15 (с, 1H).
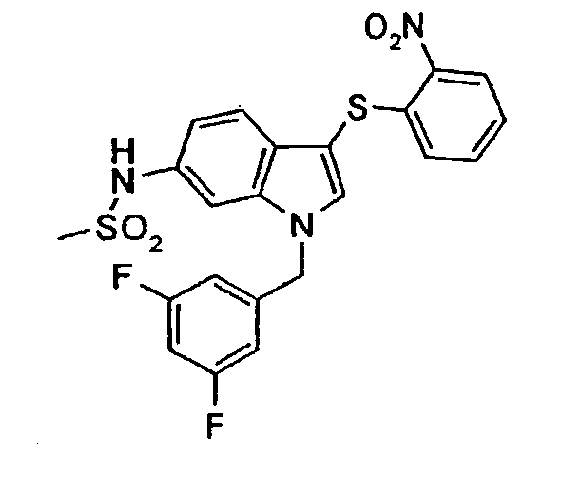
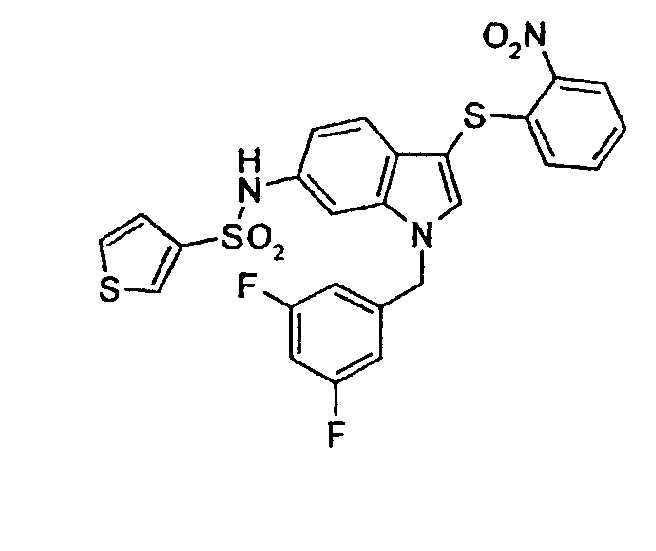
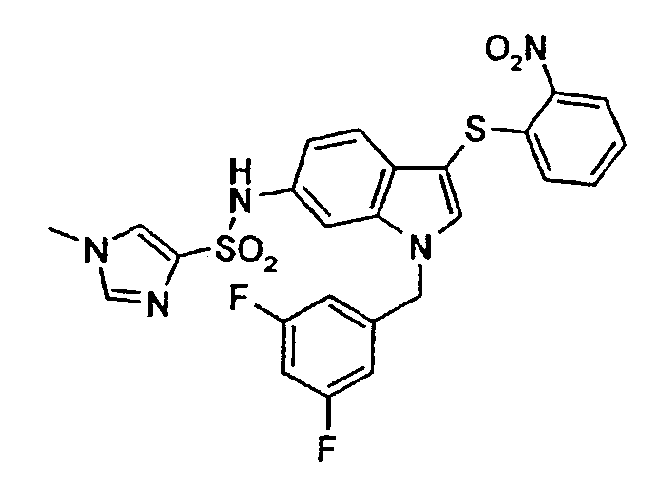
По общему способу 6 получали следующие соединения:
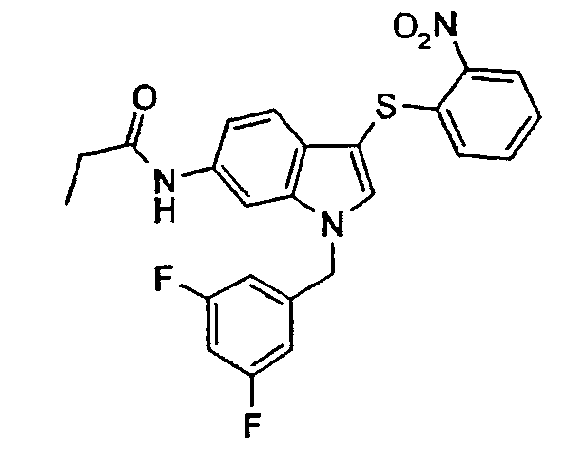
Пример 20
По общему способу 3 получали следующие соединения:
Соединение 61: [1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ол, структура 25 со схемы VI, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, R5=ОН
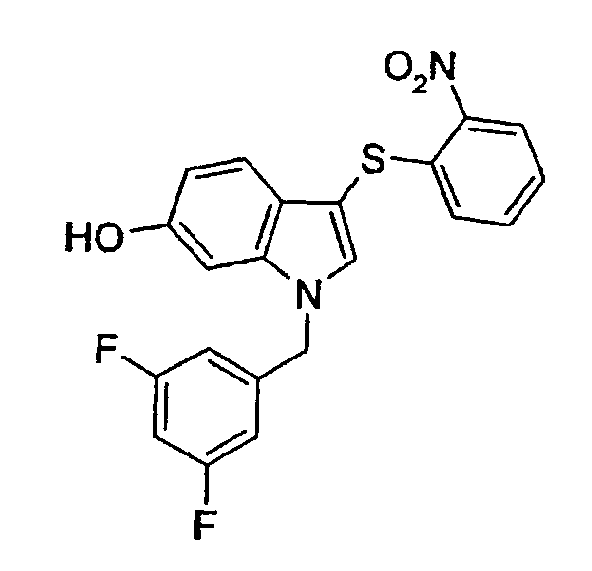
К раствору соединения 63 (240 мг, 0,56 ммоль) в СН2Cl2 (10 мл) добавляли при 0°С комплекс трифторид бора-метилсульфид (2,37 мл, 22,5 ммоль). После перемешивания в течение 2 часов при 0°С реакционной смеси давали нагреться до комнатной температуры и перемешивание продолжали в течение еще 4 часов. Реакционную смесь выливали в ледяную воду (20 мл) и после добавления этилацетата (10 мл) слои разделяли. Органический слой промывали насыщенным водным раствором NaHCO3 (20 мл) и насыщенным раствором соли (20 мл) и сушили над Na2SO4. Концентрирование давало неочищенный продукт, который очищали, используя флэш-хроматографию (гептан/этилацетат 3:2), с получением соединения 61 в виде желтого масла (87 мг, 0,21 ммоль, 38%).
1Н-ЯМР (CDCl3) δ: 4,75 (2, 1H), 5,29 (с, 2H), 4,66 (м, 1H), 6,72-6,79 (м, 3H), 6,98 (дд, 1H, J1=8,4 Гц, J2=1,5 Гц), 7,17-7,21 (м, 1H), 7,27-7,31 (м, 1H), 7,35-7,37 (м, 3H), 8,27 (дд, 1H, J1=8,4 Гц, J2=1,5 Гц).
Пример 22
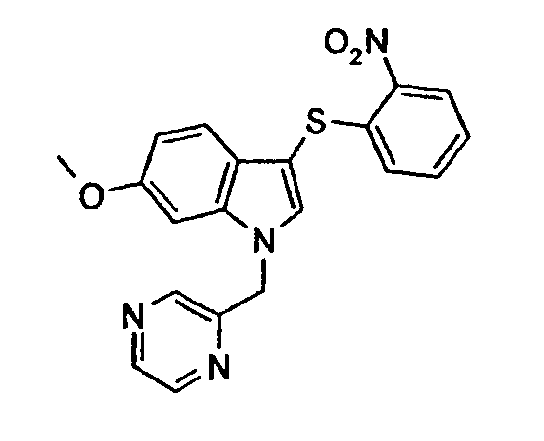
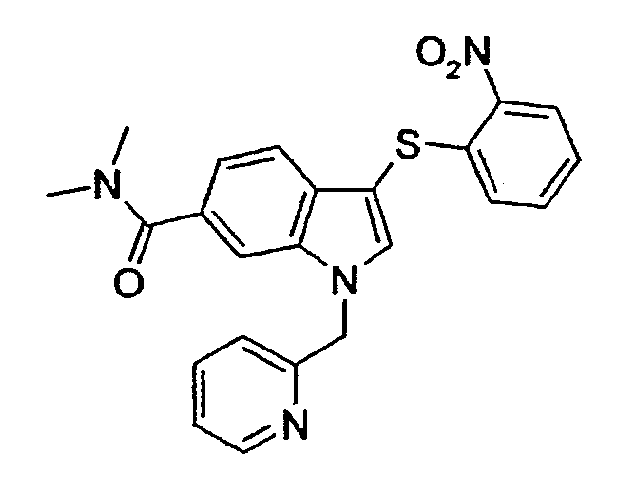
Соединение 109: Диметиламид 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбоновой кислоты, структура 15 со схемы V, где R1=2-пиридил, R2=2-нитрофенил, R3=R4=Н, R8=R9=Ме
а) Метиловый эфир 1-пиридин-2-илметил-1Н-индол-6-карбоновой кислоты
В атмосфере азота к раствору метилового эфира 1Н-индол-6-карбоновой кислоты (в отношении синтеза см. пример 2а) (2,47 г, 14,1 ммоль) в NMP (140 мл) добавляли Cs2СО3 (10,1 мг, 31 ммоль) при 0°С. После перемешивания в течение 15 мин добавляли гидрохлорид 2-пиколилхлорида (2,77 г, 16,9 ммоль) и смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли этилацетат (200 мл) и смесь промывали насыщенным водным раствором хлорида аммония (3·150 мл) и насыщенным раствором соли (200 мл). Органическую фазу сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали, используя колоночную хроматографию (этилацетат/гептан 1:3), с получением указанного в заголовке соединения в виде бесцветного масла, которое медленно кристаллизовалось при стоянии (2,72 г, 10,2 ммоль, 72%).
b) Метиловый эфир 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбоновой кислоты, структура 13 со схемы IV, где R1=2-пиридил, R2=2-нитрофенил, R3=R4=Н
К раствору метилового эфира 1-пиридин-2-илметил-1Н-индол-6-карбоновой кислоты (2,72 г, 10,2 ммоль) в дихлорметане (75 мл) добавляли при комнатной температуре раствор 2-нитробензолсульфенилхлорида (1,93 г, 10,2 ммоль) в дихлорметане (75 мл). Смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали и неочищенный продукт очищали, используя колоночную хроматографию (этилацетат/гептан от 1:5 до 1:2), с получением указанного в заголовке соединения в виде желтого твердого вещества (3,21 г, 7,65 ммоль, 75%).
с) 3-(2-Нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбоновая кислота, структура 14 со схемы IV, где R1=2-пиридил, R2=2-нитрофенил, R3=R4=Н
К суспензии метилового эфира 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбоновой кислоты (3,0 г, 6,58 ммоль) в диоксане добавляли раствор LiOH·Н2О (1,66 г, 39,6 ммоль) в воде (65 мл). Реакционную смесь перемешивали в течение ночи при 60°С. Смесь затем подкисляли до рН 6 добавлением 15% водного раствора HCl и смесь экстрагировали этилацетатом (2·100 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали с получением желтого порошка. Продукт перекристаллизовывали из смеси гептан/этилацетат с получением указанного в заголовке соединения в виде желто/оранжевых кристаллов (2,47 г, 6,09 ммоль, 93%).
Общий способ 7: амидирование 6-карбоксилиндолов структуры 14 с получением карбоксамидиндолов структуры 15 (схема IV).
В атмосфере азота к раствору 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбоновой кислоты (700 мг, 1,73 ммоль) в безводном СН2Cl2 (70 мл) добавляли DIPEA (0,9 мл, 5,2 ммоль), TBTU (840 мг, 2,6 ммоль) и гидрохлорид диметиламина (420 мг, 5,1 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем выливали в насыщенный водный раствор NaHCO3 (100 мл). Органический слой промывали насыщенным раствором соли (50 мл), сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали колоночной хроматографией (этилацетат/МеОН 95:5) с получением соединения 109 (540 мг, 1,25 ммоль, 72%, желтое твердое вещество).
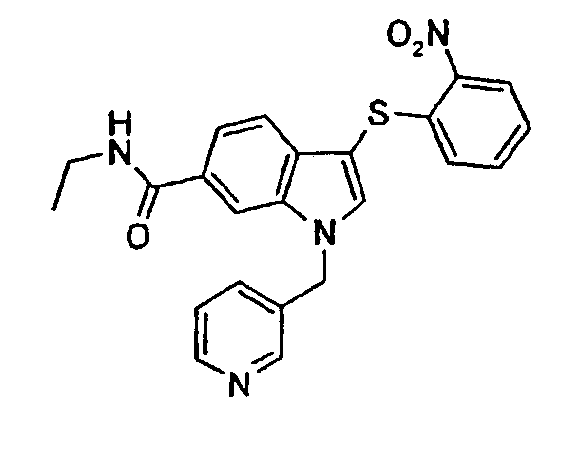
1Н-ЯМР (CDCl3) δ: 2,97 (с, 3Н), 3,11 (с, 3H), 5,53 (с, 2H), 6,90 (дд, 1H, J1=7,6 Гц, J2=1,5 Гц), 6,95 (д, 1H, J=7,6 Гц), 7,17-7,28 (м, 4H), 7,51 (д, 1H, J=7,6 Гц), 7,54 (с, 1H), 7,61-7,66 (м, 2H), 8,28 (дд, 1H, J1=8,4 Гц, J2=1,5 Гц), 8,61 (д, 1H, J=4,6 Гц).
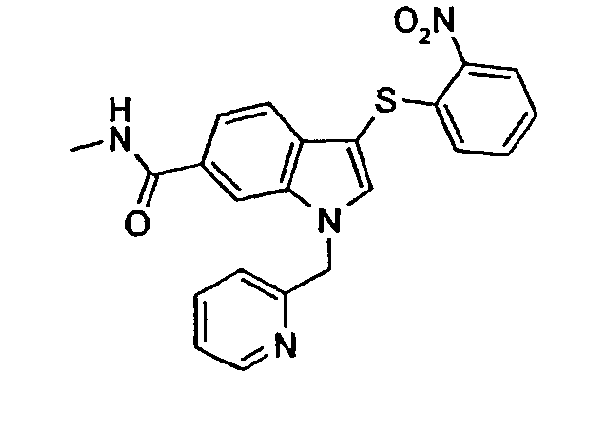
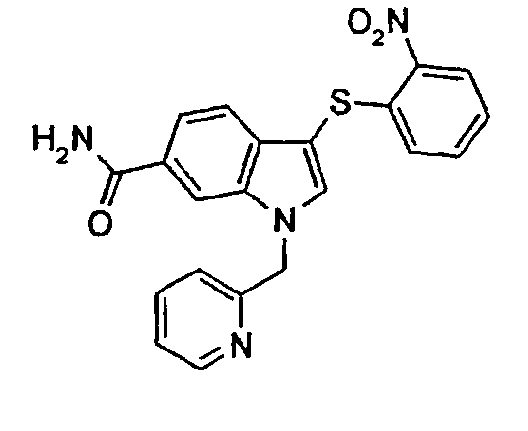
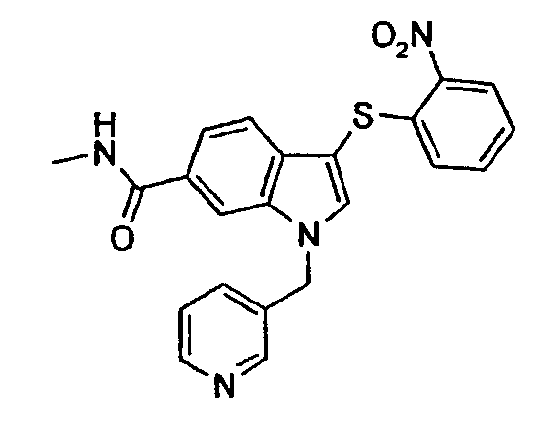
Следующие соединения получали, применяя общий способ 7:

Пример 23
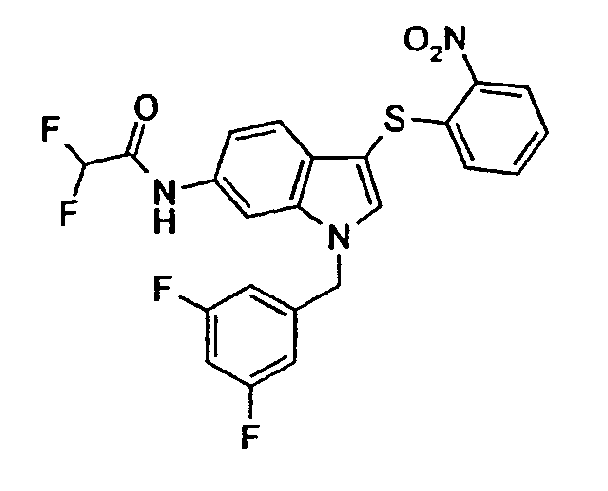
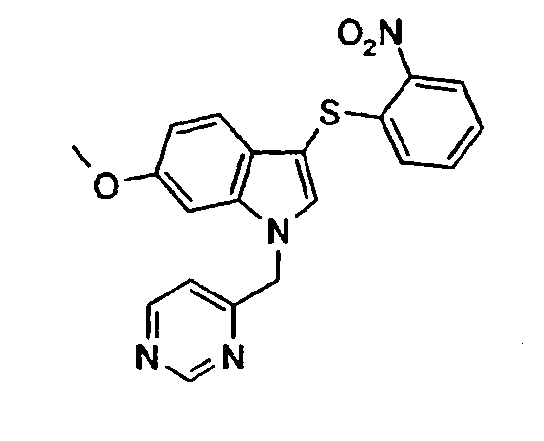
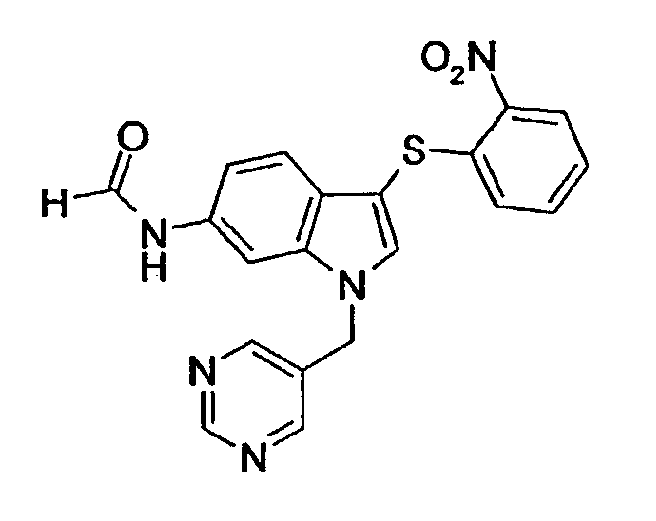
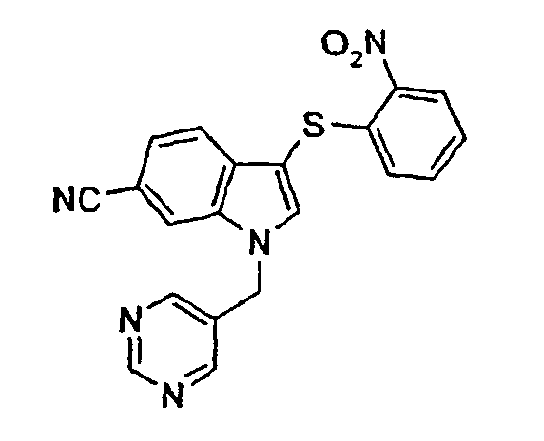
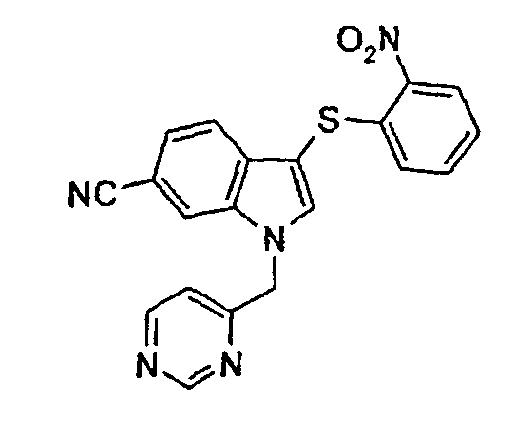
Соединение 118: N-[3-(2-Нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-ил]формамид, структура 28 со схемы VII, где R1=3,5-пиримидил, R2=2-нитрофенил, R3=R4=Н, Z=Н
а) 6-Нитро-1-пиримидин-5-илметил-1Н-индол
5-(Гидроксиметил)пиримидин (16,2 г, 147 ммоль) растворяли в 500 мл СН2Cl2 и охлаждали до -40°С. Добавляли MsCl (16,0 г, 140 ммоль) при -40°С. Смесь перемешивали в течение 1 часа, давая температуре достичь -20°С. Раствор использовали как таковой. 6-Нитроиндол-1Н-индол (35,6 г, 220 ммоль) растворяли в 750 мл ДМФА, порциями добавляли NaH (50%, 12 г, 250 ммоль) и смесь перемешивали в течение 1 часа. Смесь охлаждали до -40°С и по каплям добавляли раствор мезилата. Смеси давали достичь комнатной температуры в течение ночи. Смесь гасили водой и экстрагировали этилацетатом (2×). Объединенные органические слои промывали водой (2×) и насыщенным раствором соли и сушили над Na2SO4. После концентрирования в вакууме вещество очищали колоночной хроматографией (диоксид кремния, гептан/этилацетат (1:1)→(1:4)), получая указанное в заголовке соединение в виде желтого твердого вещества (14 г, 55 ммоль, 39%).
b) 1-Пиримидин-5-илметил-1Н-индол-6-иламин
6-нитро-1-пиримидин-5-илметил-1Н-индол (4,1 г, 16,1 ммоль) растворяли в 100 мл ТГФ и 100 мл изопропанола. Добавляли Pd/С (2 г) и смесь перемешивали в атмосфере Н2 (баллон) в течение 2 часов. Смесь фильтровали через целит и промывали этилацетатом с получением указанного в заголовке соединения после концентрирования (3,5 г, 15,6 ммоль, 97%).
с) трет-Бутиловый эфир (1-пиримидин-5-илметил-1Н-индол-6-ил)карбаминовой кислоты
1-Пиримидин-5-илметил-1Н-индол-6-иламин (5,5 г, 24,6 ммоль) растворяли в 100 мл NMP и добавляли триэтиламин (3,5 г, 35 ммоль) и ди-трет-бутилдикарбонат (7,0 г, 32 ммоль). Смесь перемешивали в течение ночи, гасили насыщенным NaHCO3 и экстрагировали толуолом (3×). Объединенные органические слои промывали водой (4×) и насыщенным раствором соли и сушили над Na2SO4. Концентрирование этих слоев давало указанное в заголовке соединение (3,1 г, 39%).
d) трет-бутиловый эфир [3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-ил]карбаминовой кислоты
трет-Бутиловый эфир (1-пиримидин-5-илметил-1Н-индол-6-ил)-карбаминовой кислоты (3,1 г, 9,6 ммоль) растворяли в 150 мл СН2Cl2 и добавляли 2-нитробензолсульфенилхлорид (1,86 г, 9,8 ммоль). Смесь перемешивали в течение 18 часов, гасили насыщенным NaHCO3 и экстрагировали этилацетатом (2×). Объединенные органические слои промывали насыщенным раствором соли и сушили над Na2SO4. Продукт очищали колоночной хроматографией (диоксид кремния, гептан/этилацетат (1:1)), которая давала названное в заголовке соединение в виде желтого твердого вещества (3,8 г, 83%).
е) N-[3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-ил]формамид
трет-Бутиловый эфир [3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-ил]карбаминовой кислоты (3,8 г, 8,0 ммоль) растворяли в 150 мл муравьиной кислоты и перемешивали в течение 4 часов. Раствор концентрировали в вакууме. Добавляли насыщенный NaHCO3 и смесь экстрагировали СН2Cl2 (2×). Объединенные органические слои промывали насыщенным раствором соли и сушили над Na2SO4. Раствору давали стоять в течение ночи. Образовавшееся твердое вещество отфильтровывали с получением смеси соединения 118 и соединения структуры 23 со схемы VII, где R1=3,5-пиримидил, R2=2-нитрофенил, R3=R4=Н (2,4 г).
Соединение 118: 1Н-ЯМР (CDCl3 + капля MeOD) δ: 5,47 (с, 2H), 6,91 (дд, 1H, J1=8,4 Гц, J2=1,1 Гц), 6,99 (дд, 1H, J1=8,4 Гц, J2=1,9 Гц), 7,19-7,23 (м, 1H), 7,27-7,31 (м, 1H), 7,33 (с, 1H), 7,42 (д, 1H, J=8,4 Гц), 7,49 (с, 1H), 8,22 (д, 1H, J=1,9 Гц), 8,27 (дд, 1H, J1=8,4 Гц, J2=1,1 Гц), 8,66 (с, 2H), 9,16 (с, 1H).
Пример 24
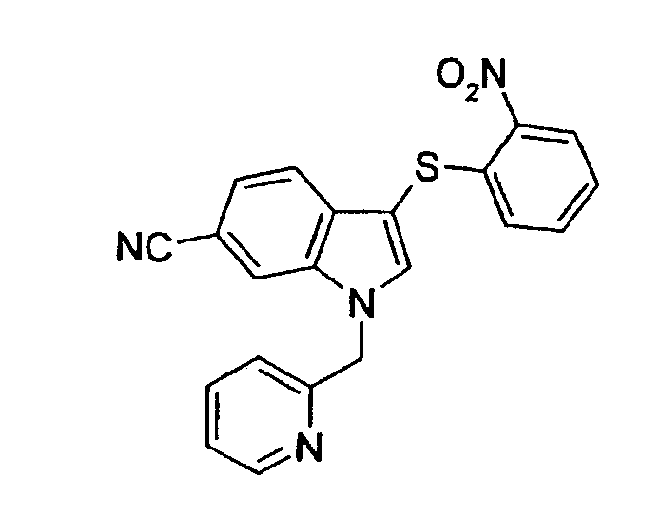
Соединение 119: 3-(2-Нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрил, структура 3 со схемы I, где R1=2-пиридил, R2=2-нитрофенил, R3=R4=Н, R5=CN
а) К раствору 1Н-индол-6-карбонитрила (1,00 г, 7,04 ммоль) в диэтиловом эфире (50 мл) добавляли при комнатной температуре 2-нитробензолсульфенилхлорид (1,34 г, 7,04 ммоль) и реакционную смесь перемешивали в течение 18 часов. Смесь концентрировали и неочищенный продукт очищали, используя колоночную хроматографию (этилацетат/гептан 1:4→4:1), с получением 3-(2-нитрофенилсульфанил)-1Н-индол-6-карбонитрила (1,62 г, 5,49 ммоль, 78%).
b) К раствору 3-(2-нитрофенилсульфанил)-1Н-индол-6-карбонитрила (200 мг, 0,68 ммоль) в ДМФА (5 мл) добавляли при 0°С CsCO3 (442 мг, 1,36 ммоль) и смесь перемешивали в течение 20 мин. Затем добавляли гидрохлорид 2-пиколилхлорида (112 мг, 0,68 ммоль) и смесь перемешивали в течение 18 часов при комнатной температуре. Добавляли насыщенный водный раствор NaHCO3 и смесь экстрагировали этилацетатом (2×). Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали. Неочищенный продукт очищали, используя колоночную хроматографию, с получением соединения 119 (223 мг, 0,58 ммоль, 85%).
1Н-ЯМР (CDCl3) δ: 5,54 (с, 2H), 6,86 (дд, 1H, J1=8,4 Гц, J2=1,1 Гц), 7,04 (д, 1H, J=8,4 Гц), 7,19-7,23 (м, 1H), 7,26-7,31 (м, 2H), 7,40 (дд, 1H, J1=8,4 Гц, J2=1,1 Гц), 7,59 (д, 1H, J=8,4 Гц), 7,70 (тд, 1H, J1=8,4 Гц, J2=1,9 Гц), 7,76 (с, 1H), 7,78 (с, 1H), 8,29 (дд, 1H, J1=8,4 Гц, J2=1,1 Гц), 8,63 (д, 1H, J=3,0 Гц).
По общему способу 3 получали следующие соединения:
Пример 25
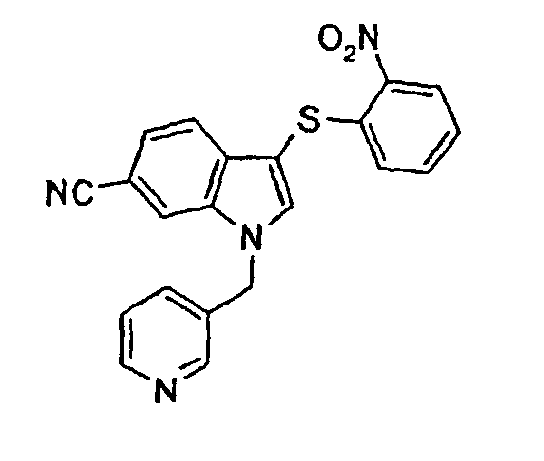
Соединение 120: моногидрохлорид 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрила
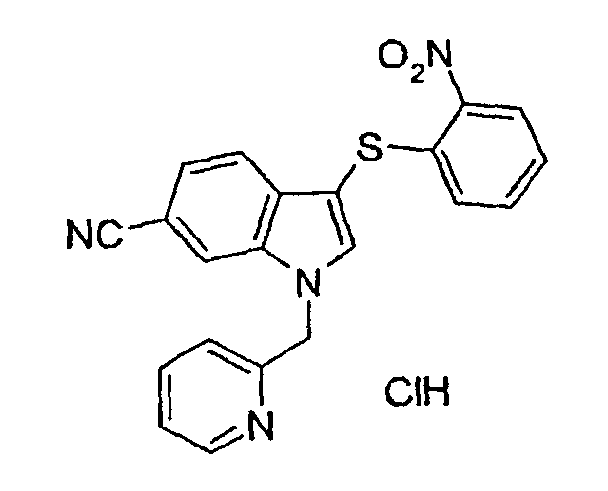
Концентрированную хлористоводородную кислоту (0,0225 мл) добавляли к раствору соединения 119 (0,093 г) в диоксане. Смесь перемешивали в течение 20 мин и затем концентрировали при пониженном давлении с получением соединения 120 (0,096 г).
1Н-ЯМР (MeOD) δ: 6,01 (с, 2H), 6,98 (дд, 1H, J1=7,6 Гц, J2=1,1 Гц), 7,28-7,32 (м, 1H), 7,36-7,41 (м, 1H), 7,48 (дд, 1H, J1=7,6 Гц, J2=1,1 Гц), 7,53 (д, 1H, J=8,4 Гц), 7,60 (д, 1H, J=8,4 Гц), 7,93 (т, 1H, J=6,1 Гц), 8,08 (с, 1H), 8,10 (с, 1H), 8,27 (дд, 1H, J1=8,4 Гц, J2=1,1 Гц), 8,44 (тд, 1H, J1=8,4 Гц, J2=1,1 Гц), 8,85 (дд, 1H, J1=6,1 Гц, J2=1,9 Гц).
Соединения испытывали на активность в отношении андрогеновых рецепторов при исследовании трансактивации и при исследовании связывания.
(Анти-)андрогенную активность испытываемых соединений (ЕС50 и истинную активность) определяли в биологическом испытании in vitro на клетках яичников китайских хомячков (СНО), стабильно трансфицированных плазмидой экспрессии человеческих андрогеновых рецепторов и репортерной плазмидой, в которой MMTV-промотор связан с репортерным геном люциферазы. Линия клеток СНО-AR-pMMTV-LUC 1G12-А5-CA описана у Schoonen et al. (2000), Journal of Steroid Biochemistry and Molecular Biology 74(4):213-222. Антиандрогенную активность испытываемого соединения определяли ингибированием трансактивации через андрогеновые рецепторы фермента люциферазы в присутствии 1 нМ DHT (5α-дигидротестостерона, 17β-гидрокси-5α-андростан-3-она). Истинную активность от антиандрогенной активности определяли в присутствии эталонного антиандрогена 2-гидрокси-2-метил-N-(4-нитро-3-трифторметилфенил)пропионамида (гидроксифлутамида) и принимали за 100%. В отношении антиандрогенной активности максимальная истинная активность в присутствии 100 нМ DHT принималась за 100%. Результаты представлены в таблице 4.
Активность в отношении андрогеновых рецепторов
соед.
ЕС50
эффективность
ЕС50
эффективность
Примечание 2: уровень эффективности (максимальная истинная активность, т.е. истинную активность, наблюдаемую в присутствии 100 нМ DHT, принимали за 1,00): ++ ≥0,80; + от 0,50 до 0,80; ± от 0,20 до 0,50; - <0,20
Андрогенную активность (ЕС50, активность и эффективность) соединений в таблице 5 определяли в биоисследовании in vitro на клетках яичников китайских хомячков (СНО), стабильно трансфицированных плазмидой экспрессии человеческих андрогеновых рецепторов и репортерной плазмидой, в которой MMTV-промотор связан с репортерным геном люциферазы. Линия клеток СНО-AR-pMMTV-LUC 1G12-А5-CA описана у Schoonen et al. (2000), (J. Steroid Biochem. Molec. Biol. 74: 213-222). Активность в отношении андрогеновых рецепторов определяли в присутствии 0,1 мкмоль/л онапристона. Максимальная эффективность в присутствии 100 нмоль/л DHT принимали за 100%. Активность выражена в процентах от активности DHT.
Активность в отношении андрогеновых рецепторов
соед.
активность
эффективность
Примечание 2: уровень эффективности (максимальная истинная активность, т.е. истинную активность, наблюдаемую в присутствии 100 нМ DHT, принимали за 1,00): ++ ≥0,80; + от 0,50 до 0,80; ± от 0,20 до 0,50; - <0,20
Определение конкурентного связывания с цитоплазматическими человеческими андрогеновыми рецепторами из рекомбинантных клеток СНО используют для оценки относительной аффинности связывания (RBA) испытываемого соединения для андрогеновых рецепторов, присутствующих в цитозоле, полученном из рекомбинантной клеточной линии СНО, СНО-AR-pMMTV-LUC 1G12-А5-CA.
Соединение 63 и соединение 92 испытывали при этом исследовании на связывание, и оба соединения, как было обнаружено, обладают относительной аффинностью связывания >1% по отношению к DHT.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ТИРОЗИНФОСФАТАЗЫ БЕЛКА ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2435763C2 |
| ПРОИЗВОДНЫЕ ТАКСАНА, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПО 14-ПОЛОЖЕНИЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2320652C2 |
| ПРОИЗВОДНЫЕ 5-АМИНО-4, 6-ДИЗАМЕЩЕННОГО ИНДОЛА И 5-АМИНО-4, 6-ДИЗАМЕЩЕННОГО ИНДОЛИНА КАК МОДУЛЯТОРЫ КАЛИЕВЫХ КАНАЛОВ | 2008 |
|
RU2483060C2 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ПРЕДУПРЕЖДЕНИЯ МЕТАСТАЗОВ РАКОВЫХ КЛЕТОК | 2010 |
|
RU2519123C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2012 |
|
RU2608610C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2016 |
|
RU2765714C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2006 |
|
RU2463303C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ 8-ГЕТЕРОАРИЛКСАНТИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2004 |
|
RU2357969C2 |
| ЗАМЕЩЕННЫЕ 1-(ПИРИДИНИЛ-3)-2-ФЕНОКСИЭТАНОЛЫ-1, ИХ СПОСОБ ПОЛУЧЕНИЯ И ФУНГИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2003 |
|
RU2248351C1 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛО [4,5-d]ПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ ПУРИНЕРГИЧЕСКОГО РЕЦЕПТОРА | 2002 |
|
RU2317084C2 |
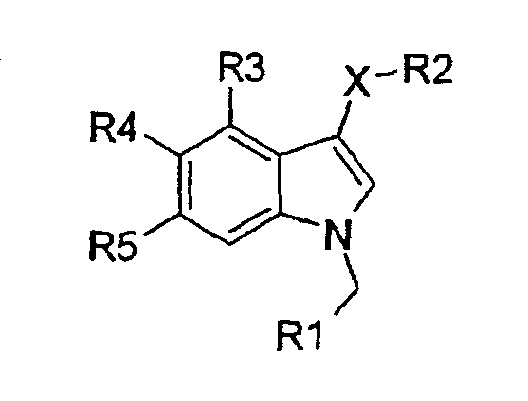
Изобретение относится к новым производным индола формулы
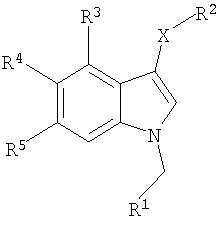
Х означает S, SO, SO2;
R1 означает 6-членную моногомоциклическую насыщенную или ненасыщенную кольцевую структуру или 5-, 6-членную моногетероциклическую насыщенную или ненасыщенную кольцевую структуру с одним или двумя гетероатомами, выбранными из N, О, S, причем каждая из указанных структур необязательно замещена одним или более заместителями, выбранными из группы, состоящей из галогена, CN, (1С-4С)фторалкила, NO2, (1С-4С)алкила, (1С-4С)алкокси или (1С-4С)фторалкокси;
R2 означает 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамид, метиловый эфир 2-бензойной кислоты или 2-метоксифенил;
R3 означает Н, галоген или (1С-4С)алкил;
R4 означает Н, ОН, (1С-4С) алкокси или галоген;
R5 означает Н, ОН, (1С-4С) алкокси, NH2, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, CO2H, СО2(1С-6С)алкил, или R5 означает NHR6, где R6 означает (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(O)2(1С-4С)алкил или S(O)2гетероарил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, где гетероарил представляет 5-членную моногетероциклическую ненасыщенную кольцевую структуру с одним атомом S или двумя атомами N, или
R5 означает C(O)N(R8,R9), где R8 и R9, каждый независимо, означают H, (3С-6С)циклоалкил или CH2R10, где R10 означает Н, (1С-5С)алкил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил или фенил, или где R8 и R9 вместе с N образуют 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно содержащее N или О в качестве второго гетероатома, необязательно замещенное (1С-4С)алкилом;
или его солевая или гидратная форма.
Соединения обладают андрогеновой активностью, что позволяет использовать их для получения лекарственного средства и в способе ингибирования активности в отношении 5α-дигидротестостерона. 3 н. и 14 з.п. ф-лы, 5 табл.
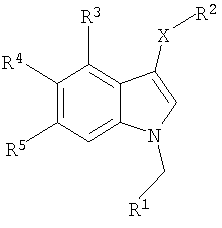
X представляет S, SO или SO2;
R1 представляет 6-членную моно-гомоциклическую насыщенную или ненасыщенную кольцевую структуру или 5-, 6-членную моногетероциклическую насыщенную или ненасыщенную кольцевую структуру с одним или двумя гетероатомами, выбранными из N, О или S, причем каждая из указанных структур необязательно замещена одним или более заместителями, выбранными из группы, состоящей из галогена, CN, (1C-4С)фторалкила, нитро, (1С-4С)алкила, (1С-4С)алкокси или (1С-4С)фторалкокси;
R2 представляет 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамид, метиловый эфир 2-бензойной кислоты или 2-метоксифенил;
R3 представляет Н, галоген или (1С-4С)алкил;
R4 представляет Н, ОН, (1С-4С)алкокси или галоген;
R5 представляет Н, ОН, (1С-4С)алкокси, NH2, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, СО2Н, CO2(1С-6С) алкил, или R5 представляет NHR6, где R6 представляет (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(O)2(1С-4С)алкил или S(O)2гетероарил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, где гетероарил представляет 5-членную моногетероциклическую ненасыщенную кольцевую структуру с одним атомом S или двумя атомами N, или
R5 представляет C(O)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-6С)циклоалкил или CH2R10, где R10 представляет Н, (1С-5С)алкил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил или фенил, или где R8 и R9 вместе с N образуют 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно содержащее N или О в качестве второго гетероатома, необязательно замещенное (1С-4С)алкилом;
или его солевая или гидратная форма.
R1 представляет 6-членную моно-гомоциклическую насыщенную или ненасыщенную кольцевую структуру или 5-, 6-членную моногетероциклическую насыщенную или ненасыщенную кольцевую структуру с одним или двумя гетероатомами, выбранными из N, О или S, причем каждая из указанных структур необязательно замещена одним или более заместителями, выбранными из группы, состоящей из галогена, CN, CF3, нитро, метокси, трифторметокси или метила;
R2 представляет 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамид, метиловый эфир 2-бензойной кислоты или 2-метоксифенил;
R3 представляет Н, галоген или (1С-2С)алкил;
R4 представляет Н или F.
R5 представляет Н, ОН, (1С-4С)алкокси, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, CO2(1С-6С)алкил, или
R5 представляет NHR6, где R6 представляет (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(O)2(1С-4С)алкил или S(O)2гетероарил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, где гетероарил представляет 5-членную моногетероциклическую ненасыщенную кольцевую структуру с одним атомом S или двумя атомами N, или
R5 представляет собой C(O)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-6С)циклоалкил или CH2R10, где R10 представляет Н, (1С-5С)алкил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил или фенил, или где R8 и R9 вместе с N образуют 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно содержащее N или О в качестве второго гетероатома, необязательно замещенное (1С-4С)алкилом.
R3 представляет Н или галоген;
R4 представляет Н;
R5 представляет Н, ОН, (1С-4С)алкокси, CN, F, Cl, CF3, NO2, гидрокси(1С-4С)алкил, CO2(1С-6С)алкил, или
R5 представляет NHR6, где R6 представляет (1С-3С)ацил, необязательно замещенный одним или более галогенами, или
R5 представляет C(O)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-5С)циклоалкил или CH2R10, где R10 представляет Н, (1С-5С)алкил, гидрокси(1С-3С)алкил, сложный (1С-2С)алкиловый эфир карбокси(1С-2С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил или (моно- или ди(1С-4С)алкил)аминокарбонил.
Х представляет S или SO2;
R2 представляет 2-нитрофенил, 2-гидроксиметилфенил, 2-бензамид, 2-метоксифенил, 2-цианофенил или пиридин-2-ил;
R3 представляет Н или F;
R5 представляет Н, ОН, (1С-2С)алкокси, CN, F, Cl, CF3, NO2, гидрокси(1С-4С)алкил, CO2(1С-6С)алкил, или
R5 представляет NHR6, где R6 представляет ацетил, фторацетил, дифторацетил или трифторацетил, или
R5 представляет C(O)N(R8,R9), где R8 представляет Н, и R9 представляет Н, циклопропил, или R9 представляет CH2R10, где R10 представляет Н, (1С-2С)алкил, гидрокси(1С-2С)алкил, метокси(1С-2С)алкил.
Х представляет S;
R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил, пиримидин-4-ил, пиразин-2-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил;
R2 представляет 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил;
R3 представляет Н;
R5 представляет ОН, (1С-2С)алкокси, CN, CF3, NO2, гидрокси(1С-4С)алкил, СО2(1С-4С) алкил, или NHR6, где R6 представляет ацетил, фторацетил, дифторацетил или трифторацетил.
R1 представляет собой 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил, пиримидин-4-ил или пиразин-2-ил;
R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил;
R5 представляет ОН, (1С-2С)алкокси, CN, гидрокси(1С-4С)алкил или NHR6, где R6 представляет ацетил, фторацетил, дифторацетил или трифторацетил.
R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил или пиримидин-4-ил;
R2 представляет собой 2-нитрофенил;
R5 представляет ОН, (1С-2С)алкокси, CN или NHR6, где R6 представляет ацетил, фторацетил, дифторацетил или трифторацетил.
6-метокси-3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индола,
3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрила,
гидрохлорида 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрила,
3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-карбонитрила,
3-(2-нитрофенилсульфанил)-1-пиримидин-4-илметил-1Н-индол-6-карбонитрила,
N-[1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]-2-фторацетамида и
N-[3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-ил]формамида.
Х является S;
R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил;
R2 представляет собой 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил;
R3 представляет Н;
R5 представляет C(O)N(R8,R9), где R8 представляет Н, и R9 представляет Н или CH2R10, где R10 представляет Н, (1С-2С) алкил, гидрокси(1С-2С)алкил или метокси(1С-2С)алкил.
R1 представляет 3,5-дифторфенил, пиридин-2-ил или пиридин-3-ил;
R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил;
R5 представляет C(O)N(R8,R9), где R8 представляет Н, и R9 представляет CH2R10, где R10 представляет Н или (1С-2С)алкил.
R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил;
R2 представляет собой 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил;
R3 представляет Н;
R5 представляет C(O)N(R8,R9), где R8 и R9, каждый независимо, представляют Н или CH2R10, где R10 представляет Н, (1С-5С) алкил, гидрокси(1С-3С)алкил, (1С-3С)алкокси(1С-3С)алкил или (моно- или ди(1С-4С)алкил)аминометил.
R1 представляет 3,5-дифторфенил, пиридин-2-ил или пиридин-3-ил;
R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил;
R5 представляет C(O)N(R8,R9), где R8 и R9, каждый независимо, представляют Н или CH2R10, где R10 представляет Н, (1С-5С)алкил, гидрокси(1С-3С)алкил или (1С-3С)алкокси(1С-3С)алкил.
| US 5767139, 16.06.1998 | |||
| Способ получения производных индола или их солей | 1975 |
|
SU667132A3 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2008-07-10—Публикация
2003-11-03—Подача