Данное изобретение имеет отношение к применению для профилактики и терапии определенных новых соединений 3-гидрокси-7-гидроксистероидов и их некоторых кетонных производных, а точнее к применению указанных соединений для предупреждения или лечения нарушений, вызванных ишемическим стрессом периферических органов, таких как сердце или почки, а также для лечения повреждения спинного мозга.
С использованием специальной модели нейропротекции, было продемонстрировано, что соединения указанного типа обладают нейропротекторной активностью. В настоящее время заявителями установлено, что тот же самый способ действия, который приводит к упомянутому нейропротекторному эффекту, также реализуется в тканях периферических органов, таких как сердце и почки, и, таким образом, соединения также характеризуются кардиопротекторным действием и способностью предупреждать ишемическое поражение почек.
Таким образом, данное изобретение предусматривает применение 3-гидрокси-7-гидроксистероида или 3-оксо-7-гидроксистероида или их фармацевтически приемлемого сложного эфира для производства лекарственного средства для защиты против ишемического нарушения в тканях периферических органов (то есть в любой функциональной ткани в организме, за исключением мозга и спинного мозга), особенно поражения сердца и почек, и для лечения поражения спинного мозга, индуцированного повреждением в спинном мозге.
Особым классом соединений, которые предпочтительны для применения в данном изобретении, являются 7β-гидроксистероиды, а из числа указанных - соединения, которые представляют исключительный интерес для данного изобретения, представляют собой 3β,7β-дигидроксистероиды и их фармацевтически приемлемые сложные эфиры.
Предпочтительные сложные эфиры представляют собой сложные эфиры карбоновых кислот и аминокислот.
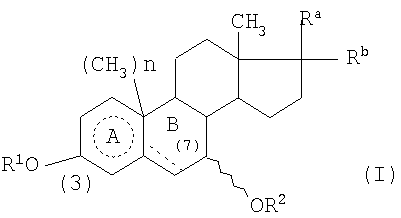
Примерами необязательно замещенных 3β,7β-дигидроксистероидов и их фармацевтически приемлемых сложных эфиров и других производных, которые могут быть использованы в данном изобретении, являются соединения формулы (I)
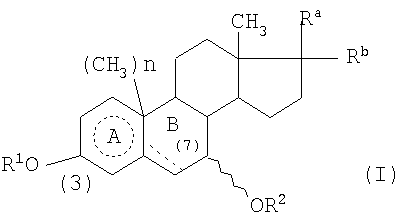
в которой R1 и R2 являются одинаковыми или отличаются друг от друга и каждый означает атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, алкенильную группу, содержащую от 2 до 6 атомов углерода, алкинильную группу, содержащую от 2 до 6 атомов углерода, арильную группу, содержащую от 6 до 10 атомов углерода, формильную группу, алкилкарбонильную группу, содержащую от 2 до 7 атомов углерода, алкенилкарбонильную группу, содержащую от 3 до 7 атомов углерода, алкинилкарбонильную группу, содержащую от 3 до 7 атомов углерода, арилкарбонильную группу, содержащую от 7 до 11 атомов углерода, аралкилкарбонильную группу, содержащую от 8 до 15 атомов углерода, аралкенилкарбонильную группу, содержащую от 9 до 15 атомов углерода, остаток аминокислоты или гетероциклическую карбонильную группу, которая описана ниже;
один из Ra и Rb представляет собой группу формулы -Rc, предпочтительно в β-конфигурации, а другой означает атом водорода, или Ra и Rb вместе означают оксогруппу;
Rc означает алканоильную группу, содержащую от 1 до 6 атомов углерода, арилкарбонильную группу, в которой арильная часть представляет собой ароматическую карбоциклическую группу, содержащую от 6 до 10 атомов углерода в кольце, гетероциклическую карбонильную группу, которая описана ниже, или группу формулы -OR4, в которой R4 означает любую одну из групп и атомов, определенных выше для R1 и R2;
кольцо А 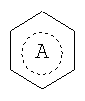 представляет собой кольцо бензола или циклогексана;
представляет собой кольцо бензола или циклогексана;
если кольцо А представляет собой кольцо циклогексана, пунктирная линия в кольце В означает одинарную или двойную связь углерод-углерод, а n равно 1, или если кольцо А представляет собой кольцо бензола, пунктирная линия в кольце В означает одинарную связь углерод-углерод, а n равно 0;
указанная гетероциклическая карбонильная группа представляет собой группу формулы R3-CO, в которой R3 означает гетероциклическую группу, содержащую от 3 до 7 атомов в кольце, из которых от 1 до 3 являются гетероатомами, выбранными из атомов азота, атомов кислорода и атомов серы, а оставшийся атом или атомы, из которых имеется, по меньшей мере, один, является или являются атомами углерода;
указанные алкильные, алкенильные и алкинильные группы и алкильный, алкенильный и алкинильный фрагменты указанных алкилкарбонильной, алкенилкарбонильной и алкинилкарбонильной групп являются незамещенными или содержат, по меньшей мере, один из следующих заместителей ψ:
заместители ψ: гидроксигруппы, меркаптогруппы, атомы галогенов, аминогруппы, алкиламиногруппы, содержащие от 1 до 6 атомов углерода, диалкиламиногруппы, в которых каждая группа алкила содержит от 1 до 6 атомов углерода, карбамоильные группы, нитрогруппы, алкоксигруппы, содержащие от 1 до 6 атомов углерода, алкилтиогруппы, содержащие от 1 до 6 атомов углерода, карбоксигруппы, алкоксикарбонильные группы и незамещенные арильные группы, содержащие от 6 до 10 атомов углерода;
указанные арильные группы, указанные гетероциклические группы и арильные фрагменты указанных арилкарбонильных групп и указанные аралкилкарбонильные группы являются незамещенными или содержат, по меньшей мере, один из следующих заместителей ξ:
заместители ξ: любой из заместителей ψ и алкильные группы, содержащие от 1 до 6 атомов углерода, гидроксиалкильные группы, содержащие от 1 до 6 атомов углерода, и галогеналкильные группы, содержащие от 1 до 6 атомов углерода,
и их фармацевтически приемлемые соли и сложные эфиры.
Активность соединений данного изобретения иллюстрируют с помощью сопровождающих чертежей, в которых
на фиг.1А показаны данные, имеющие отношение к примеру 22, представленные как среднее количество ± SEM (средняя квадратичная ошибка) интактных нейронов на 400 мкм длины области CA1;
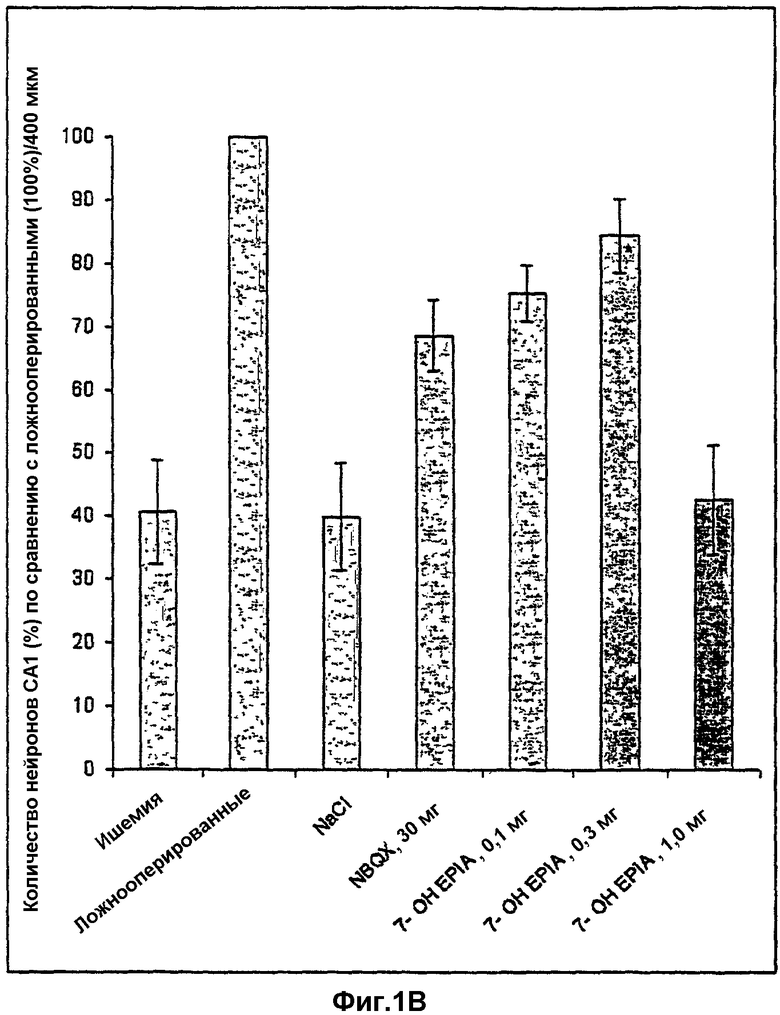
на фиг.1В представлены данные примера 22, выраженные как процент интактных нейронов на 400 мкм длины области CAl по сравнению с ложнооперированными животными, рассматриваемыми как 100%;
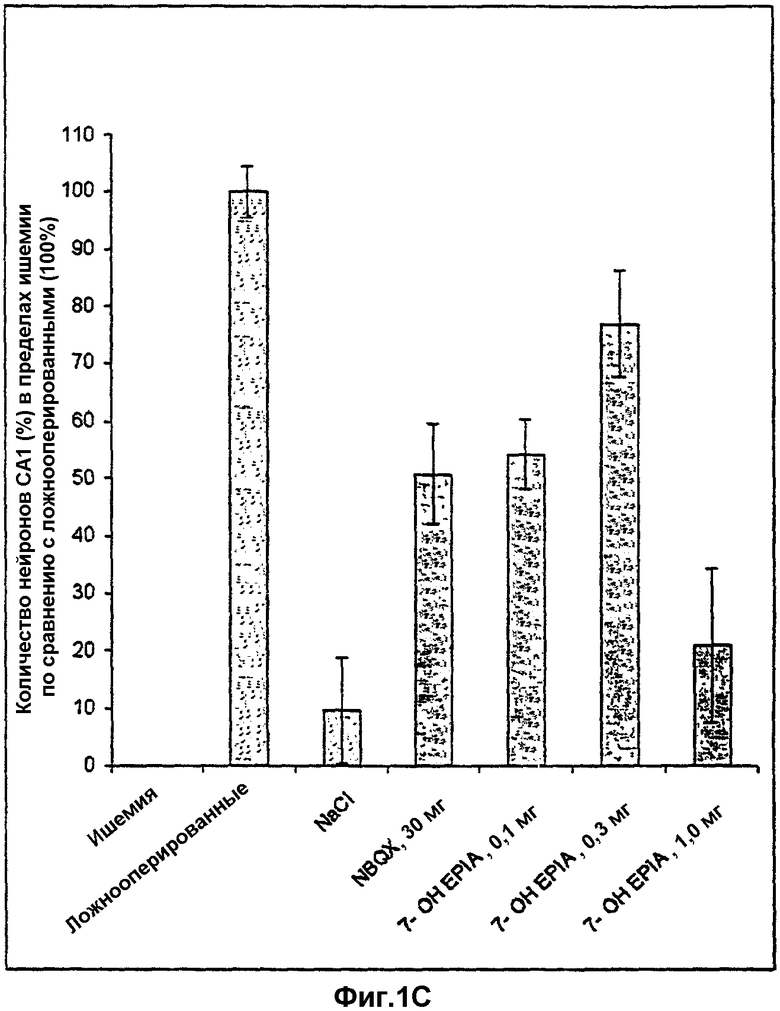
на фиг.1С показаны данные примера 22, представленные как абсолютный процент нейропротекции, если количество выживших нейронов в ишемической группе принимали за нуль, а количество выживших нейронов в ложнооперированной группе - за 100%;
на фиг.2 показан размер инфаркта согласно примеру 23 в контрольных, обработанных наполнителем сердцах и обработанных 7β-ОН-EPIA сердцах до, во время и после региональной ишемии; 7β-ОН-EPIA добавляли в перфузат на 25 минуте, региональную ишемию проводили на 55 минуте, ишемическую область повторно перфузировали на 85 минуте;
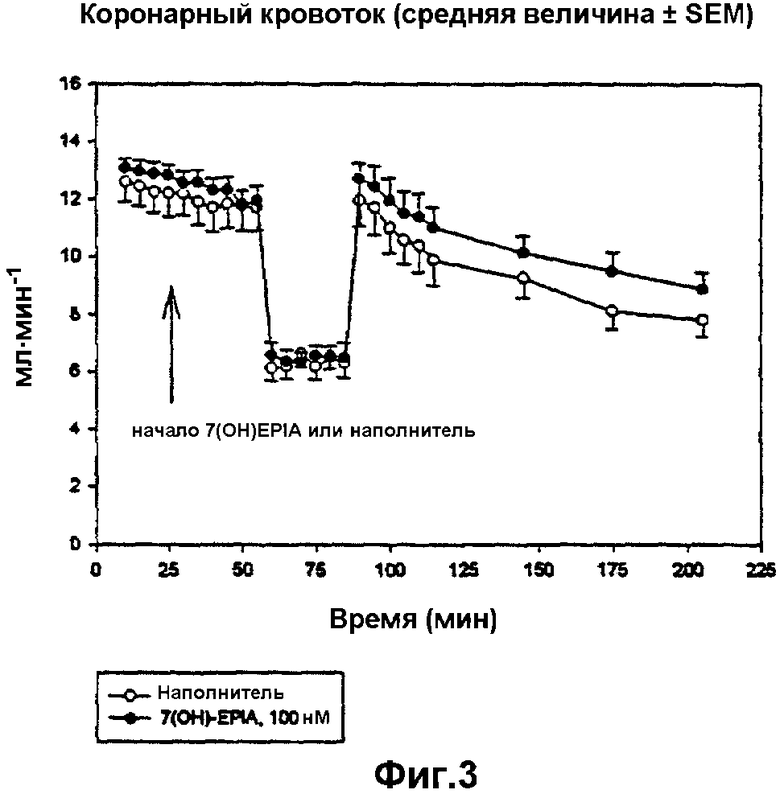
на фиг.3 представлен коронарный кровоток согласно примеру 23 в контрольных, обработанных наполнителем сердцах и сердцах, обработанных 7β-ОН-EPIA, перед, во время и после региональной ишемии; 7β-ОН-EPIA добавляли в перфузат на 25 минуте, региональную ишемию проводили на 55 минуте, ишемическую область повторно перфузировали на 85 минуте;
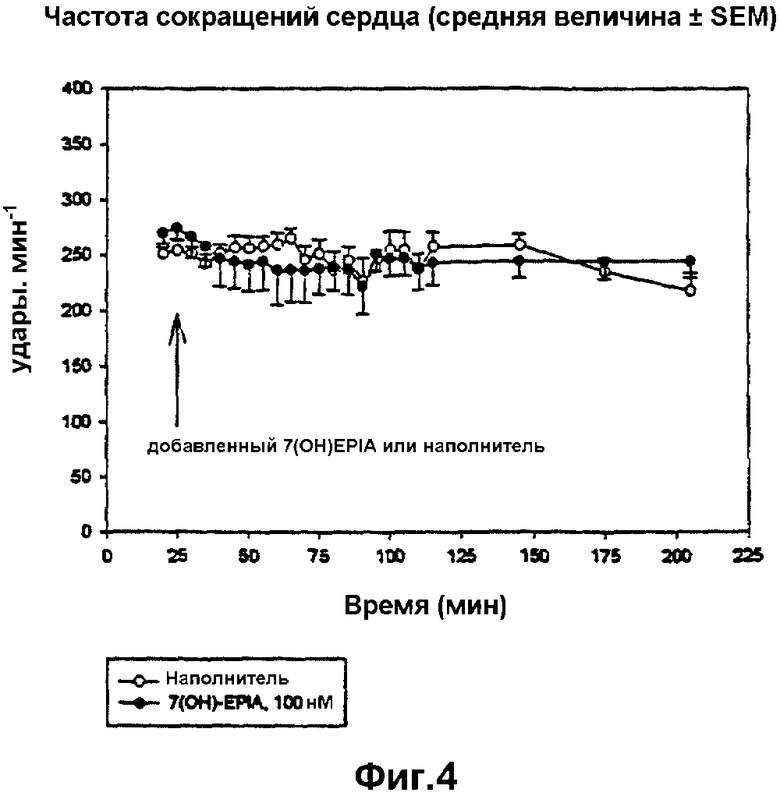
на фиг.4 представлена частота сердечных сокращений согласно примеру 23 контрольных, обработанных наполнителем сердец и сердец, обработанных 7β-ОН-EPIA, перед, во время и после региональной ишемии; 7β-ОН-EPIA добавляли в перфузат на 25 минуте, региональную ишемию проводили на 55 минуте, ишемическую область повторно перфузировали на 85 минуте;
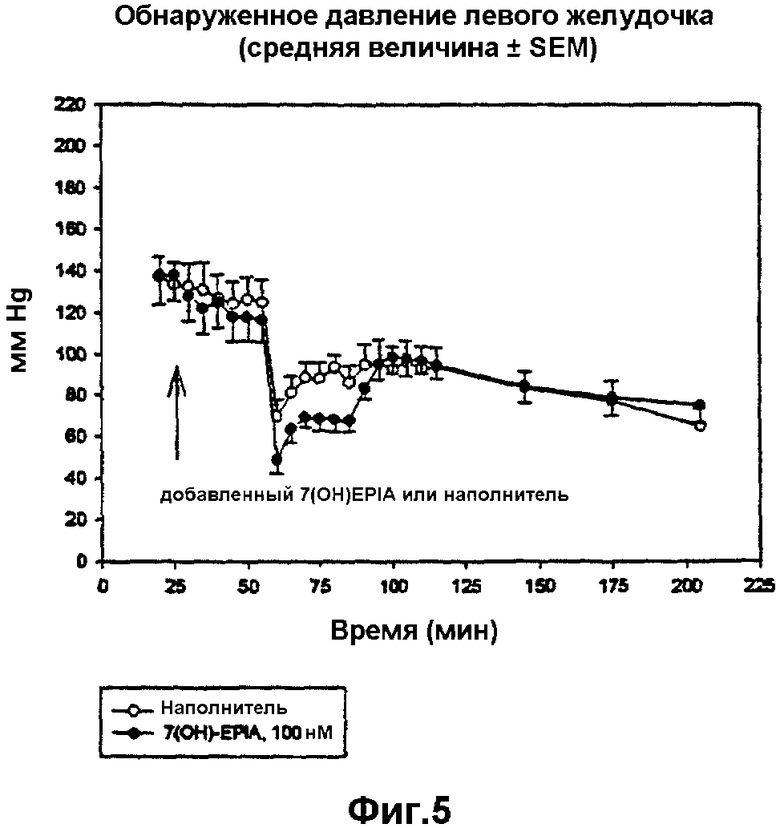
на фиг.5 продемонстировано наблюдаемое давление левого желудочка согласно примеру 23 в контрольных, обработанных наполнителем сердцах и сердцах, обработанных 7β-ОН-EPIA, перед, во время и после региональной ишемии; 7β-ОН-EPIA добавляли в перфузат на 25 минуте, региональную ишемию проводили на 55 минуте, ишемическую область повторно перфузировали на 85 минуте;
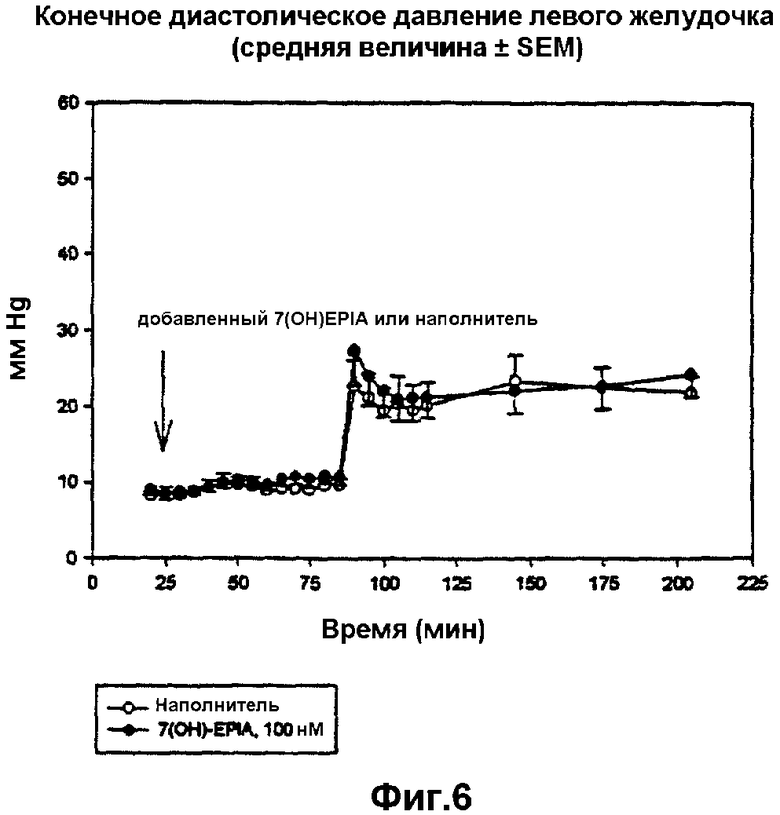
на фиг.6 представлено конечное диастолическое давление согласно примеру 23 в контрольных, обработанных наполнителем сердцах и сердцах, обработанных 7β-ОН-EPIA, перед, во время и после региональной ишемии; 7β-ОН-EPIA добавляли в перфузат на 25 минуте, региональную ишемию проводили на 55 минуте, ишемическую область повторно перфузировали на 85 минуте.
В описанных выше соединениях формулы (I) группа -OR2 в положении 7 может быть в α- или β-конфигурации, однако предпочтительной является β-конфигурация.
Более предпочтительно в соединениях формулы (I)
R1 и R2 являются одинаковыми или отличаются друг от друга и каждый означает атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, необязательно замещенную фенильную группу, формильную группу, алкилкарбонильную группу, содержащую от 2 до 5 атомов углерода, арилкарбонильную группу, содержащую от 7 до 11 атомов углерода, аралкилкарбонильную группу, содержащую от 8 до 15 атомов углерода, остаток аминокислоты или гетероциклическую карбонильную группу, которая описана ниже; особенно предпочтительно, что R1 и R2 оба должны представлять собой атомы водорода;
один из Ra и Rb представляет собой алканоильную группу, содержащую от 1 до 6 атомов углерода, или группу формулы -OR4, в которой R4 означает любую одну из групп и атомов, описанных выше для R1 и R2, предпочтительно в β-конфигурации, а другой представляет собой атом водорода, или Ra и Rb вместе означают оксогруппу; особенно предпочтительно, что Ra и Rb должны вместе означать оксогруппу, или что один из Ra и Rb должен означать атом водорода, а другой должен представлять собой гидроксигруппу или алканоильную группу, содержащую от 1 до 4 атомов углерода, особенно гидроксигруппу или ацетильную группу;
указанная гетероциклическая карбонильная группа представляет собой группу формулы R3-CO, в которой R3 соответствует гетероциклической группе, содержащей от 3 до 7 атомов в кольце, из которых 1-3 являются гетероатомами, выбранными из атомов азота, атомов кислорода и атомов серы, а оставшийся атом или атомы, из которых имеется, по меньшей мере, один, является или являются атомами углерода.
Наиболее предпочтительными соединениями формулы (I) являются такие соединения, в которых
R1 и R2 оба представляют собой атомы водорода и
Ra и Rb вместе означают оксогруппу, или один из Ra и Rb представляет собой атом водорода, а другой означает гидроксигруппу или алканоильную группу, содержащую от 1 до 4 атомов углерода, особенно предпочтительна гидроксигруппа или ацетильная группа,
и их фармацевтически приемлемые сложные эфиры.
Примерами 3-оксо-7β-гидроксистероидов, которые можно использовать в данном изобретении, являются соединения формулы (II)
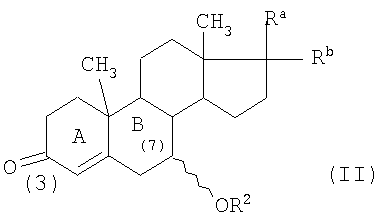
в которой Ra, Rb и R2 являются такими, как описано выше, и предпочтительно Ra и Rb вместе представляют собой оксогруппу или один из Ra и Rb означает атом водорода, а другой представляет собой гидроксигруппу, предпочтительно в β-конфигурации, или ацетильную группу,
и их фармацевтически приемлемые сложные эфиры.
В вышеприведенных соединениях формулы (II) группа -OR2 в положении 7 может быть в α- или β-конфигурации, однако предпочтительной является β-конфигурация.
Более предпочтительно в соединениях формулы (II)
R2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, необязательно замещенную фенильную группу, формильную группу, алкилкарбонильную группу, содержащую от 2 до 5 атомов углерода, арилкарбонильную группу, содержащую от 7 до 11 атомов углерода, аралкилкарбонильную группу, содержащую от 8 до 15 атомов углерода, или гетероциклическую карбонильную группу, которая описана ниже; особенно предпочтительным является то, что R2 должен представлять собой атом водорода;
один из Ra и Rb представляет собой алканоильную группу, содержащую от 1 до 6 атомов углерода, или группу формулы -OR4, в которой R4 означает любую одну из групп и атомов, описанных выше для R2, предпочтительно в β-конфигурации, а другой представляет собой атом водорода, или Ra и Rb, вместе означают оксогруппу; особенно предпочтительно, что Ra и Rb вместе должны представлять собой оксогруппу или что один из Ra и Rb должен означать атом водорода, а другой должен представлять собой гидроксигруппу или алканоильную группу, содержащую от 1 до 4 атомов углерода, в особенности гидроксигруппу или ацетильную группу;
указанная гетероциклическая карбонильная группа представляет собой группу формулы R3-CO, в которой R3 соответствует гетероциклической группе, содержащей от 3 до 7 атомов в кольце, из которых от 1 до 3 являются гетероатомами, выбранными из атомов азота, атомов кислорода и атомов серы, а оставшийся атом или атомы, из которых имеется, по меньшей мере, один, означает или означают атомы углерода;
и их фармацевтически приемлемые сложные эфиры.
Наиболее предпочтительными соединениями формулы (II) являются те соединения, в которых
R2 означает атом водорода и
Ra и Rb вместе представляют собой оксогруппу или один из Ra и Rb является атомом водорода, а другой представляет собой гидроксигруппу или алканоильную группу, содержащую от 1 до 4 атомов углерода, в особенности гидроксигруппу или ацетильную группу,
и их фармацевтически приемлемые сложные эфиры.
В соединениях данного изобретения, в которых R1, R2, R4 или заместитель ξ представляет собой алкильную группу, это может быть алкильная группа с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, и примеры включают в себя группы метила, этила, пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, 1-метилбутила, 2-метилбутила, 3-метилбутила, 1-этилпропила, 2-этилпропила, 1,1-диметилпропила, гексила, 1-метилпентила, 2-метилпентила, 3-метилпентила, 4-метилпентила, 1-этилбутила, 2-этилбутила, 3-этилбутила, трет-гексила и 1,1-диметилпентила, из которых предпочтительными являются группы, содержащие от 1 до 4 атомов углерода, группы метила и этила являются наиболее предпочтительными.
В которых R1, R2 или R4 представляет собой алкенильную группу, которая может быть алкенильной группой с прямой или разветвленной цепью, содержащей от 2 до 6 атомов углерода, а примеры включают в себя группы винила, 1-пропенила, аллила, изопропенила, металлила, 1-, 2-, 3-бутенила, изобутенила, 1-, 2-, 3-, 4-пентенила и группы 1-, 2-, 3-, 4-, 5-гексенила, из которых предпочтительными являются группы алкенила, содержащие от 2 до 4 атомов углерода, наиболее предпочтительны группы винила и аллила.
В которых R1, R2 или R4 представляет собой алкинильную группу, которая может быть алкинильной группой с прямой или разветвленной цепью, содержащей от 2 до 6 атомов углерода, а примеры включают в себя группы этинила, 1-, 2-пропинила, 1-, 2-, 3-бутинила, изобутинила, 1-, 2-, 3-, 4-пентинила и 1-, 2-, 3-, 4-, 5-гексинила, из которых предпочтительными являются группы алкинила, содержащие от 2 до 4 атомов углерода.
В которых R1, R2, R4 или заместитель ψ представляет собой арильную группу, указанная группа представляет собой ароматическую карбоциклическую группу, содержащую от 6 до 10 атомов углерода. Примеры таких групп включают в себя группы фенила, 1-нафтила, 2-нафтила и инденила, из которых предпочтительной является группа фенила. Кроме заместителя ψ, упомянутые группы могут быть замещенными или незамещенными. В случае замещенной группы количество заместителей ограничено только количеством замещаемых положений, и возможно, в некоторых примерах, пространственными ограничениями. Таким образом, в случае фенильных групп максимальное количество заместителей составляет 5, в случае нафтильных групп максимальное количество заместителей составляет 7 и так далее. Однако предпочтительное количество заместителей составляет от 1 до 3, а заместители являются такими, как описано в дальнейшем.
В которых R1, R2 или R4 представляет собой алкилкарбонильную группу, указанная группа представляет собой алканоильную группу, которая может быть группой с прямой или разветвленной цепью, содержащей от 2 до 7 атомов углерода (то есть от 1 до 6 атомов углерода в алкильном фрагменте), а примеры включают в себя группы ацетила, пропионила, бутирила, изобутирила, валерила, изовалерила, пивалоила, гексаноила и гептаноила, из которых предпочтительными являются группы, содержащие от 2 до 5 атомов углерода, наиболее предпочтительными являются группы ацетила и пропионила. Алкильная часть указанной группы может быть замещенной или незамещенной, и, если замещена, заместителей выбирают из заместителей ψ. Примеры таких заместительных групп включают в себя группы аланила, β-аланила, фенилаланила, аспарагинила, цистеинила, гликолоила, глицила, метионила, орнитила, глицероила, тропоила, глутаминила, глутамила, гомоцистеинила, серила, гомосерила, треонила, лактоила, лейцила, изолейцила, норлейцила, лизила, валила, норвалила и саркозила.
В которых R1, R2 или R4 представляет собой алкенилкарбонильную группу, указанная группа может быть алкенилкарбонильной группой с прямой или разветвленной цепью, содержащей от 3 до 7 атомов углерода, а примеры включают в себя группы акрилоила, метакрилоила, кротоноила, изокротоноила, 3-бутеноила, пентоноила и гексеноила, из которых предпочтительными являются алкенилкарбонильные группы, содержащие от 3 до 5 атомов углерода, наиболее предпочтительными являются группы акрилоила и метакрилоила.
В которых R1, R2 или R4 представляет собой алкинилкарбонильную группу, указанная группа может быть алкинилкарбонильной группой с прямой или разветвленной цепью, содержащей от 3 до 7 атомов углерода, а примеры включают в себя группы пропиолоила, 3-бутинилкарбонила, пентинилкарбонила и гексинилкарбонила, из которых предпочтительными являются те алкинилкарбонильные группы, которые содержат от 3 до 5 атомов углерода.
В которых Rc, R1, R2 или R4 представляет собой арилкарбонильную группу, арильная часть указанной группы может быть любой из арильных групп, описанных и приведенных в качестве примера выше. Предпочтительные арилкарбонильные группы включают в себя группы бензоила, o-, м- или п-толуоила, o-, м- или п-анизоила, o-, м- или п-гидроксибензоила, пикрила, галлоила, протокатехоила, ваниллоила, вератроила, антранилоила, 1-нафтоила и 2-нафтоила.
В которых R1, R2 или R4 представляет собой аралкилкарбонильную или аралкенилкарбонильную группу, группа арила и, в зависимости от обстоятельств, алкила или алкенила может быть любой из указанных групп, описанных и приведенных в качестве примера выше. Специальные примеры таких групп включают в себя группы фенилацетила, 3-фенилпропионила, бензилоила, тирозила, атропоила, гидратропоила и циннамоила.
В которых Rc, R1, R2 или R4 представляет собой гетероциклическую карбонильную группу, которая является группой формулы R3-CO-, в которой R3 представляет собой гетероциклическую группу, содержащую от 3 до 7 атомов в кольце, из которых от 1 до 3 являются атомами азота, кислорода или серы, остальные являются атомами углерода. По меньшей мере, один из атомов в кольце должен быть атомом углерода. В соединениях, в которых имеется 3 гетероатома, предпочтительно, что, по меньшей мере, один является атомом азота. Примеры таких групп включают в себя группы 2- и 3-фуроила, 2- и 3-теноила, 2-пиридинкарбонила, никотиноила, изоникотиноила, пролила, пиперидинкарбонила, пиперазинкарбонила и морфолинкарбонила.
В которых R1 и/или R2 представляют собой остаток аминокислоты, указанный остаток может быть любой аминокислотой, в которой гидроксигруппа удалена или карбокси (-СООН) группой. Примеры таких аминокислотных остатков включают в себя группы аланила, β-аланила, цистатионила, цистила, глицила, гистидила, гомосерила, изолейцила, лантионила, лейцила, лизила, метионила, норлейцила, норвалила, орнитила, пролила, саркозила, серила, треонила, тиронила, тирозила, валила, цистеинила, гомоцистеинила, триптофила, α-аспартила, β-аспартила, аспартоила, аспарагинила, α-глутамила, γ-глутамила и глутаминила.
В которых Rc представляет собой группу алканоила, указанная группа может быть группой с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, а примеры таких групп включают в себя группы формила, ацетила, пропионила, бутирила, изобутирила, валерила, изовалерила, пивалоила, гексаноила и гептаноила, из числа которых предпочтительными являются группы, содержащие от 2 до 5 атомов углерода, более предпочтительными являются группы ацетила и пропионила, а наиболее предпочтительной является ацетильная группа.
В которых заместитель ψ или заместитель ξ представляет собой алкиламиногруппу, содержащую от 1 до 6 атомов углерода, алкильная часть может быть любой из групп алкила, описанных и приведенных в качестве примеров выше. Предпочтительные примеры таких алкиламиногрупп включают в себя группы метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор-бутиламино, трет-бутиламино, пентиламино, изопентиламино, неопентиламино, трет-пентиламино, гексиламино и изогексиламино, из числа которых предпочтительны группы, содержащие от 1 до 4 атомов углерода, наиболее предпочтительными являются группы метиламино и этиламино.
В которых заместитель ψ или заместитель ξ представляет собой диалкиламиногруппу, каждая алкильная часть содержит от 1 до 6 атомов углерода, а две алкильные группы могут быть одинаковыми или отличаться друг от друга. Алкильные группы могут быть любыми из групп алкила, описанных и приведенных в качестве примеров выше. Предпочтительные примеры таких диалкиламиногрупп включают в себя группы диметиламино, метилэтиламино, диэтиламино, метилпропиламино, дипропиламино, диизопропиламино, этилбутиламино, дибутиламино, ди-трет-бутиламино, метилпентиламино, дипентиламино, диизопентиламино и дигексиламино, из числа которых предпочтительными являются группы, содержащие от 1 до 4 атомов углерода в каждой алкильной группе, наиболее предпочтительными являются группы диметиламино и диэтиламино.
В которых заместитель ψ или заместитель ζ представляет собой алкоксигруппу, указанная группа может быть алкоксигруппой с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, а примеры таких групп включают в себя группы метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, трет-пентилокси, гексилокси и изогексилокси, из числа которых предпочтительны группы, содержащие от 1 до 4 атомов углерода, наиболее предпочтительными являются группы метокси и этокси.
В которых заместитель ψ или заместитель ζ представляет собой алкилтиогруппу, содержащую от 1 до 6 атомов углерода, алкильная часть может быть любой из групп алкила, описанных и приведенных в качестве примеров выше. Предпочтительные примеры таких алкилтиогрупп включают в себя группы метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, изопентилтио, неопентилтио, трет-пентилтио, гексилтио и изогексилтио, из числа которых те группы, которые содержат от 1 до 4 атомов углерода, являются предпочтительными, наиболее предпочтительны группы метилтио и этилтио.
В которых заместитель ψ или заместитель ζ представляет собой алкоксикарбонильную группу, указанная группа может быть алкоксикарбонильной группой с прямой или разветвленной цепью, содержащей от 2 до 7 атомов углерода, а примеры таких групп включают в себя метоксикарбонильную, этоксикарбонильную, пропоксикарбонильную, изопропоксикарбонильную, бутоксикарбонильную, изобутоксикарбонильную, втор-бутоксикарбонильную, трет-бутоксикарбонильную, пентилоксикарбонильную, изопентилоксикарбонильную, неопентилоксикарбонильную, трет-пентилоксикарбонильную, гексилоксикарбонильную и изогексилоксикарбонильную группы, из числа которых предпочтительными являются группы, содержащие от 1 до 4 атомов углерода, наиболее предпочтительными являются метоксикарбонильные и этоксикарбонильные группы.
В которых заместитель ζ представляет собой группу гидроксиалкила, содержащую от 1 до 6 атомов углерода, алкильная часть может быть любой из групп алкила, описанных и приведенных в качестве примеров выше. Предпочтительные примеры таких групп гидроксиалкила включают в себя группы гидроксиметила, 1- и 2-гидроксиэтила, 1-, 2- и 3-гидроксипропила, 1,2-дигидроксиэтила, 1,2,3-тригидроксипропила, 4-гидроксибутила, 5-гидроксипентила и 6-гидроксигексила.
В которых заместитель ζ представляет собой группу галогеналкила, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, алкильный фрагмент может быть таким, как описанные и приведенные в качестве примера выше, а атомом галогена предпочтительно является хлором, фтором, бромом или йодом. Примеры таких групп включают в себя группы фторметила, хлорметила, бромметила, йодметила, дихлорметила, дифторметила, трихлорметила, трифторметила, 2,2,2-трихлорэтила, 2-хлорэтила, 2-фторэтила, 2-бромэтила, 2-йодэтила, 2,2-дибромэтила, 2,2,2-трибромэтила, 3-фторпропила, 3-хлорпропила, 4-бромбутила, 4-фторбутила, 5-фторпентила и 6-фторгексила.
Следует оценить, что когда соединение содержит группу формулы -OR, в которой R представляет собой любую из групп и атомов, описанных выше относительно R1 и так далее, возможно, активным типом является соединение, содержащее свободную гидроксигруппу. Соответственно, любую группу, которая может in vivo превращаться в гидроксигруппу, можно использовать вместо гидроксигруппы.
Специальные примеры соединений, которые можно применять в данном изобретении, включают в себя следующие:
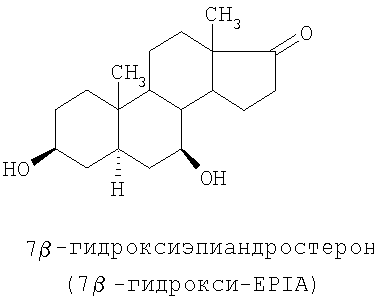
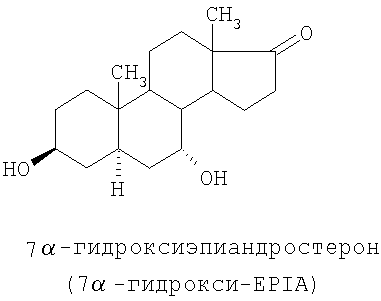
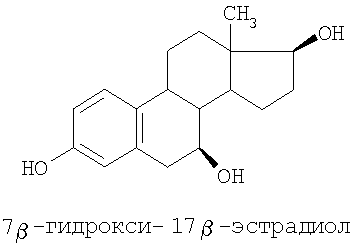
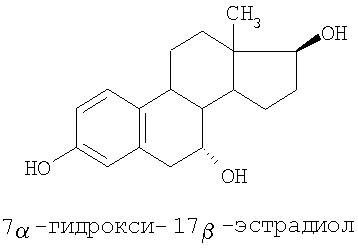
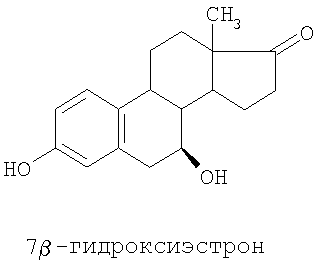
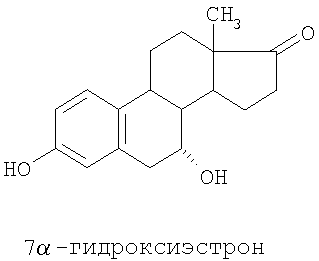
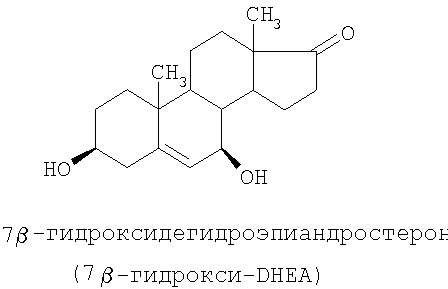
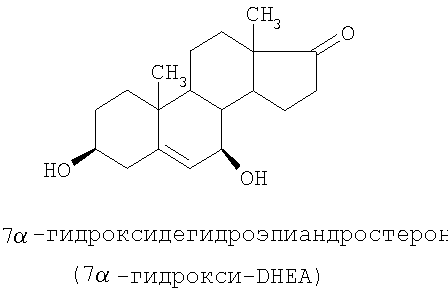
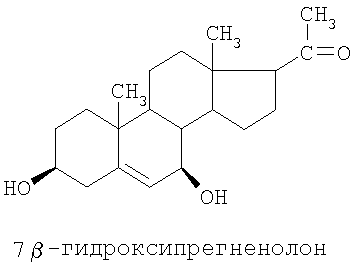
Из числа приведенных выше соединений предпочтительными являются 7β-изомеры.
Когда соединения данного изобретения содержат гидроксигруппу, их можно превращать в соответствующие соли или сложные эфиры, что хорошо известно в данной области, и не существует никакого особого ограничения относительно природы образованной соли или сложного эфира. Если указанные соли или сложные эфиры предназначены для введения пациенту, они должны быть фармацевтически приемлемыми. Однако, если соединения предназначены для некоторых других целей, например для использования в виде интермедиата в другом синтезе, даже в таком случае упомянутое ограничение не является необходимым. Соли и сложные эфиры могут быть выбраны из солей и эфиров, хорошо известных в данной области для описанного типа соединения. Предпочтительными сложными эфирами являются сложные эфиры карбоновых кислот и сложные эфира аминокислот, таких как, например, аланин, β-аланин, цистатионин, цистин, глицин, гистидин, гомосерин, изолейцин, лантионин, лейцин, лизин, метионин, норлейцин, норвалин, орнитин, пролин, саркозин, серин, треонин, тиронин, тирозин, валин, цистеин, гомоцистеин, триптофан, аспарагиновая кислота, аспарагин, глутаминовая кислота и глутамин.
Соединения данного изобретения можно получать, начиная с исходных стероидов, с помощью целого ряда способов, хорошо известных специалистам. Например, их можно получать по способам, описанным в литературе, упомянутой выше, которые дают смесь 7β- и соответствующих 7α-соединений, которые, если желательно, затем можно разделить с помощью известных технологий. Однако при некоторых обстоятельствах может быть необходимо или удобно использовать смесь 7α- и 7β-изомеров без разделения их.
Например, 7α-гидрокси-EPIA и 7β-гидрокси-EPIA можно получать из DHEA в результате окисления аллила после защиты 3β-гидроксигруппы и 17-кетонной группы, используя общепринятые способы. Затем продукт восстанавливают катализатором, растворимым соединением металла (таким как гидрид натрия) и снимают защиту с 3β-гидрокси- и 17-кетонных групп. Потом 7α-гидрокси- и 7β-гидроксиэпимеры можно разделить по общепринятым способам, например методом колоночной хроматографии, а 7α-гидрокси-EPIA и 7β-гидрокси-EPIA для очистки можно кристаллизовать.
Альтернативный способ синтеза представлен в следующей схеме реакций:
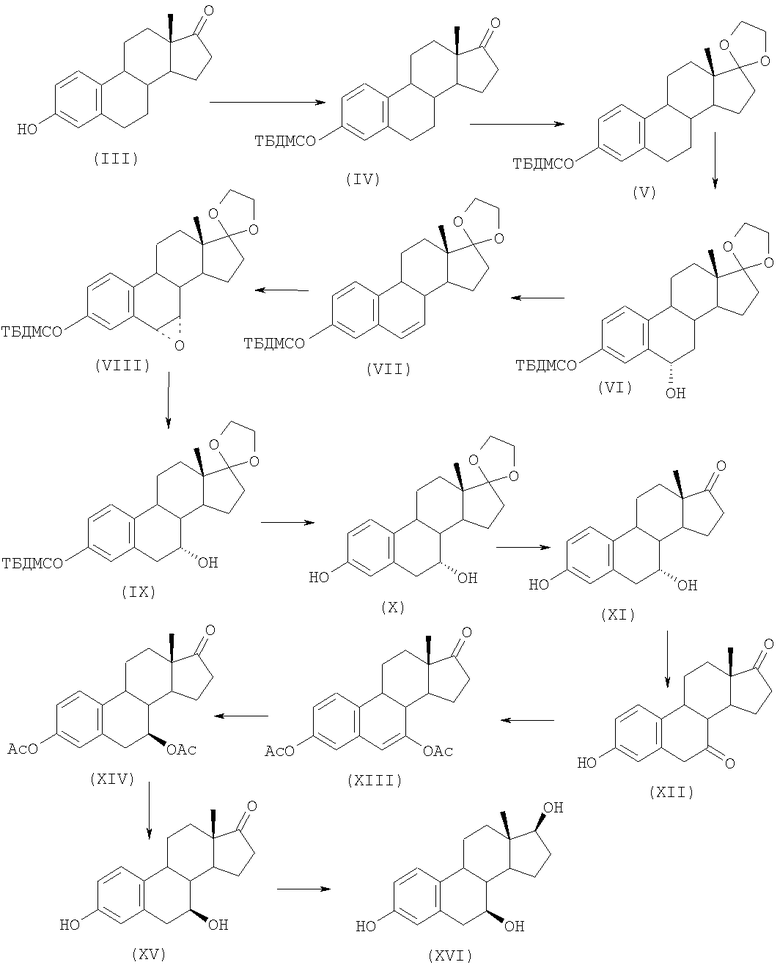
В вышеприведенных формулах ТБДМСО означает трет-бутилдиметилсилилокси, а Ас означает ацетил. При использовании в дальнейшем указанные сокращения имеют такие же значения.
На первой стадии вышеприведенной схемы реакций соединение формулы (III), эстрон, защищают трет-бутилдиметилсилилоксигруппой обычным способом, чтобы получить защищенное соединение формулы (IV). Затем полученное соединение вводят в реакцию с этиленгликолем в присутствии кислотного катализатора (такого как п-толуолсульфоновая кислота), чтобы защитить кетогруппу в положении 17 и получить соединение формулы (V). Затем гидроксигруппу вводят в положение 6, что иллюстрируют в дальнейшем в примере 3, чтобы получить соединение формулы (VI), которое потом дегидратируют для получения соединения формулы (VII). Последнее эпоксидируют с получением соединения формулы (VIII), которое затем восстанавливают до соединения формулы (IX) с 7α-гидроксигруппой. Защитную группу трет-бутилдиметилсилила удаляют, получая соединение формулы (Х), а полученное соединение нагревают с каталитическим количеством кислоты, чтобы получить 7α-гидроксиэстрон (XI), который можно использовать в данном изобретении. Потом полученное соединение можно окислить, например, используя хромовую кислоту/фосфорную кислоту, чтобы получить 7-кетоэстрон (XII), который затем вводят в реакцию с уксусным ангидридом для получения соединения формулы (XIII). Полученное соединение гидрируют, используя, например, водород в присутствии палладиевого катализатора, чтобы получить соединение формулы (XIV), и наконец удаляют ацетильные группы, чтобы получить 7β-гидроксиэстрон (XV), соединение данного изобретения. Если требуется, полученное соединение можно восстановить, чтобы получить 7β-гидроксиэстрадиол (XVI), также соединение данного изобретения. Соответствующее 7α-соединение можно получать аналогичным способом из 7α-гидроксиэстрона (XI).
Другие 7α- и 7β-гидроксисоединения данного изобретения можно получать подобным способом, например 7β-гидрокси-DHEA может быть получен, как показано с помощью следующей схемы реакции:
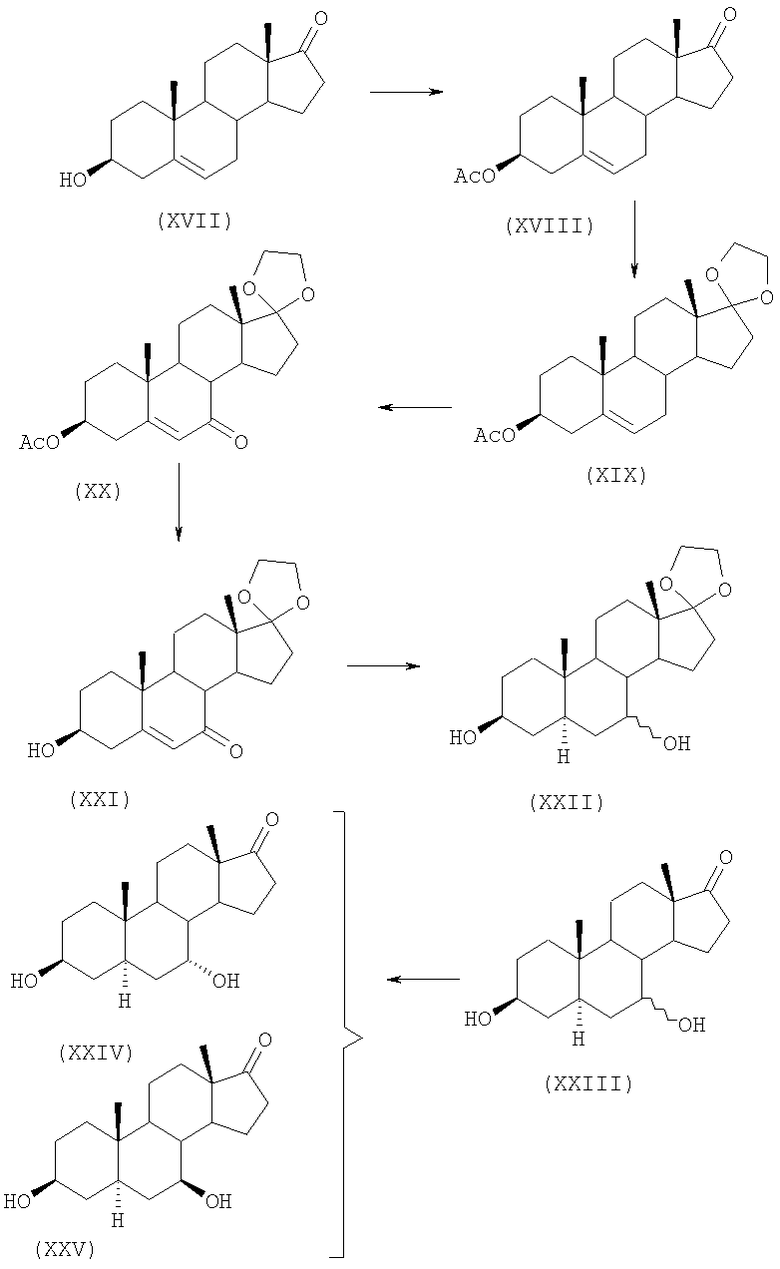
По приведенной схеме реакций DHEA (XVII) ацетилируют, чтобы получить соответствующий ацетат формулы (XVIII), который затем вводят в реакцию с этиленгликолем для получения кеталя формулы (XIX). Затем кеталь (XIX) окисляют, как описано в примере 16, чтобы получить соответствующее 7-кетосоединение (ХХ), которое потом деацетилируют с получением соединения формулы (XXI). Полученное соединение восстанавливают, чтобы получить 7-гидрокси-17-кеталь-EPIA формулы (XXII), который затем обрабатывают кислотой, чтобы удалить группу кеталя и получить 7-гидрокси-EPIA, который, в конце концов, разделяют на 7β- и 7α-изомеры методом хроматографии, чтобы получить 7α-гидрокси-EPIA (XXIV) и 7β-гидрокси-EPIA (XXV).
Каждая из стадий приведенных выше схем реакций в отдельности хорошо известна и может быть осуществлена с использованием известных растворителей и катализаторов (если уместно) и при известных реакционных условиях, например, временные и температурные условия.
Описанные выше соединения характеризуются нейропротективным действием. В соответствии с данным изобретением установлено, что указанные соединения также обладают кардиопротективным действием, и поэтому их можно применять для предупреждения или лечения заболеваний сердца, развивающихся в результате ишемического поражения, например инфаркта миокарда. Соединения также обладают способностью защищать против ишемического поражения почек, например гломерулонефрита или острой почечной недостаточности. Вообще, на основании продемонстрированной активности можно предсказать, что соединения будут оказывать подобное защитное действие на ткани других периферических органов.
Действительно, соединения данного изобретения также можно использовать для лечения повреждения спинного мозга.
Соединения данного изобретения можно применять пациенту, если предполагают, что у пациента существует опасность ишемии, особенно инфаркта миокарда или ишемического поражения почек. Такое профилактическое применение может быть очень эффективным. Однако также продемонстрировано, что соединения данного изобретения оказывают эффективное действие, даже если применять их после ишемического события, но следует принимать во внимание, что предпочтительно вводить соединения, как только становится возможным, чтобы насколько возможно избежать поражения миокарда или ткани почек. При некоторых обстоятельствах может быть необходимым введение повторных доз, особенно когда у пациента сохраняется опасность ишемии.
Соединения также можно вводить профилактически при антиципации повреждения спинного мозга или можно применять для лечения такого повреждения после его появления.
Для того чтобы достигнуть насколько возможно желаемого результата, подходящими способами введения обычно является инъекция. Таким образом, внутривенная инъекция оказывается особенно предпочтительной.
Доза соединения данного изобретения будет изменяться в зависимости от многих факторов, включая возраст, массу тела и общее состояние пациента, а также способа, частоты и пути введения. Однако обычно рекомендуют дозу от 0,01 до 50 мг/кг массы тела, доза от 0,05 до 20 мг/кг является более предпочтительной. Дозу можно вводить в виде однократной дозы или в виде разделенной общей дозы.
В дальнейшем изобретение иллюстрируют следующими, не ограничивающими изобретение примерами, из которых примеры 1-20 иллюстрируют получение соединений данного изобретения, а примеры 21-23 демонстрируют их активность. В примерах 1-20 римские цифры относятся к формулам в представленных выше схемах реакций.
ПРИМЕР 1
3-трет-Бутилдиметилсилилэстрон (IV)
4,25 г трет-бутилдиметилсилилхлорида (28,2 ммоль, 3 экв.) добавляли к раствору 50 мл диметилформамида (ДМФ), содержащему 2,54 г эстрона (III) (9,41 ммоль, 1 экв.) и 3,84 г имидазола (56,5 ммоль, 6 экв.), в трехгорлой колбе на 100 мл. Затем смесь оставляли на ночь при комнатной температуре в атмосфере азота. 10% мас./об. водный раствор карбоната калия добавляли в реакционную смесь, которую затем экстрагировали этилацетатом. Органическую фазу промывали водой, а потом высушивали над безводным сульфатом натрия и выпаривали досуха. Получали 3,76 г 3-трет-бутилдиметилсилилэстрона (IV) (9,41 ммоль, 100%).
ПРИМЕР 2
17-Кеталь-3-трет-бутилдиметилсилилэстрон (V)
Раствор 60 мл толуола, содержащий 3 г 3-трет-бутилдиметилсилилэстрона (IV) (7,50 ммоль), 3 мл этиленгликоля и каталитическое количество п-толуолсульфоновой кислоты, нагревали до кипения с обратным холодильником с перегонкой с водяным паром, используя аппарат Дина-Старка (Dean-Stark), в течение 24 часов. Затем реакционную среду вливали в 50 мл 10% мас./об. водного раствора карбоната калия. Органическую фазу сливали. Водную фазу экстрагировали этилацетатом. Органические фазы объединяли и выпаривали досуха. Получали 3,16 г 17-кеталь-3-трет-бутилдиметилсилилэстрона (V) (7,12 ммоль, 95%).
ПРИМЕР 3
6α-гидрокси-17-кеталь-3-трет-бутилдиметилсилилэстрон (VI)
В 1-литровой трехгорлой колбе проводили дегазацию 100 мл раствора безводного тетрагидрофурана (ТГФ) промывкой азотом и охлаждали до -80°C. В реакционную среду добавляли диизопропиламин (20 мл, 143,30 ммоль). В реакционную среду по каплям добавляли 15% мас./об. раствор бутиллития в циклогексане (89,9 мл, 143,30 ммоль). Через 10 минут в реакционную среду по каплям добавляли раствор 100 мл безводного ТГФ, предварительно дегазированного, содержащего 17,5 г трет-бутирата калия. Еще через 15 минут в реакционную среду по каплям добавляли раствор 50 мл безводного ТГФ, предварительно дегазированного, содержащего 12,27 г 17-кеталь-3-трет-бутилдиметилсилилэстрона (V) (27,63 ммоль). Реакционную смесь оставляли в течение 2 часов при -80°С. В конце указанного периода времени 48 мл триметилбората (429,90 ммоль) по каплям добавляли при -80°С в реакционную среду, которую оставляли при 0°С в течение 1 часа. Затем добавляли 100 мл 30% водного раствора перекиси водорода. Реакционную смесь оставляли в течение 1 часа при комнатной температуре, а затем добавляли 500 мл воды. Реакционную смесь экстрагировали этилацетатом. Органическую фазу промывали 10% мас./об. водным раствором тиосульфата натрия, промывали водой, высушивали над безводным сульфатом натрия и упаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат:циклогексан 1/9, потом 2/8). Получали 6,35 г 6α-гидрокси-17-кеталь-3-трет-бутилдиметилсилилэстрона (VI) (13,81 ммоль, 50%).
ПРИМЕР 4
17-Кеталь-3-трет-бутилдиметилсилил-6-дегидроэстрон (VII)
Раствор 40 мл толуола, содержащий 1,54 г 6α-гидрокси-17-кеталь-3-трет-бутилдиметилсилилэстрона (VI) (3,35 ммоль), 4 мл этиленгликоля и каталитическое количество п-толуолсульфоновой кислоты, нагревали до кипения с обратным холодильником с перегонкой с водяным паром, используя аппарат Дина-Старка (Dean-Stark), в течение 24 часов. Затем реакционную среду вливали в 50 мл 10% мас./об. водного раствора карбоната калия. Органическую фазу сливали. Затем водную фазу экстрагировали этилацетатом. Органические фазы объединяли и выпаривали досуха. Получали 1,48 г 17-кеталь-3-трет-бутилдиметилсилил-6-дегидроэстрона (VII) (3,35 ммоль, 100%).
ПРИМЕР 5
17-Кеталь-3-трет-бутилдиметилсилил-6α,7α-эпоксиэстрон (VIII)
Раствор 20 мл дихлорметана, содержащего 1,16 г м-хлорбензойной кислоты (55%, 3,69 ммоль, 1,1 экв.), при 0°С по каплям добавляли к раствору 20 мл дихлорметана, содержащего 1,85 г 17-кеталь-3-трет-бутилдиметилсилил-6-дегидроэстрона (VII) (3,36 ммоль, 1 экв.). Через 2 часа реакционную смесь вливали в 10% мас./об. водный раствор гидрокарбоната натрия, а затем экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем упаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат:циклогексан 1/9). Получали 769 мг 17-кеталь-3-трет-бутилдиметилсилил-6α,7α-эпоксиэстрона (VIII) (1,68 ммоль, 50%).
ПРИМЕР 6
7α-Гидрокси-17-кеталь-3-трет-бутилдиметилсилилэстрон (IX)
200 мг гидрида лития, алюминия (5,40 ммоль, 2 экв.) добавляли к раствору 50 мл безводного ТГФ, содержащего 1,13 г 17-кеталь-3-трет-бутилдиметилсилил-6α,7α-эпоксиэстрона (VIII) (2,60 ммоль, 1 экв.). Реакционную смесь нагревали до кипения с обратным холодильником в течение 2 часов, а затем охлаждали, вливали в лед, фильтровали через Целит (Celite; торговая марка), вспомогательный порошок для фильтрования, и экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем упаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат:циклогексан 1/9). Получали 837 мг 7α-гидрокси-17-кеталь-3-трет-бутилдиметилсилилэстрона (IX) (1,82 ммоль, 70%).
ПРИМЕР 7
7α-Гидрокси-17-кетальэстрон (Х)
Раствор 20 мл ТГФ, содержащего 1,5 г хлорида тетрабутиламмония (4,78 ммоль, 1,10 экв.), при комнатной температуре добавляли к раствору 50 мл ТГФ, содержащего 2 г 7α-гидрокси-17-кеталь-3-трет-бутилдиметилсилилэстрона (IX) (4,35 ммоль, 1 экв.). Реакционную смесь вливали в 70 мл 10% мас./об. водного раствора карбоната натрия. Реакционную смесь экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали досуха. Получали 1,39 г 7α-гидрокси-17-кетальэстрона (X) (4,22 ммоль, 97%).
ПРИМЕР 8
7α-Гидроксиэстрон (XI)
Раствор 50 мл ацетона, содержащий 1 мл воды, 1,0 г 7α-гидрокси-17-кетальэстрона (X) (3,03 ммоль) и каталитическое количество п-толуолсульфоновой кислоты, нагревали до кипения с обратным холодильником в течение 2 часов. Затем реакционную смесь вливали в 70 мл 10% мас./об. водного раствора карбоната натрия. Реакционную смесь экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали досуха. Получали 814 мг 7α-гидроксиэстрона (XI) (2,85 ммоль, 94%), который перекристаллизовывали из этилацетата.
ПРИМЕР 9
7-Кетоэстрон (XII)
8 н. раствор хромовой кислоты в серной кислоте по каплям добавляли до тех пор, пока сохранялся желтый цвет, к охлажденному до 0°С раствору 40 мл ацетона, содержащего 300 мг 7α-гидроксиэстрона (XI) (1,05 ммоль). Реакционную смесь вливали в 50 мл воды, а затем экстрагировали этилацетатом. Органическую фазу промывали водным раствором карбоната натрия, а затем высушивали над безводным сульфатом натрия и выпаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат:циклогексан 3/7). Получали 200 мг 7-кетоэстрона (XII) (0,70 ммоль, 67%).
ПРИМЕР 10
7-Гидрокси-6-дегидроэстрон-3,7-диацетат (XIII)
Раствор 10 мл уксусного ангидрида, содержащий 5 г безводного ацетата натрия и 1 г 7-кетоэстрона (XII) (3,52 ммоль), нагревали до кипения с обратным холодильником в течение 1 часа. Затем реакционную смесь охлаждали, а потом вливали в воду и экстрагировали диэтиловым эфиром. Органическую фазу промывали водным раствором карбоната натрия, а затем высушивали над безводным сульфатом натрия и выпаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат:циклогексан 1/9). Получали 1,25 г 7-гидрокси-6-дегидроэстрон-3,7-диацетата (XIII) (3,41 ммоль, 97%).
ПРИМЕР 11
7-Гидроксиэстрон-3,7-диацетат (XIV)
Раствор 80 мл ледяной уксусной кислоты, содержащий 1,0 г 7-гидрокси-6-дегидроэстрона-3,7-диацетата (XIII) (2,72 ммоль), гидрогенизировали с 200 мг 10% палладиевого катализатора на угле под давлением водорода 1 бар. Через 2 часа реакционную среду фильтровали и выпаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат:циклогексан 1/9). Получали 855 мг 7-гидроксиэстрон-3,7-диацетата (XIV) (2,31 ммоль, 85%).
ПРИМЕР 12
7β-Гидроксиэстрон (XV)
Раствор 50 мл метанола, содержащий 1% гидроксида калия и 1 г 7-гидроксиэстрон-3,7-диацетата (XIV) (2,70 ммоль), нагревали до кипения с обратным холодильником в течение 2 часов. Затем реакционную смесь охлаждали, нейтрализовали, а потом экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали досуха. Получали 695 мг 7β-гидроксиэстрона (XV) (2,43 ммоль, 90%), который перекристаллизовывали из метанола.
ПРИМЕР 13
7β-Гидроксиэстрадиола (XVI)
264 мг борогидрида натрия (7,00 ммоль, 2 экв.) добавляли к раствору 50 мл метанола, содержащего 1,0 г 7β-гидроксиэстрона (XV) (3,50 ммоль). Реакционную смесь вливали в воду и экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали досуха. Получали 917 мг 7β-гидроксиэстрадиола (XVI) (3,18 ммоль, 91%), который перекристаллизовывали из метанола.
ПРИМЕР 14
DHEA-3-ацетат (XVIII)
Раствор 50 мл пиридина и 50 мл уксусного ангидрида, содержащий 10 г DHEA (XVII) (34,72 ммоль), нагревали до кипения с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали, вливали в воду и экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия и выпаривали досуха. Получали 11,0 г DHEA-3-ацетата (XVIII) (33,33 ммоль, 96%), который перекристаллизовывали из этанола.
ПРИМЕР 15
17-кеталь-DHEA-3-ацетат (XIX)
Раствор 100 мл толуола, содержащий 5 г DHEA-3-ацетата (XVIII) (15,15 ммоль), 5 мл этиленгликоля и каталитическое количество п-толуолсульфоновой кислоты, нагревали до кипения с обратным холодильником с перегонкой с водяным паром, используя аппарат Дина-Старка (Dean-Stark), в течение 24 часов. Реакционную смесь вливали в 100 мл 10% мас./об. водного раствора карбоната калия. Органическую фазу сливали. Водную фазу экстрагировали этилацетатом. Органические фазы объединяли и выпаривали досуха. Получали 5,10 г 17-кеталь-3-DHEA-ацетата (XIX) (13,64 ммоль, 90%), который перекристаллизовывали из этанола.
ПРИМЕР 16
7-Кето-17-кеталь-DHEA-3-ацетат (ХХ)
Раствор 70 мл пиридина, содержащий 5 г 17-кеталь-DHEA-3-ацетата (XIX) (13,37 ммоль) и каталитическое количество бенгальского розового, облучали, используя ртутную газоразрядную лампу среднего давления с распределением кислорода. Через 24 часа в реакционную среду добавляли каталитическое количество ацетата меди. Реакционную смесь через 24 часа выпаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат:циклогексан 3/7). Получали 3,11 г 7-кето-17-кеталь-DHEA-3-ацетата (ХХ) (8,02 ммоль, 60%).
ПРИМЕР 17
7-Кето-17-кеталь-DHEA (XXI)
Раствор 50 мл метанола, содержащий 1% гидроксид калия и 1 г 7-кето-17-кеталь-DHEA-3-ацетата (ХХ) (2,58 ммоль), нагревали до кипения с обратным холодильником в течение 2 часов. Затем реакционную среду охлаждали, нейтрализовали, а потом экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали досуха. Получали 802 мг 7-кето-17-кеталь-DHEA (XXI) (2,32 ммоль, 90%), который перекристаллизовывали из метанола.
ПРИМЕР 18
7-Гидрокси-17-кеталь-EPIA (XXII)
10 г 7-кето-17-кеталь-DHEA (XXI) (28,90 ммоль) добавляли к раствору жидкого аммония при -33°С, содержащего 2,65 г натрия. Через 4 часа хлорид аммония добавляли до тех пор, пока не исчезал голубой цвет. Затем добавляли 2,65 г натрия. Через 4 часа снова добавляли хлорид аммония до тех пор, пока не исчезал голубой цвет. Добавляли воду, а аммоний оставляли выпариваться. Реакционную смесь экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали досуха. Получали 6,07 г 7-гидрокси-17-кеталь-EPIA (XXII) (17,34 ммоль, 60%).
ПРИМЕР 19
7-Гидрокси-EPIA (XXIII)
Раствор 100 мл ацетона, содержащий 5 мл воды, 10 г 7-гидрокси-17-кеталь-EPIA (XXII) (28,57 ммоль, 50%) и каталитическое количество пара-толуолсульфоновой кислоты, нагревали до кипения с обратным холодильником в течение 4 часов. Реакционную среду охлаждали, вливали в 100 мл 10% мас./об. водного раствора карбоната натрия, а затем экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, а потом выпаривали досуха. Остаток очищали методом флеш-хроматографии (SiO2/этилацетат). Получали 5,24 г 7-гидрокси-EPIA (XXIII) (17,14 ммоль, 60%).
ПРИМЕР 20
7α-Гидрокси-EPIA (XXIV) и 7β-гидрокси-EPIA (XXV)
7-Гидрокси-EPIA (XXIII) (5 г), содержащий 7α- и 7β-эпимеры в соотношении 65/35, очищали методом флеш-хроматографии (Al2O3/CHCl3). Сначала получали 7β-гидрокси-EPIA (XXV) (2,5 г) до 7α-гидрокси-EPIA (XXIV) (1,34 г). 7β-Гидрокси-EPIA (XXV) и 7α-гидрокси-EPIA (XXIV) перекристаллизовывали из этилацетата.
ПРИМЕР 21
Протокол для изучения гипоксического нейронального поражения
Органотипические культуры срезов гиппокампа получали, используя основной способ Pringle et al. (1996, 1997), модифицированный следующим образом.
Крысят линии Вистар (в возрасте 8-11 дней) декапитировали и гиппокамп быстро отслаивали в охлажденный льдом сбалансированный солевой раствор Гея, дополненный 4,5 мг/мл глюкозы. Срезы разделяли и помещали в культуральные вставки Millicell CM (4 на лунку) и поддерживали при 37°С / 5% СО2 в течение 14 дней. Поддерживающая среда состояла из 25% термоинактивированной лошадиной сыворотки, 25% сбалансированного солевого раствора Хенкса (HBSS) и 50% минимальной эссенциальной среды Игла с добавленными солями (МЕМ), дополненной 1 мМ глутамина и 4,5 мг/мл глюкозы. Среду заменяли каждые 3-4 дня.
Экспериментальную гипоксию проводили, как было описано ранее (Pringle et al., 1996; 1997). Вкратце, культуры переносили в бессывороточную среду (SFM: 75% MEM, 25% HBSS, дополненную 1 мМ глутамином, и 4,5 мг/мл глюкозы), содержащую 5 мкг/мл йодида пропидия (PI), флуоресцентного красителя. Культуры оставляли для уравновешивания в SFM в течение 60 минут до визуализации. Флуоресценцию PI определяли, используя инвертированный микроскоп Лейка (Leica), снабженный набором родаминовых фильтров. Любые культуры, в которых определяли флуоресценцию PI на упомянутой стадии, исключали из дальнейшего исследования. Гипоксию индуцировали переносом культур в SFM (+PI), которую насыщали 95% N2/5% CO2. Затем культуральные чашки (без крышек) закрывали в герметичную камеру, в которой атмосферу насыщали 95% N2/5% CO2, непрерывно пропуская газ при скорости 10 литров/минуту в течение десяти минут перед тем, как закрывали и помещали в термостат на 170 минут (поэтому общее время гипоксии 180 минут). В конце периода гипоксии культуры возвращали в нормальную SFM, содержащую PI, и снова помещали в термостат на 24 часа.
Нейрональное поражение оценивали, как было описано ранее (Pringle et al., 1996; 1997), используя или изображение NIH, прохождение 1,60, на компьютере Apple Ilsi или OpenLab, прохождение 2,1 (Improvision), на Macintosh G4/400. Изображения получали, используя монохромную камеру, и хранили на оптическом диске для независимого анализа. Световые трансмиссионные изображения получали до добавления лекарственных средств, а изображение флуоресценции PI регистрировали в конце 24-часового постгипоксического периода восстановления. Область клеточного слоя CA1 определяли из трансмиссионного изображения. Область флуоресценции PI в СА1 измеряли, используя функцию плотности массива в изображении NIH или OpenLab, а нейрональное повреждение выражали как процент СА1, в котором определяли флуоресценцию PI выше базовой.
Стероидные соединения получали в результате приготовления исходного раствора 1 мг/мл в этаноле и дальнейшего разведения в SFM. Соединения добавляли в культуры в течение 45 минут до гипоксии, во время периода гипоксии и во время постгипоксического периода восстановления. Контрольные эксперименты включали культуры, обработанные только наполнителем.
РЕЗУЛЬТАТЫ
Эксперимент 1
Первоначальный эксперимент проводили, чтобы определить, являются ли 7α-ОН-EPIA и 7β-ОН-EPIA нейропротекторами при высокой концентрации 100 нМ. Гипоксия вызывала повреждение в 25,5±6,4% СА1. Указанное повреждение значительно уменьшали с помощью как 7α-ОН-EPIA, так и 7β-ОН-EPIA, которые давали перед гипоксией, во время и после гипоксии (см. таблицу I).
Эксперимент 2
Чтобы установить, что как α-, так и β-изомеры 7-ОН-EPIA являются нейропротекторами, оценивали зависимость упомянутого эффекта от концентрации. Контрольная гипоксия приводила к поражению до 31,9±4,7% СА1. 7β-ОН-EPIA оказывал значительное нейропротективное действие при концентрации 10 нМ и 100 нМ, но активность исчезала, если концентрацию снижали до 1 нМ, что показано в таблице II ниже.
Эксперимент 3
При наблюдении за нейропротективной активностью 7β-ОН-EPIA также исследовали, является ли 7β-ОН-DHEA нейропротектором. Культуры инкубировали или с 100 нМ 7β-ОН-DHEA, или наполнителем перед, во время или после гипоксии. Гипоксия вызывала поражение в 29,0±6,2% СА1. В культурах, обработанных 7β-ОН-DHEA, наблюдали обширное, очень значительное снижение нейронального поражения, что показано в таблице III ниже.
ПРИМЕР 22
Глобальная церебральная ишемия у крыс (окклюзия 4 сосудов)
Церебральную ишемию вызывали окклюзией четырех сосудов (4VO) у самцов крыс линии Вистар (250-280 г). Обе позвоночные артерии закупоривали посредством электрокатеризации с пентобарбитальной анестезией (60 мг/кг внутриперитонеально). Животных оставляли для восстановления на 24 часа при свободном доступе к воде, но без еды. На следующий день сонные артерии подвергали действию 2% галотана с анестезией смесью 30% кислород/70% закись азота и перекрывали сосуды на 10 минут, используя микрососудистые зажимы. Впоследствии оба зажима удаляли и обе артерии обследовали для прямой повторной перфузии. Во время операции и следующих 3 часов нормотермию животных (37,5±0,5°С) поддерживали при использовании одеяла, термостатически контролирующего нагревание, соединенного с ректальным термометром. Для контроля у ложнооперированных животных обе позвоночные артерии прижигали с пентобарбитальной анестезией и на следующий день обе общие сонные артерии подвергали действию 2% галотана с анестезией смесью 30% кислород / 70% закись азота, но не пережимали сосуды. Рану обрабатывали лидокаиновым гелем, а затем накладывали швы. Животных содержали под нагревающей лампой при температуре окружающей среды 30°С до возвращения сознания.
Исследовали семь групп животных:
1) (n=8) стероидное соединение, 7β-ОН-EPIA (0,1 мг/кг, внутривенно через хвостовую вену, три инъекции: за 15 минут до индукции ишемии, во время ишемии и через 5 минут после повторной перфузии);
2) (n=8) стероидное соединение, 7β-ОН-EPIA (0,3 мг/кг, внутривенно три инъекции, как описано в пункте 1);
3) (n=8) стероидное соединение, 7β-ОН-EPIA (1 мг/кг, внутривенно три инъекции, как описано в пункте 1);
4) (n=8) NBQX (двунатриевая соль, так как лучше растворима в воде) в качестве стандартного вещества и положительного контроля (TOCRIS, Germany, 30 мг/кг, внутрибрюшинно, три инъекции, как описано в пункте 1);
5) (n=8) получали наполнитель (0,9% NaCl, содержащий 100 мкл этанола) (три инъекции, как описано в пункте 1);
6) (n=8) только ишемия;
7) (n=8) ложнооперированные контроли.
NBQX представляет собой 2,3-дигидрокси-6-нитро-7-сульфамоилбензо(F)хиноксалин и, как известно, обладает нейропротективной активностью [Gill, R., Nordholm, L., Lodge D.: The neuroprotective action of 2,3-dihydroxy-6-nitro-7-sulfamoyl-benzo(F)quinoxaline (NBQX) in a rat focal ischaemia model. Brain Res. 580, 35-43, 1992].
7β-OH-EPIA представляет собой 7β-гидроксиэпиандростерон, соединение данного изобретения.
Вещества растворяли в 100 мкл этанола и в конечном счете разводили 0,9% NaCl.
После периода выживания 7 дней после ишемии всем животным транскардиально производили стационарную перфузию 4% параформальдегидом. Затем осторожно удаляли мозг и вторично фиксировали в определенном фиксаторе в течение 2 часов. После криозащиты в 30% сахарозе мозг быстро замораживали в изопентане и хранили при -80°С. Криостатированные двадцатимикрометровые срезы, содержащие гиппокамповую формацию, окрашивали по Нисслю (Nissl) толуидиновым голубым или флуоресцирующим Neuro Trace.
Данные анализа
Тяжесть нейронального поражения в области СА1 гиппокампа после ишемии оценивали по числу выживших нейронов, используя окрашивание по Нисслю. Среднее количество морфологически интактных нейронов на 400 мкм длины рассчитывали в области СА1 для каждой группы. Подсчет клеток производили в 3-5 последовательных срезах на животное и в 6-кратной 400-мкм области СА1, на срез, используя световой микроскоп, снабженный объективом 20×. Данные статистически анализировали по парному t критерия Стьюдента. Данные представлены как средняя величина ± SEM.
Результаты и обсуждение
Морфологически интактные нейроны СА1 гиппокампа характеризовали при окрашивании по Нисслю (толуидиновый голубой или Neuro Trace) по следующим критериям: четкая форма нейронального перикариона, большое ядро с позитивно меченым ядрышком, небольшая цитоплазматическая зона вокруг ядра с позитивным окрашиванием по Нисслю, указывающая на интактный шероховатый эндоплазматический ретикулум с рибосомами и поэтому интактный механизм белкового синтеза.
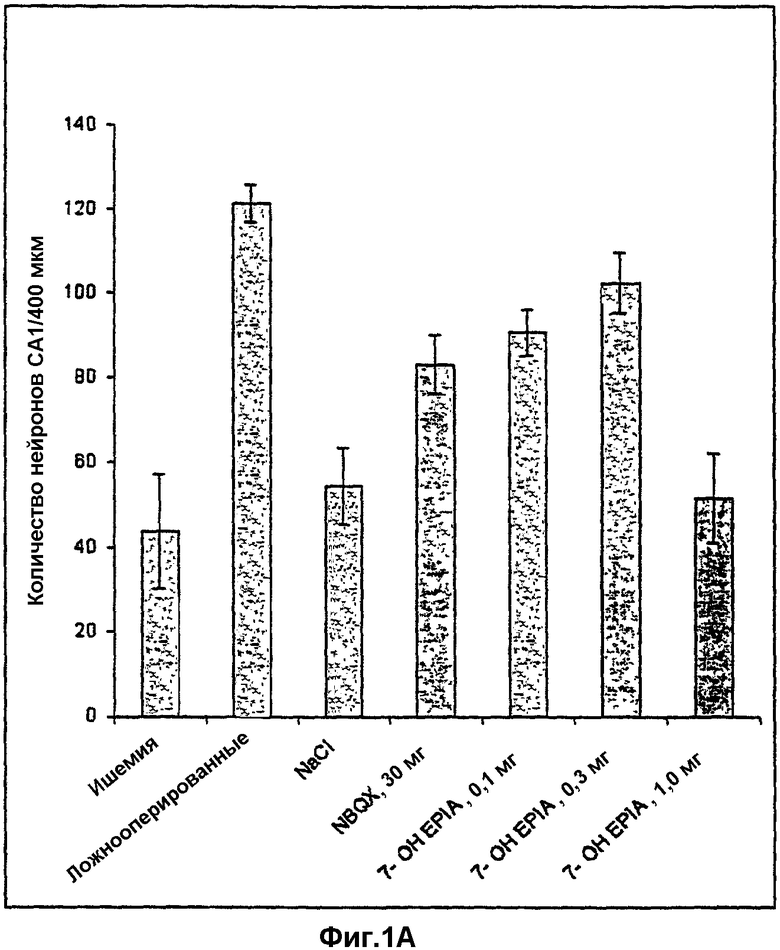
10 минут глобальной ишемии (легкая ишемия) и период выживания 7 дней избирательно приводят к нейродегенерации пирамидальных клеток в области СА1 гиппокампа (фиг.1А-1С). Среднее количество пирамидальных клеток в СА1 ложнооперированных животных составляло 121,5±4,3 (рассматривали как 100%). Поэтому 60% нейронов СА1 погибали после 10 минут глобальной ишемии (фиг.1В). Количество нейронов в группе животных, которым индуцировали ишемию и производили внутривенную инъекцию наполнителя (NaCl плюс 100 мкл этанола), как описано в эксперименте, оказалось сопоставимым с количеством в группе животных только с ишемией (фиг.1А, 1В). NBQX (30 мг/кг, три инъекции внутривенно, как описано в эксперименте) показал значительную (р=0,03) нейрозащиту в пирамидальных клетках СА1 по сравнению с ишемической группой. По сравнению с только ишемией NBQX приводил к 47,5% нейрозащиты, в то время как по сравнению с ложнооперированными животными защитное действие составляло 68,5%. Вызванная NBQX нейрозащита согласуется с данными Gill et al., 1992, и Gill, 1994, что демонстрирует обоснованность модели глобальной ишемии, использованной в описанных экспериментах. 7β-ОН-EPIA приводит к зависимой от концентрации нейрозащите пирамидальных клеток СА1 гиппокампа после 10 минут глобальной ишемии и периода выживания 7 дней (фиг.1А). Т-тест-анализ выявил существенное нейропротективное действие 7β-ОН-EPIA в концентрации 0,1 мг/кг (р=0,01) и 0,3 мг/кг (р=0,0008). В отличие от ложнооперированной группы нейропротективное действие на пирамидальные клетки СА1 7β-ОН-EPIA составляло 74,8% (0,1 мг/кг) и 83,9% (0,3 мг/кг) соответственно (фиг.1С). 7β-ОН-EPIA в концентрации 1,0 мг/кг показал только тенденцию к нейрозащите, а действие оказалось незначительным.
Во всех экспериментах с 7β-ОН-EPIA, вводимым внутривенно перед, во время и после ишемии, никогда не наблюдали никаких поведенческих нарушений у животных.
Подписи к чертежам
Количество морфологически интактных пирамидальных клеток СА1 гиппокампа у крыс через 7 дней после глобальной церебральной ишемии у крыс и при воздействии различными соединениями.
Фиг.1А: данные представлены как среднее количество (SEM интактных нейронов на 400 мкм длины области СА1.
Фиг.1В: данные представлены как процент интактных нейронов на 400 мкм длины области СА1 по сравнению с ложнооперированными животными, которых принимали за 100%.
Фиг.1С: данные представлены как абсолютный процент нейрозащиты, когда количество выживших нейронов в ишемической группе рассматривали как нуль, а количество выживших нейронов в ложнооперированной группе принимали за 100%.
Хотя вышеприведенные данные демонстрируют нейрозащиту, недавно было показано, что Cyp7b1, фермент, ответственный за 7-гидроксилирование 3-гидроксистероидов и который, таким образом, приводит к превращению эстрадиола, DHEA и EPIA в их нейропротективные производные, присутствует в других тканях субъекта с ишемическим поражением, включая ткани сердца и почек. Соответственно, из вышеприведенных данных можно заключить, что соединения данного изобретения будут защищать ткани сердца и почек от ишемического поражения.
ПРИМЕР 23
Кардиопротективное действие
Исследование предназначали для тестирования возможного противоишемического и кардиопротективного действия 7β-ОН-EPIA в перфузированных сердцах самцов крыс Лангендорф. Конечная цель оценки защиты на данной модели заключалась в размере инфаркта (защита против смертельного поражения, гибели клеток). Использованная модель размера инфаркта основана на стандартизированном ишемическом поражении с последующей повторной перфузией. В данном исследовании обработки добавляли ex vivo (к перфузионному раствору изолированного сердца) в течение 30 минут перед образованием инфаркта и продолжали на протяжении 30 минут региональной ишемии (образование инфаркта) и 120 минут повторной перфузии. На основании результатов экспериментальных исследований использовали концентрацию 100 нМ и сравнивали с сердцами, обработанными наполнителем. Лекарственное средство растворяли в ДМСО (наполнитель) и конечная концентрация ДМСО в перфузионном растворе составляла 1·10-6. Результаты исследования показали, что соединение при концентрации 100 нМ значительно уменьшало размер инфаркта от 46,3±2,49 до 14,4±1,22% зоны ишемического риска (р<0,001). Также исследовали деятельность сердца вместе с добавлением лекарственного средства, а добавление 7β-ОН-EPIA само собой не приводило к определяемым изменениям в деятельности сердца. Обработанные 7β-ОН-EPIA сердца демонстрировали незначительное снижение глобальных параметров систолического давления левого желудочка во время региональной ишемии (р<0,05 при 25-минутной региональной ишемии), которое исчезало после повторной ишемии.
Исследование подтвердило кардиопротективные, противоишемические свойства соединения при концентрации 100 нМ на изолированном, перфузированном сердце самцов крыс.
Обработка животных
Животных помещали в отделе для животных Университета Troms и обрабатывали в соответствии с установками, сформулированными Европейской конвенцией для защиты позвоночных животных, используемых для экспериментальных и других целей. Поставку крыс линии Вистар производила фирма Harland (The Netherlands), а крыс содержали в отделе для животных в течение одной недели до начала экспериментов. Вес животных ограничивали 240-380 г и использовали только сердца самцов. Животные соответствовали возрасту 60-120 дней. В день эксперимента крыс переносили в фильтруемых камерах из отдела для животных в лабораторию. Затем крысам внутрибрюшинно производили анестезию инъекцией пентобарбитала (50-75 мг/кг), а также гепаринизировали 200 МЕ.
Перфузия
Сердца быстро (в течение 1-2 минут) переносили в перфузионное устройство, используя бикарбонатный буфер Кребса-Хенселейта как перфузионный раствор. Перфузат и сердце поддерживали при 37°С.
Бикарбонатный буфер Кребса-Хенселейта содержал, мМ/л:
Буфер уравновешивали смесью газов приблизительно 5% СО2 в О2.
Перфузионное давление составляло 100 мм Н2О. Латексный баллон устанавливали на конце поливинилового тюбинга, соединенного с датчиком давления, и вставляли в полость левого желудочка для измерений давления левого желудочка. Размер баллона не изменяли во время эксперимента, и поэтому экспериментальное устройство представляло собой изоволюметрический препарат левого желудочка. Синхронизированное собирание венозной вытекающей жидкости из правой стороны сердца (венечного синуса через легочный ствол и правое предсердие) использовали для измерения коронарного кровотока. Частоту сердечных сокращений рассчитывали по регистрации давления.
Основанные на применении компьютера сбор и анализ данных использовали для оценки деятельности сердца (Lab View based software).
Экспериментальный протокол
Период стабилизации составлял 20-25 минут, а сердца, которые не достигали стабильной эффективности во время указанного периода, отбрасывали. Использовали сердца с LVDP (наблюдаемым давлением левого желудочка) между 80 мм Hg и 175 мм Hg, диастолическим давлением между 0-10 мм Hg и коронарным кровотоком между 9-18 мл/мин в конце стабилизационного периода.
Готовили 100 мМ исходного раствора 7β-ОН-EPIA в ДМСО и хранили в виде аликвот в пробирках Эппендорфа при 20°С. В дальнейшем упомянутый раствор разводили в перфузионном растворе до концентрации 100 нМ активного лекарственного средства непосредственно перед экспериментом. Предварительные обработки 7β-ОН-EPIA (n=8) или наполнителем (n=8) осуществляли в течение 30 минут перед образованием инфаркта и продолжали до конца экспериментов.
Региональную ишемию (образование инфаркта) успешно достигали наложением шелковых швов вокруг главной ветви левой коронарной артерии. Обратимое лигирование получали в результате использования небольшого кусочка поливиниловой трубки. Стандартизированную региональную ишемию поддерживали 30 минут, а затем сердца повторно перфузировали в течение 2 часов.
Размер инфаркта и размер зоны риска
В конце эксперимента проводили следующие процедуры.
1) Повторно лигировали левую коронарную артерию.
2) В перфузионную линию добавляли суспензию голубого красителя. Ишемическую зону идентифицировали как область без красителя.
3) Сердце быстро удаляли, взвешивали и замораживали.
4) Через один день после этого сердце разрезали на срезы толщиной 2 мм и окрашивали тетразолием. Срезы сердца инкубировали в течение 20 минут в 1% ТТС (хлорид трифенилтетразолия) в 0,2 М фосфатном буфере (рН 7,4) при 37°С. В пораженной инфарктом ткани не развивалась цветная реакция, тогда как в окружающей ткани появлялся пурпурный цвет вследствие присутствия в ткани дегидрогеназ и кофакторов.
5) После окрашивания сердца помещали в формалин (4%) для фиксации.
6) Окрашивание ТТС со временем исчезает, а поэтому все срезы сердец сканировали компьютером и сохраняли в виде цифровых записей изображения для подтверждения.
7) Основанную на применении компьютера планиметрию использовали, чтобы рассчитать объем желудочков, зоны ишемического риска и инфаркта. Результаты представляли как инфаркт в % от зоны ишемического риска.
Результаты
Результаты представлены в следующей таблице 1.
Результаты также проиллюстрированы на фиг.2-6.
Инфаркт
Имеется значительное различие между двумя группами (р<0,001) с явным снижением инфарктов в группе, обработанной лекарственным средством. Инфаркты в контрольных сердцах, обработанных наполнителем, оказались сопоставимыми по размеру со стандартными контрольными инфарктами, обычно наблюдаемыми в необработанных сердцах, подвергнутых 30-минутной региональной ишемии.
Функционирование сердца:
Деятельность сердца исследовали в течение всего экспериментального периода. Значительное снижение коронарного кровотока наблюдали вместе с окклюзией коронарной артерии на описанной экспериментальной модели и подтвердили, что предполагаемая закупорка коронарной артерии имела место. На коронарный кровоток не оказывало влияние добавление 7β-ОН-EPIA. Частота сердечных сокращений значительно не различалась между двумя группами и оставалась стабильной на протяжении всего эксперимента. Наблюдаемое давление левого желудочка (LVDP) также снижалось во время региональной ишемии. Наблюдаемое снижение оказалось больше в обработанных лекарственным средством сердцах по сравнению с контролем. Значительное различие в LDVP между двумя группами было отмечено за 25 минут региональной ишемии. Никаких различий в диастолическом давлении не наблюдали между двумя группами.
Наполнитель
Наполнитель ДМСО ранее использовали как наполнитель в перфузируемых буфером сердцах и результаты показали, что в условиях данного исследования указанное соединение само не оказывало определяемого влияния.
Заключение
В исследовании продемонстрировано явное и значительное кардиопротективное действие 7β-ОН-EPIA. Степень защиты сравнима по величине с некоторыми наиболее сильными и хорошо охарактеризованными кардиопротективными лекарственными средствами или лечебными схемами, подобными NHE-блокаде или ишемическому прекондиционированию, когда применяли на одной и той же экспериментальной модели.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕЙРОПРОТЕКТОРНЫЕ 7-БЕТА-ГИДРОКСИСТЕРОИДЫ | 2001 |
|
RU2258511C2 |
| МОДУЛЯЦИЯ ПУТЕЙ ОБМЕНА ПРОСТАГЛАНДИНА/ЦИКЛООКСИГЕНАЗЫ | 2007 |
|
RU2448712C2 |
| 7-ГИДРОКСИЭПИАНДРОСТЕРОН, ОБЛАДАЮЩИЙ НЕЙРОПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 2001 |
|
RU2307654C2 |
| ТРАНСДЕРМАЛЬНЫЕ СТЕРОИДНЫЕ КОМПОЗИЦИИ | 2005 |
|
RU2371183C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭПЛЕРЕНОНА | 2003 |
|
RU2339642C9 |
| 18-МЕТИЛ-19-НОРАНДРОСТ-4-ЕН-17,17-СПИРОЭФИР (18-МЕТИЛ-19-НОР-20-СПИРОКС-4-ЕН-3-ОН) И ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ, КОТОРЫЕ ЕГО СОДЕРЖАТ | 2007 |
|
RU2440365C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-КЕТО-7α-АЛКОКСИКАРБОНИЛЗАМЕЩЕННОГО Δ4,5-СТЕРОИДА, СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2261865C2 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУКЦИНИМИДНЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2298554C2 |
| ТРИЦИКЛИЧЕСКИЕ ЦИТОПРОТЕКТОРНЫЕ СОЕДИНЕНИЯ | 2006 |
|
RU2404967C2 |
| 17-ДЕЗОКСИ-1,3,5(10)-ЭСТРАТРИЕН, СПОСОБЫ ЛЕЧЕНИЯ, СПОСОБ СИНТЕЗА 7АЛЬФА-МЕТИЛЭСТРОНА, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2233288C2 |

Изобретение относится к лекарственным средствам и касается применения 3-гидрокси-7-гидроксистероидов для защиты против ишемического поражения периферических органов и для лечения поражения спинного мозга, индуцированного повреждением спинного мозга, где стероид представляет собой соединение формулы (I) и его фармацевтически приемлемые соли и сложные эфиры. Также раскрывается способ защиты млекопитающего против индуцированного ишемией поражения ткани в периферических органах или против индуцированного повреждением спинного мозга поражения спинного мозга введением эффективного количества 3-гидрокси-7-гидроксистероида или его фармацевтически приемлемого сложного эфира. Данное изобретение позволяет расширить арсенал средств для защиты против ишемического нарушения в тканях периферических органов. 2 н. и 15 з.п. ф-лы, 6 ил., 4 табл.
где каждый из R1, R2, Ra, Rb, А и n имеет указанные в описании значения,
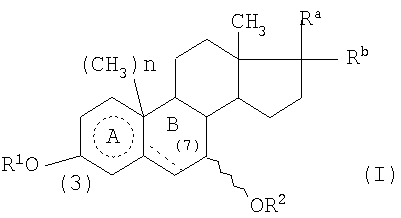
в котором R1 и R2 представляет собой атом водорода и
один из Ra и Rb представляет собой группу формулы - Rc, предпочтительно в β-конфигурации, а другой представляет собой атом водорода, или Ra и Rb, вместе представляют собой оксогруппу;
Rc представляет собой алканоильную группу, содержащую 2 атома углерода или группу формулы -OR4, в которой R4 представляет собой водород и кольцо А 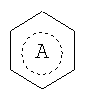 , представляет собой кольцо бензола или циклогексана;
, представляет собой кольцо бензола или циклогексана;
когда кольцо А представляет собой кольцо циклогексана, пунктирная линия в кольце В представляет собой одинарную или двойную связь углерод-углерод, а n равно 1; или когда кольцо А представляет собой кольцо бензола, пунктирная линия в кольце В представляет собой одинарную связь углерод-углерод, а n равно 0;
и его фармацевтически приемлемые соли и сложные эфиры.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| US 5792759 A1 11.08.1998 | |||
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ПОВРЕЖДЕНИЯМИ ПОЗВОНОЧНИКА И СПИННОГО МОЗГА | 2000 |
|
RU2171677C1 |
| БЕЛИКОВ В.Г | |||
| Фармацевтическая химия | |||
| - М.: Высшая школа, 1993 г., т.1, с.43-47 | |||
| ГЕОРГИЕВСКИЙ В.П | |||
| и КОНЕВ Ф.А | |||
| Технология и стандартизация лекарств | |||
| ООО «РИРЕГ» | |||
| - Харьков, 1996 г | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2008-07-20—Публикация
2002-08-13—Подача