Настоящее изобретение относится к лечению или профилактике хронических и острых нейродегенеративных заболеваний или состояний с применением определенных трициклических нейропротекторных соединений. Хронические состояния включают в себя такие заболевания, как болезнь Альцгеймера, болезнь Паркинсона, хорея Хантингтона и множественный склероз. Острые состояния включают в себя последствия после случаев острой ишемии, таких как сердечный приступ, удар или повреждение головы. Соединения также являются пригодными для предотвращения или лечения повреждений, вызванных ишемическим стрессом периферических органов (то есть любой функциональной ткани в теле за исключением головного мозга и спинного мозга), таких как сердце или почки.
В тканях, подверженных воздействию состояний с недостатком кислорода, таких как длительная гипоксия и ишемия, которые могут быть связаны или не связаны с гипогликемией, встречается повреждение нейронов до различных степеней. Ишемия, как правило, возникает в результате острого случая, например сердечного приступа, удара или травматического повреждения головы. Во время сердечного приступа возникающее повреждение ограничивается по существу тканями сердца, и разработаны определенные способы лечения. При ударе или травматическом повреждении головы, повреждение нейронов возникает в результате воздействия более продолжительной ишемии на головной мозг. Тяжесть ишемии зависит от природы удара или повреждения, но неизменно имеется повреждение головного мозга. WO 99/31049 относится к воздействию ишемии на головной мозг, такого как осуществляется у пациентов с ударом или в результате повреждения головы, и описывает определенные нейропротекторные агенты и их использование при лечении повреждения нейронов, вызываемого случаями острой ишемии, такими как удар и повреждение головы.
В противоположность повреждению нейронов, возникающему в результате случаев острой ишемии, таких как сердечный приступ, удар или повреждение головы, основополагающие причины хронических нейродегенеративных заболеваний или состояний, таких как болезнь Альцгеймера (AD), болезнь Паркинсона (PD), хорея Хантингтона (HC), множественный склероз (MS) и амиотрофический латеральный склероз (ALS), являются сложными и, видимо, определяются многими факторами. В каждом случае некротическая и апоптическая гибель клеток нейронов может происходить в результате действия одного или нескольких механизмов, включая ослабление метаболизма, эксцитотоксичность и оксидативный стресс. Ряд исследований указывает на оксидативный стресс как на главный фактор возникновения множества хронических нейродегенеративных заболеваний, включая AD, PD и ALS (например, см.: Sayre et al., (2001), Curr. Med. Chem, 8(7), 721-38; Bains et al., (1997), Brain Res. Rev., 25, 335-358; Alexi et al. (2000), Progress in Neurobiol, 60, 409-470).
Оксидативный стресс происходит, когда нарушается нормальный баланс между оксидативными событиями и механизмами антиоксидативной защиты, либо из-за потери восстанавливающих агентов и/или антиоксидантов, либо из-за увеличения уровней окислителей. Оксидативный стресс приписывается воздействиям высокотоксичных свободных радикалов, включая химически активные оксиды (ROS), такие как супероксидный анион (*O2 -) и гидроксильный радикал (*OH), и химически активные производные азота (RNS), образующиеся при реакции оксида азота (NO) с супероксидом или пероксидом, такие как пероксинитрит (*ONOO-).
Эксцитотоксическая гибель клеток вызывается посредством избыточной активации рецепторов глутамата посредством глутамата и глутаматергических агонистов, таких как NMDA и другие возбуждающие аминокислоты (EAA). Ряд исследований также говорит о том, что оксидативный стресс может действовать в качестве медиатора эксцитотоксически индуцированной гибели клеток нейронов. Например, показано, как для NMDA, так и для каината (отличного от NMDA агониста рецептора), что активирование рецепторов EAA увеличивает повреждение липидов свободными радикалами и что это повреждение может предотвращаться посредством одновременного лечения антиоксидантами.
Ослабление метаболизма может вызываться ударом, асфиксией, гипогликемией и определенными ядами, вмешивающимися в митохондриальное дыхание. Митохондриальная дисфункция и возникающее в результате обеднение ATP и потеря буферной емкости внутриклеточного кальция может вызвать увеличение продуцирования химически активных свободных радикалов кислорода и азота, приводящих к оксидативному стрессу.
Таким образом, не только оксидативный стресс под действием свободных радикалов, как понимается, является первичным фактором гибели клеток нейронов в ряде хронических нейродегенеративных заболеваний, но он также может медиировать эксцитотоксические стимулы и ослабление метаболизма. Кроме того, может также происходить обратное взаимодействие, поскольку оксидативный стресс под действием свободных радикалов может инициировать эксцитотоксические пути и вызывать метаболические нарушения.
Авторы обнаружили теперь, что определенные трициклические соединения могут применяться для лечения хронических и острых нейродегенеративных заболеваний или состояний и для предотвращения или лечения повреждения, вызванного ишемическим стрессом, периферических органов, таких как сердце или почки.
Таким образом, настоящее изобретение предусматривает применение соединений формулы (I) и их фармацевтически приемлемых солей и сложных эфиров для производства лекарственного средства для лечения или профилактики острых или хронических нейродегенеративных заболеваний или состояний и для защиты против ишемического повреждения тканей периферических органов. Используемые соединения имеют формулу (I):
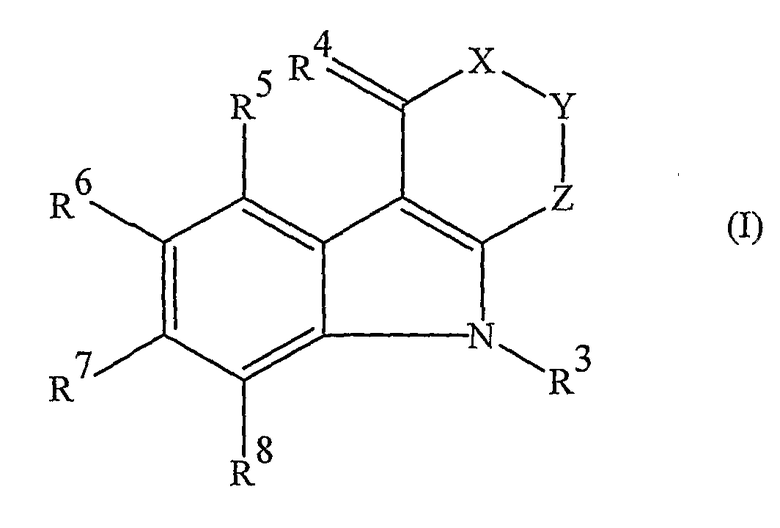
в которой:
X представляет собой группу формулы >CR1R2 или, когда R6 не представляет собой атом водорода, группу формулы >SO2;
Y представляет собой группу формулы >NH или >CR1R2;
Z представляет собой группу формулы >C=O, группу формулы >CH2 или прямую связь;
R1 представляет собой атом водорода и R2 представляет собой атом водорода, карбокси группу или гидрокси группу;
или
R1 и R2 вместе представляют собой оксо группу, метилендиокси группу или гидроксиимино группу;
R3 представляет собой атом водорода или низшую алкильную группу;
R4 представляет собой два атома водорода или оксо или гидроксиимино группу;
R5 представляет собой атом водорода, низшую алкильную группу или атом галогена;
R6 представляет собой атом водорода, низшую алкокси группу или карбокси группу;
R7 и R8 являются одинаковыми или отличными друг от друга, и каждый представляет собой атом водорода, низшую алкильную группу или атом галогена;
и соли и сложные эфиры, когда соединение содержит карбокси группу.
Определенные соединения формулы (I) представляют собой новые соединения сами по себе.
В соединениях по настоящему изобретению Z может представлять собой прямую связь, в этом случае она образует часть 5-членного кольца, конденсированного с 5-членным азотсодержащим гетероциклическим кольцом, или она может представлять собой группу формулы >CH2 или >C=O, в этом случае она образует часть 6-членного кольца.
Когда R3, R5, R7 или R8 представляют собой низшую алкильную группу, она может представлять собой алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 10, предпочтительно, от 1 до 6 атомов углерода. Примеры таких групп включают метильную, этильную, пропильную, изопропильную, бутильную, втор-бутильную, трет-бутильную, пентильную, изопентильную, неопентильную, 2-метилбутильную, 1-этилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,3-диметилбутильную, 2-этилбутильную, гексильную, изогексильную, гептильную, октильную, нонильную и децильную группы, из которых метильная, этильная, пропильная, бутильная и гексильная группы являются предпочтительными, метильная и этильная группы являются более предпочтительными, а метильная группа является наиболее предпочтительной.
Когда R5, R7 или R8 представляет собой атом галогена, он может представлять собой атом фтора, хлора, брома или йода, из которых атомы фтора и хлора являются предпочтительными.
Когда R6 представляет собой низшую алкокси группу, она может представлять собой алкокси группу с прямой или разветвленной цепью, имеющую от 1 до 10, предпочтительно, от 1 до 6 атомов углерода.
Примеры таких групп включают метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, 2-метилбутокси, 1-этилпропокси, 4-метилпентилокси, 3-метилпентилокси, 2-метилпентилокси, 1-метилпентилокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,3-диметилбутокси, 2-этилбутокси, гексилокси, изогексилокси, гептилокси, окстилокси, нонилокси и децилокси группы, из которых метокси, этокси, пропокси, бутокси и гексилокси группы являются предпочтительными, метокси и этокси группы являются более предпочтительными, а метокси группа является наиболее предпочтительной.
Из соединений по настоящему изобретению авторы особенно предпочитают такие, в которых:
X представляет собой группу формулы >CR1R2, где R1 представляет собой атом водорода и R2 представляет собой атом водорода, гидрокси группу или карбокси группу, или R1 и R2, вместе, представляют собой оксо группу или метилендиокси группу;
Y представляет собой группу формулы >CR1R2, где R1 представляет собой атом водорода и R2 представляет собой атом водорода или карбокси группу;
R3 представляет собой атом водорода;
R4 представляет собой два атома водорода или оксо группу;
R5 представляет собой атом водорода;
R6 представляет собой атом водорода, C1-C4 алкокси группу или карбокси группу; и R7 и R8 являются одинаковыми или отличными друг от друга и каждый представляет собой атом водорода или C1-C4 алкильную группу;
и их соли и сложные эфиры.
Конкретные примеры соединений по настоящему изобретению представлены в следующей далее Таблице 1:
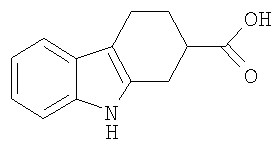
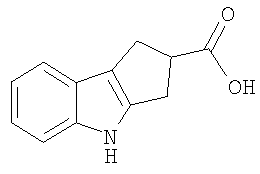
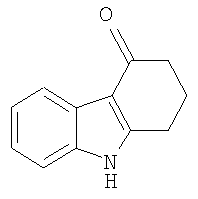
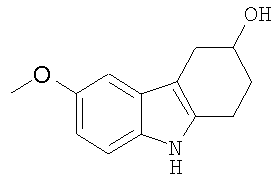
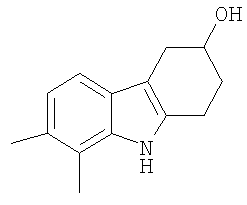
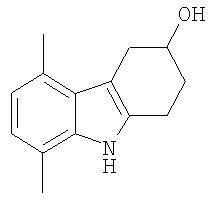
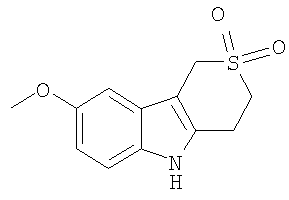
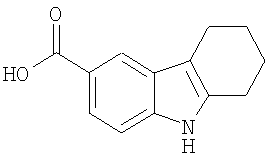
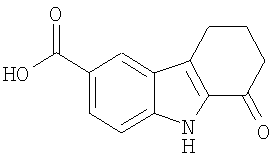
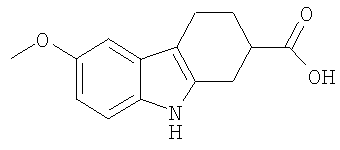
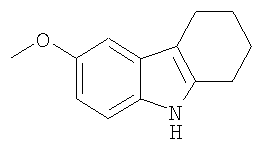
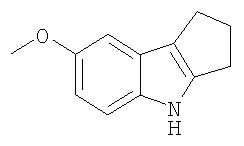
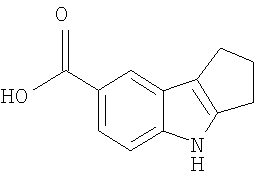
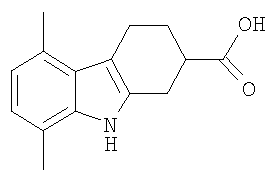
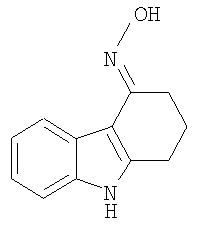
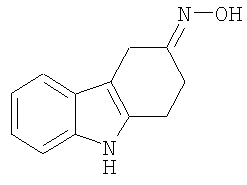
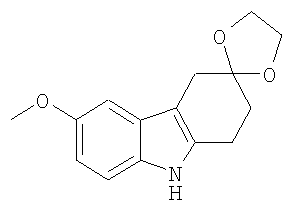
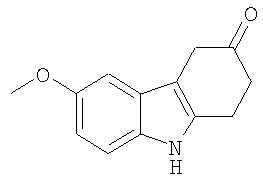
В указанной выше Таблице 1 те соединения, которые отмечены звездочкой, сами по себе являются новыми соединениями и также составляют часть настоящего изобретения. Наиболее предпочтительные соединения по настоящему изобретению представляют собой соединения с номерами 4, 6, 7, 8, 10, 14, 15, 16, 17, 20, 21, 22 и 23 в указанной выше Таблице.
Когда соединения по настоящему изобретению содержат карбокси группу, например когда R1 или R6 представляет собой карбокси группу, соединения по настоящему изобретению могут образовывать сложные эфиры, которые могут быть получены посредством обычных способов эстерификации. Нет каких-либо ограничений на природу сложного эфира при условии, что, когда полученное соединение должно использоваться в медицине, соединение является фармацевтически приемлемым, то есть оно не является ни менее активным или неприемлемо менее активным, ни более токсичным или неприемлемо более токсичным, чем исходное соединение. Однако, когда соединение должно использоваться для немедицинских применений, например, в качестве промежуточного соединения при получении других соединений, даже это ограничение не применяется и нет ограничения на природу сложных эфиров, которые могут образовываться.
Примеры сложноэфирных групп включают:
алкильные группы, имеющие от 1 до 20 атомов углерода, более предпочтительно, от 1 до 10 атомов углерода, такие как те, которые иллюстрируются по отношению к R3, R5, R7 или R8, и высшие алкильные группы, как те, которые хорошо известны в данной области, такие как додецильная, тридецильная, пентадецильная, октадецильная, нонадецильная и икозильная группы;
циклоалкильные группы, имеющие от 3 до 7 атомов углерода, например циклопропильная, циклобутильная, циклопентильная, циклогексильная и циклогептильная группы;
аралкильные группы, в которых алкильная часть имеет от 1 до 3 атомов углерода и арильная часть представляет собой карбоциклическую ароматическую группу, имеющую от 6 до 14 атомов углерода, которые могут быть замещенными или незамещенными; примеры таких аралкильных групп включают в себя бензильную, фенэтильную, 1-фенилэтильную, 3-фенилпропильную, 2-фенилпропильную, 1-нафтилметильную, 2-нафтилметильную, 2-(1-нафтил)этильную, 2-(2-нафтил)этильную, бензгидрильную (то есть дифенилметильную), трифенилметильную, бис(o-нитрофенил)метильную, 9-антрилметильную, 2,4,6-триметилбензильную, 4-бромбензильную, 2-нитробензильную, 4-нитробензильную, 3-нитробензильную, 4-метоксибензильную и пиперонильную группы;
алкенильные группы, имеющие от 2 до 6 атомов углерода, такие как винильная, аллильная, 2-метилаллильная, 1-пропенильная и изопропенильная группы;
галогенированные алкильные группы, имеющие от 1 до 6, предпочтительно, от 1 до 4 атомов углерода, такие как 2,2,2-трихлорэтильная, 2-галогенэтильная (например, 2-хлорэтильная, 2-фторэтильная, 2-бромэтильная или 2-йодэтильная), 2,2-дибромэтильная и 2,2,2-трибромэтильная группы;
замещенные силилалкильные группы, например 2-три(C1-C4)алкилсилилэтильные группы, в частности 2-триметилсилилэтильная группа;
замещенные и незамещенные фенильные группы, например фенильная, толильная и бензамидофенильная группы;
замещенные и незамещенные фенацильные группы, например сама фенацильная группа или п-бромфенацильная группа;
циклические и ациклические терпенильные группы, например геранильная, нерильная, линалильная, фитильная, ментильная (в частности, м- и п-ментильная), туйильная, карильная, пинанильная, борнильная, норкарильная, норпинанильная, норборнильная, ментенильная, камфенильная и норборненильная группы;
алкоксиметильные группы, в которых алкокси часть имеет от 1 до 6, предпочтительно, от 1 до 4 атомов углерода и может сама по себе быть замещенной одной незамещенной алкокси группой, такой как метоксиметильная, этоксиметильная, пропоксиметильная, изопропоксиметильная, бутоксиметильная и метоксиэтоксиметильная группы;
алифатические ацилоксиалкильные группы, в которых ацильная группа, предпочтительно, представляет собой алканоильную группу, а более предпочтительно, представляет собой алканоильную группу, имеющую от 2 до 6 атомов углерода, и алкильная часть имеет от 1 до 6, а предпочтительно, от 1 до 4 атомов углерода, такие как ацетоксиметильная, пропионилоксиметильная, бутирилоксиметильная, изобутирилоксиметильная, пивалоилоксиметильная, 1-пивалоилоксиэтильная, 1-ацетоксиэтильная, 1-изобутирилоксиэтильная, 1-пивалоилоксипропильная, 2-метил-1-пивалоилоксипропильная, 2-пивалоилоксипропильная, 1-изобутирилоксиэтильная, 1-изобутирилоксипропильная, 1-ацетоксипропильная, 1-ацетокси-2-метилпропильная, 1-пропионилоксиэтильная, 1-пропионилоксипропильная, 2-ацетоксипропильная и 1-бутирилоксиэтильная группы;
циклоалкил-замещенные алифатические ацилоксиалкильные группы, в которых ацильная группа, предпочтительно, представляет собой алканоильную группу, а более предпочтительно, представляет собой алканоильную группу, имеющую от 2 до 6 атомов углерода, циклоалкильный заместитель имеет от 3 до 7 атомов углерода и алкильная часть имеет от 1 до 6, предпочтительно, от 1 до 4 атомов углерода, такие как циклогексилацетоксиметильная, 1-(циклогексилацетокси)этильная, 1-(циклогексилацетокси)пропильная, 2-метил-1-(циклогексилацетокси)пропильная, циклопентилацетоксиметильная, 1-(циклопентилацетокси)этильная, 1-(циклопентилацетокси)пропильная и 2-метил-1-(циклопентилацетокси)пропильная группы;
алкоксикарбонилоксиалкильные группы, в частности 1-(алкоксикарбонилокси)этильные группы, такие как 1-метоксикарбонилоксиэтильная, 1-этоксикарбонилоксиэтильная, 1-пропоксикарбонилоксиэтильная, 1-изопропоксикарбонилоксиэтильная, 1-бутоксикарбонилоксиэтильная, 1-изобутоксикарбонилоксиэтильная, 1-втор-бутоксикарбонилоксиэтильная, 1-трет-бутоксикарбонилоксиэтильная, 1-(1-этил-пропоксикарбонилокси)этильная и 1-(1,1-дипропилбутоксикарбонилокси)этильная группы, и другие алкоксикарбонилалкильные группы, в которых как алкокси, так и алкильные группы имеют от 1 до 6, предпочтительно, от 1 до 4 атомов углерода, такие как 2-метил-1-(изопропоксикарбонилокси)пропильная, 2-(изопропоксикарбонилокси)пропильная, изопропоксикарбонилоксиметильная, трет-бутоксикарбонилоксиметильная, метоксикарбонилоксиметильная и этоксикарбонилоксиметильная группы;
циклоалкилкарбонилоксиалкильные и циклоалкилоксикарбонилоксиалкильные группы, например 1-метилциклогексилкарбонилоксиметильная, 1-метилциклогексилоксикарбонилоксиметильная, циклопентилоксикарбонилоксиметильная, циклопентилкарбонилоксиметильная, 1-(циклогексилоксикарбонилокси)этильная, 1-(циклогексилкарбонилокси)этильная, 1-(циклопентилоксикарбонилокси)этильная, 1-(циклопентилкарбонилокси)этильная, 1-(циклогептилоксикарбонилокси)этильная, 1-(циклогептилкарбонилокси)этильная, 1-метилциклопентилкарбонилоксиметильная, 1-метилциклопентилоксикарбонилоксиметильная, 2-метил-1-(1-метилциклогексилкарбонилокси)пропильная, 1-(1-метилциклогексилкарбонилокси)пропильная, 2-(1-метилциклогексилкарбонилокси)пропильная, 1-(циклогексилкарбонилокси)пропильная, 2-(циклогексилкарбонилокси)пропильная, 2-метил-1-(1-метилциклопентилкарбонилокси)пропильная, 1-(1-метилциклопентилкарбонилокси)пропильная, 2-(1-метилциклопентилкарбонилокси)пропильная, 1-(циклопентилкарбонилокси)пропильная, 2-(циклопентилкарбонилокси)пропильная, 1-(1-метилциклопентилкарбонилокси)этильная, 1-(1-метилциклопентилкарбонилокси)пропильная, адамантилоксикарбонилоксиметильная, адамантилкарбонилоксиметильная, 1-адамантилоксикарбонилоксиэтильная и 1-адамантилкарбонилоксиэтильная группы;
циклоалкилалкоксикарбонилоксиалкильные группы, например циклопропилметоксикарбонилоксиметильная, циклобутилметоксикарбонилоксиметильная, циклопентилметоксикарбонилоксиметильная, циклогексилметоксикарбонилоксиметильная, 1-(циклопропилметоксикарбонилокси)этильная, 1-(циклобутилметоксикарбонилокси)этильная, 1-(циклопентилметоксикарбонилокси)этильная и 1-(циклогексилметоксикарбонилокси)этильная группы;
терпенилкарбонилоксиалкильные и терпенилоксикарбонилоксиалкильные группы, например 1-(ментилоксикарбонилокси)этильная, 1-(ментилкарбонилокси)этильная, метилоксикарбонилоксиметильная, ментилкарбонилоксиметильная, 1-(3-пинанилоксикарбонилокси)этильная, 1-(3-пинанилкарбонилокси)этильная, 3-пинанилоксикарбонилоксиметильная и 3-пинанилкарбонилоксиметильная группы;
5-алкил- или 5-фенил-(2-оксо-1,3-диоксолен-4-ил)алкильные группы, например (5-метил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-фенил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-изопропил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-терт-бутил-2-оксо-1,3-диоксолен-4-ил)метильная и 1-(5-метил-2-оксо-1,3-диоксолен-4-ил)этильная группы; и
другие группы, в частности группы, которые легко удаляются in vivo, такие как фталидильная, инданильная и 2-оксо-4,5,6,7-тетрагидро-1,3-бензодиоксолен-4-ильная группы.
Также, если соединения по настоящему изобретению содержат карбокси группу, они могут преобразовываться в соли с помощью основания посредством обычных способов. Нет какого-либо ограничения на природу таких солей при условии, что, когда эти соединения должны использоваться в медицине, соединения являются фармацевтически приемлемыми. Однако, когда соединение должно использоваться для немедицинских применений, например в качестве промежуточного соединения при получении других соединений, даже это ограничение не применяется и тогда нет ограничения на природу солей, которые могут образовываться. Примеры таких солей включают: соли щелочного металла, такого как натрий, калий или литий; соли щелочноземельного металла, такого как барий или кальций; соли другого металла, такого как магний или алюминий; соли аммония; соли органических оснований, такие как соль метиламина, диметиламина, триэтиламина, диизопропиламина, циклогексиламина или дициклогексиламина; и соли основной аминокислоты, такой как лизин или аргинин. Авторы предпочитают фармацевтически приемлемые соли.
Соединения по настоящему изобретению могут также преобразовываться в соли с помощью кислот посредством обычных способов. Нет какого-либо ограничения на природу таких солей при условии, что, когда соединения должны использоваться в медицине, соединения являются фармацевтически приемлемыми. Однако, когда соединение должно использоваться для немедицинских применений, например в качестве промежуточного соединения при получении других соединений, даже это ограничение не применяется и нет ограничения на природу солей, которые могут образовываться. Примеры таких солей включают в себя: соли минеральных кислот, в частности галогенводородных кислот (такие как фтористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота или хлористоводородная кислота), азотной кислоты, перхлорной кислоты, угольной кислоты, серной кислоты или фосфорной кислоты; соли низших алкилсульфоновых кислот, таких как метансульфоновая кислота, трифторметансульфоновая кислота или этансульфоновая кислота; соли арилсульфоновых кислот, таких как бензолсульфоновая кислота или п-толуолсульфоновая кислота; соли органических карбоновых кислот, таких как уксусная кислота, фумаровая кислота, винная кислота, щавелевая кислота, малеиновая кислота, яблочная кислота, янтарная кислота, бензойная кислота, миндальная кислота, аскорбиновая кислота, молочная кислота, глюконовая кислота или лимонная кислота; и соли аминокислот, таких как глутаминовая кислота или аспарагиновая кислота. Авторы предпочитают фармацевтически приемлемые соли.
Соединения, используемые в настоящем изобретении, либо являются известными, либо могут быть получены посредством способов, аналогичных тем, которые используются при получении известных соединений.
Соединения по настоящему изобретению могут, следовательно, использоваться при лечении или профилактике хронических и острых нейродегенеративных заболеваний или состояний или для защиты против ишемического повреждения тканей периферических органов и для этих целей могут быть получены в виде обычных фармацевтических препаратов, как хорошо известно в данной области. Таким образом, соединения могут вводиться перорально, например в форме таблеток, капсул, гранул, порошков, сиропов, спреев или других таких хорошо известных форм, или парентерально, например посредством инъекций, спреев, глазных капель, адгезивных пластырей или суппозиториев и тому подобного.
Эти фармацевтические препараты могут быть получены с помощью обычных методов и могут содержать известные вспомогательные вещества типа, обычно используемого в этой области, например носители, связующие, дезинтегранты, лубриканты, стабилизаторы, модификаторы и тому подобное в зависимости от предполагаемого применения и формы препарата. Доза будет зависеть от состояния, возраста и массы тела пациента, а также от природы и тяжести расстройства, которое должно лечиться, но в случае перорального введения взрослому пациенту-человеку авторы обычно предложили бы общую дневную дозу от 0,01 до 50 мг/кг массы тела (более предпочтительно, от 0,05 до 20 мг/кг массы тела), которая может вводиться в одной дозе или в разделенных дозах, например, от одного до трех раз в день.
Настоящее изобретение дополнительно иллюстрируется с помощью следующих далее неограничивающих Примеров, из которых Примеры 1-23 иллюстрируют получение соединений, в то время как Пример 24 иллюстрирует их терапевтические свойства. В Примерах используются следующие сокращения: ушир., уширенный; с, синглет; д, дублет; т, триплет; кв, квартет; обм., обмениваемый; DCM, дихлорметан; DMF, N,N-диметилформамид; HREIMS, масс-спектроскопия высокого разрешения с ионизацией электронным ударом; HRFABMS, масс-спектроскопия высокого разрешения с бомбардировкой быстрыми атомами; LRESMS, масс-спектроскопия низкого разрешения с электрораспылением; NMM, N-метилморфолин; Pd/C, палладий на угле; т.пл., температура плавления; TFA, трифторуксусная кислота, THF, тетрагидрофуран; TLC, тонкослойная хроматография; SFM, среда без сыворотки; MEM, минимальная основная среда с солью Эрла; DMSO, диметилсульфоксид. HREIMS и HRFABMS получают на масс-спектрометре Jeol® JMS-AX505HA. LRESMS получают на Fisons® VG Platform Benchtop LC-MS. Спектры ЯМР получают на спектрометре Bruker® AMX 400. ИК спектры получают на дисках из KBr и на жидкостях в виде пленок, используя Nicolet® Impact 400D. Колоночную хроматографию осуществляют на силикагеле Prolabo® (200-400 меш). Номера соединений, упоминаемые в Примерах, те же, что и присвоенные соединениям в приведенной выше Таблице 1.
Пример 1
2,3,4,9-Тетрагидро-1H-карбазол-2-карбоновая кислота [Соединение № 1]
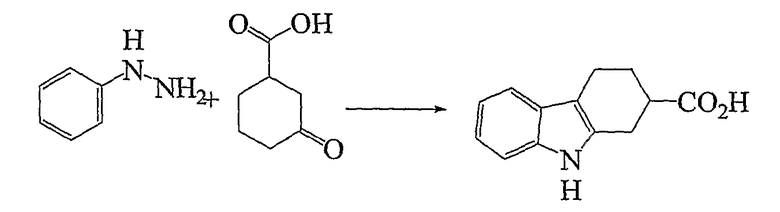
3-Оксоциклогексанкарбоновую кислоту (200 мг, 1,407 ммоль) растворяют в уксусной кислоте (3 мл), к которой добавляют раствор фенилгидразина (160 мг, 1,480 ммоль) в уксусной кислоте (2 мл) при комнатной температуре при перемешивании. Реакционную смесь нагревают при кипении с обратным холодильником в течение 2 часов. Затем реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом и экстрагируют насыщенным раствором соли. Органические слои собирают и сушат (Na2SO4) и растворитель удаляют при пониженном давлении. Неочищенный продукт перекристаллизовывают из этилацетата/н-гексана с получением светло-коричневого микрокристаллического твердого вещества (191 мг, 63%), т.пл. 235-238°C [см. Asselin, A. A., et al., J. Med. Chem., 1976,19, 787-792, т.пл. 239-241°C; Allen, et al., J. Heterocyclic Chem., 1970, 7, 239-241, т.пл. 233-235°C]. ИК (KBr): 3416, 3048, 2923, 2844, 1689, 1465, 1444, 1415, 1288, 1264, 1226, 935, 740 см-1. 1H ЯМР (ДМСO-d6): δ 12,27 (1H, с), 10,66 (1H, с), 7,33 (1H, д, J=7,6 Гц), 7,24 (1H, д, J=7,6 Гц), 6,98 (1H, дт, J=1,2 Гц и J=6,8 Гц), 6,91 (1H, дт, J=1,2 Гц и J=6,8 Гц), 2,89-2,62 (5H, м), 2,17 (1H, м), 1,87-1,81 (1H, м).
Пример 2
1,2,3,4-Тетрагидроциклопента[b]индол-2-карбоновая кислота [Соединение № 2]
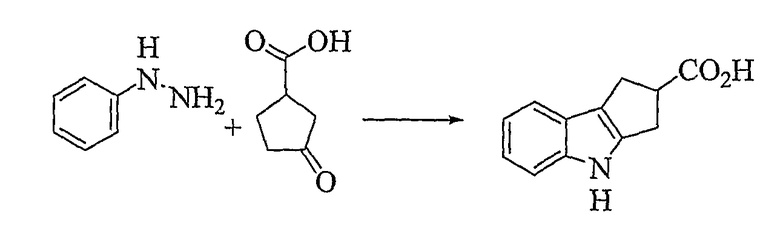
3-Оксоциклопентанкарбоновую кислоту (200 мг, 1,561 ммоль) растворяют в уксусной кислоте (3 мл), к которой добавляют фенилгидразин (180 мг, 1,665 ммоль) в уксусной кислоте (2 мл) при комнатной температуре, при перемешивании. Реакционную смесь нагревают при кипении с обратным холодильником в течение 2 часов. Затем ее оставляют охлаждаться до комнатной температуры, разбавляют этилацетатом и экстрагируют насыщенным раствором соли. Органические слои собирают и сушат (Na2SO4) и растворитель удаляют при пониженном давлении с получением черной массы, которую используют для колоночной хроматографии на силикагеле с использованием этилацетата/гексана, 1/1, для элюирования продукта. Фракции, содержащие требуемый материал (RF=0,50), собирают и растворители удаляют при пониженном давлении. Продукт перекристаллизовывают из этилацетата/гексана с получением светло-коричневого микрокристаллического твердого вещества (48 мг, 15%), т.пл. 215-217°C [см. Lacoume, B.; Milcent, G. and Olivier, A., Tetrahedron, 1972, 28, 667-674, т.пл. 215°C]. ИК (KBr): 3362, 3028, 2910, 2859, 1691, 1438, 1411, 1323, 1277, 1238, 741 см-1. 1H ЯМР (ДМСO-d6): 12,27 (1H, с), 10,81 (1H, с), 7,31 (1H, д, J=7,6 Гц), 7,27 (1H, д, J=7,6 Гц), 6,97 (1H, дт, J=1,2 Гц и J=6,8 Гц), 6,92 (1H, дт, J=1,2 Гц и J=6,8 Гц), 3,76-3,68 (1H, м), 3,09-3,03 (3H, м), 2,95 (1H, м).
Пример 3
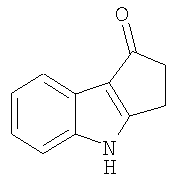
1,2,3,9-Тетрагидро-4H-карбазол-4-он [Соединение № 3]
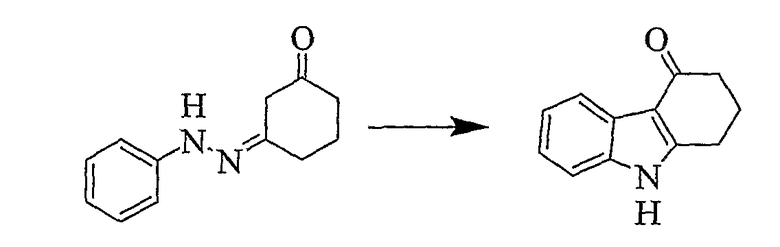
(1E)-1,3-Циклогександион 1-(фенилгидразон) (2,031 г, 10,045 ммоль) растворяют в TFA (10 мл) при комнатной температуре при перемешивании. Реакционную смесь нагревают при кипении с обратным холодильником в течение 8 часов, после чего ее оставляют при комнатной температуре в течение ночи. Полученный раствор темного цвета медленно выливают в воду со льдом при перемешивании. Полутвердый материал экстрагируют этилацетатом и сушат (MgSO4) и растворитель удаляют при пониженном давлении с получением бледно-желтого твердого вещества, которое при перекристаллизации из метанола дает 1,004 г. Маточную жидкость концентрируют и используют для колоночной хроматографии на силикагеле с использованием этилацетата/н-гексана (1/1) RF=0,15 с получением дополнительного количества продукта в виде белого твердого вещества (80 мг) после перекристаллизации из метанола. Общая масса полученного продукта равна 1,084 г, 58%, т.пл. 226-228°C [Clemo, G.R. and Felton, D.G.I, J. Chem. Soc. 1951,700-702, т.пл. 223°C]. ИК (KBr): 3144, 2937, 1622, 1581, 1468, 1406, 1250, 1175, 1140, 751 см-1. 1H ЯМР (ДМСO-d6): 11,83 (1H, ушир.); 7,95 (1H, дд, J=2,3 Гц & J=6,7 Гц); 7,39 (1H, дд, J=1,3 Гц & J=6,3 Гц); 7,18-7,11 (2H, м); 2,96 (2H, т, J=6,1 Гц); 2,42 (2H, т, J=6,1 Гц); 2,12 (2H, кв, J=6,4 Гц).
Пример 4
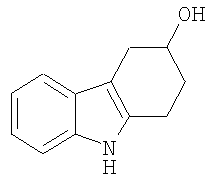
2,3,4,9-Тетрагидро-1H-карбазол-3-ол [Соединение № 4)
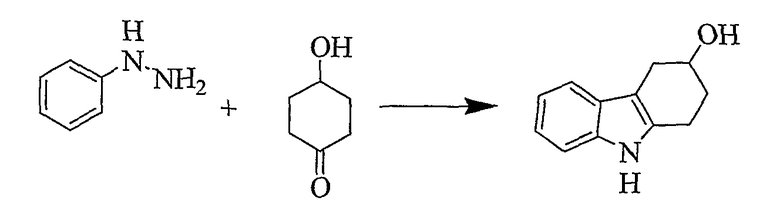
К раствору 4-гидроксициклогексанона (0,970 г, 8,220 ммоль) в уксусной кислоте (10 мл) добавляют по каплям фенилгидразин (1,216 г, 11,249 ммоль) при перемешивании при комнатной температуре. Материал начинает кристаллизоваться почти немедленно, и добавляют дополнительную уксусную кислоту (5 мл) и этанол (5 мл). Затем реакционную смесь нагревают при кипении с обратным холодильником в течение 3 часов. Полученный темно-красный раствор концентрируют при пониженном давлении примерно до 6 мл, а затем разбавляют достаточным количеством воды с получением помутнения. Охлаждение и наличие царапин вызывает кристаллизацию. Смесь фильтруют и твердое вещество промывают водой. Кристаллизация из метанола/воды с последующей перекристаллизацией из этилацетата/н-гексана дает требуемый продукт в виде желтовато-коричневого твердого продукта (670 мг, 44%), т.пл. 148-150°C [Gardner, P.D.; Haynes, G.R. and Brandon, R.L., J. Org. Chem., 1957, 22, 1206-1210, т.пл. 148,5-149,5°C], RF=0,32 (этилацетат/н-гексан 1/1). ИК (KBr): 3384, 2920, 2843, 1620, 1453, 1367, 1324, 1054,1004, 744, 637 см-1. 1H ЯМР (CDCl3): 7,81 (1H, ушир.); 7,52 (1H, д, J=7,4 Гц); 7,34 (1H, д, J=7,4 Гц); 7,19 (1H, т, J=6,3 Гц); 7,16 (1H, т, 6,3 Гц); 4,33 (1H, м); 3,18 (1H, дд, J=4,8 Гц & J=15,2 Гц); 2,98-2,74 (3H, м); 2,22-2,04 (2H, м); 1,77 (1H, ушир.).
Пример 5
Соединение № 5
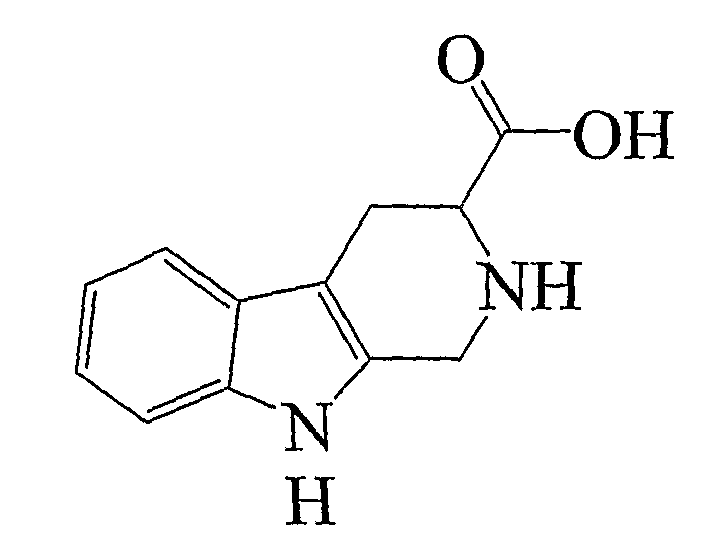
Это соединение получают от Aldrich, UK, и оно может быть получено посредством способа Cox et al. (1995, Med. Chem. Res., 5 (9), 710-718) или Speitel et al. (1949, Helv. Chim., 32, 860).
Пример 6
(a) Фенилгидразин 1,4-диоксаспиро[4,5]декан-8-она
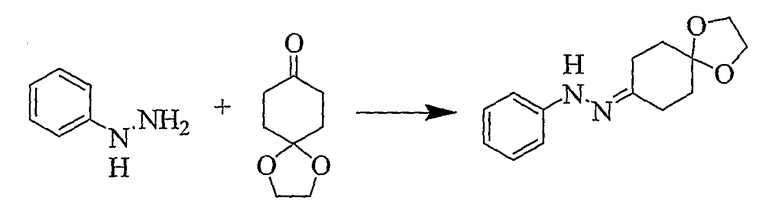
Фенилгидразин (1,098 г, 10,155 ммоль) растворяют в толуоле (20 мл), к которому добавляют 1,4-диоксаспиро[4,5]декан-8-он (1,586 г, 10,155 ммоль). Затем реакционную смесь нагревают при кипении с обратным холодильником в течение 30 минут, после чего растворитель удаляют при пониженном давлении с получением продукта в виде оранжевого масла (2,370 г, 95%), которое используют в следующей реакции без дополнительной очистки.
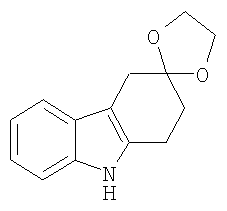
(b) 1,2,4,9-Тетрагидроспиро[карбазол-3,2'-[1,3-диоксолан] [Соединение № 6]
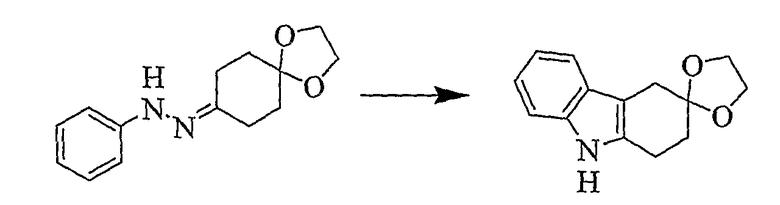
Фенилгидразин 1,4-диоксаспиро[4,5]декан-8-она [2,360 г, 9,581 ммоль, полученный на стадии (a)] растворяют в этиленгликоле (25 мл). Реакционную смесь нагревают при 180°C в течение 4 часов, а затем оставляют охлаждаться до комнатной температуры, после чего ее выливают в воду при 0°C, экстрагируют дихлорметаном (50 мл) и сушат (MgSO4). Продукт получают в виде розового твердого вещества, которое перекристаллизовывают из этилацетата/н-гексана с получением белого твердого вещества (1,030 г, 47%), RF=0,75 (этилацетат/н-гексан, 1/1), т.пл. 146-148°C [Urrutia, A. and Rodriguez, J.G., Tetrahedron, 1999, 55, 11095-11108, т.пл. 146-148°C]. ИК (KBr): 3405, 2975, 2897, 1620, 1587, 1463, 1436, 1373, 1296, 1152, 1097, 1054, 1019, 945, 739 см-1. 1H ЯМР (CDCl3): 7,75 (1H, ушир.); 7,43 (1H, д, J=7,5 Гц); 7,28 (1H, д, J=7,5); 7,12 (1H, дт, J=6,0 Гц & 1,3 Гц); 7,07 (1H, дт, J=6,0 Гц & 1,3 Гц); 4,11-4,03 (4H, м); 2,98 (2H, с); 2,95 (2H, т, J=6,5 Гц); 2,09 (2H, т, J=6,5 Гц).
Пример 7
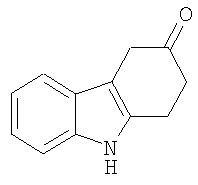
1,2,4,9-Тетрагидро-3H-карбазол-3-он [Соединение № 7]
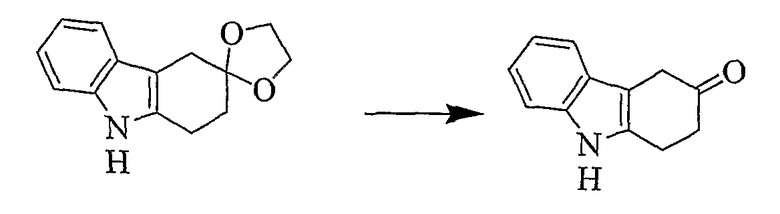
К раствору 1,2,4,9-Тетрагидроспиро[карбазол-3,2'-[1,3-диоксолана] (200 мг, 8,723 ммоль) в THF (30 мл) добавляют хлористоводородную кислоту (7 мл, 15%). Смесь перемешивают при комнатной температуре в течение 2 часов, нейтрализуют карбонатом натрия (твердым), а затем экстрагируют дихлорметаном и сушат (MgSO4). Растворитель удаляют при пониженном давлении и неочищенный продукт очищают с помощью колоночной хроматографии с использованием этилацетата/н-гексана (1/2) в качестве элюента. Продукт получают в виде белого микрокристаллического твердого вещества (120 мг, 65%), RF=0,17, т.пл. 156-158°C [Urrutia, A. and Rodriguez, J.G., Tetrahedron, 1999, 55,11095-11108, т.пл. 157-159°C]. ИК (KBr): 3382, 2962, 2915, 1707, 1465, 1435, 1328, 1164, 990, 745 см-1. 1H ЯМР (CDCl3): 7,88 (1H, ушир.); 7,45 (1H, д, J=7,7 Гц); 7,35 (1H, д, J=7,7 Гц); 7,19 (1H, т, J=7,1 Гц); 7,13 (1H, т, J=7,1 Гц); 3,63 (2H, с); 3,19 (2H, т, J=6,9 Гц); 2,82 (2H, т, J=6,9 Гц).
Пример 8
3,4-Дигидроциклопента[b]индол-1(2H)-он [Соединение № 8]
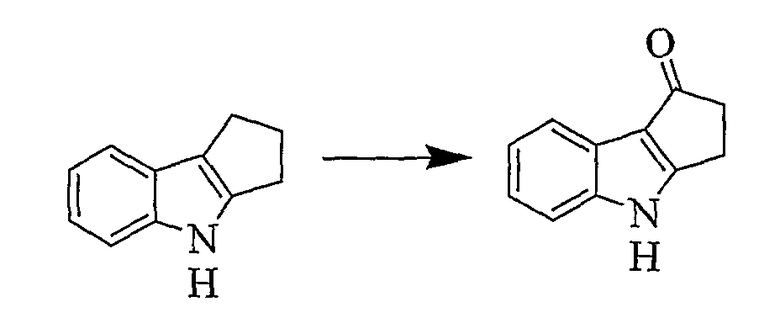
Охлажденный на льду раствор 1,2,3,4-тетрагидроциклопента[b]индола (1,006 г, 6,361 ммоль) в смеси THF (15 мл) и воды (1,5 мл) деоксигенируют посредством пропускания через него потока азота в течение 10 минут. Затем его выдерживают в атмосфере азота, в то время как раствор 2,3-дихлор-5,6-дициано-1,4-бензохинона (3,206 г, 14,123 ммоль), растворенного в THF (12 мл), добавляют по каплям в течение 10 минут. Затем перемешивание продолжают в течение еще одного часа, реакционной смеси дают возможность нагреваться до комнатной температуры в течение этого периода. Затем выпаривание растворителя дает красно-коричневый твердый остаток, который наносят на хроматографическую колонку, и продукты элюируют с использованием только этилацетата. Для очистки этого материала используют три колонки. Продукт получают в виде желтого твердого вещества (300 мг, 28%), т.пл. 252-255°C (разложение), RF=0,10 (этилацетат/н-гексан 1/1), [Rodriguez, J.G.; Temprano, F.; Esteban-Calderon, C; Martinez-Ripoll, M.; Garcia-Blanco, S., Tetrahedron, 1985, 41(18), 3813-3823, т.пл. 257-259°C]. ИК (KBr): 3210, 1655, 1614, 1471, 1429, 1241, 1152, 1047, 738 см-1. 1H ЯМР (ДМСO-d6): 12,01 (1H, ушир.); 7,67 (1H, д, J=7,3 Гц); 7,45 (1H, д, J=7,3 Гц); 7,21 (1H, дт, J=7,2 Гц & 1,4 Гц); 7,15 (1H, дт, J=7,2 Гц & 1,4 Гц); 3,08 (2H, м); 2,82 (2H, м).
Пример 9
6-Метокси-2,3,4,9-тетрагидро-1H-карбазол-3-ол [Соединение №9]
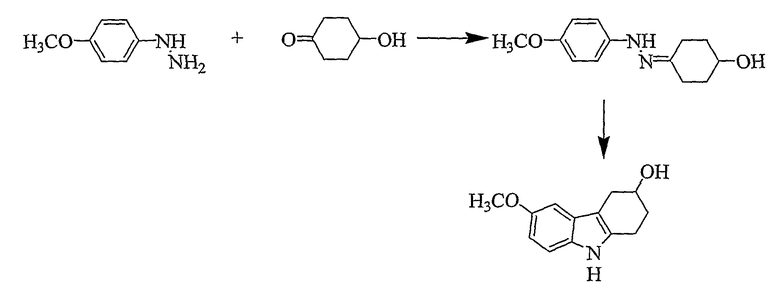
4-Метоксифенилгидразин (0,644 г, 3,688 ммоль) суспендируют в уксусной кислоте (20 мл) и этаноле (10 мл). 4-Гидроксициклогексанон (0,420 мг, 3,688 ммоль) растворяют в уксусной кислоте (10 мл), а затем добавляют к реакционной смеси при комнатной температуре при перемешивании. Реакционную смесь нагревают при кипении с обратным холодильником в течение 3 часов. Растворители частично удаляют при пониженном давлении, а затем реакционную смесь разбавляют водой (25 мл) и экстрагируют этилацетатом (2×50 мл). Органические слои собирают и сушат (MgSO4) и растворители удаляют при пониженном давлении с получением коричневого масла. Неочищенный продукт очищают с помощью колоночной хроматографии с использованием силикагеля и (этилацетата/н-гексана, 1/2). Фракции, содержащие требуемый материал, собирают и растворитель удаляют при пониженном давлении с получением продукта в виде мелкокристаллического материала (661 мг, 83%), т.пл. 100-103°C [C.W. Bird, A.G.H. Wee, J. Heterocycl. Chem., 1985, 22, 191-192, т.пл. 103-106°C], RF=0,17 (этилацетат/н-гексан 1/1). ИК (KBr): 3392, 2916, 2841, 1622, 1590, 1483, 1436, 1214, 1176, 1050, 1020, 830, 798 см-1. 1H ЯМР (CDCl3): 7,60 (1H, ушир.), 7,19 (1H, д, J=8,7 Гц), 6,92 (1H, д, J=2,4 Гц), 6,81 (1H, дд, J=2,4 & 8,71 Гц), 4,29 (1H, м), 3,86 (3H, с), 3,09-2,67 (4H, м), 2,11-2,02 (2H, м), 1,75 (1H, ушир.).
Пример 10
7,8-Диметил-2,3,4,9-тетрагидро-1H-карбазол-3-ол [Соединение № 10]
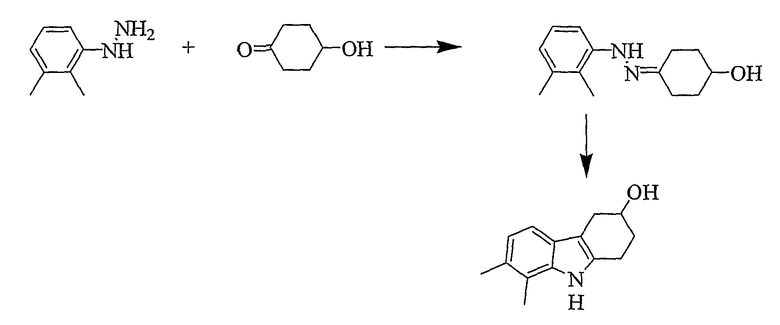
2,3-Диметилфенилгидразин (0,643 г, 3,723 ммоль) суспендируют в уксусной кислоте (20 мл) и этаноле (10 мл). 4-Гидроксициклогексанон (425 мг, 3,723 ммоль) растворяют в уксусной кислоте (10 мл), а затем добавляют к реакционной смеси при комнатной температуре при перемешивании. Затем реакционную смесь нагревают при кипении с обратным холодильником в течение 3 часов. Растворители частично удаляют при пониженном давлении, а затем реакционную смесь разбавляют водой (25 мл) и экстрагируют этилацетатом (2×50 мл). Органические слои собирают и сушат (MgSO4) и растворители удаляют при пониженном давлении с получением коричневого масла. Неочищенный продукт очищают с помощью колоночной хроматографии с использованием силикагеля и (этилацетата/н-гексана, 1/2). Фракции, содержащие требуемый материал, собирают и растворитель удаляют при пониженном давлении. Продукт получают в виде бледно-желтого микрокристаллического материала (410 мг, 51%), т.пл. 192-195°C, RF=0,39 (этилацетат/н-гексан 1/1). ИК (KBr): 3408, 2915, 2847, 1622, 1592, 1443, 1413, 1365, 1324, 1086, 1037, 795 см-1. 1H ЯМР (ДМСO-d6): 10,32 (1H, с), 7,02 (1H, д, J=7,8 Гц), 6,73 (1H, д, J=7,8 Гц), 4,72 (1H, д, J=4,3 Гц), 3,94 (1H, м), 2,87-2,67 (3H, м), 2,43 (1H, м), 2,30 (3H, с), 2,27 (3H, с), 1,97 (1H, м), 1,78-1,69 (1H, м).
HRFABMS: Найдено 216,13952, вычислено для C14H18ON 216,13884.
Пример 11
5,8-Диметил-2,3,4,9-тетрагидро-1H-карбазол-3-ол [Соединение № 11]
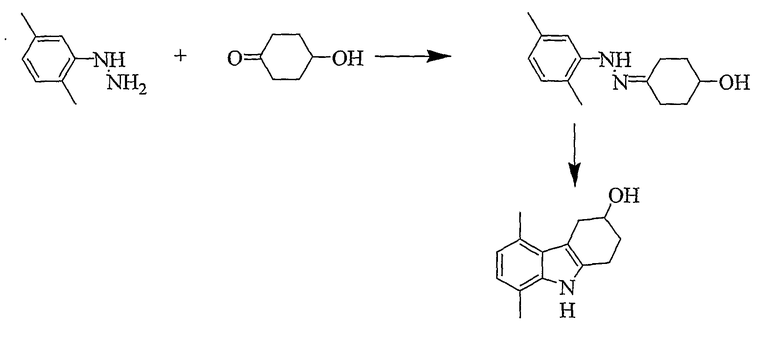
2,5-Диметилфенилгидразин (0,643 г, 3,723 ммоль) суспендируют в уксусной кислоте (20 мл) и этаноле (10 мл). 4-Гидроксициклогексанон (0,425 мг, 3,723 ммоль) растворяют в уксусной кислоте (10 мл), а затем добавляют к реакционной смеси при комнатной температуре при перемешивании. Затем реакционную смесь нагревают при кипении с обратным холодильником в течение 3 часов. Растворители частично удаляют при пониженном давлении, а затем реакционную смесь разбавляют водой (25 мл) и экстрагируют этилацетатом (2×50 мл). Органические слои собирают и сушат (MgSO4) и растворители удаляют при пониженном давлении с получением коричневого масла. Неочищенный продукт очищают с помощью колоночной хроматографии с использованием силикагеля и (этилацетата/н-гексана, 1/2). Фракции, содержащие требуемый материал, собирают и растворитель удаляют при пониженном давлении. Продукт получают в виде бледно-желтого микрокристаллического материала (431 мг, 54%), т.пл. 158-161°C, RF=0,39 (этилацетат/н-гексан, 1/1). ИК (KBr): 3423, 3269, 2930, 2852, 1615, 1580, 1514, 1456, 1378, 1327, 1054, 1030, 801 см-1. 1H ЯМР (ДМСO-d6): 1041 (1H, с), 6,61 (1H, д, J=7,3 Гц), 6,52 (1H, д, J=7,3 Гц), 4,72 (1H, д, J=4,2 Гц), 3,93 (1H, м), 3,23 (1H, м), 2,76-2,67 (3H, м), 2,51 (3H, с), 2,32 (3H, с), 1,98 (1H, м), 1,73 (1H, м).
HRFABMS: Найдено 216,13783, вычислено для C14H18ON 216,13884.
Пример 12
8-Метокси-1,3,4,5-тетрагидротиопирано[4,3-b]индол-2,2-диоксид [Соединение № 12]
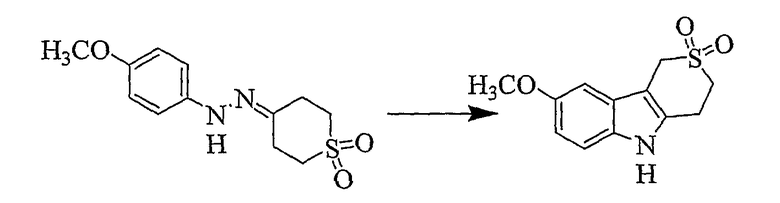
4-Метоксигидразингидрохлорид (1,228 г, 7,031 ммоль) и тетрагидро-4H-тиопиран-4-он-1,1-диоксид (1,042 г, 7,031 ммоль) суспендируют в этаноле (25 мл). Затем реакционную смесь нагревают при кипении с обратным холодильником в течение 1 часа. Твердый материал, который осаждается, отфильтровывают, промывают водой и малым количеством этанола, а затем сушат при пониженном давлении при 60°C с получением желаемого материала в виде коричневого твердого вещества (789 мг, 45%), т.пл. 283-286°C (разложение), ИК (KBr): 3343, 2994, 2937, 1623, 1592, 1484, 1455, 1314, 1269, 1219, 1164, 1101, 1024, 892, 814 см-1. 1H ЯМР (ДМСO-d6): 10,93 (1H, с), 7,21 (1H, д, J=8,7 Гц), 6,95 (1H, д, J=2,3 Гц), 6,73 (1H, дд, J=2,4 & 8,7 Гц), 4,38 (2H, с), 3,74 (3H, с), 3,45 (2H, т, J=6,1 Гц), 3,23 (2H, т, J=6,1 Гц).
HRFABMS: Найдено 252,06877, вычислено для C12H14O3NS 252,06944.
Пример 13
2,3,4,9-Тетрагидро-1H-карбазол-6-карбоновая кислота [Соединение № 13]
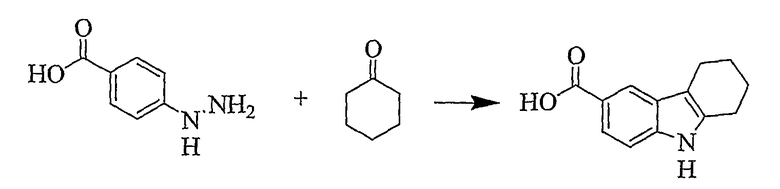
4-Гидразинобензойную кислоту (760 мг, 4,995 ммоль) и циклогексанон (637 мг, 6,490 ммоль) смешивают и нагревают при 70°C в течение 15 минут, а затем добавляют серную кислоту (20 мл, 10%) и реакционную смесь нагревают при кипении с обратным холодильником при перемешивании в течение 30 минут. Реакционную смесь охлаждают до комнатной температуры и образовавшееся твердое вещество отфильтровывают, промывают водой и сушат при пониженном давлении с получением требуемого продукта (1,010 г, 99%) в виде светло-коричневого твердого вещества, т.пл. 275-278°C [Burtner, Lehmann, J. Amer. Chem. Soc., 1940, 62(3), 527-532, т.пл. 279°C]. ИК (KBr): 3399, 2941, 2907, 2848, 1671, 1615, 1465, 1412, 1316, 1275, 1247, 1127, 954, 771 см-1. 1H ЯМР (ДМСO-d6): 12,23 (1H, ушир.), 11,01 (1H, с), 8,01 (1H, с), 7,64 (1H, дд, J=1,6 & 8,4 Гц), 7,29 (1H, д, J=8,4 Гц), 2,71 (2H, т, J=5,0 Гц), 2,65 (2H, т, J=5,0 Гц), 1,85-1,79 (4H, м).
Пример 14
1-Оксо-2,3,4,9-тетрагидро-1H-карбазол-6-карбоновая кислота [Соединение № 14]
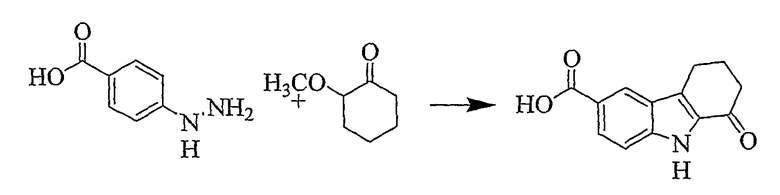
4-Гидразинобензойную кислоту (760 мг, 4,995 ммоль) и 2-метоксициклогексанон (960 мг, 7,493 ммоль) смешивают вместе и нагревают при 80°C в течение 15 минут, а затем добавляют серную кислоту (30 мл, 10%) и реакционную смесь нагревают при кипении с обратным холодильником в течение 30 минут при перемешивании. После охлаждения выпавший в осадок материал отфильтровывают, промывают водой и н-гексаном и сушат при пониженном давлении. Продукт получают в виде коричневого твердого вещества (517 мг, 45%), т.пл. 275-280°C, хотя большая часть материала сублимируется [S., Desikachari, P., Karnam, J. Rajend, Heterocycles, 1986,24(3). 711-717, т.пл. 285-286°C]. Некоторую часть этого материала дополнительно очищают с помощью колоночной хроматографии с использованием силикагеля и этилацетата/метанола, 1/1. Фракции, содержащие продукт, собирают и растворители удаляют при пониженном давлении с получением желтого твердого вещества. ИК (KBr): 3248, 2931, 1680, 1650, 1612, 1417, 1326, 1258, 1162, 901, 826, 770 см-1. 1H ЯМР (ДМСO-d6): 11,60 (1H, с), 8,32 (1H, с), 7,96 (1H, д, J=8,6 Гц), 7,34 (1H, д, J=8,6 Гц), 2,95 (2H, т, J=6,4 Гц), 2,55 (2H, т, J=6,4 Гц), 2,14 (2H, т, J=6,4 Гц).
Пример 15
6-Метокси-2,3,4,9-тетрагидро-1H-карбазол-2-карбоновая кислота [Соединение № 15]
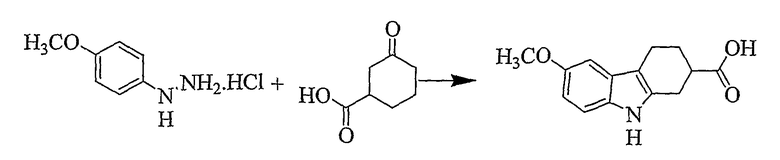
Этот материал получают в соответствии со стандартной процедурой из литературы (выход 80%) в виде белого твердого вещества, RF=0,22 (этилацетат/н-гексан, 1/1), т.пл. 226-228°C [Allen, J. Heterocycl. Chem., 1970, 7, 239, т.пл. 226-227°C]. ИК (KBr): 3386, 2926, 1695, 1591, 1481, 1457, 1432, 1287, 1243, 1214, 1133, 1029, 949, 809 см-1. 1H ЯМР (ДМСO-d6): 12,26 (1H, ушир.), 10,48 (1H, с), 7,13 (1H, д, J=6,6 Гц), 6,82 (1H, д, J=2,4 Гц), 5,54 (1H, дд, J=2,4 & 8,7 Гц), 3,72 (3H, с), 2,85-2,59 (5H, м), 2,14 (1H, м), 1,81 (1H, м).
Пример 16
Простой метил-2,3,4,9-тетрагидро-1H-карбазол-6-иловый эфир [Соединение 16]
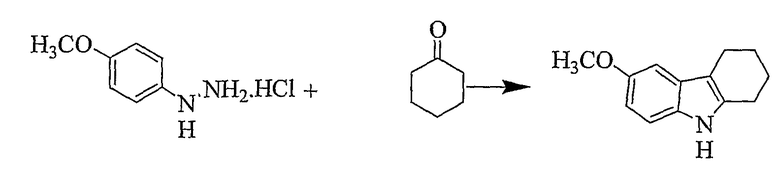
4-Метоксигидразингидрохлорид (1,746 г, 0,01 моль) суспендируют в уксусной кислоте (10 мл) и нагревают до 80°C при перемешивании. Циклогексанон (1,00 г, 0,01 моль) добавляют по каплям при перемешивании. Реакционную смесь нагревают в течение 1 часа, охлаждают до комнатной температуры, а затем выдерживают в холодильнике в течение ночи. Цвет реакционной смеси изменяется до темно-коричневого. Твердое вещество отфильтровывают и промывают малым количеством уксусной кислоты. Дополнительный материал извлекают из фильтрата. Объединенные твердые вещества сушат при пониженном давлении с получением беловатого кристаллического материала (1,596 г, 79%), т.пл. 108-110°C [Clark, D.W.; Jackson, A.H.; Prasirpan, N. and Shannon, P.V.R., J. Chem. Soc. Perkin Trans. II, 1982, 909-916, т.пл. 94-96°C], RF=0,50 (этилацетат/н-гексан 1/4). ИК (KBr): 3389, 2915, 2845, 1622, 1589, 1482, 1434, 1218, 1134, 1028, 826, 798 см-1. 1H ЯМР (ДМСO-d6): 10,39 (1H, с), 7,11 (1H, д, J=8,7 Гц), 6,81 (1H, д, J=2,4 Гц), 6,62 (1H, дд, J=2,4 & 8,6 Гц), 3,73 (3H, с), 2,67 (2H, т, J=5,4 Гц), 2,57 (1H, т, J=5,8 Гц), 1,82-1,77 (4H, м).
Пример 17
7-Метокси-1,2,3,4-тетрагидроциклопента[b]индол [Соединение № 17]
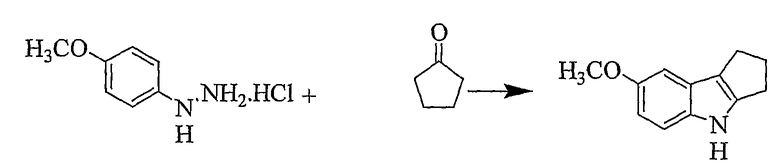
Используемая процедура является такой же, как описана в Примере 16. Продукт получают в виде коричневого твердого вещества (выход 65%), т.пл. 128-130°C, RF=0,60 (этилацетат/н-гексан, 1/4, пластинка для TLC из окиси алюминия. Этот материал разлагается, когда его наносят на силикагель TLC). ИК (KBr): 3317, 2898, 2849, 1581, 1456, 1432, 1298, 1206, 1168, 1085, 1025, 846, 787 см-1. 1H ЯМР (ДМСO-d6): 10,45 (1H, с), 7,21 (1H, д, J=8,8 Гц), 6,87 (1H, д, J=2,4 Гц), 6,67 (1H, дд, J=2,5 & 8,7 Гц), 3,78 (3H, с), 2,85 (2H, т, J=6,7 Гц), 2,76 (2H, т, J=6,7 Гц), 2,48 (2H, квинтет, J=7,3 Гц).
HRFABMS: Найдено 188,10749, вычислено для C12H14NO 188,10754.
Пример 18
1,2,3,4-Тетрагидроциклопента[b]индол-7-карбоновая кислота [Соединение № 18]
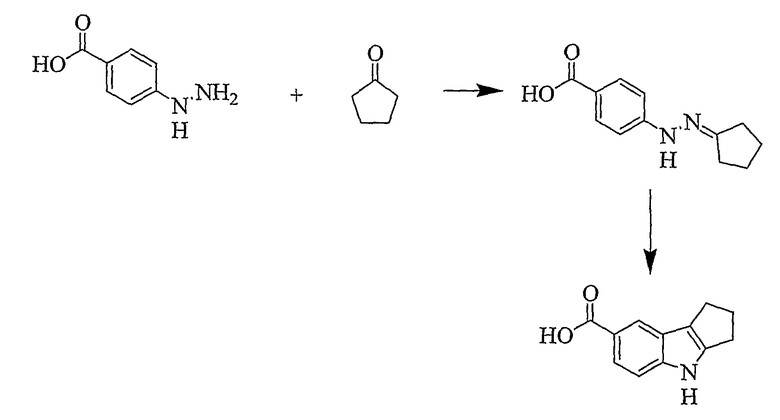
4-Гидразинобензойную кислоту (637 мг, 4,187 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают до 50°C. Циклопентанон (352 мг, 4,187 ммоль) добавляют по каплям при перемешивании к реакционной смеси, которую затем нагревают до 110°C в течение 1 часа. В ходе реакции образуется прозрачный светло-коричневый раствор. Затем реакционную смесь охлаждают до комнатной температуры и желтое твердое вещество, которое осаждается, отфильтровывают и промывают малым количеством уксусной кислоты (разбавленной) и водой, а затем сушат при пониженном давлении при 45°C с получением 4-(2-циклопентилиденгидразино)бензойной кислоты (711 мг, 78%), т.пл. 250-253°C. Гидразоновое промежуточное соединение (300 мг, ммоль) суспендируют в серной кислоте (3 мл, 10%) и нагревают при кипении с обратным холодильником в течение 15 минут. Твердый сиреневый материал, который образуется, отфильтровывают после того, как раствор охлаждается до комнатной температуры, промывают водой и сушат при пониженном давлении (30 мг, 11%), т.пл. 270-274°C (большая часть материала сублимируется, и регистрируется температура плавления сублимировавшихся кристаллов). ИК (KBr): 3380, 2946, 1656, 1616, 1473, 1410, 1347, 1295, 1261, 1129, 770, 746 см-1. 1H ЯМР (ДМСO-d6): 11,17 (1H, с), 7,98 (1H, с), 7,62 (1H, дд, J=1,6 & 8,5 Гц), 7,32 (1H, д, J=8,5 Гц), 2,83 (2H, т, J=7,5 Гц), 2,77 (2H, т, J=6,8 Гц), 2,47 (2H, квинтет, J=7,2 Гц).
HRFABMS: Найдено 202,08733, вычислено для C12H12NO2 202,08680.
Пример 19
5,8-Диметил-2,3,4,9-тетрагидро-1H-карбазол-2-карбоновая кислота [Соединение № 19]
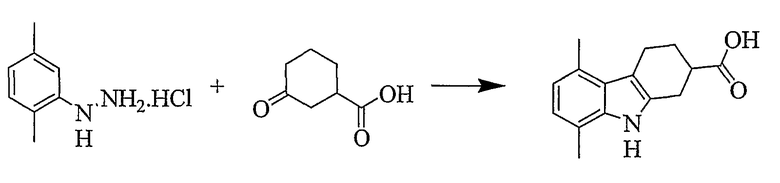
N-(2,5-Диметилфенил)гидразингидрохлорид (243 мг, 1,407 ммоль) растворяют в уксусной кислоте (3 мл), к которой добавляют 3-оксоциклогексанкарбоновую кислоту (200 мг, 1,407 моль), растворенную в уксусной кислоте (2 мл), при перемешивании. Реакционную смесь нагревают при кипении с обратным холодильником в течение 2 часов. Охлажденную реакционную смесь разбавляют насыщенным раствором соли и экстрагируют этилацетатом. Органический слой сушат (MgSO4) и растворитель удаляют при пониженном давлении. Неочищенный продукт наносят на хроматографическую колонку с силикагелем с использованием этилацетата/н-гексана (1/4) в качестве элюента (RF=0,50, этилацетат/н-гексан, 1/1). Продукт получают в виде желтого твердого вещества (153 мг, 45%), т.пл. 228-230°C. ИК (KBr): 3390, 2928, 1702, 1436, 1294, 1230, 946, 800 см-1. 1H ЯМР (ДМСO-d6): 12,21 (1H, с), 10,46 (1H, с), 6,63 (1Н, д, J=7,2 Гц), 6,54 (1H, д, J=7,2 Гц), 3,01-2,74 (5H, м), 2,50 (3H, с), 2,34 (3H, с), 2,13 (1H, м), 1,81 (1H, м).
HRFABMS: Найдено 244,13394, вычислено для C15H18NO2 244,13375.
Пример 20
Оксим (4E)-1,2,3,9-тетрагидро-4H-карбазол-4-она [Соединение № 20]
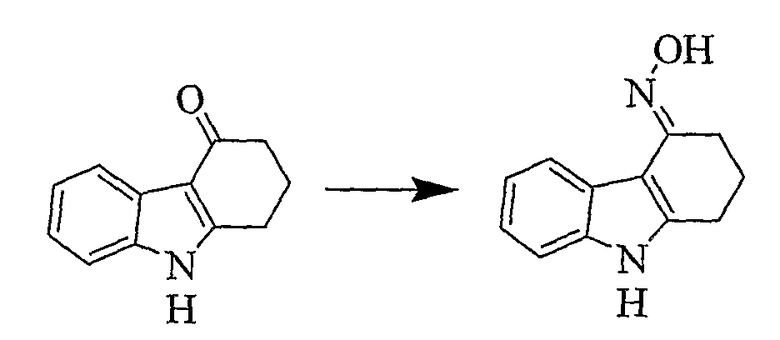
Смесь 1,2,3,4-тетрагидрокарбазол-4-она (450 мг, 2,432 ммоль) гидроксиламингидрохлорида (253 мг, 3,640 ммоль, молярный избыток 1,5), ацетата натрия (298 мг, 3,640 ммоль, молярный избыток 1,5), этанола (5 мл) и воды (2 мл) нагревают при кипении с обратным холодильником в атмосфере азота в течение 4 часов. Охлажденную смесь концентрируют при пониженном давлении и остаток суспендируют в воде. Кристаллический материал собирают посредством фильтрования, промывают водой и сушат при пониженном давлении с получением неочищенного продукта (410 мг, 84%), т.пл. 200-205°C (разложение). Этот материал подвергают хроматографии на силикагеле с помощью этилацетата/н-гексана, 1/3 (RF=0,35). Продукт получают в виде белого кристаллического материала (380 мг, 78%), т.пл. 206-208°C (разложение), (Hester, J.B., J.Org.Chem., 1967, 52, 3804-3807, т.пл. 208,5-210°C). ИК (KBr): 3415, 29-25,1620, 1556, 1481, 1451, 1418, 920, 890, 853, 746 см-1. 1H ЯМР (ДМСO-d6): 11,19 (1H, с), 10,21 (1H, с), 7,89 (1H, д, J=7,6 Гц), 7,31 (1H, д, J=7,6 Гц), 7,08-5,99 (2H, м), 2,79 (2H, т, J=6,1 Гц), 2,67 (2H, т, J=6,1 Гц), 1,91 (2H, квинтет, J=6,2 Гц).
Пример 21
Оксим (3E)-1,2,4,9-тетрагидро-3H-карбазол-3-она [Соединение № 21]
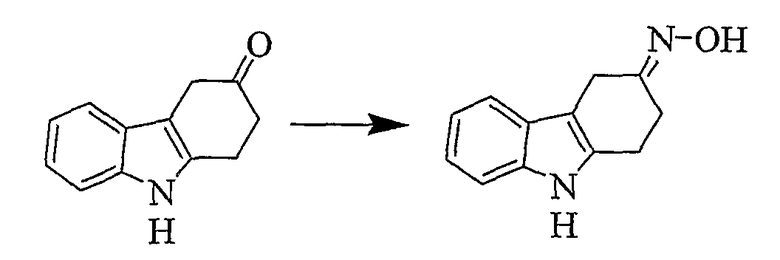
Используемая процедура является такой же, как описана в Примере 20. Требуемый продукт получают в виде светло-коричневого твердого вещества (20 мг, 22%), т.пл. 173-175°C (разложение), RF=0,35 (этилацетат/н-гексан, 1/3). ИК (KBr): 3392, 3280, 1461, 14, 39, 1356, 1327, 1224, 1004, 920, 741 см-1. 1H ЯМР (ДМСO-d6): 10,76 (1H, с), 10,52 (1H, с), 7,39 (1H, д, J=7,7 Гц), 7,27 (1H, д, J=7,7 Гц), 7,02 (1H, т, J=7,0 Гц), 5,94 (1H, т, J=7,0 Гц), 3,50 (2H, с), 2,87 (2H, т, J=6,5 Гц), 2,60 (2H, т, J=6,5 Гц).
HREMS: Найдено 200,09506, вычислено для C12H12N2O 200,09496.
Пример 22
Синтез Соединения № 22
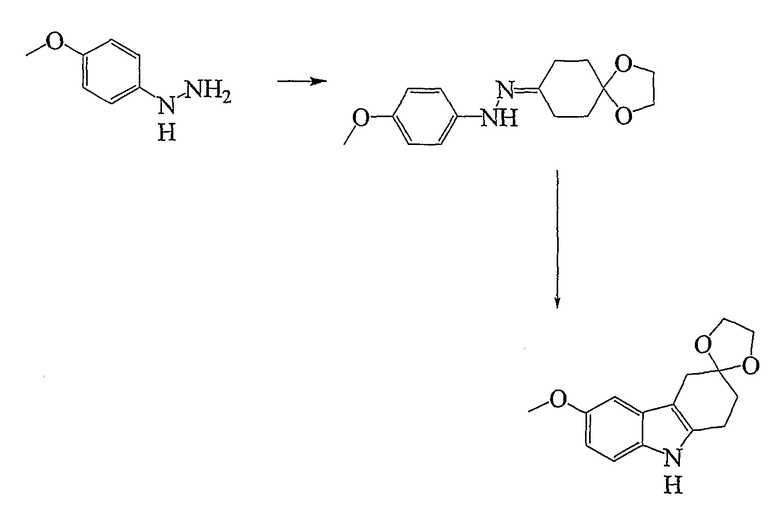
4-Метоксигидразингидрохлорид (1,172 г, 6,712 ммоль) растворяют в воде (25 мл), в которую добавляют насыщенный бикарбонат натрия до тех пор, пока раствор не станет основным и не прекратится выделение пузырьков. Добавляют дихлорметан и органические слои собирают после экстрагирования. Сушка (MgSO4) с последующим удалением растворителя дает требуемый материал в виде бледно-желтого кристаллического материала, который используют на следующей стадии без дополнительной очистки (0,710 г). К 4-метоксигидразину добавляют кетон (806 мг, 5,160 ммоль), а затем толуол (50 мл). Реакционную смесь нагревают при кипении с обратным холодильником в течение 30 минут и затем растворитель удаляют при пониженном давлении с получением продукта, 1,4-диоксаспиро[4,5]декан-8-он (4-метоксифенил)гидразона, в виде коричневого масла, который используют в следующей стадии без дополнительной очистки. Добавляют этиленгликоль (20 мл) и реакционную смесь нагревают при 180°C в течение 3 часов в атмосфере азота. Охлажденный раствор выливают в воду со льдом и экстрагируют дихлорметаном. Органические слои собирают и сушат (MgSO4) и растворитель удаляют при пониженном давлении с получением темно-коричневого масла. Очистка с помощью колоночной хроматографии на силикагеле и элюирование этилацетатом/н-гексаном (1/3) дает требуемый продукт в виде бледно-желтого микрокристаллического материала после перекристаллизации из этилацетата/н-гексана (630 мг, 36%), т.пл. 168-169°C. ИК (KBr): 3345, 2891, 1627, 1597, 1483, 1456, 1326, 1212, 1139, 1120, 1101, 1062, 1031, 951 см-1. 1H ЯМР (ДМСO-d6): 10,50 (1H, с), 7,13 (1H, д, J=8,7 Гц), 6,81 (1H, д, J=2,8 Гц), 6,64 (1H, дд, J=2,5 & 8,7 Гц), 3,95 (2H, с), 3,73 (3H, с), 2,81 (4H, с & т), 1,94 (2H, т, J=6,7 Гц).
HREIMS: Найдено 259,12065, вычислено для C15H17NO3 259,12084.
Пример 23
6-Метокси-1,2,4,9-тетрагидро-3H-карбазол-3-он [AIK-18/49]
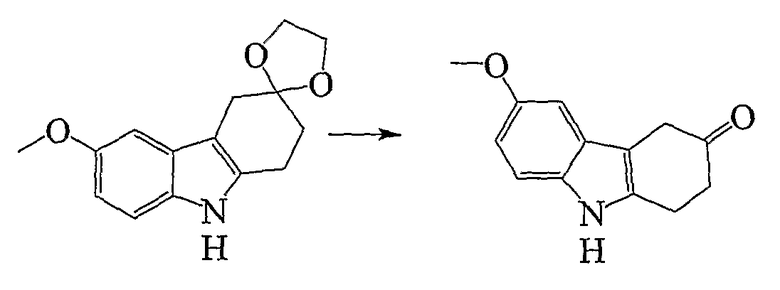
Исходный материал (375 мг, 1,446 ммоль, полученный, как описано в Примере 22), растворяют в тетрагидрофуране (10 мл) и хлористоводородной кислоте (10 мл, 50%) при перемешивании при комнатной температуре. Реакционную смесь нагревают при 40-50°C в течение 4 часов. К охлажденному раствору добавляют по каплям карбонат натрия (водный раствор, насыщенный) при перемешивании до тех пор, пока не прекратится выделение пузырьков. Затем добавляют дихлорметан и реакционную смесь экстрагируют. Органический слой собирают и сушат (MgSO4) и растворитель удаляют при пониженном давлении. Неочищенный продукт наносят на хроматографическую колонку и элюируют этилацетатом/н-гексаном (1/2). Продукт перекристаллизовывают из этилацетата/н-гексана (RF=0,50) с получением чистого материала в виде белого микрокристаллического материала (212 мг, 68%), т.пл. 155-l58°C (Caubere C.; Caubere P.; Renard P.; Bizot-Espiart J.; Jamart-Gregoire B.; Tetrahedron Lett. 1993, 34(43), 6889-6892, т.пл. 149-151°C). ИК (KBr): 3275, 2951, 2898, 1690, 1603, 1486, 1209, 1136, 1020, 827 см-1. 1H ЯМР (ДМСO-d6): 10,73 (1H, с), 7,19 (1H, д, J=8,7 Гц), 6,86 (1H, д, J=2,3 Гц), 6,69 (1H, дд, J=2,5 & 8,7 Гц), 3,73 (3H, с), 3,47 (2H, с), 3,08 (2H, т, J=6,9 Гц), 2,69 (2H, т, J=6,9 Гц).
Пример 24
Протокол
Органотипические культуры срезов гиппокампа получают с использованием основного способа, Pringle et al. [Brain Res. 755, 36-46 (1997)], модифицированного следующим образом.
Детенышей крыс Wistar (возраст 8-11 дней) декапитируют и гиппокамп быстро иссекают в сбалансированный солевой раствор Гейза на льду, дополненном 4,5 мг/мл глюкозы. Срезы разделяют и помещают на планшеты, на вставки для культивирования Millicell CM (4 на лунку) и сохраняют при 37°C/5% CO2 в течение 14 дней. Поддерживающая среда состоит из 25% термически активированной сыворотки лошади, 25% сбалансированного солевого раствора Хэнка (HBSS) и 50% минимальной основной среды с добавленными солями Эрла (MEM), дополненной 1 мМ глутамина и 4,5 мг/мл глюкозы. Среду заменяют каждые 3-4 дней.
Экспериментальную гипоксию осуществляют, как описано ранее (Pringle et al., Stroke 27,21-24 (1996) & Brain Res. 755,36-46 (1997)]. Вкратце, культуры переносят в среду, не содержащую сыворотки (SFM - 75% MEM, 25% HBSS, дополненную 1 мМ глутамина и 4,5 мг/мл глюкозы), содержащую 5 мкг/мл флуоресцентного эксклюзионного красителя йодида пропидия (PI). Культурам дают возможность уравновеситься в SFM в течение 60 минут перед получением изображений. Флуоресценция PI детектируется с использованием инвертированного микроскопа Leica DMIL, соединенного с набором родаминовых фильтров. Любые культуры, в которых на этой стадии детектируется флуоресценция PI, исключаются из дальнейших исследований. Гипоксия индуцируется посредством переноса культур в SFM (+PI), которая насыщается 95% N2/5% CO2. Планшеты для культивирования (без крышек) затем герметизируются в непроницаемой для воздуха камере, в которой атмосфера насыщается 95% N2/5% CO2 посредством непрерывной продувки через нее газа при скорости 10 л/минут в течение десяти минут перед герметизацией, и помещают в инкубатор на 170 минут (общее время гипоксии равно, следовательно, 180 минут). В конце периода гипоксии культуры возвращаются в нормальную по содержанию кислорода SFM, содержащую PI, и помещают обратно в инкубатор на 24 часа.
Повреждение нейронов оценивают с использованием запуска ImageJ на PC. Изображения получают с использованием CCD камеры и сохраняют для анализа off line. Изображения, полученные при прохождении света, регистрируют перед добавлением лекарственных средств, а изображения флуоресценции PI регистрируют в конце 24-часового восстановительного периода после гипоксии. Площадь субрегиона CA1 определяется из изображения, полученного при прохождении света. Площадь флуоресценции PI в CA1 измеряют с использованием пороговой функции на ImageJ и повреждения нейронов выражают как процент CA1, для которого детектируется флуоресценция PI, превышающая фоновую.
Непарные t-тесты Стьюдента используют для оценки статистической значимости.
Ряд соединений исследуются на возможное нейропротекторное действие против гипоксии в органотипических культурах срезов гиппокампа. Соединения № 4, 6, 7, 8, 10, 14, 15, 16, 17, 20, 21, 22 и 23 растворяют в DMSO до концентрации 1 мг/мл.
7β-гидрокси-эпиандростерон (7β-OH EPIA), нейропротекторное соединение, при концентрациях 100 нМ используют в качестве положительного контроля. Исходный раствор 1 мг/мл растворяют в этаноле. Конечные разбавления осуществляют в SFM.
Эффективность всех соединений оценивают с использованием схемы до, во время и после гипоксии - соединения присутствуют в среде 45 минут до гипоксии, 3 часа во время гипоксии и 24 часа после гипоксии.
Результаты приводятся в следующей далее Таблице 2, которая показывает % повреждения нейронов в модели гипоксии по сравнению с контролем (только гипоксия - 100% повреждение). Чем ниже % повреждения, тем более нейропротекторным является соединение. Последний столбец в таблице показывает % повреждения с 7β-OH EPIA (положительный контроль). Все значения являются статистически значимыми.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЕ ИМИДАЗОПИРИДИНА | 2005 |
|
RU2373206C2 |
| ИНДОЛОПИРРОЛОКАРБАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ САХАРОВ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕЙ | 1997 |
|
RU2167880C2 |
| ТРИАЗОЛОВЫЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ПРОТИВОГРИБКОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2146250C1 |
| ТИЕНОПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2142275C1 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2006 |
|
RU2382781C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО И ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2011 |
|
RU2560171C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ИЛИ ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЯ НАКОПЛЕНИЯ МОЧИ | 2011 |
|
RU2559318C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ИЛИ ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОМИАЛГИИ | 2011 |
|
RU2560168C2 |
| БИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ ГАММА-АМИНОКИСЛОТЫ | 2008 |
|
RU2446148C2 |
| N-ГИДРОКСИЛМОЧЕВИНЫ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ | 1995 |
|
RU2152935C2 |
Применение соединений формулы (I):
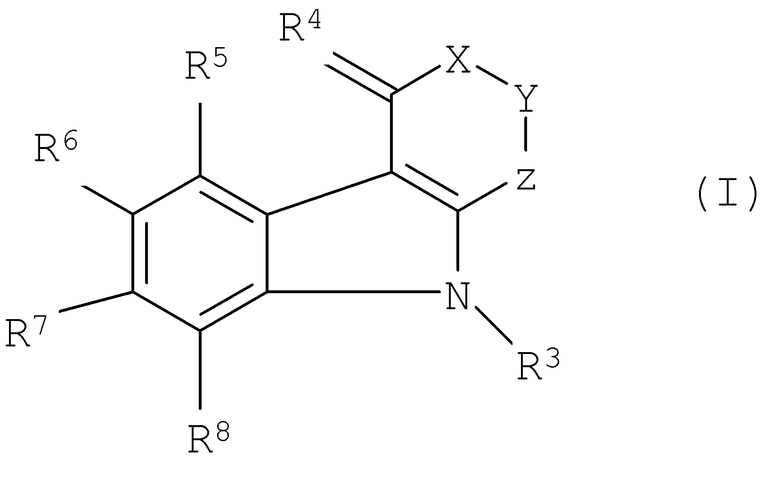
где: Х означает >CR1R2 или, когда R6 не означает Н, Х означает >SO2; Y означает >CR1R2; Z означает >С=O, >СН2, прямую связь; R1 означает Н, R2 означает Н, -СООН, -ОН; или R1 и R2 вместе означают =O, этилендиокси или гидроксиимино группу; R3 означает Н, низшую алкильную группу; R4 означает два Н, =O, гидроксиимино группу; R5 означает Н, низшую алкильную группу, галоген; R6 означает Н, низший алкокси, СООН; R7 и R8 являются одинаковыми или отличными друг от друга и каждый означает Н, низший алкил, галоген и их фармацевтически приемлемых солей и сложных эфиров для производства лекарственного средства, обладающего нейропротекторным действием против гипоксии. 4 н. и 9 з.п. ф-лы, 2 табл.
1. Применение соединений формулы (I):
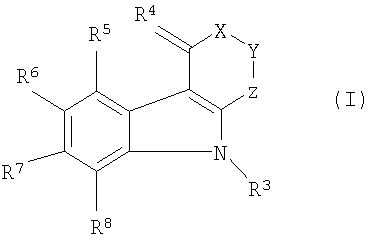
в которой X представляет собой группу формулы >CR1R2 или, когда R6 не представляет собой атом водорода, группу формулы >SO2;
Y представляет собой группу формулы >CR1R2;
Z представляет собой группу формулы >С=O, группу формулы >СН2 или прямую связь;
R1 представляет собой атом водорода, и R2 представляет собой атом водорода, карбоксигруппу или гидроксигруппу;
или
R1 и R2 вместе представляют собой оксогруппу, этилендиоксигруппу или гидроксииминогруппу;
R3 представляет собой атом водорода или низшую алкильную группу;
R4 представляет собой два атома водорода или оксо- или гидроксииминогруппу;
R5 представляет собой атом водорода, низшую алкильную группу или атом галогена;
R6 представляет собой атом водорода, низшую алкоксигруппу или карбоксигруппу;
R7 и R8 являются одинаковыми или отличными друг от друга и каждый представляет собой атом водорода, низшую алкильную группу или атом галогена;
и их фармацевтически приемлемых солей и сложных эфиров для производства лекарственного средства, обладающего нейропротекторным действием против гипоксии.
2. Применение по п.1, в котором:
Х представляет собой группу формулы >CR1R2, где R1 представляет собой атом водорода, и R2 представляет собой атом водорода, гидроксигруппу или карбоксигруппу, или R1 и R2 вместе представляют собой оксогруппу или этилендиоксигруппу;
Y представляет собой группу формулы >CR1R2, где R1 представляет собой атом водорода, и R2 представляет собой атом водорода или карбоксигруппу;
R3 представляет собой атом водорода;
R4 представляет собой два атома водорода или оксогруппу;
R5 представляет собой атом водорода;
R6 представляет собой атом водорода, C1-C4 алкоксигруппу или карбоксигруппу; и R7 и R8 являются одинаковыми или отличными друг от друга и каждый представляет собой атом водорода или C1-C4 алкильную группу;
и их соли и сложные эфиры.
3. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
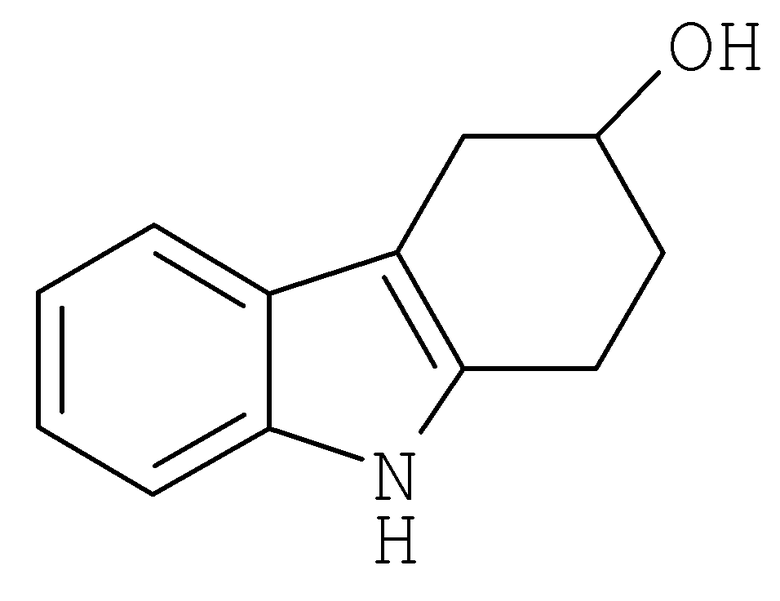
4. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
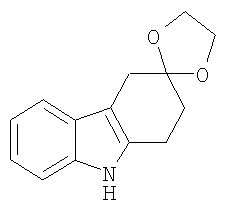
5. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
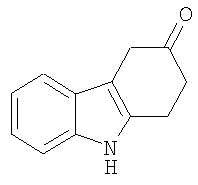
6. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
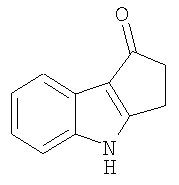
7. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
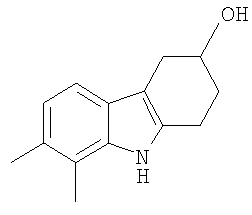
8. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
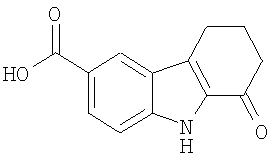
9. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
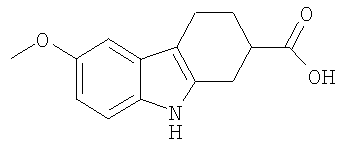
10. Применение по п.1, в котором указанное соединение представляет собой соединение формулы:
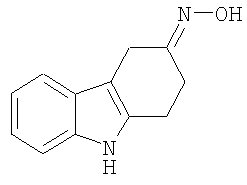
11. Соединение формулы:
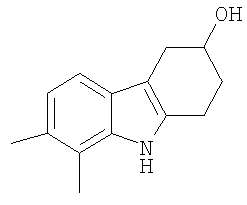
12. Соединение формулы:
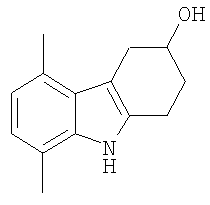
13. Соединение формулы:
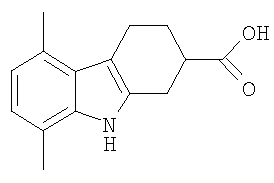
| WO 00/02878 А1, 20.01.2000 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Ж.Общей химии, т.33, 1963, с.3331-3335 | |||
| ГЕТЕРОЦИКЛИЛОКСИ-БЕНЗОИЛГУАНИДИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1995 |
|
RU2160732C2 |
Авторы
Даты
2010-11-27—Публикация
2006-02-02—Подача