Область изобретения
Настоящее изобретение относится к конденсированным циклическим соединениям, к способам использования таких соединений для лечения заболеваний, связанных с рецептором ядерного гормона, таких как раковые заболевания, и к фармацевтическим композициям, содержащим такие соединения.
Уровень техники
Рецепторы ядерного гормона (NHR) составляют многочисленное надсемейство лиганд-зависимых и специфичных к последовательности факторов транскрипции. Члены этого надсемейства оказывают влияние на транскрипцию либо непосредственно, через специфическое связывание с промотором целевых генов (Evans, Science 240: 889-895 (1988)), либо косвенно, через белок-белковые взаимодействия с другими факторами транскрипции (Jonat et al., Cell 62: 1189-1204 (1990), Schuele et al., Cell 62: 1217-1226 (1990), и Yang-Yen et al., Cell 62: 1205-1215 (1990)). Надсемейство рецепторов ядерного гормона (также известное как "надсемейство рецепторов стеорид/тиреоидных гормонов") включает рецепторы для множества гидрофобных лигандов, включая кортизол, альдостерон, эстроген, прогестерон, тестостерон, витамин D3, тиреоидный гормон и ретиноевую кислоту (Evans, 1988, supra). Дополнительно к этим обычным рецепторам ядерного гормона надсемейство включает ряд белков, которые не имеют известных лигандов, называемые орфановыми рецепторами ядерных гормонов (Mangelsdorf et al., Cell 83: 835-839 (1995), O'Malley et al., Mol. Endocrinol. 10: 1293 (1996), Enmark et al., Mol. Endocrinol. 10, 1293-1307 (1996) и Giguere, Endocrin. Rev. 20, 689-725 (1999)). Обычные рецепторы ядерных гормонов вообще являются трансактиваторами в присутствии лиганда и могут быть активными репрессорами или транскрипционно инертными в отсутствие лиганда. Некоторые из орфановых рецепторов проявляют себя так, как если бы они были транскрипционно инертными в отсутствие лиганда. Остальные, тем не менее, проявляют себя как существенные активаторы или репрессоры. Эти орфановые рецепторы ядерного гормона находятся под контролем повсеместных лигандов, которые являются неидентифицированными или не нуждаются в связывании лигандами для проявления их активности.
Одновременно с другими факторами транскрипции рецепторы ядерного гормона имеют модульную структурную формулу, включающую три отдельные области: N-конечный домен вариабельной длины, содержащий транскрипционную активационную функцию AF-I, высоко сохраненный ДНК-связанный домен и умеренно сохраненный лиганд-связанный домен. Лиганд-связанный домен ответственен не только за связывание специфического лиганда, но также содержит транскрипционную активационную функцию, называемую AF-2, и димеризационный домен (Wurtz et al., Nature Struc. Biol. 3, 87-94 (1996), Parker et al. Nature Struc. Biol. 3, 113-115 (1996) и Kumar et al. Steroids 64, 310-319 (1999)). Хотя полная белковая последовательность этих рецепторов может значительно изменяться, все они проявляют как общее структурное расположение, показывающее отклонение от родового архитипа, так и существенную гомологию (особенно идентичность последовательности) на лиганд-связанном домене.
Связанные со стероидом рецепторы ядерного гормона (SB-NHR) составляют надсемейство рецепторов ядерного гормона. Эти рецепторы похожи тем, что они проявляют более сильную гомологию последовательности друг к другу, особенно в лиганд-связанном домене (LBD), по сравнению с другими членами NHR надсемейства (Evans, 1988, supra), и все они используют лиганды, основанные на стероиде. Некоторыми примерами этого надсемейства NHR являются андрогеновый рецептор (AR), эстрогеновый рецептор (ER), прогестероновый рецептор (PR), глюкокортикоидный рецептор (GR), минералокортикоидный рецептор (MR), альдостероновый рецептор (ALDR) и рецептор стероида и ксенобиотика (SXR) (Evans et al, WO 99/35246). На основании сильной гомологии последовательности LBD, некоторые орфановые рецепторы могут также являться членами SB-NHR подсемейства.
Согласно высокой гомологической последовательности, обнаруженной у LBD для каждого SB-NHR, природные лиганды для каждого происходят от общего стероидного ядра. Примеры некоторых лигандов, основанных на стероиде и используемых членами SB-NHR, включают кортизол, альдостерон, эстроген, прогестерон, тестостерон и дигидротестостерон. Специфичность конкретного лиганда, основанного на стероиде, по отношению одного SB-NHR к другому, получают различным замещением в стероидном ядре. Высокое сродство связывания с конкретным SB-NHR, определяемое высоким уровнем специфичности по отношению к этому конкретному SB-NHR, может достигаться только незначительными структурными изменениями в стероидном ядре (например, Waller et al., Toxicol. AppI Pharmacol. 137, 219-227 (1996) и Mekenyan et al., Environ. Sd. Technol. 31, 3702-3711 (1997), сродство связывания для прогестерона по отношению к андрогенному рецептору в сравнении с тестостероном).
Описаны многочисленные синтетически полученные стероидные и нестероидные агонисты и антагонисты членов SB-NHR семейства. Многие из этих лигандов агонистов и антагонистов используются клинически для лечения множества медицинских заболеваний у человека. RU486 является примером синтетического агониста PR, который используется в качестве средства для контроля родов (Vegeto et al., Cell 69: 703-713 (1992)), и Флутамид является примером антагониста AR, который используется для лечения рака простаты (Neri et al, Endo. 91,427-437 (1972)). Тамоксифен является примером тканевого специфического модулятора функции ER, который используется для лечения рака груди (Smigel, J. Nati Рак Inst. 90, 647-648 (1998)). Тамоксифен может действовать как антагонист ER в ткане груди и как агонист ER в кости (Grese et al., Proc. Natl. Acad. Sci. USA 94, 14105-14110 (1997)). Из-за тканеизбирательных действий, проявляемых Тамоксифеном, этот агент и подобные ему агенты, называются "частичным агонистом" или "частичным антагонистом". Дополнительно к синтетически полученным неэндогенным лигандам, неэндогенные лиганды для NHR могут быть получены из пищевых продуктов (Regal et al., Proc. Soc. Exp. Biol. Med. 223, 372-378 (2000) и Hempstock et al., J. Med. Food 2, 267-269 (1999)). Флаваноидные фитоэстрогены являются примером неприродного лиганда для SB- NHR, которые легко получают из пищевых продуктов, таких как соя (Quella et al., J. din. Oncol. 18, 1068-1074 (2000) и Banz et al., J. Med. Food 2, 271-273 (1999)). Способность модулировать транскрипционную активность индивидуального NHR добавлением небольшой молекулы лиганда делает их идеальными мишенями для разработки фармацевтических средств для множества заболеваний.
Как указано выше, неприродные лиганды могут быть синтетически получены для использования в качестве модуляторов функции NHR. В случае с NHR получение неприродного лиганда может включать идентификацию ядра структуры, которое имитирует систему ядра природного стероида. Это может достигаться случайным скринингом против некоторых NHR или направленными подходами, используя доступные кристаллические структуры множества NHR лиганд-связанных доменов (Bourguet et al., Nature 375, 377-382 (1995), Brzozowski, et al., Nature 389, 753-758 (1997), Shiau et al., Cell 95, 927-937 (1998) и Tanenbaum et al., Proc. Natl. Acad. Sd. USA 95, 5998-6003 (1998)). Различное замещение в таком стероид-имитирующем ядре может привести к получению агентов с селективностью для одного рецептора по отношению к другому.
Дополнительно, такие модификации могут использоваться для получения агентов с агонистической или антагонистической активностью для конкретного SB-NHR. Различное замещение в стероид-имитирующем ядре может привести к получению ряда высоко специфичных агонистов и антагонистов со специфичностью, например, для ER по отношению к PR, по отношению к AR, по отношению к GR, по отношению к MR. Такой подход различного замещения сообщался, например, для модуляторов, основанных на хинолине, для стероидного NHR в J. Med. Chem., 41, 623 (1999); WO 9749709; US 5696133; US 5696130; US 5696127; US 5693647; US 5693646; US 5688810; US 5688808 и WO 9619458, все включены в настоящее изобретение в качестве ссылок.
Соединения настоящего изобретения включают ядро, которое выступает как имитатор стероида, и являются полезными в качестве модуляторов функции связанных со стероидом рецепторов ядерного гормона, а также других NHR, описанных далее.
Сущность изобретения
Настоящее изобретение относится к конденсированным циклическим соединениям формулы I и их солям, которые в особенности полезны в качестве модуляторов функции рецептора ядерного гормона:
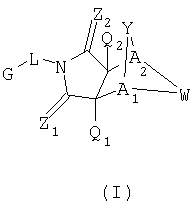
Как используют в формуле I, а также в описании, радикалы имеют следующие значения, если иное не обозначено, и являются для каждого случая независимо выбранными из:
G, которая представляет собой арильную или гетероцикло (например, гетероарильную) группу, где
указанная группа представляет собой моно- или полициклическую группу, замещенную по одному или более положениям, предпочтительно водородом, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, алкинилом или замещенным алкинилом, галогеном, циклоалкилом или замещенным циклоалкилом, циклоалкенил или замещенным циклоалкенилом, арилом или замещенным арилом, гетероцикло или замещенным гетероцикло, арилалкилом или замещенным арилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, CN, R1OC=О, R1C=О, R1C=S, R1HNC=О, R1R2NC=О, HOCR3R3', нитро, R1OCH2, R1O, NH2, NR4R5, SR1, S=OR1, SO2R1, SO2OR1, SO2NR1R1', (R1O)(R1O)P=О, оксо, (R1)(R1')P=О, или (R1')(NHR1)P=О;
Z1 представляет собой О, S, NH или NR6;
Z2 представляет собой О, S, NH или NR6;
a1 представляет собой CR7 или N;
А2 представляет собой CR7 или N;
Y представляет собой J-J'-J'', где J представляет собой (CR7R7')n и n=0-3, J' представляет собой связь или О, S, S=О, SO2, NH, NR7, С=О, ОС=O, NR1C=O, CR7R7', С=CR8R8', R2P=О, R2P=S, R2OP=О, R2NHP=О, ОР=OOR2, ОР=ONHR2, ОР=OR2, OSO2, С=NR7, NHNH, NHNR6, NR6NH, N=N, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло или арил или замещенный арил и J'' представляет собой (CR7R7)n и n=0-3, где Y не является связью;
W представляет собой CR7R7'-CR7R7', CR8=CR8', CR7R7'-C=О, NR9-CR7R7', N=CR8, N=N, NR9-NR9', S-CR7R7', SO-CR7R7', SO2-CR7R7', циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло или арил или замещенный арил, где когда W не является NR9-CR7R7', N=CR8, N=N, NR9-NR9', S-CR7R7', SO-CR7R7', SO2CR7R7 или гетероцикло или замещенным гетероцикло, тогда J' должен быть О, S, S=О, SO2, NH, NR7, ОС=О, NR1C=О, ОР=OOR2, ОР=ONHR2, OSO2, NHNH, NHNR6, NR6NH, или n=N;
Q1 представляет собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероциклоалкил или замещенный гетероциклоалкил, арилалкил или замещенный арилалкил, алкинил или замещенный алкинил, арил или замещенный арил, гетероцикло (например, гетероарил) или замещенный гетероцикло (например, замещенный гетероарил), галоген, CN, R1ОС=О, R4С=O, R5R6C=O, HOCR7R7', нитро, R1OCH2, R1O, NH2, C=OSR1, SO2R1 или NR4R5;
Q2 представляет собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероциклоалкил или замещенный гетероциклоалкил, арилалкил или замещенный арилалкил, алкинил или замещенный алкинил, арил или замещенный арил, гетероцикло (например, гетероарил) или замещенный гетероцикло (например, замещенный гетероарил), галоген, СН, R1OC=О, R4C=О, R5R6NC=О, HOCR7R7', нитро, R1OCH2, R1O, NH2, C=OSR1, SO2Rl или NR4R5;
L представляет собой связь, (CR7R7')n NH, NR5, NH (CR7R7')n, или NR5(CR7R7')n, где n=0-3;
R1 и R1 каждый независимо представляют собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил;
R2 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенным гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил;
R3 и R3 каждый независимо представляют собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, галоген, CN, гидроксиламин, гидроксамид, алкокси или замещенный алкокси, амино, NR1R2, тиол, алкилтио или замещенный алкилтио;
R4 представляет собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкения или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, R1C=О, R1NHC=О, SO2OR1 или SO2NR1R1';
R5 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенным арил, арилалкил или замещенный арилалкил, R1C=О, R1NHC=О, SO2R1, SO2OR1 или SO2NR1R1';
R6 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, CN, ОН, OR1, R1C=О, R1NHC=О, SO2R1, SO2OR1 или SO2NR1R1';
R7 и R7 каждый независимо представляют собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, галоген, CN, OR1, нитро, гидроксиламин, гидроксиламид, амино, NHR4, NR2R5, NOR1, тиол, алкилтио или замещенный алкилтио, R1С=О, R1OC=О, R1NHC=О, SO2R1,SOR1, РО3R1R1', R1R1NC=О, С=OSR1, SO2R1, SO2OR1, или SO2NR1R1', или, где
A1 или А2 содержит группу R7 и W содержит группу R7, указанные R7 групп A1 или А2 и W вместе образуют гетероциклическое кольцо;
R8 и R8' каждый независимо представляют собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, нитро, галоген, CN, OR1, амино, NHR4, NR2R5, NOR1, алкилтио или замещенный алкилтио, С=OSR1, R1OC=О, R1С=О, R1NHC=О, R1R1'NC=О, SO2 OR1, S=OR1, SO2R1, PO3R1R1', или SO2NR1R1'; и
R9 и R9' каждый независимо представляют собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, CN, ОН, OR1, R1С=О, R1OC=О, R1NHC=О, SO2R1, SO2 OR1 или SO2NR1R1';
Соединения формулы I являются новыми, предпочтительная подгруппа имеет следующую формулу Ia:
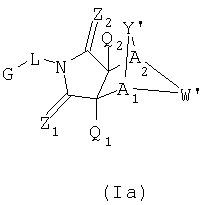
где G, L, Z1, Z2, A1, A2, Q1 и Q2 имеют значения, определенные выше;
Y' представляет собой J-J'-J", где J представляет собой (CR7R7')n и n=0-3, J' представляет собой связь или О, S, S=О, SO2, NH, NR7, CR7R7', R2P=О, R2P=S, R2OP=O, R2NHP-O, OP=OOR2, OP=ONHR2, OSO2. NHNH, NHNR6, NR6NH, N=N, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил или гетероцикло или замещенный гетероцикло и J'' представляет собой (CR7 R7')n и n=0-3, где Y не является связью; и
W' представляет собой CR7R7'-CR7R7', CR7R7'-C=О, NR9-CR7R7', N=CR8, N=N, NR9-
NR9', циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло или арил или замещенный арил, где, когда W не является NR9-CR7R7', N=CR8, N=N, NR9-NR9' или гетероцикло или замещенный гетероцикло, тогда J1 может быть О, S, S=О, SO2, NH, NR7, ОР=OOR2, ОР=ONHR2, OSO2, NHNH, NHNR6, NR6NH или N=N; или альтернативно,
Y' представляет собой NR7-CR7R7' и W представляет собой CR8=CR8'; или альтернативно,
Y' представляет собой CR7R7'-C=О и W' представляет собой NR9-CR7R7';
где R2, R6, R7, R7', R8, R9 и R9' являются, как определено выше, и при условии, что (1) когда Y является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W' является -СН2-СН2-, и A1 и А2 представляют собой СН, тогда G-L не является фенилом, однозамещенным фенилом или фенилом, который является замещенным двумя или больше следующими группами: метокси, галоген, NO2, метилом, СН3-S-, ОН, CO2Н, трифторметилом, -С(O)-С6Н5, NH2,4-7-эпокси, гексагидро-1N-изоиндол-1,3(2Н)дионом или -С(O)-СН3;
(2) когда Y1 является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W' представляет собой СН2-СН2, и один из A1 и А2 представляет собой СН и другой является CR7, тогда G-L не является незамещенным фенилом;
(3) когда Y' является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W' является СН2-СН2, и один из A1 и А2 является СН и другой является С-СН3, тогда G-L не является фенилом, замещенным хлором и/или метилом;
(4) когда Y1 является -О- или -S-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W' является СН2-СН2 и один из A1 и А2 является СН, а другой является СН или С-алкилом, тогда G-L не является N-замещенным пиперазин-алкил- или N-замещенным имидазолидин-алкил-;
(5) когда Y' является -О-; Q1 и Q2 являются водородом, Z1 и Z2 являются О, W' является CH2-CH2, и A1 и А2 являются СН, тогда G-L не является оксазолом или триазолом;
(6) когда Y1 является -О-; Q1 и Q2 являются водородом или метилом, Z1 и Z2 являются О, W' является СН2-СН2, и A1 и А2 являются СН или С-СН3, тогда G-L не является тиазолом или замещенным тиазолом (кроме того, такие соединения, где G-L является необязательно замещенным тиадиазолом или частично насыщенным тиазолом необязательно удаляют при условии, когда A1 и А2 оба являются СН);
(7) когда Y' содержит группу J1, выбранную из S, S=О, SO2, NH, NR7, R2P=O, R2P=S, R2OP=O, R2NHP=О, ОР=OOR2, ОР=ONHR2, OSO2, NHNH, NHR6, NR6NH или N=N, W является CR7R7'-CR7R7', и Z1 и Z2 являются О, тогда G-L не является незамещенным фенилом;
(8) когда Y1 является NR7, W' является незамещенным или замещенным фенилом, и Q1 и Q2 являются водородом, тогда Z1 и Z2 не являются О;
(9) когда Y1 является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W является дигидроизоксазолом, несущим необязательно замещенную фенильную группу и A1 и А2 являются СН, тогда G-L не является незамещенным фенилом или дихлорфенилом;
(10) когда Y' является О, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W' является этиленоксидом и A1 и А2 являются СН, тогда G-L не является метилфенилом или хлорфенилом;
(11) когда Y1 является NR7-CR7R7', W является CR8=CR8', Q1 и Q2 являются водородом, A1 и A2 являются СН, С-СН3, С-СН2-С6Н5 или С-CH2-СН3, и Z1 и Z2 являются О, тогда G-L не является незамещенным фенилом, однозамещенным фенилом или метилпиридинилом;
(12) когда Y1 является CR7R7'-C=О, W' является NR9-CR7R7', Q1 и Q2 являются водородом, A1 и А2 являются СН, и Z1 и Z2 являются О, тогда G-L не является незамещенным фенилом;
(13) когда Y' является CHR7-NR7', где R7 является незамещенным фенилом, метокси или этокси и R7 является незамещенным фенилом, метилом или -С(O)-С6Н5, W является диметоксифениленом или незамещенным фениленом, Z1 и Z2 являются О, Q1 и Q2 являются водородом, и A1 и А2 являются СН, C-CN, С-С(О)-С6Н5, или -С(O)-диметоксифенилом, тогда G-L не является незамещенным фенилом;
(14) соединение формулы Ia не является 6,10-эпитио-4Н-тиено-[3',4':5,6]циклоокт[1,2-f]изоиндол-7,9(5Н,8Н)-дионом, 8-(3,5-дихлорфенил)-6,6а,9а, 10,11,12,-гексагидро-1,3,6,10-тетраметил-2,2,13-триоксидом, (6R,6aR,9aS,10S);
(15) когда Y' является О, W' является -СН2-СН2-, Q1 и Q2 являются метилом, Z1 и Z2 являются О, и A1 и А2 являются СН, тогда G-L не является незамещенным фенилом, фенилом, замещенным метокси, фенилалкилом-, или морфолиналкилом, и ни одно из соединений не присоединено само к себе через группу L, которая является алкиленовой, чтобы образовывать биссоединение;
(16) когда Y' является -O-, Q1 и Q2 являются водородом, Z, и Z2 являются О, W' является CR7R7'-CR7R7' и A1 и А2 являются СН, тогда G-L не является незамещенной фенильной группой; и
(17) когда Y1 является -О-, Q, и Q2 являются водородом, Z1 и Z2 являются О, W' является циклопентилом, циклогексилом, 3-фенил-2-изоксазолином или CR7R7'-
CR7R7', где R7 и R7' каждый независимо определен как Cl, Br, H и 4-бутиролактон и R7 и R7' не являются все одновременно Н и A1 и А2 являются СН, тогда G-L не является незамещенным нафтиловым кольцом или однозамещенным фенильным кольцом, где указанный заместитель является метокси, Br, Cl, NO2, метилом, этилом, СН2-фенилом, S-фенилом, или O-фенилом.
Предпочтительно, соединения формулы I являются мономерными и не содержат внутри других олигомеров или полимеров.
Другой предпочтительной новой подгруппой являются соединения следующей формулы Ib:

где G, Z1, Z2, Q1 и Q2 являются, как определено выше;
Y' представляет собой J-J'-J", где J представляет собой (CR7R7')n и n=0-3, J' представляет собой связь или О, S, S=О, SO2, NH, NR7, CR7R7'', R2P=О, R2P=S, R2OP=O, R2NHP=О, ОР=OOR2, OP=ONHR2, OSO2, NHNH, NHNR6, NR6NH, N=N, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил или гетероцикло или замещенный гетероцикло и J" представляет собой (CR7R7')n и n=0-3, где Y не является связью; и
W' представляет собой CR7R7'-CR7R7', CR7R7'-C=О, NR9-CR7R7', N=CR8, N=N, NR9-NR9'-, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло или арил или замещенный арил, где,
когда W' не представляет собой NR9-CR7R7', N=CR8, N=N, NR9-NR9' или гетероцикло или изамещенный гетероцикло, тогда J' может быть О, S, S=О, SO2, NH, NR7, ОР=OOR2, ОР=ONHR2, OSO2, NHNH, NHNR6, NR6NH или N=N; или альтернативно,
Y' представляет собой CR7R7'-C=О и W представляет собой NR9- CR7R7';
L представляет собой связь; и
A1 и А2 являются, как определено выше, в особенности, когда А и/или А2 являются алкилом или необязательно замещенным алкилом (предпочтительно такими необязательными заместителями являются одна или больше групп V1, определенные ниже), при условии, что когда Y'=О и W'=-СН2-СН2-, тогда по крайней мере один из А1 или A2 не является CH;
при дополнительных условиях (2), (3), (6), (7) и (8), как указано выше.
Соединения формулы I и их соли содержат ядро, которое может служить в качестве имитатора стеорида, ( и не требующего присутствия типичного стеорида (например, аналог циклопентанопергидрофенантреновый структурный аналог).
Подробное описание изобретения
Далее следуют определения терминов, используемых в описании к настоящему изобретению. Первоначальные определения предназначены для группы или для термина, принадлежащего к этой группе по настоящему изобретению или к термину как таковому, употребляющемуся на протяжении описания или или относящемуся к части другой группы, если иное не обозначено.
Термины "алкил" и "алк" относится к прямому или разветвленному цепочечному алкановому (углеводородному) радикалу, содержащему от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода. Примеры таких групп включают, без ограничения, метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, нонил, децил, андецил, додецил и подобные. "Замещенный алкил" относится к алкильной группе, замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями, по любому доступному месту присоединения. Примеры заместителей включают, без ограничения, одну или более следующих групп: галоген (например, отдельный галогеновый заместитель или множественные галогеновые заместители образующие, в последнем случае, такие группы, как перфторалкильная группа или алкильные группы, несущие Cl3 или CF3), алкокси, алкилтио, гидрокси, карбокси (то есть, -СООН), алкоксикарбонил, алкилкарбонилокси, амино (то есть, -NH2), карбамоил или замещенный карбомоил, карбамат или замещенный карбамат, мочевину или замещенную мочевину, амидинил или замещенный амидинил, тиол (то есть -SH), арил, гетероцикл, циклоалкил, гетероциклоалкил, -S-арил, -S-гетероцикл, -S=O-арил, -S=O-гетероцикл, арилалкил -O-, -S(O)2-арил, -S(O)2-гетероцикл, -NHS(O)2-арил, -NHS(O)2-гетероцикл, -NHS(O)2NH-арил, -NHS(O)2NH-гетероцикл, -Р(O)2-арил, -Р(O)2-гетероцикл, -NHP(O)2-арил, -NHP(O)2-гетероцикл, -NHP(O)2NH-арил, -NHP(O)2NH-гетероцикл, -O-арил, -O-гетероцикл, -NH-арил, -NH-гетероцикл, -NHC=O-арил, -NHC=O-алкил, -NHC=O-гетероцикл, -ОС=O-арил, -ОС=O-гетероцикл, -NHC=ONH-арил, -NHC=ONH-гетероцикл, -ОС=OO-арил, -ОС=OO-гетероцикл, -ОС=ONH-арил. -ОС=ONH-гетероцикл, -NHC=OO-арил, -NHC=OO-гетероцикл, -NHC=OO-алкил, -С=ONH-арил, -С=ONH-гетероцикл, -С=OO-арил, -С=OO-гетероцикл, -N(алкил)S(O)2-арил, -N(алкил)S(O)2-гетероцикл, -N(алкил)S(O)2NH-арил, -N(алкил)S(O)2NH-гетероцикл,-N(алкил)P(O)2-арил,-N(алкил)Р(O)2-гетероцикл, -N(алкил)P(O)2NH-арил, -N(алкил)P(O)2NH-гетероцикл, -N(алкил)-арил, -N(алкил)-гетероцикл, -N(алкил)С=O-арил, -N(алкил)С=O-гетероцикл, -N(алкил)С=ONH-арил, -N(алкил)С=ONH-гетороцикл,-OC=ON(алкил)-арил,-ОС=ON(алкил)-гетероцикл, -N(алкил)С=OO-арил, -N(алкил)С=OO-гетероцикл, -С=НА(алкил)-арил, -С=ON(алкил)-гетероцикл,-NHS(O)2N(алкил)-арил,-NHS(O)2N(алкил)-гетероцикл, -NHP(J)2N(алкил)-арил, NHP(O)2N(алкил)-гетероцикл, -NHC=ON(алкил)-арил, -NHC=ON(алкил)-гетероцикл,-N(алкил)S(O)2N(алкил)-арил, (алкил)S(O)2N(алкил)-гетероцикл, -N(алкил)Р(O)2N(алкил)-арил, N(алкил)P(O)2N(алкил)-гетероцикл, -N(алкил)С=ON(алкил)-арил, и -N(алкил)С=ON(алкил)-гетероцикл. В упомянутых выше определениях заместителей, в каждом случае, группы, такие как "алкил", "арил" и "гетероцикл" могут сами быть необязательно замещенными; например, "алкил" в группе "NCH=OO-алкил", упомянутый выше, может быть необязательно замещенным так, что оба "NHCOO-алкил" и "NHC=OO-замещенный алкил" являются примерами типичных заместителей. Примеры алкильные заместителей также включают группы, такие как "Т" и "T-R12" (которые определены ниже), в особенности, для замещенных алкильных групп внутри A1 или А2.
Термин "алкенил" относится к прямому или разветвленному цепочечному углеводородному радикалу, содержащему от 2 до 12 атомов углерода и по крайней мере одну углерод-углеродную двойную связь. Примеры таких групп включают этенил или аллил. "Замещенный алкенил" относится к алкенильной группе, замещенной одним или более заместителей, предпочтительно от 1 до 4 заместителями, в любом доступном месте присоединения. Примеры заместителей включают, без ограничения, алкил или замещенный алкил, так же как те группы, которые упомянуты выше как примеры алкильных заместителей.
Термин "алкинил" относится к прямому или разветвленному цепочечному углеводородному радикалу, содержащему от 2 до 12 атомов углерода и по крайней мере одну углерод-углеродную тройную связь. Примеры таких групп включают этинил. "Замещенный алкинил" относится к алкинильной группе, замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями, в любом доступном месте присоединения. Примеры заместителей включают, без ограничения, алкил или замещенный алкил, так же как те группы, которые упомянуты выше как примеры алкильных заместителей.
Термин "циклоалкил" относится к полностью насыщенной циклической углеводородной группе, содержащей от 1 до 4 кольца и от 3 до 8 углеродов в кольце. Примеры таких групп включают циклопропил, циклобутил, циклопентил, циклогексил и так далее. "Замещенный циклоалкил" относится к циклоалкильной группе, замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями, в любом доступном месте присоединения. Примеры заместителей включают, без ограничения, нитро, циано, алкил или замещенный алкил, так же как те группы, которые упомянуты выше как примеры алкильных заместителей, и как предварительно упомянутые как предпочтительные арильные заместители в определение для G. Примеры заместителей также включают спиро-присоединенные или конденсированные циклические заместители, главным образом циклоалкенил или замещенный циклоалкенил.
Термин "циклоалкенил" относится к частично ненасыщенной циклической углеводородной группе, содержащей. от 1 до 4 колец и от 3 до 8 углеродов в кольце. Примеры таких групп включают циклобутенил, циклопентенил, циклогексенил и так далее "Замещенный циклоалкенил" относится к циклоалкенильной группе, замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями, в любом доступном месте присоединения. Примеры заместителей включают, без ограничения нитро, циано, алкил или замещенный алкил, так же как те группы, которые упомянуты выше как примеры алкильных заместителей, и как предварительно упомянутые как предпочтительные арильные заместители в определении для G. Примеры заместителей также включают спиро-прикрепленные или конденсированные циклические заместители, главным образом циклоалкил или замещенный циклоалкил.
Термины "алкокси" или "алкилтио" относятся к алкильным группам, как описано выше, связанным через кислородный мостик (-O-) или мостик из серы (-S-) соответственно. Термины "замещенный алкокси" или "замещенный алкилтио" относится к замещенным алкильным группам, как описано выше, связанным через кислородный мостик или мостик из серы соответственно.
Термин "алкоксикарбонил" относится к алкоксигруппе, связанной через карбонильную группу.
Термин "алкилкарбонил" относится к алкильным группам, связанным через карбонильную группу.
Термин "алкилкарбонилокси" относится к алкилкарбонильной группе, связанной через кислородный мостик.
Термины "арилалкил", "замещенный арилалкил," "циклоалкилалкил," "замещенный циклоалкилалкил," "циклоалкенилалкил", "замещенный циклоалкенилалкил", "гетероциклоалкил" и "замещенный гетероциклоалкил" относятся к арилу, циклоалкилу, циклоалкенилу и гетероциклогруппе, связанным через алкильные группы, замещенные арильной, циклоалкильной, циклоалкенильной или гетероцикло и/или алкильной группой, которая обозначена как "замещенная."
Термин "арил" относится к циклическим, ароматическим углеводородным группам, которые имеют от 1 до 5 ароматических колец, главным образом моноциклической или бициклической группам, таким как фенильная, бифенильная или нафтиловая, которая содержит два или больше ароматических кольца (бициклическое, и так далее), ароматические кольца арильной группы могут быть объединены в одной точке (например, бифенил) или сконденсированы (например, нафтил, фенантренил и подобные). "Замещенный арил" относится к арильной группе, замещенной с помощью одного или более заместителей, предпочтительно 1, 2, 3, 4 или 5 заместителей, в любом месте присоединения. Примеры заместителей включают, без ограничения, нитро, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, циано, алкил-S(O)m- (m=0,1 или 2), алкил или замещенный алкил, так же как те группы, которые упомянуты выше как примеры алкильных заместителей и как предварительно упомянутые в качестве предпочтительных арильных заместителей в определении для G. Примеры заместителей также включают конденсированные "циклические заместители, такие как гетероцикло или циклоалкенил или замещенный гетероцикло или циклоалкенильные группы (например, таким образом образованный фторенил, тетрагидронафталинильная или дигидроинденильная группа).
"Карбамоил" относится к группе -CONH-, которая связана по одному концу с остатком молекулы и по другому - с водородом или органическим компонентом (таким как алкил, замещенный алкил, арил, замещенный арил, гетероцикл, алкилкарбонил, гидроксил и замещенный азот). "Карбамат" относится к группе -O-CO-NH-, которая связана по одному концу с остатком молекулы и по другому - с водородом или органическим компонентом (таким, как указан выше). "Мочевина" относится к группе -NH-CO-NH-, которая связана по одному концу с остатком молекулы и по другому с водородом или органическим компонентом (таким, как указан выше). "Амидинил" относится к группе -С(= NH)(NH2). "Замещенный карбамоил," "замещенный карбамат," "замещенная мочевина" и "замещенный амидинил" относятся к карбамоильной, карбаматной, мочевинной или амидинильной группам, как описано выше, в который одна или больше водородных групп являются замененные органическим компонентом (таким, как указан выше).
Термины "гетероцикл", гетероциклический" и "гетероцикло" относится к полностью насыщенным или частично или полностью ненасыщенным, включая ароматические (то есть "гетероарил") циклическим группам (например, от 3 до 7 членным моноциклическим, от 7 до 11 членным бициклическим или от 10 до 16-членным трициклическим кольцевым системам), которые имеют по крайней мере одним гетероатом по крайней мере в одном углеродсодержащем кольце. Каждое кольцо гетероциклической группы, содержащее гетероатом может иметь 1,2, 3, или 4 гетероатомов, выбранных из атомов азота, атомов кислорода и/или атомов серы, где гетероатомы азота и серы могут необязательно быть окисленными и гетероатомы азота могут необязательно быть кватернизированы. (Термин "гетероарилий" относится к гетероарильной группе, имеющей кватернизированный атом азота и, таким образом, положительный заряд.) Гетероциклическая группа может быть присоединена к остатку молекулы через любой гетероатом или атомом углерода кольца или кольцевой системы. Примеры моноциклических гетероциклических групп включают этиленоксид, азетидинил, пирролидинил, пирролил, пиразолил, оксетанил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, оксазолил, оксазолидинил, изоксазолинил, изоксазолил, тиазолил, тиадиазолил, тиазолидинил, изотиазолил, изотиазолидинил, фурил, тетрагидрофурил, тиенил, оксадиазолил, пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролодинил, 2-оксоазепинил, азепинил, гексагидродиазепинил, 4-пиперидонил, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, тетразолил, тетрагидропиранил, морфолинил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, 1,3-диоксолан и тетрагидро-1,1-диоксотиенил, и тому подобное. Примеры бициклических гетероциклических групп включают индолил, изоиндолил, бензотиазолил, бензодиоксолил, бензоксазолил, бензоксадиазолил, бензотиенил, хинуклидинил, хинолинил, тетрагидроизохинолинил, изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофурил, бензофуразанил, хромонил, кумаринил, бензопиранил, пиннолинил, хиноксалинил, имидазолил, пирролопиридил, фуропиридинил (такие, как фуро[2,3-с]пиридинил, фуро[3,2-b]пиридинил] или фуро[2,3-b]пиридинил), дигидробензодиоксинил, дигидродиоксидобензотиофенил, дигидроизоиндолил, дигидроиндолил, дигидрохинолинил, дигидрохиназолинил (такие, как 3,4-дигидро-4-оксо-хиназолинил), триазинилазепинил, тетрагидрохинолинил и подобные. Примеры трициклических гетероциклических групп включают карбазолил, бензидолил, фенантролинил, дибензофуранил, акридинил, фенантридинил, ксантенил и тому подобное.
"Замещенный гетероцикл," "замещенный гетероциклический" и "замещенный гетероцикло" (такие как "замещенный гетероарил") относится к гетероциклам, гетероциклическим или гетероциклогруппам, замещенным одним или более заместителями, предпочтительно от 1 до 4 заместителями, в любом доступном месте присоединения. Примеры заместителей включают, без ограничения, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, нитро, оксо (то есть = О), циано, алкил-S(O)m- (m=0, 1 или 2), алкил или замещенный алкил, так же как те группы, которые упомянуты выше как типичные алкильные заместители и как предварительно упомянутые в качестве предпочтительных гетероциклозаместителей в определении для G.
Термин "четвертичный азот" относится к а тетравалентному положительно заряженному атому азота, включая, например, положительно заряженный азот в тетраалкиламмонийной группе (например, тетраметиламмоний, N-метилпиридиний), положительно заряженный азот в протонированной аммонийной разновидности (например, триметилгидроаммоний, N-гидропиридиний), положительно заряженный азот в амино N-оксидах (например, N-метил-морфолин-N-оксид, пиридин-N-оксид) и положительно заряженный азот в N-аминоаммонийной группе (например, N-аминопиридиний).
Термины "галогенген" или "гало" относится к хлору, брому, фтору или иоду.
Термины "гидроксиламин" и "гидроксиламид" относятся к группам OH-NH-и ОН-NH-CO- соответственно.
Когда функциональная группа определена как "защищенная", это означает, что группа в модифицированной форме преобразована, чтобы смягчить, в основном устранить нежелательные побочные реакции по защищенному положению. Пригодные защитные группы для способов и соединений, описанных в настоящем изобретении включают, без ограничения, те, которые описаны в известных монографиях, таких как Greene, Т. W. et al., Protective Groups in Organic Synthesis, Wiley, N.Y. (1991).
Когда используют термины, такие как "(CRR)n", это означает необязательно замещенную алкильную цепочку, находящуюся между двумя фрагментами, с которыми она связана, длина которой определяется интервалом, который определяет термин n. Примером этого является цепочка с n=0-3, содержащая от нуля до трех (CRR) звеньев, существующая между двумя фрагментами, которые прикреплены к первому и последнему (CRR) звену. В ситуации, когда термин n имеет значение ноль (n=0), связь, существующая между двумя фрагментами, прикреплена к (CRR).
Если иное не обозначено, любой гетероатом с ненасыщенной валентностью, как предполагается, присоединяет атомы водорода в количестве, достаточном для насыщения всех валентностей.
Двухвалентные группы, такие как те, что определены как W (например, NR -CR7R7'), могут быть связаны в любом направлении с остатком молекулы (например, 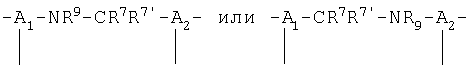 для вышеупомянутой группы в определении W).
для вышеупомянутой группы в определении W).
Карбоксилатный анион относится к отрицательно заряженной группе -СОС-. Соединения формулы I образуют соли, которые находятся также в рамках настоящего изобретения. Ссылка на соединения формулы I в настоящем изобретении, как должно быть понятно, включает ссылку на их соли, если иное не обозначено. Термин "соль(и)", как используют в настоящем изобретении, означает кислые и/или основные соли, образованные с неорганическими и/или органическими кислотами и основаниями. Кроме того, когда соединение формулы I содержит оба: основной компонент, такой как, без ограничения, пиридин или имидазол, и кислый компонент, такой как, без ограничения, карбоновые кислоты, могут быть образованы цвиттерионы ("внутренние соли") и включены в термин "соль(и)", как используют в настоящем изобретении. Фармацевтически приемлемые (то есть нетоксичные, физиологически приемлемые) соли являются предпочтительными, хотя другие соли являются также полезными, например, при выделении или очистке в процессе получения соединений. Соли соединения формулы I могут быть образованы, например, при взаимодействии соединения формулы I с определенным количеством кислоты или основания, таким как эквивалентное количество, в такой среде, из которой соль выпадает в осадок или в водной среде, с последующей лиофилизацией.
Соединения формулы I, которые содержат основной компонент, такой как, без ограничения, амин или пиридин или имидазольное кольцо, могут образовывать соли с множеством органических и неорганических кислот. Примеры кислотно-аддитивных солей включают ацетаты (такие, как образованные с уксусной кислотой или тригалогенуксусной кислотой, например, трифторуксусной кислотой), адипаты, альгинаты, аскорбаты, аспартаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, фумараты, глюкогептаноаты, глицерофосфаты, гемисульфаты, гептаноаты, гексаноаты, гидрохлориды, гидробромиды, гидроиодиды, гидроксиэтансульфонаты (например, 2-гидроксиэтансульфонаты), лактаты, малеаты, метансульфонаты, нафталинсульфонаты (например, 2-нафталинсульфонаты), никотинаты, нитраты, оксалаты, пектинаты, персульфаты, фенилпропионаты (например, 3-фенилпропионаты), фосфаты, пикраты, пивалаты, пропионаты, салицилаты, сукцинаты, сульфаты (такие, как образованные с серной кислотой), сульфонаты (такие, как упомянутые в настоящем изобретении), тартраты, тиоцианаты, толуолсульфонаты, такие как тозилаты, ундеканоаты, и тому подобное.
Соединения формулы I, которые содержат кислый компонент, такой как, без ограничения, карбоновая кислота, могут образовывать соли со множеством органических и неорганических оснований. Примеры основных солей включают соли аммония, соли щелочных металлов, таких как соли натрия, лития и калия, соли щелочноземельных металлов, таких как соли кальция и магния, соли с органическими основаниями (например, органические амины), такие как бензатины, дициклогексиламины, гидрабамины (образованные с N,N-бис(дегидроабиетил)этилендиамином), N-метил-D-глюкамины, N-метил-О-глюкамиды, трет-бутил амины и соли с аминокислотами, такими как агринин, лизин и подобные. Основные азотсодержащие группы могут быть кватернизированы с помощью агентов, таких как низшие алкилгалоиды (например метил, этил, пропил и бутил хлориды, бромиды и иодиды), диалкилсульфаты (например диметил, диэтил, дибутил и диамилсульфаты), длинноцепочечные галоиды (например децил, лаурил, миристил и стеарил хлориды, бромиды и иодиды), аралкилгалоиды (например бензил и фенэтилбромиды) и остальные.
Пролекарства и сольваты соединений также рассмотрены в настоящем изобретении. Термин "пролекарство", как используют в настоящем изобретении, означает соединение, которое после введения в субъект, подвергается химическим превращениям с помощью метаболических или химических процессов, что дает соединение формулы I или его соль и/или их сольват. Сольваты соединений формулы I включают, например, гидраты.
Соединения формулы I и их соли могут существовать в их таутомерной форме (например, как амидо или иминоэфир). Подобные таутомерные формы рассмотрены в настоящем изобретении как его часть.
Все стереоизомеры соединений по настоящему изобретению (например, те, которые могут существовать благодаря асимметричным атомам углерода с различными заместителями), включая энантиомерные и диастереомерные формы, рассмотрены в рамках настоящего изобретения. Индивидуальные стереоизомеры соединений по изобретению могут, например, быть в основном свободными от других изомеров (например, как чистый или в основном чистый оптический изомер, имеющий специфическую активность) или могут смешиваться, например, как рацематы или все другие, или другие выбранные стереоизомеры. Хиральные центры соединений настоящего изобретения могут иметь S или R конфигурацию, как определяют Рекомендации IUPAC, 1974. Рацемические формы могут быть разделены с помощью физических методов, таких как, например, фракционная кристаллизация, разделение или кристаллизация диастереоизомерных производных или разделение с помощью хиральной хроматографии на колонке. Индивидуальные оптические изомеры могут быть получены из рацематов с помощью любого пригодного способа, включая без ограничения, обычные способы, такие как, например, формирование соли с оптически активной кислотой, а затем кристаллизация.
Все конфигурационные изомеры соединений настоящего изобретения рассмотрены любо в смеси, либо в чистом или в основном чистом состоянии. Определение соединений настоящего изобретения включает оба цис (Z) и транс (Е) алкенизомеры, так же как цис и транс изомеры циклического углеводорода или гетероциклоколец. В некоторые случаях, например, эксо- или эндоконформация может быть предпочтительнее для конденсированной кольцевой системы, связанной с G-L в формуле I. Например, для антагонистов андрогенового рецептора (или селективных модуляторов андрогенового рецептора), где Y является О или NR7, эксоконфигурация может быть предпочтительнее, в то время как для других определений Y, эндоконфигурация может быть предпочтительнее. Как может быть оценено, предпочтительная конфигурация может быть функцией отдельных соединений и их предпочтительной активности. Разделение конфигурационных изомеров может быть достигнуто с помощью любого пригодного способа, такого как хроматография на колонке.
На протяжении всего описания группы и их заместители могут быть выбраны, чтобы обеспечить стабильность компонентов и соединений.
Воплощения, обозначенные в настоящем описании как примерные или предпочтительные, должны служить только иллюстрацией, но не ограничением.
Способы получения
Соединения настоящего изобретения могут быть получены с помощью способов, таких как те, которые изображены на следующих схемах от I до XI. Растворители, температуры, давления и другие условия реакции могут легко быть выбраны средним специалистом в данной области знаний. Исходные продукты являются коммерчески доступными, или они могут быть легко получены с помощью одного из обычных приемов в данной области знаний. Комбинированные технические приемы могут быть применены при получении соединений, например, если промежуточные продукты несут группы, пригодные для этих технических приемов. Смотри следующие ссылки, которые описывают другие способы, которые могут быть применены для получения соединений настоящего изобретения: Li, et al., Eur. J. Org. Chem. 9, 1841-1850 (1998); Li, Y-Q, Synlett. 5, 461-464 (1996); Thiemann, et al., Bull. Chem. Soc. Jpn. 67, 1886-1893 (1994); Tsuge et al., Heterocydes 14, 423-428 (1980); Ward et al., Can. J. Chem. 75, 681-693 (1997); Ward et al, Can. J. Chem. 69, 1487-1497 (1991); Ward et al., Tetpahedron Lett. 31, 845-848 (1990); Fleming et al., J. Org. Chem. 44, 2280-2282 (1979); Jankowski et al., J. Organomet. Chem. 595, 109-113 (2000); Keglevich et al., J. Organomet. Chem. 579, 182-189 (1999); Keglevich et al, J. Organomet. Chem. 570, 49-539 (1998); Jankowski et al, Hetroat. Chem. 7, 369-374 (1996); Jankowski et al, J. Am. Chem. Soc. 113, 7011-7017 (1991); Quin et al, Tetrahedron Lett. 31,6473-6476 (1990); Quin et al, J. Org. Chem. 59, 120-129 (1994); Quin et al, J. Org. Chem. 58, 6212-6216 (1993); Quin et al, Phosphorous, Sulfur Silicon Relat. Elem. 63, 349-362 (1991); Quin et al, Hetroat. Chem. 2, 359-367 (1991); Hussong et al, Phosphorus Sulfur. 25, 201-212 (1985); Quin et al., J. Org. Chem. 51, 3341-3347 (1986); Myers et al, J. Am. Chem. Soc. 114, 5684-5692 (1992); Myers et al, J. Am. Chem. Soc. 113, 6682-6683 (1991); Shen et al., US Patent No. 5817679; Cordone et al, J. Am. Chem. Soc. Ill, 5969-5970 (1989); Jung et al, J. Chem. Soc. Commun. 630-632 (1984); Lay et al, J. Am. Chem. Soc. 104, 7658-7659 (1982); Gonzalez et al, J. Am. Chem. Soc. 117, 3405-3421 (1995); Kreher et al, Chem Ber. 125, 183-189 (1992); Simig et al, Synlett. 7, 425-426 (1990); Sha et al, J. Org. Chem. 55, 2446-2450 (1990); Drew et al, J. Chem. Soc., Perkin Trans. 17, 1277-1284 (1985); Kreher et al, Anorg. Chem., Org Chem. 31B, 599-604 (1976); Avalos et al, Tetrahedron Lett. 39, 9301-9304 (1998); Gousse et al, Macromolecules 31, 314-321 (1998); Mikhailyuchenko et al, Khim. Geterotsikl Soedin. 6, 751-758 (1993); Lubowitz et al, US Patent №4476184; Padwa et al., J. Org. Chem. 61, 3706-3714 (1996); Schlessinger et al, J. Org. Chem. 59, 3246-3247 (1994); Buchmeiser et al., WO Publication №9827423; Tanabe et al., Japanese Patent Document JP 07144477; Mochizucki et al, Japanese Patent Document JP 63170383; Hosoda et al, Japanese Patent Document JP 62053963; Onaka et al, Japanese Patent Document JP 62053964; Kato et al, Japanese Patent Document JP 53086035; Kato et al, Japanese Patent Document JP 51088631; Tottori et al, Japanese Patent Document JP 49124225; Augustin et al, German Patent Document DD101271; Названное et al, French Patent Document FR 2031538; Gousse et al, Polym. Int. 48, 723-731 (1999); Padwa et al, J. Org. Chem. 62, 4088-4096(1997); Theurillampem-Moritz et al, Tetrahedron: Asymmetry 7, 3163-3168 (1996); Mathews et al, J. Carbohydr. Chem. 14, 287-97 (1995); Srivastava et al, Natl Acad. Sd. Lett. (India) 15, 41-44 (1992); Mayorga et al, Rev. Cubana Quim. 4, 1-6 (1988); Kondoli et al, J. Chem. Res., Synop. 3, 76 (1987); Primelles et al, Cent. Azucar 7-14 (1985); Solov'eva et al, Khim. Geterotsikl Soedin. 5, 613-15 (1984); Liu et al, Yaqxue Xuebao 18, 752-759 (1983); Joshi et al, Indian J. Chem, Sect. B. 22, 131-135(1983); Amos et al, WO Publication №9829495; Odagiri et al, US Patent №4670536; Gallucci et al, European Patent Document EP 355435; Redmore, D. US Patent №3821232; Nakano et al. Heterocycles 35, 37-40 (1993); Tomisawa et al, Chem. Pharm. Bull 36, 1692-1697 (1988); Krow et al, J. Heterocycl Chem. 22, 131-135 (1985); Krow et al, J. Org. Chem. 47, 1989-1993 (1982); Liu et al, Yaoxue Xuebao 18, 752-759 (1983); Nishikawa et al, Yaoxue Xuebao JP 01061457; and/or Rice et al, J. Med. Chem. 11, 183-185 (1968).
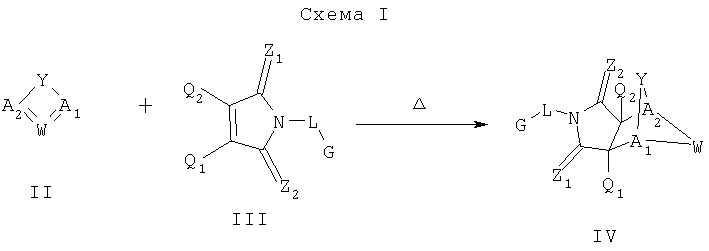
Как изображено на Схеме I, диен формулы II может реагировать с диенофилом формулы III в условиях, легко выбранных средним специалистом в данной области (в таких, нагревание ("Δ")), чтобы получить соединение формулы IV, которое является соединением формулы I. Промежуточный диен формулы II может быть получен из коммерческих источников или легко приготовлен специалистом в данной области, например, в соответствии с следующими литературными документами и ссылками, относящимися к этому процессу: Hofman et al., J. Agric. Food Chem. 45, 898-906 (1997); Baciocchi et al, J. Chem. Soc., Perkin Trans. 28, 821-824 (1975); Wu et al, J. Heterocycles 38, 1507-1518 (1994); Yin et al, Tetrahedron Lett. 38, 5953-5954 (1997); Mic'ovic' et al, Tetrahedron 20, 2279-2287 (1964); Gorbunova et al, J. Org. Chem.. 35, 1557-1566 (1999); Rassu et al, Chem. Soc. Rev. 29, 109-118 (2000); Kaberdin et al, Russ. Chem. Rev. 68, 765-779(1999); Barluenga et al, Aldrichimica Acta 32, 4-15 (1999); Bogdanowicz-Szwedefa et al., Wiad. Chem. 52, 821-842(1998); Casiraghi et al, Adv. Asymmetric Synth. 3, 113-189 (1998); and/or Baeckvall et al, Chem. Rev.98, 2291-2312 (1998). Промежуточный диенофил формулы III может быть получен из коммерческих источников или легко приготовлен средним специалистом в данной области, например, в соответствии с следующими найденными литературными ссылками: Deshpande et al, Heterocycles 51, 2159-2162 (1999); Seijas et al, J. Chem. Res., Synop. 7, 420-421 (1999); Langer et al, Eur. J. Org. Chem. 7, 1467-1470 (1998); Kita et al, Japanese Patent Document JP 09194458; Lopez-Alvarado et al, J. Org. Chem. 61, 5865-5870 (1996); Condon et al, US Patent №5523277; Sasakihara et al, Japanese Patent Document JP 04290868; Igarashi et al, Japanese Patent Document JP 04149173; Aoyama et al, Japanese Patent Document JP 04134063; Aoyama et al, Japanese Patent Document JP 04134062; Pastor et al, J. Org. Chem. 53, 5776-5779 (1988); and/or Takahashi et al, Chem. Lett. 6, 1229-1232 (1987).
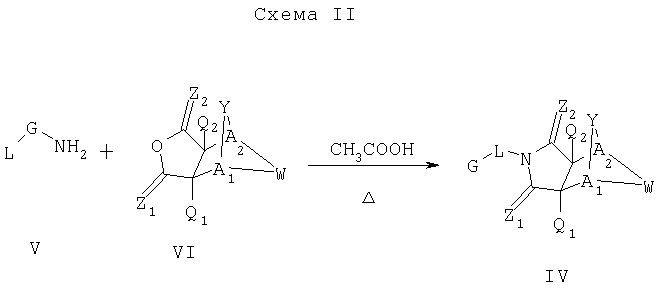
Как изображено на Схеме II, соединения формулы I могут быть получены с помощью реакции первичного амина формулы V с замещенным промежуточным ангидридо-подобным формулы VI, например в растворителе, таком как уксусная кислота с или без нагревания, что дает соединение формулы IV, которое является соединением формулы I. Первичные амины формулы V могут быть получены из коммерческих источников или легко синтезированы с помощью квалифицированного специалиста в данной области. Ангидридо-подобные агенты формулы VI могут быть получены из коммерческих источников или легко синтезированы с помощью квалифицированного специалиста в данной области. Документы, внесенные в следующий список, описывают типичные подходы для синтеза промежуточных формулы VI, так же как методики синтеза, которые могут быть применены для синтеза соединения формулы IV (все включены в настоящее изобретение в качестве ссылки полностью): Kohler, Е.Р.; Tishler, М.; Potter, Н.; Thompson, Н.Т. J. Am. Chem. Soc. 1939, 1057-1061; Yur'ev, Y.К.; Zefirov, N.S. J. Gen. Chem. U.S.S.R. (Engl. Transl.) 1961, 31, 772-5; Norman G. Gaylord US Patent №3995099; Schueler, P.E.; Rhodes, Y.E. J. Org. Chem. 1974, 39. 2063-9; Ishitobi, H.; Tanida, H; Tsuji, Т. Bull. Chem. Soc. Japan 1971, 44, 2993-3000; Stajer, G.; Virag, M.; Szabo, A.E.; Bemath, G.; Sohar, P.; Sillanpaa, R. Ada. Chem. Scand. 1996, 50, 922-30; Hart, H.; Ghosh, Т. Tetrahedron Lett. 1988, 29,881-884; Kato, M.; Yamamoto, S.; Yoshihara, Т.; Furuichi, К; Miwa, Т. Chem. Lett. 1987, 1823-1826; Kottwitz, J.; Vorbruggen, H. Synthesis 1995, 636-637; Creary, X. J. Org. Chem. 1975, 40, 3326-3331; Alder, К.; Ache, H.-J.; Flock, F.H. Chem. Ber. 1960, 93, 1888-1895; Toder, B.H.; Branca, S.J.; Dieter, R.K.; Smith, A.B. Ill Synth. Commun. 1975, 5, 435-439; Sprague, P.W.; Heikes, J.E.; Gougoutas, J.Z.; Malley, M.F.; Harris, D.N.; and/or Greenberg, R. J. Med. Chem. 1985, 28, 1580-1590.
Вышеупомянутый(е) подход(ы) могут быть применены в комбинаторной методике получения соединений, например, с помощью использования реакционного блока со множеством ячеек, такого как описан в Waldemar Ruediger, Wen-Jeng Li, John W., Alien Jr., and Harold N. Weller III, US Patent №5961925, Apparatus for Synthesis of Multiple Organic Compounds With Pinch Valve Block (включены в настоящее изобретение в качестве ссылки во всей их полноте полноте). При использовании описанного выше реакционного блока со множеством ячеек можно, например, выполнять многократно 96 реакций одновременно. Растворитель может затем быть удален из реакционных трубок, без удаления из реакционного блока и сырые продукты могут быть осаждены, используя такие основания, как бикарбонат натрия. Остаток может быть собран фильтрацией реакционного блока, а затем желаемые продукты могут быть перенесены непосредственно в 96 камерные плашки для скрининга. При таком способе действия многочисленная масса соединений формулы I может быть синтезирована и подвергнута тестированию желательно с помощью автоматизированного подхода.
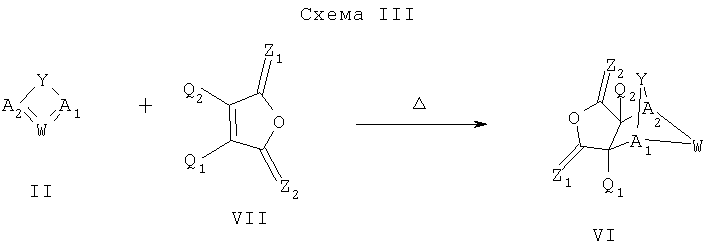
Схема III описывает способ получения промежуточного соединения формулы VI, которое может быть использовано для синтеза соединения формулы I, как описано на Схеме II. Как описано на Схеме III, диен формулы II может реагировать с диенофилом формулы VII, что дает промежуточное соединение формулы VI. Способы, использованные для осуществления такого преобразования, аналогичны тем, что описаны на Схеме I.
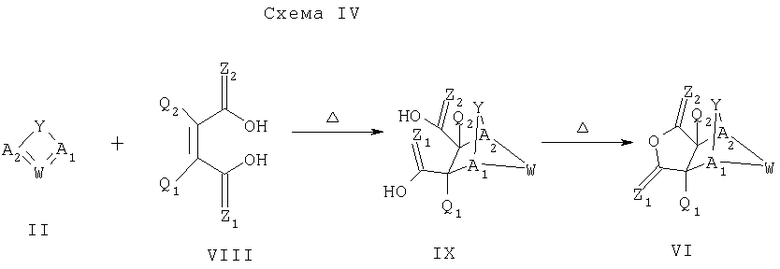
Схема IV описывает способ получения промежуточного соединения формулы VI, которое может быть использовано для синтеза соединения формулы I, как описано на Схеме II. Как показано на Схеме IV, диен формулы II может реагировать с диенофилом формулы VIII, что дает промежуточное соединение формулы IX. Промежуточное соединение формулы IX может быть дегидрировано до ангидридоподобного промежуточного соединения формулы VI. Дегидрирование бис-кислотного промежуточного формулы IX может быть достигнуто с помощью множества способов, известных квалифицированному специалисту в данной области и описанных в следующих документах и ссылках: Sprague et al, J. Med. Chem. 28, 1580-1590 (1985); and/or Retemi et al, J. Org. Chem. 61, 6296-6301 (1996).
Схемы с I no IV описывают общие способы синтеза соединений формулы I и их промежуточных, в которых проводят непосредственное замещение по кольцевой системе, например на уровне промежуточного диена, диенофила, ангидридоподобного промежуточного соединения и аминогрупп. Дополнительно к указанным подходам дополнительное замещение может быть осуществлено на уже полученном соединении формулы I с помощью множества подходов, которые позволяют получить другие соединения формулы I. Примеры способов дальнейшего замещения описаны на схемах с V до XI.
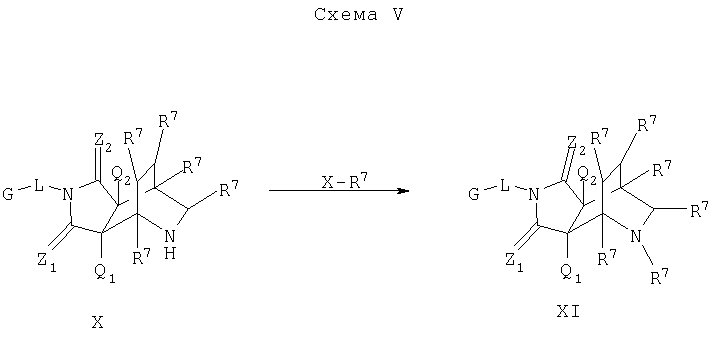
Схема V описывает один из таких подходов осуществления дополнительного замещения в соединении формулы I. Как изображено на Схеме V, соединение формулы X, которое является соединением формулы I, где A1 и A2 являются CR7, W является NH-CHR7 и Y является CHR7-CHR7, может быть функционализировано по свободной аминогруппе W с помощью любой из реакций со множеством электрофильных агентов, таких как галоидангидриды кислот или алкилгалоиды, в присутствии основания, например, с помощью способов, известных квалифицированному специалисту в данной области. На Схеме V, Х является уходящей группой и соединением формулы XI является соединение формулы I, где A1 и А2 являются CR7, W является NR7-CHR7 и Y является CHR7-CHR7.
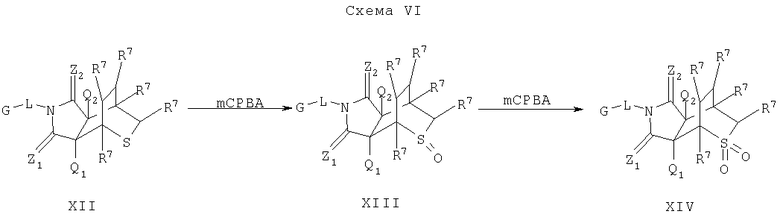
Схема VI описывает дополнительный подход к дальнейшему осуществлению замещения соединения формулы I. Как изображено на Схеме VI, соединение формулы XII, которое является соединением формулы I, где A1 и А2 являютя CR7, W является S-CHR7 и Y является CHR7-CHR7, может быть частично окислено окисляющим агентом, таким как mCPBA, или другими агентами, такими как те, что известны квалифицированному специалисту в данной области, что дает сульфоксидный аналог формулы XIII, который является соединением формулы I, где A1 и А2 являютя CR7, W являютя SO-CHR7 и Y являютя CHR7-CHR7. Дальнейшая обработка соединения формулы XIII окисляющим агентом, таким как mCPBA, или другими агентами, такими как те, что известны квалифицированному специалисту в данной области, может давать на выходе сульфоновый аналог формулы XIV, который является соединением формулы I, где A1 и А2 являютя CR7, W являются SO-CHR7 и Y являются CHR7-CHR7. Альтернативно, соединение формулы XII может быть преобразовано непосредственно в соединение формулы XIV с помощью длительной обработки окисляющим агентом, таким как mCPBA, или другими агентами, такими как те, что известны квалифицированному специалисту в данной области.
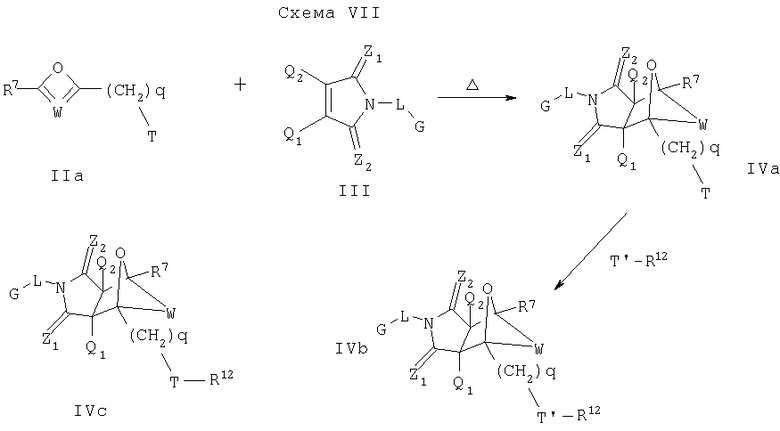
Схема VII описывает другой подход введения дополнительного замещения в соединение формулы I. Как изображено на Схеме VII, диен формулы IIa может реагировать с диенофилом формулы III, как описано на Схеме I, что дает соединение формулы IVa, которое является соединением формулы I, где Y является О, А2 является CR7 и A1 является С-(CH2)q-Т. Соединение формулы IVa может реагировать с реагентом формулы R12-Т', чтобы получить соединение формулы IVb или IVc, которые являются соединениями формулы I, где Y является О, А2 является CR и A1 является С-(CH2)q-Т-R12 или С-(CH2)q-Т-R12 соответственно. Реагент R12-Т' может быть получен из коммерческих источников или может легко быть получен квалифицированным специалистом в данной области.
В описанной выше Схеме R12 имеет то же самое значение, что и R7, определенное ранее, q имеет значение ноль или целое число от 0 до 8 и Т определено как (1) нуклеофильный центр, такой как, но без ограничения, азот, кислород или серу содержащая группа, способная вступать в нуклеофильную реакцию замещения с уходящей группой Т'; или (2) уходящая группа способна вступать в нуклеофильную реакцию замещения с нуклеофильной группой Т (такой как, но без ограничения, как азот, кислород или серу содержащая нуклеофильная группа). Т' имеет то же самое определение, что и Т. В данном случае, например, нуклеофильная реакция замещения происходит тогда, когда атакующий реагент (нуклеофил) приносит электронную пару субстрату, используя эту пару для образования новой связи и уходящая группа (нуклеофуг) уходит с электронной парой, уходя как анионное промежуточное соединение. Подробное обсуждение механизма алифатической нуклеофильной замены и обзор специфической алифатической нуклеофильной реакции замещения смотри в Advanced Organic Chemistry, Reactions, Mechanisms, and Structure, 4th Addition. Jerry March (Ed.), John Wiley & Sons, New York (1992) 293-500 и имеющие к этому отношению ссылки. Соединения формул IVa, IVb или IVc могут, конечно, быть применены в способах, описанных в настоящем изобретении (главным образом, при лечении ассоциируемых с ядерными гормональными рецепторами заболеваний), не подвергаясь дальнейшей реакции Т или Т'.
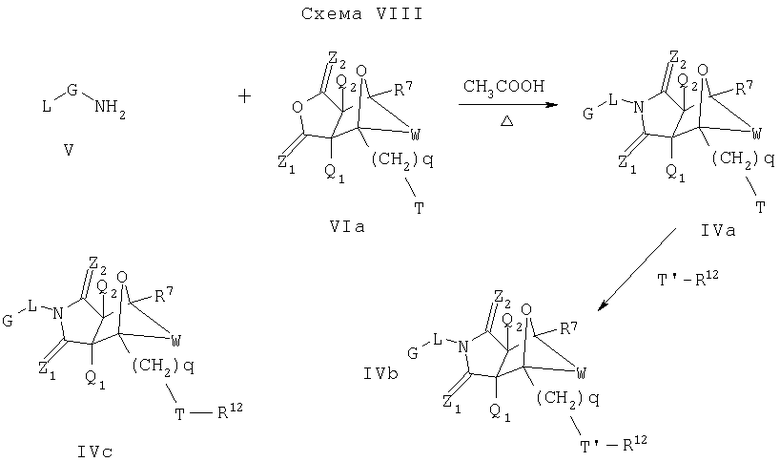
Альтернативный подход к соединениям формулы IVa, IVb и IVc приведен на Схеме VIII. Для этого подхода методики, такие как те, что описаны на схемах II, III и IV, могут быть применены для получения промежуточного соединения формулы VIa, где Т и q имеют значения, приведенные на Схеме VII. Промежуточное соединение формулы VIa может вступить в реакцию с замещенным амином формулы V, как описано на Схеме II, что дает соединение формулы IVa, которое является соединением формулы I, где Y является О, A2 является CR7 и A1 является С-(CH2)q-Т. Соединение формулы IVa может быть обработано способом, описанным на Схеме VII, чтобы получить соединения формулы IVb или IVc, которые являются соединениями формулы I, где Y является О, А2 является CR7 и A1 является С-(CH2)q-Т'-R12 или С-(CH2)q-Т-R12 соответственно.
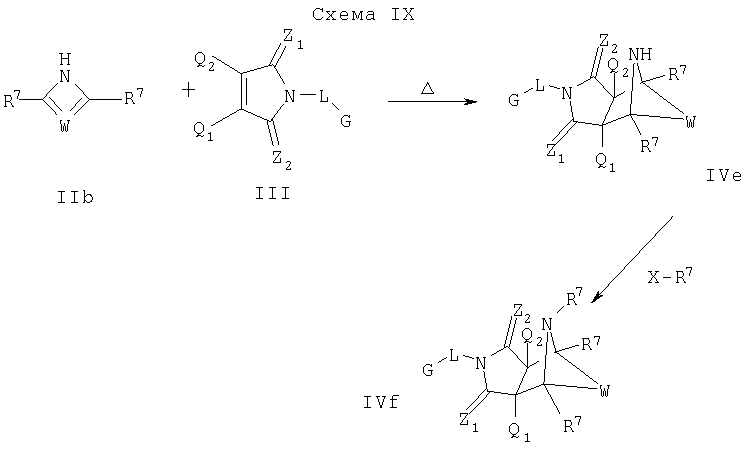
Схема IX описывает другой подход к введению еще одного замещения в соединение формулы I. Как изображено на Схеме IX (где Х является уходящей группой), диен формулы IIb может реагировать с диенофилом формулы III, как описано на Схеме I, что дает соединение формулы IVe, которое является соединением формулы I, где Y является NH, и A1 и А2 являются CR7. Соединение формулы IVe может быть функционализировано по свободному амину с помощью реакций с различными электрофильными агентами, такими как галоидангидриды кислот или алкилгалоиды в присутствии основания, например с помощью способов, известных квалифицированному специалисту в данной области и описанному на Схеме V, что дает соединение формулы IVf, которое является соединением формулы I, где Y является NR7 и A1 и А2 являются CR7.
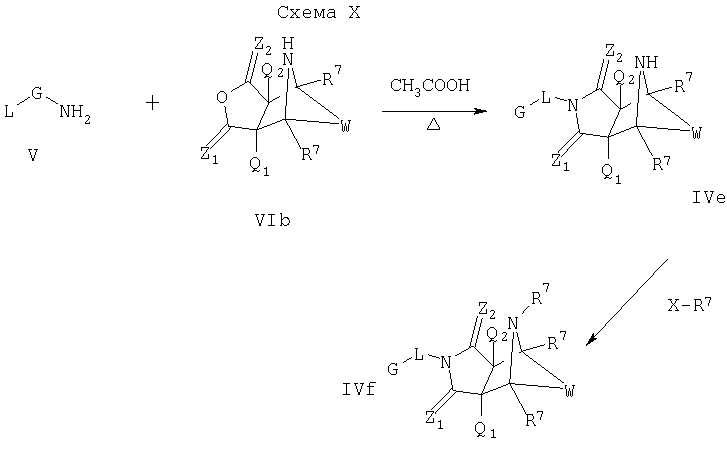
Альтернативный подход к соединениям формулы IVe и IVf приведен на Схеме X. Для этого подхода, методики, такие как те, что описаны в схемах II, III и IV могут быть применены для получения промежуточного соединения формулы VIb. Промежуточное соединение формулы VIb может вступить в реакцию с замещенным амином формулы V, как описано на Схеме II, что дает соединение формулы IVe, которое является соединением формулы I, где Y является NH, и A1 и А2 являются CR7. Последнее промежуточное соединение может быть обработано способом, описанным на Схеме V, чтобы получить соединение формулы IVf, которое является соединением формулы I где Y является NR7 и A1 и А2 являются CR7.
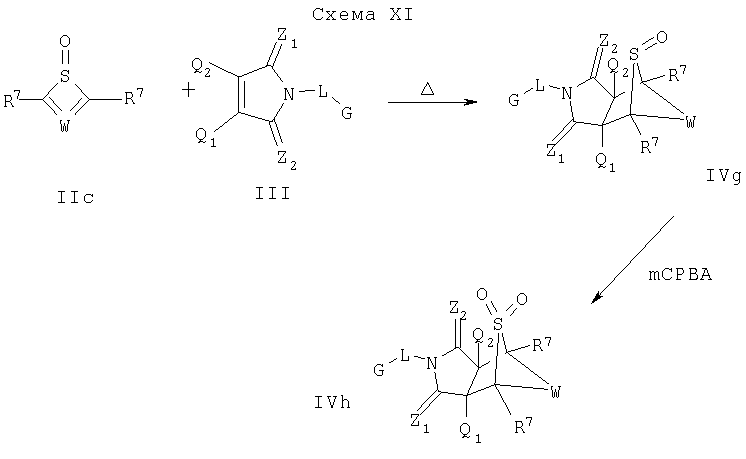
Схема XI описывает еще один подход к введению замещения в соединение формулы I. Как изображено на Схеме XI, диен формулы IIc может реагировать с диенофилом формулы III, как описано на Схеме I, что дает соединение формулы IVg, которое является соединением формулы I, где Y является SO и A1 и А2 являются CR7. Соединение формулы IVg может быть обработано окисляющим агентом, таким как mCPBA, как описано на Схеме VI, что дает соединение формулы IVh, которое является соединением формулы I, где Y является SO2 и A1 и А2 являются CR7.
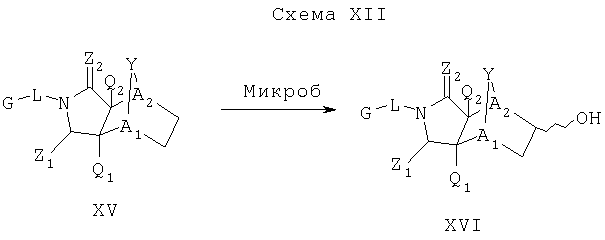
Схема XII описывает еще один подход к осуществлению дополнительного замещения соединения формулы I. Как изображено на Схеме XII, соединение формулы XV, которое может быть получено в соответствии с описанными выше схемами, может быть инкубировано в присутствии подходящего фермента или микроорганизма, что приводит к формированию гидроксилированного аналога формулы XVI. Такой процесс может быть применен, чтобы осуществить региоспецифическое, так же как энантиоспецифическое введение гидроксильной группы в молекулу формулы XV с помощью специфического микроорганизма или с помощью серий различных микроорганизмов. Такие микроорганизмы могут, например, быть природными бактериями, дрожжами или грибами и могут быть получены из дистрибуторов, таких как АТСС, или идентифицированы для применения в этом способе, так же, как с помощью способов, известных квалифицированному специалисту в данной области. Соединение XVI является соединением формулы I, где Y имеет значения приведенные выше и A1 и A2 являются предпочтительно CR7.
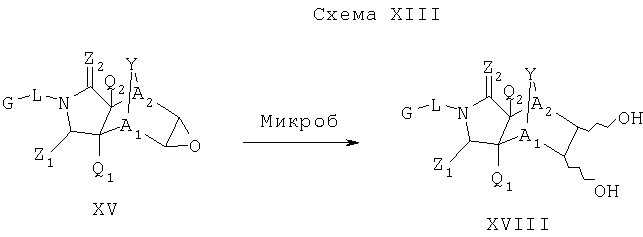
Схема XIII описывает еще один подход к осуществлению дополнительного замещения соединения формулы I. Как изображено на Схеме XIII, соединение формулы XVII, которое может быть получено в соответствии с описанными выше схемами, может быть инкубировано в присутствии подходящего фермента или микроорганизма, что приводит к формированию диольного аналога формулы XVIII. Такой процесс может быть применен, чтобы осуществить региоспецифическую, так же как энантиоспецифическую трансформацию соединения формулы XVII в 1-2 диол формулы XVIII с помощью специфического микроорганизма или с помощью серий различных микроорганизмом. Такие микроорганизмы могут, например, быть природными бактериями, дрожжами или грибами и могут быть получены из дистрибуторов, таких как АТСС, или идентифицированы для применения в этом способе, так же, как с помощью способов, известных квалифицированному специалисту в данной области. Соединение XVIII является соединением формулы I, где Y является тем, как описано выше, и A1 и А2 являются предпочтительно CR7.
Настоящее изобретение также обеспечивает способы, описанные на схемах XII и XIII
Таким образом, в одном воплощении, настоящее изобретение обеспечивает способ получения соединения следующей формулы XVI или его соли:
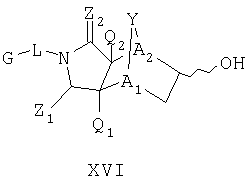
где радикалы определены в настоящем описании,
включающий стадию контактирования соединения формулы XV или его соли:
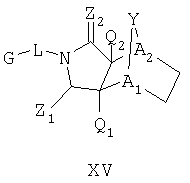
где радикалы определены выше;
с ферментом или микроорганизмом, способным катализировать гидроксилирование указанного соединения XV с образованием указанного соединения XVI и инициировать указанное гидроксилирование.
В еще одном предпочтительном воплощении, настоящее изобретение обеспечивает способ получения соединения формулы XVIII или его соли:
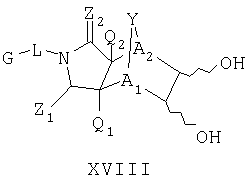
где радикалы определены в настоящем описании,
включающий стадию контактирования соединения формулы XVII или его соли:
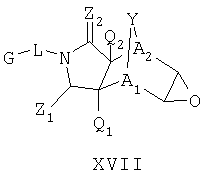
где радикалы определены выше;
с ферментом или микроорганизмом, способным катализировать раскрытие эпоксидного кольца соединения XVII с образованием диола указанного соединения XVIII и инициировать раскрытие указанного кольца и образование диола.
Все стреоконфигурации неспецифических хиральных центров соединений формул XV, XVI, XVII и XVIII рассмотрены в способах настоящего изобретения как индивидуальные (как в основном свободные от других стреоизомеров) или в смеси с другими стреоизомерными формами. Селективное превращение одного изомера (например, гидроксилирование экзоизомера предпочтительно до гидроксилирования эндоизомера) при взаимодействии изомерной смеси является предпочтительным воплощением изобретения. Конверсия селективно в один изомер (например, гидроксилирование на экзоповерхности "экзоизомера" предпочтительно до эндоповерхности "эндоизомера" или региоселективное раскрытие эпоксида с образованием только одного из двух возможных региоизомеров транс диола) является предпочтительным воплощением изобретения. Гидроксилирование ахирального промежуточного соединения с образованием простого оптического изомера гидроксилированного продукта является также предпочтительным воплощением изобретения. Расщепление рацемической смеси промежуточного соединения селективным гидроксилированием или раскрытие элоксидного кольца и образование диола для получения одного из двух возможных оптических изомеров является также предпочтительным воплощением изобретения. Используемый здесь термин "расщепление" обозначает частичное, а также, предпочтительно, полное расщепление.
Используемые здесь термины "ферментный процесс" или "ферментный способ" обозначают процесс или способ настоящего изобретения, использующий фермент или микроорганизм. Используемый здесь термин "гидроксилирование" обозначает введение гидроксильной группы в метиленовую группу, описанную выше. Гидроксилирование может проводиться, например, взаимодействием молекулярного кислорода в соответствии со способами настоящего изобретения. Образование диола может проводиться, например, взаимодействием с водой в соответствии со способами настоящего изобретения. Использующийся в представленных способах "фермент или микроорганизм" включает использование двух или более, а также одного фермента или микроорганизма.
Фермент или микроорганизм, использующийся в настоящем изобретении, может быть любым ферментом или микроорганизмом, способным катализировать описанные здесь ферментные превращения. Ферментные или микробные материалы независимо от происхождения или чистоты, могут использоваться в свободном виде или могут быть иммобилизованы на подложке, например, физической адсорбцией или захватом. Микроорганизмы или ферменты, пригодные для использования в настоящем изобретении, могут выбираться с помощью скрининга на необходимую активность, например, взаимодействием микроорганизма или фермента с исходным соединением XV или XVII или их солью, и определением конверсии в соответствующее соединение XVI или XVIII или его соль. Фермент может, например, являться видом животных или растительных ферментов или их смесей, клетками микроорганизмов, измельченными клетками, экстрактами клеток или природного происхождения.
Примеры микроорганизмов включают микроорганизмы класса: Streptomyces или Amycolatopsis. Особенно предпочтительными микроорганизмами являются микроорганизмы типа Streptomyces griseus, особенно Streptomyces griseus ATCC 10137 и Amycolatopsis orientalis, такие как ATCC 14930, ATCC 21425, ATCC 35165, ATCC 39444, ATCC 43333, ATCC 43490, ATCC 53550, ATCC 53630, и особенно ATCC 43491. Использующийся здесь термин "ATCC" обозначает доступный номер American Type Culture Collection, 10801 University Blvd., Manassas Virginia 20110-2209, относящийся к депозитарии микроорганизма. Ясно, что мутанты этих организмов также предполагаются настоящим изобретением для использования в вышеописанных способах, такие как мутанты, модифицированные использованием химических, физических (например, X-лучи) или биологических средств (например, методами молекулярной биологии).
Предпочтительные ферменты включают ферменты, полученные из микроорганизмов, особенно микроорганизмов, описанных выше. Ферменты могут быть выделены, например, экстракцией и методами очистки, такими как методы, известные специалисту в данной области техники. Фермент может, например, использоваться в чистом виде или в иммобилизованной форме. Одним из воплощений изобретения является фермент, адсорбированный на подходящем носителе, например, горная мука (пористый Celite Hyflo Supercel), микропористый полипропилен (Enka Accurel® полипропиленовый порошок) или неионный полимерный адсорбент, такой как Amberlite® XAD-2 (полистирол) или XAD-7 (полиакрилат) от Rohm and Haas Co. При использовании иммобилизованного фермента носитель может определять размер частиц фермента и предотвращать агрегацию частиц фермента при использовании в органическом растворителе. Иммобилизация может осуществляться, например, осаждением водного раствора фермента холодным ацетоном в присутствии Celite Hyflo Supercel с последующей вакуумной сушкой, или, при использовании неионного полимерного адсорбента, инкубацией растворов фермента с адсорбентом в смесителе, удаляя избыток раствора и высушивая фермент-смолу адсорбента в вакууме. Хотя использование минимального возможного количества фермента является желательным, необходимое количество фермента сильно зависит от конкретной активности использующегося фермента.
Гидроксилирование, описанное выше, может происходить in vivo. Например, фермент печени может селективно, непосредственно до эндоизомера, гидроксилировать экзоизомер соединения настоящего изобретения. При проведении способов настоящего изобретения вне организма в качестве катализатора может использоваться фермент микросомальная гидроксилаза печени.
Эти способы могут также проводиться с использованием микробных клеток, содержащих фермент, обладающий способностью катализировать превращения. При использовании микроорганизма для осуществления конверсии эти способы обычно проводят при добавлении клеток и исходного сырья в необходимую реакционную среду.
Там, где используются микроорганизмы, клетки могут использоваться в виде интактных сырых клеток или высушенных клеток, например лиофилизованных, высушенных распылением или высушенных теплом клеток, или в виде обработанного клеточного материала, такого как разрушенные клетки или клеточные экстракты. Могут также использоваться клеточные экстракты, иммобилизованные на Celite® или Accurel® полипропилене, как описано выше. Возможно также применение генноинженерных организмов. Клеткой-хозяином может быть любая клетка, например Escherichia coli, модифицированная включением гена или генов для экспрессии одного или более ферментов, способных к указанному выше катализу.
При использовании одного или более микроорганизмов ферментные способы настоящего изобретения могут проводиться последовательно с ферментацией микроорганизма (двухстадийная ферментация и конверсия) или конкурентно с ней, что в последнем случае является in situ ферментацией и конверсией (одностадийная ферментация и конверсия).
Рост микроорганизмов может осуществляться специалистом в данной области техники при использовании подходящей среды. Подходящие среды для роста микроорганизмов включают среды, которые включают питательные вещества, необходимые для роста микробных клеток. Обычная среда для роста включает необходимые источники углерода, источники азота и элементы (например, в следовых количествах). Могут также добавляться индукторы. Использующийся здесь термин "индуктор" включает любое соединение, вызывающее появление необходимой ферментной активности в микробной клетке.
Источники углерода могут включать углеводы, такие как мальтоза, лактоза, глюкоза, фруктоза, глицерин, сорбит, сахароза, крахмал, манноза, пропиленгликоль и им подобные; органические кислоты, такие как ацетат натрия, цитрат натрия и им подобные; и спирты, такие как этанол, пропанол и им подобные.
Источники азота могут включать N-Z амин А, водный кукурузный настой, муку соевых бобов, мясные экстракты, дрожжевые экстракты, мелассу, пекарские дрожжи, триптон, нутрисою, пептон, дрожжевой амин, аминокислоты, такие как глутамат натрия и им подобные, нитрат натрия, сульфат аммония и им подобные.
Следовые элементы могут включать соли магния, марганца, кальция, кобальта, никеля, железа, натрия и калия. Фосфаты также могут добавляться в следовых или, предпочтительно, более чем в следовых количествах.
Использующаяся среда может включать более одного источника углерода или азота или другое питательное вещество.
Предпочтительная среда для роста включает водную среду.
Агитация и аэрация реакционной смеси делает доступным количество кислорода в проводимом процессе превращения, например, в культурах, встряхивая колбу, или в ферментативных баках в процессе роста микроорганизмов.
Инкубация реакционной среды проходит предпочтительно при температуре между около 4 и около 60°С. Время реакции может быть выбрано в зависимости от количества использующегося фермента и его специфической активности. Время реакции может быть уменьшено при повышении температуры реакции и/или повышении количества фермента, добавляемого к реакционному раствору.
Предпочтительным является также использование воды в качестве реакционной смеси, хотя может также использоваться органическая жидкость, смешивающаяся или несмешивающаяся (бифазная) органическая/водная жидкая смесь. Количество фермента или микроорганизма, использующегося относительно исходного сырья, выбирают так, чтобы обеспечить катализ ферментных превращений настоящего изобретения.
Растворителями для органической фазы бифазной системы растворителей может быть любой органический растворитель несмешивающийся с водой, такой как толуол, циклогексан, ксилол, трихлортрифторэтан и им подобные. Водной фазой обычно является вода, предпочтительно деионизированная вода, или подходящий водный буферный раствор, особенно фосфатный буферный раствор. Бифазная система растворителей предпочтительно содержит между около 10 до 90 процентов по объему органической фазы и между около 90 до 10 процентов по объему водной фазы и предпочтительно содержит 20 процентов или около этого по объему органической фазы и 80 процентов или около этого по объему водной фазы.
Примерные воплощения таких способов начинают с получения использующегося водного раствора фермента(ов) или микробов. Например, предпочтительный фермент(ы) или микробы могут добавляться к подходящему количеству водного растворителя, такого как фосфатный буфер и им подобные. Эту смесь предпочтительно доводят и поддерживают при необходимом рН.
Соединения XVI и XVIII, полученные способами настоящего изобретения, могут выделяться и очищаться, например, различными способами, такими как экстракция, дистилляция, кристаллизация и колоночная хроматография.
Предпочтительные Соединения
Предпочтительные подподгруппы соединений настоящего изобретения, включают соединения формулы I или их соли, в которых один или более, предпочтительно все, имеют следующие заместители, что определены ниже:
G представляет собой арильную или гетероцикло (например, гетероарильную) группу, где указанная группа представляет собой моно- или полициклическую группу, которая является необязательно замещенной по одному или более положениям, предпочтительно водородом, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, алкинилом или замещенным алкинилом, галогеном, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, арилом или замещенным арилом, гетероцикло или замещенным гетероцикло, арилалкилом или замещенным арилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, CN, R1OC=О, R1C=О, R1HNC=О, R1R2NC=О, HOCR3R3', нитро, R1OCH2, R1O, NH2, NR4R5, S=OR1, SO2R1, SO2NR1R1', (R1)(1R1')P-О или (R1')(NHR1)P=О;
Z1 представляет собой О, S, NH или NR6;
Z2 представляет собой О, S, NH, или NR6;
A1 представляет собой CR7 или N;
А2 представляет собой CR7 или N;
Y представляет собой J-J'-J", где J представляет собой (CR7R7')n и n=0-3, J' представляет собой связь или О, S, S=О, SO2, NH, ОС=О, С =O, NR7, CR7R7'. R2P=O, R2P=S, R2OP=O, R2NHP=О, ОР=OOR2, OP=ONHR2, OP=OR2, OSO2, NHNH, NHNR, NR6NH, N=N, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, или гетероцикло или замещенный гетероцикло, и J" представляет собой (CR7R7')n и n=0-3, где Y не является связью;
W представляет собой CR7R7'-CR7R7', CR7R7'-C=О, NR9-CR7R7', N =CR8,N =N,NR9-
NR9', циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло или арил или замещенный арил, при этом, когда W не является NR9CR7R7', N=CR8, N=N, NR9-NR9' или гетероцикло или замещенный гетероцикло, тогда J' должен быть О, S,S=О, SO2, NH, NR7, OP=OR2, OP=ONHR2, OSO2, NHNH, NHNR6, NR6NH, или N=N;
Q1 представляет собой Н, алкил или замещенный алкил, алкенил или замещенный
алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероциклоалкил или замещенный гетероциклоалкил, арилалкил или замещенный арилалкил, алкинил или замещенный алкинил, арил или замещенный арил, гетероцикло (например, гетероарил) или замещенный гетероцикло (например, замещенный гетероарил), галоген, CN, R1OC=О, R4С=О, R5R6NC=О, HOCR7R7', нитро, R1OCH2, R1O, NH2, или NR4R5;
Q2 представляет собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероциклоалкил или замещенный гетероциклоалкил, арилалкил или замещенный арилалкил, алкинил или замещенный алкинил, арил или замещенный арил, гетероцикло (например, гетероарил) или замещенный гетероцикло (например, замещенным гетероарил), галоген, CN, R1OC=О, R4C= О, R5R6NC=О, HOCR7R7', нитро, R1OCH2, R1O, NH2, или NR4R5;
L представляет собой связь, (CR7R7')n, NH, NR5 или NR(CR7R7')n, где n =0-3;
R1 и R1 каждый независимо является Н, алкилом или замещенным алкилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом;
R2 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил;
R3 и R3' каждый независимо является Н, алкилом или замещенноым алкилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, галогеном, CN, гидроксиламином, гидроксамидом, алкокси или замещенным алкокси, амино, NR1R2, тиолом, алкилтио или замещенным алкилтио;
R4 представляет собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, R1C=О, R1NHC=О или SO2NR1R1';
R5 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, R1C=О, R1NHC=О, SO2R1, или SO2NR1R1';
R6 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, CN, ОН, OR1, R1С=О, R1NHC=О, SO2R1, или SO2NR1R1';
R7 и R7 каждый независимо является Н, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, галогеном, CN, OR1, нитро, гидроксиламином, гидроксиламидом, амино, NHR4, NR2R5, NOR1, тиолом, алкилтио или замещенным алкилтио, R1C =O, R1OC=О, R1NHC=О, SOR1, PO3R1R1', R1R1'NC=О, С=OSR1, SO2R1, или SO2NR1R1';
R8 и R8 каждый независимо является Н, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, нитро, галогеном, CN, OR1, амино, NHR4, NR2R5, NOR1, алкилтио или замещенным алкилтио, С=OSR1, R1ОС=О, R1С=О, R1NHC=О, R1R1'NC=О, S=OR1, SO2R1, PO3R1R1' или SO2NR1R1';
R9 и R9 каждый независимо является Н, алкилом или замещенным алкилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, CN, ОН, OR1, R1C=О, R1OC=О, R1NHC=O или SO2NR1R1';
где, в особенности, группы W и Y в этих предпочтительных подгруппах имеют значения, входящие в определения W' и Y' формулы Ia, при условиях от (1) до (14) для указанных соединений формулы Ia, являются подходящими для этих групп и наиболее предпочтительно, когда (i) Y' представляет собой -О- и W' представляет собой CR7R7'-CR7R7', A1 и А2 не являются одновременно СН; и (ii) когда L представляет собой связь, G не является незамещенной фенильной группой.
Другие более предпочтительные подгруппы соединений настоящего изобретения, включают соединения формулы I или их соли, в которых один или более, предпочтительно все заместители имеют значения те же, что определены ниже:
G представляет собой арильную или гетероцикло (например, гетероарильную) группу, где указанная группа представляет собой моно- или полициклическую группу, которая является необязательно замещенной по одному или более положениям, предпочтительно водородом, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, алкинилом или замещенным алкинилом, галогеном, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, арилом или замещенным арилом, гетероцикло или замещенным гетероцикло, арилалкилом или замещенным арилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, CN, R1C=О, R1HNC=О, R1R2NC=О, HOCR3R3', нитро, R1OCH2, R1O, NH2, NR4R5, SO2R1, или SO2NR1R1';
Z1 представляет собой О;
Z2 представляет собой О;
A1 представляет собой CR7;
А2 представляет собой CR7;
Y представляет собой J-J'-J", где J представляет собой (CR7R7')n и n=0-3, J' представляет собой связь или О, S, S=О, SO2, NH, NR7, CR7R7', R2P=О, R2P=S, R2OP=О, R2NHP= О, ОР=OOR2, OP=ONHR2, OP=OR2, OSO2, NHNH, NHNR6, NR6NH, N=N, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, или гетероцикло или замещенный гетероцикло, и J" представляет собой (CR7R7')n и n=0-3, где Y не является связью;
W представляет собой CR7R7'-CR7R7', CR7R7'=О, NR9-CR7R7', N=CR8, N=N, NR9-NR9', циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, или арил или замещенный арил, где, когда W не является NR9-CR7R7', N=CR8, N=N, NR9-NR9', или гетероцикло или замещенным гетероцикло, тогда J' должен быть О, S, S=О, SO2, NH, NR7, ОР=OOR2, ОР=ONHR2, OSO2, NHNH, NHNR6, NR6NH, или N =N;
Q1 представляет собой Н, алкил или замещенный алкил, алкенил или замещенный
алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероциклоалкил или замещенный гетероциклоалкил, арилалкил или замещенный арилалкил, алкинил или замещенный алкинил, арил или замещенный арил, гетероцикло (например, гетероарил) или замещенный гетероцикло (например, замещенный гетероарил), галоген, CN, R4С=О, R5R6NC=О, HOCR7R7', нитро, R1OCH2, R1O, NH2, или NR4R5;
Q2 представляет собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероциклоалкил или замещенный гетероциклоалкил, арилалкил или замещенный арилалкил, алкинил или замещенный алкинил, арил или замещенный арил, гетероцикло (например, гетероарил) или замещенный гетероцикло (например, замещенным гетероарил), галоген, CN, R4С=О, R5R6NC=О, HOCR7R7', нитро, R1OCH2, R1O, NH2, или NR4R5;
L представляет собой связь;
R1 и R1' каждый независимо является Н, алкилом или замещенным алкилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероцикло алкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом;
R2 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил;
R3 и R3' каждый независимо является Н, алкилом или замещенным алкилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, галогеном, CN, алкокси или замещенным алкокси, амино, NR1R2, алкилтио или замещенным алкилтио;
R4 представляет собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, R1C=О, R1NHC=О, или SO2NR1R1';
R5 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, R1C=О, R1NHC=О, SO2R1, или SO2NR1R1';
R6 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, CN, ОН, OR1, R1C=O, Р1NHC=O, SO2R1 или SO2NR1R1';
R7 и R7' каждый независимо является Н, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, галогеном, CN, OR1, нитро, амино, NHR4, NR4R5, алкилтио или замещенным алкилтио, R1C=O, R1NHC=О, SO2R1, R1R1'NC=О, или SO2NR1R1';
R8 и R8' каждый независимо является Н, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, нитро, галогеном, CN, OR1, амино, NHR4, NR2R5, алкилтио или замещенным алкилтио, R1C= О, R1NHC=О, R1R1'NC=О, SO2R1 или SO2NR1R1'; и
R9 и R9' каждый независимо является Н, алкилом или замещенным алкилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, CN, ОН, OR1, R1C=О, R1NHC=O или SO2NR1R1';
в особенности, где группы W и Y этих предпочтительных подгрупп также входят в определения W' и Y' соединения формулы Ia, при условиях от (1) до (14) для указанного соединения формулы Ia, которые соответствуют этим подгруппам и наиболее предпочтительно, (i) когда Y' представляет собой -О- и W' представляет собой CR7R7'-CR7R7', A1 и A2 не являются одновременно СН; и (ii) Когда L представляет собой связь, G не является незамещенной фенильной группой.
Особенно предпочтительная подгруппа соединений настоящего изобретения включает соединения формулы I или их соли, в которых один или более, предпочтительно все заместители имеют значения те же, что определены ниже:
G представляет собой арильную (особенно фенильную или нафтильную) или гетероцикло (в особенности те гетероциклогруппы G соединений, которые приведены в примерах настоящего изобретения) группу, где указанная группа представляет собой моно- или полициклическую группу и которая является необязательно замещенной по одному или более положениям, предпочтительно заместителями, как иллюстрируется по любому примеру для любого соединения в настоящем изобретении;
L представляет собой связь, (CR7R7' )n (где n имеет значение 1 и R7 и R7' каждый независимо является Н, алкилом или замещенным алкилом), или -CH2-NH-;
А1 и А2 каждый независимо является CR7, где R7 (i) представляет собой водород, алкил или замещенный алкил, арилалкил или замещенный арилалкил, алкенил или замещенный алкенил (например, алкенил, замещенный арилом (главным образом, фенилом или нафтиловом) или замещенный арил или алкенил, замещенный гетероцикло или замещенный гетероцикло), арил или замещенный арил, гетероцикло или замещенный гетероцикло, гетероциклоалкил или замещенный гетероциклоалкил, где для каждого предпочтительными заместителями являются одна или более групп, выбранных из V1 (в особенности A1 и А2 группы формулы CR7, где R7 для каждого из A1 и/или А2 является независимо выбранным из С1-4 алкила, в котором алкил является замещенным с помощью одной или больше групп V1), или (ii) форм, вместе с R7 из группы W (в особенности, где W представляет собой CR7R7'-CR7R7'), гетероциклическим кольцом;
V представляет собой ОН, CN, галоген, -O-арил, -O-замещенный арил, -O-гетероцикло,
-О- замещенный гетероцикло, -O-СО-алкил, -O-СО-замещенный алкил, -O-(алкилсилил), -O-арилалкил, -O-замещенный арилалкил, -O-СО-алкил, -O-СО-замещенный алкил, -O-СО-арилалкил, -O-СО-замещенный арилалкил, -O-СО-арил, -O-СО-замещенный арил, -O-СО-гетероцикло, -O-СО-замещенный гетероцикло, -S-(необязательно замещенный арил)-NH-СО-(необязательно замещенный алкил), -SO-(необязательно замещенный арил)-NH-СО-(необязательно замещенный алкил), -SO2-(необязательно замещенный арил)-NH-СО-(необязательно замещенный алкил), -NH-SO2-арил, -NH-SO2-замещенный арил, -NH-СО-O-(необязательно замещенный арилалкил), -NH-CO-O-алкил, -NH-CO-O-замещенный алкил, -NH-СО-алкил, -NH-CO-замещенный алкил, -NH-CO-арил, -NH-CO-замещенный арил, -NH-СО-(необязательно замещенный арилалкил), -NH-СО-(необязательно замещенный алкил)-O-(необязательно замещенный арил), -N(необязательно замещенный алкил)(необязательно замещенный арил), -N(необязательно замещенный алкил)(необязательно замещенный арилалкил), -СОН, -СООН, -СО-O-алкил, -СО-O-замещенный алкил, -СО-O-необязательно замещенный арилалкил, -СО-арил, -СО-замещенный арил, -O-CO-NH-арил, -O-CO-NH-замещенный арил, -CO-NH-арил, -CO-NH-замещенный арил, -CO-NH-арилалкил, -CO-NH-замещенный арилалкил, -O-(необязательно замещенный арил)-NH-CO-(необязательно замещенный алкил);
Y представляет собой -О-, -SO-, -N(V2)-, -CH2-N(V2)-, -СО-N(алкил)-, -CH2-S-, -CH2-SO2-;
V2 представляет собой водород, алкил, арилалкил, -СО-алкил, -СО-O-арил, -СО-O-арилалкил;
W представляет собой CR7R7'-CR7R7' (где R7 и R7' каждый представляет собой независимо выбранный из Н, ОН, алкила или замещенного алкила (таких как гидроксиалкил) или, где R7 образует гетероциклическое кольцо вместе с R7 из A1 или A2), CR8=CR8(где R8 и R8' каждый представляет собой независимо выбранный из Н, алкила или замещенного алкила (таких как гидроксиалкил)), CR7R7'-C=О (где R7 и R7' каждый является водородом или, где R7 образует гетероциклического кольца вместе с R7 из A1 или А2), N=CR8(где R8 представляет собой алкил), циклоалкил или замещенный циклоалкил или гетероцикло или замещенный гетероцикло;
Z1 и Z2 проедставляют собой О; и Q1 и Q2 проедставляют собой Н.
Предпочтительные G-L группы представляют собой необязательно замещенный нафтил и необязательно замещенные конденсированные бициклические гетероциклические группы, такими как необязательно замещенные бензо-конденсированные гетероциклические группы (например, присоединенные к остатку молекулы через бензольную часть), в особенности такие группы представляют собой группы, где гетероциклическое кольцо, связанное с бензолом, имеет 5 членов, например бензоксазол, бензотиазол, бензотиадиазол, бензоксадиазол или бензотиофен, например:

или
где Х = галоген (особенно F), OH, CN, NO2 или
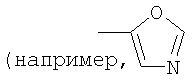 ,
, 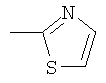 или
или 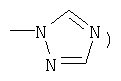 ;
;
U представляет собой О или S (где S может необязательно быть окислено, например, до SO);
U1 представляет собой СН3 или CF3;
каждый U2 независимо является N, СН или CF;
U3 представляет собой N, О или S;
U4 и U5 вместе с атомами, с которыми они связаны, образуют необязательно замещенное 5-членное гетероциклическое кольцо, которое может быть частично ненасыщенным или ароматическим и которое содержит от 1 до 3 кольцевых гетероатомов;
каждый U6 независимо представляет собой СН или N; и
означает необязательную(ые) двойную(ые) связь(и) внутри кольца, образованного с помощью U3, U4 и U5.
Особенно предпочтительные подгруппы включают соединения формулы I следующей формулы или их соли:
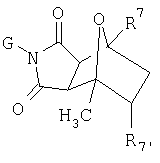
где G представляет собой необязательно замещенный нафтил или бензоконденсированную бициклическую гетероциклическую группу, R7 представляет собой СН3 или С1-4алкил, замещенный с помощью V и R7' представляет собой Н или гидроксил.
Соединения, где R7' представляет собой гидроксил, могут обеспечивать повышенную растворимость в воде и метаболическую стабильность, по отношению к соответствующим соединениям, где R7' представляет собой Н, в дополнение к имеющейся хорошей проходимости и высоким системным уровням крови. Эти соединения, несущие гидроксил, могут быть получены in vivo путем метаболизма соответствующего соединения, где R7' представляет собой Н, так же как с помощью синтетических способов получения, таких как те, что описаны в настоящем изобретении.
Применение и полезность
Соединения настоящего изобретения модулируют функцию рецепторов ядерного гормона (NHR) и включают соединения, которые являются, например, агонистами, частичными агонистами, антагонистами или частичными антагонистами андрогенового рецептора (AR), эстрогенового рецептора (ER), прогестеронового рецептора (PR), глюкокортикоидного рецептора (GR), минералокортикоидного рецептора (MR), рецептора стероида и ксенобиотика (SXR), другого стероида, связанного с NHR, орфановых рецепторов или других NHR. Предпочтительным является селективное модулирование одного из таких NHR, связанного с другими из NHR семейства. "Модулирование" включает, например, активацию (например, агонистическая активность, такая как селективная агонистическая активность по отношению к андрогеновому рецептору), или ингибирование (например, антагонистическая активность).
Соединения по изобретению, следовательно, могут быть полезными для лечения связанных с NHR состояний. "Связанное с NHR состояние", как здесь используется, обозначает состояние или заболевание, которое может лечиться модулированием функции NHR у субъекта, где лечение включает предупреждение (например, профилактическое лечение), частичное облегчение или полное излечение состояния или заболевания. Модулирование может протекать локально, например, в определенных тканях субъекта, или более широко, во всем субъекте, находящемся на излечении от такого состояния заболевания.
Соединения настоящего изобретения являются полезными для лечения множества состояний и заболеваний, включая, но не ограничиваясь, следующие:
Соединения формулы I могут использоваться в качестве агонистов, частичных агонистов, антагонистов или частичных антагонистов эстрогенового рецептора, предпочтительно селективно по отношению к этому рецептору, во множестве медицинских состояний, которые включают модулирование пути эстрогенового рецептора. Применения указанных соединений включают, но не ограничиваются: остеопороз, приливы, вагинальная сухость, рак простаты, рак груди, рак эндометрия, раки, вызванные эстрогеновым рецептором, такие как указанные выше раки и другие, контрацепция, прерывание беременности, менопауза, аменорея и дисменорея.
Соединения формулы I могут использоваться в качестве агонистов, частичных агонистов, антагонистов или частичных антагонистов прогестеронового рецептора, предпочтительно селективно по отношению к этому рецептору, во множестве медицинских состояний, которые включают модулирование пути прогестеронового рецептора. Применения указанных соединений включают, но не ограничиваются: рак груди, другие раки, включающие прогестероновый рецептор, эндометриоз, кахексия, контрацепция, менопауза, циклосинхрония, менигинома, дисменорея, фиброиды, прерывание беременности, вызывание родов и остеопороз.
Соединения формулы I могут использоваться в качестве агонистов, частичных агонистов, антагонистов или частичных антагонистов глюкокортикоидного рецептора, предпочтительно селективно по отношению к этому рецептору, во множестве медицинских состояний, которые включают модулирование пути глюкокортикоидного рецептора. Применения указанных соединений включают, но не ограничиваются: воспалительные заболевания, аутоиммунные заболевания, рак простаты, рак груди, Болезнь Альцгеймера, психические заболевания, лекарственная зависимость, инсулин-независимый сахарный диабет, и в качестве блокирующих агентов допаминового рецептора или в качестве агентов для лечения заболеваний, опосредованных допаминовым рецептором.
Соединения формулы I могут использоваться в качестве агонистов, частичных агонистов, антагонистов или частичных антагонистов минералокортикоидного рецептора, предпочтительно селективно по отношению к рецептору, во множестве медицинских состояний, которые включают модулирование пути минералокортикоидного рецептора. Применения указанных соединений включают, но не ограничиваются: лекарственная абстиненция и воспалительные заболевания.
Соединения формулы I могут использоваться в качестве агонистов, частичных агонистов, антагонистов или частичных антагонистов альдостеронового рецептора, предпочтительно селективно по отношению к этому рецептору, во множестве медицинских состояний, которые включают модулирование пути альдостеронового рецептора. Одно из применений указанных соединений включает, но не ограничивается им: накопленная сердечная недостаточность.
Соединения формулы I могут использоваться в качестве агонистов, частичных агонистов, антагонистов или частичных антагонистов андрогенового рецептора, предпочтительно селективно по отношению к этому рецептору, во множестве медицинских состояний, которые включают модулирование пути андрогенового рецептора. Применения указанных соединений включают, но не ограничиваются: волосатость, прыщи, себорея, болезнь Альцгеймера, андрогенное облысение, гипогонадизм, гипергирсутизм, доброкачественная гипертрофия простаты, адемомы и неоплазии простаты (такие как развитые метастазы рака простаты), лечение доброкачественных или злокачественных раковых клеток, содержащих андрогеновый рецептор, таких как при раке груди, мозга, кожи, яичников, мочевого пузыря, лимфы, печени и почек, панкреатическое модулирование VCAM экспрессии и применения их для лечения заболевания сердца, воспалительные и иммунные модулирования, модулирование VEGF экспрессии и применения их для использования у амбулаторных пациентов в качестве антиангиогенных агентов, при остеопорозе, подавлении выработки спермы, либидо, кахексии, эндометриозе, полициститном синдроме яичников, анорексии, поддержание уровня андрогена при возрастном уменьшении уровня тестостерона у мужчин, женская менопауза, мужское гормональное замещение, мужская и женская сексуальная дисфункция и ингибирование мышечной атрофии. Например, предполагается AR модулирование, особо предпочтительно селективное AR модулирование простаты ("SARM"), такое как при лечении ранних стадий рака простаты.
Соединения формулы I могут использоваться в качестве (предпочтительно селективных) антагонистов мутированного андрогенового рецептора, например, обнаруженного во многих видах опухолей. Примеры таких мутантов обнаружены в клеточных линиях, представляющих опухоль простаты, такие как LNCap, (T877A мутация, Biophys. Acta, 187, 1052 (1990)), PCa2b, (L701H и T877A мутации, J. Urol, 162, 2192 (1999)) и CWR22, (H874Y мутация, Mol. Endo., 11, 450 (1997)). Применения указанных соединений включают, но не ограничиваются: аденомы и неоплазии простаты, рак груди и рак эндометрия.
Соединения формулы I могут использоваться в качестве агонистов, частичных агонистов, антагонистов или частичных антагонистов рецептора стероида и ксенобиотика, предпочтительно селективно по отношению к этому рецептору, во множестве медицинских состояний, которые включают модулирование пути рецептора стероида и ксенобиотика. Применения указанных соединений включают, но не ограничиваются: лечение дисрегулирования холестеринового гомеостаза, ослабление метаболизма фармацевтических агентов при совместном введении агента (соединение настоящего изобретения), который модулирует Р450 регуляторные действия SXR.
Вместе с указанными выше NHR существует также ряд NHR, для которого не могут быть охарактеризованы активирующие или дезактивирующие лиганды. Эти протеины классифицируются как NHR благодаря их сильной гомологии последовательности с другими NHR, и известны как орфановые рецепторы. Из-за того что орфановые рецепторы проявляют сильную гомологию последовательности с другими NHR, соединения формулы I включают те, которые выступают в качестве модуляторов функции орфановых NHR. Орфановые рецепторы, которые модулируются NHR модуляторами, такими как соединения в пределах формулы I, представлены теми, которые приведены в Таблице 1, но не ограничиваясь ими. Примеры терапевтических применений модуляторов указанных орфановых рецепторов также представлены в Таблице 1, но не ограничиваются этими примерами.
Надпочечники, тимус
Настоящее изобретение также относится к способам лечения состояний, связанных с NHR, включающие стадию введения субъекту, нуждающемуся в этом, по крайней мере одного соединения формулы I в его эффективном количестве. В этих способах с соединениями по изобретению могут использоваться другие терапевтические агенты, такие как агенты, описанные ниже (например, отдельно или в одном составе как фиксированная доза). В способах настоящего изобретения такой другой терапевтический агент(ы) могут вводиться заранее, совместно или следом за введением соединениями) настоящего изобретения.
Настоящее изобретение также относится к фармацевтическим композициям, включающим по крайней мере одно из соединений формулы I, способное лечить состояние, связанное с NHR, в его эффективном количестве, и фармацевтически приемлемый носитель (связующее вещество или разбавитель). Композиции настоящего изобретения могут содержать другие терапевтические агенты, описанные ниже, и могут составляться, например, используя обычные твердые или жидкие связующие вещества или разбавители, а также фармацевтические добавки, подходящие к данному способу введения (например, эксципиенты, наполнители, консерванты, стабилизаторы, отдушки и т.д.) в соответствии со способами, хорошо известными в данной области для фармацевтических составов.
Следует заметить, что соединения настоящего изобретения, без ограничения механизма их действия, являются полезными для лечения любых состояний или заболеваний, представленных или перечисленных здесь, таких как воспалительные заболевания или рак, или другие пролиферативные заболевания, и в композициях для лечения таких состояний или заболеваний. Такие состояния и заболевания включают, без ограничения, любые описанные ранее, а также состояния и заболевания, описанные далее, такие как: поддержание силы и функции мышц (например, при старении); лечение или предупреждение хрупкости или функциональных нарушений, связанных с возрастом ("ARFD") при старении (например, саркопения); лечение катаболических побочных эффектов глюкокортикоидов; предупреждение и/или лечение снижения костной массы, плотности или роста (например, остеопороз и остеопения); лечение синдрома хронической усталости (CFS); хронической малярии; лечение синдрома острой усталости и потери мышечной массы вследствие избирательной хирургии (например, постхирургическая реабилитация); ускорение заживления ран; ускорение срастания костной ткани (такое как ускорение восстановления пациентов с переломами бедра); ускорение лечения сложных переломов, например отвлеченный остеогенез; для замещения стыков; предупреждение образования постхирургической адгезии; ускорение восстановления или роста зубов; поддержание сенсорной функции (например, слух, зрение, обоняние и вкус); лечение болезни периодонта; лечение истощения, вызванного переломами, и истощения, связанного с хронической обструктивной легочной болезнью (COPD), хронической болезнью печени, СПИДом, потерей веса, раковой кахексией, восстановлением после ожога и травмы, хронического катаболического состояния (например, кома), заболевания, связанные с приемом пищи (например, анорексия) и химиотерапия; лечение кардиомиопатии; лечение тромбоцитопении; лечение замедления роста, связанного с болезнью Крона; лечение непродолжительного кишечного синдрома; лечение раздражительного кишечного синдрома; лечение воспалительной кишечной болезни; лечение болезни Крона и язвенного колита; лечение осложнений, связанных с трансплантацией; лечение физиологически небольшого роста, включая дефицит гормона роста у детей и небольшого роста, связанного с хроническими заболеваниями; лечение ожирения и задержки роста, связанной с ожирением; лечение анорексии (например, связанной с кахексией или возрастом); лечение гиперкортизолизма и синдрома Гушинга; болезнь Паджета; лечение остеоартрита; усиление пульсирующего высвобождения гормона роста; лечение остеохондродисплазии; лечение депрессии, нервозности, раздражительности и стресса; лечение сниженной ментальной энергии и низкой самооценки (например, мотивация/утверждение); улучшение познавательной функции (например, лечение слабоумия, включая болезнь Альцгеймера и кратковременную потерю памяти); лечение катаболизма, связанного с легочной дисфункцией и кислородной зависимостью; лечение сердечной дисфункции (например, связанные с болезнью порока клапанов, инфарктом миокарды, сердечной гипертрофией или перегруженной сердечной недостаточностью); понижение кровяного давления; защита от дисфункции желудочков или предупреждение реперфузии; лечение пожилых людей от хронического диализа; прекращение или замедление катаболического состояния при старении; ослабление или прекращение протеиновых катаболических откликов вследствие травмы (например, прекращение катаболического состояния, связанного с хирургическим вмешательством, перегруженной сердечной недостаточностью, сердечной миопатией, ожогами, раком, COPD и т.д.); снижение кахексии и потери протеинов, обусловленной хронической болезнью, такой как рак или СПИД; лечение гиперинсулинемии, включая незидиобластоз; лечение иммуносуппрессорных пациентов; лечение изнурения, связанного с рассеянным склерозом или другим нейродегенеративным заболеванием; усиление выделения миелина; поддержание толщины кожи; лечение метаболического гомеостаза и почечного гомеостаза (например, при болезненном старении); стимулирование остеобластов, реконструирование роста кости и хряща; регулирование приема пищи; лечение инсулиновой резистентности, включая NIDDM, у млекопитающих (например, людей); лечение инсулиновой резистентности в сердце; улучшение качества сна и коррекция относительного старческого гипосоматотрофизма, обусловленного сильным повышением REM сна и уменьшением REM скрытого состояния; лечение гипотермии; лечение перегруженной сердечной недостаточности; лечение липодистрофии (например, у пациентов, лечащихся от ВИЧ или СПИД а, такие как ингибиторы протеаз); лечение мышечной атрофии (например, обусловленной физической неактивностью, постельным режимом или состоянием пониженного веса); лечение мышечно-скелетного повреждения (например, при старении); улучшение общей легочной функции; лечение заболеваний сна и лечение катаболического состояния длительной критической болезни; лечение волосатости, прыщей, себореи, андрогенного облысения, анемии, гиперволосатости, доброкачественной гипертрифии простаты, аденомы и неоплазии простаты (например, обширные метастазы рака простаты) и злокачественных опухолевых клеток, содержащих андрогеновый рецептор, таких как при раке груди, мозга, кожи, яичников, мочевого пузыря, лимфы, печени и почек; рак кожи, поджелудочной железы, эндометрия, легких и толстой кишки; остеосаркома; злокачественная гиперкальцемия; метастазная болезнь кости; лечение сперматогенеза, эндометриоз и полициститный синдром яичников; поздний токсикоз, эклампсия при беременности и прерывании родов; лечение предменструального синдрома; лечение вагинальной сухости; снижение уровней тестостерона, связанное с возрастом человека, мужская менопауза, гипогонадизм, замещение мужских гормонов, мужская и женская сексуальная дисфункция (например, эректильная дисфункция, снижение сексуального влечения, сексуальное состояние, пониженное либидо), мужская и женская контрацепция, потеря волос, синдром Ривена и повышение подвижности/прочности кости и мышцы и состояния, заболевания и расстройство, вместе называющиеся "синдром X" или метаболический синдром, описанный Johannsson.Z Clin. Endocrinol. Metab., 82, 727-34 (1997).
Соединения по изобретению обладают терапевтической активностью при модулировании активации/пролиферации иммунной клетки, например, в качестве конкурентных ингибиторов реакций внеклеточного лиганд/рецепторного связывания, включая САМ (клеточные адгезионные молекулы) и лейкоинтегрины. Например, соединения по изобретению модулируют LFA-ICAM 1 и являются особенно полезными в качестве LFA-ICAM 1 антагонистов и для лечения всех состояний, связанных с LFA-ICAM 1, таких как иммунные заболевания. Предпочтительные применения соединений по изобретению включают, но не ограничиваются: воспалительные состояния, такие как состояния в результате отклика неспецифической иммунной системы у млекопитающего (например, возрастной респираторный стрессовый синдром, шок, кислородная токсичность, синдром множественного повреждения органов вследствие септицемии, синдром множественного повреждения органов вследствие травмы, повреждение тканей, обусловленные сердечно-сосудистым обходом, инфаркт миокарды или использование с тромболитическими агентами, острый гломерулонефрит, васкулит, реакционный артрит, дерматит с острыми воспалительными составляющими, паралич, термическое повреждение, гемодиализ, лейкаферез, язвенный колит, некротический энтероколит и синдром, связанный с переливанием гранулоцита) и состояния, возникающие вследствие отклика специфической иммунной системы у млекопитающего (например, псориаз, отторжение орган/тканевого трансплантата, реакция против пересадки ткани и аутоиммунные заболевания, включающие синдром Райнауда, аутоиммунный тироидит, дерматит, рассеянный склероз, ревматоидный артрит, инсулинзависимый сахарный диабет, ювеит, воспалительная болезнь кишечники, включая болезнь Крона и язвенный колит и систематическая красная волчанка). Соединения по изобретению могут использоваться для лечения астмы или в качестве дополнения для снижения токсичности при питокиновой терапии при лечении рака. Соединения по изобретению могут использоваться для лечения всех заболеваний, которые в настоящее время лечат стероидной терапией. Соединения по изобретению могут использоваться для лечения этих и других заболеваний отдельно или вместе с другими иммуносупрессорными или противовоспалительными агентами. В соответствии с изобретением, соединение формулы I может вводиться заранее до начала воспаления (для подавления ожидаемого воспаления) или после начала воспаления. При профилактическом использовании иммуносупрессорное соединение(я) предпочтительно вводят для предотвращения любого воспалительного отклика или симптома (например, заранее, в процессе или незадолго после трансплантации органа или ткани, но при предотвращении любых симптомов или отторжении органа). Профилактическое введение соединения формулы I предотвращает или снижает любой последующий воспалительный отклик (такой как, например, отторжение трансплантируемого органа или ткани и т.д.). Введение соединения формулы I ослабляет любое острое воспаление (такое как, например, отторжение трансплантируемого органа или ткани).
Соединения формулы I могут вводиться любыми описанными здесь способами любыми подходящими средствами, например, орально, в виде таблеток, капсул, гранул или порошков; сублингвально; буккально; парентерально, например, подкожно, внутривенно, внутримышечно или интрастенальной инъекцией или методами вливания (например, в виде стерильных инъекционных водных или неводных растворов или суспензий); назально, включая введение в назальные мембраны, например, ингаляционным спреем; местно, в виде крема или притирания; или ректально, например, в виде свечей; в дозированных единичных составах, содержащих нетоксичные, фармацевтически приемлемые связующие вещества или разбавители. Соединения по изобретению могут, например, вводиться в виде подходящего для немедленного высвобождения или длительного высвобождения. Немедленное высвобождение или длительное высвобождение могут достигаться использованием подходящих фармацевтических композиций, включающих соединения по изобретению, или, особенно в случае длительного высвобождения, использованием устройств, таких как подкожные имплантанты или осмотические насосы. Соединения по изобретению могут также вводиться липосомально.
Примеры композиций для орального введения включают суспензии, которые могут содержать, например, микрокристаллическую целлюлозу для придания объема, альгиновую кислоту или альгинат натрия в качестве суспендирующего агента, метилцеллюлозу в качестве усилителя вязкости и подсластители или отдушки, известные из уровня техники; и таблетки немедленного высвобождения, которые могут содержать, например, микрокристаллическую целлюлозу, фосфат кальция, крахмал, стеарат магния, и/или лактозу, и/или другие эксципиенты, наполнители, увеличители объема, разрыхлители, разбавители и лубриканты, известные из уровня техники. Соединения формулы I могут также доставляться через оральную полость сублингвальным и/или буккальным введением. Формованные таблетки, прессованные таблетки или таблетки, полученные замораживанием-высушиванием являются примерами форм, которые могут использоваться. Примеры композиций включают композиции, содержащие соединение(я) по изобретению с быстро растворяющимися разбавителями, такими как манноза, лактоза, сахароза и/или циклодекстрины. Также в такие составы могут включаться эксципиенты с высоким молекулярным весом, такие как целлюлозы (авицель) или полиэтиленгликоли (ПЭГ). Такие составы могут также включать эксципиент, способствующий адгезии через слизистую оболочку, такой как гидроксипропилцеллюлоза (НРС), гидроксипропилметилцеллюлоза (НРМС), карбоксиметилцеллюлоза натрия (SCMC), сополимер малеинового ангидрида (например, Gantrez) и агенты, контролирующие высвобождение, такие как полиакриловый сополимер (например Carbopol 934). Также могут добавляться лубриканты, агенты для скольжения, отдушки, красители и стабилизаторы для упрощения изготовления и использования.
Примерами композиций для назального аэрозоля или ингаляционного введения включают солевые растворы, которые могут содержать, например, бензиловый спирт или другие подходящие консерванты, промотеры абсорбции для повышения биодоступности и/или другие растворяющие или диспергирующие агенты, известные из уровня техники.
Примерами композиций для парентерального введения включают инъекционные растворы или суспензии, которые могут содержать, например, подходящие нетоксичные, парентерально приемлемые разбавители или растворители, такие как манноза, 1,3-бутандиол, вода, раствор Рингери, изотонический раствор хлорида натрия или другие подходящие диспергирующие или увлажняющие и суспендирующие агенты, включая синтетические моно- или диглицериды и жирные кислоты, включающие олеиновую кислоту или кремафор.
Примеры композиций для ректального введения включают свечи, которые могут содержать, например, подходящий нераздражающий эксципиент, такой как масло какао, синтетические глицериновые эфиры или полиэтиленгликоли, которые являются твердыми при обычных температурах, но становятся жидкими и/или растворяются в ректальной полости для высвобождения лекарства.
Примеры композиций для местного введения включают местный носитель, такой как Plastibase (минеральное масло, желатинизированное полиэтиленом).
Эффективное количество соединения настоящего изобретения может определяться специалистом в данной области техники, и включает примерные дозированные количества для взрослого человека от около 1 до 100 (например, 15) мг/кг веса тела активного соединения в день, которые могут вводиться в однократной дозе или в виде индивидуально разделенных доз, например от 1 до 4 раз в день. Ясно, что конкретный уровень дозы и частота дозы для каждого отдельного субъекта может изменяться и зависит от различных факторов, включающих активность конкретного используемого соединения, метаболическую стабильность и продолжительность действия этого соединения, тип, возраст, вес тела, общее здоровье, пол и питание субъекта, способ и время введения, скорость выведения, сочетание лекарств и строгость особых условий. Предпочтительные субъекты для лечения включают животных, наиболее предпочтительно видов млекопитающих, таких как человек, и домашних животных, таких как собаки, кошки и им подобные, субъекты с состояниями, связанными с NHR.
Как указано выше, соединения настоящего изобретения могут использоваться отдельно или в сочетании друг с другом и/или другими подходящими терапевтическими агентами, полезными для лечения состояний, связанных с NHR, например, антибиотиком или другим фармацевтически активным средством.
Например, соединения настоящего изобретения могут объединяться с вызывающими рост агентами, такими как, но не ограничиваясь, TRH, диэтилстильбестрол, теофиллин, энкефалины, Е типы простагландинов, соединения, описанные в US 3239345, например, зераноль, и соединения, описанные в US 4036979, например, сульбенокс или пептиды, описанные в US 4411890.
Соединения по изобретению могут также использоваться в сочетании со средствами, усиливающими секрецию гормона роста, такими как GHRP-6, GHRP-1 (как описано в US 4411890 и публикациях WO 89/07110 и WO 89/07111), GHRP-2 (как описано в WO 93/04081), NN703 (Novo Nordisk), LY444711 (Lilly), MK-677 (Merck), CP424391 (Pfizer) и В-НТ920, или с фактором для высвобождения гормона роста и его аналогами или гормоном роста и его аналогами или соматомединами, включающими IGF-1 и IGF-2, или с альфа-адренергическими агонистами, такими как клонидиновые или серотининовые S-HTD агонисты, такие как суматриптан, или агентами, которые ингибируют соматостатин или его высвобождение, такие как физистигмин и пиридостигмин. Еще одним использованием описанных соединений по изобретению является сочетание с паратиреоидным гормоном, РТН(1-34) или бисфосфонатами, такими как МК-217 (алендронат).
Еще одним использованием соединений по изобретению является сочетание с эстрогеном, тестостероном, селективным модулятором эстрогенового рецептора, таким как тамоксифен или ралоксифен, или другими модуляторами андрогенового рецептора, такими как модуляторы, описанные в Edwards, J.Р. и др., Bio. Med. Chem. Let., 9, 1003-1008 (1999) и Hamaim, L.G. и др., J. Med. Chem., 42, 210-212 (1999).
Еще одним использованием соединений настоящего изобретения является сочетание с агонистами прогестеронового рецептора ("PRA"), такими как левоноргестрель, медроксипрогестерон ацетат (МРА).
Соединения настоящего изобретения могут использоваться отдельно или в сочетании друг с другом и/или другими модуляторами рецепторов ядерного гормона или другими подходящими терапевтическими агентами, пригодными для лечения указанных выше заболеваний, включающих: антидиабетические агенты; агенты против остеопороза; агенты против ожирения; противовоспалительные агенты; успокоительные агенты; антидепрессанты; антигипертензивные агенты; антиагрегирующие агенты; антитромботические и тромболитические агенты; сердечные гликозиды; агенты, понижающие холестерин/липиды; антагонисты минералокортикоидного рецептора; ингибиторы фосфодиэстеразы; ингибиторы протеин тирозин киназы; тиреоидные миметики (включающие агонисты тиреоидного рецептора); обезболивающие агенты; лекарства против ВИЧ или СПИДа; лекарства, используемые для лечения болезни Альцгеймера и других известных заболеваний; лекарства, используемые для лечения заболеваний сна; антипролиферативные агенты и агенты против рака.
Примеры подходящих антидиабетических агентов для использования в сочетании с соединениями настоящего изобретения включают бигуанидины (например, метформин), ингибиторы глюкозидазы (например, акарбоза), инсулины (включая средства, усиливающие секрецию инсулина или инсулиновые сенсибилизаторы), меглитинвды (например, репаглинид), сульфонилмочевины (например, глимепирид, глубурид и глипизид), комбинации бигуанид/глибурид (например, Glucovance®), тиазолидиндионы (например, троглитазон, розиглитазон и пиоглитазон), PPAR-альфа агонисты, PPAR-гамма агонисты, PPAR альфа/гамма двойственные агонисты, SGLT2 ингибиторы, ингибиторы гликогенфосфорилазы, ингибиторы протеина, связывающего жирные кислоты (аР2), такие как описаны в US 09/519079 поданной 06.03.2000, глюкагон-подобного пептида-1 (GLP-I) и ингибиторы дипептидилпептидазы IV (DP4).
Примеры подходящих агентов против остеопороза для использования в сочетании с соединениями настоящего изобретения включают алендронат, ризедронат, РТН, фрагменты РТН, ралоксифен, кальцитонин, стероидные или нестероидные агонисты прогестеронового рецептора, антагонисты лиганда RANK, антагонисты чувствительного к кальцию рецептора, TRAP ингибиторы, селективные модуляторы эстрогенового рецептора (SERM), эстроген и АР-1 ингибиторы.
Примеры подходящих агентов против ожирения для использования в сочетании с соединениями настоящего изобретения включают аР2 ингибиторы, такие как описаны US 09/519079, поданной 06.03.2000, PPAR гамма антагонисты, PPAR дельта агонисты, бета 3 адренергические агонисты, такие как AJ9677 (Takeda/Dainippon), L750355 (Merck) или СР331648 (Pfizer) или другие известные бета 3 агонисты, как описано в US 5541204, 5770615, 5491134, 5776983 и 5488064, ингибитор липазы, такой как орлистат или ATL-962 (Alizyme), ингибитор захвата серотонина (и допамина), такой как сибутрамин, топирамат (Johnson & Johnson) или аксокин (Regeneron), лекарство для бета тиреоидного рецептора, такой как лиганд тиреоидного рецептора, как описано в WO 97/21993 (U. Cal SF), WO 99/00353 (KaroBio) и GB98/284425 (KaroBio), и/или агент, снижающий аппетит, такой как дексамфетамин, фентермин, фенилпропаноламин или мазиндол.
Примеры подходящих противовоспалительных агентов для использования в сочетании с соединениями настоящего изобретения включают преднизон, дексаметазон, Enbrel®, ингибиторы циклооксигеназы (например, ингибиторы СОХ-1 и/или СОХ-2, такие как NSAID, аспирин, индометацин, ибупрофен, пироксикам, Naproxen®, Celebrex®, Vioxx®), CTLA4-Ig агонисты/антагонисты, лигандные антагонисты CD40, IMPDH ингибиторы, такие как микофенолатные (CellCept®) интегриновые антагонисты, альфа-4 бета-7 интегриновые антагонисты, ингибиторы клеточной адгезии, антагонисты гамма интерферона, ICAM-1, антагонисты фактора некроза опухоли (TNF) (например, инфликсимаб, OR1384), ингибиторы синтеза простагландина, будесонид, клофазимин, CNI-1493, CD4 антагонисты (например, приликсимаб), ингибиторы р38 митоген-активируемой протеинкиназы, ингибиторы протеинтирозинкиназы (РТК), IKK ингибиторы и лекарства для лечения синдрома воспаленного кишечника (например, открытые Zeimac® и Maxi-K®, такие как описаны в US 6184231 B1).
Примером подходящих успокоительных агентов для использования в сочетании с соединениями настоящего изобретения включают диазепам, лоразепам, буспирон, оксазепам и гидроксизина памоат.
Примеры подходящих антидепрессантов для использования в сочетании с соединениями настоящего изобретения включают питалопрам, флуоксетин, нефазодон, сертралин и пароксетин.
Примеры подходящих антигипертензивных агентов для использования в сочетании с соединениями настоящего изобретения включают бета-адреноблокаторы, блокаторы кальциевого канала (L-типа и Т-типа; например дильтиазем, верапамил, нифедипин, амлодипин и мибефрадил), диуретики (например, хлортиазид, гидрохлортиазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид, бензтиазид, трикринафен этакриновой кислоты, хлорталидон, фуросемид, мусолимин, буметанид, триамтренен, амилорид, спиронолактон), ингибиторы ренина, АСЕ ингибиторы (например, каптоприл, зофеноприл, фозиноприл, эналаприл, цераноприл, цилазоприл, делаприл, пентоприл, куинаприл, рамиприл, лизиноприл), антагонисты АТ-1 рецептора (например, лозартан, ирбесартан, вальсартан), антагонисты ЕТ рецептора (например, ситакссентан, атрсентан и соединения, описанные в US 5612359 и 6043265), двойственные ET/AII антагонисты (например, соединения, описанные в WO 00/01389), ингибиторы нейтральной эндопептидазы (NEP), ингибиторы вазопептидазы (двойственные NEP-ACE ингибиторы) (например, омалатрилат и гемопатрилат) и нитраты.
Примеры подходящих антиагрегирующих агентов для использования в сочетании с соединениями настоящего изобретения включают GPIIb/IIIa блокаторы (например, абсиксимаб, эптифибатид, тирофибан), P2Y12 антагонисты (например, клопидогрел, тиклопедин, CS-747), антагонисты тромбоксанового рецептора (например, ифетробан), аспирин и PDE-III ингибиторы (например, дипиридамол) с аспирином или без него.
Примеры подходящих сердечных гликозидов для использования в сочетании с соединениями настоящего изобретения включают дигитализ и оуабаин.
Примеры подходящих агентов для снижения холистерин/липида для использования в сочетании с соединениями настоящего изобретения включают ингибиторы HMG-CoA редуктазы (например, правастатин, ловастатин, аторвастатин, синвастатин, NK-104 (a.k.a. итавастатин, или нисвастатин, или нисбастатин) и ZD-4522 (a.k.a. росувастатин, или атавастатин, или визастатин)), ингибиторы скваленовой синтетазы, фибраты, выделения желчной кислоты, АСАТ ингибиторы, МТР ингибиторы, ингибиторы липооксигеназы, ингибиторы абсорбции холестерина и ингибиторы протеина, переносящего эфир холистерина (например, СР-529414).
Примеры подходящих антагонистов минералокортикоидного рецептора для использования в сочетании с соединениями настоящего изобретения включают спиронолактон и эплеринон.
Примеры подходящих ингибиторы фосфодиэстеразы для использования в сочетании с соединениями настоящего изобретения включают PDEIII ингибиторы, такие как цилостазол, и PDE V ингибиторы, такие как сильденафил.
Примеры подходящих тиреоидных миметиков для использования в сочетании с соединениями настоящего изобретения включают тиротропин, политироид, КВ-130015 и дронедарон.
Примеры подходящих обезболивающих агентов для использования в сочетании с соединениями настоящего изобретения включают тестостерон, TRH диэтилстильбестрол, эстрогены, β-агонисты, теофиллин, анаболические стероиды, дегидроэпиандростерон, энкефалины, Е-типы простагландинов, ретиноевую кислоту и соединения, описанные в US 3239345, например, Zeranol®; US 4036979, например, Сульбенокс® или пептиды, описанные в US 4411890.
Примеры подходящих лекарств против ВИЧ или СПИДа для использования в сочетании с соединениями настоящего изобретения включают индинавир сульфат, сакуинавир, сакуинавир мезилат, ритонавир, ламивудин, зидовудин, комбинацию ламивудин/зидовудин, зальцитабин, диданозин, ставудин и мегестрол ацетат.
Примеры подходящих лекарственных средств для лечения болезни Альцгеймера и близких заболеваний для использования в сочетании с соединениями настоящего изобретения включают донепезил, такрин, ревастигмин, 5НТ6, ингибиторы гамма секретаз, ингибиторы бета секретаз, блокаторы SK канала, маски-К блокаторы и K-CNQ блокаторы.
Примеры подходящих лекарственных средств для лечения заболеваний сна для использования в сочетании с соединениями настоящего изобретения включают аналоги мелатонина, антагонисты мелатонинового рецептора, МL1В агонисты и антагонисты GABA/NMDA рецептора.
Примеры подходящих антипролиферативных агентов для использования в сочетании с соединениями настоящего изобретения включают циклоспорин А, паклитаксель, FK 506 и адриамипин.
Примеры подходящих противораковых агентов для использования в сочетании с соединениями настоящего изобретения включают паклитаксель, адриамицин, эпотилоны, цисплатин и карьоплатин.
Соединения настоящего изобретения могут также использоваться в сочетании с питательными поддержками, такими как описаны в US 5179080, особенно в сочетании с сывороточным протеином или казеином, аминокислотами (такими как лейцин, разветвленные аминокислоты и гидроксиметилбутират), триглицеридами, витаминами (например, А, В6, В 12, фолат, С, D и Е), минералами (например, селен, магний, цинк, хром, кальций и калий), карнитином, липоевой кислотой, креатином и коэнзимом Q-10.
Кроме того, соединения настоящего изобретения могут использоваться в сочетании с терапевтическими агентами, использующимися для лечения сексуальной дисфункции, включая, но не ограничиваясь, PDE5 ингибиторы, такие как сильденафил или IC-351; с антирезорбтивными агентами, лекарственными средствами для гормонального замещения, аналогами витамина D, кальцитонинами, дополителями элементарного кальция и кальция, ингибиторами катепсина К, ММР ингибиторами, антагонистами витронектинового рецептора, Src SH2 антагонисты, ингибиторами вакулярных-Н+-АТРаз, агонистами прогестеронового рецептора, иприфлавоном, фтором, RANK антагонистами, РТН и его аналогами и фрагментами, тиболоном, ингибиторами HMG-СоА редуктазы, SERM, р38 ингибиторами, простаноидами, ингибиторами 17-бета гидроксистероидной дегидрогеназы и ингибиторами Src киназы.
Соединения настоящего изобретения могут использоваться в сочетании с мужскими контрацептивами, такими как ноноксинон 9, или терапевтическими агентами для лечения облысения, такими как миноксидил и финастерид или химиотерапевтическими агентами, такими как LHRH агонисты.
Для предпочтительного противоракового или антиангиогенного применения соединения настоящего изобретения могут вводиться отдельно или в сочетании с другими противораковыми и цитотоксическими агентами и лекарственными средствами, полезными для лечения рака или других пролиферативных заболеваний, например, когда второе лекарственное средство имеет тот же или другой механизм действия, что и соединения по изобретению формулы I. Примеры классов противораковых и цитотоксических агентов, использующихся в сочетании с соединениями по изобретению, включают, но не ограничиваются: алкилирующие агенты, такие как горчичный азот, алкилсульфонаты, нитромочевины, этиленимины и триазены; антиметаболиты, такие как фолатные антагонисты, пуриновые аналоги и пиримидиновые аналоги; антибиотики, такие как антрациклины, блеомицины, митомицин, дактиномицин и пликамицин; ферменты, такие как L-аспарагиназа; ингибиторы фарнезил-протеин трансферазы; ингибиторы 5α редуктазы; ингибиторы 17β-гидроксистероидной дегидрогеназы типа 3; гормональные агенты, такие как глюкокортикоиды, эстрогены/антиэстрогены, андрогены/антиандрогены, прогестины и антагонисты лютеинизин-высвобождающего гормона, окиреотид ацетат; микротрубчатые-разрушающие агенты, такие как эктеинаскидины или из аналоги и производные; микротрубчатые-стабилизирующие агенты, такие, как таксаны, например, паклитаксель (Taxol®), доцетаксель (Taxotere®) и их аналоги, и эпотилоны, такие как эпотилоны A-F и их аналоги; растительные продукты, такие как винкаиновые алкалоиды, эпиподофилотоксины, таксаны; и ингибиторы топоизомеразы; ингибиторы пренил-протеин трансферазы; и разнообразные агенты, такие как гидроксимочевина, прокарбазин, митотан, гексаметилмеламин, комплексы с платиной, такие как писплатин и карбоплатин; и другие агенты, использующиеся в качестве противораковых и цитотоксических агентов, таких как модификаторы биологического отклика, факторы роста; иммунные модуляторы и моноклональные антитела. Соединения по изобретению могут также использоваться в сочетании с радиационной терапией.
Представляющие примеры этих классов противораковых и цитотоксических агентов включают, но не ограничиваются, мехлорэтамина гидрохлорид, циклофосфамид, хлорамбуцин, мелфалан, ифосфамид, бусульфан, кармустин, ломустин, семистин, стрептозоцин, тиотепа, дакарбазин, метотрексат, тиогианин, меркаптопурин, флударабин, пентастатин, кладрибин, цитарабин, фторурацил, доксорубицина гидрохлорид, даунорубицин, идарубицин, блеомицин сульфат, митомицин С, антиномицин D, сафрацины, сафрамицины, куинокарцины, дискодермолиды, винкристин, винбластин, винорелбин тартрат, этопозид, этопозид фосфат, тенипозид, паклитаксель, тамоксифен, эстрамустин, эстрамустин фосфат натрия, флутамид, бусерелин, леупролид, птеридины, дайнезы, левамизол, афлакон, интерферон, интерлейкины, альдеслейкины, фильграстим, сарграмостим, ритуксимаб, BCG, третиноин, иринотекана гидрохлорид, бетаметозон, гемцитабина гидрохлорид, альтретамин и топотека и любые их аналоги или производные.
Предпочтительные представители этих классов включают, но не ограничиваются, поклитаксель, цисплатин, карбоплатин, доксорубицин, карминомицин, даунорубицин, аминоптерин, метотрексат, метоптерин, митомицин С, эктеинасцидин 743 или порфиромицин, 5-фторурацил, 6-меркаптопурин, гемцитабин, цитозин арабинозид, подофиллотоксин или производные подофиллотоксина, такие как этопозид, этопозид фосфат или тенипозид, мельфалан, винбластин, винкристин, леурозидин, виндезин и леурозин.
Примеры противораковых и других цитотоксических агентов включают следующие: эпотилоновые производные, описанные в DE 4138042.8; WO 97/19086, WO 98/22461, WO 98/25929. WO 98/38192, WO 99/01124, WO 99/02224, WO 99/02514, WO 99/03848, WO 99/07692, WO 99/27890, WO 99/28324, WO 99/43653, WO 99/54330, WO 99/54318, WO 99/54319, WO 99/65913, WO 99/67252, WO 99/67253 и WO 00/00485; ингибиторы циклин-зависимой киназы, описанные в WO 99/24416 (см. также US 6040321); и ингибиторы пренил-протеин трансферазы, описанные в WO 97/30992 и WO 98/54966; и агенты, такие как описанные вообще и конкретно в US 6011029 (соединения, которые могут использоваться вместе с любыми NHR модуляторами (включая, но не ограничиваясь, соединениями настоящего изобретения), такие как AR модуляторы, ER модуляторы, с LHRH модуляторами или с хирургической кастрацией, особенно при лечении рака).
Композиции настоящего изобретения могут также соединяться или вводиться вместе с другими терапевтическими агентами, которые выбираются в зависимости от их конкретной пригодности для введения лекарственных средств, связанных с указанными выше состояниями. Например, соединения по изобретению могут соединяться с агентами для предотвращения тошноты, гиперчувствительности и раздражения желудка, такими как противорвотные средства и антигистамины H1 и Н2.
Подходящие к лечению рака соединения настоящего изобретения наиболее предпочтительно используются отдельно или в сочетании с противораковыми терапиями, такими как радиационная терапия, и/или с цитостатическими и/или цитотоксическими агентами, такими как, но не ограничиваясь, ДНК интерактивные агенты, такие как цисплатин или доксорубицин; ингибиторами фарнезил протеин трансферазы, такими как описанные в US 6011029; ингибиторами топоизомеразы II, такими как этопозид; ингибиторами топоизомеразы I, такими как СРТ-11 или топотекан; тубулин стабилизирующими агентами, такими как паклитаксель, докетаксель, другими таксанами, или эпотилонами; гормональными агентами, такими как тамоксифен; ингибиторами тимидилат синтазы, такими как 5-фторурапил; антиметаболитами, такими как метокстрексат; антиангиогенными агентами, такими как ангиостатин, ZD6474, ZD6126 и комберстатин А2; ингибиторами киназы, такими как специфические антитела her2, ингибиторами Iressa и CDK; ингибиторами гистон деацетилазы, такими как CI-994 и MS-27-275. Такие соединения могут также объединяться с агентами, которые подавляют выделение циркулирующего тестостерона, такими как LHRH агонисты или антагонисты, или с хирургической кастрацией.
Например, известные терапии для обширного метастазного рака простаты включают "терапию с полным удалением андрогена", где рост опухоли подавляют при контролировании потока андрогена к тканям простаты посредством химической кастрации (кастрация служит для ингибирования выделения циркулирующего тестостерона (Т) и дигидротестостерона (DHT)) с последующим введением антагонистов андрогенового рецептора (AR) (которые ингибируют функцию T/DHT, полученного конверсией циркулирующих предшественников андрогена в T/DHT тканью простаты). Соединения настоящего изобретения могут использоваться в качестве AR антагонистов в полной удаляющей терапии, отдельно или в сочетании с другими AR антагонистами, такими как флутамид, касодекс, нилутамид или ципротерон ацетат.
Соединения настоящего изобретения могут использоваться совместно с хирургией.
Другим применением соединений по изобретению является применение в сочетании с терапией антителами, такой как, но не ограничиваясь, терапия с антителами против PSCA. Дополнительное применение касается вакцина/иммунных модулирующих агентов для лечения рака.
Соединения настоящего изобретения могут использоваться в соответствии со способами, описанными в заявке US 60/284,438, с названием "Селективные модуляторы андрогенового рецептора и способы их идентификации, получение и применение", поданной 18.04.2001 Mark E. Salvati и др. (Attorney Docket No. LD0250(PSP)), которая приведена здесь полностью в качестве ссылки (включая, но не ограничиваясь, ссылок на все конкретные соединения формулы I настоящего изобретения), и заявке US (не обозначено), с названием "Селективные модуляторы андрогенового рецептора и способы их идентификации, получение и применение", поданной 20.06.2001 Mark E. Salvati и др. (Attorney Docket No. LD0250(NP)), которая приведена здесь полностью в качестве ссылки (включая, но не ограничиваясь, ссылок на все конкретные соединения формулы I настоящего изобретения).
В случае использования рацематов соединений настоящего изобретения один энантиомер может, например, быть полным AR антагонистом, тогда как другой может быть AR антагонистом в опухолевой ткани, хотя не иметь активности или агонистической активности в нераковых тканях, содержащих андрогеновый рецептор.
Указанные выше другие терапевтические агенты при употреблении в сочетании с соединениями настоящего изобретения могут использоваться, например, в количествах, указанных в Physicians' Desk Reference (PDR) или иным образом определенных специалистом в данной области техники.
Следующие испытания могут использоваться для подтверждения активности соединений в качестве NHR модулятора. Предпочтительными являются те соединения, активность которых больше 20 мкм для связывания или трансактивации в любом из этих испытаний. Используя испытания на трансактивацию и стандартные испытания на AR связывание, описанные далее, показано, что различные соединения настоящего изобретения имеют активность AR модулятора.
Трансактивадионные испытания:
AR специфический эксперимент:
Соединения настоящего изобретения тестируют в трансактивационных испытаниях с трансфекционной конструкцией переноса и используя эндогенный андрогеновый рецептор клеток-хозяев. Трансактивационный эксперимент относится к способу идентификации функциональных агонистов и частичных агонистов, которые копируют, или антагонистов, которые ингибируют действие природных гормонов, в данном случае дигидротестостерона (DHT). Этот эксперимент может использоваться для предсказания in vivo активности, так как существует взаимосвязь в обоих типах данных. См., например, Т. Berger и др., J. Steroid Biochem. Molec. Biol. 773 (1992), сущность которого приведена здесь в качестве ссылки.
В трансактивационном эксперименте репортерную плазмиду вводят трансфекцией (процедура введения в клетки чужеродных генов) в соответственные клетки. Эта репортерная плазмида, включающая кДНК для репортерного протеина, такая как выделенная щелочная фосфатаза (SEAP), контролируется предшествующим участком по ходу транскрипции последовательностями специфического антигена простаты (PSA), содержащими элементы андрогенового отклика (ARE). Эта репортерная плазмида действует как репортерная для активности, модулирующей транскрипцию AR. Следовательно, репортер действует как суррогат для продуктов (мРНК, затем протеин), обычно экспрессируемых геном под контролем AR и его природным гормоном. Для того чтобы выявить антагонисты, трансактивационный эксперимент проводят в присутствии постоянной концентрации природного AR гормона (DHT), который, как известно, помогает определить репортерный сигнал. Повышение концентраций предполагаемого антагониста приведет к понижению репортерного сигнала (например, SEAP продукция). С другой стороны, подвергание трансфицируемых клеток повышению концентраций предполагаемого агониста будет приводить к повышению продукции репортерного сигнала.
Для этого эксперимента LNCaP и MDA 453 клетки получают из American Type Culture Collection (Rockville, MD) и выращивают в RPMI 1640 или DMEM среде с добавлением 10% бычьей эмбриональной сыворотки (FBS; Gibco) соответственно. Соответствующие клетки быстро трансфицируют электропорацией в соответствии с оптимальной процедурой, описанной Heiser, 130 Methods Mol. Biol, 117 (2000), с помощью pSEAP2/PSA540/энхансер репортерной плазмиды. Репортерную плазмиду конструируют следующим образом: коммерчески доступную человеческую плацентарную геномную ДНК используют для получения с помощью полимеразной циклической реакции (PCR) фрагмента, содержащего Bg1II сайт (положение 5284) и Hind III сайт в положении 5831 человеческого промотера специфического антигена простаты (Accession # U37672), Schuur, и др., J. Biol. Chem., 271 (12): 7043-51 (1996). Этот фрагмент субклонируют в р8ЕАР2/основу (Clontech), с заранее встроенными Bg1II и HindIII для получения pSEAP2/PSA540 конструкции. Затем фрагмент, переносящий фрагмент человеческой PSA, предшествующий участку по ходу транскрипции последовательности между положениями -5322 и -3873, переносят на PCR из человеческой плацентарной геномной ДНК. Xhol и Bg1II сайты вводят в праймеры. Полученный фрагмент субклонируют в pSEAP2/PSA540, со встроенными Xhol и Bg1II соответственно, для получения pSEAP2/PSA540/энхансер конструкции. LNCaP и MDA 453 клетки собирают в среду, содержащую 10% лишенного угля FBS. Каждую клеточную суспензию вводят в две генные пульсирующие кюветы (Bio-Rad), в которые затем вносят 8 мкг репортерной конструкции и используют электропорация Bio-Rad генного пульсатора с 210 вольтами и 960 мкфарад. Полученные трансфицируемые клетки промывают и инкубируют в среде, содержащей лишенную угля бычью эмбриональную сыворотку в отсутствие (чистый) или присутствии (контроль) 1 нМ дигидротестостерона (DHT; Sigma Chemical) и в присутствии или в отсутствие стандарта антиандрогенового бикалутамида или соединений настоящего изобретения в концентрациях в пределах от 10-10 до 10-5 М (образец). Для каждого образца используют дубликаты. Растворения соединений проводят на Biomek 2000 лабораторном оборудовании. Через 48 часов фракцию супернатанта исследуют на SEAP активность с помощью Phospha-Light Chemiluminescent Reporter Gene Assay System (Tropix, Inc). Жизнеспособность оставшихся клеток определяют с помощью CellTiter 96 Aqueous Non-Radioactive Cell Proliferation Assay (MTS Assay, Promega). Кратко, смесь тетразольного соединения (3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразол, внутренняя соль; MTS) и связывающий электрон реагент (феназин метосульфат; PMS) добавляют к клеткам. MTS (Owen реагент) биовосстанавливается клетками в формазан, который растворим в среде культуры ткани, и, следовательно, его поглощение при 490 нм может измеряться непосредственно в 96-ячеечных экспериментальных подложках без дополнительной обработки. Количество формазанового продукта, измеренное как количество при 490 нм поглощении, прямо пропорционально числу живых клеток культуры. Для каждого повтора SEAP показание выравнивают по Abs490 величине, полученной из MTS эксперимента. Для антагониста % ингибирования рассчитывают как:
% ингибирования=100×(1-[средний контроль-средний чистый]/[средний образец -средний чистый])
По результатам данных строят график и вычисляют концентрацию соединения, которая ингибирует 50% выровненной SEAP (IC50).
Для агонистов % контроля определяют как действие тестируемого соединения по сравнению с максимальным действием, наблюдаемым для природного гормона, в данном случае DHT, и рассчитывают как:
% Контроля=100×[(средний образец-средний чистый)/(средний контроль-средний чистый)]
По результатам данных строят график и вычисляют концентрацию соединения, которая активирует до 50% уровня выровненной SEAP в контроле (EC50).
GR специфичный эксперимент:
Использующаяся репортерная плазмида содержит кДНК для репортерного SEAP протеина, как описано для эксперимента AR специфической трансактивации. Экспрессию репортерного SEAP протеина контролируют последовательностью с долгосрочным повторением вируса грудной опухоли мыши (MMTV LTR), которая содержит три элемента ответного гормона (HRE), которые можно регулировать GR и PR, см., например, G. Chalepakis и др.. Cell, 53(3), 371 (1988). Эту плазмиду трансфицируют в А549 клетки, которые экспрессируют эндогенный GR, для проведения эксперимента GR специфической трансактивации. А549 клетки получают из American Type Culture Collection (Rockville, MD) и выращивают в RPMI 1640 с 10% бычьей эмбриональной сывороткой (FBS; Gibco). Определение GR специфической антагонистической активности соединений настоящего изобретения проводят, как описано для эксперимента AR специфической трансактивации, за исключением того, что DHT замещают на 5 нМ дексаметазон (Sigma Chemicals), специфичный агонист для GR. Определение GR специфической агонистической активности соединений настоящего изобретения осуществляют, как описано для эксперимента AR трансактивации, где измеряют активацию GR специфической репортерной системы при добавлении тестируемого соединения, в отсутствие известного лиганда GR специфических агонистов.
PR Специфический эксперимент:
Использующаяся репортерная плазмида содержит кДНК для репортерного SEAP протеина, как описано для эксперимента AR специфической трансактивации. Экспрессию репортерного SEAP протеина контролируют последовательностью с долгосрочным повторением вируса грудной опухоли мыши (MMTV LTR), которая содержит три элемента ответного гормона (HRE), которые можно регулировать GR и PR. Эту плазмиду трансфицируют в T47D, которая экспрессирует эндогенный PR, для проведения эксперимента PR специфической трансактивации. T47D клетки получают из American Type Culture Collection (Rockville, MD) и выращивают в DMEM среде с 10% бычьей эмбриональной сывороткой (FBS; Gibco). Определение PR специфической антагонистической активности соединений настоящего изобретения проводят, как описано для эксперимента AR специфической трансактивации, за исключением того, что DHT замещают на 1 нМ промегастона (NEN), специфического агониста для PR. Определение PR специфической агонистической активности соединений настоящего изобретения осуществляют, как описано в эксперименте AR трансактивации, где измеряют активацию PR специфической репортерной системы при добавлении тестируемого соединения, в отсутствие известного лиганда PR специфических агонистов.
Эксперимент AR связывания:
В эксперименте связывания всей клетки человеческие LNCaP клетки (Т877А мутант AR) или MDA 453 (дикий тип AR) в 96-ячеечных микротитровальных подложках, содержащих RPMI 1640 или DMEM с 10% лишенным угля CA-FBS (Cocaleco Biologicals) соответственно, инкубируют при 37°С для удаления любого эндогенного лиганда, который может связаться с рецептором в клетках. Через 48 часов проводят или анализ насыщения для определения Kd насыщенного тритием дигидротестостерона, [3H]-DHT, или эксперимент конкурентного связывания для определения способности тестируемых соединений конкурировать с [3H]-DHT. В анализе насыщения к клеткам добавляют среду (RPMI 1640 или DMEM - 0.2% CA-FBS), содержащую [3H]DHT (в концентрации в пределах от 0.1 нМ до 16 нМ) в отсутствие (полное связывание) или присутствии (неспецифическое связывание) 500-кратного молярного избытка немеченого DHT. Через 4 часа при 37 С отбирают аликвоту среды полного связывания при каждой концентрации [3H]-DHT для определения количества свободного [3H]-DHT. Оставшуюся среду отделяют, клетки промывают трижды PBS и высеивают на UniFiker GF/B подложки (Packard), добавляют микросцинт (Packard) и подложки помещают в верхний счетчик (Packard) для определения количества связавшегося [3H]-DHT.
В анализе насыщения разницу между полным связыванием и неспецифическим связыванием определяют как специфическое связывание. Специфическое связывание определяют Scatchard анализом для вычисления Kd для [3H]-DHT. См., например, D. Rodbard, Mathematics and statistics ofligand assays: an illustrated guide: In: J. Langon and J.J. Clapp, eds., Ligand Assays, Masson Publishing U.S.A., Inc., New York, pp. 45-99, (1981), описание которых приведено здесь в качестве ссылок.
В конкурентных испытаниях к клеткам добавляют среду, содержащую 1 нМ [3H]-DHT и соединения по изобретению ("тестируемые соединения") в концентрации в пределах от 10-10 до 10-5 М. Используют два повтора для каждого образца. Через 4 часа при 37°С клетки промывают, высаживают и вычисляют, как описано выше. По результатам данных строят график кривой отклика необходимого количества [3H]-DHT (% контроля в отсутствие тестируемого соединения) от уровня дозы для данного соединения. Вычисляют концентрацию тестируемого соединения, которая ингибирует 50% количества связанного [3H]-DHT в отсутствие конкурентного лиганда (IC50), после log-logit трансформации. Значения K1 определяют с помощью Cheng-Prusoff уравнения для IC50 величин, где:
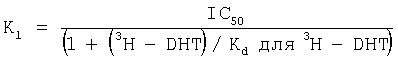 .
.
После уточнения неспецифического связывания определяют IC50 величины. IC50 определяют как концентрацию конкурентного лиганда, необходимого для понижения специфического связывания на 50%. Kds для [3H]-DHT для MDA 453 и LNCaP составляют 0.7 и 0.2 нМ соответственно.
Эксперимент пролиферации клетки простаты человека;
Соединения настоящего изобретения тестируют ("тестируемые соединения") на пролиферацию клеточных линий рака простаты человека. Для этого MDA РСа2b клетки, клеточную линию, полученную из метастаз пациента, подвергнувшегося кастрации, Navone и др., Clin. Cancer Res., 3, 2493-500 (1997), инкубируют с или без тестируемых соединений в течение 72 часов и вычисляют количество [3H]-тимидина, встроенного в ДНК, для определения числа клеток и, следовательно, пролиферации. MDA PCa2b клеточную линию выращивают в BRFF-HPC1 среде (Biological Research Faculty & Facility Inc., MD) с 10% FBS. В эксперименте клетки помещают на биопокрытые 96-ячеечные микроподложки и инкубируют при 37°С в 10% FBS (лишенный угля)/BRFF-BMZERO (без андрогенов). Через 24 часа клетки обрабатывают в отсутствие (чистый) или присутствии 1 нМ DHT (контроль) или тестируемыми соединениями (образец) настоящего изобретения в концентрации в пределах от 10-10 до 10-5М. Для каждого образца используют дубликаты. Разбавления соединения проводят на Biomek 2000 лабораторном рабочем устройстве. Через семьдесят два часа добавляют 0.44 uCi. [3H]-тимидина (Amersham) на ячейку и инкубируют еще 24 ч с последующей трипсинизацией, выращивая клетки на GF/B фильтрах. К фильтрам добавляют микросцинт PS до измерения их на Beckman TopCount.% Ингибирования рассчитывают как:
% Ингибирования=100×(1-[среднийконтроль-среднийчистый]/[среднийобразец-среднийчистый.])
По результатам данных строят график и вычисляют концентрацию соединения, которое ингибирует на 50% введение [3H]-тимидина (IC50).
Эксперимент трансактивации С2С12 миобласта мыши:
Проводят два функциональных трансактивационных испытания для определения эффективности андрогеновых агонистов на предшественники мышечной клетки с помощью репортера люциферазы. Первый эксперимент (ARTA стабильный 1) включает использование клеточной линии, стабильный 1 (клон #72), который стабильно экспрессирует полную длину андрогенового рецептора крысы, но требует временной трансфекции энхансер/репортера. Эту клеточную линию получают из С2С12 клеток миобласта мыши. Второй эксперимент (ARTA стабильный 2) включает использование клеточной линии, стабильный 2 (клон #133), полученной из стабильного 1, которая стабильно экспрессирует и rAR и энхансер/репортер люциферазы.
Энхансер/репортерной конструкцией, использующейся в этой системе, является рGL3/2ХВК-1/люцифераза. Сообщалось, что 2XDR-1 является AR специфическим ответным элементом в CV-1 клетках. Brown et. al. Journal of Biological Chemisty 272, 8227-8235, (1997). Он был получен случайным мутагенезом AR/GR конечной энхансерной последовательности.
ART Стабильный 1:
1. Клетки стабильного 1 помещают в 96 ячеек в количестве 6,000 клеток/ячейка в DMEM с большим содержанием глюкозы без фенола красного (Gibco BRL, Cat. No.: 21063-029), содержащих 10% FBS, обработанный декстраном и углем (HyClone Cat. No.:SH30068.02), 50 нМ HEPES буфера (Gibco BRL, Cat. No.: 15630-080), IX MEM пирувата Na (Gibco BRL, Cat. No.: 11360-070), 0.5X противогрибковый антибиотик и 800 мкг/мл генетицина (Gibco BRL, Cat. No.:10131-035).
2. Через 48 часа клетки трансфипируют pGL3/2XDR-l/лициферазой с помощью LipofectAMINE Plus™ реагента (Gibco BRL, Cat. No.: 10964-013). Более конкретно, 5 мкг/ячейка ДНК pGL3/2XDR-l/люциферазы и 50 нг/ячейка Salmon Sperm ДНК (в качестве носителя) разбавляют 5 мкл/ячейка Opti-MEMem средой (Gibco BRL, Cat. No.: 31985-070). Для этого добавляют 0.5 мкл/ячейка Plus реагента. Эту смесь инкубируют в течение 15 минут при комнатной температуре. В отдельном сосуде 0.385 мкл/ячейка LipofectAMINE реагент разбавляют 5 мк/ячейка Opti-MEM. Смесь ДНК затем объединяют со смесью LipofectAMINE и инкубируют еще 15 минут при комнатной температуре. В течение этого времени удаляют среду из клеток и заменяют 60 мкл/ячейка Opti-MEM. Для этого добавляют 10 мкл/ячейка трансфекционную смесь ДНК/LipofectAMINE. Клетки инкубируют в течение 4 часов.
3. Трансфекционную смесь удаляют из клеток и замещают 90 мкл среды, как описано выше в #1.
4. Помещают 10 мкл/ячейка подходящего разбавленного лекарственного средства в каждую ячейку.
5. Через 24 часа экспериментальную систему Steady-Glo™ люциферазы используют для определения активности в соответствии с инструкциями производителя (Promega, Cat. No.: E2520).
ARTA стабильный 2
1. Стабильные 2 клетки помещают в 96 ячеек в количестве 6,000 клеток/ячейка в DMEM с большим содержанием глюкозы без фенола красного (Gibco BRL, Cat. No.: 21063-029) содержащих 10% FBS, обработанный декстраном и углем (HyClone Cat. No.: SH30068.02), 50 мМ HEPES буфера (Gibco BRL, Cat. No.: 15630-080), IX MEM пирувата Na (Gibco BRL, Cat. No.: 11360-070), 0.5X противогрибковый антибиотик, 800 мкг/мл генетицина (Gibco BRL, Cat. No.: 10131-035) и 800 мкг/мл гигромицина β (Gibco BRL, Cat. No.: 10687-010).
2. Через 48 часа среду из клеток удаляют и замещают 90 мкл свежей среды. В каждую ячейку помещают 10 мкл/ячейка подходящего разбавленного лекарственного средства.
3. Через 24 часа экспериментальную систему Steady-Glo™ люциферазы используют для определения активности в соответствии с инструкциями производителя (Promega, Cat. No.: E2520).
См. US No. (не обозначено), с названием "Cell Lines and Cell-BasedAssays for Identification ofAndrogen Receptor Modulators", поданную 20.06.2001 Jacek Ostrowski и др. (Attorney Docket No. DO 177), который приведен здесь полностью в качестве ссылки.
Испытания пролиферации
Эксперимент на пролиферацию клетки муриновой грудной железы:
Способность соединений настоящего изобретения ("тестируемые соединения") модулировать функцию AR определяют тестированием указанных соединений в эксперименте на пролиферацию с помощью ответственной за андроген клеточной линии муриновой грудной железы, полученной из опухоли Шионоги, Hiraoka и др., Cancer Res., 47, 6560-6564 (1987). Стабильные AR-зависимые клоны родственной линии Шионоги, определенные подверганием опухолевых фрагментов общим процедурам, изначально описаны в Tetuo, et. al., Cancer Research 25, 1168-1175 (1965). В соответствии с указанной процедурой одну стабильную линию, SC114, выделяют, характеризуют и используют для определения примеров соединений. SC114 клетки инкубируют с или без тестируемых соединений в течение 72 часов и вычисляют количество [ЗН]-тимидина, встроенного в ДНК как точка для определения числа клеток и, следовательно, скорости пролиферации, как описано в Suzuki et. al, J. Steroid Biochem. Mol. Biol. 37, 559-567 (1990). SC114 клеточную линию выращивают в MEM, содержащей 10-8 М тестостерона и 2% FCS, обработанной DCC. В эксперименте клетки помещают на 96-ячеечные микроподложки в поддерживаемой среде и инкубируют при 37°С. На следующий день среду заменяют на среду без сыворотки [Ham F-12-.MEM (1;1, объем/объем), содержащую 0.1% BSA] с (антагонистический способ) или без (агонистический способ) 10-8 М тестостерона и тестируемых соединений настоящего изобретения в концентрации в пределах от 10-10 до 10-5 М. Для каждого образца используют дубликаты. Разбавления соединения проводят на Biomek 2000 лабораторном рабочем оборудовании. Через семьдесят два часа добавляют 0.44 uCi [3Н]-тимидина (Amersham) на ячейку и инкубируют еще 2 ч с последующей трипсинизацией, выращивая клетки на GF/B фильтрах. К фильтрам добавляют микросцинт PS до измерения их на Beckman TopCount. Для антагонистического способа% ингибирования рассчитывают как:
% Ингибирования=100×(1-[среднийобразец-среднийчистый]/[среднийконтроль-среднийчистый])
По результатам данных строят график и вычисляют концентрацию соединения, которая ингибирует на 50% введение [3H]-тимидина (IC50).
Для агонистического способа% контроля определяют как действие тестируемого соединения по сравнению с максимальным действием, наблюдаемым для природного гормона, в данном случае DHT, и рассчитывают как:
% Контроля=100×(среднийобразец-среднийчистый)/(среднийконтроль-среднийчистый)
По результатам данных строят график и вычисляют концентрацию соединения, которая ингибирует на 50% введение [3H]-тимидина (IC50).
In Vitro Эксперимент для определения АР-1 трансрепрессии, вызванной GR:
АР-1 эксперимент представляет собой эксперимент, основанный на клетке люциферазного репортера. А549 клетки, которые содержат эндогенный глюкокортикоидный рецептор, стабильно трансфицируют АР-1 ДНК-связывающим сайтом, присоединенным к люциферазному гену. Клетки затем выращивают в RPMI+10% эмбриональной телячьей сыворотки (обработанной углем)+Пенициллин/стрептомицином с 0.5мг/мл генетицина. Клетки помещают за день до эксперимента приблизительно в количестве 40000 клеток/ячейка. В день эксперимента среду удаляют и добавляют 20 мкл экспериментального буфера (RPMI без фенола красного+10% FCS (обработанного углем)+Pen/Strep) в каждую ячейку. В этот момент в каждую ячейку добавляют или 20 мкл экспериментального буфера (контрольные эксперименты), соединения настоящего изобретения ("тестируемые соединения") (растворенные в DMSO и добавляемые в различных концентрациях) или дексаметазон (100 нМ в DMSO, положительный контроль). Подложки затем проинкубируют в течение 15 минут при 37°С с последующим стимулированием клеток 10 нг/мл РМА. Подложки затем инкубируют в течение 7 часов при 37°С, через которые в каждую ячейку добавляют 40 мкл субстратного реагента люциферазы. Активность измеряют анализом на люминометре по сравнению с контрольными экспериментами, обрабатываемыми буфером или дексаметазоном. Активность обозначена как % ингибирования репортерной системы по сравнению с буферным контролем с 10 нг/мл РМА отдельно. Контроль, дексаметазон в концентрации <10 мкМ обычно подавляет активность на 65%. Тестируемые соединения, которые проявляют ингибирование индукции РМА на 50% или более в концентрации тестируемого соединения <10 мкМ, считаются активными.
AR Антагонистический эксперимент сырой массы простаты:
Активность соединений настоящего изобретения в качестве AR антагонистов определяют на модели незрелых самцов крыс, стандартном известном тесте антиандрогеновой активности данного соединения, как описано в L.G.Hershberger и др., Proc. Soc. Expt. Biol. Med., 83,175 (1953); Р.С.Walsh и R.F.Gittes, "Inhibition of extratesticular stimuli to prostate growth in castrated rat by antiandrogens". Endocrinology, 86, 624 (1970); и В. J. Furr и др., "ICI 176,334: novel non-steroid, peripherally selective antiandrogen", J. Endocrinol., 113, R7-9 (1987), описание которых приведено здесь в качестве ссылки.
Основа этого эксперимента заключается в том, что мужские половые органы, такие как простата и семенные пузырьки, играют важную роль в репродуктивной функции. Стимулирование роста этих органов и выращенный размер и выделительная функция зависит от продолжительного присутствия тестостерона в сыворотке (Т), который является главным андрогеном сыворотки (>95%), вырабатываемым грандулоцитами яичка в яичках под контролем лютеинизирующего гормона гипофиза (LH) и фолликулостимулирующего гормона (FSH). Тестостерон превращается в более активную форму, дигидротестостерон, (DHT), в простате с помощью 5α-редуктазы. Андрогены надпочечников также составляют около 20% общего DHT в простате крысы по сравнению с 40% андрогенов у 65-летнего мужчины. F.Labrie и др. din. Invest. Med., 16, 475-492 (1993). Однако это не главный путь, так как у млекопитающего и людей кастрация приводит к почти полной дегенерации простаты и семенных пузырьков без сопутствующей адреналектомии. Следовательно, в нормальном состоянии надпочечники не вызывают значительного роста тканей простаты. М.С.Luke и D.S.Coffey, " Physiology of Reproduction" ed. By E.Knobil и J.D.Neill, 1, 1435-1487 (1994). Так как мужские половые органы являются тканями, наиболее ответственными за модулирование андрогеновой активности, эту модель используют для определения зависимого от андрогена роста половых органов у незрелых кастрированных крыс.
Самцов незрелых крыс (19-20 дневного возраста Sprague-Dawley, Harlan Sprague-Dawely) кастрируют под анестезией метофаном. Через пять дней после хирургической операции этим кастрированным крысам (60-70 г, 23-25 дневного возраста) дают лекарство в течение 3 дней. Животным вводят лекарство подкожно (s.c.) 1 мг/кг с пропионатом тестостерона (ТР) в связующем арахисовом масле и антиандрогеновые тестируемые соединения (соединения настоящего изобретения) вводят орально через зонд (р.о.) в растворе/суспензии 80% PEG 400 и 20% Tween 80 (PEGTW). Животным вводят (v/w) 0.5 мл связующего вещества /100 г веса тела. Экспериментальными группами являются следующие:
1. Контрольное связующее вещество
2. Пропионат тестостерона (ТР) (3 мг/крыса/день, подкожно)
3. ТР плюс Казодекс (вводимый р.о. в PEGTW, QD), известный антиандроген, в качестве ссылочного соединения.
4. Для определения антагонистической активности соединение настоящего изобретения ("тестируемое соединение") вводят (р.о. в PEGTW, QD) с ТР (s.c., как вводят в группе 2) в различных дозах.
5. Для определения агонистической активности соединение настоящего изобретения ("тестируемое соединение") вводят отдельно (р.о. в PEGTW, QD) в различных дозах.
В конце 3-дневного лечения животных умерщвляют и брюшную простату взвешивают. Для сравнения данных из различных экспериментов вес половых органов сначала стандартизуют как мг на 100 г веса тела, и увеличение веса органа, вызванное ТР, считается максимальным увеличением (100%). ANOVA с последующим одноконечным Student или Fischer точным тестом используют для статистического анализа.
Увеличение и уменьшение веса полового органа отражает изменения числа клеток (содержащих ДНК) и клеточной массы (содержащей протеин), в зависимости от концентрации андрогена в сыворотке. См. Y. Okuda и др., J. Urol., 145, 188-191 (1991). Следовательно, измерение веса сырого органа способно показать биоактивность андрогенов и андрогеновых антагонистов. У неразвитых кастрированных крыс замещение экзогенных андрогенов увеличивает семенные пузырьки (SV) и брюшную простату (VP) в зависимости от дозы.
Максимальное увеличение веса органа составляет 4 или 5-кратное при дозе 3 мг/крыса/день тестостерона (Т) или 1 мг/крыса/день пропионата тестостерона (ТР) в течение 3 дней. EC50 для Т и ТР составляют около 1 мг и 0.03 мг соответственно. повышение веса VP и SV также соотносится с увеличением в сыворотке Т и DHT концентрации. Хотя введение Т оказывает повышение концентрации Т и DHT в сыворотке в 5 раз через 2 часа после подкожной инъекции по сравнению с ТР, после этого эти высокие уровни уменьшаются очень быстро. Наоборот, концентрации в сыворотке Т и DHT у ТР-обрабатываемых животных явно постоянны в течение 24 часов, и следовательно, ТР проявляют около 10-30-раз большую активность по сравнению с чистым Т.
В этой недозрелой кастрированной модели крысы известный AR антагонист (касодекс) также вводят одновременно с 0.1 мг ТР (ED80), ингибируя тестостерон-опосредованное увеличение веса VP и SV в зависимости от дозы. Антагонистические действия примерно одинаковы при введении орально или подкожно. Соединения по изобретению также проявляют AR антагонистическую активность, подавляя тестостерон-опосредованное увеличение веса VP и SV.
AR Агонистический эксперимент с поднимающей мышцей ануса и сырым весом простаты:
Активность соединений настоящего изобретения в качестве AR агонистов исследуют на модели незрелых самцов крыс, известном тесте на обезболивающие действия на мышцы и продолжительные действия на половые органы для данного соединения, как описано в L.G. Hershberger и др., Proc. Soc. Expt. Biol. Med., 83, 175 (1953); В.L. Beyler и др, "Methods for evaluating anabolic and catabolic agents in laboratory animals", J. Amer. Med. Women's Ass., 23, 708 (1968); H. Fukuda и др., "Investigations of levator ani muscle as an anabolic steroid assay", Nago Dai. Yak. Ken. Nem. 14, 84 (1966).
Основа этого эксперимента лежит в хорошо изученном действии андрогенных агентов на поддержание и рост мышечных тканей и половых органов у животных и человека. Андрогенные стероиды, такие как тестостерон (Т), хорошо характеризуются на их способность поддерживать мышечную массу. Лечение животных или людей после кастраций экзогенным источником Т приводит к прекращению мышечной атрофии.
Влияние Т на мышечную атрофию в поднимающей мышце ануса крысы хорошо известно. М.Masuoka и др., "Constant cell population in normal, testosteron deprived and testosteron stimulated levator ani muscles" Am. J. Anat. 119,263 (1966); Z. Gori и др., "Testosteron hypertrophy of levator ani muscle of castrated rats. I. Quantitative data" Boll. - Soc. Ital. Biol. Sper. 42, 1596 (1966); Z. Gori и др., "Testosteron hypertrophy of levator ani muscle of castrated rats. II. Electron-microscopic observations" 5o//. - Soc. Ital. Biol. Sper. 42, 1600 (1966); A. Boris и др.. Steroids 15, 61 (1970). Как описано выше, влияние андрогенов на поддержание мужских половых органов, таких как простата и семенные пузырьки, хорошо известны. Кастрация приводит к быстрой дегенерации и атрофии простаты и семенных пузырьков. Это действие может быть остановлено экзогенным добавлением андрогенов. Так как поднимающая мышца ануса и мужские половые органы являются тканями, наиболее ответственными за действие андрогенных агентов, эта модель используется для определения андроген-зависимой атрофии в поднимающей мышце ануса и половых органах у неразвитых кастрированных крыс. Половозрелые крысы (200-250 г, 6-8-недельного возраста, Sprague-Dawley, Harlan) кастрированы производителем (Taconic). Крыс делят на группы и обрабатывают ежедневно в течение от 7 до 14 дней одним из следующих реагентов:
1. Контрольное связующее вещество
2. Пропионат тестостерона (ТР) (3 мг/крыса/день, подкожно)
3. ТР плюс Казодекс (вводимый р.о. в PEGTW, QD), известный антиандроген, в качестве ссылочного соединения.
4. Для определения антагонистической активности соединение настоящего изобретения ("тестируемое соединение") вводят (р.о. в PEGTW, QD) с ТР (s.c. как вводят в группе 2) в различных дозах.
5. Для определения агонистической активности соединение настоящего изобретения ("тестируемое соединение") вводят отдельно (р.о. в PEGTW, QD) в различных дозах.
В конце 7-14-дневного лечения животных умерщвляют диоксидом углерода и поднимающую мышцу ануса, семенной пузырек и брюшную простату взвешивают. Для сравнения данных из различных экспериментов вес поднимающей мышце ануса и полового органа сначала стандартизуют как мг на 100 г веса тела, и увеличение веса органа, вызванное ТР, считается максимальным увеличением (100%). Для статистического анализа используют Super-anova (однофакторный).
Увеличение и уменьшение веса полового органа отражает изменения числа клеток (содержащих ДНК) и клеточной массы (содержащей протеин), в зависимости от концентрации андрогена в сыворотке. См. Y. Okuda и др., J, Urol, 145,188-191 (1991), описание которых приведено здесь в качестве ссылки. Следовательно, измерение веса сырого органа способно показать биоактивность андрогенов и андрогеновых антагонистов. У неразвитых кастрированных крыс замещение экзогенных андрогенов увеличивает поднимающую мышцу ануса, семенные пузырьки (SV) и простату в зависимости от дозы.
Максимальное увеличение веса органа составляет 4 или 5 раз при введении 3 мг/крыса/день тестостерона (Т) или 1 мг/крыса/день пропионата тестостерона (ТР) в течение 3 дней. ЕС50 Т и ТР составляют около 1 мг и 0.03 мг соответственно. Повышение веса VP и SV также соотносится с увеличением концентрации Т и DHT в сыворотке. Хотя введение Т проявляет повышение концентрации Т и DHT в сыворотке в 5 раз через 2 часа после подкожной инъекции по сравнению с ТР, после этого эти высокие уровни уменьшаются очень быстро. Наоборот, концентрации в сыворотке Т и DHT в ТР-обрабатываемых животных явно постоянны в течение 24 часов, и следовательно, ТР проявляют около 10-30-кратную большую активность по сравнению с чистым Т.
Зенографический эксперимент MDA РСа2b простаты человека:
In Vivo Противоопухолевый тест: опухоли MDA-PCa-2b простаты человека выращивают в Balb/c nu/nu лишенных шерсти мышах. Опухоли вводят как подкожные трансплантанты во взрослых самцов лишенных шерсти мышей (4-6 недельного возраста) используя опухолевые фрагменты, полученные от донорских мышей. Пересадку опухоли проводят каждые 5-6 недель.
Для испытаний на противоопухолевую эффективность необходимое число животных, нуждающихся в определении значения отклика, объединяют в начале эксперимента и каждому вводят подкожно имплантант опухолевого фрагмента (˜50 мг) с помощью 13-калиберного троакара. Опухолям позволяют расти до приблизительно 100-200 мг (опухоли вне области исключаются) и животных случайно разделяют на группы для различного лечения и контроля. Лечение каждого животного основано на индивидуальном весе тела. Обрабатываемых животных контролируют ежедневно на токсичность/смертность, связанные с лечением. Каждую группу животных взвешивают до начала лечения (Wt1) и затем снова следующую последнюю лечебную дозу (Wt2). Различие веса тела (Wt2-Wt1) обеспечивает измерение связанной с лечением токсичности.
Опухолевый отклик измеряют измерением опухолей кронциркулем дважды в неделю, пока опухоли не достигнут "конечного" размера 0.5 гм. Вес опухоли (мг) определяют по формуле: Вес опухоли=(длина×ширина2)÷2
Конечную точку опухолевого отклика выражают как ингибирование роста опухоли (%Т/С), определяемого как отношение среднего веса опухоли обрабатываемых опухолей (Т) к среднему севу контрольной группы (С).
Для определения уничтожения опухолевой клетки время удвоения объема опухоли сначала рассчитывают по формуле:
TVDT=Среднее время (дни) для контрольных опухолей для достижения конечного размера-Среднее время (дни) для контрольных опухолей для достижения половины конечного размера s And, Log уничтожение клетки=(Т-С)-(3.32×TVDT).
Статистическую обработку данных проводят с помощью теста Уилкоксона, основанного Геханом.
Длительная опухоль простаты:
Длительная R3327H опухоль простаты представляет собой спонтанно развивающуюся, хорошо различимую андрогензависимую аденокарциному простаты (Smolev JK, Heston WD, Scott WW и Coffey DS, Cancer Treat Rep. 61, 273-287 (1977)). Рост R3327H субран за ее высокий андрогензависимый и воспроизводимый рост нетронутых самцов крыс. Следовательно, эта модель и другие сублинии этой опухоли широко используются для определения in vivo противоопухолевой активности антиандрогенов, таких как флутамид и бацилутамид/Казодекс (Maucher А., и von Angerer, J. Cancer Res. din. Oncol., 119, 669-674 (1993), Furr B.J.A. Euro. URL 18 (suppl. 3), 2-9 (1990), Shain S.A. и Huot Rl. J. Steriod Biochem. 31, 711-718 (1988)).
В начале изучения длительные опухолевые фрагменты (около 4х4 мм) трансплантируют подкожно в бок зрелых самцов крыс из Копенгагена (6-7 недельного возраста, Harlan-Sprague Daw-ley, Indianapolis, MD). Через около 6 недель после имплантации животных с опухолями измеренного размера (около 80-120 мм) разбивают в лечебные группы (8-10 крыс/группа) и начинают лечение. Одну группу крыс кастрируют, что служит отрицательным контролем роста опухоли. Животных обрабатывают ежедневно соединениями настоящего изобретения, стандартными антиандрогенами, такими как бацилутамид или связующее вещество (контроль) в среднем от 10 до 14 недель. Тестируемые соединения растворяют в связующем веществе (2.5 мл/кг веса тела) 10% полиэтиленгликоля и 0.05% Tween-80 в 1% карбоксиметилцеллюлозе, PEG/CMC, (Sigma, St Louis, МО). Обычные терапевтические эксперименты включают три группы из трех возрастающих доз для каждого стандартного или тестируемого соединения (в области 300-3 мг/кг).
Опухоли в группе со связующим веществом (контроль) достигают размера от 1500 до 2500 мм, тогда как группа кастрированных животных обычно проявляет остановку опухоли через 14 недель наблюдения. Ожидается, что животные, обрабатываемые орально 20 мг/кг бикалутамидом или флутамидом, проявляют 40% уменьшение объема опухоли по сравнению с контролем через 14 недель лечения. Размер опухолей измеряют еженедельно нониусом кронциркуля (Froboz, Switzerland), проводя перпендикулярные измерения длины и ширины. Объемы опухолей вычисляют в мм3 по формуле: Длина х Ширина х Высота=Объем. Статистические различия между лечебными группами и контролем оцениваются с помощью множественного ANOVA анализа с последующим одноконечным непараметральным Student t тестом.
Эксперимент веса простаты зрелой крысы:
Активность соединений настоящего изобретения исследуют на зрелой модели самцов крыс, которая является вариантом эксперимента поднимающей мышце ануса и сырого веса простаты, описанного выше. Указанные выше in vivo испытания являются известными испытаниями для определения обезболивающих эффектов на мышцы и поддерживающих эффектов на половые органы для данного соединения, как описано в L.G.Hershberger и др., 83 Proc. Soc. Expt. Biol. Med., 175 (1953); В.L.Beyler и др, "Methods for evaluating anabolic and catabolic agents in laboratory animals", 23 J. Amer. Med. Women's Ass., 708 (1968); H.Fukuda и др., "Investigations of levator ani muscle as an anabolic steroid assay", 14 Nago Dai. Yak. Ken. Nem. 84 (1966), описание которых приведено здесь в качестве ссылки. Основа этого эксперимента заключается в хорошо известном действии андрогенных агентов на поддержание и рост мышечных тканей и половых органов у животных и человека.
Мужские половые органы, такие как простата и семенные пузырьки, играют важную роль в репродуктивной функции. Стимулирование роста этих органов и выращенный размер и выделительная функция зависит от продолжительного присутствия тестостерона в сыворотке (Т), который является главным андрогеном сыворотки (>95%), вырабатываемым грандулоцитами яичка в яичках под контролем лютеинизирующего гормона гипофиза (LH) и фолликулостимулирующего гормона (FSH). Тестостерон превращается в более активную форму, дигидротестостерон, (DHT), в простате с помощью 5α-редуктазы. Андрогены надпочечников также составляют около 20% общего DHT в простате крысы, по сравнению с 40% андрогенов у 65-летнего мужчины. F.Labrie и др. din. Invest. Med., 16, 475-492 (1993). Однако это не главный путь, так как у млекопитающего и людей кастрация приводит к почти полной дегенерации простаты и семенных пузырьков без сопутствующей адреналектомии. Следовательно, в нормальном состоянии надпочечники не вызывают значительного роста тканей простаты. М.С.Luke и D.S.Coffey, "Physiology of Reproduction" ed. By E.Knobil и J.D.Neill, 1, 1435-1487 (1994). Так как мужские половые органы и поднимающая мышцы ануса являются тканями, наиболее ответственными за модулирование андрогеновой активности, эту модель используют для определения активности соединений, которые модулируют путь андрогенового рецептора в зрелых крысах.
Вместе с митогенной активность на ткани, такие как простата, семенные пузырьки и мышцы, тестостерон также выступает как отрицательный регулятор для его собственного биосинтеза. Выработка тестостерона в грандулоцитах яичка в яичках контролируется уровнем циркулирующего LH выделяемого из железы гипофиза. LH уровни сами контролируются уровнем LHRH, вырабатываемого областью гипоталамуса. Уровни тестостерона в крови служат для ингибирования выделения LHRH и значительного понижения уровней LH и альтернативных уровней циркулирующих уровней тестостерона. Путем измерения уровней LH в крови, что осуществляется соединениями настоящего изобретения ("тестируемые соединения"), возможно определение уровня агонистической или антагонистической активности указанных соединений в системе гипоталамуса этого эндокринного цикла.
Отобранным группам Harlan Sprague-Dawely крыс (40-42 дневного возраста, 180-220 г), вводят орально через зонд (р.о.) тестируемые соединения в растворе/суспензии 80% PEG 400 и 20% Tween 20 (PEGTW) в течение 14 дней. Двум контрольным группам, одной интактной и одной кастрированной, вводят орально только PEGTW связующее вещество. Животным вводят (v/w) 0.5 мл связующего вещества /100 г веса тела. Экспериментальными группами являются следующие:
1. Интактное связующее вещество (р.о., PEGTW, QD)
2. Контрольное связующее вещество (р.о., PEGTW, QD)
3. Бикалутамид (Казодекс, известный антиандроген, в качестве ссылочного соединения) или соединение настоящего изобретения, р. о. в PEGTW QD (в различных дозах). В конце 14-дневного лечения животных умерщвляют и брюшную простату, семенные пузырьки и поднимающую мышцу ануса удаляют хирургически и взвешивают. Для сравнения данных из различных экспериментов вес органов сначала стандартизуют как мг на 100 г веса тела и выражают как процентное соотношение величины соответствующего органа в интактной группе.
Лютеинизирующий гормон крысы (rLH) количественно определяют с помощью Biotrak [125 I] оборудования (Amersham Pharmacia Biotek), следуя указаниям производителя. Эксперимент основан на сравнении присутствующего в сыворотке LH, связавшего [125I]rLH, с суспензией Amerlex-M гранула/антитело. Радиоактивность, оставшаяся после инкубирования с сывороткой и последующих.промываний, экстраполируют на стандартной кривой для получения значений в нг/мг.
Увеличение и уменьшение веса полового органа и поднимающей мышцы ануса отражает изменения числа клеток (содержащих ДНК) и клеточной массы (содержащей протеин), в зависимости от концентрации андрогена в сыворотке, см. Y.Okuda и др., J. Urol., 145, 188-191 (1991), описание которых приведено здесь в качестве ссылки. Следовательно, измерение веса сырого органа способно показать биоактивность андрогенов и андрогеновых антагонистов. В эксперименте с развитыми крысами активные агонистические агенты не оказывают действия или не повышают вес одного или более андрогензависимых органов (поднимающая мышца ануса, простата, семенной пузырек) и не оказывают действия или подавляющего действия на выделение LH. Соединения с антагонистической активностью понижают вес одного или более андрогензависимых органов (поднимающая мышца ануса, простата, семенной пузырек) и не оказывают действия или снижают подавляющее действие на выделение LH.
Зенографический эксперимент CWR22 простаты человека;
In Vivo Противоопухолевый тест: Опухоли CWR22 простаты человека выращивают в Balb/c nu/nu лишенных шерсти мышах. Опухоли вводят как подкожные трансплантаты во взрослых самцов лишенных шерсти мышей (4-6 недельного возраста), используя опухолевые фрагменты, полученные от донорских мышей. Пересадку опухоли проводят каждые 5-6 недель.
Для испытаний на противоопухолевую эффективность необходимое число животных, нуждающихся в определении значения отклика, объединяют в начале эксперимента и каждому вводят подкожно имплантант опухолевого фрагмента (˜50 мг) с помощью 13-калиберного троакара. Опухолям позволяют расти приблизительно до 100-200 мг (опухоли вне области исключаются) и животных произвольно разделяют на группы с различным лечением и контролем. Лечение каждого животного основано на индивидуальном весе тела. Обрабатываемых животных контролируют ежедневно на токсичность и смертность, связанные с лечением. Каждую группу животных взвешивают до начала лечения (Wt1) и затем после последней лечебной дозы (Wt2). Различие веса тела (Wt2-Wt1) обеспечивает измерение связанной с лечением токсичности.
Опухолевый отклик измеряют определением опухолей кронциркулем дважды в неделю, пока опухоли не достигнут "конечного" размера в 0.5 гм. Вес опухоли (мг) определяют по формуле: Вес опухоли = (длина·ширина2)÷2.
Конечную точку опухолевого отклика выражают как ингибирование роста опухоли (% Т/С), определяемого как отношение среднего веса опухоли обрабатываемых опухолей (Т) к среднему весу контрольной группы (С).
Для определения уничтожения опухолевой клетки сначала рассчитывают время удвоения объема опухоли по формуле:
TVDT = Среднее время (дни) контрольных опухолей для достижения конечного размера - Среднее время (дни) контрольных опухолей для достижения половины конечного размера And, Log уничтожение клетки = (Т-С)+(3.32×TVDT)
Статистическую обработку данных проводят с помощью теста Уилкоксона, основанного Геханом.
Следующие примеры иллюстрируют воплощения настоящего изобретения и не ограничивают объем настоящего изобретения.
Сокращения
Используются следующие сокращения:
DBU = 1,8-диазабицикло[5.4.0]ундек-7-ен
4-DMAP = 4-диметиламинопиридин
ее = энантиомерный избыток
DMF = диметилформамид
EtOAc = этилапетат
LDA = диизопропиламид лития
Hunig's Base = N,N-диизопропилэтиламин
Me = метил
RT = время удержания
TFA = трифторуксусная кислота
ТГФ = тетрагидрофуран
TLC = тонкослойная хроматография
TMS = триметилсилил
pTSA = пара-толуолсульфоновая кислота
Δ = тепло
t-Bu = трет-бутил
PhCH3 = толуол
Pd/C = палладий на активированном угле
TsCl = тозилхлорид
TBSOTf = трет-бутилдиметилсилил трифторметан сульфонат
TBS = трет-бутилдиметилсилан
MeI = метил иодид
(ВОС)2О = ди-трет-бутилдикарбонат
TEA = триэтиламин
н-BuLi = н-бутиллитий
комнатная температура = комнатная температура
LC = жидкостная хроматография
Ts = тозил
Ph = фенил
EtOH = этанол
DCE = дихлорэтан
ДМСО = диметилсульфоксид
Ra-Ni = никель Ренея
MS = молекулярные сита
MS(EC) = электроспрейная массспектрография
mCPB A = м-хлорпероксибензойная кислота
насыщенный = насыщенный
АсОН = уксусная кислота
МеОН = метанол
Et2O = диэтиловый эфир
Ас = ацетил
DEAD = диэтил азодикарбоксилат
h = часы
Et = этил
WSDCC = растворимый в воде дикарбонилдиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид
TBAF = тетрабутиламмоний фторид
DBAD = ди-трет.-бутилазодикарбоксилат
DCC = Дициклогексилкарбодиимид
Wilkinson's catalyst = RhCl(PPh3)3 (катализатор Вилкинсона)
ADDP = 1,1-[азодикарбонил]дипиперидин
DMA = диметилацетамид
DME = 1,2-диметоксиэтан
ВОР = бензотриазол-1-илокситрис(диметиламино)-фосфоний гексафторфосфат
TFA = трифторуксусная кислота
Пример 1
(3аα,4α,7α,7аα)-2-(4-Бром-3-метилфенил)тетрагидро-4,7-этанотиопирано [3,4-с]пиррол-1,3,8(2Н,4Н)-трион(1С)
А. 4-(трет-Бутилдиметилсилокси)-2Н-тиопиран (1А)
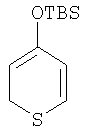
2,3-Дигидро-4Н-тиопиран-4-он (1.50 г, 13.14 моль, синтезированный, как описано у Richards et al, J. Org. Chem. 46, 4836-4842 (1981)), растворяют в СН2Cl2 (130 мл) и добавляют триэтиламин (5.47 мл, 39.41 ммоль). Затем добавляют трет-бутилдиметилсилил трифторметансульфонат (3.62 мл, 15.77 ммоль). Через 10 минут летучие вещества удаляют с помощью роторного испарителя при 25°С. Полученное желтое масло пропускают через короткую колонку с SiO2, элюируя 3% TEA в гексане, что дает 1.82 г соединения 1А в виде масла оранжевого цвета.
В. 1-[4-бром-3-метилфенил]-1N-пиррол-2,5-дион (IB)
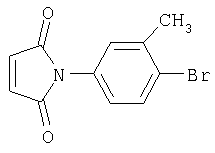
4-Бром-3-метиланилин (1.55 г, 8.33 ммоль) и малеиновый ангидрид (0.898 г, 9.16 ммоль) растворяют в уксусной кислоте (10 мл) и нагревают при температуре 115°С в течение 12 часов. Реакционную смесь затем охлаждают до температуры 25°C и уксусную кислоту удаляют в вакууме. Полученный остаток суспендируют в 5% К2СО3 (100 мл), перемешивают в течение 25 минут, а затем фильруют и промывают водой. Полученный продукт затем сушат в вакууме, что дает соединение 1В в виде светло-коричневого твердого вещества (1.65 г). HPLC: 100% в течение 2.96 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм).
С. (3аα,4α,7α,7аα)-2-(4-Бром-3-метилфенил)тетрагидро-4,7-этанотиопирано[3,4-с]пиррол-1,3,8(2Н,4Н)-трион (1С)
Соединение 1А (0.313 г, 1.41 ммоль) и соединение 1В (0.250 г, 0.94 ммоль) растворяют в толуоле и нагревают при кипении с обратным холодильником в течение 5 часов. Затем толуол удаляют, продувая аргон через реакционную колбу. Остаток очищают с помощью флеш хроматографии на SiO2, элюируя 20% гексаном в хлорформе. Это дает 0.168 г промежуточного энола эфира в виде твердого вещества желтого цвета. Промежуточный энол эфир растворяют в дихлорэтане (2.0 мл) и добавляют TFA (0.25 мл). Через 0.5 часов реакцию захолаживают насыщенным водным раствором NaHCO3 и экстрагируют CH2Cl2 (2×30 мл). Органику сушат над безводным сульфатом натрия и выпаривают, что дает 0.079 г соединения 1С в виде твердого вещества белого цвета. HPLC: 99% в течение 3.010 минут (время удержания) (YMC S5 ODS колонка 4.6Ч50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 396.9 [М+NH4]+.
Пример 2
(3аα,4α,7α,7аα)-2-(4-Бром-3-метилфенил)тетрагидро-4,7-этанотиопирано[3,4-с]пиррол-1,3,8(2Н,4Н)-трион5,5-диоксид (2)
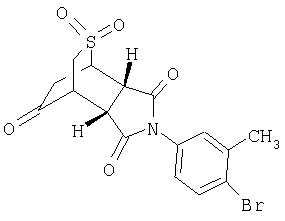
Соединение 1С (0.040 г, 0.105 ммоль) растворяют в CH2Cl2 (4.0 мл) и охлаждают до температуры 0°С. Затем добавляют м-СРВА (60% чистота, 0.061 г, 0.210 ммоль) и реакционную смесь нагревают до температуры 25С. Через час при энергичном перемешивании добавляют смесь 1:1 насыщенного NaHCO3 и насыщенного сульфата натрия (20 мл). Через 15 минут смесь экстрагируют СН2Cl2 (2×30 мл) и органику сушат над безводным сульфатом натрия, что дает 0.031 г соединения 2 в виде твердого вещества белого цвета. Дальнейшая очистка не требуется. HPLC: 78% в течение 2.290 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 429.8 [M+NH4]+.
Пример 3
(3аα,4β,7β,7аα)-2-(3-Хлорфенил)гексагидро-4-метил-4,7-эпокси-1N-изоиндол-13(2H)-дион (3)
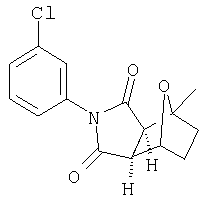
3-Хлоранилин (0.100 г, 0.787 ммоль) и 3,6-эндоксо-3-метилгексагидрофталевый ангидрид (0.172 г, 0.945 ммоль) растворяют в АсОН (2.0 мл) и нагревают до температуры 110°С в течение часа. Реакционную смесь затем охлаждают до температуры 25°С и выливают в холодный насыщенный раствор К2СО3, после чего энергично перемешивают в течение 10 минут. Затем раствор отфильтровывают и промывают водой. Полученный фильтрат сушат в вакууме, что дает 0.118 г соединения 3 в виде твердого вещества белого цвета. Дальнейшая очистка не требуется. HPLC: 99% в течение 2.510 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 292.32 [М+Н]+.
Пример 4
(3аα,4α,7α,7аα)-и(3аα,4β,7β,7аα)-4-[(Ацетилокси)метил]-3α4,7,7а-тетрагидро-2-[3-(трифторметил)фенил]-4,7-эпокси-1N-изоиндол-1,3(2H)-дион (4i и 4ii соответственно)
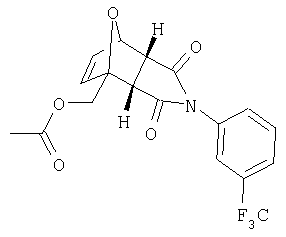
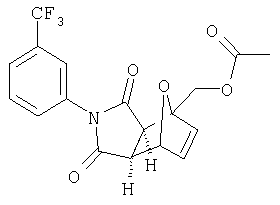
2-Ацетоксиметилфуран (0.599 мл, 4.78 ммоль) и 1-[3-(трифторметил)-фенил]-1N-пиррол-2,5-дион (0.500 г, 2.39 ммоль) растворяют в хлористом метилене (3.0 мл) при 25°С. Через 22 часа летучие вещества удаляют в вакууме и полученный остаток очищают с помощью флеш хроматографии на SiO2, элюируя 0-15% ацетоном в хлористом метилене, что дает 0.438 г желтого масла в виде 2:1 смеси соединения 4i и соединение 4ii, которую не разделеяют. HPLC: 100% в течение 3.093 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 398.9 [М+NH4]+.
Пример 5
(3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-4-[(Ацетилокси)метил]-Гексагидро-2-[3-(трифторметил)фенил]-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион (5i и 5ii соответственно)

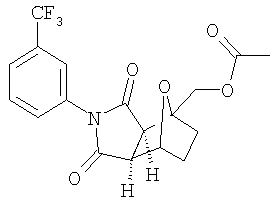
Смесь 2:1 соединений 4i и 4ii (0.361 г, из примера 4) растворяют в этилацетате (25 мл) и добавляют Pd/C (10% Pd, 0.2 г). Водород вводят через баллон и реакционную массу перемешивают при температуре 25°С в течение 4 часов; затем фильтруют через целит и промывают этилацетатом. Концентрация в вакууме дает масло желтого цвета, которое определяют, как смесь 2:1 соединения 5i и соединения 5ii (0.348 г) и которую не разделяют. HPLC: 100% в течение 2.900 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 40 1.0 [М+NH4]+
Пример 6
(3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-3а,4,7,7а-Тетрагидро-5-(гидроксиметил)-2-[3-(трифторметил)(фенил]-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион (6i и 6ii соответственно)
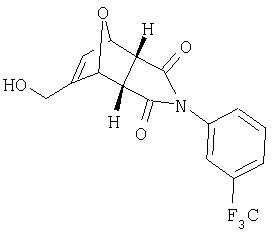
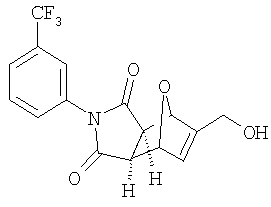
1-[3-(Трифторметил)фенил]-1Н-пиррол-2,5-дион (0.500 г, 2.39 ммоль) и 3-фуранметанол (0.412 мл, 4.78 ммоль) растворяют в хлористом метилене (3.0 мл) и перемешивают при температуре 25°С в течение 20 часов. Летучие вещества затем удаляют в вакууме и полученный продукт очищают с помощью флеш хроматографии на SiO2, элюируя хлороформом/ацетоном, что дает 0.379 г соединения 6i и 0.220 г соединения 6ii, оба в виде твердого вещества белого цвета. Соединение 6i: HPLC: 100% в течение 2.197 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/мин, контролирование при 220 нм), MS (ES): м/е 338.0 [M-H]-. Соединение 611: HPLC: 100% в течение 2. минут (время удержания) (YMC S5 ODS колонка 4.6 х мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/мин, контролирование при 220 нм), MS (ES): м/е 338.0 [М-Н]-.
Пример 7
(3аα,4α,7α,7аα)-3а,4,7,7а-Тетрагидро-5-(гидроксиметил)-4-метил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион

2-Метил-3-фуранметанол (0.537 г, 4.78 ммоль) и 1-[3-(трифторметил)-фенил]-1N-пиррол-2,5-дион (0.500 г, 2.39 ммоль) растворяют в дихлорэтане (2.0 мл) и перемешивают при температуре 25°С в течение 20 часов. Реакционную смесь затем концентрируют в вакууме и очищают с помощью флеш хроматографии на SiO2, элюируя этилацетатом/хлористым метиленом, что дает 0.317 г соединения 7 в виде твердого вещества белого цвета. Никакой другой возможный изомер не выделяют после хроматографии. HPLC: 100% в течение 2.197 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 351.9 [М-Н]-.
Пример 8
(3аα,4β,7β,7аα)-2-[3,5-Бис(трифторметил)фенил]гексагидро-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион(8)
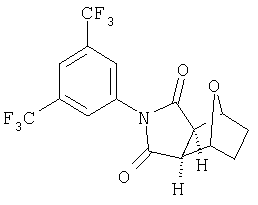
3,5-Бис-(трифторметил)-анилин (0.017 г, 0.0075 ммоль) растворяют в уксусной кислоте (0.300 мл) и переносят в конический ампулу объемом 1.5 мл с перегородкой. Растворы исходных дополнительных 95 аминов получают, как описано выше. В каждую из описанных выше ампул добавляют 0.4 мл (0.12 ммоль) исходного раствора эксо-7-оксабицикло[2.2.1]гептан-2,3-ангидрида дикарбоновой кислоты в уксусной кислоте. Ампулы затем герметизируют и нагревают при температуре 110°С в течение часа. После охлаждения до 25°С ампулы вскрывают, а затем удаляют уксусную кислоту под вакуумом. В каждую ампулу добавляют 1 мл смеси 2:1 ацетон/хлористый метилен и сосуды нагревают при температуре 40°С в течение часа. Одновременно все продукты, находящиеся в растворе, переносят автоматически в пробирки с фильтрами, заполненными крупными фриттами, предварительно смоченными 0.2 мл воды. Пропускают азот через каждую пробирку, пока не удалят органические летучие вещества. Затем в каждую пробирку добавляют 1.5 мл 10% раствора К2СО3, а затем энергично встряхивают при 25°С в течение 15 минут. Затем декантируют из пробирки, повторно герметизируют и добавляют 1.0 мл воды в каждую пробирку, затем встряхивают. Снова декантируют и промывают водой второй раз. Полученные остатки в каждой пробирке сушат в вакууме в течение 48 часов. После сушки в каждую пробирку добавляют 1.0 мл 20% TFA в хлористом метилене и емкости встряхивают в течение 30 минут. Пробирки затем сливают в 96-ячеистую плашку с предварительно изготовленными микротрубками. В каждой пробирке проверяют чистоту продукта (аналитическая LC) и идентичность (LC-МС). Содержимое пробирки затем концентрируют в вакууме и взвешивают для определения выхода. Пробирка, в которой проводят реакцию 3,5-бистрифторметиланилина и эксо-7-оксабицикло[2.2.1]гептан-2,3-ангидрида дикарбоновой кислоты, дает 0.022 г соединения 8 в виде твердого вещества белого цвета. HPLC: 94% в течение 4.03 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 434.2 [M+Na+MeOH]+. Осуществление 95 дополнительных реакций дает общее число конечных соединений, равное 80, с чистотой >70% и выходом >5 мг. Несколько образцов нуждаются в дальнейшей очистке, которую выполняют с помощью короткой SiO2 колонки, элюируя хлористым метиленом/ацетоном. Смотри таблицу 2 ниже.
Пример 9
(3аα,4α,7α,7аα)-2-(4-Бромфенил)октагидро-1,3-диоксо-4,7-этено-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фениловый эфир(9)
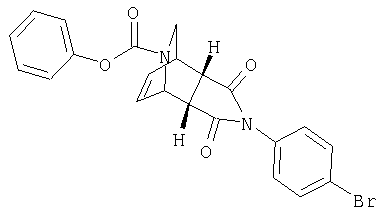
1-[4-Бромфенил]-1N-пиррол-2,5-дион (0.250 г, 0.992 ммоль, синтезированный, как описано в примере 1В) и 1 (2Н)-пиридинкарбоновой кислоты фенилметилового эфира (0.299 г, 1.49 ммоль, синтезированный, как описано у Richard et. al, J. Org. Chem. 46, 4836-4842 (1981)) растворяют в толуоле и нагревают до температуры 85°С в течение часа. После охлаждения до 25°С толуол удаляют в вакууме. Полученный остаток растворяют в минимальном количестве хлорформа и полученный продукт осаждают путем добавления гексана. Через час при 25°С, продукт отфильтровывают и промывают холодным 20% гексаномом в хлорформе, получая соединение 9 в виде твердого вещества белого цвета (0.243 г) в виде отдельного изомера. HPLC: 100% в течение 3.393 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 run), MS (EC): м/е 454.98 [М+H]+.
Пример 10
(3аα,4α,7α,7аα)-2-(4-Бромфенил)октагидро-1,3-диоксо-4,7-этено-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фенилметиловый эфир(10)
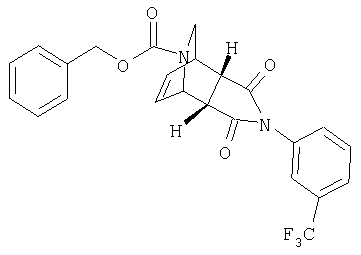
1-[3-(Трифторметил)фенил]-1N-пиррол-2,5-дион (3.78 г, 15.7 ммоль) и 1(2Н)-пиридинкарбоновой кислоты фенилметиловый эфир (4.0 г, 18.8 ммоль, синтезированный, как описано в Richard et. al, J. Org. Chem. 46, 4836-4842 (1981)) растворяют в толуоле и нагревают при температуре 80°С в течение 3 часов. После охлаждения до 25°С толуол удаляют в вакууме и полученный остаток очищают с помощью флеш хроматографии на SiO2, элюируя метанолом/хлористым метиленом, что дает 3.2 г соединения 10 в виде масла желтого цвета. HPLC: 95% в течение 3.510 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 457.2 [М+Н]+.
Пример 11
(3аα,4α,7α,7аα)-Гексагидро-2-[3-(трифторметил)фенил]-4,7-этано-1N-цирроло[3,4-с]пиридин-1,3(2Н)-дион трифторацетат (11)

Соединение 10 (3.2 г) растворяют в 100 мл МеОН и добавляют 10% Pd/C катализатор Дегусса (2 г). Затем вводят водород из баллона. Через час реакционную массу отфильтровывают через целит и промывают МеОН. Летучие вещества удаляют в вакууме и подученный сырой продукт очищают с помощью препаративной HPLC с обращенной фазой, что дает 2.5 г соединения 11 в виде соли с TFA (трифторуксусной кислотой) (белое твердое вещество). HPLC: 99% в течение 1.843 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 325.12 [М+Н]+.
Пример 12
(3аα,4α,7α,7аα)-5-Ацетилгексагидро-2-[3-(трифторметил)фенил]-4,7-этано-1N-пирроло[3,4-с]пиридин-1,3(2Н)-дион(12)
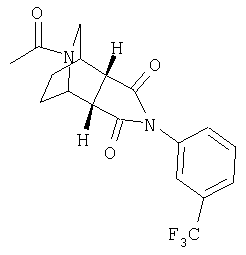
Соединение 11 (0.100 г, 0.23 ммоль) суспендируют в ТГФ (5.0 мл) и добавляют TEA (0.097 мл, 0.46 ммоль), получая гомогенный раствор. Затем добавляют ацетилхлорид (0.033 мл, 0.46 ммоль). Через 2 часа реакционную массу захолаживают насыщенным водным раствором NaHCO3 и экстрагируют хлористым метиленом (3×15 мл). Сырой продукт очищают с помощью препаративной-TLC, элюируя хлорформом/ацетоном, что дает 0.099 г соединения 12 в виде бесцветного масла. HPLC: 99% в течение 2.66 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 367.0 [М+Н]+.
Пример 13
(3аα,4α,7α,7аα)-5-Бензоилгексагидро-2-(3-(трифторметил)фенил]-4,7-этано-1N-пирроло[3,4-с]пиридин-1,3(2Н)-дион(13)
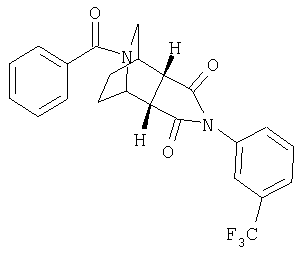
Соединение 11 (0.100 г, 0.23 ммоль) суспендируют в ТГФ (5.0 мл) и добавляют TEA (0.097 мл, 0.46 ммоль), получая гомогенный раствор. Затем добавляют бензоилхлорид (0.05433 мл, 0.46 ммоль). Через 2 часа реакционную массу захолаживают насыщенным водным раствором NaHCO3 и экстрагируют хлористым метиленом (3×15 мл). Сырой продукт очищают с помощью препаративной HPLC с обращенной фазой, что дает 0.020 г соединения 13 в виде белой пены. HPLC: 99% в течение 3.183 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 429.1 [М+Н]+.
Пример 14
(3аα,4α,7α,7аα)-Гексагидро-5-метил-2-[3-(трифторметил)фенил]-4,7-этано-1N-пирроло[3,4-с]пиридин-1,3(2Н)-дион(14)
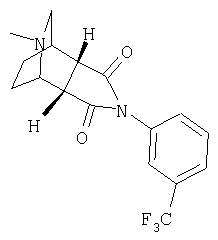
Соединение 11(0.100 г, 0.23 моль) суспендируют в ТГФ (5.0 мл) и добавляют TEA (0.097 мл, 0.46 ммоль), получая гомогенный раствор. Добавляют диметилсульфат (0.043 мл, 0.46 ммоль) и реакционную массу перемешивают при температуре 25°С. Через 14 часов реакционную массу концентрируют в вакууме и сырой продукт очищают с помощью препаративной-TLC, элюируя 10% МеОН в хлористом метилене, что дает 0.030 г соединения 14 в виде твердого вещества белого цвета. HPLC: 100% в течение 1.797 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 339.21
Пример 15
(3аα,4α,7α,7аα)-Гексагидро-5-(фенилметил)-2-[3-(трифторметил)фенил]-4,7-этано-1Н-пирроло[3,4-c]пиридин-1,3(2Н)-дион трифторацетат(15)
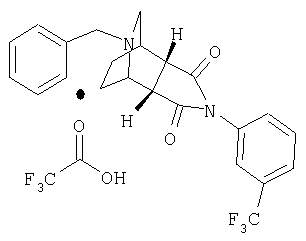
Соединение 11 (0.100 г, 0.23 ммоль) растворяют в ДМФА (5.0 мл) и добавляют К2СО3 (0.063 г, 0.46 ммоль). Затем добавляют бензилбромид (0.041 мл, 0.35 ммоль). Реакционную массу перемешивают при температуре 25°С в течение часа, а затем отфильтровывают и концентрируют. Сырой продукт очищают с помощью препаративной HPLC с обращенной фазой, что дает 0.055 г соединения 15 в виде твердого вещества белого цвета. HPLC: 100% в течение 2.31 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 415.36 [М+Н]+.
Пример 16
(3аα,4α,7α,7аα)-Гексагидро-5-пропил-2-[3-(трифторметил)фенил 1-4,7-этано-1N-пирроло[3,4-с]пиридин-1,3(2Н)-дион трифторацетат(16)

Соединение 11 (0.100 г, 0.23 ммоль) растворяют в ДМФА (5.0 мл) и добавляют К2СО3 (0.079 г, 0.57 ммоль), а затем 1-бромпропан (0.031 мл, 0.34 ммоль). Реакционную массу перемешивают при температуре 25°С в течение 6 часов, а затем фильтруют и концентрируют. Сырой продукт очищают с помощью препаративной HPLC с обращенной фазой, что дает 0.070 г соединения 16 в виде твердого вещества белого цвета. HPLC: 100% в течение 1.907 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 340.22 [М+Н]+
Пример 17
(3аα,4α,4аβ,5аβ,6α,6аα)-2-[4-Циано-3-(трифторметил)фенил]декагидро-1,3-диоксо-4,6-(иминометано)циклопроп [f] изоиндол-7-карбоновой кислоты фенилметиловый эфир(17)
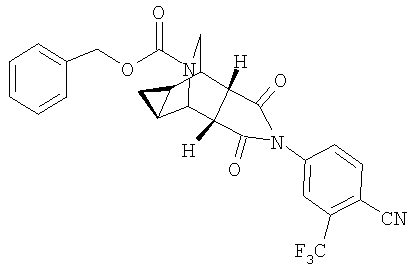
1-Метил-3-нитро-1-нитрозогуанидин (2.5 г, 17 ммоль) добавляют порциями к 40% раствору КОН/Н2О (15 мл) и Et2O (25 мл) при 0°С. После того как добавление закончено, слой эфира становится желтым. Через 30 минут при 0°С эфирный слой выливают в раствор (3аα,4α,7α,7аα)-2-[4-циано-3-(трифторметил)фенил]-октагидро-1,3-диоксо-4,7-этено-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фенилметилового эфира (0.50 г, 1.09 ммоль, полученного, как описано в примере 10) и Pd(OAc)2 (0.010 г) в ТГФ (10 мл) при 0°С. Реакционную смесь затем медленно нагревают до температуры 25°С и перемешивают в течение 24 часов, а затем отфильтровывают через целит, промывают ТГФ. Сырой продукт затем очищают с помощью флеш хроматографии на SiO2, элюируя МеОН/СН2Cl2, что дает 0.34 г соединения 17 в виде твердого вещества белого цвета и как отдельный изомер. HPLC: 100% в течение 3.61 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 496.25 [М+H]+.
Пример 18
(3аα,4α,4аβ,5аβ,6α,6аα)-4-[Декагидро-1,3-диоксо-4,6-(иминометано)диклопрод]изоиндол-2-ил]-2-(трифторметил)бензонитрил(18)
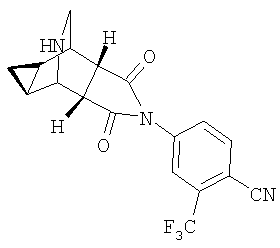
Соединение 17 (0.200 г, 0.404 ммоль) растворяют в МеОН (20 мл) и добавляют 5% Pd/C (0.200 г). Затем вводят водород из баллона. Через 3 часа реакционную массу отфильтровывают через целит, промывают МеОН и летучие вещества удаляют в вакууме, что дает соединение 18 (0.130 г) в виде твердого вещества белого цвета. HPLC: 100% в течение 1.80 минут (время удержания) (YMC S5 ODS колонка 4.6 х 50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 362.09 [М+Н]+.
Пример 19
(3аα,4α,4аβ,5аβ,6α,6аα)-4-[Декагидро-7-метил-1,3-диоксо-4,6-(иминометано)циклопроп[f]изоиндол-2-ил]-2-трифторметил)бензонитрил(19)
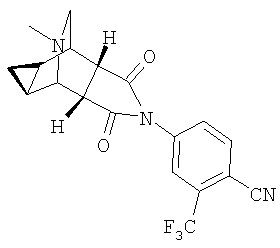
Соединение 17 (0.100 г, 0.277 ммоль) растворяют в CH3CN (2.0 мл). TEA (0.19 мл, 1.39 ммоль) и затем добавляют MeI (0.052 мл, 0.83 ммоль) и реакционную массу перемешивают при температуре 25°С в течение 14 часов. Затем ее концентрируют и сырой продукт растворяют в СН2Cl2/воде и экстрагируют CHhCIa (3×15 мл). Объединенную органику сушат над безводным Na2SO4. Сырой продукт очищают с помощью флеш хроматографии, элюируя 3% MeOH/CH2Cl2, что дает 0.030 г соединения 19 в виде твердого вещества светло-желтого цвета. HPLC: 100% в течение 1.720 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 376.11 [М+Н]+.
Пример 20
(3аα,4α,7β,7аα)-4-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил(20В)
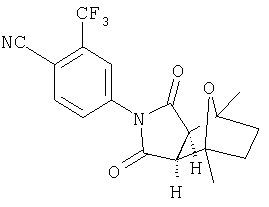
А. (3аα,4β,7β,7аα)-Гексагидро-4,7-эпоксиизобензофуран-1,3-дион(20А)
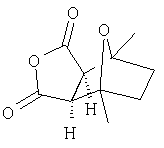
Свежеперегнанный диметилфуран (1.60 мл, 15.3 ммоль) растворяют в CH2Cl2 (2.0 мл) и добавляют малеиновый ангидрид (1.0 г, 10.2 ммоль). Реакционную массу перемешивают при температуре 25°С в течение 16 часов и затем концентрируют в вакууме, что дает твердое вещество желтого цвета. Полученное твердое вещество растворяют в этилацетате (30 мл) и добавляют Pd/C (10% Pd, 0.200 г). Затем вводят водород с помощью баллона и реакционную массу перемешивают в течение 24 часов. Pd удаляют фильтрацией через целит, промывая EtOAc, затем концентруя в вакууме, что дает соединение 20А (1.69 г) в виде твердого вещества белого цвета. 2-Мерные NOE эксперименты подтвердили структурное строение соединение 20А.
В. (3аα,4β,7β,7аα)-4-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил(20В)
Раствор соединения 20А (603 мг, 3.21 ммоль, 1 экв.), 5-амино-2-цианобензотрифторид (640 мг, 3.44 ммоль, 1.07 экв.) и TsOH (10 мг, каталитическое количество) в толуоле (5 мл) нагревают в герметично закрытой трубке в течение 2 дней. Реакционную смесь охлаждают до комнатной температуры, а затем концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 50% EtOAc/гексан дает 400 мг (1.10 ммоль, 34%) соединения 20В в виде твердого вещества белого цвета. HPLC: 99% в течение 3.04 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорную кислоту, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 382.2 [M+NH4]+.
Пример 21
(3аα,4β,7β,7аα)-N-[4-[[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]тио]фенил] ацетамид (21Е)
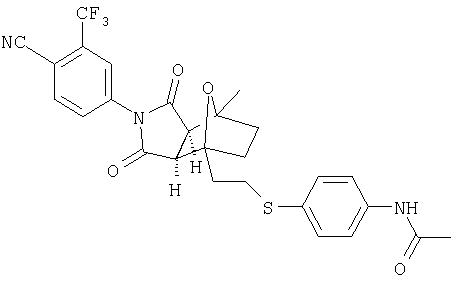
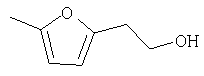
Раствор н-BuLi (83 мл, 133.0 ммоль, 1.2 экв., 1.6 М в гексане) добавляют к перемешиваемому раствору 2-метилфурана (10 мл, 1 10.8 ммоль, 1 экв.) в ТГФ (85 мл) при 0°С в инертной атмосфере. Реакционную смесь перемешивают в течение 4 часов при комнатной температуре, затем охлаждают до температуры 0°С. Добавляют по каплям этиленоксид (8.3 мл, 166.3 ммоль, 1.5 экв.) и реакционной смеси дают возможность нагреться до комнатной температуры в течение ночи. После захолаживания насыщенным водным раствором NH4Cl полученные слои отделяют и водный слой экстрагируют Et2O (2х). Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Дистилляция при атмосферном давлении (-170-185°С), дает 10.13 г (80.3 ммоль, 72%) соединения 21А в виде масла светло-желтого цвета. В. 2-(2-Бромэтил)-5-метилфуран (21В)
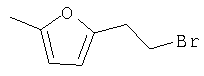
Ph3Br2 (3.68 г, 8.72 ммоль, 1.1 экв.) добавляют в раствор соединения 21А (1 г, 7.93 ммоль, 1 экв.) в ДМФА (8 мл) и реакционную смесь перемешивают при комнатной температуре в течение часа. Реакционную смесь добавляют к Н2О и экстрагируют EtOAc (3х). Объединенные органические слои промывают Н2О (2х), сушат над Na2SO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 10% EtOAc/гексаном, дает 0.507 г (2.68 ммоль, 34%) соединения 21В.
С. N-[4-[[2-(5-Метил-2-фуранил)этил)тио]фенил]ацетамид(21С)
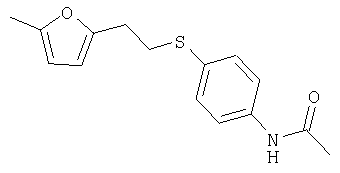
К раствору 4-ацетамидотиофенола (442 мг, 2.64 ммоль, 1 экв.) в ТГФ (1 мл) при 0°С в инертной атмосфере добавляют раствор н-BuLi (2 мл, 3.17 ммоль, 1.2 экв., 1.6 М в гексане) в ТГФ (1 мл). Реакционный раствор перемешивают при комнатной температуре в течение 10 минут и добавляют раствор соединения 21В (0.5 г, 2.64 ммоль, 1 экв.) в ТГФ (3 мл). После того как весь первоначальный продукт израсходуют, как определяют с помощью TLC, реакционную массу захолаживают Н2О и смесь экстрагируют EtOAc (2х), сушат над Na2SO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 50% EtOAc/гексаном, дает 0.644 г (2.34 ммоль, 88%) соединение 21 С. MS (ESI): м/е 276.09 [М+Н]+.
D. (3аα,4β,7β,7аα)-N-[4-[[2-[2-[4-Циано-3-(трифторметил)фенил]-1,2,3,3а,7,7а-гексагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]тио]фенил]ацетамид (21D)
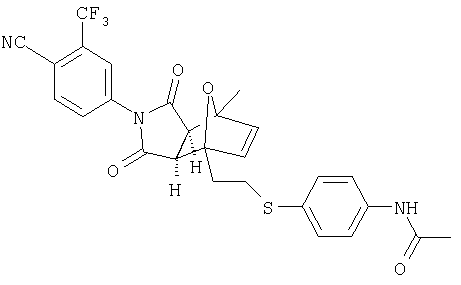
Раствор соединения 21С (195 мг, 0.708 ммоль, 1 экв.) и 4-(2,5-дигидро-2,5-диоксо-1N-пиррол-1-ил)-2-трифторметилбензонитрила (377 мг, 1.416 ммоль, 2 экв., полученного, как описано в примере 1В) в CH2Cl2 (1.5 мл) перемешивают при комнатной температуре в течение двух дней. Реакционную смесь концентрируют при пониженном давлении, что дает соединение 21D, как определяют с помощью ЯМР анализа. Соединение 21D используют непосредственно на следующем этапе без очистки.
Е. (3аα,4β,7β,7аα)-N-[4[[2-[2-[4-Циано-3-(трифторметил)фенил]-октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]тио]-фенил] ацетамид (21Е)
Раствор сырого соединения 21D (0.708 ммоль) и 10% Pd/C (200 мг) в МеОН (20 мл) перемешивают в атмосфере водорода в течение более ночи. Очистка с помощью препаративной хроматографии [HPLC в течение 34.4 минуты (время удержания) (YMC S5 ODS колонка 20 х 250 мм, 0-100% водным раствором метанола в течение более 30 минут, содержащим 0.1% TFA, 10 мл/минут, контролирование при 220 нм)] затем флеш хроматографией на силикагеле, элюируя 1% МеОН/СН2Cl2, дает 29 мг (0.053 ммоль, 7.5%) соединения 21Е в виде порошке желтого цвета. HPLC: 99% в течение 3.44 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорную кислоту, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 544.01 [М+Н]+
Пример 22
[3aα,4β,7β,7aα)-N-[4-[[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]сульфинил]фенил]ацетамид(22)
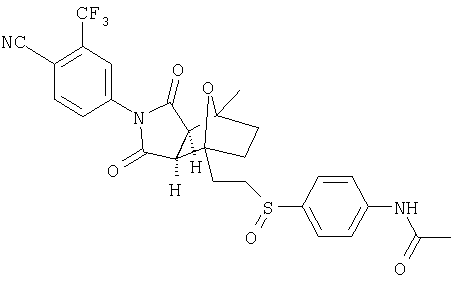
mCPBA (12 мг, 0.05 ммоль) добавляют порциями к раствору сырого соединения 21Е (65 мг, 0.12 ммоль, 1 экв.) в СН2Cl2 (6 мл), пока не израсходуют первоначальный продукт. Очистка с помощью препаративной хроматографии [HPLC в течение 30.5 минут (время удержания) (YMC S5 ODS колонка 30×250 мм, 0-100% водным раствором метанола в течение более 30 минут, содержащим 0.1% TFA, 25 мл/минут, контролирование при 220 нм)] дает 27.5 мг (0.049 ммоль, 41%) соединения 22 в виде твердого вещества рыжего цвета (˜1:1 смесь диастреомеров). HPLC: 96% в течение 2.88 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 559.97 [М+Н]+.
Пример 23
(3аα,4β,7β,7аα)-N-[4-[[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]сульфонил]фенил] ацетамид
(23)
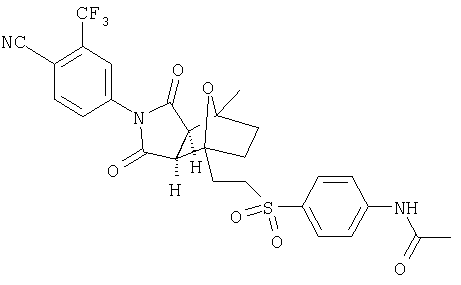
mCPBA (26 мг, 0.105 ммоль, 3 экв.) добавляют к раствору соединения 21Е (19 мг, 0.035 ммоль, 1 экв.) в CH2Cl2 (6 мл) и реакционную массу перемешивают при комнатной температуре, пока не израсходуется исходный продукт и промежуточный сульфоксид (соединение 22), как определяют с помощью TLC. Очистка с помощью препаративной хроматографии [HPLC в течение 53.3 минут (время удержания) (YMC S5 ODS колонка 30×250 мм, 0-70% водным раствором метанола в течение более 45 минут, содержащим 0.1% TFA, 25 мл/минут, контролирование при 220 нм)] дает 27.5 мг (0.049 ммоль, 40%) соединение 23 в виде твердого вещества белого цвета. HPLC: 99% в течение 2.94 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорную кислоту, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 575.95 [M+H]+.
Пример 24
(3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-N-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]бензолсульфонамид (24Ci и 24Cii соответственно)
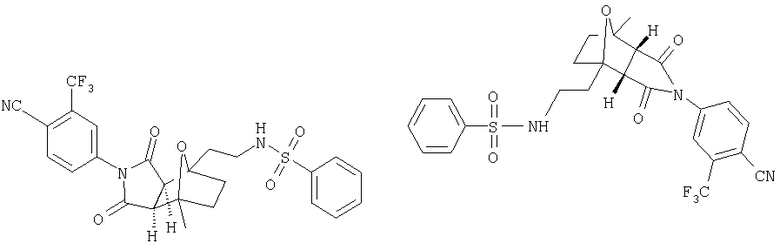
А. 5-Метил-2-фуранэтанол 4-метилбензолсульфонат (24А)
4-Метилбензолсульфонилхлорид (907 мг, 4.76 ммоль) добавляют к раствору соединения 21А (500 мг, 3.96 ммоль) в 6 мл сухого пиридина. Реакционную массу перемешивают при комнатной температуре в течение 4 часов, затем захолаживают льдом. Реакционную смесь экстрагируют СН2Cl2 и объединенные органические слои промывают насыщенным водным раствором бикарбоната натрия и водой, сушат и концентрируют при пониженном давлении, что дает 900 мг (81%) соединения 24 А в виде масла желтого цвета.
В. N-[2-(5-Метил-2-фуранил)этил]бензолсульфонамид (24В)
Бензолсульфонамид (157 мг, 1 ммоль) добавляют к 10% водному раствору гидроксида натрия (0.4 мл, 1 ммоль). Затем добавляют раствор соединения 24А (280 мг, 1 ммоль) в ацетоне (1 мл). Реакционную смесь нагревают при температуре 90°С в течение 8 часов, затем охлаждают до комнатной температуры. Добавляют лед и смесь экстрагируют СН2Cl2. Объединенные органические слои промывают водой, сушат и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя СН2Cl2 дает 60 мг (23%) соединение 24В в виде масла желтого цвета.
С. (3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-N-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]бензол сульфонамид (24Ci и 24Сii соответственно)
4-(2,5-Дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрил (129 мг, 0.45 ммоль, полученный, как описано в примере 1В) добавляют к раствору соединения 24В (60 мг, 0.23 ммоль) в CH2Cl2 (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 дней, концентрируют при пониженном давлении и очищают с помощью флеш хроматографии на силикагеле, элюируя 70% EtOAc/гексаном, что дает 20 мг (16%) ненасыщенного продукта Дельса-Альдера. Ненасыщенной продукт (20 мг) немедленно растворяют в 2 мл этанола и добавляют 10 мг 10% Pd/C. Раствор перемешивают при комнатной температуре в течение ночи в атмосфере водорода. Смесь отфильтровывают и фильтрат концентрируют при пониженном давлении. Очистка с помощью препаративной HPLC с обращенной фазой дает 7 мг соединения 24Ci и 2 мг соединения 24Cii. Соединение 24Ci: HPLC: 96% в течение 3.17 минут (время удержания) (YMC ODSA S5 CIS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиент с 0.1% TFA, определенный при 220 нм), MS (EC): м/е: 533.99 [М+Н]+. Соединение 24Cii: HPLC: 99% в течение 38.95 минут (время удержания) (YMC ODS S5 20×250 мм, 10%-90% водный раствором метанола в течение более 40 минут градиент с 0.1% TFA, определенный при 220 нм), MS (ЕС): м/е 533.99 [М+Н]+
Пример 25
(3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (25В)
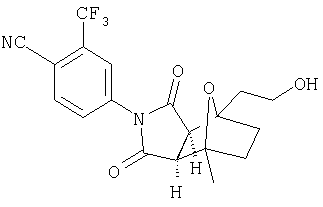
А. (3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-4-[1,3,3а,4,7,7а-Гексагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (25Ai и 25Aii соответственно)
Раствор соединения 21А (252 мг, 2 ммоль, 1 экв.) и 4-(2,5-дигидро-2,5-диоксо-1N-пиррол-1-ил)-2-трифторметилбензонитрила (798 мг, 3 ммоль, 1.5 экв.) в СН2Cl2 (10 мл) перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 65% EtOAc/гексаном, дает 217 мг чистого соединения 25Ai, 73 мг чистого соединения 25Aii и 310 мг смеси обоих соединений 25Ai и 25Aii. Все три фракции выделяют в виде твердых веществ белого цвета с общим выходом 600 мг (1.53 ммоль, 76.5%). Соединение 25Ai: HPLC 90% в течение 2.56 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм). Соединение 25AU: HPLC 90% в течение 2.56 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорную кислоту, 4 мл/минут, контролирование при 220 нм).
В. (3аα,4β,7β,7аα)-4-[октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил(25В)
Раствор соединения 25Ai (0.2 г, 0.51 ммоль, 1 экв.) и 10% Pd/C (43 мг, каталитическое количество) в EtOH (12 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 2 часов. Реакционную смесь отфильтровывают через целит и концентрируют при пониженном давлении, что дает 0.2 г (0.51 ммоль, 100%) соединения 25В в виде твердого вещества белого цвета. HPLC: 95% в течение 2.59 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 394.97 [М+Н]+.
Пример 26
(3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-N-[4-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]фенил]ацетамид (26Ci и 26Cii соответственно)
А. 2-[4-[2-(5-Метил-2-фуранил)этокси]фенил]ацетамид (26А)
Трифенилфосфин (681 мг, 2.6 ммоль, 1.3 экв.) добавляют к раствору соединения 21А (252 мг, 2 ммоль, 1 экв.) и 4-ацетамидофенола (302 мг, 2 ммоль, 1 экв.) в CH2Cl2 (4 мл). ТТФ (5 мл) добавляют, чтобы сделать реакционную смесь гомогенной, и затем смесь охлаждают до температуры 0°С. Добавляют по каплям DEAD (0.41 мл, 2.6 ммоль, 1.3 экв.) и реакционную смесь перемешивают при комнатной температуре в течение ночи, затем концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 60% EtOAc/гексан, затем препаративной HPLC с обращенной фазой дает 270 мг (52%, 1.04 ммоль) соединения 26А в виде твердого вещества светло-коричневого цвета. MS (ESI): м/е 260.09 [М+Н]+.
В. (3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-N-[4-[2-[2-[4-Циано-3-(трифторметил)фенил]-1,2,3,3а,7,7а-гексагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]фенил]ацетамид (26Bi и 26Bii соответственно)
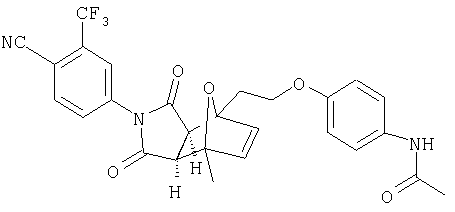
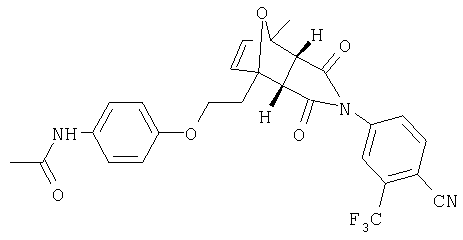
Раствор соединения 26А (40 мг, 0.154 ммоль, 1 экв.) и 4-(2,5-дигидро-2,5-диоксо-1N-пиррол-1-ил)-2-трифторметилбензонитрила (88 мг, 0.31 ммоль, 2 экв.) в CH2Cl2 (2 мл) перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 75% EtOAc/гексаном, дает 55 мг (0.105 ммоль, 68%) от 5 до 1 смеси соединений 26Bi и 26Bii в виде твердого вещества белого цвета, которую используют непосредственно на следующем этапе. HPLC 90% в течение 3.28 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
С. (3аα,4α,7α,7аα)- и (3аα,4β,7β,7аβ)-N-[4-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]фенил]ацетамид (26Ci и 26Cii соответственно)
Раствор смеси соединений 26Bi и 26Bii (55 мг, 0.105 ммоль, 1 экв.) и 10% Pd/C (12 мг, каталитическое количество) в EtOH (3 мл) перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Реакционную смесь отфильтровывают через целит и концентрируют при пониженном давлении, что дает 50 мг сырого продукта. Очистка с помощью флеш хроматографии на силикагеле, элюируя 70% EtOAc/гексаном, дает 18 мг (0.034 ммоль, 32%) соединения 26Ci [HPLC: 96% в течение 3.33 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм). MS (ЕС): м/е 528.01 [М+Н]+]; и 2.3 мг (0.004 ммоль, 4%, 85:15-эндо:эксо) 85:15 смесь соединения (с помощью 1H ЯМР) 26Cii и соединения 26Ci соответственно [HPLC: 90% в течение 3.35 минут (время удержания) (YMC S5 ODS колонка 4.6Ч50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/e 528.12 [M+H]+].
Пример 27
(3аα,4α,7α,7аα)-Гексагидро-2-(2-нафталинил)-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион (27D)
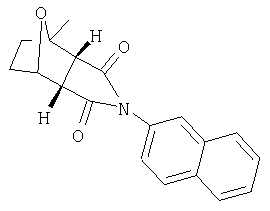
А. (эндо, эндо)-7-Оксабицикло[2.2.1]гепт-5-ене-2,3-дикарбоновая кислота (27А)

Соединения 27А, 27В и 27С синтезированы в соответствии с методиками, описанными в Sprague et al, J. Med. Chem. 28, 1580-1590 (1985). Смесь фурана (100 мл, 1.38 моль, 1 экв.) и малеиновой кислоты (159.6 г, 1.38 моль, 1 экв.) в Н2О (340 мл) перемешивают при комнатной температуре в течение 5 дней. Смесь помещают в делительную воронку и водный слой отделяют от слоя, содержащего непрореагировавший фуран. Водный слой обрабатывают древесным углем, отфильтровывают через целит и помещают в холодильник. Желаемый продукт кристаллизуют из раствора после затравливания, отфильтровывают, промывают холодной водой и сушат над P2O5, что дает 70 г (0.38 моль, 28%) соединения 27А в виде твердого вещества белого цвета.
В. (эндо, эндо)-7-оксабицикло[2.2.1]гептан-2,3-дикарбоновая кислота (27В)
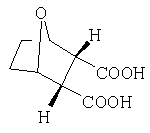
К раствору соединения 27А (69 г, 0.375 моль, 1 экв.) в EtOH (700 мл) добавляют 10% Pd/C (4.5 г, каталитическое количество) и смесь встряхивают в атмосфере водорода при 55 пси, пока не прекратися поглощение газа. Смесь отфильтровывают через целит и концентрируют в вакууме, что дает 66 г (0.355 моль, 95%) соединения 27В в виде твердого вещества белого цвета.
С. (3аα,4β,7β,7аα)-Гексагидро-4,7-эпоксиизобензофуран-1,3-дион (27С)
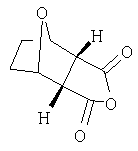
Раствор соединения 27В (66 г, 355 моль) в ацетилхлориде (300 мл) нагревают при кипении с обратным холодильником в течение часа. Реакционный раствор концентрируют в вакууме и полученный остаток перекристаллизовывают из бензола, что дает 49.2 г (0.292 моль, 82%) соединения 27С в виде твердого вещества белого цвета (>99% эндо с помощью 1Н ЯМР).
D. (3аα,4α,7α,7аα)-Гексагидро-2-(2-нафталинил)-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион (27D)
Соединение 27С (45 мг, 0.30 ммоль, 1 экв.) объединяют с 2-нафталинамином (47 мг, 0.33 ммоль, 1.1 экв.) в уксусной кислоте (1 мл) и нагревают при температуре 115°С в течение ночи. После этого реакционную массу охлаждают до комнатной температуры, добавляют каплю воды и полученный осадок отфильтровывают. Полученный продукт промывают метанолом и сушат, чтобы получить 65.7 мг (74.5%) соединения 27D в виде кристаллического твердого вещества белого цвета. HPLC: 99% в течение 2.68 минут (время удержания)-(YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 294.0 [М+Н]+.
Пример 28
(1аα,2β,2аα,5аα,6β,6аα)-Гексагидро-4-(2-нафталинил)-2,6-эпокси-3Н-оксирено[f]изоиндол-3,5(4Н)-дион(28В)
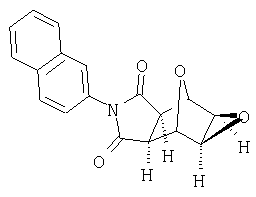
А. (1аα,2β,2аα,5аα,6β,6аα)-Тетрагидро-2,6-эпоксиоксирено[f]изобензофуран-3,5(2аН,5аН)-дион (28А)
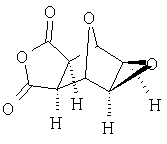
Как описано у Yur'ev, et al, J. Gen. Chem. U.S.S.R. (Engl. Transl.) 31, 772-775 (1961), раствор ангидрида эксо-7-оксабицикло[2.2.1]гептан-2,3-дикарбоновой кислоты (5 г, 30.09 ммоль), муравьиной кислоты (10 мл) и пероксида водорода (6 мл) перемешивают при комнатной температуре. Через 30 минут реакционную массу помещают на ледяную баню (она становится экзотермической вместе с газовыделением) и дают возможность медленно нагреться до комнатной температуры. После перемешивания в течение ночи полученный осадок собирают фильтрованием, промывают ледяной уксусной кислотой и сушат, что дает 3.02 г порошка белого цвета. Сырое твердое вещество кипятят в ацетилхлориде (100 мл) в течение 10 часов и смесь концентрируют -20 мл при пониженном давлении. Полученный осадок отфильтровывают, промывают диоксаном и сушат, что дает 2.37 г соединения 28А в виде порошка белого цвета.
В. (1аα,2β,2aα,5aα,6β,6аα)-Гексагидро-4-(2-нафталинил)-2,6-эпокси-3Н-оксирено [f] изоиндол-3,5(4Н)-дион (28В)
Соединение 28А (100 мг, 0.520 ммоль, 1.2 экв.) смешивают с 2-нафталинамином (0.434 ммоль, 1 экв.) в уксусной кислоте (2 мл) и нагревают при температуре 115°С в течение ночи. После чего реакции дают возможность остыть до комнатной температуры, добавляют воду и полученный осадок отфильтровывают. Полученный продукт промывают последовательно водным раствором К2СО3 и водой, а затем сушат в вакуумном термостате, чтобы получить 113.7 мг (85.3%) соединения 28В в виде кристаллического твердого вещества грязно-белого цвета. HPLC: 99% в течение 1.76 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 308.0 [М+Н]+.
Пример 29
(3аα,4α,7α,7аα)-2-[4-Бром-3-(трифторметил)фенил]-3а,4,7,7а-тетрагидро-4,7-диметил-4,7-эпитио-1N-изоиндол-1,3(2Н)-дион 8-оксид (29)
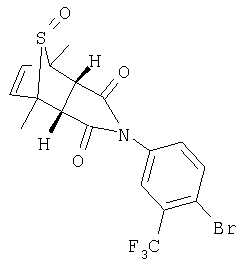
2,5-Диметилтиофен (0.048 мл, 0.42 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1N-пиррол-1-ил)-2-трифторметилбензонитрил (0.290 г, 0.625 ммоль) растворяют в CH2Cl2 (8.0 мл) и охлаждают до температуры -20 °С. Медленно добавляют сначала BF3 Et2O (0.412 мл, 3.36 ммоль), а затем - mCPBA (-50%, 0.290 г, 0.84 ммоль). Через 2 часа при температуре -20 °С реакционную массу выливают в насыщенный раствор NaHCO3 и экстрагируют CH2Cl2 (3×20 мл), органику сушат над безводным Na2SO4. Сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя 5%-10%-20% EtOAc в СН2Cl2, что дает 0.119 г соединения 29 в виде твердого вещества белого цвета. HPLC: 91% в течение 3.303 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метаяола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм). MS (ESI): м/е 480.2 [М+Н]+.
Пример 30
(3аα,4α,7α,7аα)-2-[4-Бром-3-(трифторметил)фенил]-3а,4,7,7а-тетрагидро-4,7-эпитио-1N-изоиндол-1,3(2Н)-дион 8-оксид (30)

Тиофен (0.375 мл, 4.69 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1N-пиррол-1-ил)-2-трифторметилбензонитрил (0.100 г, 0.313 ммоль) растворяют в СН2Cl2 (50 мл), добавляют mCPBA (-50%, 1.62 г, 4.69 ммоль) и перемешивают при температуре 25°С в течение 3 часов. Затем добавляют трифенилфосфин (2.0 г). Через 15 минут летучие вещества удаляют в вакууме и полученный остаток растворяют в CH2Cl2 (200 мл) и промывают насыщенным раствором NaHCO3 (3×50 мл) и сушат над Na2SO4. Затем сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя 1%-3%-5% метанолом в CH2Cl2, что дает соединение 30 в виде порошка белого цвета (0.059 г). ЯМР спектроскопия и LC анализ показывает один диастереомер. HPLC: 100% в течение 3.437 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 443.2 [М+Н]+
Пример 31
(3аα,4α,7α,7аα)-Гексагидро-2-[3-(трифторметил)фенил-4,7-имино-1N-изоиндол-1,3(2Н)-дион (31D)
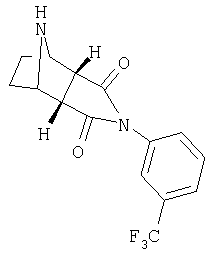
А. 7-Азабицикло[2.2.1]гепта-2,5-диен-2,3,7-трикарбоновой кислоты 2,3-диметил 7-(1,1-диметилэтил) эфир (31А)
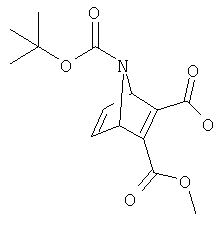
Свежеперегнанный ацетилендикарбоновой кислоты диметиловый эфир (6.7 мл, 54.0 ммоль) и N-(трет-бурилоксикарбонил)-1N-пиррол (9.0 мл, 54.0 ммоль) объединяют и нагревают при температуре 120°С в течение 3 часов. Очистка с помощью флеш хроматографии на SiO2, элюируя EtOAc/CH2Cl2 дает 8.3 г соединения 31А в виде твердого вещества желтого цвета.
В. (эксо,эндо)-7-Азабицикло[2.2.1]гепт-2,5-диен-2,3,7-трикарбоновой кислоты 7-(1,1-диметилэтил) эфир (31В)
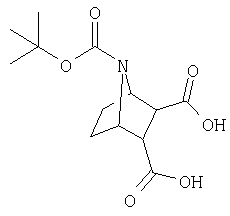
Соединение 31А (1.0 г, 3.5 ммоль) растворяют в МеОН (2.0 мл) и добавляют раствор КОН (1 г в 5 мл Н2O). Реакционную массу нагревают до температуры 50°С в течение часа. Реакционную смесь затем охлаждают до температуры 25 С и добавляют Pd/C (0.5 г, 10% Pd), а затем смесь помещают в аппарат Парра на 14 часов при 25°С. Реакционную смесь затем отфильтровывают через целит и промывают водой. Водный раствор подкисляют до рН 2 с помощью добавления IN HCl и затем экстрагируют EtOAc (2×100 мл). Концентрация органики дает соединение 31В в виде твердого вещества бледно-желтого цвета.
С. (3аα,4α,7α,7аα)-Гексагидро-1,3-диоксо-4,7-иминоизобензофуран-8-карбоновой кислоты 1,1-диметилэтиловый эфир (31С)
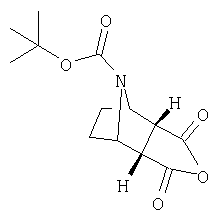
Сырое соединение 31В нагревают до температуры 120°С в вакууме в камере сублимации, получая сублимированное соединение 31С в виде твердого вещества белого цвета (0.051 г), которое собирают непосредственно и используют на следующем этапе без дальнейшей очистки.
D. (3аα,4α,7α,7аα)-Гексагидро-2-[3-(трифторметил)фенил]-4,7-имино-1N-изоиндол-1,3(2Н)-дион (31D)
Соединение 31С (0.050 г, 0.187 ммоль) и 1-амино-3-(трифторметил)бензол (0.030 г, 0.187 ммоль) растворяют в АсОН (2.5 мл) и нагревают до температуры 115°С в течение 4.5 часов. Реакционную массу захолаживают с помощью добавления насыщенного водного раствора NaHCO3 и экстрагируют хлористым метиленом (3×15 мл). Сырой продукт очищают с помощью препаративной HPLC с обращенной фазой, что дает 0.030 г соединения 31D в виде твердого вещества белого цвета. HPLC: 99% в течение 2.33 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 311.15
Пример 32
(3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-3а,4,7,7а-Тетрагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион (32i и 32ii соответственно)
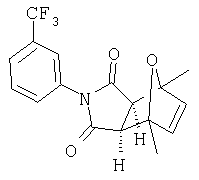
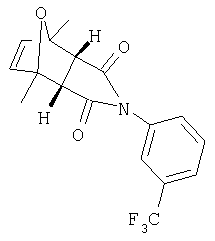
Свежеперегнанный 2,5-диметилфуран (0.32 мл, 2.6 ммоль) растворяют в CH2Cl2 (2.0 мл) и добавляют 1-[3-(трифторметил)фенил]-1N-пиррол-2,5-дион (0.5 г, 2.5 ммоль). Реакционную массу перемешивают при температуре 25°С в течение 16 часов, а затем концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 0.5% МеОН/СН2Cl2, дает 50 мг соединения 32i и 250 мг соединения 32ii, в виде твердых веществ белого цвета. Соединение 32i: HPLC: 92% в течение 3.047 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е: 338.75 [М+Н]+ Соединение 32ii: HPLC: 98% в течение 3.08 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 338.30 [М+Н].
Пример 33
(3аα,4α,7α,7аα)-Гексагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н изоиндол-1,3(2Н)-дион (33)
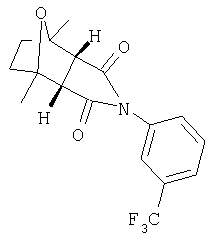
Соединение 32ii (0.080 г, 0.237 ммоль) растворяют в EtOAc (2 мл) и EtOH (1 мл) и добавляют Pd/C (10% Pd, 0.050 г). Из баллона затем вводят водород и реакционную массу перемешивают в течение 24 часов. Смесь отфильтровывают через целит, промывают EtOAc и концентрируют в вакууме, что дает соединение 33 (0.075 г) в виде твердого вещества белого цвета. Дальнейшая очистка не требуется. HPLC: 90% в течение 3.233 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 340.40 [М+H]+.
Пример 34
(3аα,4α,7α,7аα)-Тетрагидро-5-метил-2-(4-нитро-1-нафталинил)-4,7-этено-1N-пирроло[3,4-с]пиридин-1,3,6(2Н,,5Н)-трион(34В)
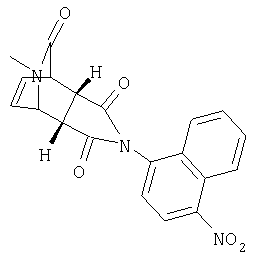
А. 4,5,7,7а-Тетрагидро-5-метил-4,7-этенофуро[3,4-с]пиридин-1,3,6(3аН)-трион (34А)
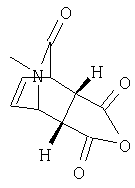
Соединение 34А синтезируют с помощью усовершенствованных способов, описанных в Tomisawa et al, Heterocycles 6, 1765-1766 (1977) and Tetrahedron Lett. 29, 2465-2468 (1969). Малеиновый ангидрид и 1-метил-2-пиридон суспендируют в 30 мл безводного толуола. Реакционный сосуд оснащают ловушкой Дина Старка и нагревают при кипении с обратным холодильником в течение 48 часов. Раствору, окрашенному в темный цвет, дают возможность остыть до комнатной температуры и затем летучие вещества удаляют в вакууме. Полученную пасту коричневого цвета растворяют в 10 мл кипящего толуола и горячий раствор отфильтровывают под током азота, чтобы удалить мелкие частицы. Оставляя стоять при 25°С, желаемый продукт осаждают из раствора. Твердое вещество выделяют фильтрацией и промывают холодным толуолом, что дает соединение 34А, которое используют без дальнейшей очистки.
В. (3аα,4α,7α,7аα)-тетрагидро-5-метил-2-(4-нитро-1-нафталинил)-4,7-этено-1N пирроло [3,4-с] пиридин-1,3,6(2Н,5Н)-трион(34В)
1-Амино-4-нитронафталин (0.094 г, 0.5 ммоль) и соединение 34А (0.130 г, 0.63 ммоль) растворяют в АсОН (2.0 мл) и нагревают до температуры 110°С в течение часа. Реакционную смесь затем охлаждают до температуры 25°С и выливают в холодный насыщенный водный раствор К2СО3, после чего энергично перемешивают в течение 10 минут. Раствор отфильтровывают и промывают водой. Полученный фильтрат сушат в вакууме и очищают с помощью хроматографии на силикагеле, используя растворитель системы 4:6 EtOAc/гексан, что дает 0.172 г соединения 34В в виде твердого вещества белого цвета. HPLC: 92% в течение 2.472 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 378.29 [М+Н]+
Пример 35
(3аα,4β,7β,7аα)-4-[4-[2-(4-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил(35)
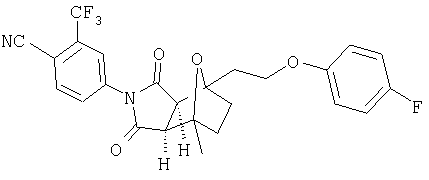
DEAD (0.06 мл, 0.380 ммоль, 1.5 экв.) добавляют к раствору трифенилфосфина (100 мг, 0.380 ммоль, 1.5 экв.) в ТГФ (1.3 мл) при комнатной температуре в инертной атмосфере. После перемешивания в течение 10 минут добавляют одной дозой 4-фторфенол (43 мг, 0.380 ммоль, 1.5 экв.). Реакционную смесь перемешивают в течение 5 минут добавляют соединение 25В (100 мг, 0.254 ммоль, 1 экв.) и перемешивание продолжают в течение 3.5 часов. Очистка с помощью флеш хроматографии на силикагеле, элюируя 50% EtOAc/гексан, затем препаративная хроматография [HPLC: 1 1.93 минут (время удержания) (YMC S5 ODS колонка 20×100 мм, 0-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/мйнут, контролирование при 220 нм)], дают 72 мг (58%) соединения 35 в виде твердого вещества. HPLC: 99% в течение 3.74 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 487.1 [М-Н]-.
Пример 36
(3aα,4β,7β,7аα)-4-[4-(2-Бромэтил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (36)
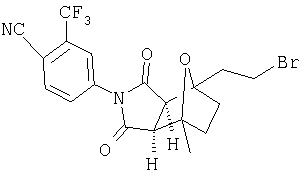
Раствор 25В (495 мг, 1.26 ммоль, 1 экв.) и пиридина (0.1 мл, 1.26 ммоль, 1 экв.) в СН2Cl2 (2 мл) добавляют к раствору Ph3PBr2 (636 мг, 1.51 ммоль, 1.2 экв.) в CH2Cl2 (2 мл) при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, затем растворитель удаляют при пониженном давлении. Полученный остаток промывают дважды 10 мл дозами EtOAc-гексан (6:4) и объединенные смывки очищают с помощью флеш хроматографии на силикагеле, элюируя 60% EtOAc/гексан, что дает 390 мг (0.85 ммоль, 67.7%) соединения 36 в виде твердого вещества белого цвета. HPLC: 99% в течение 3.51 минут (время удержания) (YMC S5 ODS колонка 4.6 х 50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм). MS (ESI): м/е 456.7 [М-Н]-.
Пример 37
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(3-метил-4-нитрофенил)-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион (37)
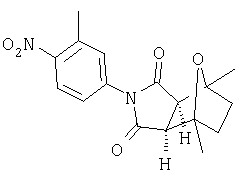
Смесь из 4-нитро-3-метиланилина (0.050 г, 0.33 ммоль), соединения 20А (0.083 г, 0.43 ммоль), TEA (0.2 мл), MgSO4 (0.075 г) и толуола (0.8 мл) объединяют в герметично закрытой трубке и смесь нагревают до температуры 120°С в течение 14 часов. После охлаждения до 25 С реакционную массу отфильтровывают, промывают CH2Cl2 и концентрируют. Сырой продукт очищают с помощью препаративной-TLC на SiO2, элюируя СН2Cl2, что дает 0.075 г соединения 37 в виде твердого вещества бледно -желтого цвета. HPLC: 100% в течение 2.733 минут (время удержания)-(YMC S5 ODS колонка, 4.6 Х 50 мм; 10-90% MeOH/H2O градиент, + 0.1% TFA; 4 мл/минут, 220 нм определение), MS (EC): м/е 348.2 [M+NH4]+.
Примеры с 38 по 121
Дополнительные соединения настоящего изобретения получают с помощью методик, аналогичных тем, что описаны выше. Соединения примеров с 38 по 121 имеют следующую структурную формулу (L представляет собой связь):
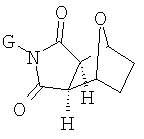
где значение G, наименование соединения, время удержания, молекулярная масса и способ получения, сформулированный в таблице 2. Хроматографическая техника, используемая для определения времени удержания в таблице 2, определена следующим образом: LCMS=YMC S5 ODS колонка, 4.6х50 мм, элюируя 10-90% MeOH/H2O более чем 4 минут, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. Молекулярная масса соединений, приведенная в таблице 2, была определена с помощью MS (EC) по формуле м/е.


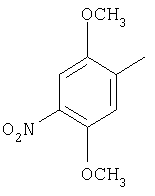
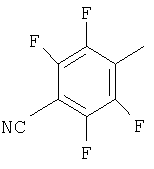
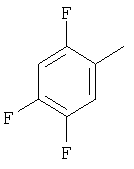
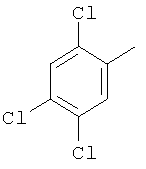

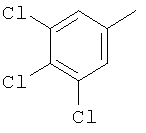
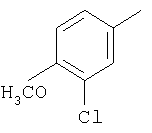
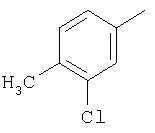

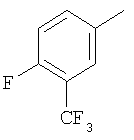
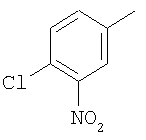
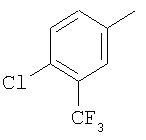
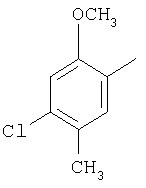
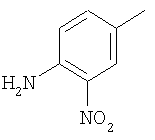
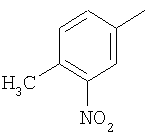
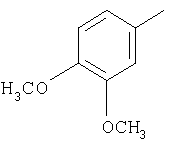
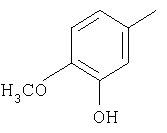



Примеры с 122 по 164
Последующие соединения настоящего изобретения получают с помощью способов, аналогичных тем, что описаны выше. В Таблице 3 приведены наименование соединения и их структурная формула, время удержания, так же как номер примера, в котором описан способ, на котором основано получение соединений по Таблице 3 по примерам с 122 по 164. Хроматограф ию используют, чтобы определить время удержания соединений из Таблицы 3, как следует далее:
LCMS=YMC S5 ODS колонка, 4.6×50 мм, элюент 10-90% МеО/Н2О, более чем 4 минуты, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LC=YMC S5 ODS колонка 4.6×50 мм, элюент 10-90% МеОН/Н2О более чем 4 минут, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм
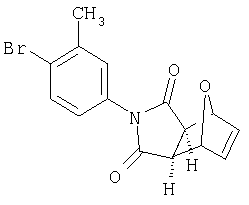
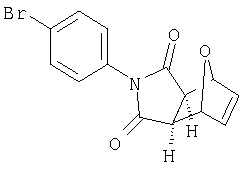
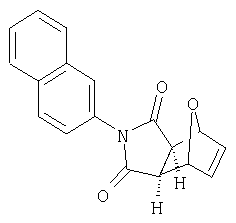
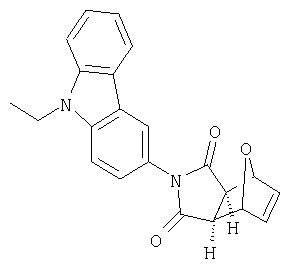
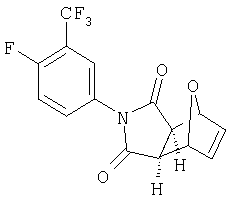
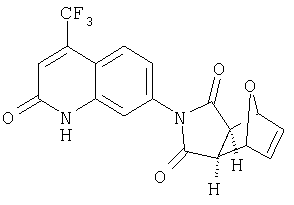
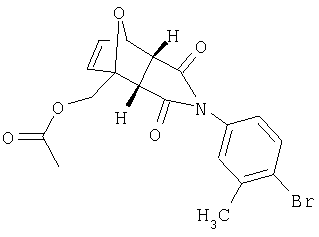
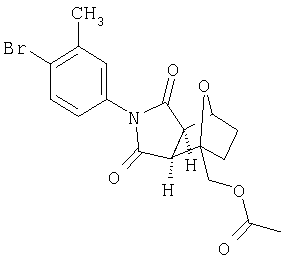
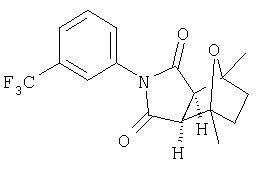
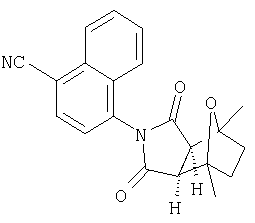
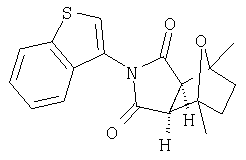
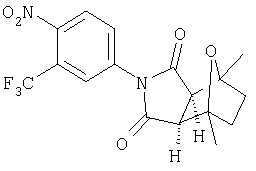
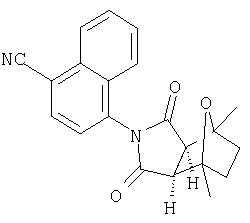
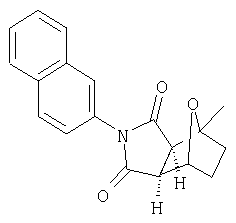
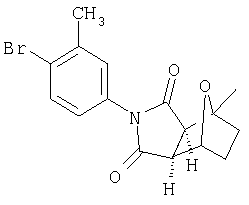
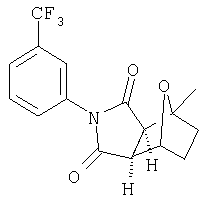
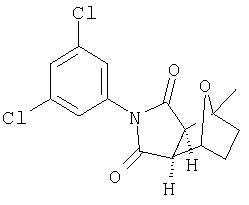
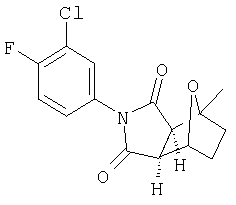
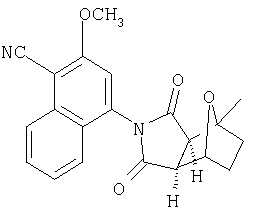
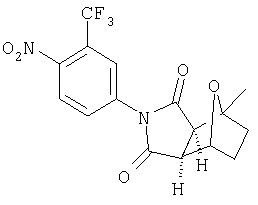
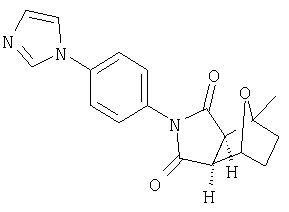
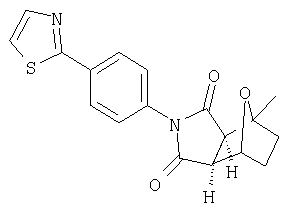
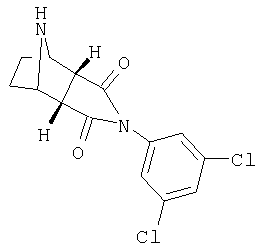
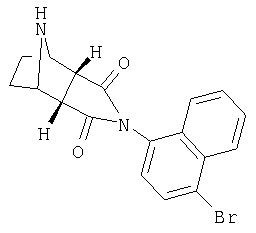

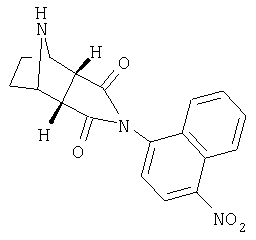
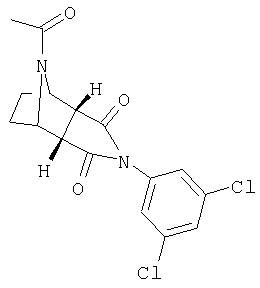
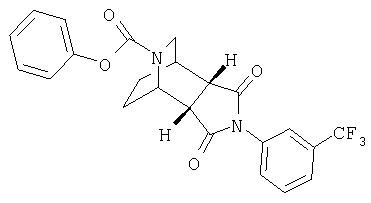
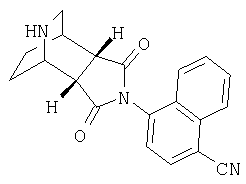
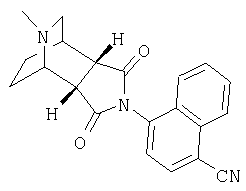
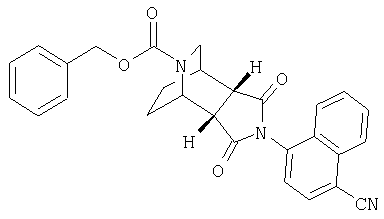
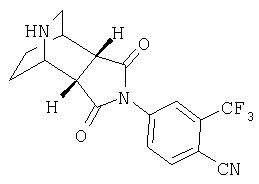
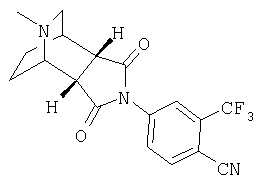
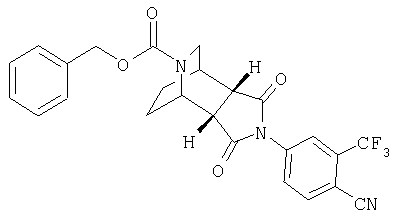
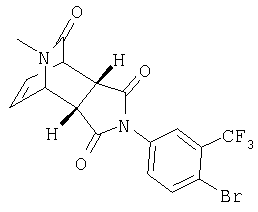
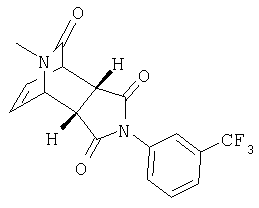
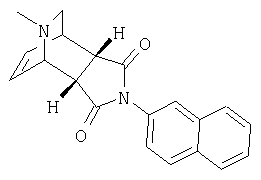
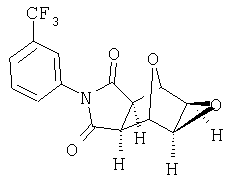
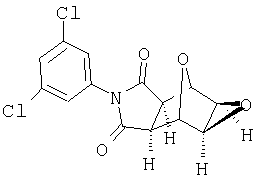
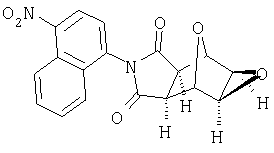
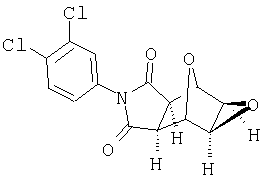
Примеры с 165 до 203
Дополнительные соединения настоящего изобретения получены и приведены в следующей ниже Таблице 4. В Таблице 4 даны наименование соединения и его структурная формула, так же как приведен номер примера, в котором описан способ, на котором основан процесс получения соединений из Таблицы 4, с 165 по 203.
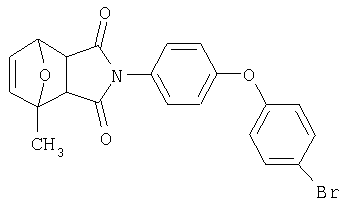
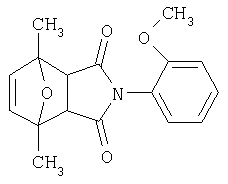
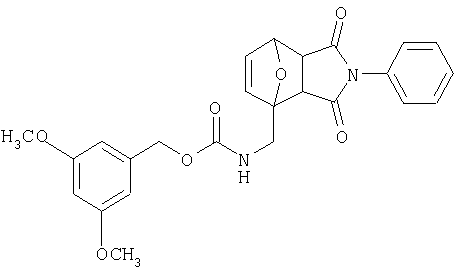
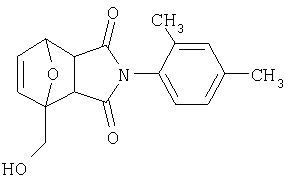
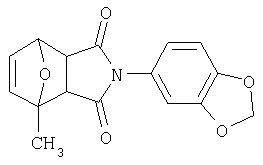
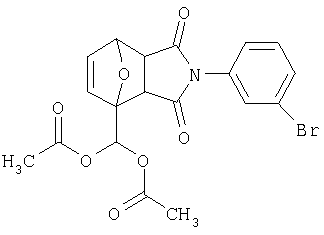
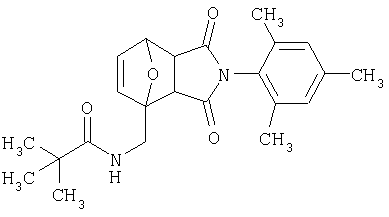
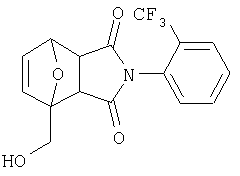
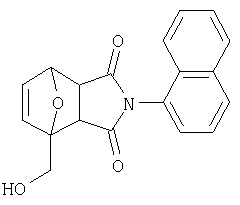
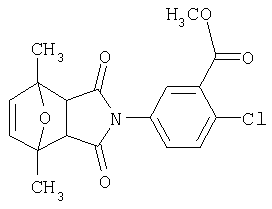
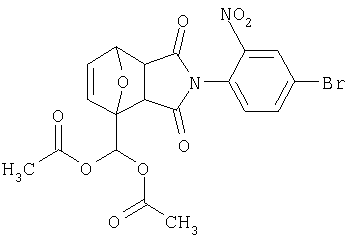
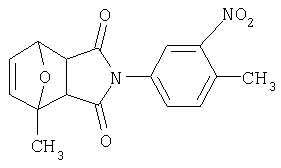
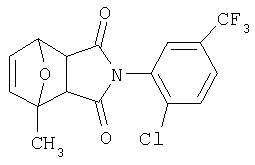
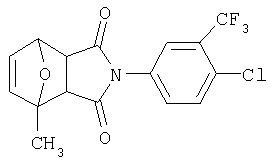
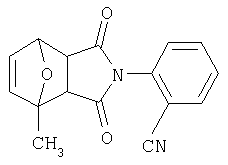
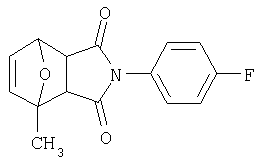
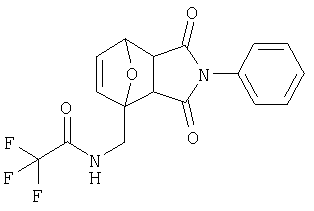
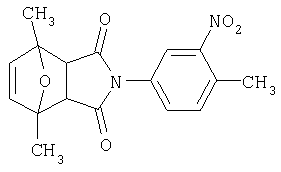
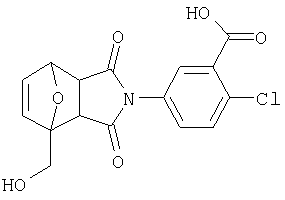

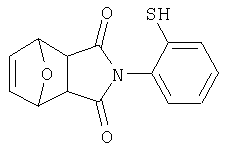
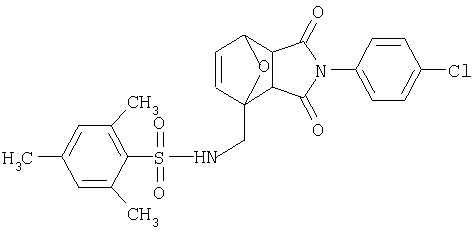
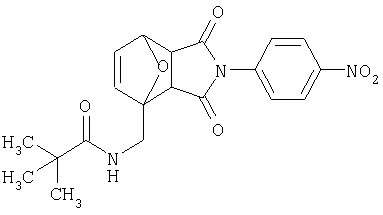
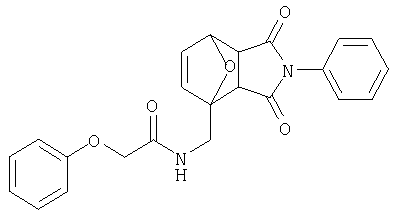
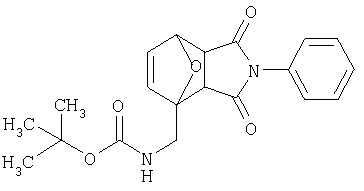
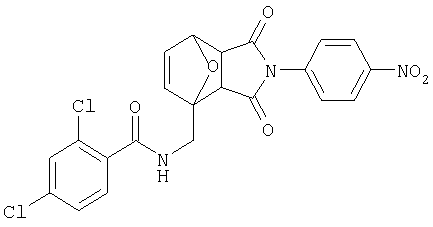
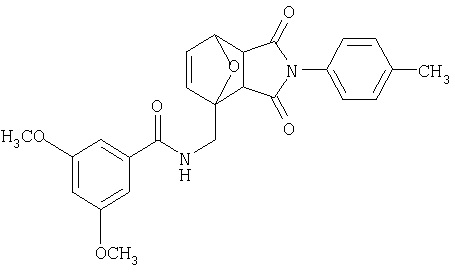
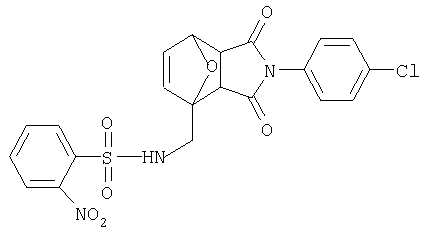
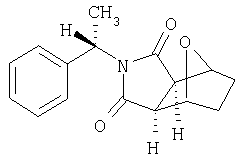
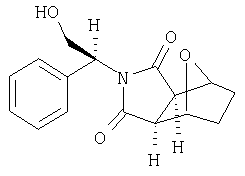
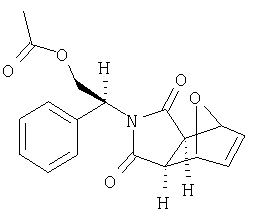
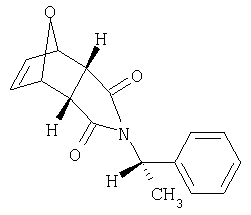
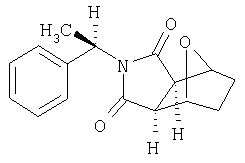
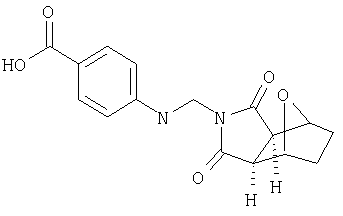
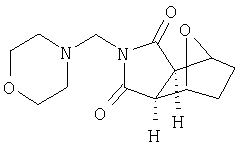
Пример 204
(3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (204D/25В)
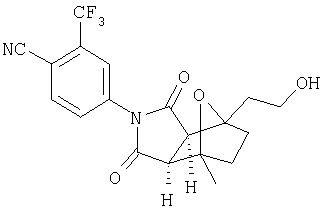
2-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-5-метилфуран (204А)
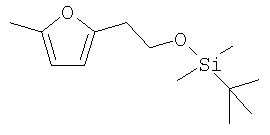
К раствору соединения 21А (2.00 г, 15.9 ммоль) в ДМФА (50 мл) добавляют имидазол (1.62 г, 23.9 ммоль), затем трет-бутилдиметилсилилхлорид (2.63 г, 17.5 ммоль). Через 2 часа при 25°С реакционную массу выливают в диэтиловый эфир (300 мл) и промывают водой (1×100 мл), 1 N HCl (1×100 мл), водой (1×100 мл), рассолом (1×50 мл) и сушат над безводным MgSO4. Сырое соединение 204А анализируют с помощью LCMS и ЯМР и определяют достаточность его чистоты для переноса непосредственно на следующую стадию. HPLC: 100% в течение 4.347 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм).
В. (3аα,4β,7β,7аα)-4-[2-[[(1,1-Диметилэтил)диметилсилил]-окси]этил]гексагидро-7-метил-4,7-эпокси-1Н-изобензофуран-1,3(2Н)-дион (204В)
Соединение 204А (4.0 г, 18.9 ммоль) и малеиновый ангидрид (1.42 г, 14.51 ммоль) растворяют в дихлорэтане (10 мл) и перемешивают при температуре 25°С в течение 60 часов. Летучие вещества затем удаляют в вакууме и полученное оранжевое масло растворяют в абсолютном этаноле (50 мл) и добавляют Pd/C (10% Pd, 1.00 г). Затем вводят водород из баллона. Через 3 часа реакционную массу отфильтровывают через целит, промывают EtOAc и концентрируют в вакууме. Сырой ангидрид очищают с помощью повторной флеш хроматографии на SiO2, элюируя ацетоном/хлорформом (0-2-4% ацетон), что дает 1.30 г соединения 204В в виде бесцветного масла, дополнительно к 3.00 г исходного соединения 204А. Характеристика с помощью протоновой ЯМР спектроскопии показывает только эксоизомер. 1Н ЯМР, 400 мГц, CDCl3, 3.83 (2Н, т, J=6.0 Гц), 3.22 (1Н, д, J=8.2 Гц), 3.06 (1Н, д, J=8.2 Гц), 1.70-2.25 (6Н, м), 1.55 (3Н, с), 0.82 (9Н, с), 0.00 (6Н, с).
С. (3аα,4β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]-окси]этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (204С)
Соединение 204В (0.250 г, 0.8 ммоль) и 4-амино-2-трифторметилбензонитрил (0.124 г, 0.668 ммоль) суспендируют в сухой толуол (2.0 мл) в герметично закрытой трубке. Затем добавляют MgSO4 (6.200 г) и триэтиламин (0.5 мл), трубку герметизируют и помещают на масляную баню при 125°С. Через 40 часов, реакционную массу охлаждают до температуры 25°С, отфильтровывают и концентрируют в вакууме. Сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя СН2Cl2, что дает 0.111 г соединения 204С в виде твердого вещества желтого цвета. HPLC: 92% в течение 4.203 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм). MS (ESI): м/е 531.1 [M+Na]+.
D. (3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (204В)
Соединение 204С (0.031 г, 0.061 ммоль) растворяют в ТГФ (0.5 мл) и переносят в контейнер с пропиленом, затем охлаждают до температуры 0°С. Затем добавляют НР·пиридин (˜47% HF, 0.1 мл). Через 15 минут реакцию завершают, как определяют с помощью LC, и выливают в холодный насыщенный водный раствор NaHCO3. Смесь экстрагируют СН2Cl2 (3×10 мл). Объединенные органические слои промывают 1 N HCl (1×20 мл) и сушат над безводным Na2SO4. Соединение 204D выделяют в виде масла желтого цвета и сравнивают с продуктом, полученным в примере 25. Дальнейшая очистка не требуется.
Пример 205
(3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-(фенилметил)-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (205Ci и 205Cii соответственно)
A. 2-Метил-5-(фенилметил)-фуран (205А)
н-BuLi (1.8 мл, 4.51 ммоль, 1.1 экв., 2.5 М в гексане) добавляют к раствору 2-метилфурана (0.37 мл, 4.10 ммоль, 1 экв.) в безводном ТГФ (3 мл) при температуре -25°С. Полученный раствор перемешивают при комнатной температуре в течение 3 часов, а затем охлаждают до температуры -15°С. Добавляют бензилбромид (0.59 мл, 4.92 ммоль, 1.2 экв.), который поступает через слой из оксида алюминия и раствор нагревают до комнатной температуры и перемешивают в течение ночи. Добавляют насыщенный раствор NH4Cl (5 мл) и смесь перемешивают в течение часа. Реакционную затем смесь экстрагируют с помощью эфира (2×) и объединенные органические экстракты сушат и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя гексаном, дает 323 мг (46%, 1.88 ммоль) соединения 205А в виде бесцветного масла. HPLC: 95% в течение 3.72 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм) и приблизительно 400 мг смесь продукта и бензил бромид (˜2:1 с помощью HPLC).
В. (3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-(фенилметил)-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (205 Bi и 205Bii соответственно)
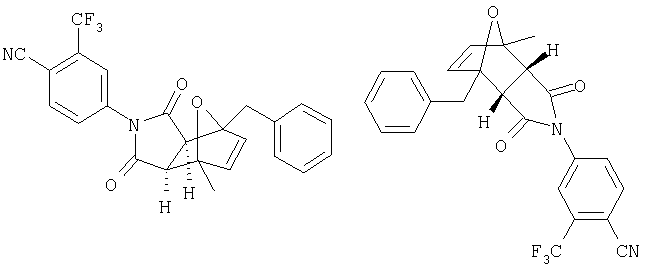
Раствор соединения 205А (124 мг, 0.72 ммоль, 1 экв.) и 4-(2,5-дигидро-2,5-диоксо-1N-пиррол-1-ил)-2-трифторметилбензонитрила (290 мг, 1.09 ммоль, 1.5 экв.) в СН2Cl2 (2 мл) перемешивают при комнатной температуре. Через 4 дня реакционную смесь концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя СН2Cl2, дает 62 мг (0.14 ммоль, 20%) смеси соединений 205Bi и 205Bii в виде твердого вещества белого цвета, которую используют непосредственно на следующем этапе. HPLC: 93% в течение 3.69 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
С. (3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-(фенилметил)-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)-бензонитрил (205Ci и 205Сii соответственно)
Раствор смеси соединений 205Bi и 205Bii (62 мг, 0.14 ммоль, 1 экв.) и 10% Pd/C (12 мг, каталитическое количество) в EtOH (3.5 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 2 часов. Реакционную смесь отфильтровывают через целит и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 35% EtOAc/гексаном, дает 22 мг (0.05 ммоль, 35%) соединения 205Ci и 12 мг (0.027 ммоль, 19%) соединения 205Сii. Соединение 205Ci: HPLC: 98% в течение 3.75 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 458.2 [M+NH4]+. Соединение 205Сii: HPLC: 97% в течение 3.78 минут (YMC S5 ODS колонке 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ESI): м/е 473.45 [М+СН3ОН]+.
Пример 206
(3аα,4β,7β,7аα)-2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил (206)
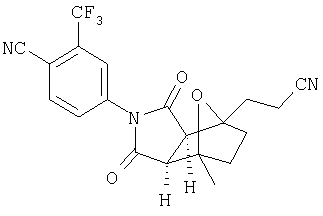
Раствор соединения 36 (34 мг, 0.074 ммоль) и NaCN (24 мг, 0.49 ммоль) в ДМСО (1 мл) нагревают при температуре 100°С в течение 0.5 часов. После охлаждения реакционную смесь выливают в Н2О и водный слой экстрагируют EtOAc (2×). Объединенные органические слои промывают Н2О (2×), сушат над Na2SO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на SiO2, элюируя 50% EtOAc/гексан, затем препаративной HPLC, 30.41 минут (время удержания) (YMC S5 ODS 30×250 мм, 10-90% водным раствором метанола в течение более 30 минут, содержащим 0.1% TFA, 25 мл/минут, контролирование при 220 нм), дает 6.6 мг (22%) соединения 206 в виде твердого вещества белого цвета. HPLC: 99% в течение 2.89 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 402.1 [М-Н]-
Пример 207
(3аα,4β,7β,7аα)-[Октагидро-4-метил-7-[2-(4-морфолинил)этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил, трифторацетат (1:1) (207)
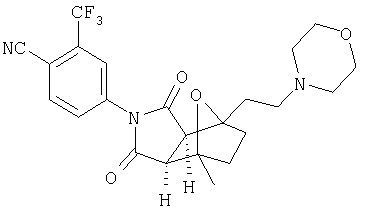
Раствор соединения 36 (15.6 мг, 0.034 ммоль) и морфолин (6 мл, 0.068 ммоль) в толуоле (1 мл) нагревают при температуре 100°С в течение ночи. После охлаждения реакционную смесь концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на SiO2, элюируя 10% MeOH/CH2Cl2, затем препаративной HPLC 23.96 минут (время удержания) (YMC S5 ODS 30×250 мм, 10-90% водным раствором метанола в течение более 30 минут, содержащим 0.1% TFA, 25 мл/минут, контролирование при 220 нм), дает 8.7 мг (55%) соединения 207 (TFA соль) в виде твердого вещества белого цвета. HPLC: 99% в течение 2.02 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 464.3 [М+Н]+.
Пример 208
(3аα,4β,7β,7аα)-2-(5-Фтор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (208С)
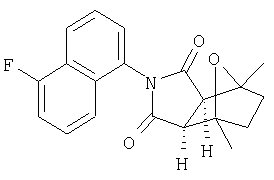
А. 1-Фтор-5-нитронафталин (208А)

К раствору 6N HCl (12 мл) добавляют 1.47 г (7.83 ммоль) сухой порошкообразный 5-нитро-1-нафтиламин, как описано у J. Chem. Soc. 1187 (1949). Смесь охлаждают до температуры 0°С и медленно добавляют холодный раствор NaNO2 (547 мг, 7.93 ммоль) в 2 мл H2O так, чтобы температура держалась около 0°С. После завершения добавления реакционную смесь перемешивают в течение 30 минут и отфильтровывают. Фильтрат охлаждают до температуры 0°С и обрабатывают холодным 4.5 М NaBF4 раствором (5 мл), что дает полное осаждение борфторида диазония. Смесь оставляют при 0°С в течение 30 минут, затем ее фильтруют и остаток промывают холодным 4.5 М NaBF4 раствором (5 мл), ледяным этанолом (10 мл) и Et2O (20 мл). Полученные твердые вещества сушат на воздухе, что дает 1.74 г (77%) соответствующей соли диазония.
К 1.70 г (5.92 ммоль) описанного выше борфторида диазония добавляют 5 г песка и компоненты тщательно перемешивают. Реакционную смесь осторожно нагревают при температуре пониженном давлении, пока не наступит разложение. До конца реакции колбу нагревают еще в течение 30 минут до 130°С, что гарантирует полное превращение. После охлаждения реакционную смесь растворяют в ацетоне и содержимое предварительно абсорбируют на силикагель. Очистки достигают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 0 до 10%), которая дает 449 мг (50%) соединения 208А в виде твердого вещества белого цвета.
В. 1-Амино-5-фторнафталин (208В)

Раствор соединения 208А (62 мг, 0.32 ммоль) в 1 мл EtOH, содержащий 0.1 мл 12 N HCl, нагревают при кипении с обратным холодильником. Добавляют небольшими дозами металлический порошок (62 мг, 1.11 ммоль) и нагревание продолжают в течение 2 часов. Смесь охлаждают, нейтрализуют раствором 1 N NaOH и водный слой экстрагируют CH2Cl2. Объединенные органические фазы сушат над MgSO4 и концентрируют, оставляя остаток, который очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 40 до 80%) получая 42 мг (80%) соединения 208В в виде твердого вещества желтого цвета.
С. (3аα,4β,7β,7аα)-2-(5-Фтор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (208С)
Соединение 208В (42 мг, 0.26 ммоль), соединение 20А (54 мг, 0.27 ммоль), MgSO4 (69 мг, 0.58 ммоль) и триэтиламин (191 мкл, 1.37 ммоль) вносят в 2 мл толуола и помещают в герметичную трубку. Герметичную трубку нагревают до температуры 135°С в течение 14 часов. Охлажденную реакционную смесь отфильтровывают через небольшой слой из целита, элюируя CH2Cl2 и растворитель удаляют при пониженном давлении. Остаток очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/минут), что дает 15 мг (17%) соединения 208С в виде твердого вещества светло-желтого цвета. HPLC: 16% в течение 2.96 минут; 77% в течение 3.06 минут (время удержания, атропные изомеры) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 340.2
Пример 209
(3аα,4β,7β,7аα)-2-(5-Фтор-4-нитро-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (209C)
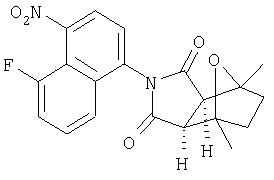
А. N-(5-Фтор-1-нафталинил)ацетамид (209А)

Раствор 141 мг (0.74 ммоль) соединения 208А в 2 мл АсОН нагревают при кипении с обратным холодильником и обрабатывают небольшими дозами металлического порошка (118 мг, 2.11 ммоль). Смесь кипятят с обратным холодильником в течение 15 минут, перед тем как добавляют 73 мкл (0.78 ммоль) Ас2О. После дополнительных 15 минут кипения с обратным холодильником смесь охлаждают и отфильтровывают, элюируя СН2Cl2. Фильтрат затем концентрируют и остаток очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 20 до 50%), что дает соединение 209А (145 мг, 97%) в виде твердого вещества белого цвета.
В. 1-Амино-5-фтор-4-нитронафталин (209В)
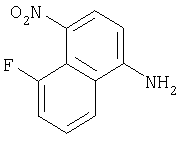
Соединение 209А (133 мг, 0.66 ммоль) растворяют в 1 мл АсОН и полученный раствор охлаждают до температуры 10°С. При этой температуре добавляют 80 мкл (2.00 ммоль) дымящейся бурым цветом HNO3 и перемешивание продолжают в течение 15 минут, перед тем как реакционную массу захолаживают путем добавления измельченного льда. Водный слой экстрагируют СН2Cl2 и объединенные органические фазы сушат над MgSO4 и концентрируют. Полученный остаток растворяют в 3 мл EtOH, нагревают при кипении с обратным холодильником и обрабатывают 0.5 мл 40% водного раствора NaOH. Перемешивание продолжают в течение 15 минут, перед тем как реакционную массу охлаждают и разбавляют Н2О. Водный слой экстрагируют CH2Cl2 и объединенные органические фазы сушат над MgSO4 и концентрируют. Полученный остаток очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 40 до 70%), чтобы получить 36 мг (27%) соединения 209В в виде твердого вещества желтого цвета.
С. 3аα,4β,7β,7аα)-2-(5-Фтор-4-нитро-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (209С)
Соединение 209В (36 мг, 0.18 ммоль) реагирует в герметично закрытой трубке с соединением 20А (38 мг, 0.19 ммоль), MgSO4 (46 мг, 0.39 ммоль) и Et3N (128 мкл, 0.92 ммоль) в 250 мкл толуола в соответствии с описанным выше способом в примере 208С, что дает, после очистки с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/минут), 27 мг (40%) соединения 209С в виде твердого вещества желтого цвета. HPLC: 8% в течение 2.88 минут; 84% в течение 3.06 минут (атромизомеры, время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 402.0 [М+Н]+
Пример 210
(3аα,4β,7β,7аα)-2-(1,1-Диоксидобензо[b]тиофен-3-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (210)
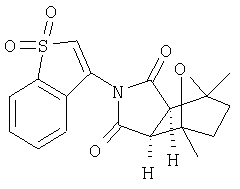
mCPBA (160 мг, 0.641 ммоль, 70% чистый) добавляют к раствору соединения 134 (70 мг, 0.214 ммоль) в CH2Cl2 (2 мл) при комнатной температуре. После того как первоначальный продукт израсходуют, реакционную массу захолаживают насыщенным раствором NaHCO3 и экстрагируют CH2Cl2. Органический слой промывают 1N NaOH, сушат над Na2SO4 и концентрируют при пониженном давлении, что дает 63.9 мг (83%) соединения 210 в виде твердого вещества белого цвета. HPLC: 99% в течение 3.81 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 360.0 [М+Н]+.
Пример 211
4-(1,3,3а,4,7,7а-Гексагидро-4,6,7-триметил-1,3-диоксо-4,7-эпокси-2Н-пирроло[3,4-c]пиридин-2-ил)-2-(трифторметил)бензонитрил (211)
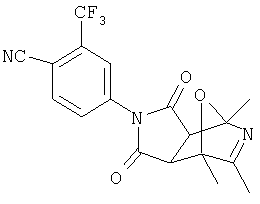
2,4,5-Триметилоксазол (0.48 мл, 4.14 ммоль) растворяют в толуоле (2.0 мл) и добавляют 4-(2,5-дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрил (1.0 г 3.76 ммоль). Реакционную смесь перемешивают при температуре 75°С в атмосфере азота в течение 2.5 часов. Раствор охлаждают до комнатной температуры и полученный осадок отфильтровывают и промывают толуолом, что дает 0.51 г (35% выход) соединения 211 в виде твердого вещества светло-серого цвета. ЯМР анализ показывает, что соединение 211 имеет один изомер (эксо/эндо), тем не менее идентичность изомера не может быть определена с помощью ЯМР анализа. HPLC: 100% в течение 2.85 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 378.42 [M+H]+.
Пример 212
(3аα,4β,7β,7аα)-Тетрагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3,5(2Н.4Н)-трион и (3аα,4α,7α,7аα)-Тетрагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3,5(2Н,4Н)-трион (212i и 212ii соответственно)
2,2-Диметил-3(Н)-фуранон (0.500 г, 4.46 ммоль) и 1-[3-(трифторметил)фенил]-1Н-пиррол-2,5-дион (1.07 г, 4.46 ммоль) суспендируют в толуоле (20 мл) в герметично закрытой трубке. Смесь нагревают при температуре 110°С в течение 4 часов, а затем охлаждают до температуры 25°С и концентрируют в вакууме. Полученный остаток очищают с помощью флеш хроматографии на SiO2, элюируя хлористым метиленом, что дает 0.411 г соединения 212i в виде твердого вещества белого цвета и 0.193 г соединения 212ii в виде твердого вещества белого цвета. Структурные построения подтверждены с помощью 1-D NOE протоновых ЯМР экспериментов. Соединение 212i: HPLC: 100% в течение 2.817 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 376.0 [М+Na]+. Соединение 212ii: HPLC: 100% в течение 3.013 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 354.02 [М+Н]+.
Пример 213
(3аα,4β,7β,7аα)-2-(5-Хлор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (213В)
А 1-Амино-5-хлорнафталин (213А)
К раствору 1.74 г (6.06 ммоль) диазоборфторида (описанного в примере 208А) в ацетоне (7 мл) добавляют небольшими дозами 693 мг (7.00 ммоль) CuCl. После того как выделение азота прекратится, удаляют ацетон при пониженном давлении и остаток помещают в СН2Cl2 (30 мл). Органическую фазу промывают Н2О (30 мл), сушат над MgSO4, концентрируют и в конце очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 0 до 15%), что дает 754 мг (70%) 1-хлор-5-нитронафталина.
Описанный выше синтезированный 1-хлор-5-нитронафталин (540 мг, 2.6 ммоль) растворяют в 10 мл АсОН, затем обрабатывают 415 мг (7.43 ммоль) металлического порошка и потом ацилируют Ас2O (0.26 мл, 2.73 ммоль) в соответствии со способом, описанным в примере 209А, что дает 543 мг (95%) 1-ацетамино-5-хлорнафталина.
Описанный выше синтезированный раствор 1-ацетамино-5-хлорнафталина (52 мг, 0.24 ммоль) в 3 мл EtOH нагревают при кипении с обратным холодильником и обрабатывают 0.5 мл 40% водным раствором NaOH. Смесь нагревают при кипении с обратным холодильником, пока не будет полностью израсходован первоначальный продукт, охлаждают и концентрируют при пониженном давлении. Остаток помещают в СН2Cl2 (50 мл) и промывают H2O (25 мл). Органический слой сушат над MgSO4 и концентрируют, чтобы оставить 41 мг (98%) соединения 213А в виде твердого вещества белого цвета.
В (3аα,4β,7β,7аα)-2-(5-Хлор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (213В)
Соединение 213А (24 мг, 0.14 ммоль) реагирует в герметично закрытой трубке с соединением 20А (29 мг, 0.15 ммоль), MgSO4 (36 мг, 0.30 ммоль) и Et3N (100 мкл, 0.71 ммоль) в 250 мкл толуола в соответствии со способом, описанным в примере 208С, что дает, после очистки с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/минут), 27 мг (40%) соединение 213В в виде твердого вещества белого цвета. HPLC: 98% в течение 1.82 минут (время удержания) (YMC S5 TurboPack Pro колонке 4.6×33 мм, элюируя 10-90% водным раствором метанола в течение более 2 минут, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 356.4 [М+Н]+.
Пример 214
(3аα,4β,7β,7аα)-2-(5-Хлор-4-нитро-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (214В)
А. 1-Амино-5-хлор-4-нитронафталин (214А)
1-Ацетамино-5-хлорнафталин (150 мг, 0.68 ммоль, полученный, как описано в примере 213А) растворяют в 1 мл АсОН и обрабатывают 82 мкл, дымящейся бурым цветом HNO3 и потом деацилируют 1 мл 40% водного раствора NaOH в 3 мл EtOH в соответствии со способом, описанным в примере 209А, что дает 49 мг (32%) соединения 214А в виде твердого вещества желтого цвета.
В. (3аα,4β,7β,7аα)-2-(5-Хлор-4-нитро-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (214В)
Соединение 214А (27 мг, 0.12 ммоль) реагирует в герметично закрытой трубке с соединением 20А (26 мг, 0.13 ммоль), MgSO4 (32 мг, 0.27 ммоль) и Et3N (88 мкл, 0.63 ммоль) в 250 мкл толуола в соответствии со способом, описанным в примере 208С, что дает после очистки с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/минут) 22 мг (45%) соединения 214В в виде твердого вещества желтого цвета. HPLC: 24% в течение 3.06 минут; 76% в течение 3.25 минут (атропные изомеры, время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 418.0 [M+NH4]+.
Пример 215
(3аα,4β,7β,7аα)-4-Этилгексагидро-7-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (215В)
А. (3аα,4β,7β,7аα)-4-Этилгексагидро-7-метил-4,7-эпоксиизобензофуран-1,3-дион (215А)
2-Этил-5-метилфуран (1.89 мл, 15.3 ммоль) растворяют в хлористом метилене (10 мл) и добавляют малеиновый ангидрид (1.00 г, 10.2 ммоль). Реакционную массу перемешивают при температуре 25°С в течение 18 часов, а затем концентрируют в вакууме. Полученный сырой бицикл растворяют в EtOAc (50 мл) и добавляют 10% Pd/C (0.40 г). Затем вводят водород из баллона. Через 4 часа реакционную массу отфильтровывают через целит, промывают EtOAc. Концентрация в вакууме дает сырое соединение 215А (1.93 г) в виде твердого вещества белого цвета. Полученный продукт используют непосредственно на следующей стадии без очистки.
В. (3аα,4β,7β,7аα)-4-Этилгексагидро-7-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (215В)
Соединение 215А (0.168 г, 0.798 ммоль) и 4-нитро-1-нафталамин (0.10 г, 0.53 ммоль) суспендируют в толуоле (0.8 мл) и TEA (0.2 мл) и добавляют сульфат магния (0.1 г). Смесь нагревают при температуре 135°С в герметично закрытой трубке в течение 18 часов. Реакционную смесь затем охлаждают до комнатной температуры, отфильтровывают и промывают хлорформом. Концентрация дает сырой продукт, который очищают с помощью препаративной TLC на SiO2, элюируя хлористым метиленом. Это дает соединение 215В (0.077 г) в виде твердого вещества желтого цвета. HPLC: 100% в течение 3.260 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 381.05
Пример 216
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-N-(4-фторфенил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ацетамид (216В)
А. N-(4-Фторфенил)-5-метил-2-фуранацетамид (216А)
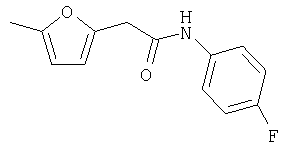
5-Метил-2-фурануксусную кислоту (1.00 г, 7.14 ммоль, синтезированную, как описано WO 9507893, Пример 19) растворяют в СН3CN/ДМФА (4:1, 25 мл); добавляют 1-[3-(диметиламино)пропил]-3-этилкарбодиимид (1.37 г, 7.14 ммоль), а затем 1-гидрокси-7-азабензотриазол (0.972 г, 7.14 ммоль). А затем 4-фторанилин (0.676 мл, 7.14 ммоль). Через 3 часа реакционную массу разбавляют EtOAc (150 мл) и промывают 1N HCl (1×30 мл), насыщенным водным раствором NaHCO3 (1×30 мл), рассолом (1×40 мл) и сушат над сульфатом натрия. Соединение 216А (1.581 г) выделяют в виде пены желтого цвета после концентрирования в вакууме. Дальнейшая очистка не требуется. HPLC: 78% в течение 2.647 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
В. 3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-N-(4-фторфенил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ацетамид (216В)
Соединение 216А (0.200 г, 0.858 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрил (0.164 г, 0.66 ммоль) растворяют в бензоле и нагревают при температуре 60°С в течение 14 часов. Реакционную смесь затем охлаждают и концентрируют в вакууме. Полученное масло оранжевого цвета растворяют в EtOAc (15 мл) и добавляют 10% Pd/C (0.050 г). Затем вводят водород из баллона. Через 3 часа реакционную массу отфильтровывают через целит, промывают EtOAc и концентрируют в вакууме. Полученный сырой продукт очищают с помощью препаративной TLC на кварце, элюируя 5% ацетона в хлористом метилене, что дает 0.166 г соединения 216В в виде твердого вещества белого цвета. ЯМР спектроскопия показывает только отдельный изомер, который определяют на идентичность с эксо изомером с помощью NOE экспериментов. HPLC: 95% в течение 3.200 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 484.0 [М+Н]+.
Пример 217
(3аα,4β,7β,7аα)-Гексагидро-4-метил-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион, более быстро элюируемый энантиомер; (3аα,4β,7β,7аα)-Гексагидро-4-метил-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион, медленно элюируемый энантиомер (2171; 21711, соответственно)
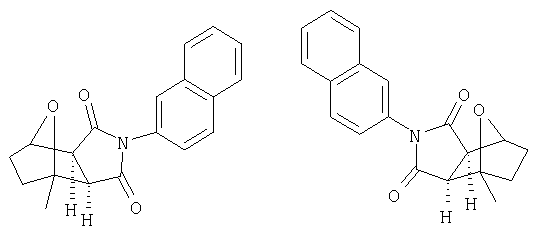
Рацемическое соединение 137 разделяют на отдельные антиподы с помощью хиральной жидкостной хроматографии с обращенной фазой. Используют Chiralpak AD-R колонку (4.6×250 мм), элюируя 70% ацетонитрилом/30% воды со скоростью 1 мл/минута. Используют УФ, определенный при 220 нм. Быстро элюируемый изомер, соединения 217i (время удержания = 15.66 минут), как показано, имеет значение 99.9% и медленно элюируемый изомер, соединение 217ii (время удержания = 15.66 минут) имеет выход 99.6% по данным аналитической хиральной хроматографии с обращенной фазой.
Пример 218
(3аα,4β,7β,7аα)-4-[4-[[2-[[(4-Фторфенил)метил]метиламино]этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (218В)
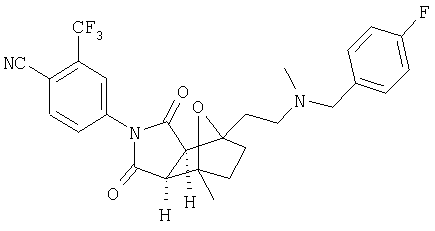
А. (4-Фторбензил)метиламин; Бис(4-фторбензил)метиламин (218А; 218А')
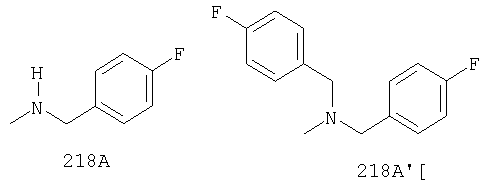
Соединения 218А и 218А' получают в соответствии со способом, описанным в Singer, ef. Al., J. Med. Chem. 29; 40-44 (1986). 4-Фторбензилбромид (189 мг, 1.00 ммоль) нагревают при кипении с обратным холодильником в растворе этанола (1.5 мл) и метиламина (5 мл, 2 М раствор в МеОН) в течение 3 часов. Вводят дополнительную порцию метиламина (2 мл) и смесь нагревают при кипении с обратным холодильником в течение дополнительного часа. Раствор охлаждают и концентрируют в вакууме и остаток растворяют в смеси 2N HCl (3 мл) и эфира (1.5 мл). Слои отделяют и водный слой экстрагируют дополнительно эфиром. Водный раствор охлаждают до температуры 0°С, титруют до pH 11 с NaOH и экстрагируют СН2Cl2. Экстракты сушат над MgSO4 и концентрируют, что дает 120 мг 2.5:1 смеси соединения 218А и соединения 218А' соответственно. Сырую смесь используют без дальнейшей очистки.
В. (3аα,4β,7β,7аα)-4-[4-[2-[[(4-Фторфенил)метил]-метиламина]этил]октагидро-7-метил-1,3-Диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (218В)
Раствор соединения 36 (34.3 мг, 0.075 ммоль) и соединений 218А и 218А' (21 мг, ˜0.088 ммоль (218А)) в толуоле (0.4 мл) нагревают при температуре 100°С в течение ночи. Реакционную смесь охлаждают до комнатной температуры, а затем концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 25% ацетоном/75% СН2Cl2 дает 30 мг (0.058 ммоль, 77.7%) 218В в виде твердого вещества желтого цвета. HPLC: 99% в течение 2.46 минут (время удержания) (YMC S5 ODS 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, контролирование при 220 нм), MS (ЕС): м/е 516.26 [М+Н]+.
Пример 219
(3аα,4β,5β,6β,7β,7аα)-4-(Октагидро-4,5,6,7-тетраметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (219D)
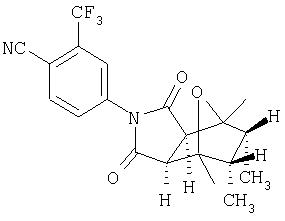
А. 2,3,4,5-Тетраметилфуран (219А)

Соединение 219А получают в соответствии со способом, описанным в Hancock et. Al, J. Org. Chem. 42, 1850-1856 (1977) & Amamath, et. Al., J. Org. Chem., 60, 301-307 (1995). 2-Пропанон (100 мл, 1.1 моль) нагревают при кипении с обратным холодильником над PbO2 (26.7 г, 0.11 моль) в течение 28 часов. После охлаждения до комнатной температуры реакционную смесь отфильтровывают и остаток промывают ацетоном. Фильтрат концентрируют при пониженном давлении, чтобы удалить ацетон, и затем дистиллируют при 20 торр. Фракции, которые появились в промежутке температур между 100-120°С, собирают, что дает 6.75 г (42.5%) 3,4-диметилгексан-2,5-диона в виде масла светло-желтого цвета.
Раствор 3,4-диметилгексан-2,5-диона (3.00 г, 21.1 ммоль) и n-толуолсульфоновой кислоты (401 мг, 2.11 ммоль) в бензоле (30 мл) нагревают при кипении с обратным холодильником в ловушке Дина-Старка в течение ночи. Реакционную смесь перегоняют при атмосферном давлении, чтобы удалить лишний бензол. Оставшуюся смесь переносят в маленькую колбу и перегоняют при атмосферном давлении. Фракции, которые появились в промежутке температур между 80-100°С собирают, что дает 509 мг (19%) соединения 219А в виде масла светло-желтого цвета.
В. (3аα,4β,7β,7аα)-4-Этил-3а,4,7,7а-тетрагидро-4,5,6,7-тетраметил-4,7-эпоксиизобензофуран-1,3-дион (219В)
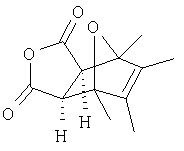
Раствор соединения 219А (400 мг, 3.22 ммоль) и малеиновый ангидрид (442 мг, 4.51 ммоль) в E2tO (1.5 мл) перемешивают при комнатной температуре в течение ночи. Реакционную затем смесь помещают в морозильник на 5 дней, по истечении указанного времени полученные кристаллы собирают и сушат, что дает 0.26 г (37%) соединения 219В в виде кристаллов желто - коричневого цвета. Сырое соединение 219В используют на следующем этапе без дальнейшей очистки.
С. (3аα,4β,5α,6α,7β,7аα)-4-Этилгексагидро-4,5,6,7-тетраметил-4,7-эпоксиизобензофуран-1,3-дион (219С)

Раствор соединения 219В (120 мг, 0.545 ммоль) и 10% Pd/C (24 мг, каталитическое количество) в EtOAc (2 мл) перемешивают в атмосфере баллонного водорода при комнатной температуре в течение ночи. Реакционную смесь отфильтровывают через целит и концентрируют при пониженном давлении, что дает 100 мг (0.446 ммоль, 81.9%) соединения 219С в виде твердого вещества белого цвета, которое используют без дальнейшей очистки.
D. (3аα,4β,5β,6β,7β,7аα)-4-(Октагидро-4,5,6,7-тетраметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (219D)
Раствор соединения 219С (44.4 мг, 0.2 ммоль), 5-амино-2-цианобензотрифторида (45 мг, 0.24 ммоль), TEA (0.04 мл) и MgSO4 (20 мг) в толуоле (0.2 мл) нагревают при температуре 135°С в течение ночи. Реакционную смесь охлаждают до комнатной температуры, отфильтровывают и затем концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 40% EtOAc/гексаном, затем промывание полученного твердого вещества МеОН дает 17 мг (0.043 ммоль, 21.7%) соединения 219D в виде твердого вещества белого цвета. HPLC: 90% в течение 3.11 минут (время удержания) (YMC S5 ODS 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, контролирование при 220 нм), MS (ЕС): м/е 391.2 [М-Н]-.
Пример 220
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил, быстро элюируемый антипод; (3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-β4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил, медленно элюируемый энантиомер (220i; 220ii, соответственно)
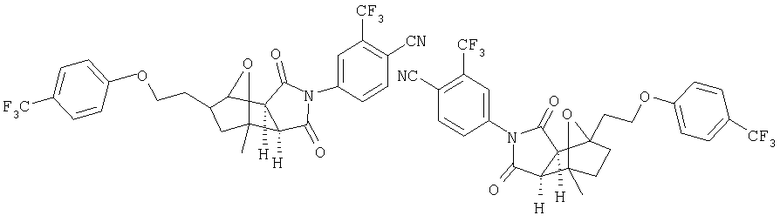
Рацемическое соединение 35 разделяют на отдельные антиподы с помощью хиральной жидкостной хроматографии с нормальной фазой. Chiralpak AD колонку (50×500 мм) используют, элюируя 85% гексаном/7.5% метанолом/7.5% этанолом, @ 50 мл/минуту. Используют УФ, определенный при 220 нм. Быстро элюируемый изомер соединения 220i (время удержания = 55.86 минут), как показано, имеет чистоту 95.8% ([α]D 25=-53.02°, С=3.134 мг/см3 в СН2Cl2) и медленно элюируемый изомер соединения 220М (время удержания = 62.86 минут) имеет чистоту 86% ([α]D 25=+48.74°, С=2.242 мг/см3 в СН2Cl2) с помощью аналитической хиральной хроматографии с нормальной фазой.
Пример 221
(3аα,4β,5β,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (221В)
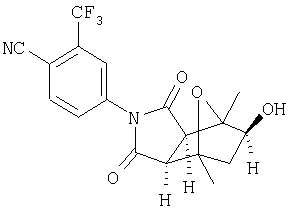
А. (3аα,4β,7β,7аα)-4-(гексагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (221Ai); (3аα,4β,7β,7аα)-4-(гексагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (221Аii)
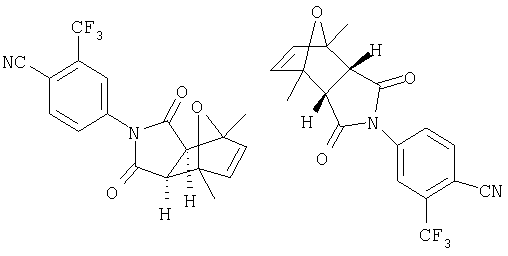
Раствор 2,5-диметилфурана (0.8 мл, 7.51 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрила (синтезирован, как описано у примере 1В) (1.00 г, 3.75 ммоль) в бензоле (4 мл) нагревают при температуре 60°С в течение ночи. Реакционную смесь концентрируют при пониженном давлении и помещают в ротор с насосом с высокого вакуума, пока масло не застынет, что дает 3:1 смесь (определяют с помощью LC и ЯМР) соединений 221Ai и 221Aii соответственно в виде твердого вещества коричневого цвета, которое используют непосредственно на следующем этапе без дальнейшей очистки.
В. (3аα,4β,5β,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (221В)
ВН3·ТГФ (3.75 мл, 3.75 ммоль, 1 М в ТГФ) добавляют к раствору сырых соединений 221Ai и 221АН (3.75 ммоль) в ТГФ (12.5 мл) при 0°С. После того как первоначальный продукт израсходуют, реакционную смесь концентрируют при пониженном давлении. Затем полученный остаток растворяют в толуоле (12.5 мл), добавляют Ме3NO (845 мг, 11.25 ммоль) и смесь нагревают при кипении с обратным холодильником в течение ночи. Реакционную смесь затем охлаждают до комнатной температуры, добавляют к Н2О и экстрагируют EtOAc (трижды). Объединенные органические слои сушат над MgSO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на SiO2, элюируя 75% EtOAc/гексаном, дает 0.354 г (25%) соединения 221 В в виде порошка желто-коричневого цвета. HPLC: 90% в течение 2.45 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 381.11
Пример 222
(3аα,4β,5β,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (222D)
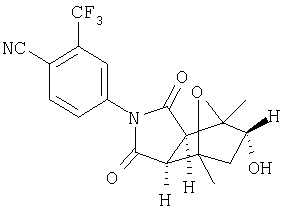
А. 3-[[(1,1-Диметилэтил)диметилсилил]окси]-2,5-диметилфуран (222А)
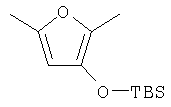
2,5-Диметил-3(3Н)-фуранон (2.00 г, 17.8 ммоль) растворяют в хлористом метилене (180 мл). Добавляют TEA (7.43 мл, 53.5 ммоль), а затем TBSOTf (4.92 мл, 21.4 ммоль) при 25°С. Через час реакционную массу концентрируют под вакуумом и полученную суспенизию пропускают через колонку на силикагеле в заполненную 3% TEA в гексане. Продукт элюируют 3% ТЕА/гексаном, что дает 3.6 г соединения 222А в виде масла оранжевого цвета, которое используют непосредственно в последующей реакции.
В. (3аα,4β,7β,7аα)-4-[5-[[(1,1-Диметилэтил)диметилсилил]окси]-1,3,3а,4,7,7а-гексагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (222В)
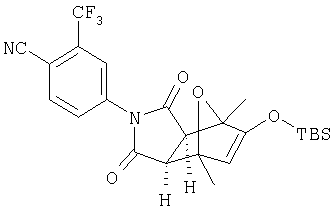
4-(2,5-Дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрил (1.00 г, 3.85 ммоль) растворяют в бензоле (5.0 мл) и добавляют соединение 222А (1.30 г, 5.77 ммоль). Реакционную смесь нагревают до температуры 60°С в течение 2 часов, а затем охлаждают до температуры 25°С. Затем раствор концентрируют в вакууме, что дает соединение 222В в виде масла желтого цвета, которое переносят в следующую реакцию без очистки. HPLC: 60% в течение 4.013 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
С. (3аα,4β,5α,7β,7аα)-4-[5-[[(1,1-Диметилэтил)диметилсилил]окси]октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (222С)
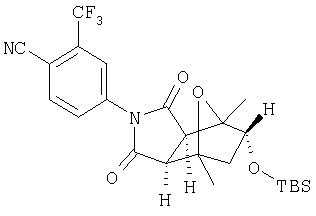
Сырое соединение 222В (3.85 ммоль) растворяют в этилацетате (75 мл) и добавляют 10% Pd/C (1.20 г). Затем вводят водород из баллона. Через 24 часа реакционную массу отфильтровывают через целит, промывают этилацетатом и концентрируют в вакууме, что дает масло желтого цвета. Сырой продукт очищают с помощью флеш хроматографии на силикагеле, элюируя хлористым метиленом/ацетоном (0%-1%-2% ацетон), что дает соединение 222С в виде твердого вещества желтого цвета (0.710 г). HPLC: 100% в течение 4.160 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 517.6 [M+Na]+.
D. (3аα,4β,5α,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (222D)
Соединение 222С (0.040 г, 0.081 ммоль) растворяют в ТГФ (1.0 мл) и добавляют НР·Пиридин (0.5 мл). Через 2 часа реакционную массу осторожно выливают в холодный насыщенный раствор NaHCO3. Затем смесь экстрагируют хлористым метиленом (3×10 мл). Объединенную органику промывают 1N HCl (1×10 мл) и сушат над безводным сульфатом натрия. Концентрация в вакууме дает соединение 222D в виде твердого вещества желтого цвета (0.031 г). NOE эксперименты подтверждают определение изомера. HPLC: 98% в течение 2.777 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 403.06 [M+Na]+.
Пример 223
(αR)-α-Метоксибензолуксусная кислота, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир (223C)
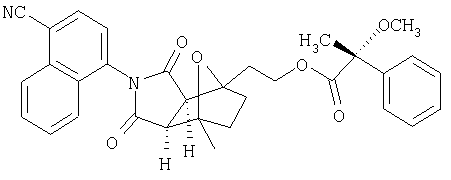
A. (3аα,4β,7β,7аα)-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (223А)
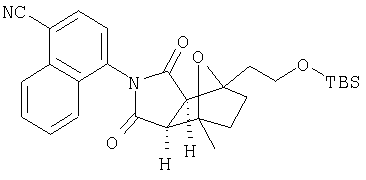
Раствор 4-амино-1-нафталинкарбонитрила (19.2 г, 114 ммоль) и малеинового ангидрида (14.0 г, 1 13 ммоль) в АсОН (230 мл) нагревают при температуре 115°С в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении, затем разбавляют СН2Cl2 (2.5 л). Органический слой промывают трижды Н2O (3 л), один раз насыщенным водным раствором Na2CO3 (1 л) и один раз рассолом (1 л), сушат над MgSO4 и концентрируют до ˜200 мл при пониженном давлении. Очистка с помощью флеш хроматографии на катионообменной смоле (60 г, CUBX13M6 из United Chemical Technologies), элюируя CH2Cl2, дает 25.0 г (88%) 4-(2,5-Дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрила в виде твердого вещества желтого цвета. HPLC 96% в течение 2.48 минут (Phenomenex-prime S5-C18 колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 249.25 [М+Н]+.
4-(2,5-Дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрил (1.00 г, 4.03 ммоль) суспендируют в бензоле (6.0 мл) в герметично закрытой трубке и добавляют соединение 204А (1.11 г, 5.24 ммоль). Реакционную массу нагревают при температуре 60°С в течение 16 часов, а затем охлаждают до температуры 25°С. Бензол удаляют в вакууме, что дает твердое вещество желтого цвета. Указанное твердое вещество растворяют в этилацетате (40 мл) и добавляют Pd/C (10% Pd, 0.300 г). Затем вводят водород из баллона. Через 4 часа реакционную массу отфильтровывают через целит и промывают этилацетатом. Концентрация в вакууме дает твердое вещество светло-желтого цвета, которое очищают с помощью флеш хроматографии на силикагеле, элюируя ацетоном/хлорформом (0%-1.5%-3% ацетон), что дает соединение 223А (1.53 г) в виде пены желтого цвета. HPLC: 86% в течение 4.173 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
В. (3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксизтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (223В)
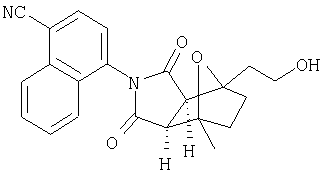
Соединение 223А (1.37 г, 2.97 ммоль) растворяют в ТГФ (8.0 мл) и переносят в пробирку с полипропиленом и охлаждают до температуры 0°С. Затем добавляют HF·Пиридин (2.0 мл). Через 20 минут реакционную массу осторожно выливают в холодный насыщенный. Раствор бикарбоната натрия и экстрагируют хлористым метиленом (3×30 мл). Органику затем промывают 1N HCl и сушат над безводным сульфатом натрия. Концентрация в вакууме дает соединение 223В (0.99 г) в виде пены желтого цвета, которую не очищают в дальнейшем. HPLC: 96% в течение 2.443 и 2.597 (атропные изомеры) минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 399.02 [M+Na]+.
С. (αR)-α-Метоксибензолуксусной кислоты, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир (223С)
Соединение 223В (0.200 г, 0.575 ммоль) добавляют к раствору WSDCC (0.138 г, 0.719 ммоль) и ®-миндальной кислоте (0.096 г, 0.575 ммоль) в дихлорметане (6.0 мл). Затем добавляют 4-DMAP (0.005 г) и реакционную массу перемешивают при температуре 25°С в течение 4 часов. Затем смесь разбавляют дихлорметаном и промывают 1N HCl (2×10 мл) и один раз бикарбонатом натрия (10 мл) и сушат над безводным сульфатом натрия. Концентрация в вакууме дает соединение 223С (0.220 г) в виде твердого вещества желтого цвета, которое не требует очистки в дальнейшем. HPLC: 100% в течение 3.283 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 547.26 [M+Na]+.
Пример 224
(3аα,4β,7β,7аα)-2-(Метилтио)-4-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил (224)

4-Амино-2-(метилтио)бензонитрил (100 мг, 0.61 ммоль, синтезированный, как описано в ЕР 40931 А1) реагирует в герметично закрытой трубке с соединением 20А (131 мг, 0.67 ммоль), MgSO4 (161 мг, 1.34 ммоль) и Et3N (0.44 мл, 3.17 ммоль) в 0.50 мл толуола в соответствии со способом, описанным в примере 208С, что дает, после очистки с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/минут), 137 мг (0.40 ммоль, 66%) соединения 224 в виде твердого вещества белого цвета. HPLC: 100% в течение 2.73 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 401.0 [М-Н+Оас].
Пример 225
(3аα,4β,7β,7аα)-2-(Метилсульфинил)-4-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил (225)
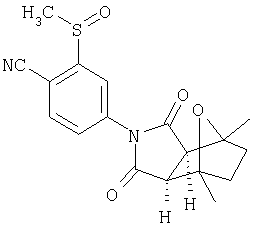
К охлажденной льдом суспензии соединения 224 (30 мг, 0.09 ммоль) в 2 мл Н2О/МеОН (1:1) добавляют оксон (80 мг, 0.26 ммоль) одной дозой в виде твердого вещества. Полученную смесь перемешивают в течение 4 часов при 0°С, перед тем как ее разбавляют Н2О (10 мл) и экстрагируют CH2Cl2 (2×20 мл). Объединенные органические слои сушат и концентрируют, чтобы получить остаток, который очищают фильтрированием продукта через небольшой слой из силикагеля, элюируя СН2Cl2, что дает 32 мг (0.09 ммоль, 100%) соединения 225 в виде бесцветного масла. HPLC: 99% в течение 2.01 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 376.0 [M+NH4]+.
Пример 226
(3аα,4β,7β,7аα)-2-(Метилсульфонил)-4-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил (226)
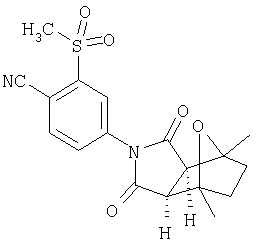
К раствору соединения 225 (48 мг, 0.14 ммоль) в CH2Cl2 (2 мл) добавляют mCPBA (145 мг, 50% смесь, 0.42 ммоль) одной порцией в виде твердого вещества. Полученной смеси дают возможность нагреться до комнатной температуры и затем ее перемешивают в течение 60 часов, в течение которых первоначальный продукт полностью расходуется, что определяется с помощью HPLC. Реакционную массу захолаживают добавлением насыщенного водного раствора NaHCO3 (5 мл), слои отделяют и водный слой экстрагируют СН2Cl2 (20 мл). Объединенные органические фазы сушат над MgSO4 и концентрируют. Оствшийся остаток очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/минут), чтобы получить 48 мг (0.13 ммоль, 92%) соединения 226 в виде твердого вещества белого цвета. HPLC: 100% в течение 2.07 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 392.0 [M+NH]+.
Пример 227
(3аα,4β,5β,7β,7аα)-7-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]гексагидро-5-гидрокси-4-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (227В)
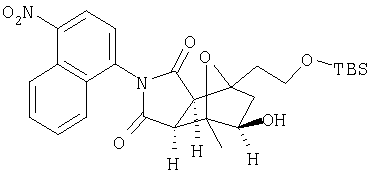
А. (3аα,4β,7β,7аα)-4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-3а,4,7,7а-тетрагидро-7-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-13(2Н)-дион (227А)
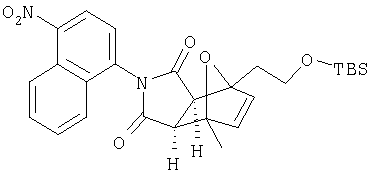
Раствор соединения 204А (455 мг, 1.894 ммоль, 2 экв.) и 1-[4-нитронафталин]-1Н-пиррол-2,5-дион (254 мг, 0.947 ммоль, 1 экв.) (получают, как описано для 4-(2,5-дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрила, Пример 223А) в бензоле (2 мл) нагревают при температуре 60°С в течение ночи. Реакционную смесь концентрируют при пониженном давлении, что дает сырое соединение 227А в виде твердого вещества коричневого цвета, которое используют непосредственно на следующем этапе без дальнейшей очистки.
В. (3аα,4β,5β,7β,7аα)-7-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]гексагидро-5-гидрокси-4-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-13(2Н)-дион (227В)
ВН3·ТГФ (0.95 мл, 0.95 ммоль, 1М в ТГФ, 1 экв.) добавляют к раствору сырого соединения 227А (0.95 ммоль, 1 экв.) в ТГФ (2 мл) при 0°С. После того как соединение 227А израсходуют, как явно определяется с помощью HPLC, реакционную смесь концентрируют при пониженном давлении. Затем полученный остаток растворяют в толуоле (2, мл), добавляют Me3NO (71 мг, 2.84 ммоль, 3 экв.) и смесь нагревают при кипении с обратным холодильником в течение более ночи. Реакционную смесь затем охлаждают до комнатной температуры, добавляют к Н2O и экстрагируют EtOAc (3×). Объединенные органические слои сушат над MgSO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на SiO2, элюируя смесью 75% EtOAc/гексан, дает 130.2 мг (26%) соединения 227В в виде твердого вещества коричневого цвета. HPLC: 94% в течение 3.92 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 527.5 [М+Н]+.
Пример 228
(3аα,4β,5β,7β,7аα)-Гексагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (228)
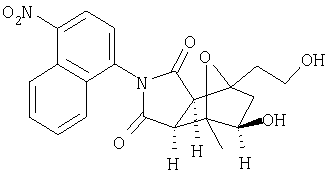
Смесь TBAF (0.3 мл, 0.296 ммоль, 1 М раствор в ТГФ) и HF (0.3 мл, 50% в H2O) в CH3CN (6 мл) добавляют к раствору 227В (104 мг, 0.197 ммоль) в ТГФ (2 мл) при 0°С. Реакционную смесь перемешивают в течение ночи при комнатной температуре. После того как первоначальный продукт израсходуют, как явно определяется с помощью TLC, добавляют Н2О и EtOAc и слои отделяют. Водный слой экстрагируют EtOAc (1×) и объединенные органические слои промывают Н2O (1×) и рассолом (1×), сушат над Na2SO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на SiO2, элюируя 5% МеОН/СН2Cl2 дает 61.2 мг (75%) соединения 228 в виде твердого вещества желтого цвета. HPLC: 99% в течение 2.47 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 411.2[М-Н]-.
Пример 229
(3аα,4β,5β,7β,7аα)-7-[2-(4-Фторфенокси)этил)гексагидро-5-гидрокси-4-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (229)
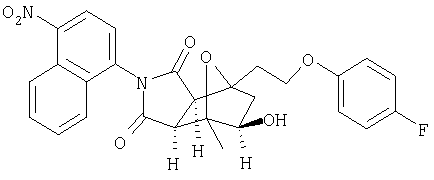
DBAD (37.7 мг, 0.164 ммоль) добавляют к раствору PPh3 (43 мг, 0.164 ммоль) в ТГФ (1 мл). После перемешивания в течение 10 минут добавляют 4-фторфенол (18.3 мг, 0.164 ммоль) и реакционную смесь перемешивают в течение дальнейших 5 минут. Добавляют раствор соединения 228 (45 мг, 0.109 ммоль) в ТГФ (1 мл) и смесь перемешивают при комнатной температуре в течение ночи. Используя HPLC, анализируют сырую реакционную смесь, которая содержит главным образом исходный диол (соединение 228), так что эту смесь добавляют к предварительно сформированной смеси, как до PPh3 (86 мг), DBAD (75.4 мг) и фенола (36.6 мг) в ТГФ (4 мл) при комнатной температуре. Перемешивание продолжают, пока не будет израсходовано полностью соединение 228. Реакционную смесь затем концентрируют при пониженном давлении. Очистка с помощью препаративной хроматографии [HPLC в течение 15.2 минут (время удержания) (YMC S5 ODS колонка 20×100 мм, 10-90% водным раствором метанола в течение более 15 минут, содержащим 0.1% TFA, 20 мл/минут, контролирование при 220 нм)] дает 25.0 мг (45%) соединения 229 в виде твердого вещества светло-желтого цвета. HPLC: 99% в течение 3.53 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 505.2 [М-Н]-
Пример 230
(3аα,4β,5β,6β,7β,7аα)-4-(Октагидро-5.6-дигидрокси-4,7-диметил-13-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил; (3аα,4β,5α,6α,7β,7аα)-4-(Октагидро-5.6-дигидрокси-4,7-диметил-1,3-Диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (230Bi и 230bii соответственно)
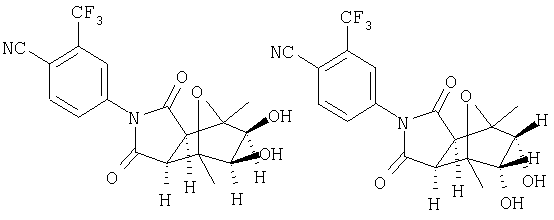
А. (3аα,4β,7β,7аα)-4-(1,3,3а,4,7,7а-Гексагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (230А)
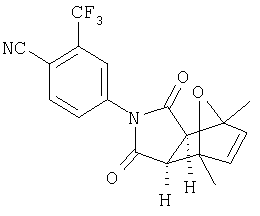
3,5-Диметилфуран (1.23 мл, 11.54 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрил (2.00 г, 7.69 ммоль) растворяют в бензоле (10 мл) и нагревают при температуре 60°С в течение 18 часов. Летучую органику затем удаляют в вакууме. Полученное сырое соединение 230А применяют без дальнейшей очистки. HPLC: 71% в течение 3.007 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
В. (3аα,4β,5β,6β,7β,7аα)-4-(Октагидро-5,6-дигидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил; ((3аα,4β,5β,6β,7β,7аα)-4-(Октагидро-5,6-дигидрокси-4,7-диметил-1,3-Диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (230Bi и 230Bii)
Соединение 230А (0.100 г, 0.281 ммоль) растворяют в ацетоне и добавляют N-метилморфолин-N-оксид (50% раствор, 0.100 мл, 0.42 ммоль). Затем добавляют OsO4 (4% раствор, 0.014 ммоль). Через 3 часа при 25°С реакцию завершают и добавляют сульфат натрия (0.250 г) с энергичным перемешиванием. Через 15 минут добавляют рассол (10 мл) и раствор экстрагируют EtOAc (3×15 мл). Органику сушат над безводным сульфатом натрия и затем концентрируют в вакууме. Смесь сырого диола очищают с помощью препаративной TLC, элюируя 18% ацетоном в хлорформе, что дает 0.038 г соединения 230Bi (бета сторона) и 0.012 г соединения 230Bii (альфа сторона) в виде твердых веществ бледно-желтого цвета. Соединение 230Bi: HPLC: 100% в течение 2.567 минут (время удержания) (YMC 85 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 397.08 [М+Н]+. Соединение 230Bii: HPLC: 100% в течение 2.417 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 397.08 [M+H]+.
Пример 231
(3аα,4β,5β,6β,7β,7аα)-4-[Октагидро-5,6-дигидрокси-4-(гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (231C)
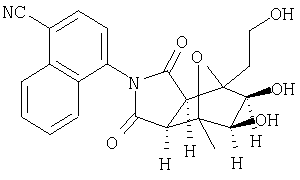
А. (3аα,4β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-1,3,3а,4,7,7а-гексагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (231А)
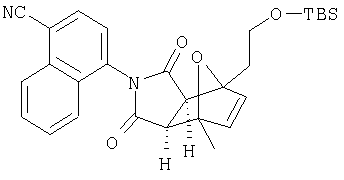
Соединение 204А (29.03 г, 120 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрил (20.0 г, 80.6 ммоль) суспендируют в бензоле (80 мл) и нагревают до температуры 60°С в течение 14 часов. Затем смесь концентрируют в вакууме при температуре 40°С в течение 40 минут. Полученную суспенизию охлаждают до температуры 25°С, затем суспендируют в МеОН (200 мл) и перемешивают при комнатной температуре в течение 30 минут. Затем раствор охлаждают до температуры 0°С в течение 30 минут, а затем отфильтровывают и промывают холодным МеОН. Полученное твердое вещество сушат в вакууме, что дает 26.1 г сырого соединения 231А в виде твердого вещества белого цвета. Раствор метанола концентрируют в вакууме и повторно суспендируют в МеОН (50 мл) и охлаждают до температуры -20°С в течение 4 часов. Затем раствор отфильтровывают и промывают холодным МеОН. Полученное твердое вещество сушат в вакууме, что дает 3.8 г соединения 231А в виде твердого вещества белого цвета. HPLC: 95% в течение 4.227 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм)
В. (3аα,4β,5β,6β,7β,7аα)-4-[4-[2-[[(1,1-метилэтил)диметилсилил]окси]этил]октагидро-5,6-дигидрокси-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (231В)
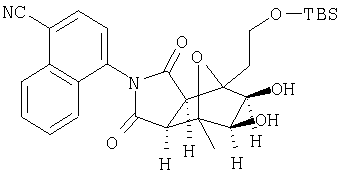
Соединение 231А (0.400 г, 0.851 ммоль) растворяют в ацетоне (9.0 мл) и добавляют N-метилморфолин-N-оксид (50% раствор, 0.0.150 мл, 1.28 ммоль). Затем добавляют OsO4 (4% раствор, 0.043 ммоль). Через 3 часа при 25°С реакцию завершают и добавляют сульфат натрия (1.0 г) с энергичным перемешиванием. Через 15 минут добавляют рассол (30 мл) и раствор экстрагируют EtOAc (3×50 мл). Органику сушат над безводным сульфатом натрия и затем концентрируют в вакууме. Сырой диол очищают с помощью флеш хроматографии на диоксиде кремния, элюируя 5-25% ацетоном в хлорформе, что дает 0.355 г соединения 231В в виде твердого вещества желтого цвета. HPLC: 93% в течение 3.903 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 522.00 [М+H]+.
С. (3аα,4β,5β,6β,7β,7аα)-4-[Октагидро-5,6-дигидрокси-4-(гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (231С)
Соединение 231В (0.400 г, 0.766 ммоль) растворяют в ТГФ (5.0 мл) и переносят в пробирку с полипропиленом и охлаждают до температуры 0°С. Затем добавляют HF·Пиридин (1.0 мл). Через 20 минут, реакционную массу осторожно выливают в холодный насыщенный раствор бикарбоната натрия и экстрагируют хлористым метиленом (3×30 мл). Органику затем промывают один раз 1N HCl и сушат над безводным сульфатом натрия. Концентрация в вакууме дает соединение 231С (0.290 г) в виде пены желтого цвета, которое не требует дополнительной очистки. HPLC: 92% в течение 2.273 и 2.423 (атропные изомеры) минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 409.10 [М+Н]+.
Пример 232
(3аα,4β,5β,6β,7β,7аα)-4-[Октагидро-5.6-дигидрокси-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил, (232C)
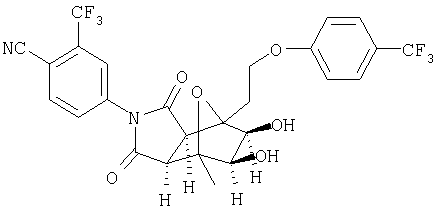
А. 2-Метил-5-[2-[4-(трифторметил)фенокси]этил]фуран (232А)
К раствору трифенилфосфина (1.56 г, 5.95 ммоль) в ТГФ (40 мл) добавляют DBAD (1.37 г, 5.95 ммоль). Через 10 минут добавляют 4-трифторметилфенол (0.964 г, 5.95 ммоль). Еще через 10 минут добавляют соединение 21А (0.500 г, 3.97 ммоль). Через 14 часов при 25°С реакционную массу концентрируют в вакууме и очищают с помощью флеш хроматографии на диоксиде кремния, элюируя хлорформом, что дает 0.713 г соединения 232А в виде бесцветного масла.
В. (3аα,4β,7β,7аα)-4-[1,3,3а,4,7,7а-гексагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (232В)
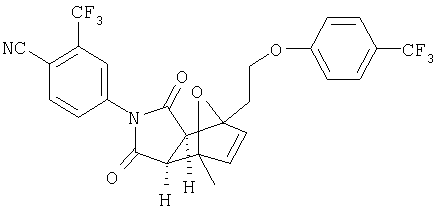
Соединение 232А (0.301 г, 1.15 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрил (0.220 г, 0.846 ммоль) суспендируют в бензоле (1.5 мл) и нагревают до температуры 60°С в течение 14 часов. Затем смесь концентрируют в вакууме при температуре 40°С в течение 40 минут. Сырой продукт очищают с помощью флеш хроматографии на диоксиде кремния, элюируя 10-0% гексаном в хлористом метилене, что дает 0.199 г соединения 232В в виде твердого вещества желтого цвета. Соединение 232В характеризуется как эксодиастереомер с помощью NOE экспериментов. HPLC: 94% в течение 3.993 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
С. (3аα,4β,5β,6β,7β,7аα)-4-[Октагидро-5,6-дигидрокси-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (232С)
Соединение 232В (0.075 г, 0.140 ммоль) растворяют в ацетоне (2.0 мл) и добавляют N-метилморфолин-N-оксид (50% раствор, 0.025 мл, 0.21 ммоль). Затем добавляют OsO4 (4% раствор, 0.007 ммоль). Через 3 часа при 25°С реакцию завершают и добавляют сульфат натрия (0.25 г) с энергичным перемешиванием. Через 15 минут, добавляют рассол (5 мл) и раствор экстрагируют EtOAc (3×10 мл). Органику сушат над безводным сульфатом натрия, а затем концентрируют в вакууме. Сырой диол очищают с помощью препаративной TLC на силикагеле, элюируя 10% ацетоном в хлорформе, что дает 0.038 г соединения 232С в виде твердого вещества желтого цвета. HPLC: 98% в течение 3.747 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 593.08 [M+Na]+.
Пример 233
(3аα,4β,5β,5аβ,8аβ,8bα)-4-(Декагидро-5-гидрокси-4-метил-1,3-диоксо-4,8а-эпокси-2Н-фуро[3,2-е]изоиндол-2-ил)-1-нафталинкарбонитрил, (233)
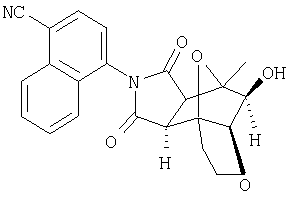
К раствору трифенилфосфина (0.072 г, 0.276 ммоль) в ТГФ (3.0 мл) добавляют DBAD (0.063 г, 0.276 ммоль). Через 10 минут добавляют 4-цианофенол (0.033 г, 0.276 ммоль). Еще через 10 минут добавляют соединение 231С (0.075 г, 0.184 ммоль). Через 3 часа при 25°С реакционную массу концентрируют в вакууме и очищают с помощью препаративной TLC на силикагеле, элюируя 15% ацетоном в хлорформе, что дает 0.068 г соединения 233 в виде твердого вещества белого цвета. HPLC: 95% в течение 2.430 и 2.560 минут (атропные изомеры) (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 391.09 [М+Н]+.
Пример 234
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-уксусная кислота, (234В)
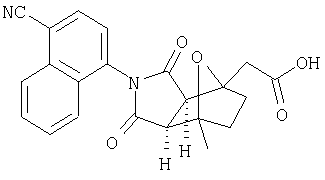
А. (3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-1,2,3,3а,7,7а-гексагидро-7-метил-1,3-диоксо-4,7-эпокси-4н-изоиндол-4-уксусная кислота (234А)
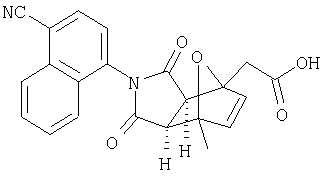
5-Метил-2-фурануксусную кислоту (0.500 г, 3.57 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрил (0.899 г, 3.57 ммоль) растворяют в бензоле (3.0 мл) и нагревают при температуре 60°С в течение 2 часов, а затем охлаждают до температуры 25°С. Через 12 часов белое твердое вещество осаждают из раствора, отфильтровывают и промывают диэтиловым эфиром, что дает 1.20 г соединения 234А в виде твердого вещества светло-желтого цвета. ЯМР показывает наличие только одного диастереомера. HPLC: 86% в течение 2.767 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 389.45 [М+Н]+.
В. (3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-Диоксо-4,7-эпокси-4Н-изоиндол-4-уксусная кислота (234В).
Соединение 234А (1.1 г, 2.82 ммоль) растворяют в EtOH/EtOAc (1:1, 50 мл) и добавляют Pd/C (10% Pd, 0.4 г), затем H2 через баллон. Через 5 часов при 25°С, реакционную массу отфильтровывают через целит, промывают EtOAc и концентрируют в вакууме, что дает 1.00 г соединения 234В в виде твердого вещества желтого цвета. HPLC: 80% в течение 2.84 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 391.1
Пример 235
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-уксусной кислоты, метиловый эфир (235)
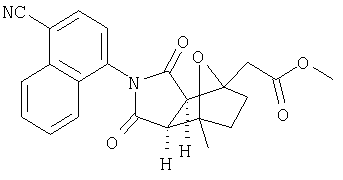
Соединение 234В (0.050 г, 0.125 ммоль) растворяют в ацетонитриле (2.0 мл), затем добавляют DCC (0.025 г, 0.125 ммоль), а затем - НОАс (0.018 г, 0.125 ммоль). Добавляют 4-фторбензиловый спирт (0.014 мл, 0.125 ммоль) и реакционную массу перемешивают в течение 3 часов. Реакционную смесь затем концентрируют в вакууме и очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, 10-90% водным раствором метанола в течение более 15 минут, содержащим 0.1% TFA, 20 мл/минут, контролирование при 220 нм). Очистка дает 0.040 г соединения 235 в виде твердого вещества белого цвета, скорее, чем ожидаемый бензиловый эфир. Никакого ожидаемого бензилового эфира не наблюдают и с помощью ЯМР или LC-MS. HPLC: 100% в течение 3.033 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 405.51 [М+Н]+.
Пример 236
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-N-[(4-фторфенил)метил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ацетамид, (236)
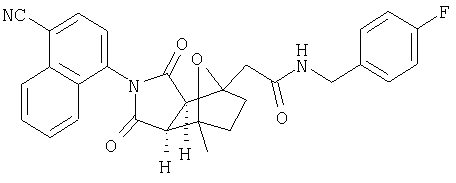
Соединение 234В (0.100 г, 0.256 ммоль) растворяют в ацетонитриле (4.0 мл). Затем добавляют НОАс (0.035 г, 0.256 ммоль) и DCC (0.049 г, 0.256 ммоль) и -4-фторбензиламин (0.030 мл, 0.256 ммоль). Через 4 часа при 25°С реакционную массу концентрируют в вакууме и очищают с помощью препаративной HPLC (YMC S5 ODS 20×100 мм, 10-90% водный метанол в течение более 15 минут, содержащим 0.1% TFA, 20 мл/минут, контролирование при 220 нм), что дает 0.085 г соединения 236 в виде твердого вещества белого цвета. HPLC: 100% в течение 3.277 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 498.43 [M+H]+.
Пример 237
(3аα,4β,7β,7аα)-N-[2-[2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]-4-фторбензамид. (237В)
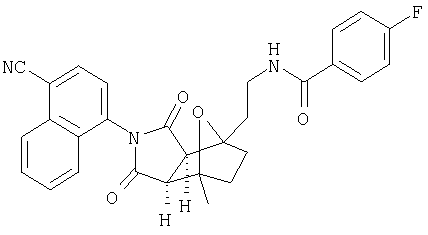
А. 4-Фтор-N-[2-(5-метил-2-фуранил)этил]бензамид (237А)

4-Фторфенилацетилхлорид (0.29 мл, 2.44 ммоль) добавляют по каплям к раствору В-(5-метил-2-фуранил)этанамина (300 мг, 2.44 ммоль, получен в соответствии со способом Yur'ev, Yu.К. Et. Al. J. Gen. Chem. USSR (Engl. Transl.) 33, 3444-8 (1963)) в ТГФ (2.5 мл) при комнатной температуре, затем добавляют по каплям Et3N (0.34 мл, 2.44 ммоль). Когда первоначальный продукт весь вступает в реакцию, как явно определяется с помощью HPLC, реакционную массу захолаживают H2O и экстрагируют CH2Cl2. Объединенные органические слои сушат над MgSO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии, элюируя 0%-50% EtOAc/гексананом градиентом, дает 523 мг (95%) соединения 237А в виде твердого вещества белого цвета. HPLC: 99% в течение 2.84 минут (время удержания) (Phenomenex-prime S5-C18 колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 248.15 [М+Н]+.
В. (3аα,4β,7β,7аα)-N-[2-[2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]-4-фторбензамид, (237В)
Раствор соединения 237А (221.5 мг, 0.896 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрила (222.4 мг, 0.896 ммоль) в бензоле (4 мл) нагревают при температуре 60°С в течение ночи. Реакционную смесь концентрируют при пониженном давлении и растворяют в EtOAc (30 мл). Добавляют 10% Pd/C (50 мг) и смесь перемешивают в атмофере балонного водорода в течение ночи. Реакционную смесь отфильтровывают через подушку из целита и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии, элюируя 25%-75% EtOAc/гексановым градиентом, дает 160.3 мг (36%) соединения 237В в виде твердого вещества грязно-белого цвета. HPLC: 97% в течение 3.13; 3.23 минут (время удержания) (Phenomenex-prime S5-C18 колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е' 498.11 [М+Н].
Пример 238
[3аR-((3аα,4β,7β,7аα)-4-[Октагидро-4-[2-гидроксиэтил)-7-метил-13-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3aS-(3aα,4β,7β,7aα)]-4-[Октагидро-4-[2-гидрокситил-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил. (238i и 238ii)
Рацемическое соединение 223В разделяют на его энатиомеры с помощью препаративной хиральной HPLC (CHIRALPAK AD 5×50 см колонка, элюируя 20% MeOH/EtOH (1:1) гептаном (изократик) при 50 мл/минут, @ 220 нм), что дает быстро элюируемое соединение 238i (хиральная HPLC: 13.54 минут; CHIRALPAK AD 4.6×250 мм колонка, элюируя 20% MeOH/EtOH (1:1) в гептане при 1 мл/минута) и медленно элюируемое соединение 238ii (хиральная HPLC: 14.99 минут; CHIRALPAK AD 4.6×250 мм колонка, элюируя 20% MeOH/EtOH (1:1) гептаном при 1 мл/минута). Абсолютную конфигурацию соединений 238i и 238ii не устанавливают. Для простоты номенклатуры соединение 238i обозначено в настоящем изобретении как имеющие "R" конфигурацию и соединение 238ii изобретения как имеющее "S" конфигурацию. Энатиометрно чистые продукты, полученные из соединения 238i, обозначены в настоящем изобретении как имеющие "R" конфигурацию и энатиометрно чистые продукты, полученные из соединения 238ii обозначены в настоящем изобретении как имеющие "S" конфигурацию.
Пример 239
[3аR-((3аα,4β,7β,7аα)-4-[2-(3-Фторфенокси)этил)октагидро-7метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3aS-(3aα,4β,7β,7aα)]-4-[4-[2-(3-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (239i и 239ii)
К раствору трифенилфосфина (0.0524 г, 0.20 ммоль) в ТГФ (2.0 мл) добавляют DBAD (0.046 г, 0.2 ммоль). Через 10 минут добавляют 3-фторфенол (0.018 мл, 0.2 ммоль). Еще через 10 минут добавляют энатиомерно чистое соединение 238i (0.050 г, 0.133 ммоль). Через 3 часа при 25°С реакционную массу концентрируют в вакууме и очищают с помощью препаративной HPLC (YMC S5 ODS 20×100 мм, 10-90% водным раствором метанола в течение более 15 минут, содержащим 0.2% TFA, 20 мл/минут, контролирование при 220 нм), что дает 0.031 г соединения 239i в виде твердого вещества белого цвета. Этот процесс повторяют с энатиомерно чистым соединением 238ii, что дает соединение 239ii. Соединение 239i: HPLC: 100% в течение 3.80 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 471.65 [M+H]+, [α]D 25=-47.371 (с=4.412 мг/см3, СН2Cl2). Соединение 239ii: HPLC: 100% в течение 3.80 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 471.65 [М+Н]+, [α]D 25=+24.3 (с=4.165 мг/см3, СН2Cl2).
Пример 240
(4-Фторфенил)карбаминовой кислоты, 2-[(3aα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир, (240)
Соединение 223В (0.100 г, 0.279 ммоль) растворяют в дихлорэтане (3.0 мл) и добавляют 4-фторфенилизоцианат (0.048 мл, 0.419 ммоль), затем нагревают до температуры 60°С. Через 2 часа реакционную массу охлаждают до температуры 25°С и разбавляют хлористым метиленом. Смесь промывают один раз насыщенный раствором бикарбоната натрия (20 мл) и затем органику сушат над безводным сульфатом натрия. Сырой продукт очищают с помощью флеш хроматографии на диоксиде кремния, элюируя 15% ацетоном в хлорформе, что дает 0.098 г соединения 240 в виде пены желтого цвета. HPLC: 98% в течение 3.320 и 3.457 минут (атропные изомеры) (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 514.13 [M+H]+.
Пример 241
(3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (241D)
А. 2-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]фуран (241А)
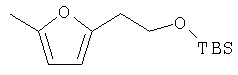
2-(2-Гидроксиэтил)фуран (1.00 г, 8.93 ммоль. Пример 255А) растворяют в ДМФА при температуре 25°С и добавляют имидазол (0.790 г, 11.61 ммоль). Затем порциям добавляют TBSCl (1.35 г, 8.93 ммоль) в течение более 5 минут. Через 2 часа реакционную массу выливают в диэтиловый эфир (300 мл) и промывают последовательно водой (1×100 мл), 1N HCl (1×100 мл) и рассолом (1×100 мл). Объединенную органику затем сушат над сульфатом магния и концентрируют в вакууме. Соединение 241А выделяют в виде бесцветного масла (1.77 г) и используют без очистки. HPLC: 100% в течение 4.233 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
В. (3аα,4β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-1,3,3a,4,7,7a-гексагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (241В)
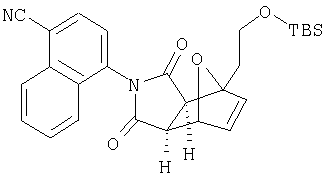
4-(2,5-Дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрил (0.721 г, 3.40 ммоль) суспендируют в бензоле (5.0 мл) в герметично закрытой трубке и добавляют соединение 241А (1.00 г, 4.42 ммоль). Реакционную массу нагревают при температуре 60°С в течение 16 часов, а затем охлаждают до температуры 25°С. Бензол удаляют в вакууме, что дает твердое вещество желтого цвета. Сырой продукт очищают с помощью флеш хроматографии на диоксиде кремния, элюируя 1-5% ацетоном в хлорформе, что дает 1.37 г соединения 241В в виде твердого вещества желтого цвета. ЯМР данные подтверждают эксоконфигурацию изомера. HPLC: 100% в течение 4.030 и 4.110 (атропные изомеры) минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм).
С. (3аα,4β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (241С)
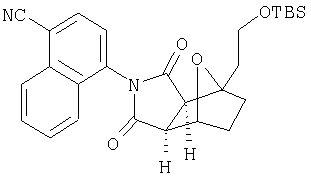
Соединение 241В (0.500 г, 1.14 ммоль) растворяют в этилацетате (40 мл) и добавляют Pd/C (10% Pd, 0.200 г). Затем вводят водород из баллона. Через 4 часа реакционную массу отфильтровывают через целит, промывают этилацетатом и концентрируют в вакууме, что дает твердое вещество светло-желтого цвета, которое очищают с помощью флеш хроматографии на силикагеле, элюируя ацетоном/хлорформом (0%-1.5%-3% ацетон), что дает соединение 241С (0.450 г) в виде пены желтого цвета.
D. (3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-1,3-Диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (241D)
Соединение 241С (0.283 г, 0.50 ммоль) растворяют в растворе 2% 12N HCl в абсолютном этаноле (10 мл). Через час реакционную массу захолаживают насыщенным раствором бикарбоната натрия и экстрагируют хлористым метиленом (4×20 мл). Объединенную органику сушат над сульфатом натрия и концентрируют в вакууме, что дает 0.211 г соединения 241D в виде твердого вещества белого цвета. HPLC: 100% в течение 2.14 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водный метанол в течение более чем 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 363.45
Пример 242
(3аα,4β,6β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]октагидро-6-гидрокси-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (242C)
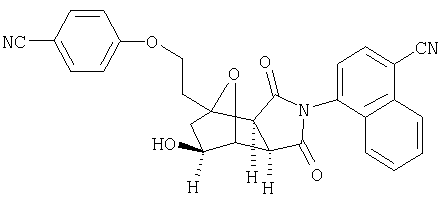
А. (3аα,4β,6β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-6-гидрокси-13-диоксо-4,7-эпокси-2н-изоиндол-2-ил]-1-нафталинкарбонитрил (242А)
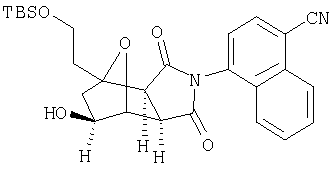
Соединение 241В (1.00 г, 2.28 ммоль) и катализатор Вилкинсона (0.105 г, 0.114 ммоль) быстро перемешивают в вакууме при 25°С в течение часа и затем продувают N2. После этого добавляют ТГФ (30 мл), а затем, после того как олефин полностью растворят - катехол борана (0.487 мл, 4.57 ммоль). Через час реакционную массу охлаждают до температуры 0°С и добавляют фосфатный буфер с pH 7.2 (33 мл), а затем EtOH (13 мл) и Н2O2 (30% раствор, 3.0 г). Через 3 часа при 0°С реакцию завершают с помощью LC и смесь экстрагируют хлористым метиленом (3×50 мл). Объединенную органику промывают 1:1 смесью 10% сульфата натрия/1N NaOH (50 мл) и один раз рассолом (50 мл). Все водные фазы объединяют и экстрагируют хлористым метиленом (50 мл) и органическую фазу объединяют с предыдущими выделениями. Затем органику сушат над безводным сульфатом натрия и концентрируют в вакууме. Сырой продукт очищают с помощью флеш хроматографии на диоксиде кремния, элюируя 10-20% ацетоном в хлорформе, что дает 0.634 г соединения 242А в виде белой пены. HPLC: 96% в течение 3.797 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 493.13 [М+Н]+.
В. (3аα,4β,6β,7β,7аα)-4-[Октагидро-6-гидрокси-4-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (242В)

Соединение 242А (0.400 г, 0.813 ммоль) растворяют в растворе 2% 12N HCl в абсолютном этаноле (10 мл). Через час реакционную массу захолаживают насыщенным раствором бикарбоната натрия и экстрагируют EtOAc (4×20 мл). Объединенную органику сушат над сульфатом натрия и концентрируют в вакууме, что дает 0.305 г соединения 242В в виде твердого вещества белого цвета. HPLC: 90% в течение 2.043 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 379.09 [М+Н]+.
С. (3аα,4β,5β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]октагидро-6-гидрокси-13-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (242С)
К раствору трифенилфосфина (0.054 г, 0.207 ммоль) в ТГФ (2.0 мл) добавляют DBAD (0.048 г, 0.207 ммоль). Через 10 минут добавляют 4-цианофенол (0.025 г, 0.207 ммоль). Еще через 10 минут добавляют соединение 242В (0.050 г, 0.138 ммоль). Через 3 часа при 25°С реакционную массу концентрируют в вакууме и очищают с помощью препаративной TLC на диоксиде кремния, элюируя 25% ацетоном/хлорформом, что дает 0.056 г соединения 242С в виде твердого вещества белого цвета. HPLC: 90% в течение 2.987 минут (время удержания) (VMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 480.10 [М+Н]+.
Пример 243
[3aS-(3аα,4β,5β,7β,7аα)-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3аR-(3аα,4β,5β,7β,7аα)-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (243Di и 243Dii)
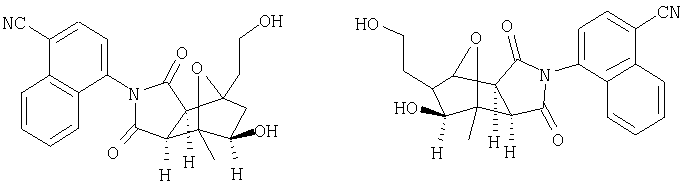
А. (3аα,4β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-1,3,3а,4,7,7а-гексагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (243А)
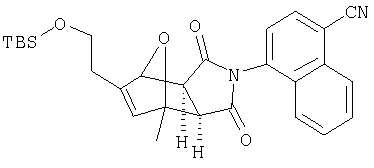
4-(2,5-Дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрил (18.3 г, 68.7 ммоль) добавляют к раствору соединения 204А (26.6 г, 110.6 ммоль) в бензоле (75 мл) и нагревают до температуры 60°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. Остаток обрабатывают МеОН (250 мл) с перемешиванием при температуре 0°С в течение 10 минут. Полученное твердое вещество отфильтровывают, промывают холодным МеОН (2×10 мл) и сушат, что дает 26.7 г (79.5%) соединения 243А в виде твердого вещества желтого цвета. HPLC анализ описанного выше твердого вещество показывает то, что оно имеет 95% чистоту (HPLC условия: 95% в течение 2.48 минут (Phenomenex-prime S5-C18 колонка, 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм)). Фильтрат затем концентрируют при пониженном давлении и полученное твердое вещество хроматографируют, элюируя 3% ацетоном/CHCl3, что дает дополнительно 4.36 г соединения 243А (13%), получая общий конечный выход 92.5%.
В. (3аα,4β,5β,7β,7аα)-4-[7-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (243В)
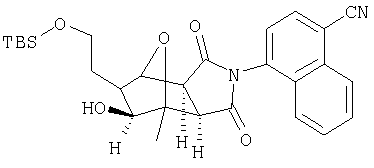
Смесь 243А (10 г, 20.46 ммоль) и RhCl(PPh3)3 (0.947 мг, 1.02 ммоль) вакуумируют и заполняют аргоном (3×). Добавляют ТГФ (200 мл) и одновременно растворяют все мелкие частицы, затем медленно добавляют по каплям катехолборан (4.4 мл, 40.93 ммоль). Когда формирование продукта закончится, как определяют с помощью HPLC, реакционную смесь охлаждают до температуры 0°С и захолаживают фосфатным буфером (330 мл, pH 7.2), затем добавляют EtOH (130 мл) и Н2О2 (300 мл, 30% раствор). После того как боронат вступит в реакцию, смесь экстрагируют СН2Cl2 (3×) и объединенные органические слои промывают 1N NaOH, 10% водным раствором NaHSO3 (1:1, 1×) и рассолом (1×). Объединенные промывные воды экстрагируют СН2Cl2 (1×) и объединенные органические слои сушат над Na2SO4. Очистка с помощью флеш хроматографии на силикагеле, элюируя от 10% до 30% ацетоном/CHCl3 градиентом более чем 25 минут, дает 7.1 г (68%) 243В в виде твердого вещества светло-желтого цвета. HPLC условия: 98% в течение 3.82 минут (Phenomenex-prime S5-C18 колонка 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм).
С. [3аR-(3аα,4β,5β,7β,7аα)-4-[7-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3аS-(3аα,4β,5β,7β,7аα)-4-[7-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (243Ci и 243Сii)
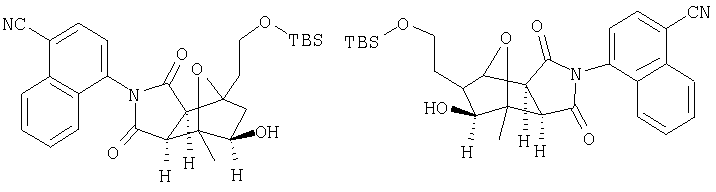
Рацемическое соединение 243В разделяют на отдельные энатиомеры с помощью хиральной жидкостной хроматографии с нормальной фазой. Используют Chiralpak OD колонку (50×500 мм), элюируя 13% EtOH/гексаном в течение более чем 99 минут при 50 мл/минут, определенный при 220 им. Быстро элюируемое изомерное соединение 243Ci имеет время удержания = 45 минут и медленно элюируемое изомерное соединение 243Cii имеет время удержания = 66 минут.
D. [3аS-(3аα,4β,5β,7β,7аα)-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3aR-(3аα,4β,5β,7β,7аα)-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (243Di и 243Dii)
Соединение 243Ci (0.84 г, 2.14 ммоль) растворяют в 2% 12N HCl/EtOH (20 мл). перемешивают в течение 5 минут и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 5-10% MeOH/CH2Cl2 дает 0.57 г (88%) 243Di. Соединение 243Di, которое появилось как быстро элюируемый изомер (243Ci), с энантиомерным избытком 99.7%, как определяют с помощью аналитической хиральной хроматографии с нормальной фазой. HPLC условия: 99.7% в течение 2.17 минут (Chiralcel OJ 44.6×250 мм, 10 микрон, 40°С, изократик 80% гептан/20% EtOH/МеОН (1:1), 1.0 мл/минут, определенный при 288 нм).
Соединение 243Cii (0.86 г, 2.19 ммоль) растворяют в 2% 12N HCl/EtOH (20 мл), перемешивают в течение 5 минут и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 5-10% MeOH/CH2Cl2 дает 0.60 г (90%) 243Dii. Соединение 243Dii, которое появляется как медленно элюируемый изомер (243Cii), появляется с энантиомерным избытком 87.1%, как определяют с помощью аналитической хиральной хроматографии с нормальной фазой. HPLC условия: 87.1% в течение 18.4 минут (Chiralcel OJ 44.6×250 мм, 10 микрон, 40°С, изократик 80% гептан/20% EtOH/МеОН (1:1), 1.0 мл/минут, определенный при 288 нм).
Абсолютные конфигурации для соединений 243Di и 243DH не определяют. Для простоты номенклатуры соединение 243Di обозначено в настоящем изобретении как имеющее "S" конфигурацию и соединение 243Dii в настоящем изобретении как имеющее "R" конфигурацию. Энатиометрно чистые продукты, полученные из соединения 243Di, обозначены в настоящем изобретении как имеющие "S" конфигурацию и энатиометрно чистые продукты, полученные из соединения 243Dii, обозначены в настоящем изобретении как имеющие "R" конфигурацию.
Пример 244
[3аS-(3аα,4β,5β,7β,7аα)-4-[7-[2-(4-Цианофенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3aR-((3аα,4β,5β,7β,7аα)-4-[7-[2-[4-Цианофенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (244! и 244ii)
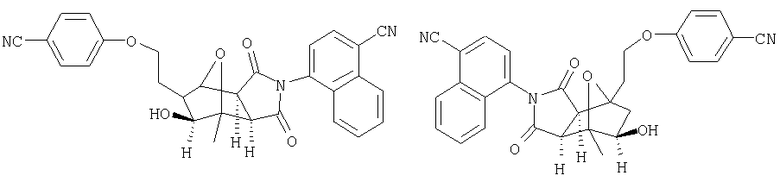
DBAD (26 мг, 0.115 ммоль) добавляют к раствору PPh3 (30 мг, 0.115 ммоль) в ТГФ (0.65 мл). После перемешивания в течение 10 минут добавляют 4-цианофенол (13.6 мг, 0.115 ммоль) и реакционную смесь перемешивают в течение дальнейших 5 минут. Добавляют соединение 243Di (30 мг, 0.076 ммоль) и смесь перемешивают при комнатной температуре в течение часа. Реакционную массу концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 30% ацетоном/70% CHCl3, дает 23.1 мг (0.047 ммоль, 61.7%) соединения 244i. HPLC условия: 95% в течение 3.06 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минуты градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (ЕС): м/е 494.09 [М+Н]+. [α]D=53.30°, С=4.5 мг/см3 в ТГФ, @ 589 нм)
DBAD (26 мг, 0.115 ммоль) добавляют к раствору PPh3 (30 мг, 0.115 ммоль) в ТГФ (0.65 мл). После перемешивания в течение 10 минут добавляют 4-цианофенол (13.6 мг, 0.115 ммоль) и реакционную смесь перемешивают в течение дальнейших 5 минут. Добавляют соединение 243Dii (30 мг, 0.076 ммоль) и смесь перемешивают при комнатной температуре в течение часа. Реакционную массу концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 30% ацетоном/70% CHCl3, дает 20.3 мг (0.041 ммоль, 54.2%) соединения 244ii. HPLC условия: 90% в течение 3.07 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (ЕС): м/е 494.09 [М+Н]. [α]D=-42.87°, С=6.6 мг/см3 в ТГФ, @ 589 нм)
Пример 245
(3аα,4β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]-7-этилоктагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил. (245D)
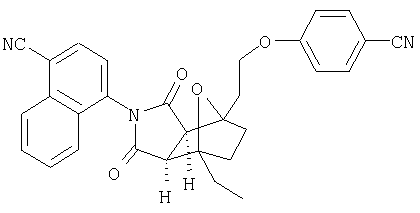
А. 2-Этил-5-(2-гидроксиэтил)фуран (245А)
н-BuLi (2.5 М в гексане, 4.4 мл, 11 ммоль) добавляют к раствору 2-этилфурана (1.05 мл, 10 ммоль) в ТГФ (10 мл) при температуре -25°С. Раствор нагревают при комнатной температуре и перемешивают в течение 3 часов. Этиленоксид (0.75 мл) добавляют при температуре -78°С. Реакционную массу перемешивают в течение 0.5 часов при температуре -15°С и в течение ночи при комнатной температуре. Добавляют насыщенный водный раствор NH4Cl и смесь экстрагируют эфиром (3×). Объединенные экстракты промывают водой (1×) и рассолом (1×) и сушат над Na2SO4. Очистка с помощью флеш хроматографии на силикагеле, элюируя 30% EtOAc/70% гексаном, дает 1.12 г (8.02 ммоль, 80.2%) соединения 245 А в виде масла желтого цвета.
В. (3аα,4β,7β,7аα)-4-[4-Этил-1,3,3а,4,7,7а-гексагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (245В)
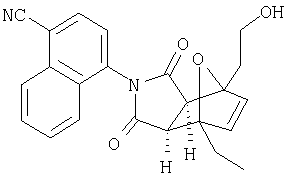
Раствор соединения 245А (280 мг, 2.00 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрила (496 мг, 2.00 ммоль) в бензоле (2 мл) перемешивают при температуре 60°С в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении. Твердое вещество желтого цвета, соединение 245В, используют непосредственно на следующем этапе.
С. (3аα,4β,7β,7аα)-4-[4-Этилоктагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (245С)
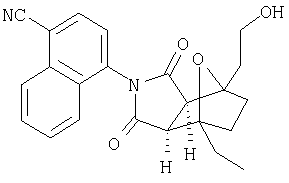
Смесь соединения 245В (764 мг, 1.97 ммоль) и 10% Pd/C (115 мг, каталитическое количество) в EtOAc (36 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 2 часов. Реакционную смесь отфильтровывают через целит и концентрируют при пониженном давлении, что дает 779 мг сырого соединения 245С. Очистка этого сырого продукта с помощью флеш хроматографии на силикагеле, элюируя 70% EtOAc/30% гексаном, дает 235 мг (0.6 ммоль, 30.1%) соединения 245С. HPLC условия: 99% в течение 2.84 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (EC): м/е 391.12 [М+Н]+.
D. (3аα,4β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]-7-этилоктагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (245D)
DBAD (44.2 мг, 0.192 ммоль) добавляют к раствору PPh3 (50.4 мг, 0.192 ммоль) в ТГФ (1 мл). После перемешивания в течение 10 минут добавляют 4-цианофенол (23 мг, 0.192 ммоль) и реакционную смесь перемешивают в течение дополнительных 5 минут. Добавляют соединение 245С (50 мг, 0.128 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную массу концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 40% EtOAc/60% гексаном, дает 43 мг (0.087 ммоль, 68.4%) соединения 245D в виде твердого вещества белого цвета. HPLC условия: 99% в течение 3.65 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минутного градиента с 0.2% Н3PO4, определенный при 220 нм). MS (ЕС): м/е 492.16 [М+Н]+.
Пример 246
(3аα,4β,7β,7аα)-4-[2-(Ацетилокси)этил]-2-(4-циано-1-нафталинил)гексагидро-7-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион, (246)
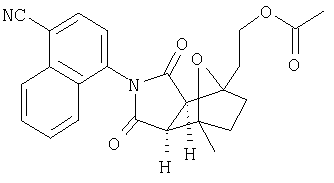
Соединение 223В (0.100 г, 0.279 ммоль) растворяют в хлористом метилене (3.0 мл) при 25°С и пиридине (0.071 мл, 0.837 ммоль) и добавляют 4-DMAP (1.0 мг). Затем добавляют уксусный ангидрид (0.053 мл, 0.559 ммоль) и реакционную массу перемешивают в течение 20 часов при 25°С. Через 20 часов добавляют насыщенный раствор бикарбоната натрия и реакционную массу еще перемешивают в течение 30 минут. Затем смесь экстрагируют хлористым метиленом (2×20 мл). После чего органику промывают один раз 1N HCl (10 мл), а затем сушат над безводным сульфатом натрия. После концентрация в вакууме сырой продукт очищают с помощью препаративной TLC на диоксиде кремния, элюируя 12% ацетона в хлорформе, что дает 0.073 г соединения 246 в виде пены желтого цвета. HPLC: 95% в течение 2.837 и 3.027 минут (атропные изомеры) (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 441.10 [M+Na]+.
Пример 247
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-(2-оксоэтил)-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (247)
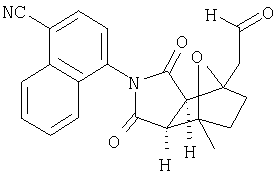
Оксалилхлорид (2.0 М раствор, 1.73 мл, 3.5 ммоль) добавляют к сухому хлористому метилену (10 мл) и охлаждают до температуры -78°С. Затем добавляют по каплям ДМСО (0.283 мл, 3.99 ммоль) при этом выдиляется газ. Через 15 минут добавляют соединение 223В (1.00 г, 2.66 ммоль) в хлористом метилене (10 мл). Через 15 минут добавляют TEA (1.10 мл, 7.98 ммоль) и реакционную массу медленно нагревают до температуры 25°С. Затем добавляют воду (30 мл) и смесь разбавляют хлористым метиленом (100 мл). Органику промывают один раз 1N HCl (30 мл), один раз водой (30 мл) и один раз рассолом (30 мл), а затем сушат над безводным сульфатом натрия. Сырой продукт выделяют концентрацией в вакууме, что дает соединение 247 в виде оранжевой пены. Сырое соединение 247 используют непосредственно на следующей стадии. HPLC: 100% в течение 2.70 минут (время удержания) (YMC 85 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 483.65
Пример 248
[3аα,4β(Е),7α,7аα]-4-[4-[3-(4-Цианофенил)-2-пропенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3aα,4β(E),7α,7aα]-4-[4-[3-(4-Цианофенил)-2-пропенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (248i и 248ii)

(4-цианобензил)-трифенилфосфоний хлорид (0.072 г, 0.174 ммоль) суспендируют в ТГФ (2.0 мл) и охлаждают до температуры 0°С. Затем добавляют по каплям н-BuLi (1.6 М раствор, 0.092 мл, 0.147 ммоль), получая гомогенный раствор. Раствор нагревают до температуры 25°С в течение 15 минут, а затем охлаждают до температуры 0°С. Затем добавляют соединение 247 (0.050 г, 0.134 ммоль) в ТГФ. Через час реакционную массу захолаживают насыщенным раствором хлорида аммония, а затем экстрагируют хлористым метиленом (3×20 мл). Объединенную органику сушат над безводным сульфатом натрия, а затем концентрируют в вакууме. Сырой продукт очищают с помощью препаративной TLC, элюируя 5% ацетоном в хлорформе, что дает 0.010 г смеси соединений 248i и 248ii в виде твердого вещества белого цвета. Смесь 1:1 изомерных олефинов Е и Z определена с помощью ЯМР спектроскопии. HPLC: 100% в течение 3.517 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 474.2
Пример 249
(3аα,4β,7β,7аα)-4-|4-[3-(4-Цианофенил)пропил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (249)
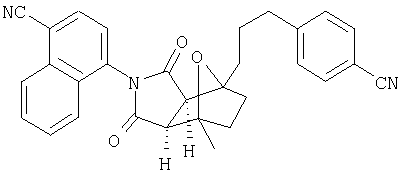
Смесь соединений 248i и 248ii (0.008 г, 0.017 ммоль) растворяют в EtOH (3.0 мл) и добавляют Pd/C (10% Pd, 0.008 г). Затем вводят H2 из баллона. Через 18 часов реакционную массу отфильтровывают через целит, элюируя EtOAc, затем концентрируют в вакууме. Соединение 249 выделяют в виде твердого вещества белого цвета (0.007 г). HPLC: 90% в течение 3.520 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 476.13 [М+Н]+.
Пример 250
(3аα,4β,7β,7аα)-4-[4-[2-[(6-Хлор-1,2-бензизоксазол-3-ил)окси]этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (250)
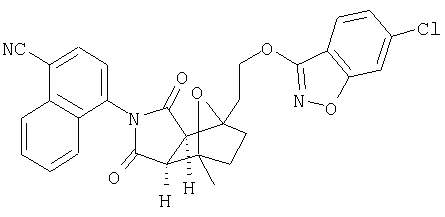
К раствору PPh3 (52 мг, 0.20 ммоль) в 0.5 мл ТГФ добавляют DBAD (46 мг, 0.20 ммоль) одной порцией в виде твердого вещества. Полученную смесь перемешивают в течение 10 минут, перед тем как добавить 6-хлор-3-гидрокси-1,2-бензизоксазол (34 мг, 0.20 ммоль). Перемешивание продолжают в течение 10 минут, перед тем как раствор соединения 223В (50 мг, 0.13 ммоль) в 0.5 мл ТГФ вводят через канюлю. Полученную смесь перемешивают при температуре окружающей среды в течение 24 часов, концентрируют и очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм колонка, элюируя 30-100% водный раствор МеОН, содержит 0.1% TFA в течение более чем 10 минут при 20 мл/минут), что дает твердое вещество белого цвета. Полученные твердые вещества растворяют в CH2Cl2, промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют, что дает 50 мг (71%) соединения 250 в виде бесцветного масла. HPLC: 26% в течение 3.89 минут и 74% в течение 4.02 минут (смесь атромизомеров, время удержания) (YMC S5 ODS колонка 4.6×50 мм Ballistic, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% Н3PO4, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 528.4 [М+H]+.
Пример 251
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[2-[(6-нитро-1Н-индазол-3-ил)окси]этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (251)
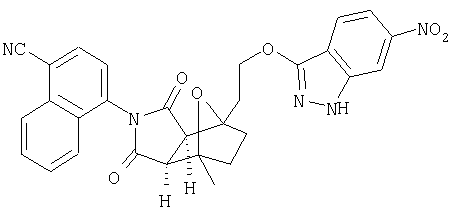
К раствору соединения 223В (50 мг, 0.13 ммоль) в толуоле (1 мл) добавляют ADDP (50 мг, 0.20 ммоль), 6-нитро-3-индазолинон (36 мг, 0.20 ммоль) и н-Bu3Р (50 мкл, 0.2 ммоль). Полученную смесь нагревают до температуры 80°С в течение 24 часов, концентрируют и очищают с помощью комбинационной препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм колонка, элюируя 30-100% водный раствор МеОН, содержит 0.1% TFA в течение более чем 10 минут при 20 мл/минут) и флеш хроматографии (силикагель, 25% ацетон в CHCl3), что дает 17 мг (25%) соединения 251 в виде твердого вещества желтого цвета. HPLC: 24% в течение 3.60 минут и 76% в течение 3.74 минут (смесь атромизомеров, время удержания) (YMC S5 ODS колонка 4.6×50 мм Ballistic, 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% Н3PO4, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 537.6 [М+Н]+.
Пример 252
[3аS-(3аα,4β,5β,7β,7аα)]-4-[7-[2-(1,2-Бензизоксазол-3-илокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (252)
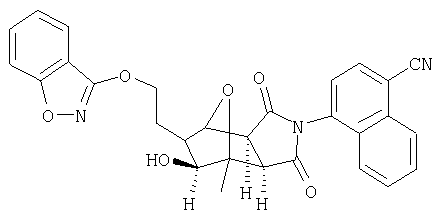
PPh3 (47 мг, 0.18 ммоль), DBAD (41 мг, 0.18 ммоль), 3-гидрокси-1,2-бензизоксазол (24 мг, 0.18 ммоль) и соединение 243Di (35 мг, 0.09 ммоль) реагируют в соответствии со способом, описанным для получения соединения 250. Очистка достигнута с помощью HPLC с обращенной фазой (YMC S5 ODS 20×100 мм колонка, элюируя 30-100% водный раствор МеОН, содержит 0.1% TFA в течение более чем 10 минут при 20 мл/минут), что дает твердое вещество белого цвета. Полученные твердые вещества растворяют в CH2Cl2, промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют, что дает 29 мг (64%) соединения 252 в виде бесцветного масла. HPLC: 96% в течение 3.29 минут (смесь атромизомеров, время удержания) (YMC S5 ODS колонка 4.6×50 мм Ballistic, 0-100% водным раствором метанола в течение более 4 минут, содержащим 0.2% Н3PO4, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 510.2 [М+Н]+.
Пример 253
[3aR-(3aα,4β,5β,7β,7аα)]-4-[7-[2-(1,2-Бензизоксазол-3-илокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (253)
PPh3 (47 мг, 0.18 ммоль), DBAD (41 мг, 0.18 ммоль), 3-гидрокси-1,2-бензизоксазол (24 мг, 0.18 ммоль) и соединение 243DH (35 мг, 0.09 ммоль) реагируют в соответствии со способом, описанным для получения соединения 250. Очистка достигнута с помощью HPLC с обращенной фазой (YMC S5 ODS 20×100 мм колонка, элюируя 30-100% водный раствор МеОН, содержит 0.1% TFA в течение более чем 10 минут при 20 мл/минут), что дает твердое вещество белого цвета. Полученные твердые вещества растворяют в CH2Cl2, промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют, что дает 23 мг (51%) соединения 253 в виде бесцветного масла. HPLC: 95% в течение 3.29 минут (смесь атромизомеров, время удержания) (YMC S5 ODS колонка 4.6×50 мм Ballistic, 0-100% водным раствором метанола в течение более 4 минут, содержащим 0.2% НзР04, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 510.4 [М+Н]+.
Пример 254
(3аα,4β,5β,7β,7аα)]-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил; ((3аα,4β,5β,7β,7аα)]-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил, (254i и 254ii)
Рацемическое соединение 221В разделяют на энатиомеры с помощью препаративной хиральной HPLC (CHIRALPAK AD 5×50 см колонка, элюируя 20% MeOH/EtOH (1:1) в гептане (изократик) при 50 мл/минут), что дает быстро элюируемое соединение 254i (хиральная HPLC: 10.02 минут; CHIRALPAK AD 4.6×250 мм колонка, элюируя 20% MeOH/EtOH (1:1) в гептане при 1 мл/минут) и медленно элюируемое 254ii (хиральная HPLC: 14.74 минут; CHIRALPAK AD 4.6×250 мм колонка, элюируя 20% MeOH/EtOH (1:1) в гептане при 1 мл/минута).
Пример 255
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-1,3-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил; (3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-1,3-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил, (255Hi и 255Нii)
А 2-(2-Гидроксиэтил)фуран (255А)
2-(2-Гидроксиэтил)фуран получают в соответствии с следующими способами, приведенными в ссылках: Harmata, M, et al. J. Org. Chem. 60, 5077-5092 (1995). К раствору фурана (8 мл, 1 10 ммоль) в 100 мл ТГФ при температуре -78°С добавляют H-BuLi (2.5 M в гексане, 44 мл, 1 10 ммоль). Раствор перемешивают при температуре 0°С в течение 4 часов, а затем добавляют этиленоксид (7.5 мл) при температуре -78°С. Реакционную смесь перемешивают при температуре -15°С в течение часа, а затем в течение ночи при комнатной температуре. Реакционную массу захолаживают насыщенным водным раствором NH4Cl и экстрагируют эфиром (3×). Объединенные экстракты промывают водой (1×) и рассолом (1×). Раствор эфира сушат над Na2SO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 40% EtOAc/60% гексаном, дает 5.4 г (48.2 ммоль, 43.8%) соединения 255А в виде масла светло-коричневого цвета.
В. 2-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]фуран (255В)
Имидазол (3.65 г, 53.6 ммоль) и TBSC1 (6.47 г, 42.9 ммоль) добавляют к раствору соединения 255А (4.00 г, 35.7 ммоль) в 50 мл ДМФА. Смесь перемешивают при комнатной температуре в течение 2 часов, а затем реакционную смесь выливают в эфир. Раствор эфира промывают водой (1×), 1N HCl (1×), водой (1×) и рассолом (1×). Органический слой сушат над Na2SO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 30% СН2Cl2/70% гексаном, дает 7.4 г (32.7 ммоль, 9 1.7%) 255В в виде бесцветного масла.
С. 2-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-5-(2-гидроксиэтил)фуран (255С)
r-BuLi (1.2 М в пентане, 10 мл, 16.99 ммоль) добавляют по каплям к перемешиваемому раствору 255В (3.49 г, 15.44 ммоль) в 13 мл ТГФ при температуре -78°С. Смесь перемешивают еще в течение 4 часов при 0°С. В реакционный раствор добавляют этиленоксид (1.05 мл) при температуре -78°С. Смесь нагревают до комнатной температуры и перемешивают в течение ночи. Добавляют насыщенный водный раствор NH4Cl и большую часть ТГФ удаляют при пониженном давлении. Смесь экстрагируют эфиром (3×) и объединенные органические слои промывают водой (1×), рассолом (1×) и сушат над Na2SO4. Очистка с помощью флеш хроматографии на силикагеле, элюируя 5% EtOAc/95% СН2Cl2 дает 2.8 г (10.4 ммоль, 67%) соединения 255С в виде масла желтого цвета.
D. 2-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-5-[2-(фенилметокси)этил]фуран (255D)
Спирт 255С (1.00 г, 3.7 ммоль) в 12 мл ТГФ обрабатывают 60% NaH (177.8 мг, 4.44 ммоль), бензилбромидом (0.53 мл, 4.44 ммоль) и тетрабутиламмоний иодидом (50 мг, 5%) в течение 3 часов при комнатной температуре. Добавляют воду и смесь экстрагируют EtOAc (3×). Объединенные экстракты промывают водой (1×) и рассолом (1×) и сушат над Na2SO4. Очистка с помощью флеш хроматографии на силикагеле, элюируя 20% гексаном/80% СН2Cl2 дает 1.10 г (3.05 ммоль, 82.6%) соединения 255D в виде масла желтого цвета.
Е. 2-(2-Гидроксиэтил)-5-[2-(фенилметокси)этил]фуран (255Е)
Тетрабутиламмоний фторид (1.0 М в ТГФ, 3.06 мл, 3.06 ммоль) добавляют к раствору соединения 255D (1.1 г, 3.06 ммоль) в 10 мл ТГФ при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут, захолаживают с помощью насыщенного водного раствора NH4Cl и экстрагируют эфиром (3×). Объединенные экстракты сушат над Na2SO4. Очистка с помощью флеш хроматографии на силикагеле, элюируя 10% EtOAc/90% СН2Cl2 дает 750 мг (3.05 ммоль, 99.6%) соединения 255Е в виде масла светло-желтого цвета.
F. 5-[2-(Фенилметокси)этил]фуран-2-пропаннитрил (255F)
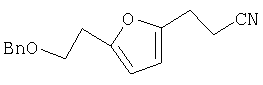
DEAD (1.285 мл, 8.17 ммоль) добавляют к перемешиваемому раствору Ph3P (2.14 г, 8.17 ммоль) в 12 мл сухого ТГФ при 0°С. Раствор перемешивают в течение 30 минут при комнатной температуре и добавляют соединение 255Е (670 мг, 2.72 ммоль). Реакционную массу перемешивают в течение 15 минут и добавляют ацетонцианогидрин (0.745 мл, 8.17 ммоль) при температуре -15°С. Реакционную массу перемешивают в течение 30 минут при температуре -15°С, затем при комнатной температуре в течение ночи. Затем смесь концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 100% CH2Cl2 дает 180 мг (0.705 ммоль, 26%) соединение 255F в виде бесцветного масла.
G. (3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-1,2,3,3а,7,7а-гексагидро-1,3-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил (255G)
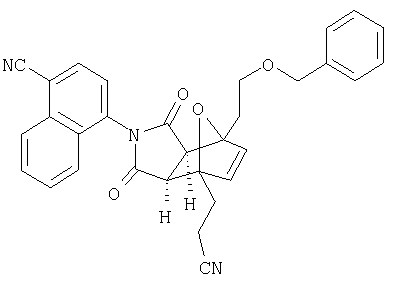
Раствор соединения 255F (180 мг, 0.706 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрила (263 мг, 1.06 ммоль) в CH2Cl2 (3 мл) перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 5% EtOAc/CH2Cl2 дает 318 мг (0.63 ммоль, 89.6%) соединения 255G в виде твердого вещества светло-серого цвета, которое используют непосредственно на следующем этапе.
Н. (3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-1,3-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил; (3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-13-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил (255Hi и 255Hii)
Смесь соединения 255G (318 мг, 0.63 ммоль) и 10% Pd/C (64 мг) в EtOH (10 мл) и EtOAc (5 мл) перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Реакционную смесь отфильтровывают через целит и концентрируют при пониженном давлении, что дает 320 мг сырые соединения 255Hi и 255Hii. Очистка 25 мг этого сырого продукта с помощью флеш хроматографии на силикагеле, элюируя 55% EtOAc/гексаном, дает 6.5 мг (0.013 ммоль, 26% (основанного на 25 мг)) соединение 255Hi и 8.1 мг (0.016 ммоль, 32.4% (основа на 25 мг)) соединение 255Hii. Соединение 255Hi: HPLC условия: 98% в течение 3.57 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм, MS (EC): м/е 506.15 [М+Н]+. Соединение 255Hii: HPLC условия: 98% в течение 3.51 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм), MS (EC): м/е 506.15 [М+Н]+.
Пример 256
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил; (3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил, (256i и 256ii)

Смесь соединений 255Hi и 255Hii (200 мг, 0.396 ммоль) и PdCl2 (8.4 мг, каталитическое количество) в EtOH (1 мл) и EOAc (3 мл) перемешивают в атмосфере водорода (30 пси) при комнатной температуре в течение ночи. Реакционную смесь отфильтровывают через целит и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 5% МеОН/СН2Cl2, затем с помощью второй колонки, элюируя 100% EtOAc, дает 28.9 мг (0.0696 ммоль, 17.6%) соединения 256ii и 26.5 мг (0.0639 ммоль, 16.1%) соединения 256i. Соединение 256ii: HPLC условия: 90% в течение 2.44 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм.), MS (ЕС): м/е 416.11 [М+Н]+. Соединение 256i: HPLC условия: 99% в течение 2.47 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм), MS (EC): м/е 416.11 [M+H]+.
Пример 257
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-7-[2-(4-фторфенокси)этил]октагидро-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил (257)
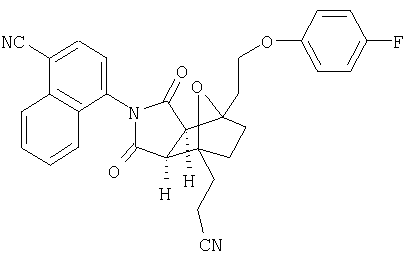
DBAD (15 мг, 0.065 ммоль) добавляют к раствору PPh3 (17 мг, 0.065 ммоль) в ТГФ (0.3 мл). После перемешивания в течение 10 минут добавляют 4-фторфенол (7.33 мг, 0.065 ммоль) и реакционную смесь перемешивают в течение еще 5 минут. Добавляют соединение 256i (18.1 мг, 0.044 ммоль) и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную массу концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 60% EtOAc/30% гексаном, дает 5.9 мг (0.0116 ммоль, 26.34%) соединения 257. HPLC условия: 98% в течение 3.59 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водным раствором метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (ЕС): м/е 510.14 [М+H]+.
Пример 258
(3аα,4β,7β,7аα)-2-(7-Хлор-2,1,3-бензоксадиазол-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (258)
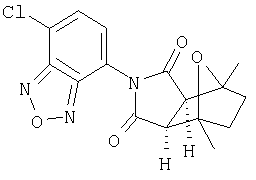
А. 4-Амино-7-хлор-2,1,3-бензоксадиазол (258А)
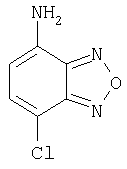
Раствор 1.0 г (5.02 ммоль) 4-хлор-7-нитробензофуразана в 20 мл АсОН, 10 мл EtOAc и 2 мл Н2О нагревают до температуры 50°С и обрабатывают порошком железа (1.4 г, 251 ммоль). Смесь нагревают при температуре 80°С в течение 30 минут, а затем ей дают возможность остыть до комнатной температуры. Смесь отфильтровывают через целит, элюируя EtOAc. Фильтрат промывают насыщенным водным раствором NaHCO3, сушат над MgSO4 и концентрируют, что дает соединение 258А (0.80 г, 94%) в виде твердого вещества красного цвета.
В. (3аα,4β,7β,7аα)-2-(7-Хлор-2,1,3-бензоксадиазол-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (258В)
Соединение 258А (42 мг, 0.25 ммоль) реагирует в герметично закрытой трубке с соединением 20А (73.5 мг, 0.375 ммоль), MgSO4 (75 мг, 0.625 ммоль) и Et3N (170 мкл, 1.25 ммоль) в 250 мкл толуола в соответствии со способом, описанным в примере 208С, что дает после очистки с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водный метанол, содержит 0.1% TFA в течение более чем 12 минут, 20 мл/минут) 23 мг (26%) соединение 258В в виде твердого вещества желтого цвета. HPLC: 97.6% в течение 2.87 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водный метанол, содержит 0.2% фосфорная кислота более чем 4 минут, 4 мл/минут, контролирование при 220 нм), MS (DCl): м/е 347.9 [М]+.
Пример 259
(3аα,4β,7β,7аα)-2-(7-Хлор-2-метил-4-бензофуранил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион. (259).
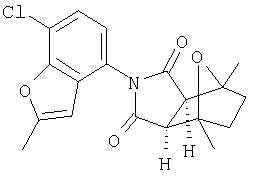
7-Хлор-2-метил-4-бензофуранамин (38 мг, 0.25 ммоль, полученный в соответствии со способом, описанный Enomoto и Takemura в ЕР 0476697 А1) реагирует в герметично закрытой трубке с соединением 20А (73.5 мг, 0.375 ммоль), MgSO4 (75 мг, 0.625 ммоль) и Et3N (170 мкл, 1.25 ммоль) в 250 мкл толуола в соответствии со способом, описанным в примере 208С, что дает после очистки с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100 водный метанол, содержит 0.1% TFA в течение более чем 12 минут, 20 мл/минут), 42 мг (47%) соединения 259 в виде твердого вещества белого цвета. HPLC: 98% в течение 3.45 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (DCl): м/е 359.9 [М]+.
Пример 260
(3аα,4β,7β,7аα)-2-(7-Хлор-2-метилбензо[b]тиофен-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (260)
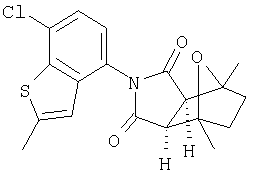
А. 1-Хлор-2-(2-хлораллилсульфанил)-4-нитробензол (260А)
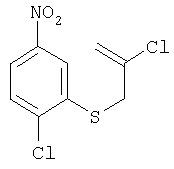
Раствор 2-хлор-5-нитробензолтиола (1.0 г, 5.27 ммоль, полученный в соответствии со способом, описанный Still et. Al., Synth. Comm. 13, 1181 (1983)) в 15 мл ДМФА обрабатывают 2,3-дихлорпропеном (693 мкл, 7.52 ммоль) и К2СО3 (433 мг, 3.13 ммоль). Смесь нагревают при температуре 80°С в течение 2 часов, а затем ей дают возможность остыть до комнатной температуры. Добавляют EtOAc (200 мл) и H2O (100 мл). Органическую фазу промывают Н2О (2×250 мл), насыщенным водным раствором NaCl (100 мл), сушат над MgSO4 и концентрируют. Сырой продукт очищают с помощью флеш хроматографии на колонке с силикагелем, элюируя 20% EtOAc в гексане, что дает соединение 260А (1.09 г, 89%) в виде масла оранжевого цвета.
В. 4-Амино-7-хлор-2-метилбензо[b]тиофен (260В)

Раствор 1.09 г (4.67 ммоль) соединения 260А в 20 мл АсОН с 10 мл EtOAc и 2 мл Н2О нагревают до температуры 80°С и обрабатывают порошком железа (1.3 г, 23.4 ммоль). Смесь нагревают при температуре 80°С в течение 40 минут, а затем ей дают возможность остыть до комнатной температуры. Смесь отфильтровывают через целит, элюируя EtOAc. Фильтрат промывают насыщенным водным раствором NaHCO3, сушат над MgSO4 и концентрируют в вакууме. Добавляют N,N-диэтиланилин (10 мл) и реакционную массу нагревают при температуре 215°С в течение 6 часов. После охлаждения до комнатной температуры добавляют 1N водного раствора HCl (20 мл) и реакционную массу перемешивают при комнатной температуре в течение 2 часов. Смесь экстрагируют EtOAc (3×30 мл). Органическую фазу промывают насыщенным водным раствором NaHCO3, сушат над MgSO4 и концентрируют. Сырой продукт очищают с помощью флеш хроматографии на колонке с силикагелем элюируя 25% EtOAc в гексане, что дает соединение 260В (320 мг, 35%) в виде твердого вещества серовато-желтого цвета.
С. (3аα,4β,7β,7аα)-2-(7-Хлор-2-метилбензо[b]тиофен-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (260С)
Соединение 260В (49 мг, 0.25 ммоль) реагирует в герметично закрытой трубке с соединением 20А (73.5 мг, 0.38 ммоль), MgSO4 (75 мг, 0.63 ммоль) и Et3N (170 мкл, 1.25 ммоль) в 250 мкл толуола в соответствии со способом, описанным в примере 208С, что дает, после очистки с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 30-100% водным раствором метанола в течение более 12 минут, содержащим 0.1% TFA, 20 мл/минут), 28 мг (30%) соединения 260С в виде твердого вещества бледно-желтого цвета. HPLC: 96% в течение 3.18 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (DC1): м/е 376.0 [М]+.
Пример 261
[3аα,4β(Е),7β,7аα]-4-[2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]-2-бутеновой кислоты фенилметиловый эфир (261)
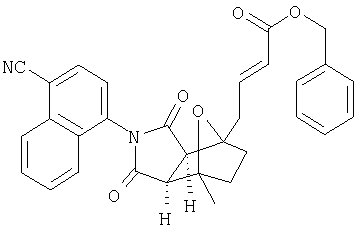
Соединение 247 (0.500 г, 0.134 ммоль) растворяют в ТГФ (20 мл) и добавляют бензил(трифенилфосфоранилиден) (0.55 г, 0.134 ммоль). Реакционную смесь перемешивают при температуре 67°С в течение 2 часов, а затем концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на SiO2, элюируя 5% ацетоном/95% CHCl3 дает 0.65 г соединения 261 в виде твердого вещества желтого цвета. HPLC: 99% в течение 3.717 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 507.1 [М+Н]+.
Пример 262
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-бутеновая кислота (262)
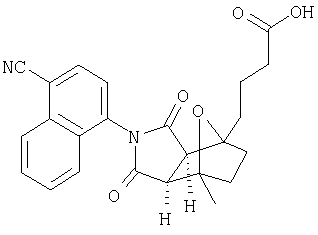
Соединение 261 (0.60 г, 1.19 ммоль) растворяют в EtOH/EtOAc (5 мл/5 мл) и добавляют 10% Pd/C (0.30 г). Затем вводят водород из баллона. Через 8 часов реакционную массу отфильтровывают через целит, а затем концентрируют при пониженном давлении, что дает соединение 262 (0.47 г) в виде твердого вещества белого цвета. HPLC: 98% в течение 2.81 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 419.1 [М+Н]+.
Пример 263
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-N-f4-фторфенил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-бутанамид, (263)
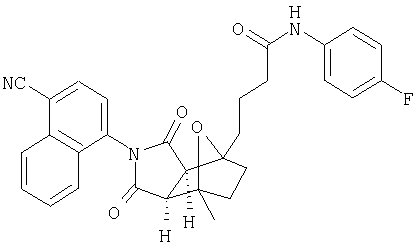
Соединение 262 (0.030 г, 0.072 ммоль) растворяют в CH3CN (1 мл). DCC (0.014 г, 0.072 ммоль) и затем добавляют НОАс (0.0098 г, 0.072 ммоль), а затем 4-фторанилин (0.007 мл, 0.072 ммоль). Реакционную смесь перемешивают в атмосфере аргона в течение 14 часов, сырой продукт растворяют в МеОН и очищают с помощью препаративной HPLC (YMC VP-ODS колонка, 20×100 мм, элюируя от 20% В до 100% В в 15 минут и долодным @ 100% В в течение 10 минут). Соединение 263 (0.020 г) выделяют в виде твердого вещества белого цвета. HPLC: 100% в течение 3.217 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 512.1
Пример 264
[3aS-(3aα,4β,5β,7β,7аβ)]-4-[7-[2-[Ацетилокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3aR-(3аα,4β,5β,7β,7аβ)]-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил]-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, (264Di и 243Dii)

Рацемическую смесь соединений 243Di и 243Dii (1.90 грамм) растворяют в 100 мл безводного ТГФ в 2 л колбе. Безводный трет-бутилметиловый эфир (900 мл) и винилацетат (40 мл) переносят в колбу при перемешивании и добавляют липазу (20 г, образец, сырой продукт, из поджелудочной железы свиньи; Sigma, Cat# L3126). Реакционную смесь перемешивают в течение 2 часов при комнатной температуре, при этом добавляют еще 5 граммов липазы и 20 мл винилацетата. Реакционную массу перемешивают при комнатной температуре в течение еще 19 часов, сохраняют при температуре 4°С без перемешивания в течение 36 часов, а затем перемешивают при комнатной температуре в течение остальных 22 часов (пока требуемый % энантомерного избытка не будет достигнут, как определит хиральная HPLC). Для анализа забирают 200 ед./мл смеси и центрифугируют. Суспернатат (100 uL) сушат в атмосфере азота и полученный остаток растворяют в 100 ед./мл EtOH и подвергают HPLC анализу:
1) HPLC с обращенной фазой: колонка YMC-ODS AQ 150×4.6; скорость потока, 1.2 мл/минут; объем выборки, 10 мкл
растворитель А,: 1 нМ HCl в воде; растворитель В, MeCN; контролируют при 300 нм
2) Хиральная-HPLC: Колонка, CHIRALCEL OJ 4.6×250 мм подвижная фаза, гексан/МеОН/EtOH (8:1:1). Скорость потока 1 мл/минуту; объем выборки 20 ед./мл контролируют при значениях 220 и 300 нм, выполняют при температуре 25°С; 40°С (для определения энантомерного избытка в реакционной смеси)
Фермент удаляют с помощью фильтрования и фильтрат концентрируют в вакууме. Полученную смесь растворяют в CHCl3 и адсорбируют на силикагеле (63-200 микрон). Эти твердые вещества применяют в VLC воронке (3 см I.D., VLC представляет собой вакуумную жидкостную хроматографию, использующую стеклянные воронки, имеющие 24/40 мест присоединения в основании), содержащую 5 см подложку из силикагеля (25-40 микрон) и выполняемый шаг градиента. Градиент составлен: 100% CHCl3 в первых трех фракциях, затем CHCl3-1% МеОН (3 фракции), CHCl3-2% МеОН (3 фракции), CHCl3-3% МеОН (3 фракции), CHCl3-4% МеОН (3 фракции) и, наконец, CHCl3-5% МеОН (3 фракции). Объем фракций составил 100 мл для достижения CHCl3-3% МеОН и в этой точке он составил 200 мл. Соединение 264 элюируют в последних двух фракциях 100% CHCl3, и до первой фракции CHCl3-2% МеОН. Соединение 243Dii элюируется первоначально со второй фракцией CHCl3-2% МеОН и продолжает элюироваться до первой фракции CHCl3-5% МеОН. Сырое соединение 243Dii содержит небольшое количество цветной примеси, которую удаляют с помощью Sephadex колонки [LN-20, набухшей в CHCl3-МеОН (2:1), колонка (2.5 см I.D.; 90 см в длину), что дает 632 мг соединения 243Dii. Соединение 264: HPLC условия: 98% в течение 7.2 минут (способ 1), хиральной HPLC условия: 29.0 минут @ 25°С (способ 2). Соединение 243Dii: HPLC условия: 98% в течение 4.6 минут (способ 1), хиральной HPLC условия: 96% ее при 25.7 минут (@ 25°С) и 19.8 минут (@ 40°С) (способ 2).
Пример 265
(3аα,4β,7β,7аα(Е)]-4-[Октагидро-4-метил-1,3-диоксо-7-(4-оксо-4-фенил-2-бутенил)-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (265)
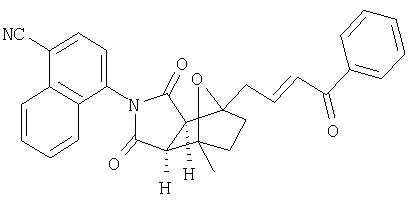
Соединение 247 (0.050 г, 0.134 ммоль) растворяют в ТГФ (1.5 мл) и добавляют (фенацилиден)трифенилфосфоран (0.051 г, 0.134 ммоль). Реакционную смесь перемешивают при температуре 67°С в течение 24 часов, а затем охлаждают до температуры 23°С и концентрируют в вакууме. Сырой продукт затем очищают с помощью препаративной HPLC. (YMC VP-ODS колонка, 20×100 мм, элюируя от 20% В до 100% В в течение 15 минут и холодный @ 100% В в течение 10 минут.), что дает соединение 265 (0.040 г) в виде твердого вещества белого цвета. HPLC: 100% в течение 3.503 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/е 477.1 [М+Н]+.
Пример 266
(3аα,4β,7β,7аα(Е)]-4-[Октагидро-4-метил-1,3-диоксо-7-(4-оксо-4-фенил-бутенил)-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (266)
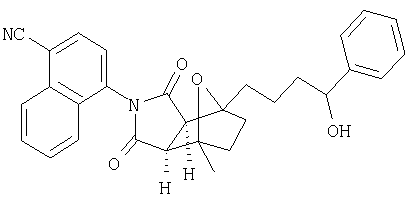
Соединение 265 (0.010 г, 0.021 ммоль) растворяют в EtOH (2.0 мл) и добавляют Pd/C (10% Pd, 0.005 г). Затем вводят водород из баллона и реакционную массу перемешивают при температуре 25°С в течение 3 часов. Реакционную смесь затем отфильтровывают через целит, промывают EtOAc и концентрируют в вакууме, что дает соединение 266 в виде твердого вещества желто-коричневого цвета (0.009 г). Дальнейшая очистка не требуется. HPLC: 100% в течение 3.38 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 503.2 [M+Na]+.
Примеры от 267 до 378
Дополнительные соединения настоящего изобретения получают с помощью методик, аналогичных тем, что описаны выше. Соединения примеров с 267 по 378 имеют следующую структурную формулу (L представляет собой связь):
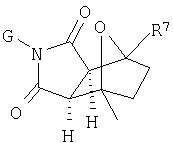
где G, R7, наименование соединения, время удержания, молекулярная масса и способ получения, приведены в таблице 5. Абсолютную конфигурацию для следующих соединений не определяют. Для простоты в номенклатуре, соединение 238i обозначено как имеющее "R" конфигурацию, и соединение 238ii обозначено как имеющее "S" конфигурацию. Энатиомерно чистые продукты, полученные из соединения 238i, обозначены в настоящем изобретении как имеющие "R" конфигурацию и энатиомерно чистые продукты, полученные из соединения 238ii обозначены в настоящем изобретении как имеющие "S" конфигурацию.
Хроматографические методики используют, чтобы определить время удержания соединений из таблицы 5, следующие: LCMS=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/Н2O более 4 минут, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LCMS*=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/Н2О более 2 минут, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LC=YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% МеОН/Н2О более чем 4 минут, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм. Молекулярная масса соединений приведена в таблице 5, определена с помощью MS (EC) по формуле м/е.













































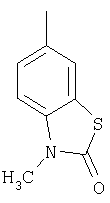
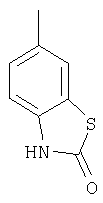



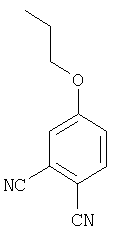
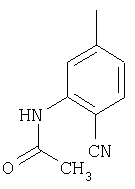







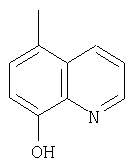
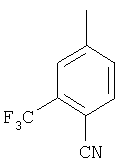
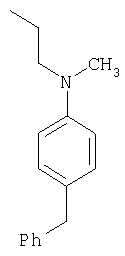
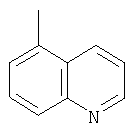
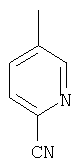
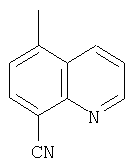
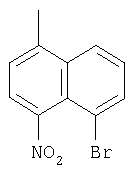
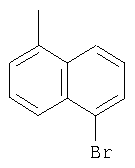

























Примеры с 379 по 381
Дополнительные соединения настоящего изобретения получают с помощью методик, аналогичных тем, что описаны выше. Соединения по примерам с 379 по 381 имеют следующую структурную формулу (L представляет собой связь):
где значения G, R7, наименование соединения, время удержания, молекулярная масса и способ получения, приведены в таблице 6. Хроматографическая техника, используемая для определения времени удержания в таблице 6, следующая: LCMS=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% MeOH/H2O более чем 4 минуты, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LCMS*=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/Н2О в течение более чем 2 минут, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LC=YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% МеОН/Н2О более чем 4 минуты, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм.
Молекулярная масса соединений, приведенная в таблице 6, была определена с помощью MS (EC) по формуле м/е.
Примеры с 382 по 383
Дополнительные соединения настоящего изобретения получают с помощью методик, аналогичных тем, что описаны выше. Соединения по примерам с 382 по 383 имеют структурную формулу, наименование соединения, время удержания, молекулярную массу, и способ получения, приведенные в таблице 7. Хроматографическая техника, используемая для определения времени удержания в таблице 7, определена следующим образом: LCMS=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/H2О, более 4 минут, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LCMS*=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% MeOH/H2O более чем 2 минуты, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LC=YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% МеОН/H2О, более 4 минут, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм. Молекулярную массу соединений, перечисленных в таблице 7, определяют с помощью MS (EC) по формуле м/е.
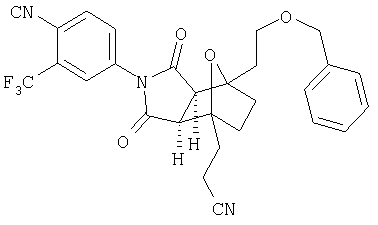
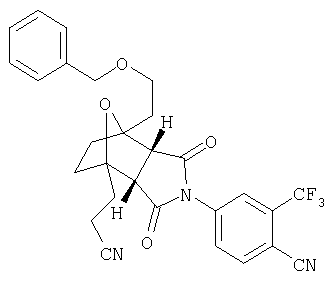
Примеры с 384 по 418
Дополнительные соединения настоящего изобретения получают с помощью методик, аналогичных тем, что описаны выше. Соединения по примерам с 384 по 418 имеют следующую структурную формулу (L представляет собой связь):
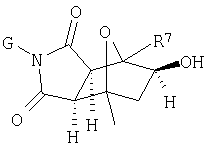
где G, R7, наименование соединения, время удержания, молекулярная масса и способ получения, приведены в таблице 8. Абсолютную конфигурацию для следующих соединений не определяют. Для простоты, по номенклатуре соединение 243Di обозначено в настоящем изобретении как имеющее "S" конфигурацию и соединение 243Dii изобретении как имеющее "R" конфигурацию. Энатиомерно чистые продукты, полученные из соединения 243Di, обозначены в настоящем изобретении как имеющие "S" конфигурацию и энатиомерно чистые продукты, полученные из соединения 243Dii обозначены в настоящем изобретении как имеющие "R" конфигурацию.
Хроматографическая техника, используемая для определения времени удержания в таблице 8, определена следующим образом: LCMS=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% MeOH/H2O более чем 4 минуты, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LCMS*=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/Н2O более чем 2 минут, содержащим 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LC=YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% МеОН/Н2O более чем 4 минуты, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм. Молекулярную массу соединений, перечисленных в таблице 8, определяют с помощью MS (EC) по формуле м/е.












































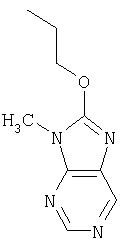

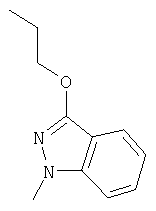

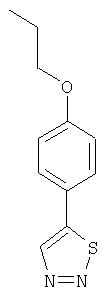



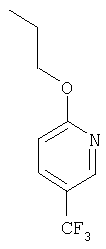





Пример 422
(3аα,4β,7β,7аα)-2-(7-Бром-2,1,3-бензоксадиазол-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (422С)
А. 4-Бром-7-нитробензофуразан (422А)
К раствору 2,6-диброманилина (1.0 г, 4.0 ммоль) в CHCl3 (8 мл) добавляют суспензию mCPBA (70% по HPLC, 1.4 г, 8.0 ммоль) в CHCl3 (8 мл) и полученную смесь перемешивают в течение 24 часов при комнатной температуре. Реакционную смесь разбавляют CHCl3 и промывают последовательно 2% раствором Na2S2О3, 5% раствором Na2CO3 и рассолом. Органический слой сушат над Na2SO4 и концентрируют при пониженном давлении до образования твердого вещества, которое суспендируют в ДМСО (15 мл). К полученной суспензии добавляют раствор NaN3 (272 мг, 4.19 ммоль) в ДМСО (15 мл) при комнатной температуре. Полученную смесь перемешивают при комнатной температуре, пока не перестанет выделяться азот, а затем быстро нагревают до температуры 120°С в течение 3 минут. Затем реакционную смесь охлаждают и выливают на дробленый лед (100 г). После стояния в течение часа выпавший остаток отфильтровывают, сушат в вакууме и повторно растворяют в концентрированной H2SO4 (5 мл). К этому раствору добавляют раствор NaNO3 (400 мг, 4.7 ммоль) в 50% H2SO4 (1.6 мл), температуру поддерживают при 60°С. После завершения добавления, смесь нагревают до температуры 85°С в течение 30 минут, охлаждают до комнатной температуры и выливают на дробленный лед (40 г). Затем добавляют EtOAc, слои отделяют и водный слой экстрагируют EtOAc. Объединенные органические слои сушат над Na2SO4 и концентрируют, чтобы оставить твердое вещество, которое очищают с помощью флеш хроматографии (силикагель, EtOAc (20%) в гексане), получая соединение 422А (785 мг, 81%) в виде твердого вещества желто-коричневого цвета.
В. 4-Бром-7-аминобензофуразан (422В)
Раствор соединения 422А (563 мг, 2.31 ммоль) в АсОН (5 мл) нагревают до температуры 70°С и одной порцией добавляют порошок Fe0 (258 мг, 4.62 ммоль). Полученную темную реакционную смесь перемешивают в течение 15 минут, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток помещают в EtOAc и полученный раствор промывают насыщенным водным раствором Na2CO3. Органической слой сушат над Na2SO4, концентрируют и очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 10 до 60%), получая соединение 422В (470 мг, 95%) в виде твердого вещества красного цвета.
С. (3аα,4β,7β,7аα)-2-(7-Бром-2,1,3-бензоксадиазол-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (422С)
Смесь соединения 422В (43 мг, 0.20 ммоль), соединения 20А (45 мг, 0.23 ммоль), MgSO4 (60 мг, 0.50 ммоль), Et3N (139 мкл, 1.0 ммоль) и 1,2-диметоксиэтана (300 мкл) помещают в герметично закрытую трубку и нагревают до температуры 135°С в течение 14 часов. После охлаждения до комнатной температуры смесь отфильтровывают через целит, элюируя МеОН, что дает темное твердое вещество темного цвета, которое очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 5 до 40%), что дает соединение 422С (42 мг, 54%) в виде твердого вещества желтого цвета. HPLC: 99% в течение 2.96 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм Ballistic, 10-90% водный раствор метанола в течение более 4 минут, содержащий 0.2% Н3PO4, 4 мл/минут, контролирование при 220 нм). 1H ЯМР (ацетон-d6, 400 мГц): δ=8.00 (д, J=7.5 Гц, 1Н), 7.45 (д, J=7.5 Гц, 1Н), 3.31 (с, 2Н), 1.98-1.93 (м, 2Н), 1.74-1.69 (м, 2Н), 1.57 (с, 6Н).
Пример 423
(3аα,4β,7β,7аα)-7-[Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2,1,3-бензоксадиазол-4-карбонитрил (423)
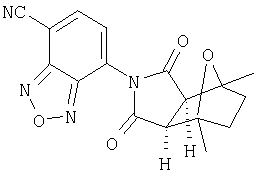
К раствору соединения 422С (42 мг, 0.11 ммоль) в DMA (1 мл) добавляют CuCN (20 мг, 0.22 ммоль) и полученную смесь нагревают до температуры 150°С в течение 5 часов. Смеси дают возможность остыть до комнатной температуры и затем ее разделяют между EtOAc и водным раствором NaCN (5 г/50 мл). Слои отделяют и водный слой экстрагируют один раз EtOAc. Объединенные органические фазы сушат над Na2SO4, концентрируют и очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане от 20 до 70%), что дает соединение 423 (13 мг, 35%) в виде масла желтого цвета. HPLC: 99% в течение 2.66 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм Ballistic, 10-90% водный раствор метанола в течение более 4 минут, содержащий 0.2% Н3PO4, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 396.9 [М-Н+ОАс]-.
Пример 424
(3аα,4β,7β,7аα)-7-[Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2,1,3-бензотиадиазол-4-карбонитрил (424В)
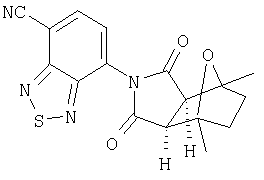
А. 4-Циано-7-амино-бензотиадиазол (424А)
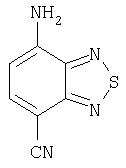
Раствор 2-циано-5-нитрофенилендиамина (78 мг, 0.44 ммоль, полученного, как описано в WO 0076501) в SOCl2 (2 мл), нагревают при кипении с обратным холодильником в течение 3 часов. Полученной смеси дают возможность остыть до комнатной температуры, а ее затем помещают на баню с ледяной водой. Добавляют СН2Cl2, слои отделяют и водный слой экстрагируют дважды CH2Cl2. Объединенные органические фазы сушат над MgSO4, концентрируют и очищают с помощью флеш хроматографии (силикагель, EtOAc в гексане 50%), что дает 4-циано-7-нитробензотиадиазол. Этой продукт растворяют в АсОН (2 мл), содержащем EtOAc (1 мл) и Н2О (0.2 мл) и нагревают до температуры 70°С. При этой температуре добавляют в одной порцией твердый Fe0 порошок (78 мг, 1.41 ммоль) и смесь темного цвета перемешивают в течение 20 минут, а затем охлаждают до комнатной температуры. Реакционную смесь фильтруют через Целит, элюируя EtOAc, промывают насыщенным водным раствором Na2CO3, сушат над MgSO4 и концентрируют. Очистка с помощью флеш хроматографии (силикагель, EtOAc в гексане от 20 до 70%), дает соединение 424А (47 мг, 61%) в виде твердого вещества коричневого цвета.
В. (3аα,4β,7β,7аα)-7-[Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2,1,3-бензотиадиазол-4-карбонитрил (424В)
Смесь соединения (35 мг, 0.20 ммоль), соединения 20А (45 мг, 0.23 ммоль), MgSO4 (60 мг, 0.50 ммоль), Et3N (139 мкл, 1.0 ммоль) и DME (200 мкл) помещают в герметично закрытую трубку и нагревают до температуры 135°С в течение 14 часов. После охлаждения до комнатной температуры смесь отфильтровывают через Целит, элюируя МеОН, что дает твердое вещество темного цвета, которое очищают с помощью комбинации из флеш хроматографии (силикагель, EtOAc в гексане от 10 до 50%) и препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, элюируя 27-100% водным раствором метанола в течение более 10 минут, содержащим 0.1% TFA, 20 мл/минут), что дает соединение 424В (36 мг, 51%) в виде твердого вещества желтого цвета. HPLC: 98% в течение 2.45 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм Ballistic, 10-90% водный раствор метанола в течение более 4 минут, содержащий 0.2% Н3PO4, 4 мл/минут, контролирование при 220 нм), MS (DCl): м/e 355.0 [М+Н]+.
Пример 425
(3аα,4β,7β,7aα)-N-[2-[2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]-4-фтор-N-метилбензамид
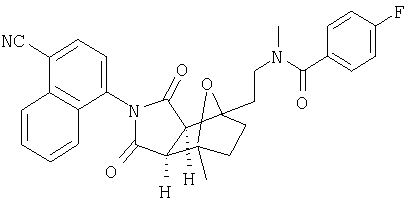
А. 4-Фтор-N-метил-N-[2-(5-метилфуран-2-ил)-этил]-бензамид (425А)
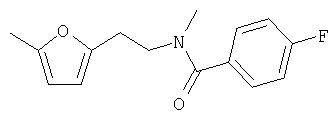
К раствору 4-фтор-N-[2-(5-метил-2-фуранил)этил]бензамида (269 мг, 1.09 ммоль, 237А) в ТГФ (5 мл) добавляют порциями NaH (60% дисперсия в масле, 65 мг, 1.63 ммоль). После окончания выделения газа добавляют по каплям йодметан (0.14 мл, 2.18 ммоль). Когда HPLC анализ показывает, что реакция на 50% закончилась, смесь концентрируют при пониженном давлении и повторно подвергают описанным выше обработкам. После того как исходный продукт введут в реакцию, добавляют Н2О и полученную смесь экстрагируют EtOAc (2×5 мл). Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии, элюируя 20% ацетоном/CHCl3 дает 238 мг (84%) соединения 425 A. HPLC: 98% в течение 2.94 минут (время удержания) (Phenomenex-prime S5-C18 колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e [М+Н] - 262.38.
В. (3аα,4β,7β,7аα)-N-[2-[2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]-4-фтор-N-метилбензамид (425В)
Раствор соединения 425А (183 мг, 0.75 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1N-1-ил)-1-нафталинкарбонитрила (174 мг, 0.75 ммоль) в бензоле (1 мл) нагревают при температуре 60°С в течение 15 часов. Реакционную смесь концентрируют при пониженном давлении, что дает 357 мг сырого промежуточного продукта. Сырой промежуточный продукт (156 мг) растворяют в EtOAc (6 мл), добавляют 10% Pd/C (16 мг) и смесь перемешивают в атмофере водорода из баллона в течение ночи. Реакционную смесь отфильтровывают через подушку из целита и концентрируют при пониженном давлении. Очистка с помощью препаративной хроматографии с обращенной фазой (YMC S5 ODS 20×100 мм, 20-100% водный раствор метанола в течение более 15 минут, содержащий 0.1% TFA, 20 мл/минут, контролирование при 220 нм), дает 160.3 мг (72%) соединения 425 В в виде твердого вещества грязно-белого цвета. HPLC: 99% в течение 3.23 минут (время удержания) (Phenomenex-prime S5-C18 колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e [М+Н]=512.19.
Пример 426
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (426В)
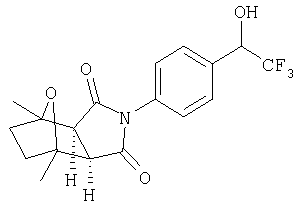
1-(4-Аминофенил)-2,2,2-трифторэтанол (426А)
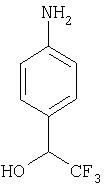
Соединение 426А получают в соответствии со способом, описанным в Stewart, R. et. al. Can. J. Chem. 58, 2491-2496 (1980). NaBH4 (47 мг, 1.235 ммоль) добавляют к раствору п-аминотрифторацетофенона (155.7 мг, 0.823 ммоль, синтезированный, как описано у Klabunde, К.J. et. al., J. Org. Chem. 35, 1711-1712 (1970)) в изопропаноле (3 мл) при комнатной температуре. Через 30 минут реакционную массу захолаживают фосфатным буфером (pH 7.2), разбавляют Н2O и экстрагируют EtOAc (2×10 мл). Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении, что дает 154 мг (98%) соединения 426А в виде твердого вещества желто-коричневого цвета. Полученный продукт используют непосредственно на следующем этапе без очистки. HPLC: 99% в течение 0.42 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e [М+Н]=192.13.
В. (3аα,4β,7β,7ааα)-Гексагидро-4,7-диметил-2-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион (426В)
Смесь соединения 426А (75.3 мг, 0.394), соединения 20А (51.5 мг, 0.262 ммоль), триэтиламина (0.15 мл) и MgSO4 (50 мг) в толуоле (1 мл) нагревают в герметично закрытой трубке до температуры 135°С в течение 15 часов. Смесь отфильтровывают и концентрируют при пониженном давлении. Очистка с помощью препаративной хроматографии с обращенной фазой (YMC S5 ODS 20×100 мм, 20-100% водный раствор метанола в течение более 15 минут, содержащий 0.1% TFA, 20 мл/минут, контролирование при 220 нм), дает 63.1 мг (65%) соединения 426В в виде твердого вещества белого цвета. HPLC: 98% в течение 2.49 минут (время удержания) (Phenomenex-prime S5-C18 колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e [М+Н]=370.16.
Пример 427
(3аα,4β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси1этил]-1,3,3а,4,7,7а-гексагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил]бензонитрил; (3аα,4α,7α,7аα)-4-[4-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]-1,3,3а,4,7,7а-гексагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (427i и 427ii)

Соединение 204А (2.00 г, 8.50 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-пиррол-1-ил)-2-трифторметилбензонитрил (1.50 г, 5.60 ммоль) перемешивают в бензоле (5.0 мл) и нагревают при температуре 60°С в течение 14 часов, затем охлаждают до температуры 25°С. Растворитель удаляют при 40°С в вакууме в течение часа, что дает сырой продукт, который очищают с помощью флеш хроматографии на SiO2, элюируя 0.5% EtOAc/CH2Cl2, что дает 2.0 г соединения 427i и 1.3 г соединения 427ii, оба в виде твердых веществ светло-коричневого цвета. Соединение 427i: HPLC: 95% в течение 4.200 минут (время удержания) (YMC S5 ODS колонка 4.6 ч 50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 507.1 [M+H]+. Соединение 427ii: HPLC: 95% в течение 4.20 минут (время удержания) (YMC S5 ODS колонка 4.6 ч 50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 507.1 [М+Н]+.
Пример 428
[3aR-(3aα,4β,5β,7β,7aα)]-4-[7-[2-[[1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил; [3aS-(3aα,4β,5β,7Bβ,7aaα)]-4-[7-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (428i и 428ii)
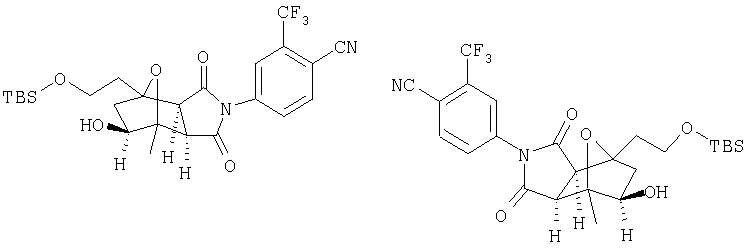
Соединение 427i (1.40 г, 2.77 ммоль) и RhCl(PPh3)3 (0.128 г, 0.14 ммоль) перемешивают в колбе. Затем колбу вакуумируют и трижды продувают аргоном, затем шприцем добавляют ТГФ (3.0 мл). За один раз все мелкие частицы растворяют и добавляют по каплям катехол боран (0.59 мл, 5.54 ммоль). Реакционную смесь перемешивают при температуре 25°С в атмосфере аргона в течение 30 минут, затем охлаждают до температуры 0°С. Добавляют фосфатный буфер (pH 7,20 мл), а затем EtOH (10 мл), 30% Н2O2/Н2O (2 мл). Реакционную смесь перемешивают при температуре 0°С в течение 3 часов, затем экстрагируют дихлорметаном (3×25 мл). Объединенные органические слои промывают 1N NaOH (25 мл), 10% Na2SO3 (25 мл) и рассолом (25 мл). Сырой продукт затем концентрируют и очищают с помощью флеш хроматографии на SiO2, элюируя от 2% EtOAc/CH2Cl2 до 10% EtOAc/CH2Cl2, что дает 0.63 г рацемической смеси соединений 428i и 428ii в виде твердого вещества светло-желтого цвета. HPLC: 99% в течение 3.867 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/е 525.1 [М+Н].
Рацемическую смесь соединений 428i и 428ii отделяют с помощью препаративной хиральной HPLC с нормальной фазой, используя Chiracel OD колонку (5 см×50 см), элюируя 13% растворителем В (EtOH) в растворитель А (Гексан), скорость потока: 50 мл/минут. Соединение 428i элюируют от 34 минут до 38 минут и соединение 428ii элюируют от 44 минут до 49 минут. Энантиомерный избыток определяют с помощью хиральной HPLC. Соединение 428i: >99% ее (12.576 минут (время удержания) (Chiralcel OJ колонка 4.6×250 мм, элюируя изократик 85% гептаном/15% МеОН/этанолом (1:1), 1 мл/минут, контролирование при 220 нм, 40°С). Соединение 428ii: 99% в течение 18.133 минут (время удержания) (Chiralcel OJ колонка 4.6×250 мм, элюируя изократик 85% гептаном/15% МеОН/этанолом (1:1), 1 мл/минут, контролирование при 220 нм, 40°С).
Абсолютные конфигурации соединений 428i и 428ii не установлены. Для простоты номенклатуры соединение 428i обозначено в настоящем изобретении как имеющее "R" конфигурацию и соединение 428ii как имеющее "S" конфигурацию. Энатиомерно чистые продукты, полученные из соединения 428i, обозначены в настоящем изобретении как имеющие "R" конфигурацию и энатиомерно чистые продукты, полученные из соединения 428ii обозначены в настоящем изобретении как имеющие "S" конфигурацию.
Пример 429
[3аR-(3аα,4β,5β,7β,7аα)]-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил; [3аS-(3аα,4β,5β,7β,7аα)]-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол]-2-ил]-2-(трифторметил)бензонитрил (4291 и 429ii)
Соединение 428i (180 мг, 0.34 ммоль) растворяют в 2% HCl/EtOH (5.0 мл). Через 30 минут добавляют насыщенный водный раствор NaHCO3 и водный слой экстрагируют дихлорметаном (20 мл×3), промывают рассолом и сушат над Na2SO4, что дает 135 мг соединения 429i в виде твердого вещества белого цвета. HPLC: 99% в течение 2.257 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 411.1 [М+Н]+.
Описанный выше способ повторяют с соединением 428ii, что дает желаемое диольное соединение 429ii с аналогичным выходом.
Пример 430
[3аR-(3аα,4β,5β,7β,7аα)]-4-[7-[2-[(5-Хлор-2-пиридинил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (430)
Трифенилфосфин (0.026 г, 0.098 ммоль) и DBAD (0.023 г, 0.098 ммоль) перемешивают в ТГФ (0.5 мл). После того как полученной смеси дают возможность прореагировать в течение 15 минут, добавляют 2-гидрокси-6-хлорпиридин (0.016 г, 0.100 ммоль) и вновь образовавшейся смеси дают возможность перемешиваться в течение 10 минут, а затем добавляют соединение 429i (0.020 г, 0.049 ммоль). Реакционную смесь перемешивают при температуре 25°С в течение 2 часов, а затем сырой продукт очищают с помощью препаративной TLC, элюируя 10% ацетоном/CHCl3, что дает 0.014 г соединения 430 в виде твердого вещества светло-коричневого цвета. HPLC: 100% в течение 3.370 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 522.08 [М+Н]+.
Пример 431
[3аS-(3аα,4β,5β,7β,7аα)]-4-[7-[2-[(5-Хлор-2-пиридинил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил (431)
Трифенилфосфин (0.026 г, 0.098 ммоль) и DBAD (0.023 г, 0.098 ммоль) перемешивают в ТГФ (0.5 мл). После того как полученной смеси дают возможность прореагировать в течение 15 минут, добавляют 2-гидрокси-6-хлорпиридин (0.016 г, 0.100 ммоль), смеси дают возможность перемешиваться в течение еще 10 минут, а затем добавляют соединение 429ii (0.020 г, 0.049 ммоль). Реакционную смесь перемешивают при температуре 25°С в течение 2 часов, а затем сырой продукт очищают с помощью препаративной TLC, элюируя 10% ацетоном/CHCl3, что дает 0.015 г соединения 431 в виде твердого вещества светло-коричневого цвета. HPLC: 100% в течение 3.370 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 522.08 [М+Н]+.
Пример 432
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-N-(2-гидроксифенил)-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-бутанамид (432)

Соединение 262 (0.100 г, 0.239 ммоль) растворяют в ДМФА (безводный, 1.5 мл), ВОР (0.211 г, 0.478 ммоль), затем добавляют 2-аминофенол (0.052 г, 0.478 ммоль) и N-метилморфолин (0.052 мл, 0.478 ммоль). Реакционную смесь перемешивают при температуре 25°С в атмосфере аргона в течение 3 часов, затем сырой продукт очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, 20-100% водный раствор метанола в течение более 15 минут, содержащий 0.1% TFA, 20 мл/минут, контролирование при 220 нм), что дает 0.060 г соединения 432 в виде твердого вещества светло-коричневого цвета. HPLC: 100% в течение 3.037 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 510.34 [М+Н]+.
Пример 433
(3аα,4β,7β,7аα)-4-[4-[3-(2-Бензоксазолил)пропил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (433)
Трифенилфосфин (0.031 г, 0.118 ммоль) и DBAD (0.027 г, 0.118 ммоль) перемешивают в ТГФ (0.5 мл). Предыдущей смеси дают возможность прореагировать в течение 15 минут, затем добавляют соединение 432 (0.030 г, 0.059 ммоль). Реакционную смесь перемешивают при температуре 25°С в течение 2 часов, а затем сырой продукт очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, 20-100% водный раствор метанола в течение более 15 минут, содержащий 0.1% TFA, 20 мл/минут, контролирование при 220 нм), что дает 0.018 г соединения 433 в виде твердого вещества светло-коричневого цвета. HPLC: 100% в течение 3.357 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 492.37 [М+Н]+.
Пример 434
(3аα,4β,5β,7β,7аα)-4-[4-Этилоктагидро-5-гидрокси-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (434С)
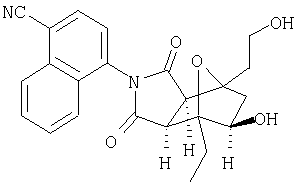
А. трет-Бутил-[2-(5-этилфуран-2-ил)-этокси]-диметилсилан (434А)
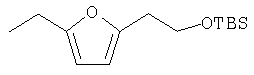
Имидазол (255 мг, 3.75 ммоль) и TBSCl (414 мг, 2.75 ммоль) добавляют к раствору 245А (350 мг, 2.5 ммоль) в ДМФА (4 мл). Смесь перемешивают при комнатной температуре в течение 15 часов, а затем добавляют 100 мг (0.66 ммоль) дополнительного количества TBSCl, чтобы довести реакцию до завершения. После перемешивания в течение еще часа реакционную смесь разбавляют диэтиловым эфиром (100 мл) и промывают водой (20 мл), 1N HCl (20 мл), водой (20 мл) и рассолом (20 мл). Органический слой сушат над Na2SO4 и концентрируют при пониженном давлении, что дает 509 мг соединения 434А (80.3%) в виде масла желтого цвета.
В. (3аα,4β,7β,7аα)-4-[4-[2-[[(1,1-Диметилэтил)-диметилсилил]окси]этил]-4-этил-1,3,3а,4,7,7а-гексагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (434В)
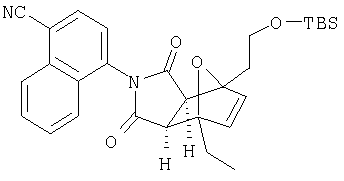
Раствор соединения 434А (509 мг, 2.00 ммоль) и 4-(2,5-дигидро-2,5-диоксо-1Н-1-ил)-1-нафталинкарбонитрила (498 мг, 2.00 ммоль) в бензоле (2 мл) нагревают при температуре 60°С в течение 18 часов. Реакционную смесь концентрируют при пониженном давлении, что дает 992 мг (99%) сырого соединения 434В, которое используют непосредственно на следующем этапе без дальнейшей очистки.
С. (3аα,4β,5β,7β,7аα)-4-[4-Этилоктагидро-5-гидрокси-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (434С)
Смесь соединения 434В (992 мг, 1.98 ммоль) и RhCl2(PPh3)3 (183 мг, 0.198 ммоль) вакуумируют и заполняют аргоном (3×). Добавляют ТГФ (20 мл) и за один раз растворяют все мелкие частицы, а затем медленно добавляют по каплям катехолборан (0.42 мл, 3.96 ммоль). Когда формирование продукта прекратится, как определяют с помощью HPLC, реакционную смесь охлаждают до температуры 0°С и захолаживают фосфатным буфером (34 мл, pH 7.2), затем добавляют EtOH (19 мл) и H2O2 (2.9 мл, 30% водный раствор). Через 2 часа, добавляют фосфатный буфер (6.8 мл, pH 7.2), EtOH (3.8 мл) и H2O2 (0.6 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Когда промежуточный боронат израсходуют, смесь экстрагируют СН2Cl2 (300 мл) и объединенные органические слои промывают 1N NaOH, 10% водным раствором NaHSO3 и рассолом. Объединенные органические слои сушат над Na2SO4. Очистка с помощью флеш хроматографии на силикагеле, элюируя 10% MeOH/CH2Cl2, дает 75 мг (9.3%) соединения 434С в виде твердого вещества серого цвета. HPLC условия: 97% в течение 2.43 минут (Phenomenex-prime S5-C18 колонка 4.6×50 мм, 10%-90% водный раствор метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (ЕС): м/e 407.18 [М-I-Н]+.
Пример 435
(3аα,4β,5β,7β,7аα)-4-[7-[2-(4-Цианофенокси)этил]-4-этилоктагидро-5-гидрокси-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (435)
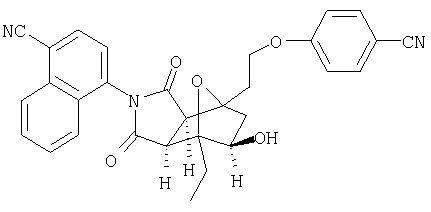
DBAD (39.6 мг, 0.172 ммоль) добавляют к раствору PPh3 (45.1 мг, 0.172 ммоль) в ТГФ (0.8 мл). После перемешивания в течение 10 минут добавляют 4-цианофенол (20.5 мг, 0.172 ммоль) и реакционную смесь перемешивают дополнительно в течение 5 минут. Добавляют соединение 434С (25.0 мг, 0.062 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную массу концентрируют при пониженном давлении. Очистка с помощью препаративной TLC, элюируя 10% ацетоном/CHCl3, дает 18.1 мг (0.036 ммоль, 57.6%) соединения 435. HPLC условия: 96% в течение 3.15 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водный раствор метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (EC): м/e 508.14 [М+Н].
Пример 436
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафтиаленил)октагидро-N-(2-гидроксифенил)-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-этанамид (436)
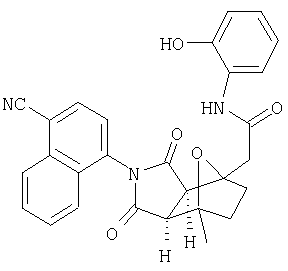
Соединение 234В (0.100 г, 0.256 ммоль) растворяют в ДМФА (безводный, 1.5 мл), добавляют ВОР (0.225 г, 0.51 ммоль), затем 2-аминофенол (0.056 г, 0.51 ммоль) и N-метил-морфолин (0.056 мл, 0.51 ммолъ). Реакционную смесь перемешивают при температуре 25°С в атмосфере аргона в течение 3 часов, затем сырой продукт очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, 20-100% водный раствор метанола в течение более 15 минут, содержащий 0.1% TFA, 20 мл/минут, контролирование при 220 нм), что дает 0.078 г соединения 436 в виде твердого вещества светло-коричневого цвета. HPLC: 100% в течение 3.037 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e 482.34 [М+Н]+.
Пример 437
(3аα,4β,7β,7аα)-4-[4-(2-Бензоксазолилметил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (437)
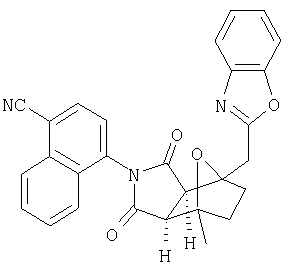
Трифенилфосфин (0.082 г, 0.312 ммоль) и DBAD (0.072 г, 0.312 ммоль) перемешивают в ТГФ (0.5 мл). Полученной смеси дают возможность реагировать в течение 15 минут, затем добавляют соединение 436 (0.075 г, 0.156 ммоль). Реакционную смесь перемешивают при температуре 25°С в течение 2 часов, а затем сырой продукт очищают с помощью препаративной HPLC с обращенной фазой (YMC S5 ODS 20×100 мм, 20-100% водный раствор метанола в течение более 15 минут, содержащий 0.1% TFA, 20 мл/минут, контролирование при 220 нм), что дает 0.052 г соединения 437 в виде твердого вещества светло-коричневого цвета. HPLC: 100% в течение 3.443 минут (время удержания) (YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.1% TFA, 4 мл/минут, контролирование при 220 нм), MS (EC): м/e 464.18 [M+H]+.
Пример 438
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-[4-[2,2,2-трифтор-1-гидрокси-1-(трифторметил)этил]фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион (438)
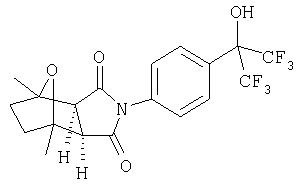
Смесь 2-(4'-аминофенил)-1,1,1,3,3,3-гексафтор-2-пропанола (95.7 мг, 0.369), соединения 20А (48.3 мг, 0.246 ммоль), триэтиламина (0.15 мл) и MgSO4 (50 мг) в толуоле (1 мл) нагревают в герметично закрытой трубке до температуры 135°С в течение ночи. Смесь отфильтровывают и концентрируют при пониженном давлении. Очистка с помощью препаративной хроматографии с обращенной фазой (YMC S5 ODS 20×100 мм, 20-100% водный раствор метанола в течение более 15 минут, содержащий 0.1% TFA, 20 мл/минут, контролирование при 220 нм), дает 44.0 мг (41%) соединения 438 в виде твердого вещества белого цвета. HPLC: 99% в течение 3.10 минут (время удержания) (Phenomenex-prime S5-C18 колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e [М+Н]=438.14.
Примеры с 439 по 454
Дополнительные соединения настоящего изобретения получают с помощью методик, аналогичных тем, что описаны выше. Соединения по примерам с 439 по 454 имеют следующую структурную формулу (L представляет собой связь):

где G, R7, наименование соединения, время удержания, молекулярная масса и способ получения, приведены в таблице 9. Абсолютную конфигурацию для следующих соединений не определяют. Для простоты по номенклатуре соединение 243Di обозначено в настоящем изобретении как имеющее "S" конфигурацию и соединение 243Dii изобретении как имеющее "R" конфигурацию. Энатиометрно чистые продукты, полученные из соединения 243Di, обозначены в настоящем изобретении как имеющие "S" конфигурацию и энатиометрно чистые продукты, полученные из соединения 243Dii, обозначены в настоящем изобретении как имеющее "R" конфигурацию. Также соединение 428i обозначено в настоящем изобретении как имеющее "S" конфигурацию и соединение 428ii изобретения как имеющее "R" конфигурацию. Энатиомерно чистые продукты, полученные из соединения 428i, обозначены в настоящем изобретении как имеющие "S" конфигурацию и энатиомерно чистые продукты, полученные из соединения 428ii, обозначены в настоящем изобретении как имеющие "R" конфигурацию.
Хроматографическая техника, используемая для определения времени удержания в таблице 9, определена следующим образом: LCMS=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/Н2O более чем 4 минуты, содержащий 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LCMS*=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% MeOH/H2O более чем 2 минуты, содержащий 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LC=YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% МеОН/Н2О более чем 4 минуты, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм. Молекулярную массу соединений, перечисленных в таблице 9, определяют с помощью MS (EC) по формуле м/е.
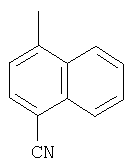

525.2 [М+Н^

















Примеры с 455 по 457
Дополнительные соединения настоящего изобретения получают с помощью методик, аналогичных тем, что описаны выше. Соединения по примерам с 455 по 457 имеют следующую структурную формулу (L представляет собой связь):
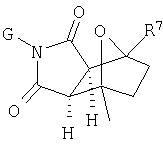
где G, R7, наименование соединения, время удержания, молекулярная масса и способ получения приведены в таблице 10. Абсолютную конфигурацию для следующих соединений не определяют. Для простоты по номенклатуре соединение 238i обозначено в настоящем изобретении как имеющее "R" конфигурацию и соединение 238ii изобретении как имеющее "S" конфигурацию.
Энатиомерно чистые продукты, полученные из соединения 238i, обозначены в настоящем изобретении как имеющие "R" конфигурацию и энатиомерно чистые продукты, полученные из соединения 238ii, обозначены в настоящем изобретении как имеющие "S" конфигурацию.
Хроматографическая техника, используемая для определения времени удержания в таблице 10, определена следующим образом: LCMS=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/Н2О более чем 4 минуты, содержащий 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LCMS*=YMC S5 ODS колонка, 4.6×50 мм, элюируя 10-90% МеОН/Н2О более чем 2 минуты, содержащий 0.1% TFA; 4 мл/минут, контролирование при 220 нм. LC=YMC S5 ODS колонка 4.6×50 мм, элюируя 10-90% МеОН/Н2O более чем 4 минуты, содержащий 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм. Молекулярную массу соединений, перечисленных в таблице 10 определяют с помощью MS (EC) по формуле м/е.



Пример 458
(3аα,4β,5β,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил; (3аα,4β,5β,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил (221B и 222D)
Соединение 20В преобразовывают в соединения 221В и 222D (синтезированное так же как соединения 221В и 222D) с помощью биотрансформации.
Соединение 20В гидроксилируют с помощью Amycolatopsis orientalis (ATCC 43491). 1 мл культуры из замороженной пробирки используют, чтобы засеять 100 мл среды в Эйленмейровской колбе объемом 500 мл и культуру выращивают при температуре 28° при 200 об/мин в течение 3 дней. 10 мл порцию указанной культуры используют, чтобы засеять 100 мл среды в Эйленмейровской колбе объемом 500 мл и культуру выращивают при температуре 28°С С при 200 об/мин в течение 1 дня. 10 мл порцию однодневной культуры распределяют в каждую из трех колб объемом 50 мл. Соединение 20В (3 мг в 0.1 мл метанола) добавляют к каждой культуре и инкубацию продолжают течение 3 дней. Культурный бульон в каждой колбе экстрагируют 20 мл этилацетатом и объединенные этилацетатные экстракты выпаривают досуха при температуре 40°С в токе азота. Остаток растворяют в 1.2 мл метанола и анализируют с помощью HPLC, LC/MS и LC/ЯМР. Раствор содержит 2.5 мг оставшегося соединения 20В, 1.6 мг соединения 221В и 1.3 мг соединения 222D. MS и ЯМР анализы в соответствии со структурами приведены выше.
Среда: 0.5% высушенная мука из бобов сои (нутрисой), 2% глюкозы, 0.5% экстракта дрожжей, 0.5% К2HPO4, 0.5% NaCl, доводят до рН 7 с HCl (R.V.Smith и J.P.Rosazza, Arch. Biochem. Biophys., 161, 551-558 (1974).
HPLC анализ
Колонка: Phenomenex Luna CIS, 150×2 мм, 5 микрон.
подвижная фаза: растворитель А: 95% 20 ммоль ацетата аммония, pH 5.1, 5% ацетонитрила; растворитель В: 95% ацетонитрил, 5% 20 ммоль ацетата аммония, pH 5.1; линейный градиент, начинается от 100% растворителя А до 5% растворителя А в течение 25 минут, затем равновесие при 100% растворителе А в течение 8 минут, температура: 40°С
определение: 250 нм
объем введения: 1 мкл
время удержания: соединение 20В, 20.8 минут; соединение 221В, 16.5 минут; соединение 222D, 17.8 минут
HPLC условия
Хиральные HPLC условия применены для отделения энатиомеров, и ахиральные HPLC условия применены для отделения диастереомеров гидроксилированных аналогов соединения 20 В (то есть соединения 221В и 222D и соединения 254i и 254ii)
Два способа используют в хиральной HPLC, обращенную фазу (RP) для хирального анализа при биотрансформации продуктов в биологические образцы и нормальную фазу (NP) для небиологических образцов.
Хиральные RP-HPLC условия:
Колонка: CHIRALPAK AD-R; 4.6×250 мм, 10 микрон.
Температура: 40°С
Объем введения: 5 или 20 мкл
Подвижная фаза: А: MeCN; В: Н2O; Изократик, 30% А, 18 мин.
Скорость потока: 1 мл/минут.
УФ определение: 242 нм
Хиральные NP-HPLC условия:
Колонка: CHIRALPAK AD; 4.6×250 мм, 10 микрон.
Температура: 25°С
Объем введения: 5 или 20 мкл
Подвижная фаза: А: Гептан; В: МеОН/этанол (1:1); Изократик, 80% А, 20 мин.
Скорость потока: 1 мл/минут.
УФ определение: 242 нм
При этих условиях соединения 254i и 254ii имеют время удержания от 8.5 минут и 9.85 минут соответственно.
HPLC с обращенной фазой используют для разделения диастереомерных соединений 221В и 222D:
Подвижная фаза:
Растворитель А: 95% 20 ммоль ацетата аммония, pH 5.1, 5% ацетонитрила
Растворитель В: 95% ацетонитрила, 5% 20 ммоль ацетата аммония, рН 5.1
Градиент:
Линейный градиент, начинается от 100% растворителя А до 5% растворителя А в течение 25 минут, затем равновесие при 100% растворителе А в течение 8 минут. Общее время 36 минут.
Скорость потока
0.2 мл/минут
Колонка:
Phenomenex Luna 5 микрон C18 150×2.0 мм id
Определение:
УФ определение при 242 нм
При этих условиях соединения 221B и 222D имеют время удержания 18.983 минут и 20.362 минут соответственно.
Пример 459
(3аα,4β,5β,7β,7аα)-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (459)
Соединения 223А и 331 преобразовывают в соединение 459 с помощью биотрансформации.
Микробное гидроксилирование соединения 223А
1. Реакция
В колбу объемом 500 мл, содержащую 100 мл среды, для трансформации добавляют одну заморженную пробирку (приблизительно 2 мл) Streptomyces griseus ATCC 10137. Среду для трансформации получают следующим образом: в 2 л пластиковую мензурку добавляют 20 г декстрозы, 5.0 г экстракта дрожжей, 5.0 г соевой муки, 5.0 г хлорида натрия, 5.0 г фосфата калия (промежуточный) и 1 л деонизированной воды и смесь перемешивают при комнатной температуре в течение от 3 до 30 минут. Затем pH смеси доводят до 7.0 с 1N HCl или 1N NaOH. Полученную смесь распределяют в колбы с объемом по 500 мл (100 мл в колбе). Колбы покрывают биооберткой и помещают в автоклав при температуре 121°С на 15 минут, а затем охлаждают до комнатной температуры перед применением.
Культуру выращивают при температуре 28°С и при 250 об/мин в течение 24 часов. Десять мл полученной культуры переносят в колбу объемом 50 мл, в которую добавляют 1 мг соединения 223А в 0.2 мл этанола. Колбу инкубируют при температуре 28°С и при 250 об/мин в течение 24 часов и выращенную культуру экстрагируют EtOAc (10 мл). Экстракт EtOAc сушат в атмосфере N2 и остаток растворяют в 1 мл МеОН (реакционный экстракт).
2. Анализ продукта
HPLC:
10 мкл реакционного экстракта впрыскивают в HPLC колонку (YMC ODS-AQ С-18 колонка, 150×6.0 мм i.d.). Колонку элюируют 1 мМ HCl в воде/CH3CN при скорости потока 1.2 мл/минут: от 30 до 60% CH3CN в течение более 8 минут, от 60 до 85% CH3CN в течение более более 0.5 минуты, 85% CH3CN в течение 1 минуты, от 85 до 30% CH3CN в течение более более чем 0.5 минуты. Элюенты анализируют при 300 нм. Наблюдают два основных пика приблизительно с соотношением площадей от 1 до 1, которые имеют те же самые УФ спектры, что и соединения 459 и 331, и имеют время удержания 4.55 минуты и 7.23 минуты соответственно, соответствие времени удержания подлинных образцов соединения 459 (4.53 минуты) и соединения 331 (7.2 минуты).
LC/MS
Реакционный экстракт: два основных УФ пика.
Пик 1, Tr 4.68 минуты: 391 [М+Н]+, 343, 319, 303, 289
пика 2, Tr 5.35 минуты: 375 [М+Н]+, 345
Подлинные образцы
Соединение 459, Tr 4.82 минуты: 391 [М+Н]+ 343, 319, 289
Соединение 331, Tr 5.48 минуты: 375 [М+Н]+, 345
Микробное гидроксилирование соединения 331
В колбу объемом 500 мл, содержащую 100 мл среды, для трансформации добавляют одну заморженную пробирку (приблизительно 2 мл) Streptomyces griseus ATCC 10137. Среду для трансформации получают следующим образом: в 2 л пластиковую мензурку добавляют 20 г декстрозы, 5.0 г экстракта дрожжей, 5.0 г соевой муки, 5.0 г хлорида натрия, 5.0 г фосфата калия (промежуточный) и 1 л деонизированной воды и смесь перемешивают при комнатной температуре в течение от 3 до 30 минут. Затем pH смеси доводят до 7.0 с 1N HCl или 1N NaOH. Полученную смесь распределяют в колбы объемом по 500 мл (100 мл в колбе). Колбы закрывают биопокрывалом и помещают в автоклав при температуре 121°С на 15 минут, а затем охлаждают до комнатной температуры, перед применением.
Культуру выращивают при температуре 28°С и 250 об/мин в течение 3 дней. Добавляют один мл полученной культуры в колбу объемом 500 мл, содержащую 100 мл среды для трансформации и колбу инкубируют при температуре 28°С и при 250 об/мин в течение 24 часов. Десять мл полученной культуры переносят в колбу объемом 50 мл, в которую добавляют 1 мг соединения 331 в 0.2 мл этанола. Колбу инкубируют при температуре 28°С и при 250 об/мин в течение 23 часов. HPLC анализ показывает, что пиковое соотношение площадей соединения 459 и соединения 331 в реакционной культуре составляет приблизительно 1.1/1.
Пример 460
(1aα,2β,2aα,5aα,6βR,6aα)-4-[2-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]октагидро-6-метил-3,5-диоксо-2,6-эпокси-4Н-оксирено[f]изондол1-4-ил]-1-нафталинкарбонитрил (460)
Соединение 231А (2.00 г, 4.10 ммоль) растворяют в дихлорметане (40 мл) и охлаждают до температуры 0°С. Затем добавляют mCPBA (2.36 г, 8.20 ммоль). Реакционную смесь затем нагревают до комнатной температуры и перемешивают в атмосфере аргона в течение 18 часов, затем добавляют 10% Na2SO3 (25 мл) и насыщенный NaHCO3 (25 мл). После перемешивания в течение 20 минут, органический слой отделяют и водный слой экстрагируют дихлорметаном (3×50 мл). Объединенные органические слои промывают рассолом, сушат над Na2SO4 и концентрируют, что дает 2.0 г соединения 460 в виде твердого вещества светло-желтого цвета. HPLC: 99% в течение 4.00 минут (время удержания) (Phenomenex-prime S5-C18 колонка 4.6×50 мм, элюируя 10-90% водным раствором метанола в течение более 4 минут, содержащим 0.2% фосфорной кислоты, 4 мл/минут, контролирование при 220 нм), MS (ЕС): м/e [М+Н]=505.19
Пример 461
[3аR-(3аα,4β,7β,7аα)]-4-[4-Этилоктагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; [3aS-(3aα,4β,7α,7aβ)1-4-R4-Этилоктагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (461i и 461ii)
Рацемическую смесь соединений 245С разделяют с помощью препаративной хиральной HPLC с нормальной фазой, используя Chiracel AD колонку (5 см×50 см), элюируя 20% растворителем В (50% MeOH/EtOH) в растворителе А (гептан), скорость потока: 50 мл/минут. Соединение 461i элюируют от 80 минут до 100 минут и соединение 461ii элюируют от 125 минут до 150 минут.
Абсолютную конфигурацию для соединений 461i и 461ii не определяют.Для простоты по номенклатуре соединение 461i обозначено в настоящем изобретении как имеющие "R" конфигурацию и соединение 461ii изобретении как имеющее "S" конфигурацию. Энатиометрно чистые продукты, полученные из соединения 461i, обозначены в настоящем изобретении как имеющее "R" конфигурацию и энатиометрно чистые продукты, полученные из соединения 461ii, обозначены в настоящем изобретении как имеющие "S" конфигурацию.
Пример 462
[3аR-(3аα,4β,7β,7аα)]-4-[4-[2-(4-Цианофенокси)этил]-7-этилоктагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (462)
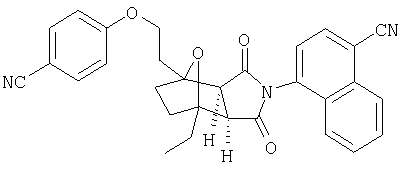
Добавляют DBAD (29.5 мг, 0.128 ммоль) к раствору PPh3 (33.6 мг, 0.128 ммоль) в ТГФ (0.5 мл). После перемешивания в течение 10 минут добавляют 4-цианофенол (15.2 мг, 0.128 ммоль) и реакционную смесь перемешивают в течение дополнительных 5 минут. Добавляют соединение 461i (18.3 мг, 0.047 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную массу концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 40% EtOAc/гексаном, дает 16.9 мг (0.034 ммоль, 73.2%) соединения 462. HPLC условия: 98% в течение 3.64 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водный раствор метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (EC): м/e 492.23 [М+Н]+.
Пример 463
[3аS-(3аα,4β,7β,7аα)]-4-[4-[2-(4-Цианофенокси)этил]-7-этилоктагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил (463)
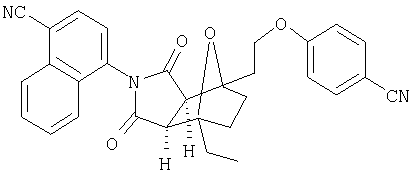
Добавляют DBAD (29.5 мг, 0.128 ммоль) к раствору PPh3 (33.6 мг, 0.128 ммоль) в ТГФ (0.5 мл). После перемешивания в течение 10 минут добавляют 4-цианофенол (15.2 мг, 0.128 ммоль) и реакционную смесь перемешивают в течение дополнительных 5 минут. Добавляют соединение 461ii (18.3 мг, 0.047 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную массу концентрируют при пониженном давлении. Очистка с помощью флеш хроматографии на силикагеле, элюируя 40% EtOAc/гексаном, дает 18.1 мг (0.037 ммоль, 78.4%) соединения 463. HPLC условия: 97% в течение 3.63 минут (YMC S5 ODS 4.6×50 мм, 10%-90% водный раствор метанола в течение более 4 минут градиентом с 0.2% Н3PO4, определенный при 220 нм). MS (EC): м/e 492.17 [M+H]+.
Пример 464
Анализ методом определения веса простаты неполовозрелых крыс (IRPW)
а. Метод
Активность соединений 1-6 в Таблице 11 (далее в данном описании "Соединения 1-6") оценивают методом IRPW общепризнанной модели для оценки антиандрогенной активности соединений. Анализ IRPW основан на том, что рост мужских половых дополнительных органов неполовозрелого грызуна, таких как простата и семенной пузырек, заметно стимулируется после трехдневной экспозиции с экзогенным тестостероном. Неполовозрелых самцов (в возрасте 19-20 дней) крыс Sprague-Dawley, Harlan Sprague-Dawley, кастрируют и через пять дней подкожно (s.c.) вводят дозу тестостерона пропионата (ТР), 1 мг/кг, в кунжутном масле в качестве носителя одновременно с оральным введением через зонд (п.о.) антиандрогенных тестируемых соединений в виде растворов/суспензий в 80% ПЭГ 400 и 20% Tween 80 (PEGTW). Животным вводят дозу (об/вес) в 0.5 мл носителя/100 г веса тела. Имеются следующие группы подопытных животных:
1. Контрольный носитель (s.c. (подкожно), кунжутное масло, п.о., PEGTW, QD)
2. Тестостерон пропионат (ТР) (1 мг/кг s.c. кунжутное масло, QD)
3. ТР (s.c. как в Группе 2) плюс Соединение 6 или бикалютамид (AstraZeneca) п.о. в PEGTW QD. (в интервале доз).
По окончании 3-дневного лечения животных умерщвляют и взвешивают вентральную простату и семенные пузырьки. Мозг и сыворотку собирают для определения концентрации соединения. Сначала вес половых органов выражают как мг на 100 г веса тела (стандартизация), а увеличение веса органа, вызванное ТР, рассматривают как максимальное увеличение (100%).
6. Результаты
Прибавка и потеря в весе полового органа отражает то, что изменения числа клеток (содержание ДНК) и клеточная масса (содержание белка) зависят от концентрации андрогена в сыворотке. Следовательно, определения сырого веса (во влажном состоянии) органа достаточно для того, чтобы показать биоактивность андрогенов и антагонистов андрогенов. Максимальное увеличение веса вентральной простаты и семенных пузырьков составляет 3-5 раз соответственно, когда животным дают дозу 1 мг/кг/день тестостерона пропионата (ТР) в течение 3 дней.
Одновременное введение либо Соединений 1-6, либо бикалютамида ТР ингибирует опосредованное тестостероном увеличение веса VP и SV в зависимости от дозы.
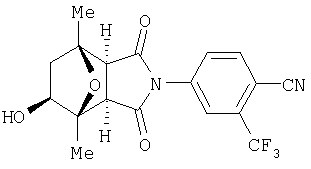
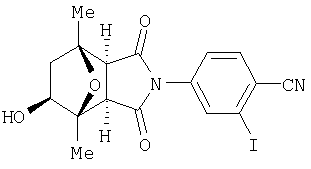
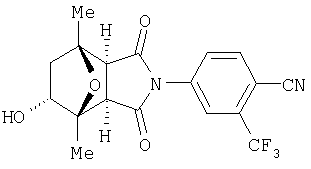
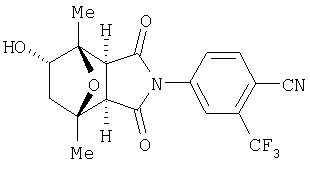
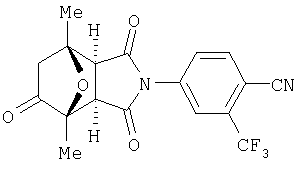
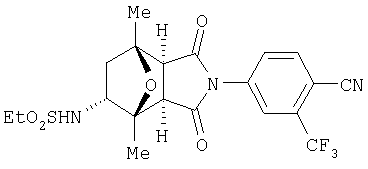
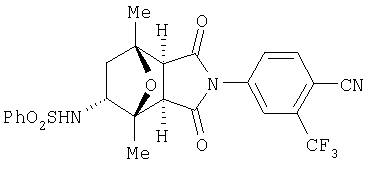
Ниже приводятся данные о биологической активности (значения IC50) ряда соединений согласно настоящему изобретению.
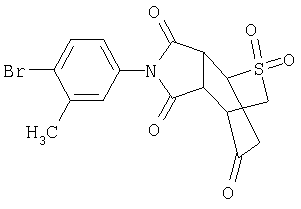
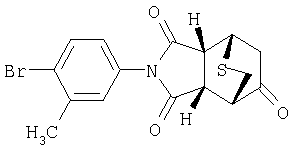
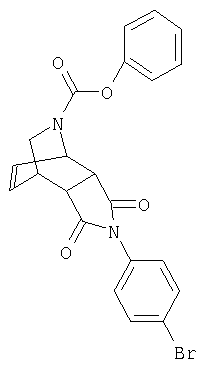
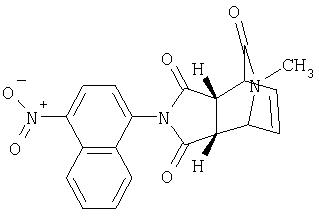
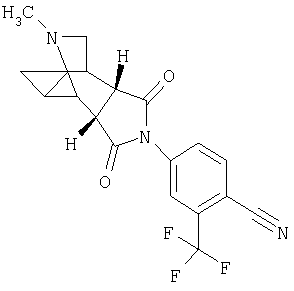
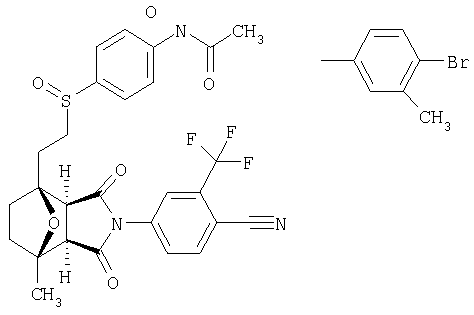
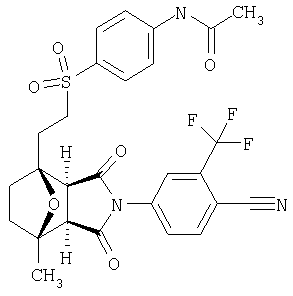
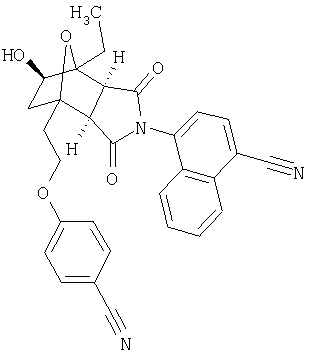
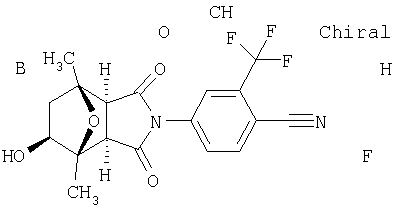
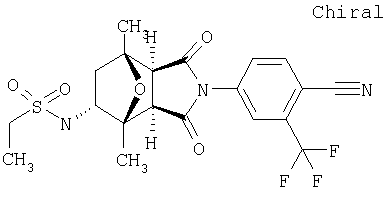
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ КОНДЕНСИРОВАННОЕ ЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2815814C1 |
| ПРОИЗВОДНЫЕ СОРДАРИНА И ОБЛАДАЮЩИЙ ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ НА ИХ ОСНОВЕ | 1995 |
|
RU2152398C1 |
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| ИМИДНЫЕ МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2738833C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ДИГИДРОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2296766C2 |
| АЛКИЛЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКИЕ АМИНЫ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ЛИГАНДОВ D3-ДОПАМИНА | 1997 |
|
RU2185372C2 |
| ОКТАГИДРО КОНДЕНСИРОВАННЫЕ АЗАДЕКАЛИНОВЫЕ МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНОГО РЕЦЕПТОРА | 2014 |
|
RU2674983C1 |
| ПРОИЗВОДНЫЕ АРИЛМЕТОКСИ ИЗОИНДОЛИНА И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ИХ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2567753C2 |
| 5-ЗАМЕЩЕННЫЕ ИЗОИНДОЛИНОВЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2448101C2 |
| МЕТИЛ, ХЛОР И НИТРОПРОИЗВОДНЫЕ N-{3, 5-ДИОКСО-4-АЗАТЕТРАЦИКЛО[5.3.2.0.0]ДОДЕЦ-11-ЕН-4-ИЛ}-2-ГИДРОКСИБЕНЗАМИДА-ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ, ИНГИБИРУЮЩИЕ РЕПЛИКАЦИЮ РАЗЛИЧНЫХ ВИДОВ ОРТОПОКСВИРУСОВ | 2010 |
|
RU2440983C1 |
Настоящее изобретение относится к конденсированным гетероциклическим сукцинимидным соединениям формулы I, их фармацевтически приемлемым солям, сольватам или изомерам.
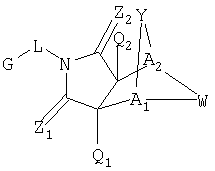
G представляет собой моно или полицикличную арильную или гетероциклическую группу, возможно замещенную в одном или более положениях;
L представляет собой связь, (CR7R7')n (где n=1 и R7 и R7' независимо представляют собой Н, алкил или замещенный алкил) или -CH2-NH-;
Z1 представляет собой О;
Z2 представляет собой О;
A1 и А2 независимо представляют собой CR7 или вместе с R7 из группы W, гетероциклическое кольцо, в котором в качестве гетероатома кислород;
Y представляет собой -О-, -SO-, -N(V2)-, -CH2-N(V2)-, -СО-N(алкил)-, -CH2-S-, -CH2-SO2-;
V2 представляет собой водород, алкил, арилалкил, -СО-алкил, -СО-O-арил, -СО-O-арилалкил;
W представляет собой CR7R7'-CR7R7', CR7R7'-C=O, NR9-, CR7R7', N=CR8, N=N, NR9-NR9', циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, арил или замещенный арил, где когда W не является NR9-CR7R7', N=CR8, N=N, NR9-NR9' или гетероцикло или замещенный гетероцикло, тогда Y должен быть -О-, -CH2-S-, -SO-, -CH2-SO2-, N(V2)-, или CH2-N(V2),
Q1 и Q2 представляют собой Н;
Описаны также способ получения промежуточных соединений в синтезе соединений I, применение последних для изготовления средств, моделирующих функцию рецептора ядерного гормона. Соединения I могут быть использованы для лечения рака простаты. 5 н.з. и 3 з.п. ф-лы, 11 табл.
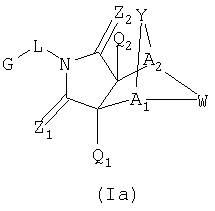
их фармацевтически приемлемые соли, сольваты или изомер, где радикалы имеют следующие значения, и в каждом случае являются независимо выбранными из:
G представляет собой моно или полицикличную арильную или гетероциклическую группу, возможно замещенную в одном или более положениях;
L представляет собой связь, (CR7R7')n (где n=1 и R7 и R7' независимо представляют собой Н, алкил или замещенный алкил) или -CH2-NH-;
Z1 представляет собой О;
Z2 представляет собой О;
A1 и А2 независимо представляют собой CR7, где R7 (i) представляет собой водород, алкил или замещенный алкил, арилалкил или замещенный арилалкил, алкенил или замещенный алкенил, арил или замещенный арил, гетероцикло или замещенный гетероцикло, гетероциклоалкил или замещенный гетероциклоалкил, где предпочтительными заместителями являются одна или более групп, выбранных из V1 или (ii) формирует, вместе с R7 из группы W, гетероциклическое кольцо, в котором в качестве от 1 до 4 гетероатомов кислород;
V1 представляет собой ОН, CN, галоген, -O-арил, -O-замещенный арил, -O-гетероцикло, -О-замещенный гетероцикло, -O-СО-алкил, -O-СО-замещенный алкил, -О-(алкилсилил), -O-арилалкил, -O-замещенный арилалкил, -O-СО-арилалкил, -O-СО-замещенный арилалкил, -O-СО-арил, -O-СО-замещенный арил, -O-СО-гетероцикло, -O-СО-замещенный гетероцикло, -S-(необязательно замещенный арил)-NH-СО-(необязательно замещенный алкил), -SO-(необязательно замещенный арил)-NH-СО-(необязательно замещенный алкил), -SO2-(необязательно замещенный арил)-NH-СО-(необязательно замещенный алкил), -NH-SO2-арил, -NH-SO2-замещенный арил, -NH-CO-O-алкил, -NH-CO-O-замещенный алкил, -NH-CO-алкил, -NH-CO-замещенный алкил, -NH-CO-арил, -NH-CO-замещенный арил, -NH-СО-(необязательно замещенный арилалкил), -N(необязательно замещенный алкил)(необязательно замещенный арил), -N(необязательно замещенный алкил)(необязательно замещенный арилалкил), -СОН, -СООН, -СО-O-алкил, -СО-O-замещенный алкил, -СО-O-необязательно замещенный арилалкил, -СО-арил, -СО-замещенный арил, -O-CO-NH-арил, -O-CO-NH-замещенный арил, -CO-NH-арил, -CO-NH-замещенный арил, -CO-NH-арилалкил, -CO-NH-замещенный арилалкил, -O-(необязательно замещенный арил)-NH-СО-(необязательно замещенный алкил);
Y представляет собой -О-, -SO-, -N(V2)-, -CH2-N(V2)-, -СО-N-(алкил)-, -CH2-S-, -CH2-SO2-;
V2 представляет собой водород, алкил, арилалкил, -СО-алкил, -СО-O-арил, -СО-O-арилалкил;
W представляет собой CR7R7'-CR7R7', CR7R7'-C=O, NR9-, CR7R7', N=CR8, N=N, NR9-NR9', циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, арил или замещенный арил, где когда W не является NR9-CR7R7', N=CR8, N=N, NR9-NR9' или гетероцикло или замещенный гетероцикло, тогда Y должен быть -О-, -CH2-S-, -SO-, -CH2-SO2-, N(V2)-, или CH2-N(V2),
Q1 и Q2 представляют собой Н;
R1 и R1' каждый независимо представляют собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил;
R2 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил;
R3 и R3' каждый независимо представляют собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, галоген, CN, гидроксиамин, гидроксиамид, алкокси или замещенный алкокси, амино, NR1R2, тиол, алкилтио или замещенный алкилтио;
R4 представляет собой Н, алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, R1C=O, R1NHC=O, SO2OR1 или SO2NR1R1;
R5 представляет собой алкил или замещенный алкил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, R1C=O, R1NHC=O, SO2R1, SO2OR1 или SO2NR1R1';
R7 и R7' каждый независимо представляют собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, галоген, CN, OR1, нитро, гидроксиламин, гидроксиламид, амино, NHR4, NR2R5, NOR1, тиол, алкилтио или замещенный алкилтио, R1C=O, R1OC=O, R1NHC=O, SO2R1, SOR1, РО3R1R1', R1R1'NC=O, C=OSR1, SO2R1, SO2OR1 или SO2NR1R1'; или, когда А1 или А2 содержат группу R7 и W содержит группу R7, эти группы R7 вместе формируют гетероциклическое кольцо;
R8 представляет собой Н, алкил или замещенный алкил, алкенил или замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, нитро, галоген, CN, OR1, амино, NHR4, NR2R5, NOR1, алкилтио или замещенный алкилтио, C=OSR1, R1OC=O, R1C=O, R1NHC=O, R1R1'NC=O, SO2OR1, S=OR1, SO2R1, РО3R1R1', или SO2NR1R1'; и
R9 и R9' каждый независимо представляют собой Н, алкил или замещенный алкил, алкенил, замещенный алкенил, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, гетероцикло или замещенный гетероцикло, циклоалкилалкил или замещенный циклоалкилалкил, циклоалкенилалкил или замещенный циклоалкенилалкил, гетероциклоалкил или замещенный гетероциклоалкил, арил или замещенный арил, арилалкил или замещенный арилалкил, CN, ОН, OR1, R1C=O, R1OC=O, R1NHC=O, SO2R1, SO2OR1, или SO2NR1R1';
при условии, что
(1) когда Y является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W является -СН2-СН2-, и один из A1 и А2 представляет собой СН, а другой -CR7, тогда G-L не является незамещенным фенилом;
(2) когда Y является -O-, Q1 и Q2 являются водородом, Z1 и Z2 являются О и один из A1 и A2 представляет собой СН и другой является С-СН3, тогда G-L не является фенилом, замещенным хлором и/или метилом;
(3) когда Y является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W является -СН2-СН2- и один из A1 и А2 является СН, а другой является С-алкилом, тогда G-L не является N-замещенным пиперазин-алкилом или N-замещенным имидазолидин-алкилом;
(4) когда Y является -О-; Q1 и Q2 являются водородом, Z1 и Z2 являются О, W является CH2-CH2, и A1 и А2 являются С-СН3, тогда G-L не является тиазолом или замещенным тиазолом;
(5) когда Y представляет собой -CH2-S-, -SO-, -CH2-SO2-, -N(V2)-, или -CH2-N(V2)-, W является CR7R7'-CR7R7', и Z1 и Z2 являются О, тогда G-L не является незамещенным фенилом;
(6) когда Y является NR7, W является незамещенным или замещенным фенилом, и Q1 и Q2 являются водородом, тогда эти соединения не включаются в формулу I;
(7) когда Y является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W является этиленоксидом и A1 и А2 являются СН, тогда G-L не является метилфенилом или хлорфенилом;
(8) соединение формулы I не является 6,10-эпитио-4Н-тиено-[3',4':5,6]циклоокт[1,2-f]изоиндол-7,9(5Н,8Н)-дионом, 8-(3,5-дихлорфенил)-6,6а,9а,10,11,12,-гексагидро-1,3,6,10-тетраметил-2,2,13-триоксидом, (6R,6aR,9aS, 10S);
(9) когда Y является -О-, Q1 и Q2 являются водородом, Z1 и Z2 являются О, W является циклопентилом, циклогексилом, 3-фенил-2-изоксазолином или CR7R7'-CR7R7', где R7 и R7' каждый независимо определен как Н и 4-бутиролактон и R7 и R7' не являются все одновременно Н и A1 и А2 являются СН, тогда G-L не является незамещенным нафтиловым кольцом или однозамещенным фенильным кольцом, где указанный заместитель является метокси, Br, Cl, NO2, метилом, этилом, СН2-фенилом, S-фенилом, или O-фенилом;
(10) когда Y является -О-, W является -СН2-СН2-, тогда по меньшей мере один A1 не является СН;
(11) соединения формулы I не являются
где термин "алкил" относится к прямому или разветвленному цепочечному алкановому (углеводородному) радикалу, содержащему от 1 до 12 атомов углерода; "замещенный алкил" относится к алкильной группе, замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями, по любому доступному месту присоединения, где заместители включают одну или более следующих групп: галоген, алкокси, алкилтио, гидрокси, карбокси, алкоксикарбонил, алкилкарбонилокси, амино,карбамоил или замещенный карбомоил, карбамат или замещенный карбамат, мочевину или замещенную мочевину, амидинил или замещенный амидинил, тиол, арил, гетероцикл, циклоалкил, гетероциклоалкил, -S-арил, -S-гетероцикл, -S=O-арил, -S=O-гетероцикл, арилалкил-O-, -S(O)2-арил, -S(O)2-гетероцикл, -NHS(O)2-арил, -NHS(O)2-гетероцикл, -NHS(O)2NH-арил, -NHS(O)2-NH-гетероцикл, -P(O)2-арил, -Р(O)2-гетероцикл, -NHP(O)2-арил, -NHP(O)2-гетероцикл, -NHP(O)2NH-арил, -NHP(O)2NH-гетероцикл, -O-арил, -O-гетероцикл, -NH-арил, -NH-гетероцикл, -NHC=O-арил, -NHC=O-алкил, -NHC=O-гетероцикл, -ОС=O-арил, -ОС=O-гетероцикл, -NHC=ONH-арил, -NHC=ONH-гетероцикл, -ОС=OO-арил, -ОС=OO-гетероцикл, -ОС=ONH-арил, -ОС=ONH-гетероцикл, -NHC=OO-арил, -NHC=OO-гетероцикл, -NHC=OO-алкил, -С=ONH-арил, -С=ONH-гетероцикл, -С=OO-арил, -С=OO-гетероцикл, -N(алкил)S(O)2-арил, -N(алкил)S(O)2-гетероцикл, N(алкил)S(O)2NH-арил, -N(алкил)S(O)2NH-гетероцикл, -N(алкил)Р(O)2-арил, -N(алкил)P(O)2-гетероцикл, -N(алкил)P(O)2NH-арил, N(алкил)P(O)2NH-гетероцикл, -N(алкил)-арил, -N(алкил)-гетероцикл, -N(алкил)С=O-арил, -N(алкил)C=O-гетероцикл, -N(алкил)С=ONH-арил, -N(алкил)С=ONH-гетероцикл, -ОС=ON(алкил)-арил, -OC=ON(алкил)-гетероцикл, -N(алкил)С=OO-арил, -N(алкил)С=OO-гетероцикл, -С=НА(алкил)-арил, -С=ON(алкил)-гетероцикл, -NHS(O)2N(алкил)-арил, -NHS(O)2N(алкил)-гетероцикл, -NHP(J)2(алкил)-арил, NHP(O)2N(алкил)-гетероцикл, NHC=ON(алкил)-арил, -NHC=ON(алкил)-гетероцикл, N(алкил)S(O)2N(алкил)-арил, -N(алкил)S(O)2N(алкил)-гетероцикл, -N(алкил)P(O)2N(алкил)-арил, -N(алкил)P(O)2N(алкил)-гетероцикл, -N(алкил)С=ON(алкил)-арил, и -N(алкил)С=ON(алкил)-гетероцикл, где, в каждом случае, группы, такие как "алкил", "арил" и "гетероцикл" могут сами быть необязательно замещенными;
алкильные заместители также включают группы, такие как "Т" и "Т-R'2", где Т определяется как азот, кислород или азот или серосодержащая группа, R'2 является Н, алкилом или замещенным алкилом, алкенилом или замещенным алкенилом, циклоалкилом или замещенным циклоалкилом, циклоалкенилом или замещенным циклоалкенилом, гетероцикло или замещенным гетероцикло, циклоалкилалкилом или замещенным циклоалкилалкилом, циклоалкенилалкилом или замещенным циклоалкенилалкилом, гетероциклоалкилом или замещенным гетероциклоалкилом, арилом или замещенным арилом, арилалкилом или замещенным арилалкилом, галогена, CN, OR1, нитро, гидроксиламином, гидроксиламидом, амино, NHR4, NR2R5, NOR1, тиолом, алкилтио или замещенным алкилтио, R1C=O, R1OC=О, R1NHC=О, SO2R1, SOR1, PO3R1R1, R1R1'NC=О, С=OSR1, SO2R', SO2OR1, или SO2NR1R1;
термин "алкенил" относится к прямому или разветвленному цепочечному углеводородному радикалу, содержащему от 2 до 12 атомов углерода и по крайней мере одну углерод-углеродную двойную связь; "замещенный алкенил" относится к алкенильной группе, замещенной от 1 до 4 заместителями, в любом доступном месте присоединения, где заместители выбираются из алкила или замещенного алкила, а также из групп, упомянутых выше, в качестве алкильных заместителей;
термин "циклоалкил" относится к полностью насыщенной циклической углеводородной группе, содержащей от 1 до 4 кольца и от 3 до 8 углеродов в кольце; "замещенный циклоалкил" относится к циклоалкильной группе, замещенной от 1 до 4 заместителями, в любом доступном месте присоединения, где заместители выбираются из нитро, циано, алкил или замещенный алкил, а также групп, упомянутых выше, в качестве алкильных заместителей, и водорода, алкила или замещенного алкила, алкенила или замещенного алкенила, алкинила или замещенного алкинила, галогена, циклоалкила или замещенного циклоалкила, циклоалкенила или замещенного циклоалкенила, арила или замещенного арила, гетероцикло или замещенного гетероцикло, арилалкила или замещенного арилалкила, гетероциклоалкила или замещенного гетероциклоалкила, CN, R1OC=O, R1C=O, R1HNC=O, R1R2NC=O, HOCR3R3', нитро, R1OCH2, R1O, NH2, NR4R5, S=OR1, SO2R1, SO2NR1R1', (R1)(R1')P=O или (R1')(NHR1)P=O и спиро - присоединенного или конденсированного циклоалкенила или замещенного циклоалкенила;
термин "циклоалкенил" относится к частично ненасыщенной циклической углеводородной группе, содержащей от 1 до 4 колец и от 3 до 8 углеродов в кольце; "замещенный циклоалкенил" относится к циклоалкенильной группе, замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями, в любом доступном месте присоединения, где заместители выбираются из нитро, циано, алкил или замещенный алкил, а также их групп, упомянутых выше в качестве алкильных заместителей, и водорода, алкила или замещенного алкила, алкенила или замещенного алкенила, алкинила или замещенного алкинила, галогена, циклоалкила или замещенного циклоалкила, циклоалкенила или замещенного циклоалкенила, арила или замещенного арила, гетероцикло или замещенного гетероцикло, арилалкила или замещенного арилалкила, гетероциклоалкила или замещенного гетероциклоалкила, CN, R1OC=O, R1C=O, R1HNC=O, R1R2NC=O, HOCR3R3', нитро, R1OCH2, R1O, NH2, NR4R5, S=OR1, SO2R1, SO2NR1R1', (R1)(R1')P=O или (R1')(NHR1)P=O и спиро - присоединенного или конденсированного циклоалкенила или замещенного циклоалкенила;
термины "алкокси" или "алкилтио" относятся к алкильным группам, как описано выше, связанным через кислородный мостик (-O-) или мостик из серы (-S-), соответственно;
термины "замещенный алкокси" или "замещенный алкилтио" относится к замещенным алкильным группам, как описано выше, связанным через кислородный мостик или мостик из серы, соответственно;
термин "алкоксикарбонил" относится к алкокси группе, связанной через карбонильную группу;
термин "алкилкарбонил" относится к алкильным группам, связанным через карбонильную группу;
термин "алкилкарбонилокси" относится к алкилкарбонильной группе, связанной через кислородный мостик;
термины "арилалкил", "замещенный арилалкил," "циклоалкилалкил," "замещенный циклоалкилалкил," "циклоалкенилалкил", "замещенный циклоалкенилалкил", "гетероциклоалкил" и "замещенный гетероциклоалкил" относятся к арилу, циклоалкилу, циклоалкенилу и гетероциклогруппе, связанным через алкильные группы, замещенные арильной, циклоалкильной, циклоалкенильной или гетероцикло и/или алкильной группой, которая обозначена как "замещенная";
термин "арил" относится к циклическим, ароматическим углеводородным группам, которые имеют от 1 до 5 ароматических колец, ароматические кольца арильной группы могут быть объединены в одной или сконденсированы, "замещенный арил" относится к арильной группе, замещенной с помощью 1, 2, 3, 4 или 5 заместителей, в любом месте присоединения, где заместители выбираются из нитро, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, циано, алкил-S(O)m- (m=0, 1 или 2), алкил или замещенный алкил, а также из групп, упомянутых выше, как примеры алкильных заместителей, и водорода, алкила или замещенного алкила, алкенила или замещенного алкенила, алкинила или замещенного алкинила, галогена, циклоалкила или замещенного циклоалкила, циклоалкенила или замещенного циклоалкенила, арила или замещенного арила, гетероцикло или замещенного гетероцикло, арилалкила или замещенного арилалкила, гетероциклоалкила или замещенного гетероциклоалкила, CN, R1OC=O, R1C=O, R1HNC=O, R1R2C=O, HOCR3R3', нитро, R1OCH2, R1O, NH2, NR4R5, S=OR1, SO2R1, SO2NR1R1', (R1)(R1')P=O или (R1)(NHR1)P=O и групп конденсированного гетероцикло или циклоалкенила, либо замещенного гетероцикло или циклоалкенила; "замещенный карбамоил," "замещенный карбамат," "замещенная мочевина" и "замещенный амидинил" относятся к карбамоильной, карбаматной, мочевинной или амидинильной группам, как описано выше, в которых одна или больше водородных групп являются замененные органическим компонентом (таким как указан выше);
термины "гетероцикл", "гетероциклический" и "гетероцикло" относится к полностью насыщенным или частично или полностью ненасыщенным, включая ароматические от 3 до 7 членные моноциклические, от 7 до 11 членные бициклические или от 10 до 16-членные трициклические кольцевые системы, которые имеют по крайней мере один гетероатом по крайней мере в одном углеродсодержащем кольце, причем каждое кольцо гетероциклической группы, содержащее гетероатом, может иметь 1, 2, 3, или 4 гетероатомов, выбранных из атомов азота, атомов кислорода и/или атомов серы, где гетероатомы азота и серы могут необязательно быть окисленными и гетероатомы азота могут необязательно быть кватернизированы;
"замещенный гетероцикл," "замещенный гетероциклический" и "замещенный гетероцикло" относится к гетероциклам, гетероциклическим или гетероциклогруппам, замещенным одним или более заместителями, предпочтительно от 1 до 4 заместителями, в любом доступном месте присоединения, где заместители включают, без ограничения, циклоалкил или замещенный циклоалкил, циклоалкенил или замещенный циклоалкенил, нитро, оксо (то есть, =O), циано, алкил-S(O)m- (m=0, 1 или 2), алкил или замещенный алкил, а также группы, которые упомянуты выше, как заместители алкила, и водорода, алкила или замещенного алкила, алкенила или замещенного алкенила, алкинила или замещенного алкинила, галогена, циклоалкила или замещенного циклоалкила, циклоалкенила или замещенного циклоалкенила, арила или замещенного арила, гетероцикло или замещенного гетероцикло, арилалкила или замещенного арилалкила, гетероциклоалкила или замещенного гетероциклоалкила, CN, R1OC=O, R1C=O, R1HNC=O, R1R2NC=O, HOCR3R3', нитро, R1OCH2, R1O, NH2, NR4R5, S=OR1, SO2R1, SO2NR1R1', (R1)(1R1')P=O или (R1')(NHR1)P=O.
(3аα,4α,7α,7аα)-2-(4-Бром-3-метилфенил)тетрагидро-4,7-этанотиопирано[3,4-с]пиррол-1,3,8(2Н,4Н)-трион;
(3аα,4α,7α,7аα)-2-(4-Бром-3-метилфенил)тетрагидро-4,7-этанотиопирано[3,4-с]пиррол-1,3,8(2Н,4Н)-трион 5,5-диоксид;
(3аα,4α,7α,7аα)-2-(3-Хлорфенил)гексагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-4-[(Ацетилокси)метил]-3а,4,7,7а-тетрагидро-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-4-[(Ацетилокси)метил]-гексагидро-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-3а,4,7,7а-Тетрагидро-5-(гидроксиметил)-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-3а,4,7,7а-Тетрагидро-5-(гидроксиметил)-4-метил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[3,5-Бис(трифторметил)фенил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-2-(4-Бромфенил)октагидро-1,3-диоксо-4,7-этено-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фениловый эфир;
(3аα,4α,7α,7аα)-2-(4-Бромфенил)октагидро-1,3-диоксо-4,7-этено-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фенилметиловый эфир;
(3аα,4α,7α,7аα)-Гексагидро-2-[3-(трифторметил)фенил]-4,7-этано-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дион трифторацетат;
(3аα,4α,7α,7аα)-5-Ацетилгексагидро-2-[3-(трифторметил)фенил]-4,7-этано-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-5-Бензоилгексагидро-2-[3-(трифторметил)фенил1]-4,7-этано-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-5-метил-2-[3-(трифторметил)фенил]-4,7-этано-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-5-(фенилметил)-2-[3-(трифторметил)фенил]-4,7-этано-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дион трифторацетат;
(3аα,4α,7α,7аα)-Гексагидро-5-пропил-2-[3-(трифторметил)фенил]-4,7-этано-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дион трифторацетат;
(3аα,4α,4аβ,5аβ,6α,6аα)-2-[4-Циано-3-(трифторметил)фенил]декагидро-1,3-диоксо-4,6-(иминометано)циклопроп[f]изоиндол-7-карбоновой кислоты фенилметиловый эфир;
(3аα,4α,4аβ,5аβ,6α,6аα)-4-[Декагидро-1,3-диоксо-4,6-(иминометано)циклопроп[f]изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4α,4аβ,5аβ,6а,6аα)-4-[Декагидро-7-метил-1,3-диоксо-4,6-(иминометано)циклопроп[f]изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-N-[4-[[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]тио]фенил]ацетамид;
(3аα,4β,7β,7аα)-N-[4-[[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]сульфинил]фенил]ацетамид;
(3aα,4β,7β,7aα)-N-[4-[[2-[2-[4-циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]сульфонил]фенил]ацетамид;
(3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-N-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]бензолсульфонамид;
(3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4α,7α,7аα)- и (3аα,4β,7β,7аα)-N-[4-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]фенил]ацетамид;
(3аα,4α,7α,7аα)-Гексагидро-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(1аα,2β,2аα,5аα,6β,6аα)-Гексагидро-4-(2-нафталинил)-2,6-эпокси-3Н-оксирено[f]изоиндол-3,5(4Н)-дион;
(3аα,4α,7α,7аα)-2-[4-Бром-3-(трифторметил)фенил]-3а,4,7,7а-тетрагидро-4,7-диметил-4,7-эпитио-1Н-изоиндол-1,3(2Н)-дион 8-оксид;
(3аα,4α,7α,7аα)-2-[4-Бром-3-(трифторметил)фенил]-3а,4,7,7а-тетрагидро-4,7-эпитио-1Н-изоиндол-1,3(2Н)-дион 8-оксид;
(3аα,4α,7α,7аα)-Гексагидро-2-[3-(трифторметил)фенил]-4,7-имино-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)- и (3аα,4α,7α,7аα)-3а,4,7,7а-тетрагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-тетрагидро-5-метил-2-(4-нитро-1-нафталинил)-4,7-этено-1Н-пирроло[3,4-с]пиридин-1,3,6(2Н,5Н)-трион;
(3аα,4α,7α,7аα)-4-[4-[2-(4-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[4-(2-Бромэтил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4α,7α,7аα)-Гексагидро-4,7-диметил-2-(3-метил-4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2-Фторфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[3-Хлор-4-(4-морфолинил)фенил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2,3-Дигидро-1Н-инден-5-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Бром-1-нафталинил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Хлор-1-нафталинил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(5-Амино-1-нафталинил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-2-(7-гидрокси-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-2-(1Н-индол-5-ил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(1Н-индазол-6-ил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(1,3-Бензодиоксол-5-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-Амино-3-(трифторметил)фенил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3-Хлор-4-йодфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(8-хинолинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2,3-Дигидро-1,4-бензодиоксин-6-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-[2-оксо-4-(трифторметил)-2Н-1-бензопиран-7-ил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(4-метил-2-оксо-2Н-1-бензопиран-7-ил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2,5-Диметокси-4-нитрофенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2,3,5,6-тетрафтор-4-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(3аα,4β,7β,7аα)-Гексагидро-2-(2,4,5-трифторфенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2,4,5-трихлорфенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2-Амино-4,5-дихлорфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,4-Дифторфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-1-Ацетил-2,3-дигидро-6-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-1Н-индол;
(3аα,4β,7β,7аα)-2-(3-Хлор-4-фторфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,4-Дихлорфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-2-(3,4,5-трихлорфенил)-4,7-эпокси-1N-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3-Хлор-4-метоксифенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3-Хлор-4-метилфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2-метил-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Хлор-3-метилфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,4-Диметилфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-Бром-3-(трифтормети)фенил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Бром-3-метилфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Фтор-3-нитрофенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-фтор-3-(трифторметил)фенил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Хлор-3-нитрофенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-Хлор-3-(трифторметил)фенил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Хлор-2-метокси-5-метилфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Амино-3-нитрофенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(4-метил-3-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,4-Диметоксифенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(3-гидрокси-4-метоксифенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(4-метил-5-нитро-2-пиридинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-Хлор-4-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-а-фенилбензолацетонитрил;
(3аα,4β,7β,7аα)-Гексагидро-2-(2-метокси-3-дибензофуранил)-4,7-эпокси-1H-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2,3,4-трифторфенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2,3-Дигидро-2-метил-1,3-диоксо-1Н-изоиндол-5-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Бром-2,3,5,6-тетрафторфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2-гидрокси-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[2,5-Дихлор-4-(1Н-пиррол-1-ил)фенил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-[4-(метоксиметил)-2-оксо-2Н-1-бензопиран-7-ил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(6-Бензотиазолил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-Метокси-4-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензойной кислоты метиловый эфир;
(3аα,4β,7β,7аα)-2-Метил-5-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(3аα,4β,7β,7аα)Гексагидро-2-(2-оксо-2Н-1-бензопиран-6-ил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2,3,5,6-тетраметил-4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2,4,5-триметилфенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Фтор-3-метилфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(3-метокси-4-метилфенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-N-Этил-2-метил-5-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-N-фенилбензолсульфонамид;
(3аα,4β,7β,7аα)-2,6-Дибром-4-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензолсульфонамид;
(3аα,4β,7β,7аα)-2,4-Диметил-6-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-3-пиридинкарбонитрил;
(3аα,4β,7β,7аα)-2-(2,3-Диметил-1Н-индол-5-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3-Дибензофуранил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2'гидрокси[1,1':3,1''-терфенил]-5-ил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(5,6,7,8-тетрагидро-3-гидрокси-2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2,3-Дигидро-1Н-индол-6-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(1,3-Дигидро-2,2-диоксидобензо[с]тиофен-5-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2-гидрокси-4,5-диметилфенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2,3-Дигидро-2,2,3,3-тетрафтор-1,4-бензодиоксин-6-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(1Н-индазол-5-ил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Амино-2,3,5,6-тетрафторфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Бром-3-хлорфенил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(5-гидрокси-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-(Октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-2-(4-Морфолинил)-5-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензойной кислоты метиловый эфир;
(3аα,4β,7β,7аα)-2-Фтор-5-(октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(2аα,4β,7β,7аα)-Гексагидро-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(9-Этил-9Н-карбазол-3-ил)гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[1,2-Дигидро-8-метил-2-оксо-4-(трифторметил)-7-хинолинил]гексагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(2аα,4α,7α,7аα)-Гексагидро-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Бром-3-метилфенил)-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-3а,4,7,7а-тетрагидро-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(9-Этил-9Н-карбазол-3-ил)-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-Фтор-3-(трифторметил)фенил]-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[1,2-Дигидро-8-метил-2-оксо-4-(трифторметил)-7-хинолинил]-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-4-[(Ацетилокси)метил]-2-(4-бром-3-метилфенил)-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[(Ацетилокси)метил]-2-(4-бром-3-метилфенил)-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-(Бензо[b]тиофен-3-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-[4-нитро-3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-(1,3,3а,4,7,7а-Гексагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-1-нафталинкарбонитрил;
(3аα,4β,7α,7аα)-Гексагидро-4-метил-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Бром-3-метилфенил)гексагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4-метил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,5-Дихлорфенил)гексагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3-Хлор-4-фторфенил)гексагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-Метокси-4-(октагидро-1,3-диоксо-4-метил-4,7-эпокси-2Н-изоиндол-2-ил)-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-Гексагидро-4-метил-2-[4-нитро-3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-[4-(1Н-имидазол-1-ил)фенил]-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[3-Хлор-4-(2-тиазолил)фенил]гексагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-2-(3,5-Дихлорфенил)гексагидро-4,7-имино-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-2-(4-Бром-1-нафталинил)гексагидро-4,7-имино-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-2-(4-Бром-3-метилфенил)гексагидро-4,7-имино-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Гексагидро-2-(4-нитро-1-нафталинил)-4,7-имино-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-8-Ацетил-2-(3,5-дихлорфенил)гексагидро-4,7-имино-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-Октагидро-1,3-диоксо-2-[3-(трифторметил)фенил]-4,7-этано-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фениловый эфир;
(3аα,4α,7α,7аα)-4-(Октагидро-1,3-диоксо-4,7-этано-2Н-пирроло[3,4-с]пиридин-2-ил)-1-нафталинкарбонитрил;
(3аα,4α,7α,7аα)-4-(Октагидро-5-метил-1,3-диоксо-4,7-этано-2Н-пирроло[3,4-с]пиридин-2-ил)-1-нафталинкарбонитрил;
(3аα,4α,7α,7аα)-2-(4-Циано-1-нафталинил)октагидро-1,3-диоксо-4,7-этено-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фенилметиловый эфир;
(3аα,4α,7α,7аα)-4-(Октагидро-1,3-диоксо-4,7-этано-2Н-пирроло[3,4-с]пиридин-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4α,7α,7аα)-4-(Октагидро-5-метил-1,3-диоксо-4,7-этано-2Н-пирроло[3,4-с]пиридин-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4α,7α,7аα)-2-[4-Циано-3-(трифторметил)фенил]октагидро-1,3-диоксо-4,7-этено-5Н-пирроло[3,4-с]пиридин-5-карбоновой кислоты фенилметиловый эфир;
(3аα,4α,7α,7аα)-2-[4-Бром-3-(трифторметил)фенил]тетрагидро-5-метил-4,7-этено-1Н-пирроло[3,4-с]пиридин-1,3,6(2Н,5Н)-трион;
(3аα,4α,7α,7аα)-тетрагидро-5-метил-2-[3-(трифторметил)фенил]-4,7-этено-1Н-пирроло[3,4-с]пиридин-1,3,6(2Н,5Н)-трион;
(3аα,4α,7α,7аα)-тетрагидро-5-метил-2-(2-нафталинил)-4,7-этено-1Н-пирроло[3,4-с]пиридин-1,3,6(2Н,5Н)-трион;
(1аα,2β,2aα,5аα,6β,6аα)-Гексагидро-4-[3-(трифторметил)фенил]-2,6-эпокси-3Н-оксирено[f]изоиндол-3,5(4Н)-дион;
(1аα,2β,2аα,5аα,6β,6аα)-4-(3,5-Дихлорфенил)гексагидро-2,6-эпокси-3Н-оксирено[f]изоиндол-3,5(4Н)-дион;
(1аα,2β,2аα,5аα,6β,6аα)-Гексагидро-4-(4-нитро-1-нафталинил)-2,6-эпокси-3Н-оксирено[f]изоиндол-3,5(4Н)-дион;
(1аα,2β,2аα,5аα,6β,6аα)-4-(3,4-Дихлорфенил)гексагидро-2,6-эпокси-3Н-оксирено[f]изоиндол-3,5(4Н)-дион;
2-[4-(4-Бромфенокси)фенил]-3а,4,7,7а-тетрагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
3а,4,7,7а-Тетрагидро-2-(2-метоксифенил)-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-;
[(1,2,3,3а,7,7а-Гексагидро-2-фенила-4,7-эпокси-4Н-изоиндол-4-ил)метил]карбаминовой кислоты (3,5-диметоксифенил)метиловый эфир;
2-(2,4-Диметилфенил)-3а,4,7,7а-тетрагидро-4-(гидроксиметил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
2-(1,3-Бензодиоксол-5-ил)-3а,4,7,7а-тетрагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
4-[Бис(ацетилокси)метил]-2-(3-бромфенил)-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
N-[[1,2,3,3а,7,7а-Гексагидро-2-(2,4,6-триметилфенил)-4,7-эпокси-4Н-изоиндол-4-ил]метил]-2,2-диметилпропанамид;
3а,4,7,7а-Тетрагидро-4-(гидроксиметил)-2-[2-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
3а,4,7,7а-Тетрагидро-4-(гидроксиметил)-2-(1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
2-Хлор-5-(1,3,3а,4,7,7а-гексагидро-4,7-диметил-4,7-эпокси-2Н-изоиндол-2-ил)бензойной кислоты метиловый эфир;
4-[Бис(ацетилокси)метил]-2-(4-бром-2-нитрофенил)-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
3а,4,7,7а-тетрагидро-4-метил-2-(4-метил-3-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
2-[2-Хлор-5-(трифторметил)фенил]-3а,4,7,7а-тетрагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
2-[4-Хлор-3-(трифторметил)фенил]-3а,4,7,7а-тетрагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
2-(1,3,3а,4,7,7а-Гексагидро-4-метил-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
2-(4-Фторфенил)-3а,4,7,7а-тетрагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
2,2,2-Трифтор-N-[(1,2,3,3а,7,7а-гексагидро-2-фенила-4,7-эпокси-4Н-изоиндол-4-ил)метил]ацетамид;
3а,4,7,7а-Тетрагидро-4,7-диметил-2-(4-метил-3-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
2-Хлор-5-[1,3,3а,4,7,7а-гексагидро-4-(гидроксиметил)-4,7-эпокси-2Н-изоиндол-2-ил]бензойная кислота;
3а,4,7,7а-Тетрагидро-4,7-диметил-2-(4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
3а,4,7,7а-Тетрагидро-2-(2-меркаптофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
3а,4,7,7а-Тетрагидро-2-[2-[(фенилметил)тио]фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
[[2-(4-Хлорфенил)-1,2,3,3а,7,7а-гексагидро-4,7-эпокси-4Н-изоиндол-4-ил]метил]карбаминовая кислота 2-метилпропил эфир;
4-(1,1-Диметилэтил)-N-[[1,2,3,3а,7,7а-гексагидро-2-(4-метилфенил)-4,7-эпокси-4Н-изоиндол-4 ил]метил]бензамид;
2,4-Дихлор-N-[[1,2,3,3а,7,7а-гексагидро-2-(4-нитрофенил)-4,7-эпокси-4Н-изоиндол-4-ил]метил]бензамид;
N-[[2-(4-Хлорфенил)-1,2,3,3а,7,7а-гексагидро-4,7-эпокси-4Н-изоиндол-4-ил]метил]-2,4,6-триметилбензолсульфонамид;
[(1,2,3,3а,7,7а-Гексагидро-2-фенила-4,7-эпокси-4Н-изоиндол-4-ил)метил]карбаминовой кислоты 1,1-диметилэтиловый эфир;
N-[(1,2,3,3а,7,7а-Гексагидро-2-фенила-4,7-эпокси-4Н-изоиндол-4-ил)метил]-2-феноксиацетамид;
N-[[1,2,3,3а,7,7а-Гексагидро-2-(4-нитрофенил)-4,7-эпокси-4Н-изоиндол-4-ил]метил]-2,2-диметилпропанамид;
2-(2,4-Дихлорфенокси)-N-[[1,2,3,3а,7,7а-гексагидро-2-(4-нитрофенил)-4,7-эпокси-4Н-изоиндол-4-ил]метил]ацетамид;
N-[[1,2,3,3а,7,7а-Гексагидро-2-(4-метилфенил)-4,7-эпокси-4Н-изоиндол-4-ил]метил]-3,5-диметоксибензамид;
N-[[2-(4-Хлорфенил)-1,2,3,3а,7,7а-гексагидро-4,7-эпокси-4Н-изоиндол-4-ил]метил]-2-нитробензолсульфонамид;
(3аα,4β,7β,7аα)-Гексагидро-2-[(1S)-1-фенилэтил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-[(1S)-2-гидрокси-1-фенилэтил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[(1S)-2-(Ацетилокси)-1-фенилэтил]-3а,4,7,7а-тетрагидро-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-3а,4,7,7а-тетрагидро-2-[(1S)-1-фенилэтил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-[(1R)-1-фенилэтил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[[[(Октагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)метил]амино]бензойная кислота;
(3аα,4β,7β,7аα)-Гексагидро-2-(4-морфолинилметил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)- и (3аα,4α,7α,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-(фенилметил)-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-(4-[7-[2-(4-Бромфенокси)этил]октагидро-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-7-[2-(4-йодфенокси)этил]-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-7-[2-(4-метоксифенокси)этил]-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[7-[2-(4-Этоксифенокси)этил]октагидро-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[7-[2-(4-Хлорфенокси)этил]октагидро-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]бензойной кислоты метиловый эфир;
(3аα,4β,7β,7аα)-Гексагидро-4-(2-гидроксиэтил)-7-метил-2-(3-метил-4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметокси)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-2-(3,5-Дихлорфенил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[2-(4-морфолинил)этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил, трифторацетат;
(3аα,4β,7β,7аα)-2-(5-Фтор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(5-Фтор-4-нитро-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(1,1-Диоксидобензо[b]тиофен-3-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
4-(1,3,3а,4,7,7а-Гексагидро-4,6,7-триметил-1,3-диоксо-4,7-эпокси-2Н-пирроло[3,4-с]пиридин-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-Тетрагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3,5(2Н,4Н)-трион;
(3аα,4α,7α,7аα)-Тетрагидро-4,7-диметил-2-[3-(трифторметил)фенил]-4,7-эпокси-1Н-изоиндол-1,3,5(2Н,4Н)-трион;
(3аα,4β,7β,7аα)-2-(5-Хлор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(5-Хлор-4-нитро-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-Этилгексагидро-7-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-N-(4-фторфенил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ацетамид;
(3аα,4β,7β,7аα)-Гексагидро-4-метил-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион, быстро элюируемый энантиомер;
(3аα,4β,7β,7аα)-Гексагидро-4-метил-2-(2-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион, медленно элюируемый энантиомер;
(3аα,4β,7β,7аα)-4-[4-[2-[[(4-Фторфенил)метил]метиламино]этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,5β,6β,7β,7аα)-4-(Октагидро-4,5,6,7-тетраметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил, быстро элюируемый антипод;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил, медленно элюируемый энантиомер;
(3аα,4β,5β,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,5β,7β,7аα)-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(αR)-α-Метоксибензолуксусная кислота, 2-[(3α,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил эфир;
(3аα,4β,7β,7аα)-2-(Метилтио)-4-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(3аα,4β,7β,7аα)-2-(Метилсульфинил)-4-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(3аα,4β,7β,7аα)-2-(Метилсульфонил)-4-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(3аα,4β,5β,7β,7аα)-7-[2-[[(1,1-Диметилэтил)диметилсилил]окси]этил]гексагидро-5-гидрокси-4-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,5β,7β,7аα)-Гексагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,5β,7β,7аα)-7-[2-(4-Фторфенокси)этил]гексагидро-5-гидрокси-4-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3aα,4β,5β,6β,7β,7aα)-4-(Октагидро-5,6-дигидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,5β,6β,7β,7аα)-4-(Октагидро-5,6-дигидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,5β,6β,7β,7аα)-4-[Октагидро-5,6-дигидрокси-4-(гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,5β,6β,7β,7аα)-4-[Октагидро-5,6-дигидрокси-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,5β,5аβ,8аβ,8bα)-4-(Декагидро-5-гидрокси-4-метил-1,3-диоксо-4,8а-эпокси-2Н-фуро[3,2-е]изоиндол-2-ил)-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-уксусная кислота;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-уксусная кислота, метиловый эфир;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-N-[(4-фторфенил)метил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ацетамид;
(3аα,4β,7β,7аα)-N-[2-[2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этил]-4-фторбензамид;
[3аR-(3аα,4β,7β,7аα)]-4-[Октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[Октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[4-[2-(3-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(-(3аα,4β,7β,7аα)]-4-[4-[2-(3-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(4-Фторфенил)карбаминовая кислота, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
(3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,6β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]октагидро-6-гидрокси-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,5β,7β,7аα)]-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,5β,7β,7аα)]-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]-7-этилоктагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[2-(Ацетилокси)этил]-2-(4-циано-1-нафталинил)гексагидро-7-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-(2-оксоэтил)-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аα,4β(E),7β,7аα]-4-[4-[3-(4-Цианофенил)-2-пропенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аα,4β(Z),7β,7аα]-4-[4-[3-(4-Цианофенил)-2-пропенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[4-[3-(4-Цианофенил)пропил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-[(6-Хлор-1,2-бензизоксазол-3-ил)окси]этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[2-[(6-нитро-1Н-индазол-3-ил)окси]этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,5β,7β,7аα)]-4-[7-[2-(1,2-Бензизоксазол-3-илокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,5β,7β,7аα)]-4-[7-[2-(1,2-Бензизоксазол-3-илокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,5β,7β,7аα)]-4-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,5β,7β,7аα)-N-(Октагидро-5-гидрокси-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-1,3-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил;
(3аα,4α,7α,7аα)-2-(4-Циано-1-нафталинил)октагидро-1,3-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил;
(3аα,4α,7α,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-7-[2-(4-фторфенокси)этил]октагидро-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-пропаннитрил;
(3аα,4β,7β,7аα)-2-(7-Хлор-2,1,3-бензоксадиазол-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(7-Хлор-2-метил-4-бензофуранил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(7-Хлор-2-метилбензо[b]тиофен-4-ил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
[3аα,4β(Е),7β,7аα]-4-[2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]-2-бутановая кислота, фенилметиловый эфир;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-бутановая кислота;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-N-(4-фторфенил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-бутанамид;
[3аS-(3аα,4β,5β,7β,7аα)]-4-[7-[2-(Ацетилокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,5β,7β,7аα)]-4-[Октагидро-5-гидрокси-7-(2-гидроксиэтил)-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аα,4β,7β,7аα(Е)]-4-[Октагидро-4-метил-1,3-диоксо-7-(4-оксо-4-фенила-2-бутенил)-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аα,4β,7β,7аα(Е)]-4-[Октагидро-4-метил-1,3-диоксо-7-(4-оксо-4-фенила-2-бутенил)-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-(4-[7-[2-(4-Бромфенокси)этил]октагидро-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-7-[2-(4-йодфенокси)этил]-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-7-[2-(4-метоксифенокси)этил]-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[7-[2-(4-Этоксифенокси)этил]октагидро-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[7-[2-(4-Хлорфенокси)этил]октагидро-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[2-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]бензойная кислота, метиловый эфир;
(3аα,4β,7β,7аα)-Гексагидро-4-(2-гидроксиэтил)-7-метил-2-(3-метил-4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметокси)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-2-(3,5-Дихлорфенил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(фенилметокси)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-Гексагидро-4-(2-гидроксиэтил)-7-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[2-(4-Фторфенокси)этил]гексагидро-7-метил-2-(3-метил-4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-[(трифторметил)тио]фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[2-(4-нитрофенокси)этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[2-(4-Фторфенокси)этил]гексагидро-7-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-7-метил-1,3-диоксо-7-[2-[2-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(2-Бромфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(3-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-Гексагидро-2-[4-(1Н-имидазол-1-ил)фенил]-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[3-Хлор-4-(2-тиазолил)фенил]гексагидро-4-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(3-метил-4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(2-метил-4-нитрофенил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,5-Дихлорфенил)гексагидро-4-(2-гидроксиэтил)-7-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,5-Дихлорфенил)-4-[2-(4-фторфенокси)этил]гексагидро-7-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα))-4-[Октагидро-4-[2-(4-гидроксифенокси)этил]-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[3-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(3-Бромфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[4-[(4-Фторфенил)метил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-2-(1,6-Дигидро-1-метил-6-оксо-3-пиридинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(1-метил-6-оксо-3-пиперидинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[4-[2-(3-Цианофенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-4-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]бензойной кислоты фенилметиловый эфир;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-(2-феноксиэтил)-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-2-(3,5-Дихлор-4-нитрофенил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(3,5-Дихлор-4-гидроксифенил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(5-Фтор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-[3-метокси-4-(5-оксазолил)фенил]-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4-[2-(4-метоксифенокси)этил]-7-метил-2-(4-нитро-1 нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4-метил-2-(4-нитро-1-нафталинил)-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4-метил-2-(4-нитро-1-нафталинил)-7-[2-(4-нитрофенокси)этил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(1,6-Дигидро-1,4-диметил-6-оксо-3-пиридинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-7-метил-2-(4-нитро-1-нафталинил)-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]бензонитрил;
(3аα,4β,7β,7аα)-4-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-1,2-бензолдикарбонитрил;
(3аα,4β,7β,7аα)-4-(2-Бромэтил)гексагидро-7-метил-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[4-[2-(4-Цианофенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-[2-(4-метоксифенокси)этил]-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-[2-(3-метоксифенокси)этил]-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(3-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[2-[3-(4-морфолинил)фенокси]этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[2-[4-нитро-3-фенокси]этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(3-Цианофенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-2-(2,3-Дигидро-3-метил-2-оксо-6-бензотиазолил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(2,3-Дигидро-2-оксо-6-бензотиазолил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[4-[2-[3-(Диметиламино)фенокси]этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[2-[4-Циано-3-(трифторметил)фенил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]-1,2-бензолдикарбонитрил;
(3аα,4β,7β,7аα)-N-[2-Циано-5-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)фенил]ацетамид;
(3аα,4β,7β,7аα)-4-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-(трифторметокси)бензонитрил;
(3аα,4β,7β,7аα)-2-Метокси-4-(октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(3аα,4β,7β,7аα)-2-[4-(4,5-Дихлор-1Н-имидазол-1-ил)фенил]гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-(4-Бром-1-метил-1Н-пиразол-3-ил)фенил]гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-4-[Октагидро-4-(2-гидроксиэтил)-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-2-иодо-4-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)бензонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(4-Фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(4-Циано-3-фторфенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7aα)-4-[Октагидро-4-метил-1)3-диоксо-7-[2-[2,3,5,6-тетрафтор-4-(трифторметил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-[4-(1Н-1,2,4-триазол-3-ил)фенил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-(4,5-Дигидро-5-оксо-1,2,4-оксадиазол-3-ил)фенил]гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-[3-метокси-4-(2-оксазолил)фенил]-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(4-гидрокси-1-нафталинил)-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(8-гидрокси-5-хинолинил)-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион, трифторацетат;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-1,3-диоксо-7-[2-[метил(фенилметил)амино]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(5-хинолинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-5-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-2-пиридинкарбонитрил;
(3аα,4β,7β,7аα)-5-(Октагидро-4,7-диметил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил)-8-хинолинкарбонитрил;
(3аα,4β,7β,7аα)-2-(5-Бром-4-нитро-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(5-Бром-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-[8-(трифторметил)-4-хинолинил]-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
4-Фторбензойная кислота, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
Бензолуксусная кислота, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
4-Фторбензолуксусная кислота, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
(3аα,4β,7β,7аα)-Гексагидро-4-метил-7-[2-[4-(метилсульфонил)фенокси]этил]-2-(4-нитро-1-нафталинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-Гексагидро-2-(2-нафталинил)-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Хлор-1-нафталинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-N-(4-Хлорфенил)метил]-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ацетамид;
4,7,7-Триметил-3-оксо-2-оксабицикло[2.2.1]гептан-1-карбоновая кислота, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
(αS)-α-Метокси-α-(трифторметил)бензолуксусная кислота, 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
(αR)-α-Метокси-α-(трифторметил)бензолуксусной кислоты 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[2-[(7-метил-1,2-бензизоксазол-3-ил)окси]этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[4-[2-(1,2-Бензизоксазол-3-илокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[2-(Бензоилокси)этил]-2-(4-циано-1-нафталинил)гексагидро-7-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)-4-[2-[(4-нитробензоил)окси]этил]гексагидро-7-метил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
4-Хлорбензойной кислоты 2-[(3аα,4β,7β,7аα)-2-(4-циано-1-нафталинил)октагидро-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этиловый эфир;
[3аα,4β,7β,7аα(Е)]-4-[Октагидро-4-метил-7-[3-(1-нафталинил)-2-пропенил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα(х)-4-[Октагидро-4-метил-7-[3-(1-нафталинил)пропил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-Гексагидро-4,7-диметил-2-(2-метил-6-хинолинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7рβ,7аα)-Гексагидро-2-(5-изохинолинил)-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-(6-Бензотиазолил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
[3аα,4β,7β,7аα(Е)]-4-[Октагидро-4-метил-1,3-диоксо-7-(4-оксо-4-фенила-2-бутенил)-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-2-(4-Циано-1-нафталинил)октагидро-N-(2-гидроксифенил)-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ацетамид;
[3аα,4β(Е),7β,7аα]-4-[Октагидро-4-метил-7-[3-(6-метил-2-пиридинил)-2-пропенил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4β,7β,7аα)-4-[Октагидро-4-метил-7-[3-(6-метил-2-пиридинил)пропил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[Октагидро-4-[2-(3-метоксифенокси)этил]-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[Октагидро-4-[2-(3-метоксифенокси)этил]-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[4-[2-(4-Цианофенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[4-[2-(4-Цианофенокси)этил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
(3аα,4α,7α,7аα)-4-[4-[(4-Фторфенил)метил]октагидро-7-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-2-(трифторметил)бензонитрил;
(3аα,4α,7α,7аα)-Гексагидро-4,7-диметил-2-(1-метил-6-оксо-3-пиперидинил)-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4α,7α,7аα)-2-(1,6-Дигидро-1,4-диметил-6-оксо-3-пиридинил)гексагидро-4,7-диметил-4,7-эпокси-1Н-изоиндол-1,3(2Н)-дион;
(3аα,4β,7β,7аα)-2-[4-Циано-3-(трифторметил)фенил]октагидро-1,3-диоксо-7-[2-(фенилметокси)этил]-4,7-эпокси-4Н-изоиндол-4-пропаннитрил;
(3аα,4β,7β,7аα)-4-[7-[2-(4-Цианофенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-(1,3-Бензодиоксол-5-илокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-(1,3-Бензодиоксол-5-илокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-[(5-Хлор-2-пиридинил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-[(5-Хлор-2-пиридинил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-(4-Хлорфенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-(4-Хлорфенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-(4-Ацетилфенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-(4-Ацетилфенокси)этил]октагадро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-(3-Цианофенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-(3-Цианофенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[Октагидро-5-гидрокси-4-метил-1,3-диоксо-7-[2-[(5,6,7,8-тетрагидро-1-нафталинил)окси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[Октагидро-5-гидрокси-4-метил-1,3-диоксо-7-[2-[(5,6,7,8-тетрагидро-1-нафталинил)окси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-1 нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[Октагидро-5-гидрокси-4-метил-1,3-диоксо-7-[2-[(5,6,7,8-тетрагидро-5-оксо-1-нафталинил)окси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-1 нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[Октагидро-5-гидрокси-4-метил-1,3-диоксо-7-[2-[(5,6,7,8-тетрагидро-5-оксо-1-нафталинил)окси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-1 нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-(4-Фторфенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-(4-Фторфенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[Октагидро-5-гидрокси-4-метил-7-[2-[(4-метил-2-оксо-2Н-1-бензопиран-7-ил)окси]этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1 нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[Октагидро-5-гидрокси-4-метил-7-[2-[(4-метил-2-оксо-2Н-1-бензопиран-7-ил)окси]этил]-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-(3,5-Диметоксифенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-(3,5-Диметоксифенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-]-4-[7-[2-(4-Хлор-3-метилфенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-(4-Циано-2,3-дифторфенокси)этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-[(5-Хлор-1,2-бензизоксазол-3-ил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-[(5-Хлор-1,2-бензизоксазол-3-ил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-3-[2-[2-(4-Циано-1-нафталинил)октагидро-6-гидрокси-7-метил-1,3-диоксо-4,7-эпокси-4Н-изоиндол-4-ил]этокси]-5-изоксазолкарбоновой кислоты, метиловый эфир;
[3аR-(3аα,4β,7β,7аα)]-4-[Октагидро-5-гидрокси-4-метил-1,3-диоксо-7-[2-[4-(1Н-1,2,4-триазол-1-ил)фенокси]этил]-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[7-[2-[(7-Хлор-4-хинолинил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, трифторацетат;
[3аR-(3аα,4β,7β,7аα)]-4-[7-[2-[(7-Хлор-4-хинолинил)окси]этил]октагидро-5-гидрокси-4-метил-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил, трифторацетат;
(1aα,2β,2aα,5aβ,6βb,6aα)-4-[2-[2-[[(1,1-диметилэтил)-диметилсилил]окси]этил]октагидро-6-метил-3,5-диоксо-2,6-эпокси-4Н-оксирено[f]изоиндол-4-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[4-Этилоктагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аS-(3аα,4β,7β,7аα)]-4-[4-Этилоктагидро-7-(2-гидроксиэтил)-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил;
[3аR-(3аα,4β,7β,7аα)]-4-[4-[2-(4-Цианофенокси)этил]-7-этилоктагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил; и
[3аS-(3аα,4β,7β,7аα)]-4-[4-[2-(4-Цианофенокси)этил]-7-этилоктагидро-1,3-диоксо-4,7-эпокси-2Н-изоиндол-2-ил]-1-нафталинкарбонитрил.
или их соль или гидрат.
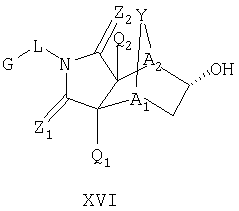
где G, L, Z1, Z2, A1, А2, Y, Q1 и Q2 имеют значения, указанные в п.1, включающий стадии контактирования соединения формулы XV или его соли:
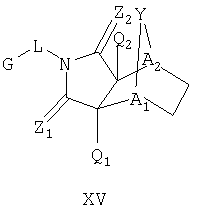
где значения радикалов определены выше;
с ферментом или микроорганизмом, способным катализировать гидроксилирование указанного соединения XV до указанного соединения XVI, и осуществления указанного гидроксилирования.
Приоритет по пунктам:
| БИЦИКЛИЧЕСКИЕ ОКСАЗИН- ИЛИ ТИАЗИН-ОКСАЗОЛИДИНОНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБЫ ЛЕЧЕНИЯ МИКРОБНЫХ ИНФЕКЦИЙ | 1995 |
|
RU2128660C1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2007-05-10—Публикация
2001-06-20—Подача