Данное изобретение относится к новому способу получения фармацевтической композиции, например, таблетки или капсулы, содержащей SB 207266 или его фармацевтически подходящую соль, и к фармацевтической композиции, которая может быть получена указанным способом или получена указанным способом.
Введение
В WO 93/18036 (Smith Kline Beecham) описывают большое количество конденсированных соединений индола как антагонистов 5-НТ4, включая в качестве примера 3 на страницах 17-18 N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB 207266, родовое название (международное непатентованное название)=пибосерод) и его предпочтительный гидрохлорид (SB 207266-A, пибосерода гидрохлорид). Названные соединения предлагают для применения при лечении или профилактике желудочно-кишечных, сердечно-сосудистых нарушений и нарушений ЦНС, в частности синдрома раздраженной толстой кишки, и при лечении недержания мочи. В WO93/18036 в основном описании на страницах 6-7 в общих чертах также утверждается, что: «Специфические антагонисты кардиального рецептора 5-НТ4, которые предотвращают фибрилляцию предсердий и другие аритмии предсердий, связанные с 5-НТ, как предполагают, также будут снижать количество случаев удара». См. также US 5852014, EP 0884319 A2, L.M. Gaster et al., J. Med. Chem. 1995, 38, 4760-4763 и Drugs of the Future, 1997, 22 (12), 1325-1332 для соединения SB 207266, которое является высокоселективным по отношению к рецептору 5-НТ4 по сравнению с другими рецепторами 5НТ. SB 207266 имеет следующую структуру:
Относительно улучшенного синтеза SB 207266 и/или его соли см. WO 98/07728, WO 98/11067, WO 00/03983 и WO 00/03984.
Существует несколько способов получения SB 207266 в виде свободного основания или в виде гидрохлорида, описанных в данной области техники. В примере 3 на страницах 17-18 WO 93/18036 описывается получение SB 207266 в виде свободного основания в способах 1 и 2. В способе 2 также описывается превращение в соль HCl и перекристаллизация из смеси этанол/60-80 бензин, чтобы получить белое твердое вещество. L. Gaster, Drugs of the Future, 1997, 22(12), 1325-1332, раскрывает подобный способ, включающий образование соли HCl путем обработки свободного основания SB 207266 безводной HCl в этаноле. В WO 98/07728, со страницы 6 строка 5 по страницу 7 строка 20, раскрываются три новых способа получения свободного основания. В WO 98/07728 также описываются два способа получения соли HCl (SB 207266-A) - способ А со страницы 7 строка 22 по страницу 8 строка 9, и способ В со страницы 8 строка 10 по страницу 8 строка 19. На странице 8 строки 10-19 WO 98/07728, способ В получения соли HCl SB 207266 представляет собой следующее: "N-[(1-Бутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB 207266) (100 г, 0,27 моль) растворяют в этаноле (870 мл) и полученный раствор фильтруют, чтобы удалить частицы. Безводную HCl в этаноле (83 мл, 3,6М, 0,30 моль) добавляют, чтобы вызвать выпадение в осадок продукта из раствора. Суспензию нагревают для повторного растворения твердого вещества и добавляют гексан (550 мл). После охлаждения до комнатной температуры смесь охлаждают до 0-5°С и перемешивают при такой температуре в течение приблизительно двух часов. Твердое вещество выделяют фильтрованием и сушат в вакууме при приблизительно 40°С, чтобы получить продукт, гидрохлорид N-[(1-бутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамида, (102,8 г) с выходом 94%".
Изобретение
В настоящее время установлено, что существуют проблемы с определенными способами получения соли HCl SB 207266, способами, которые подобны или идентичны способу, описанному как способ В на странице 8 строки 10-19 WO 98/07728, по которому соль HCl растворяют в этаноле, промышленных метилированных спиртах (IMS, например, этанол, содержащий около 1% метанола) или подобном и кристаллизуют добавлением С5-С10-углеводорода (например, гексана и/или гептана, например н-гептана) и/или растворителя, содержащего С5-С10-углеводород (например, гексан и/или гептан, например, н-гептан).
Первый аспект недавно осознанной проблемы заключается в том, что с помощью таких способов получают гидрохлорид SB 207266 в виде частиц чрезвычайно небольшого размера. Например, в следующей таблице 1 представлены данные размера частиц из партий солей HCl (SB-207266-A), полученных при использовании способа, подобного способу В на странице 8 WO 98/07728, но с применением н-гептана вместо гексана на стадии кристаллизации (подобный способ с использованием IMS вместо этанола и н-гептана вместо гексана раскрыт в описании 1 ниже):
DV-90, DV-50 и DV-10 соответственно означают, что 90%, 50% и 10% по объему вещества составляет менее, чем указанный размер в мкмах.
Одним обоснованием небольшого размера частиц и другим аспектом недавно возникшей проблемы является то, что в настоящее время при нормальных условиях соль HCl SB 207266 получают только в виде кристаллов игольчатой формы. Например, как показано на Фиг.1 и 2 и описывается в описании 2, когда только что получены, игольчатые кристаллы соли HCl SB 207266 (например, >75% или >50% их по количеству или объему или массе) обычно составляют >100 мкм или >200 мкм по длине. Однако игольчатые кристаллы (например, >75% или >50% их по количеству или объему или массе) обычно составляют <10 мкм (например, Фиг.1) или <25 мкм (например, Фиг.2) по ширине (поперечное измерение). Попытки увеличить размер частиц приводят только к увеличению длины игл, а не к более текучей, менее удлиненной кристаллической форме или габариту кристаллов.
Обработка, например перемешивание или другое перемещение этих игольчатых кристаллов, имеет тенденцию приводить к разрушению кристаллов с образованием более коротких игл с небольшим размером частиц. Укороченные/разрушенные игольчатые кристаллы обычно являются (например, >50% их по количеству или объему или массе) игольчатыми или, иначе, удлиненными; но обычно они (например, >50% кристаллов по количеству, или объему, или массе) составляют <75 мкм или <100 мкм или <200 мкм по длине и/или <10 мкм или <25 по ширине, как показано, например, на Фиг.3 и описывается в описании 2.
Второй аспект недавно осознанной проблемы заключается в установлении того, что соль HCl SB 207266, полученная приведенными способами (WO 98/07728 и/или описания 1 и/или 2 в данной заявке), является очень когезивной и имеет плохие характеристики текучести, плохую способность к течению.
Третий аспект недавно осознанной проблемы заключается в том, что при приведенных выше определенных концентрациях в фармацевтическом препарате указанное когезивное вещество лекарственного средства образует композицию с довольно плохой текучестью, которую нельзя легко таблетировать или готовить в виде капсул, когда соль HCl SB-207266 комбинируют с эксципиентами, микрокристаллической целлюлозой, маннитом и стеаратом магния. Обнаружено, что композицию с SB 207266 для перорального введения человеку, содержащую соль HCl SB-207266 (приблизительно 5,0 мг, определяли как свободное основание), микрокристаллическую целлюлозу (30,0 мг), маннит (112,0 мг) и стеарат магния (3,0 мг) при общем весе таблетки = около 150 мг, можно таблетировать, используя при таблетировании непосредственно стандартную технологию прессования, где соль HCl SB-207266 присутствует в количестве приблизительно 3,3% по массе таблетки. Однако более высокие концентрации соли HCl SB-207266 в данном типе препарата трудно таблетировать, используя прямое прессование. Это тем более относится к делу, так как клиническая поддерживающая доза SB-207266 для лечения или профилактики фибрилляции предсердий, как полагают в настоящее время, возможно, должна составлять приблизительно 20, 50 или 80 мг/день (см. клинический протокол примера и примеры таблеток ниже); в то время как клинические дозы SB-207266, испытанные предварительно для лечения синдрома раздраженной толстой кишки, составляют только 0,05, 0,25, 1 и 5 мг/день и 20 мг/день в виде четырех таблеток по 5 мг, принимаемых вместе в день.
Четвертый аспект недавно выявленной проблемы заключается в том, что соль HCl SB-207266 в виде частиц небольшого размера имеет низкую объемную плотность (например, см. таблицу в описании 1 ниже), уплотняющуюся при добавлении воды. Это означает, что можно добавлять меньше вещества в обрабатывающую машину с фиксированным объемом, что приводит к менее эффективному способу изготовления, так как большие объемы оборудования должны использоваться для относительно небольших объемов лекарственного средства (более низкая производительность оборудования).
В находящейся одновременно на рассмотрении патентной заявке РСТ/GB01/03590, поданной 8 августа 2001 Smith Kline Beecham p.1.c. et al., и опубликованной 14 февраля 2002 как WO 02/11733 A1, описывается, что некоторые или все перечисленные проблемы можно, по крайней мере, частично, преодолеть или уменьшить путем формования соли HCl SB 207266 в гранулы, которые имеют размер частиц больше, чем у исходной соли HCl SB 207266. Обнаружено, что названные гранулы имеют более лучшие характеристики текучести, например, для целей таблетирования. Как ожидали, некоторые или все из названных преимуществ гранулированных препаратов также увеличиваются для свободного основания, которое, как полагают, также обычно имеет небольшой размер частиц. Например, свободное основание очень медленно фильтруется, когда кристаллизуется добавлением гексана к раствору толуола (например, как в способе А на странице 6 строки 19-23, и способе С на странице 7 строки 14-20 WO 98/07728). Аналогично полагают, что для фармацевтически приемлемых солей, отличных от соли HCl, грануляция также является благоприятной.
Способ грануляции SB 207266, раскрытый в описании - в частности, в примерах 4 и 5 - РСТ/GB01/03590 (находящаяся одновременно на рассмотрении заявка, поданная 8 августа 2001, опубликованная 14 февраля 2002 как WO 02/11733 A1), а также описанный в примерах 7 и 8 РСТ/GB01/03544 (находящаяся одновременно на рассмотрении заявка, поданная 7 августа 2001, опубликованная 14 февраля 2002 как WO 02/11766 A2), представляет собой способ "влажной грануляции", при котором гранулы SB 207266 или его соли получают в присутствии растворителя для грануляции, такого как вода и/или этанол. Способ влажной грануляции, представленный в примере 4 РСТ/GB01/03590 (WO 02/11733 A1), описывается ниже как "Сравнительный пример" для сравнения с настоящим изобретением. Как можно видеть, SB 207266 смешивают с определенными эксципиентами в грануляторе-смесителе с высоким сдвигом и добавляют воду (в качестве растворителя для грануляции) в смеситель-гранулятор, чтобы осуществить влажную грануляцию. Полученные гранулы после высушивания имеют превосходные характеристики текучести и оказываются более плотными, чем чистая соль HCl SB 207266, и могут быть прессованы, например, вместе с экстрагрануляционным эксципиентом(ами) при средних или высоких концентрациях лекарственного средства (% лекарственного средства по массе таблетки), чтобы получить прекрасные таблетки.
Однако в настоящее время изобретатели сталкиваются с некоторыми дополнительными неожиданными проблемами при использовании названного способа "влажной грануляции" WO 02/11733 A1, которые формируют пятый аспект недавно осознанной проблемы, на которой базируется данное изобретение. Неожиданно было обнаружено, что при близком рассмотрении негомогенная грануляция (особенно физически негомогенная грануляция) и/или чрезмерная агломерация происходят во время влажной грануляции. Установлено, что, когда воду (как растворитель для грануляции) вливают в смесь лекарственное средство - эксципиент, капли воды почти тотчас поглощаются/адсорбируются той частью грануляционной смеси, которая находится вблизи с каплей воды, что часто приводит к сжатию и образованию локально частично растворенной массы, которая образует "шарики" в результате притягивания прилегающего вещества. Образованные шарики, обычно тестообразные, когда влажные, и твердые, когда сухие, приклеиваются к стенкам смесителя. Шарики, особенно после высушивания, дают в результате локализованные твердые комки из полугранулированного содержащего лекарственное средство материала. Степень образования шарик/комок имеет тенденцию к увеличению, когда увеличивается время влажной грануляции и когда повышается концентрация лекарственного средства в грануляционной смеси. В примере 4 WO 02/11733 A1 во время влажной грануляции используют микрокристаллическую целлюлозу как добавку для грануляции, чтобы диспергировать водный растворитель для грануляции во время грануляции. Однако неожиданно было обнаружено, что микрокристаллическая целлюлоза не так эффективна при диспергировании воды в грануляционную смесь (для достижения гомогенной грануляции), что обычно имеет место в процедурах влажной грануляции.
Не обращаясь к теории, полагают, что описанные непредвиденные проблемы обусловлены комбинацией очень небольшого размера частиц и очень высокой растворимости в воде соли HCl SB-207266, что приводит к крайне высокой скорости солюбилизации SB-207266 или его соли в водном растворителе для грануляции. Полагают, что локализованный SB-207266 или его соль растворяется крайне быстро при контакте с капельками воды, приводя к образованию локализованных "шариков" или больших твердых (когда сухой) комков из полугранулированного вещества, описанного выше. Когда SB-207266 - сухой, указанные большие комки являются твердыми и их трудно уменьшить до небольшого размера, так как SB-207266 или его соль, который является полурастворимым, действует как сильное связующее вещество в отношении окружающих частиц эксципиентов или активного ингредиента. (Упомянутое связующее свойство также приводит к довольно длительному времени дезинтеграции таблетки после таблетирования.)
Также поскольку большая часть воды сконцентрирована в шариках/комках, после грануляции остается некоторое количество неизмененного SB-207266 или его соли, которое не было гранулировано, уплотнено и сделано более текучим; то есть смесь после грануляции неожиданного оказалась физически негомогенной.
Приведенные выше проблемы были минимальными или выполнимыми при использовании партий 2,5 кг, обработанных в соответствии со Сравнительным примером, приводимом ниже. Однако оказалось, что при большем объеме партий (например, 14 кг) образование шарик/комок и неизмененный SB 207266 или его соль после грануляции обычно встречаются чаще и/или в большей степени. Поэтому риск получения негомогенных смесей может возрастать, когда получение по способу влажной грануляции увеличивают до промышленного масштаба, хотя тщательный выбор оборудования для грануляции в большом масштабе и/или способов может уменьшить этот риск. Такое повышенное «образование шариков» при масштабировании может быть, по крайней мере, частично, вызвано необязательным применением при масштабировании повышенной энергии лопастного колеса в смесителе-(влажном)грануляторе, когда увеличивают объем сосуда.
В настоящее время установлено, что проблемы неожиданной негомогенности способа влажной грануляции WO 02/11733 A1 можно снизить применением способа сухой грануляции, чтобы создать препараты SB-207266 (фармацевтические композиции). Сухая грануляция избегает или снижает/уменьшает (а) солюбилизацию лекарственного средства во время обработки и/или (b) образование "шарика" или твердого комка. Неожиданно установлено, что способ сухой грануляции может приводить к более твердому препарату в увеличенном масштабе, чем препарат WO 02/11733 A1, полученный влажной грануляцией. Полагают, что риск получения бракованной партии дорогостоящей композиции промышленным способом (например, вследствие «образования шариков») необходимо снизить и, возможно, что меньшие масштабы способа-контроля и/или меньшая осторожность оказываются желательными/необходимыми, чтобы минимизировать риск получения бракованной партии по сравнению с влажной грануляцией. Сухая грануляция также может приводить к более короткому времени дезинтеграции частиц, чем у препаратов, полученных способом влажной грануляции, как описано выше. Сухая грануляция сама также подходит для непрерывной обработки и автоматизации по сравнению с влажной грануляцией.
Следовательно, в первом аспекте изобретения предлагается способ получения фармацевтической композиции, содержащей N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB 207266) (пибосерод) или его фармацевтически приемлемую соль в сочетании с одним или более фармацевтически приемлемыми эксципиентами, где способ включает формирование части или всего SB 207266 или его соли в виде гранул способом сухой грануляции.
Считается, что фармацевтическая композиция, полученная указанным способом, является по существу новой по сравнению с полученным влажной грануляцией препаратом, описанным в примерах 4 и 5 РСТ/GB01/03590 (WO 02/11733 A1).
Во втором аспекте изобретения предлагается фармацевтическая композиция, которая может быть получена способом, как определено в первом аспекте изобретения.
В третьем аспекте изобретения предлагается фармацевтическая композиция, которая получена способом, как определено в первом аспекте изобретения.
В четвертом аспекте изобретения предлагается фармацевтическая композиция, содержащая N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB 207266) или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми эксципиентами, где часть или весь SB 207266 или его соль присутствует в гранулах, которые могут быть получены или получены способом сухой грануляции.
Термин "способ сухой грануляции" подразумевает способ, по которому гранулы получают по существу в отсутствие внешне применяемого растворителя для грануляции, такого как вода и/или этанол. Например, гранулы получают в присутствии предпочтительно менее 2% по массе, более предпочтительно менее 1% по массе, еще более предпочтительно менее 0,3% по массе, наиболее предпочтительно менее 0,1% по массе внешне применяемого растворителя для грануляции, такого как вода и/или этанол. В предпочтительном воплощении изобретения способ сухой грануляции по изобретению представляет собой способ, при котором гранулы получают полностью в отсутствие внешне применяемого растворителя для грануляции, такого как вода и/или этанол. Способы сухой грануляции изобретения включают способы, где растворитель, такой как вода, присутствует в форме, связанной с лекарственным средством и/или связанной с любым из эксципиентов, например в виде кристаллизационной воды (например, как с СаНРО4·2Н2О).
Термин "гранулы" имеет определение, понимаемое специалистом в области технологии приготовления лекарственного средства в контексте фармацевтических препаратов (например, как понимают в контексте The Handbook of Pharmaceutical Granulation Technology, ed. D.M. Parikh, 1997, Marcel Dekker Inc., которое включено в описание ссылкой). Термин «гранулы» в данном контексте исключает частицы чистого SB 207266 или его соли в форме, которую не подвергают способу увеличения размера частиц, и «гранулы», например, исключают соль HCl SB 207266, которую непосредственно получают по описанию 1 ниже и которая имеет размер частиц в соответствии с таблицей 1.
N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB 207266) или его фармацевтически приемлемую соль в описании часто называют «SB 207266 или его соль", "пибосерод или его соль", "активное вещество", "активный ингредиент" или "лекарственное средство" или подобно.
Предпочтительные особенности способа первого, второго, третьего и четвертого аспектов изобретения
Предпочтительно способ изобретения также включает смешивание некоторого количества или всего SB 207266 или его соли с одним или более фармацевтически приемлемыми эксципиентами (внутригранулярные эксципиенты) до сухой грануляции. Один или более внутригранулярных эксципиентов предпочтительно содержат лубрикант; это допускает смазывание во время стадии сухой грануляции и минимизирует затруднения в способе, такие как прилипание гранулированных ингредиентов к металлическим частям машины, например, в роликовом уплотнителе. Один или более внутригранулярных эксципиентов предпочтительно содержат наполнитель (разбавитель) и/или добавку для прессования. Один или более внутригранулярных эксципиентов могут необязательно содержать связующее вещество и/или дезинтегрант. Внутригранулярный лубрикант, наполнитель, добавка для прессования, связующее вещество и/или дезинтегрирующее вещество могут быть такими, как определено в данном описании.
Предпочтительно способ сухой грануляции изобретения включает прессование (то есть применение давления) и/или уплотнение (т. е. компактирование) SB 207266 или его соли. Способ предпочтительно увеличивает размер частиц (например, средний медианный (D50), D90 и/или D10 размер частиц) SB 207266 или его соли при прессовании вместе с частицами лекарственного средства, необязательно также с частицами внутригранулярных эксципиентов, чтобы получить большие гранулы.
Для сравнения, влажная грануляция использует растворитель для грануляции, чтобы получить грануляционную смесь, из которой образуют гранулы после высушивания, но обычно без применения прессования.
Предпочтительно способ сухой грануляции изобретения включает окатывание SB 207266 или его соли. Альтернативно способ сухой грануляции может включать ударное уплотнение SB 207266 или его соли. Относительно названных альтернативных способов уплотнения, «окатывания» и «ударного уплотнения», см. "Handbook of Pharmaceutical Granulation Technology", ed. D.M. Parikh, 1997, Marcel Dekker Inc., New York, Chapter 6" "Roller Compaction Technology", особенно страницы 119-132 (IV. Roller Compactor Desing) и страницы 103-107, 112 и 115-116, которые включены в данное описание ссылкой. Относительно окатывания также см., например, брошюру Fitzpatrick Company "Roll Compaction" и статью "Introduction to Roll Compaction and the Fitzpatrick Chilsonator", обе из которых включены в данное описание ссылкой и обе из которых имеются в интернете на сайте: Fitzpatrick Company www.fitzpatrick.be; и/или доступны от The Fitzpatrick Company Europe N.V., Enterpotstraat 8, B-9100 Sint-Niklaas, Belgium, fax: +32/3-766-10-84, email: Fitzpatrick_Europe@compuserve.com; и/или могут быть получены от The Fitzpatrick Company, 832 Industrial Drive, Elmhurst, IL 60126, USA, fax: +1-630-530-0832, www.fitzmill.com..
Окатывание (Роликовое уплотнение) обычно включает подачу самотеком и/или с помощью винтовой подачи предварительно гранулированного порошка, который следует уплотнить, в зазор («роликовый зазор») между парой противовращающихся роликов (валиков), имеющих по существу параллельные продольные оси. Оба ролика могут быть фиксированы на их осях. Более предпочтительно оси роликов могут быть подвижными относительно друг друга, например, ось одного ролика фиксируется на каркасе уплотнителя, а ось другого ролика оказывается подвижной относительно каркаса уплотнителя.
Ролики могут иметь гладкие внешние поверхности окружности, но предпочтительно имеют текстурированные внешние поверхности окружности, такие как радиальные синусоидальные волновые ролики или более предпочтительно взаимосвязанные рифленные ролики. Текстурированные внешние поверхности окружностей роликов предпочтительно содержат рифления (пики и впадины), обычно выровненные в направлении оси ролика ("рифленные ролики"). Более предпочтительно рифленные ролики являются взаимосвязанными рифленными роликами; названные ролики включают первый и второй ролики, в которых рифления внешней окружности (пики и впадины) первого ролика согласуются и/или являются частично или полностью взаимосвязанными с рифлениями внешней окружности (впадины и пики) второго ролика, когда ролики находятся в циркумференциально-противоположной связи. Что касается рифленных роликов (например, взаимосвязанные рифленные ролики), пики рифления могут быть, например, острыми, закругленными или выровненными в поперечном сечении, но предпочтительно пики рифлений являются закругленными в поперечном сечении. Что касается рифленных роликов, рифления увеличивают до предела продолжительность времени ("время пребывания"), которое лекарственное средство проводит в "зоне захвата" (см. ниже) ролика, увеличивая деаэрацию и уплотнение SB-207266 или его соли по сравнению с гладкими роликами для данного конкретного лекарственного средства.
Во время роликового уплотнения давление, например гидравлическое давление, применяют к одному или обоим роликам, обычно к ролику с подвижной осью (плавучий ролик) в направлении так, чтобы толкать ролики вместе. Таким образом, уплотняющее давление передается роликам. Порошок, поданный к роликовому зазору, трется о роликовые поверхности, вращающиеся в направлении роликового зазора, и затем перемещается в «область угла захвата» или «область захвата» околороликового зазора, где происходит предварительное компактирование (уплотнение). Затем порошок проходит между роликами и принимает давление уплотнения, передаваемое на ролики; при этом порошок уплотняется (компактируется).
Во время роликового уплотнения предварительно гранулированный порошок, который уплотняют, предпочтительно подают в роликовый зазор с помощью вращающейся винтовой подачи (например, шнековой винтовой подачи), примыкающей и направленной на ролики. В одном воплощении ролики могут быть, по существу, горизонтальными и, по существу, установленными на одном уровне друг с другом и можно использовать «вертикальную винтовую подачу», расположенную выше и направленную на ролики. В другом воплощении ролики могут быть, по существу, горизонтальными и размещенными один выше другого и можно использовать «горизонтальную винтовую подачу», по существу на одном уровне с и направленную к зазору ролика.
Можно использовать необязательную предварительную винтовую подачу, например горизонтальную винтовую подачу, чтобы дозировать продукт (предварительная грануляционная смесь, содержащая лекарственное средство) из впускного бункера на стадию предварительного прессования (предварительного уплотнения). Скорость предварительной винтовой подачи (например, скорость горизонтальной предварительной винтовой подачи) обычно составляет от 0 до примерно 62 об/мин и/или предпочтительно составляет, по крайней мере, приблизительно 10 об/мин или, по крайней мере, примерно 15 об/мин или, по крайней мере, примерно 20 об/мин и/или предпочтительно вплоть до приблизительно 40 об/мин или вплоть до приблизительно 62 об/мин. Скорость предварительной винтовой подачи более предпочтительно составляет от приблизительно 10 об/мин до приблизительно 62 об/мин или от примерно 20 об/мин до примерно 62 об/мин; еще более предпочтительно от приблизительно 10 об/мин до приблизительно 40 об/мин или примерно от 15 об/мин до примерно 40 об/мин; например, около 30 об/мин (например, пример 11), от приблизительно 17 до приблизительно 20 об/мин (например, пример 12) или около 20 об/мин (например, пример 13).
Основную винтовую подачу, примыкающую к роликам (ниже по ходу от любой необязательной предварительной винтовой подачи), предпочтительно вертикальную основную винтовую подачу, предпочтительно используют, например, для проведения предварительного прессования и/или деаэрации (предварительного уплотнения) предварительного грануляционного порошка и для подачи порошка на ролики. Скорость основной винтовой подачи (например, скорость вертикальной основной винтовой подачи) может составлять, например, вплоть до 600 об/мин, но обычно составляет от 0 до примерно 270 об/мин, предпочтительно от приблизительно 30 до приблизительно 270 об/мин или от примерно 30 до примерно 100 об/мин, более предпочтительно от приблизительно 40 до приблизительно 90 об/мин. Например, скорость основной винтовой подачи может составлять приблизительно 100 об/мин или приблизительно 70 об/мин (например, пример 11), или от приблизительно 49 до приблизительно 53 об/мин (например, примеры 12 и 13). Скорость основной винтовой подачи является важной для хорошего уплотнения, когда эта подача поставляет материал непосредственно на ролики.
Пример роликового уплотнителя, содержащего ролики, которые, по существу, являются горизонтальными и которые, по существу, расположены на одном уровне относительно друг друга, вертикальную основную винтовую подачу, расположенную выше, примыкающую и направленную к роликам, и вверху по ходу от вертикальной основной подачи находится горизонтальная предварительная винтовая подача: например, роликовый уплотнитель модели Fitzpatrick Chilsonator IR220 фирмы Fitzpatrick Company (раскрытый подробно на стадии 2 примера 11 и представленный на Фиг.5).
Когда используют обе подачи, предварительную винтовую подачу и основную винтовую подачу, отношение скорости предварительной винтовой подачи к скорости основной винтовой подачи обычно составляет от 1:30 до 1:1 или от 1:10 до 1:1,2, предпочтительно от 1:5 до 1:1,5, более предпочтительно от 1:4 до 1:1,5, наиболее предпочтительно от 1:3,5 до 1:2. Такое соотношение способствует ровному движению (течению) материала от бункера через предварительную подачу и основную подачу к роликам без слишком большого или слишком маленького накопления между двумя подачами.
Движению содержащего лекарственное средство материала через одну или более подач к роликам необязательно можно способствовать формированием вакуума, например, вакуумной линией (связь) к одной или более подач, в частности вакуумной линией к (основной) винтовой подаче, которая подает материал непосредственно к роликам. Это способствует деаэрации и предварительному уплотнению, например, может быть полезным при высоких внутригранулярных концентрациях данного лекарственного средства (SB-207266 или его соли), которое имеет низкую плотность.
Роликовое давление может составлять, например, от приблизительно 2000 до приблизительно 20000 фунтов на линейный дюйм (pli) (от приблизительно 3,51 до приблизительно 35,1 кН/см), но обычно составляет от приблизительно 2000 до приблизительно 16500 фунтов на линейный дюйм (pli) (от примерно 3,51 до примерно 28,93 кН/см). Роликовое давление составляет подходяще от приблизительно 8000 до приблизительно 16500 pli или от приблизительно 8000 до приблизительно 20000 pli (от приблизительно 14,0 до приблизительно 28,93 кН/см или от приблизительно 14,0 до приблизительно 35,1 кН/см), например приблизительно 8000 pli (около 14,0 кН/см). Более предпочтительно роликовое давление составляет от приблизительно 20 кН/см до 28,93 кН/см, и идеально от приблизительно 24 до приблизительно 26 кН/см (например, см. примеры 11-13).
Обычно скорость ролика может составлять от 0 до примерно 17 об/мин, но подходяще от приблизительно 1,5 до приблизительно 17 об/мин или от примерно 1,5 до примерно 10 об/мин, например приблизительно 10 об/мин. Установлено, что низкие роликовые скорости увеличивают время пребывания и повышают желаемое уплотнение лекарственного средства, но слишком низкие скорости могут увеличить риск забивания материала, содержащего лекарственное средство, в роликах. Таким образом, предпочтительно роликовая скорость составляет от приблизительно 1,5 об/мин до приблизительно 7 об/мин, более от предпочтительно 2 об/мин до приблизительно 6 об/мин, еще более предпочтительно от приблизительно 2,5 до приблизительно 5,5 об/мин, наиболее предпочтительно от приблизительно 3 до приблизительно 5 об/мин (например, см. примеры 11-13).
Установлено (например, следует из примера 11 - примера 12), возможно вследствие низкой плотности лекарственного средства (SB 207266 или его соли), что когда в предварительной грануляционной смеси увеличивают концентрацию лекарственного средства, скорость движения через винтовую подачу(и) снижается. В таком случае для получения идеального уплотнения предпочтительно увеличить скорость предварительной винтовой подачи и/или скорость основной винтовой подачи, чтобы обеспечить идеальную скорость подачи материала к роликам, и/или увеличить время пребывания в роликах. Поэтому, в частности, когда SB-207266 или его соль присутствует в гранулах (то есть во время сухой грануляции) в количестве, по крайней мере, 22% или, по крайней мере, 27%, или, по крайней мере, 32% или, по крайней мере, 35% от гранул (внутригранулярных ингредиентов), тогда:
- предпочтительно скорость предварительной винтовой подачи, если такая имеется, составляет, по крайней мере, около 20 об/мин или, по крайней мере, около 25 об/мин, или, по крайней мере, около 30 об/мин, например, от приблизительно 20 до приблизительно 62 об/мин, еще более от предпочтительно 25 об/мин до приблизительно 62 об/мин или от примерно 25 об/мин до примерно 40 об/мин, например, приблизительно 30 об/мин (например, пример 11 и 14); и/или
- предпочтительно скорость основной винтовой подачи (например, вертикальной основной винтовой подачи) составляет, по крайней мере, около 56 об/мин или, по крайней мере, около 60 об/мин, или, по крайней мере, около 65 об/мин, или, по крайней мере, около 70 об/мин, например, от приблизительно 56 об/мин либо до приблизительно 600 об/мин, либо до приблизительно 270 об/мин, и более предпочтительно от примерно 56 до примерно 100 об/мин или от примерно 60 до примерно 90 об/мин, и наиболее предпочтительно составляет от приблизительно 60 приблизительно до 80 об/мин, например, от приблизительно 60 до приблизительно 70 об/мин (например, пример 11 и 14); и/или
- предпочтительно роликовая скорость составляет вплоть до приблизительно 5 об/мин или вплоть примерно до 4 об/мин, или вплоть до приблизительно 3,5 об/мин и/или предпочтительно составляет, по крайней мере, около 1,5 об/мин; более предпочтительно роликовая скорость составляет от приблизительно 1,5 об/мин до приблизительно 4 об/мин, еще более предпочтительно от примерно 2 до примерно 4 об/мин, наиболее предпочтительно от приблизительно 2,5 об/мин до приблизительно 3,5 об/мин, например приблизительно 3 об/мин (например, см. примеры 11 и 14).
Роликовый зазор, например, может составлять от приблизительно 0,5 до приблизительно 2 мм, например, от примерно 0,7 до примерно 1,3 мм.
Уплотненную роликами смесь, когда она выходит из роликов, называют "брикет", "хлопья" или "лента".
Предпочтительно плотность ленты составляет от приблизительно 1,0 до приблизительно 1,5 г/см3 (г/мл).
Гранулы, образованные способом сухой грануляции, предпочтительно измельчают до размера частиц подходящего для применения в таблетках или капсулах. Предпочтительно, например, для роликового уплотнения, брикет (хлопья, лента), выходящий из роликов (валиков), измельчают до размера частиц, подходящего для применения в таблетках или капсулах, например, используя дробящую мельницу. Например, гранулы можно измельчать так, что они проходят через сито или решето с размером отверстий 0,110 дюйма (2,80 мм), 0,097 дюйма (около 2,46 мм), 0,093 дюйма (2,36 мм), 1,70 мм, 0,065 дюйма (1,65 мм), 0,063 дюйма (1,60 мм), 0,055 дюйма (1,40 мм), 0,032 дюйма (0,81 мм), 500 мкм или 250 мкм. Гранулы могут проходить через такое сито или решето во время или после измельчения. Предпочтительно сито имеет размер отверстий от 0,110 дюйма (2,80 мм) до 0,032 дюйма (0,81 мм), более предпочтительно размер отверстий от 0,097 дюйма (около 2,46 мм) до 0,055 дюйма (1,40 мм) или размер отверстий от 0,097 дюйма (около 2,46 мм) до 0,063 дюйма (1,60 мм); это оказывается наилучшим, например, для таблеток, включающих гранулы.
При применении, мельница, например дробящая мельница, может, например, вращаться при скорости 1000-10000 об/мин или 3000-8000 об/мин, например, около 5000 об/мин.
Предпочтительная дробящая мельница представляет собой мельницу с молотками и/или ножами. Как известно специалистам, такой тип дробящей мельницы содержит камеру с входным отверстием (обычно расположенным вверху) для ввода гранул, сито или решето (обычно помещенное внизу) для выхода измельченных гранул, и расположенный в камере между ними вращающийся вал, выступая от которого находится множество обычно радиально расположенных лопастей, которые обычно имеют острый или «ножевой» край в виде одного вращательно-направленного края и плоский или «молотковый» край в виде другого противоположного вращательно-направленного края. Один пример представлен в нижней части Фиг.6, где ось (вращающаяся в любом направлении) обозначена цифрой 18, ножи - 20, молотки -22 и сито/решето - 24. В зависимости от направления вращения оси «ножевые» края («ножи») и/или «молотковые» края («молотки») осевых лопастей являются «направленными вперед» (то есть образуют ведущий край, который во время вращения сталкивается с гранулами/частицами в камере мельницы) - обычно он представляет собой ножи, «направленные вперед» или молотки, «направленные вперед». Необязательно, мельница может быть дробящей мельницей с «молотками, направленными вперед», но предпочтительно мельница является дробящей мельницей с «ножами, направленными вперед». Способ «ножи, направленные вперед» имеет тенденцию регулировать размер частиц гранул больше (например, более мелкие) и обычно оказывается лучше для таблеток. Например, можно применять дробящую мельницу FitzMill L1A (которая описана в примере 1) (например, от фирмы Fitzpatrick, см. пример 1), с молотками и/или ножами, «направленными вперед», предпочтительно использующую сито 0,065 дюйма или 0,093 дюйма (2,36 мм) с вращением предпочтительно при 5000 об/мин.
Другим альтернативным типом мельницы является «растирающая мельница». Такая мельница содержит ротор, включающий центральный вращаемый или колеблющийся вал, присоединенный (например, обычно с помощью радиальных распорок) к множеству стержней или элементов, обычно направленных в направлении центральной оси вала, но расположенных отдельно от центрального вала. Стержни обычно все расположены отдельно от центральной оси вала приблизительно на одинаковом расстоянии. Такая мельница также обычно содержит изогнутое «растирающее решето», которое расположено отдельно от и радиально снаружи от роторных стержней (обычно расположено близко к стержням) и способно просеивать или растирать гранулы между вращающимися и колеблющимися стержнями, и растирающее решето, таким образом, уменьшает размер их частиц. Растирающее решето обычно имеет в основном частично циркулярное поперечное сечение и является коаксиальным с центральным роторным валом; и/или может иметь размер отверстий, которые описаны в другом месте.
Другим альтернативным типом мельницы является ротор-гранулятор (вибрационный гранулятор).
Следующий альтернативный тип дробящей мельницы может содержать усеченное коническое решето (например, размер отверстий 0,093 дюйма (2,36 мм), 1,70 мм, 0,065 дюйма (1,65 мм), 0,055 дюйма (1,40 мм), 0,032 дюйма (0,81 мм) или 500 мкм), образующее стенку мельницы, и коаксиальную аксиально-вращаемую усеченную коническую лопасть, расположенную близко к решету, чтобы дробить гранулы, залитые в зазор между решетом и вращающейся лопастью. Измельченные до необходимого размера гранулы могут проскальзывать через отверстия в решете.
Необязательно, мельница может быть неотъемлемой частью роликового уплотнителя, например, как показано на Фиг.6.
Используют любой тип мельницы, предпочтительно такой, с помощью которого выходная плотность гранул, полученных сухой грануляцией (например, роликовое уплотнение), и измельченных гранул составляет от приблизительно 1,0 до приблизительно 1,5 г/см3 (г/мл) и/или от примерно 0,8 до примерно 1,3 г/мл, более предпочтительно (например, для лучшего растворения) от приблизительно 0,8 до приблизительно 1,2 г/мл, еще более предпочтительно от приблизительно 1,0 до приблизительно 1,2 г/мл.
Необязательно, весь измельченный материал можно использовать во время получения фармацевтической композиции (например, таблеток или капсул). Альтернативно и предпочтительно измельченные гранулы можно «классифицировать» так, что часть их с предопределенным конкретным диапазоном размера частиц может быть отделена (отобрана), например, для включения в композицию, при исключении материала выше предопределенного размера частиц (например, отсеиванием) и/или при исключении материала ниже предопределенного размера частиц (например, отсеиванием). Например, измельченные гранулы можно пропускать через два (или более) сита, постепенно уменьшая размер отверстий, и, например, для 2 сит, материал, проходящий через первое сито (например, сито 2,00 или 1,00 или 0,85 или 0,81 мм), но удерживаемый вторым ситом (например, сито 75 или 106 или 150 или 180 мкм (мкм)) могут быть выбраны, например, для включения в композицию. Большие гранулы, удержанные первым ситом, и/или небольшие гранулы, проходящие через второе сито, могут быть необязательно рециркулированы, например, путем подачи их на стадию предварительной грануляции.
Измельченные и/или «классифицированные» гранулы могут иметь такое распределение размеров частиц, как описано далее.
Предпочтительно после образования гранул (например, после роликового уплотнения) и необязательного измельчения до соответствующего размера гранулы затем (i) необязательно смешивают с одним или более фармацевтически приемлемыми эксципиентами (экстрагранулярные эксципиенты) и (ii) необязательно прессуют в таблетки или заполняют в капсулы. Такой экстрагранулярный эксципиент(ты) предпочтительно включает дезинтегрант и/или лубрикант, и/или необязательно включает добавку для прессования и/или наполнитель (разбавитель), и/или связующее вещество, например, как описано в заявке.
Предпочтительные особенности композиции первого, второго, третьего и четвертого аспектов изобретения
Предпочтительно гранулы содержат один или более фармацевтически приемлемых внутригранулярных эксципиентов.
Предпочтительно 90% или более или 95% или более по массе или по существу весь или весь SB 207266 или его соль присутствует в гранулах, которые могут быть получены (образованы) способом сухой грануляции.
Предпочтительно фармацевтическую композицию вводят перорально (способна к пероральному введению), например, перорально вводимая человеку.
Предпочтительно фармацевтическая композиция представляет собой таблетку(и) (например, проглатываемую таблетку), или изобретение относится к капсуле, содержащей фармацевтическую композицию. Таблетка(и), например, может быть круглой в основном поперечном сечении, но предпочтительно таблетка(и) является(ются) овальной в основном сечении (продольном сечении).
Предпочтительно 50% или более по массе или по объему гранул, включающих SB 207266 или его соль, имеют размер частиц: ≥75 мкм, например, 75-1000 или 75-500 мкм, более предпочтительно ≥100 мкм, например, 100-1000 или 100-500 мкм, более предпочтительно ≥106 мкм, например, 106-1000 или 106-500 мкм, более предпочтительно ≥150 мкм, например, 150-1000 или 150-500 мкм, еще более предпочтительно ≥200 мкм, например, 200-1000 или 200-500 мкм. Предпочтительно гранулы, включающие SB 207266 или его соль, имеют размер частиц, определенный как "D50", или медианный размер частиц, например, по массе (DM50) или по объему (DV50), ≥100 мкм или один из других определенных выше предпочтительных диапазонов размеров.
Предпочтительно 70% или более по массе или по объему гранул, включающих SB 207266 или его соль, имеют размер частиц: ≥40 мкм, например, 40-1000 или 40-500 мкм, предпочтительно ≥50 мкм, например, 50-1000 или 50-500 мкм, более предпочтительно ≥53 мкм, например, 53-1000 или 53-500 мкм, еще более предпочтительно ≥63 мкм, например, 63-1000 или 63-500 мкм, наиболее предпочтительно ≥75 мкм, например, 75-1000 или 75-500 мкм.
Предпочтительно 90% или более по массе или по объему гранул, включающих SB 207266 или его соль, имеют размер частиц: ≥10 мкм, например, 10-1000 мкм, более предпочтительно ≥20 мкм, например, 20-1000 или 20-500 мкм, еще более предпочтительно ≥50 мкм, например, 50-1000 или 50-500 мкм, еще более предпочтительно ≥53 мкм, например, 53-1000 или 53-500 мкм, наиболее предпочтительно ≥75 мкм, например, 75-500 мкм. Предпочтительно гранулы, включающие SB 207266 или его соль, имеют размер частиц, определенный как "D10", например, по массе (DM10) или по объему (DV10), ≥10 мкм или один из других определенных выше предпочтительных диапазонов размеров. Как альтернативное определение предпочтительно 10% или менее по массе или по объему гранул, включающих SB 207266 или его соль, имеют размер частиц: ≤10 мкм, более предпочтительно ≤50 мкм, еще более предпочтительно ≤75 мкм.
Композиции по изобретению, содержащие гранулы с приведенными выше средним-большим размерами частиц обычно являются менее когезивными, с лучшей текучестью и обычно оказываются хорошо или приемлемо хорошо прессуемыми в таблетки, и, таким образом, вероятно, в меньшей степени являются причиной вышеприведенных проблем, связанных с приготовлением. Большой процент частиц с размерами частиц менее 75 или 100 мкм может, например, приводить к проблеме прессования таблеток и/или проблемам формообразования, а большой процент частиц с размерами частиц более 1000 мкм может вызвать проблемы с растворением.
Предпочтительно 50% или более по массе или по объему частиц SB 207266 или его соли (например, перед формированием в гранулы и/или после образования гранул; например, в гранулах) имеет размер частиц ≤75 мкм, более предпочтительно ≤50 или ≤53 или ≤63 мкм, еще более предпочтительно ≤20 мкм, даже еще более предпочтительно ≤10 мкм, наиболее предпочтительно ≤8 мкм. Другими словами, это означает, что предпочтительно частицы SB 207266 или его соли (например, перед формированием в гранулы и/или после образования гранул; например, в гранулах) имеют размер частиц, определенный как "D50", или медианный размер частиц, например, по массе (DM50) или по объему (DV50) ≤75 мкм или ≤50 или ≤53 или ≤63 мкм или один из других вышеопределенных предпочтительных диапазонов размеров.
Предпочтительно 10% или более по массе или по объему частиц SB 207266 или его соли (например, перед формированием в гранулы и/или после образования гранул; например, в гранулах) имеет размер частиц ≤20 мкм, более предпочтительно ≤10 мкм, еще более предпочтительно ≤5 мкм, даже еще более предпочтительно ≤2,5 мкм, наиболее предпочтительно ≤ 2 мкма. Другими словами, это означает, что предпочтительно частицы SB 207266 или его соли (например, перед формированием в гранулы и/или после образования гранул; например, в гранулах) имеют размер частиц, определенный как "D10", например, по массе (DM10) или по объему (DV10) ≤20 мкм или один из других вышеопределенных предпочтительных диапазонов размеров.
Предпочтительно 90% или более по массе или по объему частиц SB 207266 или его соли (например, перед формированием в гранулы и/или после образования гранул; например, в гранулах) имеет размер частиц ≤100 мкм, более предпочтительно ≤75 или ≤53 или ≤50 мкм, еще более предпочтительно ≤20 мкм. Другими словами, это означает, что предпочтительно частицы SB 207266 или его соли (например, перед формированием в гранулы и/или после образования гранул; например, в гранулах) имеют размер частиц, определенный как "D90", например, по массе (DM90) или по объему (DV90) ≤100 мкм, более предпочтительно ≤75 или ≤53 или ≤50 мкм, еще более предпочтительно ≤20 мкм.
Как обсуждалось выше, SB 207266 или его соль с такими небольшими размерами частиц является веществом, которое наиболее вероятно приводит к приведенным выше проблемам и наиболее вероятно обеспечивает преимущества, вытекающие из данного изобретения.
Вообще, размеры частиц (D50, D10, D90 и так далее) можно определять просеиванием с использованием одного или более сит (например, для гранул до дальнейшего преобразования в таблетки, и/или для определения порошка внутри капсулы). Подходящие сита включают сита 53, 63, 75, 90, 106, 125, 150, 180, 212, 250, 300, 355, 425, 500, 600, 630, 710, 810 или 850 мкм или сита 1,00, 1,18, 1,40, 1,60, 1,65, 1,70, 2,00, 2,36, 2,46, 2,80, 3,35 или 4,00 мм.
Альтернативно, размеры частиц можно определять лазерной дифракцией, также известной как малоугловое рассеяние лазерного излучения (LALLS). Лазерная дифракция основана на угловом распределении рассеянного света. Лазерная дифракция известна специалистам, и можно использовать алгоритм на основе оптической модели Fraunhoefer или Mie, также известной специалистам. Дополнительные детали методики лазерной дифракции можно найти в: Glive Washington, "Particle Size Analysis in Pharmaceutics and Other Industries, Theory and Practice", Ellis Horwood Limited, 1992, см., в частности, Chapter 6, p. 109-133, детали которого включены в данное описание ссылкой. Вычисления по Fraunhoefer описываются в данной заявке и обычно проводится с использованием программного обеспечения, предоставленного в виде части коммерчески доступного лазерного дифракционного устройства, например, как описано ниже. Соответствующее лазерное дифракционное устройство включает (а) Malvern Masterisizer S, получаемый от Malvern Instruments Limited, Enigma Business Park, Grovewood Road, Malvern, Worcestershire WR14 1XZ, United Kingdom, email: www.malvern.co.uk; и (b) Sympatec HELOS/QUIXEL, полученный от Sympatec UK and Ireland, Bury Business Centree, Kay Street, Bury BL9 6BU, United Kingdom, email:sympatec.uk@btinternet.com.
Альтернативно, размеры частиц можно определять непосредственно (например, оптически, например, с помощью микроскопа, или иным способом) особенно в таблетке. Например, размеры частиц можно определять в срезе таблетки (например, полученном при разламывании или разрезании таблетки на 2 части и исследовании поверхности поперечного сечения); можно определять диаметры отдельных частиц, что дает возможность установить распределение размера частиц по объему и из этого по массе.
Способы анализа размера частиц обычно предполагают сферичность частиц при вычислении распределения. В случаях когда анализируют несферические частицы, требуется интепретация специалистов для понимания влияния, которое форма может оказывать на асимметричность распределения размера. Способы определения частиц по размеру, в которых используют изображение частиц, такое как микроскопия, могут, однако, точно дать заключение о форме и размере частиц, хотя обычно размер следует еще выражать, допуская сферичность.
Предпочтительно SB 207266 или его соль (например, соль HCl) является формой, получаемой по, например, предпочтительно. изготовленной по способу, в котором SB 207266 или его соль (например, соль HCl) растворяют в С1-4-спирте, чтобы получить раствор, и кристаллизуют из раствора добавлением С5-С10-углеводорода (например, гексана и/или гептана, например н-гептана) и/или растворителя, содержащего С5-С10-углеводород (например, гексан и/или гептан, например н-гептан). С1-4-спирт может содержать или представлять собой: метанол, пропанол (например, изопропанол), бутанол (например, н-бутанол или трет-бутанол) и/или этанол или растворитель, содержащий этанол, такой как промышленные метилированные спирты (IMS, например, этанол, содержащий около 1% метанола). Этанол или растворитель, содержащий этанол, является предпочтительным. Такими способами часто получают SB 207266 или соль с небольшими размерами частиц, по крайней мере, для соли HCl, продукты которых наиболее вероятно приводят к приведенным выше проблемам и наиболее вероятно обеспечивают преимущества, вытекающие из данного изобретения.
Предпочтительно N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB 207266) или его фармацевтически приемлемая соль содержит (например, является) гидрохлорид SB 207266 (SB 207266-А), более предпочтительно игольчатую кристаллическую форму гидрохлорида SB 207266. Игольчатая кристаллическая форма может, например, необязательно быть такой, как описано выше, и/или может быть по существу, такой, как показано на одной или более Фигур 1, 2 и 3, в частности 3, и/или по существу такой, как раскрыто в описании 2, и/или может, например, быть определена как >50% кристаллов по количеству или по объему или по массе, являющихся игольчатыми или иным образом удлиненными; и/или может, например, быть определена как >50% кристаллов по количеству или по объему или по массе, являющихся <75 мкм или <100 мкм или <200 мкм по длине и/или <10 мкм или <25 мкм по ширине. Игольчатая кристаллическая форма является по существу безводной (например, безводной) кристаллической формой SB 207266-A. Так, SB 207266-A предпочтительно содержит (например, 70% или более, или 80% или более, 90% или более является) или состоит по существу из или является, по существу безводным или его безводной кристаллической формой. Содержание гидратной воды можно определить по известным способам, таким как способ Карла Фишера (например, как описано в фармакопее США (например, 1990 издание, страницы 1619-1621) или как описано в Европейской фармакопее (например, 2nd edition, 1992, part 2, 16th fascicule at v. 3.5.6-1). Гидрохлорид SB 207266 (например, игольчатая и/или безводная кристаллическая форма) предпочтительно имеет инфракрасный (IR) (ИК) спектр (нуол) по существу, как показано на Фиг.4; и/или имеет инфракрасный (IR) спектр (нуол) с тремя, четырьмя, пятью, шестью или более пиками (например, все) из следующих пиков 3423, 3044, 2502, 1628, 1582, 1502, 1531, 1184, 748 см-1 (допускается некоторое изменение пиков, например, около ±2 см-1 или около ±1 см-1); и/или имеет инфракрасный спектр (нуол) с тремя, четырьмя, пятью или более (например, все) из следующих пиков 1628, 1582, 1502, 1531, 1184, 748 см-1 (допускается некоторое изменение пиков, например, около ±2 см-1 или около ±1 см-1). См., например, описание 2 для описания Фиг.4.
Предпочтительно SB 207266 или его соль присутствует в композиции и/или в гранулах, в количестве, по крайней мере, 3,5 мас.%, более предпочтительно, по крайней мере, 4 мас.% или, по крайней мере, 4,4 мас.%, или, по крайней мере, 5 мас.%, или, по крайней мере, 6 мас.%, или, по крайней мере, 7 мас.%, или, по крайней мере, 8 мас.%, или, по крайней мере, 11 мас.%, или, по крайней мере, 15 мас.%, или, по крайней мере, 20 мас.% массы композиции и/или массы гранул соответственно. Предпочтительно SB 207266 или его соль присутствует в композиции и/или в гранулах в количестве вплоть до 95 мас.%, более предпочтительно вплоть до 70 мас.% или вплоть до 60 мас.%, наиболее предпочтительно вплоть до 50 мас.% или вплоть до 40 мас.% массы композиции и/или массы гранул соответственно. Наиболее предпочтительно SB 207266 или его соль присутствует в композиции и/или в гранулах в количестве 4,4-95% или 6-95%, или 6-88%, или 11-70%, или 11-60%, или 15-60% по массе от массы композиции и/или массы гранул, соответственно. Для примера, например, из примеров 1-9, SB 207266 или его соль присутствует в композиции в количестве от 4,4 мас.% до 35,2 мас.%. Эти предпочтительные проценты рассчитывают как фактическую массу SB 207266 или его соли, включая любые противоионы или добавленные кислоты (например, HCl для соли HCl), которые присутствуют.
Например, для каждых 250 мг массы композиции (например, для каждых 250 мг массы покрытой или непокрытой таблетки), композиция идеально содержит: от около 10 до около 150 мг или от около от 11 до около 150 мг (например, 10, 11, 22, 27,5, 33, 44, 55, 82,5, 88, 110 или 132 мг) SB 207266 или его соли, такой как гидрохлорид (рассчитанной как фактическая масса, включая противоионы и добавленные кислоты); или от около 10 до около 120 мг (например, 10, 20, 25, 30, 40, 50, 75, 80, 100 или 120 мг) SB 207266 или его соли (рассчитано как свободное основание).
Предпочтительно композиция находится в единичной дозированной форме (предпочтительно таблетка или капсула, например, 250 мг таблетки по массе непокрытой таблетки). В этом случае предпочтительно единичная дозированная форма (например, таблетка или капсула), являющаяся композицией или содержащая композицию, содержит: от приблизительно 10 до приблизительно 150 мг, или от приблизительно 11 до приблизительно 150 мг, или 44-132 мг, или 44-110 мг, или 82,5-110 мг (например, 10, 11, 22, 27,5, 33, 44, 55, 82,5, 88, 110 или 132 мг, предпочтительно 55 или 88 мг) SB 207266 или его соли, такой как гидрохлорид (рассчитанного как фактическая масса, включая противоионы и добавленные кислоты). Предпочтительно единичная дозированная форма (например, таблетка или капсула), являющаяся композицией или содержащая композицию, содержит: от приблизительно 10 до приблизительно 120 мг, или 40-120 мг, или 40-100 мг, или 75-100 мг (например, 10, 20, 25, 30, 40, 50, 75, 80, 100 или 120 мг, предпочтительно 50 или 80 мг) SB 207266 или его соли (рассчитанного как свободное основание).
Предпочтительно гранулы, содержащие SB 207266 или его соль, также содержат наполнитель (разбавитель). Смешивание наполнителя с SB 207266 или его солью перед грануляцией часто способствует образованию гранул. Гранулирование чистого SB 207266 или его соли может быть трудным.
Предпочтительно наполнитель (разбавитель) представляет собой абразивный материал. Абразивный материал способствует уменьшению когезионной способности SB 207266 или его соли и способствует текучести гранул.
Предпочтительно наполнитель является хрупким (в противоположность эластичному или пластичному). Хрупкость может быть определена по тестам, известным специалистам в данной области, таким как тесты имитации уплотнения, которые, например, определяют модуль Юнга наполнителя.
Предпочтительно наполнитель (разбавитель) является нерастворимым, практически нерастворимым, очень немного растворимым или немного растворимым (более предпочтительно нерастворимым или практически нерастворимым) в растворителе для грануляции, например, воде и/или этаноле и/или изопропаноле. Термины «практически нерастворимый», «очень немного растворимый» и/или «немного растворимый» могут быть такими, как определено в Британской фармакопее, Европейской фармакопее и/или Фармакопеи США. «Практически нерастворимый» согласно Британской фармакопее 1999 (страница 11) означает, что, по крайней мере, 10 литров растворителя требуется, чтобы растворить 1 грамм наполнителя/растворенного вещества (например, при температуре окружающей среды, например, при 15 или 20 или предпочтительно 25°С). «Очень немного растворимый» в соответствии Британской фармакопеей означает, что, по крайней мере, 1 литр и вплоть до 10 литров растворителя требуется, чтобы растворить 1 грамм наполнителя/растворенного вещества (например, при 25°С). «Немного растворимый» в соответствии с Британской фармакопеей означает, что, по крайней мере, 100 мл и вплоть до 1 литра растворителя требуется, чтобы растворить 1 грамм наполнителя/растворенного вещества (например, при 25°С). «Растворимый» в соответствии с Британской фармакопеей, 1999, означает, что от 10 до 30 мл растворителя требуется, чтобы растворить 1 грамм растворенного вещества при температуре окружающей среды (например, при 25°С). «Легко растворимый» согласно Британской фармакопее означает, что от 1 до 10 мл растворителя требуется, чтобы растворить 1 грамм растворенного вещества (например, при 25°С). «Хорошо растворимый» в соответствии с Британской фармакопеей означает, что менее 1 мл растворителя требуется, чтобы растворить 1 грамм растворенного вещества (например, при 25°С).
Предпочтительно наполнитель содержит (например, является) любую фармацевтически приемлемую соль металла (например, кальция или магния), которая является нерастворимой, практически нерастворимой, очень немного растворимой или немного растворимой (предпочтительно нерастворимой) в воде и/или этаноле. Соль, например, может быть фосфатом, гидрофосфатом, карбонатом, бикарбонатом или лактатом. Такие соли от нерастворимых до немного растворимых включают фосфат кальция, двухосновный фосфат кальция (гидрофосфат кальция), карбонат кальция, карбонат магния, фосфат магния, лактат кальция (например, пентагидрат) и так далее; так, наполнитель может содержать (например, являться) одну или более из названных солей.
Предпочтительно наполнитель содержит (например, является) двухосновный фосфат кальция (то есть дикальцийфосфат, гидрофосфат кальция, СаНРО4). Более предпочтительно наполнитель содержит (например, является) гидрат двухосновного фосфата кальция, например, дигидрат (то есть гидрат гидрофосфата кальция, например дигидрат или СаНРО4·2Н2О). Также можно использовать безводный двухосновный фосфат кальция. СаНРО4, например, гидратированный или безводный, является абразивным материалом и способствует снижению когезионной способности SB 207266 или его соли; и он нерастворим в воде. Альтернативно или дополнительно, наполнитель может содержать фосфат кальция, то есть трехосновный фосфат кальция, Са3(РО4)2. Гидрофосфат кальция может действовать как добавка, повышающая текучесть, например, во время сухой грануляции; он обычно способствует роликовому уплотнению и он является плотным.
Необязательно, можно использовать мелкоизмельченный наполнитель (имеющий средний и медианный размер частиц приблизительно 5-30 мкм, например, 5-20 мкм или от приблизительно 9 до приблизительно 15 мкм). Например, можно необязательно использовать мелкоизмельченный СаНРО4 (дигидрат или безводный), такой как CalipharmТМ, например калифарм D (дигидрат) или калифарм А (безводный), которые описаны, например, в Handbook of Pharmaceutical Excipients, 3rd edn, 2000; или необязательно можно использовать мелкоизмельченный Са3(РО4)2.
Однако предпочтительно использовать наполнитель грубого помола, то есть наполнитель, имеющий средний и медианный размер частиц: ≥50 или ≥53, или ≥100, или ≥106 мкм и/или ≤425, или ≤300, или ≤250, или ≤200 мкм, например, 53-300 мкм или 106-300 мкм или 106-250 мкм), например: грубый помол дигидрата СаНРО4, такой как EmcompressТМ или DI-TBATM (средний размер частиц = около 180 мкм) или безводный СаНРО4 грубого помола, такой как Emcompress безводныйТМ или А-ТАВТМ (средний размер частиц = около 136 и около 180 мкм соответственно), как описано в Handbook of Pharmaceutical Excipients, 3rd edn, 2000. EmcompressТМ и Emcompress безводныйТМ получают от фирмы Penwest Pharmaceuticals Co. at 801 First Street S.W., P.O. BoX 99, Cedar Repids, IA., USA или 2981 Route 22, Patterson, N.Y. 12563, USA. DI-TABTM и CalipharmТМ получают от фирмы Rodia в: Rhodia Inc., 259 Prospect Plains Road CN 7500, Cranbury, USA 08512-7500 или в Rhodia Organique, 190 avenue Thiers, 69457 Etoile Part-Dieu, France.
Наполнитель предпочтительно присутствует в количестве вплоть до 95 мас.% гранул и/или вплоть до 85% или вплоть до 70%, или вплоть до 60 мас.% от массы композиции и/или гранул. Предпочтительно наполнитель присутствует в количестве ≥15 мас.%, или ≥20 мас.%, или ≥30 мас.% композиции и/или массы гранул. Например, наполнитель предпочтительно присутствует в количестве от 15 до 85% или от 15 до 70% массы композиции и/или массы гранул. Например, (например, из примеров 1-8 или примера 9) наполнитель может присутствовать в количестве от 33,8% до 64,6% и/или от 38,8% до 69,6% массы композиции. Предпочтительно составляет от приблизительно 10 до приблизительно 90% массы гранул. Предпочтительно наполнитель является, по крайней мере, частично (например, полностью) внутригранулярным.
Предпочтительно массовое отношение наполнителя (например, как описывается в данной заявке) к лекарственному средству (то есть SB-207266 или его фармацевтически приемлемой соли) в композиции и/или гранулах составляет, по крайней мере, 1:3, предпочтительно, по крайней мере, 1:2,5 или, по крайней мере, 1:2, или, по крайней мере, 2:3; и/или предпочтительно составляет приблизительно ≤10:1 или ≤5:1, или ≤3:1. Например, массовое соотношение наполнителя к лекарственному средству в гранулах может предпочтительно составлять от 1:3 до примерно 10:1 (например, от 1:3 до 10:1) или от 1:2 до примерно 10:1 (например, от 1:2 до 10:1), например, от 2:3 до 10:1 или от 1:3 до 3:1 или от 1:2 до 3:1, или от 2:3 до 3:1. Соответственно массовое отношение наполнителя к лекарственному средству в композиции и/или гранулах является таким, как определено выше, причем наполнитель содержит (например, является) один или более из фосфата кальция, гидрофосфата кальция (например, гидрата и/или безводного), карбоната кальция, карбоната магния, фосфата магния и лактата кальция (например, пентагидрата); более предпочтительно наполнитель содержит (например, является) фосфат кальция и/или гидрофосфат кальция (например, гидрат и/или безводный).
Наполнитель (например, как описано в данной заявке, например, СаНРО4) может быть внутригранулярным, экстрагранулярным или частично внутригранулярным и частично экстрагранулярным; см. например, примеры 1-3 для СаНРО4. Предпочтительно, по крайней мере, часть (например, некоторое количество или весь, например, 50% или более или 70% или более, или 90% или более) наполнителя является внутригранулярным, например, см. примеры 2-9. Более предпочтительно наполнитель полностью является внутригранулярным, например, см. пример 2, примеры 4-10, которые модифицируют пример 2; и примеры 11-16. Если наполнитель, по крайней мере, частично присутствует внутригранулярно (то есть во время процесса сухой грануляции), тогда предпочтительно внутригранулярное соотношение наполнителя к лекарственному средству (то есть соотношение во время сухой грануляции) составляет от приблизительно 1:10 до приблизительно 10:1, предпочтительно, по крайней мере, 1:3 или, по крайней мере, 1:2, или, по крайней мере, 1:2,5, или, по крайней мере, 2:3, или ≥1:1, и/или предпочтительно ≤5:1 или ≤3:1. Более предпочтительно внутригранулярное отношение наполнителя к лекарственному средству, то есть соотношение во время сухой грануляции составляет от 1:3 до примерно 10:1 (например, от 1:3 до 10:1) или от 1:2 до приблизительно 10:1 (например, от 1:2 до 10:1), или от 1:3 до 3:1, например от 1:1 до примерно 10:1, или от 1:2 до 3:1, или от 1:1 до 3:1.
Предпочтительно композиция включает эксципиент, который действует как добавка для прессования, например содержащая или являющаяся микрокристаллической целлюлозой (МСС). Добавка для прессования предпочтительно присутствует в количестве, по крайней мере, 3 мас.% или, по крайней мере, 5 мас.% и/или ≤60 мас.%, или ≤50 мас.%, ≤30 мас.% массы композиции и/или массы гранул, более предпочтительно, по крайней мере, 10 мас.% или, по крайней мере, 15 мас.% массы композиции и/или массы гранул, еще более предпочтительно 10-50 мас.% или 15-50 мас.%, или 15-30 мас.% (например, приблизительно 20 мас.%) массы композиции и/или массы гранул.
Предпочтительно добавка для прессования содержит (например, является) микрокристаллическую целлюлозу (МСС), имеющую номинальный средний размер частиц от приблизительно 25 мкм до приблизительно 150 мкм, более предпочтительно от приблизительно 50 мкм до приблизительно 100 мкм. Соответствующие типы МСС включают Avicel PH-102 (номинальный средний размер частиц приблизительно 100 мкм) и Avicel PH-101 (номинальный средний размер частиц приблизительно 50 мкм), поставляемые фирмой FMC Corporation.
Альтернативно, маннит и/или лактозу (например, прессуемую лактозу, например, безводную лактозу или высушенную распылением лактозу) можно использовать как добавку для прессования. Такие добавки для прессования, которые также можно классифицировать как наполнители, классифицируют как добавки для прессования для целей данной патентной заявки. СаНРО4 и подобные соли металлов (например, которые описаны выше) рассматривают как наполнители.
«Добавка для прессования» означает эксципиент, который способствует полной прессуемости (сжимаемости), например, во время процесса сухой грануляции и/или во время любого прессования в таблетки. Например, МСС способствует пластичной деформации при таблетировании и способствует роликовому уплотнению.
Добавка для прессования может присутствовать внутри гранул (то есть внутригранулярное) и/или снаружи (вне) гранул (то есть экстрагранулярное). Добавка для прессования может присутствовать внутри гранул (то есть, внутригранулярное) и/или вне (то есть, экстрагранулярное) гранул композиции. Предпочтительно добавка для прессования, по крайней мере, частично (например, полностью) является внутригранулярной.
Предпочтительно внутригранулярное массовое соотношение, то есть массовое соотношение во время процесса сухой грануляции, наполнителя (например, как определено в описании, например, гидрофосфат кальция) к добавке для прессования (например, микрокристаллической целлюлозе, такой как Avicel PH-102 или PH-101) составляет ≥15:1 или ≥7:1, или ≥5:1, или ≥4:1, или ≥ 3:1, или ≥ 5:2, и/или предпочтительно составляет ≤1:3 или ≤1:2, или ≤2:3, или ≤1:1, или ≤3:2. Например, внутригранулярное массовое отношение наполнителя к добавке для прессования может составлять от 7:1 до 1:2, предпочтительно от 5:1 до 2:3, наиболее предпочтительно от 4:1 до 1:1, еще более предпочтительно от 3:1 до 3:2 или от 5:2 до 3:2, и наиболее предпочтительно приблизительно 2:1 (например, от 2,2:1 до 1,8:1, от 2,1:1 до 2,0:1 или от 2,07:1 до 2,04:1).
Необязательно, композиция может включать связующее вещество. Связующее вещество связывает лекарственное средство (SB 207266 или его соль) с другими внутригранулярными ингредиентами, увеличивая нагрузку гранул, с тем чтобы, например, при прессовании они образовывали более прочные связи. Связующее вещество предпочтительно представляет собой целлюлозное связующее вещество, например, содержащее или являющееся гидроксипропилметилцеллюлозой (НРМС) (например, НРМС с низкой вязкостью, такая как Pharmacoat 603, производимая фирмой Shinogi, Japan). Другие необязательные целлюлозные связующие вещества могут включать гидроксипропилцеллюлозу (НРС), гидроксиэтилцеллюлозу (НЕС), гидроксиметилцеллюлозу (НМС), метилцеллюлозу (например, от низкой до средней вязкости), этилцеллюлозу и так далее. Другие подходящие связующие вещества включают повидон (поливинилпироллидон, PVP; названное вещество по существу является линейным несшитым полимером, см. Handbook of Pharmaceutical Excipients, 3rd edn, 2000), например, типы повидона К25, К30, К60 или К90 и/или повидон, имеющий молекулярную массу от приблизительно 50000 до приблизительно 1000000. Связующее вещество предпочтительно может присутствовать в количестве от приблизительно 1 до приблизительно 10 мас.% массы композиции, например, от приблизительно 2,5 до приблизительно 10 мас.% или от приблизительно 1 до приблизительно 5 мас.% (например, приблизительно 5 мас.%) массы композиции. НРМС предпочтительно присутствуют в количестве 5 мас.%. Связующее вещество может присутствовать внутри (внутригранулярное) и/или вне (экстрагранулярное) гранул композиции (внутригранулярный и экстрагранулярный выбор не исключает возможности того, что часть связующего вещества присутствует в неустановленной области).
Однако предпочтительно композиция не включает связующее вещество НРМС; более предпочтительно композиция не включает связующее вещество (например, см. примеры 9 и 11-16).
Предпочтительно композиция включает дезинтегрирующее вещество (например, таблеточный дезинтегрант), такое как гликолят крахмала натрия (например, Primojel или ExplotabTM, последний поставляет фирма Penwest Pharmaceuticals Co. на 801 First Street S.W., P.O. Box 99, Cedar Rapids, IA., USA, или на 2981 Route 22, Patterson, N.Y. 12563, USA), натрийкроскармеллоза (например, Ac-Di-SolTM) или кросповидон (сшитый поливинилпироллидон). Дезинтегрант предпочтительно может присутствовать в композиции в количестве от приблизительно 1 до приблизительно 10 мас.%, например, от приблизительно 2,5 до приблизительно 10 мас.% или от приблизительно 3,7 до приблизительно 10 мас.%, или от приблизительно 5 до примерно 10 мас.%, или от примерно 1 до 5 мас.% (например, приблизительно 5 мас.% композиции). Предпочтительно гликолят крахмала натрия присутствует в количестве примерно 5 мас.% Дезинтегрант может присутствовать внутри (внутригрануляционный) и/или вне (экстрагрануляционный) гранул композиции (внутригрануляционный выбор и экстрагрануляционный выбор не исключает возможности того, что часть дезинтегранта присутствует в неустановленной области). Предпочтительно дезинтегрант присутствует, по крайней мере, частично (например, полностью) экстрагранулярно.
Предпочтительно композиция включает лубрикант, например, содержащий или являющийся стеаратом щелочноземельного металла, такой как стеарат кальция или, более предпочтительно, стеарат магния. Лубрикант может присутствовать предпочтительно в количестве от приблизительно 0,2 до приблизительно 5 мас.% или, более предпочтительно, от примерно 0,2 до примерно 2 мас.%, или от приблизительно 0,5 до приблизительно 2 мас.% (например, приблизительно 1 мас.% или приблизительно 2 мас.%) массы композиции и/или массы гранул. Предпочтительно, по крайней мере, часть лубриканта присутствует внутри гранул (внутригранулярная) (что не исключает возможности, что часть лубриканта находится вне гранул). Это допускает смазывание во время стадии сухой грануляции и минимизирует трудности процесса, такие как прилипание гранулированных ингредиентов к металлическим частям машины, например, в роликовом уплотнителе. Более предпочтительно лубрикант может присутствовать как внутригранулярно, так и экстрагранулярно. Необязательно, внутригранулярный лубрикант присутствует в количестве от приблизительно 1% до примерно 35% или от приблизительно 1% до приблизительно 25%, или более предпочтительно от примерно 1% до примерно 12% от массы гранул.
Гранулы (например, внутригранулярные ингредиенты), необязательно, могут составлять от приблизительно 2% до приблизительно 99,8% массы или от примерно 2% до примерно 99% массы, например, от приблизительно 4% до приблизительно 95% массы, или от примерно 4% до примерно 75% массы, или от примерно 2% до примерно 75% массы композиции. Гранулы (то есть внутригранулярные ингредиенты) предпочтительно составляют от приблизительно 50% до 99,8% или от примерно 75% до 99,8% массы композиции. Более предпочтительно гранулы составляют от приблизительно 50% до приблизительно 99% или от примерно 75% до примерно 99% массы композиции. Например, гранулы могут составлять от приблизительно 90% до 99,8% или от примерно 90% до примерно 99%, или от примерно 95% до примерно 99% массы композиции. Альтернативно, гранулы могут составлять 100% массы композиции (то есть никаких экстрагранулярных эксципиентов).
В пятом аспекте изобретения предлагается способ получения фармацевтической композиции, содержащей N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB 207266) или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми эксципиентами (носителями),
способ, включающий:
(а) растворение SB 207266 или его соли в С1-4-спирте для получения раствора,
(b) кристаллизацию SB 207266 или его соли из раствора добавлением С5-С10-углеводорода (например, гексана и/или гептана) и/или растворителя, содержащего С5-С10-углеводород (например, гексан и/или гептан), и
(с) преобразование, по крайней мере, некоторого количества SB 207266 или его соли в гранулы способам сухой грануляции.
С1-4спирт может содержать или представлять собой: метанол, пропанол (например, изопропанол), бутанол (например, н-бутанол или трет-бутанол), и/или этанол или растворитель, содержащий этанол, такой как промышленные метилированные спирты (IMS, например этанол, содержащий около 1% метанола). Предпочтительными являются этанол или растворитель, содержащий этанол.
Способ сухой грануляции и/или эксципиент(ы) могут быть такими, как описано в данной заявке.
В данном пятом аспекте изобретения особенно предпочтительным является то, что SB 207266 или его соль содержит (например, является) гидрохлорид SB 207266, например его игольчатую кристаллическую форму.
SB 207266 или его соль можно обычно вводить любым из способов, обычно используемых для введения лекарственного средства, например парентерально, перорально, местно или ингаляцией.
Способы получения композиции и/или таблетки, и/или капсулы могут включать смешивание, грануляцию и прессование ингредиентов, когда необходимо для требуемого препарата.
Эксципиент(ы)/носители, используемые в композиции, должны быть «фармацевтически приемлемыми» в смысле наличия совместимости с другими ингредиентами препарата и невредными для его реципиента.
Применяемый фармацевтически приемлемый носитель может быть, например, твердым веществом. Примерами твердых носителей являются лактоза, белая глина, сахароза, тальк, желатин, агар, пектин, аравийская камедь, стеарат магния, стеариновая кислота и тому подобное. Аналогично носитель может включать замедляющее вещество, хорошо известное в данной области, такое как глицеринмоностеарат или глицериндистеарат отдельно или в смеси с воском.
Можно использовать большое разнообразие фармацевтических форм. Таким образом, если используют твердый носитель, препарат можно таблетировать или можно помещать в твердую желатиновую капсулу, использовать в виде порошка или пилюли, или в форме пастилки или лепешки. Количество твердого носителя можно широко изменять, но предпочтительно оно составляет от приблизительно 25 мг до приблизительно 1 г.
Практическое/промышленное применение
Фармацевтическую композицию, содержащую SB 207266 или его соль, которую можно получить или получена способом данного изобретения можно применять при лечении или профилактике аритмий предсердий, таких как фибрилляция предсердий (AF) и/или при лечении или профилактике реконструкции предсердия. Фибрилляция предсердий является предпочтительной. В частности, полагают, что композиции, такие как таблетки, содержащие SB 207266 или его соль, можно вводить пациенту при симптоматической устойчивой фибрилляции предсердий (AF) для того, чтобы ингибировать симптоматические рецидивы фибрилляции предсердий. Предложенный клинический протокол представлен в примере 17 ниже.
Следовательно, изобретение также предлагает способ лечения или профилактики аритмии предсердий, такой как фибрилляция предсердий, включающий введение млекопитающему (например, человеку), при необходимости такого лечения или профилактики, эффективного количества фармацевтической композиции, как определено в данном описании, либо которую можно получить или полученную способом, как определено в данном описании. Изобретение также предлагает способ ингибирования симптоматических рецидивов фибрилляции предсердий у млекопитающего (например, человека) с симптоматической, устойчивой фибрилляцией предсердий, включающий введение млекопитающему эффективного количества фармацевтической композиции, как определено в описании, либо которую можно получить или получена способом, как определено в описании.
Композиции SB 207266 также могут снижать случаи удара у пациентов с AF. Композиции SB 207266 также можно использовать при лечении и/или профилактике недержания мочи, и/или других применений, как раскрыто в WO 93/18036.
Все публикации, но, не ограничиваясь этим, включающие патенты и патентные заявки, цитируемые в данном описании, включены в данную заявку ссылкой так, как если бы каждая индивидуальная публикация специально и индивидуально была указана для включения ссылкой во всей своей полноте.
ПРИМЕРЫ
Далее изобретение будет описано с помощью ссылок на следующие описания и примеры, которые являются только иллюстративными и которые не должны рассматриваться как ограничивающие объем изобретения, который, в частности, определяется формулой изобретения.
Описания служат примером некоторых, не ограничивающих способов, с помощью которых можно получить SB 207266 и/или его гидрохлорид; являются возможными другие способы. Не ограничивающие примеры (помимо сравнительного примера) являются примерами способов сухой грануляции для изготовления фармацевтической композиции, содержащей SB 207266 или его фармацевтически приемлемую соль, начиная с SB 207266 или его фармацевтически приемлемой соли, и являются примерами сухих гранулированных фармацевтических композиций, изготовленных, таким образом, в соответствии с воплощениями изобретения.
Примеры и/или описания частично раскрываются с помощью ссылок на фигуры, на которых:
Фиг.1 представляет собой масштабную микрофотографию (фотографию), демонстрирующую исходные стадии образования игольчатых кристаллов гидрохлорида N-[1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамида (SB-207266-A) во время стадии кристаллизации описания 2. Длинные тонкие иглы являются очевидными.
Фиг.2 представляет собой масштабную микрофотографию, демонстрирующую конечные стадии образования игольчатых кристаллов SB-207266-A, показанных на Фиг.1, после стадии кристаллизации описания 2. Иглы увеличились по ширине.
Фиг.3 представляет собой масштабную микрофотографию, демонстрирующую кристаллы SB-207266-A Фиг.2 после того, как они были перемешаны, промыты и перенесены в вакуумную печь для высушивания по описанию 2. Длинные иглы Фиг.2 сломаны до более коротких кристаллов.
Фиг.1-3 иллюстрируют и, если не указано иное, не должны рассматриваться как ограничение объема данного изобретения, который определяется, в частности, формулой изобретения. Результаты образования различных кристаллов и/или трансформации кристаллов и различные размеры кристаллов являются возможными и входят в объем изобретения, если не указано иное.
Фиг.4 представляет инфракрасный (IR) спектр (нуол) игольчатый по существу безводной кристаллической формы гидрохлорида SB-207266 (SB-207266-А), как получено по описаниям 1 и 2 и раскрыто в описании 2.
Фиг.5 представляет собой поперечный разрез определенных частей роликового уплотнителя модели Fitzpatrick Chilsonator IR220 типа, использованного в примерах 1 и 11 и как описано более подробно на стадии 2 примера 11.
Фиг.6 представляет собой поперечный разрез определенных частей роликового уплотнителя модели Fitzpatrick Chilsonator IR220 (наверху) и (внизу) дробящей мельницы FitzMill L1A, имеющей центральную ось/стержень 18 с выступающими ножами 20 и молоточками 22 и ситом/решетом 24 и как подробно описано в данной заявке выше.
Описания
SB 207266 - N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид - может быть получен с использованием способов синтеза, описанных во введении, например, предпочтительно, как описано в одном или более из WO 98/07728, WO 98/11067; WO 00/03983 и/или WO 00/03984.
Что касается способа получения гидрохлорида SB 207266 из свободного основания, см., в частности, способ В на странице 8, строки 10-19 WO 98/07728 и небольшие его изменения, которые описаны полностью в разделах "Введение" и "Изобретение" выше (например, см. на стр. 2 заявки выше). Одно небольшое и полностью эквивалентное изменение способа В WO 98/07728 представлено подробно в следующем описании 1, в котором на стадии кристаллизации использовали промышленные метилированные спирты (IMS) вместо этанола и н-гептан вместо гексана. В описаниях 1 и 2 используемым особым типом IMS был этанол, содержащий около 1% метанола. В описании 2 представлен альтернативный способ получения гидрохлорида SB 207266 из свободного основания, используя ацетилхлорид вместо безводной HCl.
Описание 1: гидрохлорид N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамида; способ с использованием безводной HCl
N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB-207266) (100 г, 0,27 моль) растворяли в промышленных метилированных спиртах (IMS) (825 мл) и полученный раствор фильтровали, чтобы удалить частицы. Безводную HCl в IMS (174 мл, 1,7М, 0,29 моль) добавляли, чтобы вызвать выпадение продукта в осадок из раствора. Суспензию нагревали для повторного растворения твердого вещества и добавляли н-гептан (550 мл). После охлаждения до комнатной температуры смесь охлаждали до 0-5°С и перемешивали при такой температуре приблизительно в течение одного часа. Твердое вещество отделяли фильтрованием и высушивали в вакууме при приблизительно 40°С, чтобы получить продукт гидрохлорид N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамида (SB-207266-А), (98 г) с 89% выходом.
Объемные плотности SB-207266-А из описания 1 (и/или вариант, использующий этанол вместо IMS) были низкими и их измеряли как:
плотность г/мл
плотность г/мл
Описание 2: гидрохлорид N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамида; способ с использованием ацетилхлорида и анализ частиц
1. N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамид (SB-207266) (20 г, 54 ммоль, 1 моль эквивалент)) растворяли в промышленных метилированных спиртах (IMS) (160 мл) и раствор фильтровали в 500 мл сосуд. [Желательно использовать вспомогательный фильтрующий материал, чтобы удалить неорганические вещества, которые могут присутствовать в виде мелкого порошка.] Остаток промывали IMS (20 мл).
2. Фильтрованный ацетилхлорид (4,6 мл, 64 ммоль, 1,2 моль эквивалентов) медленно добавляли при <45°С (например, при комнатной температуре, например, приблизительно 15-25°С) к фильтрованному раствору SB-207266 в IMS, который также был при <45°С (например, при комнатной температуре). Реакция была экзотермической, поэтому скорость добавления ацетилхлорида следует контролировать с тем, чтобы температура реакционной смеси оставалась ниже точки кипения ацетилхлорида (50°С) и предпочтительно ниже 45°С. В данном воплощении ацетилхлорид добавляли в течение 30 минут. [Следует избегать контакта ацетилхлорида с железосодержащими металлами, так как это может вызвать голубое окрашивание жидкостей]. Остатки ацетилхлорида в сосуде промывали в реакционной смеси с фильтрованным IMS (20 мл).
3. Полученную смесь нагревали до 70-80°С, чтобы получить раствор. Затем стадия 4 может следовать сразу после получения раствора; или альтернативно, горячий раствор может поддерживаться и перемешиваться при 70-80°С в течение 10 минут перед стадией 4.
4. Фильтрованный н-гептан (100 мл) при комнатной температуре добавляли к горячему (60-80°С, например, 60-70°С) раствору приблизительно в течение 1 часа, поддерживая температуру раствора при 60-80°С, например, 60-70°С. Затем стадию 5 можно проводить сразу или после короткого интервала времени (например, 10 минут).
5. Смесь охлаждали до 0-5°С, период времени зависит от размера и охлаждающей способности сосуда (например, можно охлаждать в течение периода от приблизительно 30 минут до приблизительно 2 часов). Охлажденную содержащую кристаллы смесь перемешивали в течение 1 часа.
6. Кристаллический продукт отделяли от охлажденного растворителя фильтрованием, например, используя воронку Бюхнера, и промывали фильтрованной смесью 1:1 IMS:н-гептан (20 мл). Продукт представлял собой мелкоизмельченное твердое вещество, которое довольно медленно фильтруется. Продукт сушили в вакууме при 40°С, например, в вакуумной печи, чтобы получить продукт, гидрохлорид N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-a]индол-10-карбоксамида (SB-207266-A, 20,4 г, выход 93%) в виде белых кристаллов. Выход может варьировать и может обычно составлять от приблизительно 85 до приблизительно 95%. Типичные значения плотности: аэрированная объемная плотность = около 0,14 г/мл, выходная объемная плотность = около 0,31 г/мл.
Анализ частиц: Фиг.1, 2 и 3 иллюстрируют стадии образования и трансформации кристаллов гидрохлорида SB-207266-A во время различных стадий описания 2. Следует отметить, что Фиг.1-3 являются иллюстративными и, если не указано иное, не должны рассматриваться как ограничение объема изобретения, который определен, в частности, формулой изобретения. Результаты образования различных кристаллов и/или трансформации кристаллов и разные размеры кристаллов являются возможными и входят в объем изобретения, если не указано иное.
Фиг.1 иллюстрирует начальные стадии образования кристаллов, которое происходит во время и/или через 1 час после добавления н-гептана при 60-70°С (стадия 4) и/или во время охлаждения от 60-70°С до 0-5°С (стадия 5). Можно видеть, что первоначально образуются тонкие длинные (обычно >100 мкм) игольчатые кристаллы SB-207266.
Фиг.2 иллюстрирует конечные стадии образования кристаллов, в конце 1 часа перемешивания при 0-5°С на стадии 5. Длинные (>100 мкм) игольчатые кристаллы SB-207266-А еще видны, но они имеют несколько бóльшую ширину (диаметр) вследствие роста кристаллов.
Как показано на Фиг.1 и 2, образованные игольчатые кристаллы SB-207266-А (например, >75% их по количеству или объему или массе) обычно составляют по длине >100 мкм или >200 мкм. Однако игольчатые кристаллы (например, >75% их по количеству или объему или массе) обычно составляют по ширине (боковой размер) <10 мкм (например, Фиг.1) или <25 мкм (например, Фиг.2).
Фиг.3 иллюстрирует кристаллы SB-207266-А после того, как их перемешивали, промывали и переносили в вакуумную печь для высушивания. Как можно видеть, длинные иглы Фиг.2 сломаны до значительно более коротких кристаллов, которые обычно (например, >50% их по количеству или объему или массе) являются еще игольчатыми или иным образом удлиненными, но <75 мкм или <100 мкм или <200 мкм по длине. На Фиг.3 видно некоторое количество очень небольших кристаллов.
Анализ размера частиц сломанных/укороченных кристаллов Фиг.3 допускает, что имеются кристаллы, подобные представленным в Таблице 1.
Данные спектроскопии: На фиг.4 показан инфракрасный (IR) спектр (спектр в нуоле) для кристаллического гидрохлорида SB-207266-A, полученного по описанию 1 и/или 2. Гидрохлорид является по существу безводной кристаллической формой SB-207266-А. Пики IR, обусловленные SB-207266-А, видны при волновых числах 3423, 3044, 2502, 1628, 1582, 1502, 1531, 1184, 748 см-1 (с точностью приблизительно: ±2 см-1 или ±1 см-1). Полагают, что пики при приблизительно 2960-2850, приблизительно 1466, приблизительно 1327 и приблизительно 721 см-1 обусловлены нуолом. Экспериментальное распределение пиков IR SB-207266 является следующим:
Модификация описания 2: В альтернативном воплощении описания 2, которое особенно предпочтительно при более крупном масштабе производства, вместо применения воронки Бюхнера и вакуумной печи, кристаллический продукт отделяли фильтрованием, промывали и высушивали в вакууме в одной части аппарата (а именно фильтр-сушка), необязательно при медленном перемешивании (например, механическом смешивании) кристаллического продукта, например, во время высушивания.
Сравнительный пример - таблетки, изготовленные влажной грануляцией
Таблетки, содержащие гидрохлорид SB 207266 (SB 207266-A) в количествах 10, 25 или 40 мг (определяли по свободному основанию), были изготовлены в соответствии с композицией, представленной в таблице ниже. Данный способ и композиция не соответствуют данному изобретению, а являются примером 4 WO 02/11733 A1.
**Удаляют во время обработки
Таблетки SB-207266-А данного сравнительного примера упаковывали во флаконы из высокоплотного полиэтилена (HDPE) с пластиковыми герметическими крышками, недоступными для детей.
При получении в данном сравнительном примере применяли способ влажной грануляции, используя нерастворимый основной эксципиент, дигидрат двухосновного фосфата кальция (или гидрофосфат кальция). Дигидрат двухосновного фосфата кальция является основным разбавителем вместе с микрокристаллической целлюлозой, которую добавляли, чтобы диспергировать растворитель для грануляции и способствовать полной сжимаемости. Добавленным связующим веществом была гидроксипропилметилцеллюлоза и грануляцию проводили в обычном грануляторе-смесителе. Смесь гранул высушивали, просеивали и смешивали с гликолятом крахмала натрия в качестве дезинтегранта и стеаратом магния в качестве лубриканта, чтобы получить смесь для прессования. Таблетки получали на подходящем роторном таблеточном прессе, и они могли быть или овальной или круглой формы.
Сравнительный пример - Подробный способ производства. Контроли в процессе. Способ выполнения
SB-207266-A, микрокристаллическую целлюлозу, дигидрат двухосновного фосфата кальция и гидроксипропилметилцеллюлозу смешивали вместе. Очищенную воду добавляли к смешанным порошкам при смешивании в грануляторе-смесителе с высоким сдвигом. Гранулы высушивали в сушилке с кипящем слоем и затем переносили в смеситель, где их смешивали с гликолятом крахмала натрия и стеаратом магния. Смазанную смесь прессовали в таблеточное ядро, используя роторный таблеточный пресс. Ядра таблетки покрывали пленкой, используя водную дисперсию Opadry White YS-1-7003.
Процедура:
1.0. Грануляция.
1.1 Смешивание SB-207266, микрокристаллической целлюлозы, гидроксипропилметилцеллюлозы и дигидрата двухосновного фосфата кальция в соответствующем грануляторе-смесителе с высоким сдвигом.
1.2 Добавление очищенной воды для осуществления грануляции.
1.3 Высушивание гранул в сушилке с кипящим слоем.
1.4 Пропускание высушенных гранул через сито из нержавеющей стали с использованием подходящей мельницы.
1.5 Определение выхода гранул.
2.0 Изготовление смеси для прессования.
2.1 Смешивание требуемых количеств гликолят крахмала натрия и стеарата магния с высушенными гранулами.
2.2 Определение выхода смеси для прессования.
3.0 Прессование таблеток.
3.1 Перенос смеси для прессования в соответствующую таблеточную машину.
3.2 Прессование таблеток.
3.3 Определение выхода прессованных таблеток.
4.0 Покрытие пленкой.
4.1 Перенос ядер таблеток в подходящую машину для нанесения покрытий.
4.2 Вращение ядер и распыление водной дисперсии Opadry.
4.3 Выделение опытных образцов из партии производили рандомизировано и соответственно метили.
5.0 Заполнение флаконов.
5.1 HDPE-флаконы заполняли соответствующим количеством, выпускное отверстие герметически закрывали, устанавливали недоступную для детей крышку, используя соответствующее автоматизированное оборудование.
Следующие данные регистрировали для некоторых покрытых пленкой таблеток в соответствии со сравнительным примером:
ПРИМЕРЫ согласно данному изобретению - фармацевтические композиции SB 207266, полученные сухой грануляцией
Пример 1 - таблетки SB-207266-А, изготовленные по способу сухой грануляции - SB-207266-А и часть внутригранулярного стеарата магния
Таблетки, содержащие гидрохлорид SB-207266 (SB-207266-А) в количестве 10, 20, 25, 40, 50 или 80 мг (рассчитывали по сводобному основанию), получали в соответствии с составом в Таблице 2, ниже.
Композиция примера 1
(подвергнутые роликовому уплотнению)
(4,4 мас.%)
(8,8 мас.%)
(11 мас.%)
(17,6 мас.%)
(22 мас.%)
(35,2 мас.%)
(20 мас.%)
(64,6 мас.%)
(60,2 мас.%)
(58 мас.%)
(51,4 мас.%)
(47,0 мас.%)
(33,8 мас.%)
Все ингредиенты находятся в соответствии с европейской фармакопеей или фармакопеей Ньюфаундленда или США, где необходимо.
Далее описывается способ, использованный для изготовления таблеток примера 1.
Используемое оборудование (для небольшого масштаба произведенной работы приблизительно вплоть до 1 кг) включало:
- Роликовый уплотнитель модели Fitzpatrick Chilsonator IR220 (описываемый более подробно на стадии 2 примера 11 и представленный на Фиг.5 и 6)
- Дробящая мельница FitzMill L1a с ножами или молотками и ситами (например, как описано выше в данном описании и как представлено в нижней части Фиг.6; она может быть отделена или присоединена к роликовому уплотнителю).
Названное оборудование производит фирма Fitzpatrick, чье главное управление находится в США. Оборудование также поставляет Европейское отделение фирмы: The Fitzpatrick Company Europe N.V., Entrepostraat 8, B-9100 Sint-Niklaas, Belgium; fax: +32/3-766-10-84; email: Fitzpatrick Europe@compuserve.com; www. Fitzpatrick.be.
Пример 1 - Подробный способ
1. Пропускание SB-207266-A и являющейся внутригранулярной порцией стеарата магния через номинальное сито 1250 мкм, используя вибрационное сито, если требуется, в подходящий смеситель.
2. Смешивание в течение 5 минут при приблизительно 17 об/мин (rpm).
3. Загрузка смеси в бункер роликового уплотнителя (Роликовый уплотнитель модели Fitzpatrick Chilsonator IR220) и начало роликового уплотнения. Следующие параметры рекомендовали для процедуры роликового уплотнения:
Гладкие валики (противовращение, давление, прилагаемое на плавающий ролик).
Горизонтальная винтовая подача (дозирование продукта из бункера на стадию предварительного прессования): скорость винтовой подачи от 0 до приблизительно 62 об/мин, например, приблизительно 20 об/мин.
Вертикальная винтовая подача (проводит предварительное прессование и деаэрацию материалов и подает материал на валики, где фактическое уплотнение и конечное компактирование происходят в зоне захвата роликов): скорость винтовой подачи от 0 до приблизительно 270 об/мин, например около 100 об/мин.
Роликовое давление: от приблизительно 2000 до приблизительно 16500 фунтов на линейный дюйм (pli), например, приблизительно 8000 pli
Скорость ролика: от 0 до приблизительно 17 об/мин, например, 10 об/мин.
4. Регистрация следующих параметров в способе:
Толщина ленты (мм).
Плотность ленты (г/см3) - целевая плотность от приблизительно 1,0 до приблизительно 1,5 г/см3.
Ширина ленты (мм).
Длина ленты (мм).
Масса ленты (г).
Способ определения плотности ленты является следующим. Используя пикнометр, добавляли 70 мл масла (предпочтительно жидкий парафин) и добавляли ленты уплотненных материалов вплоть до 80 мл. Затем плотность лент можно рассчитывать по вес/10 мл.
5. Сбор лент в соответствующий контейнер.
6. Размалывание лент, уплотненных роликами, используя соответствующую мельницу, такую как дробящая мельница с молотками и/или ножами, предпочтительно модель FitzMill L1A с молотками, «направленными вперед», используя сито 0,065 дюйма.
7. Определение объемной плотности измельченных гранул.
8. Просеивание экстрагранулярных эксципиентов (в описании: дигидрат гидрофосфата кальция, микрокристаллическая целлюлоза, гликолят крахмала натрия и НРМС), исключая эктрагранулярный стеарат магния, через номинальное сито 500 мкм, используя вибрационное сито, если требуется, в соответствующий смеситель.
9. Смешивание названных экстрагранулярных эксципиентов с измельченными гранулами от приблизительно 17 об/мин в течение 15 минут.
10. Просеивание экстрагранулярной части стеарата магния через номинальное сито 500 мкм в смеситель, который содержит смесь экстрагранулярных эксципиентов и гранул.
11. Смешивание при приблизительно 17 об/мин в течение 2 минут.
12. Прессование полученной смеси для прессования на соответствующем таблеточном прессе, например, роторном прессе модели Picolla или роторном прессе модели Kilian T100 с получением таблеток. Названные таблетки могут быть круглыми или овальными в основном поперечном сечении.
Пример 2 - полностью внутригранулярный дигидрат гидрофосфата кальция
В примере использовали тот же список ингредиентов и способ, как в примере 1, но весь дигидрат гидрофосфата кальция смешивали с SB-207266-A и являющейся внутригранулярной порцией стеарата магния на стадии 2 способа и полученную смесь уплотняли роликом на стадии 3 способа. Поэтому гидрофосфат кальция оказался полностью внутригранулярным в таблетке.
В примере 2 массовое отношение наполнителя СаНРО4·2Н2О к лекарственному средству в гранулах составляло, например, 2,14:1 (при 50 мг нагрузке таблетка/доза); или 0,96:1=1:1,04 (при 80 мг нагрузки таблетки).
Пример 3 - частично внутригранулярный и частично экстрагранулярный дигидрат гидрофосфата кальция
В примере использовали тот же список ингредиентов и способ, как в примере 1, но половину дигидрата гидрофосфата кальция смешивали с SB-207266-A и являющейся внутригранулярной порцией стеарата магния на стадии 2 способа и полученную смесь уплотняли роликом на стадии 3 способа. Оставшуюся половину дигидрата гидрофосфата кальция просеивали и смешивали с измельченными гранулами на стадиях 8 и 9 способа. Поэтому дигидрат гидрофосфата кальция оказался в таблетке частично внутригранулярным и частично экстрагранулярным.
Пример 4 - полностью внутригранулярная НРМС
В примере использовали тот же список ингредиентов и способ, как или в примере 2, или примере 3 (дигидрат гидрофосфата кальция или полностью внутригранулярный, или частично внутригранулярный и частично экстрагранулярный), но все связующее вещество НРМС смешивали с SB-207266-A и являющимися внутригранулярными порциями стеарата магния и гидрофосфатом кальция на стадии 2 и полученную смесь уплотняли роликом на стадии 3. Поэтому НРМС оказалась полностью внутригранулярной в таблетке.
Пример 5 - полностью внутригранулярная микрокристаллическая целлюлоза
В примере использовали тот же список ингредиентов и способ, как или в примере 2, или примере 3 (дигидрат гидрофосфата кальция или полностью внутригранулярный, или частично внутригранулярный и частично экстрагранулярный), но всю микрокристаллическую целлюлозу смешивали с SB-207266-A и являющимися внутригранулярными порциями стеарата магния и гидрофосфатом кальция на стадии 2 и полученную смесь уплотняли роликом на стадии 3. Поэтому микрокристаллическая целлюлоза оказалась полностью внутригранулярной в таблетке.
Пример 6 - частично внутригранулярная, частично экстрагранулярная микрокристаллическая целлюлоза
В примере использовали тот же список ингредиентов и способ, как или в примере 2, или примере 3 (дигидрат гидрофосфата кальция или полностью внутригранулярный, или частично внутригранулярный и частично экстрагранулярный), но половину микрокристаллической целлюлозы смешивали с SB-207266-A и являющимися внутригранулярными порциями стеарата магния и гидрофосфатом кальция на стадии 2 и полученную смесь уплотняли роликом на стадии 3. Оставшуюся половину микрокристаллической целлюлозы просеивали и смешивали с измельченными гранулами на стадиях 8 и 9. Поэтому микрокристаллическая целлюлоза оказалась в таблетке частично внутригранулярной, частично экстрагранулярной.
Пример 7 - полностью внутригранулярный гликолят крахмала натрия
В примере использовали тот же список ингредиентов и способ, как или в примере 2, или примере 3 (дигидрат гидрофосфата кальция или полностью внутригранулярный, или частично внутригранулярный и частично экстрагранулярный), но весь гликолят крахмала натрия смешивали с SB-207266-A и являющимися внутригранулярными порциями стеарата магния и гидрофосфатом кальция на стадии 2 и полученную смесь уплотняли роликом на стадии 3. Поэтому гликолят крахмала натрия оказался полностью внутригранулярным в таблетке.
Пример 8 - частично внутригранулярный, частично экстрагранулярный гликолят крахмала натрия
В примере использовали тот же список ингредиентов и способ, как или в примере 2, или примере 3 (дигидрат гидрофосфата кальция или полностью внутригранулярный, или частично внутригранулярный и частично экстрагранулярный), но половину гликолята крахмала натрия смешивали с SB-207266-A и являющимися внутригранулярными порциями стеарата магния и гидрофосфатом кальция на стадии 2 и полученную смесь уплотняли роликом на стадии 3. Оставшуюся половину гликолят крахмала натрия просеивали и смешивали с измельченными гранулами на стадиях 8 и 9. Поэтому гликолят крахмала натрия оказался в таблетке частично внутригранулярным, частично экстрагранулярным.
Пример 9 - никакого связующего вещества НРМС
В примере использовали тот же список ингредиентов и способ, как или в примерах 1-3, или 5-8, но связующее вещество НРМС отсутствовало в составе. Отсутствие связующего вещества НРМС компенсировали эквивалентным повышением количества дигидрата гидрофосфата кальция (или внутригранулярного или экстрагранулярного) с тем, чтобы сохранить неизмененным (а) общую массу покрытой таблетки 256,25 мг, (b) общую массу таблетки до покрытия 250 мг и (с) количество других эксципиентов.
Поэтому, например, в примере 9, количество и % по массе композиции дигидрата гидрофосфата кальция оказались следующими для следующих нагрузок таблетки (доза, рассчитанная для свободного основания SB-207266): 174,0 мг или 69,6 мас.% (при 10 мг нагрузке таблетка/доза); 163,0 мг или 65,2 мас.% (20 мг нагрузка); 130,0 мг или 52,0 мас.% (50 мг нагрузка); 97,0 мг или 38,8 мас.% (80 мг нагрузка). Пример 9 модифицирует пример 2 или другой пример, сам модифицирующий пример 2 (то есть СаНРО4·2Н2О полностью внутригранулярный и, таким образом, условие сохраняется), тогда массовое соотношение наполнителя СаНРО4·2Н2О к лекарственному средству в гранулах составляет, например: 15,8:1 (при 10 мг нагрузке таблетка/доза); 6,84:1 (20 мг нагрузка таблетки); 2,36:1 (50 мг нагрузка таблетки); или 1,10:1 (80 мг нагрузка таблетки).
Пример 10 - модификация дозы
При модификации любого из примеров 1-9 препараты, содержащие 30 мг, 75 мг или 120 мг SB-207266 на таблетку (присутствующего в виде гидрохлорида, но указанную здесь дозу рассчитывали как для свободного основания) можно использовать для получения таблеток вместо использованных в примерах 1-8 количеств 10, 25 и 40 мг на таблетку. Названные препараты сохраняли неизмененными: (а) общую массу покрытой таблетки 256,25 мг, (b) общую массу таблетки до покрытия 250 мг и (с) количества других эксципиентов в композициях примера 1, но корректировали количество дигидрата гидрофосфата кальция, используемого при изменении количества SB-207266.
Примеры 11-16
Более предпочтительные примеры способа и композиции изобретения представлены в следующих примерах 11-16, ни один из которых не содержит какого-либо добавленного связующего вещества, такого как НРМС. Примеры 11-16 суммируют способы, осуществляемые для изготовления: 10 кг - партия таблеток с 80 мг SB-207266 (определяли как чистое свободное основание), в которых дезинтегрант был полностью экстрагранулярным (пример 11); 10 кг - партия таблеток, как в примере 11, но с 40 мг SB-207266 (определяли как чистое свободное основание) (пример 12); 10 кг - партия таблеток с 40 мг SB-207266 (определяли как чистое свободное основание), в которых дезинтегрант был на 50% экстрагранулярным (пример 13). Пример 14 является модификацией примера 11, использующей 12-кг - партию, содержащую дополнительную экстрагранулярную микрокристаллическую целлюлозу. В примере 15 обеспечивается необязательное пленочное покрытие таблеток. В примере 16 изменяют дозу SB-207266 в таблетках примеров 11-15.
Пример 11 - таблетки с 80 мг SB-207266 без связующего вещества с микрокристаллической целлюлозой и полностью внутригранулярным гидрофосфатом кальция, с частично внутригранулярным и частично экстрагранулярным лубрикантом и с полностью экстрагранулярным дезинтегрантом
(масса на таблетку, мг)
(г)
(10 кг)
1. SB-207266-A, образованный согласно описанию 1 или 2, является эквивалентом 80,0 мг чистого свободного основания SB-207266 и является полностью внутригранулярным, составляя 37,21 мас.% гранул.
2. Микрокристаллическая целлюлоза представляет собой Avicel PH102TM (приблизительно 100 мкм номинальный средний размер частиц), полностью внутригранулярный, 20,37 мас.% гранул.
3. Дигидратом гидрофосфата кальция является EmcompressTM, и он является полностью внутригранулярнымм, составляя 41,89 мас.% гранул.
4. Гликолят крахмала натрия представляет собой ExplotabTM, полностью экстрагранулярный.
5. Стеарат магния разделен на 50% внутригранулярного (который составляет 0,53 мас.% гранул) и 50% экстрагранулярного.
6. Совокупные гранулы (внутригранулярные эксципиенты)=9450 г на 10 кг таблеток=236,25 мг на 250 мг таблетку=94,5 мас.% композиции.
Способ:
SB-207266-A пропускали через сито 1 мм из нержавеющей стали в бункер смесителя. Микрикристаллическую целлюлозу, дигидрат гидрофосфата кальция и одну половину количества стеарата магния (50 г) аналогично пропускали через сито 630 мкм из нержавеющей стали в смеситель и смесь смешивали при 15 об/мин в течение 10 минут.
2. Смесь со стадии 1 пропускали через роликовый уплотнитель (Fitzpatrick Chilsonator IR220), снабженный взаимосвязанными рифленными роликами.
Со ссылкой на Фиг.5, указанный конкретный роликовый уплотнитель 2 содержит: бункер 4 для удерживания внутригранулярных ингредиентов 6, смешанных на стадии 1, предварительную горизонтальную винтовую подачу 8, которая при использовании дозирует смесь 6 из бункера 4 на стадию предварительного прессования; и основную вертикальную винтовую подачу 10, которая непосредственно направлена вниз по ходу и при использовании снабжается непосредственно предварительной горизонтальной винтовой подачей 8, основная вертикальная винтовая подача 10 при употреблении осуществляет предварительное прессование/предварительное уплотнение и деаэрацию смеси и направляет материал вертикально прямо вниз в угловую зону захвата (зона захвата) 14 роликов 12. Ролики 12 расположены горизонтально и, по существу, на одном уровне друг с другом. Уплотненный материал (хлопья или ленты) 16 высвобождаются из нижней части роликов 12.
В приведенном примере скорость роликов уплотнителя устанавливали при 3 об/мин, скорость (предварительной) горизонтальной винтовой подачи составила 30 об/мин, скорость (основной) вертикальной винтовой подачи составляла приблизительно 60-62 об/мин или 70 об/мин, и силу роликов (роликовое давление) устанавливали 24 кН/см.
Уплотненное вещество, сформированное в роликовом уплотнителе, просеивали, используя дробящую мельницу (FitzMill L1A, например, которая описана выше в описании и представлена в нижней половине Фиг.6, она может быть отделена от роликового уплотнителя или присоединена к нему) с ножом "направленным вперед" при скорости 5000 об/мин и при использовании сита с размером 0,093 дюйма (2,36 мм). Полученный выход составлял 9173 г смеси гранул при выходной объемной плотности 1,06 г/мл. Порции подвергали анализу размера частиц, используя сита.
3. Смесь гранул со стадии 2 (9061 г) подавали в бункерный смеситель. Пропорциональные количества гликолят крахмала натрия (467 г) и стеарата магния (46,7 г) подавали в смеситель (предпочтительно пропускали через сито 630 мкм из нержавеющей стали в смеситель) и смесь смешивали в течение 5 минут при 15 об/мин.
4. Порцию смеси для прессования прессовали в таблетки, используя один таблеточный пресс с одним пуансоном (Manesty F3), снабженный овальными обычными вогнутыми пуансонами 10,5 мм×5,0 мм. Масса целевой непокрытой таблетки составляла 250 мг и целевой интервал твердости составлял 9-15 Kp. Таблетки тестировали на твердость, толщину, изменение массы, дезинтеграцию и растворимость.
Следующие данные регистрировали относительно промежуточных продуктов, использованных в вышеприведенном способе:
роликового уплотнения
Анализ с использованием сит (анализ размера частиц с применением сит) порции уплотненной роликом и измельченной смеси гранул (как в конце стадии 2) показал следующее:
(5 мас./мас.)
Следующие данные регистрировали для таблеток, изготовленных на стадии 4:
Пример 12 - таблетки с дозой 40 мг, не содержащие связующее вещество, содержащие микрокристаллическую целлюлозу и полностью внутригранулярный гидрофосфат кальция, частично внутригранулярный, частично экстрагранулярный лубрикант и полностью экстрагранулярный дезинтегрант
(масса на таблетку, мг)
(г)
(10 кг)
1. SB-207266-A, образованный согласно описанию 1 или 2, является эквивалентом 40,0 мг чистого свободного основания SB-207266 и является полностью внутригранулярным, составляя 18,60% от массы гранул.
2. Микрокристаллическая целлюлоза представляет собой Avicel PH102TM (приблизительно 100 мкм номинальный средний размер частиц), полностью внутригранулярный, в количестве 26,46% от массы гранул.
3. Дигидрат гидрофосфата кальция представляет собой EmcompressTM, и является полностью внутригранулярным, составляя 54,41% от массы гранул.
4. Гликолят крахмала натрия представляет собой ExplotabTM, полностью внутригранулярный.
5. Стеарат магния делили на 50% внутригранулярного (который составлял 0,53% массы гранул) и 50% экстрагранулярного.
6. Общее количество гранул (внутригранулярные ингредиенты)=9450 г на 10 кг таблеток=236,25 мг на 250 мг-таблетку=94,5% массы состава
Способ:
1. Микрокристаллическую целлюлозу пропускали через сито 710 мкм из нержавеющей стали в бункерный смеситель. SB-207266-A пропускали через сито 1 мм из нержавеющей стали в смеситель. Одну половину количества стеарата магния (50 г) и дигидрат гидрофосфата кальция (5142 г) аналогично пропускали через сито 710 мкм из нержавеющей стали в смеситель и смесь смешивали при 15 об/мин в течение 10 минут.
2. Смесь со стадии 1 пропускали через роликовый уплотнитель (Fitzpatrick Chilsonator IR220), снабженный взаимосвязанными рифленными роликами и при установке роликовой скорости при 5 об/мин скорость (предварительной) горизонтальной винтовой подачи устанавливали при 17-20 об/мин, скорость (основной) вертикальной винтовой подачи устанавливали при 49-53 об/мин и роликовую силу (роликовое давление) устанавливали 24-25 кН/см. Уплотненное вещество, сформированное в роликовом уплотнителе, просеивали, используя дробящую мельницу (FitzMill L1A) с ножами, «направленными вперед» при скорости 5000 об/мин и при использовании размера сита 0,093 дюйма (2,36 мм). Полученный выход составлял 9306 г смеси гранул при выходной объемной плотности 1,09 г/мл.
3. Смесь гранул со стадии 2 (9306 г) подавали в бункерный смеситель. Стеарат магния (49,3 г) и гликолят крахмала натрия (493 г) аналогично пропускали через сито 710 мкм из нержавеющей стали в смеситель и смесь смешивали в течение 5 минут при скорости 15 об/мин.
4. Порцию смеси для прессования прессовали в таблетки, используя один таблеточный пресс с одним пуансоном (Manesty F3), снабженный овальными обычными вогнутыми пуансонами 10,5 мм×5,0 мм. Масса целевой непокрытой таблетки составляла 250 мг и целевой интервал твердости составил 9-15 Kp. Таблетки тестировали на твердость, толщину, изменение массы, дезинтеграцию и растворимость.
Следующие данные регистрировали относительно промежуточных продуктов, использованных в вышеприведенном способе:
Анализ с применением сит уплотненной роликом и измельченной смеси гранул (как в конце стадии 2) показал следующее:
Следующие данные регистрировали в отношении таблеток, изготовленных на стадии 4:
Пример 13 - таблетки с дозой 40 мг, не содержащие связующее вещество, содержащие микрокристаллическую целлюлозу и полностью внутригранулярный дигидрат гидрофосфата кальция и лубрикант и частично внутригранулярный и частично экстрагранулярный дезинтегрант
(масса на таблетку, мг)
(г)
(10 кг)
1. SB-207266-A, образованный согласно описанию 1 или 2, является эквивалентом 40,0 мг чистого свободного основания SB-207266 и является полностью внутригранулярным.
2. Микрокристаллическая целлюлоза представляет собой Avicel PH102TM (приблизительно 100 мкм номинальный средний размер частиц), полностью внутригранулярный.
3. Дигидратом гидрофосфата кальция является EmcompressTM, и полностью внутригранулярный.
4. Гликолят крахмала натрия представляет собой ExplotabTM, разделенный на 50% внутригранулярного и 50% экстрагранулярного.
5. Стеарат магния делили на 50% внутригранулярного/50% экстрагранулярного.
Способ:
1. Микрокристаллическую целлюлозу пропускали через сито 710 мкм из нержавеющей стали в бункерный смеситель. SB-207266-A пропускали в смеситель через сито 1 мм из нержавеющей стали. Гликолят крахмала натрия (250 г) и одну половину количества стеарата магния (50 г) и дигидрат гидрофосфата кальция (5142 г) аналогично пропускали через сито 710 мкм из нержавеющей стали в смеситель и смесь смешивали при 15 об/мин в течение 10 минут.
2. Смесь со стадии 1 пропускали через роликовый уплотнитель (Fitzpatrick Chilsonator IR220), снабженный взаимосвязанными рифленными роликами, и при установке роликовой скорости при 5 об/мин, скорость (предварительной) горизонтальной винтовой подачи устанавливали 20 об/мин, скорость (основной) вертикальной винтовой подачи устанавливали при 49-53 об/мин и роликовую силу (роликовое давление) устанавливали 24-26 кН/см. Уплотненное вещество, сформированное в роликовом уплотнителе, просеивали, используя дробящую мельницу (FitzMill L1A) с ножами, «направленными вперед» при скорости 5000 об/мин и при использовании размера сита 0,093 дюйма (2,36 мм). Полученный выход составлял 9528 г смеси гранул при выходной объемной плотности 1,08 г/мл.
3. Смесь гранул со стадии 2 (9528 г) подавали в бункерный смеситель. Стеарат магния (49,2 г) вместе с пропорциональными количествами оставшегося гликолят крахмала натрия (245 г) пропускали через сито 710 мкм из нержавеющей стали и смесь смешивали в течение 5 минут при скорости 15 об/мин.
4. Порцию смеси для прессования прессовали в таблетки, используя один таблеточный пресс с одним пуансоном (Manesty F3), снабженный овальными обычными вогнутыми пуансонами 10,5 мм×5,0 мм. Масса целевой непокрытой таблетки составляла 250 мг и целевой интервал твердости составлял 9-15 Kp. Таблетки тестировали на твердость, толщину, изменение массы, дезинтеграцию и растворимость.
Следующие данные регистрировали относительно промежуточных продуктов, использованных в вышеприведенном способе:
Анализ с помощью сит уплотненной роликом и измельченной смеси гранул (как в конце стадии 2) показал следующее:
(мас./мас.%)
Следующие данные регистрировали в отношении таблеток, изготовленных на стадии 4:
Пример 14 - таблетки с дозой 80 мг, не содержащие связующее вещество, содержащие частично экстрагранулярную микрокристаллическую целлюлозу
(масса на таблетку,
мг)
(г)
(12 кг)
1. SB-207266-A, образованный согласно описанию 1 или 2, является эквивалентом 80,0 мг чистого свободного основания SB-207266 и является полностью внутригранулярным.
2. Микрокристаллической целлюлозой является Avicel PH102TM (приблизительно 100 мкм номинальный средний размер частиц) и он является его внутригранулярной порцией.
3. Дигидрат гидрофосфата кальция представляет собой EmcompressTM, полностью внутригранулярный.
4. Гликолят крахмала натрия представляет собой ExplotabTM, полностью экстрагранулярный.
5. Стеарат магния делили на 50% внутригранулярного/50% экстрагранулярного.
6. Типом микрокристаллической целлюлозы является Avicel PH102TM (приблизительно 100 мкм номинальный средний размер частиц) и он является его внутригранулярной порцией.
Способ:
Способ в основном является таким же, как способ примера 11 или подобным ему за исключением того, что дополнительную микрокристаллическую целлюлозу (МСС) добавляли экстрагранулярно, чтобы повысить сжимаемость таблеточной смеси для прессования (имеется приблизительно 50% экстрагранулярной МСС, приблизительно 50% внутригранулярной МСС). Поэтому стадии 1, 3 и 4 модифицировали, и способ оказался следующим:
1. SB-297266-A (3516 г) пропускали через сито 1 мм из нержавеющей стали в бункерный смеситель. Внутригранулярную порцию микрокристаллической целлюлозы (1925 г), дигидрат гидрофосфата кальция (3959) и одну половину количества стеарата магния (60 г) аналогично подавали через сита 630 мкм и 710 мкм из нержавеющей стали в смеситель и смесь перемешивали при скорости 15 об/мин в течение 10 минут.
2. Стадия 2 является такой, как для примера 11.
3. Большую часть или всю смесь для грануляции со стадии 2 подавали в бункерный смеситель. Пропорциональные количества: гликолята крахмала натрия (600 г, если 100% выход на стадии 2 и если использовали всю смесь гранул), стеарата магния (60 г, если 100% выход и если использовали всю смесь гранул) и экстрагранулярной порции микрокристаллической целлюлозы (1880 г, если 100% выход и если использовали всю смесь гранул) пропускали через сита 630 мкм и 710 мкм из нержавеющей стали в смеситель и смесь перемешивали в течение 5 минут при 15 об/мин.
4. Порцию смеси для прессования прессовали в таблетки, используя один таблеточный пресс с одним пуансоном (например, Manesty F3), снабженный овальными обычными вогнутыми пуансонами. Масса целевой непокрытой таблетки составляла 300 мг.
Пример 15 - покрытие пленкой таблеток примеров 11-14
В модификации любого из примеров 11-14 таблетки могли быть обеспечены пленочным покрытием, например, покрытием Opadry White YS-1-7033, предпочтительно приблизительно 6,25 мг/таблетка. В одном таком способе покрытия ядра таблеток переносили в соответствующую машину для нанесения покрытий, ядра вращали и на них распыляли водную дисперсию Opadry. Выделение тестируемых образцов на высвобождение из партии производили рандомизированно и соответственно метили.
Пример 16 - модификация дозы SB-207266 примеров 11-15
В модификации любого из примеров 11-15 препараты, содержащие 10 мг, 20 мг, 25 мг, 30 мг, 40 мг, 50 мг, 75 мг, 80 мг или 120 мг SB-207266 на таблетку (присутствующего в виде гидрохлорида, его дозу в данном примере устанавливали, рассчитывая как для свободного основания), можно использовать для получения таблеток. Эти дозы использовали вместо доз 40 мг и 80 мг SB-207266 (рассчитанных как свободное основание), представленных в примерах 11-15.
При изменении количества SB-207266-А (гидрохлорида) состав можно изменять одним из трех альтернативных способов замены А, В или С:
(А) При изменении количества SB-207266-А количество используемого дигидрата гидрофосфата кальция может изменяться соответственно при сохранении неизменной всей массой непокрытой, например, предварительно покрытой, таблетки 250 мг или 300 мг. Так, например, если увеличивали дозу, количество СаНРО4·2Н2О уменьшали на то же самое количество, на которое увеличивали SB-207266-А.
(В) При изменении количества SB-207266-А количество используемых дигидрата гидрофосфата кальция и микрокристаллической целлюлозы (внутригранулярная порция их) изменяли в соответствии с тем, чтобы соотношение внутригранулярного дигидрата гидрофосфата кальция и внутригранулярной микрокристаллической целлюлозы оставалось приблизительно постоянным при около 2:1 (например, от 2,2:1 до 1,8:1, например от 2,1:1 до 2,0:1, например, 2,07:1 до 2,04:1). Общую массу непокрытой, например, предварительно покрытой, таблетки 250 мг или 300 мг сохраняли неизменной. Так, количество внутригранулярных [СаНРО4·2Н2О и МСС] уменьшали при приблизительно постоянном соотношении, если увеличивали количество SB-207266-А.
(С) При изменении количества SB-207266-А общую массу непокрытой, например, предварительно покрытой, таблетки 250 мг или 300 мг увеличивали или уменьшали на то же количество, на которое увеличивали или уменьшали количество SB-207266-А. Все эксципиенты оставались неизменными.
При всех трех перестановках названные составы оставались неизмененными: количество других эксципиентов в композициях примеров 11-15 и способы (подвергнутые всем необходимым изменениям, например, в составляющих количествах).
Например, когда таблетку с дозой 80 мг примера 11 модифицировали до таблетки с дозой 50 мг (рассчитанной как свободное основание) в соответствии с заменой (В) выше, таблетки получали, как показано в следующей таблице (Пример 16(В)-50):
Пример 16(В)-50-композиции - таблетка с дозой 50 мг (рассчитанной как свободное основание)
1. SB-207266-A, образованный согласно описанию 1 или 2, является эквивалентным 50,0 мг чистого свободного основания SB-207266, полностью внутригранулярный, составляет 23,25% массы гранул.
2. Микрокристаллической целлюлозой является Avicel PH102TM (приблизительно 100 мкм номинального среднего размера), полностью внутригранулярный, составляя 25,03% массы гранул.
3. Тип дигидрата гидрофосфата кальция представляет собой EmcompressTM и является полностью внутригранулярным, составляя 51,20% от массы гранул.
Пример 17- Протокол лечения или профилактики фибрилляции предсердий и/или реконструкции предсердий у человека с использованием перорально вводимого SB 207266
Предлагаемый клинический протокол лечения или профилактики фибрилляции предсердий и/или реконструкции предсердий, использующий перорально вводимую фармацевтическую композицию, содержащую SB 207266 или его соль, композицию, которая может быть перорально вводимой композицией данного изобретения, подробно описывается ниже.
В указанном протоколе описывают введение SB 207266 или его соли (ниже "SB 207266") пациенту с симптоматической устойчивой фибрилляцией предсердий (AF). Целью является ингибирование симптоматических рецидивов фибрилляции предсердий у названных пациентов с устойчивой AF. Подходили пациенты с симптоматической устойчивой AF, продолжительностью ≥48 часов и <6 месяцев, которым требовалась электроимпульсная терапия (например, электроимпульсная терапия DC). Симптомы устойчивой AF могут, например, включать учащенное сердцебиение и так далее. Пациенты предпочтительно получали:
антикоагулянтную терапию (например, варфарин или кумарин) в течение ≥3 недель до начала терапии, предпочтительно антикоагулянты применяли по Международному стандартному соотношению (INR), по крайней мере, 2, или
в отсутствие антикоагулянтной терапии в течение ≥3 недель, пациентам делали трансэзофагальную эхокардиографию (ТЕЕ), которая оказалась негативной относительно сгустка, и пациенты получали внутривенно гепарин до тех пор, пока аРТТ не становилось стабильным и в терапевтическом диапазоне.
Пациенты получали предпочтительно SB 207266 после такой антикоагулянтной терапии, или после ТЕЕ в дополнение к внутривенному (iv) гепарину.
SB 207266 (например, в виде свободного основания, но более предпочтительно в виде гидрохлорида SB 207266-А) обычно вводили при суточных пероральных дозах 20 мг, 50 мг или 80 мг в день (раз в день) (рассчитанных как свободное основание). Однако на 1 день введения SB 207266 его обычно вводили при однократной пероральной ударной дозе, умноженной на 1,5 (1,5×) или 2 (2×), дозировку распределяли для суточной поддерживающей терапии. Поэтому предпочтительно для 1,5× ударной дозы назначали на 1 день однократную пероральную ударную дозу 30 мг, 75 мг или 120 мг (рассчитанная как свободное основание), за которой в последующие дни следовала суточная доза 20 мг 50 мг или 80 мг соответственно (рассчитанная как свободное основание). Альтернативно, для 2× ударной дозы назначали в 1 день однократную пероральную ударную дозу 40 мг, 100 мг или 160 мг (рассчитанная как свободное основание), за которой в последующие дни следовала суточная доза 20 мг, 50 мг или 80 мг соответственно (рассчитанная как свободное основание).
Когда применяют 1,5× ударные дозы, дозы можно вводить в виде трех таблеток по 10, 25 или 40 мг, назначаемых в то же самое время в 1 день; суточные поддерживающие дозы можно вводить в виде двух таблеток по 10, 25 или 40 мг, назначаемых в то же самое время в последующие дни; используемые таблетки по 10, 25 и 40 мг предпочтительно являются таблетками, описанными выше в любом из примеров 1-16. Когда применяют 2× ударные дозы, дозы можно вводить в виде двух таблеток по 20, 50 или 80 мг, назначаемых в то же время в 1 день; суточные поддерживающие дозы можно вводить в виде одной таблетки по 20, 50 или 80 мг, назначаемой в то же время в последующие дни; используемые таблетки по 20, 50 и 80 мг предпочтительно являются таблетками, описанными выше в любом из примеров 1-16.
Приблизительно через два или приблизительно пять часов после введения 1,5× или 2× пероральной ударной дозы SB 207266 первого дня пациентов, у которых сохранялась фибрилляция предсердий (и/или не применяли фармакологически кардиовертер), затем предпочтительно подвергали электроимпульсной терапии постоянного тока (DC). Можно придерживаться любого из следующих моно- или би-фазных электроимпульсных алгоритмов.
(замена 1)
Если у пациента после 3-его удара при использовании одной из вышеприведенных последовательностей не восстанавливался нормальный синусовый ритм (NSR), врач может по его усмотрению возобновить дальнейшие попытки при различной мощности. Электроимпульсную терапию считают успешной, когда NSR сохраняется в течение ≥1 часа после электроимпульсной терапии.
После успешной DC электроимпульсной терапии в отношении NSR введение SB 207266 пациенту можно продолжать ежедневно в течение 6 месяцев (например) или в течение более короткого или более длительного периодов. Тем пациентам, у которых спонтанно восстанавливался нормальный синусовый ритм (NSR), также можно назначать SB 207266 ежедневно в течение (например) 6 месяцев. Пациенты, у которых происходил рецидив AF во время этой ежедневной терапии, могут поддержать синусовый ритм DC электроимпульсной терапией и продолжать прием SB 207266.
Пациенты предпочтительно должны продолжать антикоагулянтную терапию (например, варфарин или кумарин), по крайней мере, в течение первых четырех недель после успешной электроимпульсной терапии и более предпочтительно в течение всего периода, во время которого вводят SB 207266. Предпочтительно пациенты, которые получают антикоагулянты по Международному стандартному соотношению (INR), по крайней мере, 2 в течение некоторого или всего, например, большей части или всего периода, во время которого они получают антикоагулянтную терапию. Это снижает риск кардиального свертывания крови и/или удара в случае рецидива AF.
Поэтому наиболее предпочтительный протокол представлен ниже:
Симптоматическая устойчивая AF продолжительностью
≥48 часов и <6 месяцев, плюс:
или [антикоагулянтная терапия ≥3 недели],
или [TEE (негативная) относительно сгустка+гепарин внутривенно]
↓
Введение SB 207266 (ударная доза) и наблюдение в течение 2 или
5 часов
↓
DC электроимпульсная терапия (если необходимо)
↓
Продолжать ежедневно SB 207266, + также предпочтительно антикоагулянтную терапию в течение, например, 6 месяцев
"Симптоматический рецидив" AF включает или подразумевает приступы учащенного сердцебиения или другие симптомы, типичные для пациента. Это может быть дополнительно установлено с помощью или ECG (например, ECG с 12 отведениями), регистрирующей проявляющиеся симптомы фибрилляции предсердий, или по ритму, регистрируемому на самописце и, необязательно, просматриваемому врачом.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТОК, СОДЕРЖАЩАЯ ГИДРОХЛОРИД ЦИНАКАЛЦЕТА | 2013 |
|
RU2662562C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ РИФАМПИЦИН, ИЗОНИАЗИД, ЭТАМБУТОЛ И ПИРАЗИНАМИД, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2672879C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА ЗАМЕДЛЕННОГО ВЫСВОБОЖДЕНИЯ ГЛЮКОЗАМИНА | 2011 |
|
RU2521231C2 |
| ФОРМА ПРОЛОНГИРОВАННОГО ВЫСВОБОЖДЕНИЯ ВЕНЛАФАКСИНА ГИДРОХЛОРИДА | 2004 |
|
RU2340331C2 |
| НОВЫЙ СОСТАВ | 2006 |
|
RU2821230C2 |
| НОВЫЙ СОСТАВ | 2006 |
|
RU2483716C2 |
| Твёрдые лекарственные формы палбоциклиба | 2016 |
|
RU2686840C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ КЕТОРОЛАКА | 2017 |
|
RU2677663C1 |
| ТВЕРДЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, ОБЛАДАЮЩИЕ ПРОТИВОРВОТНЫМ ДЕЙСТВИЕМ, С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2014 |
|
RU2679448C2 |
| ПРОЛОНГИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЛЕКАРСТВЕННАЯ ФОРМА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2435584C2 |



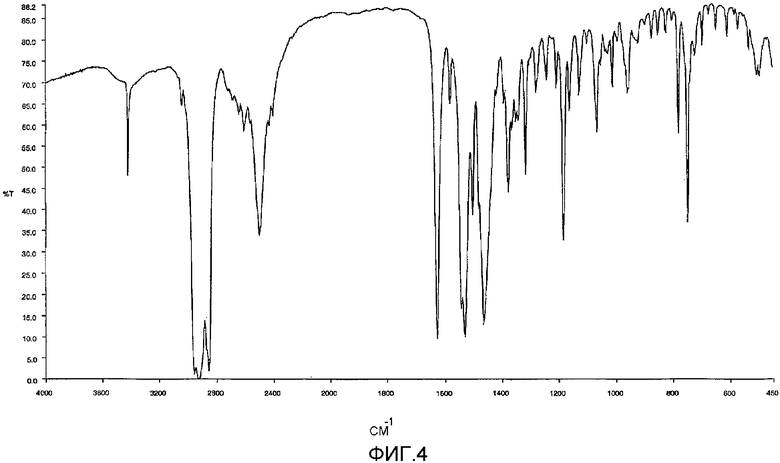
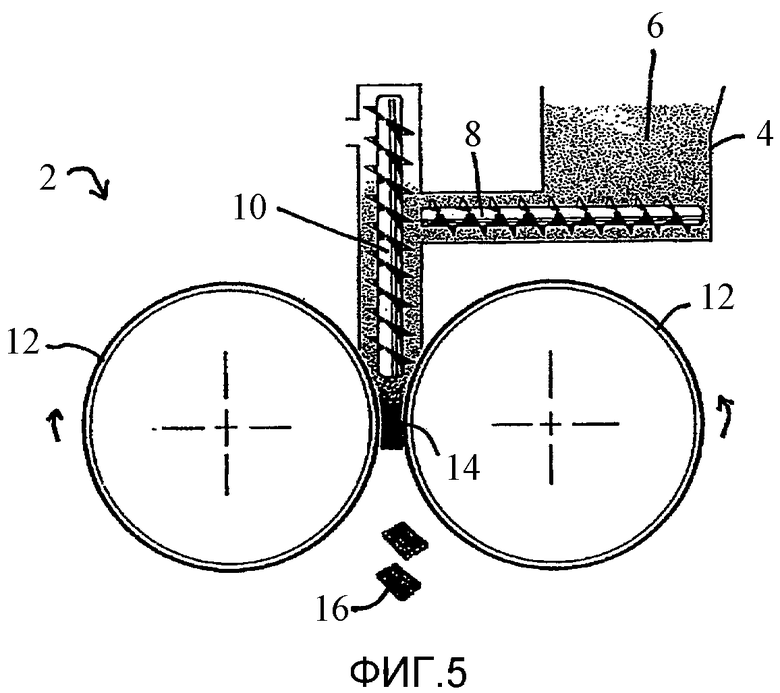
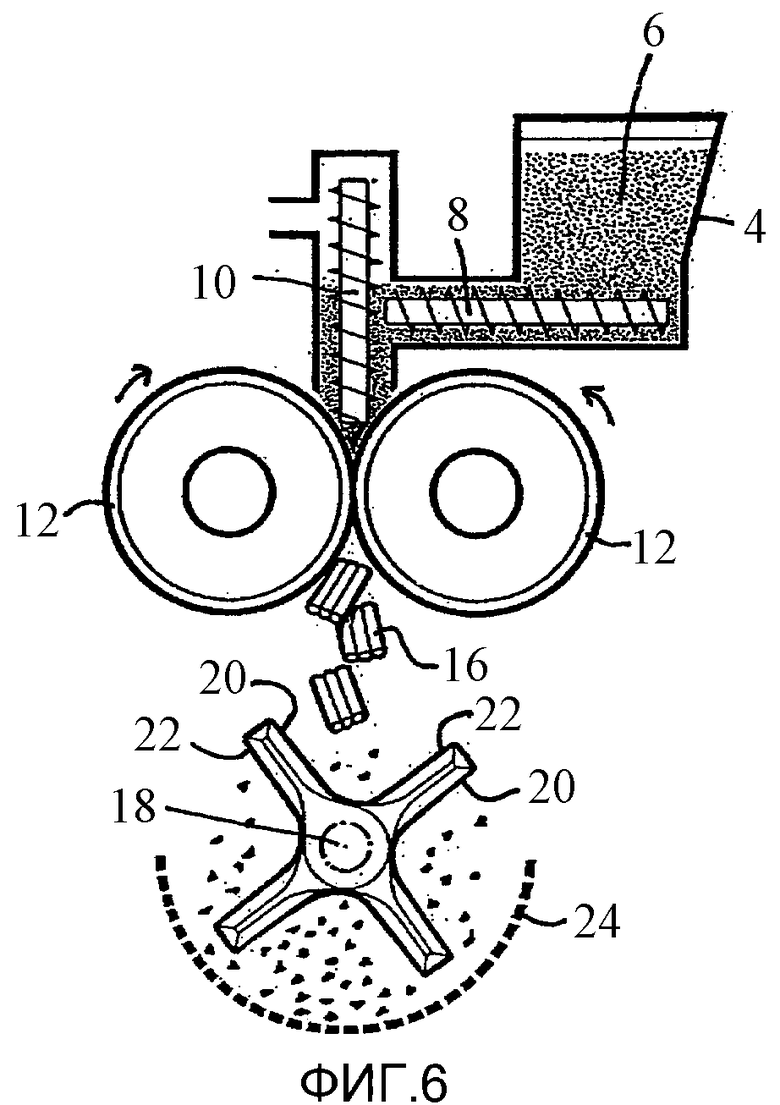
Настоящее изобретение относится к химико-фармацевтической промышленности и касается способа получения фармацевтической композиции, содержащей N-[(1-nбутил-4-пиперидинил)метил]-3,4-дигидро-2Н-[1,3]оксазино[3,2-а]индол-10-карбоксамид (SB 207266) (пибосерод) или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми эксципиентами, при этом способ включает формирование части или всего SB 207266 или его соли в гранулы способом сухой грануляции. В изобретении также предлагается фармацевтическая композиция, которая может быть получена способом сухой грануляции и/или которая получена способом сухой грануляции. Заявленное изобретение позволяет улучшить параметры готовой композиции, а также масштабировать производство. 4 н. и 71 з.п. ф-лы, 2 табл., 6 ил.
Приоритет по пунктам:
| US 5851550 А, 22.12.1998 | |||
| WO 9807728 A1, 26.02.1998. |
Авторы
Даты
2008-07-27—Публикация
2003-01-22—Подача