Настоящее изобретение относится к составу, содержащему ингибитор дипептитидилпептидазы IV (DPP-IV), предпочтительно вилдаглиптин и метформин, к таблеткам, содержащим указанные составы, и к способам их получения.
Метформин является широко используемым средством, предназначенным для снижения уровня глюкозы в крови пациентов, страдающих инсулиннезависимым сахарным диабетом, и выпускается в виде лекарственных форм с содержанием активного компонента 500, 750, 850 и 1000 мг. Однако поскольку метформин является лекарственным средством краткосрочного действия, то его необходимо вводить два или три раза в сут (таблетки с содержанием активного компонента 500-850 мг 2-3 раза в сут или 1000 мг 2 раза в сут во время еды). Бигуанидный противогипергликемический агент метформин, описанный в патенте U.S. №3174901, в настоящее время выпускается в США в виде гидрохлорида (продукт Glucophage@ фирмы Bristol-Myers Squibb Company). Получение метформина (диметилдигуанида) хорошо известно в современном уровне техники и впервые было описано в статье Emil A. Werner и James Bell, J. Chem. Soc., т.121, ее. 1790-1794 (1922). Метформин можно вводить, например, в виде продукта GLUCOPHAGE™.
Метформин повышает чувствительность периферических тканей организма хозяина к инсулину. Метформин также принимает участие в ингибировании абсорбции глюкозы из кишечника, подавлении печеночного глюконеогенеза и ингибировании окисления жирных кислот. Пригодные дозы введения метформина включают 500 мг от 2 до 3 раз в сут, а также до 5 раз в сут или 850 мг один или два раза в сут (см. Martindale, The Complete Drug Reference).
Термин «метформин», использованный в данном контексте, означает метформин или его фармацевтически приемлемую соль, такую как гидрохлорид, фумарат метформина (2:1) и сукцинат метформина (2:1), как описано в заявке U.S. №09/262526, поданной 4 марта 1999 г, гидробромид, пара-хлорфеноксиацетат или эмбонат, а также другие известные соли метформина и моно- и двухосновных карбоновых кислот, примеры которых описаны в патенте U.S. №3174901. В настоящее время предпочтительным является использование в качестве метформина его гидрохлорида, а именно продуктов GLUCOPHAGE-D или GLUCOPHAGE XR (фирмы Bristol-Myers Squibb Company).
Термины «ингибитор DPP-IV», «метформин», «глитазон» или любой другой глитазон, такой как «пиоглитазон», «розиглитазон», использованные в данном контексте, также означают их любые фармацевтически приемлемые соли, кристаллические формы, гидраты, сольваты, диастереоизомеры или энантиомеры.
Предпочтительные ингибиторы DPP-IV по настоящему изобретению описаны ниже.
Термин «ингибитор DPP-IV», использованный в данном контексте, означает также активные метаболиты и их пролекарства, такие как активные метаболиты и пролекарства ингибиторов DPP-IV. Термин «метаболит» означает активное производное ингибитора DPP-IV, которое образуется в результате метаболизма ингибитора DPP-IV. Термин «пролекарство» означает соединение, из которого в результате метаболизма образуется ингибитор DPP-IV или в метаболит(ы), аналогичный(е) ингибитору DPP-IV.
Ингибиторы DPP-IV описаны в современном уровне техники. Например, ингибиторы DPP-IV в общем виде или подробно описаны в следующих документах: WO 98/19998, DE 19616486 Al, WO 00/34241,. WO 95/15309, WO 01/72290, WO 01/52825, WO 9310127, WO 9925719, WO 9938501, WO 9946272, WO 9967278 и WO 9967279.
Предпочтительные ингибиторы DPP-IV описаны в следующих документах: WO 02053548, прежде всего соединения 1001-1293 и примеры 1-124, WO 02067918, прежде всего соединения 1000-1278 и 2001-2159, WO 02066627, прежде всего примеры, WO 02/068420, прежде всего все соединения, описанные в примерах I-LXIII, и их соответствующие аналоги, более предпочтительными являются соединения 2(28), 2(88), 2(119), 2(136), перечисленные в таблице, в которой указаны величины IC50, WO 02083128, прежде всего примеры 1-13, US 2003096846, прежде всего описанные соединения, WO 2004/037181, прежде всего примеры 1 и 33 и соединения, описанные в пунктах 3-5, WO 0168603, прежде всего соединения, описанные в примерах 1-109, ЕР1258480, прежде всего соединения, описанные в примерах 1-60, WO 0181337, прежде всего примеры 1-118, WO 02083109, прежде всего примеры 1А-1D, WO 030003250, прежде всего соединения, описанные в примерах 1-166, наиболее предпочтительно 1-8, WO 03035067, прежде всего соединения, описанные в примерах, WO 03/035057, прежде всего соединения, описанные в примерах, US2003216450, прежде всего примеры 1-450, WO 99/46272, прежде всего соединения, описанные в пунктах 12, 14, 15 и 17, WO 0197808, прежде всего соединения, описанные в пункте 2, WO 03002553, прежде всего соединения, описанные в примерах 1-33, WO 01/34594, прежде всего соединения, описанные в примерах 1-4, WO 02051836, прежде всего примеры 1-712, ЕР1245568, прежде всего примеры 1-7, ЕР1258476, прежде всего примеры 1-32, US 2003087950, прежде всего примеры, WO 02/076450, прежде всего примеры 1-128, WO 03000180, прежде всего примеры 1-162, WO 03000181, прежде всего примеры 1-66, WO 03004498, прежде всего примеры 1-33, WO 0302942, прежде всего примеры 1-68, US 6482844, прежде всего примеры, WO 0155105, прежде всего соединения, описанные в примерах 1 и 2, WO 0202560, прежде всего примеры 1-166, WO 03004496, прежде всего примеры 1-103, WO 03/024965, прежде всего примеры 1 - 54, WO 0303727, прежде всего примеры 1-209, WO 0368757, прежде всего примеры 1-88, WO 03074500, прежде всего примеры 1-72, примеры 4.1-4.23, примеры 5.1-5.10, примеры 6.1-6.30, примеры 7.1-7.23, примеры 8.1-8.10, примеры 9.1-9.30, WO 02038541, прежде всего примеры 1-53, WO 02062764, прежде всего примеры 1-293, предпочтительно соединение, описанное в примере 95, гидрохлорид (2-{{3-(аминометил)-4-бутокси-2-неопентил-1-оксо-1,2-дигидро-6-изохинолинил}окси}ацетамида), WO 02308090, прежде всего примеры 1-1-1-109, примеры 2-1-2-9, пример 3, примеры 4-1-4-19, примеры 5-1-5-39, примеры 6-1 - 6-4, примеры 7-1-7-10, примеры 8-1-8-8, примеры 7-1-7-7, стр. 90, примеры 8-1-8-59, стр.91-95, примеры 9-1-9-33, примеры 10-1-10-20, US 2003225102, прежде всего соединения 1-115, соединения, описанные в примерах 1-121, прежде всего соединения а) - z), аа) - az), ba) - bz), ca) - cz) и da) - dk), WO 0214271, прежде всего примеры 1-320, US 2003096857, WO 2004/052850, прежде всего соединения, как описано в примерах 1-42, и соединения, описанные в пункте 1, DE 10256264 А1, прежде всего соединения, такие как описано в примерах 1-181, и соединения, описанные в пункте 5, WO 04/076433, прежде всего соединения, перечисленные в табл.А, предпочтительно соединения, перечисленные в табл.В, предпочтительно соединения I-XXXXVII, или соединения, описанные в пунктах 6 - 49, WO 04/071454, прежде всего, описанные соединения, например, соединения 1-53, или соединения, перечисленные в табл.Ia-If, или соединения, описанные в пунктах 2-55, WO 02/068420, прежде всего, подробно описанные соединения, например, соединения I-LXIII, или соединение, описанное в примере I и его аналоги 1-140, или соединение, описанное в примере 2 и его аналоги 1-174, или соединение, описанное в примере 3 и его аналог 1, или соединение, описанное в примерах 4-5, или соединение, описанное в примере 6 и его аналоги 1-5, или соединение, описанное в примере 7 и его аналоги 1-3, или соединение, описанное в примере 8 и его аналог 1, или соединение, описанное в примере 9, или соединение, описанное в примере 10 и его аналоги 1-531, еще более предпочтительными являются соединения, описанные в пункте 13, WO 03/000250, прежде всего подробно описанные соединения, такие как соединения 1-166, предпочтительно, соединения, описанные в примерах 1-9, WO 03/024942, прежде всего, подробно описанные соединения, такие как соединения 1-59, соединения, перечисленные в табл.1 (1-68), соединения, описанные в пунктах 6, 7, 8, 9, WO 03024965, прежде всего, подробно описанные соединения, такие как соединения 1-54, WO 03002593, прежде всего, подробно описанные соединения, такие как соединения, перечисленные в табл.1 или в пунктах 2-15, WO 03037327, прежде всего, подробно описанные соединения, такие как соединения, описанные в примерах 1-209, WO 03/000250, прежде всего, подробно описанные соединения, такие как соединения 1-166, предпочтительно соединения, описанные в примерах 1-9, WO 03/024942, прежде всего, подробно описанные соединения, такие как соединения 1-59, соединения, перечисленные в табл.1 (1-68), соединения, описанные в пунктах 6, 7, 8, 9, WO 03024965, прежде всего, подробно описанные соединения, такие как соединения 1-54, WO 03002593, прежде всего, подробно описанные соединения, такие как соединения, перечисленные в табл.1 или в пунктах 2-15, WO 03037327, прежде всего, подробно описанные соединения, такие как соединения, описанные в примерах 1-209, WO 0238541, WO 0230890, заявка U.S. №09/788173, подданная 16 февраля 2001 г. (файл LA50), прежде всего примеры, WO 99/38501, прежде всего примеры, W099/46272, прежде всего примеры, а также DE19616 486 А1, прежде всего val-руr, val-тиазолидид, изолейцил-тиазолидид, изолейцил-пирроллидид и соли фумаровой кислоты и изолейцил-тиазолидида и изолейцил-пирроллидида, WO 0238541, прежде всего, подробно описанные соединения, такие как соединения, подробно описанные в примерах 1 - 53, WO 03/002531, прежде всего, описанные соединения, такие как соединения, перечисленные на стр. 9-13, более предпочтительно соединения, описанные в примерах 1-46, и наиболее предпочтительно соединение, описанное в примере 9, U.S. №6395767, предпочтительно соединения, описанные в примерах 1-109, наиболее предпочтительно соединение, описанное в примере 60.
Дополнительные предпочтительные примеры ингибиторов DPP-IV включают также соединения, описанные в патентах US №6124305 и №6107317, заявках WO 9819998, WO 9515309 и WO 9818763, такие как 1-[2-[(5-цианопиридин-2-ил)аминоэтиламино]ацетил-2-циано-(S)-пирролидин и (2S)-I-[(2 S)-2-aмино-3,3 -диметилбутаноил] -2-пирролидинкарбонитрил.
В заявке WO 9819998 описаны N-(N’-замещенный глицил)-2-цианопирролидины, прежде всего 1-[2-[5-цианопиридин-2-ил]амино]этиламино]ацетил-2-циано-(S)-пирролидин. Предпочтительные соединения описаны в заявке W003/002553 на стр. 9-11, которая включена в настоящее изобретение в качестве ссылки. В заявке WO 0034241 и опубликованном патенте US 6110949 описаны N-замещенные адамантиламиноацетил-2-цианопирролидины и N-(замещенный глицил)-4-цианопирролидины, соответственно. Предпочтительными ингибиторами DPP-IV являются соединения, описанные в пп.1-4. Прежде всего, в указанных заявках описано соединение 1-[[(3-гидрокси-1-адамантил)амино]ацетил]-2-циано-(S)-пирролидин (известный также под названием LAF237).
В заявке WO 9515309 описаны 2-цианопирролидинамиды аминокислот в качестве ингибиторов DPP-IV, а в заявке WO 9529691 описаны пептидилпроизводные диэфиров α-аминоалкилфосфоновых кислот, прежде всего включающие остаток пролина или аналогичные структуры. Предпочтительными ингибиторами DPP-IV являются соединения, перечисленные в табл. 1-8. В заявке WO 01/72290 описаны предпочтительные ингибиторы DPP-IV (пример 1 и пп.1, 4 и 6). В заявке WO 9310127 описаны эфиры бороновой кислоты и пролина, пригодные в качестве нгибиторов DPP-IV. Предпочтительными ингибиторами DPP-IV являются соединения, описанные в примерах 1 - 19. В заявке WO 9925719 описан сульфостин, который является ингибитором DPP-IV, полученный из штамма Streptomyces. В заявке WO 9938501 описаны N-замещенные 4-8-членные гетероциклические кольца. Предпочтительными ингибиторами DPP-IV являются соединения, описанные в пп.15-20.
В заявке WO 9946272 описаны фосфорсодержащие соединения в качестве ингибиторов DPP-IV. Предпочтительными ингибиторами DPP-IV являются соединения, описанные в пп.1-23.
Другими предпочтительными ингибиторами DPP-IV являются соединения формул I, II или III, описанные в заявке WO 03/057200 на стр. 14-27. Наиболее предпочтительными ингибиторами DPP-IV являются соединения, описанные на стр. 28 и 29.
В заявках WO 9967278 и WO 9967279 описаны пролекарства и ингибиторы DPP-IV в форме А-В-С, где С означает стабильный или нестабильный ингибитор DPP-IV.
Предпочтительный N-пептидил-О-ароилгидроксиламин является соединением формулы VII
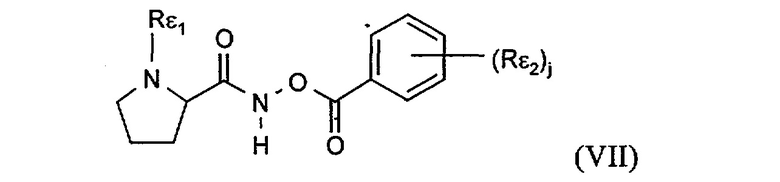
где
j равно 0, 1 или 2,
Rε1 означает боковую цепь природной аминокислоты, и
Rε2 означает (низш.)алкокси, (низш.)алкил, галоген или нитро,
или его фармацевтически приемлемой солью.
В еще более предпочтительном варианте осуществления настоящего изобретения N-пептидил-О-ароилгидроксиламин является соединением формулы Vila
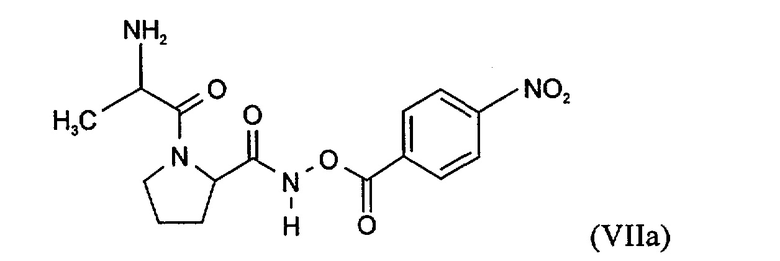
или его фармацевтически приемлемой солью.
N-Пептидил-О-ароилгидроксиламины, например, формулы VII или Vila, a также их получение описано в статье H.U. Demuth и др., J. Enzyme Inhibition, т.2, ее. 129-142, прежде всего ее. 130-132 (1988).
Наиболее предпочтительными ингибиторами являются N-(замещенный глицил)-2-цианопирролидины формулы (I)
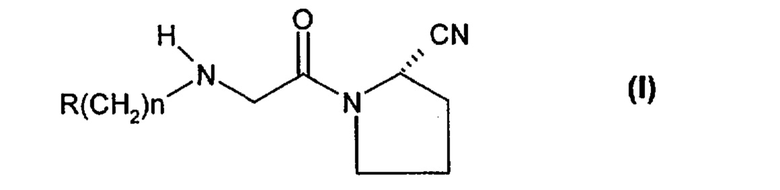
где
R означает замещенный адамантил, и
n равно от 0 до 3, в свободной форме или в форме кислотно-аддитивной соли.
Термин «замещенный адамантил» означает, например, 1- или 2-адамантил, содержащий один или более, например, два заместителя, которые выбирают из группы, включающей алкил, -OR1 или -NR2R3, где R1, R2 и R3 независимо означают водород, алкил, С1-С8алканоил, карбамил или -CO-NR4R5, где R4 и R5 независимо означают алкил, незамещенный или замещенный арил, и где один из R4 и R5 означает водород, или R4 и R5 вместе означают С2-С7алкилен.
Термин «арил» предпочтительно означает фенил. Термин «замещенный фенил» предпочтительно означает фенил, содержащий один или более, например, два заместителя, которые выбирают из группы, включающей, например, алкил, алкокси, галоген или трифторметил.
Термин «алкокси» означает алкил-O-.
Термин «галоген» означает фтор, хлор, бром и иод.
Термин «алкилен» означает мостиковую группу с прямой цепью, содержащую от 2 до 7 атомов углерода, предпочтительно от 3 до 6 атомов углерода и наиболее предпочтительно 5 атомов углерода.
Предпочтительной группой соединений по настоящему изобретению являются соединения формулы (I), где заместитель в составе адамантила присоединен к концевому атому мостиковой группы или к метиленовой группе, соседней с концевым атомом мостиковой группы. В соединениях формулы (I), где остаток глицил-2-цианопирролидина связан с концевым атомом мостиковой группы, заместитель R’ в составе адамантила предпочтительно означает 3-гидрокси. В соединениях формулы (I), где остаток глицил-2-цианопирролидина связан с метиленовой группой, соседней с концевым атомом мостиковой группы, заместитель R’ в остатке адамантила предпочтительно означает 5-гидрокси.
Настоящее изобретение прежде всего относится к соединению формулы (IA) или (IB)
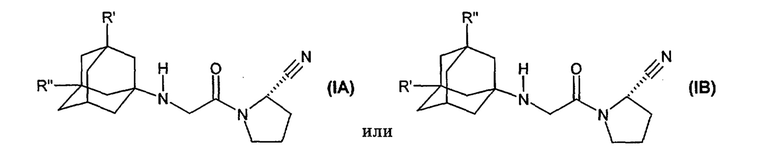
где
R’ означает гидрокси, С1-С7алкокси, С1-С8алканоилокси или R5R4N-CO-O-, где R4 и R5 независимо означают С1-С7алкил или фенил, незамещенный или содержащий заместители, которые выбирают из группы, включающей C1-С7алкил, С1-С7алкокси, галоген или трифторметил, и где R4 означает водород, или R4 и R5 вместе означают С3-С6алкилен, и
R” означает водород, или
R’ и R” независимо означают С1-С7алкил,
в свободной форме или в форме фармацевтически приемлемой кислотно-аддитивной соли.
Такие ингибиторы DPP-IV формул (I), (IA) или (IB) описаны в патенте U.S. №6166063, выданном 26 декабря 2000 г, и в заявке WO 01/52825. Примеры таких ингибиторов включают (8)-1-{2-[5-цианопиридин-2-ил)амино]этиламиноацетил)-2-цианопирролидин или (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин (продукт LAF237). Они существуют в свободной форме или в форме кислотно-аддитивной соли. Предпочтительными являются фармацевтически приемлемые, т.е. нетоксичные и физиологически приемлемые соли, хотя можно использовать другие соли, например, при выделении или очистке соединений по настоящему изобретению. Хотя предпочтительными кислотно-аддитивными солями являются гидрохлориды, можно использовать также соли метансульфоновой, серной, фосфорной, лимонной, молочной и уксусной кислот.
Предпочтительными ингибиторами DPP-IV являются ингибиторы, описанные в статье Mona Patel и др. Expert Opinion Investig Drugs., т. 12, №4, ее. 623-633 (апрель 2003), абзац 5, прежде всего продукты Р32/98, К-364, FE-999011, BDPX, NVP-DDP-728 и другие, содержание которой, прежде всего описание ингибиторов DPP-IV, включено в настоящее изобретение в качестве ссылки.
Продукт FE-999011 описан в заявке WO 95/15309, стр. 14, в качестве соединения 18.
Другим предпочтительным ингибитором является соединение BMS-477118, описанное в патенте U.S. №6395767 (соединение, описанное в примере 60), то есть бензоат (18,38,58)-2-[(28)-2-амино-2-(3-гидрокситрицикло[3.3.1.13,7]дец-1-ил)-1-оксоэтил]-2-азабицикло[3.1.0]гексан-3-карбонитрила (1:1) формулы М, описанной в заявке WO 2004/052850, стр. 2, и соответствующее свободное основание, (1S,3S,5S)-2-[(2S)-2-амино-2-(3-гидрокситрицикло[3.3.1.13,7}дeц-1-ил)-1-оксоэтил]-2-азабицикло[3.1.0]гексан-3-карбонитрил (М’) и его моногидрат (М") формулы М, описанной в заявке WO 2004/052850, стр. 3. Другим названием соединения BMS-477118 является саксаглиптин.
Еще одним предпочтительным ингибитором является соединение GSK23A, описанное в заявке WO 03/002531 (пример 9, то есть гидрохлорид (2S,4S)-1-((2К)-2-амино-3-[(4-метоксибензил)сульфонил]-3-метилбутаноил)-4-фторпирролидин-2-карбонитрила).
Другие предпочтительные ингибиторы DPP-IV по настоящему изобретению описаны в заявке WO 02/076450 (прежде всего в примерах 1-128), а также в статье Wallace Т. Ashton, Bioorganic & Medicinal Chemistry Letters, т. 14, ее. 859-863 (2004), прежде всего соединение 1 и соединения, перечисленные в табл.1 и 2. Предпочтительным соединением является соединение 21е (табл.1) формулы
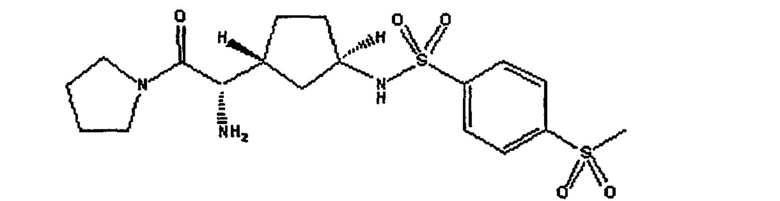
Продукт Р32/98 или Р3298 (номер CAS 251572-86-8, то есть 3-[(2S,3S)-2-амино-3-метил-1-оксопентил]тиазолидин) можно использовать в виде смеси 3-[(2S,3S)-2-амино-3-метил-1-оксопентил]тиазолидина и (2Е)-2-бутендиоата (2:1), как показано ниже
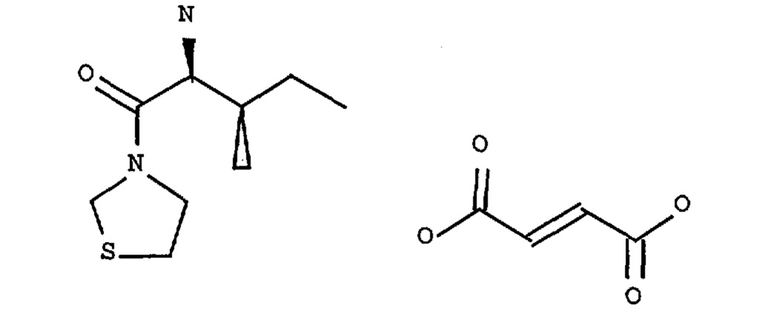
и описано в заявке WO 99/61431 и статье Diabetes, т. 47, ее. 1253-1258 (1998), под названием фирмы Probiodrug и соединения Р 93/01 той же фирмы.
Другими предпочтительными ингибиторами DPP-IV являются соединения, описанные в заявке WO 02/083128, такие как соединения, описанные в пп.1-5.
Наиболее предпочтительными ингибиторами DPP-IV являются соединения, описанные в примерах 1-13 и пп.6-10.
Другими предпочтительными ингибиторами DPP-IV являются ингибиторы, описанные в заявках WO 2004/037169, прежде всего в примерах 1-48, и WO 02/062764, прежде всего в примерах 1-293, более предпочтительными являются соединения 3-(аминометил)-2-изобутил-1-оксо-4-фенил-1,2-дигидро-6-изохинолинкарбоксамид и 2-{[3-(аминометил)-2-изобутил-4-фенил-1-оксо-1,2-дигидро-6-изохинолил]окси}ацетамид, описанные на стр. 7, а также в заявке W02004/024184, прежде всего в примерах сравнения 1-4.
Другие предпочтительные ингибиторы DPP-IV описаны в заявке WO 03/004498, прежде всего в примерах 1-33, и наиболее предпочтительное соединение формулы
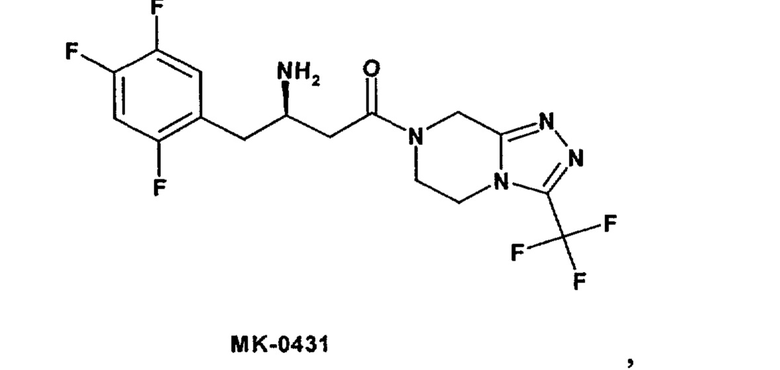
описано в примере 7 (продукт МК-0431 или зитаглипин). Предпочтительные ингибиторы DPP-IV описаны также в заявке WO 2004/037181, прежде всего в примерах 1-33, наиболее предпочтительные соединения описаны в пп.3-5.
Предпочтительными игибиторами DPP-IV являются N-замещенные адамантиламиноацетил-2-цианопирролидины, N-(замещенный глицил)-4-цианопирролидины, N-(N’-замещенный глицил)-2-цианопирролидины, N-аминоацилтиазолидины, N-аминоацилпирролидины, L-аллоизолейцилтиазолидин, L-треоизолейцилпирролидин и L-аллоизолейцилпирролидин, 1-[2-[(5-цианопиридин-2-ил)амино]этиламино]ацетил-2-циано-(S)-пирролидин и их фармацевтически приемлемые соли.
Прежде всего предпочтительным является дигидрохлорид 1-{2-[(5-цианопиридин-2-ил)амино]этиламино} ацетил-2-(S)-цианопирролидина (продукт DPP728) формулы
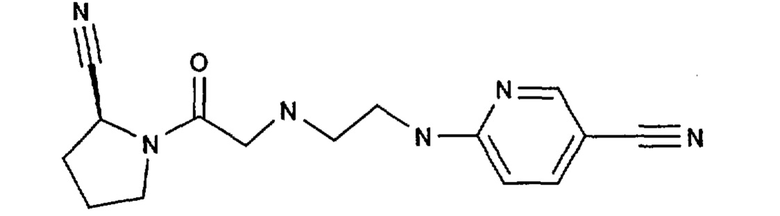
прежде всего его дигидрохлорид,
и (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин (продукт LAF237) формулы
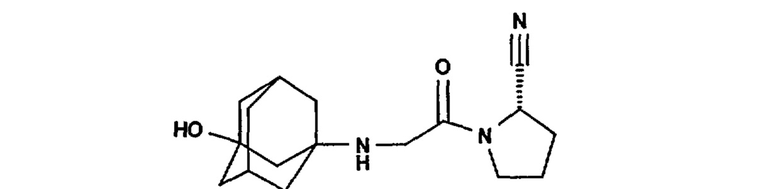
а также L-треоизолейцилтиазолидин (код соединения по каталогу Probiodrug P32/98, как описано выше), МК-0431, GSK23A, BMS-477118, 3-(аминометил)-2-изобутил-1-оксо-4-фенил-1,2-дигидро-6-изохинолинкарбоксамид и 2-{[3-(аминометил)-2-изобутил-4-фенил-1-оксо-1,2-дигидро-6-изохинолил]окси}ацетамид и необязательно фармацевтически приемлемые соли указанных соединений.
DPP728 и LAF237 являются наиболее предпочтительными соединениями и подробно описаны в заявке WO 98/19998, пример 3, и в заявке WO 00/34241, пример 1 соответственно. Ингибитор DPP-IV P32/98 (см. выше) подробно описан в статье Diabetes, т. 47, ее. 1253-1258 (1998). DPP728 и LAF237 получают, как описано на стр. 20 заявки WO 98/19998 или в заявке WO 00/34241. Предпочтительные составы, предназначенные для введения продукта LAF237, описаны в предварительной заявке US №60/604274.
Прежде всего предпочтительными являются ингибиторы DPP-IV, которые являются активными при введении пероральным способом.
Во всех случаях, прежде всего для соединений, описанных в пунктах формулы изобретения, и конечных продуктов, описанных в рабочих примерах, предмет конечных продуктов, фармацевтических составов и пунктов формулы включен в настоящее описание в качестве ссылок на указанные публикации или заявки.
Ингибиторы DPP-IV, например, соединения формулы (I), и их соответствующие фармацевтически приемлемые кислотно-аддитивные соли можно использовать в смеси с одним или более фармацевтически приемлемыми носителями и, необязательно, с одним или более стандартными фармацевтическими адъювантами и вводить энтеральным способом, например, пероральным способом, в форме таблеток, капсул, мини-таблеток и т.п., или парентеральным способом, например, внутривенным способом, в форме стерильных растворов или суспензий для инъекций. Композиции для введения энтеральным и парентеральным способом получают стандартными способами.
Ингибиторы DPP-IV, например, соединения формулы (I), и их соответствующие фармацевтически приемлемые кислотно-аддитивные соли можно перерабатывать в фармацевтические композиции для введения энтеральным и парентеральным способом, содержащие количество активного агента, которое является эффективным для лечения состояний, опосредованных ингибированием DPP-IV, и в указанные композиции в виде стандартной лекарственной формы и в указанные композиции, включающие фармацевтически приемлемый носитель.
Ингибиторы DPP-IV, например, соединения формулы (I), в том числе описанные в настоящем описании и в каждом примере, можно вводить в энантиомерно чистой форме, например, содержащей более 98%, предпочтительно более 99% индивидуального энантиомера, или в комбинации с энантиомером R, например, в форме рацемата. Указанные выше дозы приведены в расчете на соединения формулы (I) и без учета количества энантиомера R.
В связи с ингибирующей активностью в отношении DPP-IV, ингибиторы DPP-IV, например, соединения формулы (I) и их соответствующие фармацевтически приемлемые кислотно-аддитивные соли можно использовать для лечения состояний, опосредованных ингибированием DPP-IV. Принимая во внимание указанное выше, а также литературные данные, можно ожидать, что соединения, описанные в данном контексте, являются пригодными для лечения состояний, таких как инсулиннезависимый сахарный диабет, артрит, ожирение, пересадка аллотрансплантатов и кальцитонинзависимый остеопороз. Кроме того, принимая во внимание роль пептидов глюкагонового типа, таких как GLP-1 и GLP-2, и их взаимосвязь с ингибированием DPP-IV, можно ожидать, что соединения, описанные в данном контексте, можно использовать, например, для обеспечения успокаивающего действия, или для ослабления послеоперационных катаболических изменений или гормональной ответной реакции на стресс, или для снижения смертности и заболеваемости инфарктом миокарда, или для лечения состояний, связанных с указанными выше действиями, которые опосредованы изменениями уровней GLP-1 и/или GLP-2 в организме.
Более подробно, например, ингибиторы DPP-IV, например, соединения формулы (I) и их соответствующие фармацевтически приемлемые кислотно-аддитивные соли улучшают первичную ответную реакцию на инсулин при введении провокационной дозы глюкозы пероральным способом и, следовательно, являются пригодными для лечения инсулиннезависимого сахарного диабета.
Ингибиторы DPP-IV, прежде всего соединения формул I, IA или IB по настоящему изобретению, являются гигроскопичными, что приводит к возникновению проблем с устойчивостью, и, кроме того, сами по себе не поддаются уплотнению. Таким образом, существует необходимость в разработке когезионной композиции с достаточно высокой текучестью, которую можно прессовать в таблетки с приемлемым профилем растворения in vitro и достаточно высокой устойчивостью активных ингредиентов. Термин «таблетка» означает твердую лекарственную форму, содержащую лекарственное средство в присутствии или в отсутствие пригодных наполнителей. Таблетки получают прессованием или уплотнением композиции, содержащей активный компонент и определенные эксципиенты, которые выбирают для упрощения обработки и улучшения свойств продукта. Используют таблетки с покрытием или без покрытия, которые получают из порошкообразных кристаллических материалов. Таблетки могут включать различные разбавители, связующие агенты, дезинтегрирующие агенты, замасливатели, глиданты и во многих случаях красители. Используемые эксципиенты классифицируют в зависимости от их функции. Например, глиданты используют для улучшения текучести порошкообразной смеси в бункере и пресс-форме машины для таблетирования.
Таблетки широко распространены с конца 19-го века, и в настоящее время основную часть лекарственных форм выпускают в виде таблеток. Основными причинами такой популярности таблеток являются простота введения, низкая себестоимость и высокая производительность при их получении. Другие причины включают устойчивость лекарственного средства, простые способы упаковки, транспортировки и распространения. Для пациентов и для потребителей применение таблеток связано с простым способом введения, точностью дозировки, компактностью, транспортабельностью, нейтральным вкусом, простотой введения и прекрасным внешним видом.
Таблетки получают в виде плоских таблеток с пленочным или сахарным покрытием, с насечкой, в виде выпуклых, многослойных таблеток и с замедленным высвобождением. Размеры, формы и цвет таблеток различаются в широком диапазоне. Таблетки предназначены для проглатывания, разжевывания или растворения в ротовой полости или под языком. Таблетки также растворяют в воде для введения местным способом. Стерильные таблетки обычно используют для получения растворов для введения парентеральным способом и для имплантации под кожу.
Кроме активных или лекарственных агентов таблетки могут содержать ряд инертных материалов, известных в качестве эксципиентов. Их классифицируют в зависимости от функции, которую они проявляют в конечной таблетке. Первичная композиция включает наполнитель, связующий агент, замасливатель и глидант. Другими эксципиентами, придающими определенные физические свойства конечной таблетке, являются красители и ароматизаторы в случае жевательных таблеток. В отсутствие эксципиентов большинство лекарственных средств и фармацевтических компонентов не поддаются прямому прессованию в таблетки в основном из-за низких текучести и когезионных свойств большинства лекарственных средств. Обычно эксципиенты добавляют в составы для придания материалу, предназначенному для прессования, достаточно высоких текучести и компрессионных характеристик. Такие свойства получают на стадиях предварительной обработки, таких как влажная грануляция, агрегирование, сферонизация или кристаллизация с распылительной сушилкой.
Замасливатели обычно добавляют для устранения прилипания материала при таблетировании к пуансону, сведения к минимуму трения в процессе прессования таблеток и для удаления прессованной таблетки из матрицы. Такие замасливатели обычно включают в конечную смесь для получения таблеток в количестве приблизительно 1 мас.%.
Ниже приведены другие требуемые свойства эксципиентов:
- Высокая способность к прессованию для обеспечения прочных таблеток при низких силах прессования
- Придание порошкообразному материалу когезионных свойств
- Приемлемые скорости дезинтеграции
- Достаточно высокая текучесть, которая может улучшить текучесть других эксципиентов в составе, и
- Когезионная способность (для предотвращения крошения таблетки при
обработке, транспортировке и использовании).
Существует три коммерчески важных способа получения прессованных таблеток: влажная грануляция, прямое прессование и сухая грануляция (агрегирование или ротационное прессование). Способ получения и тип эксципиентов выбирают для придания составу, предназначенному для таблетирования, требуемых физических свойств, обеспечивающих быстрое прессование таблеток. После прессования таблетки должны характеризоваться рядом дополнительных свойств, таких как внешний вид, твердость, способность к дезинтеграции и приемлемый профиль растворения. Выбор наполнителей и других эксципиентов зависит от химических и физических свойств лекарственного средства, поведения смеси в процессе обработки и свойств готовых таблеток. Для определения химической и физической совместимости активного компонента с предполагаемыми эксципиентами были проведены предварительны исследования.
Свойства лекарственного средства, его лекарственные формы и экономичность способа получения определяют наиболее пригодный способ таблетирования. В большинстве случаев для получения таблеток используют влажную грануляцию и прессование.
Сухую грануляцию используют, если один из компонентов, лекарственное средство или разбавитель, характеризуется когезионными свойствами, достаточными для таблетирования. Способ включает смешивание, агрегирование ингредиентов, сухое просеивание, добавление замасливателя и прессование.
Влажную грануляцию используют для переработки порошкообразной смеси в гранулы с пригодной для таблетирования текучестью и когезионными свойствами. Способ заключается в смешивании порошков в пригодном смесителе со сдвигом с последующим добавлением в смешанные порошки гранулирующего раствора, при этом происходит грануляция. Затем влажную массу просеивают через пригодное сито и сушат в сушильных лотках или в псевдоожиженном слое. В другом варианте влажную массу сначала сушат, а затем измельчают в мельнице. Весь процесс включает взвешивание, смешивание сухих порошков, влажную грануляцию, сушку, измельчение, смешивание с замасливателем и прессование.
В большинстве случаев порошки не обладают адгезионными или когезионными свойствами, достаточными для образования твердых, прочных гранул. Обычно вследствие низких когезионных свойств большинства порошков для агрегации частиц порошка требуется связующий агент. Лекарственные средства, чувствительные к нагреванию и влаге, нельзя перерабатывать влажной грануляцией. Множество стадий обработки и время обработки приводят к проблеме вследствие высокой стоимости переработки. Известно, что влажная грануляция снижает способность к прессованию некоторых фармацевтических эксципиентов, таких как микрокристаллическая целлюлоза.
Прессование является относительно быстрым процессом, при котором порошкообразные материалы прессуются непосредственно без изменения физических и химических свойств лекарственного средства. Перед прессованием в таблетки активный компонент(ы), эксципиенты для прямого прессования и другие вспомогательные вещества, такие как глидант и замасливатель, смешивают в смесителе с двойным корпусом или в аналогичном устройстве с низким сдвигом. Такой тип смешивания является важным для получения фармацевтически приемлемых лекарственных форм. Некоторые фармацевты полагают, что необходимо строго контролировать способ добавления замасливателя в композицию. Поэтому замасливатели обычно добавляют в композицию при слабом перемешивании. Полагают также, что продолжительное перемешивание замасливателя с раствором для грануляции может значительно влиять на твердость и время дезинтеграции полученных таблеток. Избыточное смешивание замасливателя с ингредиентами гранулята приводит к образованию водоотталкивающего гранулята и снижает твердость или прочность таблеток. В таких случаях для получения лекарственных форм прямым прессованием нельзя использовать смесители с высоким сдвигом.
Преимущество прямого прессования заключается в однородности смеси, в снижении число стадий переработки, т.е. весь процесс включает взвешивание порошков, смешивание и прессование, что приводит к снижению стоимости, исключению нагревания и влаги, первичной диссоциации частиц и физической устойчивости.
Фармацевты - производители предпочитают использовать прямое прессование вместо влажной или сухой грануляции вследствие снижения времени обработки и низкой стоимости. Однако прямое прессование можно использовать только в тех случаях, если лекарственное средство или активный ингредиент обладает физическими свойствами, необходимыми для получения фармацевтически приемлемых таблеток. Однако необходимо смешивать один или более эксципиентов с активным компонентом перед прямым прессованием, поскольку большинство компонентов не обладают требуемыми свойствами. Так как добавление каждого эксципиента в композицию приводит к возрастанию размера конечной таблетки, то изготовители часто ограничены в применении прямого прессования только для составов с низким содержанием активного компонента в таблетке.
Твердую лекарственную форму с высоким содержанием лекарственного средства, т.е. если лекарственное средство составляет основную массу прессованной таблетки, можно подвергать прямому прессованию только, если лекарственное средство обладает физическими свойствами, например, когезией, достаточными для прямого прессования ингредиентов, и если лекарственное средство характеризуется пригодным составом.
Например, ингибитор DPP-IV, например, соединение формулы (I), считается лекарственным средством с высокой дозой. Большинство составов таблеток содержат 70-85 мас.% ингибитора DPP-IV в одной таблетке. Такие лекарственные средства с высоким содержанием активного компонента и физическими свойствами, непригодными для прямого прессования, нельзя перерабатывать прямым прессованием в готовые таблетки. Кроме того активные ингредиенты являются нестабильными в присутствии воды, что исключает использование влажной грануляции.
Другим ограничением применения прямого прессования для получения таблеток является размер прессованных таблеток. Если количество активного ингредиента является высоким, то следует выбрать влажную грануляцию активного ингредиента в смеси с другими эксципиентами для получения таблеток приемлемого размера с требуемым количеством активного ингредиента. Для влажной грануляции требуются меньшие количества наполнителя, связующего агента или других эксципиентов по сравнению с прямым прессованием, поскольку способ влажной грануляции придает требуемые свойства таблетки.
Несмотря на преимущества прямого прессования, например, более короткий период обработки и низкая стоимость, для получения твердых лекарственных форм в промышленности широко используют влажную грануляцию. Влажную грануляцию часто используют вместо прямого прессования, поскольку первый способ позволяет с большей вероятностью исключить проблемы, связанные с физическими свойствами различных ингредиентов состава, и позволяет получить материал, обладающий требуемыми текучестью и когезионными свойствами, необходимыми для получения твердых лекарственных форм.
Популярность влажной грануляции по сравнению с прямым прессованием связана по крайней мере с тремя преимуществами. Во-первых, при влажной грануляции получают материал для прессования с лучшими смачивающими свойствами, прежде всего в случае гидрофобных лекарственных средств. Добавление гидрофильных эксципиентов приводит к гидрофилизации поверхности гидрофобного лекарственного средства, исключая проблемы, связанные с дезинтеграцией и растворением. Во-вторых, при влажной грануляции повышается однородность состава твердой лекарственной формы, поскольку все гранулы обычно содержат одинаковое количество лекарственного средства. Наконец, можно исключить сегрегацию лекарственного средства от эксципиентов.
Сегрегация является потенциальной проблемой при прямом прессовании. Размер и форму частиц, содержащих гранулят и предназначенных для прессования, оптимизируют при влажной грануляции, поскольку в процессе грануляции связующий агент «склеивает» частицы друг с другом и они образуют агломерат в виде сферических гранул.
Поскольку в составе по настоящему изобретению присутствует значительное количество метформина, то размер и форма готовых таблеток может вызывать проблемы при введении их пероральным способом пациенту, а также при простом таблетировании, удовлетворяющем всем указанным требованиям. В связи с этим в промышленности существует необходимость в разработке способов и фармацевтических композиций, которые позволят получать в промышленном масштабе таблетки с высокой дозой комбинации ингибитора DPP-IV и метформина (таблетки с высоким содержанием лекарственного средства). Таблетки с высокой дозой ингибитора DPP-IV и метформина должны удовлетворять всем перечисленным требованиям, при этом для снижения размера таблеток предпочтительно снизить число и количество фармацевтических эксципиентов.
Объектом настоящего изобретения является разработка состава, содержащего ингибитор DPP-IV и метформин, в форме когезионного порошка для таблетирования с достаточно высокой текучестью, который можно подвергать грануляции или прессованию в таблетки.
Другим объектом настоящего изобретения является таблетка с высоким содержанием лекарственного средства в виде лекарственной формы, включающей ингибитор DPP-IV и метформин, характеризующаяся пригодным профилем растворения, приемлемыми уровнями твердости, ломкости и устойчивости к расслаиванию, а также пригодным временем дезинтеграции и высокой устойчивостью активных компонентов в таблетке.
Вилдаглиптин является чувствительным к влаге и, следовательно, является нестабильным, т.е. активный компонент разлагается. Для преодоления указанной проблемы в настоящем изобретении разработан состав (содержащий определенные эксципиенты) и способ прямого прессования (исключающий влажную грануляцию) для обеспечения требуемых свойств таблетки, например, твердости, ломкости, устойчивости к расслаиванию и улучшенной стабильности активного компонента, при этом таблетка содержит только 25% лекарственного средства.
Метформин обычно получают влажной грануляцией с высоким содержанием лекарственного средства, что является весьма затруднительным. Известно также, что ротационное прессование применять нельзя вследствие неудовлетворительной способности к прессованию, а также не рекомендуется использовать прямое прессование для получения составов с высоким содержанием лекарственного средства. Известными проблемами являются низкая способность к прессованию и высокая ломкость таблеток, и поэтому в настоящем изобретения при разработке особое внимание уделялось этим характеристикам. Другими проблемами являются:
- Большое количество метформина, что приводите к получению больших таблеток с низким содержанием лекарственного средства LAF237
- Метформин практически не поддается переработке
- Метформин перерабатывают влажной грануляцией, а влага оказывает отрицательное действие на LAF
Таким образом существует необходимость в обеспечении пациентов, страдающих от диабета, прессованными таблетками, содержащими от 25 до 100 мг вилдаглиптина и до 1000 мг метформина, приемлемого размера, с улучшенными свойствами, например, твердостью, ломкостью и устойчивостью активных компонентов.
Другим объектом настоящего изобретения является таблетка в виде стандартной лекарственной формы, включающей ингибитор DPP-IV и метформин, с высоким содержанием лекарственных средств в виде таблетки небольшого размера, сохраняющей устойчивость активных компонентов.
Еще одним объектом настоящего изобретения является способ получения состава или таблетки, содержащих ингибитор DPP-IV и метформин, или их соли.
В настоящем изобретении предлагается состав, содержащий ингибитор DPP-IV и метформин, в форме порошка для таблетирования, способного к прессованию в таблетки пригодного размера с соответствующими твердостью, стабильностью, малым временем дезинтеграции и пригодным профилем растворения.
Кроме активных компонентов, порошок для таблетирования содержит ряд инертных материалов, таких как эксципиенты. Их классифицируют в зависимости от их назначения. Первичная композиция включает наполнители, связующие агенты или разбавители, замасливатели, дезинтегрирующие агенты и глиданты. Другие эксципиенты, придающие определенные физические свойства конечной таблетке, включают красители и ароматизаторы в случае жевательных таблеток. В большинстве случаев эксципиенты добавляют в составы для обеспечения материалу, предназначенному для прессования, высоких текучести и компрессионных характеристик.
Предпочтительный состав по настоящему изобретению включает активные ингредиенты, а именно ингибитор DPP-IV и метформин, и связующий агент.
Примеры фармацевтически приемлемых связующих агентов включают, без ограничения перечисленным, крахмалы, целлюлозы и их производные, например, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, сахарозу, декстрозу, кукурузный сироп, полисахариды и желатин. Связующий агент, например, может присутствовать в количестве приблизительно от 1 до приблизительно 40 мас.% в расчете на массу композиции, предпочтительно от 1 до 30 мас.%, или от 1 до 25 мас.% или от 1 до 20 мас.%.
Необязательно в составы по настоящему изобретению добавляют 1, 2, 3 или более разбавителей. Примеры фармацевтически приемлемых наполнителей и фармацевтически приемлемых разбавителей включают, без ограничения перечисленным, кондитерский сахар, прессованный сахар, декстраны, декстрин, декстрозу, лактозу, маннит, микрокристаллическую целлюлозу, порошкообразную целлюлозу, сорбит, сахарозу и тальк. Наполнитель и/или разбавитель, например, может присутствовать в количестве приблизительно от 15 мас.% до 40 мас.% в расчете на массу композиции. Предпочтительные разбавители включают микрокристаллическую целлюлозу, которую получают при контролируемом гидролизе α-целлюлозы, полученной из мякоти волокнистых растительных материалов, в присутствии разбавленных растворов минеральных кислот. После гидролиза гидроксицеллюлозу очищают фильтрованием и водную суспензию сушат с распылением, при этом получают сухие пористые частицы с широким распределением по размерам. Средний размер частиц пригодной микрокристаллической целлюлозы составляет приблизительно от 20 нм до приблизительно 200 нм. Микрокристаллическую целлюлозу выпускают несколько-фирм-производителей. Примеры пригодной микрокристаллической целлюлозы включают продукт Avicel РН 101, Avicel PH 102, Avicel PH 103, Avicel PH 105 и Avicel PH 200 фирмы FMC Corporation. Наиболее предпочтительным по настоящему изобретению является продукт Avicel PH 102, характеризующийся меньшей площадью поверхности и пористой структурой. Предпочтительно микрокристаллическая целлюлоза присутствует в составе для таблетирования в количестве приблизительно от 25 до 70 мас.%. Другой предпочтительный интервал содержания указанного материала составляет приблизительно от 30 до 35 мас.%, еще один предпочтительный интервал составляет приблизительно от 30 до 32 мас.%. Другим разбавителем является лактоза. Предпочтительно лактозу измельчают, при этом перед добавлением в состав средний размер ее частиц составляет приблизительно от 50 до приблизительно 500 мкм. Лактоза присутствует в составе для таблетирования в количестве приблизительно от 5 до 40 мас.%, предпочтительно приблизительно от 18 до 35 мас.% и наиболее предпочтительно приблизительно от 20 до 25 мас.%.
В состав по настоящему изобретению необязательно добавляют 1, 2, 3 или более дезинтегрирующих агентов. Примеры фармацевтически приемлемых дезинтегрирующих агентов включают, без ограничения перечисленным, крахмалы, глины, целлюлозы, альгинаты, камеди, сшитые полимеры, например, сшитый поливинилпирролидон, сшитую кальциевую соль карбоксиметилцеллюлозы и сшитую натриевую соль карбоксиметилцеллюлозы, полисахариды сои и гуаровую камедь. Дезинтегрирующий агент, например, присутствует в количестве приблизительно от 2 до приблизительно 20 мас.%, например, приблизительно от 5 до приблизительно 10 мас.%, например, приблизительно мас.7% в расчете на массу композиции. Дезинтегрирующий агент является необязательным, но приемлемым компонентом состава для таблетирования. Дезинтегрирующие агенты включают в состав для обеспечения приемлемой скорости дезинтеграции. Типичные дезинтегрирующие агенты включают производные крахмала и соли карбоксиметилцеллюлозы. Предпочтительным дезинтегрирующим агентом является натриевая соль гликолята крахмала. Предпочтительно дезинтегрирующий агент присутствует в составе для таблетирования в количестве приблизительно от 0 до приблизительно 10 мас.%, приблизительно от 1 до приблизительно 4 мас.%, и наиболее предпочтительно приблизительно от 1,5 до приблизительно 2,5 мас.%.
В состав по настоящему изобретению необязательно добавляют 1, 2, 3 или более замасливателей. Примеры фармацевтически приемлемых замасливателей и фармацевтически приемлемых глидантов включают, без ограничения перечисленным, коллоидный диоксид кремния, трисиликат магния, крахмалы, тальк, трехосновный фосфат кальция, стеарат магния, стеарат алюминия, стеарат кальция, карбонат магния, оксид магния, полиэтиленгликоль, порошкообразную целлюлозу и микрокристаллическую целлюлозу. Замасливатель, например, присутствует в количестве приблизительно от 0,1 до приблизительно 5 мас.% в расчете на массу композиции, глидант, например, присутствует в количестве приблизительно от 0,1 до приблизительно 10 мас.%. Замасливатели обычно добавляют для предотвращения приклеивания материала для таблетирования к пуансонам, сведения к минимуму трения в процессе прессования и для ускорения удаления прессованной таблетки из матрицы. Такие замасливатели обычно включают в состав конечной смеси для таблетирования в количестве менее 1 мас.%. Замасливатель является гидрофобным или гидрофильным. Примеры таких замасливателей включают стеариновую кислоту, тальк и стеарат магния. Стеарат магния снижает трение между стенками матрицы и смесью для таблетирования в процессе прессования и ускоряет удаление таблеток. Он также способствует предотвращению адгезии таблеток к пуансонам и матрице. Стеарат магния повышает текучесть порошка в бункере и в матрице. Размер частиц стеарата магния составляет от 450 до 550 мкм, а плотность от 1,00 до 1,80 г/мл. Он является стабильным и не полимеризуется в составе смеси для таблетирования. Предпочтительный Замасливатель, стеарат магния, также добавляют в состав. Предпочтительно Замасливатель присутствует в составе для таблетирования в количестве приблизительно от 0,25 до 6 мас.%, более предпочтительно приблизительно от 0,5 до приблизительно 4 мас.% и наиболее предпочтительно приблизительно от 0,1 до приблизительно 2 мас.%. Другие возможные замасливатели включают тальк, полиэтиленгликоль, диоксид кремния и отвержденные растительные масла. В предпочтительном варианте осуществления настоящего изобретения замасливатель не добавляют в состав, а распыляют на матрицу или пуансоны.
Используют также другие стандартные наполнители или носители, такие как кукурузный крахмал, фосфат кальция, сульфат кальция, стеарат кальция, стеарат магния, стеариновая кислота, моно- и дистеарат глицерина, сорбит, маннит, желатин, природные или синтетические камеди, такие как карбоксиметилцеллюлоза, метилцеллюлоза, альгинат, декстран, аравийская камедь, камедь карайи, камедь плодов рожкового дерева, трагакант и т.п., разбавители, связующие агенты, замасливатели, дезинтегрирующие агенты, красители и ароматизаторы.
Другие примеры пригодных эксципиентов, которые необязательно добавляют в композицию по настоящему изобретению, описаны в книгах Handbook of pharmaceutical excipients, 3-e изд., под. ред. A.H.Kibbe, изд. American Pharmaceutical Association, Washington DC, ISBN: 0-917330-96-Х, или Handbook of Pharmaceutical Excipients (4е изд.), под. ред. Raymond С Rowe, изд. Science and Practice, которые включены в настоящее описание в качеств ссылок.
Таким образом в первом варианте настоящего изобретения предлагается фармацевтическая композиция с высоким содержанием лекарственных средств, включающая от 50 до 98 мас.%, от 50 мас.% до 96 мас.%, от 60 мас,% до 98 мас.%, от 60 мас.% до 96 мас.% или от 70 до 98 мас.%, от 70 мас.% до 96 мас.%, от 80 до 98 мас.% или от 80 до 96 мас.% в расчете на массу активных ингредиентов, при этом активные ингредиенты включают ингибитор DPP-IV, предпочтительно вилдаглиптин, и метформин, или их фармацевтически приемлемые соли.
Во втором варианте настоящего изобретения предлагается таблетка с высоким содержанием лекарственного средства или таблетка, которую получают прямым прессованием, содержащая от 50 до 98 мас.%, от 50 мас.% до 96 мас.%, от 60 мас.% до 98 мас.%, от 60 мас.% до 96 мас.% или от 70 до 98 мас.%, от 70 мас.% до 96 мас.%, предпочтительно от 80 до 98 мас.% или от 80 до 96 мас.% в расчете на массу активных ингредиентов, при этом активные ингредиенты включают ингибитор DPP-IV, предпочтительно вилдаглиптин, и метформин, или их фармацевтически приемлемые соли.
В настоящем изобретении предлагается также композиция или таблетка, как описано выше, в которых метформин присутствует в виде гранул.
В настоящем изобретении предлагается также композиция или таблетка, как описано выше, в которых метформин присутствует в виде гранул, которые содержат по крайней мере один фармацевтически приемлемый эксципиент.
В настоящем изобретении предлагается также композиция или таблетка, как описано выше, в которых метформин присутствует в виде гранул, которые содержат связующий агент.
В настоящем изобретении предлагается также композиция или таблетка, как описано выше, в которых метформин присутствует в виде гранул, которые содержат от 1 до 25 мас.% связующего агента (в расчете на массу сухих гранул).
В настоящем изобретении предлагается также таблетка, как описано выше, полученная прямым прессованием гранул метформина в смеси с вилдаглиптином и необязательно одним фармацевтически приемлемым эксципиентом.
В настоящем изобретении предлагается также композиция или таблетка, как описано выше, содержащая от 1 до 25 мас.% связующего агента, предпочтительно от 1 до 20 мас.%, предпочтительно от 1 до 12 мас.%, от 2,9 до 11 мас.%, или от 6,5 до 9,5 мас.%, или от 7,5 до 17,5 мас.%, или от 12,5 до 17,5 мас.% в расчете на массу фармацевтически приемлемого связующего агента.
В настоящем изобретении предлагается также композиция или таблетка, как описано выше, включающая по крайней мере один фармацевтически приемлемый эксципиент, который является замасливателем, предпочтительно в количестве от 0,1 мас.% до 5 мас.%, от 0,1 мас.% до 2 мас.%, или от 0,1 мас.% до 1,5 мас.% в расчете на массу композиции или таблетки, или от 0,1 мас.% до 1 мас.% в расчете на массу композиции или таблетки. В настоящем изобретении предлагается также композиция или таблетка, как описано выше, в которой замасливателем является стеарат магния.
В настоящем изобретении предлагается также фармацевтическая композиция или таблетка, как описано в данном контексте, в которой связующий агент выбирают из группы, включающей крахмалы, целлюлозы и их производные, например, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и гидроксипропилметилцеллюлозу, сахарозу, декстрозу, кукурузный сироп, полисахариды и желатин.
В настоящем-изобретении предлагается также фармацевтическая композиция или таблетка, как описано в данном контексте, в которой связующий агент выбирают из группы, включающей целлюлозы и их производные, предпочтительно гидроксипропилцеллюлозу (НРС).
Соотношения компонентов, описанные в данном контексте, определены при расчете на массу ингибиторов DPP-IV, метформина и эксципиентов, например, связующего агента.
В настоящем изобретении предлагается также фармацевтическая композиция, как описано в данном контексте, в виде стандартной лекарственной формы. Термин «стандартная лекарственная форма» означает любой вид фармацевтической лекарственной формы, такой как капсулы, таблетки (предпочтительно, таблетки, полученные прямым прессованием), гранулы, жевательные таблетки и т.п.
В другом варианте в настоящем изобретении предлагается таблетка или фармацевтическая композиция, которая в качестве активных ингредиентов включает:
1) от 0,5 до 35% или от 1,5 до 35%, предпочтительно от 0,5 до 20%, или от 1,5 до 20% ингибитора DPP-IV, предпочтительно вилдаглиптина или его фармацевтически приемлемой соли,
2) от 65 до 98,5%, предпочтительно от 80 до 98,5% метформина или его фармацевтически приемлемой соли,
и в которой метформин находится в форме гранул, содержащих от 1 до 25% связующего агента (в расчете на массу сухих гранул), или
предлагается описанная в данном контексте таблетка с высоким содержанием лекарственного средства или фармацевтическая композиция, которые в качестве активных компонентов включают:
1) от 0,5 до 35% или от 1,5 до 35%, предпочтительно от 0,5 до 20%, или от 1,5 до 20% ингибитора DPP-IV, предпочтительно вилдаглиптина или его фармацевтически приемлемой соли,
2) от 65 до 98,5%, предпочтительно от 80 до 98,5% метформина или его фармацевтически приемлемой соли, и в которой метформин находится в форме гранул, содержащих от 1 до 25% связующего агента (в расчете на массу сухих гранул).
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано в данном контексте, в которой гранулы содержат от 1 до 20%, предпочтительно от 3 до 13 мас.%, от 4,9 до 12 мас.%, или от 7,5 до 10,5 мас.%, или от 7,5 до 17,5 мас.%, или от 12,5 до 17,5 мас.% в расчете на массу фармацевтически приемлемого связующего агента.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано в данном контексте, в которой связующий агент выбирают из группы, включающей крахмалы, целлюлозы и их производные, например, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и гидроксипропилметилцеллюлозу, сахарозу, декстрозу, кукурузный сироп, полисахариды и желатин.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано в данном контексте, в которой связующий агент выбирают из группы, включающей целлюлозы и их производные, предпочтительно гидроксипропилцеллюлозу (НРС).
Композиции и таблетки, описанные в данном контексте, предпочтительно содержат по крайней мере один фармацевтически приемлемый эксципиент.
В описанные в данном контексте составы необязательно добавляют другие стандартные фармацевтически приемлемые эксципиенты, по краней мере один, например, 1, 2, 3 или 4, такие как стандартные связующие агенты, разбавители, дезинтегрирующие агенты, твердые наполнители или носители, описанные в данном контексте. Предпочтительные составы содержат не более 25 или 20 мас.%, или предпочтительно 17,5 или 15 мас.% или 11 мас.% фармацевтически приемлемого эксципиента, включая связующий агент (в расчете на массу сухого эксципиента).
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, содержащая от 1 до 12 мас.%, от 2,9 до 11 мас.%, или от 6,5 до 9,5 мас.%, или от 7,5 до 17,5 мас.%, или от 12,5 до 17,5 мас.% фармацевтически приемлемого связующего агента, или необязательно от 0,1 до 10 мас.% другого фармацевтически приемлемого эксципиента (1,2 или более), например от 0,1 мас.% до 2 мас.% замасливателя (например, стеарата магния) в расчете на массу композиции/таблетки. Предпочтительные гранулы содержат от 3 до 13 мас.%, от 4,9 до 12 мас.%, или от 7,5 до 10,5 мас.%, или от 7,5 до 17,5 мас.%, или от 12,5 до 17,5 мас.% в расчете на массу фармацевтически приемлемого связующего агента.
Таблетка или фармацевтическая композиция, как описано выше, содержит от 50 до 98 мас.%, от 70 до 98 мас.%, предпочтительно от 80 до 98 мас.% или от 80 до 96 мас.% активных ингредиентов, в расчете на массу активных компонентов, при этом активные ингредиенты включают предпочтительно вилдаглиптин и метформин, или в каждом случае их фармацевтически приемлемые соли.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, содержащая по крайней мере один фармацевтически приемлемый эксципиент.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой дополнительными фармацевтически приемлемыми эксципиентами являются наполнители, связующие агенты или разбавители, замасливатели, дезинтегрирующие агенты и глиданты. Другие эксципиенты, придающие определенные физические свойства конечной таблетке, включают красители и ароматизаторы в случае жевательных таблеток.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, содержащая по крайней мере один дополнительный фармацевтически приемлемый эксципиент, такой как замасливатель, предпочтительно в количестве от 0,1 до 5 мас.% или от 0,1 до 2 мас.% в расчете на массу композиции, наиболее предпочтительно от 0,5 до 1,5 мас.% в расчете на массу композиции/таблетки.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, содержащая от 0,1 до 5 мас.%, предпочтительно от 0,1 до 2 мас.% или от 0,5 до 1,5 мас.% стеарата магния.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой замасливателем является стеарат магния.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой гранулы метформина получают влажной грануляцией или грануляцией из расплава в присутствии связующего агента.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой гранулы метформина получают влажной грануляцией в присутствии воды или растворителя, который выбирают из органических растворителей, таких как этанол, изопропанол, этилацетат, гликофурол и пропиленгликоль.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой гранулы метформина получают грануляцией из расплава. Способы грануляции из расплава описаны в ряде публикаций, таких как Rina Chokshi и др., "Hot-melt extrusion Technique": A Review, Iranian Journal of Pharmaceutical Research, т. 3, стр. 3-16 (2004) или в обзорной статье J6rg Breitenbach "Melt extrusion: from process to drug delivery technology", European Journal of Pharmaceutics and Biopharmaceutics, т. 54, сс. 107-117 (2002), которые включены в настоящее описание в качестве ссылок.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой вилдаглиптин присутствует в форме лекарственного средства.
В настоящем изобретении предлагается также таблетка или состав, как описано выше, в которых количество ингибитора DPP-IV, предпочтительно вилдаглиптина, составляет от 0,5 до 35 мас.% или от 1,5 до 35 мас.% в расчете на массу активных компонентов, т.е. ингибитора DPP-IV и метформина.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой вилдаглиптин присутствует в форме частиц, в которых по крайней мере 40% вилдаглиптина, предпочтительно 60%, более предпочтительно 80% и наиболее предпочтительно 90% присутствует в форме частиц, распределение которых по размеру составляет менее 250 мкм, или предпочтительно от 10 до 250 мкм, или предпочтительно в которых по крайней мере 25% или по крайней мере 35% вилдаглиптина присутствует в форме частиц, распределение которых по размеру составляет от 50 до 150 мкм.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой вилдаглиптин присутствует в форме частиц.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой частицы вилдаглиптина получают грануляцией из раствора.
В настоящем изобретении предлагается также таблетка или фармацевтическая композиция, как описано выше, в которой растворитель для грануляции предпочтительно выбирают из группы, включающей этанол, изопропанол, этилацетат, гликофурол или пропиленгликоль.
В настоящем изобретении предлагается также фармацевтическая композиция, как описано в данном контексте, которая содержится в капсуле или ее получают в форме таблетки, предпочтительно прессованной таблетки или таблетки, полученной прямым прессованием. Таблетка может кроме того содержать пленочное покрытие, например, полученное из предварительной смеси Opadry.
В настоящем изобретении предлагается также фармацевтическая композиция, как описано в данном контексте, в которой состав образует один из слоев двухслойной или трехслойной таблетки. Предпочтительная двухслойная таблетка по настоящему изобретению содержит первый слой, включающий состав по настоящему изобретению, и в качестве второго слоя состав на основе метформина или глитазона (например, пиоглитазон или розиглитазон или в каждом случае их фармацевтически приемлемые соли).
В настоящем изобретении предлагается также состав по настоящему изобретению, который кроме того включает дополнительный активный компонент, глитазон, например, пиоглитазон или розиглитазон, или стимуляторы секреции инсулина, такие как сульфонилмочевины, например, продукты Glipizide, глибурид и амарил, инсулинотропные лиганды рецептора сульфонилмочевины, такие как меглитиниды, например, натеглинид и репаглинид. Глитазон или сульфонилмочевины вводят в состав гранул метформина (метформин + связующий агент+глитазон или метформин + связующий агент + сульфонилмочевины) или в смеси с лекарственным средством LAF237.
В настоящем изобретении предлагается также двухслойная или трехслойная таблетка, в которой составы по настоящему изобретению образуют один слой, а глитазон, например, пиоглитазон или розиглитазон, или сульфонилмочевины, образуют второй слой.
В описанные в данном контексте составы необязательно добавляют другие стандартные фармацевтически приемлемые эксципиенты (по крайней мере один, например, 1, 2, 3 или 4 эксципиента), такие как стандартные разбавители, дезинтегрирующие агенты, твердые наполнители или носители, описанные в данном контексте. Предпочтительный состав содержит не более 25, 20, 17,5 или 13 мас.% в расчете на массу фармацевтически приемлемого эксципиента, включающего связующий агент, т.е. связующий агент, включенный в гранулы метформина.
Наиболее предпочтительная фармацевтическая композиция включает от 0,1 до 5 мас.%, предпочтительно от 0,5 до 3 мас.% или от 0,5 до 1,5 мас.% фармацевтически приемлемого замасливателя, предпочтительно стеарата магния.
Описанные выше композиции могут включать один или два разбавителя, которые выбирают из микрокристаллической целлюлозы, такой как продукт Avicel PH 102, и лактозы.
Термин «фармацевтически приемлемый дезинтегрирующий агент», использованный в данном контексте, означает по крайней мере один дезинтегрирующий агент, смесь, например, 2 или 3, дезинтегрирующих агентов.
Термин «фармацевтически приемлемый замасливатель», использованный в данном контексте, означает по крайней мере один замасливатель, смесь, например, 2 или 3, замасливателей.
Предпочтительным ингибитором DPP-IV является продукт LAF237, предпочтительными разбавителями являются микрокристаллическая целлюлоза или лактоза, или предпочтительно комбинация микрокристаллической целлюлозы и лактозы, предпочтительным дезинтегрирующим агентом является натриевая соль гликолята крахмала, предпочтительным связующим агентом является связующий агент типа целлюлозы (целлюлоза и ее производные), например, НРС, а предпочтительным замасливателем является стеарат магния.
Описанные выше составы предназначены прежде всего для получения фармацевтических таблеток, например, прессованных таблеток или таблеток, полученных прямым прессованием, а также микротаблеток или капсул, и характеризуются требуемыми физическими свойствами, профилями растворения и высвобождения лекарственного средства, как известно в данной области техники. Таким образом, в еще одном варианте настоящего изобретения предлагается применение любого из описанных выше составов для получения фармацевтических таблеток, микротаблеток или капсул грануляцией, прямым прессованием и сухой грануляцией (агрегирование или ротационное уплотнение).
Описанные выше составы являются прежде всего пригодными для получения таблеток, прежде всего прессованных таблеток или таблеток, полученных прямым прессованием.
Таблетки, полученные из описанных выше составов, прежде всего характеризуются чрезвычайно низкой ломкостью, высоким пределом прочности на разрыв, улучшенной устойчивостью, оптимальными соотношениями толщина таблетки/масса таблетки (таблетки, полученные прямым прессованием), меньшим содержанием воды в составе, прежде всего в таблетках, полученных прямым прессованием, пригодным временем дезинтеграции DT (согласно инструкциям британской фармакопеи (1988)), достаточно высокими дисперсионными свойствами.
В настоящем изобретении описаны смешивание, грануляция и прессование. При выборе типа эксципиента принимается во внимание размер частиц в интервале, который обеспечивает гомогенность порошкообразной смеси и однородность активных ингредиентов в составе. При этом предотвращается сегрегация порошков в бункере при прессовании. Преимущество применения составов по настоящему изобретению заключается в том, что порошкообразная смесь поддается прессованию и характеризуется когезией и текучестью. Кроме того, прессование обеспечивает конкурентную стоимость, срок хранения, исключает применение нагревания и влаги, обеспечивает первичную диссоциацию частиц, физическую устойчивость и однородность размеров частиц.
Описанные преимущества композиций по настоящему изобретению можно эффективно использовать, например, при ротационном уплотнении или влажной грануляции, прессовании или прямом прессовании или при заполнении капсул.
В процессе разработки описанных в данном контексте фармацевтических композиций было неожиданно установлено, что прессованные таблетки, прежде всего, таблетки, полученные прямым прессованием, характеризуются особыми преимуществами, если выполняются следующие условия:
1) распределение по размеру частиц, включающих ингибитор DPP-IV, составляет менее 250 мкм, предпочтительно от 10 до 250 мкм, и/или
2) содержание воды в таблетке составляет менее 10% после хранения в течение 1 недели при 25°С и 60% комнатной влажности (RH).
Таким образом, в другом варианте (а) настоящего изобретения предлагается фармацевтическая композиция или прессованная таблетка, как описано в данном контексте, в которой дисперсия содержит частицы, включающие ингибитор DPP-IV, предпочтительно продукт LAF237, в свободной форме или в форме кислотно-аддитивной соли, и распределение по размеру по крайней мере 60%, предпочтительно 80% и наиболее предпочтительно 90% частиц в которой составляет менее 250 мкм или предпочтительно от 10 до 250 мкм.
В настоящем изобретении предлагается фармацевтическая композиция или прессованная таблетка, как описано в данном контексте, в которой дисперсия содержит частицы, включающие ингибитор DPP-IV, предпочтительно продукт LAF237, в свободной форме или в форме кислотно-аддитивной соли, и распределение по размеру по крайней мере 60%, предпочтительно 80% и наиболее предпочтительно 90% частиц в которой составляет более 10 мкм.
Термин «метформин находится в форме гранул» означает, что ингибитор DPP-IV не включен в состав гранул, содержащих метформин.
Термин «по крайней мере 60%, предпочтительно 80% и наиболее предпочтительно 90%» означает по крайней мере 60%, предпочтительно по крайней мере 80% и наиболее предпочтительно по крайней мере 90%.
Термин «по крайней мере 25%, предпочтительно 35% и наиболее предпочтительно 45%» означает по крайней мере 25%, предпочтительно по крайней мере 35% и наиболее предпочтительно по крайней мере 45%.
Прежде всего в настоящем изобретении предлагается фармацевтическая композиция или прессованная таблетка, как описано в данном контексте, в которой дисперсия содержит частицы, включающие ингибитор DPP-IV, предпочтительно продукт LAF237, в свободной форме или в форме кислотно-аддитивной соли, и распределение по размеру по крайней мере 25%, предпочтительно 35% и наиболее предпочтительно 45% частиц в таблетке составляет от 50 до 150 мкм.
Во втором варианте настоящего изобретения предлагается фармацевтическая композиция или прессованная таблетка, как описано в данном контексте, в которой дисперсия содержит частицы, включающие ингибитор DPP-IV, предпочтительно продукт LAF237, в свободной форме или в форме кислотно-аддитивной соли, и для которой выполняются следующие условия:
1) распределение по размеру по крайней мере 60%, предпочтительно 80% и наиболее предпочтительно 90% частиц составляет менее 250 мкм или предпочтительно от 10 до 250 мкм,
2) содержание воды в таблетке составляет менее 10% после хранения в течение 1 недели при 25°С и 60% RH.
Предпочтительно в настоящем изобретении предлагается фармацевтическая композиция или прессованная таблетка, как описано в данном контексте, в которой дисперсия содержит частицы, включающие ингибитор DPP-IV, предпочтительно продукт LAF237, в свободной форме или в форме кислотно-аддитивной соли, и для которой выполняются следующие условия:
1) распределение по размеру по крайней мере 25%, предпочтительно 35% и наиболее предпочтительно 45% частиц составляет от 50 до 150 мкм,
2) содержание воды в таблетке составляет менее 10% после хранения в течение 1 недели при 25°С и 60% RH, предпочтительно содержание воды в таблетке составляет менее 5% после хранения в течение 1 недели при 25°С и 60% RH.
Предпочтительно частицы DPPIV, прежде всего частицы продукта LAF237, содержат более 70% ингибитора DPPIV, более предпочтительно более 90% или 95% и наиболее предпочтительно более 98% ингибитора DPPIV.
Предпочтительно частицы продукта LAF237 содержат более 70% продукта LAF237, более предпочтительно более 90% или 95% и наиболее предпочтительно более 98% продукта LAF237.
Неожиданно было установлено, что выбранное распределение по размеру частиц ингибитора DPPIV, прежде всего продукта LAF237, является чрезвычайно важным для обеспечения улучшенной способности к прессованию таблеток.
Предпочтительные эксципиенты с выбранным распределением по размеру частиц описаны, например, в книге Handbook of Pharmaceutical Excipients (4 изд.), под. ред. Raymond С Rowe, Science and Practice.
Размер частиц лекарственного средства, например, размер частиц продукта LAF237, можно контролировать с использованием кристаллизации, высушивания и/или измельчения/просеивания (примеры, без ограничения перечисленным, приведены ниже). Размер частиц можно уменьшать также с использованием ротационного уплотнения и измельчения/просеивания. Получение частиц требуемого размера известно и описано, например, в книге « Pharmaceutical dosage forms», т. 2, 2е изд., под ред. H.A.Lieberman, L.Lachman, J.B.Schwartz (глава 3: SIZE REDUCTION)".
Способ получения соответствующих частиц продукта LAF237 требуемого размера описан также в заявке WO 2005/067976, включенной в настоящее описание в качестве ссылки.
Были исследованы частицы различного размера и неожиданно было установлено, что размер частиц в описанном диапазоне обеспечивает улучшенную способность к прессованию.
Оценка распределения частиц по размеру методом ситового анализа
Распределение частиц по размерам оценивали с использованием стандартного ситового анализа, фотонной корреляционной спектроскопии или лазерной дифракции (международный стандарт ISO 13320-1), методом электронно-чувствительных зон, светорассеяния, седиментации или микроскопии. Просеивание является одним из старейших методов классификации порошков по распределению частиц по размерам. Такие способы известны и описаны в данной области техники, например, в любом учебнике по аналитической химии или в фармакопее США (USP) USP-NF (2004 - глава 786 - (The United States Pharmacopeial Convention, Inc., Rockville, MD)), в которой описаны стандарты, утвержденные комитетом по контролю пищевых продуктов и лекарственных средств (FDA). Использованные методики описаны, например, в книге Pharmaceutical dosage forms: т. 2, 2е изд., под ред. H.A.Lieberman, L. Lachman, J.B.Schwartz. На стр. 187 описаны также другие методы: электронно-чувствительных зон, светорассеяния, воздухопроницаемости, седиментации в газообразной или жидкой фазе.
При измерении размера частиц с помощью воздушной струи воздух поступает вверх через сито из вращающейся щели, при этом материал на сите переходит в псевдоожиженное состояние. В то же время к нижней части сита прикладывается отрицательное давление, что приводит к удалению мелких частиц из сита в сборное устройство. Анализ размеров и определение среднего размера частиц осуществляется при отсечении частиц с меньшими размерами на кривой распределения по размеру с использованием отдельных сит при последовательном просеивании (подробное описание данного метода приведено также в книге Alien, Chapman и Hall Т, «Particle Size Measurement», 5е изд., т. 1, с. 178, London, UK (1997). Таким образом, для специалистов в данной области техники известны способы измерения размеров частиц.
Содержание воды в таблетке измеряют методом потерь воды при высушивании или методом Карла-Фишера, которые являются стандартными способами для специалистов в данной области техники (например, содержание воды можно измерить методом потерь при высушивании по данным термогравиметрии). Такие способы известны и описаны в данной области техники, например, в любом учебнике по аналитической химии (J.A. Dean, Analytical Chemistry Handbook, раздел 19, McGraw-Hill, New York (1995)) или в фармакопее США (USP) USP-NF (2004), в которой описаны стандарты, утвержденные комитетом FDA ((2004 - USP - глава 921).
В настоящем изобретении прежде всего предлагается прессованная таблетка или таблетка, полученная прямым прессованием, которая способна диспергироваться в воде в течение от 15 до 50 мин или от 20 до 45 мин с образованием дисперсии, которая проходит через сито с размером ячеек 710 мкм в соответствии с описанном в данном контексте методом испытания диспергируемых таблеток, как описано в британской фармакопее.
Таблетка по настоящему изобретению, способная быстро диспергироваться в воде, характеризуется дополнительным преимуществом, т.к. она удовлетворяет требованиям, описанным в британской фармакопее (В.Р.) для диспергируемых таблеток в отношении времени диспергирования и качества дисперсии (например, прохождение через сито с размером ячеек 710 мкм).
Предпочтительное время диспергирования таблетки по настоящему изобретению составляет менее 15 мин, более предпочтительно менее 12 мин и наиболее предпочтительно менее 10 мин.
Другое преимущество таблеток по настоящему изобретению заключается в следующем: вследствие образования относительно тонкой дисперсии таблетка характеризуется меньшим временем растворения, что приводит к снижению времени абсорбции лекарственного средства в кровоток. Более того, преимущество настоящего изобретения заключается в снижении времени образования относительно тонких дисперсий из таблеток по настоящему изобретению, которые предназначены для проглатывания. Таким образом, таблетки по настоящему изобретению предназначены как для получения дисперсий в воде, так и для непосредственного проглатывания. Такие таблетки по настоящему изобретению, предназначенные для проглатывания, предпочтительно покрывают пленочным покрытием, которое способствует проглатыванию.
В другом варианте настоящего изобретения предлагается фармацевтическая композиция или прессованная таблетка, как описано в данном контексте, удовлетворяющая следующим условиям:
1) от 90 до 99,5% продукта LAF237 высвобождается в течение от 0 до 45 мин, и
2) от 70 до 99% метформина высвобождается в течение от 10 до 45 мин. Для определения скорости растворения лекарственного средства (% высвобождения) использовали лопастной метод с использованием 1000 мл 0,01 н. НС1. Такие способы известны и описаны в данной области техники, например, в любом учебнике по аналитической химии или в фармакопее США (USP) USP - NF (2004 - глава 711 - (The United States Pharmacopeial Convention, Inc., Rockville, MD)), в которой описаны стандарты, утвержденные FDA.
В настоящем изобретении предлагается также способ получения • фармацевтической композиции, содержащей ингибитор DPP-IV, предпочтительно продукт LAF237, или их фармацевтически приемлемые соли, и метформин или его фармацевтически приемлемые соли, который заключается в том, что проводят следующие стадии:
1) грануляция метформина и связующего агента,
2) высушивание гранул, содержащих метформин и связующий агент,
3) смешивание лекарственной субстанции ингибитора DPP-IV, предпочтительно продукта LAF237, с гранулами, содержащими метформин и связующий агент,
4) необязательное смешивание замасливателя, например, стеарата магния, со смесью, полученной на стадии 3).
В настоящем изобретении предлагается также способ получения фармацевтической таблетки, содержащей ингибитор DPP-IV, предпочтительно продукт LAF237, или их фармацевтически приемлемые соли, и метформин или его фармацевтически приемлемые соли, который заключается в том, что проводят следующие стадии:
1) грануляция метформина и связующего агента,
2) высушивание гранул, содержащих метформин и связующий агент,
3) смешивание лекарственной субстанции ингибитора DPP-IV, предпочтительно продукта LAF237, с гранулами, содержащими метформин и связующий агент,
4) необязательное смешивание замасливателя, например, стеарата магния, со смесью, полученной на стадии 3),
5) прессование полученной смеси в таблетку, при этом получают стандартную лекарственную форму.
Полученную смесь получают в форме порошка для таблетирования, способного для прессования в таблетку.
Конечный уровень влаги в грануляте после высушивания (LOD) также является важным критерием, который определяет соответствующие свойства прессования и текучесть метформина при влажной грануляции (при низком уровне LOD способность к прессованию снижается и увеличивается ломкость, в то время как при высоком уровне LOD при грануляции наблюдается слипание и/или образование агрегатов, затрудняющих текучесть порошка). Требуемая величина LOD составляет приблизительно 2% (интервал от 0,5 до 3,5, предпочтительно интервал от 1,5 до 2,4%).
Таким образом, в предпочтительном варианте на стадии 2) происходит высушивание гранулята до величины LOD, равной от 0,5 до 3,5%, предпочтительно от 1,5 до 2,4% (LOD: метод определения потерь воды при высушивании согласно инструкциям фармакопеи США).
Предпочтительной грануляцией на стадии 1) является влажная грануляция или грануляция из расплава.
Неожиданно положительные результаты были получены при грануляции метформина и связующего агента из расплава (стадия 1). Полученные готовые композиции или таблетки характеризуются описанными в данном контексте преимуществами, например, улучшенной твердостью, низкой ломкостью, достаточно высокой способностью к прессованию, растворением и стабильностью.
Таким образом, в предпочтительном объекте настоящего изобретения метформин и связующий агент смешивают и полученную смесь пропускают через экструдер для грануляции из расплава.
Предпочтительная температура в экструдере в зоне смешения составляет от 140 до 220°С, или от 155 до 205°С или от 170 до 190°С.
Предпочтительной стадией прессования 5) является прямое прессование смеси, полученной на стадии 3) или 4).
В других вариантах описанные выше способы могут включать следующие стадии:
- стадию 1), чтобы при завершении стадии 2) получить метформин в форме гранул, содержащих от 1 до 25 мас.%, или от 1 до 20 мас.%, предпочтительно от 1 до 20 мас.%, более предпочтительно от 3 до 13 мас.%, от 4,9 до 12 мас.%, или от 7,5 до 10,5 мас.%, или от 7,5 до 17,5 мас.% или от 12,5 до 17,5 мас.% в расчете на массу сухого фармацевтически приемлемого носителя,
- стадию 1), на которой по крайней мере один фармацевтически приемлемый эксципиент, такой как разбавитель или фармацевтически приемлемый дезинтегрирующий агент, добавляют в смесь, предназначенную для смешения, предпочтительное содержание дополнительного фармацевтически приемлемого эксципиента(ов) составляет менее 25 мас.%, предпочтительно менее 17,5 мас.% или 15 мас.% в расчете на массу сухих гранул,
- стадию 3), на которой по крайней мере один дополнительный фармацевтически приемлемый эксципиент, такой как разбавитель или дезинтегрирующий агент, добавляют в смесь, предназначенную для смешения,
- стадию нанесения покрытия на полученное прессованное ядро (таблетки),
- прессованные ядра перед нанесением покрытия необязательно сушат до величины LOD менее 1%, предпочтительно менее 0,5%.
Предпочтительным ингибитором DPP-IV является продукт LAF237, предпочтительными разбавителями являются микрокристаллическая целлюлоза или лактоза, или предпочтительно комбинация микрокристаллической целлюлозы и лактозы, предпочтительным дезинтегрирующим агентом является натриевая соль гликолята крахмала и предпочтительным замасливателем является стеарат магния.
Перед стадией 1) предпочтительно проводят стадию просеивания состава для основного измельчения, т.е. для удаления всех агломератов/крупных частиц. Перед стадией 3) предпочтительно проводят просеивание продукта LAF237, перед его добавлением в гранулы метформина.
В другом варианте настоящего изобретения предлагается капсула, содержащая описанные выше фармацевтические композиции.
Конечный продукт получают в форме таблеток, микротаблеток, капсул и т.п. с использованием стандартных методов таблетирования или аналогичных машин.
Твердость таблетки, полученной одним из описанных выше способов, составляет от 14 до 30 тыс. фунтов при силе прессования 15 кН, а ломкость составляет от 0,5 до 0,18% при силе прессования от 15 до 20 кН.
Наиболее предпочтительный ингибитор DPP-IV для описанных в данном контексте композиций, прессованных таблеток или способов выбирают из дигидрохлорида 1-{2-[(5-цианопиридин-2-ил)амино]этиламино}ацетил-2-(S)-цианопирролидина, (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидина, L-треоизолейцилтиазолидина, продуктов МК-0431, GSK23A, BMS-477118, 3-(амином етил)-2-изобутил-1-оксо-4-фенил-1,2-дигидро-6-изохинолинкарбоксамида и 2-{[3-(аминометил)-2-изобутил-4-фенил-1-оксо-1,2-дигидро-6-изохинолил]окси}ацетамидаи необязательно их фармацевтически приемлемых солей.
Наиболее предпочтительным ингибитором DPP-IV является 1-[3-гидроксиадамант-1-иламино)ацетил]пирролидин-2(S)-карбонитрил (LAF237 или вилдаглиптин) или его фармацевтически приемлемые соли.
Доза (S)-1-[(3-гидрокси-1-адамантил)амино] ацетил-2-цианопирролидина (вилдаглиптина) предпочтительно составляет от 10 до 150 мг в сут, наиболее предпочтительно от 25 до 150 мг или от 50 до 100 мг или от 25 до 100 мг в сут. Предпочтительные примеры суточных доз для введения пероральным способом составляют 25, 30, 35, 45, 50, 55, 60, 70, 80, 90 или 100 мг. Активный ингредиент можно вводить до 3 раз в сут, предпочтительно 1 или 2 раза в сут.
Глитазоны, которые можно смешивать с составами по настоящему изобретению в форме тройной комбинации, известны в данной области техники и описаны во многих публикациях.
Глитазоны в стадии разработки включают продукты AZ242 (фирмы AstraZeneca), фаза 2, KRP-297 (фирмы Kyorin, лицензированный фирмой Merck) фазы 1-2, МСС-555 (фирмы Mitsubishi Chemicals, лицензированный фирмой J&J), фаза 2, JTT-501 (фирмы Japan Tobacco, лицензированный фирмой Pharmacia), фаза 2.
Глитазоны 5-{[4-(2-(5-этил-2-пиридил)этокси)фенил]метил}тиазолидин-2,4-дион (пиоглитазон, ЕР 0193256 А1), 5-{[4-(2-(метил-2-пиридиниламино)этокси)фенил]метил}тиазолидин-2,4-дион (розиглитазон, ЕР 0306228 А1), 5-{[4-((3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-2Н-1-бензопиран-2-ил)метокси)фенил]метил}тиазолидин-2,4-дион (троглитазон, ЕР 0139421), (S)-((3,4-дигидро-2-(фенилметил)-2Н-1-бензопиран-6-ил)метилтиазолидин-2,4-дион (энглитазон, ЕР 0207605 В1), 5-(2,4-диоксотиазолидин-5-илметил)-2-метокси-Н-(4-трифторметилбензил)бензамид (KRP297, JP 10087641-А), 5-[6-(2-фторбензилокси)нафталин-2-илметил]тиазолидин-2,4-дион (МСС555, ЕР 0604983 В1), 5-{[4-(3-(5-метил-2-фенил-4-оксазолил)-1-оксопропил)фенил]метил} тиазолидин-2,4-дион (дарглитазон, ЕР 0332332), 5-(2-нафтилсульфонил)тиазолидин-2,4-дион (AY-31637, US 4997948), 5-{[4-(1-метилциклогексил)метокси)фенил]метил}тиазолидин-2,4-дион (цикглитазон, US 4287200) в общих чертах и подробно описаны в документах, указанных в скобках после каждого из соединений, в каждом случае в пунктах формулы изобретения, в примерах, в объектах конечных продуктов, при этом фармацевтические композиции и пункты формулы изобретения включены в настоящее изобретение в качестве ссылок. Получение продукта DRF2189 и 5-{[4-(2-(2,3-дигидроиндол-1-ил)этокси)фенил]метил}тиазолидин-2,4-диона описано в статье В.В. Lohray и др., J. Med. Chem., т. 41, сс. 1619-1630 (1998), примеры 2d и 3g на стр. 1627 и 1628. Получение 5-[3-(4-хлорфенил])-2-пропинил]-5-фенилсульфонил)тиазолидин-2,4-диона и других соединений, в которых А означает фенилэтинил,и упомянутых в данном контексте, проводят по методикам, описанным в статье J. Wrobel и др., J. Med. Chem., т. 41, сс. 1084-1091 (1998).
Прежде всего, МСС555 получают, как описано на стр. 49, строки 30-45, в патенте ЕР 0604983 В1, энглитазон получают, как описано на стр. 6, строка 52 - стр.7, строка 6, или аналогично тому, как описано в примерах 27 или 28 на стр.24 в патенте ЕР 0207605 В1, а дарглитазон и 5-{4-[2-(5-метил-2-фенил-4-оксазолил)этокси)]бензил}тиазолидин-2,4-дион (ВМ-13.1246) получают, как описано на стр. 8, строки 42-54 в патенте ЕР 0332332 В1. Продукт AY-31637 вводят, как описано в столбце 4, строки 32-51 в патенте US 4997948, а розиглитазон получают, как описано на стр. 9, строки 32-40 в патенте ЕР 0306228 А1, предпочтительно в виде малеата. Розиглитазон вводят в виде коммерческого продукта, например, под торговым названием AVANDIA™. Троглитазон вводят в виде коммерческого продукта, например, под торговыми названиями ReZulin™, PRELAY™, ROMOZIN™ (в Великобритании) или NOSCAL™ (в Японии). Пиоглитазон вводят, как описано в примере 2 в патенте ЕР 0193256 А1, предпочтительно в виде моногидрохлорида. В зависимости от требований конкретного пациента пиоглитазон вводят в виде коммерческого продукта, например, под торговым названием ACTOS™. Циглитазон вводят, например, как описано в примере 13 в патенте US 4287200.
При введении глитазона взрослому пациенту, страдающему от диабета (масса тела 50 кг), например, суточная доза обычно составляет от 0,01 до 1000 мг, предпочтительно от 0,1 до 500 мг. Указанную дозу можно вводить от одного до нескольких раз в сут. Прежде всего при введении гидрохлорида пиоглитазона в качестве инсулинового сенсибилизатора суточная доза гидрохлорида пиоглитазона обычно составляет от 7,5 до 60 мг, предпочтельно от 15 до 45 мг. При введении троглитазона в качестве инсулинового сенсибилизатора суточная доза троглитазона обычно составляет от 100 до 1000 мг, предпочтельно от 200 до 600 мг. При введении розиглитазона (или его малеата) в качестве инсулинового сенсибилизатора суточная доза розиглитазона обычно составляет от 1 до 12 мг, предпочтельно от 2 до 12 мг.
Предпочтительным глитазоном является пиоглитазон, гидрохлорид пиоглитазона, троглитазон или розиглитазон (или его малеат), прежде всего предпочтительно гидрохлорид пиоглитазона.
Доза продукта ACTOS® (пиоглитазона) не должна превышать 45 мг 1 раз в сут в режиме монотерапии или в комбинации с сульфонилмочевиной, метформином или инсулином. Начальная доза продукта ACTOS в комбинации с метформином составляет 15 или 30 мг 1 раз в сут. Введение ежедневной дозы метформина следует продолжать после инициации лечения продуктом ACTOS. К сожалению, дозу метформина необходимо подбирать из-за возможной гипогликемии при комбинированном лечении в комбинации с продуктом ACTOS. Продукт ACTOS выпускается в виде таблеток массой 15 мг, 30 мг и 45 мг.
Продукт AVANDIA® (розиглитазон) в качестве начальной дозы вводят однократно в количестве 4 мг 1 раз в сут или в виде нескольких доз утром и вечером. При неадекватной ответной реакции организма пациентов в течение от 8 до 12 недель лечения (при снижении уровня глюкозы в плазме натощак (FPG)), дозу увеличивают до 8 мг в режиме монотерапии или в комбинации с метформином. Доза продукта AVANDIA не должна превышать 8 мг в сут, в виде однократной дозы или 2 раза в сут. Продукт AVANDIA выпускают в виде таблеток по 2 мг, 4 мг и 8 мг активного агента.
При лечении диабета дозы метформина подбирают индивидуально в зависимости от эффективности и переносимости, не превышая при этом максимальной рекомендованной суточной дозы метформина 2000 мг. Метформин снижает уровень глюкозы в крови пациентов с диагнозом инсулиннезависимого сахарного диабета и его выпускают в виде таблеток по 500, 750, 850 и 1000 мг активного агента. Однако поскольку метформин является быстродействующим лекарственным средством, то его следует вводить 2-или 3 раза в сут (таблетки по 500-850 мг 2-3 раза в сут или 1000 мг 2 раза в сут во время еды). Предпочтительная доза по настоящему изобретению составляет от 250 до 2000 мг, предпочтительно от 250 до 1000 мг. В настоящем изобретении предлагается также фармацевтическая композиция, таблетка или капсула по настоящему изобретению, содержащая 250 мг, 500 мг, 850 или 1000 мг метформина или его фармацевтически приемлемой соли.
Таким образом, в другом варианте настоящего изобретения предлагается таблетка или состав, содержащие следующие активные ингредиенты:
1) от 50 до 2000 мг метформина, предпочтительно от 250 до 1000 мг метформина,
2) от 25 до 100 мг ингибитора DPP-4, предпочтительно вилдаглиптина. В настоящем изобретении предлагается также фармацевтическая стандартная лекарственная форма, предпочтительно таблетка или капсула, включающая состав по настоящему изобретению, содержащий следующие активные ингредиенты:
1) от 50 до 2000 мг метформина, предпочтительно от 250 до 1000 мг метформина,
2) от 25 до 100 мг ингибитора DPP-4, предпочтительно вилдаглиптина, предпочтительно от 25 до 50 мг вилдаглиптина.
В настоящем изобретении предлагается также фармацевтическая стандартная лекарственная форма, предпочтительно таблетка или капсула, включающая состав по настоящему изобретению, включающий следующие активные ингредиенты:
1) 25 мг вилдаглиптина и 250 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
2) 25 мг вилдаглиптина и 500 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
3) 25 мг вилдаглиптина и 850 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
4) 25 мг вилдаглиптина и 1000 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
5) 50 мг вилдаглиптина и 500 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
6) 50 мг вилдаглиптина и 850 мг метформина, или в каждом случае их фармацевтически приемлемых солей или
7) 50 мг вилдаглиптина и 1000 мг метформина, или в каждом случае их фармацевтически приемлемых солей.
В настоящем изобретении предлагается также состав или таблетка по настоящему изобретению, содержащие:
а) активные ингредиенты, включающие:
1) 25 мг вилдаглиптина и 250 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
2) 25 мг вилдаглиптина и 500 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
3) 25 мг вилдаглиптина и 850 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
4) 25 мг вилдаглиптина и 1000 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
5) 50 мг вилдаглиптина и 500 мг метформина, или в каждом случае их фармацевтически приемлемых солей,
6) 50 мг вилдаглиптина и 850 мг метформина, или в каждом случае их фармацевтически приемлемых солей или
7) 50 мг вилдаглиптина и 1000 мг метформина, или в каждом случае их фармацевтически приемлемых солей, и
б) метформин в форме гранул, включающих от 1 до 25 мас.% связующего агента (в расчете на массу сухих гранул), от 1 до 20 мас.% связующего агента или от 7,5 до 17,5 мас.% связующего агента,
в) состав или таблетку, включающие от 50 до 98 мас.%, от 50 до 96 мас.%, от 60 до 98 мас.%, от 60 до 96 мас.% или от 70 до 98 мас.%, от 70 до 96 мас.%, от 80 до 98 мас.% или от 80 до 96 мас.% активных ингредиентов,
г) композицию, необязательно включающую по крайней мере один дополнительный эксципиент, например, от 0,1 до 2 мас.% стеарата магния.
В настоящем изобретении предлагается также фармацевтическая стандартная лекарственная форма, предпочтительно таблетка или капсула, включающая состав по настоящему изобретению, содержащий следующие активные ингредиенты:
1) от 50 до 2000 мг метформина, предпочтительно от 250 до 1000 мг метформина,
2) от 25 до 100 мг ингибитора DPP-4, предпочтительно вилдаглиптина, предпочтительно от 25 до 50 мг вилдаглиптина, и
3) от 2 до 50 мг глитазона, предпочтительно от 2 до 8 мг розиглитазона или от 15 до 45 мг пиоглитазона.
Таким образом, в другом варианте настоящего изобретения предлагается таблетка по настоящему изобретению, которая характеризуется следующими параметрами:
- твердость составляет от 60 до 340 Н,
- ломкость составляет менее 0,8%, и
- толщина таблетки составляет от 4,5 до 8,3 мм.
Таким образом, в еще одном варианте настоящего изобретения предлагается таблетка по настоящему изобретению, которая характеризуется следующими параметрами:
- твердость составляет от 60 до 340 Н,
- ломкость составляет менее 0,8%, и
- толщина таблетки составляет от 4,5 до 8,3 мм, и
- по крайней мере 70% вилдаглиптина растворяется в течение 30 мин,
- по крайней мере 80% гидрохлорида метформина растворяется в течение 45 мин,
по данным лопастного метода.
В другом варианте настоящего изобретения предлагается таблетка или состав по настоящему изобретению, в которых метформин присутствует в форме гидрохлорида.
В настоящем изобретении предлагается также любая из описанных композиций или таблеток, содержащих от 50 до 98 мас.%, от 50 до 96 мас.%, от 60 до 98 мас.%, от 60 до 96 мас.% или от 70 до 98 мас.%, от 70 до 96 мас.%, от 80 до 98 мас.% или от 80 до 96 мас.% активных ингредиентов, при этом активными компонентами являются вилдаглиптин и метформин или в каждом случае их фармацевтически приемлемые соли.
В другом объекте настоящего изобретения предлагается применение описанных выше составов, капсул, таблеток, прессованных таблеток, таблеток, полученных прямым прессованием, для лечения состояний, таких как инсулиннезависимый сахарный диабет, артрит, ожирение, пересадка аллотрансплантатов, кальцитонинзависимый остеопороз, сердечная недостаточность, нарушение метаболизма глюкозы, IGT (нарушение толерантности к глюкозе), нейродегенеративные заболевания, такие как болезнь Альцгеймера и Паркинсона, модулированная гиперлипидемия, модулированные состояния, связанные с гиперлипидемией или со снижением уровней ГПОНП, ГПНП и ЛП(а), сердечнососудистые или почечные заболевания, например, диабетическая кардиомиопатия, гипертрофия левого или правого желудочков, гипертрофическое срединное утолщение артерий и/или крупных сосудов, гипертрофия брыжеечных сосудов, гипертрофия мезангиальных сосудов, нейродегенеративные нарушения и нарушения познавательной функции, для обеспечения успокаивающего или седативного действия, для облегчения послеоперационных катаболических изменений и гормональной ответной реакции на стресс, для снижения смертности и заболеваемости инфарктом миокарда, для лечения состояний, связанных с описанными выше эффектами, опосредованными изменением уровней GLP-1 и/или GLP-2.
Во всех случаях, прежде всего в случае соединений, описанных в формуле изобретения, конечных продуктов, описанных в примерах, предмет конечных продуктов, аналитические методы и методы измерения (например, документы USP), способы получения частиц требуемого размера, фармацевтические составы, эксципиенты и пункты формулы изобретений включены в настоящее изобретение в качестве ссылок на упомянутые публикации или заявки.
Ниже приведены примеры, иллюстрирующие настоящее изобретение.
Пример 1
Способ получения
Поскольку лекарственное средство метформин затвердевает при хранении, то требуется его измельчение с использованием осцилляторной мельницы (Frewitt), снабженной ситом с размером ячеек 1,68 мм. Затем метформин смешивали с HPC-EXF (фирмы Aqualon, EXF означает классификацию продукта по вязкости и размеру частиц, x означает xtrafine, HF означает вязкость по сравнению с другими величинами вязкости НРС, HF, GF, LF, EF) в течение 1-2 мин при перемешивании с высоким сдвигом. 9 мас.% раствор НРС закачивали в резервуар для грануляции с высоким сдвигом при постоянной скорости (в течение 4 мин) до образования требуемых гранул (общее содержание воды приблизительно 7%). Затем гранулят сушили в сушилке с псевдоожиженным слоем до конечной величины LOD (потери при высушивании) приблизительно 2% (от 1,5 до 2,4%). Высушенный гранулят пропускали через осциллятор Fitzmill (снабженный ситом с размером ячеек 0,078” или 2 мм) или осциллятор Frewitt (снабженный ситом с размером ячеек 1,68 мм). Лекарственное средство LAF237 пропускали через ручное сито с размером ячеек 1 мм и смешивали с измельченным гранулятом метформина в смесителе с бункером в течение 300 оборотов. Стеарат магния также пропускали через ручное сито с размером ячеек 1 мм и смешивали со смесью метформин/LAF в течение 60 оборотов. Затем смесь прессовали на ротационном прессе для таблетирования. Перед нанесением покрытия прессованные ядра сушили до величины LOD менее 0,5%. На ядра наносили покрытие с плотностью приблизительно 5 мг/см.
Рабочие характеристики процесса получения серии описанных композиций, содержащих ядро метформин/ LAF237 в соотношении 5:1, 10:1, 20:1 и 40:1
Описание оборудования, использованного для получения описанного выше состава
Объем серий
Обычно объем производства серий составлял менее 1,0 кг. В процессе получения состава влажную грануляцию проводили в смесителе Collette Gral объемом 25 л, масса серии составляла от 3,0 до 6,0 кг.
Возможность масштабирования и надежность процесса
Все способы, связанные с влажной грануляцией и высушиванием метформина, а также со смешиванием, прессованием и нанесением покрытий, являются стандартными и проводятся на стандартном оборудовании. Конечная величина LOD при высушивании в псевдоожиженном слое (FBD) составляет 1,5-2,4% LOD.
Поскольку уровень влажности в высушенном грануляте значительно влияет на свойства при таблетировании, все грануляты предпочтительно получали с использованием смесителя K.G5 и сушили в сушильном шкафу до величины LOD приблизительно 2% (предпочтительный интервал от 1,5 до 2,4%).
Другой вариант способа получения
Стадия 1: Просеивали метформин и НРС через сито с размером ячеек 1700 мкм. Переносили просеянные ингредиенты в диффузионный смеситель и предварительно смешивали при 20 об/мин в течение 200 оборотов.
Стадия 2: Пропускали смесь через двухшнековый экструдер при 180°С (в зоне смешивания) - грануляция из расплава.
Стадия 3: Просеивали гранулят через сито с размером ячеек 500 мкм с использованием мельницы Frewitt (стадия измельчения).
Стадия 4: Просеивали LAF237 через сито с размером ячеек 500 мкм и смешивали с гранулятом, полученным на стадии 3, при 20 об/мин в течение 300 оборотов.
Стадия 5: Просеивали стеарат магния через сито с размером ячеек 1000 мкм и смешивали при 20 об/мин в течение 60 оборотов.
Стадия 6: Прессование полученной композиции
Стадия 7: Нанесение пленочного покрытия
Пример 1Б
Получение гранул метформина грануляцией из расплава
Ингредиенты внутренней фазы, т.е. гидрохлорид метформина и гидроксипропилцеллюлозу, продукт KLUCEL EXF фирмы Hercules Chemical Co. (Wilmington, Delaware) смешивали в смесителе с бункером в течение 200 оборотов. Смесь подавали в питающую секцию или бункер двухшнекового экструдера. Пригодным двухшнековым экструдером является фармацевтический двухшнековый экструдер PRISM (16 мм) фирмы Thermo Electron Corp.(Waltham, Massachusetts).
На конце двухшнекового экструдера расположена фильера с отверстием 3 мм. Двухшнековый экструдер состоит из 5 зон или секций, параметры каждой из которых можно устанавливать независимо. Начиная от бункера до фильеры зоны соответственно нагревали до следующих температур: 40°С, 110°С, 130°С, 170°С и 185°С. Температуры нагреваемых зон не должны превышать температуру плавления гидрохлорида метформина (приблизительно 232°С). Скорость вращения шнека составляла 150 об/мин, но максимально может составлять 400 об./мин, объемная скорость подачи составляла приблизительно от 30 до 45 г материала в мин. Производительность составляла от 4 г/мин до 80 г/мин.
Экструдат или гранулы, полученные из экструдера, охлаждали до комнатной температуры в течение от 15 до 20 мин. Охлажденные гранулы затем просеивали через сито с размером ячеек 500 мкм (т.е. сито 1 мм).
Для получения внешней фазы стеарат магния просеивали через сито с размером ячеек 1000 мкм, а лекарственное средство вилдаглиптин сначала пропускали через сито с размером ячеек 500 мкм. Затем вилдаглиптин смешивали с полученными гранулами в пригодном смесителе с бункером в течение приблизительно 150 или 300 вращений. Стеарат магния смешивали с полученной смесью в течение 50 или 70 вращений. Полученную конечную смесь прессовали в таблетки с использованием стандартного ротационного пресса для таблетирования (Manesty Beta Press) при силе прессования от 6 кН до 25 кН. Полученные таблетки являлись монолитными и их твердость составляла от 5 тыс. фунтов до 35 тыс. фунтов. Таблетки с указанной твердостью характеризуются пригодной величиной ломкости менее 1 мас.% после 500 ударов. Более того, такие таблетки характеризуются временем дезинтеграции менее или равным 20 мин при использовании дисков при 37°С в 0,1 н. HCl.
Пример 2
А. Краткое описание расширенных испытаний на совместимость
Оценивали совместимость описанных в данном контексте составов со стандартными эксципиентами при 50°С/75% (в открытом виде) в течение 4 недель. Полученные данные испытаний на совместимость указывают на меньшую степень деградации метформина или LAF237 в составе композиций и таблеток по настоящему изобретению.
В. Методика определения стабильности
Стабильность определяли при 25°С/60% RH, 30°/65% RH и 40°С/75% RH в закрытых сосудах из ПЭВП (полиэтилен высокой плотности) в присутствии осушающего агента и при 40°С/75% RH в отсутствии осушающего агента в открытом виде. Полученные результаты испытаний в различные интервалы времени свидетельствуют о повышенной стабильности для описанных в данном контексте составов и таблеток.
RH означает относительную влажность
Условия хранения составов при определении стабильности
Условия хранения при определении стабильности гранулятов, полученных грануляцией из расплава с пониженной влажностью
Результаты исследования свидетельствуют о достаточно высокой стабильности составов и таблеток по настоящему изобретению.
Стабильность составов с пониженной влажностью, соотношение метформин/LAF. 40:1
Величина общей деградации LAF237 (метформин, полученный прямым прессованием) (предварительно гранулированный материал, предназначенный для прямого прессования в таблетки, выпускается под маркой «новый продукт») + LAF237 (грануляция из раствора) составляла 2,9% при 40°С/75% RH при хранении в течение 6 недель в закрытом состоянии.
Величина общей деградации LAF237 (метформин, полученный грануляцией в воде в присутствии 6,6% НРС) + LAF237 (грануляция из раствора, состав по настоящему изобретению) составляла 0,9% при 40°С/75% 0 В при хранении в течение 6 недель в закрытом состоянии.
Величина общей деградации LAF237 при совместной грануляции (метформин + LAF237) в присутствии 6,6% НРС) составляла 6,6% при 40°С/75% RH при хранении в течение 6 недель в закрытом состоянии.
Более того, исследовали множество других составов и установили, что, например, таблетка в виде стандартной лекарственной формы, содержащая ингибитор DPP-IV и метформин, с высоким содержанием лекарственного средства характеризуется более высокой стабильностью, прежде всего в присутствии связующего агента, предпочтительно НРС.
С. Условия определения скорости растворения
Выбранный способ основан на предварительных результатах испытаний способа, которые свидетельствуют об аналогичных профилях высвобождения метформина и LAF237 при различных рН (0,01 н. НСl, рН 4,5 и буферный раствор с рН 6,8) при перемешивании (50 или 100 об/мин).
Прибор USP: I (корзиночная центрифуга)
Скорость вращения: 100 об/мин
Среда для растворения: 0,01 н. дегазированная НСl
Объем: 900 мл
Растворение (n=3) проводили только для исходных образцов. Были получены удовлетворительные результаты при растворении стабильных образцов составов и таблеток по настоящему изобретению. Составы соответствуют критериям скорости растворения.
3. Композиции
Примеры композиций со всеми величинами доз приведены в табл. 3-1-3-6
Состав таблеток с пленочным покрытием, Метформин/ LAF, 250/50 мг, соотношение 5:1
* 9 мас.% в расчете на общее количество гидрохлорида метформина и НРС.
Состав таблеток с пленочным покрытием, Метформин/LAF, 250/25 и 500/50 мг, соотношение 10:1
* 9 мас.% в расчете на общее количество гидрохлорида метформина и НРС.
Состав таблеток с пленочным покрытием, Метформин/LAF, 850/50 мг, соотношение 17:1
* 9 мас.% в расчете на общее количество гидрохлорида метформина и НРС.
Состав таблеток с пленочным покрытием, Метформин/LAF, 500/25 и 1000/50 мг, соотношение 20:1
* 9 мас.% в расчете на общее количество гидрохлорида метформина и НРС
Табл.3-5. Состав таблеток с пленочным покрытием, Метформин/LAF, 850/25 мг, соотношение 34:1
* 9 мас.% в расчете на общее количество гидрохлорида метформина и НРС.
Табл. 3-6
Состав таблеток с пленочным покрытием, Метформин/LAF, 1000/25 мг, соотношение 40:1
* 9 мас.% в расчете на общее количество гидрохлорида метформина и НРС.
Пример 4
Таблетки, полученные, как описано выше в описании и примерах.
Методы оценки таблеток
1. Средняя масса таблетки. 20 таблеток взвешивали на аналитических весах и рассчитывали среднюю массу таблеток.
2. Предел прочности таблеток на разрыв (тыс. фунтов). Каждую таблетку исследовали в устройстве для определения предела прочности Шленигера и рассчитывали средний предел прочности.
3. Ломкость (потери массы в %). 10 точно взвешенных таблеток испытывали на ломкость с использованием устройства для определения ломкости Роше в течение 10 мин. Затем таблетки обеспыливали, повторно взвешивали и потери массы вследствие ломкости рассчитывали в процентах от исходной массы.
4. Время дезинтеграции дисперсии DT (Метод испытания диспергируемых таблеток описан в британской фармакопее (ВР), т. II, с. 895 (1988)). Таблетки испытывали согласно описанной выше методике ВР (в отсутствие дисков) для диспергируемых таблеток с использованием воды при температуре 19°-21°С.
5. Качество дисперсий. Согласно методу испытаний на однородность дисперсий для диспергируемых таблеток ВР (ВР, т. II, с 895 (1988)), 2 таблетки помещали в 100 мл воды при 19°-21°С и диспергировали.
Методы оценки гранул
1. Потери при высушивании (LOD). Остаточное содержание влаги в грануле (LOD) определяли для образца массой 3-4 г с использованием анализатора влажности Computrac при 90°С согласно инструкции фирмы-изготовителя.
2. Массовый срединный диаметр (WMD). Образец гранул массой 10 г просеивали в течение 2 мин при пригодных амплитудах импульсов и просеивания на ультразвуковом сите Alien Bradley согласно инструкции фирмы-изготовителя. Использовали сита с размером ячеек 300 мкм, 250 мкм, 200 мкм, 150 мкм, 100 мкм, 53 мкм и 40 мкм. Величину WMD рассчитывали в виде процентного распределения по размерам частиц, прошедших через сито с использованием компьютерной программы.
Пример 5
Улучшенная надежность способа получения
Предварительную оценку способности к прессованию проводили на прессе Карвера с использованием различных составов.
Полученные данные свидетельствуют о том, что композиции по настоящему изобретению при прессовании при повышенном давлении (силе прессования) характеризуются чрезвычайно высокой прочностью. Прежде всего, например, составы по настоящему изобретению характеризуются высокой прочностью и прессуемостью при таблетировании. При повышенном давлении (силе прессования) составы по настоящему изобретению характеризуются значительно более высокой прочностью таблеток.
Исследования на способность к прессованию (D. Becker, неопубликованные данные) проводили на однопозиционном прессе Корша, снабженном датчиками перемещения на верхнем и нижнем пуансонах.
Полученные данные однозначно свидетельствуют о том, что таблетки LAF237 характеризуются низкими величинами прочности/предела прочности в отсутствие наполнителя с высокой степенью прессуемости. Однако составы по настоящему изобретению характеризуются требуемой прессуемостью прежде всего для LAF237/метформин при соотношении 1:5.
Полученные результаты свидетельствуют о том, что требуемую твердость таблеток можно получить при содержании в гранулах метформина, например, от 1 до 20%, предпочтительно от 3 до 13%, от 3 до 17,5% связующего агента, такого как НРС.
Пример 6
Ломкость
Оценку проводили с использованием пресса Manesty Betapress при 6 различных параметрах: скорость вращения 66-90 об/мин (63000-86000 тонн в ч) и давление 7,5-15 кН. При проведении испытаний использовали устройство с плоской поверхностью и скошенной кромкой (FFBE) диаметром 9 мм для таблеток массой 250 мг и диаметром 10 мм для таблеток массой 310 мг (в зависимости от массы исследуемых таблеток использовали также устройства с другими диаметрами). Измеряли способность к ломкости, профиль прессования, профиль скорости вращения и изменение массы. Условия испытаний и результаты по исследованию ломкости использовали для определения влияющих на прочность параметров (распределение частиц состава по размеру, толщину и массу таблеток, содержание воды в таблетках и т.п.). Составы по настоящему изобретению характеризуются требуемой ломкостью.
Пример - Таблетки, содержащие метформин/LAF237 в соотношении 20:1
Полученные результаты свидетельствуют о том, что таблетки, содержащие LAF237 + (гранулы метформина в отсутствии связующего агента) характеризуются ломкостью 0,8%, в то время как таблетки, содержащие LAF237 + (гранулы метформина, содержащие 12% НРС) характеризуются ломкостью менее 0,2% (при силе прессования 15 кН).
Пример 7. Механическое воздействие (распределение частиц по размерам)
Материал с требуемым распределением частиц по размерам можно получать из вилдаглиптина любой формы, например, аморфного вилдаглиптина, при действии механической силы. Такое действие можно обеспечить при ударе, сдвиге или сжатии. Большинство коммерческих приборов для измельчения объединяет все три принципа. Для вилдаглиптина предпочтительно используют ударную (механический удар) или вихревую мельницу. Наиболее предпочтительная ударная мельница снабжена различными лопастями, ситами, вкладышами или плитой для направляющих колонок. В способе по настоящему изобретению предпочтительно используют ударную мельницу, снабженную плоскими лопастями и ситом с плоскими ячейками размером 5×2,5 см. Скорость воздействия составляла от 20 до 100 м/с (периферическая скорость) в зависимости от партии образца. В настоящем изобретении использовали периферическую скорость лопастей приблизительно 40-50 м/с.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ СОСТАВ | 2006 |
|
RU2483716C2 |
| ТВЕРДАЯ ДОЗИРОВАННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ОРАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ КОМБИНАЦИЮ ВИЛДАГЛИПТИНА И ГЛИКВИДОНА | 2014 |
|
RU2585378C1 |
| СПОСОБ СУХОГО ГРАНУЛИРОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ МЕТФОРМИНА В ВИДЕ ТАБЛЕТОК И ЕГО КОМПОЗИЦИИ | 2013 |
|
RU2647421C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА DPP-IV ДЛЯ СНИЖЕНИЯ ПРИСТУПОВ ГЛИКЕМИИ | 2006 |
|
RU2440143C2 |
| ЭСЦИТАЛОПРАМ И ТВЕРДАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЕГО СОДЕРЖАЩАЯ | 2007 |
|
RU2463039C2 |
| КОМПОЗИЦИЯ И СПОСОБ ПРЯМОГО ПРЕССОВАНИЯ | 2005 |
|
RU2766487C2 |
| КОМПОЗИЦИЯ И СПОСОБ ПРЯМОГО ПРЕССОВАНИЯ | 2005 |
|
RU2391097C2 |
| ГАЛЕНОВЫЙ СОСТАВ АЛИСКИРЕНА И ГИДРОХЛОРТИАЗИДА | 2007 |
|
RU2491058C2 |
| ГАЛЕНОВЫЕ КОМПОЗИЦИИ АЛИСКИРЕНА | 2008 |
|
RU2483718C2 |
| КОМПОЗИЦИЯ С БЫСТРЫМ ВЫСВОБОЖДЕНИЕМ ЛЕКАРСТВЕННОГО СРЕДСТВА, ВКЛЮЧАЮЩАЯ ГРАНУЛЫ ЧУВСТВИТЕЛЬНОГО К ВЛАГЕ ЛЕКАРСТВЕННОГО СРЕДСТВА, ПОЛУЧЕННАЯ ГРАНУЛИРОВАНИЕМ ИЗ РАСПЛАВА, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2005 |
|
RU2383332C2 |
Изобретение относится к медицине и фармацевтической промышленности и касается фармацевтической композиция, представляющей собой таблетку, которая в качестве активных ингредиентов включает: 1) 50 мг вилдаглиптина и 500 мг метформина, 2) 50 мг вилдаглиптина и 850 мг метформина, или 3) 50 мг вилдаглиптина и 1000 мг метформина или в каждом случае их фармацевтически приемлемых солей, при этом активные ингредиенты соответствуют от 60 до 98% композиции, и в которой метформин находится в форме гранул, содержащих от 1 до 20 мас.% в расчете на массу сухого фармацевтически приемлемого связующего агента, выбранного из целлюлозы и ее производных. Также раскрыт способ получения указанной композиции. 2 н. и 35 з.п. ф-лы, 8 табл., 7 пр.
1. Фармацевтическая композиция, представляющая собой таблетку, которая в качестве активных ингредиентов включает:
1) 50 мг вилдаглиптина и 500 мг метформина или в каждом случае их фармацевтически приемлемых солей,
2) 50 мг вилдаглиптина и 850 мг метформина или в каждом случае их фармацевтически приемлемых солей, или
3) 50 мг вилдаглиптина и 1000 мг метформина или в каждом случае их фармацевтически приемлемых солей,
при этом активные ингредиенты соответствуют от 60 до 98% композиции,
и в которой метформин находится в форме гранул, содержащих от 1 до 20 мас.% в расчете на массу сухого фармацевтически приемлемого связующего агента, выбранного из целлюлозы и ее производных.
2. Фармацевтическая композиция по п.1, представляющая собой таблетку, полученную прямым прессованием.
3. Фармацевтическая композиция по любому из пп.1, 2, в которой гранулы содержат от 3 до 13 мас.% в расчете на массу сухого фармацевтически приемлемого связующего агента.
4. Фармацевтическая композиция по любому из пп.1, 2, в которой гранулы содержат от 4,9 до 12 мас.% в расчете на массу сухого фармацевтически приемлемого связующего агента.
5. Фармацевтическая композиция по любому из пп.1, 2, в которой гранулы содержат от 7,5 до 10,5 мас.% в расчете на массу сухого фармацевтически приемлемого связующего агента.
6. Фармацевтическая композиция по любому из пп.1, 2, в которой гранулы содержат от 7,5 до 17,5 мас.% в расчете на массу сухого фармацевтически приемлемого связующего агента.
7. Фармацевтическая композиция по любому из пп.1, 2, в которой гранулы содержат от 12,5 до 17,5 мас.% в расчете на массу сухого фармацевтически приемлемого связующего агента.
8. Фармацевтическая композиция по любому из пп.1, 2, в которой связующий агент выбирают из группы, включающей микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и гидроксипропилметилцеллюлозу.
9. Фармацевтическая композиция по любому из пп.1, 2, в которую добавляют по крайней мере один стандартный фармацевтический приемлемый эксципиент.
10. Фармацевтическая композиция по п.8, в которую добавляют по крайней мере один стандартный фармацевтический приемлемый эксципиент.
11. Фармацевтическая композиция по любому из пп.9, 10, в которой фармацевтический приемлемый эксципиент выбирают из группы, включающей связующие агенты, разбавители, дезинтегрирующие агенты, замасливатели, твердые наполнители и носители.
12. Фармацевтическая композиция по любому из пп.1, 2, в форме таблетки, полученная прямым прессованием гранул метформина в комбинации с вилдаглиптином и необязательно по крайней мере одним фармацевтически приемлемым эксципиентом.
13. Фармацевтическая композиция по любому из пп.1, 2, содержащая не более 25 или 20 мас.% фармацевтически приемлемого эксципиента, включая связующий агент в расчете на массу сухого эксципиента.
14. Фармацевтическая композиция по любому из пп.1, 2, содержащая не более 15 мас.% фармацевтически приемлемого эксципиента, включая связующий агент в расчете на массу сухого эксципиента.
15. Фармацевтическая композиция по любому из пп.1, 2, включающая:
1) от 1 до 12 мас.% фармацевтически приемлемого связующего агента в расчете на массу сухого фармацевтически приемлемого связующего агента и необязательно от 0,1 до 10 мас.% дополнительного фармацевтически приемлемого эксципиента, или
2) от 7,5 до 17,5 мас.% или от 12,5 до 17,5 мас.% фармацевтически приемлемого связующего агента в расчете на массу сухого фармацевтически приемлемого связующего агента и необязательно от 0,1 до 10 мас.% дополнительного фармацевтически приемлемого эксципиента в расчете на массу сухого дополнительного фармацевтического эксципиента.
16. Фармацевтическая композиция по любому из пп.1, 2, включающая от 7,5 до 17,5 мас.% фармацевтически приемлемого связующего агента в расчете на массу сухого фармацевтически приемлемого связующего агента и необязательно от 0,1 до 10 мас.% дополнительного фармацевтически приемлемого эксципиента в расчете на массу сухого дополнительного фармацевтического эксципиента.
17. Фармацевтическая композиция по п.10 в форме таблетки, в которой другим фармацевтически приемлемым эксципиентом является замасливатель.
18. Фармацевтическая композиция по любому из пп.1, 2 в форме таблетки, включающая от 0,1 мас.% до 5 мас.% фармацевтически приемлемого замасливателя в расчете на массу композиции.
19. Фармацевтическая композиция по п.17, включающая от 0,5 мас.% до 1,5 мас.% фармацевтически приемлемого замасливателя в расчете на массу композиции.
20. Фармацевтическая композиция по п.18, в которой замасливателем является стеарат магния.
21. Фармацевтическая композиция по любому из пп.1, 2, в которой гранулы метформина получают грануляцией из расплава в смеси со связующим агентом.
22. Фармацевтическая композиция по любому из пп.1, 2, в которой вилдаглиптин присутствует в форме частиц.
23. Фармацевтическая композиция по любому из пп.1, 2, в которой вилдаглиптин присутствует в форме частиц, в которой по крайней мере 40% вилдаглиптина присутствует в форме частиц, распределение которых по размеру составляет менее 250 мкм.
24. Фармацевтическая композиция по п.22, в которой по крайней мере 40% вилдаглиптина присутствует в форме частиц, распределение которых по размеру составляет от 10 до 250 мкм.
25. Фармацевтическая композиция по п.1, где состав входит в один из слоев двухслойной или трехслойной таблетки.
26. Фармацевтическая композиция по любому из пп.1, 2, включающая дополнительный активный ингредиент, которым являются сульфонилмочевины или глитазон, такой как пиоглитазон или розиглитазон.
27. Способ получения фармацевтической композиции, представляющей собой таблетку, содержащей ингибитор DPP-IV, которым является вилдаглиптин, и метформин или в каждом случае их фармацевтически приемлемые соли по любому из пп.1-3, включающий:
1) грануляцию метформина и связующего агента, причем грануляция представляет собой грануляцию из расплава,
2) высушивание гранул, содержащих метформин и связующий агент,
3) смешивание лекарственной субстанции ингибитора DPP-IV с гранулами, содержащими метформин и связующий агент,
4) необязательно смешивание замасливателя, например стеарата магния со смесью, полученной на стадии 3),
5) прессование полученной смеси в таблетку с получением стандартной дозированной лекарственной формы.
28. Способ по п.27, при осуществлении которого на стадии 2) гранулы высушивают до величины потерь воды при высушивании (LOD) 0,5-3,5%, предпочтительно 1,5-2,4%.
29. Способ по п.27, где в перемешиваемую смесь на стадии 1) или стадии 3) добавляют по крайней мере один дополнительный фармацевтически приемлемый эксципиент.
30. Способ по п.29, где дополнительным фармацевтически приемлемым эксципиентом является разбавитель или дезинтегрирующий агент.
31. Способ по п.27, где проводят дополнительную стадию нанесения покрытия на таблетку, полученную на стадии 5).
32. Способ по п.27, который включает стадию грануляции 1), в процессе которой смешивают метформин и связующий агент и смесь пропускают через экструдер для грануляции из расплава.
33. Способ по п.32, при осуществлении которого температура в экструдере в зоне смешения составляет от 140°С до 220°С или от 155°С до 205°С или от 170°С до 190°С.
34. Способ по п.27, при осуществлении которого в качестве связующего агента используют целлюлозу или ее производное, выбранные из группы, включающей микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и гидроксипропилметилцеллюлозу.
35. Фармацевтическая композиция по любому из пп.1, 2, в которой в качестве метформина используют гидрохлорид метформина.
36. Фармацевтический состав по любому из пп.1, 2 в форме таблетки, который характеризуется следующими параметрами:
- твердость составляет от 60 до 340 Н,
- ломкость составляет менее 0,8%, и
- толщина таблетки составляет от 4,5 до 8,3 мм.
37. Таблетка по п.36, которая характеризуется следующими параметрами:
- твердость составляет от 60 до 340 Н,
- ломкость составляет менее 0,8%, и
- толщина таблетки составляет от 4,5 до 8,3 мм, и
- по крайней мере 70% вилдаглиптина растворяется в течение 30 мин по данным лопастного метода анализа, и
- по крайней мере 80% гидрохлорида метформина растворяется в течение 45 мин по данным лопастного метода анализа.
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| US 6117451, 12.09.2000 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Ahren B | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2024-06-18—Публикация
2006-09-25—Подача