Область техники, к которой относится изобретение
Настоящая заявка относится к способу лечения боли путем обеспечения быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, причем указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества за менее, чем около 10 минут.
Уровень техники
Кеторолак является нестероидным средством с сильной обезболивающей и умеренной противовоспалительной активностью. Химически это 5-бензоил-2,3-дигидро-1H-пирролизин-1-карбоновая кислота, формула которой представляет собой:
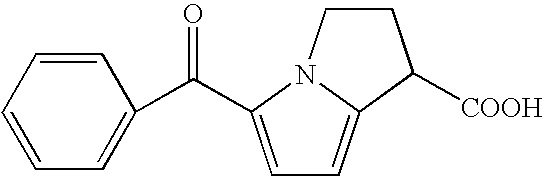
Кеторолак является ингибитором синтеза простагландинов и в течение нескольких лет был известен за счет своего противовоспалительного, обезболивающего и жаропонижающего действия, как описано в патенте США №4089969, в котором раскрыты как рацемическая форма, так и каждый из право- и левовращающего изомеров этого соединения. Также известны многие фармацевтически приемлемые соли, включая наиболее часто используемую соль (2-амино-2-гидроксиметил-1,3-пропандиола) трометамин. Известно, что кеторолак вводили несколькими путями. Например, в патенте США №4089969 предлагается пероральное, парентеральное или местное введение в нескольких фармацевтических формах, таких как таблетки, суппозиторий, пилюли, капсулы, порошок, растворы, суспензии, эмульсии, кремы, лосьоны и мази. В настоящее время, кеторолак в форме соли трометамола используют для перорального введения в виде таблеток, содержащих дозировку 10 мг, или пероральных капель, содержащих 2% раствор, путем инъекции, представленной во флаконах, содержащих дозировку 10 или 30 мг, и путем ректального введения в форме суппозиториев, содержащих дозировку 30 мг.
Кеторолака трометамин восприимчив к значительной деградации в водных композициях. Известно, что лекарственное средство подвергается химическому разрушению посредством окисления, гидроксилирования и других неизвестных путей. Указанный продукт окислительной деградации представляет собой 1-кетоаналог, и указанный продукт разрушения в результате гидроксилирования представляет собой 1-гидрокси-аналог. Водные и этанольные растворы кеторолака или его солей восприимчивы к разрушению при длительном хранении при комнатной температуре (заявки РСТ № WO 2009/087658 и WO 2012/127497). Кроме того, кеторолака трометамин горький по вкусу, и требуется адекватная степень вкусового качества, особенно для композиции, предназначенной для введения через ротовую полость.
Таблетки являются, как правило, предпочтительными пероральными лекарственными формами из-за своего удобства с точки зрения самовведения и точного дозирования. Однако проблема этой лекарственной формы заключается в плохом соблюдении пациентом инструкции по приему препарата, в частности, пожилыми людьми и детьми, которые испытывают трудности с глотанием. Удобной и ценной является быстро распадающаяся лекарственная форма, особенно та, которая распадается и растворяется/диспергируется в слюне и может быть введена без потребности в воде.
Перорально распадающиеся таблетки (ODT) или сублингвальные технологии привлекают внимание в промышленности как многообещающий подход к доставке лекарств для широкого круга пациентов. Таблетки ODT могут быть получены различными способами, включая, но не ограничиваясь ими, сушку вымораживанием (лиофилизацию), формование таблеток, распылительную сушку, сублимацию, прямое прессование, процесс формирования шариков пеллет, с оболочкой (candy cotton process) и формование массы методом экструзии. Прямое сжатие представляет собой простейшую и самую экономически эффективную технологию изготовления таблетки. В этом методе используются супердезинтегранты, такие как кроскармеллоза натрия, разбавители прямого сжатия, подсластители и ароматизаторы. Однако не все лекарственные препараты могут быть получены как препараты прямого прессования либо из-за своих плохих характеристик текучести, либо из-за своей плохой сжимаемости. В результате, необходимо применять процессы грануляции для получения сжимаемых смесей. Следовательно, выбор эксципиентов играет решающую роль в успехе конечного продукта. Другие важные факторы, которые следует учитывать при приготовдении ODT, включают эффективную маскировку вкуса и обеспечение приемлемого вкуса при пероральном распаде.
Стабильность дозированных форм ODT может быть сложной в зависимости от лекарственных средств и эксципиентов, используемых в композициях. Трудно достичь стабильных ODT, так как большинство ингредиентов, используемых при приготовлении ODT, растворяются в минимальном количестве воды. Поэтому тщательная идентификация и выбор эксципиентов имеет решающее значение для развития и долгосрочной стабильности таблеток.
Обычные пероральные таблетки кеторолака, которые доступны на рынке, непригодны для острых воспалительных состояний, где требуется мгновенный результат действия. В частности, из-за его использования в качестве анальгетика, мгновенный результат действия кеторолака имеет важное значение. Было сделано несколько попыток обеспечить быстрое начало действия кеторолака путем его формирования в различных возможных формах. Однако стабильность и маскировка вкуса этих составов, по-видимому, являются сложными факторами, поскольку кеторолак восприимчив к окислительному и гидролитическому разрушению, и горький по вкусу, что приводит к плохому соблюдению инструкций по приему.
Сублингвальные составы кеторолака описаны в патенте США № 7879901, где было обнаружено, что тройная смесь лактозы/сорбита/целлюлозы является основным компонентом композиции, и композицию вводят сублингвально для быстрой абсорбции.
Заявка РСТ № WO 2004/108110 раскрывает фармацевтическую композицию нестероидного противовоспалительного средства, вводимого сублингвальным путем для ускорения быстрого распада в полости рта и способного абсорбироваться через слизистую оболочку полости рта. Аналогично этому, патент США № 7282217 и заявка PCT № WO 2000/015195 раскрывают быстро распадающиеся таблетки или фармацевтические композиции с быстрым высвобождением.
Остается четкая неудовлетворенная клиническая потребность разработать в области технике лекарственные формы для кеторолака, предназначенные для более быстрого облегчения боли. Более конкретно, в данной области техники необходимо разработать композицию, содержащую кеторолак, которую можно вводить перорально, которая может быстро распадаться в полости рта и улучшать фармакокинетические параметры для более быстрого облегчения боли. Желательно также иметь пероральные лекарственные формы с улучшенным вкусом и в то же время сохранить стабильность, учитывая срок годности, минимизируя гидролитическую и окислительную деградацию лекарственного средства.
Для того, чтобы достичь эффективного лечения боли при быстром начале действия, высокая скорость поглощения кеторолака в начальные моменты времени столь же важна, как и полное поглощение. Также важно, чтобы поглощение в начальный момент времени должно быть как можно выше для достижения минимальной эффективной концентрации (MEC) или обезболивающей концентрации препарата в плазме. Mandema и др., Clin Pharmacol Ther, 1996; 60 (6): 619-35, раскрывает EC50 кеторолака трометамина 370 нг/мл. Крайне важно достичь высокой частичной AUC при такой минимальной эффективной концентрации препарата в плазме. Кроме того, ни одно из доступных средств в уровне технике не раскрывает фармакокинетический профиль с высокой частичной AUC при такой минимальной эффективной концентрации препарата в плазме менее, чем за 10 минут.
Соответственно, настоящая заявка относится к способу лечения боли путем введения быстрораспадающейся композиции кеторолака, где указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества за менее, чем около 10 минут. Для того, чтобы обеспечить более быстрое облегчение боли, желательно иметь композицию кеторолака, которая распадается или диспергируется в полости рта за менее, чем около 30 секунд. Кроме того, желательно иметь пероральную лекарственную форму, которая облегчает глотание дозированных форм.
Раскрытие изобретения
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, причем указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества за менее, чем около 10 минут.
В одном аспекте вышеприведенного варианта осуществления изобретения, композиция настоящей заявки при пероральном введении обеспечивает концентрацию обезболивающего вещества по меньшей мере около 370 нг/мл за менее, чем около 10 минут.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, причем указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества по меньшей мере примерно 370 нг/мл за менее, чем около 10 минут.
В аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит кеторолак в количестве от около 5 мг до около 10 мг.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит кеторолак в количестве около 5 мг.
В другом аспекте вышеупомянутых вариантов осуществления изобретения, композиция настоящей заявки содержит кеторолак в количестве около 10 мг.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит, по меньшей мере, один водонерастворимый полимер.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит, по меньшей мере, один сахарный спирт.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстро распадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(c) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества за менее, чем около 10 минут.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося этом, включающему введение пациенту быстро распадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(c) по меньшей мере один сахарный спирт,
при этом указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества по меньшей мере приблизительно 370 нг/мл за менее, чем около 10 минут.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении показывает Тlag менее, чем около 5 минут.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у нуждающегося в этом пациента, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении показывает Тlag менее, чем около 5 минут.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении показывает Тlag менее, чем около 5 минут и обеспечивает концентрацию обезболивающего вещества по меньшей мере около 370 нг/мл за менее, чем около 10 минут.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении показывает по меньшей мере один из следующих фармакокинетических параметров:
(a) AUC0-5мин от около 2,64 нг.ч/мл до около 3,96 нг.ч/мл;
(b) AUC0-10мин от около 23,35 нг.ч/мл до около 35,03 нг .ч/мл;
(c) AUC0-20мин от около 128,20 нг.ч/мл до около 192,30 нг.ч/мл; или
(d) AUC0-30min от около 297,99 нг.ч/мл до около 446,99 нг.ч /мл.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, причем указанная композиция при пероральном введении проявляет более высокие частичные AUC по сравнению с коммерчески доступной композицией кеторолака.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении показывает AUC0-5мин примерно в 4,5 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении показывает AUC0-10мин примерно в 2,6 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении показывает AUC0-20мин примерно в 1,5 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении показывает AUC0-30мин примерно в 1,3 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении демонстрирует биоэквивалентность по отношению к коммерчески доступной композиции кеторолака при введении субъектам человека в состоянии голода, при этом указанная биоэквивалентность определяется посредством: (a) 90% доверительного интервала для среднего значения Cmax, который находится в пределах от 80% до 125%, (б) 90% доверительного интервала для среднего значения AUC(0-t), который находится в пределах от 80% до 125% и (в) 90% доверительного интервала для среднего значения AUC(0-∞), который находится в пределах от 80% до 125%.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемую соль и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки содержит кеторолак в количестве от около 5 мг до около 10 мг.
В одном варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемую соль и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция содержит кеторолак в количестве от около 5 мг до около 10 мг.
В аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки разрушается за менее, чем около 30 секунд при помещении в полость рта.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемую соль и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция расщепляется за менее, чем около 30 секунд при помещении в полость рта.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция по настоящему изобретению демонстрирует, по меньшей мере, один из следующих профилей высвобождения in vitro:
i. высвобождается по меньшей мере около 80% кеторолака в течение примерно 5 минут при измерении в 600 мл искусственного желудочного сока (рН 1,2), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP);
ii. высвобождается по меньшей мере около 90% кеторолака в течение около 5 минут при измерении в 600 мл ацетатного буфера (pH 4,5), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP);
или
iii. высвобождается по меньшей мере около 95% кеторолака в течение около 5 минут при измерении в 600 мл фосфатного буфера (рН 6,8), и/или очищенной воды при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP);
В одном варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемую соль и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция проявляет по меньшей мере один из следующих профилей высвобождения in vitro:
i. высвобождается по меньшей мере около 80% кеторолака в течение примерно 5 минут при измерении в 600 мл искусственного желудочного сока (рН 1,2), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP);
ii. высвобождается по меньшей мере около 90% кеторолака в течение около 5 минут при измерении в 600 мл ацетатного буфера (pH 4,5), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP); или
iii. высвобождается по меньшей мере около 95% кеторолака в течение около 5 минут при измерении в 600 мл фосфатного буфера (рН 6,8), и/или очищенной воды при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP).
В аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит водонерастворимый полимер и сахарный спирт в массовом соотношении от около 1,0: 1,0 до около 1,5: 1,0.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит кеторолак и сахарный спирт в массовом соотношении от около 0,3: 1,0 до около 1,0: 1,0.
В одном варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемую соль и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт где указанная композиция содержит водонерастворимый полимер и сахарный спирт в массовом соотношении от около 1,0: 1,0 до около 1,5: 1,0.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемую соль и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция содержит кеторолак и сахарный спирт в массовом соотношении от около 0,3: 1,0 до около 1,0: 1,0.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки содержит водонерастворимый полимер в количестве от около 30% до около 60% по массе композиции.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки включает указанный сахарный спирт, который присутствует в количестве от около 20% до около 50% от массы композиции.
В еще одном аспекте вышеуказанных вариантов осуществления композиция настоящей заявки дополнительно содержит стабилизатор, выбранный из нерастворимых в воде антиоксидантов, модификаторов рН или их смесей.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 25°C/60% относительной (RH) и образуется менее чем 0,5% от общего количества примесей.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образуется менее чем 0,5% от общего количества примесей.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 25°C/60% относительной влажности (RH) и образуется менее чем 1,0% от общего количества примесей.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образуется менее чем 1,0% от общего количества примесей.
В еще одном аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки составлена в виде таблеток, пастилок, каплет, пилюль, капсул, пленок, порошков, гранул или саше.
Краткое описание фигур
Фиг. 1 показывает концентрацию кеторолака в плазме (нг/мл) в зависимости от времени (час) для иллюстративной композиции настоящей заявки, как указано в примере 1, содержащей 10 мг кеторолака, в отношении пероральных таблеток KETOROL® 10 мг, вводимых здоровому человеку в состоянии голода.
Осуществление изобретения
Детали одного или нескольких вариантов осуществления изобретения настоящей заявки изложены в этом документе. Модификации вариантов осуществления, описанных в этом документе, и другие варианты осуществления, будут очевидны специалисту в данной области после изучения информации, представленной в этом документе. Информация, представленная в этом документе, и особенно конкретные детали описанных иллюстративных вариантов осуществления, предоставляется в основном для ясности понимания, и из нее не следует понимать никаких ненужных ограничений. В случае противоречия, описание этого документа, включая определения, будет контролировать.
Определения: Термины, используемые в настоящем описании, имеют следующие значения:
Термин «содержащий» означает упомянутые элементы или их эквивалент по структуре или функции плюс любой другой элемент или элементы, которые не приведены. Термины «имеющий» и «включающий» также должны толковаться как открытые, если контекст не предполагает иного. Эти термины не означают в исключительном смысле «состоят только из». Все диапазоны, указанные здесь, включают конечные точки, включая те, которые читают диапазон «между» двумя значениями.
Термины, используемые здесь, понимаются как охватывающие множественное число, а также единственное или иное ясно обозначенное там, где это необходимо. Например, ссылка на «эксципиент» включает ссылку на один или несколько таких эксципиентов, а ссылка на «носитель» включает ссылку на один или несколько таких носителей.
Термины, такие как «около», «до», «в общем» и т.п., должны толковаться как изменяющие термин или значение таким образом, чтобы он не был абсолютным. Такие термины будут определяться обстоятельствами и условиями, которые они изменяют, поскольку эти термины понимаются специалистами в данной области техники. Это включает, по крайней мере, степень ожидаемой ошибки эксперимента, технической ошибки и инструментальной ошибки для данного эксперимента, метода или инструмента, используемого для измерения значения. Термин «около» используется для обеспечения гибкости конечной точки числового диапазона путем обеспечения того, что заданное значение может быть «немного выше» или «немного ниже» конечной точки. Используемый здесь термин «около» означает небольшое изменение указанного значения в пределах 10 процентов от указанного значения. Тем не менее, термин «около» может означать более высокое отклонение вариации в зависимости, например, от используемого экспериментального метода. Указанные вариации заданного значения величин понимаются специалистом в данной области и находятся в пределах контекста настоящего изобретения. В качестве иллюстрации числовой диапазон от «около 1 до около 5» должен интерпретироваться как включающий не только явно выраженные значения от 1 до 5, но также включающие отдельные значения и поддиапазоны в указанном диапазоне. Таким образом, в этот числовой диапазон входят индивидуальные значения, такие как 2, 3 и 4 и субдиапазоны, такие как 1-3, от 2-4, от 3-5 и т. д., а также 1, 2, 3, 4 и 5, индивидуально. Этот же принцип применяется к диапазонам, в которых указывается только одно числовое значение как минимум или максимум.
Используемый в настоящем описании термин «по меньшей мере» относится к присутствию указанного вещества в композиции в наименьшем количестве.
Используемый в настоящем описании термин «фармацевтическая композиция», «композиция» и «состав» используются взаимозаменяемо и относятся к смеси двух или более соединений, элементов или молекул. Кроме того, термины «композиция» и «состав» могут быть использованы для обозначения смеси одного или нескольких активных агентов с эксципиентами или другими носителями и включают твердые фармацевтические продукты, такие как таблетки, капсулы, саше, пилюли или гранулы, содержащие смесь двух или более соединений, элементов или молекул.
Термин «быстро распадающаяся композиция» может включать одну или несколько композицию (композиций) или состав (составов), представленных в приемлемой форме для перорального введения, причем указанная композиция, которая после введения или при помещении внутрь полости рта субъекта или пациента, распадается или диспергируется или растворяется в течение примерно 60 секунд или менее или в течение около 30 секунд или менее или в течение около 15 секунд или менее и облегчает введение дозы. Термин также относится к композиции, которая быстро распадается или разлагается при контакте с жидкостью, в частности водной жидкостью (например, водой, жидкостей организма (например, слюны) и тому подобного), которую можно легко проглотить. Быстрая распадающаяся композиция настоящей заявки может присутствовать в форме таблеток, пастилок, каплет, пилюль, капсул, пленок, порошков, гранул или саше.
Термин «распадаться» хорошо понимается в данной области, и, хотя композиция может быть полностью распавшейся, термин «распадаться» необязательно относится к полному растворению композиции, хотя растворенная композиция (например, таблетка, пастилка и т. д.), как правило, полностью распадались бы.
Термин «терапевтически эффективное количество» или «эффективное количество» лекарственного средства, как использовано в настоящем описании, относится к нетоксичному, но достаточному количеству лекарственного средства для достижения терапевтических результатов при лечении состояния, для которого известно, что лекарственное средство будет эффективным. В этом случае эффективное количество представляет собой количество кеторолака, которое составляет приблизительно от около 5 мг до около 10 мг, что является достаточным для обеспечения пациентам определенной степени обезболивания или помогает в управлении острой, сильной или умеренной боли или связанных с ней состояниями, но достаточно низким, чтобы избежать серьезных побочных эффектов (при разумном соотношении польза/риск) в рамках здравого медицинского суждения. Эффективное количество указанного кеторолака или его фармацевтически приемлемой соли будет варьировать в зависимости от конкретного состояния, которое подвергается лечению, возраста и физического состояния пациента, подвергаемого лечению, тяжести состояния, продолжительности лечения, характера одновременной терапии и подобных факторов с учетом знаний и опыта лечащего врача.
Термин «эксципиенты», «фармацевтически приемлемые эксципиенты» или «носители», как используется в настоящем описании, относится к любым фармацевтически приемлемым веществам или компонентам фармацевтического продукта, подходящим для настоящего фармацевтического препарата и описанным здесь, которые не обладают фармакологическим эффектом, таким как наполнитель, разбавитель, носитель и т.д. Эксципиенты, которые полезны при приготовлении фармацевтической композиции, обычно безопасны, нетоксичны, не взаимодействуют с другими компонентами композиции вредным образом и приемлемы для ветеринарии или человека. «Эксципиент» или «фармацевтически приемлемый эксципиент», используемые в настоящем описании, включает как один, так и несколько таких эксципиентов.
Используемый в настоящем описании термин «кеторолак» относится к его свободному основанию, его фармацевтически приемлемым солям, кислотно-аддитивным солям, всем полиморфным формам (аморфным или кристаллическим), гидратам, безводным формам, энантиомерам, пролекарствам кеторолака и/или их смесям. В одном аспекте термин кеторолак относится к кеторолаку трометамину.
Термин «фармацевтически приемлемая соль» включает производные раскрытых соединений, которые в пределах здравого медицинского суждения подходят для применения у людей и низших животных без чрезмерной токсичности, раздражения, аллергического ответа и тому подобного, которые хорошо известны в данной области техники. Соль может быть получена in situ во время окончательного выделения и очистки соединений по изобретению или отдельно реакцией фармацевтически активного вещества, имеющего свободное основание, с подходящей органической кислотой или неорганической кислотой. Дополнительно относится к фармацевтически приемлемым сольватам, включая гидраты, таких соединений и такой соли.
Термин «стабильность» или «стабильный», используемый в настоящем описании, включает как химическую стабильность, так и физическую/полиморфную стабильность настоящей фармацевтической композиции, включающей кеторолак или его фармацевтически приемлемую соль, где указанная композиция или указанный кеторолак остаются в пределах установленных раскрытий для поддержания своей идентичности, дозировки, качества и чистоты на протяжении всего периода хранения, повторного контроля или истечения срока годности и не меняется или разлагается из-за внутренней реакции или из-за воздействия кислорода, тепла, света, влаги или давления; и где лекарственное средство присутствует в количестве по меньшей мере от примерно 95% до примерно 100% от первоначально указанного количества и общей примеси не более чем примерно 1,0% в течение по меньшей мере примерно 3 месяцев при хранении при 25°C/60% относительной влажности (RH) или при 40°C/75% относительной влажности (RH).
Термин «боль», как используется в настоящем описании, относится к боли указанной в описании как острая боль, головная боль, гистаминовая боль, невропатическая боль, послеоперационную боль, хроническая боль в пояснице, невралгия при опоясывающем лишае, фантомная боль, центральная боль, зубная боль, нейропатическая боль, опиоидно-резистентная боль, висцеральная боль, хирургическая боль, боль при травмах костей, боль во время родов и родоразрешении, боль, вызванная ожогами, включая солнечные ожоги, послеродовая боль, боль при стенокардии и боль в области мочеполового тракта, включая цистит, боль при артрите, воспалении, остеоартрите, ювенильном ревматоидном артрите, анкилозирующем спондилоартрите и первичной дисменорее.
Термин «лечение боли», используемый здесь, относится к краткосрочному (≤ 5 дней) управлению умеренной, сильной, острой боли, которая требует эффекта обезболивания, обычно у послеоперационного пациента.
Термин «концентрация обезболивающего вещества» или «концентрация обезболивающего вещества в плазме», как используется здесь, относится к конкретной концентрации кеторолака в плазме, которая будет оказывать эффект обезболивания; и где указанная концентрация кеторолака составляет по меньшей мере около 370 нг/мл или выше.
Используемый здесь термин «Cp» означает концентрации в плазме.
Термин «частичная АUC» относится к площади в отношении концентрации вещества в плазме в зависимости от профиля времени в течение определенного периода времени, который представляет собой воздействие лекарственного средства в течении любого интервала времени, представляющего интерес, и рассчитывается по логарифмически линейному методу трапеций в отношении частичного интервала дозирования.
Термин «AUC» относится к площади в отношении концентрации вещества в плазме в зависимости от профиля времени, который рассчитывается логарифмически линейным методом трапеций в течение всего интервала дозирования.
Термин «Cmax» относится к самой высокой концентрации в плазме лекарственного средства, достигнутой в пределах интервала дозирования.
Термин «Tmax» относится к периоду времени, который истекает после введения единичной лекарственной формы, при которой концентрация лекарственного средства в плазме достигает самой высокой концентрации в плазме лекарственного средства, достигнутой в пределах интервала дозирования.
Используемый здесь термин «Тlag» относится к задержке по времени между введением композиции и первой наблюдаемой концентрацией лекарственного средства в плазме, которая находится в пределах предела количественной оценки.
Термин «коммерчески доступная композиция кеторолака», как используется в настоящем описании, относится к пероральным таблеткам KETOROL®, содержащим 10 мг кеторолака трометамина или его фармацевтических эквивалентов или его терапевтических эквивалентов или более поздних одобренных лекарств. Например, в некоторых вариантах осуществления изобретения, KETOROL® включает прессованную таблетку кеторолака трометамина, эквивалентную 5 мг или 10 мг основы кеторолака вместе с эксципиентами. В некоторых вариантах осуществления KETOROL® включает его одобренные терапевтические или фармацевтические эквиваленты. KETOROL® продается компанией Dr. Reddy's Laboratories, Ltd., Россия.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстро распадающейся композиции кеторолака или его фармацевтически приемлемой соли, причем указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества за менее, чем около 10 минут.
В аспекте вышеприведенного варианта осуществления, композиция настоящей заявки при пероральном введении обеспечивает концентрацию обезболивающего вещества по меньшей мере около 370 нг/мл за менее, чем около 10 минут.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, причем указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества по меньшей мере примерно 370 нг/мл за менее, чем около 10 минут.
В аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявке содержит кеторолак в количестве от около 5 мг до около 10 мг.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявке содержит кеторолак в количестве около 5 мг.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявке содержит кеторолак в количестве около 10 мг.
В некоторых вариантах осуществления изобретения, настоящая композиция настоящей заявки при пероральном введении человеку в условиях голода обеспечивает Тlag менее чем около 5 минут или менее чем около 4 минут или менее чем около 3 минут или меньше, чем около 2 минут или менее, чем около 1 минуты.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении показывает Tlag менее чем около 5 минут.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении показывает Tlag менее чем около 5 минут и обеспечивает концентрацию обезболивающего вещества за менее чем около 10 минут.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении показывает Tlag менее чем около 5 минут и обеспечивает концентрацию обезболивающего вещества по меньшей мере приблизительно 370 нг/мл за менее чем около 10 минут.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявке содержит, по меньшей мере, один водонерастворимый полимер.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявке содержит, по меньшей мере, один сахарный спирт.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества за менее чем около 10 минут.
В одном варианте осуществления настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт,
при этом указанная композиция при пероральном введении обеспечивает концентрацию обезболивающего вещества по меньшей мере приблизительно 370 нг/мл за менее чем около 10 минут.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении показывает Тlag менее чем около 5 минут.
В одном варианте осуществления настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении показывает Тlag менее чем около 5 минут и обеспечивает концентрацию обезболивающего вещества за менее чем около 10 минут.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(с) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении проявляет Тlag менее чем около 5 минут и обеспечивает концентрацию обезболивающего вещества по меньшей мере около 370 нг/мл за менее чем около 10 минут.
Быстро распадающаяся композиция кеторолака, раскрытая в настоящем описании, может иметь множество улучшенных фармакокинетических параметров. В некоторых вариантах осуществления композиция настоящей заявке может иметь улучшенный фармакокинетический параметр по сравнению с коммерчески доступной пероральной композицией кеторолака, такой как AUC0-5мин, AUC0-10мин, AUC0-20мин, AUC0-30мин или Tlag и т.д.
В аспекте вышеприведенных вариантов осуществления изобретения, композиция настоящей заявки при пероральном введении показывает по меньшей мере один из следующих фармакокинетических параметров:
(а) AUC0-5мин от около 2,64 нг.ч/мл до около 3,96 нг.ч/мл;
(b) AUC0-10мин от около 23,35 нг.ч/мл до около 35,03 нг.ч/мл;
(с) AUC0-20мин от около 128,20 нг.ч/мл до около 192,30 нг.ч/мл; или
(d) AUC0-30мин от около 297,99 нг.ч/мл до около 446,99 нг.ч/мл.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении имеет AUC0- 5 мин около от 2,64 нг.ч/мл до около 3,96 нг.ч/мл.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, при этом указанная композиция при пероральном введении показывает AUC0- 5мин примерно в 4,5 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении показывает AUC0- 10мин около от 23,35 нг.ч/мл до около 35,03 нг.ч/мл.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, при этом указанная композиция при пероральном введении показывает AUC0-10мин примерно в 2,6 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, при этом указанная композиция при пероральном введении показывает AUC0- 20мин от около 128,20 нг.ч/мл до около 192,30 нг.ч/мл.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении показывает AUC0-20мин примерно в 1,5 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении показывает AUC0- 30мин от около 297,99 нг.ч/мл до около 446,99 нг.ч/мл.
В одном варианте осуществления настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при пероральном введении показывает AUC0- 30мин примерно в 1,3 раза выше по сравнению с коммерчески доступной композицией кеторолака.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстро распадающейся композиции кеторолака, содержащей:
(a) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(c) по меньшей мере один сахарный спирт,
где указанная композиция при пероральном введении имеет по меньшей мере один из следующих фармакокинетических параметров:
(а) AUC0-5мин от около 2,64 нг.ч/мл до около 3,96 нг.ч/мл;
(b) AUC0-10мин от около 23,35 нг.ч/мл до около 35,03 нг.ч/мл;
(с) AUC0-20мин от около 128,20 нг.ч/мл до около 192,30 нг.ч/мл; или
(d) AUC0-30мин от около 297,99 нг.ч/мл до около 446,99 нг.ч/мл.
В аспекте вышеприведенных вариантов осуществления, композиция настоящей заявки при пероральном введении демонстрирует биоэквивалентность по отношению к коммерчески доступной композиции кеторолака при введении человеку в состоянии голода.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция при введении указанному пациенту в состоянии голода демонстрирует биоэквивалентность по отношению к коммерчески доступной композиции кеторолака.
В аспекте вышеуказанного варианта осуществления изобретения, композиция настоящей заявки при пероральном введении демонстрирует биоэквивалентность коммерчески доступной композиции кеторолака при введении субъектам человека в состоянии голода, при этом указанная биоэквивалентность определяется посредством: (a) 90% доверительного интервала для среднего значения Cmax, который находится в пределах от 80% до 125%, (b) 90% доверительного интервала для среднего значения AUC (0-t), который находится в пределах от 80% до 125% и (в) 90% доверительного интервала для среднего значения AUC(0-∞), который находится в пределах от 80% до 125%.
В одном варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(a) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(c) по меньшей мере один сахарный спирт,
при этом указанная композиция проявляет биоэквивалентность по отношению к коммерчески доступной композиции кеторолака при введении субъектам человека в состоянии голода.
В другом варианте осуществления изобретения, настоящая заявка относится к способу лечения боли у пациента, нуждающегося в этом, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(c) по меньшей мере один сахарный спирт,
где указанная композиция проявляет биоэквивалентность по отношению к коммерчески доступной композиции кеторолака при введении субъектам человека в состоянии голода, указанная биоэквивалентность определяется посредством: (a) 90% доверительного интервала для среднего значения Cmax, который находится в пределах от 80% до 125%, (b) 90% доверительного интервала для среднего значения AUC(0-t), который находится в пределах от 80% до 125% и (в) 90% доверительного интервала для среднего значения AUC(0-∞), который находится в пределах от 80% до 125%.
В аспекте вышеуказанных вариантов осуществления композиция настоящей заявки содержит кеторолак в количестве от около 5 мг до около 10 мг.
В другом аспекте вышеуказанных вариантов осуществления композиция по настоящему изобретению содержит кеторолак в количестве около 5 мг.
В другом аспекте вышеуказанных вариантов осуществления композиция по настоящему изобретению содержит кеторолак в количестве около 10 мг.
В аспекте вышеприведенных вариантов осуществления настоящего изобретения, настоящий способ лечения боли у пациента, нуждающегося в этом, включает в себя введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция расщепляется за менее, чем около 30 секунд при помещении в полость рта.
В аспекте вышеприведенных вариантов осуществления настоящего изобретения, настоящий способ лечения боли у нуждающегося в этом пациента включает в себя введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция расщепляется за менее, чем около 15 секунд, около 20 секунд, около 25 секунд или около 30 секунд при помещении в полость рта.
В одном варианте осуществления настоящая заявка относится к способу лечения боли у нуждающегося в этом пациента, включающему введение пациенту быстрораспадающейся композиции кеторолака, содержащей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(c) по меньшей мере один сахарный спирт,
где указанная композиция расщепляется за менее чем около 30 секунд при помещении в полость рта.
В аспекте вышеприведенных вариантов осуществления настоящего изобретения способ лечения боли у нуждающегося в этом пациента включает в себя введение пациенту быстрораспадающейся композиции кеторолака или его фармацевтически приемлемой соли, где указанная композиция находится в форме таблеток, пастилок, каплет, пилюль, капсул, пленок, порошков, гранул или саше.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт.
В еще одном варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(с) один или несколько фармацевтически приемлемых эксципиентов.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(с) один или несколько фармацевтически приемлемых эксципиентов,
где указанная композиция содержит кеторолак в количестве от около 5 мг до около 10 мг.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(с) один или несколько фармацевтически приемлемых эксципиентов,
где указанная композиция содержит кеторолак в количестве около 5 мг.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(с) один или несколько фармацевтически приемлемых эксципиентов,
где указанная композиция содержит кеторолак в количестве около 10 мг.
В другом варианте осуществления настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция распадается за менее, чем за около 30 секунд при помещении в полость рта.
В аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит водонерастворимый полимер и сахарный спирт в массовом соотношении от 1,0: 1,0 до 1,5: 1,0.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(c) один или несколько фармацевтически приемлемых эксципиентов,
где указанный водонерастворимый полимер и указанный сахарный спирт присутствуют в массовом отношении от около 1,0: 1,0 до около 1,5: 1,0.
В другом аспекте вышеуказанных вариантов осуществления изобретения, композиция настоящей заявки содержит кеторолак и сахарный спирт в массовом соотношении от около 0,3: 1,0 до около 1,0: 1,0.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(c) один или несколько фармацевтически приемлемых эксципиентов,
где указанный кеторолак и указанный сахарный спирт присутствуют в массовом отношении от около 0,3: 1,0 до около 1,0: 1,0.
В одном варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(c) один или несколько фармацевтически приемлемых эксципиентов,
где указанная композиция высвобождает по меньшей мере около 80% кеторолака в течение около 5 минут при измерении в 600 мл искусственного желудочного сока (рН 1,2), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартами USP.
В одном варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(c) один или несколько фармацевтически приемлемых эксципиентов,
где указанная композиция высвобождает по меньшей мере около 90% кеторолака в течение около 5 минут при измерении в 600 мл ацетатного буфера (pH 4,5), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартами USP.
В одном варианте осуществления изобретения, настоящая заявка относится к быстро распадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(с) один или несколько фармацевтически приемлемых эксципиентов,
где указанная композиция высвобождает по меньшей мере около 95% кеторолака в течение около 5 минут при измерении в 600 мл фосфатного буфера (рН 6,8), и/или очищенной воды при 50 об/мин и при 37°С, с использованием аппарата типа II в соответствии со стандартами USP.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(c) один или несколько фармацевтически приемлемых эксципиентов,
где указанная композиция проявляет по меньшей мере один из следующих профилей высвобождения in vitro:
i. высвобождается по меньшей мере около 80% кеторолака в течение около 5 минут при измерении в 600 мл искусственного желудочного сока (рН 1,2), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом USP;
ii. высвобождается по меньшей мере около 90% кеторолака в течение около 5 минут при измерении в 600 мл ацетатного буфера (pH 4,5), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом USP; или
iii. высвобождается по меньшей мере около 95% кеторолака в течение около 5 минут при измерении в 600 мл фосфатного буфера (рН 6,8), и/или очищенной воды при 50 об/мин и при 37°С, с использованием аппарата типа II в соответствии со стандартом USP.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(c) один или несколько фармацевтически приемлемых эксципиентов,
где указанный водонерастворимый полимер и указанный сахарный спирт присутствуют в массовом отношении от около 1,0: 1,0 до около 1,5: 1,0, и указанная композиция демонстрирует по меньшей мере один из следующих профилей высвобождения in-vitro:
i. высвобождается по меньшей мере около 80% кеторолака в течение около 5 минут при измерении в 600 мл искусственного желудочного сока (рН 1,2), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом USP;
ii. высвобождается по меньшей мере около 90% кеторолака в течение около 5 минут при измерении в 600 мл ацетатного буфера (pH 4,5), при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом USP; или
iii. высвобождается по меньшей мере около 95% кеторолака в течение около 5 минут при измерении в 600 мл фосфатного буфера (рН 6,8), и/или очищенной воды при 50 об/мин и при 37°С, с использованием аппарата типа II в соответствии со стандартом USP.
В другом варианте осуществления изобретения, настоящая заявка относится к быстрораспадающейся пероральной композиции кеторолака, содержащей:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер,
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт, и
(c) один или несколько фармацевтически приемлемых эксципиентов,
где указанный кеторолак и указанный сахарный спирт присутствуют в массовом отношении от около 0,3: 1,0 до около 1,0: 1,0, и указанная композиция демонстрирует по меньшей мере один из следующих профилей высвобождения in-vitro:
i. высвобождается по меньшей мере около 80% кеторолака в течение около 5 минут при измерении в 600 мл искусственного желудочного сока, рН 1,2, при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом USP;
ii. высвобождается по меньшей мере около 90% кеторолака в течение около 5 минут при измерении в 600 мл ацетатного буфера, pH 4,5, при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом USP; или
iii. высвобождается по меньшей мере около 95% кеторолака в течение около 5 минут при измерении в 600 мл фосфатного буфера, рН 6,8, и/или очищенной воды при 50 об/мин и при 37°С, с использованием аппарата типа II в соответствии со стандартом USP.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит по меньшей мере один водонерастворимый полимер во внутригранулярной части.
Водонерастворимый полимер может присутствовать в композиции, раскрытой в настоящем описании, в различных концентрациях. Например, быстро распадающаяся пероральная композиция, раскрытая в настоящем описании, может содержать водонерастворимый полимер в количестве по меньшей мере 30% по массе, по меньшей мере 35% по массе, по меньшей мере 40% по массе, по меньшей мере 45% массе, по меньшей мере 50% по массе, по меньшей мере 55% по массе, по меньшей мере 60% по массе или процент между любыми двумя из вышеуказанных значений в расчете на общую массу композиции.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся композиция для перорального введения кеторолака настоящей заявки включает по меньшей мере один водонерастворимый полимер в количестве от около 30% до около 60% по массе, или от около 30 до около 55% по массе, или от около 30 до около 50% по массе, или от около 30 до около 45% по массе, или от около 30 до около 40% по массе, или от около 30% до около 35% по массе, в расчете на общую массу композиции.
Подходящие примеры водонерастворимого полимера, используемые в настоящей заявке, включают, но не ограничиваются ими, микрокристаллическую целлюлозу, этилцеллюлозу, сшитый поливинилпирролидон, сшитую натрийкарбоксиметилцеллюлозу, сшитый декстран и тому подобное или их смеси.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит по меньшей мере один сахарный спирт в экстрагранулярной части. Сахарный спирт, присутствующий в экстрагранулярной части, помогает избежать проблемы прилипания в процессе гранулирования, а также помогает достичь желаемого распада/растворения препарата в полости рта.
Сахарный спирт может присутствовать в композиции, раскрытой в настоящем описании, в различных концентрациях. Например, быстрораспадающаяся пероральная композиция, раскрытая в настоящем описании, может содержать сахарный спирт по меньшей мере 20% по массе, по меньшей мере 25% по массе, по меньшей мере 30% по массе, по меньшей мере 35% по массе, по меньшей мере 40% по массе, по меньшей мере 45% по массе, по меньшей мере 50% по массе, или процент между любыми двумя из вышеуказанных значений в расчете на общую массу композиции.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция кеторолака настоящей заявки содержит по меньшей мере один сахарный спирт в количестве от около 20% до около 50% по массе, или от около 20 до около 45% по массе, или от около 20 до около 40% по массе, или от около 20 до около 35% по массе, или от около 20 до около 30% по массе, или от около 20 до около 25% по массе в расчете на общую массу композиции.
Подходящие примеры сахарного спирта, используемые в настоящей заявке, включают, но не ограничиваются ими, маннит, мальтит, сорбит, ксилит, лактит, эритрит, изомальт, треит и тому подобное или их смеси.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция кеторолака настоящей заявки содержит по меньшей мере один стабилизатор, выбранный из выбранных из нерастворимых в воде антиоксидантов, модификаторов рН или их смесей.
Стабилизатор может присутствовать в композиции, раскрытой в настоящем описании, в различных концентрациях. Например, быстро распадающаяся пероральная композиция, раскрытая в настоящем описании, может содержать стабилизатор по меньшей мере 0,05% по массе, по меньшей мере 0,06% по массе, по меньшей мере 0,07% по массе, по меньшей мере 0,08% по массе, по меньшей мере 0,09% по массе, по меньшей мере 0,1% по массе или процент между любыми двумя из вышеуказанных значений в расчете на общую массу композиции. Количество стабилизатора, которое может быть использовано в настоящей заявке, составляет от около 0,05% до около 1,0% по массе композиции.
Подходящие примеры нерастворимых в воде антиоксидантов, используемых в качестве стабилизатора в настоящей заявке, включают, но не ограничиваются ими, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT) или их смеси.
Подходящие примеры модификаторов рН, используемых в качестве стабилизатора в настоящей заявке, включают, но не ограничиваются ими, лимонную кислоту, винную кислоту, малеиновую кислоту, фумаровую кислоту, янтарную кислоту, малеиновую кислоту, меглюмин, гидроксид натрия, гидроксид калия, буферные вещества, такие как фосфатный буфер, ацетатный буфер, боратный буфер или их смеси.
Фармацевтическая композиция настоящей заявки дополнительно содержит фармацевтически приемлемые эксципиенты, выбранные из группы разбавителей, смазывающих веществ, скользящих веществ (глидантов), подсластителей, растворителей, таких как неводный растворитель, включает, но не ограничивается ими, различные органические растворители, например, низшие спирты, такие как метанол и этанол, изопропиловый спирт, кетоны, такие как ацетон и метилэтилкетон, метиленхлорид и тому подобное.
Другими подходящими фармацевтически приемлемыми эксципиентами, которые могут быть использованы для приготовления настоящей быстрораспадающейся композиции для полости рта, являются любые эксципиенты, известные специалисту в данной области, и описаны в Handook of Pharmaceutical Excipients, American Pharmaceutical Association (1986 год), включенной в настояшее описание в качестве ссылки.
В одном варианте осуществления изобретения, фармацевтическая композиция настоящей заявки стабильна в течении по меньшей мере около 3 месяцев при хранении в условиях 25°C/60% относительной влажности (RH).
В одном варианте осуществления изобретения, фармацевтическая композиция настоящей заявки стабильна в течении по меньшей мере около 3 месяцев при хранении в условиях 40°C/75% относительной влажности (RH).
В другом варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 25°C/60% относительной влажности (RH).
В другом варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 40°C/75% относительной влажности (RH).
В другом варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 25°C/60% относительной влажности (RH).
В другом варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 40°C/75% относительной влажности (RH).
В еще одном варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 25°C/60% относительной влажности (RH) и образуется менее, чем 0,5% от общего количества примесей.
В еще одном варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образуется менее, чем 0,5% от общего количества примесей.
В еще одном варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 25°C/60% относительной влажности (RH) и образуется менее, чем 1,0% от общего количества примесей.
В еще одном варианте осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образуется менее, чем 1,0% от общего количества примесей.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
причем указанная композиция стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 25°C/60% относительной влажности (RH).
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
причем указанная композиция стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 40°C/75% относительной влажности (RH).
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
причем указанная композиция стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 25°C/60% относительной влажности (RH) и образуется менее чем 0,5% от общего количества примесей.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образует менее 0,5% от общего количества примесей.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
причем указанная композиция стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 25°C/60% относительной влажности (RH) и образует менее чем 1,0% от общего количества примесей.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
причем указанная композиция стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образует менее 1,0% от общего количества примесей.
В аспекте вышеприведенных вариантов осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки может быть упакована в любой подходящий упаковочный материал, известный в данной области, который может обеспечить стабильность указанной композиции и кеторолаку или его фармацевтически приемлемой соли во время хранения, транзита и введения.
В аспекте вышеуказанных вариантов осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки может быть упакована с использованием подходящих упаковочных материалов, выбранных из контейнера из полиэтилена высокой плотности (HDPE), алюминиевой (Alu-Alu) блистерной упаковки, алюминиевой блистерной упаковки с влагопоглотителем (Alu-Des-Alu) или поливинилхлорид - поливинилиденхлоридной (PVC-PVdC) блистерной упаковки и подобных материалов.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция упакована с использованием блистерной упаковки из алюминия с влагопоглотителем (Alu-Des-Alu), и указанная композиция стабильна в течение по меньшей мере около 3 месяцев при хранении в условиях 25°C/60% относительной влажности (RH) и образует менее, чем 0,5% от общего количества примесей.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция упакована с использованием блистерной упаковки из алюминия с влагопоглотителем (Alu-Des-Alu), и указанная композиция стабильна в течение по меньшей мере примерно 3 месяцев при хранении в условиях 40 °C/75% относительной влажности (RH) и образует менее, чем 0,5% от общего количества примесей.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(с) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(d) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция упакована с использованием блистерной упаковки из алюминия с влагопоглотителем (Alu-Des-Alu), и указанная композиция стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 25°C/60% относительной влажности (RH) и образует менее, чем 1,0% от общего количества примесей.
В некоторых вариантах осуществления изобретения, быстрораспадающаяся пероральная композиция настоящей заявки содержит:
(а) внутригранулярную часть, содержащую терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере одного водонерастворимого полимера и
(b) экстрагранулярную часть, содержащую по меньшей мере один сахарный спирт,
где указанная композиция упакована с использованием блистерной упаковки из алюминия с влагопоглотителем (Alu-Des-Alu), и указанная композиция стабильна в течение по меньшей мере около 6 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образует менее, чем 1,0% от общего количества примесей.
В одном варианте осуществления изобретения, настоящая заявка относится к способу получения быстрораспадающейся пероральной композиции, содержащей кеторолак или его фармацевтически приемлемую соль, которая включает любой способ, известный специалисту в данной области, такой как, но не ограничиваясь ими, распыление суспензии или дисперсии лекарственного средства в обычной установке для нанесения оболочки на таблетки или оборудовании с псевдоожиженным слоем (таком как Wurster или Glatt) для приготовления гранул, содержащих лекарственное средство, с последующим высушиванием гранул при достижении желаемого размера гранул. Приготовленные таким образом гранулы, содержащие лекарственное средство могут быть смешаны с экстрагранулярным материалом, включая сахарный спирт, чтобы приготовить желаемую фармацевтическую композицию.
Для получения гранул может быть использован любой способ, известный специалисту в данной области, такой как, но не ограничиваясь ими, операции, как смешивание, способы гранулирования с использованием планетарного смесителя, винтового смесителя и тому подобное; высокоскоростные способы смешивания и гранулирования с использованием смесителя Henschel, смесителя Super и тому подобного; способы гранулирования экструзией с использованием цилиндрического гранулятора, роторного гранулятора, экструзионного шнекового гранулятора, гранулятора типа пресс-гранулятора и тому подобного; способы влажного гранулирования с высоким сдвигом, способы гранулирования с псевдоожиженным слоем, способы гранулирования c прессованием, методы гранулирования измельчения и способы гранулирования распылением.
Как только процесс гранулирования выполнен, операция сушки может быть выполнена с использованием сушильной печи, сушилки с псевдоожиженным слоем и т.п.; после сушки могут быть проведены дробление и просеивание для получения гранул или мелких гранул для использования.
Подходящее оборудование для обработки фармацевтических композиций настоящей заявки включает, но не ограничивается ими, механические просеиватели, блендеры, роликовые прессы, грануляторы (высокоскоростной смеситель-гранулятор или гранулятор с псевдоожиженным слоем), сушилки с псевдоожиженным слоем, таблеточные прессы, вращающиеся чаши или установки для нанесения оболочки, или комбинации различного оборудования.
В аспекте вышеприведенных вариантов осуществления изобретения, настоящая заявка относится к способу получения быстрораспадающейся пероральной композиции кеторолака, содержащему стадии:
(а) получение смеси терапевтически эффективного количества кеторолака и по меньшей мере одного водонерастворимого полимера;
(b) гранулирование смеси со стадии (а) с требуемым количеством стабилизатора;
(с) сушку гранул со стадии (b) с последующим смешиванием с экстрагранулированным материалом, содержащим по меньшей мере один сахарный спирт; а также
(d) формование смеси со стадии (с) в желаемую композицию.
В другом аспекте вышеприведенных вариантов осуществления изобретения, настоящая заявка относится к способу получения быстрораспадающейся пероральной композиции кеторолака, содержащему стадии:
(а) получение смеси терапевтически эффективного количества кеторолака и по меньшей мере одного водонерастворимого полимера;
(b) гранулирование смеси со стадии (а) с требуемым количеством стабилизатора;
(с) сушку гранул со стадии (b) с последующим смешиванием с экстрагранулированным материалом, содержащим по меньшей мере один сахарный спирт; а также
(d) формование смеси со стадии (с) в желаемую композицию
где указанный водонерастворимый полимер и сахарный спирт присутствуют в массовом соотношении от около 1,0: 1,0 до около 1,5: 1,0.
В другом аспекте вышеприведенных вариантов осуществления изобретения, настоящая заявка относится к способу получения быстрораспадающейся пероральной композиции кеторолака, содержащему стадии:
(а) получение смеси терапевтически эффективного количества кеторолака и по меньшей мере одного водонерастворимого полимера;
(b) гранулирование смеси со стадии (а) с требуемым количеством стабилизатора;
(с) сушку гранул со стадии (b) с последующим смешиванием с экстрагранулированным материалом, содержащим по меньшей мере один сахарный спирт; а также
(d) формование смеси со стадии (с) в желаемую композицию
где указанный кеторолак и сахарный спирт присутствуют в массовом отношении от около 0,3: 1,0 до около 1,0: 1,0.
В аспекте вышеприведенных вариантов осуществления изобретения, способ получения быстрораспадающейся композиции кеторолака включает нанесение/распыление стабилизатора над гранулами с использованием, по меньшей мере, одного неводного растворителя.
В аспекте вышеуказанных вариантов осуществления изобретения, настоящая быстрораспадающаяся композиция кеторолака может быть приготовлена в виде таблеток, пастилок, каплет, пилюль, капсул, пленок, порошков, гранул или саше.
В аспекте вышеприведенных вариантов осуществления изобретения, быстрораспадающаяся пероральная композиция кеторолака составлена в виде композиции, замаскированной по вкусу, чтобы замаскировать горький вкус кеторолака и обладать улучшенным вкусом, вкусовым качеством и соблюдать пациентами прием.
В аспекте вышеприведенных вариантов осуществления изобретения, быстрораспадающаяся пероральная композиция кеторолака может вводиться с глотком воды или без нее.
В еще одном аспекте вышеуказанных вариантов осуществления изобретения, настоящая быстрораспадающаяся пероральная композиция кеторолака также может совместно вводиться (одновременно или последовательно) с одним или несколькими фармацевтическими агентами, имеющими ценность при лечении боли или связанных с этим заболеваний.
Быстрораспадающаяся пероральная композиция кеторолака может вводиться для лечения острой боли, включающей короткий срок (≤ 5 дней), лечение умеренной и тяжелой острой боли, которая требует обезболивания на уровне опиоидов, или, как рекомендовано квалифицированным врачом.
Настоящая заявка дополнительно иллюстрируется примерами, которые приведены просто для примера фармацевтической композиции, описанной выше, и не ограничивают объем применения. Определенные модификации и эквиваленты будут очевидны для специалистов в данной области техники и предназначены для включения в объем настоящей заявки.
ПРИМЕРЫ
Примеры 1-3
Фармацевтическая композиция, содержащая кеторолак или его фармацевтически приемлемую соль, может быть приготовлена, как приведено в таблице 1.
Таблица 1
q.s. - сколько потребуется
Процедура:
(а) Кеторолака трометамин и другие внутригранулярные материалы смешивали и гранулировали с использованием очищенной воды.
(b) Гранулы, полученные на стадии (а), сушили.
(с) Раствор бутилированного гидроксианизола (BHA) готовили в изопропиловом спирте и распыляли на высушенные гранулы со стадии (b).
(d) Гранулы, полученные на стадии (с), сушили, просеивали и измельчали до получения желаемого размера.
(е) Экстрагранулярные материалы просеивали и смешивали с гранулами, полученными на стадии (d), и смесь прессовали в таблетки.
Пример 4
Фармакокинетические параметры для быстрораспадающейся пероральной композиции, полученные в примере 1, содержащие 10 мг кеторолака, изучали по сравнению с таблетками для перорального приема KETOROL® 10 мг. Рандомизированное открытое наблюдение, при однократном введение препарата, с двумя схемами, в два периода, в двух последовательностях, перекрестным исптанием, сравнительная биодоступность была выполнена путем введения однократной дозы композиции для перорального введения из примера 1 (содержащей кеторолак 10 мг) и таблетки KETOROL® 10 мг перорально (Dr. Reddy's Laboratories Ltd, Россия) 18 здоровым, взрослым, мужским субъектам в условиях голода. Результаты различных фармакокинетических данных показаны в таблицах 2, 3, 4 и на фигуре 1.
Таблица 2: Среднее значение частичной AUCs
(нг.ч/мл)
(10 mg)
Таблица 3: Сравнительные величины Tlag
Таблица 4: Фармакокинетические параметры
CI: Доверительный интервал
Из таблицы 2 (данные среднего значение частичной AUCs), очевидно, что иллюстративная композиция настоящей заявки, которая указана в примере 1, содержащая 10 мг кеторолака, имеет лучший фармакокинетический профиль по сравнению с таблетками для перорального приема KETOROL® 10 мг.
Из таблицы 3 (Tlag) видно, что иллюстративная композиция настоящей заявки, которая указана в примере 1, содержащая 10 мг кеторолака, имеет Tlag менее 5 минут по сравнению с таблетками для перорального приема KETOROL® 10 мг.
Из таблицы 4 (фармакокинетические параметры) очевидно, что иллюстративная композиция настоящей заявки, которая указана в примере 1, содержащая 10 мг кеторолака, является биоэквивалентной по отношению к коммерчески доступной композиции кеторолака, то есть таблеткам KETOROL® 10 мг.
Из фиг. 1, очевидно, что иллюстративная композиция настоящей заявки, которая указана в примере 1, содержащая 10 мг кеторолака, достигает минимальной эффективной концентрации (MEC) или концентрации обезболивающего вещества около 370 нг/мл, примерно за 8,5 минут (0,14 часа) по сравнению с 12 минутами (0,20 ч) пероральных таблеток KETOROL® 10 мг.
Пример 5
Фармацевтические композиции, полученные в примерах 1, 2 и 3, подвергали исследованию на распадаемость по сравнению с KETOROL® (10 мг). Результаты показаны в таблице 5.
Таблица 5: Сравнительное время распадаемости
Пример 6
Фармацевтическую композицию, полученную в примере 1, подвергали исследованиям на растворение в различных средах, таких как очищенная вода, искусственный желудочный сок (рН 1,2), ацетатный буфер (рН 4,5) и фосфатный буфер (рН 6,8). Исследование проводили с использованием 600 мл среды при 50 об/мин при 37°С с использованием аппарата типа II согласно стандартам USP. Результаты растворения по сравнению с KETOROL® (10 мг) приведены в таблице 7.
Пример 7
Фармацевтическую композицию, полученную в примере 1, изучали для воздействия различных упаковочных материалов. Композицию примера 1 упаковывают с использованием блистеров Alu-Alu и Alu-Des-Alu в качестве упаковочных материалов, а упакованные композиции подвергают испытанию на ускоренную стабильность в течение 6 месяцев в условиях хранения при 40°C/75% относительной влажности. В конце 6 месяцев композиции были испытаны для различных параметров, и результаты показаны в таблице 8.
Таблица 8
Alu-Alu: Алюминиевый (Aluminum-Aluminum); Alu-Des-Alu:Алюминиевый с влагопоглотителем ( Aluminum-Desiccant-Aluminum)
Пример 8
Фармацевтические композиции, полученные в примере 1 и 2, содержащие различную концентрацию антиоксиданта, изучали по своему эффекту во время стабильности. Ускоренное исследование стабильности проводили в течение 3 месяцев в условиях хранения при 40°C/75% относительной влажности с использованием алюминиевого блистера с влагопоглотителем (Alu-Desiccant Alu). Результаты показаны в таблице 9.
Таблица 9
M: Месяц, ND: Не определено
Хотя было продемонстрировано и описано несколько конкретных форм заявки, будет очевидно, что различные модификации и комбинации заявки, подробно описанные в тексте, могут быть сделаны без отклонения от сущности и объема приложения.
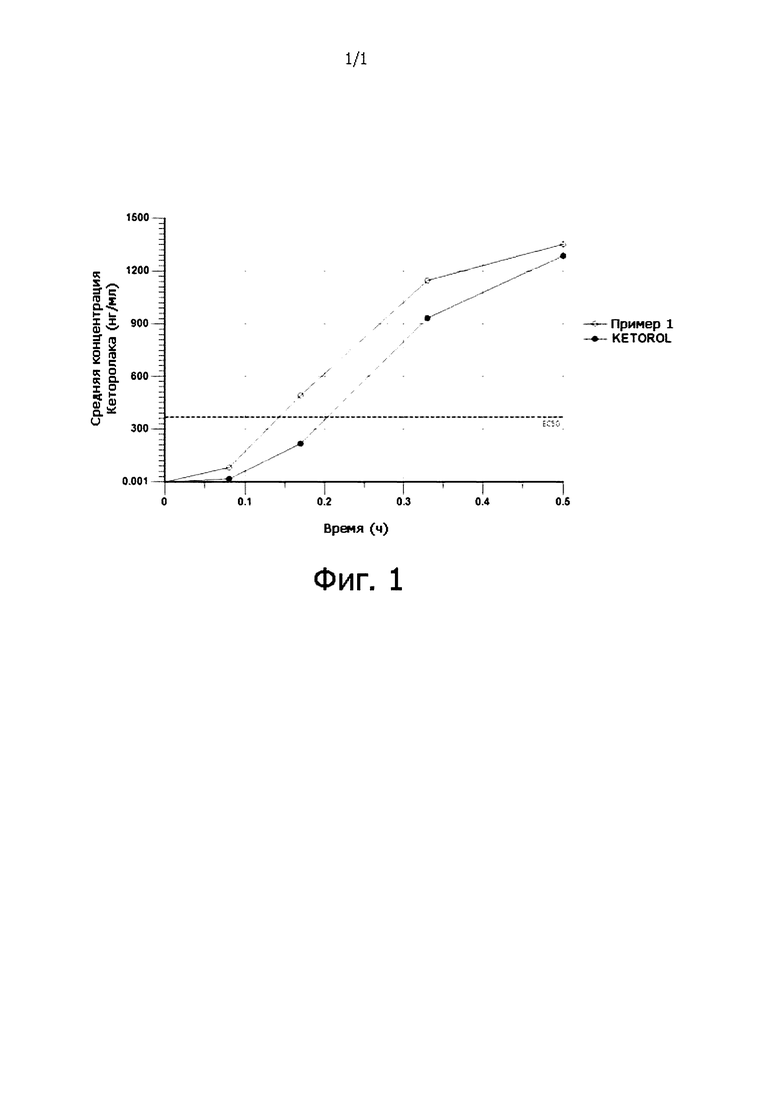
Изобретение относится к медицине, в частности к быстрораспадающейся пероральной композиции кеторолака и способу лечения боли быстрораспадающейся композицией. Быстрораспадающаяся композиция содержит эффективное количество кеторолака, водонерастворимый полимер и сахарный спирт в количестве от 20% до 50% от веса композиции. Способ лечения боли включает введение быстрораспадающейся композиции пациенту, при этом композиция обеспечивает в плазме концентрацию обезболивающего вещества около 370 нг/мл за менее 10 мин. Осуществление изобретения позволит получить композицию, обеспечивающую эффективное лечение боли, быстрое начало действия и высокий показатель кеторолака в начальный момент времени, при минимальной эффективной концентрации. 2 н. и 26 з.п. ф-лы, 1 ил., 8 табл., 8 пр.
1. Способ лечения боли у пациента, нуждающегося в этом, включающий введение пациенту быстрораспадающейся композиции кеторолака, включающей:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли,
(b) по меньшей мере один водонерастворимый полимер и
(c) по меньшей мере один сахарный спирт в количестве от 20% до 50% от веса композиции,
где указанная композиция при пероральном введении обеспечивает в плазме концентрацию по меньшей мере около 370 нг/мл обезболивающего вещества за менее чем около10 минут.
2. Способ по п.1, в котором указанную композицию вводят в количестве от около 5 мг до около 10 мг кеторолака.
3. Способ по п.1, в котором указанную композицию вводят в количестве около 10 мг кеторолака.
4. Способ по п.1, в котором указанная композиция при пероральном введении в состоянии голода показывает по меньшей мере один из следующих фармакокинетических параметров:
(а) AUC0-5мин от около 2,64 нг.ч/мл до около 3,96 нг.ч/мл;
(b) AUC0-10мин от около 23,35 нг.ч/мл до около 35,03 нг.ч/мл;
(с) AUC0-20мин от около 128,20 нг.ч/мл до около 192,30 нг.ч/мл; или
(d) AUC0-30мин от около 297,99 нг.ч/мл до около 446,99 нг.ч/мл; или
(е) Тlag менее чем около 5 минут.
5. Способ по п.3, в котором указанная композиция при пероральном введении показывает AUC0-5мин примерно в 4,5 раза выше по сравнению с коммерчески доступными таблетками для перорального введения KETOROL®.
6. Способ по п.3, в котором указанная композиция при пероральном введении показывает AUC0-10мин примерно в 2,6 раза выше по сравнению с коммерчески доступными таблетками для перорального введения KETOROL®.
7. Способ по п.3, в котором указанная композиция при пероральном введении показывает AUC0-20мин примерно в 1,5 раза выше по сравнению с коммерчески доступными таблетками для перорального введения KETOROL®.
8. Способ по п.3, в котором указанная композиция при пероральном введении показывает AUC0-30мин примерно в 1,3 раза выше по сравнению с коммерчески доступными таблетками для перорального введения KETOROL®.
9. Способ по п.1, в котором указанная композиция проявляет биоэквивалентность по отношению к коммерчески доступной композиции кеторолака при введении субъектам человека в состоянии голода, причем указанная биоэквивалентность определяется посредством: (a) 90% доверительного интервала для среднего значения Cmax, который находится в пределах от 80% до 125%, (b) 90% доверительного интервала для среднего значения AUC(0-t), который находится в пределах от 80% до 125%, и (в) 90% доверительного интервала для среднего значения AUC(0-∞), который находится в пределах от 80% до 125%.
10. Способ по п.1, в котором указанная композиция содержит водонерастворимый полимер и сахарный спирт в массовом соотношении от 1,0:1,0 до около 1,5:1,0.
11. Способ по п.10, в котором композиция содержит кеторолак и сахарный спирт в массовом соотношении от около 0,3:1,0 до около 1,0:1,0.
12. Способ по п.1, в котором указанный водонерастворимый полимер присутствует в количестве от около 30% до около 60% по массе композиции.
13. Способ по п.1, в котором указанная композиция находится в форме таблеток, пастилок, каплет, пилюль, капсул, пленок, порошков, гранул или саше.
14. Быстрораспадающаяся пероральная композиция кеторолака для лечения боли, содержащая:
(а) терапевтически эффективное количество кеторолака или его фармацевтически приемлемой соли и по меньшей мере один водонерастворимый полимер и
(b) по меньшей мере один сахарный спирт в количестве от 20% до 50% от веса композиции,
где указанная композиция распадается за менее чем около 30 секунд при помещении в полость рта.
15. Композиция по п.14, которая демонстрирует по меньшей мере один из следующих профилей высвобождения in vitro:
i. высвобождается по меньшей мере около 80% кеторолака в течение примерно 5 минут при измерении в 600 мл искусственного желудочного сока (рН 1,2) при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP);
ii. высвобождается по меньшей мере около 90% кеторолака в течение около 5 минут при измерении в 600 мл ацетатного буфера (pH 4,5) при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP); или
iii. высвобождается по меньшей мере около 95% кеторолака в течение около 5 минут при измерении в 600 мл фосфатного буфера (рН 6,8) и/или очищенной воды при 50 об/мин и при 37°С с использованием аппарата типа II в соответствии со стандартом фармакопеи США (USP).
16. Композиция по п.14, которая содержит кеторолак в количестве от около 5 мг до около 10 мг.
17. Композиция по п.14, в которой указанный водонерастворимый полимер и сахарный спирт присутствуют в массовом соотношении от около 1,0:1,0 до около 1,5:1,0.
18. Композиция по п.14, в которой указанный кеторолак и сахарный спирт присутствуют в массовом соотношении от около 0,3:1,0 до около 1,0:1,0.
19. Композиция по п.14, в которой указанный водонерастворимый полимер присутствует в количестве от около 30% до около 60% по массе композиции.
20. Композиция по п.14, в которой указанный водонерастворимый полимер выбран из группы, включающей микрокристаллическую целлюлозу, этилцеллюлозу, сшитый поливинилпирролидон, сшитую натрийкарбоксиметилцеллюлозу, сшитый декстран или их смеси.
21. Композиция по п.14, в которой указанный сахарный спирт присутствует в количестве от около 20% до около 50% по массе композиции.
22. Композиция по п.14, в которой указанный сахарный спирт выбран из группы, включающей маннит, сорбит, мальтит, сорбит, ксилит, лактит, эритрит, изомальт, треитол или их смеси.
23. Композиция по п.14, в которой указанная композиция дополнительно содержит стабилизатор, выбранный из водонерастворимых антиоксидантов, модификаторов рН или их смесей.
24. Композиция по п.23, в которой указанные водонерастворимые антиоксиданты выбраны из группы, включающей бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT) или их смеси.
25. Композиция по п.23, в которой указанные модификаторы рН выбраны из группы, включающей лимонную кислоту, винную кислоту, малеиновую кислоту, фумаровую кислоту, янтарную кислоту, малеиновую кислоту, меглюмин, гидроксид натрия, гидроксид калия, бикарбонат натрия, буферные агенты, такие как фосфатный буфер, ацетатный буфер, боратный буфер или их смеси.
26. Композиция по п.14, в которой указанная композиция стабильна в течение по меньшей мере примерно 3 месяцев при хранении в условиях 40°C/75% относительной влажности (RH) и образует менее чем 0,5% от общего количества примесей.
27. Композиция по п.14, которая стабильна в течение по меньшей мере примерно 6 месяцев при хранении в условиях 40°C/75% при относительной влажности (RH) и образует менее чем 1,0% от общего количества примесей.
28. Композиция по п.14, которая находится в форме таблеток, пастилок, каплет, пилюль, капсул, пленок, порошков, гранул или саше.
| US 7879901 B2, 01.02.201 | |||
| EP 3028698 A1, 08.06.2016 | |||
| US 2010278921 A1, 04.11.2010 | |||
| НОВЫЕ ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ МИРТАЗАПИНА ДЛЯ ПРИМЕНЕНИЯ ПРИ БОЛЕВЫХ РАССТРОЙСТВАХ | 2013 |
|
RU2509560C1 |
Авторы
Даты
2019-01-18—Публикация
2017-07-31—Подача