Настоящее изобретение относится к соединениям общей формулы
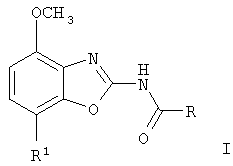
где
R обозначает фенил, незамещенный или замещенный галогеном или -СН2Н(СН3)(СН3)nОСН3, или обозначает бензил, низший алкил, низшую алкокси-группу, -(СН2)nОСН3, или обозначает пиридин-3- или -4-ил, незамещенный или замещенный низшим алкилом, галогеном, морфолинилом, -(СН2)n-галогеном, -(СН2)nОСН3, -(СН2)n-морфолин-4-ил, или -(СН2)n-пирролидин-1-ил;
R1 обозначает фенил, незамещенный или замещенный галогеном тетрагидропиран-4-ил, 3,6-дигидро-2H-пиран-4-ил или морфолин-4-ил;
n обозначает независимо друг от друга 1 или 2;
и к их фармацевтически приемлемым кислотно-аддитивным солям.
Неожиданно было найдено, что соединения общей формулы I являются лигандами рецептора аденозина. В частности, соединения согласно настоящему изобретению обладают хорошим сродством к А2A-рецептору и высокой селективностью по отношению к A1- и А3-рецепторам.
Аденозин моделирует широкую область физиологических функций посредством взаимодействия со специфическими поверхностными рецепторами клеток. Обзор потенциальных возможностей рецепторов аденозина в качестве лекарственных мишеней впервые был опубликован в 1982 г. Аденозин как структурно, так и метаболически относится к биоактивным нуклеотидам: аденозинтрифосфату (АТФ), аденозиндифосфату (АДФ), аденозинмонофосфату (АМФ) и циклическому аденозинмонофосфату (ц-АМФ); к биохимическому метилирующему агенту S-аденозил-L-метионину (SAM); и структурно к коэнзимам НАД, ФАД и коэнзиму А; и к РНК. Совместно аденозин и эти родственные соединения играют важную роль в регулировании многих аспектов клеточного метаболизма и в модуляции различной активности центральной нервной системы.
Кроме того, известно, что связывание агониста рецептора аденозина с тучными клетками, экспрессирующими А3 рецептор крысы, приводит к увеличению инозитолтрифосфата и внутриклеточным концентрациям кальция, которые потенциируют индуцируемую антигеном секрецию медиаторов воспаления. Поэтому A3 рецептор играет посредническую роль при астматических приступах и других аллергических реакциях.
Аденозин является нейромодулятором, способным модулировать многие аспекты физиологической функции мозга. Эндогенный аденозин, центральное звено между метаболизмом энергии и нейрональной активностью, изменяется в соответствии с поведенческим состоянием и (пато)физиологическими условиями. В условиях увеличенной потребности и уменьшенной доступности энергии (таких, как гипоксия, гипоглицемия и/или чрезмерная нейрональная активность) аденозин обеспечивает мощный защитный механизм обратной связи. Взаимодействие с рецепторами аденозина представляет перспективную мишень для терапевтического вмешательства в ряд неврологических и психиатрических болезней, таких как эпилепсия, нарушение сна, двигательные расстройства (болезни Паркинсона или Хантингтона), депрессия, шизофрения или наркомания. Увеличенное высвобождение нейромедиатора следует за травмами, такими как гипоксия, ишемия и припадок. Эти нейромедиаторы, в конце концов, ответственны за невральную дегенерацию и невральную смерть, которые вызывают повреждение мозга или смерть индивидуума. Агонисты аденозина A1, которые имитируют центральные ингибиторные воздействия аденозина, могут поэтому быть использованы в качестве нейропротекторных агентов. Аденозин был предложен в качестве эндогенного антиконвульсивного агента, ингибирующего выделение глутамата из возбужденных нейронов и ингибирующего нейрональное воспаление. Агонисты аденозина могут быть использованы поэтому в качестве антиэпилептических агентов. Антагонисты аденозина стимулируют активность ЦНС и, как оказалось, являются эффективными в качестве агентов повышения когнитивности. Селективные А2а антагонисты имеют терапевтический потенциал в лечении различных форм деменции, например болезни Альцгеймера, и нейродегенеративных расстройств, например инсульта. Антагонист аденозин А2а рецептора моделирует активность стриарных ГАМК-эргических нейронов и регулирует плавные и хорошо скоординированные движения, предоставляя, таким образом, возможность для терапии паркинсонических синдромов. Аденозин вовлечен также в ряд физиологических процессов, включенных в седативный эффект, гипноз, шизофрению, состояние страха, боли, дефицит дыхания, депрессию, лекарственную наркоманию (амфетамин, кокаин, опиоиды, этанол, никотин, органические вещества, получаемые из конопли). Поэтому лекарства, воздействующие на аденозиновые рецепторы, имеют терапевтический потенциал в качестве седативных средств, мышечных релаксантов, антипсихотических средств, снимающих тревогу средств, анальгетиков, респираторных стимулирующих средств, антидепрессантов, и в лечении злоупотреблением лекарственными средствами. Они могут быть также использованы в лечении ADHD (дефицит внимание, вызванный гиперактивностью).
Важную роль для сердечно-сосудистой системы аденозин выполняет в качестве кардиопротекторного агента. Уровни эндогенного аденозина увеличиваются в ответ на ишемию и гипоксию и защищают ткань сердечной мышцы во время и после травмы (прекондиционирование). Действием на A1 рецептор агонисты А1 аденозина способны защитить от повреждения, вызванного миокардиальной ишемией и реперфузией. Моделирующее влияние А2а рецепторов на адренергическую функцию может иметь значение для различных болезней, таких как коронарная артериальная болезнь и сердечная недостаточность. А2а антагонисты могут оказывать плодотворное терапевтическое воздействие в ситуациях, в которых желательна усиленная антиадренергическая реакция, такая как во время острой миокардиальной ишемии. Селективные антагонисты А2а рецепторов могут также усиливать эффективность аденозина в конечной стадии наджелудочковой аритмии.
Аденозин моделирует многие аспекты почечной функции, включая выделение ренина, скорость гломерулярной фильтрации и поток почечной крови. Соединения, которые противодействуют почечному воздействию аденозина, имеют потенциал в качестве почечных защитных агентов. Кроме того, аденозин А3 и/или А2а антагонисты могут быть использованы при лечении астмы и других аллергических реакций и в лечении сахарного диабета и ожирения.
Многочисленные документы описывают современные исследования по аденозиновым рецепторам, например, следующие публикации:
Bioorganic & Medicinal Chemistry, 6, (1998), 619-641,
Bioorganic & Medicinal Chemistry, 6, (1998), 707-719,
J. Med. Chem., (1998), 41, 2835-2845,
J. Med. Chem., (1998), 41, 3186-3201,
J. Med. Chem., (1998), 41, 2126-2133,
J. Med. Chem., (1999), 42, 706-721,
J. Med. Chem., (1996), 39, 1164-1171,
Arch. Pharm. Med. Chem., 332, 39-41, (1999),
Am. J. Physiol., 276, H1113-1116, (1999) or
Naunyn Schmied, Arch. Pharmacol. 362, 375-381, (2000).
Объектами настоящего изобретения являются соединения формулы I, как таковые, применение соединений формулы I и их фармацевтически приемлемых солей для производства медикаментов для лечения болезней, связанных с А2 рецептором, их производство, медикаменты на основе соединения в соответствии с изобретением и их получение, а также применение соединений формулы I для контроля или профилактики болезней, основанных на модулировании аденазиновой системы, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, нейропротекция, шизофрения, состояние страха, боли, дефицита дыхания, депрессия, лекарственная наркомания (амфетамин, кокаин, опиоиды, этанол, никотин, органические вещества, получаемые из конопли), или против астмы, аллергических реакций, гипоксии, ишемии, припадков и токсикомании. Кроме того, соединения по настоящему изобретению могут быть использованы в качестве седативных средств, мышечных релаксантов, антипсихотических средств, антиэпилептических средств, антиконвульсантов и кардиопротекторных агентов при таких расстройствах, как коронарная артериальная болезнь и сердечная недостаточность. Наиболее предпочтительные показания в связи с настоящим изобретением относятся к таким, которые основаны на антагонистической активности относительно А2а рецептора, и которые включают расстройства центральной нервной системы, например, лечение или профилактику болезни Альцгеймера, центральные депрессивные расстройства, наркоманию, нейропротекцию и болезнь Паркинсона, а также ADHD.
Используемый в данном описании термин "низший алкил" обозначает алкильную группу с линейной или разветвленной цепью, содержащую от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изо-бутил, 2-бутил, трет.-бутил и подобные им. Предпочтительными низшими алкильными группами являются группы, содержащие от 1 до 4 атомов углерода.
Термин "галоген" обозначает хлор, йод, фтор или бром.
Термин "низшая алкокси-группа" обозначает группу, в которой алкильный остаток определен выше и присоединен через атом кислорода.
Термин "фармацевтически приемлемая кислотно-аддитивная соль" включает соли неорганических или органических кислот, таких как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, п-толуолсульфоновая кислота и им подобные.
Предпочтительными соединениями по настоящему изобретению являются соединения формулы I, в которой R1 обозначает 4-фторфенил. Такими соединениями являются:
2-Хлорметил-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метилизоникотинамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-6-метилникотинамид,
4-Фтор-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]бензамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-морфолин-4-ил-изоникотинамид или
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метоксиметил-изоникотинамид.
Далее предпочтительными являются соединения формулы I, в которой R обозначает незамещенный фенил, например следующие соединения:
4-Фтор-N-(4-метокси-7-фенилбензооксазол-2-ил)бензамид или
4-{[(2-Метоксиэтил)метиламино]метил}-N-(4-метокси-7-фенилбензооксазол-2-ил)-бензамид.
Далее предпочтительными являются соединения, где R1 обозначает тетрагидропиран-4-ил, например следующие соединения:
N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-6-метилникотинамид или
N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-2-метилизоникотинамид.
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены известными из уровня техники методами, например методом, описанным ниже, который включает процессы:
а) реакцию соединения формулы

с соединением формулы
 или
или
с соединением формулы

с образованием соединения формулы
в которой R1 обозначает фенил, незамещенный или замещенный галогеном, или
б) реакцию соединения формулы

с соединением формулы
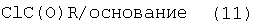
или с соединением формулы

с образованием соединения формулы

в которой R1 обозначает незамещенный или замещенный галогеном фенил,
или
в) гидрирование соединения формулы

посредством H2/Pd/C
с образованием соединения
или
г) реакцию соединения формулы
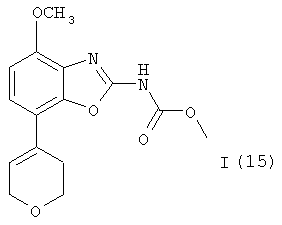
с NaOH и затем с соединением формулы

или с соединением формулы

с образованием соединения формулы

или
д) реакцию соединения формулы

с NaOH и затем с соединением формулы

или с соединением формулы
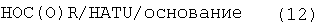
с образованием соединения формулы

или
е) реакцию соединения формулы

с соединением формулы

или с соединением формулы

с образованием соединения
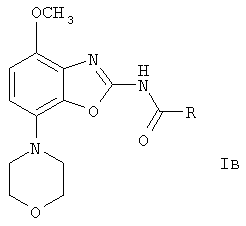
или
ж) модификацию одного или более заместителей R1 или R в пределах данных выше определений
и,
если желательно, превращение полученных выше соединении в фармацевтически приемлемые кислотно-аддитивные соли.
Соединения формулы I могут быть получены в соответствии со следующей схемой:
Получение соединений формулы I, в которой R1 обозначает фенил или фенил, замещенный галогеном
Один из методов получения соединений формулы I, в которой R1 обозначает фенил или фенил, замещенный галогеном, исходит из интермедиата формулы (5), как представлено ниже на схеме 2. Получение интермедиата формулы (5) представлено ниже в реакционной схеме 1.


где R1 обозначает фенил или замещенный галогеном фенил и R обозначен выше.
Получение интермедиата формулы (2)
Исходный 2-нитрорезорцинол формулы (1) доступен коммерчески (от фирмы Aldrich) или может быть получен согласно методам, хорошо известным из уровня техники.
2-Нитрорезорцинол формулы (1) гидрируют в присутствии катализатора гидрирования, предпочтительно 10%-ного палладия на угле. Эта реакция может протекать в различных растворителях, таких как метанол, этанол, диоксан или тетрагидрофуран, предпочтительно в метаноле, при комнатной температуре и давлении от 1 атм и выше, предпочтительно при 1 атм, в течение 2-24 часов, предпочтительно в течение около 18 ч. Продукт формулы (2), 2-аминорезорцинол, предпочтительно используется на следующей стадии без очистки.
Получение интермедиата формулы (3)
Интермедиат формулы (2) реагирует с небольшим избытком цианидбромида в смеси водного растворителя, предпочтительно в смеси низшего спирта и воды, предпочтительно в смеси метанола и воды. Реакция предпочтительно протекает при комнатной температуре в течение приблизительно 2 ч. Продукт, бензоксазольное соединение формулы (3), выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (4)
Метод получения интермедиата формулы (4) заключается в обработке интермедиата формулы (3) небольшим избытком сильного основания, предпочтительно гидрида натрия в апротонном растворителе, предпочтительно тетрагидрофуране, при повышенной температуре, предпочтительно около 50°С, в течение около 1 ч; промежуточное соединение последовательно обрабатывается метилйодидом, предпочтительно с использованием около 1 эквивалента метилйодида, при повышенной температуре, предпочтительно около 50°С, в течение 1-5 ч, предпочтительно около 3 ч. Продукт формулы (4) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (5)
Интермедиат формулы (4) реагирует с небольшим избытком метилхлорформиата в органическом растворителе, предпочтительно дихлорметане. Реакция протекает в присутствии аминного основания, такого как пиридин, триэтиламин или N-этилдиизопропиламин, предпочтительно пиридина, при температуре ниже комнатной температуры, предпочтительно при 0°С, в течение 0,25-4 ч. Продукт формулы (5) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (6)
Интермедиат формулы (5) реагирует с небольшим избытком йодирующего реагента, предпочтительно йодмонохлорида, в органическом растворителе, предпочтительно уксусной кислоте, при комнатной температуре, в течение приблизительно 2-30 ч, предпочтительно около 16 ч. Продукт формулы (6) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
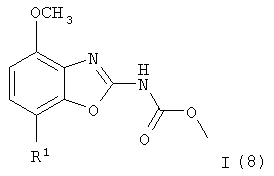
Получение соединений формулы I (8) и/или формулы (9)
Исходные трибутилстаннановые соединения формулы (7) коммерчески доступны, например, от фирмы Fluka или могут быть получены методами, хорошо известными из уровня техники.
Интермедиат формулы (6) реагирует с избытком трибутилстаннана формулы (7) в органическом растворителе, предпочтительно в N,N-диметилформамиде, содержащем палладиевый катализатор, предпочтительно трис(дибензилиденацетон)дипалладий(0), каталитическое количество фосфинового или арсинового лиганда, предпочтительно трифениларсина, и избыток Cu(I) соли, предпочтительно CuI. Реакция протекает при повышенной температуре, предпочтительно около 80°С, в течение 2-24 ч, предпочтительно около 16 ч. Продукт(ы) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации. В зависимости от реакционных параметров, таких как температура и время реакции, основной продукт реакции может представлять собой соединение формулы I (8), в других случаях основной продукт реакции может быть соединением формулы (9), или в результате реакции может быть получена смесь продуктов формулы I (8) и (9).
Альтернативное получение соединений формулы I (8) и/или формулы (9)
Исходные соединения бороновой кислоты формулы (10) доступны коммерчески, например, от фирмы Fluka или могут быть получены методами, хорошо известными из уровня техники.
Соединения формулы I (8) или формулы (9) альтернативно могут быть получены обработкой интермедиата формулы (6) избытком соединения бороновой кислоты формулы (10). Реакция протекает в водном растворителе, предпочтительно в смеси воды, диоксана и 1,2-диэтоксиэтана, содержащем палладиевый катализатор, предпочтительно тетракис(трифенилфосфин)палладий(0), избыток соли лития, предпочтительно хлорида лития, и неорганическое основание, предпочтительно карбонат натрия. Реакция протекает предпочтительно при температуре кипения растворителя, предпочтительно около 100°С, в течение 2-24 ч, предпочтительно около 16 ч. Продукт(ы) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации. В зависимости от реакционных параметров, таких как температура и время реакции, основной продукт реакции может представлять собой соединение формулы I (8), в других случаях основной продукт реакции может быть соединением формулы (9), или в результате реакции может быть получена смесь продуктов формулы I (8) и (9).
Получение интермедиатов формулы (9) из соединений формулы I (8)
Соединения формулы I (8) могут быть превращены в соответствующие интермедиаты формулы (9) реакцией с избытком водного основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, предпочтительно гидроксид натрия. Реакция протекает в водном растворителе, предпочтительно в смеси воды и смешивающегося с ней органического растворителя, такого как диоксан, тетрагидрофуран или этиленгликоль, предпочтительно этиленгликоля, при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение 2-16 ч, предпочтительно около 16 ч. Продукт формулы (9) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает фенил или галогензамещенный фенил
Один из методов получения соединений формулы I, где R1 обозначает фенил или галогензамещенный фенил, заключается в обработке интермедиата формулы (9) небольшим избытком соответствующего ацилхлорида формулы (11), который коммерчески доступен или может быть получен методами, хорошо известными из уровня техники. Может также быть использован такой катализатор, как N,N-диметил-4-аминопиридин. Реакция протекает в апротонном органическом растворителе, предпочтительно смеси дихлорметана и тетрагидрофурана, содержащем основание, предпочтительно N-этилдиизопропиламин или триэтиламин, при температуре между комнатной температурой и температурой кипения растворителя в течение 2-24 ч, предпочтительно 16 ч. Продукт формулы I, где R1 обозначает фенил или галогензамещенный фенил, выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Альтернативное получение соединений формулы I, где R1 обозначает фенил или галогензамещенный фенил
Альтернативный способ получения соединений формулы I где R1 обозначает фенил или галогензамещенный фенил, включает обработку соответствующей карбоновой кислоты формулы (12) стехиометрическим эквивалентом реагента для конденсации с пептидом, предпочтительно O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурониум гексафторфосфат (HATU), в эфирном растворителе, предпочтительно тетрагидрофуране, содержащем основание, предпочтительно N-этилдиизопропиламин, при комнатной температуре в течение 30-90 мин, предпочтительно 1 ч. Смесь обрабатывается затем интермедиатом формулы (9) в смеси растворителей, предпочтительно в смеси тетрагидрофурана, диоксана и N,N-диметилформамида, при комнатной температуре в течение 16-24 ч, предпочтительно 16 ч. Продукт формулы I, где R1 обозначает фенил или галогензамещенный фенил, выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил или тетрагидропиран-4-ил
Один из методов получения соединений формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил или тетрагидропиран-4-ил, исходит из интермедиата формулы (6), как показано ниже на схеме 3.
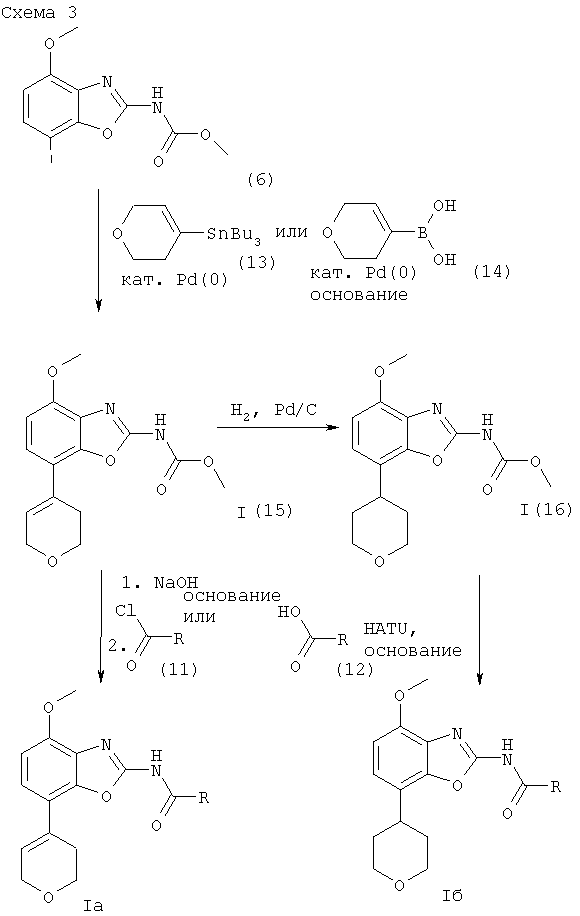
где R обозначен выше.
Получение соединений формулы I (15)
Исходные трибутилстаннановые соединения формулы (13) могут быть получены методами, хорошо известными из уровня техники.
Интермедиат формулы (6) реагирует с избытком трибутилстаннана формулы (7) в органическом растворителе, предпочтительно в диоксане, содержащем палладиевый катализатор, предпочтительно трис(дибензилиденацетон)дипалладий(0), каталитическое количество фосфинового или арсинового лиганда, предпочтительно три(2-фурил)фосфина. Реакция протекает при повышенной температуре, предпочтительно около 100°С, в течение около 2-24 ч, предпочтительно около 16 ч. Продукт формулы I (15) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Альтернативное получение соединений формулы I (15)
Исходные соединения бороновой кислоты формулы (14) могут быть получены методами, хорошо известными из уровня техники.
Соединения формулы I (15) альтернативно могут быть получены обработкой интермедиата формулы (6) избытком соединения бороновой кислоты формулы (14). Реакция протекает в водном растворителе, предпочтительно в смеси воды, диоксана и 1,2-диэтоксиэтана, содержащей палладиевый катализатор, предпочтительно тетракис-(трифенилфосфин)палладий(0), и неорганическое основание, предпочтительно карбонат натрия. Реакция протекает предпочтительно при температуре кипения растворителя, предпочтительно около 100°С, в течение около 2-24 ч, предпочтительно около 16 ч. Продукт формулы I (15) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
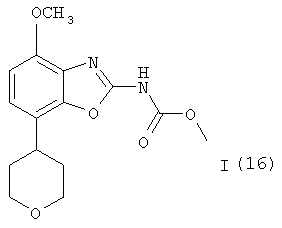
Получение соединений формулы I (16)
Соединения формулы I (15) могут быть превращены в соединения формулы I (16) гидрированием в присутствии катализатора гидрирования, предпочтительно 10%-ного палладия на активированном угле. Эта реакция протекает в различных органических растворителях, таких как метанол, этанол, диоксан, тетрагидрофуран или дихлорметан, предпочтительно в смеси метанола и дихлорметана, при комнатной температуре, при давлении 1 атм и выше, предпочтительно при 1 атм, в течение 2-24 ч, предпочтительно около 18 ч. Продукт формулы I (16) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил (Ia)
Соединения формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил, могут быть получены из соединений формулы I (15) методами, полностью аналогичными методам, описанным выше для получения соединений формулы I из интермедиатов формулы (8). Продукт формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил (Ia), выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает тетрагидропиран-4-ил (Iб)
Соединения формулы I, где R1 обозначает тетрагидропиран-4-ил, могут быть получены из соединений формулы I (16) методами, полностью аналогичными методам, описанным выше для получения соединений формулы I из интермедиатов формулы (8). Продукт формулы I, где R1 обозначает тетрагидропиран-4-ил (Ia), выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает морфолин-4-ил
Один из методов получения соединений формулы I, где R1 обозначает морфолин-4-ил, исходит из интермедиата формулы (5), как представлено ниже на схеме 4.
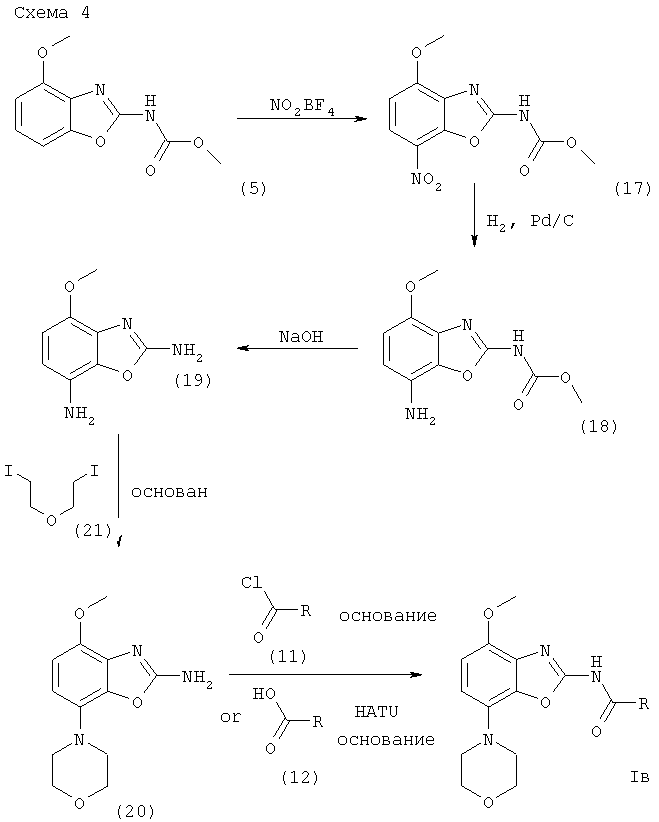
где R обозначен выше.
Получение интермедиата формулы (17)
Интермедиат формулы (5) вводят в реакцию с нитрующим агентом, предпочтительно с нитрониум тетрафторборатом, в полярном органическом растворителе, предпочтительно нитрометане. Реакция протекает в температурном интервале от 0°С до комнатной в течение приблизительно 2-24 ч, предпочтительно около 18 ч. Продукт формулы (17) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (18)
Интермедиат формулы (17) может быть превращен в интермедиат формулы (18) гидрированием в присутствии катализатора гидрирования, предпочтительно 10%-ного палладия на активированном угле. Эта реакция протекает в различных органических растворителях, таких как метанол, этанол, диоксан, тетрагидрофуран или дихлорметан, предпочтительно в смеси метанола и дихлорметана, при комнатной температуре, при давлении 1 атм и выше, предпочтительно при 1 атм, в течение 2-24 ч, предпочтительно около 18 ч. Продукт формулы (18) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (19)
Интермедиат формулы (18) может быть превращен в соответствующий интермедиат формулы (19) реакцией с избытком водного основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, предпочтительно гидроксид натрия. Реакция протекает в водном растворителе, предпочтительно в смеси воды и смешивающегося с ней органического растворителя, такого как диоксан, тетрагидрофуран или этиленгликоль, предпочтительно в смеси воды, диоксана и этиленгликоля, при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение приблизительно 2-16 ч, предпочтительно около 4 ч. Продукт формулы (19) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (20)
Интермедиат формулы (19) вводят в реакцию с дийодидалкиловым соединением формулы (21), которое может быть получено методами, хорошо известными из уровня техники, в органическом растворителе, предпочтительно в N,N-диметилформамиде, содержащем основание, предпочтительно карбонат калия. Реакция протекает в интервале между комнатной температурой и температурой кипения растворителя, предпочтительно около 60°С, в течение около 1-48 ч, предпочтительно около 48 ч. Продукт формулы (20) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы Iв (R1 обозначает морфолин-4-ил)
Соединения формулы I, где R1 обозначает морфолин-4-ил, могут быть получены из интермедиата формулы (20) методами, полностью аналогичными методам, описанным выше для получения соединений формулы I из интермедиатов формулы (9). Продукт формулы I, где R1 обозначает морфолин-4-ил, выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Конверсия соединений формулы I в другие соединения формулы I, имеющие модифицированный R заместитель
В случае если соединение формулы I содержит R заместитель, имеющий химически реакционную функциональную группу, например, когда R содержит галоидбензильную функциональную группу или 2-галопиридильную функциональную группу, соединение формулы I может быть превращено в другое соединение формулы I, имеющее модифицированный R заместитель, посредством реакций, включающих реакционную функциональную группу, содержащуюся в первоначальном R заместителе. Такие превращения могут быть проведены согласно методам, хорошо известным из уровня техники, и специфические примеры могут быть найдены в ряду примеров, приведенных ниже. Например, соединения формулы I, имеющие R заместители, несущие галоидбензильную или 2-галопиридильную функциональные группы, могут реагировать с нуклеофильными спиртовыми или аминными реагентами, образуя соединения формулы I, содержащие R заместители, имеющие соответственно бензильную эфирную или бензильную аминную функциональные группы, или пиридил-2-ил-эфирную или пиридил-2-ил-аминную функциональные группы.
Выделение и очистка соединений
Выделение и очистка соединений и интермедиатов, приведенная в данном описании, может быть осуществлена, если нужно, посредством любого подходящего метода выделения и очистки, как, например фильтрование, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная хроматография низкого или высокого давления, или комбинацией этих методов. Подходящие методы разделения и выделения в чистом виде могут быть проиллюстрированы посредством ссылок на методы получения и примеры, приведенные ниже. Однако другие эквивалентные методы разделения и выделения в чистом виде могут, конечно, также быть использованы.
Соли соединений формулы I
Соединения формулы I могут быть основными, например, в случаях, когда остаток R содержит основную группу, такую как алифатический или ароматический аминный фрагмент. В таких случаях соединения формулы I могут быть превращены в соответствующую кислотно-аддитивную соль.
Превращение осуществляется обработкой, по меньшей мере, стехиометрическим количеством соответствующей кислоты, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобными, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и им подобными. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и им подобном, после чего добавляют кислоту в аналогичном растворителе. Температура поддерживается в пределах от 0 до 50°С. Образующаяся соль самопроизвольно выпадает в осадок или может быть извлечена из раствора менее полярным растворителем.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания обработкой, по крайней мере, стехиометрическим эквивалентом подходящего основания типа гидроксидов натрия или калия, карбонатом калия, бикарбонатом натрия, аммиаком и им подобных.
Соединения формулы I и их фармацевтически приемлемые соли обладают различными фармакологическими свойствами. В частности, было найдено, что соединения по настоящему изобретению являются лигандами рецептора аденозина (А2A). Кроме того, было показано, что предпочтительные соединения формулы I обладают хорошей селективностью по отношению к A1 рецептору в области от 26 до 650.
Соединения были исследованы в соответствии с тестами, приведенными ниже.
А2A рецептор аденозина человека
A2A рецептор аденозина человека рекомбинантно экспрессируют в клетках яичника китайского хомячка (СНО), используя вирусную экспрессионную систему "леса семлики" (semliki forest). Клетки харвестируют, дважды отмывают центрифугированием, гомогенизируют и снова отмывают центрифугированием. Окончательно отмытый мембранный осадок суспендируют в Трис (50 мл) буфере, содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (pH 7,4) (буфер А). [3H]-SCH-58261 (Dionisotti и др., 1997, Br. J. Pharmacol. 121, 353; 1 nM) анализ связывания проводят в 96-луночных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг Ysi-поли-1-лизин SPA гранул и 0,1 U аденозин деаминазы в общем объеме 200 мкл буфера. Неспецифическое связывание определяют, используя ксантинамин морского угря (ХАС; 2 мкМ). Соединения тестируют при 10 концентрациях от 10 мкМ до 0,3 нМ. Все анализы были дублированы и повторены, по крайней мере, дважды. Перед центрифугированием аналитические планшеты были инкубированы в течение 1 ч при комнатной температуре и затем связанные лиганды определяли с использованием сцинтиляционного счетчика Packard Topcount. IC50 величины вычисляли, используя подходящую программу нелинейной кривой, и Ki значения вычисляли, применяя уравнение Cheng-Prussoff.
Предпочтительные соединения имели значения р Ki>7,5. В следующей таблице представлены сродство к А2а рецептору и селективность к A1 рецептору для этих соединений.
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве медикаментов, например в форме фармацевтических препаратов. Фармацевтические препараты могут быть введены орально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий и суспензий. Введение может осуществляться также ректально, например в форме суппозиториев, или парентерально, например в форме инъекционных растворов.
Соединения формулы I могут быть соединены с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Могут использоваться лактоза, кукурузный крахмал или их производные, тальк, стеариновые кислоты или их соли и подобные им, например, в качестве носителей для таблеток, таблеток, покрытых оболочкой, драже, и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например растительные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им. Однако в зависимости от природы активной субстанции может не потребоваться никаких носителей, обычно применяемых в случае мягких желатиновых капсул. Подходящими носителями для производства растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и им подобные. Подходящими носителями для суппозиториев являются, например, натуральные или твердые масла, воски, жиры, полутвердые и жидкие полиолы и подобные им.
Кроме того, фармацевтические препараты могут содержать консерванты, растворители, стабилизаторы, смягчающие агенты, эмульгаторы, заменители сахара, красители, отдушки, соли для регулировки осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут содержать также еще другие терапевтически ценные субстанции.
Медикаменты, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом по настоящему изобретению, как и способ их получения, который включает внесение одного или более соединений формулы I и/или фармацевтически приемлемых кислотно-аддитивных солей и, если желательно, одного или более других терапевтически ценных субстанций в галеновую лекарственную форму совместно с одним или более терапевтически инертными носителями.
В соответствии с изобретением соединения формулы I, как и их фармацевтически приемлемые соли, применяют для контроля или профилактики заболеваний, связанных с антагонистической активностью рецептора аденозина, таких как болезнь Альцгеймера, болезнь Паркинсона, нейропротекция, шизофрения, состояние страха, боли, дефициты дыхания, депрессия, астма, аллергические реакции, гипоксия, ишемия, припадки и токсикомания. Кроме того, соединения по настоящему изобретению могут быть использованы в качестве седативных средств, мышечных релаксантов, антипсихотических средств, антиэпилептических средств, антиконвульсантов и кардиопротекторных агентов и для производства соответствующих медикаментов.
Наиболее предпочтительными показаниями для применения в соответствии с настоящим изобретением являются такие, которые включают расстройства центральной нервной системы, например, лечение или профилактику центральных депрессивных расстройств, нейропротекцию и болезнь Паркинсона.
Дозировка может варьироваться в широких пределах и, конечно, должна быть отрегулирована в соответствии с индивидуальными требованиями в каждом отдельном случае. В случае орального введения доза для взрослого может варьироваться от около 0,01 мг до около 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Дневная доза может быть введена в виде единичной дозы или разделена на несколько доз и, кроме того, верхний предел может быть превышен, если для этого существуют показания.
Процесс производства
1. Смесь компонентов 1, 2, 3 и 4 и гранулирование с очищенной водой.
2. Сушка гранулята при 50°С.
3. Пропускание гранулята через подходящее мельничное оборудование.
4. Добавление компонента 5 и смешивание в течение 3 мин; прессование на подходящем прессе.
Процесс производства
1. Смешивание компонентов 1, 2 и 3 в подходящем смесителе в течение 30 мин.
2. Добавление компонентов 4 и 5 и перемешивание в течение 3 мин.
3. Наполнение соответствующих капсул.
Следующие примеры иллюстрируют изобретение, не имея в виду ограничение его объема.
Примеры
Пример 1: 4-Фтор-N-(4-метокси-7-фенилбензооксазол-2-ил)бензамид
а) 2-Аминобензооксазол-4-ол
К перемешиваемому раствору 30 г (193 ммоль) 2-нитрорезорцинола в 900 мл метанола добавляют 2,00 г 10%-ного палладия на активированном угле и перемешивают затем смесь в течение 18 ч при комнатной температуре в атмосфере водорода. Смесь затем фильтруют и фильтрат, содержащий 2-аминорезорцинол, добавляют по каплям к перемешиваемому раствору 22,5 г (213 ммоль) цианидбромида в 230 мл метанола и 100 мл воды. Перемешивание продолжают в течение 2 ч при комнатной температуре, а затем смесь концентрируют в вакууме. К остатку добавляют водный раствор бикарбоната натрия и трижды экстрагируют смесь этилацетатом. Объединенные органические фазы промывают насыщенным рассолом, высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (этилацетат), за которой следует растирание с эфиром, дают 27,0 г (93%) 2-аминобензооксазол-4-ола в виде бежевого кристаллического твердого вещества. ЭИ-МС м/э (%): 150 (М+, 100), 107 (28).
б) 4-Метоксибензооксазол-2-иламин
К перемешиваемому раствору 10 г (66 ммоль) 2-аминобензооксазол-4-ола в 100 мл ТГФ при комнатной температуре добавляют порциями 3,49 г (79,9 ммоль) гидрида натрия (55%-ная масляная дисперсия) и смесь перемешивают затем в течение 1 ч при 50°С. Затем добавляют по каплям раствор 14,5 мл (233 ммоль) йодметана в 500 мл ТГФ в течение 3 ч, поддерживая температуру реакционной смеси при 50°С. Смесь выливают затем в воду и трижды экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным рассолом, высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (дихлорметан, затем метанол/дихлорметан в соотношении 2:98) дает 7,5 г (69%) 4-метоксибензооксазол-2-иламина в виде коричневого кристаллического твердого вещества. ЭИ-МС м/э (%): 164 (М+, 100), 149 ([M-СН3]+, 23), 135 (46).
в) Метиловый эфир (4-метоксибензооксазол-2-ил)карбаминовой кислоты
К перемешиваемому раствору 6,5 г (40 ммоль) 4-метоксибензооксазол-2-иламина и 4,5 мл (56 ммоль) пиридина в 250 мл дихлорметана при 0°С по каплям добавляют раствор 4,1 мл (49 ммоль) метилхлорформиата в 50 мл дихлорметана и продолжают перемешивание в течение 3,5 ч. Смесь затем выливают в воду и трижды экстрагируют дихлорметаном. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (дихлорметан) дает 4,7 г (54%) в виде почти белого кристаллического твердого вещества. ЭИ-МС м/э (%): 222 (М+, 100), 190 (27), 163 (23).
г) Метиловый эфир (7-йод-4-метоксибензооксазол-2-ил)карбаминовой кислоты
К перемешиваемому раствору 4,0 г (18 ммоль) метилового эфира (4-метоксибензооксазол-2-ил)карбаминовой кислоты и 4,4 г (54 ммоль) ацетата натрия в 20 мл уксусной кислоты добавляют по каплям при комнатной температуре 8,8 г (54 ммоль) йодмонохлорида и продолжают перемешивание в течение 30 ч. Смесь затем выливают в воду и трижды экстрагируют этилацетатом. Объединенные органические фазы промывают 1-молярным раствором тиосульфата натрия, затем высушивают над сульфатом натрия и концентрируют в вакууме. Растирание с эфиром дает 4,1 г (65%) метилового эфира (7-йод-4-метоксибензооксазол-2-ил)карбаминовой кислоты в виде белого кристаллического твердого вещества. ЭИ-МС м/э (%): 349 (М+Н+, 100).
д) 4-Метокси-7-фенилбензооксазол-2-иламин
К перемешиваемому раствору 820 мг (2,36 ммоль) метилового эфира (7-йод-4-метоксибензооксазол-2-ил)карбаминовой кислоты в 20 мл N,N-диметилформамида прибавляют 1,17 мл (3,58 ммоль) фенил(три-н-бутил)станнана, 65 мг (0,21 ммоль) трифениларсина и 208 мг (1,09 ммольь) йодида меди(I). Смесь нагревают при 80°С в течение 16 ч, выливают затем в воду и трижды экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным рассолом, высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (метанол/дихлорметан в соотношении 1: 99), за которой следует растирание в эфире, дает 200 мг 4-метокси-7-фенилбензооксазол-2-иламина в виде белого твердого вещества. ЭС-МС м/э (%): 241 (М+Н+, 100).
е) 4-Фтор-N-(4-метокси-7-фенилбензооксазол-2-ил)бензамид
К перемешиваемому раствору 100 мг (0,42 ммоль) 4-метокси-7-фенилбензооксазол-2-иламина, 0,087 мл (0,62 ммоль) триэтиламина и 5,1 мг N,N-диметил-4-аминопиридина в 5 мл ТГФ при комнатной температуре добавляют по каплям раствор 0,064 мл (0,54 ммоль) 4-фторбензоилхлорида в 2 мл ТГФ и продолжают перемешивание в течение 16 ч при 65°С. Реакционную смесь затем концентрируют в вакууме. К остатку прибавляют воду и смесь трижды экстрагируют дихлорметаном. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (этилацетат/гексан в соотношении 1:4, затем 4:1), за которой следует растирание в эфире, дают 50 мг (33%) 4-фтор-N-(4-метокси-7-фенилбензооксазол-2-ил)бензамида в виде слегка желтого кристаллического твердого вещества. ЭИ-МС м/э (%): 362 (М+, 90), 123 (FC6H4CO+, 100).
Аналогичным методом получены:
Пример 2: 4-{[(2-Метоксиэтил)метиламино]метил}-N-(4-метокси-7-фенилбензооксазол-2-ил)бензамид
Из 4-метокси-7-фенилбензооксазол-2-иламина, 4-{[(2-метоксиэтил)метиламино]метил}бензоилхлорида, триэтиламина и N,N-диметил-4-аминопиридина в ТГФ. ЭС-МС м/э (%): 446 (М+Н+, 100).
Пример 3: Метиловый эфир [7-(3,6-дигидро-2Н-пиран-4-ил)-4-метоксибензооксазол-2-ил]карбаминовой кислоты
К перемешиваемому раствору 3,50 г (10,1 ммоль) метилового эфира (7-йод-4-метоксибензооксазол-2-ил)карбаминовой кислоты в 50 мл диоксана добавляют 5,63 г (15,1 ммоль) трибутил(3,6-дигидро-2Н-пиран-4-ил)станнана, 173 мг (0,30 мл) бис(дибензилиденацетон)палладия(0), 374 мг (1,61 ммоль) три(2-фурил)фосфина. Смесь нагревают при 100°С в течение 22 ч, выливают затем в воду и трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (метанол/дихлорметан в соотношении 2:98, затем 5:95), за которой следует растирание в дихлорметане дают 1,30 г (42%) метилового эфира [7-(3,6-дигидро-2Н-пиран-4-ил)-4-метоксибензооксазол-2-ил]карбаминовой кислоты в виде белого твердого вещества. ЭС-МС м/э (%): 305 (М+Н+, 100).
Пример 4: 2-Бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]изоникотинамид
а) Метиловый эфир [4-метокси-7-(тетрагидропиран-4-ил]бензооксазол-2-ил]карбаминовой кислоты
К перемешиваемому раствору 1,30 г (4,27 ммоль) метилового эфира [7-(3,6-дигидро-2Н-пиран-4-ил)-4-метоксибензооксазол-2-ил]карбаминовой кислоты в 250 мл метанола и 250 мл дихлорметана добавляют 1,00 г 10%-ного палладия на угле и смесь затем премешивают в течение 10 ч при комнатной температуре в атмосфере водорода. Смесь затем фильтруют, промывают смесью дихлорметан/метанол в соотношении 1:1 и фильтрат концентрируют в вакууме, получая 1,30 г (100%) метилового эфира [4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]карбаминовой кислоты в виде почти белого твердого вещества. ЭС-МС м/э (%): 307 (М+Н+, 100).
б) 4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-иламин
К перемешиваемому раствору 1,30 г (4,24 ммоль) метилового эфира [4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]карбаминовой кислоты в 90 мл диоксана и 30 мл этиленгликоля добавляют 90 мл 5-нормального водного раствора гидроксида натрия и нагревают смесь при 100°С в течение 16 ч. После охлаждения до комнатной температуры смесь выливают затем в воду и четыре раза экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (дихлорметан, затем метанол/дихлорметан в соотношении 5:95) дает 0,78 г (74%) 4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-иламина в виде коричневого твердого вещества. ЭС-МС м/э (%): 249 (М+Н+, 100).
в) 2-Бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]изоникотинамид
К перемешиваемому раствору 106 мг (0,52 ммоль) 2-бромизоникотиновой кислоты в 5 мл ТГФ добавляют 230 мг (0,60 ммоль) HATU и 0,10 мл (0,60 ммоль) N-этилдиизопропиламина и продолжают перемешивание при комнатной температуре в течение 5 ч. Затем добавляют 100 мг (0,40 ммоль) 4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-иламина в 5 мл диоксана и 1 мл ДМФ и продолжают перемешивание при 40°С в течение 72 ч. Реакционную смесь выливают затем в воду и трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (дихлорметан, затем метанол/дихлорметан в соотношении 20:80), за которой следует растирание в эфире, дают 146 мг (84%) 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]изоникотинамида в виде белого кристаллического твердого вещества. ЭС-МС м/э (%): 434 (M{81Br}+H+, 95), 432 (M{79Br}+H+, 100).
Аналогичным методом получены:
Пример 5: 4-Фтор-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]бензамид
Из 4-фторбензойной кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(тетрагидропиран-4-ил)бензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 371 (М+Н+, 100).
Пример 6: N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-6-метилникотинамид
Из 6-метилникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 368 (М+Н+, 100).
Пример 7: N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-2-метилизоникотинамид
Из 2-метилизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 368 (М+Н+, 100).
Пример 8: 2-Хлорметил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]изоникотинамид
Из 2-хлорметилизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 404 (M{37Cl}+H+, 30), 402 (M{35Cl}+H+, 100).
Пример 9: N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-2-морфолин-4-ил-изоникотинамид
Перемешиваемую суспензию 460 г (1,06 ммоль) 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]изоникотинамида, 693 г (2,13 ммоль) карбоната цезия и нескольких кристаллов 2,6-ди-трет.-бутил-п-крезола в 2,78 мл (3,19 ммоль) морфолина и 2 мл N-метилпирролидона нагревают при 140°С в течение 24 ч в толстостенной стеклянной трубке для высокого давления, снабженной тефлоновой крышкой. Реакционную смесь охлаждают затем до комнатной температуры и выливают в воду, а затем трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (метанол/дихлорметан в соотношении 2:98), за которой следует растирание в эфире, дают 136 мг (29%) N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-2-морфолин-4-ил-изоникотинамида в виде белого кристаллического твердого вещества. ЭС-МС м/э (%): 439 (М+Н+, 100).
Пример 10: 2-Метоксиметил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]изоникотинамид
К перемешиваемому раствору 0,05 мл (1,24 ммоль) метанола в 5 мл диоксана и 1 мл N,N-диметилформамида при комнатной температуре добавляют 27 мг (0,62 ммоль) гидрида натрия (55%-ная дисперсия в минеральном масле) и смесь нагревают в течение 1 ч при 50°С. Затем добавляют 50 мг (0,12 ммоль) 2-хлорметил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил] изоникотинамида и нагревают смесь при 50°С в течение 20 ч. Реакционную смесь охлаждают затем до комнатной температуры и выливают в воду. Смесь подкисляют 1-нормальным водным раствором хлористоводородной кислоты, а затем трижды экстрагируют дихлорметаном. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (дихлорметан), за которой следует растирание в эфире, дают 32 мг (65%) 2-метоксиметил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил] изоникотинамида в виде белого кристаллического твердого вещества. ЭС-МС м/э (%): 398 (М+Н+, 100).
Аналогично примеру 4 получены:
Пример 11: N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-2-фенилацетамид
Из фенилуксусной кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 367 (М+Н+, 100).
Пример 12: 2-Бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]изоникотинамид
а) Метиловый эфир [7-(4-фторфенил)-4-метоксибензооксазол-2-ил]карбаминовой кислоты
К перемешиваемому раствору 3,00 г (8,62 ммоль) метилового эфира (7-йод-4-метоксибензооксазол-2-ил)карбаминовой кислоты в 20 мл диоксана и 60 мл 1,2-диметоксиэтана добавляют 731 мг (17,2 ммоль) хлорида лития, 299 мг (0,26 ммоль) тетракис(трифенилфосфин)палладия(0), 1,45 г (10,3 ммоль) п-фторбензолбороновой кислоты и 18 мл 1N-ного водного раствора бикарбоната натрия. Смесь нагревают при 100°С в течение 24 ч, а затем выливают в воду и трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Растирание в эфире дает 2,67 г (98%) метилового эфира [7-(4-фторфенил)-4-метоксибензооксазол-2-ил]карбаминовой кислоты в виде почти белого твердого вещества. ЭС-МС м/э (%): 317 (М+Н+, 100).
б) 7-(4-Фторфенил)-4-метоксибензооксазол-2-иламин
К перемешиваемому раствору 2,80 г (8,85 ммоль) метилового эфира [7-(4-фторфенил)-4-метоксибензооксазол-2-ил]карбаминовой кислоты в 100 мл диоксана и 30 мл этиленгликоля добавляют 100 мл 5N-ного водного раствора гидроксида натрия и смесь нагревают при 100°С в течение 16 ч. Реакционную смесь охлаждают затем до комнатной температуры и выливают в воду, а затем трижды экстрагируют этилацетатом. Объединенные органические фазы промывают рассолом, высушивают над сульфатом натрия и концентрируют в вакууме. Растирание в эфире, дает 0,95 г (42%) 7-(4-фторфенил)-4-метоксибензооксазол-2-иламина в виде почти белого твердого вещества. ЭС-МС м/э (%): 259 (М+Н+, 100).
в) 2-Бром-N-[7-(4-фторфенил1-4-метоксибензооксазол-2-ил]изоникотинамид
К перемешиваемому раствору 203 мг (1,00 ммоль) 2-бромизоникотиновой кислоты в 5 мл ТГФ добавляют 442 мг (1,16 ммоль) HATU и 0,20 мл (1,16 ммоль) N-этилдиизопропиламина и продолжают перемешивание при комнатной температуре в течение 5 ч. Затем добавляют раствор 200 мг (0,77 ммоль) 7-(4-фторфенил)-4-метоксибензооксазол-2-иламина в 5 мл диоксана и 1 мл ДМФ и продолжают перемешивание при 40°С в течение 16 ч. Реакционную смесь выливают затем в 100 мл воды и трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Растирание в смеси эфир/этилацетат в соотношении 4: 1, дает 233 мг (68%) 2-бром-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамида в виде почти белого кристаллического твердого вещества. ЭС-МС м/э (%): 444 (M{81Br}+H+, 90), 442 (M{79Br}+H+, 100).
Аналогичным методом получены:
Пример 13: 2-Хлорметил-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамид
Из 2-хлорметилизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(4-фторфенил)-4-метоксибензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 414 (M{37Cl}+H+, 30), 412 (M{35Cl}+H+, 100).
Пример 14: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метилизоникотинамид
Из 2-метилизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(4-фторфенил)-4-метоксибензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 378 (М+Н+, 100).
Пример 15: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-пропионамид
Из пропионовой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(4-фторфенил)-4-метоксибензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 315 (М+Н+, 100).
Пример 16: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метоксиацетамид
Из метоксиуксусной кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(4-фторфенил)-4-метоксибензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 331 (М+Н+, 100).
Пример 17: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-6-метилникотинамид
Из 6-метилникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(4-фторфенил)-4-метоксибензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 378 (М+Н+, 100).
Пример 18: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]бензамид
Из 4-фторбензойной кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(4-фторфенил)-4-метоксибензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 381 (М+Н+, 100).
Пример 19: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-фенилацетамид
Из фенилуксусной кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 7-(4-фторфенил)-4-метоксибензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 377 (М+Н+, 100).
Аналогично примеру 9 получен:
Пример 20: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-морфолин-4-ил-изоникотинамид
Из 2-бром N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамида с карбонатом цезия и морфолином в N-метилпирролидоне. ЭС-МС м/э (%): 449 (М+Н+, 100).
Аналогично примеру 9 получен:
Пример 21: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метоксиметилизоникотинамид
Из 2-хлорметил N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамида с гидридом натрия и этанолом в диоксане и ДМФ. ЭС-МС м/э (%): 408 (М+Н+, 100).
Пример 22: 2-Хлорметил-N-(4-метокси-7-морфолин-4-илбензооксазол-2-ил)изоникотинамид
а) Метиловый эфир (4-метокси-7-нитробензооксазол-2-ил)карбаминовой кислоты
К перемешиваемому раствору 780 мг (3,51 ммоль) метилового эфира (4-метоксибензооксазол-2-ил)карбаминовой кислоты в 40 мл нитрометана при 0°С добавляют 699 мг (5,27 ммоль) нитрониумтетрафторбората и продолжают перемешивание в течение 18 ч, предоставляя реакционной смеси постепенно нагреваться до комнатной температуры. Смесь концентрируют затем в вакууме. Ускоренная хроматография дает 300 мг (32%) метилового эфира (4-метокси-5-нитробензооксазол-2-ил)карбаминовой кислоты в виде твердого оранжевого вещества и 220 мг (32%) метилового эфира (4-метокси-7-нитробензооксазол-2-ил)карбаминовой кислоты в виде желтого твердого вещества. ЭС-МС м/э (%): 268 (М+Н+, 100).
б) Метиловый эфир (7-амино-4-метоксибензооксазол-2-ил)карбаминовой кислоты
К перемешиваемому раствору 220 мг (0,82 ммоль) метилового эфира (4-метокси-7-нитробензооксазол-2-ил)карбаминовой кислоты в 25 мл метанола и 45 мл дихлорметана добавляют на кончике шпателя 10%-ный палладий на угле и продолжают перемешивание в течение 18 ч при комнатной температуре в атмосфере водорода. Смесь фильтруют и концентрируют затем в вакууме. Ускоренная хроматография (метанол/дихлорметан в соотношении 2:98) дает 114 мг (58%) метилового эфира (7-амино-4-метоксибензооксазол-2-ил)карбаминовой кислоты в виде белого кристаллического твердого вещества. ЭС-МС м/э (%): 238 (М+Н+, 100).
в) 4-Метоксибензооксазол-2,7-диамин
К перемешиваемому раствору 100 мг (0,42 ммоль) метилового эфира (7-амино-4-метоксибензооксазол-2-ил)карбаминовой кислоты в 15 мл диоксана и 5 мл этиленгликоля добавляют 15 мл 5N-ного водного раствора гидроксида натрия и смесь нагревают при 100°С в течение 4 ч. Реакционную смесь охлаждают затем до комнатной температуры и выливают в воду, а затем трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (метанол/дихлорметан в соотношении 5:95, затем метанол/дихлорметан/триэтиламин в соотношении 10:89:1), за которой следует растирание в эфире, дает 15 мг (20%) 4-метоксибензооксазол-2,7-диамина в виде коричневого твердого вещества. ЭС-МС м/э (%): 180 (М+Н+, 100).
г) 4-Метокси-7-морфолин-4-илбензооксазол-2-иламин
К перемешиваемому раствору 800 мг (4,47 ммоль) 4-метоксибензооксазол-2,7-диамина в 40 мл ДМФ добавляют при комнатной температуре 2,47 г (17,9 ммоль) карбоната калия и 2,18 г (6,70 ммоль) 1-йод-2-(2-йодэтокси)этана и нагревают смесь при 60°С в течение 48 ч. Реакционную смесь охлаждают затем до комнатной температуры и выливают в воду, а затем трижды экстрагируют этилацетатом. Объединенные органические фазы промывают рассолом, высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (метанол/дихлорметан в соотношении 2:98, затем метанол/дихлорметан в соотношении 10:90), дает 585 мг (53%) 4-метокси-7-морфолин-4-илбензооксазол-2-иламина в виде слегка коричневого твердого вещества. ЭС-МС м/э (%): 250 (М+Н+, 100).
д) 2-Хлорметил-N-(4-метокси-7-морфолин-4-илбензооксазол-2-ил)изоникотинамид
К перемешиваемому раствору 72 мг (0,42 ммоль) 2-хлорметилизоникотиновой кислоты в 5 мл ТГФ добавляют 183 мг (0,48 ммоль) HATU и 0,08 мл (0,48 ммоль) N-этилдиизопропиламина и продолжают перемешивание при комнатной температуре в течение 5 ч. Затем добавляют раствор 80 мг (0,32 ммоль) 4-метокси-7-морфолин-4-илбензооксазол-2-иламина в 5 мл диоксана и 1 мл ДМФ и продолжают перемешивание при 40°С в течение 48 ч. Реакционную смесь выливают затем в 50 мл воды, подкисляют 1М-ным водным раствором хлористоводородной кислоты и трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Ускоренная хроматография (метанол/дихлорметан в соотношении 3:97, затем метанол/дихлорметан в соотношении 10:90), за которой следует растирание в эфире, дает 8 мг (6%) 2-хлорметил-N-(4-метокси-7-морфолин-4-илбензооксазол-2-ил)изоникотинамида в виде почти белого кристаллического твердого вещества. ЭС-МС м/э (%): 405 (M{37Cl}+H+, 35), 403 (M{35Cl}+H+, 100).
Аналогичным методом получены:
Пример 23: N-(4-Метокси-7-морфолин-4-илбензооксазол-2-ил)-6-метилникотинамид
Из 6-метилникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-морфолин-4-илбензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 369 (М+Н+, 100).
Пример 24: 4-Фтор-N-(4-метокси-7-морфолин-4-илбензооксазол-2-ил)бензамид
Из 4-фторбензойной кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-морфолин-4-илбензооксазол-2-иламином в диоксане и ДМФ. ЭС-МС м/э (%): 372 (М+Н+, 100).
Аналогично примеру 9 получены:
Пример 25: N-(4-Метокси-7-морфолин-4-илбензооксазол-2-ил)-2-морфолин-4-ил-изоникотинамид
Из 2-бромизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, последующей обработкой 4-метокси-7-морфолин-4-илбензооксазол-2-иламином в диоксане и ДМФ, затем обработкой карбонатом цезия и морфолином в N-метилпирролидоне. ЭС-МС м/э (%): 440 (М+Н+, 100).
Пример 26: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-пирролидин-1-илметилизоникотинамид
Смесь 100 мг (0,24 ммоль) 2-хлорметил-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]-2-пирролидин-1-илметилизоникотинамида и 0,35 г (4,86 ммоль) пирролидина подвергают воздействию ультразвука при комнатной температуре в течение 10 мин. Реакционную смесь выливают затем в воду и трижды экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом натрия и концентрируют в вакууме. Растирание в смеси эфир/этилацетат в соотношении 5:1 дает 56 мг (52%) N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]-2-пирролидин-1-илметилизоникотинамида в виде желтого кристаллического твердого вещества. ЭС-МС м/э (%): 447 (M+H+, 100).
Аналогичным методом получен:
Пример 27: N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-морфолин-4-илметилизоникотинамид
Из 2-хлорметил-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамида и морфолина. ЭС-МС м/э (%): 463 (М+Н+, 100).
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕНЗОТИАЗОЛЫ | 2002 |
|
RU2293736C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗОЛА И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АДЕНОЗИНОВЫМИ А-РЕЦЕПТОРАМИ | 2004 |
|
RU2348622C2 |
| ПРОИЗВОДНЫЕ [4-(1-АМИНОЭТИЛ)ЦИКЛОГЕКСИЛ]МЕТИЛАМИНА И [6-(1-АМИНОЭТИЛ)ТЕТРАГИДРОПИРАН-3-ИЛ]МЕТИЛАМИНА | 2009 |
|
RU2515906C2 |
| 7-АМИНОБЕНЗОТИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ЛИГАНДОВ АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2002 |
|
RU2299203C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗОЛА | 2001 |
|
RU2251419C2 |
| N-ПИРИДИН-3-ИЛ ИЛИ N-ПИРАЗИН-2-ИЛ КАРБОКСАМИДЫ В КАЧЕСТВЕ АГЕНТОВ, ПОВЫШАЮЩИХ УРОВЕНЬ ХОЛЕСТЕРИНА ЛПВП | 2011 |
|
RU2540069C2 |
| ПРОИЗВОДНЫЕ 2-ГИДРОКСИЭТИЛ-1Н-ХИНОЛИН-2-ОНА И ИХ АЗАИЗОСТЕРИЧЕСКИЕ АНАЛОГИ С АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2540862C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗОЛА В КАЧЕСТВЕ ЛИГАНДОВ АДЕНОЗИНОВЫХ РЕЦЕПТОРОВ | 2004 |
|
RU2351597C2 |
| ПРОИЗВОДНЫЕ 5-АМИНОЦИКЛИЛМЕТИЛОКСАЗОЛИДИН-2-ОНА | 2008 |
|
RU2492169C2 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
Изобретение относится к производным бензотиазола общей формулы I и их фармацевтически приемлемым кислотно-аддитивным солям в качестве лигандов рецептора аденозина и к лекарственное средству на их основе. Соединения могут найти применение для лечения и профилактики заболеваний, опосредованных рецепторами аденозина, например эпилепсии, депрессий, наркомании, болезни Паркинсона. В общей формуле I

R обозначает фенил, незамещенный или замещенный галогеном или -СН2N(СН3)(СН2)nОСН3, или обозначает бензил, низший алкил, низшую алкокси-группу, -(СН2)nОСН3, или обозначает пиридин-3- или -4-ил, незамещенный или замещенный низшим алкилом, галогеном, морфолинилом, -(СН2)n-галогеном, -(СН2)nОСН3, -(СН2)n-морфолин-4-ил, или -(СН2)n-пирролидин-1-ил; R1 обозначает фенил, незамещенный или замещенный галогеном тетрагидропиран-4-ил, 3,6-дигидро-2Н-пиран-4-ил или морфолин-4-ил; n обозначает независимо друг от друга 1 или 2. 2 н. и 7 з.п.ф-лы.

где R обозначает фенил, незамещенный или замещенный галогеном или -СН2N(СН3)(СН2)nОСН3, или обозначает бензил, низший алкил, низшую алкокси-группу, -(СН2)nОСН3, или обозначает пиридин-3- или -4-ил, незамещенный или замещенный низшим алкилом, галогеном, морфолинилом, -(СН2)n-галогеном, -(СН2)nОСН3, -(СН2)n-морфолин-4-ил, или -(СН2)n-пирролидин-1-ил;
R1 обозначает фенил, незамещенный или замещенный галогеном тетрагидропиран-4-ил, 3,6-дигидро-2Н-пиран-4-ил или морфолин-4-ил;
n обозначает независимо друг от друга 1 или 2,
и их фармацевтически приемлемые кислотно-аддитивные соли.
2-Хлорметил-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метилизоникотинамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-6-метилникотинамид,
4-Фтор-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]бензамид,
N[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-морфолин-4-ил-изоникотинамид
или
N[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метоксиметилизоникотинамид.
4-{[(2-Метоксиэтил)метиламино]метил}-N-(4-метокси-7-фенилбензооксазол-2-ил)бензамид.
N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-6-метилникотинамид или
N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-2-метилизоникотинамид.
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В ВИДЕ РАЦЕМАТА ИЛИ ОТДЕЛЬНЫХ ЭНАНТИОМЕРОВ, ЯВЛЯЮЩИЕСЯ ИНГИБИТОРАМИ БИОСИНТЕЗА ЛЕЙКОТРИЕНА | 1992 |
|
RU2080321C1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2008-09-27—Публикация
2004-01-08—Подача