Предшествующий уровень техники
Область, к которой относится изобретение
В описанных здесь вариантах настоящее изобретение относится к антителам против антигена, моноцитарного хемоаттрактанта, белка-1, (МСР-1) и к применению таких антител. В частности, в соответствии со своими вариантами настоящее изобретение относится к полноразмерным человеческим моноклональным антителам против антигена (МСР-1). Настоящее изобретение относится к кодирующим нуклеотидным последовательностям и к аминокислотным последовательностям, содержащим молекулы тяжелой и легкой цепей иммуноглобулина, а более конкретно к последовательностям, соответствующим смежным последовательностям тяжелой и легкой цепей, охватывающим каркасные области и/или гипервариабельные области (области, определяющие комплементарность, CDR), в частности FR1-FR4 или CDR1-CDR3. Антитела согласно изобретению могут быть использованы для диагностики и лечения заболеваний, ассоциированных со сверхпродуцированием МСР-1. Настоящее изобретение также относится к гибридомам или к другим клеточным линиям, экспрессирующим указанные молекулы иммуноглобулина и моноклональные антитела.
Описание прототипов
Очевидно, что повышенное продуцирование ангиогенных факторов и пониженное продуцирование ингибиторов ангиогенеза раковыми клетками, везикулярными эндотелиальными клетками и другими стромальными клетками, индуцирует ангиогенез опухоли. Строма, состоящая из интерстициальных соединительных тканей, базальной мембраны, клеток крови, кровеносных сосудов и фибробластных клеток, окружает почти все клетки солидной опухоли. Взаимодействие между стромальными и раковыми клетками играет решающую роль в неоваскуляризации опухолей. Кроме того, макрофаги, которые также являются компонентами стромы, играют важную роль в ангиогенезе опухоли. (M. Ono et al., Cancer Chemother. Pharmacol. (1999) 43(Suppl.):S69-S71).
Макрофаги представляют собой крупные клетки стадии терминальной дифференцировки мононуклеарной фагоцитарной системы, а также представляют один из типов ключевых ангиогенных эффекторных клеток, продуцирующих большое число стимуляторов и ингибиторов роста. Известно, что ряд ангиогенных цитокинов продуцируется макрофагами, включая моноцитарный хемоаттрактант, белок-1, (МСР-1).
Известно, что МСР-1 является хемоаттрактантом для Т-лимфоцитов, базофилов и NK-клеток. МСР-1 является одним из наиболее эффективных молекул, обеспечивающих рекрутинг макрофагов. Макрофаги после их рекрутинга в участки воспаления или в опухоли могут генерировать различные ангиогенные цитокины, стимулируя тем самым патологический ангиогенез. Различные исследования выявили взаимосвязь между ангиогенезом, рекрутингом макрофагов и прогнозом для пациентов с различными видами опухолей (G. Fantanini et al., Int. J. Cancer (1996) 67:615; N. Weidner et al., J. Natl. Cancer. Inst. (1992) 84:1875). Leek и др. также продемонстрировали, что локальное увеличение числа макрофагов тесно связано с васкуляризацией и прогнозом тяжести заболевания у пациентов с раком молочной железы (Cancer Res. (1996) 56:4625). R. Huang и др. (Cancer Res. (2002) 62:2806-2812) показали, что коннексин 43 подавляет рост клеток глиобластомы человека путем ингибирования МСР-1, как было обнаружено с использованием технологии матричных массивов белка.
Goede и др. (Int. J. Cancer (1999) 82:765-770) впервые продемонстрировали, что МСР-1 обладает ангиогенной активностью, которая была эквивалентна активности VEGF в тесте, который проводили на кроличьей модели роговицы. В этой модели ангиогенная активность, индуцированная МСР-1, ассоциировалась с интенсивным рекрутингом макрофагов в кроличью роговицу. Salcedo и др. сообщали, что МСР-1 индуцирует хемотаксис человеческих эндотелиальных клеток в наномолярных концентрациях. Этот хемотаксический ответ ингибируется поликлональным антителом против человеческого МСР-1 (R. Salcedo et al., Blood (2000) 96(1):34-40).
МСР-1 представляет собой преобладающий цитокин, экспрессируемый в раковых клетках яичника (Negus R.P.M. et al., J. Clin. Investig. (1995) 95:2391-96; Sica A. et al., J. Immunology (2000) 164(2):733-8). Уровни МСР-1 также повышаются при ряде других раковых заболеваний человека, включая рак мочевого пузыря, рак молочной железы, рак легких и глиобластому.
Кроме того, в ряде исследований была выявлена важная роль МСР-1 в воспалении. Так, например, H.J. Anders et al. продемонстрировали экспрессию хемокинов и рецепторов хемокинов в процессе инициации и разложения иммунного комплекса, ассоциированного с гломерулонефритом (J. Am. Soc. Nephrol. (2001) 12:919-2001). Segerer и др. (J. Am. Soc. Nephrol. (2000) 11:2231-2242) также исследовали экспрессию МСР-1 и его рецептор, то есть хемокиновый рецептор 2 у человека с серповидноклеточным гломерулонефритом. J.A. Belperio и др. показали, что хемокин МСР-1/ССR2 играет решающую роль в патогенезе синдрома облитерирующего бронхиолита (J. Clin. Investig. (2001) 108:547-556). N.G. Frangogiannis et al. выявили роль МСР-1 в воспалительном ответе при инфаркте миокарда (Cardiovascular Res. (2002) 53:31-47). Gerard & Rollins (Nature Immunol. (2001) 2:108-115) и Reape & Groot (Atherosclerosis (1999) 147:213-225) также обсуждали роль МСР-1 в патогенезе атеросклероза и других заболеваний. Кроме того, Schmidt и Stern (Arterioscler. Thromb. Vasc. Biol. (2001) 21:297-299) описали взаимодействие МСР-1 при рестенозе.
Человеческий МСР-1, хемокин СС, состоящий из 76 аминокислот и имеющий на N-конце пироглутаминовую кислоту, был впервые выделен из нескольких источников, включая стимулированные фитогемаглютинином человеческие лимфоциты (Yoshimura T. et al., J. Immunol. (1989) 142:1956-62), клеточную линию глиомы человека (Yoshimura T. et al., J. Exp. Med. (1989) 169:1449-59) и миеломоноцитарную клеточную линию человека ТНР-1 (Matsushima K. et al., (1989) J. Exp. Med. (1989) 169:1485-90). МСР-1 был впервые описан как лимфоцитарный хемотаксический фактор (LDCF). Этот белок имеет другие названия, а именно опухолевый хемотаксический фактор (TDCF), происходящий от глиомы моноцитарный хемотаксический фактор (TDCF), происходящий от глиомы моноцитарный хемотаксический фактор (GDCF), хемотаксический фактор, происходящий от клеток гладкой мышцы (SMC-CF), моноцитарный фактор активации хемотаксиса (MCAF) и CCL2. Молекулярное клонирование МСР-1-кодирующей кДНК, (Furutani Y. et al., (1989) Biochem. Biophys. Res. Comm. (1989) 169:249-55; B.J. Rollins et al., Mol. Cell. Biol. (1989) 9:4687-95; Chang H.C. et al., Int. Immunol. (1989) 1:388-97) выявило присутствие открытой рамки считывания, состоящей из 99 аминокислот, включая сигнальный пептид, состоящий из 23 аминокислот. Мышиный гомолог гена МСР-1 был обозначен JE (B.J. Rollins et al., 1989).
В заявке WO 200189565, опубликованной 29 ноября 2001 г., были описаны поликлональные антитела против человеческого МСР-1 и было описано ингибирование роста опухоли у бестимусных ("голых") мышей-моделей благодаря использованию указанных поликлональных антител.
В описанных здесь вариантах настоящее изобретение относится к полноразмерным человеческим моноклональным антителам против человеческого МСР-1, которые блокируют МСР-1-индуцированный хемотаксис клеток ТНР-1, то есть клеточную линию пациента с острым моноцитарным лейкозом. Эти клетки были использованы в качестве суррогата для оценки миграции нормальных человеческих мононуклеарных клеток в кровоток. Инфильтрация мононуклеарных клеток, стимулированная МСР-1, играет определенную роль в патогенезе ряда воспалительных состояний, включая ревматоидный артрит, гломерулонефрит, атеросклероз, отторжение трансплантата, псориаз, рестеноз и аутоиммунные заболевания, такие как рассеянный склероз. Антитело, блокирующее активность МСР-1 и предотвращающее инфильтрацию моноцитов, может быть использовано для лечения этих и других воспалительных заболеваний.
Описание сущности изобретения
В описанных здесь вариантах настоящее изобретение относится к моноклональным антителам, которые, как было обнаружено, связываются с МСР-1 и влияют на функцию МСР-1. В других своих вариантах настоящее изобретение относится к человеческим анти-МСР-1 антителам и к препаратам, содержащим анти-МСР-1 антитела с нужными свойствами, а именно с перспективными терапевтическими свойствами, включая высокую аффинность связывания с МСР-1, способность нейтрализовать МСР-1 in vitro и способность ингибировать неоваскуляризацию солидных опухолей.
В одном из своих вариантов настоящее изобретение относится к полноразмерному человеческому моноклональному антителу, которое связывается с МСР-1 и имеет аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 42, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 122, 126, 130, 134, 138, 142 и 146. В одном из своих вариантов указанное антитело, кроме того, содержит аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144 и 148.
В соответствии с этим в одном из описанных здесь вариантов настоящее изобретение относится к выделенным антителам или к фрагментам этих антител, которые связываются с МСР-1. Как известно специалистам, указанными антителами предпочтительно могут быть, например, моноклональные, химерные и/или человеческие антитела. В описанных здесь вариантах настоящее изобретение также относится к клеткам, продуцирующим эти антитела.
В другом своем варианте настоящее изобретение относится к полноразмерному человеческому антителу, которое связывается с МСР-1 и которое содержит аминокислотную последовательность тяжелой цепи, включающей области CDR, имеющие последовательности, представленные на фиг.7 и 10. Следует отметить, что определение областей CDR может быть легко осуществлено специалистом. В общих чертах CDR представлены в описании настоящего изобретения в соответствии с нумерацией по Кэбату (Kabat et al., Sequences of Proteins of Immunological Interest vols. 1-3 (Firth Edition, NIH Publication 91-3242, Bethesda MD, 1991).
В еще одном своем варианте настоящее изобретение относится к полноразмерному человеческому антителу, которое связывается с МСР-1 и содержит аминокислотную последовательность легкой цепи, включающей CDR, имеющие последовательности, представленные на фиг.8 и 9.
В другом своем варианте настоящее изобретение относится к полноразмерному человеческому антителу, которое связывается с МСР-1 и содержит аминокислотную последовательность тяжелой цепи, имеющую области CDR, включающие последовательности, представленные на фиг.7 и 10, и аминокислотную последовательность легкой цепи, имеющую области CDR, включающие последовательности, представленные на фиг.8 и 9.
В другом своем варианте настоящее изобретение относится к полноразмерному человеческому антителу, которое связывается с другими членами семейства МСР-1, включая, но не ограничиваясь ими, МСР-2, МСР-3 и МСР-4. В другом своем варианте настоящее изобретение относится к антителу, которое конкурирует с полноразмерными человеческими антителами согласно изобретению за перекрестное связывание с МСР-1.
Следует отметить, что указанные варианты осуществления настоящего изобретения не ограничиваются любой конкретной формой антитела или способом его генерирования или продуцирования. Так, например, анти-МСР-1 антителом может быть полноразмерное антитело (например, антитело, содержащее интактную человеческую Fc-область) или фрагмент антитела (например, Fab, Fab' или F(ab')2). Кроме того, такое антитело может быть продуцировано из гибридомы, которая секретирует указанное антитело, или из рекомбинантно продуцированной клетки, которая была трансформирована или трансфецирована геном или генами, кодирующими указанное антитело.
В других своих вариантах настоящее изобретение относится к выделенным молекулам нуклеиновой кислоты, кодирующим любое из описанных здесь антител; к векторам, содержащим выделенные молекулы нуклеиновой кислоты, кодирующие любое из указанных здесь анти-МСР-1 антител; и к клетке-хозяину, трансформированной любой из указанных молекул нуклеиновой кислоты. Кроме того, в одном из своих вариантов настоящее изобретение относится к способу продуцирования анти-МСР-1 антитела путем культивирования клеток-хозяев в условиях, способствующих экспрессии молекулы нуклеиновой кислоты с продуцированием антитела, с последующим выделением указанного антитела.
В другом своем варианте настоящее изобретение относится к способу продуцирования высокоаффинных антител против МСР-1 путем иммунизации млекопитающего человеческим МСР-1 или его фрагментом и одним или несколькими последовательностями-ортологами или их фрагментами.
В описанных здесь вариантах настоящего изобретения предусматривается генерация и идентификация выделенных антител, которые специфически связываются с МСР-1. При неопластических заболеваниях, таких как опухоли, и при других воспалительных заболеваниях экспрессируются повышенные уровни МСР-1. Ингибирование биологической активности МСР-1 может приводить к предотвращению дальнейшей инфильтрации мононуклеарных клеток в ткани.
В другом своем варианте настоящее изобретение относится к способу диагностики заболеваний или состояний, в которых антитело, полученное в соответствии с настоящим изобретением, используется для детекции уровня МСР-1 в образце, взятом у пациента. В одном из вариантов осуществления изобретения образцом, взятом у пациента, является кровь или сыворотка. В других своих вариантах настоящее изобретение относится к способам идентификации факторов риска, установления диагноза заболевания и стадии заболевания, предусматривающим идентификацию сверхэкспрессии МСР-1 с использованием анти-МСР-1 антител.
В другом своем варианте настоящее изобретение относится к способу диагностики состояния, ассоциированного с экспрессией МСР-1 в клетке, предусматривающему контактирование указанной клетки с анти-МСР-1 антителом и детекцию присутствия МСР-1. Предпочтительными состояниями являются, но не ограничиваются ими, неопластические заболевания, включая, но не ограничиваясь ими, опухоли и раковые заболевания таких органов, как молочная железа, яичник, желудок, матка, слюнная железа, легкие, почки, толстая кишка, толстая и прямая кишка, щитовидная железа, поджелудочная железа, предстательная железа и мочевой пузырь, а также другие воспалительные заболевания, включая, но не ограничиваясь ими, ревматоидный артрит, гломерулонефрит, атеросклероз, псориаз, отторжение трансплантата, рестеноз и аутоиммунные заболевания.
В другом своем варианте настоящее изобретение относится к аналитическому набору для детекции МСР-1 и членов семейства МСР-1 в тканях и клетках млекопитающих и для скрининга на неопластические заболевания или воспалительные состояния, где указанный набор включает антитело, которое связывается с МСР-1, и средство для индикации реакции антитела с антигеном, если он присутствует. Предпочтительным антителом является моноклональное антитело. В одном из вариантов осуществления изобретения указанное антитело, которое связывается с МСР-1, является меченым. В другом варианте изобретения указанным антителом является немеченое "первое" антитело, а средство для индикации реакции включает меченое "второе" антитело, которое представляет собой антитело против иммуноглобулина. При этом предпочтительно указанное антитело мечено маркером, выбранным из группы, состоящей из флуорохрома, фермента, радионуклида и материала, не проницаемого для радиоактивного излучения.
В других своих вариантах настоящее изобретение относится к фармацевтическим композициям, содержащим эффективное количество антитела согласно изобретению в смеси с фармацевтически приемлемым носителем или разбавителем. В других вариантах осуществления изобретения анти-МСР-1 антитело или его фрагмент является конъюгированным с терапевтическим агентом. Указанным терапевтическим агентом может быть токсин или радиоизотоп. Предпочтительно указанные антитела могут быть использованы для лечения заболеваний, таких как, например, опухоли, включая, но не ограничиваясь ими, раковые заболевания таких органов, как молочная железа, яичник, желудок, матка, слюнная железа, легкие, почки, толстая кишка, толстая и прямая кишка, щитовидная железа, поджелудочная железа, предстательная железа и мочевой пузырь, а также воспалительных заболеваний, включая, но не ограничиваясь ими, ревматоидный артрит, гломерулонефрит, атеросклероз, псориаз, отторжение трансплантата, рестеноз и аутоиммунные заболевания.
В еще одном своем варианте настоящее изобретение относится к способу лечения заболеваний или состояний, ассоциированных с экспрессией МСР-1 у пациента, где указанный способ предусматривает введение пациенту эффективного количества анти-МСР-1 антитела. Такой способ может быть осуществлен in vivo. Указанным пациентом является млекопитающее, а предпочтительно человек. В предпочтительном варианте изобретения указанный способ предусматривает лечение опухолей, включая, но не ограничиваясь ими, раковые заболевания таких органов, как молочная железа, яичник, желудок, матка, слюнная железа, легкие, почки, толстая кишка, толстая и прямая кишка, щитовидная железа, поджелудочная железа, предстательная железа и мочевой пузырь. В другом варианте изобретения указанный способ предусматривает лечение воспалительных заболеваний, включая, но не ограничиваясь ими, ревматоидный артрит, гломерулонефрит, атеросклероз, псориаз, отторжение трансплантата, рестеноз и аутоиммунные заболевания. В других своих вариантах настоящее изобретение относится к способам лечения заболеваний и состояний, ассоциированных к экспрессией МСР-1, где указанные способы могут предусматривать идентификацию млекопитающего, нуждающегося в лечении заболевания, ассоциированного со сверхэкспрессией МСР-1, и введение указанному млекопитающему терапевтически эффективной дозы анти-МСР-1 антител.
В другом своем варианте настоящее изобретение относится к промышленному препарату, включающему контейнер, содержащий композицию, включающую анти-МСР-1 антитело и вкладыш, вложенный в указанную упаковку, или ярлык, прикрепленный к указанной упаковке, где указывается, что композиция может быть использована для лечения опухолевых и воспалительных заболеваний, характеризующихся сверхэкспрессией МСР-1. При этом предпочтительно, чтобы млекопитающему, а более предпочтительно человеку, было введено антитело против МСР-1. В своих предпочтительных вариантах настоящее изобретение относится к способу лечения опухолей, включая, но не ограничиваясь ими, раковые заболевания таких органов, как молочная железа, яичник, желудок, матка, слюнная железа, легкие, почки, толстая кишка, толстая и прямая кишка, щитовидная железа, поджелудочная железа, предстательная железа и мочевой пузырь, а также воспалительных заболеваний, включая, но не ограничиваясь ими, ревматоидный артрит, гломерулонефрит, атеросклероз, псориаз, отторжение трансплантата, рестеноз и аутоиммунные заболевания, такие как рассеянный склероз.
В некоторых вариантах осуществления изобретения после введения анти-МСР-1 антитела вводят клиренсстимулирующий агент для удаления циркулирующего антитела из кровотока.
В некоторых вариантах изобретения анти-МСР-1 антитела могут быть модифицированы в целях усиления их способности фиксировать комплемент и участвовать в вырабатывании комплементзависимой цитотоксичности (CDC). В одном из вариантов изобретения указанное анти-МСР-1 антитело может быть модифицировано, например, путем введения аминокислотных замен для изменения характера клиренса антител. Так, например, некоторые аминокислотные замены могут приводить к усилению клиренса антитела их организма. Альтернативно такие аминокислотные замены могут приводить к замедлению клиренса антитела из организма. В других вариантах изобретения указанное анти-МСР-1 антитело может быть модифицировано так, чтобы оно медленнее удалялось из организма.
В еще одном своем варианте настоящее изобретение относится к применению анти-МСР-1 антитела в целях приготовления лекарственного средства для лечения заболеваний, таких как опухолевые заболевания и воспалительные состояния. В одном из вариантов изобретения указанными опухолевыми заболеваниями являются опухоли и раковые заболевания таких органов, как молочная железа, яичник, желудок, матка, слюнная железа, легкие, почки, толстая кишка, толстая и прямая кишка, щитовидная железа, поджелудочная железа, предстательная железа и мочевой пузырь. В альтернативном варианте изобретения воспалительными состояниями являются, но не ограничиваются ими, ревматоидный артрит, гломерулонефрит, атеросклероз, псориаз, отторжение трансплантата, рестеноз и аутоиммунные заболевания.
Краткое описание графического материала
На фиг.1 показаны результаты исследования миграции моноцитов ТНР-1 в ответ на введение МСР-1, МСР-2, МСР-3 и МСР-4.
На фиг.2 показано дозозависимое ингибирование антителом 3.11.2 способности миграции клеток ТНР-1 в ответ на введение МСР-2.
На фиг.3 показано дозозависимое ингибирование антителом 3.11.2 способности миграции клеток ТНР-1 в ответ на введение МСР-3.
На фиг.4 показано влияние анти-МСР-1 антител 1.7.3 на рост клеток Panc-1 опухоли поджелудочной железы.
На фиг.5 представлен трехмерный корреляционный график потока кальция, хемотаксиса и аффинности антител против МСР-1.
На фиг.6 представлен трехмерный корреляционный график потока кальция, хемотаксиса и аффинности анти-МСР-1 антител в другой ориентации.
На фиг.7А проиллюстрировано сравнение с помощью программы Clustal W последовательностей анти-МСР-1 антител с использованием VH1-24, где указаны области CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма (фиг.7В).
На фиг.8А проиллюстрировано сравнение с помощью программы Clustal W последовательностей анти-МСР-1 антител с использованием VК-В3, где указаны области CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма (фиг.8В).
На фиг.9А проиллюстрировано сравнение с помощью программы Clustal W последовательностей анти-МСР-1 антител с использованием VК-08, где указаны области CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма (фиг.9В).
На фиг.10А проиллюстрировано сравнение с помощью программы Clustal W последовательностей анти-МСР-1 антител с использованием VH6-1, где указаны области CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма (фиг.10В).
Подробное описание предпочтительного варианта осуществления изобретения
В описанных здесь вариантах настоящее изобретение относится к моноклональным антителам, которые связываются с МСР-1. В некоторых вариантах изобретения указанные антитела связываются с МСР-1 и влияют на функцию МСР-1. В других своих вариантах настоящее изобретение относится к человеческим анти-МСР-1 антителам и к препаратам, содержащим анти-МСР-1 антитела с нужными свойствами, а именно с перспективными терапевтическими свойствами, включая высокую аффинность связывания с МСР-1, способность нейтрализовать МСР-1 in vitro и способность ингибировать рост и неоваскуляризацию солидных опухолей in vivo.
В соответствии с описанными здесь вариантами настоящее изобретение относится к выделенным антителам или к фрагментам этих антител, которые связываются с МСР-1. Как известно специалистам, указанными антителами могут быть преимущественно моноклональные, химерные и/или человеческие антитела. В описанных здесь вариантах настоящее изобретение также относится к клеткам, продуцирующим эти антитела.
В некоторых вариантах изобретения описанные здесь антитела обладают терапевтической ценностью. Антитело против МСР-1 может потенциально блокировать или ограничивать степень неоваскуляризации и роста опухоли. Многие раковые клетки, включая раковые клетки, происходящие от клеток глиобластомы и раковых клеток почек, экспрессируют рецептор МСР-1, CCR2. Коэкспрессия лиганда и рецептора в той же самой опухолевой клетке позволяет предположить, что МСР-1 может регулировать петлю аутокринного роста раковых клеток, которые экспрессируют оба этих компонента. Huang и др. (Cancer Res. (2002) 62:2806-2812) недавно сообщили, что МСР-1 может непосредственно влиять на рост и выживание опухолевых клеток, которые экспрессируют рецептор CCR2 для МСР-1. Таким образом, МСР-1 помимо его влияния на ангиогенез может также регулировать рост, миграцию и инвазию опухолевых клеток.
Кроме того, в некоторых своих вариантах настоящее изобретение относится к применению этих антител для диагностики или лечения заболевания. Так, например, в некоторых своих вариантах настоящее изобретение относится к способам и к антителам для ингибирования экспрессии МСР-1, ассоциированной с опухолями и воспалительными состояниями. Предпочтительно указанные антитела используются для лечения рака таких органов, как молочная железа, яичник, желудок, матка, слюнная железа, легкие, почки, толстая кишка, толстая и прямая кишка, щитовидная железа, поджелудочная железа, предстательная железа и мочевой пузырь, а также других воспалительных состояний, включая, но не ограничиваясь ими, ревматоидный артрит, гломерулонефрит, атеросклероз, псориаз, отторжение трансплантата, рестеноз и аутоиммунные заболевания. Настоящее изобретение относится к промышленным препаратам, предназначенным для такого лечения и содержащим антитела согласно изобретению. Кроме того, в описанных здесь вариантах настоящее изобретение относится к аналитическому набору, содержащему антитела, используемые для скрининга на опухолевые и воспалительные заболевания.
Кроме того, описанные здесь нуклеиновые кислоты и их фрагменты и варианты могут быть использованы (а) в качестве рекомбинантных или гетерологичных продуктов для направленного биосинтеза соответствующих кодируемых белков, полипептидов, фрагментов и вариантов, (b) в качестве зондов для детекции и количественной оценки описанных здесь нуклеиновых кислот, (с) в качестве матричных последовательностей для получения антисмысловых молекул и т.п., и эти их применения не ограничивается вышеуказанными примерами. Такие применения более подробно описаны ниже.
Кроме того, описанные здесь белки и полипептиды, а также их фрагменты и варианты могут быть использованы в способе, предусматривающем (а) их применение в качестве иммуногена для стимуляции анти-МСР-1 антитела, (b) их применение для захвата антигена в иммуногенном анализе на указанное антитело, (с) их применение в качестве мишени для скрининга на вещества, которые связываются с описанным здесь полипептидом МСР-1, и (d) их применение в качестве мишени для МСР-1-специфического антитела, такого как антитело, которое при его использовании в терапии влияет на молекулярную и/или клеточную функцию, опосредованную этой мишенью.
Благодаря сильному действию полипептида МСР-1, направленному на модуляцию клеточного роста, увеличение экспрессии или активности этого полипептида может быть использовано для стимуляции выживания клеток. И наоборот, снижение уровня экспрессии полипептида МСР-1 может быть использовано для индуцирования гибели клеток.
Другие варианты, отличительные признаки и т.п., относящиеся к антителам по изобретению, более подробно описаны ниже.
Список последовательностей
Нуклеотидные и аминокислотные последовательности вариабельной области тяжелой и легкой цепей репрезентативных человеческих анти-МСР-1 антител приводятся в нижеследующем систематизированном списке последовательностей, представленном в таблице 1.
Определения
Если это не оговорено особо, то все научные и технические термины, используемые в описании настоящего изобретения, имеют значения, хорошо известные специалистам. Кроме того, если это не очевидно из контекста изобретения, то под термином, употребляемым в единственном числе, могут подразумеваться также термины во множественном числе, и наоборот, под термином, употребляемым во множественном числе, могут подразумеваться также термины в единственном числе. В общих чертах номенклатура, используемая в описании методов молекулярной биологии, относящихся к клеточным и тканевым культурам, и химических методов получения белков и олиго- или полинуклеотидов, а также методов гибридизации, хорошо известна и широко применяется специалистами. Для получения рекомбинантных ДНК, для олигонуклеотидного синтеза, для культивирования ткани и для трансформации (например, электропорации, липофекции) используются стандартные методы. Ферментативные реакции и очистку проводят в соответствии с инструкциями производителей или в основном методами, известными специалистам, или методами, описанными в настоящей заявке. Упомянутые выше способы и процедуры обычно осуществляют в соответствии с методикой, хорошо известной специалистам, которая описана в различных общих и более конкретных цитируемых руководствах и обсуждается в описании настоящего изобретения. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. 1989). Номенклатура, используемая в описанных здесь лабораторных процедурах, в методах аналитической химии, химии органического синтеза и в медицинской и фармацевтической химии, хорошо известна и широко применяется специалистами. Для проведения химического синтеза и химических анализов, для получения фармацевтических препаратов и композиций, а также для их доставки пациентам и лечения пациентов применяются стандартные методы.
Термины, используемые в соответствии с описанными здесь вариантами настоящего изобретения, если это не оговорено особо, определены ниже:
Используемый здесь термин "выделенный полинуклеотид" означает полинуклеотид геномной ДНК, кДНК или синтезированный полинуклеотид или некоторые их комбинации, где указанный "выделенный полинуклеотид" по своему происхождению (1) не ассоциирован с полноразмерным полинуклеотидом или с частью полинуклеотида, с которыми он ассоциирован в природе, (2) функционально присоединен к полинуклеотиду, с которым он не связан в природе, или (3) не существует в природе как часть более крупной последовательности.
Используемый здесь термин "выделенный белок" означает белок, кодируемый кДНК или рекомбинантной ДНК, или синтезированный белок или некоторые их комбинации, где указанный "выделенный белок" по своему происхождению (1) не ассоциирован с природными белками, (2) не содержит других белков от того же самого источника, например, не содержит мышиных белков, (3) экспрессируется клеткой другого вида или (4) не существует в природе.
Используемый здесь термин "полипептид" представляет собой общий термин, означающий природный белок, фрагменты или аналоги полипептидной последовательности. Следовательно, природный белок, его фрагменты и аналоги представляют собой молекулы типа полипептида. В соответствии с настоящим изобретением предпочтительные полипептиды содержат молекулы тяжелой цепи человеческого иммуноглобулина и молекулы легкой каппа-цепи человеческого иммуноглобулина, а также молекулы антитела, образованные комбинациями, содержащими молекулы тяжелой цепи иммуноглобулина и молекулы легкой цепи иммуноглобулина, такие как молекулы легкой каппа-цепи иммуноглобулина и наоборот, а также их фрагменты и аналоги.
Используемый здесь термин "природный", относящийся к определенному объекту, означает, что данный объект может существовать в природе. Полипептидная или полинуклеотидная последовательность считается природной, если она присутствует в организме (включая вирусы), может быть выделена из природного источника и не является специально модифицированной человеком в лабораторных или в каких-либо иных условиях.
Используемый здесь термин "функционально присоединенный" относится к положениям описанных компонентов, присоединенных друг к другу способом, обеспечивающим их "правильное" функционирование. Регуляторная последовательность, "функционально присоединенная" к кодирующей последовательности, лигирована так, чтобы экспрессия кодирующей последовательности достигалась в условиях, совместимых с функционированием регуляторных последовательностей.
Используемый здесь термин "регуляторная последовательность" означает полинуклеотидные последовательности, которые необходимы для осуществления экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Природа таких регуляторных последовательностей варьируется в зависимости от типа организма-хозяина, например у прокариотов такие регуляторные последовательности обычно включают промотор, сайт связывания с рибосомой и последовательность терминации транскрипции, а у эукариотов такие регуляторные последовательности обычно включают промоторы и последовательность терминации транскрипции. Термин "регуляторные последовательности" включает, как минимум, все компоненты, присутствие которых необходимо для экспрессии и процессинга, и может также включать дополнительные компоненты, присутствие которых является желательным, например, для функционирования лидерных последовательностей и последовательностей партнеров по связыванию.
Используемый здесь термин "полинуклеотид" означает полимерную форму нуклеотидной последовательности длиной, по крайней мере, в 10 нуклеотидов, либо рибонуклеотидной или дезоксинуклеотидной последовательности, либо модифицированную форму, состоящую из нуклеотидов любого типа. Этот термин также включает одноцепочечные и двухцепочечные формы ДНК.
Используемый здесь термин "олигонуклеотид" означает природные и модифицированные нуклеотиды, связанные друг с другом природными или неприродными олигонуклеотидными связями. Олигонуклеотиды представляют собой полинуклеотидную подпоследовательность, обычно содержащую 200 или менее нуклеотидов. Предпочтительно олигонуклеотиды имеют длину 10-60 нуклеотидов, а наиболее предпочтительно 12, 13, 14, 15, 16, 17, 18, 19 или 20-40 нуклеотидов. Обычно олигонуклеотиды являются одноцепочечными, например олигонуклеотиды, используемые для зондов, однако они могут быть и двухцепочечными, например олигонуклеотиды, используемые для конструирования генного мутанта. Олигонуклеотиды настоящего изобретения могут быть смысловыми или антисмысловыми.
Используемый здесь термин "природные нуклеотиды" означает дезоксирибонуклеотиды и рибонуклеотиды. Используемый здесь термин "модифицированные нуклеотиды" означает нуклеотиды с модифицированными или с замещенными сахарными группами и т.п. Используемый здесь термин "олигонуклеотидные связи" включает такие олигонуклеотидные связи, как фосфортиоат, фосфордитиоат, фосфорселеноат, фосфордиселеноат, фосфоранилотиоат, фосфоранилидат, фосфорамидат и т.п. См., например, LaPlanche et al., Nucl. Acids. Res. 14:9081 (1986); Stec et al., J. Am. Chem. Soc. 106:6077 (1984); Stein et al., Nucl. Acids. Res. 16:3209 (1988); Zon et al., Anti-Cancer Drug Design 6:539 (1991); Zon et al., Oligonucleotides and Analogues: A Practical Approach, pp.87-108 (F.Eckstein Ed., Oxford University Press, Oxford England (1991)); Stec et al., патент США № 5151510; Uhlmann & Peyman Chemical Reviews, 90:543 (1990). Если необходимо, олигонуклеотид может включать метку для детекции.
Используемый здесь термин "селективная гибридизация" относится к детектируемому и специфическому связыванию. Полинуклеотиды, олигонуклеотиды и их фрагменты настоящего изобретения селективно гибридизуются с цепями нуклеиновой кислоты в таких условиях гибридизации и промывки, которые значительно минимизируют количество детектируемого связывания с неспецифическими нуклеиновыми кислотами. Для достижения селективной гибридизации, известной специалистам и обсуждаемой в настоящей заявке, могут быть использованы условия высокой жесткости. В общих чертах гомология последовательностей нуклеиновой кислоты полинуклеотидов, олигонуклеотидов и фрагментов настоящего изобретения и последовательности представляющей интерес нуклеиновой кислоты будет составлять, по крайней мере, 80%, а более предпочтительно, по крайней мере, 85%, 90%, 95%, 99% и 100%. Две аминокислотных последовательности являются гомологичными, если их последовательности являются частично или полностью идентичными. Так, например, 85%-ная гомология означает, что 85% аминокислот являются идентичными при сопоставлении этих двух последовательностей на максимальное соответствие путем их выравнивания. "Пробелы" (в любой из двух сопоставляемых последовательностей) позволяют максимизировать соответствие; при этом предпочтительная длина пробела составляет 5 или менее, а более предпочтительно 2 или менее. Альтернативно и предпочтительно две последовательности белка (или полипептидные последовательности, происходящие от этих последовательностей и имеющие длину, по крайней мере, 30 аминокислот) считаются гомологичными в общепринятом смысле этого слова, если они имеют цену выравнивания более чем 5 (в единицах стандартного отклонения) при сопоставлении, осуществляемом с использованием программы ALIGN с матрицей данных по мутации и со штрафом за "пробел" 6 или более. См. M.O. Dayhoff, Atlas of Protein Sequence and Structure, Vol. 5, 101-110 и Supplement 2 to Vol. 5, 1-10 (National Biomedical Research Foundation, 1972). Две последовательности или их части являются более предпочтительными гомологами, если их аминокислоты идентичны на 50% или более при их оптимальном выравнивании с использованием программы ALIGN. Используемый здесь термин "соответствует", относящийся к сравниваемой последовательности, означает, что полинуклеотидная последовательность является гомологичной (то есть идентичной, но эволюционно не близкородственной) всей или части эталонной полинуклеотидной последовательности, или этот термин означает, что данная полипептидная последовательность идентична эталонной полипептидной последовательности. В противоположность этому используемый здесь термин "комплементарный" означает, что комплементарная последовательность гомологична всей или части эталонной полинуклеотидной последовательности. Для иллюстрации можно сказать, что нуклеотидная последовательность "ТАТАС" соответствует эталонной последовательности "ТАТАС" и комплементарна последовательности "GTATA".
Для описания сходства между двумя или более полинуклеотидными или аминокислотными последовательностями используются следующие термины: "эталонная последовательность", "окно сравнения", "идентичность последовательностей", "процент идентичности последовательностей" и "значительная идентичность". Термин "эталонная последовательность" означает последовательность, используемую в качестве основы для сравнения последовательностей; эталонная последовательность может представлять собой подпоследовательность более крупной последовательности, например сегмент полноразмерной кДНК или генной последовательности, имеющейся в списке последовательностей, либо эта последовательность может содержать полноразмерную кДНК или генную последовательность. Вообще говоря, эталонная последовательность имеет длину, по крайней мере, в 18 нуклеотидов или 6 аминокислот, обычно, по крайней мере, 24 нуклеотида или 8 аминокислот, а чаще всего, по крайней мере, 48 нуклеотидов или 16 аминокислот. Поскольку каждая из двух полинуклеотидных или аминокислотных последовательностей (1) может содержать последовательность (то есть часть полноразмерной полинуклеотидной или аминокислотной последовательности), которая является сходной у этих двух молекул, и (2) может, кроме того, содержать последовательность, которая отличается у этих двух полинуклеотидных или аминокислотных последовательностей, то сравнение последовательностей двух (или более) молекул обычно осуществляют путем сопоставления последовательностей этих двух молекул по "окну сравнения" для идентификации и сравнения локальных областей гомологии последовательностей. Используемый здесь термин "окно сравнения" означает концептуальный сегмент, состоящий, по крайней мере, из 18 нуклеотидов в смежных положениях или из 6 аминокислот, где полинуклеотидная последовательность или аминокислотная последовательность могут сравниваться с эталонной последовательностью, состоящей, по крайней мере, из 18 нуклеотидов в смежных положениях или из 6 аминокислот, и где часть полинуклеотидной последовательности в окне сравнения может содержать добавления, делеции, замены и т.п. (то есть пробелы), которые составляют 20 процентов или менее по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) и которые используются для оптимального выравнивания этих двух последовательностей. Оптимальное выравнивание последовательностей, осуществляемое для их сопоставления по окну сравнения, может быть осуществлено с использованием алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math. 2:482 (1981), алгоритма выравнивания областей гомологии Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), метода поиска сходства Pearson & Lipman, Proc. Natl. Acad. Sci. (USA) 85:2444 (1988), компьютерной реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA in the Wisconsin Genetics Software Package Release 7.0 (Genetics Computer Group, 575 Science Dr., Madison, Wis.) (Geneworks или пакет программ MacVector) или с использованием программы контроля и построения наилучшего выравнивания (то есть получения наиболее высокого процента гомологии по окну сравнения), достигаемого различными методами.
Термин "идентичность последовательностей" означает, что две полинуклеотидные или аминокислотные последовательности являются идентичными (то есть на нуклеотидном или аминокислотном уровне) в окне сравнения. Термин "процент идентичности последовательностей" означает процент, который вычисляют путем сравнения двух оптимально выравниваемых последовательностей по окну сравнения; определения числа положений идентичных оснований нуклеиновых кислот (например, А, Т, С, G, U или I) или остатков в обеих последовательностях с получением числа соответствующих положений; деления этого числа соответствующих положений на общее число положений в окне сравнения (то есть на размер окна); и умножения полученного результата на 100 с получением процента идентичности последовательностей. Используемый здесь термин "значительная идентичность" означает характеристику полинуклеотидной или аминокислотной последовательности, где указанный полинуклеотид или указанная аминокислота составляют последовательность, которая, по крайней мере, на 85%, предпочтительно, по крайней мере, на 90-95%, а более предпочтительно, по крайней мере, на 99% идентична эталонной последовательности в окне сравнения, составляющем, по крайней мере, 18 нуклеотидов (6 аминокислот), а часто в окне сравнения, составляющем, по крайней мере, 24-48 нуклеотидов (8-16 аминокислот), где процент идентичности последовательностей вычисляют путем сравнения эталонной последовательности с последовательностью, которая может включать делеции или добавления, которые в целом составляет 20 процентов или менее по сравнению с эталонной последовательностью в окне сравнения. Эталонная последовательность может представлять собой подпоследовательность более крупной последовательности.
Используемые здесь двадцать главных аминокислот имеют общепринятые аббревиатуры. См. Immunology - A Synthesis (2d ed., Golub E.S. & Gren D.R. eds., Sinauer Associates, Sunderland, Mass. 1991). Стереоизомеры (например, D-аминокислоты) двадцати главных аминокислот, неприродных аминокислот, таких как α,α-дизамещенные аминокислоты, N-алкилзамещенных аминокислот, молочной кислоты и редких аминокислот могут также служить подходящими компонентами для описанных здесь полипептидов настоящего изобретения. Примерами редких аминокислот являются 4-гидроксипролин, γ-карбоксиглутамат, ε-N,N,N-триметиллизин, ε-N-ацетиллизин, О-фосфосерин, N-цетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, σ-N-метиларгинин и другие аналогичные аминокислоты и иминокислоты (например, 4-гидроксипролин). В используемой здесь системе обозначения полипептидов в соответствии с общепринятой практикой и принятым соглашением о терминологии левый конец аминокислоты называется аминоконцом, а правый конец аминокислоты называется карбоксиконцом.
Аналогичным образом, если это не оговорено особо, левым концом одноцепочечных полинуклеотидных последовательностей является 5'-конец, а направление слева направо для двухцепочечных полинуклеотидных последовательностей считается 5'-направление (5' →). Направление присоединения растущих РНК-транскриптов 5' → 3' называется направлением транскрипции, при этом области последовательностей на ДНК-цепи, имеющей такую же последовательность, как и РНК-цепь, которые находятся со стороны 5'-конца по отношению к 5'-концу РНК-транскрипта, называются "предшествующими последовательностями (то есть расположенными выше по ходу транскрипции)", а области последовательностей на ДНК-цепи, имеющей такую же последовательность, как и РНК-цепь, которые находятся со стороны 3'-конца по отношению к 3'-концу РНК-транскрипта, называются "последующими последовательностями" (то есть расположенными ниже по ходу транскрипции).
Термин "в основном идентичный", используемый по отношению к полипептидам, означает, что две пептидных последовательности при их оптимальном выравнивании, например, с помощью программ GAP или BESTFIT с использованием "весов" пробелов по умолчанию имеют, по крайней мере, 80%-ную идентичность последовательностей, предпочтительно, по крайней мере, 90%-ную идентичность последовательностей, более предпочтительно, по крайней мере, 95%-ную идентичность последовательностей, а наиболее предпочтительно, по крайней мере, 99%-ную идентичность последовательностей. При этом предпочтительно, чтобы положения остатков, которые не являются идентичными, отличались по своим консервативным аминокислотным заменам. Термин "консервативные аминокислотные замены" означает взаимозаменяемые остатки, составляющие сходные боковые цепи. Так, например, группу аминокислот, имеющих алифатические боковые цепи, составляют глицин, аланин, валин, лейцин и изолейцин; группу аминокислот, имеющих алифатические гидроксильные боковые цепи, составляют серин и треонин; группу аминокислот, имеющих амидсодержащие боковые цепи, составляют аспарагин и глутамин; группу аминокислот, имеющих ароматические боковые цепи, составляют фенилаланин, тирозин и триптофан; группу аминокислот, имеющих основные боковые цепи, составляют лизин, аргинин и гистидин; а группу аминокислот, имеющих серусодержащие боковые цепи, составляют цистеин и метионин. Предпочтительными консервативными аминокислотными заменами являются замены в пределах таких групп, как валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутаминовая кислота-аспарагиновая кислота и аспарагин-глутамин.
Как обсуждается в настоящей заявке, небольшие изменения в аминокислотных последовательностях антител или молекул иммуноглобулина рассматриваются как изменения, входящие в объем настоящего изобретения, при условии что такие изменения в аминокислотной последовательности будут составлять, по крайней мере, 75%, более предпочтительно, по крайней мере, 80%, 90%, 95%, а наиболее предпочтительно 99%. В частности, рассматриваются также консервативные аминокислотные замены. Консервативными заменами являются замены, которые входят в семейство аминокислот, являющихся родственными по их боковым цепям. Генетически кодируемые аминокислоты обычно подразделяются на следующие семейства: (1) кислотные аминокислоты = аспартат, глутамат; (2) основные аминокислоты = лизин, аргинин, гистидин; (3) неполярные аминокислоты = аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные аминокислоты = глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Более предпочтительными семействами являются: серин и треонин, принадлежащие к семейству алифатических гидроксикислот; аспарагин и глутамин, принадлежащие к семейству амидсодержащих кислот; аланин, валин, лейцин и изолейцин, принадлежащие к семейству алифатических аминокислот; и фенилаланин, триптофан и тирозин, принадлежащие к семейству ароматических аминокислот. Так, например, следует ожидать, что отдельная замена лейцина изолейцином или валином, замена аспартата глутаматом, замена треонина серином или аналогичная замена какой-либо аминокислоты структурно родственной аминокислотой не будет оказывать значительно влияния на связывание или свойства полученной молекулы, особенно если эта замена не является аминокислотной заменой в каркасном участке. Продуцирование функционального пептида в результате такой аминокислотной замены может быть легко установлено путем анализа на специфическую активность полипептидного производного. Такие анализы подробно описаны в настоящей заявке. Фрагменты или аналоги молекул антител или иммуноглобулинов могут быть легко получены любым специалистом. Предпочтительно, чтобы амино- и карбоксиконцы этих фрагментов или аналогов находились вблизи границ функциональных доменов. Структурные и функциональные домены могут быть идентифицированы путем сравнения данных нуклеотидных или аминокислотных последовательностей с последовательностями, имеющимися в известных общедоступных базах данных или в базах данных, находящихся в частной собственности. Предпочтительно для идентификации мотивов последовательностей или конформационных доменов предсказанных белков, которые встречаются в других белках с известной структурой и/или функцией, используются методы компьютерного сравнения. Методы идентификации последовательностей белка, которые образуют известную трехмерную структуру, известны специалистам и описаны в работе Bowie et al., Science 253:164 (1991). Таким образом, описанные там примеры продемонстрировали, что каждый специалист может легко выявить мотивы последовательностей и структурные конформации, которые могут быть использованы для определения структурных и функциональных доменов в соответствии с настоящим изобретением.
Предпочтительными аминокислотными заменами являются замены, которые приводят: (1) к снижению чувствительности к протеолизу, (2) к снижению чувствительности к окислению, (3) к изменению аффинности связывания для образования белковых комплексов, (4) к изменению аффинности связывания и (4) к сообщению или модификации других физико-химических или функциональных свойств таких аналогов. Указанными аналогами могут быть различные мутеины с последовательностью, отличающейся от природной пептидной последовательности. Так, например, в природную последовательность (предпочтительно в ту часть полипептида, которая расположена за пределами доменобразующих межмолекулярных контактов) могут быть внесены одна или множество аминокислотных замен (предпочтительно консервативных аминокислотных замен). Консервативная аминокислотная замена не должна значительно влиять на структурные свойства родительской последовательности (например, аминокислотная замена не должна приводить к разрушению спирали, присутствующей в родительской последовательности, или к нарушению вторичной структуры других типов, которая характеризует родительскую последовательность). Примеры известных вторичных и третичных структур полипептида описаны в работе Protein, Structures and Molecular Principles (Creighton ed., W.H. Freeman and Company, New York 1984); Introduction to Protein Structure (Branden C. & Tooze J. eds., Garland Publishing, New York, N,Y. 1991) и у Thornton et al., Nature 354:105 (1991).
Используемый здесь термин "фрагмент полипептида" относится к полипептиду, который имеет аминоконцевую и/или карбоксиконцевую делецию, но в котором остальная аминокислотная последовательность в соответствующих положениях аминокислот идентична природной аминокислотной последовательности, происходящей, например, от полноразмерной кДНК-последовательности. Фрагменты обычно имеют длину, по крайней мере, 5, 6, 8 или 10 аминокислот, а предпочтительно, по крайней мере, 14 аминокислот, более предпочтительно, по крайней мере, 20 аминокислот, обычно, по крайней мере, 50 аминокислот, а еще более предпочтительно, по крайней мере, 70 аминокислот. Используемый здесь термин "аналог" означает полипептиды, которые состоят из сегмента, имеющего, по крайней мере, 25 аминокислот, в основном идентичных части выведенной аминокислотной последовательности, и которые обладают, по крайней мере, одним из нижеследующих свойств, а именно, они (1) специфически связываются с МСР-1 в подходящих условиях связывания; (2) могут блокировать соответствующее связывание с МСР-1 или (3) способны ингибировать рост клеток, экспрессирующих МСР-1 in vitro или in vivo. Обычно полипептидные аналоги по сравнению с природной последовательностью содержат консервативную аминокислотную замену (добавление или делецию). Обычно аналоги имеют длину, по крайней мере, 20 аминокислот, предпочтительно, по крайней мере, 50 аминокислот или более, а часто они имеют такую же длину, как и полноразмерный природный полипептид.
Пептидные аналоги обычно используются в фармацевтической промышленности в качестве непептидных лекарственных средств со свойствами, аналогичными свойствам матричного пептида. Непептидные соединения этого типа называются "пептидными миметиками" или "пептидомиметиками". Fauchere, J. Adv. Drug. Res. 15:29 (1986); Veber & Freidinger, TINS p.392 (1985), и Evans et al., J. Med. Chem. 30:1229 (1987). Такие соединения часто разрабатывают с помощью компьютерной программы молекулярного моделирования. Пептидные миметики, структурно сходные с терапевтически ценными пептидами, могут быть использованы для достижения эквивалентного терапевтического или профилактического эффекта. Обычно пептидомиметики являются структурно сходными с репрезентативным полипептидом (то есть с полипептидом, который обладает биохимическими свойствами или фармакологической активностью), таким как человеческое антитело, и они обычно имеют одну или несколько пептидных связей, необязательно замененных связью, выбранной из группы, состоящей из -СН2NH-, -СН2S-, -СН2-СН2-, -СН=СН- (цис и транс), -СОСН2-, -Н(ОН)СН2- и -СН2SO-, в соответствии с хорошо известной методикой. Системная замена одной или нескольких аминокислот консенсусной последовательности D-аминокислотой того же типа (например, замена L-лизина на D-лизин) может быть использована для генерирования более стабильных пептидов. Кроме того, пептиды с конформационными ограничениями, содержащие консенсусную последовательность или вариант последовательности, в основном идентичный консенсусной последовательности, могут быть генерированы известными методами (Rizo & Gierasch, Ann. Rev. Biochem. 61:387 (1992)), например, путем присоединения внутренних цистеиновых остатков, способных образовывать внутримолекулярные дисульфидные мостики, которые циклизуют данный пептид.
Термин "антитело" или "пептид(ы) антитела" означает интактное антитело или его связывающий фрагмент, который конкурирует с интактным антителом за специфическое связывание. Связывающие фрагменты получают методами рекомбинантных ДНК или путем ферментативного или химического гидролиза интактных антител. Связывающими фрагментами являются Fab, Fab', F(ab')2, Fv и одноцепочечные антитела. Антитела, если они не являются "биспецифическими" или "бифункциональными", рассматриваются как антитела, каждое из которых имеет идентичные сайты связывания. Антитело в основном ингибирует адгезию рецептора к контррецептору, при этом избыток антитела снижает количество рецептора, связанного с контррецептором, по крайней мере, примерно на 20%, 40%, 60% или 80%, а чаще всего примерно более чем на 85% (как было измерено в анализе на конкурентное связывание in vitro).
Термин "эпитоп" означает любую детерминанту белка, способную специфически связываться с иммуноглобулином или Т-клеточным рецептором. Эпитопные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и в основном имеют специфическую трехмерную структуру, а также специфические зарядные характеристики. Считается, что антитело специфически связывается с антигеном, если константа диссоциации составляет ≤1 мкМ, предпочтительно ≤100 нМ, а наиболее предпочтительно ≤10 нМ.
Используемый здесь термин "агент" означает химическое соединение, смесь химических соединений, биологическую макромолекулу или экстракт, полученный из биологических материалов.
Используемый здесь термин "активный" или "активность" относится к форме(ам) полипептида МСР-1, которая(ые) сохраняет(ют) биологическую и/или иммунологическую активность нативных или встречающихся в природе полипептидов МСР-1, где термин "биологическая активность" означает другую биологическую функцию, то есть функцию, не являющуюся способностью индуцировать вырабатывание антитела против антигенной детерминанты (либо ингибирующую, либо стимулирующую), которой обладает нативный или встречающийся в природе полипептид МСР-1, а термин "иммунологическая" активность означает способность индуцировать вырабатывание антитела против антигенной детерминанты, которой обладает нативный или встречающийся в природе полипептид МСР-1.
Термин "лечение" означает как терапевтическое лечение, так и профилактические или превентивные меры, которые направлены на предупреждение или ослабление (снижение) патологического состояния или расстройства у индивидуума, подвергаемого лечению. Индивидуумом, нуждающимся в лечении, является индивидуум, который либо уже страдает данным расстройством, либо имеет предрасположенность к развитию указанного расстройства, или индивидуум, который нуждается в проведении профилактических мер по предупреждению возникновения данного расстройства.
Термин "млекопитающее" означает любое животное, относящееся к классу млекопитающих, включая человека, других приматов, таких как мартышки, шимпанзе и гориллы; домашних и сельскохозяйственных животных, животных зоопарков и животных, участвующих в спортивных мероприятиях, лабораторных животных или домашних питомцев, таких как собаки и кошки; а также крупный рогатый скот, лошадей, овец, свиней, коз, кроликов, грызунов и т.п. Предпочтительным млекопитающим, подвергаемым лечению в соответствии с настоящим изобретением, является человек.
Используемый здесь термин "носители" означает фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клеток или млекопитающего, которому вводят такие носители в соответствующих дозах и концентрациях. Наиболее часто используемым фармацевтически приемлемым носителем является водный рН-забуференный раствор. Примерами физиологически приемлемых носителей являются буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярный полипептид (имеющий примерно менее 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; спирты ряда сахаров, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как TWEENTM, полиэтиленгликоль (ПЭГ) и PLURONICSTM.
Гидролиз антител папаином приводит к продуцированию двух идентичных антигенсвязывающих фрагментов, называемых "Fab"-фрагментами, каждый из которых имеет один антигенсвязывающий сайт, и другого Fc-фрагмента, обозначение которого указывает на его способность к быстрой кристаллизации. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антигенсвязывающих сайта и обладает способностью связываться с антигеном.
"Fv"-фрагмент представляет собой минимальный фрагмент антитела, содержащий полный сайт распознавания антигена и антигенсвязывающий сайт антитела. Эта область состоит из димера, который включает один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи, жестко связанные нековалентной связью. Эта область имеет такую конфигурацию, при которой три CDR каждого вариабельного домена взаимодействуют друг с другом и определяют антигенсвязывающий сайт на поверхности димера VH-VL. В целом шесть CDR сообщают данному антителу антигенсвязывающую специфичность. Однако, например, даже один вариабельный домен (например, VH или VL-часть Fv-димера или половина Fv-димера, содержащая только три CDR, специфичных к антигену) может обладать способностью распознавать антиген и связываться с этим антигеном, хотя, возможно, с более низкой аффинностью, чем полный сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab-фрагменты отличаются от Fab'-фрагментов несколькими остатками, присоединенными у карбоксиконца домена СН1 тяжелой цепи, включая один или несколько цистеинов от шарнирной области антитела. По своей природе F(ab')2-фрагменты антитела продуцируются как пары Fab'-фрагментов, которые связаны между собой шарнирными цистеиновыми остатками. Известны также и другие химические связи фрагментов антител.
Термин "твердая фаза" означает безводную матрицу, к которой могут быть присоединены описанные здесь антитела. Примерами таких твердых фаз, описанных в настоящей заявке, являются твердые фазы, состоящие частично или полностью из стекла (например, из стекла с регулируемым размером пор), полисахарида (например, агарозы), полиакриламида, полистирола, поливинилового спирта и силиконов. В некоторых вариантах осуществления изобретения в зависимости от условий применения твердыми фазами могут служить лунки аналитического планшета, а в других случаях твердой фазой может служить колонка для очистки (например, аффинная хроматографическая колонка). Этот термин также включает дисперсную твердую фазу, состоящую из дискретных частиц, например, описанную в патенте США № 4275149.
Используемый здесь термин "липосома" означает небольшую везикулу, состоящую из липидов, фосфолипидов и/или поверхностно-активных веществ различных типов, которые могут быть использованы для доставки лекарственного средства (такого как полипептид МСР-1 или антитело против этого полипептида) млекопитающему. Компоненты липосом образуют обычно упорядоченный бислой, аналогичный расположению липидов в биологических мембранах.
Используемый здесь термин "небольшая молекула" означает молекулу, имеющую молекулярную массу примерно менее 500 дальтон.
Используемый здесь термин "метка" или "меченый" относится к включению детектируемого маркера, например, путем введения радиоактивно меченной аминокислоты или присоединения к полипептиду биотинильной группы, которая может быть детектирована по меченому авидину (например, стрептавидину, содержащему флуоресцентный маркер или ферментативную активность, которая может быть детектирована оптическими или колориметрическими методами). В некоторых случаях метка или маркер могут также обладать терапевтическими свойствами. При этом могут быть использованы различные методы мечения полипептидов и гликопротеинов, хорошо известные специалистам. Примерами меток, используемых для полипептидов, являются, но не ограничиваются ими: радиоизотопы или радионуклиды (например, 3Н, 14С, 15N, 35S, 90Y, 94Tc, 111In, 125I, 131I), флуоресцентные метки (например, ФИТЦ, родамин, комплекс "лантанид-фосфор"), ферментативные метки (например, пероксидаза хрена, β-галактозидаза, люцифераза, щелочная фосфатаза), хемилюминесцентные метки, биотинильные группы, предварительно определенные полипептидные эпитопы, распознаваемые вторичной репортерной молекулой (например, двухкомпонентная последовательность лейциновой молнии, сайты связывания для "вторых" антител, металлосвязывающие домены, эпитопные метки). В некоторых вариантах осуществления изобретения метки присоединяют посредством спейсерных групп различной длины для уменьшения возможного стерического затруднения.
Используемый здесь термин "фармацевтическое средство или лекарственное средство" означает химическое соединение или композицию, способные индуцировать нужный терапевтический эффект при его соответствующем введении пациенту. Другие общепринятые химические термины, используемые в настоящей заявке, описаны в руководстве The McGraw-Hill Dictionary of Chemical Terms (Parker S. Ed, McGraw-Hill, San Francisco (1985)).
Используемый здесь термин "в основном чистый" относится к рассматриваемой молекуле, которая является преобладающей молекулой (то есть присутствует в более высокой молярной концентрации по сравнению с другими отдельными молекулами, имеющимися в данной композиции), а предпочтительно этот термин означает "в основном очищенную фракцию", то есть композицию, в которой рассматриваемая молекула составляет, по крайней мере, примерно 50 процентов (на молярном уровне) от всех присутствующих макромолекул данного вида. Обычно в основном чистая композиция составляет примерно более 80 процентов от всех макромолекул, присутствующих в данной композиции, более предпочтительно примерно более 85%, 90%, 95% и 99%. Наиболее предпочтительно, чтобы рассматриваемая молекула была очищена почти до полной гомогенности (где примеси, присутствующие в данной композиции, не могут быть детектированы стандартными методами детекции) так, чтобы указанная композиция состояла в основном из макромолекул одного вида.
Термин "пациент" включает человека и животных.
Структура антител
Известно, что основным структурным элементом антитела является тетрамер. Каждый тетрамер состоит их двух идентичных пар полипептидных цепей, каждая из которых имеет одну "легкую" цепь (примерно 25 кДа) и одну "тяжелую" цепь (примерно 50-70 кДа). Аминоконцевая часть каждой цепи включает вариабельную область примерно из 100-110 или более аминокислот, ответственных главным образом за распознавание антигена. Карбоксиконцевая часть каждой цепи определяет константную область, ответственную главным образом за эффекторную функцию. Легкие цепи человеческого антитела классифицируются как легкие каппа- и лямбда-цепи. Тяжелые цепи классифицицируются как мю-, дельта-, гамма-, альфа- или эпсилон-цепи, которые определяют изотип антитела, такой как IgM, IgD, IgG, IgA и IgE соответственно. В легкой и тяжелой цепях вариабельные и константные области связаны "J"-областью, состоящей примерно из 12 или более аминокислот, при этом тяжелая цепь также включает "D"-область, состоящую примерно из 10 или более аминокислот. См., в общих чертах, Fundamental Immunology Ch. 7 (Paul W. ed., 2nd ed., Raven Press, N.Y. (1989)). Вариабельные области каждой пары легкая/тяжелая цепь образуют антигенсвязывающий сайт антитела. Таким образом, интактное антитело имеет два связывающих сайта. За исключением бифункциональных или биспецифических антител эти два сайта связывания являются одинаковыми.
Все цепи содержат относительно консервативные каркасные области (FR), имеющие одинаковую общую структуру и соединенные тремя гипервариабельными областями, также называемыми областями, определяющими комплементарность, или CDR. CDR этих двух цепей от каждой пары расположены между каркасными областями, что обеспечивает их связывание со специфическим эпитопом. Как легкая, так и тяжелая цепи от N-конца и до С-конца содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Присвоение аминокислот для каждого домена осуществляют в соответствии с нумерацией Кэбата, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. 1991)(1987) или Clothia and Lesk, J. Mol. Biol. 196:901-17 (1987); Clothia et al., Nature 342:878-83 (1989).
Биспецифическое или бифункциональное антитело представляет собой искусственное гибридное антитело, имеющее две различных пары "тяжелая/легкая цепь" и два различных сайта связывания. Биспецифические антитела могут быть получены различными методами, включая слияние гибридом или связывание Fab'-фрагментов. См., например, Songsivilai & Lachmann, Clin. Exp., Immunol. 79:315-21 (1990); Kosteny et al., J. Immunol. 148:1547-53 (1992). Продуцирование биспецифических антител по сравнению с продуцированием стандартных антител может оказаться довольно трудоемким процессом, при этом выход и степень чистоты, достигаемые для биспецифических антител, обычно бывают ниже, чем для стандартных антител. Биспецифические антитела не существуют в форме фрагментов, имеющих один сайт связывания (например, Fab, Fab' и Fv).
Человеческие антитела и "гуманизация" антител
Использование человеческих антител позволяет избежать некоторых проблем, возникающих при использовании антител, имеющих мышиные или крысиные вариабельные и/или константные области. Присутствие таких мышиных или крысиных белков может приводить к быстрому выведению антител, либо оно может приводить к вырабатыванию у пациента иммунного ответа против данного антитела. Во избежание использования мышиных или крысиных антител могут быть генерированы полностью человеческие антитела путем введения функционального участка человеческого антитела грызуну так, чтобы у этого грызуна вырабатывались полностью человеческие антитела.
Человеческие антитела
Один из методов генерирования полностью человеческих антител заключается в использовании мышей штаммов XenoMouse®, которые были сконструированы так, чтобы они содержали в своем геноме гены тяжелой и легкой цепи человеческого антитела. Так, например, мыши XenoMouse®, содержащие 245 т.п.н. и 190 т.п.н.-фрагменты локуса человеческой тяжелой цепи и локуса человеческой легкой каппа-цепи с конформацией зародышевой линии, описаны Green et al., Nature Genetics 7:13-21 (1994). В работе Green et al. подробно описано введение более 80% антител из всего спектра человеческих антител посредством использования мегануклеотидных фрагментов локусов человеческой тяжелой цепи и легкой каппа-цепи с конформацией зародышевой линии, YAC соответственно. См. Mendez et al., Nature Genetics 15:146-56 (1997) и заявку на патент США, рег.№ 08/759620, поданную 3 декабря 1996 г. Кроме того, были генерированы мыши XenoMouse®, которые содержали весь локус легкой лямбда-цепи (заявка на патент США, рег.№ 60/334508, поданная 30 ноября 2001 г.). Были также генерированы мыши XenoMouse®, которые продуцировали множество изотипов антител (см., например, WO 00/76310). Мыши штамма XenoMouse® поставлялись фирмой Abgenix, Inc. (Fremont, CA).
Генерирование мышей XenoMouse® дополнительно обсуждается и описывается в следующих заявках на патент США: рег.№ 07/466008, поданной 12 января 1990 г., 07/610515, поданной 8 ноября 1990 г., 07/919297, поданной 24 июля 1992 г., 07/922649, поданной 30 июля 1992 г., 08/031801, поданной 15 марта 1993 г., 08/112848, поданной 27 августа 1993 г., 08/234145, поданной 28 апреля 1994 г., 08/376279, поданной 20 января 1995 г., 08/430938, поданной 27 апреля 1995 г., 08/464584, поданной 5 июня 1995 г., 08/464582, поданной 5 июня 1995 г., 08/463191, поданной 5 июня 1995 г., 08/462837, поданной 5 июня 1995 г., 08/486853, поданной 5 июня 1995 г., 08/486857, поданной 5 июня 1995 г., 08/486859, поданной 5 июня 1995 г., 08/462513, поданной 5 июня 1995 г., 08/724752, поданной 2 октября 1996 г., и 08/759620, поданной 3 декабря 1996 г.; и в патентах США №№ 6162963, 6150584, 6114598, 6075181 и 5939598, и в японских патентных заявках №№ 3068180В2, 3068506В2 и 3068507В2. См. также Mendez et al., Nature Genetics 15:146-156 (1997) и Green & Jakobovits J. Exp., Med. 188:483-495 (1998). См. также Европатент № ЕР 463151В1, опубликованный 12 июня 1996 г., Международную патентную заявку № WO 94/02602, опубликованную 3 февраля 1994 г., Международную патентную заявку № WO 96/34096, опубликованную 31 октября 1996 г., WO 98/24893, опубликованную 11 июня 1998 г., и WO 00/76310, опубликованную 21 декабря 2000 г.
В альтернативном методе другие исследователи, включая исследователей GenPharm International, Inc., использовали "минилокусы". Этот подход с использованием минилокусов заключается в том, что был имитирован локус экзогенного Ig путем включения фрагментов (отдельных генов) из локуса Ig. Таким образом, из одного или нескольких генов VH, одного или нескольких генов DН, одного или нескольких генов JН, константной мю-области, и второй константной области (предпочтительно константной гамма-области) создавали конструкцию для введения животному. Этот способ описан в патенте США № 5545807, Surani et al., и в патентах США №№ 5545806, 5625825, 5625126, 5633425, 5661016, 5770429, 5789650, 5814318, 5877397, 5874299 и 6225458, Lonberg и Kay, в патентах США №№ 5591669 и 6023010, Krimpenfort & Berns, в патентах США №№ 5612205, 5721367 и 5789215, Berns et al., и в патенте США № 5643763, Choi & Dunn, и в Международных заявках на патент США; GenPharm: рег.№ 07/574748, поданной 29 августа 1990 г., 07/575962, поданной 31 августа 1990 г., 07/810279, поданной 17 декабря 1991 г., 07/853408, поданной 18 марта 1992 г., 07/904068, поданной 23 июня 1992 г., 07/990860, поданной 16 декабря 1992 г., 08/053131, поданной 26 апреля 1993 г., 08/096762, поданной 22 июля 1993, 08/155301, поданной 18 ноября 1993 г., 08/161739, поданной 3 декабря 1993 г., 08/165699, поданной 10 декабря 1993 г., и 08/209741, поданной 9 марта 1994 г. См. также Европатент № 546073В1, Международные патентные заявки №№ WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852 и WO 98/24884, и патент США № 5981175. См. также Taylor et al., (1992), Chen et al., (1993), Tuaillon et al., (1993), Choi et al., (1993), Londberg et al., (1994), Taylor et al. (1994) и Tuaillon et al., (1995), Fishwild et al., (1996).
Kirin продемонстрировал генерирование человеческих антител у мышей, которым путем слияния микроклеток вводили большие фрагменты хромосом или целые хромосомы. См. Европейские патентные заявки №№ 773288 и 843961.
Специалисты фирмы Lidak Pharmaceuticals (в данном случае Xenorex) также продемонстрировали вырабатывание человеческих антител у мышей SCID, модифицированных путем инъекции этим мышам незлокачественных зрелых лейкоцитов периферической крови, взятых от человека-донора. После стимуляции иммуногеном эти модифицированные мыши продуцировали иммунный ответ, характерный для человека-донора, который заключался в вырабатывании человеческих антител. См. патенты США №№ 5476996 и 5698767.
Ответы в виде продуцирования человеческого антимышиного антитела (НАМА) были положены в основу промышленного получения химерных или других "гуманизованных" антител. Хотя химерные антитела имеют человеческую константную область и мышиную вариабельную область, однако предполагается, что в этом случае будет наблюдаться некоторый уровень ответов в виде вырабатывания человеческого антитела против химерного антитела (НАСА), особенно при непрерывном введении или при многоразовом введении этого антитела. Таким образом, для снижения уровней НАМА- или НАСА-ответа и/или ослабления его эффекта было бы желательно получить полностью человеческие антитела против МСР-1.
Методы "гуманизации" антител и технология их представления
Как обсуждалось выше в связи генерированием человеческого антитела, предпочтительно продуцировать антитела с пониженной иммуногенностью. До определенной степени это может быть осуществлено методами "гуманизации" и методами представления антител с использованием соответствующих библиотек. При этом следует отметить, что мышиные антитела или антитела от других видов могут быть гуманизованы или "приматизованы" с использованием техники, хорошо известной специалистам. См., например, Winter & Harris, J. Immunol. Today 14:43-46 (1993) и Wright et al., Crit, Rewiews in J. Immunol., 12:125-168 (1992). Такое представляющее интерес антитело может быть сконструировано методами рекомбинантных ДНК с заменой СН1-, СН2-, СН3-областей, шарнирных доменов и/или каркасных доменов соответствующими последовательностями человеческого антитела (см, WO 92/02190 и патенты США №№ 5530101, 5585089, 5693761, 5693792, 5714350 и 5777085). Кроме того, использование кДНК Ig для конструирования генов химерных иммуноглобулинов известно специалистам (Liu et al., PNAS 84:3439 (1987) and J. Immunol. 139:3521 (1987)). мРНК выделяют из гибридомы или других антителопродуцирующих клеток и используют для продуцирования кДНК. Представляющая интерес кДНК может быть амплифицирована с помощью полимеразной цепной реакции с использованием специфических праймеров (патенты США №№ 4683195 и 4683202). Альтернативно может быть создана библиотека, которую скринируют для выделения нужной последовательности. Затем ДНК-последовательность, кодирующую вариабельную область антитела, присоединяют к последовательности константной области человеческого антитела. Последовательности генов константных областей человеческого антитела можно найти у Кэбата (Kabat et al., Sequences of Proteins of Immunological Interest", N.I.H. publication no.91-3242 (1991). Гены С-области человеческого антитела можно легко получить из известных клонов. Выбор изотипа может быть продиктован нужными эффекторными функциями, такими как фиксация комплемента, или активностью антитела, участвующего в продуцировании антителозависимой клеточной цитотоксичности. Предпочтительными изотипами являются IgG1, IgG3 и IgG4. При этом могут быть использованы константные области легкой цепи человеческого антитела, каппа- или лямбда-цепи. Затем химерное гуманизованное антитело экспрессируют стандартными методами.
Фрагменты антитела, такие как Fv, F(ab').sub2 и Fab, могут быть получены путем расщепления интактного белка, например путем расщепления протеазой или химического расщепления. Альтернативно может быть сконструирован усеченный ген. Так, например, для получения усеченной молекулы химерный ген, кодирующий часть F(ab')2-фрагмента, должен включать ДНК-последовательности, кодирующие СН1-домен и шарнирную область Н-цепи, за которыми следует кодон терминации трансляции.
Консенсусные последовательности J-областей Н- и L-цепей могут быть использованы в качестве праймеров в целях конструирования олигонуклеотидов для введения подходящих рестрикционных сайтов в J-область и последующего присоединения сегментов V-области к сегментам С-области человеческого антитела. кДНК С-области может быть модифицирована с помощью сайтнаправленного мутагенеза для введения рестрикционного сайта в соответствующее положение человеческой последовательности.
Экспрессирующими векторами являются плазмиды, ретровирусы, YAC, происходящие от EBV эписомы и т.п. Подходящим вектором является вектор, который кодирует функциональную полноразмерную последовательность СН или CL человеческого иммуноглобулина, при этом соответствующие рестрикционные сайты конструируют так, чтобы можно было легко встраивать и экспрессировать любую последовательность VH или VL. В таких векторах сплайсинг обычно происходит между донорным сайтом сплайсинга во встроенной J-области и акцепторным сайтом сплайсинга, расположенным перед С-областью человеческого антитела, а также в областях сплайсинга, которые присутствуют в экзонах СН человеческого антитела. Полиаденилирование и терминация транскрипции происходят в нативных хромосомных сайтах, расположенных ниже кодирующих областей. Полученное химерное антитело может быть присоединено к любому сильному промотору, включая LTR ретровируса, например ранний промотор SV-40 (Okayama et al., Mol. Cell. Bio. 3:280 (1983)), LTR вируса саркомы Рауса (Gorman et al., P.N.A.S. 79:6777 (1982)) и LTR вируса мышиного лейкоза Молони (Grosschedl et al., Cell 41:885 (1985)). Следует также отметить, что могут быть использованы и нативные промоторы Ig и т.п.
Кроме того, человеческие антитела или антитела других видов могут быть генерированы с использованием техники представления, включая, но не ограничиваясь ими, фаговое представление, ретровирусное представление, рибосомное представление, и других методов, хорошо известных специалистам, и полученные молекулы могут быть подвергнуты дополнительному созреванию, такому как аффинное созревание, в соответствии с хорошо известной методикой. Wright & Harris, см. выше, Hanes and Plucthau, PNAS USA 94:4937-4942 (1997) (рибосомное представление), Parmley & Smith, Gene 73:305-318 (1988) (фаговое представление), Scott TIBS 17:241-245 (1992), Cwirla et al., PNAS USA 87:6378-6382 (1990), Russel et al., Nucl. Acids. Res. 21:1081-1085 (1993), Hoganboom et al., Immunol. Reviews 130:43-68 (1992), Chiswell & McCafferty, TIBTECH 10:80-84 (1992) и патент США № 5733743. Если техника представления применяется для продуцирования антител, которые не являются человеческими, то такие антитела могут быть гуманизованы, как описано выше.
С использованием этой техники могут быть продуцированы антитела против МСР-1-экспрессирующих клеток, против самого МСР-1 и его форм, против его эпитопов или пептидов, и против библиотек, экспрессирующих МСР-1 (см., например, патент США № 5703057), которые могут быть затем скринированы на вышеуказанные активности, как описано выше.
Получение антител
Антитела настоящего изобретения были получены с использованием описанной ниже технологии для получения мышей XenoMouse®. Эти мыши способны продуцировать молекулы человеческого иммуноглобулина и антитела и являются дефицитными по продуцированию молекул мышиного иммуноглобулина и антител. Технология, используемая для этих целей, описана в патентах, в патентных заявках и в работах, цитируемых в разделе "Предшествующий уровень техники" настоящей заяви. Однако конкретно предпочтительный вариант получения трансгенных мышей и антител описан в заявке на патент США, рег.№ 08/759620, поданной 3 декабря 1996 г., и в Международных патентных заявках: в № WO 98/24893, опубликованной 11 июня 1998 г., и в WO 00/76310, опубликованной 21 декабря 2000 г. См. также Mendez et al., Nature Genetics 15:146-156 (1997).
Описанные здесь антитела представляют собой нейтрализующие антитела, обладающие высокой аффинностью к человеческому МСР-1. Кроме того, в некоторых вариантах осуществления изобретения эти антитела перекрестно реагируют с крысиным МСР-1. Для генерирования моноклональных антител или поликлональных антител против N-концевого человеческого МСР-1 уже применялось несколько различных методов. Эти методы предусматривают иммунизацию полноразмерным человеческим МСР-1 (hMCP-1) или коровьим МСР-1 (bMCP-1) (Vieira et al., Braz. J. Med. Biol. Res. 21:1005-1011 (1988)), а также синтетическими пептидами человеческого МСР-1 (1-34 или 1-37) (Visser et al., Acta Endocrinol 90:90-102 (1979)), Logue et al. J. Immunol. Methods 137:159-66 (1991)) и различными антигенными пептидами (МАР) hMCP-1 (1-10), hMCP-1 (9-18) и hMCP-1 (24-37) (Magerlein et al., Drug. Res. 48:783-87 (1998)). Эти методы не позволяют продуцировать антитела, подходящие для терапевтического лечения человека. (См. раздел настоящей заявки, озаглавленный "Введение и приготовление терапевтических средств", где описаны терапевтические критерии). Получить антитела с высокой аффинностью к hMCP-1 достаточно трудно, поскольку В-клетки являются толерантными к данному пептиду. Однако Bradwell и др. (1999) продемонстрировали, что иммунизация смесью МАР (мембраносвязанных белков), служащих для доставки человеческого МСР-1 (1-34) и коровьего МСР-1 (1-34), а затем смесью белков МАР, служащих для доставки hMCP-1 (51-84) и bМСР-1 (51-86), является эффективной для преодоления В-клеточной толерантности к МСР-1 у человека с неоперабельной опухолью.
Описанные здесь способы направлены на преодоление В-клеточной толерантности, а также на продуцирование полноразмерного моноклонального антитела, подходящего для использования в терапии или в диагностике. Животных XenoMouse® иммунизировали синтетическими пептидами МСР-1 (hMCP-1 (1-34) и rMCP-1 (1-34)), поскольку синтетические пептиды уже были с успехом использованы для продуцирования антител, специфичных к эндогенному человеческому МСР-1 (Visser et al., (1979)). Кроме того, поскольку N-конец мышиного МСР-1 является в высокой степени консервативным для человеческого МСР-1 (85% идентичность) и крысиного МСР-1 (91%), то такая комбинация пептидов была использована в качестве иммуногена для преодоления В-клеточной толерантности к мышиному МСР-1 посредством молекулярной мимикрии, что позволяло продуцировать высокоаффинные человеческие антитела против человеческого МСР-1. Эти пептиды были присоединены к гемоцианину лимфы улитки и эмульгированы в полном адъюванте Фрейнда или в неполном адъюванте Фрейнда для усиления иммуногенности этих белков.
После иммунизации лимфатические клетки (такие как В-клетки) выделяли у антителоэкспрессирующих мышей, и такие выделенные клеточные линии подвергали слиянию с клеточной линией миелоидного типа для получения иммортализованных гибридомных клеточных линий. Такие гибридомные клеточные линии были скринированы и отобраны для идентификации гибридомных клеточных линий, продуцирующих антитела против нужного антигена. В настоящей заявке описано получение множества гибридомных клеточных линий, продуцирующих антитела, специфичные к МСР-1. Кроме того, в настоящей заявке приводится характеризация антител, продуцируемых такими клеточными линиями, включая анализы на нуклеотидную и аминокислотную последовательности тяжелой и легкой цепей указанных антител.
В некоторых своих вариантах настоящее изобретение относится к продуцированию множества гибридомных клеточных линий, продуцирующих антитела против МСР-1. Другие варианты изобретения относятся к антителам, которые связываются с другими членами семейства МСР-1, включая МСР-2, МСР-3 и МСР-4, и нейтрализуют их активность. Супернатанты также скринируют на иммунореактивность против фрагментов МСР-1 для построения эпитопной карты различных антител против родственных человеческих хемокинов и против крысиного МСР-1 и мышиного ортолога МСР-1, JE, а также для определения перекрестной реактивности молекул. В других своих вариантах настоящее изобретение относится к характеризации антител, продуцируемых такими клеточными линиями, включая анализы на нуклеотидные и аминокислотные последовательности тяжелой и легкой цепей указанных антител.
Альтернативно вместо слияния с миеломными клетками для получения гибридом может быть проведен прямой анализ В-клеток. Так, например, CD19+-В-клетки могут быть выделены у гипериммунизированных мышей XenoMouse® и подвергнуты пролиферации и дифференцировке с получением антителосекретирующих клеток плазмы. Затем антитела, выделенные из клеточных супернатантов, скринируют с помощью ELISA на реактивность с иммуногеном МСР-1. Эти супернатанты также скринируют на иммунореактивность против фрагментов МСР-1 для построения эпитопной карты различных антител против родственных человеческих хемокинов и против крысиного МСР-1 и мышиного ортолога МСР-1, JE, а также для определения перекрестной реактивности молекул. Одиночные клетки плазмы, секретирующие антитела с нужной специфичностью, затем выделяют с использованием гемолитического анализа методом бляшек на МСР-1-специфические антитела (Babcook et al., Proc. Natl. Acad. Sci. USA, 93:7843-7848 (1996)). Клетками, подвергаемыми лизису предпочтительно являются бараньи эритроциты (SRBC), покрытые антигеном МСР-1. В присутствии В-клеточной культуры, содержащей клетки плазмы, секретирующие нужный иммуноглобулин и комплемент, образование бляшек указывает на специфический МСР-1-опосредованный лизис бараньих эритроцитов, окружающих представляющие интерес клетки плазмы. Может быть выделена одиночная антигенспецифичная клетка плазмы, присутствующая в центре бляшки, а затем из этой одиночной клетки плазмы может быть получена генетическая информация о специфичности данного антитела. С использованием ПЦР с обратной транскриптазой может быть клонирована ДНК, кодирующая вариабельные области тяжелой и легкой цепей данного антитела. Такая клонированная ДНК может быть затем встроена в подходящий экспрессирующий вектор, предпочтительно в векторный кластер, такой как pcDNA, а более предпочтительно pcDNA, содержащий константные домены тяжелой и легкой цепей иммуноглобулина. Генерированный вектор может быть затем трансфецирован в клетки-хозяева, предпочтительно в клетки СНО, и культивирован в подходящей питательной среде, модифицированной, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности. Выделение множества одиночных клеток плазмы, продуцирующих антитела против МСР-1, описано ниже. Кроме того, генетический материал, кодирующий специфическое антитело против МСР-1, может быть выделен и встроен в подходящий экспрессирующий вектор, который затем может быть трансфецирован в клетки-хозяева.
В общих чертах, антителами, продуцируемыми гибридомами, были тяжелые цепи человеческого IgG2 вместе с полноразмерными легкими каппа- или лямбда-цепями человеческого антитела. В некоторых вариантах изобретения указанные антитела имеют тяжелые цепи человеческого IgG4, а также тяжелые цепи человеческого IgG2. Такими антителами могут быть также человеческие антитела других изотипов, включая IgG1. Антитела, обладающие высокой аффинностью, обычно имеют КD примерно от 10-6 до 10-12 М или менее, как показывают измерения в твердой фазе и в растворе. Антитела, имеющие КD, по крайней мере, 10-11 М, являются предпочтительными для ингибирования активности МСР-1.
Учитывая важность такого параметра, как аффинность, для терапевтического применения анти-МСР-1 антител, следует отметить, что анти-МСР-1 антитела могут быть генерированы, например, комбинаторным методом, и такие антитела могут быть проанализированы на аффинность связывания. Одним из способов, который может быть использован для этих целей, является выделение кДНК тяжелой цепи антитела, полученного, как описано выше, с подтверждением достаточно высокой аффинности к МСР-1, и объединение этой кДНК с кДНК легкой цепи второго антитела, полученного, как описано выше, с подтверждением достаточно высокой аффинности к МСР-1 для получения третьего антитела. Аффинность полученного третьего антитела измеряют, как описано в настоящей заявке, и антитела с нужными константами диссоциации выделяют и охарактеризовывают. Альтернативно легкая цепь любого из описанных выше антител может быть использована в качестве инструмента для генерирования тяжелой цепи, которая при объединении с легкой цепью будет обладать высокой аффинностью к МСР-1 или наоборот. Эти вариабельные области тяжелой цепи в указанной библиотеке могут быть выделены у неиммунизированных животных или у гипериммунизированных животных либо они могут быть генерированы искусственно из библиотек, содержащих последовательности вариабельной тяжелой цепи, которые отличаются CDR-областями, либо они могут быть генерированы любыми другими методами, которые позволяют продуцировать вариабельность в генах, кодирующих CDR-области вариабельной области тяжелой цепи (такими как неспецифический или направленный мутагенез). Эти CDR-области, а в частности CDR3, могут значительно отличаться по длине или по идентичности своих последовательностей от последовательности тяжелой цепи, первоначально соединенной с исходным антителом. Полученная библиотека может быть затем скринирована на высокую аффинность связывания с МСР-1 в целях генерирования терапевтически ценной молекулы антитела, обладающей свойствами исходного антитела (высокой аффинностью и нейтрализующей способностью). Для генерирования терапевтически ценной молекулы антитела с уникальной вариабельной областью тяжелой цепи может быть применен аналогичный способ, предусматривающий использование тяжелой цепи или вариабельной области тяжелой цепи. Кроме того, новая вариабельная область тяжелой цепи или вариабельная область легкой цепи могут быть затем использованы, как описано выше для идентификации новой вариабельной области легкой цепи или вариабельной области тяжелой цепи, что позволяет генерировать новую молекулу антитела.
Другим комбинаторным методом, который может быть использован в этих целях, является осуществление мутагенеза на тяжелой и/или легкой цепях зародышевой линии, которое продемонстрировало возможность его использования для получения описанных здесь антител настоящего изобретения, а в частности гипервариабельных областей (CDR). Аффинность полученных антител измеряют, как описано в настоящей заявке, и антитела с нужными константами диссоциации выделяют и охарактеризовывают. После отбора предпочтительного партнера по связыванию кодирующая его последовательность (или последовательности) может быть использована для генерирования рекомбинантных антител, описанных выше. Подходящие методы проведения мутагенеза в олигонуклеотиде известны специалистам, и такими методами являются химический мутагенез, например, с использованием бисульфата натрия, ферментативное введение с ошибкой включения и облучение. При этом следует отметить, что описанное здесь изобретение включает антитела, которые являются в основном идентичными, как определено выше, антителам, подробно описанным в настоящей заявке, при их продуцировании путем мутагенеза или какими-либо другими способами. Кроме того, антитела с определенными здесь консервативными или неконсервативными аминокислотными заменами, сделанными в антителах, подробно описанных в настоящей заявке, входят в объем вариантов настоящего изобретения.
Другим комбинаторным методом, который может быть использован в этих целях, является экспрессия областей CDR, а в частности вышеописанных областей CDR3 в окружении каркасных областей, происходящих от других генов вариабельных областей. Так, например, CDR1, CDR2 и CDR3 тяжелой цепи одного анти-МСР-1 антитела могут быть экспрессированы в окружении каркасных областей других генов вариабельных областей тяжелой цепи. Аналогичным образом области CDR1, CDR2 и CDR3 легкой цепи анти-МСР-1 антитела могут быть экспрессированы в окружении каркасных областей других генов вариабельных областей легкой цепи. Кроме того, последовательности зародышевой линии этих CDR-областей могут быть экспрессированы в окружении других генов вариабельных областей тяжелой и легкой цепей. Полученные антитела могут быть проанализированы на специфичность и аффинность и могут быть использованы для генерирования новой молекулы антитела.
Как будет описано, антитела, полученные в соответствии с настоящим изобретением, могут экспрессироваться в различных клеточных линиях. Последовательности, кодирующие конкретные антитела, могут быть использованы для трансформации подходящей клетки-хозяина млекопитающего. Трансформация может быть осуществлена любым известным методом введения полинуклеотидов в клетку-хозяина, включая, например, упаковку полинуклеотидов в вирус (или в вирусный вектор) и трансфекцию клетку-хозяина вирусом (или вектором), либо она может быть осуществлена в соответствии с процедурами трансфекции, известными специалистам, как описано в патентах США №№ 4399216, 4912040, 4740461 и 4959455. Используемая процедура трансформации зависит от трансформируемого хозяина. Методы введения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны специалистам и предусматривают опосредуемую декстраном трансфекцию, преципитацию фосфатом кальция, опосредуемую полибреном трансфекцию, слияние протопластов, электропорацию, инкапсулирование полинуклеотида(ов) в липосомах и прямую микроинжекцию ДНК в ядра.
Клеточные линии млекопитающих, подходящие в качестве хозяев для экспрессии, хорошо известны специалистам, и такими клеточными линиями являются многие иммортализованные клеточные линии, которые могут быть взяты из Американской коллекции типовых культур (АТСС), включая, но не ограничиваясь ими, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почек детеныша хомячка (ВНК), клетки почек обезьяны (COS), клетки человеческой гепатоцеллюлярной карциномы (например, Hep G2) и различные другие клеточные линии. Особенно предпочтительные клеточные линии могут быть выбраны путем детекции высоких уровней экспрессии клеточными линиями и определения степени продуцирования антител с конститутивными МСР-1-связывающими свойствами.
Дополнительные критерии для терапевтических антител
Как обсуждается в настоящем изобретении, функция анти-МСР-1 антител, очевидно, имеет очень важное значение в механизме его действия или, по крайней мере, в части этого механизма. Анти-МСР-1 антитела настоящего изобретения могут быть сконструированы так, чтобы они обладали эффекторной функцией, включая комплементзависимую цитотоксичность (CDC) и антителозависимую клеточную цитотоксичность (ADCC). Такими функциями обладает ряд изотипов антител, включая, но не ограничиваясь ими: мышиное IgM, мышиное IgG2а, мышиное IgG2b, мышиное IgG3, человеческое IgM, человеческое IgG1 и человеческое IgG3. Следует отметить, что генерируемые антитела не должны изначально иметь указанный изотип, скорее, наоборот, генерируемое антитело может иметь любой изотипа, и этот изотип может быть затем переключен стандартными методами, хорошо известными специалистам. Такими методами являются прямые методы рекомбинантных ДНК (см., например, патент США № 4816397 и патент США № 6331415), методы слияния клеток (см., например, патенты США №№ 5916771 и 6207418) и т.п.
В методе слияния клеток предусматривается получение миеломы и другой клеточной линии, которая имеет тяжелую цепь любого нужного изотипа, и получение другой миеломы или другой клеточной линии, которая имеет легкую цепь. Затем такие клетки могут быть подвергнуты слиянию и может быть выделена клеточная линия, экспрессирующая интактное антитело.
Так, например, обсуждаемыми здесь антителами против МСР-1 являются человеческие анти-МСР-1 антитела IgG2 и IgG4. Если такое антитело обладает нужной способностью связываться с молекулой МСР-1, то его изотип может быть легко переключен на изотипы, в результате чего могут быть генерированы человеческие IgM, человеческие IgG1 или человеческие IgG3, IgA1 или IgGА2, которые еще сохраняют ту же самую вариабельную область (то есть область, определяющую специфичность антитела и определенную степень его аффинности). Такая молекула может затем приобретать способность к фиксации комплемента и участвовать в продуцировании CDC (в комплементзависимой цитотоксичности).
В соответствии с этим при генерировании антител-кандидатов, которые удовлетворяют нужным "структурным" требованиям, обсуждаемым выше, могут быть получены антитела, которые обладают, по крайней мере, некоторыми нужными "функциональными" признаками посредством переключения изотипов.
Картирование эпитопов
Иммуноблот-анализ
Связывание описанных здесь антител с МСР-1 может быть оценено различными методами. Так, например, МСР-1 может быть подвергнут электрофорезу в ДСН-ПААГ и проанализирован с помощью иммуноблотинга. Электрофорез в ДСН-ПААГ может быть проведен в отсутствие или в присутствии восстановителя. Такие химические модификации могут приводить к метилированию цистеиновых остатков. В соответствии с этим можно определить, могут ли описанные здесь анти-МСР-1 антитела связываться с линейным эпитопом на МСР-1.
Активация поверхностей посредством лазерной десорбции/ионизации (SELDI)
Картирование эпитопов для описанных здесь анти-МСР-1 антител может быть также осуществлено методом SELDI. Для определения участков взаимодействия белков между собой используются массивы SELDI ProteinChip®. Сначала осуществляют специфический захват антигенов антителами, ковалентно иммобилизованными на поверхности белкового чипа (Protein Chip), путем проведения инкубирования и промывки. Связанные антигены могут быть детектированы методом лазерной десорбции и непосредственно проанализированы для определения их массы. Такие фрагменты связанного антигена называются "эпитопом" белка.
Метод SELDI позволяет непосредственно детектировать отдельные компоненты в комплексных молекулярных композициях и осуществлять количественное картирование по другим компонентам быстрым высокочувствительным и масштабируемым способом. Метод SELDI предусматривает использование массива различных поверхностных химических молекул для захвата и представления большого числа отдельных белковых молекул в целях их детекции посредством индуцированной лазером десорбции. Успех метода SELDI частично определяется миниатюризацией и интеграцией на поверхности ("чипа") множества функций, каждая из которых зависит от различных технологий. Биочипы SELDI и зонды SELDI других типов представляют собой поверхности, "активированные" так, чтобы они стали активными участниками в иммобилизации, очистке (разделения), презентации, детекции и характеризации отдельных молекул-мишеней (например, белков) или популяций анализируемых молекул.
Один белковый биочип SELDI, загруженный только исходным образцом, может прочитываться тысячи раз. Белковые биочипы SELDI от LumiCyte содержат такое количество позиций, где может быть иммобилизовано 10000 адресуемых белков на 1 квадратный сантиметр. В каждой позиции может быть выявлено присутствие двенадцати отдельных белков. При сравнении данных о составе белка для каждой позиции, и при объединении этих уникальных данных, полученная композиционная карта дает представление о наборе признаков, которые, в целом, могут быть использованы для определения специфических профилей или молекулярных "фингерпринтов". Различные фингерпринты могут быть ассоциированы с различными фазами заболевания, началом развития заболевания или регрессии заболевания, ассоциированной с введением соответствующих терапевтических средств.
Более подробное описание способа SELDI может быть разделено на четыре части. В первой стадии один или несколько представляющих интерес белков иммобилизуются или "заякориваются" на массиве белкового чипа, непосредственно из исходного материала, без получения образца и без его мечения образца. Во второй стадии отношение "сигнал-шум" повышают путем снижения химического и биомолекулярного "шума". Такой "шум" снижают путем селективного удерживания мишени на чипе посредством отмывания нежелательных материалов. Кроме того, один или несколько белков-мишеней, которые являются иммобилизованными, прочитываются с помощью быстрого чувствительного индуцированного лазером способа (SELDI), который позволяет получать непосредственную информацию о данной мишени (о молекулярной массе). И наконец, белок-мишень, находящийся в любом одном или нескольких положениях данного массива, может быть охарактеризован in situ путем проведения одной или нескольких процедур связывания на чипе или модификации реакций для характеризации структуры и функции белка.
Фаговое представление
Эпитоп для описанных здесь анти-МСР-1 антител может быть определен путем обработки массива белкового чипа комбинаторной библиотекой рандомизированного 12-мера, представленного на нитчатом фаге (New England Biolabs).
Фаговое отображение представляет собой технику отбора, где пептид экспрессируется в виде гибрида с белком оболочки бактериофага, с последующим представлением гибридного белка на поверхности вириона. "Пэннинг" осуществляют путем инкубирования библиотеки фагового представления пептидов на планшете или в сосуде, сенсибилизированном данной мишенью, с последующим удалением несвязанного фага путем промывки и элюированием специфически связанного фага. Затем элюированный фаг амплифицируют и подвергают дополнительным циклам связывания и амплификации для обогащения пула, который является предпочтительным для связывающих последовательностей. После проведения трех или четырех раундов отдельные связывающиеся клоны подвергают дополнительному тестированию на связывание фага в ELISA-анализах, осуществляемых на сенсибилизированных антителом лунках, а затем охарактеризовывают путем проведения специфического секвенирования ДНК позитивных клонов.
После множественных раундов такого пэннинга описанных здесь анти-МСР-1 антител связанный фаг может быть элюирован и подвергнут последующему исследованию для идентификации и характеризации связанного пептида.
Было показано, что моноклональные антитела настоящего изобретения связываются с важными остатками в коровом домене МСР-1. Проанализированные нейтрализующие моноклональные антитела отличаются тем, что они распознают два функционально важных сайта в человеческом МСР-1, что обусловлено присутствием двух остатков, которые, как было показано ранее, необходимы для связывания с рецепторами. Один сайт распознавался всеми протестированными антителами, которые конкурируют с рецепторным белком за связывание с МСР-1, и включает остаток Arg24. Второй сайт распознавался группой из шести антител, которые связывались с конформационным эпитопом, и их связывающий сайт, очевидно, включал остатки Arg24 и Lys35, которые находились в непосредственной близости к N-концу, благодаря присутствию дисульфидной связи между С11 и С36.
Варианты описанного здесь МСР-1 были ранее проанализированы на их биологическую активность, физическое связывание с рецептором и структурную целостность (Jarnagin et al., (1999) Biochemistry 38:16167-16177; Hemmerich et al. (1999) Biochemistry 38:13013-13025), и было показано, что они представляют собой ценный материал для определения эпитопов, с которыми связываются данные антитела, как описано ниже.
Анти-МСР-1 антитело 3.11.1 распознает конформационный эпитоп и отличается от других антител своей уникальной последовательностью тяжелой и легкой цепей и своей способностью перекрестно реагировать с другими членами семейства МСР, такими как МСР-2, МСР-3 и МСР-4, или нейтрализовать их. Как показано в экспериментах по мутагенезу, связывающий сайт mAb 3.11.1, подвергается модификации благодаря замене R24А, но не К35А. Это подтверждается данными гидролиза Lyc-С на чипе, полученными в SELDI, и эти данные определяют границы связывающего эпитопа в положениях остатков 20-35 МСР-1.
Тот факт, что эпитоп для 3.11.1 находится между остатками 20-35, был также подтвержден путем выравнивания последовательностей, которое показало, что именно R24, а не К35 является консервативным для других членов семейства МСР, а в частности для МСР-2, МСР-3 и МСР-4. Анализы на связывание, проводимые с помощью пептида SPOT, синтезированного на мембране (Sigma-Genosys, The Woodlands, Texas), выявили, что сайт связывания, по крайней мере, для восьми mAb с линейными эпитопами, охватывающими остатки 20-25, включает R24. Если принять по внимание сходство результатов исследования на связывание и значительную гомологию между структурами генов вариабельных областей для всех mAb, связывающихся с линейными эпитопами на МСР-1, то становится очевидным, что все эти антитела связываются с указанным нейтрализующим эпитопом.
Присутствие кластера эпитопа, расположенного вокруг R24 и К35, объясняет нейтрализующую активность всех 36 антител. Очевидно, что распознаваемый эпитоп на МСР-1 не простирается до N-концевых остатков, начинающихся с Pro9. Этот остаток, очевидно, влияет на передачу сигнала рецептора, но не влияет на аффинность связывания.
Применение в целях диагностики
Антитела, полученные в соответствии с описанными здесь вариантами настоящего изобретения, могут быть использованы для анализов, а в частности для диагностических анализов in vitro, например для определения уровня МСР-1 и всех членов семейства МСР-1 в образцах, взятых у пациента. Образцами, взятыми у пациента, могут быть, например, физиологические жидкости, предпочтительно кровь, а более предпочтительно сыворотка крови, синовиальная жидкость, тканевые лизаты и экстракты, полученные из пораженных тканей. Примерами диагностических анализов являются измерение уровня хемокинов, принадлежащих к семейству МСР, например, в человеческой сыворотке, синовиальной жидкости и в тканевых лизатах. Мониторинг уровня специфических членов семейства МСР может быть проведен в качестве альтернативной меры для определения ответа пациента на данное лечение и в качестве контроля за тяжестью заболевания пациента. Повышенные уровни МСР-1 по сравнению с уровнями других растворимых маркеров должны указывать на наличие воспаления. Концентрацию антигена МСР-1, присутствующего в образцах, взятых у пациента, определяют методом, который позволяет определять конкретное количество присутствующего антигена. Таким методом является ELISA-метод, в котором антитела настоящего изобретения могут быть легко иммобилизованы на нерастворимой матрице, такой как полимерная матрица. С использованием набора образцов, которые дают статистически значимые результаты для каждой стадии течения заболевания или терапии, может быть определен ряд концентраций данного антигена, которые могут рассматриваться как концентрации, характерные для каждой стадии течения заболевания.
Для определения степени воспаления у обследуемого индивидуума или для характеризации ответа индивидуума на проводимый курс лечения у данного индивидуума берут пробу крови и определяют концентрацию антигена МСР-1 в данной пробе. Полученная таким образом концентрация используется для того, чтобы установить, в каких пределах концентраций находится данное значение. Установленный таким образом диапазон коррелирует со стадией развития заболевания или со стадией терапии, идентифицированной у различных групп пациентов с установленным диагнозом, что позволяет определить стадию развития заболевания у обследуемого индивидуума.
Амплификация и/или экспрессия генов может быть измерена непосредственно в образце, например, путем стандартного Саузерн-блот-анализа, Нозерн-блот-анализа для количественного определения уровня транскрипции мРНК (Thomas, Proc. Natl. Acad. Sci., USA, 77:5201-5205 (1980)), дот-блот-анализа или гибридизации in situ с использованием соответствующим образом меченного зонда, полученного на основе описанных здесь последовательностей. Альтернативно могут быть использованы антитела, которые могут распознавать специфические дуплексы, включая ДНК-дуплексы, РНК-дуплексы и ДНК-ДНК-гибридные дуплексы или дуплексы ДНК-белок. Антитела, в свою очередь, могут быть помечены, и может быть проведен анализ, где указанный дуплекс связывается с поверхностью, в результате чего после образования дуплекса на поверхности может быть детектировано присутствие антитела, связанного с указанным дуплексом.
Так, например, антитела, включая фрагменты антител, могут быть использованы для качественной или количественной детекции экспрессии белков МСР-1. Как указывалось выше, указанное антитело предпочтительно метят детектируемой меткой, например, флуоресцентной меткой, после чего может быть проведен мониторинг связывания с помощью оптической микроскопии, проточной цитометрии, флуориметрии или другими известными методами. Эти методы являются особенно подходящими в том случае, если амплифицированный ген кодирует белок клеточной поверхности, например, фактор роста. Такие анализы на связывание осуществляют известными методами.
Детекция связывания антитела с белком МСР-1 in situ может быть осуществлена, например, с помощью иммунофлуоресцентной или иммуноэлектронной микроскопии. Для этой цели у пациента берут образец тканей и на эту ткань наносят меченое антитело предпочтительно путем покрытия биологического образца антителом. Эта процедура также позволяет определить характер распределения маркерного генного продукта в исследуемой ткани. Для каждого специалиста очевидно, что существует широкий ряд гистологических методов, которые позволяют легко осуществлять детекцию in situ.
Одним из наиболее чувствительных и наиболее гибких количественных методов оценки дифференциальной экспрессии генов является реакция ОТ-ПЦР, которая может быть использована в целях сравнения уровней мРНК в наборах различных образцов, в нормальных и опухолевых тканях, подвергавшихся или не подвергавшихся лечению лекарственным средством, для определения характера экспрессии генов, выявления различий между близкородственными мРНК и анализа структуры РНК.
Первой стадией этого способа является выделение мРНК из целевого образца. Исходный материал обычно представляет собой полноразмерную РНК, выделенную из патологической ткани и соответствующей нормальной ткани. Так, например, мРНК может быть экстрагирована из замороженных или находящихся на хранении залитых в парафин и фиксированных (например, в формалине) образцов патологической ткани для сравнения с нормальной тканью того же самого типа. Методы экстракции мРНК хорошо известны специалистам и описаны в стандартных руководствах по молекулярной биологии, включая руководство Ausubel et al., Current Protocols of Molecular Biology, John Wiley & Sons (1997). Методы экстракции РНК из залитых в парафин тканей описаны, например, Rupp & Locker, Lab. Invest., 56:А67 (1987) и De Andres et al., BioTechniques 18:42044 (1995). В частности, выделение РНК может быть осуществлено с использованием наборов для очистки, серии буферов и протеазы, поставляемых фирмами-производителями, такими как Qiagen, в соответствии с инструкциями производителей. Так, например, полноразмерная РНК может быть выделена из клеток в культуре с использованием миниколонок Qiagen Rneasy. Полноразмерная РНК может быть выделена из образцов ткани с использованием набора RNA Stat-60 (Tel-Test).
Поскольку РНК не может служить в качестве матрицы для ПЦР, то первой стадией анализа на дифференциальную экспрессию гена, осуществляемого с помощью ОТ-ПЦР, является обратная транскрипция матричной РНК в кДНК с последующей экспоненциальной амплификацией в ПЦР-реакции. Двумя наиболее часто используемыми обратными транскриптазами являются обратная транскриптаза вируса птичьего миелобластоза (AMV-RT) и обратная транскриптаза вируса мышиного лейкоза Молони (MMLV-RT). Стадия обратной транскрипции обычно заключается в праймировании с использованием специфических праймеров, рандомизированных гексамеров или олиго-dT-праймеров в зависимости от условий и цели анализа профиля экспрессии. Так, например, экстрагированная РНК может быть подвергнута обратной транскрипции с использованием набора для ПЦР GeneAmp RNA PCR kit (Perkin Elmer, CA, USA) в соответствии с инструкциями производителя. Полученная кДНК может быть затем использована в качестве матрицы в последующей ПЦР-реакции.
Хотя в ПЦР-стадии могут быть использованы различные термостабильные ДНК-зависимые ДНК-полимеразы, однако обычно используется ДНК-полимераза Taq, обладающая 5'-3'-нуклеазной активностью, но не обладающая 3'-5'-эндонуклеазной активностью. Таким образом, в ПЦР TaqMan обычно используется 5'-нуклеазная активность полимеразы Taq или Tth для гидролиза гибридизационного зонда, связанного с его ампликоном-мишенью, однако может быть также использован любой фермент с эквивалентной 5'-нуклеазной активностью. Для генерирования ампликона, типичного для данной ПЦР-реакции, используют два олигонуклеотидных праймера. Третий олигонуклеотид или зонд конструируют для детекции нуклеотидной последовательности, расположенной между двумя ПЦР-праймерами. Этот зонд не удлиняется ДНК-полимеразой Taq, и его метят флуоресцентным красителем-репортером и гасителем флуоресценции. Тушение индуцированного лазером излучения от репортерного красителя обеспечивается гасителем флуоресценции, если краситель и гаситель расположены близко друг от друга, в том случае, когда они находятся на одном зонде. В процессе реакции амплификации фермент ДНК-полимераза Taq расщепляет зонд в зависимости от матрицы. Полученные фрагменты зонда диссоциируются в растворе, и сигнал от отщепленного репортерного красителя высвобождается в результате гасящего эффекта второго флуорофора. Для каждой вновь синтезируемой молекулы высвобождается одна молекула репортерного красителя, а детекция непогашенного репортерного красителя может быть положена в основу количественной интерпретации данных.
ОТ-ПЦР TaqMan может быть проведена с использованием коммерчески доступных устройств, таких как, например, система детекции последовательностей ABI PRIZM 7700TM Sequence Detection SystemTM (Perkin-Elmer-Applied Biosystems, Foster City, CA, USA) или оптическая ячейка Lightcycler (Roche Molecular Biochemicals, Mannheim, Germany). В предпочтительном варианте изобретения процедуру с использованием 5'-нуклеазы осуществляют на устройстве для проведения количественной ПЦР в оперативном режиме, таком как система детекции последовательностей ABI PRIZM 7700TM. Эта система состоит из термоячейки, лазера, устройства с зарядовой связью (УЗС), видеокамеры и компьютера. Эта система позволяет амплифицировать образцы в 96-луночном планшете на термоячейке. В процессе амплификации индуцированный лазером флуоресцентный сигнал собирают в коллекторе в оперативном режиме с помощью волоконно-оптических кабелей для всех 96 лунок и детектируют на УЗС. Эта система включает программное обеспечения для выполнения измерений и для анализа данных.
Данные 5'-нуклеазного анализа сначала выражают как Ct или пороговый цикл. Как обсуждалось выше, величины интенсивности флуоресценции регистрируют во время каждого цикла и представляют как количество продукта, амплифицированного до данного момента времени в реакции амплификации. Момент регистрации первого статистически значимого сигнала флуоресценции представляет собой пороговый цикл (Ct). Величины ΔCt используются в качестве количественной оценки относительного числа исходных копий конкретной целевой последовательности в образце нуклеиновой кислоты при сравнении экспрессии РНК в клетке патологической ткани с экспрессией РНК в нормальной клетке.
Для минимизации ошибок и эффекта варьирования результатов для разных образцов ОТ-ПЦР обычно проводят с использованием внутреннего стандарта. Идеальный внутренний стандарт выражают как постоянный уровень для различных тканей, на который не влияет экспериментальная обработка. РНК, наиболее часто используемыми для нормализации характера экспрессии генов, являются мРНК генов "домашнего хозяйства", глицеральдегид-3-фосфатдегидрогеназы (GAPDH) и β-актина.
Дифференциальная экспрессия гена может быть также идентифицирована или подтверждена методом с использованием микромассивов. В этом методе представляющие интерес нуклеотидные последовательности наносят на планшеты или распределяют в виде массива на микрочип, служащий субстратом. Затем массивы этих последовательностей гибридизуют со специфическими ДНК-зондами, полученным из представляющих интерес клеток или тканей.
В конкретном варианте метода с использованием микрочипов ПЦР-амплифицированные вставки кДНК-клонов наносят на субстрат в виде плотного массива. Предпочтительно на субстрат наносят, по крайней мере, 10000 нуклеотидных последовательностей. Микромассивы генов, иммобилизованных на микрочипе, по 10000 элементов на каждый, являются подходящими для гибридизации в жестких условиях. Флуоресцентно меченные кДНК-зонды могут быть получены путем включения флуоресцентных нуклеотидов с помощью обратной транскрипции РНК, экстрагированной из представляющих интерес тканей. Меченые кДНК зонды наносят на чип для селективной гибридизации с каждым пятном ДНК на массиве. После жесткой промывки для удаления неспецифически связанных зондов указанный чип сканируют с помощью кофокальной лазерной микроскопии. Количественная оценка гибридизации каждого элемента массива позволяет оценить соответствующий избыток мРНК. При двухцветной флуоресценции отдельно меченные кДНК-зонды, генерированные из двух источников РНК, попарно гибридизуют с данным массивом. Таким образом, одновременно определяют относительный избыток транскриптов от двух источников, соответствующих каждому конкретному гену. Миниатюризованный масштаб гибридизации позволяет проводить удобную и быструю оценку характера экспрессии больших количеств генов. Было показано, что такие методы обладают чувствительностью, необходимой для детекции редких транскриптов, которые экспрессируются в нескольких копиях на клетку, а также для репродуцируемой детекции уровней экспрессии, которые отличаются друг от друга, по крайней мере, примерно в два раза (Schena et al., Proc.Natl. Acad. Sci., USA, 93(20)L106-49). Методика гибридизации нуклеиновых кислот и технология микромассивов хорошо известны специалистам.
Агонисты и антагонисты МСР-1
В некоторых описанных здесь вариантах своего осуществления настоящее изобретение также относится к вариантам белка МСР-1, которые функционируют либо как агонисты МСР-1 (миметики), либо как антагонисты МСР-1. Варианты белка МСР-1 могут быть генерированы с помощью мутагенеза, например, путем дискретной точковой мутации или усечения белка МСР-1. Агонист белка МСР-1 может в основном сохранять такие же биологические активности или их подгруппы, характерные для природных форм белков МСР-1. Антагонист белка МСР-1 может ингибировать одну или несколько активностей природной формы белков МСР-1, например, посредством конкурентного связывания с последующим или предшествующим членом каскада реакций передачи клеточного сигнала, в которых участвует белок МСР-1. Таким образом, специфические биологические эффекты могут вырабатываться путем обработки вариантом с ограниченной функцией. В одном из вариантов изобретения лечение индивидуума вариантом, обладающим субсерией биологических активностей природной формы белка, вызывает меньше побочных эффектов у индивидуума по сравнению с лечением природной формой белка МСР-1.
Варианты белка МСР-1, которые функционируют либо как агонисты МСР-1 (миметики), либо как антагонисты МСР-1, могут быть идентифицированы путем скрининга комбинаторных библиотек мутантов, например усеченных мутантов белка МСР-1, на агонистическую или антагонистическую активность белка. В одном из вариантов изобретения библиотеку с различными вариантами МСР-1 генерируют путем комбинаторного мутагенеза на уровне нуклеиновых кислот и эта библиотека кодируется библиотекой различных генов. Библиотека с различными вариантами МСР-1 может быть продуцирована, например, путем ферментативного лигирования смеси синтетических олигонуклеотидов с генными последовательностями так, чтобы вырожденная серия потенциальных последовательностей МСР-1 экспрессировалась как отдельные полипептиды, или альтернативно как серия более крупных гибридных белков (например, для фагового представления), содержащих серию описанных здесь последовательностей МСР-1. Для продуцирования библиотек потенциальных вариантов МСР-1 из вырожденной олигонуклеотидной последовательности может быть использован ряд методов. Химический синтез вырожденной генной последовательности может быть осуществлен на автоматическом ДНК-синтезаторе, а затем синтетический ген может быть лигирован в соответствующий экспрессирующий вектор. Использование вырожденной серии генов позволяет получить в одной смеси все последовательности, кодирующие нужную серию потенциальных последовательностей вариантов МСР-1. Методы синтеза вырожденных олигонуклеотидов известны специалистам (см., например, Narang, Tetrahedron 39:3 (1983); Itakura et al., Annu. Rev. Biochem. 53:323 (1984); Itakura et al., Science 198:1056 (1984); Ike et al., Nucl. Acid. Res. 11:477 (1983).
Конструирование и получение других терапевтических средств
В соответствии с описанными здесь вариантами настоящего изобретения и исходя из активности антител против МСР-1, которые были продуцированы и охарактеризованы, как описано в настоящей заявке, помимо молекул антител может быть легко осуществлено конструирование и других терапевтических средств. Такими средствами являются, но не ограничиваются ими, усовершенствованные терапевтические антитела, такие как биспецифические антитела, иммунотоксины и радиоактивно меченные терапевтические средства, пептидные терапевтические средства, средства для генной терапии, а в частности внутриклеточное тельце, антисмысловые терапевтические молекулы и небольшие молекулы.
При генерировании усовершенствованных терапевтических антител, где желательным признаком является фиксация комплемента, может потребоваться в зависимости от комплемента проведение дополнительной стадии для цитолиза клеток с использованием, например, биспецифических антител, иммунотоксинов или радиоактивных меток.
Так, например, что касается биспецифических антител, то могут быть генерированы биспецифические антитела, которые содержат: (i) два антитела: одно со специфичностью к МСР-1, а другое со специфичностью ко второй молекуле, конъюгированной с МСР-1, (ii) одно антитело, которое имеет одну цепь, специфичную к МСР-1, и вторую цепь, специфическую ко второй молекуле, или (iii) одноцепочечное антитело, которое обладает специфичностью к МСР-1 и к другой молекуле. Такие биспецифические антитела могут быть генерированы методами, хорошо известными специалистам, например получение антител (i) и (ii), см., например, в работе Fanger et al., Immunol Methods 4:72-81 (1994) и Wright & Harris, см. выше, а получение антитела (iii), см., например, в работе Traunecker et al., Int. J. Cancer (Suppl.) 7:51-52 (1992). В каждом случае указанные антитела могут иметь вторую специфичность к рецепторам активации тяжелой цепи, включая, но не ограничиваясь ими, CD16 или CD64 (см., например, Deo et al. 18:127 (1997)) или CD89 (см., например, Valerius et al., Blood 90:4485-4492 (1997)).
Что касается иммунотоксинов, то антитела могут быть модифицированы хорошо известными методами так, чтобы они действовали как иммунотоксины. См., например, Vitetta, Immunol. Today 14:252 (1993). См. также патент США № 5194594. Что касается получения радиоактивных антител, то такие модифицированные антитела могут быть также легко получены методами, хорошо известными специалистам. См., например, Junghans et al., Cancer Chemotherapy and Biotherapy 655-686 (2d edition, Chafner & Longo, eds., Lippincott Raven (1996)). См. также патенты США №№ 4681581, 4735210, 5101827, 5102990 (RE 35500), 5648471 и 5697902.
Введение и получение терапевтических средств
Биологически активные анти-МСР-1 антитела, полученные в соответствии с описанным здесь изобретением, могут быть использованы в стерильном фармацевтическом препарате или в композиции для нейтрализации активности МСР-1, продуцирующегося в пораженных и воспаленных тканях, и, тем самым, для предупреждения инфильтрации мононуклеарных клеток в ткани. Такими пораженными и воспаленными тканями могут быть ткани многих типов, например, ткани человеческих раковых опухолей, включая рак молочной железы, яичника и легких, и ткани, пораженные такими заболеваниями, как гломерулонефрит, артериосклероз и рассеянный склероз. Биологически активное анти-МСР-1 антитело настоящего изобретения может быть использовано отдельно или в комбинации с другими терапевтическими средствами. Для лечения рака анти-МСР-1 антитела могут быть объединены с традиционными химиотерапевтическими средствами, такими как таксол, доксорубицин, цис-платин, 5-фторурацил и другие новые ингибиторы ангиогенеза. Для лечения воспалительного заболевания антитела против МСР-1 могут быть объединены со стероидами или антителами против других цитокинов и хемокинов, которые играют определенную роль в патологическом состоянии.
При использовании композиции антител для введения in vivo данная концентрация может быть стерилизована. Это может быть легко осуществлено путем фильтрации через стерильные фильтрующие мембраны до или после лиофилизации и разведения. Антитело обычно хранят в лиофилизованной форме или в растворе. Терапевтические композиции антител обычно помещают в контейнер, имеющий стерильное входное отверстие, например баллон для внутривенного введения раствора или сосуд, имеющий протыкаемую иглой крышку для подкожных инъекций.
Введение антитела может быть осуществлено известными методами, например путем внутривенной, внутрибрюшинной, интрацеребральной, внутримышечной, внутриглазной, внутрисуставной, интратекальной инъекции или инфузии; путем ингаляции или путем введения в пораженные участки, либо путем применения систем пролонгированного высвобождения, как описано ниже. Антитело предпочтительно вводят непрерывно путем вливания или инъекции ударной дозы.
Эффективное количество используемого терапевтического антитела зависит, например, от целей терапии, способа введения и состояния пациента. В соответствии с этим лечащий врач может устанавливать нужную дозу путем титрования и может модифицировать способ введения, если это необходимо для получения оптимального терапевтического эффекта. Обычно врач-клиницист может назначить введение антитела в дозе, подходящей для достижения нужного эффекта. Продолжительность этой терапии может быть легко определена с помощью стандартных анализов или анализов, описанных в настоящей заявке.
Антитела настоящего изобретения могут быть приготовлены в смеси с фармацевтически приемлемым носителем. Такая терапевтическая композиция может быть введена внутривенно, через нос или через легкие предпочтительно в виде жидкого или порошкообразного аэрозоля (в лиофилизованной форме). Указанная композиция, если это необходимо, может быть также введена парентерально или подкожно. При системном введении эта терапевтическая композиция должна быть стерильной, апирогенной, либо она может быть введена в виде парентерально приемлемого раствора, имеющего нужный рН, нужную изотоничность и стабильность. Эти условия хорошо известны специалистам. Вкратце в описанных здесь вариантах изобретения лекарственные композиции соединений, предназначенные для хранения или введения, получают путем смешивания соединения, имеющего нужную степень чистоты, с физиологически приемлемыми носителями, наполнителями или стабилизаторами. Такие материалы являются нетоксичными для реципиентов в используемых дозах и концентрациях, и ими могут быть буферы, такие как Трис-HCl, фосфат, цитрат, ацетат и другие соли органических кислот; антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные пептиды (имеющие примерно менее десяти остатков), такие как полиаргинин; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидинон; аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды и другие углеводы, включая целлюлозу или ее производные, глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; спирты ряда сахаров, такие как маннит или сорбит; противоионы, такие как натрий и/или неионогенные поверхностно-активные вещества, такие как твин, плюроники или полиэтиленгликоль.
Стерильные композиции для инъекции могут быть получены в соответствии с фармацевтической практикой, описанной в Remington's Pharmaceutical Sciences, Mack Publishing. Co., Easton, PA (1990)). Так, например, может оказаться желательным растворение или суспендирование активного соединения в носителе, таком как вода или натуральное растительное масло, такое как кунжутное масло, арахисовое масло или масло из семян хлопчатника или синтетический жирный носитель, такой как этилолеат или т.п. Буферы, консерванты, антиоксиданты и т.п. могут быть введены в соответствии с общепринятой фармацевтической практикой.
Подходящими примерами препаратов пролонгированного высвобождения являются полупроницаемые матрицы твердых гидрофобных полимеров, содержащих полипептид, где указанные матрицы получают в виде формованных изделий, пленок или микрокапсул. Примерами матриц для пролонгированного высвобождения являются сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), описанные Langer et al., J. Biomed. Mater. Res., 15:167-277 (1981) и Langer, Chem. Tech., 12:98-105 (1982) или поливиниловый спирт)), полилактиды (патент США № 3773919, ЕР 58481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al., Biopolymers, 22:547-556 (1983)), неразлагаемый этиленвинилацетат (Langer et al., см. выше), разлагаемые сополимеры молочной и гликолевой кислоты, такие как LUPRON DepotTM (микросферы для инъекций, состоящие из сополимера молочной и гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляная кислота (ЕР 133988).
Такие полимеры, как этиленвинилацетат и молочная кислота-гликолевая кислота, обеспечивают высвобождение молекул в течение периода времени свыше 100 дней, а некоторые гидрогели обеспечивают высвобождение белков за более короткие промежутки времени. Если инкапсулированные белки присутствуют в организме в течение длительного периода времени, то они могут денатурироваться или агрегироваться под действием влаги при 37°С, что приводит к потере биологической активности и к возможному изменению иммуногенности. Для стабилизации белка могут быть разработаны рациональные стратегии в зависимости от используемого механизма. Так, например, если механизмом агрегации является образование межмолекулярной связи S-S посредством дисульфидного обмена, то стабилизация белка может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, регулирования содержания влаги, использования соответствующих добавок и разработки конкретного состава полимерных матриц.
Композиции пролонгированного высвобождения также включают захваченные липосомами антитела настоящего изобретения. Липосомы, содержащие такие антитела, получают методами, известными сами по себе и описанными в патенте США № DE 3218121; в работах Epstein et al., Proc. Natl. Acad. Sci., USA, 82:3688-3692 (1985); Hwang et al., Proc. Natl. Acad. Sci., USA, 77:4030-4034 (1980); в ЕР 52322; в ЕР 36676; в ЕР 88046, в ЕР 143949 и 142641; в Японской патентной заявке 83-118008; в патентах США №№ 4485045 и 4544545, и в ЕР 102324. Дозы антитела могут быть определены лечащим врачом с учетом различных факторов, которые, как известно, могут модифицировать действие лекарственных средств, включая тяжесть и тип заболевания, массу тела, пол, режим питания пациента, время и способ введения лекарственного средства, другие медицинские показания и другие соответствующие клинические факторы. Терапевтически эффективные дозы могут быть определены любыми методами in vitro или in vivo.
Дозы композиции антител могут быть определены лечащим врачом с учетом различных факторов, которые, как известно, могут модифицировать действие лекарственных средств, включая тяжесть и тип заболевания, массу тела, пол, режим питания пациента, время и способ введения лекарственного средства, другие медицинские показания и другие соответствующие клинические факторы. Терапевтически эффективные дозы могут быть определены любыми методами in vitro или in vivo.
Эффективное количество антитела настоящего изобретения, используемого в терапии, зависит, например, от целей терапевтического лечения, способа введения и состояния здоровья пациента. В соответствии с этим каждый практический врач может подобрать нужную дозу и модифицировать способ введения, если это необходимо для достижения оптимального терапевтического эффекта. Типичная ежедневная доза может варьироваться примерно от 0,001 мг/кг до 100 мг/кг или более в зависимости от вышеупомянутых факторов. Предпочтительными концентрациями доз являются 0,001 мг/кг, 0,005 мг/кг, 0,01 мг/кг, 0,05 мг/кг, 0,1 мг/кг, 0,5 мг/кг, 1 мг/кг, 5 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг, 45 мг/кг, 50 мг/кг, 55 мг/кг, 60 мг/кг, 65 мг/кг, 70 мг/кг, 75 мг/кг, 80 мг/кг, 85 мг/кг, 90 мг/кг, 95 мг/кг и 100 мг/кг или более. Обычно врачом-клиницистом может быть назначено введение терапевтического антитела в дозе, необходимой для достижения нужного эффекта. Эффект данной терапии может быть легко определен с помощью стандартных анализов или описанными здесь методами.
Примеры
Нижеследующие примеры, включая проводимые эксперименты и результаты, полученные при проведении этих экспериментов, приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничение описанных здесь вариантов осуществления настоящего изобретения.
Пример 1
Получение антигена МСР-1
Человеческий пептид МСР-1, используемый в этих исследованиях в качестве антигена, имеет следующую аминокислотную последовательность:
QPDAINAPVTCCYNFTNRKISVQRLASYRRITSSKCPKEAVIFKTIVAKEICADPKQKWVQDSMDHLDKQTQTPKT (SEQ ID NO:149)
Этот пептид был рекомбинантно экспрессирован в E. coli и закуплен у Prepro Tech (Rocky Hill, NJ).
Пример 2
Антитела против МСР-1
Генерирование антител
Иммунизация и отбор животных для получения образцов в целях проведения ELISA. Моноклональные антитела против МСР-1 были получены путем последовательной иммунизации мышей XenoMouse® (мышей штаммов XenoMouse® XMG2, XMG4 (штамм 3С-1) и гибридного штамма, полученного путем скрещивания мышей XMG2 с мышами XMG4 (штамм 3С-1), Abgenix, Inc. Fremont, CA) в соответствии с протоколом, описанным в таблице 2. Так, например, исходная иммунизация предусматривала введение 10 мкг антигена, смешанного 1:1 (об./об.) с реагентом TiterMax Gold. Последующие бустер-инъекции осуществляли путем введения 5 или 10 мкг антигена, смешанного 1:1 (об./об.) со 100 мкг геля квасцов в апирогенном D-PBS. Некоторые бустер-дозы вводили путем инъекции 50% реагента TiterMax Gold с последующими тремя инъекциями 10 мкг антигена в виде смеси 1:1 (об/об) 10 мкг антигена МСР-1 с гелем квасцов, а последнюю бустер-дозу вводили путем введения 10 мкг антигена в PBS. В частности, каждую мышь иммунизировали в подушечку лапы путем подкожной инъекции. Животных иммунизировали на дни 0, 4, 7, 10, 14, 18, 27, 31, 35 и 42. У животных брали кровь на 13-й и 26-й дни и получали сыворотку для проведения отбора, как описано ниже.
Аналогичным образом других мышей XenoMouse® (мышей XenoMouse®, штаммов XMG2 и XMG2L3) последовательно иммунизировали в соответствии с протоколом, представленным в таблице 3.
Титры антител против МСР-1 были определены путем проведения прямого ELISA-анализа. Величина титра обратно пропорциональна наибольшему разведению сыворотки, причем зарегистрированная величина OD в два раза превышает фоновое значение. Вкратце, МСР-1 (84-мер; 1 мкг/мл) сенсибилизировали на 96-луночных полистироловых планшетах Costar Labcoat Universal Binding Polystyrene в течение ночи при 4°С. Раствор, содержащий несвязанный МСР-1, удаляли и планшеты обрабатывали УФ-излучением (365 нм) в течение 4 минут (4000 микроджоулей). Планшеты пять раз промывали dH2O. Сыворотку, взятую у МСР-1-иммунизированных животных XenoMouse® или у неиммунизированных животных XenoMouse®, титровали в 2% молоке/PBS при разведении 1:2 в дубликате, начиная с разведения 1:100. Последнюю лунку использовали в качестве контроля. Планшеты пять раз промывали dH2O.
Козье Fc-специфическое ПХ-конъюгированное антитело против человеческих IgG добавляли при конечной концентрации 1 мкг/мл в течение 1 часа при комнатной температуре. Планшеты пять раз промывали dH2O. Затем планшеты проявляли путем добавления ТМВ в течение 30 минут и ELISA-реакцию прекращали путем добавления 1 М фосфорной кислоты. Специфический титр для отдельных животных XenoMouse® определяли исходя из оптической плотности при 450 нм, и эти титры представлены в таблицах 4, 5, 6, 7 и 8. Титр представляет собой величину, обратную разведению сыворотки, а поэтому чем больше значение, тем выше гуморальный иммунный ответ на МСР-1. Затем у всех иммунизированных животных XenoMouse® брали лимфоузлы для проведения процедуры слияния.
Группа 1, подушечки лап, 7 мышей ХМG2
Группа 2, подушечки лап, 3С-1, 7 мышей
Группа 1, подушечки лап, 3С-1/XMG2(F1), 7 мышей
Группа 4, ХМG2, подушечки лап, 4 мыши
Группа 5, ХМG2L3, подушечки лап, 4 мыши
* Для таблиц 4-8, NC (негативный контроль)= группа 1 ХМG2 с KLH, подушечка лапы мыши L627-6
РС (позитивный контроль)= группа 1 ХМG2 с МСР-1, подушечка лапы мыши N160-1.
Выделение лимфоцитов, выделение В-клеток, слияние и генерирование гибридом. Иммунизированных мышей умерщвляли путем смещения шейных позвонков и лимфоузлы собирали и объединяли в группы. Лимфоидные клетки разрушали путем измельчения в DMEM для высвобождения клеток из тканей и клетки суспендировали в DMEM. Клетки подсчитывали и в клеточный осадок добавляли 0,9 мл DMEM на 100 миллионов лимфоцитов для осуществления мягкого, но полного ресуспендирования клеток. С использованием 100 мкл магнитных сфер с CD90+ на 100 миллионов клеток клетки метили путем их инкубирования с магнитными сферами при 4°С в течение 15 минут. Клеточную суспензию, меченную с использованием магнитных сфер и содержащую до 108 позитивных клеток (или всего до 2·109 клеток), загружали на колонку LS+ и эту колонку промывали DMEM. Общий выходящий поток собирали в виде CD90-негативной фракции (большую часть этих клеток составляли В-клетки).
Миеломные клетки Р3 и клетки лимфоузлов, обогащенных В-клетками, объединяли в отношении 1:1 (миелома:лимфоузлы) в конической 50-мл пробирке в DMEM. Объединенные клетки центрифугировали при 800g (2000 об/мин) в течение 5-7 минут и из полученного осадка сразу удаляли супернатант. 2-4 мл раствора проназы (CalBiochem, Cat.# 53702; 0,5 мг/мл в PBS) добавляли к клеткам для мягкого ресуспендирования клеточного осадка. Обработку ферментом проводили не более чем две минуты и реакцию прекращали добавлением 3-5 мл FBS. Затем добавляли достаточное количество раствора ECF для доведения общего объема до 40 мл, и смесь центрифугировали при 800g (2000 об/мин) в течение 5-7 минут. Супернатант удаляли и клеточный осадок мягко ресуспендировали в небольшом объеме раствора ECF, а затем добавляли достаточное количество раствора ECF для доведения общего объема до 40 мл. Клетки тщательно перемешивали и подсчитывали, а затем центрифугировали при 800g (2000 об/мин) в течение 5-7 минут. Супернатант удаляли, и клеточный осадок ресуспендировали в небольшом объеме раствора ECF. Затем добавляли еще некоторое количество раствора ECF для доведения до концентрации 2·106 клеток/мл.
Затем клетки помещали в генератор для электрического слияния клеток (ECF) (Model ЕСМ2001, Genetronic, Inc., San Diego, Ca) и осуществляли слияние клеток в соответствии с инструкциями производителей. После ECF клеточные суспензии осторожно удаляли из камеры для слияния в стерильных условиях и переносили в стерильную пробирку, содержащую такой же объем гибридомной среды в DMEM. Клетки инкубировали в течение 15-30 минут при 37°С, а затем центрифугировали при 400g (1000 об/мин) в течение пяти минут. Клетки мягко ресуспендировали в небольшом объеме 1/2 среды НА (1 флакон с 50× НА от Sigma, cat. #А9666 и 1 литр гибридомной среды) и объем соответствующим образом корректировали добавлением еще 1/2 среды НА (из расчета 5·106 В-клеток на 96-луночный планшет и 200 мкл на лунку). Клетки тщательно перемешивали, вводили пипеткой в 96-луночные планшеты и оставляли для роста. На 7-й или 10-й день половину среды удаляли и клетки снова подпитывали 1/2 среды НА.
Отбор антител-кандидатов для ELISA. После 14-дневного культивирования супернатанты гибридомы скринировали на МСР-1-специфические моноклональные антитела. ELISA-планшеты (Fisher, Cat. № 12-565-136) сенсибилизировали 50 мкл/лунку МСР-1 (2 мкг/мл) в буфере для сенсибилизации (0,1 М карбонатный буфер, рН 9,6, NaHCO3, 8,4 г/л), а затем инкубировали при 4°С в течение ночи. После инкубирования планшеты три раза промывали промывочным буфером (0,05% Твин-20 в PBS). Затем добавляли 200 мкл/лунку блокирующего буфера (0,5% BSA, 0,1% Твин-20, 0,01% тимерозал в 1× PBS) и планшеты инкубировали при комнатной температуре в течение 1 часа. После инкубирования планшеты три раза промывали промывочным буфером. После этого добавляли 50 мкл/лунку супернатантов гибридомы и позитивный и негативный контроль, а затем планшеты инкубировали при комнатной температуре в течение 2 часов.
Во время всего проведения эксперимента в качестве позитивного контроля использовали животных группы 1 XMG2 с МСР-1, подушечку лапы которых обозначали N160-7, а в качестве негативного контроля использовали животных группы 1 XMG2 с KLH, подушечку лапы которых обозначали L627-6. После инкубирования планшеты три раза промывали промывочным буфером. После этого добавляли 100 мкл/лунку детектирующего ПХ-конъюгированного козьего антитела против человеческого IgG-Fc (Caltag, Cat. # H10507) (и ПХ-конъюгированного козьего антитела против каппа-цепи человеческого Ig (Southern Biotechnology, Cat.# 2060-05) и козьего антитела против лямбда-цепи человеческого Ig (Southern Biotechnology, Cat.# 2070-05) во втором скрининге) и планшеты инкубировали при комнатной температуре в течение 1 часа. Во второй процедуре скрининга проводили скрининг трех серий образцов (позитивных в первом скрининге), а именно скрининг одной серии на детекцию rIgG, одной серии на детекцию человеческой каппа-цепи и одной серии на детекцию человеческой лямбда-цепи. После инкубирования планшеты три раза промывали промывочным буфером. Затем добавляли 100 мкл/лунку ТМВ (BioFX Lab. Cat.# TMSK-0100-01) и планшеты оставляли для проявления окраски примерно на 10 минут (до тех пор, пока в лунках негативного контроля не обнаруживалась едва заметная окраска), затем добавляли 50 мкл/лунку раствора для прекращения реакции (раствор для прекращения реакции, ТМВ (BioFX Lab. Cat.# STPR-0100-01) и планшеты считывали на ELISA-планшет-ридере на длине волны 450 нм. Зарегистрированные OD-данные для позитивных лунок приводятся в таблице 9.
ND = не проводили
Характеризация анти-МСР-1 антител на биологическую активность
Нейтрализация биологической активности МСР-1 анти-МСР-1 антителами - анализ FLIPR. В сосуд с Fluo-4 (Molecular Probes) добавляли ДМСО и плюроновую кислоту (20% раствор в ДМСО) до конечной концентрации 5 мМ Fluo-4. Клетки ТНР-1 ресуспендировали в предварительно нагретом (37°С) буфере для загрузки при 3·106/мл и добавляли 1 мкл красителя Fluo-4 на 1 мл клеток до конечной концентрации красителя 5 мкМ. Клетки инкубировали в темноте при 37°С в течение 45-50 минут. После инкубирования клетки центрифугировали при 1000 об/мин в течение 5-10 минут. Клетки ресуспендировали в буфере для загрузки и процедуру центрифугирования повторяли. Клетки ресуспендировали при плотности 1,6676/мл. Затем клетки добавляли в 96-луночный планшет при концентрации 200000 клеток/лунку и подвергали мягкому центрифугированию. После проведения первого считывания второе считывание осуществляли после добавления 3,5 нМ МСР-1 в присутствии или в отсутствие различных концентраций анти-МСР-1 антител. Добавление МСР-1 в клетки ТНР-1 приводило к повышению уровня внутриклеточного кальция, и тем самым, к усилению интенсивности флуоресценции красителя Fluo-4. После добавления возрастающих концентраций нейтрализующего антитела интенсивность флуоресцентного красителя в клетках снижалась, что указывало на то, что тестируемое антитело является нейтрализующим. Концентрация антитела, которая давала 50%-ное снижение МСР-1-индуцированной интенсивности флуоресценции, представлена в таблице 9.
Нейтрализация МСР-1-индуцированной миграции клеток. Автоматизированный анализ на хемотаксис в 96-луночном планшете проводили с использованием клеток ТНР-1 и роботизированной системы Beckman Biomek F/X. С использованием специально сконструированного 96-луночного планшета, имеющего каркасный фильтр, снабженный фильтрующей мембраной, жестко присоединенной к каркасу, проводили анализ на хемотаксис в 96-луночном сменном микропланшете NeuroProbe с объемом лунки 30 мкл или 300 мкл и диаметром пор в пределах 2-14 мкм. 96-луночный планшет Neuroprobe имел в своей нижней части лунки для помещения в них хемоаттрактанта МСР-1 и других реагентов, таких как анти-МСР-1 антитела, для анализов на миграцию клеток. Верхние части лунок не требовались, поскольку каркасный фильтр был покрыт гидрофобной "маской", которая удерживала каждый образец клеточной суспензии на верхней поверхности фильтра.
Оптимальными условиями для этого анализа являются: инкубирование 100000 клеток/лунку в течение 90 минут при 37°С. Суспензии клеток ТНР-1, которые были предварительно нагружены красителем от Molecular Probes, с помощью пипетки непосредственно наносили на участки верхней стороны фильтра и инкубировали при 37°С в течение 1-2 часов. После инкубирования клетки, которые мигрировали на дно фильтра и в микропланшет, подсчитывали путем помещения микропланшета на устройство FMAT, закупленное у Applied Biosystems.
МСР-1-индуцированная миграция клеток ТНР-1 и максимальная миграция клеток достигалась при 1 нМ, при этом отношение сигнал:шум составляло 10-15. С использованием либо супернатантов гибридомы либо свежей гибридомной среды детектировали МСР-1-зависимую миграцию. Вариабельность результатов анализа была минимальной (С.V ˜15). Число клеток, мигрировавших на дно фильтров, снижалось в зависимости от дозы в том случае, когда анти-МСР-1 антитела связывались с хемоаттрактантом.
Определение аффинности анти-МСР-1 антитела с помощью анализа Biacore. Анализ на взаимодействие антитело/МСР-1 осуществляли при 25°С с использованием двух чипов СМ5, иммобилизованных на оптических биосенсорах BIAcore 3000. Отдельные проточные ячейки на каждом чипе активировали путем 7-минутной инжекции NBS/EDC, затем присоединяли карбогидразид посредством 7-минутной инжекции NHS-эфира и остаточные активированные группы блокировали путем 7-минутной инжекции этаноламина. Моносахаридные остатки каждого антитела окисляли с использованием 1 мМ метапериодата натрия в 100 мМ ацетата натрия, рН 5,5, при 4°С в течение 30 минут. Окисленное антитело обессоливали в 10 мМ ацетате натрия, рН 5,0, для связывания антитела с поверхностью, модифицированной карбогидраидом. mAb-поверхности стабилизировали путем восстановления гидразоновой связи 0,1 М цианоборгидридом натрия. Взаимодействие антигена с антителом тестировали путем инжекции 0, 0,049, 0,15, 0,4, 1,3, 4 и 12 нМ МСР-1 (Peprotech, N.J) в буфере для электрофореза (10 мМ HEPES, 150 мМ NaCl, 0,005% поверхностно-активного вещества, 200 мкг/мл BSA, рН 7,4). Поверхности регенерировали путем подачи 12-секундного импульса 15 мМ H3PO4. Взаимодействие антигена с антителом тестировали путем инжекции образцов антигена в дубликатах, разведенных в буфере для электрофореза (10 мМ HEPES, 150 мМ NaCl, 0,005% поверхностно-активного вещества, 200 мкг/мл BSA, рН 7,4) при разведении концентрации в 300 раз. Поверхности регенерировали путем подачи 12-секундного импульса, 15 мМ H3PO4. Для определения кинетики каждого взаимодействия наборы данных в целом приводили в соответствие с моделью взаимодействия 1:1, которая включала параметр переноса массы. Вычисленные аффинности взаимодействия представлены в таблице 9.
Определение перекрестной реактивности анти-МСР-1 антител с другими хемокинами. ELISA-планшеты (Fisher, Cat. № 12-565-136) сенсибилизировали 50 мкл/лунку МСР-1, МСР-2, МСР-3, МСР-4, RANTES, GRO-альфа, MIP-1-альфа, эотаксина, крысиного МСР-1 и мышиной JE (2 мкг/мл) в буфере для сенсибилизации (0,1 М карбонатный буфер, рН 9,6, NaHCO3, 8,4 г/л), а затем инкубировали при 4°С в течение ночи. После инкубирования планшеты три раза промывали промывочным буфером (0,05% Твин-20 в PBS). Затем добавляли 200 мкл/лунку блокирующего буфера (0,5% BSA, 0,1% Твин-20, 0,01% Тимерозал в 1× PBS), и планшеты инкубировали при комнатной температуре в течение 1 часа. После инкубирования планшеты три раза промывали промывочным буфером. Затем добавляли 50 мкл/лунку супернатантов гибридомы и позитивный и негативный контроль (в качестве позитивного контроля использовали анти-МСР-1 антитело, закупленное у R&D Science, а в качестве негативного контроля использовали антитело против гемоцианина лимфы улитки, производимое Abgenix), а затем планшеты инкубировали при комнатной температуре в течение 2 часов. После инкубирования планшеты три раза промывали промывочным буфером. Затем добавляли 100 мкл/лунку детектирующего ПХ-конъюгированного козьего антитела против человеческого IgG-Fc (Caltag, Cat. # H10507) (и ПХ-конъюгированного козьего антитела против каппа-цепи человеческого Ig (Southern Biotechnology, Cat.# 2060-05) и козьего антитела против лямбда-цепи человеческого Ig (Southern Biotechnology, Cat.# 2070-05) во втором скрининге) и планшеты инкубировали при комнатной температуре в течение 1 часа. После инкубирования планшеты три раза промывали промывочным буфером, добавляли 100 мкл/лунку ТМВ (BioFX Lab. Cat.# TMSK-0100-01), и планшеты оставляли для окрашивания примерно на 10 минут. Затем добавляли 50 мкл/лунку раствора для прекращения реакции (раствор для прекращения реакции, ТМВ (BioFX Lab. Cat.# STPR-0100-01) и планшеты считывали на планшет-ридере для ELISA при длине волны 450 нм. Результаты, представленные в таблице 10, продемонстрировали, что некоторые анти-МСР-1 антитела перекрестно реагируют с родственными хемокинами.
Покрытие: Ag при 2 мкг/мл или 1 мкг/мл; О/N
Ab: очищенные клоны МСР-1, 1:50
рс (позитивный контроль): 1 мкг/мл; nc (негативный контроль): D39.2, IL-8 при 1 мкг/мл
Образцы детектировали ПХ-конъюгированным антителом против gxhG-Fc, 1:2К; контроль: смесь хmIgG1, 2a, 2b, 3 1:1К
Для того чтобы определить, может ли анти-МСР-1 антитело 3.11.2 блокировать функцию других членов семейства МСР, проводили анализы на миграцию, как описано выше. Сначала определяли способность моноцитов ТНР-1 мигрировать в ответ на введение МСР-1, МСР-2, МСР-3 и МСР-4. МСР-1, 2 и 3 эффективно индуцировали миграцию клеток ТНР-1, а МСР-4 не обнаруживал активности в этом анализе (см. фиг.1). При добавлении антитела 3.11.2 в нижнюю часть лунки при различных концентрациях способность клеток ТНР-1 мигрировать в ответ на введение МСР-2 и МСР-3 ингибировалась в зависимости от дозы (фиг.2 и 3).
Пример 3
Картирование эпитопов МСР-1
Моноцитарный хемоаттрактант, белок-1 (МСР-1) является членом семейства бета-цитокинов, который действует посредством специфического рецептора, состоящего из семи трансмембранных доменов, что приводит к рекрутингу моноцитов, базофилов и Т-лимфоцитов в участок воспаления. Антиген, то есть 76-аминокислотный остаток, является негликозилированным и имеет предсказанную молекулярную массу 8,7 кДа. Человеческий МСР-1, экспрессируемый в E. coli, был закуплен у R&D #279MC/CF. МСР обезьян был экспрессирован в клетках 293F, а три варианта МСР-1 обезьян были использованы в анализе, который проводили для определения влияния аминокислотных замен на аффинность связывания с каждым отдельным mAb.
Анализ последовательностей показал, что антитела подразделяются на пять классов. Самый большой класс включает 28 антител, которые являются близкородственными по использованию в них VH1-24, из которых 24 антитела также используют ген Vк В3. В классе, состоящем из трех антител, используется ген VH6-1, причем в двух из этих антител используется ген Vк В3. Три других класса представлены одним антителом, в каждом из которых используются VH1-2, VH3-33 и VH4-31, причем в двух из mAb используется ген Vк08. При этом следует отметить, что антитела, номера которых начинаются с 1, 2, 3 или 4, представляют различные гибридомы, происходящие от независимых групп мышей XenoMouse®. Поэтому эти моноклональные антитела продуцируются из независимых линий дифференцировки В-клеток, созревающих во время независимого первичного и вторичного иммунных ответов у мышей XenoMouse®. Благодаря такой независимости сходство нуклеотидных и аминокислотных последовательностей генов VH и Vk антитела также отражает конвергентную эволюцию и отбор на сходную структуру вариабельных областей, которые могут связываться с МСР-1 и потенциально нейтрализовать этот МСР-1 (см. таблицу 11).
Конформ. = конформационный
ND = не проводили
Не связывается = не связывается на вестерн-блоте
Для того чтобы определить, связывается ли каждое антитело с линейным или конформационным эпитопом, проводили Вестерн-блот-анализ. Для того чтобы определить, влияет ли нарушение внутримолекулярных связей под действием восстановителя на реактивность выбранных анти-МСР-1 антител, очищенный МСР-1 загружали на устройство для электрофореза в ДСН-ПААГ (4-20% гель) в невосстанавливающих (NR) или в восстанавливающих (R) условиях. Электрофорез в ДСН/ПААГ проводили методом Лэммли с использованием системы с минигелем. Разделенные белки переносили на нитроцеллюлозную мембрану. Мембраны блокировали с использованием PBS, содержащего 5% (мас./об.) обезжиренного сухого молока, по крайней мере, за 1 час до проявления и зондировали в течение 1 часа каждым из этих антител. Анти-МСР-1 антитело детектировали с использованием ПХ-конъюгированных козьих антител против человеческих иммуноглобулинов (разведение 1:8000; Sigma Catalog # A-8667). Мембраны проявляли с использованием интенсивной хемилюминесценции (ECL®; Amersham Bioscience) в соответствии с инструкциями производителей.
Комплексы "антитело-МСР-1" анализировали тремя методами: (1) методом активации поверхностей лазерной десорбцией/ионозацией (SELDI) (технология белковых чипов) для линейных и конформационных эпитопов; (2) методом сайт-направленного мутагенеза для линейных и конформационных эпитопов, и (3) методом с использованием пептидного массива SPOT для линейных эпитопов. SELDI представляет собой недавно разработанный точный, быстрый и чувствительный метод определения молекулярных масс пептидов и белков. Линейные и конформационные эпитопы были картированы по массе фрагмента, связанного с иммобилизованным антителом, с помощью технологии белковых чипов SELDI. Картирование линейных эпитопов с помощью SELDI осуществляли в три стадии. В первой стадии МСР-1 гидролизовали высокоспецифичными протеолитическими ферментами для продуцирования наборов пептидных фрагментов. Во второй стадии пептидные фрагменты, содержащие линейные эпитопы, отбирали по их специфическому связыванию с иммобилизованным антителом на белковом чипе. В этой стадии пептиды, которые содержали эпитоп, образовывали комплексы с антителом, а другие пептиды, которые не связывались с антителом, были удалены путем промывки в жестких условиях. В последней стадии идентичность связывающегося с антителом пептида определяли по его молекулярной массе с помощью SELDI и по известным сайтам рестрикции специфической протеазой.
Антитела 1.4.1, 1.8.1, 1.14.1, 1.18.1 одинаково реагировали с нативным и денатурированным МСР-1 на Вестерн-блоте, что указывало на то, что они имеют линейный эпитоп. Их эпитоп картировали с помощью SELDI. Эксперименты проводили путем карбоксиметилирования антигена МСР-1 для предупреждения образования дисульфидных связей между цистеиновыми остатками данного белка. Метилированный МСР-1 гидролизовали Glu-С-эндопротеиназой, которая специфически расщепляет пептидные связи остатков глутаминовой кислоты (Е) со стороны карбоксиконца. mAb ковалентно связывались с массивом белковых чипов, РS20. Поверхность чипов блокировали 1 М этаноламином и промывали PBS, 0,5% Тритон. Glu-C-фрагменты метилированного антигена МСР-1 были связаны с иммобилизованным антителом. Несвязанные фрагменты отмывали детергентом (PBS, 0,1% Твин). Связанные Glu-C-фрагменты (эпитоп) анализировали и идентифицировали методом SELDI по их массе. В таблице 12 систематизирована предполагаемая масса каждого пептида, продуцируемого в результате полного гидролиза метилированного МСР-1 ферментом Glu-C. МСР-1 был полностью гидролизован с образованием трех фрагментов. Теоретическое значение pI составляло: 9,39/Mw (средняя масса): 8685,03/Mw (масса моноизотопов): 8679,44. После промывки фрагмент, имеющий массу 4635 и соответствующий остаткам 1-39, был еще связанным с антителом, что указывало на то, что эпитоп всех этих антител находится в первых 39 остатках, поскольку для каждого из указанных антител наблюдалась одна и та же картина.
Метод SELDI был также использован для картирования конформационных эпитопов. В данном случае белок А, ковалентно связанный с массивами белковых чипов PS2 (Ciphergen Biosystems), использовали для захвата mAb, а затем подвергали инкубированию с МСР-1. После удаления несвязанного материала комплексы гидролизовали специфическими протеазами в высоких концентрациях. Антитела МСР-1 (1.7.2, 3,11.2 и 3.7.2) не связывались с восстановленным денатурированным антигеном на Вестерн-блотах, что указывало на то, что этот эпитоп, вероятно, является конформационным. Сначала антитела 1.7.2 и 3.7.2 подвергали ковалентному связыванию с чипом PS20. Нативный МСР-1 связывали с антителом, а затем гидролизовали эндопротеиназой (Lys-C в одном эксперименте и Asp-N в другом эксперименте). Несвязанные фрагменты отмывали PBS+, 0,2% Тритон, а затем промывали PBS и ВЭЖХ-водой. Эпитоп определяли с помощью SELDI и идентифицировали по массе фрагмента. Оба этих антитела 1.7.2 и 3.7.2 имели фрагмент массой 5712, соответствующий остаткам 3-53 (таблица 13; теоретическое значение pI составляло: 9,39/Mw (средняя масса): 8685,03/Mw (масса моноизотопов): 8679,44) и связывающийся с эпитопом после промывки, что указывало на то, что этот эпитоп всех этих антител находится в 3-53 аминокислотных остатках нативного антигена МСР-1.
Для картирования эпитопа антитела 3.11.2 размер связывающегося домена минимизировали с использованием другой протеазы. Белок А (Calbiochem, 539202) ковалентно иммобилизовали на чипе PS20. Остаточные сайты связывания блокировали этаноламином, рН 8,0. Антитело 3.11.2 связывали с белком А. Чип промывали PBS, а затем 50 мМ Hepes, рН 7,5. Антиген МСР-1 связывался с антителом. Несвязанный антиген удаляли путем промывки 0,1% Твин в PBS, а затем 50 мМ Hepes, pH 7,5 и 100 мМ бикарбонатом аммония. Гидролиз МСР-1 на одном чипе осуществляли с помощью эндопротеиназы, Lys-C. Этот чип промывали 0,1% Тритон в PBS для удаления несвязанных фрагментов. Связанный фрагмент анализировали по его массе с помощью SELDI. С антителом был связан только один пик с массой 1861,8, представляющий собой последовательность из 15 аминокислот, расположенную между остатками 20-35 (таблица 14; теоретическое значение pI: 9,39/Mw (средняя масса): 8685,03/Mw (масса моноизотопа): 8679,44) МСР-1 с массой 1865, а последовательность ISVQRLASYRRITSSK (положения 20-35 SEQ ID NO:149) была идентифицирована как фрагмент, связанный наиболее жесткой связью.
Мутагенез МСР-1. Ранее было показано, что два кластера, состоящие, главным образом, из основных остатков (R24, K35, K38, K49 и Y13), очевидно, принимают наибольшее участие во взаимодействии между МСР-1 и его рецептором (Hemmerich et al., (1999) Biochemistry 38, 13013-13025). Данные по связыванию показали, что N-концевые остатки играют незначительную роль в активности связывания и что важную роль в активности передачи сигнала МСР-1 играют только два главных остатка: К35 и R24. К35 является наиболее функционально важным остатком, поскольку значительное влияние на связывание и активность оказывает мутация К35, а также аланиновые мутанты R24 (Hemmerich et al., (1999) Biochemistry 38, 13013-13025). Arg24 является консервативным у различных видов МСР-1, а также у человеческого МСР-2-4, но значительно варьируется у других хемокинов СС, а поэтому он может быть ответственен за специфичность к рецептору. Для идентификации отдельных остатков в первых 39 остатках МСР-1, представляющих собой Glu-С-гидролизат и играющих важную роль в связывании с антителом, были генерированы три мутанта МСР-1: три основных остатка, R24, К35 и К38 мутировали с помощью сайтнаправленного мутагенеза, а затем мутантный белок анализировали на связывание со всеми 36 нейтрализующими антителами с помощью ELISA. Arg24 был заменен на аланин (R24А) и глутаминовую кислоту (R24Е). Lys35 и К38 были заменены на аланин (К35А, К38А соответственно). Все мутации были введены в исходный обезьяний МСР-1. Конструкцию обезьяньего МСР-1 выделяли с помощью ОТ-ПЦР-реакции с использованием РНК, выделенной из лимфоцитов периферической крови обезьяны (двунаправленная реакция РСR3.1 для МСР-1 собакоподобных обезьян). Выравнивание последовательностей белка человеческого и обезьяньего МСР-1 выявило 99% гомологию с двумя аминокислотными заменами у С-конца (положения 71 и 76). С-концевые остатки 59-76 не участвуют во взаимодействии с рецептором и не влияют на связывание всех 36 антител.
ELISA-анализ осуществляли с использованием супернатанта от клеток 293, трансфецированных различными мутированными конструкциями МСР-1. ELISA-планшеты сенсибилизировали козьим поликлональным антителом IgG против человеческого МСР-1 (R&D catalog № AF279NA), разведенным до 1 мкг/мл в сенсибилизирующем буфере для ELISA-планшетов. Экспрессию мутантных конструкций МСР-1 в клетках 293 подтверждали путем детекции биотинилированным козьим антителом против человеческого МСР-1 (R&D catalog № BAF279), а затем ПХ-конъюгированным стрептавидином. Связывание мутантного МСР-1 с антителами против МСР-1 детектировали с использованием ПХ-конъюгированного козьего антитела против человеческого IgG (Fc-специфического, Caltag Catalog № H10507). ELISA-результаты показали, что мутация К38 не оказывала никакого влияния на связывающую активность всех 36 антител. Связывание всех антител с мутантным антигеном R24E и R24A MCP-1 было полностью элиминировано (см. таблицу 15). Однако мутация К35А ингибировала связывание только шести антител (1.6.1, 1.9.1, 3.6.1, 3.10.1). Все эти антитела очевидно имели конформационный эпитоп, связывание с которым подавлялось мутацией либо Arg24, либо Lys35. Полученные данные позволяют предположить, что эти четыре антитела распознают другой конформационный эпитоп, который отличается от эпитопов других антител, но перекрывается с ними.
ND = не проводили
Не связывается = не связывается с вестерн-блотом
Что касается антител, связывающихся с линейным эпитопом, то их связывание с пептидным эпитопом подробно исследовали с использованием технологии SPOT. SPOT представляет собой технологию, которая позволяет проводить твердофазный синтез тысяч пептидов в формате, подходящем для осуществления системного анализа эпитопов антитела. Эта система является простой, исключительно быстрой и экономичной с точки зрения использования реагентов. Специально изготовленный пептидный массив получали от Sigma-Genosys (The Woodlands, Texas). Была синтезирована серия из 32 13-мерных пептидов, охватывающих остатки 1-76 последовательности МСР-1. Каждый последующий пептид перекрывался с двумя аминокислотами от предшествующего пептида, в результате чего образовывалось "гнездовая" перекрывающаяся библиотека. Мембрану, несущую 32 пептида, зондировали 8 антителами против МСР-1 (1 мкг/мл), детектировали ПХ-конъюгированным "вторым" антителом, а затем оценивали по усилению интенсивности хемилюминесценции (ECL). Мониторинг реакции проводили путем наблюдения пяти следующих друг за другом пептидных "пятен" (7-11), соответствующих аминокислотам 21-25 МСР-1. На основании этих результатов очевидно, что коровая область эпитопа для всех тестируемых антител против МСР-1, связывающихся с линейным эпитопом, представляет собой последовательность SVQRL (21-25). Последовательность МСР-1 представляет собой:
QPDAINAPVTCCYNFTNRKISVQRLASYRRITSSKCPKEAVIFKTIVAKEICADPKQKWVQDSMDHLDKQTQTPKT (SEQ ID NO:149)
Восемь антител, которые распознают линейный эпитоп, реагировали с теми же самыми пятнами SPOT: 1.2.1, 1.4.1, 1.5.1, 1.8.1, 1.10.1, 1.13.1, 1.14.1 и 1.18.1.
Пример 4
Определение аффинности перекрестно реагирующих антител с помощью высоразрешающего анализа Biacore
Анализ на взаимодействие осуществляли при 25°С с использованием двух чипов СМ5, иммобилизованных на оптических биосенсорах BIAcore 2000. Отдельные проточные ячейки на каждом чипе активировали путем 7-минутной инжекции NHS/EDC, затем присоединяли карбогидразид путем 7-минутной инжекции NHS-эфира и остаточные активированные группы блокировали посредством 7-минутной инжекции этаноламина. Моносахаридные остатки mAb 3.11.2, разведенные 1/50, окисляли с использованием 1мМ метапериодата натрия в 100 мМ ацетата натрия, рН 5,5, при 4°С в течение 30 минут. Окисленное антитело обессоливали в 10 мМ ацетате натрия, рН 5,0, для связывания антитела с поверхностью, модифицированной карбогидразидом. Поверхность, покрытую mAb 3.11.2 с плотностью, составляющей 250 отн.ед., использовали для измерения зарегистрированных взаимодействий МСР-1 и МСР-4, а поверхность с плотностью 110 отн.ед. использовали для измерения взаимодействий антигенов МСР-2 и МСР-3 с mAb 3.11.2. mAb-поверхности стабилизировали путем восстановления гидразоновой связи 0,1 М цианоборгидридом натрия. Взаимодействие антигена с антителом тестировали путем инжекции образцов антигена в дубликате, разведенных в буфере для электрофореза (10 мМ HEPES, 150 мМ NaCl, 0,005% поверхностно-активного вещества, 200 мкг/мл BSA, рН 7,4) при разведении концентрации в 300 раз. Поверхности регенерировали путем подачи 12-секундного импульса 15 мМ H3PO4.
Для определения кинетики каждого взаимодействия наборы данных в целом приводили в соответствие с моделью взаимодействия 1:1, которая включала параметр переноса массы. Оцененные константы ассоциации и диссоциации и вычисленные аффинности взаимодействия с антителом 3.11.2 представлены в таблице 16. Данные для всех других антител представлены в таблице 8.
Пример 5
Предотвращение ангиогенеза антителами против МСР-1
Ангиогенез индуцировали у мышей-моделей путем смешивания матригеля с человеческим bFGF (10 нг/мл), человеческим VEGF165 (100 нг/мл) и 10 мкг/мл гепарина или МСР-1 (250 нг/мл) и МСР-3 (100 нг/мл). Примерно 0,5 мл суспензии подкожно инъецировали в правый бок 6-8-недельных бестимусных самок "голых" мышей. Для каждой дозы МСР-1 и МСР-3 использовали пять мышей. Кроме того, в качестве негативного контроля использовали только матригель (без факторов роста). Имплантаты матригеля отверждались in situ и оставались неповрежденными в течение 7 дней. По истечении 7 дней мышей анестезировали и слои матригеля осторожно удаляли микрохирургическими инструментами. Гели фотографировали с использованием просвечивающего электронного микроскопа. Из одной части слоев получали срезы для заливки в парафин. Эти срезы разрезали на двух различных уровнях и окрашивали Н/Е. Другую часть геля быстро замораживали в жидком азоте и подвергали иммуноцитохимическому окрашиванию крысиным моноклональным антителом против мышиного антигена CD31, конъюгированного с фикоэритрином. Н+Е-окрашенные предметные стекла проявляли на выявление различных выстланных эндотелием сосудов. Предметные стекла, окрашенные анти-CD31 антителом, конъюгированным с фикоэритрином (РЕ), наблюдали под флуоресцентным микроскопом (с красным фильтром), к которому была подсоединена видеокамера Spot. Изображения фиксировали с помощью цифровой видеокамеры с использованием компьютерной программы Metamorph. Плотность микрососудов определяли методом, описанным Уальдом и др. (Wild et al., 2000).
Было обнаружено, что МСР-1 и МСР-3 вызывали ангиогенез эквивалентный ангиогенезу, индуцированному хорошо охарактеризованными ангиогенными факторами VEGF и bFGF. Кроме того, МСР-1- или МСР-3-индуцированный ангиогенез у животных, а следовательно, и в опухолях и пораженных тканях человека, может быть предотвращен путем обработки антителами против МСР-1 или антителом, таким как 3.11.2, которое нейтрализует активность всех членов семейства МСР. В соответствии с этим для получения зависимости "доза-ответ", необходимой для проведения требуемого лечения, животным вводили инъекцию анти-МСР антител при различных дозах, варьирующихся приблизительно от 0,1 до 0,5 мг на одно животное.
Пример 6
Продуцирование МСР-1 опухолевыми клетками
Для того чтобы определить, продуцируют ли опухолевые клетки МСР в клеточной культуре, панель клеточных линий была проанализирована на их способность секретировать МСР-1 в культуральную среду. Клетки культивировали в модифицированной по методу Дульбекко среде Игла (DMEM), содержащей 10% фетальной бычьей сыворотки или ее эквивалент, вплоть до достижения конфлюэнтности. Супернатант удаляли и аликвоту тестировали на реактивность с МСР-1 с использованием коммерчески доступного ELISA-набора от R&D Science. В таблице 17 представлены раковые клеточные линии, которые конститутивно секретируют МСР-1, и соответствующие уровни МСР-1, определенные с помощью ELISA.
Пример 7
Действие анти-МСР-1 антител в мышиной модели опухоли
Для оценки влияния анти-МСР-1 антител на рост подкожной опухоли клетки Panc-1, находящиеся в экспоненциальной фазе роста, собирали и ресуспендировали в 0,2 мл сбалансированного солевого раствора Хэнкса (HBSS). Опухоли развивались после инъекции 5·106 клеток Panc-1, смешанных с восстановленным матригелем, содержащим фактор роста, в оба бока самок "голых" мышей BALB/c. Начиная со дня имплантации животных обрабатывали 0,5 мг анти-МСР-1 антитела 1.7.3 и антитела РК против KLH, или PBS во время, указанное на графике. Затем проводили еженедельный мониторинг роста опухоли, и результаты представлены как среднее ± ср.кв.от. (фиг.4). Различие между контрольными и обработанными животными были статистически значимыми при сравнении с использованием т-критерия Стьюдента (Р<0,002). В соответствии с этим анти-МСР-1 антитела обеспечивают эффективное снижение роста опухоли in vivo.
Пример 8
Компьютерный анализ анти-МСР-1 антител
Вышеописанные данные, относящиеся к потоку кальция, хемотаксису и аффинности анти-МСР-1 антител, анализировали с использованием компьютерной программы Guided Analytic, поставляемой Spotfire, Inc., Somerville, MA. Результаты представлены на фиг.5 и 6.
Пример 9
Структурный анализ анти-МСР-1 антител
Вариабельные тяжелые цепи и вариабельные легкие цепи антител, представленных в таблице 1, секвенировали для определения их ДНК-последовательностей. Данные о полноразмерных последовательностях всех анти-МСР-1 антител приводятся в списке последовательностей вместе с нуклеотидными и аминокислотными последовательностями для каждой комбинации гамма- и каппа-цепей.
Последовательности вариабельной тяжелой цепи анализировали для определения семейства VH, последовательности D-области и последовательности J-области. Затем последовательности транслировали для определения первичной аминокислотной последовательности и сравнивали с последовательностями VH, D- и J-области зародышевой линии для оценки соматических гипермутаций. На фиг.7 проиллюстрировано сравнение, проводимое с помощью программы Clustal W, последовательностей анти-МСР-1 антител с использованием VH1-24, где указаны области CD, CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма. На фиг.8 проиллюстрировано сравнение, проводимое с помощью программы Clustal W, последовательностей анти-МСР-1 антител с использованием VК-В3, где указаны области CD, CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма. На фиг.9 проиллюстрировано сравнение с помощью программы, проводимое Clustal W, последовательностей анти-МСР-1 антител с использованием VК-08, где указаны области CD, CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма. На фиг.10 проиллюстрировано сравнение, проводимое с помощью программы Clustal W, последовательностей анти-МСР-1 антител с использованием VH6-1, где указаны области CD, CDR1, CDR2 и CDR3, и представлена построенная по этим данным дендрограмма.
Пример 10
Использование анти-МСР-1 антител в качестве диагностического средства
А. Детекция антигена МСР-1 в образце
Был разработан твердофазный иммуноферментный анализ (ELISA) для детекции антигена МСР-1 в образце. В этом анализе лунки микротитрационного планшета, такого как 96-луночный микротитрационный планшет и 384-луночный микротитрационный планшет, адсорбировали в течение нескольких часов с первым полностью человеческим моноклональным антителом против данного антигена. Иммобилизованное антитело служило в качестве антитела для захвата любого антигена, который может присутствовать в тест-образце. Для предотвращения неспецифической адсорбции аналита лунки промывали и обрабатывали блокирующим агентом, таким как белок молочной сыворотки или альбумин.
Затем лунки обрабатывали тест-образцом, который, как предполагалось, содержит данный антиген, или раствором, содержащим стандартное количество данного антигена. Таким образцом может быть, например, проба сыворотки, взятая у индивидуума, с подозрением на содержание в ней соответствующих уровней циркулирующего антигена, которые рассматриваются как диагностический признак патологии.
После отмывки тест-образца или стандарта лунки обрабатывали вторым полностью человеческим моноклональным анти-МСР-1 антителом, которое метили путем конъюгирования с биотином. Меченное анти-МСР-1 антитело служило в качестве детектирующего антитела. После отмывки избытка "второго" антитела лунки обрабатывали конъюгированной с авидином пероксидазой хрена (ПХ) и подходящим хромогенным субстратом. Концентрацию антигена в тест-образцах определяли путем сравнения со стандартной кривой, построенной для стандартных образцов.
ELISA-анализ является в высокой степени специфичным и очень чувствительным анализом на детекцию антигена МСР-1 в тест-образце.
В. Определение концентрации МСР-1 в образцах, взятых у пациента
"Сэндвич"-анализ ELISA был разработан для количественной оценки уровней МСР-1 в человеческой сыворотке. Два анти-МСР-1 антитела, используемых в "сэндвич"-анализе ELISA, преимущественно распознавали различные эпитопы на молекуле МСР-1 (данные не приводятся). ELISA проводили следующим образом: 50 мкл анти-МСР-1 антитела для захвата в сенсибилизирующем буфере (0,1 М NaHCO3, рН 9,6), при концентрации 2 мкг/мл наносили на ELISA-планшеты (Fisher). После инкубирования при 4°С в течение ночи, планшеты обрабатывали 200 мкл блокирующего буфера (0,5% BSA, 0,1% Твин-20, 0,01% тимерозал в PBS) в течение 1 часа при 25°С. Затем планшеты промывали (3×) с использованием 0,05% Твин-20 в PBS (в промывочном буфере, WB). Сыворотку здорового человека или сыворотку пациента (Clinomics, Bioreclaimation) разводили в блокирующем буфере, содержащем 50% человеческую сыворотку. Планшеты инкубировали с пробами сыворотки в течение ночи при 4°С, промывали WB, а затем инкубировали со 100 мкл/лунку биотинилированного детектирующего анти-МСР-1 антитела в течение 1 часа при 25°С. После промывки планшеты инкубировали с ПХ-стрептавидином в течение 15 минут, промывали, как описано выше, а затем обрабатывали 100 мкл/лунку о-фенилендиамина в H2O2 (проявляющим раствором Sigma) для проявления окраски. Затем реакцию прекращали добавлением 50 мкл/лунку Н2SO4 (2 М) и анализировали с использованием планшет-ридера для ELISA при 492 нм. Концентрацию антигена PRO в пробах сыворотки вычисляли путем сравнения с разведениями очищенного антигена МСР-1 с помощью программы построения кривой по четырем параметрам.
С. Определение стадии рака у пациента
Следует отметить, что на основании результатов, представленных и обсуждаемых в примерах 10А-10В в соответствии с описанным здесь вариантами настоящего изобретения, можно установить стадию развития рака у индивидуума исходя из уровней экспрессии антигена МСР-1. Для рака данного типа брали пробы крови у индивидуумов, у которых был диагностирован рак на различных стадиях развития заболевания, и/или у индивидуумов, находящихся на различных стадиях терапии рака. Концентрацию антигена МСР-1, присутствующего в этих пробах крови, определяли методом, который позволяет специфически определять количество имеющегося антигена. Таким методом является метод ELISA, который описан в примерах 10А-10В. С использованием набора проб, которые позволяют получить статистически значимые результаты для каждой стадии развития или терапии рака, определяют диапазон концентраций данного антигена, который может рассматриваться как характерный диапазон концентраций для каждой из указанный стадий.
Для определения стадии прогрессирования рака у обследуемого индивидуума или для характеризации ответа данного индивидуума на проводимый курс лечения у этого индивидуума брали пробу крови и определяли концентрацию антигена МСР-1, присутствующего в данной пробе. Полученную таким образом концентрацию использовали для того, чтобы определить, в каком диапазоне находится данная концентрация. Установленный таким образом диапазон соответствует определенной стадии развития заболевания или стадии терапии, идентифицированной у различных групп индивидуумов с данным диагнозом, что позволяет определить стадию заболевания у данного индивидуума во время исследования.
Пример 11
Использование анти-МСР-1 антител для лечения опухолей
Для определения in vivo эффектов лечения анти-МСР-1 антителом у людей, страдающих опухолями, пациентам инъецировали эффективное количество анти-МСР-1 антитела в течение определенного периода времени. Во время лечения пациента обследовали в определенные периоды времени для того, чтобы определить, прогрессирует ли у него данная опухоль, а в частности наблюдается ли у данного пациента рост и метастазирование этой опухоли.
Опухоль у пациента, подвергающегося лечению анти-МСР-1 антителами, обнаруживала низкий уровень роста и метастазирования по сравнению с ростом и метастазированием опухолей у пациентов, обработанных контрольными антителами. Контрольными антителами, которые могут быть использованы для этих целей, являются антитела такого же изотипа, как и тестируемые анти-МСР-1 антитела, однако могут быть использованы антитела, не обладающие способностью связываться с опухолевым антителом МСР-1.
Представленное выше описание изобретения является достаточным для практического применения данного изобретения. Объем описанных здесь вариантов настоящего изобретения не ограничивается представленными конструкциями, поскольку описанный здесь вариант приводится лишь в целях иллюстрации некоторых аспектов изобретения и любые конструкции, которые являются функционально эквивалентными, входят в объем настоящего изобретения.
В вышепривиденном подробном описании и в примерах приводятся лишь некоторые предпочтительные варианты осуществления настоящего изобретения и представлен наилучший способ его осуществления, предлагаемый заявителями. Однако следует отметить, что поскольку в настоящем изобретении не приводится подробного описания всех вариантов осуществления настоящего изобретения, то настоящее изобретение может быть осуществлено многими способами и его объем определяется прилагаемой формулой изобретения и любыми ее эквивалентами.










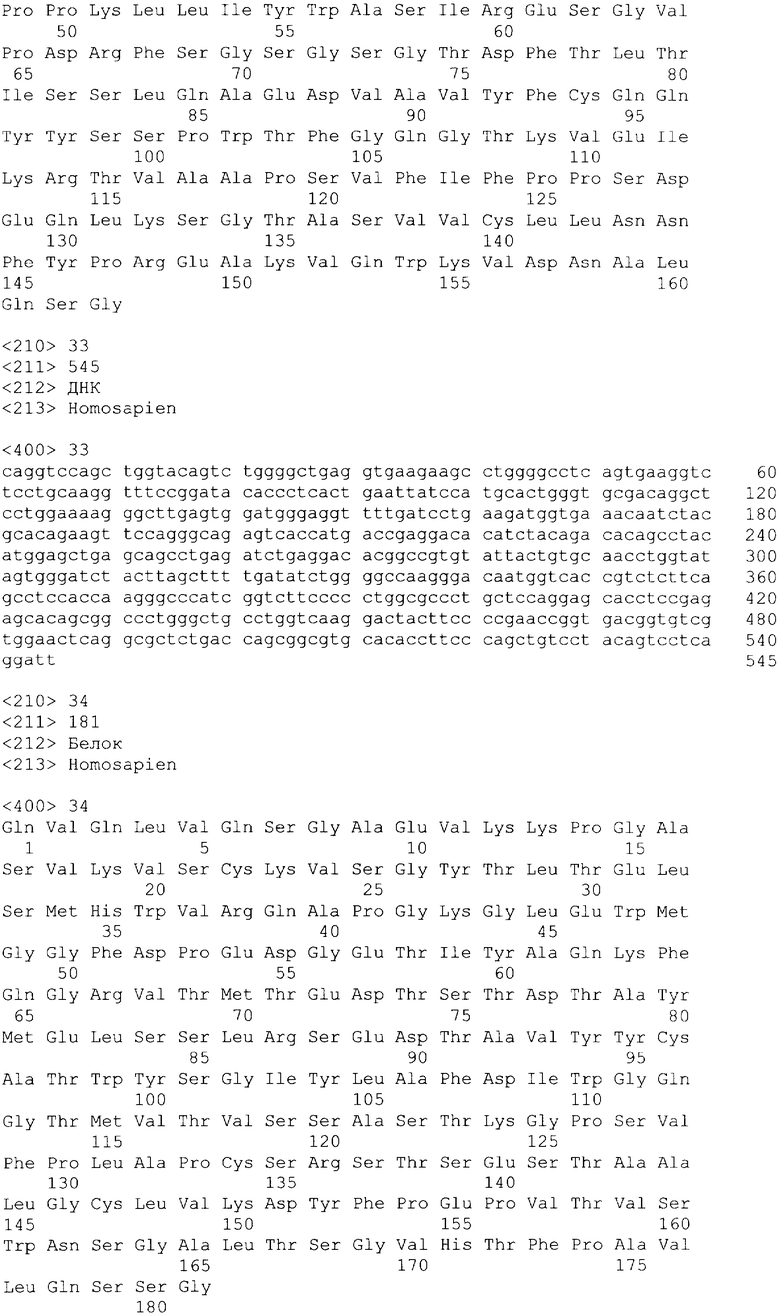
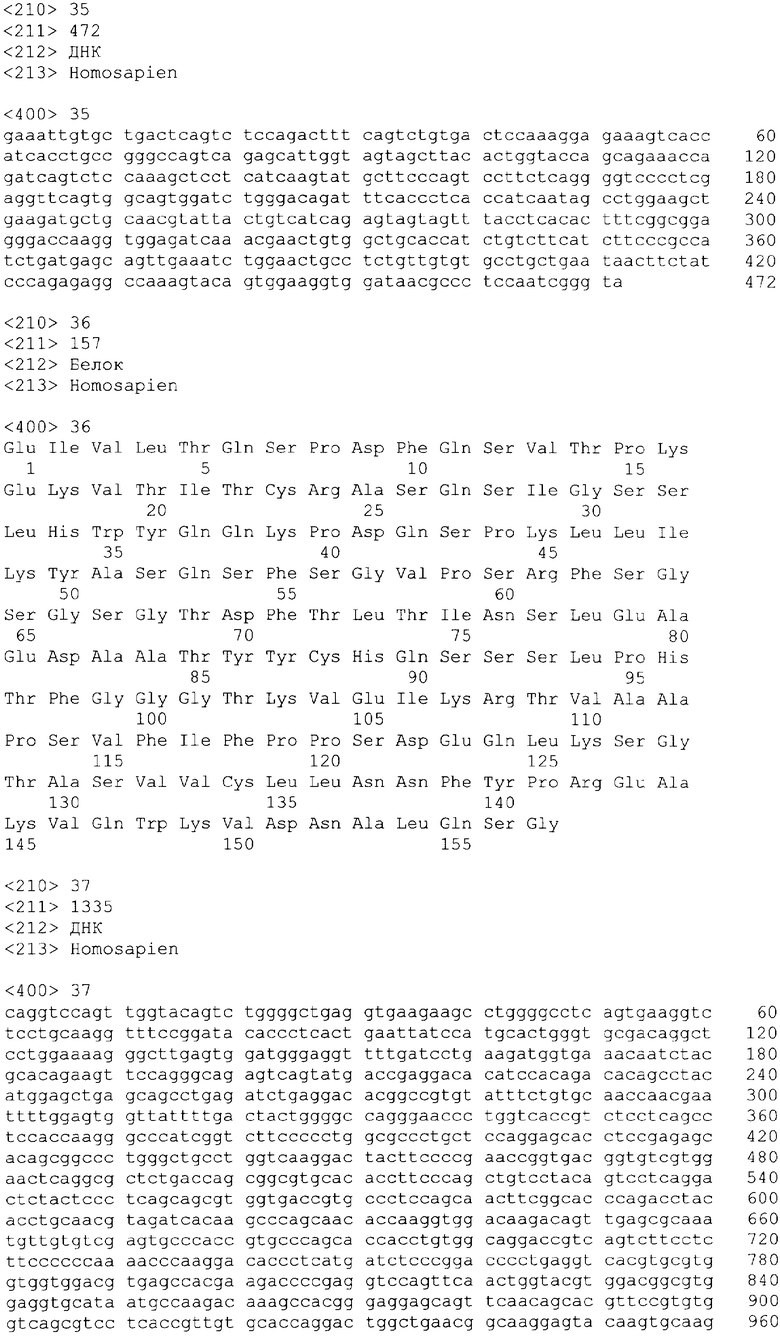
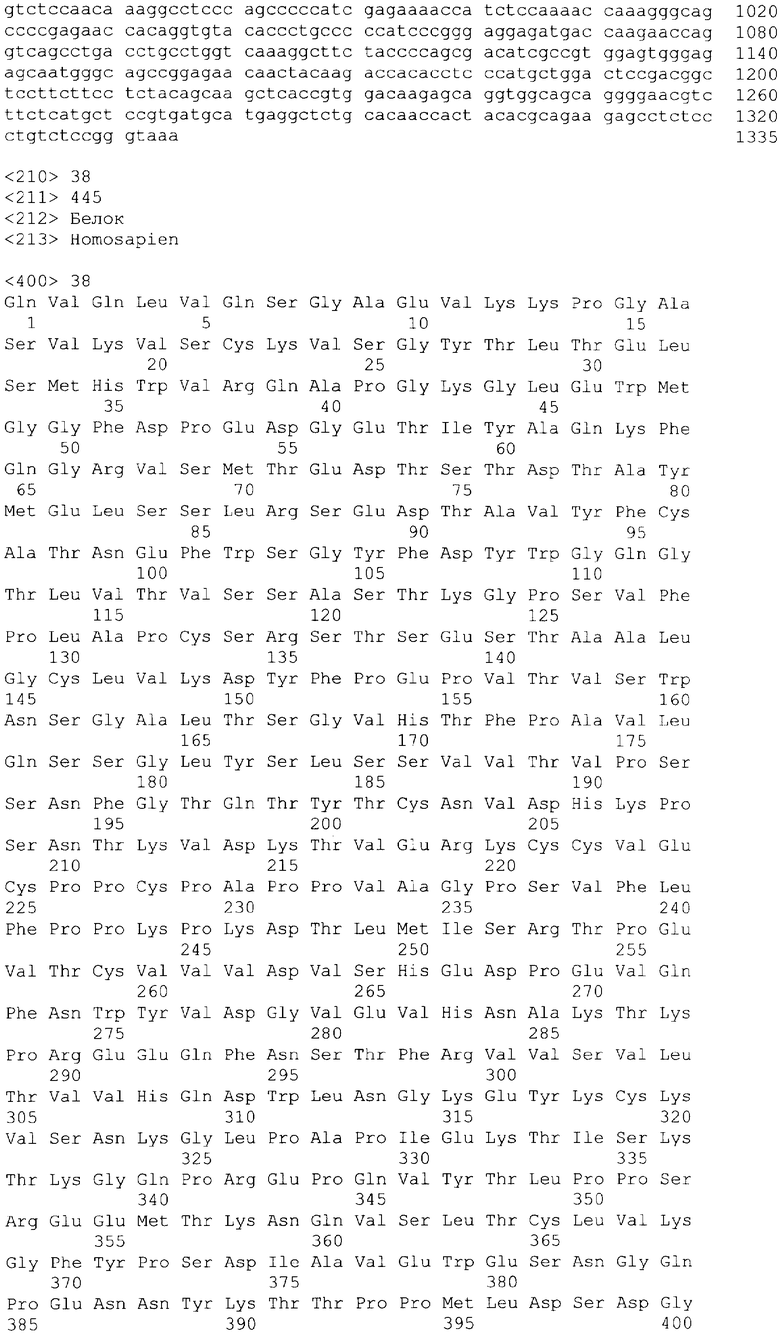



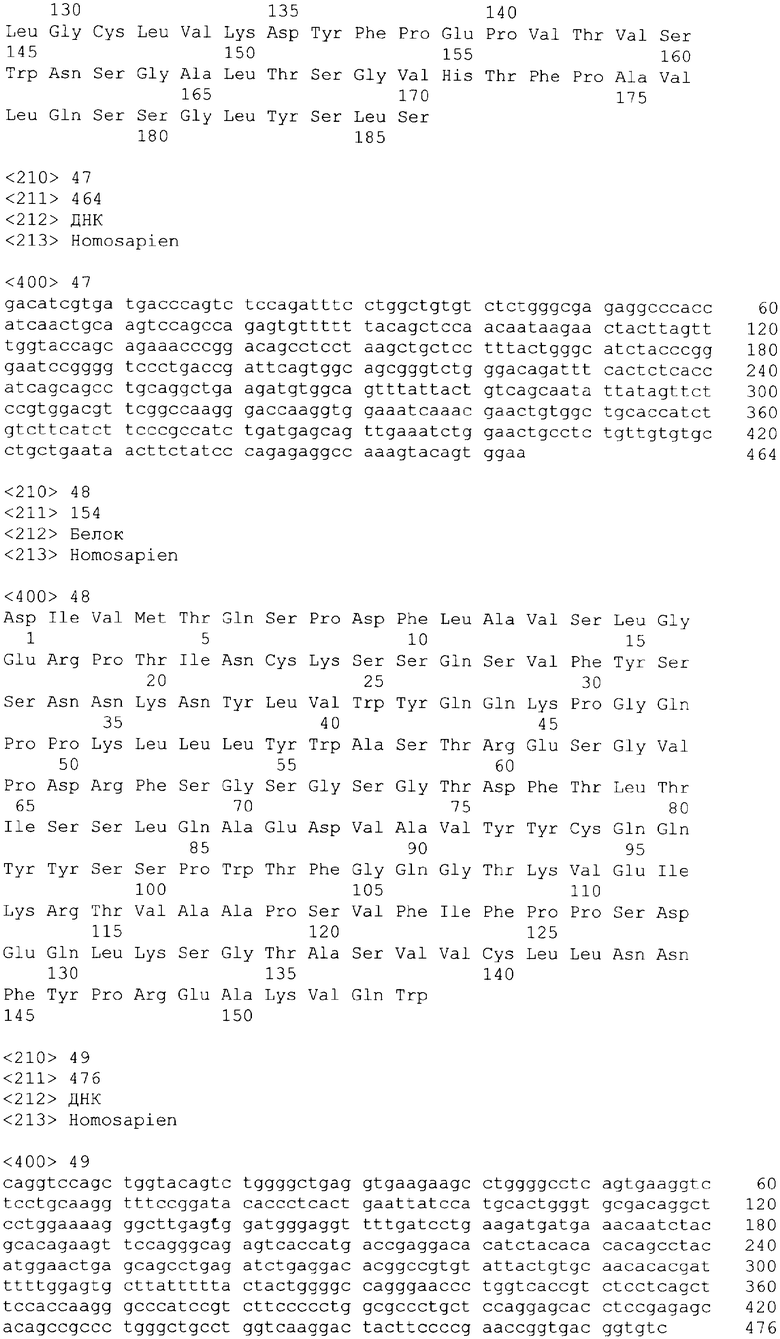


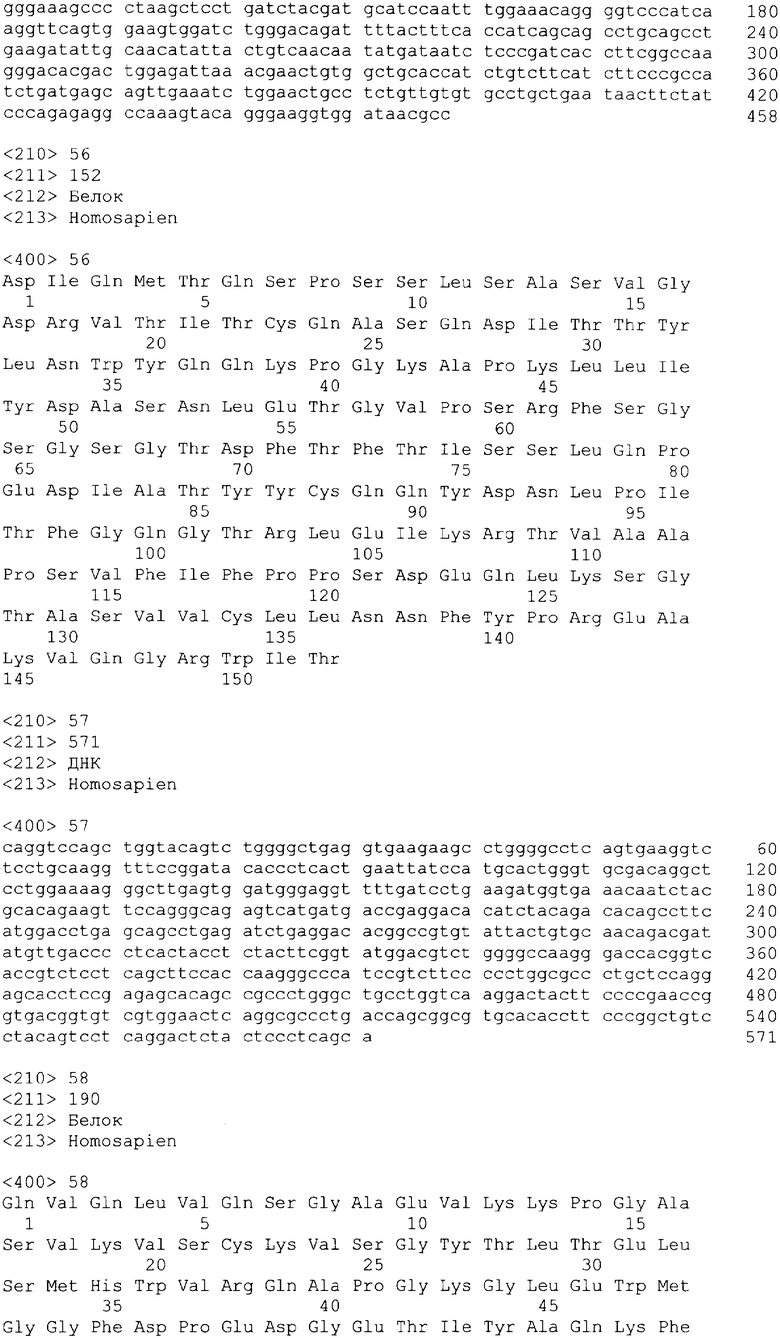











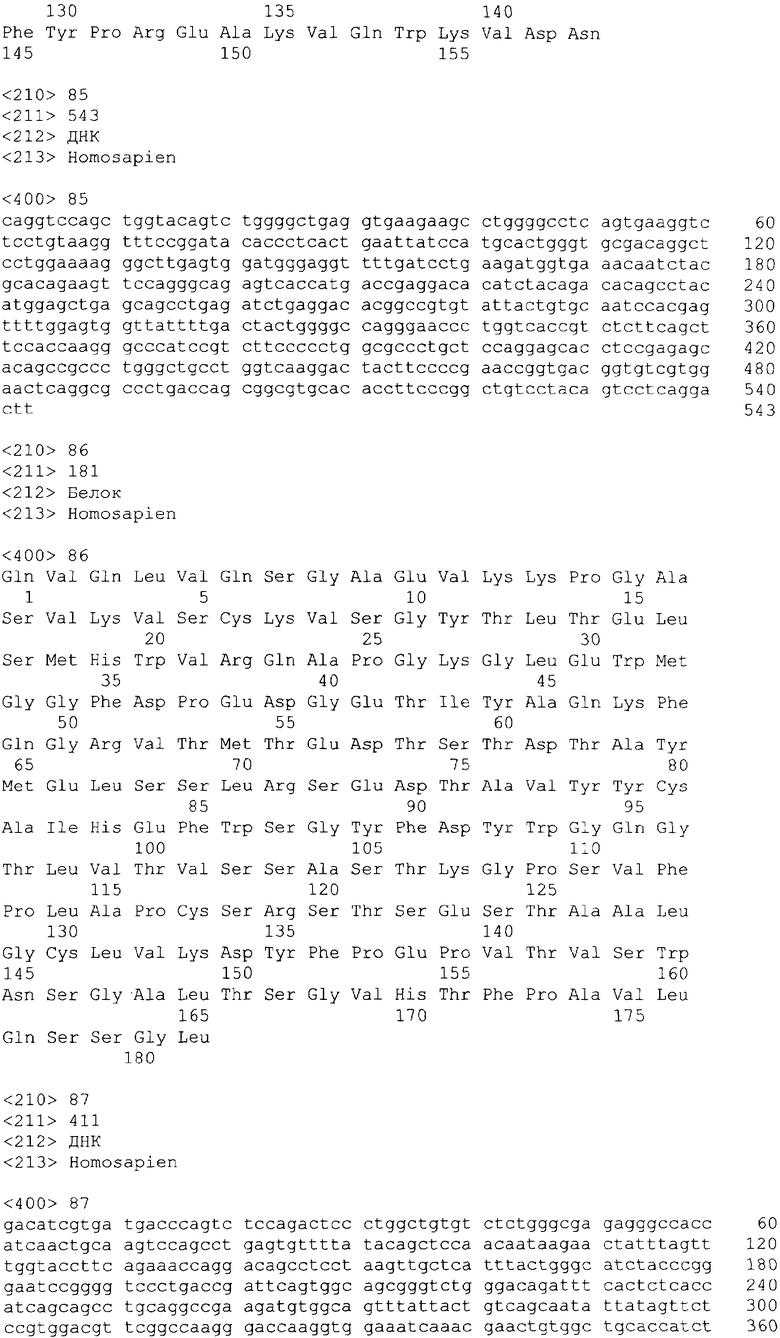



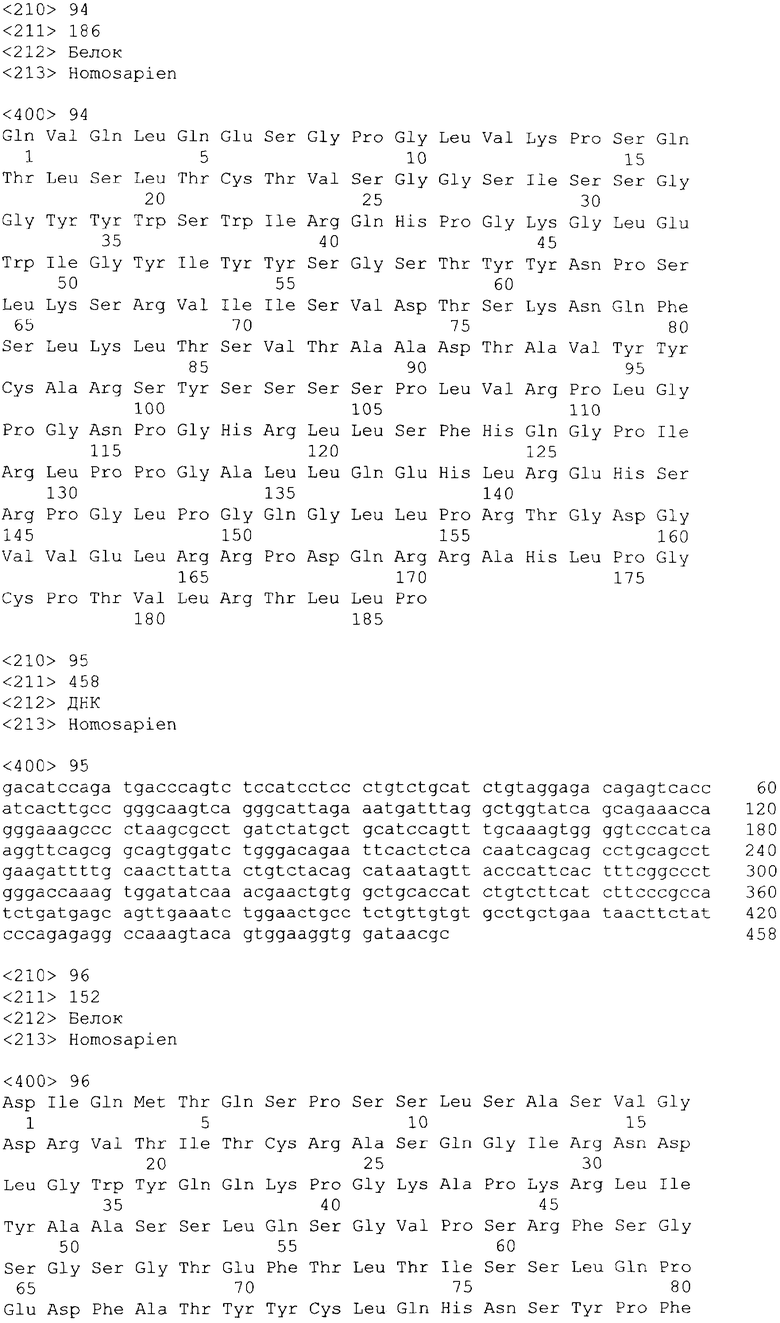
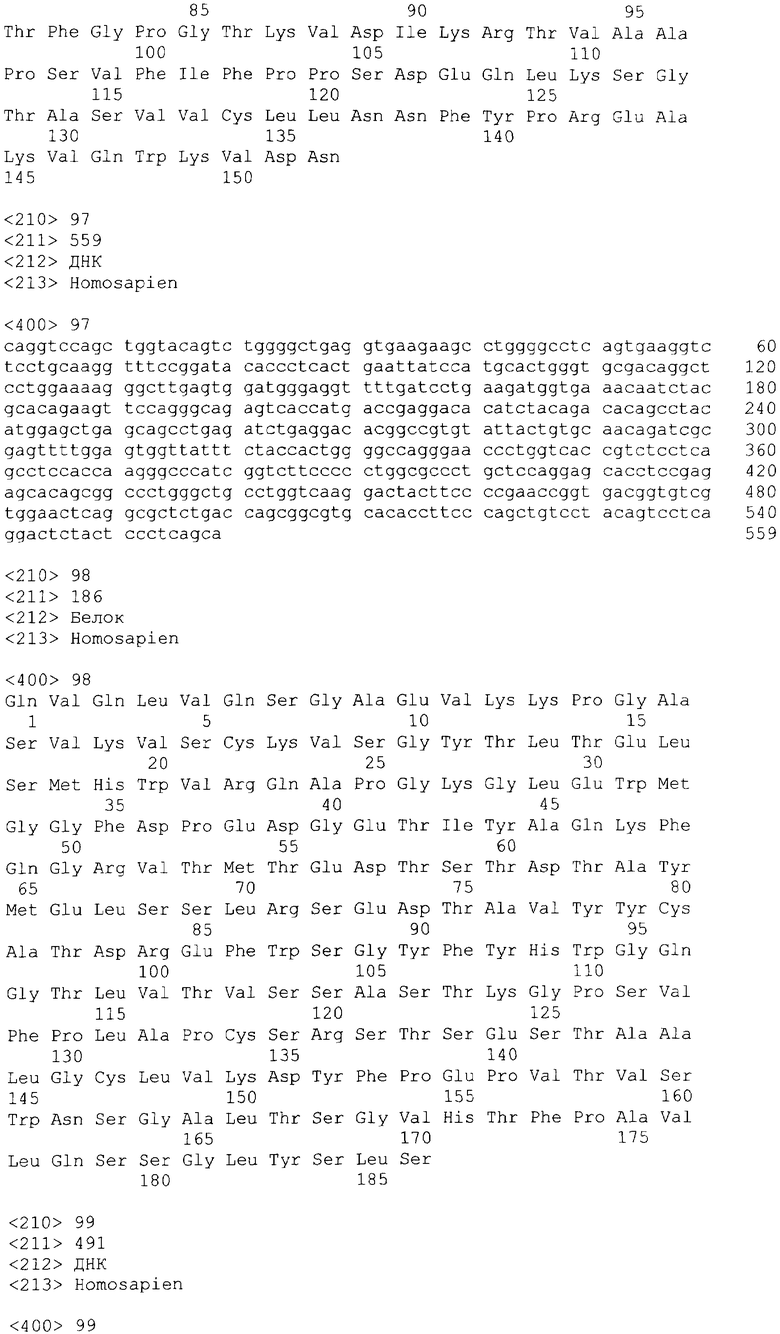
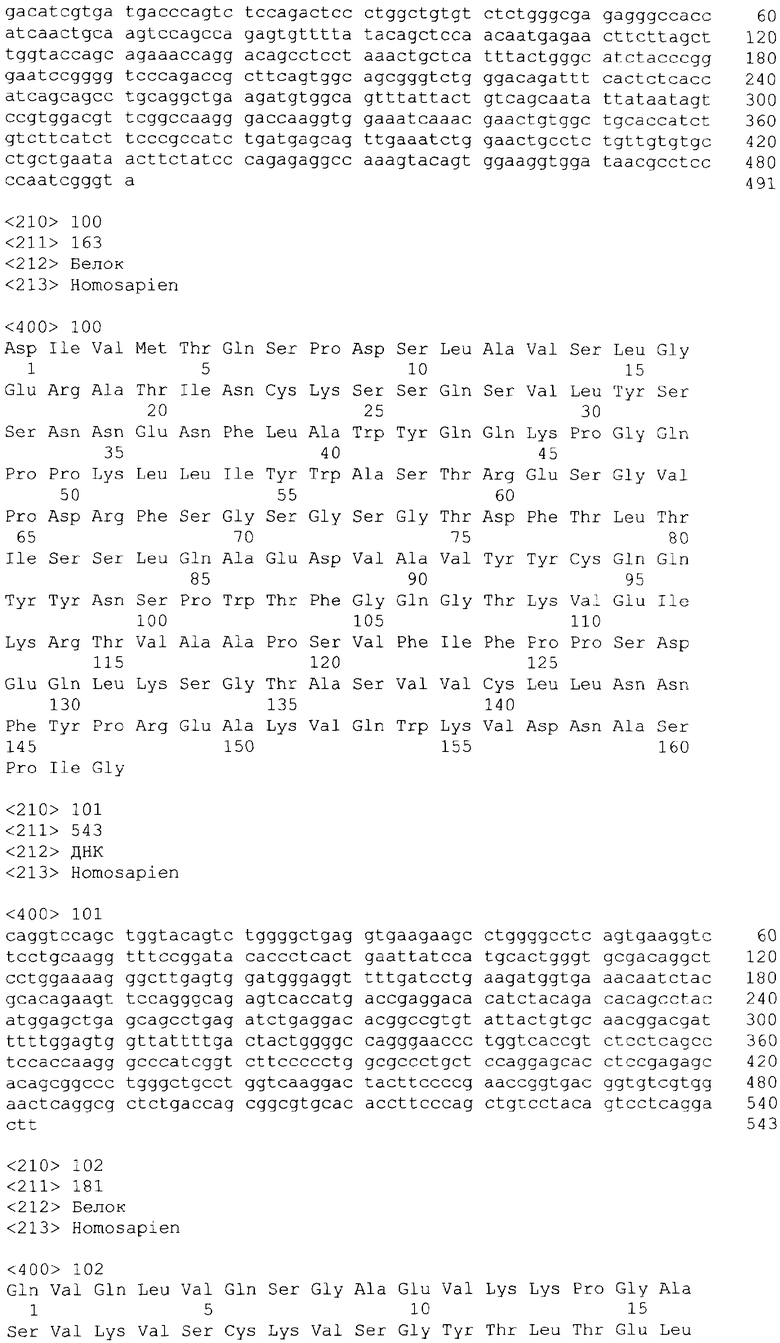



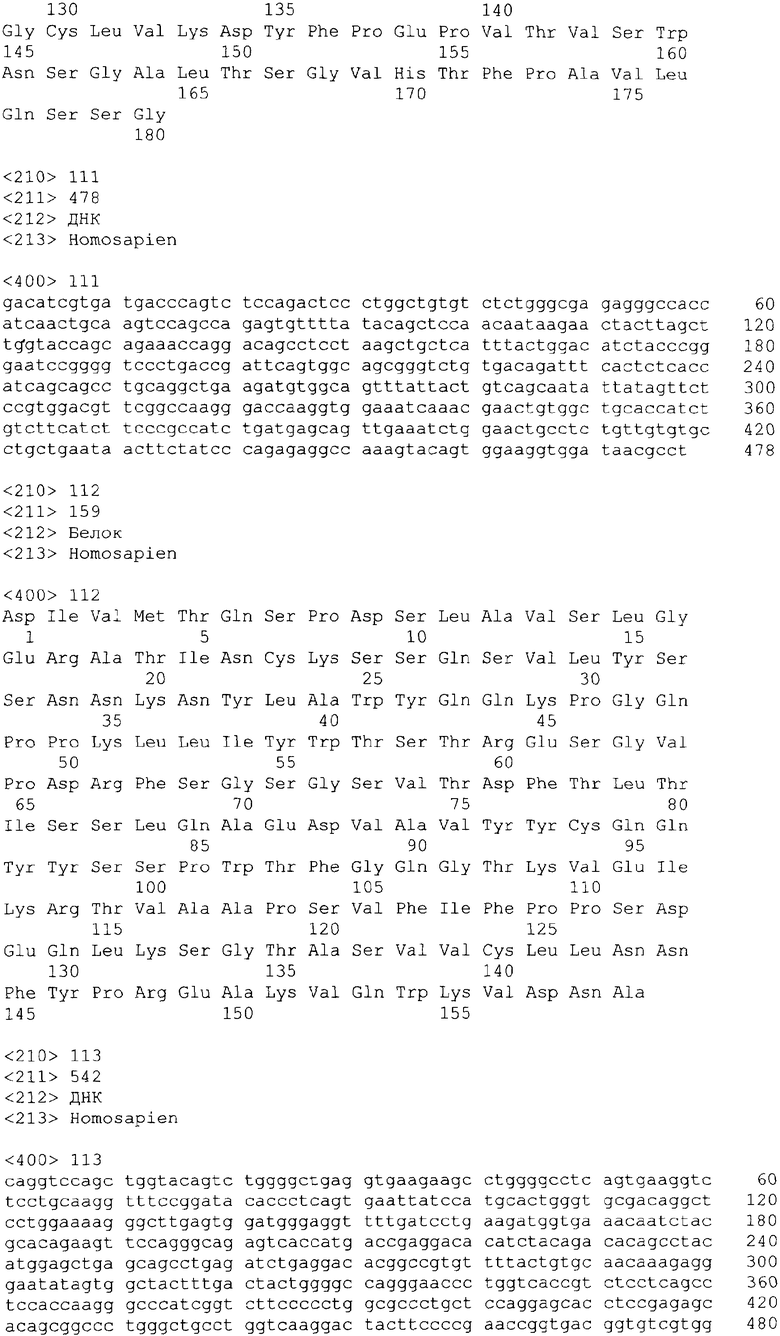
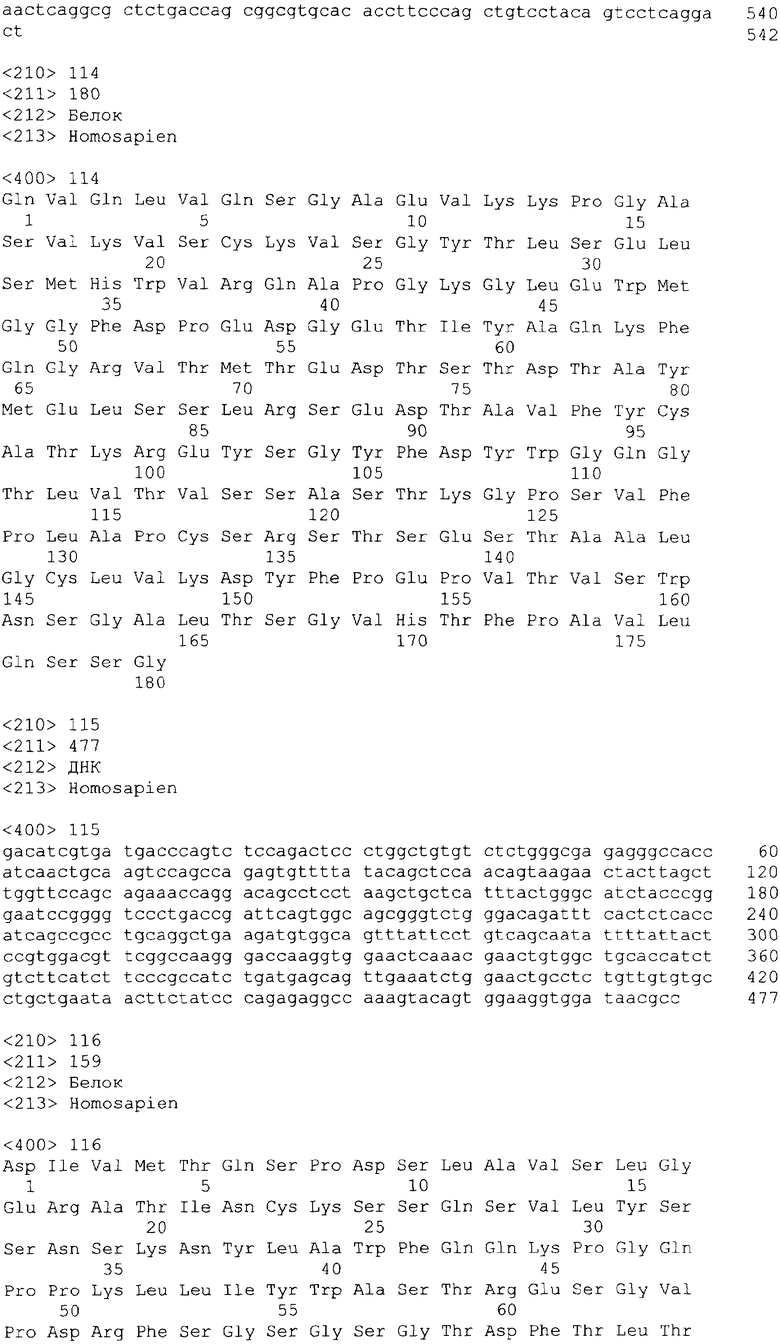
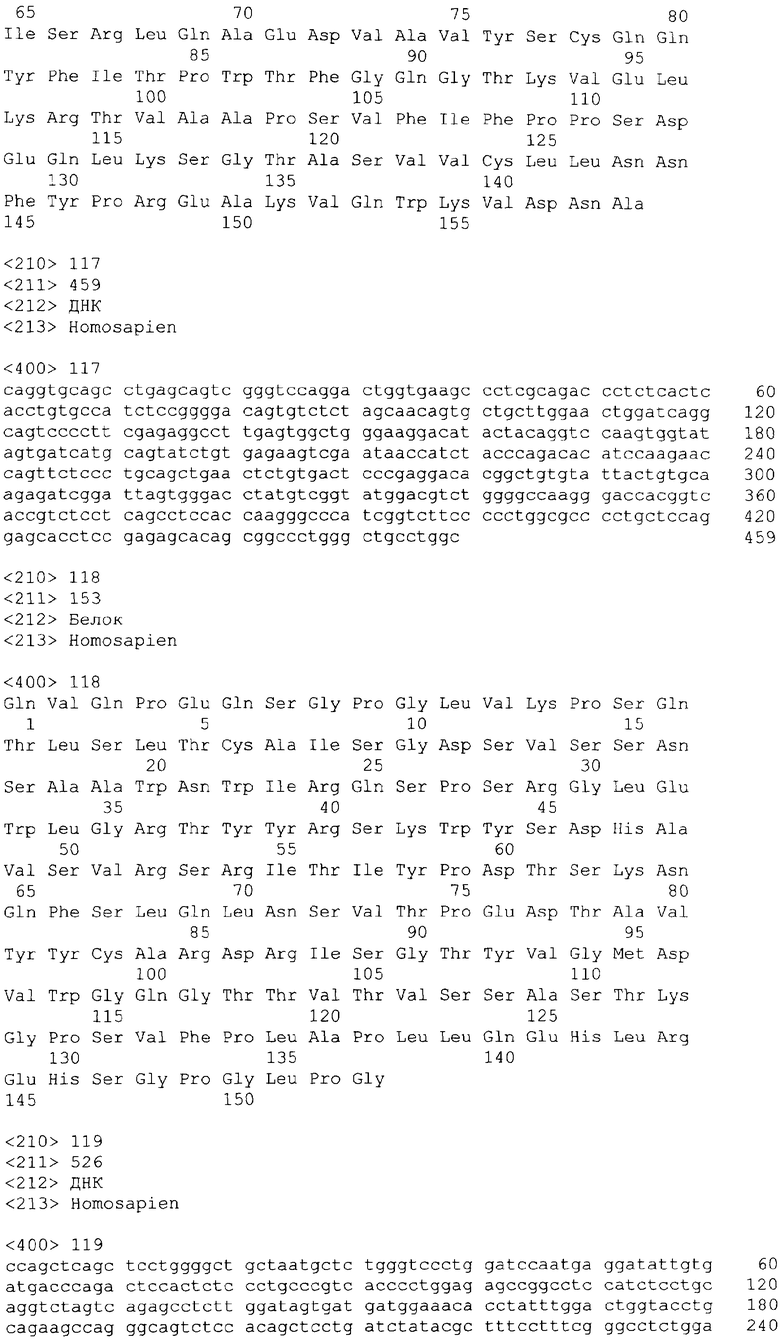
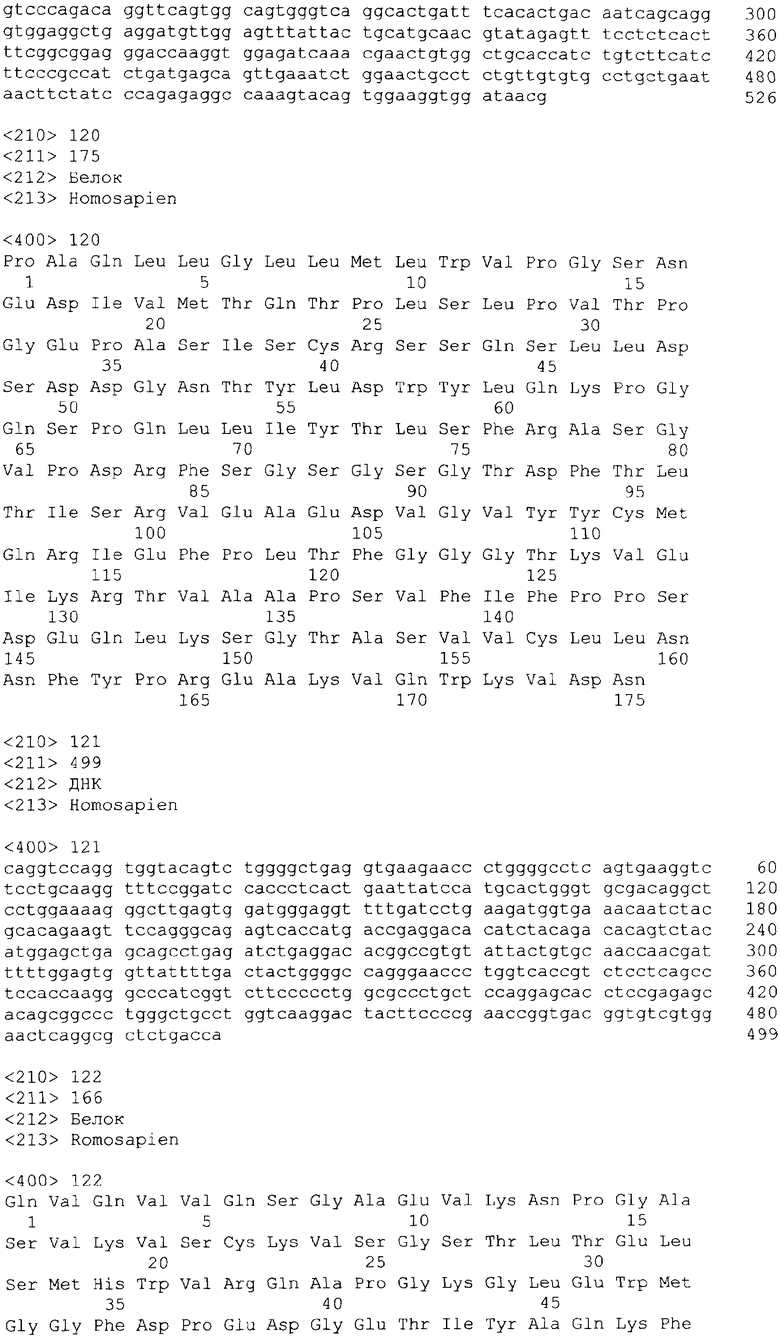



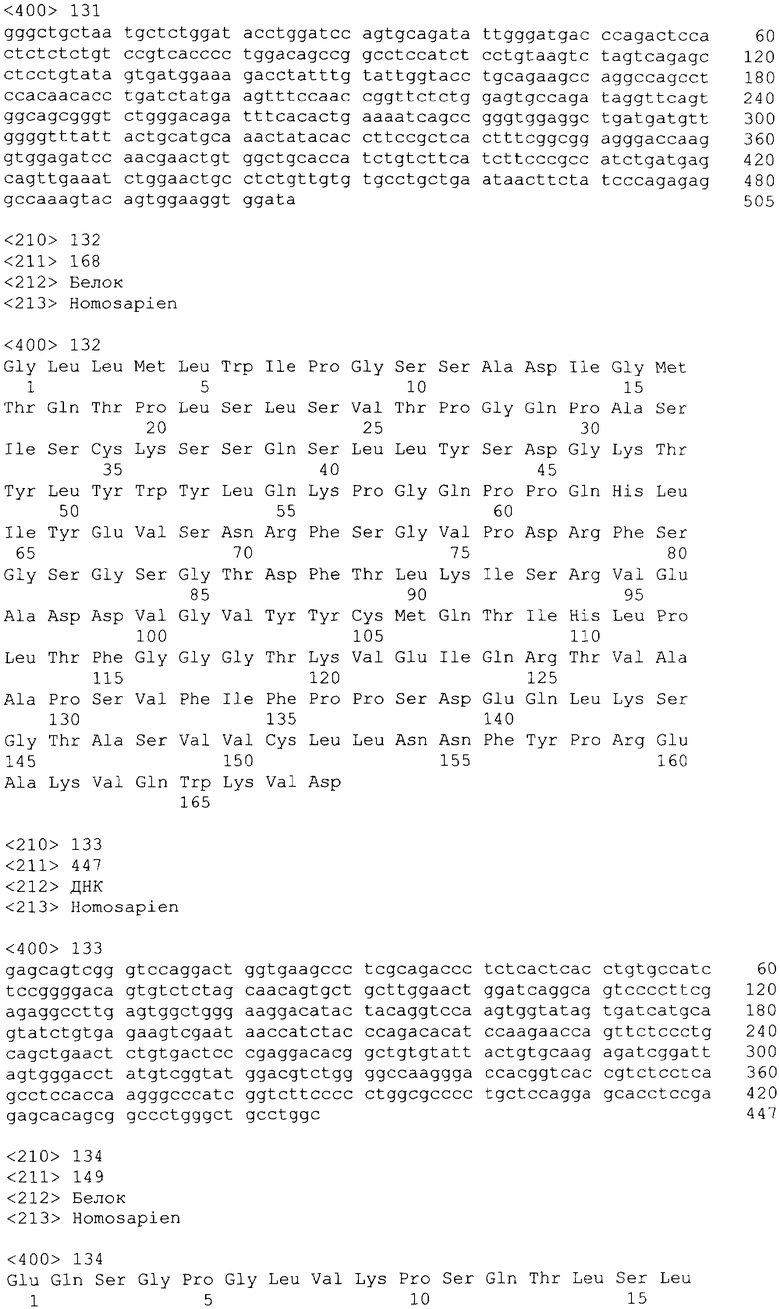






| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-CXCR3 АНТИТЕЛА | 2013 |
|
RU2663141C2 |
| АНТИТЕЛА РЕЦЕПТОРА 1 ИНТЕРФЕРОНА АЛЬФА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2600884C2 |
| АНТИТЕЛА РЕЦЕПТОРА 1 ИНТЕРФЕРОНА АЛЬФА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2412202C2 |
| АНТИ-PD-1-АНТИТЕЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2656181C1 |
| НОВЫЕ АНТИ-PD-1 АНТИТЕЛА | 2016 |
|
RU2729830C2 |
| Антитела к PD-1 и способы их применения | 2015 |
|
RU2701797C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ РАКА | 2009 |
|
RU2533460C2 |
| НОВЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1(PD-1) | 2016 |
|
RU2757316C2 |
| Антитела против эотаксина 2, которые распознают дополнительные связывающие CCR3 хемокины | 2015 |
|
RU2705255C2 |
| АНТИ-СD3-АНТИТЕЛО И МОЛЕКУЛА, СОДЕРЖАЩАЯ ЭТО АНТИТЕЛО | 2017 |
|
RU2790326C2 |
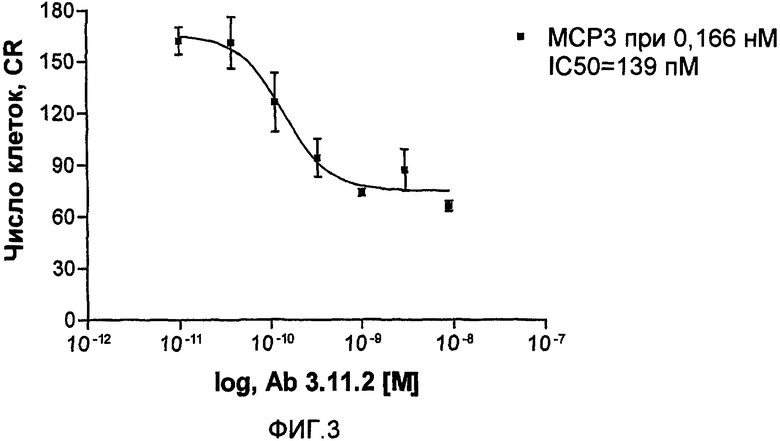
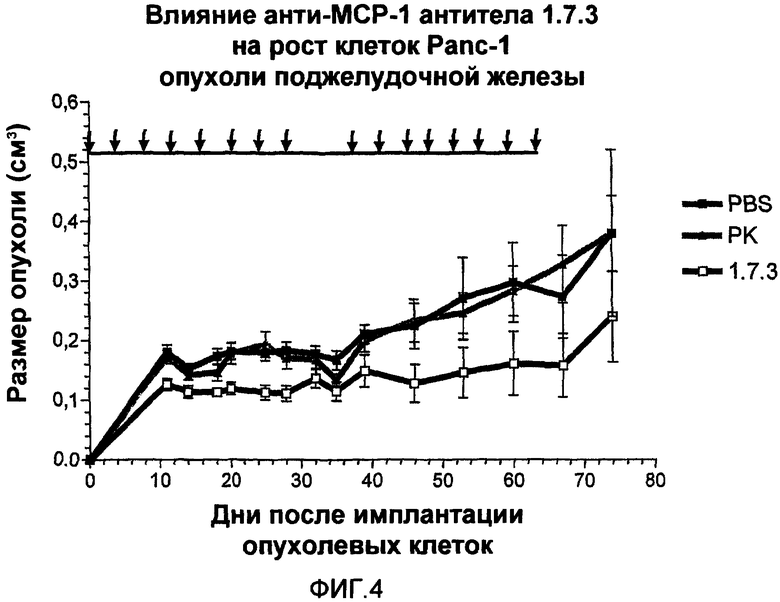
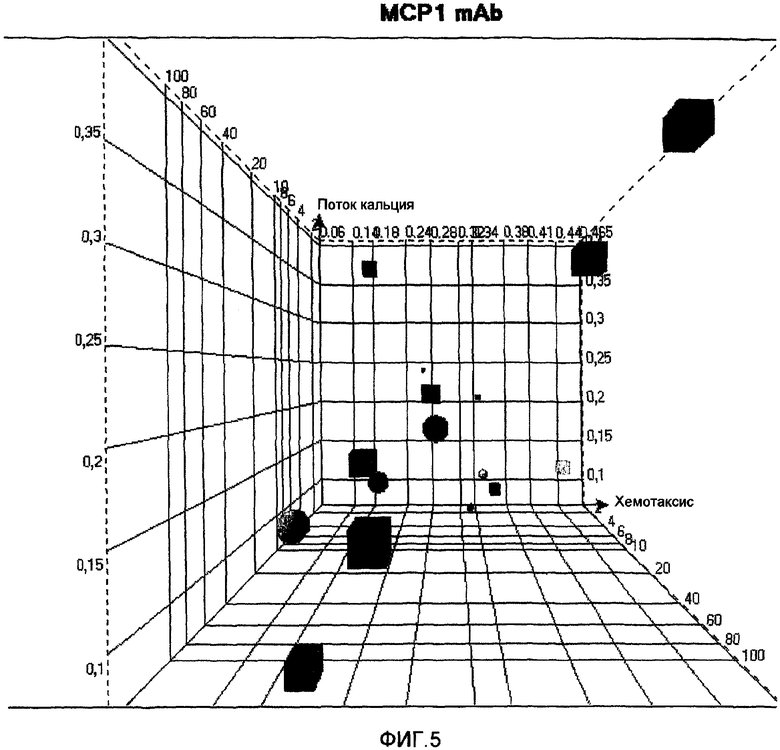
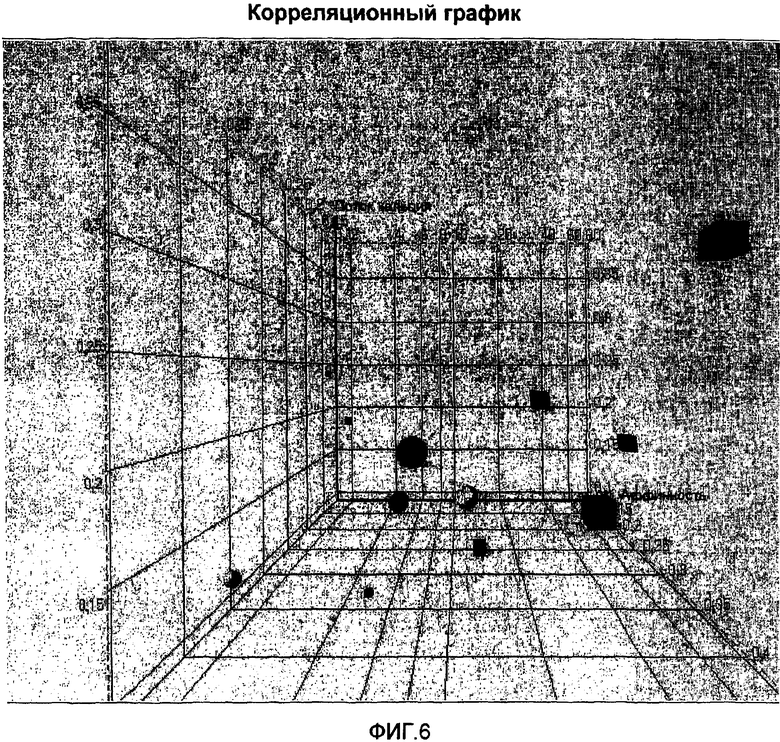



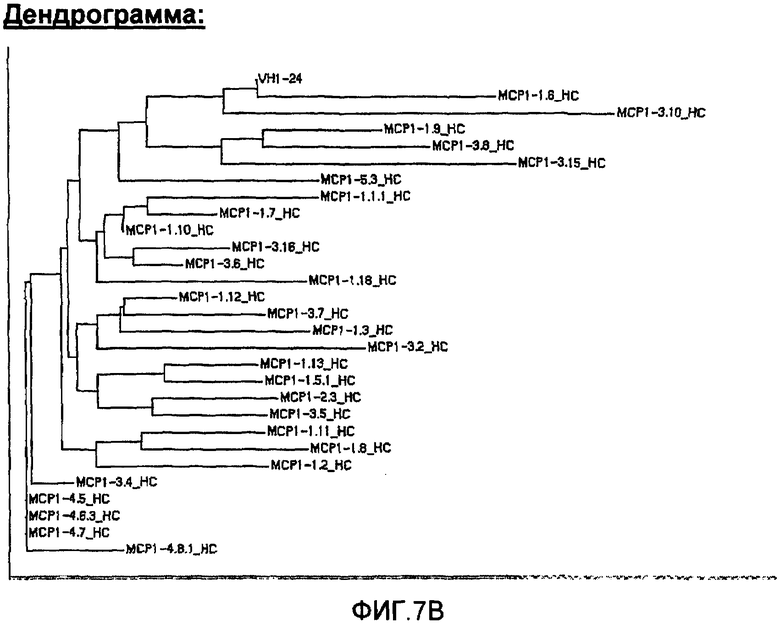

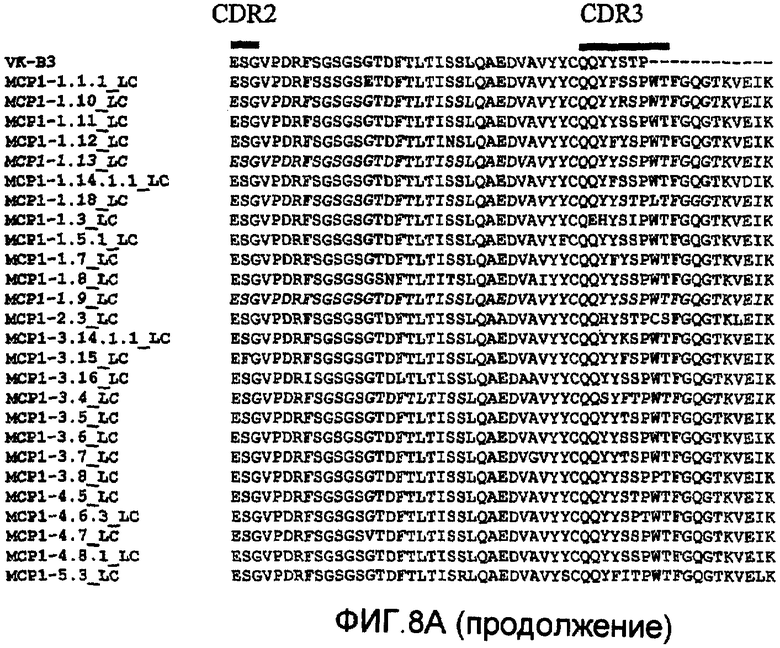
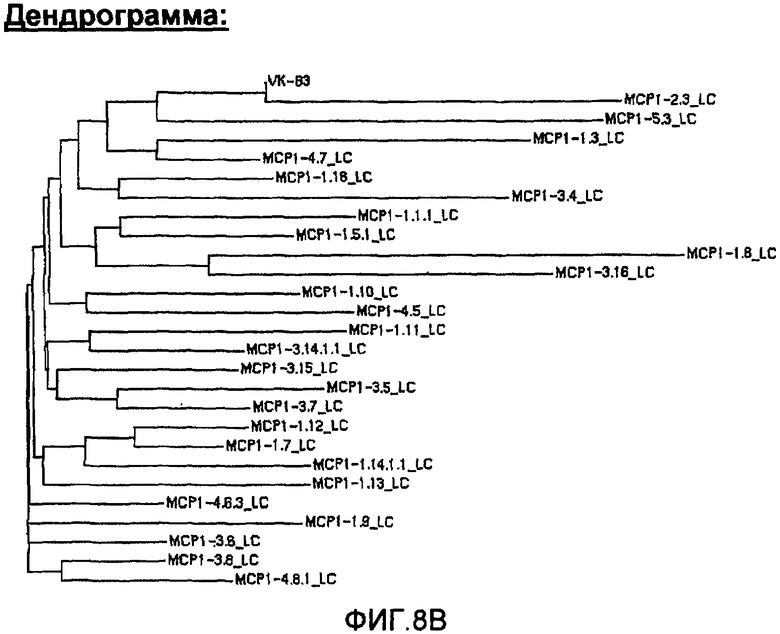
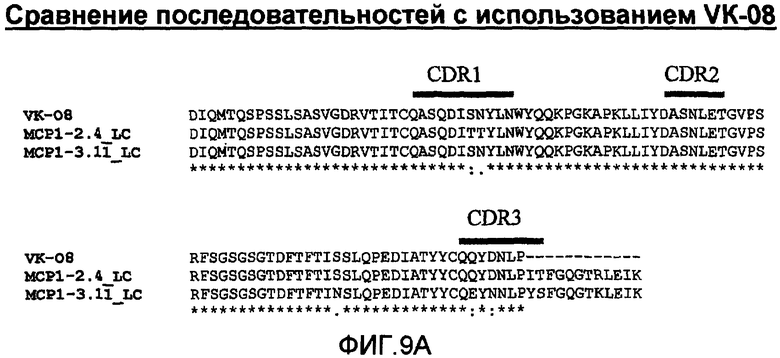
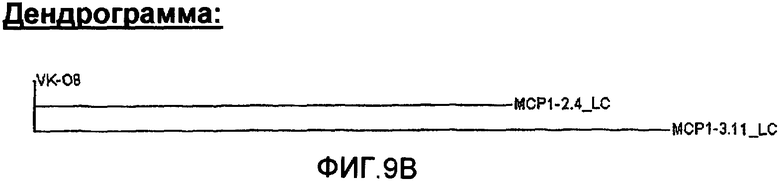

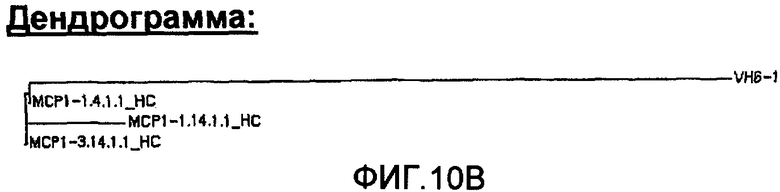
Изобретение относится к области биотехнологии, конкретно к получению антител против моноцитарного хемоаттрактантного белка-1 (МСР-1), к применению таких антител и может быть использовано в медицине. Получают полноразмерные человеческие моноклональные антитела против антигена МСР-1. Антитела используют для определения уровней МСР-1 в образце от пациента, а также для лечения опухолевых и воспалительных заболеваний. Изобретение позволяет получить высокоспецифичные к антигену МСР-1 моноклональные антитела и эффективно их использовать для лечения указанных заболеваний, а также в диагностических целях. 7 н. и 9 з.п. ф-лы, 10 ил., 17 табл.
| СПОСОБ СТАБИЛИЗАЦИИ КАУЧУКОб | 0 |
|
SU189565A1 |
| ROSALBA SALCEDO et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WANG X | |||
| et al | |||
| Immunoglobulin VH gene expression in human aging, Clin | |||
| Immunol., 1999, v.93, n.2, p.132-142, аминокислотная последовательность под №ААС18285, GI:3170965 | |||
| RU 98107631 A, 27.04.2000. | |||
Авторы
Даты
2008-11-27—Публикация
2003-08-19—Подача