Область техники
[0001] Настоящее изобретение относится к новому антителу, которое связывается с CD3 человека и с CD3 яванских макак, и к молекулам, содержащим это антитело.
Уровень техники
[0002] 1) Функция моноклональных анти–CD3 антител, как и любого другого моноклонального антитела, заключается в точном распознавании их молекул–мишеней. Каждое анти–CD3 антитело распознает только один эпитоп на молекуле–мишени CD3. Среди моноклональных антител, специфичных к комплексу CD3, OKT3 является наиболее широко используемым и лучше всего охарактеризованным.
2) OKT3 представляет собой мышиное моноклональное антитело против человеческого CD3 (Непатентный документ 1). Моноклональные анти–CD3 антитела были использованы в методе профилактики отторжения трансплантированных органов. Антитела связываются с комплексами TCR на T–клетках человека и подавляют их активацию и пролиферацию. Такое лечение применялось в течение длительного периода времени для профилактики отторжения гомотрансплантата органа. (Непатентные документы 2–4). OKT3 представляет собой анти–CD3 антитело, которое впервые используется в таком способе. OKT3 обладает сильным иммуносупрессорным эффектом, и при этом, его клиническое применение затруднено из–за серьезных побочных реакций, связанных с его иммуногенностью и митогенным потенциалом (Непатентные документы 5–8).
3) OKT3 индуцирует активацию T–клеток и продукцию цитокинов in vitro и высвобождает большое количество цитокинов in vivo, что приводит к развитию цитокинового синдрома (Непатентный документ 5). Это обусловлено тем, что OKT3 представляет собой двухвалентную молекулу IgG, и таким образом, перекрестно связывается с T–клетками и с клетками, экспрессирующими рецептор Fcγ, что в конечном счете приводит к активации T–клеток (Непатентный документ 8). Кроме того, OKT3 представляет собой мышиное антитело, а поэтому известно, что оно вызывает образование гетерофильных антител, таких как человеческие антимышиные антитела (HAMA) после его длительного введения (Непатентный документ 7). Отчеты о применении лечения анти–CD3 антителами и их побочные реакции систематизированы ниже (Патентный документ 1).
4) Для решения этих проблем были получены OKT3 в форме scFv (Непатентный документ 9) и гуманизованное OKT3 (Непатентный документ 10). Биспецифическое антитело, включающее комбинацию одной цепи OKT3 с одной цепью антитела против антигена–мишени, экспрессирующегося на поверхности злокачественных клеток, описано в другом примере применения OKT3 (Патентный документ 2 и Непатентный документ 11).
5) Предполагается, что мультиспецифические антитела, содержащие анти–CD3 антитела, описанные в литературе, обладают значительным терапевтическим потенциалом при лечении злокачественных заболеваний. Так, например, известно, что TROP2 сверхэкспрессируется в эпителиальных опухолях различных типов (Непатентные документы 12–16). Экспрессированное биспецифическое антитело, которое генетически связывает человеческое TROP2–специфическое антитело с антигенсвязывающим фрагментом анти–CD3 антитела, пока еще не было описано.
6) OKT3 реагирует с CD3 шимпанзе, но не реагирует с CD3 других приматов, таких как яванские макаки (Непатентный документ 17). Аналогичным образом, моноклональное анти–CD3 антитело UCHT–1 также реагирует с CD3 шимпанзе, но не реагирует с CD3 яванских макак (Непатентный документ 18). С другой стороны, было обнаружено, что некоторые моноклональные антитела распознают антигены яванских макак, но не распознают их человеческие аналоги. Одним из примеров антител этой группы является FN–18, которое представляет собой моноклональное антитело, направленное против CD3 яванских макак (Непатентный документ 19).
7) Ограничение в применении OKT3 и серий модифицированных антител OKT3 заключается в их специфичности к CD3 человека. Такое ограничение может оказывать серьезные препятствия в разработке терапевтических лекарственных средств для лечения заболеваний человека. Это обусловлено тем, что лекарственные средства, которые являются кандидатами на их разработку, должны проходить преклинические испытания для получения разрешения на их продажу, и желательно, чтобы такие преклинические испытания были проведены на животных, а в частности, на высших приматах, таких как яванские макаки. Таким образом, в случае лекарственных средств–кандидатов, содержащих анти–CD3 антитела, было бы крайне желательно использовать анти–CD3 антитело, которое обладало бы способностью связываться с человеческим CD3 и с CD3 яванских макак.
8) Перекрестно–реагирующее антитело, связывающееся с CD3 человека и с CD3 яванских макак, было описано в Патентных документах 3 и 4 и Непатентном документе 20. Кроме того, было описано биспецифическое антитело, в котором одна цепь такого анти–CD3 антитела связывается с одной цепью антитела против антигена–мишени, экспрессируемого на поверхности раковых клеток (Патентный документ 5 и Непатентный документ 21). Однако, для сообщения мультиспецифическим антителам или мультиспецифическим молекулам способности в высокой степени различать нужные раковые мишени, необходимо, чтобы анти–CD3 антитело связывалось с эпитопами, не являющимися эпитопами, упомянутыми выше, и связывалось с человеческим CD3 и с CD3 яванских макак.
Уровень техники
[0003] [Патентные документы]
[Патентный документ 1] Публикация Международной заявки WO2012/162067
[Патентный документ 2] Публикация Международной заявки WO2007/108152A1
[Патентный документ 3] Публикация заявки на патент США 8236308B2
[Патентный документ 4] Публикация Международной заявки WO2008/119567A1
[Патентный документ 5] Публикация Международной заявки WO2015/026892A1
[0004] [Непатентный документ]
[Непатентный документ 1] Salmeron A. et al., J. Immunol. (1991) 147, 3047–3052
[Непатентный документ 2] Cosmi AB. et al., Transplantation (1981) 32, 535–539
[Непатентный документ 3] Gilbert EM. et al., Am.J.Med. (1987) 82, 202–206
[Непатентный документ 4] Thistlethwaite JR. et al., Transplanation (1987) 43, 176–184
[Непатентный документ 5] Abramowicz D. et al., Transplanation (1989) 47, 606–608
[Непатентный документ 6] Toussaint D. et al., Transplanation (1989) 48, 524–526
[Непатентный документ 7] Thistlethwaite, JR. et al., Am. J. Kidney Dis. (1988) 11, 112–119
[Непатентный документ 8] Meuer, SC. et al., Eur. J. Immunol. (1986) 136, 4106–4112
[Непатентный документ 9] George AJ. et al., J. Immunol. (1994) 152 (4), 1802–11
[Непатентный документ 10] Woodle ES. et al., J Immunol. (1992) 148 (9), 2756–63
[Непатентный документ 11] Yankelevich M. et al., Pediatr. Blood Cancer (2012) 59 (7), 1198–1205
[Непатентный документ 12] Ohmachi T. et al., Clin. Cancer Res. (2006) 12 (18), 3857–3863
[Непатентный документ 13] Muhlmann G., et al., J. Clin. Pathol. (2009) 62 (2), 152–158
[Непатентный документ 14] Fong D., et al., Br. J. Cancer (2000) 99 (8), 1290–1295.
[Непатентный документ 15] Fong D. et al., Mod. Pathol. (2000) 21 (2) (2000), 186–191
[Непатентный документ 16] Ning S., et al., Neurol. Sci. (2013) 34 (10), 1745–1750
[Непатентный документ 17] Sandusky et al., J. Med. Primatol. (1986) 15, 441–451
[Непатентный документ 18] http://www.nhpreagents.org/NHP/clonelist.aspx?ID=77
[Непатентный документ 19] Uda et al., J.Med.Primatol. (2001) 30, 141–147
[Непатентный документ 20] Conrad ML.et al., Cytometry A. (2007) 71 (11), 925–33
[Непатентный документ 21] Lum LG. et al., BioDrugs (2011) 25 (6), 365–379.
Сущность изобретения
Проблема, которая может решается настоящим изобретением
[0005] Целью настоящего изобретения является получение нового антитела или антигенсвязывающего фрагмент этого антитела (далее также называемого антителом и тому подобное), которые связываются с человеческим CD3 и с CD3 яванских макак; молекулы, содержащей антитело и тому подобное, а также 1 или 2 или более дополнительных антител или антигенсвязывающих фрагменов этих антител, где указанная молекула является мультиспецифической; и фармацевтической композиции, обладающей цитотоксической активностью и тому подобное и включающей антитело и тому подобное или такую молекулу в качестве активного ингредиента.
Средства для решения проблемы
[0006] Авторами настоящего изобретения было проведено интенсивное исследование для достижения данной цели, и настоящее изобретение было реализовано путем получения нового анти–CD3 антитела и молекулы, содержащей это антитело.
[0007] В частности, настоящее изобретение содержит следующие аспекты:
(1) Антитело или антигенсвязывающий фрагмент антитела, где:
последовательность тяжелой цепи содержит:
CDRH1, содержащую аминокислотную последовательность SEQ ID NO:26,
CDRH2, содержащую аминокислотную последовательность SEQ ID NO:98, и
CDRH3, содержащую аминокислотную последовательность SEQ ID NO:28;
последовательность легкой цепи содержит
CDRL1, содержащую аминокислотную последовательность SEQ ID NO:29,
CDRL2, содержащую аминокислотную последовательность SEQ ID NO:99, и
CDRL3, содержащую аминокислотную последовательность SEQ ID NO:31; и
антитело или его антигенсвязывающий фрагмент связываются с человеческим CD3 и с CD3 яванских макак.
(2) Антитело или антигенсвязывающий фрагмент антитела по (1), где:
в CDRH2
первая Xaa выбрана из группы, состоящей из A, E, G, H, I, L, T, V, R и S, а
вторая Xaa представляет собой S, или
первая Xaa представляет собой N, а
вторая Xaa выбрана из группы, состоящей из E, R, F, Y, L, V, I, K, и T,
в CDRL2,
Xaa выбрана из группы, состоящей из Q, A, G, S, N, и D, и
антитело или его антигенсвязывающий фрагмент связываются с человеческим CD3 и с CD3 яванских макак.
(3) Антитело или антигенсвязывающий фрагмент антитела по (1) или (2), где:
в CDRH2,
первая Xaa выбрана из группы, состоящей из R и S, а вторая Xaa представляет собой S,
в CDRL2,
Xaa выбрана из группы, состоящей из Q, A, G, S, N, и D, и
антитело или его антигенсвязывающий фрагмент связываются с человеческим CD3 и с CD3 яванских макак.
(4) Антитело или антигенсвязывающий фрагмент антитела по (1), где:
последовательность тяжелой цепи содержит вариабельную область, имеющую CDRH1, CDRH2 и CDRH3,
CDRH1 состоит из аминокислотной последовательности SEQ ID NO:26,
CDRH2 состоит из аминокислотной последовательности SEQ ID NO:27, и
CDRH3 состоит из аминокислотной последовательности SEQ ID NO:28;
последовательность легкой цепи содержит вариабельную область, имеющую CDRL1, CDRL2 и CDRL3,
CDRL1 состоит из аминокислотной последовательности SEQ ID NO:29,
CDRL2 состоит из аминокислотной последовательности SEQ ID NO:30, и
CDRL3 состоит из аминокислотной последовательности SEQ ID NO:31; и
антитело или его антигенсвязывающий фрагмент связываются с человеческим CD3 и с CD3 яванских макак.
(5) Антитело или антигенсвязывающий фрагмент антитела по любому из п.п.(1)–(4), где последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:100.
(6) Антитело или антигенсвязывающий фрагмент антитела по (5), где:
в аминокислотной последовательности SEQ ID NO:100:
первая Xaa выбрана из группы, состоящей из A, E, G, H, I, L, T, V, R и S, а
вторая Xaa представляет собой S, или
первая Xaa представляет собой N, а
вторая Xaa выбрана из группы, состоящей из E, R, F, Y, L, V, I, K и T.
(7) Антитело или антигенсвязывающий фрагмент антитела по (5), где:
в аминокислотной последовательности SEQ ID NO:100:
первая Xaa выбрана из группы, состоящей из R и S, а вторая Xaa представляет собой S.
(8) Антитело или его антигенсвязывающий фрагмент по любому из п.п.(1)–(7), где вариабельная область легкой цепи содержит любую аминокислотную последовательность из SEQ ID NO:101, 102 и 103.
(9) Антитело или его антигенсвязывающий фрагмент по (8), где
в аминокислотной последовательности любой из SEQ ID NO:101, 102 и 103,
Xaa выбрана из группы, состоящей из Q, A, G, S, N и D.
(10) Антитело или антигенсвязывающий фрагмент антитела по (5), где последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:16.
(11) Антитело или антигенсвязывающий фрагмент антитела по (8), где последовательность вариабельной области легкой цепи содержит любую аминокислотную последовательность из SEQ ID NO:17, 20 и 23.
(12) Антитело или антигенсвязывающий фрагмент антитела по (1) или (2), где антитело или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:100, и вариабельную область легкой цепи, содержащую любую аминокислотную последовательность из SEQ ID NO:101, 102 и 103, где
в аминокислотной последовательности SEQ ID NO:100:
первая Xaa выбрана из группы, состоящей из A, E, G, H, I, L, T, V, R и S, а вторая Xaa представляет собой S, или
первая Xaa представляет собой N, а вторая Xaa выбрана из группы, состоящей из E, R, F, Y, L, V, I, K и T, и
в аминокислотной последовательности SEQ ID NO:101, 102 и 103:
Xaa выбрана из группы, состоящей из Q, A, G, S, N и D.
(13) Антитело или антигенсвязывающий фрагмент антитела по (12), где
в SEQ ID NO:100
первая Xaa выбрана из группы, состоящей из R и S, а
вторая Xaa представляет собой S, и
в аминокислотной последовательности в любой из SEQ ID NO:101, 102 и 103,
Xaa выбрана из группы, состоящей из Q, A, G, S, N и D.
(14) Антитело или антигенсвязывающий фрагмент антитела, по (13), содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:60 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:60; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:64 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–241 SEQ ID NO:64; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:66 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:66; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:68 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:68; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:70 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:70; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:72 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:72; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:74 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:74; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:76 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:76; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:78 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:78; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:80 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:80; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:82 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:82; или антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:84 и вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:84.
(15) Антитело или антигенсвязывающий фрагмент антитела по (1), (4), (5), (8), (10) или (11), где антитело или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:16, линкер и вариабельную область легкой цепи, содержащую любую аминокислотную последовательность из SEQ ID NO:17, 20 и 23.
(16) Антитело или антигенсвязывающий фрагмент антитела по (1)–(15), где вариабельная область тяжелой цепи связывается с вариабельной областью легкой цепи в указанном порядке, или вариабельная область легкой цепи связывается с вариабельной областью тяжелой цепи в указанном порядке, начиная с амино–конца и, необязательно: i) имеет линкер между обеими вариабельными областями, ii) имеет глициновый остаток у амино–конца вариабельной области с амино–концевой стороны и iii) имеет линкер, FLAG–метку и/или HIS–метку у карбоксильного конца вариабельной области со стороны карбоксильного конца.
(17) Антитело или антигенсвязывающий фрагмент антитела по (16), содержащее:
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:60,
аминокислотную последовательность, содержащую аминокислотные остатки 2–241 SEQ ID NO:64,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:66,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:68,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:70,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:72,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:74,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:76,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:78,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:80,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:82 или
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:84.
(18) Антитело или антигенсвязывающий фрагмент антитела по (16), содержащее:
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:19,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:22,
аминокислотную последовательность, содержащую аминокислотные остатки 2–267 SEQ ID NO:25,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:60,
аминокислотную последовательность, содержащую аминокислотные остатки 2–267 SEQ ID NO:64,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:66,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:68,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:70,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:72,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:74,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:76,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:78,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:80,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:82, или
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:84.
[0008] (19) Антитело или антигенсвязывающий фрагмент антитела, где антитело или его антигенсвязывающий фрагмент содержит аминокислотную последовательность, кодируемую нуклеотидной последовательностью, содержащейся в полинуклеотиде, который гибридизуется в жестких условиях с комплементарной цепью полинуклеотида, содержащего нуклеотидную последовательность, кодирующую аминокислотную последовательность, содержащуюся в антителе или антигенсвязывающем фрагменте антитела по любому из (14)–(18), и связывающуюся с человеческим CD3 и с CD3 яванских макак.
(20) Антитело или антигенсвязывающий фрагмент антитела, где антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности тяжелой цепи, содержащейся в антителе или в антигенсвязывающем фрагменте антитела по любому из (14)–(18), и легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности легкой цепи, содержащейся в антителе или в антигенсвязывающем фрагменте антитела по любому из (14)–(18), и связывается с человеческим CD3 и с CD3 яванских макак.
(21) Антитело или антигенсвязывающий фрагмент антитела, где антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность, полученную путем замены, делеции или добавления 1 или более аминокислот аминокислотной последовательности, содержащейся в тяжелой цепи, содержащейся в антителе или в антигенсвязывающем фрагменте антитела по любому из (14)–(18), и легкую цепь, включающую аминокислотную последовательность, полученную путем замены, делеции или добавления 1 или более аминокислот аминокислотной последовательности, содержащейся в легкой цепи, содержащейся в антителе или в антигенсвязывающем фрагменте антитела по любому из (14)–(18) и связывающейся с человеческим CD3 и с CD3 яванских макак.
(22) Антитело или антигенсвязывающий фрагмент антитела, где антитело или его антигенсвязывающий фрагмент связываются с тем же сайтом на CD3 человека, который связывается с антителом или с антигенсвязывающим фрагментом антитела по любому из (14)–(18) и связывается с CD3 яванских макак.
(23) Антитело или антигенсвязывающий фрагмент антитела, где антитело или его антигенсвязывающий фрагмент конкурируют с антителом или антигенсвязывающим фрагментом антитела по любому из (14)–(18) за связывание с человеческим CD3 и связываются с CD3 яванских макак.
(24) Антитело или антигенсвязывающий фрагмент антитела по (22), где сайт на человеческом CD3, связанный с антителом, состоит из 7 или более аминокислот, выбранных из 55–го серина (Ser), 56–й глутаминовой кислоты (Glu), 58–го лейцина (Leu), 59–го триптофана (Trp), 65–го аспарагина (Asn), 66–го изолейцина (Ile), 77–го серина (Ser), 78–й аспарагиновой кислоты (Asp), 101–го аргинина (Arg), 102–го глицина (Gly), 103–го серина (Ser), 104–го лизина (Lys), и 105–го пролина (Pro) в аминокислотной последовательности SEQ ID NO:1.
(25) Антитело или антигенсвязывающий фрагмент антитела по любому из (1)–(17) и (19)–(24), где антитело представляет собой IgG.
(26) Антитело или антигенсвязывающий фрагмент антитела по любому из (1)–(23), где антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, F(ab)’, Fv, scFv, и sdAb.
(27) Антитело или антигенсвязывающий фрагмент антитела по любому из (1)–(17) и (19)–(25), где антитело представляет собой гуманизованное антитело или человеческое антитело, содержащее константную область человеческого иммуноглобулина.
(28) Полинуклеотид, включающий нуклеотидную последовательность, кодирующую аминокислотную последовательность антитела или антигенсвязывающего фрагмента антитела по любому из (1)–(27).
(29) Полинуклеотид по (28), где полинуклеотид содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность:
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:19,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:22,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–241 SEQ ID NO:25,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:60,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–241 SEQ ID NO:64,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:66,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:68,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:70,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:72,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:74,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:76,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:78,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:80,
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:82, или
аминокислотной последовательностью, содержащей аминокислотные остатки 2–243 SEQ ID NO:84.
(30) Вектор, содержащий полинуклеотид по (28) или (29).
(31) Клетка, содержащая полинуклеотид по (28) или (29) или вектор по (30) или продуцирующая антитело или антигенсвязывающий фрагмент антитела по любому из (1)–(27).
(32) Способ получения антитела или антигенсвязывающего фрагмента антитела, которое связывается с CD3 человека и с CD3 яванских макак, где указанный способ включает стадии: культивирования клетки по (31); и выделения антитела или антигенсвязывающего фрагмента антитела, которые связываются с человеческим CD3, из этих культур.
(33) Антитело или антигенсвязывающий фрагмент антитела, которое связывается с CD3 человека и с CD3 яванских макак, где указанное антитело или его антигенсвязывающий фрагмент были получено способом по (32).
(34) Фармацевтическая композиция, содержащая антитело или антигенсвязывающий фрагмент антитела по любому из (1)–(27) и (33) в качестве активного ингредиента.
(35) Молекула, обладающая антигенсвязывающей активностью и содержащая антитело или антигенсвязывающий фрагмент антитела по любому из (1)–(27) и (33).
(36) Молекула по (35), где указанная молекула является мультиспецифической.
[0009] (37) Молекула по (35) или (36), также содержащая 1 или 2 или более дополнительных антител или антигенсвязывающих фрагментов антител помимо антитела или антигенсвязывающего фрагмента антитела по любому из (1)–(27) и (33).
(38) Молекула по (37), где антигенсвязывающий фрагмент дополнительного антитела представляет собой Fab, F(ab)’, Fv, scFv или sdAb.
(39) Молекула по (38), где указанная молекула содержит Fc.
(40) Молекула по любому из (37)–(38), где дополнительное антитело представляет собой гуманизованное антитело или человеческое антитело, содержащее константную область человеческого иммуноглобулина.
(41) Молекула по любому из (37)–(38), где дополнительное антитело или антигенсвязывающий фрагмент антитела связаны с антителом или антигенсвязывающим фрагментом антитела по любому из (1)–(27) и (33) посредством линкера или без линкера.
(42) Молекула по (41), где карбоксильный конец аминокислотной последовательности дополнительного антитела или антигенсвязывающего фрагмента антитела связан с линкером, а карбоксильный конец аминокислотной последовательности линкера дополнительно связан с антителом или антигенсвязывающим фрагментом антитела по любому из (1)–(27) и (33).
(43) Молекула по (42), где указанная молекула содержит аминокислотную последовательность, в которой карбоксильный конец аминокислотной последовательности дополнительного антитела или антигенсвязывающего фрагмента антитела связан с линкером, а карбоксильный конец аминокислотной последовательности линкера дополнительно связан:
с антителом или антигенсвязывающим фрагментом антитела, содержащего аминокислотные остатки 2–243 SEQ ID NO:19,
с антителом или антигенсвязывающим фрагментом антитела, содержащего аминокислотные остатки 2–243 SEQ ID NO:22, или
с антителом или антигенсвязывающим фрагментом антитела, содержащего аминокислотные остатки 2–241 SEQ ID NO:25.
(44) Молекула по любому из (35)–(42), содержащая антитело или антигенсвязывающий фрагмент антитела по любому из (1)–(27) и (33), где вариабельная область содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи в указанном порядке или вариабельную область легкой цепи и вариабельную область тяжелой цепи в указанном порядке, начиная с амино–конца и, необязательно: i) имеет линкер между обеими вариабельными областями, ii) имеет глициновый остаток у амино–конца вариабельной области с амино–концевой стороны и iii) имеет линкер, FLAG–метку и/или HIS–метку у карбоксильного конца вариабельной области со стороны карбоксильного конца. Подходящими формами являются биспецифические молекулы гибридного типа и двойного типа.
(45) Молекула по (44), где дополнительное антитело или антигенсвязывающий фрагмент антитела связаны:
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:19,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–241 SEQ ID NO:25,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:60,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–241 SEQ ID NO:64,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:66,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:68,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:70,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:72,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:74,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:76,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:78,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:80,
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:82, или
с антителом или антигенсвязывающим фрагментом антитела, содержащими аминокислотные остатки 2–243 SEQ ID NO:84. Подходящими формами являются биспецифические молекулы гибридного типа и двойного типа.
(46) Молекула по любому из (36)– (45), где дополнительное антитело представляет собой антитело против злокачественной мишени.
(47) Молекула по любому из (36)–(46), где молекула является биспецифической.
(48) Молекула по любому из (36)–(47), где молекула представляет собой полипептид.
(49) Полинуклеотид, содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность молекулы по (48).
(50) Вектор, содержащий полинуклеотид по (49).
(51) Клетка, продуцирующая полинуклеотид по (49) или вектор по (50) или молекулу по (48).
(52) Способ получения молекулы, связывающейся с CD3 человека и с CD3 яванских макак, где указанный способ включает стадии: культивирования клетки по (51); и выделения молекулы, связывающейся с человеческим CD3, из этих культур.
(53) Молекула, связывающаяся с CD3 человека и с CD3 яванских макак, где указанная молекула была получена способом по (52).
(54) Фармацевтическая композиция, содержащая молекулу по любому из (35)–(48) и (53) в качестве активного ингредиента.
(55) Фармацевтическая композиция по (54), где фармацевтическая композиция индуцирует цитотоксичность в клетках–мишенях посредством перенацеливания T–клеток на клетки–мишени.
Эффект изобретения
[0010] Настоящее изобретение относится к получению нового анти–CD3 антитела или его антигенсвязывающего фрагмента, которое связывается с CD3 человека и с CD3 яванских макак, и к новой молекуле, обладающей антигенсвязывающей активностью и содержащей антитело и тому подобное. Кроме того, была получена новая фармацевтическая композиция, содержащая такое антитело и тому подобное, или молекулу в качестве активного ингредиента. Антитело и тому подобное, или молекула обладают цитотоксической активностью, зависимой от T–клеток, и являются подходящими в качестве терапевтического или профилактического средства для лечения различных заболеваний, таких как рак.
Краткое описание чертежей
[0011] [Фигура 1] На фигуре 1 представлена диаграмма, где показана аминокислотная последовательность CD3ε человека.
[Фигура 2] На фигуре 2 представлена диаграмма, где показана аминокислотная последовательность человеческого CD3δ.
[Фигура 3] На фигуре 3 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая одноцепочечный антиген человеческого CD3εγ.
[Фигура 4] На фигуре 4 представлена диаграмма, где показана аминокислотная последовательность одноцепочечного антигена человеческого CD3εγ.
[Фигура 5] На фигуре 5 представлена диаграмма, где показана нуклеотидная последовательность смыслового праймера Nhe–polyC–S для амплификации гена тяжелой цепи.
[Фигура 6] На фигуре 6 представлена диаграмма, где показана нуклеотидная последовательность первого антисмыслового праймера rIgγ–AS1 для амплификации гена тяжелой цепи.
[Фигура 7] На фигуре 7 представлена диаграмма, где показана нуклеотидная последовательность второго антисмыслового праймера rIgγ–AS2 для амплификации гена тяжелой цепи.
[Фигура 8] На фигуре 8 представлена диаграмма, где показана нуклеотидная последовательность смыслового праймера Nhe–polyC–S2 для амплификации гена легкой цепи.
[Фигура 9] На фигуре 9 представлена диаграмма, где показана нуклеотидная последовательность первого антисмыслового праймера rIgL–AS1 для амплификации гена легкой цепи.
[Фигура 10] На фигуре 10 представлена диаграмма, где показана нуклеотидная последовательность второго антисмыслового праймера rIgL–AS2 для амплификации гена легкой цепи.
[Фигура 11] На фигуре 11 представлена диаграмма, где показана нуклеотидная последовательность смыслового праймера rIgγ–seq для секвенирования тяжелой цепи.
[Фигура 12] На фигуре 12 представлена диаграмма, где показана нуклеотидная последовательность антисмыслового праймера 1 rIgL–seq1 для секвенирования легкой цепи.
[Фигура 13] На фигуре 13 представлена диаграмма, где показана нуклеотидная последовательность антисмыслового праймера 2 rIgL–seq2 для секвенирования легкой цепи.
[Фигура 14] На фигуре 14 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи C3–147.
[Фигура 15] На фигуре 15 представлена диаграмма, где показана аминокислотная последовательность вариабельной области тяжелой цепи C3–147.
[Фигура 16] На фигуре 16 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая вариабельную область легкой цепи C3–147.
[Фигура 17] На фигуре 17 представлена диаграмма, где показана аминокислотная последовательность вариабельной области легкой цепи C3–147.
[Фигура 18] На фигуре 18 представлена диаграмма, где показана олигонуклеотидная последовательность смысловой цепи линкера G4S.
[Фигура 19] На фигуре 19 представлена диаграмма, где показана олигонуклеотидная последовательность антисмысловой цепи линкера G4S.
[Фигура 20] На фигуре 20 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7000.
[Фигура 21] На фигуре 21 представлена диаграмма, где показана аминокислотная последовательность в C3E–7000.
[Фигура 22] На фигуре 22 представлена диаграмма, где показана аминокислотная последовательность вариабельной области тяжелой цепи C3E–7034.
[Фигура 23] На фигуре 23 представлена диаграмма, где показана аминокислотная последовательность вариабельной области легкой цепи C3E–7034.
[Фигура 24] На фигуре 24 представлена диаграмма, где показана аминокислотная последовательность CDR–H1 в C3E–7000.
[Фигура 25] На фигуре 25 представлена диаграмма, где показана аминокислотная последовательность CDR–H2 в C3E–7000.
[Фигура 26] На фигуре 26 представлена диаграмма, где показана аминокислотная последовательность CDR–H3 в C3E–7000.
[Фигура 27] На фигуре 27 представлена диаграмма, где показана аминокислотная последовательность CDR–L1 в C3E–7000.
[Фигура 28] На фигуре 28 представлена диаграмма, где показана аминокислотная последовательность CDR–L2 в C3E–7000.
[Фигура 29] На фигуре 29 представлена диаграмма, где показана аминокислотная последовательность CDR–L3 в C3E–7000.
[Фигура 30] На фигуре 30 представлена диаграмма, где показана аминокислотная последовательность вариабельной области легкой цепи C3E–7035.
[Фигура 31] На фигуре 31 представлена диаграмма, где показана аминокислотная последовательность C3E–7035.
[Фигура 32] На фигуре 32 представлена диаграмма, где показана аминокислотная последовательность вариабельной области легкой цепи C3E–7036.
[Фигура 33] На фигуре 33 представлена диаграмма, где показана аминокислотная последовательность C3E–7036.
[Фигура 34] На фигуре 34 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7034.
[Фигура 35] На фигуре 35 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7035.
[Фигура 36] На фигуре 36 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7036.
[Фигура 37] На фигуре 37 представлена диаграмма, где показана аминокислотная последовательность человеческого CD3γ.
[Фигура 38] На фигуре 38 представлена диаграмма, где показана аминокислотная последовательность C3E–7034.
[Фигура 39] На фигуре 39 представлена диаграмма, где показана комплексная структура CD3εγ и C3E–7034.
[Фигура 40] На фигуре 40 представлена пара диаграмм, где показано взаимодействие между CD3εγ и тяжелыми и легкими цепями C3E–7034.
На фигуре 40A представлена диаграмма, относящаяся к вариабельной области легкой цепи C3E–7034 и CD3ε, где аминокислотные остатки CD3ε, находящиеся на расстоянии 4 ангстрем друг от друга, показаны в этой модели жирными линиями, а другие аминокислоты показаны в этой модели тонкими линиями.
На фигуре 40B представлена диаграмма, относящаяся к вариабельной области тяжелой цепи C3E–7034 и CD3ε, где аминокислотные остатки CD3ε, находящиеся на расстоянии 4 ангстрем друг от друга, показаны в этой модели жирными линиями, а другие аминокислоты показаны в этой модели тонкими линиями.
[Фигура 41] На фигуре 41 представлена диаграмма, где показаны сайты взаимодействия человеческого CD3ε с последовательностями вариабельных областей тяжелой и легкой цепей в C3E–7034.
[Фигура 42] На фигуре 42 представлена диаграмма, где показана аминокислотная последовательность вариабельной области тяжелой цепи в OKT3.
[Фигура 43] На фигуре 43 представлена диаграмма, где показана аминокислотная последовательность вариабельной области тяжелой цепи в C3E–3007.
[Фигура 44] На фигуре 44 представлена диаграмма, где показана аминокислотная последовательность вариабельной области легкой цепи в OKT3.
[Фигура 45] На фигуре 45 представлена диаграмма, где показана аминокислотная последовательность вариабельной области легкой цепи в C3E–3007.
[Фигура 46] На фигуре 46 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая scFv C3E–3007.
[Фигура 47] На фигуре 47 представлена диаграмма, где показана аминокислотная последовательность scFv C3E–3007.
[Фигура 48] На фигуре 48 представлена диаграмма, где показана активность связывания C3E–3007, C3E–7034, C3E–7035 и C3E–7036, которые представляют собой гуманизованные анти–CD3 scFv, с человеческим CD3 (МКПК).
[Фигура 49] На фигуре 49 представлена диаграмма, где показана активность связывания C3E–3007, C3E–7034, C3E–7035 и C3E–7036, которые представляют собой гуманизованные анти–CD3 scFv, с CD3 яванских макак (МКПК).
[Фигура 50] На фигуре 50A представлена диаграмма, где показано активирующее действие C3E–7034 и C3E–3007, которые представляют собой анти–CD3 scFv, на человеческие CD8–позитивные клетки, а на фигуре 50B представлена диаграмма, где показано активирующее действие C3E–7034 и C3E–3007, которые представляют собой анти–CD3 scFv, на CD8–позитивные клетки яванских макак.
[Фигура 51] На фигуре 51 представлена диаграмма, где показана аминокислотная последовательность scFv HT1–11.
[Фигура 52] На фигуре 52 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая scFv HT1–11.
[Фигура 53] На фигуре 53 представлена пара диаграмм, где показано, что scFv HT1–11 связывается с человеческой TROP2–позитивной клеточной линией.
На фигуре 53A представлена диаграмма, где показано связывание с клеточной линией плоскоклеточного рака ротоглотки FaDu.
На фигуре 53B представлена диаграмма, где показано связывание с клеточной линией рака поджелудочной железы HPAF–II.
[Фигура 54] На фигуре 54 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая T2C–0001.
[Фигура 55] На фигуре 55 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая T2C–0003.
[Фигура 56] На фигуре 56 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая T2C–0005.
[Фигура 57] На фигуре 57 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая T2C–0006.
[Фигура 58] На фигуре 58 представлена диаграмма, где показана аминокислотная последовательность T2C–0001.
[Фигура 59] На фигуре 59 представлена диаграмма, где показана аминокислотная последовательность T2C–0003.
[Фигура 60] На фигуре 60 представлена диаграмма, где показана аминокислотная последовательность T2C–0005.
[Фигура 61] На фигуре 61 представлена диаграмма, где показана аминокислотная последовательность T2C–0006.
[Фигура 62] На фигуре 62 представлена пара диаграмм, где показано, что биспецифические анти–TROP2–CD3 молекулы T2C–0001, T2C–0003, T2C–0005 и T2C–0006 связываются с TROP2–позитивной клеточной линией.
На фигуре 62A представлена диаграмма, где показано связывание с клеточной линией плоскоклеточного рака ротоглотки FaDu.
На фигуре 62B представлена диаграмма, где показано связывание с клеточной линией рака поджелудочной железы HPAF–II.
[Фигура 63] На фигуре 63 представлена диаграмма, где показана активность связывания биспецифических анти–TROP2–CD3 молекул T2C–0001, T2C–0003, T2C–0005 и T2C–0006 с человеческим CD3 (МКПК).
[Фигура 64] На фигуре 64 представлена диаграмма, где показана активность связывания биспецифических анти–TROP2–CD3 молекул T2C–0001, T2C–0003, T2C–0005 и T2C–0006 с CD3 яванских макак (МКПК).
[Фигура 65] На фигуре 65A представлена диаграмма, где показано, что TROP2 экспрессируется в клеточной линии плоскоклеточного рака ротоглотки FaDu.
На фигуре 65B представлена диаграмма, где показано, что TROP2 экспрессируется в клеточной линии рака поджелудочной железы HPAF–II.
На фигуре 65C представлена диаграмма, где показано, что TROP2 не экспрессируется в клеточной линии рака легких Calu–6.
[Фигура 66] На фигуре 66A представлена диаграмма, где показано, что биспецифические анти–TROP2–CD3 молекулы T2C–0001, T2C–0003, T2C–0005 и T2C–0006 обладают цитотоксической активностью против клеточной линии плоскоклеточного рака ротоглотки FaDu в присутствии человеческих МКПК.
На фигуре 66B представлена диаграмма, где показано, что биспецифические анти–TROP2–CD3 молекулы T2C–0001, T2C–0003, T2C–0005 и T2C–0006 обладают цитотоксической активностью против клеточной линии рака поджелудочной железы HPAF–II в присутствии человеческих МКПК.
На фигуре 66C представлена диаграмма, где показано, что биспецифические анти–TROP2–CD3 молекулы T2C–0001, T2C–0003, T2C–0005 и T2C–0006 не обладают цитотоксической активностью против клеточной линии рака легких человека Calu–6 в присутствии человеческих МКПК.
[Фигура 67] На фигуре 67 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7078.
[Фигура 68] На фигуре 68 представлена диаграмма, где показана аминокислотная последовательность C3E–7078.
[Фигура 69] На фигуре 69 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7079.
[Фигура 70] На фигуре 70 представлена диаграмма, где показана аминокислотная последовательность C3E–7079.
[Фигура 71] На фигуре 71 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7085.
[Фигура 72] На фигуре представлена диаграмма, где показана аминокислотная последовательность C3E–7085.
[Фигура 73] На фигуре 73 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7086.
[Фигура 74] На фигуре 74 представлена диаграмма, где показана аминокислотная последовательность C3E–7086.
[Фигура 75] На фигуре 75 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7087.
[Фигура 76] На фигуре 76 представлена диаграмма, где показана аминокислотная последовательность C3E–7087.
[Фигура 77] На фигуре 77 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7088.
[Фигура 78] На фигуре 78 представлена диаграмма, где показана аминокислотная последовательность C3E–7088.
[Фигура 79] На фигуре 79 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7089.
[Фигура 80] На фигуре 80 представлена диаграмма, где показана аминокислотная последовательность C3E–7089.
[Фигура 81] На фигуре 81 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7090.
[Фигура 82] На фигуре 82 представлена диаграмма, где показана аминокислотная последовательность C3E–7090.
[Фигура 83] На фигуре 83 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7091.
[Фигура 84] На фигуре 84 представлена диаграмма, где показана аминокислотная последовательность C3E–7091.
[Фигура 85] На фигуре 85 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7092.
[Фигура 86] На фигуре 86 представлена диаграмма, где показана аминокислотная последовательность C3E–7092.
[Фигура 87] На фигуре 87 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7093.
[Фигура 88] На фигуре 88 представлена диаграмма, где показана аминокислотная последовательность C3E–7093.
[Фигура 89] На фигуре 89 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7094.
[Фигура 90] На фигуре 90 представлена диаграмма, где показана аминокислотная последовательность C3E–7094.
[Фигура 91] На фигуре 91 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая C3E–7095.
[Фигура 92] На фигуре 92 представлена диаграмма, где показана аминокислотная последовательность C3E–7095.
[Фигура 93] На фигуре 93 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая праймер HN53R Fw.
[Фигура 94] На фигуре 94 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая праймер HN53R Rv.
[Фигура 95] На фигуре 95 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая праймер HN53S Fw.
[Фигура 96] На фигуре 96 представлена диаграмма, где показана нуклеотидная последовательность, кодирующая праймер HN53S Rv.
[Фигура 97] На фигуре 97 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая AXC–0001.
[Фигура 98] На фигуре 98 представлена диаграмма, где показана аминокислотная последовательность AXC–0001.
[Фигура 99] На фигуре 99 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая AXC–0002.
[Фигура 100] На фигуре 100 представлена диаграмма, где показана аминокислотная последовательность AXC–0002.
[Фигура 101] На фигуре 101 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая MGC–0001.
[Фигура 102] На фигуре представлена диаграмма, где показана аминокислотная последовательность MGC–0001.
[Фигура 103] На фигуре 103 представлена диаграмма, где показана нуклеотидная последовательность OРС, кодирующая MGC–0002.
[Фигура 104] На фигуре 104 представлена диаграмма, где показана аминокислотная последовательность MGC–0002.
[Фигура 105] На фигуре 105 представлен список праймеров, используемых для получения вариантов CDR анти–CD3 антител.
[Фигура 106–1] На фигуре 106–1 представлена диаграмма, где показана активность связывания вариантов CDR анти–CD3 антител с человеческим CD3 и с CD3 яванских макак (МКПК).
[Фигура 106–2] На фигуре 106–2 представлена диаграмма, где показана активность связывания вариантов CDR анти–CD3 антител с человеческим CD3 и с CD3 яванских макак (МКПК).
[Фигура 107] На фигуре 107 представлена диаграмма, где показана экспрессия Axl в клеточной линии рака легких человека A549 (A), в клеточной линии рака поджелудочной железы человека PANC–1 (B), в клеточной линии рака поджелудочной железы человека MIA PaCa–2 (C), в клеточной линии человеческой миеломы U266B1 (D) и в клеточной линии лимфомы клеток коры головного мозга Jeko–1 (E).
[Фигура 108] На каждой из фигур 108A, 108B и 108C представлена диаграмма, где показано, что биспецифические анти–Axl CD3 молекулы AXC–0001 и AXC–0002 обладают цитотоксичностью, направленной против Axl–экспрессирующих клеточных линий в присутствии человеческих МКПК. На каждой из фигур 108D и 108E представлена диаграмма, где показано, что биспецифические анти–Axl CD3 молекулы AXC–0001 и AXC–0002 не обладают цитотоксичностью, направленной против клеточных линий, не экспрессирующих Axl в присутствии человеческих МКПК.
[Фигура 109] На фигуре 109 представлена диаграмма, где показана активность связывания scFv MAG–032 в клетках гибридной клеточной линии человеческих лимфобластов T2, к которым были добавлены пептид MAGEC1 (A) или ДМСО (B).
[Фигура 110] На фигуре 110A представлена диаграмма, где показано, что биспецифические анти–HLA–A2/MAGEC1–CD3 молекулы MGC–0001 и MGC–0002 обладают цитотоксической активностью против клеток T2, к которым был добавлен пептид MAGEC1, в присутствии человеческих МКПК.
На фигуре 110B представлена диаграмма, где показано, что биспецифические анти–HLA–A2/MAGEC1–CD3 молекулы MGC–0001 и MGC–0002 не обладают цитотоксической активностью против клеток T2, к которым был добавлен ДМСО, в присутствии человеческих МКПК.
[Фигура 111] На фигуре 111 представлена диаграмма, где показана аминокислотная последовательность пептида MAGEC1.
[Фигура 112] На фигуре 112 представлена диаграмма, где показана аминокислотная последовательность в области CDRH2 варианта CDR. Первая Xaa и вторая Xaa представляют собой произвольно выбранный природный аминокислотный остаток.
[Фигура 113] На фигуре 113 представлена диаграмма, где показана аминокислотная последовательность в области CDRL2 варианта CDR. Xaa представляет собой произвольно выбранный природный аминокислотный остаток.
[Фигура 114] На фигуре 114 представлена диаграмма, где показана аминокислотная последовательность вариабельной области тяжелой цепи варианта CDR C3E–7034. Первая Xaa и вторая Xaa представляют собой произвольно выбранный природный аминокислотный остаток.
[Фигура 115] На фигуре 115 представлена диаграмма, где показана аминокислотная последовательность в вариабельной области легкой цепи варианта CDR C3E–7034. Xaa представляет собой произвольно выбранный природный аминокислотный остаток.
[Фигура 116] На фигуре 116 представлена диаграмма, где показана аминокислотная последовательность в вариабельной области легкой цепи варианта CDR C3E–7035. Xaa представляет собой произвольно выбранный природный аминокислотный остаток.
[Фигура 117] На фигуре 117 представлена диаграмма, где показана аминокислотная последовательность в вариабельной области легкой цепи варианта CDR C3E–7036. Xaa представляет собой произвольно выбранный природный аминокислотный остаток.
Варианты осуществления изобретения
[0012] 1. Определения
В настоящем изобретении, термин «ген» означает нуклеотид, включающий нуклеотидную последовательность, кодирующую аминокислоты белка, или ее комплементарную цепь. Термин «ген» содержит, например, полинуклеотид, олигонуклеотид, ДНК, мРНК, кДНК и кРНК как нуклеотид, содержащий нуклеотидную последовательность, кодирующую аминокислоты белка, или ее комплементарную цепь. Такой ген является одноцепочечным, двухцепочечным, трехцепочечным или другим многоцепочечным нуклеотидом. Термин «ген» также содержит комплекс цепей ДНК и РНК, смесь рибонуклеотидов (РНК) и дезоксирибонуклеотидов (ДНК) на одной нуклеотидной цепи, и двухцепочечный, трехцепочечный или другой многоцепочечный нуклеотид, содержащий такую нуклеотидную цепь. В настоящем изобретении, термины «последовательность оснований» и «нуклеотидная последовательность» являются синонимами.
[0013] В настоящем изобретении, термин «полинуклеотид» является синонимом термина «нуклеиновая кислота» и «молекула нуклеиновой кислоты» и также содержит, например, любые РНК, ДНК, зонд, олигонуклеотид и праймер. Такой полинуклеотид является одноцепочечным, двухцепочечным, трехцепочечным или другим многоцепочечным полинуклеотидом. Термин «полинуклеотид» также содержит комплекс цепей ДНК и РНК, смесь рибонуклеотидов (РНК) и дезоксирибонуклеотидов (ДНК) на одной полинуклеотидной цепи, и комплекс двух цепей или трех или более цепей, включающих такую полинуклеотидную цепь.
[0014] В настоящем изобретении, термины «полипептид», «пептид» и «белок» являются синонимами.
[0015] В настоящем изобретении, термин «антиген» иногда используется как «иммуноген».
[0016] В настоящем изобретении, термин «клетка» также содержит, например, любую клетку, происходящую от отдельных животных, субкультивированные клетки, первичные культивированные клетки, клеточные линии, рекомбинантные клетки и микробные клетки.
[0017] В настоящем изобретении, термин «антитело» является синонимом термина «иммуноглобулин». Однако, термин «антитело», если он используется для описания анти–CD3 антитела согласно изобретению, означает иммуноглобулин, имеющий константные и вариабельные области. Антитело не имеет конкретных ограничений и может представлять собой природный иммуноглобулин или иммуноглобулин, полученный путем частичного или полного синтеза. Анти–CD3 антитело согласно изобретению входит в понятие «молекула», описанное ниже.
[0018] Основная структура четвертичного антитела состоит из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью. Две тяжелых цепи связаны друг с другом одной или более дисульфидными связями, в зависимости от изотипов тяжелых цепей. Каждая легкая и тяжелая цепь имеют регулярно перемежающиеся внутрицепьевые дисульфидные связи. Каждая тяжелая и легкая цепь содержит константную область, которая имеет очень высокую степень сходства аминокислотных последовательностей, и вариабельную область, которая имеет низкую степень сходства аминокислотных последовательностей. Легкая цепь имеет вариабельную область (VL) у амино–конца, за которой расположена константная область (CL). Тяжелая цепь имеет вариабельную область (VH) у амино–конца, за которой расположены три константных области (CH1, CH2 и CH3). VL и VH являются спаренными, а CL находится на одной цепи с первой константной областью (CH1) тяжелой цепи. VL и VH являются спаренными и образуют один антигенсвязывающий сайт.
Константные области антитела согласно изобретению не имеют конкретных ограничений. Предпочтительно, константные области, происходящие от человеческого антитела, используются в антителе согласно изобретению для лечения или профилактики заболеваний у человека. Примерами константных областей тяжелой цепи в человеческом антителе являются Cγ1, Cγ2, Cγ3, Cγ4, Cµ, Cδ, Cα1, Cα2 и Cε. Примерами константных областей легкой цепи в человеческом антителе являются Cκ и Cλ.
[0019] Fab состоит из тяжелой цепи CH1, за которой следует VH, и легкой цепи CL, за которой следует VL. Каждая VH и VL содержит гипервариабельные области (CDR).
[0020] Fc состоит из карбокси–концевых областей константных областей тяжелой цепи и представляет собой димер, содержащий CH2 и CH3. Fc согласно изобретению может представлять собой Fc, имеющий природную последовательность, или он может представлять собой мутированную форму Fc, содержащую мутацию в природной последовательности.
[0021] Вариабельная область состоит из областей, называемых гипервариабельными областями (HVR), имеющими очень высокую степень вариабельности, и из относительно невариабельных областей, называемых каркасными областями (FR), прерываемыми гипервариабельными областями. Каждая природная вариабельная область тяжелой и легкой цепи содержит четыре FR, соединенных тремя гипервариабельными областями. Гипервариабельные области каждой цепи находятся в непосредственной близости с гипервариабельными областями другой цепи благодаря FR и участвуют в образовании антигенсвязывающего сайта в антителе.
[0022] Известно, что каждая тяжелая и легкая цепь молекулы антитела имеет три комплементарность–определяющих области (CDR). Комплементарность–определяющие области также называются гипервариабельными областями. Эти области расположены в вариабельных областях тяжелой и легкой цепей антитела. Эти области имеют особенно высоковариабельную первичную структуру и обычно разделены в трех положениях в соответствующих первичных структурах полипептидых цепей в тяжелой и легкой цепи. В настоящем изобретении, гипервариабельные области антитела обозначаются CDRH1, CDRH2 и CDRH3, начиная с амино–конца аминокислотной последовательности тяжелой цепи для гипервариабельных областей тяжелой цепи, и CDRL1, CDRL2 и CDRL3, начиная с амино–конца аминокислотной последовательности легкой цепи для гипервариабельных областей легкой цепи. Эти области расположены близко друг к другу в трехмерной структуре и определяют специфичность связывания с антигеном.
[0023] В настоящем изобретении, положения и длины CDR были определены в соответствии с определениями по IMGT (Developmental and Comparative Immunology 27 (2003) 55–77).
[0024] Каркасные области (FR) представляют собой вариабельные области, за исключением остатков CDR. Каждая вариабельная область обычно имеет четыре FR, а именно, FR1, FR2, FR3 и FR4.
[0025] Положения CDR и FR могут быть также определены в соответствии с другими определениями, хорошо известными специалистам, например, в соответствии с определениями по IMGT, а также по Кэбату, Чотия, AbM и по их контактированию.
[0026] В настоящем изобретении, термин «антигенсвязывающий фрагмент антитела» означает неполный фрагмент антитела, который имеет вариабельные области тяжелой и легкой цепи и обладает активностью связывания с антигеном. Примерами «антигенсвязывающих фрагментов антитела» являются, но не ограничиваются ими, антигенсвязывающие фрагменты, такие как Fab, F(ab')2, scFv, Fab', Fv и однодоменное антитело (sdAb). Такой антигенсвязывающий фрагмент антитела может быть получен бутем обработки полноразмерной молекулы белка антитела ферментом, таким как папаин или пепсин, либо он может представлять собой рекомбинантный белок, продуцируемый в соответствующей клетке–хозяине с использованием рекомбинантного гена.
[0027] В настоящем изобретении, термин «сайт», с которым связывается антитело, то есть, «сайт», распознаваемый антителом, означает неполный пептид или неполную структуру высшего порядка на антигене, которая связывается с антителом или распознается антителом.
[0028] В настоящем изобретении, такой сайт также называется эпитопом или антигенсвязывающим сайтом.
В настоящем изобретении, термин «антитело–мутант» означает полипептид, который имеет аминокислотную последовательность, происходящую от аминокислотной последовательности исходного антитела благодаря замене, делеции и/или добавлению (термин «добавление» содержит инсерцию)(далее этот термин будет называться общим термином «мутация») аминокислоты (аминокислот), и который связывается с CD3 согласно изобретению. Число мутированных аминокислот в таком антителе–мутанте составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 20, 25, 30, 40 или 50. Такое антитело–мутант может представлять собой «антитело» согласно изобретению.
[0029] В настоящем изобретении, термин «более» в выражении «1 или более» означает число от 2 до 10.
[0030] В настоящем описании, термин «молекула» означает молекулу, содержащую вышеупомянутое антитело или антигенсвязывающий фрагмент антитела, а также содержит мультиспецифические молекулы, образованные антителами или множеством антигенсвязывающих фрагментов, происходящих от этих антител.
[0031] В настоящем изобретении, термин «молекула, которая являются мультиспецифической» является синонимом термина «мультиспецифическая молекула». Такая мультиспецифическая молекула не имеет конкретных ограничений при условии, что она будет связываться со множеством эпитопов, отличающихся друг от друга, на одной молекуле, и/или с эпитопами, отличающимися друг от друга, на двух или более молекулах. Молекула, которая является мультиспецифической, также содержит антитело, содержащее вариабельные области тяжелой цепи (VH) и вариабельные области легкой цепи (VL). Примерами таких мультиспецифических молекул являются, но не ограничиваются ими, полноразмерная молекула антитела, имеющая тяжелые цепи двух или более типов, и легкие цепи двух или более типов, то есть, мультиспецифическая молекула типа IgG, и молекула, состоящая из антигенсвязывающих фрагментов двух или более типов, имеющих VL и VH, то есть, молекула, образованная комбинацией Fab, Fab', Fv, scFv, sdAb и тому подобное (то есть, тандемным scFv, диантителами, одноцепочечными диантителами и триантителами). Кроме того, термин «мультиспецифическая молекула» также содержит молекулу, образованную посредством генетического или химического присоединения белка, обладающего антигенсвязывающей активностью, без иммуноглобулинового каркаса, к антигенсвязывающему фрагменту.
[0032] Примерами активностей или свойств, которыми обладают анти–CD3 антитело согласно изобретению, антигенсвязывающий фрагмент антитела согласно изобретению или мультиспецифическая молекула согласно изобретению, могут быть биологические активности или физико–химические свойства, а в частности, такие свойства могут включать различные биологические активности, активность связывания с антигеном или эпитопом, стабильность во время продуцирования или хранения и термостабильность.
[0033] В настоящем изобретении, термин «гибридизация в жестких условиях» означает гибридизацию в условиях, включающих гибридизацию при 65°C в растворе, содержащем 5×SSC, с последующей промывкой при 65°C в течение 20 минут в водном растворе, содержащем 2×SSC–0,1% ДСН; при 65°C в течение 20 минут в водном растворе, содержащем 0,5×SSC–0,1% ДСН; и при 65°C в течение 20 минут в водном растворе, содержащем 0,2×SSC–0,1% ДСН, или гибридизацию в эквивалентных условиях. SSC означает водный раствор 150 мМ NaCl–15 мМ цитрата натрия, а n×SSC означает SSC в n–кратной концентрации.
[0034] В настоящем изобретении, термин «цитотоксичность» означает некоторые патологические изменения, происходящие в клетках, и относится не только к непосредственному повреждению, но и к любому другому структурному или функциональному повреждению клеток, включая расщепление ДНК, образование основных димеров, хромосомные разрывы, повреждение митотического аппарата и снижение активности различных ферментов.
В настоящем изобретении, термин «цитотоксическая активность» означает активность, вызывающую цитотоксичность, упомянутую выше.
[0035] В настоящем изобретении, термин «антитело–зависимая клеточная цитотоксическая (ADCC) активность» означает эффект или активность, направленные на повреждение клеток–мишеней, таких как опухолевые клетки NK–клетками под действием антител.
[0036] В настоящем изобретении, термин «цитотоксическая активность при перенацеливании T–клеток» означает цитотоксичность, вызываемую мультиспецифической молекулой, содержащей антитело против опухолевого антигена и анти–CD3 антитело. В частности, этот термин означает, что антитело против опухолевого антигена связывается с опухолевой клеткой–мишенью, а анти–CD3 антитело связывается с T–клеткой, в результате чего опухолевая клетка–мишень и T–клетка локализуются еще ближе друг к другу, что индуцирует цитотоксичность, опосредуемую активацией T–клеток. Эта молекула может присутствовать в фармацевтической композиции.
2. Антигенный белок CD3 (комплекс CD3)
В настоящем изобретении, термин «CD3» является синонимом термина «белок CD3».
[0037] CD3 экспрессируется как часть мультимолекулярного комплекса T–клеточного рецептора на T–клетках и представляет собой комплекс из полипептидных цепей 5 типов (γ, δ, ε, ζ и ƞ) (с молекулярными массами 25000–28000, 21000, 20000, 16000 и 22000, соответственно).
[0038] CD3, используемый в настоящем изобретении, может быть получен путем очистки или выделения из тканей животных (включая физиологические жидкости), из клеток, происходящих из этих тканей, или клеточных культур, а также путем рекомбинации генов, трансляции in vitro, химического синтеза и тому подобное.
[0039] Нуклеотидная последовательность кДНК, кодирующая человеческий CD3ε, имеется в GenBank под регистрационным No. NM_000733.3. Нуклеотидная последовательность кДНК, кодирующая CD3 яванских макак, имеется в GenBank под регистрационным No. NM_001283615.1. Аминокислотная последовательность человеческого CD3ε описана в SEQ ID NO:1 списка последовательностей.
[0040] кДНК CD3ε может быть получена, например, так называемым ПЦР–методом, где полимеразную цепную реакцию (далее обозначаемую «ПЦР») (Saiki, R.K., et al., Science (1988) 239, 487–489) осуществляют с использованием библиотеки кДНК, выделенной из органов, экспрессирующих мРНК CD3ε, в качестве матрицы и с использованием праймеров, способных специфически амплифицировать кДНК CD3ε.
[0041] Нуклеотидная последовательность, кодирующая белок, который состоит из аминокислотной последовательности, полученной из аминокислот CD3 посредством замены, делеции или добавления 1 или более аминокислот, и обладает биологической активностью, эквивалентной СD3, также включена в нуклеотидную последовательность гена CD3. Белок, который состоит из аминокислотной последовательности, полученной из аминокислотной последовательности CD3 посредством замены, делеции или добавления 1 или более аминокислот, и обладает биологической активностью, эквивалентной СD3, также включен в CD3.
[0042] Полинуклеотид, гибридизующийся в жестких условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей человеческий CD3ε или CD3ε яванских макак, и кодирующей белок, обладающий биологической активностью, эквивалентной CD3ε, также включен в кДНК CD3ε. Кроме того, варианты сплайсинга, транскрибируемые из локуса гена человеческого CD3ε или CD3ε яванских макак, или полинуклеотид, гибридизующиеся с ними в жестких условиях и кодирующие белок, обладающий биологической активностью, эквивалентной CD3ε, также включен в кДНК CD3ε.
[0043] 3. Анти–CD3 антитело
(3–1) Классификация антител
Анти–CD3 антитело согласно изобретению и антигенсвязывающий фрагмент антитела (далее также называемый антителом и тому подобное согласно изобретению) может представлять собой моноклональное или поликлональное антитело. Примерами моноклональных антител согласно изобретению являются антитела, происходящие от животных, не являющихся человеком (антитела животных, не являющихся человеком), человеческие антитела, химерные антитела и гуманизованные антитела.
[0044] Примерами антител животных, не являющихся человеком, являются антитела, происходящие от позвоночных, таких как млекопитающие и птицы. Примерами антител, происходящих от млекопитающих, являются антитела грызунов, такие как мышиные антитела и крысиные антитела. Примерами антител, происходящих от птиц, являются куриные антитела. Примером крысиного моноклонального антитела против человеческого CD3 является C3–147 [Пример 1)–7] согласно изобретению.
[0045] Примерами химерных антител являются, но не ограничиваются ими, антитела, содержащие вариабельные области, происходящие от антитела животного, не являющегося человеком, и связанные с константными областями человеческого антитела (человеческого иммуноглобулина).
[0046] Примерами гуманизованных антител могут быть, но не ограничиваются ими, человеческие антитела (вариабельные области человеческого иммуноглобулина), присоединенные к CDR в вариабельных областях антител животных, не являющихся человеком; человеческое антитело, присоединенное к CDR, а также к неполным последовательностям каркасных областей в антителах животного, не являющегося человеком; и антитела, имеющие аминокислоты человеческого антитела, замененные одной или более аминокислотами, происходящими от антитела животного, не являющегося человеком, в любых из этих гуманизованных антител. Примерами CDR в вариабельных областях антител животных, не являющихся человеком, являются CDRH1–CDRH3 в вариабельной области тяжелой цепи и CDRL1–CDRL3 в вариабельной области легкой цепи, происходящие от крысиного анти–CD3 антитела C3E–7000 согласно изобретению, и CDR, полученные от аминокислотных последовательностей этих CDR посредством замены 1 или 2 аминокислот другими аминокислотами.
[0047] Человеческое антитело не имеет конкретных ограничения, при условии, что такое антитело будет, предпочтительно, связываться с человеческим CD3, а более предпочтительно, с человеческим CD3 и с CD3 яванских макак. Примерами также являются человеческие антитела, связывающиеся с таким же сайтом, как и в гуманизованных антителах согласно изобретению. Примерами являются человеческие антитела, связывающиеся с таким же сайтом, как и C3E–7034.
[0048] Предпочтительно, антитело и тому подобное согласно изобретению связываются с человеческим CD3. Более предпочтительно, антитело и тому подобное согласно изобретению также обладают активностью связывания с CD3 яванских макак.
[0049] Антитело и тому подобное согласно изобретению могут состоять из частей, происходящих от множества различных антител, при условии, что такое антитело будет связываться с человеческим CD3, а также с CD3 яванских макак. Примерами этих антител являются антитела, содержащие тяжелые и/или легкие цепи, имеющие изменения по сравнению с множеством других антител; антитела, содержащие полноразмерные тяжелые и/или легкие цепи, отличающиеся между собой; антитела, содержащие вариабельные или константные области, отличающиеся между собой; и антитела, содержащие все или некоторые CDR, отличающиеся между собой. Вариабельные области тяжелой и легкой цепей химерного антитела могут происходить от различных антител согласно изобретению. CDRH1 – CDRH3 и CDRL1 – CDRL3 вариабельных областей тяжелой и легкой цепи гуманизованного антитела могут происходить от двух или более различных антител согласно изобретению. CDRH1–CDRH3 и CDRL1–CDRL3 в вариабельных областях тяжелой и легкой цепей человеческого антитела могут представлять собой комбинацию CDR, образованную двумя или более различными антителами согласно изобретению.
[0050] Примерами изотипа моноклонального антитела согласно изобретению могут быть, но не ограничиваются ими, IgG, такие как IgG1, IgG2, IgG3 и IgG4, IgM; IgA, такие как IgA1 и IgA2, IgD и IgE.
[0051] Изотип и подкласс моноклонального антитела могут быть определены, например, с помощью теста Охтерлони, твердофазного иммуноферментного анализа (ELISA) или радиоиммуноанализа (РИА). Для идентификации может быть использован коммерчески доступный набор (например, набор для ELISA в целях определения изотипа крысиного иммуноглобулина (BD Pharmingen)).
[0052] (3–2) Специфичность связывания анти–CD3 антитела
Антитело и тому подобное согласно изобретению распознают CD3. Другими словами, антитело и тому подобное согласно изобретению связываются с CD3. Антитело и тому подобное согласно изобретению предпочтительно, связываются с человеческим CD3 и с обезьяньим CD3, а более предпочтительно, с человеческим CD3 и с CD3 яванских макак.
[0053] Более конкретно, антитело согласно изобретению и его антигенсвязывающий фрагмент и их вариабельные области связываются с Ig–подобным доменом, присутствующим во внеклеточной области цепи ε (фигура 1, SEQ ID NO:1) комплекса человеческого CD3. Кроме того, они также связываются с Ig–подобным доменом, присутствующим во внеклеточной области цепи ε комплекса CD3 яванских макак.
[0054 Эпитопы, присутствующие во внеклеточной области цепи ε (фигура 1, SEQ ID NO:1) комплекса человеческого CD3, связанного с антителом и тому подобное согласно изобретению, содержат следующие аминокислоты: Ser55, Glu56, Leu58, Trp59, Asn65, Ile66, Ser77, Asp78, Arg101, Gly102, Ser103, Lys104 и Pro105.
[0055] Предпочтительно, антитело и тому подобное согласно изобретению могут сохранять способность связываться с человеческим CD3 посредством связывания с областью эпитопа, содержащей по меньшей мере 7 аминокислот, выбранных из этих 13 аминокислот.
[0056] Если антитело находится на расстоянии 4 ангстрема от этих аминокислот, то такое антитело, как было подтверждено, может иметь такую же специфичность к эпитопу, как и антитело и тому подобное согласно изобретению. С другой стороны, аминокислоты эпитопа Arg101, Gly102, Ser103, Lys104 и Pro105 представляют собой остатки данного эпитопа, которые взаимодействуют с анти–CD3 антителом OKT3 или UCHT1, известными специалистам (Lars Kjer–Nielsen et al., PNAS (2004); и Kelly L Arnett et al., PNAS (2004)). Однако, OKT3 или UCHT1 связываются с человеческим CD3, но не связываются с CD3 яванских макак.
[0057] В настоящем изобретении, термины «разпознавание», то есть, «связывание» означает связывание, которое представляет собой адсорбцию, которая не являются неспецифической. Примерами критериев для определения наличия или отсутствия разпознавания, то есть, наличия или отсутствия связывания, могут быть константа диссоциации (далее обозначаемая «KD»). Предпочтительно, антитело и тому подобное согласно изобретению имеют величину KD 1×10–5 M или менее, 5×10–6 M или менее, 2×10–6 M или менее, или 1×10–6 M или менее для CD3.
[0058] В настоящем изобретении, связывание антитела с антигеном может быть оценено или определено с использованием системы анализов биомолекулярного взаимодействия (например, ППР или BLI), ELISA или РИА. Связывание антитела с антигеном, экспрессируемым на клеточной поверхности, может быть проанализировано с помощью проточной цитометрии.
[0059] Метод ППР (анализа с помощью поверхностного плазмонного резонанаса) используется в качестве аналитического подхода для определения константы диссоциации (величины KD) и тому подобное в качестве индекса аффинности путем измерения константы скорости ассоциации (величины ka) и константы скорости диссоциации (величины kd) с помощью кинетического анализа. Примерами оборудования, используемого в анализе ППР, являются BIAcore(TM) (изготавливаемое GE Healthcare), ProteOn(TM) (изготавливаемое Bio–Rad Laboratories,), ППР–Navi(TM) (изготавливаемое BioNavis), Spreeta(TM) (изготавливаемое Texas Instruments Inc.), SPRi–Plex II(TM) (изготавливаемое Horiba, Ltd.) и Autolab ППР(TM) (изготавливаемое Metrohm).
[0060] BLI (биослойная интерферометрия) представляет собой метод измерения биомолекулярных взаимодействий с использованием интерференции биослоев. Примерами оборудования, используемого в анализе взаимодействия BLI, является система Octet (изготавливаемая Pall ForteBio Corp.).
[0061 ELISA представляет собой метод, который содержит захват представляющего интерес антитела или антигена, содержащегося в растворе образца, посредством специфического антитела или антигена, а также детектирование и количественную оценку представляющего интерес антитела или антигена посредством ферментативной реакции. Меченные ферментом антиген или антитело вводят в реакционную систему и детектируют ферментативную активность. Для детектирования ферментативной активности используют субстрат, спектр поглощения которого изменяется под действием такой реакции, а затем, этот спектр поглощения оцифровывают путем измерения оптической плотности.
[0062] Клеточный ELISA представляет собой метод на клеточной основе, который содержит захват аналита на клеточной поверхности, а затем детектирование и количественную оценку аналита посредством ферментативной реакции.
[0063] РИА (радиоиммуноанализ) позволяет количественно оценивать антитело посредством мечения антитела радиоактивным веществом и измерять уровень радиоактивности антитела.
[0064] Проточная цитометрия представляет собой метод, применяемый для оптического анализа отдельных клеток посредством диспергирования тонкодисперсных клеток в жидкости и распределения жидкости по небольшим потокам. Антитело, меченное флуоресцентным красителем, связывается с клеточной поверхностью антигена посредством реакции «антиген–антитело», после чего число клеток, связанных с антителом, измеряют по интенсивности флуоресценции, которая являются показателем антигенсвязывающей активности антитела.
Как упоминалось выше, антитело и тому подобное, связывающиеся с человеческим CD3 и с CD3 яванских макак, могут быть подвергнуты различным анализам на эффективность или безопастность у приматов, а в частности, яванских макак, которые являются особенно подходящими для неклинической разработки (преклинической разработки) фармацевтических продуктов, и таким образом, являются предпочтительными. Кроме того, антитело и тому подобное, связывающиеся с человеческим CD3 и с CD3 яванских макак, обладают цитотоксической активностью и могут быть использованы либо отдельно, либо в качестве молекулы согласно изобретению для лечения или профилактики заболеваний, таких как рак у человека и яванских макак. Фармацевтические композиции описаны ниже.
[0065] Антитело и тому подобное согласно изобретению, связывающиеся с человеческим CD3 и с CD3 яванских макак, не связываются с мышиным CD3. Поэтому, различные анализы или иммуногистохимические тесты, проводимые с использованием мышиных клеток, тканей или особей, трансфецированных человеческим геном CD3 (включая трансгенных животных, животных с нокаутом и животных с нокином) и антител и тому подобное, могут быть осуществлены так, чтобы на эти анализы не влиял CD3 мыши–хозяина. Таким образом, антитело и тому подобное являются предпочтительными для их использования в исследованиях на мышах и в неклинической разработке лекарственных средств, лекарственных средств для животных и диагностических средств, содержащих антитело и тому подобное.
(3–3) Моноклональное антитело
Настоящее изобретение относится к моноклональным антителам. Такими моноклональными антителами являются, например, моноклональные антитела, происходящие от животных, не являющихся человеком, такие как крысиные, мышиные, кроличьи, куриные и рыбьи антитела, химерные антитела, гуманизованные антитела, человеческие антитела, их антигенсвязывающие фрагменты, мутанты этих антител или их антигенсвязывающих фрагментов и варианты этих антител или их антигенсвязывающих фрагментов.
[0066] Так, например, C3–147, полученный способом, описанным в Примере 1, представляет собой крысиное моноклональное анти–CD3 антитело.
[0067] Нуклеотидная последовательность ДНК, кодирующая вариабельную область тяжелой цепи C3–147, описана в SEQ ID NO:6 (фигура 14) Списка последовательностей, а ее аминокислотная последовательность описана в SEQ ID NO:7 (фигура 15). Нуклеотидная последовательность ДНК, кодирующая вариабельную область легкой цепи C3–147, описана в SEQ ID NO:8 (фигура 16) Списка последовательностей, а ее аминокислотная последовательность описана в SEQ ID NO:9 (фигура 17).
[0068] Антитело–мутант согласно изобретению предпочтительно, может обладать, например, пониженной чувствительностью к разложению или окислению белка, улучшенными или сохраненными биологическими активностями или функциями, незначительным снижением или ухудшением таких биологических активностей или функций, повышенной способностью к связыванию с антигеном(ами) или улучшенными физикохимическими или функциональными свойствами, сообщаемыми этому антителу. Хорошо известно, что боковая цепь специфической аминокислоты в белке может быть изменена, что приводит к изменению активности или функции белка. Примерами таких изменений являются дезамидирование боковой цепи аспартата и изомеризация боковой цепи аспартата. Антителами–мутантами согласно изобретению являются антитела, в которых одна или более аминокислот были заменены другими аминокислотами для предупреждения таких модификаций.
[0069] Примерами таких антител–мутантов согласно изобретению являются антитела, имеющие аминокислотную последовательность, образованную аминокислотной последовательностью исходного антитела посредством консервативной аминокислотной замены. Консервативной аминокислотной заменой является замена в группе аминокислот с родственными аминокислотными боковыми цепями.
[0070] Предпочтительными группами аминокислот являются: группа кислотных аминокислот, включающая аспарагиновую кислоту и глутаминовую кислоту; группа основных аминокислот, включающая лизин, аргинин и гистидин; группа неполярных аминокислот, включающая аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан; и группа семейства незаряженных полярных аминокислот, включающая глицин, аспарагин, глутамин, цистеин, серин, треонин и тирозин. Другими предпочтительными группами аминокислот являются: группа алифатических оксикислот, включающая серин и треонин; группа амид–содержащих аминокислот, включающая аспарагин и глутамин; группа алифатических аминокислот, включающая аланин, валин, лейцин и изолейцин; и группа ароматических аминокислот, включающая фенилаланин, триптофан и тирозин. Аминокислотную замену вводят в антитело–мутант, предпочтительно, так, чтобы это не приводило к снижению антиген–связывающей активности исходного антитела.
[0071] Настоящее изобретение также охватывает антитело–мутант, имеющее аминокислотную последовательность, происходящую от аминокислотной последовательности, состоящей из антитела или его антигенсвязывающиего фрагмента по (1), упомянутых выше, например, C3–147, где присутствуют консервативная аминокислотная замена и/или некоторые другие аминокислотные мутации (или введенные мутации); мышиное антитело, крысиное антитело, химерное антитело, гуманизованное антитело или человеческое антитело, состоящее из CDR, имеющих аминокислотную последовательность, где присутствуют консервативная аминокислотная замена и/или некоторые другие аминокислотные мутации (или введенные мутации) в аминокислотной последовательности любых CDRH1–CDRH3 и CDRL1–CDRL3, происходящих от антитела или его антигенсвязывающего фрагмента по (1), упомянутых выше, например, C3–147; антигенсвязывающий фрагмент любого из этих антител–мутантов и мутированные антитела; и молекула, включающая такое антитело–мутант, мутированные антитела или их антигенсвязывающий фрагмент.
[0072] (3–4) Антигенсвязывающий фрагмент анти–CD3 антитела
В соответствии с одним из своих аспектов, настоящее изобретение относится к антигенсвязывающему фрагменту анти–CD3 антитела согласно изобретению. Антигенсвязывающий фрагмент антитела означает фрагмент, который, из всех функций антитела, сохраняет по меньшей мере антигенсвязывающую активность или его вариант. Примерами функций антитела, по существу, являются антигенсвязывающая активность; активность, регулирующая активность антигена; антитело–зависимая клеточная цитотоксическая активность и комплемент–зависимая цитотоксическая активность. Примерами функций антитела и тому подобное согласно изобретению и мультиспецифической молекулы, содержащей антитело и тому подобное согласно изобретению, являются перенацеливание T–клеток, активация T–клеток и цитотоксическая активность, направленная против раковых клеток посредством активации T–клеток.
[0073] Антигенсвязывающий фрагмент антитела не имеет конкретных ограничений, при условии, что фрагмент антитела будет сохранять, из всех активностей антитела, по меньшей мере антигенсвязывающую активность. Примерами являются, но не ограничиваются ими, Fab, Fab', F(ab')2, Fv, одноцепочечный Fv (scFv), содержащий Fv тяжелой и легкой цепей, связанные соответствующим линкером, и однодоменное антитело (sdAb). Антигенсвязывающий фрагмент антитела согласно изобретению также содержит молекулу, содержащую антигенсвязывающий фрагмент антитела согласно изобретению, а также другие части, такие как scFv, сохраняющий часть линкера.
[0074] В объем термина антигенсвязывающий фрагмент антитела также входит молекула, образованная белком антитела посредством делеции 1 или более аминокислот у амино–конца и/или карбоксильного конца, и сохраняющая по меньшей мере часть функций этого антитела. Такой вариант антигенсвязывающего фрагмента антитела или вариант (описанный далее) антитела или его антигенсвязывающего фрагмента также входит в объем термина «антитело согласно изобретению или его антигенсвязывающий фрагмент».
[0075] В соответствии с одним из аспектов изобретения, антигенсвязывающим фрагментом антитела согласно изобретению scFv. scFv получают путем связывания вариабельных областей тяжелой и легкой цепей антитела посредством полипептидного линкера (Pluckthun A., The Pharmacology of Monoclonal Antibodies 113, Rosenburg and Moore, ed., Springer Verlag, New York, 269–315 (1994); and Nature Biotechnology (2005), 23, 1126–1136). Кроме того, в качестве биспецифической молекулы может быть использован тандемный scFv, включающий два scFv, связанных полипептидным линкером. Альтернативно, в качестве мультиспецифической молекулы могут быть использованы триантитела и антитела, содержащие три или более scFv.
[0076] Антитело согласно изобретению может представлять собой антитело, которое имеет одну вариабельную область тяжелой цепи и не имеет последовательности легкой цепи. Сообщалось, что такое антитело, называемое однодоменным антителом (sdAb) или наноантителом, сохраняет способность связываться с антигеном (Muyldemans S. et al., Protein Eng., (1994), 7 (9), 1129–35; и Hamers–Casterman C. et al., Nature (1993), 363 (6428), 446–448). Эти антитела также входят в объем термина «антигенсвязывающий фрагмент антитела согласно изобретению».
[0077] Настоящее изобретение также содержит одноцепочечный иммуноглобулин, содержащий полноразмерные последовательности тяжелой и легкой цепей антитела, связанные посредством соответствующего линкера (Lee, H–S, et al., Molecular Immunology (1999) 36, 61–71; and Shirrmann, T. et al., mAbs (2010), 2 (1), 1–4). Такой одноцепочечный иммуноглобулин может быть димеризован для сохранения структуры и активностей, аналогичных структуре и активностям антитела, которое по своей природе является тетрамером.
[0078] (3–5) Молекулы, обладающие антигенсвязывающей активностью
Молекула согласно изобретению содержит анти–CD3 антитело согласно изобретению или его антигенсвязывающий фрагмент.
[0079] Молекула согласно изобретению может также содержать, например, сигнальную последовательность, метку для очистки, амино–концевой Gly, линкерную часть, связывающую лекарственное средство в ADC, альбумин–связывающий полипептид, полимер, такой как ПЭГ, антитело, не являющееся анти–CD3 антителом, его антигенсвязывающий фрагмент и белок, обладающий антигенсвязывающей активностью, но не имеющий иммуноглобулинового каркаса, которые будут описаны ниже.
[0080] Молекула согласно изобретению связывается с человеческим CD3 и с CD3 яванских макак.
[0081] Молекула согласно изобретению содержит мультиспецифическую молекулу, описанную ниже.
[0082] Молекула согласно изобретению может иметь форму, подходящую для ее введения в клетку, или форму, подходящую для ее представления на клеточной поверхности, такую как CAR–T, и тому подобное.
[0083] (3–6) Мультиспецифические молекулы и биспецифические молекулы
Мультиспецифическая молекула согласно изобретению представляет собой молекулу, имеющую два или более антигенсвязывающих сайтов. В частности, мультиспецифическая молекула согласно изобретению представляет собой молекулу, способную связываться с двумя или более эпитопами, отличающимися друг от друга, на одной молекуле, или с эпитопами, отличающимися друг от друга, на двух или более молекулах, и содержит множество антигенсвязывающих фрагментов, отличающимися друг от друга. Примерами мультиспецифических молекул являются, но не ограничиваются ими, мультиспецифические молекулы типа IgG и мультиспецифические молекулы, имеющие вариабельные области двух или более типов, например, фрагменты антител, такие как тандемный scFv, одноцепочечные диантитела, диантитела, триантитела и фрагменты антител, связанные ковалентной связью или нековалентной связью. Мультиспецифическая молекула может содержать Fc.
[0084] Мультиспецифическая молекула согласно изобретению содержит анти–CD3 антитело согласно изобретению или антигенсвязывающий фрагмент этого антитела. Мультиспецифическая молекула согласно изобретению содержит антитело и тому подобное согласно изобретению и 1 или 2 или более дополнительных антител или антигенсвязывающих фрагментов этих антител. Примерами антигенсвязывающих фрагментов антитела являются Fab, F(ab)’, Fv, scFv и sdAb.
[0085] Мультиспецифическая молекула согласно изобретению специфически связывается с CD3 или может также связываться с мишенью, такой как Fc–рецептор на эффекторных клетках.
[0086] Предпочтительными примерами мультиспецифических молекул согласно изобретению являются биспецифические молекулы. Термин «биспецифический» означает способность связываться с двумя или более эпитопами, отличающимися друг от друга, на одной молекуле, или с эпитопами, отличающимися друг от друга, на двух молекулах. Антитело или его антигенсвязывающий фрагмент, обладающие такой биспецифичностью, входят в объем настоящего изобретения. Биспецифическая молекула согласно изобретению связывается с CD3 и с эпитопом, который отсутствует в CD3, но присутствует в другом антигене. Более конкретно, такая биспецифическая молекула (i) связывается с эпитопом на CD3 (эпитопом 1) и (ii) связывается с эпитопом, отличающимся от эпитопа 1 на CD3 (эпитопом 2), или связывается с эпитопом на антигене, не являющимся CD3 (эпитопом 3).
[0087 Так, например, в биспецифической молекуле типа тандемного scFv, типированной BiTE, антигенсвязывающий сайт в вариабельной области тяжелой цепи первого антитела и антигенсвязывающий сайт в вариабельной области легкой цепи первого антитела связаны либо посредством линкера, либо непосредственно без линкера, с образованием первого полипептида. Кроме того, антигенсвязывающий сайт в вариабельной области тяжелой цепи второго антитела и антигенсвязывающий сайт в вариабельной области легкой цепи второго антитела связаны либо посредством линкера, либо непосредственно без линкера, с образованием второго полипептида. Первый полипептид и второй полипептид связаны либо посредством линкера, либо непосредственно без линкера. Альтернативно, первый полипептид и второй полипептид могут быть связаны посредством дополнительной молекулы.
[0088] В биспецифической молекуле типа диантитела, антигенсвязывающий сайт в вариабельной области тяжелой цепи первого антитела и антигенсвязывающий сайт в вариабельной области легкой цепи второго антитела связаны либо посредством линкера, либо непосредственно без линкера. Кроме того, антигенсвязывающий сайт в вариабельной области легкой цепи первого антитела и антигенсвязывающий сайт в вариабельной области тяжелой цепи второго антитела связаны либо посредством линкера, либо непосредственно без линкера. Кроме того, биспецифическая молекула может быть получена путем дополнительной димеризации биспецифических молекул типа диантитела. Кроме того, биспецифическая молекула типа диантитела может быть связана с одной единственной цепью или с обеими цепями Fc посредством линкера (биспецифическая молекула типа «диантитело–Fc»).
[0089] В биспецифической молекуле типа двойных scFv, два scFv, связанные с различными эпитопами, связаны с двумя цепями димерного Fc, либо посредством линкеров, либо непосредственно без линкеров. Альтернативно, scFv двух типов, связанные с различными эпитопами, связаны с CH и CL, соответственно, посредством линкеров и дополнительно связаны с двумя цепями димерного Fc, соответственно, посредством линкеров.
В биспецифической молекуле типа IgG, два Fab, связанные с различными эпитопами, связаны с двумя цепями димерного Fc либо посредством линкеров, либо непосредственно без линкеров.
Альтернативно, биспецифическая молекула согласно изобретению может представлять собой биспецифическое антитело, в котором Fab и scFv, связанные с различными эпитопами, связаны с двумя цепями димерного Fc либо посредством линкеров, либо непосредственно без линкеров. Альтернативно, биспецифическая молекула согласно изобретению может представлять собой биспецифическую молекулу, где Fab в первом антителе и scFv во втором антителе связаны с двумя цепями димерного Fc посредством линкеров.
[0090] scFv и Fab, содержащиеся в биспецифической молекуле согласно изобретению, предпочтительно, представляют собой scFv и Fab гуманизованного антитела или человеческого антитела, а Fc, предпочтительно, представляет собой Fc человеческого антитела.
[0091] В вариабельной области, содержащейся в биспецифическом антителе согласно изобретению, вариабельная область тяжелой цепи и вариабельная область легкой цепи могут быть связаны в указанном порядке, или вариабельная область легкой цепи и вариабельная область тяжелой цепи могут быть связаны в указанном порядке, начиная с амино–конца. Биспецифическое антитело согласно изобретению имеет, но необязательно, линкер между обеими вариабельными областями и может (но необязательно) иметь глициновый остаток у амино–конца вариабельной области, который расположен с амино–концевой стороны. Биспецифическое антитело типа тандемного scFv согласно изобретению имеет, но необязательно, линкер, FLAG–метку, и/или HIS–метку у карбоксильного конца вариабельной области, расположенной на карбоксильной концевой стороне. Предпочтительными примерами биспецифических антител согласно изобретению являются биспецифическое антитело, в котором вариабельная область тяжелой цепи, первый линкер, вариабельная область легкой цепи, второй линкер, FLAG–метка и HIS–метка связаны в указанном порядке, начиная с амино–конца.
[0092] Линкер также содержит одноцепочечный полипептид или одноцепочечный олигопептид, или синтетические продукты, такие как ПЭГ, нуклеотиды, сахарные цепи и соединения. Кроме того, может быть использован любой линкер, известный специалистам, без каких–либо конкретных ограничений, при условии, что такой линкер будет связывать два полипептида.
[0093] Линкер, например, пептидный линкер имеет длину от 5 до 30 аминокислот. Если биспецифическая молекула содержит множество линкеров, то все используемые линкеры могут иметь одинаковую длину, либо эти линкеры могут иметь различные длины.
[0094] Примером пептидного линкера является повторяющееся звено (Gly∙Gly∙Gly∙Gly∙Ser). Могут быть добавлены один или более аминокислотных остатков, не являющихся Gly и Ser.
[0095] (3–7) Гуманизованные анти–CD3 антитела
В соответствии с одним из своих аспектов, настоящее изобретение относится к гуманизованному анти–CD3 антителу или его антигенсвязывающему фрагменту.
[0096] Примерами гуманизованных антител согласно изобретению являются человеческие антитела, содержащие только гипервариабельные области (CDR) (Nature (1986) 321, 522–525), и человеческие антитела, присоединенные к последовательностям CDR и к некоторым аминокислотным остаткам каркасных областей посредством связывания с CDR (Публикация Международной заявки No. WO1990/07861A1).
[0097] Предпочтительно, вариабельная область тяжелой цепи, содержащаяся в гуманизованном анти–CD3 антителе согласно изобретению или в его антигенсвязывающем фрагменте, сохраняет CDRH1, состоящий из аминокислотной последовательности SEQ ID NO:26 (Фигура 24) (GVTFNYYG), и CDRH2, состоящий из аминокислотной последовательности SEQ ID NO:98 (Фигура 112) (IT Xaa Xaa GGRI) (где первая и вторая Xaa представляет собой любой природный аминокислотный остаток. Далее, первая Xaa также обозначена как X1, а вторая Xaa также обозначена как X2), и CDRH3, состоящий из аминокислотной последовательности SEQ ID NO:28 (Фигура 26) (TLDGRDGWVAY).
[0098] Также предпочтительно, чтобы вариабельная область легкой цепи, содержащаяся в гуманизованном анти–CD3 антителе согласно изобретению или в его антигенсвязывающем фрагменте, сохраняла CDRL1, состоящий из аминокислотной последовательности SEQ ID NO:29 (Фигура 27) (TGNIGSNY); CDRL2, состоящий из аминокислотной последовательности SEQ ID NO:99 (Фигура 113) (R Xaa D) (где Xaa представляет собой любой природный аминокислотный остаток. Далее, Xaa CDRL2 также обозначена как X3), и CDRL3, состоящий из аминокислотной последовательности SEQ ID NO:31 (Фигура 29) (QSYSSGFI).
[0099] В CDRH2 (ITX1X2GGRI), упомянутом выше, предпочтительно, X1 выбран из группы, состоящей из A, E, G, H, I, L, T, V, R и S, а X2 представляет собой S; или X1 представляет собой N, а X2 выбран из группы, состоящей из E, R, F, Y, L, V, I, K и T.
В CDRL2 (RX3D) упомянутом выше, предпочтительно, X3 выбран из группы, состоящей из Q, A, G, S, N и D.
[0100] В CDRH2 (ITX1X2GGRI), упомянутом выше, более предпочтительно, X1 выбран из группы, состоящей из R и S, а X2 представляет собой S.
В CDRL2 (RX3D), упомянутом выше, более предпочтительно, X3 выбран из группы, состоящей из Q, A, G, S, N и D.
[0101] Предпочтительными примерами вариабельных областей тяжелой цепи, содержащихся в таких гуманизованных анти–CD3 антителах согласно изобретению или в их антигенсвязывающих фрагментах, являются вариабельная область тяжелой цепи, содержащая аминокислотные остатки, представленные SEQ ID NO:100 (Фигура 114).
[0102] Кроме того, предпочтительными примерами вариабельных областей легкой цепи, содержащихся в гуманизованных анти–CD3 антителах согласно изобретению или в их антигенсвязывающих фрагментах, являются вариабельная область легкой цепи, содержащая аминокислотные остатки, представленные SEQ ID NO:101 (Фигура 115), SEQ ID NO:102 (Фигура 116) или SEQ ID NO:103 (Фигура 117).
[0103] Особенно предпочтительными примерами вариабельных областей тяжелой цепи, содержащихся в гуманизованных анти–CD3 антителах согласно изобретению или в их антигенсвязывающих фрагментах, являются:
вариабельная область тяжелой цепи, которая сохраняет:
CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:26 (Фигура 24) (GVTFNYYG),
CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:27 (Фигура 25) (ITNSGGRI), и
CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:28 (Фигура 26) (TLDGRDGWVAY).
[0104] Особенно предпочтительными примерами вариабельных областей легкой цепи, содержащихся в гуманизованных анти–CD3 антителах согласно изобретению или в их антигенсвязывающих фрагментах, являются:
вариабельная область легкой цепи, которая сохраняет:
CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:29 (Фигура 27) (TGNIGSNY),
CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:30 (Фигура 28) (RDD), и
CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:31 (Фигура 29) (QSYSSGFI).
[0105] В настоящем изобретении, положения и длины CDR определяют в соответствии с определениями по IMGT (Developmental and Comparative Immunology 27 (2003) 55–77).
[0106] Конкретными примерами вариабельных областей тяжелой цепи согласно изобретению является аминокислотная последовательность, содержащая аминокислотные остатки SEQ ID NO:16.
[0107] Конкретными примерами вариабельных областей легкой цепи согласно изобретению является аминокислотная последовательность, содержащая аминокислотные остатки SEQ ID NO:17, 20 или 23.
[0108] Особенно предпочтительными примерами гуманизованных анти–CD3 антител согласно изобретению или антигенсвязывающих фрагментов этих антител являются антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:60 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–241 SEQ ID NO:60,
антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:64 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–241 SEQ ID NO:64,
антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:66 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:66; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:68 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–241 SEQ ID NO:68; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:70 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:70; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:72 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:72; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:74 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:74; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:76 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:76; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:78 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:78; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:80 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:80; антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:82 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:82, или антитело или антигенсвязывающий фрагмент антитела, содержащее вариабельную область тяжелой цепи, включающую аминокислотные остатки 2–119 SEQ ID NO:44 и вариабельную область легкой цепи, включающую аминокислотные остатки 135–243 SEQ ID NO:84.
[0109] Конкретными примерами гуманизованных анти–CD3 антител или антигенсвязывающих фрагментов этих антител согласно изобретению являются антитело или антигенсвязывающий фрагмент антитела, где антитело или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:16, линкер и вариабельную область легкой цепи, включающую любую аминокислотную последовательность из SEQ ID NO:17, 20 и 23.
[0110] В вариабельных областях, содержащихся в антителах или в антигенсвязывающих фрагментах антител согласно изобретению, вариабельная область тяжелой цепи и вариабельная область легкой цепей могут быть связаны в указанном порядке, или вариабельная область легкой цепи и вариабельная область тяжелой цепи могут быть связаны в указанном порядке, начиная с амино–конца. Вариабельные области могут содержать глициновый остаток у амино–концов. Линкер, FLAG–метка и/или HIS–метка могут быть связаны у карбоксильных концов вариабельных областей.
[0111] Конкретными предпочтительными примерами гуманизованных анти–CD3 антител согласно изобретению или их антигенсвязывающих фрагментов являются антитело или антигенсвязывающий фрагмент антитела, содержащее аминокислотные остатки 2–243 SEQ ID NO:19,
антитело или антигенсвязывающий фрагмент антитела, содержащее аминокислотные остатки 2–243 SEQ ID NO:22, и
антитело или антигенсвязывающий фрагмент антитела, содержащее аминокислотные остатки 2–241 SEQ ID NO:25.
[0112] Более конкретными предпочтительноыми примерами гуманизованных анти–CD3 антител согласно изобретению или их антигенсвязывающих фрагментов являются антитело (клон ID: C3E–7078) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:60 (Фигура 68); антитело (клон ID: C3E–7085) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–241 SEQ ID NO:64 (Фигура 72); антитело (клон ID: C3E–7086) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:66 (Фигура 74); антитело (клон ID: C3E–7087) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:68 (Фигура 76); антитело (клон ID: C3E–7088) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:70 (Фигура 78); антитело (клон ID: C3E–7089) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:72 (Фигура 80); антитело (клон ID: C3E–7090) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:74 Фигура 82); антитело (клон ID: C3E–7091) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:76 (Фигура 84); антитело (клон ID: C3E–7092) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:78 (Фигура 86); антитело (клон ID: C3E–7093) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:80 (Фигура 88); антитело (клон ID: C3E–7094) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:82 (Фигура 90), и антитело (клон ID: C3E–7095) или антигенсвязывающий фрагмент антитела, содержащие аминокислотные остатки 1–243 SEQ ID NO:84 (Фигура 92).
[0113] Конкретными предпочтительными примерами гуманизованных анти–CD3 антител согласно изобретению или антигенсвязывающих фрагментов этих антител, где вариабельная область тяжелой цепи, линкер и вариабельная область легкой цепи связываются в указанном порядке у амино–конца, и кроме того, второй линкер, FLAG–метка и HIS–метка связываются у карбоксильного конца вариабельной области легкой цепи, являются антитела или антигенсвязывающие фрагменты антител, описанных в вышеупомянутом (16) и включающих:
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:22,
аминокислотную последовательность, содержащую аминокислотные остатки 2–267 SEQ ID NO:25,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:60,
аминокислотную последовательность, содержащую аминокислотные остатки 2–267 SEQ ID NO:64,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:66,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:68,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:70,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:72,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:74,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:76,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:78,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:80,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:82, или
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:84.
[0114] Антитело и тому подобное согласно изобретению могут представлять собой молекулу, включающую антитело и тому подобное, которые содержат аминокислотную последовательность вариабельной области тяжелой цепи и/или аминокислотной последовательности вариабельной области легкой цепи, которые на 70%, 71%, 72%, 73%, 74%,75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны аминокислотной последовательности вариабельной области тяжелой цепи и/или аминокислотной последовательности вариабельной области легкой цепи, содержащихся в вышеупомянутом анти–CD3 антителе согласно изобретению или в антигенсвязывающем фрагменте этого антитела и связывающихся с человеческим CD3 и с CD3 яванских макак.
[0115] Антитело и тому подобное согласно изобретению могут представлять собой антитело, у которого способность связываться с CD3 может быть оптимизирована путем введения мутации в вышеупомянутое гуманизованное анти–CD3 антитело или антигенсвязывающий фрагмент антитела. Конкретными примерами методов введения мутации могут быть неспецифический мутагенез посредством ПЦР с вероятностью ошибки; сайт–направленный аминокислотный мутагенез с использованием библиотеки NNK, сайт–направленный мутагенез на основе информации о структуре и их комбинации.
[0116] ADCC– и CDC–активности антитела и тому подобное согласно изобретению могут быть снижены путем замены константных областей для уменьшения эффекторной активности антитела.
[0117] Во избежание цитотоксичности в нормальных клетках, экспрессирующих человеческий CD3, желательно, чтобы антитело обладало низкой эффекторной активностью. Известно, что эффекторная активность отличается у антител различных подклассов. Так, например, IgG4 обладает низкой ADCC– и CDC–активностью, а IgG2 обладает CDC–активностью, но низкой ADCC–активностью. С использованием этих признаков, антитело с пониженной ADCC– и CDC–активностью может быть получено путем замены константных областей IgG1 на константные области IgG2 или IgG4. Кроме того, антитело IgG1 с пониженной ADCC– и CDC–активностью может быть получено путем замены части константных областей IgG1 на IgG2 или IgG4. Так, например, Marjan Hezareh et al., Journal of Virology, 75 (24): 12161–12168 (2001), показали, что ADCC– и CDC–активность снижалась после замены 234–го и 235–го лейциновых остатков (номера даны в соответствии с Европейской системой нумерации по Кэбату и др.) IgG1 на аланиновые остатки.
[0118] (3–8) Антитела, которые связываются с тем же сайтом, а также с CD3 яванских макак.
«Антитело, которое связывается с тем же сайтом» как и антитело и тому подобное согласно изобретению и «связывается с CD3 яванских макак» также содержит «антитело и тому подобное согласно изобретению». Термин «антитело, связывающееся с тем же сайтом» как и в случае некоторых антител, означает другое антитело, которое связывается с сайтом на молекуле антигена, распознаваемой антителом. Если второе антитело связывается с неполным пептидом или с неполной трехмерной структурой на молекуле антигена, связанной с первым антителом, то первое и второе антитела определяются как антитела, связывающиеся с одним и тем же сайтом.
[0119] Альтернативно, первое и второе антитела определяют как связывающиеся с одним и тем же сайтом, путем подтверждения, может ли второе антитело конкурировать с первым антителом за связывание с антигеном, то есть, может ли второе антитело препятствовать связыванию первого антитела с антигеном, даже если пептидная последовательность или трехмерная структура сайта специфического связывания не была определена.
[0120] Если первое и второе антитела связываются с одним и тем же сайтом, а первое антитело дает эффект, характерный для одного аспекта антитела согласно изобретению, такой как цитотоксическая активность, то второе антитело также имеет крайне высокую вероятность того, что оно будет обладать такой же активностью.
[0121] Таким образом, если второе анти–CD3 антитело связывается с сайтом, связанным с первым анти–CD3 антителом, а второе анти–CD3 антитело связывается с CD3 яванских макак, то первое и второе антитела могут быть определены как связывающиеся с одним и тем же сайтом на белке CD3. Антитело или антигенсвязывающий фрагмент антитела, которые связываются с тем же сайтом на человеческом СD3, с которым связано анти–CD3 антитело согласно изобретению или его антигенсвязывающий фрагмент, и связываются с CD3 яванских макак, также входят в понятие «антитела и тому подобное согласно изобретению».
[0122] Альтернативно, первое и второе анти–CD3 антитела могут быть определены как связывающиеся с одним и тем же сайтом на белке СD3, путем подтверждения, может ли второе анти–CD3 антитело конкурировать с первым анти–CD3 антителом за связывание с белком СD3, и может ли второе анти–CD3 антитело связываться с СD3 яванских макак. Антитело или его антигенсвязывающий фрагмент, которые конкурируют с анти–CD3 антителом согласно изобретению или с антигенсвязывающим фрагментом такого антитела за связывание с человеческим СD3 и связываются с CD3 яванских макак, также входят в понятие «антиген и тому подобное согласно изобретению».
[0123] Сайт связывания с антителом может быть определен любым методом, хорошо известным специалистам, таким как иммуноанализ. Так, например, серии пептидов могут быть получены путем соответствующего последовательного отщепления аминокислотной последовательности антигена от карбоксильного конца или амино–конца, с последующим исследованием реакционной способности антитела для приблизительного определения сайта распознавания. Затем синтезируют более короткие пептиды, после чего может быть исследована способность антитела реагировать с этими пептидами для определения сайта связывания. Пептиды антигенного фрагмента могут быть получены таким методом, как рекомбинация генов или пептидный синтез.
[0124] Антитело и тому подобное согласно изобретению разпознают область и связываются с областью, входящей в состав трехмерной структуры CD3, то есть, Ig–подобного домена. Такой сайт связывания (эпитоп) для антитела может быть определен путем идентификации аминокислотных остатков на антигене, находящемся рядом с антителом, с помощью рентгеноструктурного анализа.
[0125] (3–9) Варианты анти–CD3 антител или их антигенсвязывающих фрагментов
Настоящее изобретение относится к варианту антитела или его антигенсвязывающего фрагмента. Вариант антитела согласно изобретению или его антигенсвязывающего фрагмента означают антитело согласно изобретению или антигенсвязывающий фрагмент, в которые была введена химическая или биологическая модификация. Химический вариант содержит, например, форму, имеющую аминокислотный каркас, конъюгированый с химической группой, и форму, имеющую химически модифицированную N–связанную или O–связанную углеводную цепь. Биологический вариант содержит, например, форму, которая была подвергнута посттрансляционной модификации (например, N–связанному или O–связанному гликозилированию, процессингу амино–концевой или карбокси–концевой области, дезамидированию, изомеризации аспарагиновой кислоты или окислению метионина), и форму, содержащую метиониновый остаток, присоединенный к амино–концу посредством экспрессии с использованием прокариотических клеток–хозяев. Такой вариант также содержит форму, которая была помечена для облегчения детектирования или выделения антитела или антигена согласно изобретению, например, форму, меченную ферментом, флуоресцентно меченную форму или аффинно–меяенную форму. Такой вариант антитела согласно изобретению или его антигенсвязывающего фрагмента является подходящим для повышения стабильности и сохранения исходного антитела согласно изобретению или исходного антигенсвязывающего фрагмента антитела согласно изобретению в крови, для снижения антигенности и для облегчения детектирования или выделения антитела или антигена и тому подобное.
[0126] Примерами химических молекул, содержащихся в химических вариантах, являются водорастворимые полимеры, такие как полиэтиленгликоль, сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран и поливиниловый спирт.
[0127] Примерами биологических вариантов являются формы, модифицированные путем ферментативной обработки или клеточной обработки, формы, присоединенные к другим пептидам, таким как метка, присоединенная посредством рекомбинации генов, и формы, полученные из клеток–хозяев, экспрессирующих эндогенный или экзогенный фермент, модифицирующий сахарную цепь.
[0128] Такая модификация может быть введена в любое положение или в нужное положение антитела или его антигенсвязывающего фрагмента. Альтернативно, одни и те же или различные модификации могут быть введены в одно или два или более положений.
[0129] В настоящем изобретении, «вариант антигенсвязывающего фрагмента антитела» также содержит «фрагмент варианта антитела».
[0130] Так, например, известно, что тяжелая цепь антитела, полученного путем культивирования клеток млекопитающих, не содержит лизинового остатка у карбокси–конца (Journal of Chromatography A, 705: 129–134 (1995)). Кроме того, известно, что тяжелая цепь такого антитела не содержит двух аминокислотных остатков (глицина и лизина) у карбокси–конца, а вместо этого имеет амидированный пролиновый остаток у карбокси–конца (Analytical Biochemistry, 360: 75–83 (2007)). Кроме того, известно, что N– (амино)–концевой глутаминовый остаток или остаток глутаминовой кислоты в тяжелой или легкой цепей антитела может быть модифицирован путем реакции пироглутамилирования в процессе получения антитела, а поэтому, антитело согласно изобретению может иметь такую модификацию (публикация Международной заявки No. WO2013/147153A1).
[0131] Однако, делеции в этих последовательностях тяжелой цепи или модификации в этих последовательностях тяжелой или легкой цепи почти не влияют на способность антитела связываться с антигеном и на его эффекторные функции (активацию комплемента, антителозависимые цитотоксические эффекты и тому подобное). Таким образом, настоящее изобретение также охватывает антитела, которые были подвергнуты делеции или модификации (далее называемые «вариантами с делецией»). Примерами являются вариант с делецией, образованный из тяжелой цепи посредством делеции 1 или 2 аминокислот у карбоксильного конца; амидированная форма варианта с делецией (например, тяжелая цепь, имеющая амидированный пролиновый остаток в карбокси–концевом сайте) и антитело, имеющее пироглутамилированный амино–концевой остаток в тяжелой или легкой цепи. Однако, вариант с делецией у карбоксильного конца тяжелой и легкой цепей антитела согласно изобретению не ограничивается описанными выше типами, при условии, что такой вариант с делецией будет сохранять по меньшей мере некоторую способность связываться с антигеном. Две или более цепей (например, тяжелых цепей), присутствующих в антителе согласно изобретению, могут представлять собой цепи (например, тяжелые цепи) любого типа, выбранные из группы, состоящей из полноразмерных цепей (например, тяжелых цепей) и описанных выше вариантов с делецией, а также из любых комбинаций двух или более цепей (например, тяжелых цепей) любых двух типов, выбранных из этих цепей. Количественное или молекулярное отношение каждого варианта с делецией может зависеть от типа культивированных клеток млекопитающих, продуцирующих антитело согласно изобретению, и условий культивирования. Примерами являются делеция одного карбокси–концевого аминокислотного остатка двух тяжелых цепей как главных компонентов антитела согласно изобретению. В настоящем изобретении, «вариант антигенсвязывающего фрагмента антитела» также содержит «фрагмент варианта антитела».
[0132] Антитело–зависимая клеточная цитотоксическая активность антитела согласно изобретению может быть повышена путем регуляции модификации (гликозилирования, дефукозилирования и тому подобное) сахарной цепи, связанной с антителом. Так, например, в публикациях Международных заявок WO99/54342A1, WO00/61739A1 и WO02/31140A1 описан известный метод регуляции модификации сахарной цепи антитела, хотя этот метод не имеет конкретных ограничений. Антитело согласно изобретению и антигенсвязывающий фрагмент этого антитела также содержит антитело и антигенсвязывающий фрагмент антитела, которые были подвергнуты регулируемой таким образом модификации сахарной цепи.
[0133] В настоящем изобретении, «делеции» и «модификации» антитела или его антигенсвязывающего фрагмента и их смесь входят в объем термина «антитело или его антигенсвязывающий фрагмент». И такие «делеции» и «модификации» антитела или его антигенсвязывающего фрагмента и их смеси входят в объем термина «антитело или его антигенсвязывающий фрагмент», где указанное антитело или его антигенсвязывающий фрагмент содержатся в молекуле, которая связывается с антигеном, в мультиспецифической молекуле, в биспецифической молекуле или тому подобное согласно изобретению, которые раскрываются в (3–5) и (3–6).
[0134] 4. Продуцирование антител
(4–1) Метод с использованием гибридомы
В соответствии с одним из аспектов настоящего изобретения, клетки, продуцирующие анти–CD3 антитело, выделяют из селезенки животных, иммунизованных белком CD3, в соответствии, например, с методом Kohler and Milstein (Kohler and Milstein, Nature (1975) 256, p. 495–497; и Kennet, R. ed., Monoclonal Antibodies, p. 365–367, Plenum Press, N.Y. (1980)). Клетки подвергают слиянию с миеломными клетками и получают гибридомы. Моноклональные антитела могут быть получены из культур этих гибридом.
[0135] (4–1–1) Получение антигена
Антиген для продуцирования анти–CD3 антитела может быть получен, например, методом получения нативного или рекомбинантного белка CD3 (одноцепочечного антигена человеческого CD3εγ). Примерами антигенов, которые могут быть получены таким образом, являются белок CD3, фрагменты белка CD3 и их производные, также содержащие любую аминокислотную последовательность или добавленный носитель (далее сокращенно обозначаемые «CD3»).
[0136] Нативный CD3 может быть очищен и выделен, например, из клеток, происходящих от человеческой ткани, или из культур этих клеток. Рекомбинантный человеческий одноцепочечный антиген CD3εγ может быть получен путем трансфекции клеток–хозяев геном, содержащим нуклеотидную последовательность, кодирующую аминокислотную последовательность человеческого одноцепочечного антигена CD3εγ, и выделения антигена из культур этих клеток. CD3, полученный путем синтеза белка в отсутствии клеток в системе трансляции in vitro из гена, содержащего нуклеотидную последовательность, кодирующую аминокислотную последовательность антигена CD3, также входит в объем термина «антигены CD3» согласно изобретению.
[0137] (4–1–2) Получение моноклональных анти–CD3 антител
Моноклональное антитело обычно получают путем проведения следующих стадий:
(a) получения антигена,
(b) получения антитело–продуцирующих клеток,
(c) получения миеломных клеток (далее называемых «миеломами»),
(d) слияния антитело–продуцирующих клеток с миеломами,
(e) скрининга на гибридомную группу, продуцирующую представляющее интерес антитело, и
(f) получения моноклеточных клонов (клонирования).
[0138] Этот способ получения также содержит (g) стадию культивирования гибридом, стадию выращивания животных с гибридомным трансплантатом и тому подобное и (h) стадию анализа или определения биологической активности моноклонального антитела и тому подобное, если это необходимо.
[0139] Этот способ получения моноклональных антител подробно описан со ссылкой на эти стадии. Однако, способ получения антитела не ограничивается этими стадиями. Так, например, могут быть использованы антитело–продуцирующие клетки, не являющиеся клетками селезенки и миеломами.
(a) Стадия получения антигенов
Белок CD3 согласно изобретению может быть получен путем очистки или выделения из тканей животных (включая физиологические жидкости), из клеток, происходящих от этих тканей, или культур клеток, путем рекомбинации генов, бесклеточного синтеза белка, химического синтеза и тому подобное.
(b) Стадия получения антитело–продуцирующих клеток
Антиген, полученный в стадии (a), смешивают с адъювантом, таким как полный или неполный адъювант Фрейнда, или с алюмосульфатом калия, и лабораторных животных иммунизируют полученным иммуногеном. Для получеия гибридом известным методом может быть использовано любое лабораторное животное без ограниченй. Так, например, могут быть использованы мыши, крысы, козы, овцы, крупный рогатый скот и лошади. С точки зрения готовых доступных миеломных клеток, подвергаемых слиянию с выделенными антитело–продуцирующими клетками и тому подобное предпочтительно, иммунизировать таких животных, как мыши или крысы.
[0140] Виды используемых мышей или крыс фактически не имеют конкретных ограничений. В случае мышей, например, могут быть использованы мыши A, AKR, BALB/c, BALB/cAnNCrj, BDP, BA, CE, C3H, 57BL, C57BL, C57L, DBA, FL, HTH, HT1, LP, NZB, NZW, RF, R III, SJL, SWR, WB или 129. В случае крыс, например, могут быть использованы крысы Wistar, Low, Lewis, Sprague–Dawley, ACI, BN или Fischer.
[0141] Эти мыши и крысы поставляются специалистами по селекции лабораторных животных или дистрибьютерами, например, CLEA Japan, Inc. или Charles River Laboratories Japan, Inc.
[0142] Из мышей и крыс, особенно предпочтительными иммунизируемыми животными с точки зрения совместимости их клеток для слияния с миеломными клетками, описанными ниже, являются мыши BALB/c или крысы Wistar и Low.
[0143] Кроме того, с точки зрения гомологии между человеческими и мышиными антигенами, также предпочтительно, использовать мышей, у которых был снижен биологический механизм удаления аутоантител, то есть, у мышей с аутоиммунным заболеванием.
[0144] В этом контексте, возраст таких мышей или крыс, предпочтительно, составляет 5–12 недель, а более предпочтительно, 6–8 недель.
Животные могут быть иммунизированы белком CD3, например, методом Weir, D. M., Handbook of Experimental Immunology Vol. I. II. III., Blackwell Scientific Publications, Oxford (1987), или Kabat, E. A. and Mayer, M. M., Experimental Immunochemistry, Charles C Thomas Publisher Spigfield, Illinois (1964).
[0146] Примерами методов определения титров антител могут быть, но не ограничиваются ими, иммуноанализы, такие как РИА и ELISA.
[0147] Антитело–продуцирующие клетки, происходящие от клеток селезенки или лимфоцитов, выделенных у иммунизированных животных, могут быть получены методом, известным специалистам, например, Kohler et al., Nature (1975) 256, 495; Kohler et al., Eur. J. Immnol. (1977) 6, 511; Milstein et al., Nature (1977), 266, 550; или Walsh, Nature (1977) 266, 495.
[0148] В случае клеток селезенки может быть применен общий метод, который содержит выделение селезенки, фильтрацию клеток через сетку из нержавеющей стали, а затем выливание полученных клеток в минимальную поддерживающую среду Игла (MEM) для отделения антитело–продуцирующих клеток.
c) Стадия получения миелом
Миеломные клетки, используемые для слияния клеток, не имеют конкретных ограничений и могут быть отобраны из известных клеточных линий для их использования. Так, например, дефицитная по гипоксантин–гуанин–фосфорибозил–трансферазе (HGPRT) клеточная линия, то есть, мышиные клеточные линии X63–Ag8 (X63), NS1–ANS/1 (NS1), P3X63–Ag8.Ul (P3Ul), X63–Ag8.653 (X63.653), SP2/0–Ag14 (SP2/0), MPC11–45.6TG1.7 (45.6TG), FO, S149/5XXO, или BU.1, крысиная клеточная линия 210.RSY3.Ag.1.2.3 (Y3), или человеческие клеточные линии U266AR (SKO–007), GM1500–GTG–A12 (GM1500), UC729–6, LICR–LOW–HMy2 (HMy2) или 8226AR/NIP4–1 (NP41), процедуры скрининга которых уже хорошо разработаны, предпочтительно, использовать с точки зренеия удобства отбера гибридом из слитых клеток. Эти HGPRT–дефицитные линии поставляются, например, из Американской Коллекции типовых культур (ATCC).
[0149] Эти клеточные линии субкультивируют в соответствующей среде, например, в среде с 8–азагуанином [в среде RPMI–1640, в которую были добавлены глутамин, 2–меркаптоэтанол, гентамицин и фетальная бычья сыворотка (далее обозначаемая «FCS»), а затем 8–азагуанин], в модифицированной по способу Дульбекко среде Исков (далее обозначаемой «IMDM»), или в модифицированной по способу Дульбекко среде Игла (далее обозначаемой «DMEM»), и субкультивируют в нормальной среде [например, в среде ASF104 (изготавливаемой Ajinomoto Co., Inc.), содержащей 10% FCS] за 3–4 дня до слияния клеток для гарантии того, что на день слияния клеток, число клеток будет равно или будет превышать 2×107 клеток.
(d) Стадия слияния антитело–продуцирующих клеток с миеломными клетками
Антитело–продуцирующие клетки могут быть слиты с миеломными клетками в условиях, предупреждающих избыточное снижение жизнеспособности клеток по любому известным методом (например, Weir, D.M., Handbook of Experimental Immunology Vol. I. II. III., Blackwell Scientific Publications, Oxford (1987), Kabat, E. A. and Mayer, M. M., Experimental Immunochemistry, Charles C Thomas Publisher Spigfield, Illinois (1964)). Так, например, может быть применен химический метод, который содержит смешивание антитело–продуцирующих клеток с миеломными клетками в высококонцентрированном растворе полимера, такого как полиэтиленгликоль, или физический метод, проводимый с использованием электростимуляции.
(e) Стадия скрининга на гибридомную группу, продуцирующую представляющее интерес антитело
Метод отбора гибридом, полученных путем слияния клеток, не имеет конкретных ограничений, но обычно применяется метод отбора на основе гипоскантина–аминоптерина–тимидина (HAT) (Kohler et al., Nature (1975) 256, 495; Milstein et al., Nature (1977) 266, 550). Этот метод является эффективным для получения гибридом с использованием HGPRT–дефицитной миеломной клеточной линии, которая не может выживать в присутствии аминоптерина. В частности, неслитые клетки и гибридомы могут быть культивированы в среде HAT для получения гибридом, резистентных к аминоптерину, для их селективного выживания и роста.
(f) Стадия получения моноклеточных клонов (клонирования)
Гибридомы могут быть клонированы любым известным методом, например, с использованием метилцеллюлозы или мягкой агарозы, или методом лимитирующего разведения (например, Barbara, B.M. and Stanley, M.S.: Selected Methods in Cellular Immunology, W.H. Freeman and Company, San Francisco (1980)). Метод лимитирующего разведения является предпочтительным.
(g) Стадия культивирования гибридом и стадия разведения животных с гибридомным трансплантатом
Отобранные гибридомы могут быть культивированы для получения моноклональных антител. Предпочтительно, нужные гибридомы клонируют, а затем подвергают процедуре продуцирования антител.
[0150] Моноклональное антитело, полученное с использованием такой гибридомы, может быть выделено из культур гибридомы. Кроме того, рекомбинантное антитело может быть выделено из клеточных культур, трансфецированных геном моноклонального антитела. Альтернативно, гибридома может быть внутрибрюшинно инъецирована мышам того же типа (например, BALB/cAnNCrj, описанным выше) или мышам Nu/Nu, для ее последующего роста. Затем, моноклональные антитела могут быть выделены из асцитов.
(h) Стадия анализа или определения биологической активности моноклональных антител
Различные биологические тесты могут быть выбраны и проведены в зависимости от цели их применения.
[0151] (4–2) Метод клеточной иммунизации
Клетки, экспрессирующие нативный CD3, или клетки, экспрессирующие рекомбинантный CD3 или его фрагмент, могут быть использованы в качестве иммуногенов для получения анти–CD3 антитела гибридомным методом, описанным выше.
[0152] Примерами клеток, экспрессирующих нативный СD3, являются человеческие клетки тимуса и Т–лимфоциты. Эти CD3–экспрессирующие клетки используются в количестве от 1×105 до 1×109 клеток, предпочтительно, от 1×106 до 1×108 клеток, более предпочтительно, от 0,5 до 2×107 клеток, а еще более предпочтительно, 1×107 клеток, на одну иммунизацию. Число клеток, используемых для иммунизации, может быть изменено в зависимости от уровня экспрессии CD3. Иммуногены обычно вводят внутрибрюшинно, но они могут быть введены интрадермально. Гибридомы могут быть получены методом, описанным в разделе (4–1–2).
[0153] (4–3) Метод ДНК–иммунизации
Aнти–CD3 антитело согласно изобретению может быть также получено методом ДНК–иммунизации. Этот метод содержит трансфекцию отдельного животного, например, мыши или крысы, антиген–экспрессирующей плазмидой, и экспрессию антигена у индивидуума для вырабатывания иммунитета против антигена. Примерами методов трансфекции являются метод прямой инъекции плазмиды в мышцу, метод инъекции трансфицирующего реагента, такого как липосома или полиэтиленимин, в вену; метод с использованием вирусного вектора; метод инъекции золотых частиц, связанных с плазмидой, путем выстреливания гена, и гидродинамический метод быстрой инъекции большого количества плазмидного раствора в вену.
[0154] Фактическим примером крысиного антитела против человеческого CD3, полученного таким образом, является C3–147. Аминокислотная последовательность вариабельной области легкой цепи C3–147 показана в SEQ ID NO:9 Списка последовательностей (Фигура 17). Аминокислотная последовательность вариабельной области тяжелой цепи C3–147 показана в SEQ ID NO:7 Списка последовательностей (Фигура 15).
[0155] (4–4) Рекомбинация гена
Для получения антитела согласно изобретению, нуклеотид (нуклеотид тяжелой цепи), содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность тяжелой цепи, и нуклеотид (нуклеотид легкой цепи), содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность легкой цепи, или вектор, имеющий вставку нуклеотида тяжелой цепи, и вектор, имеющий вставку нуклеотида легкой цепи, вводят в клетки–хозяева, после чего эти клетки культивируют и из культуры выделяют антитело. Нуклеотид тяжелой цепи и нуклеотид легкой цепи могут быть встроены в один вектор.
[0156] В качестве клеток–хозяев могут быть использованы прокариотические или эукариотические клетки. Если используются эукариотические клетки–хозяева, то могут быть использованы клетки животного, клетки растений или эукариотические микробы.
[0157] Примерами клеток животных являются клетки млекопитающих, то есть, клетки почек человеческого эмбриона HEK293F (Subedi GP et al., J Vis Exp. (2015) 106), клетки почек обезьяны COS, (Gluzman, Y. Cell (1981), 23, 175–182, ATCC CRL–1650), мышиные фибробласты NIH3T3 (ATCC No. CRL–1658), клетки яичника китайского хомячка (клетки CHO, ATCC CCL–61), клеточные линии, дефицитные по дигидрофолат–редуктазе (CHOdhfr–; Urlaub, G. and Chasin, L.A. PNAS (1980), 77, 4126–4220), клетки птиц, таких как куры, и клетки насекомых.
[0158] Кроме того, в качестве хозяев могут быть использованы клетки, модифицированные для повышения биологической активности антител посредством модификации структур сахарных цепей. Так, например, клетки CHO, модифицированные так, чтобы количество сахарных цепей с фукозой, не связанной с N–ацетилглюкозамином у восстанавливающих концов, составляло 20% или более от всех сахарных цепей, связанных с N–гликозидом комплексного типа, и связанных с Fc–областью антитела, могут быть использованы для получения антитела, обладающего повышенной ADCC–активностью или CDC–активностью (публикация Международной заявки No. WO02/31140A1).
[0159] Примерами эукариотических микробов являются дрожжи. Примерами прокариотических клеток являются E. coli и Bacillus subtilis.
[0160] Сигнальный пептид для секреции антитела согласно изобретению (моноклональных антител, происходящих от каждого животного, крысиных антител, мышиных антител, химерных антител, гуманизованных антител, человеческих антител и тому подобное), не ограничивается сигналом секреции антитела того же вида, того же типа или того же подтипа, как и антитело согласно изобретению, или собственным сигналом секреции антитела согласно изобретению. При этом может быть отобран и использован любой сигнал секреции антитела другого типа или подтипа или любой сигнал секреции белка, происходящего от других эукариотов или прокариотов.
[0161] Секретированное антитело и тому подобное, содержащее сигнальный пептид, также входит в объем термина «антитело и тому подобное согласно изобретению» или «молекула согласно изобретению».
[0162] (4–5) Методы конструирования и получения гуманизованных антител
Примерами гуманизованных антител являются, но не ограничиваются ими, человеческие антитела, в которых CDR заменены на CDR антител животного, не являющегося человеком (см. Nature (1986), 321, p. 522–525), человеческие антитела, присоединенные к последовательностям CDR и к некоторым аминокислотным остаткам каркасных областей посредством присоединения CDR (см. WO90/07861A1 и US6972323B2), и антитела, в которых одна или более аминокислот человеческого антитела заменены одной или более аминокислотами антитела животного, не являющегося человеком, в любых этих гуманизованных антителах.
[0163] (4–6) Метод получения человеческих антител
Другими примерами антител согласно изобретению являются человеческие антитела. Человеческое анти–CD3 антитело представляет собой анти–CD3 антитело, состоящее из аминокислотной последовательности человеческого антитела. Человеческое анти–CD3 антитело может быть получено методом с использованием мышей, продуцирующих человеческое антитело и несущих человеческие геномные ДНК–фрагменты, содержащие гены тяжелой и легкой цепи человеческого антитела (см., например, Tomizuka, K. et al., Nature Genetics (1997) 16, 133–143; Kuroiwa, Y. et. al., Nuc. Acids Res. (1998) 26, 3447–3448; Yoshida, H. et. al., Animal Cell Technology: Basic and Applied Aspects vol. 10, 69–73 (Kitagawa, Y., Matuda, T. and Iijima, S. eds.), Kluwer Academic Publishers, 1999.; Tomizuka, K. et.al., Proc. Natl. Acad. Sci. USA (2000) 97, 722–727).
[0164] В частности, животные, продуцирующие человеческое антитело, может быть созданы путем дизрупции эндогенного генного локуса тяжелой и легкой цепей иммуноглобулина у млекопитающих, не являющихся человеком, и введения генного локуса тяжелой и легкой цепей человеческого иммуноглобулина посредством, например, векторов на основе дрожжевой искусственной хромосомы (YAC). Альтернативно, эукариотические клетки могут быть трансформированы кДНК, кодирующими тяжелые и легкие цепи, соответственно, такого человеческого антитела, а предпочтительно, векторами, содержащими кДНК, методом рекомбинации генов. Трансформированные клетки, продуцирующие рекомбинантное человеческое моноклональное антитело, могут быть культивированы. Это антитело может быть получено из супернатанта культуры.
[0165] В этом контексте, например, в качестве хозяев могут быть использованы эукариотические клетки, а предпочтительно, клетки млекопитающих, такие как клетки HEK293F или клетки CHO.
[0166] Кроме того, метод получения человеческого антитела, выбранного из библиотеки человеческих антител посредством фагового представления, также является известным. Так, например, может быть применен метод фагового представления, который содержит экспрессию вариабельных областей человеческого антитела в виде scFv на поверхности фага и отбор фага, связывающегося с антигеном. Фаг, отобранный исходя из его способности связываться с антигеном, может быть подвергнут генному анализу для определения последовательностей ДНК, кодирующих вариабельные области человеческого антитела, связывающегося с антигеном. При определении последовательности ДНК scFv, связывающегося с антигеном, может быть получен экспрессионный вектор, содержащий эту последовательность, и этот вектор может быть введен подходящему хозяину для экспрессии у него человеческого антитела (WO92/01047A1, WO92/20791 A1, WO93/06213 A1, WO93/11236 A1, WO93/19172 A1, WO95/01438 A1, WO95/15388 A1, Annu. Rev. Immunol (1994) 12, 433–455).
[0167] (4–7) Метод получения антигенсвязывающих фрагментов антител
Метод получения scFv хорошо известен специалистам (см., например, патенты США NN 4946778, 5260203, 5091513 и 5455030). В этом scFv, вариабельная область тяжелой цепи и вариабельная область легкой цепи связаны посредством линкера, а предпочтительно, полипептидного линкера, что предотвращает образование их конъюгата (Huston, J.S. et al., PNAS (1988), 85, 5879–5883). Вариабельная область тяжелой цепи и вариабельная область легкой цепи в scFv могут происходить от одного и того же антитела или от различных антител.
[0168] Так, например, в качестве полипептидного линкера, связывающего эти вариабельные области, используется любой одноцепочечный пептид, состоящий из 5–30 остатков.
[0169] Для получения scFv–кодирующих последовательностей ДНК, кодирующих тяжелую цепь или вариабельную область тяжелой цепи антитела, и ДНК, кодирующей легкую цепь или вариабельную область легкой цепи антитела, каждую ДНК–часть, кодирующую полноразмерную или нужную аминокислотную последовательность, используют в качестве матрицы и амплифицируют с помощью ПЦР с использованием пары праймеров, фланкирующих оба конца матрицы. Затем, ДНК, кодирующую часть полипептидного линкера, дополнительно амплифицируют в комбинации с парой праймеров, фланкирующих оба конца ДНК так, чтобы полученный фрагмент мог быть присоединен по концам к ДНК тяжелой и легкой цепи. Альтернативно, ДНК, кодирующая всю область scFv, может быть получена путем общего синтеза.
[0170] scFv–кодирующая ДНК может быть использована для получения, в соответствии с рутинным методом, экспрессионного вектора, содержащего ДНК, с помощью которого могут быть трансформированы клетки–хозяева. Кроме того, клетки–хозяева могут быть культивированы, а scFv может быть выделен из культур рутинным методом.
[0171] Кроме того, для получения любого другого антигенсвязывающего фрагмента антитела, ген, кодирующий антигенсвязывающий фрагмент, получают описанным выше методом и вводят в клетки. Представляющий интерес антигенсвязывающий фрагмент может быть выделен из клеточных культур.
[0172] Антитело и тому подобное согласно изобретению может быть мультимеризовано для повышения аффинности к антигену. В этом случае, антитела одного и того же типа могут быть мультимеризованы, либо может быть мультимеризовано множество антител, распознающих эпитопы одного и того же антигена, соответственно. Примерами методов мультимеризации этих антител могут быть связывание двух scFv с CH3–доменом IgG, связывание этих фрагментов со стрептавидином и введение мотива «спираль–виток–спираль».
[0173] Антитело и тому подобное согласно изобретению могут представлять собой смесь анти–CD3 антител множества типов, отличающихся аминокислотными последовательностями, то есть, поликлональное антитело. Примерами поликлонального антитела могут быть смесь антител множества типов с серией CDR, отличающихся полностью или частично. Такое поликлональное антитело может быть выделено из культур клеток, продуцирующих смеси различных антител (WO2004/061104A1). Альтернативно, отдельно полученные антитела могут быть смешаны. Антисыворотка, которая представляет собой один из вариантов поликлонального антитела, может быть получена путем иммунизации животных нужным антигеном и выделения сыворотки у животных стандартным методом.
[0174] Антитела, конъюгированые с различными молекулами, такими как полиэтиленгликоль (ПЭГ), могут быть также использованы в качестве вариантов антитела.
[0175] Антитело и тому подобное согласно изобретению могут представлять собой любой конъюгат, образованный этими антителами с другими молекулами посредством линкеров (иммуноконъюгаты). Комплекс «антитело–лекарственное средство», в котором антитело конъюгировано с радиоактивным веществом или с соединением (лекарственным средством), обладающим фармакологическим действием, может включать ADC (конъюгат «антитело–лекарственное средство») (Methods Mol Biol. (2013) 1045: 1–27).
[0176] Антитело и тому подобное согласно изобретению могут также представлять собой любын антитела, связанные с другими функциональными полипептидами. Примером такого комплекса «антитело–пептид» является комплекс антитела и альбумин–связывающего поипептида (Protein Eng Des Sel. (2012) (2): 81–8).
[0177] (4–8) Очистка антитела и антигенсвязывающего фрагмента антитела
Полученное антитело и антигенсвязывающий фрагмент антитела могут быть очищены до гомогенности так, чтобы они не содержали веществ, не являющихся антителом и тому подобное. Общие методы разделения белков и методы очистки могут быть применены для разделения и очистки антитела и антигенсвязывающего фрагмента антитела.
[0178] Антитело может быть выделено и очищено соответствующим образом отобранными или комбинированными методами, например, на хроматографических колонках, путем фильтрации, ультрафильтрации, высаливания, диализа, препаративного электрофореза в полиакриламидном геле и изоэлектрического фокусирования, хотя эти методы разделения и очистки не ограничиваются описанными методами.
[0179] Метод разделения и очистки, предпочтительно, осуществляют, например, путем получения экспрессионного вектора с использованием последовательности ДНК, кодирующей His–метку или FLAG–метку, присоединенные к карбоксильному концу вариабельной области антитела, трансформации клеток этим вектором, а затем культивирования клеток для экспрессии антитела и антигенсвязывающего фрагмента антитела, и экстракции супернатанта культуры после завершения культивирования с последующей очисткой с помощью аффинной хромотографии на металле (например, Ni или Co), на колонках с антителом против FLAG–метки, с помощью гель–фильтрации или ионообменной хромотографии.
[0180] Экспрессированное антитело и антигенсвязывающие фрагменты антитела, содержащие аминокислотную последовательность, включающую метку, такую как His–метка или FLAG–метка, также входят в объем термина «антиген и тому подобное согласно изобретению» или «молекула согласно изобретению».
[0181] (4–9) Мультиспецифические молекулы и биспецифические молекулы
Примерами методов получения биспецифической молекулы и мультиспецифической молекулы согласно изобретению являются метод, который содержит введение экспрессионных плазмид в клетки–хозяева для индуцирования транзиентной экспрессии; метод, который содержит введение плазмид в клетки–хозяева с последующим отбором стабильно экспрессирующейся клеточной линии посредством отбора с использованием лекарственного средства для индуцирования перманентной экспрессии; метод, который содержит бесклеточный синтез, и метод, который содержит получение антител или их антигенсвязывающих фрагментов любыми описанными выше способами, а затем химическое связывание этих антител или фрагментов посредством синтетического пептидного линкера.
[0182] Примерами методов получения биспецифической молекулы с использованием вариабельных областей антитела, являются метод, который содержит связывание двух одноцепочечных антител (scFv) посредством пептидного линкера (тандемного scFv); метод, который содержит перекрестное спаривание доменов двух антител с различными специфичностями и образование димера посредством нековалентной связи (диантитела); метод, который содержит перекрестное спаривание доменов двух антител с различными специфичностями и образование одной цепи (одноцепочечного диантитела) и метод, который содержит получение одноцепочечных диантител с последующим образованием димера посредством нековалентной связи (TandAb, US7129330B2).
[0183] Настоящее изобретение также относится к гену, кодирующему антитело согласно изобретению или антигенсвязывающий фрагмент антитела, или к варианту антигена и тому подобное, к рекомбинантному вектору, имеющему генную вставку, к клетке, трансфецированной этим геном или вектором, и к клетке, продуцирующей антитело согласно изобретению.
[0184] 5. Фармацевтические композиции
Настоящее изобретение относится к фармацевтической композиции, содержащей анти–CD3 антитело или его антигенсвязывающий фрагмент, или вариант антитела или его антигенсвязывающего фрагмента и/или молекулу согласно изобретению, содержащую любые из этих компонентов, например, мультиспецифическую молекулу.
[0185] В настоящем изобретении, лечение и/или профилактика заболевания содержат, но не ограничиваются ими, предупреждение начала развития заболевания, подавление или ингибирование развития или прогрессирования заболевания, ослабление одного или двух или более симптомов у индивидуума, страдающего таким заболеванием; подавление или ремиссию обострения или прогрессирования заболевания и лечение или профилактику вторичного заболевания и тому подобное. В случае указанной молекулы, примерами заболевания является рак.
[0186] Фармацевтическая композиция согласно изобретению может содержать терапевтически или профилактически эффективное количество анти–CD3 антитела или антигенсвязывающего фрагмента антитела и фармацевтически приемлемый разбавитель, носитель, солюбилизатор, эмульгатор, консервант и/или добавку.
[0187] «Терапевтически или профилактически эффективное количество» означает количество, которое оказывает терапевтическое или профилактическое действие на конкретное заболевание при введении в конкретной лекарственной форме и конкретным способом.
[0188] Фармацевтическая композиция согласно изобретению может включать вещества, изменяющие, поддерживающие или сохраняющие pH, осмотическое давление, вязкость, прозрачность, цвет, тоничность, стерильность или стабильность, а также растворимость, пролонгированное высвобождение, всасываемость, проницаемость, лекарственную форму, активность, свойства, форму и тому подобное композиции или содержащегося в ней антитела (далее называемые «фармацевтическими веществами»). Фармацевтические вещества не имеют конкретных ограничений, при условии, что они являются фармакологически приемлемыми. Так, например, предпочтительным свойством этих фармацевтических веществ являются отсутствие токсичности или низкая токсичность.
[0189] Примерами фармацевтических соединений являются, но не ограничиваются ими, следующие соединения: аминокислоты, такие как глицин, аланин, глутамин, аспарагин, гистидин, аргинин и лизин; противомикробные средства; антиоксиданты, такие как аскорбиновая кислота, сульфат натрия и бисульфит натрия; буферы, такие как фосфат, цитрат или борат, бикарбонат натрия, и растворы трис–HCl; наполнители, такие как маннит и глицин; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота (EDTA); комплекс–образующие агенты, такие как кофеин, поливинилпирролидин, β–циклодекстрин и гидроксипропил–β–циклодекстрин; агенты, придающие объем, такие как глюкоза, манноза и декстрин; углеводы, такие как моносахариды, дисахариды, глюкоза, манноза и декстрин; красители; вещества, улучшающие вкус и запах; разбавители, эмульгаторы; гидрофильные полимеры, такие как поливинилпирролидин; низкомолекулярные полипептиды; солеобразующие противоионы; антисептики, такие как хлорид бензалкония, бензойная кислота, салициловая кислота, тимерозал, фенетиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновая кислота и пероксид водорода; растворители, такие как глицерин, пропиленгликоль и полиэтиленгликоль; спирты ряда сахаров, такие как маннит и сорбит; суспендирующие агенты; поверхностно–активные вещества, такие как ПЭГ, сложный эфир сорбитана, полисорбаты, такие как полисорбат 20 и полисорбат 80, Тритон, трометамин, лецитин и холестерин; агенты, повышающие стабильность, такие как сахароза и сорбит; агенты, повышающие эластичность, такие как хлорид натрия, хлорид калия, маннит и сорбит; агенты для переноса; разбавители; наполнители и фармацевтические добавки.
[0190] Количество этих добавленных фармацевтических веществ в 0,001–1000 раз, предпочтительно, в 0,01–100 раз, а более предпочтительно, в 0,1–10 раз превышает массу анти–CD3 антитела или его антигенсвязывающего фрагмента или варианта антитела или его антигенсвязывающего фрагмента, или молекулы согласно изобретению, такой как мультиспецифическая молекула.
[0191] Иммунолипосома, содержащая анти–CD3 антитело согласно изобретению или его антигенсвязывающий фрагмент или вариант антитела или его антигенсвязывающий фрагмент или молекулу согласно изобретению, такую как мультиспецифическая молекула, инкапсулированная в липосому, или фармацевтическая композиция, содержащая модифицированное антитело, включающее антитело, конъюгированное с липосомой (патент США No. 6214388 и тому подобное), также входят в объем термина «фармацевтические композиции согласно изобретению».
[0192] Наполнители или носители не имеют конкретных ограничений, при условии, что они являются жидкими или твердыми веществами, обычно используемыми в воде для инъекций, в физиологическом растворе, в искусственных цереброспинальных жидкостях и в других препаратах для перорального или парентерального введения. Примерами физиологических растворов могут быть нейтральный физиологический раствор и физиологический раствор, содержащий сывороточный альбумин.
[0193] Примерами буферов могут быть Трис–буфер, доведенный до конечного pH фармацевтической композиции 7,0–8,5, ацетатный буфер, доведенный до конечного pH 4,0–5,5, цитратный буфер, доведенный до конечного pH 5,0–8,0, и гистидиновый буфер, доведенный до конечного pH 5,0–8,0.
[0194] Фармацевтическая композиция согласно изобретению представляет собой твердое вещество, жидкость или суспензию. Другим примером фармацевтической композиции согласно изобретению является лиофилизованный препарат. Лиофилизованные препараты могут быть получены с использованием наполнителя, такого как сахароза.
[0195] Способом введения фармацевтической композиции согласно изобретению может быть любое из таких введений, как энтеральное введение, местное введение или парентеральное введение, и такое введение, предпочтительно, выбирают в зависимости от типа заболевания, подвергаемого лечению. Конкретными примерами являются внутривенное введение, внутриартериальное введение, внутримышечное введение, интрадермальное введение, подкожное введение, внутрибрюшинное введение, трансдермальное введение, внутрикостное введение и внутрисуставное введение.
[0196] Состав фармацевтической композиции может быть определен в зависимости от способа введения, аффинности связывания антитела с белком CD3 и тому подобное.
[0197] Доза анти–CD3 антитела согласно изобретению или его антигенсвязывающего фрагмента или варианта антитела или его антигенсвязывающего фрагмента или молекулы согласно изобретению, такой как мультиспецифическая молекула, может быть определена в зависимости от вида индивидуума, типа заболевания, симптомов, пола, возраста, истории болезни, аффинности связывания антитела с белком CD3 или его биологической активности и других факторов. Доза обычно составляет 0,01–1000 мг/кг, а предпочтительно, 0,1–100 мг/кг, и может быть введена один раз в день в течение 180 дней или два, или три, или более раз в день.
Примерами форм фармацевтической композиции являются инъекции (включая лиофилизированные препараты и капли), суппозитории, препараты для интраназального всасывания, препараты для трансдермального всасывания, препараты для подъязычного введения, капсулы, таблетки, мази, гранулы, аэрозоли, драже, порошки, суспензии, эмульсии, глазные капли и препараты для биологической имплантации.
[0198] Анти–CD3 антитело согласно изобретению или его антигенсвязывающий фрагмент или вариант антитела или его антигенсвязывающего фрагмента и/или молекула согласно изобретению, содержащая любые из этих компонентов, такая как мультиспецифическая молекула (далее называемые «анти–CD3 антителом и тому подобное») могут быть использованы в комбинации с другим лекарственным средством. Анти–CD3 антитело и тому подобное или фармацевтическая композиция, содержащая анти–CD3 антитело и тому подобное в качестве активного ингредиента, могут быть введены одновременно с другим лекарственным средством или отдельно от него, то есть, в виже фармацевтической композиции, содержащей лекарственное средство, не являющееся анти–CD3 антителом и тому подобное в качестве активного ингредиента. Так, например, фармацевтическая композиция, содержащая анти–CD3 антитело и тому подобное в качестве активного ингредиента, может быть введена после введения другого лекарственного средства, либо другое лекарственное средство может быть введено после введения фармацевтической композиции, содержащей анти–CD3 антитело и тому подобное в качестве активного ингредиента. Альтернативно, фармацевтическая композиция, содержащая анти–CD3 антитело и тому подобное в качестве активного ингредиента, и другое лекарственное средство могут быть введены одновременно. В настоящем изобретении, случай, когда анти–CD3 антитело и тому подобное и другое лекарственное средство содержатся в качестве активных ингредиентов в одной фармацевтической композиции, и случай, когда эти активные ингредиенты содержатся отдельно во множестве фармацевтических композиций, входят в объем термина «фармацевтическая композиция, содержащая анти–CD3 антитело и тому подобное и другое лекарственное средство». В настоящем изобретении, термин «фармацевтическая композиция» является синонимом термина «фармацевтическая композиция, где анти–CD3 антитело и тому подобное вводят в комбинации с другим лекарственным средством».
[0199] В настоящем изобретении, выражение «вводимый в комбинации», используемое для анти–CD3 антитела и тому подобное и другого лекарственного средства, означает, что анти–CD3 и тому подобное антитело и другое лекарственное средство вводят в организм реципиента в течение определенного периода времени. Может быть введен один препарат, содержащий анти–CD3 антитело и тому подобное и другое лекарственное средство, или анти–CD3 антитело и тому подобное и другое лекарственное средство могут быть приготовлены по отдельности и введены в виде отдельных препаратов. В случае введения отдельных препаратов, время введения не имеют конкретных ограничений, и такие препараты могут быть введены вместе, либо они могут быть введены в различное время или в различные дни, поочередно. В случае, когда анти–CD3 антитело и тому подобное и другое лекарственное средство вводят отдельно в различные периоды времени или в различные дни, то порядок введения не имеют конкретных ограничений. Поскольку отдельные препараты обычно вводят соответствующими способами, то частота введения может быть такой же или другой. Кроме того, отдельные препараты могут быть введены одним и тем же методом введения (способом введения), или они могут быть введены различными методами введения (способами введения). При этом, необязательно, чтобы анти–CD3 антитело и тому подобное и другое лекарственное средство присутствовали в организме одновременно, и достаточно, чтобы анти–CD3 антитело и тому подобное и другое лекарственное средство были введены в организм в течение определенного периода времени (например, в течение 1 месяца, предпочтительно, 1 недели, более предпочтительно, нескольких дней, а еще более предпочтительно, 1 дня). Альтернативно, если вводится один из активных ингредиентов, то другой активный ингредиент может уже выводиться из организма.
[0200] Примерами введения лекарственных форм для «фармацевтической композиции, где анти–CD3 антитело и тому подобное вводят в комбинации с другим лекарственным средством», могут быть: 1) введение одного препарата, содержащего анти–CD3 антитело и тому подобное и другое лекарственное средство, 2) одновременное введение одним и тем же способом двух препаратов, полученных путем отдельного приготовления анти–CD3 антитела и тому подобное и другого лекарственного средства, 3) поочередное введение одним и тем же способом двух препаратов, полученных путем отдельного приготовления анти–CD3 антитела и тому подобное и другого лекарственного средства, 4) одновременное введение различными способами двух препаратов, полученных путем отдельного приготовления анти–CD3 антитела и тому подобное и другого лекарственного средства, и 5) поочередное введение различными способами двух препаратов, полученных путем отдельного приготовления анти–CD3 антитела и тому подобное и другого лекарственного средства. Доза, интервал введения доз, лекарственная форма, способ приготовления и тому подобное «фармацевтическая композиции, где анти–CD3 антитело и тому подобное вводят в комбинации с другим лекарственным средством» зависят от фармацевтической композиции, содержащей анти–CD3 антитело и тому подобное, но не ограничиваются ими.
[0201] Фармацевтическая композиция, приготовленная в виде двух различных препаратов, может присутствовать в форме набора, содержащего эти препараты.
[0202] В настоящем изобретении, «комбинация» анти–CD3 антитела и тому подобное и другого лекарственного средства» означает, что анти–CD3 антитело и тому подобное и другое лекарственное средство «вводят в комбинации».
[0203] Дополнительное лекарственное средство может быть также использовано в комбинации или в фармацевтической композиции согласно изобретению.
[0204] Настоящее изобретение относится к способу лечения или профилактики CD3–ассоциированных заболеваний, к применению антитела согласно изобретению в целях приготовления фармацевтической композиции для лечения или профилактики таких заболеваний, и к применению антитела согласно изобретению для лечения или профилактики заболеваний. Настоящее изобретение также охватывает набор для лечения или профилактики, содержащий антитело согласно изобретению.
Примеры
[0205] Настоящее изобретение более подробно описано со ссылкой на примеры. Однако, настоящее изобретение не ограничивается этими примерами. Процедуры, относящиеся к манипуляции генов и описанные ниже в примерах, осуществляли методами, описанными в «Molecular Cloning» (Sambrook, J., Fritsch, E.F. and Maniatis, T., Cold Spring Harbor Laboratory Press, 1989), или с использованием коммерчески доступных реагентов или наборов в соответствии с инструкциями, если это не оговорено особо.
[0206] (Пример 1) Получение крысиного антитела против человеческого CD3
1)–1 Конструирование вектора, экспрессирующего человеческий CD3εδ
Контрольный вектор pcDNA3.1–DEST, сконструированный как целевой вектор, получали с использованием системы Gateway Vector Conversion System (Thermo Fisher Scientific Inc.). кДНК, кодирующую человеческий белок CD3ε (эталонная последовательность NCBI: NP_000724.1) и представленную на фигуре 1 (SEQ ID NO:1), закупали у Sino Biological Inc. и клонировали в вектор pcDNA3.1–DEST с использованием смеси ферментов клоназы Gateway LR (Thermo Fisher Scientific Inc.) для конструирования hCD3ε–pcDNA3.1. кДНК, кодирующую человеческий белок CD3δ (NP_000723.1) и представленную на фигуре 2 (SEQ ID NO:2), амплифицировали с помощью ПЦР с использованием кДНК, происходящей от человеческих Т–клеток, в качестве матрицы методом, известным специалистом, и клонировали в pcDNA3.1(+) (Thermo Fisher Scientific Inc.) для конструирования экспрессионного вектора hCD3δ–pcDNA3.1. Для крупномасштабного получения такого экспрессионного вектора использовали набор Endofree Plasmid Giga (Qiagen N.V.).
[0207] 1)–2 Иммунизация
Для иммунизации использовали самок крыс WKY/Izm (Japan SLC, Inc.). Сначала, оба нижних бедра каждой крысы предварительно обрабатывали гиалуронидазой (Sigma–Aldrich Corp.). Затем, экспрессионные векторы hCD3ε–pcDNA3.1 и hCD3δ–pcDNA3.1, полученные как описано в Примере 1)– 1, внутримышечно инъецировали в эти участки. После этого проводили in vivo электропорацию этих участков с использованием ECM830 (BTX) и двойного игольчатого электрода. Ту же самую электропорацию in vivo, описанную выше, повторяли приблизительно один раз через каждые две недели. Затем, лимфоузлы или селезенки крыс собирали и использовали для получения гибридомы.
[0208] 1)–3 Получение гибридом
Клетки лимфоузлов или клетки селезенки подвергали электрическому слиянию с клетками мышиной миеломы SP2/0–ag14 (ATCC, No. CRL–1 581) с использованием устройства для слияния клеток LF301 (BEX Co., Ltd.). Слитые клетки разводили средой для отбора ClonaCell–HY D (StemCell Technologies Inc.) и культивировали. Колонии гибридом выделяли для получения моноклональных гибридом. Каждую выделенную таким образом колонию гибридом культивировали с использованием среды для отбора ClonaCell–HY E (StemCell Technologies Inc.), и полученный супернатант гибридомной культуры использовали для скрининга на гибридому, продуцирующую антитело против человеческого CD3.
[0209] 1)–4 Скрининг антитела с помощью клеточного ELISA
1)–4–1 Получение клеток, экспрессирующих ген антигена для клеточного ELISA
Клетки HEK293α (клеточную линию, происходящую от HEK293 и стабильно экспрессирующую интегрин αv и интегрин β3) доводили до 7,5×105 клеток/мл в среде DMEM, содержащей 10% FBS. hCD3ε–pcDNA3.1 и hCD3δ–pcDNA3.1, или контрольную pcDNA3.1–DEST трансфецировали этими клетками методами трансфекции с использованием липофектамина 2000 (Thermo Fisher Scientific Inc.). Полученные клетки распределяли в количестве 100 мкл/лунку по 96–луночному планшету (Corning Inc.) и культивировали в течение ночи при 37°C в условиях 5% CO2 в среде DMEM, содержащей 10% FBS. Полученные трансфецированные клетки использовали в связанном состоянии в клеточном ELISA.
[0210] 1)–4–2 Клеточный ELISA
После удаления супернатанта из культуры клеток HEK293α, трансфецированных экспрессионным вектором и полученных в Примере 1)–4–1, каждый супернатант гибридомной культуры добавляли к hCD3ε–pcDNA3.1– и hCD3δ–pcDNA3.1– или pcDNA3.1–DEST–трансфецированным клеткам HEK293α, и планшет оставляли на 1 час при 4°C. Клетки в лунках один раз промывали PBS, содержащим 5% FBS. Затем добавляли антикрысиный IgG и ПХ–конъюгированное полноразмерное козье Ab (GE Healthcare Bio–Sciences Corp.), 500–кратно разведенные PBS, содержащим 5% FBS, и планшет оставляли на 1 час при 4°C. Клетки в лунках два раза промывали PBS, содержащим 5% FBS. Затем добавляли хромогенный раствор OPD (раствор OPD (дигидрохлорида o–фенилендиамина (Wako Pure Chemicals Industries, Ltd.) и H2O2, растворенные в концентрациях 0,4 мг/мл и 0,6% (об/об), соответственно, в 0,05 M трицитрате натрия и 0,1 М додекагидрата динатрийбифосфата, pH 4,5)) в концентрации 100 мкл/лунку. Цветную реакцию осуществляли при периодическом перемешивании и прекращали путем добавления 1М HCl в концентрации 100 мкл/лунку. Затем измеряли оптическую плотность на 490 нм на планшет–ридере (ENVISION; PerkinElmer, Inc.). Для отбора гибридомы, продуцирующей антитело, связывающееся с человеческим CD3, экспрессирующимся на поверхности клеточной мембраны, гибридомы, в которых супернатант культуры имел более высокую оптическую плотность для клеток HEK293α, трансфецированных экспрессионными векторами hCD3ε–pcDNA3.1 и hCD3δ–pcDNA3.1, по сравнению с клеткми HEK293, трансфецированными контрольным pcDNA3.1–DEST, отбирали как гибридомы, позитивные по продуцированию антитела против человеческого CD3.
[0211] 1)–5 Скрининг антитела на основе активации человеческих T–клеток
Анти–CD3 антитело, полученное из гибридомы, оценивали на его активацию T–клеток путем детектирования маркера активации CD69 в качестве показателя такой активации. Клетки человеческой T–клеточной линии Jurkat (ATCC, No. TIB–152) доводили до концентрации 5×106 клеток/мл в среде RPMI1640, содержащей FBS, и добавляли в концентрации 100 мкл/лунку в 96–луночный планшет. После удаления супернатанта путем центрифугирования, супернатант культуры каждой гибридомы, позитивной по продуцированию антитела против человеческого CD3 и отобранной с помощью клеточного ELISA в Примере 1)–4, или крысиного антитела контрольного изотипа IgG (R&D Systems, Inc.), добавляли в конечной концентрации 5 мкг/мл к клеткам Jurkat, и планшет оставляли на 30 минут при 37°C. Затем добавляли перекрестносшитое антитело, специфичное к Fcγ–фрагменту козьего антикрысиного IgG (Jackson ImmunoResearch Laboratories, Inc.) в конечной концентрации 10 мкг/лунку, и клетки культивировали в течение ночи при 37°C в атмосфере 5% CO2. На следующий день, супернатант удаляли, и клетки в лунках один раз промывали PBS, содержащим 5% FBS. Затем добавляли ФЭ–конъюгированное мышиное антитело против человеческого CD69 (BD Biosciences) в концентрации 20 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки в лунках два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащим 5% FBS, после чего детектировали на проточном цитометре (FC500; Beckman Coulter Inc.). Данные анализировали с использованием Flowjo (Tree Star Inc.). Затем строили гистограмму по данным интенсивности флуоресценции ФЭ. Гибридомы, образец которых имел более сильный сдвиг в сторону интенсивности флуоресценции ФЭ по сравнению с интенсивностью флуоресценции на гистограмме для крысиного антитела контрольного изотипа IgG, отбирали как гибридомы, продуцирующие антитело против человеческого CD3 и позитивные по способности активировать человеческие T–клетки.
[0212] 1)–6 Скрининг на основе селективной активности связывания с человеческим CD3 и с CD3 обезьян с помощью проточной цитометрии
1)–6–1 Получение клеток, экспрессирующих ген человеческого антигена
Клетки Lenti–X293T (Takara Bio Inc., Cat# 632180) при плотности 5,3×104 клеток/см2 добавляли в 225 см2–колбу и культивировали в течение ночи при 37°C в атмосфере 5% CO2 в среде DMEM, содержащей 10% FBS. На следующий день, hCD3ε–pcDNA3.1 и hCD3δ–pcDNA3.1 или контрольный pcDNA3.1–DEST переносили в клетки Lenti–X293T с использованием липофектамина 2000, после чего эти клетки культивировали в течение ночи при 37°C в атмосфере 5% CO2. На следующий день, клетки Lenti–X293T, трансфецированные экспрессионным вектором, обрабатывали реагентом TrypLE Express (Thermo Fisher Scientific Inc.), промывали DMEM, содержащей 10% FBS, а затем доводили до концентрации 5×106 клеток/мл в PBS, содержащем 5% FBS. Полученную клеточную суспензию использовали в анализе посредством проточной цитометрии.
[0213] 1)–6–2 Проточный цитометрический анализ на активность связывания с человеческим CD3
Специфичность связывания антитела, продуцируемого каждой гибридомой, с человеческим CD3, которая, как было определено, является позитивной по способности активировать человеческие T–клетки в Примере 1)–5, дополнительно подтверждали с помощью проточной цитометрии. Каждую суспензию клеток Lenti–X293T, полученную в Примере 1)–6–1, добавляли в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном и центрифугировали для уделения супернатанта. hCD3ε–pcDNA3.1– и hCD3δ–pcDNA3.1–трансфецированные клетки Lenti–X293T или pcDNA3.1–DEST–трансфецированные клетки Lenti–X293T суспендировали путем добавления супернатанта гибридомной культуры и оставляли на 1 час при 4°C. Клетки один раз промывали PBS, содержащим 5% FBS, а затем суспендировали путем добавления ФИТЦ–конъюгированого антитела против крысиного IgG (Sigma–Aldrich Corp.), 500–кратно разведенного PBS, содержащим 5% FBS, и оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащем 5% FBS и 2 мкг/мл 7–аминоактиномицина D (Molecular Probes, Inc.), после чего детектировали на проточном цитометре. Данные анализировали с использованием Flowjo. После удаления погибших клеток, позитивных по 7–аминоактиномицину D, путем стробирования, данные интенсивности флуоресценции ФИТЦ для живых клеток откладывали на гистограмме. Гибридомы, образец которых имел более сильный сдвиг в сторону интенсивности флуоресценции на гистограмме для hCD3ε–pcDNA3.1– и hCD3δ–pcDNA3.1–трансфецированных клеток Lenti–X293T по сравнению с интенсивностью флуоресценции на гистограмме для контрольных pcDNA3.1–DEST–трансфецированных клеток Lenti–X293T, отбирали как гибридомы, продуцирующие антитела, связывающиеся с человеческим CD3.
[0214] 1)–6–3 Конструирование экспрессионного вектора CD3εδ обезьян
кДНК, кодирующие обезьяний белок CD3ε (эталонная последовательность NCBI: NP_001270544.1) и обезьяний белок CD3δ (эталонная последовательность NCBI: NP_001274617.1), амплифицировали с помощью ПЦР с использованием кДНК, происходящей от обезьяньих T–клеток, в качестве матрицы известным методом, и клонировали в pcDNA3.1(+) (Thermo Fisher Scientific Inc.) для конструирования экспрессионных векторов cynoCD3ε–pcDNA3.1 и cynoCD3δ–pcDNA3.1.
[0215] 1)–6–4 Получение клеток, экспрессирующих ген обезьяньего антигена
Клетки Lenti–X293T инокулировали при плотности 5,3×104 клеток/см2 в 225 см2–колбе и культивировали в течение ночи при 37°C в атмосфере 5% CO2 в среде DMEM, содержащей 10% FBS. На следующий день, cynoCD3ε–pcDNA3.1 и cynoCD3δ–pcDNA3.1 или контрольный pcDNA3.1–DEST переносили в клетки Lenti–X293T с использованием липофектамина 2000, после чего эти клетки культивировали в течение ночи при 37°C в атмосфере 5% CO2. На следующий день, клетки Lenti–X293T, трансфецированные экспрессионным вектором, обрабатывали реагентом TrypLE Express, промывали DMEM, содержащей 10% FBS, а затем доводили до концентрации 5×106 клеток/мл в PBS, содержащем 5% FBS. Полученную клеточную суспензию использовали в анализе посредством проточной цитометрии.
[0216] 1)–6–5 Проточный цитометрический анализ на активность связывания с обезьяньим CD3
Специфичность связывания антитела, продуцируемого каждой гибридомой, с обезьяньим CD3, которая, как было определено в Примере 1)–6–2,, продуцирует антитело, связывающееся с человеческим СD3, дополнительно подтверждали с помощью проточной цитометрии. Каждую суспензию клеток Lenti–X293T, полученную в Примере 1)–6–4, добавляли в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном и центрифугировали для удаления супернатанта. cynoCD3ε–pcDNA3.1– и cynoCD3δ–pcDNA3.1–трансфецированные клетки Lenti–X293T или pcDNA3.1–DEST–трансфецированные клетки Lenti–X293T суспендировали путем добавления супернатанта гибридомной культуры и оставляли на 1 час при 4°C. Клетки один раз промывали PBS, содержащим 5% FBS, а затем суспендировали путем добавления ФИТЦ–конъюгированого антитела против крысиного IgG, 500–кратно разведенного PBS, содержащим 5% FBS, и оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащем 5% FBS и 2 мкг/мл 7–аминоактиномицина D, после чего детектировали на проточном цитометре. Данные анализировали с использованием Flowjo. После удаления погибших клеток, позитивных по 7–аминоактиномицину D, путем стробирования, данные интенсивности флуоресценции ФИТЦ для живых клеток откладывали на гистограмме. Гибридомы, образец которых имел более сильный сдвиг в сторону интенсивности флуоресценции на гистограмме для cynoCD3ε–pcDNA3.1– и cynoCD3δ–pcDNA3.1 –трансфецированных клеток Lenti–X293T по сравнению с интенсивностью флуоресценции на гистограмме для контрольных pcDNA3.1–DEST–трансфецированных клеток Lenti–X293T, отбирали как гибридомы, продуцирующие антитела, связывающиеся с обезьяньим CD3.
[0217] 1)–6–6 Получение клеток, экспрессирующих ген человеческого CD3δ
Клетки Lenti–X293T инокулировали при плотности 5,3×104 клеток/см2 в 225 см2–колбе и культивировали в течение ночи при 37°C в атмосфере 5% CO2 в среде DMEM, содержащей 10% FBS. На следующий день, hCD3δ–pcDNA3.1 или контрольный pcDNA3.1–DEST переносили в клетки Lenti–X293T с использованием липофектамина 2000, после чего эти клетки культивировали в течение ночи при 37°C в атмосфере 5% CO2. На следующий день, клетки Lenti–X293T, трансфецированные экспрессионным вектором, обрабатывали реагентом TrypLE Express, промывали DMEM, содержащей 10% FBS, а затем доводили до концентрации 5×106 клеток/мл в PBS, содержащем 5% FBS. Полученную клеточную суспензию использовали в анализе посредством проточной цитометрии.
[0218] 1)–6–7 Проточный цитометрический анализ на активность связывания с человеческим CD3δ
Специфичность связывания антитела, продуцируемого каждой гибридомой, с человеческим CD3δ, которая, как было определено в Примере 1)–6–5, продуцирует антитело, связывающееся с обезьяньим СD3, дополнительно подтверждали с помощью проточной цитометрии. Каждую суспензию клеток Lenti–X293T, полученную в Примере 1)–6–6, добавляли в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном и центрифугировали для удаления супернатанта. hCD3δ–pcDNA3.1–трансфецированные клетки Lenti–X293T или pcDNA3.1–DEST–трансфецированные клетки Lenti–X293T суспендировали путем добавления супернатанта гибридомной культуры и оставляли на 1 час при 4°C. Клетки один раз промывали PBS, содержащим 5% FBS, а затем суспендировали путем добавления ФИТЦ–конъюгированого антитела против крысиного IgG, 500–кратно разведенного PBS, содержащим 5% FBS, и оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащем 5% FBS и 2 мкг/мл 7–аминоактиномицина D, после чего детектировали на проточном цитометре. Данные анализировали с использованием Flowjo. После удаления погибших клеток, позитивных по 7–аминоактиномицину D, путем стробирования, данные интенсивности флуоресценции ФИТЦ для живых клеток откладывали на гистограмме. Гибридомы, образец которых имел более сильный сдвиг в сторону интенсивности флуоресценции на гистограмме для hCD3δ–pcDNA3.1–трансфецированных клеток Lenti–X293T по сравнению с интенсивностью флуоресценции на гистограмме для контрольных pcDNA3.1–DEST–трансфецированных клеток Lenti–X293T, отбирали как гибридомы, продуцирующие антитела, связывающиеся с человеческим CD3δ.
[0219] 1)–6–8 Проточный цитометрический анализ на активность связывания с обезьяньими T–клеточными линиями
Специфичность связывания антитела, продуцируемого каждой антитело–продуцирующей гибридомой, которая не была исключена в Примере 1)–6–7, с обезьяньей T–клеточной линией, дополнительно подтверждали с помощью проточной цитометрии. T–клеточную линию яванских макак HSC–F (JCRB Cell Bank, No. JCRB1164) доводили до концентрации 5×106 клеток/мл в среде RPMI1640, содержащей FBS и добавляли в концентрации 100 мкл/лунку в 96–луночный планшет. После удаления супернатанта путем центрифугирования, супернатант культуры антитело–продуцирующей гибридомы, которая не была исключена в Примере 1)–5–7, или крысиного антитела крысиного изотипа IgG, добавляли к клеткам HSC–F, и планшет оставляли на 1 час при 4°C. Затем супернатант удаляли, и клетки в лунках один раз промывали PBS, содержащим 5% FBS, а затем суспендировали путем добавления ФИТЦ–конъюгированого антитела против крысиного IgG, 500–кратно разведенного PBS, содержащим 5% FBS, и оставляли на 30 минут при 4°C. Клетки три раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащем 5% FBS и 2 мкг/мл 7–аминоактиномицина D, после чего детектировали на проточном цитометре. Данные анализировали с использованием Flowjo. После удаления погибших клеток, позитивных по 7–аминоактиномицину D, путем стробирования, данные интенсивности флуоресценции ФИТЦ для живых клеток откладывали на гистограмме. Гибридомы, образец которых имел более сильный сдвиг в сторону интенсивности флуоресценции на гистограмме для ФИТЦ по сравнению с интенсивностью флуоресценции на гистограмме для крысиного антитела контрольного изотипа IgG, отбирали как гибридомы, продуцирующие антитела, также связывающиеся с обезьяньей T–клеточной линией.
[0220] 1)–7 Изотипирование антител
C3–147, который предположительно связывался с человеческим и обезьяньим CD3ε, а также с обезьяньей T–клеточной линией и обладал высокой способностью активировать человеческие T–клетки, был отобран из гибридом, продуцирующих крысиное анти–CD3 антитело и полученных как описано в Примере 1)–6, и идентифицирован путем изотипирования антитела. Изотип определяли с использованием набора для ELISA на изотип крысиного иммуноглобулина (BD Pharmingen). В результате, изотип крысиного моноклонального анти–CD3 антитела C3–147 был подтвержден как IgG2b и цепи λ.
[0221] (Пример 2) Исследование активности связывания крысиных моноклональных анти–CD3 антител (C3–147) с человеческим CD3
2)–1 Получение моноклональных антител из супернатанта гибридомы
2)–1–1 Культивирование гибридомы, продуцирующей C3–147
Крысиное моноклональное анти–CD3 антитело очищали из супернатанта гибридомной культуры. Сначала, C3–147–продуцирующую гибридому оставляли для роста до нужного количества в среде для отбора ClonaCell–HY E (StemCell Technologies Inc.). Затем, среду заменяли средой SFM для гибридом (Thermo Fisher Scientific Inc.), содержащей 5 мкг/мл гентамицина (Thermo Fisher Scientific Inc.), в которую был добавлен 20% FBS для IgG в очень низкой концентрации (Thermo Fisher Scientific Inc.), с последующим культивированием в течение 7 дней. Этот культивированный супернатант выделяли и стерилизовали через 0,22 мкм–фильтр (Corning Inc.).
[0222] 2)–1–2 Очистка
Антитело было очищено посредством аффинной хромотографии на G–белке из супернатанта гибридомной культуры, полученной в Примере 2)–1–1. Антитело адсорбировали на колонке с G–белком (GE Healthcare Bio–Sciences Corp.), и эту колонку промывали PBS, а затем элюировали водным раствором 0,1 M глицина/соляной кислоты (pH 2,7). Элюат доводили до pH 7,0–7,5 путем добавления 1 M Трис–HCl (pH 9,0). Затем буфер заменяли PBS с использованием центрифужного фильтрующего устройства UF VIVASPIN20 (с отсечкой молекулярной массы: UF30K, Sartorius Japan K.K.), а антитело концентрировали и доводили до концентрации 2 мг/мл. И наконец, концентрат фильтровали через фильтр Minisart–Plus (Sartorius Japan K.K.) и использовали в качестве очищенного образца.
[0223] 2)–2 Связывание полученного крысиного анти–CD3 антитела (C3–147) с человеческими одноцепочечными антигенами
2)–2–1 Получение человеческих одноцепочечных антигенов CD3εγ
Аминокислотную последовательность, содержащую CD3ε или CD3γ, получали из кристаллической структуры (PDBID: 1SY6) комплекса OTK3–человеческого одноцепочеченого антигена CD3εγ и заносили в базу данных белка. Тот же самый петидный линкер, состоящий из 26 аминокислот, сообщаемых для ссылки (Kim, K.S. et al., (2000) J. Mol. Biol. 302, 899–916), использовали в качестве линкера для связывания карбоксильного конца CD3ε с амино–концом CD3γ. Ген, кодирующий человеческий одноцепочечный антиген CD3εγ, представленный на фигуре 3 (SEQ ID NO:4) Списка последовательностей, синтезировали путем присоединения рестрикционных BamHI– и HindIII–сайтов к 5’– и 3’–концам, соответственно (GeneArt Gene Synthesis Service/Thermo Fisher Scientific Inc.). Фрагмент размером приблизительно 4,8 т.п.о., полученный путем гидролиза плазмиды pQE80L (Qiagen N.V.) рестриктирующими ферментами BamHI и HindIII, лигировали с фрагментом приблизительно 0,6 т.п.о., полученным путем гидролиза гена человеческого одноцепочечного антигена CD3εγ ферментами BamHI и HindIII, с использованием набора для высокоэффективного лигирования (Toyobo Co., Ltd.) с получением плазмиды pQE80L–scCD3εγ для экспрессии в E. coli. Аминокислотная последовательность полученного scCD3εγ описана на фигуре 4 (SEQ ID NO:5) Списка последовательностей. E. coli BL21 (DE3) для экспрессии трансформировали плазмидой pQE80L–scCD3εγ для экспрессии, и полученную колонию добавляли к 1 л MagicMedia (Invitrogen Corp.) с использованием колб Ultra Yield flasksTM (Thomson Instrument Company) и подвергали шейкерному культивированию при 250 об/мин при 30°C в течение 21 часа. Культивированные таким образом бактериальные клетки выделяли. Бактериальные клетки разрушали с использованием ультразвукового гомогенизатора в присутствии буферного раствора Триса, содержащего 1% раствор Тритона, и цикл замораживания–оттаивания повторяли. И наконец, тельца включения выделяли путем центрифугирования при 15000 об/мин при 4°C в течение 15 минут. Процедуры после рефолдинка телец включения для очистки осуществляли стандартным методом (Kjer–Nielsen et al. (2004) PNAS vol. 101, no. 20, 7675–7680), за исключением того, что вместо 2C11, используемого как описано в литературе, использовали анти–CD3 антитело на колонке с антителом, которое представляет собой мышиное моноклональное анти–CD антитело OKT3 (Sgro, Toxicology 105 (1995), 23–29, Orthoclone, Janssen–Cilag).
[0224] 2)–2–2 ППР–измерение активности связывания с человеческими одноцепочечными антигенами CD3εγ
Антитело анализировали на связывание с антигеном с использованием BIAcore 3000 (GE Healthcare Bio–Sciences Corp.) методом захвата, который содержит захват антитела в качестве лиганда на иммобилизованном антителе против мышиного IgG и анализ антигена в качестве аналита. Используемым антигеном является человеческий CD3εγ, полученный в Примере 2)–2–1. Приблизительно 11000 RU антитела против мышиного IgG (набор для захвата мышиного антитела, GE Healthcare Bio–Sciences Corp.) ковалентно связывали с сенсорным чипом CM5 (GE Healthcare Bio–Sciences Corp.) методом присоединения амина. Аналогичным образом, это антитело иммобилизовали на эталонной ячейке. Используемым рабочим буфером является HBS–EP+ (10 мМ HEPES (pH 7,4), 0,15 M NaCl, 3 мМ EDTA, и 0,05% поверхностно–активного вещества P20). Антитело присоединяли к чипу с иммобилизованным антителом против мышиного IgG приблизительно в течение 1 минуты, а затем захватывали в качестве лиганда. После этого добавляли 100 нМ антигена со скоростью потока 30 мкл/мин в течение 120 секунд, и проводили мониторинг связывания с антигеном. 10 мМ глицина–HCl (pH 1,7) добавляли в качестве регенерирующего раствора со скоростью потока 10 мкл/мин в течение 3 минут. В результате, сигнал связывания C3–147 через 120 секунд составлял 34 RU.
[0225] 2)–3 Подтверждение антигенсвязывающего сайта в полученном крысином анти–CD3 антителе (C3–147) с помощью ППР.
Метод подтверждения антигенсвязывающего сайта осуществляли как описано в Примере 2)–2–2. В результате, сигнал связывания, полученный для C3–147, составлял 34 RU. С другой стороны, антигенсвязывающий сайт в SP34 (BD Pharmingen), то есть, анти–CD3 антитела, известного специалистам, был подтвержден в качестве сравнительного примера. Сигнал связывания 34 RU не наблюдался в SP34. Эти результаты показали, что сайт связывания на поверхности CD3εγ, распознаваемой C3–147, отличается от сайта связывания на поверхности, распознаваемой SP34.
[0226] (Пример 3) Секвенирование кДНК, кодирующих вариабельные области крысиных анти–CD3 антител (C3–147)
кДНК, кодирующие вариабельные области крысиного анти–CD3 антитела (C3–147), секвенировали следующим методом.
[0227] 3)–1 Синтез кДНК
Клеточные лизаты (50 мМ Трис–HCl (pH 7,5), 250 мМ LiCl, 5 мМ EDTA (pH 8), 0,5% додецилсульфата лития (LiDS) и 2,5 мМ дитиотреитола (DTT)) гибридомы, продуцирующей крысиное анти–CD3 антитело (C3–147), смешивали с магнитными сферами, связанными с олиго–dT25, в наборе для прямого анализа мРНК Dynabeads (Thermo Fisher Scientific Inc.) так, чтобы мРНК связывалась с магнитными сферами. Затем, магнитные сферы один раз промывали промывочным раствором мРНК A (10 мМ Трис–HCl (pH 7,5), 0,15 M LiCl, 1 мМ EDTA, 0,1% LiDS, и 0,1% Тритона X–100) и раствором для синтеза кДНК (50 мМ Трис–HCl (pH 8,3), 75 мМ KCl, 3 мМ MgCl2, 5 мМ DTT, 0,5 мМ dNTP, 0,2% Тритона X–100, и 1,2 единиц ингибитора РНКазы (Thermo Fisher Scientific Inc.). Затем, кДНК синтезировали с использованием раствора для синтеза кДНК, в который было добавлено 12 единиц обратной транскриптазы SuperScript III (Thermo Fisher Scientific Inc.). Затем, кДНК промывали 3’–фланкирующим реакционным раствором (50 мМ фосфата калия, 4 мМ MgCl2, 0,5 мМ dGTP, 0,2% Тритона X–100 и 1,2 единиц ингибитора РНКазы), а затем 3’–фланкирующим реакционным раствором, в который было добавлено 48 единиц терминальной рекомбинантной трансферазы (Roche Applied Science).
[0228] 3)–2 Амплификация и секвенирование генных фрагментов вариабельной области тяжелой и легкой цепей крысиного иммуноглобулина
Магнитные сферы промывали раствором TE (10 мМ Трис–HCl (pH 7,5), 1 мМ EDTA, и 0,1% Тритона X–100). Затем, гены тяжелой цепи и легкой цепи крысиного иммуноглобулина амплифицировали с помощью 5'–RACE–ПЦР. В частности, магнитные сферы переносили в реакционный раствор для ПЦР (0,2 мкМ праймеров, 0,2 мМ dNTP и 0,25 единиц ДНК–полимеразы PrimeSTAR HS (Takara Bio Inc.)) и проводили 35 реакционных циклов, каждый из которых включал реакцию при 94°C в течение 30 секунд и при 68°C в течение 90 секунд. Наборы используемых праймеров описаны ниже.
Набор ПЦР–праймеров для амплификации гена тяжелой цепи:
Смысловой праймер Nhe–polyC–S
5'–GCTAGCGCTACCGGACTCAGATCCCCCCCCCCCCCDN–3'; фигура 5 (SEQ ID NO:50)
Первый антисмысловой праймер rIgγ–AS1
5'–TCACTGAGCTGGTGAGAGTGTAGAGCCC–3'; фигура 6 (SEQ ID NO:51)
Второй антисмысловой праймер rIgγ–AS2
5'–TCACCGAGCTGCTGAGGGTGTAGAGCCC–3'; На фигуре 7 (SEQ ID NO:52)
Набор ПЦР–праймеров для амплификации гена легкой цепи:
Смысловой праймер Nhe–polyC–S2
5'–GCTAGCGCTACCGGACTCAGATCCCCCCCCCCCCCDN–3'; На фигуре 8 (SEQ ID NO:53)
Первый антисмысловой праймер rIgL–AS1
5'–TTCCACATCACTCGGGTAGAAATCAG–3'; фигура 9 (SEQ ID NO:54)
Второй антисмысловой праймер rIgγ–AS2
5'–TAACACCAGGGTAGAAATCTGTCACCAT–3'; фигура 10 (SEQ ID NO:55)
Анализ последовательности проводили на нуклеотидных последовательностях фрагментов, амплифицированных с помощью ПЦР. Используемые праймеры описаны ниже.
Смысловой праймер rIgγ–seq для секвенирования легкой цепи
5'–CTGGCTCAGGGAAATAGCC–3'; фигура 11 (SEQ ID NO:56)
Антисмысловой праймер rIgL–seq1 для секвенирования легкой цепи
5'–TCCCTGGAGCTCCTCAGT–3'; фигура 12 (SEQ ID NO:57)
Антисмысловой праймер rIgL–seq2 для секвенирования легкой цепи
5'–GCCTTGTCAGTCTTGAGC–3'; фигура 13 (SEQ ID NO:58).
Анализ последовательности осуществляли с использованием анализатора генной последовательности («Анализатора ДНК ABI PRISM 3700; Applied Biosystems, Inc.» или «Applied Biosystems 3730xl Analyzer; Applied Biosystems, Inc.»). В реакции секвенирования использовали систему циклов секвенирования с терминацией красителем посредством ДНК–полимеразы AmpliTaq (Life Technologies Corp.) и GeneAmp 9700 (Applied Biosystems, Inc.).
Нуклеотидная последовательность вариабельной области тяжелой цепи C3–147, определенная с помощью анализа последовательности, описана на фигуре 14 (SEQ ID NO:6), а ее аминокислотная последовательность описана на фигуре 15 (SEQ ID NO:7). Нуклеотидная последовательность вариабельной области легкой цепи C3–147 описана на фигуре 16 (SEQ ID NO:8), а ее аминокислотная последовательность описана на фигуре 17 (SEQ ID NO:9).
[0229] (Пример 4) Получение крысиного анти–CD3 scFv (C3E–7000) и его гуманизованной формы (C3E–7034)
4)–1 Получение scFv крысиного анти–CD3 антитела (C3–147)
4)–1–1 Конструирование вектора, экспрессирующего scFv крысиного анти–CD3 антитела (pC3E–7000)
Были синтезированы олигонуклеотид смысловой цепи (фигура 18 (SEQ ID NO:10)) ДНК–фрагмента, имеющего дополнительные последовательности из 15 оснований, расположенные выше и ниже последовательности ДНК, кодирующей линкер, встроенный между вариабельной областью тяжелой цепи (VH) и вариабельной области легкой цепи (VL) C3–147, и олигонуклеотид антисмысловой цепи (фигура 19 (SEQ ID NO:11)) (Sigma–Aldrich Corp., Custom Oligo Synthesis Service), которые доводили до 100 пмоль/мкл. Затем смешивали 20 мкл каждого из этих олигонуклеотидов и оставляли на 10 минут при 96°C, на 2 минуты при 70°C, на 2 минуты при 60°C, на 2 минуты при 40°C, и на 2 минуты при 30°C для отжига в целях получения ДНК–фрагмента линкера, встроенного между VH и VL. Затем, ДНК–фрагмент, амплифицированный с помощью ПЦР для присоединения сигнальной последовательности тяжелой цепи человеческого IgG, ДНК–фрагмент (показанный на фигуре 14 (SEQ ID NO:6)) VH крысиного анти–CD3 антитела C3–147, амплифицированного с помощью ПЦР, ДНК–фрагмент линкера, встроенного между VH и VL, и ДНК–фрагмент, амплифицированный с помощью ПЦР, где последовательность ДНК, кодирующую метку FLAG–His, присоединяли к области, содержащей последовательность ДНК VL C3–147 (показанные на фигуре 16 (SEQ ID NO:8)) так, чтобы метка FLAG–His была локализована у карбоксильного конца, лигировали с векторным остовом, происходящим от экспрессионного вектора pcDNA–3.3TOPO клеток животных (Thermo Fisher Scientific Inc.) с использованием набора для клонирования In–Fusion HD (Clontech Laboratories, Inc.), в результате чего получали экспрессионный вектор scFv pC3E–7000, содержащий нуклеотидную последовательность на фигуре 20 (SEQ ID NO:14) в ОРС.
[0230] 4)–1–2 Экспрессия и очистка крысиного анти–CD3 scFv (C3E–7000)
Клетки Expi293F (Thermo Fisher Scientific Inc.) субкультивировали и культивировали в соответствии с руководством. scFv–экспрессирующий вектор переносили в клетки Expi293F в логарифмической фазе роста. scFv транзиентно экспрессировали, фильтровали, а затем использовали для очистки. Очистку проводили в две стадии, включающих аффинную хромотографию на Ni с использованием His–ловушки Excel (GE Healthcare Bio–Sciences Corp.) и гель–фильтрацию с использованием активированного Superdex 200 (GE Healthcare Bio–Sciences Corp.). Пик, соответствующий молекулярной массе мономера scFv, выделяли и использовали в качестве очищенного образца белка. Для очистки использовали хромотографическую систему AKTA, и все стадии проводили при 4°C. HBSor (25 мМ гистидина/5% сорбита, pH 5,0) использовали в качестве буфера для очищенного белка. Очищенный образец белка наносили на ЭХ–колонку для анализа в целях определения его чистоты и концентрации. Затем, этот образец использовали в различных анализах. Аминокислотная последовательность C3E–7000 описана на фигуре 21 (SEQ ID NO:15).
[0231] 4)–2 Гуманизация крысиного анти–CD3 scFv (C3E–7000)
4)–2–1 Протокол гуманизации анти–CD3 антитела
Молекулярное моделирование вариабельных областей крысиного антитела осуществляли методом, известным специалистам как гомологичное моделирование (Methods in Enzymology, 203, 121–153, (1991)) с использованием коммерчески доступной программы для анализа трехмерной структуры белков Discovery Studio 3.5 (Dassault Systems S.A.).
[0232] Гуманизацию осуществляли методом, в основном, известным как присоединение CDR (Proc. Natl. Acad. Sci. USA 86, 10029–10033 (1989)). Акцепторное антитело выбирали из консенсусных последовательностей подгруппы человеческих антител, определенных по Кэбату и др. (Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service National Institutes of Health, Bethesda, MD. (1991)) или последовательностей зародышевой линии на основе идентичности аминокислот в каркасных областях, предсказанных оценок вероятности иммуногенности или физических свойств и тому подобное. Кроме того, возвратную мутацию выбирали в соответствии с критериями и тому подобное, описанными Queen et al. (PNAS (1989) 86, 10029–10033), посредством применения трехмерной структурной модели, сконструированной описанным выше методом.
[0233] 4)–2–2 Конструирование гуманизованной аминокислотной последовательности C3E–7000
На основе метода, описанного в Примере 4)–2–1, аминокислотную последовательность C3E–7034, служащую в качестве гуманизованной формы C3E–7000, конструировали с использованием консенсусных последовательностей подгруппы человеческих антител γ3 и λ6 в качестве акцепторов. Аминокислотная последовательность C3E–7034VH, сконструированная из аминокислотной последовательности C3–147VH, показанной на фигуре 15 (SEQ ID NO:7), путем замены аргинина в положении аминокислоты 16 на глицин, аланина в положении аминокислоты 17 на серин, лизина в положении аминокислоты 19 на аргинин, валина в положении аминокислоты 23 на аланин, серина в положении аминокислоты 88 на аланин, и треонина в положении аминокислоты 93 на валин, описана на фигуре 22 (SEQ ID NO:16).
[0234] Аминокислотная последовательность C3E–7034VL, сконструированная из аминокислотной последовательности C3–147VL, показанной на фигуре 17 (SEQ ID NO:9), путем замены глутамина в положении 1 на аспарагин, валина в положении аминокислоты 3 на метионин, аспарагина в положении аминокислоты 8 на гистидин, треонина в положении аминокислоты 12 на глутаминовую кислоту, аспарагина в положении аминокислоты 13 на серин, лейцина в положении аминокислоты 14 на пролин, треонина в положении аминокислоты 16 на лизин, глутаминовой кислоты в положении аминокислоты 19 на треонин, лейцина в положении аминокислоты 20 на изолейцин, аргинина в положении аминокислоты 43 на серин, лейцина в положении аминокислоты 75 на серин, аспарагина в положении аминокислоты 79 на серин, валина в положении аминокислоты 81 на лейцин и глутамина в положении аминокислоты 82 на лизин, описана на фигуре 23 (SEQ ID NO:17).
Последовательности CDR C3E–7000 и C3E–7034, определенные на основе IMGT CDR, описаны на фигуре 24 (SEQ ID NO:26) для CDR–H1, на фигуре 25 (SEQ ID NO:27) для CDR–H2, на фигуре 26 (SEQ ID NO:28) для CDR–H3, на фигуре 27 (SEQ ID NO:29) для CDR–L1, на фигуре 28 (SEQ ID NO:30) для CDR–L2 и на фигуре 29 (SEQ ID NO:31) для CDR–L3.
[0235] 4)–2–3 Модификация гуманизованного анти–CD3 scFv C3E–7034
Для получения вариантов, обладающих специфической активностью связывания и цитотоксической активностью и сохраняющих перекрестную реактивность с обезьяньим CD3ε, были сконструированы варианты способом, описанным в Примере 4)–2–1, путем замены аминокислот в каркасных областях VL C3E–7034 соответствующими аминокислотами VL scFv (в последовательности, содержащей четыре мутации A2S, S8P, V13A и F80L в IGLV1–40*01).
[0236] 4)–2–3–1 Конструирование аминокислотной последовательности C3E–7035
Была сконструирована аминокислотная последовательность C3E–7035, служащая в качестве варианта C3E–7034. Аминокислотная последовательность легкой цепи C3E–7035, сконструированная из вариабельной области легкой цепи C3E–7034 на фигуре 23 (SEQ ID NO:17) путем замены аспарагина в положении аминокислоты 1 на глутамин, замены фенилаланина в положении аминокислоты 2 на аланин, замены метионина в положении аминокислоты 3 на валин, замены гистидина в положении аминокислоты 8 на серин, замены глутаминовой кислоты в положении аминокислоты 12 на глицин, замены серина в положении аминокислоты 13 на валин, замены лизина в положении аминокислоты 16 на глутамин, замены треонина в положении аминокислоты 17 на аргинин, замены гистидина в положении аминокислоты 40 на лейцин, замены глутаминовой кислоты в положении аминокислоты 41 на пролин, замены серина в положении аминокислоты 43 на треонин, замены серина в положении аминокислоты 44 на аланин, замены треонина в положении аминокислоты 46 на лизин, замены треонина в положении аминокислоты 47 на лейцин, замены изолейцина в положении аминокислоты 48 на лейцин, замены аспарагиновой кислоты в положении аминокислоты 57 на серин, замены серина в положении аминокислоты 60 на пролин, замены изолейцина в положении аминокислоты 67 на лизин, делеции аспарагиновой кислоты в положении аминокислоты 68, делеции аргинина в положении аминокислоты 69, замены серина в положении аминокислоты 71 на глицин, замены лизина в положении аминокислоты 72 на треонин, замены треонина в положении аминокислоты 77 на аланин, замены серина в положении аминокислоты 79 на треонин, замены аспарагина в положении аминокислоты 80 на глицин, замены лейцина в положении аминокислоты 81 на фенилаланин, замены лизина в положении аминокислоты 82 на глутамин, замены треонина в положении аминокислоты 83 на аланин и замены фенилаланина в положении аминокислоты 90 на тирозин, описана на фигуре 30 (SEQ ID NO:20). Полноразмерная последовательность C3E–7035, содержащая метионин и аланин, встроенные непосредственно перед вариабельной областью, описана на фигуре 31 (SEQ ID NO:22) Списка последовательностей.
[0237] 4)–2–3–2 Конструирование аминокислотной последовательности C3E–7036
Была сконструирована аминокислотная последовательность C3E–7036, служащая в качестве варианта C3E–7034. Аминокислотная последовательность легкой цепи C3E–7036, сконструированная из вариабельной области легкой цепи C3E–7034, показанной на фигуре 23 (SEQ ID NO:17), путем замены гистидина в положении аминокислоты 8 на серин, замены глутаминовой кислоты в положении аминокислоты 12 на глицин, замены серина в положении аминокислоты 13 на валин, замены лизина в положении аминокислоты 16 на глутамин, замены треонина в положении аминокислоты 17 на аргинин, замены лизина в положении аминокислоты 23 на треонин, замены аргинина в положении аминокислоты 24 на глицин, замены гистидина в положении аминокислоты 40 на лейцин, замены глутаминовой кислоты в положении аминокислоты 41 на пролин, замены серина в положении аминокислоты 43 на треонин, замены серина в положении аминокислоты 44 на аланин, замены треонина в положении аминокислоты 46 на лизин, замены треонина в положении аминокислоты 47 на лейцин, замены изолейцина в положении аминокислоты 48 на лейцин, замены аспарагиновой кислоты в положении аминокислоты 57 на серин, замены серина в положении аминокислоты 60 на пролин, замены изолейцина в положении аминокислоты 67 на лизин, делеции аспарагиновой кислоты в положении аминокислоты 68, делеции аргинина в положении аминокислоты 69, замены серина в положении аминокислоты 71 на глицин, замены лизина в положении аминокислоты 72 на треонин, замены треонина в положении аминокислоты 77 на аланин, замены серина в положении аминокислоты 79 на треонин, замены аспарагина в положении аминокислоты 80 на глицин, замены лейцина в положении аминокислоты 81 на фенилаланин, замены лизина в положении аминокислоты 82 на глутамин, замены треонина в положении аминокислоты 83 на аланин и замены фенилаланина в положении аминокислоты 90 на тирозин, показана на фигуре 32 (SEQ ID NO:23). Полноразмерная аминокислотная последовательность C3E–7036 описана на фигуре 33 (SEQ ID NO:25).
[0238] 4)–2–3–3 Конструирование аминокислот в вариантах CDR
В целях удаления сайта дезаминирования, присутствующего в CDRH2 C3E–7034 (фигура 25, SEQ ID NO:27), были сконструированы C3E–7078, где аспарагин был заменен аргинином в положении аминокислоты 53 в вариабельной области тяжелой цепи C3E–7034, показанной на фигуре 22 (SEQ ID NO:16) и C3E–7079, где аспарагин был заменен серином. Кроме того, был сконструирован C3E–7085, где аспарагин был заменен аргинином в положении аминокислоты 53 в вариабельной области тяжелой цепи C3E–7036. Полноразмерная аминокислотная последовательность C3E–7078 представлена на фигуре 68 (SEQ ID NO:60). Полноразмерная аминокислотная последовательность C3E–7079 представлена на фигуре 70 (SEQ ID NO:62). Полноразмерная аминокислотная последовательность C3E–7085 представлена на фигуре 72 (SEQ ID NO:64).
В целях снижения аффинности C3E–7078 к человеческому CD3 были сконструированы C3E–7086, где аспарагиновая кислота была заменена глицином в положении аминокислоты 52 в вариабельной области легкой цепи C3E–7078; C3E–7087, где аспарагиновая кислота была заменена глутамином; C3E–7088, где аспарагиновая кислота была заменена аспарагином; C3E–7089, где аспарагиновая кислота была заменена серином; и C3E–7090, где аспарагиновая кислота была заменена аланином. Аналогичным образом, в целях снижения аффинности C3E–7079 к человеческому CD3 были сконструированы C3E–7091, где аспарагиновая кислота была заменена глицином в положении аминокислоты 52 в вариабельной области легкой цепи C3E–7079; C3E–7092, где аспарагиновая кислота была заменена глутамином; C3E–7093, где аспарагиновая кислота была заменена аспарагином; C3E–7094, где аспарагиновая кислота была заменена серином; и C3E–7095, где аспарагиновая кислота была заменена аланином. Полноразмерная аминокислотная последовательность C3E–7086 представлена на фигуре 74 (SEQ ID NO:66). Полноразмерная аминокислотная последовательность C3E–7087 представлена на фигуре
76 (SEQ ID NO:68). Полноразмерная аминокислотная последовательность C3E–7088 представлена на фигуре 78 (SEQ ID NO:70). Полноразмерная аминокислотная последовательность C3E–7089 представлена на фигуре 80 (SEQ ID NO:72). Полноразмерная аминокислотная последовательность C3E–7090 представлена на фигуре 82 (SEQ ID NO:74). Полноразмерная аминокислотная последовательность C3E–7091 представлена на фигуре 84 (SEQ ID NO:76). Полноразмерная аминокислотная последовательность C3E–7092 представлена на фигуре 86 (SEQ ID NO:78). Полноразмерная аминокислотная последовательность C3E–7093 представлена на фигуре 88 (SEQ ID NO:80). Полноразмерная аминокислотная последовательность C3E–7094 представлена на фигуре 90 (SEQ ID NO:82). Полноразмерная аминокислотная последовательность C3E–7095 представлена на фигуре 92 (SEQ ID NO:84).
[0239] 4)–3 Получение гуманизованного анти–CD3 scFv (C3E–7034, C3E–7035 и C3E–7036)
4)–3–1 Конструирование вектора pC3E–7034, экспрессирующего гуманизованный анти–CD3 scFv (C3E–7034)
ДНК–фрагмент, включающий последовательность ДНК scFv, содержащего легкую цепь C3E–7034 (показанную на фигуре 23 (SEQ ID NO:17)), присоединенную к карбоксильному концу тяжелой цепи C3E–7034 (показанной на фигуре 22 (SEQ ID NO:16)) посредством гибкого линкера из 15 аминокислот, синтезировали с использованием дополнительных последовательностей из 15 оснований, присоединеных выше и ниже (GeneArt Gene Synthesis Service/Thermo Fisher Scientific Inc.). Область, содержащую ДНК C3E–7034 и дополнительные последовательности, расположенные выше и ниже, амплифицировали с помощью ПЦР с использованием этого ДНК–фрагмента в качестве матрицы для получения фрагмента ДНК–вставки. Область вектора, за исключением области scFv, амплифицировали с помощью ПЦР с использованием экспрессионного вектора pC3E–7000, полученного в Примере 4)–1–1 в качестве матрицы для получения фрагмента вектора. Эти ДНК–фрагменты подвергали отжигу с использованием набора для клонирования In–Fusion HD (Clontech Laboratories, Inc.) с получением вектора рС3Е–7034, экспрессирующего гуманизованный анти–CD3 scFv и содержащего нуклеотидную последовательность, показанную на фигуре 34 (SEQ ID NO:18), в ОРС.
[0240] 4)–3–2 Конструирование экспрессионного вектора рС3Е–7035, содержащего гуманизованный анти–CD3 scFv (C3E–7035)
ДНК–фрагмент, включающий последовательность ДНК scFv, содержащего легкую цепь C3E–7035 (показанную на фигуре 30 (SEQ ID NO:20)), присоединенную к карбоксильному концу тяжелой цепи C3E–7034 (показанной на фигуре 22 (SEQ ID NO:16)) посредством гибкого линкера из 17 аминокислот, синтезировали с использованием дополнительных последовательностей из 15 оснований, присоединеных выше и ниже (GeneArt Gene Synthesis Service/Thermo Fisher Scientific Inc.). Экспрессионный вектор C3E–7035, содержащий нуклеотидную последовательность на фигуре 35 (SEQ ID NО: 21) в ОPC, конструировали способом, описанным в Примере 4)–3–1. Полученный экспрессионный вектор был обозначен «pC3E–7035».
[0241] 4)–3–3 Конструирование экспрессионного вектора рС3Е–7036, содержащего гуманизованный анти–CD3 scFv (C3E–7036)
ДНК–фрагмент, включающий последовательность ДНК scFv, содержащего легкую цепь C3E–7036 (показанную на фигуре 32 (SEQ ID NO:23)), присоединенную к карбоксильному концу тяжелой цепи C3E–7034 (показанной на фигуре 22 (SEQ ID NO:16)) посредством гибкого линкера из 15 аминокислот, синтезировали с использованием дополнительных последовательностей из 15 оснований, присоединеных выше и ниже (GeneArt Gene Synthesis Service/Thermo Fisher Scientific Inc.). Экспрессионный вектор C3E–7036, содержащий нуклеотидную последовательность на фигуре 36 (SEQ ID NО: 24) в ОPC, конструировали способом, описанным в Примере 4)–3–1. Полученный экспрессионный вектор был обозначен «pC3E–7036».
[0242] 4)–3–4 Конструирование векторов, экспрессирующих CDR–модифицированный scFv гуманизованного анти–CD3 антитела
Сайт–направленный мутагенез на основе ПЦР проводили с использованием pC3E–7034, содержащего нуклеотидную последовательность C3E–7034, представленную на фигуре 34 (SEQ ID NO:18) в OРС в качестве матрицы и с использованием праймеров, имеющих нуклеотидные последовательности, представленные на фигурах 93 и 94 (SEQ ID NO:85 и 86) с получением экспрессионного вектора C3E–7078, содержащего нуклеотидную последовательность C3E–7078, где аспарагин был заменен аргинином в положении аминокислоты 53 в вариабельной области тяжелой цепи C3E–7034 в OРС. Полученный экспрессионный вектор был обозначен «pC3E–7078». Аналогичным образом, сайт–направленный мутагенез на основе ПЦР проводили с использованием pC3E–7034 в качестве матрицы и с использованием праймеров, представленных на фигурах 95 и 96 (SEQ ID NO:87 и 88) с получением экспрессионного вектора C3E–7079, содержащего нуклеотидную последовательность C3E–7079, где аспарагин был заменен серином в положении аминокислоты 53 в вариабельной области тяжелой цепи C3E–7034. Полученный экспрессионный вектор был обозначен «pC3E–7079». Аналогичным образом, сайт–направленный мутагенез на основе ПЦР проводили с использованием pC3E–7036 в качестве матрицы и с использованием праймеров, представленных на фигурах 93 и 94 (SEQ ID NO:85 и 86) с получением экспрессионного вектора C3E–7085, содержащего нуклеотидную последовательность C3E–7085, где аспарагин был заменен аргинином в положении аминокислоты 53 в вариабельной области тяжелой цепи C3E–7036. Полученный экспрессионный вектор был обозначен «pC3E–7085».
[0243] Экспрессионные векторы, содержащие нуклеотидную последовательность C3E–7086, где аспарагиновая кислота была заменена глицином в положении аминокислоты 52 в вариабельной области легкой цепи C3E–7078; C3E–7087, где аспарагиновая кислота была заменена глутамином; C3E–7088, где аспарагиновая кислота была заменена аспарагином; C3E–7089, где аспарагиновая кислота была заменена серином; C3E–7090, где аспарагиновая кислота была заменена аланином в ОРС; и экспрессионные векторы, содержащие нуклеотидную последовательность C3E–7091, где аспарагиновая кислота была заменена глицином в положении аминокислоты 52 в вариабельной области легкой цепи C3E–7079; C3E–7092, где аспарагиновая кислота была заменена глутамином; C3E–7093, где аспарагиновая кислота была заменена аспарагином; C3E–7094, где аспарагиновая кислота была заменена серином; C3E–7095, где аспарагиновая кислота была заменена аланином в OРС, были также получены способом, описанным выше. Список названий полученных векторов, матриц и праймеров систематизирован в Таблице 1, а список праймеров систематизирован на фигуре 105.
[0244] Таблица 1
[0245] 4)–3–5 Экспрессия и очистка гуманизованного анти–CD3 scFv
C3E–7034, C3E–7035 и C3E–7036 экспрессировали и очищали способом, описанным в Примере 4)–1–2.
[0246] 4)–3–6 Экспрессия и очистка CDR–модифицированного гуманизованного анти–CD3 scFv
Варианты CDR C3E–7078, C3E–7079, C3E–7085, C3E–7086, C3E–7087, C3E–7088, C3E–7089, C3E–7090, C3E–7091, C3E–7092, C3E–7093, C3E–7094 и C3E–7095 экспрессировали и очищали способом, описанным в Примере 4)–1–2.
[0247] (Пример 5) Анализ кристаллической структуры гуманизованного анти–CD3 scFv (C3E–7034)
5)–1 Получение комплекса «гуманизованный анти–CD3 scFv (C3E–7034)–человеческий одноцепочечный антиген CD3εγ»
CD3εγ, полученный в Примере 2)–2–1, и C3E–7034, полученный в Примере 4)–3–1, смешивали в молярном отношении 1:2. Буферный раствор заменяли 10 мМ Трис–HCl (pH 7,5) и 50 мМ NaCl с использованием устройства Amicon Ultra 15 с отсечкой молекулярной массы 10K (Merck Millipore), и полученный раствор концентрировали до 3,5 мг/мл. Этот концентрат очищали путем гель–фильтрации с использованием Superdex 200 10/300GL (GE Healthcare Bio–Sciences Corp.). Фракцию комплекса концентрировали приблизительно до 4,0 мг/мл с использованием устройства Amicon Ultra 15 с отсечкой молекулярной массы 10K (Millipore).
[0248] 5)–2 Кристаллизация
Полученный комплекс CD3εγ и C3E–7034 кристаллизовали диффузным методом в паровой фазе. К 0,5 мкл раствора белка добавляли равные количества осаждающего раствора (0,1 M моногидрата MES (pH 6,5), 1,6 M сульфата аммония и 10% об/об 1,4–диоксана), и полученный раствор помещали в герметично закрывающийся контейнер, содержащий 0,05 мл осаждающего раствора так, чтобы эти растворы не контактировали друг с другом. Контейнер оставляли при 25°C. Через один месяц были получены палочкообразные кристаллы размером 0,1 мм×0,05 мм×0,05 мм.
[0249] 5)–3 Рентгеноструктурный анализ кристаллической структуры и идентификация эпитопа
Полученный кристалл погружали в перфторполиэфир PFO–X175/08 (Hampton Research Corp.), а затем замораживали в жидком азоте. Данные рентгеновской дифракции собирали с использованием системы лучей BL41XU (SPring–8, Hyogo, Japan). Интенсивность дифракции оцифровывали из полученного изображения дифракции с использованием компьютерной программы Imosflm (CCP4: Совместный компьютерный проект No. 4) для определения структурных факторов кристалла. Кристаллы имели шестиугольную систему со пространственной группой P62 и ячейками a=193,54 ангстрем, b=193,54 ангстрем, и c=43,88 ангстрем.
[0250] Метод молекулярной замены осуществляли с использованием полученных структурных факторов и трехмерных структурных координат моделей гомологии для определения фаз. Для вычисления использовали компьютерную программу Phaser (CCP4: Совместный компьютерный проект No. 4). Кристаллы содержали один комплекс в асимметрической ячейке.
Определение структуры осуществляли с использованием компьютерной программы Refmac5 (CCP4: Совместный компьютерный проект No. 4), и коррекцию модели осуществляли с использованием программы Coot. Эту операцию осуществляли повторно с получением конечного R–фактора 22,1% и свободного R–фактора 27,0% с разрешением 3,3 ангстрем. Конечная модель содержала аминокислотные остатки 1–108 вариабельной области легкой цепи C3E–7034 (Фигура 23, SEQ ID NO:17), аминокислотные остатки 1–118 области тяжелой цепи C3E–7034 (Фигура 22, SEQ ID NO:16), аминокислотные остатки 33–67 и 71–118 области CD3ε (Фигура 1, SEQ ID NO:1), и аминокислотные остатки 23–103 области CD3γ (Фигура 37, SEQ ID NO:3). Аминокислотные остатки 68–70 области CD3ε (Фигура 1, SEQ ID NO:1), и амино–концевую область (аминокислотный остаток 1), линкерную часть (аминокислотные остатки 120–134), и карбокси–концевую область (аминокислотные остатки 243–269) C3E–7034 (Фигура 38, SEQ ID NO:19) не включали в модель из–за ее неясной электрической плотности. На фигуре 39 показана ленточная модель всего комплекса и поверхности.
На фигуре 40 показаны взаимодействия между CD3ε и легкой и тяжелой цепями C3E–7034. На панели A показана диаграмма, где аминокислоты CD3ε, находящиеся на расстоянии 4 ангстрема от вариабельной области легкой цепи C3E–7034, показаны жирными отрезками в модели, а другие аминокислоты показаны тонкими отрезками в этой модели. На этой диаграмме, Ser55, Glu56, Arg101, Gly102, Ser103, Lys104 и Pro105 обозначены с указанием названия остатка и его номера. Внутренние квадраты соответствуют аминокислотным остаткам CD3ε, находящимся на расстоянии 4 ангстрема от вариабельной области легкой цепи C3E–7034, и каждое положение аминокислоты соответствует положению в SEQ ID NO:1 Списка последовательностей. На панели B представлена диаграмма, где аминокислотные остатки CD3ε, находящиеся на расстоянии 4 ангстрема от вариабельной области тяжелой цепи C3E–7034, показаны жирными отрезками в модели, а другие аминокислоты показаны тонкими отрезками в этой модели. На этой диаграмме, Ser55, Glu56, Leu58, Trp59, Asn65, Ile66, Ser77, Asp78 и Arg101 обозначены с указанием названия остатка и его номера. Внутренние квадраты соответствуют аминокислотам CD3ε, и каждое положение аминокислоты соответствует положению в SEQ ID NO:1 Списка последовательностей. Нижеследующие аминокислотные остатки находятся на расстоянии 4 ангстрема в C3E–7034 и были интерпретированы как эпитопы на CD3ε для C3E–7034: Ser55, Glu56, Leu58, Trp59, Asn65, Ile66, Ser77, Asp78, Arg101, Gly102, Ser103, Lys104 и Pro105.
[0251] Среди этих эпитопов на CD3ε для C3E–7034, Arg101, Gly102, Ser103, Lys104 и Pro105 являются общими эпитопными остатками на CD3ε для OKT3 и UCHT1 (Kjer–Nielsen et al., PNAS 101 (2004), p. 7675–80; and Arnett et al., PNAS 101 (2004), p. 16268–73). Было также обнаружено, что C3E–7034 не взаимодействует с аминокислотами в положениях 22–48 в SEQ ID NO:1, которая соответствует эпитопам для анти–CD3 антител, таких как I2C и H2C, описанных в WO2008/119565A2. На фигуре 41 представлены взаимодействующие остатки на последовательности CD3ε. Сигнальная последовательность CD3ε показана курсивом, а аминокислоты, находящиеся на расстоянии 4 ангстрема в C3E–7034, подчеркнуты.
[0252] (Пример 6) Получение гуманизованного scFv OKT3.
6)–1 Конструирование вектора pC3E–3000, экспрессирующего scFv OKT3
scFv мышиного моноклонального анти–CD3 антитела OKT3 (Sgro, Toxicology 105 (1995), 23–29, Orthoclone, Janssen–Cilag) получали методом, описанным в Примере 4)–1–1, и встраивали в экспрессионный вектор для клеток животных, происходящий от pcDNA3.3. Полученный экспрессионный вектор был обозначен «pC3E–3000».
[0253] 6)–2 Конструирование гуманизованной аминокислотной последовательности OKT3 scFv (C3E–3000)
На основе метода, описанного в Примере 4)–2–1, аминокислотную последовательность C3E–3007, служащую в качестве гуманизованной формы OKT3, конструировали с использованием подгруппы человеческих консенсусных последовательностей гамма 1 и каппа 4 в качестве акцепторов. Аминокислоты каппа 1 вводили в некоторые сайты в зависимости от их влияния на оценку гомогенности и на физические свойства. Аминокислотная последовательность легкой цепи C3E–3007, сконструированной из вариабельной области тяжелой цепи OKT3, показанной на фигуре 42 (SEQ ID NO:36), путем замены глутамина в положении аминокислоты 5 на валин, лейцина в положении аминокислоты 11 на серин, аланина в положении аминокислоты 12 на лизин, аргинина в положении аминокислоты 13 на лизин, метионина в положении аминокислоты 20 на валин, лизина в положении аминокислоты 38 на аргинин, аргинина в положении аминокислоты 40 на аланин, изолейцина в положении аминокислоты 48 на метионин, лизина в положении аминокислоты 67 на аргинин, аланина в положении аминокислоты 68 на валин, лейцина в положении аминокислоты 70 на изолейцин, треонина в положении аминокислоты 72 на аланин, серина в положении аминокислоты 76 на треонин, глутамина в положении аминокислоты 82 на глутаминовую кислоту, треонина в положении аминокислоты 87 на аргинин, серина в положении аминокислоты 91 на треонин, треонина в положении аминокислоты 114 на лейцин и лейцина в положении аминокислоты 115 на валин, описана на фигуре 43 (SEQ ID NO:38).
[0254] Аминокислотная последовательность легкой цепи C3E–3007, сконструированной из вариабельной области легкой цепи OKT3, представленной на фигуре 44 (SEQ ID NO:37), путем замены валина в положении аминокислоты 3 на глутамин, лейцина в положении аминокислоты 4 на метионин, аланина в положении аминокислоты 9 на серин, изолейцина в положении аминокислоты 10 на серин, метионина в положении аминокислоты 11 на лейцин, серина в положении аминокислоты 12 на аланин, аланина в положении аминокислоты 13 на валин, пролина в положении аминокислоты 15 на лейцин, лизина в положении аминокислоты 18 на аргинин, валина в положении аминокислоты 19 на аланин, метионина в положении аминокислоты 21 на изолейцин, серина в положении аминокислоты 39 на пролин, треонина в положении аминокислоты 41 на лизин, серина в положении аминокислоты 42 на аланин, аланина в положении аминокислоты 59 на аспарагиновую кислоту, гистидина в положении аминокислоты 60 на аргинин, аргинина в положении аминокислоты 62 на серин, серина в положении аминокислоты 69 на аспарагиновую кислоту, тирозина в положении аминокислоты 70 на фенилаланин, серина в положении аминокислоты 71 на треонин, глицина в положении аминокислоты 76 на серин, метионина в положении аминокислоты 77 на лейцин, глутаминовой кислоты в положении аминокислоты 78 на глутамин, аланина в положении аминокислоты 82 на валин, серина в положении аминокислоты 99 на глутамин и лейцина в положении аминокислоты 103 на валин, описана на фигуре 45 (SEQ ID NO:39).
[0255] 6)–3 Конструирование вектора рС3Е–3007, экспрессирующего гуманизованный scFv ОКТ3 (C3E–3007)
Был синтезирован ДНК–фрагмент, включающий последовательность ДНК scFv, содержащей область легкой цепи C3E–3007 (показанную на фигуре 45 (SEQ ID NO:39)), связанную с карбоксильным концом тяжелой цепи (показанной на фигуре 43 (SEQ ID NО:38)) посредством гибкого линкера из 15 аминокислот и дополнительных последовательностей из 15 оснований, расположенных выше и ниже (GeneArt Gene Synthesis Service/Thermo Fisher Scientific Inc.). Экспрессионный вектор C3E–3007, содержащий нуклеотидную последовательность на фигуре 46 (SEQ ID NO:34) в OPC, конструировали способом, описанным в Примере 4)–3–1. Полученный экспрессионный вектор был обозначен «pC3E–3007».
[0256] 6)–4 Экспрессия и очистка гуманизованного scFv ОКТ3 (C3E–3007)
C3E–3007 экспрессировали и очищали как описано в Примере 4)–1–2. Аминокислотная последовательность C3E–3007 описана на фигуре 47 (SEQ ID NO:35).
[0257] (Пример 7) In vitro активность гуманизованного анти–CD3 scFv
7)–1 Исследование активности связывания гуманизованного анти–CD3 scFv (C3E–3007, C3E–7034, C3E–7035 и C3E–7036) с человеческим CD3
7)–1–1 Исследование активности связывания гуманизованного анти–CD3 scFv (C3E–3007, C3E–7034, C3E–7035 и C3E–7036) с человеческим CD3 с помощью проточной цитометрии
Коммерчески доступные человеческие МКПК (Cellular Technology Ltd. (CTL)) доводили до соответствующей концентрации путем добавления PBS, содержащего 5% FBS. К клеткам добавляли набор реагентов для окрашивания живых/погибших клеток в фиксированном интервале ИК–спектра ближнего диапазона (Thermo Fisher Scientific Inc.) и анти–CD19 антитело (Beаckman Coulter Inc.), и эти клетки оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем доводили до концентрации 1×106 клеток/мл с использованием PBS, содержащего 5% FBS и добавленного в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном, и центрифугировали для удаления супернатанта. Каждый гуманизованный анти–CD3 scFv (C3E–3007, C3E–7034, C3E–7035 и C3E–7036), разведенный PBS, содержащим 5% FBS, добавлели в концентрации 100 мкл/лунку, и планшет оставляли на 60 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS. Затем добавляли Penta–His Alexa Fluor 488 (Qiagen N.V.), разведенный PBS, содержащим 5% FBS, в концентрации 30 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащим 5% FBS и детектировали на проточном цитометре (FACSCanto(TM) II; Becton, Dickinson and Company). Данные анализировали с использованием Flowjo (Tree Star Inc.). Затем вычисляли среднюю интенсивность флуоресценции (MFI) Alexa Fluor 488 во фракции, не содержащей погибших клеток, и определяли число CD19–позитивных клеток. Величину MFI для образца, в который не добавляли scFv, вычитали из величины MFI для образца, в который добавляли scFv, для определения относительной величины MFI (rMFI). Как показано на фигуре 48, было обнаружено, что гуманизованные анти–CD3 scFv связывались с человеческим CD3.
[0258] 7)–1–2 Исследование активности связывания гуманизованных анти–CD3 scFv (C3E–3007, C3E–7034, C3E–7035 и C3E–7036) с человеческим CD3 с помощью ППР
Аффинность каждого гуманизованного анти–CD3 scFv (C3E–3007, C3E–7034, C3E–7035 и C3E–7036) к CD3 определяли методом поверхностного плазмонного резонанаса с использованием BIAcore T–200 (GE Healthcare Bio–Sciences Corp.). scFv в пяти различных концентрациях инъецировали в CD3, иммобилизованный на сенсерном чипе. Rmax оценивали исходя из полученного ответа и концентрация антитела, которая составляла 1/2 от исходной концентрации, была определена как константа диссоциации scFv для CD3. В результате, константы диссоциации этих scFv для CD3 составляли 400, 4,5, 22 и 25 нM, соответственно.
[0259] 7)–2 Исследование активности связывания гуманизованного scFv анти–CD3 антитела (C3E–3007, C3E–7034 и C3E–7036) с CD3 яванских макак
7)–2–1 Получение МКПК яванских макак
МКПК брали из крови яванских макак стандартным методом с использованием SepMate (StemCell Technologies Inc.) и раствора для разделения лимфоцитов (Nacalai Tesque Inc.).
[0260] 7)–2–2 Исследование активности связывания гуманизованных анти–CD3 scFv (C3E–3007, C3E–7034, C3E–7035 и C3E–7036) с CD3 яванских макак с помощью проточной цитометрии
МКПК яванских макак, полученные в Примере 7)–2–1, доводили до соответствующей концентрации путем добавления PBS, содержащего 5% FBS, окрашивали и анализировали как описано в Примере 7)–1–1. Как показано на фигуре 49, было обнаружено, что гуманизованные анти–CD3 scFv (C3E–7034, C3E–7035 и C3E–7036) связывались с CD3 яванских макак.
[0261] 7)–3 Активация гуманизованных анти–CD3 scFv (C3E–3007 и C3E–7034) Т–клетками
Человеческие мононуклеарные клетки периферической крови (МКПК) выделяли из свежих лейкоцитарных пленок произвольно выбранных доноров методом центрифугирования в градиенте плотности с использованием лимфолита–H (Cedarlane). Каждый гуманизованный анти–CD3 scFv (C3E–3007 и C3E–7034), разведенный до 100 нM путем добавления LR10 (в RPMI1640, содержащей 10% FBS с очень низкой концентрацией IgG (Thermo Fisher Scientific Inc.)), и анти–His антитело в той же самой концентрации (Qiagen N.V.), смешивали в одних и тех же количествах. Человеческие или обезьяньи МКПК доводили до 2×105 клеток с использованием LR10, и смешивали со смесью гуманизованного анти–CD3 scFv и анти–His антитела в тех же самых количествах в 96–луночном микропланшете с U–образным дном, и культивировали при 37°C в течение 24 часов в атмосфере 5% CO2. После завершения реакции, реакционный раствор центрифугировали и добавляли буфер для сортинга (HBSS(–) (Thermo Fisher Scientific Inc.), 0,1% BSA (Sigma–Aldrich Corp.) и 0,1% азида натрия (Sigma–Aldrich Corp.)). После центрифугирования, к клеткам добавляли набор реагентов для окрашивания живых/погибших клеток в фиксированном интервале ИК–спектра ближнего диапазона (Thermo Fisher Scientific Inc.), а затем клетки оставляли на 20 минут при 4°C. Клетки промывали буфером для сортинга. Затем к клеткам добавляли ФЭ–меченное анти–CD3 антитело (Becton, Dickinson and Company) и ФИТЦ–меченное анти–CD8 антитело (Becton, Dickinson and Company), разведенное буфером для сортинга, после чего клетки оставляли на 20 минут при 4°C. Клетки промывали буфером для сортинга, а затем ресуспендировали в PBS (Wako Pure Chemicals Industries, Ltd.), содержащем 1% параформальдегид, и детектировали на проточном цитометре (FACSCanto II; Becton, Dickinson and Company). Данные анализировали с использованием Flowjo (Tree Star Inc.). Отношение фракции, в высокой степени экспрессирующей CD8 и в высокой степени экспрессирующей ФЭ, к фракции, не содержащей погибших клеток, вычисляли как процент по отношению к популяции (% родительских клеток). Как показано на фигуре 50 было обнаружено, что гуманизованные анти–CD3 scFv активировали клетки, которые в высокой степени экспрессируют человеческий и обезьяний CD8.
[0262] 7)–4 Сравнение активности связывания CDR–модифицированного анти–CD3 scFv с человеческим CD3 и СD3 яванских макак с помощью проточной цитометрии
Человеческие МКПК, полученные в Примере 7)–1–1, и МКПК яванских макак, полученные в Примере 7)–2–1–1, доводили до соответствующей концентрации путем добавления PBS, содержащего 5% FBS, окрашивали и анализировали как описано в Примере 7)–1–1. Как показано на фигуре 106, было подтверждено, что CDR–модифицированные анти–CD3 scFv обладают активностью связывания с человеческим и обезьяньим CD3.
[0263] (Пример 8) Получение гуманизованного анти–TROP2 scFv
8)–1 Конструирование вектора pHT1–11scFv, экспрессирующего scFv HT1–11
Был синтезирован ДНК–фрагмент, содержащий последовательность ДНК, кодирующую аминокислоты scFv HT1–11, показанные на фигуре 51 (SEQ ID NO:41) (GeneArt Gene Synthesis Service/Thermo Fisher Scientific Inc.). Синтезированный ДНК–фрагмент встраивали в вектор, происходящий от pcDNA–3.3TOPO (Thermo Fisher Scientific Inc.) с использованием набора для ПЦР–клонирования In–Fusion HD PCR (Clontech Laboratories, Inc.) для конструирования вектора pHT1–11scFv, экспрессирующего гуманизованный анти–TROP2 scFv и содержащего нуклеотидную последовательность на фигуре 52 (SEQ ID NO:40) в OРС.
[0284] 8)–2 Экспрессия и очистка scFv HT1–11 (HT1–11 scFv)
scFv HT1–11 экспрессировали и очищали способом, описанным в Примере 4)–1–2.
[0265] (Пример 9) Оценка активности связывания гуманизованного анти–TROP2 scFv (HT1–11 scFv) с человеческим TROP2 с помощью проточной цитометрии
Клеточную линию плоскоклеточного рака ротоглотки FaDu (ATCC) или клеточную линию рака поджелудочной железы HPAF–II (ATCC) доводили до соответствующей концентрации путем добавления PBS, содержащего 5% FBS. К клеткам добавляли набор реагентов для окрашивания живых/погибших клеток в фиксированном интервале ИК–спектра ближнего диапазона, и эти клетки оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем доводили до концентрации 1×106 клеток/мл с использованием PBS, содержащего 5% FBS и добавленного в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном, и центрифугировали для удаления супернатанта. Гуманизованный анти–TROP2 scFv (scFv HT1–11), разведенный PBS, содержащим 5% FBS, добавляли в концентрации 100 мкл/лунку, и планшет оставляли на 60 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS. Затем добавляли Penta–His Alexa Fluor 488, разведенный PBS, содержащим 5% FBS, в концентрации 30 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащим 5% FBS и детектировали на проточном цитометре (FACSCanto(TM) II). Данные анализировали с использованием Flowjo. Затем вычисляли среднюю интенсивность флуоресценции (MFI) Alexa Fluor 488 во фракции, не содержащей погибших клеток. Величину MFI для образца, в который не добавляли антитело, вычитали из величины MFI для образца, в который добавляли scFv, для определения относительной величины MFI (rMFI). Как показано на фигуре 53, было обнаружено, что гуманизованный анти–TROP2 scFv связывался с человеческим TROP2.
[0266] (Пример 10) Получение биспецифических анти–TROP2–CD3 молекул
10)–1 Конструирование вектора, экспрессирующего биспецифическую анти–TROP2–CD3 молекулу
10)–1–1 Конструирование вектора, экспрессирующего биспецифическую молекулу HT1–11 scFv/C3E–7034 (T2C–0001)
ДНК–фрагмент–вставку получали с помощью ПЦР с использованием scFv рНТ1–11, полученного в Примере 8)–1, в качестве матрицы и с использованием праймеров, сконструированных для присоединения нуклеотидных последовательностей scFv НТ1–11 и части сигнальной последовательности тяжелой цепи человеческого антитела к 5'–стороне и для присоединения нуклеотидной последовательности линкера для связывания scFv с 3’–стороной. Кроме того, ДНК–фрагмент вектора, содержащий полноразмерную область вектора, включающую ДНК анти–CD3 scFv, получали с помощью ПЦР с использованием экспрессионного вектора pC3E–7034, полученного в Примере 4)–3–1 в качестве матрицы и с использованием праймеров, кодирующих сигнальную последовательность и амино–концевую последовательность анти–CD3 scFv. Эти ДНК–фрагменты лигировали с использованием набора для клонирования In–Fusion HD (Clontech Laboratories, Inc.) для получения вектора pT2C–0001, экспрессирующего биспецифическую анти–TROP2–анти–CD3 молекулу и содержащего нуклеотидную последовательность на фигуре 54 (SEQ ID NO:42) в OРС.
[0267] 10)–1–2 Конструирование вектора, экспрессирующего биспецифическую молекулу scFv НТ1–11/C3E–3007 (T2C–0003)
Вектор, экспрессирующий биспецифическую анти–TROP2–СD3 молекулу и содержащий нуклеотидную последовательность на фигуре 55 (SEQ ID NO:44) в OРС, конструировали способом, описанным в Примере 10)–1–1, за исключением того, что pC3E–3007 использовали в качестве матрицы для получения фрагмента вектора. Полученный экспрессионный вектор обозначали «pT2C–0003».
[0268] 10)–1–3 Конструирование вектора, экспрессирующего биспецифическую молекулу scFv HT1–11/C3E–7035 (T2C–0005)
Вектор, экспрессирующий биспецифическую анти–TROP2–СD3 молекулу и содержащий нуклеотидную последовательность на фигуре 56 (SEQ ID NO:46) в OРС, конструировали способом, описанным в Примере 10)–1–1, за исключением того, что pC3E–7035 использовали в качестве матрицы для получения фрагмента вектора. Полученный экспрессионный вектор обозначали «pT2C–0005».
[0269] 10)–1–4 Конструирование вектора, экспрессирующего биспецифическую молекулу scFv HT1–11/C3E–7036 (T2C–0006)
Вектор, экспрессирующий биспецифическую анти–TROP2–СD3 молекулу и содержащий нуклеотидную последовательность на фигуре 57 (SEQ ID NO:48) в OРС, конструировали способом, описанным в Примере 10)–1–1, за исключением того, что pC3E–7036 использовали в качестве матрицы для получения фрагмента вектора. Полученный экспрессионный вектор обозначали «pT2C–0006».
[0270] 10)–2 Экспрессия и очистка биспецифическмх анти–TROP2–CD3 молекул
T2C–0001, T2C–0003, T2C–0005 и T2C–0006 экспрессировали и очищали способом, описанным в Примере 4)–1–2. Аминокислотная последовательность T2C–0001 описана на фигуре 58 (SEQ ID NO:43). Аминокислотная последовательность T2C–0003 описана на фигуре 59 (SEQ ID NO:45). Аминокислотная последовательность T2C–0005 описана на фигуре 60 (SEQ ID NO:47). Аминокислотная последовательность T2C–0006 описана на фигуре 61 (SEQ ID NO:49).
[0271] (Пример 11) Оценка in vitro активности биспецифических анти–TROP2–CD3 молекул
11)–1 Оценка активности связывания с помощью ППР
11)–1–1 Активность связывания биспецифической анти–TROP2–CD3 молекулы с TROP2
Биспецифическую молекулу анализировали на ее связывание с TROP2 с использованием BIAcore 3000 (GE Healthcare Bio–Sciences Corp.) методом захвата, который содержит захват антигена антителом против человеческого IgG и анализ биспецифической молекулы в качестве аналита. Используемым антигеном является рекомбинантная гибридная форма «человеческий TROP–2/Fc человеческого IgG» (R&D Systems, Inc.). Приблизительно 2000 RU антитела против человеческого IgG(Fc) (набор для захвата человеческого антитела, GE Healthcare Bio–Sciences Corp.) ковалентно связывали с сенсорным чипом CM5 (GE Healthcare Bio–Sciences Corp.) методом присоединения амина. Аналогичным образом, это антитело иммобилизовали на эталонных ячейках. Используемым рабочим буфером является HBS–EP+ (10 мМ HEPES (pH 7,4), 0,15 M NaCl и 0,05% поверхностно–активного вещества P20). Биспецифическую молекулу получали при двухкратном разведении в отношении 200 нM : 1 нM. 1 мкг/мл раствора антигена добавляли на чип, иммобилизованный антителом против человеческого IgG(Fc), в течение приблизительно 30 секунд. Затем биспецифичесую молекулу в каждой концентрации добавляли со скоростью потока 30 мкл/мин в течение 300 секунд. После этого проводили мониторинг фазы диссоциации в течение 600 секунд. Затем добавляли 3 М раствора хлорида магния в качестве регенерирующего раствора в течение 30 секунд. Данные анализировали с использованием модели связывания 1:1 в соответствии с аналитической компьютерной программой (BIAevaluation software, version 4.1.1) для вычисления константы скорости ассоциации (ka), константы скорости диссоциации (kd) и константы диссоциации (KD; KD=kd/ka).
[0272] 11)–1–2 Активность связывания биспецифической анти–TROP2–CD3 молекулы с человеческим одноцепочечным антигеном CD3εγ
Биспецифичесую молекулу анализировали на связывание с антигеном CD3εγ с использованием BIAcore 3000 (GE Healthcare Bio–Sciences Corp.) методом, который содержит иммобилизацию антигена и анализ антитела в качестве аналита. Используемым антигеном является человеческий одноцепочечный антиген CD3εγ, полученный в Примере 2)–2–1. Приблизительно 100 RU антигена ковалентно связывали с сенсорным чипом CM5 (GE Healthcare Bio–Sciences Corp.) методом присоединения амина. Обработку путем иммобилизации проводили без добавления антигенного белка в качестве эталонной ячейки. Используемым рабочим буфером является HBS–P (10 мМ HEPES (pH 7,4), 0,15 M NaCl и 0,005% поверхностно–активного вещества P20). Биспецифическую молекулу получали при 2–кратном разведении в отношении 1 мкМ (наивысшая концентрация) : 4 нM или при 2–кратном разведении в отношении 200 нМ:1нМ. Биспецифичесую молекулу в каждой концентрации добавляли на чип, иммобилизованный антигеном, со скоростью потока 10 мкл/мин в течение 25 минут и проводили мониторинг количества биспецифической молекулы, связанной с этим чипом. После этого добавляли 10 мМ раствора глицина–соляной кислоты (pH 1,5) в качестве регенерирующего раствора в течение 30 секунд. Данные анализировали с использованием аналитической компьютерной программы (BIAevaluation software, version 4.1.1) для вычисления константы диссоциации (KD) исходя из количества биспецифической молекулы, связанной в каждой концентрации. Результаты представлены в Таблицах 2 и 3.
[0273] Таблица 2
[0274] Таблица 3
[0275] 11)–2 Оценка активности связывания с помощью проточной цитометрии
11)–2–1 Активность связывания биспецифической анти–TROP2–CD3 молекулы с TROP2
Были использованы те же самые раковые клеточные линии как и в Примере 9, и эти клеточные линии окрашивали и анализировали способом, описанным в Примере 9. Как показано на фигуре 62, было обнаружено, что биспецифические анти–TROP2–CD3 молекулы связывались с TROP2.
[0276] 11)–2–2 Активность связывания биспецифической анти–TROP2–CD3 молекулы с человеческим одноцепочечным антигеном CD3εγ
Клетки окрашивали и анализировали способом, описанным в Примере 7)–1–1. Как показано на фигуре 63 было обнаружено, что биспецифические анти–TROP2–CD3 молекулы связывались с человеческим одноцепочечным антигеном CD3εγ.
[0277] 11)–2–3 Активность связывания биспецифической анти–TROP2–CD3 молекулы с антигеном CD3 яванских макак
МКПК яванских макак, полученные в Примере 7)–2–1, доводили до соответствующей концентрации путем добавления PBS, содержащего 5% FBS, а затем окрашивали и анализироали как описано в Примере 7)–1–1. Как показано на фигуре 64 было обнаружено, что биспецифические анти–TROP2–CD3 молекулы (T2C–0001, T2C–0005 и T2C–0006) связывались с антигеном CD3 яванских макак.
[0278] 11)–3 Оценка цитотоксической активности биспецифических анти–TROP2–CD3 молекул
11)–3–1 Анализ на экспрессию TROP2 в клетках–мишенях
Клеточную линию плоскоклеточного рака ротоглотки FaDu (ATCC), клеточную линию рака поджелудочной железы HPAF–II (ATCC) или клетки клеточной линии рака легких человека Calu–6 доводили до соответствующей концентрации путем добавления PBS, содержащего 5% FBS. К клеткам добавляли набор реагентов для фиксируемого окрашивания живых/погибших клеток (Thermo Fisher Scientific Inc.), и эти клетки оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем доводили до концентрации 1×106 клеток/мл с использованием PBS, содержащего 5% FBS, инокулировали в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном, и центрифугировали для удаления супернатанта. Анти–TROP2 Alexa Fluor 488 антитело (Affymetrix eBioscience) и антитело контрольного изотипа (Affymetrix eBioscience), разведенные PBS, содержащим 5% FBS, добавляли в концентрации 25 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащим 5% FBS, и детектировали на проточном цитометре (Cytomics FC500, Beckman Coulter Inc.). Данные анализировали с использованием Flowjo (Tree Star Inc.). Затем вычисляли геометрически среднюю интенсивность флуоресценции (геометрическую MFI) Alexa Fluor 488 во фракции, не содержащей погибших клеток. Как показано на фигурах 65A, 65B и 65C, экспрессия TROP2 наблюдалась в клетках FaDu и HPAF–II, но не наблюдалась в клетках Calu–6.
[0279] 11)–3–2 Получение клеток–мишеней
Клетки FaDu, HPAF–II или Calu–6 доводили до концентрации 2×106 клеток/мл путем добавления среды RPMI1640 (Thermo Fisher Scientific Inc.), содержащей 10% FBS. К каждой клеточной линии добавляли 100 мкл радионуклида хрома–51 (PerkinElmer, Inc.) на мл клеточной суспензии, и клетки культивировали при 37°C в течение 2 часов в атмосфере 5% CO2. Клетки два раза промывали средой RPMI1640, содержащей 10% FBS, а затем ресуспендировали до 2×105 клеток/мл в среде RPMI1640, содержащей 10% FBS, и использовали в качестве клеток–мишеней.
[0280] 11)–3–3 Получение эффекторных клеток
Коммерчески доступные замороженные МКПК (Cellular Technology Limited) оттаивали при 37°C, переносили в раствор среды RPMI1640, содержащей 10% FBS, в которую был добавлен промывочный реагент против агрегации (Cellular Technology Limited), два раза промывали, а затем доводили до 1×106 клеток/мл путем добавления среды RPMI1640, содержащей 10% FBS, и использовали в качестве эффекторных клеток.
[0281] 11)–3–4 Анализ на цитотоксичность
Клетки FaDu, клетки HPAF–II или клетки Calu–6, полученные как описано в Примере 11)–3–2, добавляли в концентрации 50 мкл/лунку в 96–луночный микропланшет с U–образным дном. Каждую биспецифическую анти–TROP2–CD3 молекулу, доведенную до различных концентраций, добавляли в концентрации 50 мкл/лунку. Эффекторные клетки, полученные в Примере 11)–3–1–3, добавляли в концентрации 100 мкл/лунку. После центрифугирования при комнатной температуре и при 1000 об/мин в течение 1 минуты, клетки культивировали при 37°C в течение 20–24 часов в атмосфере 5% CO2. 50 мкл–аликвоту супернатанта переносили в LumaPlate (PerkinElmer, Inc.) и сушили при 50°C приблизительно в течение 2 часов, а затем проводили измерение на планшет–ридере (TopCount; PerkinElmer, Inc.). Процент клеток, подвергнутых лизису, вычисляли по следующей формуле:
Процент клеток подвергнутых лизису (%) = (A–B)/(C–B)×100
A: Число лунок с образцами
B: Среднее фоновое число (лунки, в которые не добавляли антитело) (n=3). Вместо антитела добавляли 50 мкл среды для анализа. Другие процедуры осуществляли также как и в случае лунок с образцами.
C: Средний уровень максимального высвобождения (лунки, содержащие клетки–мишени, подвергнутые лизису в поверхностно–активном веществе ) (n=3). Вместо антитела добавляли 50 мкл среды для анализа. Затем добавляли 100 мкл поверхностно–активного вещества и 50 мкл–аликвоту переносили в LumaPlate, как и в случае лунок с образцами, и анализировали.
Как показано на фигурах 66A, 66B и 66C, эти биспецифические анти–TROP2–CD3 молекулы обладали цитотоксической активностью, направленной против клеток FaDu и клеток HPAF–II. С другой стороны, эти биспецифические молекулы не обладали цитотоксической активностью в клетках Calu–6.
[0282] (Пример 12) Получение биспецифических анти–Axl–CD3 молекул
12)–1 Конструирование вектора, экспрессирующего биспецифическую анти–Axl–CD3 молекулу
12)–1–1 Конструирование вектора, экспрессирующего биспецифическую молекулу scFv 11D5–T3/C3E–7034 (AXC–0001)
Аминокислотную последовательность одноцепочечного анти–Axl scFv антитела 11D5–T3 конструировали путем связывания последовательности с добавленным глицином у N–конца h#11D5–T3H (описанной на фигуре 12 в описании публикации Европейской патентной заявки No. 2270053) и h#11D5–T3L (описанной на фигуре 6 в описании публикации Европейской патентной заявки No. 2270053) посредством полипептидного линкера, состоящего из последовательности, имеющей 3 повтора (GGGGS). Была синтезирована нуклеотидная последовательность, кодирующая эту аминокислотную последовательность (GENEART, Thermo Fisher Scientific). ДНК–фрагмент–вставку получали с помощью ПЦР с использованием этой нуклеотидной последовательности в качестве матрицы и с использованием праймеров, сконструированных для присоединения нуклеотидной последовательности части сигнальной последовательности тяжелой цепи человеческого антитела к 5’–концу и для присоединения нуклеотидной последовательности линкера для связывания scFv с 3’–концом. Кроме того, ДНК–фрагмент вектора получали путем ПЦР–амплификации полноразмерной области вектора, включающей ДНК анти–CD3 scFv с использованием экспрессионного вектора pC3E–7034, полученного в Примере 4)–3–1, в качестве матрицы и с использованием праймеров, состоящих из нуклеотидной последовательности, кодирующей сигнальную последовательность тяжелой цепи человеческого антитела и scFv CD3. ДНК–фрагменты лигировали с использованием набора для клонирования In–Fusion HD (Clontech Laboratories, Inc.), в результате чего был получен вектор pAXC–0001, экспрессирующий биспецифическую анти–AXL–анти–CD3 молекулу и содержащий нуклеотидную последовательность на фигуре 97 (SEQ ID NO:89) в OРС.
[0283] 12)–1–2 Конструирование вектора, экспрессирующего биспецифическую молекулу scFv 11D5–T3/C3E–7036 (AXC–0002)
Вектор, экспрессирующий биспецифическую анти–Axl–CD3 молекулу и содержащий нуклеотидную последовательность на фигуре 99 (SEQ ID NO:91) в OРС, конструировали способом, описанным в Примере 10)–1–1, за исключением того, что pC3E–7036 использовали в качестве матрицы для получения фрагмента вектора. Полученный экспрессионный вектор был обозначен «pAXC–0002.»
[0284] 12)–2 Экспрессия и очистка биспецифических анти–AxL–CD3 молекул
AXC–0001 и AXC–0002 экспрессировали и очищали способом, описанным в Примере 4)–1–2. Аминокислотная последовательность AXC–0001 описана на фигуре 98 (SEQ ID NO:90). Аминокислотная последовательность AXC–0002 описана на фигуре 100 (SEQ ID NO:92).
[0285] (Пример 13) Оценка in vitro активности биспецифических анти–Axl–CD3 молекул
13)–1 Анализ на экспрессию Axl в клетках–мишенях
Клеточную линию рака легких человека A549 (ATCC), клеточную линию рака поджелудочной железы человека PANC–1 (ATCC) или MIA PaCa–2 (ATCC), клеточную линию человеческой миеломы U266B1(ATCC), или клеточную линию лимфому клеток коры головного мозга Jeko–1 (ATCC) доводили до соответствующей концентрации путем добавления PBS, содержащего 5% FBS. К клеткам добавляли набор реагентов для фиксированного окрашивания живых/погибших клеток (Thermo Fisher Scientific Inc.), и эти клетки оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем доводили до концентрации 2×106 клеток/мл с использованием PBS, содержащего 5% FBS, инокулировали в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном, и центрифугировали для удаления супернатанта. Анти–Axl антитело (RD Systems, Inc.) и антитело контрольного изотипа (RD Systems, Inc.), разведенные PBS, содержащим 5% FBS, добавляли в концентрации 25 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS. Затем добавляли антитело против мышиного IgG Alexa Fluor 488 (Thermo Fisher Scientific Inc.), разведенное PBS, содержащим 5% FBS, в концентрации 25 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки два раз промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащим 5% FBS и детектировали на проточном цитометре (Cytomics FC500, Beckman Coulter Inc.). Данные анализировали с использованием Flowjo (Tree Star Inc.). Затем вычисляли геометрически среднюю интенсивность флуоресценции (геометрическую MFI) Alexa Fluor 488 во фракции, не содержащей погибших клеток. Как показано на фигурах 107A, 107B, 107C, 107D и 107E, экспрессия Axl наблюдалась в A549, PANC–1 и MIA PaCa–2, но не наблюдалась в U266B1 и Jeko–1.
[0286] 13)–2 Получение клеток–мишеней
Каждую A549, PANC–1, MIA PaCa–2, U266B1 и Jeko–1 доводили до концентрации 2×106 клеток/мл путем добавления среды RPMI1640 (Thermo Fisher Scientific Inc.), содержащей 10% FBS. К каждой клеточной линии добавляли 100 мкл радионуклида хрома–51 (PerkinElmer, Inc.) на мл клеточной суспензии, и клетки культивировали при 37°C в течение 2 часов в атмосфере 5% CO2. Клетки два раза промывали средой RPMI1640, содержащей 10% FBS, а затем ресуспендировали до 2×105 клеток/мл в среде RPMI1640, содержащей 10% FBS, и использовали в качестве клеток–мишеней.
13)–3 Получение эффекторных клеток
Коммерчески доступные замороженные МКПК (Cellular Technology Limited) оттаивали при 37°C, переносили в раствор среды RPMI1640, содержащей 10% FBS, в которую был добавлен промывочный реагент против агрегации (Cellular Technology Limited), два раза промывали, а затем доводили до 1×106 клеток/мл путем добавления среды RPMI1640, содержащей 10% FBS, и использовали в качестве эффекторных клеток.
[0287] 3)–4 Анализ на цитотоксичность
Клетки A549, PANC–1, MIA PaCa–2, U266B1 или Jeko–1, полученные как описано в Примере 13)–2, добавляли в концентрации 50 мкл/лунку в 96–луночный микропланшет с U–образным дном. Каждую биспецифическую анти–Axl CD3 молекулу, доведенную до различных концентраций, добавляли в концентрации 50 мкл/лунку. Эффекторные клетки, полученные в Примере 13)–3, добавляли в концентрации 100 мкл/лунку. После центрифугирования при комнатной температуре и при 1000 об/мин в течение 1 минуты, клетки культивировали при 37°C в течение 20–24 часов в атмосфере 5% CO2. 50 мкл–аликвоту супернатанта переносили в LumaPlate (PerkinElmer, Inc.) и сушили при 50°C приблизительно в течение 2 часов, а затем проводили измерение на планшет–ридере (TopCount; PerkinElmer, Inc.). Процент клеток, подвергнутых лизису, вычисляли по следующей формуле:
Процент клеток подвергнутых лизису (%) = (A–B)/(C–B)×100
A: Число лунок с образцами
B: Среднее фоновое число (лунки, в которые не добавляли антитело) (n=3). Вместо антитела добавляли 50 мкл среды для анализа. Другие процедуры осуществляли также, как и в случае лунок с образцами.
C: Средний уровень максивального высвобождения (лунки, содержащие клетки–мишени, подвергнутые лизису в поверхностно–активном веществе) (n=3). Вместо антитела добавляли 50 мкл среды для анализа. Затем добавляли 100 мкл поверхностно–активного вещества и 50 мкл–аликвоту переносили в LumaPlate, как и в случае лунок с образцами, и анализировали.
[0288] Как показано на фигурах 108A, 108B, 108C, 108D и 108E, эти биспецифические анти–Axl CD3 молекулы обладали цитотоксической активностью, направленной против A549, PANC–1 и MIA PaCa–2. Однако, эти биспецифические молекулы не обладали цитотоксической активностью против U266B1 или Jeko–1.
[0289] (Пример 14) Получение вектора, экспрессирующего биспецифическую анти–HLA–A2/MAGEC1–CD3 молекулу
14)–1 Конструирование вектора, экспрессирующего биспецифическую анти–HLA–A2/MAGEC1–CD3 молекулу
14)–1–1 Конструирование вектора, экспрессирующего биспецифическую молекулу MAG–032 scFv/C3E–7034 (MGC–0001)
scFv MAG–032, специфически связывающийся с HLA–A2/MAGEC1, получали из фаговой библиотеки человеческих антител. ДНК–фрагмент–вставку, содержащую нуклеотидную последовательность, кодирующую аминокислотную последовательность scFv MAG–032, получали с помощью ПЦР с использованием нуклеотидной последовательности, кодирующей аминокислотную последовательность scFv MAG–032, в качестве матрицы и с использованием праймеров, сконструированных для присоединения нуклеотидной последовательности, кодирующей сигнальную последовательность тяжелой цепи человеческого антитела, к 5’–концу, и для присоединения нуклеотидной последовательности, кодирующей линкер, для присоединения scFv и части C3E–7034 к 3’–концу. Кроме того, ДНК–фрагмент вектора получали путем ПЦР–амплификации полноразмерной области вектора, включающей ДНК анти–CD3 scFv с использованием экспрессионного вектора pC3E–7034, полученного в Примере 4)–3–1, в качестве матрицы и с использованием праймеров, состоящих из нуклеотидной последовательности, кодирующей сигнальную последовательность тяжелой цепи человеческого антитела и амино–концевую последовательность scFv CD3. Эти ДНК–фрагменты лигировали с использованием набора для клонирования In–Fusion HD (Clontech Laboratories, Inc.), в результате чего был получен вектор pMGC–0001, экспрессирующий биспецифическую анти–HLA–A2/MAGEC1–анти–CD3 и содержащий нуклеотидную последовательность на фигуре 101 (SEQ ID NO:93) в ОРС.
[0290] 14)–1–2 Конструирование вектора, экспрессирующего биспецифическую MAG–032 scFv/C3E–7036 молекулу (MGC–0002)
Вектор, экспрессирующий биспецифическую анти–HLA–A2/MAGEC1 –CD3 молекулу и содержащий нуклеотидную последовательность на фигуре 103 (SEQ ID NO:95) в OPC, конструировали способом, описанным в Примере 14)–1–1, за исключением того, что pC3E–7036 использовали в качестве матрицы для получения фрагмента вектора. Полученный экспрессионный вектор обозначали «pMGC–0002».
[0291] 14)–2 Экспрессия и очистка биспецифических анти–HLA–A2/MAGEC1–CD3 молекул
MGC–0001 и MGC–0002 экспрессировали и очищали способом, описанным в Примере 4)–1–2. Аминокислотная последовательность MGC–0001 представлена на фигуре 102 (SEQ ID NO:94). Аминокислотная последовательность MGC–0002 представлена на фигуре 104 (SEQ ID NO:96).
(Пример 15) Оценка in vitro активности биспецифических анти–HLA–A2/MAGEC1–CD3 молекул
15)–1 Анализ на экспрессию HLA–A2/MAGEC1 в клетках–мишенях
Клетки клеточной линии человеческих слитых лимфобластов T2 (ATCC) доводили до соответствующей концентрации с использованием среды AIM–V (Thermo Fisher Scientific Inc.), содержащей 20% FBS. К клеткам добавляли пептид MAGEC1, представленный на фигуре 106 (SEQ ID NO:97) (Sigma Genosys) или ДМСО, а затем клетки инкубировали при 37°C в течение 4 часов. Клетки два раза промывали средой AIM–V, содержащей 20% FBS, а затем доводили до соответствующей концентрации с использованием PBS, содержащего 5% FBS. К клеткам добавляли набор реагентов для фиксированного окрашивания живых/погибших клеток (Thermo Fisher Scientific Inc.), и эти клетки оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем доводили до концентрации 2×106 клеток/мл с использованием PBS, содержащего 5% FBS, а затем инокулировали в концентрации 100 мкл/лунку в 96–луночный микропланшет с U–образным дном, и центрифугировали для удаления супернатанта. Анти–HLA–A2/MAGEC1 антитело (MAG032 scFv), разведенное PBS, содержащим 5% FBS, добавляли в концентрации 25 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки два раз промывали PBS, содержащим 5% FBS. Затем Penta–His Alexa Fluor 488 (Qiagen N.V.), разведенный PBS, содержащим 5% FBS, добавляли в концентрации 25 мкл/лунку, и планшет оставляли на 30 минут при 4°C. Клетки два раза промывали PBS, содержащим 5% FBS, а затем ресуспендировали в PBS, содержащим 5% FBS, и детектировали на проточном цитометре (Cytomics FC500, Beckman Coulter Inc.). Данные анализировали с использованием Flowjo (Tree Star Inc.). Затем вычисляли геометрически среднюю интенсивность флуоресценции (геометрическую MFI) Alexa Fluor 488 во фракции, не содержащей погибших клеток. Как показано на фигурах 109A и 109B, экспрессия HLA–A2/MAGEC1 наблюдалась в клетках T2, к которым был добавлен пептид MAGEC1, но не наблюдалась в клетках T2, к которым был добавлен ДМСО.
[0292] 15)–2 Получение клеток–мишеней
Клетки T2 доводили до соответствующей концентрации с использованием среды AIM–V (Thermo Fisher Scientific Inc.), содержащей 20% FBS. К клеткам добавляли пептид MAGEC1 или ДМСО, а затем клетки инкубировали при 37°C в течение 4 часов. Клетки доводили до концентрации 2×106 клеток/мл с использованием среды RPMI1640 (Thermo Fisher Scientific Inc.), содержащей 10% FBS. К этой клеточной линии добавляли 100 мкл радионуклида хрома–51 (PerkinElmer, Inc.) на мл клеточной суспензии, и клетки культивировали при 37°C в течение 2 часов в атмосфере 5% CO2. Клетки два раза промывали средой RPMI1640, содержащей 10% FBS, а затем ресуспендировали до 2×105 клеток/мл в среде RPMI1640, содержащей 10% FBS, и использовали в качестве клеток–мишеней.
15)–3 Получение эффекторных клеток
Коммерчески доступные замороженные МКПК (Cellular Technology Limited) оттаивали при 37°C, переносили в раствор среды RPMI1640, содержащей 10% FBS, в которую был добавлен промывочный реагент против агрегации (Cellular Technology Limited), два раза промывали, а затем доводили до 1×106 клеток/мл путем добавления среды RPMI1640, содержащей 10% FBS, и использовали в качестве эффекторных клеток.
[0293] 15)–4 Анализ на цитотоксичность
Клетки Т2, полученные как описано в Примере 15)–2, добавляли в концентрации 50 мкл/лунку в 96–луночный микропланшет с U–образным дном. Каждую биспецифическую анти–HLA–A2/MAGEC1–CD3 молекулу, доведенную до различных концентраций, добавляли в концентрации 50 мкл/лунку. Эффекторные клетки, полученные в Примере 15)–3, добавляли в концентрации 100 мкл/лунку. После центрифугирования при комнатной температуре и при 1000 об/мин в течение 1 минуты, клетки культивировали при 37°C в течение 20–24 часов в атмосфере 5% CO2. 50 мкл–аликвоту супернатанта переносили в LumaPlate (PerkinElmer, Inc.) и сушили при 50°C приблизительно в течение 2 часов, а затем проводили измерение на планшет–ридере (TopCount; PerkinElmer, Inc.). Процент клеток, подвергнутых лизису, вычисляли по следующей формуле:
Процент клеток подвергнутых лизису (%) = (A–B)/(C–B)×100
A: Число лунок с образцами
B: Среднее фоновое число (лунки, в которые не добавляли антитело) (n=3). Вместо антитела добавляли 50 мкл среды для анализа. Другие процедуры осуществляли также как и в случае лунок с образцами.
C: Средний уровень максимального высвобождения (лунки, содержащие клетки–мишени, подвергнутые лизису в поверхностно–активном веществе) (n=3). Вместо антитела добавляли 50 мкл среды для анализа. Затем добавляли 100 мкл поверхностно–активного вещества и 50 мкл–аликвоту переносили в LumaPlate, как и в случае лунок с образцами, и анализировали.
[0294] Как показано на фигурах 110A и 110B, эти биспецифические анти–HLA–A2/MAGEC1–CD3 молекулы обладали цитотоксической активностью, направленной против клеток Т2, к которым добавляли пептид MAGEC1. С другой стороны, эти биспецифические молекулы не обладали цитотоксической активностью, направленной против клеток Т2, к которым добавляли ДМСО.
Промышленное применение
[0295] Гуманизованное анти–CD3 антитело согласно изобретению связывается с человеческим CD3, а также с CD3 яванских макак. Следовательно, гуманизованное анти–CD3 антитело согласно изобретению может быть преимущественно использовано в преклинических испытаниях для разработки лекарственных средств.
[0296] Список последовательностей в свободном формате
SEQ ID NO:1: Аминокислотная последовательность человеческого CD3ε
SEQ ID NO:2: Аминокислотная последовательность человеческого CD3δ
SEQ ID NO:3: Аминокислотная последовательность человеческого CD3γ
SEQ ID NO:4: Нуклеотидная последовательность, кодирующая одноцепочечный антиген человеческого CD3εγ
SEQ ID NO:5: Аминокислотная последовательность антигена His–scCD3
SEQ ID NO:6: Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи C3–147
SEQ ID NO:7: (C3–147_VH AA): Аминокислотная последовательность вариабельной области тяжелой цепи C3–147
SEQ ID NO:8: (C3–147_VL ДНК): Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи C3–147
SEQ ID NO:9: (C3–147_VL AA): Аминокислотная последовательность вариабельной области легкой цепи C3–147
SEQ ID NO:10: (смысловой линкер G4S):
SEQ ID NO:11: (антисмысловой линкер G4S):
SEQ ID NO:12: (C3E–7000_VH AA): Аминокислотная последовательность вариабельной области тяжелой цепи в C3E–7000
SEQ ID NO:13: (C3E–7000_VL AA): Аминокислотная последовательность вариабельной области легкой цепи в C3E–7000
SEQ ID NO:14: (OРС C3E–7000): Нуклеотидная последовательность, кодирующая C3E–7000
SEQ ID NO:15: (а.к. C3E–7000): Аминокислотная последовательность в C3E–7000
SEQ ID NO:16: (а.к. C3E–7034_VH): Аминокислотная последовательность вариабельной области тяжелой цепи C3E–7034
SEQ ID NO:17: Аминокислотная последовательность вариабельной области легкой цепи C3E–7034
SEQ ID NO:18: (OРС C3E–7034): Нуклеотидная последовательность, кодирующая C3E–7034
SEQ ID NO:19: (а.к. C3E_7034): Аминокислотная последовательность C3E–7034
SEQ ID NO:20: (а.к. C3E–7035_VL): Аминокислотная последовательность вариабельной области легкой цепи C3E–7035
SEQ ID NO:21: (OРС C3E–7035): Нуклеотидная последовательность, кодирующая C3E–7035
SEQ ID NO:22: (а.к. C3E_7035): Аминокислотная последовательность C3E–7035
SEQ ID NO:23: (а.к. 3E–7036_VL): Аминокислотная последовательность вариабельной области легкой цепи C3E–7036
SEQ ID NO:24: (OРС C3E–7036): Нуклеотидная последовательность, кодирующая C3E–7036
SEQ ID NO:25: (а.к. C3E_7036): Аминокислотная последовательность C3E–7036
SEQ ID NO:26: (7000_CDR–H1): Аминокислотная последовательность CDR–H1 в сериях C3E–7000
SEQ ID NO:27: (7000_CDR–H2): Аминокислотная последовательность CDR–H2 в сериях C3E–7000
SEQ ID NO:28: (7000_CDR–H3): Аминокислотная последовательность CDR–H3 в сериях C3E–7000
SEQ ID NO:29: (7000_CDR–L1): Аминокислотная последовательность CDR–L1 в сериях C3E–7000
SEQ ID NO:30: (7000_CDR–L2): Аминокислотная последовательность CDR–L2 в сериях C3E–7000
SEQ ID NO:31: (7000_CDR–L3): Аминокислотная последовательность CDR–L3 в сериях C3E–7000
SEQ ID NO:32: (OРС C3E–3000): Нуклеотидная последовательность, кодирующая scFv OKT3
SEQ ID NO:33: (а.к. C3E–3000): Аминокислотная последовательность scFv OKT3
SEQ ID NO:34: (OРС C3E–3007): Нуклеотидная последовательность, кодирующая scFv C3E–3007
SEQ ID NO:35: (а.к. C3E–3007): Аминокислотная последовательность scFv C3E–3007
SEQ ID NO:36: (а.к. C3E–3000_VH): Аминокислотная последовательность вариабельной области тяжелой цепи OKT3
SEQ ID NO:37: (а.к. C3E–3000_VL): Аминокислотная последовательность вариабельной области легкой цепи OKT3
SEQ ID NO:38: (а.к. C3E–3007_VH Аминокислотная последовательность вариабельной области тяжелой цепи C3E–3007
SEQ ID NO:39: (а.к. C3E–3007_VL): Аминокислотная последовательность вариабельной области легкой цепи C3E–3007
SEQ ID NO:40: (OРС HT1–11): Нуклеотидная последовательность, кодирующая scFv HT1–11
SEQ ID NO:41: (а.к. HT1–11): Аминокислотная последовательность scFv HT1–11
SEQ ID NO:42: (OРС T2C–0001): Нуклеотидная последовательность OРС, кодирующая T2C–0001
SEQ ID NO:43: (а.к. T2C–0001): Аминокислотная последовательность T2C–0001
SEQ ID NO:44: (OРС T2C–0003): Нуклеотидная последовательность OРС, кодирующая T2C–0003
SEQ ID NO:45: (а.к. T2C–0003): Аминокислотная последовательность T2C–0003
SEQ ID NO:46: (OРС T2C–0005): Нуклеотидная последовательность OРС, кодирующая T2C–0005
SEQ ID NO:47: (а.к. T2C–0005): Аминокислотная последовательность T2C–0005
SEQ ID NO:48: (OРС T2C–0006): Нуклеотидная последовательность OРС, кодирующая T2C–0006
SEQ ID NO:49: (а.к. T2C–0006): Аминокислотная последовательность T2C–0006
SEQ ID NO:50: Аминокислотная последовательность смыслового праймера для амплификации гена тяжелой цепи
SEQ ID NO:51: Нуклеотидная последовательность антисмыслового праймера первой партии для амплификации гена тяжелой цепи
SEQ ID NO:52: Нуклеотидная последовательность антисмыслового праймера второй партии для амплификации гена тяжелой цепи
SEQ ID NO:53: Нуклеотидная последовательность смыслового праймера для амплификации гена легкой цепи
SEQ ID NO:54: Нуклеотидная последовательность антисмыслового праймера первой партии для амплификации гена легкой цепи
SEQ ID NO:55: Нуклеотидная последовательность антисмыслового праймера второй партии для амплификации гена легкой цепи
SEQ ID NO:56: Нуклеотидная последовательность смыслового праймера для секвенирования тяжелой цепи
SEQ ID NO:57: Нуклеотидная последовательность антисмыслового праймера 1 для секвенирования легкой цепи
SEQ ID NO:58: Нуклеотидная последовательность антисмыслового праймера 2 для секвенирования легкой цепи
SEQ ID NO:59: Нуклеотидная последовательность OРС, кодирующая C3E–7078
SEQ ID NO:60: Аминокислотная последовательность C3E–7078
SEQ ID NO:61: Нуклеотидная последовательность OРС, кодирующая C3E–7079
SEQ ID NO:62: Аминокислотная последовательность C3E–7079
SEQ ID NO:63: Нуклеотидная последовательность OРС, кодирующая C3E–7085
SEQ ID NO:64: Аминокислотная последовательность C3E–7085
SEQ ID NO:65: Нуклеотидная последовательность OРС, кодирующая C3E–7086
SEQ ID NO:66: Аминокислотная последовательность C3E–7086
SEQ ID NO:67: Нуклеотидная последовательность OРС, кодирующая C3E–7087
SEQ ID NO:68: Аминокислотная последовательность C3E–7087
SEQ ID NO:69: Нуклеотидная последовательность OРС, кодирующая C3E–7088
SEQ ID NO:70: Аминокислотная последовательность C3E–7088
SEQ ID NO:71: Нуклеотидная последовательность OРС, кодирующая C3E–7089
SEQ ID NO:72: Аминокислотная последовательность C3E–7089
SEQ ID NO:73: Нуклеотидная последовательность OРС, кодирующая C3E–7090
SEQ ID NO:74: Аминокислотная последовательность C3E–7090
SEQ ID NO:75: Нуклеотидная последовательность OРС, кодирующая C3E–7091
SEQ ID NO:76: Аминокислотная последовательность C3E–7091
SEQ ID NO:77: Нуклеотидная последовательность OРС, кодирующая C3E–7092
SEQ ID NO:78: Аминокислотная последовательность C3E–7092
SEQ ID NO:79: Нуклеотидная последовательность OРС, кодирующая C3E–7093
SEQ ID NO:80: Аминокислотная последовательность C3E–7093
SEQ ID NO:81: Нуклеотидная последовательность OРС, кодирующая C3E–7094
SEQ ID NO:82: Аминокислотная последовательность C3E–7094
SEQ ID NO:83: Нуклеотидная последовательность OРС, кодирующая C3E–7095
SEQ ID NO:84: Аминокислотная последовательность C3E–7095
SEQ ID NO:85: Нуклеотидная последовательность смыслового праймера для C3E–7078
SEQ ID NO:86: Нуклеотидная последовательность антисмыслового праймера для C3E–7078
SEQ ID NO:87: Нуклеотидная последовательность смыслового праймера для C3E–7079
SEQ ID NO:88: Нуклеотидная последовательность антисмыслового праймера для C3E–7079
SEQ ID NO:89: (OРС AXC–0001): Нуклеотидная последовательность OРС, кодирующая AXC–0001
SEQ ID NO:90: (а.к. AXC–0001): Аминокислотная последовательность AXC–0001
SEQ ID NO:91: (OРС AXC–0002): Нуклеотидная последовательность OРС, кодирующая AXC–0002
SEQ ID NO:92: (а.к. AXC–0002): Аминокислотная последовательность AXC–0002
SEQ ID NO:93: (OРС MGC–0001): Нуклеотидная последовательность OPC, кодирующая MGC–0001
SEQ ID NO:94: (а.к. MGC–0001): Аминокислотная последовательность MGC–0001
SEQ ID NO:95: (OРС MGC–0002): Нуклеотидная последовательность OPC, кодирующая MGC–0002
SEQ ID NO:96: (а.к. MGC–0002): Аминокислотная последовательность MGC–0002
SEQ ID NO:97: (пептид MAGEC1): Аминокислотная последовательность пептида MAGEC1
SEQ ID NO:98: (CDRH2 вариантов): Аминокислотная последовательность CDRH2 варианта CDR
SEQ ID NO:99: (CDRL2 вариантов): Аминокислотная последовательность CDRL2 варианта CDR
SEQ ID NO:100: (VH вариантов C3E–7034): Аминокислотная последовательность вариабельной области тяжелой цепи варианта CDR C3E–7034
SEQ ID NO:101: (VL вариантов C3E–7034): Аминокислотная последовательность вариабельной области легкой цепи варианта CDR C3E–7034
SEQ ID NO:102: (VL вариантов C3E–7035): Аминокислотная последовательность вариабельной области легкой цепи варианта CDR C3E–7035
SEQ ID NO:103: (VL вариантов C3E–7036): Аминокислотная последовательность вариабельные области легкой цепи варианта CDR C3E–7036.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2021 |
|
RU2840407C1 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2694412C2 |
| АНТИТЕЛА ПРОТИВ CCR2 | 2009 |
|
RU2547595C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-SIRPα АНТИТЕЛА | 2019 |
|
RU2812199C2 |
| ОЧИСТКА АНТИТЕЛ С ПОМОЩЬЮ КАТИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2008 |
|
RU2498991C2 |
| АНТИТЕЛА И ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, СПЕЦИФИЧНЫЕ К CD19 | 2015 |
|
RU2741105C2 |
| АНТИИДИОТИПИЧЕСКИЕ АНТИТЕЛА И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2017 |
|
RU2773355C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2811477C2 |


















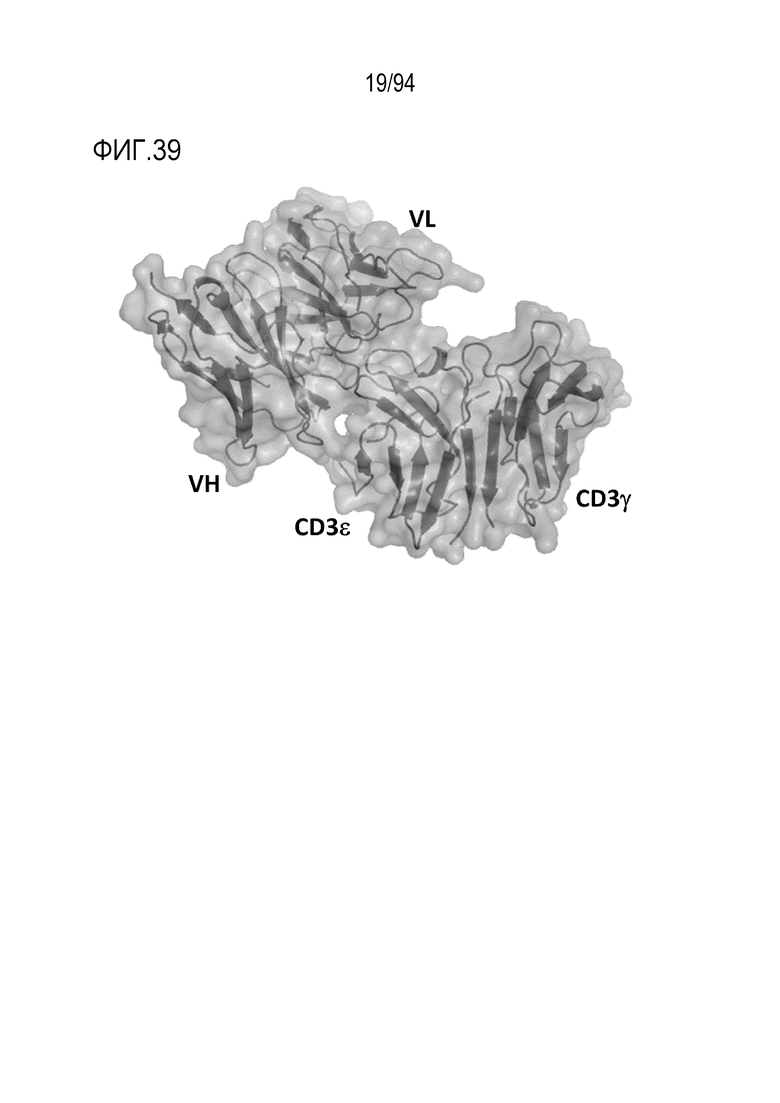
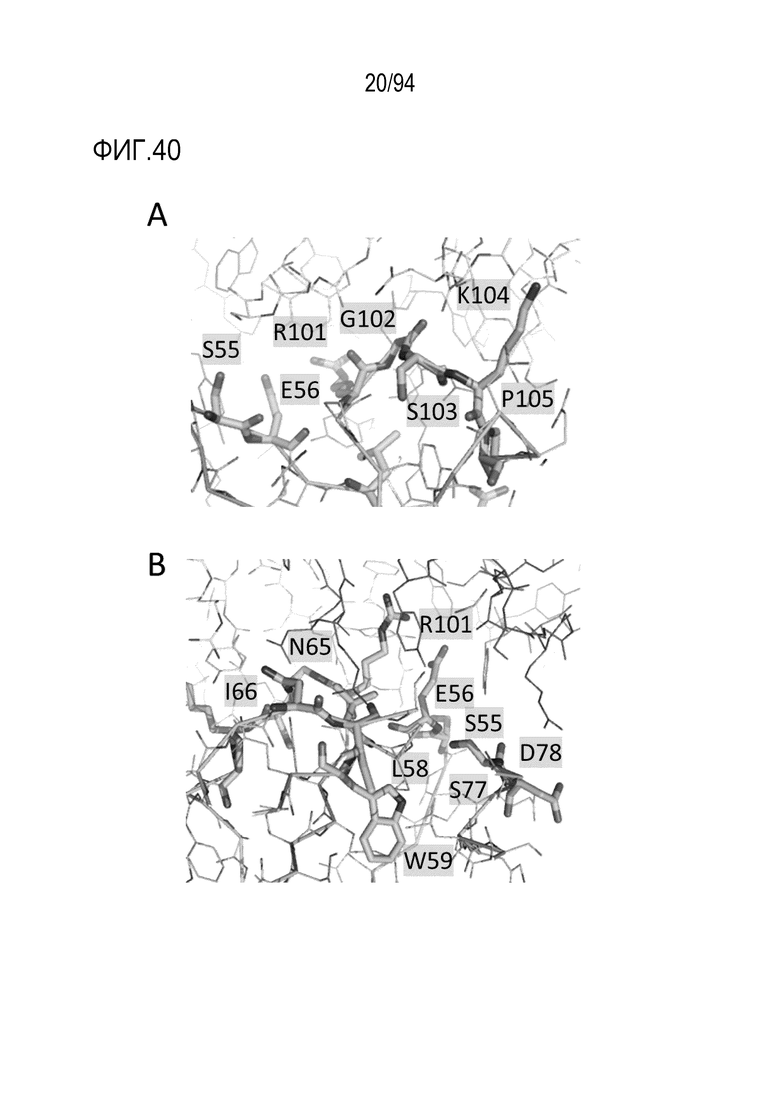




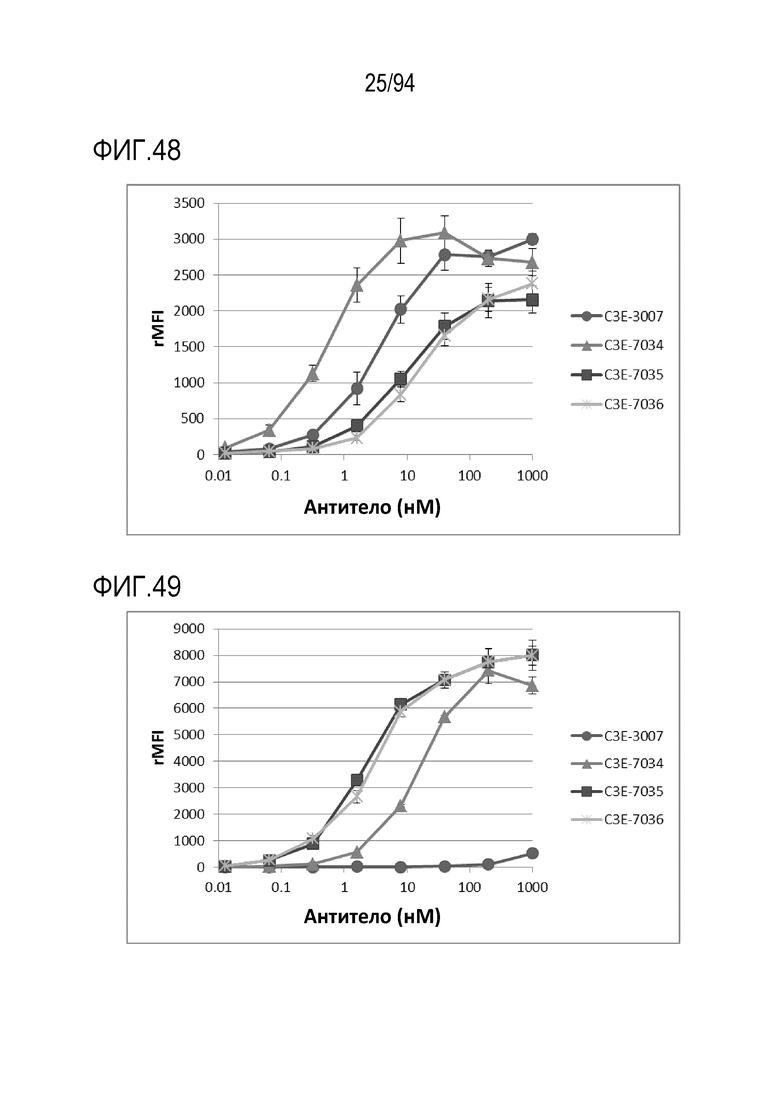
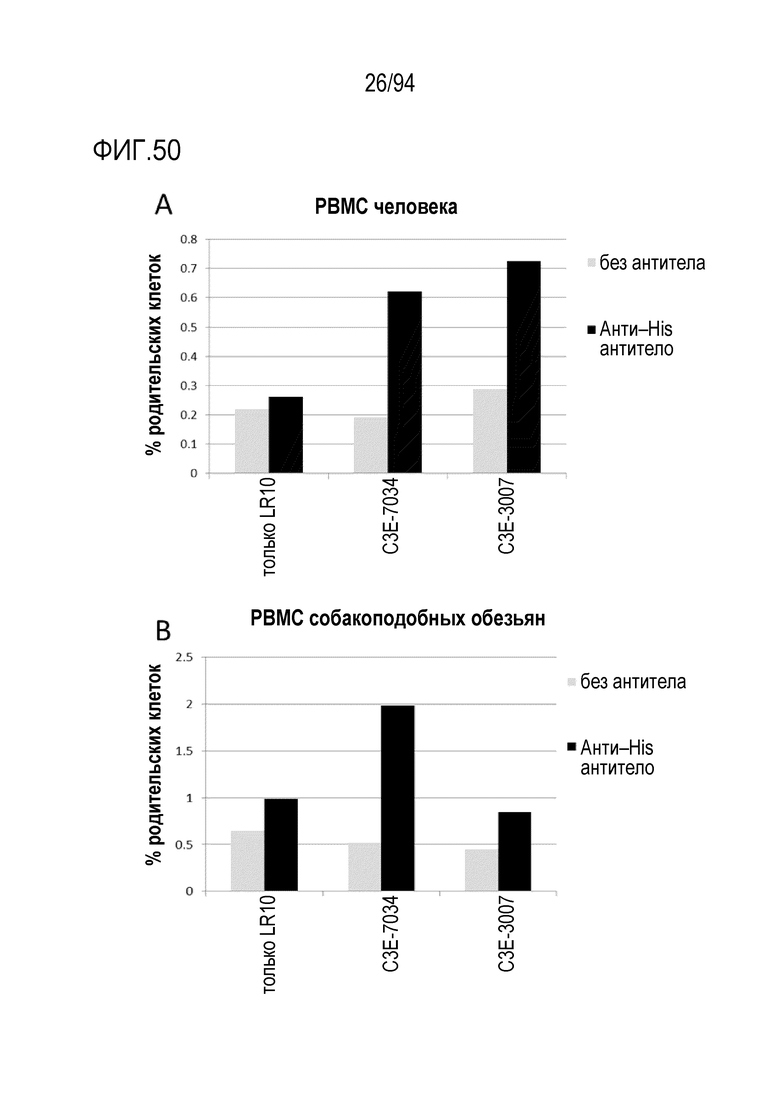


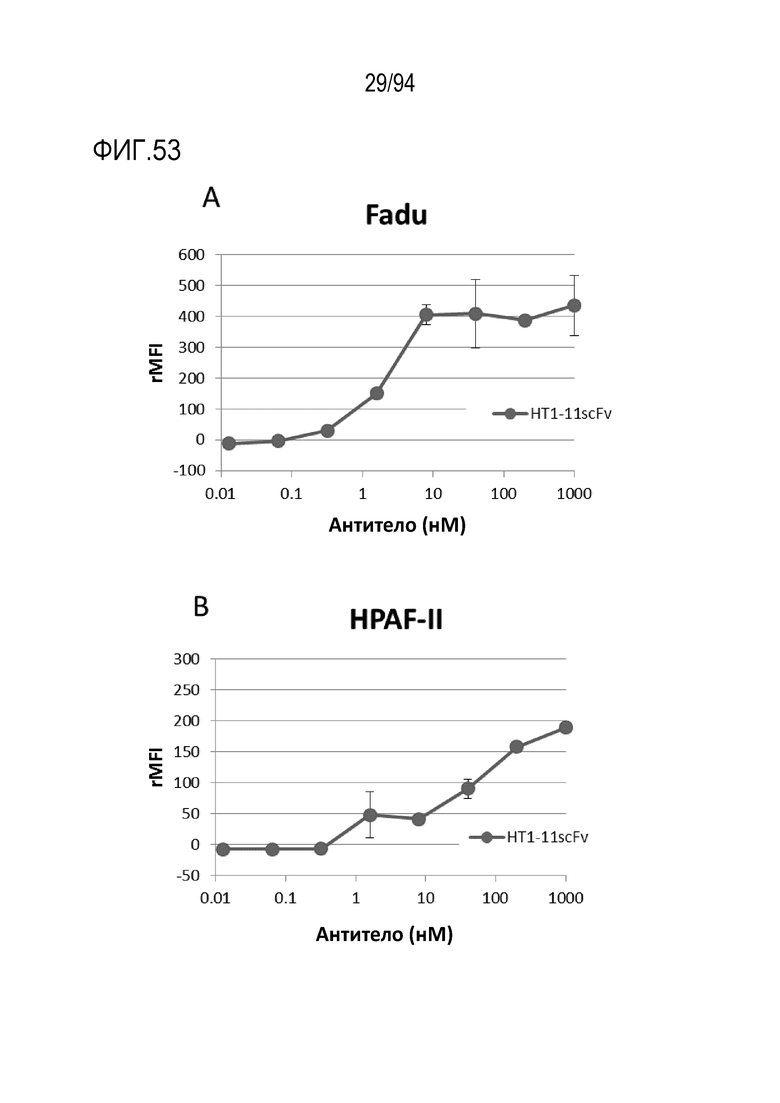












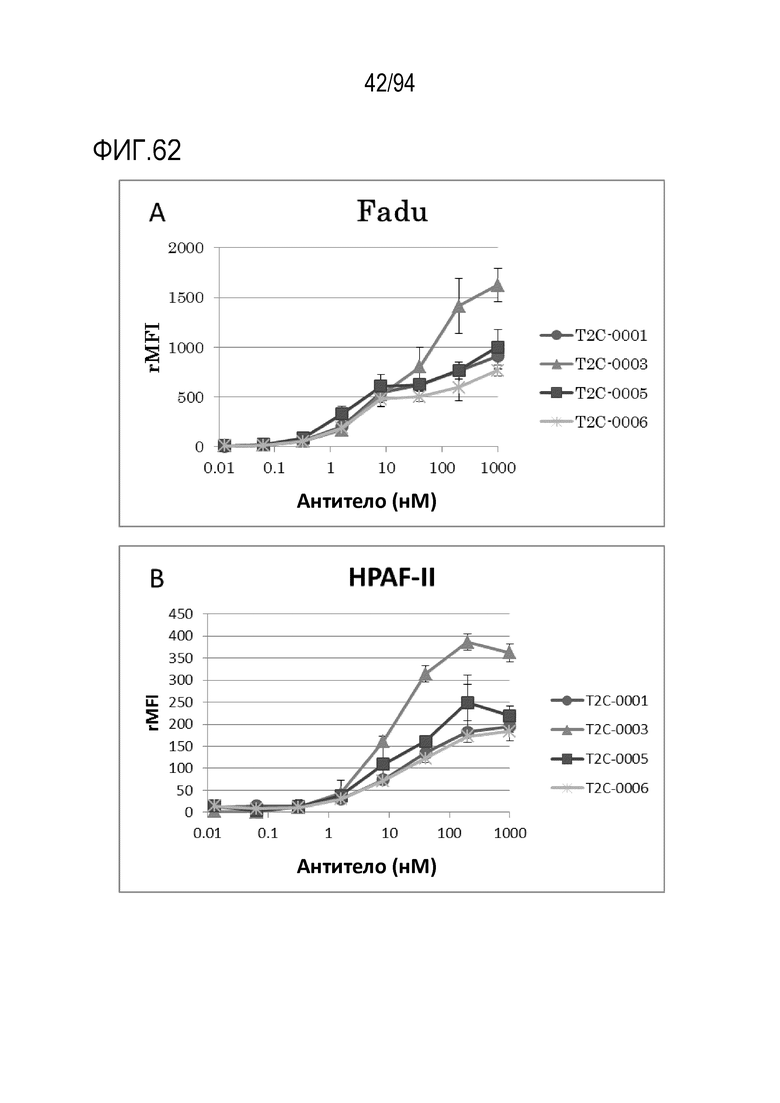
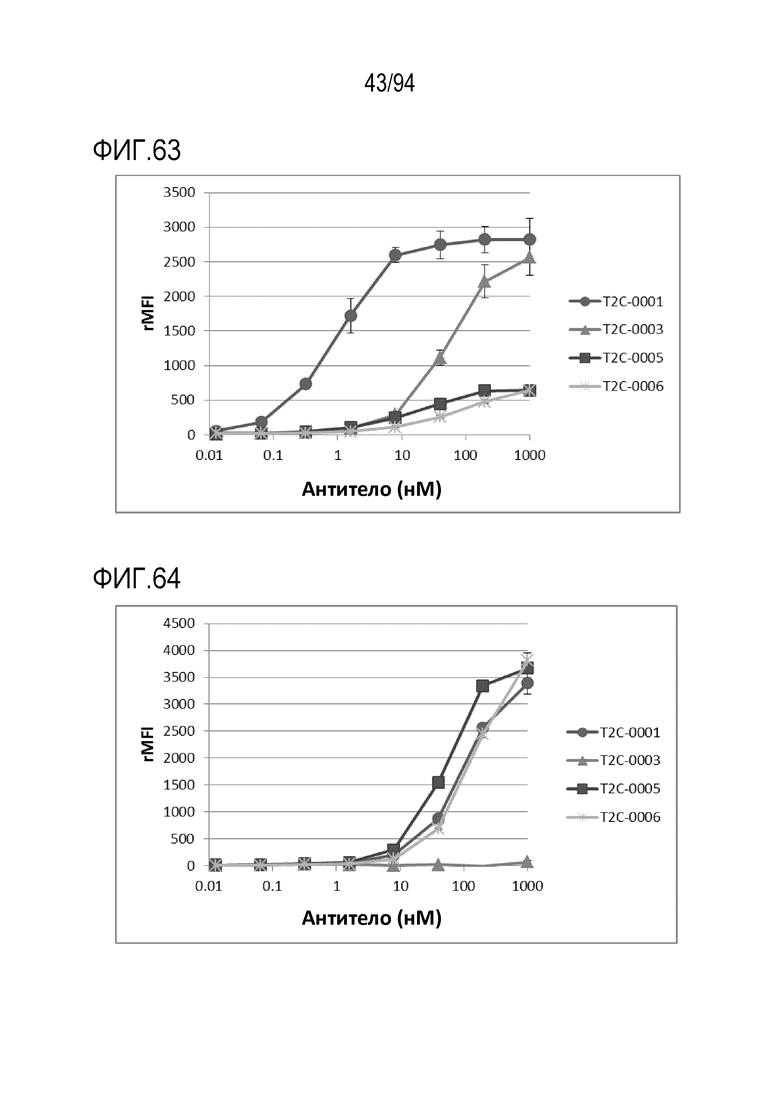
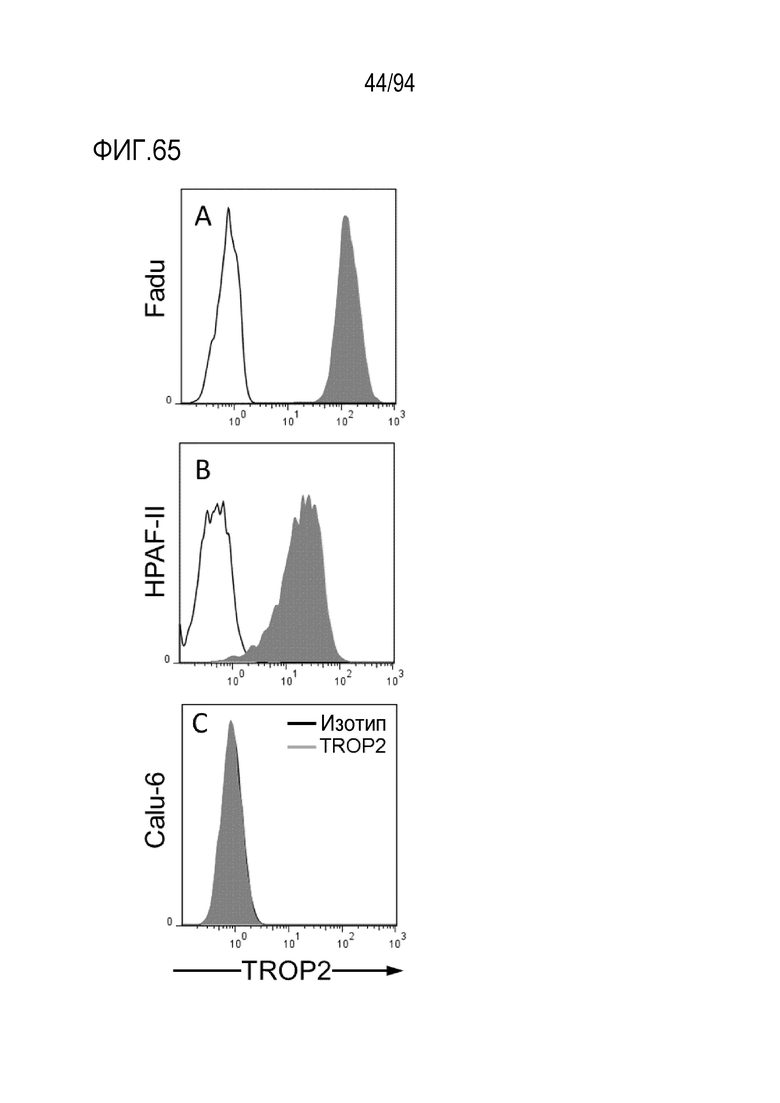
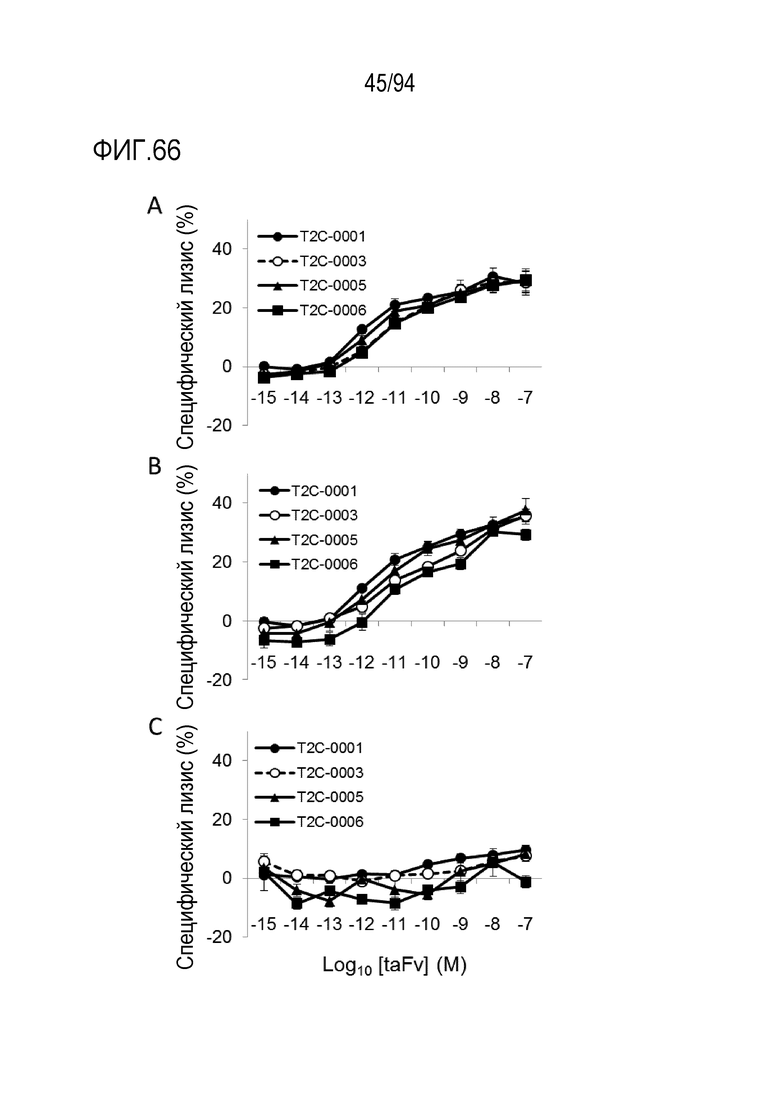








































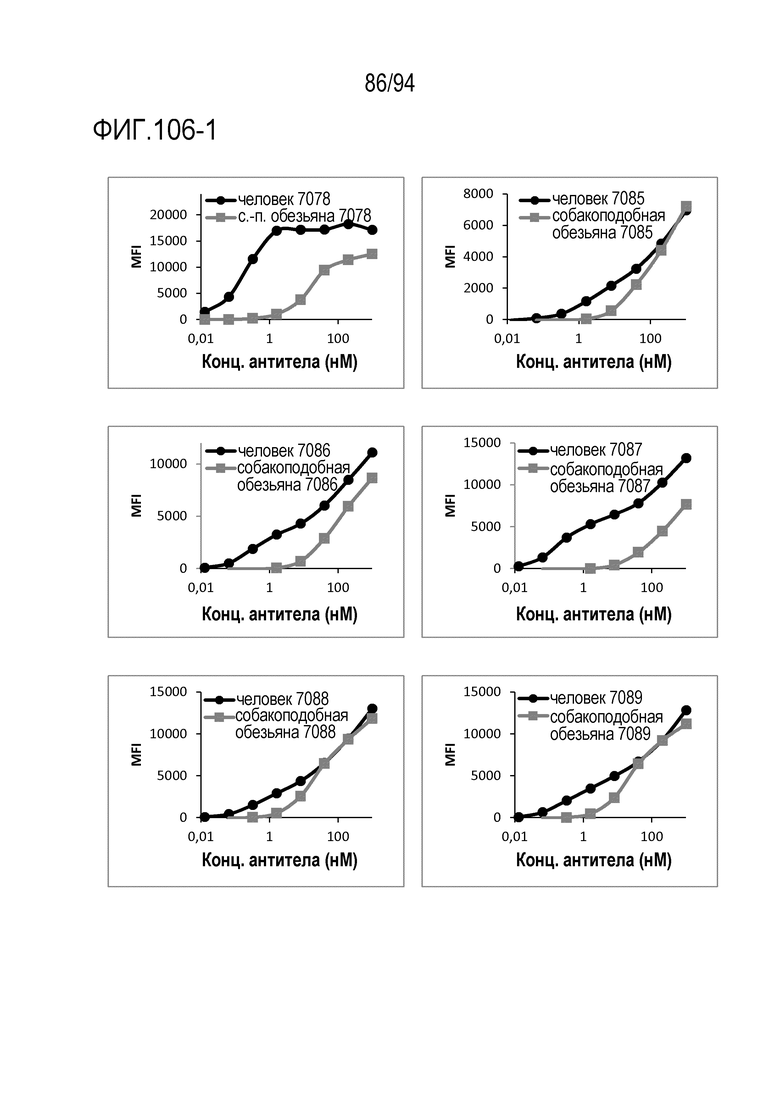
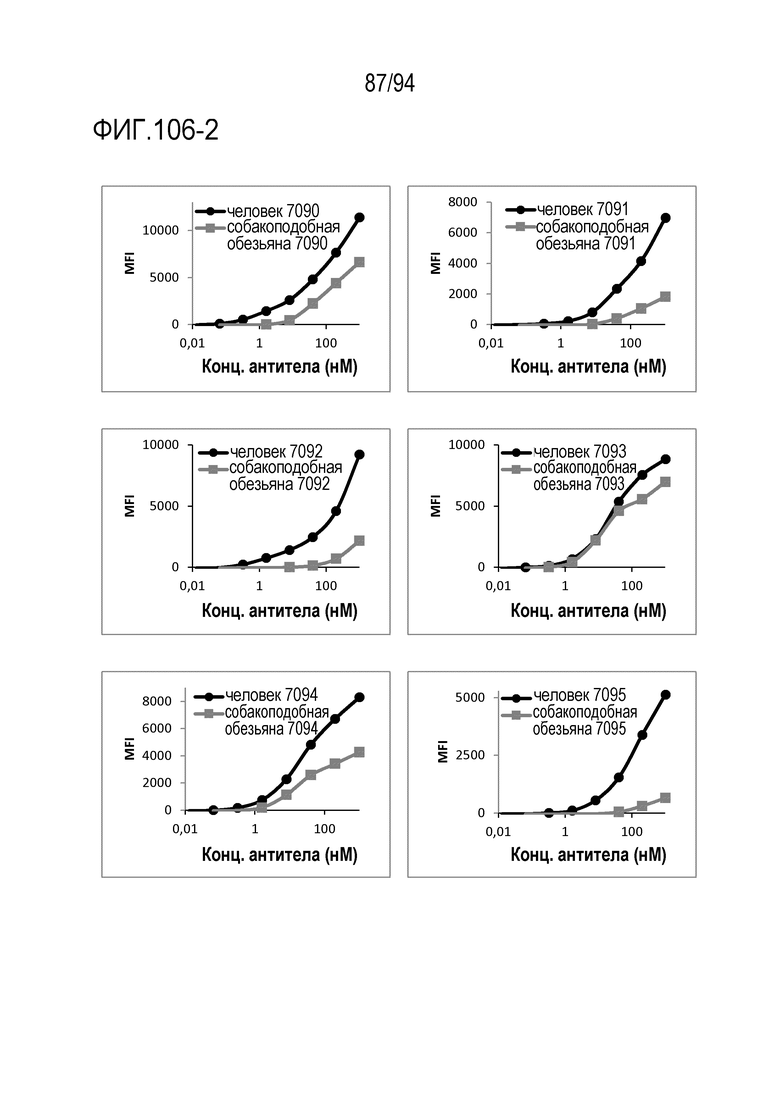
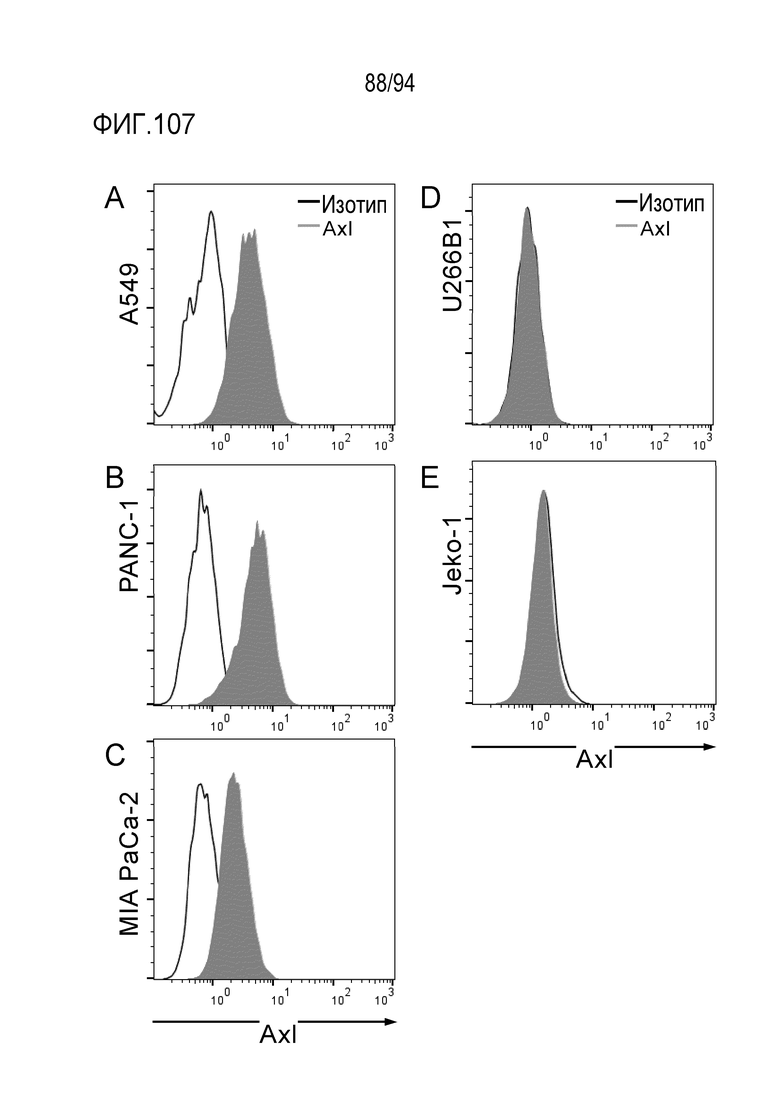
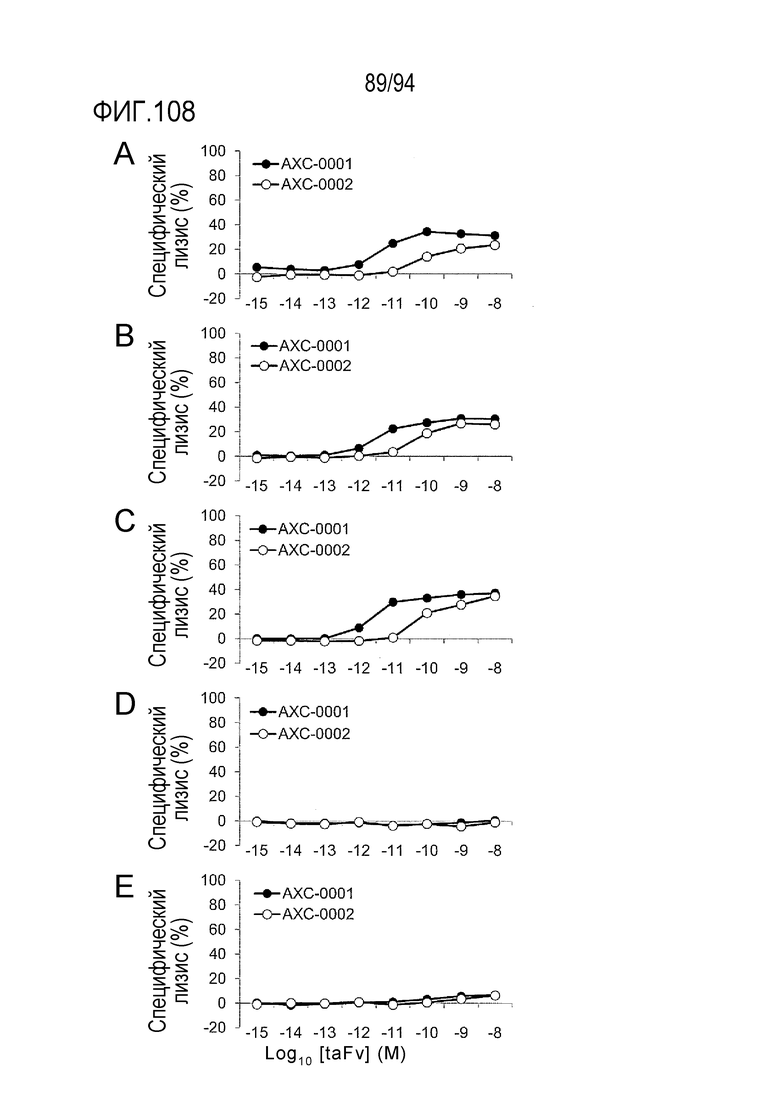
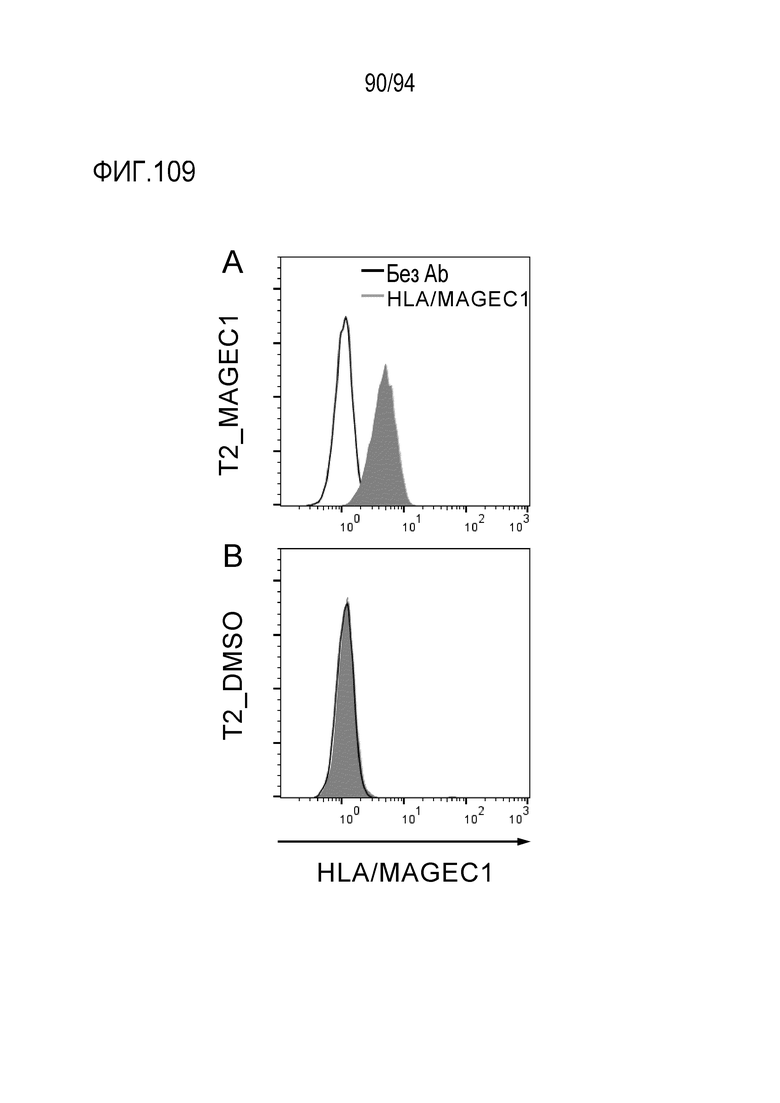
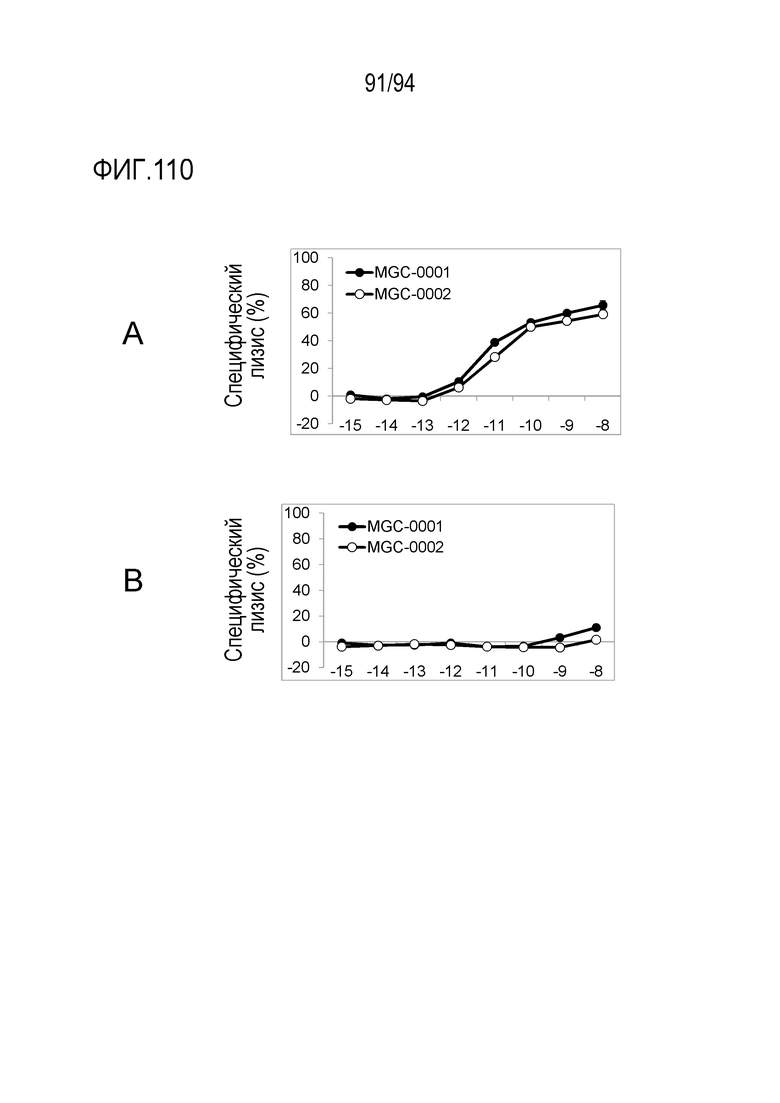



Группа изобретений относится к биотехнологии. Представлены: антитела или антигенсвязывающие фрагменты, которые связываются с CD3 человека и с CD3 яванского макака, и их применение для лечения или профилактики злокачественного новообразования. Также раскрыты полинуклеотид, содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность антитела или антигенсвязывающего фрагмента антитела, вектор и клетка для получения антитела, способ получения антитела или его антигенсвязывающего фрагмента, которое связывается с CD3 человека и CD3 яванского макака, фармацевтическая композиция и способ лечения или профилактики злокачественного новообразования. Изобретение позволяет получить новые антитела или их антигенсвязывающие фрагменты, которые обладают высокой аффиностью к CD3 человека и CD3 яванского макака. 12 н. и 21 з.п. ф-лы, 117 ил., 3 табл., 15 пр.
1. Антитело или антигенсвязывающий фрагмент антитела, отличающееся тем, что:
последовательность тяжелой цепи содержит
CDRH1, содержащую аминокислотную последовательность SEQ ID NO:26,
CDRH2, содержащую аминокислотную последовательность SEQ ID NO:98, и
CDRH3, содержащую аминокислотную последовательность SEQ ID NO:28;
последовательность легкой цепи содержит
CDRL1, содержащую аминокислотную последовательность SEQ ID NO:29,
CDRL2, содержащую аминокислотную последовательность SEQ ID NO:99, и
CDRL3, содержащую аминокислотную последовательность SEQ ID NO:31; и
где антитело или антигенсвязывающий фрагмент связывается с CD3 человека и с CD3 яванского макака.
2. Антитело или антигенсвязывающий фрагмент антитела по п.1, где
в CDRH2
первая Xaa выбрана из группы, состоящей из A, E, G, H, I, L, T, V, R и S, а вторая Xaa представляет собой S, или
первая Xaa представляет собой N, а вторая Xaa выбрана из группы, состоящей из E, R, F, Y, L, V, I, K и T,
в CDRL2
Xaa выбрана из группы, состоящей из Q, A, G, S, N и D, и
где антитело или антигенсвязывающий фрагмент связывается с CD3 человека и с CD3 яванского макака.
3. Антитело или антигенсвязывающий фрагмент антитела по п.1 или 2, где
в CDRH2
первая Xaa выбрана из группы, состоящей из R и S, а вторая Xaa представляет собой S,
в CDRL2
Xaa выбрана из группы, состоящей из Q, A, G, S, N и D, и
где антитело или антигенсвязывающий фрагмент связывается с CD3 человека и с CD3 яванского макака.
4. Антитело или антигенсвязывающий фрагмент антитела по п.1, где
последовательность тяжелой цепи содержит вариабельную область с CDRH1, CDRH2 и CDRH3,
CDRH1 состоит из аминокислотной последовательности SEQ ID NO:26,
CDRH2 состоит из аминокислотной последовательности SEQ ID NO:27, и
CDRH3 состоит из аминокислотной последовательности SEQ ID NO:28;
последовательность легкой цепи содержит вариабельную область с CDRL1, CDRL2 и CDRL3,
CDRL1 состоит из аминокислотной последовательности SEQ ID NO:29,
CDRL2 состоит из аминокислотной последовательности SEQ ID NO:30, и
CDRL3 состоит из аминокислотной последовательности SEQ ID NO:31; и
где антитело или антигенсвязывающий фрагмент связывается с CD3 человека и с CD3 яванского макака.
5. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1–4, где последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:100.
6. Антитело или антигенсвязывающий фрагмент антитела по п.5, где
в аминокислотной последовательности SEQ ID NO:100
первая Xaa выбрана из группы, состоящей из A, E, G, H, I, L, T, V, R и S, а вторая Xaa представляет собой S, или
первая Xaa представляет собой N, а вторая Xaa выбрана из группы, состоящей из E, R, F, Y, L, V, I, K и T.
7. Антитело или антигенсвязывающий фрагмент антитела по п.5, где
в аминокислотной последовательности SEQ ID NO:100
первая Xaa выбрана из группы, состоящей из R и S, и вторая Xaa представляет собой S.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп.1–7, где вариабельная область легкой цепи содержит любую аминокислотную последовательность SEQ ID NO:101, 102 или 103.
9. Антитело или его антигенсвязывающий фрагмент по п.8, где
в любой аминокислотной последовательности SEQ ID NO:101, 102 или 103 Xaa выбрана из группы, состоящей из Q, A, G, S, N и D.
10. Антитело или антигенсвязывающий фрагмент антитела по п.5, где последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:16.
11. Антитело или антигенсвязывающий фрагмент антитела по п.8, где последовательность вариабельной области легкой цепи содержит любую аминокислотную последовательность SEQ ID NO:17, 20 или 23.
12. Антитело или антигенсвязывающий фрагмент антитела по п.1 или 2,
где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:100, и
вариабельную область легкой цепи, содержащую любую аминокислотную последовательность SEQ ID NO:101, 102 или 103, где
в аминокислотной последовательности SEQ ID NO:100
первая Xaa выбрана из группы, состоящей из A, E, G, H, I, L, T, V, R и S, и вторая Xaa представляет собой S, или
первая Xaa представляет собой N, а вторая Xaa выбрана из группы, состоящей из E, R, F, Y, L, V, I, K и T, и
в аминокислотной последовательности SEQ ID NO:101, 102 и 103
Xaa выбрана из группы, состоящей из Q, A, G, S, N и D.
13. Антитело или его антигенсвязывающий фрагмент по п.12, где
в SEQ ID NO:100
первая Xaa выбрана из группы, состоящей из R и S, а вторая Xaa представляет собой S, и
в любой аминокислотной последовательности из SEQ ID NO:101, 102 и 103
Xaa выбрана из группы, состоящей из Q, A, G, S, N и D.
14. Антитело или антигенсвязывающий фрагмент антитела по п.13, которое содержит
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:22,
вариабельную область легкой цепи, содержащую аминокислотные остатки 137–243 SEQ ID NO:22;
где антитело или антигенсвязывающий фрагмент антитела содержит
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:25,
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–241 SEQ ID NO:25;
где антитело или антигенсвязывающий фрагмент антитела содержит
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:60, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:60;
антитело или антигенсвязывающий фрагмент содержит
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:64, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–241 SEQ ID NO:64; и
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:66, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:66;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:68, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:68;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:70, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:70;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:72, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:72;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:74, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:74;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:76, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:76;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:78, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:78;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:80, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:80;
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:82, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:82; или
вариабельную область тяжелой цепи, содержащую аминокислотные остатки 2–119 SEQ ID NO:84, и
вариабельную область легкой цепи, содержащую аминокислотные остатки 135–243 SEQ ID NO:84.
15. Антитело или антигенсвязывающий фрагмент антитела по пп.1, 4, 5, 8, 10 или 11, где антитело или антигенсвязывающий фрагмент антитела содержит
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:16,
линкер
и вариабельную область легкой цепи, содержащую любую аминокислотную последовательность из SEQ ID NO:17, 20 и 23.
16. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1–15,
где вариабельная область тяжелой цепи связывается с вариабельной областью легкой цепи в указанном порядке, или
вариабельная область легкой цепи связывается с вариабельной областью тяжелой цепи в указанном порядке, начиная с аминоконца
и, необязательно:
i) имеет линкер между обеими вариабельными областями,
ii) имеет глициновый остаток на аминоконце вариабельной области с стороны аминоконца и
iii) имеет линкер, FLAG–метку и/или HIS–метку на карбоксиконце вариабельной области со стороны карбоксильного конца.
17. Антитело или антигенсвязывающий фрагмент антитела по п.16, содержащее
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:22,
аминокислотную последовательность, содержащую аминокислотные остатки 2–241 SEQ ID NO:25,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:60,
аминокислотную последовательность, содержащую аминокислотные остатки 2–241 SEQ ID NO:64,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:66,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:68,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:70,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:72,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:74,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:76,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:78,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:80,
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:82, или
аминокислотную последовательность, содержащую аминокислотные остатки 2–243 SEQ ID NO:84.
18. Антитело или антигенсвязывающий фрагмент антитела по п.16, содержащее
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:19,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:22,
аминокислотную последовательность, содержащую аминокислотные остатки 2–267 SEQ ID NO:25,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:60,
аминокислотную последовательность, содержащую аминокислотные остатки 2–267 SEQ ID NO:64,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:66,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:68,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:70,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:72,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:74,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:76,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:78,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:80,
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:82, или
аминокислотную последовательность, содержащую аминокислотные остатки 2–269 SEQ ID NO:84.
19. Антитело или антигенсвязывающий фрагмент антитела, где антитело или антигенсвязывающий фрагмент содержит
аминокислотную последовательность, кодируемую нуклеотидной последовательностью, содержащейся в полинуклеотиде, который гибридизуется в жестких условиях с комплементарной цепью полинуклеотида, содержащего нуклеотидную последовательность, кодирующую аминокислотную последовательность, содержащуюся в антителе или антигенсвязывающем фрагменте антитела по любому из пп.14–18,
где области CDR антитела или антигенсвязывающего фрагмента идентичны областям CDR антитела по любому из пп.14-18,
и связывается с CD3 человека и с CD3 яванского макака.
20. Антитело или антигенсвязывающий фрагмент антитела, где антитело или антигенсвязывающий фрагмент содержит
тяжелую цепь, содержащую аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности тяжелой цепи, содержащейся в антителе или в антигенсвязывающем фрагменте антитела по любому из пп.14–18, где области СDR антитела или антигенсвязывающего фрагмента идентичны областями CDR антитела по любому из пп.14-18,
и легкую цепь, содержащую аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности легкой цепи, содержащейся в антителе или в антигенсвязывающем фрагменте антитела по любому из пп.14–18, где области СDR антитела или антигенсвязывающего фрагмента идентичны областями CDR антитела по любому из пп.14-18, и
связывается с CD3 человека и с CD3 яванского макака.
21. Антитело или антигенсвязывающий фрагмент антитела, где антитело или антигенсвязывающий фрагмент содержит
тяжелую цепь, содержащую аминокислотную последовательность, полученную путем замены, делеции или добавления 1 или более аминокислот аминокислотной последовательности, содержащейся в тяжелой цепи, содержащейся в антителе или антигенсвязывающем фрагменте антитела по любому из пп.14–18, где области СDR антитела или антигенсвязывающего фрагмента идентичны областями CDR антитела по любому из пп.14-18,
и легкую цепь, содержащую аминокислотную последовательность, полученную путем замены, делеции или добавления 1 или более аминокислот аминокислотной последовательности, содержащейся в легкой цепи, содержащейся в антителе или антигенсвязывающем фрагменте антитела по любому из пп.14–18, где области СDR антитела или антигенсвязывающего фрагмента идентичны областями CDR антитела по любому из пп.14-18, и
связывается с CD3 человека и с CD3 яванского макака.
22. Антитело или антигенсвязывающий фрагмент антитела, где антитело или антигенсвязывающий фрагмент связывается с тем же сайтом на CD3 человека, с которым связывается антитело или антигенсвязывающий фрагмент антитела по любому из пп.14–18, и связывается CD3 яванского макака, где сайт на CD3 человека, с которым связывается антитело, состоит из 7 или более аминокислот, выбранных из
55–го серина (Ser), 56–й глутаминовой кислоты (Glu),
58–го лейцина (Leu), 59–го триптофана (Trp),
65–го аспарагина (Asn), 66–го изолейцина (Ile),
77–го серина (Ser), 78–й аспарагиновой кислоты (Asp),
101–го аргинина (Arg), 102–го глицина (Gly),
103–го серина (Ser), 104–го лизина (Lys) и
105–го пролина (Pro)
в аминокислотной последовательности SEQ ID NO:1.
23. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1–17 и 19–22, где антитело представляет собой IgG.
24. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1–22, где антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, F(ab)’, Fv, scFv и sdAb.
25. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1–17 и 19–23, где антитело представляет собой гуманизованное антитело или антитело человека, содержащее константную область иммуноглобулина человека.
26. Полинуклеотид для получения антитела или антигенсвязывающего фрагмента антитела по любому из пп.1-25, содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность антитела или антигенсвязывающего фрагмента антитела по любому из пп.1–25.
27. Полинуклеотид по п.26, где полипептид содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:19,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:22,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–241 или 267 SEQ ID NO:25,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:60,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–241 или 267 SEQ ID NO:64,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:66,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:68,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:70,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:72,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:74,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:76,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:78,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:80,
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 или 269 SEQ ID NO:82, или
аминокислотной последовательностью, состоящей из аминокислотных остатков 2–243 SEQ ID NO:84.
28. Вектор для получения антитела или антигенсвязывающего фрагмента по любому из пп.1-25, содержащий полинуклеотид по любому из пп.26–27.
29. Клетка для получения антитела или антигенсвязывающего фрагмента по любому из пп.1-25, содержащая полинуклеотид по любому из пп.26–27 или вектор по п.28.
30. Способ получения антитела или антигенсвязывающего фрагмента антитела, которое связывается с CD3 человека и CD3 яванского макака,
где способ включает стадии: культивирования клетки по п.29; и
восстановления из антитела или антигенсвязывающего фрагмента антитела, которое связывается с CD3 человека, из культур.
31. Фармацевтическая композиция для лечения или профилактики злокачественного новообразования, содержащая эффективное количество антитела или антигенсвязывающего фрагмента антитела по любому из пп.1–25 в качестве активного ингредиента.
32. Способ лечения или профилактики злокачественного новообразования, включающий введение индивиду антитела по любому из пп.1-25 или фармацевтической композиции по п.31.
33. Применение антитела или антигенсвязывающего фрагмента антитела по любому из пп.1-25 или фармацевтической композиции по п.31 для лечения или профилактики злокачественного новообразования.
| JP 2009511521 A, 19.03.2009 | |||
| WO 2016116626 A1, 28.07.2016 | |||
| WO 2015181098 A1, 03.12.2015 | |||
| WO 2016076345 A1, 19.05.2016 | |||
| JP 2014517844 A, 24.07.2014 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИММУННЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2203682C2 |
Авторы
Даты
2023-02-16—Публикация
2017-12-21—Подача