Область техники, к которой относится изобретение
Настоящее изобретение касается композиции, ингибирующей секрецию кислоты в желудке, способа ее получения и ее применения при лечении заболеваний, связанных с секрецией кислоты в желудке.
Уровень техники
За последние десятилетия проделан большой прогресс в подавлении секреции кислоты, что является неотъемлемой частью лечения диспепсических заболеваний, таких как желудочно-пищеводный рефлюкс (GORD), язва желудка и двенадцатиперстной кишки и неязвенная диспепсия. Хотя патофизиология этих заболеваний неодинакова, ингибирование секреции кислоты в желудке играет кардинальную роль в лечении органических повреждений, смягчении симптомов дискомфорта и улучшении качества жизни. Более того, повреждающее действие кислоты может лежать в основе перехода в рак и других поздних осложнений этих заболеваний. Ингибирование секреции кислоты также является узловым моментом в схемах лечения, направленных на искоренение инфицированности Helicobacter pylori.
Диспепсия (кислотная диспепсия) является распространенным заболеванием. Симптомом диспепсии является изжога. По оценкам у 44% американцев отмечается изжога, по крайней мере, один раз в месяц, но только приблизительно 25% из них обращаются к врачу по поводу диспепсии. Симптомами, связанными с диспепсией, являются, к примеру, боль/дискомфорт в верхней части живота и изжога, несварение, "кислый" желудок и желудочно-пищеводный рефлюкс.
Диспепсия является многофакторным заболеванием и может быть связана с органической патологией типа язвы двенадцатиперстной кишки, язвы желудка, эзофагита, синдрома Барретта или воспаления желудка и двенадцатиперстной кишки (например, инфекции Helicobacter pylori). Диспепсия также охватывает состояния, при которых органическая патология не обнаруживается, например неязвенная диспепсия (NUD) или функциональная диспепсия.
Диспепсию можно контролировать введением лекарств, повышающих рН в желудке. К терапевтическим средствам, эффективным при лечении диспепсии, относятся средства, подавляющие высвобождение кислоты в желудке, такие как антагонисты рецепторов гистамина типа 2 (в дальнейшем именуемые антагонистами Н2-рецепторов), кислоточувствительные ингибиторы протонного насоса, антациды/альгинаты, антихолинергические и прокинетические средства. Они отличаются по механизму действия, профилю безопасности и фармакокинетике. Желудочный патоген Helicobacter pylori связывали с диспепсией, язвой желудка и двенадцатиперстной кишки и раком желудка. Лечение инфекции Н. pylori обычно включает применение комбинации из подавляющих высвобождение кислоты средств и одного или двух антибиотиков.
Терапевтический эффект на связанный с диспепсией дискомфорт и органические повреждения при ингибировании продукции кислоты применением ингибирующих секрецию кислоты препаратов зависит от степени ингибирования кислоты и также от начала и продолжительности действия конкретного препарата. У большинства пациентов с симптоматикой кислотного рефлюкса имеется нормальная слизистая пищевода или всего лишь легкая степень эзофагита. Лечение, состоящее в облегчении симптомов по мере их возникновения, возможно, является лучшим способом лечения таких пациентов, у которых скорость облегчения симптомов имеет наибольшее значение.
Антациды, то есть нейтрализующие кислоту средства, а также альгинаты являются первостепенными лекарствами при лечении легкой изжоги. Они обладают чрезвычайно короткой продолжительностью действия, но считаются недорогими и безопасными. Антациды оказывают местное действие посредством нейтрализации кислоты в желудке. Альгинаты оказывают некоторую механическую защиту от рефлюкса кислоты из желудка в пищевод. Основное преимущество антацидов и альгинатов состоит в том, что они обеспечивают быстрое ослабление симптомов. Главным недостатком антацидов и альгинатов является чрезвычайно короткая продолжительность действия, поэтому их введение приходится часто повторять, чтобы у пациентов не появлялись симптомы, кроме того, антациды зачастую не обеспечивают снятия симптомов, то есть полного ослабления симптомов. Более того, эти средства совсем непригодны для лечения вызванных кислотой органических повреждений, GORD или инфекции Helicobacter pylori.
Известно несколько классов соединений, влияющих на секрецию кислоты в желудке. Из них наиболее известны кислоточувствительные ингибиторы протонного насоса, такие как замещенные бензимидазолы - омепразол, ланзопразол, рабепразол и пантопразол, и антагонисты рецепторов гистамина типа 2, такие как циметидин, ранитидин и фамотидин. Ингибиторы Н2-рецепторов и кислоточувствительные ингибиторы протонного насоса прописывают системно в широких масштабах для уменьшения секреции кислоты в желудке.
Разработка терапии подавления кислотности требует детального понимания механизмов, лежащих в основе секреции ионов водорода, а именно париетальных клеток и водород-калиевой аденозинтрифосфатазы (Н+,К+-АТФазы), с тем, чтобы эти механизмы стали эффективной мишенью фармакологического вмешательства. Были выделены три ключевых фактора для достижения эффективного фармакологического лечения связанных с кислотой нарушений (Dig Dis Sci 1995, vol. 40: 24S-49S. Optimizing acid suppression for treatment of acid-related diseases):
1) время начала действия, то есть ингибирование секреции кислоты должно наступить как можно быстрее;
2) степень ингибирования кислоты, то есть значение рН внутри желудка должно быть значительно выше 4;
3) продолжительность действия, то есть ингибирование секреции кислоты должно оставаться практически полным на протяжении 24 часов при введении первой дозы и оставаться полным на протяжении всего курса лечения.
Все эти факторы необходимо учитывать при выборе того, как оптимизировать данную терапию подавления. Однако некоторые аспекты физиологии париетальных клеток и фармакологии/биохимии существующих фармакосредств пока что не дали возможности достижения этой цели.
Центральным элементом механизма секреции кислоты являются париетальные клетки желудка. Эти клетки секретируют ионы водорода в просвет желудка под контролем нейрокринных, паракринных и эндокринных путей. Одним из основных паракринных факторов является гистамин, который выделяется энтерохромаффиноподобными (ECL) клетками. Выделяемый клетками ECL гистамин стимулирует париетальные клетки к выделению кислоты через рецепторы гистамина типа 2, находящиеся на поверхности клеток. Срабатывание этих рецепторов ведет к повышению циклического аденозин-3,5-монофосфата (цАМФ) и связыванию цАМФ с регуляторной субъединицей. Происходит фосфорилирование целого ряда белков, имеющих отношение к активации секреции. Хотя молекулярный анализ этого внутриклеточного пути еще далеко не полон, действие цАМФ включает транслокацию Н+,К+-АТФазы в секреторные канальцы и активирование переносчиков KCl, то есть перевод париетальных клеток в секреторное состояние.
Первые попытки уменьшения секреции кислоты были направлены на паракринный путь, то есть вызванную рецепторами гистамина типа 2 стимуляцию секреции кислоты. Соответственно первый класс ингибиторов кислоты составили антагонисты Н2-рецепторов (Н2-блокаторы), в том числе такие соединения, как циметидин, ранитидин, фамотидин и низатидин. Их механизм действия заключается в антагонизме эффектов гистамина, то есть ингибировании перехода протонного насоса в секреторные канальцы и снижении активности транспорта KCl. При этом париетальные клетки переходят в несекреторное состояние и тем самым уменьшается продукция ионов водорода (Dig Dis Sci 1995, vol 40: 3S-23S. Pharmacological aspects of acid secretion).
Однако явления возврата кислотности и толерантности являются основным препятствием для применения этих препаратов при лечении связанных с кислотой заболеваний. При повторном введении происходит падение способности к уменьшению кислотности примерно на 50%, что сильно ограничивает применение этого класса препаратов при лечении, к примеру, GORD (Aliment Pharmacol Ther 1990, vol 4: 29-46. Tolerance during 29 days of conventional dosing with cimetidine, nizatidine, famotidine or ranitidine). Более того, эти средства совсем непригодны для лечения инфекции Helicobacter pylori, которое зависит от эффективного и продолжительного снижения секреции кислоты.
Современное лечение связанных с кислотой нарушений сосредоточено на более прямой мишени - Н+,К+-АТФазе ("протонном насосе") активных париетальных клеток. Эти клетки образуют конечные источники кислоты - секреторные канальцы и сам насос для кислоты. Поэтому препараты, предназначенные для ингибирования секреции кислоты на этом уровне, проявляют большую эффективность и специфичность. Поскольку ингибиторы протонного насоса (ИПН) действуют на стадии после раздражения париетальных клеток, то при применении этих соединений не вырабатывается толерантность, в отличие от антагонистов Н2-рецепторов. Более того, эти препараты поражают конечную мишень, на которой сходятся все другие пути, то есть Н+,К+-АТФазу в кислотном отсеке или канальце стимулированных париетальных клеток.
Индивидуальные ИПН близки в отношении общей структуры, которая состоит из замещенного пиридилметилсульфинилбензимидазола. У этих соединений значения рКа варьируют от 4,0 до 5,0. Все ИПН обладают одним и тем же фармакологическим механизмом, который по сути одинаков: значения рКа ограничивают накопление этих соединений кислотными отсеками типа тех, что имеются в париетальных клетках. За накоплением ИПН в канальцах париетальных клеток следует стадия кислотозависимой активации, при этом ИПН превращаются в сульфеновые кислоты или сульфенамиды. Образование этих реакционноспособных интермедиатов позволяет им связываться с остатками цистеина на выходящей в просвет поверхности Н+,К+-АТФазы. Фермент подвергается функциональной инактивации посредством образования ковалентных дисульфидных связей. Ингибирование Н+,К+-АТФазы под действием ИПН приводит к относительно устойчивому ингибированию фермента, так как для обращения ингибирования необходим синтез фермента de novo. Эти механизмы действия описаны в Dig Dis Sci 1995, vol 40: 3S-23S. Pharmacological aspects of acid secretion.
Одно из фундаментальных свойств ИПН состоит в том, что они функционируют только в активных париетальных клетках, то есть клетки должны быть в секреторном состоянии. Причин для этого три. Во-первых, у большинства париетальных клеток значение рН в кислотном отсеке (канальце) составляет около 1,0. При этом рН значения рКа ИПН позволяют им накапливаться в париетальных клетках в 1000-10000-кратной степени. Но при более высоком рН, к примеру 3, накопление уменьшается на два порядка, то есть в 10-100-кратной степени. Таким образом, свойства ИПН как слабых оснований позволяют им накапливаться только тогда, когда париетальные клетки вырабатывают кислоту. Это становится важным при введении ИПН в условиях, когда париетальные клетки переходят в несекреторное состояние. Во-вторых, превращение ИПН в сульфеновую кислоту или сульфенамид является кислотозависимым процессом. В-третьих, Н+,К+-АТФаза должна быть активирована, то есть фермент должен встроиться в мембрану секреторного канальца, где его остатки цистеина будут доступны сульфенамидам (Pharmacotherapy 1997, vol. 17: 22-37. Proton pump inhibitors and acid related diseases; Drugs 1998, vol. 56: 307-335. Proton pump inhibitors: pharmacology and rationale for use in gastrointestinal disorders; Ann NY Acad Sci 1997, vol. 834: 65-76. Structural aspects of the gastric H+,K+-ATPase; Annu Rev Pharmacol Toxicol 1995, vol. 35: 277-305. The pharmacology of the gastric acid pump).
Эти характеристики фармакологии/биохимии ИПН сильно влияют на фармакодинамику этого класса соединений. С одной стороны, этим препаратам необходим активный фермент для ингибирования, а некоторые насосы неактивны в то время, когда препарат присутствует в крови. С другой стороны, ИПН проявляют сравнительно короткое время полужизни в плазме - порядка 60 минут, а новые насосы синтезируются со скоростью 25% за 24 часа.
Эти факты указывают на терапевтическую дилемму ИПН в настоящее время. Так как эти соединения накапливаются и подвергаются превращению в кислотном отсеке париетальных клеток, то будут ингибироваться лишь те насосы, которые секретируют кислоту. Поскольку клетки обладают запасом неактивных насосов и постоянно синтезируют новые насосы, то многие насосы, которые станут активными в течение следующих 24 часов, не будут ингибироваться первой дозой. Однако на следующий день, при следующем введении ИПН, уже произойдет пополнение новых насосов, которые могут подвергаться ингибированию, а насосы, заингибированные 24 часами раньше, еще не будут полностью восполнены. Следовательно, реакция на ИПН является кумулятивной, впервые достигая стационарного состояния и терапевтического ингибирования кислоты, по меньшей мере, через три последовательных дня лечения.
Таким образом, текущая концепция в отношении механизма действия ИПН состоит в том, что для их эффекта необходимы активные насосы. В состоянии покоя париетальные клетки не вырабатывают кислоту, и насосы остаются неактивными. Ингибирование продукции кислоты ИПН происходит тогда, когда эти насосы находятся в активном состоянии, при накоплении в париетальных клетках с тем, что последующая активация препарата приводит к ингибированию насоса (Eur J of Gastroenterol Hepatol 2001, vol. 13: S35-S41. Improving on PPI-based therapy of GORD).
Итак, ни один класс антисекреторных средств, доступных в настоящее время, не достигает цели контролирования кислотности, сформулированной выше, то есть быстрого начала действия, сильного ингибирования секреции кислоты и продолжительного времени действия в курсе лечения. Эта цель имеет наибольшее значение для клинического исхода лечения, так как терапевтический эффект зависит от начала, степени и продолжительности действия, то есть от того, как быстро, как сильно и надолго будет повышено рН в желудке.
Были описаны различные комбинации из антацида и/или защищающих слизистую средств со средствами, уменьшающими секрецию кислоты, как полезные при лечении диспепсии.
В WO 95/017080 описана композиция для применения при лечении, к примеру, изжоги, включающая антагонист Н2-рецепторов типа фамотидина и альгинат, а также необязательно симетикон (активированный полисилоксан).
В ЕР 338861 А описан твердый фармацевтический препарат, состоящий из антацида и наполнителей, который предлагается использовать в сочетании с кислоточувствительным ингибитором протонного насоса или с любым другим веществом, ингибирующим секрецию кислоты в желудке. При этом не предложено комбинировать эти вещества в фиксированной дозированной форме.
В US 5244670 А описана фармацевтическая композиция для приема внутрь, включающая вещество, выбранное из группы, состоящей из антацидов, средств, предотвращающих секрецию кислоты, висмутсодержащих средств и их смесей, а также 3-(1-ментокси)-пропан-1,2-диола, который должен обеспечивать ощущение прохлады в горле.
В WO 97/25066 описана фармацевтическая композиция, включающая комбинацию из кислоточувствительного ингибитора протонного насоса или антагониста Н2-рецептора и одного или нескольких антацидов или альгинатов.
Ни кислоточувствительные ингибиторы протонного насоса, ни антагонисты Н2-рецепторов, поодиночке или в сочетании с антацидами и/или альгинатами, не обеспечивают удовлетворительным образом быстрого и длительного облегчения у пациентов, для которых скорость облегчения симптомов имеет первостепенное значение, но которые также желают оставаться свободными от симптомов в течение более длительного времени. Таким образом, ни один из твердых фармацевтических препаратов для приема внутрь, известных к настоящему времени, не удовлетворяет основным требованиям: быстрого начала ингибирования секреции кислоты, сильного уменьшения секреции кислоты и продолжительного ингибирования секреции кислоты.
Кроме того, применение ингибиторов протонного насоса имеет серьезный недостаток в плане химической стабильности.
Эти вещества чрезвычайно неустойчивы к кислоте, что вызвало необходимость в особых составах. Обычно эти вещества защищают in vivo путем нанесения устойчивого к кислоте в желудке покрытия (энтеросолюбильной оболочки) на активное вещество. Поскольку такие оболочки сами по себе являются кислотными (выделяют ионы водорода), то было найдено, что нужно обеспечивать определенную защиту также in vitro, то есть при хранении продукта.
Такая защита in vitro может быть устроена так, как описано в US 6183776 B1 (Depui et al.), когда к ингибитору протонного насоса добавляют дающее щелочную реакцию вещество и наносят дополнительное защитное покрытие (субоболочку) прямо под устойчивую к кислоте в желудке оболочку.
Другой подход описан в WO 00/78284 (US 5225202), когда устойчивую к кислоте в желудке оболочку нейтрализуют таким образом, что она не проявляет кислой реакции при хранении. После проглатывания ионы водорода в желудке будут подкислять оболочку и таким образом воссоздавать кислотозащитные свойства оболочки in situ.
Теперь же было обнаружено, что и проблема быстрого и продолжительного снятия симптомов, и проблема химической неустойчивости кислоточувствительных ингибиторов протонного насоса может быть решена с помощью настоящего изобретения.
Цели изобретения
Целью изобретения является получение лекарства, обеспечивающего быстрое и продолжительное облегчение пациентам, страдающим заболеваниями, связанными с секрецией кислоты в желудке.
Другой целью изобретения является обеспечение способа лечения пациентов, страдающих заболеваниями, связанными с секрецией кислоты в желудке, который обеспечивает быстрое и продолжительное облегчение.
Следующие цели изобретения станут очевидными из последующего краткого описания изобретения, его предпочтительного воплощения и прилагаемой формулы изобретения.
Раскрытие изобретения
Настоящее изобретение касается твердой фармацевтической дозированной формы для приема внутрь, которая отличается тем, что она включает антагонист Н2-рецепторов, предназначенный для быстрого высвобождения, и ИПН, предназначенный для длительного высвобождения. В данной дозированной форме быстро высвобождаемый антагонист Н2-рецепторов будет быстро всасываться и ингибировать секрецию кислоты по описанным выше механизмам. Предназначенный для отсроченного и/или длительного высвобождения ИПН будет обеспечивать максимальное подавление кислоты сразу после первой дозы и будет обеспечивать максимальное подавление кислоты на протяжении всего курса лечения.
Кислоточувствительные ингибиторы протонного насоса представляют собой активируемые кислотой пролекарства, которые ковалентно ингибируют Н+,К+-АТФазу желудка - фермент, транспортирующий протоны и участвующий в образовании соляной кислоты в желудке. Действие Н+,К+-АТФазы желудка является заключительной стадией в цепи событий, ведущих к секреции соляной кислоты париетальными клетками. Следовательно, ингибирование этого фермента является наиболее эффективным и специфическим средством контролирования секреции кислоты независимо от природы стимула к секреции. Как и следовало ожидать при таком механизме действия, оказалось, что ингибиторы протонного насоса типа омепразола ингибируют как базальную, так и стимулированную секрецию кислоты. Омепразол является слабым основанием, которое накапливается в кислой среде секреторной мембраны париетальных клеток, где он в присутствии кислоты подвергается превращению в активную форму сульфенамида, который затем реагирует с сульфгидрильными группами кислотного насоса.
В слизистой желудка кислоточувствительный протонный насос располагается в апикальной мембране и в трубчатых везикулах, граничащих с секреторными канальцами париетальных клеток. Так, после единственной дозы омепразол быстро накапливается в кислом компартменте секреторной мембраны, где его активная форма - сульфенамид - необратимо связывается с Н+,К+-АТФазой. Однако Н+,К+-АТФаза, находящаяся в трубчатых везикулах, будет недоступна активированному омепразолу. Большая часть синтезированной Н+,К+-АТФазы, таким образом, не будет подвергаться блокированию после единственной дозы омепразола. Видимо, этим объясняется то, что максимальный эффект ингибирования кислоты достигается только после пяти дней лечения.
Антагонисты Н2-рецепторов конкурентным образом ингибируют действие гистамина на все Н2-рецепторы, в основном, на поверхности париетальных клеток. В терапевтических дозах эти вещества способны не только уменьшить базальную и ночную секрецию кислоты, но и секрецию, стимулированную пищей, гистамином, инсулином и пентагастрином. Одиночная доза антагониста Н2-рецепторов приводит к максимальному эффекту ингибирования кислоты уже через 2 часа после приема. Более того, эффект ингибирования кислоты, достигаемый при высоких дозах антагониста Н2-рецепторов, нарастает быстро, но имеет тенденцию к значительному угасанию в течение последующих 2-7 дней, тогда как эффект ингибирования кислоты омепразолом нарастает постепенно за тот же период времени.
Настоящее изобретение основывается на неожиданном открытии того, что почти полное ингибирование секреции кислоты достигается при введении первой дозы кислоточувствительного ингибитора протонного насоса в виде состава для продолжительного высвобождения. Кроме того, поскольку следует ожидать, что ингибированию подвергаются только активированные протонные насосы, секретирующие кислоту, в то время, когда ИПН присутствует в плазме, неожиданно оказалось, что продолжительное ингибирование секреции кислоты может быть достигнуто в то время, когда париетальные клетки переходят в несекреторное состояние под действием быстро высвобождаемого антагониста Н2-рецепторов.
Итак, в соответствии с изобретением предусматривается пероральная фармацевтическая дозированная форма, включающая фармакологически эффективное количество кислоточувствительного ингибитора протонного насоса или его соли и антагониста Н2-рецепторов или его соли, а также фармацевтически приемлемые наполнители, что ведет к отсроченному и/или продолжительному высвобождению ингибитора протонного насоса. Термины "ингибитор протонного насоса" и "антагонист Н2-рецепторов" охватывают их изомеры, к примеру энантиомеры ингибиторов протонного насоса, а также фармацевтически приемлемые соли таких изомеров.
Изобретение особенно подходит для лечения «экстренных» состояний, жалоб на желудочно-пищеводный рефлюкс типа изжоги, когда требуется сильное уменьшение кислотности в течение короткого времени и наиболее важно быстрое начало действия и предпочтительно максимальное снижение кислотности. Максимальный эффект ингибирования кислоты может поддерживаться в течение 7 дней при устранении феномена "угасания", наблюдающегося после введения одного лишь Н2-блокатора. Это становится важным для того, чтобы сократить время для лечения язв желудка, вызванных кислотой, повреждений пищевода и искоренения Helicobacter pylori.
Для преодоления ранее указанных проблем, связанных с ингибиторами протонного насоса, изобретение состоит из трех частей:
1) при включении ингибитора протонного насоса в состав композиции, высвобождающей активное вещество с отсроченным эффектом (отсроченное высвобождение) и/или с пролонгированным эффектом (продолжительное высвобождение), получается композиция, которая действует полностью противоположно тому, что вплоть до настоящего времени рассматривалось как быстрое наступление эффекта. Однако предусмотрен новый тип защиты для этих неустойчивых к кислоте фармацевтических веществ.
Такой тип композиции с контролируемым высвобождением хорошо известен специалистам в этой области и имеет несколько различных обозначений.
В настоящем описании выражение "продолжительное высвобождение" применяется в качестве синонима "пролонгированного высвобождения" и "длительного высвобождения". Независимо от того, какое выражение употребляется, общее действие состоит в том, что высвобождение активного вещества замедляется и растягивается на более длительное время. Обычно это достигается либо нанесением на ядро из активного вещества покрытия или мембраны из подходящих вспомогательных средств, контролирующих высвобождение, либо включением активного вещества в матрикс из подходящих вспомогательных средств.
Выражение "отсроченное высвобождение" в настоящем описании применяется для описания композиций, не высвобождающих активное вещество немедленно. Начало высвобождения при этом смещается в тонкий кишечник или толстый кишечник. Такой тип композиции обычно получают нанесением на ядро из активного вещества покрытия или мембраны, подвергающихся изменению при прохождении через желудочно-кишечный тракт при воздействии изменений рН на композицию либо при изменении оболочки в зависимости от времени, в течение которого композиция находится в контакте с жидкой средой организма. Данный тип композиции не следует смешивать с композициями, устойчивыми к кислоте в желудке ("неэнтеросолюбильное высвобождение"), которые служат для защиты композиции от ионов водорода или, альтернативно, для защиты пациента от вредного действия медицинского соединения на желудок.
Выражения "контролируемое высвобождение" и "модифицированное высвобождение" также могут применяться для описания этой части изобретения, однако они являются больше собирательными обозначениями, которые не описывают специфически данный тип механизмов высвобождения.
Все эти типы обозначений, принципы составления рецептуры и подходящие вспомогательные средства хорошо известны специалистам в этой области и можно сослаться на руководство "Pharmaceutics. The Science of Dosage Form Design", 1st edition; Ed. M.E.Aulton, Churchill Livingstone, Edinburgh 1988, которое включено в настоящее изобретение путем ссылки. Особенно стоит отметить с.289-305.
Очевидно, полученную базовую композицию можно комбинировать с добавлением других вспомогательных средств. Так, например, ингибиторы протонного насоса можно смешать с веществом, дающим щелочную реакцию, чтобы нейтрализировать небольшое количество ионов водорода, которые могут проникать через структуру мембраны или матрикса при прохождении через желудок. Такие меры вовсе не обязательны, но они ведут к получению более совершенной композиции. Аналогичным образом можно нанести устойчивое к кислоте в желудке покрытие на внешнюю сторону мембраны или матрикса в композиции. В следующем воплощении эти две меры составления рецептуры можно применять в одно и то же время;
2) проблема слишком медленного начала повышения рН, очевидно, не решается дальнейшим замедлением или удлинением продолжительности высвобождения. Однако теперь оказалось, что можно ввести антагонист Н2-рецепторов, имеющий быстрое начало эффекта (что достигается посредством быстрого высвобождения), не подвергая риску наступление действия высвобождающегося впоследствии кислоточувствительного ингибитора протонного насоса. Это было неожиданно, так как важная особенность ИПН заключается в том, что для их действия необходим активный насос. Под влиянием антагониста Н2-рецепторов париетальные клетки переходят в состояние покоя. В состоянии покоя париетальные клетки не продуцируют кислоту и насос неактивен. Ингибирование продукции кислоты под действием ИПН происходит только тогда, когда этот насос находится в активном состоянии при накоплении его в париетальных клетках с тем, что последующая активация препарата ведет к ингибированию насоса. Таким образом, настоящее изобретение обеспечивает новую фармацевтическую композицию, используя быстрое ингибирование секреции кислоты антагонистом рецепторов гистамина типа 2 без уменьшения действия вводимого одновременно ИПН;
3) исходя из современных данных о механизме действия ИПН и биохимии Н+,К+-АТФазы неясно, как достичь максимального ингибирования секреции кислоты при помощи одной дозы ИПН (см. выше). Однако теперь оказалось, что удлинение времени, в течение которого происходит высвобождение ИПН, приводит к неожиданно эффективному ингибированию секреции кислоты от первой дозы. При удлинении времени нахождения ИПН в крови новосинтезированные насосы будут непрерывно подвергаться инактивации. Это было неожиданно, так как после первоначального ингибирования насоса значение рН в секреторном отсеке будет повышаться, а препарат подвергнется депротонированию и будет диффундировать из канальцев. Кроме того, не будет иметь место вторая, явно необходимая стадия действия ИПН, то есть кислотный катализ превращения в активный сульфенамид.
Описанная авторами настоящего изобретения комбинация может быть получена двумя способами. Во-первых, отдельная доза с отсроченным/пролонгированным высвобождением ингибитора протонного насоса может быть введена совместно с отдельной дозой антагониста Н2-рецепторов. С другой стороны, эти два вещества с различными профилями высвобождения могут быть скомпонованы в одном препарате. Несколько примеров должны пояснить, как это можно устроить.
Итак, настоящее изобретение обеспечивает продолжительное подавление кислоты уже после первой дозы. Это достигается при помощи продуктов, предложенных на предшествующем уровне техники.
Н2-блокаторы активны только в первые 6-8 часов.
Н2-блокаторы + антациды дают быстрый эффект, но они активны только 6-8 часов.
ИПН совсем не дают эффекта после первой дозы.
ИПН + антациды активны в течение примерно 1 часа благодаря эффекту антацида.
Энантиомер ИПН не достигает своего полного потенциала после первой дозы.
Медленное высвобождение ИПН само по себе дает эффект только после 5-6 часов.
Таким образом, настоящее изобретение обеспечивает значительное улучшение по сравнению с рецептурами предшествующего уровня техники. Следует полагать, что это улучшение эффекта обусловлено неожиданным клиническим/физиологическим эффектом, достигаемым посредством уникального препарата по изобретению, то есть отсроченного/пролонгированного действия ИПН в сочетании с быстрым высвобождением Н2-блокатора.
Известны некоторые патентные публикации, в которых раскрыты комбинации из ингибитора протонного насоса и композиций для отсроченного высвобождения, и можно сослаться на US 6132768, US 6274173 В1 и DE 19925710 A1. Эти ссылки направлены на повышение стабильности ингибиторов протонного насоса от деградации и обесцвечения, вызванного ионами водорода. Однако в них ничего не говорится о какой-либо комбинации из ингибитора протонного насоса и антагониста Н2-рецепторов и о неожиданных преимуществах, получаемых при этом.
Кроме того, композиция, ингибирующая секрецию кислоты в желудке, известна из международной заявки на патент PCT/SE02/00757. Эта композиция включает комбинацию из кислоточувствительного ингибитора протонного насоса и антагониста Н2-рецепторов, но не упоминается система наполнителей настоящего изобретения и ее неожиданные преимущества.
В соответствии с изобретением предусматривается пероральная дозированная форма, включающая антагонист Н2-рецепторов в количестве, эффективном для уменьшения кислотности в желудке после введения, и кислоточувствительный ингибитор протонного насоса в количестве, эффективном для поддержания низкой кислотности, вызванной антагонистом Н2-рецепторов, на протяжении длительного времени. Предпочтительно эти фармакологически эффективные количества способны повысить рН в желудке выше 3 в течение 2 часов после введения и поддерживать его выше 3, по меньшей мере, 4 часа, предпочтительно, по меньшей мере, 8 часов. Более предпочтительно эти фармакологически эффективные количества способны повысить рН в желудке выше 4 в течение 2 часов после введения и поддерживать его выше 4, по меньшей мере, 8 часов, более предпочтительно, по меньшей мере, 16 часов.
В соответствии с первым предпочтительным аспектом изобретения антагонист Н2-рецепторов находится в количестве, которое способно обеспечить, по меньшей мере, 80% от максимального снижения, более предпочтительно, по меньшей мере, 95% от максимального снижения, кислотности в желудке в течение примерно 2 часов. "Максимальное снижение" есть такое снижение кислотности, которое может быть получено максимально при введении одного лишь антагониста Н2-рецепторов в терапевтически приемлемом количестве, то есть в том количестве, в котором такие препараты применяются в этой области. Термин "антагонист(ы) Н2-рецепторов" в настоящем изобретении охватывает все средства, которые существенно ингибируют или блокируют секрецию кислоты в желудке путем связывания с рецепторами гистамина типа 2 в желудке. В терапевтических дозах такие антагонисты Н2-рецепторов способны не только уменьшить базальную и ночную секрецию кислоты, но и секрецию, стимулированную пищей, гистамином, инсулином и пентагастрином. Примеры антагонистов Н2-рецепторов по изобретению представлены циметидином, ранитидином, низатидином и фамотидином, которые обычно применяются в виде их фармакологически приемлемых солей, в частности гидрохлоридов. Дозированная форма по изобретению предпочтительно содержит от 1 мг до 800 мг антагониста Н2-рецепторов или его соли, более предпочтительно от 5 мг до 400 мг.
В соответствии со вторым предпочтительным аспектом изобретения кислоточувствительный ингибитор протонного насоса находится в количестве, которое способно поддерживать низкую кислотность, обусловленную антагонистом Н2-рецепторов, на протяжении, по меньшей мере, 6 часов. Кислоточувствительные ингибиторы протонного насоса быстро отнимают место на рынке у антагонистов Н2-рецепторов. Термин "кислоточувствительный ингибитор протонного насоса" в настоящем изобретении включает производные бензимидазола, обладающие значительной активностью ингибирования Н+,К+-АТФазы, в частности омепразол, пантопразол, ланзопразол, рабепразол, парипразол, леминопразол и их фармацевтически приемлемые соли, энантиомеры и соли энантиомеров, но также охватывает и другие соединения, описанные на с.7-11 WO 97/25066, которая включена в настоящее изобретение путем ссылки, а также соединения, раскрытые в ЕР 005129 A1, EP 174726 A1, EP 166287 A1, GB 2163747, WO 90/06925, WO 91/19711, WO 91/19712, WO 94/27988, WO 95/01977.
Итак, дозированная форма по изобретению содержит предпочтительно от 1 мг до 100 мг, более предпочтительно от 5 мг до 50 мг, на одну дозу кислоточувствительного ингибитора протонного насоса или его соли. Кислоточувствительный ингибитор протонного насоса или его соль отделены от антагониста Н2-рецепторов согласно принципу составления рецептуры, в которой только ингибитор протонного насоса покрыт мембраной или внедрен в матрикс с целью отсроченного и/или пролонгированного высвобождения.
В соответствии с третьим предпочтительным аспектом изобретения антагонист Н2-рецепторов в лекарственной форме для быстрого высвобождения и кислоточувствительный ингибитор протонного насоса в лекарственной форме для отсроченного и/или пролонгированного высвобождения не должны находиться в одной фармацевтической композиции, но могут вводиться по отдельности в течение короткого промежутка времени, к примеру в один час, предпочтительно в 30 мин, наиболее предпочтительно в 10 мин. Так выглядит соответствующий режим дозирования для раздельного, но совместного введения кислоточувствительного ингибитора протонного насоса и антагониста Н2-рецепторов для лечения заболеваний, связанных с секрецией кислоты в желудке.
Таким образом, пероральная дозированная форма по изобретению содержит кислоточувствительный ингибитор протонного насоса в лекарственной форме для отсроченного и/или пролонгированного высвобождения, антагонист Н2-рецепторов в лекарственной форме для быстрого высвобождения и, необязательно, средство для подавления кислоты в желудке и/или альгинат. Предпочтительно дозированная форма по изобретению содержит от 100 мг до 1000 мг антацидного средства и/или альгината. Антацидное средство по изобретению включает один или несколько из числа гидроксида алюминия, карбоната кальция, карбоната магния, основного карбоната магния, гидроксида магния, оксида магния и бикарбоната натрия.
Вследствие того, что кислоточувствительные ингибиторы протонного насоса в общем чувствительны к кислоте (кислоточувствительные ингибиторы протонного насоса), их нужно вводить в таком виде, который защищает их от деградации в желудке и позволяет проходить в тонкий кишечник, где они всасываются. В данном изобретении это в основном решается при помощи наполнителей для отсроченного и/или пролонгированного высвобождения, которые оказывают защиту, причем без известного недостатка энтеросолюбильных оболочек (высвобождения ионов водорода, что повышает скорость деградации ингибиторов протонного насоса). С другой стороны, антагонисты Н2-рецепторов можно вводить без таковой защиты. В соответствии со следующим предпочтительным аспектом изобретения композиции могут быть адаптированы так, чтобы они соответствовали целям настоящего изобретения из числа тех, что раскрыты в WO 97/25066.
Пероральные дозированные формы по WO 97/25066 включают кислоточувствительный ингибитор протонного насоса в количестве, близком или идентичном тому, что применяется в композиции настоящего изобретения, а также одно или несколько антацидных средств и/или альгинатов. Адаптация композиций из WO 97/25066 в основном заключается, во-первых, в добавлении системы мембраны или системы матрикса к той части композиции, которая содержит ингибитор протонного насоса, и, во-вторых, в замене фармакологически эффективным количеством антагониста Н2-рецепторов части или всего количества антацидного средства и/или альгината.
В соответствии с изобретением предусматривается пероральная многоединичная таблетированная дозированная форма, содержащая кислоточувствительный ингибитор протонного насоса в индивидуально покрытых единицах для отсроченного/пролонгированного высвобождения, необязательно покрытых энтеросолюбильной оболочкой, вместе с антагонистом Н2-рецепторов в виде порошка или гранул, запрессованных в таблетку. Энтеросолюбильная оболочка, окружающая индивидуальные единицы с кислоточувствительным ингибитором протонного насоса, обладает такими свойствами, что прессование их в таблетку не оказывает значительного влияния на устойчивость к кислоте индивидуально покрытых единиц. Более того, многоединичная таблетированная дозированная форма обеспечивает хорошую стабильность активных веществ при длительном хранении.
В соответствии с изобретением также предусматривается многоединичная таблетированная дозированная форма, которую можно разделять и легко обрабатывать. Такая многоединичная таблетированная дозированная форма содержит гранулы с покрытием для отсроченного/пролонгированного высвобождения с кислоточувствительным ингибитором протонного насоса, необязательно покрытые энтеросолюбильной оболочкой, спрессованные с порошком антагониста Н2-рецепторов. Такая дозированная форма также может содержать шипучие компоненты, способствующие быстрой дезинтеграции ее при попадании в воду. Значение рН водной фазы при этом должно быть слегка кислым, чтобы предотвратить растворение какой-либо энтеросолюбильной оболочки. Такую дозированную форму можно давать пациентам с нарушениями глотания и в педиатрии. Такую суспензию из дисперсных единиц/гранул соответствующего размера можно применять для приема внутрь, а также для введения через носожелудочную трубку.
В соответствии с изобретением также предусматривается препарат в виде таблетки, содержащий кислоточувствительный ингибитор протонного насоса в смеси с наполнителями, образующими ядро таблетки, которое покрыто наполнителями для отсроченного и/или пролонгированного высвобождения, и отдельный слой, окружающий ядро таблетки. Окружающий слой содержит антагонист Н2-рецепторов в смеси с фармацевтическим наполнителем. Необязательно разделительный слой наносится на ядро таблетки перед нанесением покрытия на ядро. Дополнительная опция состоит в том, чтобы нанести энтеросолюбильную оболочку поверх остальных покрытий. С другой стороны, готовая таблетка может состоять из отдельных слоев, причем каждый из них содержит разные активные вещества. Один из слоев, предпочтительно самый внутренний (ядро), содержит кислоточувствительный ингибитор протонного насоса в виде покрытых гранул в смеси с фармацевтическими наполнителями, а другой слой (слои) содержит антагонист(ы) рецепторов гистамина типа 2 соответственно в смеси с фармацевтическими наполнителями. Необязательно эти два слоя отделены разделительным слоем, чтобы предотвратить прилипание между двумя слоями. Покрытое ядро, содержащее кислоточувствительный ингибитор протонного насоса, также может быть покрыто энтеросолюбильной оболочкой, например, согласно методикам, раскрытым в WO 00/78284, которая включена в настоящее изобретение путем ссылки.
Согласно изобретению кислоточувствительный ингибитор протонного насоса в виде покрытых гранул может быть смешан с антагонистом(ами) Н2-рецепторов и необязательно с фармацевтическим(и) наполнителем(ями) для применения в саше для перорального введения после диспергирования в слабокислом водном растворе.
Предпочтительно дозированная форма по изобретению содержит кислоточувствительный ингибитор протонного насоса или его соль, защищенные слоем покрытия для отсроченного и/или пролонгированного высвобождения, а также необязательно энтеросолюбильную оболочку. Предпочтительно дозированная форма по изобретению включает два концентрических слоя, необязательно отделенные одним или несколькими разделяющими слоями, причем один слой содержит указанный кислоточувствительный ингибитор протонного насоса или его соль, а другой слой содержит указанный антагонист Н2-рецепторов или его соль.
Внутренний слой содержит кислоточувствительный ингибитор протонного насоса или его соль, а наружный слой содержит антагонист Н2-рецепторов или его соль. В соответствии с предпочтительным аспектом наружный слой включает дезинтегрирующее вещество. Пероральная дозированная форма по изобретению может принимать различные формы, такие как таблетки, капсулы, разделенные составы из порошка/гранул и др.
Кроме того, как описано выше, содержащая кислоточувствительный ингибитор протонного насоса часть композиции оказывает эффект отсроченного и/или пролонгированного высвобождения при нанесении покрытий на материал ядра с ингибитором протонного насоса. Однако другой подход заключается в замене оболочки, то есть мембранной системы, на систему матрикса. Затем выбирают наполнители, образующие липидный или нерастворимый в воде матрикс. Функция матрикса при этом состоит в осуществлении пролонгированного высвобождения ингибитора протонного насоса.
В соответствии с изобретением также раскрыт способ изготовления пероральной таблетированной дозированной формы, содержащей кислоточувствительный ингибитор протонного насоса или его соль и антагонист Н2-рецепторов или его соль в количестве, фармакологически эффективном при лечении заболеваний, связанных с диспепсией, причем этот способ включает формирование первого слоя, содержащего указанный кислоточувствительный ингибитор протонного насоса или его соль, покрытия из наполнителей для отсроченного и/или пролонгированного высвобождения и необязательно энтеросолюбильной оболочки, окружающей указанный первый слой, и второго слоя, содержащего указанный антагонист Н2-рецепторов или его соль и окружающего указанный первый слой и его покрытие. Также раскрыт способ изготовления пероральной дозированной формы, содержащей указанный кислоточувствительный ингибитор протонного насоса или его соль и антагонист Н2-рецепторов или его соль в количестве, фармакологически эффективном при лечении заболеваний, связанных с диспепсией, причем этот способ включает формирование гранул, содержащих указанный кислоточувствительный ингибитор протонного насоса или его соль, нанесение на указанные гранулы вышеуказанных покрытий и смешивание указанных гранул с носителем, содержащим указанный антагонист Н2-рецепторов или его соль, причем носитель необязательно включает дезинтегрирующее вещество. Вышеупомянутые способы по изобретению дополнительно включают заключительную стадию таблетирования, за которой необязательно следует стадия нанесения пленки.
Другой способ изготовления пероральной дозированной формы по изобретению включает наполнение капсулы, способной дезинтегрировать в желудочно-кишечной жидкости с высвобождением ее содержимого, смесью, включающей покрытые гранулы с ингибитором протонного насоса и антагонист Н2-рецепторов в виде порошка или гранул.
Касательно способов изготовления, как описано выше, содержащая ингибитор протонного насоса часть композиции оказывает эффект отсроченного и/или пролонгированного высвобождения при нанесении покрытий на материал ядра с ингибитором протонного насоса. Однако другой подход заключается в замене оболочки, то есть мембранной системы, на систему матрикса. Затем выбирают наполнители, образующие липидный или нерастворимый в воде матрикс. Функция матрикса при этом состоит в осуществлении пролонгированного высвобождения ингибитора протонного насоса.
Применение фармацевтической дозированной формы по изобретению, однако, не ограничивается обеспечением быстрого и длительного облегчения страданий пациента от заболеваний, связанных с секрецией кислоты в желудке. Следует ожидать, что быстрое начало ингибирования секреции кислоты в желудке в сочетании с поддержанием ингибирования настолько, насколько это нужно (путем повторного введения композиции, содержащей кислоточувствительный ингибитор протонного насоса, предпочтительно путем повторного введения композиции по изобретению), окажет положительное влияние на заживление язв желудка и двенадцатиперстной кишки и эзофагита, для которых показано поддержание рН внутри желудка выше 4 на максимальное время (Huang J.Q. and Hunt R.H., рН, healing rate and symptom relief in patients with GERD, Yale J Biol Med 1999, 72: 181-94). Таким образом, композиция по изобретению также предпочтительна для поддержания рН в желудке выше 4 на продолжительное время, к примеру на 4 часа и больше.
Дозированная форма по изобретению также может применяться, вместе с одним или несколькими антибиотиками, для искоренения Helicobacter pylori.
В соответствии с изобретением также раскрыт способ лечения заболеваний, связанных с секрецией кислоты в желудке, который включает введение дозированной формы по изобретению или одновременное введение двух отдельных пероральных дозированных форм, причем одна содержит фармакологически эффективное количество кислоточувствительного ингибитора протонного насоса или его соли в лекарственной форме для отсроченного и/или пролонгированного высвобождения, а другая содержит фармакологически эффективное количество антагониста Н2-рецепторов или его соли в лекарственной форме для быстрого высвобождения.
Кроме того, в соответствии с изобретением раскрыт способ лечения инфекции Helicobacter pylori, включающий введение дозированной формы по изобретению или одновременное введение двух отдельных пероральных дозированных форм, причем одна содержит фармакологически эффективное количество кислоточувствительного ингибитора протонного насоса или его соли, а другая содержит фармакологически эффективное количество антагониста Н2-рецепторов или его соли, в сочетании с введением одного или нескольких антибиотиков, эффективных против Н. pylori.
Вышеуказанные способы лечения согласно изобретению предпочтительно включают режим дозирования, способный поддерживать рН в желудке выше 4 на протяжении, по меньшей мере, 95% промежутка времени, начинающегося с 2 часов после введения первой дозы и продолжающегося до 6 часов после введения последней дозы, в частности такой режим, в котором промежуток времени составляет одну неделю и больше, предпочтительно две недели и больше, еще более предпочтительно четыре недели и больше. В этом плане также предпочтителен режим дозирования, способный поддерживать рН в желудке выше 3 на протяжении, по меньшей мере, 95% промежутка времени, начинающегося с 2 часов после введения первой дозы и продолжающегося до 6 часов после введения последней дозы, в частности четыре недели и больше.
Далее изобретение будет описано более подробно с привлечением ряда предпочтительных, но не ограничивающих воплощений, представленных на чертежах.
Краткое описание фигур
Фиг.1-4 представляют собой схемы в поперечном разрезе, представляющие нижеследующее.
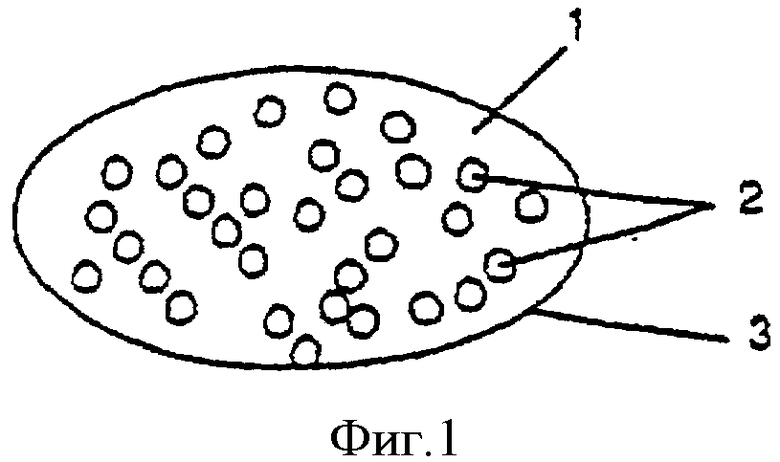
Фиг.1 - многоединичная таблетированная дозированная форма, содержащая кислоточувствительный ингибитор протонного насоса в виде покрытых оболочкой гранул для отсроченного и/или пролонгированного высвобождения в смеси с антагонистом Н2-рецепторов, диспергированным в фармацевтическом носителе.
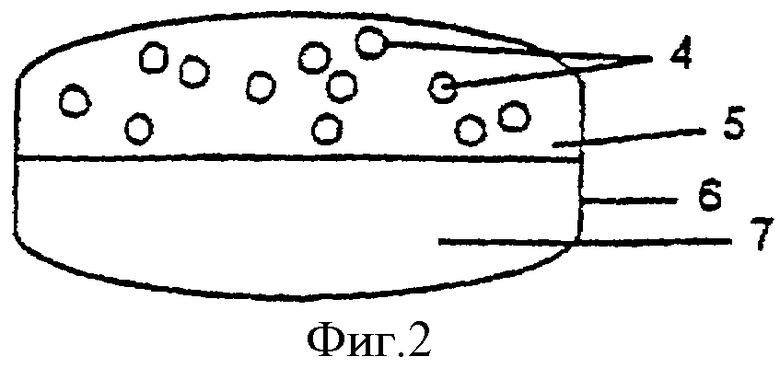
Фиг.2 - таблетированная дозированная форма из двух половинок, одна из которых содержит покрытые оболочкой для отсроченного и/или пролонгированного высвобождения гранулы с кислоточувствительным ингибитором протонного насоса в смеси с наполнителями, тогда как другая содержит антагонист Н2-рецепторов в смеси с наполнителями.
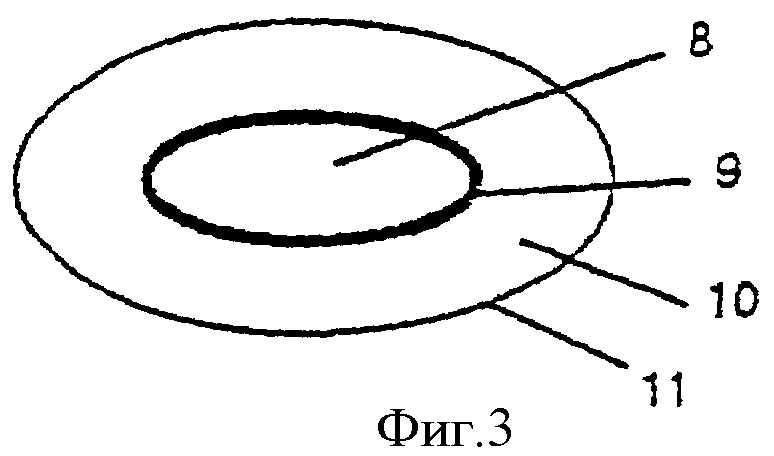
Фиг.3 - многослойная таблетированная дозированная форма, содержащая кислоточувствительный ингибитор протонного насоса в ядре, окруженном оболочкой для отсроченного и/или пролонгированного высвобождения, и окружающий ядро слой, содержащий антагонист Н2-рецепторов, диспергированный в фармацевтическом носителе.
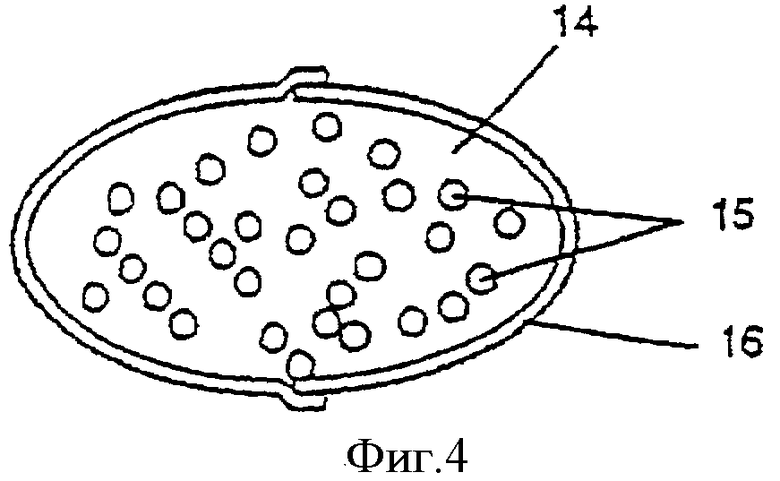
Фиг.4 - капсульная дозированная форма, содержащая кислоточувствительный ингибитор протонного насоса в покрытых оболочкой для отсроченного и/или пролонгированного высвобождения гранулах, в смеси с антагонистом Н2-рецепторов и фармацевтическими наполнителями.
Осуществление изобретения
Многоединичная таблетированная дозированная форма. Многоединичная таблетированная дозированная форма по изобретению, представленная на фиг.1, состоит из основной массы 1, необязательно покрытой слоем пленки 3, и небольших гранул 2, распределенных случайным образом в основной массе 1. Гранулы 2 содержат кислоточувствительный ингибитор протонного насоса в виде рацемата, щелочной соли или одного из энантиомеров. Индивидуальные единицы 2 (небольшие бусины, гранулы или шарики), содержащие кислоточувствительный ингибитор протонного насоса и необязательно содержащие щелочные вещества, покрывают слоем(слоями), обладающим(и) свойствами отсроченного высвобождения и/или пролонгированного высвобождения, и необязательно дополнительной энтеросолюбильной оболочкой. Затем покрытые единицы 2 смешивают с антагонистом Н2-рецепторов и стандартными наполнителями для таблеток, формируя в итоге основную массу таблетки 1. Антагонист Н2-рецепторов и наполнители для таблеток можно смешивать сухим или мокрым способом в гранулы. Смесь из покрытых оболочкой единиц, антагониста Н2-рецепторов и наполнителей подвергают прессованию в многоединичные таблетированные дозированные формы. Выражение "индивидуальные единицы" означает небольшие бусины, гранулы или шарики, которые в дальнейшем именуются гранулами с ингибитором протонного насоса. В следующем воплощении изобретения на "индивидуальные единицы" также наносят антагонист Н2-рецепторов. Тогда антагонист Н2-рецепторов должен находиться в периферическом положении по отношению к оболочкам для отсроченного и/или пролонгированного высвобождения и энтеросолюбильной оболочке с тем, чтобы он быстро высвобождался в желудочно-кишечный тракт. При таблетировании смеси необходимо соблюдать осторожность, чтобы сильно не изменить кислотоустойчивость покрытых гранул. В отношении материала для покрытия ядра гранул, содержащих кислоточувствительный ингибитор протонного насоса, отсылаем к заявке WO 97/25066, с.13, со второго до последнего абзаца, - с.15, конец второго абзаца, которая включена в настоящее изобретение путем ссылки. В отношении оболочки, осуществляющей отсроченное и/или пролонгированное высвобождение, отсылаем к US 6274173, который включен в настоящее изобретение путем ссылки. Также можно обратиться к "Pharmaceutics. The Science of Dosage Form Design", 1st edition; Ed. M.E.Aulton, Churchill Livingstone, Edinburgh 1988. При этом следует особенно отметить с.289-305. В отношении энтеросолюбильной оболочки(оболочек) отсылаем к заявке WO 97/25066, с.15, со второго до последнего абзаца, - с.18, конец второго абзаца, которая включена в настоящее изобретение путем ссылки. Гранулы с кислоточувствительным ингибитором протонного насоса, покрытые оболочкой для отсроченного и/или пролонгированного высвобождения и необязательно энтеросолюбильной оболочкой, могут быть дополнительно покрыты одним или несколькими внешними (защитными) слоями. В отношении таких внешних (защитных) слоев отсылаем к заявке WO 97/25066, с.18, последний абзац, - с.19, конец первого абзаца, которая включена в настоящее изобретение путем ссылки.
Антагонист Н2-рецепторов смешивают насухо с неактивными наполнителями, такими как заполнители, связующие вещества, дезинтегрирующие вещества и другие фармацевтически приемлемые наполнители. Из этой смеси формируют влажную массу с помощью грануляционной жидкости. Влажную массу сушат предпочтительно до потери менее 3% по весу. Затем сухую массу измельчают до соответствующего размера для гранул, предпочтительно менее 1 мм. Подходящими неактивными наполнителями являются, к примеру, маннит, кукурузный крахмал, картофельный крахмал, слабозамещенная гидроксипропилцеллюлоза, микрокристаллическая целлюлоза и сшитый поливинилпирролидон. Сухую смесь, содержащую антагонист Н2-рецепторов, можно смешать с подходящей грануляционной жидкостью, содержащей, к примеру, гидроксипропилцеллюлозу или поливинилпирролидон, растворенный в воде или спирте, или их смеси. В качестве альтернативы антагонист Н2-рецепторов смешивают насухо с фармацевтически приемлемыми наполнителями (см. выше). Как указано выше, в другом воплощении изобретения антагонист Н2-рецепторов может быть нанесен на небольшие единицы 2, а не смешан с наполнителями для формирования основной массы таблетки 1. Независимо от того, каким образом происходит включение антагониста Н2-рецепторов, он должен обладать свойством быстрого высвобождения.
Многоединичные таблетки. Покрытые оболочкой гранулы, содержащие кислоточувствительный ингибитор протонного насоса, смешивают с гранулами антагониста Н2-рецепторов или с готовой сухой смесью, содержащей антагонист Н2-рецепторов. Эту смесь перемешивают со смазывающим веществом и подвергают прессованию в многоединичную таблетированную дозированную форму. Подходящими смазывающими веществами для процесса таблетирования являются, к примеру, стеарилфумарат натрия, стеарат магния и тальк. Прессованные таблетки необязательно покрывают пленкообразующим веществом для получения гладкой поверхности. Такая оболочка может дополнительно включать такие добавки, как средства от прилипания, красители и пигменты или другие добавки.
Доля покрытых гранул предпочтительно составляет менее 60% от общего веса таблетки. При этом предпочтительная формула многоединичных таблеток состоит из покрытых оболочкой для отсроченного и/или пролонгированного высвобождения гранул, необязательно покрытых энтеросолюбильной оболочкой и содержащих кислоточувствительный ингибитор протонного насоса, необязательно в смеси с дающими щелочную реакцию веществами, запрессованных в таблетки с готовой смесью антагонист Н2-рецепторов/наполнитель(и). Необязательная энтеросолюбильная оболочка(и) делает гранулы этой дозированной формы нерастворимыми в кислых средах, но дезинтегрирующимися/растворяющимися в почти нейтральных и щелочных средах, таких как желудочный сок в проксимальной части тонкого кишечника, где желательно растворение и всасывание кислоточувствительного ингибитора протонного насоса. Тогда оболочка для отсроченного высвобождения начнет высвобождать кислоточувствительный ингибитор протонного насоса через определенный промежуток времени в желудочно-кишечном тракте или при достижении определенного значения рН в каком-то месте кишечника или толстой кишки. Оболочка для пролонгированного высвобождения будет продлевать высвобождение ингибитора протонного насоса, что приведет к всасыванию препарата на протяжении нескольких часов. Гранулы ингибитора протонного насоса с покрытием для отсроченного и/или пролонгированного высвобождения также могут быть покрыты внешним (защитным) слоем перед таблетированием, и они могут также содержать один или несколько разделительных слоев между материалом ядра и другими слоями.
Способ получения многоединичных таблеток. Способ получения этой дозированной формы представляет следующий аспект изобретения. После формирования гранул путем смешивания насухо (упорядоченная смесь), распыления или нанесения кислоточувствительного ингибитора протонного насоса на затравки либо путем экструзии/сферонизации или гранулирования на гранулы сначала необязательно наносят разделительный(ые) слой(и), затем слой(и) для отсроченного и/или пролонгированного высвобождения, а затем необязательно наносят энтеросолюбильную(ые) оболочку(и). Нанесение покрытий осуществляется, как описано выше и в сопутствующих примерах. Приготовление смеси с антагонистом Н2-рецепторов также описано в примерах. Необязательно антагонист Н2-рецепторов может быть нанесен на уже существующие слои, составляющие покрытие для отсроченного и/или пролонгированного высвобождения и энтеросолюбильную оболочку.
Покрытые гранулы, вместе с внешним (защитным) слоем или без него, смешивают с готовыми гранулами или сухим порошком антагониста Н2-рецепторов, наполнителями для таблеток и другими фармацевтически приемлемыми добавками и таблетируют. В качестве альтернативы на покрытые гранулы ингибитора протонного насоса может быть нанесен второй слой, содержащий антагонист Н2-рецепторов, как описано в последующих примерах. Кроме того, как показано на фиг.2, покрытые гранулы 4 могут быть однородно перемешаны с наполнителями 5 и подвергнуты предварительному прессованию, после чего добавляют препарат антагониста Н2-рецепторов и всю массу таблеток подвергают заключительному таблетированию, необязательно вместе с пленкообразующим(ими) веществом(ами) 6 для получения гладкой поверхности. В качестве дальнейшей альтернативы, представленной на фиг.3, кислоточувствительный ингибитор протонного насоса в виде порошка может быть смешан с наполнителями для таблеток и подвергнут прессованию в таблетки 8, которые необязательно покрывают разделяющим слоем, после чего наносят покрытие 9 для отсроченного и/или пролонгированного высвобождения. Необязательно наносят энтеросолюбильную оболочку. На полученные при этом ядра таблеток затем напрессовывают препарат антагониста Н2-рецепторов 10. Наконец, таблетки могут быть покрыты внешней оболочкой 11 для получения гладкой поверхности.
Также можно расфасовать кислоточувствительный ингибитор протонного насоса в виде покрытых оболочкой гранул в саше вместе с антагонистом Н2-рецепторов и необязательно смешать с наполнителями.
На фиг.4 представлены твердые желатиновые капсулы 16, заполненные не подвергнутым прессованию материалом ядра 14, 15 из воплощения, представленного на фиг.1.
В приведенных примерах (фиг.1, 2, 3 и 4) применяются термины покрытие, оболочка или слой. Эти термины взаимозаменимы и к тому же идентичны термину мембрана. Независимо от номенклатуры их объединяет то, что они соответствуют более-менее непрерывным фазам материалов наполнителей, нанесенных, к примеру, распылением на материал ядра. Вследствие природы их обработки эти мембраны являются сравнительно тонкими в отношении толщины.
Подходящими материалами наполнителей для формирования покрытий (или мембран) для отсроченного и/или пролонгированного высвобождения являются такие неполимерные или полимерные материалы, как фосфат кальция, этилцеллюлоза, сополимер метакрилата, полиамид, полиэтилен, поливиниловый спирт или поливинилацетат.
Кроме того, как описано выше, содержащая ингибитор протонного насоса часть композиции (2 на фиг.1, 4 на фиг.2, 8 на фиг.3 и 15 на фиг.4) оказывает эффект отсроченного и/или пролонгированного высвобождения при нанесении покрытий на материал ядра с ингибитором протонного насоса. Однако другой подход заключается в замене оболочки, то есть мембранной системы, на систему матрикса. Затем выбирают наполнители, образующие липидный или нерастворимый в воде матрикс. Функция матрикса при этом состоит в осуществлении пролонгированного высвобождения ингибитора протонного насоса. Подходящими наполнителями для формирования матрикса являются такие неполимерные или полимерные материалы, как фосфат кальция, этилцеллюлоза, сополимер метакрилата, полиамид, полиэтилен или поливинилацетат, карнаубский воск, цетиловый спирт, гидрогенизированные растительные масла, микрокристаллический воск, моно- и триглицериды, полиэтиленгликоль или полиэтиленгликольмоностеарат и наиболее предпочтительными являются карнаубский воск, цетиловый спирт, гидрогенизированные растительные масла, микрокристаллический воск, моно- и триглицериды, полиэтиленгликоль или полиэтиленгликольмоностеарат. Для достижения оптимальной скорости высвобождения можно необязательно добавить гидрофильные, порообразующие наполнители. Подходящими гидрофильными, порообразующими наполнителями являются альгинаты, карбопол, желатин, гадроксипропилцеллюлоза, гидроксипропилметилцеллюлоза или метилцеллюлоза.
В общем, способы WO 97/25066 для получения пероральных фармацевтических дозированных форм, содержащих кислоточувствительный ингибитор протонного насоса и антацидное средство или альгинат, могут быть адаптированы к целям настоящего изобретения, во-первых, добавлением системы мембраны или системы матрикса к той части композиции, которая содержит ингибитор протонного насоса, и, во-вторых, заменой части или всего количества антацидного средства или альгината на фармакологически эффективное количество антагониста Н2-рецепторов, а остальное антацидное средство или альгинат (если замена не равна 1:1 по весу) пропускается или заменяется такими наполнителями, как микрокристаллическая целлюлоза, силикагель, лактоза, маннит и т.п.
Применение дозированных форм согласно изобретению
Дозированные формы по изобретению особенно предпочтительны при лечении диспепсии и других желудочно-кишечных нарушений, связанных с продукцией кислоты в желудке, для обеспечения быстрого и длительного облегчения симптомов. Эти дозированные формы применяются один или несколько раз в день. Типичные ежедневные дозы кислоточувствительного ингибитора протонного насоса и антагониста Н2-рецепторов зависят от различных факторов, таких как индивидуальные потребности пациентов, способ применения и конкретное заболевание, подлежащее лечению. В общем случае каждая дозированная форма должна содержать от 1 мг до 100 мг кислоточувствительного ингибитора протонного насоса и от 1 мг до 800 мг антагониста Н2-рецепторов. Предпочтительно каждая дозированная форма должна содержать от 5 мг до 50 мг кислоточувствительного ингибитора протонного насоса и от 5 мг до 200 мг антагониста Н2-рецепторов. Препарат в виде многоединичной таблетки также подходит для диспергирования в воде, слегка подкисленной добавлением лимонной кислоты.
ПРИМЕР 1
Многоединичная таблетированная дозированная форма, содержащая магниевую соль омепразола и гидрохлорид циметидина, размер партии: 400 таблеток. Насчет получения гранул Mg-соли омепразола (материал ядра, разделяющий слой, энтеросолюбильная оболочка и внешний защитный слой, см. заявку WO 97/25066, с.22-23 под соответствующими заголовками) см. заявку WO 97/25066, первые два абзаца, которая вся включена в настоящее изобретение путем ссылки. Слой для пролонгированного высвобождения наносят в виде покрытия между разделительным слоем и энтеросолюбильной оболочкой в соответствии с тем, что описано в патенте US 6274173, примеры 1-4, используя этилцеллюлозу или поливинилацетат в качестве наполнителей для пролонгированного высвобождения, причем информация из него включена в настоящее изобретение путем ссылки.
Таблетки
Растворяют небольшое количество картофельного крахмала в очищенной горячей воде для образования грануляционной жидкости. Смешивают насухо гидрохлорид циметидина, остальной картофельный крахмал и микрокристаллическую целлюлозу. К сухой смеси добавляют грануляционную жидкость и перемешивают влажную массу. Влажную массу сушат в печи при 50°С. Полученную грануляционную массу измельчают через сито 1 мм на вибрационной установке. Смешивают покрытые гранулы с защитным слоем, готовые гранулы антагониста Н2-рецепторов, поперечно сшитый поливинилпирролидон и стеарилфумарат натрия и прессуют таблетки с помощью таблетировочной машины, снабженной овальными штампами. Количество омепразола в каждой таблетке составляет около 10 мг, а количество циметидина гидрохлорида около 100 мг.
При небольшой модификации эта многоединичная таблетированная форма может содержать антацидное средство (вместо 300 мг микрокристаллической целлюлозы: 100 мг микрокристаллической целлюлозы, 100 мг карбоната кальция, 100 мг оксида магния, все остальные компоненты, за исключением воды, в приведенных выше количествах).
ПРИМЕР 2
Трехслойная таблетированная дозированная форма. Таблетки содержат кислоточувствительный ингибитор протонного насоса омепразол, разделяющий слой и ядро, содержащее гидрохлорид циметидина. Размер партии: 1000 таблеток.
Первый слой таблетки
Разделяющий слой
Второй слой таблетки
Покрытые гранулы, содержащие
Составные части первого слоя таблетки смешивают насухо и подвергают предварительному прессованию в качестве первого слоя с помощью таблетировочной машины, снабженной овальными штампами. Поверх первого слоя наносят микрокристаллическую целлюлозу, формируя разделяющий слой для следующего слоя. Составные части второго слоя таблетки смешивают насухо и наносят на разделяющий слой. Эти три слоя подвергают прессованию в трехслойные таблетки, которые могут быть покрыты внешним защитным слоем. Количество омепразола составляет около 10 мг, а количество циметидина гидрохлорида около 200 мг на таблетку.
ПРИМЕР 3
Капсульная дозированная форма. Твердые желатиновые капсулы №1 (16) (фиг.4, объем 0,48 мл) заполняли гранулами омепразола с покрытием для пролонгированного высвобождения (15), содержащими 20 мг омепразола (полученного в примере 1), и сухой смесью 14 из коммерчески доступного фамотидина 20 мг и закрывали.
ПРИМЕР 4
Разделенный состав порошок/гранулы. Гранулы для пролонгированного высвобождения, содержащие 15 мг лансопразола (полученного аналогично примеру 1) и препарат фамотидина, смешивали насухо с лимонной кислотой. Порции, соответствующие одной дозе и содержащие по 10 мг лансопразола и фамотидина гидрохлорида и 200 мг порошкообразной лимонной кислоты, упаковывали всухую в пластиковый ламинат. Композицию следует высыпать в 20 мл воды, немного перемешать и выпить.
ПРИМЕР 5
Многоединичная капсульная дозированная форма. Капсулы содержат магниевую соль омепразола и фамотидин гидрохлорид. Насчет покрытия для пролонгированного высвобождения см. US 6274173, примеры 1-4, информация из которого включена в настоящее изобретение путем ссылки. Насчет энтеросолюбильной оболочки и внешнего защитного слоя см. WO 97/25066, с.22-23 под соответствующими заголовками, информация из которого включена в настоящее изобретение путем ссылки.
Смешивают магниевую соль омепразола с микросферами микрокристаллической целлюлозы до получения упорядоченной смеси. Эту смесь покрывают слоем для пролонгированного высвобождения, состоящим из поливинилацетата, тонкоизмельченной лактозы, пропиленгликоля и аммиака (25%), в установке с псевдоожиженным слоем. Затем эти гранулы для пролонгированного высвобождения покрывают энтеросолюбильной оболочкой, состоящей из сополимера метакриловой кислоты, моно- и диглицеридов, триэтилцитрата и полисорбата, в установке с псевдоожиженным слоем. Затем на эти упорядоченные единицы для пролонгированного высвобождения с энтеросолюбильной оболочкой наносят внешний слой с помощью водной суспензии, содержащей фамотидина гидрохлорид, гидроксипропилметилцеллюлозу и стеарат магния, в установке с псевдоожиженным слоем. Этой смесью для пролонгированного высвобождения с энтеросолюбильной оболочкой и внешним защитным слоем заполняют твердые желатиновые капсулы. Количество омепразола составляет около 10 мг, а количество фамотидина гидрохлорида около 200 мг на капсулу.
ПРИМЕР 6
Многоединичная таблетированная дозированная форма. Таблетки содержат магниевую соль омепразола и гидрохлорид циметидина. Магниевую соль омепразола смешивают с гранулами маннита до получения упорядоченной смеси, которую покрывают оболочкой для пролонгированного высвобождения и энтеросолюбильной оболочкой, как описано в примере 5. Циметидина гидрохлорид подвергают гранулированию, как описано в примере 1. Покрытую упорядоченную смесь, включающую магниевую соль омепразола, гранулы циметидина и наполнители, смешивают насухо и прессуют в таблетки. Количество омепразола в каждой таблетке составляет около 10 мг, а количество циметидина около 100 мг.
ПРИМЕР 7
Многоединичная таблетированная дозированная форма для быстрого высвобождения антагониста Н2-рецепторов и пролонгированного высвобождения в толстой кишке ингибитора протонного насоса. Таблетки содержат магниевую соль омепразола и гидрохлорид циметидина.
Материал ядра
Нанесение суспензии проводили в установке с псевдоожиженным слоем. Магниевую соль омепразола распыляли на зернистый сахар из водной суспензии, содержащей растворенное связующее вещество и полисорбат 80. Размеры зерен сахара были в пределах от 0,25 мм до 0,35 мм.
Слой для пролонгированного высвобождения
Слой для отсроченного высвобождения
Готовый материал ядра покрывали слоем для пролонгированного высвобождения и слоем для отсроченного высвобождения в установке с псевдоожиженным слоем с помощью коммерчески доступных водных суспензий Eudragit® RTM и Eudragit® FS 30 D соответственно.
Энтеросолюбильная оболочка
Энтеросолюбильную оболочку, состоящую из сополимера метакриловой кислоты, моно- и диглицеридов, триэтилцитрата и полисорбата, наносили распылением на гранулы, покрытые слоями для пролонгированного/отсроченного высвобождения, в установке с псевдоожиженным слоем. Гранулы с энтеросолюбильной оболочкой разделяли по крупности путем просеивания.
Таблетки
Растворяли небольшое количество картофельного крахмала в горячей очищенной воде для образования грануляционной жидкости. Смешивали насухо гидрохлорид циметидина, карбонат кальция, гидроксид магния и картофельный крахмал. К сухой смеси добавляли грануляционную жидкость и перемешивали влажную массу.
Влажную массу сушили в печи при 40°С. Полученную грануляционную массу измельчали через сито 1 мм на вибрационной установке.
Смешивали гранулы с многослойным покрытием, готовые гранулы, поперечно сшитый поливидон, микрокристаллическую целлюлозу и стеарилфумарат натрия и прессовали таблетки в таблетировочной машине, снабженной 9-ю овальными штампами на 20 мм. Количество омепразола в каждой таблетке около 20 мг и такое же количество циметидина гидрохлорида.
Твердость таблеток составляла 30N.
Необязательно полученные таблетки покрывали внешним защитным покрытием.
Настоящее изобретение относится к области лекарственных средств, в частности к пероральной фармацевтической дозированной форме для лечения состояний, связанных с секрецией кислоты в желудке, включающей кислоточувствительный ингибитор протонного насоса и антагонист Н2-рецепторов, с отсроченным и/или пролонгированным высвобождением кислоточувствительного ингибитора протонного насоса и быстрым высвобождением антагониста Н2-рецепторов. Кроме того, изобретение относится к способу получения такой дозированной формы и способу лечения заболеваний, связанных с секрецией кислоты в желудке. Технический результат заключается в максимальном подавлении кислоты в желудке после первой дозы и на протяжении всего курса лечения. 9 н. и 60 з.п. ф-лы, 4 ил.
| ГАЗО-ГИДРАВЛИЧЕСКИЙ ДВИГАТЕЛЬ | 1927 |
|
SU9092A1 |
| WO 95022320 A1, 17.02.1995 | |||
| DORET CHENG, Combined use of proton pump inhibitors and histamine-H2 receptor agonist for GERD, CPJ/RPC, 2002, vol.135, no.7 | |||
| WO 1999033448 А1, 08.07.1999 | |||
| US 6183776 A, 06.02.2001 | |||
| WO 9725065 A1, 17.07.1997. | |||
Авторы
Даты
2008-12-10—Публикация
2003-10-15—Подача